JP4925582B2 - Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 - Google Patents
Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 Download PDFInfo
- Publication number
- JP4925582B2 JP4925582B2 JP2004528780A JP2004528780A JP4925582B2 JP 4925582 B2 JP4925582 B2 JP 4925582B2 JP 2004528780 A JP2004528780 A JP 2004528780A JP 2004528780 A JP2004528780 A JP 2004528780A JP 4925582 B2 JP4925582 B2 JP 4925582B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- tnfα
- formulation
- aqueous pharmaceutical
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39591—Stabilisation, fragmentation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/22—Heterocyclic compounds, e.g. ascorbic acid, tocopherol or pyrrolidones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/19—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles lyophilised, i.e. freeze-dried, solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/06—Antigout agents, e.g. antihyperuricemic or uricosuric agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P33/00—Antiparasitic agents
- A61P33/02—Antiprotozoals, e.g. for leishmaniasis, trichomoniasis, toxoplasmosis
- A61P33/06—Antimalarials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Diabetes (AREA)
- Physical Education & Sports Medicine (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Dermatology (AREA)
- Oncology (AREA)
- Rheumatology (AREA)
- Pulmonology (AREA)
- Communicable Diseases (AREA)
- Cardiology (AREA)
- Endocrinology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Pain & Pain Management (AREA)
- Tropical Medicine & Parasitology (AREA)
- Virology (AREA)
- Heart & Thoracic Surgery (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
Description
a)表面プラズモン共鳴により測定した場合に1×10−3s−1以下のKoff速度定数でヒトTNFαから解離し;
b)配列番号3のアミノ酸配列を含むか、あるいは1、4、5、7もしくは8位の単一アラニン置換又は1、3、4、6、7、8及び/又は9位の1〜5カ所の保存アミノ酸置換により配列番号3から変異したアミノ酸配列を含む軽鎖CDR3ドメインをもち;
c)配列番号4のアミノ酸配列を含むか、あるいは2、3、4、5、6、8、9、10もしくは11位の単一アラニン置換又は2、3、4、5、6、8、9、10、11及び/又は12位の1〜5カ所の保存アミノ酸置換により配列番号4から変異したアミノ酸配列を含む重鎖CDR3ドメインをもつ抗体、又はその抗原結合部分を含有する。別の態様では、本発明の製剤は5×10−4s−1以下のKoff速度定数でヒトTNFαから解離する抗体、又はその抗原結合部分を含有する。本発明の更に別の態様では、製剤は1×10−4s−1以下のKoff速度定数でヒトTNFαから解離する抗体、又はその抗原結合部分を含有する。
配列番号3のアミノ酸配列を含むか、あるいは1、4、5、7もしくは8位の単一アラニン置換又は1、3、4、6、7、8及び/又は9位の1〜5カ所の保存アミノ酸置換により配列番号3から変異したアミノ酸配列を含む軽鎖CDR3ドメインと、
配列番号4のアミノ酸配列を含むか、あるいは2、3、4、5、6、8、9、10もしくは11位の単一アラニン置換又は2、3、4、5、6、8、9、10、11及び/又は12位の1〜5カ所の保存アミノ酸置換により配列番号4から変異したアミノ酸配列を含む重鎖CDR3ドメインを含む抗体、又はその抗原結合部分を含有する液体水性医薬製剤を提供する。1態様では、液体水性医薬製剤はヒトTNFαと結合し、配列番号3、配列番号11、配列番号12、配列番号13、配列番号14、配列番号15、配列番号16、配列番号17、配列番号18、配列番号19、配列番号20、配列番号21、配列番号22、配列番号23、配列番号24、配列番号25、配列番号26から構成される群から選択されるアミノ酸配列を含むCDR3ドメインをもつ軽鎖可変領域(LCVR)又は配列番号4、配列番号27、配列番号28、配列番号29、配列番号30、配列番号31、配列番号32、配列番号33及び配列番号34から構成される群から選択されるアミノ酸配列を含むCDR3ドメインをもつ重鎖可変領域(HCVR)を含む抗体を含有する。本発明の別の態様では、抗体、又はその抗原結合部分はヒトTNFαと結合し、抗体D2E7又はその抗原結合部分である。
本発明を理解し易くするために、まず所定の用語を定義する。
本発明はpH約4〜約8および好ましくは少なくとも約18か月間の長い保存期間をもつ製剤を形成する緩衝液中に治療有効量の抗体を含有する液体水性医薬製剤に関する。別の態様では、本発明の液体水性医薬製剤は高い安定性をもつ。本発明の別の態様では、製剤は光に感受性でない。本発明の更に別の態様では、本発明の製剤は製剤の少なくとも3回の凍結/解凍サイクル後に安定に維持される。更に別の態様では、本発明の医薬製剤は単回使用sc注射用に適している。
本発明は当分野の公認製剤に比較して改善された性質をもつ製剤(例えば蛋白質製剤及び/又は抗体製剤)に関する。例えば、本発明の製剤は当分野の公認製剤に比較して改善された保存期間及び/又は安定性をもつ。好ましい側面では、本発明の製剤は蛋白質濃度が高く、例えば、約45mg/mlを上回る蛋白質濃度、約50mg/mlを上回る蛋白質濃度、約100mg/mlを上回る蛋白質濃度、又は約150mg/mlを上回る蛋白質濃度である。本発明の好ましい態様では、蛋白質は抗体である。別の好ましい態様では、抗体はD2E7である。本発明は更に例えば約45mg/mlを上回る濃度で治療用抗体を製剤化するために十分な量のポリオール、界面活性剤、及びpH約4〜8のクエン酸及び/又はリン酸を含む緩衝液系を含有する水性医薬組成物を提供する。
本発明の製剤は各々参考として本明細書に援用されている米国特許第6,090,382号及び6,258,562号に記載されているものと同様の適応症に使用することができ、これらの疾患については追って詳述する。
腫瘍壊死因子は敗血症の病態生理に関与することが立証されており、低血圧、心筋抑制、血管外漏出症候群、臓器壊死、毒性二次メディエーター放出刺激及び凝固カスケードの活性化等の生体作用がある(例えばTracey,K.J.and Cerami,A.(1994)Annu.Rev.Med.45:491−503;Russell,D and Thompson,R.C.(1993)Curr.Opin.Biotech.4:714−721参照)。従って、発明の製剤は敗血性ショック、内毒素性ショック、グラム陰性敗血症及び毒素性ショック症候群等のその臨床症状の任意のものにおいて敗血症を治療するために使用することができる。
腫瘍壊死因子は種々の自己免疫疾患の病態生理に関与することが示されている。例えば、TNFαはリウマチ様関節炎で組織炎症を活性化し、関節破壊の原因となることが示されている(例えばTracey and Cerami,前出;Arend,W.P.and Dayer,J−M.(1995)Arth.Rheum.38:151−160;Fava,R.A.ら(1993)Clin.Exp.Immunol.94:261−266参照)。TNFαは糖尿病で膵島細胞死を促進し、インスリン抵抗性を媒介することも示されている(例えばTracey and Cerami,前出;PCT公開第WO94/08609号参照)。TNFαは多発性硬化症で希突起膠細胞への細胞毒性を媒介し、炎症性プラークを誘導することも示されている(例えばTracey and Cerami,前出参照)。キメラ及びヒト化マウス抗hTNFα抗体がリウマチ様関節炎の治療で臨床試験されている(例えばElliott,M.J.ら(1994)Lancet 344:1125−1127;Elliot,M.J.ら(1994)Lancet 344:1105−1110;Rankin,E.C.ら(1995)Br.J.Rheumatol.34:334−342参照)。
腫瘍壊死因子は種々の感染性疾患で観察される生体作用を媒介することが示されている。例えば、TNFαはマラリアで脳炎症と毛細血管血栓症及び梗塞を媒介することが示されている(例えばTracey and Cerami,前出参照)。TNFαは髄膜炎で脳炎症を媒介し、血液脳関門の損傷を誘導し、敗血性ショック症候群を誘発し、静脈梗塞を活性化することも示されている(例えばTracey and Cerami,前出参照)。TNFαは後天性免疫不全症候群(AIDS)で悪液質を誘導し、ウイルス増殖を刺激し、中枢神経系損傷を媒介することも示されている(例えばTracey and Cerami,前出参照)。従って、本発明の抗体、及び抗体部分は細菌性髄膜炎(例えばヨーロッパ特許出願公開第EP585 705号参照)、脳マラリア、AIDS及びAIDS関連症候群(ARC)(例えばヨーロッパ特許出願公開第EP230 574号参照)、並びに移植に続発するサイトメガロウイルス感染(例えばFietze,E.ら(1994)Transplantation 58:675−680参照)等の感染性疾患の治療に使用することができる。本発明の製剤は感染による発熱や筋肉痛(例えばインフルエンザ)及び感染に続発(例えばAIDS又はARCに続発)する悪液質等の感染性疾患に伴う症状を緩和するためにも使用することができる。
腫瘍壊死因子は同種移植拒絶反応と移植片対宿主疾患(GVHD)の主要メディエーターであり、T細胞受容体CD3複合体に対するラット抗体OKT3を使用して腎移植拒絶反応を抑制する場合に観察された有害反応を媒介することが示されている(例えばTracey and Cerami,前出;Eason,J.D.ら(1995)Transplantation 59:300−305;Suthanthiran,M.and Strom,T.B.(1994)New Engl.J.Med.331:365−375参照)。従って、本発明の製剤は同種移植及び異種移植拒絶反応等の移植拒絶反応を抑制したり、GVHDを抑制するために使用することができる。抗体又は抗体部分は単独で使用してもよいが、同種移植に対する免疫応答を抑制又はGVHDを抑制する1種以上の他の物質と併用するとより好ましい。例えば、1態様では、本発明の製剤をOKT3と併用し、OKT3により誘導される反応を抑制する。別の態様では、細胞表面分子CD25(インターロイキン−2受容体−α)、CD11a(LFA−1)、CD54(ICAM−1)、CD4、CD45、CD28/CTLA4、CD80(B7−1)及び/又はCD86(B7−2)等の免疫応答の調節に関与する他のターゲットに対する1種以上の抗体と本発明の製剤を併用する。更に別の態様では、シクロスポリンA又はFK506等の1種以上の汎用免疫抑制剤と本発明の製剤を併用する。
腫瘍壊死因子は悪性腫瘍で悪液質を誘導し、腫瘍増殖を刺激し、転移能力を増強し、細胞毒性を媒介することが示されている(例えばTracey and Cerami,前出参照)。従って、本発明の製剤は腫瘍増殖又は転移を抑制するため及び/又は悪性腫瘍に続発する悪液質を緩和するために悪性腫瘍の治療で使用することができる。製剤は全身又は腫瘍部位に局所投与することができる。
腫瘍壊死因子は白血球−内皮細胞活性化の刺激、肺細胞に対する細胞毒性の誘導及び血管外漏出症候群の誘導等の成人呼吸窮迫症候群の病態生理に関与することが示されてい(例えばTracey and Cerami,前出参照)。従って、本発明の製剤は成人呼吸窮迫症候群(例えばPCT公開第WO91/04054号参照)、ショック肺、慢性肺炎症性疾患、肺サルコイドーシス、肺線維症及び珪肺症等の各種肺疾患を治療するために使用することができる。製剤は全身又は例えばエアゾールとして肺表面に局所投与することができる。
腫瘍壊死因子は炎症性腸疾患の病態生理に関与することが示されている(例えばTracy,K.J.ら(1986)Science 234:470−474;Sun,X−M.ら(1988)J.Clin.Invest.81:1328−1331;MacDonald,T.T.ら(1990)Clin.Exp.Immunol.81:301−305参照)。キメラマウス抗hTNFα抗体がクローン病の治療で臨床試験されている(van Dullemen,H.M.ら(1995)Gastroenterology 109:129−135)。本発明の製剤はクローン病と潰瘍性大腸炎の2種の症候群を含む特発性炎症性腸疾患等の腸疾患を治療するためにも使用することができる。
本発明の製剤は心臓虚血(例えばヨーロッパ特許出願公開第EP453 898号参照)や心不全(心筋衰弱)(例えばPCT公開第WO94/20139号参照)等の各種心疾患を治療するためにも使用することができる。
本発明の医薬製剤はTNFα活性が有害となる他の各種疾患を治療するためにも使用することができる。TNFα活性が病態生理に関与することが示されており、従って、本発明の製剤を使用して治療することができる他の疾病及び疾患の例としては炎症性骨疾患及び骨吸収疾患(例えば、Bertolini,D.R.ら(1986)Nature 319:516−518;Konig,A.ら(1988)J.Bone Miner.Res.3:621−627;Lerner,U.H.and Ohlin,A.(1993)J.Bone Miner.Res.8:147−155;及びShankar,G.and Stern,P.H.(1993)Bone 14:871−876参照);アルコール性肝炎(例えばMcClain,C.J.and Cohen,D.A.(1989)Hepatology 9:349−351;Felver,M.E.ら(1990)Alcohol.Clin.Exp.Res.14:255−259;及びHansen,J.ら(1994)Hepatology 20:461−474参照)及びウイルス性肝炎(Sheron,N.ら(1991)J.Hepatol.12:241−245;及びHussain,M.J.ら(1994)J.Clin.Pathol.47:1112−1115)等の肝炎;凝固障害(例えばvan der Poll,T.ら(1990)N.Engl.J.Med.322:1622−1627;及びvan der Poll,T.ら(1991)Prog.Clin.Biol.Res.367:55−60参照);火傷(例えばGiroir,B.P.ら(1994)Am.J.Physiol.267:H118−124;及びLiu,X.S.ら(1994)Burns 20:40−44参照);再潅流傷害(例えばScales,W.E.ら(1994)Am.J.Physiol.267:G1122−1127;Serrick,C.ら(1994)Transplantation 58:1158−1162;及びYao,Y.M.ら(1995)Resuscitation 29:157−168参照);ケロイド形成(例えばMcCauley,R.L.ら(1992)J.Clin.Immunol.12:300−308参照);瘢痕組織形成;発熱;歯周病;肥満症及び放射線中毒が挙げられる。
以下のプロトコールに従って本発明の医薬製剤を製造した。
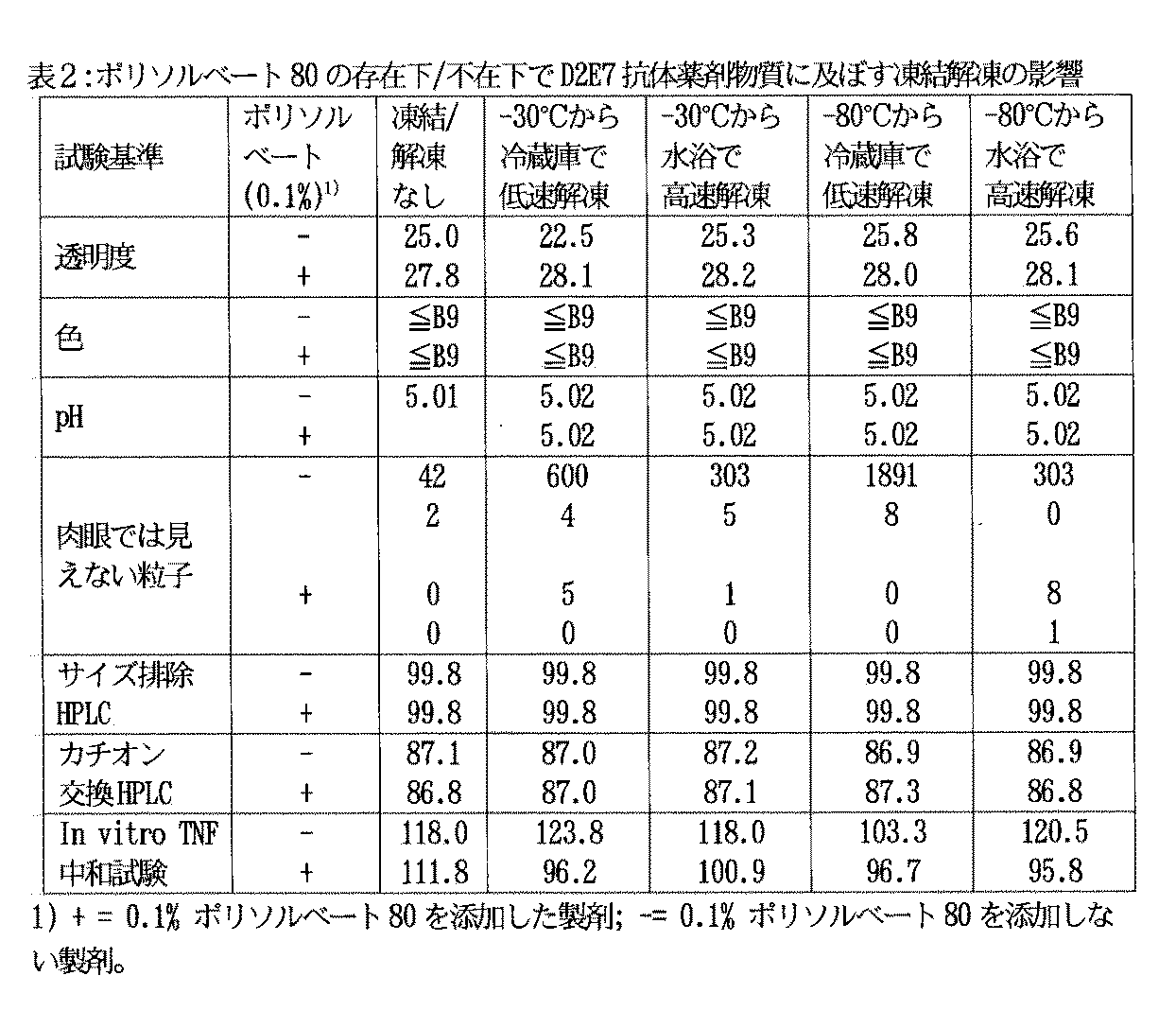
以下の成分:マンニトール240.0g、クエン酸1水和物26.1g、クエン酸ナトリウム6.1g、リン酸2ナトリウム2水和物30.6g、リン酸2水素ナトリウム2水和物17.2g、塩化ナトリウム123.3g、ポリソルベート80 20.0g、及び水19,715.7〜19,716.1gを配量した。
濾過した緩衝液を次に、以下のように製造した解凍プール抗体濃縮物(医薬製剤の活性成分)に加えた。抗体(濃縮物)は医薬製剤の製造前に水浴で解凍した。抗体濃縮物34.207g(蛋白質濃縮物中蛋白質濃度60mg/mLの蛋白質2.0kgに等価)を使用した。濃縮物の密度は1.0262g/mLとした。25.655〜37.316(蛋白質濃縮物中蛋白質濃度55〜80mg/mLに等価)の範囲の任意蛋白質濃縮物を使用することができる。バルク溶液の最終重量に達するまで撹拌下に緩衝液を加えた。
D2E7抗体用製剤緩衝液を選択した後に、薬剤物質を最終製剤と同一マトリックスで製剤化した。
製剤が微生物増殖を助長できるか否かを調べるために試験を実施した。これらの実験の結果、製剤は20〜25℃で14日間保存した場合に微生物増殖を助長しないことが判明した。この結果は滅菌製剤に微生物(例えばStaphylococous aureus,ATCC−No.:6538P,Candida albicans,ATCC−No.:10231,Aspergillus niger,ATCCC−No.:16404,Pseudomonas aeruginosa,ATCC−No.:9027,環境単離株)を低レベル(NMT100cfu/mL)で直接接種することにより判定した。その後、接種した製剤の総合微生物増殖(例えば濁度変化)を試験した。濁度が認められなければ総合増殖がないという基準で14日後に接種容器で検出した。更に、これらの容器から生物を再単離することはできなかった。従って、製剤はこれらの条件下で微生物増殖を助長しないと結論された。
本明細書に引用する全文献及び特許の内容は、全体を参考として本明細書に援用している。
本明細書に記載する本発明の特定態様の多数の等価物が当業者に自明であるか、又は単なる日常的実験を使用して確認することができよう。このような等価物も特許請求の範囲に含むものとする。
Claims (9)
- ヒト腫瘍壊死因子α(TNFα)抗体又はその抗原結合部分を含む安定な液体水性医薬製剤であって、
(a)配列番号1のアミノ酸配列を含む軽鎖可変領域と配列番号2のアミノ酸配列を含む重鎖可変領域を含む濃度が40〜75mg/mlの前記TNFα抗体又はその抗原結合部分、
(b)(i)1.0〜1.5mg/mlのクエン酸1水和物
(ii)0.25〜0.5mg/mlのクエン酸ナトリウム
(iii)1.25〜1.75mg/mlのリン酸2ナトリウム2水和物
(iv)0.7〜1.1mg/mlのリン酸2水素ナトリウム2水和物
(v)6.0〜6.4mg/mlの塩化ナトリウム
を含むクエン酸及びリン酸を含む緩衝液、
(c)10〜14mg/mlのマンニトール
(d)0.1〜5.0mg/mlのポリソルベート80
を含み、pHが4〜8であり、前記抗体又はその抗原結合部分が、表面プラズモン共鳴により測定した場合に1×10−8M以下のKd及び1×10−3s−1以下のKoff速度定数でヒトTNFαから解離し、標準in vitro L929アッセイにおいて1×10−7M以下のIC50でヒトTNFα細胞毒性を中和することを特徴とする前記安定な液体水性医薬製剤。 - 前記抗体濃度が50mg/mlである請求項1に記載の液体水性医薬製剤。
- 単回使用皮下注射用に適している請求項1に記載の液体水性医薬製剤。
- 抗体又はその抗原結合部分が、抗体D2E7又はその抗原結合部分である請求項1に記載の液体水性医薬製剤。
- 抗体又はその抗原結合部分が、組換え抗体又はその抗原結合部分である請求項1に記載の液体水性医薬製剤。
- 抗体又はその抗原結合部分が、ヒトTNFα、チンパンジーTNFα並びにヒヒTNFα、マーモセットTNFα、カニクイザルTNFα及びアカゲザルTNFαの活性を中和する請求項1に記載の液体水性医薬製剤。
- 抗体又はその抗原結合部分が、更にマウスTNFα及び/又はブタTNFαの活性を中和する請求項1に記載の液体水性医薬製剤。
- TNFα活性が有害となる疾患に罹患している被験体を治療するための製剤の製造において請求項1に記載の液体水性医薬製剤の使用。
- (a)少なくとも18か月間の保存期間をもつ液体水性医薬製剤;
(b)液体状態で少なくとも18か月間の保存期間をもつ水性医薬製剤;
(c)製剤の少なくとも3回の凍結/解凍サイクル後に安定性を維持する液体水性医薬製剤;
(d)2〜8℃の温度で少なくとも12か月間の高い安定性をもつ液体水性医薬製剤;及び
(e)少なくとも14日間無菌状態である液体水性医薬製剤;
からなる群から選択される少なくとも一つの特徴を持っている請求項1に記載の安定な液体水性医薬製剤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/222,140 US20040033228A1 (en) | 2002-08-16 | 2002-08-16 | Formulation of human antibodies for treating TNF-alpha associated disorders |
| US10/222,140 | 2002-08-16 | ||
| PCT/IB2003/004502 WO2004016286A2 (en) | 2002-08-16 | 2003-08-15 | Pharmaceutical anti-tnf-alpha antibody formulation |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011204759A Division JP5608619B2 (ja) | 2002-08-16 | 2011-09-20 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2006511457A JP2006511457A (ja) | 2006-04-06 |
| JP2006511457A5 JP2006511457A5 (ja) | 2010-07-08 |
| JP4925582B2 true JP4925582B2 (ja) | 2012-04-25 |
Family
ID=31714885
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004528780A Expired - Lifetime JP4925582B2 (ja) | 2002-08-16 | 2003-08-15 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2011204759A Expired - Lifetime JP5608619B2 (ja) | 2002-08-16 | 2011-09-20 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2013235924A Pending JP2014074034A (ja) | 2002-08-16 | 2013-11-14 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2015099796A Withdrawn JP2015199741A (ja) | 2002-08-16 | 2015-05-15 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2017074982A Pending JP2017165736A (ja) | 2002-08-16 | 2017-04-05 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011204759A Expired - Lifetime JP5608619B2 (ja) | 2002-08-16 | 2011-09-20 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2013235924A Pending JP2014074034A (ja) | 2002-08-16 | 2013-11-14 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2015099796A Withdrawn JP2015199741A (ja) | 2002-08-16 | 2015-05-15 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
| JP2017074982A Pending JP2017165736A (ja) | 2002-08-16 | 2017-04-05 | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 |
Country Status (26)
| Country | Link |
|---|---|
| US (27) | US20040033228A1 (ja) |
| EP (5) | EP2363144A1 (ja) |
| JP (5) | JP4925582B2 (ja) |
| KR (4) | KR101273568B1 (ja) |
| CN (4) | CN102049045B (ja) |
| AR (2) | AR040881A1 (ja) |
| AT (1) | ATE555809T1 (ja) |
| AU (1) | AU2003267744C1 (ja) |
| BR (1) | BR0313492A (ja) |
| CA (9) | CA2494756C (ja) |
| CL (1) | CL2010000603A1 (ja) |
| CY (2) | CY1113353T1 (ja) |
| DK (2) | DK2359856T3 (ja) |
| ES (2) | ES2636692T3 (ja) |
| IL (2) | IL166809A (ja) |
| MX (1) | MXPA05001841A (ja) |
| MY (4) | MY162068A (ja) |
| NZ (1) | NZ538030A (ja) |
| PE (1) | PE20040994A1 (ja) |
| PL (3) | PL212934B1 (ja) |
| PT (2) | PT1528933E (ja) |
| SI (2) | SI2359856T1 (ja) |
| TW (1) | TWI331532B (ja) |
| UY (1) | UY27940A1 (ja) |
| WO (1) | WO2004016286A2 (ja) |
| ZA (1) | ZA200501032B (ja) |
Families Citing this family (248)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| ATE239041T1 (de) * | 1996-02-09 | 2003-05-15 | Basf Ag | Humane antikörper welche an humanen tnfalpha binden |
| CA2385745C (en) | 2001-06-08 | 2015-02-17 | Abbott Laboratories (Bermuda) Ltd. | Methods of administering anti-tnf.alpha. antibodies |
| US20160279239A1 (en) | 2011-05-02 | 2016-09-29 | Immunomedics, Inc. | Subcutaneous administration of anti-cd74 antibody for systemic lupus erythematosus and autoimmune disease |
| US20040009172A1 (en) * | 2002-04-26 | 2004-01-15 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| US20040002451A1 (en) * | 2002-06-20 | 2004-01-01 | Bruce Kerwin | Compositions of pegylated soluble tumor necrosis factor receptors and methods of preparing |
| US20090280065A1 (en) * | 2006-04-10 | 2009-11-12 | Willian Mary K | Uses and Compositions for Treatment of Psoriasis |
| CN101745112A (zh) * | 2002-07-19 | 2010-06-23 | 艾博特生物技术有限公司 | TNFα相关疾病的治疗 |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| MY150740A (en) * | 2002-10-24 | 2014-02-28 | Abbvie Biotechnology Ltd | Low dose methods for treating disorders in which tnf? activity is detrimental |
| JP4728948B2 (ja) * | 2003-02-10 | 2011-07-20 | エラン ファーマシューティカルズ,インコーポレイテッド | 免疫グロブリン製剤およびその調製の方法 |
| EP1712240B1 (en) * | 2003-12-25 | 2015-09-09 | Kyowa Hakko Kirin Co., Ltd. | Stable water-based medicinal preparation containing antibody |
| TWI556829B (zh) * | 2004-04-09 | 2016-11-11 | 艾伯維生物技術有限責任公司 | 用於治療TNFα相關失調症之多重可變劑量療法 |
| GB0414054D0 (en) | 2004-06-23 | 2004-07-28 | Owen Mumford Ltd | Improvements relating to automatic injection devices |
| TW200621282A (en) | 2004-08-13 | 2006-07-01 | Wyeth Corp | Stabilizing formulations |
| WO2006041970A2 (en) * | 2004-10-08 | 2006-04-20 | Abbott Biotechnology Ltd. | Treatment of respiratory syncytial virus (rsv) infection |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| GT200600031A (es) | 2005-01-28 | 2006-08-29 | Formulacion anticuerpo anti a beta | |
| US20160355591A1 (en) | 2011-05-02 | 2016-12-08 | Immunomedics, Inc. | Subcutaneous anti-hla-dr monoclonal antibody for treatment of hematologic malignancies |
| EP1870458B1 (en) | 2005-03-31 | 2018-05-09 | Chugai Seiyaku Kabushiki Kaisha | sc(Fv)2 STRUCTURAL ISOMERS |
| WO2006125229A2 (en) * | 2005-05-16 | 2006-11-23 | Abbott Biotechnology Ltd. | Use of tnf inhibitor for treatment of erosive polyarthritis |
| WO2006125207A2 (en) * | 2005-05-19 | 2006-11-23 | Amgen Inc. | Compositions and methods for increasing the stability of antibodies |
| KR101360671B1 (ko) | 2005-06-10 | 2014-02-07 | 추가이 세이야쿠 가부시키가이샤 | sc(Fv)2를 함유하는 의약조성물 |
| ES2776657T3 (es) * | 2005-06-14 | 2020-07-31 | Amgen Inc | Formulaciones de proteínas autotamponantes |
| BRPI0611800A2 (pt) * | 2005-06-15 | 2008-12-09 | Schering Corp | formulaÇço estÁvel de anticorpo |
| US20070041905A1 (en) * | 2005-08-19 | 2007-02-22 | Hoffman Rebecca S | Method of treating depression using a TNF-alpha antibody |
| TWI424161B (zh) | 2005-11-01 | 2014-01-21 | Abbvie Biotechnology Ltd | 利用生物標記診斷關節黏連脊椎炎之方法及組合物 |
| EP1798504A1 (en) * | 2005-12-19 | 2007-06-20 | Koninklijke Philips Electronics N.V. | Method of making dried particles |
| US9309316B2 (en) | 2005-12-20 | 2016-04-12 | Bristol-Myers Squibb Company | Stable subcutaneous protein formulations and uses thereof |
| TWI392684B (zh) * | 2006-04-05 | 2013-04-11 | 亞培生物科技公司 | 抗體之純化 |
| US20090317399A1 (en) * | 2006-04-10 | 2009-12-24 | Pollack Paul F | Uses and compositions for treatment of CROHN'S disease |
| EP2666472A3 (en) | 2006-04-10 | 2014-04-02 | Abbott Biotechnology Ltd | Uses and compositions for treatment of psoriatic arthritis |
| US20080118496A1 (en) * | 2006-04-10 | 2008-05-22 | Medich John R | Uses and compositions for treatment of juvenile rheumatoid arthritis |
| CA2564435A1 (en) | 2006-04-10 | 2007-10-10 | Abbott Biotechnology Ltd. | Methods for monitoring and treating intestinal disorders |
| US9605064B2 (en) * | 2006-04-10 | 2017-03-28 | Abbvie Biotechnology Ltd | Methods and compositions for treatment of skin disorders |
| EP2703010A3 (en) | 2006-04-10 | 2014-08-06 | AbbVie Biotechnology Ltd | Uses and compositions for treatment of rheumatoid arthritis |
| WO2007120656A2 (en) * | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of rheumatoid arthritis |
| WO2007120626A2 (en) | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of ankylosing spondylitis |
| US20080131374A1 (en) * | 2006-04-19 | 2008-06-05 | Medich John R | Uses and compositions for treatment of rheumatoid arthritis |
| US20080311043A1 (en) * | 2006-06-08 | 2008-12-18 | Hoffman Rebecca S | Uses and compositions for treatment of psoriatic arthritis |
| US20100021451A1 (en) | 2006-06-08 | 2010-01-28 | Wong Robert L | Uses and compositions for treatment of ankylosing spondylitis |
| KR101396797B1 (ko) | 2006-06-30 | 2014-05-26 | 애브비 바이오테크놀로지 리미티드 | 자동 주사 장치 |
| JP5631591B2 (ja) * | 2006-10-06 | 2014-11-26 | アムジエン・インコーポレーテツド | 安定な抗体製剤 |
| MX2009003982A (es) * | 2006-10-20 | 2009-04-27 | Amgen Inc | Formulaciones de polipeptido estables. |
| CN104072612A (zh) | 2006-10-27 | 2014-10-01 | 艾伯维生物技术有限公司 | 结晶型抗-hTNFα抗体 |
| BRPI0809209A2 (pt) | 2007-03-29 | 2014-09-02 | Abbott Lab | Anticorpos il-12 anti-humanos cristalinos |
| EP2131834A2 (en) * | 2007-04-11 | 2009-12-16 | Alcon Research, Ltd. | Use of an inhibitor of tnfa plus an antihistamine to treat allergic rhinitis and allergic conjunctivitis |
| US8092998B2 (en) * | 2007-05-31 | 2012-01-10 | Abbott Laboratories | Biomarkers predictive of the responsiveness to TNFα inhibitors in autoimmune disorders |
| US8999337B2 (en) * | 2007-06-11 | 2015-04-07 | Abbvie Biotechnology Ltd. | Methods for treating juvenile idiopathic arthritis by inhibition of TNFα |
| US20090110679A1 (en) * | 2007-07-13 | 2009-04-30 | Luk-Chiu Li | Methods and compositions for pulmonary administration of a TNFa inhibitor |
| CN101980722A (zh) | 2007-08-08 | 2011-02-23 | 雅培制药有限公司 | 结晶抗体的组合物和方法 |
| KR20210049186A (ko) * | 2007-11-30 | 2021-05-04 | 애브비 바이오테크놀로지 리미티드 | 단백질 제형 및 이의 제조방법 |
| US8883146B2 (en) | 2007-11-30 | 2014-11-11 | Abbvie Inc. | Protein formulations and methods of making same |
| EP2235059B1 (en) | 2007-12-26 | 2015-02-18 | Xencor, Inc. | Fc variants with altered binding to fcrn |
| WO2009083225A2 (en) * | 2007-12-28 | 2009-07-09 | Biolnvent International Ab | Formulation |
| WO2009083246A1 (en) * | 2007-12-31 | 2009-07-09 | Bayer Schering Pharma Aktiengesellschaft | Antibodies to tnf alpha |
| MX2010007393A (es) * | 2008-01-03 | 2010-11-09 | Abbott Biotech Ltd | Anticipacion de eficacia a largo plazo de un compuesto en el tratamiento de psoriasis. |
| RU2537139C2 (ru) | 2008-01-15 | 2014-12-27 | Эбботт Гмбх Унд Ко.Кг | Порошковые белковые композиции и способы их получения |
| AU2009241589B2 (en) | 2008-04-29 | 2013-10-10 | Abbvie Inc. | Dual variable domain immunoglobulins and uses thereof |
| US9109026B2 (en) | 2008-06-03 | 2015-08-18 | Abbvie, Inc. | Dual variable domain immunoglobulins and uses thereof |
| EP3002299A1 (en) | 2008-06-03 | 2016-04-06 | AbbVie Inc. | Dual variable domain immunoglobulins and uses thereof |
| TW201012475A (en) | 2008-07-08 | 2010-04-01 | Abbott Lab | Prostaglandin E2 dual variable domain immunoglobulins and uses thereof |
| CA2742791A1 (en) * | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| JO3672B1 (ar) | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| TWI559930B (en) | 2009-04-16 | 2016-12-01 | Abbvie Biotherapeutics Inc | Anti-tnf-α antibodies and their uses |
| CA2760237C (en) | 2009-04-29 | 2017-11-14 | Abbott Biotechnology Ltd. | Automatic injection device and plunger for same |
| SG10201401995UA (en) * | 2009-05-04 | 2014-08-28 | Abbvie Biotechnology Ltd | Stable high protein concentration formulations of human anti-tnf-alpha-antibodies |
| US8221753B2 (en) | 2009-09-30 | 2012-07-17 | Tracon Pharmaceuticals, Inc. | Endoglin antibodies |
| WO2011029823A1 (en) | 2009-09-09 | 2011-03-17 | Novartis Ag | Monoclonal antibody reactive with cd63 when expressed at the surface of degranulated mast cells |
| BR112012007091A2 (pt) * | 2009-10-01 | 2016-04-19 | Alcon Res Ltd | composições de olopatadina e seus usos |
| BR112012008833A2 (pt) | 2009-10-15 | 2015-09-08 | Abbott Lab | imunoglobulinas de dominio variavel duplo e usos das mesmas |
| UY32979A (es) | 2009-10-28 | 2011-02-28 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| JP5940981B2 (ja) * | 2009-12-15 | 2016-06-29 | アッヴィ バイオテクノロジー リミテッド | 自動注射装置のための改善された作動ボタン |
| EP2513144A1 (en) | 2009-12-16 | 2012-10-24 | Philip Bosch | Methods of treating interstitial cystitis |
| FR2958646B1 (fr) * | 2010-04-07 | 2012-05-18 | Adocia | Polysaccharides comportant des groupes fonctionnels carboxyles substitues par un derive d'acide hydrophobe. |
| AU2011219715B2 (en) | 2010-02-26 | 2014-12-11 | Novo Nordisk A/S | Stable antibody containing compositions |
| ES2765418T3 (es) | 2010-03-01 | 2020-06-09 | Bayer Healthcare Llc | Anticuerpos monoclonales optimizados contra el inhibidor de la ruta del factor tisular (TFPI) |
| BR112012023421B1 (pt) | 2010-03-17 | 2021-09-14 | Novaliq Gmbh | Composição farmacêutica para tratamento de aumento de pressão intraocular |
| ES2727275T3 (es) | 2010-04-21 | 2019-10-15 | Abbvie Biotechnology Ltd | Dispositivo automático de inyección portátil para la liberación controlada de agentes terapéuticos |
| JP6294075B2 (ja) | 2010-05-28 | 2018-03-14 | ノヴォ ノルディスク アー/エス | 抗体及び防腐剤を含む安定した多用量組成物 |
| MX2012014080A (es) | 2010-06-03 | 2013-05-01 | Abbvie Biotechnology Ltd | Usos y composiciones para el tratamiento de hidradenitis superativa (hs). |
| NZ607480A (en) | 2010-08-03 | 2014-10-31 | Abbott Lab | Dual variable domain immunoglobulins and uses thereof |
| PH12013500337A1 (en) | 2010-08-26 | 2017-08-23 | Abbvie Inc | Dual variable domain immunoglobulins and uses thereof |
| WO2012045703A1 (en) | 2010-10-05 | 2012-04-12 | Novartis Ag | Anti-il12rbeta1 antibodies and their use in treating autoimmune and inflammatory disorders |
| EP2444063A1 (en) | 2010-10-20 | 2012-04-25 | Novaliq GmbH | Liquid pharmaceutical compositions for the delivery of active ingredients |
| LT2637690T (lt) * | 2010-11-11 | 2016-10-25 | Abbvie Biotechnology Ltd | Didelės koncentracijos anti-tnfalfa antikūno skystos kompozicijos |
| EP2471554A1 (en) | 2010-12-28 | 2012-07-04 | Hexal AG | Pharmaceutical formulation comprising a biopharmaceutical drug |
| BR112013018905B1 (pt) | 2011-01-24 | 2021-07-13 | Abbvie Biotechnology Ltd | Dispositivos de injeção automática que têm superfícies de pega sobremoldadas. |
| BR112013018877A2 (pt) | 2011-01-28 | 2016-10-04 | Sanofi Sa | composições farmacêuticas que compreendem anticorpos humanos para pcsk9 |
| EP2676677B1 (en) * | 2011-02-17 | 2019-05-22 | Kyowa Hakko Kirin Co., Ltd. | Highly concentrated anti-cd40 antibody pharmaceutical preparation |
| JP2014510730A (ja) | 2011-03-16 | 2014-05-01 | サノフイ | デュアルv領域抗体様タンパク質の使用 |
| WO2012149197A2 (en) | 2011-04-27 | 2012-11-01 | Abbott Laboratories | Methods for controlling the galactosylation profile of recombinantly-expressed proteins |
| KR102014512B1 (ko) | 2011-05-02 | 2019-08-26 | 밀레니엄 파머슈티컬스 인코퍼레이티드 | 항-α4β7 항체에 대한 제형 |
| AU2012250924B2 (en) * | 2011-05-02 | 2017-05-25 | Immunomedics, Inc. | Ultrafiltration concentration of allotype selected antibodies for small-volume administration |
| US8926980B2 (en) | 2011-07-11 | 2015-01-06 | Camas Incorporated | Compositions against bacterial toxins |
| GB201112429D0 (en) | 2011-07-19 | 2011-08-31 | Glaxo Group Ltd | Antigen-binding proteins with increased FcRn binding |
| AR087305A1 (es) | 2011-07-28 | 2014-03-12 | Regeneron Pharma | Formulaciones estabilizadas que contienen anticuerpos anti-pcsk9, metodo de preparacion y kit |
| EP4088736A1 (en) | 2011-10-25 | 2022-11-16 | Prothena Biosciences Limited | Humanized anti-amyloid antibody formulations and methods |
| CA2861610A1 (en) | 2011-12-30 | 2013-07-04 | Abbvie Inc. | Dual specific binding proteins directed against il-13 and/or il-17 |
| CN104066442B (zh) | 2012-01-23 | 2018-05-18 | 诺瓦利克有限责任公司 | 基于半氟化烷烃的稳定蛋白质组合物 |
| WO2013164837A1 (en) * | 2012-03-07 | 2013-11-07 | Cadila Healthcare Limited | Pharmaceutical formulations of tnf-alpha antibodies |
| US9592289B2 (en) | 2012-03-26 | 2017-03-14 | Sanofi | Stable IgG4 based binding agent formulations |
| ES2702246T3 (es) * | 2012-03-26 | 2019-02-28 | Sanofi Sa | Formulaciones de agente de unión IgG4 estables |
| US9150645B2 (en) | 2012-04-20 | 2015-10-06 | Abbvie, Inc. | Cell culture methods to reduce acidic species |
| US9181572B2 (en) | 2012-04-20 | 2015-11-10 | Abbvie, Inc. | Methods to modulate lysine variant distribution |
| US9067990B2 (en) | 2013-03-14 | 2015-06-30 | Abbvie, Inc. | Protein purification using displacement chromatography |
| WO2013176754A1 (en) | 2012-05-24 | 2013-11-28 | Abbvie Inc. | Novel purification of antibodies using hydrophobic interaction chromatography |
| US20150150982A1 (en) * | 2012-06-12 | 2015-06-04 | Boehringer Ingelheim International Gmbh | Pharmaceutical formulation for a therapeutic antibody |
| FR2994390B1 (fr) | 2012-08-10 | 2014-08-15 | Adocia | Procede d'abaissement de la viscosite de solutions de proteines a concentration elevee |
| US9592297B2 (en) | 2012-08-31 | 2017-03-14 | Bayer Healthcare Llc | Antibody and protein formulations |
| US9512214B2 (en) | 2012-09-02 | 2016-12-06 | Abbvie, Inc. | Methods to control protein heterogeneity |
| HK1211981A1 (en) | 2012-09-02 | 2016-06-03 | Abbvie Inc. | Methods to control protein heterogeneity |
| UA115789C2 (uk) | 2012-09-05 | 2017-12-26 | Трейкон Фармасутікалз, Інк. | Композиція антитіла до cd105 та її застосування |
| PT2892550T (pt) | 2012-09-07 | 2020-03-27 | Coherus Biosciences Inc | Formulações aquosas estáveis de adalimumab |
| EP3100722B1 (en) | 2012-09-12 | 2024-03-20 | Novaliq GmbH | Semifluorinated alkanes for use in solubilizing meibum |
| EP4342537A3 (en) | 2012-09-12 | 2024-07-03 | Novaliq GmbH | Semifluorinated alkane compositions |
| WO2014064637A1 (en) * | 2012-10-26 | 2014-05-01 | Lupin Limited | Stable pharmaceutical composition of tnfr:fc fusion protein |
| TW201811825A (zh) | 2012-11-01 | 2018-04-01 | 美商艾伯維有限公司 | 抗-vegf/dll4雙重可變區域免疫球蛋白及其用途 |
| UA117466C2 (uk) | 2012-12-13 | 2018-08-10 | Мерк Шарп Енд Доме Корп. | СТАБІЛЬНИЙ СКЛАД У ВИГЛЯДІ РОЗЧИНУ АНТИТІЛА ДО IL-23p19 |
| WO2014099636A1 (en) * | 2012-12-18 | 2014-06-26 | Merck Sharp & Dohme Corp. | Liquid formulations for an anti-tnf alpha antibody |
| CN102988984B (zh) * | 2012-12-21 | 2015-05-20 | 嘉和生物药业有限公司 | 增强稳定性的抗TNF-α人单克隆抗体的含水药物制剂 |
| KR20150110659A (ko) * | 2013-01-24 | 2015-10-02 | 글락소스미스클라인 인털렉츄얼 프로퍼티 디벨로프먼트 리미티드 | Tnf-알파 항원-결합 단백질 |
| WO2015198217A2 (en) | 2013-02-08 | 2015-12-30 | Novartis Ag | Compositions and methods for long-acting antibodies targeting il-17 |
| BR112015017338B1 (pt) | 2013-02-08 | 2022-11-29 | Novartis Ag | Anticorpo humano terapêutico isolado ou sua porção de ligação ao antígeno do mesmo, seu uso e seu processo de produção, composição farmacêutica, molécula de ácido nucleico isolada, vetor de clonagem ou de expressão e micro-organismo transgênico |
| SG11201507230PA (en) | 2013-03-12 | 2015-10-29 | Abbvie Inc | Human antibodies that bind human tnf-alpha and methods of preparing the same |
| AU2013384204B2 (en) | 2013-03-14 | 2017-03-16 | Abbvie Inc. | Low acidic species compositions and methods for producing and using the same |
| US9017687B1 (en) | 2013-10-18 | 2015-04-28 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same using displacement chromatography |
| CA2899449A1 (en) | 2013-03-14 | 2014-10-02 | Abbvie Inc. | Low acidic species compositions and methods for producing the same using displacement chromatography |
| US8921526B2 (en) | 2013-03-14 | 2014-12-30 | Abbvie, Inc. | Mutated anti-TNFα antibodies and methods of their use |
| WO2014151878A2 (en) | 2013-03-14 | 2014-09-25 | Abbvie Inc. | Methods for modulating protein glycosylation profiles of recombinant protein therapeutics using monosaccharides and oligosacharides |
| CA2904448A1 (en) | 2013-03-15 | 2014-09-18 | Tariq Ghayur | Dual specific binding proteins directed against il-1.beta. and/or il-17 |
| WO2014141149A1 (en) * | 2013-03-15 | 2014-09-18 | Glaxosmithkline Intellectual Property (No.2) Limited | Formulations with reduced viscosity |
| AU2014233528B2 (en) | 2013-03-15 | 2019-02-28 | Abbvie Biotherapeutics Inc. | Fc variants |
| CN103446583B (zh) * | 2013-03-21 | 2015-11-18 | 百奥泰生物科技(广州)有限公司 | 一种治疗TNF-α相关疾病的人抗体制剂 |
| TWI679019B (zh) | 2013-04-29 | 2019-12-11 | 法商賽諾菲公司 | 抗il-4/抗il-13之雙特異性抗體調配物 |
| EP3003369A4 (en) * | 2013-05-28 | 2017-04-26 | Momenta Pharmaceuticals, Inc. | Pharmaceutical compositions comprising pyrophosphate |
| HK1214531A1 (zh) * | 2013-06-24 | 2016-07-29 | 豪夫迈.罗氏有限公司 | 稳定的静脉内制剂 |
| RU2662558C2 (ru) | 2013-07-19 | 2018-07-26 | Хексаль Аг | Способы и композиции, которые обеспечивают модуляцию иммунных ответов, связанных с введением биофармацевтического лекарственного средства |
| AU2014295052B2 (en) * | 2013-07-23 | 2018-08-30 | Novaliq Gmbh | Stabilized antibody compositions |
| WO2015035044A2 (en) | 2013-09-04 | 2015-03-12 | Abbvie Biotherapeutics Inc. | Fc VARIANTS WITH IMPROVED ANTIBODY-DEPENDENT CELL-MEDIATED CYTOTOXICITY |
| US9598667B2 (en) | 2013-10-04 | 2017-03-21 | Abbvie Inc. | Use of metal ions for modulation of protein glycosylation profiles of recombinant proteins |
| JP6526025B2 (ja) * | 2013-10-16 | 2019-06-05 | オンコバイオロジクス,インコーポレイティド | 抗体安定性を増強する緩衝液製剤 |
| US9085618B2 (en) | 2013-10-18 | 2015-07-21 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same |
| US8946395B1 (en) | 2013-10-18 | 2015-02-03 | Abbvie Inc. | Purification of proteins using hydrophobic interaction chromatography |
| US9181337B2 (en) | 2013-10-18 | 2015-11-10 | Abbvie, Inc. | Modulated lysine variant species compositions and methods for producing and using the same |
| PL2838510T3 (pl) * | 2013-11-08 | 2017-09-29 | Eli Lilly And Company | Roztwór atomoksetyny |
| US20150139988A1 (en) | 2013-11-15 | 2015-05-21 | Abbvie, Inc. | Glycoengineered binding protein compositions |
| JP6590803B2 (ja) | 2013-11-21 | 2019-10-16 | ゲンマブ エー/エス | 抗体−薬物コンジュゲート凍結乾燥製剤 |
| CN104666242B (zh) * | 2013-11-26 | 2018-01-02 | 信达生物制药(苏州)有限公司 | 一种稳定的抗TNF‑α抗体制剂及其用途 |
| CN104707146B (zh) * | 2013-12-16 | 2019-04-16 | 浙江海正药业股份有限公司 | 一种含有阿达木单抗的药物组合物 |
| EP2960252A1 (en) * | 2014-06-26 | 2015-12-30 | Institut Pasteur | Phospholipase for treatment of immunosuppression |
| EP3125928A4 (en) | 2014-04-02 | 2017-11-29 | Intas Pharmaceuticals Ltd. | Liquid pharmaceutical composition of adalimumab |
| CN105012949A (zh) * | 2014-04-28 | 2015-11-04 | 上海药明康德新药开发有限公司 | 重组人抗人TNFα单克隆抗体的制剂 |
| EP2946765B1 (en) * | 2014-05-23 | 2016-08-31 | Ares Trading S.A. | Liquid pharmaceutical composition |
| ES2572919T3 (es) | 2014-05-23 | 2016-06-03 | Ares Trading S.A. | Composición farmacéutica líquida |
| ES2607489T3 (es) | 2014-05-23 | 2017-03-31 | Ares Trading S.A. | Composición farmacéutica líquida |
| WO2016004197A1 (en) | 2014-07-03 | 2016-01-07 | Abbvie Inc. | Methods for modulating protein glycosylation profiles of recombinant protein therapeutics using cobalt |
| US20160185848A1 (en) | 2014-07-09 | 2016-06-30 | Abbvie Inc. | Methods for modulating the glycosylation profile of recombinant proteins using sugars |
| AU2015311913B2 (en) | 2014-09-03 | 2019-09-12 | Boehringer Ingelheim International Gmbh | Compound targeting IL-23A and TNF-alpha and uses thereof |
| US9821059B2 (en) * | 2014-10-17 | 2017-11-21 | Alteogen Inc. | Composition for stabilizing protein and pharmaceutical formulation comprising the same |
| HUP1400510A1 (hu) * | 2014-10-28 | 2016-05-30 | Richter Gedeon Nyrt | Gyógyászati TNFalfa ellenes antitest készítmény |
| US9926375B2 (en) | 2014-11-12 | 2018-03-27 | Tracon Pharmaceuticals, Inc. | Anti-endoglin antibodies and uses thereof |
| US10155820B2 (en) | 2014-11-12 | 2018-12-18 | Tracon Pharmaceuticals, Inc. | Anti-endoglin antibodies and uses thereof |
| US10093733B2 (en) | 2014-12-11 | 2018-10-09 | Abbvie Inc. | LRP-8 binding dual variable domain immunoglobulin proteins |
| AR103173A1 (es) | 2014-12-22 | 2017-04-19 | Novarits Ag | Productos farmacéuticos y composiciones líquidas estables de anticuerpos il-17 |
| EP3237000A1 (en) | 2014-12-23 | 2017-11-01 | Pfizer Inc | Stable aqueous antibody formulation for anti tnf alpha antibodies |
| WO2016118707A1 (en) | 2015-01-21 | 2016-07-28 | Oncobiologics, Inc. | Modulation of charge variants in a monoclonal antibody composition |
| EP3053572A1 (en) * | 2015-02-06 | 2016-08-10 | Ares Trading S.A. | Liquid pharmaceutical composition |
| WO2016162819A1 (en) | 2015-04-07 | 2016-10-13 | Lupin Limited | Stable aqueous pharmaceutical composition of anti-tnf alpha antibody |
| EP3078675A1 (en) | 2015-04-10 | 2016-10-12 | Ares Trading S.A. | Induction dosing regimen for the treatment of tnf alpha mediated disorders |
| TW201710286A (zh) | 2015-06-15 | 2017-03-16 | 艾伯維有限公司 | 抗vegf、pdgf及/或其受體之結合蛋白 |
| HK1251493A1 (zh) | 2015-06-17 | 2019-02-01 | 豪夫迈‧罗氏有限公司 | 使用pd-1轴结合拮抗剂和紫杉烷治疗局部晚期或转移性乳腺癌的方法 |
| US20170028013A1 (en) * | 2015-07-30 | 2017-02-02 | Teva Pharmaceutical Industries, Ltd. | Combination formulation of laquinimod and glatiramer acetate with amino acids |
| ES3052976T3 (en) | 2015-08-18 | 2026-01-16 | Regeneron Pharma | Anti-pcsk9 inhibitory antibodies for treating patients with hyperlipidemia undergoing lipoprotein apheresis |
| EP3356313B1 (en) | 2015-09-30 | 2020-05-06 | Novaliq GmbH | 2-perfluorohexyl octane for ophthalmic administration |
| DE202016008738U1 (de) | 2015-09-30 | 2019-04-09 | Novaliq Gmbh | Semifluorierte Verbindungen und ihre Zusammensetzungen |
| US11229702B1 (en) | 2015-10-28 | 2022-01-25 | Coherus Biosciences, Inc. | High concentration formulations of adalimumab |
| US11583584B1 (en) * | 2015-10-28 | 2023-02-21 | Coherus Biosciences, Inc. | Stable protein compositions and methods of their use |
| KR102386735B1 (ko) * | 2015-11-06 | 2022-04-14 | 주식회사 제넥신 | 변형된 인터루킨-7 융합 단백질의 제형 |
| EP3374399A1 (en) | 2015-11-11 | 2018-09-19 | Opi Vi- IP Holdco LLC | Composition and methods for anti-tnfr2 antibodies |
| DK3380525T3 (da) * | 2015-11-25 | 2024-01-29 | Immunogen Inc | Farmaceutiske formuleringer og fremgangsmåder til anvendelse deraf |
| US11058769B2 (en) * | 2015-12-07 | 2021-07-13 | Merck Patent Gmbh | Aqueous pharmaceutical formulation comprising anti-PD-L1 antibody Avelumab |
| KR20180100224A (ko) | 2016-01-11 | 2018-09-07 | 노바르티스 아게 | 인간 인터루킨-2에 대한 면역-자극 인간화 단일클론 항체, 및 이의 융합 단백질 |
| RU2736830C2 (ru) * | 2016-01-12 | 2020-11-20 | Др. Редди'С Лабораторис Лимитед | Стабильная фармацевтическая композиция |
| SG11201805534TA (en) | 2016-01-13 | 2018-07-30 | Genmab As | Formulation for antibody and drug conjugate thereof |
| CA3013336A1 (en) | 2016-02-03 | 2017-08-10 | Oncobiologics, Inc. | Buffer formulations for enhanced antibody stability |
| US20180043020A1 (en) * | 2016-04-20 | 2018-02-15 | Coherus Biosciences, Inc. | Method of reducing immunogenicity of drug products |
| US11071782B2 (en) | 2016-04-20 | 2021-07-27 | Coherus Biosciences, Inc. | Method of filling a container with no headspace |
| JP2019520357A (ja) | 2016-06-23 | 2019-07-18 | ノバリック ゲーエムベーハー | 局所投与方法 |
| HUP1600456A2 (en) | 2016-07-19 | 2018-01-29 | Richter Gedeon Nyrt | Novel cell-based tnf-alpha binding assay |
| PL3515420T3 (pl) | 2016-09-22 | 2024-04-08 | Novaliq Gmbh | Kompozycje farmaceutyczne do zastosowania w terapii zapalenia brzegów powiek |
| CA3036306C (en) | 2016-09-23 | 2024-05-14 | Novaliq Gmbh | Ophthalmic compositions comprising ciclosporin |
| WO2018075818A1 (en) | 2016-10-21 | 2018-04-26 | Amgen Inc. | Pharmaceutical formulations and methods of making the same |
| EP4467565A3 (en) | 2016-12-21 | 2025-03-12 | Amgen Inc. | Anti-tnf alpha antibody formulations |
| EP3399962B1 (en) | 2016-12-23 | 2020-06-10 | Novaliq GmbH | Ophthalmic composition for treatment of dry eye disease |
| JOP20190162A1 (ar) | 2016-12-30 | 2019-06-27 | Biocad Joint Stock Co | تركيبة صيدلانية مائية من جسم مضاد لـ tnf? أحادي النسيلة معاود الارتباط الجيني |
| KR102513828B1 (ko) | 2017-01-11 | 2023-03-24 | (주)셀트리온 | 안정한 액체 제제 |
| US11608357B2 (en) | 2018-08-28 | 2023-03-21 | Arecor Limited | Stabilized antibody protein solutions |
| EP3372242A1 (en) | 2017-03-06 | 2018-09-12 | Ares Trading S.A. | Liquid pharmaceutical composition |
| EP3372241A1 (en) | 2017-03-06 | 2018-09-12 | Ares Trading S.A. | Liquid pharmaceutical composition |
| EP3606964A4 (en) | 2017-04-03 | 2020-12-09 | Immunomedics, Inc. | SUBCUTANE ADMINISTRATION OF ANTIBODY DRUG CONJUGATES FOR CANCER THERAPY |
| WO2018184693A1 (en) * | 2017-04-07 | 2018-10-11 | Ares Trading S.A. | Liquid pharmaceutical composition |
| CA3058097C (en) | 2017-04-21 | 2024-01-02 | Novaliq Gmbh | Iodine compositions |
| CN106918633B (zh) * | 2017-04-24 | 2019-06-25 | 中国科学院苏州生物医学工程技术研究所 | 基于适体和金磁纳米颗粒的细胞因子TNF-α的检测方法 |
| RU2019138507A (ru) | 2017-05-02 | 2021-06-02 | Мерк Шарп И Доум Корп. | Составы антител против lag3 и совместные составы антител против lag3 и антител против pd-1 |
| JOP20190260A1 (ar) | 2017-05-02 | 2019-10-31 | Merck Sharp & Dohme | صيغ ثابتة لأجسام مضادة لمستقبل الموت المبرمج 1 (pd-1) وطرق استخدامها |
| US11278503B2 (en) | 2017-05-12 | 2022-03-22 | Novaliq Gmbh | Pharmaceutical compositions comprising semifluorinated alkanes for the treatment of contact lense-related conditions |
| US11136138B2 (en) | 2017-07-10 | 2021-10-05 | Autel Robotics Co., Ltd. | Aircraft control method and apparatus and aircraft |
| WO2019023247A1 (en) | 2017-07-25 | 2019-01-31 | Immutics, Inc. | TREATMENT OF CANCER BY BLOCKING THE INTERACTION OF TIM-3 AND ITS LIGAND |
| WO2019057631A1 (en) | 2017-09-20 | 2019-03-28 | Alvotech Hf | PHARMACEUTICAL FORMULATIONS FOR ADALIMUMAB |
| MX2020003534A (es) | 2017-09-27 | 2020-07-29 | Novaliq Gmbh | Composiciones oftalmicas que comprenden latanoprost para usarse en el tratamiento de las enfermedades oculares. |
| CN119909046A (zh) | 2017-10-04 | 2025-05-02 | 诺瓦利克有限责任公司 | 包含f6h8的眼用组合物 |
| MX2017016884A (es) * | 2017-12-19 | 2019-06-20 | Probiomed S A De C V | Formulacion farmaceutica estable de una proteina anti-tnfa. |
| WO2019126133A1 (en) * | 2017-12-20 | 2019-06-27 | Alexion Pharmaceuticals, Inc. | Liquid formulations of anti-cd200 antibodies |
| WO2019126536A1 (en) | 2017-12-20 | 2019-06-27 | Alexion Pharmaceuticals Inc. | Humanized anti-cd200 antibodies and uses thereof |
| CN108414479A (zh) * | 2018-01-19 | 2018-08-17 | 祝胜郎 | 一种免疫组合物在制备IgA肾病无创检测用试剂中的用途 |
| US20210031012A1 (en) | 2018-01-26 | 2021-02-04 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a pde4 inhibitor |
| CN110151988A (zh) * | 2018-02-11 | 2019-08-23 | 百奥泰生物制药股份有限公司 | 一种靶向治疗TNF-α相关疾病的人抗体制剂 |
| CN110302377B (zh) * | 2018-02-11 | 2020-04-17 | 百奥泰生物制药股份有限公司 | 一种靶向治疗TNF-α相关疾病的人抗体制剂 |
| US11576893B2 (en) | 2018-03-02 | 2023-02-14 | Novaliq Gmbh | Pharmaceutical compositions comprising nebivolol |
| TWI841554B (zh) | 2018-03-21 | 2024-05-11 | 丹麥商珍美寶股份有限公司 | 以鉑為主之劑與抗組織因子抗體-藥物共軛物的組合治療癌症之方法 |
| CN112153970A (zh) | 2018-04-27 | 2020-12-29 | 诺瓦利克有限责任公司 | 用于治疗青光眼的包含他氟前列素的眼用组合物 |
| BR112020022642A2 (pt) | 2018-05-07 | 2021-02-17 | Genmab A/S | método para tratar câncer em um indivíduo, e, estojo |
| EP3810095A1 (en) | 2018-06-20 | 2021-04-28 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with a tnf inhibitor |
| US20230041197A1 (en) | 2018-06-20 | 2023-02-09 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with an immunomodulator |
| EP3810085A1 (en) | 2018-06-20 | 2021-04-28 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with an integrin inhibitor |
| US20210363233A1 (en) | 2018-06-20 | 2021-11-25 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with an il-12/il-23 inhibitor |
| US12171764B2 (en) | 2018-06-20 | 2024-12-24 | Biora Therapeutics, Inc. | Treatment of a disease of the gastrointestinal tract with a JAK or other kinase inhibitor |
| WO2019246317A1 (en) | 2018-06-20 | 2019-12-26 | Progenity, Inc. | Treatment of a disease or condition in a tissue originating from the endoderm |
| CN112823020A (zh) | 2018-10-12 | 2021-05-18 | 诺瓦利克有限责任公司 | 用于治疗干眼病的眼用组合物 |
| TWI844571B (zh) | 2018-10-30 | 2024-06-11 | 丹麥商珍美寶股份有限公司 | 使用抗血管內皮生長因子(vegf)抗體與抗組織因子(tf)抗體-藥物共軛體之組合以治療癌症之方法 |
| MX2021005394A (es) | 2018-11-07 | 2021-07-06 | Merck Sharp & Dohme Llc | Co-formulaciones de anticuerpos anti-gen de activacion de linfocitos 3 (anti-lag3) y anticuerpos anti-muerte programada-1 (anti-pd-1). |
| CA3101670C (en) | 2018-11-27 | 2024-02-06 | Innovent Biologics (Suzhou) Co., Ltd. | Anti-il-23p19 antibody and use thereof |
| WO2020138517A1 (ko) * | 2018-12-24 | 2020-07-02 | 삼성바이오에피스 주식회사 | 항-TNFα 항체를 포함하는 약제학적 조성물 |
| JP2022523333A (ja) | 2019-01-30 | 2022-04-22 | トゥルーバインディング,インコーポレイテッド | 抗gal3抗体およびその使用 |
| EP3923907B1 (en) | 2019-02-13 | 2024-09-25 | Novaliq GmbH | Compositions and methods for the treatment of ocular neovascularization |
| US11634485B2 (en) | 2019-02-18 | 2023-04-25 | Eli Lilly And Company | Therapeutic antibody formulation |
| AR118191A1 (es) * | 2019-02-28 | 2021-09-22 | Celltrion Inc | MÉTODOS PARA EL TRATAMIENTO DE ENFERMEDADES RELACIONADAS CON TNFa |
| WO2021168274A1 (en) | 2020-02-21 | 2021-08-26 | Silverback Therapeutics, Inc. | Nectin-4 antibody conjugates and uses thereof |
| JP7755863B2 (ja) * | 2020-04-17 | 2025-10-17 | シーフイダ ファーマシューティカル グループ (チーリン) カンパニー リミテッド | Cd137と特異的に結合する製剤とその使用について |
| TWI802882B (zh) * | 2020-05-13 | 2023-05-21 | 大陸商信達生物制藥(蘇州)有限公司 | 包含抗IL-23p19抗體的製劑、其製備方法和用途 |
| IL299570A (en) * | 2020-06-29 | 2023-02-01 | Kodiscovery Llc | Cellular energy inhibitor formulations for the treatment of pathogenic infections and associated methods |
| IL299508A (en) | 2020-07-01 | 2023-02-01 | Ars Pharmaceuticals Inc | Anti-asgr1 antibody conjugates and uses thereof |
| EP4294827A1 (en) * | 2021-02-19 | 2023-12-27 | Theripion, Inc. | Paraoxonase fusion polypeptides and related compositions and methods |
| WO2022231978A1 (en) * | 2021-04-26 | 2022-11-03 | Truebinding, Inc. | Anti-gal3 antibody formulations and methods of use thereof |
| WO2023043232A1 (ko) * | 2021-09-16 | 2023-03-23 | 주식회사 에이프로젠 | 항-TNFα 항체를 포함하는 약제학적 조성물 |
| US20230279136A1 (en) * | 2021-11-10 | 2023-09-07 | Janssen Biotech, Inc. | Stable formulations comprising a bispecific bcma/cd3 antibody |
| US11773160B1 (en) | 2022-08-05 | 2023-10-03 | Anaveon AG | Immune-stimulating IL-2 fusion proteins |
Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6024938A (en) * | 1994-07-07 | 2000-02-15 | Ortho Pharmaceutical Corporation | Lyophilized imaging agent formulation comprising a chemotactic peptide |
| JP2000507810A (ja) * | 1996-02-09 | 2000-06-27 | ベーアーエスエフ アクツィエンゲゼルシャフト | ヒトTNFαに結合するヒト抗体 |
| WO2000066160A1 (fr) * | 1999-04-28 | 2000-11-09 | Yamanouchi Pharmaceutical Co., Ltd. | Composition medicamenteuse parenterale a fragment d'anticorps monoclonal humanise et procede de stabilisation |
| JP2001503781A (ja) * | 1996-11-19 | 2001-03-21 | ロシュ ダイアグノスティクス ゲゼルシャフト ミット ベシュレンクテル ハフツング | モノクローナル抗体又はポリクローナル抗体の安定な凍結乾燥された医薬製剤 |
| WO2001047554A1 (fr) * | 1999-12-28 | 2001-07-05 | Chugai Seiyaku Kabushiki Kaisha | Compositions d'anticorps stables et preparations pour injection |
| JP2002504907A (ja) * | 1997-06-13 | 2002-02-12 | ジェネンテク,インコーポレイテッド | 抗体製剤 |
| WO2002012502A2 (en) * | 2000-08-07 | 2002-02-14 | Centocor, Inc. | Anti-tnf antibodies, compositions, methods and uses |
| WO2002012500A2 (en) * | 2000-08-07 | 2002-02-14 | Centocor, Inc. | Anti-il-12 antibodies, compositions, methods and uses |
| WO2002013860A1 (en) * | 2000-08-11 | 2002-02-21 | Chugai Seiyaku Kabushiki Kaisha | Stabilized antibody-containing preparations |
| WO2002030463A2 (en) * | 2000-10-12 | 2002-04-18 | Genentech, Inc. | Reduced-viscosity concentrated protein formulations |
Family Cites Families (147)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS605899B2 (ja) | 1975-04-10 | 1985-02-14 | 中外製薬株式会社 | 免疫化学的定量法 |
| US4396608A (en) | 1981-08-24 | 1983-08-02 | Cutter Laboratories | Intravenously injectable immune serum globulin |
| IE833023L (en) * | 1983-01-28 | 1984-07-28 | Joseph Patrick Mcauliffe | System and process of identifying and updating tuning¹constants |
| EP0168506B2 (en) | 1984-07-07 | 1998-01-07 | Armour Pharma GmbH | Process for preparing gamma globulin suitable for intravenous administration |
| IL73883A (en) | 1984-12-20 | 1990-12-23 | Yeda Res & Dev | Monoclonal antibodies against tnf-alpha,hybridomas producing them and method for the purification of tnf-alpha |
| US4597966A (en) | 1985-01-09 | 1986-07-01 | Ortho Diagnostic Systems, Inc. | Histidine stabilized immunoglobulin and method of preparation |
| US4870163A (en) | 1985-08-29 | 1989-09-26 | New York Blood Center, Inc. | Preparation of pure human tumor necrosis factor and hybridomas producing monoclonal antibodies to human tumor necrosis factor |
| EP0230574A3 (en) | 1986-01-31 | 1989-03-22 | Yale University | Pharmaceutical compositions against infections caused by lav/htlv iii virus and the use thereof |
| DE3631229A1 (de) | 1986-09-13 | 1988-03-24 | Basf Ag | Monoklonale antikoerper gegen humanen tumornekrosefaktor (tnf) und deren verwendung |
| US5237054A (en) | 1987-02-20 | 1993-08-17 | Akzo Pharma | Stabilized aqueous composition containing antibodies |
| CA1329760C (en) | 1987-10-29 | 1994-05-24 | Ted C. K. Lee | Plasma and recombinant protein formulations in high ionic strength media |
| US4877608A (en) | 1987-11-09 | 1989-10-31 | Rorer Pharmaceutical Corporation | Pharmaceutical plasma protein formulations in low ionic strength media |
| US5096885A (en) | 1988-04-15 | 1992-03-17 | Genentech, Inc. | Human growth hormone formulation |
| US5981485A (en) | 1997-07-14 | 1999-11-09 | Genentech, Inc. | Human growth hormone aqueous formulation |
| JPH03504499A (ja) | 1988-05-27 | 1991-10-03 | セントカー・インコーポレーテツド | 抗体試薬のための配合物 |
| AU4056689A (en) | 1988-07-27 | 1990-02-19 | Bmc Software, Inc. | Improved data transmission optimizer |
| US4897465A (en) | 1988-10-12 | 1990-01-30 | Abbott Laboratories | Enrichment and concentration of proteins by ultrafiltration |
| ATE147634T1 (de) | 1988-12-19 | 1997-02-15 | American Cyanamid Co | Produkte zur behandlung des endotoxin -schocks bei einem säugetier |
| CA2049342A1 (en) | 1989-03-27 | 1990-09-28 | Sally Bolmer | Formulations for stabilizing of igm antibodies |
| CA2064915C (en) | 1989-08-07 | 2001-05-29 | Deborah A. Rathjen | Tumour necrosis factor binding ligands |
| US5998378A (en) | 1989-08-16 | 1999-12-07 | Chiron Corporation | Compositions for the inhibition of TNF hormone formation and uses thereof |
| GB8921123D0 (en) | 1989-09-19 | 1989-11-08 | Millar Ann B | Treatment of ards |
| JPH0791318B2 (ja) | 1989-09-21 | 1995-10-04 | 三井東圧化学株式会社 | 蛋白質水溶液、蛋白質水溶液の濃度増大方法および蛋白質製剤 |
| US5945098A (en) | 1990-02-01 | 1999-08-31 | Baxter International Inc. | Stable intravenously-administrable immune globulin preparation |
| WO1992017583A1 (en) | 1991-03-29 | 1992-10-15 | Immunex Corporation | Isolated viral protein cytokine antagonists |
| DE4037604A1 (de) | 1990-04-25 | 1991-10-31 | Bayer Ag | Verwendung von anti-tnf-antikoerpern als arzneimittel bei der behandlung von ischaemien und deren folgen |
| EP0608212A1 (en) | 1990-08-27 | 1994-08-03 | Peptide Technology Ltd | Method of treating viral infection |
| GB9109645D0 (en) | 1991-05-03 | 1991-06-26 | Celltech Ltd | Recombinant antibodies |
| JPH0565233A (ja) | 1991-03-08 | 1993-03-19 | Mitsui Toatsu Chem Inc | モノクローナル抗体含有凍結乾燥製剤 |
| DK0575545T3 (da) | 1991-03-15 | 2003-09-15 | Amgen Inc | Pegylering af polypeptider |
| US6277969B1 (en) | 1991-03-18 | 2001-08-21 | New York University | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| EP1905782A1 (en) | 1991-03-18 | 2008-04-02 | New York University | Monoclonal and chimeric antibodies specific for human tumor necrosis factor |
| US20060246073A1 (en) | 1991-03-18 | 2006-11-02 | Knight David M | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| US6165467A (en) | 1991-07-20 | 2000-12-26 | Yoshihide Hagiwara | Stabilized human monoclonal antibody preparation |
| GB9122820D0 (en) | 1991-10-28 | 1991-12-11 | Wellcome Found | Stabilised antibodies |
| WO1993011793A1 (en) | 1991-12-17 | 1993-06-24 | Schering Corporation | Use of the combination of anti-tumor necrosis factor plus interleukin-6 to treat septic shock |
| AU3924993A (en) | 1992-04-02 | 1993-11-08 | Smithkline Beecham Corporation | Compounds useful for treating inflammatory diseases and inhibiting production of tumor necrosis factor |
| DE69321909T2 (de) | 1992-08-28 | 1999-04-01 | Bayer Corp., Pittsburgh, Pa. | Verwendung von monoklonalen Anti-TNF-Antikörpern für die Behandlung von bakteriellen Meningitiden |
| JPH08509203A (ja) | 1992-10-15 | 1996-10-01 | ダナ−ファーバー キャンサー インステテュート インコーポレイテッド | TNF−α作用の拮抗剤を用いる肥満関連糖尿病▲II▼型のインスリン耐性の治療 |
| US5358708A (en) | 1993-01-29 | 1994-10-25 | Schering Corporation | Stabilization of protein formulations |
| DK0614984T4 (da) | 1993-03-05 | 2010-12-20 | Bayer Healthcare Llc | Humane monoklonale anti-TNF-alfa-antistoffer |
| DE4307508A1 (de) | 1993-03-10 | 1994-09-15 | Knoll Ag | Verwendung von anti-TNF-Antikörpern als Arzneimittel bei der Behandlung von Herzinsuffizienz (Herzmuskelschwäche) |
| FR2708467B1 (fr) | 1993-07-30 | 1995-10-20 | Pasteur Merieux Serums Vacc | Préparations d'immunoglobulines stabilisées et procédé pour leur préparation. |
| DE4344824C1 (de) | 1993-12-28 | 1995-08-31 | Immuno Ag | Hochkonzentriertes Immunglobulin-Präparat und Verfahren zu seiner Herstellung |
| NZ278607A (en) | 1994-02-07 | 1999-05-28 | Knoll Ag | Use of tnf antagonists for treating disorders involving elevated serum levels of il-6 wherein the serum levels are 500pg/ml or above |
| GB9418092D0 (en) | 1994-09-08 | 1994-10-26 | Red Cross Found Cent Lab Blood | Organic compounds |
| US5656730A (en) | 1995-04-07 | 1997-08-12 | Enzon, Inc. | Stabilized monomeric protein compositions |
| CN102416176A (zh) * | 1995-07-27 | 2012-04-18 | 基因技术股份有限公司 | 稳定等渗的冻干蛋白质制剂 |
| US6267958B1 (en) | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| ATE234918T1 (de) | 1995-08-04 | 2003-04-15 | Lek Tovarna Farmacevtskih | Monoklonale antikörper gegen lösliche tnf-alpha rezeptoren p55 und p75 als auch gegen tnf-alpha und dessen analogen |
| US6090382A (en) | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| US5770700A (en) | 1996-01-25 | 1998-06-23 | Genetics Institute, Inc. | Liquid factor IX formulations |
| GB9610992D0 (en) * | 1996-05-24 | 1996-07-31 | Glaxo Group Ltd | Concentrated antibody preparation |
| JP2000516594A (ja) | 1996-07-26 | 2000-12-12 | スミスクライン・ビーチャム・コーポレイション | 免疫細胞介在全身性疾患の改良された治療法 |
| GB9705810D0 (en) | 1997-03-20 | 1997-05-07 | Common Services Agency | Intravenous immune globulin |
| AU6914998A (en) | 1997-04-07 | 1998-10-30 | Cangene Corporation | Intravenous immune globulin formulation containing a non-ionic surface active agent with improved pharmacokinetic properties |
| US6171586B1 (en) * | 1997-06-13 | 2001-01-09 | Genentech, Inc. | Antibody formulation |
| ES2182202T5 (es) | 1997-10-23 | 2007-12-01 | Mitsubishi Pharma Corporation | Preparacion de inmunoglobulinas para inyeccion intravenosa apta para ser almacenada a temperatura ambiente. |
| ATE220558T1 (de) | 1997-11-22 | 2002-08-15 | Roche Diagnostics Gmbh | Verbessertes verfahren zur stabilisierung von proteinen |
| AU2444899A (en) | 1998-01-22 | 1999-08-09 | Astrazeneca Ab | Pharmaceutical formulation comprising an antibody and a citrate buffer |
| JP4685238B2 (ja) | 1998-06-09 | 2011-05-18 | ツエー・エス・エル・ベーリング・アクチエンゲゼルシヤフト | 静脈投与用免疫グロブリン及び他の免疫グロブリン生成物の製造法 |
| GB9819019D0 (en) | 1998-09-01 | 1998-10-28 | Cerebrus Ltd | Chemical compounds II |
| US6537549B2 (en) | 1999-02-24 | 2003-03-25 | Edward L. Tobinick | Cytokine antagonists for the treatment of localized disorders |
| US6379666B1 (en) | 1999-02-24 | 2002-04-30 | Edward L. Tobinick | TNF inhibitors for the treatment of neurological, retinal and muscular disorders |
| US6419934B1 (en) | 1999-02-24 | 2002-07-16 | Edward L. Tobinick | TNF modulators for treating neurological disorders associated with viral infection |
| US6015557A (en) | 1999-02-24 | 2000-01-18 | Tobinick; Edward L. | Tumor necrosis factor antagonists for the treatment of neurological disorders |
| US6423321B2 (en) | 1999-02-24 | 2002-07-23 | Edward L. Tobinick | Cytokine antagonists for the treatment of sensorineural hearing loss |
| US6177077B1 (en) | 1999-02-24 | 2001-01-23 | Edward L. Tobinick | TNT inhibitors for the treatment of neurological disorders |
| US6419944B2 (en) | 1999-02-24 | 2002-07-16 | Edward L. Tobinick | Cytokine antagonists for the treatment of localized disorders |
| NZ592550A (en) | 1999-03-25 | 2012-12-21 | Abbott Gmbh & Co Kg | Compostion comprising antibody capable of binding to p40 subunit of IL-12 |
| WO2000067798A2 (en) | 1999-05-05 | 2000-11-16 | Elan Corporation Plc | Enhanced delivery of nucleic acid-based drugs |
| AUPQ026799A0 (en) | 1999-05-10 | 1999-06-03 | Csl Limited | Method of increasing protein stability by removing immunoglobulin aggregates |
| AU784045B2 (en) | 1999-06-25 | 2006-01-19 | Genentech Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| CN1409639A (zh) | 1999-12-14 | 2003-04-09 | 杰南技术公司 | 应用TNF-α拮抗剂和LFA-1拮抗剂治疗LFA-1或TNF-α介导的疾病 |
| US6585957B1 (en) | 2000-01-25 | 2003-07-01 | Aeropharm Technology Incorporated | Medicinal aerosol formulation |
| US7495018B2 (en) | 2000-03-30 | 2009-02-24 | Takeda Pharmaceutical Company Limited | Substituted 1,3-thiazole compounds, their production and use |
| DE10022092A1 (de) | 2000-05-08 | 2001-11-15 | Aventis Behring Gmbh | Stabilisiertes Protein-Präparat und Verfahren zu seiner Herstellung |
| AU750296B2 (en) | 2000-06-23 | 2002-07-11 | F. Hoffmann-La Roche Ag | Antibodies against SEMP1, methods for their production and uses thereof |
| WO2002011753A1 (en) | 2000-08-04 | 2002-02-14 | Chugai Seiyaku Kabushiki Kaisha | Protein injection preparations |
| SE0003045D0 (sv) | 2000-08-29 | 2000-08-29 | Probi Ab | New method |
| WO2002043750A2 (en) | 2000-12-01 | 2002-06-06 | Battelle Memorial Institute | Method for the stabilizing of biomolecules (e.g. insulin) in liquid formulations |
| WO2002072636A2 (en) | 2000-12-28 | 2002-09-19 | Altus Biologics Inc. | Crystals of whole antibodies and fragments thereof and methods for making and using them |
| ES2184594B1 (es) | 2001-01-17 | 2004-01-01 | Probitas Pharma Sa | Procedimiento para la produccion de gammaglobulina g humana inactivada de virus. |
| KR20020066778A (ko) | 2001-02-13 | 2002-08-21 | 한국과학기술연구원 | 체내 난흡수 물질의 흡수촉진용 조성물과 제형 및 그의제조방법 |
| JP3942091B2 (ja) | 2001-05-14 | 2007-07-11 | ザイロン コーポレイション | デジタルアナログ変換器 |
| US20030012786A1 (en) | 2001-05-25 | 2003-01-16 | Teoh Leah S. | Use of anti-TNF antibodies as drugs in treating septic disorders of anemic patients |
| WO2002098445A1 (fr) | 2001-05-30 | 2002-12-12 | Chugai Seiyaku Kabushiki Kaisha | Preparation de proteines |
| GB0113179D0 (en) | 2001-05-31 | 2001-07-25 | Novartis Ag | Organic compounds |
| CA2385745C (en) | 2001-06-08 | 2015-02-17 | Abbott Laboratories (Bermuda) Ltd. | Methods of administering anti-tnf.alpha. antibodies |
| IL159048A0 (en) | 2001-06-21 | 2004-05-12 | Genentech Inc | Sustained release formulation |
| DE60235013D1 (de) | 2001-07-25 | 2010-02-25 | Facet Biotech Corp | Stabile lyophilisierte pharmazeutische formulierung des igg-antikörpers daclizumab |
| US6818613B2 (en) | 2001-11-07 | 2004-11-16 | Ortho-Mcneil Pharmaceutical, Inc. | Aqueous sustained-release formulations of proteins |
| NZ532896A (en) | 2001-11-08 | 2007-08-31 | Pdl Biopharma Inc | Stable liquid pharmaceutical formulation of IGG antibodies including daclizumab and fontolizumab |
| GB0202633D0 (en) | 2002-02-05 | 2002-03-20 | Delta Biotechnology Ltd | Stabilization of protein preparations |
| KR101080021B1 (ko) | 2002-02-14 | 2011-11-04 | 추가이 세이야쿠 가부시키가이샤 | 항체함유 용액제제 |
| US20030161828A1 (en) | 2002-02-19 | 2003-08-28 | Abbott Gmbh & Co. Kg | Use of TNF antagonists as drugs for the treatment of patients with an inflammatory reaction and without suffering from total organ failure |
| US20030180287A1 (en) | 2002-02-27 | 2003-09-25 | Immunex Corporation | Polypeptide formulation |
| US20040009172A1 (en) | 2002-04-26 | 2004-01-15 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| US20030206898A1 (en) | 2002-04-26 | 2003-11-06 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| US20060182740A1 (en) | 2002-06-21 | 2006-08-17 | Biogen Idec, Inc. | Buffered formulations for concentrating antibodies and methods of use thereof |
| US7601351B1 (en) | 2002-06-26 | 2009-10-13 | Human Genome Sciences, Inc. | Antibodies against protective antigen |
| EP1539212A4 (en) | 2002-07-12 | 2007-05-02 | Medarex Inc | METHOD AND COMPOSITIONS FOR PREVENTING OXIDATIVE DEGRADATION OF PROTEINS |
| CN101745112A (zh) | 2002-07-19 | 2010-06-23 | 艾博特生物技术有限公司 | TNFα相关疾病的治疗 |
| US20090280065A1 (en) | 2006-04-10 | 2009-11-12 | Willian Mary K | Uses and Compositions for Treatment of Psoriasis |
| US20040033228A1 (en) * | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| MY150740A (en) | 2002-10-24 | 2014-02-28 | Abbvie Biotechnology Ltd | Low dose methods for treating disorders in which tnf? activity is detrimental |
| UY28126A1 (es) | 2002-12-24 | 2004-06-30 | Alcon Inc | Uso de glucocorticoides selectivos para la superficie ocular en el tratamiento de la sequedad ocular |
| EP1603596B1 (en) | 2003-02-28 | 2008-05-07 | Ares Trading S.A. | Liquid formulations of tumor necrosis factor-binding protein tbp-1 |
| ATE344856T1 (de) | 2003-04-25 | 2006-11-15 | Johnson & Son Inc S C | Am rand eines toilettenbeckens angebrachte vorrichtung zur abgabe von zwei flüssigkeiten |
| TWI339659B (en) | 2004-03-18 | 2011-04-01 | R Tech Ueno Ltd | Aqueous composition comprising thiazole derivative |
| TWI556829B (zh) | 2004-04-09 | 2016-11-11 | 艾伯維生物技術有限責任公司 | 用於治療TNFα相關失調症之多重可變劑量療法 |
| WO2006041970A2 (en) | 2004-10-08 | 2006-04-20 | Abbott Biotechnology Ltd. | Treatment of respiratory syncytial virus (rsv) infection |
| WO2006125229A2 (en) | 2005-05-16 | 2006-11-23 | Abbott Biotechnology Ltd. | Use of tnf inhibitor for treatment of erosive polyarthritis |
| ES2776657T3 (es) | 2005-06-14 | 2020-07-31 | Amgen Inc | Formulaciones de proteínas autotamponantes |
| US20070041905A1 (en) | 2005-08-19 | 2007-02-22 | Hoffman Rebecca S | Method of treating depression using a TNF-alpha antibody |
| TWI424161B (zh) | 2005-11-01 | 2014-01-21 | Abbvie Biotechnology Ltd | 利用生物標記診斷關節黏連脊椎炎之方法及組合物 |
| TWI392684B (zh) | 2006-04-05 | 2013-04-11 | 亞培生物科技公司 | 抗體之純化 |
| US9605064B2 (en) | 2006-04-10 | 2017-03-28 | Abbvie Biotechnology Ltd | Methods and compositions for treatment of skin disorders |
| US20080118496A1 (en) | 2006-04-10 | 2008-05-22 | Medich John R | Uses and compositions for treatment of juvenile rheumatoid arthritis |
| EP2666472A3 (en) | 2006-04-10 | 2014-04-02 | Abbott Biotechnology Ltd | Uses and compositions for treatment of psoriatic arthritis |
| WO2007120626A2 (en) | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of ankylosing spondylitis |
| WO2007120656A2 (en) | 2006-04-10 | 2007-10-25 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of rheumatoid arthritis |
| US20090317399A1 (en) | 2006-04-10 | 2009-12-24 | Pollack Paul F | Uses and compositions for treatment of CROHN'S disease |
| US20080131374A1 (en) | 2006-04-19 | 2008-06-05 | Medich John R | Uses and compositions for treatment of rheumatoid arthritis |
| US20080311043A1 (en) | 2006-06-08 | 2008-12-18 | Hoffman Rebecca S | Uses and compositions for treatment of psoriatic arthritis |
| US20100021451A1 (en) | 2006-06-08 | 2010-01-28 | Wong Robert L | Uses and compositions for treatment of ankylosing spondylitis |
| KR101396797B1 (ko) | 2006-06-30 | 2014-05-26 | 애브비 바이오테크놀로지 리미티드 | 자동 주사 장치 |
| DK1882476T3 (da) | 2006-07-25 | 2009-03-09 | Claus Herdeis | Fremstilling af antimikrobielle formuleringer under anvendelse af 7-oxa-2-thia1,5-diazabicyklo(3.3.1)nonan-2,2-dion |
| CA2842964A1 (en) | 2006-09-13 | 2008-03-20 | Abbvie Inc. | Cell culture improvements |
| CN104072612A (zh) | 2006-10-27 | 2014-10-01 | 艾伯维生物技术有限公司 | 结晶型抗-hTNFα抗体 |
| US8092998B2 (en) | 2007-05-31 | 2012-01-10 | Abbott Laboratories | Biomarkers predictive of the responsiveness to TNFα inhibitors in autoimmune disorders |
| WO2008150490A2 (en) | 2007-06-01 | 2008-12-11 | Abbott Biotechnology Ltd. | Uses and compositions for treatment of psoriasis and crohn's disease |
| US8999337B2 (en) * | 2007-06-11 | 2015-04-07 | Abbvie Biotechnology Ltd. | Methods for treating juvenile idiopathic arthritis by inhibition of TNFα |
| US20090110679A1 (en) | 2007-07-13 | 2009-04-30 | Luk-Chiu Li | Methods and compositions for pulmonary administration of a TNFa inhibitor |
| CN101980722A (zh) | 2007-08-08 | 2011-02-23 | 雅培制药有限公司 | 结晶抗体的组合物和方法 |
| WO2009032128A1 (en) | 2007-08-28 | 2009-03-12 | Abbott Biotechnology Ltd. | Compositions and methods comprising binding proteins for adalimumab |
| US8883146B2 (en) | 2007-11-30 | 2014-11-11 | Abbvie Inc. | Protein formulations and methods of making same |
| KR20210049186A (ko) | 2007-11-30 | 2021-05-04 | 애브비 바이오테크놀로지 리미티드 | 단백질 제형 및 이의 제조방법 |
| MX2010007393A (es) | 2008-01-03 | 2010-11-09 | Abbott Biotech Ltd | Anticipacion de eficacia a largo plazo de un compuesto en el tratamiento de psoriasis. |
| RU2537139C2 (ru) | 2008-01-15 | 2014-12-27 | Эбботт Гмбх Унд Ко.Кг | Порошковые белковые композиции и способы их получения |
| US8187836B2 (en) | 2008-01-15 | 2012-05-29 | Abbott Laboratories | Mammalian expression vectors and uses thereof |
| CN102282173A (zh) | 2008-03-24 | 2011-12-14 | 艾博特生物技术有限公司 | 用于治疗骨丢失的方法和组合物 |
| CA2760237C (en) | 2009-04-29 | 2017-11-14 | Abbott Biotechnology Ltd. | Automatic injection device and plunger for same |
| SG10201401995UA (en) | 2009-05-04 | 2014-08-28 | Abbvie Biotechnology Ltd | Stable high protein concentration formulations of human anti-tnf-alpha-antibodies |
| LT2637690T (lt) | 2010-11-11 | 2016-10-25 | Abbvie Biotechnology Ltd | Didelės koncentracijos anti-tnfalfa antikūno skystos kompozicijos |
| WO2013164837A1 (en) | 2012-03-07 | 2013-11-07 | Cadila Healthcare Limited | Pharmaceutical formulations of tnf-alpha antibodies |
| PT2892550T (pt) | 2012-09-07 | 2020-03-27 | Coherus Biosciences Inc | Formulações aquosas estáveis de adalimumab |
-
2002
- 2002-08-16 US US10/222,140 patent/US20040033228A1/en not_active Abandoned
-
2003
- 2003-08-08 MY MYPI20070749A patent/MY162068A/en unknown
- 2003-08-08 MY MYPI20033010A patent/MY153718A/en unknown
- 2003-08-08 MY MYPI2014003532A patent/MY172823A/en unknown
- 2003-08-08 MY MYPI2012001176A patent/MY163027A/en unknown
- 2003-08-12 TW TW092122123A patent/TWI331532B/zh not_active IP Right Cessation
- 2003-08-15 EP EP10182598A patent/EP2363144A1/en not_active Withdrawn
- 2003-08-15 CA CA2494756A patent/CA2494756C/en not_active Expired - Lifetime
- 2003-08-15 PL PL375272A patent/PL212934B1/pl unknown
- 2003-08-15 KR KR1020117007142A patent/KR101273568B1/ko not_active Expired - Lifetime
- 2003-08-15 CA CA2854798A patent/CA2854798A1/en not_active Abandoned
- 2003-08-15 CA CA2882905A patent/CA2882905C/en not_active Expired - Lifetime
- 2003-08-15 CA CA2872089A patent/CA2872089C/en not_active Expired - Lifetime
- 2003-08-15 US US10/525,292 patent/US8216583B2/en active Active
- 2003-08-15 WO PCT/IB2003/004502 patent/WO2004016286A2/en not_active Ceased
- 2003-08-15 AT AT03748439T patent/ATE555809T1/de active
- 2003-08-15 KR KR1020127026957A patent/KR101367743B1/ko not_active Expired - Lifetime
- 2003-08-15 ES ES10182610.5T patent/ES2636692T3/es not_active Expired - Lifetime
- 2003-08-15 DK DK10182610.5T patent/DK2359856T3/en active
- 2003-08-15 CN CN201010613946.7A patent/CN102049045B/zh not_active Expired - Lifetime
- 2003-08-15 CA CA2882934A patent/CA2882934C/en not_active Expired - Lifetime
- 2003-08-15 PE PE2003000831A patent/PE20040994A1/es not_active Application Discontinuation
- 2003-08-15 EP EP03748439A patent/EP1528933B1/en not_active Revoked
- 2003-08-15 EP EP20100182619 patent/EP2361637A1/en not_active Withdrawn
- 2003-08-15 CA CA2872091A patent/CA2872091A1/en not_active Abandoned
- 2003-08-15 CN CN200910253163.XA patent/CN101721702B/zh not_active Expired - Lifetime
- 2003-08-15 EP EP10182610.5A patent/EP2359856B1/en not_active Revoked
- 2003-08-15 PT PT03748439T patent/PT1528933E/pt unknown
- 2003-08-15 CA CA2882931A patent/CA2882931C/en not_active Expired - Lifetime
- 2003-08-15 EP EP10182625A patent/EP2363145A1/en not_active Withdrawn
- 2003-08-15 MX MXPA05001841A patent/MXPA05001841A/es active IP Right Grant
- 2003-08-15 DK DK03748439.1T patent/DK1528933T3/da active
- 2003-08-15 SI SI200332534T patent/SI2359856T1/sl unknown
- 2003-08-15 AR AR20030102982A patent/AR040881A1/es not_active Application Discontinuation
- 2003-08-15 CN CN038242729A patent/CN1688339B/zh not_active Expired - Lifetime
- 2003-08-15 CA CA2872088A patent/CA2872088A1/en not_active Abandoned
- 2003-08-15 AU AU2003267744A patent/AU2003267744C1/en not_active Expired
- 2003-08-15 ES ES03748439T patent/ES2387616T3/es not_active Expired - Lifetime
- 2003-08-15 KR KR1020057002604A patent/KR20050067140A/ko not_active Ceased
- 2003-08-15 NZ NZ538030A patent/NZ538030A/en not_active IP Right Cessation
- 2003-08-15 JP JP2004528780A patent/JP4925582B2/ja not_active Expired - Lifetime
- 2003-08-15 BR BR0313492-0A patent/BR0313492A/pt not_active Application Discontinuation
- 2003-08-15 PL PL406852A patent/PL218834B1/pl unknown
- 2003-08-15 PL PL398596A patent/PL218221B1/pl unknown
- 2003-08-15 SI SI200332176T patent/SI1528933T1/sl unknown
- 2003-08-15 PT PT101826105T patent/PT2359856T/pt unknown
- 2003-08-15 CA CA2882907A patent/CA2882907C/en not_active Expired - Lifetime
- 2003-08-15 KR KR1020137022247A patent/KR101529583B1/ko not_active Expired - Lifetime
- 2003-08-15 CN CN201010613919.XA patent/CN102078608B/zh not_active Expired - Lifetime
- 2003-08-15 UY UY27940A patent/UY27940A1/es not_active Application Discontinuation
-
2005
- 2005-02-03 ZA ZA200501032A patent/ZA200501032B/en unknown
- 2005-02-10 IL IL166809A patent/IL166809A/en active IP Right Grant
-
2010
- 2010-06-08 CL CL2010000603A patent/CL2010000603A1/es unknown
- 2010-07-14 AR ARP100102557A patent/AR077412A2/es unknown
- 2010-07-15 IL IL207028A patent/IL207028A/en active IP Right Grant
-
2011
- 2011-09-20 JP JP2011204759A patent/JP5608619B2/ja not_active Expired - Lifetime
-
2012
- 2012-05-15 US US13/471,820 patent/US8932591B2/en not_active Expired - Lifetime
- 2012-07-17 CY CY20121100631T patent/CY1113353T1/el unknown
-
2013
- 2013-11-14 JP JP2013235924A patent/JP2014074034A/ja active Pending
- 2013-11-27 US US14/091,661 patent/US8802100B2/en not_active Expired - Lifetime
- 2013-11-27 US US14/091,888 patent/US8802101B2/en not_active Expired - Lifetime
- 2013-11-27 US US14/091,938 patent/US8795670B2/en not_active Expired - Lifetime
-
2014
- 2014-01-03 US US14/147,287 patent/US8802102B2/en not_active Expired - Lifetime
- 2014-07-02 US US14/322,565 patent/US8940305B2/en not_active Expired - Lifetime
- 2014-07-02 US US14/322,581 patent/US8911741B2/en not_active Expired - Lifetime
- 2014-08-06 US US14/453,490 patent/US8916158B2/en not_active Expired - Lifetime
- 2014-08-06 US US14/453,461 patent/US8916157B2/en not_active Expired - Lifetime
- 2014-12-02 US US14/558,182 patent/US9114166B2/en not_active Expired - Lifetime
-
2015
- 2015-05-15 JP JP2015099796A patent/JP2015199741A/ja not_active Withdrawn
- 2015-07-14 US US14/799,211 patent/US9220781B2/en not_active Expired - Lifetime
- 2015-08-14 US US14/826,377 patent/US9295725B2/en not_active Expired - Fee Related
- 2015-08-14 US US14/826,393 patent/US9289497B2/en not_active Expired - Fee Related
- 2015-08-14 US US14/826,383 patent/US9272042B2/en not_active Expired - Fee Related
- 2015-08-14 US US14/826,357 patent/US9327032B2/en not_active Expired - Fee Related
- 2015-08-14 US US14/826,367 patent/US9272041B2/en not_active Expired - Fee Related
- 2015-10-15 US US14/884,279 patent/US9302011B2/en not_active Expired - Fee Related
-
2016
- 2016-04-11 US US15/095,393 patent/US9950066B2/en not_active Expired - Lifetime
-
2017
- 2017-01-27 US US15/418,469 patent/US9738714B2/en not_active Expired - Fee Related
- 2017-01-27 US US15/418,465 patent/US9732152B2/en not_active Expired - Fee Related
- 2017-01-27 US US15/418,460 patent/US9750808B2/en not_active Expired - Fee Related
- 2017-04-05 JP JP2017074982A patent/JP2017165736A/ja active Pending
- 2017-05-19 CY CY20171100527T patent/CY1118991T1/el unknown
-
2018
- 2018-03-12 US US15/918,663 patent/US20190054171A1/en not_active Abandoned
- 2018-08-07 US US16/057,217 patent/US20180339046A1/en not_active Abandoned
-
2020
- 2020-12-18 US US17/126,500 patent/US20210113694A1/en not_active Abandoned
-
2021
- 2021-09-10 US US17/472,004 patent/US20220241415A1/en not_active Abandoned
Patent Citations (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6024938A (en) * | 1994-07-07 | 2000-02-15 | Ortho Pharmaceutical Corporation | Lyophilized imaging agent formulation comprising a chemotactic peptide |
| JP2000507810A (ja) * | 1996-02-09 | 2000-06-27 | ベーアーエスエフ アクツィエンゲゼルシャフト | ヒトTNFαに結合するヒト抗体 |
| JP2001503781A (ja) * | 1996-11-19 | 2001-03-21 | ロシュ ダイアグノスティクス ゲゼルシャフト ミット ベシュレンクテル ハフツング | モノクローナル抗体又はポリクローナル抗体の安定な凍結乾燥された医薬製剤 |
| JP2002504907A (ja) * | 1997-06-13 | 2002-02-12 | ジェネンテク,インコーポレイテッド | 抗体製剤 |
| WO2000066160A1 (fr) * | 1999-04-28 | 2000-11-09 | Yamanouchi Pharmaceutical Co., Ltd. | Composition medicamenteuse parenterale a fragment d'anticorps monoclonal humanise et procede de stabilisation |
| WO2001047554A1 (fr) * | 1999-12-28 | 2001-07-05 | Chugai Seiyaku Kabushiki Kaisha | Compositions d'anticorps stables et preparations pour injection |
| WO2002012502A2 (en) * | 2000-08-07 | 2002-02-14 | Centocor, Inc. | Anti-tnf antibodies, compositions, methods and uses |
| WO2002012500A2 (en) * | 2000-08-07 | 2002-02-14 | Centocor, Inc. | Anti-il-12 antibodies, compositions, methods and uses |
| WO2002013860A1 (en) * | 2000-08-11 | 2002-02-21 | Chugai Seiyaku Kabushiki Kaisha | Stabilized antibody-containing preparations |
| WO2002030463A2 (en) * | 2000-10-12 | 2002-04-18 | Genentech, Inc. | Reduced-viscosity concentrated protein formulations |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4925582B2 (ja) | Tnf−アルファ関連疾患の治療用ヒト抗体の製剤 | |
| AU2003267744B2 (en) | Pharmaceutical anti-TNF-alpha antibody formulation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060811 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060811 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091020 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100113 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100120 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100420 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20100420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101005 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20101220 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20101228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110404 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110405 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110517 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110916 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110920 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110922 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20111130 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120110 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120207 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150217 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4925582 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S533 | Written request for registration of change of name |
Free format text: JAPANESE INTERMEDIATE CODE: R313533 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R153 | Grant of patent term extension |
Free format text: JAPANESE INTERMEDIATE CODE: R153 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |