JP4812937B2 - 共焦点顕微鏡イメージングシステム - Google Patents
共焦点顕微鏡イメージングシステム Download PDFInfo
- Publication number
- JP4812937B2 JP4812937B2 JP2000537103A JP2000537103A JP4812937B2 JP 4812937 B2 JP4812937 B2 JP 4812937B2 JP 2000537103 A JP2000537103 A JP 2000537103A JP 2000537103 A JP2000537103 A JP 2000537103A JP 4812937 B2 JP4812937 B2 JP 4812937B2
- Authority
- JP
- Japan
- Prior art keywords
- objective lens
- focused beam
- imaging system
- wavelength
- discontinuous surface
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0028—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders specially adapted for specific applications, e.g. for endoscopes, ophthalmoscopes, attachments to conventional microscopes
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/008—Details of detection or image processing, including general computer control
- G02B21/0084—Details of detection or image processing, including general computer control time-scale detection, e.g. strobed, ultra-fast, heterodyne detection
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
- G01N21/6458—Fluorescence microscopy
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5002—Partitioning blood components
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/006—Optical details of the image generation focusing arrangements; selection of the plane to be imaged
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0064—Optical details of the image generation multi-spectral or wavelength-selective arrangements, e.g. wavelength fan-out, chromatic profiling
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0072—Optical details of the image generation details concerning resolution or correction, including general design of CSOM objectives
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0076—Optical details of the image generation arrangements using fluorescence or luminescence
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
Landscapes
- Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Optics & Photonics (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Ophthalmology & Optometry (AREA)
- Radiology & Medical Imaging (AREA)
- Surgery (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biochemistry (AREA)
- Computer Vision & Pattern Recognition (AREA)
- Pathology (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Microscoopes, Condenser (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
これは、1998年3月16日付け米国特許出願番号09/042,527の一部の続きであり、それらすべてを引用によりこの文書に加える。
【0002】
本発明の分野
本発明は、細胞抽出物、細胞または組織で種々のアッセイを行うことによる診断および疾患の処置に有用な薬理剤の同定するための方法および装置に関連し、当該生物学的活性の測定には、ライン−スキャン共焦点イメージングシステム(line-scan confocal imaging system)および付随データ処理ルーチンの種々の実施態様の使用を含む。
【0003】
本発明の背景
現在、薬剤の発見および開発および方法の一般的生物学的研究および細胞を基とするアッセイを正確に行う装置が必要とされている。細胞を基とするアッセイは、化学化合物および新規生物学的標的の作用機構を評価するために有利に用いられる。細胞を基とするアッセイでは、目的活性が、競合的および相補性プロセスの両方の存在下、測定される。化学化合物スクリーニングに適するため、情報は、化合物の特定活性のため利用し得る。例えば、何れの化合物がアッセイの標的に結合するかばかりでなく、通常活性の標的のアゴニストまたはアンタゴニストの何れであるかということもまた評価し得る。しばしば、標的は、細胞表面レセプターである。あるシグナル経路では、最も強力な治療価値である経路のメンバーは、レセプターではないが、レセプターを付随する細胞内シグナルタンパク質である。そのため、経路を通して、好ましくは細胞環境において活性を評価する方法の開発が望ましい。
【0004】
更に、多くの化学化合物を迅速に、安価にスクリーニングする必要がある。この必要性は、種々の生物学的標的、例えばレセプター、酵素および核酸に対し活性について化学化合物を試験する医薬産業で普通に生じている。これら化学化合物は多くのライブラリーで回収され、時折、百万種の化合物を超える。化学化合物という語の使用は、広く解釈され、それには、単なる有機性および無機性分子、タンパク質、ペプチド、核酸およびオリゴヌクレオチド、炭水化物、脂質または生物学的興味の惹かれる任意の化学構造が含まれるが、これらに限らない。
【0005】
化合物スクリーニングの分野では、細胞を基とするアッセイは、細胞の回収を行う。測定した応答は、通常、細胞群全体の平均となる。例えば、イオンチャンネルアッセイに使用する通常の機器は、米国特許番号5,355,215に開示されている。典型的なアッセイは、イオン感受性色素の蛍光の時間依存の測定からなり、当該蛍光は、化学化合物の添加の結果として変化する目的イオンの細胞内濃度の尺度となる。当該色素を、測定前の時間におけるマルチウェルプレートのウェルの底に配置する。通常、細胞の応答は、強度および時間の両方において異質となる。この可変性により、化合物スクリーニングに重要な生物活性は不明確となり、妨げられる。当該異質性は、実験的な源から生じるが、より重要なことには、異質性は、任意の細胞群の基礎となる。他の間では、可変性の原因は、当該群のライフサイクルの相違の結果であるかまたは多数の活性標的分子の進化の分岐の結果である。可変性を和らげ、補い、または利用すらする方法により、化学化合物の薬理学的活性を特徴とする細胞を基とするアッセイの値が促進される。
【0006】
個々細胞の応答の定量により、細胞群の応答の不均一性により生ずる問題が回避される。群のマイナーフラクションが刺激に応答する場合を考えてみる。平均応答を測定する装置は、個々の細胞応答を測定した場合よりも低い感度となる。後者の方法から、活性細胞部分集合を選択し得る応答プロフィルの統計学的特徴が生ずる。さらなる群の特徴により、応答プロフィルの解釈を拡大する。
【0007】
種々の測定装置が、この必要性の取り組みを試みる従前の分野において用いられてきた。フロー−サイトメーターを基とするアッセイは広く実施され、ペンシルビーム(focused laser beam)に細胞を通過させると同時に細胞の性質を測定する。幾つかの不利がこの方法に付随する。医薬産業に最も重要なことは、アッセイが、マイクロタイタープレートに配置した化合物において容易に実施できないことである。更に、処理量が少なく、典型的にサンプルあたり10−100秒かかり、各細胞の観察時間は、1ms未満となり、力学的アッセイは妨げられ、最終的には細胞平均化シグナルのみが決定され得る。
【0008】
更に、多くのアッセイが、蛍光シグナルの相対的位置の決定に必要とされる。米国特許番号5,107,422および米国特許番号5,547,849に開示のスキャンニングサイトメーターと呼ばれる装置が、シグナル細胞のイメージ化に広く用いられる。許容される速度を得るためには、これら装置を低い分解能(〜5−10μm)で操作する。そのため、これら装置により、蛍光シグナルの配置における空間的情報を必要とするアッセイ用のフローサイトメーターを超える少々の利点が得られる。
【0009】
更なる他の技術は、高速カメラ(fast-camera)、全視野顕微鏡(full-field microscope)である。これら装置は、本発明に匹敵する解像度および速度で画像が得られる能力がある。しかし、それらは共焦的ではなく、結果的に蛍光のバックグラウンドに影響されやすく、光学的なサンプル区分に使用し得ない。さらに、同時に起こる、多数パラメーターのデータは容易に得られない。
【0010】
従前の技術とは対照的に、本発明を用い、化合物スクリーニングの使用に十分な早さおよび可変性を有する方法において単一細胞および細胞群の多数パラメーター蛍光イメージ化を実施し得る。方法および装置が提供され、個々細胞の原発性応答およびサンプル群の異質性の更なる測定の両方が得られ、そして分析される。更に、これら多数のフルオロホアの位置は、準細胞性分解能(sub-cellular resolution)で測定され得る。最終的に、本発明を用い、ビデオの速度で急速な変化をイメージし得る。同時に、これらの性能により、新規領域の研究が薬剤候補の作用機構に付与される。
【0011】
本発明は、発明である蛍光を基とする生化学アッセイにおいても用い得、幾分、表面シンチレーションアッセイ(“SSA”)に類似し、そのアッセイは、化学化合物のスクリーニングにより広く使用されている方法である。
【0012】
図1(a)−1(f)は、レセプター結合SSAのステップを示す。図1(a)では、選択されたレセプター12を有する可溶性膜10を、液体30を含むウェル20に加える。これら膜は、レセプターを発現する細胞から単離される。図1(b)では、放射標識リガンド14をウェルに加える。当該リガンドは、膜レセプターに対して高い結合親和性をもつことが知られている。最も通常の放射標識は、3H、35S、125I、33P及び32Pである。図1(c)では、ビーズ16をウェルに添加する。当該ビーズは、膜が強く付着する小麦胚凝集素のような物質で被覆されている。当該ビーズは、直径3−8μmであり、シンチラント(scintillant)をドープしたプラスチックで作られている。更に、図1(b)及び1(c)で示した操作の順序は、互いに入れ替えることができる。
【0013】
放射標識は、高エネルギー電子つまりベータ粒子を放出して崩壊するが、ベータ粒子は放射性同位元素に応じて停止するまでに約1−100μm移動する。放射標識がビーズに付着する膜に結合すると、ベータ粒子は、ビーズに到達し、ルミネセンスのバーストを起こす。放射標識が液体を通して分散する場合には、放出されたベータ粒子は、通常、ビーズ内のルミネセンスを励起しない。図1(d)では、放射標識の崩壊に起因するビーズのルミネセンスが検出される。図1(e)では、試験化合物18がウェルに添加される。アッセイの目的は、この化合物による放射標識化リガンドの置換の程度を測定することである。放射標識リガンドが置換されて、液体に分散すると、ビーズのルミネセンスは減少する。図1(f)では、ビーズのルミネセンスを再び検出する。ルミネセンスの減少を測定することにより、試験化合物の活性を測定し得る。
【0014】
図2(a)-2(f)は、レセプター結合SSAの他の実施態様を示す。この実施態様は、図1(a)-1(f)で示したのと本質的に同じである。但し、図2(a)-2(f)で示す実施態様では、ビーズを使用する代わりに、シンチラントでドープされたプラスチックで造られ、膜が粘着する物質で被覆されたウェル底22を用いる。その結果、ビーズのルミネセンスを検出する代わりに、図2(a)-2(f)で示される実施態様では、ウェル底のルミネセンスを検出する。
【0015】
図3(a)−3(d)は、酵素SSAの実施態様のステップを示す。図3(a)では、シンチラントでドープしたビーズ40に放射標識ペプチド42を付着させ、それを、液体60を含むウェル50に加える。図3(b)では、試験化合物44をウェルに加える。図3(c)では、酵素46をウェルに加える。酵素が阻害されなければ、酵素46によって、ビーズ40から放射標識ペプチド42が切断される。結果として放射標識が溶液中に分散し、放射標識の崩壊によるビーズ40のルミネセンスは生じない。他方、試験化合物が酵素46を(典型的には酵素の活性部位をブロックすることによって)阻害すると、酵素46は放射標識を切断せず、放射標識の崩壊によるビーズのルミネセンスが生ずる。図3(d)では、ビーズのルミネセンスを測定し、試験化合物の活性を測定する。
【0016】
図4(a)-4(d)は、酵素SSAの他の実施態様を示す。図4(a)では、放射標識されたペプチド42を、シンチラントでドープされたウェル底52に付着させる。図4(b)では、試験化合物44をウェルに加える。図4(c)では、酵素46をウェルに加える。図4(d)では、ウェル底のルミネセンスを測定し、試験化合物の活性を測定する。
【0017】
上記例により、通常のSSAの原理、すなわちシンチラントの放射崩壊時間内の多くの放射標識の変化により目的の活性をアッセイすることが示される。SSAの1つの魅力は、シンチラントに付着していない放射標識を洗浄ステップでウェルから除去する必要がないことである。
【0018】
ラジオイムノアッセイ(RIA)は、特定の型のレセプター結合アッセイであり、そのレセプターは抗体であり、そのリガンドは最もしばしば天然の、または合成のペプチド、タンパク質、炭化水素または小さな有機性分子である。RIAは、任意の調製サンプル中、最もしばしば血漿、骨髄、尿、または細胞抽出物のような生体サンプル中のリガンドの濃度を測定する間接的な方法である。標準的なRIAでは、抗体は、リガンドに対し特異的な親和性を有し、当該アッセイには、抗体、固定濃度の放射標識化リガンドおよび未知濃度の非標識リガンドが含まれる。当該非標識リガンドの濃度は、抗体への結合、およびそれによる標識化リガンドの結合の阻害の程度により測定される。RIAは、最もしばしば、洗浄ステップを伴う、非結合リガンドから結合リガンドを分離する必要のある異質アッセイとして実施される。RIAはまた、SSA配置を用い開発し、その抗体レセプターをシンチラント充填ビーズに付着させ、洗浄ステップを削除した。
【0019】
しかし、SSA及びRIAには、多くの不利な点がある。第一に、これらアッセイには、放射活性物質を扱う必要があり、そのため費用と時間がかかる。第二に、これらアッセイは、大きなウェルで効果があるのみである。ビーズ又はウェル底からのルミネセンス放出の速さは、ベータ粒子放出速度に比例する。典型的な3Hアッセイで検出される光子は、3H崩壊あたり1未満である。アッセイの速さを増すには、放射標識リガンドの量を増加させなければならず、それに応じて膜、ビーズ及び試験化合物の量を増加させなければならない。10−60秒間トリチウムSSAを実施するには、107個のビーズを用いなければならない。このビーズ量は、約150μLのウェルを必要とする。SSAは、多数の化合物のスクリーニングに望まれるμL体積のウェルには効果的ではない。
【0020】
以下に述べるように、実質的に本発明は、SSAおよびRIAの放射標識リガンドを蛍光標識リガンドと置換している。そうすることで、RIAの均一な形態が得られ、有利なことにSSAの均一形態は維持される。これは、特に、表面張力により洗浄が実施できないμL体積ウェルに重要である。しかし、均一な形態では、蛍光は、レセプター結合アッセイで示すように、問題となる。当該試験化合物を添加するとき、ある蛍光標識リガンドは置換され、ウェル体積全体に自由に分散し、その一方、他のものは膜に付着したままとなる。当該試験化合物の活性の測定に使用するのは、膜に付着した蛍光標識リガンドの蛍光である。しかし、蛍光が全ウェルから検出される場合、ウェルの体積中の蛍光標識リガンドからの放出により、膜に付着した蛍光標識リガンドからの放出が不明確となる。
【0021】
この問題に取り組む1つの方法が、Schroederらの米国特許番号5,355,215に記載されており、図5(a)および5(b)に示されている。Schroederらの方法によると、サンプルは、図5のAに示すように、斜角のウェルの底に向けられる光であるビーム134により照らされる。そのため、全ウェルは照らされない。更に、ビームが領域114を照らす一方、蛍光は、最も少ない量の照明を受けるウェル体積の下に位置する領域114aからのみ検出される。
【0022】
しかし、Schroederらの方法は、多くの不利な点を有する。第一に、ウェル底の小部分のみを検出するため、Schroederらの方法は、適度に大きいウェルにおいて十分な程度の正確性を伴い実施され得るのみである。1536ウェルプレートの約直径1mmのウェルに配置したサンプルのイメージ化には適当ではない。第二に、当該角度をなす照明の幾何学的制約により、高度アパーチャーコレクション光学(high numerical aperture collection optics)の使用、十分な感度に到達する必要性、およびウェルの底における、個々の細胞のようなミクロンサイズの物体をイメージ化する解像度が排除される。
【0023】
この問題への他のアプローチには、ポイントスキャン顕微鏡(point scan microscope)を用いる。例えば、Baerらの米国特許番号5,547,849では、ポイントスキャン共焦システム(point scan confocal system)の使用について記載する。Baerらは、ポイントスキャン共焦技術に固有のゆっくりとした画像獲得速度を、空間的分解能を犠牲にすることにより、増加する方法について記載する。例えば、10の因子によりサンプル上の照明ビームの直径を拡大するならば、次いで、照明領域は、ある条件下で100倍に増加し、スキャンは100倍早くなる。分解能を犠牲にして、速さの増加が到達される。更に、‘849特許で開示されるような当該スキャンニング方法に適する検出装置は、本発明に有利に使用される場合に、原理的に感度という点においてあまり質は良くない。最終的に、バックグラウンドの排除の程度は、分解能に従って、減少する。そのため、‘849特許に開示の装置は、本発明よりも、感度が低く、バックグラウンドが高く、分解能が低く、それらはすべて本出願において重要となる。
【0024】
本発明は、ライン-スキャン共焦点顕微鏡の新規実施態様を含む。ライン-スキャン共焦点顕微鏡は当分野に既知である。2つの典型的な実施態様は、米国特許出願番号5,452,125のWhiteらにより開示され、J. Microscopy 171 17-26 (1993)の図7に示されるBrakenhoffおよびVisscherにより刊行されたシステムである。両方とも、サンプルを通して照明を排除するスキャンニングミラーを使用する。同じミラーが蛍光放射をデスキャンする。スリットを用いる空間的フィルタリング後、肉眼で見るため蛍光をリスキャンする。振動ミラーの使用により、これら顕微鏡は視野を急速にスキャンし得る。ライン照明は、急速イメージ化を必要とする適用において原理的に有利となる。しかし、ポイント照明との比較としてのライン照明の関係に対応する、この可能な速度増加からは、イメージ化システムが、同時に、照明ラインに沿ったサンプルの各点から放出する光を検出し得るかどうか、理解し得るのみである。開示装置の本質的特徴は、物体面に結合する多種の独立検出エレメントを有する検出装置の使用である。
【0025】
本発明によると、サンプルは、“平面”中になければならず、イメージ化システムの焦点深度により平面の精密度が決定する。好ましい実施態様では、イメージ化領域は、1mm2であり、焦点深度は、10μmである。そのため、全フィールドが同時に焦点化されるならば、当該サンプルは100分の1について平坦でなければならない。これは、局所領域全体について(ウェル底の中心領域のような)多くのサンプルサブストレート(例えば、マイクロタイタープレート)にあてはまる。しかし、実際には、サンプルサブストレートは、全表面について平坦である必要性はない。〜100mmの程度のマイクロタイタープレートの場合、10,000分の1について平面が必要となる。
【0026】
本発明は、イメージ化されるサンプルサブストレートの“焦点”化部分に維持される光学的自動焦点システムを提供する。光学的自動焦点機構には、速いという利点、およびプラスチックマイクロタイタープレートおよび顕微鏡スライドのような非処理サブストレートを操作できるという利点がある。有利なことに、この焦点機構は、無視できるほどの遅延により操作され、すなわち、集束機構の応答時間が、獲得-時間、好ましくは秒のフラクションに比べて短い。本出願に適当な光学に基づく自動焦点機構は知られている。例えば、サーボ機構による制御に適当な位置エラーシグナル(position error signal)を生ずるための乱視レンズを基とするシステムは、Applied Optics 23 565-570 (1984)に開示されており、“斜めのビーム”を用いる焦点エラー検出システムは、SPIE 200 73-78 (1979)に開示されている。好ましい本発明の実施態様では、当該サンプルサブストレートはマイクロタイタープレートである。この場合、集束の好ましい達成手段は、更にプレートの性質に依存する。プレート底の厚さが、焦点深度のフラクション内で均一となるならば、物体面の不断性オフセットにおいて平面底を維持する集束機構が適当となる。目下、通常使用されているマイクロタイタープレートの均一性では不十分である。そのため、集束機構は、サンプルが存在する表面であって、典型的にマイクロタイタープレートのウェルの内側である表面を追跡しなければならない。本発明の態様は、マイクロタイタープレートのウェル底のような不連続性表面において急速に集束する新規自動焦点機構である。
【0027】
そのため、均一な形態において、正確に、素早く、そして安価に、多数の化学化合物をスクリーニングする方法および装置が必要である。加えて、個々細胞および準細胞性イベントのイメージに十分な分解能で、複数パラメーター蛍光イメージ化を実施し得る方法および装置が必要となる。ビデオの速度で、統計学的に重要な細胞群を追加的にモニターし得るイメージ化システムの必要性もある。
【0028】
本発明の要旨
本発明は、ライン−スキャン共焦点イメージングシステムおよび生物学的活性をアッセイするライン−スキャン共焦点イメージング(LCI)システムに関係する。
【0029】
好ましい実施態様では、ライン−スキャン共焦点イメージングシステムは、サンプルを照らすため複数波長のレーザー光源を用い、フルオロホアを励起し、電磁エネルギーを放射する。これら波長には、紫外線スペクトルおよび可視スペクトルが含まれる。
【0030】
本発明は、マイクロウェルプレートにおける急速の一連のアッセイを行い得、それは、素早くあるウェルから他のウェルに移動するが、共焦点顕微鏡固有の能力、薄い光学的区分(thin optical section)を分離するという利点は失わない、LCIシステムをつくり得る自動焦点能を用いることによる。
【0031】
本発明の種々の実施態様では、当該サンプルを移動させ、サンプル上の照明のラインのスキャンに効果を為す。他の実施態様では、振動ミラーを用い、固定化位置に維持させたサンプルのスキャンに効果を為す照明のラインを素早く移動させる。例の方法により、イメージは、秒あたり50フレームまでの早さで得られ得る。
【0032】
本発明は、神経又は筋肉細胞における活動電位の伝達のような急速に変化する生物学的事象を開始させる物質を添加することのできる内蔵分注系を提供する。
【0033】
本発明により、電荷結合素子(CCD)のようなマルチエレメント固体状態検出装置が好ましくは使用され得る。この装置は、好ましくは連続的に読み取る。好ましい実施態様では、本発明は直交座標表示CCD(rectangular CCD)を使用すると、完全二次元検出器の必要性が避けられ、より速いスピードで読み取ることができる。加えて、大きな有効な視野は、ステージスキャンニングの実施態様で達成し得る。
【0034】
本発明により、好ましい実施態様では、データ獲得と同時に限定化データ分析を行う能力もまた提供され、高処理のスクリーニングモードで操作し得る。
【0035】
本発明は、蛍光を用いる多種の生物学的アッセイを実施する方法を提供する。ある実施態様では、目的の標的は、固定化され、または生存細胞中にあり、または準細胞性細胞小器官中にあり、または細胞膜上にある。これらアッセイには、入射光の種々の波長に通常感受性である1つまたはそれ以上の蛍光標識の励起を必要とする1つまたはそれ以上のパラメーターの測定が含まれる。更に、これらアッセイは、二次元または三次元で位置付ける1つまたはそれ以上の波長の放射光の、同時および正確なイメージ化が必要とされ、蛍光的に標識された種およびその相関物の密度が測定される。
【0036】
更に、本発明は、蛍光放射による応答の単一イメージ化か、または同領域または細胞の素早く繰り返すイメージ化の何れかを必要とするアッセイを行う方法を提供する。種々の実施態様では、イメージ化は、秒あたり50フレームの早さで行われる。多数の波長および高い空間的分解能を伴う、迅速にイメージ化するこの能力により、本発明は、従来実施し得なかったアッセイを行えるか、または優れた方法で行い得る。
【0037】
本発明は、化学化合物をスクリーニングする幾つかの方法およびフルオロホアまたは蛍光プローブの使用を含む多くの型のアッセイを行い得る。通常、これらのアッセイおよびスクリーニング方法には、試験化合物および薬剤の使用が含まれ、それはの幾つかまたは全ては、蛍光標識でタグがつけられ本来的に蛍光性を有するか、または蛍光生成物中に代謝される。試験化合物および薬剤は種々の方法に合わされ得る。
【0038】
ある実施態様では、薬剤を、液体を含むウェルに添加する。これは、単一のウェルであるか、またはマルチウェルプレート上の多くのウェルのうち1つである。目的の生物学的活性は、ライン−スキャン共焦点顕微鏡で測定されるためウェルの底上かまたはウェルの底に位置するビーズの表面上に位置するフルオロホアの存在または非存在により、測定される。この実施態様は、SSA形態と共通する、検出種の局在化の活性の測定である。SSAの場合、局在化により、シンチラントに隣接する。本発明の方法では、局在化は、ウェルの領域となり、好ましくは底である。SSAの場合、隣接種に対する感度は、ベータ粒子の遅延時間により決定される。本発明では、局在化フルオロホアの感度は、共焦点顕微鏡のオプティカルセクショニングの深さにより決定される。
【0039】
更に、本発明は、素早く、自動化した方法の複数サンプルのスキャンニングを必要とする高処理アッセイを行い得る。これらサンプルは、個々のマイクロウェル中にあり、液体および生存もしくは固定化細胞または細胞成分を含むウェルを含む。本発明は、分析中に液体サンプルを保持するかまたは生存細胞を支持する必要のある環境調節をも提供する。
【0040】
本発明の詳細な説明
本明細書中に記載の全特許出願、刊行物、および他の参考文献は、すべて引用によりこの文書に加える。
【0041】
本発明が、疾患の処置用の薬理剤の同定に有用であるかどうか。1つまたはそれ以上の蛍光薬剤を用い生物学的応答を測定する多種の生物学的アッセイを行うための高処理方法を提供する。そのアッセイは、化学化合物または生物学的目的物の任意の分子において行われ得、それらには、コンビナトリアルライブラリーで見つかるもののような薬剤候補が含まれるがこれに限らない。更に、本発明は、細胞および組織サンプルの病状診断のための方法を提供する。本発明は、蛍光薬剤を用いる全細胞における薬剤候補の複数生物学的応答を示す方法をも提供する。
【0042】
本発明の技術をアッセイに用いると、当該データは、個々の細胞で、細胞性または準細胞性レベルで、得られ、そのため、統計的に意味のある細胞群のサンプルを構成する十分数の細胞において当該データが十分に速く得られる。本発明は、多数パラメーターにおいて同時に測定し得、また、個々細胞の複数シグナルと相関し得る。そのため、それを用い、異質性細胞応答をアッセイし、細胞の小さな部分集合に制限される応答をアッセイし得る。
【0043】
更に、本発明は、複数のシグナル経路の同時活性化をイメージとし得、同時におよび一定時間、複数のシグナルと相関し得る。この能力は、個々細胞の一時的応答または個々の細胞の一時的応答の比較が特異的アッセイを必要とするとき、きわめて重要である。
【0044】
更に、本発明は、非結合フルオロホアの存在下、または強力な薬剤候補を含む本質的な蛍光化学化合物の存在下、細胞の焦点面からの蛍光シグナルをイメージし得る。
【0045】
これらアッセイは、以下に限らないが、フルオレセイン、ローダミン、Texas Red、Amersham Corp. 染色 Cy3、Cy5、Cy5.5およびCy7、Hoechst's 核染色およびクマリン染色を含む、任意の既知フルオロホアまたは蛍光標識を使用し得る(Haugland R. P. Handbook of Fluorescent Probes and Research Chemicals 6th Ed., 1996, Molecular Probes, Inc., Eugene, Oregon参照)。
【0046】
これらのアッセイには、レセプター結合アッセイ、細胞内電気的ポテンシャルまたはpHのアッセイ、イオン濃度のアッセイ、酵素活性アッセイ、トラフィキングアッセイ(trafficking assay)、力学的イメージングアッセイ、およびあまり生じない細胞性イベントのアッセイが含まれるが、これらに限らない。
【0047】
レセプター結合および酵素活性アッセイは、ビーズを基とするアッセイか、または細胞を基とするアッセイである。ビーズを基とするアッセイの幾つかの例は、WO98/55866に開示されている。しかし、本明細書記載の方法は、ポイントスキャン共焦技術を使用し、当該ライン−スキャン共焦点イメージングシステムは、データ獲得の早さという点において重要な利点を有する。
【0048】
光学的配置
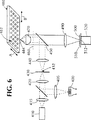
図6は、本発明の第一の実施態様を示す。当該顕微鏡は、電磁放射、例えば、光学的範囲350−750nmの光源400又は410、円筒型レンズ420、 第一スリットマスク430、第一リレーレンズ440、二色性ミラー450、対物レンズ470、サンプルウェル482の二次元的アレイを含むマイクロタイタープレート480、チューブレンズ490、フィルター500、第二スリットマスク510及び検出器520を含む。これらエレメントは、図6の面に垂直に広がるマスク430、510中のスリット口432、512を有する光学軸OAに沿って配置される。レンズ440、470及び490の焦点距離及びこれらレンズ同士の間隔、並びにマスク430とレンズ440との間隔、対物レンズ470とマイクロタイタープレート480との間隔、レンズ490とマスク510との間隔は、共焦点顕微鏡を与えるようにされる。この実施態様では、ランプ400又はレーザー410の電磁放射を、円筒型レンズ420を用いラインに焦点化される。ラインの形は、第一スリットマスク430により最適化される。当該スリットマスク430は、光学的システムの結像面つまり対象面との共役面として示される。スリットマスク430中の口432で形成される照明ストライプは、サンプルウェル482の二次元アレイを含むマイクロタイタープレート480上に、レンズ440、二色性ミラー450及び対物レンズ470によりリレーされる。説明の便宜上、図6の光学的エレメントは、断面図で示され、ウェルプレートは遠近法で示されている。ウェルプレート480上の照明のラインの投影はライン484で示され、また、図6の面に垂直であると理解される。矢印A及びBによって示されるように、ウェルプレート480は、図示していない手段によりアレイの次元に平行に2次元(X、Y)で移動し得る。
【0049】
他の実施態様では、スリットマスク430は、物体背面共焦面(objective back focal plane)(BFP)460との共役面である光学的システムのフーリエ面内に位置する。
【0050】
更に別の態様において、スリットマスク430を完全に除く。この態様にしたがって、光源はレーザー410であり、そこからの光を対物レンズ470の後焦点面460に集束させた。これは図6に示すように、円筒状レンズ420と球状レンズ440の組合わせにより達成でき、または照明を円筒状レンズ420により平面460に直接集束できる。
【0051】
サンプル領域、例えば、サンプルウェル482中のサンプルのイメージを、サンプル内の平面への照明ラインの投影により得、そこからの蛍光放射をディテクター520にイメージングし、プレート480を照明ラインに垂直な方向で移動させ、ディテクター520の読取と同調させる。図6に記載の態様において、蛍光放射を対物レンズ470で回収し、二色性ビームスプリッター450を通して投影させ、フィルター500及び第2スリットマスク510を通してレンズ490により、ディテクター520に、無限遠補正対物レンズ470を備えた共焦点イメージングシステムに適当なようにイメージさせる。二色性ビームスピリッター450及びフィルター500は、優先的にその照明波長で光を遮断する。ディテクター520は、例示的にカメラであり、一次元又は二次元のいずれかであり得る。一次元ディテクターを使用した場合、スリットマスク510は必要ない。照明、検出及びトランスレーション法は、指定された領域がイメージされるまで続ける。機械運動は、サンプルを連続的速度でトランスレートした場合、単純化される。連続運動は、カメラ読取時間が曝露時間と比較して小さい場合、最も有用である。好ましい態様において、カメラは連続的に読み取る。合わせた曝露時間及び読取時間中のサンプルの転置dは、照明ラインの幅Wよりも大きいか又は小さくてもよく、例示的に0.5W<d<5Wである。多ウェルプレートの全てのウェルを同じ方法でイメージできる。
【0052】
あるいは、顕微鏡を、主に光学システムの視野により限定される多くの隣接ウェルを通って照明ラインを集束するように構成できる。最終的に、1個以上の顕微鏡を同時に使用できる。
【0053】
照明ストライプ484の大きさおよび形は、対物レンズ後焦点面460におけるフーリエ変換ストライプの幅および長さにより決定する。例えば、ライン484の長さは460におけるラインの幅により決定され、逆に484の幅は460の長さにより決定される。回折限界性能に関して、460の照明ストライプの長さを対物レンズ後開口を一杯にするように選択する。照明ストライプ484のサイズおよび形は、円筒状レンズ420の焦点距離および420でのビームサイズの組合わせにより、即ち、各次元における有効な開口数により、対物レンズにおける収差および対物レンズ視野により負荷された制限内でコントロールされることは当業者には明白である。
【0054】
照明ライン484の次元は、シグナル対ノイズ比を最適化するために選択する。その結果、それらはサンプル依存的である。アッセイに依存して、解像度は回折限界の間、即ち、0.5μm以下および約5μmで変化し得る。ビーム長は、好ましくは対物レンズ視野、例示的に.5から1.5mmの間で決定する。Nikon ELWD, 0.6NA, 40X対物レンズは、例えば、約0.75mmの視野を有する。633nm放射で、この対物レンズでの回折限界解像度は約0.6μmまたは約1100解像度エレメントである。
【0055】
有効な深さ分解能は、原則として、スリットマスク510における開口512の幅、または一次元ディテクターの幅および対物レンズ470とレンズ490の組合わせにより作られたイメージ倍率により決定される。共焦点顕微鏡の最良の深さ分解能は1μmに近づく。本発明において、5−10μmの深さ分解能が十分であるか、有利でさえあり得る。
【0056】
例えば、目的のサンプル、例えば、生存細胞が十分に短いイメージ獲得時間で適当なシグナル対ノイズイメージを可能にする解析限界容量において不十分なフルオロフォアを含むとき、回折限界容量よりも大きい照射をし、放射を回収することが有利である。類似の状況は、イオンチャンネル開口のような一過性事象のビデオレート動態実験の場合に優勢である。実際に、これは対物レンズの後開口のアンダーフィリング(underfilling)により達成され、これは照明開口の直径の増加と同等である。照明の有効な開口数(“NA”)は対物レンズのNAよりも小さい。しかし、蛍光放射は、対物レンズの完全NAで回収される。開口512の幅はより大きな照明容量からの放射を検出するように増加すべきである。回折限界よりも数倍大きい開口幅で、幾何学的光学は検出容量エレメントのサイズに関して適当な近似を提供する:
側面幅:ad=dd/M
軸幅:zd√2ad/tanα
(式中、Mは倍率、ddは開口512の幅およびαは対物レンズ470により定められた半分角である)。本発明で、開口を有さず、検出開口512が独立して制御可能である態様における照明開口432またはその同等物は重要な部分である。
【0057】
多波長構成
多波長蛍光イメージングを可能にする態様は、あるタイプのアッセイに関して好ましい。2個またはそれ以上の測定を同時に成すことは、生物学的反応の一つの重要なパラメーターが時間であるため、有利であり、しばしば必要である。
【0058】
独立した波長又は色の数は行う具体的アッセイに依存する。一つの態様において、3つの照明波長を使用する。図8(a)及び8(b)は、3色ラインスキャン共焦点イメージングシステムにおける光線通過を記載し、おのおの平面図及び側面図である。一般に、システムは数個の電磁放射の源Sn、視準レンズLn、及び円筒状ラインCLにより第1空間フィルターで伸長したビームに集束される平行ビームを産生するためのミラーMn、第1空間フィルターの間の共焦点顕微鏡、及び第2空間フィルターSF2及びイメージングレンズIL、サンプルからの蛍光放射の異なる波長組成を分離し、検出するためのビームスピリッターDM1及びDM2及びディテクターDnを含む。空間フィルターSF、及びSF1及びSF2は、好ましくはスリットマスクである。
【0059】
特に、図8(a)は、色λ1、λ2およびλ3のための源S1、S2、およびS3および各々の源からの光を視準するレンズL1、L2およびL3を記載する。レンズL1、L2およびL3は、好ましくはシステム中の他のレンズの任意の色度を補うように調節する。ミラーM1、M2およびM3は、源Snからの照明色を合わせるために使用する。ミラーM2およびM1は部分的に伝達し、部分的に反射し、好ましくは2色性である。M2は、例えば、優先的にλ3を伝達し、優先的にλ2を反射する。したがって、λ3がλ2より大きいのが好ましい。
【0060】
共焦モードでの顕微鏡の操作は、源Snからの合わせた励起およびビームを、対象平面OP中の“ライン”に、または非常に偏心的楕円に集束させることが必要である。上記図6に関連して記載のように、種々の構成をこれの達成のために使用し得る。図8に記載の態様において、合わせた照明ビームを、空間フィルターSF1におけるスリットと一致した伸長した楕円に、円筒状レンズCLにより集束させる。図8aおよび8bに記載のように、スリットマスクSF1は、システムのイメージ平面に残り、照明光の伝搬に垂直の平面の軸に沿って、図8aのページの平面における長軸と共に配置される。レンズTLおよびOLはSF1を含む平面からの照明ラインを対象平面OPに中継する。回転ミラーTMは簡便のためである。他の態様において、DM3はTLとOLの間であり、CLは照明光を直接BFPに集束させる。他の対応は当業者には明白である。
【0061】
図8(b)に関して、サンプルにより放射され、対物レンズOLにより集められた光を、空間フィルターSF2上に管状レンズTLによりイメージする。SF2は優先的に伸長したページの平面に垂直なように配置されたスリットである。SF2は主要イメージ平面またはそれに隣接した平面に置かれ得る。DM3は部分的に反射し、部分的に伝播し、好ましくは“多色性”である。優先的にある波長バンドを反射し、優先的に他のものを伝搬する多波長“二色性”ミラー、または“多色性”ミラーが得られ得る。
【0062】
Dλ1はλ1により励起される蛍光放射と定義される。これは、一般に、λ1より幾分長い波長の分散である。δλ2およびδλ3は同様に定義される。DM3は優先的にλnを反射し、優先的にδλnを伝搬し、n=1、2、3である。SF2により伝搬される光は、一次イメージ平面に隣接した平面にある検出デバイスにイメージされる。図8(a)において、空間フィルターSF2のイメージは全3個のディテクターDn上にレンズILにより作られる。この態様は、各々のディテクターにより作られたイメージの間の完全に近い記載が要求される適用において好ましい。他の態様において、個々のレンズILnは検出デバイスと結合し、レンズ対ILおよびILnは空間フィルターSF2のイメージの各々のディテクターDn上への中継に働く。光はミラーDM1およびDM2によりディテクター間に分けられる。ミラーは、部分的に伝搬し、部分的に反射し、優先的に二色性である。DM1は優先的にδλ1を反射し、優先的にδλ2およびδλ3を伝搬する。遮断フィルターBF1は優先的にδλ1を伝搬し、存在する他の全ての波長を有効に遮断する。DM2は優先的にδλ2を反射し、優先的にδλ3を伝搬する。遮断フィルターBF2およびBF3は、優先的にδλ2およびδλ3を各々伝搬し、存在する他の全ての波長を有効に遮断する。
【0063】
走査ミラー構成
本発明のある態様において、高感度データ獲得がビデオレートでのイメージの構成に必要である。ビデオレートイメージングは、一般に1秒当たり30または60フレームを意味する。現在の使用において、30Hzの桁のフレーム速度が暗示を意図する。好ましい態様において、ビデオレートイメージングは、照明およびサンプルの相対的なトランスレーションを行うために、サンプル平面の一次元に沿った照明およびそれに垂直な方向での照明ビームの走査により達成される。走査段階は一般的に大規模である。結論として、十分に速く移動できない。
【0064】
図9は走査ミラーSMを使用した本発明の態様を記載する。ミラーは、有利には対象後焦点面(BFP)に隣接しておかれる。BFP(またはそれに隣接した平面)の回転は、対象平面(OP)およびその隣接平面を移動をさせる。SMの完全走査範囲は、レンズRL1およびRL2の焦点レンズの典型的値に対して数度のみ必要である。図9に示すように、このレンズペアはBFPをSMに1の倍率でイメージするが、種々の倍率が有利には使用できる。イメージ獲得速度の制限因子はカメラ読取速度およびシグナル強度である。上記のイメージングモードにおいて、データはカメラ読取速度、例示的には1MHzで連続して獲得できる。スキャンニングミラーにより、データを一方向で獲得するのが好ましい。連続的にデータを獲得できる理想化したスキャンニングモーションは、のこの歯である。実施に際し、転回およびリターン走査時間は、走査時間の〜1/3−2/3を成す。50%の待ち時間を考慮して、50Hzのミラー振動頻度および1mHzのピクセル獲得速度、〜10,000ピクセルが50フレームで1秒当たり1フレーム当たりで獲得され、これは細胞のような個々の対象の定義およびフレームからフレームへのトラックに十分である。イメージ当たり104ピクセルが、しかし、上記で一般的に考慮されるよりも102−時間短かった。適応に依存して、相対的に小さいイメージを高い解像度で、たとえば、50−μm×50−μmで0.5μm×0.5−μmピクセレーション、または相対的に大きなイメージを低い解像度、例えば、200−μm×200−μmを2−μmピクセレーションで獲得するのが有利である。
【0065】
自動焦点
本発明にしたがって、サンプルはイメージングシステムの対象平面になければならない。したがって、本発明はサンプルの部分を、システムの対象平面内のイメージングシステムの視野において維持する自動焦点機構を提供する。平面の精度はシステムの被写界深度により決定する。好ましい態様において、被写界深度は約10μm、および視野は約1mm2である。
【0066】
記載の自動焦点システムは、取るに足りない遅れで作動し、即ち、反応時間はイメージ獲得時間に対して短く、例示的に0.01−0.1sである。加えて、自動焦点光源は照明光源およびサンプル特性と無関係である。他の利点の中で、この構成はサンプル担体の、対象平面の位置と無関係に測定するイメージングシステムの光軸に沿った位置を可能にする。
【0067】
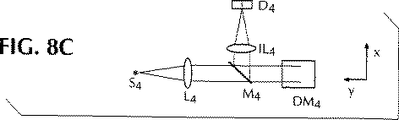
単一ビーム自動焦点の一つの態様は、図8および9に提供され、そこでは波長λ4の別の光源S4およびディテクターD4が示される。波長λ4はサンプル蛍光から必ず区別されなければならず、有意にはサンプル中の感知できる蛍光を励起しない波長である。このようにλ4は有意には近赤外線波長、例示的に800−1000nmである。部分的に伝達し、部分的に反射するミラーD4は有意には二色性であり、λ4を反射し、λnおよびδλnを伝達する、n=1、2、3。本発明に適した光学ベースの自動焦点機構は既知である。例えば、サーボ制御に適した位置エラーシグナルの発生のためのアスチグマチックレンズベースのシステムが、Applied Optics 23 565-570 (1984)に記載されている。“斜めビーム”を使用した焦点エラー検出システムがSPIE 200 73-78 (1979)に記載される。後者の実験は、図8および9に容易に実行でき、D4は分割されたディテクターである。
【0068】
ウェル底にあるサンプルを伴うマイクロタイタープレートでの使用のために、しかし、サーボループがウェル間を移動するために破壊されなければならない。これは、各時間に照明を他のウェルに移動させる再焦点の必要があるため、実質的な時間の遅れをもたらし得る。
【0069】
サンプル平面および対象平面の相対的位置の連続閉鎖ループが、本発明の好ましい態様で提供され、図10に示す。このシステムは電磁放射の二つの独立したビームを使用する。S5に由来するひとつは連続表面に集束され、例示的にマイクロタイタープレートの底である。S4に由来する他方は不連続表面に集束され、例示的にマイクロタイタープレートのウェル底である。一つの態様において、S4およびS5に由来するビームは各々波長λ4およびλ5を有する。λ5はL4により視準され、絞りI4により開口され、対物レンズOLにより不連続表面に集束される。反射光はレンズIL4およびIL5により各々ディテクターD4およびD5に集束される。部分的に伝搬し、部分的に反射するミラーDM4は好ましくは二色性であり、λ4およびλ5を反射し、λnおよびδλnを伝搬する、n=1、2、3。ミラー、M4、M5およびM6は部部的に伝搬し、部分的に反射する。λ4およびλ5が区別される場合、M6は優先的に二色性である。
【0070】
サンプルがマイクロタイタープレートに存在する態様により、λ4はウェル底に集束される。対象平面はウェル底から種々の距離でオフセットされる。これはL4の調節により、あるいはサーボコントロールループのオフセット調節により達成される。記載の簡便化のために、λ4が対象平面に集束されると仮定する。
【0071】
自動焦点システムの操作は下記の通りである。サンプルウェルの底が対物レンズOLの焦点平面中でない場合、ディテクターD4はエラーシグナルを発し、これはスイッチSWを通ってZコントロールに供給される。Zコントロールはマイクロタイタープレートを対物レンズに向かってまたは離れて移動するようにモーターをコントロールする(示していない)。あるいは、Zコントロールは対物レンズを動かせる。マイクロタイタープレートの底PBがレンズCFLと対物レンズOLの組合わせの焦点平面にない場合、ディテクターD5はスイッチSWを経由してZコントロールに適応されるエラーシグナルを産生する。XYコントロールはレンズOLの対象平面OPにおけるマイクロタイタープレートを移動するためのモーターをコントロールする(示していない)。
【0072】
示されるように、全スキャンはコンピューターのコントロール下にある。例示的スキャンは下記の通りである:特定のウェルのイメージの完了のために、コンピューターはSWを操作してD4により産生されたエラーシグナルからD5に産生されたものにサーボ機構のコントロールを切換えるようにする;次いで、コンピューターはXYコントロールを次のウェルに平面が移動するように向け、その後サーボがD4に切換えて戻す。
【0073】
プレートの底からのシグナルを利用する“粗野”集束機構は、サンプルの位置を、ウェルからウェル変化内に維持するように使用し、試験するために“精細”機構が必要な範囲を最小化する。もし、例えば、絞りI5の直径が2mmであり、IL5が100mmである場合、ディテクター上のイメージサイズは〜100μmである。同様に、絞りI4の直径が0.5mmおよびIL4が100mmである場合、ディテクター上のイメージサイズは〜400μmである。後者は、“粗野”焦点として機能するために、低い感受性を選択する。
【0074】
上記の1ビーム態様で、波長λ4およびλ5はサンプル蛍光から必ず区別され、サンプル中で検出できる波長を優先的に励起できない波長である。このように、λ4およびλ5は優先的に、800−1000nmのような近赤外である。加えて、二つの波長は好ましくは区別され、例えば、λ4=830nm、λ5=980nmである。
【0075】
2ビーム自動焦点の別の態様において、λ4=λ5であり、二つのビームは同じ源に由来し得る。優先的に、二つのビームは互いに垂直に偏光され、M6は偏光ビームスピリッターである。
擬似閉鎖ループコントロールが、下記のように操作する1ビーム自動焦点の好ましい態様で提供される。走査の最後に、コンピューターはSWを操作し、サンプルホールドデバイスをコントロールするようにスイッチし、これはZコントロールアウトプットを一定レベルに保つが、プレートは次のウェルに移り、その後SWはD4に切換えて戻す。
【0076】
検出デバイス
記載の装置の必須の特性は、種々の、独立した検出エレメントを対象平面に隣接した平面に有する検出装置の使用である。上記のように、ライン照明は、急速イメージングを必要とする適用に主として有利である。ライン照明の点照明と比較した比較における可能性のある速度増加は、照明ラインに沿ったサンプルの各点から放出される光の検出が同時に可能であるイメージングシステムでのみ実感される。
【0077】
電荷結合素子(CCD)、または他のカメラを、上記の先行技術のイメージングシステムの出力に置くことが可能である(White et al., US 5,452,125およびBrakenhoff and Visscher, J. Microscopy 171 17-26 (1993))。得られる装置は本発明と比較して3つの欠点を有する。一つはイメージの二次元ディテクターへの再走査の必要性であり、これは装置に不必要な複雑さを加える。他は、カメラを典型的に構成する1000ピクセル×1000ピクセルアレイにわたる十分な質を有する完全二次元ディテクターの必要性である。第3の欠点は、二次元デバイスからの完全イメージの読取に必要な付加的時間である。
【0078】
本発明は、これらの欠点を除き、高感受性および低ノイズ検出の束縛の中でのイメージング速度だけでなく、スループットも最適化するために設計する。一つの態様は、連続読取ラインカメラを使用し、好ましい態様において、方形CCDをラインカメラとして使用する。両方の態様はイメージ内のライン間またはイメージの間に待ち時間がない。本発明の更なる利点は、大きい有効な視野が、下記のステージ走査態様で達成可能であることである。
【0079】
検出デバイスに必要な特性は、以下の好ましい態様を考慮して更により明確となり得る。対物レンズの解像度限界は<1μm、典型的に〜0.5μmであり、ディテクターは〜1000の独立したエレメントのアレイを含む。解像度、視野(FOV)およびイメージ獲得速度は別々には変わらず、これらの性能パラメーターの中で必要とする妥協である。一般に光学システムの倍率は解像度を犠牲にすることなく、できる限りFOV程大きくするために設定される。例えば、〜1mm視野は1000エレメントアレイを1−μmピクセレーションでイメージする。検出エレメントが20−μm平方である場合、システム倍率は20×である。これは1−μm解像度をもたらさないことは注意である。ピクセレーションは解像度と同じではない。例えば、対物レンズの固有の解像限界が0.5μmであり、対象平面における各々0.5×0.5μm領域がピクセルに写像される場合、得られるデジタルイメージの真の解像度は0.5μmではない。真の0.5−μm解像度の達成のために、ピクセレーションは、対象平面で領域〜0.2μm×0.2μmに対応する必要がある。一つの好ましい態様において、イメージングシステムの倍率は、光学の真の解像度を達成するために設定する。
【0080】
現在、本出願のための十分な読み出しスピードを有する最大の検出効果、最低のノイズ検出デバイスは、CCDカメラである。図11のように、方形CCDカメラは、検出エレメントのm×nアレイ(mが実質的にnより小さい)を有するものとして描かれる。蛍光放射のイメージは、好ましくは読取記録に直ぐ近くである一つの列をカバーする。これは移動時間を最小にし、放射列と読取記録の間の列からのシグナルのスプリアスのカウントの蓄積を避ける。
【0081】
原則として、光学系の倍率を設定でき、CCDカメラ上のイメージのスリットSF2の高さは、図11に記載のように1ピクセルである。実施において、照明ラインとカメラ列軸の間の完全な配置を維持することは難しく、図8および9のように、3つのカメラと多波長照明の態様の間の配置を維持することは更に難しい。検出エレメント、例示的に2から5個のいくつかをカメラの各カラムに一緒に収納することにより、配置条件は緩くなり得るが、読取ノイズまたは読取時間の最小のペナルティに苦しむ。
【0082】
各々対象平面との共役面に配列された、図8、9及び図6の510における、可変幅検出空間フィルターSF2に関連した検出デバイスとして1個又はそれ以上の方形CCDカメラを有する好ましい態様の更なる利点は、以下のように説明される。上記のように、本発明の一つの態様において、検出空間フィルターが除かれ、ラインカメラを組合わせ検出空間フィルター及び検出デバイスとして使用する。しかし、上記また上記のように、可変幅検出空間フィルターは検出容量の最適化を可能にし、サンプル依存的シグナル対ノイズ比の検出を最適化する。以下の好ましい態様は、ラインカメラの利点、即ち、速度及び可変検出容量の柔軟性を残す。倍率は回折限界線の高さhをカメラの一つの列に造影するようにセットする。検出空間フィルターdの幅は、好ましくはh<d<10hで変化する。カメラの照射カラムにおけるディテクターは読取の前に収納され、それは曝露及び読取時間に比較して取るにたらない時間を必要とする操作である。
【0083】
好ましい態様において、カメラはPrinceton Instruments NTE/CCD-1340/100-EMDである。好ましい態様における読取速度は、読取ノイズの数電子で1MHzである。ピクセル形式は1340×100であり、カメラは、目的の領域から離れて列の大部分(80%)を移動するように配線し得、カメラを効果的に1340×20とする。
【0084】
連続読取カメラの利点、即ち、連続蓄積の間の待ち時間を無くす上記の利点に加えて、更なる利点は、サンプルの広さによってのみ限定された長さを有する方形像の獲得を可能にすることである。長さは、カメラの幅によって少ない程度、およびライン照明の範囲まで測定される。好ましい態様において、サンプルは96ウェルマイクロタイタープレートのウェルの底に配置され、その直径は7mmである。1μm×1mmのストリップが照射し、照射領域から放出される発光を検出デバイス上にイメージする。光学縦列を、視野が〜1mm2であるように設計する。本発明により、ウェル底のイメージは1×7mm視野にわたり1−μmピクレセーションを産生できる。
【0085】
環境コントロール
本発明の態様において、アッセイは生存細胞で行う。生存細胞は適当に作動するための生理学的条件の理論的近似をしばしば必要とする。とりわけ重要なパラメーターは温度である。特にサンプルの温度を37℃に保つための、温度を上昇または低下させる手段の包含が望ましい。他の態様において、相対的湿度および/またはCO2および/またはO2のコントロールが生存細胞の生存能の維持に必要である。加えて、蒸発を最小にするための湿度のコントロールは、小サンプル容量の場合重要である。
【0086】
LCIシステムと同等である、上昇した温度、好ましくは37℃で、マイクロタイタープレートを提供する3つの態様は下記である。
イメージングシステムは好ましくは耐光性囲いの中にある。第1の態様において、サンプルプレートを、囲いの内部温度を所望の温度に維持することにより、その温度に維持する。しかし37℃で、上昇した湿度が意図的に維持されない限り、蒸発冷却がサンプル容量をアッセイ期間中に限定して減少される。
【0087】
第2の態様は、固定カバー下をプレートが移動できるようにしたマイクロウェルプレートの加熱カバーを提供する。カバーは顕微鏡の光軸に配置したウェルの上に一つの開口部を有する。加熱カバープレートとマイクロウェルプレートの間の約0.5mmの空間は、マイクロウェルプレートの移動を自由にし、蒸発を最小化する。応答指令信号を送るウェルの中身が最大数秒、ディスペンサー開口部を通して環境条件に曝され、該中身は測定中、有意な温度変化を受けない。
【0088】
第3の態様において、薄い、加熱したサファイアウィンドーをプレート底囲いとして使用する。抵抗性ヒーターのウェルセパレーターに沿ったパターンはウィンドー温度を所望のレベルに維持する。
更なる態様において、3つの記載法を種々に組合わせることができる。
【0089】
統合ディスペンサー
イメージングシステムのビデオレート構成の一つの態様は、更に時間試薬分配の動力学アッセイ、特にイオンチャンネルアッセイを開始するために構成される。チャンネル開口の開始は、溶液のマイクロウェルへの分配により達成される。例えば、ボルト−ゲートチャンネルはKClの溶液を添加し、血漿膜を脱分極することにより開くことができる。チャンネル開口および続く閉鎖の時間依存性および対応する細胞内濃度の変化は、しばしば必要なビデオレートイメージングに十分速い。イメージングシステムの固有な速度は、しかし、チャンネル反応が急速に開始できないかぎり、無関係である。
【0090】
本発明の一つの態様は、統合ディスペンサーを提供する。96または384ウェルプレートで行うアッセイのために、20−100μLの範囲の付加的容量が望ましい。イオンチャンネル活性のアゴニストに加えて、例えば、適当である一ヘッドディスペンサーはIVEK Dispense 2000である。同等なユニットがCAVROから入手可能である。より一般的に、独得な化合物を各ウェルに分配できることが望ましい。一つの態様は、分析ステーション、独得な化合物を含む源プレートおよびチップ洗浄ステーションの間をディスペンスヘッドを往復させる、ロボット運動のデバイス上に1ヘッドディスペンサーを提供する。後者は固定チップディスペンサーのための洗浄ステーションおよび使い捨てチップディスペンサーのためのチップ交換ステーションである。このシステムは相対的に高価ではなく所望の機能を提供するが、低いスループットであり、化合物吸引−分配−洗浄サイクルあたり約30秒必要とする。別の態様は、Hamilton Microlab MPH-96のようなマルチヘッドディスペンサーの記載のLCIシステムへの統合により提供される。MPH-96は、上記の吸引−分配−洗浄サイクルを実行することができるロボット運動のデバイス上に乗せられた96個の独立した固定チップディスペンサーを含む。
【0091】
自動スクリーニングアッセイに用いられる本発明の更に好ましい対応において、イメージングシステムがZymark Twisterのようなプレートハンドリングロボットと統合される。
【0092】
暗視野共焦点構成
所望の側面回折が回折限界よりも小さい場合、上清液体によるバックグラウンド蛍光を暗視野イメージング法の発明的適応により減少できる。図12(a)および12(b)は慣用の暗視野における光線通過を記載する。図12(a)において、サンプル600を、対物レンズ620からの光610の中空円錐により照射する。この光の円錐は、例えば、図10(a)のレンズ440に不透明バー630を置くことにより作る。図12(b)において、サンプル600からの蛍光放射を次いで対物レンズ620の中心を通して集める。照明および回収の角度の差異により、照射および検出の両方をされる平面のみがサンプル600を含む平面である。
【0093】
図13(a)および13(b)は、逆暗視野を通過する光線を記載する。図13(a)において、サンプル700を、対物レンズ720の中心を通る光のビーム710で照射する。図13(b)において、次いで、蛍光放射を対物レンズ720の外側の周りのみから回収する。対物の外側の周りからの回収は、例えば、図10(a)におけるレンズ490への不透明バー730の配置により達成し得る。慣用の暗視野と同様に、逆暗視野は一つの角度での照明および異なる角度での回収を含み、サンプル平面のみが照射および検出の両方をされる。
【0094】
図14は、サンプル平面の回折限界領域よりも大きく照射することが有利である、上記に記載の場合の焦点領域を記載する。照明及び回収光線は図13の逆暗視野幾何学と同様である。遮断物が、照明ビームに適合した幅を有する対物逆焦点平面に共役しておかれる場合、暗視野構成が達成される。この配置が、ディテクターにおける平面外蛍光衝突の減少に寄与することは図14から理解できる。対物レンズの上及び下の暗くされた領域からの蛍光は遮断物により通過しない。点走査共焦点において、これらの平面外領域からの蛍光は、検出開口により効率的に拒絶される。ライン走査とも焦点において、ラインに沿った一つの側面位置からの平面外蛍光は、他の点でラインに沿ったバックグラウンドシグナルに寄与する;これは点走査共焦点に対したライン走査におけるシグナル対バックグラウンドにおける分解の起源である。ラインスキャン共焦点の逆暗視野構成は、点スキャン共焦点の特性であるバックグラウンド拒絶の有意なフラクションを回復するが、ラインスキャン構成の速度の利点は残したままである。
【0095】
リアルタイムデータ分析
本発明は、1秒当たりメガバイトのデータの産生が連続的にできる。一つの態様において、システムは速い高密度、高容量貯蔵デバイスと統合され、それにデータが続く分析のためにリアルタイムでスプールされる。好ましい態様において、データ分析はデータ獲得と本質的に同じように流れる。このように、データは貯蔵前に処理される。一般に、分析の結果だけでなく、有利には生データを同時にアーカイブに貯蔵する。
【0096】
実時間分析ルーチンの数例を各アッセイ群と関連づけて以下に提供する。すべての事例において、手法は対象のハードウエア・プラットフォーム上で操作ソフトウエアコードを最適化するために用いる。現時点で好適な実施態様において、コンピューターはペンティアムなどの32ビットプロセッサーである。この場合、すべてのデータは32ビットパーセルにてアクセスする。
【0097】
一般に、データの入手と分析は多くの個々のプロセスを含んでなる。第一に、蛍光を1つ以上のディジタル画像に変換するが、そこでのディジタル値は検出装置の各画素に投射する蛍光放射の強度に比例する。この工程内で、視野全般にわたる画像システムの不均一な応答に対して補正がなされるが、その際、バックグランドを差引いたデータがいわゆるフラット−フィールド−ファイルによって分割される。第二に、2進ビットマップをディジタル画像の1つから生成させるが、そこで一定の基準に合致するすべての値を1に置換え、この基準に合致しないすべての値は0に置換える。一実施態様において、この基準は画像それ自体から決定される閾値を包含する。第三に、ビットマップは連続した値の群−1画素を検索する。一実施態様において、該群はさらに最小−および/または最大−サイズの基準に対して試験を受ける。第四に、適格な群につて、同じ画像または他の画像において対応する画素の値を呼び出して記録し、そして全体の平均と他の統計的特性を決定し、記録する。種々のアッセイに適切なこの基本的手法に追加する手法および変化を以下に検討する。
【0098】
アッセイ
以下に記載するアッセイ法の多くの変法は本発明により実用化することができる。一般に、1種以上の蛍光標識体の特徴的な空間的および/または一過性の分布がアッセイを定量化するために用いられる。都合のよいことに、蛍光は線走査共焦点顕微鏡を用いて実質的に平坦な表面から観察される。このセクションを関連するデータ分析ルーチンにおいて、複雑さの程度が増大するのに概ね従ってアッセイ−タイプにより系統立てる。しかし、系統立てるのは厳密なものではない、と言うのは、分析のアルゴリズムが1つ以上のアッセイ−タイプにもしばしば適用し得るからである。
【0099】
結合アッセイ
本発明方法に従い有利に実施し得る第一のアッセイ−タイプは結合アッセイである。一般に、蛍光標識したリガンドが対象の標的に結合する度合いは、少なくともその標的と標識化リガンドを含むサンプルの1つ以上の蛍光画像を分析することにより定量し、開示した線走査共焦点画像システムにより得られる。利用されるリガンドは、これらに限定されるものではないが、発蛍光団が会合した天然および合成ペプチドとタンパク質、糖、脂質、核酸配列、ウイルス粒子、バクテリオファージ粒子、天然および合成毒素、既知薬剤、神経伝達物質の小型有機分子または合成類似体または固有の蛍光性小分子、ペプチドまたはタンパク質、コンビナトリアルライブラリーからの合成化合物、無作為のペプチド、cDNA発現ライブラリーからのタンパク質、およびペプチド模倣体などである(Haugland R. P. 蛍光プローブと研究用試薬ハンドブック、第6版、18章、参照)。標的としては、これらに限定されるものではないが、レセプターの細胞抽出物または精製品、リガンド関門およびイオン関門チャンネルタンパク質、酵素、転写因子、細胞骨格タンパク質および抗体などであり、これらはウイルス、バクテリア、バクテリオファージ、無脊椎動物および脊椎動物の細胞から誘導し得る。代表的なレセプターは、これらに限定されるものではないが、アセチルコリン、アドレナリン作動性物質(αおよびβ)、ムスカリン性物質、ドーパミン、グリシン、グルタミン、セロトニン、アスパラギン酸、γ−アミノ酪酸(GABA)、ピュリナージック物質、ヒスタミン、ノルエピネフィリン、サブスタンスP、神経ペプチドY、エンケファリン、ニューロテンシン、コレシストキニン(CCK)、エンドルフィン(オピオイド)、メラノクロチン/ACTH、ソマトスタチン、副甲状腺ホルモン、成長ホルモン、チロトロピン、チロキシン、サイトカイン、ケモカイン、インシュリン、インシュリン様成長因子(IGF)、幹細胞因子、黄体形成ホルモン放出ホルモン、ゴナドトロピン、アンギオテンシン、エンドセリン、ニューロテンシン、インターフェロン、ブラジキニン、バソプレッシン、オキシトシン、血管作動性腸内ポリペプチド(VIP)、副腎皮質刺激ホルモン放出ホルモン、ニューロトロフィン、エリスロポエチン、プロスタグランジン、ロイコトリエン、トロンボキサンA2、カルシトニン、T細胞、LDL/HDL、表皮成長因子(EGF)、エストロゲン、およびガライナンなどを包含する。
【0100】
ビーズ−ベースの結合
図15(a)〜15(f)は本発明により実施し得るレセプター−結合アッセイの実施態様工程を図示するものである。図15(a)において、細胞または組織から調製し、レセプター標的212を含む膜210を、液体230を含むウエル220に加える。図15(b)においては、蛍光標識リガンド214をウエル220に加える;これらのリガンドは膜レセプター212に結合する。図15(c)においては、ビーズ224をウエル220に加える。あるいは、15(b)と15(c)の順序は互いに入れ替えることも可能であり、好適な実施態様において、膜被覆ビーズはウエルに加える前に別途に調製する。ビーズ224は約1〜20μmの範囲の直径を有し、コムギ胚芽アグルチニンなどの物質で被覆されており、それに対して膜210が接着するか、または膜の直接共有結合または非共有結合を可能とする表面を有する。
【0101】
前記の工程は、標識が放射活性ではなく蛍光であること以外、図1(a)〜1(f)に描写した先行技術SSAの対応する工程と同じである。しかし、本発明において、ビーズ224は発光体ではなく、それらはウエルの底に沈むか、または遠沈し得る密度を有するか、あるいは磁性であって外部から磁石を用いウエルの底に移動させ得るようなものである。図15(d)においては、蛍光標識体を、例えば、要素240として図解した線共焦点顕微鏡を用い、画像化する。図15(e)においては、試験化合物218をウエルに加える。先行技術アッセイでのように、本アッセイの目的は、試験化合物がどの程度、膜レセプター212からの蛍光標識リガンド214に置き換わるかを定量することである。図15(f)においては、膜210になお結合している蛍光標識物を画像化する。2つの蛍光画像を比較することにより、試験化合物の活性を定量することができる。
【0102】
図15(a)〜15(f)に示したアッセイの替わり得る実施態様において、図15(d)に示した画像化工程は除いてもよく、また、試験化合物の活性は、図15(f)にて得られた画像を対照ウエルの画像またはウエルに添加された蛍光標識リガンドの既知量から予測される画像およびレセプターに対する既知の親和性に比較することにより定量することができる。
【0103】
図15(a)〜15(f)に示したアッセイの特定の実施態様において、該レセプターはリガンドを認識する抗体であり、蛍光標識リガンドは未知量の非標識リガンドを含むサンプルと共に反応に加える。先行技術の放射免疫アッセイにおけるように、本アッセイの目的はサンプル中の非標識リガンドの濃度を、それがどの程度、抗体レセプターからの蛍光標識リガンド214に置き換わるかを測定することにより定量することである。
【0104】
表面結合
図16(a)〜16(f)は本発明によるレセプター−結合アッセイの第二の実施態様工程を図示するものである。図16(a)において、細胞または組織から調製し、レセプター標的252を含む膜250を、液体270を含むウエル260に加える。ウエルの底部262はコムギ胚芽アグルチニンなどの物質で被覆し、そこに膜が接着する。図16(b)にて、膜250がこの物質に結合した様子を示す。図16(c)では、蛍光標識リガンド254をウエル260に加え、膜レセプター252に結合させる。また、図16(b)と16(c)の順序は入れ替えてもよい。
【0105】
図16(d)では、蛍光標識体の蛍光を、例えば、要素280に図解した線走査共焦点顕微鏡を用い、画像化する。図16(e)では、試験化合物258をウエル260に加える。図16(f)では、膜250になお付着している蛍光標識体を画像化し、第一の画像と比較して試験化合物258の活性を定量する。
【0106】
図16(a)〜16(f)に示したアッセイの替わり得る実施態様において、図16(d)に示した画像化工程は除いてもよく、また、試験化合物の活性は、図16(f)にて得られた画像を対照ウエルの画像またはウエルに添加された蛍光標識リガンドの既知量から予測される画像およびレセプターに対する既知の親和性に比較することにより定量することができる。
【0107】
細胞ベースの結合
替わり得る実施態様において、リガンド標的結合は標的を発現する細胞のコレクションに関して有利にアッセイされる。一般に、化学化合物をスクリーニングする細胞ベースのアッセイには多くの利点がある。とりわけ、対象物の活性は、該化合物の生物活性に影響する細胞の競合過程および相補過程双方の存在下に測定する。細胞アッセイにおいて、細胞系または組織から調製した細胞は組織培養ウエルに入れるか、または顕微鏡スライド上に置く。細胞は生存していてもよく、また未処理であるか、またはジゴキシゲニンなどの試薬により透過性を上昇してあるか、あるいはまた、ホルムアルデヒドなどの試薬で固定してもよい。1種以上の蛍光標識リガンドをアッセイに必要な非蛍光試薬と共に細胞に添加する;蛍光標識リガンドは1種以上の細胞成分に結合する。次いで、試験化合物を細胞に加える。あるいは、蛍光リガンドと化学化合物の添加順序を互いに取り替えてもよい。蛍光標識物は、例えば、要素240に図解した線走査共焦点顕微鏡を用い、画像化する。本アッセイの目的は、試験化合物がどの程度、レセプターからの蛍光標識リガンドに置き換わるかを定量することである。細胞になお結合している蛍光標識体は、試験化合物の存在下または不存在下に画像化する。2つの蛍光画像を比較することにより、試験化合物の活性を定量することができる。
【0108】
細胞ベースレセプター結合アッセイの替わり得る実施態様において、化合物不存在下の画像化工程は除いてもよく、また、試験化合物の活性は、化合物の存在下に得られた画像を対照ウエルの画像またはウエルに添加された蛍光標識リガンドの既知量から予測される画像およびレセプターに対する既知の親和性に比較することにより定量することができる。
【0109】
結合アッセイにおける線走査共焦点画像化の利点
第一の実施態様において、リガンド−標的結合は1つの励起波長と1つの発光波長により実施する。本発明のスピードと感度を例示する図24にデータを提示する。リガンドを放射能標識してその検出を可能とする先行技術に比較して、その性能の詳細な分析は以下のとおりである。レセプター−リガンドアッセイの先行技術はSSA方式のもの、並びに結合リガンドと非結合リガンドとを物理的に分離し、レセプターに結合したリガンドの量を液状閃光発生体(シンチラント)添加により測定する方式のものを包含する。
【0110】
第一に、本発明は少容量ウエル、例えば、1μLで使用し得る。放射能標識リガンドを採用するレセプター−リガンド結合アッセイにおいて、各放射能標識体、例えば、3Hは唯一度のみ崩壊し、1崩壊当たり高々90光子を生成するが、その崩壊速度は1秒当たり10-8未満である。1個の蛍光分子は総計104〜107光子を生成し、毎秒103と106の間の光子を放出する。かくして、蛍光標識体のカウント率は3Hに関して約1011である。したがって、本発明は1ウエル当たり非常に少ない標識物、膜およびビーズがあればよい。例えば、トリチウムSSAは1ウエル当たり107ビーズを必要とするが、本発明では1ウエル当たり103ビーズでよい。結果として、本発明はμL容量のウエルで、はるかに短時間で実施可能である。さらに、SSAでは画像化時間を変更するのが難しいが、その理由は放射能標識物が一定の率で分解するからである。対して、蛍光標識物の励起率は光子放出率が増大するように増加させることができ、それによって必要とされる画像化時間を短縮することができる。しかし、励起率は制限なしに増加させることはできない。事実、それはいわゆる発蛍光団放出率の飽和限界の存在であり、それが本出願において点走査共焦点に勝る線走査共焦点の実質的な利点の基礎をなしている。第二に、本発明では放射能を扱う時間と経費を要しない。第三に、本発明では少容量ウエルで実施することができるので、化合物と試薬の消費がSSAよりもはるかに少なく、その結果さらにコストの低減が可能となる。最後に、本発明ではシンチラントドープのビーズまたはウエル底を必要とせず、それがさらにコストを低減する。
【0111】
本発明ではウエル中サンプルの蛍光を画像化するのに線走査共焦点顕微鏡を使用する。顕微鏡の共焦点面は光学的区割を可能とする、すなわち、サンプルを置いた平面からの蛍光の検出を可能とする一方、溶液体積からの蛍光検出を最小とする。これは未結合の蛍光標識リガンドを除去するための洗浄工程の必要性を取除く;この工程は、SSAでは必要ないが、シンチラント含有ビーズを使用しないRIAなどの他のレセプター−リガンド結合アッセイではいまなお必要である。顕微鏡の共焦点面はまた本来蛍光性の試験化合物から由来する干渉も排除する。線走査面は、測定可能なバックグランド阻止能を失わずに、伝統的な点走査よりもより迅速にサンプルを画像化することができる。スピードの増大は、発蛍光団密度、側面分解能、視野、およびハードウエアのパラメーター、例えば、対物レンズNA、検出感度およびカメラ読取り速度などに依存する。理論的には、スピードの増大は線当たりの画素数に近づき、本発明の好適な態様においてはそれが1000である。実際には、その増大は約100Xである。
【0112】
これらの利点を定量化するために、代表的なサンプルについて記載する。アッセイは細胞ベースであるが、その場合、蛍光の位置は1μmの精度で分解されることになる。かくして、直径1mmのサンプル面積の画像は〜103画素の〜103線からなる。対象の蛍光シグナルは細胞表面上のリガンド由来であるか、または細胞内の局在化した起源、例えば、核内のレセプターなどの由来である。両方の場合において、発蛍光団の局所濃度が重要なパラメーターである。細胞当たり〜105レセプターを発現する工学的に設計された細胞系では、細胞平均濃度が1μMである。核内に局在する2000〜3000個のレセプターが相当する局所濃度となる。〜1μmという所望の側面分解能と矛盾なく、画素当たりの発蛍光団は〜2×103個存在する。本来の細胞性バックグランド蛍光は、同じ種類ではあるが、標識蛍光よりも小さいこと、また、所望のシグナル−ノイズ比は最小でも10であると思われる。したがって、検出される光子数は、シグナルとバックグランドの散弾雑音(ノイズ)および高品質半導体素子検出器の読取りノイズを考慮して、103近辺とすることが必要である。本装置は約0.7NAの対物レンズ、ブロッキングフィルター、および半導体素子カメラを使用しており、その捕集と検出効率は〜1%であって、1画素当たり〜105光子を放出し、または1分子当たり〜102光子を放出する必要がある。望ましいのは、画像が1秒以下、好ましくは、コンマ以下の秒単位で得られることである。もし画素が連続様式で得られるならば、その場合、画素の一時停止時間は1μ秒未満でなければならず、1分子当たり108/秒より大きい光子放出率を必要とする。この値は一般に106である殆どの発蛍光団の飽和値を超えている。重要なのは、飽和を達成するのに必要な流束、105〜106W/cm2が発蛍光団の非直線性光誘導退色を同様に推進するのに十分なことである。最後に、最高効率の検出装置は連続走査に要求されるデータの速度では使用できない。それに対して、発蛍光団当たりの放出率は、もし103画素が同時に照射されるならば、〜105であればよい。点走査共焦点のバックグランド蛍光の阻止が増大すると、劇的に減速する走査スピードのマイナス面を保証することにならない。
【0113】
図24の代表的なデータは、開示されたシステムがビーズ1個当たり数十の発蛍光団を定量するのに十分な感度を有し、しかも1秒以内で数百の個々のビーズを明瞭に解像することを示している。比較データは下に示すように、細胞ベースの結合実験にて入手することができる。
【0114】
データ分析
データ分析ルーチンは結合が細胞ベースであるか、ビーズベースであるかに密接に関係しており、下記に一緒にして示す。データは以下のルーチンにより分析し得るが、その最も簡単なのが閾値画像分析アルゴリズムである。ルーチンの目的は連続もしくは断続的様式で局在化する蛍光標識体の量を、最小の蛍光強度を超えるように、また任意ではあるが最大の蛍光強度を超えないように定量することである。一実施態様において、当該分析は化学化合物の活性をアッセイするために使用する。
【0115】
アルゴリズムの工程は以下のとおりである:
1.標識体のディジタル画像を取得する。
2.ファイルを一段ごとに開き、そして
i. 画像からカメラのオフセット値を引き、
ii. 画像の各段に平面野画像ファイルの対応する段の逆数を掛ける。
3.選択肢として、バックグランドレベルを決めるために、画像のヒストグラムを作成する。
【0116】
4.最小値と任意ではあるが最大値を含む選択基準を確立する。この値は、例えば、バックグランドのヒストグラムピーク巾に関する統計的分析により、または所定の値を用いることにより、平均バックグランドレベルの定まった倍数として、または平均バックグランドレベル以上の定まったカウント数として決定する。5.画像の各画素を選択基準に比較する。この基準に合う画像の各画素について、ランニングの総計にこの値を加える。適格画素の総数と平均強度が報告される。
【0117】
このルーチンは図24と同様にデータの処理に有利に使用されるが、ここでは個々のビーズはバックグランドと明瞭に識別され、凝集したビーズまたは細胞によるアーチファクトは少ない。かかるルーチンは同じ様に、ウエル底に結合した膜をもつアッセイタイプにも適切である。
【0118】
結合データを分析するために適用し得る第二のルーチンは局在化分析アルゴリズムであり、これはさらに形状分析プロトコールを必要とする。閾値ルーチンでのように、この目的は連続もしくは断続的様式で局在化する蛍光標識体の量を定量することである。一実施態様において、当該分析は化学化合物の活性をアッセイするために使用する。
【0119】
アルゴリズムの工程は以下のとおりである:
1.標識体のディジタル画像を取得する。
2.ファイルを一段ごとに開き、そして
i. 画像からカメラのオフセット値を引き、
ii. 画像の各段に平面野画像ファイルの対応する段の逆数を掛ける。
3.選択肢として、ヒストグラムを作成し、画像の画素値を総計する。
【0120】
4.最小値と任意ではあるが最大値を含む選択基準を確立する。この値は、例えば、バックグランドのヒストグラムピーク巾に関する統計的分析により、または所定の値を用いることにより、平均バックグランドレベルの定まった倍数として、または平均バックグランドレベル以上の定まったカウント数として決定する。
5.画像の各画素を選択基準に比較する。適格とした画素はすべて1の値とし、他はすべて0の値として、それによって16ビットから1ビットへの圧縮を実施する。
6.画像の端部は、端部に接するメンバーをもつ2進マスクにおいて、1の値とした連続画素を0にセッティングすることにより「クリーン」とする。
【0121】
7.連続的値−1のグループと定めた対象のビットマップを検索する:
1.値1の画素を見出すために線ごとのパターンの画像を検索する。
2.1)で同定した画素に連なる値−1の画素すべてを定量する。
3.選択肢として、最小および最大サイズのフィルターを対象にあてがう。フィルターのサイズは予め決めておく。
4.もし対象が適格ならば、工程8に進み、そうでなければ、対象の1値とした画像を0に変え、次の対象を求め、検索を続ける。
5.ビットマップの終端に達したならば、工程9に進む。
【0122】
8.フィルター基準を通った各対象については:
1.選択肢として、境界を広げた新たな長方形のビットマップを作成するが、このマップは対象の端部から各方向に向けて対象プラスnエキストラ0画素を含む。nは下記のように実施される伸長工程の数であり、予め決めて置く。
2.もし8.の1.を遂行するならば、その場合は、伸長工程をn回適用することにより対象を伸長するが、その場合には、値−1とした画素に触れる0値の画素を値−1とする。
3.伸長ビットマップにおいて、または当初のビットマップにおいて工程8.1.を実施しなかった場合の、値−1とした画素の各捕集については、画像からの対応する画素値を総計し、平均して、マスク下の平均画素強度を計算する。
4.当初のビットマップ画像の対象の画素すべてを0に変えて、工程7に戻り、さらに対象を検索する。
【0123】
9.すべての対象をカウントした後、対象当たりの蛍光標識体の平均強度および、選択肢として、局在化した標識体の総強度端数を画像の対象すべてについて計算し、標準偏差などの統計情報と共に報告する。
【0124】
このルーチンにおける識別操作は、以下のアルゴリズムすべてが共有するが、工程4〜6における2進マスクの生成である。マスクについての対象の選択基準は、任意ではあるが、最小値および最大値、サイズおよび形状を包含する。例えば、一実施態様において、ビーズベースアッセイのための分析ルーチンは工程7.iii.の円形フィルターを含む。
【0125】
第二の実施態様において、2種以上の蛍光標識体の発光は、1以上の照度波長で励起して同時に検出する。結合アッセイで適用したように、第一の蛍光標識体を用いて対象物を同定し、それに第二の蛍光標識体を結合させる。二色細胞ベース結合アッセイの2例を図21と23に示す。かかる画像の分析に使用し得る代表的な手法は同時局在化分析ルーチンであるが、それは局在化した第一蛍光標識体の量を、第二蛍光標識体を基準にして定量するように設計されたものである。一実施態様においては、この分析法を用いて、化学化合物の活性を、例えば、活性が対象細胞下の局在化に依存している場合に、アッセイする。
【0126】
アルゴリズムの工程は以下のとおりである:
1.第一および第二標識体それぞれのディジタル化画像を取得する。
2.ファイルを一段ごとに開き、そして
i. 各画像からそれぞれのカメラのオフセット値を引き、
ii. 各画像の各段にそれぞれの平面野画像ファイルの対応する段の逆数を掛ける。
3.選択肢として、バックグランドレベルを決定するために第一標識体のヒストグラムを作成し、第一標識体画像の強度を総計する。
4.最小値と、選択肢としての最大値を含む選択基準を確立する。これらの値は、例えば、バックグランドのヒストグラムピーク巾に関する統計的分析により、または所定の値を用いることにより、平均バックグランドレベルの定まった倍数として、または平均バックグランドレベル以上の定まったカウント数として決定する。
【0127】
5.第一標識体画像の各画素を選択基準に比較する。適格とした画素はすべて1の値とし、他はすべて0の値として、それによって16ビットから1ビットへの圧縮を実施する。
6. 画像の端部は、端部に接するメンバーをもつ2進マスクにおいて、1の値とした連続画素を0にセッティングすることにより「クリーン」とする。
【0128】
7.連続的値−1画素のグループと定めた対象のビットマップを検索する:
1.値1の画素を見出すために線ごとのパターンの画像を検索する。
2.1)で同定した画素に連なる値−1の画素すべてを定量する。
3.選択肢として、最小および最大サイズのフィルターを対象にあてがう。フィルターのサイズは予め決めておく。
4.もし対象が適格ならば、工程8に進み、そうでなければ、対象の1値とした画素を0に変え、次の対象を求め、検索を続ける。
5.ビットマップの終端に達したならば、工程9に進む。
【0129】
8.フィルター基準を通った各対象については:
1.選択肢として、境界を広げた新たな長方形のビットマップを作成するが、このマップは対象の端部から各方向に向けて対象プラスnエキストラ0画素を含む。nは下記のように実施される伸長工程の数であり、予め決めて置く。
2.もし8.の1.を遂行するならば、その場合は、伸長工程をn回適用することにより対象を伸長するが、その場合には、値−1とした画素に触れる0値の画素を値−1とする。
3.伸長ビットマップにおいて、または当初のビットマップにおいて工程8.1.を実施しなかった場合の、値−1とした画素の各捕集については、第二標識体の画像からの対応する画素値を総計し、平均して、マスク下の平均画素強度を計算する。
4.当初のビットマップ画像の対象の画素すべてを0に変えて、工程7に戻り、さらに対象を検索する。
【0130】
9.すべての対象をカウントした後、対象当たりの第二蛍光標識体の平均強度および、選択肢として、第一標識体と同時局在化した第二標識体の総強度端数を画像の対象すべてについて計算し、標準偏差などの統計情報と共に報告する。
【0131】
このより精緻なルーチンの利点は、対象が、それが細胞であろうと、ビーズであろうと、独立に同定し得るということである。図21に例示するように、すべての細胞が応答する訳ではない。細胞の個別の同定は、例えば、応答細胞と非応答細胞の比を、応答する細胞の応答の度合いと共に表とすることを可能にする。このアルゴリズムは、さらに複雑であるにもかかわらず、ペンティアムIIプラットフォーム上1秒以下以内で1メガ画素の画像を分析するように構築することができる。
【0132】
移動アッセイ
第2の態様に従って有利に行い得る追加のアッセイの種類は、1またはそれ以上の光波長によって励起させ、2またはそれ以上の蛍光標識された物体の放射(発光)を同時に検出する移動アッセイである。これらのアッセイにおいて、対象の移動は、1またはそれ以上の物体についてであって、タンパク質、脂質または別の分子複合体または細胞レベル以下の構造(例えば小胞)の充分特定された領域から他の領域へのものである。これらは、シナプチン(小胞膜タンパク質)、転写ファクター(NF−κB、NFAT、AP−1)、ホルモン受容体、LDL/HDL受容体、T細胞受容体、PTH受容体を包含するがそれに制限するものではない。
【0133】
基本型の移動アッセイは、共局在測定の特別なケースである。具体的には、第1および第2物体の共局在は、第1に関して共存する第2物体の画分、または第1物体と共在する第2物体と細胞中の他の場所に在する物体の割合によって定量される。局在画像データを処理するために好んで使用される拡張した分析手順を以下に示した。
【0134】
標識される位置は細胞の核であって、この標識は、DNAに対して特異的な蛍光孔体、例えばHoechst 33342である。別の核酸特異性染色がこの分野ではよく知られている(例えば、Haugland, R.P., Handbook of Fluorescent Probes and Research Chemicals、6版、8章を参照)。第2物体は、細胞質から核への移動がアッセイの主体である転写ファクターである。このタンパク質は、GFPとの融合体としての発現を含み、転写ファクタータンパク質に特異的な蛍光標識抗体と試料とを接触させることを含む、多様な方法によって標識することができる。
【0135】
以下の移動化データ分析手順を用いて、第2の蛍光標識された物体に関して関連のあるまたは関連のない手法で分布した第1の蛍光標識された物体の量を測定することができる。1つの態様では、該分析を用いて、化学化合物の活性を評価する。アルゴリズムの段階を以下に示す:
1.第1および第2標識物体各々の画像を獲得し、
2.行ごとに(row by row)にファイルを開き、
i)各画像から各々のカメラのオフセット値を控除し、
ii)その各フラット・フィールド(flat-field)画像ファイルにおいて、対応する行の逆数を各画像における各々の行にかける。
3.所望により、第1物体の画像を背景のレベルを測定するためにヒストグラムにし、第2物体の画像強度を合計する。
4.最小値および所望により最高値を含む選択標準を設定する。これらの値を、例えば、予め決めた値を使用することによって、ヒストグラムピーク幅についての統計学的分析により、または平均背景レベル以上の計算の定数(fixed number of count)として決定する。
5.第1物体の画像における各ピクセルを選択標準に対して比較する。全適格ピクセルを、1値にし、それ以外の全てを0値とし、それによって16−1ビット圧縮をもたらす。
6.エッジ近傍メンバー(edge-touching member)を持つ二重マスクにおける全ての1値の近傍ピクセルを0に設定することによって画像のエッジを"クリーン"化する。
7.1値近傍のピクセル群として定義される、対象に対するビットマップを以下のように検索する:
1)線画パターンにおける画像を検索し、1値ピクセルを見出し、
2)1)で同定されたピクセルに近傍する全ての1値ピクセルを決定し、
3)所望により、サイズを予め決定した最小および最高サイズのフィルターを対象に適用し、
4)対象が許容される場合、段階8に進み、そうでなければ該対象における全ての1値ピクセルを0に変化させ、次の対象に対する探索を続け、
5)ビットマップの最後に到達すると、段階9に進む。
【0136】
8.フィルター標準を通過する各々の対象に対して:
1)対象のエッジから各々の方向においてn個の0値ピクセルを有する対象を含む拡張された境界で新規の四角形のビットマップを作成する。nは、以下で行われ、予め決定された膨張段階(dilation steps)の数である。
2)1値ピクセルに隣接するピクセル値0は1値に設定する拡張段階をn回適用することによって対象を膨張する。
3)元のフルサイズのビットマップと膨張したビットマップを比較する。元のマップの対応する領域において1値である、膨張したビットマップにおける全てのピクセルを0にあわせる。これにより、環状マスク(annular mask)をつくり、拡張中にビットマップボーダーが増大したときに、ただ1つだけの対象が捕捉されることを確実にする。
4)元の対象から別のビットマップを作り、0値ピクセルに近接する1値ピクセルを0に設定することによって、m回それを減退(erode)させる。通常、mは、nに等しく、予め決定する。
5)環状かつ減退したビットマップにおける1値ピクセルの各々の収集にあたって、対応するピクセルを第2物体の画像から平均し、環状かつ減退したビットマップの下でのその平均ピクセル強度を計算する。
6)各々の対象に対し環状強度対減退強度の割合を計算し、表に移す。
7)元のビットマップにおける対象の全てのピクセルを0にかえ、より多くの対象を探索するために段階7に戻る。
a)全ての対象が計算された後、画像における全対象の平均強度比を、統計的情報、例えば標準偏差を用いて計算する。
【0137】
上記開示されたものに基づくこの手順の新しい特徴は、1つの1次マスクの環状拡張であり、1つは一次マスクの減退したバージョンである2つの娘マスクの段階8における創成である。本例においては、物体2と物体1の共局在化、転写ファクターおよび細胞核(実際には、DNA)を、それぞれ後者を用いて定量した。前者のマスクを使用して、共局在化していない物体2を定量した、本例において、これら2つの量比は、細胞(セル)基準で作成し、その結果を作表した。
【0138】
本発明の方法に従って、データ取得および分析は、約1秒間で行い得る。比較のために、2つの先行技術の例を引用する。
【0139】
Ding ら [J. Biol. Chem, 273, 28897-28905 (1998)]において、比較し得る2色局在アッセイを実施した。本発明の利点は、以下を包含する:
1)データチャンネルあたり約50倍速い画像捕捉、
2)同時の2色画像捕捉、
3)低い着色レベルを許容する約10倍の卓越した感受性、
4)すすぎ段階を省きうる共焦検出、
5)約30秒と比較して、約0.1秒の焦点時間、
6)3〜6秒/フレームと比べて約 0.2秒/フレームのデータ分析時間、
7)連続的画像捕捉。
【0140】
先行技術の第2番目の例は、Deptala ら[Cytometry,,33,, 376−382, (1998)]である。 本発明は、
1)より高い、約4倍の空間的解像力、
2)約16倍の高いピクセル捕捉速度、
3)より速いデータ解析力、
4)マイクロタイタープレートで操作できるオートフォーカス、および
5)3〜6秒/フレームと比べて約0.2秒/フレームの分析時間、
である。
【0141】
エンドサイトーシスおよびエキソサイトーシスおよび受容体隔離
一般的には、エンドサイトーシスおよびエキソサイトーシス、受容体隔離およびリサイクル、第1または第2の態様および上記で開示された関連画像分析プロトコールによって評価し得るその他の過程である。蛍光標識化は、様々な既知の方法に従って達成される。例えば、受容体およびリガンド両方の標識化を含む実験は、Tarasova ら [J. Biol. Chem.,, 272,, 14817-14824 (1997)]によって開示されている。本画像システムは、データチャンネルあたり約50倍速く、同時に2つの画像を得ることができる。さらに、例えば、本発明の分析プロトコールである、共局在化アルゴリズムを使用して、リアルタイムの隔離画像を処理することができる。先行技術においてはそのような例は、全く知られていない。
【0142】
類似の画像化および分析可能出力を必要とする多くの他のアッセイは、先行技術において既知である。例えば、ファゴサイトおよび関連細胞の事象を包含するアッセイ[J. Immunology, (1983) 130, 1910; J. Leukocyte Biol. (1988) 43, 304)];別のアッセイは、受容体介在および受容体非仲介の両方のエンドサイトーシスおよびエキソサイトーシスを包含し[Neuron 14, 983 (1995); J. Physiol. 460, 287 (1993) and Science 255, 200 (1992)]、低密度リポタンパク質複合体の受容体介在エンドサイトーシス [J. Cell Biol. 121, 1257 (1993)を参照] およびトランスフェリンの脊椎細胞への伝播[Cell 49, 423(1994)を参照];エンドサイトーシスおよび蛍光標識された表皮性成長ファクターの横軸の横方向の移動を画像化すること[Proc. Natl. Acad. Sci. USA 75, 2135 (1975); J. Cell Biol. 109, 2105 (1989)];蛍光デキストリンによるエンドサイトーシスによる細胞外物質の取込みおよび内部プロセッシングを追跡すること[J. Biol. Chem. 269, 12918 (1994)を参照]、および疎水性染料を使用して、活発にfireしているニューロンにおけるシナプシス小胞のエンドサイトーシス介在性再循環の画像化[Nature 314, 357 (1985)を参照]を包含する。
【0143】
さらに、細胞外および分泌性顆粒(例えば、クロモグラニンB,分泌顆粒タンパク質)[J. Cell Sci. 110,,1453 (1997)を参照]に局在するタンパク質か、または分化した神経細胞における成長錐体に局在するtPA[Mol. Biol. Cell 9: 2463 (1998)を参照]に融合する緑色蛍光タンパク質(GFP)を発現する遺伝子工学による細胞系は、エキソサイトーシスの追跡を可能にした。非常に多種の蛍光標識物は、そのようなアッセイに利用できる[Haugland R.P. Handbook of Fluorescent Probes and Research chemicals, 6版. 17章を参照]。
【0144】
イオンチャンネル
本発明の第3の態様は、図9に記載した1つのバージョンを用いて、1秒あたり、約30フレームの速度で、1つまたは1つ以上の蛍光標識物体の時間依存性応答を画像化することができる。これは、一過性の事象、例えばイオンチャンネンの開閉を走査することを可能にした。具体的に、イオンチャンネルは、以下:K+電位依存性、Na+電位依存性、K+電位依存性、Ca++電位依存性,Cl−、Na+/K+ATPase およびP−糖タンパク質を包含するが、これに限定しない。
【0145】
以下の動力学的画像データ分析アルゴリズムは、フレームからフレームへ個々の細胞(セル)を定義し、充分な細胞数に対する同時性動力学的分析によって、画像統計学的に意義のあるデータを得ることを可能にする。該アルゴリズムの段階を以下に示す:
1.時間関数として、1個(インジケーターのみ)または2個(マーカーとインジケーター、または2つのインジケーター)またはそれ以上のデジタル化画像を獲得する。
2.行ごとにファイルを開き、
1)各画像から各々のカメラのオフセット値を控除し、
2)その各フラット・フィールド画像ファイルにおける、対応する行の逆数を各々の画像における各行にかける。
3.所望により、第1物体の画像をヒストグラムにし、背景レベルを測定する。
4.所望により、最小値および最高値を含む選択標準を設定する。これらの値は、例えば、または背景ヒストグラムのピーク幅に対する統計学的分析によって、または予め決めた値を使用することによって、平均背景レベル以上の計算定数として、平均背景レベル以上の一定の倍数として設定する。
5.第1物体の画像における各ピクセルと選択標準とを比較する。全制限ピクセルは、1値とし、その他の全てを0値とし、それによって、16−から1ビットの圧縮をもたらす。
6.エッジ近傍メンバーを持つ二重マスクにおける全ての1値近似ピクセルを0に設定することによって画像のエッジを"クリーン"化する。
7.下記によって、隣接する値の1ピクセルのグループとして定義された対象に対するビットマップを検索することによって:
i)線ごとのパターン(line by line pattern)おいて画像を検索し、1値のピクセルをみいだし、
ii)iにおいて同定されたピクセルに隣接する全ての1値ピクセルを決定し、
iii)所望により、サイズを予め決定した最小および最大サイズのフィルターを対象に適用し、
iv)この対象が許容される場合、段階8に進み、そうでなければ対象における1値ピクセルを0に変化させ、次の対象に対する探索を継続し、
v)ビットマップのエッジに到達した場合、段階9に進む。
8.フィルターを通過した対象の標準値に対して:時系における各々の画像から対応するピクセルを平均する。1つのインジケーターを使用する場合、強度を記録する。比率計測インジケーターを用いる場合、1つの画像の値を、時系における各々の画像に対する別の値で割り、結果を記録する。
9.全ての対象を分析した後、段階8の分析結果を各々の対象に対して描写した。各々の対象に対して描写された、立ち上がり時間、立下り時間および振幅を含む動力学パラメーターは、1組の動力学的分析から、および一定時間に1組の全対象から得た統計学的情報である。
【0146】
本発明で使用する、イオンチャンネルに関連する一過性事例の画像処理および分析の2つの実施例を、図19および20で提供する。これらのアッセイでCa++-感受性色素、Fluo-3を使用し、細胞内Ca++濃度の変化がみられた。最初の実験で、変化はアセチルコリンレセプターの活性化で開始されるCa++第2シグナルによって引き起こされ、そして第2の実験で、この変化は電位作動型のCa++チャンネルの活性化によるものであった。
【0147】
イオンチャンネルは、近年、熱のこもった研究がなされている分野である。本発明の先行技術を超える有利点は、下記の比較によって明らかになるであろう。
【0148】
化合物スクリーニング適用において、技術背景部分で引用された標準の先行技術は、米国特許第5,355,215で開示されている。細胞内Ca2+の誘導された変化の検出に主として使用されるこの装置は、ディスペンサーを含んでおり、一過性事例を起こす。本発明の先行技術を超える主な有利点は、下記のとおりである:1)ウェルを全体で平均化された応答と比較した、個々の細胞応答の測定を認めるイメージングおよび分析、2)増加した感受性、必要とする試薬のより少ない添加およびより低い照明強度、および可能なより少ないサンプル容量、および3)秒毎の1ポイントの最大率で比較した、映像比率における画像の取得。
【0149】
研究適用において、Tsienの組織および協力者らは、Handbook of Biological Confocal Microscopy, J. B. Pawley,, ed.,, Plenum Press,, New York,, 1995,, pp. 459-478で開示し、それは技術水準として役立つ。本発明を超える比率での画像処理の可能性の証明を有する。しかし、これは最近の関心をもたれているサンプルでは成し遂げることはできない。先行技術は、ピクセル毎に102-103を超える発蛍光団を必要とし、比較的信号対雑音比率で本発明に相当する比率に達する。さらに、本発明は、12-または16-ビット分解能で画像を取得でき、4−16×を超えるダイナミックレンジが得られる。
【0150】
研究組織の第2の実施例は、Sun et al., J. Physiology, 509, 67-80, 1998.で開示されている。Sunによると、データは、ピクセル積分時間毎に5マイクロセカンドを有する、600-ピクセルライン毎の650Hzに至るまでの比率で生じており、共焦顕微鏡をスキャンする慣習的なスポットを用いている。ほんの1次元の“画像処理”が行なわれている。一過性を、スキャンラインに沿って横たわる対象として観察することができる。さらに、この比率は1μsピクセル積分時間でのみ達成することができ、本発明に相当する画質が得られるまで102-103を超える発蛍光団濃度を必要とする。
【0151】
外部刺激の応答における細胞内イオン濃度の変化を画像処理および分析する本発明の可能性は、化合物スクリーニングおよび一般的な生物学研究適用における多様な適用を有している(例えば、J. Cell Biol. 137(3),633 648 (1997); J. Biol. Chem. 271(9),, 4999-5006 (1996); Science 280,, 69-76 (1998); Biochem, J., 324, 645-651 (1997)参照)。多くの蛍光指示薬は、特定のイオンに対して有効に感受する(Haugland R.P. Handbook of fluorescent Probes and Research Chemicals, 6th Ed. Chaps 18, 22 and 24参照)。これらの指示薬で、Mg2+、Zn2+、Ca2+、Na+、Fe2+、Hg2+、Pb2+、Cd2+、Ni2+、Co2+、Al3+、Ga2+、Eu3+、Tb3+、Tb3+、Sm3+、およびDy3+の濃度測定ができる。 さらに、Na+およびK+のアッセイを、他の一価のカチオンの生理学的濃度の存在下であっても行なうことができ(J. Biol. Chem. 264, 19449 (1989)参照)、血液、脳および筋肉細胞などの様々な細胞中のNa+レベルまたはNa+流出のアッセイを含み(J. biol. Chem. 268, 18640 (1993); J. Neurosci. 14, 2464 (1994); Am J. Physiol. 267, H568 (1994)参照)、および精子細胞中のK+、神経終末シナプトソームおよびリンパ球を変化させる。さらに、本発明を使用して、リポソームおよび生存細胞での小胞中のCl-濃度をアッセイすることができる(Am. J. Physiol. 259, c375 (1990)参照)。
【0152】
さらに、本発明を使用して、細胞および細胞下の細胞小器官中の膜電位の変化をアッセイすることができる。膜電位中の高速画像変化の能力は、細胞および細胞小器官の生存、神経インパルス産生、筋収縮、細胞シグナルおよびイオンチャンネルゲートのアッセイに極めて重要である(Biophys J. 67,, 208 (1994); Neuron 13,, 1187 (1994); J. Membrane Biol. 130,1(1992)参照)。蛍光指示薬は有用であり、神経細胞、心臓細胞および無傷の脳細胞などの刺激性細胞中の、高速(ミリセカンド)潜在的変化に応答する(Haugland R.P. Handbook of Fluorescent probes and Research Chemicals, 6th Ed. Chap. 25)。高速膜貫通電位変化に応答する蛍光プローブは、一般に、100mV毎でほんの2−10%の蛍光変化しか示さない。細胞の形質膜は、約−70mVの膜貫通電位を有しており、ミトコンドリアなどの幾つかの細胞小器官は、-150mVの膜貫通電位を維持する。従って、高速変化などを含むアッセイは、本発明の様々な実施態様に共通する高度な感受性、高速データ取得能力が必要とされる。
【0153】
FRETに基づく測定
本発明を有利に使用して、蛍光共鳴エネルギー移送(FRET)を含むアッセイを行なうことができる。FRETは1つの発蛍光団、ドナーがフォトンを吸収したときに起こり、そして他の発蛍光団、アクセプターに対して無放射性である吸収エネルギーを移送する。アクセプターは、それから、特有な波長でエネルギーを発する。ドナーおよびアクセプター分子は、有効なエネルギーの移送を実現するため、約10nmを下まわるほどにきわめて近接していなければならない(Metods Enzymol. 211, 353 - 388 (1992); Methods Enzymol. 246, 300-334 (1995)参照)。近接の必要を使用して、ドナー-アクセプター対の間の僅かな分離に対してアッセイ感受性を構成することができる。FRETは、一般に単独の励起波長および2つの放出波長、そしてドナーおよびアクセプター放出強度の割合からなる分析を必要とする。FRETドナーアクセプター対を、ビーズに基づくアッセイおよび細胞に基づくアッセイの両方で構成することができる。いくつかの緑色蛍光タンパク質(GFP)変異体ディスプレイは蛍光を強め、そして変化した放出波長を、1つのタンパク質に対するGFP FRETドナーと、同じタンパク質または同じ細胞内で発現する他のタンパク質の何れかに対するGFP FRETアクセプターとの融合により、FRET細胞に基づくアッセイ用に対にすることができる。このようなFRET対は、Ca2+のCa2+-カルモジュリン結合などの分子内変化、またはレセプター二量体などの分子間相互作用の測定に使用できる。上記の動力学イメージングアルゴリズムを、優先的に使用することができる。
【0154】
一過性トランスフェクション
画像に基づく測定の顕著な有利点には、平均値内に喪失するような、まれな事例の検出、および対象毎の1次応答の2次応答への標準化(normalize)の、両方の機会がある。両方の特徴は、一過性トランスフェクト標的を有する株細胞を使用するアッセイで重要であろう。遺伝子発現およびそれに続く下記のトランスフェクションのタンパク質産生は、しばしば効果がなく一過性である(BioTechniques 24:478-482 (1998)参照)。本発明で有利に使用することができる、トランスフェクション効率をモニタリングする方法は、当業者に知られている。例えば、興味深い遺伝子を緑色蛍光タンパク質(GFP)用遺伝子と一緒にトランスフェクトすることができ、そして2つのタンパク質が融合してまたは異なる存在としての何れかで発現するであろう。本発明を使用して、1つの波長において存在する指示薬の量を測定し、他の波長において標的に関連する応答を測定することができる。前者のシグナルを使用して、存在する標的の量用に後者の応答を標準化することができる。これは、現在利用できるスクリーニングでは不安定過ぎて使用することができないような標的をアッセイし、僅か数パーセントのトランスフェクション効率をモニターすることを、本発明に可能にする。上記の動力学イメージングアルゴリズムを使用して、このようなデータを分析することができ、ここでただ1つの画像フレームのみが必要である。ほんの数パーセントの細胞のみが感染するとしても、ウイルス性タンパク質の発現を通して直接的に、または新たな表現型の取得により間接的にの何れかで、細胞のウイルス性感染をモニターすることができる。結局、本発明は、まれな事例の検出用の方法を提供する:多様なcDNAのライブラリーを用いる細胞集団全体のトランスフェクションの結果としての特定のcDNAのトランスフェクションによる、個々の細胞または細胞グループによる、新たな表現型の取得などである。
【0155】
酵素アッセイ
本発明を使用して、酵素活性の遺伝子アッセイを処置することができる。細胞内酵素の例として、限定する意図ではないが以下が含まれる:脱炭酸酵素、グアニンヌクレオチド-結合タンパク質(Gタンパク質)、アデニルシクラーゼ、カルモジュリン、PI、PIPおよびPIP2キナーゼ、cAMPキナーゼおよびcAMPヒドラーゼ、チトクロムP-450、セリン/スレオニンタンパク質キナーゼ、チロシンタンパク質キナーゼ、タンパク質ホスファターゼ、β-ラクタマーゼ、β-ガラクトシダーゼ、ジヒドロ葉酸レダクターゼ、ホスホジエステラーゼ、カスパーゼ(caspases)、プロテオサム(proteosome)プロテアーゼ、一酸化窒素シンターゼ、チミジンキナーゼ、ヌクレオシドデアミナーゼ、グルタチオン-S-トランスフェラーゼ、リポオキシゲナーゼ、およびホスホリパーゼ。
【0156】
図17(a)−17(d)は、本発明による酵素アッセイの第一の実施態様のステップを示す。図17(a)で、ビーズに付着した既知量の蛍光-標識ペプチド312を有するビーズ310を、液体330を含むウェル320に加える。ビーズ310はウェルの底に沈むほどの密度を有する。図17(b)で、試験化合物314をウェルに加える。図17(c)で、酵素316をウェルに加える。図17(a)、17(b)および17(c)で示すステップの順番は、ウェルが試験化合物がないときにペプチドおよび酵素を同時に含んではならないということを除けば、どう変えてもよい。抑制されていないときは、酵素316はペプチド312を切断し、蛍光標識は液体中へ拡散するであろう。また、他方では、試験化合物314は、一般に、酵素活性部位のブロッキングにより酵素316を抑制し、酵素316は蛍光標識を切断しないであろう。図17(d)で、なおビーズに付着している蛍光標識は、例えば、要素340として概略して示されたラインスキャン共焦顕微鏡を使用して画像処理される。この画像から、試験化合物314の活性を測定することができる。
【0157】
図17(a)−17(d)で示されるアッセイの他の実施態様で、試験化合物の活性を、図17(d)で得られた画像と、図17(a)または17(b)の蛍光標識の蛍光のイメージングで得られた画像または対照ウェルの画像との比較によって、測定することができる。
【0158】
図18(a)−18(d)は、本発明による酵素アッセイの、第2の実施態様のステップを示す。図18(a)で、既知量の蛍光標識ペプチド352をウェル360の底362に付着させる。図18(b)で、 試験化合物354をウェルに加える。図18(c)で、酵素356をウェルに加える。図18(d)で、なおウェルの底に付着している蛍光標識を、例えば、要素380として概略して示されたラインスキャン共焦顕微鏡を使用して画像処理し、化合物354の活性を測定する。
【0159】
図18(a)−18(d)で示されるアッセイの他の実施態様で、試験化合物の活性を、図18(d)で得られる画像と、図18(a)または18(b)の蛍光標識の蛍光のイメージングにより得られた画像または対照ウェルの画像との比較によって測定することができる。
【0160】
本発明によって行なうことができるアッセイの他の実施例は、チロシンキナーゼアッセイである。チロシンキナーゼは、基質ペプチドのチロシン残基をリン酸化する。基質ペプチドは、チロシン残基および蛍光タグの両方を有している。このアッセイで、抗体は、一方の末端でリン酸化チロシン選択的であり、他の末端でビーズなどの表面またはウェルの底に結合している。チロシンキナーゼおよびチロシン残基を有する蛍光タグペプチドをウェルに加える。チロシンキナーゼがペプチドをリン酸化すると、リン酸化チロシンは抗体に結合し、その結果、抗体が付着した表面上に蛍光タグが局在化することになる。チロシンキナーゼがペプチドをリン酸化しないときは、ペプチド上の蛍光タグはウェル中に拡散するであろう。ペプチドのリン酸化の範囲を、表面に近接した蛍光の測定によって測定することができる。このようなアッセイを、蛍光基質上の酵素の活動によって産出される蛍光産物に特異的である抗体を使用しても処理することができる。
【0161】
さらに、生存細胞酵素アッセイを本発明によって行なうことができる。生存細胞で酵素活性を調査するためのたくさんの技術が、酵素によって影響される蛍光産物を生ずる基質として(Haugland R.P. Handbook of Fluorescent Probes and Research Chemical 6th Ed. Chap. 10参照)、当分野で知られている(Biochem. Histochem 70, 243 (1995), J. Fluorescence 3, 119 (1993)参照)。一般的に、これらのアッセイは無抵抗に細胞に入るプローブを使用し、そして、続いて細胞内酵素によって進行し、細胞内に残留する産物を生成する。他の基質は、酵素活性部位で沈殿する不溶性蛍光産物が生ずる。本発明は酵素活性の度合いをアッセイすることができ、そしてプローブ等を使用する酵素活性の正確な空間的な局部制限を測定することができる。プローブは、限定する意図ではないがホスファターゼ、ATPases、5'-ヌクレオチダーゼ、DNAおよびRNAポリメラーゼ、ペプチダーゼ、プロテアーゼ、エステラーゼおよびペルオキシダーゼなど、本発明で使用する広く様々な酵素のアッセイで有用である。
酵素活性アッセイを1番目のまたは2番目のいずれかの実験態様によって行なうことができ、そして上記の画像分析プロトコルに関連する。
【0162】
形態学
本発明の方法を使用して、細胞または細胞下の形態学(限定する意図ではないが軸策および細胞小器官が含まれる)の測定を必要とするアッセイを行なうこともできる。このようなアッセイを行うために、蛍光プローブを、細胞または細胞小器官などに、マイクロインジェクションで直接的に、または細胞透過性であって、代謝または他の態様で変化して関心ある構造中で保持される試薬と細胞を接触させることによって、関心ある構造中に導入する。これらを生存細胞と共に使用するとき、蛍光標識は非毒性および生物学的に不活性でなければならない。多くの適切な色素はアッセイ用として市販されており(Haugland R.P. Handbook of Fluorescent Probes and Research Chemicals 6th Ed. Chap. 15参照)、例えば、キャピラリーフロー(flow in capillaries)、神経細胞結合性、ギャップ結合を通った色素の転位置、細胞分裂および細胞溶解、およびリポソーム融合が含まれる。さらに、これらのトレーサーを使用して、培地中の標識細胞、組織または無処置の生物の運動を追うことができる。蛍光トレーサーを用いて細胞または細胞下の形態学または運動をアッセイするたくさんの技術は、当分野で知られており、そして膜トレーサー、ビオチン標識デキストランコンジュゲーター、蛍光微粒子、またはタンパク質およびタンパク質コンジュゲートの使用を含む(Meth. Cell Biol. 29, 153 (1989); Cytometry 21. 230 (1995); Cell 84, 381 (1996); Biochem. Biophys. Acta 988, 319 (1989); Cytometry 14, 747 (1993)参照)。本発明の様々な実施例は、アッセイのタイプで使用されるとき、顕著な有利点を有する。本発明は、非常にすばらしい空間的分解能で、多様なパラメータの迅速イメージングをすることができる。
【0163】
核酸
本発明を使用して、核酸アッセイを処理することができる。本発明の空間的分解能および多波長イメージング能力から得ることができる特定のDNAアッセイは、蛍光自然位ハイブリダイゼーション(FISH)である。FISHは、細胞、組織、間期核および分裂中期染色体中の特定の核酸配列の相関的存在量の局在化および測定用として、重要な技術であり、臨床診断および遺伝子マッピングで使用されている (Histo-chem J. 27, 4 (1995); Science 247, 64 (1990); Trends Genet. 9, 71 (1993)およびScience 250,, 559 (1990)参照)。様々な蛍光ハイブリダイゼーションプローブは、多色蛍光DNAおよびRNAハイブリダイゼーション技術に有用である(Haugland R.P. Handbook of Fluorescent Probes and Research Chemicals, 6th Ed. Chap. 8.4 参照)。付加的な技術は、核酸カウンター染色を用いたATまたはGC選択的DNA-色素を使用して、染色体結合を測定する。この技術は核型分析および染色体構造研究で広く使用されている(Human Genet. 57,1 (1981)参照)。
【0164】
反応性酸素種
本発明を使用して、一重項酸素、超酸化物および一酸化窒素などの様々な反応性酸素種のレベルをアッセイすることもできる。これらの反応性酸素種の重要性は、ごく最近明らかになってきている(Biochem Phamiacol 47,373 (1994), J. Cell Biol. 126, 901 (1994)参照)。一重項酸素は、反応性酸素種によって引き起こされる多くの生理学的損傷の原因であることが、現在分かっている(J. Photochem. Photobiol. 11,,241(1991)参照)。特に一酸化窒素(NO)は、神経伝達および血圧調節を含む様々な生理学的プロセスで、分子メディエーターとして重大な役割を果たすことが、現在分かっている(Current Biology 2,437 (1995), J. Med. Chem. 38,4343 (1995), Cell 78, 919 (1994)参照)。NOを間接的に測定するアッセイを行なう技術は、当分野で知られている。例えばNOは生理学的状態下でニトリルに酸化され、そしてこれは、548nmでの吸収のモニタリングまたはニトリルと反応するプローブの使用によって検出でき、同定可能な蛍光産物を形成する(Haugland R. P., Handbook of Fluorescent Probes and Research Chemicals 6th Ed. Chap. 21参照)。
【0165】
pH
本発明を使用して、細胞または細胞を含まない培地中のpH変化測定を含むアッセイを行なうことができる。細胞内pHの役割の重要性は、細胞増殖、アポトーシス、受精、悪性腫瘍、多剤耐性、イオン輸送、リソソーム貯蔵障害およびアルツハイマー病を含む、多くの多様な生理学的および病理学的プロセスで認められている(Cell Physiol. Biochem. 2, 159 (1992); J. Biol. Chem. 270, 6235 (1995); Biophys. J. 68, 739 (1995); J. Biol. Chem. 270,, 19599 (1995); Cancer Res 54,, 5670 (1994)参照)。生理学的範囲のpHアッセイで有用な蛍光プローブは、市販されている(Haugland R.P., Handbook of Fluorescent Probes and Research Chemicals 6th Ed. Chap. 23参照)。
【0166】
実施例
本明細書で記述および権利主張している本発明は、下記実施例を参照することにより、当業者にさらに認識され得るであろう。これらの実施例は、単に発明のそれぞれの特徴を説明するために提供されるにすぎず、決して発明を限定するように解釈してはならない。
【0167】
転写因子転位置
細胞を96-ウェルプレートで培養し、固定し、テキサスレッド標識抗体(Texas-Red-labeled antibody)とともに転写因子タンパク質にインキュベートし、すすぎ、それから緩衝液中の5μM ヘキスト(Hoechst)33342で染色した。
【0168】
画像を、1.08×1.08μm2ピクセレーションの0.5×0.5mm2 平方で検分した。テキサスレッド放出を568nmで励起し、600nm長通過フィルター(long pass filter)で検出した。ヘキスト放出を364nmで励起し、420-480nm帯域フィルターを用いて検出した。画像取得時間は0.9秒であった。画像毎に〜150細胞がある。
【0169】
固定化前に活性化されていない細胞の範囲の画像を取得した。核中のテキサスレッド強度は、細胞質と比較して低い。テキサスレッド標識抗体およびヘキスト33342で染色された細胞の画像の複合物が生成した。
【0170】
固定化前に染色した細胞の範囲の画像を取得した。カラースケーリングのため、細胞質を核の染色なしでみることは困難である。テキサスレッド標識抗体およびヘキスト33342で染色された細胞の画像の複合物が生成した。
【0171】
データ分析を下記方法に従って行なった。ヘキスト画像の二成分の表示を、適切な感度限界の適用によって生成し、感度限界より大きい値を1とし、感度限界以下を0とした。これを1次マスクとした。それから、1次マスクを侵食(erode)して、ひとつを1次マスクを拡張してもうひとつを得ることによって2つの娘マスクをつくり、最初のマスクを引いて、環状(annular)マスクを形成した。テキサスレッド放出画像を侵食二成分マスクで掛けて、核中の標識転写因子の量の測定としてピクセルを総計した。同様に、テキサスレッド放出画像を環状二成分マスクで掛けて、そして細胞質中の標識転写因子の量の測定としてピクセルを総計した。活性化の度合いを核の細胞質強度に対する比率で評価した。
【0172】
ムスカリン様受容体および電位依存性チャンネル刺激の遷移Ca画像
図19および20における細胞は、神経芽細胞腫系からのものである。該細胞を増殖させ、標準媒体中で画像化した。これらの細胞は、第2シグナルとして大量の細胞内Ca放出を生じるカルバコールによって刺激され得るムスカリン様アセチルコリン受容体を発現した。さらに、該細胞は、外部K+濃度の大きな変化による細胞膜の脱分極によって刺激され、かつベラパミルによって抑制され得る電位依存性“L”Caチャンネルを発現した。
【0173】
一般には、画像シーケンスを、96ウェルプレートにおける増殖培地(100μL)における細胞へ増殖培地中の試薬(100μL)を急速に添加することによって開始した。添加体積により生じる乱れは、細胞形態における若干の歪みを生み出す。この歪みは、添加後の最初の画像フレームにおいて、各々の細胞に与えられたCa蛍光の一過性の変化として見ることができる。
【0174】
図19は、フレーム間の1.2秒の動きを示す。この画像シーケンスは、カルバコール(100μM)の急速な添加によって開始する。最終画像は、同定するために使用した2元マスクであって、画像中の蛍光対象物を列挙し、注入前のフレームから発生させる。注入前の画像がはっきりしていなくても明白である。マスクをこの物質における各画像に適用し、図25aに示したように、各々の対象に対して、注入画像を標準化した集積強度を時間に対してプロットした。該マスクは、重層する(オーバーラップ)細胞に対しては行わなかった。例えば、対象1は、1つ以上の細胞になりやすいが、応答しない。対象7は、遅延を示すものに関して、2つの重層細胞であってもよい。
【0175】
図20a-hは、電位依存性“L”チャンネルを開かせる50mM KClの添加によって突然開始される脱分極への神経芽細胞腫細胞の応答を示す映像のフレームを選択した。分析方法は、上記のような図25aに関連したものであった。この結果を図25bに示した。“画像平均”よりもむしろ“細胞平均”を用いて得られる感受性の増加を示した。
【0176】
生存細胞のGプロテイン共役受容体結合
図21a-cから図22a-cに示した画像は、96ウェルプレート中の生存細胞に対して得られたものである。該細胞を、天然ペプチドリガンドと知られているGプロテイン共役受容体とトランスフェクションした。画像処理の前に、該細胞を、10%の血清を含む通常の増殖培地中にある本来の標識していないリガンドと、37℃、20分間インキュベートし、続いて20nM蛍光標識リガンドおよび100nMLDS751を用いて30分、37℃でインキュベートした。
【0177】
(0.5×0.5)mm2であるこれらの画像は、(1.08×1.08)μm2ピクセレーションを有する。蛍光性の発光(放射)を、488nmで励起させ、535nmを中心とした45nmの帯域フィルターを用いて検出した。また、LDS751の発光を488nmで励起させ、690nmを中心とした40nmの帯域フィルターを用いて検出した。画像捕捉時間は0.9秒であった。これらの細胞は、〜100,000受容体/細胞、または約25受容体/膜表面μm2であった。
【0178】
図21aは、標識リガンドとのインキュベーションした後の細胞の画像である。洗浄工程を画像化前には全く行わない。受信(受像)活性のかなりの変化は明白である。幾つかの細胞は、リガンドが少ないので、それらは背景の低下(くぼみ)として出現する。結合活性の細胞ごとの分析を、図21bに示されているように、非特異的核酸染色であるLDS751の発光の画像からマスクを行うことによって容易にした。染色は完全に均一にされないが、細胞体積の大部分を開示する。受容体結合画像と図21bにおける閾値データから生じた2元マスクの図25cにおける重層は、受容体活性の擬似カラーマップを与えた。高い活性を黄色として示し、一方低い活性をオレンジ−赤として示した。
【0179】
図22における3つの画像は、20nmの標識リガンドと非標識リガンドとの滴定曲線上の点に対応する画像を示す。該曲線を、図22aに示した。非標識リガンドに対してAKi=3±1×1010Mが計算された。
【0180】
異なる哺乳動物細胞系に対する受容体結合を示す画像を図23a-dに示した。図23aは、256nM Cy3標識リガンドとインキュベーションした細胞の画像である。結合活性の範囲をみることができる。図23bは、1μMヘキスト33342染色核酸の同時に得られた画像とCy3データの重層を示す。後者は、各々の細胞を確実に同定するものとして機能した。図23cにおいて、この画像は、10μMの非標識リガンド存在下に、256nMCy3標識リガンドとインキュベーションした細胞の画像であり、図23dにおいて、該データは、重層した1μMヘキスト33342画像染色核酸を示したものである。非標識細胞による置換液体の影響は、図23cにおいて明らかである。図23cおよびdとの高い相関関係において、その除外体積によって細胞を同定する有効性を例証した。
【0181】
模造ビーズを基部にした受容体結合
図24a−dにおいて、Cy5標識シリカビーズの画像を示す。この実験は、蛍光標識リガンドが微少球体上に支持された膜結合受容体と結合する受容体結合アッセイのシュミレーションである。
【0182】
直径4μmシリカの微少球体は、ポリエチレンイミンで被覆し、ビオチンNHS−エステルによってビオチン化した。このビーズの活性を、既知のビーズ量の吸収によって、溶液から除去したCy5標識ストレプトアビジンの量を計量して蛍光計を用いて評価した。各々のビーズは、1.3×106のストレプトアビジン分子を保持することがわかった。ビーズは、Cy5標識ストレプトアビジンおよび非標識ストレプトアビジンの適当な割合で予め混合し、ビーズとインキュベーションすることによってCy5分子の既知量を有した。付加物は、0.16、1.6および16fmol/200μgのポリスチレンビーズと等しい。各ビーズは、各々平均して17、170または1700の標識物を有した。試料を画像化のためにCostar 96-ウェルプレートにおいた。Cy5を、647nmレー支照射によって励起させ、発光した蛍光を、690nmで集めた40nmの帯域フィルターによって検出した。スキャンした画像は、約0.7秒で、1μmピクセレーションで得られた。
【0183】
170および1700分子を有するビーズは容易に検出することができ、17−蛍光ビーズは、図24を構成する画像において識別することができた。非標識ストレプトアビジンのみを有するビーズは、評価し得る強度を生じなかった。
【図面の簡単な説明】
本発明の、これらおよび他の物体、特徴および利点は、以下の詳細な説明から容易に明らかとなる。
【図1(a)−1(f)】 図1(a)-1(f)は、第一のレセプター結合SSAを示す。
【図2(a)−2(f)】 図2(a)-2(f)は、第二のレセプター結合SSAを示す。
【図3(a)−3(d)】 図3(a)-3(d)は、第一の酵素SSAを示す。
【図4(a)−4(d)】 図4(a)-4(d)は、第二の酵素SSAを示す。
【図5(a)および5(b)】 図5(a)および5(b)は、ウェルの底上に位置するサンプルをイメージ化するための従来技術の装置の概要図である。
【図6】 図6は、本発明のサンプルのイメージに使用するライン−スキャン共焦点顕微鏡の第一の実施態様の概要図である。
【図7】 図7は、従来技術の顕微鏡の概要図である。
【図8(a)および8(b)】 図8(a)および8(b)は、それぞれ、スキャンニングモニターを伴わない、本発明の多色刷り実施態様の光線路の平面図および側面図である。
【図8(c)】 図8(c)は、単一ビーム自動焦点の光線路の平面図である。
【図9(a)および9(b)】 図9(a)および9(b)は、それぞれ、スキャンニングモニターを伴う、本発明の多色刷り実施態様の光線路の平面図および側面図である。
【図9(c)】 図9(c)は、単一ビーム自動焦点の光線路の平面図である。
【図10】 図10は、2つのビーム自動焦点システムの側面図である。
【図11(a)−11(c)】 図11(a)-11(c)は、直交座標表示CCDカメラおよびリードアウトレジスターを示す。
【図12(a)および12(b)】 図12(a)および12(b)は、通常の暗視野イメージ化を用いる本発明のライン−スキャン共焦点顕微鏡により形成される光線路の断面図である。
【図13(a)および13(b)】 図13(a)および13(b)は、逆暗視野イメージ化を用いる本発明のライン−スキャン共焦点顕微鏡により形成される光線路の断面図である。
【図14】 図14は、逆の暗-フィールドイメージ化を用いる本発明のライン−スキャン共焦点顕微鏡により形成される光線路の断面図であって、サンプル面の回折制限領域よりも大きな領域を示している。
【図15(a)−15(f)】 図15(a)-15(f)は、本発明によるレセプター結合アッセイの第一の実施態様を示す。
【図16(a)−16(f)】 図16(a)-16(f)は、本発明によるレセプター結合アッセイの第二の実施態様を示す。
【図17(a)−17(d)】 図17(a)-17(d)は、本発明による酵素アッセイの第一の実施態様を示す。
【図18(a)−18(d)】 図18(a)-18(d)は、本発明による酵素アッセイの第二の実施態様を示す。
【図19(a)−19(p)】 図19(a)-19(p)は、カルバコールに対する神経芽細胞のカルシウム応答を示す。注入前の時間、0、1.2、2.4、3.6、4.8、6.0、7.2、8.4、9.6、10.8、12.0、13.2、14.4、15.6秒における応答は見られない(すなわち、それぞれ、図19(a)-(o))
【図20(a)−20(h)】 図20(a)-20(h)は、50mM KClに対する神経芽細胞のカルシウム応答を示す。0、0.6、3.0、5.4、7.8、10.2、12.6および15.0秒における応答が見られる(すなわち、それぞれ、図20(a)-(h))。
【図21(a)−21(c)】 図21(a)-21(c)は、均質性生存細胞レセプター結合アッセイを示す。図21(a)は、蛍光標識したペプチドリガンドで染色した細胞を示す。図21(b)は、LDS751で染色した細胞質から生ずるマスクを示す。図21(c)は、図21(a)および(b)のオバーレイであり、それらは、種々のレセプター活性を示す。
【図22(a)−22(d)】 図22(a)-22(d)は、均質性生存細胞レセプター結合アッセイを示す。図22(a)は、細胞表面レセプターに対する標識および非標識リガンドの競合的結合を描写する。図22(b)-(d)は、グラフにおいて指した点での免疫蛍光のイメージを示す。
【図23(a)−23(d)】 図23(a)-23(d)は、Cy3標識化リガンドによる均質性生存細胞レセプター結合アッセイを示す。
【図24(a)−24(d)】 図24(a)-24(d)は、種々のCy5標識による4μm直径シリカビーズを示す。図24(a)は、標識されていないビーズのイメージを示す。図24(b)-(d)は、それぞれ、ビーズあたりの平均が17、170または1700のCy5標識化分子であるビーズのイメージを示す。図24(d)に示すイメージは、図24(a)-(c)のイメージと比べて10倍小さいスケールである。
【図25(a)−25(c)】 図25(a)-25(c)は、イオンチャンネルアッセイのデータをグラフとして示す。図25(a)は、カルバコールの添加に対する神経芽細胞による応答に関連する。図25(b)-(c)は、50mM KClの添加に対する神経芽細胞によるカルシウム応答に関連する。この場合、開口432は図の平面上にあり、レンズ440は対物レンズ470の後焦点面460上に開口432により形成された照明ストライプを中継し、これは図6の平面に垂直の対象平面におけるライン484に変換する。
Claims (17)
- 共焦点イメージングシステムであって、
a)放射が伝搬する光軸と直交方向に伸びる電磁放射の伸長ビームを形成するためのスリット付き空間フィルタからなる手段;
b)対象が位置する第1平面における第1伸長領域に伸長ビームを向けて集束させるとともに、対象から放射される蛍光放射を1以上の第2伸長領域に向ける手段であって、各第2伸長領域が第1平面に共役した異なる第2平面上にある手段;
c)第2共役平面において又は第2共役平面に共役した第3平面において、対象から放射される蛍光放射と一致する検出エレメントの方形アレイを含む検出デバイス;及び
d)放射された蛍光放射が検出エレメントの方形アレイに導かれて検出デバイスによって走査と同期して蛍光放射を示す複数の電子シグナルへと変換されるように、対象に対して伸長ビームを動かすか或いは伸長ビームに対して対象を動かすことにより対象を走査する手段
を含む、共焦点イメージングシステム。 - 更にa)第2伸長領域と整列した長軸を有するスリット付き空間フィルター;及び
b)検出デバイス上に、第2共役平面のイメージを形成する手段
を含む、請求項1記載の共焦点イメージングシステム。 - 対象に向かう電磁放射の伸長ビームが2以上の波長を含む、請求項1記載の共焦点イメージングシステム。
- 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置する、請求項1記載の共焦点イメージングシステムであって、当該システムが、
a)第1波長を有する電磁放射の第1集束ビームであって、対物レンズを通して不連続表面に向かい、該不連続表面で反射されて対物レンズを通して戻る第1ビーム;
b)第2波長を有する電磁放射の第2集束ビームであって、対物レンズを通して連続表面に向かい、該連続表面で反射されて対物レンズを通して戻る第2ビーム;
c)反射されて対物レンズを通して戻ってきた第1波長の放射を第2波長から分ける手段;
d)不連続表面から対物レンズを通して戻ってきた第1集束ビームの検出のための第1ディテクター;
e)連続表面から対物レンズを通して戻ってきた第2集束ビームの検出のための第2ディテクター;
f)対物レンズを表面に対して、又は表面を対物レンズに対して移動させる移動手段;及び
g)第1及び第2ディテクター及び移動手段に接続したコントローラーであって、支持体上の第1集束ビーム又は第2集束ビームの位置にしたがって、移動手段を操作するコントローラー
を備える焦点システムを更に含む、請求項1記載の共焦点イメージングシステム。 - 走査手段が対象を通して伸長ビームを移動させるための回転光学手段を含む、請求項1記載の共焦点イメージングシステム。
- 対象上に向かう電磁放射の伸長ビームが1以上の波長を含み、第2平面が一つである、請求項1記載の共焦点イメージングシステム。
- 第1平面の第1伸長領域の対象から2以上の波長の蛍光放射が放射され、更に放射波長を分離して1以上の検出デバイスで少なくとも1つの分離した波長を検出する、請求項1記載の共焦点イメージングシステム。
- 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置する請求項1記載の共焦点イメージングシステムであって、当該システムが、
a)第1波長を有する電磁放射の第1集束ビームであって、対物レンズを通して不連続表面に向かい、該不連続表面で反射されて対物レンズを通して戻る第1ビーム;
b)第2波長を有する電磁放射の第2集束ビームであって、対物レンズを通して連続表面に向かい、該連続表面で反射されて対物レンズを通して戻る第2ビーム;
c)対物レンズを表面に対して、又は表面を対物レンズに対して移動させる移動手段;及び
d)焦点ディテクター及び移動手段に接続したコントローラー、支持体上の集束ビームの位置にしたがって焦点ディテクターからのシグナルに応答して移動手段を調節するコントローラー
を備える焦点システムを更に含む、請求項1記載の共焦点イメージングシステム。 - 第1及び第2波長が同じである、請求項4記載の共焦点イメージングシステム。
- 支持体がマイクロタイタープレートであり、不連続表面がマイクロタイタープレートの底である、請求項4又は請求項8記載の共焦点イメージングシステム。
- 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置し、対象から2以上の波長の蛍光放射が放出される請求項7記載の共焦点イメージングシステムであって、当該システムが、
a)第1波長を有する電磁放射の第1集束ビームであって、対物レンズを通して不連続表面に向かい、該不連続表面で反射されて対物レンズを通して戻る第1集束ビーム;
b)第2波長を有する電磁放射の第2集束ビームであって、対物レンズを通して連続表面に向かい、該連続表面で反射されて対物レンズを通して戻る第2集束ビーム;
c)反射されて対物レンズを通して戻ってきた第1波長の放射を第2波長から分ける手段;
d)不連続表面から対物レンズを通して戻ってきた第1集束ビームの検出のための第1ディテクター;
e)連続表面から対物レンズを通して戻ってきた第2集束ビームの検出のための第2ディテクター;
f)対物レンズを表面に対して、又は表面を対物レンズに対して移動させる移動手段;及び
g)第1及び第2ディテクター及び移動手段に接続したコントローラーであって、支持体上の第1集束ビーム又は第2集束ビームの位置にしたがって、第1ディテクター又は第2ディテクターからのシグナルに応答して移動手段を操作するコントローラー
を備える焦点システムを更に含む、請求項7記載の共焦点イメージングシステム。 - 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置し、対象から2以上の波長の蛍光放射が放出される請求項7記載の共焦点イメージングシステムであって、当該システムが、
a)第1波長を有する電磁放射の第1集束ビームであって、対物レンズを通して不連続表面に向かい、該不連続表面で反射されて対物レンズを通して戻る第1集束ビーム;
b)第2波長を有する電磁放射の第2集束ビームであって、対物レンズを通して連続表面に向かい、該連続表面で反射されて対物レンズを通して戻る第2集束ビーム;
c)対物レンズを表面に対して、又は表面を対物レンズに対して移動させる移動手段;及び
d)焦点ディテクター及び移動手段に接続したコントローラーであって、支持体上の集束ビームの位置にしたがって焦点ディテクターからのシグナルに応答して移動手段を調節するコントローラー
を備える焦点システムを更に含む、請求項7記載の共焦点イメージングシステム。 - 対象の試験方法であって、
a)請求項1記載の共焦点イメージングシステムを使用した対象から放射される蛍光放射を測定する段階、並びに
b)複数のシグナルの受信;
複数のシグナルと閾値との比較;
複数のシグナルと閾値との比較に基づいた複数のシグナルに対応する一組の縮約データ値の製造;及び
一組の縮約データ値に対応する対象の複数の領域の部分の空間的に関係に基づいた少なくとも二つのグループへの縮約データのグループ化
を含む過程を使用して、検出デバイスで生成した複数の電子シグナルをグループ化する段階
を含む試験方法。 - 対象の試験方法であって、
a)スリット付き空間フィルタによって、放射が伝搬する光軸と直交方向に伸びる電磁放射の伸長ビームを形成する段階;
b)対象が位置する第1平面における第1伸長領域に伸長ビームを向けて集束させるとともに、対象から放射される蛍光放射を1以上の第2伸長領域に向ける段階であって、各第2伸長領域が第1平面に共役した異なる第2平面上にある段階;
c)第2共役平面において又は第2共役平面に共役した第3平面において、対象から放射される蛍光放射と一致する検出エレメントの方形アレイを含む検出デバイスを設置する段階;及び
d)放射された蛍光放射が検出エレメントの方形アレイに導かれて検出デバイスによって走査と同期して蛍光放射を示す複数の電子シグナルへと変換されるように、対象に対して伸長ビームを動かすか或いは伸長ビームに対して対象を動かすことにより対象を走査する段階
を含む試験方法。 - 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置する請求項14記載の試験方法であって、当該方法が、
a)第1集束ビームが対物レンズを通して不連続表面で反射されて対物レンズを通して戻るように、不連続表面への対物レンズを通して第1波長を有する電磁放射の第1集束ビームを方向付ける段階;
b)第2集束ビームが対物レンズを通して連続表面で反射されて対物レンズを通して戻るように、連続表面への対物レンズを通した第2波長を有する電磁放射の第1集束ビームの方向付ける段階;
c)反射されて対物レンズを通して戻ってきた第1波長の放射を第2波長から分離する段階;
d)不連続表面から対物レンズを通して戻ってきた第1集束ビームを第1ディテクターで検出する段階;
e)不連続表面から対物レンズを通して戻ってきた第2集束ビームを第2ディテクターで検出する段階;及び
f)支持体上の第1集束ビーム又は第2集束ビームの位置にしたがう第1ディテクター又は第2ディテクターからのシグナルに応答して、支持体に対して対物レンズを移動させるか或いは対物レンズに対して支持体を移動させる段階
を含む集束法を更に含む、試験方法。 - 不連続表面と同じ方向に伸びる連続表面を有する支持体の不連続表面に対象が位置する請求項14記載の試験方法であって、当該方法が、
a)対物レンズを通して不連続表面で反射されて対物レンズを通して戻るように、不連続表面へ対物レンズを通して電磁放射の集束ビームを方向付ける段階;
b)不連続表面から対物レンズを通して戻ってきた集束ビームを焦点ディテクターで検出する段階;及び
c)支持体上の集束ビームの位置にしたがう焦点ディテクターからのシグナルに応答して、支持体に対して対物レンズを移動させるか或いは対物レンズに対して支持体を移動させる段階
を含む集束法を更に含む、請求項14記載の試験方法。 - a)複数のシグナルの受信;
b)複数のシグナルと閾値との比較;
c)複数のシグナルと閾値との比較に基づいた複数のシグナルに対応する一組の縮約データ値の製造;そして
d)一組の縮約データ値に対応する対象の複数の領域の部分の空間的に関係に基づいた少なくとも二つのグループへの縮約データのグループ化
を含む過程を使用して検出デバイスで生成した複数の電子シグナルをグループ化する段階を更に含む、請求項14記載の試験方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4252798A | 1998-03-16 | 1998-03-16 | |
| US09/042,527 | 1998-03-16 | ||
| PCT/US1999/005589 WO1999047963A1 (en) | 1998-03-16 | 1999-03-16 | Confocal microscopy imaging system |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2002507762A JP2002507762A (ja) | 2002-03-12 |
| JP2002507762A5 JP2002507762A5 (ja) | 2008-03-21 |
| JP4812937B2 true JP4812937B2 (ja) | 2011-11-09 |
Family
ID=21922413
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000537103A Expired - Fee Related JP4812937B2 (ja) | 1998-03-16 | 1999-03-16 | 共焦点顕微鏡イメージングシステム |
Country Status (10)
| Country | Link |
|---|---|
| EP (1) | EP1064579A4 (ja) |
| JP (1) | JP4812937B2 (ja) |
| KR (2) | KR100618502B1 (ja) |
| CN (1) | CN100380160C (ja) |
| AU (1) | AU758571B2 (ja) |
| BR (1) | BR9908767B1 (ja) |
| CA (1) | CA2324262C (ja) |
| IL (2) | IL138496A0 (ja) |
| NO (1) | NO20004601L (ja) |
| WO (1) | WO1999047963A1 (ja) |
Families Citing this family (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5876946A (en) * | 1997-06-03 | 1999-03-02 | Pharmacopeia, Inc. | High-throughput assay |
| US20030036855A1 (en) | 1998-03-16 | 2003-02-20 | Praelux Incorporated, A Corporation Of New Jersey | Method and apparatus for screening chemical compounds |
| GB2338568B (en) * | 1998-06-19 | 2000-12-20 | Optiscan Pty Ltd | Two photon endoscope or microscope method and apparatus |
| US6690463B2 (en) * | 2000-02-10 | 2004-02-10 | Evotec Biosystems Ag | Fluorescence intensity and lifetime distribution analysis |
| ATE277386T1 (de) * | 2000-10-27 | 2004-10-15 | Amersham Biosciences Corp | Verfahren zum screening von chemischen verbindungen |
| FR2820828B1 (fr) * | 2001-02-09 | 2003-05-02 | Commissariat Energie Atomique | Dispositif d'observation d'echantillons par fluorescence, notamment de facon sequentielle |
| DE10117723A1 (de) * | 2001-04-09 | 2002-10-17 | Evotec Ag | Probenträger, insbesondere für biochemische Reaktionen |
| US7219016B2 (en) | 2001-04-20 | 2007-05-15 | Yale University | Systems and methods for automated analysis of cells and tissues |
| DE10122607B4 (de) * | 2001-05-10 | 2006-11-30 | Leica Microsystems Cms Gmbh | Verfahren und Anordnung zur direkten Fourierabbildung von Proben |
| DE10157511A1 (de) | 2001-11-23 | 2003-06-12 | Evotec Ag | Verfahren und Vorrichtung zur Korrektur der Größe und/oder Form eines Messvolumens in einer chemischen und/oder biologischen Probe |
| JP2003177131A (ja) * | 2001-12-11 | 2003-06-27 | Olympus Optical Co Ltd | 生物学的な結合親和性を検出する方法 |
| GB0211068D0 (en) * | 2002-05-14 | 2002-06-26 | Amersham Biosciences Uk Ltd | Method for assessing biofilms |
| GB0211072D0 (en) * | 2002-05-15 | 2002-06-26 | Amersham Biosciences Uk Ltd | Reagent and method for the determination of changes in a cellular morphological parameter |
| US6982166B2 (en) * | 2002-05-16 | 2006-01-03 | Applera Corporation | Lens assembly for biological testing |
| US9157860B2 (en) | 2002-05-16 | 2015-10-13 | Applied Biosystems, Llc | Achromatic lens array |
| DE102004014048B4 (de) * | 2004-03-19 | 2008-10-30 | Sirona Dental Systems Gmbh | Vermessungseinrichtung und Verfahren nach dem Grundprinzip der konfokalen Mikroskopie |
| US7170675B2 (en) | 2004-05-19 | 2007-01-30 | Celloptic, Inc. | Method and system for wide-field multi-photon microscopy having a confocal excitation plane |
| DE102004034970A1 (de) * | 2004-07-16 | 2006-02-02 | Carl Zeiss Jena Gmbh | Lichtrastermikroskop und Verwendung |
| CN101031837B (zh) * | 2004-07-23 | 2011-06-15 | 通用电气医疗集团尼亚加拉有限公司 | 用于荧光共焦显微镜检查的方法和设备 |
| CN1310023C (zh) * | 2004-11-10 | 2007-04-11 | 哈尔滨工业大学 | 三差动共焦显微三维超分辨成像方法 |
| GB0427050D0 (en) * | 2004-12-10 | 2005-01-12 | Amersham Biosciences Uk Ltd | Method of,and apparatus and computer software for,imaging biological objects |
| DE202005010588U1 (de) * | 2005-07-04 | 2005-10-13 | Weiss Umwelttechnik Gmbh Simulationsanlagen-Messtechnik | Anordnung zum Prüfen von pharmazeutischen Substanzen |
| US7329860B2 (en) | 2005-11-23 | 2008-02-12 | Illumina, Inc. | Confocal imaging methods and apparatus |
| KR100737170B1 (ko) * | 2006-01-20 | 2007-07-10 | 경북대학교 산학협력단 | 양자점 형광체를 이용한 이동식 형광 측정장치 |
| US7567346B2 (en) * | 2006-03-01 | 2009-07-28 | General Electric Company | System and method for multimode imaging |
| CA2650776A1 (en) | 2006-05-05 | 2007-11-15 | Yale University | Immunohistochemical methods for determining signal transduction activity in tumors |
| WO2008008500A2 (en) | 2006-07-13 | 2008-01-17 | Yale University | Methods for making cancer prognoses based on the subcellular localization of biomarkers |
| US7838302B2 (en) | 2006-08-07 | 2010-11-23 | President And Fellows Of Harvard College | Sub-diffraction limit image resolution and other imaging techniques |
| GB0625775D0 (en) | 2006-12-22 | 2007-02-07 | Isis Innovation | Focusing apparatus and method |
| JP4957458B2 (ja) * | 2007-08-27 | 2012-06-20 | 株式会社Jvcケンウッド | ボイスコイル及びスピーカ |
| JPWO2009048142A1 (ja) * | 2007-10-11 | 2011-02-24 | 株式会社ニコン | 観察装置 |
| CN101918816B (zh) * | 2007-12-21 | 2015-12-02 | 哈佛大学 | 三维中的亚衍射极限图像分辨率 |
| WO2009115108A1 (en) * | 2008-03-19 | 2009-09-24 | Ruprecht-Karls-Universität Heidelberg | A method and an apparatus for localization of single dye molecules in the fluorescent microscopy |
| KR101532611B1 (ko) * | 2009-04-28 | 2015-07-01 | 삼성전자주식회사 | 주밍샷 효과를 나타내는 디지털 영상 처리 장치 및 방법 |
| CN102782479B (zh) * | 2010-03-01 | 2014-04-30 | 奥林巴斯株式会社 | 光学分析装置、光学分析方法 |
| US8692708B2 (en) * | 2010-03-30 | 2014-04-08 | Sony Corporation | Radiometric imaging device and corresponding method |
| US8767069B2 (en) * | 2010-06-30 | 2014-07-01 | Luminex Corporation | Apparatus, system, and method for increasing measurement accuracy in a particle imaging device using light distribution |
| JP5877155B2 (ja) | 2010-07-26 | 2016-03-02 | オリンパス株式会社 | 発光プローブを用いて溶液中の希薄粒子を検出する方法 |
| CN103097878B (zh) | 2010-09-10 | 2015-07-22 | 奥林巴斯株式会社 | 使用单个发光颗粒的光强度的光学分析方法 |
| JP5893564B2 (ja) | 2010-09-10 | 2016-03-23 | オリンパス株式会社 | 複数の波長帯域の光計測を用いた光分析方法 |
| CN103119421B (zh) * | 2010-09-21 | 2015-04-08 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析方法 |
| JP5737704B2 (ja) * | 2010-09-27 | 2015-06-17 | 株式会社ライフテック | 蛍光一粒子検出方法および検出システム |
| JP5904947B2 (ja) * | 2010-10-13 | 2016-04-20 | オリンパス株式会社 | 単一発光粒子検出を用いた粒子の拡散特性値の測定方法 |
| EP2620763A4 (en) * | 2010-10-19 | 2015-05-27 | Olympus Corp | OPTICAL ANALYSIS DEVICE FOR OBSERVING THE POLARIZATION CHARACTERISTICS OF A SINGLE LIGHT-EMITTING PARTICLE, OPTICAL ANALYSIS METHOD, AND OPTICAL ANALYSIS COMPUTER PROGRAM |
| CN103229042B (zh) | 2010-11-25 | 2016-06-29 | 奥林巴斯株式会社 | 利用单个发光粒子的光的波长特性的光分析装置和光分析方法 |
| JP5856983B2 (ja) | 2011-01-20 | 2016-02-10 | オリンパス株式会社 | 単一発光粒子からの光の検出を用いた光分析方法及び光分析装置 |
| WO2012102326A1 (ja) | 2011-01-26 | 2012-08-02 | オリンパス株式会社 | 核酸分子の多型識別方法 |
| JP5856984B2 (ja) | 2011-01-26 | 2016-02-10 | オリンパス株式会社 | 核酸分子の多型識別方法 |
| US9477072B2 (en) * | 2011-03-01 | 2016-10-25 | Ge Healthcare Bio-Sciences Corp. | Systems and methods for illumination phase control in fluorescence microscopy |
| CN103460026B (zh) | 2011-03-29 | 2015-06-10 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析装置、光分析方法以及光分析用计算机程序 |
| CN103477210B (zh) | 2011-04-13 | 2015-09-23 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析装置、光分析方法以及光分析用计算机程序 |
| EP2700935A4 (en) | 2011-04-18 | 2014-10-22 | Olympus Corp | QUANTITATIVE PROCEDURE FOR TARGET PARTICLES, PHOTOMETRIC ANALYSIS DEVICE AND COMPUTER PROGRAM FOR PHOTOMETRIC ANALYSIS |
| CN103733047B (zh) | 2011-08-11 | 2016-03-30 | 奥林巴斯株式会社 | 目标粒子的检测方法 |
| EP2746748B1 (en) | 2011-08-15 | 2017-12-06 | Olympus Corporation | Photometric analysis device using single light emitting particle detection, photometric analysis method and computer program for photometric analysis, |
| CN103765195B (zh) | 2011-08-26 | 2018-06-01 | 奥林巴斯株式会社 | 利用光分析的单个粒子检测装置、单个粒子检测方法以及单个粒子检测用计算机程序 |
| CN103765196B (zh) | 2011-08-26 | 2016-03-02 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析装置及光分析方法 |
| WO2013031377A1 (ja) | 2011-08-30 | 2013-03-07 | オリンパス株式会社 | 単一発光粒子検出を用いた光分析装置、光分析方法及び光分析用コンピュータプログラム |
| EP2752655A4 (en) | 2011-08-30 | 2015-06-17 | Olympus Corp | PROCEDURE FOR DETECTING TARGET PARTICLES |
| CN103782155B (zh) * | 2011-09-06 | 2016-11-16 | 皇家飞利浦有限公司 | 具有多个传感器区域的光学生物传感器 |
| CN103930768B (zh) | 2011-11-10 | 2016-05-18 | 奥林巴斯株式会社 | 利用单个发光粒子检测的光分析装置、光分析方法以及光分析用计算机程序 |
| DE102011087196A1 (de) * | 2011-11-28 | 2013-05-29 | Leica Microsystems Cms Gmbh | Mikroskopbeleuchtungssystem und -verfahren |
| EP2816344A4 (en) | 2012-02-17 | 2015-09-23 | Olympus Corp | OPTICAL ANALYSIS DEVICE USING SINGLE PARTICLE DETECTION TECHNIQUE, OPTICAL ANALYSIS METHOD, AND COMPUTER PROGRAM FOR OPTICAL ANALYSIS |
| EP2818850B1 (en) | 2012-02-22 | 2016-08-03 | Olympus Corporation | Method for detecting a target particle |
| CH706326A2 (de) * | 2012-03-14 | 2013-09-30 | Tecan Trading Ag | Verfahren und Mikroplatten-Reader zum Untersuchung von biologischen Zellen oder Zellkulturen. |
| WO2013140890A1 (ja) | 2012-03-21 | 2013-09-26 | オリンパス株式会社 | 標的核酸分子の検出方法 |
| WO2013157319A1 (ja) | 2012-04-18 | 2013-10-24 | オリンパス株式会社 | 光分析を用いた単一粒子検出装置、単一粒子検出方法及び単一粒子検出用コンピュータプログラム |
| WO2013157283A1 (ja) | 2012-04-18 | 2013-10-24 | オリンパス株式会社 | 標的粒子の検出方法 |
| CN102841083B (zh) * | 2012-06-11 | 2014-08-20 | 北京大学 | 一种激光扫描位相显微成像方法及系统 |
| US8654352B1 (en) * | 2012-08-08 | 2014-02-18 | Asm Technology Singapore Pte Ltd | Chromatic confocal scanning apparatus |
| CN104155279B (zh) * | 2013-05-13 | 2017-04-26 | 中国科学院大连化学物理研究所 | 一种线形共聚焦紫外拉曼光谱仪 |
| JP6360481B2 (ja) | 2013-07-31 | 2018-07-18 | オリンパス株式会社 | 単一発光粒子検出技術を用いた光学顕微鏡装置、顕微鏡観察法及び顕微鏡観察のためのコンピュータプログラム |
| JP6313776B2 (ja) | 2013-10-07 | 2018-04-18 | オリンパス株式会社 | 単一発光粒子検出を用いた光分析装置、光分析方法及び光分析用コンピュータプログラム |
| CN106662530A (zh) * | 2014-09-05 | 2017-05-10 | 特莫费希尔科学公司 | 用于液体样品的光学测量的方法和装置 |
| CN104296684B (zh) * | 2014-11-05 | 2016-11-30 | 哈尔滨工业大学 | 基于表面镀膜共焦显微形貌测量装置的膜厚误差校正方法 |
| GB2534402A (en) * | 2015-01-22 | 2016-07-27 | Idea Biomedical Ltd | Auto-focussing method and device |
| CN104677884B (zh) * | 2015-03-17 | 2017-07-11 | 北京理工大学 | 高空间分辨激光分光瞳差动共焦质谱显微成像方法与装置 |
| CN104697452A (zh) * | 2015-03-24 | 2015-06-10 | 宁波高新区零零七工业设计有限公司 | 激光成像系统 |
| US9599807B2 (en) * | 2015-06-30 | 2017-03-21 | General Electric Company | Optical microscope and method for detecting lens immersion |
| JPWO2017098597A1 (ja) | 2015-12-09 | 2018-10-11 | オリンパス株式会社 | 単一発光粒子検出を用いた光分析方法及び光分析装置 |
| LU93022B1 (de) * | 2016-04-08 | 2017-11-08 | Leica Microsystems | Verfahren und Mikroskop zum Untersuchen einer Probe |
| CN108061964B (zh) * | 2017-10-25 | 2020-03-27 | 中国科学技术大学 | 一种可用于大样品的高速三维显微成像装置和方法 |
| CN108319008B (zh) * | 2018-02-02 | 2019-11-12 | 华中科技大学 | 一种光学显微成像方法及装置 |
| CN108680542B (zh) * | 2018-03-26 | 2020-01-10 | 华中科技大学 | 一种阵列式线扫描荧光显微成像装置 |
| CN108445619A (zh) * | 2018-05-11 | 2018-08-24 | 中国工程物理研究院流体物理研究所 | 光学扫描系统及方法 |
| WO2021152562A1 (en) * | 2020-01-31 | 2021-08-05 | Stellenbosch University | Method for determining mitochondrial events |
| CN111239047B (zh) * | 2020-03-09 | 2023-10-27 | 深圳中科飞测科技股份有限公司 | 一种光学设备及实现自动聚焦的方法 |
| EP4211508A1 (en) | 2020-09-14 | 2023-07-19 | Singular Genomics Systems, Inc. | Methods and systems for multidimensional imaging |
| KR102447224B1 (ko) * | 2020-10-26 | 2022-09-27 | 한국생산기술연구원 | 미세 입자의 정성 및 정량 분석 장치 |
| CN114813706B (zh) * | 2022-06-29 | 2022-12-13 | 国科大杭州高等研究院 | 一种血细胞高光谱光镊捕获能量共振转移分析仪 |
Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH04221917A (ja) * | 1990-12-25 | 1992-08-12 | Tamron Co Ltd | 顕微鏡の自動焦点調節方法およびその装置 |
| JPH05502305A (ja) * | 1989-12-05 | 1993-04-22 | ワシントン ユニヴァーシティ | 単絞り共焦走査式生体顕微鏡 |
| JPH05188301A (ja) * | 1991-09-09 | 1993-07-30 | Sumitomo Electric Ind Ltd | レーザ顕微鏡 |
| JPH05332733A (ja) * | 1992-05-27 | 1993-12-14 | Hitachi Ltd | 検出光学系並びに立体形状検出方法 |
| JPH07128596A (ja) * | 1993-09-08 | 1995-05-19 | Nikon Corp | コンフォーカル顕微鏡 |
| JPH07248453A (ja) * | 1994-03-10 | 1995-09-26 | Olympus Optical Co Ltd | 観察画像の位置調整装置 |
| JPH07281100A (ja) * | 1994-04-05 | 1995-10-27 | Nikon Corp | オートフォーカス顕微鏡用の挟持標本体 |
| WO1997021979A1 (en) * | 1995-12-12 | 1997-06-19 | Spectral Diagnostic Ltd. | Spectral bio-imaging methods for biological research, medical diagnostics and therapy |
| JPH09512446A (ja) * | 1994-04-21 | 1997-12-16 | ラルフ ザッカーマン, | 定常状態でのルミネセンスの存続時間による分析物の検出 |
| JPH09329749A (ja) * | 1996-06-11 | 1997-12-22 | Nikon Corp | 光走査型顕微鏡 |
| JPH10311950A (ja) * | 1997-05-14 | 1998-11-24 | Olympus Optical Co Ltd | 走査型顕微鏡 |
| JP2000512744A (ja) * | 1996-05-16 | 2000-09-26 | アフィメトリックス,インコーポレイテッド | 標識材料を検出するシステムおよび方法 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS63306413A (ja) * | 1987-06-09 | 1988-12-14 | Olympus Optical Co Ltd | 走査型光学顕微鏡 |
| US4844617A (en) * | 1988-01-20 | 1989-07-04 | Tencor Instruments | Confocal measuring microscope with automatic focusing |
| US5034613A (en) * | 1989-11-14 | 1991-07-23 | Cornell Research Foundation, Inc. | Two-photon laser microscopy |
| US5274240A (en) * | 1990-01-12 | 1993-12-28 | The Regents Of The University Of California | Capillary array confocal fluorescence scanner and method |
| GB9015793D0 (en) * | 1990-07-18 | 1990-09-05 | Medical Res Council | Confocal scanning optical microscope |
| US5162641A (en) * | 1991-02-19 | 1992-11-10 | Phoenix Laser Systems, Inc. | System and method for detecting, correcting and measuring depth movement of target tissue in a laser surgical system |
| US5465147A (en) * | 1991-04-29 | 1995-11-07 | Massachusetts Institute Of Technology | Method and apparatus for acquiring images using a ccd detector array and no transverse scanner |
| US5587832A (en) * | 1993-10-20 | 1996-12-24 | Biophysica Technologies, Inc. | Spatially light modulated confocal microscope and method |
| US5900949A (en) * | 1996-05-23 | 1999-05-04 | Hewlett-Packard Company | CCD imager for confocal scanning microscopy |
| US5880465A (en) * | 1996-05-31 | 1999-03-09 | Kovex Corporation | Scanning confocal microscope with oscillating objective lens |
| US5915048A (en) * | 1996-06-05 | 1999-06-22 | Zetetic Institute | Method and apparatus for discriminating in-focus images from out-of-focus light signals from background and foreground light sources |
| DE19627568A1 (de) * | 1996-07-09 | 1998-01-15 | Zeiss Carl Jena Gmbh | Anordnung und Verfahren zur konfokalen Mikroskopie |
| DE19632594A1 (de) * | 1996-08-13 | 1998-02-19 | Johannes Prof Dr Schwider | Konfokales Mikroskop unter Anwendung von refraktiven Mikrolinsen-Feldern |
| US5760901A (en) * | 1997-01-28 | 1998-06-02 | Zetetic Institute | Method and apparatus for confocal interference microscopy with background amplitude reduction and compensation |
-
1999
- 1999-03-16 EP EP99914908A patent/EP1064579A4/en not_active Withdrawn
- 1999-03-16 AU AU33547/99A patent/AU758571B2/en not_active Ceased
- 1999-03-16 CN CNB998062219A patent/CN100380160C/zh not_active Expired - Fee Related
- 1999-03-16 BR BRPI9908767-7A patent/BR9908767B1/pt not_active IP Right Cessation
- 1999-03-16 WO PCT/US1999/005589 patent/WO1999047963A1/en active IP Right Grant
- 1999-03-16 IL IL13849699A patent/IL138496A0/xx not_active IP Right Cessation
- 1999-03-16 JP JP2000537103A patent/JP4812937B2/ja not_active Expired - Fee Related
- 1999-03-16 CA CA2324262A patent/CA2324262C/en not_active Expired - Fee Related
- 1999-03-16 KR KR1020057015316A patent/KR100618502B1/ko not_active IP Right Cessation
- 1999-03-16 KR KR1020007010258A patent/KR100560588B1/ko not_active IP Right Cessation
-
2000
- 2000-09-15 NO NO20004601A patent/NO20004601L/no not_active Application Discontinuation
-
2004
- 2004-09-28 IL IL16431904A patent/IL164319A0/xx unknown
Patent Citations (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05502305A (ja) * | 1989-12-05 | 1993-04-22 | ワシントン ユニヴァーシティ | 単絞り共焦走査式生体顕微鏡 |
| JPH04221917A (ja) * | 1990-12-25 | 1992-08-12 | Tamron Co Ltd | 顕微鏡の自動焦点調節方法およびその装置 |
| JPH05188301A (ja) * | 1991-09-09 | 1993-07-30 | Sumitomo Electric Ind Ltd | レーザ顕微鏡 |
| JPH05332733A (ja) * | 1992-05-27 | 1993-12-14 | Hitachi Ltd | 検出光学系並びに立体形状検出方法 |
| JPH07128596A (ja) * | 1993-09-08 | 1995-05-19 | Nikon Corp | コンフォーカル顕微鏡 |
| JPH07248453A (ja) * | 1994-03-10 | 1995-09-26 | Olympus Optical Co Ltd | 観察画像の位置調整装置 |
| JPH07281100A (ja) * | 1994-04-05 | 1995-10-27 | Nikon Corp | オートフォーカス顕微鏡用の挟持標本体 |
| JPH09512446A (ja) * | 1994-04-21 | 1997-12-16 | ラルフ ザッカーマン, | 定常状態でのルミネセンスの存続時間による分析物の検出 |
| WO1997021979A1 (en) * | 1995-12-12 | 1997-06-19 | Spectral Diagnostic Ltd. | Spectral bio-imaging methods for biological research, medical diagnostics and therapy |
| JPH11500832A (ja) * | 1995-12-12 | 1999-01-19 | スペクトラル ダイアグノスティック リミテッド | 生物学研究、医療診断および治療用の分光生物撮像法、蛍光交配方法および細胞分類方法 |
| JP2000512744A (ja) * | 1996-05-16 | 2000-09-26 | アフィメトリックス,インコーポレイテッド | 標識材料を検出するシステムおよび方法 |
| JPH09329749A (ja) * | 1996-06-11 | 1997-12-22 | Nikon Corp | 光走査型顕微鏡 |
| JPH10311950A (ja) * | 1997-05-14 | 1998-11-24 | Olympus Optical Co Ltd | 走査型顕微鏡 |
Also Published As
| Publication number | Publication date |
|---|---|
| IL164319A0 (en) | 2005-12-18 |
| WO1999047963A9 (en) | 1999-12-23 |
| KR100618502B1 (ko) | 2006-09-01 |
| EP1064579A4 (en) | 2007-11-07 |
| KR20010041945A (ko) | 2001-05-25 |
| KR20050088500A (ko) | 2005-09-06 |
| NO20004601L (no) | 2000-11-10 |
| AU3354799A (en) | 1999-10-11 |
| BR9908767A (pt) | 2001-10-16 |
| IL138496A0 (en) | 2001-10-31 |
| JP2002507762A (ja) | 2002-03-12 |
| EP1064579A1 (en) | 2001-01-03 |
| WO1999047963A1 (en) | 1999-09-23 |
| CN100380160C (zh) | 2008-04-09 |
| BR9908767B1 (pt) | 2011-09-06 |
| WO1999047963A8 (en) | 1999-11-18 |
| KR100560588B1 (ko) | 2006-03-16 |
| CA2324262C (en) | 2010-05-25 |
| AU758571B2 (en) | 2003-03-27 |
| NO20004601D0 (no) | 2000-09-15 |
| CN1301357A (zh) | 2001-06-27 |
| CA2324262A1 (en) | 1999-09-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4812937B2 (ja) | 共焦点顕微鏡イメージングシステム | |
| US6400487B1 (en) | Method and apparatus for screening chemical compounds | |
| US7957911B2 (en) | Method and apparatus for screening chemical compounds | |
| EP1330787B1 (en) | Method for screening chemical compounds | |
| EP2453238B1 (en) | Optical microscopy with phototransformable optical labels | |
| KR101361652B1 (ko) | 라만 분석 기반 고속 다중 약물 고속 스크리닝 장치 | |
| AU2004262115B2 (en) | Analysing biological entities | |
| US7881509B2 (en) | Method of, and apparatus and computer software for, imaging biological objects | |
| JP2008523376A5 (ja) | ||
| AU2003204937B2 (en) | Confocal microscopy imaging system | |
| AU2001215764B2 (en) | Method and apparatus for screening chemical compounds | |
| AU2007203332A1 (en) | Method and apparatus for screening chemical compounds | |
| AU2001215764A1 (en) | Method and apparatus for screening chemical compounds | |
| Zemanová et al. | High-Throughput Screening of Interactions Between G ProteinCoupled Receptors and Ligands Using Confocal Optics Microscopy | |
| CASANO et al. | Uses of High Content Screening in Chemical Optimization | |
| Gradl et al. | High-Throughput/High-Content Automated Image Acquisition and Analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20041124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20041217 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20041217 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060316 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060316 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20071024 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20071030 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20080130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20081118 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090218 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090227 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090318 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090415 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20090415 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090415 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090609 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090609 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100119 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100419 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100426 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100519 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100526 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20100618 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20100625 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101224 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20110222 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110726 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110824 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140902 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |