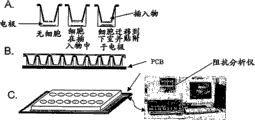
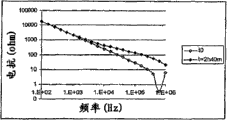
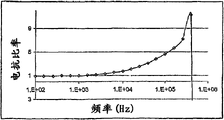
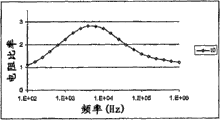
CN100577811C - 基于阻抗分析细胞和颗粒的装置和方法 - Google Patents
基于阻抗分析细胞和颗粒的装置和方法 Download PDFInfo
- Publication number
- CN100577811C CN100577811C CN03822348A CN03822348A CN100577811C CN 100577811 C CN100577811 C CN 100577811C CN 03822348 A CN03822348 A CN 03822348A CN 03822348 A CN03822348 A CN 03822348A CN 100577811 C CN100577811 C CN 100577811C
- Authority
- CN
- China
- Prior art keywords
- cell
- electrode
- chamber
- film
- migration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/12—Coulter-counters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
- G01N33/48707—Physical analysis of biological material of liquid biological material by electrical means
- G01N33/48728—Investigating individual cells, e.g. by patch clamp, voltage clamp
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
- G01N33/54373—Apparatus specially adapted for solid-phase testing involving physiochemical end-point determination, e.g. wave-guides, FETS, gratings
- G01N33/5438—Electrodes
Abstract
Description
| 孔号 | 细胞数目 | 细胞数目指数 | MTT读数 |
| B1 | 1.54E+04 | 4.74E+00 | 1.43E+00 |
| C1 | 1.19E+04 | 4.71E+00 | 1.43E+00 |
| D1 | 9.13E+03 | 3.73E+00 | 1.18E+00 |
| E1 | 7.03E+03 | 5.80E+00 | 1.01E+00 |
| F1 | 5.41E+03 | 4.41E+00 | 9.40E-01 |
| G1 | 4.17E+03 | 2.79E+00 | 7.62E-01 |
| H1 | 3.21E+03 | 1.59E+00 | 6.86E-01 |
| H2 | 2.47E+03 | 7.99E-01 | 5.99E-01 |
| G2 | 1.90E+03 | 6.94E-01 | 5.39E-01 |
| F2 | 1.47E+03 | 7.67E-01 | 4.29E-01 |
| E2 | 1.13E+03 | 5.89E-01 | 3.83E-01 |
| D2 | 8.69E+02 | 3.61E-01 | 3.30E-01 |
| C2 | 6.69E+02 | 2.62E-01 | 3.14E-01 |
| B2 | 5.15E+02 | 1.39E-01 | 2.48E-01 |
| A2 | 3.97E+02 | 1.51E-01 | 2.54E-01 |
| A1 | 0.00E+00 | 9.38E-02 | 2.38E-01 |
| 电极结构名称 | 基片材料 | 电极结构类型 | 尺寸(微米) | 活性区域直径 |
| 2CF | 玻璃 | 交错 | 48/28 | 6mm |
| 2BE | 玻璃 | 交错 | 48/18 | 3mm |
| 2AA | 玻璃 | 交错 | 80/50 | 1mm |
| 2AB | 玻璃 | 交错 | 80/15 | 1mm |
| 2AC | 玻璃 | 交错 | 50/30 | 1mm |
| 2AD | 玻璃 | 交错 | 50/10 | 1mm |
| 3C | 玻璃 | “圆在线上” | 60/160/180 | 3mm |
| 3B | 玻璃 | “圆在线上” | 30/80/90 | 3mm |
| 3A | 玻璃 | “圆在线上” | 30/80/90 | 1mm |
| 塑料(Kapton) | 交错 | 50/50 |
Claims (44)
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US60/379,749 | 2002-05-14 | ||
| US39774902P | 2002-07-20 | 2002-07-20 | |
| US43540002P | 2002-12-20 | 2002-12-20 | |
| US60/435,400 | 2002-12-20 | ||
| US46957203P | 2003-05-09 | 2003-05-09 | |
| US60/469,572 | 2003-05-09 | ||
| PCT/US2003/022557 WO2004010103A2 (en) | 2002-07-20 | 2003-07-18 | Impedance based devices and methods for use in assays |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1681937A CN1681937A (zh) | 2005-10-12 |
| CN100577811C true CN100577811C (zh) | 2010-01-06 |
Family
ID=30773523
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN03822348A Expired - Lifetime CN100577811C (zh) | 2002-07-20 | 2003-07-18 | 基于阻抗分析细胞和颗粒的装置和方法 |
| CNB038224542A Expired - Lifetime CN100487133C (zh) | 2002-07-20 | 2003-07-18 | 基于阻抗的检测装置和方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB038224542A Expired - Lifetime CN100487133C (zh) | 2002-07-20 | 2003-07-18 | 基于阻抗的检测装置和方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US7459303B2 (zh) |
| EP (2) | EP1527328B1 (zh) |
| JP (2) | JP4745056B2 (zh) |
| CN (2) | CN100577811C (zh) |
| AT (2) | ATE448482T1 (zh) |
| AU (2) | AU2003269911A1 (zh) |
| CA (2) | CA2493101C (zh) |
| DE (2) | DE60330022D1 (zh) |
| HK (2) | HK1083238A1 (zh) |
| WO (2) | WO2004010102A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110243873A (zh) * | 2019-07-01 | 2019-09-17 | 广州迈普再生医学科技股份有限公司 | 多功能细胞传感器系统及其测量方法 |
Families Citing this family (154)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8202439B2 (en) | 2002-06-05 | 2012-06-19 | Panasonic Corporation | Diaphragm and device for measuring cellular potential using the same, manufacturing method of the diaphragm |
| US8263375B2 (en) | 2002-12-20 | 2012-09-11 | Acea Biosciences | Dynamic monitoring of activation of G-protein coupled receptor (GPCR) and receptor tyrosine kinase (RTK) in living cells using real-time microelectronic cell sensing technology |
| US7560269B2 (en) | 2002-12-20 | 2009-07-14 | Acea Biosciences, Inc. | Real time electronic cell sensing system and applications for cytotoxicity profiling and compound assays |
| WO2005047482A2 (en) | 2003-11-12 | 2005-05-26 | Xiao Xu | Real time electronic cell sensing systems and applications for cell-based assays |
| US7732127B2 (en) * | 2002-12-20 | 2010-06-08 | Acea Biosciences, Inc. | Dynamic monitoring of cell adhesion and spreading using the RT-CES system |
| US8206903B2 (en) | 2002-12-20 | 2012-06-26 | Acea Biosciences | Device and method for electroporation-based delivery of molecules into cells and dynamic monitoring of cell responses |
| US11346797B2 (en) | 2002-12-20 | 2022-05-31 | Agilent Technologies, Inc. | System and method for monitoring cardiomyocyte beating, viability, morphology and electrophysiological properties |
| US10215748B2 (en) | 2002-12-20 | 2019-02-26 | Acea Biosciences, Inc. | Using impedance-based cell response profiling to identify putative inhibitors for oncogene addicted targets or pathways |
| US10539523B2 (en) | 2002-12-20 | 2020-01-21 | Acea Biosciences, Inc. | System and method for monitoring cardiomyocyte beating, viability, morphology, and electrophysiological properties |
| US10551371B2 (en) | 2003-11-10 | 2020-02-04 | Acea Biosciences, Inc. | System and method for monitoring cardiomyocyte beating, viability and morphology and for screening for pharmacological agents which may induce cardiotoxicity or modulate cardiomyocyte function |
| ATE455180T1 (de) * | 2004-01-29 | 2010-01-15 | Narvalus S R L | Biochip electroporationsgerät mit mehreren positionen zur einzelzellelectroporation |
| EP2639576B1 (en) * | 2004-02-09 | 2016-04-20 | ACEA Biosciences, Inc. | Real-time electronic cell sensing system and applications for cytotoxicity profiling and compound assays |
| CN101400780B (zh) * | 2004-02-09 | 2012-06-20 | 美国艾森生物科学公司 | 实时细胞电子分析系统及其在细胞毒性检测和化合物分析上的应用 |
| DE102004010944A1 (de) * | 2004-03-03 | 2005-09-22 | Humboldt-Universität Zu Berlin | Verfahren und Vorrichtung zum Messen einer physikalischen und/oder chemischen Eigenschaft eines biologischen Partikels in einem Mikrosystem |
| ATE437940T1 (de) * | 2004-03-15 | 2009-08-15 | Lonza Cologne Ag | Behältnis und vorrichtung zur erzeugung von elektrischen feldern in einzelnen reaktionsräumen |
| WO2005112933A2 (en) | 2004-04-20 | 2005-12-01 | Acea Biosciences Inc. | Substituted organosulfur compounds and methods of using thereof |
| KR100613612B1 (ko) | 2004-04-27 | 2006-08-18 | 삼성전자주식회사 | 인덕턴스 소자 및 캐패시턴스 소자를 이용한 바이오결합검출 장치 및 방법 |
| JP4587281B2 (ja) * | 2004-06-21 | 2010-11-24 | 則男 長尾 | 癌転移抑制能測定する方法およびその測定器 |
| EP1773979B1 (en) * | 2004-08-04 | 2016-06-29 | Acea Biosciences, Inc. | Dynamic monitoring of activation of g-protein (gpcr) in living cells using real-time microelectronic cell sensing technology |
| EP1800312A4 (en) * | 2004-09-27 | 2011-10-05 | Acea Biosciences Inc | DYNAMIC MONITORING OF CELL ADHESION AND DIFFUSION USING THE RT-CES SYSTEM |
| AU2006206426B2 (en) * | 2005-01-20 | 2012-03-15 | The Regents Of The University Of California | Cellular microarrays for screening differentiation factors |
| US7088116B1 (en) * | 2005-02-09 | 2006-08-08 | Haian Lin | Optoelectronic probe |
| US20060216203A1 (en) * | 2005-03-28 | 2006-09-28 | Mds Sciex (Us) A Division Of Mds Pharma Services (Us) Inc. | Multiwell sample plate with integrated impedance electrodes and connection scheme |
| US20060263873A1 (en) * | 2005-05-21 | 2006-11-23 | Levine Leanna M | Controlled flow microfluidic device and method of fabrication |
| WO2007026232A2 (en) * | 2005-09-01 | 2007-03-08 | Mcgill University | Methods and apparatus for detecting liquid inside individual channels in a multi-channel plate |
| US7459918B2 (en) * | 2005-09-09 | 2008-12-02 | David Jones | Impedance measurement system with incorporated internal measurement drift compensation networks |
| KR100801694B1 (ko) * | 2005-09-15 | 2008-02-11 | 삼성전자주식회사 | 원핵 세포를 이용한 독성물질 유해성의 전기적 분석방법 및분석장치 |
| US7686934B2 (en) * | 2005-12-13 | 2010-03-30 | Gamida For Life B.V. | Three dimensional dielectrophoretic separator and methods of use |
| US7776193B2 (en) * | 2005-12-20 | 2010-08-17 | Panasonic Corporation | Cell electrophysiological sensor |
| US8003380B2 (en) * | 2006-01-04 | 2011-08-23 | Agency For Science, Technology And Research | High throughput cell-based assays fabricated with integrated silicon and cell culture technologies |
| DE602007008357D1 (de) * | 2006-01-04 | 2010-09-23 | Novartis Ag | Antikörperabhängiger zellulärer zytotoxizitätstest |
| US20070182417A1 (en) * | 2006-02-03 | 2007-08-09 | Ivar Giaever | Electrical measurement of cell invasion |
| JP4858870B2 (ja) * | 2006-02-16 | 2012-01-18 | 財団法人生産技術研究奨励会 | 培養細胞の電気シグナル計測デバイスおよび該デバイスを用いる電気シグナル計測方法 |
| US8041515B2 (en) * | 2006-09-20 | 2011-10-18 | Acea Biosciences, Inc. | Use of impedance-based cytological profiling to classify cellular response profiles upon exposure to biologically active agents |
| JP2008096235A (ja) * | 2006-10-11 | 2008-04-24 | Sharp Corp | 電気化学計測マイクロチップ |
| US20080262740A1 (en) * | 2007-04-20 | 2008-10-23 | Infotonics Technology Center, Inc. | Permittivity-based material sensor |
| CN101038284B (zh) | 2007-04-25 | 2011-04-27 | 博奥生物有限公司 | 一种提高电阻抗检测装置的电阻抗检测灵敏度的方法 |
| US20080297169A1 (en) * | 2007-05-31 | 2008-12-04 | Greenquist Alfred C | Particle Fraction Determination of A Sample |
| ES2617305T3 (es) | 2007-07-17 | 2017-06-16 | Acea Biosciences, Inc. | Compuestos heterocíclicos y usos como agentes anticancerosos |
| ES2340118B1 (es) * | 2008-01-16 | 2011-04-04 | Consejo Superior De Investigaciones Cientificas (50%) | Dispositivo y procedimiento para medir concentracion de biomasa, y uso de un elemento electronico chip para medir dicha concentracion de biomasa. |
| ATE518136T1 (de) | 2008-02-25 | 2011-08-15 | Univ Leipzig | Vorrichtung und verfahren zur messung der impedanz in organischem gewebe |
| KR100952056B1 (ko) * | 2008-02-29 | 2010-04-07 | 아주대학교산학협력단 | 기계적 자극에 대한 줄기세포 분화의 최적의 조건을 검출할수 있는 셀-칩 및 이의 자동 제어 시스템 |
| KR100969667B1 (ko) * | 2008-03-24 | 2010-07-14 | 디지탈 지노믹스(주) | 생리활성물질을 전기적으로 검출하는 방법 및 이를 위한바이오칩 |
| CN101556273B (zh) | 2008-04-08 | 2013-03-20 | 博奥生物有限公司 | 利用电阻抗传感技术分析细胞迁移的方法及其专用装置 |
| WO2009137440A1 (en) | 2008-05-05 | 2009-11-12 | Acea Biosciences, Inc. | Label-free monitoring of excitation-contraction coupling and excitable cells using impedance based systems with millisecond time resolution |
| EP2271933B1 (en) * | 2008-05-07 | 2012-12-19 | University of Strathclyde | A system and method for cell characterisation |
| CN101614729B (zh) | 2008-06-27 | 2013-04-24 | 博奥生物有限公司 | 用于细胞操作及电生理信号检测的微电极阵列器件及专用装置 |
| CA2682439A1 (en) | 2008-10-17 | 2010-04-17 | F. Hoffmann-La Roche Ag | Cell monitoring and molecular analysis |
| EP2199783A1 (en) | 2008-12-17 | 2010-06-23 | Koninklijke Philips Electronics N.V. | Microelectronic device for measuring cell adhesion |
| US8227223B2 (en) * | 2009-01-27 | 2012-07-24 | Applied Biophysics, Inc. | Method and apparatus for facilitating evaluating migration of cells in vitro |
| EP2427543A4 (en) * | 2009-05-05 | 2017-11-29 | Acea Biosciences, Inc. | System and method for monitoring cardiomyocyte beating, viability and morphology and for screening for pharmacological agents which may induce cardiotoxicity or modulate cardiomyocyte function |
| WO2010141320A1 (en) * | 2009-06-01 | 2010-12-09 | Mariposa Biotechnology, Inc. | Device for removing cumulus from oocytes |
| DE102009035502A1 (de) * | 2009-07-30 | 2011-02-03 | Universitätsklinikum Jena | Verfahren und Vorrichtung zur Erfassung der Bewegung und Anlagerung von Zellen und Partikeln an Zell-, Gewebe- und Implantatschichten bei der Simulation von Flussbedingungen |
| DE102009052673A1 (de) * | 2009-11-12 | 2011-05-19 | Nanoanalytics Gmbh | Vorrichtung zur Bestimmung der Impedanz von Zellschichten |
| CN101712925B (zh) * | 2009-11-23 | 2013-01-09 | 浙江大学 | 检测单细胞和群细胞行为的多尺度集成细胞阻抗传感器 |
| CN101705184B (zh) * | 2009-11-26 | 2012-01-11 | 浙江大学 | 基于多参数检测集成芯片的全自动细胞生理参数分析仪 |
| US20110186428A1 (en) * | 2010-01-29 | 2011-08-04 | Roche Diagnostics Operations, Inc. | Electrode arrangements for biosensors |
| EP2536719A1 (en) | 2010-02-19 | 2012-12-26 | Acea Biosciences, Inc. | Heterocyclic compounds and uses as anticancer agents |
| CN102939447B (zh) * | 2010-02-25 | 2015-03-25 | 斯通瑞智公司 | 烟灰传感器系统 |
| WO2011146531A1 (en) | 2010-05-18 | 2011-11-24 | Acea Biosciences, Inc | Data analysis of impedance-based cardiomyocyte-beating signals as detected on real-time cell analysis (rtca) cardio instruments |
| US9029168B2 (en) * | 2010-06-28 | 2015-05-12 | The Trustees Of Princeton University | Use and making of biosensors utilizing antimicrobial peptides for highly sensitive biological monitoring |
| WO2012009606A1 (en) * | 2010-07-16 | 2012-01-19 | University Of Utah Research Foundation | Electrophysiological recording system and methods of using same |
| WO2012081940A2 (ko) * | 2010-12-16 | 2012-06-21 | 한국생명공학연구원 | 프린팅을 이용한 멤브레인 상 전극 및 이를 활용한 생체물질 검출 |
| KR101335246B1 (ko) * | 2010-12-16 | 2013-11-29 | 한국생명공학연구원 | 프린팅을 이용한 멤브레인 상 전극 및 이를 활용한 생체물질 검출 |
| KR101291310B1 (ko) | 2011-03-22 | 2013-07-30 | 서울대학교산학협력단 | 알루미늄 산화물 박막이 부착된 금속 전극을 이용한 미생물 측정 방법 |
| US8399262B2 (en) * | 2011-03-23 | 2013-03-19 | Darrel A. Mazzari | Biosensor |
| US8593727B2 (en) * | 2011-04-25 | 2013-11-26 | Vladimir G. Kozlov | Single-shot laser ablation of a metal film on a polymer membrane |
| US8673628B2 (en) * | 2011-06-10 | 2014-03-18 | Essen Instruments, Inc. | Methods and apparatus for improving in vitro measurements using boyden chambers |
| US8911603B2 (en) * | 2011-07-22 | 2014-12-16 | California Institute Of Technology | LED-based screener for photoelectrochemical materials discovery |
| CN102393406B (zh) * | 2011-08-05 | 2013-04-24 | 杭州柯氏生物科技有限公司 | 一种基于细胞学动态信息集成鉴别道地中药材的方法 |
| DE102011082451B4 (de) * | 2011-09-09 | 2013-05-23 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Sensorelement und Verfahren zum Versorgen und Erfassen von biologischem Material mit Nährstoffen |
| EP2581742A1 (en) | 2011-10-14 | 2013-04-17 | Universität Leipzig | Device and method for parallel recording of impedance spectra and field potential |
| US9200246B2 (en) * | 2011-12-01 | 2015-12-01 | Acea Biosciences, Inc. | Co-culture device assembly |
| CA2861010A1 (en) | 2012-01-13 | 2013-07-18 | Xiao Xu | Heterocyclic compounds and uses as anticancer agents |
| US9586965B2 (en) | 2012-01-13 | 2017-03-07 | Acea Biosciences Inc. | Pyrrolo[2,3-d]pyrimidine compounds as inhibitors of protein kinases |
| CN102539485B (zh) * | 2012-01-13 | 2014-02-19 | 武汉介观生物科技有限责任公司 | 细胞迁移高分辨率阻抗实时跟踪测控装置及其制造方法和应用方法 |
| US9034885B2 (en) | 2012-01-13 | 2015-05-19 | Acea Biosciences Inc. | EGFR modulators and uses thereof |
| US9464089B2 (en) | 2012-01-13 | 2016-10-11 | Acea Biosciences Inc. | Heterocyclic compounds and uses thereof |
| FR2986802A1 (fr) * | 2012-02-13 | 2013-08-16 | Centre Nat Rech Scient | Dispositif et procede de manipulation et traitement de cellules par champ electrique. |
| EP2815232B1 (en) * | 2012-02-15 | 2019-08-14 | Becton, Dickinson and Company | Impedence-based bacterial detection system |
| JP2013220066A (ja) * | 2012-04-17 | 2013-10-28 | Hitachi Ltd | センサチップ及びそれを用いた測定方法 |
| US20130330761A1 (en) | 2012-06-12 | 2013-12-12 | Celcuity, LLC | Whole cell assays and methods |
| KR102181365B1 (ko) | 2012-08-06 | 2020-11-23 | 에이시아 바이오사이언시스 인코포레이티드. | 단백질 키나아제 억제제로서 새로운 피롤로피리미딘 화합물 |
| EP2918999B1 (en) * | 2012-11-06 | 2018-06-06 | Panasonic Intellectual Property Management Co., Ltd. | Inspection device for biologically derived material |
| DE102013200613A1 (de) * | 2013-01-16 | 2014-07-17 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Vorrichtung und Verfahren zum Bestimmen einer Stärke einer Adhäsion eines biologischen Materials |
| US9885031B2 (en) | 2013-02-05 | 2018-02-06 | Ohio State Innovation Foundation | Galvanotaxis assay for quantitative assessment of the metastatic potential of cancer cells |
| WO2014123947A1 (en) | 2013-02-05 | 2014-08-14 | Ohio State Innovation Foundation | A galvanotaxis assay for quantitative assessment of the metastatic potential of cancer cells |
| WO2014123949A1 (en) | 2013-02-05 | 2014-08-14 | Ohio State Innovation Foundation | A non-contact method for accelerating wound healing |
| WO2015006754A2 (en) | 2013-07-11 | 2015-01-15 | Acea Biosciences Inc. | Heterocyclic compounds and uses thereof |
| WO2015089380A2 (en) | 2013-12-12 | 2015-06-18 | Celcuity Llc | Assays and methods for determining the responsiveness of an individual subject to a therapeutic agent |
| EP3084411A4 (en) * | 2013-12-19 | 2017-09-20 | The Regents of The University of California | Conductive hydrogels for affinity sensing |
| US9274071B2 (en) * | 2013-12-30 | 2016-03-01 | General Electric Company | Methods for assessing cell culture fluid by impedance spectra |
| WO2015130125A1 (ko) * | 2014-02-28 | 2015-09-03 | 주식회사 엠에스피 | 인체 내 임피던스 측정장치 |
| WO2015179035A2 (en) * | 2014-04-08 | 2015-11-26 | William Marsh Rice University | Production and use of flexible conductive films and inorganic layers in electronic devices |
| EP2950086A1 (en) * | 2014-05-29 | 2015-12-02 | Consejo Superior de Investigaciones Cientificas (CSIC) | Device for measuring the trans-layer electrical impedance in an in-vitro model of a cell barrier |
| DE102014219633A1 (de) * | 2014-09-29 | 2016-04-14 | Robert Bosch Gmbh | Vorrichtung zur Detektion von Substanzen in einer Probe |
| EP3035052A1 (en) * | 2014-12-18 | 2016-06-22 | Helmholtz-Zentrum für Infektionsforschung GmbH | Method and measuring device for determination of the growth rate of biofilm |
| WO2016139566A1 (en) | 2015-03-03 | 2016-09-09 | Abdolahad Mohammad | Electrical cell-substrate impedance sensor (ecis) |
| CN104820134A (zh) * | 2015-04-29 | 2015-08-05 | 业成光电(深圳)有限公司 | 线路检测装置及方法及其所应用的线路 |
| DE102015219023B3 (de) | 2015-10-01 | 2017-02-23 | Technische Universität München | Vorrichtung zum Analysieren von biologischen Substanzen in einer Testlösung, Herstellungsverfahren und Betriebsverfahren |
| RU2018115334A (ru) | 2015-10-09 | 2019-11-11 | Ацея Терапьютикс, Инк. | Фармацевтические соли, физические формы и композиции пирролопиримидиновых ингибиторов киназ, и способы их получения |
| GB201522323D0 (en) | 2015-12-17 | 2016-02-03 | Vrije Universiteit Brussel And Katholieke Universiteit Leuven | Systems and methods for conducting electrochemical impedance spectroscopy |
| CN105823817B (zh) * | 2016-01-04 | 2018-04-20 | 浙江农林大学 | 抗癌药物长春瑞滨药效检测装置及检测方法 |
| JP6116080B1 (ja) * | 2016-04-26 | 2017-04-19 | 日本航空電子工業株式会社 | 電気化学測定方法、電気化学測定装置及びトランスデューサ |
| US10613088B2 (en) * | 2016-06-12 | 2020-04-07 | Mohammad Abdolahad | Method and system for metastasis diagnosis and prognosis |
| US11874268B2 (en) * | 2016-06-12 | 2024-01-16 | Nanohesgarsazan Salamat Arya Ncubation Center For Equipment And Devices | Method and system for metastasis diagnosis and prognosis |
| US10761081B2 (en) * | 2016-06-12 | 2020-09-01 | Mohammad Abdolahad | Method and system for metastasis diagnosis and prognosis |
| KR101862642B1 (ko) * | 2016-08-30 | 2018-07-04 | 가천대학교 산학협력단 | 세포의 임피던스 측정 감도가 향상 된 전극 및 이를 이용한 세포 임피던스 측정센서 |
| CN106198675A (zh) * | 2016-09-28 | 2016-12-07 | 扬州大学 | 生物免疫电化学阻抗集成芯片传感器的制作方法 |
| DE102016224865B8 (de) * | 2016-12-13 | 2018-07-26 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Biopolare Elektrode zur impedimetrischen Untersuchung und Manipulation lebender Zellen in vitro |
| US20180266973A1 (en) * | 2017-02-28 | 2018-09-20 | Covidien Lp | Pathogen detection |
| US11746328B2 (en) | 2017-03-03 | 2023-09-05 | Agilent Technologies, Inc. | Methods and systems for functional maturation of iPSC and ESC derived cardiomyocytes |
| EP3602050A1 (en) | 2017-03-20 | 2020-02-05 | Celcuity Inc. | Methods of measuring signaling pathway activity for selection of therapeutic agents |
| JP2020516682A (ja) | 2017-04-07 | 2020-06-11 | エイシア セラピューティクス, インコーポレイテッド | ピロロピリミジンキナーゼの薬学的な塩、物理的形態および組成物、ならびにその作製方法 |
| CN107085097B (zh) * | 2017-05-14 | 2020-08-28 | 浙江达普生物科技有限公司 | 一种血检芯片及其制作方法 |
| CN107049587A (zh) * | 2017-05-14 | 2017-08-18 | 郭宝煊 | 智能月经杯 |
| CN107185850B (zh) * | 2017-06-06 | 2023-04-07 | 浙江大学 | 一种基于高光谱成像及电阻抗的玉米种子活力检测装置 |
| DE102017113748A1 (de) * | 2017-06-21 | 2018-12-27 | Institut für Bioprozess- und Analysenmesstechnik e.V. | Vorrichtung und Verfahren zur Impedanzmessung |
| JP7007122B2 (ja) | 2017-07-11 | 2022-01-24 | 浜松ホトニクス株式会社 | 試料観察装置及び試料観察方法 |
| CN107890577B (zh) * | 2017-10-23 | 2021-04-06 | 南方科技大学 | 一种灭菌机器人系统 |
| KR102499114B1 (ko) * | 2017-10-31 | 2023-02-13 | 주식회사 유스바이오글로벌 | 세포 및 배양액 조건에 따른 전기자극 변수 제어장치 및 방법 |
| EP3499216B1 (en) * | 2017-12-15 | 2022-05-04 | Nokia Technologies Oy | An apparatus and associated methods for detecting air-borne particles |
| CN108303364B (zh) * | 2018-02-02 | 2022-07-19 | 中国科学院电子学研究所 | 高通量检测细胞尺寸、尺寸无关单细胞电参数装置和方法 |
| CN108190828A (zh) * | 2018-02-07 | 2018-06-22 | 北京先通康桥医药科技有限公司 | Mems传感器线阵、触诊探头及其制造方法 |
| JP6486521B2 (ja) * | 2018-02-28 | 2019-03-20 | 花王株式会社 | 着用物品 |
| NL2020518B1 (en) | 2018-03-02 | 2019-09-12 | Mimetas B V | Device and method for performing electrical measurements |
| CN108680608A (zh) * | 2018-04-02 | 2018-10-19 | 东南大学 | 基于宽频电阻抗检测芯片的细胞检测方法 |
| CN108982335A (zh) * | 2018-06-29 | 2018-12-11 | 浙江大学 | 一种基于电阻抗的悬浮细胞计数芯片及其制作方法和计数方法 |
| WO2020010154A1 (en) * | 2018-07-03 | 2020-01-09 | Nanosurface Biomedical, Inc. | Topographically guided cell migration devices and methods |
| US20220113298A1 (en) * | 2018-09-07 | 2022-04-14 | Georgetown University | Systems and methods for identifying and isolating invasive subpopulations of cancer cells in real-time |
| CN109350046A (zh) * | 2018-09-07 | 2019-02-19 | 深圳市太空科技南方研究院 | 一种柔性电极及其制造方法 |
| US20210332405A1 (en) * | 2018-10-02 | 2021-10-28 | Osler Diagnostics Limited | Methods for immunoassays using electrochemical measurement |
| JP7162836B2 (ja) * | 2018-11-21 | 2022-10-31 | 株式会社島津製作所 | 細胞評価用デバイス及び細胞評価用システム |
| EP3927814A1 (en) | 2019-02-21 | 2021-12-29 | Stembiosys, Inc. | Methods for the maturation of cardiomyocytes on amniotic fluid cell-derived ecm, cellular constructs, and uses for cardiotoxicity and proarrhythmic screening of drug compounds |
| US11365386B2 (en) * | 2019-05-03 | 2022-06-21 | UNIVERSITé LAVAL | Cellular behaviour monitoring device and method for monitoring changes in cellular behaviour |
| JP7460110B2 (ja) | 2019-11-28 | 2024-04-02 | 学校法人立命館 | 測定方法及び測定装置 |
| US11054384B1 (en) | 2019-12-23 | 2021-07-06 | Nanodx, Inc. | Sensor system and methods of making |
| CN110923635A (zh) * | 2019-12-25 | 2020-03-27 | 重庆华渝电气集团有限公司 | 一种石英摆片镀膜及退膜方法 |
| US20230051840A1 (en) * | 2020-01-21 | 2023-02-16 | Synthego Corporation | Devices and methods for transfection and for generation of clonal populations of cells |
| USD941488S1 (en) | 2020-02-07 | 2022-01-18 | Agilent Technologies, Inc. | Instrument for analyzing biological cells |
| CN113683781B (zh) * | 2020-05-18 | 2023-05-05 | 天津师范大学 | 锌配位聚合物及其合成方法和在检测卡那霉素中的应用 |
| EP3913042A1 (en) | 2020-05-18 | 2021-11-24 | Incyton GmbH | Analysis device |
| CN111625587B (zh) * | 2020-05-28 | 2022-02-15 | 泰康保险集团股份有限公司 | 数据共享装置 |
| EP3944764A1 (en) * | 2020-07-28 | 2022-02-02 | BSH Hausgeräte GmbH | Household applicance and method for operating a household appliance |
| CN112263323B (zh) * | 2020-09-30 | 2021-10-08 | 杭州睿笛生物科技有限公司 | 一种阻抗测量装置及消融设备 |
| US20220205945A1 (en) * | 2020-12-25 | 2022-06-30 | Aurangzeb Nafees Nagy | Detection of Target Nucleic Acid Molecules |
| CN113589042B (zh) * | 2021-07-29 | 2023-02-17 | 重庆理工大学 | 一种包含独立激励电极和感测电极的高精度阻抗传感器 |
| CN113740423B (zh) * | 2021-09-03 | 2022-11-22 | 电子科技大学 | 一种实时检测细胞形貌变化和细胞粘附特性变化的eqcm方法 |
| CN113866240A (zh) * | 2021-09-27 | 2021-12-31 | 四川成电医联科技咨询有限公司 | 基于测量电阻抗修正的白细胞检测电极结构和方法 |
| WO2023081031A1 (en) * | 2021-11-08 | 2023-05-11 | Illumina, Inc. | Identifying nucleotides using changes in impedance between electrodes |
| TWI780996B (zh) * | 2021-11-29 | 2022-10-11 | 樂盟科技有限公司 | 氣體捕捉裝置 |
| CN114264590B (zh) * | 2021-12-14 | 2024-04-05 | 江苏济纶医工智能科技有限公司 | 一种用于细胞检测的可拆卸便携传感器、装配方法、测量方法、设计方法 |
| WO2023183920A2 (en) * | 2022-03-24 | 2023-09-28 | Georgetown University | Systems and methods for real-time detection and capture of invasive cell subpopulations from co-cultures |
| EP4317397A1 (en) * | 2022-08-02 | 2024-02-07 | Simplinext SA | Multi-well plate system for assessing cell layers |
Family Cites Families (75)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2656508A (en) | 1949-08-27 | 1953-10-20 | Wallace H Coulter | Means for counting particles suspended in a fluid |
| US3259842A (en) | 1959-08-19 | 1966-07-05 | Coulter Electronics | Particle analyzing device |
| US3743581A (en) | 1970-10-21 | 1973-07-03 | Bactomatic Inc | Microbiological detection apparatus |
| US3890201A (en) * | 1974-09-26 | 1975-06-17 | Bactomatic Inc | Multi-chamber impedance measuring module-cap combination |
| US4067951A (en) | 1975-11-19 | 1978-01-10 | Bactomatic Inc. | Process for making impedance measuring module |
| US4225410A (en) | 1978-12-04 | 1980-09-30 | Technicon Instruments Corporation | Integrated array of electrochemical sensors |
| US4686190A (en) | 1986-02-19 | 1987-08-11 | The Research Foundation Of State University Of New York | Device useful for growing and/or testing biological materials |
| US5001048A (en) | 1987-06-05 | 1991-03-19 | Aurthur D. Little, Inc. | Electrical biosensor containing a biological receptor immobilized and stabilized in a protein film |
| US4920047A (en) | 1988-05-20 | 1990-04-24 | General Electric Company | Electrical detection of the immune reaction |
| US5218312A (en) * | 1988-07-20 | 1993-06-08 | Ricardo Moro | Measurement apparatus for measuring a biological substance within a fluid substrate |
| US5278048A (en) | 1988-10-21 | 1994-01-11 | Molecular Devices Corporation | Methods for detecting the effect of cell affecting agents on living cells |
| US5766934A (en) | 1989-03-13 | 1998-06-16 | Guiseppi-Elie; Anthony | Chemical and biological sensors having electroactive polymer thin films attached to microfabricated devices and possessing immobilized indicator moieties |
| US5491097A (en) | 1989-06-15 | 1996-02-13 | Biocircuits Corporation | Analyte detection with multilayered bioelectronic conductivity sensors |
| US5643742A (en) | 1990-04-03 | 1997-07-01 | Cellstat Technologies, Inc. | System for electronically monitoring and recording cell cultures |
| US5134070A (en) | 1990-06-04 | 1992-07-28 | Casnig Dael R | Method and device for cell cultivation on electrodes |
| US5284753A (en) | 1991-03-20 | 1994-02-08 | Neuro Probe, Inc. | Multiple-site chemotactic test apparatus and method |
| US5187096A (en) * | 1991-08-08 | 1993-02-16 | Rensselaer Polytechnic Institute | Cell substrate electrical impedance sensor with multiple electrode array |
| US6017696A (en) | 1993-11-01 | 2000-01-25 | Nanogen, Inc. | Methods for electronic stringency control for molecular biological analysis and diagnostics |
| JPH07102153B2 (ja) * | 1992-01-31 | 1995-11-08 | 工業技術院長 | 血管内皮モデル調製用器及びこれを用いた癌細胞の転移能の測定方法 |
| US5247827A (en) * | 1992-04-14 | 1993-09-28 | Bell Communications Research, Inc. | Resistive measurement of airborne contaminants |
| US5514555A (en) * | 1993-03-12 | 1996-05-07 | Center For Blood Research, Inc. | Assays and therapeutic methods based on lymphocyte chemoattractants |
| US5810725A (en) | 1993-04-16 | 1998-09-22 | Matsushita Electric Industrial Co., Ltd. | Planar electrode |
| DE4417079C2 (de) * | 1994-05-17 | 1998-06-10 | Fraunhofer Ges Forschung | Objektträger zum Beobachten von biologischem Material |
| US5563067A (en) | 1994-06-13 | 1996-10-08 | Matsushita Electric Industrial Co., Ltd. | Cell potential measurement apparatus having a plurality of microelectrodes |
| US5601997A (en) * | 1995-02-03 | 1997-02-11 | Tchao; Ruy | Chemotaxis assay procedure |
| DE19512117A1 (de) | 1995-04-04 | 1996-10-10 | Itt Ind Gmbh Deutsche | Meßeinrichtung |
| JP2930181B2 (ja) | 1995-06-20 | 1999-08-03 | 松下電器産業株式会社 | 神経細胞活動測定用2次元センサ及びこれを用いた測定装置 |
| US5626734A (en) | 1995-08-18 | 1997-05-06 | University Technologies International, Inc. | Filter for perfusion cultures of animal cells and the like |
| US6573063B2 (en) | 1995-10-04 | 2003-06-03 | Cytoscan Sciences, Llc | Methods and systems for assessing biological materials using optical and spectroscopic detection techniques |
| ATE271219T1 (de) | 1995-12-01 | 2004-07-15 | Innogenetics Nv | System und verfahren zur bestimmung der impedanz und herstellungsverfahren |
| US6355436B1 (en) | 1996-05-17 | 2002-03-12 | L'ecole Centrale De Lyon | Method for analyzing biological substances in a conductive liquid medium |
| US6235520B1 (en) | 1996-06-27 | 2001-05-22 | Cellstat Technologies, Inc. | High-throughput screening method and apparatus |
| US7381525B1 (en) | 1997-03-07 | 2008-06-03 | Clinical Micro Sensors, Inc. | AC/DC voltage apparatus for detection of nucleic acids |
| DE19646505A1 (de) * | 1996-11-12 | 1998-05-14 | Itt Ind Gmbh Deutsche | Vorrichtung zur Durchführung von Untersuchungen an Zellproben und dergleichen |
| US5981268A (en) * | 1997-05-30 | 1999-11-09 | Board Of Trustees, Leland Stanford, Jr. University | Hybrid biosensors |
| US5801055A (en) | 1997-09-10 | 1998-09-01 | Becton Dickinson And Company | Multi-well culture dish assembly |
| USRE37977E1 (en) | 1997-12-25 | 2003-02-04 | Matsushita Electric Industrial Co., Ltd. | Cell potential measuring electrode and measuring apparatus using the same |
| US6132683A (en) | 1998-12-23 | 2000-10-17 | Matsushita Electric Industrial Co., Ltd. | Cell potential measuring electrode and measuring apparatus using the same |
| US6287874B1 (en) | 1998-02-02 | 2001-09-11 | Signature Bioscience, Inc. | Methods for analyzing protein binding events |
| WO1999039190A1 (en) | 1998-02-02 | 1999-08-05 | Signature Bioscience Inc. | Method and apparatus for detecting molecular binding events |
| US6485905B2 (en) | 1998-02-02 | 2002-11-26 | Signature Bioscience, Inc. | Bio-assay device |
| DE19841337C1 (de) | 1998-05-27 | 1999-09-23 | Micronas Intermetall Gmbh | Verfahren und Vorrichtung zur intrazellulären Manipulation einer biologischen Zelle |
| GB9812783D0 (en) * | 1998-06-12 | 1998-08-12 | Cenes Ltd | High throuoghput screen |
| FR2781886B1 (fr) | 1998-07-31 | 2001-02-16 | Commissariat Energie Atomique | Micro-systeme a multiple points d'analyse chimique ou biologique |
| US6169394B1 (en) | 1998-09-18 | 2001-01-02 | University Of The Utah Research Foundation | Electrical detector for micro-analysis systems |
| US6477479B1 (en) * | 1998-12-11 | 2002-11-05 | Symyx Technologies | Sensor array for rapid materials characterization |
| US20030166015A1 (en) | 1999-04-15 | 2003-09-04 | Zarowitz Michael A. | Multiplexed analysis of cell-substrate interactions |
| DE19920811B4 (de) | 1999-05-06 | 2004-08-19 | Micronas Gmbh | Vorrichtung zur Durchführung von Untersuchungen an Zellkulturen |
| CN1204404C (zh) * | 1999-10-01 | 2005-06-01 | 索菲昂生物科学有限公司 | 电生理学性质的测定组件及其构照方法 |
| US6670115B1 (en) * | 1999-11-24 | 2003-12-30 | Biotronic Technologies, Inc. | Devices and methods for detecting analytes using electrosensor having capture reagent |
| US20020090649A1 (en) | 1999-12-15 | 2002-07-11 | Tony Chan | High density column and row addressable electrode arrays |
| US6448030B1 (en) | 2000-02-18 | 2002-09-10 | University Of Nevada-Las Vegas | Method for predicting the efficacy of anti-cancer drugs |
| CN1319761A (zh) | 2000-03-15 | 2001-10-31 | 清华大学 | 高通量电旋转检测的装置和方法 |
| DE60126006D1 (de) | 2000-03-27 | 2007-03-08 | Nte Sa | Sonde, Zelle und Verfahren zur Messung der Konzentration und der Zusammensetzung von Biomasse |
| US6626902B1 (en) | 2000-04-12 | 2003-09-30 | University Of Virginia Patent Foundation | Multi-probe system |
| US7306924B2 (en) | 2000-04-17 | 2007-12-11 | Purdue Research Foundation | Biosensor and related method |
| WO2001079529A1 (en) | 2000-04-17 | 2001-10-25 | Purdue Research Foundation | Biosensor and related method |
| US20020053915A1 (en) | 2000-07-07 | 2002-05-09 | Weaver Charles David | Electrophysiology configuration suitable for high throughput screening of compounds for drug discovery |
| US7312043B2 (en) | 2000-07-10 | 2007-12-25 | Vertex Pharmaceuticals (San Diego) Llc | Ion channel assay methods |
| US6740501B2 (en) * | 2000-09-27 | 2004-05-25 | Becton, Dickinson And Company | Coated membrane for assessing the invasive capacity of a cell |
| US6451808B1 (en) * | 2000-10-17 | 2002-09-17 | Depomed, Inc. | Inhibition of emetic effect of metformin with 5-HT3 receptor antagonists |
| WO2002042766A2 (en) * | 2000-10-26 | 2002-05-30 | University Of Connecticut | A system and method for investigating the effect of chemical and other factors on cell movement |
| US20030072549A1 (en) | 2000-10-26 | 2003-04-17 | The Trustees Of Princeton University | Method and apparatus for dielectric spectroscopy of biological solutions |
| CA2430336A1 (en) | 2000-11-30 | 2002-06-06 | The Netherlands Cancer Institute | Membrane molecule indicator compositions and methods |
| US6835552B2 (en) | 2000-12-14 | 2004-12-28 | The Regents Of The University Of California | Impedance measurements for detecting pathogens attached to antibodies |
| US20040146849A1 (en) | 2002-01-24 | 2004-07-29 | Mingxian Huang | Biochips including ion transport detecting structures and methods of use |
| US6627461B2 (en) | 2001-04-18 | 2003-09-30 | Signature Bioscience, Inc. | Method and apparatus for detection of molecular events using temperature control of detection environment |
| US6461808B1 (en) | 2001-06-12 | 2002-10-08 | Signature Bioscience, Inc. | Pipette-loaded bioassay assembly for detecting molecular or cellular events |
| US20030032000A1 (en) | 2001-08-13 | 2003-02-13 | Signature Bioscience Inc. | Method for analyzing cellular events |
| US20030116447A1 (en) | 2001-11-16 | 2003-06-26 | Surridge Nigel A. | Electrodes, methods, apparatuses comprising micro-electrode arrays |
| US6637257B2 (en) * | 2002-01-02 | 2003-10-28 | Integrated Sensing Systems | Micromachined fluid analysis device and method |
| WO2005047482A2 (en) | 2003-11-12 | 2005-05-26 | Xiao Xu | Real time electronic cell sensing systems and applications for cell-based assays |
| US20040091397A1 (en) * | 2002-11-07 | 2004-05-13 | Corning Incorporated | Multiwell insert device that enables label free detection of cells and other objects |
| US20050014130A1 (en) | 2003-07-14 | 2005-01-20 | Vivian Liu | Label-free method for classification and characterization of cellular events |
| CA2531342C (en) | 2003-07-14 | 2011-07-05 | Mds Inc., Doing Business As Mds Sciex | Label-free method for classification and characterization of cellular events |
-
2003
- 2003-07-18 JP JP2005505529A patent/JP4745056B2/ja not_active Expired - Lifetime
- 2003-07-18 DE DE60330022T patent/DE60330022D1/de not_active Expired - Lifetime
- 2003-07-18 AT AT03748948T patent/ATE448482T1/de not_active IP Right Cessation
- 2003-07-18 WO PCT/US2003/022537 patent/WO2004010102A2/en active Application Filing
- 2003-07-18 CA CA2493101A patent/CA2493101C/en not_active Expired - Lifetime
- 2003-07-18 JP JP2005505531A patent/JP2005537498A/ja active Pending
- 2003-07-18 AU AU2003269911A patent/AU2003269911A1/en not_active Abandoned
- 2003-07-18 EP EP03751801A patent/EP1527328B1/en not_active Expired - Lifetime
- 2003-07-18 AU AU2003267998A patent/AU2003267998A1/en not_active Abandoned
- 2003-07-18 CN CN03822348A patent/CN100577811C/zh not_active Expired - Lifetime
- 2003-07-18 EP EP03748948A patent/EP1539992B1/en not_active Expired - Lifetime
- 2003-07-18 AT AT03751801T patent/ATE442587T1/de not_active IP Right Cessation
- 2003-07-18 WO PCT/US2003/022557 patent/WO2004010103A2/en active Search and Examination
- 2003-07-18 CA CA2493108A patent/CA2493108C/en not_active Expired - Lifetime
- 2003-07-18 DE DE60329187T patent/DE60329187D1/de not_active Expired - Lifetime
- 2003-07-18 CN CNB038224542A patent/CN100487133C/zh not_active Expired - Lifetime
- 2003-11-10 US US10/705,615 patent/US7459303B2/en active Active
-
2006
- 2006-02-23 HK HK06102440.6A patent/HK1083238A1/xx not_active IP Right Cessation
- 2006-02-23 HK HK06102441.5A patent/HK1082002A1/xx not_active IP Right Cessation
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110243873A (zh) * | 2019-07-01 | 2019-09-17 | 广州迈普再生医学科技股份有限公司 | 多功能细胞传感器系统及其测量方法 |
| CN110243873B (zh) * | 2019-07-01 | 2020-06-09 | 广州迈普再生医学科技股份有限公司 | 多功能细胞传感器系统及其测量方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2493108C (en) | 2011-08-30 |
| CN1681938A (zh) | 2005-10-12 |
| ATE448482T1 (de) | 2009-11-15 |
| CA2493108A1 (en) | 2004-01-29 |
| HK1082002A1 (en) | 2006-05-26 |
| WO2004010102A2 (en) | 2004-01-29 |
| WO2004010102A3 (en) | 2004-07-22 |
| JP2005537498A (ja) | 2005-12-08 |
| WO2004010103A2 (en) | 2004-01-29 |
| US7459303B2 (en) | 2008-12-02 |
| CA2493101C (en) | 2012-05-08 |
| EP1539992B1 (en) | 2009-11-11 |
| ATE442587T1 (de) | 2009-09-15 |
| CN100487133C (zh) | 2009-05-13 |
| EP1539992A2 (en) | 2005-06-15 |
| CA2493101A1 (en) | 2004-01-29 |
| AU2003267998A1 (en) | 2004-02-09 |
| US20040152067A1 (en) | 2004-08-05 |
| DE60329187D1 (de) | 2009-10-22 |
| EP1527328B1 (en) | 2009-09-09 |
| AU2003267998A8 (en) | 2004-02-09 |
| AU2003269911A1 (en) | 2004-02-09 |
| WO2004010103A3 (en) | 2004-04-01 |
| CN1681937A (zh) | 2005-10-12 |
| HK1083238A1 (en) | 2006-06-30 |
| JP2005538741A (ja) | 2005-12-22 |
| DE60330022D1 (de) | 2009-12-24 |
| EP1527328A2 (en) | 2005-05-04 |
| EP1539992A4 (en) | 2007-04-11 |
| EP1527328A4 (en) | 2005-12-14 |
| JP4745056B2 (ja) | 2011-08-10 |
| AU2003269911A8 (en) | 2004-02-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100577811C (zh) | 基于阻抗分析细胞和颗粒的装置和方法 | |
| US7470533B2 (en) | Impedance based devices and methods for use in assays | |
| CN101400780B (zh) | 实时细胞电子分析系统及其在细胞毒性检测和化合物分析上的应用 | |
| Gerasimenko et al. | Impedance spectroscopy as a tool for monitoring performance in 3D models of epithelial tissues | |
| US8344742B2 (en) | Real time electronic cell sensing system and applications for cytotoxicity profiling and compound assays | |
| Yeon et al. | Cytotoxicity test based on electrochemical impedance measurement of HepG2 cultured in microfabricated cell chip | |
| US8041515B2 (en) | Use of impedance-based cytological profiling to classify cellular response profiles upon exposure to biologically active agents | |
| Bao et al. | Recent advances in electric analysis of cells in microfluidic systems | |
| Spegel et al. | Chip based electroanalytical systems for cell analysis | |
| US20140199719A1 (en) | Impedance-Based Sensing of Adherent Cells on A Digital Microfluidic Device | |
| JP2005538741A5 (zh) | ||
| Ren et al. | Feasibility of tracking multiple single-cell properties with impedance spectroscopy | |
| Curtis et al. | Improved cell sensitivity and longevity in a rapid impedance‐based toxicity sensor | |
| Yalçin et al. | Electrical monitoring approaches in 3-dimensional cell culture systems: Toward label-free, high spatiotemporal resolution, and high-content data collection in vitro | |
| Matsue | Development of biosensing devices and systems using micro/nanoelectrodes | |
| US20180224421A1 (en) | Method and apparatus for a surface microstructured multielectrode array | |
| Zhang et al. | The Modeling, Design, Fabrication, and Application of Biosensor Based on Electric Cell-Substrate Impedance Sensing (ECIS) Technique in Environmental Monitoring | |
| CN216919288U (zh) | 细胞培养孔板及细胞培养在线检测装置 | |
| WO2008036375A2 (en) | Use of impedance-based cytological profiling to classify cellular response profiles upon exposure to biologically active agents | |
| Tian et al. | Micro/Nano Cell-Substrate Impedance Biosensors | |
| Wissenwasser et al. | Monitoring adherent cell cultures in microtiter-plates by a wireless sensory system | |
| Nguyen et al. | Impedance array studies of mammalian cell growth | |
| Price et al. | Characterization of Cancer Cells Using Electrical Impedance Spectroscopy |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1082002 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1082002 Country of ref document: HK |
|
| TR01 | Transfer of patent right | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20220111 Address after: California, USA Patentee after: AGILENT TECHNOLOGIES, Inc. Address before: California, USA Patentee before: ACEA BIOSCIENCES Inc. |
|
| CX01 | Expiry of patent term | ||
| CX01 | Expiry of patent term |
Granted publication date: 20100106 |