Campo técnico da invenção
A presente invenção refere-se a um método para a manufatura do antidepressivo bem conhecido escitalopram.
Fundamentos da invenção
Escitalopram é uma droga antidepressiva bem conhecida que possui a seguinte estrutura:
É um inibidor de recaptação de serotonina (5-hidróxi- triptamina; 5-HT) centralmente ativo, seletivo, conseqüentemente possuindo atividades antidepressivas.
Escitalopram e sua atividade farmacêutica são descritos na Patente U.S. 4.943.590. Dois métodos para a preparação de escitalopram são descritos. Em um deles 4-[4-(dimetil-amino)-1-(4'-fluoro-fenil)-l-hidróxi- butil]-3-(hidróxi-metil)-benzonitrila é fracionadamente cristalizada como um sal com o ácido (+)-O,O'-di p-toluoil-(S,S)-tartárico em 2-propanol. O produto cristalino produzido nesta maneira consiste de cristais pequenos que drenam muito lentamente e tendem a reter os licores-mãe. Remoção insuficiente dos licores-mãe dá um produto com uma pureza enanciomérica baixa e portanto purificações adicionais são requeridas. Purificações são consumidoras de tempo e de solvente. Estes problemas são mais evidentes em uma escala industrial.
Sumário da invenção
Agora tem sido verificado que a resolução de 4-[4-(dimetil- amino)-1 -(4'-fluoro-fenil)l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila por cristalização fracionada de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi- butil]-3-(hidróxi-metil)-benzonitrila como um sal com ácido (+)-(S,S)- ou (-)- (R,R)-<9, (9-di-p-toluoil-tartárico em um sistema de solvente compreendendo 1-propanol no qual não mais do que 0,5 mol de ácido (+)-(S,S)- ou (-)-(R,R)- 0,0 -di-p-toluoil-tartárico é usado por mol de 4-[4-(dimetil-amino)-l-(4’- fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila resulta em um produto cristalino no qual os cristais são maiores e de uma forma diferente que aqueles obtidos em 2-propanol. Este processo tem se mostrado um método estável e robusto para produzir cristais com propriedades de filtração boas. Isto resulta em propriedades de drenagem muito melhores e tempos de filtração reduzidos que têm um impacto importante sobre a produção em escala grande. Tempos de filtração típicos para uma batelada em escala industrial são de poucas horas ou menos.
Este método de resolução é útil na manufatura de escitalopram.
Descrição detalhada da invenção
Um aspecto da presente invenção é a provisão de um método para a resolução de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi-butil]- 3-(hidróxi-metil)-benzonitrila como uma mistura racêmica ou não-racêmica de enanciômeros em seus enanciômeros isolados, o citado método compreendendo as etapas de fracionadamente cristalizar 4-[4-(dimetil- amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil]-3 -(hidróxi-metil)-benzonitrila como um sal com o (+)-(S,S)- ou (-)-(R,R)-enanciômero de ácido O, O -di-p- toluoil-tartárico em um sistema de solvente compreendendo 1-propanol, etanol ou acetonitrila.
Em uma modalidade preferida não mais do que 1 mol, mais particularmente não mais do que 0,5 mol, do (+)-(S,S)- ou (-)-(R,R)- enanciômero de ácido 0,0 -di-p-toluoil-tartárico é usado por mol de 4-[4- (dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil] 3-(hidróxi-metil)- benzonitrila.
Em uma modalidade ácido (+)-O, O -di-p-toluoil-(S,S)- tartárico é usado. Em outra modalidade ácido (-)-O,O -di-p-toluoil-(R,R)- tartárico é usado.
Em uma modalidade particular 1-propanol é o constituinte principal do sistema de solvente. Em uma modalidade mais particular 1- propanol constitui pelo menos 50 % do sistema de solvente, tal como pelo menos 75 %, pelo menos 90 % ou pelo menos 95 % e em uma modalidade bem mais particular 1-propanol é o único solvente.
Em uma modalidade igualmente particular etanol é o constituinte principal do sistema de solvente. Em uma modalidade mais particular etanol constitui pelo menos 50 % (v/v) do sistema de solvente, tal como pelo menos 75 %, pelo menos 90 % ou pelo menos 95 % e em uma modalidade bem mais particular etanol é o único solvente.
Em uma modalidade igualmente particular acetonitrila é o constituinte principal do sistema de solvente. Em uma modalidade mais particular acetonitrila constitui pelo menos 50 % (v/v) do sistema de solvente, tal como pelo menos 75 %, pelo menos 90 % ou pelo menos 95 % e em uma modalidade bem mais particular acetonitrila é o único solvente.
Em outra modalidade o sistema de solvente compreende um ou mais co-solventes orgânicos, particularmente selecionados do grupo consistindo de tolueno, dietil-éter, acetato de etila, diclorometano e acetonitrila, mais particularmente tolueno. Em uma modalidade mais particular a quantidade de co-solvente está dentro da faixa de 0-20 % (v/v) do sistema de solvente, tal como 0-15 %, 0-10 %, 0,5-8 %, 1-5 % ou 1,5-3 %.
Em uma outra modalidade o sistema de solvente compreende água. Em uma modalidade mais particular a quantidade de água está dentro da faixa de 0-8 % (v/v) do sistema de solvente, tal como 0,05-5 %, 0,1-3 % ou 0,15-2%.
Em uma outra modalidade o sistema de solvente compreende um ácido aquiral, que é capaz de protonar 4-[4-(dimetil-amino)-l-(4'-fluoro- fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila mas não precipitar a 4- [4-(dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil] -3 -(hidróxi-metil)- benzonitrila como um sal na presente condição. Em uma modalidade particular o ácido aquiral é selecionado do grupo consistindo de ácidos orgânicos tais como ácido fórmico, ácido acético, ácido trifluoroacético e ácido metano-sulfônico, mais particularmente ácido acético. Em uma modalidade mais particular a quantidade de ácido aquiral está dentro da faixa de 0-0,5 equivalente relativa à quantidade de 4-[4-(dimetil-amino)-l-(4'- fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila, tal como 0-0,4 eq.
Em uma outra modalidade o sistema de solvente junto com 4- [4-(dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil] -3 -(hidróxi-metil)- benzonitrila e ácido (+)-(S,S)- ou (-)-(R,R)-Q (9 -di-p-toluoil-tartárico dissolvidos é esfriado de uma primeira temperatura dentro da faixa de 20°C para a temperatura de refluxo para o sistema de solvente, particularmente 25°C a 70°C, mais particularmente 30°C a 50°C, para uma segunda temperatura dentro da faixa de 0°C a 40°C, particularmente 10°C a 30°C, mais particularmente 15°C a 25°C. Em uma modalidade particular a diferença entre as primeira e segunda temperaturas está dentro da faixa de 5°C a 50°C, particularmente 10°C a 40°C, mais particularmente 15°C a 30°C.
Em uma modalidade particular a mistura de 4-[4-(dimetil- amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil] -3 -(hidróxi-metil)-benzonitrila, ácido (+)-(S,S)- ou (-)-(R,R)-QO-di -p-toluoil-tartárico e sistema de solvente é mantida em uma primeira temperatura por um período dentro da faixa de 0- 4 horas antes do esfriamento, mais particularmente 0,5-3 horas, e muito mais particularmente 1-2 horas.
Em outra modalidade a mistura de 4-[4-(dimetil-amino)-l-(4'- fluoro-fenil)-1 -hidróxi-butil]-3-(hidróxi-metil)-benzonitrila, ácido (+)-(S,S)- ou (-)-(R,R)-QO-di -p-toluoil-tartárico e sistema de solvente é semeada com cristais do sal desejado na primeira temperatura ou durante o esfriamento. Tipicamente a quantidade de cristais de semeadura está dentro da faixa de 0,4-0,8 g de cristais de semeadura/kg de 4-[4-(dimetil-amino)l -(4 '-fluoro- fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila, mais tipicamente dentro da faixa de 0,45-0,7 g/kg, muito mais tipicamente dentro da faixa de 0,5-0,6 g/kg.
Em uma modalidade igualmente particular o esfriamento é feito dentro de 8 horas, particularmente dentro de 4 horas, mais particularmente dentro de 2 horas. Em outra modalidade igualmente particular o sal precipitado é separado do licor-mãe dentro de 8 horas após o início da precipitação, mais particularmente dentro de 4 horas. Em ainda uma modalidade igualmente particular o sal separado é lavado dentro de 4 horas, mais particularmente dentro de 2 horas.
Em ainda uma outra modalidade o sal separado é ressuspenso ou recristalizado uma ou mais vezes em um sistema de solvente compreendendo 1-propanol ou etanol por aquecimento para uma temperatura dentro da faixa de 30°C para a temperatura de refluxo para o solvente, mais particularmente 40°C a 60°C, seguido por esfriamento para uma temperatura dentro da faixa de 0°C a 40°C, particularmente 10°C a 30°C, mais particularmente 15°C a 25°C. Em uma modalidade particular 1-propanol ou etanol é o constituinte principal do sistema de solvente. Em uma modalidade mais particular 1-propanol ou etanol constitui pelo menos 50 % do sistema de solvente, tal como pelo menos 75 %, pelo menos 90 % ou pelo menos 95 %, e em uma modalidade bem mais particular 1-propanol ou etanol é o único solvente. Em uma modalidade particular o constituinte principal do sistema de solvente usado para reprecipitação é o mesmo que o constituinte principal do sistema de solvente usado para cristalização.
Outro aspecto da presente invenção é a provisão de um método para a manufatura de escitalopram compreendendo resolução de 4-[4- (dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil 1 -3 -(hidróxi-metil)- benzonitrila em seus enanciômeros como descrito acima.
Em uma modalidade um dos isômeros isolados de 4-[4- (dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil]-3 -(hidróxi-metil)- benzonitrila é estereosseletivamente transformado em escitalopram.
Em uma modalidade particular S-4-[4-(dimetil-amino)-l-(4 '- fluoro-fenil)-1 -hidróxi-butil]-3 -(hidróxi-metil)-benzonitrila é estereosseletivamente transformada em escitalopram.
Em uma modalidade mais particular a S-4-[4-(dimetil-amino)- 1 -(4'-fluoro-fenil)-1 -hidróxi-butil] -3 -(hidróxi-metil)-benzonitrila é reagida com um derivado de ácido reativo tal como um cloreto de ácido ou anidrido de ácido, in particular cloreto de metano-sulfonila ou cloreto de p-tolueno- sulfonila, na presença de uma base, tal como trietilamina ou piridina.
Como usados em toda a descrição e nas reivindicações os termos "resolução" e "resolvido" referem-se a um processo no qual a pureza enanciomérica de uma mistura racêmica ou não-racêmica de enanciômeros é aumentada, tal como um processo no qual a proporção do enanciômero indesejado na mistura é reduzida em pelo menos 20% desde que a razão de enanciômero na mistura resultante esteja em favor do enanciômero desejado como exemplificado pelos dois exemplos seguintes: i) uma mistura racêmica (50:50) é transformada em uma mistura com uma razão de enanciômeros de pelo menos 60:40, ou ii) uma mistura 80:20 é transformada em uma mistura com uma razão de enanciômeros de pelo menos 84:16.
Como usado em toda a descrição e nas reivindicações o termo "uma mistura racêmica" significa uma mistura 50:50 de enanciômeros, enquanto que o termo "uma mistura não-racêmica" significa qualquer mistura de enanciômeros que não é 50:50.
Como usado em toda a descrição e nas reivindicações o termo "enanciômero isolado" significa um enanciômero que é pelo menos 95 % enanciomericamente puro, particularmente pelo menos 97 % enanciomericamente puro, mais particularmente pelo menos 98 % enanciomericamente puro, e muito mais particularmente pelo menos 99 % enanciomericamente puro.
Como usado em toda a descrição e nas reivindicações o termo "cristalização fracionada" significa um processo no qual um enanciômero cristaliza como um sal com um ácido quiral preferencialmente sobre o outro enanciômero e em citado processo a cristalização pode iniciar de uma solução do sal ou de uma suspensão do sal.
Como usado em toda a descrição e nas reivindicações o termo "sistema de solvente" significa a combinação de solventes orgânicos e água, quando presente. O termo "solvente orgânico" inclui qualquer solvente prótico ou aprótico, tal como álcoois, ésteres, alcanos, éteres e aromáticos mas exclui ácidos tais como ácidos carboxílicos e bases tais como aminas.
Como usado em toda a descrição e nas reivindicações o termo "ressuspenso" refere-se a um processo no qual o material cristalino é suspenso em um solvente em uma temperatura por meio do qual o material cristalino se dissolve parcialmente seguido por esfriamento depois do qual o material dissolvido cristaliza parcialmente de novo.
Como usado em toda a descrição e nas reivindicações o termo "recristalizado" refere-se a um processo no qual o material cristalino é dissolvido em um solvente em uma temperatura, opcionalmente filtrado para remover material insolúvel, e seguido por esfriamento depois do qual o material dissolvido cristaliza parcialmente de novo.
Se a pureza quiral de um produto S- ou R-4-[4-(dimetil- amino)-l-(4'-fluoro-fenil)l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila resultante do método como aqui descrito não é suficientemente alta que pode ocorrer inter alia quando se usa licor-mãe como o produto, a pureza quiral pode ser adicionalmente melhorada pela precipitação da 4-[4-(dimetil-amino)- l-(4'-fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila racêmica de uma solução do produto enriquecido em S- ou R-4-[4-(dimetil-amino)-l-(4- fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila deixando uma S- ou R-4-[4-(dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil]-3-(hidróxi- metil)-benzonitrila adicionalmente enriquecida em solução como descrito em W02004/05 6754.
S-4- [4-(dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil] -3 - (hidróxi-metil)- benzonitrila pode ser estereosseletivamente transformada em escitalopram como descrito em EP0347066.
R-4-[4-(dimetil-amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil]-3- (hidróxi-metil)-benzonitrila pode ser transformada em escitalopram como descrito em W003/000672.
Se a pureza quiral de um produto de S-citalopram resultante do método como aqui descrito não é suficiente que pode ocorrer inter alia quando se usa licor-mãe como o produto, a pureza quiral pode ser adicionalmente melhorada por precipitação de citalopram racêmico de uma solução do produto enriquecido em S-citalopram deixando um S-citalopram adicionalmente enriquecido em solução como descrito em W02003/000672.
Sessão experimental
Em toda a descrição e nas reivindicações as seguintes abreviações são usadas: Eq significa equivalentes e é calculado como a razão molar relativa à quantidade de 4-[4-(dimetil-amino)-l-(4' -fluoro-fenil)-l-hidróxi- butil] -3 -(hidróxi-metil)-benzonitrila. V significa volumes e é calculado como mililitro de solvente por grama de base livre de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi- butil]-3-(hidróxi-metil)-benzonitrila.
Rendimento molar é calculado como mol de S-4-[4-(dimetil- amino)-1 -(4'-fluoro-fenil)-1 -hidróxi-butil]-3-(hidróxi-metil)-benzonitrila no produto por mol de 4-[4-(dimetil-amino)-l-(4 -fluoro-fenil)-l -hidróxi-butil]- 3-(hidróxi-metil )-benzonitrila racêmica no material inicial.
Cristais de semeadura
Cristais de semeadura podem ser preparados por misturação de uma solução de S-4-[4-(dimetil-amino)-l-(4 '-fluoro-fenil)-l-hidróxi-butil]-3- (hidróxi-metil)-benzonitrila (10 g) em 1-propanol (9,5 mL) com uma solução de ácido (+)-(?, O -di-p-toluoil-(S,S)-tartárico (11,6 g) em 1-propanol (88 ml) ou por misturação de uma solução de R-4-[4-(dimetil-amino)-l-(4 '-fluoro- fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila (10 g) em 1-propanol (9,5 mL) com uma solução de (ácido (+)-O, O -di-p-toluoil-(R,R)-tartárico (11,6 g) em 1-propanol (88 ml). Altemativamente cristais de semeadura podem ser preparados em uma maneira similar usando etanol como o solvente em vez de 1-propanol. Preferivelmente os cristais de semeadura são cristalizados do mesmo solvente que o para a cristalização onde devem ser utilizados. Cristais produzidos de acordo com os exemplos abaixo também podem ser empregados como cristais de semeadura.
A S- ou R-4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi- butil]-3-(hidroxil-metil)-benzonitrila usada para a preparação de cristais de semeadura pode ser obtida como descrito em EP0347066 ou W003/006449. Experimento 1 Ácido (+)-<9,<?-di-p-toluoil-(S,S)-tartárico (0,39 eq) foi dissolvido em 1-propanol (3,44 V).
Uma mistura foi aquecida para até ca. 40°C e ácido acético (0,2 eq.) foi adicionado. Esta solução foi transferida dentro de uma hora para uma solução de base livre de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l- hidróxi-butil]-3-(hidróxi-metil)-benzonitrila em 1-propanol (0,95 V) contendo 0,1 V de tolueno. A mistura de resolução, contendo agora no total 4,4 V 1- propanol foi semeada com cristais semente compreendendo S-4-[4-(dimetil- amino)-l-(4'-fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila e ácido (+)-0,0-di-p-toluoil-(S,S)-tartárico e então agitada a 40°C por 2 horas. A mistura foi esfriada a 20-25°C dentro de 2 horas. O produto foi filtrado e lavado três vezes com 1-propanol. A pureza enanciomérica esteve tipicamente dentro da faixa de cerca de 91% a cerca de 98% de S.
O produto foi ressuspenso em 1-propanol (2,5 V) ao redor de 50°C por 2 horas. A mistura foi esfriada a 20-25°C. O produto foi filtrado e lavado com 1-propanol. A pureza enanciomérica foi tipicamente de cerca de 99,3% de S. O rendimento molar foi tipicamente 34-36%.
Experimento 2 Ácido (+)-QO-di-p-toluoil-(S,S)-tartárico (0,4 eq) foi dissolvido em 1-propanol (3,5 V).Uma mistura foi aquecida para até ca. 40°C, ácido acético (0,2 eq.) foi adicionado e então a solução foi transferida para uma solução de base livre de 4-[4-(dimetil-amino)-1 -(4’-fluoro-fenil)-1 -hidróxi-butil]-3-(hidróxi- metil)-benzonitrila em 1-propanol contendo 0,1 V de tolueno. A mistura de resolução, contendo agora no total 4,5 V de 1-propanol foi semeada com cristais semente compreendendo S-4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l- hidróxi-butil]-3-(hidróxi-metil)-benzonitrila e ácido (+)-(?, O -di-p-toluoil- (S,S)-tartárico e então agitada a 40°C por duas horas. A mistura foi esfriada a 20-25°C em duas horas. O produto foi filtrado (reator-filtro) e lavado com 1- propanol.
A pureza enanciomérica foi tipicamente ao redor de 97% de S ou mais alta. Uma batelada exemplar deu rendimento molar de: 33,8%, pureza enanciomérica de: 99,0% de S.
Experimento 3 O procedimento geral de Experimento 2 foi aplicado, contudo 0,5 eq de ácido (+)-O,O-di-p-toluoil-(S,S)-tartárico e 10 V de 1-propanol foram usados. Tolueno e ácido acético não estavam presentes no sistema.
Uma batelada exemplar deu rendimento molar de: 29,5%; pureza enanciomérica de: 99,2% de S. Experimento 4 O procedimento geral de Experimento 2 foi aplicado. Na solução de base livre de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi- butil]-3-(hidróxi-metil)-benzonitrila em 1-propanol foi adicionado 0,05 V de água. Tolueno e ácido acético não estavam presentes no sistema.
Uma batelada exemplar deu rendimento molar de: 29,3%; pureza enanciomérica de: 99,3% de S. Experimento 5 O procedimento geral de Experimento 2 foi aplicado usando apenas 0,25 eq de ácido (+)-O,O-di-p-toluoil-(S,S)-tartárico. Ácido acético não estava presente no sistema.
Uma batelada exemplar deu rendimento molar de: 29,4%; pureza enanciomérica de: 99,0% de S. Experimento 6 O procedimento geral de Experimento 2 foi aplicado. Ácido acético não estava presente no sistema.
Uma batelada exemplar deu rendimento molar de: 32,6%; pureza enanciomérica de: 98,0% de S.
Experimento 7 O procedimento geral de Experimento 2 foi aplicado. Ácido acético não estava presente no sistema. O experimento foi realizado com uma quantidade pequena de água (0,01 V) Uma batelada exemplar deu rendimento molar de: 32,5%; pureza enanciomérica de: 98,7% de S.
Experimento 8 O procedimento geral de Experimento 2 foi aplicado. Ácido acético não estava presente no sistema. O experimento foi realizado com uma quantidade mais alta de água (0,05 V).
Bateladas exemplares deram: Rendimento molar de: 34,7%; pureza enanciomérica de: 99,0% de S. Experimento 9 O procedimento geral de Experimento 2 foi aplicado. Adicionalmente uma quantidade pequena de água (0,05 V) foi adicionada na solução de base livre de 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l -hidróxi- butil] -3-(hidróxi-metil)-benzonitrila em 1-propanol.
Uma batelada exemplar deu rendimento molar de: 33,0%; pureza enanciomérica de: 99,1% de S. Experimento, 10 100 g (0,292 moles) de 4-(4-dimetil-amino-l-(4'-fluoro-fenil)- l-hidróxi-butil)3-(hidróxi-metil)-benzonitrila foram dissolvidos em 150 ml de etanol puro a 40°C. Mantendo a temperatura ao redor de 40°C, uma solução feita de 57,5 g (0,148 moles) de ácido (+)-(?, (2-di-p-toluoil-(S,S)-tartárico e 350 ml de etanol puro foi adicionada em uma hora. A mistura foi semeada e então esfriada para a temperatura ambiente durante a noite. A suspensão foi esfriada para 0°C e então filtrada. Rendimento molar de 29,5%, pureza enanciomérica de 98,2 %. S.
Experimento 11 Ácido (+)-Q(9-di-p-toluoil-(S,S)-tartárico (0,25 eq) foi dissolvido em 1-propanol (200 ml). Uma mistura foi aquecida para até ca. 40°C e então a solução foi transferida para uma solução de base livre de 4-[4- (dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi-butil]-3-(hidroxil-metil)- benzonitrila (100 g) em 1-propanol (100 ml) contendo 11 g de tolueno. A mistura de resolução contendo agora no total 3 V de 1-propanol foi semeada a 40°C com cristais semente compreendendo S-4-[4-(dimetil-amino)-l-(4'- fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila e ácido (+)-(?,O- di-p-toluoil-(S,S)-tartárico e então agitada a 40°C por duas horas. A mistura foi esfriada a 20°C em duas horas e mantida a 20°C durante a noite. O produto foi filtrado (reator-filtro) e lavado com 1-propanol. Rendimento molar de: 31,8%, pureza enanciomérica de: 95,5% de S.
Experimento 12 Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 10 V. Rendimento molar de: 30,7%, pureza enanciomérica de: 98,9% de S. Experimento 13
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 4,3 V e 0,39 eq de ácido (+)-<?, -di-p-toluoil-(S,S)-tartárico foi usado. Este exemplo foi repetido várias vezes. As bateladas de cristalização foram mantidas a 20°C por até 16 h, tipicamente até 8 h. Rendimentos molares de: cerca de 35%, pureza enanciomérica de: > 98%. S. Experimento 14
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 4,5 V, 0,50 eq. de ácido (+)-O,O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 36%, pureza enanciomérica de: 97,2% de S. Experimento 15
Experimento 11 foi repetido exceto que o volume total de 1 - propanol foi 4,4 V, 0,60 eq de ácido (±)-O,O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 38,9%, pureza enanciomérica de: 82,8% de S. Experimento 16
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 4,5 V, 0,675 eq de ácido (+)-(?, O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 35,2%, pureza enanciomérica de: 76,2% de S. Experimento 17
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 6 V, 0,75 eq de ácido (+)-(?, O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 24,8%, pureza enanciomérica de: 99,4% de S. Experimento 18
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 6 V, 0,75 eq de ácido (+)-Q(9-di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 31%, pureza enanciomérica de: 99,4% deS. Experimento 19
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 4,5 V, 0,75 eq de ácido (+)-O,O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 30,3%, pureza enanciomérica de: 99,0% de S. Experimento 20
Experimento 11 foi repetido exceto que o volume total de 1- propanol foi 4,5 V, 0,75 eq de ácido (+)-Q<?-di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 4 dias. Rendimento molar de: 32,2%, pureza enanciomérica de: 92,8% de S. Experimento 21
Experimento 11 foi repetido exceto que acetonitrila foi usado como o solvente no lugar de 1-propanol em um volume total de 10 V, 0,25 eq de ácido (+)-<9,<9'-di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 30,0%, pureza enanciomérica de: 96,0% de S. Experimento 22
Experimento 11 foi repetido exceto que acetonitrila foi usado como o solvente no lugar de 1-propanol em um volume total de 4,5 V, 0,50 eq de ácido (+)-O,O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 24,7%, pureza enanciomérica de: 99,2% de S. Experimento 23
Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (50:50) foi usada como o solvente no lugar de 1- propanol em um volume total de 2 V (o ácido (+)-O,O -di-p-toluoil-(S,S)- tartárico e a base livre 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l -hidróxi- butil] -3-(hidroxil-metil)-benzonitrila foram dissolvidos em 4,5 V diclorometano, 3,5 V diclorometano foi destilado e 1 V de 1-propanol foi adicionado), 0,25 eq de ácido (±}-O,O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 18,5%, pureza enanciomérica de: 96,9% de S.
Experimento 24 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (95:5) foi usado como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,35 eq de ácido (+)-<9,O-di-p- toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 35,7%, pureza enanciomérica de: 78,8% de S.
Experimento 25 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (85:15) foi usado como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,4 eq de ácido (+}-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 31%, pureza enanciomérica de: 98,2% de S.
Experimento 26 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (50:50) foi usado como o solvente no lugar de 1- propanol em um volume total de 4,4 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 16,4%, pureza enanciomérica de: 98,9% de S.
Experimento 27 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (75:25) foi usado como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 34,2%, pureza enanciomérica de: 98,8% de S.
Experimento 28 Experimento 11 foi repetido exceto que a mistura de cristalização não conteve tolueno, uma mistura de 1-propanol e diclorometano (85:15) foi usada como o solvente no lugar de 1-propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-(?, O -di-p-toluoil-(S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 37,8%, pureza enanciomérica de: 98,8% de S.
Experimento 29 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (85:15) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-(?, O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 36,6%, pureza enanciomérica de: 97,6% de S.
Experimento 29 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (90:10) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Este experimento foi realizado duas vezes com os seguintes resultados. Rendimento molar de: 38,9%, pureza enanciomérica de: 97,7% de S. Rendimento molar de: 35,8%, pureza enanciomérica de: 98,5% de S.
Experimento 30 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (92,5:7,5) foi usada como o solvente no lugar de 1- propanol em um volume total de 6,0 V, 0,5 eq de ácido (+)-Q(7'-di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Este experimento foi realizado duas vezes com os seguintes resultados. Rendimento molar de: 35,1%, pureza enanciomérica de: 98,6% de S. Rendimento molar de: 39,0%, pureza enanciomérica de: 81,3% de S.
Experimento 31 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (95:5) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-QO-di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 35,0%, pureza enanciomérica de: 98,4% de S.
Experimento 32 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e diclorometano (90:10) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,6 V, 0,6 eq de ácido (+}-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 38,5%, pureza enanciomérica de: 99,1% de S.
Experimento 33 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e acetonitrila (15:85) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 25,9%, pureza enanciomérica de: 99,2% de S.
Experimento 34 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e acetonitrila (85:15) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 18,5%, pureza enanciomérica de: 99,4% de S.
Experimento 35 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e acetonitrila (90:10) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, 0,5 eq de ácido (+)-O,O -di-p-toluoil- (S,S)-tartárico foi usado, e o tempo de retenção antes da filtração foi durante a noite. Rendimento molar de: 29,9%, pureza enanciomérica de: 99,3% de S.
Experimento 36 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e acetato de etila (31:69) foi usada como o solvente no lugar de 1- propanol em um volume total de 4,5 V, depois mais 2 V de 1-propanol foi adicionado, 0,25 eq de ácido (+)-O,O-di-p-toluoil-(S,S)tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 28,6%, pureza enanciomérica de: 98,4% de S.
Experimento 37 Experimento 11 foi repetido exceto que uma mistura de 1- propanol e etanol (50:50) foi usada como o solvente no lugar de 1-propanol em um volume total de 4,4 V, 0,5 eq de ácido (+)-O,(9-di-p-toluoil-(S,S)- tartárico foi usado, e o tempo de retenção antes da filtração foi 0,5 h. Rendimento molar de: 27,4%, pureza enanciomérica de: 99,4% de S.
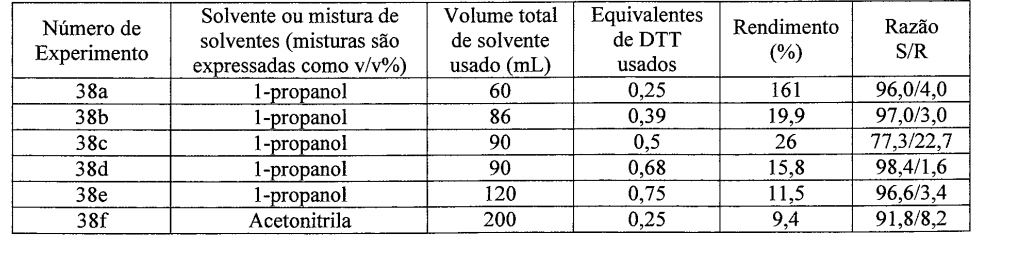
Experimento 38 Uma variedade de experimentos foi conduzida examinando a resolução de diol com (+)(S,S)-DTT. O procedimento geral é descrito abaixo, e os detalhes e resultados de cada reação estão em tabela 1. Diol racêmico (20 g, 58,4 mmol) foi dissolvido em aproximadamente metade do solvente usado para o experimento a 40°C. (+)- (S,S)-DTT.H2O (quantidade especificada na tabela) foi adicionado como uma solução na outra metade do solvente. A solução foi mantida a 40°C e foi semeada dentro de dois minutos com cristais de (S)-diol.l/2(+)-(S,S)-DTT (aproximadamente 5 mg). Cristalização tipicamente começou dentro de 5-10 minutos após a semeadura. Após 2 h a 40°C, a temperatura da solução foi abaixada a 20°C durante 2 h, e a solução foi mantida nesta temperatura por mais 1 h. O produto foi então separado por filtração, lavado com o solvente apropriado (2 x 20 mL) e seco durante a noite a 60°C sob pressão reduzida. Tabela 1: Resultados de experimento 38
Embora os experimentos acima tenham sido todos realizados usando ácido (QO-di-p-toluoil-(S,S)-tartárico que precipita junto com S-4- [4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)- benzonitrila deixando o licor-mãe enriquecido em R-4-[4-(dimetil-amino)-l- 5 (4'-fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila, a pessoa experiente verá que ele poderia também usar ácido (-)-Q(9-di-p-toluoil- (R,R)-tartárico que precipita junto com R-4-[4-(dimetil-amino)-l-(4 -(4- fluoro-fenil)-l-hidróxi-butil]-3-(hidróxi-metil)-benzonitrila deixando o licor- mãe enriquecido em S-4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)-l-hidróxi- 10 butil]-3-(hidróxi-metil)-benzonitrila.
Embora o modo padrão de adição seja: ácido (+)-<9,<9-di-p- toluoil-(S,S)-tartárico adicionado em 4-[4-(dimetil-amino)-l-(4'-fluoro-fenil)- l-hidróxi-butil]-3-(hidroxil-metil)-benzonitrila, este procedimento de adição pode ser invertido (4-[4-(dimetil-amino)-l-(4 '-fluoro-fenil)-l-hidróxi-butil]- 15 3-(hidróxi-metil)-benzonitrila adicionada em ácido (+)-<9,(9-di-p-toluoil- (S,S)-tartárico).