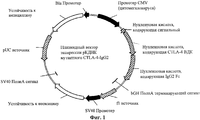
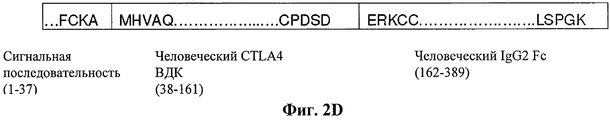
RU2506275C2 - Иммуносупрессорные полипептиды и нуклеиновые кислоты - Google Patents
Иммуносупрессорные полипептиды и нуклеиновые кислоты Download PDFInfo
- Publication number
- RU2506275C2 RU2506275C2 RU2010122053/10A RU2010122053A RU2506275C2 RU 2506275 C2 RU2506275 C2 RU 2506275C2 RU 2010122053/10 A RU2010122053/10 A RU 2010122053/10A RU 2010122053 A RU2010122053 A RU 2010122053A RU 2506275 C2 RU2506275 C2 RU 2506275C2
- Authority
- RU
- Russia
- Prior art keywords
- amino acid
- polypeptide
- fusion protein
- seq
- ctla
- Prior art date
Links
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 149
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 132
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 132
- 108090000765 processed proteins & peptides Proteins 0.000 title claims description 694
- 102000004196 processed proteins & peptides Human genes 0.000 title claims description 686
- 229920001184 polypeptide Polymers 0.000 title claims description 684
- 230000001506 immunosuppresive effect Effects 0.000 title description 15
- 230000028993 immune response Effects 0.000 claims abstract description 179
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 103
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 90
- 239000013636 protein dimer Substances 0.000 claims abstract description 89
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 76
- 201000010099 disease Diseases 0.000 claims abstract description 38
- 208000035475 disorder Diseases 0.000 claims abstract description 38
- 230000002401 inhibitory effect Effects 0.000 claims abstract description 38
- 210000000056 organ Anatomy 0.000 claims abstract description 36
- 210000000987 immune system Anatomy 0.000 claims abstract description 26
- 239000013598 vector Substances 0.000 claims abstract description 24
- 241000124008 Mammalia Species 0.000 claims abstract description 22
- 206010052779 Transplant rejections Diseases 0.000 claims abstract description 20
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims abstract description 19
- 102000054189 human CD80 Human genes 0.000 claims abstract description 18
- 101000946850 Homo sapiens T-lymphocyte activation antigen CD86 Proteins 0.000 claims abstract description 16
- 102000049849 human CD86 Human genes 0.000 claims abstract description 16
- 239000013604 expression vector Substances 0.000 claims abstract description 10
- 239000003814 drug Substances 0.000 claims abstract description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 9
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 394
- 102000037865 fusion proteins Human genes 0.000 claims description 391
- 108020001507 fusion proteins Proteins 0.000 claims description 391
- 210000004027 cell Anatomy 0.000 claims description 127
- 235000018102 proteins Nutrition 0.000 claims description 88
- 238000004519 manufacturing process Methods 0.000 claims description 55
- 210000001519 tissue Anatomy 0.000 claims description 37
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 32
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 claims description 23
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 claims description 23
- 238000010494 dissociation reaction Methods 0.000 claims description 14
- 230000005593 dissociations Effects 0.000 claims description 14
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 5
- 239000002609 medium Substances 0.000 claims description 5
- 238000012258 culturing Methods 0.000 claims description 4
- 239000001963 growth medium Substances 0.000 claims 2
- 210000001322 periplasm Anatomy 0.000 claims 2
- 239000000539 dimer Substances 0.000 abstract description 151
- 238000000034 method Methods 0.000 abstract description 119
- 230000005764 inhibitory process Effects 0.000 abstract description 6
- 230000000694 effects Effects 0.000 abstract description 5
- 239000000126 substance Substances 0.000 abstract description 5
- 229940079593 drug Drugs 0.000 abstract description 4
- 230000001629 suppression Effects 0.000 abstract description 4
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 205
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 205
- 229940045513 CTLA4 antagonist Drugs 0.000 description 205
- 235000001014 amino acid Nutrition 0.000 description 180
- 125000000539 amino acid group Chemical group 0.000 description 173
- 238000009739 binding Methods 0.000 description 163
- 230000027455 binding Effects 0.000 description 158
- 238000006467 substitution reaction Methods 0.000 description 84
- 229940024606 amino acid Drugs 0.000 description 71
- 241000282414 Homo sapiens Species 0.000 description 67
- 229940035567 orencia Drugs 0.000 description 67
- 239000000178 monomer Substances 0.000 description 65
- 150000001413 amino acids Chemical class 0.000 description 63
- 210000001744 T-lymphocyte Anatomy 0.000 description 59
- 108010076504 Protein Sorting Signals Proteins 0.000 description 56
- 230000006052 T cell proliferation Effects 0.000 description 51
- 238000000338 in vitro Methods 0.000 description 46
- 238000001727 in vivo Methods 0.000 description 46
- 230000006044 T cell activation Effects 0.000 description 42
- 230000014509 gene expression Effects 0.000 description 42
- 125000003729 nucleotide group Chemical group 0.000 description 40
- 102000040430 polynucleotide Human genes 0.000 description 39
- 108091033319 polynucleotide Proteins 0.000 description 39
- 239000002157 polynucleotide Substances 0.000 description 39
- 239000002773 nucleotide Substances 0.000 description 34
- 208000023275 Autoimmune disease Diseases 0.000 description 33
- 230000001419 dependent effect Effects 0.000 description 31
- 239000012634 fragment Substances 0.000 description 30
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 29
- 102000043321 human CTLA4 Human genes 0.000 description 29
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 27
- 230000003993 interaction Effects 0.000 description 25
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 24
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 24
- 230000015572 biosynthetic process Effects 0.000 description 24
- 230000000069 prophylactic effect Effects 0.000 description 24
- 102000005962 receptors Human genes 0.000 description 24
- 108020003175 receptors Proteins 0.000 description 24
- 239000000427 antigen Substances 0.000 description 23
- 108091007433 antigens Proteins 0.000 description 23
- 102000036639 antigens Human genes 0.000 description 23
- 238000012545 processing Methods 0.000 description 23
- 230000004913 activation Effects 0.000 description 22
- 230000016396 cytokine production Effects 0.000 description 22
- 230000006698 induction Effects 0.000 description 22
- 230000004044 response Effects 0.000 description 22
- 238000011282 treatment Methods 0.000 description 21
- 230000003367 anti-collagen effect Effects 0.000 description 19
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 19
- 239000003446 ligand Substances 0.000 description 19
- 206010061218 Inflammation Diseases 0.000 description 18
- 230000004054 inflammatory process Effects 0.000 description 18
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 17
- 108060003951 Immunoglobulin Proteins 0.000 description 16
- 102000018358 immunoglobulin Human genes 0.000 description 16
- 125000005647 linker group Chemical group 0.000 description 16
- 102200027760 rs75193786 Human genes 0.000 description 16
- 238000003786 synthesis reaction Methods 0.000 description 16
- 108020004705 Codon Proteins 0.000 description 15
- 108091028043 Nucleic acid sequence Proteins 0.000 description 15
- 102220502536 Platelet-activating factor acetylhydrolase IB subunit alpha2_G55E_mutation Human genes 0.000 description 15
- 210000004899 c-terminal region Anatomy 0.000 description 15
- 230000006870 function Effects 0.000 description 15
- 102220252247 rs1555583645 Human genes 0.000 description 15
- 230000001225 therapeutic effect Effects 0.000 description 15
- 229960005347 belatacept Drugs 0.000 description 14
- 230000002163 immunogen Effects 0.000 description 14
- 102220222791 rs1060501227 Human genes 0.000 description 14
- 102220082934 rs201875716 Human genes 0.000 description 14
- 230000028327 secretion Effects 0.000 description 14
- 230000002757 inflammatory effect Effects 0.000 description 13
- 229920000642 polymer Polymers 0.000 description 13
- 238000002560 therapeutic procedure Methods 0.000 description 13
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 12
- COLNVLDHVKWLRT-QMMMGPOBSA-N phenylalanine group Chemical group N[C@@H](CC1=CC=CC=C1)C(=O)O COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 12
- 102220340769 rs987244110 Human genes 0.000 description 12
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 11
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 11
- 108010002350 Interleukin-2 Proteins 0.000 description 11
- 102000000588 Interleukin-2 Human genes 0.000 description 11
- 238000004458 analytical method Methods 0.000 description 11
- 230000000295 complement effect Effects 0.000 description 11
- 230000007170 pathology Effects 0.000 description 11
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 11
- 108010087819 Fc receptors Proteins 0.000 description 10
- 102000009109 Fc receptors Human genes 0.000 description 10
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 10
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 10
- 108010074328 Interferon-gamma Proteins 0.000 description 10
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 10
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 10
- 102000010789 Interleukin-2 Receptors Human genes 0.000 description 10
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 10
- 239000004472 Lysine Substances 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 10
- 230000004927 fusion Effects 0.000 description 10
- 230000001976 improved effect Effects 0.000 description 10
- 102220232156 rs370120266 Human genes 0.000 description 10
- 238000012216 screening Methods 0.000 description 10
- 241000894007 species Species 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- 102100037850 Interferon gamma Human genes 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 230000001086 cytosolic effect Effects 0.000 description 9
- 239000012636 effector Substances 0.000 description 9
- 238000002650 immunosuppressive therapy Methods 0.000 description 9
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 9
- 230000011664 signaling Effects 0.000 description 9
- 102000004127 Cytokines Human genes 0.000 description 8
- 108090000695 Cytokines Proteins 0.000 description 8
- 206010062016 Immunosuppression Diseases 0.000 description 8
- 108010021466 Mutant Proteins Proteins 0.000 description 8
- 102000008300 Mutant Proteins Human genes 0.000 description 8
- 238000007792 addition Methods 0.000 description 8
- 230000005875 antibody response Effects 0.000 description 8
- 238000012217 deletion Methods 0.000 description 8
- 230000037430 deletion Effects 0.000 description 8
- 238000005755 formation reaction Methods 0.000 description 8
- 239000011159 matrix material Substances 0.000 description 8
- 239000000203 mixture Substances 0.000 description 8
- 206010039073 rheumatoid arthritis Diseases 0.000 description 8
- 102220550784 Unconventional myosin-X_V32I_mutation Human genes 0.000 description 7
- 238000004422 calculation algorithm Methods 0.000 description 7
- 229930182817 methionine Natural products 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- 108091026890 Coding region Proteins 0.000 description 6
- 102000053602 DNA Human genes 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 6
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 108020004511 Recombinant DNA Proteins 0.000 description 6
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 6
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 208000026278 immune system disease Diseases 0.000 description 6
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 241001529936 Murinae Species 0.000 description 5
- 208000002193 Pain Diseases 0.000 description 5
- 230000005867 T cell response Effects 0.000 description 5
- 230000000890 antigenic effect Effects 0.000 description 5
- 208000037765 diseases and disorders Diseases 0.000 description 5
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 5
- 230000002519 immonomodulatory effect Effects 0.000 description 5
- 210000003734 kidney Anatomy 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 238000002965 ELISA Methods 0.000 description 4
- 108091006020 Fc-tagged proteins Proteins 0.000 description 4
- 241000699666 Mus <mouse, genus> Species 0.000 description 4
- 210000000612 antigen-presenting cell Anatomy 0.000 description 4
- 238000003776 cleavage reaction Methods 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 230000003449 preventive effect Effects 0.000 description 4
- 230000001105 regulatory effect Effects 0.000 description 4
- 102200128633 rs104893843 Human genes 0.000 description 4
- 230000007017 scission Effects 0.000 description 4
- 210000002966 serum Anatomy 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 108010074051 C-Reactive Protein Proteins 0.000 description 3
- 102100032752 C-reactive protein Human genes 0.000 description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 3
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 3
- 201000004681 Psoriasis Diseases 0.000 description 3
- 108091008874 T cell receptors Proteins 0.000 description 3
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 3
- 229960003697 abatacept Drugs 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 230000004940 costimulation Effects 0.000 description 3
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 230000036039 immunity Effects 0.000 description 3
- 230000005847 immunogenicity Effects 0.000 description 3
- 239000003018 immunosuppressive agent Substances 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 102220029635 rs146867923 Human genes 0.000 description 3
- 102200163548 rs63751094 Human genes 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 230000019491 signal transduction Effects 0.000 description 3
- 230000008054 signal transmission Effects 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 229910052720 vanadium Inorganic materials 0.000 description 3
- 208000006820 Arthralgia Diseases 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 102000005738 B7 Antigens Human genes 0.000 description 2
- 108010045634 B7 Antigens Proteins 0.000 description 2
- 102220573534 C-C motif chemokine 5_G55K_mutation Human genes 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 241000283073 Equus caballus Species 0.000 description 2
- 108091029865 Exogenous DNA Proteins 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 241000282575 Gorilla Species 0.000 description 2
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 description 2
- 102000009490 IgG Receptors Human genes 0.000 description 2
- 108010073807 IgG Receptors Proteins 0.000 description 2
- 208000029462 Immunodeficiency disease Diseases 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 206010023232 Joint swelling Diseases 0.000 description 2
- 108091054438 MHC class II family Proteins 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 206010052904 Musculoskeletal stiffness Diseases 0.000 description 2
- 108091005461 Nucleic proteins Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000000833 heterodimer Substances 0.000 description 2
- 239000000710 homodimer Substances 0.000 description 2
- 238000010324 immunological assay Methods 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 238000002823 phage display Methods 0.000 description 2
- 230000012743 protein tagging Effects 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 102220277465 rs1403203490 Human genes 0.000 description 2
- 238000002864 sequence alignment Methods 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- -1 them Proteins 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 238000012800 visualization Methods 0.000 description 2
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 241000272525 Anas platyrhynchos Species 0.000 description 1
- 101100235064 Arabidopsis thaliana LEA29 gene Proteins 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 238000012492 Biacore method Methods 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 206010023439 Kidney transplant rejection Diseases 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241001504519 Papio ursinus Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 241000282405 Pongo abelii Species 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102220493431 Putative uncharacterized protein encoded by MIR7-3HG_K28N_mutation Human genes 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 230000017274 T cell anergy Effects 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000007503 antigenic stimulation Effects 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 230000000763 evoking effect Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 150000002337 glycosamines Chemical group 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 230000008348 humoral response Effects 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 230000000899 immune system response Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 230000003259 immunoinhibitory effect Effects 0.000 description 1
- 210000000428 immunological synapse Anatomy 0.000 description 1
- 230000020287 immunological synapse formation Effects 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 229940121354 immunomodulator Drugs 0.000 description 1
- 230000002584 immunomodulator Effects 0.000 description 1
- 208000025095 immunoproliferative disease Diseases 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 230000001861 immunosuppressant effect Effects 0.000 description 1
- 229940125721 immunosuppressive agent Drugs 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 210000001503 joint Anatomy 0.000 description 1
- 208000018937 joint inflammation Diseases 0.000 description 1
- 238000011005 laboratory method Methods 0.000 description 1
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000021633 leukocyte mediated immunity Effects 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- OHDXDNUPVVYWOV-UHFFFAOYSA-N n-methyl-1-(2-naphthalen-1-ylsulfanylphenyl)methanamine Chemical compound CNCC1=CC=CC=C1SC1=CC=CC2=CC=CC=C12 OHDXDNUPVVYWOV-UHFFFAOYSA-N 0.000 description 1
- 230000007896 negative regulation of T cell activation Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 210000004777 protein coat Anatomy 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000012121 regulation of immune response Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 102220065537 rs201161721 Human genes 0.000 description 1
- 102220044848 rs377730553 Human genes 0.000 description 1
- 102220321637 rs377730553 Human genes 0.000 description 1
- 102200027763 rs75193786 Human genes 0.000 description 1
- 102220059216 rs771261665 Human genes 0.000 description 1
- 102220241278 rs777474053 Human genes 0.000 description 1
- 102220000564 rs78778622 Human genes 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- General Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Pharmacology & Pharmacy (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Transplantation (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
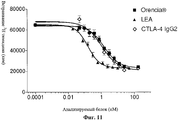
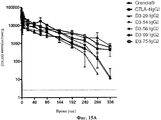
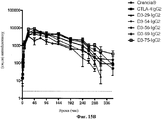
Abstract
Изобретение относится к области биохимии, в частности к рекомбинантным димерам слитого белка, предназначенным для ингибирования или подавления иммунного ответа у млекопитающего, которые связывают человеческий CD80 или человеческий CD86 или внеклеточный домен любого из них, и имеет большую способность подавлять иммунный ответ, чем димер слитого белка LEA29Y-Ig. Раскрыты нуклеиновые кислоты, кодирующие указанные димеры, экспрессирующие векторы, содержащие данные нуклеиновые кислоты, а также рекомбинаные клетки-хозяева, содержащие указанные нуклеиновые кислоты и/или указанные векторы. Раскрыты фармацевтические композиции для инибирования или подавления иммунного ответа у млекопитающего, включающие вышеуказанные димеры слитого белка, а также применение указанных димеров для изготовления лекарственных средств для ингибирования или подавления иммунного ответа у млекопитающего, лечения заболевания или расстройства иммунной системы или лечения отторжения трансплантата органа или ткани у млекопитающего. Также раскрыты способы получения вышеуказанных димеров слитого белка. Изобретение позволяет эффективно ингибировать или подавлять иммунный ответ у млекопитающего. 14 н. и 5 з.п. ф-лы, 15 ил., 11 табл., 12 пр.
Description
Область техники
Данное изобретение в общем относится к полипептидам, которые связывают CD80 и/или CD86, нуклеиновой кислоте, кодирующей такие полипептиды, и способам получения и применения таких полипептидов и нуклеиновых кислот.
Уровень техники
Т-клетки играют главную роль в инициации и регуляции иммунных ответов. Для того чтобы произошла полная активация Т-клеток, необходимы, по меньшей мере, два отдельных сигнальных события. Первый сигнал создается путем взаимодействия Т-клеточных рецепторов (ТКР), экспрессирующихся на Т-клетках специфическими антигенами (Ag), представленными в контексте молекул главного комплекса гистосовместимости (ГКГ), экспрессирующихся на антиген-презентирующих клетках (АПК). Второй (костимуляторный) сигнал является результатом взаимодействия между костимуляторными лигандами, экспрессирующимися на АПК, и их соответствующими рецепторами, экспрессирующимися на Т-клетках. Доминантный костимуляторный путь включает взаимодействие между CD80 (В7-1 или В7,1) и CD86 (В7-2 или В7,2) лигандами, экспрессирующимися на АПК с CD28 и CTLA-4 (также известным как CD 152), экспрессирующихся, главным образом, на Т-клетках. CTLA-4 (цитотоксический антиген 4Т-лимфоцита) и CD28 служат в качестве рецепторов для CD80 и CD86 лигандов.
Позитивная передача сигнала опосредуется через CD28 рецептор. Связывание CD80 и/или CD86 лиганда(ов) с CD28 снижает порог Т-клеточной активации путем стимуляции формирования иммунологических синапсов (Viola A. et al., Science 283:680-682 (1999)). Дополнительно, CD28 костимуляция активирует или усиливает продукцию факторов, направленных на Т-клеточную пролиферацию и выживание, таких как интерлейкин-2 (IL-2), NF-κВ (фактор транскрипции каппа В) и BcI-XL (Norton S. D. et at., J. Immunol. 149:1556-1561 (1992); Vella A. T. et al., J. Immunol. 158: 4714-4720 (1997)). In vivo CD28-дефицитные мыши имеют сильно подавленный иммунитет и демонстрируют слабые антиген-специфичные Т-клеточные ответы (Green, J. M. et al., Immunity 1:501-508 (1994)). Т-клеточная анергия или толерантность может возникать, когда Т-клетки активируются в отсутствие костимуляторного сигнала.
Негативная передача сигнала опосредуется через рецептор CTLA-4. Каждый из CD80 и CD86 лигандов связывается с высокой авидностью с CTLA-4 и уравновешивает иммунопролиферативные ответы, идущие от CD28 передачи сигнала. Потенциальный механизм передачи сигнала CTLA-4 включает конкурентное связывание костимуляторных молекул CD80/CD86 (Masteller, E. M. et al., J. Immunol. 164:5319 (2000)), ингибирование ТКР передачи сигнала путем привлечения фосфатаз к иммуносинапсу (Lee K. M. et al., Science 282:2263 (1998)) и нарушение иммунологического синапса (Pentcheva-Hoang Т. et al., Immunity 21:401 (2004); Chikuma S. et al., J. Exp. Med 197:129 (2003); Schneider H. et al., Science 313: 1972 (2006)). In vivo CTLA-4 дефицитные мыши демонстрируют глубоко аутоиммунные фенотипы, характеризующиеся обширной тканевой инфильтрацией и разрушением органов (Waterhouse P. et al., Science 270:985 (1995)).
Терапевтические агенты, разработанные для того, чтобы противодействовать CD80/CD86 костимуляторному пути передачи сигнала, такие как растворимый человеческий CTLA-4-Ig, выполняют обязательства по лечению аутоиммунных заболеваний и нарушений. Данное изобретение обеспечивает преимущественные молекулы, имеющие улучшенные способности модулировать или подавлять передачу сигнала через CD80/CD86 костимуляторный путь и способы применения таких молекул для выбранного и дифференциального управления Т-клеточными ответами. Такие молекулы находят полезное использование в различных применениях, обсуждаемых в деталях ниже.
Краткое описание изобретения
В первом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид CTLA-4, включающий аминокислотную последовательность, которая отличается от аминокислотной последовательности внеклеточного домена человеческого CTLA-4, представленной в SEQ ID NO (идентификационный номер последовательности): с 159 по 15 аминокислотным остаткам, где изолированный или рекомбинантный полипептид CTLA-4 имеет способность связывать CD80 или CD86 или внеклеточный домен обоих и/или имеет способность подавлять или ингибировать иммунный ответ.
Полипептид согласно первому аспекту данного изобретения может иметь, по меньшей мере, 90% идентичность последовательности или, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности к аминокислотной последовательности SEQ ID NO:36. Полипептид согласно первому аспекту данного изобретения может включать аминокислотную последовательность SEQ ID NO:36.
Полипептид согласно первому аспекту данного изобретения может иметь, по меньшей мере, 90% идентичность последовательности или, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, или, по меньшей мере, 99% идентичность последовательности к аминокислотной последовательности SEQ ID NO:50. Полипептид согласно первому аспекту данного изобретения может включать аминокислотную последовательность SEQ ID NO:50.
Полипептид согласно первому аспекту данного изобретения может иметь способность связывать человеческий CD80 или человеческий CD86 или их внеклеточный домен.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную последовательность длиной 124 аминокислотных остатка.
Полипептид согласно первому аспекту данного изобретения может включать одну аминокислотную замену в аминокислотном положении, выбранном из группы, включающей аминокислотные положения, соответствующие положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно SEQ ID NO:159.
Полипептид согласно первому аспекту данного изобретения может включать две, три или четыре аминокислотные замены в аминокислотных положениях, выбранных из группы, включающей аминокислотные положения, соответствующие положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно SEQ ID NO:159.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 70 относительно SEQ ID NO:159, такую как замена S70F. Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 104 относительно SEQ ID NO:159, такую как замена L104E.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 30 относительно SEQ ID NO:159, такую как замена T30N/D/A или замена T30N.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 64 относительно SEQ ID NO:159, такую как замена S64P.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 50 относительно SEQ ID NO:159, такую как замена А50М.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 54 относительно SEQ ID NO:159, такую как замена M54K/V или замена M54K.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 65 относительно SEQ ID NO:159, такую как замена I65S.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 56 относительно SEQ ID NO:159, такую как замена N56D.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 55 относительно SEQ ID NO:159, такую как замена G55E.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положениях 85 относительно SEQ ID NO:159, такую как замена М85А.
Полипептид согласно первому аспекту данного изобретения может включать аминокислотную замену в положении 24 относительно SEQ ID NO:159, такую как замена A24E/S или замена А24Е.
Полипептид согласно первому аспекту данного изобретения может иметь аффинность связывания к CD86 или его внеклеточному домену, которая практически равна или больше, чем аффинность связывания мономерного внеклеточного домена человеческого CTLA-4 к внеклеточному домену CD86 или CD86.
Полипептид согласно первому аспекту данного изобретения может иметь аффинность связывания к CD80 или его внеклеточному домену, которая больше, чем аффинность связывания мономерного внеклеточного домена человеческого CTLA-4 к внеклеточному домену CD80 или CD80.
Полипептид согласно первому аспекту данного изобретения может иметь способность подавлять иммунный ответ.
Полипептид согласно первому аспекту данного изобретения может иметь способность ингибировать Т-клеточную активацию или Т-клеточную пролиферацию.
Во втором аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептидный мультимер, включающий, по меньшей мере, два полипептида согласно первому аспекту данного изобретения.
В третьем аспекте данное изобретение обеспечивает изолированный или рекомбинантный слитый белок, включающий (а) полипептид согласно первому аспекту данного изобретения и (b) второй полипептид, где второй полипептид является Ig Fc полипептидом и где слитый белок имеет способность связывать CD80 и/или CD86 или внеклеточный домен каждого или обоих и/или способность модулировать или регулировать иммунный ответ.
В четвертом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димерный слитый белок, включающий два мономерных слитых белка согласно третьему аспекту данного изобретения.
В пятом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую нуклеотидную последовательность, которая кодирует полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения или димерный слитый белок согласно четвертому аспекту данного изобретения.
В шестом аспекте данное изобретение обеспечивает вектор, включающий нуклеиновую кислоту согласно пятому аспекту данного изобретения.
В седьмом аспекте данное изобретение обеспечивает изолированную или рекомбинантную клетку-хозяина, включающую полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения, димерный слитый белок согласно четвертому аспекту данного изобретения, нуклеиновую кислоту согласно пятому аспекту данного изобретения и/или вектор согласно шестому аспекту данного изобретения.
В восьмом аспекте данное изобретение обеспечивает фармацевтическую композицию, включающую фармацевтически приемлемый наполнитель, фармацевтически приемлемый носитель, или фармацевтически приемлемый растворитель и один или более из следующего: полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения, димерный слитый белок согласно четвертому аспекту данного изобретения, нуклеиновая кислота согласно пятому аспекту данного изобретения, вектор согласно шестому аспекту данного изобретения и/или клетка-хозяин согласно седьмому аспекту данного изобретения.
В девятом аспекте данное изобретение обеспечивает способ для подавления иммунного ответа, где указанный способ, включающий контакт В7-позитивной клетки с эффективным количеством, по меньшей мере, одного из: полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения, димерный слитый белок согласно четвертому аспекту данного изобретения, нуклеиновая кислота согласно пятому аспекту данного изобретения, вектор согласно шестому аспекту данного изобретения и/или клетка-хозяин согласно седьмому аспекту данного изобретения, подавление иммунного ответа, где иммунный ответ, таким образом, подавляется.
В десятом аспекте данное изобретение обеспечивает полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения, димерный слитый белок согласно четвертому аспекту данного изобретения, нуклеиновую кислоту согласно пятому аспекту данного изобретения, вектор согласно шестому аспекту данного изобретения и/или клетку-хозяина согласно седьмому аспекту данного изобретения для применения в подавлении иммунного ответа.
В одиннадцатом аспекте данное изобретение обеспечивает применение полипептида согласно первому аспекту данного изобретения, мультимера согласно второму аспекту данного изобретения, слитого белка согласно третьему аспекту данного изобретения, димерного слитого белка согласно четвертому аспекту данного изобретения, нуклеиновой кислоты согласно пятому аспекту данного изобретения, вектора согласно шестому аспекту данного изобретения и/или клетки-хозяина согласно седьмому аспекту данного изобретения в производстве медикамента для подавления иммунного ответа.
В двенадцатом аспекте данное изобретение обеспечивает конъюгат, включающий полипептид согласно первому аспекту данного изобретения, мультимер согласно второму аспекту данного изобретения, слитый белок согласно третьему аспекту данного изобретения или димерный слитый белок согласно четвертому аспекту данного изобретения, и неполипептидную часть, ковалентно прикрепленную к такому полипептиду, мультимеру, слитому белку или димерному слитому белку, где указанный конъюгат имеет способность подавлять иммунный ответ.
Другие аспекты изобретения описаны ниже.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS (идентификационные номера последовательностей): 1-73, где полипептид связывает CD80 или CD86 или внеклеточный домен (ВКД) каждого, и/или имеет способность подавлять или ингибировать иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99%), или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид имеет аффинность связывания к человеческому CD86 внеклеточному домену или внеклеточному домену человеческого CD80, которая практически равна или больше, чем аффинность связывания человеческого CTLA-4 к внеклеточному домену человеческого CD86 или внеклеточному домену человеческого CD80 соответственно, и где полипептид необязательно имеет способность подавлять иммунный ответ. Некоторые такие полипептиды имеют аффинность связывания к человеческому CD86 внеклеточному домену, которая больше, чем аффинность связывания внеклеточного домена человеческого CTLA-4 к внеклеточному домену человеческого CD86. Некоторые такие полипептиды имеют аффинность связывания к внеклеточному домену человеческого CD80, которая больше, чем аффинность связывания внеклеточного домена человеческого CTLA-4 к внеклеточному домену человеческого CD80.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мутантный полипептид CTLA-4, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленного в SEQ ID NO:159 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно SEQ ID NO:159, где мутантный полипептид CTLA-4 имеет способность связывать CD80 или CD86 или внеклеточный домен каждого и/или имеет способность подавлять или ингибировать иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, который включает аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности к аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73, где полипептид имеет способность связывать CD80 и/или CD86 или внеклеточный домен каждого или обоих и/или имеет способность подавлять или ингибировать иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мутантный полипептид CTLA-4, который связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих, и/или способен подавлять иммунный ответ, где указанный полипептид включает аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности полипептида внеклеточного домена человеческого CTLA-4, представленного в SEQ ID NO:159 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену, где указанная, по меньшей мере, аминокислотная замена включает S70F, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:159.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мутантный полипептид CTLA-4, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленного в SEQ ID NO:159 по не более чем 11, 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену в положении аминокислотных остатков, соответствующему положению 24, 30, 32, 50, 54, 55, 56, 64, 65, 70 или 85 относительно SEQ ID NO:159, где мутантный полипептид CTLA-4 имеет способность связывать CD 80 или CD 86 или внеклеточный домен каждого и/или имеет способность подавлять или ингибировать иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, представленной в SEQ ID NO:31 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, один из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31, и полипептид связывает CD80 и/или CD86 и/или ВКД каждого или обоих и/или ингибирует иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка, включающий два мономерных слитых белка, связанных посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном слитом белке, где каждый мономерный слитый белок включает (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73 и (b) полипептид Ig Fc, где димер слитого белка имеет способность связывать CD80 и/или CD86, и/или CD80-Ig и/или CD86-Ig, и/или имеет способность ингибировать или подавлять иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка, включающий два мономерных слитых белка, каждый такой мономерный слитый белок, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где полипептид связывает CD80 и/или CD86, и/или его внеклеточный домен и/или подавляет иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка, включающий два мономерных слитых белка, где каждый мономерный слитый белок включает: (1) полипептид, включающий аминокислотную последовательность, которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и где аминокислотный остаток в аминокислотной последовательности в положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной выбранной аминокислотной последовательности, и (2) полипептид Ig Fc, где димер слитого белка связывает CD80 и/или CD86, и/или ингибирует иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка, включающий два мономерных слитых белка, где каждый мономерный слитый белок включает: (1) полипептид мутантного внеклеточного домена CTLA-4, включающий аминокислотную последовательность, которая (i) отличается от аминокислотной последовательности внеклеточного домена человеческого CTLA-4, представленного в SEQ ID NO:159 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (ii) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно аминокислотной последовательности SEQ ID NO:159; и (2) полипептид Ig Fc, где димер слитого белка связывает CD80 и/или CD86, и/или подавляет или ингибирует иммунный ответ. Некоторые такие димеры слитого белка включают одну или несколько замен в аминокислотных положениях относительно SEQ ID NO:159, выбранных из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F; и (2) полипептид Ig Fc, причем Ig Fc полипептид необязательно является IgG2 Fc полипептидом, где мутантный димер CTLA-4-Ig связывает hCD80 и/или hCD86, и/или подавляет или ингибирует иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности к аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:26, SEQ ID NO:36, SEQ ID NO:38, SEQ ID NO:50 и SEQ ID NO:56, где полипептид (i) связывает CD80 и/или CD86 или внеклеточный домен каждого или обоих, и/или (ii) подавляет иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности к аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где полипептид (i) связывает CD80 и/или CD86 или внеклеточный домен каждого или обоих, (ii) связывает слитый белок CD80-Ig и/или слитый белок CD86-Ig, и/или (iii) подавляет иммунный ответ.
Также обеспечивается изолированный или рекомбинантный димер слитого белка, включающий два мономерных слитых белка, связанных посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном слитом белке, где каждый мономерный слитый белок включает (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO:79, SEQ ID NO:197, SEQ ID NO:198, SEQ ID NO:199, и SEQ ID NO:200 и (b) полипептид Ig Fc, где димер слитого белка имеет (i) способность связывать CD80 и/или CD86 и/или внеклеточный домен CD80 и/или CD86, (ii) способность связывать CD80-Ig и/или CD86-Ig, и/или (iii) имеет способность ингибировать или подавлять иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-79, 197-200, 205-214 и 219-222, где полипептид связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих, и/или имеет способность подавлять иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует слитый белок, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214, и 219-222, где полипептид связывает CD80 и/или CD86, и/или его внеклеточный домен и/или подавляет иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую: (а) полинуклеотидную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NOS:80-158, 201-204, 223, и 224; (b) комплементарную полинуклеотидную последовательность (а) или (с) фрагмент любой полинуклеотидной последовательности (а) или (b), где нуклеиновая кислота кодирует полипептид, который связывает CD80 и/или CD86, и/или внеклеточный домен каждого или обоих, и/или имеет способность подавлять или ингибировать иммунный ответ.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, который включает аминокислотную последовательность (а), которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 10, 9, 8, 7, или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) где аминокислотный остаток в аминокислотной последовательности в положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает CD80 и/или CD86, и/или внеклеточный домен каждого или обоих, и/или ингибирует иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленной в SEQ ID NO:159 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9, или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно SEQ ID NO:159, где указанный полипептид имеет способность связывать CD80 и/или CD86 и/или внеклеточный домен каждого, и/или имеет способность подавлять или ингибировать иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, имеющую (i), по меньшей мере, 95%, 96%, 97%, 98%, 99%, или 100% идентичность к аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73, где полипептид связывает hCD80 и/или hCD86 или его ВКД и/или ингибирует иммунный ответ, где указанная аминокислотная замена необязательно включает S70F, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует рекомбинантный димер полипептида, включающий два полипептида, где каждый такой полипептид включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность к последовательности, выбранной из группы, включающей SEQ ID NOS:1-73, где димер связывает hCD80 и/или hCD86 и/или ингибирует иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует слитый белок, включающий (а) полипептид, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (b) Ig полипептид, где слитый белок связывает CD80 и/или CD86, и/или имеет способность подавлять иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, представленной в SEQ ID NO:31 по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, один из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31 и где полипептид связывает CD80 и/или CD86, и/или ингибирует иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение обеспечивает вектор экспрессии, включающий: (i) первую полинуклеотидную последовательность, которая кодирует первый полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где указанный первый полипептид связывает человеческий CD86 и/или человеческий CD80, и/или внеклеточный домен каждого или обоих, и/или подавляет иммунный ответ, и (ii) вторую полинуклеотидную последовательность, которая кодирует второй полипептид, включающий шарнир, полипептид СН2 домена и СН3 домена иммуноглобулина (Ig), причем Ig полипептид необязательно является человеческим IgG2 Fc полипептидом.
В другом аспекте данное изобретение обеспечивает изолированную или рекомбинантную клетку-хозяина, трансфектированную с нуклеиновой кислотой, кодирующей слитый белок, причем нуклеиновая кислота включает: (i) первую нуклеотидную последовательность, кодирующую первый полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где указанный первый полипептид имеет способность связывать человеческий CD86 и/или человеческий CD80 и/или внеклеточный домен каждого или обоих, и/или имеет способность подавлять иммунный ответ; и (ii) вторую нуклеотидную последовательность, кодирующую второй полипептид, включающий шарнир, полипептид СН2 домена и СН3 домена иммуноглобулина (Ig), причем Ig полипептид необязательно является человеческим IgG2 Fc полипептидом, где клетка-хозяин способна экспрессировать слитый белок.
В другом аспекте данное изобретение обеспечивает способ подавления иммунного ответа, где указанный способ включает контакт В7-позитивной клетки с эффективным количеством, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки согласно изобретению, чтобы подавлять иммунный ответ, где иммунный ответ, таким образом, подавляется.
В другом аспекте данное изобретение обеспечивает способ модулирования взаимодействия Т-клеток, экспрессирующих CD28 и/или CTLA-4, с В7-позитивными клетками, где способ включает контакт В7-позитивных клеток с эффективным количеством, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки по данному изобретению, чтобы модулировать взаимодействие В7-позитивных клеток с CD28-позитивными Т-клетками и/или CTLA-4-позитивными Т-клетками, где модулируется взаимодействие В7-позитивных клеток с CD28-позитивными Т-клетками и/или CTLA-4-позитивными Т-клетками.
В другом аспекте данное изобретение обеспечивает способ ингибирования взаимодействия CD28-позитивных Т-клеток и/или CTLA-4-позитивных Т-клеток с В7- позитивными клетками, где способ включает контакт B7-позитивных клеток с эффективным количеством, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки согласно изобретению, где ингибируется взаимодействие CD28-позитивных Т-клеток и/или CTLA-4-позитивных Т-клеток с В7-позитивными клетками.
В другом аспекте данное изобретение обеспечивает способ ингибирования взаимодействия СВ28-позитивных Т-клеток с В7-позитивными клетками у субъекта, где указанный способ включает введение субъекту эффективного количества, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки согласно изобретению, где ингибируется взаимодействие эндогенных CD28-позитивных Т-клеток с эндогенными В7-позитивными клетками у субъекта.
В другом аспекте данное изобретение обеспечивает способ лечения субъекта, имеющего заболевание или нарушение иммунной системы, опосредованный путем взаимодействия эндогенных Т-клеток с эндогенными клетками, экспрессирующими CD80 и/или CD86, где указанный способ включает введение субъекту, который нуждается в таком лечении, терапевтически эффективного количества, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки согласно изобретению, где взаимодействие(я) между эндогенными Т-клетками и эндогенными клетками, экспрессирующими указанный CD80 и/или указанный CD86, ингибируется, таким образом, проводя лечение иммунного заболевания или нарушения у субъекта.
В другом аспекте данное изобретение обеспечивает способ ингибирования отторжения ткани или органа, трансплантированного от донора к субъекту-реципиенту, где способ включает введение субъекту-реципиенту, который в этом нуждается, терапевтически эффективного количества, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки согласно изобретению, таким образом, ингибируя отторжение ткани или органа, трансплантированного субъекту-реципиенту.
В другом аспекте данное изобретение обеспечивает способ получения слитого белка, где способ включает: (1) культивирование клетки-хозяина, трансформированной с нуклеиновой кислотой в клеточной среде, где нуклеиновая кислота включает (i) первую нуклеотидную последовательность, которая кодирует полипептид, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность к аминокислотной последовательности любой из SEQ ID NOS:1-73, где полипептид связывает CD86 и/или CD80, и/или внеклеточный домен каждого CD86 или CD80, и (ii) вторую нуклеотидную последовательность, кодирующую Ig полипептид, включающую шарнир, СН2 домен и СН3 домен, где экспрессируется нуклеиновая кислота и производится слитый белок; и (2) восстановление слитого белка.
Также обеспечивается способ получения полипептида, включающий введение в популяцию клеток нуклеиновой кислоты согласно изобретению, где нуклеиновая кислота функционально связана с регуляторной последовательностью, эффективной для получения полипептида, закодированного нуклеиновой кислотой; культивирование клеток в клеточной среде для получения полипептида; и выделение полипептида из клеток или клеточной среды.
Также обеспечиваются композиции, которые включают молекулу согласно изобретению (например, мутантную молекулу CTLA-4) и наполнитель, носитель или растворитель. Также обеспечиваются фармацевтические композиции, включающие молекулу согласно изобретению и фармацевтически приемлемый наполнитель, носитель или растворитель.
Дополнительные аспекты изобретения описаны ниже.
Краткое описание фигур
Фигура 1 представляет собой схематическое изображение плазмидного вектора экспрессии рКДНК мутантного CTLA-4-Ig, который включает нуклеотидную последовательность, кодирующую мутантный слитый белок CTLA-4-Ig. На фигуре 1 каждый мутантный слитый белок CTLA-4-Ig включает мутантный полипептид CTLA-4 ВКД согласно изобретению, слитый на его С-конце с N-концом человеческого IgG2 (hIgG2) Fc полипептида.
Фигуры 2A-2D представляют собой схематические изображения примеров слитых белков hCD80-Ig, hCD86-Ig, LEA29Y-Ig и hCTLA-4-IgG2 соответственно. Сигнальный пептид, внеклеточный домен (ВКД), линкер (при его наличии) и Ig Fc домен каждого слитого белка показаны схематически. Также показаны аминокислотные остатки, присутствующие в местах соединения между сигнальным пептидом, ВКД, линкером (при его наличии) и Ig Fc. Сигнальный пептид каждого слитого белка обычно отщепляется при процессинге и, таким образом, секретируемый (зрелый) слитый белок обычно не содержит последовательность сигнального пептида. Фигура 2D представляет собой схематическое изображение слитого белка человеческого CTLA-4-IgG2 ("hCTLA-4-IgG2"), включающего внеклеточный домен человеческого CTLA-4 ("hCTLA-4 ВКД"), ковалентно слитый на его С-конце с N-концом полипептида человеческого IgG2. Предположительная аминокислотная последовательность этого слитого белка hCTLA-4-IgG2 показана в SEQ ID NO:161 и включает следующие сегменты: сигнальный пептид hCTLA-4 (аминокислотные остатки 1-37), hCTLA-4 ВКД полипептид (аминокислотные остатки 38-161) и полипептид человеческого IgG2 Fc (аминокислотные остатки 162-389). Ни один линкер (например, ни одна аминокислота(ы)) не включен между С-концом полипептида hCTLA-4 ВКД и N-концом человеческого IgG2 Fc. Полипептид человеческого IgG2 Fc включает шарнирную область, СН2 домен и СНЗ домен человеческого IgG2. На фигуре 2D показаны аминокислотные остатки в местах соединения между этими различными сегментами. Специфически показаны последние четыре аминокислотных остатка сигнального пептида, первые пять и последние пять аминокислотных остатка полипептида hCTLA-4 ВКД и первые пять и последние пять аминокислотных остатка полипептида человеческого IgG2 Fc.
Сигнальный пептид обычно отщепляется в ходе процессинга и, таким образом, секретируемый слитый белок (зрелый слитый белок) hCTLA-4-IgG2 обычно не содержит последовательность сигнального пептида. Аминокислотная последовательность зрелой или секретируемой формы этого слитого белка hCTLA-4-IgG2 показана в SEQ ID NO:162. Последовательность полипептида hCTLA- 4 ВКД включает аминокислотные остатки 1-124 SEQ ID NO:162, и последовательность полипептида человеческого IgG2 Fc включает аминокислотные остатки 125-352 SEQ ID NO:162. В другом аспекте этот зрелый слитый белок hCTLA-4 Ig не включает С-терминальный лизиновый (К) остаток и, таким образом, включает аминокислотные остатки 1-351 SEQ ID NO:162.
Зрелый слитый белок hCTLA-4-IgG2, который имеет в целом 352 аминокислоты, включает аминокислотные остатки 38-389 аминокислотной последовательности полноразмерного белка ДТ hCTLA-4, представленного в SEQ ID NO:160, и начинается с аминокислотной последовательности: метионин-гистидин-валин-аланин. При необходимости аминокислоты зрелой формы нумеруются, начиная с Met (метионин) последовательности Met-His-Val-Ala, определяя Met как первый остаток (например, ВКД включает аминокислотные остатки, пронумерованные 1-124), как в SEQ ID NO:162. Зрелый димер hCTLA-4IgG2 является формой слитого белка, который обычно используют в анализах примеров, описанных ниже, если не установлено иначе. ДНК (дезоксирибонуклеиновая кислота) последовательность, кодирующая слитый белок hCTLA-4-IgG2, которая включает hCTLA-4 ВКД, слитый с hIgG2 Fc полипептидом, показана в SEQ ID NO:163.
Фигура 3 представляет SDS/PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) анализы следующих белков: маркеры молекулярного веса различной массы (килодальтоны (кДа) (полоса 1); иллюстративный мутантный слитый белок CTLA- 4-Ig по данному изобретению на основе клона D3 (а именно, D3-IgG2) (полоса 2); иллюстративный мутантный слитый белок CTLA-4-Ig на основе клона D4 (а именно D4-IgG2) (полоса 3); и Orencia® (Абатацепт) слитый белок (полоса 4) (Bristol-Myers Squibb Co., Princeton, NJ).
Фигура 4 представляет профиль элюции иллюстративного мутантного слитого белка CTLA-4-Ig по данному изобретению (а именно D3-IgG2) из SEC (эксклюзионная хроматография) анализа, показывающего, что мутантные слитые белки CTLA-4-Ig по данному изобретению являются однородными по размеру после очищения от случайно-трансфектированных COS клеток.
Фигура 5 показывает типичный Biacore™ анализ связывания следующих слитых белков с hCD86-Ig: Orencia® слитый белок, LEA29Y-Ig и D3-IgG2. Фаза диссоциации анализа начинается в момент времени, помеченный стрелкой. Orencia® слитый белок, который образован полипептидом человеческого дикого типа CTLA-4 ВКД, слитым с полипептидом мутантного домена IgGI Fc, который эффективно служит как контроль человеческого дикого типа CTLA-4-Ig. Мутантный слитый белок CTLA-4-Ig по данному изобретению, такой как D3- IgG2, который имеет более высокую авидность связывания с CD86-Ig, чем слитый белок Orencia®, имеет более медленную скорость диссоциации от CD86-Ig, чем белок Orencia®.
Фигура 6 является графическим изображением результатов анализа ингибирования пролиферации МПК (мононуклеары периферической крови) (со стимуляцией антитела против CD3), включающего иллюстративные мутантные слитые белки CTLA-4-Ig по данному изобретению (D3-04-IgG2, D3-1 1-IgG2, D3-12-IgG2, D3-14-IgG2). Эти анализы показывают, что мутантные слитые белки CTLA-4-Ig по данному изобретению значительно сильнее, чем Orencia® и LEA29Y-Ig в ингибировании Т-клеточной пролиферации in vitro.
Фигура 7 является графическим изображением анализов ингибирования CD4+ Т-клеточной пролиферации (с анти-CD3 стимуляцией и hB7,2-зависимой костимуляцией), включающих иллюстративные группы мутантных слитых белков CTLA-4-Ig по данному изобретению. Слитые белки Orencia® и LEA29Y-Ig включены как контроль для сравнения.
Фигура 8 является графическим изображением анализов ингибирования пролиферации МПК (с PPD (очищенный белковый дериват) антигенной стимуляцией), включающих иллюстративные группы мутантных слитых белков CTLA-4-Ig по данному изобретению. Orencia® и LEA29Y-Ig включены как контроли для сравнения.
Фигура 9 является графическим изображением анализов ингибирования пролиферации односторонней реакции смешанной культуры лимфоцитов (СКЛ-реакция), включающих иллюстративный мутантный слитый белок CTLA-4-Ig по данному изобретению - D3-IgG2. Слитые белки Orencia® и LEA29Y-Ig включены как контроли для сравнения.
Фигура 10 представляет собой схематическое изображение, показывающее структуру иллюстративного мутантного слитого белка CTLA-4-Ig по данному изобретению. Два идентичных мономерных мутантных слитых белка CTLA-4-Ig показаны схематически, причем каждый включает зрелый мутантный CTLA-4 ВКД, слитый на его С-конце с N-концом полипептида человеческого IgG2 Fc. Каждый полипептид человеческого IgG2 включает IgG2 шарнирную область, СН2 домен и СН3 домен. Также показаны иллюстративные аминокислотные остатки, присутствующие в местах соединения между ВКД и полипептида Ig Fсми. Аминокислотные остатки в местах соединения между этими компонентами могут отличаться в зависимости от аминокислотной последовательности мутантного CTLA-4 ВКД и/или аминокислотной последовательности Ig. Димерный слитый белок получают в результате формирования, по меньшей мере, одной дисульфидной связи между остатками цистеина в аналогичных положениях в двух мономерах. Цистеиновые (С) остатки, которые потенциально включены в формирование дисульфидных связей между двумя мономерами, обозначены звездочкой. Сигнальный пептид каждого мономерного слитого белка обычно отщепляется в ходе процессинга, и поэтому секретируемый (зрелый) слитый белок обычно не содержит последовательность сигнального пептида.
Фигура 11 является графическим изображением анализов CD4+ Т-клеточной пролиферации (с анти-CD3 стимуляцией и hB7,2-зависимой костимуляцией), включающих слитые белки hCTLA-4-IgG2, Orencia® и LEA29Y-Ig.
Фигуры 12A-12F представляют выравнивание аминокислотной последовательности внеклеточного домена дикого типа человеческого CTLA-4 (обозначенного на фигуре как "hCTLА4ВКД"), аминокислотной последовательности полипептида LEA29Y (обозначенного на фигуре как "LEA29YВКД") и аминокислотных последовательностей иллюстративных мутантных полипептидов CTLA-4 ВКД по данному изобретению. Названия клонов этих мутантных полипептидов CTLA-4 ВКД по данному изобретению определены слева. Аминокислотные остатки, которые идентичны таковым в человеческом CTLA-4 ВКД дикого типа, определены с периодом (.).
Фигура 13 представляет BLOSUM62 (на белках со средним уровнем сходства 62% попарно) матрицу.
Фигуры 14A-14D показывают иллюстративные выравнивания и показатели выравнивания, определенные путем вычисления вручную для двух аминокислотных последовательностей.
Фигуры 15А-15В показывают фармакокинетические (ФК) профили для слитого белка Orencia®, человеческого CTLA-4-IgG2 и типичных мутантных слитых белков CTLA-4-IgG2 по данному изобретению, введенных в дозе 1 мг/кг отдельного (А) внутривенного (ВВ) болюса или (В) подкожной (ПК) инъекции у крыс.
Подробное описание изобретения
Определения
Также должно быть понятно, что терминология, используемая в данном описании, применяется только с целью описания конкретных вариантов осуществления и не подразумевается для ограничения объема изобретения. Кроме тех, что определены отдельно, все технические и научные выражения, используемые в данном описании, имеют такие же значения, какие обычно понимают специалисты в области, к которой принадлежит данное изобретение.
Выражения "нуклеиновая кислота" и "полинуклеотид" используются взаимозаменяемо для обозначения полимера остатков нуклеиновых кислот (например, дезоксирибонуклеотиды или рибонуклеотиды) или в одно- или двухцепочечной форме. Кроме специфически ограниченных, выражения включают нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют свойства связывания, сходные с эталонной нуклеиновой кислотой, и метаболизируются способом, сходным для нуклеотидов, встречающихся в природе. Если не указано особо, конкретная последовательность нуклеиновой кислоты также полностью включает ее консервативно модифицированные варианты (например, замены вырожденного кодона) и комплементарные нуклеотидные последовательности, также как и последовательность точно определены. Специфически, замены вырожденного кодона могут достигаться путем образования последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено остатками смешанных, оснований и/или дезоксиинозиновыми остатками (Batzer et al., Nucleic acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605 2608 (1985); и Cassol et al. (1992); Rossolini et al., Mol. Cell. Probes 8:91 98 (1994)). Выражение нуклеиновая кислота или полинуклеотид используется взаимозаменяемо с кДНК или мРНК, кодируемыми геном.
Выражение "ген" в широком смысле относится к любому сегменту нуклеиновой кислоты (например, ДНК), связанному с биологической функцией. Ген может включать кодирующую последовательность и/или регуляторную последовательность, необходимую для его экспрессии. Ген может также включать неэкспрессированный сегмент(ы) нуклеиновой кислоты ДНК, который, например, формирует последовательности распознавания для другого белка(ов) (например, промотор, энхансер или другой регуляторный участок). Ген может быть получен из различных источников, включая клонирование из источника, представляющего интерес, или синтезирование из известного или предполагаемого источника информации о последовательности, и может включать одну или несколько последовательностей, разработанных так, что они имеют необходимые параметры.
Выражения "полипептид," "пептид" и "белок" используются взаимозаменяемо для обозначения полимера аминокислотных остатков. Выражения применяются к аминокислотным полимерам, в которых один или несколько аминокислотных остатков являются синтетическими химическими миметиками соответствующей аминокислоты, встречающейся в природе, а также относится к полимерам аминокислот, встречающихся в природе и полимерам аминокислот, не встречающихся в природе. Как используется в данном описании, выражения включают аминокислотные цепи любой длины, включая полноразмерные белки (а именно, антигены), где аминокислотные остатки связаны ковалентными пептидными связями.
Нумерация данного аминокислотного полимера или полимер нуклеиновой кислоты "соответствует" или "относится к" нумерации выбранного аминокислотного полимера или полимера нуклеиновой кислоты, когда положение любого компонента данного полимера (например, аминокислота, нуклеотид, которые также называются в общем "остаток") определяется путем соотнесения с таким же или эквивалентным положением в выбранной аминокислоте или полимере нуклеиновой кислоты, скорее, чем действительным нумерационным положением компонента в данном полимере. Таким образом, например, нумерация данного аминокислотного положения в данной аминокислотной последовательности соответствует такому же или эквивалентному аминокислотному положению в выбранной аминокислотной последовательности, которая используется как эталонная последовательность.
"Эквивалентное положение" (например, "эквивалентное положение аминокислоты", или "эквивалентное положение нуклеиновой кислоты", или "эквивалентное положение остатка") определяется здесь как положение (такое как положение аминокислоты, или положение нуклеиновой кислоты, или положение остатка) анализируемой аминокислотной (или анализируемой полинуклеотидной) последовательности, которая выравнивается с соответствующим положением эталонной аминокислотной (или эталонной полинуклеотидной) последовательности, когда используется выровненная (преимущественно оптимально выровненная) в алгоритме выравнивания, как описано в данном описании. Не нужно, чтобы эквивалентное аминокислотное положение анализируемой аминокислотной последовательности имело такой же номер положения, как соответствующее положение анализируемого полипептида. Подобно эквивалентное положение нуклеиновой кислоты анализируемой полинуклеотидной последовательности не должно иметь такой же номер положения, как соответствующее положение анализируемого полинуклеотида.
"Мутантный" полипептид включает аминокислотную последовательность, которая отличается по одному или нескольким аминокислотным остаткам от аминокислотной последовательности исходного или эталонного полипептида (такого как, например, аминокислотная последовательность дикого типа (ДТ)). В одном аспекте мутантный полипептид включает аминокислотную последовательность, которая отличается от аминокислотной последовательности исходного или эталонного полипептида на от около 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 20%, 30% 40%, 50% или больше общего числа остатков исходной или эталонной аминокислотной последовательности. В другом аспекте мутантный полипептид включает аминокислотную последовательность, которая имеет, по меньшей мере, около 50%, 60%, 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичность последовательности с аминокислотной последовательностью исходного или эталонного полипептида. В другом аспекте мутантный полипептид включает аминокислотную последовательность, которая отличается от аминокислотной последовательности исходного или эталонного полипептида по от 1 до 100 или больше аминокислотным остаткам (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше аминокислотным остаткам). Мутантный полипептид может включать аминокислотную последовательность, которая отличается от аминокислотной последовательности исходного или эталонного полипептида путем, например, делеции, дополнения или замены одного или нескольких аминокислотных остатков (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше аминокислотных остатков) исходного или эталонного полипептида или любых комбинаций такой делеции(й), дополнения(й) и/или замены(замен). Эталонный или исходный полипептид может сам быть мутантным полипептидом.
"Мутантная" нуклеиновая кислота включает нуклеотидную последовательность, которая отличается по одному или нескольким остаткам нуклеиновой кислоты от нуклеотидной последовательности исходной или эталонной нуклеиновой кислоты (такая как нуклеиновая кислота ДТ). В одном аспекте мутантная нуклеиновая кислота включает нуклеотидную последовательность, которая отличается от нуклеотидной последовательности исходной или эталонной нуклеиновой кислоты по от около 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 20%, 30% 40%, 50% или больше общего числа остатков исходной или эталонной нуклеотидной последовательности. В другом аспекте мутантная нуклеиновая кислота включает нуклеотидную последовательность, которая имеет, по меньшей мере, около 50%, 60%, 70%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентичность последовательности с нуклеотидной последовательностью исходной или эталонной нуклеиновой кислоты. В другом аспекте мутантная нуклеиновая кислота включает нуклеотидную последовательность, которая отличается от нуклеотидной последовательности исходной или эталонной нуклеиновой кислоты по от 1 до 100 или больше нуклеотидным остаткам (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше нуклеотидным остаткам). Мутантная нуклеиновая кислота может включать нуклеотидную последовательность, которая отличается от такой исходной или эталонной нуклеиновой кислоты путем, например, делеции, дополнения или замены одного или нескольких нуклеотидных остатков (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше нуклеотидных остатков) исходной или эталонной нуклеиновой кислоты, или любой комбинации такой делеции(й), дополнения(й) и/или замены(замен). Мутация в нуклеиновой кислоте может быть также результатом альтернативного сплайсинга или отсечения нуклеотидов или ошибок в процессинге или отщеплении нуклеотидов. Эталонная или исходная нуклеиновая кислота может сама быть мутантной нуклеиновой кислотой.
"Встречающийся в природе", применяемый к объекту, означает, что объект можно обнаружить в природе, что отличается от того, что синтетически производится человеком. "Не встречающийся в природе", применяемый к объекту, означает, что объект не встречается в природе (а именно, что объект не может быть обнаружен в природе). Например, не встречающийся в природе полипептид относится к полипептиду, который создан человеком, такой как, например, синтезированный in vitro или приготовленный искусственно.
"Подпоследовательность" или "фрагмент" последовательности, которая представляет интерес, является любой частью целой последовательности до целой последовательности, которая представляет интерес, но не включая ее.
Нуклеиновая кислота, белок или другой компонент является "изолированным", когда он частично или полностью отделен от компонентов, с которыми он в нормальных условиях соединен (другие белки, нуклеиновые кислоты, клетки, синтетические реагенты и т.п.). В молярном отношении изолированные виды более многочисленны, чем другие виды в композиции. Например, изолированные виды могут включать, по меньшей мере, около 50%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% (в молярном отношении) всех присутствующих макромолекулярных видов. Преимущественно виды, представляющие интерес, очищают до полной гомогенности (а именно загрязняющие виды не должны определяться в композиции традиционными способами определения). Чистота и гомогенность могут определяться с применением методов, известных в этой области техники, таких как электрофорез в агарозном или полиакриламидном геле образца белка или нуклеиновой кислоты, с последующей визуализацией путем окрашивания. При необходимости для очищения материала может использоваться метод с высоким разрешением, такой как высокоэффективная жидкостная хроматография (ВЭЖХ), или подобные методы.
Выражение "очищенный", применяемый к нуклеиновым кислотам или полипептидам, в общем обозначает нуклеиновую кислоту или полипептид, который полностью свободен от других компонентов, что определяется аналитическими методами, хорошо известными в области техники (например, очищение отдельных полос полипептидных или полинуклеотидных форм на электрофоретическом геле, хроматографическом элюате и/или посредством центрифугирования в градиенте плотности). Например, нуклеиновая кислота или полипептид, которые разгоняются только по одной полосе в электрофоретическом геле, являются "очищенными." Очищенная нуклеиновая кислота или полипептид имеют, по меньшей мере, около 50% чистоты, обычно, по меньшей мере, около 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,6%, 99,7%, 99,8% или более чистоты (например, процент по весу в молярном отношении).
В том же смысле изобретение обеспечивает способы обогащения композиций одной или несколькими молекулами по данному изобретению, такими как один или несколько полипептидов или полинуклеотидов по данному изобретению. Композиция обогащена молекулой, когда имеет место существенное возрастание концентрации молекулы после применения метода очищения или обогащения. Существенно чистый полипептид или полинуклеотид будет обычно содержать, по меньшей мере, около 55%, 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98, 99%, 99,5% или более по весу (в молярном отношении) всех макромолекулярных видов в конкретной композиции.
Нуклеиновая кислота или полипептид является "рекомбинантным", когда он синтезирован или сконструирован, или является производным от синтезированного или сконструированного белка или нуклеиновой кислоты.
Выражение "рекомбинантный", используемый по отношению к клетке, обычно означает, что клетка реплицирует гетерологичную нуклеиновую кислоту или экспрессирует полипептид, кодируемый гетерологичной нуклеиновой кислотой. Рекомбинантные клетки включают гены, которые не обнаруживаются в нативной (нерекомбинантной) форме клетки. Рекомбинантные клетки также включают те клетки, которые включают гены, которые обнаруживаются в нативной форме клетки, но модифицированы и заново встроены в клетку искусственными способами. Выражение также включает клетки, которые включают нуклеиновую кислоту эндогенную для клетки, которая модифицирована без удаления нуклеиновой кислоты из клетки; такие модификации включают те, что получены путем перемещения гена, сайт-специфической мутации и с помощью подобных методов, известных специалистам в данной области техники. Рекомбинантная ДНК методика включает методики для получения рекомбинантной ДНК in vitro и перенесения рекомбинантной ДНК в клетки, где она может экспрессироваться или репродуцироваться, тем самым, производя рекомбинантный полипептид.
"Кассета рекомбинантной экспрессии" или просто "кассета экспрессии" представляет собой конструкт нуклеиновой кислоты, образованный рекомбинантно или синтетически, с элементами нуклеиновой кислоты, которые способны осуществлять экспрессию структурного гена в хозяинах, совместимых с такой последовательностью. Кассеты экспрессии включают, по меньшей мере, промоторы и необязательно сигналы терминации транскрипции. Типично, кассета рекомбинантной экспрессии включает нуклеиновую кислоту, которую нужно транскрибировать (например, нуклеиновую кислоту, кодирующую необходимый полипептид) и промотор. Дополнительные факторы, которые необходимы или помогают в осуществлении экспрессии, также могут использоваться, как описано в данном описании. Например, кассета экспрессии может также включать нуклеотидные последовательности, которые кодируют сигнальную последовательность, которая направляет секрецию экспрессированного белка из клетки-хозяина. Сигналы терминации транскрипции, энхансеры и другие последовательности нуклеиновой кислоты, которые влияют на генную экспрессию, могут быть также включены в кассету экспрессии.
"Экзогенная" нуклеиновая кислота", "экзогенный ДНК сегмент", "гетерологичная последовательность" или "гетерологичная нуклеиновая кислота", как используются в данном описании, представляют собой те, которые имеют источник происхождения, чужеродный по отношению к конкретной клетке-хозяину, или, если они из того же источника, модифицированы по отношению к исходной форме. Таким образом, гетерологичный ген в клетке-хозяине включает ген, который является эндогенным к конкретной клетке-хозяину, но модифицированный. Модификация гетерологичной последовательности в применениях, описанных здесь, обычно осуществляется путем применения направленных методов молекулярной эволюции. Таким образом, выражения относятся к ДНК сегменту, который является чужеродным или гетерологичным к клетке, или гомологичный к клетке, но в положении внутри нуклеиновой кислоты клетки-хозяина, в котором элемент не находится обычно. Экзогенные нуклеиновые кислоты или экзогенная ДНК экспрессируются для получения экзогенных полипептидов.
"Вектор" может быть любым агентом, способным доставлять или удерживать нуклеиновую кислоту в клетке-хозяине и включает, например, но не ограничивается следующим: плазмиды (например, ДНК плазмиды), оголенные нуклеиновые кислоты, вирусные векторы, вирусы, нуклеиновые кислоты в комплексе с одним или несколькими полипептидами или другими молекулами, а также нуклеиновые кислоты, иммобилизированные на твердофазных частицах. Векторы детально описаны ниже. Вектор может применяться как агент для доставки или удержания экзогенного гена и/или белка в клетке-хозяине. Вектор может быть способным трансдуцировать, трансфектировать или трансформировать клетку, тем самым, приводя к тому, что клетка реплицирует или экспрессирует нуклеиновые кислоты и/или белки, отличные от нативных для клетки или способом, не нативным для клетки. Вектор может включать материалы для того, чтобы способствовать проникновению нуклеиновой кислоты в клетку, такие как вирусная частица, липосома, белковая оболочка или подобное. Может использоваться любой способ переноса нуклеиновой кислоты в клетку; если не указано особо, выражение вектор не подразумевает ни одного конкретного способа доставки нуклеиновой кислоты в клетку или подразумевает, что любой конкретный тип клеток является субъектом трансдукции. Данное изобретение не ограничивается каким-либо специфическим вектором для доставки или удержания любой нуклеиновой кислоты по данному изобретению, включая, например, нуклеиновую кислоту, кодирующую мутантный полипептид CTLA-4 по данному изобретению или его фрагмент (например, мутантный CTLA-4 ВКД), который связывает CD80 и/или CD86 или его фрагмент (например, CD80 ВКД или CD86 ВКД).
Выражение "вектор экспрессии" обычно относится к конструкту нуклеиновой кислоты или последовательности, образованной рекомбинантно или синтетически, с видами специфических элементов нуклеиновой кислоты, которые разрешают транскрипцию конкретной нуклеиновой кислоты в клетке-хозяине. Вектор экспрессии обычно включает нуклеиновую кислоту, которую нужно транскрибировать, функционально связанную с промотором. Выражение "экспрессия" включает любой этап, включенный в продукцию полипептида, включая, но, не ограничиваясь этим, транскрипцию, пост-транскрипционную модификацию, трансляцию, посттрансляционную модификацию и/или секрецию.
"Сигнальный пептид" - это пептидная (или аминокислотная) последовательность, которая обычно предшествует полипептиду, представляющему интерес, и транслируется вместе с полипептидом и направляет или облегчает доступ полипептида к секреторной системе. Сигнальный пептид обычно ковалентно прикреплен или слит с амино-концом полипептида, представляющего интерес, и облегчает секрецию полипептида, представляющего интерес, из клетки-хозяина. Сигнальный пептид обычно отщепляется от полипептида, представляющего интерес, после трансляции.
Выражение "кодирующий" относится к способности нуклеотидной последовательности кодировать одну или несколько аминокислот. Выражение не требует старт- или стоп-кодона. Аминокислотная последовательность может кодироваться в любой из шести различных рамок считывания, обеспеченных полинуклеотидной последовательностью и ее комплементом.
Выражение "контрольная последовательность", как обозначено в данном описании, включает все компоненты, которые необходимы или являются преимущественными для экспрессии полипептида по данному изобретению. Каждая контрольная последовательность может быть нативной или чужеродной по отношению к нуклеотидной последовательности, кодирующей полипептид. Такая контрольная последовательность включает, но не ограничивается следующим, лидерную последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. Минимально контрольная последовательность включает промотор и транскрипционный и трансляционный стоп-сигналы. Контрольные последовательности могут обеспечиваться линкерами с целью встраивания специфических сайтов рестрикции, которые облегчают лигирование контрольных последовательностей с кодирующим участком нуклеотидной последовательности, кодирующей полипептид.
Выражение "кодирующая последовательность" относится к нуклеотидной последовательности, которая точно обозначает аминокислотную последовательность ее белкового продукта. Границы кодирующей последовательности в целом определяются с помощью открытой рамки считывания (ОРС), которая может начинаться с ATG старт-кодона.
Нуклеиновая кислота является "функционально связанной" с другой последовательностью нуклеиновой кислоты, когда она находится в функциональном взаимодействии с другой последовательностью нуклеиновой кислоты. Например, промотор или энхансер функционально связан с кодирующей последовательностью, если он направляет транскрипцию кодирующей последовательности. Функционально связанный означает, что ДНК последовательности, которые связаны, являются обычно перекрывающимися и, если необходимо объединить два участка, кодирующих белок, то перекрывающиеся и в рамке считывания. Тем не менее так как энхансеры в целом функционируют, когда они отделены от промотора несколькими тысячами пар нуклеотидов и интронные последовательности могут быть разной длины, то некоторые полинуклеотидные элементы могут быть функционально связанными, но не перекрывающимися.
"Клетка-хозяин" - это любая клетка, которая пригодна для трансформации с нуклеиновой кислотой.
"По сути, полная длина полинуклеотидной последовательности" или "по сути, полна длина аминокислотной последовательности" относится к, по меньшей мере, около 50%, 60%, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или больше длины полинуклеотидной последовательности или аминокислотной последовательности соответственно.
"Антиген" относится к веществу, которое реагирует с продуктом(ами) иммунного ответа, стимулированного специфическим иммуногеном. Смотри, например, JULIUS CRUSE ET AL., ATLAS OF IMMUNOLOGY 60 (1999); RICHARD COICO ET AL., IMMUNOLOGY: SHORT COURSE 27-30 (5th ed. 2003). Иммунный ответ может включать гуморальный ответ и/или клеточно-опосредованный иммунный ответ (например, цитотоксические Т лимфоциты (ЦЛТ)). Продукты иммунного ответа могут включать антитела и/или ЦЛТ. Антигены - это обычно макромолекулы (например, полипептиды, нуклеиновые кислоты, сложные углеводороды, фосфолипиды, полисахариды), которые являются чужеродными для хозяина; та часть антигена, которая известна как антигенная детерминанта, реагирует с (например, связывается с) продуктом(ами) иммунного ответа, такими как антитело или специфический Т-клеточный рецептор на Т лимфоците. Антиген может, но не обязательно, вызывать иммунный ответ, а также реагировать с продуктом(ами) иммунного ответа. "Антигенность" обозначает состояние или свойство быть антигенным - а именно иметь свойства антигена. Специфичность антигена может быть показана в отношении антигена к его антителу или наоборот; антиген обычно реагирует с высокой специфичностью к его соответствующему антителу и не с той же степенью специфичности с другими антителами, возникающими в ответ на иммуноген. "Антигенное количество" - это количество антигена, которое видимо реагирует с продуктом(ами) иммунного ответа, стимулированным(и) специфическим иммуногеном.
"Иммуноген" - это вещество, которое способно вызывать иммунный ответ скорее, чем иммунологическую толерантность. Смотри, например, JULIUS CRUSE ET AL., выше на 60-61; RICHARD COICO, выше на 27-30. Иммуногены также реагируют с (например, связываются с) продуктом(ами) вызванного иммунного ответа, который был вызван специфически против них. Таким образом, все иммуногены являются антигенами. "Иммуногенность" относится к состоянию или свойству быть иммуногенным - а именно иметь свойства иммуногена. "Иммуногенное количество" - это количество иммуногена, которое эффективно, чтобы вызвать видимый иммунный ответ. Иммуноген может вызывать сильный иммунный ответ у субъекта, такой как, по меньшей мере, частичный или полный защитный иммунитет к, по меньшей мере, одному патогену.
"Иммуномодулятор" или "иммуномодуляторная" молекула, такая как иммуномодуляторный полипептид или нуклеиновая кислота, модулирует иммунный ответ. Под "модуляция" или "модулирующий" иммунный ответ подразумевается, что иммунный ответ изменяется. Например, "модуляция" или "модулирующий" иммунный ответ у субъекта в целом означает, что иммунный ответ стимулируется, вызывается, ингибируется, снижается, подавляется, увеличивается, усиливается или изменяется другим образом у субъекта. Такая модуляция иммунного ответа может достигаться способами, известными для специалистов в данной области техники, включая те, что описаны ниже. "Иммуносупрессор" или "иммуносупрессант" - это молекула, такая как полипептид или нуклеиновая кислота, которая подавляет иммунный ответ.
Как используется в данном описании, "антитело" (сокращенно "AT") относится к иммуноглобулиновому белку (сокращенно "Ig"), природному или полностью или частично синтетически полученному. Выражение включает все его производные, которые поддерживают специфическую связывающую способность к антигену. Выражение также включает любой белок, имеющий связывающий домен, который гомологичен или в большей степени гомологичен иммуноглобулиновому связывающему домену. Такие белки могут быть получены из природных источников, или быть частично или полностью синтетически полученными. Антитело может быть моноклональным или поликлональным. Антитело может быть членом любого класса иммуноглобулинов, включая любой из пяти человеческих классов: IgA (который включает подклассы IgA1 и IgA2), IgD, IgE, IgG (который включает подклассы IgG1, IgG2, IgG3 и IgG4) и IgM. Антитела включают парные тяжелые и легкие полипептидные цепи, и каждая такая цепь включает индивидуальные иммуноглобулиновые домены. Каждая цепь включает константную (С) область и вариабельную (V) область. Типичная структурная единица антитела включает тетрамер. Каждый тетрамер содержит две идентичные пары полипептидных цепей, причем каждая пара имеет одну "легкую" (около 25 кДа) и одну "тяжелую" цепь (около 50-70 кДа). Тяжелые цепи существуют в пяти главных типах (γ, µ, δ, α и ε) в зависимости от класса антитела и содержат около 450-600 аминокислотных остатков. Легкие цепи имеют два главных типа (λ и κ) и содержат около 230 аминокислотных остатков. В качестве примера IgG антитело представляет собой тетрамерный белок, включающий две тяжелые цепи и две легкие цепи. Каждая IgG тяжелая цепь содержит четыре иммуноглобулиновых домена, связанных в следующем порядке от N-конца до С-конца: VH-CH1-CH2-CH3 (также иногда сокращают как VH-CH 1-СН2-СН3). Эти сокращения относятся к вариабельному домену тяжелой цепи, константному домену 1 тяжелой цепи, константному домену 2 тяжелой цепи и константному домену 3 тяжелой цепи), соответственно. Тяжелая цепь может также обозначаться по классу антитела, такая как, например, Сγ1, которая представляет первый константный домен гамма (γ) тяжелой цепи IgG антитела. Каждая IgG легкая цепь включает два иммуноглобулиновых домена, связанных в следующем порядке от N- к С-концу: VH-CL, где VH и CL относится к вариабельному домену легкой цепи и константному домену легкой цепи соответственно.
Вариабельная область антитела, которая обычно включает около 100-110 или больше аминокислот на N-конце каждой полипептидной цепи, включает антиген связывающие детерминанты и, таким образом, является в первую очередь ответственной за распознавание антигена и специфичность. Наибольшая степень изменчивости аминокислотной последовательности между антителами обнаружена в вариабельной области. В основном изменчивость последовательности возникает в гипервариабельных участках (ГВУ), локализованных в вариабельной области. В целом существует шесть ГВУ, три ГВУ в каждой тяжелой цепи и три ГВУ в каждой легкой цепи, которые вместе формируют антигенсвязывающий сайт. ГВУ тяжелой цепи обозначаются как VH CDR1, VH CDR2, и VH CDR3, тогда как ГВУ легкой цепи обозначаются как VL CDR1, VL CDR2 и VL CDR3. Область, локализованная вне ГВУ, называется каркасная (КО) область. Каркасные области различных антител могут варьировать по аминокислотным остаткам, но степень аминокислотной изменчивости не больше той, которая существует между вариабельными областями различных антител. Во многих случаях каркасные области обеспечивают стабильную и постоянную основу для аминокислотного разнообразия, представленного ГВУ.
Выражение "фрагмент антитела" относится к любому производному антитела, которое меньше, чем полноразмерное антитело. Примеры фрагментов антитела включают, но не ограничивается следующим, например, антиген связывающий фрагмент (Fab), содержащий VH-CHI и VH-CL вариабельный фрагмент (Fv), содержащий VH и VL, одноцепочечный вариабельный фрагмент (scFv), содержащий VH и VL связанные вместе в одну цепь, а также другие фрагменты V области, такие как Fab', F(ab)2, F(ab')2, dsFv диатело, Fc и Fd полипептидные фрагменты. Смотри Scott, T.A. и Mercer, E.I., CONCISE ENCYCLOPEDIA: BIOCHEMISTRY AND MOLECULAR BIOLOGY (de Gruyter, 3d ed. 1997), и Watson, J.D. et al, RECOMBINANT DNA (2d ed. 1992) (далее под названием "Watson").
Фрагмент антитела может быть получен любыми способами, известными из области техники. Например, фрагмент антитела может быть ферментно или химически получен путем фрагментации интактного антитела, или он может быть рекомбинантно получен из гена, кодирующего частичную последовательность антитела. Например, фрагменты антител могут быть получены путем расщепления пептидазой. Например, пепсин расщепляет антитело ниже дисульфидных мостиков в шарнире для получения F(ab')2, димера Fab фрагмента, который представляет собой легкую цепь, соединенную с VH-CHI дисульфидной связью. F(ab')2 может уменьшаться при мягких условиях для разрыва дисульфидного мостика в шарнире, тем самым, превращая (Fab')2 димер в Fab' мономер. Fab' мономер является по сути Fab фрагментом с частью шарнира. Смотри FUNDAMENTAL IMMUNOLOGY, W.E. Paul, ed., Raven Press, N.Y. (1993) для более детального описания антител и фрагментов антитела. Так как различные фрагменты антитела обозначаются в выражениях интактного антитела, то специалисту в данной области должно быть понятно, что такие Fab' фрагменты могут быть синтезированы de novo, как химически, так и с использованием методики рекомбинантной ДНК. Таким образом, выражение также включает фрагменты антитела, либо полученные путем модификации целых антител, либо синтезированные de novo с использованием методик рекомбинантной ДНК.
Альтернативно, фрагмент антитела может быть полностью или частично получен синтетически. Фрагмент антитела может необязательно быть одноцепочечным фрагментом антитела. Альтернативно, фрагмент может включать несколько цепей, связанных вместе, например, дисульфидными мостиками. Фрагмент может также необязательно быть мультимолекулярным комплексом. Функциональный фрагмент антитела обычно включает, по меньшей мере, около 50 аминокислот и более типично, будет включать, по меньшей мере, около 200 аминокислот.
Область Fc или домен молекулы иммуноглобулина или антитела (также называемый как Ig Fc полипептид или Fc полипептид) соответствует в большей степени константной области тяжелой цепи иммуноглобулина и отвечает за различные функции, включая эффекторную(ые) функцию(и) антитела. Например, Ig Fc область IgG молекулы включает иммуноглобулиновые домены СН2 и СН3 и N-терминальный шарнир, ведущий к СН2. Шарнир - это часть тяжелой цепи между Fc и СН1, которая содержит дисульфид между тяжелыми цепями и связывает и придает гибкость молекуле антитела. Константные домены Fc области взаимодействуют с клетками иммунной системы. Fc рецепторы - это белки, которые связывают Fc область антител. Одно значительное семейство Fc рецепторов для класса антител IgG включает Fc гамма рецепторы (FcγR). Связывание антител с Fc рецепторами на клетках опосредует многие функции антител. Различные подклассы IgG проявляют различные аффинности для Fc гамма рецепторов. В целом, IgG1 и IgG3 связывают рецепторы с большей аффинностью, чем IgG2 и IgG4. Fc рецепторы экспрессируются на разных клетках, включая, например, В клетки, моноциты, дендритные клетки, нейтрофилы и некоторые лимфоциты. Связывание Ig Fc с его рецептором приносит эти эффекторные клетки к сайтам связанного антигена, что в итоге приводит к передаче сигнала и иммунным ответам, включая В клеточную активацию, воспалительные ответы, цитотоксические ответы и фагоцитарные ответы.
Слияние Ig Fc - это молекула, включающая один или несколько полипептидов (или одну или несколько малых молекул), функционально связанных с Fc областью иммуноглобулина или антитела. Смотри, например, Chamow et al., 1996, Trends Biotechnol. 14:52-60. Соответственно, Ig Fc слитый белок - это молекула, включающая один или несколько полипептидов, функционально связанных с Ig Fc областью. Ig Fc слитый белок может содержать, например, Fc область антитела (которая облегчает эффекторные функции и фармакокинетические характеристики) и связывающую область или связывающий домен рецепторного белка, или лигандного белка, или другого белка, или их фрагмент. Связывающая область или связывающий домен опосредует распознавание рецептора-мишени или лиганда-мишени (сравнимо с таковым для вариабельной области антитела для антигена). Ig Fc область может быть связана непрямо или прямо с одним или несколькими полипептидами или малыми молекулами (партнеры слияния). Различные линкеры, известные из уровня техники и описанные более подробно далее, могут использоваться для соединения Ig Fc с партнером слияния для получения Ig Fc слияния. Ig Fc слитый белок обычно включает Ig Fc область, ковалентно связанную прямо или непрямо с, по меньшей мере, одним полипептидом, причем полипептид обычно связывает лиганд-мишень или рецептор-мишень.
Могут использоваться моноклональные или поликлональные антитела могут быть приготовлены любым методом, известным из уровня техники (смотри, например, Kohler & Milstein, Nature 256:495 497 (1975); Kozbor et al., Immunology Today 4: 72 (1983); Cole et al., pp.77 96 in Monoclonal Antibodies and Cancer Therapy (1985)). Методики для получения одноцепочечных антител (Патент США №4946778) могут быть адаптированы для получения антител к полипептидам по данному изобретению. Кроме того, трансгенные мыши или другие организмы, включая млекопитающих, могут использоваться для экспрессии гуманизированных антител. Методика фагового дисплея может использоваться для определения антител и гетеромерных Fab фрагментов, которые специфически связывают выбранные антигены (смотри, например, McCafferty et al. Nature 348:552 554 (1990); Marks et al, Biotechnology 10:779 783 (1992)).
Выражение "эпитоп" относится к антигенной детерминанте, способной специфически связываться с частью антитела. Эпитопы обычно состоят из химически активных поверхностных группировок молекул, таких как боковые цепи аминокислот или сахара, и обычно имеют специфические 3-мерные структурные характеристики, а также специфические зарядные характеристики. Конформационные и неконформационные эпитопы отличаются в том, что связывание с первым, а не с последним утрачивается в присутствии денатурирующих растворителей.
"Специфическая аффинность связывания" между двумя молекулами, например, лигандом и рецептором, означает преимущественное связывание одной молекулы с другой. Связывание молекул обычно рассматривается как специфическое, если равновесная связывающая константа ассоциации (а именно KA) составляет от около 1×102 М-1 до около 1×1013 М-1 или больше, включая около 104-1013 М-1, около 106-1012 М-1, около 108 М-1-1011 М-1 или около 108-1010 М-1. Значения KA для взаимодействия связывания между антигеном и антителом обычно лежат в диапазоне от около 105 М-1 до около 1012 М-1, обычно от около 107 М-1 до около 1011 М-1 и часто от около 108 М-1 до около 1010 М-1. KA (М-1) определяется путем расчета ka/kd, где ka - это константа скорости ассоциации и kd - это константа скорости диссоциации. Единицами измерения для ka и kd являются М-1 s-1 и s-1 соответственно. Равновесная константа диссоциации, KD, является обратной величиной KA. KD=kd/ka. Для реакции + В <=> AT (которая представляет связывание отдельного лиганда с отдельным белком, который представляет интерес (например, рецептором)), KD равна ([А][В])/[АВ]. Неограничивающие примеры хорошо известных методик для измерения аффинностей связывания и/или авидностей связывания молекул включают, например, Biacore™ технологию (GE Healthcare), как обсуждается в данном описании, методы изотермической титриметрической микрокалориметрии (MicroCal LLC, Northampton, MA USA), ELISA (метод твердофазного иммуноферментного анализа) и клеточной сортировки с возбуждением флуоресценции (FACS). Например, FACS или другой способ сортировки может использоваться для отбора популяций молекул (таких как, например, лиганды на поверхности клетки), которые специфически связываются с ассоциированным связывающим парным членом (таким как рецептор, например, растворимый рецептор). Комплексы лиганд-рецептор могут определяться и сортироваться, например, с помощью флуоресценции (например, путем реагирования комплекса с флуоресцентным антителом, распознающим комплекс). Молекулы, представляющие интерес, которые связываются с ассоциированным связывающим парным членом (например, рецептором) объединяются и сортируются заново в присутствии более низких концентраций рецептора. Путем проведения множества раундов сортировки в присутствии уменьшающихся концентраций рецептора (иллюстративный концентрационный диапазон порядка от 10-6 М до 10-13 М, а именно 1 микромоль (мкМ) до 1 наномоль (нМ), или меньше (например, 10-11 М или 10-12 М), в зависимости от природы лиганд-рецепторного взаимодействия), могут быть выделены популяции молекулы, представляющей интерес, проявляющие специфическую аффинность связывания к рецептору.
Фраза "специфически (или селективно) связывает" антитело или "специфически (или селективно) проявляет иммунореактивность к", когда относится к белку, относится к реакции связывания, которая определяется в присутствии белка в гетерогенной популяции белков и других биологических агентов. Таким образом, при обозначенных условиях иммунологического анализа, специфические антитела связываются с конкретным белком, по меньшей мере, в два раза сильнее, чем фоновая активность, и не существенно связываются в достаточном количестве с другими белками, присутствующими в образце. Специфическое связывание с антителом при таких условиях может нуждаться в антителе, которое выбрано по его специфичности к конкретному белку. Могут использоваться разнообразные форматы иммунологического анализа для отбора антитела, которое специфически проявляет иммунореактивность к конкретному белку. Например, твердофазные иммунологические анализы ELISA обычно используются для отбора антител, которые специфически проявляют иммунореактивность к белку (смотри, например, Harlow & Lane, Antibodies, Laboratory Manual (1988), для описания форматов иммунологического анализа и условий, которые могут использоваться для определения специфической иммунореактивности). Обычно специфическая или селективная реакция будет, по меньшей мере, в два раза выше фоновой сигнальной или шумовой и более обычно больше, чем в 10-100 раз выше фоновой.
Выражение "цитокин" включает, например, но не ограничивается следующим, интерлейкины, интерфероны (IFN), хемокины, гематопоэтические факторы роста, факторы некроза опухоли (TNF) и трансформирующие факторы роста. В целом, это белки малого молекулярного веса, которые регулируют созревание, активацию, пролиферацию и дифференциацию клеток иммунной системы.
Выражение "скрининг" описывает, в целом, процесс, который определяет оптимальные молекулы по данному изобретению, такие как, например, включая полипептиды по данному изобретению, и родственные им слитые белки, включающие их, и нуклеиновые кислоты, кодирующие все такие молекулы. Некоторые свойства соответствующих молекул могут использоваться в отборе и скрининге, например, способность соответствующей молекулы вызывать или изменять желаемый иммунный ответ в тестовой системе или в in vitro, ex vivo или in vivo применениях. "Отбор" - это форма скрининга, при котором определение и физическое разделение достигаются одновременно с экспрессией выбранного маркера, который, при некоторых генетических обстоятельствах, позволяет клеткам, экспрессирующим маркер, выживать, тогда как другие клетки погибают (или наоборот). Маркеры скрининга включают, например, люциферазу, бета-галактозидазу и зеленый флуоресцентный белок, субстраты для реакции и подобное. Маркеры отбора включают гены, устойчивые к препаратам и токсинам и подобное. Другой способ отбора включает сортировку на основе определяемого события, такого как связывание лиганда с рецептором, реакцию субстрата с ферментом или любой другой физический процесс, который может образовывать определяемый сигнал либо прямо (например, используя хромогенный субстрат или лиганд), либо косвенно (например, путем реакции с хромогенным вторичным антителом). Отбор путем физической сортировки может производиться различными способами, включая, но не ограничиваясь, например, у FACS в целой клетке или микроанализы.
Из-за ограничений в изучении первичных иммунных ответов in vitro, in vivo исследования являются особенно важными способами скрининга. В некоторых таких исследованиях полинуклеотид или полипептид по данному изобретению вначале встраивают в исследуемый субъект (например, млекопитающее, такое как животное), и в дальнейшем изучается вызванный иммунный ответ путем анализа типа иммунного ответа у иммунизированного животного (например, продукция антител в сыворотке иммунизированного животного, пролиферация Т-клеток) или путем изучения качества или силы вызванного иммунного ответа у иммунизированного животного (например, вызванный уровень титра антител).
Выражение "субъект", как используется в данном описании, включает, но не ограничивается следующим, организм или животное, включая млекопитающих и немлекопитающих. Млекопитающее включает, например, но не ограничивается следующим, человек, примат, не являющийся человеком (например, бабуин, орангутанг, мартышка, горилла), мышь, собака, свинья, корова, коза, кошка, кролик, крыса, морская свинка, хомяк, лошадь, овца или другое млекопитающее, не являющееся человеком. Немлекопитающее включает, например, но не ограничивается следующим, беспозвоночное, не являющееся млекопитающим, и беспозвоночное, не являющееся млекопитающим, такое как птица (например, цыпленок или утка) или рыба.
Выражение "фармацевтическая композиция" относится к композиции, пригодной для фармацевтического применения у субъекта, включая животное или человека. Фармацевтическая композиция обычно включает эффективное количество активного агента и носитель, наполнитель или растворитель. Носитель, наполнитель или растворитель являются обычно фармацевтически приемлемым носителем, наполнителем или растворителем соответственно.
Выражение "эффективное количество" относится к дозировке (или дозе) или количеству вещества, необходимого для получения желаемого результата. Желаемый результат может включать объективное или субъективное улучшение реципиента дозировки или количества. Например, желаемый результат может включать измеримую, определяемую или проверяемую индукцию, стимуляцию, усиление или модуляцию иммунного ответа у субъекта, которому ввели дозировку или количество конкретного антигена или иммуногена (или их композиции). Дозировка (или доза) или количество иммуногена, достаточного для оказания такого результата, обозначается как "иммуногенная" дозировка (или доза) или количество.
"Профилактическое лечение" - это лечение, которое оказывается субъекту, который не проявляет признаков или симптомов или проявляет лишь ранние признаки или симптомы заболевания, патологии или нарушения, так что лечение вводят с целью предупреждения или снижения риска развития заболевания, патологии или нарушения. Профилактическое лечение функционирует как превентивное лечение против заболевания, патологии или нарушения или как лечение, которое ингибирует или снижает также развитие или усиление заболевания, патологии или нарушения. "Профилактическая активность" - это активность агента, который при введении субъекту, который не проявляет признаков или симптомов или проявляет лишь ранние признаки или симптомы заболевания, патологии или нарушения, предупреждает или снижает риск развития патологии, заболевания или нарушения. "Профилактически пригодный" агент (например, нуклеиновая кислота или полипептид) относится к агенту, который пригоден для предупреждения развития заболевания, патологии или нарушения, или пригоден для ингибирования или снижения также развития или усиления заболевания, патологии или нарушения.
"Терапевтическое лечение" - это лечение, которое оказывают субъекту, который проявляет симптомы или признаки патологии, заболевания или нарушения, при котором лечение вводят субъекту с целью уменьшения или удаления этих признаков или симптомов. "Терапевтическая активность" - это активность агента, который удаляет или уменьшает признаки или симптомы патологии, заболевания или нарушения при введении субъекту, страдающему от таких признаков или симптомов. "Терапевтически пригодный" агент обозначает агент, который пригоден для уменьшения, лечения или удаления признаков или симптомов заболевания, патологии или нарушения.
В общем, номенклатура, использованная в данном описании, и многие лабораторные методики по клеточной культуре, молекулярной генетике, молекулярной биологии, химии нуклеиновых кислот и химии белков, описанных ниже, хорошо известны специалистам в данной области и обычно используются специалистами в данной области техники. Стандартные методы, такие как описанные в Sambrook et al., Molecular Cloning - Laboratory Manual (2nd Ed.), Vols. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York, 1989 (далее обозначенный как "Sambrook") и CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, F. M. Ausubel et al., eds., Current Protocols, совместно с Greene Publishing Associates, Inc. и John Wiley & Sons, Inc. (1994, дополненное издание 1999) (далее обозначенный как "Ausubel"), используются для рекомбинантных методов относительно нуклеиновых кислот, синтеза нуклеиновых кислот, методов клеточной культуры и трансгенного включения, например, электропорации, инъекции, генной пушки, проникающей через кожу, и липофекции. В общем, этапы олигонуклеотидного синтеза и очищения проводятся в соответствии с описанием изобретения. Методики и процедуры в целом проводятся согласно способам, традиционным в данной области техники, и различным общим ссылкам, которые обеспечиваются во всем документе. Предполагается, что процедуры в данном описании являются хорошо известными для специалистов в данной области и предусмотрены для удобства читателя.
Другие дополнительные выражения определяются или другим образом объясняются в данном описании.
Молекулы и способы согласно изобретению
Данное изобретение обеспечивает молекулы и способы для лечения заболевания, нарушения и состояния иммунной системы, включая, например, те, при которых модуляция иммунной системы (например, зависимые от Т-клеток иммунные ответы) является желательной. Молекулы по данному изобретению (например, полипептиды по данному изобретению, конъюгаты изобретения, растворимые слитые белки по данному изобретению, нуклеиновые кислоты, кодирующие такие полипептиды или слитые белки) пригодны для лечения заболевания, нарушения и состояний иммунной системы, при которых иммуносупрессия является желательной, включая, например, но, не ограничиваясь следующим, лечение аутоиммунного заболевания, нарушения и состояний, иммунопролиферативных заболеваний, нарушений, связанных с трансплантатом, и способы лечения, включая трансплантацию ткани, клетки, органа или участка ткани или органа от донора к реципиенту, где подавление иммунного ответа у реципиента против донорской ткани, клетки, органа или участка ткани или органа является желательным.
В одном аспекте данное изобретение обеспечивает новые мутантные молекулы CTLA-4, имеющие улучшенные свойства по сравнению с молекулой CTLA-4, такие как полипептид дикого типа человеческого CTLA-4 ("hCTLA-4") или его фрагмент, которые связывают CD80 и/или CD86, такой как внеклеточный домен человека CTLA-4 ("hCTLA-4 ВКД"). Как обсуждается более детально ниже, различные стратегии мутагенеза и скрининга используются для образования и определения новых мутантных молекул CTLA-4, который связывают CD80 и/или CD86. В частности, такие стратегии используются для образования и определения мутантных молекул CTLA-4, имеющих улучшенные авидности связывания к CD80 (В7-1) и/или CD86 (В7-2) по сравнению с человеческим CTLA-4 ("hCTLA-4") и/или имеющих улучшенные связывающие аффинности к CD80 и/или CD86 по сравнению с hCTLA-4 ВКД. Мутантные молекулы CTLA-4 по данному изобретению, которые связывают эндогенные лиганды CD80 и/или CD86, экспрессирующиеся на антиген-презентирующих клетках, эффективно ингибируют или блокируют взаимодействие этих лигандов с эндогенным рецептором CD28, который экспрессируется на поверхности Т-клеток. В результате костимуляторная передача сигнала, необходимая для Т-клеточной активации, которая обеспечивается путем взаимодействия рецептора Т-клеточной поверхности CD28 с В7 молекулами (а именно CD80 и CD86), ингибируется или блокируется. Такие Т-клетки недостаточно активируются и имеют сниженные способности к пролиферации.
В случаях, когда передача сигнала между лигандом CD80 или CD86 и рецептором CD28 блокируется, Т-клетки недостаточно стимулируются, чтобы стать активными и, таким образом, недостаточно индуцированными для того, чтобы пролиферировать. Сходно с этим, в случаях, когда передача сигнала между лигандом CD80 или CD86 и рецептором CD28 ингибируется, активация и пролиферация Т-клеток ингибируется. В одном аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, которые функционируют как антагонисты по отношению к CTLA-4 передаче сигнала. В другом аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, которые функционируют как антагонисты к CD28 передаче сигнала, тем самым, подавляя или блокируя Т-клеточно-зависимые иммунные ответы; такие молекулы функционируют как иммуносупрессорные агенты. В другом аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, которые связывают как CD80, так и CD86, но, которые имеют авидность связывания к CD86, чем к CD80, и тем самым ингибируют CD86-зависимую костимуляцию в большей степени, чем CD80-зависимую костимуляцию. Предполагают, что все такие мутантные молекулы CTLA-4 по данному изобретению пригодны для лечения заболеваний, нарушений или состояний, при которых иммуносупрессия является желательной или была бы предпочтительной.
Показано, что слитый белок человеческого CTLA-4-Ig и специфический мутантный слитый белок CTLA-4-Ig - оба разработанные Bristol-Myers Squibb Co. (Princeton, NJ) - эффективны при лечении определенных иммуносвязанных заболеваний или состояний. Слитый белок Orencia® (также известный как Абатацепт ("АВА")) (Bristol-Myers Squibb Со. (Princeton, NJ)) - это растворимый рекомбинантный димерный слитый белок, состоящий из двух идентичных мономерных иммуноглобулиновых (Ig) слитых белков, ковалентно соединенных вместе дисульфидной связью, сформированной между остатком цистеина, присутствующим в каждом мономерном слитом белке. ORENCIA - это зарегистрированная торговая марка компании Bristol-Myers Squibb Company. Каждый мономерный Ig слитый белок Orencia® димера состоит из внеклеточного домена человеческого CTLA-4 (SEQ ID NO:159), слитого на его С-конце с N-концом специфического мутантного полипептида IgG1 Fc (SEQ ID NO:186). Полная аминокислотная последовательность каждого такого мономерного слитого белка показана в SEQ ID NO:164. Димер Orencia® получают в системе экспрессии млекопитающего, и он имеет приблизительный молекулярный вес 92 кДа. Предполагают, что два мономерных Ig слитых белка Orencia® димера ковалентно соединены вместе одной дисульфидной связью, сформированной между остатком цистеина в положении 120 каждого hCTLA-4-мутантного IgG1 мономера, и что не существует дисульфидных связей, сформированных между двумя мутантными IgG1 Fc полипептидами.
Димер Orencia® - это селективный костимуляторный модулятор, который ингибирует Т-клеточную активацию путем связывания с CD80 и CD86 и, таким образом, блокируя взаимодействие с CD28. В настоящее время подтверждена эффективность применения димера Orencia® для лечения взрослого человека, страдающего от ревматоидного артрита (РА) от средней до тяжелой степени. Дополнительная информация о димере Orencia® и его клинических назначениях и эффективности предоставлена на всемирном веб-сайте orencia.com и bms.com.
Как отмечалось выше, каждый мономер димера слитого белка Orencia® содержит внеклеточный домен человеческого CTLA-4. Человеческий CTLA-4 - это мембранный белок, который случайно экспрессируется на Т-клетках. Полноразмерная белковая последовательность полноразмерного hCTLA-4 ДТ показана в SEQ ID NO:160, и последовательность нуклеиновых кислот, кодирующая полноразмерный hCTLA-4 ДТ, показана в SEQ ID NO:194. Человеческий CTLA-4 включает сигнальный пептид (СП), внеклеточный домен (ВКД), трансмембранный домен (ТД) и цитоплазматический домен (ЦД), ковалентно соединенные вместе в этом порядке (например, С-конец СП ковалентно соединен с N-концом ВКД, С-конец ВКД ковалентно соединен с N-концом ТД, и С-конец ТД ковалентно соединен с N-концом ЦД). Полипептид ДТ hCTLA-4 ВКД обычно включает остатки 38-161 последовательности полноразмерного белка hCTLA-4 (SEQ ID NO:160) и обычно в длину 124 аминокислотных остатка. Эта аминокислотная последовательность hCTLA-4 ВКД показана в SEQ ID NO:159. Сигнальный пептид (СП) полноразмерного белка hCTLA-4, который обычно включает аминокислотные остатки 1-35 или 1-37 SEQ ID NO:160, отщепляется при процессинге. Смотри, например, Harper et al, J. Immunol. 147(3): 1037-1044 (1991). Последовательность человеческого CTLA-4 сигнального пептида, включающая аминокислотные остатки 1-35 или 1-37 hCTLA-4 белка, показана в SEQ ID NO:182 или SEQ ID NO:216 соответственно. Если последовательность сигнального пептида является такой, представленной в SEQ ID NO:182 или SEQ ID NO:216, когда сигнальный пептид отщепляется, то зрелый белок hCTLA-4 обычно начинается с остатка метионина в аминокислотном положении 38 последовательности полноразмерного белка hCTLA-4, представленной в SEQ ID NO:160. Таким образом, даже если последовательность сигнального пептида hCTLA-4 является такой SEQ ID NO:182, которая включает аминокислотные остатки 1-35 белка hCTLA-4, то полученный зрелый секретируемый белок hCTLA-4 начинается с метионина, который находится в положении 38 полноразмерного hCTLA-4 белка. Остатки лизина (K) и аланина (А) в положениях 36 и 37 соответственно, полноразмерного белка hCTLA-4 не присутствуют в зрелом белке hCTLA-4, и предполагается, что они отщепляются от зрелого белка hCTLA-4 при процессинге. Аминокислотные остатки последовательности зрелого белка hCTLA-4, таким образом, обычно пронумерованы, начиная с остатка метионина, присутствующего в положении 38 полноразмерного белка hCTLA-4 как первая аминокислота (а именно занимающая положение 1); соответственно, гистидиновый остаток занимает аминокислотное положение 2 в зрелом белке hCTLA-4 и т.п. Каждый мономер Orencia® димера включает hCTLA-4 ВКД аминокислотную последовательность, представленную в SEQ ID NO:159. В полноразмерном белке ДТ hCTLA-4 сигнальный пептид включает аминокислотные остатки 1-37, внеклеточный домен (ВКД) включает аминокислотные остатки 38-161, трансмембранный домен (ТД) включает аминокислотные остатки 162-182 и цитоплазматический домен (ЦД) включает аминокислотные остатки 183-223 SEQ ID NO:160. Зрелый домен (MD) белка hCTLA-4 обычно включает аминокислотные остатки 36-223, или в некоторых случаях аминокислотные остатки 37-223 или 38-223 SEQ ID NO:160.
Нуклеиновая кислота последовательности SEQ ID NO:194 включает последовательность нуклеиновых кислот, кодирующую последовательность сигнального пептида (нуклеотидные остатки 1-111), последовательность нуклеиновых кислот, кодирующая hCTLA-4 ВКД (нуклеотидные остатки 112-483), последовательность нуклеиновых кислот, кодирующая hCTLA-4 трансмембранный и цитоплазматический домены (нуклеотидные остатки 484-669); последние 3 C-терминальных нуклеотида - это TGA стоп-кодон.
Белатацепт (также известный как "LEA29Y-Ig," "LEA-Ig," или "A29YL104E-Ig") (Bristol-Myers Squibb Co. (Princeton, NJ)) - это растворимый рекомбинантный димерный белок, состоящий из двух идентичных слитых белка Ig, ковалентно соединенных вместе дисульфидной связью, сформированной между остатком цистеина в каждом мономерном слитом белке. Каждый мономерный слитый белок состоит из полипептида мутантного внеклеточного домена CTLA-4, слитого на его С-конце с N-концом специфического мутантного полипептида IgG1. Аминокислотная последовательность мутантного CTLA-4 ВКД отличается от аминокислотной последовательности человеческого CTLA-4 ВКД ДТ на две мутации, а именно замена тирозина на аланин в положении 29 (сокращенно замена A29Y) и замена глутамина на лейцин в положении 104 (сокращенно замена L 104E), где аминокислотные остатки в человеческом CTLA-4 ВКД нумеруются с метионина на N-конце, представляющем аминокислоту в положении 1. Каждый мономер Белатацепта включает аминокислотную последовательность мутантного IgG1 Fc, представленную в SEQ ID NO:186; этот мутантный полипептид IgG1 Fc идентичен мутантному полипептиду IgG1 Fc, включенному в слитый белок Orencia®. Мономерный слитый белок Белатацепт, таким образом, отличается от каждого мономерного слитого белка Orencia® на две аминокислоты. Аминокислотная последовательность каждого такого мономерного слитого белка в Белатацепте показана в SEQ ID NO:166. Название "LEA29Y-Ig", таким образом, отражает факт того, что каждый мономерный слитый белок димера Белатацепта состоит из мутантного CTLA-4 ВКД, который отличается от аминокислотной последовательности человеческого CTLA-4 ВКД на две мутации L104E и A29Y. Показано, что Белатацепт связывает CD86 около в 4 раза сильнее и связывает CD80 около в 2 раза сильнее, чем Orencia® димер (Larson et al., Amer. J. Transplat. 5:443-453, 444 (2005). Показано, что Белатацепт является около в 10 раз более сильным, чем димер Orencia® по ингибированию Т-клеточной активации in vitro, и имеет улучшенную in vivo иммуносупрессорную активность по сравнению с белком Orencia®, как показывает его увеличенная способность ингибировать Т-клеточно-зависимые ответы антител и его улучшенная пролонгация жизнеспособности почечного аллотрансплантата в клинических испытаниях на приматах, которые не являются человеком. Дополнительная информация о Белатацепте и его клинических назначениях и эффективности представлена на всемирном веб-сайте bms.com.
В одном аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные мутантные слитые белки CTLA-4-Ig, описанные здесь, которые имеют авидность связывания к CD86, которая больше, чем авидность связывания димера Orencia® (димерного hCTLA-4-Ig)к CD86. Изобретение также обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные димерные мутантные слитые белки CTLA-4-Ig, которые имеют авидность связывания к CD80, которая практически равна или больше, чем авидность связывания димера Orencia® к CD80. В другом аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные мутантные слитые белки CTLA-4-Ig, которые имеют большую способность подавлять один или несколько иммунных ответов (например, Т-клеточно-зависимые иммунные ответы), чем Orencia® (Абатацепт). Предполагают, что мутантные молекулы CTLA-4 по данному изобретению, имеющее одно или несколько улучшенных свойств по сравнению с димером Orencia®, являются более сильными и, таким образом, более эффективными, пригодными и преимущественными, чем димер Orencia® в лечении заболеваний, нарушений или состояний, при которых иммуносупрессия является желательной, включая такие заболевания, нарушения или состояния, для которых подтверждена эффективность димера Orencia® и/или было показано, что он имеет клинический эффект, такие как аутоиммунные заболевания, включая, например, ревматоидный артрит и псориаз.
В другом аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные мутантные слитые белки CTLA-4-Ig, описанные здесь, которые имеют авидность связывания к CD86, которая больше, чем авидность связывания Белатацепта (LEA29Y-Ig) к CD86. Изобретение также обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные мутантные слитые белки CTLA-4-Ig. Описанные здесь, которые имеют авидность связывания к CD86, которая больше, чем авидность связывания Белатацепта к CD86. В другом аспекте данное изобретение обеспечивает мутантные молекулы CTLA-4, включая новые растворимые рекомбинантные мутантные слитые белки CTLA-4-Ig, описанные здесь, которые имеют большую способность подавлять один или несколько иммунных ответов (например, Т-клеточно-зависимые иммунные ответы), чем Белатацепт. Предполагается, что мутантные молекулы CTLA-4 по данному изобретению, имеющие одно или несколько улучшенных свойств по сравнению с Белатацептом, являются более сильными, чем Белатацепт, и, таким образом, являются более сильными и, таким образом, более эффективными, пригодными и преимущественными, чем Белатацепт, в лечении заболеваний, нарушений или состояний, при которых иммуносупрессия является желательной, включая такие заболевания, нарушения или состояния, для которых показано, что слитый белок Белатацепт имеет клинический эффект, такой как жизнеспособность почечного аллотрансплантата у приматов, которые не являются человеком.
Безопасность, толерантность, фармакокинетические свойства, иммуногенность и клиническая эффективность молекулы по данному изобретению, такой как мутантная молекула CTLA-4 изобретения, (например, мутантный полипептид CTLA-4 ВКД или растворимый мутантный слитый белок CTLA-4-Ig, которые описаны детально ниже), у субъекта, имеющего иммунное заболевание или нарушение (например, ревматоидный артрит, рассеянный склероз, псориаз и т.п.), которому вводят конкретную дозу молекулы конкретным путем введения (например, парентеральное, внутривенное или подкожное введение), могут определяться с применением методик, сопоставимых с теми, что используются в клинических испытаниях для Orencia®, применяя подобные субъекты. Смотри, например, адреса всемирных веб-сайтов bms.com и orencia.com. Например, степень, с которой мутантная молекула CTLA-4 изобретения (например, растворимый мутантный CTLA-4-Ig) эффективна в снижении у субъектов, имеющих ревматоидный артрит (РА) прогрессирования повреждения сустава, в ослаблении признаков и симптомов РА, включая уменьшение боли, может быть оценена с помощью методик, сходных с теми, что применяются для Orencia® клинических испытаний, используя РА пациентов.
Безопасность, толерантность, фармакокинетические свойства, иммуногенность и клиническая эффективность молекулы по данному изобретению (например, мутантного полипептида CTLA-4 ВКД или растворимого мутантного слитого белка CTLA-4-Ig, как описано в деталях ниже) у субъекта, для которого желательна иммуносупрессия (например, субъекту, которому пересадили ткань, клетку, орган или участок ткани или органа от донора) и которому конкретную дозу вводят конкретным путем введения (например, парентеральное, внутривенное или подкожное введение), могут быть определены с применением методик, сопоставимых с теми, которые применяются в клинических испытаниях для Белатацепт, используя сходных субъектов. Смотри, например, адрес всемирного веб-сайта bms.com. Например, степень, с которой мутантная молекула CTLA-4 изобретения (например, растворимый мутантный CTLA-4-Ig) эффективна в уменьшении отторжения трансплантата почки или почечного трансплантата у пациента-реципиента, которому произведена трансплантация почки или почечного трансплантата, может быть оценена с помощью методик, сходных с теми, что применяются для клинического исследования Белатацепта, используя пациентов, подвергшихся трансплантации почки или почечного трансплантата.
Молекулы и способы по данному изобретению и другие аспекты изобретения обсуждаются более детально ниже.
Полипептиды по данному изобретению
Данное изобретение обеспечивает новые полипептиды, имеющие общее название "полипептиды по данному изобретению". Подразумевается, что выражение "полипептиды по данному изобретению" включает варианты и/или производные аминокислотных последовательностей, описанных в данном описании. Полипептиды по данному изобретению включают рекомбинантные, не встречающиеся в природе или мутантные полипептиды CTLA-4, которые связывают CD80 и/или CD86 и/или которые ингибируют или подавляют иммунные ответы. Полипептиды по данному изобретению включают рекомбинантные слитые белки, включающие мутантный полипептид CTLA-4 по данному изобретению, и включают мономерные и димерные формы таких слитых белков. Полипептиды по данному изобретению включают мультимеры, включающие один или несколько мутантных полипептидов CTLA-4 по данному изобретению. Изобретение также включает конъюгаты, включающие один или несколько мутантных полипептидов CTLA-4 по данному изобретению. Некоторые полипептиды по данному изобретению являются растворимыми полипептидами. Например, как описано более детально ниже, данное изобретение включает растворимые слитые белки, включающие мутантный полипептид CTLA-4 ВКД, связанный с различным полипептидом (таким как, например, иммуноглобулиновый полипептид, такой как, например, Ig Fc полипептид), который усиливает растворимость мутантного полипептида CTLA-4 ВКД.
Как обсуждается более детально ниже, в одном аспекте изобретения разнообразные стратегии мутагенеза и скрининга используются для образования и определения новых полипептидов, которые связывают CD80 и/или CD86. В частности, такие стратегии используются для образования и определения новых полипептидов, имеющих улучшенные способности связывать CD80 и/или CD86, включая новые мутантные полипептиды CTLA-4, имеющие улучшенные связывающие аффинности или авидности к CD80 и/или CD86. Полипептиды по данному изобретению, которые связывают CD80 и/или CD86 лиганды, экспрессирующиеся на антиген-презентирующих клетках влияют на или блокируют взаимодействие этих лигандов с CD28 рецепторами, экспрессирующимися на Т-клетках. В результате Т-клеточная костимуляторная передача сигнала, которая обеспечивается взаимодействием рецептора Т-клеточной поверхности CD28 с В7 молекулами (а именно CD80 и CD86), ингибируется или блокируется. Предполагают, что такие полипептиды пригодны для профилактического и терапевтического лечения заболеваний, нарушений и состояний, при которых модуляция иммунной системы (например, Т-клеточных ответов) является предпочтительной.
Мутантные полипептиды CTLA-4
В одном аспекте данное изобретение обеспечивает изолированные или рекомбинантные полипептиды, каждый из которых включает аминокислотную последовательность, которая имеет, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73 (например, SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:45, SEQ ID NO:46, SEQ ID NO:47, SEQ ID NO:48, SEQ ID NO:49, SEQ ID NO:50, SEQ ID NO:51, SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:55, SEQ ID NO:56, SEQ ID NO:57, SEQ ID NO:58, SEQ ID NO:59, SEQ ID NO:60, SEQ ID NO:61, SEQ ID NO:62, SEQ ID NO:63, SEQ ID NO:64, SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67, SEQ ID NO:68, SEQ ID NO:69, SEQ ID NO:70, SEQ ID NO:71, SEQ ID NO:72, и SEQ ID NO:73), где полипептид связывает CD80 и/или CD86 или полипептидный фрагмент CD80 и/или CD86 (или ВКД каждого или обоих), и/или модулирует или регулирует иммунный ответ. Некоторые такие полипептиды, такие как каждый из перечисленных в SEQ ID NOS:1-73, описываются как секретируемые или зрелые мутантные полипептиды CTLA-4 ВКД. Мутантные полипептиды CTLA-4 ВКД, перечисленные в каждой из SEQ ID NO:1-73, не включают сигнальный пептид; он отщепился при процессинге, тем самым образуя зрелый или секретируемый полипептид. Полипептидный фрагмент CD80 может содержать, например, полипептид внеклеточного домена CD80 полдипептида, такой как, например, человеческий CD80 ВКД полипептид ("hCD80 ВКД"). Полипептидный фрагмент CD86 может содержать, например, полипептид внеклеточный домен CD86 полипептида, такой как, например, человеческий CD86 ВКД полипептид ("hCD86 ВКД"). Некоторые такие полипептиды связывают CD80 и/или CD86 млекопитающих или их полипептидные фрагменты, такие как, например, CD80 иди CD86 ВКД млекопитающих. Некоторые такие полипептиды связывают человеческий CD80 ДТ ("hCD80") и/или человеческий CD86 ДТ ("hCD86") или его полипептидный фрагмент, такой как, например, hCD80 ВКД или hCD86 ВКД. В некоторых таких способах, по меньшей мере, один иммунный ответ подавляется или ингибируется.
Некоторые такие полипептиды имеют аффинность связывания или авидность к hCD80 или его фрагменту (например, hCD80 ВКД), которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность полипептида hCTLA-4 ВКД к hCD80 или его фрагменту соответственно. Предполагаемая полноразмерная hCD80 аминокислотная последовательность, которая включает сигнальный пептид, ВКД, трансмембранный домен и цитоплазматический домен, ковалентно соединенные вместе в таком порядке, представлена в SEQ ID NO:195. Сигнальный пептид включает аминокислотные остатки 1-34, ВКД включает аминокислотные остатки 35-242, трансмембранный домен включает аминокислотные остатки 243-263, и цитоплазматический домен включает аминокислотные остатки 264-288 SEQ ID NO:195. Аминокислотная последовательность hCD80 ВКД показана в SEQ ID NO:174. Последовательность нуклеиновых кислот, представленная в SEQ ID NO:173, кодирует ДТ человеческий CD80 сигнальный пептид (на N-конце) и человеческий CD80 ВКД.
Некоторые такие полипептиды имеют аффинность связывания или авидность к hCD86 или его фрагменту (например, hCD86 ВКД), которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность полипептида hCTLA-4 ВКД к hCD86 или его фрагменту (например, ВКД) соответственно. Предполагаемая полноразмерная аминокислотная последовательность hCD86, которая включает сигнальный пептид, ВКД, трансмембранный домен и цитоплазматический домен, ковалентно соединенные вместе в этом порядке, представлена в SEQ ID NO:175, и иллюстративная нуклеиновая кислота, кодирующая предполагаемую полноразмерную hCD86 аминокислотную последовательность, показана в SEQ ID NO:176. Аминокислотная последовательность hCD86 ВКД показана в SEQ ID NO:180. Некоторые такие полипептиды имеют аффинность связывания или авидность к hCD86, которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность полипептида LEA29Y ВКД, имеющего последовательность, представленную в SEQ ID NO:168 к hCD86. Иллюстративные полипептиды по данному изобретению, которые имеют связывающие аффинности или авидности связывания к hCD86 или hCD86 ВКД, которые, по меньшей мере, равны или больше, чем таковые для hCTLA-4 ВКД и LEA29Y ВКД (также имеющего название "A29YL104E" или "L104EA29Y" ВКД) к hCD86 или hCD86 ВКД соответственно, включают, например, но не ограничиваются следующим, те, которые включают аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с последовательностью любой из SEQ ID NOS:4, 10-12, 15, 17, 24, 26, 28, 35 и 61. Смотри, например, таблицу 5 в примере 4. Данные, представленные в таблице 5, отражают мономерное взаимодействие между репрезентативным CTLA-4-Ig и мономерным CD86 ВКД. Выражение LEA29Y (или A29YL104E, или L104EA29Y), если не определено обратное, относится к LEA29Y ВКД (или A29YL104E, или L104EA29Y ВКД).
Некоторые такие полипептиды включают аминокислотную последовательность, имеющую аминокислотную длину, приблизительно равную аминокислотной длине внеклеточного домена человеческого CTLA-4. Такие полипептиды могут быть описаны как мутантные полипептиды CTLA-4 ВКД. Некоторые такие мутантные полипептиды CTLA-4 ВКД включают аминокислотную последовательность, которая составляет от около 110 до около 138 аминокислотных остатков, от около 112 до около 136 аминокислотных остатков, от около 114 до около 134 аминокислотных остатков, от около 116 до около 132 аминокислотных остатков, от около 118 до около 130 аминокислотных остатков, от около 119 до около 129 аминокислотных остатков, от около 120 до около 128 аминокислотных остатков, от около 121 до около 127 аминокислотных остатков, от около 122 до около 126 аминокислотных остатков, от около 123 до около 125 аминокислотных остатков в длину. Некоторые такие мутантные полипептиды CTLA-4 ВКД включают последовательность длиной 124 аминокислотных остатков. Иллюстративные полипептиды включают, например, но не ограничиваются следующим полипептидом, включающим аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где такой полипептид связывает CD80 и/или CD86 (или ВКД каждого или обоих).
Некоторые такие полипептиды, описанные выше, включая, например, те изолированные или рекомбинантные полипептиды, каждый их которых включает аминокислотную последовательность, имеющую, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы SEQ ID NOS:1-73, и который связывает CD80 и/или CD86 и/или их ВКД, имеют способность модулировать или регулировать иммунный ответ. Один или несколько из множества иммунных ответов может модулироваться или регулироваться такими полипептидами по данному изобретению, включая, но не ограничиваясь следующим, например, Т-клеточная активация или пролиферация, синтез цитокина или продукция цитокина (например, продукция TNF-α (фактор некроза опухоли альфа), IFN-γ (гамма-интерферон), IL-2 (интерлейкин-2) и т.п.), индукция различных маркеров атиквации (например, CD25, IL-2 рецептор и т.п.), синтез или продукция воспалительных молекул, воспаление, опухание сустава, болезненность сустава, боль, тугоподвижность, уровни в сыворотке С-реактивного белка, продукция антиколлагеновых антител и/или Т-клеточно-зависимый(ые) ответ(ы) антител). В некоторых случаях такой полипептид имеет большую способность подавлять или ингибировать, по меньшей мере, один такой иммунный ответ, чем hCTLA-4 или hCTLA-4 ВКД.
Например, некоторые такие полипептиды способны ингибировать Т-клеточную активацию или Т-клеточную пролиферацию в анализах in vitro. Примеры 4-9, представленные ниже, например, показывают способность репрезентативных слитых белков по данному изобретению, включающих репрезентативную мутантную аминокислотную последовательность CTLA-4 ВКД, таких как те, что описаны здесь, ингибировать Т-клеточную пролиферацию in vitro. Некоторые такие полипептиды способны ингибировать или подавлять иммунный ответ у субъекта in vivo, например, через введение терапевтически или профилактически эффективного количества, по меньшей мере, одного такого полипептида субъекту, нуждающемуся в иммуносупрессорной терапии. Предполагают, что некоторые такие полипептиды пригодны для различных применений, включая, например, но не ограничиваясь следующим: профилактические и/или терапевтические способы для лечения заболеваний, нарушений и состояний иммунной системы, при которых иммуномодуляция является желательной, как описывается более детально ниже. Ожидается, что такие полипептиды пригодны в профилактических и/или терапевтических способах для ингибирования или подавления иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы млекопитающих, таких как например, люди, при которых иммуноингибирование или иммуносупрессия является желательной), способах для ингибировании отторжения ткани или органа, пересаженного от донора реципиенту (например, млекопитающему, такому как, например, человек), и других способах, описанных в данном описании.
Дополнительно или альтернативно, некоторые такие полипептиды имеют способность подавлять или ингибировать иммунный ответ, которая, по меньшей мере, приблизительно равна или больше, чем способность hCTLA-4 или hCTLA-4 ВКД подавлять или ингибировать один или несколько типов иммунных ответов. Например, некоторые такие полипептиды имеют способность ингибировать Т-клеточную активацию или пролиферацию в in vitro и/или in vivo анализах и/или применениях, таких как те, что описаны выше и более детально ниже, которая, по меньшей мере, приблизительно равна или больше, чем способность hCTLA-4 или hCTLA-4 ВКД ингибировать Т-клеточную активацию или пролиферацию в таких применениях. Дополнительно, некоторые такие полипептиды имеют способность ингибировать или подавлять иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, Т-клеточно-зависимый ответ антитела), которая больше, чем способность полипептида LEA29Y - специфического мутантного CTLA-4 ВКД, включающего аминокислотную последовательность, представленную в SEQ ID NO:168, - ингибировать или подавлять иммунный ответ. Примеры 4-9, представленные ниже, например, сравнивают способность репрезентативных слитых белков изобретения, включающего мутантную аминокислотную последовательность CTLA-4 ВКД по данному изобретению, ингибировать Т-клеточную пролиферацию in vitro относительно способности слитого белка, включающего полипептид hCTLA-4 ВКД или LEA29Y, ингибировать Т-клеточную пролиферацию in vitro. Предполагают, что такие молекулы являются эффективными для применения для различных терапевтических назначений, включая лечение аутоиммунных заболеваний и нарушений, и профилактических и терапевтических способов для ингибирования отторжения трансплантата органа, клетки или участка ткани.
Некоторые такие полипептиды могут отличаться от любых других, например, по аминокислотной делеции, дополнению и/или замене. Аминокислотная замена может быть консервативной или неконсервативной заменой. Смотри, например, раздел, названный "Изменчивость последовательностей".
В другом аспекте данное изобретение также обеспечивает изолированные или рекомбинантные полипептиды, каждый из которых включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает мономерный hCD80 или мономерный hCD86 или ВКД каждого или обоих. Некоторые такие полипептиды имеют (1) аффинность связывания к мономерному hCD86, которая практически равна или больше, чем аффинность связывания мономерного полипептида hCTLA-4 или LEA29Y к мономерному hCD86 или его ВКД, и (2) аффинность связывания к мономерному hCD80, которая практически равна или больше, чем аффинность связывания мономерного hCTLA-4 к мономерному hCD80. Полипептид LEA29Y включает аминокислотную последовательность SEQ ID NO:168. Также некоторые такие полипептиды имеют большую способность подавлять один или несколько иммунных ответов, описанных здесь (например, Т-клеточная активация/пролиферация, синтез/продукция цитокина, индукция маркеров активации, продукция воспалительных молекул, воспаление, продукция антиколлаген AT, Т-клеточно-зависимый AT ответ), чем мономерный hCTLA-4, мономерный hCTLA-4 ВКД или LEA29Y полипептид.
Изобретение также обеспечивает изолированные или рекомбинантные полипептиды, каждый из которых включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид имеет аффинность связывания к hCD86 ВКД или hCD80 ВКД, которая практически равна или больше, чем аффинность связывания hCTLA-4 ВКД к hCD86 ВКД или hCD80 ВКД соответственно. Некоторые такие полипептиды имеют аффинность связывания к hCD86 ВКД, которая больше, чем аффинность связывания полипептида hCTLA- 4 ВКД (SEQ ID NO:159) или LEA29Y (SEQ ID NO:168) к hCD86 ВКД. Некоторые такие полипептиды имеют аффинность связывания к hCD80 ВКД, которая больше, чем аффинность связывания hCTLA-4 ВКД к hCD80 ВКД. Некоторые такие полипептиды имеют способность подавлять иммунный ответ, в некоторых случаях большую способность подавлять один или несколько иммунных ответов, включая те, которые описаны выше и везде в описании, чем hCTLA-4 ВКД или LEA29Y полипептид.
В другом аспекте данное изобретение обеспечивает вариант изолированного или рекомбинантного CTLA-4 полипептида, включающего аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности человеческого CTLA-4 ВКД, представленной в SEQ ID NO:159 по не более чем 15 аминокислотным остаткам, не более чем 14 аминокислотным остаткам, не более чем 13 аминокислотным остаткам, не более чем 12 аминокислотным остаткам, не более чем 11 аминокислотным остаткам, не более чем 10 аминокислотным остаткам, не более чем 9 аминокислотным остаткам, не более чем 8 аминокислотным остаткам, не более чем 7 аминокислотным остаткам, не более чем 6 аминокислотным остаткам, не более чем 5 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 аминокислотным остаткам), и (b) где аминокислотный остаток в положении 24, 30, 32, 39, 41, 50, 54, 55, 56, 64, 65, 70, 85, 104 или 106 hCTLA-4 ВКД аминокислотной последовательности (SEQ ID NO:159) замещен на другой аминокислотный остаток в последовательности варианта CTLA-4 полипептида, где положения аминокислотных остатков варианта CTLA-4 полипептида пронумерованы в соответствии с SEQ ID NO:159 и где вариант CTLA-4 полипептида имеет способность связывать CD80 или CD86 или внеклеточный домен или фрагмент каждого и/или имеет способность подавлять или ингибировать иммунный ответ. Некоторые такие варианты включают один или несколько (например, один, два, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать, двенадцать, тринадцать, четырнадцать или пятнадцать) аминокислотных замен, выбранных из группы, включающей А24Е, A24S, S25A, G27H, K28N, T30N, T30D, Т30А, V32I, Q39K, Q39E, D41G, D41N, D41S, А50М, A50G, M54K, М54Е, M54V, G55E, G55K, N56D, D63K, S64P, I65S, I65F, I65T, S70F, М85А, M85V, М85А, L104E, L104D, и I106M, I106F и I106L.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мутантный CTLA-4 полипептид, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленной в SEQ ID NO:159, по не более чем 12 аминокислотным остаткам (например, не более чем 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 аминокислотным остаткам), и (b) включает две, три, четыре, пять, шесть, семь, восемь, девять, десять, одиннадцать или 12 аминокислотных замен, выбранных из группы, включающей аминокислотные положения, соответствующие аминокислотным положениям 24, 30, 32, 50, 54, 55, 56, 64, 65, 70 и 104 SEQ ID NO:159, где аминокислотные положения мутантного полипептида CTLA-4 пронумерованы в соответствии с SEQ ID NO:159 и где мутантный полипептид CTLA-4 имеет способность связывать CD80 или CD86 или внеклеточный домен или фрагмент каждого, и/или имеет способность подавлять или ингибировать иммунный ответ. Иллюстративные аминокислотные замены в этих положениях включают, но не ограничиваются следующим, консервативные аминокислотные замены аминокислотных остатков, представленных в ДТ hCTLA-4 ВКД и/или A24S/E (то есть A24S или А24Е), T30N/D/A (то есть T30N, или T30D, или Т30А), V32I/L/M/V, A50M/G, M54E/V/K, G55E/K/R, N56D/A, S64P/M/C, I65S/T/F/V, S70F/Y/W, L104E/M или любая комбинация этих замен.
В другом аспекте данное изобретение обеспечивает изолированные или рекомбинантные полипептиды (например, мутантные полипептиды CTLA-4 ВКД), каждый из которых включает аминокислотную последовательность, (а), которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислотному остатку(ам), и (b) где аминокислотный остаток в аминокислотной последовательности в положении аминокислотных остатков 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной выбранной аминокислотной последовательности (например, полипептид, выбранный из SEQ ID NOS:1-73), где полипептид связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих, и/или ингибирует иммунный ответ(ы). В некоторых случаях полипептид отличается от выбранного полипептида (например, выбранного из SEQ ID NOS:1-73) по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), но аминокислота, занимающая один или несколько из положений аминокислотных остатков 41, 50, 54, 55, 56, 64, 65, 70, и 85, идентична аминокислотному остатку, включенному в это положение в выбранной аминокислотной последовательности (например, выбранной из SEQ NOS:1-73), и не удаляется или замещается другой аминокислотой. Некоторые такие полипептиды включают аминокислотную последовательность, которая отличается от выбранной аминокислотной последовательности по не более чем 10, 9, 8, 7 или 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам) и которая включает аминокислотные остатки в одном или нескольких положениях аминокислотных остатков 24, 30, 32, 41, 50, 54, 55, 56, 64, 65, 70, 85, 104 и 106, которые идентичны аминокислотным остаткам в соответствующих положениях в выбранной аминокислотной последовательности. Такие полипептиды могут отличаться от выбранной аминокислотной последовательности на аминокислотную делецию(и), дополнение(я) и/или аминокислотную замену(ы) в положении(ях), которые не характеризуются тем, что имеют аминокислоту, идентичную той, которая находится в выбранной последовательности. Такие полипептиды, имеющие аффинность связывания или авидность к hCD86 или его фрагменту (например, hCD86 ВКД), которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность полипептида hCTLA-4 ВКД или LEA29Y к hCD86 или его фрагменту (например, ВКД) соответственно, включены. Некоторые такие полипептиды имеют аффинность связывания или авидность к hCDSO или его фрагменту (например, hCDSO ВКД), которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность полипептида hCTLA-4 ВКД к hCD80 или его фрагменту соответственно. Некоторые такие полипептиды включают аминокислотную последовательность, имеющую длину, приблизительно равную аминокислотной длине hCTLA-4 ВКД, например, 118-130, 119-129, 120-128, 121-127, 122-126, 123-125, или 124 аминокислотных остатка в длину.
Некоторые такие полипептиды способны подавлять один или несколько из множества иммунных ответов, включая, например, Т-клеточную активацию, Т-клеточную пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептор), воспаление, продукцию воспалительных молекул, продукцию антиколлагеновых AT, и/или Т-клеточно-зависимый AT ответ(ы)). Некоторые такие полипептиды имеют большую способность ингибировать один или несколько таких иммунных ответов, чем полипептид hCTLA-4, hCTLA-4 ВКД или полипептид LEA29Y. Например, некоторые такие полипептиды способны ингибировать Т-клеточную активацию или Т-клеточную пролиферацию в анализах in vitro. Примеры 4-9, например, сравнивают способность репрезентативных слитых белков по данному изобретению, включающих мутантную аминокислотную последовательность CTLA-4 ВКД по данному изобретению ингибировать Т-клеточную пролиферацию in vitro относительно способности слитого белка, включающего полипептид hCTLA-4 ВКД или LEA29Y, делать это. Некоторые такие полипептиды способны ингибировать или подавлять иммунный ответ у субъекта in vivo, а именно через введение терапевтически или профилактически эффективного количества, по меньшей мере, одного такого полипептида субъекту, нуждающемуся в иммуносупрессорной терапии. Предполагают, что такие полипептиды пригодны для различных применений, включая, например, но не ограничиваясь следующим, профилактические и/или терапевтические способы лечения заболеваний, нарушений и состояний иммунной системы, при которых подавление иммунного ответа является желательной, включая, например, профилактические и/или терапевтические способы лечения аутоиммунных заболеваний и нарушений, способы ингибирования отторжения ткани или органа, пересаженных от донора реципиенту (например, млекопитающему, такому как, например, человек), и другие способы, описанные в данном описании.
В другом аспекте данное изобретение обеспечивает изолированные или рекомбинантные полипептиды (например, мутантные полипептиды CTLA-4 ВКД), каждый из которых включает аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленной в SEQ ID NO:159 по не более чем 10 аминокислотным остаткам, не более чем 9 аминокислотным остаткам, не более чем 8 аминокислотным остаткам, не более чем 7 аминокислотным остаткам, не более чем 6 аминокислотным остаткам, не более чем 5 аминокислотным остаткам, не более чем 4 аминокислотным остаткам, не более чем 3 аминокислотным остаткам, не более чем 2 аминокислотным остаткам или не более чем 1 аминокислотному остатку (например, не более чем 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену в положении аминокислотных остатков, соответствующему положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно аминокислотной последовательности SEQ ID NO:159, где полипептид связывает hCD80 и/или hCD86 и/или ВКД каждого или обоих, и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора), воспаление, продукцию воспалительных молекул, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ), в таких как in vitro и/или in vivo способы и/или анализы, как описано более детально ниже. Некоторые такие полипептиды включают аминокислотную последовательность длиной в 124 аминокислотных остатков. Некоторые такие полипептиды включают 2, 3, 4, 5 или 6 аминокислотных замен в положениях относительно аминокислотной последовательности, представленной в SEQ ID NO:159, выбранных из группы, включающей положение аминокислотных остатков 50, 54, 55, 56, 64, 65, 70 и 85. Некоторые такие полипептиды также включают аминокислотную замену в положении аминокислотных остатков, соответствующем положению 104 и/или 30 относительно SEQ ID NO:159. Некоторые такие полипептиды включают, по меньшей мере, одну аминокислотную замену относительно SEQ ID NO:159 в положении 70 (необязательно S70F), положении 64 (необязательно S64P), положении 50 (необязательно A50M/G, например, А50М, A50G), положении 54 (необязательно M54K/V, например, М54К), положении 65 (необязательно I65S), положении 56 (необязательно N56D), положении 55 (необязательно G55E/K, например, G55E, G55K), положении 85 (необязательно М85А) и/или положении 24 (необязательно A24E/S, например, А24Е). Любой такой полипептид может также включать аминокислотную замену относительно SEQ ID NO:159 в положении 104 (необязательно L104E/D, например, L104E), положении 30 (необязательно T30N/D/A, например, T30N, T30D или Т30А) и/или положении 32 (необязательно V32I). В некоторых случаях полипептид включает одну или несколько замен в аминокислотном положении относительно SEQ ID NO:159, выбранных из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F. Некоторые такие полипептиды проявляют аффинность связывания к CD86 (например, hCD86) или CD86 ВКД (например, hCD86 ВКД), которая практически равна или больше, чем аффинность связывания мономерного hCTLA-4 ВКД к CD86 или CD86 ВКД соответственно. Некоторые такие полипептиды проявляют аффинность связывания к CD80 (например, hCD80) или CD80 ВКД (например, hCD80 ВКД), которая больше, чем аффинность связывания мономерного hCTLA-4 ВКД к CD80 или CD80 ВКД соответственно.
Некоторые такие полипептиды имеют способность подавлять или ингибировать один или несколько иммунных ответов (например, Т-клеточную активацию или пролиферацию, продукцию цитокина и т.п.), таких как in vitro и/или in vivo. Некоторые такие полипептиды ингибируют один или несколько таких иммунных ответов в большей степени, чем полипептид hCTLA-4, hCTLA-4 ВКД или LEA29Y. Предполагается, что такие полипептиды имеют эффективное применение в различных терапевтических сферах применения, включая профилактические и/или терапевтические способы лечения аутоиммунных заболеваний и нарушений или профилактические и/или терапевтические способы для ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает изолированные или рекомбинантные полипептиды (например, мутантные полипептиды CTLA-4 ВКД), каждый из которых включает аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человека CTLA-4, представленной в SEQ ID NO:159, по не более чем 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5 или 6 аминокислотным остаткам), и (b) включает один или несколько замен в аминокислотных положениях относительно SEQ ID NO:159, выбранных из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F, где полипептид связывает hCD80 и/или hCD86 или внеклеточный домен каждого или обоих, и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина, индукцию маркеров активации, продукцию воспалительных молекул, воспаление, опухание сустава или болезненность, боль, тугоподвижность, уровни в сыворотке C-реактивного белка, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ и т.п.) в in vitro исследованиях и/или in vivo способах. Предполагают, что такие полипептиды пригодны для лечения субъекта, страдающего от заболевания, нарушения или состояния, при котором иммуносупрессорная терапия была бы эффективна, включая, например, терапевтические и профилактические способы лечения аутоиммунных заболеваний и нарушений и профилактические и терапевтические способы ингибирования отторжения трансплантата органа, клетки или ткани.
Изобретение также включает изолированный или рекомбинантный полипептид, который включает аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с любой аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73, где полипептид связывает hCD80 и/или hCD86 или его внеклеточный домен и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина, индукцию маркеров активации, продукцию воспалительных молекул, воспаление, опухание сустава или болезненность, боль, тугоподвижность, уровни в сыворотке C-реактивного белка, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ и т.п.) в in vitro исследованиях и/или in vivo способах. Некоторые такие полипептиды включают один или несколько из следующего относительно выбранной последовательности: остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 24; остаток аспарагина в аминокислотном положении, соответствующем положению 30; остаток изолейцина в аминокислотном положении, соответствующем положению 32; остаток метионина в аминокислотном положении, соответствующем положению 50; остаток лизина в аминокислотном положении, соответствующем положению 54; остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 55; остаток аспарагиновой кислоты в аминокислотном положении, соответствующем положению 56; остаток пролина в аминокислотном положении, соответствующем положению 64; остаток серина в аминокислотном положении, соответствующем положению 65; и остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 104. Предполагают, что такие полипептиды имеют эффективное применение в различных сферах применения, включая способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
Например, в одном неограничивающем аспекте данное изобретение включает изолированный или рекомбинантный полипептид (например, мутантный CTLA-4 ВКД), который включает аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью SEQ ID NO:24 и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 аминокислотной последовательности SEQ ID NO:24, где полипептид связывает hCD80 и/или hCD86 и/или ВКД каждого или обоих, и/или ингибирует иммунный ответ in vitro и/или in vivo. Полипептид может включать, по меньшей мере, один из следующего относительно SEQ ID NO:24: остаток глутаминовой кислоты в положении 24; остаток аспарагина в положении 30; остаток изолейцина в положении 32; остаток метионина в положении 50; остаток лизина в положении 54; остаток глутаминовой кислоты в положении 55; остаток аспарагиновой кислоты в положении 56; остаток пролина в положении 64; остаток серина в положении 65; и остаток глутаминовой кислоты в положении 104.
Изобретение также включает изолированный или рекомбинантный полипептид (например, мутантный полипептид CTLA-4 ВКД), который связывает hCD80 и/или hCD86 (и/или ВКД каждого или обоих) и/или ингибирует иммунный ответ (как описано выше), например, in vitro и/или in vivo, где полипептид включает аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности человеческого CTLA-4 ВКД полипептида, представленной в SEQ ID NO:159 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену, где указанная, по меньшей мере, аминокислотная замена включает S70F, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:159. Полипептид может также включать, по меньшей мере, одну аминокислотную замену, выбранную из группы, включающей А24Е, T30N, V32I, D41G, А50М, M54K, G55E, N56D, S64P, I65S, M85A, L104E и I106F. Предполагают, что такие полипептиды имеют эффективное применение в различных сферах применения, включая способы лечения аутоиммунных заболеваний и способы ингибирования отторжения трансплантата органа, клетки или ткани.
Изобретение также включает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, представленной в SEQ ID NO:31 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, один из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31, и полипептид связывает CD80 и/или CD86 и/или ВКД каждого или обоих, и/или ингибирует иммунный ответ, как описано выше in vitro и/или in vivo. Полипептид может включать остаток глутаминовой кислоты в положении, соответствующем положению 104, остаток аспарагиновой кислоты в положении, соответствующем положению 30 и/или остаток изолейцина в положении, соответствующем положению 32 SEQ ID NO:31. Предполагают, что такие полипептиды имеют эффективное применение в различных сферах применения, включая способы лечения ревматизмов и нарушения и способы ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, который включает аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:36-46 и 55, и (ii) остаток глутаминовой кислоты в аминокислотном положении 55 указанной выбранной аминокислотной последовательности, где полипептид связывает CD80 и/или CD86 или внеклеточный домен каждого или обоих и/или подавляет иммунный ответ. Иммунные ответы, которые могут быть подавлены, включают, например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора), воспаление, продукцию воспалительных молекул, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ). Такая аминокислотная последовательность может также включать остаток фенилаланина в аминокислотном положении 70. Такая аминокислотная последовательность может также включать остаток пролина в положении 64 и/или остаток аспарагина в положении 30. Такая аминокислотная последовательность может также включать остаток метионина в положении 50 и/или остаток лизина в положении 54.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, который включает аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98% или 99% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:28, 30, 36-46, 55-57 и 65-73, и (ii) остаток глутаминовой кислоты в аминокислотном положении 55 указанной выбранной аминокислотной последовательности, где полипептид связывает CD80 и/или CD86 или внеклеточный домен каждого или обоих и/или подавляет иммунный ответ, такой как Т-клеточная активация или пролиферация, синтез или продукция цитокина (например, продукция TNF-α, IFN-γ, IL-2), индукция маркеров активации (например, CD25, IL-2 рецептор), воспаление, продукция воспалительных молекул, продукция антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ. Такая аминокислотная последовательность может также включать остаток фенилаланина в аминокислотном положении 70. Такая аминокислотная последовательность может также включать остаток пролина в положении 64 и/или остаток аспарагина в положении 30. Такая аминокислотная последовательность может также включать остаток метионина в положении 50 и/или остаток лизина в положении 54.
Любой полипептид по данному изобретению, описанный выше, может также включать пептид, который облегчает секрецию указанного полипептида. Таким образом, в одном аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий (а) любой полипептид, как описано выше (например, мутантный CTLA-4 ВКД, описанный выше), и (b) пептид, который облегчает секрецию экспрессирующегося полипептида из клетки-хозяина. Пептид является необязательно сигнальным пептидом. С-конец сигнального пептида обычно ковалентно связан с N-концом полипептида. Сигнальный пептид может включать аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:182 или SEQ ID NO:216. Сигнальный пептид может включать аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, включающей аминокислотные остатки 1-35, 1-36 или 1-37 SEQ ID NO:160.
Любой полипептид по данному изобретению, описанный выше, может также включать трансмембранный домен и/или цитоплазматический домен. Таким образом, в одном аспекте данное изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий (а) любой полипептид по данному изобретению, описанный выше (например, мутантный CTLA-4 ВКД, описанный выше), и (b) трансмембранный домен. Такой белок может необязательно также включать сигнальный пептид, как описано выше, где С-конец сигнального пептида ковалентно соединен с N-концом полипептида по данному изобретению. С-конец сигнального пептида обычно ковалентно соединен с N-концом трансмембранного домена. С-конец трансмембранного домена обычно ковалентно соединен с N-концом цитоплазматического домена. В некоторых случаях трансмембранный домен включает аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, включающей аминокислотные остатки 162-182 SEQ ID NO:160. В некоторых случаях цитоплазматический домен включает аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, включающей аминокислотные остатки 183-223 SEQ ID NO:160. Любой из вышеописанных полипептидов может включать один или несколько аминокислотных остатков, которые гликозилированы или пегилированы.
Изобретение также включает мультимеры изолированного или рекомбинантного полипептида, включающие два или более полипептидов, где, по меньшей мере, один из полипептидов мультимера является мутантным полипептидом CTLA-4 по данному изобретению, как описано здесь (например, мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig). Такой мультимер включает, по меньшей мере, один полипептид по данному изобретению и может также содержать, по меньшей мере, один дополнительный полипептид, который не должен быть полипептидом по данному изобретению. Например, мультимер может включать, по меньшей мере, один полипептид по данному изобретению и, по меньшей мере, один другой полипептид, который может быть, например, полипептидом дикого типа (например, hCTLA-4 ВКД или hCTLA-4-Ig) и/или, по меньшей мере, другой мутантный полипептид (такой как мутантный полипептид, который не является полипептидом по данному изобретению). Некоторые или все полипептиды в мультимере (или мультимерном полипептиде) могут быть идентичны друг другу, или в некоторых случаях все полипептиды в мультимере могут отличаться друг от друга. В некоторых случаях полипептидный мультимер - это димер, включающий два полипептида по данному изобретению, которые необязательно могут быть идентичными полипептидами (то есть гомодимер) или различными полипептидами (то есть гетеродимер). В некоторых случаях полипептидный мультимер - это тетрамер, включающий четыре полипептида по данному изобретению. Тетрамер может включать четыре идентичных полипептида (то есть, гомотетрамер) или любую комбинацию четырех полипептидов по данному изобретению, где, по меньшей мере, один полипептид не идентичен другим трем полипептидам (то есть, гетеротетрамер). Изобретение также включает тетрамер, включающий четыре идентичных полипептида ДТ CTLA-4 ВКД (например, hCTLA-4 ВКД) или четыре идентичных ДТ CTLA-4-Ig (например, hCTLA-4-Ig). В некоторых случаях мультимер способен ввязывать CD80 и/или CD86 (или ВКД каждого или обоих) и/или подавлять или ингибировать иммунный ответ в in vitro и/или in vivo способах (например, Т-клеточную пролиферацию или активацию, продукцию цитокина и т.п.). Некоторые такие мультимеры имеют большую способность подавлять или ингибировать иммунный ответ in vitro и/или in vivo, чем hCTLA-4 или hCTLA-4-Ig (например, hCTLA-4-IgG2 или белок Orencia®). Полипептиды мультимеров могут быть соединены вместе, например, ковалентными мостиками, например, через посредство дисульфидных связей между одним или несколькими остатками цистеина в одном или нескольких полипептидах.
Некоторые такие тетрамеры по данному изобретению включают структуру, схематически сходную с таковой у антитела, но в которой каждый из вариабельных доменов антитела замещен на любой мутантный полипептид CTLA-4 ВКД по данному изобретению, описанный здесь. Тяжелая цепь антитела включает вариабельный домен (VH) тяжелой цепи, слитый с иммуноглобулиновым (Ig) CH1 доменом (например, IgG2 СН1), который слит с шарниром. Шарнир слит с Ig CH2 доменом (например, IgG2 СН2), который слит с Ig CH3 доменом (например, IgG2 СН3). Легкая цепь антитела включает вариабельный домен (VL) легкой цепи, слитый с Ig С каппа (Ck) или С лямбда (Сλ) доменом. Две тяжелые цепи и две легкие цепи ковалентно соединены вместе одной или несколькими дисульфидными связями, сформированными остатками цистеина в тяжелых и легких цепях. Данное изобретение включает мутантный CTLA-4 тетрамер, в котором каждый из вариабельных доменов тяжелых и легких цепей замещен на мутантный полипептид CTLA-4 ВКД по данному изобретению. Таким образом, такой тетрамер включает две легкие цепи и две тяжелые цепи. Каждая легкая цепь включает мутантный полипептид CTLA-4 ВКД, слитый с Ig Сκ или Сλ доменом. Каждая тяжелая цепь включает мутантный CTLA-4 ВКД, слитый с Ig CH1 доменом (например, IgG2 CH1), который слит с шарниром. Шарнир слит с Ig CH2 доменом (например, IgG2 CH2), который слит с Ig СН3 доменом (например, IgG2 СН3). Две тяжелые цепи и две легкие цепи ковалентно соединены вместе одной или несколькими дисульфидными связями, сформированными остатками цистеина в тяжелых и легких цепях. Такой тетрамер может быть описан как тетрамер CTLA-4-Ig. Способы для составления такого тетрамера CTLA-4-Ig являются известными и будут понятны для специалистов в данной области. Тетрамерный CD4-Ig кострукт, который включает полипептид CD4 и который нейтрализует первичные изоляты ВИЧ типа 1, описан в Allaway, G. Р. et al., AIDS Res. Hum. Retroviruses 11(5):533-9 (1995). Тетрамер может включать четыре идентичных четырем мутантным полипептидам CTLA-4 ВКД или любую комбинацию четырех мутантных полипептидов CTLA-4 ВКД по данному изобретению так, что, по меньшей мере, один мутантный CTLA-4 ВКД не идентичен другим трем мутантным полипептидам CTLA-4 ВКД. Некоторые такие тетрамеры способны связывать CD80 и/или CD86 с большей авидностью связывания, чем hCTLA-4 (или hCTLA-4-Ig). Некоторые такие тетрамеры способны подавлять или ингибировать иммунный ответ; в некоторых случаях такой тетрамер имеет большую способность подавлять или ингибировать иммунный ответ в in vitro исследованиях или in vivo применениях (например, Т-клеточная пролиферация или активация, продукция цитокина и т.п.), чем hCTLA-4 или hCTLA-4-Ig (например, hCTLA-4-IgG2 или Orencia®). Предполагают, что мультимеры по данному изобретению имеют эффективное применение в различных сферах применения, включая способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
Изобретение также включает изолированные или рекомбинантные конъюгатные мультимеры, включающие два или более конъюгатов, где, по меньшей мере, один из конъюгатов является конъюгатом по данному изобретению, который включает мутантный полипептид CTLA-4 по данному изобретению (например, мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig). Некоторые или все конъюгаты в мультимере могут быть идентичны друг другу, или все конъюгаты в мультимере могут отличаться друг от друга. В некоторых случаях конъюгатный мультимер - это димер, включающий два конъюгата или тетрамер, включающий четыре конъюгата по данному изобретению. Некоторые такие конъюгатные мультимеры способны связывать CD80 и/или CD86 (или ВКД каждого или обоих) и/или подавлять или ингибировать иммунный ответ in vitro и/или in vivo. Конъюгатные молекулы в мультимерах могут быть соединены вместе, например, ковалентными мостиками, например, посредством дисульфидных связей между одним или несколькими остатками цистеина в одном или нескольких конъюгатах.
Данное изобретение включает изолированный или рекомбинантный димер полипептида, включающий любые два полипептида по данному изобретению, описанные выше (например, мутантный CTLA-4 ВКД, описанный выше), где димер имеет авидность связывания к человеческому CD86 или его внеклеточному домену, которая практически равна или больше, чем авидность связывания димера, включающего два внеклеточных домена человеческого CTLA-4, к человеческому CD86 или его внеклеточному домену соответственно.
Данное изобретение включает изолированные или рекомбинантные полипептидные димеры, включающие два полипептида по данному изобретению, описанные выше (например, мутантный CTLA-4 ВКД, описанный выше), где димер имеет авидность связывания к hCD80 или его ВКД, которая практически равна или больше, чем авидность связывания димера, включающего два полипептида hCTLA-4 ВКД (SEQ ID NO:159), к hCD80 или его ВКД соответственно. Например, в неограничивающем аспекте димер может включать два полипептида, где каждый полипептид включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и каждый полипептид связывает hCD80 и/или hCD86 и/или ингибирует иммунный ответ. В другом неограничивающем аспекте димер может включать два полипептида, где каждый полипептид отличается от аминокислотной последовательности hCTLA-4 ВКД (SEQ ID NO:159) по не более чем 6 аминокислотным остаткам и включает, по меньшей мере, одну замену в аминокислотном положении относительно SEQ ID NO:159, выбранную из группы, включающей А30М, M54K, G55E, N56D, S64P, I65S и S70F; причем полипептид необязательно также включает замену L104E, и каждый полипептид связывает hCD80 и/или hCD86 и/или ингибирует иммунный ответ.
В некоторых случаях димер имеет авидность связывания к hCD80 или его ВКД, которая практически равна или больше, чем авидность связывания димера, включающего два полипептида hCTLA-4 ВКД, к hCD80 или его ВКД соответственно. В некоторых случаях димер имеет авидность связывания к hCD86 или его ВКД, которая больше, чем авидность связывания димера, включающего два полипептида LEA29Y, к hCD86 или его ВКД соответственно, где каждый полипептид LEA29Y включает аминокислотную последовательность, представленную в SEQ ID NO:168. В некоторых случаях димер диссоциирует от связывающего hCD86 или его ВКД со скоростью, которая меньше, чем скорость, при которой димер, включающий два полипептида hCTLA-4 ВКД, диссоциирует от связывающего hCD86 или его ВКД соответственно. В некоторых случаях димер диссоциирует от связывающего hCD86 или его ВКД со скоростью, которая меньше, чем скорость, при которой димер, включающий два полипептида LEA29Y, диссоциирует от связывающего hCD86 или его ВКД соответственно, где каждый полипептид LEA29Y включает аминокислотную последовательность, представленную в SEQ ID NO:168.
В некоторых случаях димер ассоциирует с hCD86 или его ВКД со скоростью, которая больше, чем скорость, при которой димер, включающий два hCTLA-4 ВКД полипептида, ассоциирует с hCD86 или его ВКД соответственно. В некоторых случаях димер ассоциирует с hCD86 или его ВКД со скоростью, которая больше, чем скорость, при которой димер, включающий два LEA29Y полипептида, ассоциирует с hCD86 или его ВКД соответственно, где каждый LEA29Y полипептид включает аминокислотную последовательность, представленную в SEQ ID NO:168.
В некоторых случаях такой димер, включающий мутантный CTLA-4 ВКД, имеет большую способность подавлять иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина и т.п.), чем димер, включающий два внеклеточных домена человеческого CTLA-4 или два полипептида LEA29Y.
Некоторые такие димеры имеют равновесную константу диссоциации CD86 (KD), которая меньше, чем равновесная константа диссоциации CD86 (KD) димера, включающего два полипептида hCTLA-4 ВКД или два полипептида LEA29Y. Некоторые такие димеры имеют равновесную константу диссоциации CD86 (KD), которая меньше, чем равновесная константа диссоциации CD86 (KD) димера, включающего два полипептида LEA29Y, причем каждый полипептид LEA29Y включает аминокислотную последовательность, представленную в SEQ ID NO:168.
Некоторые такие мультимеры, включающие, по меньшей мере, два полипептида по данному изобретению (например, димер, включающий два мутантных полипептида CTLA-4 ВКД по данному изобретению) имеют усиленную способность подавлять иммунный ответ по сравнению с мультимером полноразмерного hCTLA-4 той же валентности (то есть мультимер, включающий то же число полноразмерных CTLA-4 полипептидов). Некоторые такие мультимеры, включающие, по меньшей мере, два полипептида по данному изобретению имеют усиленную способность подавлять иммунный ответ по сравнению с мультимером hCTLA-4 ECCD той же валентности (то есть мультимер, включающий то же число полипептидов hCTLA-4 ВКД).
Любой полипептид по данному изобретению, описанный выше, может также включать дополнительную аминокислотную последовательность, которая усиливает растворимость, такую как иммуноглобулиновая (Ig) аминокислотная последовательность, тем самым, формируя, например, растворимый слитый белок, как обсуждается более детально ниже. Каждый полипептид полипептидного мультимера может также включать дополнительную аминокислотную последовательность, которая усиливает растворимость, такую как Ig аминокислотная последовательность, тем самым формируя, например, растворимый слитый белок. Таким образом, например, каждый полипептид димера, включающий два или более полипептидов по данному изобретению, как описано выше, может также включать дополнительную аминокислотную последовательность, которая усиливает растворимость, такую как Ig аминокислотная последовательность, тем самым, формируя, например, растворимый слитый белок.
Предполагают, что такие полипептиды и димеры по данному изобретению являются эффективными для применения в различных сферах применения, включая способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
Как обсуждалось ранее, последовательность зрелого белка hCTLA-4 обычно начинается с остатка метионина в аминокислотном положении 38 последовательности полноразмерного белка hCTLA-4, представленной в SEQ ID NO:160, и аминокислотные остатки последовательности зрелого белка hCTLA-4 обычно нумеруются, начиная с этого остатка метионина как первой аминокислоты (то есть занимающей аминокислотное положение 1).
Некоторые мутантные полипептиды CTLA-4 по данному изобретению (включая мономерные и димерные слитые белки и мультимерные полипептиды) включают, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем аминокислотному положению в последовательности зрелого белка hCTLA-4, которое находится за пределами классической hCTLA-4/hB7-2 связывающей области (смотри, например, Schwartz et al., Nature 410:604-608 (2001)), включая, но не ограничиваясь следующим, например, любые из аминокислотных положений 24, 41, 54, 55, 56, 64, 65, 70 и 85. В общем, специалист в данной области не мог бы предположить, что аминокислотная замена в любом из вышеперечисленных положений (24, 41, 54, 55, 56, 64, 65, 70 и/или 85) или любая комбинация одной или нескольких замен, выбранных из группы положений 24, 41, 54, 55, 56, 64, 65, 70 и 85, будет иметь способность усиливать аффинность связывания или авидность hCTLA-4 к hB7-2, будет иметь усиленную способность ингибировать взаимодействие СВ28-позитивных с В7-2-позитивными клетками или будет обеспечивать большую способность подавлять или ингибировать иммунный ответ, чем, например, hCTLA-4 ВКД или hCTLA-4-Ig (например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина, индукцию маркеров активации, синтез или продукцию воспалительных молекул, продукцию антиколлагеновых антител, Т-клеточно-зависимый ответ антитела и подобное). Также специалист в данной области не мог бы предположить, что конкретная аминокислотная замена(ы) или комбинация конкретных аминокислотных замен, описанных здесь, в любом из вышеперечисленных положений (24, 41, 54, 55, 56, 64, 65, 70 и/или 85) или любая комбинация таких положений будет иметь способность усиливать аффинность связывания или авидность hCTLA-4 к hB7-2, иметь усиленную способность ингибировать взаимодействие СВ28-позитивных с В7-2-позитивными клетками или обеспечивать большую способность подавлять или ингибировать иммунный ответ, чем, например, hCTLA-4 ВКД или hCTLA-4-Ig.
Мутантные CTLA-4 слитые белки
Изобретение также обеспечивает новые изолированные и рекомбинантные слитые белки, которые включают первый полипептид, который, по меньшей мере, является одним из полипептидов по данному изобретению, описанных выше и везде в данном описании (такие как мутантный полипептид CTLA-4 по данному изобретению, такой как, например, мутантный полипептид CTLA-4 ВКД) связан или слит со вторым полипептидом, тем самым формируя слитый белок. Второй полипептид обычно облегчает секрецию или экспрессию первого полипептида. Иллюстративные мутантные полипептиды CTLA-4 ВКД включают те, которые включают последовательности, определенные как SEQ ID NOS:1-73. Данное изобретение включает слитые белки, включающие иммуноглобулиновые (Ig) домены, такие как Ig Fc домены, слитые или прикрепленные биологически активные части по данному изобретению, такие как мутантные полипептиды CTLA-4 по данному изобретению. Предполагают, что слитые белки по данному изобретению пригодны как профилактические и/или терапевтические агенты для профилактического и/или терапевтического лечения различных заболеваний и нарушений, а также состояний иммунной системы, при которых иммуномодуляция и/или иммуносупрессия является эффективной, в диагностических исследованиях и для приготовления медикаментов или агентов, имеющих иммуномодулирующие и/или иммуносупрессорные активности или свойства, как описано более детально в данном описании.
Слитые белки по данному изобретению, включающие мутантный полипептид CTLA-4 и полипептид Ig (например, Ig Fc), обычно называются мутантные слитые белки CTLA-4-Ig. Любые слитые белки по данному изобретению, включая мономерные и димерные слитые белки по данному изобретению, описанные более детально ниже и в примерах, могут включать в качестве Ig полипептид, такой как, например, полипептид Ig Fc, как описано здесь и везде в данном изобретении ниже и выше. Второй полипептид может быть соединен прямо с первым полипептидом. Например, N-конец второго полипептида (например, Ig полипептид, такой как Ig Fc полипептид) может быть ковалентно слит прямо с С-концом первого полипептида по данному изобретению (например, мутантный полипептид CTLA-4 ВКД). Альтернативно, второй полипептид может быть соединен косвенно с первым полипептидом, таким, в котором линкерная аминокислотная последовательность, включающая 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более аминокислотных остатков, включается между первым и вторым полипептидами. В случаях, когда линкер включен, N-конец аминокислотной линкерной последовательности обычно ковалентно слит с С-концом первого полипептида (например, мутантный CTLA-4 ВКД), и N-конец второго полипептида (например, Ig полипептид, такой как Ig Fc) обычно ковалентно слит с С-концом аминокислотной линкерной последовательности.
В некоторых случаях второй полипептид включает, по меньшей мере, часть Ig полипептида, такую как, например, один или несколько доменов Ig константной области тяжелой цепи. Второй полипептид может включать как шарнир, СН2 домен и СН3 домен полипептида Ig. В некоторых случаях второй полипептид включает Fc домен полипептида Ig ДТ (а именно полипептид Ig Fc ДТ), такой как, например, Fc домен человеческого полипептида Ig ДТ (а именно человеческий полипептид Ig Fc ДТ). Как обсуждается в данном описании, Ig полипептид может быть из разных видов, включая, например, млекопитающее, например, человека, мышь, примата, не являющегося человеком (например, мартышка, горилла), кошку, собаку, лошадь и т.п., и может быть из разных классов (например, IgG, IgM, IgE и т.п.) и подклассов (например, для IgG включают IgG1, IgG2, IgG4 и т.п.), и может включать Fc домен или часть любого такого Ig полипептида. Аминокислотные последовательности и последовательности нуклеиновых кислот Ig полипептидов таких различных видов известны в данной области техники.
В одном аспекте данное изобретение обеспечивает новые изолированные или рекомбинантные слитые белки, каждый из которых включает изолированный или рекомбинантный мутантный полипептид CTLA-4 по данному изобретению, описанный выше (например, мутантный CTLA-4 ВКД), ковалентно связанный или слитый, напрямую или косвенно (посредством аминокислотной линкерной последовательности), на его С-конце с N-концом полипептида Ig Fc, а именно, Fc домен полипептида Ig. Любой из слитых белков по данному изобретению, включая мономерные и димерные мутантные слитые белки CTLA-4-Ig по данному изобретению, описанные более детально ниже и в примерах, может включать полипептид Ig Fc, как описано здесь и везде выше и ниже в данном описании. Полипептид Ig Fc обычно включает шарнирную область, СН2 домен и СН3 домен полипептида Ig. Полипептид Ig Fc может происходить от разных видов, включая, например, человека, мышь, примата и т.п., и может включать Ig Fc полипептид дикого типа (например, IgG1, IgG2 или IgG4 ДТ). Иллюстративные человеческие IgG Fc полипептиды включают, например, но не ограничиваются следующим, человеческий IgG1, человеческий IgG2, человеческий IgG4 и т.п. Аминокислотная последовательность иллюстративного человеческого IgG1 Fc представлена в SEQ ID NO:185. Аминокислотные последовательности иллюстративных человеческих полипептидов IgG2 Fc представлены в SEQ ID NOS:184 и 218 соответственно. Альтернативно, полипептид Ig Fc может включать мутантный полипептид Ig. Например, мутантный IgG1 Fc, в котором один или несколько остатков цистеина замещены на другую аминокислоту (например, остаток серина), тем самым удаляя одну или несколько дисульфидных связей, сформированных между двумя Ig цепями или в котором один или несколько остатков пролина замещены на другую аминокислоту (например, пролин) для снижения эффекторной функции (сниженное Fc рецепторное связывание), могут включаться в мутантный слитый белок CTLA-4-Ig. Аминокислотная последовательность иллюстративного мутантного полипептида IgG1 Fc показана в SEQ ID NO:186. Данное изобретение включает изолированный или рекомбинантный слитый белок, такой как мутантный димер CTLA-4-Ig или мутантный CTLA-4-Ig мономер, который включает, по меньшей мере, один рекомбинантный мутантный полипептид CTLA-4, описанный выше, связанный на его С-конце с N-концом рекомбинантного полипептида Ig Fc, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184 (человеческий полипептид IgG2 Fc), 185 (человеческий полипептид IgG1 Fc), 186 (мутантный полипептид IgG1 Fc) и 218 (человеческий полипептид IgG2 Fc без С-терминального остатка лизина (K)).
В одном аспекте предполагаемая аминокислотная последовательность мутантного слитого белка CTLA-4-Ig по данному изобретению включает следующие сегменты: последовательность сигнального пептида, которая облегчает секрецию слитого белка (например, сигнальный пептид hCTLA-4 (SEQ ID NO:182 или SEQ ID NO:216)); мутантный полипептид CTLA-4 ВКД, причем мутантный полипептид CTLA-4 ВКД типично, но не обязательно, включает от около 118 до 130 аминокислотных остатков, и обычно около 124 аминокислотных остатков в длину; и Ig Fc полипептид. Иллюстративные мутантные полипептиды CTLA-4 ВКД включают те, что описаны выше и ниже. В некоторых случаях не включено ни одной аминокислотной линкерной последовательности между С-концом мутантного полипептида CTLA-4 ВКД и N-концом человеческого полипептида Ig Fc; то есть С-конец мутантного полипептида CTLA-4 ВКД ковалентно слит напрямую с N-концом полипептида Ig Fc в мутантном слитом белке CTLA- 4-Ig. При необходимости, тем не менее мутантный CTLA-4-Ig может включать линкер (например, один или несколько аминокислотных остатков) между С-концом мутантного полипептида CTLA-4 ВКД и N-концом человеческого полипептида Ig Fc. Сигнальный пептид предполагаемого мономерного мутантного слитого белка CTLA-4-Ig по данному изобретению обычно отщепляется от N-конца мутантного слитого белка CTLA-4 Ig в ходе процессинга и, таким образом, зрелый или секретируемый из мутантного слитого белка CTLA-4-Ig по данному изобретению обычно не включает последовательность сигнального пептида. Димер слитого белка, включающий два таких мономерных мутантных слитых белка CTLA-4-Ig, обычно формируется в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между (1) остатками цистеина в мутантном CTLA-4 ВКД и IgG2 Fc одного такого мономерного слитого белка и (2) остатками цистеина в мутантном CTLA-4 ВКД и IgG2 Fc второго (обычно, но не обязательно идентичного) мономерного слитого белка.
Данное изобретение включает димерные слитые белки (также имеющие название димер слитого белка), каждый из которых включает два мономерных слитых белка по данному изобретению. Димер может включать два идентичных или различных мономерных слитых белка. Димерный слитый белок формирован с помощью связи(ей) между двумя мономерными слитыми белками. Димерный слитый белок, включающий два таких мономерных слитых белка, обычно формируется в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между остатками цистеина в одном мономерном слитом белке и остатками цистеина во втором мономерном слитом белке. Таким образом, в некоторых случаях мутантный слитый белок CTLA-4-Ig по данному изобретению экспрессируется как димер, включающий два мономерных слитых белка по данному изобретению.
В одном аспекте данное изобретение обеспечивает изолированный или рекомбинантный димерный мутантный слитый белок CTLA-4-Ig, включающий два мономерных слитых белка, где каждый мономерный слитый белок включает мутантный полипептид CTLA-4 ВКД по данному изобретению, как описано детально выше, а также ниже, слитый на его С-конце с Ig Fc полипептидом. Димер формируется в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между остатками цистеина в мутантном CTLA-4 ВКД и Ig Fc одного мономерного слитого белка и остатками цистеина в мутантном CTLA-4 ВКД и второго мономерного слитого белка Ig Fc. Два мономерных слитых белка типично, но не обязательно, включают идентичные последовательности. Секретируемая или зрелая форма мутантного слитого белка CTLA-4-Ig не включает сигнальный пептид, так как сигнальный пептид обычно отщепляется от N-конца белка в ходе процессинга. Предполагаемый мутантный слитый белок CTLA-4-Ig включает сигнальный пептид, С-конец которого обычно ковалентно соединен с N-концом мутантного белка CTLA-4-Ig. N-конец каждого мономера зрелого мутантного слитого белка CTLA-4-Ig обычно включает метионин (М).
В качестве неограничивающего примера изобретение обеспечивает димерные слитые белки, включающие два мономерных слитых белка CTLA-4-Ig, где каждый мономерный мутантный слитый белок CTLA-4-Ig включает мутантный полипептид CTLA-4 ВКД, связанный на его С-конце с N-концом полипептида Ig Fc, где мутантный полипептид CTLA-4 ВКД включает аминокислотную последовательность, выбранную из любой из SEQ ID NOS:1-73. В некоторых таких димерных слитых белках два мономерных слитых белка ковалентно соединены вместе ковалентной дисульфидной связью. Сформированной в ходе клеточного процессинга между остатком цистеина в положении 120 в каждой аминокислотной последовательности CTLA-4 мутантного ВКД. Альтернативно, или дополнительно, два мономерных слитых белка ковалентно соединены вместе ковалентной дисульфидной связью, сформированной между одним или несколькими остатками цистеина в Ig Fc полипептиде первого мономерного слитого белка и одним или несколькими остатками цистеина в Ig Fc полипептиде второго мономерного слитого белка. Мономерные слитые белки могут быть соединены вместе многими дисульфидными связями (например, одной, двумя, тремя, четырьмя или более дисульфидными связями), сформированными в ходе клеточного процессинга между остатками цистеина, присутствующими в их соответствующих полипептида Ig Fcx. В некоторых случаях каждый мономерный слитый белок состоит из одинакового полипептида Ig Fc (например, человеческий IgG2 Fc, как представлено в, например, SEQ ID NO:184 или 218), и ковалентная дисульфидная связь(и) может быть образована в ходе клеточного процессинга между остатками цистеина в эквивалентных положениях в каждом Ig Fc полипептиде.
Иллюстративный мутантный полипептид CTLA-4 ВКД - это D3-12 мутантный полипептид CTLA-4 ВКД, включающий аминокислотную последовательность SEQ ID NO:11. Иллюстративный мутантный слитый белок CTLA-4-Ig по данному изобретению - это D3-12 мутантный полипептид CTLA-4 ВКД, ковалентно связанный или слитый напрямую (без линкера) на его С-конце с N-концом человеческого IgG2 Fc полипептида, представленного в SEQ ID NO:218, тем самым, формируя слитый белок D3-12-IgG2, представленный в SEQ ID NO:205, или ковалентно связанный или слитый напрямую (без линкера) на его С-конце с N-концом человеческого полипептида IgG2 Fc, представленного в SEQ ID NO:184, тем самым формируя D3-12-IgG2 слитый белок, представленный в SEQ ID NO:74. Последовательность SEQ ID NO:74 отличается от этой SEQ ID NO:205 на один остаток - а именно дополнительный остаток лизина присутствует на С-конце SEQ ID NO:74. Мы обнаружили экспериментально путем анализа с помощью жидкостной хроматомасс-спектрометрии (ЖХМС или подобного, что зрелый CTLA-4-Ig слитый белок, образованный в СНО (яичник китайского хомяка) клетках путем трансфекции вектора экспрессии, включающий нуклеотидную последовательность, кодирующую мутантный CTLA-4 ВКД, такой как, например, D3-12 ВКД аминокислотная последовательность, представленная в SEQ ID NO:11, и hIgG2 Fc полипептид, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (К), как ожидалось на основании hIgG2 Fc последовательности, представленной в SEQ ID NO:184.
Например, нуклеотидная последовательность SEQ ID NO:153 кодирует сигнальный пептид hCTLA-4 и слитый белок D3-12-IgG2 и включает стоп-кодон ТАА на ее С-конце. Кодон ААА, который кодирует остаток лизина, непосредственно предшествует стоп-кодону ТАА в последовательности SEQ ID NO:153. Предполагаемая аминокислотная последовательность зрелого D3-12-IgG2 слитого белка, полученного путем трансфекции вектора экспрессии, включающего нуклеотидную последовательность SEQ ID NO:153 в СНО клетки, показана в SEQ ID NO:74. Сигнальный пептид отсутствует в зрелой форме слитого белка D3-12-IgG2, так как он отщепляется в ходе процессинга с формированием зрелого слитого белка. Тем не менее мы обнаружили, основываясь на МСЖХ анализе, что в таком случает зрелый D3-12-IgG2 обычно не включает предполагаемый C-терминальный лизиновый остаток, как ожидалось на основе нуклеотидной последовательности SEQ ID NO:153. Скорее, полученная аминокислотная последовательность зрелого D3-12-IgG2, полученная таким способом, является той, что показана в SEQ ID NO:205. Предполагают, что C-терминальный лизин полипептида IgG2 Fc отщепляется в ходе процессинга или до секреции.
Предполагают, что продукция белка D3-12-IgG2 с применением клеточной линии другого млекопитающего путем трансфекции такого вектора, включающего нуклеотидную последовательность SEQ ID NO:153 в такую клетку млекопитающего (например, COS клетки и подобное) будет производить сходный слитый белок D3-12-IgG2, в котором не достает предполагаемого C-терминального остатка лизина, посредством аналогичного механизма процессинга или секреции.
Димерный слитый белок D3-12-IgG2 включает два таких мономера D3-12-IgG2, соединенных вместе одной или несколькими дисульфидными связями, сформированными в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между остатками цистеина. D3-12-IgG2 и другие слитые белки по данному изобретению могут быть образованы, например, с применением способов, изложенных в примере 3. Например, последовательность нуклеиновых кислот, кодирующая полипептид D3-12 (например, SEQ ID NO:90) может быть клонирована в вектор слияния IgG2 Fc, клетки млекопитающего могут быть трансфектированы с вектором, и полученный слитый белок может быть экспрессирован (типично в димерной форме), очищен и проанализирован, как описано в примере 3.
Другой иллюстративный мутантный полипептид CTLA-4 ВКД - это D3-54 мутантный полипептид CTLA-4 ВКД, включающий аминокислотную последовательность SEQ ID NO:36, и иллюстративный мутантный слитый белок CTLA-4-Ig включает D3-54 мутантный полипептид CTLA-4 ВКД, ковалентно связанный или слитый напрямую (без линкера) на его С-конце с N-концом hIgG2 Fc полипептида, представленного в SEQ ID NO:218 (без C-терминального лизина), тем самым формируя слитый белок D3-54-IgG2, представленный в SEQ ID NO:211 или ковалентно связанный или слитый напрямую (без линкера) на его С-конце с N-концом полипептида hIgG2 Fc, представленного в SEQ ID NO:184 (с C-терминальным лизином), тем самым формируя D3-54-IgG2 слитый белок, представленный в SEQ ID NO:197. Как обсуждалось выше, экспериментальный анализ определяет, что зрелый слитый белок D3-54-IgG2, образованный в СНО клетках, обычно не включает предполагаемый С-терминальный лизиновый остаток. Предполагают, что С-терминальный лизин hIgG2 Fc отщепляется в ходе процессинга или перед секрецией, давая в результате последовательность слитого белка D3-54-IgG2, представленную в SEQ ID NO:211. Так же, как указывалось выше, D3-29-IgG2 может быть образован с использованием способов примера 3. Димерный D3-54-IgG2 слитый белок включает два D3-54-IgG2 мономера, соединенных вместе одной или несколькими дисульфидными связями, сформированными в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между остатками цистеина. Последовательность нуклеиновых кислот, представленная в SEQ ID NO:201, кодирует слитые белки, представленные в SEQ ID NOS:197 и 211.
Другие слитые белки по данному изобретению могут сходным образом включать мутантный полипептид CTLA-4 ВКД, связанный или слитый с hIgG2 (SEQ ID NO:218 или 184). Иллюстративные зрелые мутантные слитые белки CTLA-4-IgG2 по данному изобретению включают, например, аминокислотные последовательности каждой из SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Каждая из аминокислотных последовательностей SEQ ID NOS:74-79, 197-200, 220 и 222 включает C-терминальный лизиновый остаток; этот C-терминальный остаток лизина обычно отщепляется в ходе процессинга или перед секрецией, давая в результате аминокислотные последовательности без C-терминального лизина, представленные в SEQ ID NOS:205-210, 211-214, 219 и 221 соответственно.
Фигура 10 представляет собой схематическое изображение, показывающее иллюстративную конфигурацию или структуру иллюстративного мутантного слитого белка CTLA-4-IgG2 по данному изобретению. Два идентичных мономерных мутантных слитых белка CTLA-4-IgG2 показаны схематически, причем каждый включает зрелый мутантный полипептид CTLA-4 ВКД, ковалентно связанный на его С-конце с N-концом человеческого IgG2 Fc полипептида. Каждый человеческий IgG2 полипептид включает человеческий IgG2 шарнирную область, СН2 домен и СН3 домен. Также показаны иллюстративные аминокислотные остатки, присутствующие в местах соединения между ВКД и полипептида Ig Fсми. Аминокислотные остатки в местах соединения между этими компонентами могут отличаться в зависимости от аминокислотной последовательности мутантного CTLA-4 ВКД и/или Ig аминокислотной последовательности. Этот димерный мутантный слитый белок CTLA-4-IgG2 является результатом формирования, по меньшей мере, одной дисульфидной связи между остатками цистеина в аналогичных положениях в двух мутантных мономерах слитого белка CTLA-4-IgG2. Остатки цистеина (Ц), потенциально вовлеченные в формирование дисульфидных связей между двумя мономерами, помечены звездочками. Сигнальный пептид каждого мономерного слитого белка обычно отщепляется в ходе процессинга, и, таким образом, секретируемый (зрелый) слитый белок обычно не включает последовательность сигнального пептида. Аминокислотная последовательность человеческого полипептида IgG2, которая включает шарнир, СН2 домен и СН3 домен человеческого IgG2, показана в SEQ ID NO:184. В альтернативном аспекте аминокислотная последовательность человеческого полипептида IgG2, которая включает шарнирную область, СН2 домен и СН3 домен человеческого IgG2, показана в SEQ ID NO:218; в этом случае полипептид IgG2 не включает C-терминальный лизиновый (K) остаток по сравнению с последовательностью SEQ ID NO:184.
Свойства мутантных слитых белков CTLA-4-Ig по данному изобретению, описанных в деталях в данном описании, могут сравниваться со свойствами одного или нескольких эталонных Ig слитых белков, таких как, например, hCTLA-4-IgG1, hCTLA-4-IgG2, слитый белок Orencia® и LEA29Y-Ig. Свойства, которые могут сравниваться, включают, например, способность связывать CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или способность ингибировать или подавлять иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина и т.п.). Зрелый hCTLA-4-IgG1 слитый белок обычно существует в растворе как димер слитого белка hCTLA-4-IgG1, включающий два идентичных мономерных белка hCTLA-4-IgG1, причем каждый мономерный hCTLA-4-IgG1 слитый белок включает полипептид hCTLA-4 ВКД (SEQ ID NO:159), связанный с полипептидом IgG1 Fc. Зрелый слитый белок hCTLA-4-IgG2 обычно существует в растворе как димер слитого белка hCTLA-4-IgG2, включающий два идентичных мономерных белка hCTLA-4-IgG2, каждый мономерный слитый белок hCTLA-4-IgG2 (SEQ ID NO:162) включает полипептид hCTLA-4 ВКД (SEQ ID NO:159), связанный с IgG2 Fc полипептидом. Зрелый слитый белок Orencia® - это димер слитого белка, включающий два идентичных мономерных Orencia® слитых белка, каждый мономерный слитый белок (SEQ ID NO:164) включает hCTLA-4 ВКД полипептид (SEQ ID NO:159), связанный со специфическим мутантным IgG1 полипептидом (SEQ ID NO:186). Зрелый слитый белок LEA29Y-Ig обычно существует в растворе как димер слитого белка LEA29Y-Ig, включающий два идентичных мономерных слитых белка LEA29Y-Ig, каждый мономерный LEA29Y-Ig слитый белок (SEQ ID NO:166) включает специфический мутантный полипептид CTLA-4 ВКД (SEQ ID NO:168), связанный со специфическим мутантным IgG1 полипептидом (SEQ ID NO:186). Предполагают, что два мономера слитого белка Orencia® димера ковалентно соединены вместе одной дисульфидной связью, сформированной между остатком цистеина в положении 120 каждого hCTLA-4-мутантного мономера IgG1, и что нет дисульфидных связей, сформированных между двумя мутантными полипептидами IgGI Fc.
Некоторые мутантные слитые белки CTLA-4 связывают CD80 (например, hCD80) и/или CD86 (например, hCD86). Некоторые такие мутантные слитые белки CTLA-4-Ig связывают слитый белок CD80-Ig и/или слитый белок CD86-Ig. Иллюстративные слитые белки CD80-Ig включают слитый белок hCD80-mIg (SEQ ID NO:225), который включает человеческий CD80 ВКД, связанный с мышиным полипептидом Ig Fc; и слитый белок hCD80-hIgG1 (SEQ ID NO:171), который включает последовательность hCD80 ВКД, связанный с человеческим полипептидом IgGI Fc. Иллюстративные слитые белки CD86-Ig включают слитый белок hCD86-mIg (SEQ ID NO:226), который включает hCD86 ВКД (SEQ ID NO:180), связанный с мышиным полипептидом Ig Fc; и зрелый слитый белок hCD86-hIgG1 (SEQ ID NO:178), который включает последовательность hCD86 ВКД (SEQ ID NO:180), связанный с человеческим полипептидом IgG1 Fc (SEQ ID NO:185). Иллюстративные последовательности нуклеиновых кислот, кодирующих слитые белки hCD86-mIg и hCD80-mIg, показаны в SEQ ID NOS:227 и 228 соответственно.
В одном аспекте данное изобретение обеспечивает изолированный или рекомбинантный слитый белок, включающий (а) полипептид, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (b) Ig Fc полипептид (например, hIgG2 Fc), где слитый белок связывает CD80 и/или CD86, и/или CD80-Ig и/или CD86-Ig слитый белок, и/или проявляет способность ингибировать или подавлять иммунный ответ. Полипептид Ig Fc может включать аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы SEQ ID NO:184, 185, 186 и 218. В некоторых случаях С-конец полипептида (а) ковалентно соединен с N- концом полипептида Ig Fc (b). Некоторые такие мутантные слитые белки CTLA-4-Ig связывают CD80 и/или CD86 млекопитающего (например, hCD80 и/или hCD86), и/или CD80-Ig и/или CD86-Ig слитый белок. CD80-Ig может содержать, например, человеческий CD80 ВКД, связанный с Ig Fc (например, hCD80-Ig). В одном варианте осуществления изобретения hCD80-Ig - это человеческий CD80 ВКД, связанный с человеческим Ig Fc (hCD80-hIg); в другом варианте осуществления изобретения, hCD80-Ig - это человеческий CD80 ВКД, связанный с мышиным Ig Fc (hCD80-mIg). В одном варианте осуществления изобретения hCD86-Ig - это человеческий CD86 ВКД, связанный с человеческим Ig Fc (hCD86-hIg); в другом варианте осуществления изобретения, hCD86-Ig - это человеческий CD86 ВКД, связанный с мышиным Ig Fc (hCD86-mIg). Некоторые такие слитые белки имеют способность ингибировать или подавлять один или несколько различных иммунных ответов, таких как, например, Т-клеточная активация, Т-клеточная пролиферация, синтез или продукция цитокина (например, продукция TNF-α, IFN-γ, IL-2), индукция маркеров активации (например, CD25, IL-2 рецептора) или воспалительных молекул, воспаление, продукция антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ(ы) в in vitro и/или in vivo исследованиях и/или способах. Предполагается, что такие слитые белки имеют эффективное применение в различных сферах применения, включая способы лечения заболеваний и нарушений иммунной системы (например, аутоиммунные заболевания) и способы ингибирования отторжения трансплантата органа, клетки или ткани, как обсуждается ниже.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мутантный димер слитого белка CTLA-4-Ig, включающий два мономерных мутантных слитых белка CTLA-4-Ig, связанных посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном CTLA-4-Ig слитом белке. Каждый мономер мутантного слитого белка CTLA-4-Ig включает: (а) мутантный полипептид CTLA-4 ВКД, включающий аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (b) Ig Fc полипептид (например, MgG2 Fc), где димер слитого белка связывает CD80, и/или CD86, и/или CD80-Ig, и/или CD86-Ig и/или проявляет способность ингибировать или подавлять иммунный ответ. В некоторых случаях С-конец полипептида (а) ковалентно соединен или слит с N-концом полипептида Ig Fc (b). Полипептид Ig Fc может включать аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NO:184-186 и 218. В некоторых случаях димер слитого белка сформирован ковалентной дисульфидной связью между остатком цистеина в аминокислотном положении 120 каждой аминокислотной последовательности мутантного CTLA-4 ВКД или в аминокислотном положении, соответствующем положению 120 в каждой аминокислотной последовательности мутантного относительно аминокислотной последовательности hCTLA-4 ВКД, представленной в SEQ ID NO:159. Некоторые такие димеры слитого белка имеют способность ингибировать или подавлять один или несколько различных иммунных ответов, таких как, например, Т-клеточную активацию, Т-клеточную пролиферацию, синтез или продукцию цитокина (например, продукция TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора) или воспалительных молекул, воспаление, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ(ы) в in vitro и/или in vivo исследованиях и/или способах. Предполагают, что такие димеры слитого белка имеют эффективное применение в различных сферах применения, включая способы лечения заболеваний и нарушений иммунной системы (например, аутоиммунные заболевания) и способы ингибирования отторжения трансплантата органа, клетки или ткани, как обсуждается ниже.
Некоторые такие мутантные мономеры слитого белка CTLA-4-Ig имеют связывающие аффинности к hCD86 или hCD86 ВКД, которые, по меньшей мере, равны или больше, чем таковые для hCTLA-4 ВКД и LEA29 к hCD86 или hCD86 ВКД соответственно. Смотри, например, таблицу 5 в примере 4. Мутантный полипептид CTLA-4 ВКД, присутствующий в некоторых таких димерных и мономерных слитых белках, включает аминокислотную последовательность, имеющую аминокислотную длину, приблизительно равную аминокислотной длине hCTLA-4 ВКД. Например, некоторые такие мутантные полипептиды CTLA-4 ВКД включают аминокислотную последовательность, которая составляет около 110-138, 112-136, 114-134, 116-132, 118-130, 119-129, 120-128, 121-127, 122-126 или 123-125 аминокислотных остатков в длину. Некоторые такие мутантные полипептиды CTLA-4 ВКД включают последовательность из 124 аминокислотных остатков. Иллюстративные мутантные полипептиды CTLA-4 ВКД включают, например, но не ограничиваются, теми, которые включают аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где такой мутантный полипептид CTLA-4 ВКД связывает CD80 и/или CD86 (или ВКД каждого или обоих) и/или имеет способность ингибировать иммунный ответ.
Некоторые такие мутантные димеры слитого белка CTLA-4-Ig имеют авидность связывания к hCD86 и/или hCD86-Ig, которая, по меньшей мере, приблизительно равна или больше, чем авидность связывания димера слитого белка hCTLA-4-Ig (например, hCTLA-4-IgG2 или hCTLA-4-IgG1 димера), Orencia® димера и/или LEA29Y-Ig димера к hCD86 и/или hCD86-Ig соответственно. Некоторые такие димеры слитого белка имеют авидность связывания к hCD86 и/или hCD86-mIg, которая в 2-10 раз (2х-10х), 5-10 раз (5х-10х), 10-20 раз (10х-20х), 20-40 раз (20х- 40х) или более чем в 40 раз (>40х) больше, чем авидность связывания димера Orencia® к hCD86 и/или hCD86-mIg. Смотри, например, иллюстративные димерные слитые белки по данному изобретению в таблице 3 ниже. Альтернативно или дополнительно, некоторые такие димеры слитого белка имеют авидность связывания к hCD80 и/или hCD80-Ig, которая, по меньшей мере, приблизительно равна или больше, чем авидность связывания hCTLA-4-Ig димера (например, димера hCTLA-4-IgG2 или hCTLA-4-IgG1), димера Orencia® и/или димера LEA29Y-Ig к hCD80 и/или hCD80-Ig соответственно. Некоторые такие димеры слитого белка имеют авидность связывания к hCD80 и/или hCD86-mIg, которая в 0,5-2 раза (0,5х-2х), 2-4 раза (2х-4х) или более чем в 2 раза (>2х) больше, чем авидность связывания димера Orencia® к hCD86 и/или hCD86-mIg. Смотри, например, иллюстративные димерные слитые белки по данному изобретению в таблице 4 ниже.
Некоторые такие мутантные димеры слитого белка CTLA-4-Ig диссоциируют от связывающего hCD86 и/или hCD86-Ig со скоростью, которая меньше, чем скорость, при которой hCTLA-4-Ig димер (например, димер hCTLA-4-IgG2 или hCTLA-4-IgG1), димер Orencia® и/или димер LEA29Y-Ig диссоциирует от связывающего hCD86 и/или hCD86-Ig соответственно. Некоторые такие слитые белки ассоциируются с или связываются с hCD86 и/или hCD86-Ig со скоростью, которая, по меньшей мере, равна или больше, чем скорость, при которой димер hCTLA-4-Ig (например, димер hCTLA-4-IgG2 или hCTLA-4-IgG1), Orencia® димер и/или LEA29Y-Ig димер ассоциирует с hCD86 и/или hCD86-Ig соответственно. Для некоторых таких димеров слитого белка равновесная константа диссоциации (KD) для реакции связывания между CD86 (или CD86-Ig) и димером слитого белка по данному изобретению является меньше, чем равновесная константа диссоциации (KD) для реакции связывания между CD86 (или CD86-Ig) и hCTLA-4-Ig димером (например, димером hCTLA-4-IgG2 или hCTLA-4-IgG1), димером Orencia® и/или димером LEA29Y-Ig. Смотри, например, иллюстративные димеры слитого белка по данному изобретению в таблице 3. Для некоторых таких димеров слитого белка равновесная константа диссоциации (KD) для реакции связывания между CD80 (или CD80-Ig) и димером слитого белка по данному изобретению является приблизительно равной или меньшей, чем равновесная константа диссоциации (KD) для реакции связывания между CD80 (или CD80-Ig) и димером hCTLA-4-Ig (например, димером hCTLA-4-IgG2 или hCTLA-4-IgGl), димером Orencia® или димером LEA29Y-Ig. Смотри, например, иллюстративные димеры слитого белка по данному изобретению в таблице 4.
Некоторые такие мутантные димеры слитого белка CTLA-4-Ig имеют способность ингибировать или подавлять иммунный ответ (например, ингибировать Т-клеточную активацию или пролиферацию, ингибируют продукцию цитокина и т.п.), которая, по меньшей мере, приблизительно равна или больше, чем способность димера hCTLA-4-Ig (например, димера hCTLA-4-IgG2 или hCTLA-4-IgG1), димера Orencia® и/или димера LEA29Y-Ig ингибировать или подавлять указанный иммунный ответ соответственно. Например, некоторые такие димеры слитого белка способны ингибировать Т-клеточную активацию или Т-клеточную пролиферацию в in vitro исследованиях. Примеры 4-9, приведенные ниже, например, демонстрируют способность репрезентативных димеров слитого белка по данному изобретению, включающих аминокислотную последовательность репрезентативного мутантного CTLA-4 ВКД, ингибировать Т-клеточную пролиферацию in vitro. Некоторые такие димеры способны ингибировать или подавлять иммунный ответ у субъекта in vivo, например, через введение терапевтически или профилактически эффективного количества, по меньшей мере, одного такого димера субъекту, нуждающемуся в иммуносупрессорной терапии. Предполагается, что некоторые такие димеры слитого белка пригодны в различных сферах, включая, например, но не ограничиваясь следующим, в профилактических и/или терапевтических способах для ингибирования или подавления иммунного ответа у субъекта, страдающего от иммунного заболевания или нарушения, при котором иммуносупрессия является желательной (например, аутоиммунные заболевания) и способах ингибирования отторжения трансплантата ткани, клетки или органа от донора реципиенту.
Некоторые такие димеры имеют изменяющиеся способности модулировать или подавлять передачу сигнала посредством CD28, так как они имеют различные согласующиеся авидности связывания к CD80 и CD86. Такие димеры пригодны в сферах применения, в которых дифференциальное управление Т-клеточными ответами является желательным, включая терапевтические и профилактические способы лечения заболеваний и нарушений иммунной системы, такие как, например, иммунодефицитные заболевания и нарушения (например, PA, PC, псориаз и т.п.). Иллюстративные димерные слитые белки, включающие полипептиды по данному изобретению, имеющие некоторые вышеупомянутые дифференциальные CD80/CD86 авидности связывания и иммуноингибирующие свойства, показаны в примере 4.
Некоторые такие мутантные димеры CTLA-4-Ig имеют способность подавлять или ингибировать иммунный ответ, которая, по меньшей мере, приблизительно равна или больше, чем способность белка hCTLA-4 или димера hCTLA-4-Ig подавлять или ингибировать один или несколько типов иммунных ответов. Например, некоторые такие димеры имеют способность ингибировать Т-клеточную активацию или пролиферацию в in vitro и/или in vivo исследованиях и/или применениях, таких как те, что описаны выше и ниже, которая, по меньшей мере, приблизительно равна или больше, чем способность hCTLA-4 белка или hCTLA-4-Ig димера (например, Orencia®, hCTLA-4-IgG2 димера или димера hCTLA-4-IgG1) ингибировать Т-клеточную активацию или пролиферацию в таких применениях. Дополнительно, некоторые такие димеры имеют способность ингибировать или подавлять иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, Т-клеточно-зависимый ответ антитела), которая больше, чем способность димера LEA29Y-Ig ингибировать или подавлять иммунный ответ. Примеры 4-9, например, сравнивают способность репрезентативных димерных слитых белков по данному изобретению, включающих аминокислотную последовательность мутантного CTLA-4 ВКД по данному изобретению, ингибировать Т-клеточную пролиферацию in vitro со способностью димерного hCTLA-4-IgG2, Orencia® и LEAY29-Ig ингибировать Т-клеточную пролиферацию in vitro. Смотри, например, таблицы 6-9 ниже. Некоторые такие димеры имеют как способность связывать hCD80 и/или hCD86 (или hCD80-Ig и/или hCD86-Ig), так и способность ингибировать или подавлять иммунный ответ в in vitro и/или in vivo исследованиях и/или применениях, таких как те, что описаны выше и более детально ниже (например, in vivo способ, в котором вводят терапевтически или профилактически эффективное количество, по меньшей мере, одного такого димера). Некоторые такие димеры имеют авидность связывания к hCD80 и/или hCD86 (или hCD80-Ig и/или hCD86-Ig), которая, по меньшей мере, приблизительно равна или больше, чем авидность связывания hCTLA-4 белка, димерного hCTLA-4-Ig (например, hCTLA-4-IgG2, Orencia®) или димерного LEA29Y-Ig к hCD80 и/или hCD86 (или hCD80-Ig и/или hCD86-Ig) соответственно, и способность ингибировать иммунный ответ, которая, по меньшей мере, равна или больше, чем способность белка hCTLA-4, димерного hCTLA-4-Ig (например, hCTLA-4-IgG2, Orencia®) или димерного LEA29Y-Ig ингибировать иммунный ответ. Предполагают, что такие мутантные димеры слитого белка CTLA-4-Ig пригодны в различных сферах применения, включая, например, профилактические и/или терапевтические способы лечения заболеваний, нарушений и состояний иммунной системы, как обсуждается более детально ниже.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два идентичных мономерных слитых белка (например, два мономерных мутантных слитых белка CTLA-4-Ig), где каждый такой мономерный слитый белок включает аминокислотную последовательность, имеющую, по меньшей мере, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99%, 99,5% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где димер связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig, такой как hCD80-mIg и/или hCD86-mIg, соответственно), и/или имеет способность ингибировать иммунный ответ, включая те, что описаны выше, а также ниже. Каждая из аминокислотных последовательностей, перечисленных в SEQ ID NOS:74-79, 197-200, 205-214 и 219-222 представляет собой зрелый мутантный CTLA-4 ВКД, слитый на его С-конце с N-концом IgG2 Fc полипептида, и каждая такая последовательность может быть названа мутантным слитым белком CTLA-4-Ig. Аминокислотная последовательность каждой SEQ ID NOS:74-79, 197-200, 220 и 222 идентична SEQ ID NOS:205-214, 219 и 221, кроме той SEQ ID NOS:74-79, 197-200, 220 и 222, которая включает лизин на С-конце.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный мономер слитого белка, включающий аминокислотную последовательность, имеющую, по меньшей мере, 90%, 90,5%, 91%, 91,5%, 92%, 92,5%, 93%, 93,5%, 94%, 94,5%, 95%, 95,5%, 96%, 96,5%, 97%, 97,5%, 98%, 98,5%, 99%, 99,5% или 100% идентичность с аминокислотной последовательностью, включающий аминокислотные остатки 1-351 любой из SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где слитый белок связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig, такой как hCD80-mIg и/или hCD86-mIg, соответственно), и/или имеет способность ингибировать иммунный ответ, включая те, что описаны выше, а также ниже.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка, включающий два идентичных мономерных слитых белка, где каждый такой мономерный слитый белок включает аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, включающий аминокислотные остатки 1-351 любой из SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где белок указанного димера слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig, такой как hCD80-mIg и/или hCD86-mIg, соответственно), и/или имеет способность ингибировать иммунный ответ, включая те, что описаны выше, а также ниже.
Изобретение также обеспечивает мутантный мономерный слитый белок CTLA-4-Ig, включающий аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где указанный мономерный слитый белок связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig, такой как hCD80-mIg и/или hCD86-mIg, соответственно), и/или имеет способность ингибировать иммунный ответ. Некоторые такие мономеры слитого белка и димеры имеют способность ингибировать или подавлять один или несколько иммунных ответов, включая, например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора), воспаление, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ(ы)) в in vitro и/или in vivo исследованиях и/или способах (например, in vivo у субъекта, страдающего от заболевания, нарушения или состояния, при котором иммуносупрессорная терапия была бы эффективна и которому вводят терапевтически эффективное количество такого димерного слитого белка, как обсуждается более детально ниже). Предполагают, что такие мономеры слитого белка и димеры пригодны в различных сферах применения, включая терапевтические и/или профилактические способы лечения заболеваний иммунной системы, включая те, что обсуждаются ниже.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный слитый белок CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, полипептид мутантного внеклеточного домена CTLA-4), который включает аминокислотную последовательность, которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5 или 6 аминокислотным остаткам), и где аминокислотный остаток в аминокислотной последовательности в положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной выбранной аминокислотной последовательности (например, полипептид, выбранный из SEQ ID NOS:1-73), и (2) полипептид Ig Fc (например, IgG2 Fc), где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig), и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации или воспалительных молекул, продукцию антиколлагеновых AT, Т-клеточно-зависимые AT ответы и т.п.) в in vitro и/или in vivo исследованиях и/или способах, как обсуждается более детально ниже. Изобретение также включает изолированный или рекомбинантный мономерный слитый белок, как описано выше, который связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig) и/или вызывает иммунный ответ in vitro или in vivo. В димере слитого белка два мономерных слитых белка (например, мутантный мономер CTLA-4-Ig) необязательно ковалентно соединены вместе одной или несколькими дисульфидными связями посредством остатков цистеина в каждом мономере, и два мономера обычно идентичны друг другу. В некоторых случаях мутантный полипептид CTLA-4 ВКД в таком димере слитого белка или мономере отличается от выбранного полипептида (например, выбранного из SEQ ID NOS:1-73) по не более чем 6 аминокислотным остаткам, но аминокислота, занимающая положение 41, 50, 54, 55, 56, 64, 65, 70 или 85, идентичен аминокислотному остатку, включенному в эти положения в выбранной аминокислотной последовательности; то есть, аминокислотный остаток в таком положении не может быть удален или замещен. Некоторые такие мутантные полипептиды CTLA-4 ВКД в таком слитом белке включают аминокислотную последовательность, которая отличается от выбранной аминокислотной последовательности по не более чем 6 аминокислотным остаткам и которая включает аминокислотные остатки в положениях 24, 30, 32, 41, 50, 54, 55, 56, 64, 65, 70, 85, 104 и 106, которые идентичны аминокислотным остаткам в соответствующих положениях в выбранной аминокислотной последовательности. Такой мутантный полипептид CTLA-4 ВКД может отличаться от выбранной аминокислотной последовательности на аминокислотную делецию(и), дополнение(я) и/или аминокислотную замену(ы). Аминокислотная замена может быть консервативной или неконсервативной заменой. Смотри, например, раздел "Изменчивость последовательностей". Некоторые такие димерные слитые белки имеют авидность связывания к hCD86 или hCD86-Ig, которая, по меньшей мере, приблизительно равна или больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig, димерного LEA29Y-Ig или белка Orencia® к hCD86 или hCD86-Ig соответственно. Некоторые такие мономерные слитые белки имеют аффинность связывания или авидность к hCD86, hCD86-Ig или hCD86 ВКД, которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4, мономерного hCTLA-4-Ig или мономерного LEA29Y-Ig к hCD86, hCD86-Ig или hCD86 ВКД соответственно. Альтернативно или дополнительно, некоторые такие димерные слитые белки имеют авидность связывания к hCD80 или hCD80-Ig, которая, по меньшей мере, приблизительно равна или больше, чем авидность hCTLA-4 или hCTLA-4-Ig к hCD80 соответственно. Альтернативно или дополнительно, некоторые такие мономерные слитые белки имеют аффинность связывания или авидность к hCD80, hCD80-Ig или hCD80 ВКД, которая, по меньшей мере, приблизительно равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4 или мономерного hCTLA-4-Ig к hCD80, hCD80-Ig или hCD80 ВКД соответственно. В некоторых случаях мутантный полипептид CTLA-4 ВКД в таком димере или мономере слитого белка включает аминокислотную последовательность, имеющую длину, приблизительно равную аминокислотной длине hCTLA-4 ВКД, например, около 118-130, 119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков в длину. N-конец полипептида Ig Fc (например, IgG2 Fc, IgG1 Fc, IgG4 Fc или мутантный IgG Fc, который уменьшает эффекторную функцию или связывание Fc рецептора) может быть ковалентно связанным или слитым напрямую или косвенно (посредством линкера, включающего, например, 1-10 аминокислотных остатков) с С-концом мутантного полипептида CTLA-4 ВКД. Полипептид Ig Fc может включать аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218, например, любую SEQ ID NO:184, 185, 186 и 218.
Некоторые такие мутантные димеры CTLA-4-Ig и мономеры слитого белка способны подавлять один или несколько различных иммунных ответов, включая, например, Т-клеточную активацию, Т-клеточную пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора) или воспалительных молекул, воспаление, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ(ы). Некоторые такие мутантные димеры CTLA-4-Ig имеют большую способность ингибировать один или несколько таких иммунных ответов, чем hCTLA-4, димерный hCTLA-4-Ig или димерный LEA29Y-Ig. Примеры 4-9, например, представляют данные, сравнивающие способность репрезентативных димерных слитых белков по данному изобретению, включающих мутантный полипептид CTLA-4 ВКД по данному изобретению ингибировать Т-клеточную пролиферацию in vitro со способностью димерного hCTLA-4-Ig или димерного LEA29Y-Ig делать это. Некоторые такие мутантные мономеры CTLA-4-Ig имеют большую способность ингибировать один или несколько таких иммунных ответов, чем мономерный hCTLA-4, мономерный hCTLA-4-Ig или мономерный LEA29Y-Ig. Некоторые такие мономеры и димеры способны ингибировать или подавлять иммунный ответ у субъекта in vivo, например, посредством введения терапевтически или профилактически эффективного количества, по меньшей мере, одного такого полипептида субъекту, нуждающемуся в иммуносупрессорной терапии. Предполагают, что такие слитые белки имеют эффективное применение в различных сферах применения, включая способы лечения заболевания, нарушения или состояния, при котором иммуносупрессорная терапия была бы эффективна, такие как профилактические и/или терапевтические способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает димер изолированного или рекомбинантного белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два мономерных слитых белка (например, два мономерных мутантных слитых белка CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид мутантного внеклеточного домена CTLA-4 (ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5 или 6 аминокислотным остаткам), и (b) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно аминокислотной последовательности SEQ ID NO:159; и (2) полипептид Ig Fc, где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig) и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых антител, Т-клеточно-зависимый ответ антитела и т.п.) в in vitro и/или in vivo исследованиях и/или способах, как описано более детально ниже. Изобретение также включает изолированный или рекомбинантный мономерный слитый белок, как описано выше, который связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig) и/или вызывает иммунный ответ in vitro или in vivo. В некоторых случаях CD80 - это hCD80 и CD86 - это hCD86. В димере слитого белка два мономерных слитых белка (например, мутантный мономер CTLA-4-Ig) необязательно ковалентно соединены вместе одной или несколькими дисульфидными связями через остатки цистеина в каждом мономере, и два мономера обычно идентичны друг другу. N-конец полипептида Ig Fc (например, IgG2 Fc, IgG1 Fc, IgG4 Fc или мутантный IgG Fc, который снижает эффекторную функцию или связывание Fc рецептора), может быть ковалентно связан или слит напрямую или косвенно (посредством линкера, включающего, например, 1-10 аминокислотных остатков) с С-концом мутантного полипептида CTLA-4 ВКД. Ig Fc полипептид может включать аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218.
Некоторые такие димеры или мономеры слитого белка включают мутантный полипептид CTLA-4 ВКД, который включает аминокислотную последовательность, имеющую длину, приблизительно равную аминокислотной длине hCTLA-4 ВКД, например, 118-130, 119-129, 120-128, 121-127, 122-126 или 123-125 аминокислотных остатков в длину. Некоторые такие мутантные полипептиды CTLA-4 ВКД в таком димере или мономере слитого белка включают аминокислотную последовательность длиной 124 аминокислотных остатка. Некоторые такие мутантные полипептиды CTLA-4-ВКД включают 2, 3, 4, 5 или 6 аминокислотных замен в положениях относительно последовательности, представленной в SEQ ID NO:159, выбранные из группы, включающей положение 50, 54, 55, 56, 64, 65, 70 и 85. Некоторые такие мутантные полипептиды CTLA-4 ВКД также включают аминокислотную замену в положении, соответствующем положению 104 и/или 30 относительно SEQ ID NO:159. Некоторые такие мутантные полипептиды CTLA-4 ВКД содержат, по меньшей мере, одну аминокислотную замену относительно SEQ ID NO:159 в положении 70 (необязательно S70F), положении 64 (необязательно S64P), положении 50 (необязательно А50М), положении 54 (необязательно M54K/V, например, M54K), положении 65 (необязательно I65S), положении 56 (необязательно N56D), положении 55 (необязательно G55E), положении 85 (необязательно М85А) и/или положении 24 (необязательно A24E/S, например, А24Е). Любой такой мутантный полипептид CTLA-4 ВКД может также включать аминокислотную замену относительно SEQ ID NO:159 в положении 104 (необязательно L104E/D, например, L104E), положении 30 (необязательно T30N/D/A, например, T30N, T30D или Т30А) и/или положении 32 (необязательно V32I). Некоторые такие мутантные полипептиды CTLA-4 ВКД содержат, по меньшей мере, одну замену в аминокислотном положении относительно SEQ ID NO:159, выбранную из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F. Некоторые такие мутантные полипептиды CTLA-4 ВКД включают 2, 3, 4, 5, или 6 замен в аминокислотных положениях относительно SEQ ID NO:159, выбранные из группы, включающей А50М, М54К, G55E. N56D, S64P, I65S и S70F.
Некоторые такие мутантные димеры CTLA-4-Ig проявляют авидность связывания к CD86 (например, hCD86) или димерному CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем авидность связывания hCTLA-4 белка, димерного hCTLA-4-Ig (например, CTLA-4-IgG1 или CTLA-4-IgG2), белка Orencia® или димерного LEA29Y-Ig к CD86 или димерному CD86-Ig соответственно. Некоторые такие димеры имеют авидность связывания к CD80 (например, hCD80) или димерному CD80-Ig (например, hCD80-Ig), которая больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig, белка Orencia® и/или димерного LEAY29-Ig к CD80 или димерному CD80-Ig соответственно.
Некоторые такие мутантные мономеры CTLA-4-Ig проявляют аффинность связывания или авидность к CD86 (например, hCD86) или CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4, мономерного hCTLA-4-Ig или мономерного LEA29Y-Ig к CD86 или CD86-Ig соответственно. Некоторые такие мономеры имеют аффинность связывания или авидность к CD80 (например, hCD80) или CD80-Ig (например, hCD80-Tg), которая больше, чем аффинность связывания или авидность мономерного hCTLA-4 или мономерного hCTLA-4-Ig (например, мономерного CTLA-4-IgG1 или CTLA-4-IgG2) к CD80 или димерному CD80-Ig соответственно.
Некоторые такие мутантные димеры CTLA-4-Ig и мономеры имеют способность подавлять или ингибировать один или несколько иммунных ответов, включая те, что описаны выше и везде в данном описании (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых антител, Т-клеточно-зависимые ответы антитела), в in vitro и/или in vivo исследованиях и/или способах (например, in vivo у субъекта, страдающего от заболевания, нарушения или состояния, при котором иммуносупрессорная терапия была бы эффективна и которому вводят терапевтически эффективное количество, по меньшей мере, одного такого мутантного димера CTLA-4-Ig). Некоторые такие мутантные димеры CTLA-4-Ig ингибируют один или несколько таких иммунных ответов в большей степени, чем hCTLA-4, димерный hCTLA- 4-Ig (например, димерный CTLA-4-IgG1 или CTLA-4-IgG2), белок Orencia® и/или димерный LEAY29-Ig. Некоторые такие мутантные мономеры CTLA-4-Ig ингибируют один или несколько таких иммунных ответов в большей степени, чем мономерный hCTLA-4, мономерный hCTLA-4-Ig и/или мономерный LEAY29-Ig. Предполагают, что такие мутантные димеры CTLA-4-Ig и мономеры имеют эффективное применение в различных сферах применения, включая способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный слитый белок CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный внеклеточный домен CTLA-4), включающий аминокислотную последовательность, которая (i) имеет, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с любой аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (ii) включает остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73; и (2) Ig Fc полипептид (например, IgG2 Fc, IgG1 Fc, IgG4 Fc или мутантный IgG Fc, который снижает эффекторную функцию или связывание Fc рецептора), где димер слитого белка связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) (и/или CD80-Ig, например, hDC80-Ig, и/или CD86-Ig, например, hCD86-Ig), и/или имеет способность ингибировать иммунный ответ in vitro или in vivo. Изобретение также включает изолированный или рекомбинантный мономерный слитый белок, как описано выше, который связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) (и/или CD80-Ig, например, hDC80-Ig, и/или CD86-Ig, например, hCD86-Ig) и/или вызывает иммунный ответ in vitro или in vivo. В некоторых случаях Ig Fc полипептид включает последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99%, или 100% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. N-конец полипептида Ig Fc может быть ковалентно связан или слит напрямую или косвенно (посредством линкера, включающего, например, 1-10 аминокислот) с С-концом мутантного полипептида CTLA-4 ВКД.
В некоторых таких мутантных димерах CTL-4-Ig или мономерах мутантный полипептид CTLA-4 ВКД включает один или несколько из следующего относительно указанной выбранной аминокислотной последовательности: остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 24; остаток аспарагина в аминокислотном положении, соответствующем положению 30; остаток изолейцина в аминокислотном положении, соответствующем положению 32; остаток метионина в аминокислотном положении, соответствующем положению 50; остаток лизина в аминокислотном положении, соответствующем положению 54; остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 55; остаток аспарагиновой кислоты в аминокислотном положении, соответствующем положению 56; остаток пролина в аминокислотном положении, соответствующем положению 64; остаток серина в аминокислотном положении, соответствующем положению 65; и остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 104. Например, некоторые такие мутантные полипептиды CTLA-4 ВКД в таких мутантных димерах CTLA-4-Ig или мономерах включают аминокислотную последовательность, включающую (i), по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:24, и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 аминокислотной последовательности SEQ ID NO:24, где димер слитого белка связывает hCD80 и/или hCD86 (и/или hCD80-Ig и/или hCD86-Ig) и/или ингибирует иммунный ответ в in vitro и/или in vivo исследованиях и/или способах. Некоторые такие мутантные полипептиды CTLA-4 ВКД в таких мутантных димерах CTLA-4-Ig или мономерах включают один или несколько из следующего относительно SEQ ID NO:24: остаток глутаминовой кислоты в положении 24; остаток аспарагина в положении 30; остаток изолейцина в положении 32; остаток метионина в положении 50; остаток лизина в положении 54; остаток глутаминовой кислоты в положении 55; остаток аспарагиновой кислоты в положении 56; остаток пролина в положении 64; остаток серина в положении 65; и остаток глутаминовой кислоты в положении 104.
Некоторые такие мутантные димеры CTLA-4-Ig проявляют авидность связывания к CD86 (например, hCD86) или димерному CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig, белка Orencia® или димерного LEA29Y-Ig к CD86 или димерному CD86-Ig соответственно. Некоторые такие димеры имеют авидность связывания к CD80 (например, hCD80) или димерному CD80-Ig (например, hCD80-Ig), которая больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig или белка Orencia® к CD80 или димерному CD80-Ig соответственно.
Некоторые такие мутантные мономеры CTLA-4-Ig проявляют аффинность связывания или авидность к CD86 (например, hCD86) или CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4, мономерного hCTLA-4-Ig и/или мономерного LEA29Y-Ig к CD86 или CD86-Ig соответственно. Некоторые такие мономеры имеют аффинность связывания или авидность к CD80 (например, hCD80) или CD80-Ig (например, hCD80-Ig), которая больше, чем аффинность связывания или авидность мономерного hCTLA-4 или мономерного hCTLA-4-Ig к CD80 или димерного CD80-Ig соответственно.
Некоторые такие мутантные димеры CTLA-4-Ig и мономеры имеют способность подавлять или ингибировать один или несколько иммунных ответов (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых AT, Т-клеточно-зависимые AT ответы), в in vitro и/или in vivo исследованиях и/или способах (например, in vivo у субъекта, страдающего от заболевания, нарушения или состояния иммунной системы, при которых иммуносупрессорная терапия была бы эффективна и которому вводят терапевтически эффективное количество, по меньшей мере, одного такого мутантного димера CTLA-4-Ig). Некоторые такие мутантные димеры CTLA-4-Ig имеют способность подавлять или ингибировать один или несколько таких иммунных ответов в большей степени, чем hCTLA-4, димерный hCTLA-4-Ig (например, димерный CTLA- 4-IgG1 или CTLA-4-IgG2), белок Orencia® и/или димерный LEAY29-Ig. Некоторые такие мутантные мономеры CTLA-4-Ig имеют способность подавлять или ингибировать один или несколько таких иммунных ответов в большей степени, чем мономерный hCTLA-4, мономерный hCTLA-4-Ig и/или мономерный LEAY29-Ig. Предполагают, что такие мутантные димеры CTLA-4-Ig и мономеры имеют эффективное применение в различных терапевтических и/или профилактических способах лечения заболеваний или нарушений, при которых иммуносупрессорное лечение было бы эффективно, включая, например, способы лечения аутоиммунных заболеваний и способы ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерные мутантные слитые белки CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный внеклеточный домен CTLA-4), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности полипептид внеклеточного домена человеческого CTLA-4, представленной в SEQ ID NO:159, по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену, где указанная, по меньшей мере, аминокислотная замена включает S70F, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:159; и (2) IgG Fc полипептид (например, IgG2 Fc, IgG1 Fc, IgG4 Fc или мутантный IgG Fc, который снижает эффекторную функцию или связывание Fc рецептора), где указанный димер связывает hCD80 и/или hCD86 (и/или hCD86-Ig и/или hCD86-Ig), и/или ингибирует иммунный ответ (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых антител, Т-клеточно-зависимые ответы антитела и т.п.) в in vitro и/или in vivo исследованиях и/или способах, как обсуждается детально ниже. Изобретение также включает изолированный или рекомбинантный мономерный слитый белок, как описано выше, который связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) (и/или CD80-Ig, например, hDC80-Ig, и/или CD86-Ig, например, hCD86-Ig) и/или вызывает иммунный ответ in vitro или in vivo. Полипептид Ig Fc может включать последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. N-конец полипептида Ig Fc может быть ковалентно связан или слит напрямую или косвенно (посредством линкера, включающего, например, 1-10 аминокислот) с С-концом мутантного полипептида CTLA-4 ВКД. В некоторых таких мутантных димерах или мономерах CTLA-4-Ig мутантный полипептид CTLA-4 ВКД также включает, по меньшей мере, одну аминокислотную замену, выбранную из группы, включающей А24Е, T30N, V32I, D41G, А50М, M54K, G55E, N56D, S64P, I65S, М85А, L104E и I106F. В некоторых таких мутантных димерах или мономерах CTLA-4-Ig, мутантный полипептид CTLA-4 ВКД также включает замену L104E и/или две, три или четыре дополнительных замены, выбранных из группы замен: T30N, V32I, А30М, M54K, G55E, N56D, S64P и I65S.
Некоторые такие димеры имеют авидность связывания к CD86 (например, hCD86) или димерному CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig и/или белка Orencia® к CD86 или димерному CD86-Ig соответственно. Некоторые такие димеры имеют авидность связывания к CD80 (например, hCD80) или димерному CD80-Ig (например, hCD80-Ig), которая больше, чем авидность связывания hCTLA-4, димерного hCTLA-4-Ig и/или Orencia® к CD80 или димерному CD80-Ig соответственно. Некоторые такие мономеры проявляют аффинность связывания или авидность к CD86 (например, hCD86) или CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4, мономерного hCTLA-4-Ig или мономерного LEA29Y-Ig к CD86 или CD86-Ig соответственно. Некоторые такие мономеры имеют аффинность связывания или авидность к CD80 (например, hCD80) или CD80-Ig (например, hCD80-Ig), которая больше, чем аффинность связывания или авидность мономерного hCTLA-4 или мономерного hCTLA-4-Ig к CD80 или димерному CD80-Ig соответственно.
Некоторые такие мутантные димеры CTLA-4-Ig и мономеры имеют способность подавлять или ингибировать один или несколько иммунных ответов (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых антител, Т-клеточно-зависимые ответы антитела), в in vitro и/или in vivo исследованиях и/или способах (например, in vivo у субъекта, страдающего от заболевания, нарушения или состояния, при котором иммуносупрессорная терапия была бы эффективна и которому вводят терапевтически эффективное количество, по меньшей мере, одного такого мутантного димера CTLA-4-Ig). Некоторые такие димеры имеют способность подавлять или ингибировать один или несколько таких иммунных ответов в большей степени, чем hCTLA-4, димерный hCTLA-4-Ig (например, димерный CTLA-4-IgG1 или CTLA-4-IgG2), Orencia® белок и/или димерный LEAY29-Ig. Некоторые такие мономеры имеют способность подавлять или ингибировать один или несколько таких иммунных ответов в большей степени, чем мономерный hCTLA-4, мономерный hCTLA-4-Ig и/или мономерный LEAY29-Ig. Предполагают, что такие мутантные димеры CTLA-4-Ig и мономеры имеют эффективное применение в различных терапевтических и/или профилактических способах лечения заболеваний или нарушений, при которых иммуносупрессорное лечение было бы эффективно, включая, например, способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантата органа, клетки или ткани.
В другом аспекте данное изобретение обеспечивает изолированный или рекомбинантный димер слитого белка (например, мутантный димер слитого белка CTLA-4-Ig), включающий два мономерных слитых белка (например, мутантный слитый белок CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный внеклеточный домен CTLA-4), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности SEQ ID NO:31 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, один из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31; и (2) полипептид Ig Fc, где указанный димер связывает hCD80 и/или hCD86 (и/или hCD86-Ig и/или hCD86-Ig) и/или ингибирует иммунный ответ. Изобретение также включает изолированный или рекомбинантный мономерный слитый белок, как описано выше, который связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) (и/или CD80-Ig, например, hDC80-Ig, и/или CD86-Ig, например, hCD86-Ig) и/или вызывает иммунный ответ in vitro или in vivo. Ig Fc полипептид может включать IgG2 Fc, IgG1 Fc, IgG4 Fc или мутантный IgG Fc, который снижает эффекторную функцию или связывание Fc рецептора. Ig Fc полипептид может включать последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. N-конец полипептида Ig Fc может быть ковалентно связан или слит напрямую или косвенно (посредством линкера, включающего, например, 1-10 аминокислот) с С-концом мутантного полипептида CTLA-4 ВКД. В некоторых таких димерах или мономерах мутантный полипептид CTLA-4 ВКД включает остаток глутаминовой кислоты в положении, соответствующем положению 104, остаток аспарагиновой кислоты в положении, соответствующем положению 30, и/или остаток изолейцина в положении, соответствующем положению 32 SEQ ID NO:31.
Некоторые такие димеры имеют авидность связывания к CD86 (например, hCD86) или димерному CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем авидность связывания hCTLA-4 белка, димерного hCTLA-4-Ig, белка Orencia® и/или димерного LEAY29-Ig к CD86 или димерному CD86-Ig соответственно. Некоторые такие димеры имеют авидность связывания к CD80 (например, hCD80) или димерному CD80-Ig (например, hCD80-Ig), которая больше, чем авидность связывания hCTLA-4, димерный hCTLA-4-Ig и/или белка Orencia® к CD80 или димерному CD80-Ig соответственно. Некоторые такие мономеры проявляют аффинность связывания или авидность к CD86 (например, hCD86) или CD86-Ig (например, hCD86-Ig), которая практически равна или больше, чем аффинность связывания или авидность мономерного hCTLA-4, мономерного hCTLA-4-Ig или мономерного LEA29Y-Ig к CD86 или CD86-Ig соответственно. Некоторые такие мономеры имеют аффинность связывания или авидность к CD80 (например, hCD80) или CD80-Ig (например, hCD80-Ig), которая больше, чем аффинность связывания или авидность мономерного hCTLA-4 или мономерного hCTLA-4-Ig к CD80 или димерному CD80-Ig соответственно.
Некоторые такие мутантные димеры CTLA-4-Ig и мономеры имеют способность подавлять или ингибировать один или несколько иммунных ответов (например, Т-клеточную активацию или пролиферацию, продукцию цитокина, индукцию маркеров активации, воспаление, продукцию антиколлагеновых антител, Т-клеточно-зависимые ответы антитела) in vitro и/или in vivo, как обсуждается детально ниже. Некоторые такие димеры имеют способность подавлять один или несколько таких иммунных ответов в большей степени, чем hCTLA-4, димерный hCTLA-4-Ig, белок Orencia® и/или димерный LEAY29-Ig. Некоторые такие мономеры имеют способность подавлять или ингибировать один или несколько таких иммунных ответов в большей степени, чем мономерный hCTLA-4 или мономерный hCTLA-4-Ig. Предполагают, что такие мутантные димеры CTLA-4-Ig и мономеры имеют эффективное применение в различных терапевтических и/или профилактических способах лечения заболеваний или нарушений иммунной системы, при которых иммуносупрессорное лечение было бы эффективно (например, аутоиммунные заболевания и нарушения и способы ингибирования отторжения трансплантата органа, клетки или ткани).
Любой такой димерный или мономерный мутантный димер или мономер слитого белка CTLA-4-Ig, описанный выше, может также включать пептид, который облегчает секрецию слитого белка из клетки-хозяина. Пептид представляет собой необязательно сигнальный пептид. С-конец сигнального пептида обычно ковалентно связан с N-концом слитого белка. Сигнальный пептид может включать аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью SEQ ID NO:182 или SEQ ID NO:216. Сигнальный пептид может включать аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, включающей аминокислотные остатки 1-35, 1-36 или 1-37 SEQ ID NO:160. Более того, как обсуждается ниже, любой такой мономерный или димерный мутантный слитый белок CTLA-4-Ig, описанный выше, может включать один или несколько аминокислотных остатков, которые являются гликозилированными или пегилированными.
Изобретение также обеспечивает зрелый/секретируемый мутантный слитый белок CTLA-4-IgG2 длиной в 352 аминокислоты и который включает мутантный полипептид CTLA-4 ВКД, включающий 124 аминокислотных остатка и человеческий IgG2 Fc полипептид, включающий 228 аминокислотных остатка. Иллюстративные мутантные полипептиды CTLA-4 ВКД включают те полипептиды, которые включают последовательности, идентифицированные любой SEQ ID NOS:1-73. Иллюстративные мутантные слитые белки CTLA-4-IgG2 включают те, которые включают аминокислотную последовательность, идентифицированную любой SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. При необходимости аминокислоты зрелого мутантного CTLA-4-IgG2 слитого белка могут быть пронумерованы, начиная с первого аминокислотного остатка мутантного CTLA-4-IgG2 (а именно первого остатка мутантного полипептида CTLA-4 ВКД). В некоторых аспектах первый остаток мутантного слитого белка CTLA-4-IgG2 (или мутантного CTLA-4 ВКД) представляет собой метионин, и, таким образом, нумерация аминокислот мутантного слитого белка CTLA-4-IgG2 (или мутантного CTLA-4 ВКД) будет начинаться с метионина (обозначенного как аминокислотный остаток 1).
Изобретение также включает изолированные или рекомбинантные мультимерные слитые белки, включающие два или несколько мутантных слитых белков CTLA-4-Ig, описанных выше. В некоторых случаях мультимер - это димер слитого белка, включающий два мутантных слитых белка CTLA-4-Ig, которые могут быть идентичными слитыми белками (то есть гомодимер) или различными слитыми белками (то есть гетеродимер). В некоторых случаях мультимер - это тетрамерный слитый белок, который включает четыре мутантных полипептида CTLA-4-ВКД по данному изобретению. Тетрамер может включать четыре идентичных мутантных полипептида CTLA-4 ВКД (то есть гомотетрамер) или любую комбинацию четырех мутантных CTLA-4 ВКД полипептидов по данному изобретению, так что все четыре мутантных полипептида CTLA-4 ВКД не являются идентичными (то есть, гетеротетрамер). Некоторые такие мультимеры связывают CD80 и/или CD86 (и/или hCD80-Ig и/или hCD86-Ig) и/или подавляют или ингибируют иммунный ответ.
Данное изобретение включает растворимые формы любых полипептидов, слитых белков и мультимеров, описанных выше. Также включает растворимые формы конъюгата по данному изобретению, описанные ниже. Растворимые молекулы по данному изобретению, например, растворимые полипептиды, димерные слитые белки, мономерные слитые белки, мультимеры и конъюгаты по данному изобретению не являются соединенными или объединенными или связанными с клеткой. Некоторые такие растворимые молекулы находятся в растворе или способны циркулировать, например, в жидкости (например, в организме субъекта). Сигнальный пептид может обычно использоваться для облегчения секреции такой молекулы, но сигнальный пептид отщепляется в ходе секреции молекулы из клетки-хозяина. Таким образом, в большинстве случаев растворимая молекула, такая как растворимый полипептид, димерный слитый белок, мономерный слитый белок или мультимер, не включает сигнальный пептид. Как обсуждается выше, полипептид мутантного внеклеточного домена CTLA-4 по данному изобретению может быть связан с молекулой Ig, включая, например, часть Ig полипептида, такого как, например, полипептид Ig Fc, что дает в результате растворимый слитый белок. Таким образом, в одном аспекте данное изобретение включает растворимые мутантные слитые белки CTLA-4-Ig, которые включают любой мутантный полипептид CTLA-4 ВКД по данному изобретению, как описано здесь, слитый или связанный с, по меньшей мере, частью Ig полипептида, такого как, например, дикого типа Ig Fc (например, человеческий IgG2 Fc) или мутантный Ig Fc полипептид. Такие растворимые мутантные слитые белки CTLA-4-Ig могут быть мономерными или димерными слитыми белками и включают те мутантные мономеры CTLA-4-Ig и димеры слитого белка, которые описаны детально выше и везде в данном описании, включая примеры ниже. Как описано детально выше и везде в данном описании, некоторые такие растворимые мономерные и димерные слитые белки могут иметь способность связывать CD80 и/или CD86 и/или способность подавлять или ингибировать иммунный ответ (например, Т-клеточная активацию или пролиферацию) в in vitro и/или in vivo применениях.
Предполагают, что такие растворимые молекулы по данному изобретению являются особенно эффективными в различных сферах применения, включая, например, терапевтические и профилактические способы лечения заболеваний и нарушений иммунной системы (например, аутоиммунные заболевания) и профилактические и терапевтические способы для ингибирования отторжения трансплантата клетки, органа или ткани. Растворимые молекулы по данному изобретению, например, растворимые рекомбинантные мутантные полипептиды CTLA-4 ВКД, мономерные и димерные мутантные слитые белки CTLA-4-Ig, мутантные CTLA-4 ВКД конъюгаты, мутантные конъюгаты CTLA-4-Ig, мультимеры, включающие мутантные полипептиды CTLA-4 ВКД или мутантные CTLA-4-Ig, мультимеры, включающие мутантные конъюгаты CTLA-4 или мутантные CTLA-4-Ig конъюгаты изобретения, которые связывают CD80 и/или CD86, при введении субъекту в терапевтически или профилактически эффективном количестве, ингибируют взаимодействие между эндогенным CD80 и/или CD86 и эндогенным CD28, тем самым, подавляя у субъекта ответ иммунной системы или атаку иммунной системы на здоровые ткани, органы и/или клетки организма субъекта. В случаях, когда субъект - это реципиент здоровых тканей, органов и/или клеток организма донора (например, таких, когда субъект-реципиент получил донорский тканевой трансплантат или клетку или трансплантат-орган), такие растворимые молекулы ингибируют взаимодействие между эндогенным CD80 и/или CD86 и эндогенным CD28, тем самым, ингибируя вредный ответ или атаку иммунной системы субъекта на здоровые ткани, органы и/или клетки организма, полученные субъектом от донора. Путем подавления ответа или атаки иммунной системы на здоровые ткани организма побочные эффекты (например, боль, воспаление сустава и т.п.), связанные с таким ответом или атакой иммунной системы на здоровые ткани, органы и/или клетки организма у субъекта могут снижаться, и нарушения, появляющиеся в результате такого ответа или атаки, могут быть замедлены или предотвращены.
Способы измерения связывающих аффинностей и авидностей полипептидов по данному изобретению, описанных выше, включая, например, мутантные полипептиды CTLA-4 ВКД, димерные и мономерные мутантные слитые белки CTLA-4-Ig и мультимеры по данному изобретению, известны специалистам в данной области и включают, например, но не ограничивается следующим, Biacore™ технология (GE Healthcare), изотермическая титриметрическая микрокалориметрия (MicroCal LLC, Northampton, MA), ELISA, способы фагового дисплея измерения аффинности связывания и FACS способы. Biacore способы описаны более подробно в примере 4 ниже. FACS или другие способы сортировки описаны более детально выше и везде в данном описании. Способы измерения авидностей связывания полипептидов по данному изобретению к hCD80 и/или hCD86 с помощью фагового ELISA описаны в примере 2 ниже.
Способы определения и измерения Т-клеточных ответов, индуцированных молекулами по данному изобретению (включая, например, мутантные полипептиды CTLA-4 ВКД, димерные и мономерные мутантные слитые белки CTLA-4-Ig и мультимеры по данному изобретению) хорошо известны специалистам в данной области. Т-клеточная активация типично характеризуется физиологическими событиями, включая, например, Т-клеточно-связанный синтез цитокинов (например, IFN-γ продукция) и индукцию маркеров активации (например, CD25, IL-2 рецептора). CD4+ Т-клетки распознают их иммуногенные пептиды в контексте ГКГ класса II молекул, тогда как CD8+ Т-клетки распознают их иммуногенные пептиды в контексте ГКГ класса I молекул. Иллюстративные способы оценки и измерения способности молекул по данному изобретению, описанных выше, ингибировать или подавлять Т-клеточную активацию и/или Т-клеточную пролиферацию или блокировать передачу сигнала посредством CD86 и/или CD80 описаны в примерах 5-8 и везде в данном описании.
Полипептиды, мономерные и димерные слитые белки и мультимеры по данному изобретению, включая те, что обсуждались выше, необязательно также включают дополнительную аминокислоту, такую как метионин, добавленную на N-конце и/или пептидный маркер для очищения или идентификации. Полипептиды по данному изобретению, включая те, что обсуждались выше, необязательно также включают аминокислотную подпоследовательность для очищения, такую как, например, подпоследовательность, выбранную из эпитопного маркера, FLAG маркера, полигистидиновой последовательности и GST (глутатион S-трансфераза) слияние.
Кроме того, как обсуждается более детально ниже, данное изобретение включает изолированные, рекомбинантные или синтетические нуклеиновые кислоты, кодирующие все полипептиды, слитые белки и мультимеры по данному изобретению, описанные выше и более детально ниже.
Идентичность последовательности
Как обсуждалось выше, в одном аспекте данное изобретение включает изолированный или рекомбинантный полипептид, который включает аминокислотную последовательность, имеющую, по меньшей мере, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает CD80 или CD86 или внеклеточный домен каждого и/или имеет способность подавлять или ингибировать иммунный ответ. В другом аспекте как описывается детально ниже, изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид имеет способность связывать CD80 и/или CD86 и/или его ВКД и/или имеет способность подавлять иммунный ответ или ее комплементарную полинуклеотидную последовательность.
Степень, с которой последовательность (полипептидная или нуклеиновая кислоты) сходна с другой, обеспечивает определение сходных структурных и функциональных свойств двух последовательностей. Соответственно, в контексте данного изобретения последовательности, которые имеют последовательность, сходную с любой данной последовательностью для примера, являются признаком данного изобретения. Последовательности, которые имеют процент идентичностей последовательности, как определено ниже, являются признаком данного изобретения. Могут использоваться различные способы определения взаимоотношений последовательностей, включая выравнивание вручную и выравнивание и анализ последовательностей с помощью компьютера. Доступны разнообразные компьютерные программы для проведения выравнивания последовательности, или они могут быть созданы специалистом в данной области.
Как отмечалось выше, последовательности нуклеиновых кислот и полипептидов, применяемые для субъекта по данному изобретению, не должны быть идентичными, но могут быть по сути идентичными соответствующей последовательности нуклеиновой кислоты по данному изобретению или полипептида по данному изобретению соответственно. Например, полипептиды по данному изобретению могут быть объектом различных изменений, таких как одна или несколько аминокислотных вставок, делеций и/или замен, или консервативных или неконсервативных, включая те случаи, когда, например, такие изменения могут обеспечивать определенные преимущества при их использовании, таких как при их терапевтическом или профилактическом применении или введении или диагностическом применении. Нуклеиновые кислоты по данному изобретению могут также подвергаться различным изменениям, таким как одна или несколько замен одной или нескольких нуклеиновых кислот в одном или нескольких кодонах, так что конкретный кодон кодирует такую же или другую аминокислоту, приводя либо к молчащей вариации (например, мутация в нуклеотидной последовательности в результате молчащей мутации в аминокислотной последовательности, например, когда кодируемая аминокислота не изменяется примутацией нуклеиновой кислоты) или немолчащей вариации, одной или нескольким делениям одной или нескольких нуклеиновых кислот (или кодонов) в последовательности, одному или нескольким дополнениям или вставкам одной или нескольких нуклеиновых кислот (или кодонов) в последовательности, отщеплению или одному или нескольким отщеплениям одной или нескольких нуклеиновых кислот (или кодонов) в последовательности. Нуклеиновые кислоты могут также быть модифицированными, чтобы включать один или несколько кодонов, которые обеспечивают оптимальную экспрессию в системе экспрессии (например, бактериальной или млекопитающего), причем, при необходимости, указанный один или несколько кодонов все еще кодируют одинаковую(ые) аминокислоту(ы). Такие изменения нуклеиновой кислоты могут обеспечивать определенные преимущества при их терапевтическом или профилактическом применении или введении, или диагностическом применении. Нуклеиновые кислоты и полипептиды могут модифицироваться различными путями при условии, что они включают последовательность по сути идентичную (как определено ниже) последовательности соответствующей нуклеиновой кислоты или полипептида по данному изобретению.
Выражение "идентичные" или "идентичность," в контексте двух или нескольких последовательностей нуклеиновых кислот или полипептидов, относится к двум или нескольким последовательностям, которые являются одинаковыми или имеют определенный процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми, при сравнении и выравнивании с максимальным сходством, что определяется с применением алгоритма сравнения последовательностей, описанного ниже, или с помощью визуального анализа. "Процент идентичности последовательности" ("% идентичности") исследуемой последовательности с эталонной (а именно заданная) последовательностью означает, что исследуемая последовательность идентична (а именно на основе аминокислота-к-аминокислоте для аминокислотной последовательности или на основе нуклеотид-к-нуклеотиду для полинуклеотидной последовательности) на определенный процент с заданной последовательностью через сравнение длины.
Процент идентичности последовательности ("% идентичности последовательности" или "% идентичности") исследуемой последовательности с заданной последовательностью может быть рассчитана следующим образом. Во-первых, оптимальное выравнивание двух последовательностей определяется с использованием алгоритма сравнения последовательностей со специфическими параметрами выравнивания. Это определение оптимального выравнивания может проводится с применением компьютера или может быть рассчитано вручную, как описано ниже. Затем две оптимально выровненные последовательности сравнивают через сравнение длины и определяют число положений в оптимальном выравнивании, в которых идентичные остатки находятся в обеих последовательностях, тем самым обеспечивая число совпадающих положений. Число совпадающих положений затем делят на общее число положений сравниваемой длины (которая, если не определено обратное, является длиной заданной последовательности) и затем умножают результат на 100, чтобы получить процент идентичности последовательности исследуемой последовательности с заданной последовательностью.
По отношению к аминокислотным последовательностям обычно одна последовательность рассматривается как "заданная последовательность" (например, аминокислотная последовательность по данному изобретению), с которой сравниваются одна или несколько других последовательностей, а именно "исследуемая последовательность(и)" (например, последовательности, присутствующие в базе данных последовательностей). Алгоритм сравнения последовательностей использует определенные параметры выравнивания для определения оптимального выравнивания между заданной последовательностью и исследуемой последовательностью(ями). Когда сравнивают заданную последовательность с базой данных последовательностей, такой как, например, GENBANK® база данных (Банк Данных Генетических Последовательностей; Департамент здравоохранения и социального обслуживания США) или GENESEQ® базой данных (Thomson Derwent; также доступная как DGENE® база данных на STN), обычно только заданную последовательность и параметры выравнивания вводят в компьютер; оптимальные выравнивания между заданной последовательностью и каждой исследуемой последовательностью возвращают обратно до определенного числа исследуемых последовательностей.
1. Определение оптимального выравнивания
Две аминокислотные последовательности являются "оптимально выровненными", когда они выровнены с применением определенных параметров, а именно определенной матрицы аминокислотных замен, штраф за внесение гэпа (также называемый как штраф на открытие гэпа) и штраф на продолжение гэпа, так чтобы достичь наивысшего веса сходства, возможного для этой пары последовательностей. BLOSUM62 матрица (Henikoff and Henikoff (1992) Proc. Natl. Acad. Sci. USA 89(22): 10915-10919) часто используется по умолчанию как матрица замен в алгоритмах выравнивания аминокислотных последовательностей (таких как BLASTP, описанных ниже). Штраф за внесение гэпа налагают за встраивание отдельного аминокислотного гэпа в одной из выравниваемых последовательностей, а штраф на продолжение гэпа налагают за каждое положение остатка в гэпе. Если не определено противоположное, параметры выравнивания, применяемые здесь, следующие: BLOSUM62 матрица замен, штраф за внесение гэпа = 11 и штраф на продолжение гэпа = 1. Вес выравнивания определяется аминокислотными положениями каждой последовательности, с которых выравнивание начинается и заканчивается (например, участок выравнивания), и необязательно вставкой гэпа или нескольких гэпов в одну или обе последовательности, так чтобы привести к наивысшему возможному весу сходства.
Так как оптимальное выравнивание между двумя или несколькими последовательностями может быть определено вручную (как описано ниже), процесс облегчается применением выполняемого на компьютере алгоритма выравнивания, такого как BLAST® (National Library of Medicine), например, BLASTP для аминокислотных последовательностей и BLASTN для последовательностей нуклеиновых кислот, описанные в Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402 и доступные для широких масс через ресурсы, такие как веб-сайт Национального Центра Биотехнологической Информации (NCBI). Когда применяется компьютеризированный BLAST интерфейс, если существует опция на применение "фильтр низкой сложности", то эту опцию следует выключить (а именно без фильтра).
Оптимальное выравнивание между двумя аминокислотными последовательностями может также определяться подсчетом вручную BLASTP алгоритма (а именно без помощи компьютера) с применением тех же параметров выравнивания, определенных выше (матрица = BLOSUM62, штраф на открытие гэпа = 11 и штраф на продолжение гэпа = 1). Для начала две последовательности начально выравнивают визуальным осмотром. Начальный вес выравнивания затем обсчитывают следующим образом: для каждого индивидуального положения выравнивания (а именно для каждой пары выровненных остатков), численное значение оценивают согласно BLOSUM62 матрице (фигура 13). Сумма значений, установленных для каждой пары остатков в выравнивании, представляет собой вес выравнивания. Если две последовательности, подлежащие выравниванию, являются сходными в высокой степени, часто это начальное выравнивание обеспечивает наивысший возможный вес выравнивания. Выравнивание с наивысшим возможным весом выравнивания представляет собой оптимальное выравнивание на основании применяемых параметров выравнивания.
Примеры расчета вручную показателей выравнивания для двух последовательностей представлены на фигурах 14A-14D. Фигура 14А показывает расчет веса выравнивания для произвольного выравнивания (выравнивание 14А) "заданной" последовательности, определенной здесь как остатки 39-53 последовательности человеческого CTLA-4 ВКД (SEQ ID NO:159), и "искомой" последовательности, определенной здесь как остатки 40-54 D3 (SEQ ID NO:61). Численное значение, полученное от BLOSUM62 матрицы для каждой выровненной пары аминокислот, показано под каждым положением в выравнивании.
Фигура 14В показывает вес выравнивания для оптимального выравнивания тех же двух последовательностей. Для визуализации каждая идентичная пара аминокислот в выравнивании показана жирным. Выравнивание на фигуре 14В (выравнивание 14В) ниже приводит к наивысшему возможному весу выравнивания (сумма значений, показанных под каждым выравниваемым положением) этих двух последовательностей; любое другое выравнивание этих двух последовательностей, с или без гэпов, будет приводить в более низкому весу выравнивания.
В некоторых случаях более высокий вес выравнивания может быть получен встраиванием одного или нескольких гэпов в выравнивании. Какой бы гэп ни был встроен в выравнивание, назначают штраф на открытие гэпа и в дополнение назначают штраф на продолжение гэпа за каждое положение остатка в гэпе. Тем самым, с применением параметров выравнивания, описанных выше (включая штраф на открытие гэпа = 11 и штраф на продолжение гэпа = 1), гэп одного остатка в выравнивании будет соответствовать значению - (11+(1×1))=-12, назначенному гэпу; гэп двух остатков будет соответствовать значению - (11+(2×1))=-13, назначенному гэпу и т.д. Этот расчет повторяют для каждого нового гэпа, встроенного в выравнивание.
Далее следует пример, который демонстрирует, как встраивание гэпа в выравнивание может привести к более высокому весу выравнивания, несмотря на штраф за введение гэпа. Фигура 14С показывает выравнивание (выравнивание 14С) "заданной" последовательности, определенной здесь как остатки 39-53 последовательности человеческого CTLA-4 ВКД (SEQ ID NO:159), и "искомой" последовательности, определенной здесь как остатки 41-55 D3 (SEQ ID NO:61), но в этом случае без аминокислот 49-50, которые удалили. Выравнивание 14С, которое является наилучшим возможным выравниванием без встраивания любых гэпов, приводит к весу выравнивания 34.
Выравнивание на фигуре 14D (выравнивание 14D) показывает эффект встраивания гэпа их двух остатков в более низкую последовательность по весу выравнивания. Хотя общий штраф за введение гэпа составляет 13 (штраф на открытие гэпа 11 и 2-кратный штраф на продолжение гэпа 1), общий вес выравнивания двух последовательностей возрастает до 43. Выравнивание D ниже приводит к наивысшему возможному весу выравнивания и является, таким образом, оптимальным выравниванием этих двух последовательностей; любое другое выравнивание этих двух последовательностей (с или без гэпов) будет приводить к более низкому весу выравнивания.
Должно быть понятно, что примеры расчетов выравнивания последовательностей, описанные выше, которые используют относительно короткие последовательности, приводятся только с иллюстративными целями. На практике используемые параметры выравнивания (BLOSUM62 матрица, штраф на открытие гэпа = 11 и штраф на продолжение гэпа = 1) в общем относятся к аминокислотным последовательностям длиной 85 аминокислот и более. NCBI веб-сайт обеспечивает следующие параметры выравнивания для последовательностей других длин, которые приемлемы для компьютеризированного, а также подсчета выравнивания вручную, с применением той же процедуры, как описано выше. Для последовательностей 50-85 аминокислот в длину оптимальные параметры представляют собой BLOSUM80 матрицу (Henikoff and Henikoff, смотри выше), штраф на открытие гэпа = 10, и штраф на продолжение гэпа = 1. Для последовательностей 35-50 аминокислот в длину, оптимальными параметрами являются РАМ70 матрица (Dayhoff, M.O., Schwartz, R.M. & Orcutt, B.C. (1978) "A model of evolutionary change in proteins" в Atlas of Protein Sequence and Strucrute, vol. 5, suppl. 3, M.O. Dayhoff (ed.), pp.345-352, Natl. Biomed. Res. Found., Washington, DC), штраф на открытие гэпа = 10, и штраф на продолжение гэпа = 1. Для последовательностей длиной менее чем 35 аминокислот оптимальными параметрами являются РАМЗО матрица (Dayhoff, M.O., смотри выше), штраф на открытие гэпа = 9 и штраф на продолжение гэпа = 1.
2. Расчет процента идентичности
Как только последовательности оптимально выровнены, рассчитывают процент идентичности исследуемой последовательности относительно заданной последовательности путем подсчета числа положений в оптимальном выравнивании, которые содержат идентичные пары остатков, делят это значение на количество остатков в сравниваемой длине (также называемой участком сравнения), которое, если только не определено обратное, является числом остатков в заданной последовательности, и умножают полученное число на 100. Возвращаясь обратно к выравниваниям выше, в каждом примере последовательность, обозначенная как заданная (верхняя) последовательность, имеет длину 15 аминокислот. В выравнивании В 12 пар выравниваемых аминокислотных остатков (показанных жирным) являются идентичными в оптимальном выравнивании заданной последовательности (верхняя) с исследуемыми последовательностями (нижние). Таким образом, эта конкретная исследуемая последовательность имеет (12/15)×100=80% идентичность с полноразмерной в 15 остатков заданной последовательностью; другими словами, исследуемая последовательность в выравнивании В имеет, по меньшей мере, 80% идентичность последовательности аминокислот с заданной последовательностью. В выравнивании D 11 пар аминокислотных остатков (показанные жирным) в оптимальном выравнивании являются идентичными; таким образом, эта конкретная исследуемая последовательность имеет (11/15)×100=73,3% идентичность с заданной последовательностью с полной длиной в 15 аминокислот; другими словами, исследуемая последовательность в выравнивании D имеет, по меньшей мере, 73% идентичность последовательности аминокислот с заданной последовательностью.
Применительно к полипептидам выражение "существенная идентичность" (или "по сути идентичный") обычно означает, что когда две аминокислотные последовательности (а именно заданная последовательность и исследуемая последовательность) являются оптимально выровненными с применением BLASTP алгоритма (вручную или с помощью компьютера) с применением приемлемых параметров, описанных выше, то исследуемая последовательность имеет, по меньшей мере, 70%, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность аминокислотной последовательности с заданной последовательностью. В некоторых случаях существенная идентичность существует при сравнении длин, по меньшей мере, 100 аминокислотных остатков, таких как, например, по меньшей мере, 110, 115, 118, 119, 120, 121, 122, 123, 124, 125, 130, 135, 140, 145, 150, 200, 250, 300, 345, 346, 347, 348, 349, 350, 351, 352, 353, 354, 355, 356, 357, 358, 359, 360, 375, 400, 450 или 500 аминокислотных остатков.
Сходным образом, применительно в контексте двух последовательностей нуклеиновых кислот, выражение существенная идентичность (или по сути идентичная) означает, что когда две последовательности нуклеиновых кислот (а именно заданная и исследуемая последовательность) являются оптимально выровненными с применением BLASTN алгоритма (вручную или с помощью компьютера) с применением приемлемых параметров, описанных ниже, то исследуемая последовательность имеет, по меньшей мере, около 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности нуклеиновых кислот с заданной последовательностью. Параметры, используемые для выравниваний последовательностей нуклеиновых кислот, являются следующими: вознаграждение за совпадение 1, штраф за несовпадение -3, штраф на внесение гэпа 5, штраф на продолжение гэпа 2 (матрицы замен не используются в BLASTN алгоритме). В некоторых случаях существенная идентичность существует при сравнении длин, по меньшей мере, 300 нуклеотидных остатков, например, по меньшей мере, 330, 345, 354, 357, 360, 363, 366, 369, 362, 365, 375, 390, 405, 420, 435, 450, 600, 750, 900, 1035, 1038, 1041, 1044, 1047, 1050, 1053, 1056, 1059, 1062, 1065, 1068, 1071, 1074, 1077, 1080, 1200, 1350 или 1500 нуклеотидных остатков.
Могут использоваться другие программы выравнивания последовательностей, известные в данной области техники. Программа ALIGN дает оптимальное глобальное (общее) выравнивание двух выбранных последовательностей белков или нуклеиновых кислот с применением модификации динамического программного алгоритма, описанного в Myers and Miller CABIOS 4: 11-17 (1988). Программа ALIGN обычно, хотя не обязательно, используется для взвешенных конечных гэпов. Если присутствуют штрафы за открытие или продолжение гэпа, они чаше всего находятся в диапазоне от около -5 до -15 и от 0 до -3 соответственно, более преимущественно около -12 и от -0,5 до -2 соответственно, для выравниваний аминокислотных последовательностей и от -10 до -20 и от -3 до -5 соответственно, чаще около -16 и -4 соответственно для выравниваний последовательностей нуклеиновых кислот. Программа ALIGN также описана в Pearson et al, Proc. Natl. Acad. Sci. USA 85:2444-48 (1988), и Pearson et al, Meth. Enzymol. 18:63-98 (1990).
Альтернативно, и конкретно для множественного анализа последовательностей (а именно сравнение более чем трех последовательностей) может быть использована программа CLUSTALW (описанная в, например, Thompson et al., Nucl. Acids Res. 22:4673-4680 (1994)). Программа CLUSTALW - это алгоритм, приемлемый для множественных выравниваний ДНК и аминокислотных последовательностей (Thompson et al., Nucl. Acids Res. 22:4673-4680 (1994)). CLUSTALW осуществляет множественные попарные сравнения между группами последовательностей и объединяет их множественное выравнивание на основании гомологии. В одном аспекте штрафы за открытие гэпа и за продолжение гэпа составляли 10 и 0,05 соответственно. Альтернативно или дополнительно программа CLUSTALW работает с применением "динамических" (против "быстрых") настроек. Типично, анализ нуклеотидной последовательности с CLUSTALW проводят с применением BESTFIT матрицы, тогда как аминокислотные последовательности анализируют с применением вариабельной настройки BLOSUM матриц в зависимости от уровня идентичности между последовательностями (например, как используется в CLUSTALW версии 1,6 программы, доступной от San Diego Supercomputer Center (SDSC) или версии W 1,8, доступной от Европейского Института Биоинформатики, Кембридж, Великобритания). Преимущественно, CLUSTALW настройки устанавливаются для SDSC CLUSTALW настроек по умолчанию (например, в отношении специальных штрафов за гидрофильный гэп в анализе аминокислотных последовательностей). Программа CLUSTALW также описана в, например, Higgins et al, CABIOS 8(2): 189-91 (1992), Thompson et al, Nucleic Acids Res. 22:4673-80 (1994), и Jeanmougin et al., Trends Biochem. Sci. 2:403-07 (1998).
В альтернативном формате идентичность или процент идентичности между конкретной парой выровненных аминокислотных последовательностей относится к проценту идентичности последовательности аминокислот, который получают с помощью CLUSTALW анализа (например, версия W 1,8), подсчитывая число идентичных совпадений в выравнивании и деля это число идентичных совпадений на большую из (i) длины выровненных последовательностей, и (и) 96, и с применением с следующих параметров по умолчанию ClustalW для получения медленных/точных попарных выравниваний - Штраф на открытие гэпа: 10; Штраф на продолжение гэпа: 0,10; Матрица сравнения белков: ряды Gonnet; Матрица сравнения ДНК: IUB; медленные/быстрые попарные выравнивания Toggle = медленное или полное выравнивание.
Другой полезный алгоритм для определения процента идентичности или процента сходства - это FASTA алгоритм, который описан в Pearson et al., Proc Natl. Acad. Sci. USA 85:2444 (1988) и Pearson, Methods Enzymol. 266:227-258 (1996). Типичные параметры, используемые в FASTA выравнивании ДНК последовательностей для расчета процента идентичности, являются оптимизированными, BL50 Матрица 15: -5, k-tuple (идентичный участок) = 2; штраф за связывание = 40, оптимизация = 28; штраф за введение гэпа = -12, штраф за продолжение гэпа = -2; и ширина = 16.
Другие приемлемые алгоритмы включают BLAST и BLAST 2,0 алгоритмы, которые облегчают анализ, по меньшей мере, двух аминокислотных или нуклеотидных последовательностей путем выравнивания выбранной последовательности против множественных последовательностей в базе данных (например, GenSeq), или, если они модифицированы, то с помощью дополнительного алгоритма, такого как BL2SEQ, между двумя выбранными последовательностями. Программное обеспечение для проведения BLAST анализов публично доступно от Национального Центра Биотехнологической Информации (NCBI) (адрес всемирного веб-сайта ncbi.nlm.nih.gov). BLAST алгоритм включает первое определение пар последовательностей с высоким весом (HSP) путем определение коротких слов длины W в заданной последовательности, которая либо совпадает, либо удовлетворяет некоторому позитивному пороговому значению веса Т, когда выравнивается со словом той же длины в последовательности базы данных. Т относится к пределу веса соседнего слова (Altschul et al., смотри выше). Эти начальные попадания соседних слов работают как затравка для начальных поисков для обнаружения более длинных HSP, содержащих их. Попадания слов распространяются в обоих направлениях вдоль каждой последовательности, пока совокупный показатель выравнивания может быть увеличен. Совокупные показатели рассчитывают, используя, для нуклеотидных последовательностей, параметры М (поощрительный бал за каждую пару совпадающих остатков; всегда >0) и N (штрафной балл за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей матрица замен используется для расчета совокупного показателя. Продолжение попаданий слов в каждом направлении останавливают, когда: совокупный показатель выравнивания падает на величину Х от его максимального достижимого значения; совокупный показатель идет к нулю или ниже, из-за накопления одного или нескольких выравниваний остатков с негативным показателем; или достигается конец каждой последовательности. Параметры BLAST алгоритма W, Т и Х определяют чувствительность и скорость выравнивания. BLASTN программа (для нуклеотидных последовательностей) может использоваться с длиной слов (W) равной 11, ожиданием (Е) равным 10, М=5, N=-4 и сравнением двух цепей. Для аминокислотных последовательностей BLASTP программа (например, BLASTP 2,0,14; 29 июня 2000) может быть использована с длиной слов, равной 3, и ожиданием (Е), равным 10. BLOSUM62 матрица замен (смотри Henikoff & Henikoff, (1989) Proc. Natl. Acad. Sci. USA 89:10915) использует выравнивания (В), равные 50, ожидание (Е), равное 10, М=5, N=-4, и сравнение обеих цепей. Снова, как и в других приемлемых алгоритмах, строгость сравнения может быть увеличена, пока программа определяет только последовательности, которые более близко связаны с теми в последовательности, перечисленной здесь (например, полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 85, 90, 91, 92, 93, 49, 95, 96, 97, 98, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из SEQ ID NOS:1-79, 197-200, 205-214 и 219-222; или нуклеиновая кислота, включающая нуклеотидную последовательность, имеющая, по меньшей мере, 85, 90, 91, 92, 93, 49, 95, 96, 97, 98, 99% или 100% идентичность с нуклеотидной последовательностью, выбранной из любой SEQ ID NOS:80-158, 201-204, 223 и 224, или комплементарную ей нуклеотидную последовательность.
BLAST алгоритм также проводит статистический анализ сходства или идентичности между двумя последовательностями (смотри, например, Karlin & Altschul, (1993) Proc. Natl. Acad. Sci. USA 90:5873-5787). Одно измерение сходства или идентичности, обеспеченное BLAST алгоритмом, представляет собой наименьшую суммарную вероятность (P(N)), которая обеспечивает критерий вероятности, с которой совпадение между двумя нуклеотидными или аминокислотными последовательностями будет происходить случайно. Например, нуклеиновая кислота рассматривается как сходная с эталонной последовательностью, если наименьшая суммарная вероятность в сравнении анализируемой нуклеиновой кислоты с эталонной нуклеиновой кислотой составляет менее чем около 0,2, такая как менее чем около 0,01 или менее чем около 0,001.
BLAST программный анализ также или альтернативно может быть модифицирован программами фильтрования низкой сложности, такими как DUST или SEG программы, которые преимущественно интегрированы в BLAST операционные системы (смотри, например, Wootton et al., Comput. Chem. 17:149-63 (1993), Altschul et al., Nat. Genet. 6:119-29 (1991), Hancock et al., Comput. Appl. Biosci. 10:67-70 (1991), и Wootton et al, Meth. Enzymol. 266:554-71 (1996)). В этих аспектах если используется равенство лямбда, то пригодные настройки для равенства находятся между 0,75 и 0,95, включая между 0,8 и 0,9. Если в таком аспекте используют показатели существования гэпа (или веса гэпа), то показатель существования гэпа находится обычно между около -5 и -15, чаще около -10, и наиболее часто показатель гэпа обычно находится между около 0 до -5, такой как между 0 и -3 (например, -0,5). Сходные параметры гэпа могут быть использованы в других программах как приемлемые. BLAST программы и принципы, связанные с ними, также описаны в, например, Altschul et al., J. Mol. Biol. 215:403-10 (1990), Karlin and Altschul, Proc. Natl. Acad. Sci. USA 87:2264-68 (199) (модифицированный Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-77 (1993)), и Altschul et al., Nucl. Acids Res. 25:3389-3402 (1997).
Другой пример полезного алгоритма представляет собой встроенное в PILEUP программное обеспечение. PILEUP программы создают множественное выравнивание последовательностей из группы связанных последовательностей с применением прогрессивных попарных выравниваний для того, чтобы показать взаимоотношение и процент идентичности последовательностей или процент сходства последовательностей. PILEUP использует упрощение способа прогрессивного выравнивания Feng & Doolittle (1987) J. Mol. Evol. 35:351-360, который сходен со способом, описанным в Higgins & Sharp (1989) CABIOS 5:151-153. Программа может выравнивать до 300 последовательностей, каждая максимально длиной 5000 нуклеотидов или аминокислот. Процедура множественного выравнивания начинается с попарного выравнивания двух наиболее сходных последовательностей, образуя кластер двух выровненных последовательностей. Этот кластер затем выравнивают со следующей наиболее сходной последовательностью или кластером выровненных последовательностей. Два кластера последовательностей выравнивают простым продолжением попарного выравнивания двух индивидуальных последовательностей. Конечное выравнивание достигается сериями прогрессивных попарных выравниваний. Программа работает с помощью определения специфических последовательностей и их аминокислотных или нуклеотидных координат для областей сравнения последовательностей и с помощью определенных параметров программы. С применением PILEUP эталонная последовательность сравнивается с другими анализируемыми последовательностями для определения отношения процента идентичности последовательности (или процента сходства последовательностей) с применением определенных параметров. Иллюстративные параметры для PILEUP программы следующие: масса гэпа по умолчанию (3,00), стандартный штраф за продолжение гэпа (0,10) и взвешенные конечные гэпы. PILEUP является компонентом пакета программного обеспечения GCG анализа последовательностей, например, версии 7,0 (Devereaux et al. (1984) Nucl. Acids Res. 12:387-395).
Другие полезные алгоритмы для проведения анализа идентичности включают алгоритм локальной гомологии Smith и Waterman (1981) Adv. Appl. Math. 2:482, алгоритм гомологии выравнивания Needleman и Wunsch (1970) J. Mol. Biol. 48:443 и способ поиска для сходства Pearson и Lipman (1988) Proc. Natl. Acad. Sci. USA 85:2444. Компьютеризированные осуществления этих алгоритмов (например, GAP, BESTFIT, FASTA и TFASTA) обеспечиваются в Wisconsin Genetics Software Package Release 7.0, Genetics Computer Group, 575 Science Dr., Madison, WI.
Вариации последовательностей
Как обсуждалось выше, в одном аспекте изобретение обеспечивает изолированный или рекомбинантный полипептид мутантного внеклеточного домена CTLA-4, который включает аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5 или 6 аминокислотным остаткам), где мутантный полипептид CTLA-4 ВКД связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих и/или ингибирует иммунный ответ. Такая аминокислотная(ые) замена(ы) включает(ют) консервативную(ые) аминокислотную(ые) замену(ы).
В качестве неограничивающего примера, полипептид по данному изобретению может иметь аминокислотную последовательность, которая отличается от SEQ ID NO:1 в общем на до 6 аминокислот (что может быть комбинацией аминокислотных замен, делеций и/или вставок, включая те, что описаны выше). В некоторых случаях ни одна, несколько или все замены - это замены, соответствующие группе замен, определенных ниже.
Аминокислотные замены согласно изобретению могут включать, но не ограничиваются следующим, одну или несколько консервативных аминокислотных замен. Консервативная замена аминокислотного остатка обычно включает замены члена одного функционального класса аминокислотных остатков на остаток, который принадлежит этому же функциональному классу (идентичные аминокислотные остатки рассматриваются как функционально гомологичные или консервативные в расчете функциональной гомологии). Таблицы консервативных замен, обеспечивающие функционально подобные аминокислоты, хорошо известны в области техники. Один пример представлен в таблице 1, которая приводит шесть иллюстративных групп, содержащих аминокислоты, которые могут рассматриваться как "консервативные замены" друг для друга.
| Таблица 1 | ||||
| Группы консервативных замен аминокислотных остатков | ||||
| 1 | Аланин (А) | Глицин (G) | Серин (S) | Треонин (Т) |
| 2 | Аспарагиновая кислота (D) | Глутаминовая кислота (Е) | ||
| 3 | Аспарагин (N) | Глутамин (Q) | ||
| 4 | Аргинин (R) | Лизин (K) | Гистидин (Н) | |
| 5 | Изолейцин (I) | Лейцин (L) | Метионин (М) | Валин (V) |
| 6 | Фенилаланин (F) | Тирозин (Y) | Триптофан (W) | |
Можно предположить другие группы замен аминокислот. Например, аминокислоты могут быть сгруппированы по сходной функции или химической структуре или составу (например, кислотная, основная, алифатическая, ароматическая, содержащая серу). Например, алифатическая группа может содержать: Глицин (G), Аланин (А), Валин (V), Лейцин (L), Изолейцин (I). Другие группы, содержащие аминокислоты, которые рассматриваются как консервативные замены друг для друга, включают: ароматическую: Фенилаланин (F), Тирозин (Y), Триптофан (W); содержащую серу: Метионин (М), Цистеин (С); основную: Аргинин (R), Лизин (K), Гистидин (Н); кислотную: Аспарагиновая кислота (D), Глутаминовая кислота (Е); неполярных незаряженных остатков: Цистеин (С), Метионин (М) и Пролин (Р); гидрофильных незаряженных остатков: Серин (S), Треонин (Т), Аспарагин (N) и Глутамин (Q). Смотри также Creighton (1984) Proteins, W.H. Freeman and Company, для дополнительных группировок аминокислот. Перечисление аминокислотной последовательности здесь, вместе с вышеизложенными группами замены, обеспечивает краткое перечисление всех консервативно замещенных аминокислотных последовательностей.
Более консервативные замены существуют в классах аминокислотных остатков, описанных выше, которые также или альтернативно могут быть пригодны. Консервативные группы для замен, которые являются более консервативными, включают: валин-лейцин-изолейцин, фенилаланин-тирозин, лизин-аргинин, аланин-валин и аспарагин-глутамин. Таким образом, например, в одном конкретном аспекте изобретение обеспечивает изолированный или рекомбинантный полипептид, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% идентичность с SEQ ID NO:1 (или любой SEQ ID NOS:1-79, 197-200, 205-214 и 219-222) и которая отличается от последовательности SEQ ID NO:1 на, главным образом, (например, по меньшей мере, 50%, 60%, 70%, 75%, 80%, 90%), если не полностью, на такие более консервативные аминокислотные замены.
Дополнительные группы аминокислотных замен, которые также могут использоваться, могут быть определены с использованием принципов, описанных в, например, Creighton (1984) PROTEINS: STRUCTURE AND MOLECULAR PROPERTIES (2d Ed. 1993), W.H. Freeman and Company. В некоторых аспектах, по меньшей мере, 33%, 50%, 60%, 70% или более (например, по меньшей мере, 75%, 80%, 90%, 95%, 96%, 97% или более) замен в варианте аминокислотной последовательности включают замены одного или нескольких аминокислотных остатков в аминокислотной последовательности по данному изобретению на остатки, которые находятся в том же функциональном гомологичном классе (как определяется с помощью любой пригодной классификационной системы, такой как те, что описаны выше), что и аминокислотные остатки аминокислотной последовательности, что замещаются.
Консервативно замещенные вариации аминокислотной последовательности по данному изобретению включают замены небольшого процента, обычно меньше чем 10%, 9%, 8%, 7% или 6% аминокислот аминокислотной последовательности, или более обычно меньше чем 5%, 4%, 3%, 2% или 1% аминокислот аминокислотной последовательности, на консервативно выбранную аминокислоту из той же группы консервативных замен.
Данное изобретение включает полипептиды, которые включают аминокислотные вариации аминокислотной последовательности по данному изобретению, описанные здесь. Как обсуждалось выше, в одном аспекте изобретение обеспечивает изолированные или рекомбинантные полипептиды (например, мутантные полипептиды CTLA-4, такие как, например, мутантные полипептиды CTLA-4 ВКД), каждый из которых включает аминокислотную последовательность, имеющую, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает CD80 и/или CD86 или полипептид фрагмент CD80 и/или CD86 (или ВКД каждого или обоих) и/или подавляет иммунный ответ. Такие полипептиды могут различаться на одну или несколько аминокислотных делеций, дополнений или замен, включая одну или несколько консервативных или неконсервативных замен, обеспечивая, тем не менее то, что полипептиды обладают описанными функциональными свойствами. В конкретном аспекте изобретение обеспечивает полипептидные варианты, которые включают консервативно модифицированные вариации любого такого полипептида, описанного здесь, такой как, например, тот, который включает аминокислотную последовательность, выбранную из группы SEQ ID NOS:1-73.
Как также обсуждалось выше, в другом аспекте изобретение обеспечивает изолированные или рекомбинантные слитые белки (например, мутантные слитые белки CTLA-4-Ig), каждый из которых включает аминокислотную последовательность, имеющую, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где слитый белок связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig) и/или подавляет иммунный ответ. Такие слитые белки могут отличаться на одну или несколько аминокислотных делеций, дополнений или замен, включая одну или несколько консервативных или неконсервативных замен, обеспечивая, тем не менее то, что слитые белки обладают описанными функциональными свойства. В конкретном аспекте изобретение обеспечивает полипептидные варианты, которые включают консервативно модифицированные вариации любого такого слитого белка, описанные здесь, такой как, например, тот, что включает аминокислотную последовательность, выбранную из группы SEQ ID NOS:74-79, 197-200, 205-214 и 219-222.
Также обеспечиваются полипептидные варианты любого изолированного или рекомбинантного полипептида по данному изобретению, описанного выше или везде в данном описании, где аминокислотная последовательность полипептидного варианта отличается от соответствующей аминокислотной последовательности эталонного полипептида на одну или несколько консервативных замен аминокислотных остатков, хотя неконсервативные замены иногда возможны или даже предпочтительны (примеры таких неконсервативных замен обсуждаются также в данном описании). Например, последовательность полипептидного варианта может отличаться от мутантной аминокислотной последовательности CTLA-4 на одну или несколько замен аминокислотных остатков в мутантной аминокислотной последовательности CTLA-4 ВКД и одним или несколькими аминокислотными остатками, имеющими сходный вtc (a именно остаток, который имеет гомологию веса по отношению к остатку в соответствующей аминокислотной последовательности, который замещается). Вес (и соответственно, размер) аминокислотных остатков полипептида может значительно изменять структуру полипептида. Консервативность, основанная на весе, или гомология основана на том, связана ли неидентичная соответствующая аминокислота с позитивным показателем на одной из матриц, основанных на весе, описанных здесь (например, BLOSUM50 матрица; РАМ250 матрица).
Подобно описанным выше функциональным аминокислотным классам встречающиеся в природе аминокислотные остатки можно разделить на группы консервативности по весу (которые разделены между "сильными" и "слабыми" группами консервативности). Восемь наиболее используемых сильных групп консервативности по весу представляют собой Ser Thr Ala, Asn Glu Gln Lys, Asn His Gln Lys, Asn Asp Glu Gln, Gln His Arg Lys, Met lie Leu Val, Met He Leu Phe, His Tyr и Phe Tyr Trp. Слабые группы консервативности по весу включают Cys Ser Ala, Ala Thr Val, Ser Ala Gly, Ser Thr Asn Lys, Ser Thr Pro Ala, Ser Gly Asn Asp, Ser Asn Asp Glu Gln Lys, Asn Asp Glu Gln His Lys, Asn Glu Gln His Arg Lys, Phe Val Leu He Met и His Phe Tyr. Некоторые версии программы анализа последовательностей CLUSTAL W обеспечивают анализ сильных и слабых групп консервативности по весу на выходе выравнивания, тем самым, предлагая традиционную методику для определения консервативности по весу (например, CLUSTAL W, обеспеченная SDSC, которая обычно применяется с SDSC настройками по умолчанию). В некоторых аспектах, по меньшей мере, 33%, 50%, 60%, 70%, 80% или 90% замен в таком полипептидном варианте включают замены, где остаток с консервативностью по весу, замещает аминокислотный остаток аминокислотной последовательности, который принадлежит той же группе консервативности по весу. Другими словами, такой процент замен сохраняется в выражениях характеристик веса аминокислотного остатка.
Последовательность полипептидного варианта может отличаться от мутантного полипептида CTLA-4 по данному изобретению на одну или несколько аминокислотных замен на один или несколько аминокислотных остатка, имеющих сходный гидрофильный профиль (то есть которые проявляют сходную гидрофильность) с замещенными (исходными) остатками мутантного полипептида CTLA-4. Профиль гидрофильности может быть определен с использованием Kyte-Doolittle индекса, значения для каждой встречающейся в природе аминокислоты в индексе следующие: I (+4,5), V (+4,2), L (+3,8), F (+2,8), С (+2,5), М (+1,9); (+1,8), G (-0,4), Т (-0,7), S (-0,8), W (-0,9), Y (-1,3). Р (-1,6), Н (-3,2); Е (-3,5), Q (-3,5), D (-3,5), N (-3,5), K (-3,9) и R (-4,5) (смотри, например, Патент США №4554101 и Kyte & Doolittle, J. Molec. Biol. 157:105-32 (1982) для дополнительного обсуждения). По меньшей мере, 75%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% 98%, 99% или 100% аминокислотных остатков в вариантной аминокислотной последовательности, которые не являются идентичными соответствующим остаткам в идентичной или функционально гомологичной мутантной аминокислотной последовательности CTLA-4, описанной в данном описании ("наиболее близкий гомолог"), причем гомолог может быть выбран из любой SEQ ID NOS:1-73, проявляют менее чем +/-2 изменения гидрофильности, включая менее чем +/-1 изменения гидрофильности и менее чем +/-0,5 изменения гидрофильности по отношению к неидентичному аминокислотному остатку в соответствующем положении в наиболее близком гомологе. Вариантный полипептид может проявлять полное изменение гидрофильности по отношению к его наиболее близкому гомологу, выбранному из группы SEQ ID NOS:1-73, менее чем около 150, менее чем около 100 и/или менее чем около 50 (например, менее чем около 30, 20 или 10).
Примеры типичных аминокислотных замен, которые обладают сходной или идентичной гидрофильностью, включают замены аргинин-лизин, замены глютамат-аспартат, замены серин-треонин, замены глутамин-аспарагин и замены валин-лейцин-изолейцин. Алгоритмы и программное обеспечение, такие как GREASE программа, доступные от SDSC, обеспечивают традиционный способ для быстрого расчета профиля гидрофильности аминокислотной последовательности. Так как существенная пропорция (например, по меньшей мере, около 33%), если не больше (по меньшей мере 50%) или почти все (например, около 65, 80, 90, 95, 96, 97, 98, 99%) аминокислотных замен в последовательности полипептидного варианта часто будут иметь показатель гидрофильности, сходный с аминокислотным остатком, который они заменяют в (эталонной) аминокислотной последовательности, то предполагают, что последовательность полипептидного варианта показывает данные на выходе программы GREASE, сходные с аминокислотной последовательностью. Например, в конкретном аспекте предполагают, что полипептидный вариант SEQ ID NO:61 имеет выход программы GREASE (или подобной программы), который более схож с выходом GREASE, полученным при введении аминокислотной последовательности SEQ ID NO:61, чем тот, что получен с применением полипептида ДТ CTLA-4 (например, hCTLA-4), который может быть определен визуальным обследованием или сравнением с помощью компьютера графического (например, графического перекрывания/выравнивания) и/или численного выхода, полученного при анализе исследуемой вариантной последовательности и SEQ ID NO:1 на программе.
Консервативность аминокислотных остатков в выражениях функциональной гомологии, гомологии по весу и гидрофильных характеристик также применяют к другим вариантам аминокислотной последовательности согласно изобретению, включая, но не ограничиваясь следующим, например, варианты аминокислотной последовательности, где аминокислотная последовательность выбрана из группы, включающей SEQ ID NOS:1-79197-200, 205-214 и 219-222.
В конкретном аспекте данное изобретение включает, по меньшей мере, один такой полипептидный вариант, включающий аминокислотную последовательность, которая отличается от рекомбинантной аминокислотной последовательности, выбранной из группы SEQ ID NOS:1-79, 197-200, 205-214 и 219-222, где аминокислотная последовательность варианта имеет, по меньшей мере, одну такую замену аминокислотного остатка, выбранную согласно консервативности по весу или гомологии по весу или сходного профиля гидрофильности, как обсуждалось выше. Такие полипептидные варианты, описанные выше, обычно имеют способность связывать CD80 и/или CD86 и/или способность подавлять, по меньшей мере, один тип иммунного ответа, как описано выше и более детально в примерах.
Последовательность сигнальных пептидов
Полипептиды по данному изобретению могут также дополнительно включать любое приемлемое число и тип дополнительных аминокислотных последовательностей, таких как один или несколько пептидных фрагментов. В одном варианте осуществления такой полипептид по данному изобретению также включает сигнальный пептид. В общем, сигнальный пептид направляет рекомбинантный полипептид в эндоплазматический ретикулум, когда рекомбинантный полипептид экспрессируется в клетке животного. Сигнальная последовательность, которая направляет передвижение органелл и/или секрецию, по меньшей мере, части полипептида при экспрессии в клетке, может быть включена. Такие последовательности обычно присутствуют в незрелой (а именно не полностью прошедшей процессинг) форме полипептида и последовательно удаляются/подвергаются деградации клеточными портеазами для получения зрелой формы белка. Например, мутантный полипептид CTLA-4 или слитый белок по данному изобретению может включать любую приемлемую сигнальную последовательность или комбинации сигнальных последовательностей, которые направляют полипептид к внеклеточным компартментам, такие как последовательность, которая направляет полипептид для того, чтобы он транспортировался (например, транслоцировался) в (например, так что белок обрабатывается в нем или высвобождается из него) эндоплазматический ретикулум или секреторный путь передачи (например, ЭР, аппарат Гольджи и другие связанные с секрецией органеллы и клеточные компартменты), ядро, и/или которая направляет полипептид, чтобы он секретировался из клетки, транслоцировался в клеточную мембрану или достигал второй клетки, которая находится отдельно оТ-клетки, из которой он секретируется. В этом отношении полипептид может включать внеклеточную направляющую последовательность (или "сортирующий сигнал"), которая направляет полипептид к эндосомальному и/или лизосомальному компартменту(ам) или другому компартменту, достигая ГКГ II для стимулирования CD4+ и/или CD8+ Т-клеточной презентации и ответа, такие как лизосомально/эндосомально-направляющий сортирующий сигнал, исходящий от белка 1, ассоциированного с мембраной (например, LAMP-1 - смотри, например, Wu et al. Proc. Natl. Acad. Sci. USA 92:1161-75 (1995) и Ravipraskash et al., Virology 290:74-82 (2001)), его часть или гомолог (смотри, например, Патент США №5633234) или другую приемлемую лизосомальную, эндосомальную и/или ЭР направляющую последовательность (смотри, например, Патент США №6248565). В некоторых аспектах для внеклеточной направляющей последовательности может быть желательно, чтобы она была расположена вблизи или смежно с подтвержденной /идентифицированной эпитопной последовательности(ей) в полипептиде, которая может быть определена с помощью методик, известных в области техники, тем самым увеличивая вероятность Т-клеточной презентации полипептидных фрагментов, которые включают такой эпитоп(ы). Такие полипептиды могут экспрессироваться от изолированной, рекомбинантной или синтетической ДНК или РНК, доставленной к клетке-хозяину одним или несколькими векторами переноса нуклеотидов, включая, например, один или несколько векторов переноса генов, которые описаны далее в данном описании.
Полипептид может включать сигнальную последовательность, которая направляет полипептид к эндоплазматическому ретикулуму (ЭР) (например, облегчает ЭР транслокацию полипептида), когда полипептид экспрессируется в клетке млекопитающего. Полипептид может включать любую приемлемую ЭР-направляющую последовательность. Многие ЭР-направляющие последовательности известны в области техники. Примеры таких сигнальных последовательностей описаны в Патенте США №5846540. Наиболее часто используемые ЭР/секреторные сигнальные последовательности включают сигнальную последовательность дрожжевого фактора альфа, и вирусные сигнальные последовательности млекопитающего, такие как сигнальная последовательность вируса герпеса gD. Иллюстративные сигнальные пептиды для продукции Е. coli включают STII или Ipp сигнальные последовательности Е. coli. Также примеры сигнальных последовательностей описаны в, например, Патентах США №4690898, 5284768, 5580758, 5652139 и 5932445. Приемлемые сигнальные последовательности могут быть идентифицированы специалистами в данной области. Например, SignalP программа (описанная в, например, Nielsen et al. (1997) Protein Engineering 10: 1-6), общедоступная от Center for Biological Sequence Analysis на всемирном веб-сайте cbs.dtu.dk/services/SignalP, или подобные программные обеспечения для анализа последовательностей, способные определить домены, подобные сигнальной последовательности, могут быть использованы. Связанные методики для определения пригодных сигнальных пептидов изложены в Nielsen et al., Protein Eng. 10(1): 1-6 (1997). Последовательности могут анализироваться вручную по признакам, обычно связанным с сигнальными последовательностями, как описано в, например, Заявке на Европейский патент №0621337, Zheng and Nicchitta (1999) J. Biol. Chem. 274(51): 36623-30, и Ng et al. (1996) J. Cell Biol. 134(2):269-78.
Дополнительные аспекты
Любой полипептид по данному изобретению (включая любой слитый белок по данному изобретению) может присутствовать как часть большей аминокислотной последовательности, которая возникает при дополнении одного или нескольких доменов или подпоследовательностей для стабилизации, или определения, или очищения полипептида. Такие домены или подпоследовательности могут быть ковалентно слиты с полипептидом по данному изобретению, как понятно специалисту в данной области, и могут формировать конструкт. Аминокислотная подпоследовательность для очищения может включать, например, эпитопный маркер, FLAG маркер, полигистидиновую последовательность, GST слияние или любую другую подпоследовательность определения/очищения или "маркер", известный в данной области техники. Эти дополнительные домены или подпоследовательности либо имеют небольшой, либо не имеют эффекта на активность полипептида по данному изобретению или могут быть удалены с помощью этапов процессинга после синтеза, таких как обработка протеазой, включение интеина или подобное.
Любой полипептид по данному изобретению (включая любой слитый белок по данному изобретению) может также включать один или несколько модифицированных аминокислот. Модифицированная аминокислота может быть, например, гликозилированной аминокислотой, пегилированной аминокислотой, фарнезилированной аминокислотой, ацетилированной аминокислотой, биотинилированной аминокислотой, аминокислотой, конъюгированной с липидной частью, и/или аминокислотой, конъюгированной с органическим дериватизованным агентом. Присутствие модифицированных аминокислот может быть предпочтительным в, например, (а) увеличении времени полужизни полипептида в сыворотке и/или функционального времени полужизни in vivo, (b) уменьшении антигенности или иммуногенности полипептида, (с) увеличении сохранности полипептида, (d) увеличении биодоступности, (е) уменьшении эффекторной функции и/или (f) уменьшении или ингибировании нежелательной самоассоциации (например, формировании агрегатов) между двумя или несколькими молекулами по данному изобретению (такими как между двумя или несколькими димерами слитого белка по данному изобретению). Аминокислота(ы) модифицируются, например, ко-трансляционно или пост-трансляционно в ходе рекомбинантной продукции (например, N-связанного гликозилирования на N-X-S/T мотивах в ходе экспрессии в клетках млекопитающего) или модифицированы синтетическими способами.
Полипептиды по данному изобретению (включая слитые белки по данному изобретению), описанные здесь, могут также быть модифицированы различными способами, например, путем пост-трансляционной модификации и/или синтетической модификации или их вариаций. Например, полипептиды или слитые белки по данному изобретению могут быть приемлемо гликозилированы, обычно путем экспрессии в клетке млекопитающего. Например, в одном аспекте изобретение обеспечивает гликозилированные полипептиды, которые способны связывать CD86 и/или CD80 и/или имеют способность подавлять иммунный ответ (например, Т-клеточную пролиферацию или активацию), как описано в данном описании, где каждый указанный гликозилированный полипептид включает аминокислотную последовательность, имеющую, по меньшей мере, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:1-79, 197-200, 205-214 и 219-222.
Полипептиды по данному изобретению могут быть объектом для любого количества дополнительных форм, пригодных для пост-трансляционной и/или синтетической модификации или вариации. Например, изобретение обеспечивает белок, который копирует полипептиды по данному изобретению. Пептидные миметики описаны в, например, Патенте США №5668110 и ссылках, цитированных в нем.
В другом аспекте полипептид или слитый белок по данному изобретению может быть модифицирован дополнением защитных групп к боковым цепям одной или нескольких аминокислот полипептида или слитого белка. Такие защитные группы могут облегчать транспорт полипептида или слитого белка через мембрану(ы), при необходимости, или через определенную ткань(и), например, путем уменьшения гидрофильности и увеличения липофильности полипептида или слитого белка. Примеры приемлемых защитных групп включают эфирные защитные группы, аминные защитные группы, ацильные защитные группы и защитные группы карбоновой кислоты, которые известны в области техники (смотри, например, Патент США №6121236). Синтетические слитые белки по данному изобретению могут принимать любую приемлемую форму. Например, слитый белок может быть структурно модифицирован из его встречающейся в природе конфигурации для формирования циклического пептида или другого структурно модифицированного пептида.
Полипептиды по данному изобретению также могу быть связанными с одним или несколькими небелковыми полимерами, обычно гидрофильным синтетическим полимером, например, полиэтиленгликоль (ПЭГ), полипропиленгликоль или полиоксиалкилен, применяя методики, хорошо известные в области техники, такие как описанные в, например, Патентах США №4179337, 4301144, 4496689, 4640835, 4670417 и 4791192, или подобным полимером, таким как поливиниловый спирт или поливинилпирролидон (ПВП).
Данное изобретение включает конъюгаты, включающие, по меньшей мере, один полипептид по данному изобретению (например, мутантный полипептид CTLA-4 ВКД, димерный или мономерный мутантный CTLA-4-Ig, мультимерный мутантный полипептид CTLA-4 ВКД, мультимерный мутантный CTLA-4-Ig) и неполипептидную часть. Подразумевается, что выражение "конъюгат" (или взаимозаменяемо "конъюгированный полипептид") обозначает гетерогенную (в смысле состава или химерную) молекулу, сформированную ковалентным присоединением одного или нескольких полипептидов к одной или нескольким неполипептидным частям. Выражение "ковалентное присоединение" означает, что полипептид и неполипептидная часть либо напрямую ковалентно соединены друг с другом, либо косвенно ковалентно соединены друг с другом через промежуточную часть или части, такие как мостик, спейсер, или связью части или частей с использованием группы прикрепления, присутствующей в полипептиде. Преимущественно, конъюгат является растворимым в соответствующих концентрациях и условиях, а именно, растворимым в физиологических жидкостях, таких как кровь. Примеры конъюгированных полипептидов по данному изобретению включают гликозилированные и/или пегилированные полипептиды. Выражение "неконъюгированный полипептид" может использоваться по отношению к полипептидной части конъюгата. Такой конъюгат обычно связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) и/или внеклеточный домен каждого или обоих (включая hCD80-Ig и/или hCD86-Ig) и/или имеет способность ингибировать иммунный ответ. Такой иммунный ответ может содержать, но не ограничивается следующим, например, Т-клеточную активацию или пролиферацию, синтез/продукцию цитокинов, индукцию маркеров активации, продукцию воспалительных молекул, воспаление, продукцию антиколлагеновых AT и/или Т-клеточно-зависимый AT ответ.Иллюстративные полипептиды включают те, которые имеют, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы SEQ ID NOS:1-79, 197-200, 205-214 и 219-222.
Выражение "неполипептидная часть" обозначает молекулу, которая способна конъюгировать с группой прикрепления полипептида по данному изобретению. Предпочтительные примеры такой молекулы включают полимерные молекулы, части Сахаров, липофильные соединения или органические дериватизированные агенты. При использовании в контексте конъюгата, как описано здесь, нужно понимать, что неполипептидная часть связана с полипептидной частью конъюгата через группу прикрепления полипептида.
Выражение "полимерная молекула" обозначает молекулу, сформированную ковалентной связью двух или нескольких мономеров, где ни один из мономеров не является аминокислотным остатком, кроме тех случаев, когда полимером является человеческий альбумин или другой распространенный белок плазмы. Выражение "полимер" может использоваться взаимозаменяемо с выражением "полимерная молекула".
Сайт N-гликозилировния имеет последовательность N-X-S/T/C, где Х - это любой аминокислотный остаток, кроме пролина, N - это аспарагин и S/T/C - это или серин, треонин или цистеин, преимущественно серин или треонин, и наиболее преимущественно треонин.
"Сайт O-гликозилирования" включает ОН-группу серинового или треонинового остатка.
Выражение "группа прикрепления" обозначает группу аминокислотного остатка полипептида, способную соединяться с соответствующей неполипептидной частью, такой как полимерная молекула или часть сахара. Неограничивающие примеры приемлемых групп прикрепления и некоторые соответствующий неполипептидные части приведены в таблице 2 ниже.
| Таблица 2 | ||||
| Приемлемые группы прикрепления и примеры соответствующих неполипептидных частей | ||||
| Группа прикрепле- ния |
Аминокислота | Примеры неполипептидной части | Примеры способов конъюгации/активированный ПЭГ | Ссылка |
| -NH2 | N-конец, Lys | Полимер, например ПЭГ | мПЭГ-SPA мПЭГ-NHS мПЭГ-бутирALD | Nektar Inc. 2003 Catalog; see also Nektar Therapeutics, 2005-06 Catalog |
| -СООН | С-конец, Asp, Glu | Полимер, например ПЭГ Часть сахара | мПЭГ-Hz In vitro связывание | Nektar, Inc. 2003 Catalog;смотри также NectarTherapeutics 2005-06 Catalog |
| -SH | Cys | Полимер, например ПЭГ Часть сахара | мПЭГ-VS мПЭГ-MAL (мПЭГ-малеимид) In vitro связывание | Nektar Inc. 2003 Catalog; Nektar Therapeutics 2005-2006 Catalog; Delgado et al., Critical Reviews in Therapeutic Drug Carrier Systems 9(3,4):249-304 (1992) |
| -ОН | Ser, Thr, OH- | Часть сахара | In vitro O-связанное гликозилирование | |
| -CONH2 | Asn как часть сайта N-гликозилирования | Часть сахара | In vitro N-гликозилирование | |
| Аромати- ческий остаток |
Phe, Туг, Тгр | Часть сахара | In vitro связывание | |
| -CONH2 | Gin | Часть сахара | In vitro связывание | Yan and Wold, Biochemistry, 1984,Jul31; 23(16): 3759-65 |
| Альдегид Кетон | Кислородсодержащий углеводород | Полимер, например ПЭГ, ПЭГ-гидразид | ПЭГилирование | Andresz et al., 1978, Makromol. Chem. 179:301; WO 92/16555, WO 00/23114 |
| Гуанидино | Arg | Часть сахара | In vitro связывание | Lundblad and Noyes, Chemical Reagents for Protein Modification, CRC Press Inc. Boca Raton, FI |
| Имидазоль- ное кольцо |
His | Часть сахара | In vitro связывание | Как для гуанидино |
Для in vivo N-гликозилирования выражение "группа прикрепления" используется нетрадиционным образом, обозначая аминокислотные остатки, составляющие сайт N-гликозилирования (с последовательностью N-X-S/T/C, где Х - это любой аминокислотный остаток, кроме пролина, N - это аспарагин и S/T/C - это или серии, треонин или цистеин, преимущественно серин или треонин и наиболее преимущественно треонин). Хотя аспарагиновый остаток сайта N-гликозилирования является тем, к которому прикрепляется часть сахара в процессе гликозилирования, такое прикрепление не может быть достигнуто, пока присутствуют другие аминокислотные остатки сайта N-гликозилирования. Соответственно, когда неполипептидная часть - это часть сахара и конъюгация осуществляется путем N-гликозилирования, то выражение "аминокислотный остаток, включающий группу прикрепления для неполипептидной части", как используется в связи с изменениями аминокислотной последовательности полипептида по данному изобретению, должен пониматься, что один, два или все аминокислотные остатки, составляющие сайт N-гликозилирования, подвергаются изменению таким образом, что или функциональный сайт N-гликозилирования встраивается в аминокислотную последовательность, удаляя из указанной последовательности, или функциональный сайт N-гликозилирования остается в аминокислотной последовательности (например, путем замещения остатка серина, который уже является частью сайта N-гликозилирования, на треониновый остаток, и наоборот).
Выражение "встраивать" (а именно "встроенный" аминокислотный остаток, "встраивание" аминокислотного остатка) в первую очередь, обозначает замену существующего аминокислотного остатка на другой аминокислотный остаток, но может также означать вставку дополнительного аминокислотного остатка.
Выражение "удалять" (а именно "удаленный" аминокислотный остаток, "удаление" аминокислотного остатка) в первую очередь обозначает замену аминокислотного остатка, который надо удалить, на другой аминокислотный остаток, но может также означать делецию (без замены) аминокислотного остатка, который нужно удалить.
Выражение "аминокислотный остаток, включающий группу прикрепления к неполипептидной части" обозначает, что аминокислотный остаток является тем, с чем связывается неполипептидная часть (в случае встроенного аминокислотного остатка) или с чем она связывалась (в случае удаленного аминокислотного остатка).
Путем удаления и/или встраивания аминокислотных остатков, включающих группу прикрепления к неполипептидной части, возможно специфически адаптировать полипептид по данному изобретению, с тем чтобы создать молекулу, более пригодную для конъюгации с неполипептидной частью по выбору, оптимизировать паттерн конъюгации (например, для обеспечения оптимального расположения неполипептидных частей на поверхности полипептида и, тем самым, например, эффективно экранировать эпитопы и другие части поверхности полипептида без значительного изменения его функции). Например, встраивание групп прикрепления изменяет содержание специфических аминокислотных остатков в полипептиде, с которыми связываются неполипептидные части, в результате чего достигается более эффективная, специфическая и/или обширная конъюгация. Путем удаления одной или нескольких групп прикрепления становится возможным избежать конъюгации с неполипептидной частью в частях полипептида, в которых такая конъюгация является нежелательной, например, с аминокислотным остатком, локализованным на или вблизи функционального сайта полипептида (так как конъюгация в таком сайте может приводить к инактивации или сниженному CD80- или СВ86-связыванию или сниженной иммуносупрессорной активности полученного конъюгата). Также может быть предпочтительным удаление группы прикрепления, локализованной вблизи другой группы прикрепления.
Аминокислотный остаток, включающий группу прикрепления для неполипептидной части, либо существующий остаток, либо удаленный или встроенный остаток, выбран на основе природы неполипептидной части и в некоторых случаях на основе использованного способа конъюгации. Например, когда неполипептидная часть - это полимерная молекула, такая как молекула производная полиэтиленгликоля (ПЭГ) или полиалкиленоксида (ПАО), то аминокислотные остатки, способные функционировать как группа прикрепления, могут быть выбраны из группы, включающей цистеин, лизин (и/или N-терминальная аминогруппа полипептида), аспарагиновую кислоту, глутаминовую кислоту, гистидин и аргинин. Когда неполипептидная часть - это часть сахара, то группа прикрепления - это сайт in vivo или in vitro N- или O-гликозилирования, преимущественно сайт N-гликозилирования.
В некоторых случаях в части, принадлежащей мутантному полипептиду CTLA-4, конъюгату по данному изобретению, группы прикрепления, локализованные в или вблизи сайта связывания рецептора, удаляют, например, заменой аминокислотного остатка, включающего такую группу. В некоторых случаях аминокислотные остатки, включающие группу прикрепления для неполипептидной части, такие как цистеин или лизин, часто не встраивают в или вблизи сайта связывания рецептора мутантного полипептида CTLA-4.
Мутантный полипептид CTLA-4 по данному изобретению может быть модифицирован, так чтобы экранировать и, тем самым, модифицировать или нарушить или другим способом инактивировать эпитоп, присутствующий в мутантном полипептиде CTLA-4, конъюгацией с неполипептидной частью. Эпитопы мутантных полипептидов CTLA-4 могут быть определены с применением способов, известных в области техники, также известных как картирование эпитопов, смотри, например, Romagnoli et al., J. Biol. Chem. 380(5):553-9 (1999), DeLisser HM, Methods Mol Biol, 1999, 96:11-20, Van de Water et al., Clin. Immunol. Immunopathol. 85(3):229-35 (1997), Saint-Remy JM, Toxicology 119(1):77-81 (1997).
Точное число групп прикрепления, доступных для конъюгации и присутствующих в мутантном полипептиде CTLA-4, зависит от эффекта, который желательно достичь с помощью конъюгации. Эффект, который необходимо получить, например, зависит от природы и степени конъюгации (например, идентичности неполипептидной части, числа неполипептидных частей, желательных или способных конъюгировать с полипептидом, когда они должны быть конъюгированы или когда конъюгацию следует избежать и т.п.). Например, если необходима пониженная иммуногенность, число (и их локализация) групп прикрепления должно быть значительным для того, чтобы экранировать большинство или все эпитопы. Это обычно получается, когда большая часть мутантного полипептида CTLA-4 экранирована. Эффективное экранирование эпитопов обычно получают, когда общее число групп прикрепления, доступных для конъюгации, находится в диапазоне 1-6 групп прикрепления, например, 1-5, например, в диапазоне 1-3, например, 1, 2 или 3 группы прикрепления.
Функциональное время полужизни in vivo может зависеть от молекулярного веса конъюгата и числа групп прикрепления, необходимых для обеспечения увеличенного времени полужизни, таким образом, зависит от молекулярного веса неполипептидной части, представляющей интерес. Некоторые такие конъюгаты включают 1-6, например, 1-5, например, 1-3, например, 1, 2 или 3 неполипептидные части, каждая из которых имеет молекулярный вес около 100-2000 Дальтон (Да), например, около 200 Да, около 300 Да, около 400 Да, около 600 Да, около 900 Да, около 1000 Да или около 2-40 кДа, например, около 2 кДа, около 5 кДа, около 12 кДа, около 15 кДа, около 20 кДа, около 30 кДа, около 40 кДа или около 60 кДа.
В конъюгате по данному изобретению некоторые, большинство или по сути все способные к конъюгации группы прикрепления заняты соответствующей неполипептидной частью.
Конъюгат по данному изобретению может проявлять один или несколько из следующих улучшенных свойств: (а) увеличенное время полужизни в сыворотке и/или функциональное время полужизни in vivo, (b) пониженную антигенность или иммуногенность, (с) повышенную сохранность, (d) повышенную биодоступность, (е) сниженную эффекторную функцию или (f) пониженную или ингибированную самоассоциацию (например, пониженное формирование агрегата) между двумя или несколькими молекулами по данному изобретению. Например, конъюгат может проявлять пониженную иммуногенность по сравнению с hCTLA-4 или по сравнению с соответствующим неконъюгированным полипептидом, например, снижение на, по меньшей мере, 10%, такое как снижение на, по меньшей мере, 25%, такое как снижение на, по меньшей мере, 50%, например, снижение на, по меньшей мере, 75% по сравнению с неконъюгированным полипептидом или по сравнению с hCTLA-4. Конъюгат может проявлять увеличенное функциональное in vivo время полужизни и/или увеличенное время полужизни в сыворотке по сравнению с эталонной молекулой, такой как hCTLA-4 или по сравнению с соответствующим неконъюгированным полипептидом. Конкретные предпочтительные конъюгаты представляют собой такие конъюгаты, где соотношение между функциональным in vivo временем полужизни (или временем полужизни в сыворотке) указанного конъюгата и функциональное in vivo время полужизни (или время полужизни в сыворотке) указанной эталонной молекулы составляет, по меньшей мере, 1,25, такое как, по меньшей мере, 1,50, такое как, по меньшей мере, 1,75, такое как, по меньшей мере, 2, такое как, по меньшей мере, 3, такое как, по меньшей мере, 4, такое как, по меньшей мере, 5, такое как, по меньшей мере, 6, такое как, по меньшей мере, 7, такое как, по меньшей мере, 8. Время полужизни определяется традиционным способом в экспериментальном животном, таком как крыса или обезьяна, и может быть основано на внутривенном или подкожном введении. В дополнительном аспекте конъюгат может проявлять увеличенную биодоступность по сравнению с эталонной молекулой, такой как hCTLA-4 или соответствующий неконъюгированный полипептид.
Полимерная молекула, которая должна быть присоединена к полипептиду, может быть любой приемлемой полимерной молекулой, такой как природный или синтетический гомополимер или гетерополимер, обычно с молекулярным весом в диапазоне 300-100000 Да, таким как 300-20000 Да, более преимущественно в диапазоне 500-10000 Да, даже более преимущественно в диапазоне 500-5000 Да.
Примеры гомополимеров включают полиол (а именно поли-ОН), полиамин (а именно поли-NH2) и поликарбоновую кислоту (а именно поли-СООН). Гетерополимер - это полимер, который включает один или несколько различных соединяющихся групп, таких как, например, гидроксильная группа и аминовая группа. Примеры приемлемых полимерных молекул включают полимерные молекулы, выбранные из группы, включающей полиалкиленоксид (ПАО), включая полиалкиленгликоль (ПАГ), такие как полиэтиленгликоль (ПЭГ) и полипропиленгликоль (ППГ), разветвленные ПЭГи, поливиниловый спирт (ПВС), поликарбоксилат, поли-(винилпиролидон), полиэтилен-со-ангидрид яблочной кислоты, полистирол-со-ангидрид яблочной кислоты, декстран, включая карбоксиметилдекстран, или любой другой биополимер, пригодный для уменьшения иммуногенности и/или увеличения функционального in vivo времени полужизни и/или сывороточного времени полужизни. Другой пример полимерной молекулы - это человеческий альбумин или другой распространенный белок плазмы. В общем, полимеры, производные полиалкиленгликоля, являются биосовместимыми, нетоксичными, неантигенными, неиммуногенными, имеют различные свойства водорастворимости и легко экскретируются из живых организмов.
ПЭГ - это предпочтительная полимерная молекула для использования, так как он имеет только несколько реакционных групп, способных к поперечному связыванию, по сравнению с, например, полисахаридами, такими как декстран и подобное. В частности, монофункциональный ПЭГ, например, моноэтоксиполиэтиленгликоль (мПЭГ), является предметом интереса из-за того, что его химия соединения относительно проста (только одна реакционная группа доступна для конъюгации с группами прикрепления на полипептиде). Следовательно, риск поперечного связывания устраняется, приводя к тому, что полипептидные конъюгаты являются более гомогенными и реакцию полимерных молекул с полипептидом легче контролировать. Когда молекула является пегилированной, она обычно включает 1, 2, 3, 4 или 5 молекул полиэтиленгликоля (ПЭГ). Каждая молекула ПЭГ может иметь молекулярный вес от около 5 кДа (кило Дальтон) до 100 кДа, включая, например, около 10 кДа, около 12 кДа, около 20 кДа, около 40 кДа. Приемлемые молекулы ПЭГ доступны от Shearwater polymers, Inc. and Enzon, Inc. и могут быть выбраны из SS-ПЭГ, NPC-ПЭГ, альдегид-ПЭГ, мПЭГ-SPA, мПЭГ-SCM, мПЭГ-ВТС, SC-ПЭГ, трезилированный мПЭГ (Патент США №5880255) или оксикарбонил-окси-N-дикарбохиимид-ПЭГ (Патент США №5122614).
В одном аспекте изобретение обеспечивает изолированный или синтетический конъюгат, включающий: (а) полипептид по данному изобретению (например, мутантный полипептид CTLA-4 ВКД, димерный или мономерный мутантный CTLA-4-Ig, мультимерный мутантный полипептид CTLA-4 ВКД, мультимерный мутантный CTLA-4-Ig); и (b), по меньшей мере, одну неполипептидную часть, а именно, например, 1-10, 1-9, 1-8, 1-7, 1-7, 1-6, 1-5, 1-4, 1-3, 1, 2 или 3 неполипептидные части, прикрепленные к полипептиду, где конъюгат связывает CD80 (например, hCD80) и/или CD86 (например, hCD86) и/или внеклеточный домен каждого или обоих (включая hCD80-Ig и/или hCD86-Ig), и/или имеет способность вызывать иммунный ответ (например, Т-клеточно-зависимый иммунный ответ). Иллюстративные полипептиды включают те, которые имеют, по меньшей мере, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы SEQ ID NOS:1-79, 197-200, 205-214 и 219-222. В некоторых случаях конъюгат включает одну неполипептидную часть. В некоторых случаях конъюгат включает две, три, четыре или больше неполипептидных частей. В некоторых случаях аминокислотная последовательность полипептида конъюгата также включает одну или несколько замен, каждая из которых встраивает группу прикрепления для неполипептидной части (например, заменой аминокислотного остатка аминокислотной последовательности другим остатком, который включает группу прикрепления для неполипептидной части, или вставкой в аминокислотную последовательность дополнительного аминокислотного остатка, который включает группу прикрепления для неполипептидной части).
Конъюгат может включать два или несколько полипептидов по данному изобретению. В некоторых случаях неполипептидная часть ковалентно прикреплена к каждому или обоим таким полипептидам. Если конъюгат включает два или несколько идентичных полипептида по данному изобретению, одинаковый тип и число неполипептидных частей обычно прикрепляются к каждому такому полипептиду, обычно одинаковым способом к соответствующей группе(ам) прикрепления на каждом полипептиде. Как отмечалось выше, неполипептидная часть может содержать, например, молекулу сахара, которая необязательно может быть прикрепленной к сайту N-гликозилирования, или полимер, такой как, например, часть полиэтиленгликоля. Часть полиэтиленгликоля может быть ковалентно прикреплена к остатку цистеина или остатку лизина полипептида по данному изобретению. В некоторых случаях часть полиэтиленгликоля ковалентно прикреплена к N-терминальной аминогруппе полипептида. Конъюгат, включающий мутантный CTLA-4-Ig по данному изобретению, может быть описан как мутантный CTLA-4-Ig конъюгат по данному изобретению. Мультимеры конъюгатов также включены. Мультимерные конъюгаты включают два или несколько конъюгатов, где, по меньшей мере, один конъюгат - это конъюгат по данному изобретению, включающий, по меньшей мере, один полипептид по данному изобретению. Конъюгаты в мультимерном конъюгате могут быть, но не обязательно должны быть идентичными друг другу.
Как обсуждалось выше, полипептиды по данному изобретению, включая слитые белки по данному изобретению, могут обычно быть объектом гликозилирования. Полипептиды и слитые белки по данному изобретению могут также подвергаться (или модифицироваться так, чтобы стать объектом для) других форм пост-трансляционной модификации включая, например, гидроксилирование, прикрепление липидов или производного липидов, метилирование, миристилирование, пегилирование, фосфорилирование и сульфатация. Другие пост-трансляционные модификации, которым также может быть подвержен полипептид или слитый белок по данному изобретению, включают ацетилирование, ацилирование, АДФ-рибозилирование, амидирование, ковалентное прикрепление флавина, ковалентное прикрепление части гема, ковалентное прикрепление нуклеотида или производного нуклеотида, ковалентное прикрепление фосфатидилинозитола, поперечное связывание, циклизация, формирование дисульфидной связи, деметилирование, формилирование, формирование якоря GPI (гликозилированный фосфатидилинозитол), йодирование, окисление, протеолитическая обработка, пренилирование, рацемизация, селенирование, аргинилирование и убиквитинизация. Другие типичные белковые модификации описаны в, например, Creighton, смотри выше, Seifter et al., Meth. Enzymol. 18:626-646 (1990) и Rattan et al., Ann. NY Acad. Sci. 663:48-62 (1992). Пост-трансляционные модификации для полипептидов или слитых белков, экспрессирующихся из нуклеиновых кислот в клетках-хозяевах, отличаются в зависимости от типа хозяина или типа клетки-хозяина, в которых экспрессируется пептид. Например, гликозилирование часто не возникает в бактериальных хозяевах, таких так как Е. Coli, и значительно отличается в бакуловирусных системах по сравнению с клеточными системами млекопитающего. Соответственно, когда гликозилирование является желательным (что является обычным случаем для большинства полипептидов данного изобретения), то полипептид или слитый белок должен экспрессироваться (производиться) в гликозилированном хозяине, обычно эукариотической клетке (например, клетке млекопитающего или клетке насекомого). Модификации полипептида или слитого белка в выражениях пост-трансляционной модификации могут подтверждаться любой приемлемой методикой, включая, например, рентгеновскую дифракцию, ЯМР (ядерно-магнитный резонанс) визуализацию, масс-спектрометрию и/или хроматографию (например, обратно-фазную хроматографию, аффинную хроматографию или газожидкостную хроматографию).
Полипептид или слитый белок также или альтернативно может включать любое приемлемое количество не встречающихся в природе аминокислот (например, 3 аминокислот) и/или альтернативных аминокислот (например, селеноцистеин), или аминокислотных аналогов, таких как те, что перечислены в MANUAL OF PATENT EXAMINING PROCEDURE § 2422 (7th Revision - 2000), которые могут быть встроены синтезом белка, например, посредством твердофазного синтеза белка (как описано в, например, Merrifield, Adv. Enzymol. 32:221-296 (1969) и других ссылках, процитированных там). Полипептид или слитый белок по данному изобретению может также быть модифицирован путем включения, по меньшей мере, одной модифицированной аминокислоты. Включение одной или нескольких модифицированных аминокислот может быть преимущественным в, например, (а) увеличении сывороточного времени полужизни полипептида или слитого белка, (b) снижении антигенности полипептида или слитого белка или (с) повышении сохранности полипептида или слитого белка. Аминокислоту(ы) модифицируют, например, ко-трансляционно или посттрансляционно в ходе рекомбинантной продукции (например, N-связанный сайт гликозилирования на N-X-S/T мотивах в ходе экспрессии в клетках млекопитающего) или модифицируют синтетическими способами. Неограничивающие примеры модифицированной аминокислоты включают гликозилированную аминокислоту, сульфатированную аминокислоту, пренилированную (например, фарнезилированную, геранилгеранилированную) аминокислоту, ацетилированную аминокислоту, ацилированную аминокислоту, пегилированную аминокислоту, биотинилированную аминокислоту, карбоксилированную аминокислоту, фосфорилированную аминокислоту и подобное. Ссылки, приемлемые для руководства специалиста в данной области касательно модификации аминокислот, весьма многочисленны в литературе. Пример протоколов можно найти в Walker (1998) Protein Protocols on CD-ROM Humana Press, Towata, NJ. Модифицированная аминокислота может быть выбрана из гликозилированной аминокислоты, пегилированной аминокислоты, фарнезилированной аминокислоты, ацетилированной аминокислоты, биотинилированной аминокислоты, аминокислоты, конъюгированной с липидной частью, и аминокислоты, конъюгированной с органическим дериватизированным агентом.
Изобретение также обеспечивает полипептиды (включая слитые белки), имеющие описанные выше характеристики, которые также включают дополнительные аминокислотные последовательности, которые воздействуют на биологическую функцию (например, иммуногенность, направленность и/или время полужизни) полипептида (или слитого белка).
Полипептид или слитый белок по данному изобретению может также включать направляющую последовательность, отличную от или в дополнение к сигнальной последовательности. Например, полипептид или слитый белок может включать последовательность, которая нацелена на рецептор на конкретном типе клеток (например, моноците, дендритной клетке или связанной клетке) для обеспечения направленной доставки полипептида к таким клеткам и/или связанным тканям. Сигнальные последовательности описаны выше и включают локализованные/заякоренные в мембране последовательности (например, стоп-трансферные последовательности, GPI якорные последовательности) и подобное.
Особенно пригодный партнер слияния для полипептида по данному изобретению (включая слитый белок по данному изобретению) - это пептидная последовательность, которая облегчает очищение полипептида, например, подпоследовательность для очищения полипептида. Полинуклеотид по данному изобретению может включать кодирующую последовательность, слитую внутри рамки считывания с маркерной аминокислотной последовательностью, которая, например, облегчает очищение кодируемого полипептида. Такие пептидные домены, облегчающие очищение, или подпоследовательности для очищения полипептида включают, но не ограничивается следующим, пептиды, хелатирующие металл, такие как гистидин-триптофановые модули, которые обеспечивают очищение на иммобилизированном металле, такие как гекса-гистидиновый пептид или другая полигистидиновая последовательность, последовательность, кодирующая такой маркер, встроена в pQE вектор, доступный от QIAGEN, Inc. (Chatsworth, California), последовательность, которая связывает глутатион (например, глутатион-8-трансфераза (GST)), гемаглютининовый (НА) маркер (соответствующий эпитопу, производному белка гемагглютинина вируса гриппа; Wilson et al., Cell 37:767 (1984)), белковые последовательности, связывающие мальтозу, FLAG эпитоп, используемый в системе очищения FLAGS удлинения/аффинности (Immunex Corp, Seattle, WA) (коммерчески доступные FLAG эпитопы также доступны от Kodak (New Haven, Connecticut)), Е-эпитопный маркер (Е-маркер), тиоредоксин (TRX), авидин и подобное. Эпитопные маркеры, облегчающие очищение, описаны в области техники (смотри, например, Whitehorn et al., Biotechnology 13:1215-19 (1995)). Полипептид может включать e-his (гистидиновый) маркер, который может включать полигистидиновую последовательность и последовательность анти-е-эпитопа (Pharmacia Biotech Catalog); e-his маркеры могут быть получены с помощью стандартных методик. Включение полипептидной линкерной последовательности, отщепляемой протеазой, между доменом очищения и полипептидом пригодно для облегчения очищения. Гистидиновые остатки облегчают очищение на IMIAC (аффинная хроматография с использованием иммобилизированных металлов (IMAC), как описано в Porath et al. Protein Expresion and Purifying 3:263-281 (1992)), тогда как сайт отщепления энтерокиназы обеспечивает способ отделения полипептида от слитого белка. pGEX векторы (Promega; Madison, WI) могут также использоваться для экспрессии инородных полипептидов в виде слитых белков с глутатион S-редуктазой (GST). В общем, такие слитые белки являются растворимыми и могут легко быть очищены от лизированных клеток путем адсорбции на лиганд-агарозных гранулах (например, глутатион-агарозных в случае GST-слияния) с последующей элюцией в присутствии свободного лиганда. Дополнительные примеры подпоследовательностей, облегчающих очищение полипептида, и их применение для очищения белка описаны в, например, в Публикации Международной Заявки WO 00/15823. После экспрессии полипептида, представляющего интерес, и его выделения такими партнерами слияния или другим способом, как описано выше, могут быть использованы этапы рефолдинга белка, если это необходимо, в завершении конфигурации зрелого полипептида.
Слитый белок по данному изобретению также может включать один или несколько дополнительных пептидных фрагментов или пептидных частей, которые обеспечивают определение слитого белка. Например, известный пептидный фрагмент или часть (например, зеленый флуоресцентный белок (GFP), β-галактозидаза или их определяемый домен) может быть встроен в слитый белок. Дополнительные маркерные молекулы, которые могут быть конъюгированными с полипептидом по данному изобретению, включают радионуклеиды, ферменты, флуорофоры, лиганды малых молекул и подобное. Такие обеспечивающие определение партнеры слияния особенно важны в слитых белках, используемых в диагностических методиках, обсуждаемых в данном описании.
В другом аспекте полипептид по данному изобретению может включать партнер слияния, который обеспечивает стабильность полипептида, секрецию полипептида (отличающуюся от сигнальной направленности) или обе эти характеристики. Например, полипептид может включать иммуноглобулиновый (Ig) домен, такой как полипептид IgG, включающий Fc шарнирную область, СН2 домен и СН3 домен, который обеспечивает стабильность и/или секрецию полипептида.
Пептидные фрагменты слитого белка или пептидные части могут ассоциироваться любым приемлемым образом. Различные полипептидные фрагменты или части слитого белка могут быть ковалентно объединены (например, посредством пептидной или дисульфидной связи). Полипептидные фрагменты или части могут быть слитыми напрямую (например, С-конец антигенной или иммуногенной последовательности по данному изобретению может быть слит с N-концом последовательности для очищения или гетерологичной иммуногенной последовательности). Слитый белок может включать любое приемлемое количество модифицированных связей, например, изостер, внутри или между пептидными частями. Альтернативно или дополнительно, слитый белок может включать пептидный линкер между одним или несколькими полипептидными фрагментами или частями, который включает одну или несколько аминокислотных последовательностей, не формирующих часть биологически активных пептидных частей. Любой приемлемый пептидный линкер может быть использован. Такой линкер может быть любого приемлемого размера. Типично, линкер составляет меньше чем около 30 аминокислотных остатков, меньше чем около 20 аминокислотных остатков, и/или меньше чем 10 аминокислотных остатков. Линкер преимущественно может включать или состоять из нейтральных аминокислотных остатков. Приемлемые линкеры в общем описаны в, например, Патентах США №5990275, 6010883, 6197946 и Заявке на Европейский Патент 0035384. Если отделение пептидных фрагментов или пептидных частей является желательным, то может использоваться линкер, который облегчает отделение. Пример такого линкера описан в Патенте США №4719326. "Гибкие" линкеры, которые обычно состоят из комбинаций глициновых и/или сериновых остатков, могут быть преимущественными. Примеры таких линкеров описаны в, например, McCafferty et al., Nature 348:552-554 (1990), Huston et al., Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988), Glockshuber et al., Biochemistry 29:1362-1367 (1990), и Cheadle et al., Molecular Immunol. 29:21-30 (1992), Bird et al., Science 242:423-26 (1988), и Патентах США №5672683, 6165476 и 6132992.
Применение линкера также может снижать нежелательный иммунный ответ на слитый белок, образованный слиянием двух пептидных фрагментов или пептидных частей, который может приводить к непредусмотренному ГКГ I и/или ГКГ II эпитопу, присутствующему в слитом белке. В дополнение к применению линкера, идентифицированные нежелательные эпитопные последовательности или смежные последовательности могут быть пегилированными (например, путем вставки лизиновых остатков для стимулирования прикрепления ПЭГ), чтобы экранировать идентифицированные эпитопы от проявления. Другие методики для снижения иммуногенности слитого белка по данному изобретению могут быть использованы вместе с введением слитого белка, включают методики, описанные в Патенте США №6093699.
Получение полипептидов
Рекомбинантные способы образования полипептидов для производства и выделения полипептидов по данному изобретению (включая слитые белки по данному изобретению) описаны ниже. В дополнение к рекомбинантной продукции, полипептиды могут быть произведены прямым пептидным синтезом с применением твердофазных методик (смотри, например, Stewart et al. (1969) Solid-Phase Peptide Synthesis, W.H. Freeman Co, San Francisco; Merrifield (1963) J. Am. Chem. Soc 85:2149-2154). Синтез пептида может быть проведен с применением методик вручную или автоматически. Автоматизированный синтез может быть осуществлен, например, с применением Applied Biosystemes 43 IA Пептидного Синтезатора (Perkin Elmer, Foster City, Calif.) согласно инструкциям производителя. Например, подпоследовательности могут быть химически синтезированы отдельно и совместно с применением химических способов для обеспечения мутантных полипептидов CTLA-4 или их функциональных фрагментов. Альтернативно, такие последовательности могут быть поставлены многими компаниями, которые специализируются на продукции полипептидов. Наиболее часто полипептиды по данному изобретению производят, экспрессируя кодирующие нуклеиновые кислоты и восстанавливая полипептиды, например, как описано ниже.
Изобретение обеспечивает способы продукции полипептидов (включая слитые белки) по данному изобретению. Один такой способ включает встраивание в популяцию клеток любой нуклеиновой кислоты, описанной здесь, которая функционально связана с регуляторной последовательностью, эффективной для получения кодируемого полипептида, культивированием клеток в клеточной среде для получения полипептида и выделением полипептида из клеток или клеточной среды. Используется количество нуклеиновой кислоты, достаточное для облегчения захвата клетками (трансфекции) и/или экспрессии полипептида. Клеточная среда может быть любой, описанной здесь и в примерах. Дополнительные среды известны для специалистов в данной области. Нуклеиновая кислота встраивается в такие клетки любым из описанных здесь способов доставки, включая, например, инъекцию, устройства инъекции без иглы, генную пушку, электропорацию (например, прибор для электропорации ДНК, Inovio Biomedical Corp. (San Diego)), трансдермальную доставку, пассивный захват и т.п. Нуклеиновая кислота по данному изобретению может быть частью вектора, такого как рекомбинантный вектор экспрессии, включая ДНК плазмидный вектор, вирусный вектор или любой вектор, описанный здесь. Нуклеиновая кислота или вектор, включающий нуклеиновую кислоту по данному изобретению, может быть приготовлена и сформулирована, как описано здесь, выше и в примерах ниже. Такая нуклеиновая кислота или вектор экспрессии может быть встроена в популяцию клеток млекопитающего in vivo, или выбранные клетки млекопитающего (например, клетки опухоли) могут быть удалены из млекопитающего, и вектор экспрессии нуклеиновой кислоты встроен ех vivo в популяцию таких клеток в количестве, достаточном, чтобы вызвать захват и экспрессию кодируемого полипептида. Или нуклеиновую кислоту или вектор, включающий нуклеиновую кислоту по данному изобретению, производят с применением культивированных клеток in vitro. В одном аспекте способ получения полипептида по данному изобретению включает встраивание в популяцию клеток рекомбинантного вектора экспрессии, включающего любую нуклеиновую кислоту, описанную здесь, в количестве и формуле, так чтобы обеспечить захват вектора и экспрессию полипептида; введение вектора экспрессии в млекопитающее в любом формате встраивания/доставки, описанном здесь; и выделение полипептида из млекопитающего или их побочного продукта млекопитающего. Приемлемые клетки-хозяева, векторы экспрессии, способы трансфекции клеток-хозяев вектором экспрессии, включающим последовательность нуклеиновых кислот, кодирующих полипептид по данному изобретению, клеточные культуры и процедуры получения и восстановления такого полипептида из клеточной культуры описаны детально ниже в разделе, названном "Нуклеиновые кислоты по данному изобретению". Дополнительные способы продукции обсуждаются в примерах ниже.
Как отмечалось выше, полипептиды по данному изобретению (которые включают слитые белки по данному изобретению) могут подвергаться различным изменениям, таким как одна или несколько вставок аминокислоты или нуклеиновой кислоты, делеций и замен, либо консервативные, либо неконсервативные, включая, например, такие изменения, которые могут обеспечить определенные преимущества при их использовании, например, в их терапевтическом или профилактическом применении или введении или диагностическим применении. Процедуры образования вариантов полипептидов с применением аминокислотных замен, делеций, вставок и дополнений являются рутинными в данной области техники. Полипептиды и их варианты, имеющие необходимую способность связывать CD80 и/или CD86 или их фрагмент (например, ВКД) или способность подавлять иммунный ответ in vitro или in vivo, как описано в данном описании, на сегодняшний день определены в исследованиях, известных специалистам в данной области, и в исследованиях, описанных здесь. Смотри, например, исследования, представленные в примерах ниже.
Нуклеиновые кислоты по данному изобретению, обсуждаемые более детально ниже, могут также подвергаться различным изменениям, таким как одна или несколько замен одной или нескольких нуклеиновых кислот в одном или нескольких кодонах, так что конкретный кодон кодирует одинаковые или различные аминокислоты, приводя либо к консервативной, либо к неконсервативной замене, или одна или несколько делеций одной или нескольких нуклеиновых кислот в последовательности. Нуклеиновые кислоты могут также быть модифицированными, чтобы включать один или несколько кодонов, которые обеспечивают оптимальную экспрессию в системе экспрессии (например, клетка млекопитающего или система экспрессии млекопитающего), причем, при необходимости, указанные один или несколько кодонов продолжают кодировать одинаковую(ые) аминокислоту(ы). Процедуры образования вариантов нуклеиновых кислот с применением замены, делеций, вставок и дополнений и вырожденных кодонов нуклеиновой кислоты, являются рутинными в данной области техники, и варианты нуклеиновой кислоты, кодирующие полипептиды, имеющие необходимые свойства, описанные здесь (например, способность связывать CD80 и/или CD86 и/или подавлять иммунный ответ in vitro или in vivo), на сегодняшний день определены с применением исследований, описанных здесь. Такие изменения нуклеиновой кислоты могут обеспечить определенные преимущества при их терапевтическом или профилактическом применении или введении или диагностическом применении. В одном аспекте нуклеиновые кислоты и полипептиды могут быть модифицированными многими способами при условии, что они включают последовательность нуклеиновой кислоты или аминокислотную последовательность по сути идентичные последовательности нуклеиновой кислоты соответствующей нуклеиновой кислоты, кодирующей мутантный полипептид CTLA-4 или мутантный полипептид CTLA-4 по данному изобретению соответственно.
НУКЛЕИНОВЫЕ КИСЛОТЫ ПО ДАННОМУ ИЗОБРЕТЕНИЮ
Изобретение обеспечивает изолированные или рекомбинантные нуклеиновые кислоты (также названные в данном описании как полинуклеотиды), собирательно называются "нуклеиновые кислоты по данному изобретению" (или "полинуклеотиды изобретения"), которые кодируют полипептиды по данному изобретению. Нуклеиновые кислоты по данному изобретению, включая все описанные ниже, пригодны в рекомбинантной продукции (например, экспрессии) полипептидов по данному изобретению, обычно посредством экспрессии плазмидного вектора экспрессии, включающего последовательность, кодирующую полипептид или его фрагмент; как терапевтические; как профилактические; как диагностические инструменты; как диагностические зонды на присутствие комплементарных или частично комплементарных нуклеиновых кислот (включая применение для определения нуклеиновой кислоты дикого типа CTLA-4). Например, нуклеиновые кислоты по данному изобретению, включая все описанные ниже, пригодны, так как они кодируют полипептиды, которые пригодны в подавлении или ингибировании иммунного ответа (например, Т-клеточной активации, Т-клеточной пролиферации, синтеза или продукции цитокина (например, продукции TNF-α, IFN-γ, IL-2), индукции маркеров активации (например, CD25, IL-2 рецептора), воспалении, продукции антиколлагеновых антител и/или Т-клеточно-зависимого ответа антитела) в in vitro и/или in vivo сферах применения, включая, например, профилактические и/или терапевтические способы лечения заболеваний, нарушений и состояний иммунной системы, при которых подавление иммунного ответа является желательным (например, способы лечения аутоиммунных заболеваний и нарушений и способы ингибирования отторжения трансплантат ткани, клетки или органа от донора реципиенту). Нуклеиновые кислоты по данному изобретению могут также быть встроены в векторы экспрессии, пригодные для генной терапии, вакцинации ДНК и иммуносупрессорной терапии. Дополнительные применения нуклеиновых кислот и векторов по данному изобретению, включающих такие нуклеиновые кислоты, изложены в данном описании.
В одном аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую нуклеотидную последовательность, кодирующую любой полипептид (включая любой слитый белок и т.п.) по данному изобретению, описанный выше в разделе, названном "Полипептиды по данному изобретению" и везде в данном описании. Изобретение также обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую нуклеотидную последовательность, кодирующую комбинацию двух или нескольких из любых полипептидов (включая любые слитые белки) по данному изобретению, описанные выше и везде в данном описании. Также включена нуклеиновая кислота, которая кодирует любой полипептид по данному изобретению, такой как, например, мутантный полипептид CTLA-4 ВКД или мутантный слитый белок CTLA-4-Ig, которая включает последовательность кодонов, значительно оптимизирующих экспрессию в хозяине-млекопитающем, таком как человек.
Например, в одном аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 75%, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1- 73, или ее комплементарную полинуклеотидную последовательность, где полипептид связывает CD80 и/или CD86 или полипептид фрагмент CD80 и/или CD86 (например, внеклеточный домен CD80 и/или CD86) и/или подавляет иммунный ответ in vitro и/или in vivo или ее комплементарную полинуклеотидную последовательность. Дополнительные детали в отношении функциональных свойств и характеристик таких полипептидов обсуждаются выше в разделе "Полипептиды по данному изобретению". Некоторые такие нуклеиновые кислоты кодируют полипептид, включающий аминокислотную последовательность, имеющую аминокислотную длину, приблизительно равную аминокислотной длине hCTLA-4 ВКД; как, например, 110-138, 112-132, 118-130,119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков. Иллюстративные нуклеиновые кислоты, которые кодируют мутантные полипептиды CTLA-4 ВКД, включают последовательности, приведенные в SEQ ID NOS:1-73, но не ограничиваются следующим, например, нуклеиновые кислоты, имеющие нуклеотидные последовательности, приведенные в SEQ ID NOS:80-152, соответственно. Например, иллюстративная нуклеиновая кислота, кодирующая полипептид, представленная в SEQ ID NO:1 (клон D3-1), - это нуклеиновая кислота, представленная в SEQ ID:80. Также включены фрагменты любых таких нуклеиновых кислот, где такой фрагмент кодирует полипептид, который связывает CD80 и/или CD86 и/или ВКД каждого или обоих, и/или имеет способность подавлять иммунный ответ.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид (например, мутантный полипептид CTLA-4 ВКД), которая включает аминокислотную последовательность (а), которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам (например, не более чем 1, 2, 3, 4, 5, или 6 аминокислотным остаткам), и (b) где аминокислотный остаток в аминокислотной последовательности в положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих и/или ингибирует иммунный ответ in vitro и/или in vivo, или ее комплементарную полинуклеотидную последовательность. То есть аминокислотный остаток в таком положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 в такой выбранной аминокислотной последовательности не удаляется или замещается. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие последовательность, которая отличается от выбранной аминокислотной последовательности по не более чем 6 аминокислотным остаткам и, которая включает аминокислотные остатки в 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 и/или 14 положениях, выбранных из аминокислотных положений 24, 30, 32, 41, 50, 54, 55, 56, 64, 65, 70, 85, 104 и 106, которые идентичны аминокислотным остаткам в соответствующих положениях в выбранной аминокислотной последовательности. Такие полипептиды могут отличаться от выбранной аминокислотной последовательности на аминокислотную делецию(и), дополнение(я) и/или аминокислотную замену(ы). Аминокислотная замена может быть консервативной или неконсервативной заменой. Иллюстративные консервативные замены обсуждаются в разделе, названном "Вариации последовательностей". Некоторые такие полипептиды включают последовательность, имеющую длину около 118-130, 119-129, 120-128, 121- 127, 122-126, 123-125 или 124 аминокислотных остатков. Дополнительные детали функциональных свойств и характеристик таких полипептидов обсуждаются выше. Иллюстративные нуклеиновые кислоты включают, но не ограничивается следующим, например, те, что включают нуклеотидные последовательности, приведенные в SEQ ID NOS:80-152.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности внеклеточного домена человеческого CTLA-4, представленной в SEQ ID NO:159 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно аминокислотной последовательности SEQ ID NO:159, где полипептид связывает hCD80 и/или hCD86 и/или ВКД каждого или обоих и/или ингибирует иммунный ответ in vitro и/или in vivo или ее комплементарную полинуклеотидную последовательность. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие 2, 3, 4, 5 или 6 аминокислотных замен в положениях относительно последовательности, приведенной в SEQ ID NO:159, выбранных из группы, включающей положение 50, 54, 55, 56, 64, 65, 70 и 85. Некоторые такие нуклеиновые кислоты кодируют полипептиды, также включающие аминокислотную замену в положении, соответствующем положению 104 и/или 30 относительно SEQ ID NO:159. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие, по меньшей мере, одну аминокислотную замену относительно SEQ ID NO:159 в положении 70 (например, S70F), положении 64 (например, S64P), положении 50 (например, А50М), положении 54 (например, M54K/V), положении 65 (например, I65S), положении 56 (например, N56D), положении 55 (например, G55E), положении 85 (например, М85А) и/или положении 24 (например, А24Е). Любой такой полипептид может также включать аминокислотную замену относительно SEQ ID NO:159 в положении 104 (необязательно L104E/D, например, L104E), положении 30 (например, T30N/D/A) и/или положении 32 (например, V32I). Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие одну или несколько замен в аминокислотных положениях относительно SEQ ID NO:159, выбранные из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F. Некоторые такие кодируемые полипептиды включают последовательность, имеющую аминокислотную длину около 118-130, 119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков. Дополнительные детали о функциональных свойствах и характеристиках таких полипептидов обсуждаются выше.
Изобретение также обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, включающий (i), по меньшей мере, 95%, 96%, 97%, 98%, 99%, или 100% идентичность с любой аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73 и (ii) остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73, где полипептид связывает hCD80 и/или hCD86 или его ВКД и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие один или несколько из следующего относительно выбранной последовательности: остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 24; остаток аспарагина в аминокислотном положении, соответствующем положению 30; остаток изолейцина в аминокислотном положении, соответствующем положению 32; остаток метионина в аминокислотном положении, соответствующем положению 50; остаток лизина в аминокислотном положении, соответствующем положению 54; остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 55; остаток аспарагиновой кислоты в аминокислотном положении, соответствующем положению 56; остаток пролина в аминокислотном положении, соответствующем положению 64; остаток серина в аминокислотном положении, соответствующем положению 65; и остаток глутаминовой кислоты в аминокислотном положении, соответствующем положению 104. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие аминокислотную последовательность, имеющую длину около 118-130, 119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков. Дополнительные детали касательно функциональных свойств и характеристик таких полипептидов обсуждаются выше.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности полипептида человеческого CTLA-4 ВКД, представленной в SEQ ID NO:159, по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену, где указанная, по меньшей мере, одна аминокислотная замена представляет собой S70F, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:159, где полипептид, который связывает hCD80 и/или hCD86 (и/или ВКД каждого или обоих) и/или ингибирует иммунный ответ или комплементарную ей полинуклеотидную последовательность. Некоторые такие нуклеиновые кислоты кодируют полипептид, который также включает, по меньшей мере, одну аминокислотную замену, выбранную из группы, включающей А24Е, T30N, V32I, D41G, А50М, M54K, G55E, N56D, S64P, I65S, М85А, L104E и I106F. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие аминокислотную последовательность, имеющую длину около 118-130, 119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков. Дополнительные детали касательно функциональных свойств и характеристик таких полипептидов обсуждаются выше.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, представленной в SEQ ID NO:31, по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одно из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31, и где полипептид связывает CD80 и/или CD86 и/или ВКД каждого или обоих, и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Некоторые такие кодируемые полипептиды включают остаток глутаминовой кислоты в положении, соответствующем положению 104, остаток аспарагиновой кислоты в положении, соответствующем положению 30, и/или остаток изолейцина в положении, соответствующем положению 32 SEQ ID NO:31. Некоторые такие нуклеиновые кислоты кодируют полипептиды, включающие аминокислотную последовательность, имеющую длину около 118-130, 119-129, 120-128, 121-127, 122-126, 123-125 или 124 аминокислотных остатков. Дополнительные детали касательно функциональных свойств и характеристик таких полипептидов обсуждаются выше.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, имеющую, по меньшей мере, 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность с, по меньшей мере, одной полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NOS:80- 158, 201-204, 223 и 224, или ее комплементарную полинуклеотидную последовательность, где нуклеиновая кислота кодирует полипептид, который связывает hCD80 и/или hCD86 и/или ВКД каждого или обоих, и/или подавляет иммунный ответ, или ее комплементарную полинуклеотидную последовательность. Иллюстративные нуклеиновые кислоты, включающие полинуклеотидные последовательности, определенные SEQ ID NOS:80-158, кодируют иллюстративные полипептиды, включающие аминокислотные последовательности, определенные SEQ ID NOS:1-79, соответственно. Иллюстративные нуклеиновые кислоты, включающие полинуклеотидные последовательности, определенные SEQ ID N08:201-204, кодируют иллюстративные полипептиды, включающие аминокислотные последовательности, определенные SEQ ID NOS:197-200, соответственно.
В другом аспекте данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, включающую: (а) полинуклеотидную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с РНК полинуклеотидной последовательностью, где РНК-полинуклеотидная последовательность включает ДНК последовательность, выбранную из группы, включающей SEQ ID NOS:80-158, 201-204, 223 и 224, в которой все тиминовые нуклеотидные остатки в ДНК последовательности заменены на урациловые нуклеотидные остатки; (b) комплементарную полинуклеотидную последовательность (а); или (с) фрагмент любой полинуклеотидной последовательности (а) или (b), где нуклеиновая кислота кодирует полипептид, который (i) связывает CD80 и/или CD86 и/или ВКД каждого или обоих, и/или (ii) имеет способность подавлять иммунный ответ in vitro или in vivo (например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2), индукцию маркеров активации (например, CD25, IL-2 рецептора), воспаление, продукцию антиколлагеновых антител и/или Т-клеточно-зависимый ответ антитела), или их полинуклеотидную последовательность.
Данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, кодирующую любой мультимер любого полипептида по данному изобретению, описанный выше (например, димер, тетрамер и т.п.). Как обсуждается более детально в данном описании, димер, включающий два полипептида по данному изобретению (включая два слитых белка), обычно формируется в ходе клеточного процессинга путем образования одной или нескольких ковалентных дисульфидных связей между цистеиновым остатком(ами) в одном полипептиде и цистеиновым остатком(ами) во втором полипептиде. Другие мультимеры могут формироваться сходным образом. Например, в неограничивающем аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует рекомбинантный димер полипептида, включающий два полипептида, где каждый такой полипептид включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где димер связывает hCD80 и/или hCD86 и/или ингибирует иммунный ответ, или ее комплементарную полинуклеотидную последовательность. Также включена изолированная или рекомбинантная нуклеиновая кислота, включающая полинуклеотидную последовательность, которая кодирует димер полипептида, включающий два полипептида, где каждый такой полипептид отличается от аминокислотной последовательности hCTLA-4 ВКД (SEQ ID NO:159) по не более чем 6 аминокислотным остаткам и включает, по меньшей мере, одну замену в аминокислотном положении относительно SEQ ID NO:159, выбранную из группы, включающей А50М, M54K, G55E, N56D, S64P, I65S и S70F; и где полипептид необязательно также включает замену L104E, где указанный димер связывает hCD80 и/или hCD86 и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Дополнительные детали касательно функциональных свойств таких димеров обсуждаются выше.
Изобретение также обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, кодирующую любой слитый белок по данному изобретению, включая любой мультимерный слитый белок по данному изобретению (например, димеры, тетрамеры и т.п.). В одном аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует слитый белок, включающий (а) полипептид, включающий аминокислотную последовательность, которая имеет, по меньшей мере, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (b) Ig полипептид, где слитый белок связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig) и/или имеет способность подавлять иммунный ответ или ее комплементарную полинуклеотидную последовательность. Полипептид Ig может включать полипептид Ig Fc, включая, например, полипептид Ig Fc, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. Димерный слитый белок, включающий два таких мономерных слитых белка, обычно формируется в ходе клеточного процессинга путем образования ковалентных дисульфидных связей между остатками цистеина в одном мономерном слитом белке и остатками цистеина во втором мономерном слитом белке. Другие мультимеры могут быть сформированы сходным образом. Дополнительные детали касательно функциональных свойств и характеристик таких слитых белков обсуждаются выше.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует белковый димер (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный CTLA-4-Ig), где каждый мономерный слитый белок включает: (а) полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5% или 100% идентичность с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (b) Ig полипептид, где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig и/или CD86-Ig), и/или имеет способность ингибировать или подавлять иммунный ответ, или ее комплементарную полинуклеотидную последовательность. Два мономерных слитых белка при экспрессии связаны вместе посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном CTLA-4-Ig слитом белке. Ig полипептид может включать полипептид Ig Fc, включая, например, полипептид Ig Fc, включающий последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. В некоторых случаях С-конец полипептида (а) ковалентно соединен или слит с N-концом полипептида Ig Fc (b). Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше.
Стоп-кодон (например, tga) обычно включен на С-конце каждой последовательности нуклеиновой кислоты, когда последовательность включена в вектор экспрессии для экспрессии белка, представляющего интерес. Например, каждая из нуклеотидных последовательностей по данному изобретению, кодирующая мутантный полипептид CTLA-4 или мутантный слитый белок CTLA-4, может необязательно также включать стоп-кодон на С-конце, такой как ТАА. Различные стоп-кодоны могут замещать ТАА, такие как TGA стоп-кодон. Последовательность нуклеиновых кислот, кодирующая слитый белок дикого типа (например, hCTLA-4-Ig, hCD86-Ig и т.п.), может также включать стоп-кодон на ее С-конце. Каждая из нуклеотидных последовательностей может необязательно также включать на N-конце нуклеотидную последовательность, кодирующую сигнальный пептид для облегчения секреции мутантного полипептида CTLA-4 или слитого белка.
Иллюстративные мутантные димеры слитого белка CTLA-4-Ig включают те, что включают аминокислотные последовательности, показаны в SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Иллюстративные нуклеиновые кислоты, кодирующие мутантные слитые белки CTLA-4 Ig SEQ ID NOS:74-79, 197-200, 220 и 222, приведены в SEQ ID NO:153-158, 201-204 и 223-224 соответственно. Последовательности слитых белков SEQ ID NOS:205-210, 211-214, 219 и 221 идентичны белковым последовательностям SEQ ID NOS:74-79, 197-200, 220 и 222 соответственно, кроме тех белковых последовательностей SEQ ID NOS:205-210, которые не включают C-терминальный лизиновый (K) остаток; как объяснялось выше, полагают, что предполагаемый C-терминальный лизиновый остаток, который кодируется ААА кодоном непосредственно предшествует ТАА стоп-кодону каждой такой полинуклеотидной последовательности, отщепляется от полученного слитого белка в ходе процессинга или секреции. Последовательности нуклеиновых кислот SEQ ID NOS:153-158, 201-204 и 223-224 кодируют последовательности слитых белков SEQ ID NOS:74-79, 197-200, 220 и 222 соответственно, каждая из которых после отщепления/потери C-терминального K остатка дает последовательности слитых белков, представленные в SEQ ID NOS:205-210, 211-214, 219 и 221, соответственно.
Каждая из полинуклеотидных последовательностей SEQ ID NOS:153-158, 201-204 и 223-224 также включает на ее N-конце нуклеотидную последовательность, кодирующую сигнальный пептид, представленный в SEQ ID NO:181 или 215, причем сигнальный пептид обязательно отщепляется от зрелого слитого белка. Нуклеотидные остатки 1-111 каждой из полинуклеотидных последовательностей SEQ ID NOS:153-158, 201-204 и 223-224, если считать с N-конца каждой такой полинуклеотидной последовательности (нуклеотидные остатки 1-111 приведены в SEQ ID NO:215), кодируют 37-аминокислотный остаток ДТ hCTLA-4 сигнального пептида, представленного в SEQ ID NO:216, причем сигнальный пептид обязательно отщепляется при экспрессии мономера или димера зрелого мутантного слитого белка CTLA-4; таким образом, для каждой из последовательностей нуклеиновых кислот SEQ ID NOS:153-158, 201-204 и 223-224 первый кодон, кодирующий первый аминокислотный остаток (метионин) зрелого IgG2 слитого белка, содержит нуклеотидные остатки 112-114 указанной нуклеотидной последовательности. Как отмечалось выше, в некоторых случаях последовательность сигнального пептида может включать только аминокислотные остатки 1-35, как показано в SEQ ID NO:182, и нуклеотидная последовательность, кодирующая этот сигнальный пептид из 35-аминокислотных остатков, показана в SEQ ID NO:181. Тем не менее кодируемые лизиновые (K) и аланиновые (А) остатки в положениях 36 и 37 соответственно (кодируемые двумя кодонами AAA-GCC), не присутствуют в полученном зрелом мутантном слитом белке CTLA-4-Ig, и предполагают, что они отщепляются от зрелого мутантного слитого белка CTLA-4-Ig в ходе процессинга. Последовательность зрелого мутантного белка CTLA-4 обычно начинается с остатка метионина, присутствующего в положении аминокислотных остатков 38 кодируемого мутантного слитого белка CTLA-4-Ig.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два идентичных мономерных слитых белка (например, мономерные мутантные CTLA-4-Ig), где каждый такой мономерный слитый белок включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ или ее комплементарную полинуклеотидную последовательность. Также обеспечивается изолированная или рекомбинантная нуклеиновая кислота, кодирующая такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ. Иллюстративные мутантные димеры слитого белка CTLA-4-Ig включают те, которые включают аминокислотные последовательности, представленные в SEQ ID NOS:74-79, 197-200, 220 и 222; иллюстративные нуклеиновые кислоты, кодирующие такие мутантные слитые белки CTLA-4 Ig, которые экспрессируются как мутантные димеры слитого белка CTLA-4-Ig, включают те, которые включают полинуклеотидные последовательности, представленные в SEQ ID NOS:153-158, 201-204 и 223-224 соответственно. Дополнительные иллюстративные мутантные димеры слитого белка CTLA-4-Ig включают аминокислотные последовательности SEQ ID NOS:205-210, 211-214, 219 и 222, которые экспрессируются как димеры слитого белка; в этих слитых белках не достает C-терминального остатка лизина, потому что он обычно отщепляется в ходе процессинга или перед секрецией. Иллюстративные нуклеиновые кислоты, кодирующие эти последовательности слитого белка с C-терминальным лизином (лизин отщепляется последовательно), включают полинуклеотидные последовательности SEQ ID NOS:153-158, 201-204 и 223-224 соответственно.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует слитый белок, где указанный слитый белок включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222, где слитый белок связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ или ее комплементарную полинуклеотидную последовательность.
В другом аспекте данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, включающую нуклеотидную последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с полинуклеотидной последовательностью, выбранной из группы, включающей SEQ ID NOS:153-158, 201-204 и 223-224, где такая нуклеиновая кислота кодирует мутантный белковый димер CTLA-4-Ig, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ, или ее комплементарную полинуклеотидную последовательность.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный CTLA-4 ВКД), который включает аминокислотную последовательность, которая отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам, и где аминокислотный остаток в аминокислотной последовательности в положении 41, 50, 54, 55, 56, 64, 65, 70 или 85 идентичен аминокислотному остатку в соответствующем положении указанной выбранной аминокислотной последовательности (например, полипептид, выбранный из SEQ ID NOS:1-73), и (2) полипептид Ig Fc, где димер связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше. Также обеспечивается рекомбинантная или изолированная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, включающую полинуклеотидную последовательность, которая кодирует димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, два мономерных мутантных CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид мутантного CTLA-4 внеклеточного домена, включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности, выбранной из группы, включающей SEQ ID NOS:1-73 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену в аминокислотном положении, соответствующем положению 50, 54, 55, 56, 64, 65, 70 или 85 относительно аминокислотной последовательности SEQ ID NO:159; и (2) Ig полипептид, где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше. Ig полипептид может включать полипептид Ig Fc, включая, например, полипептид Ig Fc, включающий последовательность, имеющую, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. Некоторые такие полипептиды (а) содержат, по меньшей мере, одну замену в аминокислотном положении относительно SEQ ID NO:159, выбранную из группы, включающей А50М, М54К, G55E, N56D, S64P, I65S и S70F. Некоторые такие полипептиды (а) также включают аминокислотную замену относительно SEQ ID NO:159 в положении 104 (например, L104E/D), положении 30 (например, T30N/D/A) и/или положении 32 (например, V32I). Также обеспечивается рекомбинантная или изолированная нуклеиновая кислота, кодирующая такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ.
В другом аспекте данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, кодирующую димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (i) имеет, по меньшей мере, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, и (ii) включает остаток фенилаланина в аминокислотном положении, соответствующем положению 70 указанной аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO:1-73; и (2) Ig полипептид, где димер слитого белка связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ или ее комплементарную полинуклеотидную последовательность. Кодируемый полипептид Ig может включать полипептид Ig Fc, включающий аминокислотную последовательность, имеющую, по меньшей мере, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. Некоторые такие кодируемые димеры включают один или несколько из следующего относительно указанной выбранной аминокислотной последовательности (1)(i): Glu остаток в положении, соответствующем положению 24; Asn в положении, соответствующем положению 30; Ile остаток в положении, соответствующем положению 32; Met остаток в положении, соответствующем положению 50; Lys остаток в положении, соответствующем положению 54; Glu остаток в положении, соответствующем положению 55; Asp остаток в положении, соответствующем положению 56; Pro остаток в положении, соответствующем положению 64; Ser остаток в аминокислотном положении, соответствующем положению 65; и Glu остаток в положении, соответствующем положению 104. Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше. Также обеспечивается рекомбинантная или изолированная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ.
В другом аспекте данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, кодирующую димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности полипептида человеческого CTLA-4 ВКД, представленной в SEQ ID NO:159, по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одну аминокислотную замену, где указанная, по меньшей мере, аминокислотная замена включает S70F, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:159; и (2) полипептид IgG Fc, где указанный димер связывает hCD80 и/или hCD86 (и/или hCD86-Ig, и/или hCD86-Ig) и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Ig Fc полипептид может включать последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. Кодируемый полипептид (1) может также содержать, по меньшей мере, одну аминокислотную замену, выбранную из группы, включающей А24Е, T30N, V32I, D41G, А30М, M54K, G55E, N56D, S64P, I65S, М85А, L104E и I106F. Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше. Также обеспечивается рекомбинантная или изолированная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ.
В другом аспекте изобретение обеспечивает изолированную или рекомбинантную нуклеиновую кислоту, кодирующую димер слитого белка (например, мутантный димер CTLA-4-Ig), включающий два мономерных слитых белка (например, мономерный мутантный CTLA-4-Ig), где каждый такой мономерный слитый белок включает: (1) полипептид (например, мутантный CTLA-4 ВКД), включающий аминокислотную последовательность, которая (а) отличается от аминокислотной последовательности SEQ ID NO:31 по не более чем 6 аминокислотным остаткам, и (b) включает, по меньшей мере, одно из следующего: остаток метионина в положении, соответствующем положению 50 SEQ ID NO:31, остаток лизина в положении, соответствующем положению 54 SEQ ID NO:31, остаток глутаминовой кислоты в положении, соответствующем положению 55 SEQ ID NO:31, остаток пролина в положении, соответствующем положению 64 SEQ ID NO:31, остаток серина в положении, соответствующем положению 65 SEQ ID NO:31, остаток фенилаланина в положении, соответствующем положению 70 SEQ ID NO:31, где положения аминокислотных остатков пронумерованы в соответствии с SEQ ID NO:31; и (2) Ig полипептид, где указанный димер связывает hCD80 и/или hCD86 (и/или hCD86-Ig, и/или hCD86-Ig) и/или ингибирует иммунный ответ или ее комплементарную полинуклеотидную последовательность. Ig полипептид может включать полипептид Ig Fc, включая, например, полипептид Ig Fc, включающий последовательность, имеющую, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность с последовательностью, выбранной из группы, включающей SEQ ID NOS:184-186 и 218. В некоторых таких димерах или мономерах полипептид (1) включает остаток глутаминовой кислоты в положении, соответствующем положению 104, остаток аспарагиновой кислоты в положении, соответствующем положению 30, и/или остаток изолейцина в положении, соответствующем положению 32 SEQ ID NO:31. Дополнительные детали касательно функциональных свойств и характеристик таких димеров обсуждаются выше. Также обеспечивается рекомбинантная или изолированная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует такой мономерный слитый белок, который связывает CD80 и/или CD86 (и/или CD80-Ig, и/или CD86-Ig) и/или имеет способность ингибировать иммунный ответ.
Также включены в изобретение фрагменты любых таких нуклеиновых кислот по данному изобретению, описанных выше, где такие фрагменты кодируют полипептид, который связывает hCD80 и/или hCD86 и/или ВКД каждого или обоих и/или имеет способность подавлять или ингибировать иммунный ответ. Многие фрагменты этих нуклеиновых кислот будут экспрессировать полипептиды, которые связывают hCD80 и/или hCD86 или его ВКД, или подавлять иммунный ответ, причем свойства могут быть идентифицированы путем целесообразных экспериментов. Нуклеотидные фрагменты обычно содержат, по меньшей мере, 250, 300, 400, 500, 600, 700, 800, 900, 950, 1000 или более нуклеотидных оснований.
Данное изобретение включает изолированную или рекомбинантную нуклеиновую кислоту, которая кодирует белок, включающий сигнальный пептид и полипептид по данному изобретению (который включает димерный или мономерный слитый белок по данному изобретению), такой как мутантный полипептид CTLA-4 ВКД или мутантный слитый белок CTLA-4-Ig по данному изобретению, который связывает CD80 и/или CD86 и/или подавляет иммунный ответ в in vitro или in vivo исследованиях и/или способах, как описывается детально в данном описании. Кодируемая последовательность сигнального пептида, которая направляет секрецию зрелого полипептида через мембрану прокариотической или эукариотической клетки, обычно ковалентно связана с аминоконцом указанного полипептида. Могут использоваться разнообразные сигнальные пептиды, включая, например, последовательность сигнального пептида, приведенную в SEQ ID NO:182, которая кодируется, например, нуклеотидной последовательностью, представленной в SEQ ID NO:181, или последовательность сигнального пептида, приведенную в SEQ ID NO:216, которая кодируется, например, нуклеотидной последовательностью, представленной в SEQ ID NO:215. Изобретение также включают изолированную или рекомбинантную нуклеиновую кислоту, которая кодирует белок, включающий сигнальный пептид, мутантный полипептид CTLA-4 ВКД, трансмембранный домен и/или цитоплазматический домен, как обсуждалось детально выше.
Последовательность сигнального пептида полноразмерного человеческого белка CTLA-4 может использоваться для направления экспрессии или секреции рекомбинантного мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig по данному изобретению. В одном аспекте сигнальный пептид (СП) белка hCTLA-4 включает аминокислотные остатки 1-37 hCTLA-4 белка; эта последовательность сигнального пептида показана в SEQ ID NO:216. В этом случае зрелый hCTLA-4 белок обычно начинается с остатка метионина в положении 38, и аминокислотные остатки зрелого белка hCTLA-4 нумеруются соответственно, начиная с этого остатка метионина, который обозначен как первая аминокислота (а именно, занимающая положение 1). Таким образом, сигнальный пептид, включающий пептидную последовательность, представленную в SEQ ID NO:216, может быть слит или связан с амино (N) концом мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig по данному изобретению, например, с помощью ковалентной связи, так чтобы облегчить экспрессию или секрецию мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig соответственно. Иллюстративная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует hCTLA-4 последовательность сигнального пептида SEQ ID NO:216, приведена в SEQ ID NO:215.
Когда последовательность сигнального пептида SEQ ID NO:216 слита с помощью связи с N-концом мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig, при экспрессии или секреции указанного полипептида или слитого белка, то сигнальный пептид отщепляется; полученный зрелый мутантный полипептид CTLA-4 ВКД или зрелый мутантный слитый белок CTLA-4-Ig обычно начинается с остатка метионина в положении 38, и аминокислотные остатки зрелого мутантного полипептида CTLA-4 ВКД или зрелого мутантного слитого белка CTLA-4-Ig нумеруют соответственно, начиная с этого остатка метионина, который обозначается как первая аминокислота (а именно, занимающая положение 1).
Данное изобретение включает изолированный или рекомбинантный полипептид, включающий сигнальный пептид (например, SEQ ID NO:216) и мутантный полипептид CTLA-4 ВКД (например, последовательность, выбранную из группы SEQ ID NOS:1-73), где сигнальный пептид ковалентно соединен с N-концом мутантного полипептида CTLA-4 ВКД. Также включен в изобретение изолированный или рекомбинантный полипептид, включающий сигнальный пептид (например, SEQ ID NO:216) и мутантный CTLA-4-Ig (например, последовательность, выбранную из группы SEQ ID NOS:74-79, 197-200, 205-214 и 219-222), где сигнальный пептид ковалентно соединен с N-концом мутантного CTLA-4-Ig. Также обеспечивается изолированная или рекомбинантная нуклеиновая кислота, включающая нуклеотидную последовательность (например, SEQ ID NO:215), кодирующую сигнальный пептид (например, SEQ NO:216) и нуклеотидную последовательность, кодирующую мутантный полипептид CTLA-4 ВКД (например, последовательность, выбранную из группы SEQ ID NOS:1-73) или мутантный слитый белок CTLA-4-Ig (например, последовательность, выбранную из группы SEQ ID NOS:74-79, 197-200, 205-214 и 219-222).
В альтернативном аспекте сигнальный пептид полноразмерного hCTLA-4 белка включает остатки 1-35 полноразмерного белка hCTLA-4; этот сигнальный пептид включает пептидную последовательность, представленную в SEQ ID NO:182. В этом случае два аминокислотных остатка лизина (K) и аланина (А) в положениях 36 и 37 соответственно, белка hCTLA-4, тем не менее обычно отсутствуют в зрелом секретируемом белке hCTLA-4, как определяется секвенированием белка. Таким образом, полученный зрелый белок hCTLA-4 также начинается с остатка метионина в положении 38, и аминокислотные остатки зрелого белка hCTLA-4 нумеруют соответственно, начиная с этого остатка метионина в положении 38 белка hCTLA-4, который обозначают как первую аминокислоту зрелого белка hCTLA-4. Так как аминокислотные остатки лизина (K) и аланина (А) в положениях 36 и 37 соответственно полноразмерного hCTLA-4 белка не присутствуют в полученном зрелом белке hCTLA-4, считается, что они отщепились от зрелого белка hCTLA-4 в ходе процессинга. Иллюстративная нуклеиновая кислота, включающая нуклеотидную последовательность, которая кодирует последовательность сигнального пептид hCTLA-4a (SEQ ID NO:182), показана в SEQ ID NO:181.
Сигнальный пептид, включающий пептидную последовательность, представленную в SEQ ID NO:182, может быть слит или связан с N-концом мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig по данному изобретению, например, ковалентной связью, так чтобы облегчить экспрессию или секрецию мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig соответственно. Когда последовательность сигнального пептида SEQ ID NO:182 слита или связана с N-концом мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig, при экспрессии или секреции полипептида или слитого белка, то сигнальный пептид отщепляется; полученный зрелый мутантный полипептид CTLA-4 ВКД или зрелый мутантный слитый белок CTLA-4-Ig, тем не менее обычно начинается с остатка метионина в положении 38, и аминокислотные остатки зрелого мутантного полипептида CTLA-4 ВКД или зрелого мутантного слитого белка CTLA-4-Ig нумеруют соответственно, начиная с этого остатка метионина, который обозначают как первую аминокислоту (а именно, занимающую положение 1). Так как аминокислотные остатки лизина (K) и аланина (А) в положениях 36 и 37 соответственно полноразмерного белка hCTLA-4 не присутствуют в полученном зрелом мутантном полипептиде CTLA-4 ВКД или зрелом мутантном слитом белке CTLA-4-Ig, то полагают, что они отщепились от указанного мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4- Ig в ходе процессинга.
Данное изобретение включает изолированный или рекомбинантный полипептид, включающий сигнальный пептид (например, SEQ ID NO:182) и мутантный полипептид CTLA-4 ВКД (например, последовательность, выбранную из группы SEQ ID NOS:1-73), где сигнальный пептид ковалентно соединен с N-концом мутантного полипептида CTLA-4 ВКД. Также данное изобретение включает изолированный или рекомбинантный полипептид, включающий сигнальный пептид (например, SEQ ID NO:182) и мутантный CTLA-4-Ig (например, последовательность, выбранную из группы SEQ ID NOS:74-79, 197-200, 205-214 и 219-222), где сигнальный пептид ковалентно соединен с N-концом мутантного CTLA-4-Ig. Также обеспечивается изолированная или рекомбинантная нуклеиновая кислота, включающая нуклеотидную последовательность (например, SEQ ID NO:181), кодирующую сигнальный пептид (например, SEQ NO:182), и нуклеотидную последовательность, кодирующую мутантный полипептид CTLA-4 ВКД (например, последовательность, выбранную из группы SEQ ID NOS:1-73) или мутантный слитый белок CTLA-4-Ig (например, последовательность, выбранную из группы SEQ ID NOS:74-79, 197-200, 205-214 и 219-222).
Нуклеиновая кислота по данному изобретению может также включать один или несколько приемлемых дополнительных нуклеотидных последовательностей. Например, принимая во внимание, что полипептид по данному изобретению (который включает слитый белок по данному изобретению) может включать одну или несколько дополнительных аминокислотных последовательностей, такие как, например, подпоследовательность для очищения полипептида (такая как, например, подпоследовательность, выбранная из эпитопного маркера, FLAG маркера, полигистидиновой последовательности и GST слияния), последовательность сигнального пептида и т.п., данное изобретение включает нуклеиновые кислоты, которые кодируют все такие полипептиды, включающие такие дополнительные последовательности. Иллюстративные сигнальные пептиды, которые при экспрессии обычно ковалентно связаны с N-терминальным полипептидом по данному изобретению, обсуждаются выше. Например, нуклеиновая кислота, кодирующая аминокислотную последовательность любой из SEQ ID NOS:1-79, 197-200, 205-214 и 219-222, может также включать нуклеиновую кислоту, кодирующую сигнальный пептид, такая как последовательность сигнального пептида SEQ ID NO:182, такая как, например, нуклеотидная последовательность, приведенная в SEQ ID NO:181, или последовательность сигнального пептида, приведенная в SEQ ID NO:216, которая кодируется, например, нуклеотидной последовательностью, представленной в SEQ ID NO:215. Такие нуклеотидные последовательности могут быть напрямую слиты вместе, в приемлемой рамке считывания, так что полученная нуклеиновая кислота включает нуклеотидную последовательность, кодирующую сигнальный пептид по данному изобретению, и нуклеотидную последовательность, кодирующую полипептид по данному изобретению.
Нуклеиновая кислота по данному изобретению может быть изолирована любой приемлемой методикой, которая известна для специалистов в данной области. Изолированная нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, которую получают в клетке-хозяине и далее существенно очищают любой приемлемой методикой очищения нуклеиновой кислоты) может быть снова встроена в клетку-хозяина или заново встроена в клеточное или другое биологическое окружение или композицию, где она не будет больше являться доминантными видами нуклеиновой кислоты и не будет больше отделена от других нуклеиновых кислот.
Практически любая изолированная или рекомбинантная нуклеиновая кислота по данному изобретению может быть вставлена в или слита с приемлемой большей молекулой нуклеиновой кислоты (включая например, но не ограничиваясь следующим, хромосому, плазмиду, вектор экспрессии или кассету экспрессии, вирусный геном, генную последовательность, линейный элемент экспрессии, бактериальный геном, растительный геном или синтетическую хромосому, такую как синтетическая хромосома млекопитающего (СХМ), или ее дрожжевые или бактериальные аналоги (а именно, СХД или СХБ) для образования рекомбинантной нуклеиновой кислоты с применением стандартных методик. В качестве другого примера, изолированная нуклеиновая кислота по данному изобретению может быть слита с меньшими нуклеотидными последовательностями, такими как промоторные последовательности, иммуностимуляторные последовательности и/или последовательности, кодирующие другие аминокислоты, такие как другие антигенные эпитопы и/или линкерные последовательности для образования рекомбинантной нуклеиновой кислоты.
В некоторых случаях рекомбинантная или синтетическая нуклеиновая кислота может быть образована с помощью методик химического синтеза, применяемыми не по отношению к клетке-хозяину (например, нуклеиновая кислота, полученная полимеразной цепной реакцией (ПЦР) или методики химического синтеза, примеры которых описаны также в данном описании).
Нуклеиновые кислоты, кодирующие полипептиды (включая слитые белки) по данному изобретению могут иметь любой приемлемый химический состав, который позволяет осуществить экспрессию полипептида по данному изобретению или другую необходимую биологическую активность (например, гибридизация с другими нуклеиновыми кислотами). Полинуклеотиды по данному изобретению могут быть в форме РНК или в форме ДНК и включают мРНК, кРНК, рекомбинантную или синтетическую РНК и ДНК и кДНК. Нуклеиновые кислоты по данному изобретению являются обычно ДНК молекулами и обычно двухцепочечными ДНК молекулами. Тем не менее одноцепочечные ДНК, одноцепочечные РНК, двухцепочечные РНК и гибридные ДНК/РНК нуклеиновые кислоты или их комбинации, включающие любые нуклеотидные последовательности по данному изобретению, также обеспечиваются в данном изобретении. Нуклеиновая кислота по данному изобретению может включать любое приемлемое нуклеотидное основание, аналог основания и/или остова (например, остов, сформированный или включающий фосфотиоатную связь чаще, чем фосфодиэфирную связь, например, ДНК, включающая фосфотиоатный или фосфоротиоатный остов). Нуклеиновая кислота по данному изобретению, если она одноцепочечная, может быть кодирующей цепью или некодирующей (а именно, антисмысловой или комплементарной) цепью. В дополнение к нуклеотидной последовательности, кодирующей полипептид по данному изобретению (например, нуклеотидная последовательность, которая включает кодирующую последовательность мутантного полипептида CTLA-4 ВКД или мутантного CTLA-4-Ig), полинуклеотид по данному изобретению может включать одну или несколько дополнительных кодирующих нуклеотидных последовательностей, так чтобы кодировать, например, слитый белок, направляющую последовательность (отличную от сигнальной последовательности) или подобное (более конкретные примеры которых обсуждаются также в данном описании), и/или может включать некодирующие нуклеотидные последовательности, такие как интроны, терминальную последовательность или 5' и/или 3' нетранслирующиеся области, причем эти области могут быть эффективными для экспрессии кодирующей последовательности в приемлемом хозяине, и/или контрольные элементы, такие как промотор (например, встречающийся в природе или рекомбинантный или перетасованый промотор).
Модификации нуклеиновой кислоты особенно допустимы в 3-м положении мРНК кодоновой последовательности, кодирующей такой полипептид. В конкретных аспектах, по меньшей мере, часть нуклеиновой кислоты включает фосфоротиоатный остов, встроенный, по меньшей мере, один синтетический нуклеотидный аналог в месте или дополнительно к встречающимся в природе нуклеотидам в последовательность нуклеиновых кислот. Также или альтернативно, нуклеиновая кислота может включать дополнение оснований, отличных от гуанина, аденина, урацила, тимина и цитозина. Такие модификации могут быть связаны с более длинным временем полужизни и, таким образом, могут быть желательными в векторах нуклеиновых кислот по данному изобретению. Таким образом, в одном аспекте изобретение обеспечивает рекомбинантные нуклеиновые кислоты и векторы нуклеиновой кислоты (обсуждаемые также ниже), причем нуклеиновые кислоты или векторы содержат, по меньшей мере, одну из вышеупомянутых модификаций или любую приемлемую комбинацию таковых, где нуклеиновая кислота персистирует дольше в хозяине-млекопитающем, чем по сути идентичная нуклеиновая кислота без такой модификации или модификаций. Примеры модифицированных и/или не-цитозиновых, не-адениновых, не-гуаниновых, не-тиминовых нуклеотидов, которые могут быть встроены в нуклеотидную последовательность по данному изобретению, приведены в, например, MANUAL OF PATENT EXAMINING PROCEDURE § 2422 (7th Revision - 2000).
Следует понимать, что нуклеиновая кислота, кодирующая, по меньшей мере, один из полипептидов по данному изобретению (который включает слитый белок по данному изобретению), включая те, что описаны выше и везде в данном описании, не ограничена последовательностью, которая непосредственно кодирует для экспрессии или продукции полипептида по данному изобретению. Например, нуклеиновая кислота может включать нуклеотидную последовательность, которая дает в результате полипептид по данному изобретению посредством интеин-подобной экспрессии (как описано в, например, Colson и Davis (1994) Mol. Microbiol. 12(3):959-63, Duan et al. (1997) Cell 89(4):555-64, Perler (1998) Cell 92(1): 1-4, Evans et al. (1999) Biopolymers 51(5):333-42 и de Grey, Trends Biotechnol. 18(9):394-99 (2000)), или нуклеотидную последовательность, которая включает само-сплайсирующие интроны (или другие само-сплайсирующие РНК транскрипты), которая образует промежуточную последовательность, кодирующую рекомбинантный полипептид (как описано, например, в Патенте США №6010884). Нуклеиновая кислота также или альтернативно может включать последовательности, которые приводят к другим модификациям сплайсинга на уровне РНК для получения мРНК транскрипта, кодирующего полипептид и/или на уровне ДНК с помощью механизмов транс-сплайсинга перед транскрипцией (принципы, относящиеся к таким механизмам, описаны в, например, Chabot, Trends Genet. (1996) 12(11):472-78, Cooper (1997) Am. J. Hum. Genet. 61(2):259-66 и Hertel et al. (1997) Curr. Opin. Cell. Biol. 9(3):350-57). Вследствие врожденной вырожденности генетического кода некоторые нуклеиновые кислоты могут кодировать любой конкретный полипептид по данному изобретению. Таким образом, например, любая из конкретных нуклеиновых кислот, описанных здесь, может быть модифицирована путем замещения одного или нескольких кодонов на эквивалентный кодон (относительно аминокислоты, кодируемой кодоном) на основе вырожденности генетического кода. Другие нуклеотидные последовательности, которые кодируют полипептид, имеющие такую же или функционально эквивалентную последовательность, как аминокислотная последовательность по данному изобретению, могут также использоваться для синтезирования, клонирования и экспрессирования такого полипептида.
В общем, любая из нуклеиновых кислот по данному изобретению может быть модифицирована для увеличения экспрессии в конкретном хозяине, с применением методик, представленных в данном описании для примера, по отношению к описанным выше нуклеиновым кислотам, кодирующим полипептид по данному изобретению (например, нуклеиновые кислоты, кодирующие мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig). Любая из нуклеиновых кислот по данному изобретению, как описано здесь, может быть кодон-оптимизирована для экспрессии в конкретном млекопитающем (обычно людях). Различные методики для оптимизации кодона известны в данной области техники. Кодоны, которые используются наиболее часто в конкретном хозяине, называются оптимальными кодонами, а те, которые не используются очень часто, классифицируются как редко или слабоиспользуемые кодоны (смотри, например, Zhang, S. P. et al. (1991) Gene 105:61-72). Кодоны могут быть замещены, чтобы отражать преимущественное использование кодона хозяином, процесс называется "оптимизация кодонов" или "контроль за характерным для организма статистическим отклонением от равномерности в использовании кодонов". Оптимизированная кодирующая последовательность, включающая кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина, может быть использована, чтобы увеличить скорость трансляции или чтобы получить рекомбинантные РНК транскрипты, имеющие желательные свойства, такие как увеличенное время полужизни по сравнению с транскриптами, полученными от неоптимизированной последовательности. Методики для получения последовательностей с оптимизированными кодонами являются известными (смотри, например, Е. et al. (1989) Nuc. Acids Res. 17:477-508). Трансляционные стоп-кодоны могут также быть модифицированными, чтобы отражать предпочтение хозяина. Например, предпочтительные стоп-кодоны для S. cerevisiae и млекопитающих - это UAA и UGA соответственно. Предпочтительный стоп-кодон для однодольных растений - это UGA, тогда как насекомые и Е. coli предпочитают применение UAA в качестве стоп-кодона (смотри, например, Dalphin, M.E. et al. (1996) Nuc. Acids Res. 24:216-218). Расположение кодонов по отношению к другим кодонам также может влиять на биологические свойства последовательностей нуклеиновых кислот и модификации нуклеиновых кислот для обеспечения расположения контекста кодона, характерного для конкретного хозяина, также учитывалось изобретателями. Таким образом, последовательность нуклеиновой кислоты по данному изобретению может включать нуклеотидную последовательность с оптимизированными кодонами, а именно часто использующийся оптимизированный кодом и/или кодонову пару (а именно, контекст кодона), оптимизированную для конкретных видов (например, полипептид может быть экспрессированным из полинуклеотидной последовательности, оптимизированной для экспрессии в организмах людей, путем замещения "редких" человеческих кодонов, основываясь на частоте использования кодона или контекста кодона, например, с применением методик, таких как те, что описаны в Buckingham et al. (1994) Biochimie 76(5):351-54 и Патентах США №5082767, 5786464 и 6114148).
Нуклеиновые кислоты по данному изобретению могут быть модифицированы отсечением или одного или нескольких остатков с C-концевой части последовательности. Дополнительные различные стоп- или терминирующие кодоны могут быть включены на конце нуклеотидной последовательности, что также обсуждается ниже.
Одна или несколько нуклеиновых кислот по данному изобретению могут быть включены в векторное, клеточное окружение или окружение хозяина, в котором кодирующая нуклеотидная последовательность по данному изобретению представляет собой гетерологичный ген.
Полинуклеотиды по данному изобретению включают полинуклеотидные последовательности, которые кодируют любой полипептид по данному изобретению (или его полипептидный фрагмент), который связывает CD80 и/или CD86 и/или подавляет иммунный ответ, причем полинуклеотиды, которые гибридизируют при, по меньшей мере, строгих условиях с одной или несколькими такими полинуклеотидными последовательностями, описанными здесь, полинуклеотидные последовательности, комплементарные любым таким полинуклеотидным последовательностям, и варианты, аналоги и гомологичные производные всех тех, что описаны выше. Кодирующая последовательность относится к нуклеотидной последовательности, которая кодирует конкретный полипептид или домен, подпоследовательность, область или фрагмент указанного полипептида. Кодирующая последовательность может кодировать мутантный полипептид CTLA-4 или его фрагмент, имеющий функциональное свойство, такое как способность связывать CD80 и/или CD86 и/или ингибировать или подавлять иммунный ответ. Нуклеиновая кислота по данному изобретению может включать соответствующую кодирующую последовательность мутантного полипептида CTLA-4 по данному изобретению и его варианты, аналоги и гомологичные производные.
Нуклеиновые кислоты по данному изобретению могут также обнаруживаться в комбинации с типичными композиционными составами нуклеиновых кислот, включая в присутствии носителей, буферов, вспомогательных веществ, наполнителей, растворителей и подобного, которые известны специалистам в данной области.
Если не указано иное, конкретная последовательность нуклеиновой кислоты, описанная здесь, также полностью включает ее консервативно модифицированные варианты (например, замены вырожденного кодона) и комплементарные последовательности, а также точно определенную последовательность. Специфически, замены вырожденного кодона могут достигаться образованием последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено на остатки смешанных оснований и/или дезоксиинозиновые остатки (Batzer et al. (1991) Nucl. Acid Res. 19:5081; Ohtsuka et al. (1985) J. Biol. Chem. 260:2605-2608; Cassol et al. (1992); Rossolini et al. (1994) Mol. Cell. Probes 8:91-98).
Гибридизация нуклеиновой кислоты
Как отмечалось выше, данное изобретение включает нуклеиновые кислоты, которые гибридизуются до целевой нуклеиновой кислоты по данному изобретению, такой как, например, полинуклеотид, выбранный из группы, включающей SEQ ID NOS:80-158, 201-204, 223 и 224, или его комплементарная полинуклеотидная последовательность, где гибридизация охватывает по сути всю длину целевой нуклеиновой кислоты. Гибридизированная нуклеиновая кислота может гибридизироваться с нуклеотидной последовательностью по данному изобретению, такой как, например, SEQ ID NO:80, при, по меньшей мере, строгих условиях или при, по меньшей мере, высокой строгости условий. Известны средне строгие, строгие и сильно строгие условия гибридизации для экспериментов по гибридизация нуклеиновой кислоты. Примеры факторов, которые могут быть объединены для достижения таких уровней строгости, кратко обсуждаются в данном описании.
Нуклеиновые кислоты "гибридизируются", когда они связываются, обычно в растворах. Нуклеиновые кислоты гибридизируются под действием различных хорошо описанных физико-химических сил, таких как водородная связь, исключение растворителя, стэкинг-взаимодействие и подобное. Обширное руководство по гибридизации нуклеиновых кислот можно найти в Р. Tijssen (1993) LABORATORY TECHNIQUES IN BIOCHEMISTRY AND MOLECULAR BIOLOGY-HYBRIDIZATION WITH NUCLEIC ACID PROBES, vol. 24, part I, chapter 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays," (Elsevier, NY) (далее в тексте "Tijssen"), а также в Ausubel, смотри выше, Hames and Higgins (1995) GENE PROBES 1, IRL Press at Oxford University Press, Oxford, England (Hames and Higgins 1) and Hames and Higgins (1995) GENE PROBES 2, IRL Press at Oxford University Press, Oxford, England (Hames and Higgins 2) обеспечивают детали синтеза, формирования меток, определения и количественного анализа ДНК и РНК, включая олигонуклеотиды.
Определение того, что две последовательности нуклеиновой кислоты являются по сути идентичными, состоит в том, что две молекулы гибридизируются с каждой другой при, по меньшей мере, строгих условиях. Фраза "гибридизированная специфически с" относится к связыванию, образованию дуплекса или гибридизации молекулы только с конкретной нуклеотидной последовательностью при строгих условиях, когда такая последовательность присутствует в сложной смеси (например, общие клеточные) ДНК или РНК. "Связывают(ет) по сути" относится к комплементарной гибридизации между нуклеиновой кислотой-зондом и целевой нуклеиновой кислотой и охватывает небольшие несовпадения, которые могут быть скорректированы путем уменьшения строгости сред гибридизации для получения желательного определения целевой полинуклеотидной последовательности.
"Строгие гибридизационные условия отмывки" и "строгие условия гибридизации" в контексте экспериментов по гибридизации нуклеиновой кислоты, таких как саузерн и нозерн гибридизации, являются зависимыми от последовательности и являются различными при различных параметрах окружения. Широкое руководство по гибридизации нуклеиновых кислот можно найти в Tijssen (1993), смотри выше, и в Hames и Higgins 1 и Hames и Higgins 2, смотри выше.
В общем, условия высокой строгости выбраны так, что гибридизация происходит при от около 5°С или меньше, чем температура плавления (Tm) для специфической последовательности при определенной ионной силе и рН. Tm - это температура (при определенной ионной силе и рН), при которой 50% анализируемой последовательности гибридизируется с идеально совпадающим зондом. Другими словами, Tm определяет температуру, при которой дуплекс нуклеиновых кислот является на 50% денатурированным при данных условиях и представляет прямое измерение стабильности гибрида нуклеиновой кислоты. Таким образом, Tm соответствует температуре, соответствующей срединной точке в переходе от спирали к случайной спирали; она зависит от длины, нуклеотидного состава и ионной силы для длинных нуклеотидов. Типично, при "строгий условиях" зонд будет гибридизироваться с ее целевой подпоследовательностью, а не с какими-то другими последовательностями. "Очень строгие условия" выбраны так, чтобы быть равными Tm для конкретного зонда.
Tm дуплекса ДНК-ДНК может быть вычислена с применением равенства (I): Tm (°С)=81,5°С+16,6 (log10M)+0,41 (%G+С) - 0,72 (%f) - 500/n, где М - это молярность моновалентных катионов (обычно Na+), (%G+С) - это процент нуклеотидов гуанозина (G) и цитозина (С), (%f) - это процент формалина и n - это число нуклеотидных оснований (а именно, длина) гибрида. Смотри Rapley, R. and Walker, J. M. eds., MOLECULAR BIOMETHODS HANDBOOK (1998), Humana Press, Inc. (hereinafter Rapley and Walker), Tijssen (1993), смотри выше. Tm дуплекса РНК-ДНК может быть рассчитана с применением равенства (2): Tm (°С)=79,8°С+18,5 (log10M)+0,58 (%G+С) - 11,8(%G+С)2 - 0,56 (%f) - 820/n, где M - это молярность моновалентных катионов (обычно Na+), (%G+С) - это процент нуклеотидов гуанозина (G) и цитозина (С), (%f) - это процент формамида и n - это число нуклеотидных оснований (а именно, длина) гибрида. Id. Уравнения 1 и 2 выше обычно подходят только для гибридных дуплексов длиной больше, чем около 1 100-200 нуклеотидов. Id. Tm последовательностей нуклеиновой кислоты, короче, чем 50 нуклеотидов, может быть рассчитана следующим образом: Tm (°C)=4(G+С)+2(А+Т), где А (аденин), С, Т (тимин) и G - это число соответствующих нуклеотидов.
В целом, негибридизированный материал нуклеиновой кислоты удаляют серией отмывок, строгость которых может быть отрегулирована в зависимости от желательных результатов, в отношении анализа гибридизации. Условия отмывки низкой строгости (например, с применением более высокой концентрации соли и более низкой температуры) повышает чувствительность, но может приводить к неспецифическим сигналам гибридизации и высоким фоновым сигналам. Условия высокой строгости (например, с применением более низкой концентрации соли и более высокой температуры, которая близка к температуре гибридизации) понижает фоновый сигнал, оставляя обычно только специфическую передачу сигнала. Дополнительной руководство в отношении таких методик гибридизации обеспечивается в, например, Rapley и Walker, смотри выше (в частности, по отношению к таким гибридизационным экспериментам, часть I, глава 2, "Overview of principles of hybridization and the strategy of nucleic acid probe assays"), Elsevier, New York, а также в Ausubel, смотри выше, Sambrook, смотри выше, Watson, смотри выше, Hames и Higgins (1995) GENE PROBES 1, IRL Press at Oxford Univ. Press, Oxford, England, and Hames and Higgins (1995) GENE PROBES 2, IRL Press, Oxford Univ. Press, Oxford, England.
Иллюстративные строгие (или нормальной строгости) условия для анализа, по меньшей мере, двух нуклеиновых кислот, включающих, по меньшей мере, 100 нуклеотидов, включают инкубацию в растворе или на фильтре в саузерн или нозерн блоте, который включает 50% формалина (или формамида) с 1 миллиграммом (мг) гепарина при 42°С, проводя гибридизацию на протяжении ночи. Отмывка нормальной строгости может быть проведена с применением, например, раствора, включающего 0,2х SSC отмывку при около 65°С в течение около 15 минут (смотри Sambrook, смотри выше, для описания SSC буфера). Часто отмывку нормальной строгости поводят после отмывки низкой строгости для удаления фонового сигнала зонда. Отмывка низкой строгости может быть проведена в, например, растворе, включающем 2х SSC при около 40°С в течение около 15 минут. Отмывку высокой строгости могут проводить с применением раствора, включающего 0,15 М NaCl при около 72°С в течение около 15 минут. Пример отмывки средней (нормальной) строгости, менее строгой, чем отмывка нормальной строгости, описанная выше, для дуплекса, например, более чем 100 нуклеотидов, может быть проведен в растворе, включающем 1х SSC при 45°С в течение 15 минут. Пример отмывки низкой строгости для дуплекса из, например, более чем 100 нуклеотидов, может быть проведен в растворе 4-6х SSC при 40°С в течение 15 минут. Для коротких меток (например, около 10-50 нуклеотидов), строгие условия обычно включают концентрации соли менее чем около 1,0 М Na+ иона, обычно около 0,01-1,0 М Na+ концентрации ионов (или других солей) при рН 7,0-8,3, и температуре типично, по меньшей мере, около 30°С. Строгие условия могут достигаться также дополнением дестабилизирующих агентов, таких как формамид.
Иллюстративные условия средней строгости включают инкубацию в течение ночи при 37°С в растворе, включающем 20% формалина (или формамида), 0,5х SSC, 50 мМ фосфата натрия (рН 7,6), 5х раствора Денхардта, 10% декстрана сульфата и 20 мг/мл денатурированной гидродинамически фрагментированой ДНК спермы лосося, с последующей отмывкой на фильтрах для отмывки в 1х SSC при около 37-50°С, или по сути сходных условиях, например, средне строгих условиях, описанных в Sambrook, смотри выше, и/или Ausubel, смотри выше.
Условия высокой строгости - это условия, которые используют, например, (1) низкую ионную силу и высокую температура для отмывки, например, 0,015 М хлорид натрия/0,0015 М цитрат натрия/0,1% натрия додецил сульфат (SDS) при 50°С, (2) используют денатурирующий агент в процессе гибридизации, такой как формамид, например, 50% (объем/объем) формамида с 0,1% бычий сывороточный альбумин (BSA)/0,1% Ficoll/0,1% поливинилпирролидон (PVP)/50 мМ натрий- фосфатный буфер при рН 6,5 с 750 мМ хлорида натрия, 75 мМ цитрата натрия при 42°С, или (3) используют 50% формамид, 5х SSC (0,75 М NaCl, 0,075 М цитрат натрия), 50 мМ фосфат натрия (рН 6,8), 0,1% натрия пирофосфат, 5х раствор Денхардта, ДНК спермы лосося, обработанной ультразвуком (50 мкг/мл), 0,1% SDS, и 10% декстрана сульфат при 42°С, с отмывками при (i) 42°С в 0,2х SSC, (ii) при 55°С в 50% формамиде и (iii) при 55°С в 0,1х SSC (преимущественно в комбинации с EDTA (этилендиаминтетрауксусная кислота)).
В целом, соотношение сигнал-шум было в 2 или 2,5-5 раз больше (или выше), чем это наблюдается для несвязанного зонда в конкретном анализе гибридизации, что идентифицирует определение специфической гибридизации. Определение, по меньшей мере, строгой гибридизации между двумя последовательностями в контексте данного изобретения определяет сильное структурное сходство или гомологию с, например, нуклеиновыми кислотами по данному изобретению.
Как отмечалось, "сильно строгие" условия выбраны так, чтобы быть около 5°С или ниже, чем температура плавления (Tm) для специфической последовательности при определенной ионной силе и рН. Целевые последовательности, которые тесно связаны с или идентичны с нуклеотидной последовательностью, представляющей интерес, (например, "зонд") могут быть идентифицированы при условиях высокой строгости. Условия низкой строгости пригодны для последовательностей, которые менее комплементарны. Смотри, например, Rapley и Walker; Sambrook, все смотри выше.
Сравнительная гибридизация может использоваться для определения нуклеиновых кислот по данному изобретению, и этот способ сравнительной гибридизации является предпочтительным способом для различения нуклеиновых кислот по данному изобретению. Определение высоко строгой гибридизации между двумя нуклеотидными последовательностями в контексте данного изобретения определяет относительно сильное структурное сходство/гомологию с, например, нуклеиновыми кислотами, представленными в последовательности, перечисленной в данном описании. Высоко строгая гибридизация между двумя нуклеотидными последовательностями демонстрирует степень сходства или гомологии структуры, состава нуклеотидных оснований, расположения или порядка, который больше, чем это определяется строгими условиями гибридизации. В частности, определение высоко строгой гибридизации в контексте данного изобретения определяет сильное структурное сходство или структурную гомологию (например, нуклеотидной структуры состава оснований, расположения или порядка) с, например, нуклеиновыми кислотами, представленными в последовательности, перечисленной в данном описании. Например, является желательным определение анализируемых нуклеиновых кислот, которые гибридизируются с иллюстративными нуклеиновыми кислотами в данном описании при строгих условиях.
Таким образом, измерение строгой гибридизации - это способность гибридизироваться с нуклеиновой кислотой по данному изобретению (например, нуклеиновой кислотой, включающей полинуклеотидную последовательность, выбранную из группы, включающей SEQ ID NOS:80-158, 201-204, 223 и 224, или ее комплементарную полинуклеотидную последовательность) при условиях высокой строгости (или очень строгих условиях, или условиях гибридизации сверхвысокой строгости или условиях гибридизации сверх-сверх высокой строгости). Строгие условия гибридизации (включая, например, высоко строгие, сверх высокой строгости или сверх-сверх высокой строгости условия гибридизации) и отмывки можно легко определить эмпирически для любой анализируемой нуклеиновой кислоты.
Например, при определении высоко строгих условий гибридизации и отмывки, условия гибридизации и отмывки постепенно увеличивают (например, повышая температуру, снижая концентрацию соли, повышая концентрацию детергента и/или повышая концентрацию органических растворителей, таких как формалин, при гибридизации или отмывке), пока не совпадет выбранный ряд критериев. Например, условия гибридизации и отмывки постепенно увеличивают, пока зонд, включающий одну или несколько последовательностей нуклеиновых кислот, выбранных из группы, включающей SEQ ID NOS:80-158, 201-204, 223 и 224 и их комплементарные полинуклеотидные последовательности, не свяжет до полного совпадения комплементарную мишень (снова нуклеиновую кислоту, включающую, по меньшей мере, одну последовательность нуклеиновых кислот, выбранную из группы, включающей SEQ ID NOS:80-158, 201-204, 223 и 224 или их комплементарных полинуклеотидные последовательности), с отношением сигнал-шум, которое, по меньшей мере, в 2,5 раза, и необязательно 5 раз или больше, выше, чем то, что наблюдается для гибридизации зонда с несовпадающей мишенью. Несовпадающая мишень может включать нуклеиновую кислоту, соответствующую, например, полипептид-кодирующей последовательности нуклеиновых кислот CTLA-4.
Обычно гибридизационный анализ проводят при условиях гибридизации, выбранных так, чтобы нуклеиновая кислота, включающая последовательность, которая совершенно комплементарна описываемой эталонной (или известной) нуклеотидной последовательности (например, SEQ ID NO:80), гибридизировалась с рекомбинантной антиген-кодирующей последовательностью (например, вариант нуклеотидной последовательности нуклеиновой кислоты SEQ ID NO:80) с, по меньшей мере, около в 5, 7 или 10 высшим значением отношения сигнал-шум, чем наблюдается при гибридизации совершенно комплементарной нуклеиновой кислоты с нуклеиновой кислотой, которая включает нуклеотидную последовательность, которая, по меньшей мере, около 80 или 90% идентична с эталонной нуклеиновой кислотой. Такие условия могут рассматриваться как определяющие для специфической гибридизации.
Описанные выше условия гибридизации могут быть отрегулированы, или выбраны альтернативные условия гибридизации для достижения любого желательного уровня строгости для выбора гибридизированной последовательности нуклеиновых кислот. Например, вышеупомянутые высоко строгие условия гибридизации и отмывки могут быть постепенно увеличены (например, увеличением температуры, снижением концентрации соли, увеличением концентрация детергента и/или увеличением концентрации органических растворителей, таких как формалин, при гибридизации или отмывке), пока не совпадет выбранный набор критериев. Например, условия гибридизации и отмывки могут быть постепенно увеличены, пока желательный зонд не свяжется с совпадающей комплементарной мишенью, с отношением сигнал-шум, которое, по меньшей мере, около в 2,5 раза, и необязательно, по меньшей мере, около в 5 раз (например, около 10 раз, около 20 раз, около 50 раз, около 100 раз или даже около 500 раз), выше, чем отношение сигнал-шум, наблюдаемое при гибридизации зонда с нуклеиновой кислотой не по данному изобретению, такой как нуклеиновая кислота, кодирующая полипептид ДТ CTLA-4 ВКД.
Образование и модификация нуклеиновых кислот
Нуклеиновые кислоты по данному изобретению могут быть получены и/или образованы с применением любых приемлемых методик синтеза, манипуляции и/или выделения или их комбинаций. Иллюстративные процедуры описаны ниже. Например, полинуклеотиды по данному изобретению обычно получают стандартными методиками синтеза нуклеиновых кислот, такими как методики твердофазного синтеза, известные в данной области техники. В таких методиках фрагменты до около 100 оснований обычно синтезируются отдельно, затем объединяются (например, способами ферментного или химического лигирования или рекомбинантными способами, опосредованными полимеразой) для формирования по сути последовательности нуклеиновых кислот любой желаемой протяженности. Синтез нуклеиновых кислот по данному изобретению может быть также облегчен (или альтернативно осуществлен) химическим синтезом с применением, например, классического фосфорамидитного метода, который описан в, например, Beaucage et al. (1981) Tetrahedron Letters 22:1859-69, или способа, описанного в Matthes et al. (1984) EMBO J. 3:801-05, например, как он обычно практикуется в автоматизированных способах синтеза. Нуклеиновая кислота по данному изобретению также может быть получена с применением автоматического ДНК синтезатора. Другие методики для синтеза нуклеиновых кислот и связанные с ними принципы описаны в, например, Itakura et al., Annu. Rev. Biochem. 53:323 (1984), Itakura et al.. Science 198:1056 (1984), и Ike et al., Nucl. Acid Res. 11:477 (1983).
Традиционно, выполненные по заказу нуклеиновые кислоты могут быть получены из разнообразных коммерческих источников, таких как Midland Certified Reagent Company (mcrc@olygos.com). Great American Gene Company (всемирный веб-сайт address genco.com), ExpressGen Inc. (адрес всемирного веб-сайта expressgen.com), Operon Technologies Inc. (Alameda, CA). Подобно этому выполненные по заказу пептиды и антитела могут быть получены от любого из многочисленных источников, например, PeptidoGenic (pkim@ccnet.com), HTI Bio-products, Inc. (адрес всемирного веб-сайта htibio.com), и ВМА Biomedicals Ltd. (U.K.), Bio.Synthesys, Inc.
Определенные нуклеотиды по данному изобретению могут также быть получены путем скрининга кДНК библиотек с применением олигонуклеотидных меток, которые могут гибридизироваться с или ПЦР-амплифицировать полинуклеотиды, которые кодируют полипептиды по данному изобретению. Процедуры скрининга и выделения кДНК клонов и процедуры ПЦР амплификации хорошо известны специалистам в данной области; иллюстративные процедуры описаны ниже (смотри, например, процедуры, описанные в примерах ниже). Такие методики описаны в, например, Berger и Kimmel, "Guide to Molecular Cloning Techniques," в Methods in Enzymol. Vol.152, Acad. Press, Inc., San Diego, CA ("Berger"); Sambrook, смотри выше; и Ausubel, смотри выше. Некоторые нуклеиновые кислоты по данному изобретению могут быть получены изменением встречающегося в природе скелета, например, с помощью мутагенеза, in vitro рекомбинации (например, перетасовки), или олигонуклеотидной рекомбинацией. В других случаях такие полинуклеотиды могут быть получены in silico (компьютерным моделированием) или посредством способов олигонуклеотидной рекомбинации, как описано в ссылках, процитированных в данном описании.
Методики рекомбинантной ДНК, пригодные для модификации нуклеиновых кислот, хорошо известны в данной области техники (например, рестрикционное эндонуклеазное расщепление, лигирование, обратная транскрипция и кДНК продукция, и ПЦР). Пригодные методики рекомбинантной ДНК технологии и принципы, относящиеся к ним описаны в, например, Mulligan (1993) Science 260:926-932, Friedman (1991) THERAPY FOR GENETIC DISEASES, Oxford University Press, Ibanez et al. (1991) EMBO J. 10:2105-10, Ibanez et al. (1992) Cell 69:329-41 (1992), и Патентах США №4440859, 4530901, 4582800, 4677063, 4678751, 4704362, 4710463, 4757006, 4766075 и 4810648, и более конкретно описаны в Sambrook et al. (1989) MOLECULAR CLONING: A LABORATORY MANUAL, Cold Spring Harbor Press, and the third edition thereof (2001), Ausubel et al. (1994-1999), Current Protocols in Molecular Biology, Wiley Interscience Publishers (with Greene Publishing Associates for some editions), Berger, смотри выше, и Watson, смотри выше.
Модифицированные кодирующие последовательности
Когда это необходимо, нуклеиновые кислоты по данному изобретению могут быть модифицированы для повышения или усиления экспрессии в конкретном хозяине путем модификации последовательности в свете использования кодона и/или контекста кодона, данного конкретного хозяина(ов), в котором экспрессия нуклеиновой кислоты является желательной. Кодоны, которые используются наиболее часто в конкретном хозяине, называются оптимальные кодоны, а те, что не используются очень часто, классифицируются как редко или слабо-используемые кодоны (смотри, например, Zhang, S. P. et al. (1991) Gene 105:61-72). Кодоны могут быть замещены, чтобы отражать предпочтительные кодоны, используемые хозяином, процесс называется "оптимизация кодона" или "контроль за характерным для организма статистическим отклонением от равномерности в использовании кодонов".
Оптимизированная кодирующая последовательность, включающая кодоны, предпочтительные для конкретного прокариотического или эукариотического хозяина, может быть использована для увеличения скорости трансляции или для продукции рекомбинантных РНК транскриптов, имеющих желательные свойства, такие как увеличенное время полужизни, по сравнению с транскриптами, полученными из неоптимизированной последовательности. Методики для получения кодон-оптимизированных последовательностей являются известными (смотри, например, Murray, E. et al. (1989) Nucl. Acids Res. 17:477-508). Трансляционные стоп-кодоны могут также модифицироваться, чтобы отражать предпочтение хозяина. Например, предпочтительные стоп-кодоны для S. cerevisiae и млекопитающих - это UAA и UGA соответственно. Предпочтительный стоп-кодон для однодольных растений - это UGA, тогда как насекомые и E. coli предпочитают применение UAA в качестве стоп-кодона (смотри, например, Dalphin, М. E. et al. (1996) Nucl. Acids Res. 24:216-218, для обсуждения). Расположение кодонов по отношению к другим кодонам также может влиять на биологические свойства последовательности нуклеиновых кислот, и модификации нуклеиновых кислот для обеспечения расположения контекста кодона, характерного для конкретного хозяина также предусматривается изобретателями. Таким образом, последовательность нуклеиновой кислоты по данному изобретению может включать нуклеотидную последовательность с оптимизированными кодонами, а именно, часто используемым оптимизированным кодоном и/или кодоновой парой (а именно, контекстом кодона), оптимизированной для конкретных видов (например, полипептид может экспрессироваться из полинуклеотидной последовательности, оптимизированной для экспрессии в людях путем замещения "редких" человеческих кодонов на основании частоты использования кодона или контекста кодона, например, с применением методик, таких как те, что описаны в Buckingham et al. (1994) Biochimie 76(5):351-54 и Патентах США №5082767, 5786464 и 6114148). Например, изобретение обеспечивает нуклеиновую кислоту, включающую вариант нуклеотидной последовательности SEQ ID NO:80, где вариант нуклеотидной последовательности отличается от нуклеотидной последовательности SEQ ID NO:80 на замену "редких" кодонов для конкретного хозяина на кодоны, обычно экспрессирующиеся в хозяине, где кодоны кодируют тот же аминокислотный остаток, что и замещенные "редкие" кодоны в SEQ ID NO:80.
ВЕКТОРЫ, ВЕКТОРНЫЕ КОМПОНЕНТЫ И СИСТЕМЫ ЭКСПРЕССИИ
Данное изобретение также включает рекомбинантные конструкты, включающие одну или несколько нуклеиновых кислот по данному изобретению, как широко описано выше. Такие конструкты могут включать вектор, такой как плазмида, космида, фаг, вирус, вирусная частица, вирусоподобная частица, бактериальная синтетическая хромосома (БСХ), дрожжевая синтетическая хромосома (ДСХ) или подобное, или нерепликативный вектор, такой как липосома, оголенная или конъюгированная ДНК, ДНК-микрочастицы, в которые встроена, по меньшей мере, одна последовательность нуклеиновой кислоты по данному изобретению, в прямой или обратной ориентации. В конкретном аспекте данного варианта осуществления конструкт также включает одну или несколько регуляторных последовательностей, включая, например, промотор, функционально связанный с последовательностью нуклеиновой кислоты по данному изобретению (например, нуклеиновая кислота, кодирующая изолированный или рекомбинантный мутантный полипептид CTLA-4 ВКД или димерный или мономерный мутантный CTLA-4-Ig). Большое число приемлемых векторов и промоторов известно специалистам в данной области и является коммерчески доступным. В некоторых случаях вектор, такой как, например, вирус или вирусоподобная частица, может так же или альтернативно включать один или несколько полипептидов по данному изобретению, такие как, например, встроенные в оболочку вируса или вирусоподобной частицы. Векторы могут быть пригодны в качестве агентов доставки для доставки или введения субъекту экзогенных генов или белков. Векторы по данному изобретению, включая те, что описаны здесь, пригодны как агенты доставки для доставки или введения нуклеиновых кислот и/или полипептидов по данному изобретению.
Общие статьи, описывающие молекулярные биологические методики, пригодные в данном описании, включая применение векторов, промоторов и многие другие связанные темы, включают Berger, смотри выше, Sambrook (1989), смотри выше и Ausubel, смотри выше. Примеры методик, достаточных для руководства специалиста в данной области касательно способов in vitro амплификации, включая следующие: полимеразная цепная реакция (ПЦР) лигазная цепная реакция (LCR), QΞ-репликазная амплификация и другие РНК полимеразные опосредованные методики (например, NASBA), например, для продукции гомологичных нуклеиновых кислот по данному изобретению, можно найти в Berger, Sambrook и Ausubel, все смотри выше, а также Mullis et al. (1987) Патент США №4683202; ПЦР Протоколы: Guide to Methods and Applications (Innis et al., eds.) Academic Press Inc. San Diego, CA (1990) ("Innis"); Amheim & Levinson (October 1, 1990) C&EN 36-47; Journal OfNIH Research (1991) 3:81-94; (Kwoh et al. (1989) Proc. Natl. Acad. Sci. USA 86:1173- 1177; Guatelli et al. (1990) Proc. Natl. Acad. Sci. USA 87:1874-1878; Lomeli et al. (1989) J. Clin. Chem. 35:1826-1831; Landegren et al. (1988) Science 241:1077-1080; Van Brunt (1990) Biotechnology 8:291-294; Wu и Wallace (1989) Gene 4:560-569; Barringer et al. (1990) ген 89: 117-122, и Sooknanan и Malek (1995) Biotechnology 13:563-564.
ПЦР в общем относится к процедуре, где точные количества специфической части нуклеиновой кислоты (например, РНК или ДНК) амплифицируют способами, хорошо известными в данной области техники (смотри, например. Патент США №4683195 и другие ссылки, процитированные выше). В общем, информация о последовательности с концов области, представляющей интерес, или вне этой области используется для конструирования олигонуклеотидных праймеров. Такие праймеры будут идентичны или сходны с последовательностью противоположных цепей матрицы, которую нужно амплифицировать. 5' терминальные нуклеотиды противоположных цепей могут совпадать с концами амплифицированного материала. ПЦР может использоваться для амплификации специфических РНК или специфических ДНК последовательностей, рекомбинантных ДНК или РНК последовательностей, ДНК и РНК последовательностей из общих геномных ДНК, и кДНК, транскрибируемых из общих клеточных РНК, бактериофаговых или плазмидных последовательностей и т.п. ПЦР - это один пример, но не только пример, способа полимеразной реакции нуклеиновой кислоты для амплифицирования исследуемого образца нуклеиновой кислоты, включающий применение другой (например, известной) нуклеиновой кислоты в качестве праймера. Улучшенные способы клонирования in vitro амплифицированных нуклеиновых кислот описаны в Wallace et al., Патент США №5426039. Улучшенные способы амплификации больших нуклеиновых кислот с помощью ПЦР подытожены в Cheng et al. (1994) Nature 369:684 685 и ссылках, процитированных в них, где образуются ПЦР ампликоны до 40 тысяч пар нуклеотидов (kb). Специалисту в данной области должно быть понятно, что по сути любая РНК может быть превращена в двухцепочечную ДНК, приемлемую для обработки ферментами рестрикции, продолжения ПЦР и секвенирования с применением обратной транскриптазы и полимеразы. Смотри Ausubel, Sambrook, и Berger, все смотри выше.
Нуклеиновые кислоты по данному изобретению могут быть встроены в любой один из разнообразных векторов, например, векторы экспрессии, для экспрессирующихся полипептидов, включая, например, полипептид по данному изобретению. Могут использоваться векторы экспрессии, совместимые с клетками прокариотического хозяина; такие прокариотические векторы экспрессии известны в области техники и коммерчески доступны. Такие векторы включают, но не ограничивается следующим, например, BLUESCRIPT вектор (Stratagene), T7 вектор экспрессии (Invitrogen), pET вектор (Novagen) и сходные прокариотические векторы.
Альтернативно могут использоваться векторы экспрессии, совместимые с клетками эукариотического хозяина; такие эукариотические векторы экспрессии известны в области техники и коммерчески доступны. Такие векторы включают, но не ограничивается следующим, например, pCMV векторы (например, Invitrogen), pIRES вектор (Clontech), pSG5 вектор (Stratagene), pCDNA3,l (Invitrogen Life Technologies), pCDNA3 (Invitrogen Life Technologies), Ubiquitous Chromatin Opening Element (UCOE™) вектор экспрессии (Millipore) и сходные эукариотические векторы экспрессии. UCOE™ вектор обычно используется для продукции белка в клетках млекопитающего (например, СНО клетках). Согласно Millipore, технология UCOE™ экспрессии затрудняет трансгенный сайленсинг и обеспечивает стабильную генную экспрессию высокого уровня, не привязываясь к месту хромосомной интеграции. Смотри Millipore веб-сайт по всемирному адресу millipore.com. Иллюстративный UCOE вектор экспрессии, в который, например, нуклеиновая кислота по данному изобретению может быть встроена, представляет собой UCOE вектор экспрессии, названный CET1019AS-puro-SceI, который доступен по лицензии от Millipore. Информацию касательно UCOE вектора экспрессии CET1019AS-puro-SceI можно найти в, например, John Wynne, "UCOE™ Technology Maximizes Protein Expression", BioProcess Internatonal 4(7): 104-105 (Июль/Август 2006) (RP1725ENOO) (доступной по всемирному веб-адресу millipore.com/bibliography/tech1/rp1725en00); дополнительная информация касательно этого вектора и лицензирования этого вектора от Millipore доступна на веб-сайте Millipore, включая, например, по веб-адресу millipore.com/company/cp3/ucoe_licensing и millipore.com/techpublications/tech1/ps1013en00. Таким образом, например, ДНК последовательность, кодирующая мутантный CTLA-4 ВКД (например, SEQ ID NO:36 или SEQ ID NO:50), слитая с ДНК последовательностью, кодирующей IgG2 Fc полипептид (например, SEQ ID NO:184), дающая в результате ДНК последовательность SEQ ID NO:201, встраивается в UCOE CET1019AS вектор (Millipore) и полученная ДНК плазмида может быть использована для трансфекций клеток хозяина.
Векторы экспрессии включают хромосомные, нехромосомные и синтетические ДНК последовательности, например, производные SV40, бактериальные векторы (например, S. typhimurium, S. typhi, S. flexneri, Listeria monocytogenes, B. anthracis); плазмиды; бактериальные плазмиды; фаговые ДНК; бакуловирус; дрожжевые плазмиды; векторы, производные от комбинаций плазмид и фаговых ДНК; вирусные ДНК или РНК векторы, включая, например, вирус вакцины, аденоассоциированный вирус (AAV), аденовирус, Semliki-Forest вирус (например, Notka et al., Biol. Chem. 380:341-52 (1999), поксивирус (например, MVA), альфавирус (например, вирус венесуэльского энцефаломиелита лошадей (VEE), вирус западного энцефаломиелита лошадей (WEE), вирус восточного энцефаломиелита лошадей (ЕЕЕ)), вирус везикулярного стоматита (ВВС, или VSV), fowlpox вирус, ложное бешенство, вирусы простого герпеса, ретровирусы и многие другие. Любой вектор, который переносит генетический материал в клетку и, если необходима репликация, который является репликативным и жизнеспособным в соответствующем хозяине, может быть использован. Вирусные и бактериальные векторы, служащие в качестве носителей для доставки, могут быть ослабленными; ослабление должно быть достаточным, чтобы снизить, если не элиминировать, индукцию нежелательных симптомов заболевания. Фигура 1 представляет собой схематическое изображение иллюстративного плазмидного вектора экспрессии рКДНК мутантного CTLA-4-Ig, который кодирует мутантный CTLA-4-Ig по данному изобретению. Дополнительные детали касательно приемлемых векторов экспрессии обеспечены ниже, включая примеры.
Вектор по данному изобретению, включающий последовательность нуклеиновой кислоты по данному изобретению, как описано здесь, а также приемлемый промотор или контрольную последовательность, могут использоваться для трансформации приемлемого хозяина, с тем, чтобы позволить хозяину экспрессировать белок. Примеры приемлемых хозяев экспрессии включают: бактериальные клетки, такие как Е. coli, Streptomyces и Salmonella typhimurium; грибковые клетки, такие как Saccharomyces cerevisiae, Pichiapastoris и Neurospora crassa; клетки насекомого, такие как Drosophila и Spodoptera frugiperda; клетки млекопитающего, такие как яичник китайского хомяка (Chinese Hamster Ovary, или СНО) (например, СНО-K1), COS (например, COS-I, COS-7), почка детеныша хомяка (ПДХ, или ВНК), и клетки почки человеческого эмбриона (ПЧЭ, или НЕК) (например, HEK 293), клетки меланомы Bowes и клетки растения. Понятно, что не все клетки или клеточные линии должны быть способными производить полно функциональные полипептиды по данному изобретению или их фрагменты. Изобретение не ограничивается используемыми клетками-хозяинами. Дополнительные детали в отношении приемлемых клеток-хозяев изложены ниже.
В бактериальных системах различные векторы экспрессии могут быть выбраны в зависимости от подразумеваемого применения для желаемого полипептида или его фрагмента. Например, когда большие количества конкретного полипептида или его фрагментов необходимо для индукции антител, могут быть желательными векторы, которые направляют высокий уровень экспрессии слитых белков, которые к этому моменты очищены. Такие векторы включают, но не ограничивается следующим, многофункциональные Е. coli клонирующие векторы и векторы экспрессии, такие как BLUESCRIPT (Stratagene), в которых последовательность, кодирующая нуклеотид, представляющая интерес (например, нуклеотидная последовательность, кодирующая рекомбинантный мутантный CTLA-4-Ig), может быть лигирована в вектор внутри рамки считывания с последовательностями для амино-терминального Met и последующими 7 остатками бета-галактозидазы, так чтобы получить гибридный белок; pIN векторы (Van Heeke & Schuster (1989) J. Biol. Chem. 264:5503-5509); pET векторы (Novagen, Madison WI); и подобное.
Сходным образом в дрожжах Saccharomyces cerevisiae различные векторы, включающие конститутивный или индуцибельные промоторы, такие как альфа-фактор, алкогольоксидаза и PGH, могут быть использованы для продукции полипептидов по данному изобретению. Для обзоров, смотри Ausubel, смотри выше, Berger, смотри выше, и Grant et al. (1987) Meth. Enzymol. 153:516-544.
В клетках-хозяинах млекопитающего могут использоваться различные системы экспрессии, такие как системы на основе вирусов. В случаях, когда используется аденовирус как вектор экспрессии, кодирующая последовательность необязательно лигирована в комплекс адановирусная транскрипция/трансляция, состоящий из позднего промотора и тройной лидерной последовательности. Вставка в несмысловую Е1 или Е3 область вирусного генома приводит к жизнеспособному вирусу, способному экспрессировать полипептид, представляющий интерес, в инфицированных клетках-хозяинах (Logan и Shenk (1984) Proc. Natl. Acad. Sci. USA 81:3655-3659). Кроме того, энхансеры транскрипции, такие как энхансер вируса саркомы Роуса (ВСР, или RSV), используются для усиления экспрессии в клетках-хозяинах млекопитающего.
Вектор, например вектор экспрессии, или полинуклеотид по данному изобретению может включать один или несколько последовательностей контроля экспрессии. Последовательность контроля экспрессии обычно связана с и/или функционально связана с последовательностью нуклеиновой кислоты по данному изобретению, такой как нуклеиновая кислота, кодирующая рекомбинантный мутантный полипептид CTLA-4 ВКД или рекомбинантный мутантный слитый белок CTLA-4-Ig. Последовательность контроля экспрессии - это обычно нуклеотидная последовательность, которая вызывает, усиливает или контролирует экспрессию (типично транскрипцию) другой нуклеотидной последовательности. Приемлемые последовательности контроля экспрессии, которые могут быть использованы, включают промотор, включая конститутивный промотор, индуцибельный промотор и/или репрессируемый промотор, энхансер для амплификации экспрессии, инициирующую последовательность, терминирующую трансляцию последовательность, последовательности контроля сплайсинга и подобное.
Когда нуклеиновая кислота по данному изобретению включена в вектор, то нуклеиновая кислота обычно функционально связана с приемлемой последовательностью контроля транскрипции (промотор) для направления мРНК синтеза. Промоторы проявляют особенно важное влияние на уровень экспрессии рекомбинантного полипептида. Может использоваться любой приемлемый промотор. Примеры приемлемых промоторов включают промотор цитомегаловируса (CMV) с или без первого интрона (интрона А), ВИЧ длинный терминальный повторяющийся промотор, промотор фосфоглицерат киназы (ФГК, или PGK), промоторы вируса Саркома Роуса (ВСР, или RSV), такие как RSV длинные терминальные повторяющиеся (LTR) промоторы, SV40 промоторы, промоторы вируса опухоли молочной железы мышей (ВОМЖМ, или MMTV), промоторы ВПГ(вирус простого герпеса), такие как Lap2 промотор или промотор тимидин киназы герпеса (как описано в, например, Wagner et al. (1981) Proc. Natl. Acad. Sci. 78:144-145), промоторы, производные SV40 и вируса Эпштейна-Барра, промоторы аденоассоциированного вируса (AAV), такие как р5 промотор, металлотиониновые промоторы (например, металлотиониновый промотор овцы или металлотиониновый промотор мыши (смотри, например, Palmiter et al. (1983) Science 222:809-814), промотор человеческого убиквитина С, промоторы Е. coli, такие как lac и trp промоторы, промотор фага лямбда PL, и другие промоторы, известные для контроля экспрессии генов в прокариотических или эукариотических клетках (или непосредственно в клетке, или в вирусах, которые инфицировали клетку). Промоторы, которые проявляют сильную конститутивную фоновую экспрессию у млекопитающих, особенно у людей, такие как CMV промоторы, такие как CMV немедленно-ранний промотор (описанный в, например, Патентах США №5168062, 5385839, 5688688 и 5658759), и промоторы, имеющие существенную идентичность последовательности с такими CMV промоторы, могут быть использованы. Рекомбинантные промоторы, имеющие усиливающие свойства, такие как в Публикации Международной Заявки WO 02/00897, могут также использоваться.
Промотор, который функционально связан с нуклеиновой кислотой по данному изобретению для экспрессии нуклеиновой кислоты, может иметь любой приемлемый механизм действия. Таким образом, промотор может быть, например, следующим: "индуцибельный" промотор (например, промотор гормона роста, металлотиониновый промотор, промотор белков теплового шока, Е1В промотор, промотор, вызывающий гипоксию, промотор, индуцируемый облучением или аденовирусный MLP промотор и тройной лидер), индуцибельный-репрессируемый промотор, развивающийся поэтапно промотор (например, промотор гена глобина), или тканеспецифический промотор (например, промотор α-актина клетки гладкой мускулатуры, промотор IA легкой цепи миозина, или промотор кадхерина сосудистого эндотелия). Приемлемые индуцибельные промоторы включают экдизон и экдизоновый аналог-индуцибельные промоторы. Экдизоновый аналог-индуцибельные промоторы являются коммерчески доступными, например, от Stratagene (La Jolla, CA). При необходимости, нуклеиновая кислота по данному изобретению может быть индуцирована с применением индуцибельной системы экспрессии с переключением генов. Примеры таких систем экспрессии с переключением генов включают Tet-On™ Система Генной Экспрессии и Tet-Off™ Система Генной Экспрессии, соответственно (Clontech, Palo Alto, CA; смотри, например, Clontech Catalog 2000, pg. 110-111 для детального описания каждой такой системы). Индуцибельный промотор может быть любым промотором, который активируется и/или деактивируется в ответ на приемлемый сигнал. Дополнительные индуцибельные промоторы включают арабиноза-индуцибельные промоторы, стероид-индуцибельные промоторы (например, глюкокортикоид-индуцибельные промоторы), а также рН, стресс и тепло-индуцибельные промоторы.
Промотор может быть и зачастую является нативным для хозяина, или промотор происходит из вируса, который инфицирует конкретного хозяина (например, промотор человеческого бета актина, промотор человеческого EF1α или промотор, производный от человеческого AAV, функционально связанный с нуклеиновой кислотой, представляющей интерес), особенно когда необходимо строгое предотвращение сайленсинга генной экспрессии из-за иммунологических реакций хозяина на последовательности, которые не постоянно присутствуют в хозяине. Может также использоваться двунаправленная промоторная система (как описано в, например. Патенте США №5017478), связанная с многочисленными нуклеотидными последовательностями, представляющими интерес.
Другие приемлемые промоторы и принципы, относящиеся к отбору, применению и конструкции приемлемых промоторов представлены в, например, Wemer (1999) Mamm Genome 10(2): 168-75, Walther et al. (1996) J. Mol. Med. 74(7):379-92, Novina (1996) Trends Genet. 12(9):351-55, Hart (1996) Semin. Oncol. 23(1):154-58, Gralla (1996) Curr. Opin. Genet. Dev. 6(5):526-30, Fassler et al. (1996) Methods Enzymol 273:3-29, Ayoubi et al. (1996), 10(4) FASEB J 10(4):453-60, Goldsteine et al. (1995) Biotechnol. Annu. Rev. 1:105-28, Azizkhan et al. (1993) Crit. Rev. Eukaryot. Gene Expr. 3(4):229-54, Dynan (1989) Cell 58(1): 1-4, Levine (1989) Cell 59(3):405-8, and Berk et al. (1986) Annu. Rev. Genet. 20:45-79, а также Патенте США №6194191. Другие приемлемые промоторы могут быть идентифицированы с применением Базы Данных Эукариотических Промоторов (публикация 68) (доступной на всемирном веб-сайте epd.isb-sib.ch/) и других сходных баз данных, таких как База Данных Регуляторных Участков Транскрипции (TRRD) (версия 4.1) (доступной на всемирном веб-сайте по адресу bionet.nsc.ru/trrd/) и База Данных Факторов Транскрипции (TRANSFAC) (доступной на всемирном веб-сайте по адресу transfac.gbf.de/TRANSFAC/index.html).
В качестве альтернативы промотору, особенно в РНК векторах и конструктах, вектор или нуклеиновая кислота по данному изобретению может включать один или несколько внутренних сайтов посадки рибосом (IRES), IRES-кодирующие последовательности или энхансеры РНК последовательности (аналоги консенсусной последовательности Козак), такие как лидерная последовательность вируса табачной мазайки.
Вектор или полинуклеотид по данному изобретению может включать активирующую последовательность (UAS), такую как Gal4 активаторная последовательность (смотри, например, Патент США 6133028) или другая приемлемая верхняя регуляторная последовательность (смотри, например, Патент США №6204060).
Вектор или полинуклеотид по данному изобретению может включать консенсусную последовательность Козак, которая является функциональной в клетке млекопитающего. Последовательность Козак может быть встречающейся в природе или модифицированной последовательностью, такой как модифицированные консенсусные последовательности Козак, описанные в Патенте США №6107477.
Специфические инициирующие сигналы могут способствовать эффективности трансляции кодирующей последовательности по данному изобретению, такой как нуклеотидная последовательность, кодирующая мутантный полипептид CTLA-4 ВКД. Такие сигналы могут быть включены в вектор по данному изобретению. Эти сигналы могут включать, например, ATG инициирующий кодон и смежные последовательности. В случаях, когда кодирующая последовательность, ее инициирующий кодон и верхние последовательности вставлены в приемлемый вектор экспрессии, нет необходимости в дополнительных контрольных транскрипционных сигналах. Тем не менее в случаях, когда вставлена только кодирующая последовательность (например, последовательность, кодирующая зрелый белок) или ее часть, должны обеспечиваться экзогенные сигналы контроля транскрипции нуклеиновой кислоты, включая ATG инициирующий кодон. Более того, инициирующий кодон должен быть в правильной рамке считывания для обеспечения транскрипции полной вставки. Экзогенные транскрипционные элементы и инициирующие кодоны могут быть различного происхождения - как естественного, так и синтетического. Эффективность экспрессии может быть увеличена путем включения энхансеров, приемлемых для клеточной системы, которая применяется (смотри, например, Scharf et al., Results Probl. Cell. Differ. 20:125-62 (1994); и Bittner et al., Meth. Enzymol. 153:516-544 (1987)). Приемлемые энхансеры включают энхансер вируса саркомы Роуса (ВСР, или RSV) и RTE энхансеры, описанные в Патенте США №6225082.
Специалисту в данной области должно быть понятно, что встраивание старт-кодона (ATG) на 5' конце конкретной нуклеотидной последовательности, представляющей интерес, обычно приводит к дополнению N-терминального метионина к кодируемой аминокислотной последовательности, когда последовательность экспрессируется в клетке млекопитающего (другие модификации могут происходить в бактериальных и/или других эукариотических клетках, такие как встраивание формил-остатка метионина на старт-кодон). Для экспрессии нуклеиновой кислоты по данному изобретению в эукариотических клетках старт-кодон и нуклеотидную последовательность, кодирующую сигнальный пептид, обычно включают на 5' конце последовательности нуклеиновой кислоты по данному изобретению (например, SEQ ID NO:80) и терминирующий кодон обычно включают на С-конце нуклеиновой кислоты (например, SEQ ID NO:80). Иллюстративная последовательность сигнального пептида представляет собой последовательность сигнального пептида hCTLA-4 (SEQ ID NO:182); последовательность нуклеиновых кислот, кодирующая сигнальный пептид активатора тканевого плазминогена показана в SEQ ID NO:181. Другая иллюстративная последовательность сигнального пептида представляет собой последовательность сигнального пептида hCTLA-4 (SEQ ID NO:216), которая кодируется последовательностью нуклеиновых кислот, представленной в SEQ ID NO:215.
Терминирующие последовательности обсуждаются в деталях ниже.
Такие элементы могут быть включены в векторный конструкт, который выбирают для использования. При экспрессии полипептидный вариант, кодируемый нуклеиновой кислотой (например, SEQ ID NO:80), будет изначально включать N-терминальный остаток метионина и последовательность сигнального пептида. Тем не менее N-терминальный метионин и последовательность сигнального пептида будут отщепляться при секреции, тем самым образуя кодируемый полипептид (например, SEQ ID NO:1).
Уровень экспрессии нуклеиновой кислоты по данному изобретению (или соответствующего полипептида по данному изобретению) может быть оценен с помощью любой приемлемой методики. Примеры включают нозерн-блот анализ (обсуждаемый в, например, McMaster et al., Proc. Natl. Acad. Sci. USA 74(11):4835-38 (1977) и Sambrook, смотри ниже), обратная транскриптаза-полимеразная цепная реакция (ОТ-ПЦР) (как описано в, например, Патенте США №5601820 и Zaheer et al., Neurochem. Res. 20:1457-63 (1995)), и in situ методики гибридизации (как описано в, например. Патентах США №5750340 и 5506098). Количественное определение белков также может осуществляться путем анализа Lowry и других количественных анализов белка (смотри, например, Bradford, Anal. Biochem. 72:248-254 (1976); Lowry et al., J. Biol. Chem. 193:265 (1951)). Вестерн-блот анализ рекомбинантных полипептидов по данному изобретению, полученных из лизата клеток, трансфектированных с полинуклеотидами, кодирующими такие рекомбинантные полипептиды, - это другая приемлемая методика для оценки уровней экспрессии рекомбинантного полипептида.
Вектор, например вектор экспрессии, или полинуклеотид по данному изобретению может включать сайт связывания с рибосомой для трансляции инициирующей и терминирующей транскрипцию области. Приемлемая терминирующая транскрипцию область представляет собой, например, последовательность полиаденилирования, которая облегчает отщепление и полиаденилирование РНК транскрипта, полученного из ДНК последовательности. Может быть использована любая приемлемая последовательность полиаденилирования, включая синтетическую оптимизированную последовательность, а также последовательность полиаденилирования БГР (бычьего гормона роста), гена человеческого гормона роста, вируса полиомы, ТК (тимидинкиназа), EBV (вирус Эпштейна-Барра), бета глобин кролика, и папилломавирусы, включая человеческие папилломавирусы и BPV (бычий вирус папилломы). Приемлемые последовательности полиаденилирования (полиА) также включают SV40 (человеческий вирус саркомы-40) последовательность полиаденилирования и БГР полиА последовательность. Такие полиА последовательности описаны в, например, Goodwin et al. (1998) Nucleic Acids Res. 26(12):2891-8, Schek et al. (1992) Mol. Cell. Biol. 12(12):5386-93, и van den Hoffet al. (1993) Nucleic Acids. 21(21):4987-8. Дополнительные принципы, относящиеся к выбору приемлемых последовательностей полиаденилирования, описаны в, например, Levitt et al. (1989) Genes Dev. 1989 3(7): 1019-1025, Jacob et al. (1990) Crit. Rev. Eukaryot. Gene Expr. 1(1):49-59, Chen et al. (1995) Nucleic Acids Res. 23(14):2614-2620, Moreira et al. (1995) EMBO J. 14(15):3809-3819, Carswell et al. (1989) Mol. Cell. Biol. 9(10):4248-4258.
Вектор или полинуклеотид по данному изобретению может также включать сайт-специфические сайты рекомбинации, которые могут быть использованы, чтобы модулировать транскрипцию нуклеотидной последовательности, представляющей интерес, как описано в, например, Патентах США №4959317, 5801030 и 6063627, Заявке на Европейский патент №0987326 и Публикации Международной Заявки № WO 97/09439.
Вектор или полинуклеотид по данному изобретению может также включать нуклеиновую кислоту, кодирующую последовательность секреции/локализации для направления полипептидной экспрессии к желаемому клеточному компартменту, мембране или органелле или для направления полипептидной секреции в периплазматичекому пространству или в среды клеточных культур. Такие последовательности известны в области техники и включают лидерные пептиды секреции или сигнальные пептиды, направляющие последовательности органелл (например, ядерные последовательности локализации, сигналы удержания ЭР (эндоплазматический ретикулум), митохондриальные переходные последовательности, хлоропластные переходные последовательности), мембранные последовательности локализация/якорные последовательности (например, стоп переносные последовательности, GPI якорные последовательности) и подобное. Полинуклеотиды по данному изобретению могут быть слитыми, например, внутри рамки считывания с такой нуклеиновой кислотой, кодирующей последовательность секреции и/или локализации. Полипептиды, экспрессирующиеся такими полинуклеотидами по данному изобретению, могут включать аминокислотную последовательность, соответствующую последовательности(ям) секреции и/или локализации.
Кроме того, вектор или полинуклеотид по данному изобретению может включать один или несколько селектируемых маркерных нуклеотидных последовательностей или генов для обеспечения фенотипического признака для отбора трансформированных клеток-хозяев, такого как устойчивость к дигидрофолат редуктазе, устойчивость к неомицину, устойчивость к G418, устойчивость к пиромицину и/или устойчивость к бластицидину культуры эукариотических клеток или такого как устойчивость Е. Coli к тетрациклину или ампициллину.
Вектор или полинуклеотид по данному изобретению может также включать источник репликации, пригодный для внедрения в микроорганизм. Используемый бактериальный источник репликации (Ori) является преимущественно тем, который не имеет обратного действия на генную экспрессию в клетках млекопитающего. Примеры пригодных последовательностей источника репликации включают f1 фаговый ori, RK2 oriV, pUC ori и pSC1O1 ori. Последовательности источника репликации включают CoIEI ori и p15 (доступный от Plasmid pACYC1W, New England Biolab, Inc.), альтернативно другая слабо скопированная ori последовательность (сходная с p15) может быть желательной в некоторых случаях. Нуклеиновая кислота в этом случае желательно действует как перетасованный вектор, способный реплицировать и/или экспрессироваться как в эукариотических, так и прокариотических хозяйках (например, вектор, включающий последовательности источника репликации, распознающийся как в эукариотах, так и прокариотах).
Данное изобретение включает оголенный ДНК или РНК вектор, включая, например, линейный элемент экспрессии (как описано в, например, Sykes и Johnston (1997) Nat Biotech 17:355-59), компактизированный вектор нуклеиновой кислоты (как описано в, например, Патенте США №6077835 и/или Публикации Международной Заявки № WO 00/70087), плазмидный вектор, такой как pCDNA3,1, pBR322, pUC 19/18, или pUC 118/119, вектор "мошка" нуклеиновой кислоты минимального размера (как описано в, например, Schakowski et al. (2001) Mol. Ther. 3:793-800) или как преципитированный конструкт вектора нуклеиновой кислоты, такой как СаР04 преципитированный конструкт (как описано в, например. Публикации Международной Заявки WO 00/46147, Benvenisty и Reshef (1986) Proc. Natl. Acad. Sci. USA 83:9551-55, Wigler et al. (1978), Cell 14:725, и Coraro и Pearson (1981) Somatic Cell Genetics 7:603), включающие нуклеиновую кислоту по данному изобретению. Например, изобретение обеспечивает оголенную ДНК плазмиду, включающую SEQ ID NO:80, функционально связанную с CMV промотором или вариантом CMV промотором и приемлемую последовательность полиаденилирования. Оголенные нуклеотидные векторы и их применение известны в области техники (смотри, например, Патенты США №5589466 и 5973972).
Вектор по данному изобретению обычно представляет собой вектор экспрессии, который является приемлемым для экспрессии в бактериальной системе, эукариотической системе, системе млекопитающего или другой системе (что является противоположным вектору, сконструированному для реплицирования последовательности нуклеиновой кислоты без экспрессии, который можно назвать как клонирующий вектор). Например, в одном аспекте изобретение обеспечивает бактериальный вектор экспрессии, включающий последовательность нуклеиновой кислоты по данному изобретению (например, последовательность нуклеиновых кислот, кодирующую рекомбинантный мутантный CTLA-4-Ig). Приемлемые векторы включают, например, векторы, которые направляют экспрессию высокого уровня слитых белков, заранее очищенных (например, многофункциональные Е. coli клонирующие векторы и векторы экспрессии, такие как BLUESCRIPT (Stratagene), pIN векторы (Van Heeke & Schuster, J. Biol. Chem. 264:5503-5509 (1989); pET векторы (Novagen, Madison WI); и подобное). Тогда как такие бактериальные векторы экспрессии могут быть использованы в экспрессировании конкретных полипептидов по данному изобретению гликобелки по данному изобретению преимущественно экспрессируются в эукариотических клетках, и поэтому изобретение также обеспечивает эукариотические векторы экспрессии.
Вектор экспрессии может быть вектором, приемлемым для экспрессии нуклеиновой кислоты по данному изобретению в дрожжевой клетке. Любой вектор, приемлемый для экспрессии в дрожжевой системе, может быть использован. Приемлемые векторы для применения в, например, Saccharomyces cerevisiae включают, например, векторы, включающие конститутивные или индуцибельные промоторы, такие как альфа фактор, алкогольоскидаза и PGH (описанные в обзорах Ausubel, смотри выше, Berger, смотри выше и Grant et al., Meth. Enzymol. 153:516-544 (1987)). Обычно вектор экспрессии будет вектором, приемлемым для экспрессии нуклеиновой кислоты по данному изобретению в клетке животного, такой как клетка насекомого (например, SF-9 клетка) или клетка млекопитающего (например, СНО клетка, 293 клетка, HeLa клетка, человеческая фибробластная клетка или сходная хорошо описанная клетка). Приемлемые векторы экспрессии млекопитающего известны в области техники (смотри, например, Kaufman, Mol. Biotechnol. 16(2): 151-160 (2000), Van Craenenbroeck, Eur. J. Biochem. 267(18):5665-5678 (2000), Makrides, Protein Expr. Purif. 17(2):183-202 (1999), и Yarranton, Curr. Opin. Biotechnol. 3(5):506-511 (1992)). Приемлемые плазмидные векторы экспрессии клетки насекомого также известны (Braun, Biotechniques 26(6): 1038-1040: 1042 (1999)).
Векторы экспрессии обычно могут быть внедрены в клетку-хозяина, которая может быть эукариотической клеткой (такой, как клетка млекопитающего, дрожжевая клетка или клетка растения) или прокариотической клеткой, такой как бактериальная клетка. На встраивание вектора нуклеиновой кислоты или вектора экспрессии в клетку-хозяина (например, трансфекция) может влиять трансфекция, опосредованная форсатом кальция (смотри, например, способ совместного осаждения кальция фосфата Graham et al., Virology 52:456-457 (1973)), DEAE-Декстран опосредованная трансфекция, электропорация, генная или вакцинная пушка, инъекция, липофекция и биолистическая доставка или другие традиционные методики (смотри, например, Kriegler, GENE TRANSFER AND EXPRESSION: A LABORATORY MANUAL, Stockton Press (1990); смотри Davis, L, Dibner, M, and Battey, L, BASIC METHODS IN MOLECULAR BIOLOGY (1986) для описания in vivo, ex vivo и in vitro способов). Клетки, включающие эти и другие векторы по данному изобретению, являются важной частью изобретения.
В одном аспекте изобретение обеспечивает вектор экспрессии, включающий: (i) первую полинуклеотидную последовательность, которая кодирует первый полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, 96% 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где указанный первый полипептид связывает человеческий CD86 и/или человеческий CD80 и/или внеклеточный домен каждого или обоих и/или подавляет иммунный ответ и (ii) вторую полинуклеотидную последовательность, которая кодирует второй полипептид, включающий шарнирную область, СН2 домен и СН3 домен иммуноглобулинового (Ig) полипептида. Ig полипептид является необязательно человеческим Ig Fc полипептидом (например, IgG1, IgG2, IgG4 и т.п.) или мутантным Ig Fc полипептидом (например, полипептид Ig Fc, в котором один или несколько остатков цистеина замещены другой аминокислотой (например, остатком серина), тем самым убирая одну или несколько дисульфидных связей, образованных между двумя Ig цепями, или в котором один или несколько пролиновых остатка замещают другой аминокислотой (например, пролином) для снижения эффекторной функции (сниженное связывание Fc рецептора). В другом аспекте изобретение обеспечивает вектор экспрессии, включающий нуклеотидную последовательность, кодирующую слитый белок, имеющий, по меньшей мере, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222.
Дополнительные нуклеиновые кислоты, обеспеченные изобретением, включают космиды. Любой приемлемый космидный вектор может использоваться для репликации, переноса и экспрессии последовательности нуклеиновой кислоты по данному изобретению. Типично, космида включает бактериальный oriV, селектируемый маркер антибиотика, клонирующий сайт и либо один, либо два cos сайта, происходящих от бактериофага лямбда. Космида может быть перетасованной космидой или космидой млекопитающего, включающей SV40 oriV и, желательно, приемлемые маркер(ы) отбора млекопитающего. Космидные векторы также описаны в, например, Hohn et al. (1988) Biotechnology 10: 113-27.
Нуклеиновые кислоты по данному изобретению могут быть включены в и/или введены хозяину или клетке-хозяину в форме приемлемого носителя доставки (а именно, вектора). Вектором может быть любой приемлемый вектор, включая хромосомные, нехромосомные и векторы синтетических нуклеиновых кислот или другие векторы, описанные выше, и может включать любую комбинацию вышеописанных элементов экспрессии и/или других элементов последовательности, облегчающей трансфекцию и/или стимулирующей экспрессию. Примеры таких векторов включают вирусы, бактериальные плазмиды, фаги, космиды, фагемиды, производные SV40, бакуловирусные, дрожжевые плазмиды, векторы, происходящие от комбинаций плазмид и фаговой ДНК, и векторы вирусных нуклеиновых кислот (РНК или ДНК), полилизина и бактериальных клеток.
Доставка рекомбинантной ДНК последовательности по данному изобретению может быть осуществлена оголенной ДНК плазмидой или плазмидой, связанной с одним или несколькими агентами, облегчающими трансфекцию, что также обсуждается в данном описании. Плазмидный ДНК вектор может иметь любую приемлемую комбинацию характеристик. Плазмидные ДНК векторы могут включать сильную промоторную/энхансерную область (например, человеческий CMV, RSV, SV40, SL3-3, мМТV или ВИЧ LTR промотор), эффективную поли(А) терминирующую последовательность, источник репликации для плазмидного продукта в Е. coli, ген, устойчивый к антибиотикам в качестве селектируемого маркера, и пригодный клонирующий сайт (например, полилинкер). Конкретный плазмидный вектор для доставки нуклеиновой кислоты по данному изобретению в этом отношении показан на фигуре 1; конструкция и характеристики этого вектора описаны в Примерах ниже.
В другом аспекте изобретение обеспечивает вектор ненуклеиновой кислоты, включающий, по меньшей мере, одну нуклеиновую кислоту или полипептид по данному изобретению. Такой вектор ненуклеиновой кислоты включает, например, но не ограничивается следующим: рекомбинантный вирус, конъюгат вирусной нуклеиновой кислоты и белка (который вместе с рекомбинантными вирусными частицами может иногда называться вирусным вектором), или клетка, такая как рекомбинантные (и обычно ослабленные) Salmonella, Shigella, Listeria и Bacillus Calmette-Guerin (BCG) бактериальные клетки. Таким образом, например, изобретение обеспечивает вирусный вектор, вектор насекомого, бактериальный вектор или вектор растения, включающий нуклеиновую кислоту последовательности по данному изобретению. Любой приемлемый вирусный, насекомого, растения или бактериальный вектор может быть использован в этом отношении и многие известны в области техники. Вирусный вектор может включать любое число вирусных полинуклеотидов, отдельных (вектор вирусной нуклеиновой кислоты) или чаще в комбинации с одним или несколькими (типично двумя, тремя или более) вирусными белками, которые облегчают доставку, репликацию и/или экспрессию нуклеиновой кислоты по данному изобретению в необходимой клетке-хозяине.
В одном аспекте внутриклеточные бактерии (например, Listeria monocytogenes) могут быть использованы для доставки нуклеиновой кислоты по данному изобретению. Иллюстративный бактериальный вектор для плазмидной ДНК доставки одной или нескольких нуклеиновых кислот по данному изобретению представляет собой Listeria monocytogenes (Lieberman et al., Vaccine 20:2007-2010 (2002)).
Данное изобретение включает рекомбинантные или изолированные вирусные векторы, которые модифицированы, так чтобы включать одну или несколько нуклеиновых кислот или полипептидов по данному изобретению. Вирусный вектор может включать полинуклеотид, включающий весь или часть вирусного генома, конъюгат вирусного белка и нуклеиновой кислоты, вирусоподобную частицу (ВПЧ), вектор, сходный с теми, что описаны в Патенте США №5849586 и Публикации Международной Заявки № WO 97/04748, или интактную вирусную частицу, включающую одну или несколько вирусных нуклеиновых кислот, и вирусный вектор обычно конструируют так, чтобы он включал, по меньшей мере, одну нуклеиновую кислоту и/или полипептид по данному изобретению. Вирусный вектор (а именно, рекомбинантный вирус) может включать вирусную частицу дикого типа или модифицированную вирусную частицу, конкретные примеры которых обсуждаются ниже. Различные вирусы обычно используются как векторы для доставки экзогенных нуклеиновых кислот, включая, по меньшей мере, одну нуклеиновую кислоту по данному изобретению, такую как нуклеиновая кислота, кодирующая мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig, описанная здесь. Такие векторы включают рекомбинантно модифицированные покрытые оболочкой или непокрытые оболочкой ДНК и РНК вирусы, обычно выбранные из baculoviridiae, parvoviridiae, picomoviridiae, herpesveridiae, poxviridae, adenoviridiae или picomnaviridiae. Вирусные векторы могут быть дикого типа или могут быть модифицированными методиками рекомбинантной нуклеиновой кислоты, чтобы быть недостаточной репликации, компетентной репликации или условной репликации.
Вирусный вектор может быть вектором, который нуждается в присутствии другого вектора или вируса дикого типа для репликации и/или экспрессии (а именно, хелперно-зависимый вирус), такой как аденовирусный векторный ампликон. Типично, такие вирусные векторы включают вирусную частицу дикого типа или вирусную частицу, модифицированную в ее белковом содержимом и/или содержимом нуклеиновой кислоты, для повышения трансгенной способности или облегчения трансфекции и/или экспрессии нуклеиновой кислоты (примеры таких векторов включают ампликоны вируса герпеса/AAV). Вирусный геном может быть модифицирован, чтобы включать индуцибельные промоторы, которые обеспечивают репликацию или экспрессию только при определенных условиях.
Вирусный вектор может происходить из или включать вирус, который обычно инфицирует животных, преимущественно позвоночных, таких как млекопитающие, включая, например, людей. Приемлемые вирусные векторные частицы в этом отношении, включают, например, аденовирусные векторные частицы (включая любой вирус или происходящей из вируса adenoviridiae), аденоассоциированные вирусные векторные частицы (AAV векторные частицы) или другие парвовирусы и парвовирусные векторные частицы, папилломавирусные векторные частицы, вирусный вектор Semliki-Forest, флавивирусные векторы, пикорнавирусные векторы, альфавирусные векторы, вирусные векторы герпеса, поксвирус векторы, ретровирусные векторы, включая лентивирусные векторы. Примеры таких вирусов и вирусных векторов описаны в, например. Fields Virology, смотри выше. Fields et al., eds., VIROLOGY, Raven Press, Ltd., New York (3rd ed., 1996 and 4th ed., 2001), ENCYCLOPEDIA OF VIROLOGY, R.G. Webster et al., eds., Academic Press (2nd ed., 1999), FUNDAMENTAL VIROLOGY, Fields et al., eds., Lippincott-Raven (3rd ed., 1995), Levine, "Viruses," Scientific American Library No. 37 (1992), MEDICAL VIROLOGY, D.O. White et al., eds., Academic Press (2nd ed. 1994), и INTRODUCTION TO MODERN VIROLOGY, Dimock, NJ. et al., eds., Blackwell Scientific Publications, Ltd. (1994).
Вирусные векторы, которые могут быть использованы с нуклеиновыми кислотами по данному изобретению и способы, описанные здесь, включают аденоассоциированные вирусные векторы, которые описаны в обзорах, например, Carter (1992) Curr. Opinion Biotech. 3:533-539 (1992) и Muzcyzka (1992) Curr. Top.Microbiol. Immunol. 158:97-129 (1992). Дополнительные типы и аспекты AAV векторов описаны в, например, Buschacher et al., Blood 5(8):2499-504, Carter, Contrib. Microbiol. 4:85-86 (2000), Smith-Arica, Curr. Cardiol. Rep.3(1):41-49 (2001), Taj, J. Biomed. Sci. 7(4):279-91 (2000), Vigna et al., J. Gene Med. 2(5):308-16 (2000), Klimatcheva et al., Front. Biosci. 4:D481-96 (1999), Lever et al., Biochem. Soc. Trans. 27(6):841-47 (1999), Snyder, J. Gene Med. 1(3): 166-75 (1999), Gerich et al., Knee Surg. Sports Traumatol. Arthrosc. 5(2): 118-23 (1998), и During, Adv. Drug Deliv. Review 27(1):83-94 (1997), и Патентах США №4797368, 5139941, 5173414, 5614404, 5658785, 5858775 и 5994136, а также других ссылках, обсуждаемых в данном описании). Аденоассоциированные вирусные векторы могут быть сконструированы и/или очищены с применением способов, перечисленных, например, в Патенте США №4797368 и Laughlin et al., Gene 23:65-73 (1983).
Альфавирусные векторы могут быть векторами генной доставки в других контекстах. Альфавирусные векторы известны в области техники и описаны в, например, Carter (1992) Curr Opinion Biotech 3:533-539, Schlesinger Expert Opin. Biol. Ther. (2001) 1(2): 177-91, Polo et al., Dev. Biol. (Basel). 2000; 104:181-5, Wahlfors et al., Gene Ther. (2000) 7(6):472-80, Публикациях Международных Заявок № WO 01/81609, WO 00/39318, WO 01/81553, WO 95/07994, WO 92/10578.
Другой предпочтительной группой вирусных векторов являются вирусные векторы герпеса. Примеры описаны в, например, Lachmann et al., Curr. Opin. Mol. Ther. (1999) 1(5):622- 32, Fraefel et al., Adv. Virus Res. (2000) 55:425-51, Huard et al., Neuromuscul. Disord. (1997) 7(5):299-313, Frenkel et al., Gene Ther. (1994) Suppl 1:S40-6, Патентах США №6261552 и 5599691.
Ретровирусные векторы, включая лентивирусные векторы, также могут быть предпочтительными носителями для генной доставки в конкретных контекстах. Существуют различные ретровирусные векторы, известные в данной области техники. Примеры ретровирусных векторов описаны в, например. Miller, Curr Top Microbiol. Immunol. (1992) 158:1-24, Weber et al, Curr. Opin. Mol. Ther. (2001) 3(5):439-53, Hu et al, Pharmacol. Rev. (2000) 52(4):493-511, Kirn et al., Adv. Virus Res. (2000) 55:545-63, Palu et al., Rev. Med. Virol. (2000) 10(3): 185-202, Takeuchi et al., Adv. Exp. Med. Biol. (2000) 465:23-35, Патентах США №6326195, 5888502, 5580766 и 5672510.
Бакуловирусные векторы представляют собой другую предпочтительную группу вирусных векторов, особенно для продукции полипептидов по данному изобретению. Продукция и применение бакуловирусных векторов являются известными (смотри, например, Kost, Curr. Opin. Biotechnol. 10(5):428-433 (1999); Jones, Curr. Opin. Biotechnol. 7(5):512-516 (1996)). Когда вектор используется в терапевтических применениях, то вектор выбирают так, чтобы он был способен адекватно инфицировать (или в случае векторов нуклеиновой кислоты трансфектировать или трансформировать) клетки-мишени, в которых должен осуществляться желаемый терапевтический эффект.
Аденовирусные векторы также могут быть приемлемыми вирусными векторами для переноса генов. Аденовирусные векторы хорошо известны в области техники и описаны в, например, Graham et al. (1995) Mol. Biotechnol. 33(3):207-220, Stephenson (1998) Clin. Diagn. Virol. 10(2-3): 187-94, Jacobs (1993) Clin Sci (Lond). 85(2): 117-22, Патентах США №5922576, 5965358 и 6168941 и Публикациях Международных Заявок WO 98/22588, WO 98/56937, WO 99/15686, WO 99/54441 и WO 00/32754. Аденовирусные векторы, вирусные векторы герпеса и Синдбис вирусные векторы, пригодные для практического применения изобретения и приемлемые для организменной in vivo трансдукции и экспрессии нуклеиновых кислот по данному изобретению, в общем описаны в, например. Jolly (1994) Cancer Gene Therapy 1:51-64, Latchman (1994) Molec. Biotechnol. 2:179-195, и Johanning et al. (1995) Nucl. Acids Res. 23:1495-1501.
Вирусный вектор может быть дефицитным по репликации в клетке-хозяине. Аденоассоциированные вирусные (AAV) векторы, которые являются естественно дефицитными по репликации при отсутствии комплементарных аденовирусов или, по меньшей мере, аденовирусных генных продуктов (которые обеспечиваются, например, хелперным вирусом, плазмидой или клеткой комплементации), включены в данное изобретение. Под "дефицитный по репликации" понимают, что вирусный вектор включает геном, в котором не хватает, по меньшей мере, одной необходимой для репликации генной функции. Дефицит по гену, генной функции или генной или геномной области, как используется в данном описании, обозначается как делеция генетического материала вирусного генома, достаточная для ослабления или удаления функции гена, чья последовательность нуклеиновой кислоты удаляется целиком или по частям. Генные функции, необходимые для репликации - это те генные функции, которые необходимы для репликации (а именно, распространения) дефицитного по репликации вирусного вектора. Необходимые генные функции вирусной векторной частицы отличаются в зависимости от типа вирусной векторной частицы, представляющей интерес. Примеры дефицитных по репликации вирусных векторных частиц описаны в, например, Marconi et al., Proc. Natl. Acad. Sci. USA 93(21):11319-20 (1996), Johnson и Friedmann, Methods Cell Biol. 43 (pt. A):211-30 (1994), Timiryasova et al., J. Gene Med. 3(5):468-77 (2001), Burton et al., Stem Cells 19(5):358-77 (2001), Kim et al., Virology 282(1): 154-67 (2001), Jones et al., Virology 278(1): 137-50 (2000), Gill et al., J. Med. Virol. 62(2): 127-39 (2000). Другие дефицитные по репликации векторы основаны на простых MLV векторах (Miller et al. (1990) Mol. Cell Biol. 10:4239; Kolberg (1992) J. NIH Res. 4:43, и Cometta et al. (1991) Hum. Gene. Ther. 2:215). Canary pox векторы являются предпочтительными в инфицировании человеческих клеток, но будучи естественно неспособными к репликации в них (а именно, без генетической модификации).
Основное конструирование рекомбинантных вирусных векторов хорошо понятно в данной области техники и включает применение стандартных молекулярных биологических методик, таких как те, что описаны в, например, Sambrook et al., MOLECULAR CLONING: LABORATORY MANUAL (Cold Spring Harbor Press 1989) и ее третье издание (2001), Ausubel et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (Wiley Interscience Publishers 1995), и Watson, смотри выше, и некоторых других ссылках, упоминающихся в данном описании. Например, аденовирусные векторы могут быть сконструированы и/или очищены с применением способов, перечисленных, например, в Graham et al., Mol. Biotechnol. 33(3):207-220 (1995), Патенте США №5965358, Donthine et al., Gene Ther. 7(20): 1707-14 (2000), и других ссылках, описанных здесь. Аденоассоциированные вирусные векторы могут быть сконструированы и/или очищены с применением способов, изложенных, например, в Патенте США №4797368 и Laughlin et al., Gene 23:65-73 (1983). Сходные методики известны в области техники по отношению к другим вирусным векторам, особенно по отношению к вирусным векторам герпеса (смотри, например, Lachman et al., Curr. Opin. Mol. Ther. 1(5):622-32 (1999)), лентивирусным векторам и другим ретровирусным векторам. В целом, вирусный вектор включает вставку нуклеиновой кислоты (например, аденовирусный вектор дикого типа может включать вставку до 3 KB без делеции), или, более типично, включает одну или несколько делеции вирусного генома для того, чтобы приспособить вставки нуклеиновой кислоты и дополнительных нуклеиновых кислот, как необходимо, и для предотвращения репликации в клетках-хозяинах.
Невирусные векторы, такие как, например, ДНК плазмиды, оголенные нуклеиновые кислоты и нуклеиновая кислота в комплексе в носителем для доставки, таким как липосома, также могут быть ассоциированы с молекулами, которые направляют вектор к конкретной области в хозяине (например, конкретный орган, ткань и/или клеточный тип). Например, нуклеотид может быть конъюгированный с направляющим белком, таким как вирусный белок, который связывает рецептор или белок, который связывает рецептор конкретной мишени (например, путем модификации методик в Wu et al., J. Biol. Chem. 263(29): 14621-24 (1988)). Известны направленные катионные липидные композиции (смотри, например, Патент США №6120799). Другие методики для направляющих генетических конструктов описаны в Публикации Международной Заявки № WO 99/41402.
Хозяева экспрессии
Данное изобретение также обеспечивает сконструированные клетки-хозяева, трансдуцированные, трансфектированные или трансформированные с вектором по данному изобретению (например, клонирующим вектором или вектором экспрессии) или нуклеиновой кислотой по данному изобретению. Сконструированные клетки-хозяева могут быть культивированными в соответствующих питательных средах, модифицированных приемлемо для активации промоторов, отбора трансформантов, или амплификации нуклеиновой кислоты, представляющей интерес. Условия культивирования, такие как температура, рН и подобное, являются такими, как использовались ранее для клетки-хозяина, выбранной для экспрессии, и будут очевидны для специалистов в данной области и в ссылках, процитированных в данном описании, включая, например, Freshney (1994) Culture of Animal Cells, Manual of Basic Technique, 3-е издание, Wiley - Liss, New York и ссылки, процитированные в нем. Полипептиды по данному изобретению, кодируемые такими векторами или нуклеиновыми кислотами по данному изобретению, экспрессируются в таких клетках-хозяинах и могут быть изолированы стандартными методиками. Например, полипептиды, высвобождающиеся в клеточную культуру, могут быть изолированы из культуры с помощью ультацентрифугирования или подобных методик.
Полипептиды по данному изобретению могут быть получены в различных хозяинах экспрессии, включая, но не ограничиваясь следующим: клетки животного, такие как клетки млекопитающего (например, СНО клетки), включая человеческие и нечеловеческие клетки приматов, и неживотные клетки, такие как растения, дрожжи, грибы, бактерии и подобное. Примеры приемлемых хозяев экспрессии включают бактериальные клетки, такие как Е. coli, Streptomyces и Salmonella typhimurium; грибковые клетки, такие как Saccharomyces cerevisiae, Pichia pastoris и Neurospora crassa; клетки насекомого, такие как Drosophila и Spodoptera frugiperda; клетки млекопитающего, такие как СНО (например, СНО-K1), COS (например, COS-1, COS-7), BHK, и HEK (например, HEK 293) клетки, клетки меланомы Bowes, и растительные клетки. Как отмечалось выше, изобретение не ограничивается используемыми клетками-хозяинами. В дополнение к Sambrook, Berger и Ausubel, все смотри выше, детали касательно клеточной культуры можно найти в, например, Payne et al. (1992) Plant Cell and Tissue Culture in Liquid Systems John Wiley & Sons, Inc. New York, NY; Gamborg and Phillips (eds.) (1995) Plant Cell, Tissue and Organ Culture; Fundamental Methods Springer Lab Manual, Springer-Verlag (Berlin Heidelberg NY); Atlas & Parks (eds.) The Handbook of Microbiological Media (1993) CRC Press, Boca Raton, FL. Такие клетки-хозяева могут быть адаптированы к росту в бессывороточной, безбелковой среде, среде без животных компонентов, такой как, например, химически определенная (CD) среда (такой, как, например, CD OptiCHO™ (Invitrogen, #12681) с применением процедур, известных в области техники.
Изобретение обеспечивает клетку(и), включающую любую одну или несколько нуклеиновых кислот, векторов или других конструктов по данному изобретению (например, конструкт, экспрессирующий мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig), описанные здесь, или любую их комбинацию. Также включается клетка, включающая один или несколько любых полипептидов, антител, или слитых белков, или других конструктов по данному изобретению, описанных здесь, или любую комбинацию одного или нескольких из этого. Клетка по данному изобретению является обычно изолированной или рекомбинантной клеткой и может включать клетку-хозяина. Такая клетка, например рекомбинантная клетка, может быть модифицированной путем трансформации, трансфекции и/или инфицирования, по меньшей мере, одной нуклеиновой кислотой, вектором или другим конструктом по данному изобретению. Такая клетка может быть эукариотической клеткой (например, клеткой млекопитающего, дрожжей или растения) или прокариотической клеткой (например, бактериальной клеткой) и может быть трансформированной с любым таким конструктом по данному изобретению с применением различных известных способов, включая, например, трансфекцию, опосредованную фосфатом кальция (смотри, например, способ совместного осаждения фосфата кальция), трансфекцию, опосредованную ОЕАЕ(диэтиламиноэтил)-декстраном, электропорация (Irving et al., клетка 64:891-901 (1991)), генную или вакцинную пушку, инъекцию, липофекцию и биолистическую доставку или другие традиционные методики, как отмечалось выше. Смотри также Inovio Biomedical Corp. способы и технология электропорации на всемирном сайте по адресу inovio.com.
Штамм клетки-хозяина необязательно выбран по его способности модулировать экспрессии встроенных последовательностей или обрабатывать экспрессирующийся белок желаемым способом. Такие модификации белка включают, но не ограничиваются следующим: ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидация и ацилирование. Различные клетки-хозяева, такие как Е. coli, Bacillus sp., дрожжевые клетки или клетки млекопитающего, такие как СНО, HeLa, BHK, MDCK, HEK 293, WI38 и т.п., имеют специфический клеточный аппарат и характерные механизмы для таких посттрансляционных действий и могут быть выбраны для обеспечения правильной модификации и обработки встроенного инородного белка.
Нуклеиновая кислота по данному изобретению может быть встроена в приемлемую клетку-хозяина (в культуру или в организм хозяина) для того, чтобы позволить хозяину экспрессировать белок, представляющий интерес (например, мутантный CTLA-4 ВКД или мутантный CTLA-4-Ig). Любая приемлемая клетка-хозяин может быть трансформирована/трансдуцирована нуклеиновыми кислотами по данному изобретению. Примеры приемлемых хозяев экспрессии включают: бактериальные клетки, такие как Е. coli, Streptomyces, Bacillus sp., и Salmonella typhimurium; грибковые клетки, такие как Saccharomyces cerevisiae, Pichia pastoris и Neurospora crassa; клетки насекомых, такие как Drosophila и Spodoptera frugiperda; клетки млекопитающего, такие как Vero клетки, HeLa клетки, СНО клетки (например, СНО-K1), COS клетки, WI38 клетки, NIH-3T3 клетки (и другие фибробластные клетки, такие как MRC-5 клетки), MDCK клетки, KB клетки, SW-13 клетки, MCF7 клетки, BHK клетки, HEK-293 клетки, клетки меланомы Bowes и клетки растения и т.п.
Данное изобретение также обеспечивает клетки-хозяева, которые трансдуцированы, трансформированы или трансфектированы с, по меньшей мере, одной нуклеиновой кислотой или вектором по данному изобретению. Как обсуждалось выше, вектор по данному изобретению обычно включает нуклеиновую кислоту по данному изобретению. Клетки-хозяева являются генетически сконструированными (например, трансдуцированными, трансформированными, инфицированными или трансфектированными) с векторами по данному изобретению, которые могут быть, например, клонирующим вектором или вектором экспрессии. Вектор может быть в форме плазмиды, вирусной частицы, фага, ослабленной бактерии или любого другого приемлемого типа вектора. Клетки-хозяева, приемлемые для трансдукции и/или инфицирования вирусными векторами по данному изобретению для продукции рекомбинантных полипептидов по данному изобретению и/или для репликации вирусного вектора по данному изобретению включают вышеописанные клетки. Примеры клеток, которые показаны как приемлемые для упаковки вирусных векторных частиц, описаны в, например, Polo et al., Proc. Natl. Acad. Sci. 96(8):4598-603 (1999), Farson et al., J. Gene Med. 1(3): 195-209 (1999), Sheridan et al., Mol. Ther. 2(3):262-75 (2000), Chen et al., Gene Ther. 8(9):697-703 (2001), и Pizzaro et al., Gene Ther. 8(10):737-745 (2001). Для дефицитных по репликации вирусных векторов, таких как AAV векторы, комплементарных клеточным линиям, клеточные линии трансформированы с хелперными вирусами или клеточные линии трансформированы с плазмидами, кодирующими эссенциальные гены, необходимы для репликации вирусного вектора.
Сконструированные клетки-хозяева могут быть культивированы в приемлемых питательных средах, модифицированных приемлемо для активирования промоторов, отбора трансформантов или амплификации гена, представляющего интерес. Клетки-хозяева могут быть культивированы в среде, содержащей сыворотку, или бессывороточной среде. Клетки-хозяева могут быть культивированы в бессывороточной, безбелковой, среде, не содержащей животных компонентов, включая, например, химически определенную среду (например, CD OptiCHO™ (Invitrogen, #12681)). Клеточная среда может быть дополнена, при необходимости, добавками, известными для специалистов в данной области, такими как, например, одна или несколько аминокислот, такие как L-глутамин (например, 2% объем/объем 200 мМ L-глутамин (Invitrogen, #25031)). Условия культивирования, такие как температура, рН и подобное, являются такими, как предварительно использовалось для клетки-хозяина, выбранного для экспрессии, и будут очевидны для специалистов в данной области и из ссылок, процитированных в данном описании, включая, например, ANIMAL CELL TECHNOLOGY, Rhiel et al., eds., (Kluwer Academic Publishers 1999), Chaubard et al., Genetic Erig. News 20(18) (2000), Hu et al., ASM News 59:65-68 (1993), Нu et al., Biotechnol. Prog. 1:209-215 (1985), Martin et al., Biotechnol. (1987), Freshney, CULTURE OF ANIMAL CELLS: A MANUAL OF BASIC TECHNIQUE, 4th ed. (Wiley, 2000), Mather, INTRODUCTION TO CELL AND TISSUE CULTURE: THEORY AND TECHNIQUE, (Plenum Press, 1998), Freshney, CULTURE OF IMMORTALIZED CELLS, 3rd ed. (John Wiley & Sons, 1996), CELL CULTURE: ESSENTIAL TECHNIQUES, Doyle et al, eds. (John Wiley & Sons 1998), и GENERAL TECHNIQUES OF CELL CULTURE, Harrison et al., eds. (Cambridge Univ. Press 1997).
Нуклеиновая кислота также может содержаться, реплицироваться и/или экспрессироваться в растительных клетках. Методики, относящиеся к культуре растительных клеток, описаны в, например, Рауnе et al. (1992) Рауnе et al. (1992) PLANT CELL AND TISSUE CULTURE IN LIQUID SYSTEMS John Wiley & Sons, Inc. New York, NY; Gamborg and Phillips (eds.) (1995) PLANT CELL, TISSUE AND ORGAN CULTURE: FUNDAMENTAL METHODS SPRINGER LAB MANUAL, Springer-Verlag (Berlin Heidelberg New York) and Plant Molecular Biology (1993) R.R.D. Croy (ed.) Bios Scientific Publishers, Oxford, U.K. ISBN 012 198370 6. Среды клеточных культур в целом приведены в Atlas and Parks (eds.) THE HANDBOOK OF MICROBIOLOGICAL MEDIA (1993) CRC Press, Boca Raton, FL.
Для длительной продукции с высоким выходом рекомбинантных белков могут быть использованы стабильные системы экспрессии. Например, клеточные линии, которые стабильно экспрессируют полипептид по данному изобретению, могут быть трансдуцированы с векторами экспрессии, включающими вирусные источники репликации и/или эндогенные элементы экспрессии и селектируемый маркерный ген. После встраивания вектора клеткам в клеточной линии могут позволить расти в течение 1-2 дней в обогащенных средах до того, как они будут перенесены в селективные среды. Цель селектируемого маркера состоит в подтверждении устойчивости к отбору, и его присутствие позволяет расти и восстанавливать клетки, которые успешно экспрессируют встроенные последовательности. Например, устойчивые скопления стабильно трансформированных клеток могут быть пролиферированы с применением методик тканевой культуры, приемлемых для клеточного типа. Бессывороточные среды к настоящему моменту являются доступными (например, JRH Biosciences, SAFC Biosciences, Sigma-Aldrich Corporation, всемирный сайт на sigmaaldrich.com). Бессывороточные среды или кондиционированная среда (например, ростовая среда предварительно собранная из нетрансфектированных или нативных клеточных культур) могут быть предпочтительными для продукции белка или сохранения в банках клеток в некоторых случаях.
Данное изобретение включает бессмертные клетки или клеточные линии, включающие один или несколько полипептидов (включая, например, димерные или мономерные слитые белки и мультимерные полипептиды), конъюгаты, нуклеиновые кислоты или векторы по данному изобретению.
Клетки-хозяева, трансформированные с вектором экспрессии и/или полинуклеотидом, необязательно культивируют при условиях, приемлемых для экспрессии и восстановления кодируемого белка из клеточной культуры. Полипептид или его фрагмент, полученный такой рекомбинантной клеткой, может быть секретируемым, мембраносвязанным или содержащимся внутриклеточно, в зависимости от используемой последовательности и/или вектора. Векторы экспрессии, включающие полинуклеотиды, кодирующие зрелые полипептиды по данному изобретению, могут быть сконструированы с сигнальными последовательностями, которые направляют секрецию зрелых полипептидов через мембрану прокариотической или эукариотической клетки. Такие сигнальные последовательности обычно встроены в вектор, так что сигнальная последовательность экспрессируется на N-конце полипептида по данному изобретению. Принципы, относящиеся к таким сигнальным последовательностям, обсуждаются в данном описании.
Продукция и восстановление полипептида
После трансдукции приемлемого штамма хозяина и роста штамма хозяина до приемлемой клеточной плотности выбранный промотор индуцируется приемлемыми способами (например, температурным сдвигом или химической индукцией) и клетки культивируют в течение дополнительного периода. Клетки обычно собирают с помощью центрифугирования, разрушают физическими или химическими способами и полученный сырой экстракт подвергают дополнительному очищению. Микробиальные клетки, используемые в экспрессии белков, могут быть разрушены любым традиционным способом, включая цикл замораживания-оттаивания, обработку ультразвуком, механическое разрушение или применение клеточный лизирующих агентов, или другими способами, которые хорошо известны специалистам в данной области.
Как отмечалось, многие ссылки доступны для культуры и продукции многих клеток, включая клетки бактериального, растительного, животного (особенно млекопитающего) и архебактериального происхождения. Смотри, например, Sambrook, Ausubel и Berger (все смотри выше), а также Freshney (1994) Culture of Animal Cells, a Manual of Basic Technique, Third edition, Wiley-Liss, New York и ссылки, цитированные там; Doyle and Griffiths (1997) Mammalian Cell Culture: Essential Techniques, John Wiley and Sons, NY; Humason (1979) Animal Tissue Techniques, fourth edition W.H. Freeman and Company; и Ricciardelli, et al. (1989) In vitro Cell Dev. Biol. 25:1016 1024. Для культуры растительных клеток и регенерации Payne et al. (1992) Plant Cell and Tissue Culture in Liquid Systems, John Wiley & Sons, Inc. New York, N.Y.; Gamborg and Phillips (eds.) (1995) Plant Cell, Tissue and Organ Culture; Fundamental Methods Springer Lab Manual, Springer- Verlag (Berlin Heidelberg New York) and Plant Molecular Biology (1993) R. R. D. Croy, Ed. Bios Scientific Publishers, Oxford, U.K. ISBN 0 12 198370 6. Среды клеточных культур в целом приведены в Atlas and Parks (eds.) The Handbook of Microbiological Media (1993) CRC Press, Boca Raton, FL. Дополнительную информацию касательно клеточной культуры можно найти в доступной коммерческой литературе, такой как Life Science Research Cell Culture Catalogue (1998) from Sigma-Aldrich, Inc. (St. Louis, Mo.) ("Sigma-LSRCCC") и, например, Plant Culture Catalogue and supplement (1997) также от Sigma-Aldrich, Inc (St. Louis, Mo.) ("Sigma-PCCS").
Полипептиды по данному изобретению могут быть восстановлены и очищены от рекомбинантных клеточных культур любым из многочисленных способов, хорошо известных в области техники, включая осаждение аммония сульфатом или этанолом, кислотную экстракцию, анионную или катионную обменную хроматографию, фосфоцеллюлозную хроматографию, хроматографию гидрофобного взаимодействия, аффинную хроматографию (например, с применением любой из направляющих систем, обозначенных в данном описании), гидроксилапатитную хроматографию и лецитиновую хроматографию. Этапы рефолдинга белка могут быть использованы, если желательно, в завершение конфигурации зрелого белка. В итоге высокоэффективная жидкостная хроматография (ВЭЖХ) может использоваться в окончательных этапах очищения. В дополнение к ссылкам, отмеченным выше, разнообразные способы очищения хорошо известны в области техники, включая, например, приведенные в Sandana (1997) Bioseparation of Proteins, Academic Press, Inc.; and Bollag et al. (1996) Protein Methods, 2.sup.nd Edition Wiley-Liss, NY; Walker (1996) The Protein Protocols Handbook Humana Press, NJ, Harris and Angal (1990) Protein Purification Applications: A Practical Approach IRL Press at Oxford, Oxford, England; Harris and Angal Protein Purification Methods: A Practical Approach IRL Press at Oxford, Oxford, England; Scopes (1993) Protein Purification: Principles and Practice 3.sup.rd Edition Springer Verlag, NY; Janson and Ryden (1998) Protein Purification: Principles, High Resolution Methods and Applications, Second Edition Wiley-VCH, NY; и Walker (1998) Protein Protocols on CD-ROM Humana Press, NJ.
Специалисту в данной области понятно, что слитые белки по данному изобретению (например, мутантный слитый белок CTLA-4-Ig) могут быть получены различными способами, описанными здесь, включая, например, приведенные в примере 1 для образования LEA29Y-Ig. Например, в случае EEA29Y-кодирующей нуклеиновой кислоты последовательность нуклеиновых кислот, кодирующая мутантный полипептид CTLA-4 ВКД по данному изобретению (например, D3-54 полипептид), может быть клонирована в IgG2 Fc вектор слияния для получения вектора, кодирующего мутантный слитый белок CTLA-4-Ig (например, D3-54-IgG2), стабильные СНО-K1 клетки, экспрессирующие такой мутантный слитый белок CTLA-4-Ig, могут быть получены трансфектированием таких клеток с вектором, кодирующим мутантный слитый белок CTLA-4-Ig, и полученный мутантный слитый белок CTLA-4-Ig (например, D3-54-IgG2) может экспрессироваться (обычно в димерной форме) и очищаться, как описано в примере 1.
In vitro системы экспрессии
Бесклеточные системы транскрипции/трансляции могут также применяться для получения рекомбинантных полипептидов по данному изобретению или их фрагментов с применением ДНК и/или РНК по данному изобретению или их фрагментов. Некоторые такие системы являются коммерчески доступными. Общее руководство по протоколам in vitro транскрипции и трансляции находится в Tymms (1995) IN VITRO TRANSCRIPTION AND TRANSLATION PROTOCOLS: METHODS IN MOLECULAR BIOLOGY, Объем 37, Garland Publishing, New York.
СПОСОБЫ СОГЛАСНО ИЗОБРЕТЕНИЮ
Полипептиды (включая, например, димерные и мономерные слитые белки и мультимерные полипептиды), конъюгаты, композиции, нуклеиновые кислоты, векторы и клетки по данному изобретению проявляют разнообразные свойства и характеристики, и предполагается, что они пригодны в различных сферах применения, включая, но не ограничиваясь следующим, например, в профилактических или терапевтических способах лечения различных заболеваний иммунной системы, нарушений и состояний иммунной системы, в которых модуляция или регуляция иммунной системы и ответов иммунной системы может быть эффективной. Например, полагают, что полипептиды, конъюгаты, композиции, нуклеиновые кислоты, векторы и клетки по данному изобретению, которые имеют способность связывать CD80 и/или CD86 или ВКД каждого или обоих и/или способность ингибировать иммунный ответ, пригодны в профилактических и/или терапевтических способах для ингибирования или подавления иммунного ответа у субъекта, способах ингибирования отторжения трансплантата ткани, клетки или органа от донора к реципиенту и других способах, описанных в данном описании. Предполагают, что некоторые такие полипептиды, конъюгаты, композиции, нуклеиновые кислоты, векторы и клетки по данному изобретению пригодны в способе модуляции или ингибирования взаимодействия Т-клеток, экспрессирующих CD28 и/или CTLA-4 с В7-позитивными клетками.
В одном аспекте терапевтические или профилактические способы по данному изобретению включают введение субъекту эффективного количества, по меньшей мере, одного такого полипептида (включая, например, слитый белок, мультимер и т.п.), конъюгата, композиции, нуклеиновой кислоты, вектора и/или клетки, чтобы подавлять или ингибировать иммунный ответ. В терапевтическом контексте субъект является обычно субъектом, пораженным заболеванием, нарушением или состоянием иммунной системы, и введение проводят для предотвращения дальнейшего развития заболевания, нарушения или состояния. Например, введение молекулы по данному изобретению субъекту, страдающему от заболевания иммунной системы (например, аутоиммунного заболевания), может приводить к подавлению или ингибированию такой атаки иммунной системы или биологических ответов, связанных с ней. Подавлением этой атаки иммунной системы на здоровые ткани организма, полученные физические симптомы (например, боль, воспаление сустава, опухание сустава или болезненность), являющиеся результатом или связанные с такой атакой на здоровые ткани, могут быть снижены или устранены, и биологическое и физическое повреждение в результате или связанное с атакой иммунной системы может быть снижено, задержано или остановлено.
В профилактическом контексте субъект может быть пораженным, восприимчивым к или считающим, что у него присутствует заболевание, нарушение или состояние иммунной системы, и введение обычно приводит к предотвращению развития заболевания, нарушения или состояния, ингибирует или устраняет симптомы, признаки или биологические ответы, связанные с ними, предотвращает повреждение организма, которое является их потенциальным результатом и/или поддерживает или улучшает физическое функционирование субъекта.
В одном аспекте изобретение обеспечивает способ модулирования взаимодействия Т-клеток, экспрессирующих CD28 и/или CTLA-4, с В7-позитивными клетками, где способ включает контакт B7-позитивных клеток с, по меньшей мере, одним из следующего в эффективном количестве, чтобы модулировать взаимодействие B7-позитивных клеток с СВ28-позитивными Т-клетками и/или CTLA-4-позитивными Т-клетками: (1) полипептид по данному изобретению (например, мутантный полипептид CTLA-4-ВКД или димерный или мономерный мутантный слитый белок CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или, кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, где взаимодействие В7-позитивных клеток с CD28-позитивными Т-клетками и/или CTLA-4-позитивными Т-клетками модулируется. Типично, модуляторный эффект - это ингибиторный эффект, так что взаимодействие В7-позитивных клеток с CD28-позитивными Т-клетками и/или CTLA-4-позитивными Т-клетками ингибируется. В некоторых случаях В7-позитивные клетки являются антиген-презентирующими клетками (АПК). В некоторых таких способах взаимодействие В7-2-позитивных клеток (например, АПК, экспрессирующих В7-2 (CD86)) с CD28-позитивными Т-клетками ингибируется. В некоторых таких способах взаимодействие В7-1-позитивных клеток (например, АПК, экспрессирующих В7-1 (CD80)) с СВ28-позитивными Т-клетками ингибируется.
В другом аспекте изобретение обеспечивает способ ингибирования взаимодействия CD28-позитивных Т-клеток и/или CTLA-4-позитивных Т-клеток с В7-позитивными клетками, где способ включает контакт В7-позитивных клеток (например, В7-1-позитивных клеток и/или В7-2-позитивных клеток) с, по меньшей мере, одной из следующих молекул или компонентов по данному изобретению в эффективном количестве, чтобы ингибировать взаимодействие CD28-позитивных Т-клеток и/или CTLA-4-позитивных Т-клеток с В7-позитивными клетками: (1) полипептид по данному изобретению (например, мутантный полипептид CTLA-4-ВКД или димерный или мономерный мутантный слитый белок CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, где взаимодействие СВ28-позитивных Т-клеток и/или CTLA-4-позитивных Т-клеток с В7-позитивными клетками ингибируется. В некоторых случаях В7-позитивные клетки - это АПК. В некоторых случаях взаимодействие CD28-позитивных Т-клеток с hB7-1-позитивными клетками и/или hB7-2-позитивными клетками ингибируется. В некоторых таких способах ингибирование взаимодействия CD28-позитивных Т-клеток с hB7-1-позитивными клетками и/или hB7-2-позитивными клетками приводит к подавлению или ингибированию одного или нескольких из следующего: Т-клеточная активация или пролиферация, синтез или продукция цитокина (например, продукция TNF-α, IFN-γ, IL-2), индукция различных маркеров активации (например, CD25, IL-2 рецептор), воспаление, опухание сустава или болезненность, уровень в сыворотке C-реактивного белка, продукция антиколлагеновых антител и/или Т-клеточно-зависимый ответ(ы) антител.
В некоторых таких способах, по меньшей мере, одну такую молекулу или компонент по данному изобретению вводят субъекту в эффективном количестве, чтобы ингибировать взаимодействие эндогенных СD28-позитивных Т-клеток с эндогенными В7-1-позитивными клетками и/или В7-2-позитивными клетками у субъекта. В некоторых таких способах взаимодействие эндогенных СВ28-позитивных Т-клеток с эндогенными B7-позитивными клетками, экспрессирующими В7-2 (CD86) или В7-1 (CD80), ингибируется. В некоторых случаях В7-позитивные клетки - это АПК, которые экспрессируют В7-2 или В7-1, и взаимодействие В7-2 или В7-1 с CD28-позитивными Т-клетками ингибируется. В некоторых случаях взаимодействие обоих В7-2 и В7-1, экспрессирующихся на АПК, с CD28-позитивными Т-клетками ингибируется.
В другом аспекте изобретение обеспечивает способ подавления иммунного ответа in vitro или in vivo. Способ включает контакт В7-позитивных клеток с, по меньшей мере, одним из следующих молекул или компонентов по данному изобретению в эффективном количестве, чтобы подавлять иммунный ответ: (1) полипептид по данному изобретению (например, мутантный полипептид CTLA-4-ВКД или димерный или мономерный мутантный слитый белок CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, где иммунный ответ таким образом подавляется. Один или несколько иммунных ответов могут быть подавлены, включая, например, Т-клеточный ответ, Т-клеточную пролиферацию или активацию, синтез или продукцию цитокина, воспаление, опухание сустава или болезненность, уровень в сыворотке С-реактивного белка, продукцию антиколлагеновых антител и/или Т-клеточно-зависимый ответ(ы) антител. В таких способах, включающих контакт В7-позитивной клетки с полипептидом по данному изобретению, полипептид связывает В7-1 (например, человеческий В7-1), экспрессирующийся на В7-позитивных клетках, и/или связывает В7-2 (например, человеческий В7-2), экспрессирующийся на В7-позитивных клетках. В некоторых случаях В7-позитивные клетки - это АПК. В некоторых случаях иммунный ответ подавляется in vitro, такой как в, например, in vitro исследовании, включая те, что описаны в деталях в данном описании (смотри, например, примеры ниже). В некоторых случаях иммунный ответ подавляется in vivo у субъекта, которому вводят эффективное количество, чтобы подавлять иммунный ответ, а именно, например, в терапевтических или профилактических способах лечения (например, способ лечения ревматизма, такого как ревматоидный артрит, или другого аутоиммунного заболевания), обсуждаемых детально в данном описании.
В другом аспекте изобретение обеспечивает способ подавления иммунного ответа у субъекта (например, млекопитающего, такого как человек). Способ включает введение субъекту, нуждающемуся в этом, по меньшей мере, одного из следующих молекул или компонентов по данному изобретению в терапевтически или профилактически эффективном количестве (например, терапевтически или профилактически эффективной дозе), которое подавляет иммунный ответ у субъекта: (1) полипептид по данному изобретению (например, мутантный CTLA-4-ВКД или димерный или мономерный мутантный слитый белок полипептид CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, где иммунный ответ таким образом подавляется у субъекта.
В другом аспекте изобретение обеспечивает способ лечения субъекта, имеющего иммунное заболевание или нарушение, модулируемое взаимодействием эндогенных Т-клеток с эндогенными клетками, экспрессирующими CD80 и/или CD86. Способ включает введение субъекту, который нуждается в таком лечении, терапевтически эффективное количество следующего: (1) полипептид по данному изобретению (например, мутантный полипептид CTLA-4-ВКД или димерный или мономерный мутантный слитый белок CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, тем самым, оказывая лечение иммунного заболевания или нарушения у субъекта. Если субъектом является человек, то CD80 - это человеческий CD80, CD86 - это человеческий CD86 и CD28 - это человеческий CD28. В некоторых таких способах взаимодействие между эндогенными Т-клетками, экспрессирующими CD28, и эндогенными клетками, экспрессирующими CD86, и/или эндогенными клетками, экспрессирующими CD80 ингибируется.
Полагают, что различные заболевания или нарушения иммунной системы, включая ревматоидное или аутоиммунное заболевание или нарушение, могут быть эффективно вылечены с применением одной или нескольких молекул по данному изобретению, описанных здесь, таких как, например, мутантный полипептид CTLA-4 ВКД (например, любой SEQ ID NOS:1-73, такой как, например, D3-54 (SEQ ID NO:36), D3-69 (SEQ ID NO:50), или D3-27 (SEQ ID NO:24) мутантный CTLA-4 ВКД), или его слитый белок (например, D3-54-IgG2 (SEQ ID NO:197 или 211), D3-69-IgG2 (SEQ ID NO:199 или 213), D3-29-IgG2 (SEQ ID NO:79 или 210)). Заболевание или нарушение иммунной системы может быть или включает, например, но не ограничивается следующим: Аддисонова болезнь, аллергия, круговая алопеция, болезнь Альцгеймера, васкулит, связанный с антинейтрофильными цитоплазматическими антителами (АНЦА), анкилозирующий спондилит, антифофсолипидный синдром (Синдром Хьюза), артрит, астма, атеросклероз, атеросклеротическая бляшка, аутоиммунное заболевание (например, волчанка, PA, PC, диффузный токсический зоб и т.п.), аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунный миокардит, аутоиммунный оофорит, аутоиммунный орхит, азооспермия, болезнь Бехчета, болезнь Бергера, буллезный пемфигоид, кардиомиопатия, сердечнососудистое заболевание, целиакия-спру/глютеновая энтеропатия, синдром хронической усталости и дисфункции иммунной системы (СХУДИС), хронический идиопатический полиневрит, хроническая воспалительная демиелинизация, полирадикулоневропатия (CIPD), хроническая рецидивирующая полиневропатия (синдром Гийена-Барре), синдром Черджа-Стросса (СЧС), зубцовый пемфигоид, синдром холодовой агглютинации (СХА), ХОБЛ, CREST-синдром, болезнь Крона, дерматит, герпетиформное заболевание, дерматомиозит, диабет, дискоидная волчанка, экзема, приобретенный буллезный эпидермоз, эссенциальная криоглобулинемия смешанного типа, синдром Эвана, экзофтальм, фибромиалгия, синдром Гудпасчера, заболевание или нарушение, связанное с трансплантатом, диффузный токсический зоб, РТПХ, тиреоидит Хашимото, идиопатический фиброз легких, идиопатическая тромбоцитопения пурпура (ИТП), IgA нефропатия, иммунопролиферативное заболевание или нарушение (например, псориаз), воспалительная болезнь кишечника (ВБК), инсулинозависимый сахарный диабет (ИЗСД), интерстициальное заболевание легких, ювенильный диабет, ювенильный артрит, ювенильный идиопатический артрит (ЮИА), синдром Кавасаки, синдром Итона-Ламберта, лишай Вильсона, волчанка, волчаночный нефрит, Lymphoscytic Lypophisitis, болезнь Меньера, синдром Миллера-Фишера/острая рассеянная энцефаломиелорадикулопатия, смешанное заболевание соединительной ткани, рассеянный склероз (PC), фиброзит, миалгический энцефаломиелит (МЭ), миастения гравис, воспаление глаза, листовидная пузырчатка, обыкновенная пузырчатка, злокачественная анемия, нодозный полиартериит, полихондрия, плюриграндулярные синдромы (Синдром Витакера), ревматическая полимиалгия, полимиозит, первичная агаммаглобулинемия, первичный биллиарный цирроз/аутоиммунная холангиопатия, псориаз, псориазный артрит, феномен Рейно, синдром Рейтера/реактивный артрит, рестеноз, ревматическая атака, ревматизм, ревматоидный Артрит, саркоидоз, синдром Шмидта, склеродерма, Sjδrgen's Syndrome, отторжение трансплантата цельного органа (почки, сердца, печени, легкого и т.п.), синдром скованного человека, системная красная волчанка (СКВ), системная склеродерма, синдром Такаясу, височный артериит/гигантоклеточный артериит, тиреоидит, диабет 1 типа, диабет 2 типа, язвенный колит, увеит, васкулит, витилиго, гранулематоз Вегенера, и предупреждение или подавление иммунного ответа, связанного с отторжением донорской ткани, клетки, участка ткани или органа, пересаженного субъекту-реципиенту. Связанные с трансплантатом заболевания или нарушения включают заболевание трансплантат против хозяина (GVDH), такие как связанные с трансплантацией костного мозга, и иммунные нарушения, являющиеся результатом или связанные с отторжением трансплантата органа, ткани или клетки (например, тканевые или клеточные аллотрансплантаты или ксенотрансплантаты), включая, например, трансплантаты кожи, мышцы, нейронов, островков, органов, паренхимальных клеток печени и т.п. По отношению к трансплантату донорской ткани, клетки, участка ткани или цельного органа субъекту-реципиенту, полагают, что такие молекулы по данному изобретению, описанные здесь (например, мутантный полипептид CTLA-4 ВКД или мутантный слитый белок CTLA-4-Ig) могут быть эффективными в предотвращении острого отторжения такого трансплантата в реципиенте и/или для длительной поддерживающей терапии для предотвращения отторжения такого трансплантата в реципиенте (например, ингибирование отторжения трансплантата инсулин-продуцирующих островковых клеток от донора субъекту-реципиенту, страдающему от диабета).
Данное изобретение включает любой такой мутантный полипептид CTLA-4 ВКД или мутантный слитый белок CTLA-4-Ig по данному изобретению для применения в подавлении иммунного ответа, связанного с, по меньшей мере, одним из вышеупомянутых заболеваний или нарушений иммунной системы. Также обеспечивается применение любого такого мутантного полипептида CTLA-4 ВКД или мутантного слитого белка CTLA-4-Ig по данному изобретению в производстве медикамента для подавления иммунного ответа с, по меньшей мере, одним из вышеупомянутых заболеваний или нарушений иммунной системы.
Эффективное количество молекулы по данному изобретению, такой как, например, мутантный CTLA-4 ВКД полипептид (например, D3-54, D3-69, D3-29, D3-56, D3-75) или слитый белок Ig, включающий мутантный полипептид CTLA-4 ВКД по данному изобретению (например, D3-54-IgG2, D3-69-IgG2, D3-29-IgG2, D3-56-IgG2, D3-75-IgG2, соответственно), для подавления иммунного ответа у субъекта или лечения иммунного заболевания или нарушения, модулируемого взаимодействием эндогенных Т-клеток с эндогенными клетками, экспрессирующими CD80 и/или CD86 у субъекта в способах, описанных здесь, может включать от около 0,0001 миллиграммов на килограмм (мг/кг) веса субъекта до около 200 миллиграммов на килограмм (мг/кг) веса тела субъекта, а именно, например, от около 0,001 миллиграммов на килограмм (мг/кг) веса тела субъекта до около 100 миллиграммов на килограмм (мг/кг) веса субъекта или, например, от около 0,001 мг/кг веса субъекта до, по меньшей мере, около 0,005, 0,01, 0,025, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25, 50 или 75 мг/кг веса тела субъекта. Один или несколько иммунных ответов могут быть подавлены у субъекта, включая, например, Т-клеточный ответ, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина (например, продукцию TNF-α, IFN-γ, IL-2 и т.п.), индукцию различных маркеров активации (например, CD25, IL-2 рецептор и т.п.), синтез или продукцию воспалительных молекул, воспаление, опухание сустава, болезненность сустава, боль, тугоподвижность, уровни в сыворотке C-реактивного белка, продукцию антиколлагеновых антител и/или Т-клеточно-зависимый ответ(ы) антител. Эффективное количество молекулы или компонента по данному изобретению для подавления иммунного ответа может быть количеством, которое подавляет иммунный ответ или его симптом или признак определяемым или измеряемым количеством. Иммунный ответ может быть частично или полностью подавлен. Эффективное количество для лечения иммунного заболевания или нарушения может быть количеством, которое облегчает, ослабляет или устраняет, по меньшей мере, один симптом или биологический ответ или эффект, связанный с заболеванием или нарушением, предотвращает развитие заболевания или нарушения или улучшает физическое функционирование субъекта.
Эффективное количество молекулы или компонента по данному изобретению для модулирования или ингибирования взаимодействия Т-клеток, экспрессирующих CD28 и/или CTLA-4, с В7-позитивными клетками может быть количеством, которое модулирует или ингибирует связывание между В7-позитивными клетками и СВ28-позитивными и/или CTLA-4-позитивными Т-клетками соответственно. Такое связывающее взаимодействие(я) может быть частично или полностью модулировано или ингибировано.
В некоторых таких способах мутантный димер слитого белка CTLA-4-Ig по данному изобретению вводят субъекту в терапевтически или профилактически эффективном количестве (или дозе), достаточном, чтобы подавлять иммунный ответ, лечить иммунное заболевание или нарушение, модулируемое взаимодействием Т-клеток с В7-экспрессирующими клетками, или модулировать или ингибировать взаимодействие Т-клеток, экспрессирующих CD28 и/или CTLA-4 с В7-позитивными клетками. Димер слитого белка для введения представляет собой обычно растворимый Ig димер слитого белка. В некоторых таких способах эффективное количество или доза димера слитого белка по данному изобретению включает от около 0,001 миллиграммов на килограмм (мг/кг) веса тела субъекта до около 200 миллиграммов на килограмм (мг/кг) веса тела субъекта (такого, как, например, человек) или от около 0,001 мг/кг до около 300 мг/кг веса тела субъекта. Например, эффективное количество или доза димера слитого белка может включать от около 0,001 мг/кг веса тела субъекта до, по меньшей мере, около 0,005, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 10, 25, 30, 40, 50, 60, 75, 80, 90, 100, 125, 150, 175, 200, 225, 250 или 300 мг/кг веса тела субъекта (такого, как, например, человек, включая взрослого человека). В некоторых случаях эффективное количество или доза, которая составляет от около 0,001 миллиграммов (мг) до около 50 миллиграммов на килограмм (кг) веса тела субъекта, включая, но не ограничиваясь следующим, например, от около 0,01 мг/кг до около 100 мг/кг веса тела субъекта (например, человека), от около 0,01 мг/кг до около 50 мг/кг веса тела субъекта или от около 0,01 мг/кг до около 25 мг/кг веса субъекта; например, около 0,05 мг/кг, 0,075 мг/кг, 0,1 мг/кг, 0,15 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 5 мг/кг, около 10 мг/кг, 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг или 100 мг/кг веса тела субъекта (например, взрослого человека-пациента) вводят субъекту. В некоторых случаях эффективное количество или доза димера слитого белка составляет от около 2 до 10 мг/кг, около 3 до 10 мг/кг, около 3 до 5 мг/кг, около 5 до 10 мг/кг, 0,1 до 5 мг/кг, около 0,05 до 1,0 мг/кг, около 0,05 до 3 мг/кг, около 0,05 до 2,0 мг/кг, около 0,05 до 1,0 мг/кг, около 0,1 до 2,0 мг/кг, около 0,1 до 3,0 мг/кг, около 0,1 до 0,5 мг/кг, около 0,1 до 0,8 мг/кг, около 0,1 до 0,6 мг/кг, около 0,01 мг/кг до около 0,05 мг/кг, около 0,01 мг/кг до около 0,1 мг/кг, около 0,01 мг/кг до около 0,05 мг/кг, около 0,01 мг/кг до около 1 мг/кг, около 0,01 до около 5 мг/кг, около 0,01 мг/кг до около 3 мг/кг, около 0,05 мг/кг до около 2,5 мг/кг, около 0,1 мг/кг до около 1 мг/кг, около 0,1 мг/кг до около 5 мг/кг, около 0,2 до 1 мг/кг, около 0,2 до 0,6 мг/кг, около 0,2 до 0,5 мг/кг около 0,3 до 1 мг/кг, около 0,3 до 0,6 мг/кг, около 0,3 до 0,5 мг/кг веса субъекта. В некоторых случаях эффективное количество или доза составляет менее чем около 500 мг для субъекта, который весит менее чем 60 кг (например, менее чем около 100 мг, 75 мг, 50 мг, 25 мг, 12,5 мг или 10 мг), менее чем около 750 мг для субъекта, весящего 60-100 кг (например, менее чем около 150 мг, 100 мг, 75 мг, 37,5 мг, или 20 мг) или менее чем около 1000 мг для субъекта, весящего более чем 100 кг (например, менее чем около 500 мг, 100 мг, 50 мг, 25 мг или 10 мг).
В другом аспекте в некоторых таких способах изобретения мутантный слитый белок CTLA-4-Ig по данному изобретению вводят субъекту в терапевтически или профилактически эффективном количестве или дозе, которая, например, достаточна, чтобы подавлять иммунный ответ, лечить иммунное заболевание или нарушение, модулируемое взаимодействием Т-клеток с В7-экспрессирующими клетками, или модулировать или ингибировать взаимодействие Т-клеток, экспрессирующих CD28 и/или CTLA-4, с В7-позитивными клетками. Эффективное количество или доза слитого белка, который обычно является растворимым слитым белком, может включать от около 0,001 мг/кг до около 300 мг/кг, около 0,001 мг/кг до около 200 мг/кг или около 0,001 мг/кг до около 300 мг/кг веса тела субъекта (например, человека). В одном аспекте эффективное количество или доза слитого белка включает от около 0,001 мг/кг до, по меньшей мере, около 0,005, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 10, 25, 30, 40, 50, 60, 75, 80, 90, 100, 125, 150, 175, 200, 225, 250 или 300 мг/кг веса тела субъекта. В другом аспекте эффективное количество или доза составляет от около 0,01 мг/кг до около 100 мг/кг, от около 0,01 мг/кг до около 50 мг/кг или от около 0,01 мг/кг до около 25 мг/кг веса субъекта. Иллюстративные дозы или количества включают около 0,05 мг/кг, 0,075 мг/кг, 0,1 мг/кг, 0,15 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 5 мг/кг, около 10 мг/кг, 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг и 100 мг/кг веса тела субъекта (например, взрослого человека). В другом аспекте эффективное количество или доза слитого белка составляет от около 2 до 10 мг/кг, около 3 до 10 мг/кг, около 3 до 5 мг/кг, около 5 до 10 мг/кг, 0,1 до 5 мг/кг, около 0,05 до 1,0 мг/кг, около 0,05 до 3 мг/кг, около 0,05 до 2,0 мг/кг, около 0,05 до 1,0 мг/кг, около 0,1 до 2,0 мг/кг, около 0,1 до 3,0 мг/кг, около 0,1 до 0,5 мг/кг, около 0,1 до 0,8 мг/кг, около 0,1 до 0,6 мг/кг, около 0,01 мг/кг до около 0,05 мг/кг, около 0,01 мг/кг до около 0,1 мг/кг, около 0,01 мг/кг до около 0,05 мг/кг, около 0,01 мг/кг до около 1 мг/кг, около 0,01 до около 5 мг/кг, около 0,01 мг/кг до около 3 мг/кг, около 0,05 мг/кг до около 2,5 мг/кг, около 0,1 мг/кг до около 1 мг/кг, около 0,1 мг/кг до около 5 мг/кг, около 0,2 до 1 мг/кг, около 0,2 до 0,6 мг/кг, около 0,2 до 0,5 мг/кг около 0,3 до 1 мг/кг, около 0,3 до 0,6 мг/кг, около 0,3 до 0,5 мг/кг веса субъекта. В некоторых аспектах эффективное количество или доза составляет менее чем около 500 мг для субъекта, который весит меньше чем 60 кг (например, менее чем около 100 мг, 75 мг, 50 мг, 25 мг, 12,5 мг или 10 мг, менее чем около 750 мг для субъекта, который весит между 60-100 кг (например, менее чем около 150 мг, 100 мг, 75 мг, 37,5 мг или 20 мг), или менее чем около 1000 мг для субъекта, который весит более чем 100 кг (например, менее чем около 500 мг, 100 мг, 50 мг, 25 мг или 10 мг).
Эффективное количество или доза вектора нуклеиновой кислоты, вектора, композиции и/или клеток по данному изобретению достаточна, чтобы подобным образом подавлять иммунный ответ или модулировать, лечить иммунное заболевание или нарушение, модулируемое взаимодействием Т-клеток с В7-экспрессирующими клетками, или модулировать или ингибировать взаимодействие Т-клеток, экспрессирующих CD28 и/или CTLA-4, с В7-позитивными клетками может быть определено. Например, если вектор, кодирующий такой димер слитого белка по данному изобретению, необходимо ввести субъекту, то специалист в данной области может определить количество вектора для введения, так чтобы желательное терапевтически или профилактически эффективное количество димера слитого белка смогло выработаться у субъекта.
Иллюстративные димеры слитого белка по данному изобретению включают любой из тех, что описаны в деталях выше и здесь, включая, например, димер слитого белка, включающий два идентичных мономера слитого белка, где каждый мономер слитого белка включает мутантный полипептид CTLA-4 ВКД по данному изобретению, слитый на его С-конце с N-концом полипептида Ig Fc (например, IgG2 Fc, IgG1, IgG4 или мутантный полипептид Ig Fc, который снижает эффекторную функцию). Иллюстративный мутантный полипептид CTLA-4 ВКД - это пептид, включающий аминокислотную последовательность, выбранную из группы, включающей SEQ ID NOS:1-73. Иллюстративный димер слитого белка - это димер, включающий два мономера слитого белка, где каждый мономер слитого белка включает аминокислотную последовательность, выбранную из группы, содержащей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Типично, два мономерных слитых белка в димерном слитом белке ковалентно соединены вместе посредством, по меньшей мере, одной дисульфидной связи, образованной между цистеиновым(и) остатком(ами), присутствующим в каждом мономере.
В любом из способов, описанных выше, молекула или компонент по данному изобретению (например, полипептид (включая, например, димерный или мономерный слитый белок или полипептидный мультимер), конъюгат, нуклеиновая кислота, вектор, композиция и/или клетки по данному изобретению) может быть введен субъекту в виде композиции. Композиция обычно включает, по меньшей мере, одну такую молекулу или компонент и наполнитель, носитель или растворитель. Композиция может включать фармацевтическую композицию, включающую, по меньшей мере, одну такую молекулу или компонент и фармацевтически приемлемый наполнитель, носитель или растворитель (например, PBS). рН композиций по данному изобретению обычно находится в диапазоне от около рН 6,0 до около рН 9,0, включая, например, от около рН 6,5 до около рН 8,5, обычно от около рН 7,0 до около рН 8,0. В одном аспекте рН композиций по данному изобретению обычно находится в диапазоне от около рН 3 до около рН 10, от около рН 4 до около рН 10, от около рН 5 до около рН 9, от около рН 6 до около рН 9, от около рН 5,5 до около рН 8,5, от около рН 6,0 до около рН 6,7, от около рН 6,0 до около рН 6,5, от около рН 6,2 до около рН 8,7, от около рН 6,5 до около рН 7,5, от около рН 6,2 до около рН 7,0, от около рН 6,3 до около рН 6,8, от около рН 6,4 до около рН 6,8 и около рН 7,0 до около рН 7,4. В одном аспекте композиция, включающая, по меньшей мере, одну такую молекулу или компонент по данному изобретению, такой как, например, мутантный слитый белок CTLA-4-Ig, имеет рН значение рН 5,5, рН 6,0, рН 6,1, рН 6,2, рН 6,3, рН 6,4, рН 6,5, рН 6,6, рН 6,7, рН 6,8, рН 6,9, рН 7,0, рН 7,1, рН 7,2, рН 7,3, рН 7,4, рН 7,5, рН 7,6, рН 7,7, рН 7,8, рН 7,9, рН 8,0, рН 8,1, рН 8,2, рН 8,3, рН 8,4, рН 8,5, рН 8,6, рН 8,7, рН 8,8, рН 8,9, рН 9,0, рН 9,1, рН 9,2, рН 9,3, рН 9,4, рН 9,5, рН 9,6, рН 9,7, рН 9,8, рН, 9,9 или рН 10,0. Некоторые композиции по данному изобретению включают одну или несколько солей (например, хлорид натрия, фосфат натрия, хлорид кальция и подобное), один или несколько буферов (например, HEPES (N-2-гидроксиэтил-пиперазин-N-2-этансульфоновая кислота), цитрат натрия, фосфат натрия (например, Na2HPO4ZNa3PO4), сукцинат, тартрат, фумарат, глюконат, оксалат, лактат, ацетат, трис(гидроксиметил)аминометан (Трис) и подобное), один, два, три, четыре, пять или более сахаридов или сахаров (например, сахароза, манноза, мальтоза, трегалоза, декстроза и подобное), и/или один, два, три, четыре или боле полиспиртов или сахарных спиртов (например, маннитол, сорбитол, гликоль, глицерол, арабитол, эритриол, ксилитол, рибитол, лактитол и подобное). Один, два, три, четыре, пять или более моносахаридов, дисахаридов и/или полисахаридов могут быть включены в композицию. Композиция по данному изобретению может включать любую концентрацию такой молекулы или компонента, эффективную, чтобы подавлять иммунный ответ при введении субъекту. Например, в некоторых таких способах (включая, например, способы, в которых иммуносупрессия является желательной, таких как, но не ограничиваясь следующим, например, лечение ревматоидного артрита или сходных иммунных нарушений, или для ингибирования отторжения трансплантата ткани, клетки, участка ткани или органа от донора субъекту-реципиенту), фармацевтическую композицию, включающую фармацевтически приемлемый носитель, наполнитель или растворитель и димер слитого белка по данному изобретению, вводят субъекту (например, парентерально, подкожно, внутривенно, внутримышечно и т.п.), где фармацевтическая композиция включает димер слитого белка по данному изобретению в концентрации от около 0,001 мг/мл до около 200 мг/мл, около 0,001 мг/мл до около 300 мг/мл, около 0,01 мг/мл до около 200 мг/мл, около 0,01 мг/мл до около 250 мг/мл, около 0,1 мг/мл до около 200 мг/мл, около 0,001 мг/мл до около 100 мг/мл, около 0,001 мг/мл до около 90 мг/мл, около 0,01 мг/мл до около 90 мг/мл, около 0,01 мг/мл до около 75 мг/мл, около 0,1 до около 80 мг/мл, около 0,1 до около 75 мг/мл, около 0,1 до около 60 мг/мл, около 0,1 до около 50 мг/мл, около 0,1 до около 40 мг/мл, около 0,1 до около 30 мг/мл, около 1 до около 90 мг/мл, около 1 до около 80 мг/мл, около 1 до около 75 мг/мл, около 1 до около 60 мг/мл, около 1 до около 50 мг/мл, около 1 до около 40 мг/мл, около 1 до около 30 мг/мл, около 1 до около 20 мг/мл, около 1 до около 10 мг/мл, около 1 до около 5 мг/мл, около 5 до около 90 мг/мл, около 5 до около 80 мг/мл, около 5 до около 75 мг/мл, около 5 до около 60 мг/мл, около 5 до около 50 мг/мл, около 5 до около 40 мг/мл, около 5 до около 30 мг/мл, около 5 до около 20 мг/мл, около 5 до около 10 мг/мл, около 1 до около 5 мг/мл, около 10 до около 75 мг/мл, около 25 мг/мл до около 75 мг/мл, около 30 мг/мл до около 60 мг/мл, около 25 до около 50 мг/мл, около 50 мг/мл до около 100 мг/мл, включая, например, около 1 мг/мл, 5 мг/мл, 10 мг/мл, около 15 мг/мл, около 25 мг/мл, около 30 мг/мл, около 40 мг/мл, около 50 мг/мл, около 60 мг/мл, около 70 мг/мл, около 80 мг/мл, около 90 мг/мл или 100 мг/мл. Предусматриваются другие концентрации. В некоторых способах изобретения, описанных здесь, включая некоторые терапевтические или профилактические способы, объем любой такой композиции (например, фармацевтической композиции), включающей слитый белок по данному изобретению в диапазоне от около 0,01 миллилитра (мл) до около 10 мл, около 0,01 мл до около 5 мл, около 0,1 мл до около 5 мл, около 0,5 мл до около 2 мл, около 1 мл до около 2 мл, включая, например, объем 0,01 мл, 0,025 мл, 0,05 мл, 0,1 мл, 0,2 мл, 0,3 мл, 0,4 мл, 0,5 мл, 0,75 мл, 1 мл, 2 мл, 3 мл, 4 мл, 5 мл, 10 мл, 20 мл, 25 мл, 50 мл, 75 мл, 100 мл, 200 мл, 250 мл, 300 мл, 500 мл, 1000 мл и т.п. вводят субъекту посредством отдельной в/в, п/к, в/м или и/п инъекции. Детали иллюстративных композиций по данному изобретению обсуждаются также в данном описании.
Эффективное количество или доза молекулы по данному изобретению, которую вводят конкретному субъекту, может варьировать в зависимости от, например, заболевания, нарушения или состояния, которое подлежит лечению, силы конкретной мутантной CTLA-4 молекулы по данному изобретению (а именно, ее эффективности) (например, мутантного димера CTLA-4-Ig слитого белка по данному изобретению), которое подлежит введению, способа введения молекулы и индивидуальной способности субъекта переносить специфическое количество конкретной молекулы. Например, в способе для подавления иммунного ответа у субъекта, имеющего ревматоидный артрит (РА) или способ лечения РА, эффективное количество или доза мутантного димера CTLA-4-Ig по данному изобретению (например, D3-29-IGg2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2, D3-75-IgG2 и т.п.), который подлежит введению субъекту, может быть определена на основе многих факторов, включая силу мутантного димера CTLA-4-Ig, способа введения димера и/или тяжести симптомов или признаков ревматоидного артрита у субъекта. В одном аспекте эффективное количество или доза конкретного мутантного димера CTLA-4-Ig по данному изобретению может быть определена путем сравнения силы такого мутантного димера CTLA-4-Ig с таковой у димера Orencia®. Дозы димера Orencia®, эффективные для лечения ревматоидного артрита и связанных нарушений, известны в области техники. Например, димер Orencia® вводят обычно внутривенно человеку, страдающему от ревматоидного артрита в дозе от около 10 мг Orencia® на килограмм (кг) веса тела человека. Мутантный димер CTLA-4-Ig по данному изобретению, который около в "X" раз сильнее, чем Orencia®, может быть введен (например, внутривенно, подкожно или другим образом, описанным здесь) человеку, страдающему от ревматоидного артрита, в дозе, которая около в "X" раз меньше, чем доза димера Orencia® для достижения терапевтического эффекта (например, подавления иммунного ответа), который приблизительно эквивалентен тому, который наблюдается для димера Orencia®. Если необходим больший терапевтический эффект, пропорционально увеличенное количество или доза мутантного димера CTLA-4-Ig может быть определена и введена человеку.
В любом из способов, описанных здесь, молекула или компонент по данному изобретению (например, полипептид (включая, например, димерный или мономерный слитый белок или полипептидный мультимер), конъюгат, нуклеиновая кислота, вектор, композиция и/или клетка по данному изобретению) может быть введен парентерально, подкожно или внутривенно или как описано в данном описании. Молекула или компонент по данному изобретению может быть введен в терапевтически эффективном количестве один, два, три или четыре раза в месяц, два раза в неделю, один раз в две недели (каждые две недели) или один раз в два месяца (каждые два месяца). Введение может продолжаться в течение периода 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев или дольше (например, один, два, три, четыре или более лет, в том числе в течение всей жизни субъекта).
Любой из способов, описанных здесь, может также включать введение субъекту эффективного количества, по меньшей мере, одного дополнительного терапевтического или иммуносупрессорного агента или соединения. Таким образом, например, изобретение обеспечивает способ подавления иммунного ответа, включающий введение субъекту, нуждающемуся в этом, (1) эффективного количества, по меньшей мере, одного первого иммуносупрессорного агента, где каждый такой первый иммуносупрессорный агент представляет собой полипептид, нуклеиновую кислоту, вектор, композицию и/или клетку по данному изобретению, и (2) эффективного количества, по меньшей мере, одного второго иммуносупрессорного агента, где иммунный ответ у субъекта подавляется.
Различные дополнительные терапевтические или иммуносупрессорные агенты (которые не являются молекулами по данному изобретению) могут быть использованы или введены вместе с молекулой по данному изобретению (например, полипептидом, нуклеиновой кислотой, вектором, композицией и/или клеткой по данному изобретению). Такие агенты включают, например, противоревматический препарат, модифицирующий заболевание (ППМЗ) (такойкак, например, метотрексат (МТХ), цитокиновый антагонист (например, IL-2 или IL-6 антагонист), стероидное соединение (например, кортикостероид, глюкостероид, например преднизон или метилпреднизон), нестероидное соединение, натрия или магния салицилат, ибупрофен, ацетилсалициловая кислота, ацетаминофен, антитело, биологический агент, который блокирует синтез продукции противовоспалительного цитокина, Raptiva® эфализумаб, противовоспалительный агент или соединение, и нестероидный противовоспалительный препарат (НПВП). Такой дополнительный терапевтический или иммуносупрессорный агент может быть введен субъекту в фармацевтической композиции, включающей дополнительный агент и фармацевтически приемлемый наполнитель или носитель. Эффективное количество или доза агента, подлежащего введению, будет зависеть от конкретного агента. Некоторые такие агенты на сегодняшний день используются в иммуносупрессорных терапиях, и приемлемые дозировки могут быть определены на основе заболевания, нарушения или состояния, подлежащего лечению, и способности субъекта переносить специфические количества или дозы и иммуносупрессорных эффективностей агента. Иллюстративные дозы для иммуносупрессорных агентов, описанных выше, которые не являются молекулами по данному изобретению, являются известными. Дополнительный иммуносупрессорный агент, который не является молекулой по данному изобретению, может быть введен одновременно с, или до, или после введения молекулы по данному изобретению (например, мутантного слитого белка CTLA-4-Ig).
Схема лечения, включая, например, дозу, график введения, способ введения (например, внутривенная инъекция, подкожная инъекция и т.п.) и фармацевтическую композицию, включающую, по меньшей мере, одну такую молекулу или компонент по данному изобретению, может варьировать в зависимости от заболевания, нарушения или состояния, подлежащего лечению. Одна или несколько таких молекул или компонентов по данному изобретению могут быть введены субъекту; каждая такая молекула или компонент необязательно требуют введения в одинаковой фармацевтической составы, одинаковыми способами введения, в одинаковом количестве или с одинаковым графиком частоты дозирования.
В некоторых таких способах, например, около 1 мл фармацевтической композиции, включающей фармацевтически приемлемый наполнитель, носитель или растворитель с концентрацией димера слитого белка по данному изобретению, составляющей около 50 мг/мл, вводят подкожно субъекту (например, взрослому человеку), нуждающемуся в иммуносупрессии (например, субъекту, страдающему от ревматоидного артрита). Такая начальная доза составляет 50 мг димера слитого белка. Для субъекта, имеющего вес тела около 100 кг, эта начальная доза соответствует 0,5 мг димера слитого белка на кг веса тела субъекта. Второе такое же количество вводят подкожно через одну или две недели после первой дозы. Также дозы вводят подкожно каждую неделю, раз в две недели или один раз в месяц или более или менее часто при необходимости. Полагают, что такие композиции и форматы введения пригодны, например, для лечения человека, страдающего от ревматоидного артрита или другого иммунного нарушения, при котором иммуносупрессия является желательной, или для ингибирования отторжения трансплантата ткани, клетки, участка ткани или органа от человека-донора человеку-реципиенту.
Способы лечения ревматоидного артрита
Ревматоидный артрит представляет собой одно из наиболее распространенных системных воспалительных аутоиммунных заболеваний и, как подсчитано, поражает 1-2% взрослого населения. Смотри, например, Dipiro, J. Т., Rheumatoid arthritis, в PHARMACOTHERAPY: A PATHOPHYSIOLOGIC APPROACH, 1671-1682 (Talbert, R.T. et al. eds., McGraw-Hill, New York, 6th ed. 2005). Заболевание характеризуется гиперплазией синовиальной мембраны и инфильтрацией воспалительных клеток, включая активированные Т-клетки. Активированные Т-клетки играют центральную роль в развитии ревматоидного артрита путем стимулирования различных клеточных типов для получения провоспалительных цитокинов, таких как IL-1, IL-6 и TNF-альфа, аутоантитела, и матричных металлопротеиназ (Hoffman, R.W., Front. Biosci. 6:1369-1378 (2001); Choy, E.K. et al., N. Engl. J. Med 344:907-916 (2001)). Весомый вклад Т-клеток в развитие ревматоидного артрита делает Т-клеточная активация, которая является рациональной мишенью для терапевтического вмешательства. Полагают, что такие воспалительные молекулы вызывают воспалительный ответ, повреждение ткани (например, повреждение сустава) и боль, связанную с ревматоидным артритом.
Костимуляция Т-клеток, опосредованная взаимодействиями между CD28 рецептором и CD80 и/или CD86 лигандом(ами) является необходимой для активации большинства Т-клеток (Riley, J. L. et al., Blood 105:13-21 (2005)). Показано, что терапевтические или профилактические агенты, которые являются антагонистами CD80/CD86 - CD28 костимуляторного пути, такие как Orencia® (Абатацепт) слитый белок, который является растворимым димерным hCTLA-4-Ig слитым белком, являются клинически эффективными в лечении ревматоидного артрита (Kremer, J. M. et al., Ann. Intern. Med. 144:865-876 (2006); Genovese, M.C. et al., N. Engl. J. Med. 353:1114-1123 (2005)). Полагают, что Абатацепт проявляет иммуносупрессорную функцию через связывание с CD80 и/или CD86 лигандами на антиген-презентирующих клетках при его введении субъекту (например, взрослому человеку) in vivo в терапевтически или профилактически эффективном количестве, таким образом, предотвращая взаимодействие каждого или обоих из этих лигандов с CD28 рецептором на Т-клетках.
В настоящее время доказана эффективность Абатацепта в лечении пациентов, которые являются взрослыми людьми с РА от средней до тяжелой степени, которые проявляли неадекватный ответ к одному или нескольким ППМЗ, таким как метотрексат или TNF антагонисты. Абатацепт вводят взрослому РА пациенту в дозе 10 мг/кг веса тела субъекта путем внутривенной инфузии. После первой дозы вторую и третью дозы 10 мг/кг слитого белка вводят субъекту через две и четыре недели соответственно после первый дозы. Последующие дозы вводят каждые четыре недели (а именно, один раз в месяц). Полагают, что внутривенная инфузия Абатацепта необходима для доставки высокого уровня дозировки, необходимого для получения желательной эффективности в терапии ревматоидного артрита.
Другие современные терапии ревматоидного артрита включают введение неспецифических иммуносупрессорных агентов, таких как метотрексат, и стероидных и нестероидных противовоспалительных препаратов. Дополнительно доказана эффективность биологических агентов, которые направлены на специфические провоспалительные цитокины, такие как TNF-α (например, Remicade® инфликсимаб, Enbrel® энтаерцепт, Humira® адалимумаб) и IL-1 (например, Kineret® анакинра). Тем не менее многие из этих способов терапии имеют значительные побочные эффекты - некоторые из которых являются токсичными - особенно при длительном приеме.
Несмотря на доступность различных способов терапии существует существенная неудовлетворенная необходимость для лечения РА. Например, 60% пациентов-людей с РА, которые имели неэффективное предыдущее ППМЗ лечение, и 80% пациентов-людей с РА, которые имели неэффективную предыдущую анти-TNF терапию, не достигали ACR50 показателей после лечения с Orencia в течение 6 месяцев (Kremer J.M. et al., Ann. Intern. Med. 144:865-876 (2006); Genovese, M.C. et al., N. Engl. J. Med. 353:1114-11 (2005)). Исследования ответа на дозу с применением Абатацепта и Белатацепта (LEA29Y-Ig) слитого белка в лечении РА у взрослых показали, что эффективность была дозозависимой и не была насыщенной при самом высоком уровне дозировки, который анализировался (Kremer, J.M. et al., N. Engl. J. Med. 349:1907-1915(2003); Moreland, L.W. et al., Arthrit. Rheum. 46:1470-1479 (2002)).
Растворимый димерный мутантный CTLA-4-Ig по данному изобретению, имеющий более высокую авидность связывания к hCD80 и/или hCD86, чем Абатацепт, как полагают, способен проявить более сильные иммуносупрессорные эффекты, чем Абатацепт при введении субъекту с РА. Такой мутантный CTLA-4-Ig связывает сходное количество CD80 и/или CD86 лигандов при более низкой концентрации, чем Абатацепт.
Мутантный CTLA-4-Ig с более высокой авидностью связывания к CD80 или CD86 и более низкой скоростью диссоциации от CD80 или CD86 соответственно имеет большее время нахождения на таком лиганде. Это увеличенное время нахождения, как полагают, связано с большей эффективностью in vivo. Предполагают, что такой мутантный CTLA-4-Ig может быть эффективным в терапевтическом или профилактическом лечении субъекта с РА в дозе, которая ниже, чем Абатацепт. То есть, полагают, что такой мутантный CTLA-4-Ig может достигать степени эффективности, эквивалентной таковой для Абатацепта, при введении субъекту с РА в дозе, которая меньше, чем при введении Абатацепта в дозе 10 мг/кг веса тела субъекта. Данное изобретение обеспечивает растворимые димерные мутантные слитые белки CTLA-4-Ig различных авидностей связывания к hCD80 и/или hCD86. Растворимые димерные мутантные слитые белки CTLA-4-Ig, которые имеют, по сути, более высокие авидности связывания к hCD86, чем Абатацепт, могут иметь степень эффективности, эквивалентную таковой у Абатацепта при введении субъекту с РА в дозе, которая по сути меньше, чем таковая для Абатацепта. Введение более низкой дозы такого мутантного CTLA-4-Ig может быть обеспечено использованием более приемлемого способа введения (например, подкожной инъекции), чем используют в настоящее время для введения Абатацепта (внутривенная инъекция).
Также предполагают, что растворимый мутантный слитый белок CTLA-4-Ig по данному изобретению с более высокой иммуносупрессорной силой, чем Абатацепт или Белатацепт слитый белок, будет обеспечивать более высокий уровень эффективности при лечении РА пациентов. Предполагают, что более иммуносупрессорный мутантный CTLA-4-Ig способен устранять симптомы, связанные с РА, и ингибировать развитие вредных физических эффектов РА более эффективно, чем Абатацепт. Такой мутантный CTLA-4-Ig может быть сформулирован в фармацевтически приемлемом растворителе, наполнителе или носителе (например, PBS) в концентрации в диапазоне от 0,1 до 200 мг/мл. Лечение субъекта с РА может быть достигнуто путем введения субъекту терапевтически или профилактически эффективного количества (дозы) мутантного CTLA-4-Ig посредством подкожной инъекции или внутривенной инфузии при приемлемо определенной частоте дозировки (например, начальная доза с последующей одной дозой 2-4 раза в месяц, одна доза в месяц или одна доза каждые два месяца). Доза будет зависеть от тяжести заболевания или симптомов субъекта. Например, может быть введено количество или доза мутантного CTLA-4-Ig не более чем около 10 мг/кг (включая, например, около 1 мг/кг, 0,5 мг/кг, 0,25 мг/кг, 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг или 9 мг/кг) веса тела субъекта. Более иммуносупрессорный мутантный CTLA-4-Ig может позволять менее частый график дозировки (например, один раз каждые два месяца), чем график дозировки, который обычно используют с Абатацептом. Альтернативно, количество или доза мутантного CTLA-4-Ig больше, чем около 10 мг/кг веса субъекта (например, от около 10 мг/кг до около 100 мг/кг, от около 10 мг/кг до около 25 мг/кг, около 10 мг/кг до около 50 мг/кг, около 10 мг/кг до около 75 мг/кг и т.п., включая, например, около 15 мг/кг, 20 мг/кг, 30 мг/кг, 40 мг/кг, 50 мг/кг, 60 мг/кг, 70 мг/кг, 75 мг/кг, 80 мг/кг, 90 мг/кг, 100 мг/кг) может быть введено субъекту с РА, если болезненное состояние и/или симптомы субъекта требуют такого количества или дозы.
Эффективное количество или доза мутантного димера CTLA-4-Ig по данному изобретению для лечения РА у человека, страдающего от него, может быть определено на основе различных факторов, таких как сила мутантного димера CTLA-4-Ig, способ введения димера и/или тяжесть симптомов или признаков ревматоидного артрита у субъекта. Например, эффективное количество или доза мутантного димера CTLA-4-Ig по данному изобретению может быть определена путем сравнения силы такого димера с таковой для Orencia® димера и определения количества или дозы мутантного димера CTLA-4-Ig, которая будет обеспечивать желательный иммуносупрессорный эффект по сравнению с Orencia® (например, улучшенный или приблизительно эквивалентный эффект) на основании количества или дозы Orencia®, которую обычно вводят человеку-субъекту, проявляющему сходные симптомы или признаки РА.
В одном варианте осуществления изобретения, например, изобретение обеспечивает способ лечения ревматоидного артрита у субъекта, который нуждается в таком лечении, где способ включает введение субъекту эффективного количества растворимого димерного мутантного слитого белка CTLA-4-Ig по данному изобретению путем, например, внутривенной или подкожной инъекции. Эффективное количество или дозу, которая может включать от около 0,001 миллиграммов (мг) до около 10 миллиграммов на килограмм (кг) веса тела субъекта, включая, но не ограничиваясь следующим, например, от около 0,01 мг/кг до около 10 мг/кг веса субъекта, от около 0,05 мг/кг, 0,1 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 1 мг/кг, 2 мг/кг, 5 мг/кг, 6 мг/кг, 7 мг/кг, 8 мг/кг, 9 мг/кг или 10 мг/кг веса тела взрослого человека-пациента вводят субъекту. В некоторых случаях эффективное количество или доза составляет от около 2 до 10 мг/кг, около 3 до 10 мг/кг, около 3 до 5 мг/кг, около 5 до 10 мг/кг, 0,1 до 5 мг/кг веса, около 0,05 до 1,0 мг/кг, около 0,05 до 3 мг/кг веса, около 0,05 до 2,0 мг/кг, около 0,05 до 1,0 мг/кг, около 0,05 до 2,0 мг/кг, около 0,1 до 2,0 мг/кг, около 0,1 до 3,0 мг/кг, около 0,1 до 0,5 мг/кг, около 0,1 до 0,8 мг/кг, около 0,1 до 0,6 мг/кг, около 0,2 до 1 мг/кг, около 0,2 до 0,6 мг/кг, около 0,2 до 0,5 мг/кг около 0,3 до 1 мг/кг, около 0,3 до 0,6 мг/кг, около 0,3 до 0,5 мг/кг веса субъекта. В некоторых случаях эффективное количество или доза составляет менее чем около 500 мг для субъекта, который весит меньше чем 60 кг (например, менее чем около 100 мг, 75 мг, 50 мг, 25 мг или 12,5 мг), менее чем около 750 мг для субъекта, который весит между 60-100 кг (например, менее чем около 150 мг, 100 мг, 75 мг, 37,5 мг или 20 мг), или менее чем около 1000 мг для субъекта, который весит более чем 100 кг (например, менее чем около 500 мг, 100 мг, 50 мг, 25 мг или 10 мг). После первой дозы, последующие эквивалентные дозы вводят с интервалами 1, 2, 4, 8, 10, 12, 14 или 16 недель. Частоту последующих дозировок определяют при необходимости.
Такое мутантное слияние CTLA-4-Ig может быть сформулировано с фармацевтически приемлемым наполнителем, носителем или растворителем для получения фармацевтической композиции, приемлемой для введения субъекту (например, млекопитающему, включая человека). Концентрация слитого белка в композиции может быть в диапазоне от около 0,01 мг/мл до около 300 мг/мл или от около 0,01 мг/мл до около 200 мг/мл, включая, но не ограничиваясь следующим, например, от около 0,1 мг/мл до около 300 мг/мл, от около 0,1 мг/мл до около 200 мг/мл, от около 0,1 мг/мл до около 100 мг/мл, от около 0,5 мг/мл до около 100 мг/мл, от около 0,5 мг/мл до около 50 мг/мл, от около 1 до около 100 мг/мл, от около 1 до около 75 мг/мл, от около 5 до около 75 мг/мл, от около 10 до около 75 мг/мл, от около 10 до около 60 мг/мл, от около 25 до около 60 мг/мл, от около 30 до около 60 мг/мл, от около 25 до около 50 мг/мл, от около 40 до около 50 мг/мл, от около 25 мг/мл или около 50 мг/мл. Другие композиции, включая те, что обсуждались выше и ниже, также включены в объем данного изобретения.
Предполагают, что такое лечение снижает один или несколько признаков и/или симптомов, связанных с ревматоидным артритом, таких как, например, воспаление, болезненность сустава, опухание сустава, боль и тугоподвижность, у субъекта. Такое лечение может снижать также развитие заболевания у пациента. Например, такое лечение может снижать развитие структурного повреждения у пациента. Такое лечение может улучшать физическое функционирование субъекта.
Способы ингибирования отторжения трансплантата ткани, клетки, участка ткани или органа
В другом аспекте изобретение обеспечивает способ ингибирования отторжения или подавления иммунного ответа, связанного с трансплантацией ткани, клетки, кожи или органа от донору субъекту-реципиенту, где способ включает введение субъекту-реципиенту терапевтически эффективного количества одного или нескольких из следующего: (1) полипептид по данному изобретению (например, мутантный полипептид CTLA-4-ВКД или димерный или мономерный мутантный слитый белок CTLA-4-Ig); (2) мультимер, включающий один или несколько полипептидов по данному изобретению (например, димер, включающий любые два таких полипептида, или тетрамер, включающий любые четыре таких полипептида); (3) конъюгат, включающий, по меньшей мере, один полипептид по данному изобретению; (4) нуклеиновая кислота по данному изобретению (например, нуклеиновая кислота, кодирующая полипептид по данному изобретению); (5) вектор, включающий нуклеиновую кислоту по данному изобретению или кодирующий полипептид по данному изобретению; (6) клетка или популяция клеток, включающая полипептид, нуклеиновую кислоту, конъюгат и/или вектор по данному изобретению; и/или (7) композиция по данному изобретению, тем самым ингибируя отторжение трансплантата ткани, клетки, кожи или органа субъектом-реципиентом. Донор и реципиент могут быть одинаковыми видами или различными видами. Донор или реципиент может быть млекопитающим, таким как человек, нечеловеческий примат (например, мартышка, горилла), овца, кошка, собака, свинья, корова, лошадь и т.п.
В некоторых таких способах полипептид, конъюгат, вектор и/или клетку по данному изобретению вводят субъекту-реципиенту до, одновременно или после трансплантации ткани, клетки, кожи или органа. Эффективное количество обычно включает от около 0,001 мг/кг веса субъекта до около 200 мг/кг веса тела субъекта. В некоторых таких способах, например, эффективное количество включает от около 0,001 миллиграммов на килограмм (мг/кг) веса субъекта до, по меньшей мере, около 0,005, 0,01, 0,05, 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 10, 25, 50, 75, 100, 125, 150, 175, 200, 225, 250 или 300 миллиграммов на килограмм (мг/кг) веса тела субъекта. В некоторых таких способах эффективное количество включает от около 0,001 миллиграммов на килограмм (мг/кг) веса субъекта до, по меньшей мере, около 0,005, 0,01, 0,05, 0,1, 0,2, 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 25, 50 или 75 миллиграммов на килограмм (мг/кг) веса тела субъекта. Полипептид, конъюгат, нуклеиновая кислота, вектор и/или клетка по данному изобретению может быть введен субъекту-реципиенту в процессе, до или непосредственно после трансплантации. Альтернативно или дополнительно, такая молекула по данному изобретению может быть введена через один или несколько часов после трансплантации, на следующий день после трансплантации и/или ежедневно после этого, или, по меньшей мере, один раз в неделю, по меньшей мере, один раз в две недели, или, по меньшей мере, один раз в месяц после трансплантации, при необходимости, до 12, 24 или 36 или более месяцев или дольше при необходимости. Трансплантат органа может включать любой орган, такой как, например, почка, печень, сердце или легкое.
Эффективное количество или доза мутантной молекулы CTLA-4 по данному изобретению (например, мутантного димера слитого белка CTLA-4-Ig), подлежащей введению в субъект-реципиент трансплантат органа, ткани или клетки, с тем чтобы ингибировать отторжение трансплантата (или подавлять иммунный ответ, связанный с таким трансплантатом), обычно определяют на основе силы такой молекулы, способа введения, типа трансплантации (например, клетки, ткани, органа), анамнеза и/или тяжести симптомов или признаков у субъекта-реципиента трансплантата иммунного(ых) ответа(ов), подтверждающих отторжение трансплантата. Например, эффективное количество или доза мутантного димера CTLA-4-Ig по данному изобретению (например, D3-29-IGg2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2, D3-75-IgG2 димера и т.п.) может быть определена путем сравнения силы такого димера с таковой у димера Белатацепт. Эффективные дозы Белатацепта, пригодные для предотвращения или подавления иммунного ответа, связанного с трансплантацией почки/почечной трансплантацией, являются известными. Например, Белатацепт вводят путем внутривенной инфузии человеку после трансплантации почки человеку от донора почки в количестве или дозе около 5 мг или 10 мг на килограмм веса тела человека в месяц. Мутантный димер CTLA-4-Ig по данному изобретению, который около в "X" раз более сильный, чем Белатацепт, может быть введен (например, внутривенно, подкожно или другим способом, описанным здесь) человеку, который имеет трансплантат почки в количестве или дозе, которая в около "X" раз меньше, чем доза Белатацепта для достижения терапевтического эффекта (например, подавления иммунного ответа), приблизительно эквивалентного таковому для Белатацепта. Если необходим больший терапевтический эффект, то может быть определено и введено пропорционально увеличенное количество или доза димера слитого белка CTLA-4-Ig по данному изобретению.
В другом аспекте изобретение обеспечивает способ лечения отторжения трансплантата ткани, клетки или органа (например, отторжение трансплантата цельного органа (например, почки, печени, легкого, сердца и т.п.)) у субъекта, который получил такую ткань, клетку или орган от донора, где способ включает введение реципиенту терапевтически эффективного количества, по меньшей мере, одного полипептида, конъюгата, нуклеиновой кислоты, вектора и/или клеток по данному изобретению, тем самым, ингибируя отторжение донорского трансплантата ткани, клетки или органа субъектом-реципиентом. Полипептид, конъюгат, нуклеиновая кислота, вектор и/или клетки по данному изобретению могут быть введены субъекту до, одновременно или после трансплантации клетки, ткани или органа.
В одном аспекте изобретение обеспечивает способ ингибирования отторжения трансплантации островковой клетки от донору субъекту-реципиенту, нуждающемуся в этом, где способ включает введение субъекту эффективного количества или дозы мутантной молекулы CTLA-4 по данному изобретению (например, мутантного слитого белка CTLA-4-Ig) до, одновременно или после трансплантации островковой(ых) клетки(ок) из поджелудочной железы донора субъекту. Субъект (например, человек) обычно страдает от диабета (например, IDDM), и такой способ пригоден для лечения субъекта, которому поставили диагноз или страдающего от диабета. Процедуры трансплантации островка поджелудочной железы известны в области техники. Типично, островки поджелудочной железы удаляют из поджелудочной железы умершего донора органа, очищают и обрабатывают и имплантируют субъекту-реципиенту, страдающему от диабета. После трансплантации бета-клеток в островки поджелудочной железы начинают вырабатывать и высвобождать инсулин, тем самым снижая потребность субъекта-реципиента в инсулине.
В таких способах ингибирования отторжения трансплантата мутантная молекула CTLA-4 по данному изобретению (например, мутантный CTLA-4-Ig) может быть сформулирована с фармацевтически приемлемым наполнителем, носителем или растворителем, чтобы образовать фармацевтическую композицию, приемлемую для введения субъекту (например, млекопитающему, включая человека). Некоторые такие способы включают введение фармацевтической композиции, включающей фармацевтически приемлемый наполнитель, носитель или растворитель и мутантный димер CTLA-4-Ig по данному изобретению, имеющий концентрацию от около 0,01 мг/мл до около 300 мг/мл или около 0,01 мг/мл до около 200 мг/мл, включая, но не ограничиваясь следующим, например, от около 0,1 мг/мл до около 300 мг/мл, от около 0,1 мг/мл до около 200 мг/мл, около 0,1 мг/мл до около 100 мг/мл, около 0,5 мг/мл до около 100 мг/мл, около 0,5 мг/мл до около 50 мг/мл, около 1 до около 100 мг/мл, около 1 до около 75 мг/мл, около 5 до около 75 мг/мл, около 10 до около 75 мг/мл, около 10 до около 60 мг/мл, около 25 до около 60 мг/мл, около 30 до около 60 мг/мл, около 25 до около 50 мг/мл, около 40 до около 50 мг/мл, около 25 мг/мл или около 50 мг/мл. Другие композиции, включая те, что детально обсуждаются выше и ниже также включены в объем изобретения.
Способы ингибирования иммунного ответа
В другом аспекте данное изобретение включает применение полипептида (включая, например, димерный или мономерный слитый белок или мультимерный полипептид), конъюгата, нуклеиновой кислоты, вектора или клетки по данному изобретению для производства медикамента для ингибирования или подавления иммунного ответа у млекопитающего (например, человеческого или нечеловеческого примата). Иммунные ответы, которые могут быть подавлены, включают, например, Т-клеточную активацию или пролиферацию, синтез или продукцию цитокина, индукцию маркеров активации, синтез или продукцию воспалительных молекул, воспаление, продукцию антиколлагеновых AT, Т-клеточно-зависимый AT ответ.
Изобретение также включает применение полипептида (включая, например, димерный или мономерный слитый белок или мультимерный полипептид), конъюгата, нуклеиновой кислоты, вектора или клетки по данному изобретению для производства медикамента для лечения иммунного заболевания или нарушения. Иммунное заболевание или нарушение может быть таким, которое опосредовано взаимодействием Т-клеток с CDSO-позитивными клетками и/или СВ86-позитивными клетками у млекопитающего. Иммунное заболевание или нарушение может быть заболеванием или заболеванием иммунной системы, таким как ревматизм, или нарушением или аутоиммунным заболеванием или аутоиммунным нарушением. Такое иммунное заболевание или нарушение может быть или включает, например, но не ограничивается следующим:
Аддисонова болезнь, аллергия, круговая алопеция, болезнь Альцгеймера, васкулит, связанный с антинейтрофильными цитоплазматическими антителами (АНЦА), анкилозирующий спондилит, антифофсолипидный синдром (синдром Хьюза), артрит, астма, атеросклероз, атеросклеротическая бляшка, аутоиммунное заболевание (например, волчанка, PA, PC, диффузный токсический зоб и т.п.), аутоиммунная гемолитическая анемия, аутоиммунный гепатит, аутоиммунное заболевание внутреннего уха, аутоиммунный лимфопролиферативный синдром, аутоиммунный миокардит, аутоиммунный оофорит, аутоиммунный орхит, азооспермия, болезнь Бехчета, синдром Бехчета, болезнь Бергера, буллезный пемфигоид, кардиомиопатия, сердечнососудистое заболевание, целиакия-спру/глютеновая энтеропатия, синдром хронической усталости и дисфункции иммунной системы (СХУДИС), хронический идиопатический полиневрит, хроническая воспалительная демиелинизация, полирадикулоневропатия (CIPD), хроническая рецидивирующая полиневропатия (синдром Гийена-Барре), синдром Черджа-Стросса (СЧС), рубцовый пемфигоид, синдром холодовой агглютинации (СХА), ХОБЛ, CREST-синдром, болезнь Крона, дерматит, герпетиформное заболевание, дерматомиозит, диабет, дискоидная волчанка, экзема, приобретенный буллезный эпидермоз, эссенциальная криоглобулинемия смешанного типа, синдром Эвана, экзофтальм, фибромиалгия, синдром Гудпасчера, заболевание или нарушение, связанное с трансплантатом, диффузный токсический зоб, РТПХ, тиреоидит Хашимото, идиопатический фиброз легких, идиопатическая тромбоцитопения пурпура (ИТП), IgA нефропатия, иммунопролиферативное заболевание или нарушение (например, псориаз), воспалительная болезнь кишечника (ВБК), инсулинозависимый сахарный диабет (ИЗСД), интерстициальное заболевание легких, ювенильный диабет, ювенильный артрит, ювенильный идиопатический артрит (ЮИА), синдром Кавасаки, миастенический синдром Ламберат-Итона, лишай Вильсона, волчанка, волчаночный нефрит, Lymphoscytic Lypophisitis, болезнь Меньера, синдром Миллера-Фишера/острая рассеянная энцефаломиелорадикулопатия, смешанное заболевание соединительной ткани, рассеянный склероз (PC), фиброзит, миалгический энцефаломиелит (МЭ), миастения гравис, воспаление глаза, листовидная пузырчатка, обыкновенная пузырчатка, злокачественная анемия, нодозный полиартериит, полихондрия, плюриграндулярные синдромы (синдром Витакера), ревматическая полимиалгия, полимиозит, первичная агаммаглобулинемия, первичный биллиарный цирроз/аутоиммунная холангиопатия, псориаз, псориазный артрит, феномен Рейно, синдром Рейтера/реактивный артрит, рестеноз, ревматическая атака, ревматизм, ревматоидный артрит, саркоидоз, синдром Шмидта, склеродерма, Синдром Шегрена, отторжение трансплантата цельного органа (почки, сердца, печени, легкого и т.п.), синдром скованного человека, системная красная волчанка (СКВ), системная склеродерма, синдром Такаясу, височный артериит/гигантоклеточный артериит, тиреоидит, диабет 1 типа, диабет 2 типа, язвенный колит, увеит, васкулит, витилиго, гранулематоз Вегенера и предупреждение или подавление иммунного ответа, связанного с отторжением донорской ткани, клетки, участка ткани или органа или органа, пересаженного субъекту-реципиенту.
Изобретение также обеспечивает применение полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки по данному изобретению для производства медикамента для ингибирования взаимодействия CD80-позитивных клеток и/или CD86-позитивных клеток с CD28-позитивными и/или CTLA-4-позитивными Т-клетками. В другом аспекте данное изобретение включает применение полипептида, конъюгата, нуклеиновой кислоты, вектора или клетки по данному изобретению для производства медикамента для лечения отторжения трансплантата ткани или органа (например, отторжение трансплантата цельного органа (например, почки, легкого, печени, сердца и т.п.)) у млекопитающего.
Оценка иммунных ответов
Иммунные ответы, подавляемые полипептидом, нуклеиновой кислотой, вектором, вирусом, псевдовирусом, ВПЧ или композицией по данному изобретению могут быть измерены любой приемлемой методикой. Примеры пригодных методик по оценке иммунных ответов включают следующее: проточная цитометрия, исследования иммуноблоттингом, иммуногистохимические исследования, исследования иммунопреципитации, радиоиммуноанализы (РИА) и ферментные иммуноанализы. Ферментные иммуноанализы включают фермент-связанные иммунопроточные анализы (ELIFA) и фермент-связанные иммуносорбентные анализы (ELISA), включая сэндвич ELISA и конкурентные ELISA исследования. ВЭЖХ и капиллярный электрофорез (КЭ) также могут быть использованы в иммуноанализах для определения комплексов антител и веществ-мишеней. Основное руководство, обеспечивающее такие методики и связанные принципы, описано в, например, Harlow and Lane (1988) ANTIBODIES, A LABORATORY MANUAL, Cold Spring Harbor Publications, New York, Hampton R et al. (1990) SEROLOGICAL METHODS A LABORATORY MANUAL, APS Press, St. Paul Minn., Stevens (1995) CLINICAL IMMUNOLOGY AND SEROLOGY: A LABORATORY PERSPECTIVE, CRC press, Bjerrum (1988) HANDBOOK OF IMMUNOBLOTTING OF PROTEINS, Vol.2, Zoa (1995) DIAGNOSTIC IMMUNOPATHOLOGY: LABORATORY PRACTICE AND CLINICAL APPLICATION, Cambridge University Press, Folds (1998) CLINICAL DIAGNOSTIC IMMUNOLOGY: PROTOCOLS IN QUALITY ASSURANCE AND STANDARDIZATION, Blackwell Science Inc., Bryant (1992) LABORATORY IMMUNOLOGY & SEROLOGY 3rd edition, W В Saunders Co., and Maddox D E et al. (1983) J. Exp. Med. 158:1211. Руководство в отношении ELISA методик и связанные принципы описано в, например, Reen (1994) Methods Mol. Biol. 32:461-6, Goldberg et al. (1993) Curr. Opin. Immunol. 5(2):278-81, Voller et al. (1982) Lab. Res. Methods Biol. Med. 5:59-81, Yolken et al. (1983) Ann. NY Acad. Sci. 420:381-90, Vaughn et al. (1999) Am. J. Trop. Med. Hyg. 60(4):693-8, and Kuno et al. (1991) J. Virol. Methods 33(1-2): 101-13. Руководство в отношении проточной цитометрии обеспечено в, например. Diamond (2000) IN LIVING COLOR: PROTOCOLS IN FLOW CYTOMETRY AND CELL SORTING, Springer Verlag, Jaroszeki (1998) FLOW CYTOMETRY PROTOCOLS, 1st Ed., Shapiro (1995) PRACTICAL FLOW CYTOMETRY, 3rd edition, Rieseberg et al. (2001) Appl. Microbiol. Biotechnol. 56(3-4):350-60, Scheffold and Kem (2000) J. Clin. Immunol. 20(6):400-7, and McSharry (1994) Clin. Microbiol. Rev. (4):576-604.
Цитотоксические и другие Т-клеточные иммунные ответы также могут быть измерены любой приемлемой методикой. Примеры таких методик включают ELISpot анализ (в частности, IFN-гамма ELISpot), внутриклеточное цитокиновое окрашивание (ВЦО) (в частности в комбинации с FACS анализом), окрашивание CD8+ Т-клеточного тетрамера/FACS, стандартные и модифицированные анализы Т-клеточной пролиферации, CTL (цитотоксические Т-лимфоциты) анализ высвобождения хрома, анализ ограниченных разведении (АОР, или LDA), и CTL киллинг исследования. Руководство и принципы, относящиеся к исследованиям Т-клеточной пролиферации, описаны в, например, Plebanski and Burtles (1994) J. Immunol. Meth. 170:15, Sprent et al. (2000) Philos. Trans. R. Soc. Lond. В Biol. Sci. 355(1395):317-22 and Messele et al. (2000) Clin. Diagn. Lab. Immunol. 7(4):687-92. LDA описаны в, например, Sharrock et al. (1990) Immunol. Today 11:281-286. ELISpot исследования и связанные принципы описаны в, например, Czerinsky et al. (1988) J. Immunol. Meth. 110:29-36, Olsson et al. (1990) J. Clin. Invest. 86:981-985, Schmittel et al. (2001) J. Immunol. Meth. 247(1-2): 17-24, Ogg и McMichael (1999) Immunol. Lett. 66(1-3):77-80, Schmittel et al. (2001) J. Immunol. Meth. 247(1-2): 17-24, Kurane et al. (1989) J. Exp. Med. 170(3):763-75, Chain et al. (1987) J. Immunol. Meth. 99(2):221-8, Czerkinsky et al. (1988) J. Immunol. Meth. 110:29-36, и Патентах США №5750356 и 6218132. Тетрамерные исследования обсуждаются в, например, Skinner et al. (2000) J. Immunol. 165(2):613-7. Другие Т-клеточные аналитические методики описаны в Hartel et al. (1999) Scand. J. Immunol. 49(6):649-54 и Parish et al. (1983) J. Immunol. Meth. 58(1-2):225-37.
Т-клеточная активация также может быть проанализирована с помощью измерения CTL активности или экспрессии активации антигенов, таких как IL-2 рецептор, CD69 или HLA-DR молекулы. Пролиферация очищенных Т-клеток может быть измерена в анализе реакции смешанной культуры лимфоцитов (СКЛ-реакция); такие исследования являются хорошо известными в данной области техники.
ELISpot исследования измеряют количество Т-клеток, секретирующих специфический цитокин, такой как IFN-γ или TNF-α, который служит маркером Т-клеточных эффекторов. Цитокин-специфические ELISA наборы являются коммерчески доступными (например, IFN-γ-специфический ELISPot доступен от R&D Systems, Minneapolis, MN).
Дополнительные способы оценки и измерения способности молекул по данному изобретению (например, полипептидов по данному изобретению, включая, например, растворимые мутантные слитые белки CTLA-4-Ig по данному изобретению) подавлять или ингибировать Т-клеточную активацию и/или Т-клеточную пролиферацию описаны в примерах 5-8 в разделе Примеры ниже.
Способы введения
В любом из способов, описанных здесь, фармацевтическая композиция для инъекции, включающая соответствующий фармацевтически приемлемый наполнитель или носитель (например, PBS) и эффективное количество молекулы по данному изобретению, такой как полипептид (например, мутантный CTLA-4 ВКД или мономерный, димерный или мультимерный мутантный CTLA-4-Ig) или конъюгат по данному изобретению, может быть введена парентерально, внутримышечно, интраперитониально, внутривенно, субдермально, трансдермально, подкожно или внутрикожно хозяину. Альтернативно, могут быть использованы биолистические методики доставки белка (доставка вакцинной пушкой) (примеры которых обсуждаются в данном описании). Любая другая приемлемая методика также может быть использована. Введение полипептида может быть облегчено с помощью липосом. Любая такая методика доставки может использоваться для доставки полипептида или конъюгата по данному изобретению вместе с любым терапевтическим или профилактическим способом, описанным здесь.
Поскольку нижеследующее обсуждение в первую очередь относится к нуклеиновым кислотам, следует понимать, что оно в равной степени относится к векторам нуклеиновых кислот по данному изобретению. Нуклеиновая кислота по данному изобретению или их композиция может быть введена хозяину любым приемлемым путем введения. В некоторых аспектах изобретения введение нуклеиновой кислоты является парентеральным (например, подкожным (s.c), внутримышечным (Im.) или внутрикожным (Id.)), местным или трансдермальным. Нуклеиновая кислота может быть введена непосредственно в ткань, такую как мышца, с помощью инъекции с применением иглы или другого подобного устройства. Смотри, например, Nabel et al. (1990), выше; Wolffet al. (1990) Science 247:1465-1468), Robbins (1996) Gene Therapy Protocols, Humana Press, NJ, and Joyner (1993) Gene Targeting: A Practical Approach, IRL Press, Oxford, England, и Патенты США №5580859 и 5589466. Другие способы, такие как "биолистическая" или опосредованная частицами трансформация (смотри, например. Патенты США №4945050 и 5036006, Sanford et al., J. Particulate Sci. Tech. 5:27-37 (1987), Yang et al., Proc. Natl. Acad. Sci. USA 87:9568-72 (1990), и Williams et al., Proc. Natl. Acad. Sci. USA 88:2726-30 (1991)). Эти способы пригодны не только для in vivo встраивания ДНК в субъект, такой как млекопитающее, но также для ех vivo модификации клеток для повторного встраивания в млекопитающее (что также обсуждается в данном описании).
Для стандартного введения генной пушкой, вектор или нуклеиновая кислота, представляющая интерес, преципитируются на поверхности микроскопических металлических гранул. Микропроекторы разгоняют ударной волной или расширяющимся газом гелия, они проникают в ткани на глубину нескольких слоев клеток. Например, Accel™ Прибор Доставки Гена, произведенный Agacetus, Inc. Middleton WI, является приемлемым для применения в этом варианте осуществления. Нуклеиновая кислота или вектор могут быть введены с помощью таких методик, например, внутримышечно, внутрикожно, субдермально, подкожно и/или интраперитониально. Дополнительные устройства и методики, относящиеся к биолистической доставке, можно найти в Публикациях Международных Заявок WO 99/2796, WO 99/08689, WO 99/04009 и WO 98/10750 и Патентах США №5525510, 5630796, 5865796 и 6010478.
Нуклеиновая кислота может быть введена вместе с агентом, облегчающим трансфекцию, примеры которого обсуждались выше. Нуклеиновая кислота может быть введена местно и/или с помощью доставки липидными частицами (в отличие от биолистической доставки твердыми частицами). Примеры таких методик доставки нуклеиновой кислоты, композиции и дополнительные конструкты, которые могут быть приемлемыми в качестве носителей для доставки нуклеиновых кислот по данному изобретению, обеспечиваются в, например, Патентах США №5591601, 5593972, 5679647, 5697901, 5698436, 5739118, 5770580, 5792751, 5804566, 5811406, 5817637, 5830876, 5830877, 5846949, 5849719, 5880103, 5922687, 5981505, 6087341, 6107095, 6110898 и Публикациях Международных заявок № WO 98/06863, WO 98/55495 и WO 99/57275.
Альтернативно, нуклеиновая кислота может быть введена хозяину способом генной доставки на основе липосом. Иллюстративные методики и принципы, относящиеся к генной доставке на основе липосом, обеспечиваются в, например, Debs and Zhu (1993) WO 93/24640; Mannino and Gould-Fogerite (1988) Biotechniques 6(7):682-691; Rose Патент США №5279833; Brigham (1991) Публикации Международной Заявки WO 91/06309; Brigham et al. (1989) Am. J. Med. Sci. 298:278-281; Nabel et al. (1990) Science 249:1285-1288; Hazinski et al. (1991) Am. J. Resp. Cell Molec. Biol. 4:206-209; и Wang и Huang (1987) Proc. Natl. Acad. Sci. USA 84:7851-7855), и Feigner et al. (1987) Proc. Natl Acad. Sci. USA 84:7413-7414). Приемлемые липосомные фармацевтически приемлемые композиции, которые могут быть использованы для доставки нуклеиновой кислоты, также описаны здесь.
Любое количество нуклеиновой кислоты по данному изобретению может быть использовано в способах по данному изобретению. Например, необходимая нуклеиновая кислота может быть сформулирована в фармацевтически приемлемом наполнителе или носителе и вводиться субъекту, так что кодируемый полипептид или конъюгат производятся в субъекте в количестве, которое считают эффективным для того, чтобы, например, подавлять иммунный ответ у субъекта, ингибировать взаимодействие между эндогенными В7-позитивными клетками и CD28-позитивными клетками у субъекта или ингибировать отторжение трансплантата ткани, клетки, органа или участка ткани или органа. В одном формате, когда нуклеиновую кислоту вводят с помощью инъекции, то вводят от около 50 микрограмм (мкг) до 100 мг нуклеиновой кислоты. В одном иллюстративном применении, чтобы подавить иммунный ответ, фармацевтическую композицию, включающую PBS и количество ДНК вектора, который кодирует эффективное количество мутантного полипептида CTLA-4, вводят с помощью инъекции или электропорации или другим приемлемым способом доставки (например, генной пушкой, проникающей через кожу, и липофекцией) субъекту, нуждающемуся в лечении (например, субъекту, страдающему от иммунного заболевания или нарушения, при котором иммуносупрессорное лечение является желательным). Иллюстративный вектор показан на фигуре 1.
Количество ДНК плазмиды для применения в способах по данному изобретению, когда введение осуществляют посредством генной пушки, например, составляет часто в от около 100 до около 1000 раз меньшее, чем количество, используемое для прямой инъекции (например, посредством стандартной инъекции иглой). Несмотря на такую чувствительность, по меньшей мере, около 1 мкг нуклеиновой кислоты может быть использовано в таких методиках биолистической доставки.
РНК или ДНК вирусные векторные системы могут быть пригодны для доставки нуклеиновых кислот, кодирующих полипептиды по данному изобретению. Вирусные векторы могут быть введены напрямую субъекту in vivo, или они могут быть использованы для обработки клеток in vitro, и модифицированные клетки вводят субъекту в формате ех vivo. Пригодные вирусные векторы включают те, которые обсуждались выше, такие как аденоассоциированные, аденовирусные, ретровирусные, лентивирусные и вирусные векторы простого герпеса. С такими вирусными векторами нуклеиновая кислота по данному изобретению может быть без труда трансфектирована в клетки и ткани-мишени субъекта. Дополнительно с ретровирусными, лентивирусными и аденоассоциированными вирусными способами переноса генов может быть возможна интеграция нуклеиновой кислоты по данному изобретению в геном хозяина, тем самым, приводя к продолжительной экспрессии встроенной нуклеиновой кислоты.
Доставка вирусного вектора по данному изобретению, включающего, по меньшей мере, одну нуклеиновую кислоту по данному изобретению субъекту, как считают, способна подавлять иммунный ответ у субъекта, которому вводят вектор. Необязательно, некоторые профилактические и/или терапевтические способы по данному изобретению практикуют с дозировкой приемлемого вирусного вектора, достаточной, чтобы ингибировать определяемый иммунный ответ. Любой приемлемый вирусный вектор, включающий нуклеиновую кислоту по данному изобретению, в любой приемлемой концентрации, может быть использован, чтобы подавлять иммунный ответ. Например, субъекту-хозяину может быть введена популяция ретровирусных векторов (примеры которой описаны в, например, Buchscher et al. (1992) J. Virol. 66(5) 2731-2739, Johann et al. (1992) J. Virol. 66 (5):1635-1640 (1992), Sommerfelt et al. (1990) Virol. 176:58-59, Wilson et al. (1989) J. Virol. 63:2374-2378, Miller et al., J. Virol. 65:2220-2224 (1991), Wong-Staal et al., PCT/US94/05700, Rosenburg и РППК i (1993) в FUNDAMENTAL IMMUNOLOGY, Третье издание Paul (ed.) Raven Press, Ltd., New York и ссылках в них), AAV вектор (как описано в, например. West et al. (1987) Virology 160:38-47, Kotin (1994) Human Gene Therapy 5:793-801, Muzyczka (1994) J. Clin. Invest. 94:1351, Tratschin et al. (1985) Mol. Cell. Biol. 5(11):3251-3260, Патентах США №4797368 и 5173414 и Публикации Международной Заявки WO 93/24641), или аденовирусный вектор (как описано в, например, Berns et al. (1995) Ann. NY Acad. Sci. 772:95-104; AIi et al. (1994) Gene Ther. 1:367-384; и Haddada et al. (1995) Curr. Top. Microbiol. Immunol. 199 (Pt 3):297-306), так чтобы давать иммуносупрессорные уровни экспрессии нуклеиновой кислоты, включенной в вектор, тем самым приводя к желаемому иммуносупрессорному ответу. Другие приемлемые типы вирусных векторов описаны в данном описании (включая альтернативные примеры приемлемых ретровирусных, AAV и аденовирусных векторов).
Приемлемые условия инфицирования этими и другие типы вирусных векторных частиц описаны в, например, Bachrach et al., J. Virol, 74(18), 8480-6 (2000), Mackay et al., J. Virol, 19(2), 620-36 (1976), и FIELDS VIROLOGY, смотри выше. Дополнительные методики, пригодные для продукции и применения вирусных векторов, обеспечены в, например, "Practical Molecular Virology: Viral Vectors for Gene Expression" in METHODS IN MOLECULAR BIOLOGY, vol. 8, Collins, M. Ed., (Humana Press 1991), VIRAL VECTORS: BASIC SCIENCE AND GENE THERAPY, 1st Ed. (Cid-Arregui et al., Eds.) (Eaton Publishing 2000), "Viral Expression Vectors," в CURRENT TOPICS IN MICROBIOLOGY AND IMMUNOLOGY, Oldstone et al., Eds. (Springer-Verlag, NY, 1992), и "Viral Vectors" in CURRENT COMMUNICATIONS IN BIOTECHNOLOGY. Gluzman and Hughes, eds. (Cold Spring Harbor Laboratory Press, 1988).
Токсичность и терапевтическая эффективность векторов или вирусов, которые включают одну или несколько молекул по данному изобретению, определяют с применением стандартных фармацевтических процедур в клеточных культурах или экспериментальных животных. Может быть определена величина МЛД50 (минимальная летальная доза для 50% популяции) и/или ЭД50 (доза, терапевтически эффективная для 50% популяции) с применением процедур, представленных в данном описании и другим образом известных в данной области техники. Смотри также S. Plotkin и W. Orenstein, VACCINES (W.В. Saunders Co. 1999, 3-е изд.) для подтверждения доз для известных вирусных вакцин. Нуклеиновые кислоты, полипептиды, белки, слитые белки, трансдуцированные клетки и другие составы по данному изобретению могут быть введены в количестве, определенном, например, с помощью МЛД50 состава, и его побочных эффектов при различных концентрациях, приемлемых в отношении массы и общего состояния здоровья пациента. Таким образом, например, изобретение обеспечивает способ индуцирования иммунного ответа путем введения дозы, равной или большей, чем ЭД50 фармацевтически приемлемой композиции, включающей популяцию вирусоподобных частиц или вирусов (например, ослабленный или дефицитный по репликации вирус), которые включают полипептид или нуклеиновую кислоту по данному изобретению. Введение может быть осуществлено посредством отдельной дозы или разделенных доз (или совместным введением, серийным введением или их комбинациями). Методики введения и протоколы описаны в, например, Plotkin (VACCINES), смотри выше, и других ссылках, процитированных в данном описании. В родственном смысле методики оценки дозировки нуклеиновой кислоты, полипептида, вектора и клеточных композиций, эффективных для индуцирования иммунитета, описаны в, например, Заявке на Европейский Патент №1156333 и ссылках, процитированных в ней.
Вирусный вектор может быть направлен к конкретным тканям, клеткам и/или органам субъекта, например млекопитающего. Примеры таких векторов описаны выше. Например, вирусный вектор или вектор нуклеиновой кислоты могут быть использованы для селективной доставки последовательности нуклеиновой кислоты по данному изобретению к моноцитам, дендритным клеткам, клеткам, связанным с дендритными клетками (например, кератиноциты, связанные в клетками Лангерганса), Т-клеткам и/или В-клеткам. Вирусный вектор может быть дефицитным по репликации вирусным вектором. Частица вирусного вектора также может быть модифицирована для уменьшения иммунного ответа хозяина на вирусный вектор, тем самым, обеспечивая персистентную 919 генную экспрессию. Такие "скрытые" векторы описаны в, например, Martin, Exp. Mol. Pathol. 66(1):3-7 (1999), Croyle et al., J. Virol. 75(10):4792-801 (2001), Rollins et al., Hum. Gene Ther. 7(5):619-26 (1996), Ikeda et al., J. Virol. 74(10):4765-75 (2000), Halbert et al., J. Virol. 74(3): 1524-32 (2000), и Публикации Международной Заявки № WO 98/40509. Альтернативно или дополнительно, вирусные векторные частицы могут быть введены с помощью стратегии, выбранной для уменьшения иммунного ответа хозяина на векторные частицы. Стратегии снижения иммунного ответа на вирусную векторную частицу при введении хозяину обеспечены в, например, Maione et al., Proc. Natl. Acad. Sci. USA 98(11):5986-91 (2001), Morral et al., Proc. Natl. Acad. Sci. USA 96(22):2816-21 (1999), Pastore et al., Hum. Gene Ther. 10(11):1773-81 (1999), Morsy et al., Proc. Natl. Acad. Sci. USA 95(14):7866-71 (1998), Joos et al., Hum. Gene Ther. 7(13): 1555-66 (1996), Kass-Eisler et al., Gene Ther. 3(2):154-62 (1996), Патентах США №6093699, 6211160, 6225113, Заявке на патент США №2001-0066947А1.
Кожа и мышцы в общем являются предпочтительными мишенями для введения полипептидов, конъюгатов, нуклеиновых кислот и векторов по данному изобретению, любой приемлемой методикой. Таким образом, доставка полипептида, конъюгата, нуклеиновой кислоты или вектора по данному изобретению в или через кожу субъекта (например, млекопитающего) является признаком изобретения. Такие молекулы по данному изобретению могут быть введены в фармацевтически приемлемом растворе для инъекций в или через кожу, например внутримышечно или интраперитониально. Введение может также осуществляться трансдермальными устройствами или, более типично, биолистической доставкой полипептида, конъюгата, нуклеиновой кислоты и/или вектора к, в или через кожу субъекта или в мышцу субъекта. Трансдермальные устройства, обеспеченные изобретением, описанные в данном описании, например, могут быть нанесены на кожу хозяину в течение приемлемого периода времени, так чтобы возникал достаточный перенос полинуклеотида и/или вектора субъекту, тем самым подавляя иммунный ответ у субъекта или ингибируя отторжение трансплантата участка ткани, клетки или ткани. Мышечное введение более часто облегчается инъекцией жидкого раствора, включающего полипептид, полинуклеотид или вектор по данному изобретению. Конкретные клетки, которые могут быть мишенными, включают дендритные клетки, другие АПК, В клетки, моноциты, Т-клетки (включая Т-хелперные клетки) и клетки, связанные с такими клетками иммунной системы (например, кератиноциты или другие клетки кожи, связанные с клетками Лангерганса). Направление векторов и нуклеиновых кислот по данному изобретению описано в данном описании. Такое направленное введение может осуществляться нуклеиновыми кислотами или векторами, включающими нуклеиновые кислоты, функционально связанные с клеткой и/или тканеспецифическими промоторами, примеры которых известны в области техники.
Полинуклеотид по данному изобретению может быть введен любой приемлемой системой доставки, так чтобы происходила экспрессия рекомбинантного полипептида в хозяине, приводя к подавлению иммунного ответа, ингибированию взаимодействия между B7-позитивными клетками и CD28-позитивными или ингибированию отторжения трансплантата ткани, клетки, органа или участка ткани или органа. Например, эффективное количество популяции бактериальных клеток, включающих нуклеиновую кислоту по данному изобретению может быть введено субъекту, приводя к экспрессии рекомбинантного мутантного полипептида CTLA-4 по данному изобретению, и подавлению иммунного ответа у субъекта. Бактериальные клетки, разработанные для генной доставки млекопитающего, известны в области техники.
Введение полинуклеотида или вектора по данному изобретению субъекту облегчается путем применения электропорации для эффективного количества клеток или эффективной тканевой направленности, так что нуклеиновая кислота и/или вектор захватываются клетками и экспрессируются в них, приводя к продукции рекомбинантного полипептида по данному изобретению в них и последующему подавлению иммунного ответа у субъекта.
СПОСОБЫ ПРОДУКЦИИ И ОЧИЩЕНИЯ
Изобретение также обеспечивает способы создания и очищения полипептидов, нуклеиновых кислот, векторов и клеток по данному изобретению. В одном аспекте изобретение обеспечивает способ создания рекомбинантного полипептида по данному изобретению путем встраивания нуклеиновой кислоты по данному изобретению в популяцию клеток в клеточной среде, культивирования клеток в среде (в течение времени и при условиях, приемлемых для желательного уровня генной экспрессии) для получения полипептида и выделения полипептида из клеток, клеточной среды или обоих. Нуклеиновая кислота обычно функционально связана с регуляторной последовательностью, эффективной для экспрессии полипептида, кодируемого нуклеиновой кислотой.
Полипептид может быть изолирован из клеточных лизатов, клеточных супернатантов и/или клеточной среды различными приемлемыми методиками, известными в данной области техники, включая, например, различные типы хроматографии клеточных лизатов и/или клеточных супернатантов. Например, полипептид может быть изолирован из клеточных лизатов и/или клеточной среды путем первого концентрирования клеточной среды с применением центрифужных фильтров (Amicon), альтернативно, путем осаждения полипептидов с аммония сульфатом или полиэтиленгликолем и затем ресуспендируя полипептиды в PBS или других приемлемых буферах. Полипептид может быть затем очищен с применением либо эксклюзионной хроматографии на Sephacryl S-400 колонке (Amersham Biosciences), как описано в, например, Hjorth, R. и J. Moreno-Lopez, J. Virol. Methods 5:151-158 (1982), или другой аффинной хроматографии, либо центрифугированием в 20-60% градиентах сахарозы, как описано в, например, Konish et al., Virology 188:714-720 (1992). Фракции, содержащие необходимые полипептиды, могут быть идентифицированы с помощью ELISA или SDS-PAGE с последующим серебряным окрашиванием и иммуноблоттингом. Необходимые фракции собирают вместе, а также концентрируют. Сахароза в градиентном центрифугировании фракций может быть удалена с применением гелевой фильтрации на PD-I0 колонке (Amersham Biosciences). Дополнительные методики очищения включают те, что описаны в примерах ниже и хроматография гидрофобного взаимодействия (Diogo, М. М. et al., J. Gene Med. 3:577-584 (2001)), и любой другой приемлемой методики, известной в данной области техники.
Любая приемлемая методика очищения, которая известна в данной области техники, может также использоваться. Способы очищения полипептида, известные в данной области техники, включают те, что приведены в, например, Sandana (1997) BIOSEPARATION OF PROTEINS, Academic Press, Inc., Bollag et al. (1996) PROTEIN METHODS, 2nd Edition Wiley-Liss, NY, Walker (1996) THE PROTEIN PROTOCOLS HANDBOOK Humana Press, NJ, Harris and Angal (1990) PROTEIN PURIFICATION APPLICATIONS: A PRACTICAL APPROACH IRL Press at Oxford, Oxford, England, Scopes (1993) PROTEIN PURIFICATION: PRINCIPLES AND PRACTICE 3rd Edition Springer Verlag, NY, Janson and Ryden (1998) PROTEIN PURIFICATION: PRINCIPLES, HIGH RESOLUTION METHODS AND APPLICATIONS, Second Edition Wiley-VCH, NY; and Walker (1998) PROTEIN PROTOCOLS ON CD-ROM Humana Press, NJ. Клетки, приемлемые для продукции полипептида, известны в области техники и обсуждаются в данном описании (например, Vero клетки, 293 клетки, BHK, СНО (например, СНО-K1), и COS клетки могут быть приемлемыми). Клетки могут быть лизированы любой приемлемой методикой, включая, например, обработку ультразвуком, микроразжижение, физическое разделение, френч-пресс лизис или лизис на основе детергента.
В одном аспекте изобретение обеспечивает способ очищения полипептида по данному изобретению, который включает трансформирование приемлемой клетки-хозяина с нуклеиновой кислотой по данному изобретению (например, рекомбинантной нуклеиновой кислотой, которая кодирует рекомбинантный полипептид, включающий аминокислотную последовательность SEQ ID NO:1) в клетку-хозяина (например, СНО клетка или 293 клетка), лизирование клетки приемлемой методикой лизиса (например, обработка ультразвуком, детергентный лизис или другая приемлемая методика) и подвергание лизата аффинному очищению на хроматографической колонке, включающей смолу, которая содержит, по меньшей мере, одно новое антитело по данному изобретению (обычно моноклональное антитело по данному изобретению) или антигенсвязывающий его фрагмент, так что лизат становится обогащенным необходимым полипептидом (например, полипептид, включающий аминокислотную последовательность SEQ ID NO:1).
В другом аспекте изобретение обеспечивает способ очищения таких целевых полипептидов, где способ отличается от вышеописанного способа в том, что нуклеиновая кислота, включающая нуклеотидную последовательность, кодирующую слитый белок, который включает полипептид по данному изобретению (например, SEQ ID NO:1) и приемлемый маркер (например, е-эпитоп/his маркер), и очищение полипептида улучшенными методиками иммуноаффинной, лентил-лейитиновой аффинной колонковой хроматографии, аффинной хроматографии с применением иммобилизированных металлов (IMAC) или металл-хелатирующей аффинной хроматографии (МСАС). Дополнительные способы очищения описаны в данном описании.
В другом аспекте изобретение обеспечивает способ получения полипептида по данному изобретению, где способ включает встраивание в популяцию клеток рекомбинантного вектора экспрессии, включающего нуклеиновую кислоту по данному изобретению, культивирование клеток в клеточной среде при приемлемых условиях, достаточных для экспрессии нуклеиновой кислоты из вектора, и продукцию полипептида, кодируемого нуклеиновой кислотой, и выделение полипептида из клеток, клеточной среды или обоих. Выбор клеток основывается на желательной обработке полипептида и основывается на приемлемом векторе (например, Е. coli клетки предпочтительны для бактериальных плазмид, тогда как 293 клетки предпочтительны для перетасованных плазмид млекопитающего и/или аденовирусов, особенно Е1-дефицитных аденовирусов).
В другом аспекте данное изобретение включает способ получения полипептида, где способ включает: (а) встраивание в популяцию клеток рекомбинантного вектора экспрессии, включающего, по меньшей мере, одну нуклеиновую кислоту по данному изобретению, которая кодирует полипептид по данному изобретению; (b) введение вектора экспрессии в млекопитающего; и (с) выделение полипептида из млекопитающего или из побочного продукта млекопитающего.
Полипептид по данному изобретению может также быть получен культивированием клеток или популяции клеток по данному изобретению (которые, например, были трансформированы с нуклеиновой кислотой по данному изобретению, которая кодирует такой полипептид) при условиях, достаточных для экспрессии полипептида и восстановления полипептид, экспрессирующегося в клетке или клеткой, с применением стандартных методик, известных в данной области техники.
В другом аспекте изобретение обеспечивает способ получения полипептида по данному изобретению, который включает (а) встраивание в популяцию клеток нуклеиновой кислоты по данному изобретению, где нуклеиновая кислота функционально связана с регуляторной последовательностью, эффективной для получения полипептида, кодируемого нуклеиновой кислотой; (b) культивирование клеток в клеточной среде для получения полипептида; и (с) выделение полипептида из клеток или клеточной среды. Также включается в данное изобретение культивированная клетка, в которую встраивают вектор по данному изобретению (например, вектор экспрессии по данному изобретению).
Также включается способ получения полипептида по данному изобретению, который включает встраивание нуклеиновой кислоты, кодирующей указанный полипептид в популяцию клеток в среду, где в клетках возможна экспрессия нуклеиновой кислоты, содержание клеток в условиях, в которых нуклеиновая кислота экспрессируется, и после этого выделение полипептида из среды.
В другом аспекте изобретение обеспечивает способ создания слитого белка. Способ включает: (1) культивирование клетки-хозяина, трансформированной с нуклеиновой кислотой в клеточной среде, где нуклеиновая кислота включает: (i) первую нуклеотидную последовательность, которая кодирует полипептид, имеющий, по меньшей мере, 95% идентичность с аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где полипептид связывает CD86 и/или CD80, и/или внеклеточный домен каждого CD86 или CD80, и (ii) вторую нуклеотидную последовательность, кодирующую полипептид Ig Fc, включающий шарнир, СН2 домен и СН3 домен, в результате чего нуклеиновая кислота экспрессируется и образуется слитый белок; и (2) восстановление слитого белка. Любой Ig Fc полипептид может быть использован, включая например, IgG1 Fc, IgG2 Fc, IgG4 Fc или мутантный Ig Fc полипептид. В некоторых таких способах нуклеиновая кислота также включает третью нуклеотидную последовательность, которая кодирует секреторный или сигнальный пептид, функционально связанный со слитым белком, и слитый белок секретируется из клетки-хозяина как дисульфидно-связанный димер слитого белка, включающий идентичные первый и второй слитые белки, и дисульфидно-связанный димер слитого белка восстанавливают из клеточной среды. В некоторых таких способах дисульфидно-связанный димер слитого белка формируется посредством ковалентной дисульфидной связи между остатком цистеина первого слитого белка и остатком цистеина второго слитого белка. В некоторых таких способах слитый белок восстанавливают из клеточной среды, клетки-хозяина или периплазмы клетки-хозяина.
В другом аспекте изобретение обеспечивает молекулу изолированной или рекомбинантной нуклеиновой кислоты, включающую нуклеотидную последовательность, которая кодирует (i) первый полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, 95% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:1-73, где первый полипептид связывает CD80 и/или CD86 и/или внеклеточный домен каждого или обоих, и (ii) второй полипептид, включающий шарнир, СН2 домен и СН3 домен полипептида IgG. Второй полипептид может включать любой приемлемый Ig полипептид, обсуждаемый в данном описании, включая, например, тот, который содержит аминокислотную последовательность SEQ ID NO:184 или SEQ ID NO:218.
В другом аспекте изобретение обеспечивает способ образования растворимого димера слитого белка. Способ включает культивирование клетки-хозяина, трансформированной с вектором экспрессии, включающим нуклеотидную последовательность, которая кодирует растворимый димер слитого белка по данному изобретению. Иллюстративные слитые белки включают те, что содержат аминокислотную последовательность любой из SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Вектор включает нуклеотидную последовательность, которая облегчает экспрессию слитого белка (например, нуклеотидная последовательность, кодирующая сигнальный пептид). Слитый белок секретируется из клетки-хозяина как дисульфидно-связанный димер слитого белка, включающий два идентичных слитых белка, и дисульфидно-связанный димер слитого белка восстанавливают из клеточной среды. В некоторых таких способах дисульфидно-связанный димер слитого белка формируется посредством ковалентной дисульфидной связи между остатком цистеина на каждом слитом белке. Димер слитого белка обычно восстанавливают из клеточной среды, клетки-хозяина или периплазмы клетки-хозяина. Пример 12 обеспечивает иллюстративную процедуру образования стабильной трансфектированной клеточной линии, экспрессирующей мутантный CTLA4-Ig по данному изобретению, образования мутантного слитого белка CTLA4-Ig слитого белка и очищения мутантного слитого белка из культуры.
В дополнение к рекомбинантной продукции полипептиды по данному изобретению могут быть получены прямым синтезом пептидов с применением твердофазных методик (смотри, например, Stewart et al. (1969) SOLID-PHASE PEPTIDE SYNTHESIS, W.H. Freeman Co, San Francisco и Merrifield J. (1963) J. Am. Chem. Soc. 85:2149-2154). Пептидный синтез может быть осуществлен с применением методик, проведенных вручную или автоматически. Автоматизированный синтез может быть осуществлен, например, с применением Applied Biosystems 43 IA пептидного синтезатора (Perkin Elmer, Foster City, Calif.) в соответствии с инструкциями производителя. Например, подпоследовательности могут быть химически синтезированы отдельно и комбинированы с применением химических способов для получения полипептида по данному изобретению или его фрагментов. Альтернативно, синтезированные полипептиды могут быть получены от многочисленных компаний, специализирующихся на продукции полипептидов. Наиболее часто полипептиды по данному изобретению получают путем экспрессирования кодирующих нуклеиновых кислот и восстановления полипептидов, например, как описано выше.
Данное изобретение включает способ получения полипептида по данному изобретению, включающий встраивание нуклеиновой кислоты по данному изобретению, вектора по данному изобретению или их комбинации в животное, такое как млекопитающее (включая, например, крысу, нечеловеческого примата, летучую мышь, мартышку, свинью или цыпленка), так чтобы полипептид по данному изобретению экспрессировался в животном, и полипептид изолируют из животного или побочного продукта животного. Выделение полипептида из животного или побочного продукта животного может быть осуществлено любой приемлемой методикой в зависимости от животного и желаемой стратегии восстановления. Например, полипептид может быть восстановлен из сывороток мышей, обезьян или свиней, экспрессирующих полипептид по данному изобретению. Трансгенные животные (включая вышеупомянутых млекопитающих), включающие, по меньшей мере, одну нуклеиновую кислоту по данному изобретению, включаются в данное изобретение. Трансгенное животное может иметь нуклеиновую кислоту, интегрированную в геном ее хозяина (например, с помощью AAV вектора, лентивирусного вектора, биолистических методик, проведенных с последовательностями, стимулирующих интеграцию и т.п.) или может иметь нуклеиновую кислоту, которая содержится эпихромосомно (например, в неинтегрированном плазмидном векторе или путем вставки в неинтегрированный вирусный вектор). Эпихромосомные векторы могут быть сконструированы для более кратковременной генной экспрессии, чем интегрированные векторы. Векторы на основе РНК часто особенно предпочтительны в данном отношении.
КОМПОЗИЦИИ
Изобретение также обеспечивает новые и пригодные композиции, включающие, по меньшей мере, один компонент по данному изобретению, такой как, например, по меньшей мере, один полипептид (включая, например, слитые белки и мультимерные полипептиды), конъюгат, нуклеиновая кислота, вектор, вирус, вирусоподобная частица (ВПЧ) и/или клетка по данному изобретению или их любая комбинация и носитель, наполнитель или растворитель. Носитель, наполнитель или растворитель может быть фармацевтически приемлемым носителем, наполнителем или растворителем. Такая композиция может включать любое приемлемое количество любого приемлемого числа полипептидов, конъюгатов, нуклеиновых кислот, векторов, вирусов, ВПЧ и/или клеток по данному изобретению. Также обеспечиваются фармацевтические композиции, включающие, по меньшей мере, один полипептид, конъюгат, нуклеиновую кислоту, вектор, вирус, ВПЧ и/или клетку или любую их комбинацию, и фармацевтически приемлемый носитель, наполнитель или растворитель. Такие композиции пригодны для способов по данному изобретению, описанных здесь, включая, например, способы подавления иммунных ответов.
Например, в одном неограничивающем варианте осуществления изобретение обеспечивает композицию, включающую наполнитель, растворитель или носитель и, по меньшей мере, один такой полипептид по данному изобретению (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше полипептидов), такие как мутантный полипептид CTLA-4 ВКД (например, любой SEQ ID NOS:1-73) или мутантный слитый белок CTLA-4-Ig (например, любой SEQ ID NOS:74-79, 197-200, 205-214 и 219-222), где, по меньшей мере, один полипептид присутствует в композиции в количестве, эффективном, чтобы подавлять иммунный ответ, включая, например, иммунный(ые) ответ(ы), вовлеченный(ые) в отторжение трансплантата и/или аутоиммунитет, ингибировать отторжение пересаженного трансплантата ткани, клетки или органа или ингибировать взаимодействие эндогенных В7-позитивных клеток с CD28-позитивными Т-клетками у субъекта, которому вводят композицию.
Также включена в данное изобретение фармацевтическая композиция, включающая фармацевтически приемлемый наполнитель, растворитель или носитель и эффективное количество одного или нескольких таких компонентов по данному изобретению. Эффективное количество может быть терапевтически или профилактически эффективным количеством или дозой для применения в терапевтическом или профилактическом способе, описанном здесь, таком как способ лечения аутоиммунного заболевания или способ ингибирования отторжения трансплантата ткани, клетки, участка ткани или органа от донора субъектом-реципиентом.
Композиция (или фармацевтическая композиция) может быть любой нетоксической композицией, которая не оказывает влияния на иммуносупрессорные свойства полипептида, конъюгата, нуклеиновой кислоты, вектора, вируса, ВПЧ или клетки по данному изобретению, которые в ней содержатся. Композиция может включать один или несколько наполнителей, растворителей или носителей, и фармацевтическая композиция включает один или несколько фармацевтически приемлемых наполнителей, растворителей или носителей. Широкий спектр доступных носителей, растворителей и наполнителей известен в области техники и может быть включен в композиции и фармацевтические композиции по данному изобретению. Например, различные водные носители могут быть использованы, например дистиллированная или очищенная вода, стерильный солевой раствор, забуференный солевой раствор, такой как фосфат-забуференный солевой раствор (PBS), и подобные являются предпочтительными для составов для инъекций полипептида, слитых белков, конъюгата, нуклеиновой кислоты, вектора, вируса, ВПЧ и/или клетки по данному изобретению. Многочисленные приемлемые наполнители, носители и растворители для введения терапевтических белков известны в области техники. Такие растворы преимущественно стерильны и в общем свободны от нежелательного вещества. Композиции могут быть стерилизованы традиционными, хорошо известными методиками стерилизации. Композиции по данному изобретению могут включать фармацевтически приемлемые вспомогательные вещества, если необходимо, для поддержания физиологических условий. Такие вещества включают, например, агенты для регулирования рН, буферирующие агенты и агенты для регулирования тоничности, включая, например, ацетат натрия, аскорбат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и подобное. Композиции по данному изобретению, включая фармацевтические композиции, могут также включать один или несколько компонентов, таких как растворители, наполнители, соли, буферы, поверхностно-активные вещества, эмульсфикаторы, детергенты (например, неионный детергент или эмульсификатор, такой как Tween®-20, Tween®-40, Tween®-60, Tween®-80, плюрониловый F-68 и подобное), стабилизаторы (например, сахара или безбелковые аминокислоты), консерванты, тканевые фиксаторы, растворители и/или другие материалы, приемлемые для включения в фармацевтическую композицию.
Примеры приемлемых компонентов, которые могут быть использованы в фармацевтической композиции, описаны в, например, Berge et al., J. Pharm. Sci. 66(1): 1-19 (1977), Wang и Hanson, J. Parentheral. Sci. Tech. 42:S4-S6 (1988), Патентах США №6165779 и 6225289 и в данном описании. Фармацевтические композиции также могут включать консерванты (такие, как бензиловый спирт, азид натрия, т-крезол и т.п.), антиоксиданты, хелаторы металлов (такие, как метионин, EDTA и т.п.) и/или другие вспомогательные вещества, известные специалистам в данной области. Примеры соответствующих фармацевтически приемлемых носителей для применения в фармацевтических композициях описаны в, например, Urquhart et al., Lancet 16:367 (1980), Lieberman et al., PHARMACEUTICAL DOSAGE FORMS - DISPERSE SYSTEMS (2nd ed., Vol.3, 1998), Ansel et al., PHARMACEUTICAL DOSAGE FORMS & DRUG DELIVERY SYSTEMS (7th ed. 2000), Martindale, THE EXTRA PHARMACOPEIA (31st edition), Remington's PHARMACEUTICAL SCIENCES (16th-20th editions), THE PHARMACOLOGICAL BASIS OF THERAPEUTICS, Goodman and Gilman, Eds. (9th ed. - 1996), WILSON AND GISVOLDS TEXTBOOK OF ORGANIC MEDICINAL AND PHARMACEUTICAL CHEMISTRY, Delgado and Remers, Eds. (10th ed. - 1998) и Патентах США №5708025 и 5994106. Принципы формулирования фармацевтически приемлемых композиций описаны в, например, Platt, Clin. Lab Med. 7:289-99 (1987), Aulton, PHARMACEUTICS: SCIENCE OF DOSAGE FORM DESIGN, Churchill Livingstone (New York) (1988), EXTEMPORANEOUS ORAL LIQUID DOSAGE PREPARATIONS, CSHP (1998), и "Drug Dosage," J. Kans. Med. Soc. 70(1):30-32 (1969). Дополнительные фармацевтически приемлемые носители, особенно приемлемые для введения векторов, описаны в, например, публикации международной заявки WO 98/32859.
Композиции по данному изобретению, включая фармацевтические композиции, могут включать один или несколько водных носителей или наполнителей (включая, например, фармацевтически приемлемые носители или наполнители) и один или несколько компонентов, таких как один или несколько буферов, один или несколько солей, один или несколько детергентов или эмульсификаторов и/или один или несколько сахаров. Буферная система обычно является приемлемой для поддержания рН композиции в диапазоне, который способствует стабильности молекулы по данному изобретению, присутствующей в композиции (например, мутантного CTLA-4-Ig). Иллюстративные буферы для применения в композиции включают, но не ограничиваются следующим, например, буфер N-2-гидроксиэтилпиперазин-N'-2-аминоэтан сульфоновой кислоты (HEPES), цитратный буфер (например, смесь дицитрата натрия и трицитрата натрия, смесь цитрата натрия и лимонной кислоты, смесь лимонной кислоты и трицитрата натрия, смесь моноцитрата натрия и дицитрата натрия, смесь лимонной кислоты и моноцитрата натрия), натрий-фосфатный буфер (например, смесь дифосфата натрия и трифосфата натрия (Na2HPO4/Na3PO4), смесь двухосновного фосфата натрия и одноосновного фосфата натрия), ацетатный буфер (например, смесь уксусной кислоты и ацетата натрия, смесь уксусной кислоты и гидроксида натрия), гистидиновый буфер, Трис буфер, Трис-малеиновокислый буфер, янтарнокислый буфер (например, смесь янтарной кислоты и гидроксида натрия, смесь янтарной кислоты и моносукцината натрия, смесь янтарной кислоты и дисукцината натрия, смесь моносукцината натрия и дисукцината натрия), малеиновокислый буфер, имидазольный буфер, виннокислый буфер, фумаратный буфер, глюконатный буфер, оксалатный буфер, лактатный буфер, ацетатный буфер и подобное или комбинация любого из них (например, коктейль из цитратного и ацетатного буферов и т.п.). Концентрация буфера в композиции может быть любой, которая приемлема для молекулы(молекул) по данному изобретению (например, мутантного CTLA-4-Ig), включенной в раствор композиции, такая как, но не ограничиваясь следующим, например, в диапазоне от около 1 мМ до около 100 мМ, около 1 мМ до около 50 мМ, около 5 мМ до около 50 мМ или около 5 мМ до около 25 мМ, включая, например, 1 мМ, 5 мМ, 10 мМ, 15 мМ, 20 мМ, 25 мМ, 30 мМ, 40 мМ, 50 мМ (такая, как, например, 20 мМ HEPES буфер, 20 мМ дицитрат натрия-тринатрий-цитратный буфер, 20 мМ янтарнокислый буфер и т.п.).
Иллюстративные соли для применения в композиции включают, но не ограничиваются следующим, например, водорастворимые соли, включая органическую соль или неорганическую соль (например, водорастворимую неорганическую соль), такую как хлорид натрия, хлорид магния, бикарбонат натрия, хлорид калия, хлорид кальция и хлорид аммония и подобное, или любая фармацевтически приемлемая или физиологически совместимая соль. Иллюстративные концентрации соли в растворе композиции включают, но не ограничиваются следующим, например, в диапазоне от около 1 мМ до около 150 мМ, около 10 мМ до около 125 мМ или около 75 мМ до около 125 мМ, включая, например, 10 мМ, 50 мМ, 75 мМ, 100 мМ, 125 мМ, 150 мМ (такая как, например, 100 мМ NaCl).
Иллюстративные сахара или углеводороды для применения в композиции включают, но не ограничиваются следующим, например, сахароза, мальтоза, трегалоза, декстроза, манноза, рафиноза, лактоза, мальтодекстрин, декстран, сахароза и т.п., в концентрационном диапазоне включая, но не ограничиваясь следующим, например, от около 0,1% до около 10% по весу сахара, около 1% до около 5% по весу сахара или около 1% до около 3% по весу сахара, включая например, 0,1%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% по весу сахара (например, 2% по весу сахарозы, 2% по весу трегалозы или 2% по весу маннозы) по весу композиции. Иллюстративные сахарные спирты для применения в композиции включают, но не ограничиваются следующим, например, маннитол, сорбитол, гликоль, глицерол, арабитол, эритриол, ксилитол, рибитол, лактитол и подобное в концентрационном диапазоне, включая, но не ограничиваясь следующим, например, от около 0,1% до около 10% по весу сахарного спирта, около 1-5%, около 1-3%, включая, например, 0,1%, 0,5%, 1%, 1,5%, 2%, 2,5%, 3%, 4%, 5%, 6%, 7%, 8%, 9% или 10% по весу сахарного спирта по весу композиции.
Осмолярность композиций по данному изобретению, включая фармацевтические композиции, обычно сходна с осмолярностью сыворотки крови, которая находится в диапазоне от около 250 до около 350 миллиосмолей на килограмм (мОсм/кг) воды. Концентрация соли в композиции составляет обычно менее чем 125 мМ. Концентрации соли и сахара могут быть отрегулированы или изменяться, так чтобы осмолярность композиции составляла от около 250-350 мОсм/кг воды.
Иллюстративные детергенты или эмульсификаторы для применения в композиции включают, но не ограничиваются следующим, например, полисорбаты, такие как Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68 в диапазоне, включая, но не ограничиваясь следующим, например, от около 0,001% до около 0,2% по весу детергента или эмульсификатора по весу композиции, включая, например, 0,001%, 0,002%, 0,003%, 0,004%, 0,005%, 0,006%, 0,007%, 0,008%, 0,009%, 0,01%, 0,02%, 0,03%, 0,04%, 0,05%, 0,075% и 0,1% по весу детергента или эмульсификатора (например, Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) по весу композиции.
Композиции по данному изобретению, включая фармацевтические композиции, могут включать полимер, такой как молекула ПЭГ, в концентрации, достаточной, чтобы уменьшить или ингибировать нежелательную ассоциацию между двумя или несколькими молекулами по данному изобретению, такими как, например, два или несколько мутантных димеров слитого белка CTLA-4-Ig по данному изобретению. Композиция может включать два или несколько различных полимеров (например, ПЭГ). Полимер (например, молекула ПЭГ) обычно имеет молекулярный вес от около 200 Да до около 8000 Да (например, около 200, 300, 400, 600, 900, 1000, 1450, 3350, 4500 или 8000 Да, доступные от Dow Chemical). Полагают, что добавление полимера (например, молекулы ПЭГ) к композиции снижает формирование нежелательных агрегатов, особенно нежелательных агрегатов двух или нескольких димеров слитого белка по данному изобретению.
Композиции по данному изобретению, включая фармацевтические композиции, могут включать циклический олигосахарид, такой как циклодекстрин (например, Captisol® (Cydex)). В одном аспекте композиция включает два или несколько различных циклических олигосахаридов. Добавление циклического(их) олигосахарида(ов) к композиции улучшает растворимость, стабильность, биодоступность и/или дозировку активного фармацевтического ингредиента(ов) (например, мутантной молекулы CTLA-4).
рН композиции по данному изобретению, включая фармацевтическую композицию, может находиться в диапазоне от около рН 3 до около рН 10, от около рН 4 до около рН 10, от около рН 5 до около рН 9, от около рН 6 до около рН 9, от около рН 5,5 до около рН 8,5, от около рН 6,0 до около рН 6,7, от около рН 6,0 до около рН 6,5, от около рН 6,2 до около рН 8,7, от около рН 6,5 до около рН 8,5, от около рН 6,5 до около рН 7,5, от около рН 6,2 до около рН 7,0, от около рН 6,3 до около рН 6,8, от около рН 6,4 до около рН 6,8, от около рН 7,0 до около рН 8,0, и около рН 7,0 до около рН 7,4. В одном аспекте композиции, включающие молекулу по данному изобретению, такую как, например, мутантный CTLA-4-IgG2, имеют рН уровень рН 5,0, рН 5,1, рН 5,2, рН 5,3, рН 5,4, 5,5, рН 5,6, рН 5,7, рН 5,8, рН 5,9, рН 6,0, рН 6,1, рН 6,2, рН 6,3, рН 6,4, рН 6,5, рН 6,6, рН 6,7, рН 6,8, рН 6,9, рН 7,0, рН 7,1, рН 7,2, рН 7,3, рН 7,4, рН 7,5, рН 7,6, рН 7,7, рН 7,8, рН 7,9, рН 8,0, рН 8,1, рН 8,2, рН 8,3, рН 8,4, рН 8,5, рН 8,6, рН 8,7, рН 8,8, рН 8,9, рН 9,0, рН 9,1, рН 9,2, рН 9,3, рН 9,4, рН 9,5, рН 9,6, рН 9,7, рН 9,8, рН, 9,9 или рН 10,0.
В одном аспекте изобретение обеспечивает композицию по данному изобретению, включающую наполнитель или носитель (включая, например, фармацевтическую композицию, включающую фармацевтически приемлемый наполнитель или носитель) и эффективное количество любого полипептида CTLA-4, мультимера, димера, конъюгата, слитого белка или димера слитого белка по данному изобретению, описанные везде в данном описании, а также включающую буфер, способный поддерживать рН композиции в диапазоне от около рН 3 до около рН 10, воду, необязательно неионный детергент, необязательно соль и необязательно сахарный спирт, моносахарид, дисахарид или полисахарид. Некоторые такие композиции находятся при физиологическом рН. Некоторые такие композиции имеют рН от около 4 до около 7,5, около 5,0 до около 7,5 или от около 6,4 до около 6,6, включая, например, около рН 6,5, около рН 7,4, или рН 7,5. Некоторые такие композиции включают буфер в концентрации от около 1 мМ до около 100 мМ, около 1 мМ до около 50 мМ, около 5 мМ до около 35 мМ, около 10 мМ до около 25 мМ, включая, например, около 20 мМ, 25 мМ или 30 мМ. Некоторые такие композиции включают буфер, выбранный из группы, включающей HEPES буфер, цитратный буфер, янтарнокислый буфер, ацетатный буфер, цитратный буфер, малеиновокислый буфер, фосфатный буфер и Трис буфер. Некоторые такие композиции включают буфер, выбранный из группы, включающей HEPES буфер, натрий-цитратный буфер и натрий-янтарнокислый буфер. Для некоторых таких композиций рН составляет от около 6,0 до около 6,7 и буфер - это сукцинат натрия или цитрат натрия. Для некоторых таких композиций рН составляет около 7,0 до около 7,7 и буфер - это HEPES. Некоторые такие композиции также включают сахарный спирт или сахарид, где сахарид - это моносахарид, дисахарид (например, сахароза или трегалоза) или полисахарид. Некоторые такие композиции включают соль, присутствующую в концентрации от около 1 мМ до около 50 мМ, включая, например, около 20 мМ, 25 мМ или 30 мМ. Некоторые такие композиции включают неионный детергент, такой как, например, неионный детергент, выбранный из группы, состоящей из группы, содержащей Tween®-80, Tween®-60, Tween®-40, Tween®-20 или плюрониловый F-68.
В некоторых таких композициях (включая фармацевтические композиции), описанных в параграфе выше, полипептид, мультимер, димер, конъюгат, слитый белок или димер слитого белка присутствует в концентрации в диапазоне около 1 мг/мл (вес/объем) до около 200 мг/мл (вес/объем), около 25 мг/мл (вес/объем) до около 100 мг/мл (вес/объем), около 50 мг/мл до около 300 мг/мл, необязательно в диапазоне от около 50 мг/мл (вес/объем) до около 100 мг/мл (вес/объем). Некоторые такие композиции включают эффективное количество полипептида, мультимера, димера, конъюгата, слитого белка или димера слитого белка от около 0,1 мг/кг до около 15 мг/кг, и композицию вводят млекопитающему (например, человеку). Некоторые такие композиции включают эффективное количество полипептида, мультимера, димера, конъюгата, слитого белка или димера слитого белка от около 0,5 мг/кг до около 10 мг/кг, и композицию вводят парентерально. Некоторые такие композиции включают эффективное количество полипептида, мультимера, димера, конъюгата, слитого белка или димера слитого белка от около 0,1 мг/кг до около 5 мг/кг, и необязательно около 0,5 мг/кг, и композицию вводят подкожно. Некоторые такие композиции включают эффективное количество полипептида, мультимера, димера, конъюгата, слитого белка или димера слитого белка от около 5 мг/кг до около 15 мг/кг (необязательно около 10 мг/кг), и композицию вводят внутривенно. Для некоторых таких композиций полипептид, мультимер, димер, конъюгат, слитый белок или димер слитого белка включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:36. Для некоторых таких композиций полипептид, мультимер, димер, конъюгат, слитый белок или димер слитого белка включает аминокислотную последовательность, имеющую, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:50. Некоторые такие композиции являются стерильными и/или изотоничными крови. Некоторые такие композиции являются жидкими композициями. Некоторые такие композиции находятся в жидкой или высушенной форме, где высушенная форма выбрана из группы, включающей лиофилизированную форму, форму, высушенную на воздухе, и форму, высушенную распылением.
В иллюстративном аспекте изобретение обеспечивает фармацевтическую композицию, включающую: (i) слитый белок CTLA-4-Ig по данному изобретению, имеющий концентрацию от около 1 мг/мл до около 300 мг/мл (например, около 1 мг/мл до около 100 мг/мл, около 50 мг/мл или около 100 мг/мл и т.п.) (необязательно димерный слитый белок); (ii) буфер, имеющий буферную емкость около рН 5,0 - около рН 9,0 в концентрации от около 5 мМ до около 50 мМ; (iii) фармацевтически приемлемый растворитель для придания композиции обозначенного объема; (iv) сахар в концентрации от около 0,5% до около 10% по весу сахара по весу композиции; (v) соль в концентрации от около 1 мМ до около 200 мМ; (vi) необязательно неионный детергент (например, Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) в концентрации от около 0,01 мг/мл до около 0,5 мг/мл, например, около 0,01 мг/мл до около 0,1 мг/мл; и (vii) необязательно циклический олигосахарид (например, циклодекстрин (Captisol®), где рН композиции находится в диапазоне от около рН 5,0 до около рН 8,0. Иллюстративный слитый белок CTLA-4-Ig по данному изобретению включают таковые, которые включают аминокислотную последовательность, имеющую, по меньшей мере, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222 (необязательно, например, выбранной из группы, включающей SEQ ID NOS:197, 199, 211 и 213), где слитый белок связывает CD80 и/или CD86 и/или его внеклеточный домен и/или подавляет иммунный ответ. Такие слитые белки могут быть в мономерной или димерной форме.
В другом аспекте изобретение обеспечивает фармацевтическую композицию, включающую: (i) конъюгат, включающий слитый белок CTLA-4-Ig по данному изобретению (необязательно димерный слитый белок) и неполипептидную часть, ковалентно прикрепленную к слитому белку, где указанный конъюгат имеет концентрацию от около 1 мг/мл до около 300 мг/мл (например, около 1 мг/мл до около 100 мг/мл, около 50 мг/мл или около 100 мг/мл и т.п.); (ii) буфер, имеющий буферную емкость от около рН 5,0 до около рН 8,0 в концентрации от около 5 мМ до около 50 мМ; (iii) фармацевтически приемлемый растворитель для придания композиции определенного объема; (iv) сахар в концентрации около 0,5% до около 10% по весу сахара по весу композиции; (v) соль в концентрации от около 1 мМ до около 200 мМ; и (vi) необязательно неионный детергент (например, Tween®- 20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) в концентрации от около 0,01 мг/мл до около 0,5 мг/мл, например около 0,01 мг/мл до около 0,1 мг/мл, где рН композиции находится в диапазоне от около рН 5,0 до около рН 8,0. Конъюгат может включать одну, две, три, четыре или больше неполипептидных частей. Каждая неполипептидная часть может включать полимер (например, ПЭГ или РАО) или часть сахара. В некоторых случаях неполипептидная часть представляет собой полимерную молекулу, такую как молекула ПЭГ. Полимерная молекула может иметь любой желательный молекулярный вес в зависимости от желаемого функционального эффекта (например, увеличенное время полужизни, пониженная ассоциация между молекулами слитого белка и т.п.). В некоторых случаях, например, полимер - это ПЭГ, имеющий молекулярный вес от около 1 кДа до около 100 кДа (например, 1, 2, 2,5, 3, 5, 8, 10, 12, 20, 25, 30, 40, 60 кДа и т.п.). Неполипептидная часть (например, часть сахара или полимерная молекула) ковалентно прикреплена к группе прикрепления аминокислотного остатка слитого белка с применением стандартных процедур, как описано выше. Иллюстративные слитые белки CTLA-4-Ig включают те, которые включают аминокислотную последовательность, имеющую, по меньшей мере, 91%, по меньшей мере, 92%, по меньшей мере, 93%, по меньшей мере, 94%, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222 (необязательно, например, выбранной из группы, включающей SEQ ID NOS:197, 199, 211 и 213), где слитый белок связывает CD80 и/или CD86 и/или его внеклеточный домен и/или подавляет иммунный ответ. Такие слитые белки могут быть в мономерной или димерной форме.
В другом аспекте изобретение обеспечивает фармацевтическую композицию, включающую: (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, около 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность с аминокислотной последовательностью, выбранной из группы SEQ ID NOS:1-73, такой как, например, SEQ ID NOS:36 и 50, где указанный полипептид присутствует в концентрационном диапазоне от около 1 до около 200 мг/мл (вес/объем); (b) буфер, имеющий буферную емкость около рН 5,0 - около рН 8,0 в концентрационном диапазоне от около 5 мМ до около 50 мМ; (с) фармацевтически приемлемый растворитель для придания композиции определенного объема; (d) сахар в концентрации от 0,5% до 10% по весу; (е) соль в концентрации от около 1 мМ до около 200 мМ; и (f) необязательно детергент, где рН находится в диапазоне от около рН 5,0 до около рН 8,0. В некоторых таких фармацевтических композициях (а) полипептид включает аминокислотную последовательность SEQ ID NO:36, присутствующую в концентрационном диапазоне от около 50 мг/мл до около 100 мг/мл; (b) буфером является HEPES буфер, присутствующий в концентрации от около 20 мМ; (с) фармацевтически приемлемый растворитель представляет собой воду; (d) сахар представляет собой сахарозу или трегалозу в концентрации 2% по весу; (е) солью является хлорид натрия в концентрации около 100 мМ; и (f) необязательно детергент, выбранный из группы, включающей Tween®-80, Tween®-60, Tween®-40, Tween®-20 или плюрониловый F-68 в концентрации меньшей или равной около 0,1 мг/мл, где рН композиции составляет около рН 7,4. В других таких композициях (а) полипептид включает аминокислотную последовательность SEQ NO:50, присутствующую в концентрационном диапазоне от около 50 мг/мл до около 100 мг/мл; (b) буфер представляет собой натрий-цитратный буфер, присутствующий в концентрации около 20 мМ; (с) фармацевтически приемлемый растворитель представляет собой воду; (d) сахар представляет собой сахарозу или трегалозу в концентрации 2% по весу; (е) соль представляет собой хлорид натрия в концентрации около 100 мМ; и (f) необязательно детергент, выбранный из группы, включающей Tween®-80, Tween®-60, Tween®-40, Tween®-20 или плюрониловый F-68 в концентрации, меньшей или равной около 0,1 мг/мл, где рН составляет около рН 6,5.
В другом аспекте изобретение обеспечивает фармацевтическую композицию, включающую: (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:36; и (b) HEPES или натрий-цитратный буфер (например, смесь дицитрата натрия и трицитрата натрия, смесь цитрата натрия и лимонной кислоты, смесь лимонной кислоты и трицитрата натрия, смесь моноцитрата натрия и дицитрата натрия или смесь лимонной кислоты и моноцитрата натрия).
Также обеспечивается фармацевтическая композиция, включающая: (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:36; и (b) фармацевтически приемлемый наполнитель или фармацевтически приемлемый носитель, где композиция имеет рН от около 7 до около 8. Некоторые такие фармацевтические композиции имеют рН около 7,4 или 7,5. Некоторые такие фармацевтические композиции включают HEPES или натрий-цитратный буфер.
Также обеспечивается фармацевтическая композиция, включающая: (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:50; и (b) натрий-цитратный буфер (например, смесь дицитрата натрия и трицитрата натрия, смесь цитрата натрия и лимонной кислоты, смесь лимонной кислоты и трицитрата натрия, смесь моноцитрата натрия и дицитрата натрия или смесь лимонной кислоты и моноцитрата натрия).
Также обеспечивается фармацевтическая композиция, включающая: (а) полипептид, включающий аминокислотную последовательность, имеющую, по меньшей мере, 97%, по меньшей мере, 98% или, по меньшей мере, 99% идентичность последовательности с аминокислотной последовательностью SEQ ID NO:50; и (b) фармацевтически приемлемый наполнитель или фармацевтически приемлемый носитель, где композиция имеет рН от около 6 до около 7. Некоторые такие фармацевтические композиции имеют рН около 6,5. Некоторые такие фармацевтические композиции включают натрий-цитратный буфер.
В одном иллюстративном аспекте изобретение обеспечивает фармацевтическую композицию, включающую от около 1 мг/мл до около 300 мг/мл слитого белка CTLA-4-Ig по данному изобретению (например, D3-54-IgG2) (например, от около 1 мг/мл до около 100 мг/мл, например, около 50 мг/мл или около 100 мг/мл), который типично экспрессируется как димерный слитый белок, в 20 мМ HEPES буфера в воде, 100 мМ NaCl, 2% по весу сахарозы по весу композиции, рН 7,4, необязательно включая неионный детергент (например, Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) в концентрации от около 0,01 мг/мл до около 0,5 мг/мл, например около 0,01 мг/мл до около 0,1 мг/мл, и необязательно включая полиэтиленгликоль (ПЭГ), такой как молекула ПЭГ, имеющая молекулярный вес от около 200 Дальтон (Да) до около 8000 Да (например, около 200, 300, 400, 600, 900, 1000, 1450, 3350, 4500 или 8000 Да, доступная от Dow Chemical). В другом иллюстративном аспекте изобретение обеспечивает фармацевтическую композицию, включающую от около 1 мг/мл до около 300 мг/мл слитого белка CTLA-4-Ig по данному изобретению (например, D3-69-IgG2), который типично экспрессируется как димерный слитый белок, в 20 мМ натрий-цитратном буфере в воде, 100 мМ NaCl, 2% по весу сахарозы по весу композиции, рН 6,5, необязательно включая неионный детергент (например, Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) в концентрации от около 0,01 мг/мл до около 0,5 мг/мл, например около 0,01 мг/мл до около 0,1 мг/мл, и необязательно включая молекулу ПЭГ, такую как молекула ПЭГ, имеющая молекулярный вес от около 200 Да до около 8000 Да (например, около 200, 300, 400, 600, 900, 1000, 1450, 3350, 4500 или 8000 Да, доступная от Dow Chemical).
Данное изобретение включает емкости для композиций по данному изобретению, включающих молекулу по данному изобретению (например, мутантную молекулу CTLA-4, такую как мутантный CTLA-4-Ig) и наполнитель, растворитель или носитель. Композиция может быть фармацевтической композицией, включающей молекулу по данному изобретению и фармацевтически приемлемый наполнитель, растворитель или носитель. Емкости включают, но не ограничивается следующим, например, ампулы (например, стеклянная ампула, такая как стеклянная ампула 1 типа), автоинжекторы, шприцы-ручки (фиксированной дозы или переменной дозы) и предварительно заполненные шприцы или другие приемлемые емкости. При необходимости, емкость может содержать одну или несколько предварительно определенных доз молекулы по данному изобретению, которые являются эффективными для подавления иммунного ответа или лечения иммунного заболевания или нарушения, как описано в данном описании. Некоторые такие емкости пригодны для введения композиций, содержащихся в них, субъекту, страдающему от иммунного заболевания или нарушения (например, автоинжекторы, шприцы-ручки, предварительно заполненные шприцы и т.п.). Некоторые такие емкости позволяют осуществлять самостоятельное введение композиции субъектом (например, шприцы-ручки, автоинжекторы, предварительно заполненные шприцы и т.п.).
Также обеспечиваются стабильные композиции или формуляции молекулы (например, мутантного CTLA-4 ВКД или мутантного CTLA-4-Ig) по данному изобретению, включая фармацевтически приемлемые композиции молекулы по данному изобретению с фармацевтически приемлемым носителем. В другом аспекте данное изобретение включает высушенные сублимацией или лиофилизированные композиции или формуляции. Выражение "высушенный сублимацией" или "лиофилизированный" в общем относится к состоянию вещества, которое подвергалось процедуре высушивания, такой как сушка сублимацией или лиофилизация, где, по меньшей мере, 50% влажности устраняется. Процедуры прелиофилизации и лиофилизации хорошо известны в области техники (смотри, например, LYOPHILIZATION OF BIOPHARMACEUTICALS, Vol.2 BIOTECHNOLOGY: PHARMACEUTICAL ASPECTS (Henry R. Costantino et al. eds., 2004), Патент США №6436897, Публикацию международной заявки WO 06/104852) и будут понятны специалисту в данной области техники. Любая приемлемая процедура лиофилизации может быть использована или модифицирована, чтобы стать приемлемой, специалистом в данной области техники в приготовлении лиофилизированной композиции по данному изобретению. Высушенную сублимацией, высушенную на воздухе, высушенную распылением или лиофилизированную композицию обычно готовят из жидкости, такой как раствор, суспензия, эмульсия и т.п. Жидкость, которая подлежит высушиванию сублимацией, высушиванию на воздухе, высушиванию распылением или лиофилизации, обычно включает все компоненты (кроме жидкости, например воды), которые будут присутствовать в финальной восстановленной жидкой композиции. Таким образом, высушенная сублимацией, высушенная на воздухе, высушенная распылением или лиофилизированная композиция будет иметь желательный состав жидкой композиции (например, фармацевтической композиции) при восстановлении. Иллюстративные композиции по данному изобретению, включая фармацевтические композиции, включающие молекулу по данному изобретению (например, мутантный слитый белок CTLA-4-Ig по данному изобретению, такой как, например, SEQ ID NO:197, 199, 211 или 213), которые описаны в данной заявке, могут быть высушены сублимацией, высушены на воздухе, высушены распылением или лиофилизированы для получения стабильной высушенной сублимацией, высушенной на воздухе, высушенной распылением или лиофилизированной композиции, соответственно, с применением стандартных процедур, известных в данной области техники. Смотри, например, иллюстративные процедуры, описанные в LYOPHILIZATION OF BIOPHARMACEUTICALS, смотри выше.
Например, емкость (например, ампула, такая как стеклянная ампула), содержащая жидкую композицию молекулы по данному изобретению (например, мутантный CTLA-4- Ig, слитый белок по данному изобретению, такой как, например, SEQ ID NO:197, 199, 211 или 213), которая подлежит лиофилизации, может быть лиофилизирована с применением стандартных процедур, известных специалистам в данной области техники. Смотри, например, LYOPHILIZATION OF BIOPHARMACEUTICALS, смотри выше. Лиофилизированная молекула по данному изобретению (например, мутантный CTLA-4-Ig по данному изобретению) может быть последовательно восстановлена жидкостью для получения восстановленной жидкой композиции. Лиофилизированные формуляции обычно восстанавливают путем добавления водного раствора для растворения лиофилизированной формуляции. Любая приемлемая водная жидкость или раствор могут быть использованы для восстановления лиофилизированной формуляции. Лиофилизированную формуляцию часто восстанавливают с применением стерильной или дистиллированной воды, но растворы, включающие носители, наполнители, растворители, буферы и/или другие компоненты, включая те, что описаны в данном описании, могут быть использованы для восстановления.
В одном аспекте изобретение обеспечивает фармацевтическую композицию в лиофилизированной форме, где композиция включает от около 1 мг/мл до около 300 мг/мл слитого белка CTLA-4-Ig по данному изобретению, который типично экспрессируется как димерный слитый белок, в приемлемом буфере (например, HEPES, дицитрат натрия-трицитрат натрия и т.п.) в воде в концентрации, приемлемой, чтобы поддерживать необходимый уровень рН (например, около рН 6,0 до около рН 7,5), соль (например, 50 мМ NaCl), сахар (например, 4-6% по весу сахарозы на основании веса композиции), и необязательно включая неионный детергент (Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68) в концентрации от около 0,01 мг/мл до около 0,5 мг/мл, например около 0,01 мг/мл до около 0,1 мг/мл (например, Tween®-20, Tween®-60, Tween®-80 или плюрониловый F-68). Лиофилизированная форма фармацевтической композиции обычно включает более низкую концентрацию соли и более высокую концентрацию сахара по сравнению с нелиофилизированной жидкой композицией.
В одном конкретном аспекте изобретение обеспечивает стабильную лиофилизированную композицию для терапевтического введения при восстановлении стерильной водой, которая включает терапевтически эффективное количество молекулы по данному изобретению и необязательно один или несколько из следующих фармацевтически приемлемых компонентов: (а) сахар или сахарид, такой как сахароза, манноза, декстроза или трегалоза, в количестве от около 1% по весу до около 10% по весу; (b) детергент или эмульсификатор, такие как Tween®-20, Tween®-40, Tween®-60, Tween®-80 или плюрониловый F-68; (с) изотонический агент или соль, такую как неорганическую соль (например, хлорид натрия), в концентрации от 0 мМ до около 50 мМ (включая, например, концентрацию, приведенную выше); (d) приемлемый буфер для поддержания рН композиции в диапазоне, который соотносится со стабильностью молекулы; (е) диспергирующий агент (например, в количестве, достаточном для длительной дисперсии молекулы по данному изобретению, таком как, например, от 0,001 вес/об.% до около 1,0 вес/об.%) (например, полисорбат, такой как Tween®-20, Tween®-40, Tween®-60, или Tween®-80 или плюрониловый F-68); и (f) стабилизатор (например, сахарид, декстраны, низкомолекулярная группа ПЭГ, такой как ПЭГ, имеющий MB (молекулярный вес) от около 200 Да до около 8000 Да (например, 200, 300, 400, 600, 900, 1000, 1450, 3350, 4500 или 8000 Да) или консервант. В некоторых таких стабильных лиофилизированных композициях молекула по данному изобретению представляет собой рекомбинантный или изолированный слитый белок по данному изобретению, такой как слитый белок, включающий аминокислотную последовательность, имеющую, по меньшей мере, 95%, по меньшей мере, 96%, по меньшей мере, 97%, по меньшей мере, 98%, по меньшей мере, 99% или 100% идентичность последовательности с, по меньшей мере, одной аминокислотной последовательностью, выбранной из группы, включающей SEQ ID NOS:74-79, 197-200, 205-214 и 219-222 (необязательно, например, выбранной из группы, включающей SEQ ID NOS:197, 199, 211 и 213), где слитый белок связывает CD80 и/или CD86 и/или его внеклеточный домен и/или подавляет иммунный ответ. Такие слитые белки могут быть в мономерной или димерной форме.
Иллюстративные количества каждого такого компонента в лиофилизированной композиции включают те, что описаны выше и здесь. В одном аспекте буфер выбран так, чтобы поддерживать рН композиции в диапазоне от около рН 3 до около рН 8, от около рН 4 до около рН 7,5. Лиофилизированная композиция по данному изобретению, включающая рекомбинантный мутантный слитый белок CTLA-4-Ig по данному изобретению, является обычно стабильной при от -80° до +40°С и/или по сути сохраняет свою биологическую активность в течение, по меньшей мере, одной недели, одного или нескольких месяцев (например, шесть месяцев), одного года, двух лет, трех лет, четырех лет или более при хранении при комнатных температурах (например, от около 22°С до около 30°С). При восстановлении жидкостью (например, стерильной водой для инъекций (ВДИ)) лиофилизированная композиция является приемлемой для введения (например, в/в (внутривенно), п/к (подкожно), парентерально, в/м (внутримышечно), и/д (интрадермально), и/п (интраперитониально) и т.п.) субъекту (например, человеку).
Изобретение также обеспечивает набор, включающий лиофилизированную или высушенную сублимацией композицию, включающую лиофилизированную или высушенную сублимацией молекулу по данному изобретению (например, мутантный слитый белок CTLA-4-Ig, такой как, например, SEQ ID NO:197, 199, 211 или 213) в первой емкости (например, ампуле, такой как стеклянная ампула) и инструкцию для восстановления высушенной сублимацией или лиофилизированной композиции с применением жидкости (например, стерильной воды, ВДИ или буфера). Необязательно, набор также включает вторую емкость (например, ампулу, такую как стеклянная ампула), содержащую достаточное количество жидкости (например, стерильной воды, ВДИ или буфера) для восстановления лиофилизированной или высушенной сублимацией композиции в жидкую композицию. В этом случае восстановление достигается применением шприца для удаления необходимого объема воды из второй емкости и введения воды в первую емкость. Первую емкость затем раскачивают аккуратно для введения молекулы по данному изобретению (например, слитого белка) в раствор. Набор может включать устройство(а) для восстановления лиофилизированной или высушенной сублимацией композиции и/или введения восстановленной жидкой композиции. Иллюстративные устройства включают, но не ограничиваются следующим, например, двухкомпонентный смешивающий шприц, двухкамерный шприц и двухкамерный автоинъектор. Один компонент или камера содержит лиофилизированную композицию, а второй компонент или камера содержит жидкость для восстановления. Используя такие устройства, восстановление обычно проводят непосредственно перед введением и восстановленную композицию обычно вводят парентерально (например, инъекцией п/к (подкожно), в/в (внутривенно), в/м (внутримышечно), и/д (интрадермально)).
Композиция или фармацевтическая композиция по данному изобретению может включать или быть в форме липосомы. Приемлемые липиды для липосомальной формуляции включают, без ограничения, моноглицериды, диглицерида, сульфатиды, лизолицетин, фосфолипиды, сапонин, желчные кислоты и подобное. Приготовление таких липосомальных составов описано в, например, Патентах США №4837028 и 4737323.
Форма композиций или фармацевтической композиции может быть продиктована, по меньшей мере, частично путем введения полипептида, конъюгата, нуклеиновой кислоты, вектора, вируса, ВПЧ или клетки, представляющих интерес. Так как возможно множество путей введения, то форма фармацевтической композиции и ее компоненты могут изменяться. Например, при трансмукозальном или трансдермальном введении смачивающие агенты, приемлемые для того барьера, который необходимо преодолеть, могут быть включены в композицию. Такие смачивающие агенты в общем известны в данной области техники и включают, например, для трансмукозального введения, детергенты, желчные кислоты и производные фусидовой кислоты. В противном случае трансмукозальное введение может быть облегчено применением назальных спреев или суппозиториев.
Наиболее распространенной формой для композиций по данному изобретению, включая фармацевтические композиции, является инъекция. Фармацевтически приемлемые композиции для введения инъекцией обычно включают один или несколько приемлемых жидких носителей, таких как вода, вазелин, физиологический солевой раствор, бактериостатическая вода, Cremophor ELTM (BASF, Parsippany, NJ), PBS или масла. Жидкие фармацевтические композиции могут также включать физиологический солевой раствор, раствор декстрозы (или раствор другого сахарида), спирты (например, этанол), полиолы (многоатомные спирты, такие как маннитол, сорбитол и т.п.) или гликоли, такие как этиленгликоль, пропиленгликоль, ПЭГ молекулы, покрывающие агенты, которые обеспечивают необходимую текучесть, такие как лецитин, изотонические агенты, такие как маннитол или сорбитол, органические эфиры, такие как этиолеат, и агенты, препятствующие абсорбции, такие как моностеарат алюминия и желатины. Композиция для инъекции может быть в форме непирогенного стабильного водного раствора. Водный раствор для инъекции может включать изотонический носитель, такой как хлорид натрия, раствор для инъекций Рингера, декстроза, насыщенный лактатом раствор для инъекций Рингера или эквивалентный носитель для доставки (например, раствор для инъекций хлорид натрия/декстроза). Формуляции, приемлемые для инъекции внутрисуставным, внутривенным, внутримышечным, интрадермальным, субдермальным, интраперитониальным и подкожным путями, включают водные и неводные, изотонические стерильные растворы для инъекции, которые могут включать растворители, совместные растворители, антиоксиданты, восстановители, хелатирующие агенты, буферы, бактериостатические агенты, противомикробные консерванты и растворенные вещества, которые делают формуляцию изотоничной крови реципиента, которому ее вводят (например, PBS и/или солевые растворы, такие как 0,1 М NaCl), и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, сжижающие агенты, загустители, эмульсификаторы, стабилизаторы и консерванты.
Введение полипептида, конъюгата, нуклеиновой кислоты, вектора, вируса, псевдовируса, ВПЧ или клетки по данному изобретению (или композиции, включающей любой такой компонент) может облегчаться устройством для доставки, образованным из любого приемлемого материала. Примеры приемлемых матричных материалов для производства небиораспадающихся устройств для введения включают гидроксиапатит, органическое стекло, алюминаты или другие керамические материалы. В некоторых применениях, изолирующий агент, такой как карбоксиметилцеллюлоза (КМЦ), метилцеллюлоза или гидроксипропилметилцеллюлоза (ГПМЦ), может быть использован для связывания конкретного компонента с устройством для локализированной доставки.
Нуклеиновая кислота или вектор по данному изобретению могут быть сформулированы с одним или несколькими полоксамерами, полиоксиэтилен/полиоксипропилен блок-сополимерами или другими поверхностно-активными веществами или мылоподобными липофильными веществами для доставки нуклеиновой кислоты или вектора к популяции клеток или ткани или коже субъекта. Смотри, например, Патенты США №6149922, 6086899 и 5990241.
Нуклеиновые кислоты и векторы изобретения могут быть связаны с одним или несколькими агентами, усиливающими трансфекцию. В некоторых вариантах осуществления изобретения нуклеиновая кислота и/или вектор нуклеиновой кислоты по данному изобретению обычно связаны с одним или несколькими солями, обеспечивающими стабильность, носителями (например, ПЭГ) и/или формуляциями, которые способствуют трансфекции (например, солями фосфата натрия, декстрановыми носителями, носителями оксида железа или носителями для биолистической доставки ("генной пушки"), такими как золотая гранула или порошковые носители). Смотри, например, Патент США №4945050. Дополнительные агенты, усиливающие трансфекцию, включают вирусные частицы, с которыми нуклеиновая кислота или вектор нуклеиновой кислоты могут быть конъюгированы, агент, осаждающий фосфат кальция, протеаза, липаза, раствор бипувикаина, сапонин, липид (например, заряженный липид), липосома (например, катионная липосома), пептид или белковый комплекс, облегчающий трансфекцию (например, поли(этиленимин), полилизин или комплекс вирусного белка и нуклеиновой кислоты), виросома или модифицированная клетка или клеточноподобная структура (например, слитая клетка).
Нуклеиновые кислоты и векторы по данному изобретению могут также быть доставлены in vivo или ex vivo способами электропорации, включая, например, те, что описаны в Патентах США №6110161 и 6261281 и Widera et al., J. of Immunol. 164:4635-4640 (2000).
Трансдермальное введение компонента по данному изобретению (например, полипептида, конъюгата, нуклеиновой кислоты, вектора, вируса, ВПЧ и/или клеток по данному изобретению) может облегчаться с помощью трансдермального пластыря, включающего такой компонент в любой приемлемой композиции в любой приемлемой форме. Такие устройства - трансдермальные пластыри - обеспечиваются изобретением. Например, такой компонент может содержаться в жидком резервуаре, в резервуаре для лекарства в устройстве-пластыре, или, альтернативно, компонент может быть диспергирован через материал, приемлемый для включения в устройство простого монолитного трансдермального пластыря. Типично, пластырь включает иммуносупрессорное количество, по меньшей мере, одного такого компонента - такое, как количество, эффективное, чтобы подавлять иммунный ответ у субъекта, контактирующего с пластырем. Примеры такого устройства-пластыря известны в области техники. Устройство-пластырь может быть как пассивным устройством, так и устройством, способным к ионтофоретической доставке, по меньшей мере, одного такого компонента к коже или ткани субъекта.
Композиция, особенно фармацевтическая композиция, может включать любую приемлемую дозу, по меньшей мере, одного такого компонента по данному изобретению (например, полипептида, конъюгата, нуклеиновой кислоты, вектора, вируса, ВПЧ и/или клетки), достаточную для достижения желательного иммуносупрессорного ответа у субъекта после введения. Точная дозировка может определяться с помощью любой приемлемой методики и инструкций для определения, которые точно известны в области техники. В простой анализируемой схеме дозировки низкие дозы композиции вводят анализируемому субъекту или системе (например, животной модели, бесклеточной системе или цельно-клеточной системе исследования). Дозировка зачастую определяется эффективностью конкретного компонента, подлежащего введению, состоянием субъекта, весом тела субъекта и/или целевой областью субъекта, которая подлежит лечению. Размер дозы также определяется существованием, природой и широтой проявления любых побочных эффектов, которые сопровождают введение любого такого конкретного компонента конкретному субъекту. Принципы, относящиеся к дозировке терапевтических и профилактических агентов, приводятся в, например, Platt, Clin. Lab Med. 7:289-99 (1987), "Drug Dosage," J. Kans. Med. Soc. 70(1):30-32 (1969), и других ссылках, описанных здесь (например, Remington's, смотри выше).
К примеру, терапевтически эффективное количество полипептида по данному изобретению для начальной дозировки для лечения аутоиммунного заболевания может включать от около 0,001 мг/кг веса тела субъекта до около 100 мг/кг веса тела субъекта, такое как, например, от около 0,001 миллиграммов на килограмм (мг/кг) веса тела субъекта до около 100 миллиграммов на килограмм (мг/кг) веса субъекта, или, например, от около 0,001 мг/кг веса субъекта до, по меньшей мере, около 0,005, 0,01, 0,025, 0,05, 0,1, 0,2, 0,25, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 25, 30, 40, 50, 60, 70, 75, 80, 90 или 100 мг/кг веса тела субъекта. Такая дозировка может быть для любого приемлемого протокола, например, такого как введения ежедневно, раз в неделю или раз в две недели или любой их комбинации (например, около 0, 1, 2, 4, 5, 6 и 7 дней, каждую неделю после этого или около 0, 1, 2, 4 и 6 недель), с последующими 1-, 2-, 3-месячными перерывами, и любым приемлемым способом доставки, таким как, например, путем электропорации или подкожной (п/к, или s.c.), внутримышечной (в/м, или i.m.), внутривенной (в/в, или i.v.), или интраперитониальной (и/п, или i.p.), субдермальной, трансдермальной, парентеральной или интрадермальной (и/д, или i.d.) инъекции. В некоторых случаях полипептид по данному изобретению обычно вводят в виде растворимого полипептида, такого как, например, слитый белок, включающий мутантный полипептид CTLA-4 ВКД по данному изобретению, ковалентно связанный с Ig Fc полипептидом. Например, фармацевтическая композиция, включающая мутантный слитый белок CTLA-4-Ig по данному изобретению в фармацевтически приемлемом носителе, растворителе или наполнителе, может быть введена любым приемлемым путем (например, внутрикожно, внутривенно или подкожно) в эффективном количестве в зависимости от аутоиммунного заболевания (например, ревматоидного артрита) или состояния, подлежащего лечению (например, ингибирование отторжения трансплантата ткани, клетки, участка ткани или органа или цельного органа от донора субъектом-реципиентом).
В одном иллюстративном аспекте изобретение обеспечивает способ подавления иммунного ответа у субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции, включающей, например, от около 1 мг/мл до около 300 мг/мл, включая от около 25 мг/мл до около 150 мг/мл (например, 50 или 100 мг/мл) D3-54-IgG2 слитого белка в 20 мМ HEPES буфере в воде, 100 мМ NaCl, 2% по весу сахарозы, рН 7,4, где субъект страдает от аутоиммунного нарушения (например, ревматоидного артрита). В другом иллюстративном аспекте изобретение обеспечивает способ ингибирования отторжения трансплантата ткани, клетки, участка ткани или органа или цельного органа от донора субъектом-реципиентом, включающий введение субъекту-реципиенту фармацевтической композиции, включающей от около 25 мг/мл до около 100 мг/мл (например, 50 или 100 мг/мл) D3-69-IgG2 слитого белка в 20 мМ натрий-цитратном буфере в воде, 100 мМ NaCl, 2% по весу сахарозы, рН 6,5.
Также обеспечивается композиция вирусного вектора, которая включает носитель или наполнитель и вирусный вектор по данному изобретению. Фармацевтические композиции, включающие фармацевтически приемлемый носитель или наполнитель и вирусный вектор, также обеспечиваются данным изобретением. Количество или дозировка вирусных векторных частиц или нуклеиновой кислоты, кодирующей вирусные векторные частицы, зависит от: (1) типа вирусной векторной частицы в отношении источника вектора, включая, но не ограничиваясь следующим, например, является ли вектор альфавирусным вектором, Semliki-Forest вирусным вектором, аденовирусным вектором, аденоассоциированным (AAV) вирусным вектором, флавивирусным вектором, папилломавирусным вектором и/или вирусным вектором простого герпеса (ВПГ), (2) является ли вектор трансгенным, экспрессирующим или несущим рекомбинантный пептид вектором, (3) хозяина и (4) других соображений, обсуждаемых выше. В общем, в отношении векторов переноса генов фармацевтически приемлемая композиция включает, по меньшей мере, около 1×102 вирусных векторных частиц в объеме от около 1 мл (например, по меньшей мере, около 1×102 до 1×108 частиц в около 1 мл). Более высокие дозировки также могут быть приемлемыми (например, по меньшей мере, около 1×106, около 1×108, около 1×109, около 1×1010 частиц/мл).
Изобретение также обеспечивает композицию (включая фармацевтическую композицию), включающую агрегат двух или нескольких полипептидов или конъюгатов по данному изобретению. Более того, изобретение обеспечивает композицию (включая фармацевтическую композицию), включающую популяцию одного или нескольких мультимерных полипептидов или мультимерных конъюгатов по данному изобретению. Как отмечалось выше, фармацевтические композиции включают фармацевтически приемлемый наполнитель, растворитель или носитель.
НАБОРЫ
Данное изобретение также обеспечивает наборы, включающие один, два, три или более полипептидов (например, мутантных полипептидов CTLA-4 ВКД, мутантных слитых белков CTLA-4-Ig, включая димерные слитые белки), конъюгаты, нуклеиновые кислоты, векторы, клетки и/или композиции по данному изобретению. Наборы по данному изобретению необязательно содержат: (1) по меньшей мере, один полипептид (например, мутантный слитый белок CTLA-4-Ig), конъюгат, нуклеиновую кислоту, вектор, ВПЧ, клетку и/или композицию по данному изобретению; (2) необязательно, по меньшей мере, один второй иммуносупрессорный агент (например, нестероидный противовоспалительный агент, метотрексат, стероид, антагонист TNFα и т.п.); (3) инструкции по применению любого способа, описанного здесь, включая терапевтический или профилактический способ и инструкции для применения любого компонента, определенного в (1) или (2); (4) емкость для содержания, по меньшей мере, одного такого компонента, определенного в (1) или (2); и/или (5) упаковочные материалы. Один или несколько полипептидов (например, мутантный слитый белок CTLA-4-Ig), конъюгаты, нуклеиновые кислоты, векторы, ВПЧ, клетки и/или композиции по данному изобретению, необязательно с одним или несколькими вторыми иммуносупрессорными агентами, могут быть упакованы в упаковки, дозаторы и наборы для введения субъекту, такому как млекопитающее, включая человека. Для определенного терапевтического или профилактического способа определяется эффективное количество каждого такого полипептида (например, мутантного слитого белка CTLA-4-Ig), конъюгата, нуклеиновой кислоты, вектора, ВПЧ, клетки и/или композиции по данному изобретению или необязательно второго иммуносупрессорного агента (например, доза) и обеспечивается одна или несколько таких доз. Один или несколько полипептидов (например, мутантный слитый белок CTLA-4-Ig), конъюгаты, нуклеиновые кислоты, векторы и/или клетки композиции и, при необходимости, необязательный второй иммуносупрессорный агент могут быть обеспечены в порошкообразной (например, лиофилизированной) или жидкой форме и могут быть сформулированы с наполнителем или носителем (включая, например, фармацевтически приемлемый наполнитель или носитель), тем самым образуя композицию (включая, например, фармацевтическую композицию). Обеспечиваются упаковки или дозаторы, которые включают один или несколько унифицированных дозированных форм. Типично, инструкции для введения таких компонентов предоставляются с упаковкой, наряду с соответствующей маркировкой на этикетке, на которой отмечено, что соединение является приемлемым для лечения обозначенного состояния.
Сведения, подтверждающие возможность осуществления изобретения
Следующие примеры также иллюстрируют изобретение, но не должны рассматриваться как ограничивающие его объем каким-либо путем.
Пример 1
Этот пример обеспечивает описание способов создания LEA29Y-Ig слитого белка, который использовался как контроль и для целей сравнения в исследовании Biacore™ связывания и активности на основе клеток.
Создание ДНК плазмидного вектора, кодирующего LEA29Y-Ig слитый белок.
Этот пример описывает создание ДНК плазмидного вектора, который кодирует LEA29Y-Ig слитый белок. LEA29Y-Ig включает специфический известный мутантный полипептид CTLA-4 ВКД, названный "LEA29Y" (или "LEA", или "L104EA29Y", или "A29YL104E"), который ковалентно соединен на его С-конце с N-концом специфического мутантного человеческого IgG1 Fc полипептида. LEA29Y полипептид - это мутантный полипептид CTLA-4 ВКД, включающий аминокислотную последовательность, которая отличается от аминокислотной последовательности человеческого CTLA-4 внеклеточного домена двумя мутациями - A29Y заменой и L104E заменой - где положения 29 и 104 пронумерованы с помощью ссылки на аминокислотную последовательность человеческого полипептида CTLA-4 ВКД, с первым аминокислотным остатком человеческого CTLA-4, обозначенным как положение аминокислотного остатка 1. Смотри Патент США №7094874. Плазмидный вектор pCDNA3.1-LEA, который включает нуклеотидную последовательность, которая кодирует LEA29Y-Ig, создают для получения этого слитого белка.
ДНК, кодирующая LEA29Y-Ig, образуется путем ПЦР сборки с применением перекрывающихся олигонуклеотидов, сконструированных на основе гомологии последовательности с нуклеотидной последовательностью, кодирующей LEA29Y-Ig, представленной в SEQ ID NO:167. Олигонуклеотиды конструируют, создают и собирают с применением стандартных процедур, хорошо известных специалистам в данной области, и они могут включать стоп- и старт-кодоны и сайты рестрикции при необходимости. Процедуры ПЦР амплификации, которые тут применяются, также хорошо известны в данной области техники. Смотри, например, Berger, Ausubel и Sambrook, все смотри выше.
Олигонуклеотиды собирают в 100 мкл ПЦР реакции с 1 мкМ олигонуклеотидов, 1х Taq буфера (Qiagen; #201225) и 200 мкМ dNTP (дезоксинуклеотидтрифосфаты) в течение 30 циклов амплификации (94°С, 30 сек; 60°С, 30 сек; 72°С, 60 сек). Амплифицированную ДНК очищают с помощью QiaQuick ПЦР спин-колонок (Qiagen, Кат. #28104) и обрабатывают рестрикционными ферментами NheI и SacII. Фрагменты разделяют на электрофорезе на агарозном геле, очищают с применением набора для гелевой экстракции Qiaquick (Qiagen, #28704) в соответствии с рекомендациями производителя и лигируют в таким же образом обработанную ферментами плазмидную рКДНК 3.1 (+) (Invitrogen, Кат. #V790-20). Продукты лигирования трансформируют в клетки ТОРlO Е. coli (Qiagen, Кат. #С4040-10) в соответствии с рекомендациями производителя. Полученные клетки инкубируют в течение ночи при 37°С в LB среде, содержащей 50 мкг/мл карбенициллина, с перемешиванием при 250 об/мин и затем используют для приготовления maxiprep (Qiagen; #12362) стока плазмидной ДНК (далее в данном описании называемой как плазмидный вектор pCDNA3.1-LEA).
Плазмидный вектор pCDNA3.1-LEA идентичен плазмидному вектору рКДНК мутантного вектора CTLA-4-IgG2, показанному на фигуре 1, за исключением того, что последовательность нуклеиновых кислот, кодирующая мутантный полипептид CTLA-4-IgG2, замещена на последовательность нуклеиновой кислоты, кодирующей LEA29Y-Ig слитый белок. Нуклеиновую кислоту, кодирующую сигнальный пептид человеческого CTLA-4, включают как нуклеотидную последовательность, кодирующую сигнальный пептид.
Последовательность нуклеиновых кислот, кодирующая предполагаемый LEA29Y-Ig слитый белок, представленная в SEQ ID NO:167. SEQ ID NO:167 включает нуклеотидную последовательность, кодирующую сигнальный пептид (например, аминокислотные остатки 1-37 SEQ ID NO:165). Аминокислотные последовательности предполагаемого LEA29Y-Ig и зрелого LEA29Y-Ig слитого белка (без сигнального пептида) показаны в SEQ ID NOS:165 и 166 соответственно. Как отмечено на фигуре 2С, предполагаемая аминокислотная последовательность LEA29Y-Ig включает следующие сегменты: предполагаемый сигнальный пептид (аминокислотные остатки 1-37), LEA29Y ВКД полипептид (аминокислотные остатки 38-161), линкер (аминокислотный остаток 162) и мутантный (модифицированный) Fc домен человеческого IgG1 полипептида (аминокислотные остатки 163-394). Аминокислотные остатки в местах соединения между этими различными сегментами также показаны на фигуре 2С. А именно, показаны последние четыре аминокислотных остатка сигнального пептида, первые пять и последние пять аминокислотных остатков LEA29Y ВКД, один линкерный аминокислотный остаток (Q) и первые пять и последние пять аминокислотных остатков мутантного IgG1 Fc полипептида.
Сигнальный пептид обычно отщепляется в ходе процессинга, и, таким образом, секретируемый слитый белок (а именно, зрелый слитый белок) LEA29Y-Ig не содержит обычно последовательность сигнального пептида. Зрелая/секретируемая форма LEA29Y-Ig, которая имеет общее число 357 аминокислот, включает аминокислотные остатки 38-394 (полноразмерная последовательность без сигнального пептида) предполагаемой последовательности, представленной в SEQ ID NO:165, и начинается с аминокислотной последовательности: метионин-гистидин-валин-аланин. SEQ ID NO:165 включает сигнальный пептид (например, остатки 1-37) на ее N-конце; сигнальный пептид обычно отщепляется, формируя зрелый белок, представленный в SEQ ID NO:166. При необходимости, аминокислоты зрелой формы могут быть пронумерованы начиная с Met последовательности Met-His-VaI-Ala, обозначая Met как первый остаток (например, ВКД включает аминокислотные остатки, пронумерованные 1-124), как в зрелом LEA29Y-Ig слитом белке, имеющем последовательность, представленную в SEQ ID NO:166. В одном аспекте последовательность SEQ ID NO:165 или 166 не включает C-терминальный лизиновый остаток; этот остаток может отщепляться в ходе процессинга или перед секрецией.
Белковая последовательность LEA29Y-Ig слитого белка описана в Патенте США №7094874. Специфически SEQ ID NO:4 Патента США №7094874 показывает белковую последовательность, кодирующую незрелую форму мономерного LEA29Y-Ig. В Патенте США №7094874 LEA29Y-Ig слитый белок называется "L104EA29YIg." Зрелый LEA29Y-Ig слитый белок, включающий последовательность, представленную в SEQ ID NO:166, представленной здесь, отличается от последовательности слитого белка, представленной в SEQ ID NO:4 в Патенте США №7094874, так как SEQ ID NO:4 Патента США №7094874 включает сигнальный пептид (а именно, остатки 1-26 SEQ ID NO:4). Этот сигнальный пептид обычно отщепляется в ходе процессинга, и, таким образом, зрелая (секретируемая) форма LEA29Y-Ig слитого белка обычно не включает последовательность сигнального пептида. SEQ ID NO:3 Патента США №7094874 представляет последовательность нуклеиновых кислот, которая кодирует L104EA29YIg слитый белок (а именно, LEA29Y-Ig).
LEA29Y-Ig обычно существует в растворе как димерный слитый белок, включающий два идентичных мономерных слитых белка. В этом случае каждый мономерный зрелый LEA29Y-Ig слитый белок включает LEA29Y ВКД (SEQ ID NO:168) полипептид, слитый на его С-конце с N-концом мутантного IgG1 Fc (SEQ ID NO:186). Два LEA29Y-Ig мономера ковалентно соединены вместе дисульфидными связями, сформированными между остатками цистеина в каждом мономере, тем самым образуя LEA29Y-Ig димер слитого белка. LEA29Y-Ig димер - это форма молекулы слитого белка, используемая в исследованиях, описанных в этих примерах, кроме тех случаев, в которых определено обратное.
Создание стабильной СНО-K1 клеточной линии, экспрессирующей LEA29Y-Ig слитый белок.
Стабильную клеточную линию создавали для образования многомиллиграммных количеств LEA29Y-Ig слитого белка, обсуждаемого выше.
Трансфекция СНО-K1 клеток
СНО-K1 клетки сеяли с плотностью 1×106 в Т-175 колбы (BD Falcon, #353112), содержащие 40 мл ростовой среды (DMEM/F12 среда (Invitrogen, #10565-018), дополненной 10% фетальной бычьей сывороткой (ФБС) (Hyclone, #SV30014.03) и 1х ПС (Пенициллин + Стрептомицин) (Invitrogen, #15140-122)). Клетки инкубировали в течение 24 часов (час) при 37°С и затем трансфектировали с 10 мкг Maxiprep плазмидной ДНК (например, плазмидным вектором, кодирующим LEA29Y-Ig, как описано выше), смешивая с 60 мкл Fugene 6 (Roche, #11814443001) в соответствии с условиями, рекомендованными производителем. Клетки инкубировали в течение 2 дней (дн.) при 37°С в ростовой среде и затем 10 дн. в среду отбора (ростовая среда, содержащая 300 мкг/мл генетицина (Invitrogen, #10131-027)), заменяя среды каждые 2 дня. Среду удаляли и клетки рассеивали добавлением 3 мл 0,05% трипсина (Invitrogen, Кат. #25300-054) и инкубацией при 37°С в течение 3 мин. Рассеянные клетки разводили в 10 мл ростовой среды и собирали центрифугированием при 1000 об/мин в течение 5 мин при комнатной температуре (КТ) в GH-3,8 роторе (Beckman Coulter, #360581). После исключения супернатанта клетки суспендировали в 1 мл ростовой среды, фильтровали через 40 мкМ мембраны (BD Falcon, #352340) и доводили до плотности 1×106 клеток/мл.
Отделение уникальных клонов.
Используя установку для клеточной сортировки (Dako, MoFIo), живые клетки индивидуально рассеивали в 96-ячейковые планшеты для культуры (Sigma-Aldrich, #CLS-3596), содержащие 200 мкл/ячейка ростовой среды, содержащей 25% кондиционированной среды (ростовой среды, предварительно собранной от нетрансфектированных (или нативных) клеточных культур). После инкубации при 37°С в течение 10-14 дней клетки рассеивали с помощью гидролиза трипсином и перенесли в новые планшеты для культуры, содержащие 200 мкл/ячейка ростовой среды. Клетки культивировали при 37°С в ростовой среде, пока плотность клеток не достигала 70% конфлюентности (приблизительно 14 дней в среде, которую заменяли каждые 7 дней).
Определение необходимых клонов
Клоны, экспрессирующие высокие уровни рекомбинантного LEA29Y-Ig слитого белка, определяли с помощью дот-блот анализа (анализ методом гибридизации макромолекул путем диффузии через точечные отверстия в матрице) и вестерн-анализа. Для дот-блот анализа 100 мкл среды собирали от каждой ячейки 96-ячейковых планшетов для культуры и переносили на нитроцеллюлозные мембраны (Whatman, #10439388) в соответствии с рекомендациями производителя. Мембраны отмывали дважды 200 мл PBST (PBST - это фосфат-забуференый солевой раствор (PBS)+0,05% Tween®-20) в течение 10 мин при комнатной температуре (КТ) и затем инкубировали с PBST, содержащем 5% нежирное сухое молоко (EMD, #1.15363.0500) в течение 1 часа (час) при КТ. Мембраны отмывали, как описано выше, и инкубировали в течение 1 часа при КТ в 20 мл PBST, содержащем антитело козла против человеческого Ig, конъюгированное с пероксидазой хрена (HRP) - (Вектор Labs, #BA-3000), разведенное до 1:4000. Мембраны отмывали, как описано выше, и инкубировали в течение 1 час при КТ с PBST, содержащем стрептавидин-HRP реагент (BD Biosciences, #554066), разведенный 1:2000. Мембраны отмывали, как описано выше, и сигналы определяли с применением реагента ECL (электрохимический лизис) для определения вестерн-блота (Amersham, Кат. #RPN2132) в соответствии с условиями, рекомендованными производителем. Позитивные клоны, определенные по высокой интенсивности сигнала (а именно, экспрессирующие высокие уровни слитого белка), рассеивали трипсиновым гидролизом и переносили на 6-ячейковые планшеты для культуры (BD Falcon, Кат. #353046), содержащие 2 мл/ячейка ростовой среды. После инкубации при 37°С в течение 3-4 дней клетки рассеивали трипсиновым гидролизом и переносили в Т-75 колбы (BD Falcon, Кат. #353136), содержащие 20 мл ростовой среды. После инкубации при 37°С в течение 2 дней 100 мкл среды собирали и анализировали в отношении уровней экспрессии белка с помощью вестерн-анализа. Для вестерн-анализа равные количества (15 мкл) среды из каждой клеточной культуры прогоняли через 4-12% Би-трис NuPAGE гели (Invitrogen, #NP0322BOX) в MES (MES - это 2-(N-морфолино)этансульфоновая кислота, рН 7,3) подвижном буфере (Invitrogen, #NP0002) в соответствии с условиями, рекомендованными производителем. Белки переносили из гелей на нитроцеллюлозные мембраны (Invitrogen, Кат. #LC2001) с помощью электропереноса в соответствии с условиями, рекомендованными производителем. Мембраны обрабатывали, как описано выше, для дот-блоттинга и позитивные клоны (экспрессирующие слитый белок, представляющий интерес) определяли по интенсивности сигнала и средней молекулярной массе. Позитивные клоны рассеивали трипсиновым гидролизом, как описано выше, и помещали в Т-175 колбы, содержащие 40 мл ростовой среды.
Получение и очищение LEA29Y-Ig слитого белка
Размножение культур роллерных флаконов
Стабильную СНО-K1 клеточную линию, которая была трансфектирована, как описано выше, с нуклеиновой кислотой, кодирующей слитый белок, представляющий интерес, выращивали до конфлюентности в Т-175 колбах, содержащих 40 мл ростовой среды (DMEM/F-12 среда (Invitrogen, #10565-018), дополненной 10% ФБС (Hyclone #SV30014,03) и 1х ПС (Invitrogen, #15140-122)). Клетки собирали инкубацией в 3 мл 0,05% трипсина (Invitrogen, Кат. #25300-054) в течение 3 мин при 37°С, разводили в 12 мл ростовой среды и затем переносили в роллерные флаконы (Coming, Кат. #431191), содержащие 250 мл ростовой среды. После инкубации культур в роллерных флаконах при 37°С в увлажненном роллерном инкубаторе в течение 2 дней, среды удаляли и замещали на 250 мл свежей ростовой среды. Культуры инкубировали в течение 2 дней при 37°С и среду замещали на 250 мл UltraCHO среду (UltraCHO среда (BioWhittaker, Кат. #12-724), дополненная 1/1000 EX-CYTE (Serological Proteins, Кат. #81129N) и 1х ПС)). После инкубации в течение 2 дней при 37°С среды замещали на 250 мл свежей UltraCHO среды. Культуры инкубировали в течение 2 дней при 37°С и среду замещали на 250 мл среды получения (DMEM/F-12 среда, дополненная 1/100х ITSA (Life Technologies #51300-044), 1/1000х EX-CYTE и 1x ПС). В процессе получения среду собирали и замещали на свежую среду получения каждый день.
Очищение белка
Среду получения из культур роллерных флаконов очищали центрифугированием при 2500 x g в течение 30 мин при КТ с последующей фильтрацией через 0,2 мкМ мембраны (VWR, Кат. #73520-986). Среды концентрировали в 10 раз с помощью фильтрования тангенциальным потоком с применением 10 кДа MWCO мембран (Millipore, Кат. #Р3С010С00) и затем использовали для аффинной хроматографии белка А с применением BioCad vision ВЭЖХ системы. Ig-слитый белок связывали с Poros 20 Белок-А смолой (Applied Biosystem, Кат. #1-5029-01) в PBS буфере, отмывали этим же буфером, элюировали с 80 мМ лимоннокислого буфера (рН 4,0), содержащего 160 мМ хлорида натрия, и затем нейтрализовывали добавлением 2М Трис-основания. Раствор белка подвергали конечному диализу на 6 литров (л) PBS с применением 10 кДа MWCO мембран (Pierce, Кат. #Р166810).
Пример 2
Этот пример описывает иллюстративные способы, используемые для создания и скрининга библиотек мутантов CTLA-4 для изменения активностей связывания человеческого CD80 и/или человеческого CD86 фаговым дисплеем.
Слитый белок человеческий CD80-Ig
Слитые белки человеческого CD80-Ig ("hCD80-Ig") и человеческого CD86-Ig ("hCD86-Ig") использовали как лиганды в экспериментах фагового пэннинга и фагового ELISA для определения мутантных молекул CTLA-4, которые связывают человеческий CD80 ("hCD80") и/или человеческий CD86 ("hCD86") и/или внеклеточный домен каждого или обоих. Слитые белки человеческого CD80-Ig (также называемого "hB7.1-Ig" или "hB7-1-Ig") и человеческого CD86-Ig (также называемого "hB2.1-Ig" или "hB2-1-Ig") доступны от R&D Systems (Minneapolis, MN).
Репрезентативная последовательность нуклеиновой кислоты, кодирующая предполагаемый слитый белок человеческого CD80-IgG1 ДТ, который включает сигнальный пептид человеческого CD80, человеческого CD80 ВКД и человеческого IgG1 Fc, показана в SEQ ID NO:172. Предполагаемые и зрелые аминокислотные последовательности hCD80-IgG1 слитого белка показаны в SEQ ID NO:170 и SEQ ID NO:171 соответственно. Предполагаемый слитый белок, представленный в SEQ ID NO:170, включает человеческий CD80 ВКД ДТ, ковалентно слитый на его С-конце с N-концом человеческого IgG1 Fc полипептида и включает сигнальный пептид на его N-конце. Сигнальный пептид обычно отщепляется, формируя зрелый слитый белок CD80-Ig, представленный в SEQ ID NO:171.
Человеческий CD80-IgG1 обычно в данном описании сокращают как hCD80-Ig. Как показано на фигуре 2А, предполагаемая аминокислотная последовательность слитого белка hCD80-Ig (также обозначенного как "CD80-IgG1") включает следующие сегменты: предполагаемый сигнальный пептид (аминокислотные остатки 1-34), человеческий CD80 ВКД (аминокислотные остатки 35-242), линкер (аминокислотные остатки 243-245) и полипептид человеческого IgGI Fc (аминокислотные остатки 246-476). Аминокислотные остатки в местах соединения между этими различными сегментами показаны на фигуре 2А. В особенности показаны последние четыре аминокислотных остатка сигнального пептида, первые пять и последние пять аминокислотных остатков человеческого CD80 ВКД, аминокислотные остатки линкера (GVT) и первые пять и последние пять аминокислотных остатков человеческого IgG1 Fc полипептида. В слитом белке CD80-Ig три остатка GVT присутствуют как клонирующий артефакт (или линкер) между С-концом CD80 ВКД (который заканчивается с аминокислотными остатками FPDN) и N-концом полипептида IgG1 Fc (который начинается с аминокислотных остатков PK.SC). Этот GVT клонирующий артефакт или линкер показан в предполагаемой и зрелой CD80-Ig аминокислотных последовательностях, представленных в SEQ ID NO:170 и 171 соответственно.
Сигнальный пептид обычно отщепляется в ходе процессинга, и, таким образом, секретируемый слитый белок (а именно, зрелый слитый белок) hCD80-Ig обычно не содержит сигнальный пептид. Зрелая/секретируемая форма hCD80-Ig, которая имеет общее количество 442 аминокислот, включает аминокислотные остатки 35-476 (полноразмерная последовательность без сигнального пептида) SEQ ID NO:170 и начинается с последовательности аминокислотных остатков: валин-изолейцин-гистидин-валин. При необходимости, аминокислоты зрелой формы могут быть пронумерованы, начиная с валина (Val) последовательности Val-Ile-His-Val, обозначая Val как первый остаток (например, ВКД включает аминокислотные остатки, пронумерованные 1-208), как в зрелой форме hCD80-Ig, включающей аминокислотную последовательность, представленную в SEQ ID NO:171.
Слитый белок hCD80-Ig обычно существует в растворе как димерный слитый белок, включающий два идентичных мономерных зрелых слитых белка hCD80-Ig. В этом случае каждый мономерный зрелый слитый белок hCD80-Ig (SEQ ID NO:171) включает человеческий CD80 ВКД (SEQ ID NO:174), слитый на его С-конце с N-концом человеческого IgG1 Fc (SEQ ID NO:185). Два hCD80-Ig мономера ковалентно соединены вместе дисульфидными связями, сформированными между остатками цистеина в каждом мономере, тем самым формируя димер слитого белка hCD80-Ig. Димер слитого белка hCD80-Ig - это форма молекулы слитого белка, используемая в исследованиях, описанных в этих примерах, кроме тех, в которых точно определено обратное.
Репрезентативная нуклеиновая кислота, кодирующая предполагаемый полноразмерный полипептид человеческого CD80, показана в SEQ ID NO:196. Последовательность нуклеиновых кислот, представленная в SEQ ID NO:196, кодирует сигнальный пептид человеческого CD80, ВКД, трансмембранный домен и цитоплазматический домен и включает ТАА стоп-кодон на С-конце.
Слитый белок человеческого CD86-Ig
Репрезентативная последовательность нуклеиновых кислот, кодирующая предполагаемую аминокислотную последовательность человеческого CD86-человеческого IgG1 (типично имеющего в данном описании сокращение "hCD86-Ig") слитого белка, показана в SEQ ID NO:179. Эта последовательность нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую сигнальный пептид зрелого человеческого CD86-человеческого IgG1 слитого белка. Предполагаемая аминокислотная последовательность слитого белка hCD86-Ig показана в SEQ ID NO:177, и иллюстративная нуклеиновая кислота, кодирующая предполагаемый слитый белок hCD86-Ig, показана в SEQ ID NO:179.
Как показано на фигуре 2В, предполагаемая аминокислотная последовательность слитого белка hCD86-Ig включает следующие сегменты: предполагаемый сигнальный пептид (аминокислотные остатки 1-23), внеклеточный домен человеческого CD86 (аминокислотные остатки 24-243), линкерная последовательность (аминокислотные остатки 244-246), и полипептид человеческого IgG1 Fc (аминокислотные остатки 247-477). Аминокислотные остатки в местах соединения между этими различными сегментами также показаны на фигуре 2В. В особенности показаны последние четыре аминокислотных остатка сигнального пептида, первые пять и последние семь аминокислотных остатков человеческого CD86 ВКД, аминокислотные остатки линкера (GVT) и первые пять и последние пять аминокислотных остатков полипептида человеческого IgG1 Fc.
Сигнальный пептид CD86 обычно отщепляется от предполагаемого полипептида hCD86-Ig в ходе процессинга, и, таким образом, секретируемый слитый белок человеческого CD86-Ig (а именно, зрелый слитый белок) обычно не включает сигнальный пептид. Зрелая/секретируемая форма hCD86-Ig, которая имеет в общем 454 аминокислоты, включает аминокислотные остатки 24-477 (полноразмерная последовательность без сигнального пептида) SEQ ID NO:177 и начинается со следующей последовательности аминокислотных остатков: аланин-пролин-лейцин. При необходимости, аминокислоты зрелого слитого белка могут быть пронумерованы, начиная с остатка аланина (Ala) последовательности Ala-Pro-Leu, обозначая Ala как первый остаток (например, ВКД включает аминокислотные остатки, пронумерованные 1-218), как в зрелой форме hCD86-Ig, включающий аминокислотную последовательность, представленную в SEQ ID NO:178. Зрелый слитый белок (SEQ ID NO:178) включает белок ДТ HCD86 ВКД, ковалентно слитый на его С-конце с N-концом полипептида hIgG1 Fc.
Слитый белок hCD86-Ig обычно существует в растворе как димерный слитый белок, включающий два идентичных мономерных зрелых слитых белка hCD86-Ig. В этом случае каждый мономерный зрелый слитый белок CD86-Ig (SEQ ID NO:178) включает человеческий CD86 ВКД (SEQ ID NO:180), слитый на его С-конце с N-концом человеческого IgG1 Fc (SEQ ID NO:185). Два мономера hCD86-Ig ковалентно соединены вместе дисульфидными связями, сформированными между остатками цистеина в каждом мономере, тем самым формируя димер слитого белка hCD86-Ig. Димер слитого белка hCD86-Ig - это форма молекулы слитого белка, которая используется в исследованиях, описанных в этих примерах, если точно не определено обратное.
В слитом белке CD86-Ig (например, предполагаемой и зрелой формах), три остатка GVT присутствуют как клонирующий артефакт (или линкер) между С-концом CD86 ВКД и N-концом полипептида IgG1 Fc. В другом аспекте человеческий CD86 ВКД белок ДТ включает аминокислотную последовательность, включающую аминокислотные остатки 1-218 SEQ ID NO:180 (а именно, исключая последние два C-терминальных аминокислотных остатка на (РР)).
Слитый белок Orencia®
Как дополнительный контроль и в целях сравнения, приобретали коммерчески доступный слитый белок, известный как слитый белок Orencia® (Bristol-Myers Squibb Co., Princeton, NJ). Слитый белок Orencia® состоит из человеческого CTLA-4 внеклеточного домена ДТ, ковалентно слитого на его С-конце с N-концом специфического мутантного IgG1 Fc полипептида. Белок Orencia® - это димерный слитый белок, включающий два идентичных мономерных слитых белка, ковалентно соединенных вместе дисульфидными связями, сформированными между остатками цистеина, присутствующими в каждом мономерном слитом белке. Аминокислотная последовательность каждого зрелого Orencia® мономера слитого белка показана в SEQ ID NO:164 и состоит из следующих сегментов: внеклеточный домен ДТ человеческого CTLA-4 (аминокислотные остатки 1-124), линкерная последовательность (аминокислотный остаток 125) и мутантный полипептид IgG1 Fc (аминокислотные остатки 126-357). Каждый мономер слитого белка Orencia® имеет структуру, сходную с таковой у LEA29Y-Ig мономера слитого белка, показанного схематически на фигуре 2С, кроме того, что LEA29Y ВКД замещен на человеческий CTLA-4 ВКД ДТ, и не один сигнальный пептид не присутствует в обоих мономерах слитого белка Orencia®, так как каждый мономер - это секретируемый или зрелый слитый белок. Аминокислотная последовательность незрелой формы мономера Orencia® (которая включает сигнальный пептид) и последовательность нуклеиновых кислот, кодирующая незрелую форму Orencia® мономера слитого белка, показаны в SEQ ID NO:8 и SEQ ID NO:7 соответственно патента США №7094874. Способы создания и применения слитого белка Orencia® также описаны в патенте США №7094874.
Создание ДНК последовательностей, кодирующих мутантные полипептиды CTLA-4
Способы направленного развития использовались для создания библиотек рекомбинантных не встречающихся в природе полинуклеотидов, кодирующих рекомбинантные полипептиды мутантного внеклеточного домена CTLA-4. Белковые и нуклеотидные последовательности многочисленных встречающихся в природе гомологов млекопитающего CTLA-4 являются известными. Смотри, например, Национальный Центр Информации по Биотехнологии (NCBI). Разнообразие последовательностей, определенное по различным встречающихся в природе гомологам внеклеточного домена млекопитающего CTLA-4, использовано в способах направленного развития для создания библиотек рекомбинантных полинуклеотидов, кодирующих мутантные полипептиды домена CTLA-4 ВКД. Процедуры направленного развития включают, например, in vitro процедуры рекомбинации и мутагенеза, как по сути описано в Stemmer, Proc. Natl. Acad. Sci. USA 91:10747-10751 (1994); Chang et al. Nature Biotech 17:793-797 (1999); публикации Международной заявки № WO 98/27230; и патентах США №6117679 и 6537776.
Образование библиотек ДНК последовательностей, кодирующих мутантные полипептиды CTLA-4
Мутантные ДНК последовательности, кодирующие рекомбинантные мутантные полипептиды CTLA-4 ВКД, амплифицировали из реакций сборки с помощью ПЦР с применением прямых и обратных праймеров, разработанных на основании гомологии последовательности. Праймеры конструировали, создавали и собирали с применением стандартных процедур, хорошо известных специалистам в данной области техники, и они включают стоп- и старт-кодоны и сайты рестрикции при необходимости. Процедуры ПЦР амплификации, которые применялись, также являются хорошо известными в данной области техники. Смотри, например, Berger, Ausubel и Sambrook, все смотри выше. Иллюстративные прямые и обратные праймеры включают, но не ограничиваются следующим: прямой праймер (5'-CTATTGCTACGGCCGCTATGGCCMTKCACGTCGCTCAACCAGCCGTCGTACTCGCGTCC-3') (SEQ ID NO:191) и обратный праймер (5'-GTGATGGTGATGGTGTGCGGCCGCATCAGA-3') (SEQ ID NO:192). 5 мкл реакции сборки использовали как матрицу в 100 мкл ПЦР реакции с 1 мкМ прямых и обратных праймеров, Taq буфер (Qiagen; #201225) и 200 мкМ dNTP для 15 циклов амплификации (94°С 30 сек; 50°С 30 сек; 72°С 40 сек). Амплифицированную ДНК, кодирующую мутантные полипептиды CTLA-4 ВКД, обрабатывали ферментами рестрикции (SfiI и NotI) и фрагменты отделяли с помощью электрофореза на агарозном геле, очищали с применением Qiaquick набора гелевой экстракции (Qiagen, #28704) согласно рекомендациям производителя и лигировали в сходным образом обработанный ферментами вектор фагового дисплея pSB0124 (процедура, сходная с той, что описана в Chang et al., Nature Biotech 17:793-797 (1999)). Полученную библиотеку лигирования трансформировали с помощью электропорации в ТОР10 Е. coli клетки (Invitrogen, Inc; #С4040-50) согласно с условиями, рекомендуемыми производителем. Трансформированные клетки инкубировали в LB (бульон Луриа), содержащей 50 мкг/мл карбенициллина при 250 об/мин в течение ночи при 37°С и затем использовали для приготовления maxiprep (Qiagen; #12362) стока библиотеки ДНК в соответствии с условиями, рекомендованными производителем.
Скрининг фаговых библиотек, демонстрирующих мутантные полипептиды CTLA-4, имеющие улучшенные авидности связывания к человеческому CD80 и/или человеческому CD86
Образование фаговых дисплейных библиотек мутантных полипептидов CTLA-4
Библиотеку ДНК (например, библиотеку ДНК последовательностей, кодирующих мутанты CTLA-4 ВКД) трансформировали электропорацией в TG-1 Е. coli клетки (Stratagene; #200123) в соответствии с условиями, рекомендованными производителем. Культуру выращивали в условиях фагемидного отбора (LB среда, содержащая карбенициллин в количестве 50 мкг/мл) в течение 1-2 образований, инфицировали хелперным фагом M13KO7 (при кратности уровня инфицирования 5-10) и инкубировали с встряхиванием при 250 об/мин в течение ночи при 37°С при двойном отборе для фагемиды (карбенициллин в количестве 50 мкг/мл) и хелперного фага (канамицин 70 мкг/мл). Культуры очищали центрифугированием (6000 об/мин, 15 мин, 4°С в Sorvall 600ТС роторе) и фаговые частицы осаждали путем инкубации 32 мл супернатанта культуры с 8 мл ПЭГ/NaCl раствора (20% ПЭГ-8000; 2,5 М NaCl) на льду в течение 30 мин с последующим центрифугированием (9500 об/мин, 40 мин, 4°С в Sorvall 600TC роторе). Фаговый осадок суспендировали в 1 мл PBS, содержащем 1% БСА (бычий сывороточный альбумин, Sigma; #A7906), переносили в микроцентрифужную пробирку и очищали центрифугированием (максимальная скорость, 5 мин, КТ в Eppendorf настольной центрифуге).
Пэннинг мутантных фаговых лабораторий CTLA-4
Фаговые библиотеки разделяли при помощи пэннинга в пять раундов против hCD80-Ig или слитых белков hCD86-Ig с применением стандартных условий. Смотри, например, Lowman, et al., Biochemistry 12;30(45): 10832-10838 (1991); Smith, G.P. et al., Chem. Rev. 97:391-410 (1997). Каждый раунд пэннинга включает: (а) связывание фага, демонстрирующего мутантные полипептиды CTLA-4 ВКД, с лигандами hCD80-Ig или hCD86-Ig; (b) удаление несвязавшегося фага; (с) элюирование связавшегося фага; и (d) амплификацию элюированного фага в следующем раунде пэннинга. Аликвоту фага из каждого раунда трансдуцировали в Е. coli клетки для получения индивидуальных колоний трансдукта.
Определение мутантов CTLA-4, имеющих улучшенные авидности связывания к человеческому CD80 и/или человеческому CD86 с помощью фагового ELISA.
Индивидуальные колонии, полученные от каждого раунда пэннинга, инокулировали в 96-ячейковые планшеты для культуры (NUNC; #243656), содержащие 150 мкл/ячейка 2 х ДТ (дрожжи-триптон) среды, содержащей 50 мкг/мл карбенициллина, и инкубировали при 250 об/мин в течение ночи при 37°С. В течение ночи культуры использовали, чтобы инокулировать глубоколуночные блоки (Scienceware; #378600001), содержащие 600 мкл/ячейка такой же среды. Культуры инкубировали при 250 об/мин в течение 2 часов при 37°С, инфицировали с M13KO7 хелперным фагом (кратность инфицирования (ки) 5-10) и затем инкубировали при 250 об/мин в течение ночи при 37°С при двойном отборе для маркеров фагемиды и хелперного фага (карбенициллина 50 мкг/мл и канамицина 70 мкг/мл соответственно). Культуры очищали центрифугированием при 4000 об/мин в течение 20 мин при 4°С в Beckman GH 3,8 роторе. ELISA планшеты (NUNC; #449824) покрывали добавлением 50 мкл/ячейка PBS, содержащем 10 мкг/мл hCD80-Ig или hCD86-Ig, и инкубировали в течение ночи при 4°С. Планшеты отмывали трижды с 200 мкл/ячейка PBST и перекрывали добавлением 200 мкл/ячейка PBS, содержащем 3% нежирное сухое молоко, и инкубацией при КТ в течение 1 часа (час). 25 мкл/ячейка фаговых супернатантов из глубоколуночного блока переносили на ELISA планшеты, содержащие 25 мкл/ячейка 6% нежирное сухое молоко, и планшеты инкубировали в течение 1 часа при комнатной температуре (КТ). Планшеты отмывали трижды 200 мкл/ячейка PBST и инкубировали с 50 мкл/ячейка HRP-конъюгированным анти-М13 моноклональным антителом (GE Healthcare, #27-9421-01), разведенным 1:5000 в PBST, содержащем 3% нежирное сухое молоко, в течение 1 часа при КТ. Планшеты отмывали трижды 200 мкл/ячейка PBST и сигнал определяли с применением ТМВ субстратного набора (Pierce; #34021) согласно условиям, рекомендуемым производителем. Мутантные полипептиды CTLA-4 ВКД, проявляющие увеличенную авидность связывания к человеческому CD80 и/или человеческому CD86 (что измеряли с помощью увеличенной авидности к hCD80-Ig и/или hCD86-Ig), по сравнению с авидностью связывания человеческого CTLA-4 к человеческому CD80 и/или человеческому CD86 (что измеряли с помощью авидности связывания человеческого CTLA-4 ВКД к hCD80-Ig и/или hCD86-Ig), выбрали для дельнейшего анализа.
Пример 3
Создание вектора IgG2 Fc слитого белка
Плазмидный вектор экспрессии IgG2-Fc слитого белка создавали для получения слитого белка, включающего мутантный полипептид CTLA-4 ВКД по изобретению и человеческий IgG2 Fc полипептид. ДНК, кодирующую человеческий IgG2 Fc полипептид, создавали путем ПЦР амплификации человеческой лейкоцитарной кДНК (BD Biosciences, Кат. #HL4050AH) с применением прямого праймера (5'-AAGCTGTC ACCGGTGGATCGATCCCGAACCCTGCCCTGATTCTGATGAGCGCAAATGTTGTGTCGAGTGCCCACCGT-3') (SEQ ID NO:189) и обратного праймера (5'-CAGAATTCATTATTTACCCGGAGACAGGGAGAGGCTCTTCTG-3') (SEQ ID NO:190). Праймеры конструировали, создавали и собирали с применением стандартных методик, хорошо известных специалистам в данной области техники, и они включают стоп- и старт-кодоны и сайты рестрикции при необходимости. Процедуры ПЦР амплификации, использованные здесь, являются также хорошо известными в данной области техники. Смотри, например, Berger, Ausubel и Sambrook, все смотри выше. 50-100 нг кДНК использовали как матрицу в 100 мкл ПЦР реакции с 1 мкМ прямых и обратных праймеров, Taq буфером (Stratagene; #200435) и 200 мкМ dNTP для 25 циклов амплификации (94°С, 30 сек; 55°С, 30 сек; 72°С, 60 сек). ПЦР продукт очищали с помощью QiaQuick ПЦР спин-колонок (Qiagen #28106) в соответствии с условиями, рекомендованными производителем, и обрабатывали ферментами рестрикции AgeI и EcoRI. ПЦР обработанный ферментами фрагмент отделяли электрофорезом на агарозном геле и очищали с применением Qiaquick набора гелевой экстракции (Qiagen, #28704) в соответствии с условиями, рекомендованными производителем. Модифицированная версия pCDNA3.1-LEA вектора (описанного выше), которая содержит AgeI сайт рестрикции в сигнальной последовательности CTLA-4 (встроенный как молчащая мутация), может быть обработан AgeI и EcoRI и лигирован с фрагментом, упомянутым выше. Продукт лигирования трансформируют в одноразовые ТОРlO Е. coli клетки (Invitrogen Кат. #С4040-03) в соответствии с условиями, рекомендованными производителем. Трансформированные клетки инкубируют в LB (бульон Луриа), содержащей 50 мкг/мл карбенициллина, при 250 об/мин в течение ночи при 37°С и затем используют для создания maxiprep (Qiagen; #12362) стока плазмидной ДНК в соответствии с условиями, рекомендованными производителем.
Полученный плазмидный вектор экспрессии обозначается как вектор экспрессии рКДНК IgG2 Fc слитого белка. Этот вектор идентичен плазмидному вектору рКДНК мутантного CTLA-4- IgG2, показанному на фигуре 1, за исключением того, что последовательность нуклеиновых кислот, кодирующая мутантный полипептид CTLA-4 ВКД, удалена. Последовательность нуклеиновых кислот, кодирующая сигнальный пептид в рКДНК IgG2 Fc векторе слияния (которая на фигуре 1 может быть любой приемлемой кодирующей сигнальный пептид нуклеотидной последовательностью), представляет собой нуклеиновую кислоту, кодирующую сигнальный пептид человеческого CTLA-4 (SEQ ID NO:181 или SEQ ID NO:215). Этот вектор слияния IgG2 Fc не включает любую нуклеиновую кислоту, кодирующую мутантный полипептид CTLA-4 ВКД по изобретению или любой другой полипептид CTLA-4 ВКД.
Клонирование нуклеотидных последовательностей, кодирующих мутантные полипептиды CTLA-4 в вектор слияния IgG2 Fc
Для получения мутантных полипептидов CTLA-4 в виде растворимых Fc слитых белков каждую из ДНК последовательностей, кодирующих мутантные полипептиды CTLA-4 ВКД, идентифицированные как те, что имеют улучшенные авидности связывания к человеческому CD80 и/или человеческому CD86 (по сравнению с авидностью связывания человеческого CTLA-4-ВКД к человеческому CD80 и/или человеческому CD86) из скрининга фаговой библиотеки, клонируют в вектор IgG2 Fc слитого белка, описанный выше, используя, например, следующую процедуру.
ДНК последовательности, кодирующие мутантные полипептиды CTLA-4 ВКД, проявляющие более высокие авидности связывания к hCD80-Ig и/или hCD86-Ig, во-первых восстанавливали из вектора фагового дисплея ПЦР амплификацией с применением прямых и обратных праймеров, сконструированных на основании гомологии последовательностей по числу нуклеотидных остатков (например, 30-60 нуклеотидов) на N- и С-концах мутантных полипептидов CTLA-4 ВКД и применением известных в области техники стандартных процедур. Смотри, например, процедуры, описанные в, например, Berger, Ausubel и Sambrook, все смотри выше. Например, в одном иллюстративном аспекте ДНК последовательности, кодирующие мутантные полипептиды CTLA-4 ВКД, восстанавливали из вектора фагового дисплея ПЦР амплификацией с применением прямого праймера (5'-GGAATACCGGTTTTTTGTAAAGCCATGCACGTCGCTCAACCAGCCGTCGTACTC-3') (SEQ ID NO:191) и обратного праймера (5'-GGCACTCAGATCTACGTCATCGATCCCGAA-3') (SEQ ID NO:192). 10 нанограмм (нг) плазмидной ДНК (вектор фагового дисплея, содержащий нуклеотидную последовательность, кодирующую мутантный CTLA-4 ВКД) использовали как матрицу в 100 мкл ПЦР реакции с 1 мкМ прямых и обратных праймеров, описанных выше, Taq буфером (Stratagene; #200435) и 200 мкМ dNTP для 25 циклов амплификации (94°С, 30 сек; 55°С, 30 сек; 72°С, 60 сек). ПЦР продукт очищали с применением QiaQuick ПЦР Спин-колонок (Qiagen #28106) в соответствии с условиями, рекомендованными производителем, и обрабатывали ферментами рестрикции AgeI и ClaI. Фрагменты отделяли электрофорезом на агарозном геле, очищали с применением Qiaquick набора гелевой экстракции (Qiagen, #28704) в соответствии с условиями, рекомендованными производителем, и лигировали в сходным образом обработанный ферментами плазмидный IgG2 Fc вектор слияния. Продукт лигирования трансформировали в одноразовые ТОРlO Е. coli клетки (Invitrogen Кат. #С4040-03) в соответствии с условиями, рекомендованными производителем. Трансформированные клетки инкубировали в LB (бульон Луриа), содержащий 50 мкг/мл карбенициллина, при 250 об/мин в течение ночи при 37°С и затем использовали для создания maxiprep (Qiagen; #12362) стока плазмидной ДНК в соответствии с условиями, рекомендованными производителем.
Полученный плазмидный вектор экспрессии, который включает нуклеиновую кислоту, кодирующую мутантный слитый белок CTLA-4-IgG2 по изобретению, обозначили как плазмидный вектор экспрессии рКДНК мутантного CTLA-4 ВКД IgG2 Fc. Схематическое изображение этого вектора показано на фигуре 1. Этот вектор включает Bla промотор; ген, устойчивый к ампициллину; pUC источник; сигнальную последовательность SV40 полиаденилирования (полиА); f1 источник; SV40 промотор; ген, устойчивый к неомицину; CMV промотор для облегчения экспрессии мутантного слитого белка CTLA-4-Ig по изобретению (включающего, например, сигнальный пептид человеческого CTLA-4, мутантный полипептид CTLA-4 ВКД и полипептид человеческого IgG2 Fc); последовательность нуклеиновых кислот, кодирующая сигнальный пептид человеческого CTLA-4 (SEQ ID NO:181 или SEQ ID NO:215); последовательность нуклеиновых кислот, кодирующая мутантный полипептид CTLA-4 ВКД по изобретению (включая, но не ограничиваясь следующим, например, нуклеотидная последовательность, кодирующая любую одну SEQ ID NOS:80-152); иллюстративная последовательность нуклеиновых кислот, кодирующая человеческий IgG2 Fc полипептид, показана в SEQ ID NO:183 или SEQ ID NO:217; и политерминирующая сигнальная последовательность бычьего гормона роста (БГР). Последовательность нуклеиновой кислоты SEQ ID NO:183 кодирует полипептид hIgG2 Fc с C-терминальным остатком лизина (K) (SEQ ID NO:184); последовательность нуклеиновой кислоты SEQ ID NO:217 кодирует hIgG2 Fc полипептид без C-терминального остатка лизина (SEQ ID NO:218).
Плазмидный вектор IgG2 Fc слитого белка может также использоваться для получения слитого белка человеческого CTLA-4-IgG2 ("hCTLA-4-Ig"). В этом случае последовательность нуклеиновых кислот, кодирующую человеческий CTLA-4 ВКД (например, SEQ ID NO:193), клонируют в плазмидный вектор IgG2 Fc слитого белка с применением стандартных процедур клонирования, сходных с теми, что описаны выше в месте нуклеотидной последовательности, кодирующей мутантный CTLA-4 ВКД. Слитый белок hCTLA-4-Ig обычно существует в растворе как димерный слитый белок, включающий два идентичных мономерных зрелых слитых белка hCTLA-4-Ig. В этом случае каждый мономерный зрелый слитый белок hCTLA-4-Ig включает человеческий CTLA-4 ВКД (SEQ ID NO:159) слитый на его С-конце с N-концом человеческого IgG2 Fc (SEQ ID NO:218 или SEQ ID NO:184). Два мономера hCTLA-4-Ig ковалентно соединены вместе дисульфидными связями, сформированными между остатками цистеина в каждом мономере, тем самым формируя димер слитого белка hCTLA-4-Ig. Зрелый димер слитого белка hCTLA-4-Ig - это форма слитого белка, используемая в исследованиях, описанных в этих примерах, кроме тех случаев, когда точно определено обратное.
Мы обнаружили экспериментально, что слитый белок человеческого CTLA-4-Ig или мутантный слитый белок CTLA-4-Ig, образованный в СНО клетках путем трансфекции вектора экспрессии, включающего нуклеотидную последовательность, кодирующую hCTLA-4-Ig или мутантный слитый белок CTLA-4-Ig и полипептид hIgG2 Fc, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (K), как определялось путем МСЖХ анализа; таким образом, hIgG2 Fc аминокислотная последовательность hCTLA-4-IgG2 или мутантного CTLA-4-IgG2 является той, что показана в SEQ ID NO:218, где аминокислотная последовательность hIgG2 Fc обычно не включает С-терминальный остаток лизина по сравнению с аминокислотной последовательностью, представленной в SEQ ID NO:184.
Кратковременная трансфекция COS клеток
COS-7 клетки выращивали до 80-90% конфлюэнтности в Т-175 колбах, содержащих 40 мл ростовой среды (DMEM/F12 среда (Invitrogen, Кат. #10565-018), дополненной 10% ФБС (Hyclone Кат. #SV30014,03) и 1 х ПСГ (пенициллин, стрептомицин и глутамин) (Invitrogen, Кат. #10378-016)). Непосредственно перед трансфекцией клеток с плазмидным вектором экспрессии, среду удаляли и заменяли на 35 мл среды экспрессии (OptiMem media (Gibco #51985), содержащей 1х ПСГ). Плазмидную ДНК (10 мкг) (например, вектор экспрессии рКДНК мутантного CTLA-4 ВКД IgG2 Fc, кодирующий мутантный слитый белок CTLA-4-IgG2 по изобретению) смешивали с FuGENEβ реагентом трансфекции (Roche #11815075001) в объемном соотношении 1:3 и добавляли к 1 мл ростовой среды. Эту смесь затем добавляли медленно в Т-175 колбу и разбалтывали аккуратно для перемешивания. После инкубации при 37°С в течение 3 дней среду собирали, добавляли свежую среду экспрессии и культуры инкубировали в течение дополнительных 3 дней.
Сходная процедура может быть использована для создания COS-7 клеток, трансфектированных сходным плазмидным вектором, кодирующим плазмидным вектором человеческого CTLA-4-IgG2 или pCDNA3.1-LEA, кодирующим LEA29Y-Ig.
Очищение белков
Супернатанты от трансфекции культур (например, включающие клетки, трансфектированные с рКДНК мутантным CTLA-4 ВКД IgG2 Fc вектором, кодирующий мутантный слитый белок CTLA-4-Ig) очищали центрифугированием при 1000х g в течение 10 мин при КТ и фильтрацией через 0,2 мкМ мембраны (Nalgene, VWR #73520-982). Белки очищали аффинной хроматографией белка-А с применением АКТА Explorer ВЭЖХ системы (GE Healthcare). Мутантный слитый белок CTLA-4-Ig связывали с Hitrap Белок FF колонками (GE Healthcare, #17-5079-01) в PBS буфере, отмывали тем же буфером, элюировали с 100 мМ лимоннокислого буфера (рН 4,0) и затем нейтрализовывали добавлением 1/10 объема 2М Трис-основания. Буфер в растворе белка в конце заменяли на PBS с помощью диализа с применением 10 кДа MWCO мембран (Pierce, Кат. #Р166810).
Сходная процедура может быть использована для очищения слитых белков человеческого CTLA-4-IgG2 или LEA29Y-Ig.
Расчет качества белка. Анализ SDS/PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия)
Кажущийся молекулярный вес (MB) очищенного мутантного слитого белка CTLA-4-Ig по изобретению измеряли с помощью SDS/PAGE анализа при невосстанавливающих условиях. При невосстанавливающих условиях мутантный слитый белок CTLA-4-Ig по изобретению обычно существует как димерный слитый белок, включающий два мономерных мутантных слитых белка CTLA-4-Ig. В одном аспекте димер представляет собой гомодимер, включающий два идентичных мутантных мономера слитого белка CTLA-4-Ig. В одном аспекте каждый мономер слитого белка CTLA-4-Ig включает зрелый/секретируемый мутантный CTLA-4 ВКД, слитый на его С-конце с N-концом человеческого полипептида IgG2 Fc. Два мутантных CTLA-4-Ig мономера ковалентно соединены вместе дисульфидными связями, сформированными между остатками цистеина в каждом мономере. Гомодимер - это форма молекулы мутантного слитого белка по изобретению, обычно описываемая в этих примерах, если только точно не определено обратное. Данные, представленные в этих примерах, относятся к гомодимерам мутантного слитого белка CTLA-4-Ig, если только точно не определено обратное.
Анализы SDS/PAGE проводили следующим образом. 2 мкг очищенного белка добавляли к 20 мкл LDS буфера образца (Invitrogen #NP0007) и разгоняли на NuPAGE 4-12% бис-Трис гелях (Invitrogen #NP0321BOX) в 1x MES натрия додецил сульфат (SDS) /PAGE подвижный буфер (Invitrogen #NP0002), в соответствии с условиями, рекомендуемыми производителем. Гели окрашивали инкубацией в 50 мл SimplyBlue SafeStain (Invitrogen #LC6060) в течение 1 часа с легким взбалтыванием при КТ. Гели подвергались удалению красителя путем двух инкубации с 200 мл воды в течение 1 часа с легким взбалтыванием при КТ и обрабатывались в буфере высушивания (Bio RAD 161-0752) в соответствии с условиями, рекомендуемыми производителем.
Репрезентативный SDS/PAGE гель двух иллюстративных гомодимеров мутантных слитых белков CTLA-4-Ig по изобретению (обозначенных как клоны D3 и D4) и слитого белка Orencia®, который служил контролем сравнения, показан на фигуре 3. D3-Ig димер слитого белка включает два идентичных D3-Ig мономера слитого белка, которые ковалентно связаны дисульфидными связями, сформированными между остатками цистеина в каждом D3-Ig мономере. Каждый D3-Ig мономер включает мутантный полипептид CTLA-4 ВКД (названный "D3"), включающий аминокислотную последовательность, представленную в SEQ ID NO:61, слитый напрямую с (а именно, без "линкерного" аминокислотного остатка(ов)) на его С-конце с N-концом hIgG2 Fc полипептида, представленного в SEQ ID NO:218. D4-Ig димер слитого белка сходным образом включает два идентичных D4-Ig мономера, которые ковалентно связаны дисульфидными связями, сформированными между остатками цистеина в каждом мономере D3-Ig. Каждый мономерный D4-IgG2 слитый белок включает мутантный полипептид CTLA-4 ВКД (названный "D4"), включающий аминокислотную последовательность, представленную в SEQ ID NO:62, слитый напрямую (а именно, без "линкерного" аминокислотного остатка(ов)) на его С-конце с N-концом hIgG2 Fc аминокислотной последовательности, представленной в SEQ ID NO:218.
Как объяснялось, обнаружили экспериментально, что мутантный слитый белок CTLA-4-Ig, произведенный в СНО клетках с применением вектора, включающего нуклеотидную последовательность, кодирующую предполагаемый hIgG2 Fc полипептид, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (K), как определялось МСЖХ анализом; таким образом, hIgG2 Fc аминокислотная последовательность мутантного CTLA-4-IgG2, описанная здесь, является той, что показана в SEQ ID NO:218, где MgG2 Fc аминокислотная последовательность обычно не включает C-терминальный остаток лизина по сравнению с аминокислотной последовательностью, представленной в SEQ ID NO:184.
Анализы SDS/PAGE проводили на всех препаратах белка для подтверждения качества белка в смысле кажущегося молекулярного веса, концентрации белка и чистоты. Результаты SDS/PAGE анализов были одинаковыми для всех препаратов белка. Из результатов иллюстративного геля, показанного на фигуре 3, очищенные D3-IgG2 и D4-IgG2 димеры слитого белка имели кажущийся MB приблизительно 80 кДа, который состоял из предполагаемого MB иллюстративной структуры гомодимерного мутантного CTLA-4-IgG2 слитого белка, представленной в на фигуре 10 (предполагаемый MB=78-79 кДа). (Очищенные мономеры мутантного белка CTLA-4-IgG2 обычно имеют видимый MB 39-40 кДа.) Белковые полосы на геле, показанном на фигуре 3, были окрашены с соответствующими интенсивностями; это подтверждает точность измерения концентрации белка для различных образцов. Для чистоты белка полосу с более низким MB можно наблюдать на фигуре 3 при кажущемся MB приблизительно 44 кДа, который состоит из предполагаемого MB мономерного IgG2 слитого белка. Относительная интенсивность этой полосы с более низким MB следовательно является низкой и составляет менее чем 5% от общего белка.
Аналогичные анализы SDS/PAGE могут использоваться для оценки чистоты слитых белков человеческого CTLA-4-IgG2 или LEA29Y-Ig, полученных с применением способов, сходных с теми, что описаны выше.
Эндотоксиновый Анализ
Уровни эндотоксина мутантных слитых белков CTLA-4 измеряли с применением QCL-1000 набора для исследования с использованием амебоцитного лизата «лимулуса» (ЛАЛ-анализ) (Cambrex #50-648U), следуя рекомендациям производителя относительно условий. Максимальный уровень эндотоксина для белков, используемых в клеточных исследованиях, составляет 10 эндотоксиновых единиц (ЭЕ)/мг белка.
Аналогичные анализы могут быть использованы для измерения уровней эндотоксина белковых препаратов человеческого CTLA- 4-IgG2 или LEA29Y-Ig.
Анализ гель-хроматография (SEC)
Уровни агрегации белка (включая уровни агрегации мутантных полипептидов CTLA-4 и контрольных полипептидов) измеряли с помощью гель-хроматографии с применением Dionex BioLC системы (Dionex). Белок (5 мкг) разгоняли через колонку Tosoh G3000Wx1 (Tosoh Bioscience) в PBS подвижном буфере с применением 20 мин изократического элюирования и определяли абсорбцию (А) при 214 нанометров (нм). Максимальный уровень агрегации для белка, используемого в дальнейших анализах, составлял 10%.
SEC анализ проводили на всех белковых препаратах для подтверждения качества белка в характеристиках уровней агрегации белка. Результаты были одинаковыми для всех белковых препаратов и репрезентативный профиль элюции от SEC анализа мутантного димера слитого белка CTLA-4-Ig (D3-Ig) показан на фигуре 4. y-ось показывает единицы миллиабсорбции (мАЕ); x-ось показывает время элюции в минутах. Структура D3-Ig димера выше в разделе "Анализы SDS/PAGE". Этот очищенный мутантный димер CTLA-4-Ig в большей степени гомогенный в размере не содержит высоких уровней агрегированных видов. Другие мутантные слитые белки CTLA-4-Ig по изобретению были проанализированы сходным образом и показали сходные результаты (данные не представлены). Было обнаружено, что очищенные мутантные слитые белки CTLA-4-Ig по изобретению являются гомогенными по размеру и не содержат высоких уровней (>10%) агрегированных белков. Это важно для подтверждения агрегированного состояния очищенных мутантных слитых белков CTLA-4-Ig по изобретению, так как сильно агрегированные мутантные слитые белки CTLA-4-Ig могут связывать с высокой авидностью молекулы человеческих CD80 и/или человеческих CD86 и, таким образом, могут проявлять большую биологическую активность.
Пример 4
Измерение авидности связывания мутантных слитых белков CTLA-4-Ig к слитым белкам человеческому CDSO-мышиному Ig (hCD80-mIg) и человеческому CD86-мышиному Ig (hCD86-mIg) с применением поверхностного плазменного резонанса (SPR) (Biacore™ Анализ).
Этот пример описывает процедура скрининга мутантных CTLA-4-Ig слитых белков на улучшенную авидность связывания к hCD80-mIg и/или hCD86-mIg лигандам с применением анализа взаимодействия Biacore. В номенклатуре, используемой для описания этого типа анализа, иммобилизованый связывающий партнер называется "лигандом", а связывающий партнер в подвижной фазе называется "аналит". Слитые белки, содержащие Ig домен, обычно формируют димерные структуры в растворе с помощью сильной ассоциации между двумя Ig доменами. Кроме тех случаев, в которых определено обратное, полагают, что такие димерные конформации существуют для слитых белков, описанных в этом примере (а именно, мутантного CTLA-4-Ig, слитого белка Orencia®, LEA29Y-Ig, hCD80-mIg и hCD86-mIg). Термин "авидность" обычно относиться к силе связывания между димерными аналитами (например, мутантными слитыми белками CTLA-4-Ig) и димерными лигандами (например, слитыми белками hCD80-mIg или hCD86-mIg). Увеличение авидности связывания, описанное для мутантных слитых белков CTLA-4-Ig, является результатом увеличения аффинности связывания между каждым доменом CTLA-4 ВКД и его соответствующим лигандом. Сила авидности связывания обычно описывается в терминах равновесной константы диссоциации (KD), которая описывает молярную концентрацию аналита, при которой 50% доступного лиганда связывается равновесно.
В этом методе скрининга Biacore сенсорные чипы дериватизировали с лигандами hCD80-mIg или hCD86-mIg, и мутантные слитые белки CTLA-4-Ig в буфере выливали на сенсорные чипы, покрытые лигандами. Измеряли способность молекулы мутантного слитого белка CTLA-4-Ig связываться со специфическим связывающим партнером (а именно, hCD80-mIg или hCD86-mIg). Контрольные слитые белки (а именно, человеческий CTLA-4-IgG2 слитый белок, слитый белок Orencia® и мутантный слитый белок LEA29Y-Ig) также выливали на сенсорные чипы, покрытые лигандами, и подобным образом оценивали способности этих молекул связываться с hCD80-mIg или hCD86-mIg для сравнения. С применением Biacore системы константа скорости ассоциации (kon) и диссоциации (koff) белка, представляющего интерес, связывающегося с лигандами hCD80-mIg или hCD86-mIg, могут быть оценены и использованы для расчета равновесной константы диссоциации, KD. Человеческий CTLA-4-IgG2 слитый белок, который включает полипептид ДТ человеческого CTLA-4 ВКД, слитый с полипептидом человеческого IgG2, может служить как дикого типа "контроль" человеческого CTLA-4-Ig. В дополнение или альтернативно, так как слитый белок Orencia® состоит из полипептида ДТ человеческого CTLA-4 ВКД, слитого с модифицированным полипептидом IgGI Fc, он также эффективно служит контролем дикого типа человеческого CTLA-4-Ig для целей сравнения. Определяли мутантные слитые белки CTLA-4-Ig, имеющие увеличенные авидности связывания к hCD80-mIg и/или hCD86-mIg, по сравнению с человеческим CTLA-4-IgG2, слитым белком Orencia® и/или LEA29Y-Ig. Как обсуждается более детально ниже, увеличенная авидность связывания мутантного слитого белка CTLA-4-Ig по изобретению к hCD80-mIg и/или hCD86-mIg, по сравнению с авидностью связывания слитого белка Orencia® (а именно, hCTLA-4-IgG1) и/или LEA29Y-Ig к hCD80-mIg и/или hCD86-mIg, не является результатом отличий между IgG2, присутствующим в мутантных молекулах CTLA-4-Ig и мутантного IgG1, присутствующего в молекулах Orencia® или LEA29Y-Ig.
Все анализы Biacore™ проводили на Biacore™ 2000 системе (GE Healthcare) при комнатной температуре (КТ, 25°С). HBS-EP буфер (10 мМ HEPES (рН 7,4), 150 мМ NaCl, 3 мМ EDTA, 0,005% поверхностно-активное вещество Р20) использовали как поточный буфер для всех экспериментов.
Стандартное кинетическое исследование
Стандартное кинетическое исследование измеряет кинетические параметры связывания димерного лиганда (например, слитого белка hCD80-mIg или слитого белка hCD86-mIg), покрывающего сенсорные чипы, и димерных аналитов (например, мутантных слитых белков CTLA-4-Ig по изобретению) в подвижной фазе. Антитело кролика против мышиного IgG (GE Healthcare, #BR-1005-14) иммобилизировали на СМ5 сенсорных чипах (GE Healthcare, #BR-1000-14) согласно протоколу производителя. Антитело разводили до 30 мкг/мл в буфере для иммобилизации (10 мМ ацетата натрия, рН 5,0 (BR-1003-51)). При скорости потока 5 мкл/мин сенсорный чип СМ5 активировали 35 мкл инъекцией смеси 1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорида (EDC) и N-гидроксисукцинимида (NHS) (образованного смешиванием равных объемов 11,5 мг/мл EDC и 75 мг/мл NHS) (GE Healthcare, #BR-1000-50), с последующей 35 мкл инъекцией неразведенного антитела. Непрореагировавшие сайты были погашены 35 мкл 1 М этаноламина-HCL, рН 8,5 (GE Healthcare, #BR-1000-50). Эта процедура обычно дает на выходе 15000 единиц ответа (ЕО) связанного антитела. Лиганды человеческого CTLA-4 CD80-мышиного Ig (hCD80-mIg) (Ancell, #510-820) или человеческого CD86-мышиного Ig (hCD86-mIg) (Ancell, #509-820) связывались с сенсорными чипами, покрытыми антителом при помощи инъекции 10 мкл или 16 мкл соответственно лигандного раствора (2 мкг/мл белка в HBS-EP буфере [10 мМ HEPES рН 7,4, 150 мМ NaCl, 3 мМ EDTA, 0,005% (объем/объем) поверхностно-активное вещество Р-20, GE Healthcare, #BR-1001-88]) при скорости потока 10 мкл/мин. Уровни захвата лиганда обычно составляли 135-170 ЕО. Мутантные белки CTLA-4-Ig или разведенные в HBS-EP буфере и вылитые на сенсорные чипы, покрытые лигандом в течение 2 мин при 30 мкл/мин, с последующей 5 мин инкубацией с HBS-EP буфером, не содержащим белок при той же скорости потока. Для мутантных слитых белков CTLA-4-Ig, имеющих очень низкие скорости диссоциации от hCD86-mIg, кинетические исследования проводили также с применением более длительного времени диссоциации (например, 20 мин). Rmax сигнальные уровни для мутантных белков CTLA-4-Ig лежали в диапазоне от приблизительно 70-100 ЕО. Восстановление между циклами проводили 3-минутной инкубацией с 10 мМ глициновым буфером (рН 1,7) при 50 мкл/мин. Новые чипы подвергали 4-5 циклам захват/связывание/восстановление перед применением в действительных экспериментах. Данные от эталонной клетки, содержащей только захваченное антитело кролика против мышиного IgG, вычитали из данных, полученных от текущих клеток, содержащих захваченный hCD80-mIg или hCD86-mIg. Типично, 8 разведений мутантных белков CTLA-4-Ig в диапазоне от 500 нм до 0,2 нм анализировали против холостой пробы (только HBS-EP буфер).
Записи сенсограмм от типичного Biacore анализа показаны на фигуре 5. Эта фигура показывает ответ (ЕО) во времени (в секундах (сек)), образованный связыванием следующих трех слитых белков со слитым белком hCD86-mIg: (1) слитый белок Orencia® (служащий контролем и для сравнения) (Bristol-Myers Squibb Co.; смотри, например, Larson СР. et al, Am. J. Trans. 5:443-453 (2005)); (2) LEA29Y-Ig слитый белок (для сравнения); и (3) иллюстративный мутантный слитый белок CTLA-4-Ig по изобретению, обозначенный "клон D3" (также называемый D3-IgG2). Слитый белок D3-IgG2 включает два идентичных мономерных слитых белка, которые ковалентно соединены вместе одной или несколькими дисульфидными связями, сформированными между остатками цистеина в каждом мономере. Смотри обсуждение в разделе "Анализы SDS/PAGE" выше. Каждый мономерный слитый белок включает зрелый мутантный полипептид CTLA-4 ВКД, представленный в SEQ ID NO:159, ковалентно слитый на его С-конце с N-концом человеческого IgG2 полипептида, представленного в EQ ID NO:184 или 218. Другие димерные слитые белки по изобретению могут включать структуры, сходные с таковыми у димерного слитого белка D3-IgG2 - исключая то, что D3 мутантный полипептид CTLA-4 ВКД каждого мономерного слитого белка заменяют на другой мутантный полипептид CTLA-4 ВКД.
Фаза ассоциации отражает связывание между аналитом, представляющим интерес, и лигандом, представляющим интерес. На фигуре 5 фаза ассоциации для каждого аналита представлена кривой во времени до момента времени, обозначенного стрелкой, и характеризуется связыванием аналита (D3-IgG2, Orencia® слитый белок, или лигандом LEA29Y-Ig) с hCD86-mIg. Скорость, при которой аналит ассоциирует с лигандом hCD86-mIg, отражается на кривой - смотри, например, резкое увеличение в единицах ответа, начиная с около 510 секунд.
Фаза диссоциации анализа начинается со времени, обозначенного стрелкой на фигуре 5. В ходе фазы диссоциации, аналит и лиганд диссоциируют от их связывающей конформации. На фигуре 5 скорость, при которой аналит диссоциирует от лиганда hCD86-mIg, представлена снижением единиц ответа (скорость снижения единиц ответа во времени). Основываясь на этих данных, могут быть определены относительные константы скорости диссоциации ("выкл" скорости, koff или kd) и константы скорости диссоциации ("вкл" скорости, kon или ka). Общая авидность взаимодействия может быть описана как KD, (koff)/ (kon). Увеличенные авидности связывания часто проявляются в пониженных скоростях диссоциации. Если сниженная скорость диссоциации сопровождается равной, более высокой или незначительно более низкой скоростью ассоциации, так что рассчитанная равновесная константа диссоциации KD буде ниже, то авидность будет больше. В этом случае мутантный слитый белок CTLA-4-Ig, который имеет авидность связывания к hCD86-mIg лиганду, которая больше, чем авидность связывания слитого белка Orencia® к такому же лиганду, будет также иметь более низкую скорость диссоциации от лиганда, чем Orencia® белок. Мутантный слитый белок CTLA-4-Ig, который имеет авидность связывания к hCD86-mIg лиганду, которая больше, чем авидность связывания LEA29Y-Ig к такому же лиганду, будет также иметь более низкую скорость диссоциации от лиганда, чем LEA29Y-Ig.
Фигура 5 показывает, что скорость диссоциации LEA29Y-Ig от hCD86-mIg лиганда значительно меньше, чем скорость диссоциации белка Orencia® от такого же лиганда. LEA29Y-Ig также имеет скорость ассоциации для связывания с hCD86-mIg сходную с той, которая наблюдается для слитого белка Orencia®. Таким образом, LEA29Y-Ig имеет более высокую авидность к hCD86-mIg, чем имеет белок Orencia®. Это открытие согласуется с предыдущими исследованиями, описывающими LEA29Y-Ig как имеющего более высокую авидность связывания к лиганду hCD86-mIg, чем слитый белок Orencia® (Larson СР. et al., Am. J. Trans. 5:443-453 (2005)). Фигура 5 также показывает, что мутантный D3-IgG2 слитый белок по изобретению имеет более низкую скорость диссоциации от лиганда hCD86-mIg, чем либо Orencia®, либо LEA29Y-Ig слитый белок. Слитый белок D3-IgG2 также имеет сходную (но в некоторой степени более быструю) скорость ассоциации для связывания с hCD86-mIg лигандом по сравнению со скоростями ассоциации каждого Orencia® или слитых белков LEA29Y-Ig к лиганду hCD86-mIg. Таким образом, D3-IgG2 слитый белок проявляет более высокую авидность связывания к hCD86-mIg лиганду, чем как Orencia®, так и слитый белок LEA29Y-Ig. Поэтому полагают, что слитый белок D3-IgG2 связывает нативный CD86, включая, например, CD86, экспрессирующийся in vivo на АПК в млекопитающих, таких как люди, с более высокой авидностью связывания. Это соображение также подтверждается функциональными клеточными исследованиями, обсуждаемыми в примерах ниже.
Biacore анализы проводили с применением других мутантных CTLA-4-Ig слитых белков по изобретению. Кроме того, Biacore анализы проводили с применением hCD80-mIg-покрытых сенсорных чипов и мутантных слитых белков CTLA-4-Ig по изобретению. Скорости диссоциации и авидности связывания этих мутантных молекул определяли и сравнивали со скоростями диссоциации и авидности связывания Orencia® и слитых белков LEA29Y-Ig. Репрезентативные результаты показаны в таблицах 3 и 4 и обсуждаются более детально ниже.
Стандартные Biacore анализы данных
После исключения частей восстановления и захвата на сенсограммах, кривые обнуляли до 5 сек в среднем для всех кривых приблизительно за 10 сек до инъекции образца. Холостую кривую вычитали из каждой анализируемой кривой. Данные анализировали с помощью программного обеспечения BIAevaluation (версия 4.1, доступного от GE Healthcare) с применением функции "Соответствие кинетических характеристик, синхронное ka/kd". Время начала инъекции обозначали как время до фазы ассоциации, где кривые были близки к нулю. Отбор данных для фазы ассоциации начинали приблизительно через 10 сек после времени начала инъекции и заканчивали приблизительно за 10 сек до времени окончания инъекции. Время окончания инъекции определяли как время до возникновения любых сигнальных пиков, связанных с фазой диссоциации. Фазу диссоциации выбрали начиная с 10 сек после времени окончания инъекции и включительно 280-295 сек 5-минутной фазы диссоциации. 1:1 модель Ленгмюра описывает реакцию А + В <=> АВ. Эта модель представляет связывание отдельного лиганда с отдельным белком, представляющим интерес (например, рецептором). 1:1 модель Ленгмюра из программы BIAevaluation использовали для определения константы скорости ассоциации (ka) и константы скорости диссоциации (kd) и для расчета равновесной константы диссоциации KD. KD=kd/ka. KD=([А][В])/[АВ]. Равновесная константа диссоциации KD обратно пропорциональна равновесной константе ассоциации KA. KD=1/KA. Уравнения скорости для реакции (аналит плюс лиганд В, дающие комплекс АВ), где = вводимый аналит, В = свободный лиганд и t = время, представляют собой: d[B]/dt=-(ka[А][В]-kd[АВ]) и d[AB]/dt=ka[A][B]-kd[AB]. Заменяя R, Biacore единицы ответа (ЕО) при данном времени, для [АВ], Rmax-R для [В], и С (концентрация аналита) для [А], чистый коэффициент, выраженный в Biacore единицах, представляет собой dR/dt=kaC(Rmax-R)-kdR, где R при t0=0, В[0]=Rmax и АВ[0]=0 ЕО, с общим ответом = [АВ]+RI. Сдвиг (RI) был приближен к нулю, и Rmax, ka и kd соответствовали глобально для всех кривых.
Стандартные кинетические исследования и анализы данных были проведены на белковых препаратах мутантного слитого белка CTLA-4-Ig по изобретению, а также на LEA29Y-Ig и слитых белков Orencia®. Таблицы 3 и 4 суммируют данные связывания для репрезентативных мутантных слитых белков CTLA-4-Ig по изобретению.
Таблица 3 представляет авидности связывания репрезентативных мутантных CTLA-4-Ig слитых белков к hCD86-mIg, что измерялось в стандартном Biacore исследовании, описанном выше. Специфически таблица 3 показывает название каждого мутантного слитого белка CTLA-4Ig; идентификационный номер последовательности (SEQ ID NO), соответствующий аминокислотной последовательности мономерного мутантного CTLA-4 ВКД слитого белка; равновесную константу диссоциации (KD (молярное значение (М)), определенную на основании авидности связывания мутантного белка к hCD86-mIg; и авидности связывания каждого мутантного CTLA-4-Ig к hCD86-mIg относительно авидности связывания слитого белка Orencia® к hCD86-mIg. Эта относительная авидность связывания (представленная в дальней правой колонке) показана как разы увеличения авидности связывания мутантного слитого белка к hCD86-mIg по сравнению с авидностью связывания слитого белка Orencia® к hCD86-mIg. Каждый мутантный слитый белок CTLA-4-Ig по изобретению в таблице 3 обычно существует в растворе как димерный слитый белок, включающий два идентичных мономерных слитых белка, где каждый мономерный белок включает мутантный полипептид CTLA-4 ВКД (например, названный D1, D1T, D2, D3, D4 и т.п.), слитый напрямую на его С-конце с N-концом IgG2 Fc полипептида, включающего последовательность SEQ ID NO:184 или 218. Каждый такой димерный мутантный CTLA-4-Ig может быть создан с применением стандартных методик, известных в данной области техники. Альтернативно, каждый такой димерный мутантный димер слитого белка CTLA-4-Ig может быть создан с применением способов, приведенных в примере 3 выше. Коротко, последовательность нуклеиновых кислот, кодирующая конкретный мутантный CTLA-4 ВКД, определенная в таблице 3 (например, последовательность нуклеиновых кислот, кодирующая мутантную аминокислотную последовательность CTLA-4 ВКД, определенную в таблице 3), может быть клонирована в вектор слияния IgG2 Fc, клетки млекопитающего могут быть трансфектированы с вектором, и полученный слитый белок может быть экспрессирован, очищен и проанализирован, как описано в примере 3. Иллюстративная последовательность нуклеиновой кислоты для каждого мутантного CTLA-4 ВКД показана в списке последовательностей, включенном в данное описание. Orencia® слитый белок, который включает два мономерных слитых белка, где каждый мономерный слитый белок включает дикого типа человеческого CTLA-4 ВКД, слитый с модифицированным IgG1 Fc, служит эталоном, а именно с авидностью связывания к hCD86-mIg, равной 1. KD значения для LEA29 Y-Ig слитого белка и человеческого CTLA-4-Ig слитого белка также представлены. Кроме того, также представлены разы улучшения в hCD86-mIg авидности связывания LEA29Y-Ig по сравнению с hCD86-mIg авидностью связывания белка Orencia®. Авидности связывания CTLA-4-IgG2 и Orencia® слитых белков к hCD86-mIg приблизительно равны, подтверждая, что различия между человеческим IgG2 полипептидом, присутствующим в человеческом CTLA-4-IgG2, и модифицированным IgG1, присутствующим в Orencia® белке, вносят небольшой, если вообще вносят, вклад по отношению к hCD86-mIg аффинностям связывания этих молекул. Как это обсуждается более детально в примере 5 ниже, мы подтвердили, что различия в иммуносупрессорных функциональных активностях между мутантными CTLA-4-Ig полипептидами по изобретению и белом Orencia® (или LEA29Y-Ig) не могут быть приписаны их соответствующим областям Ig Fc, включающим различные изотипы IgG.
Как показано в таблице 3, репрезентативные мутантные слитые белки CTLA-4-Ig по изобретению имеют hCD86-mIg авидности связывания, которые: (1), по меньшей мере, приблизительно равны или больше, чем авидность связывания человеческого CTLA-4-IgG2 ("hCTLA-4-IgG2") (который включает два ковалентно связанных мономерных слитых белка, где каждый такой мономерный белок включает полипептид человеческого CTLA-4 ВКД, слитый с IgG2 Fc полипептидом); (2), по меньшей мере, приблизительно равны или больше, чем авидность связывания белка Orencia® с hCD86-mIg лигандом; и/или (3), по меньшей мере, приблизительно равны или больше, чем авидность связывания LEA29Y-Ig с лигандом hCD86-mIg. Разы улучшения авидности связывания с лигандом hCD86-mIg относительно авидности связывания белка Orencia® с hCD86-mIg определяются для каждого CTLA-4-Ig мутанта (4-я колонка в таблице 3).
Обнаружено, что большинство мутантных слитых белков CTLA-4-Ig имеют скорость диссоциации от слитого белка hCD86-mIg, которая меньше, чем скорость диссоциации слитого белка Orencia® от hCD86-mIg (данные не показаны). Обнаружено, что многие мутантные слитые белки CTLA-4-Ig имеют скорость ассоциации с hCD86-mIg, большую, чем скорость ассоциации слитого белка Orencia® с таким же лигандом (данные не показаны).
Все мутантные слитые белки CTLA-4-Ig, представленные в таблице 3, имели hCD86-mIg равновесные константы диссоциации (Ко), которые были ниже, чем hCD86-mIg равновесная константа диссоциации человеческого CTLA-4-IgG2 или слитого белка Orencia®. Более того, большинство мутантных слитых белков CTLA-4-Ig, представленных в таблице 3, имели hCD86-mIg равновесные константы диссоциации, которые были ниже, чем hCD86-mIg равновесная константа LEA29Y-Ig.
Все мутантные слитые белки CTLA-4-Ig, представленные в таблице 3, имели авидности связывания к hCD86-mIg, которые больше, чем авидности связывания человеческого CTLA-4-IgG2 или слитого белка Orencia® к hCD86-mIg (рассчитанные разы улучшения для hCD86-mIg авидности связывания относительно слитого белка Orencia® показаны в 4-й колонке таблицы 3). Более того, многие мутантные слитые белки CTLA-4-Ig, представленные в таблице 3, имели авидности связывания к hCD86-mIg, которые больше, чем авидность связывания LEA29Y-Ig к hCD86-mIg (4-ая колонка таблицы 3).
Мутантный CTLA-4-Ig по изобретению, который имеет более высокую авидность связывания с hCD86-mIg лигандом, чем имеет Orencia® или LEA29Y-Ig слитый белок, будет, вероятно, иметь увеличенную in vivo иммуносупрессорную силу по сравнению с hCTLA-4-IgG2, Orencia®, или слитым белком LEA29Y-Ig, соответственно, такую как в, например, терапевтических и/или профилактических способах для подавления иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы млекопитающих, такие как например, люди, в которых иммуноингибирование или иммуносупрессия являются желательными), способах для ингибирования отторжения трансплантата ткани или органа от донора к реципиенту (например, млекопитающему, такому как, например, человек), и других способах, описанных в данном описании.
| Таблица 3 | |||
| Слитый белок (димер) | SEQ ID NO* (а именно, мутантного CTLA-4 ВДК) | KD (M) hCD86 ВКД | Авидность связывания мономерного hCD86 ВКД (по сравнению с димером слитого белка Orencia®) |
| Человеческий CTLA-4-IgG2 | 162 | 3,95×10-10 | 1,32х |
| димер слитого белка Orencia® | 164 | 5,23×10-10 | 1 |
| LEA29Y-Ig | 166 | 1,05×10-10-5,23×10-10 | 5х-10x |
| D1-IgG2 | 58 | 2,65×10-10-5,23×10-10 | 2х-10x |
| D1T-IgG2 | 59 | 5,23×10-10-2,62×10-10 | 10х-20х |
| D2-IgG2 | 60 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-IgG2 | 61 | <1,31×10-10 | >40х |
| D4-IgG2 | 62 | 2,65×10-10-5,23×10-10 | 2х-10х |
| D5-IgG2 | 63 | 2,65×10-10-5,23×10-10 | 2х-10x |
| D6-IgG2 | 64 | 2,65×10-10-5,23×10-10 | 2х-10x |
| D20-IgG2 | 65 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D21-IgG2 | 66 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D23-IgG2 | 67 | <1,31×10-10 | >40х |
| D24-IgG2 | 68 | <1,31×10-10 | >40х |
| D26-IgG2 | 69 | <1,31×10-10 | >40х |
| D27-IgG2 | 70 | <1,31×10-10 | >40х |
| D28-IgG2 | 71 | <1,31×10-10 | >40х |
| Слитый белок (димер) | SEQ ID NO* (а именно, мутантного CTLA-4 ВКД) | KD (M) hCD86 ВКД | Авидность связывания мономерного hCD86 ВКД (по сравнению с димером слитого белка Orencia®) |
| D29-IgG2 | 72 | <1,31×10-10 | >40х |
| D31-IgG2 | 73 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-1-IgG2 | 1 | <1,31×10-10 | >40х |
| D3-2-IgG2 | 2 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-3-IgG2 | 3 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-4-IgG2 | 4 | <1,31×10-10 | >40х |
| D3-5-IgG2 | 5 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-6-IgG2 | 6 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-7-IgG2 | 7 | <1,31×10-10 | >40х |
| D3-8-IgG2 | 8 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-9-IgG2 | 9 | <1,31×10-10 | >40х |
| D3-11-IgG2 | 10 | <l,31×10-10 | >40х |
| D3-12-IgG2 | 11 | <1,31×10-10 | >40х |
| D3-14-IgG2 | 12 | <1,31×10-10 | >40х |
| D3-15-IgG2 | 13 | <1,31×10-10 | >40х |
| D3-16-IgG2 | 14 | <1,31×10-10 | >40х |
| D3-17-IgG2 | 15 | <1,31×10-10 | >40х |
| D3-19-IgG2 | 16 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-20-IgG2 | 17 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-21-IgG2 | 18 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-22-IgG2 | 19 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-23-IgG2 | 20 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-24-IgG2 | 21 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-25-IgG2 | 22 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-26-IgG2 | 23 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-27-IgG2 | 24 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-28-IgG2 | 25 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-29-IgG2 | 26 | <1,31×10-10 | >40х |
| D3-30-IgG2 | 27 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-31-IgG2 | 28 | <1,31×10-10 | >40х |
| D3-32-IgG2 | 29 | <1,31×10-10 | >40х |
| D3-33-IgG2 | 30 | <1,31×10-10 | >40х |
| D3-34-IgG2 | 31 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-39-IgG2 | 32 | 5,23×10-10-2,62×10-10 | 10х-20х |
| D3-50-IgG2 | 33 | 2,62×10-10-1,31×10-10 | 20х-40х |
| D3-52-IgG2 | 34 | 5,23×10-10-2,62×10-10 | 10х-20х |
| D3-53-IgG2 | 35 | <1,31×10-10 | >40х |
| D3-54-IgG2 | 36 | <1,31×10-10 | >40х |
| D3-56-IgG2 | 38 | <1,31×10-10 | >40х |
| D3-62-IgG2 | 44 | <1,31×10-10 | >40х |
| D3-65-IgG2 | 47 | <1,31×10-10 | >40х |
| D3-66-IgG2 | 48 | <1,31×10-10 | >40х |
| D3-69-IgG2 | 50 | <1,31×10-10 | >40х |
| D3-70-IgG2 | 51 | <1,31×10-10 | >40х |
| D3-71-IgG2 | 52 | <1,31×10-10 | >40х |
| D3-72-IgG2 | 53 | <1,31×10-10 | >40х |
| D3-73-IgG2 | 54 | <1,31×10-10 | >40х |
| D3-74-IgG2 | 55 | <1,31×10-10 | >40х |
| D3-75-IgG2 | 56 | <1,31×10-10 | >40х |
| D3-76-IgG2 | 57 | <1,31×10-10 | >40х |
| * Примечание: Идентификационные номера последовательностей (SEQ ID NOS), представленные в таблице 3 для человеческого CTLA-4-IgG2, слитых белков Orencia® и LEA29Y-Ig, представляют собой аминокислотные последовательности этих Ig слитых белков соответственно. SEQ ID NO, представленная в таблице 3 для каждого мутантного слитого белка CTLA-4-Ig, обозначает аминокислотную последовательность мутантного CTLA-4 ВКД определенного мутантного слитого белка CTLA-4-Ig. Данные касаются мутантного CTLA-4-Ig, включающего мутантный CTLA-4 ВКД (например, любая из SEQ ID NOS:1-48 и 58-73), слитый на его N-конце с С-концом IgG2 Fc полипептида, представленного в SEQ ID NO:184 или 218. Способы для образования таких слитых белков известны в области техники и описаны здесь. Тем не менее, как отмечалось выше, обнаружили экспериментально, что мутантный CTLA-4-Ig, произведенный в СНО клетках с применением вектора, включающего нуклеотидную последовательность, кодирующую предполагаемый hIgG2 Fc полипептид, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (K); таким образом, hgG2 Fc аминокислотная последовательность мутантного CTLA-4-IgG2, является той, что показана в SEQ ID NO:218, где hIgG2 Fc аминокислотная последовательность не включает С-терминальный остаток лизина по сравнению с последовательностью, представленной в SEQ ID NO:184. Иллюстративные последовательности слитого белка, которые не включают C-терминальный остаток лизина, показаны в SEQ ID NOS:205-214, 219 и 221. |
Таблица 4 представляет авидности связывания мутантных CTLA-4-Ig слитых белков с hCD80-mIg, что измерялось стандартным анализом Biacore. Специфически таблица 4 показывает имя клона мутантного слитого белка CTLA-4-Ig; идентификационный номер последовательности (SEQ ID NO), соответствующий аминокислотной последовательности мономерного мутантного CTLA-4 ВКД слитого белка; равновесную константу диссоциации (KD (Молярность (М)) для анализа авидности связывания лиганда hCD80-mIg; и авидность связывания мутантного слитого белка CTLA-4-Ig к hCD80-mIg лиганду относительно авидности связывания слитого белка Orencia® к тому же лиганду. Для каждого мутантного белка показаны разы улучшения авидности связывания с hCD80-mIg лигандом по сравнению с авидностью связывания слитого белка Orencia® с hCD80-mIg лигандом (4-я колонка в таблице 4). Orencia® слитый белок служит эталоном, а именно с авидностью связывания с hCD80-mIg, принятой за 1. Мутантные слитые белки CTLA-4-Ig обычно существуют как димерные слитые белки в растворе. Как показано в таблице 4, димерные мутантные слитые белки CTLA-4-Ig по изобретению имеют авидности связывания к лиганду hCD80-mIg, которые: (1), по меньшей мере, приблизительно равны или больше, чем авидность связывания человеческого CTLA-4-IgG2; (2), по меньшей мере, приблизительно равны или больше, чем авидность связывания слитого белка Orencia® к hCD80-mIg лиганду; и/или (3), по меньшей мере, приблизительно равны или больше, чем авидность связывания LEA29Y-Ig к hCD80-mIg лиганду. Как обсуждалось выше, каждый димерный мутантный димер CTLA-4-Ig может быть создан с применением способов, приведенных в примере 3 выше.
Многие мутантные слитые белки CTLA-4-Ig, как обнаружено, имеют скорость диссоциации от hCD80-mIg слитого белка, которая практически равна или больше, чем скорость диссоциации слитого белка Orencia® от того же лиганда (данные не показаны). Некоторые мутантные слитые белки CTLA-4-Ig, как обнаружено, имеют скорость ассоциации с hCD80-mIg, приблизительно равную или большую, чем скорость ассоциации слитого белка Orencia® с тем же лигандом (данные не показаны).
Многие мутантные слитые белки CTLA-4-Ig, представленные в таблице 4, имеют hCD80-mIg равновесные константы диссоциации (KD), которые ниже, чем hCD80-mIg равновесная константа диссоциации человеческого CTLA-4-IgG2 или слитого белка Orencia®. Более того, некоторые мутантные слитые белки CTLA-4-Ig, представленные в таблице 4, имеют hCD80-mIg равновесные константы диссоциации, которые, по меньшей мере, приблизительно равны hCD80-mIg равновесной константе LEA29Y-Ig.
Многие мутантные слитые белки CTLA-4-Ig, представленные в таблице 4, имеют авидности связывания к hCD80-mIg, которые больше, чем авидности связывания человеческого CTLA-4-IgG2 или слитого белка Orencia® к тому же лиганду (разы улучшения hCD80-mIg авидности связывания относительно слитого белка Orencia® показаны в 4-й колонке). Дополнительно, некоторые мутантные слитые белки CTLA-4-Ig, представленные в таблице 4, имеют авидности связывания к hCD80-mIg, которые, по меньшей мере, приблизительно равны авидности связывания LEA29Y-Ig к тому же лиганду.
Мутантный CTLA-4-Ig по изобретению, который имеет более высокую авидность связывания к hCD80-mIg, чем имеет hCTLA-4-IgG1, Orencia®, или LEA29Y-Ig слитый белок, будет, вероятно, иметь увеличенную in vivo иммуносупрессорную силу по сравнению с hCTLA-4-IgG2, Orencia® или слитым белком LEA29Y-Ig соответственно, такую как в, например, терапевтических и/или профилактических способах для подавления иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы млекопитающих, таких как, например, люди, в которых иммуноингибирование или иммуносупрессия являются желательными), способах для ингибирования отторжения трансплантата ткани или органа от донора реципиенту (например, млекопитающему, такому как, например, человек) и других способах, описанных в данном описании.
| Таблица 4 | |||
| Слитый белок (димер) | SEQ ID NO* (а именно, мутантного CTLA-4 ВДК) | KD (М) hCD80 ВКД | Авидность связывания мономерного hCD80 ВКД (по сравнению с димером слитого белка Orencia®) |
| hCTLA-4-IgG2 | 162 | 6,55×10-10 | 1,34х |
| димер слитого белка Orencia® | 164 | 8,77×10-10 | 1 |
| LEA29Y-Ig | 166 | 4,39×10-10-2,19×10-10 | 2х-4х |
| D1-IgG2 | 58 | <4,39×10-10 | >2х |
| D1T-IgG2 | 59 | <4,39×10-10 | >2х |
| D2-IgG2 | 60 | <4,39×10-10 | >2х |
| D3-IgG2 | 61 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D4-IgG2 | 62 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D5-IgG2 | 63 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D6-IgG2 | 64 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D20-IgG2 | 65 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D21-IgG2 | 66 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D23-IgG2 | 67 | <4,39×10-10 | >2х |
| D24-IgG2 | 68 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D26-IgG2 | 69 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D27-IgG2 | 70 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D28-IgG2 | 71 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D29-IgG2 | 72 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D31-IgG2 | 73 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-1-IgG2 | 1 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-2-IgG2 | 2 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-3-IgG2 | 3 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-4-IgG2 | 4 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-5-IgG2 | 5 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-6-IgG2 | 6 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-7-IgG2 | 7 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-8-IgG2 | 8 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-9-IgG2 | 9 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-11-IgG2 | 10 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-12-IgG2 | 11 | <4,39×10-10 | >2х |
| D3-14-IgG2 | 12 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-15-IgG2 | 13 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-16-IgG2 | 14 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-17-IgG2 | 15 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-19-IgG2 | 16 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-20-IgG2 | 17 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-21-IgG2 | 18 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-22-IgG2 | 19 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-23-IgG2 | 20 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-24-IgG2 | 21 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-25-IgG2 | 22 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-27-IgG2 | 23 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-28-IgG2 | 24 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-29-IgG2 | 25 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-30-IgG2 | 26 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-31-IgG2 | 27 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| Слитый белок (димер) | SEQ ID NO* (а именно, мутантного CTLA-4 ВДК) | KD (М) hCD80 ВКД | Авидность связывания мономерного hCD80 ВКД (по сравнению с димером слитого белка Orencia®) |
| D3-32-IgG2 | 28 | <4,39×10-10 | >2х |
| D3-33-IgG2 | 29 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-34-IgG2 | 30 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-39-IgG2 | 31 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-50-IgG2 | 32 | 1,75×10-9×4,39×10-10 | 0,5х-2х |
| D3-52-IgG2 | 33 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-53-IgG2 | 35 | <4,39×10-10 | >2х |
| D3-54-IgG2 | 36 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-56-IgG2 | 38 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| D3-62-IgG2 | 44 | <4,39×10-10 | >2х |
| D3-65-IgG2 | 47 | <4,39×10-10 | >2х |
| D3-66-IgG2 | 48 | <4,39×10-10 | >2х |
| D3-69-IgG2 | 50 | <4,39×10-10 | >2х |
| D3-70-IgG2 | 51 | <4,39×10-10 | >2х |
| D3-71-IgG2 | 52 | <4,39×10-10 | >2х |
| D3-72-IgG2 | 53 | <4,39×10-10 | >2х |
| D3-73-IgG2 | 54 | <4,39×10-10 | >2х |
| D3-74-IgG2 | 55 | <4,39×10-10 | >2х |
| D3-75-IgG2 | 56 | <4,39×10-10 | >2х |
| D3-76-IgG2 | 57 | 1,75×10-9-4,39×10-10 | 0,5х-2х |
| * Примечание: SEQ ID NOS, представленные в таблице 4 для человеческого CTLA-4-IgG2, слитых белков Orencia® и LEA29Y-Ig, представляют собой аминокислотные последовательности этих слитых белков соответственно. SEQ ID NO, представленный в таблице 4 для каждого мутантного слитого белка CTLA-4-Ig, определяет аминокислотную последовательность мутантного CTLA-4 ВКД определенного мутантного слитого белка CTLA-4-Ig. Данные относятся к мутантному CTLA-4-Ig, включающему мутантный CTLA-4 ВКД (например, любой SEQ ID NOS:1-48 и 58-73), слитый на его N-конце с С-концом IgG2 Fc полипептида, представленного в SEQ ID NO:184 или 218. Тем не менее мы обнаружили экспериментально с помощью МСЖХ анализа, что мутантный CTLA-4-Ig, произведенный в СНО клетках с применением вектора, включающего нуклеотидную последовательность, кодирующую предполагаемый MgG2 Fc полипептид, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (K); таким образом, hIgG2 Fc аминокислотная последовательность мутантного CTLA-4-IgG2 является той, что показана в SEQ ID NO:218, где hIgG2 Fc аминокислотная последовательность обычно не включает С-терминальный остаток лизина по сравнению с последовательностью, представленной в SEQ ID NO:184. Иллюстративные последовательности слитого белка, которые не включают C-терминальный остаток лизина, показаны в SEQ ID NOS:205-214, 219 и 221. | |||
Мономерные кинетические исследования
Дальнейшее подтверждение связывающих свойств мутантных CTLA-4-Ig слитых белков получали с помощью одновалентного кинетического связывающего анализа. Эти исследования измеряют кинетические характеристики связывания двухвалентного анализируемого белка (например, димерного мутантного слитого белка CTLA-4-Ig), которым покрывали сенсорные чипы, и одновалентного лиганда (обработанный папаином hCD86-mIg) в подвижной фазе. Антитело козла против человеческого IgG (Jackson ImmunoResearch, #109-005-098) связывали с СМ5 сенсорными чипами согласно протоколам производителя, обычно имея на выходе 15000 единиц ответа (ЕО). Лиганд захватывался путем инкубации сенсорных чипов, покрытых антителом, с 10 мкл 2 мкг/мл раствора димерных мутантных CTLA-4-Ig слитых белков в HBS-EP буфере при скорости потока 10 мкл/мин. Уровни захвата лиганда составляли обычно 25-80 ЕО. Мономерные лиганды hCD86-mIg (созданные путем обработки папаином и белок-А сефарозной адсорбции hCD86-mIg, как описано в Hermanson, G.T. BIOCONJUGATE TECHNIQUES, Academic Press, 1996) разводили в HBS-EP буфере и выливали через сенсорные чипы, покрытые анализируемым белком, в течение 2 мин при 30 мкл/мин, с последующей 2 мин инкубацией в HBS-EP буфере, не содержащем белок, при той же скорости потока. Восстановление между циклами проводили путем 3-минутной инкубации с 10 мМ глициновым буфером (рН 1,7) при 30 мкл/мин. Типично, 8 разведений мономерных анализируемых белков в диапазоне от 3000 нм до 0,2 нм анализировали против холостой пробы (только HBS-EP буфер) в двух параллелях. Rmax сигнальные уровни для связывания с мутантными CTLA-4-Ig белками лежали в диапазоне 10-60 ЕО.
Для кинетического анализа данные от мономерных связывающих исследований отбирали, как описано выше, за исключением того, что отбор данных ассоциации начинали с и заканчивали за 5 сек от времени начала и конца инъекции, и отбор данных диссоциации начинали через 5 сек после времени окончания инъекции, и обычно включали 1-60 сек периода диссоциации. Эти данные далее анализировали в отношении уравнения динамического равновесия аффинностей с применением BIAevaluation программного обеспечения. Уровни динамического равновесия связывания для каждой концентрации (Ответравн ("Req") значения) усредняли в диапазоне 5-20 сек около завершения инъекции образца с применением BIAevaluation "основное выравнивание:среднее" функции. Установившуюся аффинность определяли из графика Req против концентрации с применением BIAevaluation программы согласно формуле Req=KA×С×Rmax/(KA×С×n+1), где С - это концентрация анализируемого агента, и n, фактор стерических помех, составляет 1, и KD=1/KA. В некоторых случаях наблюдали действительное неспецифическое связывание, представленное остаточной плоской проекцией R-значения после диссоциации. Эти данные корректировали вычитанием остаточных R-значений из значений Req. KD затем рассчитывали в GraphPad Prism программе (GraphPad Software, Inc.) с применением модели "одно сайт-специфическое связывание".
Это мономерное связывающее исследование проводили на подгруппе репрезентативных мутантных белков CTLA-4-Ig и результаты суммировали в таблице 5. В целом, степень улучшения hCD86 ВКД связывания с мутантными слитыми белками CTLA-4-Ig относительно LEA29Y-Ig, наблюдающееся в мономерных связывающих исследованиях, было сходным с тем, что наблюдалось для hCD86-mIg связывания с мутантными слитыми белками CTLA-4-Ig относительно LEA29Y-Ig в стандартных кинетических исследованиях. Эти результаты подтверждают предположение, что наблюдаемые улучшения в кинетических характеристиках связывания для мутантных белков являются результатом действительных улучшений аффинностей связывания мутантных белков (например, по сравнению с Orencia® и/или LEA29Y-Ig слитыми белками) и не обусловлены возможными артефактами, вызванными высокой валентностью агрегированных белковых препаратов.
| Таблица 5 | |||
| Слитый белок (димер) | SEQ ID NO* (a именно, мутантного CTLA-4 ВДК) | KD (М) мономерного hCD86 ВКД. | Аффинность связывания мономерного hCD86 ВКД (по сравнению с LEA29Y-Ig) |
| LEA29Y-Ig | 166 | 1,68×10-6 | 1 |
| D3-IgG2 | 61 | <3,36×10-7 | >5х |
| D3-04-IgG2 | 4 | <3,36×10-7 | >5х |
| D3-11-IgG2 | 10 | <3,36×10-7 | >5х |
| D3-12-IgG2 | 11 | <3,36×10-7 | >5х |
| D3-14-IgG2 | 12 | <3,36×10-7 | >5х |
| D3-17-IgG2 | 15 | <3,36×10-7 | >5х |
| D3-20-IgG2 | 17 | 8,4×10-7-3,36×10-7 | 2х-5х |
| D3-27-IgG2 | 24 | 8,4×10-7-3,36×10-7 | 2х-5х |
| D3-29-IgG2 | 26 | <3,36×10-7 | >5х |
| D3-31-IgG2 | 28 | <3,36×10-7 | >5х |
| D3-53-IgG2 | 35 | <3,36×10-7 | >5х |
| * Примечание: SEQ ID NO, представленный в таблице 5 для LEA29Y-Ig, является номером аминокислотной последовательности LEA29Y-Ig слитого белка. SEQ ID NO, представленный в таблице 5 для каждого мутантного слитого белка CTLA-4-Ig, определяет аминокислотную последовательность мутантного CTLA-4 ВКД, присутствующего в определенном мутантном CTLA-4-Ig слитом белке. Данные относятся к мутантному CTLA-4-Ig, включающему мутантный CTLA-4 ВКД (например, любой SEQ ID NOS:4, 10-12, 15, 17, 24, 26, 28, 35 и 61), слитый на его N-конце с С-концом IgG2 Fc полипептида, представленного в SEQ ID NO:184 или 218. Тем не менее обнаружили экспериментально с помощью МСЖХ анализа, что мутантный CTLA-4-Ig, произведенный в СНО клетках с применением вектора, включающего нуклеотидную последовательность, кодирующую предполагаемый hIgG2 Fc полипептид, представленный в SEQ ID NO:184, обычно не включает предполагаемый C-терминальный остаток лизина (K); таким образом, hIgG2 Fc аминокислотная последовательность мутантного CTLA-4-IgG2 является той, что показана в SEQ ID NO:208, причем hIgG2 Fc аминокислотная последовательность обычно не включает C-терминальный остаток лизина по сравнению с последовательностью, представленной в SEQ ID NO:184. Иллюстративные последовательности слитого белка, которые не включают С-терминальный остаток лизина, показаны в SEQ ID NOS:205-214, 219 и 221. Иллюстративные последовательности слитого белка, которые включают C-терминальный остаток лизина, показаны в SEQ ID NOS:74-79, 197-200, 220 и 222. | |||
Пример 5
Измерение биологической активности CTLA-4 мутантов с применением исследований пролиферации человеческого МПК (мононуклеары периферической крови) (стимуляция анти-CDS антитела)
Показано, что CTLA-4-Ig и его конкретные варианты являются сильными ингибиторами Т-клеточной пролиферации in vitro (смотри, например, Larson et al., Am. J. Трансплантат.5, 443). Для измерения улучшенной активности мутантных белков CTLA-4-Ig в таких исследованиях производили анализ пролиферации мононуклеаров периферической крови (МПК).
Человеческую кровь (свежесобранную по донорской программе) разводили равным объемом PBS и фракционировали, чтобы выделить МПК с применением Histopaque (Sigma, #10771) Фиколл градиента в соответствии с условиями, рекомендованными производителем. МПК разводили в ростовой среде (DMEM/F12 среда (Invitrogen, #10565-018), дополненная 10% ФБС (Hyclone #SV30014,03) и 1х ПСГ (Invitrogen, #10378-016)), и добавляли в 96-ячейковые планшеты для культуры (BD Biosciences, #353077) при плотности 1×10 клеток/ячейка. Анализируемые соединения серийно разводили в ростовой среде и добавляли в ячейки в трех параллелях. Клеточную пролиферацию инициировали добавлением мышиного антитела против человеческого CD3 (BD Pharmingen: 555329) до конечной концентрации 5 мкг/мл. После инкубации при 37°С в течение 2 дней (дн.) 3H тимидин (GE Healthcare, #TRK758-5MCI) добавляли в концентрации 1 мкСi/ячейка и планшеты инкубировали при 37°С в течение дополнительных 16 часов. Клетки собирали клеточным коллектором (FilterMate Omnifilter-96 Harvester) с применением условий, рекомендуемых производителем, и измеряли встраивание 3H тимидина с применением сцинтилляционного счетчика (Wallac Trilux, #1450-421). Степень встраивания 3H тимидина (захват 3H тимидина) является показателем степени Т-клеточной пролиферации. Встраивание 3H-тимидина измеряли с помощью стандартных методик. Пролиферацию Т-клеток выражают как среднее количество в минуту (квм) от трех параллелей ячеек.
Данные клеточной пролиферации анализировали программой GraphPad Prism 5 с применением модели кривой нелинейной регрессии (сигмоидальный ответ на дозу, переменная крутизна) и подбором методом наименьших квадратов. Показаны результаты параметров IC50 (также показанные как IC50) и их связанные 95% доверительные интервалы (таблица 6). Фигура 6 показывает кривые клеточной пролиферации от репрезентативного анализа МПК пролиферации (с применением стимуляции анти-CD3 антитела), включая перечень иллюстративных мутантных CTLA-4-Ig слитых белков по изобретению - а именно, D3-04-IgG2, D3-11-IgG2, D3-12-IgG2 и D3-14-IgG2 слитые белки. На графике изображена зависимость встраивания 3H тимидина (количеств в минуту (квм)) от концентрации белка (наномоль (нМ)). Встраивание 3H тимидина (захват 3H тимидина), которое выражается в степени клеточной пролиферации, измеряли стандартными методиками.
Orencia® и LEA29Y-Ig слитые белки были включены в исследование как контроли для сравнения. Эти результаты показывают, что мутантные CTLA-4-Ig Ig слитые белки по изобретению имеют значительно более высокую силу или большую способность, чем Orencia® и/или LEA29Y-Ig слитый белок(белки) в ингибировании или подавлении поликлональной Т-клеточной активации или Т-клеточной пролиферации in vitro.
Анализ МПК пролиферации проводили с применением других мутантных CTLA-4-Ig слитых белков по изобретению. Таблица 6 обеспечивает суммарные данные для репрезентативного перечня мутантных CTLA-4-Ig слитых белков по изобретению. Таблица 6 представляет сравнение средних значений IC50 (наномоль (нМ)) для иллюстративных мутантных CTLA-4-Ig слитых белков против контролей (Orencia®, hCTLA-4-IgG2 и LEA29Y-Ig слитые белки) в анализе МПК пролиферации (со стимуляцией анти-CD3 антитела). Значение IC50 представляет концентрацию соединения (например, мутантного слитого белка CTLA-4-Ig, hCTLA-4-IgG2, Orencia® или LEA29Y-Ig), которая необходима для 50% ингибирования Т-клеточной пролиферации in vitro. Значения IC50 от отдельных экспериментов усредняли для получения средних значений IC50, которые использовали для статистических анализов. Однофакторный анализ ANOVA с апостериорным тестом Даннетта или Бенферрони использовали для сравнения мутантных CLTA-4-Ig слитых белков и hCTLA-4-IgG2 с Orencia® или LEA29Y-Ig слитым белком соответственно (CW. Dunnett, New Tables for Multiple Comparisons with Control, Biometrics 20(3):482-491 (Sept. 1964); Abdi, Herve, "The Bonferroni and Sidak corrections for multiple comparisons", in ENCYCLOPEDIA OF MEASUREMENT AND STATISTICS (NJ. Salkind ed., Thousand Oaks, CA 2007); также доступный по адресу всемирного веб-сайта utdallas.edu/~herve/Abdi-Bonferroni2007-pretty.pdf.). Статистический анализ Ig слитого белка, состоящего из одного из следующих мутантных CTLA-4 ВКД полипептидов - клоны D24, D3-07, D3-15 и D3-16 - не проводили, так как n=1. Термин «СО (средний log IC50)» представляет стандартное отклонение от средних значений log IC50.
| Таблица 6 | |||
| Обобщение данных от иллюстративных исследований МПК пролиферации с применением стимуляции анти-CD3 антитела | |||
| Слитый белок (димер) | Среднее IC50 (нМ) | Среднее log IC50 (нМ) | СО (среднего log IC50) (нМ) |
| димер слитого белка Orencia® | 5,16 | 0,71 | 0,51 |
| hCTLA-4-Ig | 8,46 | 0,93 | 0,43 |
| LEA29Y-Ig | 0,481 | -0,32 | 0,54 |
| D3-04-IgG2 | 0,051,2 | -1,27 | 0,45 |
| D3-07-IgG2 | 0,12 | -0,93 | НО |
| D3-ll-IgG2 | 0,081,2 | -1,07 | 0,40 |
| D3-12-IgG2 | 0,061,2 | -1,27 | 0,17 |
| D3-14-IgG2 | 0,071,2 | -1,17 | 0,15 |
| D3-15-IgG2 | 0,21 | -0,69 | НО |
| D3-17-IgG2 | 0,041,2 | -1,36 | 0,37 |
| D3-20-IgG2 | 0,071,2 | -1,19 | 0,37 |
| D3-26-IgG2 | 0,151 | -0,83 | 0,49 |
| D3-27-IgG2 | 0,101,2 | -1,00 | 0,41 |
| D3-29-IgG2 | 0,071,2 | -1,13 | 0,53 |
| D3-30-IgG2 | 0,181 | -0,74 | 0,35 |
| D3-31-IgG2 | 0,041,2 | -1,42 | 0,25 |
| D3-32-IgG2 | 0,101 | -1,00 | 0,47 |
| D3-33-IgG2 | 0,121 | -0,94 | 0,69 |
| D3-34-IgG2 | 0,411 | -0,39 | 0,18 |
| D3-39-IgG2 | 0,471 | -0,33 | 0,21 |
| D3-50-IgG2 | 0,351 | -0,46 | 0,23 |
| D3-52-IgG2 | 0,491 | -0,31 | 0,20 |
| D3-53-IgG2 | 0,021,2 | -1,69 | 0,24 |
| D3-54-IgG2 | 0,171 | -0,77 | 0,22 |
| D3-56-IgG2 | 0,081 | -,08 | 0,20 |
| D3-62-IgG2 | 0,051,2 | -,29 | 0,23 |
| D3-69-IgG2 | 0,051,2 | -,34 | 0,19 |
| D3-70-IgG2 | 0,081 | -,10 | 0,10 |
| D3-71-IgG2 | 0,05 | -,32 | НО |
| D3-72-IgG2 | 0,031,2 | -,54 | 0,19 |
| D3-73-IgG2 | 0,231 | -0,64 | 0,25 |
| D3-75-IgG2 | 0,081 | -1,11 | 0,33 |
| D3-76-IgG2 | 0,131 | -0,88 | 0,36 |
| D3-IgG2 | 0,141 | -0,85 | 0,13 |
| D24-IgG2 | 0,12 | -0,93 | НО |
| Верхние индексы, представленные в таблице 6, являются следующими: 1Статистически отличающиеся от Orencia с p<0,05, как определялось с помощью однофакторного ANOVA с апостериорным тестом Даннетта. 2Статистически отличающиеся от LEA с p<0,05, как определялось с помощью однофакторного ANOVA с апостериорным тестом Бенферрони. Слитые белки, включающие D3-7, D3-15, D3-71 и D24 мутантные CTLA-4 ВКД, анализировали один раз, и поэтому не было проведено никакого статистического сравнения. Примечание: Выражение «НО» в таблице 6 означает "не определен". |
Статистический анализ показывает, что все мутантные слитые белки CTLA-4-Ig, которые были проанализированы в, по меньшей мере, двух отдельных исследованиях и обозначенные верхним индексом (1) (смотри таблицу 6), были статистически выше по силе по сравнению с Orencia® и hCTLA-4-IgG2 слитыми белками (p<0,05) (а именно, имеют большую способность подавлять или ингибировать Т-клеточную пролиферацию в in vitro анализах МПК, чем Orencia® и hCTLA-4-IgG2 слитые белки). Те, которые обозначены верхним индексом (2) (смотри таблицу 6), также статистически превосходили по силе LEA29Y-Ig слитый белок (p<0,05) (а именно, имеют большую способность подавлять или ингибировать Т-клеточную пролиферацию в in vitro анализах МПК, чем LEA29Y-Ig слитый белок), что определялось с помощью однофакторного анализа ANOVA с апостериорным тестами Даннетта и Бенферрони, обсуждаемых выше. Не наблюдалось статистической разницы между человеческими CTLA-4 слитыми белками, включающими либо модифицированный IgG1 Fc (как в Orencia®), либо дикого типа IgG2 Fc (как в hCTLA4-IgG2). Этот результат исследования подразумевает, что отличия в функциональных активностях, представленные в таблице 6 между мутантными CTLA-4-Ig слитыми белками по изобретению (каждый из которых включает человеческий IgG2 Fc) и либо Orencia®, либо hCTLA4-IgG2, были прямым следствием аминокислотных изменений (а именно, аминокислотных замен), произведенных в CTLA-4 ВКД области. Отличия в функциональных активностях между этими мутантными CTLA-4-Ig слитыми белками по изобретению и, например, Orencia® (который включает модифицированный IgG1 Fc), не были следствием отличий в их соответствующих Ig Fc аминокислотных последовательностях.
Предполагают, что, имея увеличенные способности мутантных CTLA-4-Ig слитых белков по изобретению подавлять или ингибировать Т-клеточную пролиферацию в in vitro исследованиях по сравнению с Orencia®, LEA29Y-Ig и/или hCTLA-4-IgG2 слитыми белками, такие мутантные белки будут также проявлять увеличенные иммуносупрессорные мощности в in vivo терапевтических и/или профилактических способах по сравнению с Orencia®, LEA29Y-[g и/или hCTLA-4-IgG2 слитыми белками. Каждый такой мутантный слитый белок CTLA-4-Ig по изобретению, как предполагают, имеет большую способность подавлять или ингибировать Т-клеточную пролиферацию в in vivo способах или применениях относительно Orencia®, LEA29Y-Ig и/или hCTLA-4-IgG2 слитых белков, в таких как, например, терапевтические и/или профилактические способы для подавления или ингибирования иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы у млекопитающего, такого как, например, человек), способы для подавления или ингибирования отторжения трансплантата ткани или органа от донора реципиенту (например, млекопитающему, такому как например, человек) и/или другие способы лечения или диагностические способы, описанные в данном описании.
Применяя те же статистические анализы, мы не обнаружили никакого статистического отличия между Orencia® слитым белком (содержащим человеческий CTLA-4 ВКД-мутантный IgG1) и человеческим CTLA-4-IgG2. Таким образом, предполагается, что отличия в Ig доменах этих молекул (а именно, мутантного IgG1 слитого белка Orencia® и человеческого IgG2 hCTLA-4-IgG2) не затрагивают функциональность этих молекул. Смотри фигуру 11. Ингибирование пролиферации, наблюдаемое с повышением доз слитого белка Orencia®, достоверно не отличалось от того, которое наблюдалось с CTLA-4-IgG2, указывая на то, что их соответствующие иммуносупрессорные активности не смещаются в соответствии с их различными IgG изотипами, но скорее являются результатом их hCTLA-4 ВКД полипептидов. Таким образом, различия в иммуносупрессорных активностях между мутантными CTLA-4-Ig полипептидами по изобретению и Orencia® слитым белком (или LEA29Y-Ig, так как он содержит такой же Ig, как и Orencia® белок) не могут приписываться их соответствующим Fc областям, включающим различные IgG изотипы.
Изобретение включает мономерные мутантные CTLA-4 ВКД белки, которые имеют способность и в некоторых случаях большую способность подавлять или ингибировать Т-клеточную активацию или пролиферацию, чем мономерный белок человеческого CTLA-4 или его внеклеточный домен. Также обеспечиваются мономерные мутантные слитые белки CTLA-4 ВКД, которые имеют способность и в некоторых случаях большую способность подавлять или ингибировать Т-клеточную активацию или пролиферацию, чем мономерный слитый белок hCTLA-4 Ig или его внеклеточный домен. Также включаются в объем изобретения мутантные белковые димеры CTLA-4 ВКД, которые имеют способность и в некоторых случаях большую способность подавлять или ингибировать Т-клеточную активацию или пролиферацию, чем димер, включающий два человеческих внеклеточных домена CTLA-4. Некоторые мутантные димеры слитого белка CTLA-4 ВКД по изобретению (например, мутантные димеры слитого белка CTLA-4-ВКД-Ig) имеют способность и в некоторых случаях большую способность подавлять или ингибировать Т-клеточную активацию или пролиферацию, чем hCTLA-4-IgG2 димер слитого белка, Orencia® димер слитого белка и/или LEA29YIg димер слитого белка.
Пример 6
Измерение биологической активности мутантных CTLA-4-Ig молекул с применением исследований человеческого CD4+ Т-клеточной пролиферации.
Показано, что человеческий CTLA-4-Ig и его конкретные варианты ингибируют Т-клеточную пролиферацию путем блокирования передачи сигнала CD80 и CD86 через CD28 (Linsley P.S., Immunity 1:793-801 (1994); Larson С.Р. et al., Am. J. Transplant. 5:443-453 (2005)). Так как мутантные CTLA-4-Ig белки по изобретению имеют улучшенную авидность связывания к CD86-Ig лиганду, проводили исследование CD4+ Т-клеточной пролиферации для измерения активности мутантных белков CTLA-4-Ig в блокировании передачи сигнала через CD86.
Создание ДНК последовательности, кодирующей полноразмерный человеческий CD86 белок
Создавали плазмиду pCDNA3,1 hB7,2 FL, чтобы кодировать полноразмерный человеческий CD86 белок для экспрессии на поверхности трансфектированных клеток. ДНК, кодирующую человеческий CD86, получали путем ПЦР амплификации кДНК, полученной от человеческих лейкоцитов (BD Biosciences, Cat# HL4050AH) с применением прямых и обратных олигонуклеотидных праймеров, сконструированных на основании гомологии последовательности с нуклеотидной последовательностью, кодирующей CD86, приведенной в SEQ ID NO:176. Праймеры конструировали, создавали и собирали с применением стандартных методик, хорошо известных специалистам в данной области техники, и они включают стоп- и старт-кодоны и сайты рестрикции при необходимости. Используемые процедуры ПЦР амплификации также хорошо известны в данной области техники. Такие методики описаны в, например, Berger, Ausubel и Sambrook, все смотри выше. 50 нанограмм (нг) кДНК использовали как матрицу в 100 мкл ПЦР реакции с 1 мкМ прямыми и обратными праймерами, Herculase Полимеразным буфером (Stratagene; #600260) и 200 мкМ dNTP для 30 циклов амплификации (94°С, 30 сек; 50°С, 30 сек; 72°С, 60 сек). ПЦР продукт очищали с помощью QiaQuick ПЦР спин-колонок (Qiagen #28106) и обрабатывали ферментами рестрикции Kpnl и Notl. Фрагменты отделяли электрофорезом на агарозном геле, очищали с применением Qiaquick набора гелевой экстракции (Qiagen, #28704) согласно рекомендациям производителя и лигировали в сходным образом обработанную ферментами плазмиду рКДНК 3.1(+) (Invitrogen, Кат. #V790-20). Продукты лигирования трансформировали в ТОР10 Е. coli клетки (Qiagen, Кат. #С4040-10) в соответствии с рекомендациями производителя. Трансформированные клетки инкубировали в LB (бульон Луриа), содержащей 50 мкг/мл карбенициллина при 250 об/мин в течение ночи при 37°С и затем использовали для создания maxiprep (Qiagen; #12362) стока плазмидной ДНК в соответствии с условиями, рекомендованными производителем.
Предполагаемая аминокислотная последовательность полноразмерного человеческого CD86 белка показана в SEQ ID NO:175. В этой последовательности аминокислотные остатки 1-23 включают предполагаемую сигнальную последовательность, аминокислотные остатки 24-241 включают человеческий CD86 внеклеточный домен, аминокислотные остатки 242-270 включают трансмембранный домен, и аминокислотные остатки 271-329 включают цитоплазматический домен.
Создание стабильных клеточных линий, экспрессирующих человеческий CD86 на клеточной поверхности
HEK293 клетки выращивали до 80-90% конфлюентности в Т-75 колбах, содержащих 20 мл ростовой среды (DMEM/F12 среда (Invitrogen, Кат. #10565-018), дополненная 10% ФБС (Hyclone Кат. #SV30014,03) и 1х ПСГ (Invitrogen, Кат. #10378-016)). Клетки трансфектировали с 10 мкг плазмидной ДНК (pCDNA3,1 hB7,2 FL), смешанной с 60 мкл Fugene 6 (ROCHE, #11814443001) в соответствии с условиями, рекомендованными производителем. Клетки инкубировали в течение 2 дней (дн.) при 37°С в ростовой среде и далее инкубировали 10 дн. При 37°С в среду отбора (ростовая среда, содержащая 300 мкг/мл генетицина (Invitrogen, #10131-027)), заменяя среду каждые 2 дн. Для обеспечения FACS сортировки трансфектированные клетки окрашивали FITC-меченым анти-CD86 антителом (BD Biosciences, #555) в соответствии с условиями, рекомендуемыми производителем. С применением клеточного сортирующего устройства (Dako, MoFlo), пропускающего FITC сигнал, CD86-позитивные клетки индивидуально отсортировали в 96-ячейковые планшеты для культуры (Sigma-Aldrich, #CLS-3596), содержащей 200 мкл/ячейка ростовой среды, содержащей 25% кондиционированной среды (ростовая среда, предварительно собранная от нетрансфектированных (или нативных) клеточных культур). После инкубации при 37°С в течение 13-19 дн., клетки рассеивали трипсиновым гидролизом и переносили в 24-ячейковые планшеты для культуры, содержащие 0,5 мл/ячейка ростовой среды. После инкубации при 37°С в течение 7 дн., клетки рассеивали трипсиновым гидролизом и переносили в Т-75 колбы, содержащие 20 мл ростовой среды. Конечные клеточные линии выбирали на основании высоких уровней CD86 экспрессии на клеточной поверхности, что измерялось FACS анализом клеток, окрашенных FITC-меченым анти-CD86 антителом с применением FACS Caliber (BD Biosciences), в соответствии с условиями, рекомендованными производителем.
Исследования CD4+ Т-клеточной пролиферации
CD4+ Т-клетки обогащали до >96% от человеческих препаратов лейкоцитарной пленки (Stanford University Blood Center, Stanford, CA) с применением EasySep Набора отбора позитивного человеческого CD4 (StemCell Technologies, #18052R) с магнитным клеточным разделителем (RoboSep, StemCell Technologies, #20000), следуя рекомендациям производителя. Обогащенные CD4+ Т-клетки доводили до плотности 1×106 клеток/мл в среде Yssel (Gemini Bio-Products, #400-102), дополненной 10% ФБС (Hyclone SV30014,03), и добавляли в 96-ячейковые планшеты для тканевой культуры в концентрации 50 мкл/ячейка. НЕК293 клетки, экспрессирующие мембранасвязанный человеческий CD86, облучали при 6000 рад (Stanford Research Institute, Menio Park, CA), доводили до 1×106 клеток/мл в той же среде и добавляли к планшетам для культуры в концентрации 50 мкл/ячейка. Анализируемые соединения серийно разводили в той же среде и добавляли в ячейки в трех параллелях. Клеточную пролиферацию инициировали добавлением мышиного антитела против человеческого CD3 (BD Pharmingen: 555329) до конечной концентрации 5 мкг/мл. После инкубации при 37°С в течение 3 дн. 3H тимидин (GE Healthcare, #TRK75S-5MCI) добавляли в концентрации 1 мкСi/ячейка и планшеты инкубировали при 37°С следующие 18 часов. Клетки собирали с применением клеточного коллектора (Perkin Elmer Filter Harvester D961962) и 3H тимидин измеряли с применением жидкого сцинтилляторного счетчика (Wallac Trilux 1450) в соответствии с условиями, рекомендованными производителем. Данные клеточной пролиферации анализировали программой GraphPad Prism 5 с применением уравнения переменной крутизны (Y=низ+(верх-низ)/(1+10^((LogIC50-X)(склон))) для получения IC50 для каждого анализируемого соединения. Термин "(LogIC50-X)(склон)" является экспонентой в уравнении.
Фигура 7 показывает кривые клеточной пролиферации от репрезентативных исследований CD4+ Т-клеточной пролиферации, включая иллюстративный перечень мутантных CTLA-4-Ig слитых белков по изобретению - а именно, D3-04-IgG2, D3-11-IgG2, D3-12-IgG2 и D3-14-IgG2. Orencia® и LEA29Y-Ig слитые белки включены в анализ как контроли для сравнения. Показан график зависимости встраивания 3H тимидин (квм) от концентрации (нМ) белка. Встраивание 3H тимидина - это показатель степени клеточной пролиферации, он измерялся стандартными методиками. Эти результаты показывают, что мутантные слитые белки CTLA-4-Ig по изобретению имеют достоверно более высокую силу или большую способность, чем Orencia® и/или LEA29Y-Ig слитые белки в ингибировании или подавлении CD86 костимуляции in vitro.
Этот анализ CD4+ Т-клеточной пролиферации проводили на некоторых других мутантных слитых белка CTLA-4-Igx по изобретению. Таблица 7 представляет суммарные данные для перечня иллюстративных мутантных CTLA-4-Ig слитых белков по изобретению. Таблица 7 представляет сравнения средних значений IC50 (наномоль (нМ)) для иллюстративных мутантных CTLA-4-Ig слитых белков против референтных контролей (Orencia®, LEA29Y-Ig и слитые белки человеческого CTLA-4-IgG2) с применением анализа CD4+ Т-клеточной пролиферации. Значения IC50 от отдельных экспериментов усредняли для получения средних значений IC50, которые использовали в статистических анализах. Термин «СО (средний log IC50)» представляет стандартное отклонение от средних значений log IC50.
| Таблица 7 | |||
| Суммарные данные иллюстративных исследований CD4+ Т-клеточной пролиферации | |||
| Слитый белок (димер) | Среднее IC50 (нМ) | Среднее log IC50 (нМ) | СО (среднего log IC50) (нМ) |
| димер слитого белка Orencia® | 1,56 | 0,19 | 0,22 |
| hCTLA-4-Ig | 2,24 | 0,35 | 0,28 |
| LEA29Y-Ig | 0,21 | -0,67 | 0,25 |
| D3-02-IgG2 | 0,03 | -1,56 | НО |
| D3-03-IgG2 | 0,041,2 | -1,40 | 0,11 |
| D3-04-IgG2 | 0,031,2 | -1,47 | 0,02 |
| D3-06-IgG2 | 0,051 | -1,32 | 0,03 |
| D3-11-IgG2 | 0,031,2 | -1,52 | 0,07 |
| D3-12-IgG2 | 0,041,2 | -1,45 | 0,09 |
| D3-14-IgG2 | 0,041,2 | -1,37 | 0,11 |
| D3-15-IgG2 | 0,021,2 | -1,62 | 0,08 |
| D3-17-IgG2 | 0,031,2 | -1,47 | 0,11 |
| D3-20-IgG2 | 0,041,2 | -1,40 | 0,11 |
| D3-27-IgG2 | 0,041,2 | -1,37 | 0,10 |
| D3-29-IgG2 | 0,041,2 | -1,36 | 0,13 |
| D3-31-IgG2 | 0,031,2 | -1,58 | 0,21 |
| D3-34-IgG2 | 0,051,2 | -1,28 | 0,13 |
| D3-39-IgG2 | 0,051,2 | -1,35 | 0,10 |
| D3-50-IgG2 | 0,061,2 | -1,23 | 0,24 |
| D3-52-IgG2 | 0,071,2 | -1,14 | 0,24 |
| D3-53-IgG2 | 0,021,2 | -1,70 | 0,25 |
| D3-54-IgG2 | 0,041,2 | -1,40 | 0,12 |
| D3-56-IgG2 | 0,041,2 | -1,41 | 0,07 |
| D3-62-IgG2 | 0,041,2 | -1,44 | 0,09 |
| D3-65-IgG2 | 0,061,2 | -1,26 | 0,14 |
| D3-69-IgG2 | 0,031,2 | -1,59 | 0,14 |
| D3-70-IgG2 | 0,051,2 | -1,30 | 0,06 |
| D3-71-IgG2 | 0,041,2 | -1,43 | 0,09 |
| D3-72-IgG2 | 0,031,2 | -1,48 | 0,05 |
| D3-73-IgG2 | 0,061,2 | -1,26 | 0,18 |
| D3-75-IgG2 | 0,031,2 | -1,15 | 0,12 |
| D2-IgG2 | 0,031,2 | -1,52 | 0,18 |
| D3-IgG2 | 0,041,2 | -1,45 | 0,17 |
| Верхние индексы, представленные в таблице 7, являются следующими: 1Статистически отличающиеся от Orencia с p<0,05, что определялось с помощью однофазного анализа ANOVA с апостериорным тестом Даннетта. 2Статистически отличающиеся от LEA с p<0,05, что определялось с помощью однофазного анализа ANOVA с апостериорным тестом Бонферрони. Слитый белок, включающий D3-02 мутантный CTLA-4 ВКД, анализировали один раз, поэтому не могли провести статистического сравнения. | |||
Статистический анализ показывает, что все мутантные слитые белки CTLA-4-Ig, которые были проанализированы в, по меньшей мере, двух отдельных исследованиях и обозначены верхним индексом (1) (смотри таблицу 7), статистически превосходили по силе Orencia® и hCTLA-4-IgG2 слитые белки (p<0,05) (а именно, имеют большую способность подавлять или ингибировать Т-клеточную пролиферацию в in vitro CD44+ Т-клеточных исследованиях, чем Orencia® и hCTLA-4-IgG2 слитые белки). Те, что были обозначены верхним индексом (2) (смотри таблицу 7), также статистически превосходили по силе LEA29Y-Ig слитый белок (p<0,05) (а именно, имеют большую способность подавлять или ингибировать Т-клеточную пролиферацию в in vitro CD4+ Т-клеточных исследованиях, чем LEA29Y-Ig слитый белок), что определялось с помощью однофакторного анализа ANOVA с апостериорными тестами Даннетта и Бенферрони, обсуждаемых выше. Не наблюдалось статистической разницы между слитыми белками человеческого CTLA-4, включающими либо модифицированный IgGI Fc (как в Orencia®), либо дикого типа IgG2 Fc (как в hCTLA4-IgG2). Этот результат исследования подразумевает, что отличия в функциональных активностях, представленные в таблице 7, между мутантными слитыми белками CTLA-4-Ig по изобретению (каждый из которых включают человеческий IgG2 Fc) и либо Orencia®, либо hCTLA4-IgG2, были прямым следствием аминокислотных изменений (а именно, аминокислотных замен), произведенных в области CTLA-4 ВКД. Отличия в функциональных активностях между этими мутантными CTLA-4-Ig слитыми белками по изобретению и, например, Orencia® (который включает модифицированный IgGI Fc), не были следствием отличий в их соответствующих Ig Fc аминокислотных последовательностях.
Предполагают, что, имея увеличенные способности мутантных CTLA-4-Ig белков по изобретению подавлять или ингибировать С086-опосредованную костимуляцию Т-клеток (например, человеческих Т-клеток) в in vitro исследованиях по сравнению с Orencia®, LEA29Y-Ig и/или hCTLA-4-IgG2 слитыми белками, такие мутантные белки будут также проявлять увеличенные иммуносупрессорны мощности в in vivo терапевтических и/или профилактических способах по сравнению с Orencia®, LEA29Y-Ig и/или человеческими слитыми белками CTLA-4-Ig (например, человеческим CTLA-4-IgG2 ("hCTLA-4-IgG2")) соответственно. В одном аспекте мутантные слитые белки CTLA-4-Ig по изобретению, как полагают, имеют большую способность подавлять или ингибировать СВ86-опосредованную костимуляцию Т-клеток (например, человеческих Т-клеток) в in vivo способах или применениях по сравнению с Orencia®, LEA29Y-Ig и/или слитыми белками человеческого CTLA-4-Ig (например, hCTLA-4-IgG2), соответственно, в таких как, например, терапевтические и/или профилактические способы для подавления или ингибирования иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы у млекопитающего, такого как, например, человек), способы для подавления или ингибирования отторжения трансплантата ткани или органа от донора реципиенту (например, млекопитающему, такому как, например, человек) и/или другие способы лечения или диагностические способы, описанные в данном описании.
Пример 7
Измерение биологической активности мутантных молекул CTLA-4-Ig с применением исследования пролиферации человеческих МПК (стимуляция антигенной памяти).
Активация Т-клеточной памяти является важным аспектом аутоиммунитета (Rogers NJ., et al. Eur. J. Immunol 35:2909-2919 (2005)). Для измерения иммуносупрессорной активности мутантных белков CTLA-4-Ig в этом отношении, исследование пролиферации мононуклеаров периферической крови (МПК) проводили с применением PPD антигенной стимуляция.
Человеческую кровь (свежезабранную по донорской программе) разводили равным объемом PBS и фракционировали для выделения МПК с применением Histopaque (Sigma, #10771) Фиколл градиента в соответствии с условиями, рекомендованными производителем. МПК разводили в RPMI среде (Sigma, #R8758), дополненной 10% ФБС (Hyclone # SV30014.03) и 1х ПСГ (пенициллин, стрептомицин и глутамин) (Invitrogen, #10378-016) и добавляли в 96-ячейковые планшеты для культуры (BD Biosciences, #353077) при плотности 1×105 клеток/ячейка. Анализируемые соединения серийно разводили в той же среде и добавляли в ячейки в четырех параллелях. Клеточную пролиферацию инициировали добавлением PPD антигена (очищенный белок, производный от Mycobacterium tuberculosis, Mycos, #P-1000-001) до конечной концентрации 5 мкг/мл. После инкубации при 37°С в течение 5 дн. 3H тимидин (GE Healthcare, #TRK758-5MCs) добавляли в концентрации 1 мкСi/ячейка и планшеты инкубировали при 37°С следующие 18 часов. Клетки собирали клеточным коллектором (FilterMate Omnifilter-96 Harvester, Perkin Elmer) с применением условий, рекомендуемых производителем, и измеряли на встраивание 3H тимидина с применением сцинтилляционного счетчика (Wallac Trilux, #1450-421). Данные клеточной пролиферации анализировали с помощью GraphPad Prism 5 программного обеспечения с применением модели-кривой нелинейной регрессии (сигмоидальный ответ на дозу, переменная крутизна) и подбором методом наименьших квадратов. Записывали IC50 (или "IC50") параметры и связанные с ними 95% доверительные интервалы.
Фигура 8 показывает кривые клеточной пролиферации от репрезентативных анализов МПК пролиферации, включающих перечень иллюстративных мутантных CTLA-4-Ig слитых белков по изобретению - а именно, D3-IgG2, D3-12-IgG2, D3-17-IgG2, и D3-29-IgG2 слитые белки. Orencia® и LEA29Y-Ig слитые белки были включены в анализы как контроли для сравнения. Показан график зависимости встраивания 3H тимидина (квм) от концентрации белка (нМ). Встраивание 3H тимидина, которое отображает степень клеточной пролиферации, измеряли стандартными методиками. Эти результаты показывают, что в одном аспекте мутантные слитые белки CTLA-4-Ig по изобретению имеют достоверно большую силу, чем Orencia® и/или LEA29Y-Ig белки в ингибировании или подавлении пролиферации Т-клеток памяти in vitro (например, мутантные белки CTLA-4-Ig имеют большую способность, чем Orencia® и/или LEA29Y-Ig белки в ингибировании или подавлении пролиферации Т-клеток памяти in vitro в исследованиях пролиферации человеческих МПК (стимуляция антигенной памяти)).
Этот анализ МПК пролиферации с PPD антигенной стимуляцией проводили на некоторых других мутантных слитых белка CTLA-4-Igx по изобретению. Таблица 8 представляет суммарные данные перечня иллюстративных мутантных слитых белков CTLA-4-Ig по изобретению. Таблица 8 представляет сравнения средних значений IC50 (наномоль (пМ)) для иллюстративных мутантных слитых белков CTLA-4-Ig против референтных контролей (Orencia® и LEA29Y-Ig слитых белков) с применением анализа МПК пролиферации со стимуляцией антигенной памяти. Значения IC50 от отдельных экспериментов усредняли для получения средних значений IC50, которые использовали в статистических анализах. Термин «СО (средний log IC50)» представляет стандартное отклонение от средних значений log IC50.
| Таблица 8 | |||
| Суммарные данные иллюстративных исследований МПК пролиферации с применением PPD антигенной стимуляции | |||
| Слитый белок (димер) | Среднее IC50 (нМ) | Среднее log IC50 (нМ) | СО (среднего log IC50) (нМ) |
| Димер слитого белка Orencia® | 5,92 | 0,67 | 0,37 |
| LEA29Y-Ig | 0,31 | -0,71 | 0,53 |
| D3-IgG2 | 0,03 | -1,49 | НО |
| D3-12-IgG2 | 0,06 | -1,27 | 0,17 |
| D3-14-IgG2 | 0,07 | -1,17 | 0,15 |
| D3-17-IgG2 | 0,07 | -1,24 | 0,25 |
| D3-20-IgG2 | 0,13 | -0,91 | 0,18 |
| D3-27-IgG2 | 0,17 | -0,84 | 0,30 |
| D3-29-IgG2 | 0,07 | -1,16 | 0,18 |
| D3-34-IgG2 | 0,51 | -0,29 | НО |
| D3-50-IgG2 | 0,28 | -0,55 | НО |
| D3-53-IgG2 | 0,05 | -1,29 | НО |
| D3-54-IgG2 | 0,01 | -2,00 | НО |
| D3-56-IgG2 | 0,01 | -1,92 | НО |
| D3-69-IgG2 | 0,01 | -2,00 | НО |
| D3-71-IgG2 | 0,01 | -1,87 | НО |
| D3-75-IgG2 | 0,01 | -2,02 | НО |
| D3-76-IgG2 | 0,01 | -1,89 | НО |
| Примечание: Выражение «НО» в таблице 8 означает "не определен". | |||
Статистические анализы показывают, что все проанализированные мутантные слитые белки CTLA-4-Ig статистически превосходят по силе как Orencia®, так и слитые белки LEA29Y-Ig с p<0,05, что определялось однофазным анализом ANOVA с апостериорными тестами Даннетта и Бенферрони, соответственно, которые обсуждались выше (например, мутантные слитые белки CTLA-4-Ig имеют большую способность, чем Orencia® и/или LEA29Y-Ig слитые белки в ингибировании или подавлении пролиферация Т-клеток памяти in vitro в анализах пролиферации человеческих МПК (стимуляция антигенной памяти)).
Предполагают, что, имея увеличенные способности мутантных слитых белков CTLA-4-Ig по изобретению подавлять или ингибировать пролиферацию Т-клеток памяти (например, человеческих Т-клеток памяти) в in vitro исследованиях по сравнению с Orencia® и/или LEA29Y-Ig слитые белки, такие мутантные белки будут также проявлять увеличенные иммуносупрессорные мощности в in vivo терапевтических и/или профилактических способах или применениях по сравнению с Orencia®, LEA29Y-Ig и/или слитыми белками человеческого CTLA-4-Ig (например, человеческим CTLA-4-IgG2). В одном аспекте мутантные белки CTLA-4-Ig по изобретению, как полагают, имеют большую способность подавлять или ингибировать пролиферацию Т-клеток памяти (например, человеческих Т-клеток памяти) в in vivo способе или применении по сравнению с Orencia®, LEA29Y-Ig и/или слитыми белками человеческого CTLA-4-Ig (например, человеческим CTLA-4-IgG2), в таких как, например, терапевтические и/или профилактические способы для подавления или ингибирования иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы у млекопитающего, такого как, например, человек), способы для подавления или ингибирования отторжения трансплантата ткани или органа от донора реципиенту (например, млекопитающему, такому как, например, человек) и/или другие способы лечения или диагностические способы, описанные в данном описании.
Пример 8
Измерение биологической активности мутантных молекул CTLA-4-Ig с применением исследований СКЛ-реакции (реакции смешанной культуры лимфоцитов).
CTLA-4-Ig и его варианты являются мощными ингибиторами первичных аллоответов in vitro (Vaughan, A. N. et al., J. Immunol. 165:3175-3181 (2000); Wallace P. M., et al. Трансплантация 58:602-610 (1994)). Для измерения улучшенной активности мутантных CTLA-4-Ig белков в таких исследованиях проводили анализ клеточной пролиферации человеческой реакции смешанной культуры лимфоцитов (СКЛ-реакции).
Человеческую кровь (свежесобранную по программе доноров-людей) разводили равным объемом PBS и фракционировали для выделения МПК с применением Histopaque (Sigma, #10771) Фиколл градиента в соответствии с условиями, рекомендованными производителем. МПК от одного донора разводили в RMPI среде (Sigma, #R8758) дополненной 10% ФБС (Hyclone # SV30014,03) и 1х ПСГ (Invitrogen, #10378-016) и добавляли в 96-ячейковые планшеты для культуры (BD Biosciences, #353077) при плотности 1×105 клеток/ячейка. МПК от другого донора облучали при 2500 рад, разводили в той же среде и добавляли в те же планшеты при плотности 1×105 клеток/ячейка. Анализируемые соединения серийно разводили в той же среде и добавляли в ячейки в четырех параллелях. После инкубации при 37°С в течение 5 дн 3H тимидин (GE Healthcare, #TRK758-5MCi) добавляли в концентрации 1 мкСi/ячейка и планшеты инкубировали при 37°С следующие 18 часов. Клетки собирали клеточным коллектором (FilterMate Omnifilter-96 Harvester, Perkin Elmer) с применением условий, рекомендуемых производителем, и измеряли на встраивание 3H тимидина с применением сцинтилляционного счетчика (Wallac Trilux, #1450-421). Данные клеточной пролиферации анализировали GraphPad Prism 5 программой с применением модели-кривой нелинейное регрессии (сигмоидальный ответ на дозу, переменная крутизна) и подбором методом наименьших квадратов. Записывали IC50 параметры и связанные с ними 95% доверительные интервалы.
Фигура 9 показывает кривые клеточной пролиферации от репрезентативных анализов пролиферации СКЛ-реакции, включая иллюстративный мутантный слитый белок CTLA-4-Ig по изобретению: D3- IgG2. Orencia® и LEA29Y-Ig слитые белки были включены как контроли для сравнения. График показывает зависимость встраивания 3H тимидина (квм) от концентрации белка (нМ). Встраивание 3Н тимидина, которое отображает степень клеточной пролиферации, измеряли стандартными методиками. Эти результаты показывают, что D3-IgG2 имеет достоверно большую силу, чем Orencia® и/или LEA29Y-Ig слитые белки в ингибировании или подавлении первичной аллостимуляции Т-клеток in vitro (например, D3-IgG2 имеет большую способность подавлять или ингибировать первичную аллостимуляцию Т-клеточной пролиферации в in vitro анализе СКЛ-реакции, чем Orencia® или LEA29Y-Ig слитые белки).
Это исследование СКЛ-реакции проводили на некоторых других мутантных слитых белках CTLA-4-Igx по изобретению. Таблица 9 обеспечивает суммарные данные для перечня иллюстративных мутантных CTLA-4-Ig слитых белков по изобретению. Таблица 9 представляет сравнения средних значений IC50 (наномоль (нМ)) для иллюстративных мутантных слитых белков CTLA-4-Ig против референтных контролей (Orencia® и LEA29Y-Ig слитых белков) в исследовании СКЛ-реакции. Значения IC50 от двух отдельных экспериментов усредняли, чтобы получить средние значения IC50. Термин «СО (средний log IC50)» представляет стандартное отклонение от средних значений log IC50. Средние значения IC50 от мутантных CTLA-4-Ig слитых белков, представленных в таблице 9, были ниже, чем соответствующие средние значения IC50 Orencia® и LEA29Y-Ig слитых белков.
В одном аспекте изобретение обеспечивает мутантные слитые белки CTLA-4-Ig, которые, как полагают, превосходят по силе Orencia® и/или LEA29Y-Ig слитые белки (например, мутантные слитые белки CTLA-4-Ig, как полагают, имеют большую способность подавлять или ингибировать первичную аллостимуляцию Т-клеточной пролиферации в in vitro исследовании СКЛ-реакции, чем Orencia® и/или LEA29Y-Ig слитые белки).
Предполагают, что на основании предсказанных увеличенных способностей мутантных слитых белков CTLA-4-Ig по изобретению подавлять или ингибировать первичную аллостимуляцию Т-клеток (например, человеческих Т-клеток) в in vitro исследованиях по сравнению с Orencia® и/или LEA29Y-Ig слитыми белками, такие мутантные белки должны также проявлять увеличенные иммуносупрессорные мощности в in vivo терапевтических и/или профилактических способах или сферах применения по сравнению с Orencia® и/или LEA29Y-Ig слитыми белками.
В одном аспекте мутантные слитые белки CTLA-4-Ig по изобретению имеют значительно большую силу, чем Orencia®, LEA29Y-Ig и/или человеческий CTLA-4-Ig (например, человеческий CTLA-4-IgG2) слитые белки в ингибировании или подавлении первичной аллостимуляции Т-клеток in vitro (например, мутантные слитые белки CTLA-4- Ig имеют большую способность подавлять или ингибировать первичную аллостимуляцию Т-клеточной пролиферации в in vitro исследовании СКЛ-реакции, чем Orencia®, LEA29Y-Ig и/или человеческий CTLA-4-Ig) слитые белки. В одном аспекте мутантный CTLA-4-Ig по изобретению, как полагают, имеет большую способность подавлять или ингибировать первичную аллостимуляцию Т-клеток (например, человеческих Т-клеток) в in vivo способе или применении по сравнению с Orencia®, LEA29Y-Ig и/или слитыми белками человеческого CTLA-4-Ig, в таких как, например, терапевтические и/или профилактические способы для подавления или ингибирования иммунного ответа у субъекта (например, в in vivo лечении заболеваний или нарушений иммунной системы у млекопитающего, такого как, например, человек), способы для подавления или ингибирования отторжения трансплантата ткани или органа от донора реципиенту (например, млекопитающему, такому как, например, человек) и/или другие способы лечения или диагностические способы, описанные в данном описании.
| Таблица 9 | |||
| Суммарные данные иллюстративных исследований СКЛ-реакции | |||
| Слитый белок (димер) | Среднее IC50 (нМ) | Среднее log IC50 (нМ) | СО (среднего log IC50) (нМ) |
| Димер слитого белка Orencia® | 12,53 | 1,05 | 0,23 |
| LEA29Y-Ig | 0,92 | -0,19 | 0,48 |
| D3-IgG2 | 0,06 | -1,26 | НО |
| D3-12-IgG2 | 0,09 | -1,11 | 0,34 |
| D3-14-IgG2 | 0,08 | -1,20 | 0,43 |
| D3-17-IgG2 | 0,09 | -1,15 | 0,43 |
| D3-20-IgG2 | 0,14 | -1,11 | 0,64 |
| D3-27-IgG2 | 0,13 | -1,29 | 0,86 |
| D3-29-IgG2 | 0,11 | -1,14 | 0,54 |
| D3-34-IgG2 | 0,10 | -1,09 | 0,39 |
| D3-53-IgG2 | 0,02 | -1,64 | 0,11 |
| D3-54-IgG2 | 0,07 | -1,13 | НО |
| D3-56-IgG2 | 0,06 | -1,23 | НО |
| D3-69-IgG2 | 0,04 | -1,41 | НО |
| D3-71-IgG2 | 0,05 | -1,32 | НО |
| D3-75-IgG2 | 0,08 | -1,11 | НО |
| D3-76-IgG2 | 0,08 | -1,11 | НО |
| Примечание: Выражение "НО" в таблице 9 означает "не определен". | |||
Пример 9
Пациент - взрослый человек, страдающий от ревматоидного артрита, может получить лечение растворимым мутантным слитым белком CTLA-4-Ig следующим образом. Готовят фармацевтическую композицию, включающую растворимый мутантный слитый белок CTLA-4-Ig по изобретению и фармацевтически приемлемый наполнитель или носитель (например, PBS). Иллюстративный растворимый мутантный слитый белок CTLA-4-Ig включает два идентичных мономерных мутантных слитых белка CTLA-4-Ig, соединенных вместе одной или несколькими дисульфидными связями, где каждый такой мономерный слитый белок включает мутантный полипептид CTLA-4 ВКД по изобретению, включающий аминокислотную последовательность, выбранную из любой SEQ ID NOS:1-73, слитый на его С-конце с N-концом человеческого IgG2 Fc полипептида. Иллюстративные слитые белки включают те, что включают аминокислотные последовательности, приведенные в любой SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Такие слитые белки типично экспрессируются в димерной форме. Концентрация слитого белка в фармацевтической композиции может быть в диапазоне от около 0,05 мг/мл до около 200 мг/мл, от около 1 мг/мл до около 150 мг/мл, от около 25 мг/мл до около 120 мг/мл, от около 1 мг/мл до около 100 мг/мл, от около 25 мг/мл до около 100 мг/мл, от около 50 мг/мл до около 100 мг/мл, от около 50 мг/мл до около 75 мг/мл, от около 100 мг/мл до около 150 мг/мл и подобное. Например, концентрация слитого белка в фармацевтической композиции может быть около 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл или 200 мг/мл. рН такой фармацевтической композиции составляет около рН 4 до около рН 10, включая около рН 5 до около рН 9, около рН 6,5 до около рН 8,5, преимущественно около рН 6,0 до рН 8,0, около 6,5 до рН 7,5 или около рН 7,0 до около рН 8,0.
Лечение ревматоидного артрита пациента проводят введением терапевтически эффективного количества мутантного CTLA-4-Ig пациенту (например, эффективную дозу) внутривенной или подкожной инъекцией. Местом инъекции может быть, например, рука пациента, торс или нога. Вводимая эффективная доза мутантного слитого белка CTLA-4-Ig типично, но не ограничиваясь следующим, составляет, например, от около 0,01 мг/кг до около 100 мг/кг веса тела взрослого человека-пациента, такая как, например, от около 0,01-5,0 мг/кг, около 0,01-3,0 мг/кг, около 0,05-2,5 мг/кг, около 0,1-2,0 мг/кг, около 0,1-1,0 мг/кг, около 0,01-0,05 мг/кг, около 0,5-1,5 мг/кг, около 1,0-4,0 мг/кг, около 1,0-3,0 мг/кг, около 1,0-2,0 мг/кг, включая, но не ограничиваясь следующим, около 0,01 мг/кг, 0,05 мг/кг, 0,075 мг/кг, 0,1 мг/кг, 0,15 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг, 1,25 мг/мл, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг или 100 мг/кг веса тела пациента водят пациенту. Альтернативно, могут быть использованы эффективное количество, или доза, или диапазон доз, описанные в разделе "Способы по изобретению" выше. Доза слитого белка, подлежащая введению, определяется на основании силы слитого белка и/или тяжести симптомов или признаков ревматоидного артрита у пациента. Общее количество мутантного слитого белка CTLA-4-Ig, вводимое пациенту, может составлять, например, от около 0,01 мг до около 100 мг, обычно от около 1 мг до 100 мг, от около 10 мг до 100 мг, от около 10 мг до около 75 мг или от около 10 до около 50 мг. Объем фармацевтической композиции, вводимый пациенту, определяется на основании концентрации слитого белка в композиции и дозы слитого белка, подлежащей введению. Для подкожной инъекции один-два миллилитра фармацевтической композиции, включающей слитый белок, обычно вводят за инъекцию. Для внутривенной инъекции может быть введен приемлемый объем фармацевтической композиции, включающей слитый белок.
Вслед за инъекцией начальной дозы пациенту может быть введена вторая идентичная доза слитого белка подкожно (например, п/к инъекцией) или внутривенно (например, в/в инъекцией) через, например, 1, 2, 3 или 4 недели после начальной дозы. График дозировки может быть следующим: одна доза каждые две недели, одна доза в месяц, одна доза каждые два месяца и т.п. в зависимости от, например, состояния пациента. Последующие дозы могут быть введены каждые четыре недели или более или менее часто, при необходимости. Частота дозировки может изменяться в зависимости от состояния пациента и может зависеть от тяжести симптомов или признаков ревматоидного артрита пациента.
В иллюстративном аспекте количество фармацевтической композиции, включающей мутантный димер слитого белка CTLA-4-Ig по изобретению (такой, как D3-29-IgG2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2 и т.п.) и фармацевтически приемлемый наполнитель, достаточная, чтобы обеспечить дозу димера слитого белка около 0,5 мг/кг веса тела, вводят с помощью подкожной инъекции человеку, страдающему от ревматоидного артрита один раз в неделю или один раз в месяц, при необходимости, в зависимости от состояния пациента и ответа на лекарство.
В другом иллюстративном аспекте количество фармацевтической композиции, включающей димер слитого белка CTLA-4-Ig по изобретению (такой, как D3-29-IgG2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2 и т.п.) и фармацевтически приемлемый наполнитель, достаточный, чтобы обеспечить дозу димера слитого белка около 10 мг/кг, вводят внутривенно человеку, страдающему от ревматоидного артрита, один раз в неделю или один раз в месяц, при необходимости, в зависимости от состояния пациента и ответа на лекарственный препарат. Стандартные в/в процедуры могут быть использованы для такого введения. Например, фармацевтическая композиция может быть инфузирована в организм человека с другой жидкостью, такой как стерильный солевой раствор, раствор декстрозы или другой изотонический раствор, с применением стандартных длительных внутривенных капельных введений посредством стандартного внутривенного устройства доступа.
Предполагается, что каждый вышеописанный способ лечения путем п/к или в/в инъекции снижает или облегчает один или несколько признаков, симптомов или биологических ответов, связанных с ревматоидным артритом, такие как, например, воспаление, болезненность сустава, опухание сустава, боль, атрофия ткани и тугоподвижность у пациента. Такое лечение может снижать также развитие заболевания у пациента, в частности, в соединительной, мышечной и костной тканях. Например, такое лечение может снижать развитие повреждения или деградацию соединительной ткани, атрофию мышечной ткани, кости, суставов, хряща и/или позвоночного столба и подобного у пациента. Дополнительные клинические симптомы заболевания, включая повреждение кожи, центральной нервной системы или органов, могут также уменьшаться или облегчаться. Такое лечение может также улучшать физическое функционирование пациента.
Пример 10
Пациент - взрослый человек, получающий поддерживающую терапию для предотвращения отторжения трансплантата органа, может получать лечение растворимым мутантным слитым белком CTLA-4-Ig следующим образом. Готовят фармацевтическую композицию, включающую растворимый мутантный слитый белок CTLA-4-Ig по изобретению и фармацевтически приемлемый наполнитель или носитель (например, PBS или подобное). Иллюстративный растворимый мутантный слитый белок CTLA-4-Ig включает два идентичных мономерных мутантных слитых белка CTLA-4-Ig, соединенных вместе одной или несколькими дисульфидными связями, где каждый такой мономерный слитый белок включает мутантный полипептид CTLA-4 ВКД по изобретению, включающий аминокислотную последовательность, выбранную из любой SEQ ID NOS:1-73, слитый на его С-конце с N-концом человеческого IgG2 Fc полипептида. Иллюстративные слитые белки включают те, которые включают аминокислотные последовательности, приведенные в любой SEQ ID NOS:74-79, 197-200, 205-214 и 219-222. Концентрация слитого белка в фармацевтической композиции может быть в диапазоне от около 0,05 мг/мл до около 200 мг/мл, от около 1 мг/мл до около 150 мг/мл, от около 25 мг/мл до около 120 мг/мл, от около 1 мг/мл до около 100 мг/мл, от около 25 мг/мл до около 100 мг/мл, от около 50 мг/мл до около 100 мг/мл, от около 50 мг/мл до около 75 мг/мл, от около 100 мг/мл до около 150 мг/мл и подобное. Например, концентрация слитого белка в фармацевтической композиции может быть около 1 мг/мл, 5 мг/мл, 10 мг/мл, 15 мг/мл, 25 мг/мл, 30 мг/мл, 40 мг/мл, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 150 мг/мл или 200 мг/мл. рН такой фармацевтической композиции составляет около рН 4 до около рН 10, включая около рН 5 до около рН 9, около рН 6,5 до около рН 8,5, около рН 6,0 до рН 8,0, около 6,5 до рН 7,5 или около рН 7,0 до около рН 8,0
Поддерживающую терапию для предотвращения или подавления отторжения трансплантата органа проводят путем введения терапевтически эффективного количества мутантного CTLA-4-Ig пациенту (например, эффективной дозы), который получил трансплантат органа (например, трансплантат почки) путем внутривенной или подкожной инъекции. Местом инъекции может быть, например, рука пациента, торс или нога. Эффективную дозу мутантного слитого белка CTLA-4-Ig для введения, которая обычно составляет, но не ограничивается следующим, например, от около 0,01 мг/кг до около 100 мг/кг веса тела взрослого человека-пациента, такая как, например, от около 0,01-5,0 мг/кг, около 0,01-3,0 мг/кг, около 0,05-2,5 мг/кг, около 0,1-2,0 мг/кг, около 0,1-1,0 мг/кг, около 0,01-0,05 мг/кг, около 0,5-1,5 мг/кг, около 1,0-4,0 мг/кг, около 1,0-3,0 мг/кг, около 1,0-2,0 мг/кг, включая, но не ограничиваясь следующим, около 0,01 мг/кг, 0,05 мг/кг, 0,075 мг/кг, 0,1 мг/кг, 0,15 мг/кг, 0,2 мг/кг, 0,25 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 0,75 мг/кг, 1 мг/кг, 1,25 мг/мл, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 4 мг/кг, 5 мг/кг, 10 мг/кг, 20 мг/кг, 25 мг/кг, 50 мг/кг, 75 мг/кг, или 100 мг/кг веса тела пациента, вводят пациенту. Альтернативно, эффективное количество, или доза, или диапазон доз, описанные выше в разделе "Способы по изобретению", могут быть использованы. Доза слитого белка, подлежащая введению, определяется на основании силы слитого белка и/или тяжести симптомов или признаков отторжения трансплантата органа пациента. Общее количество мутантного слитого белка CTLA-4-Ig, вводимого пациенту, может составлять, например, от около 0,01 мг до около 100 мг, обычно от около 1 мг до 100 мг, от около 10 мг до 100 мг, от около 10 мг до около 75 мг, или от около 10 до около 50 мг. Объем фармацевтической композиции, вводимой пациенту, определяется в зависимости от концентрации слитого белка в композиции и дозы слитого белка, подлежащего введению. Слитый белок может быть введен на любой день после трансплантации, например 1, 4, 7, 14, 28, 56, 84 день и т.п. после трансплантации. Для подкожной инъекции обычно вводят один-два миллилитра фармацевтической композиции. Для внутривенной инъекции может быть введен приемлемый объем фармацевтической композиции, включающей слитый белок.
После инъекции начальной дозы пациенту может быть введена вторая идентичная доза слитого белка подкожно или внутривенно через 1, 2, 3 или 4 недели после начальной дозы. График дозировки может быть следующим: одна доза каждые две недели, одна доза каждый месяц, одна доза каждые два месяца и т.п. в зависимости от, например, состояния пациента. Последующие дозы могут быть введены каждые четыре недели или более или менее часто, при необходимости, и продолжаться, при необходимости, на месячной основе. Частота дозирования может изменяться в зависимости от состояния пациента и может зависеть от тяжести симптомов или признаков отторжения трансплантата органа у пациента.
Предполагают, что такое лечение снижает или облегчает один или несколько признаков, симптомов или биологических ответов, связанных с отторжением трансплантата органа, таким как, например, острое отторжение трансплантированного органа, хроническое отторжение трансплантированного органа, снижение функции трансплантированного органа, увеличение уровней креатинина в сыворотке пациента и/или увеличенная инфильтрация Т-клеток в трансплантированный орган. Такое лечение может снижать вероятность отторжения трансплантированного органа со стороны иммунной системы пациента.
Пример 11
Фармакокинетическое исследование мутантных слитых белков CTLA-4-IgG2 у крыс
Концентрация в сыворотке терапевтического агента после наружного введения живому организму сильно влияет на терапевтическую эффективность и определяется фармакокинетической (ФК) оценкой. В следующей процедуре ФК профили оценивали у крыс для репрезентативных мутантных CTLA-4-IgG2 анализируемых продуктах D3-29-IgG2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2 и D3-75-IgG2 в сравнении с обоими анализируемыми продуктами: hCTLA-4-IgG2 и Orencia® слитый белок. Схема эксперимента, а также получение данных и их интерпретация описаны ниже.
Схема эксперимента на живых животных
Сверенных по весу самцов крыс линии Hans Wistar использовали после акклиматизационного периода, который составлял, по меньшей мере, 5 дней. Объемы дозировки анализируемого продукта рассчитывали для отдельных животных на основании их веса, так чтобы все получали 1 мг/кг анализируемого продукта. Типичная 150-граммовая (г) крыса, таким образом, получала 150 мкл дозированного объема, тогда как каждый анализируемый продукт был приготовлен в концентрации 1 мг/мл в PBS. Отдельное введение мутантного тестируемого продукта CTLA-4-IgG2, описанного выше, hCTLA-4IgG2 или слитого белка Orencia® доставляли либо путем внутривенного (в/в или ВВ) болюса, либо подкожным (сокращенно "п/к" или "SC") путем. Объем исследования был достаточным для минимально четырех заборов образцов крови по 300 мкл в каждый момент времени, при этом ограничение объема крови, забираемого от любой данной крысы, составляло не более чем 10% общего объема крови. Динамика забора крови была как перед введением дозы, 5 минут (мин), 30 мин, 2 часов (час), 4 час, 8 час, 1 день (дн.), 2 дн., 3 дн., 4 дн., 6 дн., 8 дн., 10 дн., 12 дн. и 14 дн. перед введением, так и 5 мин, 30 мин, 2 час, 4 час, 8 час, 1 дн., 2 дн., 3 дн., 4 дн., 6 дн., 8 дн., 10 дн., 11 дн., 12 дн., 13 дн., 14 дн. и 15 дн. после введения дозы для в/в и п/к введений соответственно. Сыворотку готовили их индивидуальных образцов крови и анализировали с помощью ELISA для расчета процента введенного анализируемого продукта.
Метод ФК ELISA
Мутантный слитый белок CTLA-4-IgG2, hCTLA-4IgG2 или Orencia®, присутствующие в образцах сыворотки, связывались с человеческим CDSO-мышиным IgG (описанным выше), которым предварительно покрывали микротировальные планшеты. Определение осуществляли добавлением антитела козла против человеческого IgG, конъюгированного с пероксидазой хрена (HRP) (Jackson ImmunoResearch #109-035-098). Количественное определение проводили посредством применения хромогенного HRP субстрата, 3,3',5,5'-тетраметилбензидин (ТМВ), с добавлением перекиси водорода (Kem-En-Тес #4390А), в результате чего реакцию останавливали добавлением 0,2N серной кислоты (H2SO4) и измеряли оптическую абсорбцию при 450 нм на спектрофотометре. Образцы сыворотки предварительно разводили 1/20 до добавления на ELISA планшет, так чтобы матрица была нормализована до 5% крысиной сыворотки, и далее разводили в 5% крысиной сыворотке до восьми разведений в целом. Концентрацию каждого разведенного образца сыворотки количественно определяли против стандартной кривой, полученной с применением титрований того же анализируемого продукта, введенного шприцом в 5% крысиную сыворотку. Стандартную кривую в диапазоне от 10 до 0,078 нг/мл и точный диапазон определяли так, чтобы он был от двукратно превышающего фоновое значение до 5 нг/мл в 5% крысиной сыворотке. Качество стандартной кривой оценивали с помощью контролей качества (КК) того же анализируемого продукта, приготовленных в 5% крысиной сыворотке при высоких, средних и низких концентрациях точного диапазона стандартной кривой. Критерий допустимости КК был для наблюдаемой КК концентрации в пределах 20% предположительной КК концентрации. Концентрацию индивидуального образца сыворотки получали путем усреднения концентраций, обозначенных для разведении с оптическими плотностями (ОП) в пределах точного диапазона стандартной кривой. По меньшей мере, использовали 4 индивидуальных образцов сыворотки для расчета средней концентрации в сыворотке в каждом номинальном моменте времени.
ФК Параметры
Фигуры 15А и 15В показывают ФК профили для слитого белка Orencia®, hCTLA-4-IgG2 и мутантных слитых белков CTLA-4-IgG2, введенных в количестве 1 мг/кг в виде отдельного (А) внутривенного (ВВ) болюса или (В) подкожной (ПК) инъекции крысам. Планки погрешности представляют стандартное отклонение от среднего (СО). Заштрихованная линия показывает нижний предел количественного определения для ELISA (~3 нг/мл для анализируемого продукта в 100% сыворотке). Средняя концентрация в сыворотке в каждом номинальном моменте времени после введения анализируемого продукта во времени 0 час включает данные полу-log профиля концентрация-время на фигуре 15.
Средние концентрации в сыворотке использовали для получения ФК параметров с применением модели WinNonLin 201 (в/в - болюсное введение) или модели 200 (внесосудистое введение) для в/в (ВВ) или s.c. (ПК) путей дозирования соответственно. Таблица 10 приводит итоговые ключевые ФК параметры для п/к и в/в путей введения, соответственно.
| Таблица 10 | ||||||
| Суммарная таблица ФК параметров для слитого белка Orencia®, hCTLA-4- IgG2 и мутантных слитых белков CTLA-4-IgG2, введенных в количестве 1 мг/кг в виде отдельного ВВ или П/К болюса крысам. | ||||||
| Соединение | Путь | Kмакс (мкг/л) | Т1/2 (час) | ППК (час*нг/л) | Кл (мл/час/кг) | Vz (мл/кг). |
| Orencia | ПК | 3,3 | 70,0 | 391 | 2,6 | 258,13 |
| CTLA-4lgG2 | ПК | 5,9 | 45,0 | 838 | 1,2 | 77,49 |
| D3-29 | ПК | 4,6 | 11,2 | 650 | 1,5 | 24,90 |
| D3-54 | ПК | 4,5 | 23,6 | 528 | 1,9 | 64,52 |
| D3-56 | ПК | 7,4 | 23,7 | 1049 | 1,0 | 32,67 |
| D3-69 | ПК | 6,0 | 28,1 | 967 | 1,0 | 41,97 |
| D3-75 | ПК | 9,0 | 56,4 | 1204 | 0,8 | 67,59 |
| Orencia | ВВ | 22,3 | 42,3 | 728 | 1,37 | 83,9 |
| CTLA-4lgG2 | ВВ | 66,2 | 49,8 | 2483 | 0,40 | 29,0 |
| D3-29 | ВВ | 43,0 | 33,0 | 912 | 1,10 | 52,2 |
| D3-54 | ВВ | 20,6 | 39,4 | 1034 | 0,97 | 55,0 |
| D3-56 | ВВ | 34,2 | 15,3 | 1822 | 0,55 | 12,1 |
| D3-69 | ВВ | 81,9 | 83,0 | 2133 | 0,47 | 56,1 |
| D3-75 | ВВ | 30,1 | 65,4 | 2326 | 0,43 | 40,5 |
Kмакс относится к максимальной концентрации в сыворотке анализируемого продукта. Значение терминального времени полужизни (Т 1/2) - это время, взятое в часах, за которое концентрация анализируемого продукта в сыворотке уменьшается на половину в ходе терминальной фазы на профиле концентрация-время. Площадь под кривой концентрация в сыворотке-время (ППК) рассчитывают от нуля до бесконечности с применением правила трапеции. Клиренс (Кл) рассчитывают с применением уравнения доза/ППК, тогда как объем распределения (Vz) терминальной фазы рассчитывают с применением уравнения Кл/k.
Фактор биодоступности (F) для каждого соединения представлен в таблице 11 и определялся путем расчета ППК через подкожный путь/ ППК через внутривенный путь.
| Таблица 11 | |
| Сравнение биодоступности слитого белка Orencia®, hCTLA-4-Ig2, D3-29-IgG2, D3-54-IgG2, D3-56-IgG2, D3-69-IgG2 и D3-75-IgG2 слитых белков | |
| Соединение | Биодоступность |
| Orencia | 0,54 |
| CTLA-4-Ig2 | 0,34 |
| D3-29 | 0,71 |
| D3-54 | 0,51 |
| D3-56 | 0,58 |
| D3-69 | 0,45 |
| D3-75 | 0,52 |
Слитый белок человеческого CTLA-4IgG2 и Orencia® показывали сходные ФК профили, несмотря на их отличия в структуре IgG, допуская, что человеческий IgG2 и мутированные человеческие IgGI Fc части этих соответственных анализируемых продуктов имеют сопоставимую ФК активность, если функциональный домен является постоянным. Можно сделать вывод, что любые изменения, наблюдаемые в ФК профиле для мутантных слитых белков CTLA-4-IgG2 по сравнению со слитым белком Orencia®, будут тем самым вносить свой вклад в различия в функциональном домене и не затрагивать Fc часть.
Для каждого мутантного слитого белка CTLA-4-IgG2, элиминация была медленной, что подтверждается длительными значениями времени полужизни и большой площадью под кривыми. Полужизни лежали в диапазоне от 11,2 до 56,4 часов для ПК дозирования, и от 15,3 до 83,0 часов (час) для ВВ дозирования в сравнении с Orencia® слитым белком, который имел время полужизни 70,0 или 42,3 часов при введении ПК или ВВ путями соответственно. Значения ППК для мутантных слитых белков CTLA-4-IgG2 были в среднем выше таковых для слитого белка Orencia®. После ПК дозирования составляла 879,5+/-281,6 час·кг·нг/л/мг по сравнению с 391 час·кг·нг/л/мг для ПК слитого белка Orencia®, тогда как ВВ введение давало среднюю ППК 1645,5+/-641,1 час·кг·нг/л/мг по сравнению с 728 час·кг·нг/л/мг для ВВ слитого белка Orencia®.
Объем распределения был сходный для обоих путей введения, которыми мутантные слитые белки CTLA-4-IgG2 распределялись за пределами сыворотки, но в пределах внесосудистой жидкости, что подтверждалось средним значением 44,8 мл/кг, которое выше референтного объема плазмы 30 мл/кг, и в пределах референтной границы внеклеточной жидкости 300 мл/кг для стандартной крысы (Davies, В. et al., Pharm. Res. 10(7): 1093-95 (1993)).
Биодоступность была также сходна для большинства мутантных слитых белков CTLA-4-IgG2, со средним значением 0,6+/-0,1, которое сравнимо благоприятно с 0,53 биодоступностью слитого белка Orencia®.
В итоге Kмакс была в общем выше для мутантных CTLA-4-IgG2 слитых белков по сравнению со слитым белком Orencia®. Значения Kмакс находились в диапазоне от 4,5 до 9,3 мкг/л для ПК дозирования и от 20,6 до 81,9 мкг/л для ВВ дозирования в сравнении со слитым белком Orencia®, который имел Kмакс 3,3 или 22,3 мкг/л при введении ПК или ВВ путями соответственно.
В целом, ФК данные показывали, что все анализируемые мутантные CTLA-4-IgG2 слитые белки обычно имели ФК профиль не ниже, чем слитый белок Orencia® при введении крысам в количестве 1 мг/кг ПК или ВВ путями, и что IgG1 или IgG2 Fc части были сопоставимы, когда функциональный домен был постоянным.
Пример 12
Этот пример описывает способ создания стабильной трансфектированной клеточной линии для экспрессирования мутантных слитых белков CTLA4-Ig по изобретению с применением клеточной линии для рутинного лабораторного масштаба продукции мутантного слитого белка CTLA4-Ig и очищения мутантных CTLA-4-Ig слитых белков от сред клеточной экспрессии. Хотя этот пример специфически описывает способ создания стабильной трансфектированной клеточной линии СНО-K1 для экспрессирования D3-54-IgG2 слитого белка, применение такой клетки для лабораторного масштаба продукции и очищение белка от сред, способы, описанные здесь, могут быть использованы с любым мутантным слитым белком CTLA-4-Ig по изобретению и/или любой приемлемой клеточной линией, описанной выше.
Создание стабильной трансфектированной клеточной линии
Материалы
СНО-K1 нативные (нетрансфектированные) клетки: СНО-K1 клетки, адаптированные к бессывороточной суспензии, выращенные в химически определенной среде (Cell ID: M4-PeM-0436-l 12-01), сохраняли в паровой фазе жидкого азота (Dewar MVE1536P). Один сосуд M4-PeM-0436-112-01 отстаивали и культивировали со CD OptiCHO™ средой (Invitrogen, #12681) во встряхиваемых колбах. Культуры обеспечивали клетками для трансфекции и кондиционированной средой для роста и клонирования. Все культуры выращивали при 37°С, 5% CO2.
Плазмида: ДНК, кодирующая D3-54 мутантный CTLA-4 ВКД, слитый с Fc областью человеческого IgG2a, встраивали в CET1019AS UCOE вектор (Millipore) и полученную плазмиду CET1019AS-D3-54-IgG2 использовали для всех трансфекций.
Среда клеточной культуры: CD Opti-CHO (Invitrogen #12681) химически определенная среда, лишенная животного компонента, дополненная 2% объем/объем 200 мМ L-глутамина (Invitrogen #25031), использовалась для всех культур.
Кондиционированная среда: Кондиционированную среду получали путем культивирования родительской СНО-K1 клеточной линии в CD Opti-CHO среде. При количестве клеток >5×105 клеток/мл клеточную культуру центрифугировали и супернатант кондиционированной среды фильтровали в стерильных условиях.
Кондиционированную среду готовили свежей каждый день для применения или сохраняли при 2-8°С до 7 дней. 50% кондиционированная среда: Кондиционированную среду (смотри выше) комбинировали с равным объемом свежей клеточной среды; готовили свежую каждый день для использования.
Аналитические методы
Подсчет клеток и определение жизнеспособности проводили на Cedex или Cedex HiRes клеточном счетчике (Innovatis).
Начальный скрининг клонов, экспрессирующих мутантный слитый белок CTLA-4-Ig (D3-54-IgG2) для продукции, проводили с помощью ELISA. ELISA планшеты покрывали hCD80-мышиным Ig слитым белком в течение ночи. На следующий день образцы, подлежащие анализу, переносили на ELISA планшеты при 50- и 200-кратном разведении в двух параллелях. После двух часов инкубации добавляли античеловеческое IgG-HRP антитело и инкубировали в течение 30 минут. Планшеты обрабатывали ТМВ и анализировали при 450 нм. Записывали исходные данные оптических плотностей (ОП).
Количественное определение концентрации слитого белка D3-54-IgG2 проводили способом белковой ВЭЖХ с применением Poros А/20 колонки (ABI # 1-5024-12). Использовали два буфера: Буфер А: 50 мМ фосфорная кислота, 150 мМ хлорид калия, рН 7,6±0,1 и Буфер В: 50 мМ фосфорная кислота, 150 мМ хлорид калия, рН 2,5±0,1. Оба буфера дополнительно содержали добавленный 5% изопропанол. Эквилиборацию и отмывку после инъекции образца проводили с 42% Буфера А и 58% Буфера В (рН 6,5). Элюция была линейным градиентом 12% Буфера А и 88% Буфера B в течение 1 минуты.
Процедура
Нативные прикрепленные СНО-K1 клетки, используемые для создания стабильных клеточных линий, использованных в GMP продукции D3-54-IgG2 слитого белка, адаптировали для роста суспензии в химически определенной CD OptiCHO™ среде. Сосуд с этими нативными СНО-K1 клетками отстаивали и выращивали в 125 мл во встряхиваемых колбах, содержащих CD OptiCHO™ среду до плотности 5×105 жизнеспособных клеток/мл. 2×106 жизнеспособных клетки ресуспендировали в 400 мкл 50% кондиционированной среды и соединяли с 20 мкг плазмидной ДНК (D3-54-IgG2 в CET1019AS UCEO векторе) в кювете. Электропорацию проводили с генным импульсным генератором Xcell (BioRad) при 320 Вольт (В) с длиной прямоугольного импульса 15 миллисекунд (PC). Проводили дублированные трансфекции и затем объединяли клетки. Объединенные клетки переносили в Т-25 колбу, содержащую 5 мл 50% кондиционированную среду и инкубировали два дня.
Трансфектированные клетки либо непосредственно распределяли в 96-ячейковые планшеты для клонирования либо культивировали с подбором антибиотиков, пока не получали стабильный пул, и затем распределяли в 96-ячейковые планшеты. Через два дня после электропорации культуры разводили до 1250 клеток/мл в кондиционированной среде, содержащей 8 мкг/мл пуромицина для давления отбора. Клетки распределяли в 96-ячейковые планшеты в количестве 200 мкл на ячейку (250 клеток/ячейка). Планшеты инкубировали в течение приблизительно 10 дней, чтобы убить нетрансфектированные и временно-трансфектированные клетки. Через 10-12 дней каждую ячейку на каждом планшете визуально обследовали, чтобы выявить ячейки с отдельными колониями. Эти ячейки позднее обследовали заново, чтобы подтвердить наличие в них отдельных здоровых колоний, приемлемых для переноса в 24-ячейковые планшеты.
Через два дня после электропорации культуру центрифугировали и ресуспендировали в 50% кондиционированной среде, содержащей 7 мкг/мл пуромицина для давления отбора. Контрольную колбу также инокулировали нетрансфектированными клетками в той же среде. Основываясь на непрерывных исследованиях оптимизации, концентрацию пуромицина увеличивали до 8 мкг/мл через 3 дней. Стабильный пул образовывался через 10-12 дней после отбора, когда все клетки в контрольной колбе погибали. Продукт экспрессии в стабильном пуле подтверждали с помощью белковой ВЭЖХ и подтверждали, что жизнеспособность культуры составляла >95%. Клетки серийно разводили в кондиционированной среде без пуромицина до конечной концентрации 3,8 клеток/мл. Клетки сеяли в 96-ячейковые планшеты в количестве 200 мкл на ячейку (75 клеток/планшет или 0,8 клеток/ячейка).
Через один день каждая ячейка в каждом планшете была визуально обследована для выявления ячеек с отдельными клетками или колониями. На следующий день ячейки с отдельными колониями из 2-4 клеток отбирали. Любые ячейки с более чем двумя колониями удаляли. Второй оператор подтверждал отборы. Ячейки были позднее заново обследованы для подтверждения того, что они содержат отдельные здоровые колонии, приемлемые для переноса в 24-ячейковые планшеты.
Клоны из 96-ячейковых планшетов переносили на 24-ячейковые планшеты, содержащие 1 мл кондиционированной среды на ячейку с 8 мкг/мл пуромицина. Внутреннее содержимое выбранных ячеек из 96-ячейковых планшетов с отдельными колониями переносили в индивидуальные ячейки в 24-ячейковые планшеты. 200 мкл отбирали из каждой новой ячейки в 24-ячейковом планшете для отмывки соответствующей ячейки в 96-ячейковом планшете и переносили обратно. Для резервной копии 200 мкл кондиционированной среды, содержащей 8 мкг/мл пуромицина, добавляли обратно в каждую ячейку в 96-ячейковых планшетах.
Через 1-3 дня отбирали образец из каждой ячейки в 24-ячейковых планшетах и анализировали на D3-54-IgG2 экспрессию с помощью ELISA. Клоны для дальнейшего использования были выбраны на основании исходных значений ОП ELISA, а также демонстрации приемлемого роста.
Верхние 35-40 клонов, на основе результатов ELISA и наблюдаемого роста переносили в Т-25 колбы, содержащие 5 мл кондиционированной среды с 8 мкг/мл пуромицина. Внутренне содержимое каждой из выбранных ячеек из 24-ячейковых планшетов переносили в индивидуальные Т-25 колбы. Оставшиеся клетки в ячейках отмывали той же средой и добавляли в соответствующую Т-25 колбу. Для резервной копии 1 мл кондиционированной среды, содержащей 8 мкг/мл пуромицина, добавляли обратно в каждую ячейку в 24-ячейковых планшетах.
Количество клонов далее уменьшали, отбирая клоны с наивысшей продуктивностью. Клетки ресуспендировали в свежей среде при концентрации 1-2×105 жизнеспособных клеток/мл и сеяли в Т25 колбы (5 мл культуры) или 125 мл встряхиваемые колбы (12 мл культуры). Культуры инкубировали в течение 22-24 часов и затем определяли конечную плотность клеток и жизнеспособность и отбирали образцы для определения концентрации продукта путем белковой ВЭЖХ. Продуктивность рассчитывали делением общего количества белка, произведенного общим числом жизнеспособных клеток в колбе, срок действия культуры. Единицы были переведены в пиктограммы на клетку на день или "пкд". Клоны упорядочили согласно их значениям пкд, однако клоны, которые не проявляли значительного роста, были опущены. Верхние клоны перенесли в 125 мл встряхиваемые колбы для криоконсервации и дальнейшего исследования роста и продуктивности.
Клоны, подлежащие дальнейшему анализу, сеяли в 250 мл встряхиваемые колбы в количестве 1×105 жизнеспособных клеток/мл в 50 мл свежей среды. Когда плотность клеток достигала 1×106 жизнеспособных клеток/мл, культуры переносили в новую встряхиваемую колбу, снова при 1×105 жизнеспособных клеток/мл в 50 мл свежей среды. Перенос повторяли еще один раз. В ходе этого третьего переноса каждый день отбирали образцы культуры для определения количества клеток, жизнеспособности и концентрации продукта с помощью белковой ВЭЖХ.
Верхние клоны, экспрессирующие D3-54-IgG2 слитый белок, на основании скоростей роста и специфической продукции отбирали для субклонирования. Субклонирование проводили ограниченным разведением, как описано в разделе выше, для стабильных пулов, за исключением того, что пуромицин не использовали на каком-либо промежутке времени. Распределение, скрининг и оценку субклонов проводили так же, как описано выше.
Выбранные субклоны повторно переносили во встряхиваемые колбы на приблизительно 90 дней для оценки стабильности продукции. При каждом пассаже клетки сеяли в 125 мл встряхиваемые колбы в количестве 1×105 жизнеспособных клеток/мл в 25 мл свежей среды. Культуры переносили каждые 3-4 дней. Перед каждым пассажем измеряли плотность клеток и жизнеспособность и отбирали образцы для определения концентрации продукта белковой ВЭЖХ.
Выбранные клоны и субклоны криоконсервировали от времени упорядочивания по значениям пкд до различных точек в измерении стабильности. Готовили свежую среду замораживания с 90% ростовой среды и 10% ДМСО (диметилсульфоксид) (Sigma). Клетки из культур во встряхиваемой колбе центрифугировали и ресуспендировали в среде замораживания при плотностях в диапазоне 2-10×106 клеток/мл. Клеточную суспензию в 1 мл аликвотах переносили в криогенные сосуды. Криогенные сосуды помещали в изопропаноловые контейнеры для замораживания и сохраняли при -80°С в течение ночи. Замороженные сосуды, перенесенные в паровую фазу жидкого азота, сохраняли в течение следующего дня.
Получение мутантных слитых белков CTLA4-IgG2.
Криососуд, содержащий 1 мл объема СНО-K1 клеток, экспрессирующих D3-54-IgG2 слитый белок, оттаивали и выращивали в 125 мл встряхиваемых колбах, содержащих CD OptiCHO™ среды, при 37°С и 5% CO2 до плотности 5×105 жизнеспособных клеток/мл. Некоторые колбы комбинировали с колебательной емкостью для инокуляции в количестве 1-2×105 клеток/мл в 5 или 10 л объема CD OptiCHO™ среды с 4 мМ глутамина. Культуры из колебательной емкости содержали в инкубаторе при 37°C с добавлением 5% CO2 на устройстве качающейся платформы с 18-22 об/мин и углом 8 градусов для оборудования, закупленного в Sartorius Stedim Biotech. Каждый день отбирали образцы культуры для анализа количества клеток, жизнеспособности, уровня питательных веществ, метаболического профиля и уровня экспрессии мутантного CTLA4-IgG2 (а именно, D3-54-IgG2) с применением белковой ВЭЖХ. Культуру собирали, когда жизнеспособность снижалась до ~50%, обычно через 9-11 дней после инокуляции. Материал клеточной культуры очищали фильтрацией с применением комбинации глубокой фильтрации и стерильной фильтрации и либо использовали немедленно для дальнейшей обработки, либо сохраняли при 2-8°С.
Очищение мутантных слитых белков CTLA-4-IgG2
Мутантные слитые белки CTLA4-IgG2 (D3-54-IgG2) очищали белок-аффинной хроматографией с применением АКТА Explorer ВЭЖХ системы (GE Healthcare). Мутантный слитый белок CTLA-4-Ig (D3-54-IgG2) связывали с MabSelect Protein FF колонкой (GE Healthcare, #17-5079-01) в PBS буфере (Invitrogen), загружали в концентрации ~10 мг/мл среды хроматографии, отмывали тем же буфером, элюировали 100 мМ лимоннокислым буфером (рН 4,0) и затем нейтрализовали добавлением 1/10 объема 2М Трис-основания. Белковый очищенный образец дальше обрабатывали диафильтрацией с применением системы фильтрования тангенциальным потоком (TFF) с буфером, замененным на 20 мМ Трис-Cl, рН 7,5.
Белковый образец с замененным буфером далее очищали анионообменной хроматографией на Q-Sepharose колонке, загруженной в концентрации ~10 мг/мл плотности загрузки. Связанный белок элюировали с применением 20 объема колонки (ОК) линейного NaCl градиента 0-500 мМ NaCl в 20 мМ Трис-Cl, рН 7,5. Основные пиковые фракции собирали и определяли концентрацию путем измерения абсорбции при 280 нм.
Чистоту белка подтверждали SDS-PAGE анализом и содержание мономера определяли с применением гель-ВЭЖХ способа. Образцы сохраняли в аликвотах при 2-8°С или при -20°С в течение длительных периодов времени до использования.
Так как вышеизложенное изобретение было описано в некоторых деталях с целью разъяснения и понимания, то специалисту в данной области должно быть понятно из прочитанного данного описания, что различные изменения по форме и в деталях могут быть сделаны без ограничения действительного объема изобретения. Понятно, что материалы, примеры и варианты осуществления изобретения, описанные здесь, приведены лишь с иллюстративными целями и не подразумевают ограничения и что различные модификации или изменения в этом свете должны подразумеваться специалистами в данной области техники и являются включенными в смысл и область данной заявки, а также объем изобретения, заявленный в формуле изобретения. Все публикации, патентные заявки, патенты или другие документу, упоминаемые здесь, включены с помощью ссылок в их полноте для любых целей в том же объеме, как если бы каждая такая отдельная публикация, патент, патентная заявка или другой документ отдельно специфически был определен путем включения ссылки в данное описание во всей ее полноте для любых целей и был приведен в своей полноте в данном описании. В случае конфликта данное описание изобретения, включая определения, будет контролироваться.
Claims (19)
1. Рекомбинантный димер слитого белка, включающий два мономерных слитых белка, связанных посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном слитом белке, причем каждый мономерный слитый белок включает (а) полипептид, имеющий полипептидную последовательность, представленную в SEQ ID NO: 36, и (b) Ig Fc полипептид, где C-конец полипептида ковалентно связан напрямую или ненапрямую через линкер с N-концом полипептида Ig Fc и где димер слитого белка связывает человеческий CD80 или человеческий CD86 или внеклеточный домен любого из них и имеет большую способность подавлять иммунный ответ, чем димер слитого белка LEA29Y-Ig, где димер слитого белка LEA29Y-Ig включает два мономерных слитых белка LEA29Y-Ig, каждый из которых включает аминокислотную последовательность SEQ ID NO: 166, где рекомбинантный димер слитого белка предназначен для ингибирования или подавления иммунного ответа у млекопитающего.
2. Димер слитого белка по п.1, в котором полипептид IgFc является полипептидом IgG2 Fc.
3. Димер слитого белка по п.1, в котором каждый мономерный слитый белок содержит полипептидную последовательность, показанную в SEQ ID NO: 197 или 211.
4. Рекомбинантный димер слитого белка, включающий два мономерных слитых белка, связанных посредством, по меньшей мере, одной дисульфидной связи, сформированной между двумя остатками цистеина, присутствующими в каждом мономерном мутантном слитом белке, причем каждый мономерный слитый белок включает (а) полипептид, имеющий полипептидную последовательность, представленную в SEQ ID NO: 50, и (b) Ig Fc полипептид, где C-конец полипептида ковалентно связан напрямую или ненапрямую через линкер с N-концом полипептида Ig Fc и где димер слитого белка связывает человеческий CD80 или человеческий CD86 или внеклеточный домен любого из них и имеет большую способность подавлять иммунный ответ, чем димер слитого белка LEA29Y-Ig, где димер слитого белка LEA29Y-Ig включает два мономерных слитых белка LEA29Y-Ig, каждый из которых включает аминокислотную последовательность SEQ ID NO: 166, где рекомбинантный димер слитого белка предназначен для ингибирования или подавления иммунного ответа у млекопитающего.
5. Димер слитого белка по п.4, в котором полипептид IgFc является полипептидом IgG2 Fc.
6. Димер слитого белка по п.4, в котором каждый мономерный слитый белок содержит полипептидную последовательность, представленную в SEQ ID NO: 199 или 213.
7. Димер слитого белка по п.1, который имеет равновесную константу диссоциации CD86 (KD), которая меньше, чем равновесная константа диссоциации CD86 (KD) димера слитого белка LEA29Y-Ig, причем димер слитого белка LEA29Y-Ig включает два мономерных слитых белка LEA29Y-Ig, каждый из которых включает аминокислотную последовательность SEQ ID NO: 166.
8. Рекомбинантная нуклеиновая кислота, которая кодирует мономерный слитый белок димера слитого белка по любому из пп.1-3.
9. Рекомбинантная нуклеиновая кислота, которая кодирует мономерный слитый белок димера слитого белка по любому из пп.4-6.
10. Экспрессирующий вектор, включающий нуклеиновую кислоту по п.8.
11. Экспрессирующий вектор, включающий нуклеиновую кислоту по п.9.
12. Рекомбинантная клетка-хозяин для получения димера слитого белка по любому из пп. 1-3, включающая:
(а) нуклеиновую кислоту по п.8 и/или
(b) вектор по п.10.
(а) нуклеиновую кислоту по п.8 и/или
(b) вектор по п.10.
13. Рекомбинантная клетка-хозяин для получения димера слитого белка по любому из пп.4-6, включающая:
(а) нуклеиновую кислоту по п.9 и/или
(b) вектор по п. 11.
(а) нуклеиновую кислоту по п.9 и/или
(b) вектор по п. 11.
14. Фармацевтическая композиция, включающая фармацевтически приемлемый наполнитель или фармацевтически приемлемый носитель и димер слитого белка по любому из пп.1-3, где фармацевтическая композиция предназначена для ингибирования или подавления иммунного ответа у млекопитающего.
15. Фармацевтическая композиция, включающая фармацевтически приемлемый наполнитель или фармацевтически приемлемый носитель и димер слитого белка по любому из пп.4-6, где фармацевтическая композиция предназначена для ингибирования или подавления иммунного ответа у млекопитающего.
16. Применение димера слитого белка по любому из пп.1-3 при изготовлении лекарственного средства для:
(i) ингибирования или подавления иммунного ответа у млекопитающего;
(ii) лечения заболевания или расстройства иммунной системы или
(iii) лечения отторжения трансплантата органа или ткани у млекопитающего.
(i) ингибирования или подавления иммунного ответа у млекопитающего;
(ii) лечения заболевания или расстройства иммунной системы или
(iii) лечения отторжения трансплантата органа или ткани у млекопитающего.
17. Применение димера слитого белка по любому из пп.4-6 при изготовлении лекарственного средства для:
(i) ингибирования или подавления иммунного ответа у млекопитающего;
(ii) лечения заболевания или расстройства иммунной системы или
(iii) лечения отторжения трансплантата органа или ткани у млекопитающего.
(i) ингибирования или подавления иммунного ответа у млекопитающего;
(ii) лечения заболевания или расстройства иммунной системы или
(iii) лечения отторжения трансплантата органа или ткани у млекопитающего.
18. Способ получения димера слитого белка по любому из пп.1-3, включающий культивирование клетки-хозяина по п. 12 в культуральной среде и выделение димера слитого белка из клетки-хозяина, среды клетки-хозяина или периплазмы клетки-хозяина.
19. Способ получения димера слитого белка по любому из пп.4-6, включающий культивирование клетки-хозяина по п.13 в культуральной среде и выделение димера слитого белка из клетки-хозяина, среды клетки-хозяина или периплазмы клетки-хозяина.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US98463107P | 2007-11-01 | 2007-11-01 | |
| US60/984,631 | 2007-11-01 | ||
| US5121508P | 2008-05-07 | 2008-05-07 | |
| US61/051,215 | 2008-05-07 | ||
| PCT/US2008/079981 WO2009058564A2 (en) | 2007-11-01 | 2008-10-15 | Immunosuppressive polypeptides and nucleic acids |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010122053A RU2010122053A (ru) | 2011-12-10 |
| RU2506275C2 true RU2506275C2 (ru) | 2014-02-10 |
Family
ID=40124836
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010122053/10A RU2506275C2 (ru) | 2007-11-01 | 2008-10-15 | Иммуносупрессорные полипептиды и нуклеиновые кислоты |
Country Status (20)
| Country | Link |
|---|---|
| US (8) | US7794718B2 (ru) |
| EP (4) | EP2612868B1 (ru) |
| JP (1) | JP5298134B2 (ru) |
| KR (1) | KR101383476B1 (ru) |
| CN (2) | CN101998965B (ru) |
| AU (1) | AU2008319053B2 (ru) |
| CA (1) | CA2703263C (ru) |
| CY (1) | CY1113713T1 (ru) |
| DK (1) | DK2222697T3 (ru) |
| ES (2) | ES2399088T3 (ru) |
| HR (1) | HRP20130194T1 (ru) |
| IL (1) | IL205036A (ru) |
| MX (1) | MX2010004883A (ru) |
| PH (1) | PH12013501101B1 (ru) |
| PL (2) | PL2612868T3 (ru) |
| PT (2) | PT2222697E (ru) |
| RU (1) | RU2506275C2 (ru) |
| TW (1) | TWI448473B (ru) |
| WO (1) | WO2009058564A2 (ru) |
| ZA (1) | ZA201002872B (ru) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2742691C2 (ru) * | 2014-08-07 | 2021-02-09 | Аффимед Гмбх | Cd3-связывающий домен |
| RU2760578C2 (ru) * | 2019-12-25 | 2021-11-29 | федеральное государственное автономное образовательное учреждение высшего образования "Российский университет дружбы народов" (РУДН) | Слитый белок, содержащий модифицированный безметиониновый белок GroEL и димер полипептида полифемузина I |
Families Citing this family (76)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US20150010550A1 (en) | 2004-07-15 | 2015-01-08 | Xencor, Inc. | OPTIMIZED Fc VARIANTS |
| JP4652414B2 (ja) | 2004-11-12 | 2011-03-16 | ゼンコー・インコーポレイテッド | FcRnとの変化した結合を有するFc変異体 |
| US8367805B2 (en) | 2004-11-12 | 2013-02-05 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| KR101580937B1 (ko) | 2007-06-01 | 2015-12-31 | 유니버시티 오브 매릴랜드, 발티모어 | 면역글로불린 불변영역 Fc 수용체 결합제 |
| PT2222697E (pt) | 2007-11-01 | 2013-02-15 | Perseid Therapeutics Llc | Polipeptídeos imunossupressores e ácidos nucleicos |
| JP5547083B2 (ja) * | 2007-11-20 | 2014-07-09 | アンブルックス,インコーポレイテッド | 修飾されたインスリンポリペプチドおよびそれらの使用 |
| AU2009298131B2 (en) | 2008-10-02 | 2016-07-14 | Aptevo Research And Development Llc | CD86 antagonist multi-target binding proteins |
| BR112012001981A2 (pt) * | 2009-07-28 | 2018-06-12 | Ligacept Llc | moléculas de ligação a ligante erbb de amplo espectro e métodos para preparar usar as mesmas fundamentos |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| US10813917B2 (en) * | 2009-12-11 | 2020-10-27 | Medregen, Llc | Treatment methods utilizing stem cell mobilizers and immunosuppressive agents |
| KR101193940B1 (ko) * | 2009-12-14 | 2012-10-24 | 고려대학교 산학협력단 | 레서스 원숭이 ctla-4 융합 이뮤노글로불린 |
| AU2011217770B2 (en) * | 2010-02-19 | 2016-02-04 | Xencor, Inc. | Novel CTLA4-IG immunoadhesins |
| KR20130049775A (ko) | 2010-03-12 | 2013-05-14 | 애브비 바이오테라퓨틱스 인크. | Ctla4 단백질 및 이의 용도 |
| JP6002659B2 (ja) | 2010-04-13 | 2016-10-05 | セルデックス・セラピューティクス・インコーポレイテッド | ヒトcd27に結合する抗体およびその使用 |
| US20130231464A1 (en) * | 2010-04-28 | 2013-09-05 | Oncolmmune, Inc. | Methods of use of soluble cd24 for therapy of rheumatoid arthritis |
| KR102148265B1 (ko) | 2010-07-28 | 2020-08-26 | 글리크닉 인코포레이티드 | 순차적으로 다중화된 면역글로불린 fc 조성물을 제조하기 위한 천연 인간 단백질 단편들의 융합 단백질 |
| CA2826286C (en) | 2011-01-31 | 2021-09-21 | Intellect Neurosciences Inc. | Treatment of tauopathies |
| US20120219590A1 (en) * | 2011-02-24 | 2012-08-30 | Paxvax, Inc. | Formulations useful for spray drying vaccines |
| WO2012159075A1 (en) * | 2011-05-19 | 2012-11-22 | Seattle Biomedical Research Institute | Bioprobe compositions and their methods of use |
| CN102391377B (zh) * | 2011-11-01 | 2013-11-06 | 孙嘉琳 | 一种可诱导和激活癌靶向t细胞的融合蛋白及制备方法及用途 |
| CN102382193B (zh) * | 2011-11-01 | 2013-08-14 | 孙嘉琳 | 诱导和激活癌靶向t细胞的融合蛋白及制备方法及用途 |
| CN102516392B (zh) * | 2011-11-25 | 2014-05-28 | 孙嘉琳 | 一种癌靶向超抗原融合蛋白及制备方法及用途 |
| JP2015506372A (ja) * | 2012-01-27 | 2015-03-02 | グリックニック インコーポレイテッド | IgG2ヒンジドメインを含む融合タンパク質 |
| DK3207938T3 (da) | 2012-05-11 | 2020-03-16 | Medimmune Ltd | Ctla-4-varianter |
| WO2014100073A2 (en) * | 2012-12-21 | 2014-06-26 | Merck Sharp & Dohme Corp. | Expression vectors for recombinant protein production in mammalian cells |
| EP2855533A4 (en) | 2013-03-15 | 2015-11-25 | Momenta Pharmaceuticals Inc | METHODS RELATING TO CTLA4-FC FUSION PROTEINS |
| ES2708759T3 (es) | 2013-05-13 | 2019-04-11 | Momenta Pharmaceuticals Inc | Procedimientos para el tratamiento de la neurodegeneración |
| CN104277112B (zh) | 2013-07-04 | 2018-01-26 | 嘉和生物药业有限公司 | 长效降血糖融合蛋白 |
| EP3058084A4 (en) | 2013-10-16 | 2017-07-05 | Momenta Pharmaceuticals, Inc. | Sialylated glycoproteins |
| US11340235B2 (en) | 2014-02-28 | 2022-05-24 | Ga Generic Assays Gmbh | GP2 isoforms and their use in autoantibody capture |
| CN103923934B (zh) * | 2014-03-22 | 2016-11-02 | 复旦大学 | 一种具有免疫负调控作用的基因工程蛋白及其制备方法与应用 |
| KR20160141865A (ko) | 2014-04-25 | 2016-12-09 | 블루버드 바이오, 인코포레이티드. | 양자 세포 치료제를 제조하는 개선된 방법 |
| AU2015292590B2 (en) | 2014-07-24 | 2020-01-16 | 2Seventy Bio, Inc. | BCMA chimeric antigen receptors |
| RS62527B1 (sr) | 2014-12-12 | 2021-11-30 | 2Seventy Bio Inc | Bcma receptori himernog antigena |
| HUE054616T2 (hu) | 2015-04-17 | 2021-09-28 | Alpine Immune Sciences Inc | Immunmodulátor fehérjék hangolható affinitásokkal |
| EP3288536B1 (en) * | 2015-04-28 | 2019-06-26 | Swedish Orphan Biovitrum AB (publ) | Compositions comprising anakinra |
| CN108368165A (zh) * | 2015-06-24 | 2018-08-03 | 德克萨斯大学系统董事会 | 用于治疗颅内出血相关症状的方法和组合物 |
| ES2846024T7 (es) | 2015-07-24 | 2023-06-22 | Gliknik Inc | Proteínas de fusión de fragmentos de proteína humana para crear composiciones de Fc de inmunoglobulina multimerizada de forma ordenada con unión al complemento aumentada |
| US11053295B2 (en) | 2015-08-21 | 2021-07-06 | Iucf-Hyu (Industry-University Cooperation Foundation Hanyang University) | Peptides having effects of preventing or treating central nervous system diseases and pharmaceutical compositions for preventing or treating central nervous system diseases containing same as active ingredient |
| US11351224B2 (en) | 2015-08-21 | 2022-06-07 | Iucf-Hyu (Industry-University Cooperation Foundation Hanyang University) | Pharmaceutical composition for preventing and treating transplant rejection |
| WO2017034244A1 (ko) * | 2015-08-21 | 2017-03-02 | 한양대학교 산학협력단 | 중추신경계 질환에 대한 예방 또는 치료효과를 갖는 펩타이드 및 이를 유효성분으로 하는 중추신경계 질환 예방 및 치료용 약학적 조성물 |
| WO2017036255A1 (en) * | 2015-09-01 | 2017-03-09 | Tse-Wen Chang | Molecular constructs for preventing the formation of blood clot and/or treating thrombosis |
| US10273281B2 (en) | 2015-11-02 | 2019-04-30 | Five Prime Therapeutics, Inc. | CD80 extracellular domain polypeptides and their use in cancer treatment |
| IL310729A (en) | 2016-04-15 | 2024-04-01 | Alpine Immune Sciences Inc | Cd80 variant immunomodulatory proteins and uses thereof |
| AU2017279538A1 (en) | 2016-06-07 | 2019-01-03 | Gliknik Inc. | Cysteine-optimized stradomers |
| WO2017214834A1 (zh) * | 2016-06-14 | 2017-12-21 | 石庆学 | 特异促进 ctla-4 基因高表达的慢病毒表达载体及其应用 |
| CN107815468B (zh) | 2016-08-31 | 2021-03-16 | 百奥赛图(北京)医药科技股份有限公司 | 人源化基因改造动物模型的制备方法及应用 |
| WO2018041121A1 (en) * | 2016-08-31 | 2018-03-08 | Beijing Biocytogen Co., Ltd | Genetically modified non-human animal with human or chimeric ctla-4 |
| NZ753088A (en) | 2016-11-04 | 2025-05-30 | 2Seventy Bio Inc | Anti-bcma car t cell compositions |
| CN110022898B (zh) | 2016-12-09 | 2023-07-04 | 格利克尼克股份有限公司 | 用多价Fc化合物治疗炎性疾病的方法 |
| JP2020503855A (ja) | 2016-12-09 | 2020-02-06 | グリックニック インコーポレイテッド | 多量体化ストラドマーgl−2045の製造最適化 |
| MA47106A (fr) | 2016-12-21 | 2019-10-30 | Amgen Inc | Formulations d'anticorps anti-tnf alpha |
| AU2018258661A1 (en) * | 2017-04-28 | 2019-10-17 | Five Prime Therapeutics, Inc. | Methods of treatment with CD80 extracellular domain polypeptides |
| KR102758545B1 (ko) | 2017-10-10 | 2025-01-23 | 알파인 이뮨 사이언시즈, 인코포레이티드 | Ctla-4 변이체 면역조절 단백질 및 이의 용도 |
| US20200283500A1 (en) | 2017-10-18 | 2020-09-10 | Alpine Immune Sciences, Inc. | Variant icos ligand immunomodulatory proteins and related compositions and methods |
| US12297253B2 (en) | 2018-01-03 | 2025-05-13 | Alpine Immune Sciences, Inc. | Multi-domain immunomodulatory proteins and methods of use thereof |
| CN112292185A (zh) | 2018-04-17 | 2021-01-29 | 塞德斯医疗公司 | 抗cd27和抗pd-l1抗体及双特异性构建体 |
| WO2020022782A1 (ko) * | 2018-07-24 | 2020-01-30 | 주식회사 굳티셀 | 면역 관련 질환의 예방 또는 치료용 조성물 |
| EP3843767A1 (en) * | 2018-08-29 | 2021-07-07 | Five Prime Therapeutics, Inc. | Cd80 extracellular domain fc fusion protein dosing regimens |
| AU2019372675A1 (en) * | 2018-11-02 | 2021-02-04 | Beijing Vdjbio Co., Ltd. | Modified CTLA4 and methods of use thereof |
| EP3948281A1 (en) | 2019-03-29 | 2022-02-09 | F. Hoffmann-La Roche AG | Spr-based binding assay for the functional analysis of multivalent molecules |
| CA3135170A1 (en) | 2019-04-05 | 2020-10-08 | Tauc3 Biologics Limited | Anti-tauc3 antibodies and uses thereof |
| JP7405361B2 (ja) * | 2019-10-21 | 2023-12-26 | 東亞合成株式会社 | 抗腫瘍ペプチドおよびその利用 |
| CN111592580A (zh) * | 2020-05-08 | 2020-08-28 | 中国药科大学 | 一种具有免疫检查点ctla-4抑制活性的多肽及其应用 |
| EP3957649A1 (en) | 2020-08-18 | 2022-02-23 | Athebio AG | Improved n-terminal capping modules of ankyrin repeat domains |
| CU24723B1 (es) | 2021-01-29 | 2024-12-09 | Ct Ingenieria Genetica Biotecnologia | Composición farmacéutica que comprende el ghrp-6 |
| AU2022227552A1 (en) * | 2021-02-23 | 2023-10-05 | University Of Washington | Compositions and methods for cardiomyocyte transplantation |
| US11993657B2 (en) * | 2021-03-16 | 2024-05-28 | Jn Biosciences Llc | Bifunctional molecules for treatment of immune disorders |
| EP4323388B1 (en) | 2021-04-16 | 2025-01-29 | Athebio AG | N-terminal capping modules of ankyrin repeat domains |
| WO2023021050A1 (en) | 2021-08-17 | 2023-02-23 | Athebio Ag | Variants of ankyrin repeat domains |
| EP4137508A1 (en) | 2021-08-17 | 2023-02-22 | Athebio AG | Variants of ankyrin repeat domains |
| WO2023244760A1 (en) * | 2022-06-15 | 2023-12-21 | Duke University | Protein library display systems and methods thereof |
| WO2023194628A2 (en) | 2022-08-16 | 2023-10-12 | Athebio Ag | Variants of ankyrin repeat domains |
| WO2024037743A1 (en) | 2022-08-16 | 2024-02-22 | Athebio Ag | Variants of ankyrin repeat domains |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997032900A1 (en) * | 1996-03-04 | 1997-09-12 | Scios Inc. | ASSAY AND REAGENTS FOR QUANTIFYING hBNP |
| US20060074009A1 (en) * | 2004-05-26 | 2006-04-06 | James Kenneth D | Natriuretic compounds, conjugates, and uses thereof |
| WO2006088700A2 (en) * | 2005-02-17 | 2006-08-24 | Abbott Laboratories | Human ring specific bnp antibodies |
| RU2315773C2 (ru) * | 2002-08-07 | 2008-01-27 | Био-Рад Пастер | Специфические антитела для диагностики сердечной недостаточности |
Family Cites Families (203)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US511A (en) * | 1837-12-15 | Improved mode of coloring and finishing leather | ||
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4440859A (en) | 1977-05-27 | 1984-04-03 | The Regents Of The University Of California | Method for producing recombinant bacterial plasmids containing the coding sequences of higher organisms |
| US4704362A (en) | 1977-11-08 | 1987-11-03 | Genentech, Inc. | Recombinant cloning vehicle microbial polypeptide expression |
| NZ192465A (en) | 1978-12-22 | 1983-09-30 | Biogen Nv | Recombinant dna molecule comprising gene coding for polypeptide displaying hbv (hepatitis b virus) antigenicity usesthereof |
| JPS6023084B2 (ja) | 1979-07-11 | 1985-06-05 | 味の素株式会社 | 代用血液 |
| US4530901A (en) | 1980-01-08 | 1985-07-23 | Biogen N.V. | Recombinant DNA molecules and their use in producing human interferon-like polypeptides |
| CA1200773A (en) | 1980-02-29 | 1986-02-18 | William J. Rutter | Expression linkers |
| US4554101A (en) | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| US4678751A (en) | 1981-09-25 | 1987-07-07 | Genentech, Inc. | Hybrid human leukocyte interferons |
| US4640835A (en) | 1981-10-30 | 1987-02-03 | Nippon Chemiphar Company, Ltd. | Plasminogen activator derivatives |
| US4766075A (en) | 1982-07-14 | 1988-08-23 | Genentech, Inc. | Human tissue plasminogen activator |
| US4582800A (en) | 1982-07-12 | 1986-04-15 | Hoffmann-La Roche Inc. | Novel vectors and method for controlling interferon expression |
| US4757006A (en) | 1983-10-28 | 1988-07-12 | Genetics Institute, Inc. | Human factor VIII:C gene and recombinant methods for production |
| US4496689A (en) | 1983-12-27 | 1985-01-29 | Miles Laboratories, Inc. | Covalently attached complex of alpha-1-proteinase inhibitor with a water soluble polymer |
| JPS60188070A (ja) | 1984-03-09 | 1985-09-25 | Kunio Yamane | シグナルペプチドをコードするdna |
| GB8412517D0 (en) | 1984-05-16 | 1984-06-20 | Nagai K | Recombinant fusion proteins |
| CA1282721C (en) | 1984-06-04 | 1991-04-09 | Bernard Roizman | Herpes simplex virus as a vector |
| US4677063A (en) | 1985-05-02 | 1987-06-30 | Cetus Corporation | Human tumor necrosis factor |
| CA1341482C (en) | 1984-10-31 | 2005-05-10 | Paul A. Luciw | Process for preparing fragments of aids-associated retroviruses |
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5036006A (en) | 1984-11-13 | 1991-07-30 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| US4797368A (en) | 1985-03-15 | 1989-01-10 | The United States Of America As Represented By The Department Of Health And Human Services | Adeno-associated virus as eukaryotic expression vector |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| DE3675588D1 (de) | 1985-06-19 | 1990-12-20 | Ajinomoto Kk | Haemoglobin, das an ein poly(alkenylenoxid) gebunden ist. |
| DE3681787D1 (de) | 1985-07-05 | 1991-11-07 | Whitehead Biomedical Inst | Expression von fremdem genetischem material in epithelzellen. |
| KR890003620Y1 (ko) | 1985-07-25 | 1989-05-27 | 삼성전자주식회사 | 전자레인지의 파워릴레이 구동회로 |
| CA1293460C (en) | 1985-10-07 | 1991-12-24 | Brian Lee Sauer | Site-specific recombination of dna in yeast |
| US5139941A (en) | 1985-10-31 | 1992-08-18 | University Of Florida Research Foundation, Inc. | AAV transduction vectors |
| US4810648A (en) | 1986-01-08 | 1989-03-07 | Rhone Poulenc Agrochimie | Haloarylnitrile degrading gene, its use, and cells containing the gene |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4791192A (en) | 1986-06-26 | 1988-12-13 | Takeda Chemical Industries, Ltd. | Chemically modified protein with polyethyleneglycol |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5084384A (en) | 1987-04-23 | 1992-01-28 | Monsanto Company | Secretion of insulin-like growth factor-I |
| US6093699A (en) | 1987-07-09 | 2000-07-25 | The University Of Manitoba | Method for gene therapy involving suppression of an immune response |
| US5017478A (en) | 1987-07-16 | 1991-05-21 | Berlex Laboratories, Inc. | Transfected cells containing plasmids having genes oriented in opposing directions and methods of using |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| ZA887365B (en) | 1987-10-02 | 1990-05-30 | Genentech Inc | Adheson variants |
| PT88641B (pt) | 1987-10-02 | 1993-04-30 | Genentech Inc | Metodo para a preparacao de uma variante de adesao |
| US5336603A (en) | 1987-10-02 | 1994-08-09 | Genentech, Inc. | CD4 adheson variants |
| US6710169B2 (en) | 1987-10-02 | 2004-03-23 | Genentech, Inc. | Adheson variants |
| US5567584A (en) | 1988-01-22 | 1996-10-22 | Zymogenetics, Inc. | Methods of using biologically active dimerized polypeptide fusions to detect PDGF |
| US6018026A (en) | 1988-01-22 | 2000-01-25 | Zymogenetics, Inc. | Biologically active dimerized and multimerized polypeptide fusions |
| EP1762623A1 (en) | 1988-01-22 | 2007-03-14 | ZymoGenetics, Inc. | Methods for producing biologically active peptide dimers |
| US5716826A (en) | 1988-03-21 | 1998-02-10 | Chiron Viagene, Inc. | Recombinant retroviruses |
| US5614404A (en) | 1988-06-10 | 1997-03-25 | Theriod Biologics, Incorporated | Self-assembled, defective, non-self-propagating lentivirus particles |
| US5284768A (en) | 1988-08-24 | 1994-02-08 | Sanofi | Signal peptide, DNA sequences coding for the latter, expression vectors carrying one of these sequences, gram-negative bacteria transformed by these vectors, and process for the periplasmic production of a polypeptide |
| US5349052A (en) | 1988-10-20 | 1994-09-20 | Royal Free Hospital School Of Medicine | Process for fractionating polyethylene glycol (PEG)-protein adducts and an adduct for PEG and granulocyte-macrophage colony stimulating factor |
| US6685941B1 (en) | 1988-11-23 | 2004-02-03 | The Regents Of The University Of Michigan | Methods of treating autoimmune disease via CTLA-4Ig |
| DE3901681A1 (de) | 1989-01-21 | 1990-07-26 | Behringwerke Ag | Signalpeptid fuer die sekretion von peptiden in escherichia coli, verfahren zu seiner gewinnung und seine verwendung |
| US5116964A (en) | 1989-02-23 | 1992-05-26 | Genentech, Inc. | Hybrid immunoglobulins |
| US5225538A (en) | 1989-02-23 | 1993-07-06 | Genentech, Inc. | Lymphocyte homing receptor/immunoglobulin fusion proteins |
| US6406697B1 (en) | 1989-02-23 | 2002-06-18 | Genentech, Inc. | Hybrid immunoglobulins |
| US5082767A (en) | 1989-02-27 | 1992-01-21 | Hatfield G Wesley | Codon pair utilization |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5122614A (en) | 1989-04-19 | 1992-06-16 | Enzon, Inc. | Active carbonates of polyalkylene oxides for modification of polypeptides |
| US5672683A (en) | 1989-09-07 | 1997-09-30 | Alkermes, Inc. | Transferrin neuropharmaceutical agent fusion protein |
| JP3203599B2 (ja) | 1989-10-24 | 2001-08-27 | カイロン コーポレイション | 感染性タンパク質デリバリーシステム |
| EP0452457B1 (en) | 1989-11-03 | 1997-08-20 | Vanderbilt University | Method of in vivo delivery of functioning foreign genes |
| US5697901A (en) | 1989-12-14 | 1997-12-16 | Elof Eriksson | Gene delivery by microneedle injection |
| US5672510A (en) | 1990-01-19 | 1997-09-30 | Genetic Therapy, Inc. | Retroviral vectors |
| US7070776B1 (en) | 1990-03-26 | 2006-07-04 | Bristol-Myers Squibb Company | Methods for blocking binding of CD28 receptor to B7 |
| US5279833A (en) | 1990-04-04 | 1994-01-18 | Yale University | Liposomal transfection of nucleic acids into animal cells |
| US5173414A (en) | 1990-10-30 | 1992-12-22 | Applied Immune Sciences, Inc. | Production of recombinant adeno-associated virus vectors |
| SE9003978D0 (sv) | 1990-12-13 | 1990-12-13 | Henrik Garoff | Dna expressionssystem baserade paa ett virus replikon |
| WO1992016484A1 (en) | 1991-03-19 | 1992-10-01 | Cytrx Corporation | Polyoxypropylene/polyoxyethylene copolymers with improved biological activity |
| US5770197A (en) | 1991-06-27 | 1998-06-23 | Bristol-Myers Squibb Company | Methods for regulating the immune response using B7 binding molecules and IL4-binding molecules |
| AU661854B2 (en) | 1991-06-27 | 1995-08-10 | Bristol-Myers Squibb Company | CTL4A receptor, fusion proteins containing it and uses thereof |
| US6887471B1 (en) | 1991-06-27 | 2005-05-03 | Bristol-Myers Squibb Company | Method to inhibit T cell interactions with soluble B7 |
| US6090914A (en) | 1991-06-27 | 2000-07-18 | Bristol-Myers Squibb Company | CTLA4/CD28Ig hybrid fusion proteins and uses thereof |
| US5851795A (en) | 1991-06-27 | 1998-12-22 | Bristol-Myers Squibb Company | Soluble CTLA4 molecules and uses thereof |
| US5844095A (en) | 1991-06-27 | 1998-12-01 | Bristol-Myers Squibb Company | CTLA4 Ig fusion proteins |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| US5506098A (en) | 1991-09-04 | 1996-04-09 | Daikin Industries, Ltd. | In situ hybridization method |
| US5635532A (en) | 1991-10-21 | 1997-06-03 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Compositions and methods for therapy and prevention of pathologies including cancer, AIDS and anemia |
| EP0637963B1 (en) | 1992-04-07 | 2004-08-04 | The Regents of the University of Michigan | Cd28 pathway immunoregulation |
| US5792751A (en) | 1992-04-13 | 1998-08-11 | Baylor College Of Medicine | Tranformation of cells associated with fluid spaces |
| US5587308A (en) | 1992-06-02 | 1996-12-24 | The United States Of America As Represented By The Department Of Health & Human Services | Modified adeno-associated virus vector capable of expression from a novel promoter |
| CA2134773A1 (en) | 1992-06-04 | 1993-12-09 | Robert J. Debs | Methods and compositions for in vivo gene therapy |
| CA2142007C (en) | 1992-08-11 | 2007-10-30 | Robert Glen Urban | Immunomodulatory peptides |
| WO1994012520A1 (en) | 1992-11-20 | 1994-06-09 | Enzon, Inc. | Linker for linked fusion polypeptides |
| CA2150262C (en) | 1992-12-04 | 2008-07-08 | Kaspar-Philipp Holliger | Multivalent and multispecific binding proteins, their manufacture and use |
| US5633234A (en) | 1993-01-22 | 1997-05-27 | The Johns Hopkins University | Lysosomal targeting of immunogens |
| US5773253A (en) | 1993-01-22 | 1998-06-30 | Bristol-Myers Squibb Company | MYPPPY variants of CTL A4 and uses thereof |
| EP0621337A1 (en) | 1993-01-25 | 1994-10-26 | American Cyanamid Company | Codon optimized DNA sequence for insect toxin AaIT |
| US5981505A (en) | 1993-01-26 | 1999-11-09 | The Trustees Of The University Of Pennsylvania | Compositions and methods for delivery of genetic material |
| US5593972A (en) | 1993-01-26 | 1997-01-14 | The Wistar Institute | Genetic immunization |
| US6482919B2 (en) | 1993-02-01 | 2002-11-19 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| CA2158455C (en) | 1993-03-17 | 2003-05-27 | Nicholas P. Restifo | Immunogenic chimeras comprising nucleic acid sequences encoding endoplasmic reticulum signal sequence peptides and at least one other peptide and their uses in vaccines and disease treatments |
| TW360548B (en) | 1993-04-08 | 1999-06-11 | Powderject Res Ltd | Products for therapeutic use |
| ES2181717T3 (es) | 1993-04-21 | 2003-03-01 | Pasteur Institut | Implante biocompatible para la expresion y la secrecion in vivo de un compuesto terapeutico. |
| US5591601A (en) | 1993-05-14 | 1997-01-07 | Ohio University Edison Animal Biotechnology Institute | DNA polymerase gene expression system utilizing an RNA polymerase co-delivered with the gene expression vector system |
| US6133028A (en) | 1993-05-28 | 2000-10-17 | Transgene S.A. | Defective adenoviruses and corresponding complementation lines |
| US5830877A (en) | 1993-08-26 | 1998-11-03 | The Regents Of The University Of California | Method, compositions and devices for administration of naked polynucleotides which encode antigens and immunostimulatory |
| US5804566A (en) | 1993-08-26 | 1998-09-08 | The Regents Of The University Of California | Methods and devices for immunizing a host through administration of naked polynucleotides with encode allergenic peptides |
| US5849719A (en) | 1993-08-26 | 1998-12-15 | The Regents Of The University Of California | Method for treating allergic lung disease |
| US5679647A (en) | 1993-08-26 | 1997-10-21 | The Regents Of The University Of California | Methods and devices for immunizing a host against tumor-associated antigens through administration of naked polynucleotides which encode tumor-associated antigenic peptides |
| US5426039A (en) | 1993-09-08 | 1995-06-20 | Bio-Rad Laboratories, Inc. | Direct molecular cloning of primer extended DNA containing an alkane diol |
| ATE440957T1 (de) | 1993-09-15 | 2009-09-15 | Novartis Vaccines & Diagnostic | Rekombinante alphavirus vektoren |
| US6107095A (en) | 1993-11-26 | 2000-08-22 | Mazurkiewicz; Marian | Method for introducing substances into living cells and tissues |
| US5580766A (en) | 1994-01-14 | 1996-12-03 | Alexion Pharmaceuticals, Inc. | Retroviral vector particles for transducing non-proliferating cells |
| HK1013804A1 (en) | 1994-01-21 | 1999-09-10 | Powderject Vaccines Inc | Gas driven gene delivery instrument |
| US6117679A (en) | 1994-02-17 | 2000-09-12 | Maxygen, Inc. | Methods for generating polynucleotides having desired characteristics by iterative selection and recombination |
| US6335160B1 (en) | 1995-02-17 | 2002-01-01 | Maxygen, Inc. | Methods and compositions for polypeptide engineering |
| US6077835A (en) | 1994-03-23 | 2000-06-20 | Case Western Reserve University | Delivery of compacted nucleic acid to cells |
| US5739118A (en) | 1994-04-01 | 1998-04-14 | Apollon, Inc. | Compositions and methods for delivery of genetic material |
| GB9406974D0 (en) | 1994-04-08 | 1994-06-01 | Pharmaceutical Proteins Ltd | Transgenic production |
| US5658785A (en) | 1994-06-06 | 1997-08-19 | Children's Hospital, Inc. | Adeno-associated virus materials and methods |
| JP3816518B2 (ja) | 1994-06-10 | 2006-08-30 | ジェンベク、インコーポレイティッド | 相補的なアデノウイルスベクター系と細胞系 |
| US5601820A (en) | 1994-07-07 | 1997-02-11 | Children's Hospital Of Philadelphia | Compositions and methods of making and using human full length TRK-B |
| US5855579A (en) * | 1994-07-15 | 1999-01-05 | Smith & Nephew, Inc. | Cannulated modular intramedullary nail |
| EP1181937A3 (en) | 1994-08-09 | 2004-02-04 | Cytrx Corporation | Novel vaccine adjuvant and vaccine |
| US5786464C1 (en) | 1994-09-19 | 2012-04-24 | Gen Hospital Corp | Overexpression of mammalian and viral proteins |
| GB9502879D0 (en) | 1995-02-14 | 1995-04-05 | Oxford Biosciences Ltd | Particle delivery |
| US6127525A (en) | 1995-02-21 | 2000-10-03 | Cornell Research Foundation, Inc. | Chimeric adenoviral coat protein and methods of using same |
| US5750340A (en) | 1995-04-07 | 1998-05-12 | University Of New Mexico | In situ hybridization solution and process |
| US5922687A (en) | 1995-05-04 | 1999-07-13 | Board Of Trustees Of The Leland Stanford Junior University | Intracellular delivery of nucleic acids using pressure |
| US5525510A (en) | 1995-06-02 | 1996-06-11 | Agracetus, Inc. | Coanda effect gene delivery instrument |
| US5993800A (en) | 1995-06-05 | 1999-11-30 | Bristol-Myers Squibb Company | Methods for prolonging the expression of a heterologous gene of interest using soluble CTLA4 molecules and an antiCD40 ligand |
| DE69634297T2 (de) | 1995-06-05 | 2006-01-05 | University Of Washington, Seattle | Verfahren zur verlängerung der expression eines interessierenden gens unter verwendung von löslichen ctla4 molekülen |
| US5668110A (en) | 1995-06-07 | 1997-09-16 | Affymax Technologies N.V. | Peptides and compounds that bind to the IL-5 receptor |
| US5811406A (en) | 1995-06-07 | 1998-09-22 | Regents Of The University Of California | Dry powder formulations of polynucleotide complexes |
| FR2737222B1 (fr) | 1995-07-24 | 1997-10-17 | Transgene Sa | Nouveaux vecteurs viraux et lignee pour la therapie genique |
| WO1997004748A2 (en) | 1995-08-01 | 1997-02-13 | Advanced Therapies, Inc. | Enhanced artificial viral envelopes for cellular delivery of therapeutic substances |
| US5966560A (en) * | 1995-08-29 | 1999-10-12 | Minolta Co., Ltd. | Image forming apparatus with enhanced pretransfer erasing |
| US5801030A (en) | 1995-09-01 | 1998-09-01 | Genvec, Inc. | Methods and vectors for site-specific recombination |
| US7041634B2 (en) | 1995-09-27 | 2006-05-09 | Emory University | Method of inhibiting immune system destruction of transplanted viable cells |
| CA2232815A1 (en) | 1995-09-27 | 1997-04-03 | Emory University | Method of inhibiting immune system destruction of transplanted viable cells |
| KR970029803A (ko) | 1995-11-03 | 1997-06-26 | 김광호 | 반도체 메모리장치의 프리차지 회로 |
| US6537776B1 (en) | 1999-06-14 | 2003-03-25 | Diversa Corporation | Synthetic ligation reassembly in directed evolution |
| US5789244A (en) | 1996-01-08 | 1998-08-04 | Canji, Inc. | Compositions and methods for the treatment of cancer using recombinant viral vector delivery systems |
| US6750334B1 (en) | 1996-02-02 | 2004-06-15 | Repligen Corporation | CTLA4-immunoglobulin fusion proteins having modified effector functions and uses therefor |
| DK0892643T4 (da) | 1996-03-20 | 2009-12-14 | Bristol Myers Squibb Co | Fremgangsmåder til inhibering af et immunrespons ved blokering af GP39/CD40- og CTLA4/CD28/B7-banerne og præparater til anvendelse derved |
| US6261552B1 (en) | 1997-05-22 | 2001-07-17 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Herpes simplex virus vectors |
| WO1997044446A1 (en) | 1996-05-24 | 1997-11-27 | University Of Maryland At Baltimore | Dna vaccines for eliciting a mucosal immune response |
| US5750356A (en) | 1996-05-31 | 1998-05-12 | Anergen, Inc. | Method for monitoring T cell reactivity |
| GB9619002D0 (en) | 1996-09-11 | 1996-10-23 | Oxford Biosciences Ltd | Particle delivery |
| EP0987326A4 (en) | 1996-07-11 | 2002-11-06 | Takara Shuzo Co | METHOD FOR PERFORMING A DIRECTED MUTAGENESIS |
| EP0920522B1 (en) | 1996-08-14 | 2003-10-29 | THE GOVERNMENT OF THE UNITED STATES OF AMERICA, as represented by THE SECRETARY, DEPARTMENT OF HEALTH AND HUMAN SERVICES | A vector for polynucleotide vaccines |
| US6211160B1 (en) | 1996-09-06 | 2001-04-03 | The Trustees Of The University Of Pennsylvania | Method for tolerizing a mammalian patient to administration of gene therapy virus vectors |
| US6114148C1 (en) | 1996-09-20 | 2012-05-01 | Gen Hospital Corp | High level expression of proteins |
| US6107477A (en) | 1996-09-26 | 2000-08-22 | Aurora Biosciences Corporation | Non-optimal Kozaks sequences |
| AU733719B2 (en) | 1996-10-23 | 2001-05-24 | Trustees Of The University Of Pennsylvania, The | Improved vaccines |
| US7732129B1 (en) | 1998-12-01 | 2010-06-08 | Crucell Holland B.V. | Method for the production and purification of adenoviral vectors |
| ATE348155T1 (de) | 1996-11-20 | 2007-01-15 | Introgen Therapeutics Inc | Ein verbessertes verfahren zur produktion und reinigung von adenoviralen vektoren |
| PL334902A1 (en) | 1997-01-29 | 2000-03-27 | Cornell Res Foundation Inc | Repeatable local delivery of adenoviral vector in order to induce angiogenesis |
| ZA98533B (en) * | 1997-01-31 | 1999-07-22 | Bristol Myers Squibb Co | Soluble CTLA4 mutant molecules and uses thereof. |
| US5837283A (en) | 1997-03-12 | 1998-11-17 | The Regents Of The University Of California | Cationic lipid compositions targeting angiogenic endothelial cells |
| NZ337853A (en) | 1997-04-03 | 2002-03-28 | Electrofect As | Method for introducing pharmaceutical drugs and nucleic acids into skeletal muscle |
| US6261281B1 (en) | 1997-04-03 | 2001-07-17 | Electrofect As | Method for genetic immunization and introduction of molecules into skeletal muscle and immune cells |
| US6225082B1 (en) | 1997-05-09 | 2001-05-01 | Research Corporation Technologies, Inc. | Myelin basic protein MRNA transport and translation enhancer sequences |
| CA2293489C (en) | 1997-06-06 | 2009-09-29 | The Regents Of The University Of California | Inhibitors of dna immunostimulatory sequence activity |
| AU8067698A (en) | 1997-06-09 | 1998-12-30 | Genvec, Inc. | Chimeric vectors comprising a phage packaging site and a portion derived from a genome of a eukaryotic virus |
| DE19729058A1 (de) | 1997-07-08 | 1999-01-14 | Sika Ag | Verbundelement und Verfahren zu seiner Herstellung |
| US6165476A (en) | 1997-07-10 | 2000-12-26 | Beth Israel Deaconess Medical Center | Fusion proteins with an immunoglobulin hinge region linker |
| WO1999004009A1 (en) | 1997-07-14 | 1999-01-28 | Wisconsin Alumni Research Foundation | Method of dna vaccination using dna encoding antigen and encoding il6 |
| WO1999008689A1 (en) | 1997-08-21 | 1999-02-25 | Powderject Vaccines, Inc. | Mucosal immunization using particle-mediated delivery techniques |
| WO1999015686A1 (en) | 1997-09-23 | 1999-04-01 | Genvec, Inc. | Plasmids for construction of eukaryotic viral vectors |
| US5932445A (en) | 1997-11-07 | 1999-08-03 | Incyte Pharmaceuticals, Inc. | Signal peptide-containing proteins |
| US5994136A (en) | 1997-12-12 | 1999-11-30 | Cell Genesys, Inc. | Method and means for producing high titer, safe, recombinant lentivirus vectors |
| JP2002503461A (ja) | 1998-02-11 | 2002-02-05 | マキシジェン, インコーポレイテッド | 遺伝子ワクチンベクター工学 |
| US6087341A (en) | 1998-02-12 | 2000-07-11 | The Board Of Trustees Of The Leland Standford Junior University | Introduction of nucleic acid into skin cells by topical application |
| US5922576A (en) | 1998-02-27 | 1999-07-13 | The John Hopkins University | Simplified system for generating recombinant adenoviruses |
| US6852847B1 (en) | 1998-03-19 | 2005-02-08 | Heska Corporation | Canine and feline B7-2 nucleic acid molecules and uses thereof |
| US6121236A (en) | 1998-03-24 | 2000-09-19 | The Children's Medical Center Corporation | Multivalent ligands which modulate angiogenesis |
| DE69927013T2 (de) | 1998-04-22 | 2006-06-29 | Genvec, Inc. | Effiziente reinigung von adenovirus |
| WO1999057275A1 (en) | 1998-05-06 | 1999-11-11 | Pharmacia & Upjohn Company | Introduction of naked dna or rna encoding non-human vertebrate peptide hormones or cytokines into a non-human vertebrate |
| US6436897B2 (en) | 1998-06-01 | 2002-08-20 | Celtrix Pharmaceuticals, Inc. | Pharmaceutical formulations for IGF/IGFBP |
| US5965358A (en) | 1998-08-26 | 1999-10-12 | Genvec, Inc. | Method for assessing the relative purity of viral gene transfer vector stocks |
| EP1112372A1 (en) | 1998-09-11 | 2001-07-04 | Genvec, Inc. | Alternatively targeted adenovirus |
| US6521419B1 (en) | 1998-09-22 | 2003-02-18 | Kanakaraju Koduri | Expression vectors containing hot spot for increased recombinant protein expression in transfected cells |
| US6800457B2 (en) | 1998-09-22 | 2004-10-05 | Bristol-Myers Squibb Company | Expression vectors containing hot spot for increased recombinant protein expression in transfected cells |
| US6225113B1 (en) | 1998-12-04 | 2001-05-01 | Genvec, Inc. | Use of trans-activation and cis-activation to modulate the persistence of expression of a transgene in an at least E4-deficient adenovirus |
| US6225289B1 (en) | 1998-12-10 | 2001-05-01 | Genvec, Inc. | Methods and compositions for preserving adenoviral vectors |
| IL143797A0 (en) | 1998-12-23 | 2002-04-21 | Pfizer | Human monoclonal antibodies to cytotoxic t lymphocyte antigen 4 |
| AU2220800A (en) | 1998-12-31 | 2000-07-31 | Chiron Corporation | Compositions and methods for packaging of alphavirus vectors |
| MXPA01007895A (es) | 1999-02-03 | 2003-07-21 | Biosante Pharmaceuticals Inc | Particulas terapeuticas de fosfato de calcio, metodos de manufactura y usos. |
| US6281005B1 (en) | 1999-05-14 | 2001-08-28 | Copernicus Therapeutics, Inc. | Automated nucleic acid compaction device |
| AU2001249380A1 (en) | 2000-03-22 | 2001-11-07 | Chiron Corporation | Compositions and methods for generating an immune response utilizing alphavirus-based vector systems |
| US6168941B1 (en) | 2000-04-07 | 2001-01-02 | Genvec, Inc. | Method of producing adenoviral vector stocks |
| US20030170871A1 (en) | 2000-04-25 | 2003-09-11 | Chiron Corporation | Alphavirus-based vectors for persistent infection |
| US20020058039A1 (en) | 2000-04-27 | 2002-05-16 | Coyne Michael J. | Method of measuring the duration of adequate immune memory in companion animals |
| MXPA02011534A (es) * | 2000-05-26 | 2004-08-12 | Bristol Myers Squibb Co | Moleculas mutantes ctla4 solubles y uso de las mismas. |
| US7094874B2 (en) | 2000-05-26 | 2006-08-22 | Bristol-Myers Squibb Co. | Soluble CTLA4 mutant molecules |
| US7183376B2 (en) * | 2000-06-23 | 2007-02-27 | Maxygen, Inc. | Variant B7 co-stimulatory molecules |
| US20050154189A1 (en) * | 2000-06-23 | 2005-07-14 | Maxygen Inc | Novel co-stimulatory molecules |
| US7094875B2 (en) * | 2000-06-23 | 2006-08-22 | Maxygen, Inc. | Co-stimulatory polypeptides |
| US7074590B2 (en) | 2000-06-23 | 2006-07-11 | Maxygen, Inc. | Chimeric promoters |
| CA2413190C (en) * | 2000-07-03 | 2009-04-07 | Bristol-Myers Squibb Company | Methods for treating rheumatic diseases using a soluble ctla4 molecule |
| US20040022787A1 (en) | 2000-07-03 | 2004-02-05 | Robert Cohen | Methods for treating an autoimmune disease using a soluble CTLA4 molecule and a DMARD or NSAID |
| WO2002002639A2 (en) * | 2000-07-05 | 2002-01-10 | Pharmacia & Upjohn Company | Human ion channels |
| US7829084B2 (en) | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| PL204899B1 (pl) | 2001-05-23 | 2010-02-26 | Bristol Myers Squibb Co | Zastosowanie rozpuszczalnej zmutowanej cząsteczki CTLA4 |
| PT1576182E (pt) | 2002-12-23 | 2011-01-21 | Bristol Myers Squibb Co | Optimizador da qualidade do produto em processos de cultura celular de mamíferos destinados à produção de proteínas |
| KR20060132541A (ko) | 2003-08-04 | 2006-12-21 | 브리스톨-마이어스 스큅 컴퍼니 | 가용성 ctla4 분자를 사용한 심혈관 질환의 치료 방법 |
| PT2586459T (pt) | 2005-03-25 | 2017-07-25 | Regeneron Pharma | Formulações antagonistas de fcev |
| CA2603970A1 (en) | 2005-04-06 | 2006-10-12 | Bristol-Myers Squibb Company | Methods for treating immune disorders associated with graft transplantation with soluble ctla4 mutant molecules |
| GB0620934D0 (en) | 2006-10-20 | 2006-11-29 | Cambridge Antibody Tech | Protein variants |
| PT2222697E (pt) * | 2007-11-01 | 2013-02-15 | Perseid Therapeutics Llc | Polipeptídeos imunossupressores e ácidos nucleicos |
| US9405700B2 (en) | 2010-11-04 | 2016-08-02 | Sonics, Inc. | Methods and apparatus for virtualization in an integrated circuit |
-
2008
- 2008-10-15 PT PT88444419T patent/PT2222697E/pt unknown
- 2008-10-15 JP JP2010532121A patent/JP5298134B2/ja active Active
- 2008-10-15 US US12/251,960 patent/US7794718B2/en active Active
- 2008-10-15 KR KR1020107011711A patent/KR101383476B1/ko not_active Expired - Fee Related
- 2008-10-15 EP EP13150320.3A patent/EP2612868B1/en active Active
- 2008-10-15 PT PT13150320T patent/PT2612868T/pt unknown
- 2008-10-15 ES ES08844441T patent/ES2399088T3/es active Active
- 2008-10-15 CN CN200880114532.0A patent/CN101998965B/zh active Active
- 2008-10-15 MX MX2010004883A patent/MX2010004883A/es active IP Right Grant
- 2008-10-15 EP EP11166011A patent/EP2385065A1/en not_active Withdrawn
- 2008-10-15 RU RU2010122053/10A patent/RU2506275C2/ru not_active IP Right Cessation
- 2008-10-15 ES ES13150320.3T patent/ES2688721T3/es active Active
- 2008-10-15 DK DK08844441.9T patent/DK2222697T3/da active
- 2008-10-15 PL PL13150320T patent/PL2612868T3/pl unknown
- 2008-10-15 AU AU2008319053A patent/AU2008319053B2/en not_active Ceased
- 2008-10-15 WO PCT/US2008/079981 patent/WO2009058564A2/en active Application Filing
- 2008-10-15 EP EP13150303.9A patent/EP2612867A1/en not_active Withdrawn
- 2008-10-15 EP EP08844441A patent/EP2222697B1/en active Active
- 2008-10-15 CA CA2703263A patent/CA2703263C/en not_active Expired - Fee Related
- 2008-10-15 PL PL08844441T patent/PL2222697T3/pl unknown
- 2008-10-15 CN CN201310056076.1A patent/CN103172750B/zh active Active
- 2008-10-29 TW TW097141645A patent/TWI448473B/zh not_active IP Right Cessation
-
2010
- 2010-04-13 IL IL205036A patent/IL205036A/en not_active IP Right Cessation
- 2010-04-20 US US12/763,902 patent/US8071095B2/en active Active
- 2010-04-23 ZA ZA2010/02872A patent/ZA201002872B/en unknown
-
2011
- 2011-01-21 US US13/011,042 patent/US8268587B2/en active Active
- 2011-01-21 US US13/011,497 patent/US8318176B2/en active Active
- 2011-01-21 US US13/011,351 patent/US8445230B2/en active Active
- 2011-01-21 US US13/011,463 patent/US8283447B2/en active Active
- 2011-03-10 US US13/045,335 patent/US8491899B2/en active Active
- 2011-03-16 US US13/049,727 patent/US8496935B2/en active Active
-
2013
- 2013-02-21 CY CY20131100164T patent/CY1113713T1/el unknown
- 2013-03-05 HR HRP20130194AT patent/HRP20130194T1/hr unknown
- 2013-05-30 PH PH12013501101A patent/PH12013501101B1/en unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1997032900A1 (en) * | 1996-03-04 | 1997-09-12 | Scios Inc. | ASSAY AND REAGENTS FOR QUANTIFYING hBNP |
| RU2315773C2 (ru) * | 2002-08-07 | 2008-01-27 | Био-Рад Пастер | Специфические антитела для диагностики сердечной недостаточности |
| US20060074009A1 (en) * | 2004-05-26 | 2006-04-06 | James Kenneth D | Natriuretic compounds, conjugates, and uses thereof |
| WO2006088700A2 (en) * | 2005-02-17 | 2006-08-24 | Abbott Laboratories | Human ring specific bnp antibodies |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2742691C2 (ru) * | 2014-08-07 | 2021-02-09 | Аффимед Гмбх | Cd3-связывающий домен |
| RU2760578C2 (ru) * | 2019-12-25 | 2021-11-29 | федеральное государственное автономное образовательное учреждение высшего образования "Российский университет дружбы народов" (РУДН) | Слитый белок, содержащий модифицированный безметиониновый белок GroEL и димер полипептида полифемузина I |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2506275C2 (ru) | Иммуносупрессорные полипептиды и нуклеиновые кислоты | |
| KR20180012260A (ko) | 조율가능한 친화성을 갖는 면역조절 단백질 | |
| CN101198347A (zh) | 使用可溶性ctla4突变型分子治疗与移植物移植有关的免疫病症的方法 | |
| EP2076536A2 (en) | Variants of ctla4 | |
| AU2014250683B2 (en) | Immunosuppressive polypeptides and nucleic acids | |
| AU2012202324B2 (en) | Immunosuppressive polypeptides and nucleic acids | |
| CA2805976C (en) | Immunosuppressive polypeptides and nucleic acids |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| HZ9A | Changing address for correspondence with an applicant | ||
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20181016 |