JP5298134B2 - 免疫抑制ポリペプチドおよび核酸 - Google Patents
免疫抑制ポリペプチドおよび核酸 Download PDFInfo
- Publication number
- JP5298134B2 JP5298134B2 JP2010532121A JP2010532121A JP5298134B2 JP 5298134 B2 JP5298134 B2 JP 5298134B2 JP 2010532121 A JP2010532121 A JP 2010532121A JP 2010532121 A JP2010532121 A JP 2010532121A JP 5298134 B2 JP5298134 B2 JP 5298134B2
- Authority
- JP
- Japan
- Prior art keywords
- polypeptide
- fusion protein
- seq
- amino acid
- dimer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 901
- 229920001184 polypeptide Polymers 0.000 title claims abstract description 890
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 890
- 150000007523 nucleic acids Chemical class 0.000 title claims abstract description 218
- 102000039446 nucleic acids Human genes 0.000 title claims abstract description 206
- 108020004707 nucleic acids Proteins 0.000 title claims abstract description 206
- 230000001506 immunosuppresive effect Effects 0.000 title abstract description 17
- 102000037865 fusion proteins Human genes 0.000 claims description 385
- 108020001507 fusion proteins Proteins 0.000 claims description 385
- 230000028993 immune response Effects 0.000 claims description 163
- 239000013636 protein dimer Substances 0.000 claims description 150
- 239000000539 dimer Substances 0.000 claims description 104
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 77
- 239000013598 vector Substances 0.000 claims description 73
- 101000946850 Homo sapiens T-lymphocyte activation antigen CD86 Proteins 0.000 claims description 72
- 102000049849 human CD86 Human genes 0.000 claims description 72
- 108091033319 polynucleotide Proteins 0.000 claims description 67
- 102000040430 polynucleotide Human genes 0.000 claims description 67
- 239000002157 polynucleotide Substances 0.000 claims description 67
- 239000000178 monomer Substances 0.000 claims description 43
- 201000010099 disease Diseases 0.000 claims description 39
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims description 38
- 208000035475 disorder Diseases 0.000 claims description 38
- 102000054189 human CD80 Human genes 0.000 claims description 37
- 238000002054 transplantation Methods 0.000 claims description 33
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 claims description 29
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 claims description 29
- 230000000295 complement effect Effects 0.000 claims description 23
- 230000002401 inhibitory effect Effects 0.000 claims description 22
- 238000004519 manufacturing process Methods 0.000 claims description 22
- 210000000056 organ Anatomy 0.000 claims description 22
- 210000000987 immune system Anatomy 0.000 claims description 17
- 239000003814 drug Substances 0.000 claims description 16
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims description 15
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 15
- 239000013604 expression vector Substances 0.000 claims description 14
- 241000124008 Mammalia Species 0.000 claims description 13
- 239000003937 drug carrier Substances 0.000 claims description 12
- 238000000034 method Methods 0.000 abstract description 119
- 102000008203 CTLA-4 Antigen Human genes 0.000 abstract description 98
- 108010021064 CTLA-4 Antigen Proteins 0.000 abstract description 98
- 239000000203 mixture Substances 0.000 abstract description 55
- 229940045513 CTLA4 antagonist Drugs 0.000 abstract 2
- 210000004027 cell Anatomy 0.000 description 176
- 235000001014 amino acid Nutrition 0.000 description 172
- 125000003275 alpha amino acid group Chemical group 0.000 description 165
- 125000000539 amino acid group Chemical group 0.000 description 134
- 238000006467 substitution reaction Methods 0.000 description 119
- 238000009739 binding Methods 0.000 description 115
- 230000027455 binding Effects 0.000 description 114
- 108090000623 proteins and genes Proteins 0.000 description 80
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 78
- 102000043321 human CTLA4 Human genes 0.000 description 77
- 102000004169 proteins and genes Human genes 0.000 description 68
- 235000018102 proteins Nutrition 0.000 description 67
- 210000001744 T-lymphocyte Anatomy 0.000 description 59
- 241000282414 Homo sapiens Species 0.000 description 49
- 125000003729 nucleotide group Chemical group 0.000 description 44
- 108010076504 Protein Sorting Signals Proteins 0.000 description 38
- 230000006052 T cell proliferation Effects 0.000 description 37
- 239000002773 nucleotide Substances 0.000 description 36
- 229940024606 amino acid Drugs 0.000 description 35
- 150000001413 amino acids Chemical class 0.000 description 35
- 229940035567 orencia Drugs 0.000 description 35
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 34
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 33
- 230000003993 interaction Effects 0.000 description 33
- 230000006044 T cell activation Effects 0.000 description 31
- 239000012634 fragment Substances 0.000 description 29
- 239000000427 antigen Substances 0.000 description 25
- 108091007433 antigens Proteins 0.000 description 25
- 102000036639 antigens Human genes 0.000 description 25
- 102000005962 receptors Human genes 0.000 description 22
- 108020003175 receptors Proteins 0.000 description 22
- 238000011282 treatment Methods 0.000 description 22
- 239000003446 ligand Substances 0.000 description 19
- 210000001519 tissue Anatomy 0.000 description 18
- 239000000872 buffer Substances 0.000 description 17
- 229960005347 belatacept Drugs 0.000 description 16
- 206010039073 rheumatoid arthritis Diseases 0.000 description 16
- 108060003951 Immunoglobulin Proteins 0.000 description 15
- 108091028043 Nucleic acid sequence Proteins 0.000 description 15
- 230000002163 immunogen Effects 0.000 description 15
- 102000018358 immunoglobulin Human genes 0.000 description 15
- 230000037396 body weight Effects 0.000 description 14
- 238000010494 dissociation reaction Methods 0.000 description 14
- 230000005593 dissociations Effects 0.000 description 14
- 229920000642 polymer Polymers 0.000 description 14
- 230000014509 gene expression Effects 0.000 description 13
- 230000007170 pathology Effects 0.000 description 13
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 12
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 12
- 230000001419 dependent effect Effects 0.000 description 12
- 239000003018 immunosuppressive agent Substances 0.000 description 12
- 102220252247 rs1555583645 Human genes 0.000 description 12
- 208000023275 Autoimmune disease Diseases 0.000 description 11
- 230000001086 cytosolic effect Effects 0.000 description 11
- 229940125721 immunosuppressive agent Drugs 0.000 description 11
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 11
- 102220340769 rs987244110 Human genes 0.000 description 11
- 208000003456 Juvenile Arthritis Diseases 0.000 description 10
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 description 10
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 10
- 230000001976 improved effect Effects 0.000 description 10
- -1 multimer Proteins 0.000 description 10
- 208000024891 symptom Diseases 0.000 description 10
- 208000011580 syndromic disease Diseases 0.000 description 10
- 102220502536 Platelet-activating factor acetylhydrolase IB subunit alpha2_G55E_mutation Human genes 0.000 description 9
- 239000003085 diluting agent Substances 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 210000003734 kidney Anatomy 0.000 description 9
- 201000006417 multiple sclerosis Diseases 0.000 description 9
- 102220222791 rs1060501227 Human genes 0.000 description 9
- 102220082934 rs201875716 Human genes 0.000 description 9
- 102220232156 rs370120266 Human genes 0.000 description 9
- 102200027760 rs75193786 Human genes 0.000 description 9
- 241000894007 species Species 0.000 description 9
- 206010063836 Atrioventricular septal defect Diseases 0.000 description 8
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 8
- 201000004681 Psoriasis Diseases 0.000 description 8
- 230000001363 autoimmune Effects 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 8
- 230000000139 costimulatory effect Effects 0.000 description 8
- 230000004927 fusion Effects 0.000 description 8
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 8
- 208000026278 immune system disease Diseases 0.000 description 8
- 201000002215 juvenile rheumatoid arthritis Diseases 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- COLNVLDHVKWLRT-QMMMGPOBSA-N phenylalanine group Chemical group N[C@@H](CC1=CC=CC=C1)C(=O)O COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 8
- 229920000136 polysorbate Polymers 0.000 description 8
- 230000011664 signaling Effects 0.000 description 8
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 108020004414 DNA Proteins 0.000 description 7
- 206010062016 Immunosuppression Diseases 0.000 description 7
- 108020004511 Recombinant DNA Proteins 0.000 description 7
- 210000000612 antigen-presenting cell Anatomy 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000001211 electron capture detection Methods 0.000 description 7
- 238000001990 intravenous administration Methods 0.000 description 7
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 7
- 238000012545 processing Methods 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 230000001105 regulatory effect Effects 0.000 description 7
- 238000012216 screening Methods 0.000 description 7
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical group OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 6
- 208000015023 Graves' disease Diseases 0.000 description 6
- 239000007995 HEPES buffer Substances 0.000 description 6
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 206010047115 Vasculitis Diseases 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000012258 culturing Methods 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 206010025135 lupus erythematosus Diseases 0.000 description 6
- 150000003839 salts Chemical class 0.000 description 6
- 238000007920 subcutaneous administration Methods 0.000 description 6
- 108091026890 Coding region Proteins 0.000 description 5
- 108020004705 Codon Proteins 0.000 description 5
- 230000005867 T cell response Effects 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 238000004458 analytical method Methods 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 230000002519 immonomodulatory effect Effects 0.000 description 5
- 125000005647 linker group Chemical group 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 230000000069 prophylactic effect Effects 0.000 description 5
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 5
- 235000000346 sugar Nutrition 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- 208000026872 Addison Disease Diseases 0.000 description 4
- 208000032671 Allergic granulomatous angiitis Diseases 0.000 description 4
- 206010002556 Ankylosing Spondylitis Diseases 0.000 description 4
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 description 4
- 208000023328 Basedow disease Diseases 0.000 description 4
- 208000009137 Behcet syndrome Diseases 0.000 description 4
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 description 4
- 208000006344 Churg-Strauss Syndrome Diseases 0.000 description 4
- 208000015943 Coeliac disease Diseases 0.000 description 4
- 208000011038 Cold agglutinin disease Diseases 0.000 description 4
- 206010009868 Cold type haemolytic anaemia Diseases 0.000 description 4
- 206010009900 Colitis ulcerative Diseases 0.000 description 4
- 208000011231 Crohn disease Diseases 0.000 description 4
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 4
- 208000018428 Eosinophilic granulomatosis with polyangiitis Diseases 0.000 description 4
- 108010087819 Fc receptors Proteins 0.000 description 4
- 102000009109 Fc receptors Human genes 0.000 description 4
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 4
- 208000010159 IgA glomerulonephritis Diseases 0.000 description 4
- 206010021263 IgA nephropathy Diseases 0.000 description 4
- 108091005461 Nucleic proteins Proteins 0.000 description 4
- 241000721454 Pemphigus Species 0.000 description 4
- 239000002202 Polyethylene glycol Substances 0.000 description 4
- 206010057244 Post viral fatigue syndrome Diseases 0.000 description 4
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 4
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 4
- 208000025747 Rheumatic disease Diseases 0.000 description 4
- 201000009594 Systemic Scleroderma Diseases 0.000 description 4
- 206010042953 Systemic sclerosis Diseases 0.000 description 4
- 108091008874 T cell receptors Proteins 0.000 description 4
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 4
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 4
- 206010052779 Transplant rejections Diseases 0.000 description 4
- 201000006704 Ulcerative Colitis Diseases 0.000 description 4
- 102220550784 Unconventional myosin-X_V32I_mutation Human genes 0.000 description 4
- 238000007792 addition Methods 0.000 description 4
- 206010003246 arthritis Diseases 0.000 description 4
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 4
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 description 4
- 230000004940 costimulation Effects 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 206010012601 diabetes mellitus Diseases 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 4
- 125000003827 glycol group Chemical group 0.000 description 4
- 238000003018 immunoassay Methods 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 description 4
- 206010028417 myasthenia gravis Diseases 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 229920001223 polyethylene glycol Polymers 0.000 description 4
- 230000003389 potentiating effect Effects 0.000 description 4
- 208000002574 reactive arthritis Diseases 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 239000001509 sodium citrate Substances 0.000 description 4
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 4
- 230000009870 specific binding Effects 0.000 description 4
- 230000000638 stimulation Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 230000001629 suppression Effects 0.000 description 4
- 229940124597 therapeutic agent Drugs 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000013518 transcription Methods 0.000 description 4
- 230000035897 transcription Effects 0.000 description 4
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 4
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 3
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- 108091006020 Fc-tagged proteins Proteins 0.000 description 3
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 3
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 3
- 108010002350 Interleukin-2 Proteins 0.000 description 3
- 102000000588 Interleukin-2 Human genes 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- 108700026244 Open Reading Frames Proteins 0.000 description 3
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- 229960003697 abatacept Drugs 0.000 description 3
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 3
- 230000003110 anti-inflammatory effect Effects 0.000 description 3
- 230000005875 antibody response Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 150000002016 disaccharides Chemical class 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 230000009036 growth inhibition Effects 0.000 description 3
- 210000002216 heart Anatomy 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 208000025095 immunoproliferative disease Diseases 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 239000002736 nonionic surfactant Substances 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 229920001993 poloxamer 188 Polymers 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 230000002062 proliferating effect Effects 0.000 description 3
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 102220029635 rs146867923 Human genes 0.000 description 3
- 239000005720 sucrose Substances 0.000 description 3
- 229960004793 sucrose Drugs 0.000 description 3
- 125000000185 sucrose group Chemical group 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 210000000225 synapse Anatomy 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000005030 transcription termination Effects 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 239000013603 viral vector Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- 206010056508 Acquired epidermolysis bullosa Diseases 0.000 description 2
- 208000008190 Agammaglobulinemia Diseases 0.000 description 2
- 206010003267 Arthritis reactive Diseases 0.000 description 2
- 201000001320 Atherosclerosis Diseases 0.000 description 2
- 208000002017 Autoimmune Hypophysitis Diseases 0.000 description 2
- 206010003827 Autoimmune hepatitis Diseases 0.000 description 2
- 206010064539 Autoimmune myocarditis Diseases 0.000 description 2
- 208000031212 Autoimmune polyendocrinopathy Diseases 0.000 description 2
- 208000022106 Autoimmune polyendocrinopathy type 2 Diseases 0.000 description 2
- 102000005738 B7 Antigens Human genes 0.000 description 2
- 108010045634 B7 Antigens Proteins 0.000 description 2
- 208000027496 Behcet disease Diseases 0.000 description 2
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 2
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 2
- 201000002829 CREST Syndrome Diseases 0.000 description 2
- 208000031229 Cardiomyopathies Diseases 0.000 description 2
- 208000024172 Cardiovascular disease Diseases 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 206010057645 Chronic Inflammatory Demyelinating Polyradiculoneuropathy Diseases 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- 208000019707 Cryoglobulinemic vasculitis Diseases 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- 229940123907 Disease modifying antirheumatic drug Drugs 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 208000004332 Evans syndrome Diseases 0.000 description 2
- 108091029865 Exogenous DNA Proteins 0.000 description 2
- 206010015943 Eye inflammation Diseases 0.000 description 2
- 208000001640 Fibromyalgia Diseases 0.000 description 2
- 208000007465 Giant cell arteritis Diseases 0.000 description 2
- 208000024869 Goodpasture syndrome Diseases 0.000 description 2
- 208000003807 Graves Disease Diseases 0.000 description 2
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 2
- 101100166600 Homo sapiens CD28 gene Proteins 0.000 description 2
- 206010020751 Hypersensitivity Diseases 0.000 description 2
- 206010020983 Hypogammaglobulinaemia Diseases 0.000 description 2
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 2
- 102000009490 IgG Receptors Human genes 0.000 description 2
- 108010073807 IgG Receptors Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108010050904 Interferons Proteins 0.000 description 2
- 102000014150 Interferons Human genes 0.000 description 2
- 208000029523 Interstitial Lung disease Diseases 0.000 description 2
- 208000011200 Kawasaki disease Diseases 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- 208000005777 Lupus Nephritis Diseases 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 2
- 208000027530 Meniere disease Diseases 0.000 description 2
- 208000003250 Mixed connective tissue disease Diseases 0.000 description 2
- 206010028372 Muscular weakness Diseases 0.000 description 2
- 206010029240 Neuritis Diseases 0.000 description 2
- 206010034277 Pemphigoid Diseases 0.000 description 2
- 201000011152 Pemphigus Diseases 0.000 description 2
- 208000031845 Pernicious anaemia Diseases 0.000 description 2
- 206010065159 Polychondritis Diseases 0.000 description 2
- 208000007048 Polymyalgia Rheumatica Diseases 0.000 description 2
- 206010036105 Polyneuropathy Diseases 0.000 description 2
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 206010037779 Radiculopathy Diseases 0.000 description 2
- 208000012322 Raynaud phenomenon Diseases 0.000 description 2
- 208000033464 Reiter syndrome Diseases 0.000 description 2
- 206010039710 Scleroderma Diseases 0.000 description 2
- 208000021386 Sjogren Syndrome Diseases 0.000 description 2
- 206010072148 Stiff-Person syndrome Diseases 0.000 description 2
- 208000001106 Takayasu Arteritis Diseases 0.000 description 2
- 206010046851 Uveitis Diseases 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 206010047642 Vitiligo Diseases 0.000 description 2
- 230000001154 acute effect Effects 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 208000004631 alopecia areata Diseases 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 230000003367 anti-collagen effect Effects 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 208000006673 asthma Diseases 0.000 description 2
- 230000003143 atherosclerotic effect Effects 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 208000018093 autoimmune cholangitis Diseases 0.000 description 2
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 2
- 208000027625 autoimmune inner ear disease Diseases 0.000 description 2
- 201000009780 autoimmune polyendocrine syndrome type 2 Diseases 0.000 description 2
- 206010003883 azoospermia Diseases 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 208000000594 bullous pemphigoid Diseases 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 201000005795 chronic inflammatory demyelinating polyneuritis Diseases 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 201000003278 cryoglobulinemia Diseases 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 230000016396 cytokine production Effects 0.000 description 2
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 201000001981 dermatomyositis Diseases 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000002988 disease modifying antirheumatic drug Substances 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 201000011114 epidermolysis bullosa acquisita Diseases 0.000 description 2
- 206010016256 fatigue Diseases 0.000 description 2
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 208000024908 graft versus host disease Diseases 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 230000016784 immunoglobulin production Effects 0.000 description 2
- 238000000099 in vitro assay Methods 0.000 description 2
- 208000033065 inborn errors of immunity Diseases 0.000 description 2
- 230000002757 inflammatory effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- 210000001503 joint Anatomy 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 201000011486 lichen planus Diseases 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000002751 lymph Anatomy 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 238000007799 mixed lymphocyte reaction assay Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- 208000001725 mucocutaneous lymph node syndrome Diseases 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 230000036473 myasthenia Effects 0.000 description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 201000005737 orchitis Diseases 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 201000001976 pemphigus vulgaris Diseases 0.000 description 2
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 2
- 201000006292 polyarteritis nodosa Diseases 0.000 description 2
- 208000005987 polymyositis Diseases 0.000 description 2
- 208000019629 polyneuritis Diseases 0.000 description 2
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 208000005069 pulmonary fibrosis Diseases 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 238000003259 recombinant expression Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 208000037803 restenosis Diseases 0.000 description 2
- 201000003068 rheumatic fever Diseases 0.000 description 2
- 102200128633 rs104893843 Human genes 0.000 description 2
- 102200163548 rs63751094 Human genes 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 201000000306 sarcoidosis Diseases 0.000 description 2
- 230000037390 scarring Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 229940074404 sodium succinate Drugs 0.000 description 2
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 2
- 239000007790 solid phase Substances 0.000 description 2
- 230000003637 steroidlike Effects 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000008362 succinate buffer Substances 0.000 description 2
- 150000005846 sugar alcohols Chemical class 0.000 description 2
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 2
- 206010043207 temporal arteritis Diseases 0.000 description 2
- 206010043778 thyroiditis Diseases 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- VGONTNSXDCQUGY-RRKCRQDMSA-N 2'-deoxyinosine Chemical group C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC2=O)=C2N=C1 VGONTNSXDCQUGY-RRKCRQDMSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- 102100028626 4-hydroxyphenylpyruvate dioxygenase Human genes 0.000 description 1
- BSYNRYMUTXBXSQ-FOQJRBATSA-N 59096-14-9 Chemical compound CC(=O)OC1=CC=CC=C1[14C](O)=O BSYNRYMUTXBXSQ-FOQJRBATSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 241000272517 Anseriformes Species 0.000 description 1
- 208000006820 Arthralgia Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 230000003844 B-cell-activation Effects 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102220573534 C-C motif chemokine 5_G55K_mutation Human genes 0.000 description 1
- 108010074051 C-Reactive Protein Proteins 0.000 description 1
- 102100032752 C-reactive protein Human genes 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- HECLRDQVFMWTQS-UHFFFAOYSA-N Dicyclopentadiene Chemical compound C1C2C3CC=CC3C1C=C2 HECLRDQVFMWTQS-UHFFFAOYSA-N 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241000282575 Gorilla Species 0.000 description 1
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 1
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 1
- 102000010789 Interleukin-2 Receptors Human genes 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- 206010023230 Joint stiffness Diseases 0.000 description 1
- 206010023232 Joint swelling Diseases 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- MQHWFIOJQSCFNM-UHFFFAOYSA-L Magnesium salicylate Chemical compound [Mg+2].OC1=CC=CC=C1C([O-])=O.OC1=CC=CC=C1C([O-])=O MQHWFIOJQSCFNM-UHFFFAOYSA-L 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 102000003945 NF-kappa B Human genes 0.000 description 1
- 108010057466 NF-kappa B Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 241000282520 Papio Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 241000276498 Pollachius virens Species 0.000 description 1
- 241000282405 Pongo abelii Species 0.000 description 1
- 102220493431 Putative uncharacterized protein encoded by MIR7-3HG_K28N_mutation Human genes 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 1
- ABBQHOQBGMUPJH-UHFFFAOYSA-M Sodium salicylate Chemical compound [Na+].OC1=CC=CC=C1C([O-])=O ABBQHOQBGMUPJH-UHFFFAOYSA-M 0.000 description 1
- 108091081024 Start codon Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 230000017274 T cell anergy Effects 0.000 description 1
- 230000024932 T cell mediated immunity Effects 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 108700019146 Transgenes Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical group O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 125000000613 asparagine group Chemical group N[C@@H](CC(N)=O)C(=O)* 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N aspartic acid group Chemical group N[C@@H](CC(=O)O)C(=O)O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 102000055104 bcl-X Human genes 0.000 description 1
- 108700000711 bcl-X Proteins 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000001516 cell proliferation assay Methods 0.000 description 1
- 230000008614 cellular interaction Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 239000003593 chromogenic compound Substances 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000007402 cytotoxic response Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000000432 density-gradient centrifugation Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- 229960000284 efalizumab Drugs 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 238000013467 fragmentation Methods 0.000 description 1
- 238000006062 fragmentation reaction Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000000404 glutamine group Chemical group N[C@@H](CCC(N)=O)C(=O)* 0.000 description 1
- 150000002337 glycosamines Chemical group 0.000 description 1
- 239000005090 green fluorescent protein Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 239000000710 homodimer Substances 0.000 description 1
- 230000008348 humoral response Effects 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000005462 in vivo assay Methods 0.000 description 1
- 230000001965 increasing effect Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 125000000741 isoleucyl group Chemical group [H]N([H])C(C(C([H])([H])[H])C([H])([H])C([H])([H])[H])C(=O)O* 0.000 description 1
- 238000000111 isothermal titration calorimetry Methods 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 229940072082 magnesium salicylate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 238000001216 nucleic acid method Methods 0.000 description 1
- 238000001668 nucleic acid synthesis Methods 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000009696 proliferative response Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000012121 regulation of immune response Effects 0.000 description 1
- 230000032537 response to toxin Effects 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 102220277465 rs1403203490 Human genes 0.000 description 1
- 102220065537 rs201161721 Human genes 0.000 description 1
- 102220044848 rs377730553 Human genes 0.000 description 1
- 102220321637 rs377730553 Human genes 0.000 description 1
- 102200027763 rs75193786 Human genes 0.000 description 1
- 102220059216 rs771261665 Human genes 0.000 description 1
- 102220241278 rs777474053 Human genes 0.000 description 1
- 102220000564 rs78778622 Human genes 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 229960004025 sodium salicylate Drugs 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical group CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000001131 transforming effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 208000014001 urinary system disease Diseases 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70521—CD28, CD152
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Immunology (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Toxicology (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Transplantation (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
本願は、2007年11月1日に出願された米国特許仮出願第60/984,631号および2008年5月7日に出願された米国特許仮出願第61/051,215号に係る優先権およびこれらの利益を主張する。これらのそれぞれの開示はその全体が、全ての目的のために参照により本明細書に組み入れられる。
37 C.F.R. 1.71(e)に従って、出願人らは、この開示の一部が、著作権保護対象の要素を含むことを注記する。著作権者は、特許文書または特許開示が米国特許商標庁の特許ファイルまたは記録に公表されているため、いかなる者でも特許文書または特許開示の複製を拒否しないが、その他の場合には、いかなるものでも全ての著作権を所有する。
本発明は、概して、CD80および/またはCD86に結合する新規のポリペプチド、このようなポリペプチドをコードする核酸、ならびにこのようなポリペプチドおよび核酸を作る方法および使用する方法に関する。
T細胞は、免疫応答の開始および調整において主要な役割を果たしている。T細胞の完全な活性化が起こるためには、少なくとも2つの異なるシグナル伝達事象が必要とされる。第1のシグナルは、T細胞上に発現しているT細胞受容体(TCR)と、抗原提示細胞(APC)上に発現している主要組織適合複合体(MHC)分子と関連して提示された特異的抗原(Ag)が相互作用することによって発生する。第2のシグナル(補助刺激)は、APC上に発現している補助刺激リガンドと、T細胞上に発現している対応する受容体が相互作用することによって発生する。主要な補助刺激経路は、APC上に発現しているCD80(B7-1またはB7.1)およびCD86(B7-2またはB7.2)リガンドと、主にT細胞上で発現しているCD28およびCTLA-4(CD152とも知られる)との相互作用を伴う。CTLA-4(細胞傷害性Tリンパ球抗原4)およびCD28は、CD80およびCD86リガンドの受容体として役立つ。
[請求項1001]
15個までのアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なるポリペプチド配列を含み、CD80もしくはCD86またはいずれかの細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、単離されたまたは組換え型のCTLA-4ポリペプチド。
[請求項1002]
SEQ ID NO:36のポリペプチド配列と少なくとも90%の配列同一性を有する、請求項1001記載の単離されたまたは組換え型のポリペプチド。
[請求項1003]
SEQ ID NO:36のポリペプチド配列と少なくとも95%の配列同一性を有する、請求項1002記載の単離されたまたは組換え型のポリペプチド。
[請求項1004]
SEQ ID NO:36のポリペプチド配列を含む、請求項1003記載の単離されたまたは組換え型のポリペプチド。
[請求項1005]
SEQ ID NO:50のポリペプチド配列と少なくとも90%の配列同一性を有する、請求項1001記載の単離されたまたは組換え型のポリペプチド。
[請求項1006]
SEQ ID NO:50のポリペプチド配列と少なくとも95%の配列同一性を有する、請求項1005記載の単離されたまたは組換え型のポリペプチド。
[請求項1007]
SEQ ID NO:50のポリペプチド配列を含む、請求項1006記載の単離されたまたは組換え型のポリペプチド。
[請求項1008]
CD80がヒトCD80であり、CD86がヒトCD86である、前記請求項のいずれか一項記載のポリペプチド。
[請求項1009]
124アミノ酸残基長のポリペプチド配列を含む、前記請求項のいずれか一項記載のポリペプチド。
[請求項1010]
SEQ ID NO:159を基準として、位置50、54、55、56、64、65、70、または85に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において1個のアミノ酸置換を含む、前記請求項のいずれか一項記載のポリペプチド。
[請求項1011]
SEQ ID NO:159を基準として、位置50、54、55、56、64、65、70、または85に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において2個のアミノ酸置換を含む、前記請求項のいずれか一項記載のポリペプチド。
[請求項1012]
SEQ ID NO:159を基準として、位置50、54、55、56、64、65、70、または85に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において3個のアミノ酸置換を含む、前記請求項のいずれか一項記載のポリペプチド。
[請求項1013]
SEQ ID NO:159を基準として、位置50、54、55、56、64、65、70、または85に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において4個のアミノ酸置換を含む、前記請求項のいずれか一項記載のポリペプチド。
[請求項1014]
SEQ ID NO:159を基準として、位置70におけるアミノ酸置換を含む、請求項1010〜1013のいずれか一項記載のポリペプチド。
[請求項1015]
SEQ ID NO:159を基準として、位置70のアミノ酸置換がS70Fである、請求項1014記載のポリペプチド。
[請求項1016]
SEQ ID NO:159を基準として、位置104におけるアミノ酸置換をさらに含む、請求項1010〜1015のいずれか一項記載のポリペプチド。
[請求項1017]
SEQ ID NO:159を基準として、位置104のアミノ酸置換がL104Eである、請求項1016記載のポリペプチド。
[請求項1018]
SEQ ID NO:159を基準として、位置30におけるアミノ酸置換をさらに含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1019]
SEQ ID NO:159を基準として、位置30のアミノ酸置換がT30N/D/Aである、請求項1018記載のポリペプチド。
[請求項1020]
SEQ ID NO:159を基準として、位置30の置換がT30Nである、請求項1019記載のポリペプチド。
[請求項1021]
SEQ ID NO:159を基準として、位置64におけるアミノ酸置換を含む、請求項1010〜1020のいずれか一項記載のポリペプチド。
[請求項1022]
SEQ ID NO:159を基準として、位置64のアミノ酸置換がS64Pである、請求項1021記載のポリペプチド。
[請求項1023]
SEQ ID NO:159を基準として、位置50におけるアミノ酸置換を含む、請求項1010〜1022のいずれか一項記載のポリペプチド。
[請求項1024]
SEQ ID NO:159を基準として、位置50のアミノ酸置換がA50Mである、請求項1023記載のポリペプチド。
[請求項1025]
SEQ ID NO:159を基準として、位置54におけるアミノ酸置換を含む、請求項1010〜1024のいずれか一項記載のポリペプチド。
[請求項1026]
SEQ ID NO:159を基準として、位置54のアミノ酸置換がM54K/Vである、請求項1025記載のポリペプチド。
[請求項1027]
SEQ ID NO:159を基準として、位置54のアミノ酸置換がM54Kである、請求項1026記載のポリペプチド。
[請求項1028]
SEQ ID NO:159を基準として、位置65におけるアミノ酸置換を含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1029]
SEQ ID NO:159を基準として、位置65のアミノ酸置換がI65Sである、請求項1028記載のポリペプチド。
[請求項1030]
SEQ ID NO:159を基準として、位置56におけるアミノ酸置換を含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1031]
SEQ ID NO:159を基準として、位置56のアミノ酸置換がN56Dである、請求項1030記載のポリペプチド。
[請求項1032]
SEQ ID NO:159を基準として、位置55におけるアミノ酸置換を含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1033]
SEQ ID NO:159を基準として、位置55のアミノ酸置換がG55Eである、請求項1032記載のポリペプチド。
[請求項1034]
SEQ ID NO:159を基準として、位置85におけるアミノ酸置換を含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1035]
SEQ ID NO:159を基準として、位置55のアミノ酸置換がM85Aである、請求項1034記載のポリペプチド。
[請求項1036]
SEQ ID NO:159を基準として、位置24におけるアミノ酸置換をさらに含む、請求項1010〜1017のいずれか一項記載のポリペプチド。
[請求項1037]
SEQ ID NO:159を基準として、位置24のアミノ酸置換がA24E/Sである、請求項1036記載のポリペプチド。
[請求項1038]
SEQ ID NO:159を基準として、位置24のアミノ酸置換がA24Eである、請求項1037記載のポリペプチド。
[請求項1039]
CD86またはCD86の細胞外ドメインに対する単量体ヒトCTLA-4の細胞外ドメインの結合親和性にほぼ等しいか、またはこれより大きな、CD86またはその細胞外ドメインに対する結合親和性を有する、前記請求項のいずれか一項記載のポリペプチド。
[請求項1040]
CD80またはCD80の細胞外ドメインに対する単量体ヒトCTLA-4の細胞外ドメインの結合親和性より大きな、CD80またはその細胞外ドメインに対する結合親和性を有する、前記請求項のいずれか一項記載のポリペプチド。
[請求項1041]
免疫応答を抑制する能力を有する、前記請求項のいずれか一項記載のポリペプチド。
[請求項1042]
T細胞活性化またはT細胞増殖を阻害する能力を有する、前記請求項のいずれか一項記載のポリペプチド。
[請求項1043]
前記請求項のいずれか一項記載の少なくとも2つのポリペプチドを含む、単離されたまたは組換え型のポリペプチド多量体。
[請求項1044]
(a)請求項1001〜1042のいずれか一項記載のポリペプチドと、(b)Ig Fcポリペプチドである第2のポリペプチドとを含み、
CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合する能力、ならびに/あるいは免疫応答を調節または調整する能力を有する、
単離されたまたは組換え型の融合タンパク質。
[請求項1045]
請求項1044記載の2つの単量体融合タンパク質を含む、単離されたまたは組換え型の二量体融合タンパク質。
[請求項1046]
請求項1001〜1042のいずれか一項記載のポリペプチド、請求項1043記載の多量体、請求項1044記載の融合タンパク質、または請求項1045記載の二量体融合タンパク質をコードするヌクレオチド配列を含む、単離されたまたは組換え型の核酸。
[請求項1047]
請求項1046記載の核酸を含む、ベクター。
[請求項1048]
(a)請求項1001〜1042のいずれか一項記載のポリペプチド;
(b)請求項1043記載の多量体;
(c)請求項1044記載の融合タンパク質;
(d)請求項1045記載の二量体融合タンパク質;
(e)請求項1046記載の核酸;および/または
(f)請求項1047記載のベクター
を含む、単離されたまたは組換え型の宿主細胞。
[請求項1049]
薬学的に許容される賦形剤または薬学的に許容される担体、ならびに以下:
(a)請求項1001〜1042のいずれか一項記載のポリペプチド;
(b)請求項1043記載の多量体;
(c)請求項1044記載の融合タンパク質;
(d)請求項1045記載の二量体融合タンパク質;
(e)請求項1046記載の核酸;
(f)請求項1047記載のベクター;および/もしくは
(g)請求項1048記載の宿主細胞
の1つまたは複数を含む、薬学的組成物。
[請求項1050]
免疫応答を抑制するのに有効な量の
(a)請求項1001〜1042のいずれか一項記載のポリペプチド;
(b)請求項1043記載の多量体;
(c)請求項1044記載の融合タンパク質;
(d)請求項1045記載の二量体融合タンパク質;
(e)請求項1046記載の核酸;
(f)請求項1047記載のベクター;および/または
(g)請求項1048記載の宿主細胞
の少なくとも1つとB7陽性細胞とを接触させる工程であって、それによって免疫応答が抑制される、工程
を含む、免疫応答を抑制するための方法。
[請求項1051]
免疫応答の抑制において使用するための、請求項1001〜1042のいずれか一項記載のポリペプチド、請求項1043記載の多量体、請求項1044記載の融合タンパク質、請求項1045記載の二量体融合タンパク質、請求項1046記載の核酸、請求項1047記載のベクター、および/または請求項1048記載の宿主細胞。
[請求項1052]
免疫応答を抑制するための医薬の製造における、請求項1001〜1042のいずれか一項記載のポリペプチド、請求項1043記載の多量体、請求項1044記載の融合タンパク質、請求項1045記載の二量体融合タンパク質、請求項1046記載の核酸、請求項1047記載のベクター、および/または請求項1048記載の宿主細胞の使用。
[請求項1053]
SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含み、CD80もしくはCD86またはいずれかの細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、単離されたまたは組換え型のポリペプチド。
[請求項1054]
CD80がヒトCD80であり、CD86がヒトCD86である、請求項1053記載のポリペプチド。
[請求項1055]
免疫応答を抑制もしくは阻害する能力を有する、請求項1053〜1054のいずれか一項記載のポリペプチド。
[請求項1056]
T細胞活性化を阻害する能力を有する、請求項1053〜1055のいずれか一項記載のポリペプチド。
[請求項1057]
T細胞増殖を阻害する能力を有する、請求項1053〜1055のいずれか一項記載のポリペプチド。
[請求項1058]
CTLA-4より大きな、免疫応答を抑制または阻害する能力を有する、請求項1053〜1057のいずれか一項記載のポリペプチド。
[請求項1059]
ヒトCTLA-4がT細胞活性化またはT細胞増殖を阻害する能力より大きな、T細胞活性化またはT細胞増殖を阻害する能力を有する、請求項1053記載のポリペプチド。
[請求項1060]
ヒトCTLA-4の細胞外ドメインがT細胞活性化またはT細胞増殖を阻害する能力より大きな、T細胞活性化またはT細胞増殖を阻害する能力を有する、請求項1053記載のポリペプチド。
[請求項1061]
SEQ ID NO:168に示したポリペプチド配列を含むLEA29Yポリペプチドが免疫応答を阻害する能力より大きな、免疫応答を阻害する能力を有する、請求項1053〜1057のいずれか一項記載のポリペプチド。
[請求項1062]
SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも96%、97%、98%、または99%の配列同一性を有するポリペプチド配列を含む、請求項1053〜1061のいずれか一項記載のポリペプチド。
[請求項1063]
SEQ ID NO:1-73からなる群より選択されるポリペプチド配列を含む、請求項1053〜1062のいずれか一項記載のポリペプチド。
[請求項1064]
SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含み、単量体ヒトCD80もしくは単量体ヒトCD86またはいずれかの細胞外ドメインに結合する、単離されたまたは組換え型のポリペプチド。
[請求項1065]
単量体ヒトCD86に対する単量体ヒトCTLA-4の結合親和性にほぼ等しいか、またはこれより大きな、単量体ヒトCD86に対する結合親和性を有する、請求項1064記載のポリペプチド。
[請求項1066]
単量体ヒトCD80に対する単量体ヒトCTLA-4の結合親和性にほぼ等しいか、またはこれより大きな、単量体ヒトCD80に対する結合親和性を有する、請求項1064記載のポリペプチド。
[請求項1067]
単量体ヒトCD80に対する単量体ヒトCTLA-4の結合親和性にほぼ等しいか、またはこれより大きな、単量体ヒトCD80に対する結合親和性を有する、請求項1065記載のポリペプチド。
[請求項1068]
単量体ヒトCTLA-4より大きな、免疫応答を抑制する能力、T細胞活性化を阻害する能力、および/またはT細胞増殖を阻害する能力を有する、請求項1064〜1067のいずれか一項記載のポリペプチド。
[請求項1069]
SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含む、単離されたまたは組換え型のポリペプチドであって、
該ポリペプチドが、それぞれ、ヒトCD86の細胞外ドメインまたはヒトCD80の細胞外ドメインに対するヒトCTLA-4の細胞外ドメインの結合親和性にほぼ等しいか、またはこれより大きな、ヒトCD86の細胞外ドメインまたはヒトCD80の細胞外ドメインに対する結合親和性を有し、
該ポリペプチドが、任意で、免疫応答を抑制する能力を有する、
単離されたまたは組換え型のポリペプチド。
[請求項1070]
ヒトCD86の細胞外ドメインに対するヒトCTLA-4の細胞外ドメインの結合親和性より大きな、ヒトCD86の細胞外ドメインに対する結合親和性を有する、請求項1069記載のポリペプチド。
[請求項1071]
ヒトCD80の細胞外ドメインに対するヒトCTLA-4の細胞外ドメインの結合親和性より大きな、ヒトCD80の細胞外ドメインに対する結合親和性を有する、請求項1070記載のポリペプチド。
[請求項1072]
ヒトCTLA-4の細胞外ドメインより大きな、免疫応答を抑制する能力、T細胞活性化を阻害する能力、および/またはT細胞増殖を阻害する能力を有する、請求項1069〜1071のいずれか一項記載のポリペプチド。
[請求項1073]
変異体ポリペプチドが124アミノ酸残基長のポリペプチド配列を含む、請求項1053記載のポリペプチド。
[請求項1074]
(a)11個以下、10個以下、9個以下、8個以下、7個以下、または6個以下のアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なり、(b)SEQ ID NO:159を基準として、位置24、30、32、50、54、55、56、64、65、70、または85に対応するアミノ酸残基位置において少なくとも1個のアミノ酸置換を含む、ポリペプチド配列
を含む、単離されたまたは組換え型の変異体CTLA-4ポリペプチドであって、
CD80もしくはCD86またはいずれかの細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、
単離されたまたは組換え型の変異体CTLA-4ポリペプチド。
[請求項1075]
CD80がヒトCD80であり、CD86がヒトCD86である、請求項1074記載のポリペプチド。
[請求項1076]
変異体ポリペプチドが124アミノ酸残基長のポリペプチド配列を含む、請求項1074記載のポリペプチド。
[請求項1077]
SEQ ID NO:159を基準として、位置24、30、32、50、54、55、56、64、65、70、85、または104に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において2個のアミノ酸置換を含む、請求項1074記載のポリペプチド。
[請求項1078]
SEQ ID NO:159を基準として、位置24、30、32、50、54、55、56、64、65、70、85、または104に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において3個のアミノ酸置換を含む、請求項1074記載のポリペプチド。
[請求項1079]
SEQ ID NO:159を基準として、位置24、30、32、50、54、55、56、64、65、70、85、または104に対応するアミノ酸位置からなる群より選択されるアミノ酸位置において4個のアミノ酸置換を含む、請求項1074記載のポリペプチド。
[請求項1080]
SEQ ID NO:159を基準として、位置70におけるアミノ酸置換を含む、請求項1074記載のポリペプチド。
[請求項1081]
SEQ ID NO:159を基準として、位置70のアミノ酸置換がS70Fである、請求項1080記載のポリペプチド。
[請求項1082]
SEQ ID NO:159を基準として、位置104におけるアミノ酸置換をさらに含む、請求項1074〜1081のいずれか一項記載のポリペプチド。
[請求項1083]
SEQ ID NO:159を基準として、位置104のアミノ酸置換がL104Eである、請求項1082記載のポリペプチド。
[請求項1084]
SEQ ID NO:159を基準として、位置30でのアミノ酸置換をさらに含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1085]
SEQ ID NO:159を基準として、位置30の置換がT30N/D/Aである、請求項1084記載のポリペプチド。
[請求項1086]
SEQ ID NO:159を基準として、位置30の置換がT30Nである、請求項1085記載のポリペプチド。
[請求項1087]
SEQ ID NO:159を基準として、位置64におけるアミノ酸置換を含む、請求項1074〜1086のいずれか一項記載のポリペプチド。
[請求項1088]
SEQ ID NO:159を基準として、位置64のアミノ酸置換がS64Pである、請求項1087記載のポリペプチド。
[請求項1089]
SEQ ID NO:159を基準として、位置50におけるアミノ酸置換を含む、請求項1074〜1088のいずれか一項記載のポリペプチド。
[請求項1090]
SEQ ID NO:159を基準として、位置50のアミノ酸置換がA50Mである、請求項1089記載のポリペプチド。
[請求項1091]
SEQ ID NO:159を基準として、位置54におけるアミノ酸置換を含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1092]
SEQ ID NO:159を基準として、位置54のアミノ酸置換がM54K/Vである、請求項1091記載のポリペプチド。
[請求項1093]
SEQ ID NO:159を基準として、位置54のアミノ酸置換がM54Kである、請求項1092記載のポリペプチド。
[請求項1094]
SEQ ID NO:159を基準として、位置65におけるアミノ酸置換を含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1095]
SEQ ID NO:159を基準として、位置65のアミノ酸置換がI65Sである、請求項1094記載のポリペプチド。
[請求項1096]
SEQ ID NO:159を基準として、位置56におけるアミノ酸置換を含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1097]
SEQ ID NO:159を基準として、位置56のアミノ酸置換がN56Dである、請求項1096記載のポリペプチド。
[請求項1098]
SEQ ID NO:159を基準として、位置55におけるアミノ酸置換を含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1099]
SEQ ID NO:159を基準として、位置55のアミノ酸置換がG55Eである、請求項1098記載のポリペプチド。
[請求項1100]
SEQ ID NO:159を基準として、位置85におけるアミノ酸置換を含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1101]
SEQ ID NO:159を基準として、位置55のアミノ酸置換がM85Aである、請求項1100記載のポリペプチド。
[請求項1102]
SEQ ID NO:159を基準として、位置24のアミノ酸置換をさらに含む、請求項1074〜1083のいずれか一項記載のポリペプチド。
[請求項1103]
SEQ ID NO:159を基準として、位置24のアミノ酸置換がA24E/Sである、請求項1102記載のポリペプチド。
[請求項1104]
SEQ ID NO:159を基準として、位置24のアミノ酸置換がA24Eである、請求項1103記載のポリペプチド。
[請求項1105]
CD86またはCD86の細胞外ドメインに対する単量体ヒトCTLA-4の細胞外ドメインの結合親和性にほぼ等しいか、またはこれより大きな、CD86またはその細胞外ドメインに対する結合親和性を有する、請求項1074〜1104のいずれか一項記載のポリペプチド。
[請求項1106]
CD80またはCD80の細胞外ドメインに対する単量体ヒトCTLA-4の細胞外ドメインの結合親和性より大きな、CD80またはその細胞外ドメインに対する結合親和性を有する、請求項1074〜1105のいずれか一項記載のポリペプチド。
[請求項1107]
免疫応答を抑制する能力を有する、請求項1074〜1106のいずれか一項記載のポリペプチド。
[請求項1108]
T細胞活性化またはT細胞増殖を阻害する能力を有する、請求項1074〜1107のいずれか一項記載のポリペプチド。
[請求項1109]
(i)SEQ ID NO:1-73からなる群より選択されるポリペプチド配列と少なくとも95%の配列同一性と、(ii)SEQ ID NO:1-73からなる群より選択される該ポリペプチド配列の位置70に対応するアミノ酸位置にあるフェニルアラニン残基とを含む、ポリペプチド配列
を含む、単離されたまたは組換え型のポリペプチドであって、
CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、
単離されたまたは組換え型のポリペプチド。
[請求項1110]
位置24に対応するアミノ酸位置にあるグルタミン酸残基;
位置30に対応するアミノ酸位置にあるアスパラギン残基;
位置32に対応するアミノ酸位置にあるイソロイシン残基;
位置50に対応するアミノ酸位置にあるメチオニン残基;
位置54に対応するアミノ酸位置にあるリジン残基;
位置55に対応するアミノ酸位置にあるグルタミン酸残基;
位置56に対応するアミノ酸位置にあるアスパラギン酸残基;
位置64に対応するアミノ酸位置にあるプロリン残基;
位置65に対応するアミノ酸位置にあるセリン残基;および
位置104に対応するアミノ酸位置にあるグルタミン酸残基
の1つまたは複数を含む、請求項1109記載のポリペプチド。
[請求項1111]
CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制することができる、単離されたまたは組換え型の変異体CTLA-4ポリペプチドであって、
該ポリペプチドが、(a)6個以下のアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインポリペプチドのポリペプチド配列とは異なり、かつ(b)少なくとも1個のアミノ酸置換を含むポリペプチド配列であって、少なくとも1個のアミノ酸置換がS70Fを含み、アミノ酸残基位置の番号がSEQ ID NO:159に従って付けられている、ポリペプチド配列を含む、
単離されたまたは組換え型の変異体CTLA-4ポリペプチド。
[請求項1112]
A24E、T30N、V32I、D41G、A50M、M54K、G55E、N56D、S64P、I65S、M85A、L104E、およびI106Fからなる群より選択される少なくとも1個のアミノ酸置換をさらに含む、請求項1111記載のポリペプチド。
[請求項1113]
SEQ ID NO:1-79からなる群より選択されるポリペプチド配列、または任意の該ポリペプチド配列の断片を含む、単離されたまたは組換え型のポリペプチドであって、
該断片が、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、
単離されたまたは組換え型のポリペプチド。
[請求項1114]
断片が、ヒトCD80およびヒトCD86ならびに/またはそれぞれの細胞外ドメインに結合する、請求項1113記載のポリペプチド。
[請求項1115]
可溶性ポリペプチドである、請求項1053〜1114のいずれか一項記載のポリペプチド。
[請求項1116]
(a)請求項1053〜1115のいずれか一項記載のポリペプチドと、
(b)ポリペプチドの分泌を促進するペプチドと
を含む、単離されたまたは組換え型のタンパク質。
[請求項1117]
ペプチドがシグナルペプチドである、請求項1116記載のタンパク質。
[請求項1118]
シグナルペプチドが、SEQ ID NO:182またはSEQ ID NO:216のアミノ酸配列と少なくとも95%の配列同一性を有するアミノ酸配列を含む、請求項1117記載のタンパク質。
[請求項1119]
シグナルペプチドが、SEQ ID NO:182またはSEQ ID NO:216のアミノ酸配列を含む、請求項1118記載のタンパク質。
[請求項1120]
請求項1053〜1115のいずれか一項記載のポリペプチドおよび膜貫通ドメインを含む、単離されたまたは組換え型のタンパク質。
[請求項1121]
膜貫通ドメインが、SEQ ID NO:160のアミノ酸残基162〜182を含むアミノ酸配列と少なくとも95%の同一性を有するアミノ酸配列を含む、請求項1120記載のタンパク質。
[請求項1122]
膜貫通ドメインがSEQ ID NO:160のアミノ酸残基162〜182を含む、請求項1121記載のタンパク質。
[請求項1123]
細胞質ドメインをさらに含む、請求項1120記載のタンパク質。
[請求項1124]
細胞質ドメインが、SEQ ID NO:160のアミノ酸残基183〜223を含むアミノ酸配列と少なくとも95%の同一性を有するアミノ酸配列を含む、請求項1122記載のタンパク質。
[請求項1125]
細胞質ドメインが、SEQ ID NO:160のアミノ酸残基183〜223を含むアミノ酸配列を含む、請求項1124記載のタンパク質。
[請求項1126]
シグナルペプチドをさらに含む、請求項1120〜1125のいずれか一項記載のタンパク質。
[請求項1127]
ポリペプチドのアミノ酸残基の1つまたは複数がグリコシル化されている、請求項1053〜1115のいずれか一項記載のポリペプチドまたは請求項1116〜1126のいずれか一項記載のタンパク質。
[請求項1128]
ポリペプチドのアミノ酸残基の1つまたは複数がペグ化されている、請求項1053〜1115もしくは1127のいずれか一項記載のポリペプチドまたは請求項1116〜1127のいずれか一項記載のタンパク質。
[請求項1129]
請求項1053〜1115のいずれか一項記載の少なくとも2つのポリペプチドまたは請求項1116〜1128のいずれか一項記載の少なくとも2つのタンパク質を含む、単離されたまたは組換え型のポリペプチド多量体。
[請求項1130]
少なくとも2つのポリペプチドの全てが同一である、請求項1129記載の多量体。
[請求項1131]
免疫応答を抑制または阻害することができる、請求項1129記載の多量体。
[請求項1132]
T細胞活性化またはT細胞増殖を阻害することができる、請求項1129記載の多量体。
[請求項1133]
4つのポリペプチドを含む、請求項1129記載の多量体。
[請求項1134]
請求項1053〜1115のいずれか一項記載の2つのポリペプチドを含む、単離されたまたは組換え型のポリペプチド二量体。
[請求項1135]
ホモ二量体である、請求項1134記載の二量体。
[請求項1136]
ヘテロ二量体である、請求項1134記載の二量体。
[請求項1137]
免疫応答を抑制または阻害することができる、請求項1134記載の二量体。
[請求項1138]
T細胞活性化またはT細胞増殖を阻害することができる、請求項1134記載の二量体。
[請求項1139]
それぞれ、ヒトCD86またはその細胞外ドメインに対する、2つのヒトCTLA-4の細胞外ドメインを含む二量体の結合アビディティにほぼ等しいか、またはこれより大きな、ヒトCD86またはその細胞外ドメインに対する結合アビディティを有する、請求項1053〜1115のいずれか一項記載の2つのポリペプチドを含む単離されたまたは組換え型のポリペプチド二量体。
[請求項1140]
それぞれ、ヒトCD80またはその細胞外ドメインに対する、2つのヒトCTLA-4の細胞外ドメインを含む二量体の結合アビディティにほぼ等しいか、またはこれより大きな、ヒトCD80またはその細胞外ドメインに対する結合アビディティを有する、請求項1053〜1115のいずれか一項記載の2つのポリペプチドを含む単離されたまたは組換え型のポリペプチド二量体。
[請求項1141]
それぞれ、ヒトCD80またはその細胞外ドメインに対する、2つのヒトCTLA-4の細胞外ドメインを含む二量体の結合アビディティにほぼ等しいか、またはこれより大きな、ヒトCD80またはその細胞外ドメインに対する結合アビディティを有する、請求項1139記載の二量体。
[請求項1142]
前記二量体が、それぞれ、ヒトCD86またはその細胞外ドメインに対する、2つのLEA29Yポリペプチドを含む二量体の結合アビディティより大きな、ヒトCD86またはその細胞外ドメインに対する結合アビディティを有し、
各LEA29Yポリペプチドが、SEQ ID NO:168に示したポリペプチド配列を含む、
請求項1140記載の二量体。
[請求項1143]
2つのヒトCTLA-4の細胞外ドメインを含む二量体がそれぞれ結合しているヒトCD86またはその細胞外ドメインから解離する速度より遅い速度で、結合しているヒトCD86またはその細胞外ドメインから解離する、請求項1140記載の二量体。
[請求項1144]
前記二量体が、2つのLEA29Yポリペプチドを含む二量体がそれぞれ結合しているヒトCD86またはその細胞外ドメインから解離する速度より遅い速度で、結合しているヒトCD86またはその細胞外ドメインから解離し、
各LEA29Yポリペプチドが、SEQ ID NO:168に示したポリペプチド配列を含む、
請求項1140記載の二量体。
[請求項1145]
それぞれヒトCD86またはその細胞外ドメインと2つのヒトCTLA-4の細胞外ドメインを含む二量体とが会合する速度より速い速度で、ヒトCD86またはその細胞外ドメインと会合する、請求項1140記載の二量体。
[請求項1146]
前記二量体が、それぞれヒトCD86またはその細胞外ドメインと2つのLEA29Yポリペプチドを含む二量体とが会合する速度より速い速度で、ヒトCD86またはその細胞外ドメインと会合し、
各LEA29Yポリペプチドが、SEQ ID NO:168に示したポリペプチド配列を含む、
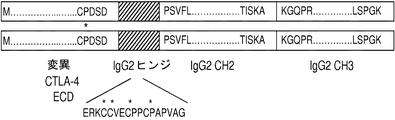
請求項1140記載の二量体。
[請求項1147]
2つのヒトCTLA-4の細胞外ドメインまたは2つのLEA29Yポリペプチドを含む二量体より大きな、免疫応答を抑制する能力を有し、請求項1053〜1115のいずれか一項記載の2つのポリペプチドを含む、単離されたまたは組換え型のポリペプチド二量体。
[請求項1148]
2つのヒトCTLA-4の細胞外ドメインを含む二量体より大きな、T細胞活性化またはT細胞増殖を阻害する能力を有する、請求項1147記載の二量体。
[請求項1149]
2つのヒトCTLA-4の細胞外ドメインまたは2つのLEA29Yポリペプチドを含む二量体のCD86平衡解離定数(K D )より小さな、CD86平衡解離定数(K D )を有する、請求項1053〜1115のいずれか一項記載の2つのポリペプチドを含む単離されたまたは組換え型のポリペプチド二量体。
[請求項1150]
(a)請求項1001〜1115のいずれか一項記載のポリペプチドと、
(b)該ポリペプチドに共有結合により取り付けられている非ポリペプチド部分と
を含む、単離されたまたは合成のコンジュゲート。
[請求項1151]
CD80もしくはCD86またはいずれかの細胞外ドメインに結合する、請求項1150記載のコンジュゲート。
[請求項1152]
CD80がヒトCD80であり、CD86がヒトCD86である、請求項1151記載のコンジュゲート。
[請求項1153]
少なくとも2つの非ポリペプチド部分を含む、請求項1150記載のコンジュゲート。
[請求項1154]
非ポリペプチド部分が糖分子である、請求項1153記載のコンジュゲート。
[請求項1155]
糖分子がN-グリコシル化部位に取り付けられている、請求項1154記載のコンジュゲート。
[請求項1156]
非ポリペプチド部分がポリマーである、請求項1150記載のコンジュゲート。
[請求項1157]
ポリマーがポリエチレングリコール部分である、請求項1156記載のコンジュゲート。
[請求項1158]
ポリエチレングリコール部分がポリペプチドのシステイン残基に共有結合により取り付けられている、請求項1157記載のコンジュゲート。
[請求項1159]
ポリペプチドのリジン残基に共有結合により取り付けられているポリエチレングリコール部分を含む、請求項1157記載のコンジュゲート。
[請求項1160]
ポリペプチドのN末端アミノ基に共有結合により取り付けられているポリエチレングリコール部分を含む、請求項1159記載のコンジュゲート。
[請求項1161]
(a)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含む第1のポリペプチドと、(b)Ig Fcポリペプチドである第2のポリペプチドとを含む、単離されたまたは組換え型の融合タンパク質であって、
該融合タンパク質が、CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合する能力、ならびに/あるいは免疫応答を調節または調整する能力を有する、
単離されたまたは組換え型の融合タンパク質。
[請求項1162]
T細胞活性化もしくはT細胞増殖またはサイトカイン産生を調節または調整する、請求項1161記載の融合タンパク質。
[請求項1163]
第2のポリペプチドが第1のポリペプチドに直接融合している、請求項1161または1162記載の融合タンパク質。
[請求項1164]
第2のポリペプチドが、第1のポリペプチドに融合したリンカーアミノ酸配列に融合している、請求項1161または1162記載の融合タンパク質。
[請求項1165]
第2のポリペプチドが第1のポリペプチドのC末端に融合している、請求項1161記載の融合タンパク質。
[請求項1166]
第2のポリペプチドがIg重鎖定常領域の1つまたは複数のドメインを含む、請求項1161記載の融合タンパク質。
[請求項1167]
第2のポリペプチドが、Igポリペプチドのヒンジ領域、CH2ドメイン、およびCH3ドメインを含む、請求項1161記載の融合タンパク質。
[請求項1168]
Ig Fcポリペプチドが、野生型ヒトIg Fcポリペプチドまたは変異体Ig Fcポリペプチドである、請求項1161記載の融合タンパク質。
[請求項1169]
第2のポリペプチドが、ヒトIgポリペプチドのヒンジ領域、CH2ドメイン、およびCH3ドメインを含む、請求項1161記載の融合タンパク質。
[請求項1170]
ヒトIgポリペプチドがヒトIgGポリペプチドであり、ヒトIgG2ポリペプチドが、任意で、ヒトIgG2ポリペプチドである、請求項1169記載の融合タンパク質。
[請求項1171]
各単量体変異体融合タンパク質に存在する2つのシステイン残基間で形成された少なくとも1つのジスルフィド結合を介して連結している2つの単量体融合タンパク質を含む、単離されたまたは組換え型の融合タンパク質二量体であって、
各単量体融合タンパク質が、(a)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含み、
該融合タンパク質二量体が、CD80および/もしくはCD86ならびに/またはCD80-Igおよび/またはCD86-Igに結合する能力を有し、かつ/あるいは免疫応答を阻害または抑制する能力を有する、
単離されたまたは組換え型の融合タンパク質二量体。
[請求項1172]
2つの単量体融合タンパク質を含む、単離されたまたは組換え型の融合タンパク質二量体であって、
このような単量体融合タンパク質それぞれが、
(1)10個以下、9個以下、8個以下、7個以下、または6個以下のアミノ酸残基において、SEQ ID NO:1-73からなる群より選択されるポリペプチド配列とは異なるポリペプチド配列を含むポリペプチドであって、該ポリペプチド配列中の位置24、30、32、41、50、54、55、56、64、65、70、または85にあるアミノ酸残基が、該選択されたポリペプチド配列の対応する位置にあるアミノ酸残基と同一である、ポリペプチドと、
(2)Ig Fcポリペプチドと
を含み、
該融合タンパク質二量体が、CD80および/またはCD86に結合し、かつ/あるいは免疫応答を阻害する、
単離されたまたは組換え型の融合タンパク質二量体。
[請求項1173]
2つの単量体融合タンパク質を含む、単離されたまたは組換え型の融合タンパク質二量体であって、
単量体融合タンパク質それぞれが、
(1)(i)10個以下、9個以下、8個以下、7個以下、または6個以下のアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なり、かつ(ii)SEQ ID NO:159のポリペプチド配列を基準として、位置24、30、32、50、54、55、56、64、65、70、または85に対応するアミノ酸位置において少なくとも1個のアミノ酸置換を含むポリペプチド配列を含む、変異体CTLA-4の細胞外ドメインポリペプチドと、
(2)Ig Fcポリペプチドと
を含み、
該融合タンパク質二量体が、CD80および/またはCD86に結合し、かつ/あるいは免疫応答を抑制または阻害する、
単離されたまたは組換え型の融合タンパク質二量体。
[請求項1174]
2つの変異体CTLA-4-Ig融合タンパク質単量体を含む、単離されたまたは組換え型の変異体CTLA-4-Ig融合タンパク質二量体であって、
変異体CTLA-4-Ig融合単量体それぞれが、
(1)(a)10個以下、9個以下、8個以下、7個以下、または6個以下のアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なり、かつ(b) SEQ ID NO:159を基準として、A50M、M54K、G55E、N56D、S64P、I65S、およびS70Fからなる群より選択されるアミノ酸位置において1個または複数の置換を含むポリペプチド配列を含む、変異体CTLA-4-ECDポリペプチドと、
(2)任意でIgG2 Fcポリペプチドである、Ig Fcポリペプチドと
を含み、
該変異体CTLA-4-Ig二量体が、hCD80および/またはhCD86に結合し、かつ/あるいは免疫応答を抑制または阻害する、
単離されたまたは組換え型の変異体CTLA-4-Ig融合タンパク質二量体。
[請求項1175]
請求項1161〜1171および1314〜1316のいずれか一項記載の2つの単量体融合タンパク質を含む、単離されたまたは組換え型の融合タンパク質二量体であって、
2つの単量体融合タンパク質が、
(i)それぞれ2つの第1のポリペプチドのうちの1つに存在する2つのシステイン残基間で形成している少なくとも1つのジスルフィド結合、および/または
(ii) それぞれ2つの第2のポリペプチドのうちの1つに存在する2つのシステイン残基間で形成している少なくとも1つのジスルフィド結合
を介して連結している、
単離されたまたは組換え型の融合タンパク質二量体。
[請求項1176]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対する、それぞれIgポリペプチドに融合した野生型ヒトCTLA-4の細胞外ドメインを含む2つの単量体融合タンパク質を含む融合タンパク質二量体の結合アビディティより大きな、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対する結合アビディティを有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1177]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対するCTLA-4-IgG2融合タンパク質二量体の結合アビディティより大きな、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対する結合アビディティを有する、融合タンパク質二量体であって、
CTLA-4-IgG2融合タンパク質二量体が、それぞれSEQ ID NO:162のポリペプチド配列を含む2つの単量体CTLA-4-IgG2融合タンパク質を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1178]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対するヒトCTLA-Ig融合タンパク質二量体の結合アビディティに少なくとも等しいかまたはこれより大きな、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対する結合アビディティを有する、融合タンパク質二量体であって、
ヒトCTLA-4-Ig融合タンパク質二量体が2つの融合タンパク質単量体を含み、このような単量体がそれぞれSEQ ID NO:164のポリペプチド配列を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1179]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対するLEA29Y-Ig融合タンパク質二量体の結合アビディティに少なくとも等しいかまたはこれより大きな、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igに対する結合アビディティを有する、融合タンパク質二量体であって、
LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166のポリペプチド配列を含む2つの単量体LEA29Y-Ig融合タンパク質を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1180]
それぞれIgポリペプチドに融合した野生型ヒトCTLA-4の細胞外ドメインを含む2つの融合タンパク質を含む融合タンパク質二量体の能力に少なくとも等しいかまたはこれより大きな、免疫応答を抑制、T細胞活性化を阻害、またはT細胞増殖を阻害する能力を有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1181]
それぞれSEQ ID NO:162のポリペプチド配列を有する2つの単量体融合タンパク質を含むCTLA-4-IgG2融合タンパク質二量体の、免疫応答を抑制、T細胞活性化を阻害、またはT細胞増殖を阻害する能力に少なくとも等しいか、またはこれより大きな、免疫応答を抑制、T細胞活性化を阻害、またはT細胞増殖を阻害する能力を有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1182]
ヒトCTLA-4-Ig融合タンパク質二量体の、免疫応答を抑制、T細胞活性化を阻害、またはT細胞増殖を阻害する能力に少なくとも等しいかまたはこれより大きな、免疫応答を抑制、T細胞活性化を阻害、またはT細胞増殖を阻害する能力を有する、融合タンパク質二量体であって、
ヒトCTLA-4-Ig融合タンパク質二量体が、それぞれSEQ ID NO:164のポリペプチド配列を含む2つの融合タンパク質単量体を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1183]
それぞれ、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから、2つのヒトCTLA-4の細胞外ドメインを含む融合タンパク質二量体が解離する速度より遅い速度で、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから解離する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1184]
それぞれ、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから、CTLA-4-IgG2融合タンパク質二量体が解離する速度より遅い速度で、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから解離する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1185]
それぞれ、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから、ヒトCTLA-4-Ig融合タンパク質二量体が解離する速度より遅い速度で、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから解離する、融合タンパク質二量体であって、
ヒトCTLA-4-Ig融合タンパク質二量体が2つの融合タンパク質単量体を含み、このような単量体それぞれがSEQ ID NO:164のポリペプチド配列を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1186]
それぞれ、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから、LEA29Y-Ig融合タンパク質二量体が解離する速度より遅い速度で、結合しているヒトCD86もしくはその細胞外ドメインまたはhCD86-Igから解離する、融合タンパク質二量体であって、
LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166の配列を有する2つの融合タンパク質を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1187]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと、2つのヒトCTLA-4の細胞外ドメインを含む融合タンパク質二量体とが会合する速度に少なくとも等しいかまたはこれより速い速度で、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと会合する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1188]
それぞれ、ヒトCD86もしくはその細胞外ドメイン(またはhCD86-Ig)と、CTLA-4-IgG2融合タンパク質二量体とが会合する速度に少なくとも等しいかまたはこれより速い速度で、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと会合する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1189]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと、CTLA-4-Ig融合タンパク質二量体とが会合する速度に少なくとも等しいかまたはこれより速い速度で、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと会合する融合タンパク質二量体であって、
ヒトCTLA-4-Ig融合タンパク質二量体が2つの融合タンパク質単量体を含み、このような単量体それぞれがSEQ ID NO:164のポリペプチド配列を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1190]
それぞれ、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと、LEAY29-Ig融合タンパク質二量体とが会合する速度に少なくとも等しいかまたはこれより速い速度で、ヒトCD86もしくはその細胞外ドメインまたはhCD86-Igと会合する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1191]
2つのヒトCTLA-4の細胞外ドメインを含む融合タンパク質二量体のCD86平衡解離定数(K D )より小さな、CD86平衡解離定数(K D )を有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1192]
CTLA-4-IgG2融合タンパク質二量体のCD86平衡解離定数(K D )より小さな、CD86平衡解離定数(K D )を有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1193]
ヒトCTLA-4-Ig融合タンパク質二量体のCD86平衡解離定数(K D )より小さな、CD86平衡解離定数(K D )を有する、融合タンパク質二量体であって、
ヒトCTLA-4-Ig融合タンパク質二量体が2つの融合タンパク質単量体を含み、このような単量体がそれぞれSEQ ID NO:164のポリペプチド配列を含む、
請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1194]
LEA29Y-Ig融合タンパク質二量体のCD86平衡解離定数(K D )より小さな、CD86平衡解離定数(K D )を有する、請求項1171、1172、1173、または1174記載の融合タンパク質二量体。
[請求項1195]
請求項1053〜1115のいずれか一項記載のポリペプチド、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質、または請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸。
[請求項1196]
SEQ ID NO:1-79、197-200、205-214、および219-222からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するポリペプチド配列を含む、ポリペプチド
をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該ポリペプチドが、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制する能力を有する、
単離されたまたは組換え型の核酸。
[請求項1197]
それぞれ、ヒトCTLA-4単量体またはその細胞外ドメインよりも大きな、ヒトCD86またはその細胞外ドメインに対する結合親和性を有するポリペプチドをコードする、請求項1196記載の核酸。
[請求項1198]
SEQ ID NO:74-79、197-200、205-214、および219-222からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有する、ポリペプチド配列
を含む融合タンパク質をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該ポリペプチドが、CD80および/もしくはCD86ならびに/またはそれらの細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制する、
単離されたまたは組換え型の核酸。
[請求項1199]
(a)SEQ ID NO:80-158、201-204、223、および224からなる群より選択される少なくとも1つのポリヌクレオチド配列と少なくとも95%の配列同一性を有するポリヌクレオチド配列;(b)(a)と相補的なポリヌクレオチド配列;または(c)(a)もしくは(b)の任意のポリヌクレオチド配列の断片を含み、
CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合しかつ/あるいは免疫応答を抑制または阻害する能力を有するポリペプチドをコードする、
単離されたまたは組換え型の核酸。
[請求項1200]
(a)10個以下、9個以下、8個以下、7個以下、または6個以下のアミノ酸残基において、SEQ ID NO:1-73からなる群より選択されるポリペプチド配列と異なり、かつ(b)ポリペプチド配列中の位置24、30、32、41、50、54、55、56、64、65、70、または85にあるアミノ酸残基が、SEQ ID NO:1-73からなる群より選択される該ポリペプチド配列の対応する位置にあるアミノ酸残基と同一である、ポリペプチド配列
を含むポリペプチドをコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該ポリペプチドが、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは免疫応答を阻害する、
単離されたまたは組換え型の核酸。
[請求項1201]
(a)6個以下のアミノ酸残基において、SEQ ID NO:159に示したヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なり、かつ(b)SEQ ID NO:159を基準として、位置30、32、50、54、55、56、64、65、70、または85に対応するアミノ酸位置において少なくとも1個のアミノ酸置換を含む、ポリペプチド配列
を含むポリペプチドをコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該ポリペプチドが、CD80および/もしくはCD86ならびに/またはいずれかの細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制または阻害する能力を有する、
単離されたまたは組換え型の核酸。
[請求項1202]
SEQ ID NO:159を基準として、A50M、M54K、G55E、N56D、S64P、I65S、およびS70Fからなる群より選択される少なくとも1個のアミノ酸置換を含み、任意で、SEQ ID NO:159を基準として、L104E/D、T30N/D/A、およびV32Iからなる群より選択される少なくとも1個のアミノ酸置換をさらに含む、請求項1201記載の核酸。
[請求項1203]
(i)SEQ ID NO:1-73からなる群より選択されるポリペプチド配列と少なくとも95%の同一性と、(ii)SEQ ID NO:1-73からなる群より選択される該ポリペプチド配列の位置70に対応するアミノ酸位置にあるフェニルアラニン残基とを有する、ポリペプチド配列
を含むポリペプチドをコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該ポリペプチドが、hCD80および/もしくはhCD86またはそのECDに結合し、かつ/あるいは免疫応答を阻害し、該アミノ酸置換が任意でS70Fを含む、
単離されたまたは組換え型の核酸。
[請求項1204]
2つのポリペプチドを含む組換えポリペプチド二量体をコードするポリヌクレオチド配列またはそれと相補的なポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
このようなポリペプチドそれぞれが、SEQ ID NO:1-73からなる群より選択される配列と少なくとも95%の同一性を有するポリペプチド配列を含み、
前記二量体が、hCD80および/もしくはhCD86に結合し、かつ/または免疫応答を阻害する、
単離されたまたは組換え型の核酸。
[請求項1205]
(a)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含むポリペプチドと、(b)Igポリペプチドとを含む融合タンパク質をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
該融合タンパク質が、CD80および/もしくはCD86に結合し、かつ/または免疫応答を抑制する能力を有する、
単離されたまたは組換え型の核酸。
[請求項1206]
融合タンパク質二量体をコードする、請求項1205記載の核酸。
[請求項1207]
ヒトCTLA-4単量体またはその細胞外ドメインより大きな、免疫応答を抑制する能力を有するポリペプチドをコードする、請求項1196記載の核酸。
[請求項1208]
ヒトCTLA-4単量体またはその細胞外ドメインより大きな、T細胞活性化またはT細胞増殖を阻害する能力を有するポリペプチドをコードする、請求項1207記載の核酸。
[請求項1209]
結合しているヒトCD86またはその細胞外ドメインからヒトCTLA-4単量体またはその細胞外ドメインが解離する速度より遅い速度で、結合しているヒトCD86またはその細胞外ドメインから解離するポリペプチドをコードする、請求項1196記載の核酸。
[請求項1210]
(a)DNA配列中のチミンヌクレオチド残基が全てウラシルヌクレオチド残基で置換されている、SEQ ID NO:80-158、201-204、223、および224からなる群より選択されるDNA配列を含むRNAポリヌクレオチド配列と少なくとも95%の配列同一性を有するポリヌクレオチド配列;
(b)(a)の相補ポリヌクレオチド配列;または
(c)(a)もしくは(b)の任意のポリヌクレオチド配列の断片
を含む、単離されたまたは組換え型の核酸であって、
該核酸が、(i)CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは(ii)T細胞活性化および/またはT細胞増殖を任意で含む免疫応答を抑制する能力を有する、ポリペプチドをコードする、
単離されたまたは組換え型の核酸。
[請求項1211]
シグナルペプチドをコードするヌクレオチド配列をさらに含む、請求項1195〜1210のいずれか一項記載の核酸。
[請求項1212]
(a)6個以下のアミノ酸残基において、SEQ ID NO:31に示したポリペプチド配列とは異なり、かつ(b) SEQ ID NO:31の位置50に対応する位置にあるメチオニン残基、SEQ ID NO:31の位置54に対応する位置にあるリジン残基、SEQ ID NO:31の位置55に対応する位置にあるグルタミン酸残基、SEQ ID NO:31の位置64に対応する位置にあるプロリン残基、SEQ ID NO:31の位置65に対応する位置にあるセリン残基、SEQ ID NO:31の位置70に対応する位置にあるフェニルアラニン残基の少なくとも1つを含む、ポリペプチド配列
を含むポリペプチドをコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸であって、
アミノ酸残基位置の番号がSEQ ID NO:31に従って付けられており、かつ
該ポリペプチドが、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方のECDに結合し、かつ/あるいは免疫応答を阻害する、
単離されたまたは組換え型の核酸。
[請求項1213]
請求項1143〜1160のいずれか一項記載の核酸、請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチドをコードする核酸、請求項1129〜1133のいずれか一項記載のポリペプチド多量体をコードする核酸、請求項1134〜1149のいずれか一項記載のポリペプチド二量体をコードする核酸、請求項1150〜1160のいずれか一項記載のコンジュゲートをコードする核酸、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質をコードする核酸、または請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体をコードする核酸を含む、ベクター。
[請求項1214]
DNAベクターである、請求項1213記載のベクター。
[請求項1215]
RNAベクターである、請求項1213記載のベクター。
[請求項1216]
核酸がプロモーターと機能的に連結されている、請求項1213記載のベクター。
[請求項1217]
発現ベクターである、請求項1213記載のベクター。
[請求項1218]
発現ベクターが、図1Cに示したプラスミド発現ベクターを含む、請求項1217記載のベクター。
[請求項1219]
ウイルスベクター、酵母ベクター、植物ベクター、細菌ベクター、または昆虫ベクターである、請求項1213記載のベクター。
[請求項1220]
ウイルスベクターがアデノウイルスベクターである、請求項1219記載のベクター。
[請求項1221]
プラスミドベクターである、請求項1213記載のベクター。
[請求項1222]
選択マーカーをさらに含む、請求項1213〜1221のいずれか一項記載のベクター。
[請求項1223]
(i)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含み、ヒトCD86および/もしくはヒトCD80ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制する、第1のポリペプチドをコードする、第1のポリヌクレオチド配列と、
(ii)任意でヒトIgG2 Fcポリペプチドである免疫グロブリン(Ig)ポリペプチドのヒンジ領域、CH2ドメイン、およびCH3ドメインを含む第2のポリペプチドをコードする、第2のポリヌクレオチド配列と
を含む、発現ベクター。
[請求項1224]
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;ならびに/または
(h)請求項1213〜1223のいずれか一項記載のベクター
を含む、単離されたまたは組換え型の宿主細胞。
[請求項1225]
請求項1143〜1160のいずれか一項記載の核酸でトランスフェクトまたは形質転換された、単離されたまたは組換え型の宿主細胞。
[請求項1226]
融合タンパク質をコードする核酸でトランスフェクトされた、単離されたまたは組換え型の宿主細胞であって、
該核酸が、
(i)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含み、ヒトCD86および/もしくはヒトCD80ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合する能力を有し、かつ/あるいは免疫応答を抑制する能力を有する第1のポリペプチドをコードする、第1のヌクレオチド配列と;
(ii)任意でヒトIgG2 Fcポリペプチドである免疫グロブリン(Ig)ポリペプチドのヒンジ領域、CH2ドメイン、およびCH3ドメインを含む第2のポリペプチドをコードする、第2のヌクレオチド配列と
を含む、
単離されたまたは組換え型の宿主細胞。
[請求項1227]
請求項1213〜1223のいずれか一項記載のベクターを含む、単離されたまたは組換え型の単離された宿主細胞。
[請求項1228]
請求項1213〜1223のいずれか一項記載のベクターでトランスフェクトまたは形質転換された、単離された宿主細胞。
[請求項1229]
真核細胞である、請求項1224〜1228のいずれか一項記載の宿主細胞。
[請求項1230]
チャイニーズハムスター卵巣(CHO)細胞またはCOS細胞である、請求項1229記載の宿主細胞。
[請求項1231]
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
を含む、不死化細胞株。
[請求項1232]
賦形剤または担体、ならびに以下:
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター
(i)請求項1224〜1230のいずれか一項記載の細胞;ならびに/または
(j)請求項1231記載の細胞株
の1つまたは複数を含む、組成物。
[請求項1233]
薬学的に許容される賦形剤または薬学的に許容される担体、ならびに以下:
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター
(i)請求項1224〜1230のいずれか一項記載の細胞;ならびに/または
(j)請求項1231記載の細胞株
の1つまたは複数を含む、薬学的組成物。
[請求項1234]
免疫応答を抑制するのに有効な量の
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
の少なくとも1つとB7陽性細胞とを接触させる工程であって、それによって免疫応答が抑制される、工程
を含む、免疫応答を抑制する方法。
[請求項1235]
抑制される免疫応答がT細胞応答である、請求項1234記載の方法。
[請求項1236]
B7陽性細胞上に発現しているB7-1に結合するポリペプチドおよび/またはB7陽性細胞上に発現しているB7-2に結合するポリペプチドと、B7陽性細胞とを接触させる工程を含む、請求項1234記載の方法。
[請求項1237]
B7陽性細胞とCD28陽性T細胞および/またはCTLA-4陽性T細胞との相互作用を調節するのに有効な量の
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
の少なくとも1つとB7陽性細胞とを接触させる工程であって、B7陽性細胞とCD28陽性T細胞および/またはCTLA-4陽性T細胞との相互作用が調節される、工程
を含む、CD28を発現するT細胞および/またはCTLA-4を発現するT細胞とB7陽性細胞との相互作用を調節する方法。
[請求項1238]
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞;
の少なくとも1つの有効量とB7陽性細胞とを接触させる工程であって、CD28陽性T細胞および/またはCTLA-4陽性T細胞とB7陽性細胞との相互作用が阻害される、工程
を含む、CD28陽性T細胞および/またはCTLA-4陽性T細胞とB7陽性細胞との相互作用を阻害する方法。
[請求項1239]
T細胞活性化またはT細胞増殖が阻害される、請求項1238記載の方法。
[請求項1240]
B7陽性細胞が抗原提示細胞である、請求項1238記載の方法。
[請求項1241]
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b)請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
の少なくとも1つの有効量を対象に投与する工程であって、対象における内因性CD28陽性T細胞と内因性B7陽性細胞との相互作用が阻害される、工程
を含む、対象におけるCD28陽性T細胞とB7陽性細胞との相互作用を阻害する方法。
[請求項1242]
内因性CD28陽性T細胞と、B7-2(CD86)またはB7-1(CD80)を発現する内因性B7陽性細胞との相互作用が阻害される、請求項1241記載の方法。
[請求項1243]
B7陽性細胞がB7-2(CD86)および/またはB7-1(CD80)を発現し、B7-2(CD86)および/またはB7-1(CD80)とCD28陽性T細胞との相互作用が阻害される、請求項1241記載の方法。
[請求項1244]
B7-2(CD86)およびB7-1(CD80)とCD28陽性T細胞との相互作用が阻害される、請求項1243記載の方法。
[請求項1245]
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
の1つまたは複数の治療的有効量を、免疫応答の抑制を必要とする対象に投与する工程であって、それによって対象における免疫応答が抑制される、工程
を含む、対象における免疫応答を抑制する方法。
[請求項1246]
可溶性融合タンパク質二量体が、約0.001ミリグラム/キログラム対象体重(mg/kg)〜約100ミリグラム/キログラム対象体重(mg/kg)を含む治療的有効量で対象に投与される、請求項1245記載の方法。
[請求項1247]
可溶性融合タンパク質二量体の治療的有効量が、約0.001mg/kg対象体重〜少なくとも約0.005、0.01、0.025、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、1.5、2、3、4、5、6、7、8、9、10、25、または50mg/kg対象体重を含む、請求項1246記載の方法。
[請求項1248]
ポリペプチド、融合タンパク質、二量体、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、薬学的に許容される賦形剤または担体中で対象に投与される、請求項1245記載の方法。
[請求項1249]
ポリペプチド、融合タンパク質、二量体、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、非経口投与、皮下投与、または静脈内投与される、請求項1245記載の方法。
[請求項1250]
ポリペプチド、融合タンパク質、二量体、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、1ヶ月に1回、2回、3回、または4回皮下投与される、請求項1245記載の方法。
[請求項1251]
可溶性融合タンパク質二量体が、薬学的に許容される賦形剤または担体中で、約0.01mg/ml〜約200mg/ml、約0.1mg/ml〜約200mg/ml、約1〜約200mg/ml、約1〜約100mg/ml、約5〜約75mg/ml、約10〜約50mg/ml、約25〜約50mg/ml、または約50〜約100mg/mlの濃度で、対象に投与される、請求項1245〜1250のいずれか一項記載の方法。
[請求項1252]
ポリペプチドが可溶性ポリペプチドであり、融合タンパク質が可溶性融合タンパク質であり、二量体が可溶性二量体であり、多量体が可溶性多量体であり、融合タンパク質二量体が可溶性融合タンパク質二量体である、請求項1245記載の方法。
[請求項1253]
免疫応答の抑制を必要とする対象に、有効量の第1の免疫抑制剤または免疫抑制化合物を投与する工程であって、該第1の免疫抑制剤が、
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
を含み、それによって対象における免疫応答が抑制される、工程
を含む、対象における免疫応答を抑制する方法。
[請求項1254]
有効量の少なくとも1種類のさらなる免疫抑制剤または治療剤を投与する工程をさらに含む、請求項1253記載の方法。
[請求項1255]
少なくとも1種類のさらなる免疫抑制剤または治療剤が、疾患修飾性抗リウマチ薬(DMARD)、ステロイド化合物、非ステロイド化合物、サリチル酸ナトリウムまたはサリチル酸マグネシウム、イブプロフェン、アセチルサリチル酸、アセトアミノフェン、抗体、抗炎症性サイトカインの合成または産生をブロックする生物学的薬剤、エファリズマブ、抗炎症剤または抗炎症化合物、および非ステロイド性抗炎症薬(NSAID)からなる群より選択される、請求項1254記載の方法。
[請求項1256]
少なくとも1種類のさらなる免疫抑制剤または治療剤が、薬学的に許容される賦形剤または担体中で対象に投与される、請求項1254または1255記載の方法。
[請求項1257]
ポリペプチド、融合タンパク質、二量体、多量体、コンジュゲート、融合タンパク質二量体、核酸、ベクター、および/または細胞が、少なくとも1日に1回、少なくとも1週間に1回、少なくとも2週間に1回、または少なくとも1ヶ月に1回投与される、請求項1253〜1256のいずれか一項記載の方法。
[請求項1258]
少なくとも1種類のさらなる免疫抑制化合物または免疫抑制剤が、(i)第1の免疫抑制剤もしくは免疫抑制化合物の投与と同時に;(ii)第1の免疫抑制剤もしくは免疫抑制化合物の投与後に;または(iii)第1の免疫抑制剤もしくは免疫抑制化合物の投与前に投与される、請求項1254〜1257のいずれか一項記載の方法。
[請求項1259]
内因性T細胞と、CD80を発現する内因性細胞および/またはCD86を発現する内因性細胞との相互作用によって調節される免疫系の疾患または障害を有する対象を処置する方法であって、
そのような処置を必要とする対象に、治療的有効量の、
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
を投与する工程であって、内因性T細胞と、前記CD80を発現する内因性細胞および/または前記CD86を発現する内因性細胞との相互作用が阻害され、それによって対象における免疫系の疾患または障害が処置される、工程
を含む、方法。
[請求項1260]
CD80がヒトCD80であり、CD86がヒトCD86である、請求項1259記載の方法。
[請求項1261]
CD28を発現する内因性T細胞と、CD86を発現する内因性細胞および/またはCD80を発現する内因性細胞との相互作用が阻害される、請求項1259記載の方法。
[請求項1262]
CD80がヒトCD80であり、CD86がヒトCD86であり、CD28がヒトCD28である、請求項1261記載の方法。
[請求項1263]
免疫系の疾患または障害が自己免疫疾患または自己免疫障害である、請求項1259〜1262のいずれか一項記載の方法。
[請求項1264]
免疫系の疾患または障害が、関節炎、慢性関節リウマチ、若年性特発性関節炎(JIA)、全身性エリテマトーデス(SLE)、乾癬、乾癬性関節炎、糖尿病、若年性糖尿病、I型糖尿病、多発性硬化症、クローン病、全身硬皮症、潰瘍性大腸炎、炎症性腸疾患(IBD)、ウェゲナー肉芽腫症、アジソン病、グレーブス病、筋肉リウマチ、リウマチ性疾患、強直性脊椎炎、重症筋無力症、およびANCA関連脈管炎からなる群より選択される、請求項1263記載の方法。
[請求項1265]
ポリペプチド、融合タンパク質、二量体、コンジュゲート、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、薬学的に許容される賦形剤または担体中で対象に投与される、請求項1259〜1264のいずれか一項記載の方法。
[請求項1266]
可溶性融合タンパク質二量体が、約0.001mg/kg対象体重〜約100mg/kg対象体重を含む治療的有効量で投与される、請求項1259のいずれか一項記載の方法。
[請求項1267]
可溶性融合タンパク質二量体の治療的有効量が、少なくとも約0.001、0.005、0.01、0.025、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、25、50、75、または100mg/kg対象体重を含む、請求項1266記載の方法。
[請求項1268]
可溶性融合タンパク質二量体の治療的有効量が、約0.001mg/kg対象体重〜少なくとも約0.005、0.01、0.025、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、25、50、75、または100mg/kg対象体重を含む、請求項1266記載の方法。
[請求項1269]
ポリペプチド、融合タンパク質、二量体、コンジュゲート、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、少なくとも1日に1回、少なくとも1週間に1回、少なくとも2週間に1回、または少なくとも1ヶ月に1回、投与される、請求項1259〜1268のいずれか一項記載の方法。
[請求項1270]
請求項1224〜1230のいずれか一項記載の宿主細胞を培地中で培養する工程、および該細胞によって発現されたポリペプチドを回収する工程を含む、ポリペプチドを産生する方法。
[請求項1271]
(a)請求項1195〜1212のいずれか一項記載の核酸を細胞集団に導入する工程であって、核酸が、核酸によりコードされるポリペプチドを産生するのに有効な調節配列に機能的に連結されている、工程;
(b)培地中で細胞を培養して、ポリペプチドを産生する工程;および
(c)細胞または培地からポリペプチドを単離する工程
を含む、ポリペプチドを産生する方法。
[請求項1272]
請求項1213〜1223のいずれか一項記載のベクターが導入されている、培養細胞。
[請求項1273]
請求項1161〜1171のいずれか一項記載の発現ベクターが導入されている、培養細胞。
[請求項1274]
(1)核酸で形質転換された宿主細胞を培地中で培養する工程であって、核酸が、
(i)SEQ ID NO:1-73からなる群より選択されるポリペプチド配列と少なくとも95%の同一性を有し、CD86および/もしくはCD80ならびに/またはCD86もしくはCD80の細胞外ドメインに結合する、ポリペプチドをコードする第1のヌクレオチド配列と、
(ii)ヒンジ領域、CH2ドメイン、およびCH3ドメインを含み、任意でヒトIgG2 FcであるIgポリペプチドをコードする第2のヌクレオチド配列と
を含み、それによって、核酸が発現され、融合タンパク質が産生される、工程;ならびに
(2)融合タンパク質を回収する工程
を含む、融合タンパク質を作る方法。
[請求項1275]
核酸が、融合タンパク質に機能的に連結された分泌ペプチドまたはシグナルペプチドをコードする第3のヌクレオチド配列をさらに含み、
融合タンパク質が、同一の第1の融合タンパク質および第2の融合タンパク質を含むジスルフィド結合した融合タンパク質二量体として宿主細胞から分泌され、
ジスルフィド結合した融合タンパク質二量体が、培地から回収される、
請求項1274記載の方法。
[請求項1276]
ジスルフィド結合した融合タンパク質二量体が、第1の融合タンパク質のシステイン残基と第2の融合タンパク質のシステイン残基とのジスルフィド共有結合を介して形成される、請求項1275記載の方法。
[請求項1277]
融合タンパク質が、培地、宿主細胞、または宿主細胞ペリプラズムから回収される、請求項1274記載の方法。
[請求項1278]
(i)SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含み、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合する、第1のポリペプチドと、
(ii)IgGポリペプチドのヒンジ領域、CH2ドメイン、およびCH3ドメインを含む第2のポリペプチドと
をコードするヌクレオチド配列を含む、単離されたまたは組換え型の核酸。
[請求項1279]
第2のポリペプチドが、SEQ ID NO:184記載のポリペプチド配列を含む、請求項1278記載の核酸分子。
[請求項1280]
請求項1278または1279記載の核酸を含む、発現ベクター。
[請求項1281]
第1のポリペプチドおよび第2のポリペプチドの発現を促進する第3のヌクレオチド配列をさらに含む、請求項1280記載の発現ベクター。
[請求項1282]
第4のヌクレオチド配列がさらに第2のポリペプチドの発現を促進し、第3および第4のヌクレオチド配列が同一であるか、または異なる、請求項1280記載の発現ベクター。
[請求項1283]
請求項1280、1281、または1282記載の発現ベクターを含む、宿主細胞。
[請求項1284]
請求項1283記載の宿主細胞を培養する工程を含む、融合タンパク質二量体を作る方法。
[請求項1285]
融合タンパク質二量体が宿主細胞培地から回収される、請求項1284記載の方法。
[請求項1286]
二量体が宿主細胞から回収される、請求項1285記載の方法。
[請求項1287]
二量体が宿主細胞ペリプラズムから回収される、請求項1285記載の方法。
[請求項1288]
ドナーからの組織移植、細胞移植、移植片移植、または臓器移植の、レシピエント対象による拒絶反応を阻害する方法であって、
それを必要とするレシピエント対象に、治療的有効量の
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
を投与する工程であって、それによってレシピエント対象による組織移植、細胞移植、移植片移植、または臓器移植の拒絶反応を阻害する、工程
を含む、方法。
[請求項1289]
組織移植、細胞移植、移植片移植、もしくは臓器移植の前に、それらと同時に、またはそれらの後に、ポリペプチド、融合タンパク質、二量体、多量体、コンジュゲート、融合タンパク質二量体、核酸、ベクター、および/または細胞がレシピエント対象に投与される、請求項1288記載の方法。
[請求項1290]
ドナーおよびレシピエント対象が同じ種である、請求項1288記載の方法。
[請求項1291]
ドナーおよびレシピエント対象が異なる種である、請求項1288記載の方法。
[請求項1292]
ドナーおよびレシピエント対象が両方ともヒトである、請求項1290記載の方法。
[請求項1293]
有効量が約0.001mg/kg対象体重〜約200mg/kg対象体重を含む、請求項1288記載の方法。
[請求項1294]
有効量が、約0.001ミリグラム/キログラム対象体重(mg/kg)〜少なくとも約0.005、0.01、0.05、0.1、0.2、0.25、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、10、15、25、50、75、100、125、150、または175ミリグラム/キログラム対象体重(mg/kg)を含む、請求項1293記載の方法。
[請求項1295]
有効量が、約0.001ミリグラム/キログラム対象体重(mg/kg)〜少なくとも約0.005、0.01、0.05、0.1、0.2、0.25、0.5、1、2、3、4、または5ミリグラム/キログラム対象体重(mg/kg)を含む、請求項1294記載の方法。
[請求項1296]
ポリペプチド、融合タンパク質、二量体、コンジュゲート、多量体、融合タンパク質二量体、核酸、ベクター、および/または細胞が、組織移植、細胞移植、移植片移植、または臓器移植の翌日に、および移植後、少なくとも1週間に1回または少なくとも1ヶ月に1回、必要に応じて、12ヶ月まで、24ヶ月まで、もしくは36ヶ月までまたはそれ以上投与される、請求項1288記載の方法。
[請求項1297]
臓器移植が、腎臓移植、肝臓移植、肺移植、または心臓移植である、請求項1288記載の方法。
[請求項1298]
対象における、組織移植、細胞移植、移植片移植、または臓器移植の拒絶反応を処置する方法であって、
そのような処置を必要とする対象に、治療的有効量の、
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体;
(g)請求項1195〜1212のいずれか一項記載の核酸;
(h)請求項1213〜1223のいずれか一項記載のベクター;ならびに/または
(i)請求項1224〜1230のいずれか一項記載の細胞
を投与する工程であって、それによって、対象による、組織移植、細胞移植、移植片移植、または臓器移植の拒絶反応を軽減または緩和する、工程
を含む、方法。
[請求項1299]
組織移植、細胞移植、移植片移植、もしくは臓器移植の前に、それらと同時に、またはそれらの後に、ポリペプチド、融合タンパク質、二量体、多量体、コンジュゲート、融合タンパク質二量体、核酸、ベクター、および/または細胞が対象に投与される、請求項1298記載の方法。
[請求項1300]
哺乳動物における免疫応答を阻害または抑制するための医薬を製造するための、請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド、)請求項1129〜1133のいずれか一項記載のポリペプチド多量体、請求項1134〜1149のいずれか一項記載の二量体、請求項1150〜1160のいずれか一項記載のコンジュゲート、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質、請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体、請求項1195〜1212のいずれか一項記載の核酸、請求項1213〜1223のいずれか一項記載のベクター、または請求項1224〜1230のいずれか一項記載の細胞の使用。
[請求項1301]
免疫応答がT細胞応答である、請求項1300記載の使用。
[請求項1302]
免疫系の疾患または障害を処置するための医薬を製造するための、請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド、)請求項1129〜1133のいずれか一項記載のポリペプチド多量体、請求項1134〜1149のいずれか一項記載の二量体、請求項1150〜1160のいずれか一項記載のコンジュゲート、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質、請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体、請求項1195〜1212のいずれか一項記載の核酸、請求項1213〜1223のいずれか一項記載のベクター、または請求項1224〜1230のいずれか一項記載の細胞の使用。
[請求項1303]
免疫系の疾患または障害が、哺乳動物におけるT細胞とCD80陽性細胞および/またはCD86陽性細胞との相互作用によって媒介される、請求項1302記載の使用。
[請求項1304]
免疫系の疾患または障害が自己免疫疾患または自己免疫障害である、請求項1303記載の使用。
[請求項1305]
免疫系の疾患または障害が、関節炎、慢性関節リウマチ、若年性特発性関節炎(JIA)、全身性エリテマトーデス(SLE)、乾癬、乾癬性関節炎、糖尿病、若年性糖尿病、I型糖尿病、多発性硬化症、クローン病、全身硬皮症、潰瘍性大腸炎、炎症性腸疾患(IBD)、ウェゲナー肉芽腫症、アジソン病、グレーブス病、筋肉リウマチ、リウマチ性疾患、強直性脊椎炎、重症筋無力症、およびANCA関連脈管炎からなる群より選択される、請求項1302記載の使用。
[請求項1306]
哺乳動物における組織移植片または臓器移植の拒絶反応を処置するための医薬を製造するための、請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド、)請求項1129〜1133のいずれか一項記載のポリペプチド多量体、請求項1134〜1149のいずれか一項記載の二量体、請求項1150〜1160のいずれか一項記載のコンジュゲート、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質、請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体、請求項1195〜1212のいずれか一項記載の核酸、請求項1213〜1223のいずれか一項記載のベクター、または請求項1224〜1230のいずれか一項記載の細胞の使用。
[請求項1307]
CD80陽性細胞および/またはCD86陽性細胞と、CD28陽性T細胞および/またはCTLA-4陽性T細胞との相互作用を阻害するための医薬を製造するための、請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド、)請求項1129〜1133のいずれか一項記載のポリペプチド多量体、請求項1134〜1149のいずれか一項記載の二量体、請求項1150〜1160のいずれか一項記載のコンジュゲート、請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質、請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体、請求項1195〜1212のいずれか一項記載の核酸、請求項1213〜1223のいずれか一項記載のベクター、または請求項1224〜1230のいずれか一項記載の細胞の使用。
[請求項1308]
アミノ酸位置24、30、32、41、50、54、55、56、64、65、70、85、104および106にあるアミノ酸残基が、選択されたポリペプチド配列の対応する位置にあるアミノ酸残基と同一である、請求項1172記載のポリペプチド。
[請求項1309]
単離されたまたは組換え型の融合タンパク質二量体であって、2つの単量体融合タンパク質、このような単量体融合タンパク質が、それぞれ、SEQ ID NO:74-79、197-200、205-214、および219-222からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含み、該ポリペプチドが、CD80および/もしくはCD86ならびに/またはその細胞外ドメインに結合し、かつ/あるいは免疫応答を抑制する、単離されたまたは組換え型の融合タンパク質二量体。
[請求項1310]
(a)6個以下のアミノ酸残基において、SEQ ID NO:31に示したポリペプチド配列とは異なり、かつ(b)SEQ ID NO:31の位置50に対応する位置にあるメチオニン残基、SEQ ID NO:31の位置54に対応する位置にあるリジン残基、SEQ ID NO:31の位置55に対応する位置にあるグルタミン酸残基、SEQ ID NO:31の位置64に対応する位置にあるプロリン残基、SEQ ID NO:31の位置65に対応する位置にあるセリン残基、SEQ ID NO:31の位置70に対応する位置にあるフェニルアラニン残基の少なくとも1つを含む、ポリペプチド配列
を含む、単離されたまたは組換え型のポリペプチドであって、
アミノ酸残基位置の番号がSEQ ID NO:31に従って付けられており、
該ポリペプチドが、CD80および/またはCD86ならびに/またはそのいずれかもしくは両方のECDに結合し、かつ/あるいは免疫応答を阻害する、
単離されたまたは組換え型のポリペプチド。
[請求項1311]
(i) SEQ ID NO:36-46および55からなる群より選択されるポリペプチド配列と少なくとも95%の配列同一性と、(ii)選択されたポリペプチド配列のアミノ酸位置55にあるグルタミン酸残基とを含むポリペプチド配列を含む、単離されたまたは組換え型のポリペプチドであって、
該ポリペプチドが、(i)CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは(ii)免疫応答を抑制する、
単離されたまたは組換え型のポリペプチド。
[請求項1312]
SEQ ID NO:26、SEQ ID NO:36、SEQ ID NO:38、SEQ ID NO:50、およびSEQ ID NO:56からなる群より選択されるポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含む、単離されたまたは組換え型のポリペプチドであって、
該ポリペプチドが、(i)CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは(ii)免疫応答を抑制する、
単離されたまたは組換え型のポリペプチド。
[請求項1313]
SEQ ID NO:74-79、197-200、205-214、および219-222からなる群より選択されるポリペプチド配列と少なくとも95%の配列同一性を有するポリペプチド配列を含む、単離されたまたは組換え型のポリペプチドであって、
該ポリペプチドが、(i)CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合し、(ii)CD80-Ig融合タンパク質および/またはCD86-Ig融合タンパク質に結合し、かつ/あるいは(iii)免疫応答を抑制する、
単離されたまたは組換え型のポリペプチド。
[請求項1314]
(a) SEQ ID NO:26、SEQ ID NO:36、SEQ ID NO:38、SEQ ID NO:50、SEQ ID NO:56からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含む第1のポリペプチドと、
(b)Ig Fcポリペプチドである第2のポリペプチドとを含む、
単離されたまたは組換え型の融合タンパク質であって、
該融合タンパク質が、CD80および/もしくはCD86またはそのいずれかもしくは両方の細胞外ドメインに結合する能力、ならびに/あるいは免疫応答を調節または調整する能力を有する、
請求項1161記載の単離されたまたは組換え型の融合タンパク質。
[請求項1315]
Ig Fcポリペプチドが野生型ヒトIg Fcポリペプチドまたは変異体Ig Fcポリペプチドである、請求項1314記載の融合タンパク質。
[請求項1316]
Ig FcポリペプチドがヒトIgG Fcポリペプチドであり、ヒトIgG2 Fcポリペプチドが、任意でヒトIgG2 Fcポリペプチドである、請求項1314記載の融合タンパク質。
[請求項1317]
各単量体変異体融合タンパク質に存在する2つのシステイン残基間で形成した少なくとも1つのジスルフィド結合を介して連結している2つの単量体融合タンパク質を含む、単離されたまたは組換え型の融合タンパク質二量体であって、
各単量体融合タンパク質が、(a)SEQ ID NO:79、SEQ ID NO:197、SEQ ID NO:198、SEQ ID NO:199、およびSEQ ID NO:200からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも95%の同一性を有するポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含み、
該融合タンパク質二量体が、(i)CD80および/もしくはCD86ならびに/またはCD80および/もしくはCD86の細胞外ドメインに結合する能力、(ii)CD80-Igおよび/もしくはCD86-Igに結合する能力、ならびに/または(iii)免疫応答を阻害または抑制する能力を有する、
単離されたまたは組換え型の融合タンパク質二量体。
[請求項1318]
免疫系の疾患または障害が、アジソン病、アレルギー、円形脱毛症、アルツハイマー、抗好中球細胞質抗体(ANCA)関連脈管炎、強直性脊椎炎、抗リン脂質症候群(ヒューズ症候群)、関節炎、喘息、アテローム性動脈硬化症、アテローム性動脈硬化巣、自己免疫疾患(例えば、狼瘡、RA、MS、グレーブス病など)、自己免疫溶血性貧血、自己免疫肝炎、自己免疫性内耳疾患、自己免疫性リンパ球増殖症候群、自己免疫性心筋炎、自己免疫性卵巣炎、自己免疫性精巣炎、無精子症、ベーチェット病、ベーチェット症候群、ベルジェ病、水疱性類天疱瘡、心筋症、心血管疾患、セリアックスプルー/セリアック病、慢性疲労免疫不全症候群(CFIDS)、慢性特発性多発神経炎、慢性炎症性脱髄性多発神経炎(CIPD)、慢性再発性多発ニューロパシー(ギラン・バレー症候群)、チャーグ・ストラウス症候群(CSS)、瘢痕性類天疱瘡、寒冷凝集素症(CAD)、COPD、CREST症候群、クローン病、疱疹状皮膚炎、皮膚筋炎、糖尿病、円盤状狼瘡、湿疹、後天性表皮水疱症、本態性混合型クリオグロブリン血症、エヴァンス症候群、眼球突出、線維筋痛症、グッドパスチャー症候群、移植片に関連した疾患または障害、グレーブス病、GVHD、橋本甲状腺炎、特発性肺線維症、特発性血小板減少性紫斑病(ITP)、IgA腎症、免疫増殖性疾患または障害(例えば、乾癬)、炎症性腸疾患(IBD)、インスリン依存性糖尿病(IDDM)、間質性肺疾患、若年性糖尿病、若年性関節炎、若年性特発性関節炎(JIA)、川崎病、ランバート・イートン筋無力症症候群、扁平苔癬、狼瘡、ループス腎炎、リンパ球性下垂体炎、メニエール病、ミラー・フィッシャー症候群/急性散在性脳脊髄神経根障害、混合結合組織病、多発性硬化症(MS)、筋肉リウマチ、筋痛性脳脊髄炎(ME)、重症筋無力症、眼の炎症、落葉状天疱瘡、尋常性天疱瘡、悪性貧血、結節性多発動脈炎、多発性軟骨炎、多腺性症候群(ホイッタカー症候群(Whitaker's syndrome))、リウマチ性多発筋痛、多発性筋炎、原発性無ガンマグロブリン血症、原発性胆汁性肝硬変/自己免疫胆管症、乾癬、乾癬性関節炎、レイノー現象、ライター症候群/反応性関節炎、再狭窄、リウマチ熱、リウマチ性疾患、慢性関節リウマチ、類肉腫症、シュミット症候群、硬皮症、シェーグレン症候群、実質臓器(腎臓、心臓、肝臓、肺など)移植の拒絶反応、スティッフマン症候群、全身性エリテマトーデス(SLE)、全身硬皮症、高安動脈炎、側頭動脈炎/巨細胞性動脈炎、甲状腺炎、1型糖尿病、2型糖尿病、潰瘍性大腸炎、ブドウ膜炎、脈管炎、白斑、ウェゲナー肉芽腫症、およびレシピエント対象によるドナー組織移植、細胞移植、移植片移植、または臓器移植の拒絶反応に関連した免疫応答の阻止または抑制からなる群より選択される、請求項1263記載の方法。
[請求項1319]
有効量の、
(a)請求項1053〜1128および1312〜1313のいずれか一項記載のポリペプチド;
(b))請求項1129〜1133のいずれか一項記載の多量体;
(c)請求項1134〜1149のいずれか一項記載の二量体;
(d)請求項1150〜1160のいずれか一項記載のコンジュゲート;
(e)請求項1161〜1171および1314〜1316のいずれか一項記載の融合タンパク質;または
(f)請求項1172〜1194および1317のいずれか一項記載の融合タンパク質二量体
を含む、請求項1232または233記載の組成物。
[請求項1320]
組成物のpHを約pH3〜約pH10の範囲に維持することができる緩衝液、水、任意で非イオン界面活性剤、任意で塩、および任意で糖アルコール、単糖、二糖、または多糖を含む、請求項1232、1233、または1319記載の組成物。
[請求項1321]
生理学的pHである、請求項1319〜1320のいずれか一項記載の組成物。
[請求項1322]
約4〜約7.5のpHを有する、請求項1319〜1321のいずれか一項記載の組成物。
[請求項1323]
約5.0〜約7.5のpHを有する、請求項1319〜1322のいずれか一項記載の組成物。
[請求項1324]
約6.4のpHを有する、請求項1319〜1323のいずれか一項記載の組成物。
[請求項1325]
約7.4または7.5のpHを有する、請求項1319〜1323のいずれか一項記載の組成物。
[請求項1326]
緩衝液が、約1mM〜約100mMまたは1mM〜約50mMの濃度で存在する、請求項1319〜1325のいずれか一項記載の組成物。
[請求項1327]
緩衝液が約5mM〜約35mMの濃度で存在する、請求項1319〜1326のいずれか一項記載の組成物。
[請求項1328]
緩衝液が約10mM〜約25mMの濃度で存在する、請求項1319〜1327のいずれか一項記載の組成物。
[請求項1329]
緩衝液が約20mMの濃度で存在する、請求項1319〜1328のいずれか一項記載の組成物。
[請求項1330]
緩衝液が、HEPES緩衝液、クエン酸緩衝液、コハク酸緩衝液、酢酸緩衝液、クエン酸緩衝液、マレイン酸緩衝液、リン酸緩衝液、およびTris緩衝液からなる群より選択される、請求項1319〜1329のいずれか一項記載の組成物。
[請求項1331]
緩衝液が、HEPES緩衝液、クエン酸ナトリウム緩衝液、およびコハク酸ナトリウム緩衝液からなる群より選択される、請求項1319〜1330のいずれか一項記載の組成物。
[請求項1332]
pHが約6.0〜約6.7であり、緩衝液がコハク酸ナトリウムまたはクエン酸ナトリウムである、請求項1319〜1331のいずれか一項記載の組成物。
[請求項1333]
pHが約7.0〜約7.7であり、緩衝液がHEPESである、請求項1319〜1332のいずれか一項記載の組成物。
[請求項1334]
糖アルコール、または単糖、二糖、もしくは多糖である糖類を含む、請求項1319〜1333のいずれか一項記載の組成物。
[請求項1335]
二糖がスクロースまたはトレハロースである、請求項1319〜1334のいずれか一項記載の組成物。
[請求項1336]
約1mM〜約50mMの濃度で存在する塩を含む、請求項1319〜1335のいずれか一項記載の組成物。
[請求項1337]
約20mMの濃度で存在する塩を含む、請求項1319〜1336のいずれか一項記載の組成物。
[請求項1338]
非イオン界面活性剤を含む、請求項1319〜1337のいずれか一項記載の組成物。
[請求項1339]
Tween(登録商標)-80、Tween(登録商標)-60、Tween(登録商標)-20、またはpluronic F-68からなる群より選択される非イオン界面活性剤を含む、請求項1319〜1338のいずれか一項記載の組成物。
[請求項1340]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体が、約1mg/ml(w/v)〜約200mg/ml(w/v)の範囲の濃度で存在する、請求項1319〜1339のいずれか一項記載の組成物。
[請求項1341]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体が、約25mg/ml(w/v)〜約100mg/ml(w/v)の範囲の濃度で存在する、請求項1319〜1340のいずれか一項記載の組成物。
[請求項1342]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体が、約50mg/ml(w/v)〜約300mg/ml(w/v)、任意でおよそ約50mg/ml(w/v)〜約100mg/ml(w/v)の範囲の濃度で存在する、請求項1319〜1341のいずれか一項記載の組成物。
[請求項1343]
組成物のポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体の有効量が約0.1mg/kg〜約15mg/kgであり、かつ哺乳動物に投与される、請求項1319〜1342のいずれか一項記載の組成物。
[請求項1344]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体の有効量が約0.5mg/kg〜約10mg/kgであり、かつ非経口投与される、請求項1319〜1343のいずれか一項記載の組成物。
[請求項1345]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体の有効量が約0.1mg/kg〜約5mg/kg、任意で約0.5mg/kgであり、かつ皮下投与される、請求項1319〜1344のいずれか一項記載の組成物。
[請求項1346]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体の有効量が約5mg/kg〜約15mg/kgであり、任意で約10mg/kgであり、かつ静脈内投与される、請求項1319〜1345のいずれか一項記載の組成物。
[請求項1347]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体が、SEQ ID NO:36のアミノ酸配列と少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む、請求項1319〜1346のいずれか一項記載の組成物。
[請求項1348]
ポリペプチド、多量体、二量体、コンジュゲート、融合タンパク質、または融合タンパク質二量体が、SEQ ID NO:50のアミノ酸配列と少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含む、請求項1319〜1346のいずれか一項記載の組成物。
[請求項1349]
無菌である、請求項1319〜1348のいずれか一項記載の組成物。
[請求項1350]
血液と等張である、請求項1319〜1349のいずれか一項記載の組成物。
[請求項1351]
液体組成物である、請求項1319〜1350のいずれか一項記載の組成物。
[請求項1352]
液体または乾燥した形態であり、乾燥した形態が、凍結乾燥した形態、風乾した形態、および噴霧乾燥した形態からなる群より選択される、請求項1319〜1351のいずれか一項記載の組成物。
[請求項1353]
凍結乾燥した形態である、請求項1319〜1352のいずれか一項記載の組成物。
[請求項1354]
(a)約1〜約200mg/ml(w/v)の濃度範囲で存在する、SEQ ID NO:36および50からなる群より選択されるポリペプチド配列を含むポリペプチド;(b)約5mM〜約50mMの濃度で約pH5.0〜約pH8.0の緩衝能を有する緩衝液;(c)組成物を指定の容量にするための薬学的に許容される希釈剤;(d)0.5重量%〜10重量%の濃度の糖;(e)約1mM〜約200mMの濃度の塩;(f)約pH5.0〜約pH8.0の範囲のpH;ならびに(g)任意で界面活性剤を含む、薬学的組成物。
[請求項1355]
(a)ポリペプチドが、約50mg/ml〜約100mg/mlの濃度で存在するSEQ ID NO:36のポリペプチド配列を含み;(b)緩衝液が、約20mMの濃度で存在するHEPES緩衝液であり;(c)薬学的に許容される希釈剤が、水であり;(d)糖が、2重量%の濃度のスクロースまたはトレハロースであり;(e)塩が、約100mMの濃度の塩化ナトリウムであり;(f)pHが約pH7.4であり;(g)任意で、約0.1mg/ml未満または約0.1mg/mlに等しい濃度の、Tween(登録商標)-80、Tween(登録商標)-60、Tween(登録商標)-20、またはpluronic F-68からなる群より選択される界面活性剤が存在する、請求項1354記載の組成物。
[請求項1356]
(a)ポリペプチドが、約50mg/ml〜約100mg/mlの濃度範囲で存在するSEQ ID NO:50のポリペプチド配列を含み;(b)緩衝液が、約20mMの濃度で存在するクエン酸ナトリウム緩衝液であり;(c)薬学的に許容される希釈剤が、水であり;(d)糖が、2重量%の濃度のスクロースまたはトレハロースであり;(e)塩が、約100mMの濃度の塩化ナトリウムであり;(f)pHが約pH6.5であり;(g)任意で、界面活性剤が、約0.1mg/ml未満または約0.1mg/mlに等しい濃度の、Tween(登録商標)-80、Tween(登録商標)-60、Tween(登録商標)-20、またはpluronic F-68からなる群より選択される、請求項1354記載の組成物。
[請求項1357]
(a) SEQ ID NO:36のアミノ酸配列と少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含むポリペプチドと、(b)HEPES緩衝液とを含む、薬学的組成物。
[請求項1358]
(a)SEQ ID NO:36のアミノ酸配列と少なくとも96%、少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含むポリペプチドと、(b)薬学的に許容される賦形剤または薬学的に許容される担体とを含み、約7〜約8のpHを有する、薬学的組成物。
[請求項1359]
約7.4のpHを有する、請求項1358記載の薬学的組成物。
[請求項1360]
HEPES緩衝液を含む、請求項1358または1359記載の薬学的組成物。
[請求項1361]
(a)SEQ ID NO:50のアミノ酸配列と少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含むポリペプチドと、(b)クエン酸ナトリウム緩衝液とを含む、薬学的組成物。
[請求項1362]
(a)SEQ ID NO:50のアミノ酸配列と少なくとも97%、少なくとも98%、または少なくとも99%の配列同一性を有するアミノ酸配列を含むポリペプチドと、(b)薬学的に許容される賦形剤または薬学的に許容される担体とを含み、約6〜約7のpHを有する、薬学的組成物。
[請求項1363]
約6.5のpHを有する、請求項1362記載の薬学的組成物。
[請求項1364]
クエン酸ナトリウム緩衝液を含む、請求項1362または1363記載の薬学的組成物。
[請求項1365]
免疫系の疾患または障害が、アジソン病、アレルギー、円形脱毛症、アルツハイマー、抗好中球細胞質抗体(ANCA)関連脈管炎、強直性脊椎炎、抗リン脂質症候群(ヒューズ症候群)、関節炎、喘息、アテローム性動脈硬化症、アテローム性動脈硬化巣、自己免疫疾患(例えば、狼瘡、RA、MS、グレーブス病など)、自己免疫溶血性貧血、自己免疫肝炎、自己免疫性内耳疾患、自己免疫性リンパ球増殖症候群、自己免疫性心筋炎、自己免疫性卵巣炎、自己免疫性精巣炎、無精子症、ベーチェット病、ベーチェット症候群、ベルジェ病、水疱性類天疱瘡、心筋症、心血管疾患、セリアックスプルー/セリアック病、慢性疲労免疫不全症候群(CFIDS)、慢性特発性多発神経炎、慢性炎症性脱髄性多発神経炎(CIPD)、慢性再発性多発ニューロパシー(ギラン・バレー症候群)、チャーグ・ストラウス症候群(CSS)、瘢痕性類天疱瘡、寒冷凝集素症(CAD)、COPD、CREST症候群、クローン病、疱疹状皮膚炎、皮膚筋炎、糖尿病、円盤状狼瘡、湿疹、後天性表皮水疱症、本態性混合型クリオグロブリン血症、エヴァンス症候群、眼球突出、線維筋痛症、グッドパスチャー症候群、移植片に関連した疾患または障害、グレーブス病、GVHD、橋本甲状腺炎、特発性肺線維症、特発性血小板減少性紫斑病(ITP)、IgA腎症、免疫増殖性疾患または障害(例えば、乾癬)、炎症性腸疾患(IBD)、インスリン依存性糖尿病(IDDM)、間質性肺疾患、若年性糖尿病、若年性関節炎、若年性特発性関節炎(JIA)、川崎病、ランバート・イートン筋無力症症候群、扁平苔癬、狼瘡、ループス腎炎、リンパ球性下垂体炎、メニエール病、ミラー・フィッシャー症候群/急性散在性脳脊髄神経根障害、混合結合組織病、多発性硬化症(MS)、筋肉リウマチ、筋痛性脳脊髄炎(ME)、重症筋無力症、眼の炎症、落葉状天疱瘡、尋常性天疱瘡、悪性貧血、結節性多発動脈炎、多発性軟骨炎、多腺性症候群(ホイッタカー症候群(Whitaker's syndrome))、リウマチ性多発筋痛、多発性筋炎、原発性無ガンマグロブリン血症、原発性胆汁性肝硬変/自己免疫胆管症、乾癬、乾癬性関節炎、レイノー現象、ライター症候群/反応性関節炎、再狭窄、リウマチ熱、リウマチ性疾患、慢性関節リウマチ、類肉腫症、シュミット症候群、硬皮症、シェーグレン症候群、実質臓器(腎臓、心臓、肝臓、肺など)移植の拒絶反応、スティッフマン症候群、全身性エリテマトーデス(SLE)、全身硬皮症、高安動脈炎、側頭動脈炎/巨細胞性動脈炎、甲状腺炎、1型糖尿病、2型糖尿病、潰瘍性大腸炎、ブドウ膜炎、脈管炎、白斑、ウェゲナー肉芽腫症、およびレシピエント対象によるドナー組織移植、細胞移植、移植片移植、または臓器移植の拒絶反応に関連した免疫応答の阻止または抑制であるかまたはこれらを含んでもよいがこれらに限定されない免疫系の疾患または障害からなる群より選択される、請求項1302記載の使用。
定義
本明細書において用いられる専門用語は特定の態様の説明のみを目的とし、限定を目的としないことも理解されるはずである。特に定めのない限り、本明細書中で使用する技術用語および科学用語は全て、本発明が属する当業者により一般に理解されているものと同義である。
本発明は、例えば、免疫系(例えば、T細胞依存性免疫応答)の調節が望ましい疾患、障害、および状態を含む、免疫系の疾患、障害、および状態を処置するための分子および方法を提供する。本発明の分子(例えば、本発明のポリペプチド、本発明のコンジュゲート、本発明の可溶性融合タンパク質、このようなポリペプチドまたは融合タンパク質をコードする核酸)は、免疫抑制が望ましい免疫系の疾患、障害、および状態の処置に有用である。処置には、例えば、自己免疫疾患、自己免疫障害、および自己免疫状態、免疫増殖性疾患、移植片に関連した障害の処置、ならびにドナーの組織、細胞、臓器、または移植片に対するレシピエントの免疫応答の抑制が望ましい、ドナーからレシピエントへの組織移植、細胞移植、臓器移植、または移植片移植に関与する処置方法を含むが、これに限定されない。
本発明は、総称して「本発明のポリペプチド」と呼ばれる、新規のポリペプチドを提供する。「本発明のポリペプチド」という用語は、本明細書において開示されたポリペプチド配列の変種および/または誘導体を含むことが意図される。本発明のポリペプチドには、CD80および/もしくはCD86に結合し、かつ/または免疫応答を阻害もしくは抑制する、組換え非天然または変異体CTLA-4ポリペプチドが含まれる。本発明のポリペプチドには、本発明の変異体CTLA-4ポリペプチドを含む組換え融合タンパク質、ならびにこのような融合タンパク質の単量体型および二量体型が含まれる。本発明のポリペプチドには、本発明の1つまたは複数の変異体CTLA-4ポリペプチドを含む多量体が含まれる。本発明はまた、本発明の1つまたは複数の変異体CTLA-4ポリペプチドを含むコンジュゲートも含む。本発明のポリペプチドの一部は可溶性ポリペプチドである。例えば、以下で詳述するように、本発明は、変異体CTLA-4 ECDポリペプチドが、変異体CTLA-4 ECDポリペプチドの溶解度を上げる異なるポリペプチド(例えば、免疫グロブリンポリペプチド、例えば、Ig Fcポリペプチド)に連結している可溶性融合タンパク質を含む。
1つの局面において、本発明は、SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列(例えば、SEQ ID NO:1、SEQ ID NO:2、SEQ ID NO:3、SEQ ID NO:4、SEQ ID NO:5、SEQ ID NO:6、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:9、SEQ ID NO:10、SEQ ID NO:11、SEQ ID NO:12、SEQ ID NO:13、SEQ ID NO:14、SEQ ID NO:15、SEQ ID NO:16、SEQ ID NO:17、SEQ ID NO:18、SEQ ID NO:19、SEQ ID NO:20、SEQ ID NO:21、SEQ ID NO:22、SEQ ID NO:23、SEQ ID NO:24、SEQ ID NO:25、SEQ ID NO:26、SEQ ID NO:27、SEQ ID NO:28、SEQ ID NO:29、SEQ ID NO:30、SEQ ID NO:31、SEQ ID NO:32、SEQ ID NO:33、SEQ ID NO:34、SEQ ID NO:35、SEQ ID NO:36、SEQ ID NO:37、SEQ ID NO:38、SEQ ID NO:39、SEQ ID NO:40、SEQ ID NO:41、SEQ ID NO:42、SEQ ID NO:43、SEQ ID NO:44、SEQ ID NO:45、SEQ ID NO:46、SEQ ID NO:47、SEQ ID NO:48、SEQ ID NO:49、SEQ ID NO:50、SEQ ID NO:51、SEQ ID NO:52、SEQ ID NO:53、SEQ ID NO:54、SEQ ID NO:55、SEQ ID NO:56、SEQ ID NO:57、SEQ ID NO:58、SEQ ID NO:59、SEQ ID NO:60、SEQ ID NO:61、SEQ ID NO:62、SEQ ID NO:63、SEQ ID NO:64、SEQ ID NO:65、SEQ ID NO:66、SEQ ID NO:67、SEQ ID NO:68、SEQ ID NO:69、SEQ ID NO:70、SEQ ID NO:71、SEQ ID NO:72、および SEQ ID NO:73)と少なくとも75%、80%、85%、86%、87%、88%、89%、90%、90.5%、91%、91.5%、92%、92.5%、93%、93.5%、94%、94.5%、95%、95.5%、96%、96.5%、97%、97.5%、98%、98.5%、99%、99.5%、または100%の配列同一性を有するポリペプチド配列を含み、CD80および/もしくはCD86またはCD80および/もしくはCD86のポリペプチド断片(あるいはそのいずれかもしくは両方のECD)に結合し、かつ/あるいは免疫応答を調節または調整する、単離されたまたは組換え型のポリペプチドを提供する。このようなポリペプチドの一部、例えば、SEQ ID NO:1-73に示された各ポリペプチドは、分泌または成熟変異体CTLA-4 ECDポリペプチドとして説明される。SEQ ID NO:1-73のそれぞれに示された変異体CTLA-4 ECDポリペプチドはシグナルペプチドを含まない。シグナルペプチドは、プロセシング中に切断されており、それによって、成熟型または分泌型ポリペプチドが生成される。CD80のポリペプチド断片は、例えば、CD80ポリペプチドの細胞外ドメインポリペプチド、例えば、ヒトCD80 ECDポリペプチド(「hCD80 ECD」)を含んでもよい。CD86のポリペプチド断片は、例えば、CD86ポリペプチドの細胞外ドメインポリペプチド、例えば、ヒトCD86 ECDポリペプチド(「hCD86 ECD」)を含んでもよい。このようなポリペプチドの一部は、哺乳動物CD80および/もしくはCD86、またはそのポリペプチド断片、例えば、哺乳動物CD80もしくはCD86 ECDに結合する。このようなポリペプチドの一部は、WTヒトCD80(「hCD80」)および/もしくはWTヒトCD86(「hCD86」)またはそのポリペプチド断片、例えば、hCD80 ECDもしくはhCD86 ECDに結合する。このような方法の一部では、少なくとも1つの免疫応答が抑制または阻害される。
本発明はまた、前記のおよび全体を通して記載される本発明のポリペプチドの少なくとも1つである第1のポリペプチド(例えば、本発明の変異体CTLA-4ポリペプチド、例えば、変異体CTLA-4 ECDポリペプチド)が第2のポリペプチドと連結または融合して、融合タンパク質が形成した、新規の単離されたおよび組換え融合タンパク質を提供する。第2のポリペプチドは、典型的には、第1のポリペプチドの分泌または発現を促進する。例示的な変異体CTLA-4 ECDポリペプチドには、SEQ ID NO:1-73として特定される配列を含むものが含まれる。本発明は、免疫グロブリン(Ig)ドメイン、例えば、Ig Fcドメインが本発明の生物学的に活性な部分、例えば、本発明の変異体CTLA-4ポリペプチドに融合した、または取り付けられた、融合タンパク質を含む。本発明の融合タンパク質は、本明細書の他の場所でさらに詳細に議論されるように、免疫調節および/または免疫抑制が利益となる様々な免疫系の疾患および障害および状態の予防的処置および/または治療的処置のための予防剤および/または治療剤として、診断アッセイにおいて、ならびに免疫調節および/または免疫抑制の活性または特性を有する医薬または薬剤の調製に有用だと考えられる。
前記で議論したように、1つの局面において、本発明は、SEQ ID NO:1-73からなる群より選択されるポリペプチド配列と少なくとも85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、または100%の配列同一性を有するポリペプチド配列を含み、CD80もしくはCD86またはいずれかの細胞外ドメインに結合する、および/あるいは免疫応答を抑制または阻害する能力を有する、単離されたまたは組換え型のポリペプチドを含む。別の局面において、以下で詳述するように、本発明は、SEQ ID NO:1-73からなる群より選択される少なくとも1つのポリペプチド配列と少なくとも75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%、または100%の配列同一性を有するポリペプチド配列を含み、CD80および/もしくはCD86ならびに/またはそのECDに結合する能力を有し、かつ/あるいは免疫応答を抑制する能力を有するポリペプチドをコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、単離されたまたは組換え型の核酸を提供する。
2つのポリペプチド配列は、規定されたパラメータ、すなわち、規定されたアミノ酸置換行列、ギャップ存在ペナルティ(ギャップオープンペナルティとも呼ばれる)、およびギャップ延長ペナルティを用いて、その配列対について可能性のある最も高い類似性スコアとなるようにアラインメントされた時に、「最適にアラインメントされる」。BLOSUM62行列(Henikoff and Henikoff (1992) Proc. Natl. Acad. Sci. USA 89(22):10915-10919)は、多くの場合、ポリペプチド配列アラインメントアルゴリズム(例えば、下記のBLASTP)においてデフォルトスコアリング置換行列として用いられる。アラインメントされた配列の1つに1個のアミノ酸ギャップが導入された場合、ギャップ存在ペナルティが課せられ、ギャップにあるそれぞれの残基位置についてギャップ延長ペナルティが課せられる。特に定めのない限り、本明細書において用いられるアラインメントパラメータは、BLOSUM62スコアリング行列、ギャップ存在ペナルティ=11、およびギャップ延長ペナルティ=1である。アラインメントスコアは、アラインメントが開始および終了する各配列のアミノ酸位置(例えば、アラインメントウインドウ)によって、任意で、可能性のある最も高い類似性スコアになるように、一方または両方の配列に1個のギャップまたは複数のギャップを挿入することによって規定される。
配列が最適にアラインメントされたら、同一の残基対を含む最適アラインメント内の位置の数を数え、その数を比較長(比較ウィンドウとも呼ばれる)内の残基数で割り、結果として生じた数に100を掛けることによって、クエリー配列を基準として対象配列のパーセント同一性を計算する。特に定めのない限り、比較長内の残基数はクエリー配列中の残基数である。前記のアラインメントに戻って、各例において、クエリー(上)配列と指定された配列は、15アミノ酸長である。アラインメントBでは、アラインメントされた12のアミノ酸残基対(太字で示した)が、クエリー配列(上)と対象配列(下)との最適アラインメントにおいて同一である。従って、この特定の対象配列と、15残基クエリー配列の全長との同一性は、(12/15)x100=80%である。言い換えると、アラインメントBの対象配列とクエリー配列とのアミノ酸配列同一性は、少なくとも80%である。アラインメントDにおいて、最適アラインメントにおいて11のアミノ酸残基対(太字で示した)が同一である。従って、この特定の対象配列と、15残基クエリー配列の全長との同一性は、(11/15)x100=73.3%である。言い換えると、アラインメントDにおいて、対象配列とクエリー配列とのアミノ酸配列同一性は少なくとも73%である。
前記で議論したように、1つの局面において、本発明は、(a)6個以下のアミノ酸残基(例えば、1個以下、2個以下、3個以下、4個以下、5個以下、または6個以下のアミノ酸残基)において、SEQ ID NO:1-73からなる群より選択されるポリペプチド配列とは異なるポリペプチド配列を含み、CD80および/もしくはCD86ならびに/またはそのいずれかもしくは両方の細胞外ドメインに結合し、かつ/あるいは免疫応答を阻害する、単離されたまたは組換え型の変異体CTLA-4の細胞外ドメインポリペプチドを提供する。このようなアミノ酸置換には保存的アミノ酸置換が含まれる。
本発明のポリペプチドはまた、任意の適切な数およびタイプのさらなるアミノ酸配列、例えば、1つまたは複数のペプチド断片をさらに含んでもよい。1つの態様において、このような本発明のポリペプチドは、シグナルペプチドをさらに含む。一般的に、シグナルペプチドは、組換えポリペプチドが動物細胞において発現された時に組換えポリペプチドを小胞体に向ける。細胞内で発現された時にポリペプチドの少なくとも一部を細胞小器官に輸送および/または分泌するシグナル配列も含まれ得る。このような配列は、典型的には、未熟な(すなわち、完全にプロセシングされていない)形のポリペプチドに存在し、その後に、細胞プロテアーゼによって除去/分解されて成熟型タンパク質になる。例えば、本発明の変異体CTLA-4ポリペプチドまたは融合タンパク質は、任意の適切なシグナル配列、あるいはポリペプチドを細胞内区画に向けるシグナル配列、例えば、輸送(例えば、転位置)しようとするポリペプチドを、(例えば、タンパク質がプロセシングおよび放出されるように)小胞体または分泌経路(例えば、ER、ゴルジ、ならびに/または分泌に関連する細胞小器官および細胞区画)に向ける配列、核に向ける配列、ならびに/あるいはタンパク質が分泌型の場合、ポリペプチドを細胞から分泌させる配列、細胞膜に転位置させる配列、または細胞から離れた第2の細胞に標的化する配列の組み合わせを含んでもよい。これに関して、ポリペプチドは、ポリペプチドを、エンドソーム区画および/もしくはリソソーム区画、またはCD4+T細胞提示および/もしくはCD8+T細胞提示および応答を促進するようなMHCIIに富む他の区画に向ける細胞内標的化配列(または「局在化シグナル」)、例えば、リソソーム関連膜タンパク質1(例えば、LAMP-1。例えば、Wu et al. Proc. Natl. Acad. Sci. USA 92:1161-75 (1995) および Ravipraskash et al., Virology 290:74-82 (2001)を参照されたい)に由来するリソソーム/エンドソーム標的化局在化シグナル、その一部またはホモログ(例えば、米国特許第5,633,234号を参照されたい)、あるいは他の適切なリソソーム標的化配列、エンドソーム標的化配列、および/またはER標的化配列(例えば、米国特許第6,248,565号を参照されたい)を含んでもよい。ある局面では、細胞内標的化配列を、当技術分野において公知の技法によって同定することができる、ポリペプチド内の証明/同定されたエピトープ配列の近くにまたは隣接して配置し、それによって、このようなエピトープを含むポリペプチド断片のT細胞提示の可能性を高めることが望ましい場合がある。このようなポリペプチドは、例えば、本明細書においてさらに記載される遺伝子導入ベクターの1つまたは複数を含む、ヌクレオチド導入ベクターの1つまたは複数によって宿主細胞に送達された、単離された、組換えの、または合成のDNAまたはRNAから発現されてもよい。
本発明のポリペプチド(本発明の任意の融合タンパク質を含む)はいずれも、さらに長いポリペプチド配列の一部として存在してもよく、さらに長いポリペプチド配列は、例えば、ポリペプチドの安定化または検出または精製のための1つまたは複数のドメインまたは部分配列を付加することによって生じる。このようなドメインまたは部分配列は、当業者が容易に理解し、構築できるように、本発明のポリペプチドに共有結合により融合されてもよい。ポリペプチド精製用部分配列は、例えば、エピトープタグ、FLAGタグ、ポリヒスチジン配列、GST融合、または当技術分野において公知の他の任意の検出/精製用部分配列もしくは「タグ」を含んでもよい。これらのさらなるドメインまたは部分配列は、本発明のポリペプチドの活性にほとんど影響がないか、もしくは全く影響がないか、または合成後プロセシング工程によって、例えば、プロテアーゼ処理、インテイン含有などによって除去することができる。
本発明のポリペプチド(本発明の融合タンパク質を含む)を産生および単離するための組換え法を下記に記載した。組換え産生に加えて、ポリペプチドは、固相技法を用いた直接ペプチド合成によって作製されてもよい(例えば、Stewart et al. (1969) Solid-Phase Peptide Synthesis, W.H. Freeman Co, San Francisco; Merrifield (1963) J. Am. Chem. Soc 85:2149-2154を参照されたい)。ペプチド合成は、手作業による技法を用いて、または自動化によって行われてもよい。自動化合成は、例えば、Applied Biosystems 431A Peptide Synthesizer (Perkin Elmer, Foster City, Calif.)を用いて、製造業者により提供された説明書に従って達成することができる。例えば、変異体CTLA-4ポリペプチドまたはその機能断片を得るために、部分配列を別々に化学合成し、化学的方法を用いて組み合わせてもよい。または、このような配列は、ポリペプチドの作製を専門とする多数の会社に注文することができる。最も一般的には、本発明のポリペプチドは、例えば、下記のように、コード核酸を発現させ、ポリペプチドを回収することによって作製される。
本発明は、本発明のポリペプチドをコードする単離されたまたは組換え型の核酸(本明細書ではポリヌクレオチドとも呼ばれる)を提供し、これは、総称して「本発明の核酸」(または「本発明のポリヌクレオチド」)と呼ばれる。本発明の核酸は下記の全てを含めて、本発明のポリペプチドの組換え産生(例えば、発現)において、典型的には、ポリペプチドまたはその断片をコードする配列を含むプラスミド発現ベクターを発現させることによる組換え産生において;治療剤として;予防剤として;診断ツールとして;相補的な核酸または部分的に相補的な核酸の存在についての診断プローブ(野生型CTLA-4核酸の検出用を含む)として有用である。例えば、下記の全てを含む本発明の核酸は、インビトロおよび/またはインビボ用途において、免疫応答(例えば、T細胞活性化、T細胞増殖、サイトカインの合成もしくは産生(例えば、TNF-α、IFN-γ、IL-2の産生)、活性化マーカー(例えば、CD25、IL-2受容体)の誘導、炎症、抗コラーゲン抗体産生、および/またはT細胞依存性抗体応答)の抑制または阻害において有用なポリペプチドをコードするので有用である。用途には、例えば、免疫応答の抑制が望まし免疫系の疾患、障害、および状態を処置する予防方法および/または治療方法(例えば、自己免疫の疾患および障害を処置する方法、ならびにレシピエントによるドナーからの組織移植、細胞移植、または臓器移植の拒絶反応を阻害する方法)が含まれる。本発明の核酸はまた、遺伝子療法、DNAワクチン接種、および免疫抑制療法に有用な発現ベクターに組み込むこともできる。核酸およびこのような核酸を含む本発明のベクターのさらなる使用は、本明細書の他の場所に記載されている。
前記のように、本発明は、本発明の標的核酸、例えば、SEQ ID NO:80-158、201-204、223、および224からなる群より選択されるポリヌクレオチド、またはその相補ポリヌクレオチド配列にハイブリダイズする核酸を含む。ここで、ハイブリダイゼーションは、標的核酸の実質的に全長にわたる。ハイブリダイズする核酸は、少なくともストリンジェントな条件下または少なくとも高ストリンジェンシー条件下で、本発明のヌクレオチド配列、例えば、SEQ ID NO:80のヌクレオチド配列にハイブリダイズしてもよい。核酸ハイブリダイゼーション実験のための中程度にストリンジェントな、ストリンジェントな、および高度にストリンジェントなハイブリダイゼーション条件は公知である。このようなストリンジェンシーレベルを実現するのに組み合わせることができる要因の例は、本明細書において手短に議論されている。
本発明の核酸は、任意の適切な合成法、操作法、および/または単離法、またはその組み合わせを適用することによって入手および/または作製することができる。例示的な手順は下記に記載されている。例えば、本発明のポリヌクレオチドは、典型的には、当技術分野において公知の標準的な核酸合成法、例えば、固相合成法によって作製される。このような技法において、通常、約100塩基までの断片が個々に合成され、次いで、本質的に全ての望ましい連続した核酸配列を形成するように、(例えば、酵素的もしくは化学的な連結方法、またはポリメラーゼを介した組換え法によって)接合される。本発明の核酸の合成はまた、化学合成、例えば、Beaucage et al. (1981) Tetrahedron Letters 22:1859-69に記載の古典的なホスホルアミダイト法、または、例えば、典型的には、自動化合成法において実施されるような、Matthes et al. (1984) EMBO J. 3:801-05に記載の方法を用いた化学合成によって容易にすることができる(または達成することができる)。本発明の核酸はまた自動DNA合成機を用いて作製することもできる。核酸を合成する他の技法および関連する原理は、例えば、Itakura et al., Annu. Rev. Biochem. 53:323 (1984)、Itakura et al., Science 198:1056 (1984)、および Ike et al., Nucl. Acid Res. 11:477(1983)に記載されている。
適宜、本発明の核酸は、核酸の発現が望ましい特定の宿主があれば、コドン使用頻度および/またはコドンコンテキストに関して配列を改変することによって、特定の宿主において発現を増大または増強するように改変することができる。特定の宿主において最も多く用いられるコドンは最適コドンと呼ばれ、あまり用いられないコドンは、稀なコドンまたは低使用頻度コドンと分類される(例えば、Zhang, S. P. et al.(1991) Gene 105:61-72を参照されたい)。コドンは、宿主の好ましいコドン使用頻度を反映するように置換することができ、このプロセスは、「コドン最適化」または「種コドンの偏りを制御する」と呼ばれる。
本発明はまた、前記で広範に説明したように、本発明の核酸の1つまたは複数を含む組換え構築物を含む。このような構築物は、ベクター、例えば、プラスミド、コスミド、ファージ、ウイルス、ウイルス粒子、ウイルス様粒子、細菌人工染色体(BAC)、酵母人工染色体(YAC)など、または非複製ベクター、例えば、リポソーム、裸のDNAまたはコンジュゲート化DNA、DNA微小粒子を含んでもよく、これらには、本発明の少なくとも1つの核酸配列が順方向または逆方向に挿入されている。この態様の特定の局面において、構築物は、本発明の核酸配列(例えば、単離されたもしくは組換え変異体CTLA-4 ECDポリペプチドまたは二量体もしくは単量体の変異体CTLA-4-Igをコードする、核酸)に機能的に連結された、例えば、プロモーターを含む、1つまたは複数の調節配列をさらに含む。多数の適切なベクターおよびプロモーターが当業者に公知であり、市販されている。同様にもしくはその代わりに、場合によっては、ベクター、例えば、ウイルスまたはウイルス様粒子は、本発明の1つまたは複数のポリペプチド、例えば、ウイルスまたはウイルス様粒子のコートに組み込まれた本発明の1つまたは複数のポリペプチドを含んでもよい。ベクターは、外因性遺伝子または外因性タンパク質を対象に送達または投与するための送達薬剤として有用であり得る。本明細書に記載のベクターを含む、本発明のベクターは、本発明の核酸および/またはポリペプチドを送達または投与するための送達剤として有用である。
本発明はまた、本発明のベクター(例えば、クローニングベクターもしくは発現ベクター)または本発明の核酸によって形質導入、トランスフェクト、または形質転換された、操作された宿主細胞も提供する。操作された宿主細胞は、プロモーターの活性化、形質転換体の選択、または関心対象の遺伝子の増幅のために適宜改変される従来の栄養培地中で培養することができる。培養条件、例えば、温度、pHなどは、発現のために選択された宿主細胞と共に以前に用いられたものであり、当業者に、ならびに、例えば、Freshney (1994) Culture of Animal Cells, a Manual of Basic Technique, 3rd ed., Wiley - Liss, New Yorkおよびその中で引用された参考文献を含む、本明細書において引用された参考文献において明らかであろう。このような本発明のベクターまたは核酸によってコードされる本発明のポリペプチドは、このような宿主細胞内で発現され、標準的な技法によって単離することができる。例えば、細胞培養物に放出されたポリペプチドは、超遠心または類似の技法によって培養物から単離することができる。
適切な宿主株に形質導入し、宿主株を適切な細胞密度まで増殖させた後に、選択されたプロモーターを適切な手段(例えば、温度変化または化学的誘導)によって誘導し、細胞をさらなる期間培養する。細胞は、典型的には、遠心分離によって採取され、物理的手段または化学的手段によって破壊され、結果として生じた粗抽出物が、さらなる精製のために保持される。タンパク質発現において用いられた微生物細胞は、凍結融解サイクル、超音波処理、機械的破壊、もしくは細胞溶解剤の使用、または当業者に周知の他の方法を含む任意の便利な方法によって破壊することができる。
本発明のDNAおよび/もしくはRNAまたはその断片を用いて、本発明の組換えポリペプチドまたはその断片を産生するために、無細胞転写/翻訳系も使用することができる。いくつかのこのような系は市販されている。インビトロでの転写および翻訳のプロトコールに対する一般的なガイドは、Tymms(1995) IN VITRO TRANSCRIPTION AND TRANSLATION PROTOCOLS: METHODS IN MOLECULAR BIOLOGY, Volume 37, Garland Publishing, NewYorkにおいて見出される。
本発明のポリペプチド(例えば、二量体および単量体融合タンパク質ならびに多量体ポリペプチドを含む)、コンジュゲート、組成物、核酸、ベクター、ならびに細胞は、様々な特性および特徴を示し、例えば、免疫系および免疫系応答の調節または調整が利益となり得る様々な免疫系疾患、障害、および状態を処置する予防方法または治療方法を含むが、これに限定されない様々な用途において有用であると考えられる。例えば、CD80および/もしくはCD86またはそのいずれかもしくは両方のECDに結合する能力を有し、かつ/あるいは免疫応答を阻害する能力を有する、本発明のポリペプチド、コンジュゲート、組成物、核酸、ベクター、および細胞は、対象における免疫応答を阻害または抑制するための予防方法および/または治療方法、レシピエントによるドナーからの組織移植、細胞移植、または臓器移植の拒絶反応を阻害する方法、ならびに本明細書の他の場所に記載の他の方法において有用であると考えられる。このような本発明のポリペプチド、コンジュゲート、組成物、核酸、ベクター、および細胞の一部は、CD28および/またはCTLA-4を発現するT細胞とB7陽性細胞との相互作用を調節または阻害する方法において有用であると予想される。
慢性関節リウマチは、最もよく見られる全身炎症性自己免疫疾患の1つであり、成人集団の1〜2%が罹患していると見積もられている。例えば、Dipiro, J.T., Rheumatoid arthritis, in PHARMACOTHERAPY: A PATHOPHYSIOLOGIC APPROACH, 1671-1682(Talbert, R.T. et al. eds., McGraw-Hill, New York, 6th ed. 2005)を参照されたい。この疾患は、滑膜過形成および活性化T細胞を含む炎症細胞の浸潤を特徴とする。活性化T細胞は、炎症誘発性サイトカイン、例えば、IL-1、IL-6、およびTNF-α、自己抗体、およびマトリックスメタロプロテイナーゼを産生するように様々な細胞タイプを刺激するよって、慢性関節リウマチの進行において中心的な役割を果たしている(Hoffman, R.W., Front. Biosci. 6:1369-1378(2001); Choy, E.K. et al., N. Engl. J. Med 344:907-916(2001))。T細胞が慢性関節リウマチの進行に強く寄与しているので、T細胞活性化は、治療介入の合理的な標的となっている。このような炎症性分子は、慢性関節リウマチに関連する炎症応答、組織損傷(例えば、関節損傷)、および疼痛の原因であると考えられる。
別の局面において、本発明は、レシピエント対象によるドナーからの組織移植、細胞移植、皮膚移植片移植、もしくは臓器移植の拒絶反応を阻害する方法、またはレシピエント対象によるドナーからの組織移植、細胞移植、皮膚移植片移植、もしくは臓器移植に関連する免疫応答を抑制する方法を提供する。前記方法は、レシピエント対象に、治療的有効量の、以下:(1)本発明のポリペプチド(例えば、変異体CTLA-4-ECDポリペプチドまたは二量体もしくは単量体の変異体CTLA-4-Ig融合タンパク質);(2)本発明の1つもしくはそれ以上のポリペプチドを含む多量体(例えば、任意の2つのこのようなポリペプチドを含む二量体、もしくは任意の4つのこのようなポリペプチドを含む四量体);(3)本発明の少なくとも1つのポリペプチドを含む、コンジュゲート;(4)本発明の核酸(例えば、本発明のポリペプチドをコードする核酸);(5)本発明の核酸を含む、もしくは本発明のポリペプチドをコードする、ベクター;(6)本発明のポリペプチド、核酸、コンジュゲート、および/もしくはベクターを含む、細胞もしくは細胞集団;および/または(7)本発明の組成物の1つまたは複数を投与し、それによって、レシピエント対象による組織移植、細胞移植、皮膚移植片移植、または臓器移植の拒絶反応を阻害する工程を含む。ドナーおよびレシピエントは同じ種でもよく、異なる種でもよい。ドナーまたはレシピエントは、哺乳動物、例えば、ヒト、非ヒト霊長類(例えば、サル、ゴリラ)、ヒツジ、ネコ、イヌ、ブタ、ウシ、ウマなどでよい。このような方法の一部では、本発明のポリペプチド、コンジュゲート、ベクター、および/または細胞は、組織移植、細胞移植、皮膚移植片、もしくは臓器移植の前に、組織移植、細胞移植、皮膚移植片、もしくは臓器移植と同時に、または組織移植、細胞移植、皮膚移植片、もしくは臓器移植の後に、レシピエント対象に投与される。有効量は、典型的には、約0.001mg/kg対象体重〜約200mg/kg対象体重を含む。このような方法の一部では、例えば、有効量は、約0.001ミリグラム/キログラム対象体重(mg/kg)〜少なくとも約0.005、0.01、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、10、25、50、75、100、125、150、175、200、225、250、または300ミリグラム/キログラム対象体重(mg/kg)を含む。このような方法の一部では、有効量は、約0.001ミリグラム/キログラム対象体重(mg/kg)〜少なくとも約0.005、0.01、0.05、0.1、0.2、0.5、1、2、3、4、5、6、7、8、9、10、20、25、50、または75ミリグラム/キログラム対象体重(mg/kg)を含む。本発明のポリペプチド、コンジュゲート、核酸、ベクター、および/または細胞は、移植中、移植前、または移植の直後にレシピエント対象に投与されてもよい。その代わりとして、またはさらに、本発明のこのような分子は、必要に応じて、移植の1時間後もしくは数時間後に、移植の翌日に、および/もしくは移植後毎日、または移植後、1週間に少なくとも1回、2週間に少なくとも1回、もしくは1ヶ月に少なくとも1回、必要に応じて、12ヶ月まで、24ヶ月まで、もしくは36ヶ月まで、またはそれ以上投与されてもよい。臓器移植は、任意の臓器、例えば、腎臓、肝臓、心臓、または肺が関与してよい。
別の局面において、本発明は、哺乳動物(例えば、ヒトまたは非ヒト霊長類)における免疫応答を阻害または抑制するための医薬を製造するための、本発明のポリペプチド(例えば、二量体もしくは単量体の融合タンパク質もしくは多量体ポリペプチドを含む)、コンジュゲート、核酸、ベクター、または細胞の使用を含む。抑制することができる免疫応答には、例えば、T細胞活性化またはT細胞増殖、サイトカインの合成または産生、活性化マーカーの誘導、炎症性分子の合成または産生、炎症、抗コラーゲンAbの産生、T細胞依存性Ab応答が含まれる。
本発明のポリペプチド、核酸、ベクター、ウイルス、シュードウイルス(pseudovirus)、VLP、または組成物によって抑制される免疫応答は、任意の適切な技法によって測定することができる。体液性免疫応答の評価における有用な技法の例には、フローサイトメトリー、イムノブロッティングアッセイ、免疫組織化学アッセイ、免疫沈降アッセイ、ラジオイムノアッセイ(RIA)、および酵素イムノアッセイが含まれる。酵素イムノアッセイには、酵素結合イムノフローアッセイ(ELIFA)、ならびにサンドイッチELISAおよび競合的ELISAアッセイを含む酵素結合免疫測定法(ELISA)が含まれる。抗体および標的物質の複合体を検出するために、HPLCおよびキャピラリー電気泳動(CE)もまたイムノアッセイにおいて利用することができる。このような技法および関連する原理を実施するための大まかなガイダンスは、例えば、Harlow and Lane (1988) ANTIBODIES, A LABORATORY MANUAL, Cold Spring Harbor Publications, New York、Hampton R et al. (1990) SEROLOGICAL METHODS A LABORATORY MANUAL, APS Press, St. Paul Minn.、Stevens (1995) CLINICAL IMMUNOLOGY AND SEROLOGY: A LABORATORY PERSPECTIVE, CRC press、Bjerrum (1988) HANDBOOK OF IMMUNOBLOTTING OF PROTEINS, Vol. 2、Zoa (1995) DIAGNOSTIC IMMUNOPATHOLOGY: LABORATORY Practice AND CLINICAL APPLICATION, Cambridge University Press、Folds (1998) CLINICAL DIAGNOSTIC IMMUNOLOGY: PROTOCOLS IN QUALITY ASSURANCE AND STANDARDIZATION、Blackwell Science Inc., Bryant (1992) LABORATORY IMMUNOLOGY & SEROLOGY 3rd edition, W B Saunders Co.、およびMaddox D E et al. (1983) J. Exp. Med. 158:1211に記載されている。ELISA法および関連する原理に関するガイダンスは、例えば、Reen (1994) Methods Mol. Biol. 32:461-6、Goldberg et al. (1993) Curr. Opin. Immunol. 5(2):278-81、Voller et al. (1982) Lab. Res. Methods Biol. Med. 5:59-81、Yolken et al. (1983) Ann. NY Acad. Sci. 420:381-90、Vaughn et al. (1999) Am. J. Trop. Med. Hyg. 60(4):693-8、およびKuno et al. (1991) J. Virol. Methods 33(1-2):101-13に記載されている。フローサイトメトリー法に関するガイダンスは、例えば、Diamond (2000) IN LIVING COLOR : PROTOCOLS IN FLOW CYTOMETRY AND CELL SORTING, Springer Verlag, Jaroszeki (1998) FLOW CYTOMETRY PROTOCOLS, 1st Ed., Shapiro (1995) PRACTICAL FLOW CYTOMETRY, 3rd edition、Rieseberg et al. (2001) Appl. Microbiol. Biotechnol. 56(3-4):350-60、Scheffold and Kern (2000) J. Clin. Immunol. 20(6):400-7、およびMcSharry (1994) Clin. Microbiol. Rev. (4):576-604に示めされている。
本明細書に記載のいずれの方法でも、適切な薬学的に許容される賦形剤または担体(例えば、PBS)および有効量の本発明の分子、例えば、本発明のポリペプチド(例えば、変異体CTLA-4 ECD、または単量体、二量体、もしくは多量体変異体CTLA-4-Ig)あるいはコンジュゲートを含む注射用薬学的組成物を、宿主に、非経口投与、筋肉内投与、腹腔内投与、静脈内投与、真皮下投与、経皮投与、または皮下投与することができる。または、バイオリスティックタンパク質送達法(ワクチン銃送達)を使用することができる(この例は本明細書の他の場所で議論される)。他の任意の適切な技法も使用することができる。ポリペプチド投与はリポソームを介して容易にすることができる。任意のこのような送達技法を用いて、本発明のポリペプチドまたはコンジュゲートを、本明細書に記載の任意の治療方法または予防方法と組み合わせて送達することができる。
本発明は、本発明のポリペプチド、核酸、ベクター、および細胞を作る、および精製する方法をさらに提供する。1つの局面において、本発明は、本発明の核酸を培地中の細胞集団に導入し、(遺伝子発現の望ましいレベルに適した時間、および条件下で)培地中の細胞を培養してポリペプチドを産生し、細胞、培地、またはその両方からポリペプチドを単離することによって、本発明の組換えポリペプチドを作る方法を提供する。核酸は、典型的には、核酸によってコードされるポリペプチドを発現するのに有効な調節配列に機能的に連結される。
本発明は、本発明の少なくとも1つの成分、例えば、本発明の少なくとも1つのポリペプチド(例えば、融合タンパク質および多量体ポリペプチドを含む)、コンジュゲート、核酸、ベクター、ウイルス、ウイルス様粒子(VLP)、ならびに/または細胞あるいはその任意の組み合わせ、ならびに担体、賦形剤、または希釈剤を含む、新規のかつ有用な組成物をさらに提供する。担体、賦形剤、または希釈剤は、薬学的に許容される担体、賦形剤、または希釈剤でもよい。このような組成物は、任意の適切な量の任意の適切な数の本発明のポリペプチド、コンジュゲート、核酸、ベクター、ウイルス、VLPs、および/または細胞を含んでもよい。少なくとも1つのポリペプチド、コンジュゲート、核酸、ベクター、ウイルス、VLP、および/もしくは細胞、またはその任意の組み合わせ、ならびに薬学的に許容される担体、賦形剤、または希釈剤を含む、薬学的組成物も提供される。このような組成物は、例えば、免疫応答を抑制する方法を含む、本明細書に記載の本発明の方法において有用である。
本発明はまた、本発明のポリペプチド(例えば、二量体融合タンパク質を含む、変異体CTLA-4 ECDポリペプチド、変異体CTLA-4-Ig融合タンパク質)、コンジュゲート、核酸、ベクター、細胞、および/または組成物のうちの1つ、2つ、3つ、またはそれ以上を含むキットも提供する。本発明のキットは、任意で、(1)本発明の少なくとも1つのポリペプチド(例えば、変異体CTLA-4-Ig融合タンパク質)、コンジュゲート、核酸、ベクター、VLP、細胞、および/もしくは組成物;(2)任意で、少なくとも1つの第2の免疫抑制剤(例えば、非ステロイド性抗炎症剤、メトトレキセート、ステロイド、TNFαアンタゴニストなど);(3)治療方法もしくは予防方法を含む、本明細書に記載の任意の方法を実施するための説明書、および(1)もしくは(2)において特定された任意の成分を使用するための説明書;(4)(1)もしくは(2)において特定された少なくとも1つのこのような成分を保持するための容器;ならびに/または(5)包装材料を備える。本発明のポリペプチド(例えば、変異体CTLA-4-Ig融合タンパク質)、コンジュゲート、核酸、ベクター、VLPs、細胞、および/または組成物の1つまたは複数と、任意で、1つまたは複数の第2の免疫抑制剤は、対象、例えば、ヒトを含む哺乳動物に投与するためにパック、ディスペンサー装置、およびキットに入れることができる。指示された治療方法または予防方法について、本発明のこのような各ポリペプチド(例えば、変異体CTLA-4-Ig融合タンパク質)、コンジュゲート、核酸、ベクター、VLP、細胞、および/もしくは組成物、または任意の第2の免疫抑制剤の有効量(例えば、用量)が示され、1つまたは複数のこのような用量が提供される。1つまたは複数のポリペプチド(例えば、変異体CTLA-4-Ig融合タンパク質)、コンジュゲート、核酸、ベクター、および/または細胞組成物、所望であれば、任意の第2の免疫抑制剤は、粉末(例えば、凍結乾燥粉末)または液体の形で提供されてもよく、賦形剤または担体(例えば、薬学的に許容される賦形剤または担体を含む)を用いて処方されて、組成物(例えば、薬学的組成物を含む)を形成してもよい。1つまたは複数の単位剤形を含むパックまたはディスペンサー装置が提供される。典型的には、指示された状態の処置に化合物が適しているとラベルに適切に示されると同時に、このような成分を投与するための説明書が包装と共に提供される。
本実施例は、Biacore(商標)結合アッセイ法および細胞ベースの活性アッセイ法において対照として比較目的のために使用したLEA29Y-Ig融合タンパク質を作製するための方法の説明を提供する。
本実施例では、LEA29Y-Ig融合タンパク質をコードするDNAプラスミドベクターの作製について説明する。LEA29Y-Igは、特定のヒト変異IgG1 FcポリペプチドのN末端にそのC末端が共有結合されている、「LEA29Y」(または「LEA」もしくは「L104EA29Y」もしくは「A29YL104E」)と名付けられた特定の公知の変異CTLA-4 ECDポリペプチドを含む。LEA29Yポリペプチドは、2つの変異、すなわちA29Y置換およびL104E置換(29位および104位は、ヒトCTLA-4 ECDポリペプチドのポリペプチド配列を参照し、ヒトCTLA-4の最初のアミノ酸残基をアミノ酸残基1位と指定して付けた番号である)により、ヒトCTLA-4の細胞外ドメインのポリペプチド配列とは異なるポリペプチド配列を含む変異CTLA-4 ECDポリペプチドである。U.S.7,094,874を参照されたい。LEA29Y-Igをコードするヌクレオチド配列を含むプラスミドベクターpCDNA3.1-LEAを作製して、この融合タンパク質を作製した。
数ミリグラム(multi-milligram)量の上記のLEA29Y-Ig融合タンパク質を生成するために安定な細胞株を作製した。
10%ウシ胎児血清(FBS)(Hyclone、SV30014.03番)および1×PS(Penicillin+Streptomycin)(Invitrogen、15140-122番)を添加した増殖培地(DMEM/F12培地(Invitrogen、10565-018番))40mlを含むT-175フラスコ(BD Falcon、353112番)に密度1×106個でCHO-K1細胞を播種した。細胞を37℃で24時間(hrs)インキュベートし、次いで、製造業者が推奨する条件に従って、Fugene 6(Roche、11814443001番)60μlと混合したMaxiprepプラスミドDNA(例えば、前述のLEA29Y-Igをコードするプラスミドベクター)10μgをトランスフェクトした。37℃で2日(d)間、増殖培地中で、次いで、選択培地(300μg/ml Geneticin(Invitrogen、10131-027番)を含む増殖培地)中で、2日毎に培地を変更して10日間、細胞をインキュベートした。培地を除去し、0.05%トリプシン(Invitrogen、カタログ番号25300-054)3mlを添加し37℃で3分間インキュベーションすることにより、細胞を分散させた。分散させた細胞を増殖培地10ml中に希釈し、GH-3.8ローター(Beckman Coulter、360581番)を用いて室温(RT)、1000rpmで5分間遠心分離することにより回収した。上清を廃棄した後、細胞を増殖培地1ml中に懸濁し、40μmのメンブレン(BD Falcon、352340番)に通して濾過し、密度1×106細胞/mlに調整した。
細胞選別機(Dako、MoFlo)を用いて、25%順化培地(トランスフェクトされていない(または未処理の)細胞培養物から前もって回収した増殖培地)を含む増殖培地を200μl/ウェルで含む96ウェル培養プレート(Sigma-Aldrich、CLS-3596番)中に個々に生細胞を分散させた。37℃で10〜14日間インキュベーションした後、トリプシン加水分解によって細胞を分散させ、200μl/ウェルの増殖培地を含む新しい培養プレートに移した。細胞密度が70%コンフルエントな状態に到達するまで(7日毎に培地を交換して約14日)、増殖培地中、37℃で細胞を培養した。
ドットブロットおよびウェスタン解析によって、高レベルの組換えLEA29Y-Ig融合タンパク質を発現するクローンを同定した。ドットブロット解析のために、製造業者の推奨に従って、96ウェル培養プレートの各ウェルから培地100μlを回収し、ニトロセルロース膜(Whatman、10439388番)に移した。室温(RT)で10分間、PBST(PBSTは、リン酸緩衝化生理食塩水(PBS)+0.05% Tween(登録商標)-20である)200mlで膜を2回洗浄し、次いで、RTで1時間(hr)、5%脱脂粉乳(EMD、1.15363.0500番)を含むPBSTと共にインキュベートした。前述したように膜を洗浄し、1:4000に希釈した西洋ワサビペルオキシダーゼ(HRP)結合ヤギ抗ヒトIg抗体(Vector Labs、BA-3000番)を含むPBST 20ml中でRTにて1時間、インキュベートした。前述したように膜を洗浄し、1:2000希釈したストレプトアビジン-HRP試薬(BD Biosciences、554066番)を含むPBSTと共にRTで1時間、インキュベートした。前述したように膜を洗浄し、製造業者の推奨条件に従ってECL Western Blot Detection Reagent(Amersham、カタログ番号RPN2132)を用いてシグナルを検出した。高いシグナル強度に基づいて同定された(すなわち、高レベルの融合タンパク質を発現している)陽性クローンをトリプシン加水分解によって分散させて、2ml/ウェルの増殖培地を含む6ウェル培養プレート(BD Falcon、カタログ番号353046)に移した。37℃で3〜4日間インキュベーションした後、トリプシン加水分解によって細胞を分散させ、増殖培地20mlを含むT-75フラスコ(BD Falcon、カタログ番号353136)に移した。37℃で2日間インキュベーションした後、培地100μlを回収し、タンパク質発現レベルをウェスタン解析によって解析した。ウェスタン解析のために、各細胞培養物に由来する等量(15μl)の培地を、製造業者の推奨条件に従って、MES(MESは、2-(N-モルホリノ)エタンスルホン酸である、pH7.3)泳動用緩衝液(Invitrogen、NP0002番)を用いて4〜12%Bis-Tris NuPAGEゲル(Invitrogen、NP0322BOX番)を泳動させた。製造業者の推奨条件に従って、エレクトロトランスファーにより、タンパク質をゲルからニトロセルロース膜(Invitrogen、カタログ番号LC2001)に移した。ドットブロッティングに関して前述したようにして膜を処理し、シグナル強度および見かけの分子量に基づいて、(関心対象の融合タンパク質を発現する)陽性クローンを同定した。前述したようにトリプシン加水分解によって陽性クローンを分散させ、増殖培地40mlを含むT-175フラスコ中で増殖させた。
ローラーボトル培養物の増殖
関心対象の融合タンパク質をコードする核酸で前述のようにしてトランスフェクトした安定なCHO-K1細胞株を、10%FBS(Hyclone SV30014.03番)および1×PS(Invitrogen、15140-122番)を添加した増殖培地(DMEM/F-12培地(Invitrogen、10565-018番)40mlを含むT-175フラスコにおいてコンフルエントな状態になるまで増殖させた。0.05%トリプシン3ml(Invitrogen、カタログ番号25300-054)中で、37℃にて3分間インキュベーションすることによって細胞を回収し、増殖培地12ml中に希釈し、次いで、増殖培地250mlを含むローラーボトル(Corning、カタログ番号431191)に移した。加湿した回転インキュベーター中、37℃で2日間ローラーボトル培養物をインキュベーションした後、培地を除去し、新鮮な増殖培地250mlに交換した。培養物を37℃で2日間インキュベートし、培地をUltraCHO培地(1/1000 EX-CYTE (Serologicals Proteins、カタログ番号81129N)および1×PSを添加したUltraCHO培地(BioWhittaker、カタログ番号12-724))250mlに交換した。37℃で2日間インキュベーションした後、培地を新鮮なUltraCHO培地250mlに交換した。培養物を37℃で2日間インキュベートし、培地を産生用培地(1/100×ITSA(Life Technologies 51300-044番)、1/1000×EX-CYTE、および1×PSを添加したDMEM/F-12倍地)250mlに交換した。産生の間、培地を回収し、1日おきに新鮮な産生培地に交換した。
ローラーボトル培養物から得た産生用培地を、2500×g、RTで30分間遠心分離し、続いて0.2μMのメンブレン(VWR、カタログ番号73520-986)に通して濾過することによって清澄にした。10kDa MWCOのメンブレン(Millipore、カタログ番号P3C010C00)を用いた接線流濾過によって培地を10倍に濃縮し、次いで、BioCad vision HPLCシステムを用いたプロテインAアフィニティクロマトグラフィーのために使用した。Ig融合タンパク質をPBS緩衝液中のPoros 20プロテインA樹脂(Applied Biosystems、カタログ番号1-5029-01)に結合させ、同じ緩衝液で洗浄し、160mM塩化ナトリウムを含む80mMクエン酸緩衝液(pH 4.0)で溶出させ、次いで、2M Tris塩基を添加して中和した。最後に、10kDa MWCOメンブレン(Pierce、カタログ番号PI66810)を用いて、このタンパク質溶液を6リットル(l)のPBSに対して透析した。
本実施例は、ファージディスプレイによって、CTLA-4変異体のライブラリーを作製し、改変ヒトCD80結合アビディティおよび/または改変ヒトCD86結合アビディティを求めてスクリーニングするために使用される例示的な方法を説明する。
ヒトCD80-Ig(「hCD80-Ig」)融合タンパク質およびヒトCD86-Ig(「hCD86-Ig」)融合タンパク質をファージパニング法およびファージELISA実験においてリガンドとして使用して、ヒトCD80(「hCD80」)および/もしくはヒトCD86(「hCD86」)ならびに/またはいずれか一方もしくは両方の細胞外ドメインに結合する変異CTLA-4分子を同定した。ヒトCD80-Ig(「hB7.1-Ig」または「hB7-1-Ig」とも呼ばれる)融合タンパク質およびヒトCD86-Ig融合タンパク質(「hB2.1-Ig」または「hB2-1-Ig」とも呼ばれる)は、R&D Systems(Minneapolis, MN)から入手可能である。
ヒトCD86-ヒトIgG1(典型的には本明細書において「hCD86-Ig」と略される)融合タンパク質の予測されるアミノ酸配列をコードする代表的な核酸配列を、SEQ ID NO: 179に示す。この核酸配列は、シグナルペプチド成熟ヒトCD86-ヒトIgG1融合タンパク質をコードするヌクレオチド配列を含む。hCD86-Ig融合タンパク質の予測されるアミノ酸配列をSEQ ID NO: 177に示し、予測されるhCD86-Ig融合タンパク質をコードする例示的な核酸をSEQ ID NO: 179に示す。
追加の対照として、かつ比較目的のために、Orencia(登録商標)融合タンパク質(Bristol-Myers Squibb Co., Princeton, NJ)として公知の市販されている融合タンパク質を購入した。Orencia(登録商標)融合タンパク質は、特定の変異IgG1 FcポリペプチドのN末端にそのC末端が共有結合的に融合されているWTヒトCTLA-4の細胞外ドメインから構成される。Orencia(登録商標)タンパク質は、各単量体融合タンパク質中に存在するシステイン残基間で形成されるジスルフィド結合によって一つに共有結合された2つの同一な単量体融合タンパク質を含む二量体融合タンパク質である。各成熟Orencia(登録商標)融合タンパク質単量体のポリペプチド配列はSEQ ID NO: 164に示され、次のセグメントから構成される:WTヒトCTLA-4の細胞外ドメイン(アミノ酸残基1〜124)、リンカー配列(アミノ酸残基125)、および変異IgG1 Fcポリペプチド(アミノ酸残基126〜357)。各Orencia(登録商標)融合タンパク質単量体は、LEA29Y ECDがWTヒトCTLA-4 ECDで置き換えられていることを除いては、図2Cに模式図的に示すLEA29Y-Ig融合タンパク質単量体の構造と類似した構造を有し、各単量体は分泌された融合タンパク質または成熟融合タンパク質であるため、いずれのOrencia(登録商標)融合タンパク質単量体にもシグナルペプチドは存在しない。非成熟型(シグナルペプチドを含む)のOrencia(登録商標)単量体のポリペプチド配列および非成熟型のOrencia(登録商標)融合タンパク質単量体をコードする核酸配列は、それぞれU.S.7,094,874のSEQ ID NO: 8およびSEQ ID NO: 7に示されている。Orencia(登録商標)融合タンパク質を作製および使用する方法もまた、U.S.7,094,874において開示されている。
定向進化法を用いて、組換え変異CTLA-4の細胞外ドメインポリペプチドをコードする組換え非天然ポリヌクレオチドのライブラリーを作製した。いくつかの天然の哺乳動物CTLA-4ホモログのタンパク質配列およびヌクレオチド配列が公知である。例えば、国立バイオテクノロジー情報センター(National Center for Biotechnology Information)(NCBI)を参照されたい。様々な天然の哺乳動物CTLA-4の細胞外ドメインホモログにおいて確認された配列多様性を定向進化法において用いて、変異CTLA-4 ECDドメインポリペプチドをコードする組換えポリヌクレオチドのライブラリーを作製した。定向進化法の手順には、例えば、インビトロでの組換え手順および変異誘発手順が含まれ、これらはStemmer, Proc. Natl. Acad. Sci. USA 91:10747-10751 (1994); Chang et al., Nature Biotech 17:793-797 (1999);国際特許出願公開WO 98/27230; ならびに米国特許第6,117,679 号および同第6,537,776号において実質的に説明されている。
組換え変異CTLA-4 ECDポリペプチドをコードする変異DNA配列を、配列相同性に基づいて設計したフォワードプライマーおよびリバースプライマーを用いたPCRによるアセンブリ反応によって増幅した。これらのプライマーは、当業者には周知の標準手順を用いて設計し、作製し、組み立て、これらは必要に応じて停止コドンおよび開始コドンならびに制限部位を含んだ。使用したPCR増幅手順もまた、当技術分野において周知である。例えば、いずれも前記のBerger、Ausubel、およびSambrookの文献を参照されたい。例示的なフォワードプライマーおよびリバースプライマーには、非限定的に、次のものが含まれる:フォワードプライマー
およびリバースプライマー
。
アセンブリ反応産物5μlを、1μMのフォワードプライマーおよびリバースプライマー、Taq緩衝液(Qiagen;201225番)、ならびに200μM dNTPを用いた増幅サイクル(94℃で30秒;50℃で30秒;72℃で40秒)15回の100μl PCR反応において鋳型として使用した。変異CTLA-4 ECDポリペプチドをコードする増幅されたDNAを制限酵素(SfiIおよびNotI)で消化し、これらの断片をアガロースゲル電気泳動によって分離し、製造業者の推奨に従ってQiaquick Gel Extraction Kit(Qiagen、28704番)を用いて精製し、同様に消化したファージディスプレイベクターpSB0124に連結した(Chang et al., Nature Biotech 17:793-797 (1999)で説明されているものに類似した手順)。結果として生じるライブラリー連結物を、製造業者の推奨条件に従ってエレクトロポレーションによってTOP10大腸菌細胞(Invitrogen, Inc; C4040-50番)中にトランスフォームした。50μg/mlカルベニシリンを含むLB(Luria broth media)中で250rpm、37℃で一晩、形質転換細胞をインキュベートし、次いで、製造業者の推奨条件に従ってライブラリーDNAのmaxiprep(Qiagen;12362番)用ストック溶液を作製するために使用した。
変異CTLA-4ポリペプチドのファージディスプレイライブラリーの作製
ライブラリーDNA(例えば、CTLA-4 ECD変異体をコードするDNA配列のライブラリー)を、製造業者の推奨条件に従って、エレクトロポレーションによってTG-1大腸菌細胞(Stratagene;200123番)中にトランスフォームした。培養物をファージミド選択条件(50μg/mlのカルベニシリンを含むLB培地)下で1〜2世代増殖させ、ヘルパーファージM13KO7に感染させ(感染多重度レベル5〜10)、ファージミド(50μg/mlのカルベニシリン)およびヘルパーファージ(70μg/mlのカナマイシン)に関する二重選択下で、250rpmで振盪しながら37℃で一晩インキュベートした。遠心分離(Sorvall 600TCローターにおいて6000rpm、15分、4℃)によって培養物を清澄にし、PEG/NaCl溶液(20%PEG-8000;2.5M NaCl)8mlと共に培養物上清32mlを氷上で30分間インキュベートすることによってファージ粒子を沈殿させ、続いて、遠心分離(Sorvall 600TCローターにおいて9500rpm、40分、4℃)を行った。1%BSA(bovine serum albumin、Sigma;A7906番)含有PBS 1ml中にファージ沈殿物を懸濁し、マイクロチューブに移し、遠心分離(Eppendorf卓上遠心分離機において最大速度、5分、RT)によって清澄にした。
標準的条件を用いて、hCD80-Ig融合タンパク質またはhCD86-Ig融合タンパク質に対して最高5回、ファージライブラリーをパンニングした。例えば、Lowman, et al., Biochemistry 12;30(45):10832-10838 (1991); Smith, G.P. et al., Chem. Rev. 97:391-410(1997)を参照されたい。パンニングの各回は以下を含んだ:(a)変異CTLA-4 ECDポリペプチドを提示するファージをhCD80-IgリガンドまたはhCD86-Igリガンドに結合させること;(b)未結合のファージの除去;(c)結合されたファージの溶離;および(d)溶離されたファージを次回のパンニングのために増幅すること。各回からの一定量のファージを大腸菌細胞中に形質導入して、個々の形質導入体コロニーを得た。
各回のパンニングから得られた個々のコロニーを、50μg/mlカルベニシリンを含む2×YT(yeast-tryptone)培地150μl/ウェルを含む96ウェル培養プレート(NUNC;243656番)中に播種し、250rpm、37℃で一晩インキュベートした。一晩培養物は、600μl/ウェルの同じ培地を含むディープウェルブロック(Scienceware;378600001番)に播種するのに用いた。250rpm、37℃で2時間、培養物をインキュベートし、M13K07ヘルパーファージに感染させ(感染多重度(moi)5〜10)、次いで、ファージミドマーカーおよびヘルパーファージマーカーに関する二重選択(それぞれ50μg/mlのカルベニシリンおよび70μg/mlのカナマイシン)下で、250rpm、37℃で一晩インキュベートした。Beckman GH 3.8ローターにおいて4000 rpm、4℃で20分間遠心分離することにより、培養物を清澄にした。10μg/mlのhCD80-IgまたはhCD86-Igを含む50μl/ウェルのPBSを追加してELISAプレート(NUNC;449824番)をコーティングし、4℃で一晩インキュベートした。200μl/ウェルのPBSTでプレートを3回洗浄し、200μl/ウェルの3%脱脂粉乳含有PBSを添加しRTで1時間(hr)インキュベーションすることによりブロッキングした。ディープウェルブロックから得た25μl/ウェルのファージ上清を、25μl/ウェルの6%脱脂粉乳を含むELISAプレートに移し、プレートを室温(RT)で1時間インキュベートした。200μl/ウェルのPBSTでプレートを3回洗浄し、3%脱脂粉乳含有PBST中で1:5000希釈した50μl/ウェルのHRP結合抗M13モノクローナル抗体(GE Healthcare、27-9421-01番)と共にRTで1時間インキュベートした。200μl/ウェルのPBSTでプレートを3回洗浄し、製造業者の推奨条件に従ってTMB基質キット(Pierce; 34021番)を用いてシグナルを検出した。ヒトCD80および/またはヒトCD86へのヒトCTLA-4の結合アビディティと比べて(hCD80-Igおよび/またはhCD86-IgへのヒトCTLA-4 ECDの結合アビディティに基づいて測定される)、ヒトCD80および/またはヒトCD86への結合アビディティが増大している変異CTLA-4 ECDポリペプチド(hCD80-Igおよび/またはhCD86-Igへのアビディティの増大に基づいて測定される)を、さらに解析するために選択した。
IgG2 Fc融合タンパク質ベクターの作製
本発明の変異CTLA-4 ECDポリペプチドおよびヒトIgG2 Fcポリペプチドを含む融合タンパク質を産生させるために、IgG2-Fc融合タンパク質発現プラスミドベクターを作製した。フォワードプライマー
およびリバースプライマー
を用いてヒト白血球cDNA(BD Biosciences、カタログ番号HL4050AH)をPCR増幅することによって、ヒトIgG2 FcポリペプチドをコードするDNAを作製した。これらのプライマーは、当業者には周知の標準技術を用いて設計し、作製し、組み立て、これらは必要に応じて停止コドンおよび開始コドンならびに制限部位を含んだ。使用したPCR増幅手順もまた、当技術分野において周知である。例えば、いずれも前記のBerger、Ausubel、およびSambrookの文献を参照されたい。cDNA 50〜100ngを、1μMのフォワードプライマーおよびリバースプライマー、Taq緩衝液(Stratagene;200435番)、ならびに200μM dNTPを用いた増幅サイクル(94℃で30秒;50℃で30秒;72℃で60秒)25回の100μl PCR反応において鋳型として使用した。製造業者の推奨条件に従ってQiaQuick PCR Spin Column(Qiagen 28106番)によってPCR産物を精製し、制限酵素AgeIおよびEcoRIで消化した。PCR消化断片をアガロースゲル電気泳動によって分離し、製造業者の推奨条件に従ってQiaquick Gel Extraction Kit(Qiagen、28704番)を用いて精製した。(サイレント変異として導入されて)CTLA-4シグナル配列中にAgeI制限酵素部位を含む、pCDNA3.1-LEAベクター(前述)の改変型をAgeIおよびEcoRIで消化し、前述の断片に連結することができる。製造業者の推奨条件に従って、連結物をワンショットTOP10大腸菌細胞(Invitrogen、カタログ番号C4040-03)中にトランスフォームする。50μg/mlカルベニシリンを含むLB(Luria broth media)中で250rpm、37℃で一晩、形質転換細胞をインキュベートし、次いで、製造業者の推奨条件に従ってプラスミドDNAのmaxiprep(Qiagen;12362番)用ストック溶液を作製するために使用する。
変異CTLA-4ポリペプチドを可溶性Fc融合タンパク質として産生させるために、ファージライブラリースクリーニングにより、(ヒトCD80および/またはヒトCD86へのヒトCTLA-4-ECDの結合アビディティと比べて)ヒトCD80および/またはヒトCD86への結合アビディティが改善していると確認された変異CTLA-4 ECDポリペプチドをコードするDNA配列を、例えば以下の手順を用いて、前述のIgG2 Fc融合タンパク質ベクター中にそれぞれクローニングした。
およびリバースプライマー
を用いるPCR増幅によって、変異CTLA-4 ECDポリペプチドをコードするDNA配列をファージディスプレイベクターから回収した。プラスミドDNA(変異CTLA-4 ECDをコードするヌクレオチド配列を含むファージディスプレイベクター)10ナノグラム(ng)を、1μMの前述のフォワードプライマーおよびリバースプライマー、Taq緩衝液(Stratagene;200435番)、ならびに200μM dNTPを用いた増幅サイクル(94℃で30秒;55℃で30秒;72℃で60秒)25回の100μl PCR反応において鋳型として使用した。製造業者の推奨条件に従ってQiaQuick PCR Spin Column(Qiagen 28106番)によってPCR産物を精製し、制限酵素AgeIおよびClaIで消化した。断片をアガロースゲル電気泳動によって分離し、製造業者の推奨条件に従ってQiaquick Gel Extraction Kit(Qiagen、28704番)を用いて精製し、同様に消化したプラスミドIgG2 Fc融合ベクターに連結した。製造業者の推奨条件に従って、連結物をワンショットTOP10大腸菌細胞(Invitrogen、カタログ番号C4040-03)中にトランスフォームした。50μg/mlカルベニシリンを含むLB(Luria broth media)中で250rpm、37℃で一晩、形質転換細胞をインキュベートし、次いで、製造業者の推奨条件に従ってプラスミドDNAのmaxiprep(Qiagen;12362番)用ストック溶液を作製するために使用した。
10%FBS(Hycloneカタログ番号SV30014.03)および1×PSG(penicillin, streptomycin and glutamine)(Invitrogen、カタログ番号10378-016)を添加した増殖培地(DMEM/F-12培地(Invitrogen、カタログ番号10565-018)40mlを含むT-175フラスコにおいて80〜90%コンフルエントな状態になるまでCOS-7細胞を増殖させた。細胞をプラスミド発現ベクターでトランスフェクションする直前に、培地を除去し、発現培地(Expression Medium)(1×PSGを含むOptiMem培地(Gibco 51985番))35mlに交換した。プラスミドDNA(10μg)(例えば、本発明の変異CTLA-4-IgG2融合タンパク質をコードするpCDNA変異CTLA-4 ECD IgG2 Fc発現ベクター)を1:3の体積比でFuGENE6トランスフェクション試薬(Roche 11 815 075 001番)と混合し、増殖培地1mlに加えた。次いで、この混合物をT-175フラスコにゆっくりと加え、穏やかに回転させて混合した。37℃で3日間インキュベーションした後、培地を回収し、新鮮な発現培地を加え、さらに3日間、培養物をインキュベートした。
1000×g、RTで10分間遠心分離し、0.2μmメンブレン(Nalgene, VWR 73520-982番)を通して濾過することにより、トランスフェクション培養物の上清(例えば、変異CTLA-4-Ig融合タンパク質をコードするpCDNA変異CTLA-4 ECD IgG2 Fcベクターをトランスフェクトした細胞を含む)を清澄にした。AKTA Explorer HPLCシステム(GE Healthcare)を用いたプロテインAアフィニティクロマトグラフィーによってタンパク質を精製した。変異CTLA-4-Ig融合タンパク質をPBS緩衝液中でHitrap Protein A FFカラム(GE Healthcare、17-5079-01番)に結合させ、同じ緩衝液で洗浄し、100mMクエン酸緩衝液(pH4.0)を用いて溶出させ、次いで、1/10体積の2M Tris塩基を添加して中和した。10kDa MWCOメンブレン(Pierce, カタログ番号PI66810)を用いた透析によって、タンパク質溶液中の緩衝液を最終的にPBSに交換した。
SDS/PAGE解析
精製した本発明の変異CTLA-4-Ig融合タンパク質の見かけの分子量(MW)を、非還元条件下でSDS/PAGE解析によって測定した。非還元条件下で、本発明の変異CTLA-4-Ig融合タンパク質は典型的に、2つの単量体変異CTLA-4-Ig融合タンパク質を含む二量体融合タンパク質として存在する。1つの局面において、二量体は、2つの同一な変異CTLA-4-Ig融合タンパク質単量体を含むホモ二量体である。1つの局面において、各CTLA-4-Ig融合タンパク質単量体は、ヒトIgG2 FcポリペプチドのN末端にそのC末端が融合されている成熟した/分泌された変異CTLA-4 ECDを含む。2つの変異CTLA-4-Ig単量体は、各単量体中のシステイン残基間で形成されるジスルフィド結合によって一つに共有結合されている。ホモ二量体は、明瞭な別段の記載が無い限り、本明細書の実施例で典型的に説明する本発明の変異融合タンパク質分子の形態である。本明細書の実施例で示すデータは、明瞭な別段の記載が無い限り、変異CTLA-4-Ig融合タンパク質ホモ二量体に関する。
製造業者の推奨条件に従ってQCL-1000リムルスアメーバ様細胞分解産物アッセイキット(Cambrex 50-648U番)を用いて、変異CTLA-4融合タンパク質のエンドトキシンレベルを測定した。細胞ベースのアッセイ法で使用されるタンパク質の最大エンドトキシンレベルを10エンドトキシン単位(EU)/mgタンパク質に設定した。
Dionex BioLCシステム(Dionex)を用いたサイズ排除クロマトグラフィーによって、タンパク質凝集レベル(変異CTLA-4ポリペプチドおよび対照ポリペプチドの凝集レベルを含む)を測定した。20分間の無勾配運転によって、PBS泳動用緩衝液を用いてTosoh G3000Wx1カラム(Tosoh Bioscience)にタンパク質(5μg)を通過させ、214ナノメートル(nm)における吸光度(A)に基づいて検出した。さらなるアッセイ法で使用するタンパク質の最大凝集レベルを10%に設定した。
表面プラズモン共鳴(SPR)(Biacore(商標)解析)を用いた、ヒトCD80-マウスIg(hCD80-mIg)およびヒトCD86-マウスIg(hCD86-mIg)融合タンパク質への変異CTLA-4-Ig融合タンパク質の結合アビディティの測定
本実施例では、Biacore相互作用解析を用いて、hCD80-mIgリガンドおよび/またはhCD86-mIgリガンドに対する結合アビディティの改善に基づいて変異CTLA-4-Ig融合タンパク質をスクリーニングするための手順を説明する。このタイプの解析を説明するのに使用される学術用語では、固定された結合相手が「リガンド」と呼ばれ、移動相中の結合相手が「分析物」と呼ばれる。Igドメインを含む融合タンパク質は典型的には、2つのIgドメイン間の強い会合によって、溶液中で二量体構造体を形成する。別段の定めが無い限り、このような二量体立体構造は、本明細書の実施例で説明する融合タンパク質(すなわち、変異CTLA-4-Ig、Orencia(登録商標)融合タンパク質、LEA29Y-Ig、hCD80-mIg、およびhCD86-mIg)において存在すると予想される。「アビディティ」という用語は典型的には、二量体分析物(例えば変異CTLA-4-Ig融合タンパク質)と二量体リガンド(例えば、hCD80-mIg融合タンパク質またはhCD86-mIg融合タンパク質)との結合強度に関する。変異CTLA-4-Ig融合タンパク質に関して説明する結合アビディティの増大は、各CTLA-4 ECDドメインと対応するそのリガンドとの結合親和性の増大に起因する。結合アビディティの強度は典型的には、利用可能なリガンドの50%が平衡状態で結合される分析物のモル濃度である平衡解離定数(KD)によって説明される。
標準的な動力学的アッセイ法では、センサーチップに塗られた二量体リガンド(例えば、hCD80-mIg融合タンパク質またはhCD86-mIg融合タンパク質)および二量体分析物(例えば、本発明の変異CTLA-4-Ig融合タンパク質)の移動相における結合動態を測定する。製造業者のプロトコールに従って、ウサギ抗マウスIgG抗体(GE Healthcare、BR-1005-14番)をCM5センサーチップ(GE Healthcare、BR-1000-14番)上に固定した。固定化緩衝液(10mM酢酸ナトリウム、pH 5.0(BR-1003-51))中に抗体を30μg/mlになるまで希釈した。5μl/分の流速で、1-エチル-3-[3-ジメチルアミノプロピル]カルボジイミドヒドロクロリド(EDC)とN-ヒドロキシスクシンイミド(NHS)の混合物(等体積の11.5mg/ml EDCおよび75mg/ml NHSを混合することによって作製)(GE Healthcare、BR-1000-50番)35μlを注入し、続いて未希釈の抗体35μlを注入して、センサーチップCM5を活性化した。1Mエタノールアミン-HCL、pH8.5(GE Healthcare、BR-1000-50番)35μlによって未反応部位の反応を停止した。この手順により、典型的には15,000応答単位(RU)の結合抗体が得られた。CTLA-4リガンドであるヒトCD80-マウスIg(hCD80-mIg)(Ancell、510-820番)またはヒトCD86-マウスIg(hCD86-mIg)(Ancell、509-820番)のリガンド溶液(HBS-EP緩衝液[10mM HEPES pH7.4、150mM NaCl、3mM EDTA、0.005%(v/v)界面活性剤P-20、GE Healthcare, BR-1001-88番]に溶かした2μg/mlのタンパク質)を流速10μl/分でそれぞれ10μlまたは16μl注入することによって、抗体でコーティングしたセンサーチップに結合させた。リガンド捕捉レベルは典型的には135〜170RUであった。変異CTLA-4-Igタンパク質をHBS-EP緩衝液中で希釈し、リガンドでコーティングしたセンサーチップの上に30μl/分で2分間流し、続いて、タンパク質を含まないHBS-EP緩衝液と共に同じ流速で5分間インキュベーションした。hCD86-mIgからの解離速度が非常に遅い変異CTLA-4-Ig融合タンパク質の場合、より長い解離時間(例えば20分)も用いて動力学的アッセイ法を行った。変異CTLA-4-Igタンパク質のRmaxシグナルレベルは、約70〜100RUの範囲であった。50μl/分で10mMグリシン緩衝液(pH1.7)と共に3分間インキュベーションすることによって、サイクル間の再生を実施した。実際の実験での使用に先立って、新しいチップを4〜5サイクルの捕捉/結合/再生に供した。ウサギ抗マウスIgG捕捉抗体のみを含む参照セルからのデータを、捕捉されたhCD80-mIgまたはhCD86-mIgを含むフローセルから得られたデータから差し引いた。典型的には、変異CTLA-4-Igタンパク質の500nM〜0.2nMの範囲の希釈物8種をブランク参照(HBS-EP緩衝液のみ)に対して解析した。
センサーグラムの再生部分および捕捉部分を削除した後、試料注入の約10秒前のすべての曲線の5秒間の平均に曲線の0の位置を合わせた。各試験曲線からブランク曲線を差し引いた。「Fit kinetics, Simultaneous ka/kd(フィットカイネティクス、同時ka/kd)」機能を用いて、BIAevaluationソフトウェア(v4.1、GE Healthcareから入手可能)によってデータを解析した。注入開始時期は、すべての曲線が0に近づく、結合相の前の時点と定義した。結合相に関するデータ選択は、注入開始時点から約10秒後に開始し、注入停止時点より約10秒前に終了した。注入停止時点は、解離相に関連する任意のシグナルスパイクが出現する前の時点と定義した。解離相は、注入停止時点から10秒後に開始するように選択し、5分の解離相の内の280〜295秒を含んだ。1:1ラングミュア(Langmuir)モデルは、反応A+B<=>ABを説明する。このモデルは、関心対象の単一のタンパク質(例えば受容体)に対する単一のリガンド結合を表す。BIAevaluationソフトウェアの1:1ラングミュアモデルを用いて、結合速度定数(ka)および解離速度定数(kd)を決定し、平衡解離定数KDを算出した。KD=kd/ka。KD=([A][B])/[AB]。平衡解離定数KDは、平衡結合定数KAの逆数に等しい。KD=1/KA。反応の速度式(分析物AにリガンドBを加えると複合体ABを生じる)は、次のとおりである:d[B]/dt=-(ka[A][B]-kd[AB])およびd[AB]/dt=ka[A][B]-kd[AB](A=注入される分析物、B=遊離リガンド、およびt=時間)。[AB]を所与の時点のBiacore応答単位R(RU)で、[B]をRmax-Rで、および[A]をC(分析物濃度)で置き換えることにより、Biacore単位の正味の速度式は、dR/dt=kaC(Rmax-R)-kdR(t0でのR=0、B[0]=Rmax、およびAB[0]=0RU)となり、総応答=[AB]+RIである。バルクシフト(RI)を0に設定し、全曲線に対してRmax、ka、およびkdを全体的にフィットさせた。
変異CTLA-4-Ig融合タンパク質の結合特性を、一価の動力学的結合アッセイ法によってさらに確認した。これらのアッセイ法では、移動相において、センサーチップに塗られた二価の試験タンパク質(例えば、二量体変異CTLA-4-Ig融合タンパク質)および一価のリガンド(パパインで消化したhCD86-mIg)の結合動態を測定する。ヤギ抗ヒトIgG抗体(Jackson ImmunoResearch、109-005-098番)を製造業者のプロトコールに従ってCM5センサーチップに結合させて、典型的には15,000応答単位(RU)を得た。流速10μl/分で、HBS-EP緩衝液に溶かした2μl/ml二量体変異CTLA-4-Ig融合タンパク質溶液10μlと共に、抗体でコーティングしたセンサーチップをインキュベーションすることによってリガンドを捕捉した。リガンド捕捉レベルは典型的には25〜80RUであった。単量体のhCD86-mIgリガンド(Hermanson, G.T. BIOCONJUGATE TECHNIQUES, Academic Press, 1996において説明されているように、hCD86-mIgのパパイン消化およびプロテインAセファロース吸着によって作製した)をHBS-EP緩衝液中に希釈し、試験タンパク質でコーティングしたセンサーチップに30μl/分で2分間流し、続いて、同じ流速で、タンパク質を含まないHBS-EP緩衝液と共に2分間インキュベーションした。30μl/分で10mMグリシン緩衝液(pH1.7)と共に3分間インキュベーションすることによって、サイクル間の再生を実施した。典型的には、単量体分析物タンパク質の3000nM〜0.2nMの範囲の希釈物8種をブランク参照(HBS-EP緩衝液のみ)に対して2つ1組で解析した。変異CTLA-4-Igタンパク質に対する結合のRmaxシグナルレベルは、10〜60RUの範囲であった。
ヒトPBMC増殖アッセイ法(抗CD3抗体刺激)を用いた、CTLA-4変異体の生物活性の測定
CTLA-4-Igおよびその特定の変種は、インビトロにおいてT細胞増殖の強力な阻害物質であることが示されている(例えば、Larson et al., Am. J. Transplant. 5, 443を参照されたい)。このようなアッセイ法において変異CTLA-4-Igタンパク質の改善した活性を測定するために、末梢血単核細胞(PBMC)増殖アッセイ法を開発した。
ヒトCD4+T細胞増殖アッセイ法による、変異CTLA-4-Ig分子の生物活性の測定
ヒトCTLA-4-Igおよびその特定の変種は、CD28を介したCD80およびCD86のシグナル伝達を遮断することによってT細胞増殖を阻害することが示されている(Linsley P.S., Immunity 1:793-801 (1994); Larson C. P. et al., Am. J. Transplant. 5:443-453 (2005))。本発明の変異CTLA-4-Igタンパク質は、CD86-Igリガンドに対する結合アビディティが改善しているため、CD86を介したシグナル伝達を遮断する際の変異CTLA-4-Igタンパク質の活性を測定するために、CD4+T細胞増殖アッセイ法を開発した。
トランスフェクトされた細胞の表面で発現させるために、完全長ヒトCD86タンパク質をコードするプラスミドpCDNA3.1 hB7.2 FLを作製した。SEQ ID NO: 176に示すCD86をコードするヌクレオチド配列に対する配列相同性に基づいて設計したフォワードオリゴヌクレオチドプライマーおよびリバースオリゴヌクレオチドプライマーを用いて、ヒト白血球(BD Biosciences、カタログ番号HL4050AH)に由来するcDNAをPCR増幅することによって、ヒトCD86をコードするDNAを作製した。これらのプライマーは、当業者には周知の標準技術を用いて設計し、作製し、組み立て、これらは必要に応じて停止コドンおよび開始コドンならびに制限部位を含んだ。使用したPCR増幅手順もまた、当技術分野において周知である。このような技術は、例えば、いずれも前記のBerger、Ausubel、およびSambrookの文献において説明されている。cDNA 50ナノグラム(ng)を、1μMのフォワードプライマーおよびリバースプライマー、Herculaseポリメラーゼ緩衝液(Stratagene;600260番)、ならびに200μM dNTPを用いた増幅サイクル(94℃で30秒;50℃で30秒;72℃で60秒)30回の100μl PCR反応において鋳型として使用した。QiaQuick PCR Spin Columns(Qiagen 28106番)によってPCR産物を精製し、制限酵素KpnIおよびNotIで消化した。断片をアガロースゲル電気泳動によって分離し、製造業者の推奨に従ってQiaquick Gel Extraction Kit(Qiagen、28704番)を用いて精製し、同様に消化したプラスミドpCDNA 3.1(+)(Invitrogen、カタログ番号V790-20)に連結した。製造業者の推奨に従って、連結物をTOP10大腸菌細胞(Qiagen、カタログ番号C4040-10)中にトランスフォームした。50μg/mlカルベニシリンを含むLB(Luria broth media)中で250rpm、37℃で一晩、形質転換細胞をインキュベートし、次いで、製造業者の推奨条件に従ってプラスミドDNAのmaxiprep(Qiagen;12362番)用ストック溶液を作製するために使用した。
10% FBS(Hycloneカタログ番号SV30014.03)および1×PSG(Invitrogen、カタログ番号10378-016)を添加した増殖培地(DMEM/F12培地(Invitrogen、カタログ番号10565-018)20mlを含むT-75フラスコにおいて80〜90%コンフルエントな状態になるまでHEK293細胞を増殖させた。製造業者の推奨条件に従って、Fugene 6(ROCHE、11814443001番)60μlと混合したプラスミドDNA(pCDNA3.1 hB7.2 FL)10μgを細胞にトランスフェクトした。細胞を37℃で2日(d)間、増殖培地中でインキュベートし、さらに、選択培地(300μg/ml Geneticin(Invitrogen、10131-027番)を含む増殖培地)中で、2日毎に培地を変更して37℃で10日間、インキュベートした。FACS選別を可能にするために、製造業者の推奨条件に従って、トランスフェクトされた細胞をFITC標識抗CD86抗体(BD Biosciences、555番)で染色した。FITCシグナルに対してゲートをかけた細胞選別機(Dako、MoFlo)を用いて、25%順化培地(トランスフェクトされていない(または未処理の)細胞培養物から前もって回収した増殖培地)を含む200μl/ウェルの増殖培地を含む96ウェル培養プレート(Sigma-Aldrich、CLS-3596番)中に個々にCD86陽性細胞を選別した。37℃で13〜19日間インキュベーションした後、トリプシン加水分解によって細胞を分散させ、0.5ml/ウェルの増殖培地を含む24ウェル培養プレートに移した。37℃で7日間インキュベーションした後、トリプシン加水分解によって細胞を分散させ、増殖培地20mlを含むT-75フラスコに移した。製造業者の推奨条件に従ってFACS Caliber (BD Biosciences)を用いて、FITC標識抗CD86抗体で染色された細胞をFACS解析することにより測定した際に細胞表面CD86発現が高レベルであることを基準として、最終の細胞株を選択した。
製造業者の推奨に従って、磁性細胞選別装置(RoboSep、StemCell Technologies、20000番)と共にEasySep Human CD4 Positive Selection Kit (StemCell Technologies、18052R番)を用いて、ヒトバフィコート調製物(Stanford University Blood Center, Stanford, CA)からCD4+T細胞を96%超まで濃縮した。濃縮したCD4+T細胞を、10%FBS(Hyclone SV30014.03)を添加したイセル(Yssel)培地(Gemini Bio-Products、400-102番)中で密度1×106細胞/mlに調整し、96ウェル組織培養プレートに50μl/ウェルで添加した。膜結合型ヒトCD86を発現するHEK293細胞を6000ラドで放射線照射し(Stanford Research Institute, Menlo Park, CA)、同じ培地中で1×106細胞/mlに調整し、培養プレートに50μl/ウェルで添加した。試験化合物を同じ培地で段階希釈し、3つ1組でウェルに添加した。マウス抗ヒトCD3抗体(BD Pharmingen: 555329)を最終濃度が5μg/mlになるまで添加することにより、細胞増殖を開始させた。37℃で3日間インキュベーションした後、3Hチミジン(GE Healthcare, TRK758-5MCI番)を1μCi/ウェルで添加し、37℃でさらに18時間、プレートをインキュベートした。製造業者の推奨条件に従って細胞回収装置(Perkin Elmer Filter Harvester D961962)を用いて細胞を回収し、3Hチミジンを液体シンチレーションカウンター(Wallac Trilux 1450)によって測定した。GraphPad Prism 5ソフトウェアにより、可変勾配式(Y=最小値+(最大値-最小値)/(1+10(LogIC50-X)(Hill勾配)))を用いて細胞増殖データを解析して、各試験化合物のIC50を得た。「(LogIC50-X)(Hill勾配)」という用語は、この式において指数である。
ヒトPBMC増殖アッセイ法(リコール抗原刺激)による、変異CTLA-4-Ig分子の生物活性の測定
記憶T細胞の活性化は、自己免疫の重要な局面である(Rogers N.J., et al. Eur. J. Immunol 35:2909-2919 (2005))。この点に関して変異CTLA-4-Igタンパク質の免疫抑制活性を測定するために、PPD抗原刺激を用いた末梢血単核細胞(PBMC)増殖アッセイ法を開発した。
ヒトMLR(混合リンパ球反応(Mixed Lymphocyte Reaction))アッセイ法を用いた、変異CTLA-4-Ig分子の生物活性の測定
CTLA-4-Igおよびその変種は、インビトロにおいて一次アロ応答(alloresponse)の強力な阻害物質である(Vaughan, A. N. et al., J. Immunol. 165:3175-3181 (2000); Wallace P. M., et al., Transplantation 58:602-610 (1994))。このようなアッセイ法において変異CTLA-4-Igタンパク質の改善した活性を測定するために、ヒト混合リンパ球反応(MLR)細胞増殖アッセイ法を開発した。
関節リウマチに罹患しているヒト成人患者は、以下のようにして可溶性変異CTLA-4-Ig融合タンパク質で治療することができる。本発明の可溶性変異CTLA-4-Ig融合タンパク質および薬学的に許容される賦形剤または担体(例えばPBS)を含む薬学的組成物を調製する。例示的な可溶性変異CTLA-4-Ig融合タンパク質は、1つまたは複数のジスルフィド結合によって一つに結合されている2つの同一な単量体変異CTLA-4-Ig融合タンパク質を含み、このような各単量体融合タンパク質は、ヒトIgG2 FcポリペプチドのN末端にそのC末端が融合されている、SEQ ID NO: 1〜73のいずれかより選択されるポリペプチド配列を含む本発明の変異CTLA-4 ECDポリペプチドを含む。例示的な融合タンパク質には、SEQ ID NO: 74〜79、197〜200、205〜214、および219〜222のいずれかに示すポリペプチド配列を含むものが含まれる。このような融合タンパク質は、典型的には二量体型で発現される。薬学的組成物中の融合タンパク質の濃度は、約0.05mg/ml〜約200mg/ml、約1mg/ml〜約150mg/ml、約25mg/ml〜約120mg/ml、約1mg/ml〜約100mg/ml、約25mg/ml〜約100mg/ml、約50mg/ml〜約100mg/ml、約50mg/ml〜約75mg/ml、および約100mg/ml〜約150mg/mlなどの範囲でよい。例えば、薬学的組成物中の融合タンパク質濃度は、約1mg/ml、5mg/ml、10mg/ml、15mg/ml、25mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml、100mg/ml、150mg/ml、または200mg/mlでよい。このような薬学的組成物のpHは、約pH4〜約pH10であり、約pH5〜約pH9、約pH6.5〜約pH8.5、好ましくは約pH6.0〜pH8.0、約6.5〜pH7.5、または約pH7.0〜約pH8.0を含む。
臓器移植拒絶を予防するための維持療法を受けているヒト成人患者を以下のように可溶性変異CTLA-4-Ig融合タンパク質で治療することができる。本発明の可溶性変異CTLA-4-Ig融合タンパク質および薬学的に許容される賦形剤または担体(例えばPBSなど)を含む薬学的組成物を調製する。例示的な可溶性変異CTLA-4-Ig融合タンパク質は、1つまたは複数のジスルフィド結合によって一つに結合されている2つの同一な単量体変異CTLA-4-Ig融合タンパク質を含み、このような各単量体融合タンパク質は、ヒトIgG2 FcポリペプチドのN末端にそのC末端が融合されている、SEQ ID NO: 1〜73のいずれかより選択されるポリペプチド配列を含む本発明の変異CTLA-4 ECDポリペプチドを含む。例示的な融合タンパク質には、SEQ ID NO: 74〜79、197〜200、205〜214、および219〜222のいずれかに示すポリペプチド配列を含むものが含まれる。薬学的組成物中の融合タンパク質の濃度は、約0.05mg/ml〜約200mg/ml、約1mg/ml〜約150mg/ml、約25mg/ml〜約120mg/ml、約1mg/ml〜約100mg/ml、約25mg/ml〜約100mg/ml、約50mg/ml〜約100mg/ml、約50mg/ml〜約75mg/ml、および約100mg/ml〜約150mg/mlなどの範囲でよい。例えば、薬学的組成物中の融合タンパク質濃度は、約1mg/ml、5mg/ml、10mg/ml、15mg/ml、25mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml、100mg/ml、150mg/ml、または200mg/mlでよい。このような薬学的組成物のpHは、約pH4〜約pH10であり、約pH5〜約pH9、約pH6.5〜約pH8.5、約pH6.0〜pH8.0、約6.5〜pH7.5、または約pH7.0〜約pH8.0を含む。
ラットにおける変異CTLA-4-IgG2融合タンパク質の薬物動態学的評価
生物に外用投与した後の治療物質の血清濃度は、治療的有効性に大きく影響し、薬物動態学的(PK)評価によって測定される。下記の手順において、変異CTLA-4-IgG2試験物質D3-29-IgG2、D3-54-IgG2、D3-56-IgG2、D3-69-IgG2、およびD3-75-IgG2のPKプロファイルを、hCTLA-4-IgG2融合タンパク質試験物質およびOrencia(登録商標)融合タンパク質試験物質の両方と比較してラットにおいて評価した。試験デザインならびにデータ作成および解釈は、直ちに説明する。
体重をマッチさせた雄のハンスウィスター(Hans Wistar)ラットを、少なくとも5日間の順化期間の後に使用した。ラットすべてが1mg/kgの試験物質を与えられるように、個々の動物に対して体重に基づいて試験物質投薬量を計算した。したがって、試験物質はすべて1mg/mlのPBS溶液として調製したため、典型的な150グラム(g)のラットには、150μlの投薬量が与えられた。前述の変異CTLA-4-IgG2試験物質、hCTLA-4IgG2融合タンパク質、またはOrencia(登録商標)融合タンパク質の単回投与を、静脈内(i.v.もしくはIV)ボーラスとして、または皮下(「s.c.」または「SC」と略する)経路によって行った。試験規模は、任意の所与のラットから取り出される血液体積を全血液体積の10%以下に制限しつつ、一時点当たり300μlの血液試料採取を4回行う最少量には充分であった。血液試料採取の時間経過は、投与前、投与後5分(min)、30分、2時間(h)、4h、8h、1日(d)、2d、3d、4d、6d、8d、10d、12d、および14d、または静脈投与および皮下投与それぞれに関して投与後5分、30分、2h、4h、8h、1d、2d、3d、4d、6d、8d、10d、11d、12d、13d、14d、および15dであった。個々の血液試料から血清を調製し、ELISAによって試験して、投与された試験物質の存在を定量した。
血清試料中に存在する変異CTLA-4-IgG2融合タンパク質、hCTLA-4IgG2融合タンパク質、またはOrencia(登録商標)融合タンパク質を、マイクロタイタープレート上に予めコーティングしたヒトCD80-マウスIgG(前述)に結合させた。西洋ワサビペルオキシダーゼ(HRP)を結合したヤギ抗ヒトIgG(Jackson ImmunoResearch 109-035-098番)を添加することによって、検出を実行した。発色性HRP基質、3,3',5,5'-テトラメチルベンジジン(TMB)、および過酸化水素(Kem-En-Tec 4390A番)を用いて定量を行った。その際、0.2N硫酸(H2SO4)を添加して反応を停止し、分光光度計によって450nmでの光学的吸光度を測定した。ELISAプレートに添加する前に血清試料を1/20に前もって希釈し、マトリックスを5%ラット血清に標準化し(matrix was normalized)、5%ラット血清中でさらに希釈して、合計8個の希釈物を作製した。希釈した各血清試料の濃度を、5%ラット血清に添加した同じ試験物質の滴定を用いて準備した検量線によって定量した。検量線は、10〜0.078ng/mlの範囲であり、精度範囲は、バックグラウンドの2倍から5%ラット血清中5ng/mlであると決定された。検量線の品質は、検量線精度範囲の高濃度、中程度の濃度、および低濃度における、5%ラット血清中で調製した同じ試験物質の品質管理(QC)によって評価した。QC受入れ基準は、観察されたQC濃度が、予想されるQC濃度から20%以内であるというものであった。検量線の精度範囲内の光学濃度(OD)を有する希釈物に割り当てられた濃度を平均することによって、個々の未知の血清試料の濃度を求めた。少なくとも4個の個別の血清試料を用いて、予定の各時点における平均血清濃度を計算した。
図15Aおよび15Bは、1回の(A)静脈内(IV)ボーラスまたは(B)皮下(SC)注射として1mg/kgでラットに投与したOrencia(登録商標)融合タンパク質、hCTLA-4-IgG2融合タンパク質、および変異CTLA-4-IgG2融合タンパク質のPKプロファイルを示す。誤差棒は、平均値の標準偏差(SD)を表す。点線は、ELISAの定量の下限値を示す(試験物質の場合、100%血清中約3ng/ml)。図15において、時点0hの試験物質投与後の予定の各時点における平均血清濃度は、片対数濃度-時間プロファイルのデータポイントを含む。
本実施例では、本発明の変異CTLA4-Ig融合タンパク質を発現させるために安定にトランスフェクトされた細胞株を作製し、変異CTLA4-Ig融合タンパク質の日常的な実験室規模の作製のためにその細胞株を使用し、細胞発現培地から変異CTLA4-Ig融合タンパク質を精製するための方法を説明する。本実施例では、D3-54-IgG2融合タンパク質を発現させるために安定にトランスフェクトされたCHO-K1細胞株を作製し、実験室規模の作製のためにそのような細胞を使用し、培地からこのタンパク質を精製するための方法を具体的に説明するが、本明細書において説明する方法は、上記に開示した本発明の任意の変異CTLA-4-Ig融合タンパク質および/または任意の適切な細胞株と共に使用することができる。
材料
CHO-K1未処理(トランスフェクトされていない)細胞:合成培地中での無血清浮遊増殖に順応させたCHO-K1細胞(細胞ID: M4-PeM-0436-112-01)を、液体窒素気相中で保管した(Dewar MVE1536P)。1個のバイアルのM4-PeM-0436-112-01を解凍し、振盪フラスコ中でCD OptiCHO(商標)培地(Invitrogen、12681番)と共に培養した。培養物から、トランスフェクション用の細胞ならびに増殖およびクローン化用の順化培地が得られた。すべての培養物は37℃、5%CO2で増殖させた。
Cedex細胞計数器またはCedex HiRes細胞計数器(Innovatis)を用いて細胞計数および生存率決定を実施した。
D3-54-IgG2融合タンパク質のGMP作製において使用される安定な細胞株の作製のために使用される未処理の付着性CHO-K1細胞を、CD OptiCHO(商標)合成培地中での浮遊増殖に順応させた。これらの未処理のCHO-KI細胞を含む1つのバイアルを解凍し、CD OptiCHO(商標)培地を含む125ml振盪フラスコ中で密度5×105生細胞/mlまで増殖させた。生細胞2×106個を50%順化培地400μl中に再懸濁し、キュベット中でプラスミドDNA(CET1019AS UCEOベクター中のD3-54-IgG2)20μgと混合した。方形波パルス長15ミリ秒(ms)、320ボルト(V)でGene Xcell Pulser (BioRad)を用いてエレクトロポレーションを実施した。2つ1組でトランスフェクションを実施し、次いで細胞を集めた。集めた細胞を、50%順化培地5mlを含むT-25フラスコに移し、2日間インキュベートした。
D3-54-IgG2融合タンパク質を発現するCHO-K1細胞1ml体積量を含む凍結保存用バイアル(cryovial)を解凍し、37℃および5%CO2、CD OptiCHO(商標)培地を含む125ml振盪フラスコ中で5×105生細胞/mlの密度になるまで増殖させた。いくつかのフラスコを合一して、4mMグルタミンを含むCDOptiCHO(商標)培地5L体積量または10L体積量を入れたウェーブバッグに1〜2×105細胞/mlで播種した。ウェーブバッグ培養物を、Sartorius Stedim Biotechから購入した機器を18〜22 rpmの振動プラットフォーム設定および8度の角度で用い、5%CO2を補充した37℃インキュベーター中で維持した。プロテインA HPLCアッセイ法によって細胞計数値、生存率、栄養素レベル、代謝産物プロファイル、および変異CTLA-4-IgG2(すなわちD3-54-IgG2)の発現レベルを求めるために、培養物から毎日試料を採取する。典型的には播種後9〜11日目に生存率が約50%に減少した際に、培養物を回収する。深層濾過および滅菌濾過の組み合わせを用いた濾過によって細胞培養物質を清澄化し、さらに処理するために直ちに使用するか、または2〜8℃で保存する。
AKTA Explorer HPLCシステム(GE Healthcare)を用いたプロテインAアフィニティクロマトグラフィーによって変異CTLA4-IgG2融合タンパク質(D3-54-IgG2)を精製した。変異CTLA-4-Ig融合タンパク質(D3-54-IgG2)をPBS緩衝液(Invitrogen)中でMabSelect Protein A FFカラム(GE Healthcare、17-5079-01番)に結合させ、約10mg/mlでクロマトグラフィー媒体をロードし、同じ緩衝液で洗浄し、100mMクエン酸緩衝液(pH4.0)を用いて溶出させ、次いで、1/10体積の2M Tris塩基を添加して中和した。20mM Tris-Cl、pH7.5への緩衝液交換を伴う接線流濾過(TFF)システムを用いたダイアフィルトレーションによって、プロテインAで精製した試料をさらに処理する。
Claims (18)
- 各単量体融合タンパク質に存在する2つのシステイン残基間で形成された少なくとも1つのジスルフィド結合を介して連結している2つの単量体融合タンパク質を含む、組換え型の融合タンパク質二量体であって、
各単量体融合タンパク質が、(a)SEQ ID NO:36のポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含み、
該融合タンパク質二量体が、ヒトCD80もしくはヒトCD86またはいずれかの細胞外ドメインに結合し、かつLEA29Y-Ig融合タンパク質二量体より大きな免疫応答を抑制する能力を有し、LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166のポリペプチド配列を含む2つの単量体LEA29Y-Ig融合タンパク質を含む、
組換え型の融合タンパク質二量体。 - 各単量体融合タンパク質に存在する2つのシステイン残基間で形成された少なくとも1つのジスルフィド結合を介して連結している2つの単量体融合タンパク質を含む、組換え型の融合タンパク質二量体であって、
各単量体融合タンパク質が、(a)SEQ ID NO:50のポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含み、
該融合タンパク質二量体が、ヒトCD80もしくはヒトCD86またはいずれかの細胞外ドメインに結合し、かつLEA29Y-Ig融合タンパク質二量体より大きな免疫応答を抑制する能力を有し、LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166のポリペプチド配列を含む2つの単量体LEA29Y-Ig融合タンパク質を含む、
組換え型の融合タンパク質二量体。 - 各単量体融合タンパク質がSEQ ID NO:197に示したポリペプチド配列を含む、請求項1記載の融合タンパク質二量体。
- 各単量体融合タンパク質がSEQ ID NO:211に示したポリペプチド配列を含む、請求項1記載の融合タンパク質二量体。
- 各単量体融合タンパク質がSEQ ID NO:199に示したポリペプチド配列を含む、請求項2記載の融合タンパク質二量体。
- 各単量体融合タンパク質がSEQ ID NO:213に示したポリペプチド配列を含む、請求項2記載の融合タンパク質二量体。
- (a)SEQ ID NO:36のポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含む組換え型の融合タンパク質をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、組換え型の核酸であって、
該融合タンパク質二量体が、ヒトCD80もしくはヒトCD86またはいずれかの細胞外ドメインに結合し、かつLEA29Y-Ig融合タンパク質二量体より大きな免疫応答を抑制する能力を有し、LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166のポリペプチド配列を含む2つの単量体LEA29Y-Ig融合タンパク質を含む、
組換え型の核酸。 - 融合タンパク質がSEQ ID NO:197に示したポリペプチド配列を含む、請求項7記載の核酸。
- 融合タンパク質がSEQ ID NO:211に示したポリペプチド配列を含む、請求項7記載の核酸。
- (a)SEQ ID NO:50のポリペプチド配列を含むポリペプチドと、(b)Ig Fcポリペプチドとを含む組換え型の融合タンパク質をコードするポリヌクレオチド配列、あるいはその相補ポリヌクレオチド配列を含む、組換え型の核酸であって、
該融合タンパク質二量体が、ヒトCD80もしくはヒトCD86またはいずれかの細胞外ドメインに結合し、かつLEA29Y-Ig融合タンパク質二量体より大きな免疫応答を抑制する能力を有し、LEA29Y-Ig融合タンパク質二量体が、それぞれSEQ ID NO:166のポリペプチド配列を含む2つの単量体LEA29Y-Ig融合タンパク質を含む、
組換え型の核酸。 - 融合タンパク質がSEQ ID NO:199に示したポリペプチド配列を含む、請求項10記載の核酸。
- 融合タンパク質がSEQ ID NO:213に示したポリペプチド配列を含む、請求項10記載の核酸。
- 請求項7〜12のいずれか一項記載の核酸を含む、発現ベクター。
- (a)請求項7〜12のいずれか一項記載の核酸;および/または
(b)請求項13記載のベクター
を含む、組換え型の宿主細胞。 - 薬学的に許容される賦形剤または薬学的に許容される担体、および請求項1〜6のいずれか一項記載の融合タンパク質二量体を含む、薬学的組成物。
- 哺乳動物における免疫応答を阻害または抑制するための医薬を製造するための、請求項1〜6のいずれか一項記載の融合タンパク質二量体の使用。
- 免疫系の疾患または障害を処置するための医薬を製造するための、請求項1〜6のいずれか一項記載の融合タンパク質二量体の使用。
- 哺乳動物における組織移植または臓器移植の拒絶反応を処置するための医薬を製造するための、請求項1〜6のいずれか一項記載の融合タンパク質二量体の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US98463107P | 2007-11-01 | 2007-11-01 | |
| US60/984,631 | 2007-11-01 | ||
| US5121508P | 2008-05-07 | 2008-05-07 | |
| US61/051,215 | 2008-05-07 | ||
| PCT/US2008/079981 WO2009058564A2 (en) | 2007-11-01 | 2008-10-15 | Immunosuppressive polypeptides and nucleic acids |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2011502479A JP2011502479A (ja) | 2011-01-27 |
| JP2011502479A5 JP2011502479A5 (ja) | 2013-01-31 |
| JP5298134B2 true JP5298134B2 (ja) | 2013-09-25 |
Family
ID=40124836
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010532121A Active JP5298134B2 (ja) | 2007-11-01 | 2008-10-15 | 免疫抑制ポリペプチドおよび核酸 |
Country Status (20)
| Country | Link |
|---|---|
| US (8) | US7794718B2 (ja) |
| EP (4) | EP2222697B1 (ja) |
| JP (1) | JP5298134B2 (ja) |
| KR (1) | KR101383476B1 (ja) |
| CN (2) | CN103172750B (ja) |
| AU (1) | AU2008319053B2 (ja) |
| CA (1) | CA2703263C (ja) |
| CY (1) | CY1113713T1 (ja) |
| DK (1) | DK2222697T3 (ja) |
| ES (2) | ES2688721T3 (ja) |
| HR (1) | HRP20130194T1 (ja) |
| IL (1) | IL205036A (ja) |
| MX (1) | MX2010004883A (ja) |
| PH (1) | PH12013501101A1 (ja) |
| PL (2) | PL2612868T3 (ja) |
| PT (2) | PT2222697E (ja) |
| RU (1) | RU2506275C2 (ja) |
| TW (1) | TWI448473B (ja) |
| WO (1) | WO2009058564A2 (ja) |
| ZA (1) | ZA201002872B (ja) |
Families Citing this family (71)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| US20090010920A1 (en) | 2003-03-03 | 2009-01-08 | Xencor, Inc. | Fc Variants Having Decreased Affinity for FcyRIIb |
| US20150010550A1 (en) | 2004-07-15 | 2015-01-08 | Xencor, Inc. | OPTIMIZED Fc VARIANTS |
| US8367805B2 (en) | 2004-11-12 | 2013-02-05 | Xencor, Inc. | Fc variants with altered binding to FcRn |
| EP2845865A1 (en) | 2004-11-12 | 2015-03-11 | Xencor Inc. | Fc variants with altered binding to FcRn |
| CN101835802B (zh) | 2007-06-01 | 2014-04-09 | 马里兰大学巴尔的摩分校 | 免疫球蛋白恒定区Fc受体结合剂 |
| KR101383476B1 (ko) | 2007-11-01 | 2014-04-11 | 아스테라스 세이야쿠 가부시키가이샤 | 면역억제 폴리펩티드 및 핵산 |
| JP5547083B2 (ja) * | 2007-11-20 | 2014-07-09 | アンブルックス,インコーポレイテッド | 修飾されたインスリンポリペプチドおよびそれらの使用 |
| EP2344540B1 (en) | 2008-10-02 | 2017-11-29 | Aptevo Research and Development LLC | Cd86 antagonist multi-target binding proteins |
| MX2012000991A (es) * | 2009-07-28 | 2012-03-16 | Ligacept Llc | Moleculas de union a ligandos de erbb de amplio espectro y metodos para su preparacion y utilizacion. |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| KR101193940B1 (ko) * | 2009-12-14 | 2012-10-24 | 고려대학교 산학협력단 | 레서스 원숭이 ctla-4 융합 이뮤노글로불린 |
| WO2011103584A2 (en) | 2010-02-19 | 2011-08-25 | Xencor, Inc. | Novel ctla4-ig immunoadhesins |
| CN106432474A (zh) * | 2010-03-12 | 2017-02-22 | 艾伯维生物医疗股份有限公司 | Ctla4蛋白和其用途 |
| WO2011130434A2 (en) | 2010-04-13 | 2011-10-20 | Celldex Therapeutics Inc. | Antibodies that bind human cd27 and uses thereof |
| US20130231464A1 (en) * | 2010-04-28 | 2013-09-05 | Oncolmmune, Inc. | Methods of use of soluble cd24 for therapy of rheumatoid arthritis |
| AU2011282579B2 (en) | 2010-07-28 | 2014-10-23 | Gliknik Inc. | Fusion proteins of natural human protein fragments to create orderly multimerized immunoglobulin Fc compositions |
| WO2012106363A2 (en) | 2011-01-31 | 2012-08-09 | Intellect Neurosciences Inc. | Treatment of tauopathies |
| RU2013143149A (ru) * | 2011-02-24 | 2015-03-27 | Пэксвэкс, Инк. | Составы, пригодные для вакцин, получаемых сушкой распылением |
| WO2012159075A1 (en) * | 2011-05-19 | 2012-11-22 | Seattle Biomedical Research Institute | Bioprobe compositions and their methods of use |
| CN102382193B (zh) * | 2011-11-01 | 2013-08-14 | 孙嘉琳 | 诱导和激活癌靶向t细胞的融合蛋白及制备方法及用途 |
| CN102391377B (zh) * | 2011-11-01 | 2013-11-06 | 孙嘉琳 | 一种可诱导和激活癌靶向t细胞的融合蛋白及制备方法及用途 |
| CN102516392B (zh) * | 2011-11-25 | 2014-05-28 | 孙嘉琳 | 一种癌靶向超抗原融合蛋白及制备方法及用途 |
| US20140370012A1 (en) * | 2012-01-27 | 2014-12-18 | Gliknik Inc. | Fusion proteins comprising igg2 hinge domains |
| WO2013169338A1 (en) * | 2012-05-11 | 2013-11-14 | Medimmune, Llc | Ctla-4 variants |
| EP2935581A4 (en) * | 2012-12-21 | 2016-07-27 | Merck Sharp & Dohme | EXPRESSION VECTORS FOR THE PRODUCTION OF RECOMBINANT PROTEINS IN MAMMALIAN CELLS |
| US10450361B2 (en) | 2013-03-15 | 2019-10-22 | Momenta Pharmaceuticals, Inc. | Methods related to CTLA4-Fc fusion proteins |
| EP2996772B1 (en) | 2013-05-13 | 2018-12-19 | Momenta Pharmaceuticals, Inc. | Methods for the treatment of neurodegeneration |
| CN104277112B (zh) | 2013-07-04 | 2018-01-26 | 嘉和生物药业有限公司 | 长效降血糖融合蛋白 |
| EP3058084A4 (en) | 2013-10-16 | 2017-07-05 | Momenta Pharmaceuticals, Inc. | Sialylated glycoproteins |
| US11340235B2 (en) | 2014-02-28 | 2022-05-24 | Ga Generic Assays Gmbh | GP2 isoforms and their use in autoantibody capture |
| CN103923934B (zh) * | 2014-03-22 | 2016-11-02 | 复旦大学 | 一种具有免疫负调控作用的基因工程蛋白及其制备方法与应用 |
| CN106795217B (zh) | 2014-07-24 | 2021-08-06 | 蓝鸟生物公司 | Bcma嵌合抗原受体 |
| EP2982693A1 (en) * | 2014-08-07 | 2016-02-10 | Affimed Therapeutics AG | CD3 binding domain |
| SG11201704727WA (en) | 2014-12-12 | 2017-07-28 | Bluebird Bio Inc | Bcma chimeric antigen receptors |
| US11319359B2 (en) | 2015-04-17 | 2022-05-03 | Alpine Immune Sciences, Inc. | Immunomodulatory proteins with tunable affinities |
| CN107645956B (zh) * | 2015-04-28 | 2021-07-20 | 瑞典孤儿比奥维特鲁姆有限公司 | 包含阿那白滞素的组合物 |
| EP3313875A4 (en) * | 2015-06-24 | 2018-12-26 | Board of Regents of the University of Texas System | Methods and compositions for treatment of symptoms associated with intracranial hemorrhage |
| US11351224B2 (en) | 2015-08-21 | 2022-06-07 | Iucf-Hyu (Industry-University Cooperation Foundation Hanyang University) | Pharmaceutical composition for preventing and treating transplant rejection |
| WO2017034244A1 (ko) * | 2015-08-21 | 2017-03-02 | 한양대학교 산학협력단 | 중추신경계 질환에 대한 예방 또는 치료효과를 갖는 펩타이드 및 이를 유효성분으로 하는 중추신경계 질환 예방 및 치료용 약학적 조성물 |
| US11053295B2 (en) | 2015-08-21 | 2021-07-06 | Iucf-Hyu (Industry-University Cooperation Foundation Hanyang University) | Peptides having effects of preventing or treating central nervous system diseases and pharmaceutical compositions for preventing or treating central nervous system diseases containing same as active ingredient |
| JP2018527350A (ja) * | 2015-09-01 | 2018-09-20 | イミュンワーク インク.Immunwork Inc. | 血餅形成の予防及び/又は血栓症の治療のための分子構築物 |
| EA201891106A1 (ru) * | 2015-11-02 | 2018-12-28 | Файв Прайм Терапьютикс, Инк. | Полипептиды внеклеточного домена cd80 и их применение в лечении рака |
| NZ746934A (en) | 2016-04-15 | 2023-11-24 | Alpine Immune Sciences Inc | Cd80 variant immunomodulatory proteins and uses thereof |
| CA3026420A1 (en) | 2016-06-07 | 2017-12-14 | Gliknik Inc. | Cysteine-optimized stradomers |
| WO2017214834A1 (zh) * | 2016-06-14 | 2017-12-21 | 石庆学 | 特异促进 ctla-4 基因高表达的慢病毒表达载体及其应用 |
| CN107815468B (zh) | 2016-08-31 | 2021-03-16 | 百奥赛图(北京)医药科技股份有限公司 | 人源化基因改造动物模型的制备方法及应用 |
| WO2018041121A1 (en) * | 2016-08-31 | 2018-03-08 | Beijing Biocytogen Co., Ltd | Genetically modified non-human animal with human or chimeric ctla-4 |
| MX2019005277A (es) | 2016-11-04 | 2019-09-27 | Bluebird Bio Inc | Composiciones de celulas t con car anti-bcma. |
| AU2017371179B2 (en) | 2016-12-09 | 2022-07-14 | Gliknik Inc. | Manufacturing optimization of GL-2045, a multimerizing stradomer |
| US11789010B2 (en) * | 2017-04-28 | 2023-10-17 | Five Prime Therapeutics, Inc. | Methods of treatment with CD80 extracellular domain polypeptides |
| EP4219540A3 (en) | 2017-10-10 | 2023-12-06 | Alpine Immune Sciences, Inc. | Ctla-4 variant immunomodulatory proteins and uses thereof |
| TW201925223A (zh) | 2017-10-18 | 2019-07-01 | 美商艾爾潘免疫科學有限公司 | 變異型icos 配位體免疫調節蛋白及相關組合物及方法 |
| BR112020021271A2 (pt) | 2018-04-17 | 2021-01-26 | Celldex Therapeutics, Inc. | construtos bispecíficos e anticorpos anti- cd27 e anti-pd-l1 |
| US20210347849A1 (en) * | 2018-07-24 | 2021-11-11 | Good T Cells, Inc. | Composition for Preventing or Treating Immune-Related Diseases |
| CN112543642A (zh) * | 2018-08-29 | 2021-03-23 | 戊瑞治疗有限公司 | CD80胞外结构域Fc融合蛋白给药方案 |
| JP2022505045A (ja) * | 2018-11-02 | 2022-01-14 | ベイジン ブイディージェイバイオ カンパニー, リミテッド | 修飾されたctla4およびその使用方法 |
| JP7249432B2 (ja) | 2019-03-29 | 2023-03-30 | エフ. ホフマン-ラ ロシュ アーゲー | 多価分子の機能分析のための、sprをベースとする結合アッセイ |
| CA3135170A1 (en) | 2019-04-05 | 2020-10-08 | Tauc3 Biologics Limited | Anti-tauc3 antibodies and uses thereof |
| JP7405361B2 (ja) * | 2019-10-21 | 2023-12-26 | 東亞合成株式会社 | 抗腫瘍ペプチドおよびその利用 |
| RU2760578C2 (ru) * | 2019-12-25 | 2021-11-29 | федеральное государственное автономное образовательное учреждение высшего образования "Российский университет дружбы народов" (РУДН) | Слитый белок, содержащий модифицированный безметиониновый белок GroEL и димер полипептида полифемузина I |
| CN111592580A (zh) * | 2020-05-08 | 2020-08-28 | 中国药科大学 | 一种具有免疫检查点ctla-4抑制活性的多肽及其应用 |
| EP3957649A1 (en) | 2020-08-18 | 2022-02-23 | Athebio AG | Improved n-terminal capping modules of ankyrin repeat domains |
| US20240122990A1 (en) * | 2021-02-23 | 2024-04-18 | University Of Washington | Compositions and methods for cardiomyocyte transplantation |
| US11993657B2 (en) * | 2021-03-16 | 2024-05-28 | Jn Biosciences Llc | Bifunctional molecules for treatment of immune disorders |
| WO2022219185A1 (en) | 2021-04-16 | 2022-10-20 | Athebio Ag | N-terminal capping modules of ankyrin repeat domains |
| EP4137508A1 (en) | 2021-08-17 | 2023-02-22 | Athebio AG | Variants of ankyrin repeat domains |
| WO2023021050A1 (en) | 2021-08-17 | 2023-02-23 | Athebio Ag | Variants of ankyrin repeat domains |
| WO2023244760A1 (en) * | 2022-06-15 | 2023-12-21 | Duke University | Protein library display systems and methods thereof |
| WO2024037743A1 (en) | 2022-08-16 | 2024-02-22 | Athebio Ag | Variants of ankyrin repeat domains |
| WO2023194628A2 (en) | 2022-08-16 | 2023-10-12 | Athebio Ag | Variants of ankyrin repeat domains |
Family Cites Families (207)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US511A (en) * | 1837-12-15 | Improved mode of coloring and finishing leather | ||
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| US4440859A (en) | 1977-05-27 | 1984-04-03 | The Regents Of The University Of California | Method for producing recombinant bacterial plasmids containing the coding sequences of higher organisms |
| US4704362A (en) | 1977-11-08 | 1987-11-03 | Genentech, Inc. | Recombinant cloning vehicle microbial polypeptide expression |
| ES487106A0 (es) | 1978-12-22 | 1981-05-16 | Biogen Nv | Un metodo para producir al menos un polipeptido que muestra antigenicidad de hbv |
| JPS6023084B2 (ja) | 1979-07-11 | 1985-06-05 | 味の素株式会社 | 代用血液 |
| US4530901A (en) | 1980-01-08 | 1985-07-23 | Biogen N.V. | Recombinant DNA molecules and their use in producing human interferon-like polypeptides |
| CA1200773A (en) | 1980-02-29 | 1986-02-18 | William J. Rutter | Expression linkers |
| US4554101A (en) | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| US4678751A (en) | 1981-09-25 | 1987-07-07 | Genentech, Inc. | Hybrid human leukocyte interferons |
| US4640835A (en) | 1981-10-30 | 1987-02-03 | Nippon Chemiphar Company, Ltd. | Plasminogen activator derivatives |
| US4766075A (en) | 1982-07-14 | 1988-08-23 | Genentech, Inc. | Human tissue plasminogen activator |
| US4582800A (en) | 1982-07-12 | 1986-04-15 | Hoffmann-La Roche Inc. | Novel vectors and method for controlling interferon expression |
| US4757006A (en) | 1983-10-28 | 1988-07-12 | Genetics Institute, Inc. | Human factor VIII:C gene and recombinant methods for production |
| US4496689A (en) | 1983-12-27 | 1985-01-29 | Miles Laboratories, Inc. | Covalently attached complex of alpha-1-proteinase inhibitor with a water soluble polymer |
| JPS60188070A (ja) | 1984-03-09 | 1985-09-25 | Kunio Yamane | シグナルペプチドをコードするdna |
| GB8412517D0 (en) | 1984-05-16 | 1984-06-20 | Nagai K | Recombinant fusion proteins |
| CA1282721C (en) | 1984-06-04 | 1991-04-09 | Bernard Roizman | Herpes simplex virus as a vector |
| US4677063A (en) | 1985-05-02 | 1987-06-30 | Cetus Corporation | Human tumor necrosis factor |
| CA1341482C (en) | 1984-10-31 | 2005-05-10 | Paul A. Luciw | Process for preparing fragments of aids-associated retroviruses |
| US5036006A (en) | 1984-11-13 | 1991-07-30 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US4945050A (en) | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US5168062A (en) | 1985-01-30 | 1992-12-01 | University Of Iowa Research Foundation | Transfer vectors and microorganisms containing human cytomegalovirus immediate-early promoter-regulatory DNA sequence |
| US4797368A (en) | 1985-03-15 | 1989-01-10 | The United States Of America As Represented By The Department Of Health And Human Services | Adeno-associated virus as eukaryotic expression vector |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US4683202A (en) | 1985-03-28 | 1987-07-28 | Cetus Corporation | Process for amplifying nucleic acid sequences |
| EP0206448B1 (en) | 1985-06-19 | 1990-11-14 | Ajinomoto Co., Inc. | Hemoglobin combined with a poly(alkylene oxide) |
| EP0228458B2 (en) | 1985-07-05 | 1997-10-22 | Whitehead Institute For Biomedical Research | Epithelial cells expressing foreign genetic material |
| KR890003620Y1 (ko) | 1985-07-25 | 1989-05-27 | 삼성전자주식회사 | 전자레인지의 파워릴레이 구동회로 |
| CA1293460C (en) | 1985-10-07 | 1991-12-24 | Brian Lee Sauer | Site-specific recombination of dna in yeast |
| US5139941A (en) | 1985-10-31 | 1992-08-18 | University Of Florida Research Foundation, Inc. | AAV transduction vectors |
| US4810648A (en) | 1986-01-08 | 1989-03-07 | Rhone Poulenc Agrochimie | Haloarylnitrile degrading gene, its use, and cells containing the gene |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4791192A (en) | 1986-06-26 | 1988-12-13 | Takeda Chemical Industries, Ltd. | Chemically modified protein with polyethyleneglycol |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US5084384A (en) | 1987-04-23 | 1992-01-28 | Monsanto Company | Secretion of insulin-like growth factor-I |
| US6093699A (en) | 1987-07-09 | 2000-07-25 | The University Of Manitoba | Method for gene therapy involving suppression of an immune response |
| US5017478A (en) | 1987-07-16 | 1991-05-21 | Berlex Laboratories, Inc. | Transfected cells containing plasmids having genes oriented in opposing directions and methods of using |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| ZA887365B (en) | 1987-10-02 | 1990-05-30 | Genentech Inc | Adheson variants |
| US6710169B2 (en) | 1987-10-02 | 2004-03-23 | Genentech, Inc. | Adheson variants |
| PT88641B (pt) | 1987-10-02 | 1993-04-30 | Genentech Inc | Metodo para a preparacao de uma variante de adesao |
| US5336603A (en) | 1987-10-02 | 1994-08-09 | Genentech, Inc. | CD4 adheson variants |
| US5567584A (en) | 1988-01-22 | 1996-10-22 | Zymogenetics, Inc. | Methods of using biologically active dimerized polypeptide fusions to detect PDGF |
| EP0325224B1 (en) | 1988-01-22 | 1996-07-31 | ZymoGenetics, Inc. | Methods of producing secreted receptor analogs |
| US6018026A (en) | 1988-01-22 | 2000-01-25 | Zymogenetics, Inc. | Biologically active dimerized and multimerized polypeptide fusions |
| US5716826A (en) | 1988-03-21 | 1998-02-10 | Chiron Viagene, Inc. | Recombinant retroviruses |
| US5614404A (en) | 1988-06-10 | 1997-03-25 | Theriod Biologics, Incorporated | Self-assembled, defective, non-self-propagating lentivirus particles |
| US5284768A (en) | 1988-08-24 | 1994-02-08 | Sanofi | Signal peptide, DNA sequences coding for the latter, expression vectors carrying one of these sequences, gram-negative bacteria transformed by these vectors, and process for the periplasmic production of a polypeptide |
| US5349052A (en) | 1988-10-20 | 1994-09-20 | Royal Free Hospital School Of Medicine | Process for fractionating polyethylene glycol (PEG)-protein adducts and an adduct for PEG and granulocyte-macrophage colony stimulating factor |
| US6685941B1 (en) | 1988-11-23 | 2004-02-03 | The Regents Of The University Of Michigan | Methods of treating autoimmune disease via CTLA-4Ig |
| DE3901681A1 (de) | 1989-01-21 | 1990-07-26 | Behringwerke Ag | Signalpeptid fuer die sekretion von peptiden in escherichia coli, verfahren zu seiner gewinnung und seine verwendung |
| US6406697B1 (en) | 1989-02-23 | 2002-06-18 | Genentech, Inc. | Hybrid immunoglobulins |
| US5225538A (en) | 1989-02-23 | 1993-07-06 | Genentech, Inc. | Lymphocyte homing receptor/immunoglobulin fusion proteins |
| US5116964A (en) | 1989-02-23 | 1992-05-26 | Genentech, Inc. | Hybrid immunoglobulins |
| US5082767A (en) | 1989-02-27 | 1992-01-21 | Hatfield G Wesley | Codon pair utilization |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5122614A (en) | 1989-04-19 | 1992-06-16 | Enzon, Inc. | Active carbonates of polyalkylene oxides for modification of polypeptides |
| US5672683A (en) | 1989-09-07 | 1997-09-30 | Alkermes, Inc. | Transferrin neuropharmaceutical agent fusion protein |
| DE69033911D1 (de) | 1989-10-24 | 2002-03-14 | Chiron Corp | System zur freisetzung von infektiösen proteinen |
| EP0800830A3 (en) | 1989-11-03 | 1999-03-17 | Vanderbilt University | Method of in vivo delivery of functioning foreign genes |
| US5697901A (en) | 1989-12-14 | 1997-12-16 | Elof Eriksson | Gene delivery by microneedle injection |
| US5672510A (en) | 1990-01-19 | 1997-09-30 | Genetic Therapy, Inc. | Retroviral vectors |
| US7070776B1 (en) | 1990-03-26 | 2006-07-04 | Bristol-Myers Squibb Company | Methods for blocking binding of CD28 receptor to B7 |
| US5279833A (en) | 1990-04-04 | 1994-01-18 | Yale University | Liposomal transfection of nucleic acids into animal cells |
| US5173414A (en) | 1990-10-30 | 1992-12-22 | Applied Immune Sciences, Inc. | Production of recombinant adeno-associated virus vectors |
| SE9003978D0 (sv) | 1990-12-13 | 1990-12-13 | Henrik Garoff | Dna expressionssystem baserade paa ett virus replikon |
| AU662146B2 (en) | 1991-03-19 | 1995-08-24 | Cytrx Corporation | Polyoxypropylene/polyoxyethylene copolymers with improved biological activity |
| US5770197A (en) | 1991-06-27 | 1998-06-23 | Bristol-Myers Squibb Company | Methods for regulating the immune response using B7 binding molecules and IL4-binding molecules |
| DE122007000078I2 (de) | 1991-06-27 | 2011-01-13 | Bristol Myers Squibb Co | CTL4A-Rezeptor, ihn enthaltenden Fusionsproteine und deren Verwendung |
| US5851795A (en) | 1991-06-27 | 1998-12-22 | Bristol-Myers Squibb Company | Soluble CTLA4 molecules and uses thereof |
| US5844095A (en) | 1991-06-27 | 1998-12-01 | Bristol-Myers Squibb Company | CTLA4 Ig fusion proteins |
| US6090914A (en) | 1991-06-27 | 2000-07-18 | Bristol-Myers Squibb Company | CTLA4/CD28Ig hybrid fusion proteins and uses thereof |
| US6887471B1 (en) | 1991-06-27 | 2005-05-03 | Bristol-Myers Squibb Company | Method to inhibit T cell interactions with soluble B7 |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| US5506098A (en) | 1991-09-04 | 1996-04-09 | Daikin Industries, Ltd. | In situ hybridization method |
| US5635532A (en) | 1991-10-21 | 1997-06-03 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Compositions and methods for therapy and prevention of pathologies including cancer, AIDS and anemia |
| CA2133075A1 (en) | 1992-04-07 | 1993-10-14 | Craig B. Thompson | CD28 Pathway Immunoregulation |
| US5792751A (en) | 1992-04-13 | 1998-08-11 | Baylor College Of Medicine | Tranformation of cells associated with fluid spaces |
| US5587308A (en) | 1992-06-02 | 1996-12-24 | The United States Of America As Represented By The Department Of Health & Human Services | Modified adeno-associated virus vector capable of expression from a novel promoter |
| EP0646178A1 (en) | 1992-06-04 | 1995-04-05 | The Regents Of The University Of California | expression cassette with regularoty regions functional in the mammmlian host |
| EP0671926B1 (en) | 1992-08-11 | 2002-11-13 | President And Fellows Of Harvard College | Immunomodulatory peptides |
| AU5670194A (en) | 1992-11-20 | 1994-06-22 | Enzon, Inc. | Linker for linked fusion polypeptides |
| WO1994013804A1 (en) | 1992-12-04 | 1994-06-23 | Medical Research Council | Multivalent and multispecific binding proteins, their manufacture and use |
| US5773253A (en) | 1993-01-22 | 1998-06-30 | Bristol-Myers Squibb Company | MYPPPY variants of CTL A4 and uses thereof |
| US5633234A (en) | 1993-01-22 | 1997-05-27 | The Johns Hopkins University | Lysosomal targeting of immunogens |
| EP0621337A1 (en) | 1993-01-25 | 1994-10-26 | American Cyanamid Company | Codon optimized DNA sequence for insect toxin AaIT |
| US5593972A (en) | 1993-01-26 | 1997-01-14 | The Wistar Institute | Genetic immunization |
| US5981505A (en) | 1993-01-26 | 1999-11-09 | The Trustees Of The University Of Pennsylvania | Compositions and methods for delivery of genetic material |
| US6482919B2 (en) | 1993-02-01 | 2002-11-19 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| CA2158455C (en) | 1993-03-17 | 2003-05-27 | Nicholas P. Restifo | Immunogenic chimeras comprising nucleic acid sequences encoding endoplasmic reticulum signal sequence peptides and at least one other peptide and their uses in vaccines and disease treatments |
| TW404844B (en) | 1993-04-08 | 2000-09-11 | Oxford Biosciences Ltd | Needleless syringe |
| WO1994024298A1 (fr) | 1993-04-21 | 1994-10-27 | Institut Pasteur | Implant biocompatible pour l'expression et secretion in vivo du compose therapeutique |
| US5591601A (en) | 1993-05-14 | 1997-01-07 | Ohio University Edison Animal Biotechnology Institute | DNA polymerase gene expression system utilizing an RNA polymerase co-delivered with the gene expression vector system |
| US6133028A (en) | 1993-05-28 | 2000-10-17 | Transgene S.A. | Defective adenoviruses and corresponding complementation lines |
| US5849719A (en) | 1993-08-26 | 1998-12-15 | The Regents Of The University Of California | Method for treating allergic lung disease |
| US5830877A (en) | 1993-08-26 | 1998-11-03 | The Regents Of The University Of California | Method, compositions and devices for administration of naked polynucleotides which encode antigens and immunostimulatory |
| US5804566A (en) | 1993-08-26 | 1998-09-08 | The Regents Of The University Of California | Methods and devices for immunizing a host through administration of naked polynucleotides with encode allergenic peptides |
| US5679647A (en) | 1993-08-26 | 1997-10-21 | The Regents Of The University Of California | Methods and devices for immunizing a host against tumor-associated antigens through administration of naked polynucleotides which encode tumor-associated antigenic peptides |
| US5426039A (en) | 1993-09-08 | 1995-06-20 | Bio-Rad Laboratories, Inc. | Direct molecular cloning of primer extended DNA containing an alkane diol |
| DE69435224D1 (de) | 1993-09-15 | 2009-09-10 | Novartis Vaccines & Diagnostic | Rekombinante Alphavirus-Vektoren |
| US6107095A (en) | 1993-11-26 | 2000-08-22 | Mazurkiewicz; Marian | Method for introducing substances into living cells and tissues |
| US5580766A (en) | 1994-01-14 | 1996-12-03 | Alexion Pharmaceuticals, Inc. | Retroviral vector particles for transducing non-proliferating cells |
| ATE231733T1 (de) | 1994-01-21 | 2003-02-15 | Powderject Vaccines Inc | Gasbetätigtes element zum austragen von genmaterial |
| US6117679A (en) | 1994-02-17 | 2000-09-12 | Maxygen, Inc. | Methods for generating polynucleotides having desired characteristics by iterative selection and recombination |
| US6335160B1 (en) | 1995-02-17 | 2002-01-01 | Maxygen, Inc. | Methods and compositions for polypeptide engineering |
| US6077835A (en) | 1994-03-23 | 2000-06-20 | Case Western Reserve University | Delivery of compacted nucleic acid to cells |
| US5739118A (en) | 1994-04-01 | 1998-04-14 | Apollon, Inc. | Compositions and methods for delivery of genetic material |
| GB9406974D0 (en) | 1994-04-08 | 1994-06-01 | Pharmaceutical Proteins Ltd | Transgenic production |
| US5658785A (en) | 1994-06-06 | 1997-08-19 | Children's Hospital, Inc. | Adeno-associated virus materials and methods |
| JP3816518B2 (ja) | 1994-06-10 | 2006-08-30 | ジェンベク、インコーポレイティッド | 相補的なアデノウイルスベクター系と細胞系 |
| US5601820A (en) | 1994-07-07 | 1997-02-11 | Children's Hospital Of Philadelphia | Compositions and methods of making and using human full length TRK-B |
| US5855579A (en) * | 1994-07-15 | 1999-01-05 | Smith & Nephew, Inc. | Cannulated modular intramedullary nail |
| EP1181937A3 (en) | 1994-08-09 | 2004-02-04 | Cytrx Corporation | Novel vaccine adjuvant and vaccine |
| US5786464C1 (en) | 1994-09-19 | 2012-04-24 | Gen Hospital Corp | Overexpression of mammalian and viral proteins |
| GB9502879D0 (en) | 1995-02-14 | 1995-04-05 | Oxford Biosciences Ltd | Particle delivery |
| US6127525A (en) | 1995-02-21 | 2000-10-03 | Cornell Research Foundation, Inc. | Chimeric adenoviral coat protein and methods of using same |
| US5750340A (en) | 1995-04-07 | 1998-05-12 | University Of New Mexico | In situ hybridization solution and process |
| US5922687A (en) | 1995-05-04 | 1999-07-13 | Board Of Trustees Of The Leland Stanford Junior University | Intracellular delivery of nucleic acids using pressure |
| US5525510A (en) | 1995-06-02 | 1996-06-11 | Agracetus, Inc. | Coanda effect gene delivery instrument |
| US5993800A (en) | 1995-06-05 | 1999-11-30 | Bristol-Myers Squibb Company | Methods for prolonging the expression of a heterologous gene of interest using soluble CTLA4 molecules and an antiCD40 ligand |
| ES2236735T4 (es) | 1995-06-05 | 2007-03-01 | University Of Washington | Procedimiento de prolongacion de la expresion de un gen de interes usando moleculas ctla4 solubles. |
| US5811406A (en) | 1995-06-07 | 1998-09-22 | Regents Of The University Of California | Dry powder formulations of polynucleotide complexes |
| US5668110A (en) | 1995-06-07 | 1997-09-16 | Affymax Technologies N.V. | Peptides and compounds that bind to the IL-5 receptor |
| FR2737222B1 (fr) | 1995-07-24 | 1997-10-17 | Transgene Sa | Nouveaux vecteurs viraux et lignee pour la therapie genique |
| AU6691496A (en) | 1995-08-01 | 1997-02-26 | Advanced Therapies, Inc. | Enhanced artificial viral envelopes for cellular delivery of therapeutic substances |
| US5966560A (en) * | 1995-08-29 | 1999-10-12 | Minolta Co., Ltd. | Image forming apparatus with enhanced pretransfer erasing |
| US5801030A (en) | 1995-09-01 | 1998-09-01 | Genvec, Inc. | Methods and vectors for site-specific recombination |
| WO1997011607A1 (en) | 1995-09-27 | 1997-04-03 | Emory University | Method of inhibiting immune system destruction of transplanted viable cells |
| US7041634B2 (en) | 1995-09-27 | 2006-05-09 | Emory University | Method of inhibiting immune system destruction of transplanted viable cells |
| KR970029803A (ko) | 1995-11-03 | 1997-06-26 | 김광호 | 반도체 메모리장치의 프리차지 회로 |
| US6537776B1 (en) | 1999-06-14 | 2003-03-25 | Diversa Corporation | Synthetic ligation reassembly in directed evolution |
| US5789244A (en) | 1996-01-08 | 1998-08-04 | Canji, Inc. | Compositions and methods for the treatment of cancer using recombinant viral vector delivery systems |
| US6750334B1 (en) | 1996-02-02 | 2004-06-15 | Repligen Corporation | CTLA4-immunoglobulin fusion proteins having modified effector functions and uses therefor |
| JP4049816B2 (ja) * | 1996-03-04 | 2008-02-20 | サイオス インコーポレイテッド | hBNP定量のためのアッセイおよび試薬 |
| IL125928A (en) | 1996-03-20 | 2002-11-10 | Bristol Myers Squibb Co | The use of soluble ligands that react with CTLA4, B7, CD40, gp39 and / or CD28 for the preparation of pharmaceutical preparations |
| US6261552B1 (en) | 1997-05-22 | 2001-07-17 | University Of Pittsburgh Of The Commonwealth System Of Higher Education | Herpes simplex virus vectors |
| WO1997044446A1 (en) | 1996-05-24 | 1997-11-27 | University Of Maryland At Baltimore | Dna vaccines for eliciting a mucosal immune response |
| US5750356A (en) | 1996-05-31 | 1998-05-12 | Anergen, Inc. | Method for monitoring T cell reactivity |
| GB9619002D0 (en) | 1996-09-11 | 1996-10-23 | Oxford Biosciences Ltd | Particle delivery |
| WO1998002535A1 (fr) | 1996-07-11 | 1998-01-22 | Takara Shuzo Co., Ltd. | Procede pour effectuer une mutagenese dirigee |
| WO1998006863A1 (en) | 1996-08-14 | 1998-02-19 | The Government Of The United States Of America, Represented By The Secretary, Department Of Health And Human Services | A vector for polynucleotide vaccines |
| US6211160B1 (en) | 1996-09-06 | 2001-04-03 | The Trustees Of The University Of Pennsylvania | Method for tolerizing a mammalian patient to administration of gene therapy virus vectors |
| US6114148C1 (en) | 1996-09-20 | 2012-05-01 | Gen Hospital Corp | High level expression of proteins |
| US6107477A (en) | 1996-09-26 | 2000-08-22 | Aurora Biosciences Corporation | Non-optimal Kozaks sequences |
| EP0934083B1 (en) | 1996-10-23 | 2009-04-29 | The Trustees Of The University Of Pennsylvania | Improved vaccines |
| ATE550429T1 (de) | 1996-11-20 | 2012-04-15 | Crucell Holland Bv | Adenovirus-zusammensetzungen erhältlich durch ein verbessertes produktions- und reinigungsverfahren |
| US7732129B1 (en) | 1998-12-01 | 2010-06-08 | Crucell Holland B.V. | Method for the production and purification of adenoviral vectors |
| KR20000070572A (ko) | 1997-01-29 | 2000-11-25 | 해우슬러 에이치 월터, 리처드 에스. 카훈 | 혈관형성 유도용 아데노바이러스 벡터의 다중 부위 운반 |
| ZA98533B (en) * | 1997-01-31 | 1999-07-22 | Bristol Myers Squibb Co | Soluble CTLA4 mutant molecules and uses thereof. |
| US5837283A (en) | 1997-03-12 | 1998-11-17 | The Regents Of The University Of California | Cationic lipid compositions targeting angiogenic endothelial cells |
| US6261281B1 (en) | 1997-04-03 | 2001-07-17 | Electrofect As | Method for genetic immunization and introduction of molecules into skeletal muscle and immune cells |
| DE69835761T2 (de) | 1997-04-03 | 2007-09-13 | Electrofect As. | Verfahren zum verabreichen von pharmazeutischen präparaten und nukleinsäuren an den skelettmuskel |
| US6225082B1 (en) | 1997-05-09 | 2001-05-01 | Research Corporation Technologies, Inc. | Myelin basic protein MRNA transport and translation enhancer sequences |
| PT1003850E (pt) | 1997-06-06 | 2009-08-13 | Dynavax Tech Corp | Inibidores da actividade de sequências de adn imunoestimulantes |
| EP0996735B1 (en) | 1997-06-09 | 2003-12-10 | Genvec, Inc. | Chimeric vectors comprising a phage packaging site and a portion derived from the genome of a eukaryotic virus |
| DE19729058A1 (de) | 1997-07-08 | 1999-01-14 | Sika Ag | Verbundelement und Verfahren zu seiner Herstellung |
| US6165476A (en) | 1997-07-10 | 2000-12-26 | Beth Israel Deaconess Medical Center | Fusion proteins with an immunoglobulin hinge region linker |
| AU8392898A (en) | 1997-07-14 | 1999-02-10 | Powerject Vaccines, Inc. | Method of dna vaccination using dna encoding antigen and encoding il6 |
| WO1999008689A1 (en) | 1997-08-21 | 1999-02-25 | Powderject Vaccines, Inc. | Mucosal immunization using particle-mediated delivery techniques |
| ATE303448T1 (de) | 1997-09-23 | 2005-09-15 | Genvec Inc | Duale selektionkassette und sie enthaltende plasmide |
| US5932445A (en) | 1997-11-07 | 1999-08-03 | Incyte Pharmaceuticals, Inc. | Signal peptide-containing proteins |
| US5994136A (en) | 1997-12-12 | 1999-11-30 | Cell Genesys, Inc. | Method and means for producing high titer, safe, recombinant lentivirus vectors |
| EP1053343A2 (en) | 1998-02-11 | 2000-11-22 | Maxygen, Inc. | Targeting of genetic vaccine vectors |
| US6087341A (en) | 1998-02-12 | 2000-07-11 | The Board Of Trustees Of The Leland Standford Junior University | Introduction of nucleic acid into skin cells by topical application |
| US5922576A (en) | 1998-02-27 | 1999-07-13 | The John Hopkins University | Simplified system for generating recombinant adenoviruses |
| WO1999047558A2 (en) | 1998-03-19 | 1999-09-23 | Heska Corporation | T cell costimulatory proteins, sequences and uses thereof |
| US6121236A (en) | 1998-03-24 | 2000-09-19 | The Children's Medical Center Corporation | Multivalent ligands which modulate angiogenesis |
| EE200000605A (et) | 1998-04-22 | 2002-04-15 | Genvec, Inc. | Adenoviiruse efektiivne puhastamine |
| WO1999057275A1 (en) | 1998-05-06 | 1999-11-11 | Pharmacia & Upjohn Company | Introduction of naked dna or rna encoding non-human vertebrate peptide hormones or cytokines into a non-human vertebrate |
| US6436897B2 (en) | 1998-06-01 | 2002-08-20 | Celtrix Pharmaceuticals, Inc. | Pharmaceutical formulations for IGF/IGFBP |
| US5965358A (en) | 1998-08-26 | 1999-10-12 | Genvec, Inc. | Method for assessing the relative purity of viral gene transfer vector stocks |
| JP2002525065A (ja) | 1998-09-11 | 2002-08-13 | ジェンベク、インコーポレイティッド | 選択的にターゲッティングされるアデノウイルス |
| US6800457B2 (en) | 1998-09-22 | 2004-10-05 | Bristol-Myers Squibb Company | Expression vectors containing hot spot for increased recombinant protein expression in transfected cells |
| US6521419B1 (en) | 1998-09-22 | 2003-02-18 | Kanakaraju Koduri | Expression vectors containing hot spot for increased recombinant protein expression in transfected cells |
| US6225113B1 (en) | 1998-12-04 | 2001-05-01 | Genvec, Inc. | Use of trans-activation and cis-activation to modulate the persistence of expression of a transgene in an at least E4-deficient adenovirus |
| US6225289B1 (en) | 1998-12-10 | 2001-05-01 | Genvec, Inc. | Methods and compositions for preserving adenoviral vectors |
| CZ303703B6 (cs) | 1998-12-23 | 2013-03-20 | Pfizer Inc. | Monoklonální protilátka nebo její antigen-vázající fragment, farmaceutická kompozice obsahující tuto protilátku nebo fragment, bunecná linie produkující tuto protilátku nebo fragment, zpusob prípravy této protilátky, izolovaná nukleová kyselina kóduj |
| AU2220800A (en) | 1998-12-31 | 2000-07-31 | Chiron Corporation | Compositions and methods for packaging of alphavirus vectors |
| CA2361421A1 (en) | 1999-02-03 | 2000-08-10 | Biosante Pharmaceuticals, Inc. | Therapeutic calcium phosphate particles and methods of manufacture and use |
| US6281005B1 (en) | 1999-05-14 | 2001-08-28 | Copernicus Therapeutics, Inc. | Automated nucleic acid compaction device |
| WO2001081609A2 (en) | 2000-03-22 | 2001-11-01 | Chiron Corporation | Compositions and methods for generating an immune response utilizing alphavirus-based vector systems |
| US6168941B1 (en) | 2000-04-07 | 2001-01-02 | Genvec, Inc. | Method of producing adenoviral vector stocks |
| CA2407050A1 (en) | 2000-04-25 | 2001-11-01 | Chiron Corporation | Alphavirus-based vectors for persistent infection |
| US20020058039A1 (en) | 2000-04-27 | 2002-05-16 | Coyne Michael J. | Method of measuring the duration of adequate immune memory in companion animals |
| CN101255192A (zh) * | 2000-05-26 | 2008-09-03 | 布里斯托尔-迈尔斯斯奎布公司 | 可溶性ctla4突变体分子及其应用 |
| US7094874B2 (en) | 2000-05-26 | 2006-08-22 | Bristol-Myers Squibb Co. | Soluble CTLA4 mutant molecules |
| US20050154189A1 (en) * | 2000-06-23 | 2005-07-14 | Maxygen Inc | Novel co-stimulatory molecules |
| EP1360290A2 (en) * | 2000-06-23 | 2003-11-12 | Maxygen, Inc. | Co-stimulatory molecules |
| US7183376B2 (en) * | 2000-06-23 | 2007-02-27 | Maxygen, Inc. | Variant B7 co-stimulatory molecules |
| EP1297146A2 (en) | 2000-06-23 | 2003-04-02 | Maxygen, Inc. | Novel chimeric promoters |
| SI1935427T1 (en) | 2000-07-03 | 2018-05-31 | Bristol-Myers Squibb Company | USE OF HEATED CTLA4 MUTANT MOLECULES |
| US20040022787A1 (en) | 2000-07-03 | 2004-02-05 | Robert Cohen | Methods for treating an autoimmune disease using a soluble CTLA4 molecule and a DMARD or NSAID |
| WO2002002639A2 (en) * | 2000-07-05 | 2002-01-10 | Pharmacia & Upjohn Company | Human ion channels |
| US7829084B2 (en) * | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| PT1397153E (pt) | 2001-05-23 | 2008-06-12 | Bristol Myers Squibb Co | Métodos para proteger um transplante alogénico de ilhéus utilizando moléculas mutantes de ctla4 solúveis |
| FR2843396B1 (fr) * | 2002-08-07 | 2005-04-15 | Bio Rad Pasteur | Anticorps specifiques pour le diagnostic de l'insuffisance cardiaque |
| US7648962B2 (en) * | 2002-11-26 | 2010-01-19 | Biocon Limited | Natriuretic compounds, conjugates, and uses thereof |
| ATE488600T1 (de) | 2002-12-23 | 2010-12-15 | Bristol Myers Squibb Co | Produktqualitätsverbesserung in säugerzellkulturverfahrenzur proteinproduktion |
| CA2534474C (en) | 2003-08-04 | 2014-09-23 | Bristol-Myers Squibb Company | Methods for treating cardiovascular disease using a soluble ctla4 molecule |
| US7731965B2 (en) * | 2005-02-17 | 2010-06-08 | Abbott Lab | Human ring specific BNP antibodies |
| PT1861116E (pt) | 2005-03-25 | 2015-11-04 | Regeneron Pharma | Formulações de antagonista do vegf |
| WO2006108035A1 (en) | 2005-04-06 | 2006-10-12 | Bristol-Myers Squibb Company | Methods for treating immune disorders associated with graft transplantation with soluble ctla4 mutant molecules |
| GB0620934D0 (en) | 2006-10-20 | 2006-11-29 | Cambridge Antibody Tech | Protein variants |
| KR101383476B1 (ko) * | 2007-11-01 | 2014-04-11 | 아스테라스 세이야쿠 가부시키가이샤 | 면역억제 폴리펩티드 및 핵산 |
| US9405700B2 (en) | 2010-11-04 | 2016-08-02 | Sonics, Inc. | Methods and apparatus for virtualization in an integrated circuit |
-
2008
- 2008-10-15 KR KR1020107011711A patent/KR101383476B1/ko not_active IP Right Cessation
- 2008-10-15 WO PCT/US2008/079981 patent/WO2009058564A2/en active Application Filing
- 2008-10-15 EP EP08844441A patent/EP2222697B1/en active Active
- 2008-10-15 DK DK08844441.9T patent/DK2222697T3/da active
- 2008-10-15 AU AU2008319053A patent/AU2008319053B2/en not_active Ceased
- 2008-10-15 US US12/251,960 patent/US7794718B2/en active Active
- 2008-10-15 PL PL13150320T patent/PL2612868T3/pl unknown
- 2008-10-15 EP EP13150303.9A patent/EP2612867A1/en not_active Withdrawn
- 2008-10-15 PT PT88444419T patent/PT2222697E/pt unknown
- 2008-10-15 EP EP13150320.3A patent/EP2612868B1/en active Active
- 2008-10-15 RU RU2010122053/10A patent/RU2506275C2/ru not_active IP Right Cessation
- 2008-10-15 CN CN201310056076.1A patent/CN103172750B/zh active Active
- 2008-10-15 PL PL08844441T patent/PL2222697T3/pl unknown
- 2008-10-15 CN CN200880114532.0A patent/CN101998965B/zh active Active
- 2008-10-15 MX MX2010004883A patent/MX2010004883A/es active IP Right Grant
- 2008-10-15 ES ES13150320.3T patent/ES2688721T3/es active Active
- 2008-10-15 JP JP2010532121A patent/JP5298134B2/ja active Active
- 2008-10-15 CA CA2703263A patent/CA2703263C/en not_active Expired - Fee Related
- 2008-10-15 ES ES08844441T patent/ES2399088T3/es active Active
- 2008-10-15 PT PT13150320T patent/PT2612868T/pt unknown
- 2008-10-15 EP EP11166011A patent/EP2385065A1/en not_active Withdrawn
- 2008-10-29 TW TW097141645A patent/TWI448473B/zh not_active IP Right Cessation
-
2010
- 2010-04-13 IL IL205036A patent/IL205036A/en not_active IP Right Cessation
- 2010-04-20 US US12/763,902 patent/US8071095B2/en active Active
- 2010-04-23 ZA ZA2010/02872A patent/ZA201002872B/en unknown
-
2011
- 2011-01-21 US US13/011,463 patent/US8283447B2/en active Active
- 2011-01-21 US US13/011,497 patent/US8318176B2/en active Active
- 2011-01-21 US US13/011,351 patent/US8445230B2/en active Active
- 2011-01-21 US US13/011,042 patent/US8268587B2/en active Active
- 2011-03-10 US US13/045,335 patent/US8491899B2/en active Active
- 2011-03-16 US US13/049,727 patent/US8496935B2/en active Active
-
2013
- 2013-02-21 CY CY20131100164T patent/CY1113713T1/el unknown
- 2013-03-05 HR HRP20130194AT patent/HRP20130194T1/hr unknown
- 2013-05-30 PH PH12013501101A patent/PH12013501101A1/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5298134B2 (ja) | 免疫抑制ポリペプチドおよび核酸 | |
| KR20180012260A (ko) | 조율가능한 친화성을 갖는 면역조절 단백질 | |
| CN101198347A (zh) | 使用可溶性ctla4突变型分子治疗与移植物移植有关的免疫病症的方法 | |
| AU2014250683B2 (en) | Immunosuppressive polypeptides and nucleic acids | |
| CA2805976C (en) | Immunosuppressive polypeptides and nucleic acids | |
| AU2012202324B2 (en) | Immunosuppressive polypeptides and nucleic acids | |
| Bakhtiyorovna | REVOLUTIONIZING AUTOIMMUNE DISEASE TREATMENT: EXPLORING IMMUNE CHECKPOINTS AS INNOVATIVE THERAPEUTIC TARGETS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110317 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121204 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20121219 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20130110 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130322 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130610 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130617 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5298134 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |