RU2358716C2 - Органические соединения - Google Patents
Органические соединения Download PDFInfo
- Publication number
- RU2358716C2 RU2358716C2 RU2005134173/15A RU2005134173A RU2358716C2 RU 2358716 C2 RU2358716 C2 RU 2358716C2 RU 2005134173/15 A RU2005134173/15 A RU 2005134173/15A RU 2005134173 A RU2005134173 A RU 2005134173A RU 2358716 C2 RU2358716 C2 RU 2358716C2
- Authority
- RU
- Russia
- Prior art keywords
- alkyl
- composition according
- group
- halogen
- substituted
- Prior art date
Links
- DHKOHUJNSQPJPQ-ASXGKARISA-N C[C@@H]1[C@@H]2C(C)=CC[C@H](C)[C@@H]2C1 Chemical compound C[C@@H]1[C@@H]2C(C)=CC[C@H](C)[C@@H]2C1 DHKOHUJNSQPJPQ-ASXGKARISA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/145—Amines having sulfur, e.g. thiurams (>N—C(S)—S—C(S)—N< and >N—C(S)—S—S—C(S)—N<), Sulfinylamines (—N=SO), Sulfonylamines (—N=SO2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4858—Organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4841—Filling excipients; Inactive ingredients
- A61K9/4866—Organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P41/00—Drugs used in surgical methods, e.g. surgery adjuvants for preventing adhesion or for vitreum substitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Biophysics (AREA)
- Emergency Medicine (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Nutrition Science (AREA)
- Physiology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Biochemistry (AREA)
- Cardiology (AREA)
- Transplantation (AREA)
- Hospice & Palliative Care (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Virology (AREA)
- Heart & Thoracic Surgery (AREA)
- Psychiatry (AREA)
- Surgery (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicinal Preparation (AREA)
Abstract
Изобретение относится к области фармацевтики и касается твердой фармацевтической композиции, пригодной для орального введения, которая содержит: (а) агонист рецептора S1P и (б) сахарный спирт. Изобретение обеспечивает однородное распределение активного компонента в твердой композиции и ее высокую стабильность. 17 з.п. ф-лы, 2 табл.
Description
Настоящее изобретение относится к фармацевтическим композициям, содержащим агонист сфингозин-1 -фосфатного рецептора. Сфингозин-1-фосфат (ниже в настоящем описании обозначен как «S1P») представляет собой встречающийся в естественных условиях сывороточный липид. В настоящее время известно 8 рецепторов S1P, а именно S1P1 - S1P8. Агонисты рецептора S1P обладают способностями ускорять хоминг лимфоцитов.
Агонисты рецептора S1P представляют собой иммуномодуляторы, которые вызывают лимфопению, обусловленную перераспределением, предпочтительно обратимым, лимфоцитов из кровотока во вторичную лимфатическую ткань, что приводит к генерализованной иммуносупрессии. Нестимулированные клетки подвергаются разрушению, происходит стимуляция миграции CD4- и CD8-T-клеток и В-клеток из кровотока в лимфатические узлы (ЛУ) и пейеровы бляшки (БП), в результате чего ингибируется инфильтрация клеток в трансплантированные органы.
Различные известные агонисты рецептора S1P обладают структурным сходством, что вызывает связанные с этим проблемы при создании требуемого препарата. Прежде всего существует необходимость в создании содержащего агонист рецептора S1P препарата, хорошо приспособленного для орального введения в твердой форме, например в форме таблетки или капсулы.
В соответствии с этим в настоящем изобретении предложена твердая фармацевтическая композиция для орального введения, содержащая агонист рецептора S1P и сахарный спирт.
При создании изобретения неожиданно было установлено, что твердые композиции, содержащие сахарный спирт, позволяют создавать препараты, наиболее хорошо приспособленные для орального введения агонистов рецептора S1P. Композиции представляют собой удобное средство для системного введения агонистов рецептора S1P, не имеют недостатков, присущих жидким препаратам для инъекции или для орального применения, и обладают хорошими физико-химическими свойствами и способностью к хранению. Прежде всего, композиции, предлагаемые в настоящем изобретении, могут характеризоваться высоким уровнем однородности распределения агониста рецептора S1P в композиции, а также высокой стабильностью. Композиции, предлагаемые в изобретении, можно приготавливать на высокоскоростном автоматическом оборудовании и тем самым не требуется осуществлять капсуляцию вручную.
Агонисты рецептора S1P как правило представляют собой аналоги сфингозина, такие как 2-замещенные 2-аминопропан-1,3-диольные или 2-аминопропанольные производные. Примерами пригодных агонистов рецептора S1P являются, например, соединения, описанные в ЕР 627406 А1, например соединение формулы I
в которой R1 обозначает прямую или разветвленную (С12-С22)-углеродную цепь,
- причем указанная цепь может нести связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, NR6, где R6 обозначает Н, алкил, аралкил, ацил или алкоксикарбонил, и карбонила, и/или
- может иметь в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксииминогруппу, гидроксигруппу или карбоксигруппу; или
R1 обозначает
- фенилалкил, в котором алкил обозначает прямую или разветвленную (С6-С20)-углеродную цепь; или
- фенилалкил, в котором алкил обозначает прямую или разветвленную (С1-С30)-углеродную цепь, где фенилалкил замещен
- прямой или разветвленной (С6-С20)-углеродной цепью, необязательно замещенной галогеном,
- С6-С20алкоксигруппой с прямой или разветвленной цепью, необязательно замещенной галогеном,
- С6-С20алкенилоксигруппой с прямой или разветвленной цепью,
- фенилалкоксигруппой, галофенилалкоксигруппой, фенилалкоксиалкилом, феноксиалкоксигруппой или феноксиалкилом,
- циклоалкилом, замещенным С6-С20алкилом,
- гетероарилалкилом, замещенным С6-С20алкилом,
- гетероциклическим С6-С20алкилом, или
- гетероциклическим алкилом, замещенным С6-С20алкилом,
и где
алкильная группа может нести
- в углеродной цепи связь или гетероатом, выбранные из двойной связи, тройной связи. О, S, сульфинила, сульфонила или NR6, где R6 имеет указанные выше значения, и
- в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксигруппу или карбоксигруппу; и
R2, R3, R4 и R5 каждый независимо друг от друга обозначает Н, С1-С4алкил или ацил,
или его фармацевтически приемлемая соль;
- соединения, описанные в ЕР 1002792 А1, например соединение формулы II
в которой m обозначает 1-9 и R'2, R'3, R'4 и R'5 каждый независимо друг от друга обозначает Н, алкил или ацил,
или его фармацевтически приемлемая соль;
- соединения, описанные в ЕР 0778263 А1, например соединение формулы III
в которой W обозначает Н; C1-С6алкил, С2-С6алкенил или С2-С6алкинил; незамещенный или замещенный ОН-группой фенил; R''4O(CH2)n; или С1-С6алкил, замещенный 1-3 заместителями, выбранными из ряда, включающего галоген, С3-С8циклоалкил, фенил и фенил, замещенный ОН;
Х обозначает Н или незамещенный или замещенный алкил с прямой цепью, несущий р атомов углерода, или незамещенную или замещенную алкоксигруппу с прямой цепью, несущую (р-1) атомов углерода, например замещенную 1-3 заместителями, выбранными из ряда, включающего C1-С6алкил, ОН, C1-С6алкоксигруппу, ацилоксигруппу, аминогруппу, C1-С6алкиламиногруппу, ациламиногруппу, оксогруппу, галоC1-С6алкил, галоген, незамещенный фенил и фенил, замещенный 1-3 заместителями, выбранными из ряда, включающего C1-С6алкил, ОН, C1-С6алкоксигруппу, ацил, ацилоксигруппу, аминогруппу, C1-С6алкиламиногруппу, ациламиногруппу, галоС1-С6алкил и галоген; Y обозначает Н, C1-С6алкил, ОН, С1-С6алкоксигруппу, ацил, ацилоксигруппу, аминогруппу, C1-С6алкиламиногруппу, ациламиногруппу, галоС1-С6алкил или галоген; Z2 обозначат простую связь или алкилен с прямой цепью, несущий q атомов углерода,
где р и q каждый независимо друг от друга обозначает целое число от 1 до 20 при условии, что 6≤p+q≤23, m' обозначает 1, 2 или 3, n обозначает 2 или 3, R''1, R''2, R''3 и R''4 каждый независимо друг от друга обозначает Н, С1-С4алкил или ацил,
или его фармацевтически приемлемая соль;
- соединения, описанные в WO 02/18395, например соединение формулы IVa или IVb
в котором Ха обозначает О, S, NRis или группу -(СН2)na-, где группа является незамещенной или замещена 1-4 атомами галогена; nа обозначает 1 или 2, R1s обозначает Н или С1-С4алкил, где алкил является незамещенным или замещен галогеном; R1a обозначает Н, ОН, С1-С4алкил или O(С1-С4)алкил, где алкил является незамещенным или замещен 1-3 атомами галогена; R1b обозначает Н, ОН или (С1-С4)алкил, где алкил является незамещенным или замещен галогеном;
R2a каждый независимо друг от друга выбран из Н или С1-С4алкила, где алкил является незамещенным или замещен галогеном; R3a обозначает Н, ОН, галоген или O(С1-С4)алкил, где алкил является незамещенным или замещен галогеном; и R3b обозначает Н, ОН, галоген, С1-С4алкил, где алкил является незамещенным или замещен гидроксигруппой, или O(С1-С4)алкил, где алкил является незамещенным или замещен галогеном; Ya обозначает -CH2-, -C(O)-, -СН(ОН)-, -C(=NOH)-, О или S, и R4a обозначает С4-С14алкил или С4-С14алкенил;
или его фармацевтически приемлемая соль или гидрат;
- соединения, описанные в WO 02/076995, например соединение формулы V
в которой
mc обозначает 1, 2 или 3;
Ха обозначает О или прямую связь;
R1c обозначает Н, C1-С6алкил, необязательно замещенный ОН, ацилом, галогеном, С3-С10циклоалкилом, фенилом или гидроксифениленом; С3-С6алкенил; С2-С6алкинил; или фенил, необязательно замещенный ОН;
R2c обозначает
в которой R5c обозначает Н, С1-С4алкил, необязательно замещенный 1, 2 или 3 атомами галогена, и R6c обозначает Н или С1-С4алкил, необязательно замещенный галогеном;
R3c и R4c каждый независимо друг от друга обозначает Н, С1-С4алкил, необязательно замещенный галогеном, или ацил, и
Rc обозначает С13-С20алкил, который необязательно может нести в цепи атом кислорода и который необязательно может быть замещен нитрогруппой,
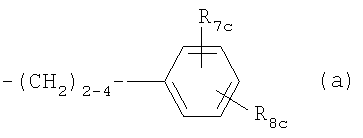
галогеном, аминогруппой, гидроксигруппой или карбоксигруппой; или группу формулы (а)
в которой R7c обозначает Н, C1-C4алкил или С1-С4алкоксигруппу, и R8c обозначает замещенный C1-С20алканоил, фенилС1-С14алкил, где С1-С14алкил необязательно замещен галогеном или ОН, циклоалкилС1-С14алкоксигруппу или фенилС1-С14алкоксигруппу, где циклоалкильное или фенильное кольцо необязательно замещено галогеном, С1-С4алкилом и/или С1-С4алкоксигруппой, фенилС1-С14алкоксиС1-С14алкил,
феноксиС1-С14алкоксигруппу или феноксиС1-С14алкил,
Rc обозначает также группу формулы (а), в котором R8c обозначает C1-С14алкоксигруппу, когда R1c обозначает С1-С4алкил, С2-С6алкенил или C2-С6алкинил,
или соединение формулы VI
в которой
nx обозначает 2, 3 или 4
R1x обозначает Н, C1-С6алкил, необязательно замещенный ОН, ацилом, галогеном, циклоалкилом, фенилом или гидроксифениленом; С2-С6алкенил; С2-С6алкинил; или фенил, необязательно замещенный ОН;
R2x обозначает Н; С1-С4алкил или ацил
R3x и R4x каждый независимо друг от друга обозначает Н, С1-С4алкил, необязательно замещенный галогеном или ацилом,
R5x обозначает Н, С1-С4алкил или С1-С4алкоксигруппу, и
R6x обозначает С1-С20алканоил, замещенный циклоалкилом; циклоалкилС1-С14алкоксигруппу, где циклоалкильное кольцо необязательно замещено галогеном, С1-С4алкилом и/или С1-С4алкоксигруппой; фенилС1-С14алкоксигруппу, где фенильное кольцо необязательно замещено галогеном, С1-С4алкилом и/или С1-С4алкоксигруппой,
R6x может обозначать также С4-С14алкоксигруппу, когда R1x обозначает С2-С4алкил, замещенный ОН, или пентилоксигруппу или гексилоксигруппу, когда R1x обозначает С1-С4алкил,
при условии, что R6x не обозначает фенилбутиленоксигруппу, когда либо R5x обозначает Н, либо R1x обозначает метил, или его фармацевтически приемлемая соль.
- соединения, описанные в WO 02/06268 A1, например соединение формулы VII
в которой R1d и R2d каждый независимо друг от друга обозначает Н или аминозащитную группу;
R3d обозначает водород, гидроксизащитную группу или группу формулы
R4d обозначает (низш.)алкил;
nd обозначает целое число от 1 до 6;
Xd обозначает этилен, винилен, этинилен, группу формулы -D-CH2- (в которой D обозначает карбонил, -СН(ОН)-, О, S или N), арил или арил, имеющий вплоть до трех заместителей, выбранных из указанной ниже группы а;
Yd обозначает простую связь, C1-С10алкилен, C1-С10алкилен, имеющий вплоть до трех заместителей, выбранных из групп а и б, C1-С10алкилен, несущий О или S в середине или на конце углеродной цепи, или C1-С10алкилен, несущий О или S в середине или на конце углеродной цепи, который имеет вплоть до трех заместителей, выбранных из групп а и б;
R5d обозначает водород, циклоалкил, арил, гетероцикл, циклоалкил, имеющий вплоть до трех заместителей, выбранных из групп а и б, арил, имеющий вплоть до трех заместителей, выбранных из групп а и б, или гетероцикл, имеющий вплоть до трех заместителей, выбранных из групп а и б;
R6d и R7d каждый независимо друг от друга обозначает Н или заместитель, выбранный из группы а;
R6d и R9d каждый независимо друг от друга обозначает Н или
C1-C4алкил, необязательно замещенный галогеном;
«группа а» включает галоген, (низш.)алкил, галоген(низш.)алкил, (низш.)алкоксигруппу, (низш.)алкилтиогруппу, карбоксил, (низш.)алкоксикарбонил, гидроксигруппу, алифатический (низш.)ацил, аминогруппу, моно(низш.)алкиламиногруппу, ди(низш.)алкиламиногруппу, алифатическую (низш.)ациламиногруппу, цианогруппу или нитрогруппу; и «группа б» включает циклоалкил, арил, гетероцикл, каждый из которых необязательно имеет вплоть до трех заместителей, выбранных из группы а; при условии, что когда R5d обозначает водород, Yd не обозначает простую связь и линейный C1-С10алкилен, или его фармакологически приемлемая соль или сложный эфир;
- соединения, описанные в JP-14316985 (JP 2002316985), например соединение формулы VIII
в котором R1e, R2e, R3e, R4e, R5e, R6e, R7e, ne, Хе И Ye имеют значения, указанные в JP-14316985;
или его фармакологически приемлемая соль или сложный эфир;
- соединения, описанные в WO 03/29184 и WO 03/29205, например соединение формулы IX
в которой
Xf обозначает О или S и R1f, R2f, R3f и nf имеют значения, указанные в WO 03/29184 и WO 03/29205,
R4f и R5f каждый независимо друг от друга обозначает Н или группу формулы
в которой R8f и R9f каждый независимо друг от друга обозначает Н или C1-С4алкил, необязательно замещенный галогеном; например 2-амино-2-[4-(3-бензилоксифенокси)-2-хлорфенил]пропил-1,3-пропандиол или 2-амино-2-[4-(бензилоксифенилтио)-2-хлорфенил]пропил-1,3-пропандиол, или его фармакологическая соль.
- соединения, описанные в WO 03/062252 А1, например соединение формулы Х
в которой
Ar обозначает фенил или нафтил; mg и ng каждый независимо друг от друга обозначают 0 или 1; А выбран из СООН, РО3Н2, РО2Н, SO3Н, РО(С1-С3алкил)ОН и 1H-тетразол-5-ила; R1g и R2g каждый независимо друг от друга обозначает Н, галоген, ОН, СООН или С1-С4алкил, необязательно замещенный галогеном; R3g обозначает Н или С1-С4алкил, необязательно замещенный галогеном или ОН; R4g каждый независимо друг от друга обозначает галоген или необязательно замещенные галогеном С1-С4алкил или C1-С3алкоксигруппу; и Rg и М имеют одно из значений, указанных для В и С соответственно в WO 03/062252 A1;
- соединения, описанные в WO 03/062248 A2, например соединение формулы XI
в которой
Ar обозначает фенил или нафтил; n обозначает 2, 3 или 4; А обозначает СООН, 1H-тетразол-5-ил, РО3Н2, PO2Н2, -SO3Н или PO(R5h)OH, где R5h выбран из C1-С4алкила, гидроксиС1-С4алкила, фенила, -СО-С1-С3алкоксигруппы и -СН(ОН)фенила, где фенил или фенильная группа необязательно являются замещенными; R1h и R2h каждый независимо друг от друга обозначает Н, галоген, ОН, СООН или необязательно замещенный галогеном C1-С6алкил или фенил; R3h обозначает Н или С1-С4алкил, необязательно замещенный галогеном и/или ОН; R4h каждый независимо друг от друга обозначает галоген, ОН, СООН, С1-С4алкил,
S(O)(С1-С3)0,2 или 3алкил, C1-С3алкоксигруппу, С3-С6циклоалкоксигруппу, арил или аралкоксигруппу, где арильные группы необязательно могут быть замещены 1-3 атомами галогена; и Rg и М каждый имеют одно из значений, указанных для В и С соответственно в WO 03/062248 A2.
Согласно следующему варианту осуществления изобретения агонист рецептора S1P, который применяют в комбинации, предлагаемой в настоящем изобретении, может представлять собой также соединение, обладающее избирательным действием в отношении рецептора S1P1, например соединение, действие которого в отношении рецептора S1P1 превосходит его действие в отношении рецептора S1P3 по меньшей мере в 20 раз, например в 100, 500, 1000 или 2000 раз, что оценивали на основе соотношения значения ЕС50 для рецептора S1P1 и значения ЕС50 для рецептора S1P3, полученных с помощью анализа связывания 358-ГТФγS, при этом значение ЕС50 указанного соединения при связывании с рецептором S1P1 составляло примерно 100нМ или менее по данным анализа связывания 358-ГТФγS. Репрезентативными агонистами рецептора S1P1 являются, например соединения, перечисленные в WO 03/061567, содержание которой включено в настоящее описание в качестве ссылки, например соединение формулы
или
В каждом случае, когда даны ссылки на заявки на патент, подразумевается, что тем самым их сущность, касающаяся соединений, включена в настоящее описание в качестве ссылки.
Ацил может представлять собой группу Ry-CO-, в которой Ry обозначает C1-С6алкил, С3-С6циклоалкил, фенил или фенилС1-С4алкил. Если не указано иное, алкил, алкоксигруппа, алкенил или алкинил могут иметь прямую или разветвленную цепь.
Когда в соединениях формулы I углеродная цепь, представляющая собой R1, является замещенной, то предпочтительно она замещена галогеном, нитрогруппой, аминогруппой, гидроксигруппой или карбоксигруппой. Когда углеродная цепь несет необязательно замещенный фенилен, то углеродная цепь предпочтительно является незамещенной. Когда фениленовая группа является замещенной, то предпочтительно она замещена галогеном, нитрогруппой, аминогруппой, метоксигруппой, гидроксигруппой или карбоксигруппой.
Предпочтительными соединениями формулы I являются соединения, в которых R1 обозначает С13-С20алкил, необязательно замещенный нитрогруппой, галогеном, аминогруппой, гидроксигруппой или карбоксигруппой, и более предпочтительно соединения, в которых R1 обозначает фенилалкил, замещенный С6-С14алкильной цепью, необязательно замещенной галогеном, и алкильная группа обозначает C1-С6алкил, необязательно замещенный гидроксигруппой. Более предпочтительно R1 обозначает фенилС1-С6алкил, замещенный на фенильной группе прямой или разветвленной, предпочтительно прямой С6-С14алкильной цепью. С6-С14алкильная цепь может находиться в орто-, мета- или пара-положении, предпочтительно в пара-положении.
Предпочтительно R2-R5 каждый обозначают Н.
Предпочтительным соединением формулы I является 2-амино-2-тетрадецил-1,3-пропандиол. Наиболее предпочтительным агонистом рецептора S1P формулы I является FTY720, т.е. 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли (ниже в настоящем описании обозначен как соединение А), например в форме гидрохлорида приведенной ниже формулы
Предпочтительным соединением формулы II является соединение, в котором R'2-R'5 каждый обозначают Н и m обозначает 4, т.е. 2-амино-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил}пропан-1,3-диол, в свободной форме или в форме его фармацевтически приемлемой соли (ниже в настоящем описании обозначено как соединение Б), например в форме гидрохлорида.
Предпочтительным соединением формулы III является соединение, в котором W обозначает СН3, R''1-R''3 каждый обозначают Н, Z2 обозначает этилен, Х обозначает гептилоксигруппу и Y обозначает Н, т.е. 2-амино-4-(4-гептилоксифенил)-2-метилбутанол, в свободной форме или в форме его фармацевтически приемлемой соли (ниже в настоящем описании обозначено как соединение В), например в форме гидрохлорида. Наиболее предпочтительным является R-энантиомер.
Предпочтительным соединением формулы IVa является PTY720-фосфат (R2a обозначает Н, R3а обозначает ОН, Ха обозначает О, R1a и R1b обозначают ОН). Предпочтительным соединением формулы IVб является фосфат соединения В (R2a обозначает Н, R3b обозначает ОН, Ха обозначает О, R1a и R1b обозначают ОН, Ya обозначает О и R4a обозначает гептил). Предпочтительным соединением формулы V является фосфат соединения Б.
Предпочтительным соединением формулы V является моно[(R)-2-амино-2-метил-4-(4-пентилоксифенил)бутиловый]эфир фосфорной кислоты.
Предпочтительным соединением формулы VIII является (2R)-2-амино-4-[3-(4-циклогексилоксибутил)бензо[b]тиен-6-ил]-2-метилбутан-1-ол.
Когда соединения формул I-XIII имеют один или несколько асимметричных центров в молекуле, то под объем изобретения подпадают различные оптические изомеры, а также рацематы, диастереоизомеры и их смеси.
Примеры фармацевтически приемлемых солей соединений формул I-XIII включают соли с неорганическими кислотами, такие как гидрохлорид, гидробромид и сульфат, соли с органическими кислотами, такие как ацетат, фумарат, малеат, бензоат, цитрат, малат, метансульфонат и бензолсульфонат, или при необходимости соли с металлами, такими как натрий, калий, кальций и алюминий, соли с аминами, такими как триэтиламин, и соли с двухосновными аминокислотами, такими как лизин. Под объем соединений и солей, предлагаемых в настоящем изобретении, подпадают формы в виде гидратов и сольватов.
Связывание с рецепторами S1P можно оценивать с помощью следующих методов анализа.
А. Аффинность к связыванию агонистов рецептора S1P с индивидуальными человеческими рецепторами S1P.
Кратковременная трансфекция человеческими рецепторами S1P клеток линии НЕК293
Клонировали рецепторы S1P и протеины G1, смешивали равные количества четырех кДНК, кодирующих рецептор EDG, Gi-α, Gi-β и Gi-γ, и использовали для трансфекции монослоев клеток линии НЕК293 с помощью осаждения фосфатом кальция (М.Wigler и др., Cell., 11, 1977, с.223 и D.S. Im и др., Mol. Pharmacol., 57, 2000, с.753). В целом метод состоял в следующем. Смесь ДНК, содержащую 25 мкг ДНК и 0.25М CACL2, добавляли к HEPES, забуференному 2 мМ Na2HPO4. В субконфлюентные монослои клеток линии НЕК293 вносили 25 мМ хлорохин и затем к клеткам добавляли осадок ДНК. Через 4 ч монослои промывали забуференным фосфатом физиологическим раствором и подпитывали средами (90% смеси (1:1) модифицированная по способу Дульбекко среда Игла (DMEM):F-12+10% фетальной бычьей сыворотки). Клетки собирали через 48-72 ч после добавления ДНК путем соскабливания в буфер НМЕ (20 мМ HEPES, 5 мМ MgCl2, 1 мМ ЭДТК, рН 7,4), содержащий 10% охлажденной на льду сахарозы, и разрушали с использованием гомогенизатора Dounce, После центрифугирования при 800×g, супернатант разбавляли НМЕ без добавления сахарозы и центрифугировали при 100000×g в течение 1 ч. Образовавшийся дебрис повторно гомогенизировали и центрифугировали при 100000×g в течение еще одного часа. Полученный неочищенный дебрис мембран ресуспендировали в НМЕ с добавлением сахарозы, разделяли на аликвоты и мгновенно замораживали путем погружения в жидкий азот. Мембраны хранили при -70°С. Концентрацию протеина определяли спектроскопическим путем с помощью анализа протеина по методу Брэдфорда.
Анализ связывания ГТФγS с использованием препаратов мембран рецептор S1P/HEK293
Эксперименты по оценке связывания ГТФγS осуществляли согласно методу, описанному у D.S.Im и др., Mol. Pharmacol., 57, 2000, с.753. Опосредуемое лигандом связывание ГТФγS с G-протеинами оценивали в буфере для связывания ГТФ (50 мМ HEPES, 100 мМ NaCl, 10 мМ MgCl2, рН 7,5) с использованием 25 мкг препарата мембран, полученных из подвергнутых кратковременной трансфекции клеток линии НЕК293. Лиганд добавляли к мембранам в присутствии 10 мкМ ГДФ и
0,1 нМ [35S] ГТФγS (1200 Ки/ммоль) и инкубировали при 30°С в течение 30 мин. Связанный ГТФγS отделяли от несвязанного с использованием харвестера Брандела (Гейтерсберг, шт.Мэриленд) и подсчитывали с помощью жидкостного сцинтилляционного счетчика.
Композиция, предлагаемая в изобретении, предпочтительно содержит от 0,01 до 20 мас.% агонистов рецептора S1P, более предпочтительно от 0,1 до 10 мас.%, например от 0,5 до 5 мас.% в пересчете на массу всей композиции.
Сахарный спирт может действовать в качестве разбавителя, носителя, наполнителя или агента для увеличения объема и в качестве него удобно применять маннит, мальтит, инозит, ксилит или лактит, предпочтительно практически негигроскопический сахарный спирт, например маннит (D-маннит). Можно применять сахарный спирт индивидуально или использовать смесь двух или большего количества сахарных спиртов, например смесь маннита и ксилита, например в соотношении от 1:1 до 4:1.
В наиболее предпочтительном варианте осуществления изобретения сахарный спирт приготавливают из высушенной распылением композиции, например композиции маннита, которая обладает большой удельной площадью поверхности. Применение композиции маннита такого типа может способствовать обеспечению однородного распределения агониста рецептора S1P в манните в композиции. Большую площадь поверхности можно получать путем создания препарата сахарного спирта, например маннита, состоящего из частиц, которые имеют меньший средний размер и/или более шероховатую поверхность каждой частицы. Было установлено также, что применение высушенного распылением сахарного спирта, например маннита, со средним размером частиц 300 мкм или менее позволяет улучшать сжимаемость и твердость таблеток, изготовленных из композиции.
Предпочтительно удельная площадь поверхности одной частицы препарата сахарного спирта, например маннита, составляет от 1 до 7, например от 2 до 6 или от 3 до 5 м2/г. Пригодный препарат маннита может иметь средний размер частиц от 100 до 300, например от 150 до 250 мкм, и насыпную плотность от 0,4 до 0,6, например от 0,45 до 0,55 г/мл. Пригодным маннитом с большой площадью поверхности является Parteck M200, поступающий в продажу от фирмы E.Merck.
Композиция предпочтительно содержит от 75 до 99,99 мас.% сахарного спирта, более предпочтительно от 85 до 99,9, например от 90 до 99,5 мас.% в пересчете на массу всей композиции.
Композиция предпочтительно содержит также замасливатель. Пригодными замасливателями являются стеариновая кислота, стеарат магния, стеарат кальция, стеарат цинка, глицерилпальмитостеарат, натрийстеарилфумарат, масло канолы, гидрогенизированное растительное масло, такое как гидрогенизированное касторовое масло (например, Cutina® или Lubriwax® 101), минеральное масло, натрийлаурилсульфат, оксид магния, коллоидный диоксид кремния, кремнийорганическая жидкость, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, тальк, полоксамер или смесь любых из указанных выше веществ. Предпочтительно замасливатель представляет собой стеарат магния, гидрогенизированное касторовое масло или минеральное масло. Менее предпочтительными в качестве замасливателя являются коллоидный диоксид кремния и полиэтиленгликоль.
Композиция предпочтительно содержит от 0,01 до 5 мас.% замасливателя, более предпочтительно от 1 до 3, например примерно 2 мас.% в пересчете на массу всей композиции.
Композиция может содержать один или несколько других эксципиентов, таких как носители, связующие вещества или разбавители. В частности, композиция может содержать микрокристаллическую целлюлозу (например Avicel®), метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, крахмал (например, кукурузный крахмал) или дикальцийфосфат, предпочтительно в количестве от 0,1 до 90, например от 1 до 30 мас.% в пересчете на массу всей композиции. Если применяют связующее вещество, например микрокристаллическую целлюлозу, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, ее предпочтительно включают в количестве от 1 до 8, например от 3 до 6 мас.% в пересчете на массу всей композиции. Применение связующего вещества повышает прочность гранул препарата, что очень важно для тонких гранулятов. Микрокристаллическую целлюлозу и метилцеллюлозу наиболее предпочтительно применяют в том случае, когда требуется высокая твердость таблеток и/или более длительное время дезинтеграции. Гидроксипропилцеллюлозу предпочтительно применяют в том случае, когда требуется более быстрая дезинтеграция. При необходимости можно добавлять также ксилит в качестве дополнительного связующего вещества, например в дополнение к микрокристаллической целлюлозе, например в количестве вплоть до 20 мас.% в пересчете на сахарный спирт, например ксилит.
В одном из вариантов осуществления изобретения композиция дополнительно содержит стабилизатор, предпочтительно глицин-HCl или бикарбонат натрия. Стабилизатор может присутствовать в количестве, например от 0,1 до 30, предпочтительно от 1 до 20 мас.%.
Композиция может находиться в форме порошка, гранулы или пеллетов или в форме стандартной дозы, например в виде таблетки или капсулы. Композиции, предлагаемые в настоящем изобретении, хорошо приспособлены для инкапсуляции в оболочку, предназначенную для орального введения капсулы, прежде всего в твердую желатиновую оболочку.
В альтернативном варианте композиции можно спрессовывать в таблетки. На таблетки необязательно можно наносить покрытие, например из талька или полисахарида (например, целлюлозы), или покрытие из гидроксипропилметилцеллюлозы.
Если фармацевтическая капсула представляет собой стандартную дозу, то удобно, чтобы каждая стандартная доза содержала от 0,5 до 10 мг агониста рецептора S1P.
Композиции, предлагаемые в изобретении, могут иметь хорошие характеристики стабильности, что продемонстрировано в стандартных опытах по оценке стабильности, например они сохраняют стабильность при хранении в течение периода времени вплоть до одного, двух или трех лет и даже дольше. Характеристики стабильности можно определять, например, путем оценки продуктов разложения с помощью ЖХВР-анализа после хранения в течение конкретных периодов времени при конкретных температурах, например при 20, 40 или 60°С.
Фармацевтические композиции, предлагаемые в настоящем изобретении, можно получать стандартными методами, например с использованием общепринятых методов смешения, грануляции, нанесения сахарного покрытия, растворения или лиофилизации. Процедуры, которые можно использовать для этого, являются известными в данной области техники, например они описаны у L.Lachman и др., The Theory and Practice of Industrial Pharmacy, 3-е изд., 1986, H.Sucker и др., Pharmazeutische Technology, изд-во Thieme, 1991, Hagers Handbuch der pharmazeutischen Praxis, 4-е изд., изд-во Springer, 1971 и Remington's Pharmaceutical Sciences, 13-е изд., изд-во Mack Publ. Co., 1970 или в более поздних изданиях.
Одним из объектов настоящего изобретения является способ получения фармацевтической композиции, который заключается в том, что
(а) смешивают агонист рецептора S1P с сахарным спиртом;
(б) размалывают и/или гранулируют смесь, полученную на стадии (а); и
(в) смешивают размолотую и/или гранулированную смесь, полученную на стадии (б), с замасливателем.
С использованием этого способа получают препараты, имеющие высокий уровень содержания и однородности смеси (т.е. практически однородное распределение агониста рецептора S1P в композиции), требуемое время растворения и стабильность.
Перед осуществлением стадии (а) агонист рецептора S1P, т.е. гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола, необязательно можно тонко измельчать и/или предварительно просеивать через сито с размером ячеек от 400 до 500 мкм для удаления комков. Стадию смешения (а) можно осуществлять путем смешения агониста рецептора S1P и сахарного спирта, например маннита, в любом пригодном смесителе или миксере в течение, например, 100-400 оборотов.
Способ можно осуществлять путем сухого смешения компонентов. В этом варианте осуществления изобретения на стадии смешения (б) можно пропускать полученную на стадии (а) смесь через сито, предпочтительно имеющее размер отверстий от 400 до 500 мкм. На стадии (а) способа можно осуществлять стадию смешения всего количества агониста рецептора S1P сначала с небольшим количеством сахарного спирта, составляющего, например, от 5 до 25 мас.% от общей массы сахарного спирта, для приготовления премикса. Затем к премиксу добавляют остальную часть сахарного спирта. Стадия (а) может включать также стадию добавления к смеси раствора связующего вещества, например метилцеллюлозы и/или ксилита, например в виде водного раствора. В альтернативном варианте связующее вещество добавляют к смеси в сухом виде и на стадии грануляции добавляют воду.
Размолотую смесь, полученную на стадии (б), необязательно можно еще раз перемешивать перед смешением с замасливателем. Перед смешением замасливатель, например стеарат магния, предпочтительно просеивают, например, через сито с размером отверстий от 800 до 900 мкм.
В альтернативном варианте применяют метод мокрой грануляции. В этом варианте осуществления изобретения агонист рецептора S1P предпочтительно сначала смешивают в сухом состоянии с требуемым сахарным спиртом, например маннитом, и затем полученную смесь сахарный спирт/агонист рецептора S1P смешивают в сухом состоянии со связующим веществом, таким как гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Затем добавляют воду и смесь гранулируют, например с использованием автоматического гранулятора. Затем гранулят сушат и размалывают.
При необходимости на стадии (в) к смеси, полученной на стадии (б), можно добавлять дополнительное количество связующего вещества.
Способ может включать дополнительную стадию таблетирования или капсулирования смеси, полученной на стадии (в), например, в твердую желатиновую капсулу с использованием автоматического капсулирующего устройства. Капсулы можно окрашивать или маркировать для придания индивидуального внешнего вида и для быстрого распознавания. Применение красителей может служить как для улучшения внешнего вида, так и для идентификации капсул. Красители, пригодные для применения в фармацевтике, как правило включают каротиноиды, оксиды железа и хлорофилл. Предпочтительно капсулы, предлагаемые в изобретении, маркируют с использованием кода.
Фармацевтические композиции, предлагаемые в настоящем изобретении, можно применять либо индивидуально, либо в сочетании с другими действующими веществами для лечения и предупреждения состояний, например описанных в US 5604229, WO 97/24112, WO 01/01978, US 6004565, US 6274629 и JP-14316985, содержание которых включено в настоящее описание в качестве ссылки.
Фармацевтические композиции можно применять прежде всего для
а) лечения и предупреждения отторжения трансплантата органа или ткани, например, для лечения реципиентов трансплантатов сердца, легкого, комбинированных трансплантатов сердце-легкое, печени, почек, поджелудочной железы, кожи или роговицы, и для предупреждения реакции трансплантат против хозяина, которая иногда возникает после трансплантации костного мозга; прежде всего для лечения острого или хронического отторжения алло- и ксенотрансплантата или при трансплантации инсулинпродуцирующих клеток, например островковых клеток поджелудочной железы;
б) лечения и предупреждения аутоиммунного заболевания или воспалительных состояний, например рассеянного склероза, артрита (например, ревматоидного артрита), воспалительного заболевания кишечника, гепатита и т.д.
в) лечения и предупреждения вирусного миокардита и вирусных заболеваний, связанных с вирусным миокардитом, включая гепатит и СПИД.
Следовательно, следующими объектами настоящего изобретения являются следующие
1. Указанная выше композиция, предназначенная для лечения или предупреждения указанного выше заболевания или состояния.
2. Способ лечения индивидуума, нуждающегося в иммуномодуляции, заключающийся в том, что индивидууму вводят эффективное количество указанной выше композиции.
3. Способ лечения или предупреждения указанного выше заболевания или состояния, заключающийся в том, что индивидууму вводят указанную выше композицию.
4. Применение указанной выше фармацевтической композиции для приготовления лекарственного средства, предназначенного для предупреждения или лечения указанного выше заболевания или состояния.
Ниже изобретение описано со ссылкой на следующие конкретные варианты осуществления изобретения.
Пример 1
Просеивают через сито тонкоизмельченное соединение А, например гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720) и 116,7 г просеянного соединения смешивают с 9683,3 г маннита (Parteck M200, фирма Е.Merck). Затем смесь размалывают в устройстве типа Frewitt MGI (фирма Key International Inc. USA) с использованием сита с номером 30 меш. Стеарат магния просеивают через сито с номером 20 меш. и 200 г просеянного соединения смешивают со смесью FTY720/маннит, получая композицию продукта.
Затем композицию продукта спрессовывают с помощью таблеточного пресса с использованием пуансона размером 7 мм с получением таблеток массой по 120 мг, каждая из которых содержит:
| Соединение А, например FTY720* | 1,4 мг |
| Маннит M200 | 116,2 мг |
| Стеарат магния | 2,4 мг |
| Всего | 120 мг |
| * 1 мг соединения А в свободной форме эквивалентен 1,12 мг FTY720 | |
Пример 2
В следующем примере повторяют процесс, описанный в примере 1, за исключением того, что вместо стеарата магния используют Cutina® (гидрогенизированное касторовое масло).
Пример 3
Соединение А, например FTY720, и маннит (Parteck M200, фирма Е. Merck) каждое по отдельности просеивают через сито с номером 18 меш. 1,9 г просеянного FTY720 смешивают с 40 г просеянного маннита в смесителе при 32 об/мин в течение 120 оборотов. Затем смесь PTY720/маннит просеивают через сито с номером 35 меш.
Просеянную смесь FTY720/маннит вносят в гранулятор вместе с еще 340,1 г маннита и 12 г гидроксипропилцеллюлозы. Смесь перемешивают в течение 3 мин. Затем добавляют воду со скоростью 100 мл/мин и смесь гранулируют в течение 2 мин. Гранулят переносят в лотковую сушилку и сушат при 50°С в течение 150 мин.
Затем смесь размалывают в устройстве типа Frewitt MGI с использованием сита с размером 35 меш. Просеивают стеарат магния и 6 г просеянного соединения смешивают в течение 90 оборотов при 32 об/мин со смесью FTY720/маннит с получением композиции продукта, имеющей практически однородное распределение агониста рецептора S1P в манните в смеси.
Затем композицией продукта заполняют с помощью капсулирующего устройства типа Hoflinger & Karg 400 твердые желатиновые оболочки размера 3. В каждую капсулу вносят по 120 мг композиции продукта.
Таким образом, каждая капсула содержит:
| FTY720* | 0,56 мг |
| Маннит M200 | 114,04 мг |
| Гидроксипропилцеллюлоза | 3,6 мг |
| Стеарат магния | 1,8 мг |
| Всего | 120 мг |
Пример 4
В следующем примере повторяют процесс, описанный в примере 3, за исключением того, что вместо стеарата магния используют Cutina® (гидрогенизированное касторовое масло).
Пример 5
В следующем примере повторяют процесс, описанный в примере 3, за исключением того, что вместо гидроксипропилцеллюлозы используют гидроксипропилметилцеллюлозу.
Пример 6а
Тонкоизмельченное соединение А, например FTY720, просеивают с использованием сита с размером ячеек 400 мкм (40 меш.). 58,35 г просеянного соединения смешивают с 4841,65 г маннита (Parteck M200, фирма Е.Merck) в бункерном смесителе типа Bohle объемом 25 л в течение 240 оборотов. Затем смесь размалывают в устройстве типа Frewitt MGI с использованием сита с размером отверстий 400 мкм и размолотую смесь перемешивают еще один раз. Просеивают стеарат магния и 100 г просеянного продукта смешивают со смесью PTY720/маннит с получением композиции продукта, имеющей практически однородное распределение агониста рецептора S1P в манните в смеси.
Затем композицией продукта заполняют с помощью капсулирующего устройства типа Hoflinger & Karg 400 твердые желатиновые оболочки размера 3. В каждую капсулу вносят по 120 мг композиции продукта. Таким образом, каждая капсула содержит:
| FTY720* | 1,4 мг |
| Маннит M200 | 116,2 мг |
| Стеарат магния | 2,4 мг |
| Всего | 120 мг |
Пример 6б
В альтернативном варианте осуществления изобретения капсулы изготавливают с использованием компонентов и их количеств, указанных в примере 6а, но сначала FTY720 смешивают с 14 мг маннита (до просеивания). Затем смесь просеивают как описано выше. После этого просеянную смесь смешивают с оставшейся частью маннита и добавляют стеарат магния, после чего осуществляют дополнительное смешение и заполнение капсул.
Примеры 7 и 8
В следующих примерах капсулы получают согласно методу, описанному в примере 6, за исключением того, что каждая капсула содержит следующие количества каждого компонента:
| Пример 7 | Пример 8 | |
| FTY720* | 2,8 мг | 5,6 мг |
| Маннит М200 | 114,8 мг | 112 мг |
| Стеарат магния | 2,4 мг | 2,4 мг |
| Всего | 120 мг | 120 мг |
Примеры 9-11
В следующих примерах капсулы получают согласно методу, описанному в примерах 6-8, за исключением того, что в каждом случае стеарат магния заменяют на Cutina® (гидрогенизированное касторовое масло).
Примеры 12-22
В следующих примерах капсулы или таблетки получают согласно методу, описанному в примерах 1-11, за исключением того, что в каждом случае вместо FTY720 используют гидрохлорид 2-амино-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил} пропан-1,3-диола.
Примеры 23 и 24
Капсулы, содержащие следующие ингредиенты, получают путем взвешивания каждого компонента и смешения в ступке, после чего смесью заполняют капсулы:
| Пример 23 | Пример 24 | |
| FTY720 | 5 мг | 1 мг |
| D-маннит | 83,7 мг | 117 мг |
| Кукурузный крахмал | 24 мг | - |
| Avicel® PPH101 | 12 мг | - |
| Гидроксипропилцеллюлоза | 0,3 мг | 7 мг |
| Тальк | 3 мг | 3 мг |
| Lubri wax® 101 | 2 мг | 2 мг |
| Всего | 130 мг | 130 мг |
Примеры 25-27
Получают фармацевтические композиции, содержащие следующие ингредиенты:
| Пример 25 | Пример 26 | Пример 27 |
| FTY720 | 5 г | 10 г | 100 г |
| D-маннит | 991 г | 986 г | 897 г |
| Метилцеллюлоза SM-25 | 4 г | 4 г | 3 г |
| Всего | 1000 г | 1000 г | 1000 г |
FTY720 и часть D-маннита, масса которой равна двум массам FTY720, смешивают в смесителе типа Microspeed Mixer MS-5 (фирма Palmer, США) в течение 2 мин при 1200 об/мин. К смеси добавляют оставшуюся часть D-маннита и смешивают в течение еще 2 мин. Из бункера добавляют 80 или 60 мл 5%-ного раствора метилцеллюлозы SM-25 и гранулируют в тех же самых условиях. Смесь экструдируют через сито с размером отверстий 0,4 мм с использованием экструдера типа RG-5. Экструдированный продукт сушат при 65°С в грануляторе с псевдоожиженным слоем типа STREA I (фирма Patheon, Канада) и затем просеивают через сито с номером 24 меш. Удаляют мелкие частицы, прошедшие через сито с номером 60 меш. Полученными мелкими гранулами заполняют капсулы с помощью машины для заполнения капсул типа Zuma (100 мг на капсулу).
Примеры 28-31
Получают таблетки, содержащие следующие ингредиенты (в мг):
| Пример 28 | Пример 29 | Пример 30 | Пример 31 | |
| FTY720 | 1 | 1 | 1 | 1 |
| D-маннит | 62,3 | 62,3 | 62,0 | 62,0 |
| Ксилит* | 26,7 (5,4) | 26,7 (5,4) | 26,6 | 26,6 |
| Метилцеллюлоза | - | - | 0,4 | 0,4 |
| Микрокристаллическая целлюлоза | 24,0 | - | 24,0 | - |
| Низкозамещенная гидроксипропилцеллюлоза | - | 24,0 | - | 24,0 |
| Гидрогенизированное мас ло | 6,0 | 6,0 | 6,0 | 6,0 |
| Всего | 120,0 | 120,0 | 120,0 | 120,0 |
| * указанное в скобках количество ксилита используют в качестве связующего вещества | ||||
FTY720, D-маннит и ксилит вносят в гранулятор с псевдоожиженным слоем (модель МР-01, фирма Powrex), смешивают в течение 5 мин и гранулируют в распыляемом растворе связующего вещества, после чего сушат до тех пор, пока температура на выходе не достигнет 40°С. Условия грануляции приведены ниже. Высушенный порошок пропускают через сито 24 меш., добавляют к определенному количеству наполнителя и замасливателя и смешивают в смесителе (Tubular Mixer, фирма WAB) в течение трех минут с получением порошка, предназначенного для прессования.
Полученный порошок спрессовывают с помощью таблетировочной машины (типа Cleanpress correct 12 HUK, фирма Kikushui Seasakusho) с использованием пуансона размером 7 мм (внутренний диаметр) ×7,5 мм R при силе сжатия 9800 Н.
Условия грануляции:
| Параметр | регулировочный параметр |
| Загружаемое количество | 1170 г |
| Объем всасываемого воздуха | 50 м3/мин |
| Температура всасываемого воздуха | 75°С |
| Скорость потока распыляемого раствора | 15 мл/мин |
| Давление распыляемого воздуха | 15 Н/см2 |
| Объем распыляемого воздуха | 30 л/мин |
| Объем раствора связывающего вещества | 351 мл |
Примеры 32-39
Получают таблетки, содержащие следующие ингредиенты (в мг):
Claims (18)
1. Твердая фармацевтическая композиция, пригодная для орального введения, которая содержит
(а) агонист рецептора S1P; и
(б) сахарный спирт,
в которой агонист рецептора S1P выбран из
соединения формулы I
в которой R1 обозначает прямую или разветвленную (С12-С22)-углеродную цепь,
причем указанная цепь может нести связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, NR6, где R6 обозначает Н, алкил, аралкил, ацил или алкоксикарбонил, и карбонила, и/или
может иметь в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксииминогруппу, гидроксигруппу или карбоксигруппу; или R1 обозначает
фенилалкил, в котором алкил обозначает прямую или разветвленную (С6-С20)-углеродную цепь; или
фенилалкил, в котором алкил обозначает прямую или разветвленную (C1-С30)-углеродную цепь, где фенилалкил замещен
прямой или разветвленной (С6-С20)-углеродной цепью, необязательно замещенной галогеном,
С6-С20алкоксигруппой с прямой или разветвленной цепью, необязательно замещенной галогеном,
С6-С20алкенилоксигруппой с прямой или разветвленной цепью,
фенилалкоксигруппой, галофенилалкоксигруппой, фенилалкоксиалкилом, феноксиалкоксигруппой или феноксиалкилом, циклоалкилом, замещенным С6-С20алкилом,
гетероарилалкилом, замещенным С6-С20алкилом,
гетероциклическим С6-С20алкилом, или
гетероциклическим алкилом, замещенным С6-С20алкилом, и где алкильная группа может нести
в углеродной цепи связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, сульфинила, сульфонила или NR6, где R6 имеет указанные выше значения, и
в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксигруппу или карбоксигруппу; R2, R3, R4 и R5 каждый независимо друг от друга обозначает Н, С1-C4алкил или ацил, или его фармацевтически приемлемой соли.
(а) агонист рецептора S1P; и
(б) сахарный спирт,
в которой агонист рецептора S1P выбран из
соединения формулы I
в которой R1 обозначает прямую или разветвленную (С12-С22)-углеродную цепь,
причем указанная цепь может нести связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, NR6, где R6 обозначает Н, алкил, аралкил, ацил или алкоксикарбонил, и карбонила, и/или
может иметь в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксииминогруппу, гидроксигруппу или карбоксигруппу; или R1 обозначает
фенилалкил, в котором алкил обозначает прямую или разветвленную (С6-С20)-углеродную цепь; или
фенилалкил, в котором алкил обозначает прямую или разветвленную (C1-С30)-углеродную цепь, где фенилалкил замещен
прямой или разветвленной (С6-С20)-углеродной цепью, необязательно замещенной галогеном,
С6-С20алкоксигруппой с прямой или разветвленной цепью, необязательно замещенной галогеном,
С6-С20алкенилоксигруппой с прямой или разветвленной цепью,
фенилалкоксигруппой, галофенилалкоксигруппой, фенилалкоксиалкилом, феноксиалкоксигруппой или феноксиалкилом, циклоалкилом, замещенным С6-С20алкилом,
гетероарилалкилом, замещенным С6-С20алкилом,
гетероциклическим С6-С20алкилом, или
гетероциклическим алкилом, замещенным С6-С20алкилом, и где алкильная группа может нести
в углеродной цепи связь или гетероатом, выбранные из двойной связи, тройной связи, О, S, сульфинила, сульфонила или NR6, где R6 имеет указанные выше значения, и
в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксигруппу или карбоксигруппу; R2, R3, R4 и R5 каждый независимо друг от друга обозначает Н, С1-C4алкил или ацил, или его фармацевтически приемлемой соли.
2. Композиция по п.1, в которой агонист рецептора S1P выбран из 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола или его фармацевтически приемлемой соли.
3. Композиция по п.2, в которой соль представлена гидрохлоридом.
4. Композиция по одному из пп.1-3, в которой сахарный спирт представляет собой негигроскопический сахарный спирт или их смеси.
5. Композиция по п.4, в которой сахарный спирт представляет собой маннит.
6. Композиция по одному из пп.1-5, дополнительно содержащая замасливатель.
7. Композиция по п.6, в которой замасливатель представляет собой стеарат магния.
8. Композиция по одному из пп.1-7, которая содержит от 0,01 до 20 мас.% агониста рецептора S1P.
9. Композиция по одному из пп.1-8, содержащая от 0,5 до 5 мас.% агониста рецептора S1P.
10. Композиция по одному из пп.1-9, которая содержит от 75 до 99,99 мас.% сахарного спирта.
11. Композиция по одному из пп.1-10, содержащая от 90 до 99,5 мас.% сахарного спирта.
12. Композиция по одному из пп.6-11, которая содержит от 0,01 до 5 мас.% замасливателя.
13. Композиция по одному из пп.6-9, содержащая от 1,5 до 2,5 мас.% замасливателя.
14. Композиция по одному из пп.1-13, в которой агонист рецептора S1P является измельченным.
15. Композиция по одному из пп.1-14, в которой агонист рецептора S1P является предварительно просеянным через сито с размерами ячеек от 400 до 500 мкм.
16. Композиция по одному из пп.1-15, находящаяся в форме таблетки или капсулы.
17. Композиция по одному из пп.1-16, предназначенная для использования при изготовлении лекарственного средства для предупреждения или лечения отторжения трансплантата органа или ткани, реакции трансплантат против хозяина, аутоиммунного заболевания, воспалительных состояний, вирусного миокардита и вирусных заболеваний, связанных с вирусным миокардитом.
18. Композиция по одному из пп.1-16, предназначенная для использования при изготовлении лекарственного средства для лечения рассеянного склероза.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US46121503P | 2003-04-08 | 2003-04-08 | |
| US60/461,215 | 2003-04-08 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009105403/15A Division RU2009105403A (ru) | 2003-04-08 | 2009-02-17 | Твердая фармацевтическая композиция для перорального введения (варианты) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2005134173A RU2005134173A (ru) | 2006-09-10 |
| RU2358716C2 true RU2358716C2 (ru) | 2009-06-20 |
Family
ID=32326722
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2005134173/15A RU2358716C2 (ru) | 2003-04-08 | 2004-04-06 | Органические соединения |
| RU2009105403/15A RU2009105403A (ru) | 2003-04-08 | 2009-02-17 | Твердая фармацевтическая композиция для перорального введения (варианты) |
| RU2010146697/15A RU2475236C2 (ru) | 2003-04-08 | 2010-11-17 | Способ получения фармацевтической композиции |
| RU2010147000/15A RU2475237C2 (ru) | 2003-04-08 | 2010-11-18 | Предназначенная для перорального применения фармацевтическая композиция |
| RU2012148593/15A RU2012148593A (ru) | 2003-04-08 | 2012-11-15 | Предназначенная для перорального применения фармацевтическая композиция |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009105403/15A RU2009105403A (ru) | 2003-04-08 | 2009-02-17 | Твердая фармацевтическая композиция для перорального введения (варианты) |
| RU2010146697/15A RU2475236C2 (ru) | 2003-04-08 | 2010-11-17 | Способ получения фармацевтической композиции |
| RU2010147000/15A RU2475237C2 (ru) | 2003-04-08 | 2010-11-18 | Предназначенная для перорального применения фармацевтическая композиция |
| RU2012148593/15A RU2012148593A (ru) | 2003-04-08 | 2012-11-15 | Предназначенная для перорального применения фармацевтическая композиция |
Country Status (42)
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013187795A1 (ru) * | 2012-06-13 | 2013-12-19 | Открытое акционерное общество "Новосибхимфарм" | Фармацевтическая композиция агониста рецептора s1p для лечения демиелинизационных заболеваний |
| WO2014011083A2 (ru) | 2012-07-11 | 2014-01-16 | Алла Хем, Ллс | Фармацевтическая композиция с улучшенной сыпучестью, лекарственное средство, способ получения и применение |
Families Citing this family (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT1773307E (pt) * | 2004-07-30 | 2015-01-14 | Novartis Ag | Formulações de compostos à base de 2-amino-1,3- propanodiol |
| CN1891212B (zh) * | 2005-07-07 | 2010-10-13 | 马启明 | 一种口服制剂及其制备方法 |
| BRPI0615906A2 (pt) * | 2005-09-09 | 2011-05-31 | Novartis Ag | tratamento de doenças autoimunes |
| AU2006311584B2 (en) | 2005-11-09 | 2012-03-08 | Onyx Therapeutics, Inc. | Compounds for enzyme inhibition |
| TWI389683B (zh) * | 2006-02-06 | 2013-03-21 | Kyorin Seiyaku Kk | A therapeutic agent for an inflammatory bowel disease or an inflammatory bowel disease treatment using a 2-amino-1,3-propanediol derivative as an active ingredient |
| AU2007261345B2 (en) | 2006-06-19 | 2012-02-23 | Onyx Therapeutics, Inc. | Peptide epoxyketones for proteasome inhibition |
| GB0612721D0 (en) | 2006-06-27 | 2006-08-09 | Novartis Ag | Organic compounds |
| EP1923055A1 (en) * | 2006-09-26 | 2008-05-21 | Novartis AG | Freeze-dried pharmaceutical composition comprising an S1P agonist or modulator |
| MX2009002993A (es) * | 2006-09-26 | 2009-04-01 | Novartis Ag | Composiciones farmaceuticas que comprenden un modulador de s1p. |
| EP1923058A1 (en) * | 2006-09-26 | 2008-05-21 | Novartis AG | Coated pharmaceutical composition comprising an S1P agonist or modulator |
| AU2011235934A1 (en) * | 2006-09-26 | 2011-11-03 | Novartis Ag | Pharmaceutical compositions comprising an S1P modulator |
| EP1905434A1 (en) * | 2006-09-26 | 2008-04-02 | Novartis AG | Organic compounds comprising an S1P receptor agonist and their therapeutic use |
| EP1923054A1 (en) * | 2006-09-26 | 2008-05-21 | Novartis AG | Fast disintegrating pharmaceutical composition comprising an S1P agonist or modulator |
| WO2008124210A1 (en) * | 2007-02-14 | 2008-10-16 | Emory University | Methods and compositions for treating or preventing infection using leukocyte sequestration agents |
| BRPI0809205B8 (pt) | 2007-03-29 | 2021-05-25 | Daiichi Sankyo Co Ltd | composição farmacêutica |
| KR20170125413A (ko) | 2007-10-04 | 2017-11-14 | 오닉스 세라퓨틱스, 인크. | 결정형 펩티드 에폭시 케톤 프로테아제 저해제 및 아미노산 케토-에폭시드의 합성 |
| SG187458A1 (en) * | 2007-10-12 | 2013-02-28 | Novartis Ag | Compositions comprising sphingosine 1 phosphate (s1p) receptor modulators |
| AU2012216630B2 (en) * | 2007-10-12 | 2015-01-22 | Novartis Ag | Compositions comprising sphingosine 1 phosphate (S1P) receptor modulators |
| JP5534645B2 (ja) * | 2008-01-11 | 2014-07-02 | 日医工株式会社 | 無包装状態において安定性に優れた塩酸サルポグレラート含有経口投与製剤 |
| US8476305B2 (en) | 2008-02-07 | 2013-07-02 | Kyorin Pharmaceutical Co., Ltd. | Therapeutic agent or prophylactic agent for inflammatory bowel disease comprising amino alcohol derivative as active ingredient |
| ES2617628T5 (es) | 2008-03-17 | 2020-06-01 | Actelion Pharmaceuticals Ltd | Régimen de dosificación para un agonista selectivo del receptor de S1P1 |
| CA2728436C (en) * | 2008-06-20 | 2016-07-26 | Merck Patent Gmbh | Directly compressible and rapidly disintegrating tablet matrix |
| EP3545953A1 (en) | 2008-06-20 | 2019-10-02 | Novartis AG | Paediatric compositions for treating1 multiple sclerosis |
| PL2334202T3 (pl) * | 2008-09-04 | 2012-04-30 | Cargill Inc | Tabletkowanie erytrytolu |
| CA2741312C (en) | 2008-10-21 | 2020-10-27 | Onyx Therapeutics, Inc. | Combination therapy with peptide epoxyketones |
| CN107233336A (zh) * | 2008-11-11 | 2017-10-10 | 诺华股份有限公司 | 芬戈莫德的结晶形式 |
| AU2013100532B4 (en) * | 2008-11-11 | 2013-11-28 | Novartis Ag | Crystalline forms of fingolimod HCL |
| AU2009315735B2 (en) | 2008-11-11 | 2013-01-10 | Novartis Ag | Salts of fingolimod |
| CA2747427C (en) | 2008-12-17 | 2015-10-13 | Daiichi Sankyo Company, Limited | Method for producing diamine derivative |
| EP2383272A4 (en) | 2009-01-13 | 2012-07-25 | Daiichi Sankyo Co Ltd | INHIBITOR OF AN ACTIVE FACTOR OF BLOOD COAGULATION |
| EP2407457B1 (en) | 2009-03-10 | 2015-04-22 | Daiichi Sankyo Company, Limited | Process for producing diamine derivative |
| ES2542237T3 (es) | 2009-03-13 | 2015-08-03 | Daiichi Sankyo Company, Limited | Procedimiento de producción de un derivado de diamina ópticamente activo |
| TWI504598B (zh) | 2009-03-20 | 2015-10-21 | Onyx Therapeutics Inc | 結晶性三肽環氧酮蛋白酶抑制劑 |
| KR20120037396A (ko) * | 2009-06-18 | 2012-04-19 | 다이이찌 산쿄 가부시키가이샤 | 용출성이 개선된 의약 조성물 |
| US9675566B2 (en) | 2009-07-16 | 2017-06-13 | Pathologica Llc | Method of treatment with anti-inflammatory and analgesic compounds which are GI-, renal-, and platelet-sparing |
| JP5919196B2 (ja) | 2009-11-13 | 2016-05-18 | オニキス セラピューティクス, インク.Onyx Therapeutics, Inc. | 転移抑制のためのペプチドエポキシケトンの使用 |
| SG183843A1 (en) | 2010-03-01 | 2012-10-30 | Onyx Therapeutics Inc | Compounds for immunoproteasome inhibition |
| WO2011115066A1 (ja) | 2010-03-19 | 2011-09-22 | 第一三共株式会社 | ジアミン誘導体の結晶およびその製造方法 |
| ES2601884T3 (es) | 2010-03-19 | 2017-02-16 | Daiichi Sankyo Company, Limited | Procedimiento para mejorar la capacidad de disolución de un anticoagulante |
| WO2011131368A2 (en) * | 2010-04-22 | 2011-10-27 | Ratiopharm Gmbh | A method of preparing an oral dosage form comprising fingolimod |
| JP5780657B2 (ja) | 2010-07-02 | 2015-09-16 | 第一三共株式会社 | 光学活性ジアミン誘導体の塩の製造方法 |
| WO2012070059A1 (en) | 2010-11-25 | 2012-05-31 | Shilpa Medicare Limited | Fingolimod polymorphs and their processes |
| MX371290B (es) | 2011-01-07 | 2020-01-24 | Novartis Ag | Formulaciones inmunosupresoras. |
| ES2662373T3 (es) | 2011-01-19 | 2018-04-06 | Pathologica, Llc. | Formas de dosificación farmacéutica oral de liberación controlada que comprenden MGBG |
| JO3177B1 (ar) | 2011-04-01 | 2018-03-08 | Novartis Ag | تركيبات تتالف من 2-أمينو-2- [ 2- ( 4- أكتيل فينيل ) إثيل ] بروبان - 3, 1- ديول |
| US9186333B2 (en) * | 2011-08-01 | 2015-11-17 | Teva Pharmaceutical Industries Ltd. | Process for preparing pharmaceutical compositions of fingolimod |
| CN103732227B (zh) | 2011-08-10 | 2017-04-12 | 第一三共株式会社 | 含有二胺衍生物的药物组合物 |
| WO2013091704A1 (en) | 2011-12-22 | 2013-06-27 | Synthon Bv | Pharmaceutical composition comprising fingolimod |
| RU2482842C1 (ru) * | 2012-04-26 | 2013-05-27 | Открытое акционерное общество "Новосибхимфарм" | Фармацевтическая композиция агониста рецептора s1p для лечения демиелинизационных заболеваний (варианты) и способ ее получения |
| JP2015524394A (ja) | 2012-07-09 | 2015-08-24 | オニキス セラピューティクス, インク.Onyx Therapeutics, Inc. | ペプチドエポキシケトンプロテアーゼ阻害剤のプロドラッグ |
| EP3831372A1 (en) * | 2013-01-08 | 2021-06-09 | Pathologica LLC | Mitoguazone for preventing the relapse or the progression of multiple sclerosis |
| WO2014141298A2 (en) * | 2013-03-11 | 2014-09-18 | Astron Research Limited | Stable pharmaceutical composition of fingolimod |
| ES2733920T3 (es) * | 2013-04-26 | 2019-12-03 | Univ Kyoto | Composición que comprende un agonista del receptor 1 de esfingosina-1-fosfato para inhibir la formación y/o el aumento de tamaño de un aneurisma cerebral o para reducirlo |
| MX370184B (es) * | 2013-05-13 | 2019-12-04 | Synthon Bv | Composición farmacéutica que comprende fingolimod. |
| US20160128951A1 (en) * | 2013-07-29 | 2016-05-12 | Aizant Drug Research Solutions Pvt Ltd | Pharmaceutical compositions of fingolimod |
| RU2530626C1 (ru) * | 2013-10-21 | 2014-10-10 | Ооо "Валента-Интеллект" | Фармацевтическая композиция агониста рецептора s1p для лечения демиелинизационных заболеваний |
| CN106794159A (zh) * | 2014-08-22 | 2017-05-31 | 广东东阳光药业有限公司 | 一种芬戈莫德固体组合物及其制备方法 |
| WO2016042493A1 (en) * | 2014-09-19 | 2016-03-24 | Aizant Drug Research Pvt. Ltd | Pharmaceutical compositions of fingolimod |
| JP2018502168A (ja) * | 2015-01-20 | 2018-01-25 | ハンダ ファーマシューティカルズ エルエルシー | 安定な固体フィンゴリモド剤形 |
| US9925138B2 (en) | 2015-01-20 | 2018-03-27 | Handa Pharmaceuticals, Llc | Stable solid fingolimod dosage forms |
| US20180042895A1 (en) | 2015-02-26 | 2018-02-15 | Novartis Ag | Treatment of autoimmune disease in a patient receiving additionally a beta-blocker |
| RU2577230C1 (ru) * | 2015-04-09 | 2016-03-10 | Общество с ограниченной ответственностью "Лонг Шенг Фарма Рус" | Способ получения капсул финголимода гидрохлорида |
| US9690975B2 (en) * | 2015-05-28 | 2017-06-27 | Axogen Corporation | Quantitative structural assay of a nerve graft |
| US11434200B2 (en) | 2017-03-09 | 2022-09-06 | Novartis Ag | Solid forms comprising an oxime ether compound and a coformer, compositions and methods of use thereof |
| EP3419607B1 (en) | 2017-03-29 | 2019-11-20 | Deva Holding Anonim Sirketi | Stable formulations of fingolimod |
| GR1009654B (el) | 2018-08-31 | 2019-11-18 | Φαρματεν Α.Β.Ε.Ε. | Φαρμακευτικο σκευασμα που περιλαμβανει εναν ανοσοτροποποιητικο παραγοντα και μεθοδος για την παρασκευη αυτου |
| DE102018217334A1 (de) | 2018-10-10 | 2020-04-16 | Harbins Ruhr Bioscience, Inc. | Sphingoid-Base und/oder Wirkstoff zur Verwendung bei der Prophylaxe und/oder Therapie einer viralen Infektion und/oder viralen Infektionskrankheit oder der Desinfektion, Nahrungsmittel/Nahrungsergänzungsmittel, Futtermittel/Futterergänzungsmittel und Pflanzenschutzmittel |
| JP7503420B2 (ja) * | 2020-05-18 | 2024-06-20 | 東和薬品株式会社 | フィンゴリモドを含む医薬組成物とその製造方法及び安定化方法 |
| WO2022015348A1 (en) | 2020-07-16 | 2022-01-20 | Harbins Ruhr Bioscience, Inc. | Sphingoid compounds for use in prophylaxis and/or therapy of coronaviridae infection |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL7607683A (nl) * | 1976-07-12 | 1978-01-16 | Akzo Nv | Werkwijze ter bereiding van nieuwe peptiden en peptide-derivaten en de toepassing hiervan. |
| US4110332A (en) * | 1977-05-05 | 1978-08-29 | Chevron Research Company | 1-Triorganostannyl-3-organothio-4-substituted-1,2,4-delta2 -triazolidin-5-ones |
| US4559153A (en) | 1983-10-25 | 1985-12-17 | Phillips Petroleum Company | Metal working lubricant |
| US5112616A (en) | 1988-11-30 | 1992-05-12 | Schering Corporation | Fast dissolving buccal tablet |
| JP2841857B2 (ja) * | 1990-11-29 | 1998-12-24 | 田辺製薬株式会社 | 長期間安定な経口用医薬製剤 |
| DK0627406T3 (da) | 1992-10-21 | 1999-07-12 | Taito Co | 2-Amino-1,3-propandiolforbindelser og immunundertrykkende midler |
| ES2171191T3 (es) | 1994-08-22 | 2002-09-01 | Mitsubishi Pharma Corp | Compuesto de benceno y uso medicinal del mismo. |
| EP0812588B1 (en) | 1995-12-28 | 2004-10-13 | Mitsubishi Pharma Corporation | Pharmaceutical external preparations for topical administration comprising 2-amino-2-(2-(4-octylphenyl)ethyl)propane-1,3-diol for the treatment of diseases induced from immune disorder |
| US6476004B1 (en) | 1996-07-18 | 2002-11-05 | Mitsubishi Pharma Corporation | Pharmaceutical composition |
| JPH11209277A (ja) * | 1998-01-19 | 1999-08-03 | Yoshitomi Pharmaceut Ind Ltd | 医薬組成物 |
| JP2002241272A (ja) | 1996-07-18 | 2002-08-28 | Mitsubishi Pharma Corp | 医薬処方組成物 |
| GB9624038D0 (en) | 1996-11-19 | 1997-01-08 | Sandoz Ltd | Organic compounds |
| DK0990440T3 (da) * | 1997-02-27 | 2009-02-23 | Novartis Ag | Farmaceutisk sammensætning indeholdende 2-amino-2[2-(4-octylphenyl)-ethyl]-propan-1,3-diol, en lecithin og et saccharid |
| PT1002792E (pt) * | 1997-04-04 | 2004-12-31 | Mitsubishi Pharma Corp | Compostos de 2-aminopropano-1,3-diol, sua utilizacao medicinal e intermediariosda sintese dos mesmos |
| JPH1180026A (ja) * | 1997-09-02 | 1999-03-23 | Yoshitomi Pharmaceut Ind Ltd | 新規免疫抑制剤、その使用方法およびその同定方法 |
| JP3545595B2 (ja) | 1998-04-01 | 2004-07-21 | 花王株式会社 | スフィンゴ糖脂質の製造法 |
| JP4627356B2 (ja) | 1999-06-30 | 2011-02-09 | 松森 昭 | ウイルス性心筋炎の予防または治療薬剤 |
| KR20020027463A (ko) * | 1999-07-12 | 2002-04-13 | 우에노 도시오 | 스핀고신-1-인산 수용체 아고니스트 또는스핀고신-1-인산을 유효 성분으로서 함유하는 선유화 억제제 |
| AU6950301A (en) | 2000-07-13 | 2002-01-30 | Sankyo Co | Amino alcohol derivatives |
| CA2421893A1 (en) * | 2000-08-31 | 2002-03-07 | Merck And Co., Inc. | Phosphate derivatives as immunoregulatory agents |
| US6953332B1 (en) | 2000-11-28 | 2005-10-11 | St. Jude Medical, Inc. | Mandrel for use in forming valved prostheses having polymer leaflets by dip coating |
| US7326801B2 (en) | 2001-03-26 | 2008-02-05 | Novartis Ag | 2-amino-propanol derivatives |
| US7521192B2 (en) | 2001-04-18 | 2009-04-21 | Rigel Pharmaceuticals, Inc. | EDG: modulators of lymphocyte activation and migration |
| JP2002316985A (ja) | 2001-04-20 | 2002-10-31 | Sankyo Co Ltd | ベンゾチオフェン誘導体 |
| WO2003020313A1 (fr) | 2001-09-04 | 2003-03-13 | Ono Pharmaceutical Co., Ltd. | Medicaments contre les maladies respiratoires renfermant un agent de regulation du recepteur de la sphingosine-1-phosphate |
| US6963012B2 (en) | 2001-09-27 | 2005-11-08 | Kyorin Pharmaceutical Co., Ltd. | Diaryl ether derivative, addition salt thereof, and immunosuppressant |
| US6960692B2 (en) | 2001-09-27 | 2005-11-01 | Kyorin Pharmaceutical Co., Ltd. | Diaryl sulfide derivative, addition salt thereof, and immunosuppressant |
| EP1470137B1 (en) | 2002-01-18 | 2009-09-02 | Merck & Co., Inc. | Edg receptor agonists |
| US20050070506A1 (en) | 2002-01-18 | 2005-03-31 | Doherty George A. | Selective s1p1/edg1 receptor agonists |
| WO2003062392A2 (en) | 2002-01-18 | 2003-07-31 | Ceretek Llc | Methods of treating conditions associated with an edg receptor |
| US7351725B2 (en) | 2002-01-18 | 2008-04-01 | Merck & Co., Inc. | N-(benzyl)aminoalkylcarboxylates, phosphinates, phosphonates and tetrazoles as Edg receptor agonists |
| SI1772145T1 (sl) * | 2004-07-16 | 2011-06-30 | Kyorin Seiyaku Kk | Postopek za učinkovito uporabo zdravila in postopek za preprečevanje stranskih učinkov |
-
2004
- 2004-04-06 PE PE2013000382A patent/PE20131352A1/es active IP Right Grant
- 2004-04-06 EP EP08161161A patent/EP2008650A3/en not_active Withdrawn
- 2004-04-06 GB GB0407819A patent/GB2400318B/en not_active Expired - Lifetime
- 2004-04-06 DE DE202004021680U patent/DE202004021680U1/de not_active Expired - Lifetime
- 2004-04-06 JP JP2004111761A patent/JP5495467B2/ja not_active Expired - Lifetime
- 2004-04-06 KR KR1020107029859A patent/KR20110005320A/ko not_active Application Discontinuation
- 2004-04-06 BR BRPI0409250A patent/BRPI0409250B8/pt active IP Right Grant
- 2004-04-06 DE DE602004017847T patent/DE602004017847D1/de not_active Expired - Lifetime
- 2004-04-06 IT IT000682A patent/ITMI20040682A1/it unknown
- 2004-04-06 CA CA2707750A patent/CA2707750A1/en not_active Abandoned
- 2004-04-06 RU RU2005134173/15A patent/RU2358716C2/ru not_active IP Right Cessation
- 2004-04-06 DE DE201112100047 patent/DE122011100047I1/de active Pending
- 2004-04-06 DK DK04725895T patent/DK1613288T3/da active
- 2004-04-06 GR GR20040100121A patent/GR1005052B/el unknown
- 2004-04-06 ES ES200400852A patent/ES2228282B1/es not_active Expired - Fee Related
- 2004-04-06 HU HUE10184951A patent/HUE028247T2/en unknown
- 2004-04-06 NZ NZ542622A patent/NZ542622A/xx not_active IP Right Cessation
- 2004-04-06 NZ NZ592339A patent/NZ592339A/xx not_active IP Right Cessation
- 2004-04-06 PT PT04725895T patent/PT1613288E/pt unknown
- 2004-04-06 WO PCT/EP2004/003656 patent/WO2004089341A1/en active Application Filing
- 2004-04-06 PL PL04725895T patent/PL1613288T3/pl unknown
- 2004-04-06 DE DE102004016947A patent/DE102004016947A1/de active Pending
- 2004-04-06 CN CN2010101213007A patent/CN101797241B/zh not_active Expired - Lifetime
- 2004-04-06 SI SI200431037T patent/SI1613288T1/sl unknown
- 2004-04-06 PE PE2015000303A patent/PE20150676A1/es not_active Application Discontinuation
- 2004-04-06 KR KR1020127019448A patent/KR101367574B1/ko active IP Right Grant
- 2004-04-06 PE PE2004000355A patent/PE20050396A1/es not_active Application Discontinuation
- 2004-04-06 PE PE2008001684A patent/PE20090743A1/es not_active Application Discontinuation
- 2004-04-06 AR ARP040101162A patent/AR043987A1/es not_active Application Discontinuation
- 2004-04-06 AT ATA606/2004A patent/AT501681B1/de not_active IP Right Cessation
- 2004-04-06 KR KR1020057019066A patent/KR20050121712A/ko not_active Application Discontinuation
- 2004-04-06 EP EP14163450.1A patent/EP2769713A1/en not_active Withdrawn
- 2004-04-06 US US10/552,005 patent/US20060275357A1/en not_active Abandoned
- 2004-04-06 EP EP10184951.1A patent/EP2316431B1/en not_active Revoked
- 2004-04-06 PL PL10184951.1T patent/PL2316431T3/pl unknown
- 2004-04-06 FR FR0450692A patent/FR2854073B1/fr not_active Expired - Lifetime
- 2004-04-06 EP EP10186307A patent/EP2319502A1/en not_active Withdrawn
- 2004-04-06 EP EP04725895A patent/EP1613288B1/en not_active Expired - Lifetime
- 2004-04-06 CA CA2521325A patent/CA2521325C/en not_active Expired - Lifetime
- 2004-04-06 SG SG2008040545A patent/SG175449A1/en unknown
- 2004-04-06 AU AU2004228929A patent/AU2004228929B2/en active Active
- 2004-04-06 MX MXPA05010860A patent/MXPA05010860A/es active IP Right Grant
- 2004-04-06 AT AT04725895T patent/ATE414508T1/de active
- 2004-04-06 PE PE2012002027A patent/PE20130200A1/es not_active Application Discontinuation
- 2004-04-06 SI SI200432283T patent/SI2316431T1/sl unknown
- 2004-04-06 ES ES04725895T patent/ES2320767T3/es not_active Expired - Lifetime
- 2004-04-06 CN CN2004800092370A patent/CN1767819B/zh not_active Expired - Lifetime
- 2004-04-06 NZ NZ586280A patent/NZ586280A/en not_active IP Right Cessation
- 2004-04-06 ES ES10184951.1T patent/ES2556947T3/es not_active Expired - Lifetime
- 2004-04-06 DK DK10184951.1T patent/DK2316431T3/en active
- 2004-04-07 CL CL200400745A patent/CL2004000745A1/es unknown
- 2004-04-07 MY MYPI20041275A patent/MY141249A/en unknown
- 2004-04-07 TW TW093109631A patent/TWI332847B/zh active
- 2004-04-07 BE BE2004/0180A patent/BE1015972A5/fr not_active IP Right Cessation
-
2005
- 2005-03-31 HK HK05102715A patent/HK1071685A1/xx not_active IP Right Cessation
- 2005-09-14 ZA ZA200507394A patent/ZA200507394B/en unknown
- 2005-09-15 IL IL170888A patent/IL170888A/en active IP Right Grant
- 2005-10-06 HR HR20050886A patent/HRP20050886B1/xx not_active IP Right Cessation
- 2005-10-07 EC EC2005006090A patent/ECSP056090A/es unknown
- 2005-10-07 TN TNP2005000256A patent/TNSN05256A1/en unknown
- 2005-10-19 MA MA28560A patent/MA27729A1/fr unknown
- 2005-11-01 IS IS8114A patent/IS2682B/is unknown
- 2005-11-07 NO NO20055231A patent/NO329332B1/no active Protection Beyond IP Right Term
-
2006
- 2006-07-06 HK HK06107621.6A patent/HK1091114A1/xx not_active IP Right Cessation
-
2008
- 2008-05-08 AT AT0074408A patent/AT504853A2/de not_active Application Discontinuation
- 2008-08-11 US US12/189,323 patent/US8324283B2/en not_active Expired - Fee Related
- 2008-08-13 US US12/191,098 patent/US20090203798A1/en not_active Abandoned
-
2009
- 2009-02-17 RU RU2009105403/15A patent/RU2009105403A/ru not_active Application Discontinuation
- 2009-02-19 CY CY20091100192T patent/CY1110260T1/el unknown
- 2009-03-12 IL IL197578A patent/IL197578A/en active IP Right Grant
-
2010
- 2010-02-18 NO NO20100250A patent/NO334116B1/no unknown
- 2010-02-25 IS IS8885A patent/IS8885A/is unknown
- 2010-08-25 JP JP2010188835A patent/JP5543298B2/ja not_active Expired - Lifetime
- 2010-10-26 AR ARP100103930A patent/AR078781A2/es not_active Application Discontinuation
- 2010-10-26 AR ARP100103931A patent/AR078782A2/es not_active Application Discontinuation
- 2010-11-08 HR HRP20100601AA patent/HRP20100601B1/hr not_active IP Right Cessation
- 2010-11-08 HR HR20100600A patent/HRP20100600A2/hr not_active Application Discontinuation
- 2010-11-17 RU RU2010146697/15A patent/RU2475236C2/ru active
- 2010-11-18 RU RU2010147000/15A patent/RU2475237C2/ru active
-
2011
- 2011-01-10 US US12/987,726 patent/US20110105620A1/en not_active Abandoned
- 2011-03-01 CL CL2011000450A patent/CL2011000450A1/es unknown
- 2011-09-06 HU HUS1100016C patent/HUS1100016I1/hu unknown
- 2011-09-08 NO NO2011016C patent/NO2011016I2/no unknown
- 2011-09-08 CY CY2011013C patent/CY2011013I2/el unknown
- 2011-09-08 BE BE2011C030C patent/BE2011C030I2/fr unknown
- 2011-09-08 FR FR11C0036C patent/FR11C0036I2/fr active Active
- 2011-09-08 LU LU91867C patent/LU91867I2/fr unknown
- 2011-09-21 HK HK11109933.8A patent/HK1155647A1/xx not_active IP Right Cessation
-
2012
- 2012-11-15 RU RU2012148593/15A patent/RU2012148593A/ru not_active Application Discontinuation
- 2012-12-20 US US13/721,278 patent/US20130108675A1/en not_active Abandoned
-
2013
- 2013-04-23 JP JP2013090602A patent/JP2013177404A/ja active Pending
- 2013-09-16 US US14/027,943 patent/US20140011885A1/en not_active Abandoned
- 2013-09-26 NO NO20131287A patent/NO335120B1/no unknown
-
2014
- 2014-05-23 US US14/285,808 patent/US20140255497A1/en not_active Abandoned
-
2015
- 2015-10-12 IL IL242037A patent/IL242037A0/en unknown
- 2015-12-29 CY CY20151101194T patent/CY1117071T1/el unknown
-
2017
- 2017-06-27 US US15/634,579 patent/US20170290787A1/en not_active Abandoned
-
2019
- 2019-02-13 US US16/274,357 patent/US20190175527A1/en not_active Abandoned
-
2020
- 2020-04-03 US US16/839,703 patent/US20200237690A1/en not_active Abandoned
-
2021
- 2021-10-14 US US17/501,173 patent/US20220031609A1/en not_active Abandoned
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2013187795A1 (ru) * | 2012-06-13 | 2013-12-19 | Открытое акционерное общество "Новосибхимфарм" | Фармацевтическая композиция агониста рецептора s1p для лечения демиелинизационных заболеваний |
| RU2506949C1 (ru) * | 2012-06-13 | 2014-02-20 | Открытое акционерное общество "Новосибхимфарм" | Фармацевтическая композиция агониста рецептора s1p для лечения демиелинизационных заболеваний |
| WO2014011083A2 (ru) | 2012-07-11 | 2014-01-16 | Алла Хем, Ллс | Фармацевтическая композиция с улучшенной сыпучестью, лекарственное средство, способ получения и применение |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2358716C2 (ru) | Органические соединения | |
| IE85095B1 (en) | Pharmaceutical composition comprising a sphingosine-1 phosphate receptor agonist | |
| AU2008200368A1 (en) | Solid pharmaceutical compositions comprising a S1P receptor agonist and a sugar alcohol |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ND4A | Extension of patent duration |
Free format text: CLAIMS: 1-13, 16 Extension date: 20250818 |
|
| PC43 | Official registration of the transfer of the exclusive right without contract for inventions |
Effective date: 20110602 |
|
| MF41 | Cancelling an invention patent (total invalidation of the patent) |
Effective date: 20201210 |