JP3545595B2 - スフィンゴ糖脂質の製造法 - Google Patents
スフィンゴ糖脂質の製造法 Download PDFInfo
- Publication number
- JP3545595B2 JP3545595B2 JP08839398A JP8839398A JP3545595B2 JP 3545595 B2 JP3545595 B2 JP 3545595B2 JP 08839398 A JP08839398 A JP 08839398A JP 8839398 A JP8839398 A JP 8839398A JP 3545595 B2 JP3545595 B2 JP 3545595B2
- Authority
- JP
- Japan
- Prior art keywords
- sample
- synthase
- glycosphingolipid
- reaction
- sugar
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Landscapes
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
【発明の属する技術分野】
本発明はスフィンゴ糖脂質の製造法に関し、更に詳細には2種以上の糖が結合したスフィンゴ糖脂質の効率的な製造法に関する。
【0002】
【従来の技術】
スフィンゴ糖脂質は、スフィンゴシン等の長鎖塩基と長鎖脂肪酸と糖とが結合した複合脂質の1種であり、下等動物から高等動物まで広く分布しており、動物中では細胞表層に存在し、各種の認識機構に関与するといわれている。
【0003】
かかるスフィンゴ糖脂質は、例えばN−アシルスフィンゴシンであるセラミドに種々の糖鎖が順次結合して生合成されることが判明している。そして、当該セラミドに代表される糖受容体と、これに反応する糖供与体とは、これら糖受容体と糖供与体の組み合せに特異的なスフィンゴ糖脂質合成酵素の作用により反応することもまた判明している。このスフィンゴ糖脂質合成酵素としては、ガラクトシルセラミド合成酵素(セラミドとUDP−ガラクトースとからガラクトシルセラミドを合成する酵素)、グルコシルセラミド合成酵素(セラミドとUDP−グルコースとからグルコシルセラミドを合成する酵素)、ラクトシルセラミド合成酵素(グルコシルセラミドとUDP−ガラクトースとからラクトシルセラミドを合成する酵素)、等の外、GD3合成酵素、GM2/GD2合成酵素、GD1b/GM1/GA1合成酵素等が知られている。
【0004】
【発明が解決しようとする課題】
このようにスフィンゴ糖脂質は、糖受容体及び糖供与体を原料とし、これらの原料に特異的なスフィンゴ糖脂質合成酵素の作用により、順次糖が結合していくのであるから、2以上の糖が結合したスフィンゴ糖脂質を得るためには、糖受容体と、2以上の糖供与体と、2種以上の対応するスフィンゴ糖脂質合成酵素とを作用させればいいはずである。ところが、このような2段階以上の酵素反応は1ポットでは生起せず、2以上の糖が結合したスフィンゴ糖脂質を製造するためには、1段階目の反応を行い、当該1段階目の反応物を単離した後に2段階目の反応を行わなければならなかった。
【0005】
従って、本発明の目的は、糖受容体に2以上の糖が結合したスフィンゴ糖脂質を、容易な操作で製造するための方法を提供することにある。
【0006】
【課題を解決するための手段】
そこで本発明者は、2段階以上の酵素反応を途中の単離操作なしに進行させ、糖受容体に2以上の糖が結合したスフィンゴ糖脂質を効率良く得るべく種々検討した結果、2種以上のスフィンゴ糖脂質合成酵素を一の脂質ベシクル中に含有させ、当該脂質ベシクルの存在下に糖受容体と2以上の糖供与体とを反応させれば、所望の2以上の糖が結合したスフィンゴ糖脂質が得られることを見出し、本発明を完成するに至った。
【0007】
すなわち、本発明は、糖受容体となるスフィンゴ脂質又はスフィンゴ糖脂質と2以上の糖供与体とを、2種以上のスフィンゴ糖脂質合成酵素を含有する脂質ベシクルの存在下に反応させることを特徴とする糖受容体に2以上の糖が結合したスフィンゴ糖脂質の製造法を提供するものである。
【0008】
【発明の実施の形態】
本発明方法は、糖受容体に2以上の糖が結合する2段階以上の酵素反応を連続して行わせようとするものであり、当該反応を触媒する2種以上のスフィンゴ糖脂質合成酵素を一の脂質ベシクル中に含有させて用いることを特徴とする。糖受容体は、スフィンゴ脂質又はスフィンゴ糖脂質であり、スフィンゴ脂質としては、セラミド(N−アシルスフィンゴシン)、フィトスフィンゴシン等が挙げられる。スフィンゴ糖脂質としては、当該スフィンゴ脂質に糖が結合したものであり、ガラクトシルセラミド(Gal−Cer)、GM4(Sia−Gal−Cer)、SM4(HSO3−Gal−Cer)、グルコシルセラミド(Glc−Cer)、ラクトシルセラミド(Gal−Glc−Cer)、Gb3Cer(Gal−Gal−Glc−Cer)、GM3(Sia−Gal−Glc−Cer)、GD3(Sia−Sia−Gal−Glc−Cer)、Lc3Cer(GlcNAc−Gal−Glc−Cer)等が挙げられる。
【0009】
また、糖供与体としては、糖ヌクレオチドであれば特に制限されないが、ガラクトシルヌクレオチド、グルコシルヌクレオチド、シアリルヌクレオチド、GlcNAcヌクレオチド、GalNAcヌクレオチド等が挙げられる。ここで、ヌクレオチド部としては、UDP、CMP、GDP等が挙げられる。本発明においては、これらの糖供与体の2以上が組み合せて用いられる。例えばグルコースとガラクトースを結合させようとする場合、UDP−Glc及びUDP−Galが用いられる。
【0010】
また、目的物である原料糖受容体に2以上の糖が結合したスフィンゴ糖脂質としては、少なくとも2個以上の糖が結合したスフィンゴ糖脂質、例えばGM4、SM4、Lac−Cer、Gb3Cer、Gb4Cer、GM3、GD3、GM2、GD2、GM1、GD1、GD1a、GT1a、GD1b、GT1b、GQ1b、GT1c、GQ1c、GA2、GA1、Lc3Cer、Lc4Cer、nLc4Cer、nLc6Cer等が挙げられる。
【0011】
本発明に用いられる2種以上のスフィンゴ糖脂質合成酵素は、2段階以上の連続して生起し得る糖結合反応を触媒する2種以上の酵素であり、前記糖受容体と2以上の糖供与体との組み合せにより適宜選択して用いればよい。具体的には、ガラクトシルセラミド合成酵素、グルコシルセラミド合成酵素、ラクトシルセラミド合成酵素、GD3合成酵素、GM2/GD2合成酵素、GD1b/GM1/GA1合成酵素等の他、種々のフコシルトランスフェラーゼ等から2種以上を選択して用いる。
【0012】
本発明に用いられる脂質ベシクルは、一の脂質ベシクル中に前記2種以上のスフィンゴ糖脂質合成酵素を含有しているものであれば特に制限されず、前記2種以上のスフィンゴ糖脂質合成酵素を添加する以外は通常のリポソーム等の脂質ベシクル調製法に従って調製すればよいが、前記2種以上のスフィンゴ糖脂質合成酵素は、脂質ベシクル中の膜の構成成分として含有せしめるのが望ましい。このような脂質ベシクルの調製法としては、リン脂質等のベシクル形成能のある脂質、界面活性剤及び酵素の混合ミセルから界面活性剤を除く方法が一般的である。界面活性剤を除く方法としては透析、ゲル濾過、希釈法等が挙げられる。
【0013】
ここで用いられる脂質としてはレシチン類、ホスファチジン酸、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルグリセロール、ホスファチジルイノシトール、プラズマローゲン、カルジオリピン、コレステロール等が挙げられる。また、界面活性剤としては、CHAPS、BIGCHAP、コール酸ナトリウム、オクチルグルコシド等が用いられる。
【0014】
また、本発明で用いる脂質ベシクルは、通常のリポソームの形態でもよいが、粒子の表面を脂質でコートした形態、磁性化無機コロイド表面を脂質膜でコートした形態、ゲルマトリックスにリポソームが不動化された形態、あるいはシリカゲルビーズ上に脂質膜が形成された形態であってもよい。
【0015】
反応は、糖受容体と、2以上の糖供与体と、2種以上のスフィンゴ糖脂質合成酵素を含有する脂質ベシクルとを混合し、通常の酵素反応の条件(例えば、20〜50℃)に従って行えばよい。
【0016】
反応終了後の目的物の単離は、目的スフィンゴ糖脂質の性質に応じた手段で行えばよい。
【0017】
以上の方法はスフィンゴ糖脂質の一種であるスルファチドの合成にも、供与体としてホスホアデノシンホスホ硫酸を、酵素の一つとして糖脂質スルホトランスフェラーゼを用いることにより応用することができる。
【0018】
【実施例】
次に実施例を挙げて、本発明を更に詳細に説明するが、本発明は何らこれに限定されるものではない。
【0019】
実施例1
(1)グルコシルセラミド合成酵素の調製
ラット脳のホモジェネートを800×gにて10分間遠心した上清を10,000×gにて30分間遠心して得られた膜画分を0.25M蔗糖、1mM DTTを含む10mM Tris−HCl緩衝液、pH7.4に懸濁し、界面活性剤CHAPSを加え、最終蛋白質濃度4mg/ml、CHAPS濃度3%(w/v)とし、4℃にて2時間攪拌した。これを100,000×gにて60分間遠心し、上清を可溶化酵素とした。1%CHAPSを含む上記緩衝液(0.25M蔗糖、1mMDTTを含む10mM Tris−HCl緩衝液、pH7.4)で平衡化したDEAE−トヨパールカラムに可溶化酵素溶液を添加、洗浄した後、250mM NaClを含む同緩衝液で蛋白質を溶出した。これをグルコシルセラミド合成酵素とした。
【0020】
(2)ラクトシルセラミド合成酵素の精製
ラット脳のホモジェネートの10,000×g沈殿画分を0.25M蔗糖、1mM DTTを含む50mM Tris−HCl緩衝液pH7.4に懸濁し、界面活性剤Triton X−100を加え、最終蛋白質濃度4mg/ml、TritonX−100濃度1%(w/v)とし、2時間氷中で処理した後、100,000×gにて60分間遠心し、上清を得た。この上清画分を可溶化酵素液として下記精製過程に供した。
上記可溶化酵素液にNaClを加え50mMとし、サンプル液と同じ緩衝液にて平衡化したWGA−アガロースカラムに供与し、同緩衝液にて洗浄した後、GlcNAcを200mM含む同緩衝液で溶出した。この溶出画分にMnCl2を加えて10mMとし、サンプル液と同じ緩衝液にて平衡化したUDP−ヘキサノールアミンアガロースカラムに供与、洗浄後、1mM UDPを含む同緩衝液にて酵素を溶出した。
【0021】
この溶出画分中の緩衝液をゲル濾過により1mM DTT、1%TritonX−100を含む10mMリン酸緩衝液pH6.8に交換した。これを同緩衝液で平衡化したヒドロキシアパタイトカラムに供与し、活性のある非吸着画分を集めた。この活性画分を同緩衝液で平衡化したMiniQカラム(ファルマシア社製)に供与後、界面活性剤としてTriton X−100の代わりに1%CHAPSを加えた同緩衝液で洗浄した後、NaClの直線的濃度勾配により吸着蛋白質の溶出を行い、塩濃度約250mM付近に精製酵素を得た。
【0022】
(3)リン脂質ベシクルへの酵素の再構成
▲1▼再構成の方法
リン脂質、界面活性剤、膜蛋白質の混合ミセルから界面活性剤を除くことによりリン脂質ベシクルへ膜酵素を再構成した。界面活性剤を除く方法としてセファデックスG100によるゲル濾過法を用いた。すなわち、1ml容のセファデックス G−100の小カラムを作製し、150mMのNaCl、1mM DTTを含む10mM Tris−HClバッファーpH7.4で洗浄した。これを1000rpm で5分間遠心した後、150μlのサンプルを添加し再度1500rpm で5分間遠心し、得られた濾液を再構成サンプルとした。全ての操作は氷上、又は5℃で行った。
【0023】
再構成の際、脂質と基質濃度を保つためにサンプル50μlに対して15mg/mlの大豆レシチン、1mg/mlのセラミド(タイプ3)を含むCHAPS溶液50μlを添加した。これに50μlのもう1つの酵素サンプル又は1%CHAPSを含み、脂質や基質を含まないバッファーを添加し再構成に供した。この脂質、基質添加のための溶液(PC/Cer/CHAPS液)は以下のように作製した。1.5mlのクロロホルム:メタノール2:1に溶かした15mgの大豆レシチン(シグマP3644)、1mlのメタノールに溶かした10mgCHAPS、1mlのクロロホルム:メタノール=2:1に溶かした1mgセラミド(シグマC2137、Non−hydroxy Fatty Acid Ceramide)を混合し、窒素ガスで溶媒を蒸発させた後、真空下で1時間以上減圧することによりリピッドフィルムを作製した。これを1mlの水にサスペンド、温浴で超音波処理して得られた均一な液をPC/Cer/CHAPS液とした。
【0024】
▲2▼混合酵素の再構成
前記(1)及び(2)の方法により得られたグルコシルセラミド合成酵素、ラクトシルセラミド合成酵素を混合した後、ゲル濾過で再構成を行った。すなわち、50μlのグルコシルセラミド合成酵素可溶化画分に50μlのラクトシルセラミド合成酵素(いずれもバッファー中の界面活性剤はCHAPS)、50μlの15mg/ml大豆PC、1mg/mlセラミド(タイプ3)を含む1%CHAPS(PC/Cer/CHAPS液)を加えよく混合した後、1ml容のセファデックスG−100のスピンカラムによりCHAPSを除き再構成を行った(サンプルA)。
【0025】
▲3▼ラクトシルセラミド合成酵素の再構成
前記(2)の方法により得られたバッファーの界面活性剤をCHAPSに置換されたラクトシルセラミド合成酵素の50μlに50μlの1%CHAPS、50μlのPC/Cer/CHAPS液を加え混合した後、1ml容のセファデックスG−100のスピンカラムに添加しCHAPSを除き再構成を行った(サンプルB)。
【0026】
▲4▼グルコシルセラミド合成酵素の再構成
前記(1)の方法で得られた50μlのグルコシルセラミド合成酵素可溶化画分に50μlの1%CHAPS、50μlのPC/Cer/CHAPS液を加え混合した後、1ml容のセファデックスG−100のスピンカラムに添加しCHAPSを除き再構成を行った(サンプルC)。
【0027】
(4)酵素反応
それぞれの酵素及び、2段階酵素反応は以下のように別々な反応系で行った。混合ミセル系では界面活性剤を加えて、また、再構成酵素の系では界面活性剤を加えずに反応を行った。
【0028】
▲1▼再構成グルコシルセラミド合成酵素の活性
この反応は界面活性剤非存在下で行った。1アッセイにつき10μlの0.5M MES pH6.4(50mM MnCl2 、25mM MgCl2 、50mM DTTを含む)及び、水50μlを混合した反応液に再構成サンプル(サンプルC)を15μl、〔14C〕UDP−Glu 25μlを添加し37℃、30分反応を行った。
【0029】
▲2▼再構成ラクトシルセラミド合成酵素の活性
この反応は界面活性剤非存在下で行った。1アッセイにつき20μlの1Mカコジル酸バッファー pH7.2、5μlの200mM MgCl2 、更に、15mg/mlのDOPCを10μl、75mM CDPコリンを10μl添加、攪拌し、基質液とした。これにサンプルB15μl、水15μl、〔14C〕UDP−Gal25μlを添加し37℃、30分反応を行った。
【0030】
▲3▼2段階反応
a.サンプルAの反応
2つの酵素を混合した後、リン脂質ベシクルに再構成したサンプルAを用いた2段階反応の測定は以下のように行った。すなわち、1アッセイにつき10μlの0.5M MES pH6.4(50mM MnCl2 、25mM MgCl2 、50mM DTTを含む)及び、5μlの5mM UDP−Gal(非標識)、30μlの水を混合した反応液にサンプルAを25μl、水5μl、〔14C〕UDP−Glc 25μlを添加し37℃、30分、1時間、2時間、4時間反応を行った。
【0031】
b.サンプルBとサンプルCの混合物の反応
コントロール実験として、2つの酵素をそれぞれ別々に再構成したサンプルB及びサンプルCを混合して2段階反応が行われるか否かを検討した。上記a.の測定系ではサンプルAの代わりにサンプルBを、水の代わりにサンプルCを添加し同様に反応を行った。すなわち、1アッセイにつき10μlの0.5M MES pH6.4(50mM MnCl2 、25mM MgCl2 、50mM DTTを含む)及び、5μlの5mM UDP−Gal(非標識)を混合した反応液にサンプルB25μl、サンプルC25μl、水10μl、〔14C〕UDP−Glc 25μlを添加し37℃、30分、1時間、2時間、4時間反応を行った。
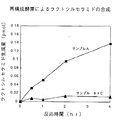
2段階反応では、生成したグルコシルセラミド、ラクトシルセラミドをTLCで分離(クロロホルム:メタノール:水=65:25:4で展開)して各々のバンドを定量した。
【0032】
(5)結果
▲1▼再構成グルコシルセラミド合成酵素の活性
サンプルCをCHAPSを含まない系で活性測定を行った。
グルコシルセラミド合成酵素に大豆レシチンと基質のセラミドを添加して再構成したサンプルCのグルコシルセラミド合成酵素の比活性は10〜20pmol/mg/minであった。1mlの酵素液当りの活性は5〜10pmol/nimであった。
【0033】
▲2▼ラクトシルセラミド合成酵素
ラット脳から精製したラクトシルセラミド合成酵素とグルコシルセラミド合成酵素を混合して再構成したサンプルA、ラクトシルセラミド合成酵素だけを再構成したサンプルB中のラクトシルセラミド合成酵素活性はそれぞれ6.8、6.0pmol/min/mlであった。
【0034】
▲3▼2段階反応
2つの酵素を界面活性剤存在下で混合した後、界面活性剤を除去し、リン脂質ベシクルに再構成したサンプルAはサンプルB、Cの混合サンプルと比べ、同一脂質ベシクルにグルコシルセラミド合成酵素、ラクトシルセラミド合成酵素の2つの酵素が存在する確立が高いと考えられる。このサンプルAには1段階目の基質であるセラミドが含まれているが、これに14CラベルUDP−Glcと2段階目の反応の基質である(非標識)UDP−Galを添加して行った反応では30分、1時間、2時間、4時間と、時間の経過と共にラクトシルセラミドの生成量が増加した(図1サンプルA)。これに対して、2つの酵素をそれぞれ別々に再構成したサンプルB及びサンプルCの混合サンプルで同様に反応を行った場合、全くラクトシルセラミドの生成は認められなかった(図1サンプルB+C)。
以上の結果から、2つ以上の膜酵素による2段階反応は2つ以上の酵素が同一の脂質ベシクル上に存在することが必須であることが判明した。
【0035】
【発明の効果】
本発明によれば2段階以上のスフィンゴ糖脂質合成酵素による反応を、1ポットにより、簡便かつ効率的に行うことができ、種々のスフィンゴ糖脂質を効率よく製造することができる。
【図面の簡単な説明】
【図1】2段階反応による反応量を示す図である。
Claims (1)
- 糖受容体となるスフィンゴ脂質又はスフィンゴ糖脂質と2以上の糖供与体とを、2種以上のスフィンゴ糖脂質合成酵素を含有する脂質ベシクルの存在下に反応させることを特徴とする糖受容体に2以上の糖が結合したスフィンゴ糖脂質の製造法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08839398A JP3545595B2 (ja) | 1998-04-01 | 1998-04-01 | スフィンゴ糖脂質の製造法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP08839398A JP3545595B2 (ja) | 1998-04-01 | 1998-04-01 | スフィンゴ糖脂質の製造法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH11276191A JPH11276191A (ja) | 1999-10-12 |
| JP3545595B2 true JP3545595B2 (ja) | 2004-07-21 |
Family
ID=13941562
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP08839398A Expired - Fee Related JP3545595B2 (ja) | 1998-04-01 | 1998-04-01 | スフィンゴ糖脂質の製造法 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP3545595B2 (ja) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101367574B1 (ko) | 2003-04-08 | 2014-02-25 | 미쓰비시 타나베 파마 코퍼레이션 | S1p 수용체 아고니스트 및 당 알콜을 포함하는 고형 제약 조성물 |
-
1998
- 1998-04-01 JP JP08839398A patent/JP3545595B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH11276191A (ja) | 1999-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Basu et al. | Enzymatic synthesis of a blood group B-related pentaglycosylceramide by an α-galactosyltransferase from rabbit bone marrow | |
| Meier et al. | The human GM2 activator protein. A substrate specific cofactor of beta-hexosaminidase A | |
| Merrill Jr et al. | Sphingolipids: metabolism and cell signalling | |
| AU1800799A (en) | Enzymatic synthesis of gangliosides | |
| CA2260768C (en) | Methods for producing sphingolipids and sphingolipid derivatives | |
| Fauré et al. | Synthesis of a library of xylogluco-oligosaccharides for active-site mapping of xyloglucan endo-transglycosylase | |
| Pacuszka et al. | Enzymatic synthesis of two fucose‐containing glycolipids with fucosyltransferases of human serum | |
| Lucas et al. | Polyisoprenoid glycolipids involved in glycoprotein biosynthesis | |
| JP2001519669A (ja) | 活性化されたグリコシド誘導体を用いてのオリゴ糖類の改良された合成 | |
| Eppler et al. | Ganglioside biosynthesis in rat liver characterization of cytidine-5′-monophospho-n-acetylneuraminic acid: Hematoside (Gm3) sialyltransferase | |
| JP3545595B2 (ja) | スフィンゴ糖脂質の製造法 | |
| Yusuf et al. | Ganglioside biosynthesis in Golgi apparatus: new perspectives on its mechanism | |
| Keenan | Membranes of mammary gland. IX. Concentration of glycosphingolipid galactosyl and sialyltransferases in Golgi apparatus from bovine mammary gland | |
| Crocken et al. | Utilization of l-α-glycerophosphorylcholine by a lecithin-deficient strain of Neurospora crassa | |
| Mårtensson et al. | Galactosyltransferases catalyzing the formation of the galactosyl-galactosyl linkage in glycosphingolipids | |
| Bårström et al. | New derivatives of reducing oligosaccharides and their use in enzymatic reactions: efficient synthesis of sialyl Lewis a and sialyl dimeric Lewis x glycoconjugates | |
| Basu et al. | [31] Properties of animal ceramide glycanases | |
| HU216881B (hu) | Eljárás és berendezés szaharidkészítmények glikozil transzferáz által katalizált előállítása | |
| JP2832746B2 (ja) | スフィンゴ糖脂質の製造方法 | |
| JP3868052B2 (ja) | スフィンゴ脂質セラミドn−デアシラーゼ | |
| Chou et al. | Characterization and Developmental Expression of Lactotriosylceramider: Galactosyltransferase for the Synthesis of Neolactotetraosylceramide in the Nervous System | |
| JPH07107988A (ja) | リゾ糖脂質の製造方法 | |
| JP2754358B2 (ja) | スフィンゴ糖脂質の製造法 | |
| JP2960804B2 (ja) | グルコース転移酵素 | |
| Maccioni et al. | Some properties of uridine‐5′‐diphospho‐N‐acetylgalactosamine: Hematoside N‐acetylgalactosaminyltransferase at early and late stages of embryonic development of chicken retina |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20040406 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20040408 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090416 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20090416 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20100416 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |