KR20170072188A - 미세 유체 눈물 포집 및 관심 대상인 분석물의 측방 유동 분석의 통합을 위한 시스템 및 방법 - Google Patents
미세 유체 눈물 포집 및 관심 대상인 분석물의 측방 유동 분석의 통합을 위한 시스템 및 방법 Download PDFInfo
- Publication number
- KR20170072188A KR20170072188A KR1020177007833A KR20177007833A KR20170072188A KR 20170072188 A KR20170072188 A KR 20170072188A KR 1020177007833 A KR1020177007833 A KR 1020177007833A KR 20177007833 A KR20177007833 A KR 20177007833A KR 20170072188 A KR20170072188 A KR 20170072188A
- Authority
- KR
- South Korea
- Prior art keywords
- sample
- fluid
- volume
- region
- sample region
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/483—Physical analysis of biological material
- G01N33/487—Physical analysis of biological material of liquid biological material
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502738—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by integrated valves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502746—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by the means for controlling flow resistance, e.g. flow controllers, baffles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502761—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip specially adapted for handling suspended solids or molecules independently from the bulk fluid flow, e.g. for trapping or sorting beads, for physically stretching molecules
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B81—MICROSTRUCTURAL TECHNOLOGY
- B81B—MICROSTRUCTURAL DEVICES OR SYSTEMS, e.g. MICROMECHANICAL DEVICES
- B81B1/00—Devices without movable or flexible elements, e.g. microcapillary devices
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N13/00—Investigating surface or boundary effects, e.g. wetting power; Investigating diffusion effects; Analysing materials by determining surface, boundary, or diffusion effects
- G01N13/04—Investigating osmotic effects
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N25/00—Investigating or analyzing materials by the use of thermal means
- G01N25/02—Investigating or analyzing materials by the use of thermal means by investigating changes of state or changes of phase; by investigating sintering
- G01N25/04—Investigating or analyzing materials by the use of thermal means by investigating changes of state or changes of phase; by investigating sintering of melting point; of freezing point; of softening point
- G01N25/06—Analysis by measuring change of freezing point
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/10—Devices for transferring samples or any liquids to, in, or from, the analysis apparatus, e.g. suction devices, injection devices
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0605—Metering of fluids
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0642—Filling fluids into wells by specific techniques
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0647—Handling flowable solids, e.g. microscopic beads, cells, particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0684—Venting, avoiding backpressure, avoid gas bubbles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0672—Integrated piercing tool
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/069—Absorbents; Gels to retain a fluid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0832—Geometry, shape and general structure cylindrical, tube shaped
- B01L2300/0838—Capillaries
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0848—Specific forms of parts of containers
- B01L2300/0858—Side walls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/16—Surface properties and coatings
- B01L2300/161—Control and use of surface tension forces, e.g. hydrophobic, hydrophilic
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/16—Surface properties and coatings
- B01L2300/161—Control and use of surface tension forces, e.g. hydrophobic, hydrophilic
- B01L2300/165—Specific details about hydrophobic, oleophobic surfaces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0688—Valves, specific forms thereof surface tension valves, capillary stop, capillary break
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/08—Regulating or influencing the flow resistance
- B01L2400/084—Passive control of flow resistance
- B01L2400/086—Passive control of flow resistance using baffles or other fixed flow obstructions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B81—MICROSTRUCTURAL TECHNOLOGY
- B81B—MICROSTRUCTURAL DEVICES OR SYSTEMS, e.g. MICROMECHANICAL DEVICES
- B81B2201/00—Specific applications of microelectromechanical systems
- B81B2201/05—Microfluidics
- B81B2201/058—Microfluidics not provided for in B81B2201/051 - B81B2201/054
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B81—MICROSTRUCTURAL TECHNOLOGY
- B81B—MICROSTRUCTURAL DEVICES OR SYSTEMS, e.g. MICROMECHANICAL DEVICES
- B81B2203/00—Basic microelectromechanical structures
- B81B2203/03—Static structures
- B81B2203/0323—Grooves
- B81B2203/0338—Channels
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N2035/00178—Special arrangements of analysers
- G01N2035/00237—Handling microquantities of analyte, e.g. microvalves, capillary networks
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N35/00—Automatic analysis not limited to methods or materials provided for in any single one of groups G01N1/00 - G01N33/00; Handling materials therefor
- G01N35/10—Devices for transferring samples or any liquids to, in, or from, the analysis apparatus, e.g. suction devices, injection devices
- G01N2035/1027—General features of the devices
- G01N2035/1034—Transferring microquantities of liquid
Abstract
비제한적인 예로서 20 마이크로리터 미만인 소량의 유체 샘플을 분석하기 위한 시스템, 방법, 및 장치가 제공된다. 장치는 제1 샘플 판독값이, 예컨대 몰삼투압 농도와 같은 유체 샘플의 에너지 특성을 측정하게 하거나, 제2 샘플 판독값이, 예컨대 유체 샘플 내의 하나 이상의 분석물의 존재 또는 농도를 검출하게 하거나, 또는 제1 샘플 판독값과 제2 샘플 판독값 모두가, 예컨대 유체 샘플의 에너지 특성을 측정하는 것 뿐만 아니라 유체 샘플 내의 하나 이상의 분석물의 존재 또는 농도를 검출하는 것을 행하게 하도록 구성된다.
Description
관련 출원들에 대한 상호 참조
본 출원은 2014년 9월 23일자로 출원되었고 발명의 명칭이 "미세 유체 눈물 포집 및 관심 대상인 분석물의 측방 유동 분석의 통합을 위한 시스템 및 방법"인 미국 가출원 제62/053,923호에 대해 35 U.S.C. 119(e) 하의 이익 및 우선권을 주장하며, 상기 출원의 전체 개시는 본 명세서에 참조로 포함된다.
눈물은 안구 표면의 무결성을 유지하고, 미생물 공격에 대해 보호하며, 시력을 보존하는 데에 필수적인 역할을 수행한다. 이 기능들은 다시, 하부의 뮤신 기부(mucin foundation), 중간의 수성 성분, 및 상부의 지질층을 포함하는 눈물막 구조의 조성 및 안정성에 따라 결정적으로 좌우된다. 눈물막의 파괴, 결핍, 또는 부재는 눈에 심각한 영향을 미칠 수 있다. 인공 눈물 대체품이나 눈물막 보존 치료제로 관리하지 않으면, 각막 상피의 만성적인 건조, 각막의 궤양 및 천공, 감염성 질환의 발병률 증가, 및 궁극적으로 확연한 시각 장애 및 시각 상실을 초래할 수 있다.
건성 각결막염(KCS; Keratoconjunctivitis sicca), 또는 "안구 건조증(dry eye)"은 위에 나열된 눈물막 구조 성분들 중 하나 이상이 불충분한 부피로 존재하거나 이와 달리 다른 성분들과의 균형이 맞지 않는 상태이다. KCS가 있는 환자에서 눈물의 유체 긴장성(Fluid tonicity) 또는 몰삼투압 농도(osmolarity)가 증가된다. KCS는 쇼그렌 증후군(Sjogren's syndrome), 노화, 및 안드로겐 결핍과 같은 신체의 전반적인 건강에 영향을 미치는 조건과 관련이 있다.
눈물막의 몰삼투압 농도는 KCS 및 다른 상태의 진단을 위한 민감하고 구체적인 지표이다. 샘플 유체(비제한적인 예로서, 눈물)의 몰삼투압 농도는, 비제한적인 예로서, "빙점 강하(freezing point depression)"라 불리는 생체 외 기술에 의해 결정되는데, 이 기술에서 용제(비제한적인 예로서, 물) 내의 용질 또는 이온은 이온이 존재하지 않는 상태로부터 유체 응고점을 낮추게 한다. 빙점 강하 분석에서, 이온화된 샘플 유체의 빙점은 샘플의 양(통상적으로, 약 수 밀리리터 정도)이 컨테이너(비제한적인 예로서, 튜브) 내에서 처음으로 결빙되기 시작하는 온도를 검출함으로써 발견된다. 빙점을 측정하기 위하여, 샘플 유체의 부피는 튜브 등의 컨테이너 내에 포집된다. 다음에, 온도 프로브를 샘플 유체에 담그고, 용기를 빙결 욕조 또는 펠티어 냉각 장치와 접촉시킨다. 샘플은 빙점 아래의 과냉각 액체 상태를 달성하도록 연속적으로 교반된다. 기계적 유도 시에, 샘플이 고형화되어 열역학적 융해열로 인해 빙점으로 상승된다. 0℃로부터 샘플 빙점의 편차는 샘플 유체의 용질 레벨에 비례한다. 이 유형의 측정 장치는 때로는 삼투압계(osmometer)로서 지칭된다.
현재, 빙점 강하 측정은 마이크로피펫(micropipette) 또는 모세관(capillary tube)을 사용하여 눈에서 눈물 샘플을 제거하고 몰삼투압 농도의 증가로 생긴 빙점의 강하를 측정함으로써 생체 외에서 이루어진다. 그러나, 이러한 생체 외 측정은 종종 많은 어려움에 시달리고 있다. 예컨대, 눈물 샘플의 빙점 강하 분석을 수행하기 위해서는, 비교적 큰 부피를, 통상적으로 20 마이크로리터(μL) 정도의 눈물막을 포집해야 한다. KCS 환자로부터 한번에 약 10 내지 약 100 나노리터(nL) 이상의 눈물 샘플을 얻지 못하기 때문에, 통상적인 생체 외 기술을 위해 충분한 양의 유체를 포집하는 것은 의사가 환자에게 반사 눈물(reflex tearing)을 유도할 것을 요구한다. 반사 눈물은 큰 먼지가 눈에 박힐 때와 유사하게 안구 표면에 날카롭거나 지속되는 자극에 의해 유발된다. 반사 눈물은 더 묽고, 바꿔 말해서 눈에서 정상적으로 보이는 눈물보다 더 적은 용질 이온을 갖는다. 눈물막이 묽으면 안구 건조증에 대한 몰삼투압 농도 테스트의 진단 능력을 무효화시키므로, 현재 이용 가능한 생체 외 방법을 임상 환경에서 엄두를 못내게 만든다.
유사한 생체 외 기술은 증기압 삼투압법(vapor pressure osmometry)으로, 작은 원형의 여과지를 환자의 눈꺼풀 아래에 충분한 유체가 흡수될 때까지 넣어두는 것이다. 여과지 디스크는 밀봉된 챔버 내에 배치되고, 냉각된 온도 센서가 그 표면의 증기 응축을 측정한다. 결국, 온도 센서는 샘플의 이슬점까지 상승된다. 물에 비례한 이슬점의 감소는 몰삼투압 농도로 변환된다. 기존의 증기압 삼투압계에서 반사 눈물의 유도 및 큰 부피 요건 때문에, 이러한 기술은 현재 안구 건조증의 결정에 비실용적이다.
클리프톤 나노리터 삼투압계(Clifton Nanoliter Osmometer)(미국 뉴욕주 하트 포드 소재의 Clifton Technical Physics사에서 입수 가능)는 KCS 환자의 용질 농도를 정량화하기 위해 실험실 환경에서 광범위하게 사용되어 왔지만, 작동에 상당량의 훈련이 요구된다. 이 장치의 작동에는 일반적으로 허용 가능한 데이터를 생성하기 위해 1 시간의 교정과 숙련된 기술자가 요구된다. 클리프톤 나노리터 삼투압계는 또한 부피가 크고 비교적 고가이다. 이러한 특성은 임상 삼투압계로서 사용하는 것을 심각하게 저해시킨다.
또한, 눈물막의 몰삼투압 농도에서 깜박임간 변화는 안구 건조증의 근본적인 특징이다. 불안정한 눈물막의 증발 및 수분 손실에 의해 유도되는 이러한 깜박임간 변화는 질환의 심각성이 증가함에 따라 진폭이 증가하여 깜박임 사이에 관심 대상인 분석물의 혼란스러운 농도 프로파일을 초래한다. 눈물 몰삼투압 농도와 관심 대상인 분석물의 동시적인 또는 연속적인 측정은, 샘플 삼투압에 대해 정규화함으로써 안구 건조증 질환의 생물학적 변이를 보상할 수 있기 때문에 유용하다.
눈물막 내의 분석물을 측정하는 기존의 기술은, 스펀지로 안구 표면을 반복적으로 두드리거나, 환자의 눈꺼풀 아래에 셔머씨 스트립(Schirmer strip)과 유사한 여과지를 놓거나, 또는 세포의 표면층을 나중에 박리시키기 위해 종이가 가압되는 결막 압흔 세포 검사에 의해, 다량의 눈물막을 포집하는 것을 필요로 한다. 연구 환경에서, 모세관으로의 반복적인 샘플링을 사용하여 마이크로리터의 눈물을 포집하지만, 이 기술은 특별한 훈련을 필요로 하며, 몇몇의 경우에는, 안구 건조증 환자에게 기존의 분석을 수행하는 데에 필요한 양을 얻기 위해 10 분 이상이 소요된다. 이 기술들은 모두 반사 눈물의 위험을 야기하여, 전체 안구 표면 및 눈꺼풀판샘(meibomian gland)으부터의 기여를 보다 잘 반영하는 기초 눈물보다는 눈물 출력쪽으로 편향된 저삼투압성 유체를 생성한다.
관심 대상인 분석물 및 눈물 몰삼투압 농도에 대한 통합된 포집과 측정 기술은 일반적으로 임상 환경에서는 이용할 수 없으며 대부분의 환자에게서 이용할 수 있는 작은 부피로는 달성할 수 없다는 것이 위의 설명으로부터 명백하다. 따라서, 개선되고 임상적으로 실현 가능한 나노리터 규모의 몰삼투압 농도 및 분석물 측정 기술이 요구된다. 본 발명은 작은 부피 분석을 위해 다양한 개선을 갖는 장치로 이러한 요구를 만족시킨다.
본 개시는 눈물 샘플과 같은 유체 샘플을 분석하기 위한 시스템, 방법, 및 장치를 제공한다.
본 명세서에 설명된 방안은 단일의 미세 유체 장치를 사용하여 관심 대상인 유체 샘플의 하나 이상의 특성(비제한적인 예로서, 몰삼투압 농도, 분석물 농도, 또는 양쪽 모두)을 검출함으로써, 몇몇 실시예에서, 정량화되어 다양한 의학적 상태를 진단하는 데에 사용되는 하나 이상의 샘플 판독값을 생성한다. 특정 실시예에서, 본 발명은 단일 샘플 부피에 대해 복수 개의 상이한 분석을 수행함으로써, 진단 테스트의 속도, 융통성, 및 편의성을 증가시킨다. 또한, 본 개시의 시스템, 방법, 및 장치는 제한된 양의 샘플만이 이용 가능한 용례, 비제한적인 예로서, 눈 상태의 분석을 위한 눈물막 샘플에 특히 유리한 작은 샘플 부피(비제한적인 예로서, 마이크로리터 또는 나노리터 부피)와 함께 사용하기에 적합하다.
몇몇 실시예에서, 유체 샘플의 부피를 수용하도록 형성되고 제1 샘플 판독값을 생성하기 위해 부피의 에너지 특성을 검출하도록 구성되는 적어도 하나의 트랜스듀서를 포함하는 제1 샘플 영역; 및 제1 샘플 영역과 유체 연통하고 부피의 적어도 일부를 수용하도록 형성되는 제2 샘플 영역을 포함하고, 제2 샘플 영역은 제2 샘플 판독값을 생성하기 위해 부피의 적어도 일부 내의 하나 이상의 분석물을 검출하도록 구성되는 검출 기재를 포함하는 것인 유체 샘플 분석 장치가 제공된다.
몇몇 실시예에서, 장치는 제1 샘플 영역으로부터 제2 샘플 영역으로의 부피 유동을 제어하는 계량 메카니즘을 더 포함한다. 몇몇 실시예에서, 계량 메카니즘은 수동 밸브 또는 능동 밸브를 포함한다. 비제한적이고 예시적인 수동 밸브는 제2 샘플 영역으로 유체 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함한다. 몇몇 실시예에서, 수동 밸브는 수용 기재의 친수성의 불연속성으로 구성된다. 몇몇 실시예에서, 수동 밸브는 가압 유체 부피에 의해 극복된다. 몇몇 실시예에서, 본 명세서에 개시된 수동 밸브는 적어도 유체의 기계적 에너지에 의해 작동된다. 몇몇 실시예에서, 유체는 하나 이상의 액체, 하나 이상의 기체, 또는 이들의 조합이다. 몇몇 실시예에서, 유체는 샘플 유체, 세정액, 또는 전달 유체이다. 몇몇 실시예에서, 본 명세서에 개시된 수동 밸브는 그 적절한 기능을 위해 본 명세서에 개시된 바와 같이 시스템의 요소 외부에 어떠한 에너지원도 필요로 하지 않는다. 몇몇 실시예에서, 수동 밸브는 유체의 에너지 및/또는 모세관 작용의 에너지, 또는 그로부터 변환된 에너지 이외의 추가 에너지를 필요로 하지 않는다. 대안적으로 또는 조합하여, 계량 메카니즘은 몇몇 실시예에서 능동 밸브를 포함한다. 몇몇 실시예에서, 능동 밸브는 소수성 코팅[비제한적인 예로서, 알칸티올 자체 조립 단층(SAM; self-assembled monolayer)]을 갖는 전극을 포함한다. 몇몇 실시예에서, 전압이 전극에 대해 인가되어 소수성 코팅을 용해시킴으로써, 제2 샘플 영역으로 부피의 유동을 허용한다. 몇몇 실시예에서, 본 명세서에 개시된 능동 밸브는 그 적절한 기능을 위해 본 명세서에 개시된 바와 같이 장치 또는 시스템의 내부 또는 외부 요소로부터의 전기 에너지원을 필요로 한다. 몇몇 실시예에서, 능동 밸브는 유체의 에너지 및/또는 모세관 작용의 에너지, 또는 그로부터 변환된 에너지 외에 추가 에너지를 필요로 한다. 몇몇 실시예에서, 본 명세서에 개시된 밸브는 단방향성이다. 다른 실시예에서, 밸브는 유체 부피가 양방향으로 통과하게 하도록 구성된다. 몇몇 실시예에서, 수동 밸브 또는 능동 밸브는 평형 밸브, 팁 밸브, 및 벤트 밸브로부터 선택된 하나 이상을 포함한다.
몇몇 실시예에서, 제1 샘플 영역은 모세관 채널을 포함한다. 몇몇 실시예에서, 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치된다. 몇몇 실시예에서, 모세관 채널의 적어도 하나의 벽은 감압 접착제층을 포함한다. 몇몇 실시예에서, 감압 접착제층은 부피와 상호 작용하여 모세관 채널을 통한 부피의 유동을 지연시킨다.
몇몇 실시예에서, 유체 샘플은 눈물 유체를 포함한다.
몇몇 실시예에서, 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타낸다. 몇몇 실시예에서, 제2 샘플 판독값은 유체 샘플의 하나 이상의 분석물의 농도를 나타낸다. 몇몇 실시예에서, 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타내고, 제2 샘플 판독값은 유체 샘플의 하나 이상의 분석물의 농도를 나타낸다.
몇몇 실시예에서, 부피는 약 10 nL 내지 약 10 μL의 범위, 예컨대 약 50 nL 내지 약 250 nL의 범위 내에 있다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 중 임의의 2개의 값들 사이의 범위 내에 있다. 몇몇 실시예에서, 부피는 약 20 μL, 약 250 nL, 약 200 nL, 또는 약 50 nL 이하이다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 이하이다.
몇몇 실시예에서, 장치는 제1 샘플 영역과 유체 연통하는 전달 유체의 저장 조를 더 포함한다. 몇몇 실시예에서, 유체 저장조로부터 제1 샘플 영역으로 전달 유체의 도입은 부피의 적어도 일부가 제1 샘플 영역으로부터 제2 샘플 영역으로 변위되게 한다. 몇몇 실시예에서, 제어된 유동은 미세 다공성 기재의 모세관 위킹 속도를 저장조로부터의 유체 펌핑 속도와 일치시키는 데에 사용된다. 다른 실시예에서, 공기 펄스는 제1 샘플 영역 내의 유체를 제2 샘플 영역으로 변위시킨다.
몇몇 실시예에서, 샘플 유체는, 제2 샘플 영역 내의 분석물의 검출을 용이하게 하도록, 제1 샘플 영역 내에서 시약(비제한적인 예로서, 항체 또는 그 항원 결합 단편, 또는 생합성 항체 결합 부위, 예컨대 scFv, 앱타머, 아비바디(avibody), 펩티드, PNA, 기능화된 나노 입자 등)에 의해 배향되게 된다. 몇몇 실시예에서, 시약은 미세 다공성 기재 또는 유리 복합체 패드와 같은 다른 중간층 내에 수용되며, 수동 밸브의 틈은 샘플 유체를 미세 다공성 기재 상의 배양 영역으로 도입한다. 다른 실시예에서, 샘플 유체는 먼저 제1 또는 제2 샘플 영역의 변환 영역을 통해 유동되고, 그 다음에 저장조로부터의 유체를 사용하여 상류 검출 성분의 재수화 및 운반을 행한다.
몇몇 실시예에서, 검출 기재는 미세 다공성 기재를 포함하고 유체 부피는 미세 다공성 기재를 통해 유동한다. 몇몇 실시예에서, 검출 기재는 미세 다공성 기재를 포함하고, 작동 중에, 부피의 적어도 일부는 미세 다공성 기재를 가로지른다. 몇몇 실시예에서, 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는다. 몇몇 실시예에서, 유체 부피는 하나 이상의 액체, 하나 이상의 기체, 또는 이들의 조합을 포함한다. 다른 실시예에서, 유체 부피는 적어도 샘플 유체를 포함한다. 몇몇 실시예에서, 유체 부피는 적어도 하나의 유효 샘플 판독값을 생성하기 위해 최소 부피 이상이다. 몇몇 실시예에서, 유체 부피는 제1 샘플 영역으로부터의 적어도 하나의 유효 샘플 판독값 및 제2 샘플 영역으로부터의 적어도 하나의 유효 샘플 판독값을 생성하기 위해 최소 부피 이상이다. 몇몇 실시예에서, 미세 다공성 기재는 미세 다공성 기재를 통해 유동할 때에 부피의 균질화를 생성 또는 증가시키도록 형성되는 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 더 선형이고 더 짧은 경로 길이의 재수화 채널에 의해 둘러싸이는 중앙의 사형 채널을 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 유동 균질화를 증가시키는 복수 개의 개구를 포함한다. 다른 실시예에서, 미세 다공성 기재는 고저항 영역의 우선적인 재수화를 수행하도록 형성된다. 또 다른 실시예에서, 미세 다공성 기재는 샘플 유체가 보다 높은 저항 또는 보다 높은 경로 길이 영역을 통해 지연되는 동안에 재수화 유동이 낮은 저항 또는 낮은 경로 길이 영역을 통해 이동하게 하도록 형성된다.
몇몇 실시예에서, 본 명세서에는, 유체 샘플의 부피를 제1 샘플 영역 내로 도입하는 단계; 적어도 하나의 트랜스듀서를 이용하여 제1 샘플 영역 내의 부피의 에너지 특성을 검출함으로써, 제1 샘플 판독값을 생성하는 단계; 부피의 적어도 일부가 제2 샘플 영역으로 유동하게 하는 단계; 및 검출 기재를 이용하여 제2 샘플 영역 내의 부피의 적어도 일부 내의 하나 이상의 분석물을 검출함으로써, 제2 샘플 판독값을 생성하는 단계를 포함하는 유체 샘플 분석 방법이 개시된다.
몇몇 실시예에서, 방법은 계량 메카니즘을 이용하여 제1 샘플 영역으로부터 제2 샘플 영역으로의 유체 유동을 제어하는 단계를 더 포함한다. 몇몇 실시예에서, 계량 메카니즘은 수동 밸브를 포함한다. 몇몇 실시예에서, 계량 메카니즘은 제2 샘플 영역으로 유체 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함한다. 다른 실시예에서, 방법은 수용 기재의 친수성의 불연속성을 이용하여 유체 유동을 더 저지한다. 대안적으로 또는 조합하여, 몇몇 실시예에서, 계량 메카니즘은 능동 밸브를 포함한다. 몇몇 실시예에서, 능동 밸브는 소수성 코팅[비제한적인 예로서, 알칸티올 자체 조립 단층(SAM; self-assembled monolayer)]을 갖는 전극을 포함한다. 몇몇 실시예에서, 전압이 전극에 대해 인가되어 소수성 코팅을 용해시킴으로써, 제2 샘플 영역으로 유체의 유동을 허용한다. 몇몇 실시예에서, 가압 세정액이 사용되어 수동 밸브를 극복하고 샘플 유체를 제2 샘플 영역으로 운반한다. 몇몇 실시예에서, 제1 샘플 영역은 모세관 채널을 포함한다. 몇몇 실시예에서, 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치된다. 몇몇 실시예에서, 모세관 채널의 적어도 하나의 벽은 감압 접착제층을 포함한다. 몇몇 실시예에서, 감압 접착제층은 부피와 상호 작용하여 모세관 채널을 통한 부피의 유동을 지연시킨다.
몇몇 실시예에서, 유체 샘플은 눈물 유체를 포함한다.
몇몇 실시예에서, 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타낸다. 몇몇 실시예에서, 제2 샘플 판독값은 유체 샘플의 하나 이상의 분석물의 농도를 나타낸다. 몇몇 실시예에서, 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타내고, 제2 샘플 판독값은 유체 샘플의 하나 이상의 분석물의 농도를 나타낸다.
몇몇 실시예에서, 부피는 약 10 nL 내지 약 10 μL의 범위, 예컨대 약 50 nL 내지 약 250 nL의 범위 내에 있다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 중 임의의 2개의 값들 사이의 범위 내에 있다. 몇몇 실시예에서, 부피는 약 20 μL, 약 250 nL, 약 200 nL, 또는 약 50 nL 이하이다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 이하이다.
몇몇 실시예에서, 방법은 전달 유체를 제1 샘플 영역으로 도입하여 부피의 적어도 일부를 제1 샘플 영역으로부터 제2 샘플 영역으로 변위시키는 단계를 더 포함한다. 몇몇 실시예에서, 전달 유체는 제1 샘플 영역과 유체 연통하도록 유체 저장조로부터 도입된다. 몇몇 실시예에서, 펌핑 메카니즘은 미세 다공성 기재의 모세관 위킹 속도에 실질적으로 일치하는 속도로 저장조로부터 유체를 압박하는 데에 사용된다. 다른 실시예에서, 공기 펄스는 제1 샘플 영역 내의 유체를 제2 샘플 영역으로 변위시킨다.
몇몇 실시예에서, 샘플 유체는, 제1 샘플 영역 내에서 검출 성분 또는 분석 시약(비제한적인 예로서, 항체 또는 그 항원 결합 단편, scFv, 앱타머, 아비바디, 펩티드, PNA, 기능화된 나노 입자 등을 포함하는 생합성 항체 결합 부위)에 의해 배향되게 된다. 다른 실시예에서, 검출 성분은 미세 다공성 기재 또는 유리 복합체 패드와 같은 다른 중간층 내에 수용되며, 수동 밸브의 틈은 샘플 유체를 미세 다공성 기재 상의 배양 영역으로 도입한다. 다른 실시예에서, 샘플 유체는 먼저 제1 또는 제2 샘플 영역의 변환 영역 위에서 유동되고, 그 다음에 저장조로부터의 유체를 사용하여 상류 검출 성분의 재수화 및 운반을 행한다.
몇몇 실시예에서, 검출 기재는 미세 다공성 기재를 포함하고 유체는 미세 다공성 기재를 통해 유동한다. 몇몇 실시예에서, 검출 기재는 미세 다공성 기재를 포함하고, 부피의 적어도 일부는 미세 다공성 기재를 가로지른다. 몇몇 실시예에서, 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 더 선형이고 더 짧은 경로 길이의 수화 채널에 의해 둘러싸이는 중앙의 사형 채널을 갖는다. 몇몇 실시예에서, 미세 다공성 기재의 기하학적 형태는 유동 균질화를 증가시키는 복수 개의 구멍을 포함한다. 다른 실시예에서, 미세 다공성 기재는 고저항 영역의 우선적인 재수화를 수행하도록 형성된다. 또 다른 실시예에서, 미세 다공성 기재는 샘플 유체가 보다 높은 저항 또는 보다 높은 경로 길이 영역을 통해 지연되는 동안에 수화 유동이 낮은 저항 또는 낮은 경로 길이 영역을 통해 이동하게 하도록 형성된다.
몇몇 실시예에서, 본 명세서에는, 개인으로부터의 눈물막 샘플의 부피를 분석 장치의 제1 샘플 영역에 도입하는 단계; 적어도 하나의 트랜스듀서를 이용하여 제1 샘플 영역 내의 부피의 에너지 특성을 검출함으로써, 제1 샘플 판독값을 생성하는 단계; 부피의 적어도 일부가 분석 장치의 제2 샘플 영역으로 유동하게 하는 단계; 검출 기재를 이용하여 제2 샘플 영역 내의 부피의 적어도 일부 내의 하나 이상의 분석물을 검출함으로써, 제2 샘플 판독값을 생성하는 단계; 및 제1 및 제2 샘플 판독값을 기초로 하여 개인의 눈 상태를 치료하는 치료 계획을 조절하는 단계를 포함하는, 필요로 하는 개인의 눈 상태를 치료 또는 모니터링하는 방법이 개시된다. 몇몇 실시예에서, 방법은 눈물막 샘플의 부피를 포집하는 단계를 더 포함한다. 몇몇 실시예에서, 상기 눈 상태는 건성 각결막염이다. 몇몇 실시예에서, 상기 눈 상태는 알러지이다. 몇몇 실시예에서, 상기 눈 상태는 당뇨병이다. 몇몇 실시예에서, 상기 눈 상태는 당뇨병성 망막증(diabetic retinopathy)이다. 몇몇 실시예에서, 상기 눈 상태는 연령 관련 황반 변성(age-related macular degeneration)이다. 몇몇 실시예에서, 상기 눈 상태는 녹내장이다. 몇몇 실시예에서, 상기 눈 상태는, 연령 관련 황반 변성, 알러지, 안검염(blepharitis), 백내장(cataract), 결막염(conjunctivitis), 봉와직염(cellulitis), 중심 장액 망막 병증(central serous retinopathy), 콩다래끼(chalazion), 콘택트 렌즈 관련 손상, 각막/결막 찰과상, 이영양증(dystrophies), 짓무름(erosion), 열상(laceration), 궤양(ulcer), 각막 이식 거부(corneal transplant rejection), 거대세포바이러스 망막염(cytomegalovirus retinitis), 당뇨병성 망막증(diabetic retinopathy), 안암(eye cancer), 푸크스 이영양증(Fuch's dystrophy), 그레이브스병(Grave's disease), 히스토플라스마증(histoplasmosis), 녹내장(glaucoma), 감염(infection), 각막염(keratitis), 원추 각막(keratoconus), 황반 질환(macular disease), 신생 혈관증(neovascularization), 고안압증(ocular hypertension), 시신경염(optic neuritis), 검열반(pinguecula), 익상편(pterygium), 망막 세포 변성증(retinitis pigmentosa), 망막 모세포종(retinoblastoma), 공막염(scleritis), 트라코마(trachoma), 첩모난생증(trichiasis), 또는 포도막염(uveitis) 중 하나 이상이다.
샘플 유체가 미세 다공성 기재와 상호 작용할 때에, 미세 다공성 멤브레인을 통해 경로 길이를 따라 점진적으로 신호를 제거하는 특정한 비특이성 결합 속도가 존재한다. 따라서, 특정 실시예는 비특이성 손실 및 정밀도의 감소를 제거하기 위해, 트랜스듀서 위로 유동하기 전에 베어(bare) 미세 다공성 기재와 샘플 유체의 상호 작용을 최소화한다. 몇몇 실시예에서, 미세 다공성 기재의 기하학적 형태는 샘플 영역들 사이에 초기 계면의 역할을 하도록 짧은 쐐기형 또는 삼각형의 돌출부를 이용함으로써, 샘플 유체와 상호 작용하는 베어 멤브레인의 양을 최소화한다. 몇몇 실시예에서, 검출 성분은 샘플 유체가 베어 멤브레인과 함께 상호 작용하는 것을 피하기 위하여, 포집 채널 내에 위치되고 샘플 유체에 의해 배양되게 된다.
몇몇 실시예에서, (a)유체 입구; (b)유체 입구와 유체 연통하도록 장치 내에 배치되고 유체 샘플의 부피를 수용하도록 형성되는 샘플 영역으로서, 샘플 영역은 부피 내의 하나 이상의 분석물의 검출을 허용하여 제1 샘플 판독값을 생성하도록 구성되는 검출 기재를 포함하는 것인 샘플 영역; 및 (c)장치 내에 배치되고 샘플 영역과 유체 연통하는 유체 저장조를 포함하고, 유제 저장조는 전달 유체를 수용하며, 전달 유체는, 샘플 영역으로 전달될 때에, 샘플 영역 내에 배치된 시약을 수화시키는 것, 장치의 작동 중에 검출 기재를 세정하는 것, 또는 양자를 행할 수 있는 것인 유체 샘플 분석 장치가 개시되어 있다. 몇몇 실시예에서, 장치는 유체 입구와 샘플 영역 사이의 유체 유동을 제어하는 계량 메카니즘을 더 포함한다. 몇몇 실시예에서, 계량 메카니즘은 수동 밸브, 능동 밸브, 또는 이들의 조합을 포함한다. 몇몇 실시예에서, 수동 밸브는 샘플 영역으로 부피의 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함한다. 몇몇 실시예에서, 능동 밸브는 소수성 코팅을 갖는 전극을 포함하고, 전극에 대한 전압의 인가는 소수성 코팅을 용해시킴으로써, 샘플 영역으로 부피의 적어도 일부의 유동을 허용한다. 몇몇 실시예에서, 소수성 코팅은 알칸티올 자체 조립 단층(SAM; self-assembled monolayer)을 포함한다. 몇몇 실시예에서, 장치는 입구와 제1 샘플 영역 사이에 배치되어 이들과 유체 연통하는 제2 샘플 영역을 더 포함하고, 제2 샘플 영역은 유체 샘플의 에너지 특성을 검출하도록 구성되는 적어도 하나의 트랜스듀서를 포함한다. 몇몇 실시예에서, 제2 샘플 영역은 모세관 채널을 포함한다. 몇몇 실시예에서, 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치된다. 몇몇 실시예에서, 유체 샘플은 눈물 유체를 포함한다. 몇몇 실시예에서, 제2 샘플 판독값은 유체 샘플의 하나 이상의 분석물의 존재 또는 농도를 나타낸다. 몇몇 실시예에서, 제2 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타낸다. 몇몇 실시예에서, 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있다. 몇몇 실시예에서, 부피는 약 50 nL 내지 약 250 nL의 범위 내에 있다. 몇몇 실시예에서, 부피는 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 이하이다. 몇몇 실시예에서, 검출 기재는 미세 다공성 기재를 포함하고, 작동 중에, 부피의 적어도 일부는 미세 다공성 기재를 가로지른다. 몇몇 실시예에서, 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는다. 몇몇 실시예에서, 미세 다공성 기재는 실질적으로 균일한 유체 전방을 용이하게 하는 복수 개의 구멍을 포함한다. 몇몇 실시예에서, 검출 기재는 부피 내에 존재하는 경우 하나 이상의 분석물을 직접적으로 또는 간접적으로 결합시킬 수 있는 고정화된 제1 결합제를 더 포함한다. 몇몇 실시예에서, 제1 결합제는 항체 또는 항체의 항원 결합 단편, 아비딘-비오틴 결합 쌍의 멤버, 및 스트렙타비딘-비오틴 결합 쌍의 멤버로 이루어진 군으로부터 선택된다. 몇몇 실시예에서, 검출 기재는 부피 내에 존재하는 경우 하나 이상의 분석물을 결합시킬 수 있는 제2 결합제를 더 포함하고, 제2 결합제는 선택적으로 검출 가능한 성분과 공액 결합된다. 몇몇 실시예에서, 검출 가능한 성분은 나노 입자, 시각적으로 검출 가능한 라벨, 형광 라벨, 또는 생물 발광 라벨이다.
몇몇 실시예에서, 본 명세서에는 유체 샘플을 분석하는 방법이 개시되고, 이 방법은, (a)유체 샘플의 부피를 본 명세서에 제공되는 유체 샘플 분석 장치의 샘플 영역 내로 도입하는 단계; 및 (b)유체 샘플 내에 존재하는 경우 부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 검출하는 단계를 포함한다. 몇몇 실시예에서, 유체 샘플은 눈물 유체를 포함한다. 몇몇 실시예에서, 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있다. 몇몇 실시예에서, 부피는 약 50 nL 내지 약 250 nL의 범위 내에 있다. 몇몇 실시예에서, 부피는 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 이하이다.
몇몇 실시예에서, 본 명세서에는 개인의 눈 상태를 치료 또는 모니터링하는 방법이 개시되고, 이 방법은, (a)개인으로부터의 눈물막 샘플의 부피를 본 명세서에 제공되는 유체 샘플 분석 장치의 샘플 영역 내로 도입하는 단계; (b)부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 검출하는 단계; 및 (c)부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 기초로 하여 개인의 눈 상태를 치료하는 치료 계획을 조절하는 단계를 포함한다. 몇몇 실시예에서, 상기 눈 상태는 건성 각결막염이다. 몇몇 실시예에서, 상기 눈 상태는 알러지이다. 몇몇 실시예에서, 상기 눈 상태는 당뇨병이다. 몇몇 실시예에서, 상기 눈 상태는 당뇨병성 망막증(diabetic retinopathy)이다. 몇몇 실시예에서, 상기 눈 상태는 연령 관련 황반 변성(age-related macular degeneration)이다. 몇몇 실시예에서, 상기 눈 상태는 녹내장이다. 몇몇 실시예에서, 상기 눈 상태는, 연령 관련 황반 변성, 알러지, 안검염(blepharitis), 백내장(cataract), 결막염(conjunctivitis), 봉와직염(cellulitis), 중심 장액 망막 병증(central serous retinopathy), 콩다래끼(chalazion), 콘택트 렌즈 관련 손상, 각막/결막 찰과상, 이영양증(dystrophies), 짓무름(erosion), 열상(laceration), 궤양(ulcer), 각막 이식 거부(corneal transplant rejection), 거대세포바이러스 망막염(cytomegalovirus retinitis), 당뇨병성 망막증(diabetic retinopathy), 안암(eye cancer), 푸크스 이영양증(Fuch's dystrophy), 그레이브스병(Grave's disease), 히스토플라스마증(histoplasmosis), 녹내장(glaucoma), 감염(infection), 각막염(keratitis), 원추 각막(keratoconus), 황반 질환(macular disease), 신생 혈관증(neovascularization), 고안압증(ocular hypertension), 시신경염(optic neuritis), 검열반(pinguecula), 익상편(pterygium), 망막 세포 변성증(retinitis pigmentosa), 망막 모세포종(retinoblastoma), 공막염(scleritis), 트라코마(trachoma), 첩모난생증(trichiasis), 및 포도막염(uveitis) 중 하나 이상이다.
본 발명의 다른 목적 및 특징은 명세서, 청구범위, 및 첨부 도면을 검토하면 명백해질 것이다.
본 발명의 신규한 특징은 첨부된 청구범위에 상세하게 기술된다. 본 발명의 특징 및 이점에 대한 더 나은 이해는 본 발명의 원리가 이용되는 예시적인 실시예를 기술하는 다음의 상세한 설명 및 첨부 도면을 참조하여 얻어질 것이다. 첨부 도면에서:
도 1은 몇몇 실시예에 따른, 유체 유동을 계량하기 위한 수동 밸브를 구비한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하고;
도 2는 몇몇 실시예에 따른, 유체 유동을 계량하기 위한 능동 밸브를 구비한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하며;
도 3a는 몇몇 실시예에 따른, 유체 유동을 지연시키기 위해 표면 에너지의 상호 작용을 이용하는 관심 대상인 하나 이상의 분석물과 몰삼투압 농도의 통합 검출을 위한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하고;
도 3b 및 도 3c는 몇몇 실시예에 따른, 표면 에너지 기반 유동 지연 메카니즘을 구현하는 미세 유체 장치를 사용하여 얻어진 비제한적인 예시적인 유동 결과를 도시하며;
도 4a는 몇몇 실시예에 따른, 수동 밸브를 구비한, 하나 이상의 분석물의 검출과 몰삼투압 농도의 통합 검출을 위한 비제한적인 예시적인 미세 유체 장치의 분해도를 도시하고;
도 4b는 도 4a의 조립된 미세 유체 장치의 단면도를 도시하며;
도 5a 및 도 5b는 몇몇 실시예에 따른, 몰삼투압 농도와 관심 대상인 하나 이상의 분석물의 통합 검출을 위한 비제한적인 예시적인 조립된 미세 유체 장치의 평면도 및 저면도를 도시하고;
도 6a 내지 도 6g는 몇몇 실시예에 따른, 유동 균질화를 달성하기 위한 기하학적 형태를 갖는 비제한적인 예시적인 검출 기재를 도시하며;
도 7은 몇몇 실시예에 따른, 정밀 유체 타이밍 지연을 수행하도록 구성된 비제한적인 예시적인 검출 기재를 도시하고;
도 8은 약 100 nL의 인간 눈물 유체를 사용하여 연속적으로 측정된 몰삼투압 농도와 250 ng/mL IgE의 비제한적인 예시를 도시하며;
도 9는 분리된 재수화 채널을 포함하는 재수화 구조 내의 멀티플렉스 분석의 비제한적인 예시를 도시한다.
도 1은 몇몇 실시예에 따른, 유체 유동을 계량하기 위한 수동 밸브를 구비한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하고;
도 2는 몇몇 실시예에 따른, 유체 유동을 계량하기 위한 능동 밸브를 구비한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하며;
도 3a는 몇몇 실시예에 따른, 유체 유동을 지연시키기 위해 표면 에너지의 상호 작용을 이용하는 관심 대상인 하나 이상의 분석물과 몰삼투압 농도의 통합 검출을 위한 비제한적인 예시적인 미세 유체 장치의 단면도를 도시하고;
도 3b 및 도 3c는 몇몇 실시예에 따른, 표면 에너지 기반 유동 지연 메카니즘을 구현하는 미세 유체 장치를 사용하여 얻어진 비제한적인 예시적인 유동 결과를 도시하며;
도 4a는 몇몇 실시예에 따른, 수동 밸브를 구비한, 하나 이상의 분석물의 검출과 몰삼투압 농도의 통합 검출을 위한 비제한적인 예시적인 미세 유체 장치의 분해도를 도시하고;
도 4b는 도 4a의 조립된 미세 유체 장치의 단면도를 도시하며;
도 5a 및 도 5b는 몇몇 실시예에 따른, 몰삼투압 농도와 관심 대상인 하나 이상의 분석물의 통합 검출을 위한 비제한적인 예시적인 조립된 미세 유체 장치의 평면도 및 저면도를 도시하고;
도 6a 내지 도 6g는 몇몇 실시예에 따른, 유동 균질화를 달성하기 위한 기하학적 형태를 갖는 비제한적인 예시적인 검출 기재를 도시하며;
도 7은 몇몇 실시예에 따른, 정밀 유체 타이밍 지연을 수행하도록 구성된 비제한적인 예시적인 검출 기재를 도시하고;
도 8은 약 100 nL의 인간 눈물 유체를 사용하여 연속적으로 측정된 몰삼투압 농도와 250 ng/mL IgE의 비제한적인 예시를 도시하며;
도 9는 분리된 재수화 채널을 포함하는 재수화 구조 내의 멀티플렉스 분석의 비제한적인 예시를 도시한다.
본 개시는, 특정 실시예에서, 소량(비제한적인 예로서, 약 20 마이크로리터 미만)의 유체 샘플을 포집 및 분석하기 위한 시스템, 방법, 및 장치를 제공한다. 본 명세서에 개시되는 시스템, 방법 및 장치는, 몇몇 실시예에서, 관심 대상인 유체 샘플의 하나 이상의 피쳐를 검출 및/또는 측정하는 데에 사용된다. 비제한적인 예로서, 시스템, 방법 및 장치는 제1 피쳐(비제한적인 예로서, 관심 대상인 유체의 삼투질 농도(osmolality)) 및 관심 대상인 제2 피쳐(비제한적인 예로서, 관심 대상인 유체 내의 하나 이상의 분석물의 존재 및/또는 농도)를 측정하는 데에 사용된다. 몇몇 실시예에서, 시스템, 방법 및 장치는 관심 대상인 유체 내의 하나 이상의 분석물의 존재 및/또는 농도를 측정하는 데에 사용된다. 몇몇 실시예에서, 시스템, 방법 및 장치는 제1 피쳐(비제한적인 예로서, 관심 대상인 유체의 삼투질 농도) 또는 관심 대상인 제2 피쳐(비제한적인 예로서, 관심 대상인 유체 내의 하나 이상의 분석물의 존재 및/또는 농도)를 측정하는 데에 사용된다.
본 발명은 현장에서의 사용을 위해 통합된 장치에서 유체의 나노리터(nL) 샘플을 포집 및 분석하려고 할 때에 발생할 수 있는 문제들을 처리한다. 소량의 샘플은 동일한 농도에서 더 큰 부피보다 검출할 분자가 적고 매우 높은 민감도를 필요로 한다. 일반적으로, 분석은 비특이적인 배경을 제거하기 위해 반복적이고 엄격한 세정이 동반되는 검출기 표면에서 확산이 관심 대상인 분석물을 축적하는 데에 일조하게 하도록 1시간 넘게 하룻밤 이상까지 긴 배양 시간에 의해 이 문제를 해결하려고 한다. 이러한 기술 중 어느 것도 현장에서 이용 가능하지 않으며, 이는 완전히 훈련되지 않은 유저에 의해 작동 가능한 간단한 시스템에 의해 신속한 테스트(비제한적인 예로서, 몇 분 미만)를 필요로 한다. 또한, 임피던스 기반의 눈물 몰삼투압 농도와 크로마토그래피 유형(또는 측방 유동)의 샌드위치 분석을 연속적으로 분석할 때에, 다음과 같은 다양한 문제들 중 임의의 문제가 발생할 수 있다: 포집된 유체를 정확하게 계량하는 것, 검출 항체의 재수화(또는 비제한적인 예로서, 나노 입자 복합체, 앱타머(aptamer), scFv 등을 포함함), 샘플 전달 효율, 눈물 샘플이 샘플 영역을 완전히 통과하기 전에 포획 항체의 재수화를 달성하는 것, 미 공성 측방 유동 멤브레인 위에서 흐르는 완충제의 오버플로우를 방지하는 것, 균질화 유동(검출 항체의 선단 에지에서 실질적으로 등방성이며 균일한 유동 패턴을 생성하는 것, 또는 이와 달리, 반응된 눈물 샘플과 검출 복합체 앞쪽의 대부분이 그 주위가 아니라 포획 영역을 통해 유동함), 그리고 유동을 크로마토그래피 시스템의 한쪽 또는 다른 쪽으로 무작위로 이동시키는 유동 불안정성을 피하는 것.
이들 문제를 해결하기 위해, 본 개시는, 몇몇 실시예에서, (a)샘플 유체의 부분 표본 부피를 수용하는 기재로서, 기재는 모세관 작용을 통해 샘플 유체의 부분 표본 부피를 수용하도록 작동 가능하게 형성되는 것인 기재; 및 (b)샘플 유체의 부피가 샘플 영역의 일부를 작동 가능하게 덮기에 충분한 크기로 되어, 샘플 유체의 에너지 특성이 샘플의 몰삼투압 농도를 나타내는 샘플 유체 판독값을 생성하도록 변환되게 하는, 상기 기재의 샘플 유체 영역, 및(c) 관심 대상인 분석물에 대해 샘플 유체의 일부를 분석하는 제2 샘플 영역 중 적어도 하나를 포함하는 일체형 미세 유체 포집 장치를 제공한다. 특정 실시예에서, 본 명세서에 개시된 장치 및 시스템은 또한 샘플 유체를 계량하기 위한 일련의 하나 이상의 평형 수동 밸브를 포함하며, 시스템을 통과하는 가압 유체는 미리 결정된 순서로 밸브를 횡단하게 된다. 특정 실시예에서, 본 명세서에 개시된 장치 및 시스템은 또한 적어도 하나의 일체형 저장조를 포함한다. 몇몇 실시예에서, 저장조는 그 내부에 완충제, 세정액, 전달 유체, 샘플 유체, 기체, 공기 또는 임의의 다른 유체 부피를 보유한다. 몇몇 실시예에서, 저장조는 그 내부에 전달 완충제, 세정액, 전달 유체, 샘플 유체, 기체, 공기 또는 임의의 다른 유체 부피 중 2개 이상을 보유하도록 분할된다. 몇몇 실시예는 샘플 전달 효율, 재수화 역학, 오버플로우 보호 및 유동 불안정성을 피하기 위한 유체 저항 평형을 최적화하도록 작동 가능하게 형성되는, 미세 다공성 기재를 포함하는 제2 샘플 영역을 특징으로 한다. 특정 실시예에서, 샘플 전달 효율은 미세 다공성 기재의 작은 돌출부를 2 개의 샘플 영역들 사이의 계면에 배치함으로써 최적화된다. 다른 실시예에서, 검출 복합체의 재수화 역학은 면역 분석의 검출 복합체를 수동 밸브의 계량된 쪽, 또는 포집 채널 내측, 또는 양쪽 모두에 위치시킴으로써 달성된다. 다른 실시예에서, 검출 복합체의 재수화는 샘플 전달 후에 미세 다공성 기재 내에서 달성된다. 다른 실시예에서, 포획 영역의 재수화 역학은 최소 저항의 유체 경로가 그 주위가 아닌 포획 영역을 통과하도록 하류 유체 협착부를 위치시킴으로써 달성된다. 다른 실시예에서, 포획 영역의 재수화는 유체 단면 경로의 신속한 팽창의 하류에서 달성된다. 또 다른 실시예에서, 포획 영역의 재수화는 유체 지연 및 샘플 전달을 위한 우선 경로로서 작용하는 하나 이상의 사형 채널을 미세 다공성 기재 내에 패터닝함으로써 달성되며, 보다 짧은 경로 길이의 재수화 채널은 지연된 샘플이 도달하기 전에 하류 포획 영역으로 전달 완충제를 위킹하며, 이 지점에서 재수화 및 샘플 경로가 병합된다. 다른 실시예에서, 중앙 샘플 경로를 둘러싸는 보다 짧은 경로 길이의 재수화 채널은 재수화 채널 및 샘플 채널이 단일 경로로 병합된 후에 검출기의 생성된 유동을 보다 예측 가능한 영역으로 집중시킨다. 다른 실시예에서, 저장조로부터의 압력 구동 오버플로우(pressure driven overflow)의 가능성을 완화하는 데에 일조하도록 하나 이상의 유체 채널이 추가된다. 다른 실시예에서, 재수화 및 오버플로우 보호 채널은 하나의 구조로 결합된다. 추가적인 실시예에서, 하류의 샘플 유동 저항기들은, 시스템 내에서 유동 불안정성 및 예측 불가능성을 야기하는 미세 다공성 기재를 통과하는 비대칭 경로를 유동이 무작위로 선택하는 것을 방지하도록 밸런싱된다. 다른 실시예에서, 비대칭 유동 불안정성이 시스템에서 허용되고 대칭 경로의 양측에 여분의 포획 영역을 위치시킴으로써 보상되며 그 강도는 소프트웨어에서 평균이 된다. 총괄하여, 이들 피쳐는 나노리터 크기의 샘플에서 관심 대상인 하나 이상의 분석물의 병렬 분석 문제를 해결한다.
몇몇 실시예에서, 관심 대상인 유체 샘플의 부피는 단일의 미세 유체 장치 내의 복수 개의 샘플 영역을 통해 순차적으로 그리고 제어 가능하게 유동된다. 몇몇 실시예에서, 각각의 샘플 영역은 삼투압, 총 농도, 삼투질 농도 및/또는 몰삼투압 농도와 같은 샘플 부피의 다양한 특성을 분석하고 검출하기 위한, 뿐만 아니라 관심 대상인 하나 이상의 분석물의 검출을 위한 다양한 검출 구성요소를 포함한다. 본 개시의 몇몇 실시예는 환자에게 상해의 위험을 최소화하면서 비교적 빠르며, 비침습적이고, 저렴하며, 및/또는 사용하기 쉽도록 구성된다. 몇몇 실시예에서, 최소한 마이크로리터 부피의 샘플 유체에 정확한 측정이 제공된다. 비제한적인 예로서, 본 명세서에 설명된 몇몇 실시예에 따라 구성된 측정 장치는 20 마이크로리터 이하의 샘플 유체에 몰삼투압 농도 측정을 가능하게 한다. 몇몇 실시예에서, 비제한적인 예로서, 보다 작은 부피, 때로는 20 나노리터만큼 작은 나노리터 부피가 성공적으로 측정된다. 몇몇 실시예에서, 측정 성능은 포집된 샘플 유체의 부피의 변화에 의해 손상되지 않으므로, 몰삼투압 농도 및 관심 대상인 하나 이상의 분석물의 측정은 포집된 부피와 실질적으로 무관하다. 일 실시예에서, 이는 샘플 유체의 부분 표본 부피의 널리 정의된 하위 세트를 조사함으로써 달성된다. 몇몇 실시예에서, 본 명세서에 설명된 방안은 단일의 통합 장치 내에서 작은 샘플 부피의 신속한 분석을 가능하게 함으로써, 유체 샘플의 진단 테스트의 속도, 융통성, 사용자 편리성, 및 비용 효율성을 향상시킨다.
몇몇 실시예에서, 본 명세서에 설명된 장치는 눈물막, 땀, 혈액, 소변, 침, 또는 다른 체액, 또는 이들의 조합을 비롯하여 다양한 상이한 유형의 유체를 분석하는 데에 사용된다. 몇몇 실시예에서, 본 명세서에 설명된 장치는 우유 또는 다른 음료 뿐만 아니라 다양한 완충제, 용액, 시약, 또는 화학 물질, 또는 이들의 조합과 같은 다른 샘플 유체를 분석하는 데에 사용된다.
몇몇 실시예에서, 본 명세서에 설명된 장치는 환자로부터의 눈물 유체를 분석하는 데에 사용된다. 몇몇 실시예에서, 눈물 유체 분석은 환자의 눈물막에 이상이 나타나는 다양한 눈 상태의 진단, 모니터링 및/또는 치료에 유익하다. 예컨대, 건성 각결막염(KCS; Keratoconjunctivitis sicca), 또는 "안구 건조증(dry eye)"은 눈물막 구조 성분들(비제한적인 예로서, 하부의 뮤신 기부, 중간의 수성 성분, 상부의 지질층) 중 하나 이상이 불충분한 부피로 존재하거나 이와 달리 다른 성분들과의 균형이 맞지 않는 상태이다. KCS가 있는 환자에서 눈물의 유체 긴장성 또는 몰삼투압 농도가 증가된다는 점이 알려져 있다. KCS는 쇼그렌 증후군, 노화, 및 안드로겐 결핍과 같은 신체의 전반적인 건강에 영향을 미치는 조건과 관련이 있다. 따라서, 눈물막의 몰삼투압 농도는 KCS 및 다른 상태의 진단을 위한 민감하고 구체적인 지표이다.
또한, 최근의 증거에 따르면, 눈물의 고 몰삼투압 농도(hyperosmolarity)는 눈물막의 불안정성, 즉 눈물막이 혈액 몰삼투 농도와 평형을 이루는 항상성계(homeostatic system)로부터 점진적으로 더 혼란하고 예측 불가능한 구조의 형태로 전이되는 상태와 직접적으로 연계되어 있다는 점이 밝혀졌다. 안구 건조증의 초기 단계에서, 눈물막은 준안정적일 수 있고, 이 경우, 깜박임간 강도 변화, 눈꺼풀 접촉 등이 전술한 변수에 따라 가변적으로 유능한 박막을 끌어낸다. 진행된 안구 건조증, 또는 불안정성을 조장하는 임의의 다른 안구 표면 상태에서, 눈물막은 응집력이 막의 어떠한 외관을 유지하기에 불충분하고 각막과 결막 위에서 신속한 증발이 생기는 단계까지 손상된다. 그러한 불안정성은 눈물막 샘플 내의 단백질 바이오마커와 같은 분석물을 측정하려고 할 때에 관련 있다. 예컨대, 눈물 바이오마커의 포인트 샘플(비제한적인 예로서, 단일의 샘플 포집 시점에서 바이오마커의 농도에 데이터를 제공하는 체외 진단 단일 사용 일회용 테스트를 위한)은, 눈물의 불안정성으로 인한 농도의 1차 변화와 증발성 수분 손실로 인한 결과적인 고 몰삼투압 농도 때문에 샘플 몰삼투압 농도가 해명되지 않는다면 임상적 결정을 내릴 때에 받아들일 수 없는 변화가 생기기 쉽다.
몇몇 실시예에서, 관심 대상인 복수 개의 분석물이 분석되어 하나 이상의 안질환의 진단 및 관리를 돕는 데에 사용된다. 안질환의 비제한적인 예는, 연령 관련 황반 변성, 알러지, 안검염(blepharitis), 백내장(cataract), 결막염(conjunctivitis), 봉와직염(cellulitis), 중심 장액 망막 병증(central serous retinopathy), 콩다래끼(chalazion), 콘택트 렌즈 관련 손상, 각막/결막 찰과상, 이영양증(dystrophies), 짓무름(erosion), 열상(laceration), 궤양(ulcer), 각막 이식 거부(corneal transplant rejection), 거대세포바이러스 망막염(cytomegalovirus retinitis), 당뇨병성 망막증(diabetic retinopathy), 안암(eye cancer), 푸크스 이영양증(Fuch's dystrophy), 그레이브스병(Grave's disease), 히스토플라스마증(histoplasmosis), 녹내장(glaucoma), 감염(infection), 각막염(keratitis), 원추 각막(keratoconus), 황반 질환(macular disease), 신생 혈관증(neovascularization), 고안압증(ocular hypertension), 시신경염(optic neuritis), 검열반(pinguecula), 익상편(pterygium), 망막 세포 변성증(retinitis pigmentosa), 망막 모세포종(retinoblastoma), 공막염(scleritis), 트라코마(trachoma), 첩모난생증(trichiasis), 및 포도막염(uveitis)을 포함한다. 몇몇 실시예에서, 특정 분석물(및/또는 몰삼투압 농도와 같은 유체 특성)의 평행 해석(비제한적인 예로서, 복수 개의 분석물 중 임의의 분석물이 긍정적이면, 긍정적인 진단을 내리는 논리 OR)이 사용되어 많은 특이성을 희생시키지 않으면서 안질환 테스트 전반적인 민감도를 증가시킨다. 비제한적인 예로서, 일 실시예에서, 몰삼투압 농도, 락토페린, 알부민, 및 리포칼린의 평행 해석이 안구 건조증 질환을 진단하는 데에 사용된다. 다른 실시예에서, 몰삼투압 농도, 리포칼린, 프롤린-농후 단백질 4(PRR4) 및 아연-알파-2-글리코프로테인 2(ZAG2)(또는 다른 주요 눈물 단백질)의 평행 해석이 단백질 레벨이 정상 범위보다 낮을 때에 안구 건조증 질환을 진단하는 데에 사용된다. 또 다른 실시예에서, 몰삼투압 농도, 리포칼린, PRR4 및 ZAG2(또는 다른 주요 눈물 단백질)의 평행 해석이 단백질 레벨이 정상 범위보다 높을 때에 생무지의 미치료 녹내장(naive untreated glaucoma)을 진단하는 데에 사용된다. 또 다른 실시예에서, 몰삼투압 농도, 리포칼린, PRR4 및 ZAG2(또는 다른 주요 눈물 단백질)의 평행 해석이 동일한 장치에서 안구 건조증과 녹내장을 모두 진단하는 데에 사용된다. 몇몇 실시예에서, 몰삼투압 농도 및 당화 알부민(glycated albumin)의 평행 해석은, 측정된 몰삼투압 농도에 대해 당화 알부민 농도를 정규화함으로써 눈물 농도의 깜박임 간 변화를 보상하여, 건강한 환자, 당뇨병 환자, 및 망막증을 가진 당뇨병 환자 간의 구별에 있어서 정밀도를 증가시킬 수 있게 한다. 또 다른 실시예에서, 몰삼투압 농도와 뇌유래 신경 영양 인자(BDNF; brain-derived neurotrophic factor)의 평행 해석은 측정된 눈물 몰삼투압 농도에 대해 BDNF 레벨을 정규화함으로써 저안압 녹내장(low tension glaucoma)의 결정에 개선된 정밀도를 허용한다. 다른 실시예에서, 몰삼투압 농도, IL-1Ra, MMP-9 및 S100A8의 평행 해석은 염증성 또는 수분 결핍 여부에 상관없이 안구 건조증 질환 및 장애의 원인 하위 세트 모두를 진단하는 데에 일조한다. 다른 실시예예에서, 중첩되는 증상 및 임상 징후를 갖는 상이한 질환으로부터의 관심 대상인 다수의 분석물이 병행하여 측정된다. 비제한적인 예로서, 일 실시예에서, 유사한 임상 증상 및 징후에도 불구하고 안구 건조증과 알러지를 구별하면서 조기 및 후기 알러지 모두를 조사하기 위해 몰삼투압 농도 뿐만 아니라 IgE, ECP 및/또는 EDN과 같은 복수 개의 알러지 마커가 측정된다. 다른 실시예에서, 몰삼투압 농도는 측정되지 않고, 관심 대상인 분석물이 측정된다. 이들 예는 제한되도록 의도되지 않고, 개시된 장치를 현장에서 어떻게 적용하는지에 관한 예를 제공한다.
따라서, 본 개시는 몇몇 실시예에서, 일정 부피 내에 관심 대상인 하나 이상의 분석물(비제한적인 예로서, 하나 이상의 분석물의 존재 및/또는 농도)을 측정하는 것과 함께 (비제한적인 예로서, 눈물막 또는 다른 유체 샘플의) 부분 표본 부피의 몰삼투압 농도를 측정하는 시스템, 방법, 및 장치를 제공한다. 몇몇 실시예에서, 몰삼투압 농도와 분석물 측정은 동시에 또는 순차적으로 수행된다. 몇몇 실시예에서, 몰삼투압 농도 측정이 먼저 수행되고, 이후에 샘플 부피 내에서 하나 이상의 분석물의 존재 및/또는 농도를 검출하기 위한 분석이 수행된다. 몇몇 실시예에서, 몰삼투압 농도 측정은, 샘플 부피 내에서 하나 이상의 분석물의 존재 및/또는 농도를 검출하기 위한 분석 다음에 수행된다. 다른 실시예에서, 샘플의 몰삼투압 농도는 비교적 일정하며 관심 대상인 분석물만이 분석된다.
몇몇 실시예에서, 임의의 적절한 기법이 유체 샘플의 몰삼투압 농도를 측정하는 데에 사용된다. 몇몇 실시예에서, 몰삼투압 농도는, 샘플의 에너지 특성(비제한적인 예로서, 열적, 광학적, 및/또는 전기적 특성)을 검출함으로써, 예컨대 에너지를 샘플에 전달하고, 인가된 에너지를 검출하며, 검출 결과를 몰삼투압 농도를 결정하는 데에 이용함으로써, 측정된다. 몇몇 실시예에서, 하나 이상의 트랜스듀서 또는 전극이 적절한 전기 신호를 인가함으로써 비제한적인 예로서 유체의 전기 전도도를 측정하는 데에 사용된다. 전기 전도도는 유체의 이온 농도와 관련되어 있으므로, 온도 보정 및 적절한 교정 기능이 적용되면 유체의 몰삼투압 농도가 결정될 수 있다.
본 명세서에서 제시된 기술, 시스템 및 장치를 사용하여 유체 샘플에서 측정될 수 있는 분석물은, 제한하지 않지만, 다른 생물학적 성분과 고차 어셈블리 중에서도 단백질, 펩타이드, 대사 산물, 전해질, 소분자, 지질, 당, 핵산 및 프로테오글리칸을 뿐만 아니라 이들의 조합을 포함한다. 몇몇 실시예에서, 분석물은 단백질 바이오마커를 포함한다. 몇몇 실시예에서, 분석물은, 제한하지 않지만, 면역글로불린[비제한적인 예로서, 면역글로불린 E(IgE), 면역글로불린 M(IgM), 면역글로블린 A(IgA), 면역글로불린 G(IgG)], 사이토카인[비제한적인 예로서, 변환 성장 인자-β(TGF-β), 종양 괴사 인자(TNF-α), 인터루킨 1-A], 단백질[S100, 락토페린, 리포칼린, 카텝신, BDNF, 엔올라제, 호산구 양이온 단백질(ECP; Eosinophil Cationic Protein), 호산구 유래 신경독소(EDN; Eosinophil Derived Neurotoxin), PRR4, ZAG2, 시스스타틴(cystatin), 알부민 등] 또는 뮤신 및 기타 당단백질[비제한적인 예로서, 세포 표면 관련 뮤신 5(MUC-5), 프로테오글리칸 4(PRG4), 세포 표면 관련 뮤신 16(MUC16)]을 포함한다. 몇몇 실시예에서, 분석물 검출 및/또는 측정 절차는 검출 기재를 통해 유체 샘플을 유동시키는 것을 포함한다. 비제한적이고 예시적인 검출 기재는 미세 다공성 기재 또는 미세 다공성 멤브레인을 포함한다. 추가의 실시예에서, 검출 기재는 니트로셀룰로오스, 유리 섬유 복합 패드, 퓨전 5(Fusion 5), POREX® 물질, 종이, PVDF 등으로부터 선택되는 하나 이상의 기재이다. 몇몇 실시예에서, 미세 다공성 기재 및 미세 다공성 멤브레인은 동등하며, 본 명세서 내에서 상호 교환 가능하다. 몇몇 실시예에서, 포집 채널, 모세관 채널, 및 미세 유체 채널은 동등한 용어이며, 본 명세서 내에서 상호 교환 가능하다. 몇몇 실시예에서, 검출 기재는 관심 대상인 하나 이상의 분석물의 크로마토그래피, 플로우 스루, 또는 측방 유동 분석을 위해 구성된다. 다른 비제한적이고 예시적인 기술은 임피던스, 임피던스 분광법, 표면 강화 라만 분광법(SERS; surface-enhanced Raman spectroscopy), 전기화학적 트랜스듀서, 표면 플라스몬 공명과 같은 비표지형 트랜스듀서(label-free transducer), 간섭계 등을 포함한다. 유체 부피 내의 분석물을 검출하기 위한 분석은 당업자에게 공지되어 있으며, 아래에서 더 상세히 설명된다.
몇몇 실시예에서, 본 명세서에서 제공되는 시스템, 방법 및 장치는 약 10 nL 내지 약 10 μL의 범위 내, 또는 약 50 nL 내지 250 nL 범위 내의 부피와 같이 비교적 작은 부피의 유체 샘플의 몰삼투압 농도 및 분석물 농도의 분석에 적용된다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 중 임의의 2개의 값들 사이의 범위 내에 있다. 몇몇 실시예에서, 부피는 약 20 μL, 약 250 nL, 약 200 nL, 또는 약 50 nL 이하이다. 몇몇 실시예에서, 부피는, 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL , 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 또는 약 10 μL 이하이다.
몇몇 실시예에서, 몰삼투압 농도 및 분석물 측정은 미세 유체 칩 등의 단일 미세 유체 장치에서 수행된다. 몇몇 실시예에서, 미세 유체 장치는 유체 샘플의 부피를 수용하도록 형성된 복수 개의 샘플 영역, 비제한적인 예로서, 미세 유체 채널, 챔버 등을 포함한다. 몇몇 실시예에서, 미세 유체 구조의 치수는 원하는 데로 변경된다. 몇몇 실시예에서, 본 명세서에서 설명되는 미세 유체 채널, 분석 채널, 또는 오버플로우 채널은, 약 10 ㎛, 약 20 ㎛, 약 30 ㎛, 약 40 ㎛, 약 50 ㎛, 약 60 ㎛, 약 70 ㎛ 약 100 ㎛, 약 200 ㎛, 약 300 ㎛, 약 400 ㎛, 약 500 ㎛, 약 600 ㎛, 약 700 ㎛, 약 800 ㎛, 약 900 ㎛ 또는 약 1 mm의 채널 폭을 갖는다. 몇몇 실시예에서, 채널 깊이 또는 높이는 약 5 ㎛, 약 10 ㎛, 약 20 ㎛, 약 30 ㎛, 약 40 ㎛, 약 50 ㎛, 약 60 ㎛, 약 70 ㎛, 약 80 ㎛, 약 90 ㎛, 약 100 ㎛, 약 150 ㎛, 약 200 ㎛, 약 250 ㎛, 약 300 ㎛ 또는 약 400 ㎛이다. 몇몇 실시예에서, 본 명세서에서 설명되는 장치는 약 300 ㎛의 채널 폭 및 약 75 ㎛의 채널 깊이를 갖는, 샘플 부피에서 몰삼투압 농도 검출을 수행하기 위한 모세관 채널을 포함한다. 몇몇 실시예에서, 채널 폭은 채널의 단면 윤곽의 2개의 공간 지점들을 연결하는 가장 큰 거리이다.
몇몇 실시예에서, 미세 유체 장치의 샘플 영역 각각은 상이한 분석 기능을 수행하는 데에 사용된다. 몇몇 실시예에서, 장치는 몰삼투압 농도를 측정하기 위한 적어도 하나의 트랜스듀서를 포함하는 제1 샘플 영역 및 분석물 검출을 수행하기 위한 검출 기재를 포함하는 제2 샘플 영역을 포함한다. 몰삼투압 농도 및 분석물 측정이 순차적으로 수행되는 실시예(비제한적인 예로서, 몰삼투압 농도 검출이 분석물 검출 이전에 수행됨)에서, 샘플 영역은 서로 유체 연통하여(비제한적인 예로서, 통로, 관통 구멍, 또는 다른 유체 요소에 의해 연결됨) 제1 샘플 영역으로부터 제2 샘플 영역으로 샘플 부피의 유동을 가능하게 한다. 몇몇 실시예에서, 유동은, 제한하지 않지만, 대류 유동, 압력 구동 유동(pressure-driven flow), 위킹(wicking), 모세관 작용, 증발, 용해, 또는 이들의 적합한 조합을 비롯한 다양한 방법에 의해 작동된다. 몇몇 실시예에서, 세정액과 같은 제2 유체가 샘플 부피를 변위시키고 시스템을 통한 유동을 작동시키기 위해 미세 유체 장치 내로 도입된다. 몇몇 실시예에서, 샘플의 유체 유동은 제1 및 제2 샘플 영역 중 하나로부터 제1 및 제2 샘플 영역의 다른 샘플 영역으로 이동한다.
몇몇 실시예에서, 측정을 수행하고 샘플 프로세싱을 용이하게 하기에 충분한 시간을 보장하기 위해, 비제한적인 예로서, 미세 유체 장치의 상이한 샘플 영역들 사이의 유동의 타이밍 및/또는 속도를 제어하는 것이 유리하다. 몇몇 실시예에서, 몰삼투압 농도 측정은 수행하는 데에 약 1-2 초를 필요로 한다. 장치의 다른 실시예에서, 몰삼투압 농도 측정은 시스템이 일시적인 유동 동역학이 결정되기를 기다린 후에 수행하는 데에 약 3-10 초를 필요로 한다. 따라서, 본 명세서에서 설명되는 미세 유동 장치의 몇몇 실시예는, 샘플 부피가 적절한 길이의 시간 동안 샘플 영역에 유지되는 것을 보장하고 다른 영역으로 샘플 부피의 조기 유동을 방지하기 위해, 하나 이상의 계량 메카니즘 또는 다른 유동 제어 요소를 통합한다.
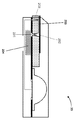
특정 실시예에서, 도 1은 몇몇 실시예에 따라, 계량 메카니즘으로서 수동 밸브를 갖는, 몰삼투압 농도와 관심 대상인 분석물의 통합된 검출을 위한 미세 유체 장치(10)의 단면도를 예시한다. 도 1의 실시예에서, 미세 유체 모세관 칩(100)은 취급 중에 내부의 내용물을 보호하는 편리한 방법을 제공하는 미세 유체 캡슐(101)의 내부에 통합된다. 캡슐(101)은, 하나 이상의 검출 기재(103)(비제한적인 예로서, 니트로셀룰로오스, 유리 섬유 복합 패드, 퓨전 5, 포렉스 물질, 종이, PVDF 등)를 수용하고 조립 중에 기재들이 수직 방향으로 적층되게 하는 공동을 형성하는 내부면(점선 102로 지시됨)을 포함한다. 몇몇 실시예에서, 캡슐 내부는 아래에서 더 상세히 설명되는 바와 같이, 가압 될 때에 전달 유체(105)의 저장조(비제한적인 예로서, 블리스터 팩(blister pack))가 파열되게 하는 상승된 피쳐(104)를 포함한다. 감압 접착제(106)가 캡슐의 내부면(102) 상에 놓이고, 미세 다공성 기재를 친수성 감압 접착제(107)에 의해 밀봉되는 캡슐(101) 및 미세 유체 모세관 칩(100)에 결합시킨다. 몇몇 실시예에서, 모세관 채널(112)은 감압 접착제(107)와 미세 유체 칩(100)의 상부면 사이에 형성되어, 접착제(107)가 채널(112)의 하나의 벽의 역할을 하고 칩(100)의 상부면이 제2 벽의 역할을 한다.
몇몇 실시예에서, 모세관 채널(112)은 몰삼투압 농도 측정이 수행되는 제1 샘플 영역의 역할을 하고, 검출 기재(103)를 포함하는 공동은 분석물 측정이 수행되는 제2 샘플 영역의 역할을 한다. 몇몇 실시예에서, 장치(10)의 제1 및 제2 샘플 영역은 연속적인 통로 또는 관통 구멍(114)에 의해 서로 연결된다. 몇몇 실시예에서, 통로(114)는 2개의 샘플 영역들 사이의 유동을 제어하기 위한 계량 메카니즘의 역할을 하는 수동 밸브(108)를 포함한다. 예컨대, 수동 밸브(108)는 유체 유동을 구속하는 데에 사용되는 하나 이상의 기하학적 피쳐를 포함한다. 몇몇 실시예에서, 수동 밸브는 유체 경로를 따른 측벽 각도의 급격한 변화, 또는 일반적으로 친수성인 층 위에 실질적으로 소수성인 물질의 스트라이프 또는 영역과 같은 친수성의 조절을 포함한다. 도 1에서와 같은 특정 실시예에서, 밸브의 기하학적 형태의 급격한 전이 각도는 샘플 부피에 대한 계량 기능을 제공한다.
유체 샘플 부피가 미세 유체 칩(100)의 입구(113)를 통해 장치(10)로 도입되는 경우, 유체 샘플 부피는 수동 밸브(108)에 의해 정지될 때까지 채널(112)을 통해 흐를 것이다. 몇몇 실시예에서, 부피의 몰삼투압 농도는 채널(112) 내에 위치된 하나 이상의 트랜스듀서를 이용하여 채널(112)에서 결정된다. 몇몇 실시예에서, 전극(도시 생략)은 채널(112) 내에(비제한적인 예로서, 칩(100)에 의해 형성되는 채널 벽 상에) 매립된다. 몇몇 실시예에서, 전극은 금속 증발 및 후속하는 레이저 어블레이션에 의해 칩(100)의 표면 상에 패터닝되고, 충분한 샘플 유체가 채널(112)에 수집되었을 때를 결정하는 데에 사용된다. 또한, 몇몇 실시예에서, 모세관 채널(112)의 전극은 임피던스 기반 트랜스듀서를 생성함으로써, 샘플 부피의 에너지 특성이 모세관 채널(112) 내에서 검출되어 샘플 유체의 몰삼투압 농도를 나타내는 샘플 판독값을 생성한다.
몇몇 실시예에서, 일단 샘플의 몰삼투압 농도가 측정되면, 샘플 부피는 분석 물 측정을 수행하기 위해 제1 샘플 영역[채널(112)]으로부터 제2 샘플 영역으로 변위된다. 이러한 유체 부피의 변위를 달성하기 위해 임의의 적절한 기법이 사용된다. 몇몇 실시예에서, 저장조(105)는 구동력에 의해(비제한적인 예로서, 엄지 또는 다른 손가락, 나사, 판독기 시스템 슬롯에서 돌출된 고정 피쳐, 또는 다른 구동 소자에 의해) 외측에서 가압된다. 이 힘은, 비제한적인 예로서, 압력 구동 유동 및/또는 위킹에 의해 전달 유체가 캡슐 미세 유동 장치(109)를 통해 그리고 칩(100)의 수직 입구(몇몇 실시예에서, 추가적인 수동 밸브로 구성됨)(110)로 유동하게 한다. 몇몇 실시예에서, 제1 샘플 영역 내로 세정액(비제한적인 예로서, 약 1 μL 내지 약 50 μL 부피)의 도입은 샘플 부피가 수동 밸브(108)를 통과하여 미세 다공성 검출 기재(103)를 포함하는 샘플 영역 위로 이동하게 한다. 몇몇 실시예에서, 입구(113) 또는 수직 입구(110)는 하나 이상의 단방향 밸브를 포함한다. 몇몇 실시예에서, 하나 이상의 밸브는 유체 압력에 의해 작동된다.
몇몇 실시예에서, 샘플이 검출 기재(103)의 말단부(비제한적인 예로서, 도 1에 도시된 바와 같이 검출 기재(103)의 우측)을 향해 유동할 때에, 샘플은 검출 기재(103) 상에 또는 검출 기재 내에 배치된 분석 시약과 상호 작용하여 샘플 유체 내의 하나 이상의 분석물의 농도를 나타내는 샘플 판독값을 생성한다. 몇몇 실시예에서, 검출 기재(103)의 적어도 일부는 캡슐(101) 내의 윈도우(111)를 통해 노출됨으로써, 분석물 분석 결과의 광학적인 조사를 가능하게 한다. 다른 실시예에서, 칩(100)과 저장조(105)는 별개의 캐리어 상에 조립되고, 그 다음 캡슐에 스냅 체결되거나 다른 방식으로 부착된다. 그러한 실시예에서, 별개의 캐리어는, 유체 연통이 저장조(105)로부터, 수직 입구(110)로, 채널(112)을 통해, 통로(114)와 수동 밸브(108)를 통해 위로, 그리고 캡슐 플라이스틱이 아닌 검출 기재(103) 상으로 유동하게 하는 미세 유체 채널을 제공한다.
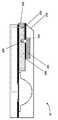
특정 실시예에서, 도 2는 몇몇 실시예에 따라, 계량 메카니즘으로서 능동 밸브를 갖는, 몰삼투압 농도와 관심 대상인 분석물의 통합된 검출을 위한 미세 유체 장치(20)의 단면도를 예시한다. 장치(20)의 구성요소는, 장치(20)가 유체 유동을 제어하기 위한 계량 메카니즘으로서 수동 밸브가 아닌 능동 밸브를 포함한다는 점을 제외하고는 장치(10)의 구성요소와 대체로 유사하다. 도 2의 실시예에서, 미세 유체 모세관 칩(200)은 제1 샘플 영역[모세관 채널(203)]과 제2 샘플 영역[검출 기재(204)] 사이의 유체 유동을 제한 및/또는 저지시키는 능동 요소(202)로 구성된 능동 밸브를 포함한다. 몇몇 실시예에서, 능동 요소(202)는 관통 구멍(201) 내에, 또는 모세관 채널(203) 내에 배치된다.
장치(20) 내의 유체 유동을 제어하기 위하여 임의의 적절한 유형의 능동 밸브가 사용된다. 비제한적인 예로서, 능동 밸브는, 제1 및 제2 샘플 영역 사이의 유동을 물리적으로 차단하지만, 유동을 허용하기 위해 자극 또는 신호의 인가 시에 변위되는 요소를 포함한다. 다른 예로서, 능동 밸브는 실질적인 유체 유동을 감소시키거나 방지하기 위해 샘플 유체와 상호 작용하는 표면 에너지 조절 피쳐를 포함한다. 비제한적인 예로서, 능동 요소(202)는 알칸티올 표면 조립 단층(SAM)와 같이 유체 유동을 방해하는 소수성 코팅을 갖는 하나 이상의 전극을 포함한다. 예컨대, 전극에 전기장이 인가되어 알칸티올 그룹의 표면 단층을 전기 분해시킴으로써, 표면 에너지를 전이시키고 선택된 시간에 유체가 통과하게 한다. 인가 전압은 약 1 V 내지 약 100 V 범위, 예컨대 약 1 V 내지 약 10 V 범위 내에 있다. 다른 실시예에서, 자극에 반응하여 소수성 대 친수성 전이를 겪을 수 있는 다른 유형의 능동 소자(202)가 사용된다.
몇몇 실시예에서, 표면 에너지 조절 피쳐는 샘플 유체에 대한 노출 시에 용해되도록 설계되어, 용해를 위해 충분한 시간이 경과되면 밸브를 통과할 수 있게 한다. 비제한적인 예로서, 능동 요소(202)는 용해되어 유체가 하류의 제2 샘플 영역으로 자유롭게 유동하기 전에 대략 1-30 초 동안 유동을 저지시킨다. 선택적으로, 장치(20)는 유체가 유동하는 동안 공기가 빠져나가게 하도록 통기구로서 작용하는 추가적인 미세 채널을 포함한다. 이러한 미세 채널 통기구는 유체가 통기구 내로 들어가는 것을 방지하기 위해 소수성 물질로 제조되거나 소수성 표면 코팅을 포함한다.
특정 실시예에서, 도 3a는 몇몇 실시예에 따라, 유체 유동을 지연시키기 위해 표면 에너지 상호 작용을 이용하는, 몰삼투압 농도와 관심 대상인 분석물의 통합된 검출을 위한 미세 유체 장치(30)의 단면도를 예시한다. 미세 유체 장치(30)의 구성요소는 아래에서 특정되는 점을 제외하고는 장치(10, 20)의 구성요소와 대체로 유사하다. 장치(10, 20)와 유사하게, 장치(30)는 미세 유체 캡슐(302) 내에 미세 유체 모세관 칩(300)과 검출 기재(301)를 포함한다. 몇몇 실시예에서, 칩(300)과 기재(301)는 감압 접착제층(303)에 의해 밀봉되고 서로 결합된다. 특히, 검출 기재(301)는 장치(10, 20)에서와 같이 아래가 아닌 미세 유체 칩(300)의 상부에 위치 설정된다. 모세관 채널(304)은 칩(300)의 상부면과 감압 접착제층(303)에 의해 형성된다. 몇몇 실시예에서, 칩과 저장조는 별개의 캐리어 상에 조립되고, 그 다음 캡슐에 스냅 체결되거나 다른 방식으로 부착된다. 그러한 실시예에서, 별개의 캐리어는, 유체 연통이 저장조로부터, 수직 입구로, 채널을 통해, 통로와 수동 밸브를 통해 위로, 그리고 캡슐 플라이스틱이 아닌 검출 기재 상으로 유동하게 하는 미세 유체 채널을 제공한다. 특정 실시예에서, 캐리어는 주 저장조의 초기 파열 후에 유동을 지연 시키거나 기포를 포획하기 위한 유체 정전 용량을 제공하는 미세 유체 저장조를 포함한다.
몇몇 실시예에서, 본 명세서에 설명된 다른 실시예와 유사하게, 채널(304)은 샘플 부피의 몰삼투압 농도 측정을 수행하기 위한 제1 샘플 영역의 역할을 하고, 검출 기재(301)는 분석물 검출을 위한 제2 샘플 영역의 역할을 한다. 제1 및 제2 샘플 영역은 칩 기재 내의 개구(306) 위에서 감압 접착제층(303)에 형성된 관통 구멍 또는 통로(305)를 통해 유동적으로 결합된다. 몇몇 실시예에서, 통로(305)와 모세관 채널(304)은 유체 유동을 제한하기 위한 임의의 밸브 또는 다른 계량 메카니즘을 포함하지 않는다. 대신에, 장치(30)는 제1 및 제2 샘플 영역 사이의 유체 유동을 제어하기 위하여 접착제층(303)과 유체 샘플 부피의 표면 에너지 상호 작용을 이용한다. 몇몇 실시예에서, 접착제층(303)의 친수성 및/또는 소수성은 유체 유동에 대한 제어를 달성하기 위해 원하는 대로 조정된다. 비제한적인 예로서, 접착제층(303)은 2개의 친수성 외부층(비제한적인 예로서, 25 μm의 층) 사이에 위치된 소수성 내부층(비제한적인 예로서, 75 μm의 PET 층)을 포함한다. 몇몇 실시예에서, 이 다층 접착제 재료는 채널(304)을 통과하는 샘플 부피의 유동을 느리게 하여, 채널(304)에서 몰삼투압 농도를 측정하는 데에 충분한 시간을 허용하고 샘플이 제2 샘플 영역에서 검출 기재(301)로 들어가는 것을 지연시킨다. 도 1 및 도 2의 다른 실시예에서와 같이, 샌드위치 ELISA의 절반에 대한 반응 성분은 몇몇 실시예에서 채널(304)에서 건조, 스폿팅 및 달리 고정화된다(공유 결합으로, 이온으로, 소수성으로, 비특이적으로 흡착된다). 다른 실시예에서, 샌드위치 ELISA의 절반에 대한 반응 성분은 개구(306)에서 건조, 스폿팅, 또는 달리 고정화된다(공유 결합으로, 이온으로, 소수성으로, 비특이적으로 흡착된다). 또 다른 실시예에서, 샌드위치 ELISA의 절반에 대한 반응 성분은 기재(301) 상에서 건조, 스폿팅, 또는 달리 고정화된다(공유 결합으로, 이온으로, 소수성으로, 비특이적으로 흡착된다). 몇몇 실시예에서, 그러한 반응 성분은 항체 또는 그 항원 결합 단편(antigen binding fragment), 생합성 항체 결합 부위(biosynthetic antibody binding site), 앱타머, 단쇄 단편 변수(short chain fragment variable) 등을 포함한다. 특정 실시예에서, 샌드위치 ELISA의 제2 절반은 채널(304), 개구(306), 또는 기재(301) 내에서 건조, 스폿팅, 또는 달리 고정화된다(공유 결합으로, 이온으로, 소수성으로, 비특이적으로). 형광 염료, 나노 입자, 효소, 전기화학 발광, 화학 발광, HCR, 발광 나노 구체, 반사 나노 입자, 산화 환원 라벨(redox label), 스트렙타비딘(streptavidin), 아비딘(avidin), 뉴트라비딘(neutravidin), 바이오틴(biotin), 유로퓸 킬레이트 염료(europium chelated dye), 상향 변환 형광체(upconverting phosphor), FRET 시스템, 플라즈몬 라벨 등과 같은 적절한 라벨이, 몇몇 실시예에서, 샌드위치 ELISA의 검출 절반을 수반한다.
비제한적이고 예시적인 시약, 기재 구성, 및 관심 대상인 분석물의 존재 및/또는 농도를 검출하기 위해 기재를 제조하고 사용하는 방법은, 예컨대 미국 특허 제6,319,676호; 제5,141,850호; 제5,602,040호; 제5,656,503호; 제5,714,389호; 제5,591,645호; 제5,989,921호; 제6,319,676호; 제6,485,982호; 제7,763,454호; 및 미국 특허 출원 공개 제US2015/0017068호에 개시되어 있다. 미국 특허 제5,714,389호; 제5,989,921호 및 제6,485,982호는 테스트 영역에 고정화된 분석물[비제한적인 예로서, 항-분석물 항체(anti-analyte antibody)]에 대한 고정화된 결합제를 통해 테스트 영역에서 관심 대상인 분석물이 직접 포획되는 분석 기재를 기술한다. 이 방안에서, "절반 샌드위치(half sandwich)"의 형태로 분석물(비제한적인 예로서, 제2 항-분석물 항체)에 라벨을 붙인 제2 결합제에 결합된 분석물은 테스트 영역에서 결합된다. 미국 특허 제6,319,676호 및 제5,141,850호는 관심 대상인 분석물이 관심 대상인 분석물(비제한적인 예로서, 항-분석물 항체)을 위한 결합제에 공유 결합된 결합제 파트너(비오틴)에 결합되는 고정화된 결합제(비 제한적인 예로서, 아비딘 또는 스트렙타비딘)를 통해 테스트 영역에서 간접적으로 포획되는 분석 기재를 기술한다. 이 방안에서, 포획 가능한 결합 성분(비제한적인 예로서, 비오틴화 항-분석물 항 항체) -- 분석물 -- 검출 가능한 결합 성분(비제한적인 예로서, 라벨을 붙인 항-분석물 항체)의 복합체를 포함하는 "완전 샌드위치(full sandwich)"는 유체가 기재를 가로지를 때에 형성된 다음, 포획 가능한 결합 성분과 결합하는 결합 성분(비제한적인 예로서, 아비딘 또는 스트렙타비딘)을 통해 테스트 영역에서 포획된다.
다른 실시예에서, 장치는 유체 샘플을 분석하도록 구성되는 것으로, 유체 입구를 획정하는 하우징; 유체 입구와 유체 연통하도록 하우징 내에 배치되고 유체 샘플의 부피를 수용하도록 형성된 샘플 처리 영역으로서, 샘플 처리 영역은 부피 내의 하나 이상의 분석물을 검출하여 제1 샘플 판독값을 생성하게 하도록 구성된 검출 기재를 포함하는 것인 샘플 처리 영역; 및 하우징 내에 배치되고 샘플 처리 영역과 유체 연통하는 유체 저장조를 포함하고, 유체 저장조는, 샘플 처리 영역으로 전달될 때에 샘플 처리 영역 내에 배치된 시약을 수화시키고 장치의 작동 중에 검출 기재를 세정할 수 있는 유체를 수용한다.
다양한 실시예들에서, 도 1, 도 2 및 도 3a의 장치(10, 20 또는 30)는, 분석물의 검출 및/또는 하나 이상의 분석물의 농도의 측정을 원할 때에, 비제한적인 예로서, 제1 샘플 영역을 생략하고 제2 샘플 영역만을 포함한다. 이들 실시예에서, 제2 샘플 영역은 샘플 처리 영역으로서 지칭된다. 몇몇 실시예에서, 본 명세서에 개시된 장치는 제2 샘플 영역만을 포함한다. 다른 실시예에서, 검사될 샘플 부피는 제1 샘플 영역으로 이동되기 전에 입구 및/또는 수직 입구로부터 제2 샘플 영역으로 직접 이동된다. 변형예에서, 샘플 부피는 제1 샘플 영역으로 이동한 후에 제2 샘플 영역으로 이동된다.
특정 실시예에서, 도 3b 및 도 3c는 도 3a의 장치(30)와 유사하게, 표면 에너지 기반 유동 지연 메카니즘을 구현하는 미세 유체 장치를 사용하여 얻어진 예시적인 유동 결과를 예시한다. 도 3b는 제2 샘플 영역으로서 작용하는 미세 다공성 멤브레인(패터닝된 니트로셀룰로오스 멤브레인)으로 적색 식용 염료를 함유하는 샘플 유체의 지연된 유동을 예시한다. 그러한 구조는, 압력 구동 유동이 큰 종이 영역에 흡수되고 멤브레인의 측면 채널을 거슬러 내려간 다음 크로마토그래피 분석을 수행하기 위해 우회할 때에 모세관 유동이 하류 반응을 유도하게 할 수 있다. 도 3c는 미세 다공성 기재를 습윤시키기 전에 관통 구멍 직경과 지연 시간 사이의 관계를 예시하는 그래프이다. 구멍 직경이 200 μm일 때에, 약 0 초 내지 약 60 초 범위의 지연 시간의 높은 가변성이 관찰된다. 그러나, 가변성은 300 μm 및 400 μm의 구멍 직경을 갖는 장치에서 더 낮고, 이는 약 10 초의 지연 시간을 나타낸다. 도 3b의 실시예에서, 칩 기재 개구는 직경이 약 300 μm이고, 이는 감압 접착제 관통 구멍 직경 대 칩 기재 개구 직경의 이상적인 비율이 약 0.5:1 내지 약 2:1이라는 점을 시사한다.
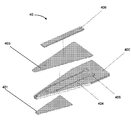
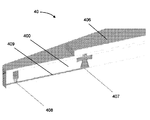
특정 실시예에서, 도 4a 및 도 4b는 몇몇 실시예에 따라, 수동 밸브를 갖는, 몰삼투압 농도와 관심 대상인 분석물의 통합된 검출을 위한 미세 유체 장치(40)를 예시한다. 장치(40)의 분해도를 예시하는 도 4a의 실시예에서, 미세 유체 모세관 칩(400)은 바닥 모세관 채널의 일 표면을 형성하는 친수성 감압 접착제(401), 미세 유체(404)를 칩(400)의 상부면 상에 밀봉하는 양면 감압 접착제층(403)과 함께 층상으로 조립된다. 양면 층(403)은, 각각 세정액을 받아들이고 공기가 빠져나가게 하는 유체 입구 및 공기 출구 포트(405)까지 연장된다. 제2 샘플 영역으로서 작용하는 검출 기재(비제한적인 예로, 미세 다공성 멤브레인 또는 기재)(406)는 양면 감압 접착제(403)에 대해 가압 밀봉된다. 도 4b는 수동 밸브(407), 유체 입구(408), 및 모세관 채널(409)의 상세를 볼 수 있는 조립된 미세 유체 장치(40)의 단면도를 도시한다. 몇몇 실시예에서, 모세관 채널(409)은 몰삼투압 농도를 분석하기 위한 제1 샘플 영역의 역할을 하고, 검출 기재(406)는 관심 대상인 하나 이상의 분석물을 검출하기 위한 제2 샘플 영역의 역할을 한다. 몇몇 실시예에서, 샘플 부피는 제1 샘플 영역의 모세관 채널(409) 내로 포집되고 전술한 메카니즘을 통해 수동 밸브(407)에 의해 제2 샘플 영역으로 유동하는 것이 제한된다. 몇몇 실시예에서, 세정 입구(408)를 통해 채널(409) 내로 세정액이 도입되면, 샘플 부피는 채널(409)로부터 제2 샘플 영역의 검출 기재(406)로 변위된다.
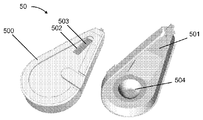
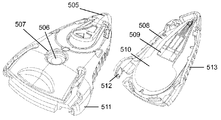
특정 실시예에서, 도 5a는 몇몇 실시예에 따라, 몰삼투압 농도와 관심 대상인 분석물의 통합 검출을 위한 조립된 미세 유체 장치(50)의 평면도(좌측) 및 저면도(우측)를 도시한다. 본 명세서에 제공된 다른 실시예와 유사하게, 장치(50)는 미세 유체 캡슐(500)과 미세 유체 칩(501)을 포함한다. 캡슐(500)은 검출 기재(503)(비제한적인 예로서, 미세 다공성 기재)의 일부를 볼 수 있는 윈도우(502)를 포함한다. 몇몇 실시예에서, 기재(503)는 측방 유동 분석 또는 다른 분석물 검출 분석의 판독이 (비제한적인 예로서, 사용자 또는 판독기 시스템과 같은 검출 장치에 의해) 윈도우(502)를 통해 관찰되도록 배치된다. 몇몇 실시예에서, 장치(50)는 또한 전술한 바와 같이 테스트되는 유체 샘플을 미세 유체 칩(501)의 모세관 채널로부터 검출 기재(503)로 변위시키기 위해 유체 부피를 방출하도록 기계적으로 작동되는 유체 저장조(504)(비제한적인 예로서, 전달 유체, 세정 유체 및/또는 수화 유체로서 사용되는 유체 부피를 함유하는 블리스터 팩)을 포함한다. 도 5a의 실시예에서, 블리스터 팩의 외부면은 노출된다. 몇몇 실시예에서, 블리스터 팩은 작동을 허용하는 작은 구멍을 제외하고는 실질적으로 덮여 있다. 몇몇 실시예에서, 블리스터 팩의 구성은 우발적인 작동 및 파열의 가능성을 최소화하기 위해 사용자가 블리스터 팩에 액세스하는 것을 방지하도록 사용된다. 도 5b는 몰삼투압 농도와 관심 대상인 분석물의 합동 검출, 또는 몰삼투압 농도와 관심 대상인 분석물의 개별 검출을 위한 조립된 미세 유체 장치의 실시예를 도시한다. 이 특정 실시예에서, 통합된 시스(505; sheath)는 미세 유체 칩, 윈도우 및 검출 기재의 팁을 보호하고, 일단 장치가 펜형 장치 상에 배치되고 테스트 할 준비가 되면 통합된 시스(505)가 제거된다. 블리스터 팩 저장조(506)는 캡슐(하우징)에 의한 사용자 상호 작용으로부터 보호되지만, 캡슐/하우징 홀(507)은 플런저[도시 생략, 비제한적인 예로서, 미세 유체 장치(50) 외부의 적절한 크기의 플런저)가 블리스터를 파열시키게 하고 캐리어(508) 내의 미세 유체 네트워크를 통해 압력 구동 유동을 제공하는데, 캐리어는 감압 접착제(510)를 통해 미세 유체 몰삼투압 농도 칩(509)에 결합된다. 몇몇 실시예에서, 캡슐 날개(511) 및 플랜지(512)는 대향 펜을 위한 기계적 메이팅 피쳐를 제공하고, 그립 피쳐(513)는 사용자가 전체적으로 장치를 용이하게 파지하고 취급할 수 있게 한다.
전술한 실시예는, 몇몇 실시예에서, 몰삼투압 농도 및 관심 대상인 다른 분석물이 최소한의 사용자 상호 작용으로 동일한 플랫폼 상에서 정량화되게 한다. 몇몇 실시예에서, 본 명세서에 설명된 미세 유체 장치는 샘플 포집 및 측정 결과의 판독을 용이하게 하도록 다양한 상이한 포맷으로 제공된다. 비제한적인 예로서, 미세 유체 장치는 펜형 장치와 함께 사용되는 일회용 유닛으로서 제공된다. 몇몇 실시예에서, 펜 장치는 미세 유체 장치를 수용하여 결합하도록 형성된다. 몇몇 실시예에서, 펜 장치는 미세 유체 장치를 유효화하고 미세 유체 장치가 사용되지 않고 샘플링할 준비가되어 있음을 사용자에게 알린다. 몇몇 실시예에서, 사용자는 샘플링 팁을 깨끗하게 유지하는 보호 시스를 제거하고 샘플링 팁을 사용하여 환자로부터(비제한적인 예로서, 한쪽 눈으로부터 또는 양쪽 눈으로부터) 눈물을 포집한다.
몇몇 실시예에서, 본 명세서에 개시된 시스템, 장치 및 방법은 베이스 유닛을 포함한다. 몇몇 실시예에서, 베이스 유닛은 미세 유체 장치에 가역적으로 부착된다. 다른 실시예에서, 가역적 부착은 기계적 부착, 유체 연통, 및 전기 또는 전자 통신으로부터 선택된 하나 이상이다. 몇몇 실시예에서, 일단 샘플 포집이 완료되면, 펜 장치 및 결합된 미세 유체 장치는 임의의 능동 밸브를 자동적으로 작동시켜 세정액의 방출 및 유동을 가능하게 하는 베이스 유닛(비제한적인 예로서, 판독 장치)에 도킹된 다음, 분석물 검출 분석을 수행하고 및/또는 기록된 샘플 판독값을 판독한다. 다른 실시예에서, 일단 샘플 포집이 완료되면, 펜 장치 및 결합된 미세 유체 장치는, 플런저를 자동적으로 작동시켜 최종적으로 블리스터 팩을 파열시키고 미세 유체 회로를 통한 전달 유체의 방출 및 유동을 가능하게 하는 베이스 유닛(비제한적인 예로서, 판독 장치)에 도킹된 다음, 분석물 검출 분석을 수행하고 및/또는 기록된 샘플 판독값을 판독한다. 몇몇 실시예에서, 사용자는 눈물 포집 후에 펜 장치로부터 미세 유체 장치를 제거하고 미세 유체 장치를 베이스 유닛 내에 위치시킨 다음, 자동적으로 작동을 수행하고 샘플 판독 결과를 표시한다. 그러한 실시예에서, 펜 장치는 기록된 몰삼투압 농도 판독값을 (비제한적인 예로서, 무선 통신 방법을 이용하여) 베이스 유닛에 전달하고 베이스 유닛은 관심 대상인 분석물의 분석을 수행한다. 다수의 분석물이 이 시스템에 의해 조사될 수 있다고 가정하면, 몇몇 실시예에서, 일회용 미세 유체 장치는 베이스 유닛이 관련 분석 파라미터(비제한적인 예로서, 타이밍, 강도, 여기 파장, 방출 파장, 또는 분석물의 갯수)를 인식하게 하는 바코드 또는 2 차원 바코드 등의 마킹을 포함하고 적절한 분석 절차를 수행한다. 변형예에서, 미세 유체 장치 자체는 사용자에 의해 직접 판독되는 관심 대상인 분석물의 반정량적 또는 정성적 광학 판독을 제공한다.
몇몇 실시예에서, 펜 장치는 충분한 양의 눈물 유체가 수집되면 이를 검출하고 사용자에게 알리는 메카니즘을 포함한다(비제한적인 예로서, 경고음 등을 포함하는 가청 신호, 조명 등을 포함하는 시각 신호, 진동 등을 포함하는 촉각 신호). 몇몇 실시예에서, 사용자는 일회용 미세 유체 장치를 제거하고, 수동으로 블리스터를 눌러 블리스터로부터 유체를 방출한 다음, 분석을 위해 미세 유체 장치를 베이스 유닛에 도킹시킨다.
본 명세서에서 설명된 시스템, 장치 및 방법은 다양한 분석 형식과 양립할 수 있다. 분석의 비제한적인 예는 효소 결합 면역 흡착 분석(ELISA; enzyme-linked immunosorbent assay)에 기초한 분석, 샌드위치 ELISA, 경쟁적 ELISA, 나노 입자 기반 검출, 표면 플라스몬 공명(SPR; surface plasmon resonance) 기반 검출, 전기 화학적 검출, 크로마토그래피 검출, 플로우 스루 분석, 측방 유동 등으로부터 선택된 하나 이상을 포함한다. 몇몇 실시예에서, 미세 다공성 기재가 세정액을 포획하는 역할을 하고 분석 반응은 모세관 채널 내에서 수행된다. 비 제한적인 예로서, 특정 실시예에서, 몰삼투압 농도를 나타내는 임피던스 및 차동 임피던스 측정 모두는, 비특이적 항체가 부착된 상류의 상호 맞물림형 전극 어레이와 비교하여, 모세관 채널 내의 상호 맞물림형 전극 어레이 상에 나노 입자가 축적됨에 따라 이루어진다. 다른 실시예에서, 임피던스(몰삼투압 농도)와 전기 화학적 측정은 모세관 채널 내에서 이루어진다. 변형예에서, 몰삼투압 농도를 나타내는 임피던스 측정은 모세관 채널 내에서 이루어지고, 미세 다공성 기재는 형광 검출을 허용하는 측방 유동 기재로서 작용한다.
몇몇 실시예에서, 본 명세서에 제공된 기재는 (비제한적인 예로서, 제조 편차, 기재 밀도의 국부적 이방성으로부터의) 기재 불균질성, (기재의 공극 내에 축적되는 미립자 물질 및 생물학적 가교 결합으로 인한) 막힘 및/또는 다른 유체 이방성 소스의 효과를 최소화시키기 위해 샘플 영역에 걸쳐서 유동 균질성을 증가시키도록 형성된 기하학적 형태를 갖는다. 몇몇 실시예에서, 기하학적 형태는 검출 기재에서 증가된 유동 저항의 미리 결정된 영역을 생성하도록 설계된다. 이러한 방식으로 유동 저항을 이용함으로써, 시간 지연, 예측 가능한 유동 팽창 및/또는 유동 수축이, 샘플 영역의 막힘 및 불균일한 습윤을 달리 야기할 수 있는 임의의 나노 입자 또는 생물학적 가교 결합이 감소되거나 제거되는 것을 보장하는 데에 사용될 수 있다. 몇몇 실시예에서, 유사하게, 기재는 모세관 채널로부터 멤브레인의 적어도 하나의 특정 영역으로의 유체 전달을 촉진시키는 동시에, 압력 구동 오버플로우가 제2 샘플 영역으로 들어가기보다는 멀리 위킹되는 것을 촉진하도록 작동 가능하게 형성된다. 몇몇 실시예에서, 적어도 하나의 특정 영역은 제1 또는 제2 샘플 영역이다. 다른 실시예에서, 작은 부피의 눈물 유체는 눈물 덩어리가 제1 샘플 영역을 지나쳐 갈 때까지 니트로셀룰로오스 멤브레인 내의 항체의 고 저항 필러(pillar)를 재수화하기에 불충분할 수 있으므로, 기재는 매립된 포획 항체를 수화시키기 위해 전달 유체가 ELISA의 반응 성분 전에 하류로 우선적으로 유동하게 하도록 작동 가능하게 형성된다.
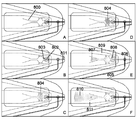
도 6a 내지 도 6e는 많은 실시예에 따라, 유체가 유동 방향으로 제2 샘플 영역을 가로지를 때에 실질적으로 등방성(균일한) 유체 전방을 달성하기 위한 기하학적 형태를 갖는 예시적인 검출 기재들을 도시한다. 도 6f 내지 도 6g는 상류 나노 입자 분포 및 결과적인 비변형된 유동의 초기 조건의 직접적인 결과로서 비균질한 이방성 나노 입자 하류 분포의 비제한적인 예를 도시한다. 구체적으로, 도 6f는 나노 입자가 스트라이프 포획 영역의 에지에 도달하는 것을 방지하는 보다 빠른 이동 유체에 의해 중앙 트레일로 집중되면서 중앙선(도면의 아래쪽에)에 점재된 나노 입자가 수직 상방으로 어떻게 유동하는 지를 도시한다. 도 6g는 정반대의 예를 도시하는데, 스트립의 폭을 가로질러 점재된 나노 입자는 에지로 밀려나서, 스트라이프 포획 영역의 외부 에지에서만 신호가 생성된다. 따라서, 도 6a는 패턴의 긴 에지보다 저항이 적기 때문에 중앙을 향해 유동을 집중시키는 패턴을 도시하는데, 이는 검출 나노 입자가 멤브레인의 전체 폭에 걸쳐 스트라이프될 때에 유용하다: 나노 입자가 유체 경로에 저항을 부가하기 때문에, 수평 나노 입자의 상류 스트라이프는 유체가 우선적으로 중앙 아래로 유동하면서 스트립의 먼 에지에 나노 입자를 침착시키게 하는 경향이 있고, 이에 따라, 중앙 아래로 유동을 집중시키면 균일한 유동 프로파일을 생성하는 데에 도움이 된다. 도 6b는 나노 입자가 중앙 아래에 점재된(또는 멤브레인 상으로 전달된) 경우를 보상하기 위해 유체를 에지를 향해 압박하기에 유용한 디자인의 특정 실시예를 입증한다. 도 6c 내지 도 6d는 단면 저항을 변화시킴으로써 유동을 보다 균일하게 하는 수축, 팽창 및 하류 저항기를 포함하는 상이한 유형의 유동 제어 구조물의 비제한적인 예를 도시한다. 또한, 도 6c 내지 도 6d의 이들 구조물은 균형을 돕고 무작위 불안정성이 멤브레인의 한 면에서 다른 면으로 유동을 이동시키는 것을 방지하는 하류 저항을 특징으로 한다. 이들 방안은, 특히 검출 가능한 성분이 나노 입자를 라벨로서 이용하는 경우에 샘플이 멤브레인을 가로질러 유동하는 횟수 만큼 시간과 공간에 따라 변화하는 저항을 검출 가능한 성분이 도입하는 안내 없이는 시료 유동 전방이 유체 채널 또는 검출 영역을 가로질러 검출 가능한 성분들의 균일한 운반을 허용하지 않을 수 있기 때문에 작은 샘플 부피를 분석할 때에 매우 중요하다.
도 6a 내지 도 6e와 관련하여, 몇몇 실시예에서, 검출 기재는 전술한 바와 같이 미세 다공성 멤브레인 또는 미세 다공성 기재이다. 몇몇 실시예에서, 기재는 유동 제한부를 생성하도록 설계된 하나 이상의 기하학적 형태를 포함한다. 그러한 기하학적 형태는, 비제한정적인 예로서, 펀칭, 가열, 브랜딩, 왁스 침착, 항체 또는 다른 단백질 침착, 고 저항 폴리머 또는 무기 화합물의 공유 결합, 또는 레이저 패터닝과 같은 다양한 방법에 의해 제조된다. 도 6a 내지 도 6e의 도시에서, 유체 유동은 유동 균질화를 증가시키기 위한 제한 후에 유입 영역 효과 및 유동 팽창을 이용하기 위해 샘플 부피가 기재를 통해 (바닥에서 상부로) 이동하게 하도록 설계된다. 예컨대, 도 6a의 기재는 기재의 중앙 근처에 일련의 평행한 세장형 구멍을 포함한다. 구멍의 길이는 기재의 에지로부터 중앙으로 가면서 감소한다. 도 6b의 기재는 기재의 에지로부터 중앙으로 가면서 구멍의 길이가 증가한다는 점을 제외하고 도 6a의 기재와 유사하다. 도 6c의 기재는 격자 패턴으로 배치된 복수 개의 작은 개구를 포함한다. 도 6d의 기재는 모래 시계 형상으로 형성되어 기재의 중앙부가 단부보다 상당히 좁다. 도 6e의 기재는 중앙부에 타원형 구멍을 포함함으로써, 기재의 상단부가 2 개의 비교적 좁은 스트립 재료에 의해 기재의 하단부에 결합된다.
본 명세서에서 제공되는 특정 실시예는 또한 각각의 멤브레인 내에 평행한 샘플 영역을 허용하도록 유동 집중시키는 데에 적합하다. 도 6d 및 도 6e의 실시예는 평행한 샘플 처리가 가능하도록 기재의 상부에 일련의 평행한 채널을 포함한다. 몇몇 실시예에서, 이들 채널은 샘플 부피가 기재의 제한된 영역으로부터 팽창된 영역으로 통과한 후에 발생하는 증가된 유동 균질화를 이용하도록 설계된다.
몇몇 실시예에서, 전술한 바와 같이, 사용된 유체 부피는 매우 작다. 다른 실시예에서, 유체 부피는 샘플 유체 부피, 세정액 부피, 및 전달 유체 부피에서 선택된 하나 이상을 포함한다. 따라서, 다양한 실시예에서, 하나 이상의 추가 피쳐가 유동을 제어하고 샘플을 정확하게 계량하기 위해서 모세관 채널 및/또는 검출 기재에 통합된다. 그러한 피쳐의 비제한적 예는 모세관 채널 내의 표면 에너지의 높은 공간 주파수 변화로서, 증발 동안 물러나는 메니스커스의 형상을 변화시키는 속도 범프로서 작용하여 유체 부피의 이동을 효과적으로 늦추는 것으로 알려져 있다. 유사하게, 몇몇 실시예에서, 사형(serpentine) 채널 또는 다른 지연이 분석 타이밍을 조절하고 분석 감도를 향상시키도록 검출 기재에 패터닝된다(비제한적인 예로서, 더 느린 유동은 샘플 영역에 걸쳐 반응 시간을 더 길게 만든다).
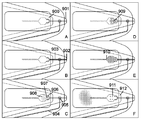
특정 실시예에서, 도 7은 많은 실시예에 따라 유체 타이밍 지연을 초래하는 검출 기재 패턴의 실시예를 예시한다. 몇몇 실시예에서, 검출 기재는 전술한 바와 같이 미세 다공성 멤브레인 또는 미세 다공성 기재이다. 몇몇 실시예에서, 검출 기재의 기하학적 형태는 타이밍 지연의 길이에 영향을 미침으로써 다양한 분석 파라미터에 관한 제어를 제공하도록 설계된다. 예컨대, 기재(700, 701, 702, 703)는 사형 채널 구조의 감소량을 나타내는데, 기재(700)는 가장 많은 사형 사형 구조를 갖고 기재(703)는 사형 구조를 갖지 않는다. 염료 전방(704, 705, 706, 707)이 각각의 기재(700, 701, 702, 703)를 가로질러 전진한 상이한 범위에 의해 입증되는 바와 같이, 기재 내의 사형 구조의 양은 기재를 통과하는 유체 유동이 지연되는 양에 영향을 미친다. 특히, 고도의 사형 기재(700)는 유체 유동의 최대 지연 시간을 나타내지만, 선형 기재(703)는 유체 유동의 최소 지연을 나타낸다.
특정 실시예에서, 도 8은 통합된 임피던스 전극을 갖는 폴리카보네이트 미세 유체 칩에 접합된 미세 다공성 니트로셀룰로오스 폴리머(800)(점선)의 바람직한 실시예를 예시한다. 이 실시예에서, 팁에서 나노 리터의 눈물 유체를 포집할 때에, 눈물 유체는 도 8a에 도시된 바와 같이 눈물 몰삼투압 농도에 대해 먼저 분석된다. 동일한 실시예에서, 컴퓨터 제어된 스텝 모터 구동식 플런저(도시 생략)를 통한 블리스터 팩 저장조의 후속 작동은 눈물을 포집 채널(801)로부터 수동 밸브(802)(벤트 밸브)를 지나 미세 다공성 니트로셀룰로오스 멤브레인 상으로 압박하는 공기 펄스를 생성하는데, 미세 다공성 니트로셀룰로오스 멤브레인에는 도 8b에 도시 된 바와 같이 [수동 밸브(802)의 상부로 실질적으로 하강하는] 설형 구조(803)가 패터닝되어 있다. 도 8c는 초기 블리스터 저장조 작동 후에, 그러나 파열되기 전에 미세 다공성 멤브레인 위로 완전히 위킹된 눈물 샘플(804)을 도시한다. 이 특정 실시예에서, 도 8d에서 블리스터의 파열을 기다리고 완충액 유동을 흐르게 하여 분석을 수행하는 동안, 눈물 샘플은 항체 기능화 형광 유로퓸 킬레이트 나노 입자(적색의 롱패스 필터가 있는 자외선(UV) 조명 하에 도시됨)를 포함하는 검출기 복합체에 의해 배양된다. 블리스터 파열 후에, 완충액은 미세 채널(805)을 통과하고, 팁 밸브(806)를 가로질러 아래로, 다시 채널(801)을 통해, 벤트 밸브(802)를 통해 위로, 설형부(803) 상으로 이동함으로써, 도 8e에 도시된 바와 같이, 제2 샘플 영역(807) 위에서 반응된 나노 입자/눈물 복합체의 유동을 트리거한다. 이 실시예에서, 완충액은 측방 유동 반응을 제공하면서 벤트 밸브와 설형부 위에 축적되어 4개의 조명광의 렌즈 반사에 의해 예시된 유체 돔(808)을 생성한다. 이 실시예에서, 미세 다공성 기재에는 밸브(802)에 인접한 오버플로우 채널(809)이 패터닝된다. 몇몇 실시예에서, 오버플로우 채널(809)은 유체가 멤브레인을 통과하기보다는 멤브레인 위로 이동하는 짧은 회로 경로를 제공하는, 측방 유동 분석에 걸쳐서 유체 생성 및 크레스팅(cresting)이라는 돔의 위험을 완화하는 데에 일조한다. 도 8f는 반응된 나노 입자/눈물 복합체(810)의 초기 덩어리가 미세 다공성 멤브레인 구조의 윤곽과 일치하도록 확산된, 완료된 분석의 결과를 보여준다. 몇몇 실시예에서, 덩어리(810)의 두께는 미세 다공성 멤브레인 상에 점재된 나노 입자의 초기 농도, 분포, 전하 밀도, 가교 결합 상태 및 부피에 의해 제어된다. 몇몇 실시예에서, 이용 가능한 전체 부피의 하위 세트만을 조사하도록 제2 샘플 영역을 구성함으로써, 분석은 스폿(811)의 강도가 상대적으로 부피 독립적으로 되게 한다. 몇몇 실시예에서, 분석 선형성 한계값 내에서, 눈물 내의 분석물의 농도가 높을 수록 스폿(811)의 강도가 높아지고, 농도가 낮을 수록 강도는 낮아진다.
도 9는 도 9a에 도시된 바와 같이 통합된 임피던스 전극을 갖는 폴리카보네이트 미세 유체 칩(901)에 접합된 니트로셀룰로오스 폴리머(900)(점선)의 바람직한 실시예를 예시한다. 가장 좌측의 팁(902)에서 나노 리터의 눈물 유체를 포집할 때에, 눈물 유체는 도 9b에서 채널(903) 내에 있는 동안에 눈물 몰삼투압 농도에 대해 먼저 분석된다. 컴퓨터 제어식 스텝퍼 모터 구동 플런저(도시 생략)를 통한 블리스터 팩 저장조의 후속 작동은, 채널(904)을 따라 팁 밸브(905)를 통해 이동하고, 눈물을 수동 벤트 밸브(906)를 지나 설형 구조(907; 캐리어 플라스틱 하우징(도시 생략)의 상부로부터 아래로 나오는 폴리카보네이트 핑거 돌출부에 의해 실질적으로 벤트 밸브의 상부로 가압됨)가 패터닝된 미세 다공성 멤브레인 상으로 압박하는 공기 펄스를 생성하여, 도 9c에 도시된 바와 같이 초리 샘플 전달을 초래한다. 도 9에 도시된 특정 실시예에서, 항체 기능화 Eu 킬레이트 나노 입자는 니트로셀룰로스 멤브레인이 아니라 분석을 수행하기 전에 벤트 밸브(906)에 포함되어, 포집 채널에 있는 동안에 눈물 및 나노 입자가 배양되게 한다. 도 9c에서 입증된 바와 같이, 다중 점재된 포획 항체(908)는, 유체의 작은 나노리터 부피가 샘플 영역을 효과적으로 재수화하는 것을 방지하는 유체 저항을 생성한다. 이는 도 9d에서 적색 필터링된 UV 조명 하에서도 볼 수 있는데, 여기서 나노 입자(909)의 작열(glow)이 포획 항체 스폿으로부터 효과적으로 배제된다. 관심 대상인 분석물 전체 전체가 유체의 초기 덩어리 내에 포함되므로, 스폿이 도 9e에 도시된 바와 같이 나노 입자가 포획 항체 위에서 유동하는 곳에서 크로마토그래피 분석을 용이하게 하도록 채널의 중앙을 통하는 것보다 낮은 저항을 갖기 때문에, 하류 유체 제한부(910)는 샘플 유체가 포획 스폿 주위가 아니라 포획 스폿을 통해 우선적으로 유동하게 하는 하류 저항의 증가를 생성한다. 통과할 때에 샘플 유체 내에 관심 대상인 일련의 검출 복합체 결합 분석물을 포획하는 샌드위치 면역 검사의 결과로서, 다중 결과(911)가 도 9f에서 확인된다. 또한, 분석 채널을 둘러싸는 오버플로우 채널(912)은 버퍼의 돔이 미세 다공성 기재의 상부 위로 유동하는 것을 방지하고 러닝 버퍼에 제2 샘플 영역을 통하는 것 이외의 최소 저항의 경로를 부여하기 위해 여분의 유체를 흡수한다.
몇몇 실시예에서, 모세관 채널, 검출 기재, 미세 다공성 기재, 캡슐, 모세관 칩, 캡슐의 내벽에 의해 형성된 공동, 저장조, 검출 기재에 유동적으로 연결된 통로, 밸브, 수직 입구, 및 입구로부터 선택된 2개의 요소가 서로 유체 연통한다.
몇몇 실시예에서, 본 명세서에 개시된 시스템, 장치 및 방법은 블리스터 팩 또는 동일한 용도를 포함한다. 몇몇 실시예에서, 블리스터 팩은 유체 부피를 내부에 보유하도록 구성되는 적어도 하나의 밀폐되고 밀봉된 부피를 포함한다. 몇몇 실시예에서, 블리스터 팩 내에 밀폐된 유체 부피는 작동 요소가 블리스터 팩에 인가될 때에 미리 결정된 방식으로 방출된다. 몇몇 실시예에서, 작동 요소는 본 명세서에 개시된 장치 또는 시스템의 외측에 또는 내측에 있다. 몇몇 실시예에서, 블리스터 내의 유체 부피는 제1 샘플 영역, 제2 샘플 영역, 또는 본 명세서에 개시된 장치 또는 시스템 내의 요소들의 중 하나 이상을 세정하는 데에 충분하다. 몇몇 실시예에서, 블리스터 내의 유체 부피는 샘플 유체를 제1 샘플 영역, 제2 샘플 영역, 또는 본 명세서에 개시된 장치 또는 시스템 내의 요소들 중 하나 이상으로 전달하기에 충분하여, 시스템 또는 장치는 이에 의해 전달된 샘플 유체를 기초로 하여 유효한 제1 샘플 판독값 또는 유효한 제2 샘플 판독값을 생성한다. 몇몇 실시예에서, 블리스터 내의 유체 부피는 약 10 nL 내지 약 50 μL의 범위, 예컨대 약 50 nL 내지 약 500 nL의 범위 내에 있다. 몇몇 실시예에서, 유체 부피는 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 90 nL, 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 약 10 μL, 약 11 μL, 약 12 μL, 약 13 μL, 약 14 μL, 약 15 μL, 약 16 μL, 약 17 μL, 약 18 μL, 약 19 μL, 약 20 μL, 약 21 μL, 약 22 μL, 약 23 μL, 약 24 μL, 약 25 μL, 약 26 μL, 약 27 μL, 약 28 μL, 약 29 μL, 약 30 μL, 약 31 μL, 약 32 μL, 약 33 μL, 약 34 μL, 약 35 μL, 약 36 μL, 약 37 μL, 약 38 μL, 약 39 μL, 약 40 μL, 약 41 μL, 약 42 μL, 약 43 μL, 약 44 μL, 약 45 μL, 약 46 μL, 약 47 μL, 약 48 μL, 약 49 μL, 또는 약 50 μL 중 임의의 2개의 값들 사이의 범위 내에 있다. 몇몇 실시예에서, 유체 부피는 약 20 μL, 약 250 nL, 약 200 nL, 또는 약 50 nL 이하이다. 유체 부피는 약 10 nL, 약 20 nL, 약 30 nL, 약 40 nL, 약 50 nL, 약 60 nL, 약 70 nL, 약 80 nL, 약 90 nL, 약 100 nL, 약 150 nL, 약 200 nL, 약 250 nL, 약 300 nL, 약 400 nL, 약 500 nL, 약 600 nL, 약 700 nL, 약 800 nL, 약 900 nL, 약 1 μL, 약 2 μL, 약 3 μL, 약 4 μL, 약 5 μL, 약 6 μL, 약 7 μL, 약 8 μL, 약 9 μL, 약 10 μL, 약 11 μL, 약 12 μL, 약 13 μL, 약 14 μL, 약 15 μL, 약 16 μL, 약 17 μL, 약 18 μL, 약 19 μL, 약 20 μL, 약 21 μL, 약 22 μL, 약 23 μL, 약 24 μL, 약 25 μL, 약 26 μL, 약 27 μL, 약 28 μL, 약 29 μL, 약 30 μL, 약 31 μL, 약 32 μL, 약 33 μL, 약 34 μL, 약 35 μL, 약 36 μL, 약 37 μL, 약 38 μL, 약 39 μL, 약 40 μL, 약 41 μL, 약 42 μL, 약 43 μL, 약 44 μL, 약 45 μL, 약 46 μL, 약 47 μL, 약 48 μL, 약 49 μL, 또는 약 50 μL 이하이다.
몇몇 실시예에서, 본 명세서에 개시된 시스템, 장치 및 방법은 계면을 포함한다. 다른 실시예에서, 계면은 제1 샘플 영역과 제2 샘플 영역 사이에 배치된다. 또 다른 실시예에서, 계면은 샘플 유체와 상호 작용하는 베어 멤브레인의 양을 최소화하도록 구성된다. 몇몇 실시예에서, 계면은 샘플 유체와 상호 작용하는 베어 멤브레인의 양을 최소화하도록 성형 및 배치된다.
따라서, 몇몇 실시예에서, 본 개시는 미세 유체 눈물의 포집과 관심 대상인 분석물의 생물학적 분석을 단일의 수용 장치에 통합하는 것을 용이하게 하는 시스템, 방법, 및 장치를 제공한다. 본 명세서에 설명된 통합된 장치의 다양한 실시예는 나노리터 규모의 눈물 포집, 눈물 유체의 정확한 계량, 눈물 몰삼투압 농도 측정을 용이하게 하는 유체 이동 지연, 검출 복합체에 의한 눈물 배양, 샘플 영역으로의 나노리터 액체의 타이밍 전달, 및/또는 관심 대상인 복수 개의 분석물의 블리스터-작동식 세정 및 광학적 정량화를 가능하게하는 피쳐를 허용한다. 몇몇 실시예에서, 그러한 분석의 결과는 안구 건조증, 녹내장, 당뇨병성 망막증, 알러지, 원추 각막, 황반 변성, 또는 다른 안질환과 같은 다양한 눈 상태의 치료 및 모니터링에 적용된다. 비제한적인 예로서, 본 명세서에 설명된 방안을 사용하여 생성된 샘플 판독값은 다양한 눈 상태에 대한 치료 계획을 조정하기 위한 기초로서 사용된다.
본 명세서에서 사용되는 바와 같이, A 및/또는 B는 A 또는 B 중 하나 이상, 및 이들의 조합, 예컨대 A와 B를 포함한다.
값들의 범위가 제공되는 경우, 그 범위의 상한과 하한 사이에서, 문맥에서 달리 명확하게 지시되지 않는 한, 하한 단위의 10 분의 1까지 각각의 중간의 값, 및 언급된 범위 내에서 임의의 다른 언급된 또는 중간의 값이 본 명세서에 제공된 개시 내에 포함된다. 몇몇 실시예에서, 이들의 보다 작은 범위의 상한 및 하한은 보다 작은 범위에 독립적으로 포함되고, 또한 언급된 범위에서 임의의 특별히 배제된 제한에 따라 본 개시 내에 포함된다. 언급된 범위가 한계 중 한쪽 또는 양쪽을 포함하는 경우, 이들 포함된 한계 중 어느 한쪽 또는 양쪽을 제외한 범위도 본 명세서에 제공된 개시 내에 포함된다.
몇몇 실시예에서, 범위는 본 명세서에서 "약" 하나의 특정값에서, 및/또는 "약" 다른 특정값까지 표현된다. 그러한 범위가 표현될 때, 다른 실시예는 하나의 특정값에서 및/또는 다른 특정값까지 포함한다. 유사하게, 값이 근사값으로 표현될 때, 선행하는 "약"의 사용에 의해, 특정값이 또 다른 실시예를 형성한다는 것이 이해될 것이다. 범위의 각각의 종점은 다른 종점과 관련하여, 그리고 다른 종점과는 독립적으로 중요하다는 것이 또한 이해될 것이다. 본 명세서에 사용되는 용어 "약"은 특정 용도의 문맥 내에서 언급된 수치값으로부터 ±10%인 범위를 지칭한다.
달리 명시하지 않는 한, 현재 기술된 방법 및 프로세스는 임의의 순서로 수행된다. 비제한적인 예로서, 단계 (a), (b) 및 (c)를 설명하는 방법은 먼저 단계 (a)가 수행된 후에, 단계 (b)가 그 다음 단계 (c)가 수행된다. 또는, 몇몇 실시예에서, 방법은, 비제한적인 예로서, 먼저 단계 (b), 그 후에 단계 (c), 그리고 그 다음에 단계 (a)와 같은 상이한 순서로 수행된다. 또한, 몇몇 실시예에서, 이들 단계는, 특이적으로 달리 특정되지 않는 한, 동시에 또는 개별적으로 수행된다.
본 개시의 장치, 디바이스, 시스템 및 그 구성요소 중 임의의 것의 특정 치수는 본 명세서의 개시를 고려하여 당업자에게 명백한 바와 같이, 소기의 용례에 따라 쉽게 변경될 수 있다. 또한, 본 명세서에 설명된 예 및 실시예는 단지 예시를 위한 것이며, 그에 대한 다양한 수정 또는 변경이 당업자에게 제시될 수 있으며 본 출원의 사상 및 범위와 첨부된 청구범위 내에 포함된다. 본 명세서에에 설명된 실시예들의 다수의 상이한 조합이 가능하며, 그러한 조합은 본 개시의 일부분으로 고려된다. 또한, 본 명세서의 임의의 일 실시예와 관련하여 논의된 모든 피쳐는 본 명세서의 다른 실시예에서의 사용에 쉽게 적용될 수 있다. 상이한 실시예들에서 유사한 피쳐들에 대해 상이한 용어 또는 참조 번호를 사용하는 것이 반드시 명시적으로 기재된 것과 다른 차이점을 의미하는 것은 아니다.
달리 정의되지 않는 한, 본 명세서에서 사용되는 모든 기술 용어는 본 발명이 속하는 기술 분야의 숙련자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다. 본 명세서 및 첨부된 청구범위에 사용되는 바와 같이, 단일 형태는 문맥에서 명확하게 달리 지시되지 않는 한 복수의 언급을 포함한다. 본 명세서에서 "또는"에 대한 임의의 언급은 달리 지적되지 않는 한 "및/또는"을 포함하도록 의도된다. 본 명세서 및 청구범위에 사용되는 바와 같이, 달리 지적되지 않는 한, 용어 "약" 또는 "대략"은, 실시예에 따라, +/- 1 %, +/- 2 %, +/- 3 %, +/- 4 % +/- 5 %, +/- 6 %, +/- 7 %, +/- 8 %, +/- 9 %, +/- 10 %, +/- 11 %, +/- 12 % +/- 14 %, +/- 15 %, +/- 16 %, +/- 17 %, +/- 18 %, +/- 19 %, +/- 20 %, +/- 22 %, 또는 +/- 25 %이다. 비제한적인 예로서, 약 100 미터는 실시예에 따라 95 미터 내지 105 미터, 90 미터 내지 110 미터, 또는 85 미터 내지 115 미터의 범위를 나타낸다.
예 1
이 예는 작은 부피의 유체 샘플에서 몰삼투압 농도와 관심 대상인 분석물의 양을 모두 측정할 수 있는 장치의 작동을 설명한다.
장치는 도 8 및 도 9와 관련하여 전술한 바와 같이 구성되고 작동되었다. 도 8에 예시된 바와 같이, 250 ng/mL IgE가 섞인 약 150 nL의 인간 눈물을 조립된 장치의 유체 입구에 인가하였다. 조립된 장치는 샘플의 임피던스 및 온도를 조사하면서 유체를 모세관으로 위킹한다. 샘플의 도입은 임피던스의 급격한 감소를 유발하고, 이는 컴퓨터 프로그램을 트리거시켜 플런저를 하강시키기 시작함으로써 조립된 장치의 캡슐/하우징 내에 배치된 블리스터 팩 저장조를 파열시킨다. 블리스터가 파열하고 전달 유체가 시스템을 통과하면, 직경 36 픽셀의 스폿이 52.74의 평균 8 비트 강도로 나타나고, 동일한 스폿의 상류 배경 평균은 28.14를 보이고 하류 배경 평균은 20.23을 보였으며, 그 결과 최종 신호는 적색 채널로부터 52.74 - ((28.14 + 20.23)/2) = 28.56이 되었다. 100 ng/mL의 혼합 IgE를 이용하는 동등한 설정은 34.12의 스폿 강도, 28.88의 상류 배경 평균 및 21.71의 하류 강도를 초래하였고, 그 결과 최종 신호는 34.12 - ((28.88 + 21.71)/2) = 8.83이 되었고, 건강한 비혼합형 대조군 눈물 샘플은 21.91의 스폿 강도, 23.46의 상류 배경, 및 19.03의 하류 배경을 초래하였고, 그 결과 최종 신호는 21.91 - ((23.46 + 19.03)/2) = 0.67이 되었다. 250 ng/mL의 신호 대 잡음비는 42.3이었고, 100 ng/mL 샘플의 신호 대 잡음비는 13.2였다. 이 실험은 매우 작은 샘플 부피에서 관심 대상인 분석물의 검출 및 정량화를 입증하였다. 장치는 또한 몰삼투압 농도를 측정할 수 있었지만, 테스트 샘플에서 관심 대상인 하나 이상의 분석물의 존재 및/또는 양을 측정하도록 장치를 구성 할 수 있다고 생각된다.
본 발명의 바람직한 실시예가 본 명세서에 도시되고 설명되었지만, 당업자에게는 그러한 실시예가 단지 예로서 제공된다는 것이 명백할 것이다. 본 발명으로부터 벗어남이 없이 당업자에게 다양한 변형, 변화 및 대체가 안출될 것이다. 본 명세서에 설명된 본 발명의 실시예에 대한 다양한 변형예가 본 발명을 실시하는 데에 채용될 수 있다는 점을 이해해야 한다. 이하의 청구범위는 본 발명의 범위를 한정하고, 청구범위 및 그 균등물의 범주 내에 있는 방법 및 구조가 그 범위에 의해 커버된다.
본 명세서에 언급된 각 특허 문헌 및 과학 기사의 전체 개시는 모든 목적을 위해 참조로 포함된다.
본 발명은 그 사상 또는 본질적인 특성에서 벗어남이 없이 다른 특정 형태로 구현될 수 있다. 따라서, 전술한 실시 예는 본 명세서에서 설명된 본 발명을 제한하는 것이 아니라 예시적인 모든 면에서 고려되어야 한다. 따라서, 본 발명의 범위는 전술한 설명보다는 첨부된 청구범위에 의해 지시되며, 청구범위의 균등 범위 및 의미 내에 있는 모든 변화가 그 안에 포함되는 것으로 의도된다.
Claims (89)
- 유체 샘플 분석 장치로서,
(a)유체 샘플의 부피를 수용하도록 형성되고 제1 샘플 판독값을 생성하기 위해 부피의 에너지 특성을 검출하도록 구성되는 적어도 하나의 트랜스듀서를 포함하는 제1 샘플 영역; 및
(b)상기 제1 샘플 영역과 유체 연통하고 상기 부피의 적어도 일부를 수용하도록 형성되는 제2 샘플 영역
을 포함하고, 상기 제2 샘플 영역은 제2 샘플 판독값을 생성하기 위해 부피 내의 하나 이상의 분석물을 검출하도록 구성되는 검출 기재를 포함하는 것인 유체 샘플 분석 장치. - 제1항에 있어서,
상기 제1 샘플 영역으로부터 제2 샘플 영역으로의 유체 유동을 제어하는 계량 메카니즘
을 더 포함하는 유체 샘플 분석 장치. - 제2항에 있어서, 상기 계량 메카니즘은 수동 밸브를 포함하는 것인 유체 샘플 분석 장치.
- 제3항에 있어서, 상기 수동 밸브는 제2 샘플 영역으로 부피의 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함하는 것인 유체 샘플 분석 장치.
- 제2항에 있어서, 상기 계량 메카니즘은 능동 밸브를 포함하는 것인 유체 샘플 분석 장치.
- 제5항에 있어서, 상기 능동 밸브는 소수성 코팅을 갖는 전극을 포함하고, 전극에 대한 전압의 인가는 소수성 코팅을 용해시킴으로써, 제2 샘플 영역으로 부피의 적어도 일부의 유동을 허용하는 것인 유체 샘플 분석 장치.
- 제6항에 있어서, 상기 소수성 코팅은 알칸티올 자체 조립 단층(alkanethiol self-assembled monolayer)을 포함하는 것인 유체 샘플 분석 장치.
- 제1항에 있어서, 상기 제1 샘플 영역은 모세관 채널을 포함하는 것인 유체 샘플 분석 장치.
- 제8항에 있어서, 상기 모세관 채널의 적어도 하나의 벽은 감압 접착제층을 포함하는 것인 유체 샘플 분석 장치.
- 제9항에 있어서, 상기 감압 접착제층은 부피의 적어도 일부와 상호 작용하여 모세관 채널을 통한 부피의 적어도 일부의 유동을 지연시키는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치되는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 유체 샘플은 눈물 유체를 포함하는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타내는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 제2 샘플은 유체 샘플 내의 하나 이상의 분석물의 존재 또는 농도를 나타내는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있는 것인 유체 샘플 분석 장치.
- 제15항에 있어서, 상기 부피는 약 50 nL 내지 약 250 μL의 범위 내에 있는 것인 유체 샘플 분석 장치.
- 제1항에 있어서, 상기 부피는, 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 중 임의의 2개의 값들 사이의 범위 내에 있는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 약 20 μL 이하인 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 약 250 μL 이하인 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 약 200 μL 이하인 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 약 50 μL 이하인 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 부피는 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 이하인 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서,
전달 유체를 수용하고 상기 제1 샘플 영역과 유체 연통하는 유체 저장조
를 더 포함하는 유체 샘플 분석 장치. - 제23항에 있어서, 상기 유체 저장조로부터 제1 샘플 영역으로 전달 유체의 도입은 부피의 적어도 일부가 제1 샘플 영역으로부터 제2 샘플 영역으로 변위되게 하는 것인 유체 샘플 분석 장치.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 상기 검출 기재는 미세 다공성 기재를 포함하고, 작동 중에, 부피의 적어도 일부는 미세 다공성 기재를 가로지르는 것인 유체 샘플 분석 장치.
- 제25항에 있어서, 상기 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는 것인 유체 샘플 분석 장치.
- 제25항에 있어서, 상기 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는 것인 유체 샘플 분석 장치.
- 제25항에 있어서, 상기 미세 다공성 기재는 실질적으로 균일한 유체 전방을 용이하게 하는 복수 개의 구멍을 포함하는 것인 유체 샘플 분석 장치.
- 유체 샘플 분석 방법으로서,
(a)유체 샘플의 부피를 제1 샘플 영역 내로 도입하는 단계;
(b)적어도 하나의 트랜스듀서를 이용하여 제1 샘플 영역에서 부피의 에너지 특성을 검출함으로써, 제1 샘플 판독값을 생성하는 단계;
(c)부피의 적어도 일부가 제2 샘플 영역으로 유동하게 하는 단계; 및
(d)검출 기재를 이용하여 제2 샘플 영역에서 부피의 적어도 일부 내의 하나 이상의 분석물을 검출함으로써, 제2 샘플 판독값을 생성하는 단계
를 포함하는 유체 샘플 분석 방법. - 제29항에 있어서,
계량 메카니즘을 이용하여 제1 샘플 영역으로부터 제2 샘플 영역으로의 유체 유동을 제어하는 단계
를 더 포함하는 유체 샘플 분석 방법. - 제30항에 있어서, 상기 계량 메카니즘은 수동 밸브를 포함하는 것인 유체 샘플 분석 방법.
- 제31항에 있어서, 상기 수동 밸브는 제2 샘플 영역으로 유체 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함하는 것인 유체 샘플 분석 방법.
- 제30항에 있어서, 상기 계량 메카니즘은 능동 밸브를 포함하는 것인 유체 샘플 분석 방법.
- 제33항에 있어서, 상기 능동 밸브는 소수성 코팅을 갖는 전극을 포함하고, 전극에 대한 전압의 인가는 소수성 코팅을 용해시킴으로써, 제2 샘플 영역으로 유체 유동을 허용하는 것인 유체 샘플 분석 방법.
- 제34항에 있어서, 상기 소수성 코팅은 알칸티올 자체 조립 단층을 포함하는 것인 유체 샘플 분석 방법.
- 제29항 내지 35항 중 어느 한 항에 있어서, 상기 제1 샘플 영역은 모세관 채널을 포함하는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 모세관 채널의 적어도 하나의 벽은 감압 접착제층을 포함하는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 감압 접착제층은 상기 모세관 채널 내에 배치된 유체와 상호 작용하여 모세관 채널을 통한 유체 유동을 지연시키는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치되는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 유체 샘플은 눈물 유체를 포함하는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 제1 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타내는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 제2 샘플은 유체 샘플 내의 하나 이상의 분석물의 농도를 나타내는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 부피는 약 50 nL 내지 약 250 μL의 범위 내에 있는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 부피는 약 20 μL 이하, 약 250 nL 이하, 약 200 nL 이하, 또는 약 50 nL 이하인 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서,
전달 유체를 제1 샘플 영역으로 도입하여 상기 부피의 적어도 일부를 제1 샘플 영역으로부터 제2 샘플 영역으로 변위시키는 단계
를 더 포함하는 유체 샘플 분석 방법. - 제46항에 있어서, 상기 전달 유체는 상기 제1 샘플 영역과 유체 연통하도록 유체 저장조로부터 도입되는 것인 유체 샘플 분석 방법.
- 제29항 내지 제35항 중 어느 한 항에 있어서, 상기 검출 기재는 미세 다공성 기재를 포함하고, 부피의 적어도 일부는 미세 다공성 기재를 가로지르는 것인 유체 샘플 분석 방법.
- 제48항에 있어서, 상기 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는 것인 유체 샘플 분석 방법.
- 제49항에 있어서, 상기 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는 것인 유체 샘플 분석 방법.
- 제49항에 있어서, 상기 미세 다공성 기재는 실질적으로 균일한 유체 전방을 용이하게 하는 복수 개의 구멍을 포함하는 것인 유체 샘플 분석 방법.
- 필요로 하는 개인의 눈 상태를 치료 또는 모니터링하는 방법으로서,
(a)개인으로부터의 눈물막 샘플의 부피를 분석 장치의 제1 샘플 영역 내에 포집하는 단계;
(b)적어도 하나의 트랜스듀서를 이용하여 제1 샘플 영역 내의 부피의 에너지 특성을 검출함으로써, 제1 샘플 판독값을 생성하는 단계;
(c)부피의 적어도 일부가 분석 장치의 제2 샘플 영역으로 유동하게 하는 단계;
(d)검출 기재를 이용하여 제2 샘플 영역 내의 부피의 적어도 일부 내의 하나 이상의 분석물을 검출함으로써, 제2 샘플 판독값을 생성하는 단계; 및
(e)상기 제1 및 제2 샘플 판독값을 기초로 하여 개인의 눈 상태를 치료하는 치료 계획을 조절하는 단계
를 포함하는 눈 상태의 치료 또는 모니터링 방법. - 제52항에 있어서, 상기 눈 상태는 건성 각결막염(Keratoconjunctivitis sicca)인 것인 눈 상태의 치료 또는 모니터링 방법.
- 유체 샘플 분석 장치로서,
(a)유체 입구;
(b)상기 유체 입구와 유체 연통하도록 장치 내에 배치되고 유체 샘플의 부피를 수용하도록 형성되는 샘플 영역으로서, 샘플 영역은 부피 내의 하나 이상의 분석물의 검출을 허용하여 제1 샘플 판독값을 생성하도록 구성되는 검출 기재를 포함하는 것인 샘플 영역; 및
(c)상기 장치 내에 배치되고 샘플 영역과 유체 연통하는 유체 저장조
를 포함하고, 유제 저장조는 전달 유체를 수용하며, 전달 유체는, 샘플 영역으로 전달될 때에, 샘플 영역 내에 배치된 시약을 수화시키는 것, 장치의 작동 중에 검출 기재를 세정하는 것, 또는 양자를 행할 수 있는 것인 유체 샘플 분석 장치. - 제54항에 있어서,
상기 유체 입구와 샘플 영역 사이의 유체 유동을 제어하는 계량 메카니즘
을 더 포함하는 유체 샘플 분석 장치. - 제55항에 있어서, 상기 계량 메카니즘은 수동 밸브 또는 능동 밸브를 포함하는 것인 유체 샘플 분석 장치.
- 제56항에 있어서, 상기 수동 밸브는 샘플 영역으로 부피의 유동을 제한하는 하나 이상의 기하학적 피쳐를 포함하는 것인 유체 샘플 분석 장치.
- 제56항에 있어서, 상기 능동 밸브는 소수성 코팅을 갖는 전극을 포함하고, 전극에 대한 전압의 인가는 소수성 코팅을 용해시킴으로써, 샘플 영역으로 부피의 적어도 일부의 유동을 허용하는 것인 유체 샘플 분석 장치.
- 제58항에 있어서, 상기 소수성 코팅은 알칸티올 자체 조립 단층을 포함하는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항 중 어느 한 항에 있어서,
상기 입구와 제1 샘플 영역 사이에 배치되어 이들과 유체 연통하는 제2 샘플 영역을 더 포함하고, 상기 제2 샘플 영역은 유체 샘플의 에너지 특성을 검출하도록 구성되는 적어도 하나의 트랜스듀서를 포함하는 것인 유체 샘플 분석 장치. - 제60항에 있어서, 상기 제2 샘플 영역은 모세관 채널을 포함하는 것인 유체 샘플 분석 장치.
- 제61항에 있어서, 상기 적어도 하나의 트랜스듀서는 모세관 채널의 벽에 위치되는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 유체 샘플은 눈물 유체를 포함하는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 제1 샘플 판독값은 유체 샘플 내의 하나 이상의 분석물의 존재 또는 농도를 나타내는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 제2 샘플 판독값은 유체 샘플의 몰삼투압 농도를 나타내는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 부피는 약 50 nL 내지 약 250 nL의 범위 내에 있는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 부피는 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 이하인 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항 또는 제62항 중 어느 한 항에 있어서, 상기 검출 기재는 미세 다공성 기재를 포함하고, 작동 중에, 부피의 적어도 일부는 미세 다공성 기재를 가로지르는 것인 유체 샘플 분석 장치.
- 제69항에 있어서, 상기 미세 다공성 기재는, 부피의 적어도 일부가 유동 방향으로 미세 다공성 기재를 가로지를 때에 실질적으로 균일한 유체 전방을 용이하게 하도록 구성되는 기하학적 형태를 갖는 것인 유체 샘플 분석 장치.
- 제69항 또는 제70항에 있어서, 상기 미세 다공성 기재는 모래 시계 형상의 기하학적 형태를 갖는 것인 유체 샘플 분석 장치.
- 제69항 또는 제70항에 있어서, 상기 미세 다공성 기재는 실질적으로 균일한 유체 전방을 용이하게 하는 복수 개의 구멍을 포함하는 것인 유체 샘플 분석 장치.
- 제54항 내지 제59항, 제61항, 및 제62항 중 어느 한 항에 있어서, 상기 검출 기재는 부피 내에 존재하는 경우, 하나 이상의 분석물을 직접적으로 또는 간접적으로 결합시킬 수 있는 고정화된 제1 결합제를 더 포함하는 것인 유체 샘플 분석 장치.
- 제73항에 있어서, 상기 제1 결합제는 항체 또는 항체의 항원 결합 단편, 아비딘-비오틴 결합 쌍의 멤버, 및 스트렙타비딘-비오틴 결합 쌍의 멤버로 이루어진 군으로부터 선택되는 것인 유체 샘플 분석 장치.
- 제73항에 있어서, 상기 검출 기재는 부피 내에 존재하는 경우 하나 이상의 분석물을 결합시킬 수 있는 제2 결합제를 더 포함하고, 제2 결합제는 선택적으로 검출 가능한 성분과 공액 결합되는 것인 유체 샘플 분석 장치.
- 제75항에 있어서, 상기 검출 가능한 성분은 나노 입자, 시각적으로 검출 가능한 라벨, 형광 라벨, 또는 생물 발광 라벨인 것인 유체 샘플 분석 장치.
- 유체 샘플 분석 방법으로서,
(a)유체 샘플의 부피를 제54항 내지 제59항, 제61항, 제62항, 제70항 또는 제74항 내지 제76항 중 어느 한 항의 유체 샘플 분석 장치의 샘플 영역 내로 도입하는 단계; 및
(b)유체 샘플 내에 존재하는 경우 부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 검출하는 단계
를 포함하는 유체 샘플 분석 방법. - 제77항에 있어서, 상기 유체 샘플은 눈물 유체를 포함하는 것인 유체 샘플 분석 방법.
- 제77항 또는 제78항에 있어서, 상기 부피는 약 10 nL 내지 약 10 μL의 범위 내에 있는 것인 유체 샘플 분석 방법.
- 제77항 또는 제78항에 있어서, 상기 부피는 약 50 nL 내지 약 250 nL의 범위 내에 있는 것인 유체 샘플 분석 방법.
- 제77항 또는 제78항에 있어서, 상기 부피는 10 nL, 20 nL, 30 nL, 40 nL, 50 nL, 60 nL, 70 nL, 80 nL, 90 nL, 100 nL, 150 nL, 200 nL, 250 nL, 300 nL, 400 nL, 500 nL, 600 nL, 700 nL, 800 nL, 900 nL, 1 μL, 2 μL, 3 μL, 4 μL, 5 μL, 6 μL, 7 μL, 8 μL, 9 μL, 또는 10 μL 이하인 것인 유체 샘플 분석 방법.
- 개인의 눈 상태를 치료 또는 모니터링하는 방법으로서,
(a)개인으로부터의 눈물막 샘플의 부피를 제54항 내지 제59항, 제61항, 제62항, 제70항, 및 제74항 내지 제76항 중 어느 한 항의 유체 샘플 분석 장치의 샘플 영역 내로 도입하는 단계;
(b)부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 검출하는 단계; 및
(c)부피 내의 하나 이상의 분석물의 존재 및/또는 농도를 기초로 하여 개인의 눈 상태를 치료하는 치료 계획을 조절하는 단계
를 포함하는 눈 상태의 치료 또는 모니터링 방법. - 제82항에 있어서, 상기 눈 상태는 건성 각결막염인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는 알러지인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는 당뇨병인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는 당뇨병성 망막증(diabetic retinopathy)인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는 연령 관련 황반 변성(age-related macular degeneration)인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는 녹내장(glaucoma)인 것인 눈 상태의 치료 또는 모니터링 방법.
- 제82항에 있어서, 상기 눈 상태는, 연령 관련 황반 변성, 알러지, 안검염(blepharitis), 백내장(cataract), 결막염(conjunctivitis), 봉와직염(cellulitis), 중심 장액 망막 병증(central serous retinopathy), 콩다래끼(chalazion), 콘택트 렌즈 관련 손상, 각막/결막 찰과상, 이영양증(dystrophies), 짓무름(erosion), 열상(laceration), 궤양(ulcer), 각막 이식 거부(corneal transplant rejection), 거대세포바이러스 망막염(cytomegalovirus retinitis), 당뇨병성 망막증(diabetic retinopathy), 안암(eye cancer), 푸크스 이영양증(Fuch's dystrophy), 그레이브스병(Grave's disease), 히스토플라스마증(histoplasmosis), 녹내장(glaucoma), 감염(infection), 각막염(keratitis), 원추 각막(keratoconus), 황반 질환(macular disease), 신생 혈관증(neovascularization), 고안압증(ocular hypertension), 시신경염(optic neuritis), 검열반(pinguecula), 익상편(pterygium), 망막 세포 변성증(retinitis pigmentosa), 망막 모세포종(retinoblastoma), 공막염(scleritis), 트라코마(trachoma), 첩모난생증(trichiasis), 및 포도막염(uveitis) 중 하나 이상인 것인 눈 상태의 치료 또는 모니터링 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462053923P | 2014-09-23 | 2014-09-23 | |
| US62/053,923 | 2014-09-23 | ||
| PCT/US2015/051772 WO2016049221A1 (en) | 2014-09-23 | 2015-09-23 | Systems and methods for integration of microfluidic tear collection and lateral flow analysis of analytes of interest |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170072188A true KR20170072188A (ko) | 2017-06-26 |
Family
ID=55581963
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177007833A KR20170072188A (ko) | 2014-09-23 | 2015-09-23 | 미세 유체 눈물 포집 및 관심 대상인 분석물의 측방 유동 분석의 통합을 위한 시스템 및 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US11536707B2 (ko) |
| EP (2) | EP3198257B1 (ko) |
| JP (1) | JP6792556B2 (ko) |
| KR (1) | KR20170072188A (ko) |
| CN (1) | CN106716116B (ko) |
| AU (1) | AU2015320685B2 (ko) |
| BR (1) | BR112017005121A2 (ko) |
| CA (1) | CA2959073A1 (ko) |
| CO (1) | CO2017002710A2 (ko) |
| ES (1) | ES2828278T3 (ko) |
| MX (1) | MX2017003454A (ko) |
| WO (1) | WO2016049221A1 (ko) |
Families Citing this family (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3198257B1 (en) | 2014-09-23 | 2020-08-12 | Tearlab Research, Inc. | System for integration of microfluidic tear collection and lateral flow analysis of analytes of interest |
| US10060838B2 (en) | 2015-04-09 | 2018-08-28 | Ut-Battelle, Llc | Capture probe |
| US9632066B2 (en) | 2015-04-09 | 2017-04-25 | Ut-Battelle, Llc | Open port sampling interface |
| US20200011778A1 (en) * | 2017-02-07 | 2020-01-09 | Arizona Board Of Regents On Behalf Of Arizona State University | Electrochemical osmolarity or osmolality sensor for clinical assessment |
| EP3580566A1 (en) | 2017-02-10 | 2019-12-18 | Quidel Corporation | Lateral flow assay with substrate having channels for controlled fluid flow |
| WO2018223058A1 (en) * | 2017-06-02 | 2018-12-06 | Northwestern University | Epidermal microfluidic sensor for sweat collection and analysis from aquatic athletes |
| CN107202891B (zh) * | 2017-06-27 | 2019-06-28 | 江苏大学 | 一种黄曲霉毒素b1免疫快速检测装置和检测方法 |
| DE102017211451B4 (de) * | 2017-07-05 | 2019-03-21 | Robert Bosch Gmbh | Mikromechanische Sensorvorrichtung und entsprechendes Herstellungsverfahren |
| CN108414034A (zh) * | 2018-02-05 | 2018-08-17 | 大连理工大学 | 一种基于毛细-蒸发效应可实时监测汗液流量的微泵 |
| JP7042140B2 (ja) * | 2018-03-30 | 2022-03-25 | 株式会社Provigate | センサチップ |
| EP3887827B1 (en) * | 2018-11-28 | 2024-01-17 | 2PI-sigma Corporation | Lateral flow assay with controlled conjugate and controlled flow time |
| CN111366518B (zh) * | 2020-01-22 | 2022-08-16 | 苏州大学 | 一种测定聚合物膜渗透性能的方法及装置 |
| CN111766181B (zh) * | 2020-06-29 | 2023-05-12 | 东北电力大学 | 原位水生态营养盐沉积物-上覆水界面迁移转化模拟系统 |
| WO2022150647A1 (en) * | 2021-01-07 | 2022-07-14 | Koniku, Inc. | System and methods for detection of volatile organic compounds in air |
| CN112973815B (zh) * | 2021-03-09 | 2022-06-03 | 西北大学 | 一种聚集非球形微游泳体的微流管道及一种过滤方法 |
| WO2022192571A1 (en) * | 2021-03-12 | 2022-09-15 | University Of Utah Research Foundation | A microfluidic microparticle-labeled impedance sensor array for enhancing bioassay sensitivity |
Family Cites Families (215)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5622871A (en) | 1987-04-27 | 1997-04-22 | Unilever Patent Holdings B.V. | Capillary immunoassay and device therefor comprising mobilizable particulate labelled reagents |
| US4028931A (en) | 1976-02-13 | 1977-06-14 | Cardio Pulminary Laboratory Research Foundation | Osmotic pressure sensing head |
| US4123701A (en) | 1976-07-01 | 1978-10-31 | United States Surgical Corporation | Disposable sample card having a well with electrodes for testing a liquid sample |
| JPS5443267Y2 (ko) | 1976-07-02 | 1979-12-14 | ||
| US4134730A (en) | 1977-09-20 | 1979-01-16 | Quame Babington A | Spotting systems and methods pertaining thereto |
| JPS5489797A (en) | 1977-12-27 | 1979-07-17 | Hokkaido Daigakuchiyou | Needle shaped colloid osmosis pressure meter |
| CH645391A5 (de) | 1978-02-21 | 1984-09-28 | Ciba Geigy Ag | Polymere mit succinylobernsteinsaeureester-resten. |
| US4150564A (en) | 1978-04-10 | 1979-04-24 | Wescor, Inc. | Osmometer for colloid osmometry |
| JPS5542048A (en) | 1978-09-19 | 1980-03-25 | Kyoto Daiichi Kagaku:Kk | Method of and apparatus for measuring freezing point depression using ultrasonic wave |
| US4269197A (en) | 1979-04-05 | 1981-05-26 | Gilbard Jeffrey P | Method of measuring tear osmolarity and apparatus therefor |
| US4301412A (en) | 1979-10-29 | 1981-11-17 | United States Surgical Corporation | Liquid conductivity measuring system and sample cards therefor |
| US4436094A (en) | 1981-03-09 | 1984-03-13 | Evreka, Inc. | Monitor for continuous in vivo measurement of glucose concentration |
| DE3110183C2 (de) | 1981-03-17 | 1983-12-01 | Franz Dr.-Ing. 1000 Berlin Wallner | Membranosmometer |
| JPS5810645A (ja) | 1981-07-13 | 1983-01-21 | Fuji Photo Film Co Ltd | フイルム状イオン選択電極及びこれを用いるイオン濃度測定法 |
| US4448207A (en) | 1981-11-03 | 1984-05-15 | Vital Metrics, Inc. | Medical fluid measuring system |
| US4449538A (en) | 1982-01-25 | 1984-05-22 | John Corbitt | Medical-electronic body fluid accounting system |
| US4475556A (en) | 1983-01-03 | 1984-10-09 | Reiff Theodore R | Rapid measurement of colloid osmotic equilibrium pressure |
| GB8306353D0 (en) | 1983-03-08 | 1983-04-13 | Stuart J F B | Monitoring of drug levels |
| GB8313846D0 (en) | 1983-05-19 | 1983-06-22 | City Tech | Gas sensor |
| DE3414866A1 (de) | 1984-04-19 | 1985-10-31 | Karl Dipl.-Phys. 8011 Pliening Schickle | Verfahren und vorrichtung zum messen der osmolaritaet von fluessigkeitsproben |
| DE3525668A1 (de) | 1984-10-31 | 1986-05-07 | Kernforschungsanlage Jülich GmbH, 5170 Jülich | Verfahren zur bestimmung des gehaltes an in einem loesungsmittel geloesten stoffen |
| US4603699A (en) | 1984-11-20 | 1986-08-05 | Himpens Jacques M | Apparatus and method for measuring osmotic pressure in situ |
| AU602868B2 (en) | 1985-06-27 | 1990-11-01 | Eos Technology Corporation | Sensor having ion-selective electrodes |
| US4867909A (en) | 1985-07-02 | 1989-09-19 | Dow Chemical Company | Novel catalytic electrically coducting polymeric articles |
| JPH0689954B2 (ja) | 1986-10-09 | 1994-11-14 | 株式会社日立製作所 | 極低温冷凍機の冷却部構造 |
| JPS63148159A (ja) | 1986-12-11 | 1988-06-21 | Horiba Ltd | イオン濃度等の測定方法 |
| KR900005223B1 (ko) | 1986-12-11 | 1990-07-21 | 가부시끼가이샤 호리바 세이사꾸쇼 | 이온농도등의 측정방법과 그 측정에 사용하는 계측기의 교정용시이트 및 교정방법 |
| CA1303983C (en) | 1987-03-27 | 1992-06-23 | Robert W. Rosenstein | Solid phase assay |
| EP1248112A3 (en) | 1987-04-27 | 2004-08-25 | Inverness Medical Switzerland GmbH | Immunochromatographic specific binding assay device |
| US4787963A (en) | 1987-05-04 | 1988-11-29 | Syntro Corporation | Method and means for annealing complementary nucleic acid molecules at an accelerated rate |
| US5211055A (en) | 1987-10-27 | 1993-05-18 | Kernforschungsanlage Lulich Gesellschaft mit beschrankter Haftung | Apparatus for the selective determination of the concentration of a substance dissolved in a solvent |
| US5132012A (en) | 1988-06-24 | 1992-07-21 | Hitachi, Ltd. | Liquid chromatograph |
| AU2684488A (en) | 1988-06-27 | 1990-01-04 | Carter-Wallace, Inc. | Test device and method for colored particle immunoassay |
| DE3825208C1 (ko) | 1988-07-25 | 1989-11-02 | Ernst Prof. Dr. 8581 Eckersdorf De Steudle | |
| US5143080A (en) | 1988-12-07 | 1992-09-01 | York Kenneth K | In vivo osmometer |
| US4996993A (en) | 1988-12-07 | 1991-03-05 | York Kenneth K | In vivo osmometer |
| US4951683A (en) | 1989-01-19 | 1990-08-28 | Davis Jeffrey P | Device for detecting keratoconjunctivitis sicca |
| AT403528B (de) | 1989-04-04 | 1998-03-25 | Urban Gerald | Mikro-mehrelektrodenstruktur für elektrochemische anwendungen und verfahren zu ihrer herstellung |
| DE69025969T2 (de) | 1989-04-05 | 1996-08-08 | Univ New York | Verfahren zur Charakterisierung von Teilchen |
| US5094959A (en) | 1989-04-26 | 1992-03-10 | Foxs Labs | Method and material for measurement of oxygen concentration |
| US5491097A (en) | 1989-06-15 | 1996-02-13 | Biocircuits Corporation | Analyte detection with multilayered bioelectronic conductivity sensors |
| JPH0353550A (ja) | 1989-07-21 | 1991-03-07 | Nec Corp | Icパッケージ |
| US5218088A (en) | 1989-11-02 | 1993-06-08 | Purdue Research Foundation | Process for preparing dithiophosphate oligonucleotide analogs via nucleoside thiophosphoramidite intermediates |
| US5112622A (en) | 1990-01-19 | 1992-05-12 | Kopp Klaus F | Intravenous solutions for influencing renal function and for maintenance therapy |
| US5141850A (en) | 1990-02-07 | 1992-08-25 | Hygeia Sciences, Inc. | Porous strip form assay device method |
| CA2043807A1 (en) | 1990-07-19 | 1992-01-20 | Matthew K. Musho | Conductive sensors and their use in diagnostic assays |
| US5202261A (en) | 1990-07-19 | 1993-04-13 | Miles Inc. | Conductive sensors and their use in diagnostic assays |
| SE466987B (sv) | 1990-10-18 | 1992-05-11 | Stiftelsen Ct Foer Dentaltekni | Anordning foer djupselektiv icke-invasiv, lokal maetning av elektrisk impedans i organiska och biologiska material samt prob foer maetning av elektrisk impedans |
| US5230864A (en) | 1991-04-10 | 1993-07-27 | Eastman Kodak Company | Gravity assisted collection device |
| US5221457A (en) | 1991-09-23 | 1993-06-22 | Porton Diagnostics, Inc. | System for analyzing ion levels in fluids |
| US5849486A (en) | 1993-11-01 | 1998-12-15 | Nanogen, Inc. | Methods for hybridization analysis utilizing electrically controlled hybridization |
| US6048690A (en) | 1991-11-07 | 2000-04-11 | Nanogen, Inc. | Methods for electronic fluorescent perturbation for analysis and electronic perturbation catalysis for synthesis |
| US5605662A (en) | 1993-11-01 | 1997-02-25 | Nanogen, Inc. | Active programmable electronic devices for molecular biological analysis and diagnostics |
| ATE174813T1 (de) | 1992-05-01 | 1999-01-15 | Univ Pennsylvania | Polynukleotide amplifikationsanalyse mit einer mikrofabrizierten vorrichtung |
| US5212092A (en) | 1992-05-22 | 1993-05-18 | Puritan-Bennett Corporation | Storage and calibration solution for multiparameter intravascular blood gas sensor device |
| JP3101122B2 (ja) | 1993-04-16 | 2000-10-23 | 松下電器産業株式会社 | 一体化複合電極 |
| US5505831A (en) | 1993-01-26 | 1996-04-09 | Bio-Rad Laboratories, Inc. | Concentration of biological samples on a microliter scale and analysis by capillary electrophoresis |
| US5810725A (en) | 1993-04-16 | 1998-09-22 | Matsushita Electric Industrial Co., Ltd. | Planar electrode |
| DE4313481A1 (de) | 1993-04-24 | 1994-10-27 | Hoechst Ag | Fullerenderivate, Verfahren zur Herstellung und deren Verwendung |
| US5388449A (en) | 1993-07-06 | 1995-02-14 | Leveen; Harry H. | Osmolarity sensor |
| US5821399A (en) | 1993-07-16 | 1998-10-13 | I-Stat Corporation | Automatic test parameters compensation of a real time fluid analysis sensing device |
| US5591636A (en) | 1993-10-18 | 1997-01-07 | Precision Instrument Design | Membrane holder |
| DE4335961A1 (de) | 1993-10-21 | 1995-04-27 | Behringwerke Ag | Probenabnahmebesteck zur Gewinnung von Tränenflüssigkeit |
| US5461699A (en) | 1993-10-25 | 1995-10-24 | International Business Machines Corporation | Forecasting using a neural network and a statistical forecast |
| US5489515A (en) | 1993-12-09 | 1996-02-06 | Avl Medical Instruments Ag | Device for analyzing the metabolism of cells |
| JP3166471B2 (ja) | 1994-02-28 | 2001-05-14 | 株式会社島津製作所 | 導電率測定方法 |
| DE4407637C2 (de) | 1994-03-08 | 1995-12-21 | Forschungszentrum Juelich Gmbh | Osmometer-Meßeinrichtung und Verfahren zur Bestimmung des Gehaltes des Analyts aus einer Stoffgemisch-Lösung |
| DK0672765T3 (da) | 1994-03-14 | 2000-01-24 | Studiengesellschaft Kohle Mbh | Fremgangsmåde til fremstilling af højdisperse metalkolloider og substratbundne metal-clusters ved elektrokemisk reduktion a |
| US5522805B1 (en) | 1994-05-03 | 1998-06-16 | Aquintel Inc | Surgical fluid monitor |
| DE4417079C2 (de) | 1994-05-17 | 1998-06-10 | Fraunhofer Ges Forschung | Objektträger zum Beobachten von biologischem Material |
| US5760100B1 (en) | 1994-09-06 | 2000-11-14 | Ciba Vision Corp | Extended wear ophthalmic lens |
| AU4146396A (en) | 1994-11-08 | 1996-05-31 | Regents Of The University Of California, The | Temperature-gradient osmometry |
| US20010051350A1 (en) | 1995-05-02 | 2001-12-13 | Albert Nazareth | Diagnostic detection device and method |
| US6162926A (en) | 1995-07-31 | 2000-12-19 | Sphere Biosystems, Inc. | Multi-substituted fullerenes and methods for their preparation and characterization |
| JPH0961312A (ja) | 1995-08-30 | 1997-03-07 | Mochida Pharmaceut Co Ltd | 簡易測定装置 |
| US5849208A (en) | 1995-09-07 | 1998-12-15 | Microfab Technoologies, Inc. | Making apparatus for conducting biochemical analyses |
| US6183714B1 (en) | 1995-09-08 | 2001-02-06 | Rice University | Method of making ropes of single-wall carbon nanotubes |
| US5959671A (en) | 1995-09-14 | 1999-09-28 | Canon Kabushiki Kaisha | Adapter system for connection and disconnection of peripheral equipment with an electric apparatus and having a cam system |
| US5911131A (en) | 1995-12-20 | 1999-06-08 | Vig; Tommy | Computer aided calculation, appraisal and valuation of works of art |
| US5648523A (en) | 1995-10-26 | 1997-07-15 | Chiang Long Y | Fullerene derivatives as free-radical scavengers |
| US6126899A (en) | 1996-04-03 | 2000-10-03 | The Perkins-Elmer Corporation | Device for multiple analyte detection |
| US6767702B2 (en) | 1996-07-29 | 2004-07-27 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| US6582921B2 (en) | 1996-07-29 | 2003-06-24 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses thereof |
| US6750016B2 (en) | 1996-07-29 | 2004-06-15 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| US6506564B1 (en) | 1996-07-29 | 2003-01-14 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| EP1818417B1 (en) | 1996-07-29 | 2014-02-12 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses therefor |
| US5772585A (en) | 1996-08-30 | 1998-06-30 | Emc, Inc | System and method for managing patient medical records |
| US6120460A (en) | 1996-09-04 | 2000-09-19 | Abreu; Marcio Marc | Method and apparatus for signal acquisition, processing and transmission for evaluation of bodily functions |
| US6544193B2 (en) | 1996-09-04 | 2003-04-08 | Marcio Marc Abreu | Noninvasive measurement of chemical substances |
| US6695964B1 (en) | 1996-12-02 | 2004-02-24 | Ngk Spark Plug Co., Ltd. | Method and apparatus for measuring NOx gas concentration |
| EP0845670B1 (en) | 1996-12-02 | 2000-09-06 | Ngk Spark Plug Co., Ltd | Method and apparatus for measuring NOx gas concentration |
| NO311817B1 (no) | 1996-12-23 | 2002-01-28 | Lifecare As | Fremgangsmåte for registrering av endringene i nivået av en osmotisk aktiv komponent i kroppsv¶ske og innretning for utförelseav fremgangsmåten |
| JP3394262B2 (ja) | 1997-02-06 | 2003-04-07 | セラセンス、インク. | 小体積インビトロ被検体センサー |
| ATE241018T1 (de) | 1997-02-27 | 2003-06-15 | Ingeneus Corp | Untersuchung von nukleotiden in loesung mit hilfe von pna-sonden |
| US6344272B1 (en) | 1997-03-12 | 2002-02-05 | Wm. Marsh Rice University | Metal nanoshells |
| US5798031A (en) | 1997-05-12 | 1998-08-25 | Bayer Corporation | Electrochemical biosensor |
| US6010454A (en) | 1997-05-29 | 2000-01-04 | Aquintel, Inc. | Fluid and electrolyte balance monitoring system for surgical and critically ill patients |
| US6090251A (en) | 1997-06-06 | 2000-07-18 | Caliper Technologies, Inc. | Microfabricated structures for facilitating fluid introduction into microfluidic devices |
| US6886421B2 (en) | 1997-07-21 | 2005-05-03 | Vijay Mathur | Modular film sensors with record memory for modular automated diagnostic apparatus |
| AU735912B2 (en) | 1997-08-29 | 2001-07-19 | Avery Dennison Corporation | Biological fluid absorbing pressure sensitive adhesives |
| US6117643A (en) | 1997-11-25 | 2000-09-12 | Ut Battelle, Llc | Bioluminescent bioreporter integrated circuit |
| US5997817A (en) | 1997-12-05 | 1999-12-07 | Roche Diagnostics Corporation | Electrochemical biosensor test strip |
| JP3486171B2 (ja) | 1997-12-17 | 2004-01-13 | エコル・ポリテクニック・フェデラル・ドゥ・ロザンヌ(エ・ペー・エフ・エル) | ミクロ構造キャリア上における細胞単体および再構成膜系のポジショニングおよび電気生理学的特性決定 |
| WO1999047907A1 (en) | 1998-03-19 | 1999-09-23 | Orgenics Biosensors Ltd. | Device for the determination of blood clotting by capacitance or resistance |
| US7021122B1 (en) | 1998-03-19 | 2006-04-04 | Orgenics Biosensors Ltd. | Device for the determination of blood clotting by capacitance or resistance |
| PT1077634E (pt) | 1998-05-13 | 2003-12-31 | Cygnus Therapeutic Systems | Monitorizacao de substancias fisiologicas a analisar |
| DK1053043T3 (da) | 1998-05-13 | 2002-11-18 | Cygnus Therapeutic Systems | Opsamlingsenheder til transdermale prøveudtagningssystemer |
| EP1104263A4 (en) | 1998-08-12 | 2008-11-19 | Ocular Res Of Boston Inc | MEASUREMENT OF THE CRACKING TIME OF THE TISSUE FILM |
| US6259518B1 (en) | 1999-08-10 | 2001-07-10 | Novartis Ag | Wetcell device for inspection |
| US6740518B1 (en) | 1998-09-17 | 2004-05-25 | Clinical Micro Sensors, Inc. | Signal detection techniques for the detection of analytes |
| US6602469B1 (en) | 1998-11-09 | 2003-08-05 | Lifestream Technologies, Inc. | Health monitoring and diagnostic device and network-based health assessment and medical records maintenance system |
| US6558945B1 (en) | 1999-03-08 | 2003-05-06 | Aclara Biosciences, Inc. | Method and device for rapid color detection |
| US6403317B1 (en) | 1999-03-26 | 2002-06-11 | Affymetrix, Inc. | Electronic detection of hybridization on nucleic acid arrays |
| DE19916921A1 (de) | 1999-04-14 | 2000-10-19 | Fraunhofer Ges Forschung | Elektrisches Sensorarray |
| US6245297B1 (en) | 1999-04-16 | 2001-06-12 | Pe Corporation (Ny) | Apparatus and method for transferring small volumes of substances |
| DE60042738D1 (de) | 1999-05-07 | 2009-09-24 | Life Technologies Corp | Verfahren zum nachweis von analyten mit hilfe von halbleiternanokrystallen |
| US6514689B2 (en) | 1999-05-11 | 2003-02-04 | M-Biotech, Inc. | Hydrogel biosensor |
| US20030027204A1 (en) | 1999-09-03 | 2003-02-06 | Yokogawa Electric Corporation, A Japan Corporation | Method and apparatus for producing biochips |
| CN1204404C (zh) | 1999-10-01 | 2005-06-01 | 索菲昂生物科学有限公司 | 电生理学性质的测定组件及其构照方法 |
| AU1047401A (en) | 1999-11-08 | 2001-06-06 | Cytion Sa | Apparatus and methods for positioning and analyzing biological membranous objects |
| US6605453B2 (en) | 1999-12-01 | 2003-08-12 | The Regents Of The University Of California | Electric-field-assisted fluidic assembly of inorganic and organic materials, molecules and like small things including living cells |
| AU2009401A (en) | 1999-12-17 | 2001-06-25 | Zeptosens Ag | Flow cell array and the utilization thereof for multianalyte determination |
| GB0001568D0 (en) | 2000-01-24 | 2000-03-15 | Isis Innovation | Method and apparatus for measuring surface configuration |
| US6998273B1 (en) * | 2000-02-09 | 2006-02-14 | A-Fem Medical Corporation | Collection device for lateral flow chromatography |
| US20040146918A1 (en) | 2000-02-18 | 2004-07-29 | Weiner Michael L. | Hybrid nucleic acid assembly |
| US6375627B1 (en) * | 2000-03-02 | 2002-04-23 | Agilent Technologies, Inc. | Physiological fluid extraction with rapid analysis |
| DE10015380A1 (de) * | 2000-03-28 | 2001-10-11 | Nmi Univ Tuebingen | Mikrofluidkomponente und Verfahren zur Oberflächenbehandlung einer solchen |
| CA2407973C (en) | 2000-05-03 | 2011-06-07 | Jen-Jr Gau | Biological identification system with integrated sensor chip |
| US6602400B1 (en) | 2000-06-15 | 2003-08-05 | Motorola, Inc. | Method for enhanced bio-conjugation events |
| US6529277B1 (en) | 2000-07-07 | 2003-03-04 | California Institute Of Technology | Optical devices based on resonant configurational effects |
| JP3909738B2 (ja) | 2000-07-13 | 2007-04-25 | 松下電器産業株式会社 | 細胞外記録用一体化複合電極 |
| US6884356B2 (en) | 2000-08-07 | 2005-04-26 | Sievers Instruments, Inc. | Low-level boron detection and measurement |
| US6633772B2 (en) | 2000-08-18 | 2003-10-14 | Cygnus, Inc. | Formulation and manipulation of databases of analyte and associated values |
| EP1325332B1 (en) * | 2000-10-03 | 2006-12-20 | Minerva Biotechnologies Corporation | Magnetic in situ dilution |
| DE10050883A1 (de) | 2000-10-13 | 2002-05-16 | It Dr Gambert Gmbh | Vorrichtung zur Bestimmung von ionalen Bestandteilen in Körperflüssigkeiten |
| JP2002176999A (ja) | 2000-12-12 | 2002-06-25 | Canon Inc | 核酸の検出方法 |
| US20040099813A1 (en) | 2000-12-21 | 2004-05-27 | Christian Eggeling | Method for characterizing samples of secondary light emitting particles |
| US20020119581A1 (en) | 2001-01-05 | 2002-08-29 | Daniloff George Y. | Detection of analytes |
| US20020094580A1 (en) | 2001-01-16 | 2002-07-18 | Jorgenson James W. | Photothermal absorbance detection apparatus and method of using same |
| WO2002059598A1 (en) | 2001-01-26 | 2002-08-01 | Cytion S.A. | Method and apparatus for the precise positioning of cells and other small objects |
| CA2441366A1 (en) | 2001-03-24 | 2002-10-03 | Aviva Biosciences Corporation | Biochips including ion transport detecting structures and methods of use |
| US20050009004A1 (en) | 2002-05-04 | 2005-01-13 | Jia Xu | Apparatus including ion transport detecting structures and methods of use |
| US20050032204A1 (en) | 2001-04-10 | 2005-02-10 | Bioprocessors Corp. | Microreactor architecture and methods |
| EP1397677A1 (en) | 2001-06-20 | 2004-03-17 | Sophion Bioscience A/S | An apparatus and method for determining and/or monitoring electrophysiological properties of ion channels |
| US20030013109A1 (en) | 2001-06-21 | 2003-01-16 | Ballinger Clinton T. | Hairpin sensors using quenchable fluorescing agents |
| US6855538B2 (en) | 2001-06-27 | 2005-02-15 | The Regents Of The University Of California | High-efficiency microarray printing device |
| AU2002317557A1 (en) | 2001-07-09 | 2003-01-29 | Arizona Board Of Regents A Body Corporate Acting On Behalf Of Arizona State University | Afinity biosensor for monitoring of biological process |
| AU2002336421A1 (en) | 2001-08-31 | 2003-04-14 | The Government Of The United States Of America, Asrepresented By The Secretary Of The Department Of | Measurements of multiple molecules using a cryoarray |
| EP3252139A1 (en) | 2001-09-06 | 2017-12-06 | Rapid Micro Biosystems, Inc. | Rapid detection of replicating cells |
| US20040220089A1 (en) | 2001-10-03 | 2004-11-04 | Ellis Edward J. | Ophthalmic preparation containing glycoprotein |
| US6778316B2 (en) | 2001-10-24 | 2004-08-17 | William Marsh Rice University | Nanoparticle-based all-optical sensors |
| KR100475634B1 (ko) | 2001-12-24 | 2005-03-15 | 주식회사 아이센스 | 일정 소량의 시료를 빠르게 도입할 수 있는 시료도입부를구비한 바이오 센서 |
| JP2005517409A (ja) | 2002-02-15 | 2005-06-16 | マクマスター ユニヴァーシティー | デオキシリボザイム |
| CA2478083A1 (en) | 2002-03-05 | 2003-09-18 | Board Of Regents, The University Of Texas System | Biospecific contrast agents |
| AU2003233468A1 (en) | 2002-04-05 | 2003-10-27 | Eyelab Group, Llc | Monitoring blood substances using self-sampled tears |
| GB0208153D0 (en) | 2002-04-09 | 2002-05-22 | Univ Warwick | Biosensor |
| JP3914806B2 (ja) * | 2002-04-09 | 2007-05-16 | 三菱化学株式会社 | 分析用チップ |
| US20030211488A1 (en) | 2002-05-07 | 2003-11-13 | Northwestern University | Nanoparticle probs with Raman spectrocopic fingerprints for analyte detection |
| US6951728B2 (en) | 2002-05-10 | 2005-10-04 | Lifescan, Inc. | Multilayer reagent test strips to quantify glycated protein in a physiological sample |
| US20050106714A1 (en) | 2002-06-05 | 2005-05-19 | Zarur Andrey J. | Rotatable reactor systems and methods |
| ES2320871T3 (es) | 2002-07-18 | 2009-05-29 | Panasonic Corporation | Aparato de medicion con un biosensor. |
| WO2004017050A1 (en) | 2002-08-06 | 2004-02-26 | The Regents Of The University Of California | Tear film osmometry |
| US7905134B2 (en) | 2002-08-06 | 2011-03-15 | The Regents Of The University Of California | Biomarker normalization |
| US7051569B2 (en) | 2002-08-06 | 2006-05-30 | Ocusense, Inc. | Systems and methods for calibrating osmolarity measuring devices |
| US7111502B2 (en) | 2002-08-06 | 2006-09-26 | Ocusense, Inc. | Systems and methods for reducing the effect of corruptive signals during nanoliter osmometry |
| US7810380B2 (en) | 2003-03-25 | 2010-10-12 | Tearlab Research, Inc. | Systems and methods for collecting tear film and measuring tear film osmolarity |
| US8020433B2 (en) | 2003-03-25 | 2011-09-20 | Tearlab Research, Inc. | Systems and methods for a sample fluid collection device |
| US7244394B2 (en) | 2002-10-03 | 2007-07-17 | Novartis Ag | Methods and kits for assays of analytes of interest in tears |
| US7964390B2 (en) | 2002-10-11 | 2011-06-21 | Case Western Reserve University | Sensor system |
| US7449307B2 (en) | 2002-10-28 | 2008-11-11 | Transform Pharmaceuticals, Inc. | Raised surface assay plate |
| GB0300820D0 (en) | 2003-01-14 | 2003-02-12 | Diagnoswiss Sa | Membrane-microchannel strip |
| JP4073323B2 (ja) | 2003-01-23 | 2008-04-09 | 日立ソフトウエアエンジニアリング株式会社 | 機能性ビーズ、その読み取り方法および読み取り装置 |
| WO2005024437A1 (ja) | 2003-09-05 | 2005-03-17 | Nec Corporation | 測定システム |
| US7718133B2 (en) | 2003-10-09 | 2010-05-18 | 3M Innovative Properties Company | Multilayer processing devices and methods |
| EP1678495A4 (en) | 2003-10-20 | 2007-06-27 | Univ California | TRANSDUCTION SYSTEMS IN THE NANOMASSIC STATION FOR DETECTING MOLECULAR INTERACTIONS |
| US7129717B2 (en) | 2003-11-19 | 2006-10-31 | Ocusense, Inc. | Systems and methods for measuring tear film osmolarity |
| US7395103B2 (en) | 2004-01-08 | 2008-07-01 | Osmopen, Llc | Surface plasmon resonance based nanoliter tear osmometer |
| US8030057B2 (en) * | 2004-01-26 | 2011-10-04 | President And Fellows Of Harvard College | Fluid delivery system and method |
| US8021625B2 (en) * | 2004-01-28 | 2011-09-20 | Dnt Scientific Research, Llc | Interrupted, gravity-promoted, diffused flow chromatography strip testing device and method |
| US20050201895A1 (en) | 2004-03-12 | 2005-09-15 | Eric Donsky | Systems and methods for delivering a sample fluid to a receiving substrate |
| WO2005089210A2 (en) | 2004-03-12 | 2005-09-29 | Ocusense, Inc. | Systems and methods for collecting and analysing tear film osmolarity data |
| CA2568238C (en) | 2004-04-12 | 2013-10-15 | Medical College Of Ohio | Methods and compositions for assaying analytes |
| US7763454B2 (en) | 2004-07-09 | 2010-07-27 | Church & Dwight Co., Inc. | Electronic analyte assaying device |
| US20060127964A1 (en) | 2004-07-30 | 2006-06-15 | Russell Ford | Microprocessors, devices, and methods for use in monitoring of physiological analytes |
| JP2006112881A (ja) | 2004-10-14 | 2006-04-27 | Nikkiso Co Ltd | 生体物質測定装置および生体物質測定装置用チップ |
| US8249682B2 (en) * | 2005-01-07 | 2012-08-21 | Lacrisciences, Llc | Device for measuring concentrations of constituents of tear sample |
| CN101171346B (zh) | 2005-05-06 | 2011-11-09 | 三星电子股份有限公司 | 数字生物盘、数字生物盘驱动器装置及其应用化验方法 |
| WO2006133102A2 (en) | 2005-06-03 | 2006-12-14 | Trans-Dermal Patents Company, Llc | Agent delivery system and uses of the same |
| US20070031283A1 (en) | 2005-06-23 | 2007-02-08 | Davis Charles Q | Assay cartridges and methods for point of care instruments |
| US7344679B2 (en) | 2005-10-14 | 2008-03-18 | International Business Machines Corporation | Method and apparatus for point of care osmolarity testing |
| JP2007268486A (ja) * | 2006-03-31 | 2007-10-18 | Fujifilm Corp | マイクロデバイスの流体制御方法及び機構、並びにそれを用いた科学現象の評価装置 |
| KR101361888B1 (ko) | 2006-05-08 | 2014-02-12 | 바이엘 헬쓰케어, 엘엘씨 | 시료 용적을 줄인 전기화학적 시험용 센서 |
| US7914460B2 (en) | 2006-08-15 | 2011-03-29 | University Of Florida Research Foundation, Inc. | Condensate glucose analyzer |
| US7908906B2 (en) | 2006-08-29 | 2011-03-22 | International Business Machines Corporation | Fluidic test apparatus and method |
| US20100096276A1 (en) * | 2006-10-05 | 2010-04-22 | Panasonic Corporation | Multicomponent analysis sensor and method of measuring multiple components |
| US8090426B2 (en) | 2006-10-27 | 2012-01-03 | Felder Robin A | Microelectronic biosensor plug |
| EP2100155B1 (en) | 2006-12-11 | 2022-02-16 | Tearlab Research, Inc. | Systems and methods for collecting tear film and measuring tear film osmolarity |
| ITFI20060322A1 (it) | 2006-12-13 | 2008-06-14 | Menarini Farma Ind | Processo per la preparazione di elettrodi modificati, elettrodi preparati con tale processo, e biosensori enzimatici che li comprendono. |
| WO2008119069A1 (en) | 2007-03-28 | 2008-10-02 | Ocusense, Inc. | Systems and methods for a sample fluid collection device |
| EP2587247A1 (en) | 2007-04-16 | 2013-05-01 | The Regents Of The University Of California | Biomarker normalization |
| WO2008137863A2 (en) | 2007-05-04 | 2008-11-13 | Advanced Medical Optics, Inc. | Methods and devices for measuring tear film and diagnosing tear disorders |
| WO2010005467A2 (en) | 2008-07-09 | 2010-01-14 | Micropoint Bioscience Inc | Analytical cartridge with fluid flow control |
| JP2010203779A (ja) | 2009-02-27 | 2010-09-16 | Konica Minolta Holdings Inc | 検査用マイクロチップ |
| US8898069B2 (en) | 2009-08-28 | 2014-11-25 | The Invention Science Fund I, Llc | Devices and methods for detecting an analyte in salivary fluid |
| EP2483075A1 (en) * | 2009-09-30 | 2012-08-08 | Mycrolab Diagnostics Pty Ltd | Selective bond reduction in microfluidic devices |
| GB0919159D0 (en) * | 2009-11-02 | 2009-12-16 | Sec Dep For Environment Food A | Device and apparatus |
| WO2011099569A1 (ja) | 2010-02-10 | 2011-08-18 | 藤森工業株式会社 | 血小板検査用マイクロチップ及びそれを用いた血小板検査装置 |
| US10161927B2 (en) * | 2010-06-30 | 2018-12-25 | Anpac Bio-Medical Science Co., Ltd. | Apparatus for disease detection |
| US8828329B2 (en) | 2010-10-01 | 2014-09-09 | Church & Dwight, Co., Inc. | Electronic analyte assaying device |
| US20130008803A1 (en) | 2011-01-03 | 2013-01-10 | The Regents Of The University Of Michigan | Methods and Systems for Measurement of Tear Glucose Levels |
| WO2012170435A2 (en) * | 2011-06-09 | 2012-12-13 | Gen-Probe Incorporated | Diagnostic devices, methods and systems for detecting platelet factor 4 (pf4)/heparin antibodies |
| JP2013170835A (ja) | 2012-02-17 | 2013-09-02 | Sharp Corp | イムノクロマト用検査器具、分析装置、および分析方法 |
| US20140088381A1 (en) | 2012-09-26 | 2014-03-27 | Google Inc. | Facilitation of tear sample collection and testing using a contact lens |
| US10101342B2 (en) * | 2014-02-12 | 2018-10-16 | Church & Dwight Co., Inc. | Devices and methods for electronic analyte assaying |
| EP3198257B1 (en) | 2014-09-23 | 2020-08-12 | Tearlab Research, Inc. | System for integration of microfluidic tear collection and lateral flow analysis of analytes of interest |
-
2015
- 2015-09-23 EP EP15843475.3A patent/EP3198257B1/en active Active
- 2015-09-23 ES ES15843475T patent/ES2828278T3/es active Active
- 2015-09-23 JP JP2017535632A patent/JP6792556B2/ja active Active
- 2015-09-23 WO PCT/US2015/051772 patent/WO2016049221A1/en active Application Filing
- 2015-09-23 KR KR1020177007833A patent/KR20170072188A/ko unknown
- 2015-09-23 MX MX2017003454A patent/MX2017003454A/es unknown
- 2015-09-23 EP EP20189776.6A patent/EP3792615A1/en not_active Withdrawn
- 2015-09-23 CA CA2959073A patent/CA2959073A1/en not_active Abandoned
- 2015-09-23 BR BR112017005121A patent/BR112017005121A2/pt not_active Application Discontinuation
- 2015-09-23 US US15/503,823 patent/US11536707B2/en active Active
- 2015-09-23 AU AU2015320685A patent/AU2015320685B2/en not_active Ceased
- 2015-09-23 CN CN201580051508.7A patent/CN106716116B/zh not_active Expired - Fee Related
-
2017
- 2017-03-22 CO CONC2017/0002710A patent/CO2017002710A2/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| CA2959073A1 (en) | 2016-03-31 |
| MX2017003454A (es) | 2017-11-13 |
| JP6792556B2 (ja) | 2020-11-25 |
| CN106716116B (zh) | 2021-04-27 |
| AU2015320685B2 (en) | 2021-01-28 |
| JP2017529218A (ja) | 2017-10-05 |
| US11536707B2 (en) | 2022-12-27 |
| ES2828278T3 (es) | 2021-05-25 |
| EP3792615A1 (en) | 2021-03-17 |
| WO2016049221A1 (en) | 2016-03-31 |
| US20170248573A1 (en) | 2017-08-31 |
| EP3198257A4 (en) | 2018-07-18 |
| CN106716116A (zh) | 2017-05-24 |
| CO2017002710A2 (es) | 2017-08-10 |
| AU2015320685A1 (en) | 2017-03-30 |
| EP3198257A1 (en) | 2017-08-02 |
| BR112017005121A2 (pt) | 2018-07-31 |
| EP3198257B1 (en) | 2020-08-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20170072188A (ko) | 미세 유체 눈물 포집 및 관심 대상인 분석물의 측방 유동 분석의 통합을 위한 시스템 및 방법 | |
| KR101262407B1 (ko) | 측방 유동 분석 측정 기구를 위한 계량 기술 | |
| US7279136B2 (en) | Metering technique for lateral flow assay devices | |
| JP2736091B2 (ja) | バイオアッセイを正確に、敏速に且つ単純に実施するためのエレメント及び方法 | |
| US20110124130A1 (en) | Device and method for analysis of samples with depletion of analyte content | |
| US20130236914A1 (en) | Devices and methods for analysis of samples with depletion of analyte content | |
| JP6199527B1 (ja) | 濾過流制御を有する側方流アッセイ装置 | |
| JP2007532881A (ja) | 生体液を分析する使い捨てチャンバ | |
| KR20080015784A (ko) | 분석 측정 기구를 위한 유동 조절 기술 | |
| Vinitha et al. | A new polymer lab-on-a-chip (LOC) based on a microfluidic capillary flow assay (MCFA) for detecting unbound cortisol in saliva | |
| JP2014515494A (ja) | 毛細管の液体流れ測定及びそのための毛細管流れ装置 | |
| US20170234817A1 (en) | Lateral flow assays with thermal contrast readers | |
| JP6677284B2 (ja) | 分析対象物の検出方法及びラテラルフロー用テストストリップ | |
| WO2008156491A2 (en) | Devices and methods for analysis of samples with depletion of analyte content | |
| KR20150139639A (ko) | 종이기반 바이오센서 | |
| CN109416357B (zh) | 用于检测包含多个细胞的体液样本中的分析物的设备、系统和方法 | |
| JP2008268198A (ja) | 分離チップおよび分離方法 | |
| JP2005291744A (ja) | 液物性測定チップおよび測定装置 | |
| EP2090365A1 (en) | Combined cell and protein analysis on a substrate | |
| WO2023178416A1 (en) | Paper-based microfluidic chip for measurement of cystatin c in plasma and serum (cys-c paper chip) |