KR20110031369A - 프로스타글란딘 e2 이원 가변 도메인 면역글로불린 및 이의 용도 - Google Patents
프로스타글란딘 e2 이원 가변 도메인 면역글로불린 및 이의 용도 Download PDFInfo
- Publication number
- KR20110031369A KR20110031369A KR1020117002816A KR20117002816A KR20110031369A KR 20110031369 A KR20110031369 A KR 20110031369A KR 1020117002816 A KR1020117002816 A KR 1020117002816A KR 20117002816 A KR20117002816 A KR 20117002816A KR 20110031369 A KR20110031369 A KR 20110031369A
- Authority
- KR
- South Korea
- Prior art keywords
- pge2
- binding
- antigen
- disease
- seq
- Prior art date
Links
- XEYBRNLFEZDVAW-ARSRFYASSA-N dinoprostone Chemical compound CCCCC[C@H](O)\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1C\C=C/CCCC(O)=O XEYBRNLFEZDVAW-ARSRFYASSA-N 0.000 title claims description 169
- 229960002986 dinoprostone Drugs 0.000 title claims description 168
- XEYBRNLFEZDVAW-UHFFFAOYSA-N prostaglandin E2 Natural products CCCCCC(O)C=CC1C(O)CC(=O)C1CC=CCCCC(O)=O XEYBRNLFEZDVAW-UHFFFAOYSA-N 0.000 title claims description 166
- 108060003951 Immunoglobulin Proteins 0.000 title claims description 46
- 102000018358 immunoglobulin Human genes 0.000 title claims description 46
- 229940072221 immunoglobulins Drugs 0.000 title claims description 10
- 230000009977 dual effect Effects 0.000 title claims 2
- 108091008324 binding proteins Proteins 0.000 claims abstract description 216
- 238000000034 method Methods 0.000 claims abstract description 133
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 76
- 201000010099 disease Diseases 0.000 claims abstract description 43
- 238000011282 treatment Methods 0.000 claims abstract description 21
- 230000027455 binding Effects 0.000 claims description 298
- 238000009739 binding Methods 0.000 claims description 296
- 239000000427 antigen Substances 0.000 claims description 272
- 108091007433 antigens Proteins 0.000 claims description 271
- 102000036639 antigens Human genes 0.000 claims description 271
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 140
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 127
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 127
- 229920001184 polypeptide Polymers 0.000 claims description 125
- 210000004027 cell Anatomy 0.000 claims description 108
- 108090000623 proteins and genes Proteins 0.000 claims description 95
- 241000282414 Homo sapiens Species 0.000 claims description 90
- 102000004169 proteins and genes Human genes 0.000 claims description 79
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 75
- 239000012634 fragment Substances 0.000 claims description 48
- 208000011580 syndromic disease Diseases 0.000 claims description 35
- 102000004127 Cytokines Human genes 0.000 claims description 34
- 108090000695 Cytokines Proteins 0.000 claims description 34
- 230000001225 therapeutic effect Effects 0.000 claims description 34
- 239000003814 drug Substances 0.000 claims description 31
- 208000035475 disorder Diseases 0.000 claims description 28
- 210000001519 tissue Anatomy 0.000 claims description 27
- 238000004519 manufacturing process Methods 0.000 claims description 25
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 24
- 239000013598 vector Substances 0.000 claims description 24
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims description 23
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 22
- 230000001154 acute effect Effects 0.000 claims description 22
- 230000001684 chronic effect Effects 0.000 claims description 22
- 238000001727 in vivo Methods 0.000 claims description 22
- 208000019693 Lung disease Diseases 0.000 claims description 20
- 230000005847 immunogenicity Effects 0.000 claims description 20
- 108090000171 Interleukin-18 Proteins 0.000 claims description 19
- 102000003810 Interleukin-18 Human genes 0.000 claims description 19
- 102000001301 EGF receptor Human genes 0.000 claims description 18
- 108060006698 EGF receptor Proteins 0.000 claims description 18
- 229940079593 drug Drugs 0.000 claims description 18
- 210000000056 organ Anatomy 0.000 claims description 18
- 201000008482 osteoarthritis Diseases 0.000 claims description 18
- 208000029523 Interstitial Lung disease Diseases 0.000 claims description 17
- 239000003795 chemical substances by application Substances 0.000 claims description 17
- 150000007523 nucleic acids Chemical class 0.000 claims description 16
- 201000004624 Dermatitis Diseases 0.000 claims description 15
- 206010020751 Hypersensitivity Diseases 0.000 claims description 15
- 102000003812 Interleukin-15 Human genes 0.000 claims description 15
- 108090000172 Interleukin-15 Proteins 0.000 claims description 15
- 102000004889 Interleukin-6 Human genes 0.000 claims description 15
- 108090001005 Interleukin-6 Proteins 0.000 claims description 15
- 108010038501 Interleukin-6 Receptors Proteins 0.000 claims description 15
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 claims description 15
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims description 15
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims description 15
- 230000001363 autoimmune Effects 0.000 claims description 15
- 230000004071 biological effect Effects 0.000 claims description 15
- 230000002757 inflammatory effect Effects 0.000 claims description 15
- 229940100601 interleukin-6 Drugs 0.000 claims description 15
- 206010047115 Vasculitis Diseases 0.000 claims description 14
- 208000015181 infectious disease Diseases 0.000 claims description 14
- 230000001404 mediated effect Effects 0.000 claims description 14
- 102000039446 nucleic acids Human genes 0.000 claims description 14
- 108020004707 nucleic acids Proteins 0.000 claims description 14
- 102000013691 Interleukin-17 Human genes 0.000 claims description 13
- 108050003558 Interleukin-17 Proteins 0.000 claims description 13
- 206010028980 Neoplasm Diseases 0.000 claims description 12
- 206010042674 Swelling Diseases 0.000 claims description 12
- 239000005557 antagonist Substances 0.000 claims description 12
- 238000010494 dissociation reaction Methods 0.000 claims description 12
- 230000005593 dissociations Effects 0.000 claims description 12
- 208000006454 hepatitis Diseases 0.000 claims description 12
- 231100000283 hepatitis Toxicity 0.000 claims description 12
- 210000003491 skin Anatomy 0.000 claims description 12
- 230000008961 swelling Effects 0.000 claims description 12
- 229940124597 therapeutic agent Drugs 0.000 claims description 12
- 208000018631 connective tissue disease Diseases 0.000 claims description 11
- 208000032839 leukemia Diseases 0.000 claims description 11
- 230000008569 process Effects 0.000 claims description 11
- DUYSYHSSBDVJSM-KRWOKUGFSA-N sphingosine 1-phosphate Chemical compound CCCCCCCCCCCCC\C=C\[C@@H](O)[C@@H](N)COP(O)(O)=O DUYSYHSSBDVJSM-KRWOKUGFSA-N 0.000 claims description 11
- 238000007920 subcutaneous administration Methods 0.000 claims description 11
- 230000009258 tissue cross reactivity Effects 0.000 claims description 11
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 claims description 10
- 102000004190 Enzymes Human genes 0.000 claims description 10
- 108090000790 Enzymes Proteins 0.000 claims description 10
- 206010025323 Lymphomas Diseases 0.000 claims description 10
- 102000004584 Somatomedin Receptors Human genes 0.000 claims description 10
- 108010017622 Somatomedin Receptors Proteins 0.000 claims description 10
- 206010052779 Transplant rejections Diseases 0.000 claims description 10
- 230000008827 biological function Effects 0.000 claims description 10
- 239000013078 crystal Substances 0.000 claims description 10
- 210000002966 serum Anatomy 0.000 claims description 10
- 238000002054 transplantation Methods 0.000 claims description 10
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 claims description 9
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 claims description 9
- 102000010781 Interleukin-6 Receptors Human genes 0.000 claims description 9
- 208000002193 Pain Diseases 0.000 claims description 9
- 229940127089 cytotoxic agent Drugs 0.000 claims description 9
- 208000007475 hemolytic anemia Diseases 0.000 claims description 9
- 230000002093 peripheral effect Effects 0.000 claims description 9
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 claims description 9
- 206010003210 Arteriosclerosis Diseases 0.000 claims description 8
- 206010010741 Conjunctivitis Diseases 0.000 claims description 8
- 208000030836 Hashimoto thyroiditis Diseases 0.000 claims description 8
- 208000018737 Parkinson disease Diseases 0.000 claims description 8
- 208000005764 Peripheral Arterial Disease Diseases 0.000 claims description 8
- 208000030831 Peripheral arterial occlusive disease Diseases 0.000 claims description 8
- 208000018262 Peripheral vascular disease Diseases 0.000 claims description 8
- 201000004681 Psoriasis Diseases 0.000 claims description 8
- 206010040047 Sepsis Diseases 0.000 claims description 8
- -1 anthracyclines Substances 0.000 claims description 8
- 206010003246 arthritis Diseases 0.000 claims description 8
- 201000011510 cancer Diseases 0.000 claims description 8
- 208000019069 chronic childhood arthritis Diseases 0.000 claims description 8
- 239000002254 cytotoxic agent Substances 0.000 claims description 8
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 8
- 230000007812 deficiency Effects 0.000 claims description 8
- 206010012601 diabetes mellitus Diseases 0.000 claims description 8
- 239000012216 imaging agent Substances 0.000 claims description 8
- 210000003734 kidney Anatomy 0.000 claims description 8
- 206010003827 Autoimmune hepatitis Diseases 0.000 claims description 7
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 7
- 206010039710 Scleroderma Diseases 0.000 claims description 7
- 241000193990 Streptococcus sp. 'group B' Species 0.000 claims description 7
- 206010051379 Systemic Inflammatory Response Syndrome Diseases 0.000 claims description 7
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 7
- 230000007815 allergy Effects 0.000 claims description 7
- 208000011775 arteriosclerosis disease Diseases 0.000 claims description 7
- 229960002685 biotin Drugs 0.000 claims description 7
- 239000011616 biotin Substances 0.000 claims description 7
- 210000004978 chinese hamster ovary cell Anatomy 0.000 claims description 7
- 210000003527 eukaryotic cell Anatomy 0.000 claims description 7
- 239000003102 growth factor Substances 0.000 claims description 7
- 238000007918 intramuscular administration Methods 0.000 claims description 7
- 208000017169 kidney disease Diseases 0.000 claims description 7
- 210000004962 mammalian cell Anatomy 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- 239000003053 toxin Substances 0.000 claims description 7
- 231100000765 toxin Toxicity 0.000 claims description 7
- 108700012359 toxins Proteins 0.000 claims description 7
- 208000030507 AIDS Diseases 0.000 claims description 6
- 206010002556 Ankylosing Spondylitis Diseases 0.000 claims description 6
- 206010003591 Ataxia Diseases 0.000 claims description 6
- 208000031229 Cardiomyopathies Diseases 0.000 claims description 6
- 206010012438 Dermatitis atopic Diseases 0.000 claims description 6
- 206010015150 Erythema Diseases 0.000 claims description 6
- 208000002250 Hematologic Neoplasms Diseases 0.000 claims description 6
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 claims description 6
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 claims description 6
- 208000000112 Myalgia Diseases 0.000 claims description 6
- 208000031845 Pernicious anaemia Diseases 0.000 claims description 6
- 206010035664 Pneumonia Diseases 0.000 claims description 6
- 240000004808 Saccharomyces cerevisiae Species 0.000 claims description 6
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 claims description 6
- 208000026935 allergic disease Diseases 0.000 claims description 6
- 206010003119 arrhythmia Diseases 0.000 claims description 6
- 208000006673 asthma Diseases 0.000 claims description 6
- 201000008937 atopic dermatitis Diseases 0.000 claims description 6
- 230000000903 blocking effect Effects 0.000 claims description 6
- 230000007850 degeneration Effects 0.000 claims description 6
- 231100000321 erythema Toxicity 0.000 claims description 6
- 230000009033 hematopoietic malignancy Effects 0.000 claims description 6
- 208000026278 immune system disease Diseases 0.000 claims description 6
- 238000002347 injection Methods 0.000 claims description 6
- 239000007924 injection Substances 0.000 claims description 6
- 208000028867 ischemia Diseases 0.000 claims description 6
- 206010023332 keratitis Diseases 0.000 claims description 6
- 208000019423 liver disease Diseases 0.000 claims description 6
- 201000001441 melanoma Diseases 0.000 claims description 6
- 208000010125 myocardial infarction Diseases 0.000 claims description 6
- 230000002685 pulmonary effect Effects 0.000 claims description 6
- 208000024891 symptom Diseases 0.000 claims description 6
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 claims description 5
- 206010002198 Anaphylactic reaction Diseases 0.000 claims description 5
- 208000003343 Antiphospholipid Syndrome Diseases 0.000 claims description 5
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims description 5
- 208000016192 Demyelinating disease Diseases 0.000 claims description 5
- 102000003951 Erythropoietin Human genes 0.000 claims description 5
- 108090000394 Erythropoietin Proteins 0.000 claims description 5
- 208000032843 Hemorrhage Diseases 0.000 claims description 5
- 241000238631 Hexapoda Species 0.000 claims description 5
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 claims description 5
- 201000002481 Myositis Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 5
- 206010033799 Paralysis Diseases 0.000 claims description 5
- 206010036105 Polyneuropathy Diseases 0.000 claims description 5
- 206010060862 Prostate cancer Diseases 0.000 claims description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 5
- 208000012322 Raynaud phenomenon Diseases 0.000 claims description 5
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 5
- 208000013616 Respiratory Distress Syndrome Diseases 0.000 claims description 5
- 208000024780 Urticaria Diseases 0.000 claims description 5
- 208000004631 alopecia areata Diseases 0.000 claims description 5
- 208000003455 anaphylaxis Diseases 0.000 claims description 5
- 208000010668 atopic eczema Diseases 0.000 claims description 5
- 235000020958 biotin Nutrition 0.000 claims description 5
- 210000000988 bone and bone Anatomy 0.000 claims description 5
- 210000001638 cerebellum Anatomy 0.000 claims description 5
- 230000008859 change Effects 0.000 claims description 5
- 206010014665 endocarditis Diseases 0.000 claims description 5
- 229940105423 erythropoietin Drugs 0.000 claims description 5
- 230000002538 fungal effect Effects 0.000 claims description 5
- 208000019622 heart disease Diseases 0.000 claims description 5
- 230000002458 infectious effect Effects 0.000 claims description 5
- 238000001990 intravenous administration Methods 0.000 claims description 5
- 201000002215 juvenile rheumatoid arthritis Diseases 0.000 claims description 5
- 201000006417 multiple sclerosis Diseases 0.000 claims description 5
- 206010028417 myasthenia gravis Diseases 0.000 claims description 5
- 201000008383 nephritis Diseases 0.000 claims description 5
- 201000001119 neuropathy Diseases 0.000 claims description 5
- 230000007823 neuropathy Effects 0.000 claims description 5
- 230000000414 obstructive effect Effects 0.000 claims description 5
- 230000036407 pain Effects 0.000 claims description 5
- 208000033808 peripheral neuropathy Diseases 0.000 claims description 5
- 208000005987 polymyositis Diseases 0.000 claims description 5
- OXCMYAYHXIHQOA-UHFFFAOYSA-N potassium;[2-butyl-5-chloro-3-[[4-[2-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)phenyl]phenyl]methyl]imidazol-4-yl]methanol Chemical compound [K+].CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C2=N[N-]N=N2)C=C1 OXCMYAYHXIHQOA-UHFFFAOYSA-N 0.000 claims description 5
- 210000001236 prokaryotic cell Anatomy 0.000 claims description 5
- 210000002307 prostate Anatomy 0.000 claims description 5
- 206010038038 rectal cancer Diseases 0.000 claims description 5
- 201000001275 rectum cancer Diseases 0.000 claims description 5
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 5
- 238000000926 separation method Methods 0.000 claims description 5
- 210000000278 spinal cord Anatomy 0.000 claims description 5
- 230000009885 systemic effect Effects 0.000 claims description 5
- 208000004476 Acute Coronary Syndrome Diseases 0.000 claims description 4
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 4
- 208000026872 Addison Disease Diseases 0.000 claims description 4
- 206010002383 Angina Pectoris Diseases 0.000 claims description 4
- 201000001320 Atherosclerosis Diseases 0.000 claims description 4
- 206010003658 Atrial Fibrillation Diseases 0.000 claims description 4
- 208000023275 Autoimmune disease Diseases 0.000 claims description 4
- 206010050245 Autoimmune thrombocytopenia Diseases 0.000 claims description 4
- 206010008874 Chronic Fatigue Syndrome Diseases 0.000 claims description 4
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 4
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 claims description 4
- 229930105110 Cyclosporin A Natural products 0.000 claims description 4
- 108010036949 Cyclosporine Proteins 0.000 claims description 4
- 206010012442 Dermatitis contact Diseases 0.000 claims description 4
- 206010018364 Glomerulonephritis Diseases 0.000 claims description 4
- 206010019280 Heart failures Diseases 0.000 claims description 4
- 206010020772 Hypertension Diseases 0.000 claims description 4
- 206010020880 Hypertrophy Diseases 0.000 claims description 4
- 201000009794 Idiopathic Pulmonary Fibrosis Diseases 0.000 claims description 4
- 208000016604 Lyme disease Diseases 0.000 claims description 4
- 201000009906 Meningitis Diseases 0.000 claims description 4
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 4
- 208000001132 Osteoporosis Diseases 0.000 claims description 4
- 208000002500 Primary Ovarian Insufficiency Diseases 0.000 claims description 4
- 241000607142 Salmonella Species 0.000 claims description 4
- 206010039491 Sarcoma Diseases 0.000 claims description 4
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 4
- 208000003954 Spinal Muscular Atrophies of Childhood Diseases 0.000 claims description 4
- 208000006045 Spondylarthropathies Diseases 0.000 claims description 4
- 201000009594 Systemic Scleroderma Diseases 0.000 claims description 4
- 206010042953 Systemic sclerosis Diseases 0.000 claims description 4
- 208000001106 Takayasu Arteritis Diseases 0.000 claims description 4
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 claims description 4
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 4
- 206010046851 Uveitis Diseases 0.000 claims description 4
- 208000001445 Uveomeningoencephalitic Syndrome Diseases 0.000 claims description 4
- 241000607734 Yersinia <bacteria> Species 0.000 claims description 4
- 239000004037 angiogenesis inhibitor Substances 0.000 claims description 4
- 210000004102 animal cell Anatomy 0.000 claims description 4
- 230000006907 apoptotic process Effects 0.000 claims description 4
- 230000006793 arrhythmia Effects 0.000 claims description 4
- 208000034158 bleeding Diseases 0.000 claims description 4
- 230000000740 bleeding effect Effects 0.000 claims description 4
- 238000010322 bone marrow transplantation Methods 0.000 claims description 4
- 230000000747 cardiac effect Effects 0.000 claims description 4
- 210000000845 cartilage Anatomy 0.000 claims description 4
- 230000002490 cerebral effect Effects 0.000 claims description 4
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 claims description 4
- 229960001265 ciclosporin Drugs 0.000 claims description 4
- 150000001875 compounds Chemical class 0.000 claims description 4
- 239000003246 corticosteroid Substances 0.000 claims description 4
- 229930182912 cyclosporin Natural products 0.000 claims description 4
- 206010014599 encephalitis Diseases 0.000 claims description 4
- 208000030172 endocrine system disease Diseases 0.000 claims description 4
- 210000000981 epithelium Anatomy 0.000 claims description 4
- 210000002216 heart Anatomy 0.000 claims description 4
- 208000014674 injury Diseases 0.000 claims description 4
- 230000003834 intracellular effect Effects 0.000 claims description 4
- 238000007912 intraperitoneal administration Methods 0.000 claims description 4
- 230000003902 lesion Effects 0.000 claims description 4
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 claims description 4
- 230000003287 optical effect Effects 0.000 claims description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 4
- 206010036601 premature menopause Diseases 0.000 claims description 4
- 208000017942 premature ovarian failure 1 Diseases 0.000 claims description 4
- 239000000047 product Substances 0.000 claims description 4
- 230000002784 sclerotic effect Effects 0.000 claims description 4
- 230000035939 shock Effects 0.000 claims description 4
- 201000005671 spondyloarthropathy Diseases 0.000 claims description 4
- 230000001988 toxicity Effects 0.000 claims description 4
- 231100000419 toxicity Toxicity 0.000 claims description 4
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 4
- 208000023769 AA amyloidosis Diseases 0.000 claims description 3
- 208000002874 Acne Vulgaris Diseases 0.000 claims description 3
- 208000035285 Allergic Seasonal Rhinitis Diseases 0.000 claims description 3
- 208000024827 Alzheimer disease Diseases 0.000 claims description 3
- 208000032467 Aplastic anaemia Diseases 0.000 claims description 3
- 206010064539 Autoimmune myocarditis Diseases 0.000 claims description 3
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 3
- 201000009030 Carcinoma Diseases 0.000 claims description 3
- 208000024172 Cardiovascular disease Diseases 0.000 claims description 3
- 208000029713 Catastrophic antiphospholipid syndrome Diseases 0.000 claims description 3
- 208000015879 Cerebellar disease Diseases 0.000 claims description 3
- 208000015943 Coeliac disease Diseases 0.000 claims description 3
- 206010011878 Deafness Diseases 0.000 claims description 3
- 206010012289 Dementia Diseases 0.000 claims description 3
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 3
- 241000588724 Escherichia coli Species 0.000 claims description 3
- 206010015943 Eye inflammation Diseases 0.000 claims description 3
- 206010016654 Fibrosis Diseases 0.000 claims description 3
- 208000035895 Guillain-Barré syndrome Diseases 0.000 claims description 3
- 206010019786 Hepatitis non-A non-B Diseases 0.000 claims description 3
- 206010019909 Hernia Diseases 0.000 claims description 3
- 208000017604 Hodgkin disease Diseases 0.000 claims description 3
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 3
- 208000019758 Hypergammaglobulinemia Diseases 0.000 claims description 3
- 201000003838 Idiopathic interstitial pneumonia Diseases 0.000 claims description 3
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 claims description 3
- 201000005099 Langerhans cell histiocytosis Diseases 0.000 claims description 3
- 206010049567 Miller Fisher syndrome Diseases 0.000 claims description 3
- 208000009525 Myocarditis Diseases 0.000 claims description 3
- 206010029240 Neuritis Diseases 0.000 claims description 3
- 208000003435 Optic Neuritis Diseases 0.000 claims description 3
- 208000003076 Osteolysis Diseases 0.000 claims description 3
- 206010031252 Osteomyelitis Diseases 0.000 claims description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 3
- 206010065159 Polychondritis Diseases 0.000 claims description 3
- 208000028017 Psychotic disease Diseases 0.000 claims description 3
- 206010037549 Purpura Diseases 0.000 claims description 3
- 241001672981 Purpura Species 0.000 claims description 3
- 206010037888 Rash pustular Diseases 0.000 claims description 3
- 208000003782 Raynaud disease Diseases 0.000 claims description 3
- 208000008765 Sciatica Diseases 0.000 claims description 3
- 206010039705 Scleritis Diseases 0.000 claims description 3
- 206010039807 Secondary adrenocortical insufficiency Diseases 0.000 claims description 3
- 206010039811 Secondary amyloidosis Diseases 0.000 claims description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 claims description 3
- 206010041591 Spinal osteoarthritis Diseases 0.000 claims description 3
- 241000194017 Streptococcus Species 0.000 claims description 3
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 claims description 3
- 241000223996 Toxoplasma Species 0.000 claims description 3
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 claims description 3
- 206010064948 Viral rhinitis Diseases 0.000 claims description 3
- 208000000208 Wet Macular Degeneration Diseases 0.000 claims description 3
- 208000016807 X-linked intellectual disability-macrocephaly-macroorchidism syndrome Diseases 0.000 claims description 3
- 206010000496 acne Diseases 0.000 claims description 3
- 201000000028 adult respiratory distress syndrome Diseases 0.000 claims description 3
- 206010064930 age-related macular degeneration Diseases 0.000 claims description 3
- 208000030961 allergic reaction Diseases 0.000 claims description 3
- 230000036783 anaphylactic response Effects 0.000 claims description 3
- 208000007502 anemia Diseases 0.000 claims description 3
- 230000003092 anti-cytokine Effects 0.000 claims description 3
- 208000021328 arterial occlusion Diseases 0.000 claims description 3
- 230000005784 autoimmunity Effects 0.000 claims description 3
- 201000003308 autosomal dominant familial periodic fever Diseases 0.000 claims description 3
- 208000018300 basal ganglia disease Diseases 0.000 claims description 3
- 208000010217 blepharitis Diseases 0.000 claims description 3
- 201000009267 bronchiectasis Diseases 0.000 claims description 3
- 210000003169 central nervous system Anatomy 0.000 claims description 3
- 208000036319 cervical spondylosis Diseases 0.000 claims description 3
- 206010061811 demyelinating polyneuropathy Diseases 0.000 claims description 3
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 3
- 210000003743 erythrocyte Anatomy 0.000 claims description 3
- 230000004761 fibrosis Effects 0.000 claims description 3
- 108010074605 gamma-Globulins Proteins 0.000 claims description 3
- 239000000122 growth hormone Substances 0.000 claims description 3
- 230000010370 hearing loss Effects 0.000 claims description 3
- 231100000888 hearing loss Toxicity 0.000 claims description 3
- 208000016354 hearing loss disease Diseases 0.000 claims description 3
- 229940088597 hormone Drugs 0.000 claims description 3
- 239000005556 hormone Substances 0.000 claims description 3
- 208000008384 ileus Diseases 0.000 claims description 3
- 201000010666 keratoconjunctivitis Diseases 0.000 claims description 3
- 208000029791 lytic metastatic bone lesion Diseases 0.000 claims description 3
- 208000002780 macular degeneration Diseases 0.000 claims description 3
- 229960000485 methotrexate Drugs 0.000 claims description 3
- 208000005264 motor neuron disease Diseases 0.000 claims description 3
- 208000018360 neuromuscular disease Diseases 0.000 claims description 3
- 201000005737 orchitis Diseases 0.000 claims description 3
- 230000008816 organ damage Effects 0.000 claims description 3
- 208000021090 palsy Diseases 0.000 claims description 3
- 208000001297 phlebitis Diseases 0.000 claims description 3
- 208000019629 polyneuritis Diseases 0.000 claims description 3
- 201000007094 prostatitis Diseases 0.000 claims description 3
- 208000029561 pustule Diseases 0.000 claims description 3
- 238000001959 radiotherapy Methods 0.000 claims description 3
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 claims description 3
- 230000000306 recurrent effect Effects 0.000 claims description 3
- 208000037803 restenosis Diseases 0.000 claims description 3
- 230000002207 retinal effect Effects 0.000 claims description 3
- 208000004124 rheumatic heart disease Diseases 0.000 claims description 3
- 206010039083 rhinitis Diseases 0.000 claims description 3
- 150000003839 salts Chemical class 0.000 claims description 3
- 231100000241 scar Toxicity 0.000 claims description 3
- 208000023087 secondary adrenal insufficiency Diseases 0.000 claims description 3
- 229910052710 silicon Inorganic materials 0.000 claims description 3
- 239000010703 silicon Substances 0.000 claims description 3
- 229960002930 sirolimus Drugs 0.000 claims description 3
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 claims description 3
- 210000000813 small intestine Anatomy 0.000 claims description 3
- 208000005801 spondylosis Diseases 0.000 claims description 3
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 3
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 claims description 3
- 206010043554 thrombocytopenia Diseases 0.000 claims description 3
- 102000003298 tumor necrosis factor receptor Human genes 0.000 claims description 3
- 230000002485 urinary effect Effects 0.000 claims description 3
- 210000003462 vein Anatomy 0.000 claims description 3
- 230000029663 wound healing Effects 0.000 claims description 3
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 claims description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 2
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 claims description 2
- 229930182837 (R)-adrenaline Natural products 0.000 claims description 2
- 208000009304 Acute Kidney Injury Diseases 0.000 claims description 2
- 206010000830 Acute leukaemia Diseases 0.000 claims description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 2
- 201000004384 Alopecia Diseases 0.000 claims description 2
- 102000013455 Amyloid beta-Peptides Human genes 0.000 claims description 2
- 108010090849 Amyloid beta-Peptides Proteins 0.000 claims description 2
- 206010002388 Angina unstable Diseases 0.000 claims description 2
- 206010003130 Arrhythmia supraventricular Diseases 0.000 claims description 2
- 200000000007 Arterial disease Diseases 0.000 claims description 2
- 206010003226 Arteriovenous fistula Diseases 0.000 claims description 2
- 206010053555 Arthritis bacterial Diseases 0.000 claims description 2
- 206010003267 Arthritis reactive Diseases 0.000 claims description 2
- 208000006740 Aseptic Meningitis Diseases 0.000 claims description 2
- 206010003645 Atopy Diseases 0.000 claims description 2
- 206010055128 Autoimmune neutropenia Diseases 0.000 claims description 2
- 208000031212 Autoimmune polyendocrinopathy Diseases 0.000 claims description 2
- 208000022106 Autoimmune polyendocrinopathy type 2 Diseases 0.000 claims description 2
- 241000271566 Aves Species 0.000 claims description 2
- 208000037157 Azotemia Diseases 0.000 claims description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 2
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 2
- 208000031729 Bacteremia Diseases 0.000 claims description 2
- 208000035143 Bacterial infection Diseases 0.000 claims description 2
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 claims description 2
- 208000033222 Biliary cirrhosis primary Diseases 0.000 claims description 2
- 206010005003 Bladder cancer Diseases 0.000 claims description 2
- 206010006187 Breast cancer Diseases 0.000 claims description 2
- 208000026310 Breast neoplasm Diseases 0.000 claims description 2
- 206010006448 Bronchiolitis Diseases 0.000 claims description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 2
- 206010006895 Cachexia Diseases 0.000 claims description 2
- 241000222122 Candida albicans Species 0.000 claims description 2
- 206010007134 Candida infections Diseases 0.000 claims description 2
- 206010007559 Cardiac failure congestive Diseases 0.000 claims description 2
- 208000008964 Chemical and Drug Induced Liver Injury Diseases 0.000 claims description 2
- 241000606161 Chlamydia Species 0.000 claims description 2
- 206010008748 Chorea Diseases 0.000 claims description 2
- 206010008909 Chronic Hepatitis Diseases 0.000 claims description 2
- 208000000094 Chronic Pain Diseases 0.000 claims description 2
- 206010009208 Cirrhosis alcoholic Diseases 0.000 claims description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 2
- 201000003874 Common Variable Immunodeficiency Diseases 0.000 claims description 2
- 208000035473 Communicable disease Diseases 0.000 claims description 2
- 206010056370 Congestive cardiomyopathy Diseases 0.000 claims description 2
- 206010010744 Conjunctivitis allergic Diseases 0.000 claims description 2
- 208000020406 Creutzfeldt Jacob disease Diseases 0.000 claims description 2
- 208000003407 Creutzfeldt-Jakob Syndrome Diseases 0.000 claims description 2
- 208000010859 Creutzfeldt-Jakob disease Diseases 0.000 claims description 2
- 208000011231 Crohn disease Diseases 0.000 claims description 2
- 206010011703 Cyanosis Diseases 0.000 claims description 2
- 201000003883 Cystic fibrosis Diseases 0.000 claims description 2
- 208000006313 Delayed Hypersensitivity Diseases 0.000 claims description 2
- 206010012310 Dengue fever Diseases 0.000 claims description 2
- 208000020401 Depressive disease Diseases 0.000 claims description 2
- 206010048768 Dermatosis Diseases 0.000 claims description 2
- 208000002251 Dissecting Aneurysm Diseases 0.000 claims description 2
- 102000015554 Dopamine receptor Human genes 0.000 claims description 2
- 108050004812 Dopamine receptor Proteins 0.000 claims description 2
- 201000010374 Down Syndrome Diseases 0.000 claims description 2
- 206010072268 Drug-induced liver injury Diseases 0.000 claims description 2
- 208000012661 Dyskinesia Diseases 0.000 claims description 2
- 201000009273 Endometriosis Diseases 0.000 claims description 2
- 206010059284 Epidermal necrosis Diseases 0.000 claims description 2
- 206010015108 Epstein-Barr virus infection Diseases 0.000 claims description 2
- 208000004248 Familial Primary Pulmonary Hypertension Diseases 0.000 claims description 2
- 208000007984 Female Infertility Diseases 0.000 claims description 2
- 206010016936 Folliculitis Diseases 0.000 claims description 2
- 206010017533 Fungal infection Diseases 0.000 claims description 2
- 206010058872 Fungal sepsis Diseases 0.000 claims description 2
- 208000007465 Giant cell arteritis Diseases 0.000 claims description 2
- 201000005569 Gout Diseases 0.000 claims description 2
- 206010018634 Gouty Arthritis Diseases 0.000 claims description 2
- 208000009329 Graft vs Host Disease Diseases 0.000 claims description 2
- 206010018691 Granuloma Diseases 0.000 claims description 2
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 claims description 2
- 208000003807 Graves Disease Diseases 0.000 claims description 2
- 208000015023 Graves' disease Diseases 0.000 claims description 2
- 208000031886 HIV Infections Diseases 0.000 claims description 2
- 208000037357 HIV infectious disease Diseases 0.000 claims description 2
- 208000001204 Hashimoto Disease Diseases 0.000 claims description 2
- 206010019315 Heart transplant rejection Diseases 0.000 claims description 2
- 208000018565 Hemochromatosis Diseases 0.000 claims description 2
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 claims description 2
- 208000032759 Hemolytic-Uremic Syndrome Diseases 0.000 claims description 2
- 208000005176 Hepatitis C Diseases 0.000 claims description 2
- 206010019755 Hepatitis chronic active Diseases 0.000 claims description 2
- 208000002972 Hepatolenticular Degeneration Diseases 0.000 claims description 2
- 208000002291 Histiocytic Sarcoma Diseases 0.000 claims description 2
- 208000023105 Huntington disease Diseases 0.000 claims description 2
- 206010020843 Hyperthermia Diseases 0.000 claims description 2
- 206010020850 Hyperthyroidism Diseases 0.000 claims description 2
- 208000013016 Hypoglycemia Diseases 0.000 claims description 2
- 208000016300 Idiopathic chronic eosinophilic pneumonia Diseases 0.000 claims description 2
- 208000004575 Infectious Arthritis Diseases 0.000 claims description 2
- 206010021928 Infertility female Diseases 0.000 claims description 2
- 206010061218 Inflammation Diseases 0.000 claims description 2
- 102000003777 Interleukin-1 beta Human genes 0.000 claims description 2
- 108090000193 Interleukin-1 beta Proteins 0.000 claims description 2
- 208000003618 Intervertebral Disc Displacement Diseases 0.000 claims description 2
- 206010058142 Intestine transplant rejection Diseases 0.000 claims description 2
- 208000032382 Ischaemic stroke Diseases 0.000 claims description 2
- 208000003456 Juvenile Arthritis Diseases 0.000 claims description 2
- 208000011200 Kawasaki disease Diseases 0.000 claims description 2
- 206010023439 Kidney transplant rejection Diseases 0.000 claims description 2
- 208000006264 Korsakoff syndrome Diseases 0.000 claims description 2
- 201000008197 Laryngitis Diseases 0.000 claims description 2
- 241000589248 Legionella Species 0.000 claims description 2
- 208000007764 Legionnaires' Disease Diseases 0.000 claims description 2
- 206010024229 Leprosy Diseases 0.000 claims description 2
- 208000009829 Lewy Body Disease Diseases 0.000 claims description 2
- 201000002832 Lewy body dementia Diseases 0.000 claims description 2
- 206010067125 Liver injury Diseases 0.000 claims description 2
- 206010024715 Liver transplant rejection Diseases 0.000 claims description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 2
- 206010025280 Lymphocytosis Diseases 0.000 claims description 2
- 208000007466 Male Infertility Diseases 0.000 claims description 2
- 206010027201 Meningitis aseptic Diseases 0.000 claims description 2
- 208000019695 Migraine disease Diseases 0.000 claims description 2
- 208000034578 Multiple myelomas Diseases 0.000 claims description 2
- 208000031998 Mycobacterium Infections Diseases 0.000 claims description 2
- 241000187479 Mycobacterium tuberculosis Species 0.000 claims description 2
- 208000031888 Mycoses Diseases 0.000 claims description 2
- 206010028665 Myxoedema Diseases 0.000 claims description 2
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 claims description 2
- 206010061306 Nasopharyngeal cancer Diseases 0.000 claims description 2
- 206010029164 Nephrotic syndrome Diseases 0.000 claims description 2
- 241001420836 Ophthalmitis Species 0.000 claims description 2
- 206010053869 POEMS syndrome Diseases 0.000 claims description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 2
- 206010033645 Pancreatitis Diseases 0.000 claims description 2
- 206010033647 Pancreatitis acute Diseases 0.000 claims description 2
- 208000029082 Pelvic Inflammatory Disease Diseases 0.000 claims description 2
- 208000025584 Pericardial disease Diseases 0.000 claims description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims description 2
- 208000005374 Poisoning Diseases 0.000 claims description 2
- 206010057244 Post viral fatigue syndrome Diseases 0.000 claims description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 2
- 208000012654 Primary biliary cholangitis Diseases 0.000 claims description 2
- 208000032225 Proximal spinal muscular atrophy type 1 Diseases 0.000 claims description 2
- 208000033526 Proximal spinal muscular atrophy type 3 Diseases 0.000 claims description 2
- 201000001263 Psoriatic Arthritis Diseases 0.000 claims description 2
- 208000036824 Psoriatic arthropathy Diseases 0.000 claims description 2
- 206010064911 Pulmonary arterial hypertension Diseases 0.000 claims description 2
- 206010037660 Pyrexia Diseases 0.000 claims description 2
- 208000032056 Radiation Fibrosis Syndrome Diseases 0.000 claims description 2
- 206010067953 Radiation fibrosis Diseases 0.000 claims description 2
- 208000033626 Renal failure acute Diseases 0.000 claims description 2
- 206010063837 Reperfusion injury Diseases 0.000 claims description 2
- 206010038748 Restrictive cardiomyopathy Diseases 0.000 claims description 2
- 208000025747 Rheumatic disease Diseases 0.000 claims description 2
- 206010039085 Rhinitis allergic Diseases 0.000 claims description 2
- 206010039094 Rhinitis perennial Diseases 0.000 claims description 2
- 241000876474 Sapho Species 0.000 claims description 2
- 206010053879 Sepsis syndrome Diseases 0.000 claims description 2
- 206010040070 Septic Shock Diseases 0.000 claims description 2
- 208000009714 Severe Dengue Diseases 0.000 claims description 2
- 208000032384 Severe immune-mediated enteropathy Diseases 0.000 claims description 2
- 208000028347 Sinus disease Diseases 0.000 claims description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 2
- 208000007107 Stomach Ulcer Diseases 0.000 claims description 2
- 208000006011 Stroke Diseases 0.000 claims description 2
- 208000037065 Subacute sclerosing leukoencephalitis Diseases 0.000 claims description 2
- 206010042297 Subacute sclerosing panencephalitis Diseases 0.000 claims description 2
- 206010042742 Sympathetic ophthalmia Diseases 0.000 claims description 2
- 208000007536 Thrombosis Diseases 0.000 claims description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 2
- 206010053614 Type III immune complex mediated reaction Diseases 0.000 claims description 2
- 208000007814 Unstable Angina Diseases 0.000 claims description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 2
- 206010047249 Venous thrombosis Diseases 0.000 claims description 2
- 206010047642 Vitiligo Diseases 0.000 claims description 2
- 201000008485 Wernicke-Korsakoff syndrome Diseases 0.000 claims description 2
- 208000018839 Wilson disease Diseases 0.000 claims description 2
- 208000027418 Wounds and injury Diseases 0.000 claims description 2
- 208000004622 abetalipoproteinemia Diseases 0.000 claims description 2
- 201000011040 acute kidney failure Diseases 0.000 claims description 2
- 208000005298 acute pain Diseases 0.000 claims description 2
- 201000003229 acute pancreatitis Diseases 0.000 claims description 2
- 208000012998 acute renal failure Diseases 0.000 claims description 2
- 208000018254 acute transverse myelitis Diseases 0.000 claims description 2
- 208000009956 adenocarcinoma Diseases 0.000 claims description 2
- 208000010002 alcoholic liver cirrhosis Diseases 0.000 claims description 2
- 229940100198 alkylating agent Drugs 0.000 claims description 2
- 239000002168 alkylating agent Substances 0.000 claims description 2
- 208000002205 allergic conjunctivitis Diseases 0.000 claims description 2
- 208000002029 allergic contact dermatitis Diseases 0.000 claims description 2
- 201000010105 allergic rhinitis Diseases 0.000 claims description 2
- 231100000360 alopecia Toxicity 0.000 claims description 2
- 208000006682 alpha 1-Antitrypsin Deficiency Diseases 0.000 claims description 2
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 2
- 239000003263 anabolic agent Substances 0.000 claims description 2
- 229940070021 anabolic steroids Drugs 0.000 claims description 2
- 229940035676 analgesics Drugs 0.000 claims description 2
- 229940035674 anesthetics Drugs 0.000 claims description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 claims description 2
- 239000000730 antalgic agent Substances 0.000 claims description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 claims description 2
- 239000003242 anti bacterial agent Substances 0.000 claims description 2
- 230000001399 anti-metabolic effect Effects 0.000 claims description 2
- 229940088710 antibiotic agent Drugs 0.000 claims description 2
- 230000009227 antibody-mediated cytotoxicity Effects 0.000 claims description 2
- 239000000935 antidepressant agent Substances 0.000 claims description 2
- 229940005513 antidepressants Drugs 0.000 claims description 2
- 239000004599 antimicrobial Substances 0.000 claims description 2
- 239000003080 antimitotic agent Substances 0.000 claims description 2
- 239000000164 antipsychotic agent Substances 0.000 claims description 2
- 229940005529 antipsychotics Drugs 0.000 claims description 2
- 239000003435 antirheumatic agent Substances 0.000 claims description 2
- 206010002895 aortic dissection Diseases 0.000 claims description 2
- 208000037849 arterial hypertension Diseases 0.000 claims description 2
- 206010003549 asthenia Diseases 0.000 claims description 2
- 208000024998 atopic conjunctivitis Diseases 0.000 claims description 2
- 206010003668 atrial tachycardia Diseases 0.000 claims description 2
- 208000001974 autoimmune enteropathy Diseases 0.000 claims description 2
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 claims description 2
- 201000009780 autoimmune polyendocrine syndrome type 2 Diseases 0.000 claims description 2
- 208000022362 bacterial infectious disease Diseases 0.000 claims description 2
- 229940125388 beta agonist Drugs 0.000 claims description 2
- 201000003984 candidiasis Diseases 0.000 claims description 2
- 230000002612 cardiopulmonary effect Effects 0.000 claims description 2
- 210000003198 cerebellar cortex Anatomy 0.000 claims description 2
- 208000025434 cerebellar degeneration Diseases 0.000 claims description 2
- 208000003167 cholangitis Diseases 0.000 claims description 2
- 208000012601 choreatic disease Diseases 0.000 claims description 2
- 201000009323 chronic eosinophilic pneumonia Diseases 0.000 claims description 2
- 208000029742 colonic neoplasm Diseases 0.000 claims description 2
- 201000010989 colorectal carcinoma Diseases 0.000 claims description 2
- 208000010247 contact dermatitis Diseases 0.000 claims description 2
- 238000013270 controlled release Methods 0.000 claims description 2
- 208000029078 coronary artery disease Diseases 0.000 claims description 2
- 230000001054 cortical effect Effects 0.000 claims description 2
- 229960001334 corticosteroids Drugs 0.000 claims description 2
- 238000012258 culturing Methods 0.000 claims description 2
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 claims description 2
- 230000006378 damage Effects 0.000 claims description 2
- 230000003412 degenerative effect Effects 0.000 claims description 2
- 230000003111 delayed effect Effects 0.000 claims description 2
- 208000017004 dementia pugilistica Diseases 0.000 claims description 2
- 201000002950 dengue hemorrhagic fever Diseases 0.000 claims description 2
- 201000011304 dilated cardiomyopathy 1A Diseases 0.000 claims description 2
- 208000009190 disseminated intravascular coagulation Diseases 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 201000008865 drug-induced hepatitis Diseases 0.000 claims description 2
- 201000002491 encephalomyelitis Diseases 0.000 claims description 2
- 229960005139 epinephrine Drugs 0.000 claims description 2
- 238000011156 evaluation Methods 0.000 claims description 2
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 claims description 2
- 230000001605 fetal effect Effects 0.000 claims description 2
- 201000008825 fibrosarcoma of bone Diseases 0.000 claims description 2
- 206010017758 gastric cancer Diseases 0.000 claims description 2
- 230000002496 gastric effect Effects 0.000 claims description 2
- 201000005917 gastric ulcer Diseases 0.000 claims description 2
- 239000003193 general anesthetic agent Substances 0.000 claims description 2
- 230000000762 glandular Effects 0.000 claims description 2
- 208000024908 graft versus host disease Diseases 0.000 claims description 2
- 239000001963 growth medium Substances 0.000 claims description 2
- 238000001631 haemodialysis Methods 0.000 claims description 2
- 210000002768 hair cell Anatomy 0.000 claims description 2
- 208000024348 heart neoplasm Diseases 0.000 claims description 2
- 230000000322 hemodialysis Effects 0.000 claims description 2
- 231100000753 hepatic injury Toxicity 0.000 claims description 2
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 claims description 2
- 230000036031 hyperthermia Effects 0.000 claims description 2
- 230000002218 hypoglycaemic effect Effects 0.000 claims description 2
- 208000003532 hypothyroidism Diseases 0.000 claims description 2
- 230000002989 hypothyroidism Effects 0.000 claims description 2
- 229940124452 immunizing agent Drugs 0.000 claims description 2
- 229960003444 immunosuppressant agent Drugs 0.000 claims description 2
- 239000003018 immunosuppressive agent Substances 0.000 claims description 2
- 208000027866 inflammatory disease Diseases 0.000 claims description 2
- 230000004054 inflammatory process Effects 0.000 claims description 2
- 230000028709 inflammatory response Effects 0.000 claims description 2
- 206010022000 influenza Diseases 0.000 claims description 2
- 201000004332 intermediate coronary syndrome Diseases 0.000 claims description 2
- 230000000968 intestinal effect Effects 0.000 claims description 2
- 230000005865 ionizing radiation Effects 0.000 claims description 2
- 230000000302 ischemic effect Effects 0.000 claims description 2
- 230000000366 juvenile effect Effects 0.000 claims description 2
- 201000004815 juvenile spinal muscular atrophy Diseases 0.000 claims description 2
- 229940043355 kinase inhibitor Drugs 0.000 claims description 2
- 201000002364 leukopenia Diseases 0.000 claims description 2
- 231100001022 leukopenia Toxicity 0.000 claims description 2
- 239000003589 local anesthetic agent Substances 0.000 claims description 2
- 229960005015 local anesthetics Drugs 0.000 claims description 2
- 210000003141 lower extremity Anatomy 0.000 claims description 2
- 201000005202 lung cancer Diseases 0.000 claims description 2
- 208000020816 lung neoplasm Diseases 0.000 claims description 2
- 230000000527 lymphocytic effect Effects 0.000 claims description 2
- 201000004792 malaria Diseases 0.000 claims description 2
- 230000003211 malignant effect Effects 0.000 claims description 2
- 201000006812 malignant histiocytosis Diseases 0.000 claims description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 2
- 230000002503 metabolic effect Effects 0.000 claims description 2
- 206010063344 microscopic polyangiitis Diseases 0.000 claims description 2
- 206010027599 migraine Diseases 0.000 claims description 2
- 230000002438 mitochondrial effect Effects 0.000 claims description 2
- 208000001725 mucocutaneous lymph node syndrome Diseases 0.000 claims description 2
- 208000017972 multifocal atrial tachycardia Diseases 0.000 claims description 2
- 229940035363 muscle relaxants Drugs 0.000 claims description 2
- 201000000585 muscular atrophy Diseases 0.000 claims description 2
- 208000029766 myalgic encephalomeyelitis/chronic fatigue syndrome Diseases 0.000 claims description 2
- 208000027531 mycobacterial infectious disease Diseases 0.000 claims description 2
- 208000031225 myocardial ischemia Diseases 0.000 claims description 2
- 239000003158 myorelaxant agent Substances 0.000 claims description 2
- 230000003274 myotonic effect Effects 0.000 claims description 2
- 208000003786 myxedema Diseases 0.000 claims description 2
- 201000011216 nasopharynx carcinoma Diseases 0.000 claims description 2
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 2
- 230000002232 neuromuscular Effects 0.000 claims description 2
- 239000000842 neuromuscular blocking agent Substances 0.000 claims description 2
- 208000004235 neutropenia Diseases 0.000 claims description 2
- 208000008338 non-alcoholic fatty liver disease Diseases 0.000 claims description 2
- 206010053219 non-alcoholic steatohepatitis Diseases 0.000 claims description 2
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 claims description 2
- 201000004535 ovarian dysfunction Diseases 0.000 claims description 2
- 201000002528 pancreatic cancer Diseases 0.000 claims description 2
- 208000010403 panophthalmitis Diseases 0.000 claims description 2
- 230000003071 parasitic effect Effects 0.000 claims description 2
- 230000000849 parathyroid Effects 0.000 claims description 2
- 230000001314 paroxysmal effect Effects 0.000 claims description 2
- 230000007170 pathology Effects 0.000 claims description 2
- 230000010412 perfusion Effects 0.000 claims description 2
- 206010034674 peritonitis Diseases 0.000 claims description 2
- 239000003757 phosphotransferase inhibitor Substances 0.000 claims description 2
- 231100000572 poisoning Toxicity 0.000 claims description 2
- 230000000607 poisoning effect Effects 0.000 claims description 2
- 230000007824 polyneuropathy Effects 0.000 claims description 2
- 201000011461 pre-eclampsia Diseases 0.000 claims description 2
- 201000008312 primary pulmonary hypertension Diseases 0.000 claims description 2
- 230000000750 progressive effect Effects 0.000 claims description 2
- 230000001185 psoriatic effect Effects 0.000 claims description 2
- 208000020016 psychiatric disease Diseases 0.000 claims description 2
- 208000002815 pulmonary hypertension Diseases 0.000 claims description 2
- 229940121896 radiopharmaceutical Drugs 0.000 claims description 2
- 239000012217 radiopharmaceutical Substances 0.000 claims description 2
- 230000002799 radiopharmaceutical effect Effects 0.000 claims description 2
- 208000002574 reactive arthritis Diseases 0.000 claims description 2
- 230000009467 reduction Effects 0.000 claims description 2
- 230000000552 rheumatic effect Effects 0.000 claims description 2
- 201000003068 rheumatic fever Diseases 0.000 claims description 2
- 229960001860 salicylate Drugs 0.000 claims description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 claims description 2
- 201000000306 sarcoidosis Diseases 0.000 claims description 2
- 201000000980 schizophrenia Diseases 0.000 claims description 2
- 229940125723 sedative agent Drugs 0.000 claims description 2
- 239000000932 sedative agent Substances 0.000 claims description 2
- 201000001223 septic arthritis Diseases 0.000 claims description 2
- 230000036303 septic shock Effects 0.000 claims description 2
- 208000013223 septicemia Diseases 0.000 claims description 2
- 208000007056 sickle cell anemia Diseases 0.000 claims description 2
- 208000017520 skin disease Diseases 0.000 claims description 2
- 150000003431 steroids Chemical class 0.000 claims description 2
- 239000000021 stimulant Substances 0.000 claims description 2
- 201000011549 stomach cancer Diseases 0.000 claims description 2
- 206010042772 syncope Diseases 0.000 claims description 2
- 206010043207 temporal arteritis Diseases 0.000 claims description 2
- 230000002992 thymic effect Effects 0.000 claims description 2
- 206010043778 thyroiditis Diseases 0.000 claims description 2
- 208000009174 transverse myelitis Diseases 0.000 claims description 2
- 230000008733 trauma Effects 0.000 claims description 2
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 claims description 2
- 208000025883 type III hypersensitivity disease Diseases 0.000 claims description 2
- 230000005951 type IV hypersensitivity Effects 0.000 claims description 2
- 208000027930 type IV hypersensitivity disease Diseases 0.000 claims description 2
- 208000009852 uremia Diseases 0.000 claims description 2
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 2
- 230000024883 vasodilation Effects 0.000 claims description 2
- 208000003663 ventricular fibrillation Diseases 0.000 claims description 2
- 238000002689 xenotransplantation Methods 0.000 claims description 2
- 102000023732 binding proteins Human genes 0.000 claims 64
- 102100040247 Tumor necrosis factor Human genes 0.000 claims 6
- 208000036971 interstitial lung disease 2 Diseases 0.000 claims 3
- 206010020565 Hyperaemia Diseases 0.000 claims 2
- 208000002672 hepatitis B Diseases 0.000 claims 2
- 230000036039 immunity Effects 0.000 claims 2
- 206010025135 lupus erythematosus Diseases 0.000 claims 2
- 210000005253 yeast cell Anatomy 0.000 claims 2
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 claims 1
- 208000036487 Arthropathies Diseases 0.000 claims 1
- 208000000135 Cardiovascular Syphilis Diseases 0.000 claims 1
- 206010063547 Diabetic macroangiopathy Diseases 0.000 claims 1
- 206010013700 Drug hypersensitivity Diseases 0.000 claims 1
- 206010053430 Erythrophagocytosis Diseases 0.000 claims 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims 1
- 208000012659 Joint disease Diseases 0.000 claims 1
- 208000004554 Leishmaniasis Diseases 0.000 claims 1
- 206010025282 Lymphoedema Diseases 0.000 claims 1
- 208000019430 Motor disease Diseases 0.000 claims 1
- 206010028851 Necrosis Diseases 0.000 claims 1
- 206010030113 Oedema Diseases 0.000 claims 1
- 206010049169 Pancreas transplant rejection Diseases 0.000 claims 1
- 206010039966 Senile dementia Diseases 0.000 claims 1
- 206010062164 Seronegative arthritis Diseases 0.000 claims 1
- 241000700605 Viruses Species 0.000 claims 1
- 210000004404 adrenal cortex Anatomy 0.000 claims 1
- 210000000709 aorta Anatomy 0.000 claims 1
- 210000000702 aorta abdominal Anatomy 0.000 claims 1
- 206010003230 arteritis Diseases 0.000 claims 1
- 208000010928 autoimmune thyroid disease Diseases 0.000 claims 1
- 239000011230 binding agent Substances 0.000 claims 1
- 238000002512 chemotherapy Methods 0.000 claims 1
- 230000001886 ciliary effect Effects 0.000 claims 1
- 230000003176 fibrotic effect Effects 0.000 claims 1
- 238000007429 general method Methods 0.000 claims 1
- 230000007774 longterm Effects 0.000 claims 1
- 208000002502 lymphedema Diseases 0.000 claims 1
- 210000004115 mitral valve Anatomy 0.000 claims 1
- 230000017074 necrotic cell death Effects 0.000 claims 1
- 230000007514 neuronal growth Effects 0.000 claims 1
- 208000012111 paraneoplastic syndrome Diseases 0.000 claims 1
- 244000045947 parasite Species 0.000 claims 1
- 229910052698 phosphorus Inorganic materials 0.000 claims 1
- 239000011574 phosphorus Substances 0.000 claims 1
- 230000001732 thrombotic effect Effects 0.000 claims 1
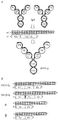
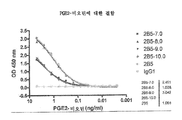
- 102000014914 Carrier Proteins Human genes 0.000 abstract description 152
- 238000002360 preparation method Methods 0.000 abstract description 7
- 238000003745 diagnosis Methods 0.000 abstract description 2
- 230000002265 prevention Effects 0.000 abstract description 2
- 235000018102 proteins Nutrition 0.000 description 74
- 230000006870 function Effects 0.000 description 51
- 235000001014 amino acid Nutrition 0.000 description 40
- 229940024606 amino acid Drugs 0.000 description 39
- 150000001413 amino acids Chemical class 0.000 description 37
- 229940027941 immunoglobulin g Drugs 0.000 description 32
- 230000000694 effects Effects 0.000 description 28
- 239000000203 mixture Substances 0.000 description 27
- 102000005962 receptors Human genes 0.000 description 27
- 108020003175 receptors Proteins 0.000 description 27
- 241001529936 Murinae Species 0.000 description 26
- 230000014509 gene expression Effects 0.000 description 25
- 239000012636 effector Substances 0.000 description 24
- 241000894007 species Species 0.000 description 24
- 230000003993 interaction Effects 0.000 description 23
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 20
- 230000035772 mutation Effects 0.000 description 20
- 238000004458 analytical method Methods 0.000 description 18
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 238000009472 formulation Methods 0.000 description 15
- 210000004408 hybridoma Anatomy 0.000 description 15
- 230000009870 specific binding Effects 0.000 description 14
- 239000012491 analyte Substances 0.000 description 13
- 239000003446 ligand Substances 0.000 description 13
- 239000000126 substance Substances 0.000 description 13
- 241000894006 Bacteria Species 0.000 description 12
- 125000000539 amino acid group Chemical group 0.000 description 11
- 238000009826 distribution Methods 0.000 description 11
- 102000040430 polynucleotide Human genes 0.000 description 11
- 108091033319 polynucleotide Proteins 0.000 description 11
- 239000002157 polynucleotide Substances 0.000 description 11
- 230000002441 reversible effect Effects 0.000 description 11
- 241001465754 Metazoa Species 0.000 description 10
- 210000004602 germ cell Anatomy 0.000 description 10
- 238000000338 in vitro Methods 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- 229940088598 enzyme Drugs 0.000 description 9
- 239000003112 inhibitor Substances 0.000 description 9
- 238000002823 phage display Methods 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 238000013459 approach Methods 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 8
- 238000006471 dimerization reaction Methods 0.000 description 8
- 239000013604 expression vector Substances 0.000 description 8
- 238000003018 immunoassay Methods 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 108020004414 DNA Proteins 0.000 description 7
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 7
- 230000008901 benefit Effects 0.000 description 7
- 230000017531 blood circulation Effects 0.000 description 7
- 239000000872 buffer Substances 0.000 description 7
- 102000057041 human TNF Human genes 0.000 description 7
- 230000001965 increasing effect Effects 0.000 description 7
- 238000006386 neutralization reaction Methods 0.000 description 7
- 210000002381 plasma Anatomy 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 238000012216 screening Methods 0.000 description 7
- 238000006467 substitution reaction Methods 0.000 description 7
- 241000282412 Homo Species 0.000 description 6
- 102100037792 Interleukin-6 receptor subunit alpha Human genes 0.000 description 6
- 108010025020 Nerve Growth Factor Proteins 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- 230000007423 decrease Effects 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 230000001976 improved effect Effects 0.000 description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 6
- 230000003472 neutralizing effect Effects 0.000 description 6
- 210000000496 pancreas Anatomy 0.000 description 6
- 229920000642 polymer Polymers 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 230000019491 signal transduction Effects 0.000 description 6
- 102100023995 Beta-nerve growth factor Human genes 0.000 description 5
- 102000009109 Fc receptors Human genes 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 241000283984 Rodentia Species 0.000 description 5
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 150000001720 carbohydrates Chemical class 0.000 description 5
- 235000014633 carbohydrates Nutrition 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 230000021615 conjugation Effects 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 210000004698 lymphocyte Anatomy 0.000 description 5
- 108020004999 messenger RNA Proteins 0.000 description 5
- 239000000178 monomer Substances 0.000 description 5
- 238000002703 mutagenesis Methods 0.000 description 5
- 231100000350 mutagenesis Toxicity 0.000 description 5
- 229940053128 nerve growth factor Drugs 0.000 description 5
- 230000001575 pathological effect Effects 0.000 description 5
- 239000012071 phase Substances 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 238000012545 processing Methods 0.000 description 5
- 230000035945 sensitivity Effects 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000003860 storage Methods 0.000 description 5
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 4
- 108010087819 Fc receptors Proteins 0.000 description 4
- 238000010521 absorption reaction Methods 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 239000000556 agonist Substances 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 102000003675 cytokine receptors Human genes 0.000 description 4
- 108010057085 cytokine receptors Proteins 0.000 description 4
- 235000019441 ethanol Nutrition 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 210000001508 eye Anatomy 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000001900 immune effect Effects 0.000 description 4
- 210000004072 lung Anatomy 0.000 description 4
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 4
- 239000013641 positive control Substances 0.000 description 4
- 230000017854 proteolysis Effects 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 230000009466 transformation Effects 0.000 description 4
- 230000009261 transgenic effect Effects 0.000 description 4
- 230000007704 transition Effects 0.000 description 4
- 210000003932 urinary bladder Anatomy 0.000 description 4
- 210000004291 uterus Anatomy 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- 102000000844 Cell Surface Receptors Human genes 0.000 description 3
- 108010001857 Cell Surface Receptors Proteins 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- 102100025101 GATA-type zinc finger protein 1 Human genes 0.000 description 3
- 108091016366 Histone-lysine N-methyltransferase EHMT1 Proteins 0.000 description 3
- 101000690301 Homo sapiens Aldo-keto reductase family 1 member C4 Proteins 0.000 description 3
- 101001116548 Homo sapiens Protein CBFA2T1 Proteins 0.000 description 3
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 description 3
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 3
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 3
- 102000004877 Insulin Human genes 0.000 description 3
- 108090001061 Insulin Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241000699660 Mus musculus Species 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- 238000012452 Xenomouse strains Methods 0.000 description 3
- 210000004100 adrenal gland Anatomy 0.000 description 3
- 230000009824 affinity maturation Effects 0.000 description 3
- 230000003302 anti-idiotype Effects 0.000 description 3
- 230000003110 anti-inflammatory effect Effects 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000005277 cation exchange chromatography Methods 0.000 description 3
- 210000001072 colon Anatomy 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 238000012377 drug delivery Methods 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 150000004676 glycans Chemical class 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 102000054751 human RUNX1T1 Human genes 0.000 description 3
- 230000002163 immunogen Effects 0.000 description 3
- 230000016784 immunoglobulin production Effects 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 229940125396 insulin Drugs 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 210000001165 lymph node Anatomy 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 108010068617 neonatal Fc receptor Proteins 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 230000035790 physiological processes and functions Effects 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 238000002818 protein evolution Methods 0.000 description 3
- 238000003259 recombinant expression Methods 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 235000002639 sodium chloride Nutrition 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 229940126622 therapeutic monoclonal antibody Drugs 0.000 description 3
- 238000011830 transgenic mouse model Methods 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- 210000002700 urine Anatomy 0.000 description 3
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- 239000005541 ACE inhibitor Substances 0.000 description 2
- 206010001367 Adrenal insufficiency Diseases 0.000 description 2
- 102100027211 Albumin Human genes 0.000 description 2
- 108010088751 Albumins Proteins 0.000 description 2
- 101800001718 Amyloid-beta protein Proteins 0.000 description 2
- 241000272517 Anseriformes Species 0.000 description 2
- 108010032595 Antibody Binding Sites Proteins 0.000 description 2
- 208000031104 Arterial Occlusive disease Diseases 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 2
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 102000009410 Chemokine receptor Human genes 0.000 description 2
- 108050000299 Chemokine receptor Proteins 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- 108010071942 Colony-Stimulating Factors Proteins 0.000 description 2
- 108020004635 Complementary DNA Chemical group 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 239000004971 Cross linker Substances 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 208000017701 Endocrine disease Diseases 0.000 description 2
- 241000283086 Equidae Species 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- 108091029865 Exogenous DNA Proteins 0.000 description 2
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 2
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102000006395 Globulins Human genes 0.000 description 2
- 108010044091 Globulins Proteins 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 description 2
- 108010000521 Human Growth Hormone Proteins 0.000 description 2
- 102000002265 Human Growth Hormone Human genes 0.000 description 2
- 239000000854 Human Growth Hormone Substances 0.000 description 2
- 206010062767 Hypophysitis Diseases 0.000 description 2
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 2
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 102000000589 Interleukin-1 Human genes 0.000 description 2
- 108010002352 Interleukin-1 Proteins 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 102000003815 Interleukin-11 Human genes 0.000 description 2
- 108090000177 Interleukin-11 Proteins 0.000 description 2
- 102000013462 Interleukin-12 Human genes 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102100030703 Interleukin-22 Human genes 0.000 description 2
- 108010065637 Interleukin-23 Proteins 0.000 description 2
- 102100036705 Interleukin-23 subunit alpha Human genes 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 108010002586 Interleukin-7 Proteins 0.000 description 2
- 102000000704 Interleukin-7 Human genes 0.000 description 2
- 108090001007 Interleukin-8 Proteins 0.000 description 2
- 102000004890 Interleukin-8 Human genes 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- UETNIIAIRMUTSM-UHFFFAOYSA-N Jacareubin Natural products CC1(C)OC2=CC3Oc4c(O)c(O)ccc4C(=O)C3C(=C2C=C1)O UETNIIAIRMUTSM-UHFFFAOYSA-N 0.000 description 2
- 102100020880 Kit ligand Human genes 0.000 description 2
- 102000008072 Lymphokines Human genes 0.000 description 2
- 108010074338 Lymphokines Proteins 0.000 description 2
- 102000004083 Lymphotoxin-alpha Human genes 0.000 description 2
- 108090000542 Lymphotoxin-alpha Proteins 0.000 description 2
- 241000282567 Macaca fascicularis Species 0.000 description 2
- 102000013967 Monokines Human genes 0.000 description 2
- 108010050619 Monokines Proteins 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 102000015731 Peptide Hormones Human genes 0.000 description 2
- 108010038988 Peptide Hormones Proteins 0.000 description 2
- 206010057249 Phagocytosis Diseases 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 108010039445 Stem Cell Factor Proteins 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 description 2
- 102000036693 Thrombopoietin Human genes 0.000 description 2
- 108010041111 Thrombopoietin Proteins 0.000 description 2
- 102000011923 Thyrotropin Human genes 0.000 description 2
- 108010061174 Thyrotropin Proteins 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 2
- 208000036142 Viral infection Diseases 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 229960002964 adalimumab Drugs 0.000 description 2
- 208000017515 adrenocortical insufficiency Diseases 0.000 description 2
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 229960002170 azathioprine Drugs 0.000 description 2
- LMEKQMALGUDUQG-UHFFFAOYSA-N azathioprine Chemical compound CN1C=NC([N+]([O-])=O)=C1SC1=NC=NC2=C1NC=N2 LMEKQMALGUDUQG-UHFFFAOYSA-N 0.000 description 2
- 230000001580 bacterial effect Effects 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 210000003679 cervix uteri Anatomy 0.000 description 2
- 239000002738 chelating agent Substances 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 230000002124 endocrine Effects 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- 210000003238 esophagus Anatomy 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 102000006815 folate receptor Human genes 0.000 description 2
- 108020005243 folate receptor Proteins 0.000 description 2
- 229940028334 follicle stimulating hormone Drugs 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 229940014259 gelatin Drugs 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 230000003394 haemopoietic effect Effects 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- 238000010348 incorporation Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 102000006495 integrins Human genes 0.000 description 2
- 108010044426 integrins Proteins 0.000 description 2
- 238000012004 kinetic exclusion assay Methods 0.000 description 2
- 238000001638 lipofection Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 230000001926 lymphatic effect Effects 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000003607 modifier Substances 0.000 description 2
- 239000012514 monoclonal antibody product Substances 0.000 description 2
- 239000002773 nucleotide Substances 0.000 description 2
- 125000003729 nucleotide group Chemical group 0.000 description 2
- 239000000813 peptide hormone Substances 0.000 description 2
- 230000008782 phagocytosis Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 210000003635 pituitary gland Anatomy 0.000 description 2
- 210000002826 placenta Anatomy 0.000 description 2
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 2
- 230000000069 prophylactic effect Effects 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- 238000001742 protein purification Methods 0.000 description 2
- 239000012460 protein solution Substances 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003908 quality control method Methods 0.000 description 2
- 238000002708 random mutagenesis Methods 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000009450 sialylation Effects 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 238000001542 size-exclusion chromatography Methods 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 230000007928 solubilization Effects 0.000 description 2
- 238000005063 solubilization Methods 0.000 description 2
- 230000000392 somatic effect Effects 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 150000005846 sugar alcohols Chemical class 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 229960001940 sulfasalazine Drugs 0.000 description 2
- NCEXYHBECQHGNR-QZQOTICOSA-N sulfasalazine Chemical compound C1=C(O)C(C(=O)O)=CC(\N=N\C=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-QZQOTICOSA-N 0.000 description 2
- NCEXYHBECQHGNR-UHFFFAOYSA-N sulfasalazine Natural products C1=C(O)C(C(=O)O)=CC(N=NC=2C=CC(=CC=2)S(=O)(=O)NC=2N=CC=CC=2)=C1 NCEXYHBECQHGNR-UHFFFAOYSA-N 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 230000005030 transcription termination Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- 230000003612 virological effect Effects 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- BQIMPGFMMOZASS-CLZZGJSISA-N (6r,7r)-7-amino-3-(hydroxymethyl)-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid Chemical compound S1CC(CO)=C(C(O)=O)N2C(=O)[C@@H](N)[C@H]21 BQIMPGFMMOZASS-CLZZGJSISA-N 0.000 description 1
- ROKOFZNQCIIJMI-UHFFFAOYSA-N 4-(4-fluorophenyl)-1-cycloropropylmethyl-5-(4-pyridyl)-imidazole Chemical class C1=CC(F)=CC=C1C1=C(C=2C=CN=CC=2)N(CC2CC2)C=N1 ROKOFZNQCIIJMI-UHFFFAOYSA-N 0.000 description 1
- WUBBRNOQWQTFEX-UHFFFAOYSA-N 4-aminosalicylic acid Chemical compound NC1=CC=C(C(O)=O)C(O)=C1 WUBBRNOQWQTFEX-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 206010001513 AIDS related complex Diseases 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 208000029483 Acquired immunodeficiency Diseases 0.000 description 1
- 206010001343 Adrenal cortical hypofunctions Diseases 0.000 description 1
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 206010001889 Alveolitis Diseases 0.000 description 1
- 208000037259 Amyloid Plaque Diseases 0.000 description 1
- 102100022014 Angiopoietin-1 receptor Human genes 0.000 description 1
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 description 1
- 235000002198 Annona diversifolia Nutrition 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 1
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 description 1
- 102400000667 Brain natriuretic peptide 32 Human genes 0.000 description 1
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 1
- 101800002247 Brain natriuretic peptide 45 Proteins 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 102100035904 Caspase-1 Human genes 0.000 description 1
- 108090000426 Caspase-1 Proteins 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 241000283153 Cetacea Species 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 208000006332 Choriocarcinoma Diseases 0.000 description 1
- 102100021809 Chorionic somatomammotropin hormone 1 Human genes 0.000 description 1
- 208000017667 Chronic Disease Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000014447 Complement C1q Human genes 0.000 description 1
- 108010078043 Complement C1q Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- 241000219130 Cucurbita pepo subsp. pepo Species 0.000 description 1
- 235000003954 Cucurbita pepo var melopepo Nutrition 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- 102100028712 Cytosolic purine 5'-nucleotidase Human genes 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 206010011844 Dacryocystitis Diseases 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- 108010002156 Depsipeptides Proteins 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 208000006926 Discoid Lupus Erythematosus Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 1
- 229940122858 Elastase inhibitor Drugs 0.000 description 1
- MBYXEBXZARTUSS-QLWBXOBMSA-N Emetamine Natural products O(C)c1c(OC)cc2c(c(C[C@@H]3[C@H](CC)CN4[C@H](c5c(cc(OC)c(OC)c5)CC4)C3)ncc2)c1 MBYXEBXZARTUSS-QLWBXOBMSA-N 0.000 description 1
- 102400000792 Endothelial monocyte-activating polypeptide 2 Human genes 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010073385 Fibrin Proteins 0.000 description 1
- 102000009123 Fibrin Human genes 0.000 description 1
- BWGVNKXGVNDBDI-UHFFFAOYSA-N Fibrin monomer Chemical compound CNC(=O)CNC(=O)CN BWGVNKXGVNDBDI-UHFFFAOYSA-N 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 241000724791 Filamentous phage Species 0.000 description 1
- 229930091371 Fructose Natural products 0.000 description 1
- 239000005715 Fructose Substances 0.000 description 1
- RFSUNEUAIZKAJO-ARQDHWQXSA-N Fructose Chemical compound OC[C@H]1O[C@](O)(CO)[C@@H](O)[C@@H]1O RFSUNEUAIZKAJO-ARQDHWQXSA-N 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- 208000007882 Gastritis Diseases 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 206010018498 Goitre Diseases 0.000 description 1
- 102000006771 Gonadotropins Human genes 0.000 description 1
- 108010086677 Gonadotropins Proteins 0.000 description 1
- 208000024869 Goodpasture syndrome Diseases 0.000 description 1
- 241000989913 Gunnera petaloidea Species 0.000 description 1
- 101000753291 Homo sapiens Angiopoietin-1 receptor Proteins 0.000 description 1
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 1
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 1
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 1
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 description 1
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 1
- 101000800116 Homo sapiens Thy-1 membrane glycoprotein Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 208000037147 Hypercalcaemia Diseases 0.000 description 1
- 101150019209 IL13 gene Proteins 0.000 description 1
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 1
- 206010021245 Idiopathic thrombocytopenic purpura Diseases 0.000 description 1
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 206010022489 Insulin Resistance Diseases 0.000 description 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102100026018 Interleukin-1 receptor antagonist protein Human genes 0.000 description 1
- 101710144554 Interleukin-1 receptor antagonist protein Proteins 0.000 description 1
- 102400000025 Interleukin-1 receptor type 1, soluble form Human genes 0.000 description 1
- 101800000542 Interleukin-1 receptor type 1, soluble form Proteins 0.000 description 1
- 102400000027 Interleukin-1 receptor type 2, soluble form Human genes 0.000 description 1
- 101800001003 Interleukin-1 receptor type 2, soluble form Proteins 0.000 description 1
- 102100036342 Interleukin-1 receptor-associated kinase 1 Human genes 0.000 description 1
- 101710199015 Interleukin-1 receptor-associated kinase 1 Proteins 0.000 description 1
- 102000003816 Interleukin-13 Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 101800003050 Interleukin-16 Proteins 0.000 description 1
- 102000049772 Interleukin-16 Human genes 0.000 description 1
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 description 1
- 108010002386 Interleukin-3 Proteins 0.000 description 1
- 102000000646 Interleukin-3 Human genes 0.000 description 1
- 108010067003 Interleukin-33 Proteins 0.000 description 1
- 102000017761 Interleukin-33 Human genes 0.000 description 1
- 108010002616 Interleukin-5 Proteins 0.000 description 1
- 102000000743 Interleukin-5 Human genes 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 102000000585 Interleukin-9 Human genes 0.000 description 1
- 206010050296 Intervertebral disc protrusion Diseases 0.000 description 1
- 108010092694 L-Selectin Proteins 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- 102000016551 L-selectin Human genes 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000282838 Lama Species 0.000 description 1
- 108090001090 Lectins Chemical group 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 206010024558 Lip oedema Diseases 0.000 description 1
- 208000007021 Lipedema Diseases 0.000 description 1
- 108010051335 Lipocalin-2 Proteins 0.000 description 1
- 102000013519 Lipocalin-2 Human genes 0.000 description 1
- 239000000867 Lipoxygenase Inhibitor Substances 0.000 description 1
- 229940122142 Lipoxygenase inhibitor Drugs 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241001436793 Meru Species 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- MWCLLHOVUTZFKS-UHFFFAOYSA-N Methyl cyanoacrylate Chemical compound COC(=O)C(=C)C#N MWCLLHOVUTZFKS-UHFFFAOYSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 208000016285 Movement disease Diseases 0.000 description 1
- 101100046526 Mus musculus Tnf gene Proteins 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- NSTPXGARCQOSAU-VIFPVBQESA-N N-formyl-L-phenylalanine Chemical compound O=CN[C@H](C(=O)O)CC1=CC=CC=C1 NSTPXGARCQOSAU-VIFPVBQESA-N 0.000 description 1
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 208000005890 Neuroma Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 206010030111 Oedema mucosal Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 102000003982 Parathyroid hormone Human genes 0.000 description 1
- 108090000445 Parathyroid hormone Proteins 0.000 description 1
- 108010067902 Peptide Library Proteins 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- 108010003044 Placental Lactogen Proteins 0.000 description 1
- 239000000381 Placental Lactogen Substances 0.000 description 1
- 206010036030 Polyarthritis Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 1
- 241000866625 Polymorphus Species 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 229920001219 Polysorbate 40 Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 108010076181 Proinsulin Proteins 0.000 description 1
- 102100024819 Prolactin Human genes 0.000 description 1
- 108010057464 Prolactin Proteins 0.000 description 1
- 102100024450 Prostaglandin E2 receptor EP4 subtype Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 1
- 101000648290 Rattus norvegicus Tumor necrosis factor Proteins 0.000 description 1
- 230000010799 Receptor Interactions Effects 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- AUVVAXYIELKVAI-UHFFFAOYSA-N SJ000285215 Natural products N1CCC2=CC(OC)=C(OC)C=C2C1CC1CC2C3=CC(OC)=C(OC)C=C3CCN2CC1CC AUVVAXYIELKVAI-UHFFFAOYSA-N 0.000 description 1
- 208000003837 Second Primary Neoplasms Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 201000002661 Spondylitis Diseases 0.000 description 1
- 108010008038 Synthetic Vaccines Proteins 0.000 description 1
- 108091008874 T cell receptors Proteins 0.000 description 1
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 1
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 1
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 1
- 241000188156 Tamu Species 0.000 description 1
- 206010043561 Thrombocytopenic purpura Diseases 0.000 description 1
- 102100033523 Thy-1 membrane glycoprotein Human genes 0.000 description 1
- 208000024799 Thyroid disease Diseases 0.000 description 1
- 206010044223 Toxic epidermal necrolysis Diseases 0.000 description 1
- 231100000087 Toxic epidermal necrolysis Toxicity 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 1
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 description 1
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 208000034705 Vogt-Koyanagi-Harada syndrome Diseases 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 229940022663 acetate Drugs 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical class C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 208000038016 acute inflammation Diseases 0.000 description 1
- 230000006022 acute inflammation Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000464 adrenergic agent Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 1
- 108010035879 albumin-bilirubin complex Proteins 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 229940113720 aminosalicylate Drugs 0.000 description 1
- 210000004381 amniotic fluid Anatomy 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 1
- 229940124691 antibody therapeutics Drugs 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 229960004676 antithrombotic agent Drugs 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- 208000015802 attention deficit-hyperactivity disease Diseases 0.000 description 1
- 201000003710 autoimmune thrombocytopenic purpura Diseases 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 235000013405 beer Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 238000010256 biochemical assay Methods 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 229920002988 biodegradable polymer Polymers 0.000 description 1
- 239000004621 biodegradable polymer Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 210000000601 blood cell Anatomy 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- RSIHSRDYCUFFLA-DYKIIFRCSA-N boldenone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 RSIHSRDYCUFFLA-DYKIIFRCSA-N 0.000 description 1
- 238000006664 bond formation reaction Methods 0.000 description 1
- 108010006025 bovine growth hormone Proteins 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 210000000748 cardiovascular system Anatomy 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000001925 catabolic effect Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000007910 cell fusion Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 210000003710 cerebral cortex Anatomy 0.000 description 1
- 210000004720 cerebrum Anatomy 0.000 description 1
- 239000013626 chemical specie Substances 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 230000006020 chronic inflammation Effects 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229960005188 collagen Drugs 0.000 description 1
- 238000004737 colorimetric analysis Methods 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 239000004074 complement inhibitor Substances 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 238000010668 complexation reaction Methods 0.000 description 1
- 238000000205 computational method Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 208000004921 cutaneous lupus erythematosus Diseases 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- RSIHSRDYCUFFLA-UHFFFAOYSA-N dehydrotestosterone Natural products O=C1C=CC2(C)C3CCC(C)(C(CC4)O)C4C3CCC2=C1 RSIHSRDYCUFFLA-UHFFFAOYSA-N 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000003602 elastase inhibitor Substances 0.000 description 1
- 229960002694 emetine Drugs 0.000 description 1
- AUVVAXYIELKVAI-CKBKHPSWSA-N emetine Chemical compound N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC AUVVAXYIELKVAI-CKBKHPSWSA-N 0.000 description 1
- AUVVAXYIELKVAI-UWBTVBNJSA-N emetine Natural products N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@H]1CC AUVVAXYIELKVAI-UWBTVBNJSA-N 0.000 description 1
- 210000003372 endocrine gland Anatomy 0.000 description 1
- 206010014801 endophthalmitis Diseases 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000003511 endothelial effect Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 239000003797 essential amino acid Substances 0.000 description 1
- 235000020776 essential amino acid Nutrition 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- AJIPIJNNOJSSQC-NYLIRDPKSA-N estetrol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H]([C@H](O)[C@@H]4O)O)[C@@H]4[C@@H]3CCC2=C1 AJIPIJNNOJSSQC-NYLIRDPKSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 201000001155 extrinsic allergic alveolitis Diseases 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 210000005002 female reproductive tract Anatomy 0.000 description 1
- 229950003499 fibrin Drugs 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 238000007730 finishing process Methods 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- UIWYJDYFSGRHKR-UHFFFAOYSA-N gadolinium atom Chemical compound [Gd] UIWYJDYFSGRHKR-UHFFFAOYSA-N 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 238000013110 gastrectomy Methods 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 201000003872 goiter Diseases 0.000 description 1
- 239000002622 gonadotropin Substances 0.000 description 1
- ZWCXYZRRTRDGQE-SORVKSEFSA-N gramicidina Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-SORVKSEFSA-N 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 208000013210 hematogenous Diseases 0.000 description 1
- 230000002949 hemolytic effect Effects 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- 229960002050 hydrofluoric acid Drugs 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 230000000148 hypercalcaemia Effects 0.000 description 1
- 208000030915 hypercalcemia disease Diseases 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 208000022098 hypersensitivity pneumonitis Diseases 0.000 description 1
- 229960001680 ibuprofen Drugs 0.000 description 1
- 208000036260 idiopathic disease Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000009851 immunogenic response Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000000099 in vitro assay Methods 0.000 description 1
- 238000012606 in vitro cell culture Methods 0.000 description 1
- 208000035231 inattentive type attention deficit hyperactivity disease Diseases 0.000 description 1
- 201000008319 inclusion body myositis Diseases 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000012482 interaction analysis Methods 0.000 description 1
- 229940047124 interferons Drugs 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 108010074109 interleukin-22 Proteins 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000000832 lactitol Substances 0.000 description 1
- VQHSOMBJVWLPSR-JVCRWLNRSA-N lactitol Chemical compound OC[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O VQHSOMBJVWLPSR-JVCRWLNRSA-N 0.000 description 1
- 235000010448 lactitol Nutrition 0.000 description 1
- 229960003451 lactitol Drugs 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 239000002523 lectin Chemical group 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 230000004807 localization Effects 0.000 description 1
- 230000001050 lubricating effect Effects 0.000 description 1
- 210000002751 lymph Anatomy 0.000 description 1
- 210000003712 lysosome Anatomy 0.000 description 1
- 230000001868 lysosomic effect Effects 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 210000005001 male reproductive tract Anatomy 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 108010000525 member 1 small inducible cytokine subfamily E Proteins 0.000 description 1
- 206010027191 meningioma Diseases 0.000 description 1
- KBOPZPXVLCULAV-UHFFFAOYSA-N mesalamine Chemical compound NC1=CC=C(O)C(C(O)=O)=C1 KBOPZPXVLCULAV-UHFFFAOYSA-N 0.000 description 1
- 229960004963 mesalazine Drugs 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 229960000282 metronidazole Drugs 0.000 description 1
- VAOCPAMSLUNLGC-UHFFFAOYSA-N metronidazole Chemical compound CC1=NC=C([N+]([O-])=O)N1CCO VAOCPAMSLUNLGC-UHFFFAOYSA-N 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000004879 molecular function Effects 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 230000004660 morphological change Effects 0.000 description 1
- 208000013465 muscle pain Diseases 0.000 description 1
- 230000000869 mutational effect Effects 0.000 description 1
- RTGDFNSFWBGLEC-SYZQJQIISA-N mycophenolate mofetil Chemical compound COC1=C(C)C=2COC(=O)C=2C(O)=C1C\C=C(/C)CCC(=O)OCCN1CCOCC1 RTGDFNSFWBGLEC-SYZQJQIISA-N 0.000 description 1
- 229960004866 mycophenolate mofetil Drugs 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- ZTUGCJNAJJDKDC-UHFFFAOYSA-N n-(3-hydroxypropyl)-2-methylprop-2-enamide Chemical compound CC(=C)C(=O)NCCCO ZTUGCJNAJJDKDC-UHFFFAOYSA-N 0.000 description 1
- GKTNLYAAZKKMTQ-UHFFFAOYSA-N n-[bis(dimethylamino)phosphinimyl]-n-methylmethanamine Chemical compound CN(C)P(=N)(N(C)C)N(C)C GKTNLYAAZKKMTQ-UHFFFAOYSA-N 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000017095 negative regulation of cell growth Effects 0.000 description 1
- 208000029522 neoplastic syndrome Diseases 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- 238000002515 oligonucleotide synthesis Methods 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 125000000962 organic group Chemical group 0.000 description 1
- 230000002138 osteoinductive effect Effects 0.000 description 1
- 210000003101 oviduct Anatomy 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 230000000242 pagocytic effect Effects 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 210000002990 parathyroid gland Anatomy 0.000 description 1
- 239000000199 parathyroid hormone Substances 0.000 description 1
- 229960001319 parathyroid hormone Drugs 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 238000012510 peptide mapping method Methods 0.000 description 1
- 125000001151 peptidyl group Chemical group 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 102000013415 peroxidase activity proteins Human genes 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 229920000117 poly(dioxanone) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000002745 poly(ortho ester) Substances 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 208000030428 polyarticular arthritis Diseases 0.000 description 1
- 229920001610 polycaprolactone Polymers 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010483 polyoxyethylene sorbitan monopalmitate Nutrition 0.000 description 1
- 239000000249 polyoxyethylene sorbitan monopalmitate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940101027 polysorbate 40 Drugs 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229940097325 prolactin Drugs 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 108010087851 prorelaxin Proteins 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 230000004853 protein function Effects 0.000 description 1
- 230000012743 protein tagging Effects 0.000 description 1
- 230000004850 protein–protein interaction Effects 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 238000005086 pumping Methods 0.000 description 1
- 239000003379 purinergic P1 receptor agonist Substances 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 238000012340 reverse transcriptase PCR Methods 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 1
- 238000013077 scoring method Methods 0.000 description 1
- 238000005204 segregation Methods 0.000 description 1
- 210000001625 seminal vesicle Anatomy 0.000 description 1
- 230000035807 sensation Effects 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 229940043517 specific immunoglobulins Drugs 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 201000004595 synovitis Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 208000006379 syphilis Diseases 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- GKCBAIGFKIBETG-UHFFFAOYSA-N tetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 GKCBAIGFKIBETG-UHFFFAOYSA-N 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RZWIIPASKMUIAC-VQTJNVASSA-N thromboxane Chemical compound CCCCCCCC[C@H]1OCCC[C@@H]1CCCCCCC RZWIIPASKMUIAC-VQTJNVASSA-N 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 208000021510 thyroid gland disease Diseases 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 231100000027 toxicology Toxicity 0.000 description 1
- 230000005026 transcription initiation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- ODLHGICHYURWBS-LKONHMLTSA-N trappsol cyclo Chemical compound CC(O)COC[C@H]([C@H]([C@@H]([C@H]1O)O)O[C@H]2O[C@@H]([C@@H](O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O[C@H]3O[C@H](COCC(C)O)[C@H]([C@@H]([C@H]3O)O)O3)[C@H](O)[C@H]2O)COCC(O)C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H]3O[C@@H]1COCC(C)O ODLHGICHYURWBS-LKONHMLTSA-N 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 239000002447 tumor necrosis factor alpha converting enzyme inhibitor Substances 0.000 description 1
- 208000013706 tumor of meninges Diseases 0.000 description 1
- 229940079023 tysabri Drugs 0.000 description 1
- 238000000108 ultra-filtration Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 210000000626 ureter Anatomy 0.000 description 1
- 210000001635 urinary tract Anatomy 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 201000010653 vesiculitis Diseases 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 229940099073 xolair Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6875—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody being a hybrid immunoglobulin
- A61K47/6879—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody being a hybrid immunoglobulin the immunoglobulin having two or more different antigen-binding sites, e.g. bispecific or multispecific immunoglobulin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
- A61K51/1084—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody the antibody being a hybrid immunoglobulin
- A61K51/109—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody the antibody being a hybrid immunoglobulin immunoglobulins having two or more different antigen-binding sites or multifunctional antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4713—Autoimmune diseases, e.g. Insulin-dependent diabetes mellitus, multiple sclerosis, rheumathoid arthritis, systemic lupus erythematosus; Autoantigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/26—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against hormones ; against hormone releasing or inhibiting factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/44—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material not provided for elsewhere, e.g. haptens, metals, DNA, RNA, amino acids
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/6863—Cytokines, i.e. immune system proteins modifying a biological response such as cell growth proliferation or differentiation, e.g. TNF, CNF, GM-CSF, lymphotoxin, MIF or their receptors
- G01N33/6869—Interleukin
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/74—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving hormones or other non-cytokine intercellular protein regulatory factors such as growth factors, including receptors to hormones and growth factors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/88—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving prostaglandins or their receptors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2121/00—Preparations for use in therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/734—Complement-dependent cytotoxicity [CDC]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4709—Amyloid plaque core protein
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/48—Nerve growth factor [NGF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/525—Tumor necrosis factor [TNF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/54—Interleukins [IL]
- G01N2333/5443—IL-15
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/52—Assays involving cytokines
- G01N2333/54—Interleukins [IL]
- G01N2333/545—IL-1
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/715—Assays involving receptors, cell surface antigens or cell surface determinants for cytokines; for lymphokines; for interferons
- G01N2333/7155—Assays involving receptors, cell surface antigens or cell surface determinants for cytokines; for lymphokines; for interferons for interleukins [IL]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Physics & Mathematics (AREA)
- Endocrinology (AREA)
- Neurosurgery (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Rheumatology (AREA)
Abstract
본 발명은 유전자조작된 다가 및 다중특이성 결합 단백질, 이의 제조방법, 및 특히 질병의 예방, 진단 및/또는 치료에 있어서의 이들의 용도에 관한 것이다.
Description
관련 출원에 대한 참조
본 출원은 2008년 7월 8일에 출원된 미국 임시출원번호 61/134,284, 및 2008년 9월 11일에 출원된 미국 임시출원번호 61/191,711에 대한 우선권을 주장하는 정규 출원으로, 각 관련 출원의 내용은 본 발명에 참고인용되고 있다.
발명의 분야
본 발명은 다가(multivalent) 및 다특이적(multispecific) 결합 단백질, 프로스타글란딘 E2(PGE2)에 특이적인 적어도 하나의 가변 도메인, 이의 제조방법, 특히 급성 및 만성 염증, 자가면역 질환, 암, 통증, 뼈, 신경 및 기타 질환의 진단, 예방 및/또는 치료에 있어서의 이들의 용도에 관한 것이다.
유전자조작된 단백질, 예컨대 2종 이상의 항원에 결합할 수 있는 다특이적 항체는 당업계에 공지되어 있다. 이러한 다특이적 결합 단백질은 세포 융합, 화학적 접합 또는 재조합 DNA 기술을 이용해 발생시킬 수 있다.
이특이적 항체는 이특이적 항체의 목적 특이성을 가진 쥐 모노클로날 항체(mAb)를 발현하는 2종의 다른 하이브리도마 세포주의 체세포 융합을 기초로 한 쿼드로마(quadroma) 기술(Milstein, C. and A.C. Cuello (1983) Nature 305(5934): 537-40)을 이용하여 생산하고 있다. 최종 하이브리드-하이브리도마(또는 쿼드로마) 세포주에서 2종의 다른 면역글로불린(Ig) 중쇄와 경쇄가 무작위 짝짓기(pairing)를 하기 때문에 최고 10종의 다른 Ig 종이 발생되고, 이 중 하나만이 기능적인 이특이적 항체이다. 부정-짝지어진 부산물의 존재, 및 현저히 감소된 생산 수율은 고도의 정제 절차가 필요하다는 것을 의미한다.
또한, 이특이적 항체는 2종의 다른 mAb를 화학적 접합시켜 생산할 수도 있다(Staerz, U.D. et al.(1985) Nature 314(6012): 628-31). 이러한 시도는 균질 제조물을 생산하지 않는다. 다른 시도는 2종의 다른 mAb 또는 이보다 작은 항체 단편의 화학적 접합을 이용했다(Brennan, M., et al.(1985) Science 229(4708): 81-3).
이특이적 항체를 생산하는데 사용된 다른 방법으로는 이종-이작용기성 가교제를 이용하여 2종의 모 항체를 커플링하는 방법이 있지만, 모 항체와 가교제의 반응이 부위-지향성이 아니기 때문에 최종 이특이적 항체는 상당한 분자 불균질성을 나타낸다. 이특이적 항체의 더욱 균질한 제조물을 얻기 위해 2종의 다른 Fab 단편을 이들의 힌지 시스테인 잔기에서 부위 지향 방식으로 화학 가교시켰다(Glennie, M.J. et al.(1987) J. Immunol. 139(7): 2367-75). 하지만, 이 방법은 완전한 IgG 분자가 아닌 Fab'2 단편을 생산한다.
다른 재조합 이특이적 항체는 매우 다양한 형식(format)이 개발되었다(Kriangkum, J., et al.(2001) Biomol. Eng. 18(2): 31-40). 이 중에서, 직렬 단일 쇄 Fv 분자 및 디아바디(diabody), 및 이의 다양한 유도체는 가장 널리 사용된다. 통상, 이 분자들의 작제는 다른 항원을 인식하는 2종의 단일 쇄 Fv(scFv) 단편에서 시작한다(Economides, A.N., et al.(2003) Nat. Med. 9(1): 47-52). 직렬 scFv 분자(taFv)는 단순히 2종의 scFv 분자를 추가 펩타이드 링커와 연결하는 간단한 형식을 나타낸다. 이러한 직렬 scFv 분자에 존재하는 2종의 scFv 단편은 단독 폴딩 실체를 형성한다. 2종의 scFv 단편과 길이가 최고 63잔기인 링커를 연결하는 데에는 다양한 링커가 사용될 수 있다(Nakanishi, K., et al.(2001) Ann Rev. Immunol. 19: 423-74). 모 scFv 단편은 보통 세균에서 가용성 형태로 발현될 수 있지만, 직렬 scFv 분자는 세균에서 불용성 응집물을 형성하는 것이 종종 발견된다. 따라서, 가용성 직렬 scFv 분자의 생산에는 통상적으로 재폴딩(refolding) 프로토콜이나 포유동물 발현 시스템의 이용이 적용된다. 최근 연구에서, CD28 및 흑색종-관련 프로테오글리칸에 대해 지향성인 직렬 scFv가 돌연변이 토끼 및 소에 의해 생체내 발현된다는 것이 보고되었다(Gracie, J.A., et al., (1999) J. Clin. Invest. 104(10): 1393-401). 이 작제물에서 2종의 scFv 분자는 CH1 링커에 의해 연결되었고 혈청 농도 100 mg/L 이하의 이특이적 항체가 발견되었다. 세균에서 가용성 발현을 가능하게 하기 위해 도메인 순서 변경 또는 다양한 길이 또는 유연성의 중간 링커의 이용을 비롯한 다양한 전략이 이용되었다. 몇몇 연구는 현재 매우 짧은 Ala3 링커 또는 긴 글리신/세린-풍부 링커를 이용하여 세균에서 가용성 직렬 scFv 분자의 발현에 대해 보고했다(Leung, B.P., et al.(2000) J. Immunol. 164(12): 6495-502; Ito, A., et al.(2003) J. Immunol. 170(9): 4802-9; Karni, A., et al.(2002) J. Neuroimmunol. 125(1-2): 134-40). 다른 최근 연구에서는 3 또는 6개 잔기 길이의 무작위적 중간 링커를 함유하는 직렬 scFv 레퍼토리의 파지 디스플레이를 이용하여 세균에서 가용성이며 활성인 형태로 생산되는 상기 분자를 농축시켰다. 이 시도는 6개 아미노산 잔기 링커를 보유한 직렬 scFv 분자의 분리를 초래했다(Arndt, M. and J. Krauss(2003) Methods Mol. Biol. 207: 305-21). 이 링커 서열이 직렬 scFv 분자의 가용성 발현에 대한 일반적인 해법을 제시하는지는 불분명하다. 그럼에도 불구하고, 이 연구는 지향성 돌연변이유발과 함께 직렬 scFv 분자의 파지 디스플레이가 세균에서 활성 형태로 발현될 수 있는 상기 분자를 농축시키는 강력한 도구임을 입증했다.
이특이적 디아바디(Db)는 디아바디 발현 형식을 이용한다. 디아바디는 VH 및 VL 도메인을 연결하는 링커의 길이를 약 5개 잔기로 감소시켜 scFv 단편으로부터 생산한다(Peipp, M. and T. Valerius(2002) Biochem. Soc. Trans. 30(4): 507-11). 이러한 링커 크기의 감소는 VH 및 VL 도메인의 교차 짝짓기(crossover pairing)에 의해 두 폴리펩타이드 쇄의 이량체화를 용이하게 한다. 이특이적 디아바디는 같은 세포 내에서 구조 VHA-VLB 및 VHB-VLA(VH-VL 형태), 또는 VLA-VHB 및 VLB-VHA(VL-VH 형태)의 2종의 폴리펩타이드 쇄를 발현시킴으로써 생산한다. 매우 다양한 여러 이특이적 디아바디가 과거에 생산되었고, 이 중 대부분은 세균에서 가용성 형태로 발현된다. 하지만, 최근 비교 연구에서는 가변 도메인의 배향이 활성 결합 부위의 형성 및 발현에 영향을 미칠 수 있음을 증명한다(Mack, M. et al.(1995) Proc. Natl. Acad. Sci. USA 92(15): 7021-5). 그럼에도 불구하고, 세균에서 가용성 발현은 직렬 scFv 분자에 비해 중요한 이점을 나타낸다. 하지만, 2종의 다른 폴리펩타이드 쇄가 단세포에서 발현되기 때문에 불활성 동종이량체가 활성 이종이량체와 함께 생산될 수 있다. 이것은 이특이적 디아바디의 균질한 제조물을 얻기 위해서는 추가 정제 단계의 실행을 필요하게 한다. 이특이적 디아바디를 생성시키는 1가지 시도는 노브-인투-홀(knob-into-hole) 디아바디의 생산이다(Holliger, P., T. Prospero, and G. Winter(1993) Proc. Natl. Acad. Sci. USA 90(14): 6444-8.18). 이 시도는 HER2 및 CD3에 대해 지향성인 이특이적 디아바디에서 입증되었다. 큰 노브는 Val37을 Phe으로, Leu45를 Trp으로 교환하여 VH 도메인에 도입되었고, 상보성 홀은 항-HER2 또는 항-CD3 가변 도메인에 있는 Phe98을 Met으로, Tyr87을 Ala으로 돌연변이시켜 VL 도메인에 생성되었다. 이러한 시도를 이용하여 이특이적 항체의 생산은 모 디아바디 기준의 72%로부터 노브-인투-홀 디아바디 기준의 90% 이상으로 증가될 수 있다. 중요한 것은, 이러한 돌연변이의 결과로서 생산 수율이 약간 감소한다는 것이다. 하지만, 항원-결합 활성의 감소는 여러 작제물에서 관찰되었다. 따라서, 이 다소 복잡한 시도는 결합 활성이 변경되지 않은 헤테로이량체 분자를 생산하는 돌연변이를 동정하기 위해 다양한 작제물의 분석을 필요로 한다. 또한, 이 시도는 불변 영역에서 면역글로불린 서열의 돌연변이적 변형을 필요로 하여 항체 서열의 비자연 및 비천연 형태를 산출하고, 이것은 면역원성의 증가, 불량한 생체내 안정성 및 부적절한 약동학을 초래할 수 있다.
단일 쇄 디아바디(scDb)는 이특이적 디아바디-유사 분자의 형성을 향상시키는 대체 전략이다(Holliger, P. and G. Winter(1997) Cancer Immunol. Immunother. 45(3-4): 128-30; Wu, A.M., et al.(1996) Immunotechnology 2(1): p. 21-36). 이특이적 단일 쇄 디아바디는 2종의 디아바디-형성 폴리펩타이드 쇄를 약 15개 아미노산 잔기 길이의 추가 중간 링커와 연결시켜 생산한다. 결과적으로, 단량체 단일 쇄 디아바디에 해당하는 분자량(50-60kDa)을 가진 모든 분자는 이특이적이다. 여러 연구들은 이특이적 단일 쇄 디아바디가 정제된 분자 대부분이 단량체로 존재하는 가용성 및 활성 형태로 세균에서 발현된다는 것을 입증했다(Holliger, P. and G. Winter(1997) Cancer Immunol. Immunother. 45(3-4): 128-30; Wu, A.M., et al.(1996) Immunotechnol. 2(1): 21-36; Pluckthun, A. and P. Pack(1997) Immunotechnol. 3(2): 83-105; Ridgway, J.B., et al.(1996) Protein Engin. 9(7): 617-21). 따라서, 단일 쇄 디아바디는 직렬 scFv의 장점(모든 단량체가 이특이적) 및 디아바디의 장점(세균에서 가용성 발현)을 조합한다.
더 최근에 디아바디를 Fc에 융합하여 디-디아바디(di-diabody)로 불리는 더욱 Ig-유사 분자를 생산했다(Lu, D., et al.(2004) J. Biol. Chem. 279(4): 2856-65). 또한, IgG1의 중쇄에 2개의 Fab 반복체를 함유하고 4개의 항원 분자를 결합시킬 수 있는 다가 항체 작제물이 기술된 바 있다(WO 0177342A1, 및 Miller, K., et al.(2003) J. Immunol. 170(9): 4854-61).
이에, 당업계에서는 2개 이상의 항원에 결합할 수 있는 개선된 다가 결합 단백질이 필요한 실정이다. 미국 특허출원 일련번호 11/507,050은 2종 이상의 항원을 높은 친화도로 결합시킬 수 있는, 이원 가변 도메인 면역글로불린(DVD-Ig™)으로 불리는 결합 단백질의 신규 패밀리를 제공한다. 본 발명은 추가로 2종 이상의 항원에 결합할 수 있는 신규 결합 단백질을 제공한다.
본 발명은 2종 이상의 항원에 결합할 수 있는 다가 결합 단백질에 관한 것이다. 본 발명은 높은 친화성으로 2종 이상의 항원에 결합할 수 있는 신규 결합 단백질 패밀리를 제공한다.
한 양태에서, 본 발명은 폴리펩타이드 쇄를 함유하는 결합 단백질로, 이 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C(X2)n을 포함하고, 여기서 VD1은 제1 가변 도메인이고, V2는 제2 가변 도메인이며, C는 불변 도메인이고, X1은 아미노산 또는 폴리펩타이드를 나타내고, X2는 Fc 영역을 나타내며, n은 0 또는 1이다. 한 양태에서, 결합 단백질의 VD1 및 VD2는 중쇄 가변 도메인이다. 다른 양태에서, 중쇄 가변 도메인은 쥐 중쇄 가변 도메인, 사람 중쇄 가변 도메인, CDR 이식된 중쇄 가변 도메인 및 사람화된 중쇄 가변 도메인으로 이루어진 그룹 중에서 선택된다. 또 다른 양태에서, VD1 및 VD2는 동일한 항원에 결합할 수 있다. 다른 양태에서, VD1 및 VD2는 다른 항원에 결합할 수 있다. 또 다른 양태에서, C는 중쇄 불변 도메인이다. 예를 들어, X1은 링커지만, X1은 CH1은 아니다. 예를 들어, X1은 AKTTPKLEEGEFSEAR (서열번호 1); AKTTPKLEEGEFSEARV (서열번호 2); AKTTPKLGG (서열번호 3); SAKTTPKLGG (서열번호 4); SAKTTP (서열번호 5); RADAAP (서열번호 6); RADAAPTVS (서열번호 7); RADAAAAGGPGS (서열번호 8); RADAAAA(G4S)4 (서열번호 9); SAKTTPKLEEGEFSEARV (서열번호 10); ADAAP (서열번호 11); ADAAPTVSIFPP (서열번호 12); TVAAP (서열번호 13); TVAAPSVFIFPP (서열번호 14); QPKAAP (서열번호 15); QPKAAPSVTLFPP (서열번호 16); AKTTPP (서열번호 17); AKTTPPSVTPLAP (서열번호 18); AKTTAP(서열번호 19); AKTTAPSVYPLAP (서열번호 20); ASTKGP (서열번호 21); ASTKGPSVFPLAP (서열번호 22), GGGGSGGGGSGGGGS (서열번호 23); GENKVEYAPALMALS (서열번호 24); GPAKELTPLKEAKVS (서열번호 25); 및 GHEAAAVMQVQYPAS (서열번호 26)으로 이루어진 그룹 중에서 선택되는 링커이다. 한 양태에서, X2는 Fc 영역이다. 다른 양태에서, X2는 변형체 Fc 영역이다.
한 양태에서, 본 명세서에 개시된 결합 단백질은 폴리펩타이드 쇄를 포함하고, 상기 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서 VD1은 제1 중쇄 가변 도메인이고, V2는 제2 중쇄 가변 도메인이며, C는 중쇄 불변 도메인이고, X1은 링커로, 단 CH1은 아니고, X2는 Fc 영역이다.
한 양태에서, 결합 단백질 중의 VD1 및 VD2는 경쇄 가변 도메인이다. 한 양태에서, 경쇄 가변 도메인은 쥐 경쇄 가변 도메인, 사람 경쇄 가변 도메인, CDR 이식된 경쇄 가변 도메인 및 사람화된 경쇄 가변 도메인으로 이루어진 그룹 중에서 선택된다. 한 양태에서, VD1 및 VD2는 동일한 항원에 결합할 수 있다. 다른 양태에서, VD1 및 VD2는 다른 항원에 결합할 수 있다. 한 양태에서, C는 경쇄 불변 도메인이다. 다른 양태에서, X1은 링커지만, X1은 CL1은 아니다. 예를 들어, X1은 AKTTPKLEEGEFSEAR (서열번호 1); AKTTPKLEEGEFSEARV (서열번호 2); AKTTPKLGG (서열번호 3); SAKTTPKLGG (서열번호 4); SAKTTP (서열번호 5); RADAAP (서열번호 6); RADAAPTVS (서열번호 7); RADAAAAGGPGS (서열번호 8); RADAAAA(G4S)4 (서열번호 9); SAKTTPKLEEGEFSEARV (서열번호 10); ADAAP (서열번호 11); ADAAPTVSIFPP (서열번호 12); TVAAP (서열번호 13); TVAAPSVFIFPP (서열번호 14); QPKAAP (서열번호 15); QPKAAPSVTLFPP (서열번호 16); AKTTPP (서열번호 17); AKTTPPSVTPLAP (서열번호 18); AKTTAP(서열번호 19); AKTTAPSVYPLAP (서열번호 20); ASTKGP (서열번호 21); ASTKGPSVFPLAP (서열번호 22), GGGGSGGGGSGGGGS (서열번호 23); GENKVEYAPALMALS (서열번호 24); GPAKELTPLKEAKVS (서열번호 25) 및 GHEAAAVMQVQYPAS (서열번호 26)으로 이루어진 그룹 중에서 선택되는 링커이다. 한 양태에서, 결합 단백질은 X2를 포함하지 않는다.
한 양태에서, 가변 중쇄 및 가변 경쇄는 동일한 링커를 포함한다. 다른 양태에서, 가변 중쇄 및 가변 경쇄는 다른 링커를 포함한다. 다른 양태에서, 가변 중쇄 및 가변 경쇄는 짧은(약 6개 아미노산) 링커를 포함한다. 다른 양태에서, 가변 중쇄 및 가변 경쇄는 긴(6개 초과 아미노산) 링커를 포함한다. 다른 양태에서, 가변 중쇄는 짧은 링커를 포함하고, 가변 경쇄는 긴 링커를 포함한다. 다른 양태에서, 가변 중쇄는 긴 링커를 포함하고 가변 경쇄는 짧은 링커를 포함한다.
한 양태에서, 본 명세서에 개시된 결합 단백질은 폴리펩타이드 쇄를 포함하고, 이 폴리펩타이드 쇄는 VD1-(X1)n-(VD2)-C-(X2)n을 포함하되, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이며, C는 경쇄 불변 도메인이고, X1은 링커이지만, 단 CH1은 아니고, X2는 Fc 영역을 포함하지 않는다.
다른 양태에서, 본 발명은 2개의 폴리펩타이드 쇄를 함유하는 결합 단백질로, 상기 제1 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 중쇄 가변 도메인이고,VD2는 제2 중쇄 가변 도메인이며, C는 중쇄 불변 도메인이고, X1은 링커이지만, CH1은 아니고, X2는 Fc 영역이고; 상기 제2 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이며, C는 경쇄 불변 도메인이고, X1은 링커이지만, 단 CH1은 아니고, X2는 Fc 영역을 포함하지 않는다. 특정 양태에서, 이원 가변 도메인(DVD) 결합 단백질은 4개의 폴리펩타이드 쇄를 포함하되, 제1의 두 폴리펩타이드 쇄는 각각 VD1-(X1)n-VD2-C(X2)n[여기서, VD1은 제1 중쇄 가변 도메인이고, VD2는 제2 중쇄 가변 도메인이며, C는 중쇄 불변 도메인이고, X1은 링커이지만, CH1은 아니고, X2는 Fc 영역이다]를 포함하고; 제2의 두 폴리펩타이드 쇄는 각각 VD1-(X1)n-VD2-C-(X2)n[여기서, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이며, C는 경쇄 불변 도메인이고, X1은 링커이지만, CH1은 아니고, X2는 Fc 영역을 포함하지 않는다]을 포함한다. 이러한 이원 가변 도메인(DVD) 단백질은 4개의 항원 결합 부위를 보유한다.
다른 양태에서, 본 명세서에 개시된 결합 단백질은 하나 이상의 표적에 결합할 수 있다. 한 양태에서, 표적은 사이토킨, 세포 표면 단백질, 효소 및 수용체로 이루어진 그룹 중에서 선택된다. 다른 양태에서, 결합 단백질은 하나 이상의 표적의 생물학적 기능을 조절할 수 있다. 다른 양태에서, 결합 단백질은 하나 이상의 표적을 중화시킬 수 있다. 본 발명의 결합 단백질은 림포킨, 모노킨, 폴리펩타이드 호르몬, 수용체 또는 종양 마커로 이루어진 그룹 중에서 선택된 사이토킨에 결합할 수 있다. 예를 들어, 본 발명의 DVD-Ig은 다음 중 2가지 이상에 결합할 수 있다: 쥐 또는 사람 종양괴사인자 알파(TNF-α), 프로스타글란딘 E2(PGE2), 아밀로이드 베타(Abeta)(서열 1), Abeta(서열 2), Abeta(서열 3), 인터류킨 1β(IL-1β), 인슐린-유사 성장인자 수용체(IGFR), 인터류킨 17A(IL-17A), 인터류킨 6(IL-6), 인터류킨 6 수용체(IL-6R), 인터류킨 15(IL-15), 인터류킨 18(IL-18), 신경성장인자(NGF), 표피성장인자 수용체(EGFR)(서열 1), EGFR(서열 2), 혈관 내피성장인자(VEGF) 및 S1P(표 2 및 실시예 2도 참고). 특정 양태에서, 결합 단백질은 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeat(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 표적 쌍에 결합할 수 있다(실시예 참조).
한 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 86, 92, 94, 96, 98, 100, 102, 104, 106 및 108로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 89, 93, 95, 97, 99, 101, 103, 105, 107 및 109로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 86의 DVD 중쇄 아미노산 서열 및 서열번호 89의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 92의 DVD 중쇄 아미노산 서열 및 서열번호 93의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 94의 DVD 중쇄 아미노산 서열 및 서열번호 95의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 96의 DVD 중쇄 아미노산 서열 및 서열번호 97의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 98의 DVD 중쇄 아미노산 서열 및 서열번호 99의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 100의 DVD 중쇄 아미노산 서열 및 서열번호 101의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 102의 DVD 중쇄 아미노산 서열 및 서열번호 103의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 104의 DVD 중쇄 아미노산 서열 및 서열번호 105의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 106의 DVD 중쇄 아미노산 서열 및 서열번호 107의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 쥐 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 108의 DVD 중쇄 아미노산 서열 및 서열번호 109의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, 사람 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 114, 116, 118 및 120으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 115, 117, 119 및 121로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, 사람 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 114의 DVD 중쇄 아미노산 서열 및 서열번호 115의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 사람 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 116의 DVD 중쇄 아미노산 서열 및 서열번호 117의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 사람 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 118의 DVD 중쇄 아미노산 서열 및 서열번호 119의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, 사람 TNF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 120의 DVD 중쇄 아미노산 서열 및 서열번호 121의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, VEGF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 128 및 서열번호 130으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 129 및 서열번호 131로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, VEGF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 128의 DVD 중쇄 아미노산 서열 및 서열번호 129의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, VEGF 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 130의 DVD 중쇄 아미노산 서열 및 서열번호 131의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, NGF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 132 및 서열번호 134로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 133 및 서열번호 135로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, NGF 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 132의 DVD 중쇄 아미노산 서열 및 서열번호 133의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, VEGF 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 134의 DVD 중쇄 아미노산 서열 및 서열번호 135의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-17A 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 136 및 서열번호 138로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 137 및 서열번호 139로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-17A 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 136의 DVD 중쇄 아미노산 서열 및 서열번호 137의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-17A 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 138의 DVD 중쇄 아미노산 서열 및 서열번호 139의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-1b 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 140 및 서열번호 142로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 141 및 서열번호 143으로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-1b 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 140의 DVD 중쇄 아미노산 서열 및 서열번호 141의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-1b 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 142의 DVD 중쇄 아미노산 서열 및 서열번호 143의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-6 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 144 및 서열번호 146으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 145 및 서열번호 147로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-6 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 144의 DVD 중쇄 아미노산 서열 및 서열번호 145의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-6 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 146의 DVD 중쇄 아미노산 서열 및 서열번호 147의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, Abeta(서열 1) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 148 및 서열번호 150으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 149 및 서열번호 151로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, Abeta(서열 1) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 148의 DVD 중쇄 아미노산 서열 및 서열번호 149의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, Abeta(서열 1) 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 150의 DVD 중쇄 아미노산 서열 및 서열번호 151의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, Abeta(서열 2) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 152 및 서열번호 154로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 153 및 서열번호 155로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, Abeta(서열 2) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 152의 DVD 중쇄 아미노산 서열 및 서열번호 153의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, Abeta(서열 2) 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 154의 DVD 중쇄 아미노산 서열 및 서열번호 155의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, Abeta(서열 3) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 156 및 서열번호 158로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 157 및 서열번호 159로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, Abeta(서열 3) 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 156의 DVD 중쇄 아미노산 서열 및 서열번호 157의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, Abeta(서열 3) 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 158의 DVD 중쇄 아미노산 서열 및 서열번호 159의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-18 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 160 및 서열번호 162로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 161 및 서열번호 163으로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-18 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 160의 DVD 중쇄 아미노산 서열 및 서열번호 161의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-18 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 162의 DVD 중쇄 아미노산 서열 및 서열번호 163의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-15 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 164 및 서열번호 166으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 165 및 서열번호 167로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-15 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 164의 DVD 중쇄 아미노산 서열 및 서열번호 165의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-15 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 166의 DVD 중쇄 아미노산 서열 및 서열번호 167의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, S1P 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 168 및 서열번호 170으로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 169 및 서열번호 171로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, S1P 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 168의 DVD 중쇄 아미노산 서열 및 서열번호 169의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, S1P 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 170의 DVD 중쇄 아미노산 서열 및 서열번호 171의 DVD 경쇄 아미노산 서열을 포함한다.
한 양태에서, IL-6R 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 172 및 서열번호 174로 이루어진 그룹 중에서 선택되는 DVD 중쇄 아미노산 서열; 및 서열번호 173 및 서열번호 175로 이루어진 그룹 중에서 선택되는 DVD 경쇄 아미노산 서열을 포함한다. 한 양태에서, IL-6R 및 PGE2에 결합할 수 있는 결합 단백질은 서열번호 172의 DVD 중쇄 아미노산 서열 및 서열번호 173의 DVD 경쇄 아미노산 서열을 포함한다. 다른 양태에서, IL-6R 및 PGE2에 결합할 수 있는 결합 단백질은 역배향이고 서열번호 174의 DVD 중쇄 아미노산 서열 및 서열번호 175의 DVD 경쇄 아미노산 서열을 포함한다.
다른 양태에서, DVD 중쇄 아미노산 서열은 서열번호 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 87, 90, 110 및 112로 이루어진 그룹 중에서 선택되는 적어도 하나의 VH 영역을 포함하고; DVD 경쇄 아미노산 서열은 서열번호 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 88, 91, 111 및 113으로 이루어진 그룹 중에서 선택되는 적어도 하나의 VL 영역을 포함한다.
다른 양태에서, 본 발명은 폴리펩타이드 쇄를 함유하는 결합 단백질로, 이 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며; C는 중쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역이고, (X2)n은 존재하거나 부재한다. 한 양태에서, Fc 영역은 결합 단백질에서 부재한다.
다른 양태에서, 본 발명은 폴리펩타이드 쇄를 함유하는 결합 단백질로, 이 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며; C는 경쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역을 포함하지 않고, (X2)n은 존재하거나 부재한다. 한 양태에서, Fc 영역은 결합 단백질에서 부재한다.
다른 양태에서, 본 발명의 결합 단백질은 제1 및 제2 폴리펩타이드 쇄를 함유하며, 상기 제1 폴리펩타이드 쇄가 제1 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며; C는 중쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역이고, (X2)n은 존재하거나 부재하며; 상기 제2 폴리펩타이드 쇄가 제2 VD1-(X1)n-VD2-C-(X2)n을 포함하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며; C는 경쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역을 포함하지 않고, (X2)n은 존재하거나 부재한다. 다른 양태에서, 결합 단백질은 2개의 제1 폴리펩타이드 쇄 및 2개의 제2 폴리펩타이드 쇄를 포함한다. 또 다른 양태에서, (X2)n은 제2 폴리펩타이드에서 부재한다. 또 다른 양태에서, 제1 폴리펩타이드에 존재한다면 Fc 영역은 천연 서열 Fc 영역 및 변형체 서열 Fc 영역으로 이루어진 그룹 중에서 선택된다. 또 다른 양태에서, Fc 영역은 IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE 및 IgD로 이루어진 그룹 중에서 선택된다.
다른 양태에서, 본 발명의 결합 단백질은 4개의 폴리펩타이드 쇄를 함유하는, 2개의 항원에 결합할 수 있는 DVD-Ig을 제공하되, 여기서 제1 및 제3 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서 VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며; C는 중쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역이고, (X2)n은 존재하거나 부재하고; 상기 제2 및 제4 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서 VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며; C는 경쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, (X1)n은 존재하거나 부재하며; (X2)n은 Fc 영역을 포함하지 않고 (X2)n은 존재하거나 부재한다.
다른 관점에서, 본 발명은 폴리펩타이드 쇄를 함유하는 사람화된 결합 단백질을 제공하되, 상기 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 함유하고, 여기서 VD1은 제1 사람화된 가변 도메인이고, VD2는 제2 사람화된 가변 도메인이고, C는 불변 도메인이고, X1은 아미노산 또는 폴리펩타이드를 나타내고, X2는 Fc 영역을 나타내며, n은 0 또는 1이며, 이 결합 단백질은 프로스타글란딘 E2 및 종양 괴사 인자 알파에 결합한다.
한 양태에서, C는 중쇄 불변 도메인이고, 예컨대 C는 IgG1, IgG2, IgG3, IgG4, IgA, IgA1, IgA2, IgD, IgM, IgE, IgY 및 IgG 변이체로 이루어진 그룹 중에서 선택되는 항체 클래스의 사람 중쇄 불변 도메인이다. C는 야생형 또는 변이체의 중쇄 불변 도메인일 수 있다. 예를 들어, C는 서열번호 122 또는 123의 서열 또는 이의 기능적 변형체 또는 변이체를 포함한다.
다른 양태에서, C는 경쇄 카파 불변 도메인이다. 예를 들어, C는 IgG, IgG1, IgG2, IgG3, IgG4, IgA, IgA1, IgA2, IgD, IgM, IgE, IgY 및 이의 변이체로 이루어진 그룹 중에서 선택되는 항체 클래스의 사람 경쇄 카파 불변 도메인이다. C는 야생형 또는 변이체의 경쇄 카파 또는 람다 불변 도메인일 수 있다. 예를 들어, C는 서열번호 124 또는 125의 서열, 또는 이의 기능성 변형체 또는 변이체를 포함한다.
다른 관점에서, 본 발명은 폴리펩타이드 쇄를 함유하는 결합 단백질을 제공하되, 상기 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 함유하되, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이고, C는 경쇄 불변 도메인이고, X1은 링커이며, 단, X1이 CH1은 아니고, X2는 Fc 영역을 포함하지 않고, 이 결합 단백질은 프로스타글란딘 E2 및 종양 괴사 인자 알파에 결합한다.
다른 관점에서, 본 발명은 제1 및 제2 폴리펩타이드 쇄를 함유하는 결합 단백질을 제공하되, 상기 제1 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 함유하되, VD1은 제1 중쇄 가변 도메인이고, VD2는 제2 중쇄 가변 도메인이며, C는 중쇄 불변 도메인이고, X1은 링커이며, 단, X1이 CH1은 아니고, X2는 Fc 영역이고; 제2 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 함유하되, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이며, C는 경쇄 불변 도메인이고, X1은 링커이며, 단, X1이 CH1은 아니고, X2는 Fc 영역을 포함하지 않으며, 이 결합 단백질은 프로스타글란딘 E2 및 종양 괴사 인자 알파에 결합한다.
또 다른 관점에서, 본 발명은 4개의 폴리펩타이드 쇄를 함유하는 결합 단백질로, 여기서 2개의 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 함유하고(여기서, VD1은 제1 중쇄 가변 도메인이고, VD2는 제2 중쇄 가변 도메인이며, C는 중쇄 불변 도메인이고, X1은 링커이며, 단, X1이 CH1은 아니고, X2는 Fc 영역이다), 2개의 폴리펩타이드 쇄는 VD1-(X1)n-VD2-C-(X2)n을 함유하며(여기서, VD1은 제1 경쇄 가변 도메인이고, VD2는 제2 경쇄 가변 도메인이며, C는 경쇄 불변 도메인이고, X1은 링커이며, 단, X1이 CH1은 아니고, X2는 Fc 영역을 포함하지 않는다), 프로스타글란딘 E2 및 종양 괴사 인자 알파에 결합하는 결합 단백질을 제공한다.
본 발명은 모 항체를 사전선택하여 DVD-Ig 결합 단백질을 제조하는 방법을 제공한다. 한 양태에서, 2개의 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린을 제조하는 방법은 a) 제1 항원에 결합할 수 있는 제1 모 항체 또는 이의 항원결합부를 수득하는 단계; b) 제2 항원에 결합할 수 있는 제2 모 항체 또는 이의 항원결합부를 수득하는 단계; c) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제1 및 제3 폴리펩타이드 쇄를 작제하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며; C는 중쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, 이 (X1)n은 존재하거나 부재하고; (X2)n은 Fc 영역이고, 이 (X2)n은 존재하거나 부재인 단계; d) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제2 및 제4 폴리펩타이드 쇄를 작제하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며; C는 경쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, 이 (X1)n은 존재하거나 부재하고; (X2)n은 Fc 영역을 포함하지 않고, 이 (X2)n은 존재하거나 부재인 단계; e) 상기 제1, 제2, 제3 및 제4 폴리펩타이드 쇄를 발현하는 단계를 포함하여, 상기 제1 및 제2 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린이 제조된다.
또 다른 양태에서, 본 발명은 목적 성질을 가진 2개의 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린을 제조하는 방법으로, a) 제1 항원에 결합할 수 있고 이원 가변 도메인 면역글로불린이 나타내는 적어도 하나의 목적 성질을 보유하는 제1 모 항체 또는 이의 항원결합부를 수득하는 단계; b) 제2 항원에 결합할 수 있고 이원 가변 도메인 면역글로불린이 나타내는 적어도 하나의 목적 성질을 보유하는 제2 모 항체 또는 이의 항원결합부를 수득하는 단계; c) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제1 및 제3 폴리펩타이드 쇄를 작제하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며; C는 중쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, 이 (X1)n은 존재하거나 부재하고; (X2)n은 Fc 영역으로, 이 (X2)n은 존재하거나 부재하는 단계; d) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제2 및 제4 폴리펩타이드 쇄를 작제하되, VD1은 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고; VD2는 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며; C는 경쇄 불변 도메인이고; (X1)n은 링커이지만 CH1은 아니고, 이 (X1)n은 존재하거나 부재하고; (X2)n은 Fc 영역을 포함하지 않고, 이 (X2)n은 존재하거나 부재하는 단계; e) 상기 제1, 제2, 제3 및 제4 폴리펩타이드 쇄를 발현하는 단계를 포함하여, 상기 제1 및 제2 항원에 결합할 수 있는 목적 성질을 가진 이원 가변 도메인 면역글로불린이 제조되는 방법을 제공한다.
한 양태에서, 본 명세서에 개시된 제1 및 제2 폴리펩타이드 쇄의 VD1은 동일한 모 항체 또는 이의 항원결합부로부터 수득된다. 다른 양태에서, 본 명세서에 개시된 제1 및 제2 폴리펩타이드 쇄의 VD1은 다른 모 항체 또는 이의 항원결합부로부터 수득된다. 다른 양태에서, 본 명세서에 개시된 제1 및 제2 폴리펩타이드 쇄의 VD2는 동일한 모 항체 또는 이의 항원결합부로부터 수득된다. 다른 양태에서, 본 명세서에 개시된 제1 및 제2 폴리펩타이드 쇄의 VD2는 다른 모 항체 또는 이의 항원결합부로부터 수득된다.
한 양태에서, 제1 모 항체 또는 이의 항원결합부, 및 제2 모 항체 또는 이의 항원결합부는 동일한 항체이다. 다른 양태에서, 제1 모 항체 또는 이의 항원결합부, 및 제2 모 항체 또는 이의 항원결합부는 다른 항체이다.
한 양태에서, 제1 모 항체 또는 이의 항원결합부는 제1 항원에 결합하고, 제2 모 항체 또는 이의 항원결합부는 제2 항원에 결합한다. 특정 양태에서, 제1 및 제2 항원은 동일한 항원이다. 다른 양태에서, 모 항체는 동일한 항원 상의 다른 에피토프에 결합한다. 다른 양태에서, 제1 및 제2 항원은 다른 항원이다. 다른 양태에서, 제1 모 항체 또는 이의 항원결합부는 제2 모 항체 또는 이의 항원결합부가 제2 항원에 결합하는 효능과 다른 효능으로 제1 항원에 결합한다. 또 다른 양태에서, 제1 모 항체 또는 이의 항원결합부는 제2 모 항체 또는 이의 항원결합부가 제2 항원에 결합하는 친화성과 다른 친화성으로 제1 항원에 결합한다.
다른 양태에서, 제1 모 항체 또는 이의 항원결합부, 및 제2 모 항체 또는 이의 항원결합부는 사람 항체, CDR 이식된 항체 및 사람화된 항체로 이루어진 그룹 중에서 선택된다. 한 양태에서, 항원결합부는 Fab 단편, F(ab')2 단편, 힌지 영역에서 이황화 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편; VH 및 CH1 도메인으로 이루어진 Fd 단편; 항체의 단일 아암의 VL 및 VH 도메인으로 이루어진 Fv 단편, dAb 단편, 분리된 상보성 결정 영역(CDR), 단일 쇄 항체 및 디아바디로 이루어진 그룹 중에서 선택된다.
다른 양태에서, 본 발명의 결합 단백질은 제1 모 항체 또는 이의 항원결합부, 또는 제2 모 항체 또는 이의 항원결합부가 나타내는 적어도 하나의 목적 성질을 보유한다. 대안적으로, 제1 모 항체 또는 이의 항원결합부 및 제2 모 항체 또는 이의 항원결합부는 이원 가변 도메인 면역글로불린가 나타내는 적어도 하나의 목적 성질을 보유한다. 한 양태에서, 목적 성질은 하나 이상의 항체 파라미터 중에서 선택된다. 다른 양태에서, 항체 파라미터는 항원 특이성, 항원에 대한 특이성, 효능, 생물학적 기능, 에피토프 인식, 안정성, 가용성, 생산 효율, 면역원성, 약동학, 생체이용률, 조직 교차반응성 및 이종상동성(orthologous) 항원 결합으로 이루어진 그룹 중에서 선택된다. 한 양태에서, 결합 단백질은 다가(multivalent)이다. 다른 양태에서, 결합 단백질은 다특이적이다. 본 명세서에 기술된 다가 및/또는 다특이적 결합 단백질은 특히 치료적 견지에서 바람직한 성질은 나타낸다. 예를 들어, 다가 및/또는 다특이적 결합 단백질은 (1) 항체들이 결합하는 항원을 발현하는 세포에 의해 2가 항체보다 빠르게 내재화(및/또는 이화)할 수 있고; (2) 작용제(agonist) 항체일 수 있으며; 및/또는 (3) 다가 항체가 결합할 수 있는 항원을 발현하는 세포의 아폽토시스 및/또는 세포사(cell death)를 유도할 수 있다. 다가 및/또는 다특이적 결합 단백질의 적어도 하나의 항원 결합 특이성을 제공하는 "모 항체"는 항체가 결합하는 항원을 발현하는 세포에 의해 내재화(및/또는 이화)될 수 있고; 및/또는 작용제, 세포사-유도 및/또는 아폽토시스-유도 항체일 수 있고, 본 명세서에 기술된 다가 및/다특이적 결합 단백질은 이러한 하나 이상의 성질의 향상(들)을 나타낼 수 있다. 더욱이, 모 항체는 상기 성질 중 하나 이상이 결여될 수 있으나, 본 명세서에 기술된 다가 결합 단백질로 작제되었을 때 그 성질이 부여될 수 있다.
다른 양태에서, 본 발명의 결합 단백질은 표면 플라스몬 공명으로 측정했을 때, 적어도 약 102M-1s-1; 적어도 약 103M-1s-1; 적어도 약 104M-1s-1; 적어도 약 105M-1s-1; 및 적어도 약 106M-1s-1로 이루어진 그룹 중에서 선택되는 하나 이상의 표적에 대한 온 속도 상수(on rate constant)(Kon)를 보유한다. 한 양태에서, 본 발명의 결합 단백질은 표면 플라스몬 공명으로 측정했을 때, 하나 이상의 표적에 대한 102M-1s-1 내지 103M-1s-1; 103M-1s-1 내지 104M-1s-1; 104M-1s-1 내지 105M-1s-1; 또는 105M-1s-1 내지 106M-1s-1의 온 속도 상수(Kon)를 보유한다.
다른 양태에서, 결합 단백질은 표면 플라스몬 공명으로 측정했을 때, 최대 약 10-3s-1; 최대 약 10-4s-1; 최대 약 10-5s-1; 최대 약 10-6s-1로 이루어진 그룹 중에서 선택되는 오프 속도 상수(off rate constant)(Koff)를 보유한다. 한 양태에서, 본 발명의 결합 단백질은 표면 플라스몬 공명으로 측정했을 때, 하나 이상의 표적에 대한 10-3s-1 내지 10-4s-1; 10-4s-1 내지 10-5s-1; 또는 10-5s-1 내지 10-6s-1의 오프 속도 상수(Koff)를 보유한다.
다른 양태에서, 결합 단백질은 최대 약 10-7 M; 최대 약 10-8 M; 최대 약 10-9 M; 최대 약 10-10 M; 최대 약 10-11 M; 최대 약 10-12 M; 최대 약 10-13 M로 이루어진 그룹 중에서 선택되는 하나 이상의 표적에 대한 해리 상수(KD)를 나타낸다. 한 양태에서, 본 발명의 결합 단백질은 표적에 대한 해리 상수(KD)가 10-7 M 내지 10-8 M; 10-8 M 내지 10-9 M; 10-9 M 내지 10-10 M; 10-10 M 내지 10-11 M; 10-11 M 내지 10-12 M; 또는 10-12 M 내지 10-13 M이다.
다른 양태에서, 본 명세서에 기술된 결합 단백질은 추가로 면역부착 분자, 영상화제, 치료제 및 세포독성제로 이루어진 그룹 중에서 선택되는 제제를 함유하는 접합체이다. 한 양태에서, 영상화제는 방사능표지, 효소, 형광 표지, 발광 표지, 생체발광 표지, 자성 표지 및 비오틴으로 이루어진 그룹 중에서 선택된다. 다른 양태에서, 영상화제는 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho 및 153Sm으로 이루어진 그룹 중에서 선택되는 방사능표지이다. 또 다른 양태에서, 치료제 또는 세포독성제는 항대사산물, 알킬화제, 항생제, 성장 인자, 사이토킨, 항혈관형성제, 항유사분열제, 안트라사이클린, 독소 및 아폽토시스제로 이루어진 그룹 중에서 선택된다.
다른 양태에서, 본 명세서에 기술된 결합 단백질은 결정화된 결합 단백질이며 결정으로 존재한다. 한 양태에서, 결정은 무담체 약제학적 제어 방출 결정이다. 또 다른 양태에서, 결정화된 결합 단백질은 이 결합 단백질의 가용성 대응물보다 긴 생체내 반감기를 나타낸다. 또 다른 양태에서, 결정화된 결합 단백질은 생물학적 활성을 보유한다.
다른 양태에서, 본 명세서에 기술된 결합 단백질은 글리코실화되어 있다. 예를 들어, 글리코실화는 사람 글리코실화 패턴이다.
본 발명의 한 관점은 본 명세서에 개시된 어느 하나의 결합 단백질을 암호화하는 분리된 핵산에 관한 것이다. 또 다른 양태는 본 명세서에 개시된 분리된 핵산을 함유하는 벡터를 제공하며, 이 벡터는 pcDNA; pTT(Durocher et al., Nucleic Acids Research 2002, Vol 30, No.2); pTT3(추가 다중 클로닝 부위를 보유하는 pTT); pEFBOS(Mizushima, S. and Nagata, S.,(1990) Nucleic Acids Research Vol 18, No. 17); pBV; pJV; pcDNA3.1 TOPO; pEF6 TOPO 및 pBJ로 이루어진 그룹 중에서 선택된다. 한 양태에서, 벡터는 미국 특허출원번호 61/021,282에 개시된 벡터이다.
다른 관점에서, 숙주 세포는 본 명세서에 개시된 벡터로 형질전환된다. 한 양태에서, 숙주 세포는 원핵 세포이다. 다른 양태에서, 숙주 세포는 이.콜라이(E. coli)이다. 관련 양태에서, 숙주 세포는 진핵 세포이다. 다른 양태에서, 진핵 세포는 원생생물 세포, 동물 세포, 조류 세포, 식물 세포 및 진균 세포로 이루어진 그룹으로부터 선택된다. 또 다른 양태에서, 숙주 세포는 CHO, COS; NS0, SP2, PER.C6을 포함하지만 이에 제한되지 않는 포유동물 세포; 또는 사카로마이세스 세레비지애(Saccharomyces cerevisiae)와 같은 진균 세포 또는 Sf9과 같은 곤충 세포로 이루어진 그룹 중에서 선택된다.
한 양태에서, 예를 들어, 상이한 특이성을 갖는 2개 이상의 DVD-Ig은 단일 재조합 숙주 세포에서 생산된다. 예를 들어, 항체의 혼합물의 발현은 OligoclonicsTM(Merus B.V., The Netherlands)로 불렸다(미국특허 7,262,028; 7,429,486).
본 발명의 또 다른 측면은 상기된 숙주 세포 중 임의의 하나를 결합 단백질을 생산하기에 충분한 조건하에 배양 배지에서 배양함을 포함하는, 상기된 결합 단백질을 제조하는 방법을 제공한다. 한 양태에서, 당해 방법에 의해 제조되는 결합 단백질중 50% 내지 75%는 이원 특이적 4가 결합 단백질이다. 특정 양태에서, 당해 방법에 의해 제조되는 결합 단백질 중 75% 내지 90%는 이원 특이적 4가 결합 단백질이다. 특정 양태에서, 제조되는 결합 단백질 중 90% 내지 95%는 이원 특이적 4가 결합 단백질이다.
하나의 양태는 결합 단백질 방출용 조성물을 제공하고 이때 당해 조성물은 상기된 바와 같은 결정화된 결합 단백질 및 성분 및 하나 이상의 중합체 담체를 포함하는 제형을 포함한다. 예를 들어, 중합체 담체는 폴리(아크릴산), 폴리 (시아노아크릴레이트), 폴리(아미노산), 폴리(무수물), 폴리(데프시펩타이드), 폴리(에스테르), 폴리(락트산), 폴리(락틱-코-글리콜산) 또는 PLGA, 폴리(b-하이드록시부티레이트), 폴리(카프로락톤), 폴리(디옥사논); 폴리(에틸렌 글리콜), 폴리(하이드록시프로필) 메타크릴아미드, 폴리[(오르가노)포스파젠], 폴리(오르토 에스테르), 폴리(비닐 알콜), 폴리(비닐피롤리돈), 말레산 무수물-알킬 비닐 에테르 공중합체, 플루론산 폴리올, 알부민, 알기네이트, 셀룰로스 및 셀룰로스 유도체, 콜라겐, 피브린, 젤라틴, 하이알루론산, 올리고사카라이드, 글리카미노글리칸, 황화 폴리사카라이드, 이의 블렌드 및 공중합체로 이루어진 하나 이상의 그룹으로부터 선택된 중합체이다. 예를 들어, 당해 성분은 알부민, 수크로오스, 트레할로스, 락티톨, 젤라틴, 하이드록시프로필-β-사이클로덱스트린, 메톡시폴리에틸렌 글리콜 및 폴리에틸렌 글리콜로 이루어진 그룹으로부터 선택된다. 또 다른 양태는 상기된 유효량의 조성물을 포유동물에게 투여하는 단계를 포함하는, 포유동물을 치료하는 방법을 제공한다.
본 발명은 또한 상기된 바와 같은 결합 단백질 및 약제학적으로 허용되는 담체를 포함하는 약제학적 조성물을 제공한다. 추가의 양태에서, 약제학적 조성물은 장애를 치료하기 위한 하나 이상의 추가 치료제를 포함한다. 예컨대, 추가 제제는 치료제, 영상화제, 세포독성 제제, 혈관형성 저해제 (항-VEGF 항체 또는 VEGF-트랩을 포함하지만 이에 제한되지 않음); 키나제 저해제 (KDR 및 TIE-2 저해제를 포함하지만 이에 제한되지 않음); 공동 자극 분자 차단제(항-B7.1, 항-B7.2, CTLA4-Ig, 항-CD20을 포함하지만 이에 제한되지 않음); 부착 분자 차단제(항-LFA-1 항체, 항-E/L 셀렉틴 항체, 소분자 저해제를 포함하지만 이에 제한되지 않음); 항-사이토킨 항체 또는 이의 기능성 단편(항-IL-18, 항-TNF, 항-IL-6/사이토킨 수용체 항체를 포함하지만 이에 제한되지 않음); 메토트렉세이트; 사이클로스포린; 라파마이신; FK506; 검출가능한 표지 또는 리포터; TNF 길항제; 항류마티스제; 근육 이완제, 마약류, 비스테로이드 소염 약물(NSAID), 진통제, 마취제, 진정제, 국소 마취제, 신경근 차단제, 항 미생물성 제제, 건선치료제, 코르티코스테로이드, 동화작용 스테로이드, 에리트로포이에틴, 면역화제, 면역글로불린, 면역억제제, 성장 호르몬, 호르몬 대체 약물, 방사선 약제, 항우울증제, 항정신병제, 자극제, 천식 약물, 베타 작용제, 흡입 스테로이드, 에피네프린 또는 유사체, 사이토킨 및 사이토킨 길항제로 이루어진 그룹으로부터 선택된다.
또 다른 측면에서, 본 발명은 상기된 결합 단백질을 사람 피검체에 투여하여 사람 피검체내 표적 또는 표적들의 활성이 억제되어 하나 이상의 증상이 경감되거나 치료가 달성됨을 포함하는, 상기된 결합 단백질이 결합할 수 있는 표적 또는 표적들이 해로운 장애를 앓는 사람 피검체를 치료하는 방법을 제공한다. 예컨대, 장애는 관절염, 골관절염, 연소성 만성 관절염, 패혈성 관절염, 라임 관절염, 건선 관절염, 반응성 관절염, 척추관절증, 전신 홍반성 낭창, 크론 질환, 궤양 대장염, 장 염증 질환, 인슐린 의존성 진성 당뇨병, 갑상선염, 천식, 알레르기성 질환, 건선, 피부경화증, 이식편 대 숙주 질환, 기관 이식 거부, 기관 이식과 관련된 급성 또는 만성 면역 질환, 유육종증, 동맥경화증, 파종성 혈관내 응고, 가와사키병, 그레이브병, 신증후군, 만성 피로 증후군, 베게너 육아종증, 헤노흐-쇤라인 자반증, 신장의 현미경적 혈관염, 만성 활성 간염, 포도막염, 패혈성 쇼크, 독소 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질환, 기생충 질환, 후천성 면역결핍 증후군, 급성 횡단성 척수염, 헌팅톤 무도병, 파킨슨병, 알츠하이머병, 뇌졸중, 원발성 담즙성 간경변, 용혈성 빈혈, 악성 종양, 심부전증, 심근경색, 애디슨병, 산발성 질환, 다분비선 제I형 결핍증 및 다분비선 제II형 결핍증, 슈미트 증후군, 성인성(급성) 호흡 곤란 증후군, 탈모증, 원형 탈모증, 혈청반응 음성 관절증, 관절증, 라이터병, 건선성 관절증, 궤양성 대장염성 관절증, 장병증성 활막염, 클라미디아증, 예르시니아 및 살모넬라 관련 관절증, 척추관절증, 죽종 질환/동맥경화증, 아토피성 알레르기, 자가면역 수포성 질환, 심상성 천포창, 낙엽성 천포창, 유천포창, 선상 IgA 질환, 자가면역 용혈성 빈혈, 크움즈 양성 용혈성 빈혈, 후천성 악성 빈혈, 연소성 악성 빈혈, 근통성 뇌염/로얄 프리(Royal Free) 질환, 만성 점막 피부 칸디다증, 거세포 동맥염, 원발성 경화성 간염, 잠복성 자가면역 간염, 후천성 면역결핍 질환 증후군, 후천성 면역결핍 관련 질환, B형 간염, C형 간염, 공통 가변성 면역결핍증(공통 가변성 감마글로불린저혈증), 확장형 심근증, 여성 불임증, 난소 부전증, 조숙 난소부전, 섬유성 폐 질환, 잠복성 섬유조직 폐포염, 후-염증성 간질성 폐질환, 간질성 폐렴, 결합 조직 질환 관련 간질성 폐 질환, 조합성 결합 조직 질환 관련 폐 질환, 전신성 경화증 관련 간질성 폐 질환, 류마티스성 관절염 관련 간질성 폐 질환, 전신 홍반성 낭창 관련 폐 질환, 피부근염/다발성 근염 관련 폐 질환, 쇼그렌 질환 관련 폐 질환, 강직성 척추염 관련 폐 질환, 혈관염 범발성 폐 질환, 혈철증 관련 폐 질환, 약물-유도된 간질성 폐 질환, 섬유증, 방사선 섬유증, 폐색성 세기관지염, 만성 호산구성 폐렴, 림프구성 침윤성 폐 질환, 감염후 간질성 폐 질환, 통풍성 관절염, 자가면역 간염, 1형 자가면역 간염(전형적 자가면역 또는 루포이드 간염), 2형 자가면역 간염(항-LKM 항체 간염), 자가면역 매개된 저혈당증, 흑색 극세포증에 따른 B형 인슐린 내성, 부갑상선 기능저하증, 기관 이식과 관련된 급성 면역 질환, 기관 이식과 관련된 만성 면역 질환, 골관절증, 원발성 경화성 담관염, 1형 건선, 2형 건선, 특발성 백혈구감소증, 자가면역 호중구감소증, 신장 질환 NOS, 사구체신염, 신장의 현미경적 혈관염, 라임병, 원판양 홍반성 낭창, 남성 불임증 특발증 또는 NOS, 정자 자가면역, 다발성 경화증(모든 아형), 교감성 안염, 결합 조직 질환에 속발성인 폐 고혈압증, 구드패스튜어 증후군, 결절성 다발성 동맥염의 폐 징후, 급성 류마티스성 열, 류마티스성 척추염, 스틸씨 병, 전신성 경화증, 쇼그렌 증후군, 다카야스 병/동맥염, 자가면역 혈소판감소증, 특발성 혈소판감소증, 자가면역 갑상선 질환, 갑상선 기능항진증, 갑상선종증 자가면역 갑상선 기능저하증(하시모토 병), 위축성 자가 면역 갑상선 기능저하증, 원발성 점액수종, 수정체성 포도막염, 원발성 혈관염, 백반증 급성 간 질환, 만성 간질환, 알콜성 경변, 알콜 유도 간 손상, 콜레오사타티스(choleosatatis), 특이체질성 간 질환, 약물 유도 간염, 비알콜성 지방간염, 알레르기 및 천식, B 그룹 스트렙토코커스 (GBS) 감염, 정신 장애(예를 들어, 우울증 및 정신분열증), Th2 형 및 Th1 형 매개 질환, 급성 및 만성 통증(상이한 형태의 통증), 및 폐암, 유방암, 위암, 방광암, 결장암, 췌장암, 난소암, 전립선암 및 직장암과 같은 암종 및 조혈 악성종양(백혈병 및 림프종), 아베타지방단백질혈증, 말초청색증, 급성 및 만성 기생충성 또는 감염성 과정, 급성 백혈병, 급성 림프성 모구성 백혈병 (ALL), 급성 골수 백혈병(AML), 급성 또는 만성 세균 감염, 급성 췌장염, 급성 신부전증, 선암종, 공기 이소성 심방박동, AIDS 치매 합병증, 알콜 유도 간염, 알레르기성 결막염, 알레르기성 접촉 피부염, 알레르기성 비염, 동종이식 거부, 알파-1-안티트립신 결핍, 근위축성 측삭 경화증, 빈혈, 앙기나 협심증, 전각 세포 퇴화, 항 cd3 치료, 항 인지질 증후군, 항-수용체 과민성 반응, 대동맥 및 말초 결찰증, 대동맥 해부, 동맥 고혈압, 동맥경화증, 동정맥 누공, 운동실조증, 심방세동 (지연 또는 발작성), 심방조동, 동정맥 막힘, B 세포 림프종, 골 이식 거부, 골수 이식 (BMT) 거부, 좌각차단, 버키트 림프종, 화상, 심장성 부정맥, 심장성 기절 증후군, 심장 종양, 심근증, 심폐 우회 염증 반응, 연골 이식 거부, 소뇌피질 퇴화, 소뇌 장애, 혼란 또는 다초점 심방 빈맥, 화학치료 관련 장애, 만성 골수성 백혈병(CML), 만성 알콜증, 만성 염증 병리, 만성 림프성 백혈병(CLL), 만성 폐쇄 폐 질환(COPD), 만성 살리실레이트 중독, 결장직장 암종, 울혈성 심부전, 결막염, 접촉성 피부염, 폐 심장, 관상 동맥 질환, 크로이츠펠트-야콥(Creutzfeldt-Jakob) 질환, 배양 음성 패혈증, 낭섬유증, 사이토킨 치료 관련 장애, 권투선수치매(Dementia pugilistica), 탈수초성 질환, 댕기 출혈열, 피부염, 피부학적 증상, 당뇨병, 진성 당뇨병, 당뇨병성 동맥경화 질환, 광범위 루이체 질환, 확장성 울혈성 심근증, 기저핵 장애, 중년 다운 증후군, CNS 도파민 수용체 차단 약물에 의해 유도된 약물 유도 운동 장애, 약물 과민증, 습진, 뇌척수염, 심내막염, 내분비질환, 후두개염, 엡스타인-바르 바이러스 감염, 피부홍통증, 추체외로 및 소뇌 장애, 가족성 적혈구잠식성 림프조직구증, 태아 흉선 이식 거부, 프리드리히 운동실조증, 기능성 말초 동맥 장애, 진균 패혈증, 가스괴저, 위궤양, 사구체신염, 임의의 기관 또는 조직 이식 거부, 그람 음성 패혈증, 그람 양성 패혈증, 세포내 기관으로 인한 육아종, 모발 세포 백혈병, 할레로르덴-스파츠 질환(Hallerrorden-Spatz disease), 하시모토 갑상선염, 고초열, 심장 이식 거부, 혈색소증, 혈액투석, 용혈성 요독증후군/혈전성 혈소판감소성 자반증, 출혈, 간염(A), 히스 다발 부정맥, HIV 감염/HIV 신경병증, 호지킨 질환, 과운동성 장애, 과민성 반응, 과민성 폐렴, 고혈압, 운동 부족 장애, 시상하부-뇌하수체-부신피질계 평가, 특발성 애디슨 질환, 특발성 폐 섬유증, 항체 매개 세포독성, 무력증, 유아 척추 근육 위축증, 대동맥 염증, 인플루엔자 a, 이온화 방사선 노출, 홍채섬모체염/자궁염/광학적 신경근염, 허혈 관류 손상, 허혈 뇌졸중, 연소성 류마티스 관절염, 연소성 척추 근육 위축증, 카포시 육종, 신장 이식 거부, 레지오넬라, 리슈마니아증, 나병, 피질척수계 병변, 지방부종, 간 이식 거부, 림프피부종, 말라리아, 악성 림프종, 악성 조직구증, 악성 흑색종, 수막염, 수막염 균혈증, 대사/특발성 질환, 편두통, 미토콘드리아 다중 시스템 장애, 복합 연결 조직 질환, 모노클로날 감마글로불린혈증, 다발성 골수종, 다발성 시스템 퇴화(만셀 데제린-토마스 쉬-드라거 및 마차도-조셉), 중증 근무력증, 세포내 마이코박테리움 감염증, 마이코박테리움 결핵, 골수이형성증후군, 심근 경색, 심근 허혈 장애, 비인두 암종, 신생아 만성 폐 질환, 신염, 신증, 신경퇴행성 질환, 신경성 I 근육 위축증, 호중구감소성 발열, 비-호지킨 림프종, 복부 대동맥 및 이의 지류 폐색, 폐색성 동맥 질환, okt3 치료, 고환염/부고환염, 고환염/혈관절제술 반전 과정, 기비대, 골다공증, 췌장 이식 거부, 췌장 암종, 부수종양성 증후군/악성 고칼슘혈증, 부갑상선 이식 거부, 골반 염증 질환, 다년성 비염, 심막 질환, 말초 동맥경화 질환, 말초 혈관 장애, 복막염, 악성빈혈, 폐포자충 폐렴, 폐렴, POEMS 증후군 (다발신경병증, 장기비대, 내분비질환, 모노클로날 감마글로불린혈증, 및 피부 변화 증후군), 관류후 증후군, 펌프후 증후군, MI 후 심장절개 증후군, 자간전증, 전진적 상핵 마비, 원발성 폐 고혈압, 방사선 치료, 레이노드 현상 및 질환, 레이노드 질환, 레프섬 질환, 일반 협소 QRS 심근증, 신혈관성고혈압, 재관류 손상, 제한성 심근병증, 육종, 피부경화증, 노인 무도병, 루이체형 노인성 치매, 혈청음성 관절병증, 쇼크, 겸상적혈구 빈혈증, 피부 동종이식 거부, 피부 변화 증후군, 소장 이식 거부, 고형 종양, 특이적 부정맥, 척수운동실조, 척수소뇌 퇴화, 스트렙토코커스 근염, 소뇌 구조적 병변, 아급성 경화성 범뇌염, 실신, 심혈관계 매독, 전신 아나팔락시스, 전신 염증 반응 증후군, 전신 개시 연소성 류마티스 관절염, T-세포 또는 FAB ALL, 말초혈관 확장증, 폐색성 혈전 혈관염, 혈소판감소증, 독성, 이식, 외상/출혈, III형 과민성 반응, IV형 과민성, 불안정 앙기나, 요독증, 요로패혈증, 두드러기, 승모판 심장 질환, 하지 정맥, 혈관염, 정맥동 질환, 정맥종 혈전증, 심실 세동, 바이러스 및 진균 감염, 바이탈 뇌염/무균성 수막염, 바이탈-연관 적혈구식작용 증후군, 베르니케-코르사코프 증후군, 윌슨 질환, 임의의 기관 또는 조직의 이종이식 거부, 급성 관상동맥 증후군, 급성 특발성 다발신경염, 급성 염증성 탈수초성 다발성신경병증, 급성 허혈, 성인 스틸씨병, 원형 탈모증, 아나필락시스, 항-인지질 항체 증후군, 재생불량성 빈혈, 동맥경화증, 아토피성 습진, 아토피성 피부염, 자가면역 피부염, 스트렙토코커스 감염과 관련된 자가면역 장애, 자가면역 장병증, 자가면역 청각 상실, 자가면역 림프증식 증후군(ALPS), 자가면역 심근염, 자가면역 조숙 난소 부전, 안검염, 기관지확장증, 수포성 유천포창, 심혈관 질환, 격변성 항인지질 증후군, 셀리악병, 경부척추증, 만성 허혈, 흉터성 유천포창, 다발경화증의 위험이 있는 임상 분리 증후군(cis), 결막염, 유년기 개시 정신병, 만성 폐색성 폐질환(COPD), 누낭염, 피부근염, 당뇨 신장병, 진성 당뇨병, 추간판 헤르니아, 추간판 탈출증, 약물 유도 면역 용혈성 빈혈, 심내막염, 자궁내막증, 안구내염, 상공막염, 다형홍반, 주요 다형홍반, 임신성 유천포창, 길랑-바레 증후군(GBS), 건초열, 휴그 증후군, 특발성 파킨슨병, 특발성 사이질 폐렴, IgE-매개 알레르기, 면역 용혈성 빈혈, 봉입체 근염, 감염성 눈 염증, 염증성 탈수초성 질환, 염증성 심장 질환, 염증성 신장 질환, IPF/UIP, 홍채염, 각막염, 건성각막결막염, 쿠스마울 질환 또는 쿠스마울-마이어 질환, 랜드리 마비, 랑게르한스 세포 조직구증, 망상피반, 황반변성, 현미경적 다발혈관염, 베크테레브병, 운동 신경 장애, 점막 유천포창, 다발 기관 손상, 중증근무력증, 골수형성이상 증후군, 심근염, 신경근 장애, 신경병, 비-A 비-B 간염, 시각신경염, 골용해, 난소암, 소수관절 JRA, 말초 동맥 폐색 질환(PAOD), 말초 혈관 질환(PVD), 말초 동맥 질환(PAD), 정맥염, 결절성 다발동맥염(또는 결절성 동맥주위염), 다발연골염, 류마티스성 다발근육통, 백모증, 다관절 JRA, 다중내분비 결핍 증후군, 다발근육염, 류마티스성 다발근육통(PMR), 펌프 후 증후군, 원발성 파킨슨증, 전립선 및 직장 암 및 조혈성 악성종양(백혈병 및 림프종), 전립선염, 진정적혈구계 무형성, 부신피질부전, 재발 시신경척수염, 재협착증, 류마티스성 심장 질환, sapho(윤활막염, 여드름, 농포증, 골과다증 및 골염), 피부경화증, 2차 아밀로이드증, 쇼크 폐, 공막염, 좌골신경통, 2차 부신부전, 실리콘 관련 결합조직 질환, 스네던-윌킨슨 피부병, 강직 척추염, 스티븐슨-존슨 증후군(SJS), 전신 염증 반응 증후군, 관자동맥염, 톡소플라스마성 비염, 독소 표피 괴사용해, 횡단성 골수염, TRAPS(종양 괴사 인자 수용체, 1형 알레르기 반응, II형 당뇨병, 두드러기, 일반 사이질폐렴(UIP), 혈관염, 봄철 결막염, 바이러스 비염, 보그트-코야나기-하라다 증후군(VKH 증후군), 젖은 황반 변성, 상처 치유, 예르시니아 및 살모넬라 관련 관절병을 포함하는 그룹으로부터 선택된다.
한 양태에서, 본 발명의 조성물 및 방법으로 치료되거나 진단될 수 있는 질환으로는 원발성 및 전이성 암, 예컨대 유방, 결장, 직장, 폐, 입인두, 후두인두, 식도, 위, 췌장, 간, 방광 및 담관, 소장, 요로(예컨대, 신장, 방광 및 요로상피), 여성 생식관(예컨대, 자궁경부, 자궁, 및 난소뿐만 아니라 융모막암종 및 임신영양막병), 남성 생식관(예컨대, 전립선, 정낭, 고환 및 생식세포종양), 내분비선(예컨대, 갑상선, 부신 및 뇌하수체), 및 피부의 암종뿐만 아니라 혈관종, 흑색종, 육종(예컨대, 카포시 육종뿐만 아니라 골조직 및 연조직 유래 육종), 뇌, 신경, 눈 및 수막의 종양(예컨대, 성상세포종, 신경아교종, 아교모세포종, 망막모세포종, 신경종, 신경모세포종, 슈반세포종, 수막종), 백혈병과 같은 조혈계 악성종양 유래의 고형암, 및 림프종(호지킨 및 비-호지킨 림프종)을 포함하나, 이에 국한되는 것은 아니다.
또한, 본 발명의 DVD-Ig은 다음 질환 중 하나 이상을 치료할 수 있다: 급성 관상동맥 증후군, 급성 특발성 다발신경염, 급성 염증성 탈수초성 다발성신경병증, 급성 허혈, 성인 스틸씨병, 원형 탈모증, 아나필락시스, 항-인지질 항체 증후군, 재생불량성 빈혈, 동맥경화증, 아토피성 습진, 아토피성 피부염, 자가면역 피부염, 스트렙토코커스 감염과 관련된 자가면역 장애, 자가면역 청각 상실, 자가면역 림프증식 증후군(ALPS), 자가면역 심근염, 자가면역 혈소판감소증(AITP), 안검염, 기관지확장증, 수포성 유천포창, 심혈관 질환, 격변성 항인지질 증후군, 셀리악병, 경부척추증, 만성 허혈, 흉터성 유천포창, 다발경화증의 위험이 있는 임상 분리 증후군(CIS), 결막염, 유년기 개시 정신병, 만성 폐색성 폐질환(COPD), 누낭염, 피부근염, 당뇨 신장병, 진성 당뇨병, 추간판 헤르니아, 추간판 탈출증, 약물 유도 면역 용혈성 빈혈, 심내막염, 자궁내막증, 안구내염, 상공막염, 다형홍반, 주요 다형홍반, 임신성 유천포창, 길랑-바레 증후군(GBS), 건초열, 휴그 증후군, 특발성 파킨슨병, 특발성 사이질 폐렴, IgE-매개 알레르기, 면역 용혈성 빈혈, 봉입체 근염, 감염성 눈 염증, 염증성 탈수초성 질환, 염증성 심장 질환, 염증성 신장 질환, IPF/UIP, 홍채염, 각막염, 건성각막결막염, 쿠스마울 질환 또는 쿠스마울-마이어 질환, 랜드리 마비, 랑게르한스 세포 조직구증, 망상피반, 황반변성, 현미경적 다발혈관염, 베크테레브병, 운동 신경 장애, 점막 유천포창, 다발 기관 손상, 중증근무력증, 골수형성이상 증후군, 심근염, 신경근 장애, 신경병, 비-A 비-B 간염, 시각신경염, 골용해, 난소암, 소수관절 JRA, 말초 동맥 폐색 질환(PAOD), 말초 혈관 질환(PVD), 말초 동맥 질환(PAD), 정맥염, 결절성 다발동맥염(또는 결절성 동맥주위염), 다발연골염, 류마티스성 다발근육통, 백모증, 다관절 JRA, 다중내분비 결핍 증후군, 다발근육염, 류마티스성 다발근육통(PMR), 펌프 후 증후군, 원발성 파킨슨증, 전립선 및 직장 암 및 조혈성 악성종양(백혈병 및 림프종), 전립선염, 진정적혈구계 무형성, 부신피질부전, 재발 시신경척수염, 재협착증, 류마티스성 심장 질환, SAPHO(윤활막염, 여드름, 농포증, 골과다증 및 골염), 피부경화증, 2차 아밀로이드증, 쇼크 폐, 공막염, 좌골신경통, 2차 부신부전, 실리콘 관련 결합조직 질환, 스네던-윌킨슨 피부병, 강직 척추염, 스티븐슨-존슨 증후군(SJS), 전신 염증 반응 증후군, 관자동맥염, 톡소플라스마성 비염, 독소 표피 괴사용해, 횡단성 골수염, TRAPS(종양 괴사 인자 수용체, 1형 알레르기 반응, II형 당뇨병, 두드러기, 일반 사이질폐렴(UIP), 혈관염, 봄철 결막염, 바이러스 비염, 보그트-코야나기-하라다 증후군(VKH 증후군), 젖은 황반 변성 및 상처 치유.
한 양태에서, 본 발명의 항체 또는 이의 항원결합부는 단독으로 또는 방사선요법 및/또는 다른 화학요법 제제와 함께 사용되어, 본 명세서에 기술된 종양 유래의 전이를 예방하거나 암을 치료하는데 사용된다.
또 다른 측면에서, 본 발명은 상기된 결합 단백질 중 임의의 하나를 상기 논의된 바와 같은 제2 제제의 투여 전후 또는 동시에 투여하는 단계를 포함하는, 장애를 앓는 환자를 치료하는 방법을 제공한다. 바람직한 양태에서, 제2 제제는 부데노사이드, 상피 성장 인자, 코르티코스테로이드, 사이클로스포린, 설파살라진, 아미노살리실레이트, 6-머캅토퓨린, 아자티오프린, 메트로니다졸, 리폭시게나제 저해제, 메살라민, 올살라진, 발살라지드, 항산화제, 트롬복산 저해제, IL-1 수용체 길항제, 항-IL-1β mAb, 항-IL-6 또는 IL-6 수용체 mAb, 성장 인자, 엘라스타제 저해제, 피리디닐-이미다졸 화합물, TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-12, Il-13, IL-15, IL-16, IL-18, IL-23, EMAP-II, GM-CSF, FGF 및 PDGF의 항체 또는 작용제, CD2, CD3, CD4, CD8, CD-19, CD25, CD28, CD30, CD40, CD45, CD69, CD90 또는 이의 리간드의 항체, 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 마이코페놀레이트 모페틸, 레플루노마이드, NSAID, 이부프로펜, 코르티코스테로이드, 프레드니솔론, 포스포디에스테라제 저해제, 아데노신 작용제, 항혈전제, 보체 저해제, 아드레날린 제제, IRAK, NIK, IKK, p38, MAP 키나제 저해제, IL-1β전환 효소 저해제, TNFα 전환 효소 저해제, T-세포 시그널 전달 저해제, 메탈로프로테이나제 저해제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 저해제, 가용성 사이토킨 수용체, 가용성 p55 TNF 수용체, 가용성 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R, 소염 사이토킨, IL-4, IL-10, IL-11, IL-13 및 TGFβ로 이루어진 그룹으로부터 선택된다.
특정 양태에서, 본 명세서에 개시된 약제학적 조성물은 비경구, 피하, 근육내, 정맥내, 관절내, 기관지내, 복강내, 관절낭내, 연골내, 강내, 체강내, 소뇌내, 소뇌심실내, 결장내, 경부내, 위내, 간내, 심근내, 골내, 골반내, 심장주위내, 복강내, 흉막내, 전립선내, 폐내, 직장내, 신장내, 망막내, 척추내, 활막내, 흉부내, 자궁내, 방광내, 일시주사, 질내, 직장, 협측, 설하, 비내 및 경피 투여로부터 선택되는 하나 이상의 방식으로 환자에게 투여된다.
본 발명의 한 측면은 본 발명의 하나 이상의 결합 단백질에 대한 하나 이상의 항-이디오타입(idiotype) 항체를 제공한다. 항-이디오타입 항체는 본 발명의 결합 단백질에 도입될 수 있는, 면역글로불린의 적어도 일부, 예컨대 비제한적으로 중쇄 또는 경쇄 또는 이의 리간드 결합부의 하나 이상의 상보성 결정 영역(CDR), 중쇄 또는 경쇄 가변 영역, 중쇄 또는 경쇄 불변 영역, 골격 영역 또는 이의 일부를 포함하는 임의의 단백질 또는 펩타이드 함유 분자를 포함한다.
이상의 목적과 여타 목적, 본 발명의 특징과 장점뿐 아니라 본 발명 자체는 첨부 도면과 함께 이하 바람직한 양태의 상세한 설명으로부터 더욱 완전하게 이해될 것이다:
도 1A는 이원 가변 도메인(DVD)-Ig 작제물의 모식도로서, 두 모 항체로부터 DVD-Ig을 생성하는 전략을 도시한 것이다.
도 1B는 링커 없이 (DVD1-Ig) 및 링커와 함께 (DVD2-Ig), 및 2개의 모 일특이적 항체: 항-TNF D2E7(α) 및 항-PGE2 2B5-8.0(β)를 보유하는 TNF/PGE2 DVD-Ig의 모식도이다.
도 2는 PGE2-비오틴에 대한 2B5-7.0, 2B5-8.0, 2B5-9.0 및 2B5-10.0의 결합을 나타낸 ELISA 데이터를 도시한 것이다.
도 3은 2B5 및 IgG1에 대한 2B5-8.0의 결합을 나타낸 EP4 생체분석 데이터이다.
도 4는 15일 동안 주당 2회씩 주사했을 때 마우스의 평균 관절염 점수에 미치는 항-TNF mAb 8C11 및 항-PGE2 mAb 2B5, 단독물 및 배합물의 효과를 도시한 것이다.
도 5는 아달리무마브(IgG1)의 온도-유도된 언폴딩(unfolding)을 도시한 것이다. 3개의 언폴딩 전이를 관찰할 수 있고, 이는 항체에 전형적인 3 도메인의 언폴딩을 증명한다. Tm 값은 56.9℃, 67.4℃ 및 76.75℃(pH 4.3 완충액)이다.
도 6은 D2E7-SL-Hu2B5.7 DVD-Ig의 온도-유도된 언폴딩을 도시한 것이다. 4개의 언폴딩 전이를 관찰할 수 있고, 이는 4 도메인의 언폴딩을 증명하는 것이다. Tm 값은 58.8℃, 68.6℃, 75.0℃ 및 83.4℃(pH 6.0 완충액).
도 7은 아달리무마브(IgG1)의 온도-유도된 언폴딩(unfolding)을 도시한 것이다. 3개의 언폴딩 전이를 관찰할 수 있고, 이는 항체에 전형적인 3 도메인의 언폴딩을 증명한다. Tm 값은 68.3℃, 75.4℃ 및 83.1℃(pH 6.1 완충액)이다.
도 1A는 이원 가변 도메인(DVD)-Ig 작제물의 모식도로서, 두 모 항체로부터 DVD-Ig을 생성하는 전략을 도시한 것이다.
도 1B는 링커 없이 (DVD1-Ig) 및 링커와 함께 (DVD2-Ig), 및 2개의 모 일특이적 항체: 항-TNF D2E7(α) 및 항-PGE2 2B5-8.0(β)를 보유하는 TNF/PGE2 DVD-Ig의 모식도이다.
도 2는 PGE2-비오틴에 대한 2B5-7.0, 2B5-8.0, 2B5-9.0 및 2B5-10.0의 결합을 나타낸 ELISA 데이터를 도시한 것이다.
도 3은 2B5 및 IgG1에 대한 2B5-8.0의 결합을 나타낸 EP4 생체분석 데이터이다.
도 4는 15일 동안 주당 2회씩 주사했을 때 마우스의 평균 관절염 점수에 미치는 항-TNF mAb 8C11 및 항-PGE2 mAb 2B5, 단독물 및 배합물의 효과를 도시한 것이다.
도 5는 아달리무마브(IgG1)의 온도-유도된 언폴딩(unfolding)을 도시한 것이다. 3개의 언폴딩 전이를 관찰할 수 있고, 이는 항체에 전형적인 3 도메인의 언폴딩을 증명한다. Tm 값은 56.9℃, 67.4℃ 및 76.75℃(pH 4.3 완충액)이다.
도 6은 D2E7-SL-Hu2B5.7 DVD-Ig의 온도-유도된 언폴딩을 도시한 것이다. 4개의 언폴딩 전이를 관찰할 수 있고, 이는 4 도메인의 언폴딩을 증명하는 것이다. Tm 값은 58.8℃, 68.6℃, 75.0℃ 및 83.4℃(pH 6.0 완충액).
도 7은 아달리무마브(IgG1)의 온도-유도된 언폴딩(unfolding)을 도시한 것이다. 3개의 언폴딩 전이를 관찰할 수 있고, 이는 항체에 전형적인 3 도메인의 언폴딩을 증명한다. Tm 값은 68.3℃, 75.4℃ 및 83.1℃(pH 6.1 완충액)이다.
본 발명은 2개 이상의 항원과 결합할 수 있는 다가 및/또는 다특이적 결합 단백질에 관한 것이다. 특히, 본 발명은 이원 가변 도메인 면역글로불린(DVD-Ig) 및 이의 약제학적 조성물뿐만 아니라 DVD-Ig을 제조하기 위한 핵산, 재조합 발현 벡터 및 숙주 세포에 관한 것이다. 시험관내 또는 생체내에서 특이적 항원을 검출하는데 본 발명의 DVD-Ig을 사용하는 방법도 본 발명에 포함된다.
본 명세서에서 다른 표시가 없는 한, 본 발명과 관련하여 사용된 과학 및 기술적 용어들은 당업자가 일반적으로 알고 있는 의미를 나타낸다. 하지만, 용어들의 의미 및 범위는 어떠한 잠재적인 모호함이 있는 경우, 어떤 사전적 정의 또는 외적 정의보다 본 명세서에 제공된 정의가 우선되어야 한다. 또한, 정황상 다른 필요가 없는 한, 용어의 단수적 표현은 복수도 포함하며, 복수적 표현은 단수도 포함하는 것이다. 본 명세서에서, "또는"은 다른 표시가 없는 한 "및/또는"을 의미한다. 또한, "포함하는" 및 이러한 유형어, 예컨대 "포함한다" 및 "포함한" 등은 제한적 의미가 아니다. 또한, "요소" 또는 "성분" 등의 용어도 다른 구체적 표현이 없는 한, 하나의 유니트를 포함하는 요소 및 성분은 물론 하나 이상의 서브유니트를 포함하는 요소 및 성분들도 포함한다.
일반적으로, 본 명세서에 기술된 세포 및 조직 배양, 분자 생물학, 면역학, 미생물학, 유전학 및 단백질과 핵산 화학 및 하이브리드화 등과 관련하여 사용된 용어들은 당업계에 공지되어 있고 공통적으로 사용되는 것이다. 본 발명의 방법 및 기술은 당업계에 공지되어 있고, 다른 표시가 없는 한 본 명세서 전체에서 인용되고 논의된 각종 일반 서적 및 구체적인 문헌들에 기술된 바와 같은 통상의 방법에 따라 일반적으로 수행된다. 효소 반응 및 정제 기술은 당업계에서 공통적으로 수행되거나 본 명세서에 기술된 바와 같이 제조자의 지침에 따라 수행한다. 본 명세서에 기술된 분석 화학, 합성 유기 화학 및 의학 및 약제 화학과 관련하여 사용된 용어 및 그 실험 절차 및 기술은 당업계에 공지되어 일반적으로 사용되는 것이다. 화학 합성, 화학 분석, 약제, 제형, 전달 및 환자 치료에 대해서도 표준 기술을 사용한다.
본 발명을 더 용이하게 이해할 수 있도록 이하에 사용된 용어들의 정의를 정리했다.
본 명세서에 사용된 "폴리펩타이드"란 용어는 아미노산의 임의의 중합체 쇄를 의미한다. "펩타이드" 및 "단백질"이란 용어는 폴리펩타이드란 용어와 혼용할 수 있는 것으로서, 이 역시 아미노산의 중합체 쇄를 의미한다. "폴리펩타이드"란 용어는 천연 또는 합성 단백질, 단백질 단편 및 단백질 서열의 폴리펩타이드 유사체를 포함한다. 폴리펩타이드는 단량체 또는 중합체일 수 있다. 본 명세서에서 "폴리펩타이드"의 사용은 정황상 다른 반대 언급이 없는 한 폴리펩타이드 및 이의 단편과 변형체(변형체의 단편을 포함해서)를 포함하고자 한다. 항원성 폴리펩타이드에서, 폴리펩타이드의 단편은 경우에 따라 폴리펩타이드의 적어도 하나의 근접 또는 비선형 에피토프를 함유한다. 적어도 하나의 에피토프 단편의 정확한 경계는 당업계의 통상의 기술을 이용하여 확인할 수 있다. 단편은 적어도 약 5개의 연속 아미노산, 예컨대 적어도 약 10개의 연속 아미노산, 적어도 약 15개의 연속 아미노산, 또는 적어도 약 20개의 연속 아미노산을 포함한다. 폴리펩타이드의 변형체는 본 명세서에 기술된 바와 같다.
"분리된 단백질" 또는 "분리된 폴리펩타이드"란 용어는 그 기원이나 파생급원에 따라서 자연 상태일 때 동반되던 자연 관련 성분과 관련되어 있지 않은 단백질 또는 폴리펩타이드이다. 즉, 동일한 종 유래의 다른 단백질이 실질적으로 없고; 다른 종 유래의 세포에 의해서 발현되거나; 자연에서 발생되지 않는 것이다. 즉, 자연적으로 생성하는 세포와 다른 세포 시스템에서 합성되거나 화학적으로 합성된 폴리펩타이드는 이의 자연 관련 성분에서 "분리된" 것이다. 또한, 단백질은 당업계에 공지된 단백질 정제 기술을 사용하여 분리를 통해 자연 관련 성분으로부터 실질적으로 유리될 수도 있다.
본 명세서에 사용된 "회수하는"이란 용어는 당업계에 공지된 단백질 정제 기술 등을 사용하여 분리에 의해 자연 관련 성분이 실질적으로 제거된 폴리펩타이드와 같은 화학종을 제공하는 과정을 의미한다.
본원에 사용된 바와 같은 "생물학적 활성"은 분자의 임의의 하나 이상의 고유 생물학적 성질(생체내에서 발견되는 것처럼 자연 존재하든지 또는 재조합 수단에 의해 제공되거나 가능해진 것이든지 간에)을 의미한다. 생물학적 성질은 수용체 결합; 세포 증식의 유도, 세포 성장의 억제, 기타 사이토킨의 유도, 아폽토시스의 유도 및 효소 활성을 포함하지만 이에 제한되지 않는다. 또한, 생물학적 활성은 Ig 분자의 활성도 포함한다.
항체, 단백질 또는 펩타이드의 제2 화학종과의 상호작용과 관련하여 본 명세서에 사용된 "특이적 결합" 또는 "특이적으로 결합하는"이란 용어는 그 상호작용이 화학종 상의 특정 구조(예컨대, 항원 결정인자 또는 에피토프)의 존재에 따라 이루어진다는 것을 의미한다. 예컨대, 항체는 일반적으로 단백질보다는 특정 단백질 구조를 인식하여 여기에 결합한다. 항체가 에피토프 "A"에 특이적이라면, 표지된 "A"와 항체를 포함하는 반응에서 에피토프 A(또는 유리된 미표지 A)를 포함하는 분자의 존재는 항체에 결합된 표지된 A의 양을 감소시킬 것이다.
본 명세서에 사용된 "항체"란 용어는 4개의 폴리펩타이드 쇄, 즉 2개의 중쇄(H)와 2개의 경쇄(L)로 구성된 임의의 면역글로불린(Ig) 분자 또는 이러한 Ig 분자의 필수적인 에피토프 결합 특징을 갖는 임의의 기능성 단편, 돌연변이체, 변형체 또는 유도체를 의미한다. 이러한 돌연변이체, 변형체 또는 유도체 항체형은 당업계에 공지되어 있다. 이의 구체예에 대해서는 이하에 논의되나, 이에 국한되지는 않는다.
전체 길이 항체에서, 각 중쇄는 중쇄 가변 영역(본 명세서에서 약어로 HCVR 또는 VH로 표시됨)과 중쇄 불변 영역으로 구성된다. 중쇄 불변 영역은 3개의 도메인, CH1, CH2 및 CH3으로 구성된다. 각 경쇄는 경쇄 가변 영역(본 명세서에서 약어로 LCVR 또는 VL로 표시됨)과 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 1개 도메인, CL로 구성된다. VH 및 VL 영역은 다시 상보성 결정 영역(CDR)이라 불리는 초가변성 영역들로 나뉠 수 있고, 여기에는 골격 영역(FR)이라는 더 보존적인 영역들이 산재되어 있다. 각 VH 및 VL은 3개의 CDR 및 4개의 FR로 구성되며, 이들은 아미노 말단에서 카복시 말단으로 다음과 같은 순서에 따라 배열된다: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. 면역글로불린 분자는 임의의 유형(예를 들어, IgG, IgE, IgM, IgD, IgA 및 IgY), 클래스(예를 들어, IgG 1, IgG2, IgG 3, IgG4, IgA1 및 IgA2) 또는 서브클래스일 수 있다.
용어 "Fc 영역"은 온전한 항체의 파파인 분해에 의해 생성될 수 있는 면역글로불린 중쇄의 C-말단 영역을 정의하는데 사용된다. Fc 영역은 고유 서열 Fc 영역 또는 변이체 Fc 영역일 수 있다. 면역글로불린의 Fc 영역은 일반적으로 2개의 불변 도메인, CH2 도메인 및 CH3 도메인을 포함하고 임의로 CH4 도메인을 포함한다. 항체 이펙터 기능을 변경시키기 위한 Fc 부 내의 아미노산 잔기의 치환은 당업계에 공지되어 있다(Winter et al., 미국 특허 5,648,260; 5,624,821). 항체의 Fc 부는 여러 중요한 이펙터 기능, 예컨대 사이토킨 유도, ADCC, 식세포작용, 보체 의존적 세포독성(CDC) 및 항체와 항원-항체 복합체의 반감기/제거율 등을 매개한다. 몇몇 경우에는 이러한 이펙터 가능이 치료 항체에 바람직하지만, 어떤 다른 경우에는 치료 목적에 따라서 불필요하거나 심지어 유해할 수도 있다. 특정 사람 IgG 이소타입, 구체적으로 IgG1 및 IgG3은 각각 FcγR 및 보체 C1q에 대한 결합을 통해 ADCC 및 CDC를 매개한다. 신생 Fc 수용체(FcRn)는 항체의 혈행 반감기를 결정하는 중요한 성분이다. 또 다른 양태에서는, 항체의 불변 영역, 예컨대 항체의 Fc 영역에 존재하는 적어도 하나의 아미노산 잔기가 치환되어 이펙터 기능이 변경된 항체가 제공된다. 면역글로불린의 2개의 동일한 중쇄의 이량체화는 CH3 도메인의 이량체화에 의해 매개되고 힌지 영역내에서 이황화 결합에 의해 안정화된다(문헌참조: Huber et al. Nature; 264: 415-20; Thies et al 1999 J Mol Biol; 293: 67-79.). 중쇄-중쇄 이황화 결합을 방지하기 위한 힌지 영역내 시스테인 잔기의 돌연변이는 CH3 도메인의 이량체화를 불안정화시킬 것이다. CH3 이량체화에 관여하는 잔기들은 동정되었다(문헌참조: Dall'Acqua 1998 Biochemistry 37: 9266-73.). 따라서, 1가의 반쪽 Ig을 생성시킬 수 있다. 흥미롭게도, 이들 1가의 반쪽 Ig 분자는 IgG 및 IgA 서브클래스 둘다에 대해 천연에서 발견되었다(Seligman 1978 Ann Immunol 129: 855-70.;Biewenga et al 1983 Clin Exp Immunol 51: 395-400). FcRn: Ig Fc 영역의 화학양론은 2:1인 것으로 측정되었고(문헌참조: West et al .2000 Biochemistry 39: 9698-708), 반쪽 Fc는 FcRn 결합을 매개하기에 충분하다(문헌참조: Kim et al 1994 Eur J Immunol; 24: 542-548.). CH3 이량체화에 중요한 잔기가 CH3 베타 쉬트 구조의 내부 접지면상에 존재하는 반면에, FcRn 결합에 관여하는 영역이 CH2-CH3 도메인의 외부 접지면상에 존재하기 때문에, CH3 도메인의 이량체화를 붕괴시키기 위한 돌연변이는 FcRn 결합에 대해 큰 역효과를 나타내지 않을 수 있다. 그러나, 반쪽 Ig 분자는 통상의 항체 크기보다 작기 때문에 조직 침투에 있어서 특정 이점을 가질 수 있다. 하나의 양태에서, 하나 이상의 아미노산 잔기는 본 발명의 결합 단백질의 불변 영역, 예를 들어, Fc 영역에서 치환되어 중쇄의 이량체화가 붕괴되어 반쪽 DVD Ig 분자가 생성된다. IgG의 소염 활성은 IgG Fc 단편의 N-연결된 글리칸의 시알릴화에 전적으로 의존한다. 소염 활성에 대한 정확한 글리칸 요건은 정확한 IgG1 Fc 단편이 산출될 수 있도록 측정되었고, 결과적으로 효능이 크게 향상된 완전 재조합 시알릴화된 IgG1 Fc가 수득되었다(Anthony, R.M., et al.(2008) Science 320: 373-376).
본 명세서에 사용된 항체의 "항원 결합부"(또는 간단히 "항체부")란 용어는 항원에 대한 특이적 결합능을 갖는 하나 이상의 항체 단편을 의미한다. 항체의 항원 결합 기능은 완전한 항체의 단편에 의해 수행될 수 있는 것으로 밝혀져 있다. 이러한 항체 양태들은 또한 이특이적, 이중특이 또는 다중특이 형일 수 있으며, 즉 2개 이상의 다른 항원에 특이적으로 결합할 수 있다. 항체의 "항원 결합부"라는 용어에 포함되는 결합 단편의 예에는 (i) VL, VH, CL 및 CH1 도메인으로 이루어진 일가 단편인 Fab 단편; (ii) 2개의 Fab 단편이 힌지(hinge) 영역에서 이황화 가교에 의해 결합되어 있는 이가 단편인 F(ab')2; (iii) VH 및 CH1 도메인으로 이루어진 Fd 단편; (iv) 항체 한쪽 아암의 VL 및 VH 도메인으로 이루어진 Fv 단편; (v) 하나의 가변 도메인을 포함하는 dAb 단편(본원에 참조로서 인용되는, Ward et al.,(1989) Nature 341: 544-546; Winter et al., PCT 공보 WO90/05144 A1); 및 (vi) 분리된 상보성 결정 영역(CDR)을 포함한다. 또한, Fv 단편의 두 도메인, VL 및 VH는 다른 유전자에 의해 암호화되지만, VL 및 VH 영역이 쌍을 이루어 일가 분자(단일 쇄 Fv(scFv)로 알려진 것; 예컨대 Bird et al.(1998) Science 242: 423-426; 및 Huston et al.(1988) Proc. Natl. Acad. Sci. USA 85:5879-5883)를 형성하고 있는 단일 단백질 쇄로서 제조될 수 있게 하는 합성 링커를 이용하여 VL 및 VH 영역은 재조합법으로 결합될 수 있다. 이러한 단일 쇄 항체는 항체의 "항원 결합부"라는 용어에도 포함되는 것으로도 간주된다. 단일 쇄 항체의 다른 형태, 예컨대 디아바디(diabody)도 포함된다. 디아바디는 단일 폴리펩타이드 쇄에서 VH 및 VL 도메인이 발현되지만, 동일 쇄 상의 두 도메인 사이에 쌍 형성을 허용하기에는 너무 짧은 링커를 사용하여 상기 도메인들이 다른 쇄의 상보성 도메인과 쌍을 이루어 2개의 항원 결합 부위를 생성하는 2가의 이특이적 항체이다(예컨대, Holliger, P., et al.(1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R.J., et al.(1994) Structure 2: 1121-1123). 이러한 항체 결합부는 당업계에 공지되어 있다(Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5)). 추가로, 단일 쇄 항체는 또한 상보적 경쇄 폴리펩타이드와 함께 한쌍의 항원 결합 영역을 형성하는 한쌍의 탠덤 Fv 절편 (VH-CH1-VH-CH1)을 포함하는 "선형 항체"를 포함한다(문헌참조: Zapata et al. Protein Eng. 8(10):1057-1062 (1995); 및 미국 특허 제 5,641,870호).
용어 "다가 결합 단백질"은 본원 명세서 전반에 걸쳐 2개 이상의 항원 결합 부위를 포함하는 결합 단백질을 지칭하는데 사용된다. 한 양태에서, 다가 결합 단백질은 바람직하게 3개 이상의 항원 결합 부위를 갖도록 가공되고 일반적으로 천연 항체이다. 용어 "다특이적 결합 단백질"은 2개 이상의 관련 또는 비관련 표적에 결합할 수 있는 결합 단백질을 언급한다. 본 발명의 이원 가변 도메인 (DVD) 결합 단백질은 2개 이상의 항원 결합 부위를 포함하고 4가 또는 다가의 결합 단백질이다. DVD는 즉, 하나의 항원에 결합할 수 있는 일특이적이거나 2개 이상의 항원에 결합할 수 있는 다특이적일 수 있다. 2개의 중쇄 DVD 폴리펩타이드 및 2개의 경쇄 DVD 폴리펩타이드를 포함하는 DVD 결합 단백질은 DVD Ig로 언급된다. DVD Ig의 각 반쪽은 하나의 중쇄 DVD 폴리펩타이드 및 하나의 경쇄 DVD 폴리펩타이드 및 2개의 항원 결합 부위를 포함한다. 각각의 결합 부위는 항원 결합 부위당 항원 결합에 관여하는 총 6개의 CDR을 갖는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함한다.
본원에 사용된 바와 같은 용어 "이특이적 항체"는 쿼드로마 기술 (문헌참조: Milstein, C. and A.C. Cuello, Nature, 1983. 305(5934): p. 537-40), 2개의 상이한 mAb의 화학적 접합 (문헌참조: Staerz, U.D., et al., Nature, 1985. 314(6012): p. 628-31), 또는 Fc 영역에 돌연변이를 도입하는 크놉 인투 홀 또는 유사한 방법(문헌참조: Holliger, P., T. Prospero, and G. Winter, Proc Natl Acad Sci U S A, 1993. 90(14): p. 6444-8.18)에 의해, 다중의 상이한 면역글로빈 종(이 중에 하나만이 작용성 이특이적 항체이다)을 생성시킴으로써 제조되는 완전한 길이의 항체를 언급한다. 분자 기능에 의해, 이특이적 항체는 이의 2개의 결합 암(한쌍의 HC/LC) 중 하나상의 하나의 항원(또는 에피토프)에 결합하고 이의 2번째 암(다른 쌍의 HC/LC)상의 다른 항원(또는 에피토프)에 결합한다. 당해 정의에 따라, 이특이적 항체는 2개의 구분된 항원 결합 암(2개 특이성 및 CDR 서열로)을 갖고 이것이 결합하는 각각의 항원에 대해 1가이다.
본원에 사용된 바와 같은 용어 "이원-특이적 항체"는 이의 결합 암(한 쌍의 HC/LC)의 각각에서 2개의 상이한 항원(또는 에피토프)와 결합할 수 있는 완전한 길이의 항체를 언급한다(문헌참조: PCT 공보 WO 02/02773). 따라서, 이원-특이적 결합 단백질은 동일한 특이성 및 동일한 CDR 서열을 갖는 2개의 동일한 항원 결합 암을 갖고 이것이 결합하는 각각의 항원에 대해 2가이다.
결합 단백질의 "작용성 항원 결합 부위"는 표적 항원에 결합할 수 있는 부위이다. 항원 결합 부위의 항원 결합 친화성은 근본적으로 항원 결합 부위가 유래된 모 항체 만큼 강하지 않지만 항원에 결합하는 능력은 항원에 결합하는 항체를 평가하기 위해 공지된 다수의 방법중 임의의 하나를 사용하여 측정가능해야만 한다. 더욱이, 본원에서 다가의 항체의 항원 결합 부위의 항원 결합 친화성은 정량적으로 동일할 필요는 없다.
용어 "사이토킨"은 세포간 매개체로서 다른 세포 집단에 작용하는 하나의 세포 집단에 의해 방출되는 단백질에 대한 일반적 용어이다. 당해 사이토킨의 예는 림포킨, 모노킨 및 통상적인 폴리펩타이드 호르몬이다. 사이토킨 중에는 사람 성장 호르몬, N-메티오닐 사람 성장 호르몬 및 소 성장 호르몬과 같은 성장 호르몬; 부갑상선 호르몬; 티록신; 인슐린; 프로인슐린; 렐락신; 프로렐락신; 난포 자극 호르몬(FSH), 갑상선 자극 호르몬(TSH) 및 황체 호르몬(LH)와 같은 당단백질 호르몬; 간 성장 인자; 섬유아세포 성장 인자; 프롤락틴; 태반 락토겐; 종양 괴사 인자-알파 및 - 베타 뮬러리안 억제 물질; 마우스 생식선자극호르몬 관련 펩타이드; 인히빈; 액티빈; 혈관 내피 성장 인자; 인테그린; 트롬보포이에틴 (TPO); NGF-알파와 같은 신경 성장 인자; 혈소판 성장 인자; TGF-알파 및 TGF-베타와 같은 전환 성장 인자 (TGF); 인슐린형 성장 인자 -1 및 -11; 에리트로포이에틴 (EPO); 골유도성 인자; 인터페론-알파, -베타 및 감마 콜로니 자극 인자(CSF)(예를 들어, 대식세포-CSF(M-CSF))와 같은 인터페론; 과립구 대식세포-CSF(GM-CSF); 및 과립구-CSF(G-CSF); IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-18, IL-21, IL-22, IL-23, IL-33과 같은 인터류킨(IL); TNF-알파 또는 TNF-베타와 같은 종양 괴사 인자; 및 LIF 및 키트 리간드(KL)를 포함하는 기타 폴리펩타이드 인자가 포함된다. 본원에 사용된 바와 같이, 용어 사이토킨은 천연 공급원 또는 재조합 세포 배양물 및 천연 서열 사이토킨의 생물학적 활성 등가물 기원의 단백질을 포함한다.
용어 "링커"는 펩타이드 결합에 의해 연결된 2개 이상의 아미노산 잔기를 포함하는 폴리펩타이드를 지칭하는데 사용되고 하나 이상의 항원 결합부를 연결하는데 사용된다. 당해 링커 폴리펩타이드는 문헌(참조: Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak, R.J., et al. (1994) Structure 2:1121-1123)]에 널리 공지되어 있다. 예시적인 링커는 AKTTPKLEEGEFSEAR (서열번호 1); AKTTPKLEEGEFSEARV (서열번호 2); AKTTPKLGG (서열번호 3); SAKTTPKLGG (서열번호 4); SAKTTP (서열번호 5); RADAAP (서열번호 6); RADAAPTVS (서열번호 7); RADAAAAGGPGS (서열번호 8); RADAAAA(G4S)4 (서열번호 9); SAKTTPKLEEGEFSEARV (서열번호 10); ADAAP (서열번호 11); ADAAPTVSIFPP (서열번호 12); TVAAP (서열번호 13); TVAAPSVFIFPP (서열번호 14); QPKAAP (서열번호 15); QPKAAPSVTLFPP (서열번호 16); AKTTPP (서열번호 17); AKTTPPSVTPLAP (서열번호 18); AKTTAP (서열번호 19); AKTTAPSVYPLAP (서열번호 20); ASTKGP (서열번호 21); ASTKGPSVFPLAP (서열번호 22), GGGGSGGGGSGGGGS (서열번호 23); GENKVEYAPALMALS (서열번호 24); GPAKELTPLKEAKVS (서열번호 25); 및 GHEAAAVMQVQYPAS (서열번호 26)를 포함하지만 이에 제한되지 않는다.
"면역글로불린 불변 도메인"은 중쇄 또는 경쇄 불변 도메인을 언급한다. 사람 IgG 중쇄 및 경쇄 불변 도메인 아미노산 서열은 당업계에 공지되어 있다.
본원에 사용된 바와 같은 용어 "모노클로날 항체" 또는 "mAb"는 실질적으로 균질의 항체 집단으로부터 수득된 항체를 언급하고, 즉, 집단을 구성하는 개개의 항체들은 최소량으로 존재할 수 있는 가능한 천연 돌연변이를 제외하고는 동일하다. 모노클로날 항체는 고도로 특이적이고 단일 항원에 대해 지시된 것이다. 추가로, 전형적으로 상이한 결정인자(에피토프들)에 대해 지시된 상이한 항체들을 포함하는 폴리클로날 항체 집단과는 반대로, 각각의 mAb는 항원상의 단일 결정인자에 대해 지시된다. 수식어 "모노클로날"은 임의의 특정 방법에 의해 항체 생성을 요구하는 것으로 해석되지 말아야 한다.
본원에 사용된 바와 같은 용어 "사람 항체"는 사람 생식계열 면역글로불린 서열로부터 유래하는 가변 및 불변 영역을 보유하는 항체를 포함하는 것으로 의도된다. 본 발명의 사람 항체는 예를 들어, CDR 및 특히 CDR3에서 사람 생식계열 면역글로불린 서열에 의해 암호화되지 않은 아미노산 잔기(예를 들어, 시험관내 무작위 또는 부위 특이적 돌연변이유발에 의해 또는 생체내 체세포 돌연변이에 의해 도입된 돌연변이)를 포함할 수 있다. 그러나, 본원에 사용된 바와 같은 용어 "사람 항체"는 마우스와 같은 또 다른 포유동물 종의 생식계열로부터 유래하는 CDR 서열이 사람 골격 서열상에 이식된 항체를 포함하는 것으로 의도되지 않는다.
본원에 사용된 바와 같은 용어 "재조합 사람 항체"는 재조합 수단에 의해 생성되거나, 발현되거나, 제작되거나 분리된 모든 사람 항체, 예를 들어, 숙주 세포내로 형질감염된 재조합 발현 벡터를 사용하여 발현된 항체(하기 섹션 II C에서 추가로 기재됨), 재조합, 조합된 사람 항체 라이브러리로부터 유래된 항체 (Hoogenboom H.R., (1997) TIB Tech. 15:62-70; Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35:425-445; Gavilondo J.V., and Larrick J.W. (2002) BioTechniques 29:128-145; Hoogenboom H., and Chames P. (2000) Immunology Today 21:371-378 ), 사람 면역글로불린 유전자로 유전자전이된 동물(예를 들어, 마우스)로부터 분리된 항체(Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295; Kellermann S-A., and Green L.L. (2002) Current Opinion in Biotechnology 13:593-597; Little M. et al (2000) Immunology Today 21:364-370) 또는 사람 면역글로불린 유전자 서열을 기타 DNA 서열로 스플라이싱함을 포함하는 임의의 기타 수단에 의해 생성되거나 발현되거나 제작되거나 분리된 항체를 포함하는 것으로 의도된다. 당해 재조합 사람 항체는 사람 생식계열 면역 글로불린 서열로부터 유래된 가변 및 불변 영역을 갖는다. 그러나 특정 양태에서, 당해 재조합 사람 항체는 시험관내 돌연변이유발(또는 사람 Ig 서열로 유전자전이된 동물이 사용되는 경우, 생체내 체세포 돌연변이유발)에 적용되고 따라서 재조합 항체의 VH 및 VL 영역의 아미노산 서열은 사람 생식계열 VH 및 VL 서열로부터 유래하고 이와 관련된 것이지만 생체내 사람 항체 생식계열 레퍼토리내에 천연적으로 존재하지 않을 수 있는 서열이다.
"친화성 성숙된" 항체는 하나 이상의 CDR에서 하나 이상이 변형되어 당해 변형된 것을 갖지 않는 모 항체에 비해 항원에 대한 항체의 친화성이 개선된 것이다. 바람직한 친화성 성숙된 항체는 표적 항원에 대해 나노몰 또는 심지어 피코몰 친화성을 갖는다. 친화성 성숙된 항체는 당업계에 공지된 과정에 의해 생성된다. 문헌[참조: Marks et al. BidlTechnology 10:779-783 (1992)]은 VH 및 VL 도메인 셔플링에 의한 친화성 성숙화를 기재하고 있다. CDR 및/또는 골격 잔기의 무작위 돌연변이 유발은 문헌[참조: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147- 155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); Hawkins et al, J. Mol. BioL 226:889-896 (1992)]에 기재되어 있고 선택적 돌연변이유발 위치, 접촉 위치 또는 초돌연변이 위치에서 활성 증강성 아미노산 잔기로의 선택적 돌연변이는 미국 특허 US 6914128B1에 기술된 바와 같다.
"키메라 항체"란 용어는 한 종 유래의 중쇄 및 경쇄 가변 영역 서열과 다른 종 유래의 불변 영역 서열을 포함하는 항체, 예컨대 쥐의 중쇄 및 경쇄 가변 영역이 사람 불변 영역에 결합된 항체를 의미한다.
"CDR 이식된 항체"란 용어는 한 종에서 유래되는 중쇄 및 경쇄 가변 영역 서열을 포함하지만, VH 및/또는 VL의 하나 이상의 CDR 영역의 서열들이 다른 종의 CDR 서열로 교체된 항체를 의미하는 것으로서, 예컨대 쥐의 CDR의 하나 이상(예컨대, CDR3)이 사람 CDR 서열로 교체된 쥐의 중쇄 및 경쇄 가변 영역을 보유한 항체가 있다.
"사람화된 항체"란 용어는 사람을 제외한 종(예컨대, 마우스) 유래의 중쇄 및 경쇄 가변 영역 서열을 포함하지만 VH 및/또는 VL 서열의 적어도 일부가 더 "사람다운", 즉 사람 생식계열 가변 서열과 더 유사한 서열로 변경된 항체를 의미한다. 사람화된 항체의 일 형태는 사람 CDR 서열이 대응하는 비-사람 CDR 서열을 대신하기 위하여 비-사람 VH 및 VL 서열로 도입된 CDR 이식된 항체이다. 또한, "사람화된 항체"는 목적하는 항원과 면역특이적으로 결합하고 실질적으로 사람 항체의 아미노산 서열을 갖는 골격(FR) 영역 및 실질적으로 비-사람 항체의 아미노산 서열을 갖는 상보성 결정 영역(CDR)을 포함하는 항체 또는 변이 유도체, 유사체 또는 이의 단편이다. CDR과 관련하여 본원에 사용된 바와 같은 용어 "실질적으로"는 비-사람 항체 CDR과 80% 이상, 바람직하게는 85% 이상, 90% 이상, 95% 이상, 98% 이상 또는 99% 이상 동일한 아미노산 서열을 갖는 CDR을 언급한다. 사람화된 항체는 실질적으로 하나 이상 및 전형적으로 2개의 가변 도메인(Fab, Fab', F(ab') 2, FabC, Fv)를 포함하고 여기서, CDR 영역 모두 또는 실질적으로 모두는 비-사람 면역글로불린(즉, 공여자 항체)의 CDR에 상응하고 골격 영역의 모두 또는 실질적으로 모두는 사람 면역글로불린 컨센서스 서열의 CDR이다. 한 양태에서, 사람화된 항체는 또한 사람 면역글로불린의 전형적인 영역인 면역글로불린 불변 영역(Fc)의 하나 이상의 부분을 포함한다. 몇몇 양태에서, 사람화된 항체는 적어도 중쇄의 가변 도메인 뿐만 아니라 경쇄 둘다를 함유한다. 당해 항체는 또한 중쇄의 CH1, 힌지, CH2, CH3 및 CH4 영역을 포함할 수 있다. 몇몇 양태에서, 사람화된 항체는 사람화된 경쇄만을 함유한다. 몇몇 양태에서, 사람화된 항체는 사람화된 중쇄만을 함유한다. 특정 양태에서, 사람화된 항체는 경쇄 및/또는 사람화된 중쇄의 사람화된 가변 도메인만을 함유한다.
용어 "캐뱃(Kabat) 번호", "캐뱃 정의" 및 "캐뱃 표지"는 상호교환적으로 본원에서 사용된다. 이러한 용어는 당해 분야에서 인지되며 항체 또는 이의 항원 결합부의 중쇄 및 경쇄 가변 영역에서 다른 아미노산 잔기보다 더 가변적인(즉, 초가변성) 아미노산 잔기의 번호를 매기는 시스템을 의미한다[Kabat et al. (1971) Ann. NY Acad. Sci. 190: 382-391 및, kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242]. 중쇄 가변 영역에 있어서, 초가변 영역은 CDR1에 있어서 아미노산 31 내지 35 위치, CDR2에 있어서 아미노산 50 내지 65 위치, 및 CDR3에 있어서 아미노산 95 내지 102 위치의 범위이다. 경쇄 가변 영역에 있어서, 초가변 영역은 CDR1에 있어서 아미노산 24 내지 34 위치, CDR2에 있어서 아미노산 50 내지 56 위치, 및 CDR3에 있어서 아미노산 89 내지 97 위치의 범위이다.
용어 "CDR"은 항체 가변 서열내 상보성 결정 영역을 언급한다. 중쇄 및 경쇄 각각의 가변 영역에는 3개의 CDR이 있고 가변 영역 각각에 대해 CDR1, CDR2 및 CDR3으로서 명명된다. 본원에 사용된 바와 같은 용어 "CDR 세트"는 항원에 결합할 수 있는 단일 가변 영역내 존재하는 3개의 CDR 그룹을 언급한다. 이들 CDR의 정확한 경계선은 상이한 시스템에 따라 상이하게 정의되었다. 문헌[Kabat (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) and (1991))]에 기재된 시스템은 항체의 임의의 가변 영역에 적용될 수 있는 명확한 잔기 번호매김 시스템을 제공할 뿐만 아니라 3개의 CDR을 한정하는 정확한 잔기 경계선을 제공한다. 이들 CDR은 캐뱃 CDR로서 언급될 수 있다. 문헌[Chothia and coworkers (Chothia &Lesk, J. Mol. Biol. 196:901-917 (1987) 및 Chothia et al., Nature 342:877-883 (1989))]에서는, 아미노산 서열 수준에서 다양성이 크다 할지라도 캐뱃 CDR내에 특정 하위부위는 거의 동일한 펩타이드 골격 형태를 취하고 있음을 밝혔다. 이들 하위부위는 L1, L2 및 L3 또는 H1, H2 및 H3로서 명명되었고 여기서, "L" 및 "H"는 각각 경쇄 및 중쇄 영역을 지칭한다. 이들 영역은 초티아 CDR로서 언급될 수 있고 이는 캐뱃 CDR과 중복되는 경계선을 갖는다. 캐뱃 CDR과 중복하는 CDR을 한정하는 또 다른 경계선은 문헌[Padlan (FASEB J. 9:133-139 (1995)) 및 MacCallum (J Mol Biol 262(5):732-45 (1996)]에 기재되어 있다. 또 다른 CDR 경계선 한정은 상기 시스템 중 하나를 엄격하게 따르지는 않지만, 특정 잔기 또는 잔기 그룹 또는 심지어 전체 CDR이 항원 결합에 영향주지 않는다는 예측 또는 실험적 발견의 측면에서 이들이 단축되거나 연장될 수 있다하더라도 캐뱃 CDR과 중복된다. 본원에 사용된 방법은 당해 시스템 중 어느 하나에 따라 정의된 CDR을 사용할 수 있지만 바람직한 양태는 캐뱃 또는 초티아에 의해 정의된 CDR을 사용하는 것이다.
본원에 사용된 바와 같은 용어 "골격" 또는 "골격 서열"은 CDR을 제외한 가변 영역의 나머지 서열을 언급한다. CDR 서열의 정확한 정의는 상이한 시스템에 의해 결정될 수 있기 때문에, 골격 서열의 의미는 이에 따라 상이하게 해석된다. 6개의 CDR (경쇄의 CDR-L1, -L2, 및 -L3 및 중쇄의 CDR-H1, -H2, 및 -H3)은 또한 경쇄 또는 중쇄상의 골격 영역을 각 쇄상에 4개의 서브-영역(FR1, FR2, FR3 및 FR4)으로 나누고 여기서, CDR1은 FR1과 FR2 사이에 위치되고, CDR2는 FR2와 FR3 사이에 위치되고 CDR3은 FR3과 FR4 사이에 위치된다. FR1, FR2, FR3 또는 FR4로서 특정 서브-영역으로 특정화하는 것 없이 다르게 언급된 골격 영역은 단일의 천연 면역글로불린 쇄의 가변 영역내에 조합 FR을 나타낸다. 본원에 사용된 바와 같은 FR은 4개의 서브-영역중 하나를 나타내고 FR들은 골격 영역을 구성하는 4개의 서브-영역중 2개 이상을 나타낸다.
본원에 사용된 바와 같은, "생식계열 항체 유전자" 또는 "유전자 단편"은 특정 면역글로불린의 발현을 위해 유전학적 재배열 및 돌연변이를 유발하는 성숙 과정을 거치지 않는 비-림프성 세포에 의해 암호화된 면역글로불린 서열을 언급한다[Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv Exp Med Biol. 484:13-30 (2001)]. 본 발명의 다양한 양태에 의해 제공되는 이점 중 하나는 생식계열 항체 유전자가 성숙 항체 유전자 보다 종에서 개체에 특징적인 필수 아미노산 서열을 보존할 가능성이 높음에 따라 당해 종에서 치료학적으로 사용되는 경우 외래 공급원으로서 인지될 가능성이 낮다는 사실에 기인한다.
본원에 사용된 바와 같은 용어 "중화하는"은 결합 단백질이 사이토킨에 특이적으로 결합하는 경우 사이토킨의 생물학적 활성을 중화시킴을 언급한다. 바람직하게, 중화 결합 단백질은 사이토킨에 결합하여 약 20% 이상, 40% 이상, 60% 이상, 80% 이상 또는 85% 이상으로 사이토킨의 생물학적 활성을 감소시킨다.
용어 "활성"은 2개 이상의 항원에 대한 DVD-Ig의 결합 특이성/친화성과 같은 활성을 포함한다.
"에피토프"란 용어는 면역글로불린 또는 T-세포 수용체에 특이적 결합이 가능한 임의의 폴리펩타이드 결정인자를 포함한다. 특정 양태에서, 에피토프 결정인자에는 아미노산, 당 측쇄, 포스포릴 또는 설포닐과 같은 분자의 화학적 활성 표면 기가 포함되고, 다른 특정 양태에서는 특이적인 입체 구조 특징, 및/또는 특이적 하전 특징을 갖는 것일 수 있다. 에피토프는 항체에 의해 결합되는 항원의 일 영역이다. 특정 양태에서, 항체는 단백질 및/또는 거대분자의 배합 혼합물에서 자신의 표적 항원을 우선적으로 인식할 때 항원에 특이적으로 결합한다. 항체는 이 항체들이 교차 경쟁한다면(한 항체가 다른 항체의 결합 또는 조절 효과를 방해한다), "동일한 에피토프에 결합한다"고 말한다. 또한, 에피토프의 추가 구조 정의(중첩성, 유사성, 동일성)는 정보를 제공하지만, 기능적 정의가 구조적(결합) 및 기능적(조절, 경쟁) 파라미터를 포함하는 것으로 종종 더 적절하다.
본 명세서에 사용된 "표면 플라스몬 공명"이란 용어는 BIAcore®시스템(Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ) 등을 이용하여 바이오센서 매트릭스 내의 단백질 농도의 변경을 검출하여 생체특이적 상호작용을 실시간 분석할 수 있는 광학 현상을 의미한다. 이에 대한 상세한 설명은 문헌[Jonsson, U., et al. (1993) Ann. Biol. Clin. 51: 19-26; Jonsson, U., et al. (1991) Biotechniques 11: 620-627; Johnsson, B., et al.(1995) J. Mol. Recognit. 8: 125-131; 및 Johnnson, B., et al. (1991) Anal. Biochem. 198: 268-277]에 기술되어 있다.
본 명세서에 사용된 "Kon"이란 용어는 당업계에 공지된 바와 같이 항체/항원 복합체를 형성하기 위한 항원에 대한 항체의 결합을 나타내는 온 속도 상수(on rate constant)를 의미하는 것으로 간주한다. 또한, "Kon"은 "결합 속도 상수" 또는 "ka"란 용어로도 알려져 있고, 본 명세서에 혼용된다. 이 값은 항체의 표적 항원에 대한 항체의 결합 속도 또는 항체와 항원 간에 복합체 형성 속도를 나타내는 것으로, 다음 식으로 표시된다:
항체("Ab") + 항원("Ag") → Ab-Ag
본 명세서에 사용된 "Koff"란 용어는 당업계에 공지된 바와 같이 항체/항원 복합체로부터 결합 단백질(예: 항체)의 해리를 나타내는 오프 속도 상수(off rate constant) 또는 "해리 속도 상수"를 의미하는 것으로 간주한다. 이 값은 항체 표적 항원으로부터 항체의 해리 속도 또는 Ab-Ag 복합체의 유리 항체 및 항원으로의 경시적인 분리를 나타내며, 하기 식으로 표시된다:
Ab + Ag → Ab-Ag
본 명세서에 사용된 "KD"란 용어는 "평형 해리 상수"를 의미하는 것으로 간주하고, 평형 시 적정법에 의해 수득되는 값, 또는 해리 속도 상수(Koff)를 결합 속도 상수(Kon)로 나눈 값을 의미한다. 결합 속도 상수, 해리 속도 상수 및 평형 해리 상수는 항원에 대한 항체의 결합 친화성을 나타내는데 사용한다. 결합 속도 상수 및 해리 속도 상수를 측정하는 방법은 당업계에 잘 알려져 있다. 형광 기반 기술의 사용은 높은 감도를 제공하고, 평형 시 생리학적 완충액에서 시료를 조사하는 능력을 제공한다. 다른 실험적 시도 및 기구, 예컨대 BIAcore®(생체분자 상호작용 분석) 분석도 사용할 수 있다(예: BIAcore International AB, GE Healthcare company, Uppsala, Sweden 에서 입수가능한 기구). 또한, Sapidyne Instruments(Boise, Idaho)에서 입수가능한 KinExA®(Kinetic Exclusion Assay) 분석도 사용할 수 있다.
"표지" 및 "검출가능 표지"는 항체 또는 피분석물과 같이 특정 결합 파트너에 부착된 부분을 의미하는 것으로, 예컨대 항체와 피분석물과 같은 특정 결합 쌍의 구성원들 간에 반응을 검출할 수 있게 하며, 이와 같이 표지화된 특정 결합 파트너, 예컨대 항체 또는 피분석물은 "검출가능하게 표지된"이라 언급한다. 즉, 본 명세서에 사용된 "표지된 결합 단백질"이란 용어는 결합 단백질을 식별할 수 있게 하는 표지(label)가 혼입되어 있는 단백질을 의미한다. 한 양태에서, 표지는 육안이나 기구에 의해 검출가능한 시그널을 생산할 수 있는 검출가능 마커이며, 예컨대 방사능표지화된 아미노산의 혼입 또는 비오틴 부분의 폴리펩타이드에 대한 부착은 표식된 아비딘에 의해 검출될 수 있다(예컨대, 형광 마커 또는 효소 활성을 함유하는 스트렙타비딘은 광학법 또는 비색법에 의해 검출될 수 있다). 폴리펩타이드에 대한 표지의 예에는 다음과 같은 것이 있으나, 이에 국한되지 않는다: 방사선동위원소 또는 방사선핵종(예: 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho, 및 153Sm); 발색원, 형광 표지(예를 들어, FITC, 로다민, 란타니드 포스포르), 효소 표지(예: 양고추냉이 퍼옥시다제, 루시퍼라제, 알칼리성 포스파타제); 화학발광 마커; 비오틴 기; 2차 리포터(예컨대, 류신 지퍼 쌍 서열, 2차 항체에 대한 결합 부위, 금속 결합 도메인, 에피토프 태그)에 의해 인식되는 소정의 폴리펩타이드 에피토프; 및 자성 제제, 예컨대 가돌리늄 킬레이트. 면역분석에 통용되는 표지의 대표예로는 빛을 생산하는 부분, 예컨대 아크리디늄 화합물, 및 형광을 생산하는 부분, 예컨대 플루오레세인을 포함한다. 다른 표지들도 본 명세서에 기술되어 있다. 이와 관련하여, 부분 자체는 검출가능하게 표지될 수 없지만, 또 다른 부분과 반응 후 검출가능할 수도 있다. "검출가능하게 표지된"의 사용은 이하 검출가능 표지화 종류도 포함하는 것으로 간주한다.
"접합체"란 용어는 제2 화학 잔기, 예컨대 치료제 또는 세포독성제에 화학적으로 결합된 결합 단백질, 예컨대 항체를 의미한다. 본 명세서에 사용된 "제제"라는 용어는 화학적 화합물, 화학적 화합물의 혼합물, 생물학적 거대분자 또는 생물학적 물질로부터 제조된 추출물을 의미한다. 한 양태에서, 치료제 또는 세포독성제는 백일해 독소, 탁솔, 시토칼라신 B, 그라미시딘 D, 에티디움 브로마이드, 에메틴, 미토마이신, 에토포사이드, 테노포사이드, 빈크리스틴, 빈블라스튼, 콜히친, 독소루비신, 다우노루비신, 디하이드록시 안트라신 디온, 미토크산트론, 미트라마이신, 액티노마이신 D, 1-데하이드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤 및 퓨로마이신 및 이의 유사체 또는 동족체가 포함되나, 이에 국한되지 않는다. 면역분석의 상황에 이용될 때, 접합체 항체는 검출 항체로 이용된 검출가능하게 표지된 항체일 수 있다.
본원에 사용된 바와 같은 용어 "결정" 또는 "결정화된"은 결정 형태로 존재하는 결합 단백질(예: 항체) 또는 이의 항원 결합부를 의미한다. 결정은 고체 상태의 물질의 일 형태로서, 무정형 고체 상태 또는 액정 상태와 같은 다른 형태와 상이하다. 결정은 원자, 이온, 분자(예: 항체와 같은 단백질) 또는 분자 어셈블리(예: 항원/항체 복합체)의 규칙적이고 반복적인 입체 배열로 구성된다. 이러한 입체 배열은 당업계에 공지된 특이적인 수학적 관계에 따라 배열된다. 결정 중에서 반복되는 기본 유니트 또는 빌딩 블록은 비대칭 유니트라 한다. 배열내 비대칭 유니트의 반복은 분명한 소정의 결정학적 대칭과 일치하게 하여 결정의 "유니트 셀"을 제공한다. 모든 3차원에서 규칙적 해독에 의한 유니트 셀의 반복은 결정을 제공한다[Giege, R. and Ducruix, A. Barrett, Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ea., pp. 20 1-16, Oxford University Press, New York, New York (1999)].
본 명세서에 사용된 "폴리뉴클레오타이드"란 용어는 2개 이상의 뉴클레오타이드의 중합체 형태를 의미하는 것으로서, 리보뉴클레오타이드이거나 데옥시리보뉴클레오타이드 또는 어느 한 뉴클레오타이드의 변형된 형태를 의미한다. 이 용어에는 일본쇄 및 이본쇄 형태의 DNA가 포함된다.
"분리된 폴리뉴클레오타이드"란 용어는 그 기원에 따라서, "분리된 폴리뉴클레오타이드"는 자연에서 발견되는 "분리된 폴리뉴클레오타이드"의 폴리뉴클레오타이드 전부 또는 일부와 관련되어 있지 않은 폴리뉴클레오타이드(예컨대, 게놈, cDNA 또는 합성 기원 또는 이의 일부 조합); 자연에서는 결합되어 있지 않은 폴리뉴클레오타이드에 작동가능하게 결합된 폴리뉴클레오타이드(예컨대, 게놈, cDNA 또는 합성 기원 또는 이의 일부 조합); 또는 더 큰 서열의 일부로서 자연에서 발생되지 않는 폴리뉴클레오타이드(예컨대, 게놈, cDNA 또는 합성 기원 또는 이의 일부 조합)이다.
본 명세서에 사용된 "벡터"라는 용어는 결합된 다른 핵산을 수송할 수 있는 핵산 분자를 의미하는 것으로 간주한다. 벡터의 한가지 형태는 추가 DNA 분절이 연결될 수 있는 원형의 이본쇄 DNA 루프를 의미하는 "플라스미드"이다. 다른 형태의 벡터는 추가 DNA 분절이 바이러스 게놈에 연결될 수 있는 바이러스 벡터이다. 특정 벡터는 도입된 숙주 세포에서 자율 복제할 수 있다(예컨대, 세균 복제 오리진을 보유한 세균 벡터 및 에피솜성 포유동물 벡터). 다른 벡터(예컨대, 비에피솜성 포유동물 벡터)는 숙주 세포에 도입 시 숙주 세포의 게놈으로 통합될 수 있고, 이로써 숙주 게놈에 따라 복제된다. 더욱이, 특정 벡터는 작동가능하게 결합된 유전자의 발현을 유도할 수 있다. 이러한 벡터는 본 명세서에서 "재조합 발현 벡터"(또는 간단히 "발현 벡터")라 한다. 일반적으로 재조합 DNA법에 유용한 발현 벡터는 흔히 플라스미드 형태이다. 따라서, 본 명세서에 사용된 "플라스미드" 및 "벡터"는 플라스미드가 벡터의 가장 일반적으로 사용되는 형태이기 때문에 대체될 수 있다. 하지만, 본 발명은 등가 기능을 하는 바이러스 벡터(예: 복제 결손성 레트로바이러스, 아데노바이러스 및 아데노관련 바이러스)와 같은 다른 형태의 발현 벡터도 포함한다.
"작동가능하게 결합된"이란 용어는 기술된 성분이 의도한 방식대로 기능할 수 있는 관계에 있는 병치 상태를 의미한다. 암호화 서열에 "작동가능하게 결합된" 조절 서열은 암호화 서열의 발현이 조절 서열에 적합한 조건 하에서 수행되도록 연결된다. "작동가능하게 결합된" 서열에는 당해 유전자에 근접한 발현 조절 서열 및 당해 유전자를 조절하기 위하여 트랜스로 작용하거나 일정 거리에 있는 발현 조절 서열이 포함된다. 본 명세서에 사용된 바와 같은 "발현 조절 서열"이란 용어는 이들이 연결된 암호화 서열의 발현과 프로세싱을 수행하는데 필요한 폴리뉴클레오타이드 서열을 의미한다. 발현 조절 서열에는 적당한 전사 개시, 종결, 프로모터 및 인핸서 서열; 이식된 및 폴리아데닐화 시그널과 같은 효과적인 RNA 프로세싱 시그널; 세포질 mRNA를 안정화시키는 서열; 해독 효율을 증강시키는 서열(즉, 코작(Kozak) 컨센서스 서열); 단백질 안정성을 증강시키는 서열; 필요한 경우 단백질 분비를 증강시키는 서열 등이 포함된다. 이러한 조절 서열의 성질은 숙주 유기체에 따라 다르며, 원핵생물인 경우, 이러한 조절 서열에는 일반적으로 프로모터, 리보솜 결합 부위 및 전사 종결 서열이 있고; 진핵생물인 경우, 이러한 조절 서열에는 프로모터 및 전사 종결 서열이 있다. "조절 서열"이란 용어는 그 존재가 발현 및 프로세싱에 필수적인 성분을 포함하는 것으로 간주하고, 리더 서열 번호 및 융합 파트너 서열과 같이 그 존재가 유리한 추가 성분을 포함할 수도 있다.
본 명세서에 정의된 바와 같은 "형질전환"은 외인성 DNA가 숙주 세포로 유입되는 임의의 공정을 의미한다. 형질전환은 당업계에 공지된 다양한 방법을 사용하여 자연 또는 인공 조건 하에서 실시될 수 있다. 형질전환은 이종 핵산 서열을 원핵생물 또는 진핵생물 숙주 세포로 삽입하기 위한 임의의 공지된 방법에 따라 달라질 수 있다. 이러한 방법은 형질전환되는 숙주 세포에 따라 선택되는데, 그 예로는 바이러스 감염, 전기천공, 리포펙션 및 입자 충격이 있으나, 이에 국한되지는 않는다. 이러한 "형질감염된" 세포는 삽입된 DNA가 자율 복제성 플라스미드로서 또는 숙주 염색체의 일부로서 복제할 수 있는 안정적으로 형질전환된 세포를 포함한다. 또한, 이들 세포는 삽입된 DNA 또는 RNA를 한정된 시간 동안 일시적으로 발현하는 세포도 포함한다.
본 명세서에 사용된 "재조합 숙주 세포"(또는 간단히 "숙주 세포")란 용어는 외인성 DNA가 도입된 세포를 의미하는 것으로 간주한다. 한 양태에서, 숙주 세포는 예컨대 미국 특허 7,262,028에 기술된 숙주 세포와 같은 2종 이상의(예컨대, 복수의) 핵산 암호화 항체를 포함한다. 이러한 용어는 특정 피검체 세포뿐만 아니라 이 세포의 자손도 의미하는 것으로 간주되어야 한다. 후속 세대에는 돌연변이 또는 환경적 영향으로 인해 특정 변형이 일어날 수 있기 때문에, 상기 자손은 사실상 모세포와 동일하지 않지만 본 명세서에 사용된 "숙주 세포"란 용어의 범위에는 포함되는 것으로 간주한다. 한 양태에서, 숙주 세포는 임의의 생물계에서 선택되는 원핵생물 및 진핵 세포를 포함하는 것이 바람직하다. 다른 양태에서, 진핵 세포에는 원생생물, 진균, 식물 및 동물 세포가 포함된다. 다른 양태에서, 숙주 세포는 원핵 세포주 이.콜라이; 포유동물 세포주 CHO, HEK 293, COS, NS0, SP2 및 PER.C6; 곤충 세포주 Sf9; 및 진균 세포 사카로마이세스 세레비지애를 포함하지만, 이에 국한되지는 않는다.
재조합 DNA, 올리고뉴클레오타이드 합성 및 조직 배양과 형질전환(예: 전기천공, 리포펙션)에는 표준 기술을 사용할 수 있다. 효소 반응과 정제 기술은 제조업자의 지침에 따라 수행하거나 당업계에서 일반적으로 수행하는 바와 같이 또는 본 명세서에 기술된 바와 같이 수행할 수 있다. 상기 기술 및 절차들은 당업계에 공지된 통상의 방법에 따라 또는 본 명세서에서 인용되고 논의된 각종 일반 문헌 및 특정 문헌들에 기술된 바와 같이 일반적으로 수행할 수 있다[예컨대, Sambrook et al. Molecular Cloning: A Laboratory Manual(2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.(1989) 참조].
당업계에 공지되고 본 명세서에 사용된 바와 같은 "유전자전이 유기체"란 용어는 전이유전자(transgene)를 포함하는 세포를 가진 유기체를 의미하는 것으로서, 유기체(또는 이 유기체의 선조)에 도입된 전이유전자는 유기체에서 자연 발현되지 않는 폴리펩타이드를 발현한다. "전이유전자"는 유전자전이 유기체가 발생하는 세포의 게놈으로 안정적이고 작동가능하게 통합되어, 유전자전이 유기체의 하나 이상의 세포 형태 또는 조직에서 암호화된 유전자 산물의 발현을 유도하는 DNA 작제물이다.
본 명세서에 사용된 "조절하다" 및 "조정하다"란 용어는 호환 가능하며, 본 명세서에 사용된 바와 같이 당해 분자의 활성(예: 사이토킨의 생물학적 활성)에 있어서 변화 또는 변경을 의미한다. 조절은 당해 분자의 특정 활성 또는 기능의 정도(magnitude)에 있어서의 증가 또는 감소일 수 있다. 분자 활성 및 기능의 예에는 결합 특징, 효소 활성, 세포 수용체 활성화 및 시그널 전달 등이 있으나, 이에 국한되지는 않는다.
이와 마찬가지로, 본 명세서에 사용된 "조절인자"란 용어는 당해 분자의 활성 또는 기능(예: 사이토킨의 생물학적 활성)을 변화 또는 변경시킬 수 있는 화합물이다. 예를 들어, 조절인자는 이 조절인자의 부재 시 관찰되는 활성 또는 기능의 정도와 비교했을 때 분자의 특정 활성 또는 기능의 정도에 있어서의 증가 또는 감소를 유발할 수 있다. 특정 양태에서, 조절인자는 분자의 하나 이상의 활성 또는 기능의 정도를 감소시키는 저해제이다. 저해제의 예에는 단백질, 펩타이드, 항체, 펩티바디(peptibody), 탄수화물 또는 유기 소분자가 있으나, 이에 국한되지 않는다. 펩티바디는 WO 01/83525 등에 기술되어 있다.
본 명세서에 사용된 바와 같은 "작용제(agonist)"란 용어는 목적하는 분자와 접촉했을 때 작용제의 부재 시 관찰되는 활성 또는 기능의 정도와 비교했을 때 당해 분자의 특정 활성 또는 기능의 정도에 있어서의 증가를 유발하는 조절인자를 의미한다. 목적하는 작용제의 구체예에는 항원에 결합하는 폴리펩타이드, 핵산, 탄수화물 또는 임의의 다른 분자가 포함될 수 있으나, 이에 국한되는 것은 아니다.
본 명세서에 사용된 "길항제" 또는 "저해제"란 용어는 목적하는 분자와 접촉했을 때, 길항제의 부재 시 관찰되는 활성이나 기능의 정도와 비교했을 때 당해 분자의 특정 활성이나 기능의 정도에 있어서의 감소를 유발하는 조절인자를 의미한다. 목적하는 길항제의 구체예에는 항원의 생물학적 또는 면역학적 활성을 차단 또는 조절하는 물질이 포함된다. 항원의 길항제 및 저해제에는 항원에 결합하는 단백질, 핵산, 탄수화물 또는 임의의 다른 분자가 포함되나, 이에 국한되지는 않는다.
본원에 사용된 바와 같은 용어 "유효량"은 장애 또는 이의 하나 이상의 증상을 경감시키거나 완화시키거나 장애의 진행을 차단하거나, 장애를 퇴화시키거나, 재발, 발병, 장애와 연관된 하나 이상의 증상의 개시 또는 진행을 차단하거나, 장애를 검출하거나 또 다른 치료의 예방학적 또는 치료학적 효과(예를 들어, 예방학적 또는 치료학적 제제)를 증진시키거나 개선시키는데 충분한 치료양을 언급한다.
"환자" 및 "피검체"는 본 명세서에서 호환 사용될 수 있는 것으로, 동물, 예컨대 포유동물, 예컨대 영장류(예를 들어, 사람, 원숭이 및 침팬지), 비-영장류(예를 들어, 소, 돼지, 낙타, 라마, 말, 염소, 토끼, 양, 햄스터, 기니아 피그, 고양이, 개, 래트, 마우스, 고래), 새(예: 오리 또는 거위) 및 상어가 있다. 환자 또는 피검체는 사람, 예컨대 질환, 장애 또는 상태에 대해 치료 또는 평가되고 있는 사람, 질환, 장애 또는 상태의 위험이 있는 사람, 질환, 장애 또는 상태가 있는 사람, 및/또는 질환, 장애 또는 상태를 치료하고 있는 사람인 것이 바람직하다.
본 명세서에 사용된 "시료"란 용어는 가장 광범위한 의미로 사용되고 있다. 본 명세서에 사용된 "생물학적 시료"는 생물체 또는 이전 생물체에서 유래하는 임의의 양의 물질을 포함하나, 이에 국한되는 것은 아니다. 이러한 생물체에는 사람, 마우스, 래트, 원숭이, 개, 토끼 및 다른 동물이 있으나, 이에 국한되는 것은 아니다. 상기 물질에는 혈액(예: 전혈), 혈장, 혈청, 소변, 양수, 윤활액, 내피 세포, 백혈구, 단핵구, 다른 세포, 기관, 조직, 골수, 림프절 및 비장이 있으나, 이에 국한되지 않는다.
"성분", "성분들" 및 "적어도 하나의 성분"은 일반적으로 포획 항체, 검출 또는 접합 항체, 대조군, 캘리브레이터(calibrator), 일련의 캘리브레이터, 감응도 패널, 용기, 완충액, 희석제, 염, 효소, 효소와 같은 보조인자, 검출 시약, 전처리 시약/용액, 기질(예컨대, 용액으로), 중단 용액 및 본 명세서에 기술된 방법 및 당업계에 공지된 여타 방법에 따라 검사 시료, 예컨대 환자 소변, 혈청 또는 혈장 시료의 분석용 키트에 포함될 수 있는 이의 유사물을 의미한다. 따라서, 본 명세서의 문맥에서, "적어도 하나의 성분", "성분" 및 "성분들"은 폴리펩타이드 또는 전술한 바와 같은 다른 피분석물, 예컨대 항-피분석물(예: 항-폴리펩타이드) 항체에 대한 결합 등에 의해 고체 지지체 상에 선택적으로 고정화된 폴리펩타이드와 같은 피분석물을 함유하는 조성물을 포함할 수 있다. 일부 성분은 용액 중이거나 동결건조되어 분석을 위해 재구성할 수 있다.
"대조군"은 피분석물을 포함하지 않는("음성 대조군") 또는 피분석물을 포함하는("양성 대조군") 것으로 알려진 조성물을 의미한다. 양성 대조군은 피분석물의 공지된 농도를 포함할 수 있다. "대조군", "양성 대조군" 및 "캘리브레이터"는 본 명세서에서 호환 사용될 수 있는 것으로, 공지된 농도의 피분석물을 함유하는 조성물을 의미한다. "양성 대조군"은 분석 성능 특징을 수립하는데 사용될 수 있고, 시약(예: 피분석물)의 완전성에 대한 유용한 지표인자이다.
"소정의 컷오프" 및 "소정의 수준"은 일반적으로 분석 결과를 소정의 컷오프/수준과 비교하여 진단/예후/치료 효능 결과를 평가하는데 사용되는 분석 컷오프 값을 의미하는 것으로, 소정의 컷오프/수준은 이미 다양한 임상 파라미터(예: 질환 중증도, 진행/비진행/호전 등)와 관련 또는 연관이 있는 것이다. 본 명세서는 소정의 수준의 예를 제공할 수 있지만, 컷오프 값은 면역분석의 특성(예: 이용된 항체 등)에 따라 달라질 수 있음은 잘 알려져 있다. 또한, 당업자라면 본 발명의 개시내용을 다른 면역분석을 위해 개조하여 본 개시내용을 바탕으로 한 다른 면역분석의 면역분석-특이적 컷오프 값을 충분히 수득할 수 있다. 소정의 컷오프/수준의 정확한 값은 분석마다 달라질 수 있지만, 본 명세서에 기술된 상관관계(존재한다면)는 일반적으로 적용될 수 있어야 한다.
본 명세서에 기술된 진단 분석에 사용된 "전처리 시약", 예컨대 용해, 침전 및/또는 가용화 시약은 임의의 세포를 용해하고/하거나 검사 시료에 존재하는 임의의 피분석물을 가용화하는 것이다. 전처리는 이하에 상세히 설명되는 바와 같이 모든 시료에 필요한 것은 아니다. 다른 것 중에서, 피분석물(예: 당해 폴리펩타이드)의 가용화는 시료에 존재하는 임의의 내인성 결합 단백질로부터 피분석물의 방출을 수반할 수 있다. 전처리 시약은 균질성(분리 단계가 필요 없음) 또는 불균질성(분리 단계가 필요함)일 수 있다. 불균질성 전처리 시약의 사용 시, 분석의 다음 단계로 진행하기 전에 검사 시료로부터 임의의 침전된 피분석물 결합 단백질은 제거한다.
본 명세서에 기술된 면역분석 및 키트의 문맥에서 "품질 조절 시약"은 캘리브레이터, 대조군 및 감응도 패널을 포함하지만, 이에 국한되는 것은 아니다. "캘리브레이터" 또는 "표준물"이 일반적으로 사용되어(예컨대, 하나 이상, 예컨대 복수개) 항체와 같은 피분석물의 농도 내삽을 위한 캘리브레이션(표준) 곡선을 작도한다. 대안적으로, 소정의 양성/음성 컷오프에 가까운 단일 캘리브레이터가 사용될 수도 있다. 복수의 캘리브레이터(즉, 하나 이상의 캘리브레이터 또는 다양한 양의 캘리브레이터(들))는 "감응도 패널"을 구성하기 위해 동시에 사용할 수 있다.
"위험"은 현재 또는 미래 어느 시점에 발생할 특정 사건의 가능성 또는 확률을 의미한다. "위험 등급화"는 의사가 환자를 특정 질환, 장애 또는 상태가 발생할 위험이 낮은, 중간, 높은 또는 가장 높은 환자로 분류할 수 있게 하는 일련의 공지된 임상 위험률을 의미한다.
특정 결합 쌍의 구성원들(예: 항원(또는 이의 단편)과 항체(또는 이의 항원 반응성 단편)) 간에 상호작용의 상황에서 "특이적" 및 "특이성"은 상호작용의 선택적 반응성을 의미한다. "-에 특이적으로 결합한다"란 어구는 피분석물(또는 이의 단편)에 특이적으로 결합하고 다른 실체에는 특이적으로 결합하지 않는 항체(또는 이의 항원 반응성 단편)의 능력을 의미한다.
"특이적 결합 파트너"는 특이적 결합 쌍의 구성원이다. 특이적 결합 쌍은 화학적 또는 물리적 수단을 통해 서로 특이적으로 결합하는 2종의 다른 분자를 포함한다. 따라서, 일반 면역분석의 항원 및 항체 특이적 결합 쌍 외에, 다른 특이적 결합 쌍으로는 비오틴과 아비딘(또는 스트렙타비딘), 탄수화물과 렉틴, 상보성 뉴클레오타이드 서열, 이펙터 및 수용체 분자, 보조인자 및 효소, 효소 저해제와 효소 등을 포함할 수 있다. 또한, 특이적 결합 쌍은 원 특이적 결합 구성원의 유사체인 구성원을 포함할 수 있으며, 그 예로는 피분석물-유사체가 있다. 면역반응성 특이적 결합 구성원은 항원, 항원 단편 및 항체, 예컨대 모노클로날 및 폴리클로날 항체뿐만 아니라 복합체, 단편 및 이의 변형체(변형체의 단편도 포함)를 포함하며, 이는 분리물 또는 재조합 생산물이어도 상관없다.
본 명세서에 사용된 "변형체"는 주어진 폴리펩타이드(예: IL-18, BNP, NGAL 또는 HIV 폴리펩타이드 또는 항-폴리펩타이드 항체)에서 아미노산 서열이 아미노산의 첨가(예: 삽입), 결실 또는 보존적 치환에 의해 달라지지만, 주어진 폴리펩타이드의 생물학적 활성을 유지하는(예컨대, 변형 IL-18은 IL-18에 결합하기 위해 항-IL-18 항체와 경쟁할 수 있다) 폴리펩타이드를 의미한다. 아미노산의 보존적 치환, 즉 유사한 성질(예: 친수성 및 하전 영역의 분포 및 정도)의 다른 아미노산으로의 교체는 일반적으로 미세한 변화를 수반하는 것으로 당업계에서 인식되어 있다. 이러한 미세한 변화는 당업계에 알려진 아미노산의 친수도 지수(hydropathic index)를 고려하여 부분적으로 확인할 수 있다(Kyte et al., J. Mol. Biol. 157: 105-132 (1982)). 아미노산의 친수도 지수는 이의 소수성 및 하전의 고려를 기초로 한다. 친수도 지수가 유사한 아미노산은 치환될 수 있고 여전히 단백질 기능을 유지하는 것으로 당업계에 공지되어 있다. 한 관점에서, 친수도 지수가 ±2인 아미노산이 치환된다. 또한, 아미노산의 친수성을 이용하여 치환 후 생물학적 기능을 유지하는 단백질을 수득할 수도 있다. 펩타이드의 상황에서 아미노산 친수성의 고려는 그 펩타이드의 최대 국소 평균 친수성을 계산할 수 있게 해주는 것으로, 항원성 및 면역원성과 양호한 상관성이 있는 것으로 보고된 바 있는 유용한 척도이다(예컨대, 참고인용되는 미국 특허 4,554,101 참조). 친수성 값이 유사한 아미노산의 치환은 당업계에 알려진 바와 같이 면역원성과 같은 생물학적 활성을 유지하는 펩타이드를 산출할 수 있다. 한 관점에서, 친수성 값이 서로 ±2 이내인 아미노산으로 치환이 수행된다. 아미노산의 소수성 지수 및 친수성 값은 모두 아미노산의 특정 측쇄가 영향을 미친다. 이러한 관찰과 일치하게, 생물학적 기능과 융화성인 아미노산 치환은 아미노산의 상대적 유사성, 특히 아미노산 측쇄에 의존적인 것으로 이해되고 있으며, 이는 소수성, 친수성, 하전, 크기 및 다른 성질들에 의해 확인된다. 또한, "변형체"는 단백분해, 인산화 또는 다른 해독후 변형 등에 의해 다르게 가공되지만, 생물학적 활성 또는 항원 반응성, 예컨대 IL-18에 결합하는 능력은 유지하는 폴리펩타이드 또는 이의 단편을 나타내는 데에도 사용될 수 있다. 본 명세서에서 "변형체"의 사용은 문맥상 모순되지 않는 한, 변형체의 단편을 포함하고자 한다.
I.
DVD
결합 단백질의 제조
본 발명은 하나 이상의 표적과 결합할 수 있는 이원 가변 도메인(DVD) 결합 단백질 및 이의 제조 방법에 관한 것이다. 한 양태에서, 결합 단백질은 VD1-(X1)n-VD2-C-(X2)n[여기서, VD1은 제1 가변 도메인이고, VD2는 제2 가변 도메인이고, C는 불변 도메인이고, X1은 아미노산 또는 폴리펩타이드이고, X2는 Fc 영역이고 n은 0 또는 1이다]를 포함하는 폴리펩타이드 쇄를 포함한다. 본 발명의 결합 단백질은 다양한 기술을 사용하여 제조될 수 있다. 본 발명은 발현 벡터, 숙주 세포 및 결합 단백질을 제조하는 방법을 제공한다.
1.A: 모
모노클로날
항체의 제조
DVD 결합 단백질의 가변 도메인은 목적하는 항원에 결합할 수 있는 폴리클로날 및 mAb를 포함하는, 모 항체로부터 수득될 수 있다. 이들 항체는 천연에 존재할 수 있거나 재조합 기술에 의해 제조될 수 있다.
mAb는 하이브리도마, 재조합 및 파아지 디스플레이 기술 또는 이의 조합을 포함하는 당업계에 공지된 광범위한 기술을 사용하여 제조될 수 있다. 예를 들어, mAb는 당업계에 공지된 기술을 포함하여 예를 들어, 문헌[Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981) (본 문헌은 이의 전반전인 내용이 본원에 참고 인용된다)]에 교시된 하이브리도마 기술을 사용하여 제조될 수 있다. 본원에 사용된 바와 같은 용어 "모노클로날 항체"는 하이브리도마 기술을 통해 생산된 항체에 제한되지 않는다. 용어 "모노클로날 항체"는 임의의 진핵, 원핵 또는 파아지 클론을 포함하여 단일 클론으로부터 유래되지만 이를 생성시키는 방법에 의해 유래되지 않는 항체를 언급한다. 하이브리도마는 하기 실시예 1에서 논의되는 바와 같이 선별하고 클로닝하고 추가로 강한 하이브리도마 성장, 고 항체 생산 및 목적하는 항체 특성을 포함하여 목적하는 특성에 대해 스크리닝한다. 하이브리도마는 동일유전자계 동물, 면역계가 결핍된 동물, 예를 들어, 누드 마우스와 같은 생체내에서 또는 시험관내 세포 배양에서 배양하고 증식시킬 수 있다. 하이브리도마를 선별하고 클로닝하고 증식시키는 방법은 당업자에게 널리 공지되어 있다. 특정 양태에서, 하이브리도마는 마우스 하이브리도마이다. 다른 양태에서, 하이브리도마는 랫트, 양, 돼지, 염소, 소 또는 말과 같은 비-사람, 비-마우스 종에서 제조된다. 다른 양태에서, 하이브리도마는 사람 하이브리도마이고 이때 사람 비-분비 골수종이 특이 항원과 결합할 수 있는 항체를 발현하는 사람 세포와 융합된다.
재조합 모노클로날 항체는 문헌[미국특허 5,627,052, PCT 공보 WO 92/02551 및 Babcock, J.S. et al. (1996) Proc. Natl. Acad. Sci. USA 93:7843-7848]에 기재된 바와 같이 선택된 림프구 항체 방법(SLAM)과 같이 당업계에 언급된 과정을 사용하여 단일의 분리된 림프구로부터 생성된다. 본 방법에서, 목적하는 항체를 분비하는 단일 세포, 예를 들어, 면역화된 동물로부터 유래된 림프구는 동정되고, 중쇄 및 경쇄 가변 영역 cDNA를 역전사효소 PCR에 의해 세포로부터 수득하고 이어서 이들 가변 영역을 적절한 면역글로불린 불변 영역(예를 들어, 사람 불변 영역)과 관련하여 COS 또는 CHO 세포와 같은 포유동물 숙주 세포에서 발현시킬 수 있다. 생체내 선별된 림프구로부터 유래된 증폭된 면역글로불린 서열로 형질감염된 숙주 세포를 이어서 추가 분석하고 예를 들어, 형질감염된 세포를 선별하여 목적하는 항원에 대한 항체를 발현하는 세포를 분리함에 의해 선별할 수 있다. 증폭된 면역글로불린 서열은 추가로 예를 들어, 문헌[PCT 공개번호 WO 97/29131 및 PCT 공개번호 WO 00/56772]에 기재된 바와 같은 시험관내 친화성 성숙화 방법에 의해 추가로 조작할 수 있다.
모노클로날 항체는 또한 사람 면역글로불린 좌의 일부 또는 전부를 포함하는 비-사람 동물을 목적하는 항원으로 면역화시켜 제조된다. 한 양태에서, 비-사람 동물은 사람 면역글로불린 좌의 대형 단편을 포함하고 마우스 항체 생산이 결핍된 유전자 조작된 마우스 계통인 XENOMOUSE 유전자전이 마우스이다. 문헌[Green et al. Nature Genetics 7: 13-21 (1994) 및 미국 특허 5,916,771, 5,939,598, 5,985,615, 5,998,209, 6,075,181, 6,091,001, 6,114,598 및 6,130,364]을 참조한다. 1991년 7월 25일에 공개된 WO 91/10741, 1994년 2월 3일에 공개된 WO94/02602, 1996년 10월 31일에 공개된 WO 96/34096 및 WO 96/33735, 1998년 4월 23일에 공개된 WO98/16654, 1998년 6월 11일에 공개된 WO 98/24893, 1998년 11월 12일에 공개된 WO 98/50433, 1999년 9월 10일에 공기된 WO 99/45031, 1999년 10월 21일에 공개된 WO 99/53049, 2000년 2월 24일에 공개된 WO 00 09560 및 2000년 6월 29일에 공개된 WO 00/037504도 참조한다. XENOMOUSE 유전자전이 마우스는 완전하게 사람 항체의 성인계 사람 목록을 생산하고, 항원 특이적인 사람 모노클로날 항체를 생성한다. XENOMOUSE 유전자전이 마우스는 사람 중쇄 좌 및 x 경쇄 좌의 메가염기 크기의 생식계열 형태 YAC 단편의 도입을 통해 사람 항체 목록의 약 80%를 포함한다[본원에 참고인용된 Mendez et al., Nature Genetics 15: 146-156 (1997), Green and Jakobovits J. Exp. Med. 188: 483-495(1998) 참조].
또한, 본 발명의 항체 제조에는 시험관내 방법도 사용할 수 있는데, 여기서 항체 라이브러리를 스크리닝하여 목적하는 결합 특이성을 갖는 항체를 동정한다. 재조합 항체 라이브러리를 선별하는 방법은 당업계에 공지되어 있고, 예컨대 문헌[Ladner et al. 미국 특허 5,223,409; Kang et al. PCT 공보 WO 92/18619; Dower et al. PCT 공보 WO 91/17271; Winter et al. PCT 공보 WO 92/20791; Markland et al. PCT 공보 WO 92/15679; Breitling et al. PCT 공보 WO 93/01288; McCafferty et al. PCT 공보 WO 92/01047; Garrard et al. PCT 공보 WO 92/09690; Fuchs et al. (1991) Bio/Technology 9: 1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3: 81-85 ; Huse et al. (1989) Science 246: 1275-1281; McCafferty et al., Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J. 12: 725-734; Hawkins et al. (1992) J. Mol. Biol. 226: 889-896; Clackson et al. (1991) Nature 352: 624-628; Gram et al. (1992) PNAS 89: 3576-3580; Garrad et al.(1991) Bio/Technology 9: 1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19: 4133-4137; 및 Barbas et al. (1991) PNAS 88: 7978-7982, 미국 특허출원 공보 20030186374, 및 PCT 공보 WO 97/29131]등에 설명된 방법을 포함한다.
본 발명의 모 항체는 또한 당업계에 공지된 다양한 파아지 디스플레이 방법을 사용하여 제조될 수 있다. 파아지 디스플레이 방법에서, 기능성 항체 도메인은 파아지 입자를 암호화하는 폴리뉴클레오타이드 서열을 갖는 파아지 입자 표면상에 나타난다. 특히, 당해 파아지는 레퍼토리 또는 조합 항체 라이브러리(예를 들어, 사람 또는 쥐)로부터 발현된 항원-결합 도메인을 나타내는데 사용될 수 있다. 목적하는 항원과 결합하는 항원 결합 도메인 발현 파아지는 예를 들어, 표지된 항원 또는 고형 표면 또는 비드에 결합되거나 포획된 항원을 사용하여 선별되거나 동정될 수 있다. 이들 방법에 사용되는 파아지는 전형적으로 파아지 유전자 III 또는 유전자 VIII 단백질에 재조합적으로 융합된 Fab, Fv 또는 이황화 안정화된 Fv 항체 도메인을 갖는 파아지로부터 발현된 fd 및 M13 결합 도메인을 포함하는 필라멘트형 파아지이다. 본 발명의 항체를 제조하는데 사용될 수 있는 파아지 디스플레이 방법의 예는 문헌[Brinkman et al., J. Immunol. Methods 182:41-50 (1995); Ames et al., J. Immunol. Methods 184:177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persicet al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57:191-280 (1994); PCT 출원번호 PCT/GB91/01134; PCT 공개번호 WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; 및 미국 특허 5,698,426; 5,223,409; 5,403,484; 5,580,717; 5,427,908; 5,750,753; 5,821,047; 5,571,698; 5,427,908; 5,516,637; 5,780,225; 5,658,727; 5,733,743 및 5,969,108에 기재된 것들을 포함한다.
파아지 선별 후, 파아지로부터 항체 암호화 영역을, 하기에 상세히 기재되는 바와 같이 분리할 수 있고 이를 사용하여 포유동물 세포, 곤충 세포, 식물 세포, 효모 및 세균을 포함하는 임의의 목적하는 숙주에서 발현되는 사람 항체 또는 임의의 다른 목적하는 항원 결합 단편을 포함하는 전체 항체를 생산할 수 있다. 예를 들어, Fab, Fab' 및 F(ab')2 단편을 재조합으로 생산하기 위한 기술은 또한 문헌[PCT 공개번호 WO 92/22324; Mullinax et al., BioTechniques 12(6):864-869 (1992); 및 Sawai et al., AJRI 34:26-34 (1995); 및 Better et al., Science 240:1041-1043 (1988)]에 기재된 것들과 같은 방법을 당업계에 공지된 방법을 사용하여 사용될 수 있다. 단일 쇄 Fv 및 항체를 생산하기 위해 사용될 수 있는 기술의 예는 문헌[미국 특허 4,946,778 및 5,258, 498; Huston et al., Methods in Enzymology 203:46-88 (1991); Shu et al., PNAS 90:7995-7999 (1993); 및 Skerra et al., Science 240:1038-1040 (1988)]에 기재된 것들을 포함한다.
파아지 디스플레이에 의한 재조합 항체 라이브러리의 스크리닝에 대한 대안으로, 대형 조합 라이브러리에 대해 당업계에 공지된 기타 방법을 적용하여 본 발명의 이원 특이성 항체를 동정할 수 있다. 한가지 유형의 또 다른 발현 시스템은 문헌[PCT 공보 WO 98/31700 (Szostak and Roberts), 및 Roberts, R.W. and Szostak, J.W. (1997) Proc. Natl. Acad. Sci. USA 94:12297-12302]에 기재된 바와 같이 재조합 항체 라이브러리가 RNA 단백질 융합으로서 발현되는 것이다. 당해 시스템에서, 공유 융합은 mRNA 및 3' 말단에 푸로마이신, 펩티딜 수용체 항생제를 함유하는 합성 mRNA의 시험관내 해독에 의해, 암호화된 펩타이드 또는 단백질 사이에서 형성된다. 따라서, 특이적 mRNA는 암호화된 펩타이드 또는 단백질, 예를 들어, 항체 또는 이의 일부(예를 들어, 항체 결합부 또는 이의 일부)의 이원 특이성 항원에 대한 성질을 기준으로 mRNA의 배합 혼합물(예를 들어, 조합 라이브러리)로부터 집적될 수 있다. 당해 라이브러리의 스크리닝으로부터 회수된 항체 또는 이의 일부를 암호화하는 핵산 서열은 상기된 바와 같이(예를 들어, 포유동물 숙주 세포에서) 재조합 수단에 의해 발현될 수 있고 특히, 본래에 선별된 서열에 돌연변이가 도입된 mRNA-펩타이드 융합을 추가로 스크리닝함에 의해 또는 상기된 바와 같은 재조합 항체의 친화성 성숙화를 위한 기타 방법에 의해 친화성이 추가로 성숙화될 수 있다.
또 다른 방법에서, 본 발명의 항체는 또한 당업계에 공지된 효모 디스플레이 방법을 사용하여 제조될 수 있다. 효모 디스플레이 방법에서, 유전학적 방법을 사용하여 항체 도메인을 효소 세포벽에 부착시키고 이들을 효모의 표면상에 나타나게 할 수 있다. 특히, 당해 효모를 사용하여 레퍼토리 또는 조합 항체 라이브러리(예를 들어, 사람 또는 쥐)로부터 발현되는 항원 결합 도메인이 나타나게 할 수 있다. 본 발명의 항체를 제조하는데 사용될 수 있는 효모 디스플레이 방법의 예는 문헌[본원에 참조로서 인용된 Wittrup, et al. 미국 특허번호 6,699,658]에 기재된 것들을 포함한다.
상기된 항체는 추가로 변형시켜 CDR 이식된 및 사람화된 모 항체를 생성시킬 수 있다. CDR-이식된 모 항체는 사람 항체 기원의 중쇄 및 경쇄 가변 영역 서열을 포함하고 이때, VH 및/또는 VL의 하나 이상의 CDR 영역은 목적하는 항원과 결합할 수 있는 쥐 항체의 CDR 서열로 대체된다. 임의의 사람 항체 기원의 골격 서열은 CDR 이식을 위한 주형으로서 작용할 수 있다. 그러나, 당해 골격상으로의 직쇄 대체는 흔히 항원에 대한 결합 친화성을 약간 손상시킨다. 사람 항체가 본래의 쥐 항체와 보다 동일할수록 쥐 CDR과 사람 골격의 조합이 CDR내에서 뒤틀림을 유발하여 친화성을 감소시킬 가능성이 보다 적어진다. 따라서, 한 양태에서, CDR을 제외한 쥐 가변 골격을 대체하도록 선택된 사람 가변 골격은 쥐 항체 가변 영역 골격과 65% 이상의 서열 동일성을 갖는다. 한 양태에서, CDR을 제외한 사람 및 쥐 가변 영역은 70% 이상의 서열 동일성을 갖는다. 특정 양태에서, CDR을 제외한 사람 및 쥐 가변 영역은 쥐 항체 가변 영역 골격과 75% 이상의 서열 동일성을 갖는다. 다른 양태에서, CDR을 제외한 사람 및 쥐 가변 영역은 쥐 항체 가변 영역 골격과 80% 이상의 서열 동일성을 갖는다. 당해 항체를 제조하는 방법은 당업계에 공지되어 있고(문헌참조: EP 239,400; PCT 공개번호 WO 91/09967; 미국 특허 5,225,539; 5,530,101; 및 5,585,089), 베니어링(veneering) 또는 재표면화(문헌 참조: EP 592,106; EP 519,596; Padlan, Molecular Immunology 28(4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska et al., PNAS 91:969-973 (1994)), 및 쇄 셔플링(미국 특허 제5,565,352호), 및 항-이디오타입 항체가 있다.
사람화된 항체는 비-사람 종 기원의 하나 이상의 상보성 결정 영역(CDR) 및 사람 면역글로불린 분자 기원의 골격 영역을 갖는, 목적하는 항원에 결합하는 비-사람 종 항체 기원의 항체 분자이다. 공지된 사람 Ig 서열은 예를 들어, 본원에 전반적인 내용이 참조로서 인용되는 하기 인터넷 주소 및 문헌에 기재되어 있다: www.ncbi.nlm.nih.gov/entrez-/query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/.about.pedro/research_tools.html; www.mgen.uni-heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH- 05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/.about.mrc7/m- ikeimages.html; www.antibodyresource.com/; mcb.harvard.edu/BioLinks/Immuno- logy.html.www.immunologylink.com/; pathbox.wustl.edu/.about.hcenter/index.- html; www.biotech.ufl.edu/.about.hcl/; www.pebio.com/pa/340913/340913.html-; www.nal.usda.gov/awic/pubs/antibody/; www.m.ehimeu.acjp/.about.yasuhito- /Elisa.html; www.biodesign.com/table.asp; www.icnet.uk/axp/facs/davies/links.html; www.biotech.ufl.edu/.about.fccl/protocol.html; www.isac-net.org/sites_geo.html; aximtl.imt.uni-marburg.de/.about.rek/AEP- Start.html; baserv.uci.kun.nl/.about.jraats/linksl.html; www.recab.uni-hd.de/immuno.bme.nwu.edu/; www.mrc-cpe.cam.ac.uk/imt-doc/pu- blic/INTRO.html; www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr:8104/; www.biochem.ucl.ac.uk/.about.martin/abs/index.html; antibody.bath.ac.uk/; abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/.about.honegger/AHOsem- inar/Slide01.html; www.cryst.bbk.ac.uk/.about.ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.ac.uk/.about.mrc7/h- umanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.cryst.bioc.cam.ac.uk/.abo- ut.fmolina/Webpages/Pept/spottech.html; www.jerini.de/fr roducts.htm; www.patents.ibm.com/ibm.html.Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983). 당해 입수된 서열을 사용하여 당업계에 공지된 바와 같이 면역원성을 감소시키거나 결합, 친화성, 온(on) 속도, 오프(off) 속도, 결합도(avidity), 특이성, 반감기 또는 임의의 기타 적합한 특징을 감소시키거나 증진시키거나 변형시킬 수 있다.
사람 골격 영역내 골격 잔기는 상응하는 CDR 공여자 항체로 대체하여 항원 결합을 변화, 바람직하게는 개선시킬 수 있다. 이들 골격 대체는 예를 들어, CDR 및 골격 잔기의 상호작용에 대해 모델링하여 항원 결합과 서열 비교에 중요한 골격 잔기를 동정하여 특정 위치에서의 특정 골격 잔기를 동정함에 의해 당업계에 널리 공지된 방법에 의해 동정된다(Queen et al., 미국 특허번호 5,585,089; Riechmann et al., Nature 332:323 (1988)). 3차원 면역글로불린 모델은 통상적으로 유용하고 당업자에게 익숙하다. 선택된 후보 면역글로불린 서열의 가능한 3차원 형태 구조를 설명하고 나타내는 컴퓨터 프로그램은 유용하다. 이들 디스플레이의 조사는 후보 면역글로불린 서열의 기능에 있어서 가능한 잔기의 역할에 대한 분석, 즉, 항원에 결합하는 후보 면역글로불린의 능력에 영향을 주는 잔기의 분석을 가능하게 한다. 이러한 방식으로, FR 잔기가 선별될 수 있고 컨센서스 및 입수 서열로부터 조합될 수 있어 표적 항원에 대한 증가된 친화성과 같은 목적하는 항체 특성이 달성된다. 일반적으로, CDR 잔기는 직접적으로 및 가장 실질적으로 항원 결합에 영향을 주는데 관여한다. 항체는 문헌[Jones et al., Nature 321:522 (1986); Verhoeyen et al., Science 239:1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993), Padlan, Molecular Immunology 28(4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska. et al., PNAS 91:969-973 (1994); PCT 공보 WO 91/09967, PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, EP 592,106; EP 519,596, EP 239,400, 미국 특허 5,565,332, 5,723,323, 5,976,862, 5,824,514, 5,817,483, 5814476, 5763192, 5723323, 5,766886, 5,714,352, 6,204,023, 6,180,370, 5,693,762, 5,530,101, 5,585,089, 5,225,539; 4,816,567]에 기재된 것들을 제한 없이 포함하는 당업계에 공지된 다양한 기술을 사용하여 사람화될 수 있다.
다른 시도로, 모 항체는 임의의 항체들의 밝혀진 단백질 서열을 기초로 하여 표준 분자생물학 기술로 생산할 수도 있다. 임의의 항체들의 단백질 서열은 에드만(Edman) 분해, 질량 스펙트럼 및 BLAST 분석을 조합하여 밝혀낼 수 있다(Edman P. Acta Chem. Scand. 4: 283(1950), Nial1 HD Methods Emzymol. 27: 942-1010(1973), Vicki H.W. et al. Methods 35: 211-222(2005) 및 NCBI Blast 프로그램: http://www.ncbi.nlm.nih.gov/blast/about/).
1.B: 모
모노클로날
항체의 선택 기준
본 발명의 한 양태는 DVD-Ig 분자에 필요한 하나 이상의 성질을 보유한 모 항체를 선택하는 것에 관한 것이다. 한 양태에서, 목적 성질은 하나 이상의 항체 파라미터로부터 선택된다. 다른 양태에서, 항체 파라미터는 항원 특이성, 항원에 대한 친화성, 효능, 생물학적 기능, 에피토프 인식, 안정성, 생산 효율, 면역원성, 약동학, 생체이용률, 조직 교차반응성 및 이종상동성(orthologous) 항원 결합으로 이루어진 그룹 중에서 선택된다.
1.B.1: 항원에 대한 친화성
치료용 mAb의 필요한 친화성은 항원의 특성 및 필요한 치료 종점에 따라 달라질 수 있다. 한 양태에서, 모노클로날 항체는 보통 친화성 상호작용이 높은(예컨대, <pM 내지 <nM 범위) 사이토킨-사이토킨 수용체 상호작용을 차단할 때, 친화성이 더 높아진다(Kd = 0.01 내지 0.50 pM). 이러한 경우에, 표적에 대한 mAb 친화성은 사이토킨(리간드)의 이의 수용체에 대한 친화성보다 우수하거나 동일해야 한다. 한편, 친화성이 보다 낮은 mAb(>nM 범위)는 혈행의 잠재적 병원성 단백질을 제거하는 등에 치료적으로 효과적일 수 있으며, 그 예로는 혈행의 A-β 아밀로이드 종에 결합하고, 격리시켜 제거하는 모노클로날 항체가 있다. 다른 한편, 기존에 높은 친화성인 mAb의 친화성을 부위-지시된 돌연변이유발에 의해 감소시키거나, 또는 표적에 대한 친화성이 더 낮은 mAb를 사용하는 것은 잠재적인 부작용(예컨대, 높은 친화성의 mAb는 의도한 표적 전부를 격리/중화시킬 수 있어 표적화된 단백질의 기능(들)을 완전하게 고갈/없앨 수 있다)을 피하는데 사용할 수 있다. 이러한 시나리오에서, 낮은 친화성의 mAb는 질환 증상에 책임이 있을 수 있는 표적의 일부(병리학적 수준 또는 과잉생산된 수준)를 격리/중화시킬 수 있고, 이에 따라 표적의 일부는 정상적인 생리적 기능(들)을 계속해서 수행할 수 있다. 따라서, 용량을 조정하고/하거나 부작용을 줄이기 위해 Kd를 감소시키는 것이 가능할 수 있다. 모 mAb의 친화성은 원하는 치료 결과를 달성하기 위해 세포 표면 분자를 적당히 표적화하는데 역할을 할 수도 있다. 예를 들어, 표적이 암 세포에서는 높은 밀도로 발현되고 정상 세포에서는 낮은 밀도로 발현한다면, 친화성이 보다 낮은 mAb는 정상 세포보다 종양 세포에 존재하는 더 많은 수의 표적에 결합하여, ADCC 또는 CDC를 통해 종양 세포를 제거할 수 있으며, 이로써 치료적으로 바람직한 효과를 얻을 수 있다. 따라서, 바람직한 친화성의 mAb의 선택은 가용성 및 표면 표적 모두와 관련이 있을 수 있다.
리간드와 상호작용 후 수용체를 통한 시그널 전달은 수용체-리간드 상호작용의 친화성에 따라 달라질 수 있다. 이와 유사하게, mAb의 표면 수용체에 대한 친화성은 세포내 시그널 전달의 특성을 결정할 수 있고, mAb가 작용제 또는 길항제 시그널을 전달할 수 있는지 여부를 생각할 수 있다. mAb-매개 시그널 전달의 친화성 기반 특성은 그 부작용 프로필에 영향을 미칠 수 있다. 따라서, 치료용 모노클로날 항체의 바람직한 친화성 및 바람직한 기능은 시험관내 및 생체내 실험을 통해 조심스럽게 결정되어야 할 필요가 있다.
결합 단백질(예: 항체)의 바람직한 Kd는 원하는 치료 결과에 따라 실험적으로 결정될 수 있다. 한 양태에서, 특정 항원에 대한 친화성(Kd)이 동일 항원에 대한 DVD-Ig의 바람직한 친화성과 동일하거나, 이보다 우수한 모 항체를 선택한다. 항원 결합 친화성 및 속도론은 Biacore 또는 다른 유사 기술로 평가한다. 한 양태에서, 각 모 항체는 이의 항원에 대한 해리 상수(Kd)가 최대 약 10-7 M; 최대 약 10-8 M; 최대 약 10-9 M; 최대 약 10-10 M; 최대 약 10-11 M; 최대 약 10-12 M; 및 최대 약 10-13 M로 이루어진 그룹 중에서 선택되는 것이다. VD1이 수득되는 제1 모 항체 및 VD2가 수득되는 제2 모 항체는 각 항원에 대한 친화성(KD)이 유사하거나 상이할 수 있다. 각 모 항체는 표면 플라스몬 공명으로 측정했을 때, 항원에 대한 온 속도 상수(Kon)가 적어도 약 102 M-1s-1; 적어도 약 103 M-1s-1; 적어도 약 104 M-1s-1; 적어도 약 105 M-1s-1; 및 적어도 약 106 M-1s-1로 이루어진 그룹 중에서 선택되는 것이다. VD1이 수득되는 제1 모 항체 및 VD2가 수득되는 제2 모 항체는 각 항원에 대한 온 속도 상수(Kon)가 유사하거나 싱이할 수 있다. 한 양태에서, 각 모 항체는 표면 플라스몬 공명으로 측정했을 때 항원에 대한 오프 속도 상수(Koff)가 최대 약 10-3 s-1; 최대 약 10-4 s-1; 최대 약 10-5 s-1; 및 최대 약 10-6 s-1로 이루어진 그룹 중에서 선택되는 것이다. VD1이 수득되는 제1 모 항체 및 VD2가 수득되는 제2 모 항체는 각 항원에 대한 오프 속도 상수(Koff)가 유사하거나 상이할 수 있다.
1.B.2: 효능
모 모노클로날 항체의 바람직한 친화성/효능은 원하는 치료 결과에 따라 달라질 것이다. 예를 들어, 수용체-리간드(R-L) 상호작용에서, 친화성(kd)은 R-L kd(pM 범위)보다 우수하거나 동일하다. 병리학적 혈행 단백질의 간단한 제거 시, 예컨대 혈행 A-β 펩타이드의 다양한 종의 제거 시, kd는 낮은 nM 범위일 수 있다. 또한, kd는 표적이 동일한 에피토프의 다수의 카피를 발현하는지의 여부에 따라 달라질 것이며, 예컨대 Aβ 올리고머의 입체형태적 에피토프를 표적화하는 mAb가 있다.
VD1 및 VD2가 동일한 항원이지만, 상이한 에피토프에 결합하는 경우, DVD-Ig은 동일 항원에 대한 4개의 결합 부위를 함유하여 결합도 및 이에 따른 DVD-Ig의 겉보기 kd를 증가시킬 수 있다. 한 양태에서, 모 항체는 DVD-Ig에서 필요한 것보다 낮거나 동일한 kd를 보유한 모 항체가 선택된다. 모 mAb의 친화성 고려는 DVD-Ig이 4개 이상의 동일한 항원 결합 부위를 함유하는지(즉, 단일 mAb로부터의 DVD-Ig)의 여부에 의존할 수도 있다. 이러한 경우에, 겉보기 kd는 결합도로 인해 mAb보다 커질 수 있다. 이러한 DVD-Ig은 표면 수용체에 교차결합하고, 중화 효능을 증가시키며, 병리학적 단백질의 제거율을 증가시키는 등에 이용될 수 있다.
한 양태에서, 특정 항원에 대한 중화 효능이 동일 항원에 대한 DVD-Ig의 바람직한 중화 가능성보다 우수하거나 동일한 모 항체를 선택한다. 이 중화 효능은 적당한 종류의 세포가 표적 자극에 대한 반응에서 측정가능한 시그널(즉, 증식 또는 사이토킨 생산)을 생산하는 경우 표적-의존적 생물학적 정량으로 평가할 수 있고, mAb에 의한 표적 중화는 용량 의존적 방식으로 시그널을 감소시킬 수 있다.
1.B: 생물학적 기능
모노클로날 항체는 잠재적으로 여러가지 기능을 수행할 수 있다. 이러한 기능 중 일부는 표 1에 열거했다. 이 기능들은 시험관내 분석(예: 세포 기반 및 생화학적 분석) 및 생체내 동물 모델에서 평가될 수 있다.
| 표적(클래스) | 작용 기전(표적) |
| 가용성(사이토킨, 기타) | 활성의 중화(예: 사이토킨) 제거율 향상(예: Aβ 올리고머) 반감기 증가(예: GLP1) |
| 세포 표면 (수용체, 기타) |
작용제(예: GLP1 R; EPO R 등) 길항제(예: 인테그린 등) 세포독성(CD20 등) |
| 단백질 침전물 | 제거/분해 향상(예: Aβ 플라크, 아밀로이드 침전물) |
표 1에 열거된 본 명세서의 실시예에 기술된 기능이 상이한 mAb는 목적한 치료 결과를 달성하는 것으로 선택할 수 있다. 그 다음, 2가지 이상의 선택한 모 모노클로날 항체를 DVD-Ig 형식에 이용하여 단일 DVD-Ig 분자에 2가지 상이한 기능을 제공할 수 있다. 예를 들어, DVD-Ig은 특정 사이토킨의 기능을 중화시키는 모 mAb를 선택하고, 병리학적 단백질의 제거율을 향상시키는 모 mAb를 선택하여 수득할 수 있다. 이와 마찬가지로, 2가지 다른 세포 표면 수용체를 인식하는 2개의 모 모노클로날 항체, 즉 한 수용체에서 작용제 기능을 하는 mAb 및 다른 수용체에서 길항제 기능을 하는 mAb를 선택할 수 있다. 각각 상이한 기능을 보유하는 2개의 선택된 모노클로날 항체는 단일 분자에서 상기 선택된 모노클로날 항체의 2가지 다른 기능(작용제 및 길항제)을 보유하는 단일 DVD-Ig 분자를 작제하는데 이용될 수 있다. 이와 마찬가지로, 각 수용체 리간드(예: EGF 및 IGF)의 결합을 각각 차단하는 세포 표면 수용체에 대한 2개의 길항성 모노클로날 항체는 DVD-Ig 형식에 사용될 수 있다. 이에 반해, 길항성 항-수용체 mAb(예: 항-EGFR) 및 중화성 항-가용성 매개인자(예: 항-IGF1/2) mAb가 DVD-Ig을 제조하는데 선택될 수 있다.
1.B.4:
에피토프
인식:
단백질의 다른 영역은 다른 기능을 수행할 수 있다. 예를 들어, 사이토킨의 특정 영역은 사이토킨 수용체와 상호작용하여 수용체 활성화를 유발할 수 있고, 이에 반해 단백질의 다른 영역은 사이토킨의 안정화에 필요할 수 있다. 이러한 경우에, mAb는 사이토킨 상의 수용체 상호작용 영역(들)에 특이적으로 결합하여 사이토킨-수용체 상호작용을 차단하는 mAb를 선택할 수 있다. 다수의 리간드에 결합하는 특정 케모킨 수용체와 같은 몇몇 경우에는, 하나의 리간드와만 상호작용하는 에피토프(케모킨 수용체 상의 영역)에 결합하는 mAb를 선택할 수 있다. 다른 경우, 모노클로날 항체는 단백질의 생리학적 기능에 직접적인 책임은 없지만, 이들 영역에 대한 mAb의 결합이 생리학적 기능(입체 장애)을 방해할 수 있거나, 단백질이 기능할 수 없도록 단백질의 입체형태를 변경시키는 표적 상의 에피토프에 결합할 수 있다(어떠한 리간드도 결합할 수 없도록 수용체 형태를 변경시키는 다수 리간드를 보유한 수용체에 대한 mAb). 또한, 수용체에 대한 사이토킨의 결합을 차단하지 않고 시그널 전달을 차단하는 항-사이토킨 모노클로날 항체도 동정되었다(예: 125-2H, 항-IL-18 mAb).
에피토프 및 mAb 기능의 예에는 수용체-리간드(R-L) 상호작용의 차단(R-상호작용 부위에 결합하는 중화성 mAb); R-결합을 감소시키거나 없애는 입체 장애를 포함하지만, 이에 국한되는 것은 아니다. Ab는 수용체 결합 부위와 다른 부위에서 표적에 결합할 수 있지만, 여전히 입체형태 변화를 유도하여 수용체 결합 및 표적의 기능을 방해하고 기능을 없애고(예: Xolair), R에 결합하지만, 시그널 전달을 차단할 수 있다(125-2H).
한 양태에서, 모 mAb는 최대 효능을 위해 적당한 에피토프를 표적으로 삼아야 한다. 이러한 에피토프는 DVD-Ig에서 보존되어야 한다. mAb의 결합 에피토프는 여러 시도들, 예컨대 공동-결정학, mAb-항원 복합체의 제한적 단백분해 + 질량 분광측정 펩타이드 맵핑(Legros V. et al. 2000 Protein Sci. 9: 1002-10), 파지 디스플레이 펩타이드 라이브러리(O'Connor KH et al 2005 J Immunol Methods. 299: 21-35)뿐만 아니라 돌연변이유발(Wu C. et al. 2003 J Immunol 170: 5571-7)에 의해 결정될 수 있다.
1.B.5: 이화학적 성질 및 약제학적 성질
종종 항체를 이용한 치료적 처치는 고 용량, 종종 수 mg/kg의 투여를 필요로 한다(일반적으로 분자량이 커서, 그 결과 질량 대비 효능이 낮기 때문이다). 환자의 순응을 도모하고 만성 질환 치료법 및 외래 환자 치료에 적당하게 처리하기 위해서는 치료용 mAb의 피하(s.c.) 또는 근육내(i.m.) 투여가 바람직하다. 예를 들어, s.c. 투여에 바람직한 최대 용적은 약 1.0ml이고, 따라서 용량당 주사 횟수를 제한하기 위해 >100mg/ml의 농도가 필요하다. 한 양태에서, 치료용 항체는 단회 용량으로 투여한다. 하지만, 이러한 제형의 개발은 단백질-단백질 상호작용(예컨대, 면역원성 위험을 잠재적으로 증가시키는 응집) 및 프로세싱 및 전달 중의 제한(예: 점도)으로 인해 제약된다. 결과적으로, 임상 효능에 필요한 다량과 이와 관련된 개발 제약은 항체 제형의 가능성의 충분한 개척 및 고용량 용법으로의 s.c. 투여를 제한한다. 따라서, 단백질 분자 및 단백질 용액의 이화학적 성질 및 약제학적 성질, 예컨대 안정성, 가용성 및 점도 특징이 가장 중요하다는 것은 분명하다.
1.B.5.1: 안정성
"안정한" 항체 제형은 당해의 항체가 물리적 안정성 및/또는 화학적 안정성 및/또는 생물학적 활성을 보관 시에 본질적으로 유지하는 것이다. 안정성은 선택된 시간 기간 동안 선택된 온도에서 측정할 수 있다. 한 양태에서, 제형 중의 항체는 실온(약 30℃) 또는 40℃에서 적어도 1개월 동안 안정하고/하거나 약 2 내지 8℃에서 적어도 1년, 적어도 2년 동안 안정하다. 또한, 한 양태에서, 제형은 제형의 동결(예: -70℃) 및 해동(이하, "동결/해동 사이클"이라 불린다) 후에도 안정하다. 다른 예에서, "안정한" 제형은 이 제형에서 단백질의 약 10% 이하, 약 5% 이하가 응집물로 존재하는 것일 수 있다.
장기간 동안 다양한 온도에서 시험관내 안정한 DVD-Ig이 바람직하다. 이것은, 승온, 예컨대 40℃에서 2 내지 4주 동안 시험관내에서 안정한 모 mAb를 빠르게 선별하고, 그 후 안정성을 평가함으로써 수득할 수 있다. 2 내지 8℃에서 보관 동안, 단백질은 적어도 12개월, 예컨대 적어도 24개월 동안 안정성을 나타낸다. 안정성(단량체 무손상 분자의 %)은 양이온 교환 크로마토그래피, 크기 배제 크로마토그래피, SDS-PAGE 뿐만 아니라 생체활성 검사와 같은 다양한 기술로 평가할 수 있다. 공유 및 형태적 변경을 분석하는데 이용할 수 있는 분석 기술에 대한 더 포괄적인 목록은 다음 문헌을 참조하기 바란다: Jones, A. J. S. (1993) Analytical methods for the assessment of protein formulations and delivery systems. In: Cleland, J. L.; Langer, R., editors. Formulation and delivery of peptides and proteins, 1st edition, Washington, ACS, pg. 22-45; 및 Pearlman, R.; Nguyen, T. H.(1990) Analysis of protein drugs. In: Lee, V. H., editor. Peptide and protein drug delivery, 1st edition, New York, Marcel Dekker, Inc., pg. 247-301.
불균질성 및 응집물 형성: 항체의 안정성은 제형에 응집물로 존재하는 GMP 항체 물질이 약 10% 이하, 한 양태에 따르면 약 5% 이하, 다른 양태에 따르면, 약 2% 이하, 또는 한 양태에 따르면 0.5% 내지 1.5% 범위 또는 그 이하로 나타나는 정도일 수 있다. 크기 배제 크로마토그래피는 단백질 응집물 검출에 있어서 민감하고, 재현가능하고 매우 확고한 방법이다.
낮은 응집물 수준 외에, 항체는 한 양태에서 화학적으로 안정해야 한다. 화학적 안정성은 이온 교환 크로마토그래피(예: 양이온 또는 음이온 교환 크로마토그래피), 소수성 상호작용 크로마토그래피, 또는 다른 방법, 예컨대 등전 촛점 또는 모세관 전기영동에 의해 측정될 수 있다. 예를 들어, 항체의 화학적 안정성은 2 내지 8℃에서 적어도 12개월 보관한 후 양이온 교환 크로마토그래피에서 미변형 항체를 나타내는 피크가 보관 검사 전인 항체 용액과 비교하여 20% 이하, 한 양태에 따르면 10% 이하, 또는 다른 양태에서 5% 이하로 증가할 수 있는 정도일 수 있다.
한 양태에서, 모 항체는 구조적 무결함; 정확한 이황화 결합 형성, 및 정확한 폴딩을 나타낸다: 항체의 2차 또는 3차 구조의 변화로 인한 화학적 안정성은 항체 활성에 영향을 줄 수 있다. 예를 들어, 항체의 활성에 의해 나타나는 안정성은 2 내지 8℃에서 적어도 12개월 동안 보관한 후 항체 활성이 보관 검사 전인 항체 용액과 비교하여 50% 이하, 한 양태에 따르면 30% 이하, 또는 심지어 10% 이하, 또는 한 양태에 따르면 5% 이하 또는 1% 이하 감소한 활성인 정도일 수 있다. 적당한 항원-결합 분석은 항체 활성을 측정하는데 이용될 수 있다.
1.B.5.2: 가용성
mAb의 "가용성"은 정확하게 폴딩된 단량체 IgG의 생산과 상관성이 있다. 따라서, IgG의 가용성은 HPLC로 평가할 수 있다. 예를 들어, 가용성(단량체) IgG는 HPLC 크로마토그래피에서 단일 피크를 발생할 것인 반면, 불용성(예컨대, 다량체 및 응집물)은 다수의 피크를 발생할 것이다. 따라서, 당업자는 IgG의 가용성 증가 또는 감소를 통상의 HPLC 기술로 검출할 수 있다. 가용성 분석에 이용할 수 있는 분석 기술의 더 포괄적인 목록은 다음 문헌을 참조한다: Jones, A. G. Dep. Chem. Biochem. Eng., Univ. Coll. London, London, UK. Editor(s): Shamlou, P. Ayazi. Process. Solid-Liq. Suspensions (1993), 93-117. Publisher: Butterworth-Heinemann, Oxford, UK and Pearlman, Rodney; Nguyen, Tue H, Advances in Parenteral Sciences (1990), 4 (Pept. Protein Drug Delivery), 247-301. 치료용 mAb의 가용성은 적당한 용량투여에 종종 필요한 고 농도로의 제형화에 중요하다. 본 명세서에 개략된 바와 같이, >100mg/ml의 가용성은 효과적인 항체 용량투여를 도모하는데 필요할 수 있다. 예를 들어, 항체 가용성은 연구 단계 초기에는 약 5mg/ml 이상일 수 있고, 한 양태에서 첨단 공정 과학 단계에서 약 25mg/ml 이상, 또는 한 양태에서 약 100mg/ml 이상, 또는 한 양태에서 약 150mg/ml 이상일 수 있다. 당업자에게 자명하듯이, 단백질 분자의 고유 성질은 단백질 용액의 이화학적 성질, 예컨대 안정성, 가용성, 점도 등에 중요하다. 하지만, 당업자는 최종 단백질 제형의 특징에 유익한 영향을 미치는 첨가제로 사용할 수 있는 매우 다양한 부형제가 존재한다는 것을 알고 있다. 이러한 부형제로는, (i) 액체 용매, 공용매(예: 에탄올과 같은 알콜); (ii) 완충액(예: 인산염, 아세트산염, 시트르산염, 아미노산 완충액); (iii) 당 또는 당 알콜(예: 수크로오스, 트레할로스, 프럭토스, 라피노스, 만니톨, 소르비톨, 덱스트란); (iv) 계면활성제(예: 폴리소르베이트 20, 40, 60, 80 또는 폴록사머); (v) 등장성 조정제(예: 염, 예컨대 NaCl, 당, 당 알콜); 및 (vi) 기타(예: 보존제, 킬레이트화제, 항산화제, 킬레이트성 물질(예: EDTA), 생체분해성 중합체, 담체 분자(예: HSA, PEG)가 있다.
점도는 항체 제조 및 항체 가공(예: 정용여과/한외여과), 충전-마무리 공정(펌핑 측면, 여과 측면) 및 전달 측면(주사성, 정교한 장치 전달)과 관련하여 매우 중요한 파라미터이다. 낮은 점도는 항체의 액체 농도가 고농도일 수 있게 해준다. 이것은 동일 용량이 더 소량으로 투여될 수 있게 해준다. 소량의 주사 용량은 주사 감각에서 통증을 낮추는 장점을 부여하고 용액은 환자에게 주사 시에 통증을 줄이기 위해 등장성이어야 할 필요가 없다. 항체 용액의 점도는 100(l/s) 전단 속도에서 200mPa s이하, 한 양태에서 125mPa s 이하, 다른 양태에서 70 mPa s 이하, 또 다른 양태에서, 25 mPa s 이하 또는 10 mPa s 이하인 정도일 수 있다.
1.B.5.3: 생산 효율
포유동물 세포, 예컨대 중국 햄스터 난소 세포(CHO)에서 효과적으로 발현되는 DVD-Ig의 생성은 한 양태에 따르면 포유동물 세포에서 효과적으로 자체 발현되는 2개의 모 모노클로날 항체를 필요로 할 것이다. 안정한 포유동물 계열(즉, CHO)의 생산 수율은 약 0.5g/L 이상, 한 양태에 따르면 약 1g/L 이상, 다른 양태에 따르면 약 2 내지 5 g/L 범위 또는 그 이상이어야 한다(Kipriyanov SM, Little M. 1999 Mol Biotechnol. 12: 173-201; Carroll S, Al-Rubeai M, 2004 Expert Opin Biol Ther. 4:1821-9).
포유동물 세포에서 항체 및 Ig 융합 단백질의 생산은 여러 요인들에 의해 영향받는다. 강한 프로모터, 인핸서 및 선택 마커의 혼입을 통한 발현 벡터의 유전자 조작은 통합된 벡터 카피로부터 당해 유전자의 전사를 최대화할 수 있다. 높은 수준의 유전자 전사를 허용하는 벡터 통합 부위의 확인은 벡터로부터 단백질 발현을 증대시킬 수 있다(Wurm et al., 2004, Nature Biotechnology, 2004, Vol/Iss/Pg. 22/11(1393-1398)). 또한, 생산 수준은 항체 중쇄 및 경쇄의 비 및 단백질 어셈블리 및 분비 과정에서 다양한 단계들에 의해 영향을 받는다(Jiang et al. 2006, Biotechnology Progress, Jan-Feb 2006, Vol. 22, no. 1, p.313-8).
1.B.6: 면역원성
치료용 mAb의 투여는 특정 빈도의 면역 반응(즉, 치료용 mAb에 대해 지향성인 내인성 항체의 형성)을 초래할 수 있다. 면역원성을 유도할 수도 있는 잠재적 요소들은 모 모노클로날 항체의 선택 동안 분석되어야 하고, 이러한 위험을 감소시키는 단계가 DVD-Ig 작제 전에 모 모노클로날 항체의 최적화를 위해 수행되어야 한다. 마우스 유래 항체는 환자 중에서 매우 면역원성인 것으로 밝혀져 있다. 마우스 가변 영역과 사람 불변 영역으로 구성된 키메라 항체의 생산은 치료용 항체의 면역원성을 감소하기 위한 필연적인 후속 단계이다(Morrison and Schlom, 1990). 대안적으로, 면역원성은 쥐 CDR 서열을 사람 항체 프레임워크 내로 전이시켜(재형성/CDR 이식/사람화) 감소시킬 수 있다(Riechmann et al., 1988에서 치료 항체에 대해 기술된 바와 같다). 다른 방법은 "재표면화" 또는 "베니어링(veneering)"으로 불리는 것으로, 설치류 가변 경쇄 및 중쇄 도메인으로 시작해서, 표면-접근가능한 프레임워크 아미노산만을 사람 것으로 변경시키고, CDR 및 매립된 아미노산은 모 설치류 항체의 것을 유지하는 방법이다(Roguska et al., 1996). 다른 종류의 사람화에서는 전체 CDR을 이식하는 대신에, 한 기술에서는 항체의 표적에 대한 결합에 관여하는 CDR 잔기의 서브세트로 정의된 "특이성 결정 영역(SDR)"만을 이식한다(Kashmiri et al., 2005). 이것은 이용가능한 항체-표적 복합체의 3차원 구조의 분석을 통한 또는 표적과 상호작용하는지를 결정하는 항체 CDR 잔기의 돌연변이 분석을 통한 SDR의 동정을 필요로 한다. 대안적으로, 완전한 사람 항체는 쥐, 키메릭 또는 사람화된 항체에 비해 감소된 면역원성을 나타낼 수 있다.
치료용 항체의 면역원성을 감소시키는 다른 시도는 면역원성인 것으로 예상되는 임의의 특정 서열의 제거이다. 한 시도에서, 1차 생성 후 생물제제는 사람에서 검사되고 허용할 수 없을 정도로 면역원성인 것으로 밝혀지면, B-세포 에피토프를 맵핑한 후, 면역 검출을 피하도록 변경할 수 있다. 다른 시도는 잠재적 T-세포 에피토프를 예측하여 제거하는 방법을 이용한다. 전산 방법은 MHC 단백질에 결합할 가능성이 있는 생물학적 치료제의 펩타이드 서열을 스캔하고 동정하기 위해 개발되었다(Desmet et al., 2005). 대안적으로, 사람 수지상 세포를 기반으로 한 방법은 잠재적 단백질 알레르기항원에 존재하는 CD4+ T-세포 에피토프를 동정하는데 사용될 수 있다(Stickler et al., 2005; S.L. Morrison and J. Schlom, Important Adv . Oncol. (1990), pp. 3-18; Riechmann, L., Clark, M., Waldmann, H. and Winter, G. "Reshaping human antibodies for therapy ." Nature (1988) 332: 323-327; Roguska-M-A, Pedersen-J-T, Henry-A-H, Searle-S-M, Roja-C-M, Avery-B, Hoffee-M, Cook-S, Lambert-J-M, Blatler -W-A, Rees -A-R, Guild -B-C. A comparison of two murine mAbs humanized by CDR-grafting and variable domain resurfacing.Protein engineering, {Protein-Eng}, 1996, vol. 9, p. 895-904; Kashmiri-Syed-V-S, De-Pascalis-Roberto, Gonzales-Noreen-R, Schlom-Jeffrey. SDR grafting--a new approach to antibody humanization. Methods (San Diego Calif.), {Methods}, May 2005, vol. 36, no. 1, p. 25-34; Desmet-Johan, Meersseman-Geert, Boutonnet-Nathalie, Pletinckx-Jurgen, De-Clercq-Krista, Debulpaep-Maja, Braeckman-Tessa, Lasters-Ignace. Anchor profiles of HLA-specific peptides: analysis by a novel affinity scoring method and experimental validation. Proteins, 2005, vol. 58, p. 53-69; Stickler-M-M, Estell -D-A, Harding -F-A. CD4+ T-cell epitope determination using unexposed human donor peripheral blood mononuclear cells. Journal of immunotherapy 2000, vol. 23, p. 654-60).
1.B.7:
생체내
효능
원하는 생체내 효능을 보유하는 DVD-Ig 분자를 제조하기 위해, 함께 제공했을 때 원하는 생체내 효능이 유사한 mAb를 제조하고 선택하는 것이 중요하다. 하지만, 몇몇 경우에, DVD-Ig은 2종의 다른 mAb의 병용에 의해 달성될 수 없는 생체내 효능을 나타낼 수 있다. 예를 들어, DVD-Ig은 두 표적을 밀접하게 하여 2가지 다른 mAb이 병용 시에 달성될 수 없는 활성을 초래할 수 있다. 또 다른 바람직한 생물학적 기능에 대해서는 섹션 B 3에 기술되어 있다. DVD-Ig 분자에서 필요한 특징을 보유하는 모 항체는 약동학 t ½; 조직 분포; 가용성 대 세포 표면 표적; 및 표적 농도-가용성/밀도-표면과 같은 인자를 기초로 하여 선택할 수 있다.
1.B.8:
생체내
조직 분포
원하는 생체내 조직 분포를 보유한 DVD-Ig 분자를 제조하기 위해, 한 양태로 원하는 생체내 조직 분포 프로필이 유사한 모 mAb를 선택해야 한다. 대안적으로, 이원-특이적 표적화 전략의 기전을 기초로 할 때, 다른 때에는 병용 사용 시 원하는 생체내 조직 분포가 유사한 모 mAb를 선택할 필요가 없을 수도 있다. 예를 들어, 하나의 결합 성분이 DVD-Ig을 특정 부위로 표적화하여 두번째 결합 성분을 동일 표적 부위로 가져오는 DVD-Ig인 경우이다. 예를 들어, DVD-Ig의 하나의 결합 특이성은 췌장(섬세포)를 표적으로 할 수 있고, 다른 특이성은 GLP1을 췌장으로 가져와 인슐린을 유도할 수 있다.
1.B.9:
이소타입
:
이소타입, 이펙터 기능 및 혈행 반감기를 비롯한, 이에 국한되지 않는 원하는 성질을 나타내는 DVD-Ig 분자를 제조하기 위해, 한 양태로 치료 유용성 및 원하는 치료 종점에 따라 적당한 Fc-이펙터 기능을 보유하는 모 mAb를 선택한다. 5종의 주요 중쇄 클래스 또는 이소타입이 있으며, 이 중 일부는 몇몇 서브타입을 나타내고, 이들은 항체 분자의 이펙터 기능을 결정한다. 이 이펙터 기능들은 힌지 영역, 항체 분자의 CH2 및 CH3 도메인에 존재한다. 하지만, 항체 분자의 다른 부분에 있는 잔기들도 마찬가지로 이펙터 기능에 영향을 미칠 수 있다. 힌지 영역 Fc-이펙터 기능으로는 (i) 항체-의존적 세포의 세포독성, (ii) 보체(C1q) 결합, 활성화 및 보체-의존적 세포독성(CDC), (iii) 항원-항체 복합체의 식세포작용/제거율, 및 (iv) 몇몇 경우에 사이토킨 방출을 포함한다. 이러한 항체 분자의 Fc-이펙터 기능은 클래스-특이적 세포 표면 수용체와 Fc-영역의 상호작용을 통해 매개된다. IgG1 이소타입의 항체는 가장 활성적이지만, IgG2 및 IgG4는 이펙터 기능을 거의 또는 전혀 나타내지 않는다. IgG 항체의 이펙터 기능은 3가지 구조적 상동성 세포의 Fc 수용체 타입(및 서브타입)(FcgR1, FcgRII 및 FcgRIII)과 상호작용을 통해 매개된다. 이러한 IgG1의 이펙터 기능은 FcgR 및 C1q 결합에 필요한 하위 힌지 영역(예: L234A, L235A)에 있는 특정 아미노산 잔기를 돌연변이시켜 제거할 수 있다. Fc 영역, 특히 CH2-CH3 도메인의 아미노산 잔기는 또한 항체 분자의 혈형 반감기를 결정한다. 이 Fc 기능은 항체 분자를 산성 리소좀으로부터 일반 혈행으로 다시 재순환시키는데 책임이 있는 신생 Fc 수용체(FcRn)에 대한 Fc-영역의 결합을 통해 매개된다. 다른 양태에서, Fc 단편의 활성은 Fc 부의 N-결합 글리칸의 시알릴화(예컨대, 면역글로불린 G(IgG)의 Asn297에서 발견되는 복합체 양안테나성(biantenary) 글리칸 상의 끝에서 두 번째 갈락토스와의 2,6-결합)에 의해 크게 상승할 수 있다.
mAb가 활성 또는 비활성 이소타입을 보유해야 하는지의 여부는 항체의 원하는 치료 종점에 따라 달라질 것이다. 이소타입의 사용 및 원하는 치료 결과의 일부 예는 이하에 열거한다:
a) 원하는 종점이 가용성 사이토킨의 기능적 중화라면, 비활성 이소타입이 사용될 수 있다;
b) 원하는 결과가 병리학적 단백질의 제거라면 활성 이소타입이 사용될 수 있다;
c) 원하는 결과가 단백질 응집물의 제거라면, 활성 이소타입이 사용될 수 있다;
d) 원하는 결과가 표면 수용체에 길항작용하는 것이라면 비활성 이소타입이 사용된다(Tysabri, IgG4; OKT3, 돌연변이된 IgG1);
e) 원하는 결과가 표적 세포를 제거하는 것이라면, 활성 이소타입이 사용된다(Herceptin, IgG1 및 증강된 이펙터 기능을 보유하는 것);
f) 원하는 결과가 CNS에 들어가지 않고 혈행으로부터 단백질을 제거하는 것이라면 IgM 이소타입이 사용될 수 있다(예: 혈행 Ab 펩타이드 종의 제거).
모 mAb의 Fc 이펙터 기능은 당업계에 공지된 다양한 시험관내 방법으로 결정할 수 있다.
논의한 바와 같이, 이소타입의 선택과 이에 따른 이펙터 기능은 원하는 치료 종점에 따라 달라질 것이다. 혈행 표적의 단순한 중화, 예컨대 수용체-리간드 상호작용의 차단이 필요한 경우에는, 이펙터 기능이 필요하지 않을 수 있다. 이러한 경우, 이펙터 기능을 제거하는 항체의 Fc-영역의 돌연변이 또는 이소타입이 바람직하다. 표적 세포의 제거, 예컨대 종양 세포의 제거가 치료 종점인 경우에는 이펙터 기능을 증강시키는 Fc 영역의 탈푸코실화 또는 돌연변이 또는 이소타입이 바람직하다(Presta GL, Adv. Drug Delivery Rev. 58:640-656, 2006; Satoh M., Iida S., Shitara K. Expert Opinion Biol. Ther. 6:1161-1173, 2006). 이와 유사하게, 치료 용도에 따라 항체 분자의 혈행 반감기는 Fc 영역에 특정 돌연변이를 도입시켜 항체-FcRn 상호작용을 조절하여 감소/연장시킬 수 있다(Dall'Acqua WF, Kiener PA, Wu H. J. Biol. Chem. 281:23514-23524, 2006; Petkova SB., Akilesh S., Sproule TJ. et al. Internat. Immunol. 18:1759-1769, 2006; Vaccaro C., Bawdon R., Wanjie S et al. PNAS 103:18709-18714, 2007).
정상 치료용 mAb의 다른 이펙터 기능에 영향을 미치는 다양한 잔기들에 대한 공개된 정보는 DVD-Ig에 대해 확인되어야 할 필요가 있다. DVD-Ig 방식에서, 모노클로날 항체 이펙터 기능의 조절에 대해 동정된 것 외에, 추가(다른) Fc-영역 잔기가 중요할 수도 있다.
종합해보면, Fc-이펙터 기능(이소타입)이 최종 DVD-Ig 형식에 중요할 것인지에 관한 결정은 질환 징후, 치료 표적, 원하는 치료 종점 및 안전성 고찰에 따라 달라질 것이다. 이하에는 적당한 중쇄 및 경쇄 불변 영역의 예를 예시했지만, 이에 국한되는 것은 아니다.
o IgG1 - 동종이형(allotype): G1mz
o IgG1 돌연변이체 - A234, A235
o IgG2 - 동종이형: G2m(n-)
o 카파 - Km3
o 람다
Fc 수용체 및 C1q 연구: 세포 막에 존재하는 임의의 과발현된 표적에 대한 항체 복합체화에 의한 불필요한 항체 의존적 세포 매개 세포독성(ADCC) 및 보체-의존적 세포독성(CDC)의 가능성은 힌지 영역(예를 들어, L234A, L235A) 돌연변이에 의해 폐기될 수 있다. 이러한 치환된 아미노산은 mAb의 IgG1 힌지 영역에 존재하여 사람 Fc 수용체(FcRn은 아님)에 대한 mAb의 결합을 감소시킬 것으로 예상되는데, 그 이유는 FcgR 결합이 IgG1 힌지 영역 상의 오버랩핑 부위 내에서 일어나는 것으로 생각되기 때문이다. mAb의 이러한 특징인 야생형 IgG을 함유하는 항체보다 개선된 안전성 프로필을 산출할 수 있다. 사람 Fc 수용체에 대한 mAb의 결합은 세포주(예: THP-1, K562) 및 FcgRIIb(또는 다른 FcgR)를 발현하는 유전자조작된 CHO 세포주를 이용한 유세포분석 실험에 의해 측정될 수 있다. IgG1 대조용 모노클로날 항체와 비교했을 때, mAb는 FcgRI 및 FcgRIIa에 대한 감소된 결합을 나타내는 반면, FcgRIIb에 대한 결합은 영향을 받지 않는다. 항원/IgG 면역 복합체에 의한 C1q의 결합 및 활성화는 고전적 보체 캐스캐이드를 촉발하고 결과적으로 염증 반응 및/또는 면역조절 반응을 초래한다. IgG에 대한 C1q 결합 부위는 IgG 힌지 영역 내의 잔기들에 국재화되어 있다. mAb의 농도 증가에 따른 C1q 결합은 C1q ELISA로 평가했다. 그 결과, 야생형 대조용 IgG1의 결합과 비교했을 때 예상한 바와 같이 mAb가 C1q에 결합할 수 없다는 것을 증명한다. 종합하면, L234A, L235A 힌지 영역 돌연변이는 FcgRI, FcgRIIa 및 C1q에 대한 mAb의 결합을 없애지만, FcgRIIb와 mAb의 상호작용에는 영향을 미치지 않는다. 이 데이터는 생체내에서 돌연변이 Fc를 보유한 mAb가 일반적으로 저해성 FcgRIIb와 상호작용하지만, 활성화 FcgRI 및 FcgRIIa 수용체 또는 C1q와는 상호작용하지 못할 가능성이 있음을 시사한다.
사람 FcRn 결합: 신생 수용체(FcRn)는 태반을 통한 IgG의 수송 및 IgG 분자의 이화성 반감기 조절에 책임이 있다. 항체의 말기 반감기를 증가시켜 효능을 증가시키거나, 용량 또는 투여 빈도를 줄이거나, 또는 표적에 대한 국재화를 향상시키는 것이 바람직할 것이다. 대안적으로, 그 반대인 것이 유리할 수도 있는데, 즉 항체의 말기 반감기를 감소시켜 전신 노출을 줄이거나 또는 표적 대 비표적 결합 비를 향상시키는 것이 유리할 수 있다. IgG와 이의 재이용 수용체, FcRn 간에 상호작용의 조정은 IgG의 말기 반감기를 증가 또는 감소시키는 방법을 제공한다. 혈행 중의 단백질, 예컨대 IgG는 혈관 내피 세포와 같은 특정 세포에 의한 미소세포 흡수 작용을 통해 유체 상 내에 흡수된다. IgG는 약간 산성 조건(pH 6.0 내지 6.5)에서 엔도솜 중의 FcRn에 결합하고 세포 표면으로 재순환할 수 있으며, 여기서 거의 중성 조건(pH 7.0 내지 7.4) 하에 방출된다. FcRn80, 16, 17 상의 Fc 영역 결합 부위의 맵핑은, 종을 따라 보존적인 2개의 히스티딘 잔기, His310 및 His435가 상기 상호작용의 pH 의존성에 책임이 있음을 보여주었다. 파지-디스플레이 기술을 이용하여 FcRn에 대한 결합을 증가시키고 마우스 IgG의 반감기를 연장시키는 마우스 Fc-영역 돌연변이가 동정되었다(Victor, G. et al.; Nature Biotechnology (1997), 15(7), 637-640)]. pH 7.4에서는 아니고 pH 6.0에서 FcRn에 대한 사람 IgG의 결합 친화성을 증가시키는 Fc-영역 돌연변이도 동정되었다(Dall'Acqua William F, et al., Journal of Immunology(2002), 169(9), 5171-80). 더욱이, 한 경우에 따르면 유사한 pH 의존적 결합 증가(최고 27배)가 리서스 FcRn에서 관찰되었고, 이것은 모 IgG와 비교했을 때 리서스 원숭이에서 2개 증가된 혈청 반감기를 초래했다(Hinton, Paul R. et al., Journal of Biological Chemistry (2004), 279(8), 6213-6216). 이러한 발견은 FcRn과 Fc 영역의 상호작용을 조정하여 항체 치료제의 혈장 반감기를 연장시키는 것이 가능하다는 것을 시사한다. 이에 반해, FcRn과의 상호작용을 약화시키는 Fc-영역 돌연변이는 항체 반감기를 감소시킬 수 있다.
1.B.10: 약동학(
PK
)
원하는 약동학 프로필을 가진 DVD-Ig 분자를 제조하기 위해, 한 양태에서는 원하는 약동학 프로필이 유사한 모 mAb를 선택한다. 1가지 고려할 사항은 모노클로날 항체에 대한 면역원성 반응(즉, HAHA, 사람 항-사람 항체 반응; HACA, 사람 항-키메라 항체 반응)이 이 치료제의 약동학을 더욱 복잡하게 한다는 것이다. 한 양태에서, 면역원성이 최소이거나 전혀 없는 모노클로날 항체가 DVD-Ig 분자를 작제하는데 사용되어 최종 DVD-Ig 역시 면역원성이 최소이거나 전혀 없을 것이다. mAb의 PK를 결정하는 일부 인자로는, mAb의 고유 성질(VH 아미노산 서열); 면역원성; FcRn 결합 및 Fc 기능을 포함하지만, 이에 국한되는 것은 아니다.
선택된 모 모노클로날 항체의 PK 프로필은 설치류에서 쉽게 측정할 수 있는데, 그 이유는 설치류의 PK 프로필 이 사이노몰거스 원숭이 및 사람의 모노클로날 항체의 PK 프로필과 양호한 상관성(또는 근접한 예측)이 있기 때문이다. PK 프로필은 실시예 섹션 1.3.3.1에 기술되어 있다.
원하는 PK 특성(및 본 명세서에 논의된 다른 원하는 기능적 성질을 보유한 모 모노클로날 항체를 선택한 후, DVD-Ig을 작제한다. DVD-Ig 분자는 2개의 모 모노클로날 항체 유래의 2개의 항원-결합 도메인을 함유하므로, DVD-Ig의 PK 성질도 마찬가지로 평가했다. 따라서, DVD-Ig의 PK 성질을 측정하는 동안, PK 분석은 2개의 모 모노클로날 항체 유래의 2개의 항원-결합 도메인의 기능성을 기초로 하여 PK 프로필을 측정하는 PK 분석이 이용될 수 있다. DVD-Ig의 PK 프로필은 실시예 1.3.3.1에 기술된 바와 같이 측정될 수 있다. DVD-Ig의 PK 프로필에 영향을 미칠 수 있는 추가 요인으로는 항원-결합 도메인(CDR) 배향; 링커 크기; 및 Fc/FcRn 상호작용을 포함한다. 모 항체의 PK 특징은 다음과 같은 파라미터, 흡수, 분포, 대사 및 배출을 평가하여 평가할 수 있다.
흡수: 지금까지 치료용 모노클로날 항체의 투여는 비경구 경로(예: 정맥내(IV), 피하(SC) 또는 근육내(IM))를 통해서이다. SC 또는 IM 투여 후 사이질 공간 유래의 전신 혈행 내로 mAb의 흡수는 주로 림프관 경로를 통해서이다. 포화성, 예비전신성(presystemic), 단백분해성 분해는 혈관외 투여 후 가변적인 절대 생체이용률을 초래할 수 있다. 보통, 모노클로날 항체의 용량 증가에 따른 절대 생체이용률의 증가는 더 높은 용량에서 포화된 단백분해능으로 인해 관찰될 수 있다. mAb의 흡수 과정은 림프액이 혈관계로 느리게 배출되기 때문에 보통 매우 느리며, 흡수 기간은 수시간 이상에서 수일까지 일어날 수 있다. SC 투여 후 모노클로날 항체의 절대 생체이용률은 일반적으로 50% 내지 100% 범위이다.
분포: IV 투여 후, 모노클로날 항체는 고속 분포 상으로 시작한 뒤, 느린 제거 상을 나타내는, 2상 혈청(또는 혈장) 농도-시간 프로필을 나타낸다. 일반적으로, 이러한 종류의 약동학 프로필은 이중지수적 약동학 모델이 가장 잘 설명한다. mAb의 중심 구역(Vc)에서 분포 용적은 혈장 용적(2 내지 3 리터)보다 약간 많거나 보통 동일하다. 혈청(혈장) 농도 대 시간 프로필의 상이한 2상 패턴은 다른 비경구 투여 경로, 예컨대 IM 또는 SC에서는 분명하지 않을 수 있는데, 그 이유는 혈청(혈장) 농도-시간 곡선의 분포 상이 긴 흡수 부위에 의해 가려진 때문이다. 많은 요인들, 예컨대 이화학적 성질, 부위-특이적 및 표적-지향성 수용체 매개 흡수, 조직의 결합능 및 mAb 용량은 mAb의 생체분포에 영향을 미칠 수 있다. 이러한 요인 중 일부는 mAb의 생체분포의 비선형성에 기여할 수 있다.
대사 및 배출: 분자 크기 때문에, 무손상 모노클로날 항체는 신장을 통해 소변으로 배출되지 않는다. 이들은 주로 대사(예: 이화작용)에 의해 불활성화된다. IgG-기반의 치료용 모노클로날 항체에서 반감기는 보통 수 시간 또는 1 내지 2일 내지 20일 이상 범위이다. mAb의 제거는 많은 요인들, 예컨대 FcRn 수용체에 대한 친화성, mAb의 면역원성, mAb의 글리코실화 정도, mAb의 단백분해에 대한 민감도 및 수용체-매개 제거 등(이에 국한되지 않는다)에 의해 영향을 받을 수 있다.
1.B.11: 사람 및
톡스
(
tox
) 종에서의 조직 교차반응성 패턴
동일한 염색 패턴은 톡스(tox) 종에서 잠재적 사람 독성이 평가될 수 있음을 시사한다. 톡스 종은 관련없는 독성이 연구되는 동물이다.
다음 2가지 기준에 부합하는 각 항체를 선택한다. (1) 항체 표적의 공지된 발현에 적당한 조직 염색. (2) 동일 기관 유래의 톡스 종 조직 및 사람 조직 간에 유사한 염색 패턴.
기준 1: 면역화 및/또는 항체 분비는 일반적으로 재조합 또는 합성 항원(단백질, 탄수화물 또는 기타 분자)을 이용한다. 천연의 대응물에 대한 결합 및 무관련 항원에 대한 대비선별은 종종 치료 항체에 대한 선별 깔때기의 일부이다. 하지만, 다수의 항원에 대한 선별은 종종 비실용적이다. 따라서, 모든 주요 기관 유래의 사람 조직을 이용한 조직 교차반응성 연구는 임의의 무관련 항원에 대한 항체의 바람직하지 않은 결합을 제외시키는 작용을 한다.
기준 2: 사람과 톡스 종 조직(사이노몰거스 원숭이, 개, 가능하게는 설치류 및 기타, 동일한 36개 또는 37개 조직이 사람 연구에서와 같이 검사된다)을 이용한 비교 조직 교차반응성은 톡스 종의 선택을 확인하는데 도움을 준다. 동결 조직 절편에 대한 전형적인 조직 교차반응성 연구는 치료 항체의 공지된 항원에 대한 예상된 결합 및/또는 이보다 적은 낮은 수준의 상호작용(비특이적 결합, 유사 항원에 대한 낮은 수준의 결합, 낮은 수준의 하전 기반 상호작용 등)을 기초로 한 조직에 대한 결합도를 증명할 수 있다. 임의의 경우에, 가장 관련성이 있는 독성학 동물 종은 사람 및 동물 조직에 대한 최고의 일치 결합도를 나타내는 것이다.
조직 교차반응성 연구는 적당한 규제 지침에 따른다[예컨대, EC CPMP Guideline III/5271/94 "Production and quality control of mAbs" 및 1997 US FDA/CBER "Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use"]. 부검 또는 생검에서 수득한 사람 조직의 동결절편(5 ㎛)은 대물 유리에 고정 후 건조했다. 조직 절편의 퍼옥시다제 염색은 아비딘-비오틴 시스템을 이용하여 수행했다[FDA's Guidance " Points to Consider in the Manufacture and Testing of Monoclonal Antibody Products for Human Use"]. 관련 참고문헌으로는 Clarke J 2004, Boon L. 2002a, Boon L 2002b, Ryan A 1999를 포함한다.
조직 교차반응성 연구는 종종 2 단계로 수행되며, 제1 단계는 한 사람 공여자 유래의 32가지 조직의 동결절편을 포함한다(일반적으로, 부신, 위장관, 전립선, 방광, 심장, 골격근, 혈액 세포, 신장, 피부, 골수, 간, 척수, 유방, 폐, 비장, 소뇌, 림프절, 고환, 대뇌 피질, 난소, 흉선, 결장, 췌장, 갑상선, 내피, 부갑상선, 요관, 눈, 뇌하수체, 자궁, 팔로피안관 및 태반). 제2 단계는 3명의 무관련 성인으로부터 최대 38가지 조직으로 완전 교차반응성 연구가 수행된다(예컨대, 부신, 혈액, 혈관, 골수, 소뇌, 대뇌, 경부, 식도, 눈, 심장, 신장, 대장, 간, 폐, 림프절, 유방 유선, 난소, 난관, 췌장, 부갑상선, 말초 신경, 뇌하수체, 태반, 전립선, 침샘, 피부, 소장, 척수, 비장, 위, 횡문근, 정소, 흉선, 갑상선, 편도선, 요관, 방광 및 자궁). 연구는 일반적으로 최소한으로 2가지 용량 수준에서 수행한다.
치료 항체(즉, 검사 물품) 및 이소타입 부합된 대조용 항체는 아비딘-비오틴 복합체(ABC) 검출을 위해 비오티닐화할 수 있다; 다른 검출 방법으로는 FITC(또는 다르게) 표지화된 검사 물품에 대한 3차 항체 검출, 또는 미표지화된 검사 물품에 대한 표지화된 항-사람 IgG의 예비복합체화를 포함할 수 있다.
간략히 설명하면, 부검 또는 생검에서 수득한 사람 조직의 동결절편(약 5㎛)은 대물유리에 고정 후 건조한다. 조직 절편의 퍼옥시다제 염색은 아비딘-비오틴 시스템으로 수행한다. 먼저(예비복합체화 검출 시스템의 경우), 검사 물품은 2차 비오티닐화된 항-사람 IgG와 함께 항온처리하고 면역 복합체로 형성시킨다. 검사 물품의 최종 농도가 2 및 10 ㎍/ml인 면역 복합체를 대물유리 상의 조직 절편 상에 첨가한 다음, 조직 절편을 아비딘-비오틴-퍼옥시다제 키트와 30분 동안 반응시킨다. 이어서, 퍼옥시다제 반응의 기질인 DAB(3,3'-디아미노벤지딘)을 조직 염색을 위해 4분 동안 적용했다. 항원-세파로스 비드는 양성 대조용 조직 절편으로 사용했다.
임의의 특이적 염색은 당해 표적 항원의 공지된 발현을 기초로 하여 예상한 반응성(예컨대, 항원 발현이 일치함) 또는 예상치못한 반응성인지를 판단한다. 특이적으로 판단된 임의의 염색은 강도 및 빈도에 대해 채점한다. 항원 또는 혈청 경쟁 또는 차단 연구는 관찰된 염색이 특이적 또는 비특이적인지를 결정하는데 있어서 도움을 줄 수 있다.
2개의 선택된 항체가 선택 기준, 즉 적당한 조직 염색성, 사람 및 독성 동물 특이적 조질 간에 부합 염색성을 충족하는 것으로 발견되면, DVD-Ig 제조용으로 선택할 수 있다.
조직 교차반응성 연구는 최종 DVD-Ig 작제물을 이용하여 반복해야 하지만, 이 연구는 앞에서 개략한 동일 프로토콜을 따르면서 평가하기는 더욱 복잡한데, 그 이유는 임의의 결합이 두 모 항체 중 어느 하나로 인한 것일 수 있고, 설명되지 않는 모든 결합이 복잡한 항원 경쟁 연구로 확인되어야 하기 때문이다.
DVD-Ig과 같은 다특이적 분자를 이용한 조직 교차반응성 연구의 복잡한 수행은, 두 모 항체가 (1) 예상치 않은 조직 교차반응성의 결과의 결여 및 (2) 대응하는 사람 및 독성 동물 종 조직 간에 조직 교차반응성 결과의 적당한 유사성에 대해 선택된다면 매우 간단해진다.
1.B.12: 특이성 및 선택성
원하는 특이성 및 선택성이 있는 DVD-Ig 분자를 제조하기 위해서는 원하는 특이성 및 선택성 프로필이 유사한 모 mAb를 제조하고 선택해야만 한다.
DVD-Ig을 이용한 특이성 및 선택성에 대한 결합 연구는 각 항원당 각각 2개씩 4개 또는 그 이상의 결합 부위로 인해 복잡할 수 있다. 간략히 설명하면, ELISA, BIAcore.KinExA 또는 DVD-Ig과 다른 상호작용 연구를 이용한 결합 연구는 DVD-Ig 분자에 대한 하나 또는 2 이상의 항원의 결합을 모니터해야 한다. BIAcore 기술은 다수 항원들의 연속적이고 독립적인 결합을 분리할 수 있지만, ELISA를 비롯한 전통 방법 또는 KinExA와 같은 근대 기술은 그럴 수 없다. 따라서, 각 모 항체의 조심스런 특성규명이 중요하다. 각 개별 항체를 특이성에 대해 특성규명한 후, DVD-Ig 분자에 존재하는 각 결합 부위의 특이성 유지 확인은 매우 간단해진다.
DVD-Ig의 특이성을 측정하는 복잡한 작업은 2개의 모 항체가 DVD-Ig으로 조합되기 전에 특이성에 대해 선택된다면 매우 간단해진다는 것은 자명하다.
항원-항체 상호작용 연구는 다양한 형태일 수 있으며, 예컨대 많은 고전적 단백질 단백질 상호작용 연구, 예컨대 ELISA(효소 결합 면역흡착 분석법), 질량분광분석, 화학교차결합, 광산란을 이용한 SEC, 평형 투석, 젤 투과, 한외여과, 겔 크로마토그래피, 라지-존 분석 SEC, 미량제조용 한외여과(침전 평형), 분광검사 방법, 적정 미량열량계, 침전 평형(분석용 한외여과에서), 침전 속도(분석용 원심분리에서), 표면 플라스몬 공명(BIAcore 포함)을 포함한다. 관련 참조문헌은 다음과 같다["Current Protocols in Protein Science", John E. Coligan, Ben M. Dunn, David W. Speicher, Paul T, Wingfield (eds.) Volume 3, chapters 19 and 20, published by John Wiley & Sons Inc., 및 여기에 포함된 참고문헌 및 "Current Protocols in Immunology", John E. Coligan, Barbara E. Bierer, David H. Margulies, Ethan M. Shevach, Warren Strober (eds.) published by John Wiley & Sons Inc 및 여기에 포함된 관련 참고문헌].
전혈에서의 사이토킨 방출: 사람 혈액 세포와 mAb의 상호작용은 사이토킨 방출 분석에 의해 조사될 수 있다(Wing, M. G. Therapeutic Immunology (1995), 2(4), 183-190; "Current Protocols in Pharmacology", S.J. Enna, Michael Williams, John W. Ferkany, Terry Kenakin, Paul Moser, (eds.) published by John Wiley & Sons Inc; Madhusudan, S. Clinical Cancer Research (2004), 10(19), 6528-6534; Cox, J. Methods (2006), 38(4), 274-282; Choi, I. European Journal of Immunology (2001), 31(1), 94-106). 간략히 설명하면, mAb의 다양한 농도를 사람 전체 혈액과 24시간 동안 항온처리한다. 검사된 농도는 환자 중의 일반적인 혈액 수준과 유사한 최종 농도를 포함하는 넓은 범위를 포함해야 한다(예컨대, 100 ng/ml 내지 100 ㎍/ml 포함). 항온처리 후, 상청액과 세포 용해물은 IL-1Rα, TNF-α, IL-1b, IL-6 및 IL-8의 존재에 대해 분석했다. mAb에 대해 생성된 사이토킨 농도는 음성 사람 IgG 대조군 및 양성 LPS 또는 PHA 대조군에 의해 수득된 프로필과 비교했다. 세포 상청액과 세포 용해물 유래의 mAb에 의해 나타난 사이토킨 프로필은 대조용 사람 IgG와 비슷했다. 한 양태에서, 상기 모노클로날 항체는 염증성 사이토킨을 자발적으로 방출하는 사람 혈액 세포와 상호작용하지 않는다.
DVD-Ig의 사이토킨 방출 연구는 각 항원당 2개씩 4개 이상인 결합 부위로 인해 복잡하다. 간략히 설명하면, 본원에 기술한 사이토킨 방출 연구는 전체 혈액 또는 다른 세포계에 미치는 전체 DVD-Ig의 효과를 측정하지만, 분자의 어느 부위가 사이토킨 방출을 유발하는지를 분석할 수 있다. 사이토킨 방출이 검출되면, DVD-Ig 제조물의 순도가 확인되어야 하는데, 그 이유는 일부 공동정제한 세포 성분이 직접 사이토킨 방출을 유발할 수 있기 때문이다. 순도가 문제가 아니라면, DVD-Ig의 단편화(예컨대, Fc 부위의 제거, 결합 부위의 분리 등, 이에 국한되지 않는다), 결합 부위 돌연변이유발 또는 다른 방법을 임의의 관찰을 분석하는데 이용할 필요가 있다. 이러한 복잡한 일이 두 모 항체가 DVD-Ig으로 조합하기 전에 사이토킨 방출 결여에 대해 선택한다면 매우 간단해진다.
1.B.13: 독성 연구를 위한 다른 종과의 교차반응성
한 양태에서, 각 항체는 적당한 톡스 종, 예컨대 사이노몰거스 원숭이에 대한 충분한 교차반응성으로 선택했다. 모 항체는 이종상동성 종 표적(즉, 사이노몰거스 원숭이)에 결합하고 적절한 반응(조절, 중화, 활성화)을 유도할 필요가 있다. 한 양태에서, 이종상동성 종 표적에 대한 교차반응성(친화성/효능)이 사람 표적의 10배 이내여야 한다. 실제, 모 항체는 마우스, 래트, 개, 원숭이(및 다른 비-사람 영장류)뿐만 아니라 질환 모델 종(즉, 천식 모델의 경우 양)에 대해 평가한다. 모 모노클로날 항체 유래의 톡스 종에 대한 허용되는 교차반응성은 향후 동일 종에서 DVD-Ig-Ig의 독성학 연구를 가능하게 한다. 이러한 이유로, 두 모 모노클로날 항체는 공통 톡스 종에 대해 허용되는 교차반응성을 나타내야 하고, 이에 따라 동일 종에서 DVD-Ig의 독성학 연구가 가능하게 된다.
모 모노클로날 항체는 당업계에 널리 공지되어 있는, 특정 표적에 결합할 수 있는 다양한 모노클로날 항체로부터 선택될 수 있다. 이들은 항-TNF 항체(미국 특허 제6,258,562호), 마우스 또는 사람화된 항-PGE2 항체(미국 출원 61/134,264 및 61/197,258 및 함께 출원된 Attorney Docket 9263.US.01), 항-IL-12 및/또는 항-IL-12p40 항체(미국 특허 제6,914,128호); 항-IL-18 항체 (US 2005/0147610 A1), 항-C5, 항-CBL, 항-CD147, 항-gp120, 항-VLA-4, 항-CD11a, 항-CD18, 항-VEGF, 항-CD40L, 항CD-40(예: WO 2007124299 참조), 항-Id, 항-ICAM-1, 항-CXCL13, 항-CD2, 항-EGFR, 항-TGF-베타 2, 항-HGF, 항 cMet, 항 DLL4, 항 NPR1, 항-PLGF, 항 ErbB3, 항-E-셀렉틴, 항-Fact VII, 항-Her2/neu, 항-F gp, 항-CD11/18, 항-CD14, 항-ICAM-3, 항-RON, 항 CD-19, 항-CD80 (예: WO 2003039486 참조), 항-CD4, 항-CD3, 항-CD23, 항-베타2-인테그린, 항-알파4베타7, 항-CD52, 항-HLA DR, 항-CD22(예: 미국 특허 5,789,554 참조), 항-CD20, 항-MIF, 항-CD64 (FcR), 항-TCR 알파 베타, 항-CD2, 항-Hep B, 항-CA 125, 항-EpCAM, 항-gp120, 항-CMV, 항-gpIIbIIIa, 항-IgE, 항-CD25, 항-CD33, 항-HLA, 항-IGF1,2, 항 IG FR, 항-VNR인테그린, 항-IL-1알파, 항-IL-1베타, 항-IL-1 수용체, 항-IL-2 수용체, 항-IL-4, 항-IL-4 수용체, 항-IL5, 항-IL-5 수용체, 항-IL-6, 항-IL-8, 항-IL-9, 항-IL-13, 항-IL-13 수용체, 항-IL-17 및 항-IL-23; IL-23p19를 포함하지만 이에 제한되지 않는다(문헌참조: Presta LG. 2005 Selection, design, and engineering of therapeutic antibodies J Allergy Clin Immunol. 116:731-6 및 http://www.path.cam.ac.uk/~mrc7/humanisation/antibodies.html).
모 모노클로날 항체는 또한 임상적 시험용 또는 임상 사용 개발용으로 승인된 다양한 치료학적 항체로부터 선택될 수 있다. 당해 치료학적 항체는 리툭시마브 (Rituxan®, IDEC/Genentech/Roche) (문헌참조: 예를 들어 미국 특허 제5,736,137호), 비호지킨 림프종을 치료하기 위해 승인된 키메라 항-CD20 항체; HuMax-CD20, Genmab에 의해 현재 개발 중인 항-CD20, 미국 특허 제5,500,362호에 기재된 항-CD20 항체; AME-133 (Applied Molecular Evolution), hA20 (Immunomedics, Inc.), HumaLYM (Intracel), 및 PRO70769 (PCT/US2003/040426, 발명의 명칭: "Immunoglobulin Variants and Uses Thereof"), 트라스투즈마브 (Herceptin®, Genentech) (문헌참조: 예를 들어, 미국 특허 제5,677,171호), 유방암을 치료하기 위해 승인된 사람화된 항-Her2/neu 항체; Genentech에 현재 개발된 퍼투주마브 (rhuMab-2C4, Omnitarg®); 미국 특허 제4,753,894호에 기재된 항-Her2 항체; 세툭시마브(Erbitux®, Imclone) (미국 특허 제4,943,533호; PCT WO 96/40210), 다양한 암에 대해 임상 시험중인 키메라 항-EGFR; Abgenix-Immunex-Amgen에 의해 현재 개발 중인 ABX-EGF(미국 특허 제6,235,883호); Genmab에 의해 현재 개발된 HuMax-EGFr (미국 출원 번호 제10/172,317호); 425, EMD55900, EMD62000, 및 EMD72000 (Merck KGaA)(미국 특허 제5,558,864호; Murthy et al. 1987, Arch Biochem Biophys. 252(2):549-60; Rodeck et al., 1987, J Cell Biochem. 35(4):315-20; Kettleborough et al., 1991, Protein Eng. 4(7):773-83); ICR62 (Institute of Cancer Research) (PCT WO 95/20045; Modjtahedi et al., 1993, J. Cell Biophys. 1993, 22(1-3):129-46; Modjtahedi et al., 1993, Br J Cancer. 1993, 67(2):247-53; Modjtahedi et al, 1996, Br J Cancer, 73(2):228-35; Modjtahedi et al, 2003, Int J Cancer, 105(2):273-80); TheraCIM hR3 (YM Biosciences, Canada and Centro de Immunologia Molecular, Cuba (미국 특허번호 5,891,996; 미국 특허번호 6,506,883; Mateo et al, 1997, Immunotechnology, 3(1):71-81); mAb-806 (Ludwig Institue for Cancer Research, Memorial Sloan-Kettering) (Jungbluth et al. 2003, Proc Natl Acad Sci USA. 100(2):639-44); KSB-102 (KS Biomedix); MR1-1 (IVAX, National Cancer Institute) (PCT WO 0162931A2); 및 SC100 (Scancell) (PCT WO 01/88138); B-세포 만성 림프구 백혈병의 치료용으로 현재 승인된 사람화된 모노클로날 항체인 알렘투주마브 (Campath®, Millenium); 무로모나브-CD3 (Orthoclone OKT3®), Ortho Biotech/Johnson &Johnson에 의해 개발된 항-CD3 항체; 이브리투모마브 티욱세탄(Zevalin®), IDEC/Schering AG에 의해 개발된 항-CD20 항체; 젬투주마브 오조가미신(Mylotarg®), Celltech/Wyeth에 의해 개발된 항-CD33(p67 단백질) 항체; 알레파셉트(Amevive®), Biogen에 의해 개발된 항-LFA-3 Fc 융합체; Centocor/Lilly에 의해 개발된 아브식시마브(ReoPro®); Novartis에 의해 개발된 바실릭시마브(Simulect®); Medimmune에 의해 개발된 팔리비주마브(Synagis®); 인플릭시마브 (Remicade®), Centocor에 의해 개발된 항-TNF알파 항체; 아달리무마브 (Humira®), Abbott에 의해 개발된 항-TNF알파 항체; Humicade®, Celltech에 의해 개발된 항-TNF알파 항체; 골리무마브 (CNTO-148), Centocor에 의해 개발된 완전한 사람 TNF 항체; 에타네르셉트 (Enbrel®), Immunex/Amgen에 의해 개발된 p75 TNF 수용체 Fc 융합체; 레너셉트, Roche에 의해 종래 개발된 p55 TNF 수용체 Fc 융합체; ABX-CBL, Abgenix에 의해 개발된 항-CD147 항체; ABX-IL8, Abgenix에 의해 개발된 항-IL-8 항체; ABX-MA1, Abgenix에 의해 개발된 항-MUC18 항체; 펨투모마브(R1549, 90Y-muHMFG1), Antisoma에 의해 개발중인 항-MUC1; 테렉스 (R1550), Antisoma에 의해 개발된 항-MUC1 항체; Antisoma에 의해 개발된 AngioMab(AS1405); Antisoma에 의해 개발된 HuBC-1; Antisoma에 의해 개발된 티오플라틴 (AS1407); Antegren® (나탈리주마브), Biogen에 의해 개발된 항-알파-4-베타-1 (VLA-4) 및 알파-4-베타-7 항체; VLA-1 mAb, Biogen에 의해 개발된 항-VLA-1 인테그린 항체; LTBR mAb, Biogen에 의해 개발된 항 림포톡신 베타 수용체(LTBR) 항체; CAT-152, Cambridge Antibody Technology에 의해 개발된 항-TGF-β2 항체; ABT 874(J695), Abbott에 의해 개발된 항-IL-12 p40 항체; CAT-192, Cambridge Antibody Technology 및 Genzyme에 의해 개발된 항-TGFβ1 항체, CAT-213, Cambridge Antibody Technology에 의해 개발된 항-에오탁신1 항체; LymphoStat-B®, Cambridge Antibody Technology 및 Human Genome Sciences Inc.에 의해 개발된 항-Blys 항체; TRAIL-R1mAb, Cambridge Antibody Technology 및 Human Genome Sciences,Inc.에 의해 개발된 항-TRAIL-R1 항체; Avastin® 베바시주마브, rhuMAb-VEGF, Genentech에 의해 개발된 항-VEGF 항체; Genentech에 의해 개발된 항-HER 수용체 계열 항체; 항-조직 인자 (ATF), Genentech, Xolair 에 의해 개발된 항-조직 인자 항체; Xolair®(오말리주마브), Genentech에 의해 개발된 항-IgE 항체; Raptiva® (에팔리주마브), Genentech 및 Xoma에 의해 개발된 항-CD11a 항체; Genentech 및 Millenium Pharmaceuticals에 의해 개발된 MLN-02 항체(종래, LDP-02); HuMax CD4, Genmab에 의해 개발된 항-CD4 항체; HuMax-IL15, Genmab 및 Amgen에 의해 개발된 항-IL15 항체; Genmab 및 Medarex에 의해 개발된 HuMax-Inflam; HuMax-Cancer, Genmab 및 Medarex 및 Oxford GcoSciences에 의해 개발된 항-헤파라나제 I 항체; Genmab 및 Amgen에 의해 개발된 HuMax-림프종; Genmab에 의해 개발된 HuMax-TAC; IDEC-131, IDEC Pharmaceuticals에 의해 개발된 항-CD40L 항체; IDEC-151 (클레놀릭시마브), IDEC Pharmaceuticals에 의해 개발된 항-CD4 항체; IDEC-114, IDEC Pharmaceuticals에 의해 개발된 항-CD80 항체; IDEC-152, IDEC Pharmaceuticals에 의해 개발된 항-CD23; IDEC Pharmaceuticals에 의해 개발된 항-대식세포 이동 인자(MIF) 항체; BEC2, Imclone에 의해 개발된 항-이디오타입 항체; IMC-1C11, Imclone에 의해 개발된 항-KDR 항체; DC101, Imclone에 의해 개발된 항-flk-1; Imclone에 의해 개발된 항-VE 캐드헤린 항체; CEA-Cide® (라베투주마브), Immunomedics에 의해 개발된 항-암배아 항원(CEA) 항체; LymphoCide® (에프라투주마브), Immunomedics에 의해 개발된 항-CD22 항체; Immunomedics에 의해 개발된 AFP-Cide; Immunomedics에 의해 개발된 MyelomaCide; Immunomedics에 의해 개발된 LkoCide; Immunomedics에 의해 개발된 ProstaCide; MDX-010, Medarex에 의해 개발된 항-CTLA4 항체; MDX-060, Medarex에 의해 개발된 항-CD30 항체; Medarex에 의해 개발된 MDX-070; Medarex에 의해 개발된 MDX-018; Osidem®(IDM-1), 및 Medarex 및 Immuno-Designed Molecules에 의해 개발된 항-Her2 항체; HuMax®-CD4, Medarex 및 Genmab에 의해 개발된 항-CD4 항체; HuMax-IL15, Medarex 및 Genmab에 의해 개발된 항-IL15 항체; CNTO 148, Medarex 및 Centocor/J&J에 의해 개발된 항-TNFα 항체; CNTO 1275, Centocor/J&J에 의해 개발된 항-사이토킨 항체; MOR101 및 MOR102, MorphoSys에 의해 개발된 항-세포간 부착 분자-1(ICAM-1)(CD54) 항체; MOR201, MorphoSys에 의해 개발된 항-섬유아세포 성장 인자 수용체 3(FGFR-3); Nuvion®(비실리주마브), Protein Design Labs에 의해 개발된 항-CD3 항체; HuZAF®, Protein Design Labs에 의해 개발된 항-감마 인터페론 항체; Protein Design Labs에 의해 개발된 항-α5β1 인테그린, Protein Design Labs에 의해 개발된 항-IL-12; ING-1, Xoma에 의해 개발된 항-Ep-CAM 항체; Xolair® (Omalizumab), Genentech 및 Novartis에 의해 개발된 사람화된 항-IgE 항체; 및 MLN01, Xoma에 의해 개발된 항-베타2 인테그린 항체를 포함하지만 이에 제한되지 않고 당해 인용된 문헌 모두는 특별히 본원에 참조 인용된다. 다른 양태로, 치료제는 KRN330 (Kirin); huA33 항체 (A33, Ludwig Institute for Cancer Research); CNTO 95 (알파 V 인테그린, Centocor); MEDI-522 (알파 V β3 인테그린, Medimmune); 볼로식시마브(알파 Vβ1 인테그린, Biogen/PDL); 사람 mAb 216 (B 세포 글리코솔화된 에피토프, NCI); BiTE MT103 (이특이적 CD19 x CD3, Medimmune); 4G7xH22 (이특이적 BcellxFcgammaR1, Medarex/Merck KGa); rM28 (이특이적 CD28 x MAPG, 미국 특허번호 EP1444268); MDX447 (EMD 82633) (이특이적 CD64 x EGFR, Medarex); 카투막소마브(레모바브) (이특이적 EpCAM x 항-CD3, Trion/Fres); 에르투마조마브(이특이적 HER2/CD3, Fresenius Biotech); 오레고보마브(OvaRex) (CA-125, ViRexx); Rencarex®(WX G250) (탄산 탈수소효소 IX, Wilex); CNTO 888 (CCL2, Centocor); TRC105 (CD105 (엔도글린), Tracon); BMS-663513 (CD137 작용제, Brystol Myers Squibb); MDX-1342 (CD19, Medarex); 시플리주마브(MEDI-507) (CD2, Medimmune); 오파투무마브(Humax-CD20) (CD20, Genmab); 리툭시마브(Rituxan) (CD20, Genentech); 벨투주마브(hA20) (CD20, Immunomedics); 에프라투주마브(CD22, Amgen); 루미릭시마브(IDEC 152) (CD23, Biogen); 무로모나브-CD3 (CD3, Ortho); HuM291 (CD3 fc 수용체, PDL Biopharma); HeFi-1, CD30, NCI); MDX-060 (CD30, Medarex); MDX-1401 (CD30, Medarex); SGN-30 (CD30, Seattle Genentics); SGN-33 (린투주마브) (CD33, Seattle Genentics); 자놀리무마브(HuMax-CD4) (CD4, Genmab); HCD122 (CD40, Novartis); SGN-40 (CD40, Seattle Genentics); Campath1h (알렘투주마브) (CD52, Genzyme); MDX-1411 (CD70, Medarex); hLL1 (EPB-1) (CD74.38, Immunomedics); 갈릭시마브(IDEC-144) (CD80, Biogen); MT293 (TRC093/D93) (절단된 콜라겐, Tracon); HuLuc63 (CS1, PDL Pharma); 이필리무마브(MDX-010) (CTLA4, Brystol Myers Squibb); 트레멜리무마브(Ticilimumab, CP-675,2) (CTLA4, Pfizer); HGS-ETR1 (Mapatumumab) (DR4 TRAIL-R1 작용제, Human Genome Science /Glaxo Smith Kline); AMG-655 (DR5, Amgen); 아포마브(DR5, Genentech); CS-1008 (DR5, Daiichi Sankyo); HGS-ETR2 (렉사투무마브) (DR5 TRAIL-R2 agonist, HGS); 세툭시마브(Erbitux) (EGFR, Imclone); IMC-11F8 (EGFR, Imclone); 니모투주마브(EGFR, YM Bio); 파니투무마브(Vectabix) (EGFR, Amgen); 잘루투무마브(HuMaxEGFr) (EGFR, Genmab); CDX-110 (EGFRvIII, AVANT Immunotherapeutics); 아데카투무마브(MT201) (Epcam, Merck); 에드레콜로마브(Panorex, 17-1A) (Epcam, Glaxo/Centocor); MORAb-003 (폴레이트 수용체 a, Morphotech); KW-2871 (강글리오사이드 GD3, Kyowa); MORAb-009 (GP-9, Morphotech); CDX-1307 (MDX-1307) (hCGb, Celldex); 트라스투주마브 (Herceptin) (HER2, Celldex); 퍼투주마브(rhuMAb 2C4) (HER2 (DI), Genentech); 아폴리주마브(HLA-DR beta chain, PDL Pharma); AMG-479 (IGF-1R, Amgen); 항-IGF-1R R1507 (IGF1-R, Roche); CP 751871 (IGF1-R, Pfizer); IMC-A12 (IGF1-R, Imclone); BIIB022 (IGF-1R, Biogen); Mik-beta-1 (IL-2Rb (CD122), Hoffman LaRoche); CNTO 328 (IL6, Centocor); Anti-KIR (1-7F9) (킬러 세포 Ig-유사 수용체(KIR), Novo); Hu3S193 (Lewis (y), Wyeth, Ludwig Institute of Cancer Research); hCBE-11 (LTβR, Biogen); HuHMFG1 (MUC1, Antisoma/NCI); RAV12 (N-결합된 탄수화물 에피토프, Raven); CAL (부갑상선 호르몬-관련 단백질(PTH-rP), University of California); CT-011(PD1, CureTech); MDX-1106 (ono-4538) (PD1, Medarex/Ono); MAb CT-011 (PD1, Curetech); IMC-3G3 (PDGFRa, Imclone); 바비툭시마브(포스파티딜세린, Peregrine); huJ591 (PSMA, Cornell Research Foundation); muJ591 (PSMA, Cornell Research Foundation); GC1008 (TGFb (pan) 억제제 (IgG4), Genzyme); 인플릭시마브(Remicade) (TNFa, Centocor); A27.15 (트랜스페린 수용체, Salk Institute, INSERN WO 2005/111082); E2.3 (트랜스페린 수용체, Salk Institute); 베바시주마브(Avastin) (VEGF, Genentech); HuMV833 (VEGF, Tsukuba Research Lab-WO/2000/034337, University of Texas); IMC-18F1 (VEGFR1, Imclone); IMC-1121 (VEGFR2, Imclone)을 포함한다.
C:
DVD
분자의
작제
이원 가변 도메인 면역글로불린 (DVD-Ig) 분자는 2개 상이한 모 mAb 기원의 2개의 상이한 경쇄 가변 도메인(VL)이 직접적으로 탠덤으로 연결되거나 재조합 DNA 기술에 의해 짧은 링커를 통해 연결되고 이어서 경쇄 불변 도메인이 연결되도록 디자인한다. 유사하게, 중쇄는 탠덤으로 연결된 2개의 상이한 중쇄 가변 도메인(VH)에 이어서 불변 도메인 CH1 및 Fc 영역을 포함한다 (도 1A).
가변 도메인은 상기된 방법중 어느 하나에 의해 생성된 모 항체로부터 재조합 DNA 기술을 사용하여 수득될 수 있다. 한 양태에서, 가변 도메인은 쥐 중쇄 또는 경쇄 가변 도메인이다. 다른 양태에서, 가변 도메인은 CDR 이식되거나 사람화된 가변 중쇄 또는 경쇄 도메인이다. 한 양태에서, 가변 도메인은 사람 중쇄 또는 경쇄 가변 도메인이다.
하나의 양태에서, 제1 및 제2 가변 도메인은 재조합 DNA 기술을 사용하여 서로 직접적으로 연결된다. 또 다른 양태에서, 가변 도메인은 링커 서열을 통해 연결된다. 한 양태에서, 2개의 가변 도메인이 연결된다. 3개 이상의 가변 도메인은 또한 직접적으로 또는 링커 서열을 통해 연결될 수 있다. 가변 도메인은 동일한 항원에 결합할 수 있거나 상이한 항원에 결합할 수 있다. 본 발명의 DVD 분자는 수용체의 리간드 결합 도메인, 효소의 활성 도메인과 같은 하나의 면역글로불린 가변 도메인 및 하나의 비-면역글로불린 가변 도메인을 포함할 수 있다. DVD 분자는 또한 2개 이상의 비-Ig 도메인을 포함할 수 있다.
링커 서열은 단일 아미노산 또는 폴리펩타이드 서열일 수 있다. 한 양태에서, 링커 서열은 AKTTPKLEEGEFSEAR (서열번호 1); AKTTPKLEEGEFSEARV (서열번호 2); AKTTPKLGG (서열번호 3); SAKTTPKLGG (서열번호 4); SAKTTP (서열번호 5); RADAAP (서열번호 6); RADAAPTVS (서열번호 7); RADAAAAGGPGS (서열번호 8); RADAAAA(G4S)4 (서열번호 9); SAKTTPKLEEGEFSEARV (서열번호 10); ADAAP (서열번호 11); ADAAPTVSIFPP (서열번호 12); TVAAP (서열번호 13); TVAAPSVFIFPP (서열번호 14); QPKAAP (서열번호 15); QPKAAPSVTLFPP (서열번호 16); AKTTPP (서열번호 17); AKTTPPSVTPLAP (서열번호 18); AKTTAP (서열번호 19); AKTTAPSVYPLAP (서열번호 20); ASTKGP (서열번호 21); ASTKGPSVFPLAP (서열번호 22), GGGGSGGGGSGGGGS (서열번호 23); GENKVEYAPALMALS (서열번호 24); GPAKELTPLKEAKVS (서열번호 25); GHEAAAVMQVQYPAS (서열번호 26)로 이루어진 그룹으로부터 선택된다. 링커 서열의 선택은 여러 Fab 분자의 결정 구조 분석을 기초로 한다. Fab 또는 항체 분자 구조에서 가변 도메인과 CH1/CL 불변 도메인간에는 천연 유연성 연결이 있다. 당해 천연 연결체는 약 10 내지 12개의 아미노산 잔기를 포함하고, 이중 4 내지 6개의 잔기는 V 도메인의 C-말단으로부터 유래된 것이고 4 내지 6개의 잔기는 CL/CH1 도메인의 N-말단으로부터 유래된 것이다. 본 발명의 DVD Ig은 각각 DVD-Ig의 경쇄 및 중쇄에서 링커로서 CL 또는 CH1의 N-말단의 5 내지 6개의 아미노산 잔기 또는 11개 내지 12개의 아미노산 잔기를 사용하여 제조된다. CL 또는 CH1 도메인의 N-말단 잔기, 특히 처음 5개 내지 6개의 아미노산 잔기는 강한 2차 구조 없이 루프 형태를 취함에 따라서 2개의 가변 도메인간의 유연성 링커로서 작용할 수 있다. CL 또는 CH1 도메인의 N-말단 잔기는 천연 연장의 가변 도메인이고 이들은 Ig 서열의 일부이므로 링커 및 연결부로부터 잠재적으로 유발되는 면역원성을 크게 감소시킨다.
또 다른 링커 서열은 임의의 길이의 CL/CH1 도메인의 임의의 서열, 예를 들어, CL/CH1 도메인의 처음 5 내지 12개의 아미노산 잔기를 포함할 수 있지만 CL/CH1 도메인의 모든 잔기를 포함하지는 않고, 경쇄 링커는 Cκ 또는 Cλ로부터 비롯될 수 있고; 중쇄 링커는 Cγ1, Cγ2, Cγ3, Cγ4, Cα1, Cα2, Cδ, Cε, 및 Cμ를 포함하는 임의의 이소타입의 CH1로부터 비롯될 수 있다. 링커 서열은 또한 Ig-형 단백질 (예를 들어, TCR, FcR, KIR)과 같은 기타 단백질; G/S 기본 서열 (예를 들어, G4S 반복체); 힌지 영역 유래 서열 및 기타 단백질 기원의 기타 천연 단백질로부터 유래할 수 있다.
한 양태에서, 불변 도메인은 재조합 DNA 기술을 사용하여 2개의 연결된 가변 도메인에 연결한다. 한 양태에서, 연결된 중쇄 가변 도메인을 포함하는 서열은 중쇄 불변 도메인에 연결하고 연결된 경쇄 가변 도메인을 포함하는 서열은 경쇄 불변 도메인에 연결한다. 한 양태에서, 불변 도메인은 각각 사람 중쇄 불변 도메인 및 사람 경쇄 불변 도메인이다. 한 양태에서, DVD 중쇄는 추가로 Fc 영역에 연결한다. Fc 영역은 천연 서열 Fc 영역 또는 변이체 Fc 영역일 수 있다. 다른 양태에서, Fc 영역은 사람 Fc 영역이다. 다른 양태에서, Fc 영역은 IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE, 또는 IgD의 Fc 영역을 포함한다.
다른 양태에서, 2개의 중쇄 DVD 폴리펩타이드 및 2개의 경쇄 DVD 폴리펩타이드는 조합되어 DVD-Ig 분자를 형성한다. 표 2는 질환 치료, 예컨대 암 치료에 유용한 표적에 대한 예시적 항체들의 VH 및 VL 영역의 아미노산 서열을 열거한 것이다. 한 양태에서, 본 발명은 표 2에 열거된 VH 및/또는 VL 영역 중 적어도 2개를 임의의 배향으로 포함하는 DVD를 제공한다. 실시예 3은 표 2에 열거한 VH 및 VL 영역에 지향성인 DVD-Ig을 제공한다. 실시예 2는 TNF 및 PGE2에 지향성인 DVD-Ig의 VH 및 VL 영역을 제공한다(표 5 내지 8 참조).
특이적 표적에 결합할 수 있는 특이적 DVD-Ig 분자 및 이의 제조방법에 관한 상세한 설명은 이하 실시예 부분에 제공된다.
D:
DVD
단백질의 제조
본 발명의 결합 단백질은 당업계에 공지된 임의의 다수의 기술에 의해 제조될 수 있다. 예를 들어, 숙주 세포로부터 발현되고 여기서, DVD 중쇄 및 DVD 경쇄를 암호화하는 발현 벡터는 표준 기술에 의해 숙주 세포로 형질감염된다. "형질감염"이란 용어의 다양한 형태는 원핵생물 또는 진핵생물 숙주 세포에 외인성 DNA를 도입시키는데 일반적으로 사용되는 다양한 기술, 예컨대 전기천공, 인산칼슘 침전, DEAE-덱스트란 형질감염 등을 포함하는 것으로 간주한다. 본 발명의 DVD 단백질은 원핵생물 숙주 세포 또는 진핵생물 숙주 세포에서 발현시킬 수 있지만, 진핵 세포에서의 DVD 단백질의 발현이 바람직하며, 특히 포유동물 숙주 세포에서의 발현이 가장 바람직한데, 그 이유는 이러한 진핵 세포(특히 포유동물 세포)가 적당한 폴딩을 이루어 면역학적 활성인 DVD 단백질을 어셈블리하여 분비하는데 원핵 세포보다 더 적당하기 때문이다.
본 발명의 재조합 항체를 발현하기에 바람직한 포유동물 숙주 세포에는 중국 햄스터 난소(CHO 세포)(예컨대, R.J.Kaufman and P.A.Sharp(1982) Mol. Biol. 159:601-621에 기술된 바와 같은 DHFR 선택성 마커와 함께 사용된, Urlaub and Chasin(1980) Proc. Natl. Acad. Sci. USA 77:4216-4220에 기술된 dhfr- CHO 세포), NS0 골수종 세포, COS 세포, SP2 및 PER.C6 세포가 있다. DVD 단백질을 암호화하는 재조합 발현 벡터가 포유동물 숙주 세포에 도입되면, DVD 단백질은 숙주 세포에서 DVD 단백질이 발현되기에 또는 바람직하게는 숙주 세포가 증식되는 배양 배지로 DVD 단백질이 분비되기에 충분한 시간 동안 숙주 세포를 배양하여 생산한다. DVD 단백질은 표준 단백질 정제법을 사용하여 배양 배지로부터 회수할 수 있다.
본 발명의 DVD 단백질을 재조합 발현하기 위한 예시적 시스템에서, DVD 중쇄 및 DVD 경쇄 둘다를 암호화하는 재조합 발현 벡터는 인산칼슘 매개 형질감염에 의해 dhfr- CHO 세포로 도입된다. 재조합 발현 벡터내에서, DVD 중쇄 및 경쇄는 CMV 인핸서/AdMLP 프로모터 조절 인자에 각각 작동가능하게 결합되어 상기 유전자의 높은 전사율을 유도한다. 또한, 재조합 발현 벡터는 DHFR 유전자를 보유하며, 이 유전자는 메토트렉세이트 선별/증폭을 통해 상기 벡터로 형질감염된 CHO 세포를 선별할 수 있게 해준다. 선별된 형질전환 숙주 세포는 DVD 중쇄 및 경쇄를 발현할 수 있도록 배양하고, 이러한 배양 배지로부터 완전한 DVD가 회수된다. 재조합 발현 벡터 제조, 숙주 세포 형질감염, 형질전환체 선별, 숙주 세포 배양 및 배양 배지로부터 DVD의 회수에는 표준 분자 생물학 기술을 사용한다. 또한, 본 발명은 본 발명의 숙주 세포를 본 발명의 DVD 단백질이 합성될 때까지 적당한 배양 배지에서 배양하여 본 발명의 DVD 단백질을 합성하는 방법을 제공한다. 이 방법은 추가로 배양 배지로부터 DVD 단백질을 분리하는 단계를 포함할 수 있다.
DVD-Ig의 중요한 특징은 이것이 통상적인 항체와 유사한 방법으로 제조되고 정제될 수 있다는 것이다. DVD-Ig의 제조는 목적하는 이원-특이적 활성을 갖는 균질의 단일 주요 생성물을 유도하고 불변 영역의 임의의 서열의 변형 또는 임의의 종류의 화학적 변형이 필요 없다. "이특이적", "다특이적" 및 "다특이적 다가"의 완전한 길이의 결합 단백질을 제조하는 종래 기술된 방법은 단일의 주요 생성물을 유도하지 못하고 대신 어셈블리된 불활성, 단일 특이적, 다특이적, 다가, 완전한 길이의 결합 단백질 및 상이한 결합 부위가 조합된 다가의 완전한 길이의 결합 단백질을 유도한다. 하나의 예로서, 문헌[참조: Miller 및 Presta (PCT 공개번호 WO2001/077342(A1)]에 기재된 디자인을 기초로, 16개의 가능한 중쇄 및 경쇄의 조합이 있다. 결과적으로 단백질의 단지 6.25%만이 목적하는 활성 형태로 존재할 가능성이 있고, 단일 주요 산물로서, 또는 여타 15개의 가능한 조합과 비교했을 때 단일 주요 산물로서 존재할 가능성이 없다. 전형적으로 대규모 제조에 사용되는 표준 크로마토그래피 기술을 사용한 불활성 및 부분 활성 형태의 단백질로부터 완전한 활성 형태의 단백질의 분리는 아직 입증되어야만 한다.
놀랍게도, 본 발명의 "이원 특이적 다가 완전한 길이의 결합 단백질"의 디자인은 주로 목적하는 "이원-특이적 다가의 완전한 길이의 결합 단백질"로 어셈블리하는 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 유도한다.
어셈블리되고 발현된 이원 가변 도메인 면역글로불린 분자 중 50% 이상, 바람직하게는 75% 이상 및 보다 바람직하게는 90% 이상은 목적하는 이원-특이적 4가 단백질이다. 본 발명의 당해 측면은 특히, 본 발명의 상업적 이용도를 증진시킨다. 따라서, 본 발명은 "이원-특이적 4가 완전한 길이의 결합 단백질"의 단일 주요 생성물을 유도하는 단일 세포에서 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 발현시키기 위한 방법을 포함한다.
본 발명은 단일 세포에서 "이원 특이적 4가의 완전한 길이의 결합 단백질"의 단일 "주요 생성물"을 유도하는, 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 발현시키는 방법을 제공하고, 여기서 "주요 생성물"은 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 포함하는, 50% 초과의 모든 어셈블리된 단백질이다.
본 발명은 단일 세포에서 "이원 특이적 4가의 완전한 길이의 결합 단백질"의 단일 "주요 생성물"을 유도하는, 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 발현시키는 방법을 제공하고, 여기서 "주요 생성물"은 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 포함하는, 75% 초과의 모든 어셈블리된 단백질이다.
본 발명은 단일 세포에서 "이원 특이적 4가의 완전한 길이의 결합 단백질"의 단일 "주요 생성물"을 유도하는, 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 발현시키는 방법을 제공하고, 여기서 "주요 생성물"은 이원 가변 도메인 경쇄 및 이원 가변 도메인 중쇄를 포함하는, 90% 초과의 모든 어셈블리된 단백질이다.
II
.
유도체화된
DVD
결합 단백질
일 양태는 본 발명의 결합 단백질이 유도체화되거나 또는 다른 기능성 분자(예컨대, 다른 펩타이드 또는 단백질)에 결합된 표지된 결합 단백질을 제공한다. 예를 들어, 본 발명의 표지된 결합 단백질은 본 발명의 결합 단백질(화학적 커플링, 유전자 융합, 비공유 연합 등에 의해)을 하나 이상의 다른 분자 실체, 예컨대 다른 항체(예: 이특이적 항체 또는 디아바디), 검출가능 제제, 세포독성제, 약제 및/또는 다른 분자와 결합 단백질의 연합을 매개할 수 있는 단백질이나 펩타이드(예컨대, 스트렙타비딘 코어 영역 또는 폴리히스티딘 태그) 등에 기능적으로 연결시켜 수득할 수 있다.
본 발명의 결합 단백질이 유도체화될 수 있는 유용한 검출가능 제제에는 형광 화합물이 포함된다. 검출가능 형광 제제의 예에는 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 5-디메틸아민-1-나프탈렌설포닐 클로라이드, 피코에리트린 등이 있다. 또한, 결합 단백질은 검출가능 효소, 예컨대 알칼리성 포스파타제, 서양고추냉이 퍼옥시다제, 글루코스 옥시다제 등에 의해 유도체화될 수 있다. 결합 단백질이 검출가능 효소로 유도체화된 경우에는, 효소가 검출가능 반응 산물을 생산하기 위해 사용하는 추가 시약을 첨가하여 검출한다. 예를 들어, 검출가능 제제 서양고추냉이 퍼옥시다제가 존재하는 경우, 과산화수소 및 디아미노벤지딘의 첨가는 검출가능한 발색 반응 생성물을 유도한다. 결합 단백질은 또한 비오틴으로 유도체화될 수 있고, 이 경우 아비딘이나 스트렙타비딘 결합의 간접 측정을 통해 검출한다.
본 발명의 다른 양태는 결정화된 결합 단백질, 및 이러한 결정을 포함하는 제형 및 조성물을 제공한다. 일 양태에서, 결정화된 결합 단백질은 이에 대응하는 가용성 결합 단백질보다 생체내 반감기가 더 길다. 다른 양태에서, 결합 단백질은 결정화 후 생물학적 활성을 보유한다.
본 발명의 결정화된 결합 단백질은 당업계에 공지되어 있고 WO 02072636에 개시된 바와 같이 생산할 수 있다.
본 발명의 다른 양태는 항체 또는 이의 항원 결합부가 하나 이상의 탄수화물 잔기를 포함하는 글리코실화된 결합 단백질을 제공한다. 생체내 생산된 초기 단백질은 해독후 변형으로 알려진 추가 프로세싱으로 처리될 수 있다. 구체적으로, 당(글리코실) 잔기는 글리코실화로 알려진 방법에 의해 효소적으로 첨가될 수 있다. 그 결과 수득되는 공유 결합된 올리고사카라이드 측쇄를 보유한 단백질은 글리코실화된 단백질 또는 당단백질로서 공지되어 있다. 항체는 가변성 도메인 뿐만 아니라 Fc 도메인에 하나 이상의 탄수화물 잔기를 갖는 당단백질이다. Fc 도메인내 탄수화물 잔기는 Fc 도메인의 이펙터 기능에 중요한 효과를 나타내고 항체의 항원 결합 또는 반감기에 최소의 효과를 나타낸다(R. Jefferis, Biotechnol. Prog. 21 (2005), pp. 11 - 16). 대조적으로, 가변성 도메인의 글리코실화는 항체의 항원 결합 활성에 효과를 가질 수 있다. 가변성 도메인내 글리코실화는 아마도 입체 장애로 인해 항체 결합 친화성에 대해 음성 효과를 나타낼 수 있고(Co, M.S., et al., Mol. Immunol. (1993) 30:1361- 1367), 또는 항원에 대한 친화성을 증가시킬 수도 있다(Wallick, S.C., et al., Exp. Med. (1988) 168:1099-1109; Wright, A., et al., EMBO J. (1991) 10:2717 2723).
본 발명의 한 측면은 결합 단백질의 O- 또는 N- 결합된 글리코실화 부위가 돌연변이된 글리코실화 부위 돌연변이체를 제조하는 것에 관한 것이다. 당업자는 널리 공지된 표준 기술을 사용하여 당해 돌연변이체를 제조할 수 있다. 생물학적 활성을 보유하지만 결합 활성이 증가되거나 감소된 글리코실화 부위 돌연변이체는 본 발명의 또 다른 목적이다.
또 다른 양태에서, 본 발명의 항체 또는 항원 결합부의 글리코실화는 변형된다. 예를 들어, 글리코실화되지 않은 항체가 제조될 수 있다(즉, 항체는 글리코실화되어 있지 않다). 항원에 대한 항체의 친화성을 증가시키기 위해 글리코실화를 변경시킬 수 있다. 당해 탄수화물 변형은 예를 들어, 항체 서열내 하나 이상의 글리코실화 부위를 변경시킴에 의해 달성될 수 있다. 예를 들어, 하나 이상의 아미노산이 치환되어 하나 이상의 가변 영역 글리코실화 부위가 제거됨으로써 그 부위에서의 글리코실화가 제거된다. 당해 글리코실화 제거는 항원에 대한 항체의 친화성을 증가시킬 수 있다. 당해 방법은 문헌[PCT 공개번호 WO2003016466A2, 및 미국 특허 5,714,350 및 6,350,861]에 상세하게 추가로 기재되어 있다.
또한, 또는 대안적으로, 본 발명의 변형된 결합 단백질은 푸코실 잔기의 양이 감소된 저푸코실화된 항체(Kanda, Yutaka et al., Journal of Biotechnology(2007), 130(3), 300-310) 또는 GlcNAc 구조의 2등분이 증가된 항체와 같은 변형된 유형의 글리코실화를 가질 수 있다. 당해 변경된 글리코실화 패턴은 항체의 ADCC 활성을 증가시키는 것으로 입증되었다. 당해 탄수화물 변형은 예를 들어, 변경된 글리코실화 기구를 갖는 숙주 세포에서 항체를 발현시켜 달성될 수 있다. 변경된 글리코실화 기구를 갖는 세포는 당업계에 보고되어 있고 본 발명의 재조합 항체를 발현시켜 변형된 글리코실화를 갖는 항체를 제조하기 위한 숙주 세포로서 사용될 수 있다[Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740; Umana et al. (1999) Nat. Biotech. 17:176-1, 및 유럽특허 EP 1,176,195; PCT 공개번호 WO 03/035835; WO 99/54342 80].
단백질 글리코실화는 당해 단백질의 아미노산 서열, 및 단백질이 발현되는 숙주 세포에 따라 달라진다. 다른 유기체는 다른 글리코실화 효소(예컨대, 글리코실트랜스퍼라제 및 글리코시다제)를 생산하고, 이용할 수 있는 기질(뉴클레오타이드 당)이 다를 수 있다. 이러한 요인으로 인해, 단백질 글리코실화 패턴 및 글리코실 잔기의 조성은 특정 단백질이 발현되는 숙주계에 따라 다를 수 있다. 본 발명에 유용한 글리코실 잔기는 글루코스, 갈락토스, 만노스, 푸코스, n-아세틸글루코사민 및 시알산 등을 이에 국한됨이 없이 포함할 수 있다. 한 양태에서, 글리코실화된 결합 단백질은 글리코실화 패턴이 사람이도록 글리코실 잔기를 포함하는 것이 바람직하다.
당업자에게 공지된 바와 같이, 상이한 단백질 글리코실화는 상이한 단백질 특징을 제공할 수 있다. 예를 들어, 효모와 같은 미생물 숙주에서 생산되고 효모 내인성 경로를 이용하여 글리코실화된 치료 단백질의 효능은 CHO 세포주와 같은 포유동물 세포에서 발현된 동일 단백질 효능에 비해 저하될 수 있다. 이러한 당단백질은 또한 사람 중에서 면역원성일 수 있고 투여 후 생체내 반감기가 감소될 수 있다. 사람 및 다른 동물에 존재하는 특정 수용체는 특정 글리코실화 잔기를 인식하고 혈류로부터 그 단백질의 신속 제거를 촉진할 수 있다. 다른 부작용으로는, 단백질 폴딩, 가용성, 프로테아제에 대한 민감성, 트래피킹(trafficking), 수송, 구획화, 분비, 다른 단백질이나 인자에 의해 인식, 항원성 또는 알레르기원성 등의 변화를 포함할 수 있다. 따라서, 당업자는 특정 조성과 글리코실화 패턴을 가진 치료 단백질, 예컨대 사람 세포 또는 의도된 피검체 동물의 종 특이적 세포에서 생산되는 것과 동일하거나 적어도 유사한 글리코실화 조성 및 패턴을 가진 치료 단백질을 선호할 수 있다.
숙주 세포와 상이한 글리코실화된 단백질의 발현은 숙주 세포의 유전자 변형을 통해 이종 글리코실화 효소를 발현하도록 함으로써 수득될 수 있다. 사람 단백질 글리코실화를 나타내는 항체 또는 항원 결합부는 당업계에 공지된 기술을 사용하여 당업자라면 제조할 수 있다. 예를 들어, 효모 균주는 비자연발생의 글리코실화 효소를 발현하도록 유전자변형되어, 이 효모 균주에서 생산된 글리코실화된 단백질(당단백질)이 동물 세포, 특히 사람 세포에서 생산된 것과 동일한 단백질 글리코실화가 수득된 바 있다(미국 특허 출원 20040018590 및 20020137134 및 PCT 공개공보 WO2005100584 A2).
결합 단백질 외에도, 본 발명은 또한 본 발명의 당해 결합 단백질에 특이적인 항-이디오타입(항-Id) 항체에 관한 것이다. 항-Id 항체는 일반적으로 또 다른 항체의 항원 결합 영역과 연합된 유일한 결정인자를 인지하는 항체이다. 항-Id는 결합 단백질 또는 CDR 함유 영역으로 동물을 면역화시켜 제조될 수 있다. 면역화된 동물은 면역화 항체의 이디오타입 결정인자를 인지하고 이에 응답하여 항-Id 항체를 생산한다. DVD-Ig 분자에 혼입된 2종 이상의 모 항체에 대한 항-이디오타입 항체를 제조하는 것이 더 용이할 수 있다는 것은 쉽게 드러나며; 당업계에 공지된 방법(예: BIAcore, ELISA)에 의한 결합 연구를 통해 각 모 항체의 이디오타입에 특이적인 항-이디오타입 항체가 또한 DVD-Ig의 상황에서 이디오타입(예: 항원 결합부)을 인식한다는 것이 입증된다. DVD-Ig의 2종 이상의 항원 결합 부위 각각에 특이적인 항-이디오타입 항체는 환자 혈청 중의 사람 DVD-Ig의 DVD-Ig 농도를 측정하는 이상적인 시약을 제공하며; DVD-Ig 농도 분석은 제1 항원 결합 영역에 대한 항체를 고상(예: BIAcore 칩, ELISA 평판 등)에 코팅하고, 세정 완충액으로 세정하고, 혈청 시료와 항온처리하고, 다시 세정 단계 및 최종적으로 결합 반응의 정량분석을 위한 효소로 자체 표지화된, 다른 항원 결합 부위에 대한 다른 항-이디오타입 항체와 항온처리하는 "샌드위치 분석 ELISA 형식"을 이용하여 수립할 수 있다. 한 양태에서, 2개가 넘는 다른 결합 부위를 보유한 DVD-Ig의 경우에는, 2개의 최외각 결합 부위(불변 영역에서 가장 먼 부위 및 가장 가까운 부위)에 대한 항-이디오타입 항체가 사람 혈청 중의 DVD-Ig의 농도를 측정하는데 도움을 줄 뿐만 아니라, 생체내 분자의 완전성을 증명할 것이다. 또한, 항-Id 항체는 소위 항-항-Id 항체를 생산하는 또 다른 동물에서 면역반응을 유도하기 위한 "면역원"으로서 사용될 수 있다.
또한, 목적하는 단백질은 다양한 글리코실화 효소를 발현하도록 유전자 조작된 숙주 세포의 라이브러리를 사용하여 발현시킬 수 있음을 당업자라면 잘 알고 있을 것이며, 이에 따라 상기 라이브러리의 구성 숙주 세포는 변형된 글리코실화 패턴을 가진 당해의 단백질을 생산한다. 그 다음, 당업자는 새로운 특정 글리코실화 패턴을 가진 당해의 단백질을 선별하여 분리할 수 있다. 한 양태에서, 특별하게 선별된 신규 글리코실화 패턴을 가진 단백질은 생물학적 성질이 개선되거나 변경된 단백질이다.
III
.
DVD
-
Ig
의 용도
2개 이상의 항원에 결합하는 성질이 있다면, 본 발명의 결합 단백질은 통상의 면역분석법, 예컨대 효소 결합된 면역흡착분석법(ELISA), 방사선면역분석법(RIA) 또는 조직 면역조직화학법을 통해 항원(예컨대 혈청이나 혈장과 같은 생물학적 시료에서)을 검출하는데 사용할 수 있다. DVD-Ig은 결합 또는 미결합된 항체의 검출을 촉진시키기 위해 직간접적으로 검출가능 물질로 표지화된다. 적당한 검출가능 물질에는 각종 효소, 보결분자단, 형광 물질, 발광 물질 및 방사능 물질이 있다. 적당한 효소의 예에는 양고추냉이 퍼옥시다제, 알칼리성 포스파타제, β-갈락토시다제 또는 아세틸콜린에스터라제가 있고; 적당한 보결분자단 복합체의 예에는 스트렙타비딘/비오틴 및 아비딘/비오틴이 있으며; 적당한 형광 물질의 예에는 움벨리페론, 플루오레세인, 플루오레세인 이소티오시아네이트, 로다민, 디클로로트리아지닐아민 플루오레세인, 단실 클로라이드 또는 피코에리트린이 있고; 발광 물질의 예에는 루미놀이 있으며; 적당한 방사능 물질의 예에는 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho, 또는 153Sm이 있다.
한 양태에서, 본 발명의 결합 단백질은 시험관내 및 생체내 모두에서 항원의 활성을 중화시킬 수 있다. 따라서, 당해 DVD-Ig을 사용하여, 예를 들어, 항원을 함유하는 세포 배양물에서, 사람 피검체 또는 본 발명의 결합 단백질이 교차 반응하는 항원을 갖는 기타 포유동물 피검체에서 항원 활성을 억제할 수 있다. 또 다른 양태에서, 본 발명은 항원 활성이 해로운 질환 또는 장애를 앓는 피검체에서 항원 활성을 감소시키는 방법을 제공한다. 본 발명의 결합 단백질은 치료 목적을 위해 사람 피검체에 투여될 수 있다.
본원에 사용된 바와 같이, 용어 "항원 활성이 해로운 장애"는 장애를 앓는 피검체에서 항원의 존재가 장애의 병리에 관여하거나 장애의 악화에 기여하는 인자이거나 의심되는 것으로 나타나는 질환 및 기타 장애를 포함하는 것으로 의도된다. 따라서, 항원 활성이 해로운 장애는 항원 활성의 감소가 장애의 증상 및/또는 진행을 완화시킬 것으로 예상되는 장애이다. 당해 장애는 예를 들어, 장애를 앓는 피검체의 생물학적 유체중에 항원 농도를 증가시켜(예를 들어, 피검체의 혈청, 혈장, 윤활액중의 항원 농도의 증가) 입증될 수 있다. 본 발명의 결합 단백질로 치료될 수 있는 장애의 비제한적인 예는 하기에서 및 본 발명의 항체의 약제학적 조성물에 관한 부분에서 논의되는 장애를 포함한다.
본 발명의 DVD-Ig은 하나의 항원 또는 다중 항원에 결합할 수 있다. 당해 항원은 본원에 참조로서 인용되는 하기의 데이터베이스에 열거된 표적물을 포함하지만 이에 제한되지 않는다. 이들 표적 데이터베이스는 하기와 같은 목록을 포함한다:
치료학적 표적 (http://xin.cz3.nus.edu.sg/group/cjttd/ttd.asp);
사이토킨 및 사이토킨 수용체 (http://www.cytokinewebfacts.com/, http://www.copewithcytokines.de/cope.cgi, 및 http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytokine.medic.kumamoto-u.ac.jp/CFC/indexR.html);
케모킨 (http://cytokine.medic.kumamoto-u.ac.jp/CFC/CK/Chemokine.html);
케모킨 수용체 및 GPCR (http://csp.medic.kumamoto-u.ac.jp/CSP/Receptor.html, http://www.gpcr.org/7tm/);
후각 수용체 (http://senselab.med.yale.edu/senselab/ORDB/default.asp);
수용체 (http://www.iuphar-db.org/iuphar-rd/list/index.htm);
암 표적 (http://cged.hgc.jp/cgi-bin/input.cgi);
잠재적 항체 표적으로서 분비된 단백질 (http://spd.cbi.pku.edu.cn/);
단백질 키나제 (http://spd.cbi.pku.edu.cn/), 및
사람 CD 마커 (http://content.labvelocity.com/tools/6/1226/CD_table_final_locked.pdf) 및 (Zola H, 2005 CD molecules 2005: human cell differentiation molecules Blood, 106:3123-6).
DVD-Ig은 효능/안정성을 증진시키고/시키거나 환자의 적용 범위를 증가시키기 위해 2개의 상이한 표적을 동시에 차단시키는 치료제로서 유용하다. 당해 표적은 가용성 표적 (TNF) 및 세포 표면 수용체 표적 (VEGFR 및 EGFR)을 포함할 수 있다. 이것은 또한 암 치료를 위해 종양 세포와 T 세포(Her2 및 CD3) 간에, 또는 자가면역 질환 또는 이식을 위해 자가반응성 세포와 이펙터 세포 간에, 또는 임의의 특정 질환에서 발병 세포를 제거하기 위한 임의의 표적 세포와 이펙터 세포간에 재지시된 세포독성을 유도하는데 사용될 수 있다.
추가로, 동일한 수용체상에 2개의 상이한 에피토프를 표적화하도록 디자인되는 경우, DVD-Ig은 수용체 클러스터링 및 활성화를 유도하기 위해 사용될 수 있다. 이것은 작용제성 및 길항성 항-GPCR 치료제를 제조하는데 이득일 수 있다. 이 경우에, DVD-Ig을 사용하여 클러스터링/시그널 전달(2개의 세포 표면 분자) 또는 시그널 전달(하나의 분자 상에)을 위해 하나의 세포에 대해 2개의 상이한 에피토프(루프 영역 및 세포외 도메인 상의 에피토프를 포함)를 표적화할 수 있다. 유사하게, DVD-Ig 분자는 CTLA-4 연결, 및 CTLA-4 세포외 도메인의 2개의 상이한 에피토프(또는 2개 카피의 동일한 에피토프)를 표적화함에 의한 음성 시그널을 유발하여 면역 반응을 하향 조절하도록 디자인될 수 있다. CTLA-4는 다수의 면역학적 장애의 치료를 위해 임상적으로 유효하다. CTLA-4/B7은 세포 주기 진행, IL-2 생성 및 활성화 후 T 세포의 증식을 약화시킴에 의해 T 세포 활성화를 음성으로 조절하고 CTLA-4 (CD152) 관여는 T 세포 활성화를 하향조절할 수 있고 면역 내성의 유도를 촉진시킬 수 있다. 그러나, CTLA-4의 작용제성 항체 관여에 의해 T 세포 활성화를 약화시키는 전략은 CTLA-4 활성화가 연결을 요구하기 때문에 성공적이지 못하였다. CTLA-4/B7의 분자 상호작용은 결정 구조 분석 (Stamper 2001 Nature 410:608)에 의해 입증된 바와 같이 "경사진 지퍼" 정렬로 있다. 그러나, 항-CTLA-4 mAb를 포함하는, 현재 시판되는 CTLA-4 결합 시약의 어떠한 것도 연결 성질을 갖지 않는다. 이러한 문제를 해결하기 위한 여러 시도가 있었다. 한 경우에, 세포 구성원 결합 단일쇄 항체가 제조되었고 마우스에서 동형접합성 거부를 억제하였다 (Hwang 2002 JI 169:633). 별도의 경우에, CTLA-4에 대한 인공 APC 표면 연결된 단일쇄 항체를 제조하고 T 세포 반응을 약화시키는 것으로 입증되었다(Griffin 2000 JI 164:4433). 두 경우에, CTLA-4 연결은 인공 시스템에서 막 결합 항체를 밀접하게 국소화시킴으로써 달성되었다. 당해 실험은 CTLA-4 음성 시그널 전달에 의해 면역을 하향조절한다는 개념의 증거를 제공하지만 이들 보고에 사용되는 시약은 치료학적 용도로서 적합하지 않다. 이를 위해, CTLA-4 연결은 CTLA-4 세포외 도메인의 2개의 상이한 에피토프(또는 2개 카피의 동일한 에피토프)에 표적화되는 DVD-Ig 분자를 사용함에 의해 달성될 수 있다. 추론적으로 IgG의 2개의 결합 부위간의 거리는 약 150-170Å으로서 CTLA-4의 활성 연결(2개의 CTLA-4 동종이량체 간에 30 내지 50Å)에 대해서 너무 크다. 그러나, DVD-Ig(하나의 암)상의 2개의 결합 부위간의 거리는 30 내지 50Å의 범위로서 훨씬 짧고 CTLA-4의 적당한 연결을 허용한다.
유사하게, DVD-Ig은 2개의 상이한 세포 표면 수용체 복합체의 구성원(예를 들어, IL12-R 알파 및 베타)을 표적화할 수 있다. 추가로, DVD-Ig은 CR1 및 가용성 단백질/병원체를 표적화하여 표적 가용성 단백질/병원체의 신속한 제거를 유도할 수 있다.
또한, 본 발명의 DVD-Ig은 세포내 전달(내재화 수용체 및 세포내 분자를 표적화하는) 또는 뇌 내부로의 전달(혈뇌 장벽을 통과하기 위해 트랜스페린 수용체 및 CNS 질환 매개체를 표적화)을 포함하는, 조직-특이적 전달(국소 PK가 증진됨에 따라 효능을 보다 증진시키고/시키거나 독성을 저하시키기 위한 조직 마커 및 질환 매개체를 표적화함)을 위해 사용될 수 있다. DVD-Ig은 또한 항원의 비중화 에피토프에 결합함으로써 특정 위치로 항원을 전달하고 또한 항원의 반감기를 증가시키는 캐리어 단백질로서 작용할 수 있다. 또한, DVD-Ig은 환자에게 이식된 의료 장치에 물리적으로 연결되거나 이들 의료 장치를 표적화하도록 디자인될 수 있다(문헌참조: Burke, Sandra E.; Kuntz, Richard E.; Schwartz, Lewis B., Zotarolimus eluting stents. Advanced Drug Delivery Reviews (2006), 58(3), 437-446; Surface coatings for biological activation and functionalization of medical devices, Hildebrand, H. F.; Blanchemain, N.; Mayer, G.; Chai, F.; Lefebvre, M.; Boschin, F., Surface and Coatings Technology (2006), 200(22-23), 6318-6324; Drug/ device combinations for local drug therapies and infection prophylaxis, Wu, Peng; Grainger, David W., Biomaterials (2006), 27(11), 2450-2467; Mediation of the cytokine network in the implantation of orthopedic devices., Marques, A. P.; Hunt, J. A.; Reis, Rui L., Biodegradable Systems in Tissue Engineering and Regenerative Medicine (2005), 377-397). 간략히 설명하면, 적당한 유형의 세포를 의학적 이식체 부위에 지시함으로써 정상적인 조직 기능을 치유하고 회복시킬 수 있다. 또는, 매개체(사이토킨을 포함하지만 이에 제한되지 않음)의 억제는 커플링된 DVD에 의한 장치 이식 즉시 또는 장치에 표적화되는 즉시 제공된다. 예를 들어, 스텐트는 차단된 동맥을 제거하고 심근으로의 혈류를 개선시키기 위해 개재 심장학에서 수년 동안 사용되어 왔다. 그러나, 통상적인 노출된 금속 스텐트는 몇몇 환자에서 재발협착증(처리된 영역에서 동맥의 재협소화)을 일으켜 혈액 응고를 유발할 수 있는 것으로 공지되어 있다. 최근에, 항-CD34 항체 피복된 스텐트가 보고되었고 이는 혈액 전반에 걸쳐 순환하는 내피 선조 세포(EPC)를 포획함으로 인해 발생되는 혈액 응고를 방지하고 재발협착증을 감소시킨다. 내피 세포는 혈관을 따라 존재하여 혈류를 원할하게 하는 세포이다. EPC는 스텐트의 경표면에 부착하여 연한 층을 형성하고 치유를 촉진시킬 뿐만 아니라 이전에 스텐트의 사용과 연관된 합병증인 재발협착증 및 혈액 응고를 방지한다 (Aoji et al . 2005 J Am Coll Cardiol. 45(10):1574-9). 스텐트를 필요로 하는 환자에 대한 성과를 개선시킬 뿐만 아니라 심혈관 우회 수술을 필요로 하는 환자와도 관련이 있다. 예를 들어, 항-EPC 항체로 피복된 보족 혈관(인공 동맥)은 우회 수술 이식을 위해 환자 다리 또는 팔로부터 동맥을 사용할 필요가 없다. 이것은 수술 및 마취 시간을 감소시키고 이어서 관상 수술 사망을 감소시킬 것이다. DVD-Ig은 세포 보강을 촉진시키는 이식된 장치상에 피복된 단백질(또는 지질 및 폴리사카라이드를 포함하지만 이에 제한되지 않는 임의의 종류의 에피토프) 뿐만 아니라 세포 표면 마커(CD34와 같은)에 결합되도록 하는 방식으로 디자인된다. 당해 방법은 또한 일반적으로 기타 의학적 이식체에 적용될 수 있다. 또는, DVD-Ig은 의료 장치에 피복될 수 있고 이식 및 장치로부터 모든 DVD가 방출되는 즉시(또는 이미 로딩된 DVD-Ig의 노화 및 변성을 포함하는 추가의 신선한 DVD-Ig을 필요로 할 수 있는 임의의 기타 요구시), 당해 장치는 신선한 DVD-Ig을 환자에게 전신 투여하여 재로딩될 수 있고 이때, DVD-Ig은 목적하는 표적(사이토킨, 세포 표면 마커(예를 들어, CD34)등)에 결합하도록 디자인되고 이는 장치상에 피복된 표적(지질, 폴리사카라이드 및 중합체를 포함하지만 이에 제한되지 않는 임의의 종류의 단백질, 에피토프를 포함함)에 대한 한 세트의 결합 부위와 다른 결합 부위를 갖는다. 당해 기술은 피복된 이식체의 유용성을 연장시키는 이점을 갖는다.
한 양태에서, DVD-Ig은 비세포독성 탄소 나노튜브(CNT)에 부착되어 조직, 예컨대 종양 조직에 대한 표적화된다. CNT는 근적외선(NIR) 유래의 에너지를 흡수할 때 열을 방출한다. DVD-Ig이 종양 항원(들)에 결합하면 NIR에 대한 비침습적 노출은 NIR 범위 내의 종양을 제거한다(Chakravarty, P. et al.(2008) Proc.Natl.Acad.Sci. 105: 8697-8702).
A. 다양한 질환에서
DVD
-
Ig
의 용도
본 발명의 DVD-Ig 분자는 또한 다양한 질환을 치료하기 위한 치료학적 분자로서 유용하다. 당해 DVD 분자는 특정 질환에 관련된 하나 이상의 표적에 결합할 수 있다. 다양한 질환에서 당해 표적의 예는 하기된 바와 같다.
1. 사람 자가면역 및 염증 반응
많은 단백질은 일반적인 자가면역 및 염증 반응에 연관되어 있고 다음을 포함한다: C5, CCL1 (I-309), CCL11 (에오탁신), CCL13 (mcp-4), CCL15 (MIP-1d), CCL16 (HCC-4), CCL17 (TARC), CCL18 (PARC), CCL19, CCL2 (mcp-1), CCL20 (MIP-3a), CCL21 (MIP-2), CCL23 (MPIF-1), CCL24 (MPIF-2 /에오탁신-2), CCL25 (TECK), CCL26, CCL3 (MIP-1a), CCL4 (MIP-1b), CCL5 (RANTES), CCL7 (mcp-3), CCL8 (mcp-2), CXCL1, CXCL10 (IP-10), CXCL11 (I-TAC / IP-9), CXCL12 (SDF1), CXCL13, CXCL14, CXCL2, CXCL3, CXCL5 (ENA-78 / LIX), CXCL6 (GCP-2), CXCL9, IL13, IL8, CCL13 (mcp-4), CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CR1, IL8RA, XCR1 (CCXCR1), IFNA2, IL10, IL13, IL17C, IL1A, IL1B, IL1F10, IL1F5, IL1F6, IL1F7, IL1F8, IL1F9, IL22, IL5, IL8, IL9, LTA, LTB, MIF, SCYE1 (내피 단핵구 활성화 사이토킨), SPP1, TNF, TNFSF5, IFNA2, IL10RA, IL10RB, IL13, IL13RA1, IL5RA, IL9, IL9R, ABCF1, BCL6, C3, C4A, CEBPB, CRP, ICEBERG, IL1R1, IL1RN, IL8RB, LTB4R, TOLLIP, FADD, IRAK1, IRAK2, MYD88, NCK2, TNFAIP3, TRADD, TRAF1, TRAF2, TRAF3, TRAF4, TRAF5, TRAF6, ACVR1, ACVR1B, ACVR2, ACVR2B, ACVRL1, CD28, CD3E, CD3G, CD3Z, CD69, CD80, CD86, CNR1, CTLA4, CYSLTR1, FCER1A, FCER2, FCGR3A, GPR44, HAVCR2, OPRD1, P2RX7, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, BLR1, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL11, CCL13, CCL15, CCL16, CCL17, CCL18, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CX3CL1, CX3CR1, CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL10, CXCL11, CXCL12, CXCL13, CXCR4, GPR2, SCYE1, SDF2, XCL1, XCL2, XCR1, AMH, AMHR2, BMPR1A, BMPR1B, BMPR2, C19orf10 (IL27w), CER1, CSF1, CSF2, CSF3, DKFZp451J0118, FGF2, GFI1, IFNA1, IFNB1, IFNG, IGF1, IL1A, IL1B, IL1R1, IL1R2, IL2, IL2RA, IL2RB, IL2RG, IL3, IL4, IL4R, IL5, IL5RA, IL6, IL6R, IL6ST, IL7, IL8, IL8RA, IL8RB, IL9, IL9R, IL10, IL10RA, IL10RB, IL11, IL11RA, IL12A, IL12B, IL12RB1, IL12RB2, IL13, IL13RA1, IL13RA2, IL15, IL15RA, IL16, IL17, IL17R, IL18, IL18R1, IL19, IL20, KITLG, LEP, LTA, LTB, LTB4R, LTB4R2, LTBR, MIF, NPPB, PDGFB, TBX21, TDGF1, TGFA, TGFB1, TGFB1I1, TGFB2, TGFB3, TGFBI, TGFBR1, TGFBR2, TGFBR3, TH1L, TNF, TNFRSF1A, TNFRSF1B, TNFRSF7, TNFRSF8, TNFRSF9, TNFRSF11A, TNFRSF21, TNFSF4, TNFSF5, TNFSF6, TNFSF11, VEGF, ZFPM2, RNF110 (ZNF144), FGF 패밀리, PLGF, DLL4 및 NPR-1. 한 측면에서, 상기 열거된 하나 이상의 표적에 결합할 수 있는 DVD-Ig가 제공된다.
염증 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
2. 천식
알레르기성 천식은 상승된 혈청 IgE 수준 뿐만 아니라 호산구증가증, 배상세포 이형성증, 상피 세포 변화, 기도 과민반응 (AHR), 및 Th2 및 Th1 사이토킨 발현의 존재를 특징으로 한다. 현재 기도 염증이, T 세포, B 세포, 호산구, 비만세포 및 대식세포의 복합 상호작용 및 사이토킨 및 케모킨을 포함하는 이들의 분비 매개체의 상호작용을 포함하는, 천식 병리학의 주요 인자인 것으로 광범위하게 수긍되고 있다. 코르티코스테로이드는 오늘날 천식에 대해 가장 중요한 소염 치료제이지만 이의 작용 기작은 비특이적이고 특히 어린 환자 집단에서 안전성 문제가 존재한다. 따라서 보다 특이적이고 표적화된 치료제의 개발이 요구된다. 마우스에서 IL-13이, 호산구 염증과는 무관하게, AHR, 점액 과분비 및 기도 섬유증을 포함하는 천식의 많은 특징을 모방하고 있다는 증거가 증가하고 있다 (Finotto et al., International Immunology (2005), 17(8), 993-1007; Padilla et al., Journal of Immunology (2005), 174(12), 8097-8105).
IL-13은 천식과 연관된 병리학적 반응을 유발하는데 주요 역할을 가짐으로서 관련되어 있다. 폐에서 IL-13의 효과를 감소시키는 항-IL-13 mAb 치료제 개발은 신규 천식 치료제의 개발을 위해 상당히 전망있는 흥미로운 신규 방법이다. 그러나, 상이한 면역학적 경로의 기타 매개체가 또한 천식 병리에 연관되어 있고 IL-13 뿐만 아니라 이들 매개체를 차단하는 것이 추가의 치료학적 이득들 제공할 수 있다. 당해 표적 쌍은 IL-13, 및 종양 괴사 인자-α (TNF-α)와 같은 염증촉진성 사이토킨을 포함하지만 이에 제한되지 않는다. TNF-α는 천식에서 염증 반응을 증폭시킬 수 있고 질환 중증도와 관련될 수 있다 (McDonnell, et al., Progress in Respiratory Research (2001), 31(New Drugs for Asthma, Allergy and COPD), 247-250.). 이것은 IL-13 및 TNF-α 둘다의 차단이 특히, 심각한 기도 질환에서 이로운 효과를 가질 수 있음을 시사한다. 바람직한 양태에서, 본 발명의 DVD-Ig은 표적 IL-13 및 TNFα에 결합하고 천식을 치료하기 위해 사용된다.
염증 및 AHR 둘다가 평가될 수 있는 OVA 유도된 천식 마우스 모델과 같은 동물 모델은 당업계에 공지되어 있고 천식을 치료하는 다양한 DVD-Ig의 능력을 측정하는데 사용될 수 있다. 천식을 연구하기 위한 동물 모델은 문헌[참조: Coffman, et al., Journal of Experimental Medicine (2005), 201(12), 1875-1879; Lloyd, et al., Advances in Immunology (2001), 77, 263-295; Boyce et al., Journal of Experimental Medicine (2005), 201(12), 1869-1873; 및 Snibson, et al., Journal of the British Society for Allergy and Clinical Immunology (2005), 35(2), 146-52]에 기재되어 있다. 당해 표적 쌍의 통상적인 안전성 평가 뿐만 아니라, 면역억제 정도에 대한 특이적 시험이 요구될 수 있고 최상의 표적 쌍을 선별하는데 도움이 된다(문헌참조: Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257).
상기된 추론 및 효능 및 안전성에 대한 동일한 평가 모델을 사용함을 기초로, DVD-Ig 분자가 결합할 수 있고 천식을 치료하는데 유용한 기타 표적 쌍을 측정할 수 있다. 바람직하게, 당해 표적은 IL-13과 IL-1베타(IL-1 베타는 또한 천식에서 염증 반응에 연관되어 있다); 염증에 관여하는 IL-13 및 사이토킨과 케모킨, 예를 들어 IL-13과 IL-9; IL-13과 IL-4; IL-13과 IL-5; IL-13과 IL-25; IL-13과 TARC; IL-13과 MDC; IL-13과 MIF; IL-13과 TGF-β; IL-13과 LHR 효능제; IL-13과 CL25; IL-13과 SPRR2a; IL-13과 SPRR2b; 및 IL-13과 ADAM8을 포함하지만 이에 제한되지 않는다. 본 발명은 또한 하기의 그룹으로 이루어진 그룹으로부터 선택되는 천식에 연관된 하나 이상의 표적과 결합할 수 있는 DVD-Ig을 제공한다: CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNA1, IFNB1, IFNG, 히스타민 및 히스타민 수용체, IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL13, IL14, IL15, IL16, IL17, IL18, IL19, KITLG, PDGFB, IL2RA, IL4R, IL5RA, IL8RA, IL8RB, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24,CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR, 및 키티나제.
천식을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
3.
류마티스성
관절염
전신성 질환인 류마티스 관절염(RA)는 관절 활막에서의 만성 염증 반응을 특징으로 하고 연골의 퇴화 및 관절 인접 골의 부식과 연관되어 있다. TNF, 케모킨 및 성장 인자를 포함하는 많은 염증 촉진 사이토킨은 환부 관절에서 발현된다. RA의 마우스 모델에 항-TNF 항체 또는 sTNFR 융합 단백질 융합 단백질의 전신성 투여는 소염 및 관절 보호성인 것으로 나타났다. RA 환자에서 TNF의 활성이 정맥내 투여되는 인플릭시마브에 차단된 임상적 연구 (Harriman G, Harper LK, Schaible TF. 1999 Summary of clinical trials in rheumatoid arthritis using infliximab, an anti-TNFalpha treatment. Ann Rheum Dis 58 Suppl 1:I61-4)에서, 키메라 항-TNF mAb는 TNF가 IL-6, IL-8, MCP-1 및 VEGF의 생산, 면역 및 염증 세포의 관절로의 보강, 혈관형성 및 매트릭스 메탈로프로테이나제-1 및 3의 혈액 수준의 감소를 조절한다는 증거를 제공했다. 류마티스 관절염에서 염증 경로의 보다 나은 이해를 통해 류마티스 관절염에 연관된 기타 치료학적 표적을 동정하게 되었다. 인터류킨-6 길항제(IL-6 수용체 항체 MRA, 개발자 Chugai, Roche (Nishimoto, Norihiro et al., Arthritis & Rheumatism (2004), 50(6), 1761-1769 참조), CTLA4Ig (아바타셉트, Genovese Mc et al 2005 Abatacept for rheumatoid arthritis refractory to tumor necrosis factor alpha inhibition. N Engl J Med. 353:1114-23.), 및 항-B 세포 치료(리툭시마브, Okamoto H, Kamatani N. 2004 Rituximab for rheumatoid arthritis. N Engl J Med. 351:1909)와 같은 전망있는 치료제가 지난해에 걸쳐 무작위 조절된 시험에서 이미 시험되었다. 인터류킨-15(치료용 항체 HuMax-IL_15, AMG 714; Baslund, Bo et al., Arthritis & Rheumatism (2005), 52(9), 2686-2692 참조), 인터류킨-17 및 인터류킨-18을 포함하는 기타 사이토킨이 동정되었고 동물 모델에서 이로운 것으로 나타났고 이들 제제의 임상적 시험이 진행중에 있다. 항-TNF와 또 다른 매개체를 병용하는 이원 특이적 항체 치료는 임상적 효능 및/또는 환자 보호에 큰 잠재력을 갖는다. 예를 들어, TNF 및 VEGF 둘다를 차단함으로써 RA의 병리생리학에 연관된 염증 및 혈관형성을 잠재적으로 근절시킬 수 있다. RA에 관여하는 다른 표적 쌍, 예컨대 비제한적으로 TNF 및 PGE2; TNFα 및 IL-18; TNFα 및 IL-12; TNFα 및 IL-23; TNFα 및 IL-1베타; TNFα 및 MIF; TNFα 및 IL-17; TNFα 및 IL-17A; TNFα 및 IL-17F; TNFα 및 IL-17C; TNFα 및 IL-15; TNFα 및 VEGF; TNFα 및 OX40; TNFα 및 OX40L; TNFα 및 BAFF; TNFα 및 CD20; TNFα 및 HMGB1; TNFα 및 히스타민; TNFα 및 RAGE; TNFα 및 CXCL12; TNFα 및 CTLA4; TNFα 및 Cad-11; TNFα 및 Wnt5A; TNFα 및 ADMATS-4; TNFα 및 ADMATS-5; TNFα 및 ADMATS-4/5; TNFα 및 MMP13; TNFα 및 MMP1; TNFα 및 MMP3; TNFα 및 MMP4; TNFα 및 RANKL; TNFα 및 SOST; TNFα 및 DKK1; TNFα 및 LRP5/6; TNFα 및 크레멘(Kremen); TNFα 및 SFRPS; TNFα 및 IL-6; TNFα 및 IL-32; TNFα 및 IL-33; TNFα 및 IL-6R; TNFα 및 카뎁신(Cathepsin) K; TNFα 및 브래디키닌(Bradykinin); TNFα 및 NGF; PGE2 및 CTLA4; PGE2 및 IL-1b; PGE2 및 IL-12; PGE2 및 IL-23; PGE2 및 IL-15, PGE2 및 IL-17; PGE2 및 IL-17A; PGE2 및 IL-17F; PGE2 및 IL-17C; PGE2 및 IL-18; PGE2 및 IL-6; PGE2 및 IL-6R; PGE2 및 gp130; PGE2 및 BAFF; S1P 및 PGE2, EGFR (서열 1) 및 PGE2, EGFR (서열 2) 및 PGE2, 및 IGFR 및 PGE2, PGE2 및 Abeta (서열 1, 2, 또는 3), PGE2 및 ADMATS-4; PGE2 및 ADMATS-5; PGE2 및 ADMATS-4/5; PGE2 및 MMP-1; PGE2 및 MMP-3; PGE2 및 MMP-4; PGE2 및 MMP-13; PGE2 및 카뎁신 K; PGE2 및 브래디키닌; PGE2 및 RANKL; PGE2 및 DKK1; PGE2 및 SOST; PGE2 및 NGF; PGE2 및 RAGE; PGE2 및 S1P; PGE2 및 IL-15; PGE2 및 VEGF; PGE2 및 캐드헤린(Cadherin)의 특정 DVD Ig에 의한 차단도 고찰된다. 이들 표적 쌍에 대한 통상적인 안전성 평가뿐만 아니라 면역 억제 정도에 대한 특정 시험이 요구될 수 있고 표적 쌍을 선별하는데 도움이 된다(문헌참조: Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization(1992), 77 99-102; Hart et al., Journal of Allergy and Clinical Immunology (2001), 108(2), 250-257). DVD Ig 분자가 류마티스 관절염 치료를 위해 유용할 것인지의 여부는 콜라겐 유도된 관절염 마우스 모델과 같은 임상전 동물 RA 모델을 사용하여 평가할 수 있다. 기타 유용한 모델은 또한 당업계에 널리 공지되어 있다(문헌 참조: Brand DD., Comp Med. (2005) 55(2):114-22). 사람 및 마우스 이종상동체에 대한 모 항체의 교차 반응성에 기초하여(예컨대, 사람 및 마우스 TNF, 사람 및 마우스 IL-15 등의 반응성), 마우스 CIA 모델에서 확인 연구는 "부합성 대리 항체(matched surrogate antibody)" 유래의 DVD-Ig 분자를 이용하여 수행할 수 있으며; 간략히 설명하면, 2종(또는 그 이상의) 마우스 표적 특이적 항체에 기초한 DVD-Ig은 사람 DVD-Ig 작제에 사용된 모 사람 또는 사람화된 항체의 특징에 가능한 정도로 부합될 수 있다(유사한 친화성, 유사한 중화 효능, 유사한 반감기 등).
4. 전신 홍반성 낭창(
SLE
)
SLE의 면역병리학적 특징은 폴리클로날 B 세포가 활성화되어 글로불린 과다 혈증, 자가항체 생산 및 면역 복합체의 형성이 유도된다는 것이다. 기본적인 비정상적 현상은 T 세포가, 일반화된 T 세포 조절불능으로 인해 막아야 될 B 세포 클론을 억제하지 못한다는 것이다. 또한, B 및 T-세포 상호작용은, 제2 시그널을 개시하는 CD40과 CD40L, B7과 CD28 및 CTLA-4와 같은 공동 자극 분자 뿐만 아니라 여러 사이토킨(예를 들어, IL-10)에 의해 촉진된다. 이들 상호작용은, 면역 복합체 및 아폽토시스 물질에 대한 식세포 제거의 손상과 함께 면역 반응을 존속시키고 조직 손상이 유발된다. 하기의 표적이 SLE에 연관될 수 있고 잠재적으로 치료학적 중재를 위한 DVD-Ig 방법(B 세포 표적 치료)을 위해 잠재적으로 사용될 수 있다: CD-20, CD-22, CD-19, CD28, CD4, CD80, HLA-DRA, IL10, IL2, IL4, TNFRSF5, TNFRSF6, TNFSF5, TNFSF6, BLR1, HDAC4, HDAC5, HDAC7A, HDAC9, ICOSL, IGBP1, MS4A1, RGS1, SLA2, CD81, IFNB1, IL10, TNFRSF5, TNFRSF7, TNFSF5, AICDA, BLNK, GALNAC4S-6ST, HDAC4, HDAC5, HDAC7A, HDAC9, IL10, IL11, IL4, INHA, INHBA, KLF6, TNFRSF7, CD28, CD38, CD69, CD80, CD83, CD86, DPP4, FCER2, IL2RA, TNFRSF8, TNFSF7, CD24, CD37, CD40, CD72, CD74, CD79A, CD79B, CR2, IL1R2, ITGA2, ITGA3, MS4A1, ST6GAL1, CD1C, CHST10, HLA-A, HLA-DRA, 및 NT5E.; 공동 자극 시그널: CTLA4 또는 B7.1/B7.2; B 세포 생존 억제: BlyS, BAFF; 보체 불활성화: C5; 사이토킨 조절. 주요 원리는 임의의 조직에서 총 생물학적 반응이 염증 촉진 또는 소염 사이토킨의 국소적 수준간에 이의 균형에 따른 결과인 것이다(문헌참조: Sfikakis PP et al 2005 Curr Opin Rheumatol 17:550-7). SLE는 혈청중에서 IL-4, IL-6, IL-10이 상승하는 것으로 입증된 Th-2 유발 질환인 것으로 간주된다. IL-4, IL-6, IL-10, IFN-α, PGE2, 및 TNF-α로 이루어진 그룹으로부터 선택되는 하나 이상의 표적과 결합할 수 있는 DVD Ig가 또한 고려된다. 상기 논의된 표적의 조합은 SLE에 대한 치료학적 효능을 증진시킬 것이고 이것은 다수의 낭창 임상전 모델에서 시험될 수 있다(문헌참조: Peng SL (2004) Methods Mol Med.;102:227-72). 사람 및 마우스 이종상동체에 대한 모 항체의 교차 반응성에 기초하여(예컨대, 사람 및 마우스 CD20, 사람 및 마우스 인터페론 알파 등에 대한 반응성), 마우스 루프스 모델에서 확인 연구는 "부합성 대리 항체" 유래의 DVD-Ig 분자를 이용하여 수행할 수 있으며; 간략히 설명하면, 2종(또는 그 이상의) 마우스 표적 특이적 항체에 기초한 DVD-Ig은 사람 DVD-Ig 작제에 사용된 모 사람 또는 사람화된 항체의 특징에 가능한 정도로 부합될 수 있다(유사한 친화성, 유사한 중화 효능, 유사한 반감기 등).
SLE를 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
5. 다발성 경화증
다발성 경화증 (MS)은 병인이 명백하게 미지인 복합 사람 자가면역형 질환이다. 신경계 전반에 걸친 미엘린 염기성 단백질(MBP)의 면역학적 파괴는 다발성 경화증의 주요 병리이다. MS는 CD4+ 및 CD8+ T 세포에 의한 침투를 포함하는 복합 병리 질환이고 중추 신경계내 반응 질환이다. 사이토킨, 반응성 질소 종 및 공동자극 인자 분자의 CNS내 발현은 모두 MS에서 기재되었다. 주로 고려되는 것은 자가면역 발병에 기여하는 면역학적 기작이다. 특히, 항원 발현, 사이토킨 및 백혈구 상호작용 및 조절 T-세포는 Th1 및 Th2 세포와 같은 기타 T-세포의 균형/조절을 도와주고 치료학적 표적 동정을 위해 중요한 영역이다.
IL-12는 염증 촉진 사이토킨이고 APC에 의해 생성되어 Th1 이펙터 세포의 분화를 촉진한다. IL-12는 MS를 앓는 환자 및 EAE에 걸린 동물의 발생 병변에서 생성된다. 이전에, IL-12 경로에서의 간섭은 설치류에서 EAE를 예방하고 항-IL-12 mAb를 사용한 IL-12p40의 생체내 중화는 통상의 마모셋에서 미엘린 유도된 EAE 모델에서 이로운 효과를 갖는 다는 것을 보여주었다.
TWEAK는 TNF 계열의 구성원이고, 염증 촉진, 증식 또는 아폽토시스 효과가 세포 유형에 의존하는 중추 신경계(CNS)내에서 항상성으로 발현된다. 이의 수용체인 Fn14는 내피 세포, 반응성 성상세포 및 뉴런에 의해 CNS에서 발현된다. TWEAK 및 Fn14 mRNA 발현은 실험적 자가면역 뇌척수염(EAE) 동안에 척수에서 증가된다. C57BL/6 마우스에서 미엘린 올리고수지상세포 당단백질(MOG) 유도된 EAA에서 항-TWEAK 항체 처리는 마우스가 적응(priming) 기간 후 처리되는 경우 질환 중증도 및 백혈구 침투를 감소시킨다.
본 발명의 한 측면은 PGE, PGE1, PGE2, S1P, S1P1, S1P2, S1P3, S1P4, S1P5, S1P5, VLA-4, CD44, RAGE, 포스파티딜 세린(PS), 리소포스파타이드 산(LPA), IL-12, TWEAK, IL-23, CXCL13, CD40, CD40L, IL-18, VEGF, VLA-4, TNF, CD45RB, CD200, IFN감마, GM-CSF, FGF, C5, CD52, 및 CCR2로 이루어진 그룹으로부터 선택되는 하나 이상, 예컨대 2개의 표적과 결합할 수 있는 DVD Ig 분자에 관한 것이다. 한 양태는 MS의 치료에 이로운 치료제로서 이원-특이적 항-IL-12/TWEAK DVD Ig을 포함한다.
MS를 치료하기 위한 DVD 분자의 유용성을 평가하기 위한 여러 동물 모델은 당업계에 공지되어 있다 (문헌참조: Steinman L, et al., (2005) Trends Immunol. 26(11):565-71; Lublin FD., et al., (1985) Springer Semin Immunopathol.8(3):197-208; Genain CP, et al., (1997) J Mol Med. 75(3):187-97; Tuohy VK, et al., (1999) J Exp Med. 189(7):1033-42; Owens T, et al., (1995) Neurol Clin.13(1):51-73; 및 't Hart BA, et al., (2005) J Immunol 175(7):4761-8). 사람 및 동물 종 이종상동체에 대한 모 항체의 교차 반응성에 기초하여(예컨대, 사람 및 마우스 IL-12, 사람 및 마우스 TWEAK 등의 반응성), 마우스 EAE 모델에서 확인 연구는 "부합성 대리 항체" 유래의 DVD-Ig 분자를 이용하여 수행할 수 있으며; 간략히 설명하면, 2종(또는 그 이상의) 마우스 표적 특이적 항체에 기초한 DVD-Ig은 사람 DVD-Ig 작제에 사용된 모 사람 또는 사람화된 항체의 특징에 가능한 정도로 부합될 수 있다(유사한 친화성, 유사한 중화 효능, 유사한 반감기 등). 이와 동일한 개념을 다른 비-설치류 종의 동물 모델에 적용하고, 여기서 "부합성 대리 항체" 유래의 DVD-Ig은 예상 약리학 및 가능하다면 안전성 연구로 선택할 수 있다. 또한, 이러한 표적 쌍의 통상적인 안전성 평가 외에, 면역억제 정도에 대한 특이적 검사는 최고의 표적 쌍을 선택하는데 도움이 되고 보증이 될 수 있다(문헌참조: Luster et al., Toxicology (1994), 92(1-3), 229-43; Descotes, et al., Developments in biological standardization (1992), 77 99-102; Jones R. 2000 Rovelizumab (ICOS Corp). IDrugs.3(4):442-6).
MS를 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 및 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
6. 패혈증
패혈증의 병태생리학은 그람 음성 유기체의 외막 성분(리포폴리사카라이드[LPS], 지질 A, 내독소) 및 그람 양성 유기체의 외막 성분(리포테이코산, 펩티도글리칸)에 의해 개시된다. 이들 외막 성분은 단핵구의 표면상의 CD14 수용체와 결합할 수 있다. 이어서 최근에 보고된 톨(toll)형 수용체에 의해, 시그널은 세포로 전달되어 결국 염증 촉진 사이토킨 종양 괴사 인자-알파(TNF-알파) 및 인터류킨-1(IL-1)의 생성을 유발한다. 압도적인 염증 및 면역 반응은 패혈성 쇼크의 필수적 특징이고 조직 손상, 다발성 기관 부전증 및 패혈증 유도된 사멸의 병리에 중추 역할을 한다. 사이토킨, 특히, 종양 괴사 인자 (TNF) 및 인터류킨 (IL)-1은 패혈성 쇼크의 중요한 매개체인 것으로 밝혀졌다. 이들 사이토킨은 조직에 대한 직접적인 독성 효과를 갖고 이들은 또한 포스포리파제 A2를 활성화시킨다. 이들 및 기타 효과는 혈소판 활성화 인자의 농도를 증가시키고 산화질소 신타제 활성을 촉진시키고 호중구에 의한 조직 침투를 촉진시키고 호중구 활성을 촉진시킨다.
종양괴사인자는 저혈압, 심근 억제, 혈관 누수 증후군, 기관 괴사, 독성 2차 매개인자의 방출 자극 및 응혈 캐스캐이드의 활성화를 포함하는 생물학적 효과를 가진 패혈증의 병태생리에 확립된 역할을 한다(Tracey, K.J. and Cerami, A.(1994) Annu. Rev. Med. 45: 491-503; Russell, D and Thompson, R.C.(1993) Curr. Opin. Biotech. 4: 714-721). 프로스타글란딘 E2 합성 및 대사는 화상 및 외상 시에 증가한다(Hahn, E.L. and Gamelli, R.L.(2000) J. Trauma. 49: 1147-1154). 따라서, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 패혈성 쇼크, 화상, 외상, 내독소 쇼크, 그램 음성 패혈증 및 독성 쇼크 증후군을 비롯한 임의의 임상 환경에서 패혈증을 치료하는데 사용할 수 있다.
패혈증 및 패혈성 쇼크의 치료는 임상적 난제로서 남아있고 염증 반응에 겨냥된 생물학적 반응 개질제(즉, 항-TNF, 항-MIF)를 사용한 최근 기대되는 시험이 단지 약간의 임상적 이득을 나타내었다. 최근에, 관심이 면역 억제의 수반된 기간을 역전시키는 것을 목표로 하는 치료쪽으로 전환되었다. 실험 동물 및 중증 환자에 대한 연구는 림프성 기관 및 몇몇 유조직의 증가된 아폽토시스가 당해 면역 억제, 아네르기 및 기관계 기능부전에 기여하는 것임을 입증하였다. 패혈증 증후군 동안에, 림프구 아폽토시스는 IL-12의 부재 또는 글루코코르티코이드, 그랜자임 또는 소위 '사멸' 사이토킨, 종양 괴사 인자 알파 또는 Fas 리간드의 방출에 의해 유발될 수 있다. 아폽토시스는 세포질 및/또는 미토콘드리아 카스파제의 자가 활성화를 통해 진행하고, 당해 카스파제는 Bcl-2 계열의 아폽토시스 촉진 및 항-아폽토시스 구성원에 의해 영향받을 수 있다. 실험적 동물에서, 아폽토시스의 억제제를 사용한 치료로 림프구 세포 아폽토시스를 방지할 수 있을 뿐만 아니라 이것은 또한 당해 결과를 개선시킬 수 있다. 항-아폽토시스 제제를 사용한 임상적 시도는 대부분 이들의 투여 및 조직 표적화와 연관된 기술적 어려움으로 인해 아득하지만 림프구 아폽토시스의 억제는 패혈성 환자에 대한 매력적인 치료학적 표적을 나타낸다. 또한, 염증 매개체 및 아폽토시스 매개체를 표적화하는 이원 특이적 제제는 부가 이득을 가질 수 있다.
더욱이, 패혈증 치료를 위해 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 인터류킨-1 저해제(예컨대, PCT 공개번호 WO 92/16221 및 WO 92/17583에 기술된 것), 사이토킨 인터류킨-6(예컨대, PCT 공개번호 WO 93/11793 참조) 또는 혈소판 활성화 인자의 길항물질(예컨대 유럽 특허출원 공개번호 EP 374 510 참조)과 같이 패혈증을 더욱 경감시킬 수 있는 하나 이상의 추가 치료제와 함께 공동투여할 수 있다.
또한, 바람직한 양태에서, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 치료 시기에 IL-6의 혈청 또는 혈장 농도가 500 pg/ml 이상, 더욱 바람직하게는 1000 pg/ml인 패혈증 환자의 서브그룹에 속하는 사람 피검체에게 투여된다(PCT 공개번호 WO 95/20978, Daum, L., et al.).
본 발명의 한 측면은 하기의 표적으로 이루어진 그룹으로부터 선택되는, 패혈증에 연관된 하나 이상의 표적, 한 양태에서 2개의 표적에 결합할 수 있는 DVD Ig에 관한 것이다: PGE, PGE1, PGE2, S1P, S1P1, S1P2, S1P3, S1P4, S1P5, RAGE, VLA-4, CD44, RAGE, HMGB1, S100, TNF, IL-1, MIF, IL-6, IL-8, IL-18, IL-12, IL-23, FasL, LPS, 톨형 수용체, TLR-4, 조직 인자, MIP-2, ADORA2A, CASP1, CASP4, IL10, IL1B, NFKB1, PROC, TNFRSF1A, CSF3, IL10, IL1B, IL6, ADORA2A, CCR3, IL10, IL1B, IL1RN, MIF, NFKB1, PTAFR, TLR2, TLR4, GPR44, HMOX1, 미드킨, IRAK1, NFKB2, SERPINA1, SERPINE1, 및 TREM1. 패혈증에 대한 당해 DVD Ig의 효능은 당업계에 공지된 임상전 동물 모델에서 평가될 수 있다(문헌참조: Buras JA, et al.,(2005) Nat Rev Drug Discov. 4(10):854-65 및 Calandra T, et al., (2000) Nat Med. 6(2):164-70).
패혈증을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
7. 신경학적 장애
7.1. 신경퇴행성 질환
만성 신경퇴행성 질환은 일반적으로 연령 의존적 질환이고 신경 기능의 점진적인 상실(뉴런 세포사, 탈수초화), 운동성 상실 및 기억 상실을 특징으로 한다. 만성 신경퇴행성 질환(예를 들어, 알츠하이머 질환)을 뒷받침하는 기작에 대한 새로운 지식은 복합적 병인을 보여주고 다양한 인자, 예를 들어, 혈당 상태, 아밀로이드 생산 및 다량체화, 수용체 RAGE(AGE에 대한 수용체)에 결합하는 진전된 당화 최종 생성물의 축적, 증가된 뇌 산화 스트레스, 감소된 뇌 혈류, 염증성 사이토킨 및 케모킨을 포함하는 신경염증, 뉴런 기능부전 및 소교 세포 활성화가 이들의 발병 및 진행에 기여하는 것으로 인지되었다. 따라서, 이들 만성 신경퇴행성 질환은 다발성 세포 유형 및 매개체간에 복잡한 상호작용을 나타낸다. 당해 질환에 대한 치료 전략은 제한되고 대부분 비특이적 소염제(예를 들어, 코르티코스테로이드, COX 억제제)로 염증 과정을 차단하거나 당해 제제로 뉴런 상실 및/또는 시냅스 기능을 차단하는 것으로 구성된다. 이들 치료는 질환 진행을 중지시키는데 실패한다. 최근 연구는 가용성 A-b 펩타이드(A-b 올리고머 형태를 포함함)에 대한 항체와 같은 보다 표적화된 치료가 질환 진행의 중지를 도와줄 수 있을 뿐만 아니라 기억의 유지를 도와줄 수 있음을 시사한다. 이들 예비 관찰은 하나 이상의 질환 매개체(예를 들어, A-b, 및 TNF와 같은 염증 촉진 사이토킨)를 표적화하는 특정 치료가 단일 질환 기작(예를 들어, 가용성 A-b 단독)을 표적화하여 관찰되는 것보다 만성 신경퇴행성 질환에 대해 보다 우수한 치료학적 효능을 제공할 수 있음을 시사한다(문헌참조: C.E. Shepherd, et al, Neurobiol Aging. 2005 Oct 24; Nelson RB., Curr Pharm Des. 2005;11:3335; William L. Klein.; Neurochem Int. 2002 ;41:345; Michelle C Janelsins, et al., J Neuroinflammation. 2005 ;2:23; Soloman B., Curr Alzheimer Res. 2004;1:149; Igor Klyubin, et al., Nat Med. 2005;11:556-61; Arancio O, et al., EMBO Journal (2004) 1-10; Bornemann KD, et al., Am J Pathol. 2001;158:63; Deane R, et al., Nat Med. 2003;9:907-13; 및 Eliezer Masliah, et al., Neuron. 2005;46:857).
본 발명의 DVD-Ig 분자는 알츠하이머와 같은 만성 신경퇴행성 질환에 연관된 하나 이상의 표적에 결합할 수 있다. 당해 표적은 AD 병리학에 연관된 임의의 매개체, 가용성 또는 세포 표면, 예를 들어, AGE(S100 A, 암포테린), 염증 촉진 사이토킨(예를 들어, IL-1), 케모킨(예를 들어, MCP 1), 신경 재생을 억제하는 분자(예를 들어, Nogo, RGM A), 신경 성장을 증진시키는 분자(뉴로트로핀)를 포함하지만 이에 제한되지 않는다. DVD-Ig 분자의 효능은 아밀로이드 전구체 단백질 또는 RAGE를 과발현하고 알츠하이머 질환 유사 증상을 나타내는 유전자전이 마우스와 같은 임상전 동물 모델에서 유효할 수 있다. 또한, DVD-Ig 분자는 작제되고 동물 모델에서 효능에 대해 시험될 수 있고 사람 환자에서 시험하기 위한 최상의 치료학적 DVD-Ig가 선택될 수 있다. DVD-Ig 분자는 또한 파킨슨 질환과 같은 기타 신경퇴행성 질환의 치료를 위해 사용될 수 있다. 알파-시누클레인은 파킨슨 병리학에 관여한다. 알파-시누클레인 및 염증 매개체(예를 들어, PGE, PGE1, PGE2, RAGE, HMGB1, S100, TNF, IL-1, MCP-1)를 표적화할 수 있는 DVD-Ig은 파킨슨 질환에 대해 효과적인 치료임을 입증할 수 있고 본 발명에 고려된다.
신경학적 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
7.2 신경 재생 및
척수
손상
병리학적 기작의 지식이 증가했음에도 불구하고 척수 손상(SCI)은 여전히 황무지인 상태이고 고도의 의학적 요구를 특징으로 하는 의학적 징후를 나타낸다. 대부분의 척수는 타박상이거나 압착 손상이고 1차 손상은 일반적으로 2차 손상 기작(염증 매개체, 예를 들어, 사이토킨 및 케모킨)에 따른 것이고 이것은 초기 손상을 악화시키고 환부를, 때때로 10배 이상으로 증대시킨다. SCI에서 이들 1차 및 2차 기작은 기타 수단에 의해 유발되는 뇌손상, 예를 들어, 뇌졸중의 기작이 매우 유사하다. 어떠한 만족할만한 치료가 존재하지 않고 메틸프레드니솔론(MP)의 고 투여량의 일시 주사가 손상 후 8시간의 좁은 시간 범위에서만 사용되는 치료이다. 그러나, 당해 치료는 단지 임의의 상당한 기능적 회복 없이 2차 손상을 예방하기 위해 의도된다. 명백한 효능의 부재 및 후속 감염 및 중증 조직학적 근육 변형을 갖는 면역억제와 같이 중증 역효과 때문에 가혹하게 비판받고 있다. 내인성 소행 잠재력을 자극하는 어떠한 다른 약물, 생물학적 또는 소분자도 승인되지 않았지만 최근해에 SCI의 동물 모델에서 전망있는 치료 원리 및 약물 후보가 효능을 나타내었다. 사람 SCI에서 기능적 회복의 부재는 대부분, 환부, 상처 조직, 미엘린에서 및 손상 관련 세포상에서 신경돌기 성장을 억제하는 인자에 의해 유발된다. 당해 인자는 미엘린 연관 단백질 NogoA, OMgp 및 MAG, RGM A, 상처 연관 CSPG(콘드로이틴 설페이트 프로테오글리칸) 및 반응성 성상세포에 대한 억제 인자(몇몇 세마포린 및 에프린)이다. 그러나, 환부에는 성장 억제 인자뿐만 아니라 뉴로트로핀, 라미닌, L1 및 기타와 같은 신경돌기 성장 자극 인자가 존재한다. 신경돌기 성장 억제 및 성장 촉진 분자의 전체적 효과는 NogoA 또는 RGM A와 같은 단일 인자의 차단이, 억제 영향의 감소가 성장 억제로부터 성장 촉진으로의 균형을 전환시킬 수 있기 때문에, 설치류 SCI 모델에서 기능적으로 상당히 회복시킴을 설명할 수 있다. 그러나, 단일 신경돌기 과증식 억제 분자를 차단함으로써 관찰되는 회복은 완전하지 않다. 보다 신속하고 보다 명백한 회복을 달성하기 위해, Nogo 및 RGM A와 같은 2개의 신경돌기 과증식 억제 분자를 차단하거나 신경돌기 과증식 억제 분작를 차단하고 신경돌기 과증식 증진 분자(예를 들어, Nogo 및 뉴로트로핀)의 기능을 증진시키거나 신경돌기 과증식 억제 분자(Nogo 및 염증 촉진 분자, 예를 들어, TNF)를 차단하는 것이 바람직할 수 있다 (문헌참조: McGee AW, et al., Trends Neurosci. 2003;26:193; Marco Domeniconi, et al., J Neurol Sci. 2005;233:43; Milan Makwana1, et al., FEBS J. 2005;272:2628; Barry J. Dickson, Science. 2002;298:1959; Felicia Yu Hsuan Teng, et al., J Neurosci Res. 2005;79:273; Tara Karnezis, et al., Nature Neuroscience 2004; 7, 736; Gang Xu, et al., J. Neurochem.2004; 91; 1018).
한 측면에서, NgR과 RGM A; NogoA와 RGM A; MAG과 RGM A; OMGp와 RGM A; RGM A와 RGM B; CSPG와 RGM A; 아그레칸, 미드킨, 뉴로칸, 베르시칸, 포스파칸, Te38 및 TNF-α; Aβ 글로불로머 특이적 항체와 같은 표적 쌍과 결합할 수 있는 DVD-Ig가 수지상세포 및 액손 발아를 촉진하는 항체와 배합되어 제공된다. 수지상세포 병리는 AD에 대한 매우 조기 징후이고 NOGO A가 수지상세포 성장을 제한시키는 것으로 공지되어 있다. 당업자는 당해 유형의 ab를 SCI-후보물(미엘린-단백질) Ab와 배합할 수 있다. 기타 DVD-Ig 표적은 NgR-p75, NgR-Troy, NgR-Nogo66 (Nogo), NgR-Lingo, Lingo-Troy, Lingo-p75, MAG 또는 Omgp의 조합체를 포함할 수 있다. 추가로, 표적은 또한 신경돌기의 억제에 연관된 임의의 매개체, 가용성 또는 세포 표면, 예를 들어, Nogo, Ompg, MAG, RGM A, 세마포린, 에프린, 가용성 A-b, 염증 촉진 사이토킨(예를 들어, IL-1), 케모킨(예를 들어, MIP 1a), 신경 소행을 억제하는 분자를 포함할 수 있다. 항-nogo/항-RGM A 또는 유사한 DVD-Ig 분자의 효능은 척수 손상의 임상전 동물 모델에서 유효할 수 있다. 또한, 이들 DVD-Ig 분자가 작제될 수 있고 동물 모델에서 효능에 대해 시험될 수 있고 최상의 치료학적 DVD-Ig가 사람 환자에서 시험하기 위해 선택될 수 있다. 또한, 단일 수용체, 예를 들어, 3개의 리간드 Nogo, Ompg 및 MAG와 결합하는 Nogo 수용체 및 A-b 및 S100 A와 결합하는 RAGE상에 2개의 별도의 결합 부위를 표적화하는 DVD-Ig 분자가 작제될 수 있다. 추가로, 신경돌기 과증식 억제제, 예를 들어, nogo 및 nogo 수용체는 또한 다발성 경화증과 같은 면역학적 질환에서 신경 재생을 방지하는 역할을 한다. nogo-nogo 수용체 상호작용의 억제는 다발성 경화증의 동물 모델에서 회복을 증진시키는 것으로 나타났다. 따라서, 하나의 면역 매개체, 예를 들어, IL-12와 같은 사이토킨의 기능 및 신경돌기 과증식 억제제 분자, 예를 들어, nogo 또는 RGM의 기능을 을 차단할 수 있는 DVD-Ig 분자는 면역 또는 신경돌기 억제제 분자만을 차단하는 것보다 신속하고 보다 큰 효능을 제공할 수 있다.
척수 손상을 치료하거나 신경세포 재생을 촉진하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
8. 종양학적 장애
모노클로날 항체 치료는 암에 대한 중요한 치료학적 방식으로서 나타났다 (von Mehren M, et al. (2003). Annu Rev Med.;54:343-69). 항체는 아폽토시스, 재지시된 세포독성, 리간드-수용체 상호작용의 간섭을 유도하거나 신생물 표현형에 중요한 단백질의 발현을 차단함에 의해 항종양 효과를 발휘할 수 있다. 또한, 항체는 종양 미세환경의 성분을 표적화하여 종양 연관 혈관형성과 같은 중요한 구조물을 교란시킬 수 있다. 항체는 또한 리간드가 성장 인자인 수용체, 예를 들어, 상피 성장 인자 수용체를 표적화할 수 있다. 따라서, 당해 항체는 표적화된 종양 세포에 결합하여 세포 성장을 자극하는 중성 리간드를 억제한다. 또는, 항체는 항-이디오타입 네트워크, 보체 매개 세포독성 또는 항체 의존성 세포성 세포 독성(ADCC)를 유도할 수 있다. 2개의 별도의 종양 매개체를 표적화하는 이원-특이적 항체의 사용은 단일 특이적 치료에 비하여 추가의 이득을 제공할 것이다.
종양 괴사 인자는 악액질 유도, 종양 성장 자극, 전이능 증가 및 악성종양의 세포독성 매개에 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조). COX-2는 유방, 위, 폐 및 췌장 등의 암에서 과잉발현되고 PGE2를 비롯한 많은 프로스타글란딘의 생성을 야기한다. NSAID 및 COX-1/2 저해제는 종양 모델에서 효과적인 것으로 나타났다. 또한, 항-PGE2 항체는 다수의 다른 악성종양의 예방/치료에 광범한 관련이 있을 수 있다(Chell, S. and Kaidi A. Biochim Biophys Acta.(2006) 1766: 104-119). 따라서, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 악성종양의 치료, 종양 성장 또는 두경부 암, 폐암, 위암, 전립선암, 췌장암을 비롯한, 이에 국한되지 않는 종양의 전이를 억제하고/하거나 악성종양에 2차적인 악액질을 경감시키는데 사용될 수 있다. DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 전신 투여하거나 또는 종양 부위에 국소적으로 투여할 수 있다.
다른 양태에서, 본 발명의 DVD는 PGE2 및 IGF1, 2, PGE2 및 Erb2B, PGE2 및 VEGFR, PGE2 및 IGFR, PGE2 및 EGFR, PGE2 및 CD20, PGE2 및 CD138, PGE2 및 CD40, PGE2 및 CD38, VEGF 및 포스파티딜세린; VEGF 및 ErbB3; VEGF과 PLGF; VEGF 및 ROBO4; VEGF 및 BSG2; VEGF 및 CDCP1; VEGF 및 ANPEP; VEGF 및 c-MET; HER-2 및 ERB3; HER-2 및 BSG2; HER2- 및 CDCP1; HER-2 및 ANPEP; EGFR 및 CD64; EGFR 및 BSG2; EGFR 및 CDCP1; EGFR 및 ANPEP; IGF1R 및 PDGFR; IGF1R 및 VEGF; IGF1R 및 CD20; CD20 및 CD74; CD20 및 CD30; CD20 및 DR4; CD20 및 VEGFR2; CD20 및 CD52; CD20 및 CD4; HGF 및 c-MET; HGF 및 NRP1; HGF 및 포스파티딜세린; ErbB3 및 IGF1R; ErbB3 및 IGF1,2; c-Met 및 Her-2; c-Met 및 NRP1; c-Met 및 IGF1R; IGF1,2 및 PDGFR; IGF1,2 및 CD20; IGF1,2 및 IGF1R; IGF2 및 EGFR; IGF2 및 HER2; IGF2 및 CD20; IGF2 및 VEGF; IGF2 및 IGF1R; IGF1 및 IGF2; PDGFRa 및 VEGFR2; PDGFRa 및 PLGF; PDGFRa 및 VEGF; PDGFRa 및 c-Met; PDGFRa 및 EGFR; PDGFRb 및 VEGFR2; PDGFRb 및 c-Met; PDGFRb 및 EGFR; RON 및 c-Met; RON 및 MTSP1; RON 및 MSP; RON 및 CDCP1; VGFR1 및 PLGF; VGFR1 및 RON; VGFR1 및 EGFR; VEGFR2 및 PLGF; VEGFR2 및 NRP1; VEGFR2 및 RON; VEGFR2 및 DLL4; VEGFR2 및 EGFR; VEGFR2 및 ROBO4; VEGFR2 및 CD55; LPA 및 S1P; EPHB2 및 RON; CTLA4 및 VEGF; CD3 및 EPCAM; CD40 및 IL6; CD40 및 IGF; CD40 및 CD56; CD40 및 CD70; CD40 및 VEGFR1; CD40 및 DR5; CD40 및 DR4; CD40 및 APRIL; CD40 및 BCMA; CD40 및 RANKL; CD28 및 MAPG; CD80 및 CD40; CD80 및 CD30; CD80 및 CD33; CD80 및 CD74; CD80 및 CD2; CD80 및 CD3; CD80 및 CD19; CD80 및 CD4; CD80 및 CD52; CD80 및 VEGF; CD80 및 DR5; CD80 및 VEGFR2; CD22 및 CD20; CD22 및 CD80; CD22 및 CD40; CD22 및 CD23; CD22 및 CD33; CD22 및 CD74; CD22 및 CD19; CD22 및 DR5; CD22 및 DR4; CD22 및 VEGF; CD22 및 CD52; CD30 및 CD20; CD30 및 CD22; CD30 및 CD23; CD30 및 CD40; CD30 및 VEGF; CD30 및 CD74; CD30 및 CD19; CD30 및 DR5; CD30 및 DR4; CD30 및 VEGFR2; CD30 및 CD52; CD30 및 CD4; CD138 및 RANKL; CD33 및 FTL3; CD33 및 VEGF; CD33 및 VEGFR2; CD33 및 CD44; CD33 및 DR4; CD33 및 DR5; DR4 및 CD137; DR4 및 IGF1,2; DR4 및 IGF1R; DR4 및 DR5; DR5 및 CD40; DR5 및 CD137; DR5 및 CD20; DR5 및 EGFR; DR5 및 IGF1,2; DR5 및 IGFR, DR5 및 HER-2, EGFR 및 DLL4에 결합할 수 있다. 기타 표적 조합은 EGF/erb-2/erb-3 계열의 하나 이상의 구성원을 포함한다. 종양학적 질환에 관련되고 DVD Ig가 결합할 수 있는 기타 표적(하나 이상)은 다음으로 이루어진 그룹으로부터 선택되는 것들을 포함하지만 이에 제한되지 않는다: PGE2, Muc-1, TRAIL, CD52, CD20, CD19, CD3, CD4, CD8, BMP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, TNF, TNFSF10, BMP6, EGF, FGF1, FGF10, FGF11, FGF12, FGF13, FGF14, FGF16, FGF17, FGF18, FGF19, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GRP, IGF1, IGF2, IL12A, IL1A, IL1B, IL2, INHA, TGFA, TGFB1, TGFB2, TGFB3, VEGF, CDK2, EGF, FGF10, FGF18, FGF2, FGF4, FGF7, IGF1, IGF1R, IL2, VEGF, BCL2, CD164, CDKN1A, CDKN1B, CDKN1C, CDKN2A, CDKN2B, CDKN2C, CDKN3, GNRH1, IGFBP6, IL1A, IL1B, ODZ1, PAWR, PLG, TGFB1I1, AR, BRCA1, CDK3, CDK4, CDK5, CDK6, CDK7, CDK9, E2F1, EGFR, ENO1, ERBB2, ESR1, ESR2, IGFBP3, IGFBP6, IL2, INSL4, MYC, NOX5, NR6A1, PAP, PCNA, PRKCQ, PRKD1, PRL, TP53, FGF22, FGF23, FGF9, IGFBP3, IL2, INHA, KLK6, TP53, CHGB, GNRH1, IGF1, IGF2, INHA, INSL3, INSL4, PRL, KLK6, SHBG, NR1D1, NR1H3, NR1I3, NR2F6, NR4A3, ESR1, ESR2, NR0B1, NR0B2, NR1D2, NR1H2, NR1H4, NR1I2, NR2C1, NR2C2, NR2E1, NR2E3, NR2F1, NR2F2, NR3C1, NR3C2, NR4A1, NR4A2, NR5A1, NR5A2, NR6A1, PGR, RARB, FGF1, FGF2, FGF6, KLK3, KRT1, APOC1, BRCA1, CHGA, CHGB, CLU, COL1A1, COL6A1, EGF, ERBB2, ERK8, FGF1, FGF10, FGF11, FGF13, FGF14, FGF16, FGF17, FGF18, FGF2, FGF20, FGF21, FGF22, FGF23, FGF3, FGF4, FGF5, FGF6, FGF7, FGF8, FGF9, GNRH1, IGF1, IGF2, IGFBP3, IGFBP6, IL12A, IL1A, IL1B, IL2, IL24, INHA, INSL3, INSL4, KLK10, KLK12, KLK13, KLK14, KLK15, KLK3, KLK4, KLK5, KLK6, KLK9, MMP2, MMP9, MSMB, NTN4, ODZ1, PAP, PLAU, PRL, PSAP, SERPINA3, SHBG, TGFA, TIMP3, CD44, CDH1, CDH10, CDH19, CDH20, CDH7, CDH9, CDH1, CDH10, CDH13, CDH18, CDH19, CDH20, CDH7, CDH8, CDH9, ROBO2, CD44, ILK, ITGA1, APC, CD164, COL6A1, MTSS1, PAP, TGFB1I1, AGR2, AIG1, AKAP1, AKAP2, CANT1, CAV1, CDH12, CLDN3, CLN3, CYB5, CYC1, DAB2IP, DES, DNCL1, ELAC2, ENO2, ENO3, FASN, FLJ12584, FLJ25530, GAGEB1, GAGEC1, GGT1, GSTP1, HIP1, HUMCYT2A, IL29, K6HF, KAI1, KRT2A, MIB1, PART1, PATE, PCA3, PIAS2, PIK3CG, PPID, PR1, PSCA, SLC2A2, SLC33A1, SLC43A1, STEAP, STEAP2, TPM1, TPM2, TRPC6, ANGPT1, ANGPT2, ANPEP, ECGF1, EREG, FGF1, FGF2, FIGF, FLT1, JAG1, KDR, LAMA5, NRP1, NRP2, PGF, PLXDC1, STAB1, VEGF, VEGFC, ANGPTL3, BAI1, COL4A3, IL8, LAMA5, NRP1, NRP2, STAB1, ANGPTL4, PECAM1, PF4, PROK2, SERPINF1, TNFαIP2, CCL11, CCL2, CXCL1, CXCL10, CXCL3, CXCL5, CXCL6, CXCL9, IFNA1, IFNB1, IFNG, IL1B, IL6, MDK, EDG1, EFNA1, EFNA3, EFNB2, EGF, EPHB4, FGFR3, HGF, IGF1, ITGB3, PDGFA, TEK, TGFA, TGFB1, TGFB2, TGFBR1, CCL2, CDH5, COL18A1, EDG1, ENG, ITGAV, ITGB3, THBS1, THBS2, BAD, BAG1, BCL2, CCNA1, CCNA2, CCND1, CCNE1, CCNE2, CDH1 (E-카드헤린), CDKN1B (p27Kip1), CDKN2A (p16INK4a), COL6A1, CTNNB1 (b-카테닌), CTSB (카텝신 B), ERBB2 (Her-2), ESR1, ESR2, F3 (TF), FOSL1 (FRA-1), GATA3, GSN (겔솔린), IGFBP2, IL2RA, IL6, IL6R, IL6ST (당단백질 130), ITGA6 (a6 인테그린), JUN, KLK5, KRT19, MAP2K7 (c-Jun), MKI67 (Ki-67), NGFB (NGF), NGFR, NME1 (NM23A), PGR, PLAU (uPA), PTEN, SERPINB5 (마스핀), SERPINE1 (PAI-1), TGFA, THBS1 (트롬보스폰딘-1), TIE (Tie-1), TNFRSF6 (Fas), TNFSF6 (FasL), TOP2A (토포이소머라제 Iia), TP53, AZGP1 (아연-a-당단백질), BPAG1 (플렉틴), CDKN1A (p21Wap1/Cip1), CLDN7 (클라우딘-7), CLU (클러스테린), ERBB2 (Her-2), FGF1, FLRT1 (피브로넥틴), GABRP (GABAa), GNAS1, ID2, ITGA6 (a6 인테그린), ITGB4 (b 4 인테그린), KLF5 (GC Box BP), KRT19 (케라틴 19), KRTHB6 (모발 특이적 II형 케라틴), MACMARCKS, MT3 (메탈로티오넥틴-III), MUC1 (뮤신), PTGS2 (COX-2), RAC2 (p21Rac2), S100A2, SCGB1D2 (리포필린 B), SCGB2A1 (맘마글로빈 2), SCGB2A2 (맘마글로빈 1), SPRR1B (Spr1), THBS1, THBS2, THBS4, 및 TNFα(B94), RON, c-Met, CD64, DLL4, PLGF, CTLA4, 포스파티딜세린, ROBO4, CD80, CD22, CD40, CD23, CD28, CD80, CD55, CD38, CD70, CD74, CD30, CD138, CD56, CD33, CD2, CD137, DR4, DR5, RANKL, VEGFR2, PDGFR, VEGFR1, MTSP1, MSP, EPHB2, EPHA1, EPHA2, EpCAM, PGE2, NKG2D, LPA, SIP, APRIL, BCMA, MAPG, FLT3, PDGFR 알파, PDGFR 베타, ROR1, PSMA, PSCA, SCD1, 및 CD59. PGE2 외에 DVD Ig이 결합할 수 있는 종양 질환에 연루된 바람직한 표적(하나 이상)은 상기 목록 중에서 선택되는 것을 포함하지만, 이에 국한되는 것은 아니다.
종양 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
9. 감염성 질환
종양 괴사 인자 및 프로스타글란딘 E2는 다양한 감염성 질환에서 관찰되는 생물학적 효과를 매개하는데 연루되어 있다. 예를 들어, TNFα는 말라리아에서의 뇌염증 및 모세관 혈전증 및 경색을 매개하는데 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조). 또한, TNFα는 뇌 염증 매개, 혈액-뇌 장벽의 붕괴 유도, 패혈증 쇼크 증후군의 자극 및 수막염에서 정맥 경색의 활성화에도 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조). 또한, TNFα는 악액질 유도, 바이러스 증식 자극 및 후천성 면역결핍증(AIDS)의 중추신경계 손상의 매개에도 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조). 따라서, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 감염성 질환, 예컨대 세균성 수막염(예, 유럽특허출원 공개번호 EP 585 705 참조), 뇌 말라리아, AIDS 및 AIDS-관련 합병증(ARC)(예컨대, 유럽 특허출원 공개번호 EP 230 574), 바이러스에 의해 유도된 특정 병, 예컨대 길랑 바레 증후군, 전염성 단핵증, 기타 바이러스 림프샘 장애 및 헤르페스 바이러스 감염; 뿐만 아니라 이식에 2차적인 사이토메갈로바이러스 감염(예컨대, Fietze, E., et al.(1994) Transplantation 58: 675-680)의 치료에 사용될 수 있다. 또한, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 감염성 질환과 관련된 증상, 예컨대 열 및 감염(예컨대, 인플루엔자)으로 인한 근육통, 및 감염에 2차적인(예컨대, AIDS 또는 ARC에 2차적인) 악액질을 경감시키는데 사용될 수 있다.
감염성 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
10. 이식
종양 괴사 인자 및 프로스타글란딘 E2는 동종이식 거부 및 이식편대숙주질환(GVHD)의 주요 매개인자로서 연루되어 있고, T 세포 수용체 CD3 복합체에 대해 지향성인 래트 항체 OKT3이 신장 이식물의 거부를 억제하는데 사용될 때 관찰되는 부작용을 매개하는데 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조; Eason, J.D., et al.(1995) Transplantation 59: 300-305; Suthanthiran, M. and Strom, T.B.(1994) New Engl. J. Med. 331: 365-375). 따라서, 본 발명의 항체 및 항체 부분은 이식 거부, 예컨대 동종이식편 및 이종이식편의 거부를 비롯한 이식물 거부를 억제하고 GVHD를 억제하는데 사용될 수 있다. DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 단독으로 사용될 수 있고, 더 바람직하게는 동종이식편에 대한 면역 반응을 억제하거나 GVHD를 억제하는 하나 이상의 다른 제제와 함께 사용되는 것이 바람직하다. 예를 들어, 한 양태에서, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 OKT3-유도 반응을 억제하기 위해 OKT3과 함께 사용된다. 다른 양태에서, 본 발명의 항체 또는 항체 부분은 면역 반응을 조절하는데 연루된 다른 표적들, 예컨대 세포 표면 분자 CD25(인터류킨-2 수용체-알파), CD11a(LFA-1), CD54(ICAM-1), CD4, CD45, CD28/CTLA4, CD80(B7-1) 및/또는 CD86(B7-2)에 지향성인 하나 이상의 항체와 함께 사용된다. 또 다른 양태에서, 본 발명의 항체 또는 항체 부분은 사이클로스포린 A 또는 FK506.11과 같은 하나 이상의 광범위 면역억제제와 함께 사용된다.
폐 장애
종양 괴사 인자는 성인 호흡곤란 증후군의 병태생리, 예컨대 백혈구-내피세포 활성화 자극, 폐세포에 대한 세포독성 유도 및 혈관 누수증 유도 등에 연루되어 있다(예컨대, Tracey and Cerami, 상기 문헌 참조). 따라서, 본 발명의 항체 및 항체 부분은 성인 호흡 곤란 증후군(예컨대, PCT 공개번호 WO 91/04054), 쇼크 폐, 만성 폐 염증 질환, 폐 사르코이드증, 폐 섬유증 및 규폐증을 치료하는데 사용될 수 있다. DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 전신으로 또는 폐 표면에 국소적으로, 예컨대 에어로졸로서 투여될 수 있다.
이식 관련 장애를 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
11. 장 장애
종양 괴사 인자 및 프로스타글란딘은 염증성 장 장애의 병태생리에 연루되어 있다(예컨대, Tracy, K.J. et al.(1986) Science 234: 470-474; Sun, X-M., et al.(1988) J.Clin.Invest. 81: 1328-1331; MacDonald, T.T., et al.(1990) Clin. Exp. Immunol. 81: 301-305). 키메릭 쥐 항-hTNFα 항체는 크론 병 치료에 대한 임상 검사를 받았다(van Dullemen, H.M., et al.(1995) Gastroenterology 109: 129-135). 항-TNFα 항체 HUMIRA는 크론 병 치료용으로 승인을 받았다. 또한, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 크론병과 궤양성 대장염, 2 증후군을 포함하는 장 장애, 예컨대 특발성 염증성 장 질환을 치료하는 데에도 사용될 수 있다.
장 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
12. 심장 장애
또한, 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 다양한 심장 장애, 예컨대 심장 허혈(예컨대, 유럽 특허출원 공개번호 EP 453 898) 및 심부전(심근 허약)(예컨대, PCT 공개번호 WO 94/20139 참조)을 치료하는데 사용될 수도 있다.
심장 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
13. 기타
본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분은 또한 TNFα 및/또는 PGE2 활성이 해로운 다양한 다른 장애를 치료하는 데에도 사용될 수 있다. TNFα 및/또는 PGE2 활성이 병태생리에 연루되어 있어 본 발명의 DVD-Ig™ 분자 또는 DVD-Ig™ 부분으로 치료할 수 있는 다른 질환 및 장애의 예로는 염증성 골 장애, 골 성장 질환 및 골 재흡수 질환(예컨대, Bertolini, D. R., et al. (1986) Nature 319:516-518; Konig, A., et al. (1988) J. Bone Miner. Res. 3:621-627; Lerner, U. H. and Ohlin, A. (1993) J. Bone Miner. Res. 8:147-155; 및 Shankar, G. and Stem, P. H. (1993) Bone 14:871-876), 간염, 예컨대 알콜성 간염(예컨대, McClain, C. J. and Cohen, D. A. (1989) Hepatology 9:349-351; Felver, M. E., et al. (1990) Alcohol. Clin. Exp. Res. 14:255-259; 및 Hansen, J., et al. (1994) Hepatology 20:461-474) 및 바이러스성 간염(Sheron, N., et al. (1991) J. Hepatol. 12:241-245; 및 Hussain, M. J., et al. (1994) J. Clin. Pathol. 47:1112-1115), 응고 방해(예컨대, van der Poll, T., et al. (1990) N. Engl. J. Med. 322:1622-1627; 및 van der Poll, T., et al. (1991) Prog. Clin. Biol. Res. 367:55-60), 화상(예컨대, Giroir, B. P., et al. (1994) Am. J. Physiol. 267:H118-124; 및 Liu, X. S., et al. (1994) Burns 20:40-44 참조), 재관류 손상(예컨대, Scales, W. E., et al. (1994) Am. J. Physiol. 267:G1122-1127; Serrick, C., et al. (1994) Transplantation 58:1158-1162; 및 Yao, Y. M., et al. (1995) Resuscitation 29:157-168 참조), 켈로이드 형성(예컨대, McCauley, R. L., et al. (1992) J. Clin. Immunol. 12:300-308 참조), 흉터 조직 형성 및 발열, 알레르기성 관절염, 혈액 장애, 예컨대 용혈성 빈혈 및 혈소판감소증, 내분비 장애, 예컨대 진성당뇨병, 애디슨씨병, 특발성 부갑상선기능저하증 및 만성 림프구 갑상선염, 무월경, 불임, 습관성 유산 및 자간과 같은 생식 장애, 및 나이-관련 황반 변성(AMD)과 같은 안구 장애를 포함한다.
상기 질환을 치료하기 위해 다음과 같은 표적 쌍에 결합할 수 있는 DVD-Ig이 고찰된다: 마우스 또는 사람 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2(실시예 참조).
IV
. 약제학적 조성물
또한, 본 발명은 본 발명의 결합 단백질과 약제학적으로 허용되는 담체를 포함하는 약제학적 조성물을 제공한다. 본 발명의 결합 단백질을 포함하는 약제학적 조성물은 장애를 진단, 검출 또는 모니터링하거나 장애 또는 이의 하나 이상의 증상을 예방, 치료, 처리 또는 완화시키고/시키거나 연구에 사용하기 위한 것이다. 특정 양태에서, 조성물은 본 발명의 하나 이상의 결합 단백질을 포함한다. 또 다른 양태에서, 약제학적 조성물은 본 발명의 하나 이상의 결합 단백질, 및 본 발명의 결합 단백질 이외에 장애를 치료하기 위한 하나 이상의 예방제 또는 치료제를 포함한다. 한 양태에서, 예방제 또는 치료제는 장애 또는 이의 하나 이상의 증상을 예방, 치료, 처리 또는 완화시키는데 유용한 것으로 공지되거나 이에 사용되었거나 현재 사용중인 것들이다. 이들 양태에 따라, 당해 조성물은 담체, 희석제 또는 부형제를 추가로 포함할 수 있다.
본 발명의 결합 단백질은 피검체에 투여하기에 적합한 약제학적 조성물에 혼입될 수 있다. 일반적으로, 약제학적 조성물은 본 발명의 결합 단백질과 약제학적으로 허용되는 담체를 포함한다. 본 명세서에 사용된 바와 같은 "약제학적으로 허용되는 담체"란 용어에는 생리학적으로 화합성인 임의의 모든 용매, 분산 매질, 피복, 항균제 및 항진균제, 등장제 및 흡수 지연제 등이 포함된다. 약제학적으로 허용되는 담체의 예에는 물, 식염수, 인산염 완충 식염수, 덱스트로스, 글리세롤, 에탄올 등 중의 하나 이상 또는 이의 배합물이 포함된다. 일부 양태에서, 조성물에 당과 같은 등장제, 만니톨, 소르비톨과 같은 폴리알콜 또는 염화나트륨이 포함된다. 약제학적으로 허용되는 담체는 추가로 항체 또는 항체 일부의 저장 수명이나 효과를 증강시키는 습윤화제 또는 유화제, 보존제 또는 완충액과 같은 보조 물질을 소량 포함할 수도 있다.
다양한 전달 시스템이 공지되어 있고 장애 또는 이의 하나 이상의 증상을 예방하거나 처리하거나 치료하거나 완화시키는데 유용한 본 발명의 하나 이상의 항체 또는 본 발명의 조합된 하나 이상의 항체 및 예방제 또는 치료제를 투여하는데 사용될 수 있고, 리포좀내 캅셀화제, 미세입자, 미세캅셀제, 항체 또는 항체 단편을 발현할 수 있는 재조합 세포, 수용체 매개된 세포내이입[Wu and Wu, J. Biol. Chem. 262:4429-4432 (1987)], 레트로바이러스 또는 기타 벡터 등의 일부로서 핵산의 작제를 예로 들 수 있다. 본 발명의 예방제 또는 치료제를 투여하는 방법은 비경구 투여(예를 들어, 피부내, 근육내, 복강내, 정맥내 및 피하), 뇌척수 경막외 투여, 종양내 투여 및 점막 투여 (예를 들어, 비내 및 경구 경로)를 포함하지만 이에 제한되지 않는다. 또한, 흡입기 또는 분무기 및 분무제를 갖는 제형을 사용하는 폐 투여가 사용될 수 있다[미국특허 6,019,968, 5,985,320, 5,985,309, 5,934,272, 5,874,064, 5,855,913, 5,290,540, 및 4,880,078; 및 PCT 공보 WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346, 및 WO 99/66903 참조]. 하나의 양태에서, 본 발명의 결합 단백질, 병용 치료제 또는 본 발명의 조성물은 Alkermes AIR® 폐 약물 전달 기술 (Alkermes, Inc., Cambridge, Mass.)을 사용하여 투여된다. 특정 양태에서, 본 발명의 예방 또는 치료제는 근육내, 정맥내, 종양내, 경구적으로, 비내, 폐 또는 피하로 투여된다. 예방제 또는 치료제는 임의의 간편한 경로, 예를 들어, 주입 또는 일시 주사, 상피 또는 점막 내층(예를 들어, 경구 점막, 직장 및 장내 점막 등)을 통한 흡수에 의해 투여될 수 있고 기타 생물학적 활성제와 함께 투여될 수 있다. 투여는 전신성 또는 국소적일 수 있다.
한 양태에서, 시험관내 종양 세포에 대한 항체-커플링된 탄소 나노튜브(CNT)의 특이적 결합, 그 다음 근적외선(NIR) 광을 이용한 고특이적 절제는 종양 세포를 표적화하는데 사용될 수 있다. 예를 들어, 비오티닐화된 극성 지질은 안정한, 생체융화성, 비세포독성 CNT 분산액을 제조하는데 사용될 수 있고, 이 분산액은 하나 이상의 종양 항원(예: CD22)에 대해 지향성인 하나 또는 2종의 다른 뉴트랄라이트 아비딘-유도체화된 DVD-Ig에 부착된다(Chakravarty, P. et al.(2008) Proc. Natl. Acad. Sci. USA 105: 8697-8702).
특정 양태에서, 치료를 필요로 하는 영역에 본 발명의 예방제 또는 치료제를 국소적으로 투여하는 것이 요구될 수 있다. 이것은 예를 들어, 비제한적으로, 국소 주입, 주사 또는 임플란트에 의해 달성될 수 있고 당해 임플란트는 막 및 매트릭스, 예를 들어, 시알라스틱 막, 중합체, 섬유성 매트릭스(예를 들어, Tissuel®) 또는 콜라겐 매트릭스를 포함하는 다공성 또는 비-다공성 물질로 이루어진다. 한 양태에서, 본 발명의 길항제인 유효량의 하나 이상의 항체는 장애 또는 이의 증상을 예방, 치료, 처리 및/또는 완화시키기 위해 피검체의 환부에 국소적으로 투여된다. 또 다른 양태에서, 본 발명의 유효량의 하나 이상의 항체는 장애 또는 이의 하나 이상의 증상을 예방, 치료, 처리 및/또는 완화시키기 위해 본 발명의 피검체 외에도 유효량의 하나 이상의 치료제(예를 들어, 하나 이상의 예방제 또는 치료제)와 병용하여 피검체의 환부에 국소적으로 투여된다.
또 다른 양태에서, 예방제 또는 치료제는 제어 방출 또는 지연 방출 시스템으로 전달될 수 있다. 한 양태에서, 펌프를 사용하여 제어 또는 지연 방출을 달성할 수 있다(Langer, supra; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:20; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321:574). 또 다른 양태에서, 중합재를 사용하여 본 발명의 치료제의 제어 또는 지연 방출을 달성할 수 있다[Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, Fla. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. Sci. Rev. Macromol. Chem. 23:61; 및 Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 7 1:105); 미국 특허번호 5,679,377; 미국 특허번호 5,916,597; 미국 특허번호 5,912,015; 미국 특허번호 5,989,463; 미국 특허번호 5,128,326; PCT 공보 WO 99/15154; 및 PCT 공보 WO 99/20253]. 지연 방출 제형에 사용되는 중합체의 예는 폴리(2-하이드록시 에틸 메타크릴레이트), 폴리(메틸 메타크릴레이트), 폴리(아크릴산), 폴리(에틸렌-코-비닐 아세테이트), 폴리(메타크릴산), 폴리글리콜리드(PLG), 폴리안하이드라이드, 폴리(N-비닐 피롤리돈), 폴리(비닐 알콜), 폴리아크릴아미드, 폴리(에틸렌 글리콜), 폴리락티드(PLA), 폴리(락티드-코-글리콜리드) (PLGA) 및 폴리오르토에스테르를 포함하지만 이에 제한되지 않는다. 한 양태에서, 지연 방출 제형에 사용되는 중합체는 불활성이고, 누출되는 불순물이 없고, 저장시 안정하고 생분해성이다. 또 다른 양태에서, 제어 또는 지연 방출 시스템은 예방제 또는 치료제와 근접하게 위치됨에 따라서 전신 투여량의 일부만을 필요로 한다(Goodson, Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)).
제어 방출 시스템은 문헌[Langer (1990, Science 249:1527-1533)]에서 논의되었다. 당업자에게 공지된 임의의 기술을 사용하여 본 발명의 하나 이상의 치료제를 포함하는 지연 방출 제형을 제조할 수 있다[미국 특허 4,526,938, PCT 공개번호 WO 91/05548, PCT 공개번호 WO 96/20698, Ning et al., 1996, "Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel," Radiotherapy &Oncology 39:179-189, Song et al., 1995, "Antibody Mediated Lung Targeting of Long-Circulating Emulsions," PDA Journal of Pharmaceutical Science &Technology 50:372-397, Cleek et al., 1997, "Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application," Pro. Int'l. Symp. Control. Rel. Bioact. Mater. 24:853-854, 및 Lam et al., 1997, "Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery," Proc. Int'l. Symp. Control Rel. Bioact. Mater. 24:759-760 참조].
본 발명의 조성물이 예방제 또는 치료제를 암호화하는 핵산인 특정 양태에서, 핵산은 생체내 투여되어 암호화된 예방제 또는 치료제의 발현을 촉진시킬 수 있고 당해 핵산은 적당한 핵산 발현 벡터의 일부로서 구성되고 이것이 세포내로 투여되도록 하며, 예를 들어, 레트로바이러스 벡터(미국 특허 4,980,286) 또는 직접 주사 또는 미세입자 충격(예를 들어, 유전자 총; 바이올리스틱, 듀퐁) 또는 지질 또는 세포 표면 수용체 또는 형질감염제로의 피복을 투여에 사용하거나 핵으로 진입하는 것으로 공지된 호메오박스형 펩타이드에 연결시켜 투여한다(Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868). 또한, 핵산은 세포내로 도입되고 발현을 위해 상동 재조합에 의해 숙주 세포 DNA 내로 통합된다.
본 발명의 약제학적 조성물은 이의 의도된 투여 경로와 양립할 수 있도록 제형화된다. 투여 경로의 예는 비경구, 예를 들어, 정맥내, 피내, 피하, 경구, 비내(예를 들어, 흡입), 경피(예를 들어, 국소), 경점막 및 직장 투여를 포함하지만 이에 제한되지 않는다. 특정 양태에서, 당해 조성물은 사람에게 정맥내, 피하, 근육내, 경구, 비내 또는 경구 투여용으로 채택된 약제학적 조성물로서 통상적인 과정에 따라 제형화된다. 전형적으로, 정맥내 투여용 조성물은 멸균 등장 수성 완충액중의 용액이다. 필요한 경우, 당해 조성물은 또한 가용화제 및 주사 부위에서 통증을 완화하기 위한 리그노캠과 같은 국소 마취제를 함유할 수 있다.
본 발명의 조성물이 국소적으로 투여되어야만 하는 경우, 당해 조성물은 연고, 크림, 경피 패취, 로션, 젤, 샴푸, 분무제, 에어로졸 또는 당업자에게 널리 공지된 기타 형태로 제형화될 수 있다[Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995)]. 한 양태에서, 분무 불가능한 국소 투여 형태를 위해, 통상적으로 국소 적용과 양립할 수 있는 담체 또는 하나 이상의 부형제를 포함하고 물보다 큰 역학 점도를 갖는 조성물이 사용될 수 있다. 적합한 제형은 제한없이 용제, 현탁제, 유제, 크림, 연고, 산제, 도찰제, 고약 등을 포함하고 경우에 따라 이들은 예를 들어, 삼투압과 같은 다양한 성질에 영향을 미치기 위해 보조제(예를 들어, 보존제, 안정화제, 습윤화제, 완충제 또는 염)과 함께 멸균되거나 혼합된다. 기타 적합한 국소 투여 형태는 바람직하게 고체 또는 액체 불활성 담체와 배합된 활성 성분이 가압된 휘발성 물질(예를 들어, 가스 분사제, 예를 들어, 프레온)과의 혼합물 또는 압착병에 팩키징된 분무 가능한 에어로졸 제제를 포함한다. 수분화제 또는 보습제가 또한 경우에 따라 약제학적 조성물 및 투여 형태에 첨가될 수 있다. 당해 추가의 성분의 예는 당업계에 널리 공지되어 있다.
본 발명의 방법이 조성물의 비내 투여를 포함하는 경우, 당해 조성물은 에어로졸 형태, 분무, 연무 또는 적가 형태로 제형화될 수 있다. 특히, 본 발명에 다라 사용하기 위한 예방제 또는 치료제는 간편하게 가압된 팩 또는 분무기로부터 에어로졸 분무 제공 형태로 적합한 분사제(예를 들어, 디클로로디플루오로메탄, 트리클로로플루오로메탄, 디클로로테트라플루오로에탄, 이산화탄소 또는 기타 적합한 가스)의 사용과 함께 전달될 수 있다. 가압된 에어로졸의 경우에, 용량 단위는 계량된 양이 전달되도록 밸브를 설치하여 측정될 수 있다. 흡입기 또는 취입기에 사용하기 위한 캅셀제 및 카트리지(예를 들어, 젤라틴으로 구성된)는 화합물 및 락토스 또는 전분과 같은 적합한 분말 기제의 분말 혼합물을 함유하도록 제형화될 수 있다.
본 발명의 방법이 경구 투여를 포함하는 경우, 당해 조성물은 정제, 캅셀제, 카쉐제, 젤캡, 용제, 현탁제의 형태로 경구적으로 제형화될 수 있다. 정제 또는 캅셀제는 결합제(예를 들어, 예비젤화된 옥수수 전분, 폴리비닐피롤리돈 또는 하이드록시프로필 메틸셀룰로스); 충전재(예를 들어, 락토스, 미세결정 셀룰로스 또는 인산수소칼슘); 윤활제(예를 들어, 마그네슘 스테아레이트, 탈크 또는 실리카); 붕해제(예를 들어, 감자 전분 또는 나트륨 전분 글리콜레이트) 또는 습윤화제(예를 들어, 나트륨 라우릴 설페이트)와 같은 약제학적으로 허용되는 부형제와 함께 통상적인 수단으로 제조될 수 있다. 정제는 당업자에게 널리 공지된 방법으로 피복될 수 있다. 경구 투여용 액상 제제는 제한 없이 용제, 시럽 또는 현탁제 형태를 취할 수 있거나 이들은 사용전에 물 또는 기타 적합한 비히클과의 구성을 위해 무수 생성물로서 제공될 수 있다. 당해 액상 제제는 현탁화제(예를 들어, 소르비톨 시럽, 셀룰로스 유도체 또는 수소화된 식용 지방); 유화제(예를 들어, 렉시틴 또는 아카시아); 비-수성 비히클(예를 들어, 아몬드유, 오일 에스테르, 에틸 알콜 또는 분획화된 식물성 오일) 및 보존제(예를 들어, 메틸 또는 프로필-p-하이드록시벤조에이트 또는 소르브산)와 같은 약제학적으로 허용되는 첨가제를 사용한 통상적인 수단에 의해 제조될 수 있다. 당해 제제는 또한 적절하게 완충염, 방향제, 착색제 및 감미제를 함유할 수 있다. 경구 투여용 제제는 적합하게 예방제 또는 치료제(들)의 느린 방출, 제어 방출 또는 지연 방출용으로 제형화될 수 있다.
본 발명의 방법은 예를 들어, 흡입기 또는 분무기를 사용함에 의한, 분무화제로 제형화된 조성물의 폐 투여를 포함할 수 있다[미국 특허 6,019,968, 5,985,320, 5,985,309, 5,934,272, 5,874,064, 5,855,913, 5,290,540 및 4,880,078; 및 PCT 공보 WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346, 및 WO 99/66903, 이의 각각의 전반적인 내용은 본원에 참조로서 인용된다]. 특정 양태에서, 본 발명 항체, 병용 치료제 및/또는 본 발명의 조성물은 Alkermes AIR® 폐 약물 전달 기술(Alkermes, Inc., Cambridge, Mass.)을 사용하여 투여된다.
본 발명의 방법은 주사(예를 들어, 일시 주사 또는 연속 주입)에 의해 비경구 투여용으로 제형화된 조성물을 투여함을 포함할 수 있다. 주사용 제형은 보존제 첨가와 함께 단위 용량 형태(예를 들어, 앰플 또는 다용량 용기)로 제공될 수 있다. 당해 조성물은 현탁제, 용제 또는 유제와 같은 형태를 취할 수 있고 현탁화제, 가용화제 및/또는 분산제와 같은 제형화제를 함유할 수 있다. 또는, 활성 성분은 사용전에 적합한 비히클(예를 들어, 멸균 발연원 부재 물)과의 구성을 위해 분말 형태일 수 있다.
본 발명의 방법은 추가로 데포(depot) 제조물로 제형화된 조성물의 투여를 포함할 수 있다. 이러한 장기 작용성 제형은 이식(예컨대, 피하 또는 근육내) 또는 근육내 주사에 의해 투여될 수 있다. 따라서, 예를 들어, 조성물은 적당한 중합체 또는 소수성 물질(예: 허용성 오일 중의 에멀젼으로), 또는 이온 교환 수지와 함께 제형화되거나, 난용성 유도체(예: 난용성 염)로 제형화될 수 있다.
본 발명의 방법은 중성 형태 또는 염 형태로 제형화된 조성물의 투여를 포함한다. 약제학적으로 허용되는 염으로는 염산, 인산, 아세트산, 옥살산, 타르타르산 등에서 유래되는 것과 같은 음이온에 의해 형성된 염; 및 나트륨, 칼륨, 암모늄, 칼슘, 수산화제2철, 이소프로필아민, 트리에틸아민, 2-에틸아미노 에탄올, 히스티딘, 프로카인 등에서 유래되는 것과 같은 양이온에 의해 형성된 염을 포함한다.
일반적으로, 조성물의 성분은 별도로 또는 함께 혼합되어 단위 투약 형태, 예컨대 건조 동결건조된 분말 또는 무수 농축물 형태로, 활성제의 양을 나타내는 앰플 또는 사세트와 같은 용봉 용기에 공급된다. 투여 방식이 주입인 경우, 조성물은 멸균 약제학적 등급 수 또는 식염수를 함유하는 주입병에 분배될 수 있다. 투여 방식이 주입에 의한 경우, 주사용 멸균수 또는 식염수의 앰플이 제공되어 투여 전에 성분이 혼합될 수 있다.
구체적으로, 본 발명은 제제의 함량을 나타내는 앰플 또는 사세트와 같은 용봉된 용기에 포장된 하나 이상의 예방요법제 또는 치료요법제, 또는 본 발명의 약제학적 조성물을 제공한다. 한 양태에서, 본 발명의 하나 이상의 예방요법제 또는 치료요법제, 또는 약제학적 조성물은 건식멸균된 동결건조 분말로 제공되거나, 용봉된 용기에 무수 농축물로 제공되며, 피검체에게 투여하기에 적당한 농도로 재구성(예: 물 또는 식염수에 의해)될 수 있다. 한 양태에서, 본 발명의 하나 이상의 예방요법제 또는 치료요법제 또는 약제학적 조성물은 용봉된 용기에 건식멸균된 동결건조 분말로서 적어도 5mg, 적어도 10mg, 적어도 15mg, 적어도 25mg, 적어도 35mg, 적어도 45mg, 적어도 50mg, 적어도 75mg, 또는 적어도 100mg의 단위 투약량으로 공급된다. 본 발명의 동결건조된 예방요법제 또는 치료요법제 또는 약제학적 조성물은 2℃ 내지 8℃ 사이에서 원 용기에 보관되어야 하며, 본 발명의 예방요법제, 치료요법제, 또는 약제학적 조성물은 재구성 후 1주 이내, 예컨대 5일 이내, 72시간 이내, 48시간 이내, 24시간 이내, 12시간 이내, 6시간 이내, 5시간 이내, 3시간 이내 또는 1시간 이내에 투여되어야 한다. 대안적 양태에서, 본 발명의 하나 이상의 예방요법적 또는 치료요법적 제제 또는 약제학적 조성물은 제제의 양 및 농도를 나타내는 용봉된 용기에 액체 형태로 공급된다. 한 양태에서, 투여된 조성물의 액체 형태는 용봉된 용기에 적어도 0.25mg/ml, 적어도 0.5mg/ml, 적어도 1mg/ml, 적어도 2.5mg/ml, 적어도 5mg/ml, 적어도 8mg/ml, 적어도 10mg/ml, 적어도 15mg/ml, 적어도 25mg/ml, 적어도 50mg/ml, 적어도 75mg/ml, 적어도 100mg/ml, 적어도 150mg/ml, 또는 적어도 200mg/ml로 공급된다. 액체 형태는 원 용기에서 2 내지 8℃에서 보관되어야 한다.
본 발명의 결합 단백질은 비경구 투여에 적합한 약제학적 조성물에 혼입될 수 있다. 한 양태에서, 항체 또는 항체부는 0.1 내지 250mg/ml 결합 단백질을 함유하는 주사용 용액으로 제조될 것이다. 주사용 용액은 플린트 또는 호박색 바이알에 액체 또는 동결건조 투약 형태로 구성될 수 있다. 완충액은 L-히스티딘(1 내지 50mM), 최적으로는 5 내지 10mM(pH 5.0 내지 7.0(최적은 pH 6.0))일 수 있다. 다른 적당한 완충액으로는, 석신산나트륨, 시트르산나트륨, 인산나트륨 또는 인산칼륨을 포함하나, 이에 국한되는 것은 아니다. 염화나트륨은 0 내지 300mM(액체 투약 형태에는 최적은 150mM)의 농도로, 용액의 독성을 완화시키는데 사용될 수 있다. 동결건조된 투약 형태에는 동결방지제가 포함될 수 있고, 원칙적으로 0 내지 10% 수크로오스(최적은 0.5 내지 1.0%)가 포함될 수 있다. 다른 적당한 동결보호제로는 트레할로스 및 락토오스가 있다. 팽창제는 동결건조된 투약 형태에 포함될 수 있고, 원칙적으로 1 내지 10%(최적은 2 내지 4%) 만니톨이 있다. 안정제는 약체 및 동결건조된 투약 형태 모두에 사용될 수 있고, 원칙적으로 1 내지 50mM L-메티오닌(최적은 5 내지 10mM)이 있다. 다른 적당한 팽창제로는 글리신, 아르기닌이 있고, 0 내지 0.05% 폴리소르베이트-80(최적은 0.005 내지 0.01%)으로 포함될 수 있다. 추가 계면활성제로는 폴리소르베이트 20 및 BRIJ 계면활성제가 포함되나, 이에 국한되는 것은 아니다. 비경구 투여용 주사 용액으로 제조된 본 발명의 결합 단백질을 함유하는 약제학적 조성물은 추가로 보강제로 유용한 제제, 예컨대 치료 단백질(예: 항체)의 흡수 또는 분산을 증가시키는데 사용되는 보강제로 유용한 제제를 포함할 수 있다. 특히 유용한 보강제는 히알우로니다제, 예컨대 Hylenex®(재조합 사람 히알우로니다제)이다. 주사용 용액에 히알우로니다제의 첨가는 비경구 투여 후, 특히 피하 투여 후 사람 생체이용률을 향상시킨다. 또한, 주사 부위 용량을 늘리면서(즉, 1ml 초과), 통증과 불안을 줄이고 주사 부위 반응의 발생을 최소화할 수 있다(참고 인용된 WO 2004078140 및 US2006104968 참조).
본 발명의 조성물은 다양한 형태일 수 있다. 그 예로는 액체, 반고체 및 고체 투약 형태, 예컨대 액체 용액(예: 주사 용액 및 주입 용액), 분산액 또는 현탁액, 정제, 환제, 분말, 리포좀 및 좌약을 포함한다. 선택되는 형태는 의도한 투여 방식 및 치료 적용에 따라 달라진다. 전형적인 조성물은 주사 용액 또는 주입 용액 형태로, 예컨대 다른 항체에 의한 사람의 수동 면역화에 사용된 것과 유사한 조성물이다. 선택된 투여 방식은 비경구(예: 정맥내, 피하, 복강내, 근육내) 방식이다. 한 양태에서, 항체는 정맥내 주입 또는 주사에 의해 투여된다. 다른 양태에서, 항체는 근육내 또는 피하 주사에 의해 투여된다.
치료 조성물은 일반적으로 멸균되고 제조 및 보관 조건 하에서 안정해야 한다. 조성물은 용액, 마이크로에멀젼, 분산액, 리포좀, 또는 고농도의 약물에 적합한 다른 규정된 구조로 제형화될 수 있다. 멸균 주사 용액은 활성 화합물(즉, 항체 또는 항체부)을 필요한 경우 본 명세서에 열거된 하나 또는 여러 성분들과 함께 적당한 용매에 필요한 양으로 첨가하는 단계, 및 그 다음 여과 멸균하는 단계에 의해 제조될 수 있다. 일반적으로, 분산액은 본 명세서에 열거된 다른 필요 성분 및 염기성 분산 매질을 함유하는 멸균 비히클에 활성 화합물을 첨가하여 제조한다. 멸균된 주사 용액을 제조하기 위한 멸균된 동결건조 분말의 경우, 제조 방법은 앞서 멸균 여과 용액으로부터 활성 성분과 임의의 추가 필요 성분의 분말을 생산하는 진공건조 및 분무건조이다. 용액의 적당한 유동성은, 예컨대 레시틴과 같은 코팅의 사용, 분산액의 경우에는 필요한 입자 크기 유지, 및 계면활성제의 사용 등에 의해 유지될 수 있다. 주사용 조성물의 지속적인 흡수는 조성물에 흡수를 지연시키는 제제, 예컨대 모노스테아레이트 염 및 젤라틴을 첨가함으로써 초래될 수 있다.
본 발명의 결합 단백질은 많은 치료요법적 적용에서이지만 당업계에 공지된 다양한 방법에 의해 투여될 수 있고, 한 양태에 따르면, 투여 경로/방식은 피하 주사, 정맥내 주사 또는 주입이다. 당업자라면 이해할 수 있는 것처럼, 투여 경로 및/또는 방식은 원하는 결과에 따라 달라질 것이다. 특정 양태에서, 활성 화합물은 빠른 방출에 대해 화합물을 보호하는 담체와 함께 제조될 수 있고, 그 예로는 이식, 경피 패치 및 마이크로캡슐화된 전달 시스템과 같은 제어 방출 제형이 있다. 생체분해성, 생체화합성 중합체가 사용될 수 있고, 그 예로는 에틸렌 비닐 아세테이트, 폴리안하이드라이드, 폴리글리콜산, 콜라겐, 폴리오르토에스테르 및 폴리락트산이 있다. 이러한 제형을 제조하는 다수의 방법은 특허되어 있거나 당업자에게 공지된어 있다[예컨대, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978].
특정 양태에서, 본 발명의 결합 단백질은 예컨대 불활성 희석제 또는 동화성 식용 담체와 함께 경구 투여될 수 있다. 화합물(및 필요한 경우 다른 성분)은 또한 경질 또는 연질 외피 젤라틴 캡슐에 동봉되거나, 정제로 압축되거나, 또는 피검체의 식이에 직접 혼입될 수 있다. 경구 치료적 투여인 경우, 화합물은 부형제와 혼합될 수 있고 섭취가능한 정제, 협측 정제, 트로키, 캡슐, 엘리시르, 현탁액, 시럽, 웨이퍼 등의 형태로 사용될 수 있다. 비경구 투여 외에 다른 방식으로 본 발명의 화합물을 투여하기 위해, 당해 화합물은 실활 방지제로 코팅하거나, 실활 방지제와 함께 공동투여할 필요가 있을 수 있다.
또한, 보충 활성 화합물도 조성물에 혼입될 수 있다. 특정 양태에서, 본 발명의 결합 단백질은 본 발명의 결합 단백질과 함께 장애를 치료하는데 유용한 하나 이상의 추가 치료제와 함께 공동제형화 및/또는 공동투여된다. 예를 들어, 본 발명의 결합 단백질은 다른 표적에 결합하는 하나 이상의 추가 항체(예: 다른 사이토킨에 결합하거나 세포 표면 분자에 결합하는 항체)와 함께 공동제형화 및/또는 공동투여될 수 있다. 또한, 본 발명의 하나 이상의 항체는 전술한 치료제 2종 이상과 함께 사용될 수 있다. 이러한 병용 요법은 투여된 치료제의 낮은 투약량을 이용할 수 있게 하여 다양한 단독요법과 관련이 있는 가능한 독성 또는 합병증을 피할 수 있어 유리할 수 있다.
특정 양태에서, 결합 단백질은 당업계에 공지된 반감기 연장 비히클에 결합된다. 이러한 비히클로는 Fc 도메인, 폴리에틸렌 글리콜 및 덱스트란을 포함하나, 이에 국한되는 것은 아니다. 이러한 비히클은 예컨대 미국 특허출원 일련번호 09/428,082 및 PCT 출원 공개번호 WO 99/25044에 기술되어 있다.
특정 양태에서, 본 발명의 결합 단백질 또는 본 발명의 다른 예방요법적 또는 치료요법적 제제를 암호화하는 핵산 서열은 유전자 요법에 의해 장애 또는 이의 하나 이상의 증상을 치료, 예방, 관리 또는 호전시키기 위해 투여한다. 유전자 요법은 발현된 핵산 또는 발현가능한 핵산을 피검체에게 투여하여 수행되는 치료법을 의미한다. 본 발명의 이러한 양태에서, 핵산은 이의 암호화된 항체 또는 예방요법적 또는 치료요법적 효과를 매개하는 본 발명의 예방요법적 제제 또는 치료요법적 제제를 생산한다.
당업계에서 이용할 수 있는 유전자 요법의 임의의 방법은 본 발명에 따라 사용될 수 있다. 유전자 요법의 일반적인 검토에 대해서는 문헌[Goldspiel et al., 1993, Clinical Pharmacy 12:488-505; Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, Science 260:926- 932 (1993); 및 Morgan and Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIBTECH 11(5):155-215]을 참조한다. 사용될 수 있는 재조합 DNA 기술 분야에 널리 공지된 방법은 문헌[Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley &Sons, NY (1993); 및 Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990)]을 참조한다. 유전자요법의 다양한 방법에 대한 상세한 설명은 US2005042664 A1에 개시되어 있다.
본 발명의 결합 단백질은 이 결합 단백질이 인식하는 표적이 유해한 다양한 질환을 치료하는데 유용하다. 이러한 질환으로는, 류마티스성 관절염, 골관절염, 연소성 만성 관절염, 패혈성 관절염, 라임 관절염, 건선 관절염, 반응성 관절염, 척추관절증, 전신 홍반성 낭창, 크론 질환, 궤양 대장염, 장 염증 질환, 인슐린 의존성 진성 당뇨병, 갑상선염, 천식, 알레르기성 질환, 건선, 피부경화증, 이식편 대 숙주 질환, 기관 이식 거부, 기관 이식과 관련된 급성 또는 만성 면역 질환, 유육종증, 동맥경화증, 파종성 혈관내 응고, 가와사키병, 그레이브병, 신증후군, 만성 피로 증후군, 베게너 육아종증, 헤노흐-쇤라인 자반증, 신장의 현미경적 혈관염, 만성 활성 간염, 포도막염, 패혈성 쇼크, 독소 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질환, 기생충 질환, 후천성 면역결핍 증후군, 급성 횡단성 척수염, 헌팅톤 무도병, 파킨슨병, 알츠하이머병, 뇌졸중, 원발성 담즙성 간경변, 용혈성 빈혈, 악성 종양, 심부전증, 심근경색, 애디슨병, 산발성 질환, 다분비선 제I형 결핍증 및 다분비선 제II형 결핍증, 슈미트 증후군, 성인성(급성) 호흡 곤란 증후군, 탈모증, 원형 탈모증, 혈청반응 음성 관절증, 관절증, 라이터병, 건선성 관절증, 궤양성 대장염성 관절증, 장병증성 활막염, 클라미디아증, 예르시니아 및 살모넬라 관련 관절증, 척추관절증, 죽종 질환/동맥경화증, 아토피성 알레르기, 자가면역 수포성 질환, 심상성 천포창, 낙엽성 천포창, 유천포창, 선상 IgA 질환, 자가면역 용혈성 빈혈, 크움즈 양성 용혈성 빈혈, 후천성 악성 빈혈, 연소성 악성 빈혈, 근통성 뇌염/로얄 프리(Royal Free) 질환, 만성 점막 피부 칸디다증, 거세포 동맥염, 원발성 경화성 간염, 잠복성 자가면역 간염, 후천성 면역결핍 질환 증후군, 후천성 면역결핍 관련 질환, B형 간염, C형 간염, 공통 가변성 면역결핍증(공통 가변성 감마글로불린저혈증), 확장형 심근증, 여성 불임증, 난소 부전증, 조숙 난소부전, 섬유성 폐 질환, 잠복성 섬유조직 폐포염, 후-염증성 간질성 폐질환, 간질성 폐렴, 결합 조직 질환 관련 간질성 폐 질환, 조합성 결합 조직 질환 관련 폐 질환, 전신성 경화증 관련 간질성 폐 질환, 류마티스성 관절염 관련 간질성 폐 질환, 전신 홍반성 낭창 관련 폐 질환, 피부근염/다발성 근염 관련 폐 질환, 쇼그렌 질환 관련 폐 질환, 강직성 척추염 관련 폐 질환, 혈관염 범발성 폐 질환, 혈철증 관련 폐 질환, 약물-유도된 간질성 폐 질환, 섬유증, 방사선 섬유증, 폐색성 세기관지염, 만성 호산구성 폐렴, 림프구성 침윤성 폐 질환, 감염후 간질성 폐 질환, 통풍성 관절염, 자가면역 간염, 1형 자가면역 간염(전형적 자가 면역 또는 루포이드 간염), 2형 자가면역 간염(항-LKM 항체 간염), 자가면역 매개된 저혈당증, 흑색 극세포증에 따른 B형 인슐린 내성, 부갑상선 기능저하증, 기관 이식과 관련된 급성 면역 질환, 기관 이식과 관련된 만성 면역 질환, 골관절증, 원발성 경화성 담관염, 1형 건선, 2형 건선, 특발성 백혈구감소증, 자가면역 호중구감소증, 신장 질환 NOS, 사구체신염, 신장의 현미경적 혈관염, 라임병, 원판양 홍반성 낭창, 남성 불임증 특발증 또는 NOS, 정자 자가면역, 다발성 경화증(모든 아형), 교감성 안염, 결합 조직 질환에 속발성인 폐 고혈압증, 구드패스튜어 증후군, 결절성 다발성 동맥염의 폐 징후, 급성 류마티스성 열, 류마티스성 척추염, 스틸씨 병, 전신성 경화증, 쇼그렌 증후군, 다카야스 병/동맥염, 자가면역 혈소판감소증, 특발성 혈소판감소증, 자가 면역 갑상선 질환, 갑상선 기능항진증, 갑상선종증 자가면역 갑상선 기능저하증(하시모토 병), 위축성 자가면역 갑상선 기능저하증, 원발성 점액수종, 수정체성 포도막염, 원발성 혈관염, 백반증 급성 간 질환, 만성 간 질환, 알콜성 경변, 알콜 유도 간 손상, 콜레오사타티스(choleosatatis), 특이체질성 간 질환, 약물 유도 간염, 비알콜성 지방간염, 알레르기 및 천식, B 그룹 스트렙토코커스 (GBS) 감염, 정신 장애(예를 들어, 우울증 및 정신분열증), Th2 형 및 Th1 형 매개 질환, 급성 및 만성 통증(상이한 형태의 통증), 및 폐암, 유방암, 위암, 방광암, 결장암, 췌장암, 난소암, 전립선암 및 직장암과 같은 암종 및 조혈 악성종양(백혈병 및 림프종), 아베타지방단백질혈증, 말초청색증, 급성 및 만성 기생충성 또는 감염성 과정, 급성 백혈병, 급성 림프성모구성 백혈병 (ALL), 급성 골수 백혈병(AML), 급성 또는 만성 세균 감염, 급성 췌장염, 급성 신부전증, 선암종, 공기 이소성 심방박동, AIDS 치매 합병증, 알콜 유도 간염, 알레르기성 결막염, 알레르기성 접촉 피부염, 알레르기성 비염, 동종이식 거부, 알파-l-안티트립신 결핍, 근위축성 측삭 경화증, 빈혈, 앙기나 협심증, 전각 세포 퇴화, 항 cd3 치료, 항 인지질 증후군, 항-수용체 과민성 반응, 대동맥 및 말초 결찰증, 대동맥 해부, 동맥 고혈압, 동맥경화증, 동정맥 누공, 운동실조증, 심방세동 (지연 또는 발작성), 심방조동, 동정맥 막힘, B 세포 림프종, 골 이식 거부, 골수 이식 (BMT) 거부, 좌각차단, 버키트 림프종, 화상, 심장성 부정맥, 심장성 기절 증후군, 심장 종양, 심근증, 심폐 우회 염증 반응, 연골 이식 거부, 소뇌피질 퇴화, 소뇌 장애, 혼란 또는 다초점 심방 빈맥, 화학치료 관련 장애, 만성 골수성 백혈병(CML), 만성 알콜증, 만성 염증 병리, 만성 림프성 백혈병(CLL), 만성 폐쇄 폐 질환(COPD), 만성 살리실레이트 중독, 결장직장 암종, 울혈성 심부전, 결막염, 접촉성 피부염, 폐 심장, 관상 동맥 질환, 크로이츠펠트-야콥(Creutzfeldt-Jakob) 질환, 배양 음성 패혈증, 낭섬유증, 사이토킨 치료 관련 장애, 권투선수치매(Dementia pugilistica), 탈수초성 질환, 댕기 출혈열, 피부염, 피부학적 증상, 당뇨병, 진성 당뇨병, 당뇨병성 동맥경화 질환(diabetic ateriosclerotic disease), 광범위 루이체 질환, 확장성 울혈성 심근증, 기저핵 장애, 중년 다운 증후군, CNS 도파민 수용체 차단 약물에 의해 유도된 약물 유도 운동 장애, 약물 과민증, 습진, 뇌척수염, 심내막염, 내분비질환, 후두개염, 엡스타인-바르 바이러스 감염, 피부홍통증, 추체외로 및 소뇌 장애, 가족성 적혈구잠식성 림프조직구증, 태아 흉선 이식 거부, 프리드리히 운동실조증, 기능성 말초 동맥 장애, 진균 패혈증, 가스괴저, 위궤양, 사구체신염, 임의의 기관 또는 조직 이식 거부, 그람 음성 패혈증, 그람 양성 패혈증, 세포내 기관으로 인한 육아종, 모발 세포 백혈병, 할레로르덴-스파츠 질환(Hallerrorden-Spatz disease), 하시모토 갑상선염, 고초열, 심장 이식 거부, 혈색소증, 혈액투석, 용혈성 요독증후군/혈전성 혈소판감소성 자반증, 출혈, 간염(A), 히스 다발 부정맥, HIV 감염/HIV 신경병증, 호지킨 질환, 과운동성 장애, 과민성 반응, 과민성 폐렴, 고혈압, 운동 부족 장애, 시상하부-뇌하수체-부신피질계 평가, 특발성 애디슨 질환, 특발성 폐 섬유증, 항체 매개 세포독성, 무력증, 유아 척추 근육 위축증, 대동맥 염증, 인플루엔자 A, 이온화 방사선 노출, 홍채섬모체염/자궁염/광학적 신경근염, 허혈 관류 손상, 허혈 뇌졸중, 연소성 류마티스 관절염, 연소성 척추 근육 위축증, 카포시 육종, 신장 이식 거부, 레지오넬라, 리슈마니아증, 나병, 피질척수계 병변, 지방부종, 간 이식 거부, 림프피부종, 말라리아, 악성 림프종, 악성 조직구증, 악성 흑색종, 뇌막염, 수막염 균혈증, 대사/특발성, 편두통, 미토콘드리아 다중 시스템 장애, 복합 연결 조직 질환, 모노클로날 감마글로불린혈증, 다발성 골수종, 다발성 시스템 퇴화(만셀 데제린-토마스 쉬-드라거 및 마차도-조셉), 중증 근무력증, 세포내 마이코박테리움 감염증, 마이코박테리움 결핵, 골수이형성증후군, 심근 경색, 심근 허혈 장애, 비인두 암종, 신생아 만성 폐 질환, 신염, 신증, 신경퇴행성 질환, 신경성 I 근육 위축증, 호중구감소성 발열, 비-호지킨 림프종, 복부 대동맥 및 이의 지류 폐색, 폐색성 동맥 질환, okt3 치료, 고환염/부고환염, 고환염/절관절제술 반전 과정, 기비대, 골다공증, 췌장 이식 거부, 췌장 암종, 부수종양성 증후군/악성 고칼슘혈증, 부갑상선 이식 거부, 골반 염증 질환, 다년성 비염, 심막 질환, 말초 동맥경화 질환, 말초 혈관 장애, 복막염, 악성빈혈, 폐포자충 폐렴, 폐렴, POEMS 증후군 (다발신경병증, 장기비대, 내분비질환, 모노클로날 감마글로불린혈증, 및 피부 변화 증후군), 관류후 증후군, 펌프후 증후군, MI 후 심장절개 증후군, 자간전증, 전진적 상핵 마비, 원발성 폐 고혈압, 방사선 치료, 레이노드 현상 및 질환, 레이노드 질환, 레프섬 질환, 일반 협소 QRS 심근증, 신혈관성고혈압, 재관류 손상, 제한성 심근병증, 육종, 피부경화증, 노인 무도병, 루이체형 노인성 치매, 혈청음성 관절병증, 쇼크, 겸상적혈구 빈혈증, 피부 동종이식 거부, 피부 변화 증후군, 소장 이식 거부, 고형 종양, 특이적 부정맥, 척수운동실조, 척수소뇌 퇴화, 스트렙토코커스 근염, 소뇌 구조적 병변, 아급성 경화성 범뇌염, 실신, 심혈관계 매독, 전신 아나팔락시스, 전신 염증 반응 증후군, 전신 개시 연소성 류마티스 관절염, T-세포 또는 FAB ALL, 말초혈관 확장증, 폐색성 혈전 혈관염, 혈소판감소증, 독성, 이식, 외상/출혈, III형 과민성 반응, IV형 과민성, 불안정 앙기나, 요독증, 요로패혈증, 두드러기, 승모판 심장 질환, 하지 정맥, 혈관염, 정맥동 질환, 정맥종 혈전증, 심실 세동, 바이러스 및 진균 감염, 바이탈 뇌염/무균성 수막염, 바이탈-연관 적혈구식작용 증후군, 베르니케-코르사코프 증후군, 윌슨 질환, 임의의 기관 또는 조직의 이종이식 거부를 포함하지만, 이에 국한되는 것은 아니다(Peritt et al. PCT 공개번호 WO2002097048A2, Leonard et al., PCT 공개번호 WO9524918 A1, 및 Salfeld et al., PCT 공개번호 WO00/56772A1 참조).
본 발명의 DVD-Ig은 또한 다음과 같은 질환 중 하나 이상을 치료할 수 있다: 급성 관상동맥 증후군, 급성 특발성 다발신경염, 급성 염증성 탈수초성 다발성신경병증, 급성 허혈, 성인 스틸씨병, 원형 탈모증, 아나필락시스, 항-인지질 항체 증후군, 재생불량성 빈혈, 동맥경화증, 아토피성 습진, 아토피성 피부염, 자가면역 피부염, 스트렙토코커스 감염과 관련된 자가면역 장애, 자가면역 청각 상실, 자가면역 림프증식 증후군(ALPS), 자가면역 심근염, 자가면역 혈소판감소증(AITP), 안검염, 기관지확장증, 수포성 유천포창, 심혈관 질환, 격변성 항인지질 증후군, 셀리악병, 경부척추증, 만성 허혈, 흉터성 유천포창, 다발경화증의 위험이 있는 임상 분리 증후군(CIS), 결막염, 유년기 개시 정신병, 만성 폐색성 폐질환(COPD), 누낭염, 피부근염, 당뇨 신장병, 진성 당뇨병, 추간판 헤르니아, 추간판 탈출증, 약물 유도 면역 용혈성 빈혈, 심내막염, 자궁내막증, 안구내염, 상공막염, 다형홍반, 주요 다형홍반, 임신성 유천포창, 길랑-바레 증후군(GBS), 건초열, 휴그 증후군, 특발성 파킨슨병, 특발성 사이질 폐렴, IgE-매개 알레르기, 면역 용혈성 빈혈, 봉입체 근염, 감염성 눈 염증, 염증성 탈수초성 질환, 염증성 심장 질환, 염증성 신장 질환, IPF/UIP, 홍채염, 각막염, 건성각막결막염, 쿠스마울 질환 또는 쿠스마울-마이어 질환, 랜드리 마비, 랑게르한스 세포 조직구증, 망상피반, 황반변성, 현미경적 다발혈관염, 베크테레브병, 운동 신경 장애, 점막 유천포창, 다발 기관 손상, 중증근무력증, 골수형성이상 증후군, 심근염, 신경근 장애, 신경병, 비-A 비-B 간염, 시각신경염, 골용해, 난소암, 소수관절 JRA, 말초 동맥 폐색 질환(PAOD), 말초 혈관 질환(PVD), 말초 동맥 질환(PAD), 정맥염, 결절성 다발동맥염(또는 결절성 동맥주위염), 다발연골염, 류마티스성 다발근육통, 백모증, 다관절 JRA, 다중내분비 결핍 증후군, 다발근육염, 류마티스성 다발근육통(PMR), 펌프 후 증후군, 원발성 파킨슨증, 전립선 및 직장 암 및 조혈성 악성종양(백혈병 및 림프종), 전립선염, 진정적혈구계 무형성, 부신피질부전, 재발 시신경척수염, 재협착증, 류마티스성 심장 질환, SAPHO(윤활막염, 여드름, 농포증, 골과다증 및 골염), 피부경화증, 2차 아밀로이드증, 쇼크 폐, 공막염, 좌골신경통, 2차 부신부전, 실리콘 관련 결합조직 질환, 스네던-윌킨슨 피부병, 강직 척추염, 스티븐슨-존슨 증후군(SJS), 전신 염증 반응 증후군, 관자동맥염, 톡소플라스마성 비염, 독소 표피 괴사용해, 횡단성 골수염, TRAPS(종양 괴사 인자 수용체, 1형 알레르기 반응, II형 당뇨병, 두드러기, 일반 사이질폐렴(UIP), 혈관염, 봄철 결막염, 바이러스 비염, 보그트-코야나기-하라다 증후군(VKH 증후군), 젖은 황반 변성 및 상처 치유.
본 발명의 결합 단백질은 자가면역 질환, 구체적으로 염증 관련 질환, 예컨대 류마티스성 관절염, 척추염, 알레르기, 자가면역 당뇨병, 자가면역 포도막염 등을 앓고 있는 사람의 치료에 사용될 수 있다. 한 양태에서, 본 발명의 결합 단백질 또는 이의 항원 결합부는 류마티스성 관절염, 크론병, 다발성 경화증, 인슐린 의존 진성 당뇨병 및 건선의 치료에 사용되는 것이 바람직하다.
한 양태에서, 본 발명의 조성물 및 방법으로 치료되거나 진단될 수 있는 질환으로는 원발성 및 전이성 암, 예컨대 유방, 결장, 직장, 폐, 입인두, 후두인두, 식도, 위, 췌장, 간, 방광 및 담관, 소장, 요로(예컨대, 신장, 방광 및 요로상피), 여성 생식관(예컨대, 자궁경부, 자궁, 및 난소뿐만 아니라 융모막암종 및 임신영양막병), 남성 생식관(예컨대, 전립선, 정낭, 고환 및 생식세포종양), 내분비선(예컨대, 갑상선, 부신 및 뇌하수체), 및 피부의 암종뿐만 아니라 혈관종, 흑색종, 육종(예컨대, 카포시 육종뿐만 아니라 골조직 및 연조직 유래 육종), 뇌, 신경, 눈 및 수막의 종양(예컨대, 성상세포종, 신경아교종, 아교모세포종, 망막모세포종, 신경종, 신경모세포종, 슈반세포종, 수막종), 백혈병과 같은 조혈계 악성종양 유래의 고형암, 및 림프종(호지킨 및 비-호지킨 림프종)을 포함하나, 이에 국한되는 것은 아니다.
한 양태에서, 본 발명의 항체 또는 이의 항원결합부는 단독으로 또는 방사선요법 및/또는 다른 화학요법 제제와 함께 사용되어, 본 명세서에 기술된 종양 유래의 전이를 예방하거나 암을 치료하는데 사용된다.
본 발명의 항체 또는 이의 항원결합부는 항신생물제, 방사선요법, 화학요법, 예컨대 DNA 알킬화제, 시스플라스틴, 카르보플라틴, 항-튜불린 제제, 파클리탁셀, 도세탁셀, 탁솔, 독소루비신, 젬시타빈, 젬자르, 안트라사이클린, 아드리아마이신, 토포이소머라제 I 저해제, 토포이소머라제 II 저해제, 5-플루오로우라실(5-FU), 류코보린, 이리노테칸, 수용체 티로신 키나제 저해제(예: 에를로티니브, 제피티니브), COX-2 저해제(예: 셀레콕시브), 키나제 저해제 및 siRNA를 포함하나, 이에 국한되지 않는 제제와 배합될 수 있다.
바람직하게는, 본 발명의 결합 단백질 또는 이의 항원결합부는 류마티스성 관절염, 소아 관절염, 류마티스성 척추염, 강직 척추염, 골관절염, 통풍 관절염, 건선 관절염, 건선, 알레르기, 다발성 경화증, 탈수초성 질환, 자가면역 질환, 전신홍반 루푸스, 신증후군, 골관절염 통증, 관절염 통증, 신경세포 통증, 패혈성 쇼크, 화상, 외상, 내독소 쇼크, 그램 음성 패혈증, 독소 쇼크 증후군, 이식, 이식편대숙주 질환(GVHD), 숙주대이식편 질환(HVGD), 두경부암, 폐암, 위암, 전립선암, 췌장암, 악성종양에 2차적인 악액질, 세균성 수막염, 뇌 말라리아, AIDS, AIDS-관련 합병증(ARC), 길랑 바레 증후군, 전염성 단핵증, 바이러스 림프샘 장애, 헤르페스 바이러스 감염, 이식에 2차적인 사이토메갈로바이러스 감염, 감염(예, 인플루엔자)으로 인한 열 및 근육통, 감염에 2차적인(예컨대, AIDS 또는 ARC에 2차적인) 악액질, 성인 호흡곤란 증후군, 쇼크 폐, 만성 폐렴 질환, 폐 사이코이드증, 폐 섬유증 및 규토증, 특발성 염증성 장 질환, 크론병 및 궤양성 대장염, 심장 허혈, 심부전(심근 허약), 염증성 골 장애, 골 성장 질환, 골 재흡수 질환, 간염, 알콜성 간염, 바이러스성 간염, 응고 방해, 화상, 재관류 손상, 켈로이드 형성, 흉터조직 형성, 발열, 알레르기성 관절염, 혈액 장애, 예컨대 용혈성 빈혈 및 혈소판감소증, 내분비 장애, 예컨대 진성당뇨병, 애디슨씨병, 특발성 부갑상선기능저하증 및 만성 림프구 갑상선염, 생식 장애, 무월경, 불임, 습관성 유산, 자간, 안구 장애, 나이-관련 황반 변성(AMD)을 포함한다.
또한, 본 발명의 결합 단백질은 각종 질환의 치료에 유용한 하나 이상의 추가 치료제와 함께 투여될 수 있다.
본 발명의 결합 단백질은 전술한 질환의 치료에 단독으로 또는 배합물로서 사용될 수 있다. 당해 결합 단백질은 단독으로 사용되거나 또는 의도한 목적에 따라 당업자에 의해 선택된 추가 제제, 예컨대 치료제와 함께 사용될 수 있는 것으로 이해되어야 한다. 예를 들어, 추가 제제는 본 발명의 항체에 의해 치료되는 질환이나 증상의 치료에 유용한 것으로 당업계에서 인식된 치료제일 수 있다. 또한, 추가 제제는 치료 조성물에 유익한 특성을 부여하는 제제, 예컨대 조성물의 점도에 유효한 제제일 수 있다.
또한, 본 발명에 포함되어야 하는 배합물은 의도한 목적에 유용한 배합물로 이해되어야 한다. 이하에 설명되는 제제는 목적에 유용한 예시적 제제로서, 한정하기 위한 것이 아니다. 본 발명의 일부인 배합물은 본 발명의 항체와 이하에 기술되는 목록 중에서 선택되는 하나 이상의 추가 제제일 수 있다. 이러한 배합물은 또한 하나 이상의 추가 제제를 포함할 수 있으며, 예를 들어 형성된 조성물이 의도한 기능을 수행할 수 있을 정도의 배합이라면 2개 또는 3개의 추가 제제가 첨가될 수도 있다.
자가면역 및 염증 질환을 치료하기 위한 배합물은 이부프로펜과 같은 약물을 포함하는 NSAID로 언급되기도 하는 비스테로이드 소염 약물이다. 다른 바람직한 배합물은 프레드니솔론을 비롯한 코르티코스테로이드류이며; 본 발명의 DVD Ig와 함께 환자를 치료하는 경우, 필요한 스테로이드 용량이 점감되어 스테로이드 사용 시의 공지된 부작용이 저하되거나 심지어 제거될 수 있다. 본 발명의 항체 또는 항체부가 배합될 수 있는 류마티스성 관절염용 치료제의 비제한적 예에는 다음과 같은 것이 있다: 사이토킨 억제성 소염제(CSAID); 다른 사람 사이토킨 또는 성장 인자(예컨대, TNF, LT, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-23, 인터페론, EMAP-II, GM-CSF, FGF 및 PDGF)에 대한 항체 또는 길항제. 본 발명의 결합 단백질 또는 이의 항원 결합부는 CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80(B7.1), CD86(B7.2), CD90, CTLA와 같은 세포 표면 분자 또는 이들의 리간드, 예컨대 CD154(gp39 또는 CD40L)에 대한 항체와 배합될 수 있다.
치료제의 배합물은 자가면역 및 후속 염증 캐스캐이드의 여러 지점에서 방해할 수 있다; 그 예에는 TNF 길항제, 예를 들어, 키메라, 사람화된 또는 사람 TNF 항체, ADALIMUMAB, (PCT 공개번호 WO 97/29131), CA2(Remicade™), CDP571, 및 가용성 p55 또는 p75 TNF 수용체, 이의 유도체, (p75TNFR1gG (Enbrel™) 또는 p55TNFR1gG (Lenercept), 및 또한 TNFα 전환 효소(TACE) 저해제가 있고, 유사하게 IL-1 저해제(인터류킨-1-전환 효소 저해제, IL-1RA 등)는 동일 이유로 인해 유효할 수 있다. 다른 배합물에는 인터류킨 11이 포함된다. 또 다른 배합물은 IL-12 기능과 병행하거나, IL-12 기능에 의존적이거나 IL-12 기능과 협동적인 작용을 할 수 있는 자가면역 반응의 다른 주요 작용인자이다. 특히 IL-18 항체 또는 가용성 IL-18 수용체를 포함하는 IL-18 길항제 또는 IL-18 결합 단백질이 있다. 확인된 바에 따르면, IL-12와 IL-18이 중복되지만 독특한 기능을 보유하여, 이 둘에 대한 길항제의 배합물이 가장 효과적이었다. 또 다른 바람직한 배합물은 비고갈성 항-CD4 저해제이다. 또 다른 바람직한 배합물에는 공동자극 경로의 길항제 CD80(B7.1) 또는 CD86(B7.2), 예컨대 항체, 가용성 수용체 또는 길항제성 리간드 등이 포함된다.
본 발명의 결합 단백질은 또한 메토트렉세이트, 6-MP, 아자티오프린 설파살라진, 메살라진, 올살라진 클로로퀴닌/하이드록시클로로퀸, 펜실라민, 오로티오말레이트(근육내 및 경구), 아자티오프린, 콜히친, 코르티코스테로이드(경구, 흡입 및 국소 주사), 베타-2 아드레날린수용체 작용제(살부타몰, 터부탈린, 살메테랄), 크산틴(테오필린, 아미노필린), 크로모글리케이트, 네도크로밀, 케토티펜, 이프라트로퓸 및 옥시트로퓸, 사이클로스포린, FK506, 라파마이신, 미코페놀레이트 모페틸, 레플루노미드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 저해제, 아데노신 작용제, 항혈전제, 보체 저해제, 아드레날린작용제, 염증촉진성 사이토킨, 예컨대 TNF-α 또는 IL-1에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 저해제), IL-1β 전환효소 저해제, TNFα 전환 효소(TACE) 저해제, T-세포 시그널 전달 저해제, 키나제 저해제, 메탈로프로테이나제 저해제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 저해제, 가용성 사이토킨 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체 및 유도체 p75TNFRIgG(Enbrel™ 및 p55TNFRIgG(Lenercept)), sIL-1RI, sIL-1RII, sIL-6R), 소염성 사이토킨(예: IL-4, IL-10, IL-11, IL-13 및 TGFβ), 셀레콕시브, 엽산, 하이드록시클로로퀸 설페이트, 로페콕시브, 에타너셉트, 인플릭시마브, 나프록센, 발데콕시브, 설파살라진, 메틸프레드니솔론, 멜록시캄, 메틸프레드니솔론 아세테이트, 골드 나트륨 티오말레이트, 아스피린, 트리암시놀론 아세토나이드, 프로폭시펜 나프실레이트/apap, 폴레이트, 나부메톤, 디클로페낙, 피록시캄, 에토돌락, 디클로페낙 나트륨, 옥사프로진, 옥시코돈 hcl, 하이드로코돈 비타르트레이트/apap, 디클로페낙 나트륨/미소프로스톨, 펜타닐, 아나킨라, 사람 재조합체, 트라마돌 hcl, 살살레이트, 설린닥, 시아노코발라민/fa/피리독신, 아세트아미노펜, 알렌드로네이트 나트륨, 프레드니솔론, 몰핀 설페이트, 리도카인 하이드로클로라이드, 인도메타신, 글루코사민 설프/콘드로이틴, 아미트립틸린 hcl, 설파디아진, 옥시코돈 hcl/아세트아미노펜, 올로파타딘 hcl, 미소프로스톨, 나프록센 나트륨, 오메프라졸, 시클로포스파미드, 리툭시마브, IL-1 TRAP, MRA, CTLA4-IG, IL-18 BP, 항-IL-18, 항-IL15, BIRB-796, SCIO-469, VX-702, AMG-548, VX-740, 로플루밀라스트, IC-485, CDC-801 및 메소프람 등의 제제와도 배합될 수 있다. 배합물에는 메토트렉세이트 또는 레플루노미드가 포함되며, 보통 또는 중증 류마티스성 관절염 증례에는 사이클로스포린이 포함된다.
류마티스 관절염을 치료하기 위해 결합 단백질과 배합하여 사용될 수 있는 비제한적인 추가의 제제는 하기의 제제를 포함하지만 이에 제한되지 않는다: 비-스테로이드 소염 약물(NSAID); 사이토킨 억제 소염 약물(CSAID); CDP-571/BAY-10-3356 (사람화된 항-TNFα 항체; Celltech/Bayer); cA2/인플릭시마브 (키메라 항-TNFα 항체; Centocor); 75 kdTNFR-IgG/에타너셉트 (75 kD TNF 수용체-IgG 융합 단백질; Immunex; Arthritis & Rheumatism (1994) Vol. 37, S295; J. Invest. Med. (1996) Vol. 44, 235A); 55 kdTNF-IgG (55 kD TNF 수용체-IgG 융합 단백질; Hoffmann-LaRoche); IDEC-CE9.1/SB 210396 (비-고갈 영장류화된 항-CD4 항체; IDEC/SmithKline; Arthritis & Rheumatism (1995) Vol. 38, S185); DAB 486-IL-2 및/또는 DAB 389-IL-2 (IL-2 융합 단백질; Seragen; Arthritis & Rheumatism (1993) Vol. 36, 1223); 항-Tac (사람화된 항-IL-2Rα; Protein Design Labs/Roche); IL-4 (소염 사이토킨; DNAX/Schering); IL-10 (SCH 52000; 재조합 IL-10, 소염 사이토킨; DNAX/Schering); IL-4; IL-10 및/또는 IL-4 작용제 (예를 들어, 작용제 항체); IL-1RA (IL-1 수용체 길항제; Synergen/Amgen); 아나킨라(Kineret®/Amgen); TNF-bp/s-TNF (가용성 TNF 결합 단백질; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284; Amer. J. Physiol. - Heart and Circulatory Physiology (1995) Vol. 268, pp. 37-42); R973401 (포스포디에스테라제 IV형 저해제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); MK-966 (COX-2 억제제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S81); 일로프로스트(Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S82); 메토트렉세이트; 탈리도미드 (Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282) 및 탈리도미드-관련 약물(예를 들어, Celgen); 레플루노미드 (소염 및 사이토킨 저해제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S131; Inflammation Research (1996) Vol. 45, pp. 103-107); 트라넥삼산(플라스미노겐 활성화 저해제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S284); T-614 (사이토킨 저해제; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); 프로스타글란딘 E1 (Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S282); 테니댑 (비스테로이드 소염 약물; Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S280); 나프록센(비스테로이드 소염 약물; Neuro Report (1996) Vol. 7, pp. 1209-1213); 멜록시캠(비스테로이드 소염 약물); 이부프로펜(비스테로이드 소염 약물); 피록시캠(비스테로이드 소염 약물); 디클로페낙 (비스테로이드 소염 약물); 인도메타신(비스테로이드 소염 약물); 설파살라진(Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281); 아자티오프린(Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S281); ICE 저해제(효소 인터류킨-1β 전환 효소의 저해제); zap-70 및/또는 lck 저해제 (타이로신 키나제 zap-70 또는 lck의 저해제); VEGF 저해제 및/또는 VEGF-R 저해제 (혈관 내피 세포 성장 인자 또는 혈관 내피 세포 성장 인자 수용체의 저해제; 혈관형성의 저해제); 코르티코스테로이드 소염 약물(예를 들어, SB203580); TNF-컨버타제 저해제; 항-IL-12 항체; 항-IL-18 항체; 인터류킨-11 (Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S296); 인터류킨-13(Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S308); 인터류킨-17 저해제(Arthritis & Rheumatism (1996) Vol. 39, No. 9 (supplement), S120); 금; 페니실라민; 클로로퀸; 클로람부실; 하이드록시클로로퀸; 사이클로스포린; 사이클로포스파미드; 총 림프계 조사; 항-흉선 글로불린; 항-CD4 항체; CD5-독소; 경구 투여된 펩타이드 및 콜라겐; 로벤자리트 이나트륨; 사이토킨 조절제(CRA) HP228 및 HP466 (Houghten Pharmaceuticals, Inc.); ICAM-1 안티센스 포스포로티오에이트 올리고-데옥시뉴클레오타이드(ISIS 2302; Isis Pharmaceuticals, Inc.); 가용성 보체 수용체 1 (TP10; T Cell Sciences, Inc.); 프레드니손; 오르고테인; 글리코사미노글리칸 폴리설페이트; 미노사이클린; 항-IL2R 항체; 해양 및 식물 지질(어류 및 식물 종자 씨드 지방산; DeLuca et al. (1995) Rheum. Dis. Clin. North Am. 21:759-777); 아우라노핀; 페닐부타존; 메클로페남산; 플루페남산; 정맥내 면역글로불린; 질레우톤; 아자리빈; 마이코페놀산(RS-61443); 타크롤리무스(FK-506); 시롤리무스 (라파마이신); 아미프릴로스(테라펙틴); 클라드리빈(2-클로로데옥시아데노신); 메토트렉세이트; bcl-2 저해제(Bruncko, Milan et al., Journal of Medicinal Chemistry(2007), 50(4), 641-662); 항바이러스제 및 면역 조절제.
한 양태에서, 결합 단백질 또는 이의 항원 결합부는 류마티스 관절염 치료를 위해 하기의 제제 중 하나와 배합하여 투여된다: KDR의 소분자 저해제, Tie-2의 소분자 저해제; 메토트렉세이트; 프레드니손; 셀레콕시브; 엽산; 하이드록시클로로퀸 설페이트; 로페콕시브; 에타너셉트; 인플릭시마브; 레플루노미드; 나프록센; 발데콕시브; 설파살라진; 메틸프레드니솔론; 이부프로펜; 멜록시캠; 메틸프레드니솔론 아세테이트; 금 나트륨 티오말레이트; 아스피린; 아자티오프린; 트리암시놀론 아세토니드; 프로프시펜 나프실레이트/apap; 폴레이트; 나부메톤; 디클로페낙; 피록시캠; 에토돌락; 디클로페낙 나트륨; 옥사프로진; 옥시코돈 hcl; 하이드로코돈 비타르트레이트/apap; 디클로페낙 나트륨/미소프로스톨; 펜타닐; 아나킨라, 사람 재조합 트라마돌 hcl; 살살레이트; 설린닥; 시아노코발라민/fa/피리독신; 아세트아미노펜; 알렌드로네이트 나트륨; 프레드니솔론; 모르핀 설페이트; 리도카인 하이드로클로라이드; 인도메타신; 글루코사민 설페이트/콘드로이틴; 사이클로스포린; 아미트립틸린 hcl; 설파디아진; 옥시코돈 hcl/아세트아미노펜; 올로파타딘 hcl; 미소프로스톨; 나프록센 나트륨; 오메프라졸; 미코페놀레이트 모페틸; 사이클로포스파미드; 리툭시마브; IL-1 TRAP; MRA; CTLA4-IG; IL-18 BP; IL-12/23; 항-IL 18; 항-IL 15; BIRB-796; SCIO-469; VX-702; AMG-548; VX-740; 로플루밀라스트; IC-485; CDC-801; 및 메소프람.
본 발명의 결합 단백질이 배합될 수 있는 염증장병에 유용한 치료제의 비제한적 예에는 다음과 같은 것이 있다: 부데노사이드; 표피 성장 인자; 코르티코스테로이드; 사이클로스포린, 설파살라진; 아미노살리실레이트; 6-머캅토퓨린; 아자티오프린; 메트로니다졸; 리폭시게나제 저해제; 메살라민; 올살라진; 발살라지드; 항산화제; 트롬복산 저해제; IL-1 수용체 길항제; 항-IL-1β mAb; 항-IL-6 mAb; 성장 인자; 엘라스타제 저해제; 피리디닐-이미다졸 화합물; 다른 사람 사이토킨 또는 성장 인자, 예컨대 TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-17, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF 등에 대한 항체 또는 길항제. 본 발명의 항체 또는 이의 항원 결합부는 세포 표면 분자, 예컨대 CD2, CD3, CD4, CD8, CD25, CD30, CD40, CD45, CD69, CD90 또는 이들의 리간드에 대한 항체와 배합될 수도 있다. 본 발명의 항체 또는 이의 항원 결합부는 또한 제제, 예컨대 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 마이코페놀레이트 모페틸, 레플루노마이드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 저해제, 아데노신 작용제, 항혈전제, 보체 저해제, 아드레날린작용제, TNFα 또는 IL-1과 같은 염증촉진성 사이토킨에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 저해제), IL-1β 전환 효소 저해제, TNFα 전환 효소 저해제, T-세포 시그널 전달 저해제, 예컨대 키나제 저해제, 메탈로프로테이나제 저해제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 저해제, 가용성 사이토킨 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R) 및 소염성 사이토킨(예: IL-4, IL-10, IL-11, IL-13 및 TGFβ) 및 bcl-2 저해제와 배합될 수 있다.
결합 단백질이 배합될 수 있는 크론병 치료제의 바람직한 예에는 다음과 같은 것이 있다: TNF 길항제, 예컨대 항-TNF 항체, ADALIMUMAB(PCT 공보 WO 97/29131; HUMIRA), CA2(REMICADE), CDP 571, TNFR-Ig 작제물, (p75TNFR1gG (Enbrel) 및 p55TNFR1gG(Lenercept)) 저해제 및 PDE4 저해제. 본 발명의 항체 또는 이의 항원 결합부는 코르티코스테로이드, 예컨대 부데노사이드 및 덱사메타손과 배합될 수 있다. 본 발명의 결합 단백질 또는 이의 항원 결합부는 또한 설파살라진, 5-아미노살리실산 및 올살라진과 같은 제제, 및 염증촉진성 사이토킨, 예컨대 IL-1, 예를 들어 IL-1β 전환효소 저해제 및 IL-1ra의 합성 또는 작용을 방해하는 제제와 배합될 수 있다. 본 발명의 항체 또는 이의 항원 결합부는 또한 T 세포 시그널 전달 저해제, 예컨대 타이로신 키나제 저해제 6-머캅토퓨린과 함께 사용될 수 있다. 본 발명의 결합 단백질 또는 이의 항원 결합부는 IL-11과 배합될 수 있다. 본 발명의 결합 단백질 또는 이의 항원 결합부는 메살라민, 프레드니손, 아자티오프린, 머캅토퓨린, 인플릭시마브, 메틸프레드니솔론 나트륨 석시네이트, 디페녹실레이트/아트로프 설페이트, 로퍼아미드 하이드로클로라이드, 메토트렉세이트, 오메프라졸, 폴레이트, 시프로플록사신/덱스트로스-물, 하이드로코돈 비타르트레이트/apap, 테트라사이클린 하이드로클로라이드, 플루오시노나이드, 메트로니다졸, 티메로살/붕산, 콜레스티라민/슈크로스, 시프로플록사신 하이드로클로라이드, 하이오시아민 설페이트, 메페리딘 하이드로클로라이드, 미다졸람 하이드로클로라이드, 옥시코돈 hcl/아세트아미노펜, 프로메타진 하이드로클로라이드, 인산나트륨, 설파메톡사졸/트리메토프림, 셀레콕시브, 폴리카르보필, 프로폭시펜 나프실레이트, 하이드로코르티손, 멀티비타민, 발살라지드 이나트륨, 코데인 포스페이트/apap, 콜레세벨람 hcl, 시아노코발라민, 엽산, 레보플록사신, 메틸프레드니솔론, 나탈리주마브 및 인터페론-감마와 배합될 수 있다.
본 발명의 결합 단백질과 배합될 수 있는 다발성 경화증 치료제의 비제한적 예에는 다음과 같은 것이 있다: 코르티코스테로이드; 프레드니솔론; 메틸프레드니솔론; 아자티오프린; 사이클로포스파미드; 사이클로스포린; 메토트렉세이트; 4-아미노피리딘; 티자니딘; 인터페론-β1a(AVONEX; Biogen); 인터페론-β1b(BETASERON; Chiron/Berlex); 인터페론 α-n3(Interferon Sciences/Fujimoto), 인터페론-α(Alfa Wassermann/J&J), 인터페론 β1A-IF(Serono/Inhale Therapeutics), 페그인터페론 α2b(Enzon/Schering-Plough), 공중합체 1(Cop-1; COPAXONE; Teva Pharmaceutical Industries, Inc.); 고압 산소; 정맥내 면역글로불린; 클라브리빈; 기타 사람 사이토킨 또는 성장 인자 및 이의 수용체, 예컨대 TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-23, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF 및 PDGF에 대한 항체 또는 길항제. 본 발명의 결합 단백질은 CD2, CD3, CD4, CD8, CD19, CD20, CD25, CD28, CD30, CD40, CD45, CD69, CD80, CD86, CD90과 같은 세포 표면 분자 또는 이의 리간드에 대한 항체와 배합될 수 있다. 본 발명의 결합 단백질은 또한 제제, 예컨대 메토트렉세이트, 사이클로스포린, FK506, 라파마이신, 마이코페놀레이트 모페틸, 레플루노마이드, NSAID, 예컨대 이부프로펜, 코르티코스테로이드, 예컨대 프레드니솔론, 포스포디에스터라제 저해제, 아데노신 작용제, 항혈전제, 보체 저해제, 아드레날린작용제, TNFα 또는 IL-1과 같은 염증촉진성 사이토킨에 의한 시그널 전달을 방해하는 제제(예: IRAK, NIK, IKK, p38 또는 MAP 키나제 저해제), IL-1β 전환 효소 저해제, TACE 저해제, T-세포 시그널 전달 저해제, 예컨대 키나제 저해제, 메탈로프로테이나제 저해제, 설파살라진, 아자티오프린, 6-머캅토퓨린, 안지오텐신 전환 효소 저해제, 가용성 사이토킨 수용체 및 이의 유도체(예: 가용성 p55 또는 p75 TNF 수용체, sIL-1RI, sIL-1RII, sIL-6R) 및 소염성 사이토킨(예: IL-4, IL-10, IL-13 및 TGFβ) 및 bcl-2 저해제와 배합될 수 있다.
본 발명의 결합 단백질과 배합될 수 있는 다발성 경화증 치료제의 예에는 인터페론 β, 예컨대 IFNβ1a 및 IFNβ1b; 코팍손, 코르티코스테로이드, 카스파제 저해제, 예컨대 카스파제-1 저해제, IL-1 저해제, TNF 저해제 및 CD40 리간드 및 CD80에 대한 항체가 포함된다.
본 발명의 결합 단백질은 또한 제제, 예컨대 알렘투주마브, 드로나비놀, 유니메드, 다클리주마브, 미토크산트론, 크살리 프로덴 하이드로클로라이드, 팜프리딘, 글라티라머 아세테이트, 나탈리주마브, 신나비돌, a-임뮤노킨 NNSO3, ABR-215062, AnergiX.MS, 케모킨 수용체 길항제, BBR-2778, 칼라구알린, CPI-1189, LEM(리포좀 캡슐화된 미토크산트론), THC.CBD(칸나비노이드 작용제) MBP-8298, 메소프람(PDE4 저해제), MNA-715, 항-IL-6 수용체 항체, 뉴로박스, 피르페니돈, 알로트랩 1258(RDP-1258), sTNF-R1, 탈람파넬, 테리플루노마이드, TGF-베타2, 티플리모타이드, VLA-4 길항제(예컨대, TR-14035, VLA4 Ultrahaler, Antegran-ELAN/Biogen), 인터페론 감마 길항제, IL-4 작용제와 배합될 수 있다.
본 발명의 결합 단백질과 배합될 수 있는 협심증 치료제의 비제한적 예에는 다음과 같은 것이 있다: 아스피린, 니트로글리세린, 이소소르비드 모노니트레이트, 메토프롤롤 석시네이트, 아테놀로, 메토프롤롤 타르트레이트, 암로디핀 베실레이트, 딜티아젬 하이드로클로라이드, 이소소르비드 디니트레이트, 클로피도그렐 비설페이트, 니페디핀, 이토바스타틴 칼슘, 염화칼륨, 후로세미드, 심바스타틴, 베라파밀 hcl, 디곡신, 프로프라놀롤, 하이드로클로라이드, 카베딜롤, 리시노프릴, 스피로노락톤, 하이드로클로로티아지드, 에나라프릴 말레이트, 나돌로, 라미프릴, 에녹사파린 나트륨, 헤라핀 나트륨, 발사르탄, 소탈롤 하이드로클로라이드, 페노피브레이트, 에제티미브, 부메타니드, 로사탄 포타슘, 리시노프릴/하이드로클로로티아지드, 펠로디핀, 캅토프릴, 비소프롤롤 푸마레이트.
본 발명의 결합 단백질과 배합될 수 있는 강직 척추염 치료제의 비제한적 예에는 다음과 같은 것이 있다: 이브푸로펜, 디클로페낙 및 미소프로스톨, 나프록센, 멜록시캄, 인도메타신, 디클로페낙, 셀레콕시브, 로페콕시브, 설파살라진, 메토트렉세이트, 아자티오프린, 미노시클린, 프레드니손, 에타너셉트, 인플릭시마브.
본 발명의 결합 단백질과 배합될 수 있는 천식 치료제의 비제한적 예에는 다음과 같은 것이 있다: 알부테롤, 살메테롤/플루티카손, 몬텔루카스트 나트륨, 플루티카손 프로피오네이트, 부데소니드, 프레드니손, 살메테롤 크시나포에이트, 레발부테롤 hcl, 알부테롤 설페이트/이프라트로퓸, 프레드니솔론 나트륨 포스페이트, 트리암시놀론 아세토나이드, 베클로메타손 디프로피오네이트, 이프라트로퓸 브로마이드, 아지트로마이신, 피르부테롤 아세테이트, 프레드니솔론, 무수 테오필린, 메틸프레드니솔론 나트륨 석시네이트, 클라리트로마이신, 자피르루카스트, 포르모테롤 푸마레이트, 인플루엔자 바이러스 백신, 메틸프레드니솔론, 아목시실린 트리하이드레이트, 플루니솔라이드, 알레르기 주사, 크로몰린 나트륨, 펙소페나딘 하이드로클로라이드, 플루니솔라이드/멘톨, 아목시실린/클라불라네이트, 레보플록사신, 흡입기 보조 장치, 구아이페네신, 덱사메타손 나트륨 포스페이트, 목시플록사신 hcl, 독시사이클린 하이클레이트, 구아이페네신/d-메토판, p-에페드린/cod/클로페니르, 가티플록사신, 세테리진 하이드로클로라이드, 모메타손 퓨로에이트, 살메테롤 신나포에이트, 벤조나테이트, 세팔렉신, pe/하이드로코돈/클로르페니르, 세티리진 hcl/슈도에페드, 페닐에프린/cod/프로메타진, 코데인/프로메타진, 세프프로질, 덱사메타손, 구아이페네신/슈도에페드린, 클로페니라민/하이드로코돈, 네도크로밀 나트륨, 테르부탈린 설페이트, 에피네프린, 메틸프레드니솔론, 메타프로테레놀 설페이트.
본 발명의 결합 단백질과 배합될 수 있는 COPD 치료제의 비제한적 예에는 다음과 같은 것이 있다: 알부테롤 설페이트/이프라트로퓸, 이프라트로퓸 브로마이드, 살메테롤/플루티카손, 알부테롤, 살메테롤 크시나포에이트, 플루티카손 프로피오네이트, 프레드니손, 무수 테오필린, 메틸프레드니솔론 나트륨 석시네이트, 몬텔루카스트 나트륨, 부데소니드, 포르모테롤 푸마레이트, 트리암시놀론 아세토나이드, 레보플록사신, 구아이페네신, 아지트로마이신, 베클로메타손 디프로피오네이트, 레발부테롤 hcl, 플루니솔라이드, 세프트리악손 나트륨, 아목시실린 트리하이드레이트, 가티플록사신, 자피르루카스트, 아목시실린/클라불라네이트, 플루니솔라이드/멘톨, 클로르페니라민/하이드로코돈, 메타프로테레놀 설페이트, 메틸프레드니솔론, 모메타손 푸로에이트, p-에페드린/cod/클로르페니르, 피르부테롤 아세테이트, p-에페드린/로라타딘, 테르부탈린 설페이트, 티오트로퓸 브로마이드, (R,R)-포르모테롤, TgAAT, 실로밀라스트, 로플루밀라스트.
본 발명의 결합 단백질과 배합될 수 있는 HCV 치료제의 비제한적 예에는 다음과 같은 것이 있다: 인터페론-알파-2a, 인터페론-알파-2b, 인터페론-알파 con1, 인터페론-알파-n1, 페길화된 인터페론-알파-2a, 페길화된 인터페론-알파-2b, 리바비린, 페그인터페론 알파-2b + 리바비린, 우르소데옥시콜린산, 글리시리진산, 티말파신, 막사민, VX-497 및 표적, 즉 HCV 폴리머라제, HCV 프로테아제, HCV 헬리카제, HCV IRES(내부 리보솜 진입 부위)의 간섭을 통해 HCV를 치료하는데 사용되는 임의의 화합물.
본 발명의 결합 단백질과 배합될 수 있는 특발폐섬유증 치료제의 비제한적 예에는 다음과 같은 것이 있다: 프레드니손, 아자티오프린, 알부테롤, 콜히친, 알부테롤 설페이트, 디곡신, 감마 인터페론, 메틸프레드니솔론 sod succ, 로라제팜, 후로세미드, 리시노프릴, 니트로글리세린, 스피로놀락톤, 시클로포스파미드, 이프라트로퓸 브로마이드, 악티노마이신 d, 알테플라스, 플루티카손 프로피오네이트, 레보플록사신, 메타프로테레놀 설페이트, 몰핀 설페이트, 옥시코돈 hcl, 염화칼륨, 트리암시놀론 아세토나이드, 무수 태크롤리무스, 칼슘, 인터페론-알파, 메토트렉세이트, 마이코페놀레이트 모페틸, 인터페론-감마-1β.
본 발명의 결합 단백질과 배합될 수 있는 심근경색 치료제의 비제한적 예에는 다음과 같은 것이 있다: 아스피린, 니트로글리세린, 메토프롤롤 타르트레이트, 에녹사파린 나트륨, 헤파린 나트륨, 클로피도그렐 비설페이트, 카베딜롤, 아테놀롤, 몰핀 설페이트, 메토프롤롤 석시네이트, 워파린 나트륨, 리시노프릴, 이소소르비드 모노니트레이트, 디곡신, 후로세미드, 심바스타틴, 라미프릴, 테넥테플라스, 에나라프릴 말레이트, 토르세미드, 레타바스, 로사탄 포타슘, 퀴나프릴 hcl/mag carb, 부메타니드, 알테플라스, 아날라프릴라트, 아미오다론 하이드로클로라이드, 티로피반 hcl m-하이드레이트, 딜티아젬 하이드로클로라이드, 캡토프릴, 이르베사탄, 발사탄, 프로프라놀롤 하이드로클로라이드, 호시노프릴 나트륨, 리도카인 하이드로클로라이드, 엡티피바타이드, 세파졸린 나트륨, 아트로핀 설페이트, 아미노카프린산, 스피로노락톤, 인터페론, 소탈롤 하이드로클로라이드, 염화칼륨, 도큐세이트 나트륨, 도부타민 hcl, 알프라졸람, 프라바스타틴 나트륨, 아토바스타틴 칼슘, 미다졸람 염산염, 메페리딘 하이드로클로라이드, 이소소르비드 디니트레이트, 에피네프린, 도파민 하이드로클로라이드, 비파리루딘, 로수바스타틴, 엑제티미브/심바스타틴, 아바시미브, 카리포라이드.
본 발명의 결합 단백질과 배합될 수 있는 건선 치료제의 비제한적 예에는 다음과 같은 것이 있다: KDR의 소분자 저해제, Tie-2의 소분자 저해제, 칼시포트리엔, 클로베타솔 프로피오네이트, 트리암시놀론 아세토나이드, 할로베타솔 프로피오네이트, 타자로텐, 메토트렉세이트, 플루오시노나이드, 베타메타손 diprop 보강형, 플루오시놀론 아세토나이드, 아시트레틴, 타르 샴푸, 베타메타손 발레레이트, 모메타손 후로에이트, 케토코나졸, 프라목신/플루오시놀론, 하이드로코르티손 발레레이트, 플루안드레놀라이드, 우레아, 베타메타손, 클로베타솔 프로피오네이트/에몰, 플루티카손 프로피오네이트, 아지트로마이신, 하이드로코르티손, 보습 포뮬라, 엽산, 데소니드, 피메크롤리무스, 콜타르, 디플로라손 디아세테이트, 에타너셉트 폴레이트, 락트산, 메톡살렌, hc/비스무스 subgal/znox/resor, 메틸프레드니솔론 아세테이트, 프레드니손, 선스크린, 할시노나이트, 살리실산, 안트랄린, 클로코르톨론 피발레이트, 석탄 추출물, 콜타르/살리실산, 콜타르/살리실산/황, 데속시메타손, 디아제팜, 피부연화제, 플루오시노나이드/피부연화제, 광유/피마자유/na lact, 광유/땅콩유, 석유/이소프로필 미리스테이트, 프소랄렌, 살리실산, 비누/트리브롬살란, 티메로살/붕산, 셀레콕시브, 인플릭시마브, 사이클로스포린, 알레파셉트, 에팔리주마브, 태크롤리무스, 피메크롤리무스, PUVA, UVB, 설파살라진.
본 발명의 결합 단백질과 배합될 수 있는 건선 관절염 치료제의 비제한적 예에는 다음과 같은 것이 있다: 메토트렉세이트, 에타너셉트, 로페콕시브, 셀레콕시브, 엽산, 설파살라진, 나프록센, 레플루노미드, 메틸프레드니솔론 아세테이트, 인도메타신, 하이드록시클로로퀸 설페이트, 프레드니손, 설린닥, 베타메타손 diprop 보강형, 인플릭시마브, 메토트렉세이트, 폴레이트, 트리암시놀론 아세토나이드, 디클로페낙, 디메틸설폭사이드, 피록시캄, 디클로페낙 나트륨, 케토프로펜, 멜록시캄, 메틸프레드니솔론, 나부메톤, 톨메틴 나트륨, 칼시포트리엔, 사이클로스포린, 디클로페낙 나트륨/미소프로스톨, 플루오시노나이드, 글루코사민 설페이트, 골드 나트륨 티오말레이트, 하이드로코돈 비타르트레이트/apap, 이부프로펜, 리세드로네이트 나트륨, 설파디아진, 티오구아닌, 발데콕시브, 알레파셉트, 에팔리주마브 및 bcl-2 억제제.
본 발명의 결합 단백질과 배합될 수 있는 재협착증 치료제의 비제한적 예에는 다음과 같은 것이 있다: 시롤리무스, 파클리탁셀, 에버롤리무스, 태크롤리무스, 조타롤리무스, 아세트아미노펜.
본 발명의 결합 단백질과 배합될 수 있는 좌골신경통 치료제의 비제한적 예에는 다음과 같은 것이 있다: 하이드로코돈 비타르트레이트/apap, 로페콕시브, 시클로벤자프린 hcl, 메틸프레드니솔론, 나프록센, 이부프로펜, 옥시코돈 hcl/아세트아미노펜, 셀렉코시브, 발데콕시브, 메틸프레드니솔론 아세테이트, 프레드니손, 코데인 포스페이트/apap, 트라마돌 hcl/아세트아미노펜, 메탁사론, 멜록시캄, 메토카르바몰, 리도카인 하이드로클로라, 디플로페낙 나트륨, 가바펜틴, 덱사메타손, 카리소프로돌, 케토롤락 트로메타민, 인도메타신, 아세트아미노펜, 디아제팜, 나부메톤, 옥시코돈 hcl, 티자니딘 hcl, 디클로페낙 나트륨/미소프로스톨, 프로폭시펜 냅실레이트/apap, asa/oxycod/옥시코돈 ter, 이부프로펜/하이드로코돈 bit, 트라마돌 hcl, 에토돌락, 프로폭시펜 hcl, 아미트립틸린 hcl, 카리소프로돌/코데인 phos/asa, 몰핀 설페이트, 멀티비타민, 나프록센 나트륨, 오르페나드린 시트레이트, 테마제팜.
본 발명의 결합 단백질과 배합될 수 있는 SLE(루푸스) 치료제의 바람직한 예에는 다음과 같은 것이 있다: NSAID, 예컨대 디클로페낙, 나프록센, 이부프로펜, 피록시캄, 인도메타신; COX2 저해제, 예컨대 셀레콕시브, 로페콕시브, 발데콕시브; 항말라리아제, 예컨대 하이드록시클로로퀸; 스테로이드, 예컨대 프레드니손, 프레드니솔론, 부데노사이드, 덱사메타손; 세포독성제, 예컨대 아자티오프린, 시클로포스파미드, 미코페놀레이트 모페틸, 메토트렉세이트; PDE4 저해제 또는 퓨린 합성 저해제, 예컨대 셀레셉트. 본 발명의 결합 단백질은 또한 설파살라진, 5-아미노살리실산, 올살라진, 이뮤란 및 IL-1과 같은 염증촉진성 사이토킨의 합성, 생산 또는 작용을 방해하는 제제, 예컨대 IL-1β 전환효소 저해제 및 IL-1ra와 같은 카스파제 저해제와 배합될 수 있다. 본 발명의 결합 단백질은 또한 T 세포 시그널 전달 저해제, 예컨대 티로신 키나제 저해제; 또는 T 세포 활성화 분자를 표적으로 하는 분자, 예컨대 CTLA-4-IgG 또는 항-B7계 항체, 항-PD-1계 항체 등과 함께 사용될 수 있다. 본 발명의 결합 단백질은 IL-11 또는 항-사이토킨 항체, 예컨대 포노토리주마브(항-IFNg 항체) 또는 항수용체 항체, 예컨대 항-IL-6 수용체 항체 및 B-세포 표면 분자에 대한 항체와 조합될 수 있다. 또한, 본 발명의 항체 또는 이의 항원 결합부는 LJP 394(아베티무스), B-세포를 불활성화시키거나 고갈시키는 제제, 예컨대 리툭시마브(항-CD20 항체), 림포스태트-B(항-BlyS 항체), TNF 길항제, 예컨대 항-TNF 항체, 아달리무마브(PCT 공보 WO 97/29131; HUMIRA), CA2(REMICADE), CDP571, TNFR-Ig 작제물(P75TNFRIgG(ENBREL) 및 p55TNFRIgG(LENERCEPT)), 및 bcl-2 저해제와 함께 사용될 수 있으며, 그 이유는 돌연변이 마우스에서 bcl-2 과발현이 루푸스 유사 표현형을 유발하는 것으로 입증된 바 있어(Marquina, Regina et al., Journal of Immunology (2004), 172(11), 7177-7185), 저해가 치료 효과를 나타낼 것으로 생각된다.
본 발명의 약제학적 조성물은 본 발명의 결합 단백질의 "치료학적 유효량" 또는 "예방학적 유효량"을 포함할 수 있다. "치료학적 유효량"이란 용어는 원하는 치료 결과를 수득하기 위한 투여량과 필요 기간 동안의 유효한 양을 의미한다. 상기 항체 또는 항체 일부의 치료학적 유효량은 당업자라면 결정할 수 있는 것으로서, 질환 상태, 연령, 성별 및 개체의 체중과 개체 내에서 원하는 반응을 유도하는 항체 또는 항체 일부의 능력과 같은 요인에 따라 달라질 수 있다. 또한, 치료학적 유효량은 치료학적 유익 효과가 항체 또는 항체 일부의 임의의 독성 또는 유해 효과를 능가하는 양이다. "예방학적 유효량"은 원하는 예방학적 결과를 수득하기 위한 투여량 및 필요 기간 동안의 유효한 양을 의미한다. 일반적으로, 예방학적 용량은 질환의 초기 단계전이나 초기 단계에 피검체에 사용되기 때문에 예방학적 유효량은 치료학적 유효량보다 적은 양일 것이다.
투여 계획은 원하는 최적 반응(예컨대, 치료학적 또는 예방학적 반응)을 제공하도록 조정될 수 있다. 예를 들어, 1회의 일시주사를 투여할 수도 있고, 여러 분할 용량을 경시적으로 투여할 수도 있으며 또는 치료 상황의 위급성에 따라 비례하여 감소 또는 증가된 용량을 투여할 수도 있다. 특히, 투여 용이성과 투여량의 균일성을 위해 비경구 조성물을 투여 단위 형태로 제형화하는 것이 유리하다. 본 명세서에 사용된 투여 단위 형태는 치료하는 포유동물 피검체에 대하여 단일 투여량으로서 적당한 물리적으로 분리된 단위를 의미한다. 따라서, 각 단위는 필요한 약제학적 담체와 관련하여 원하는 치료 효과를 제공하도록 계산된 소정의 양의 활성 화합물을 포함한다. 본 발명의 투여 단위 형태에 대한 세부사항은 (a) 활성 화합물의 독특한 특징 및 수득하고자 하는 특정 치료 또는 예방학적 효과, 및 (b) 개체의 감응도 치료에 있어서 상기 활성 화합물을 배합하는 기술 고유의 제한에 따라 결정되고 직접 좌우된다.
본 발명의 결합 단백질의 치료학적 또는 예방학적 유효량에 대한 비제한의 예시적 범위는 0.1 내지 20mg/kg, 예컨대 1 내지 10mg/kg이다. 또한, 투여량 값은 개체의 필요 및 조성물 투여를 관리하거나 감독하는 자의 전문가적 판단에 따라 경시적으로 조정되어야 하며, 본 명세서에 제시된 투여량 범위는 예시적일 뿐이며 청구된 조성물의 범위 또는 실시를 제한하고자 하는 것이 아님을 명심해야 한다.
본원에 기재된 발명의 방법이 기타 적합하게 변형되고 적용될 수 있고 본 발명의 범위 또는 본원에 기재된 양태로부터 벗어나지 않고서도 적합한 등가물을 사용하여 변형되고 적용될 수 있다는 것은 당업자에게 자명하다. 현재 본 발명을 상세하게 설명했고 이와 동일하게 하기의 실시예를 참조로 보다 명백하게 이해될 수 있을 것이고 당해 실시예는 설명을 목적으로 포함된 것이지 본 발명을 제한하고자 한 것은 아니다.
V. 진단학
또한, 본 발명은 진단 용도를 제공한다. 이것은 이하에 상세하게 설명된다.
1. 분석 방법
본 발명은 본원에 기술된 적어도 하나의 DVD-Ig을 이용하여 검사 시료에서 피분석물(또는 이의 단편)의 존재, 양 또는 농도를 측정하는 방법을 제공한다. 당업계에 공지된 바와 같은 임의의 적당한 분석법을 본 방법에 사용할 수 있다. 그 예로는, 면역분석법, 예컨대 샌드위치 면역분석법(예: 모노클로날, 폴리클로날 및/또는 DVD-Ig 샌드위치 면역분석법, 또는 이의 임의의 변형법(예: 모노클로날/DVD-Ig, DVD-Ig/폴리클로날 등), 예를 들어 방사능동위원소 검출(방사능면역분석(RIA)) 및 효소 검출(효소 면역 분석법(EIA) 또는 효소 결합 면역흡착 분석법(ELISA)(예: Quantikine ELISA 분석, R&D Systems, Minneapolis, MN)), 경쟁적 저해 면역분석법(예: 정방향 및 역방향), 형광 편광 면역분석법(FPIA), 효소 배가된 면역분석 기술(EMIT), 생물발광 공명 에너지 전이(BRET), 및 균질 화학발광 분석 등이 있으나, 이에 국한되는 것은 아니다. SELDI 기반 면역분석에서, 당해 피분석물(또는 이의 단편)에 특이적으로 결합하는 포획 시약은 예비활성화된 단백질 칩 어레이와 같은 질량분광분석 프로브의 표면에 부착된다. 그 다음, 피분석물(또는 이의 단편)은 바이오칩 위에 특이적으로 포획되고, 포획된 피분석물(또는 이의 단편)은 질량분광분석에 의해 검출된다. 대안적으로, 피분석물(또는 이의 단편)은 포획 시약으로부터 용출되어 통상의 MALDI(매트릭스-보조 레이저 탈착/이온화) 또는 SELDI에 의해 검출될 수 있다. 화학발광 미량입자 면역분석, 특히 ARCHITECT® 자동 분석기(Abbott Laboratories, Abbott Park, IL)를 이용한 면역분석은 바람직한 면역분석의 한 예이다.
소변, 혈액, 혈청 및 혈장, 및 기타 체액을 수집, 취급 및 처리하는 당업계에 공지된 방법은 본 발명의 실시에서, 예를 들어 당해의 DVD-Ig을 면역진단 시약 및/또는 피분석물 면역분석 키트에 이용할 때 사용된다. 검사 시료는 항체, 항원, 합텐, 호르몬, 약물, 효소, 수용체, 단백질, 펩타이드, 폴리펩타이드, 올리고뉴클레오타이드 및/또는 폴리뉴클레오타이드와 같은 당해 피분석물 외에 추가 부분을 포함할 수 있다. 예를 들어, 시료는 피검체로부터 수득된 전체 혈액 시료일 수 있다. 검사 시료, 특히 전체 혈액은 본 명세서에 기술된 면역분석 전에, 전처리 시약 등으로 처리되는 것이 바람직하거나 필요할 수 있다. 전처리가 필요하지 않은 경우(예컨대, 대부분의 소변 시료)에도 경우에 따라 전처리가 수행될 수 있다(예: 상업적 플랫폼에서 양생의 일부로서).
전처리 시약은 본 발명의 면역분석 및 키트와 함께 사용하기에 적합한 임의의 시약일 수 있다. 전처리는 경우에 따라 (a) 하나 이상의 용매(예: 메탄올 및 에틸렌 글리콜), 및 경우에 따라, 염, (b) 하나 이상의 용매 및 염, 및 경우에 따라 계면활성제, (c) 계면활성제, 또는 (d) 계면활성제 및 염을 포함한다. 전처리 시약은 당업계에 공지되어 있고, 이러한 전처리는 예컨대 Abbott TDx, AxSYM®, 및 ARCHITECT® 분석기(Abbott Laboratories, Abbott Park, IL)에서의 분석법에 사용했던 바와 같이(문헌, Yatscoff et al., Abbott TDx Monoclonal Antibody Assay Evaluated for Measuring Cyclosporine in Whole Blood, Clin. Chem. 36: 1969-1973 (1990), 및 Wallemacq et al., Evaluation of the New AxSYM Cyclosporine Assay: Comparison with TDx Monoclonal Whole Blood and EMIT Cyclosporine Assays, Clin. Chem. 45: 432-435 (1999)에 기술된 바와 같이), 및/또는 시중에서 입수가능한 것으로 이용할 수 있다. 또한, 전처리는 Abbott의 미국 특허 5,135,875, 유럽 특허 공개번호 0 471 293, 미국 임시 특허출원 60/878,017(2006.12.29) 및 미국 특허출원 공개번호 2008/0020401(전처리에 대한 교시내용은 전부 참고 인용됨)에 기술된 바와 같이 수행될 수 있다. 전처리 시약은 불균질 제제 또는 균질 제제일 수 있다.
불균질 전처리 시약의 이용 시, 이 전처리 시약은 시료에 존재하는 피분석물 결합 단백질(예: 피분석물 또는 이의 단편에 결합할 수 있는 단백질)을 침전시킨다. 이러한 전처리 단계는 시료에 전처리 제제를 첨가하여 형성된 혼합물의 상청액을 침전된 피분석물 결합 단백질로부터 분리하여 임의의 피분석물 결합 단백질을 제거하는 단계를 포함한다. 이러한 분석에서, 임의의 결합 단백질이 없는 혼합물의 상청액을 분석에 사용하여 항체 포획 단계로 직접 진행시킨다.
균질 전처리 시약의 이용 시에는 상기 분리 단계가 없다. 검사 시료와 전처리 시약의 전체 혼합물을 피분석물(또는 이의 단편)에 대해 표지화된 특이적 결합 파트너, 예컨대 표지화된 항-피분석물 항체(또는 이의 항원 반응성 단편)와 접촉시킨다. 이 분석법에 이용된 전처리 시약은 1차 특이적 결합 파트너에 의한 포획 전이나 포획 중에, 전처리된 검사 시료 혼합물에 통상 희석한다. 이러한 희석에도 불구하고, 전처리 시약의 특정 양은 포획 동안 검사 시료 혼합물에 여전히 존재한다(또는 남는다). 본 발명에 따르면, 표지화된 특이적 결합 파트너는 DVD-Ig(또는 이의 단편, 변형체, 또는 변형체의 단편)일 수 있다.
불균질 형식에서, 검사 시료를 피검체로부터 수득한 후, 1차 혼합물을 준비한다. 이 혼합물은 피분석물(또는 이의 단편)에 대해 평가되는 검사 시료 및 1차 특이적 결합 파트너를 함유하고, 이 1차 특이적 결합 파트너와 검사 시료에 함유된 임의의 피분석물은 1차 특이적 결합 파트너-피분석물 복합체를 형성한다. 1차 특이적 결합 파트는 항-피분석물 항체 또는 이의 단편인 것이 바람직하다. 1차 특이적 결합 파트너는 본 명세서에 기술된 DVD-Ig(또는 이의 단편, 변형체, 또는 변형체의 단편)일 수 있다. 혼합물 형성을 위해 검사 시료와 1차 특이적 결합 파트너가 첨가되는 순서는 중요하지 않다. 1차 특이적 결합 파트너는 고상에 고정화되는 것이 바람직하다. 면역분석에 사용된 고상(1차 특이적 결합 파트너용, 및 경우에 따라 2차 특이적 결합 파트너용)은 당업계에 공지된 임의의 고상, 예컨대 자성 입자, 비드, 시험관, 미세역가 평판, 큐벳, 막, 스캐폴딩 분자, 필름, 여과지, 디스크 및 칩일 수 있으나, 이에 국한되는 것은 아니다.
1차 특이적 결합 파트너-피분석물 복합체를 함유하는 혼합물이 형성된 후, 결합되지 않은 임의의 피분석물은 당업계에 공지된 임의의 기술로 복합체로부터 제거한다. 예를 들어, 결합되지 않은 피분석물은 세척에 의해 제거할 수 있다. 하지만, 검사 시료에 존재하는 모든 피분석물이 1차 특이적 결합 파트너에 의해 결합되도록 검사 시료에 존재하는 임의의 피분석물보다 과량으로 1차 특이적 결합 파트너가 존재하는 것이 적당하다.
결합되지 않은 임의의 피분석물을 제거한 후, 혼합물에 2차 특이적 결합 파트너를 첨가하여 1차 특이적 결합 파트너-2차 특이적 결합 파트너 복합체를 제조한다. 2차 특이적 결합 파트너는 1차 특이적 결합 파트너에 의해 결합된 피분석물 상의 에피토프와 다른, 피분석물 상의 에피토프에 결합하는 항-피분석물 항체인 것이 바람직하다. 또한, 2차 특이적 결합 파트너는 전술한 검출가능 표지로 표지화되거나 검출가능 표지를 함유하는 것이 바람직하다. 2차 특이적 결합 파트너는 본 명세서에 기술된 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)일 수 있다.
당업계에 공지된 임의의 적당한 검출가능 표지가 사용될 수 있다. 예를 들어, 검출가능 표지는 방사능활성 표지(예: 3H, 125I, 35S, 14C, 32P 및 33P), 효소 표지(예: 양고추냉이 퍼독시다제, 알칼리성 퍼옥시다제, 글루코스-6-포스페이트 탈수소효소 등), 화학발광 표지(예: 아크리디늄 에스테르, 티오에스테르 또는 설폰아미드; 루미놀, 이소루미놀, 페난트리디늄 에스테르 등), 형광 표지(예: 플루오레세인(예: 5-플루오레세인, 6-카르복시플루오레세인, 3,6-카르복시플루오레세인, 5(6)-카복시플루오레세인, 6-헥사클로로-플루오레세인, 6-테트라클로로플루오레세인, 플루오레세인 이소티오시아네이트 등)), 로다민, 피코빌리프로테인, R-피코에리트린, 양자 점(예: 황화아연-캡핑된 카드뮴 셀레나이드), 온도계상 표지, 또는 면역-폴리머라제 연쇄 반응 표지일 수 있다. 표지에 대한 서론, 표지화 절차 및 표지의 검출에 대해서는 문헌[Polak and Van Noorden, Introduction to Immunocytochemistry, 2nd ed., Springer Verlag, N.Y. (1997), 및 Haugland, Handbook of Fluorescent Probes and Research Chemicals (1996), Molecular Probes, Inc.(Eugene, Oregon)에 의해 출판된 합동 핸드북 및 카타로그]에서 찾아볼 수 있다. 형광 표지는 FPIA에 사용될 수 있다(예컨대, 미국 특허 5,593,896, 5,573,904, 5,496,925, 5,359,093, 및 5,352,803, 전문이 참고인용됨). 아크리디늄 화합물은 균질 또는 비균질 화학발광 분석에서 검출가능 표지로 사용될 수 있다(예컨대, Adamczyk et al., Bioorg. Med. Chem. Lett. 16: 1324-1328 (2006); Adamczyk et al., Bioorg. Med. Chem. Lett. 4: 2313-2317 (2004); Adamczyk et al., Biorg. Med. Chem. Lett. 14: 3917-3921 (2004); 및 Adamczyk et al., Org. Lett. 5: 3779-3782 (2003) 참조).
바람직한 아크리디늄 화합물은 아크리디늄-9-카르복사미드이다. 아크리디늄 9-카르복사미드를 제조하는 방법은 문헌[Mattingly, J. Biolumin. Chemilumin. 6: 107-114 (1991); Adamczyk et al., J. Org. Chem. 63: 5636-5639 (1998); Adamczyk et al., Tetrahedron 55: 10899-10914 (1999); Adamczyk et al., Org. Lett. 1: 779-781 (1999); Adamczyk et al., Bioconjugate Chem. 11: 714-724 (2000); Mattingly et al., In Luminescence Biotechnology : Instruments and Applications; Dyke, K. V. Ed.; CRC Press: Boca Raton, pp. 77-105 (2002); Adamczyk et al., Org. Lett. 5: 3779-3782 (2003); 및 미국 특허 5,468,646, 5,543,524 및 5,783,699 (이에 대한 교시 내용이 전부 본원에 참고 인용됨)]에 기술되어 있다. 다른 바람직한 아크리디늄 화합물은 아크리디늄-9-카르복실레이트 아릴 에스테르이다. 아크리디늄-9-카르복실레이트 아릴 에스테르의 한 예는 10-메틸-9-(페녹시카르보닐)아크리디늄 플루오로설포네이트(Cayman Chemical, Ann Arbor, MI에서 입수가능함)이다. 아크리디늄 9-카르복실레이트 아릴 에스테르를 제조하는 방법은 문헌[McCapra et al., Photochem. Photobiol. 4: 1111-21 (1965); Razavi et al., Luminescence 15: 245-249 (2000); Razavi et al., Luminescence 15: 239-244 (2000); 및 미국 특허 5,241,070 (각 문헌은 그 방법에 관한 교시내용이 전부 참고인용됨)]에 기술되어 있다. 아크리디늄-9-카르복실레이트 아릴 에스테르 및 이의 사용에 대해서는 US 2008-0248493에 기술되어 있다.
화학발광 분석(예: 전술한 아크리디늄 또는 다른 화학발광제 사용)은 문헌[Adamczyk et al., Anal. Chim. Acta 579(1): 61-67 (2006)]에 기술된 방법에 따라 수행될 수 있다. 임의의 적당한 분석 형식을 이용할 수 있으나, 마이크로플레이트 화학발광측정기(microplate chemiluminometer (Mithras LB-940, Berthold Technologies U.S.A., LLC, Oak Ridge, TN))는 소량의 여러 시료를 빠르게 분석할 수 있게 해준다.
화학발광 분석의 혼합물을 제조하기 위해 검사 시료와 특정 결합 파트너(들)를 첨가하는 순서는 중요하지 않다. 1차 특이적 결합 파트너가 아크리디늄 화합물과 같은 화학발광제로 검출가능하게 표지화되면, 검출가능하게 표지화된 1차 특이적 결합 파트너-피분석물 복합체가 형성된다. 대안적으로, 2차 특이적 결합 파트너가 사용되고 아크리디늄 화합물과 같은 화학발광제로 2차 특이적 결합 파트너가 검출가능하게 표지화되면, 검출가능하게 표지화된 1차 특이적 결합 파트너-피분석물-2차 특이적 결합 파트너 복합체가 형성된다. 표지화 여부에 관계없이 임의의 미결합된 특이적 결합 파트너는 세척과 같은 당업계에 공지된 임의의 기술로 혼합물로부터 제거할 수 있다.
과산화수소는 혼합물에서 동일계에서 생성될 수도 있고, 또는 전술한 아크리디늄 화합물의 첨가 전, 첨가와 동시에 또는 첨가 후에 혼합물에 제공 또는 공급될 수 있다(예컨대, 과산화수소의 급원은 과산화수소를 함유하는 것으로 알려진 하나 이상의 완충액 또는 다른 용액이다). 과산화수소는 당업자에게 자명한 것과 같은 다수의 방법으로 동일계에서 생성될 수 있다.
시료에 적어도 하나의 염기성 용액을 동시 첨가 또는 후속 첨가한 후, 피분석물의 존재를 표시하는 검출가능 시그널, 즉 화학발광 시그널이 생성된다. 염기성 용액은 적어도 하나의 염기를 함유하고, pH가 10 이상, 바람직하게는 12 이상이다. 염기성 용액의 예는 수산화나트륨, 수산화칼륨, 수산화칼슘, 수산화암모늄, 수산화마그네슘, 탄산나트륨, 중탄산나트륨, 수산화칼슘, 탄산칼슘 및 중탄산칼슘을 포함하지만, 이에 국한되는 것은 아니다. 사용된 염기성 용액의 농도를 기초로 하여, 당업자는 시료에 첨가할 염기성 용액의 양을 쉽게 결정할 수 있다.
발생되는 화학발광 시그널은 당업자에게 통상적인 기술로 검출할 수 있다. 발생된 시그널의 강도를 기초로 하여, 시료에 존재하는 피분석물의 양을 정량분석할 수 있다. 구체적으로, 시료에 존재하는 피분석물의 양은 발생된 시그널의 강도에 비례한다. 존재하는 피분석물의 양은 발생된 광의 양을 피분석물의 표준곡선과 비교하거나, 참조 표준물과 비교하여 정량분석할 수 있다. 표준 곡선은 질량 분광분석법, 중량측정법 및 당업계에 공지된 기타 기술에 의해 피분석물의 공지된 농도의 용액 또는 연속 희석물을 이용하여 작도할 수 있다. 이상은 화학발광제로서 아크리디늄 화합물의 사용에 대해 비중을 두어 설명했지만, 당업자는 다른 화학발광제의 사용에도 본 설명을 쉽게 채택할 수 있다.
피분석물 면역분석은 일반적으로 당업계에 공지된 임의의 형식, 예컨대 샌드위치 형식으로 수행할 수 있으나, 이에 국한되는 것은 아니다. 구체적으로, 하나의 면역분석 형식에서는 사람 피분석물과 같은 피분석물 또는 이의 단편을 시료에서 분리 및 정량분석하기 위해 적어도 2종의 항체를 이용한다. 더 구체적으로, 적어도 2종의 항체는 피분석물(또는 이의 단편) 상의 다른 에피토프에 결합하여 면역 복합체를 형성하고, 이는 "샌드위치"라고 불린다. 일반적으로, 면역분석법에서, 하나 이상의 항체는 검사 시료에 있는 피분석물(또는 이의 단편)을 포획하는데 사용될 수 있고(이 항체들은 종종 "포획" 항체 또는 "포획" 항체들이라 불린다), 하나 이상의 항체는 샌드위치에 검출가능(즉, 정량분석성) 표지를 결합시키는데 사용될 수 있다(이 항체들은 종종 "검출 항체", "검출 항체들", "접합체" 또는 "접합체들"이라 불리기도 한다). 따라서, 샌드위치 면역분석 형식과 관련하여, 본원에 기술된 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)은 포획 항체, 검출 항체 또는 둘다로서 사용될 수 있다. 예를 들어, 피분석물(또는 이의 단편) 상의 제1 에피토프에 결합할 수 있는 도메인을 보유한 하나의 DVD-Ig은 포획 항체로 사용될 수 있고/있거나, 피분석물(또는 이의 단편) 상의 제2 에피토프에 결합할 수 있는 도메인을 보유한 다른 DVD-Ig은 검출 항체로 사용될 수 있다. 이와 관련하여, 피분석물(또는 이의 단편) 상의 제1 에피토프에 결합할 수 있는 제1 도메인 및 피분석물(또는 이의 단편) 상의 제2 에피토프에 결합할 수 있는 제2 도메인을 보유하는 DVD-Ig은 포획 항체 및/또는 검출 항체로 사용될 수 있다. 대안적으로, 제1 피분석물(또는 이의 단편) 상의 에피토프에 결합할 수 있는 제1 도메인 및 제2 피분석물(또는 이의 단편) 상의 에피토프에 결합할 수 있는 제2 도메인을 보유하는 하나의 DVD-Ig은 2종 이상의 피분석물을 검출하고, 경우에 따라 정량분석하는 포획 항체 및/또는 검출 항체로 사용될 수 있다. 피분석물이 하나보다 많은 형태, 예컨대 단량체 형태 및 이량체/다량체 형태(동종체 또는 이종체성일 수 있다)로 시료에 존재할 수 있는 경우, 단량체 형태에서 유일하게 노출된 에피토프에 결합할 수 있는 하나의 DVD-Ig 및 이량체/다량체 형태의 다른 부분에 있는 에피토프에 결합할 수 있는 도메인을 보유하는 다른 DVD-Ig을 포획 항체들 및/또는 검출 항체들로 이용하여, 주어진 피분석물의 여러 형태를 검출 및 선택적으로 정량분석할 수 있다. 또한, 단일 DVD-Ig 내에서 다른 친화성을 보유하는 DVD-Ig을 이용하고/하거나 DVD-Ig 간에 다른 친화성을 보유하는 DVD-Ig을 이용하면, 결합도 이점을 제공할 수 있다. 본 명세서에 기술된 면역분석의 정황에서, DVD-Ig의 구조 내에는 하나 이상의 링커를 포함하는 것이 일반적으로 도움이 되거나 바람직할 수 있다. 존재할 때, 최적의 링커는 내부 도메인에 의한 에피토프의 결합뿐만 아니라 외부 도메인에 의한 다른 에피토프의 결합을 가능하게 하는 충분한 길이와 구조직 유연성이 있어야 한다. 이와 관련하여, DVD-Ig이 2가지 다른 피분석물에 결합할 수 있고, 하나의 피분석물이 다른 피분석물보다 크다면, 큰 피분석물이 외부 도메인에 의해 결합되는 것이 바람직하다.
일반적으로 말하면, 피분석물(또는 이의 단편)에 대해 검사되는(예컨대, 함유가 의심되는) 시료를 적어도 하나의 포획 항체(또는 항체들) 및 적어도 하나의 검출 항체(제2 검출 항체 또는 제3 검출 항체 또는 심지어 그 이상의 항체, 예컨대 포획 및/또는 검출 항체가 다수 항체를 포함하는 경우처럼)와 동시 또는 연속해서 임의의 순서로 접촉시킬 수 있다. 예를 들어, 검사 시료는 먼저 적어도 하나의 포획 항체와 접촉시킨 후, 그 다음(연속해서) 적어도 하나의 검출 항체와 접촉시킬 수 있다. 대안적으로, 검사 시료는 먼저 적어도 하나의 검출 항체와 접촉시키고, 그 다음(연속해서) 적어도 하나의 포획 항체와 접촉시킬 수 있다. 또 다른 대안으로, 검사 시료는 포획 항체 및 검출 항체와 동시에 접촉시킬 수 있다.
샌드위치 분석 형식에서, 피분석물(또는 이의 단편)을 함유하는 것으로 의심되는 시료를 먼저 적어도 하나의 제1 포획 항체와 제1 항체/피분석물 복합체의 형성을 허용하는 조건 하에 접촉시킨다. 하나보다 많은 포획 항체가 사용되면, 2종 이상의 포획 항체를 함유하는 제1 포획 항체/피분석물 복합체를 제조한다. 샌드위치 분석에서, 항체, 즉 바람직하게는 적어도 하나의 포획 항체는 검사 시료에서 예상된 피분석물(또는 이의 단편)의 최대량의 몰 과량으로 사용한다. 예를 들어, 완충액(예: 마이크로입자 코팅 완충액) 1ml당 항체 약 5 ㎍ 내지 약 1mg을 사용할 수 있다.
하나의 항체에 의한 결합만이 필요하기 때문에 소량의 피분석물을 측정하는데 종종 사용되는 경쟁적 저해 면역분석은 순차 형식 및 고전적 형식을 포함한다. 순차 경쟁적 저해 면역분석에서, 당해 피분석물에 대한 포획 항체가 미세역가 평판의 웰 또는 다른 고상 지지체 상에 코팅된다. 당해 피분석물을 함유하는 시료가 웰에 첨가되면, 당해 피분석물은 포획 항체에 결합한다. 세척 후, 공지 양의 표지화된(예: 비오틴 또는 양고추냉이 퍼옥시다제(HRP)) 피분석물을 웰에 첨가한다. 효소적 표지의 기질은 시그널 생성에 필수적이다. HRP에 적당한 기질의 예는 3,3',5,5'-테트라메틸벤지딘(TMB)이다. 세척 후, 표지화된 피분석물에 의해 생성된 시그널을 측정하고, 시료 중의 피분석물의 양에 반비례한다. 고전적 경쟁 저해 면역분석에서는 당해 피분석물에 대한 항체를 고상 지지체(예: 미세역가 평판의 웰) 위에 코팅한다. 하지만, 순차 경쟁적 저해 면역분석과 달리, 시료와 표지화된 피분석물을 동시에 웰에 첨가한다. 시료 중의 모든 피분석물은 포획 항체에 결합하기 위해 표지화된 피분석물과 경쟁한다. 세척 후, 표지화된 피분석물에 의해 생성된 시그널을 측정하고 시료에 있는 피분석물의 양에 반비례한다.
경우에 따라, 검사 시료를 적어도 하나의 포획 항체(예컨대, 제1 포획 항체)와 접촉시키기 전에, 적어도 하나의 포획 항체는 고상 지지체에 결합시킬 수 있는데, 이는 검사 시료로부터 제1 항체/피분석물(또는 이의 단편) 복합체의 분리를 촉진시킨다. 포획 항체가 결합되는 기질은 시료로부터 포획 항체/피분석물 복합체의 분리를 촉진하는 임의의 적합한 고상 지지체 또는 고상일 수 있다.
그 예로는, 평판, 예컨대 미세역가 평판의 웰, 시험관, 다공성 겔(예: 실리카겔, 아가로스, 덱스트란 또는 젤라틴), 중합체성 필름(예: 폴리아크릴아미드), 비드(예: 폴리스티렌 비드 또는 자성 비드), 필터/막(예: 니트로셀룰로스 또는 나일론)의 스트립, 마이크로입자(예: 라텍스 입자, 자성화성 마이크로입자(예: 산화제2철 또는 산화크롬 코어 및 동종중합체성 또는 이종중합체성 코트를 보유하고 약 1 내지 10 미크론의 반경을 보유하는 마이크로입자)를 포함한다. 기질은 항원에 결합하는 적당한 표면 친화성 및 검출 항체에 의한 접근을 허용하기에 충분한 다공성을 보유하는 적당한 다공성 재질을 포함한다. 수화된 상태의 젤라틴성 물질을 사용할 수 있지만, 마이크로다공성 재료가 일반적으로 바람직하다. 이러한 다공성 기질은 두께가 약 0.01 내지 약 0.5mm, 바람직하게는 약 0.1mm인 시트 형태인 것이 바람직하다. 기공 크기는 매우 다양할 수 있지만, 기공 크기는 0.025 내지 약 15 미크론 범위가 바람직하고, 약 0.15 내지 약 15 미크론 범위가 더 바람직하다. 이러한 기질의 표면은 기질에 대한 항체의 공유 결합을 유발하는 화학 공정에 의해 활성화될 수 있다. 기질에 대한 항체 또는 항원의 비가역적 결합, 일반적으로 소수성 힘을 통한 흡착에 의한 결합이 초래되고; 대안적으로, 화학적 커플링제 또는 다른 수단을 이용하여 항체를 기질에 공유 결합할 수 있으나, 단 이러한 결합은 피분석물에 결합하는 항체의 능력을 방해하지 않아야 한다. 대안적으로, 항체는, 사전에 스트렙타비딘(예: DYNAL® Magnetic Beads, Invitrogen, Carlsbad, CA) 또는 비오틴(예: Power-BindTM-SA-MP 스트렙타비딘-코팅된 마이크로입자(Seradyn, Indianapolis, IN) 또는 항-종-특이적 모노클로날 항체로 코팅된 마이크로입자에 결합될 수 있다. 필요하다면, 기질은 항체 상의 다양한 작용기와 반응성을 허용하도록 유도체화될 수 있다. 이러한 유도체화는 특정 커플링제의 사용을 필요로 하고, 그러한 커플링제의 예로는 말레산 무수물, N-하이드록시석신이미드, 및 1-에틸-3-(3-디메틸아미노프로필) 카르보디이미드를 포함하지만, 이에 국한되는 것은 아니다. 필요하다면, 피분석물(들)에 각각 특이적인 하나 이상의 포획제, 예컨대 항체(또는 이의 단편)를 다른 물리적 또는 어드레스가능한 위치(예: 바이오칩 구성에서(예컨대, 미국 특허 6,225,047; 국제출원 공개번호 WO 99/51773; 미국 특허 6,329,209; 국제출원 공개번호 00/56934 및 미국 특허 5,242,828 참조))의 고상에 부착시킬 수 있다. 포획 시약이 고상 지지체로서 질량 분광분석 프로브에 부착되면, 프로브에 결합된 피분석물의 양은 레이저 탈착 이온화 질량 분광분석으로 검출할 수 있다. 대안적으로, 단일 컬럼이 여러 비드들로 충진될 수 잇고, 이 비드들은 하나 이상의 포획 시약으로 유도체화되어 단일 위치에서 피분석물을 포획할 수 있다(항체-유도체화된 비드계 기술, 예컨대 Luminex(Austin, TX)의 xMAP 기술을 참조).
피분석물(또는 이의 단편)에 대해 분석되는 검사 시료를 적어도 하나의 포획 항체(예컨대, 제1 포획 항체)와 접촉시킨 후, 혼합물은 제1 항체(또는 다중 항체)-피분석물(또는 이의 단편) 복합체를 형성하도록 항온처리한다. 항온처리는 약 4.5 내지 약 10.0의 pH, 약 2℃ 내지 약 45℃의 온도에서 적어도 약 1분 내지 약 18시간, 바람직하게는 약 1 내지 약 24분, 가장 바람직하게는 약 4 내지 약 18분 동안 수행할 수 있다. 본 명세서에 기술된 면역분석은 한 단계로 수행할 수 있고(이는 검사 시료, 적어도 하나의 포획 항체 및 적어도 하나의 검출 항체가 모두 반응기에 순차로 또는 동시에 첨가되는 것을 의미한다) 또는 2 이상의 단계, 예컨대 2 단계, 3 단계 등으로 수행할 수 있다.
포획 항체(제1 포획 항체 또는 다수의 포획 항체)/피분석물(또는 이의 단편) 복합체의 형성 후, 복합체는 그 후 (제1 또는 다수의) 포획 항체/피분석물(또는 이의 단편)/제2 검출 항체 복합체의 형성을 허용하는 조건 하에 적어도 하나의 검출 항체와 접촉시킨다. "제2" 항체(예컨대, 제2 검출 항체)와 같이 분명하게 캡션이 붙은 경우, 사실상 다수의 항체가 포획 및/또는 검출에 사용되는 경우, 적어도 하나의 검출 항체는 면역분석에 사용된 제2, 제3, 제4 항체 등일 수 있다. 포획 항체/피분석물(또는 이의 단편) 복합체가 하나보다 많은 검출 항체와 접촉되는 경우, (제1 또는 다수의) 포획 항체/피분석물(또는 이의 단편)/(다수의) 검출 항체 복합체가 형성된다. 포획 항체(예: 제1 포획 항체)와 관련하여, 적어도 하나(예컨대, 제2 및 임의의 후속) 검출 항체가 포획 항체/피분석물(또는 이의 단편) 복합체와 접촉하게 될 때, (제1 또는 다수의) 포획 항체/피분석물(또는 이의 단편)/(제2 또는 다수의) 검출 항체 복합체의 형성에는 전술한 것과 유사한 조건 하에 항온처리 기간이 필요하다. 적어도 하나의 검출 항체는 검출가능 표지를 함유하는 것이 바람직하다. 검출가능 표지는 (제1 또는 다수의) 포획 항체/피분석물(또는 이의 단편)/(제2 또는 다수의) 검출 항체 복합체의 형성 전, 동시 또는 형성 후에 적어도 하나의 검출 항체(예: 제2 검출 항체)에 결합될 수 있다. 당업계에 공지된 임의의 검출가능 표지가 사용될 수 있다(앞에서 논한 설명 참조, 예컨대 Polak and Van Noorden(1997) 및 Haugland(1996) 참조문헌).
검출가능 표지는 커플링제를 통해 또는 직접 항체에 결합될 수 있다. 사용될 수 있는 커플링제의 예는 EDAC(1-에틸-3-(3-디메틸아미노프로필)카르보디이미드, 염산염)로, 이는 시그마-알드리치(St.Louis, MO)에서 구입할 수 있다. 사용될 수 있는 다른 커플링제는 당업계에 공지되어 있다. 검출가능 표지를 항체에 결합하기 위한 방법은 당업계에 공지되어 있다. 또한, 많은 검출가능 표지는 항체에 대한 검출가능 표지의 커플링을 촉진하는 말단 기를 이미 함유하는 것으로 구입하거나 합성할 수 있으며, 예컨대 CPSP-아크리디늄 에스테르(즉, 9-[N-토실-N-(3-카르복시프로필)]-10-(3-설포프로필)아크리디늄 카르복사미드) 또는 SPSP-아크리디늄 에스테르(즉, N10-(3-설포프로필)-N-(3-설포프로필)-아크리디늄-9-카르복사미드)가 있다.
(제1 또는 다수의) 포획 항체/피분석물/(제2 또는 다수의) 검출 항체 복합체는 표지를 정량하기 전에 검사 시료의 나머지로부터 분리할 수 있지만, 반드시 분리해야 할 필요는 없다. 예를 들어, 적어도 하나의 포획 항체(예: 제1 포획 항체)가 고상 지지체, 예컨대 웰 또는 비드에 결합되어 있다면, 분리는 고상 지지체와 접촉으로부터 유체(검사 시료의 유체)를 제거하여 달성할 수 있다. 대안적으로, 적어도 하나의 제1 포획 항체가 고상 지지체에 결합되면, 동시에 피분석물 함유 시료 및 적어도 하나의 제2 검출 항체와 동시에 접촉시켜 제1(다수의) 항체/피분석물/제2(다수의) 항체 복합체를 형성할 수 있고, 그 후 고상 지지체와 접촉으로부터 유체(검사 시료)를 제거할 수 있다. 적어도 하나의 제1 포획 항체가 고상 지지체에 결합되어 있지 않다면, (제1 또는 다수의) 포획 항체/피분석물/(제2 또는 다수의) 검출 항체 복합체는 표지 양을 정량하기 위해 검사 시료로부터 제거해야 할 필요가 없다.
표지화된 포획 항체/피분석물/검출 항체는 복합체(예: 제1 포획 항체/피분석물/제2 검출 항체 복합체)의 형성 후, 복합체 중의 표지의 양은 당업계에 공지된 기술을 이용하여 정량분석한다. 예를 들어, 효소 표지가 사용되면, 표지화된 복합체를 발색과 같은 정량성 반응을 제공하는 표지의 기질과 반응시킨다. 표지가 방사능 표지인 경우, 표지는 신틸레이션 계수기와 같은 적당한 수단으로 정량한다. 표지가 형광 표지이면, 표지는 이 표지를 한 색의 빛("여기 파장"으로 알려진 빛)으로 자극하고, 자극에 대한 반응으로 표지에 의해 방출되는 다른 색("방출 파장"으로 알려진 빛)을 검출하여 정량한다. 표지가 화학발광 표지라면, 표지는 방출되는 빛을 육안으로 또는 발광계, x선 필름, 고속 사진 필름, CCD 카메라 등으로 검출하여 정량분석한다. 복합체 중의 표지의 양이 정량분석되면, 검사 시료에 있는 피분석물 또는 이의 단편의 농도를 적당한 수단으로, 예컨대 공지된 농도의 피분석물 또는 이의 단편의 연속 희석물을 이용해 만든 표준 곡선을 이용하여 측정한다. 피분석물 또는 이의 단편의 연속 희석물을 이용하는 것 외에, 표준 곡선은 중량분석, 질량 분광분석 및 당업계에 공지된 다른 기술로 만들 수 있다.
ARCHITECT® 분석기를 이용한 화학발광 마이크로입자 분석에서, 접합체 희석제 pH는 약 6.0 +/- 0.2이어야 하고, 마이크로입자 코팅 완충액은 대략 실온(즉, 약 17 내지 27℃)에서 유지되어야 하며, 마이크로입자 코팅 완충액 pH는 약 6.5 +/- 0.2이어야 하고, 마이크로입자 희석제 pH는 약 7.8 +/- 0.2이어야 한다. 고상은 바람직하게는 약 0.2% 미만, 예컨대 약 0.15% 미만, 약 0.14% 미만, 약 0.13% 미만, 약 0.12% 미만, 또는 약 0.11% 미만, 예컨대 약 0.10%이다.
FPIA는 경쟁적 결합 면역분석 원리를 기초로 한다. 형광 표지된 화합물은 선상 편광에 의해 여기될 때 편광도가 회전률에 반비례하는 형광을 방출한다. 형광 표지된 추적자-항체 복합체가 선상 편광에 의해 여기될 때, 방출 빛은 높은 편광을 유지하는데, 그 이유는 빛이 흡수되는 시간과 빛이 방출되는 시간 사이에 형광단이 회전 제약을 받기 때문이다. "유리" 추적자 화합물(즉, 항체에 결합되지 않는 화합물)이 선상 편광에 의해 여기될 때, 회전은 경쟁적 결합 면역분석에서 생산된 대응하는 추적자-항체 접합체보다 훨씬 빠르다. FPIA는 특별한 취급과 폐기를 필요로 하는 방사능 물질이 없는 만큼 RIA보다 유리하다. 또한, FPIA는 쉽고 빠르게 수행될 수 있는 균질 분석이다.
전술한 관점에서, 검사 시료 중의 피분석물(또는 이의 피분석물)의 존재, 양 또는 농도를 측정하는 방법이 제공된다. 이 방법은 (i) (i') 적어도 하나의 항체, 피분석물에 결합할 수 있는 항체의 단편, 피분석물에 결합할 수 있는 항체의 변형체, 피분석물에 결합할 수 있는 항체 변형체의 단편, 및 피분석물에 결합할 수 있는 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편), 및 (ii') 적어도 하나의 검출가능 표지를 이용하고 (ii) 검사 시료 중의 피분석물(또는 이의 단편)의 존재, 양 또는 농도의 직접 또는 간접 표시로서 검출가능 표지에 의해 생성된 시그널을 대조군 또는 캘리브레이터 중의 피분석물(또는 이의 단편)의 존재, 양 또는 농도의 직접 또는 간접 표시로서 생성된 시그널과 비교하는 것을 포함하는 분석에 의해 피분석물(또는 이의 단편)에 대해 검사 시료를 분석하는 것을 포함한다. 캘리브레이터는 경우에 따라 일련의 캘리브레이터의 일부로서, 각 캘리브레이터는 피분석물의 농도가 다른 캘리브레이터와 다르다.
당해 방법은 (i) 항체, 피분석물에 결합할 수 있는 항체의 단편, 피분석물에 결합할 수 있는 항체의 변형체, 피분석물에 결합할 수 있는 항체 변형체의 단편 및 피분석물에 결합할 수 있는 DVD-Ig(또는 이의 단편, 변형체, 또는 변형체의 단편)로 이루어진 그룹 중에서 선택되는 피분석물(또는 이의 단편)의 적어도 하나의 제1 특이적 결합 파트너와 검사 시료를 접촉시켜 제1 특이적 결합 파트너/피분석물(이의 단편) 복합체를 형성시키는 단계, (ii) 검출가능하게 표지화된 항-피분석물 항체, 피분석물에 결합할 수 있는 항-피분석물 항체의 검출가능하게 표지화된 단편, 피분석물에 결합할 수 있는 항-피분석물 항체의 검출가능한 표지화된 변형체, 피분석물에 결합할 수 있는 항-피분석물 항체의 변형체의 검출가능하게 표지화된 단편, 및 검출가능하게 표지화된 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)로 이루어진 그룹 중에서 선택되는 피분석물(또는 이의 단편)의 적어도 하나의 제2 특이적 결합 파트너와 제1 특이적 결합 파트너/피분석물(또는 이의 단편)을 접촉시켜 제1 특이적 결합 파트너/피분석물(또는 이의 단편)/제2 특이적 결합 파트너 복합체를 형성시키는 단계, 및 (iii) 상기 (ii)에서 형성된 제1 특이적 결합 파트너/피분석물(또는 이의 단편)/제2 특이적 결합 파트너 복합체에서 검출가능 표지에 의해 생성된 시그널을 검출하거나 측정하여 검사 시료 중의 피분석물의 존재, 양 또는 농도를 측정하는 단계를 포함할 수 있다. 피분석물(또는 이의 단편)의 적어도 하나의 제1 특이적 결합 파트너 및/또는 피분석물(또는 이의 단편)의 적어도 하나의 제2 특이적 결합 파트너가 본 명세서에 기술된 DVD-Ig(또는 이의 단편, 변형체, 변형체의 단편)인 방법이 바람직할 수 있다.
대안적으로, 당해 방법은 항체, 피분석물에 결합할 수 있는 항체의 단편, 피분석물에 결합할 수 있는 항체의 변형체, 피분석물에 결합할 수 있는 항체 변형체의 단편, 및 DVD-Ig(또는 이의 단편, 변형체, 변형체의 단편)로 이루어진 그룹 중에서 선택되는 피분석물(또는 이의 단편)의 적어도 하나의 제1 특이적 결합 파트너와 검사 시료를 접촉시키는 단계, 및 동시에 또는 순차로 어떤 순서든지, 적어도 하나의 제1 특이적 결합 파트너에 결합하기 위해 피분석물(또는 이의 단편)과 경쟁할 수 있고 검출가능하게 표지화된 피분석물, 제1 특이적 결합 파트너에 결합할 수 있는 피분석물의 검출가능하게 표지화된 단편, 제1 특이적 결합 파트너에 결합할 수 있는 피분석물의 검출가능하게 표지화된 변형체, 및 제1 특이적 결합 파트너에 결합할 수 있는 피분석물의 변형체의 검출가능하게 표지화된 단편으로 이루어진 그룹 중에서 선택되는 적어도 하나의 제2 특이적 결합 파트너와 검사 시료를 접촉시키는 단계를 포함할 수 있다. 검사 시료에 존재하는 임의의 피분석물(또는 이의 단편)과 적어도 하나의 제2 특이적 결합 파트너는 서로 경쟁하여 제1 특이적 결합 파트너/피분석물(또는 이의 단편) 복합체 및 제1 특이적 결합 파트너/제2 특이적 결합 파트너 복합체를 각각 형성한다. 당해 방법은 또한 (ii)에서 형성된 제1 특이적 결합 파트너/제2 특이적 결합 파트너 복합체 중의 검출가능 표지에 의해 생성된 시그널을 검출하거나 측정하여 검사 시료 중의 피분석물의 존재, 양 또는 농도를 측정하는 단계를 포함하며, 여기서 제1 특이적 결합 파트너/제2 특이적 결합 파트너 복합체에서 검출가능 표지에 의해 생성된 시그널은 검사 시료 중의 피분석물의 양 또는 농도에 반비례한다.
상기 방법은 또한 검사 시료가 수득되는 환자의 치료요법적/예방요법적 치료 효능을 진단, 예후 또는 평가하는 단계를 포함할 수 있다. 이 방법이 또한 검사 시료가 수득된 환자의 치료요법적/예방요법적 치료 효능을 평가하는 단계를 포함한다면, 이 방법은 경우에 따라 추가로 효능을 향상시키기 위해 필요한 경우, 환자의 치료요법적/예방요법적 치료를 조정하는 단계를 포함한다. 이 방법은 자동 시스템 또는 반자동 시스템에 사용하기 위해 조정할 수 있다.
분석 방법(및 이를 위한 키트)과 관련하여, 문헌에 기술된 바와 같이 항-피분석물의 생산 방법 또는 시판 항-피분석물 항체를 이용하는 것이 가능할 수 있다. 다양한 항체의 시판원으로는 Santa Cruz Biotechnology Inc.(Santa Cruz, CA), GenWay Biotech, Inc.(San Diego, CA) 및 R&D Systems(RDS; Minneapolis, MN)을 포함하지만, 이에 국한되는 것은 아니다.
일반적으로, 예컨대 질환이나 질환의 위험을 검출하기 위해, 피분석물 또는 이의 단편에 대해 검사 시료를 분석할 때, 수득되는 결과를 평가하는 벤치마크로서 소정의 수준을 이용할 수 있다. 일반적으로, 이러한 비교 시, 소정의 수준은 질환, 장애 또는 상태의 특정 단계 또는 종점과 또는 특정 임상 지표와 피분석물 존재, 양 또는 농도의 연계 또는 관계가 이루어질 수 있도록 적당한 조건 하에 충분한 횟수로 특정 분석을 수행하여 수득한다. 일반적으로, 소정의 수준은 참조 피검체(또는 피검체 집단)의 분석으로 수득한다. 측정된 피분석물은 이의 단편, 이의 분해 산물 및/또는 이의 효소적 절단 산물을 포함할 수 있다.
특히, 질환 진행 및/또는 치료의 모니터 시에 이용된 소정의 수준과 관련하여, 피분석물 또는 이의 단편의 양 또는 농도는 "변화되지 않은", "바람직한"(또는 "바람직하게는 변경된") 또는 "바람직하지 않은" (또는 "바람직하지 않게 변경된") 것일 수 있다. "상승된" 또는 "증가된"은 전형적 또는 정상 수준 또는 범위(예: 소정의 수준)보다 높은, 또는 다른 참조 수준 또는 범위(예컨대, 이전 시료 또는 기준 시료)보다 높은 검사 시료 중의 양 또는 농도를 의미한다. "저하된" 또는 "감소된"이란 용어는 전형적 또는 정상 수준 또는 범위(예: 소정의 수준)보다 낮은, 또는 다른 참조 수준 또는 범위(예컨대, 이전 시료 또는 기준 시료)보다 낮은 검사 시료 중의 양 또는 농도를 의미한다. "변경된"이란 용어는 전형적 또는 정상 수준 또는 범위(예: 소정의 수준), 또는 다른 참조 수준 또는 범위(예컨대, 이전 시료 또는 기준 시료)에 비해 변경된(증가된 또는 감소된) 시료 중의 양 또는 농도를 의미한다.
피분석물의 전형적 또는 정상 수준 또는 범위는 표준 관례에 따라 정의한다. 일부 경우에 피분석물의 수준은 매우 낮을 것이기 때문에, 실험 오차 또는 시료 변화에 의해 설명할 수 없는, 전형적 또는 정상 수준 또는 범위, 또는 참조 수준 또는 범위와 비교하여 임의의 순 변화가 있을 때 소위 변경된 수준 또는 변경이 일어난 것으로 간주할 수 있다. 따라서, 특정 시료에서 측정된 수준은 소위 정상 피검체 유래의 유사 시료에서 측정된 수준 또는 수준 범위와 비슷할 것이다. 이러한 정황에서, "정상 피검체"는 예컨대 검출가능 질환이 없는 개체이며, "정상"(때로는 "대조군"이라 불림) 환자 또는 집단은 예컨대 검출가능 질환을 각각 전혀 나타내지 않는 환자 또는 집단이다. 또한, 피분석물의 사람 집단의 대부분에서 높은 수준으로 통상적으로 발견되지 않는다면, "정상 피검체"는 피분석물의 실질적으로 검출가능한 증가 또는 상승된 양 또는 농도가 전혀 없는 개체로 간주할 수 있고, "정상" (때로는 "대조군"이라 지칭됨) 환자 또는 집단은 실질적으로 검출가능한 증가 또는 감소된 양 또는 농도의 피분석물을 나타내지 않는 환자 또는 집단이다. "겉보기 정상 피검체"는 피분석물이 아직 평가되지 않았거나, 현재 평가되고 있는 피검체이다. 피분석물의 수준은 보통 검출할 수 없지만(예컨대, 정상 수준은 0 또는 정상 집단의 약 25 내지 약 75 백분위수 범위 이내이다), 검사 시료에서 검출될 때뿐만 아니라 검사 시료에서 정상 수준보다 높게 존재할 때 "상승된"이라고 말한다. 따라서, 특히 본 발명은 특정 질환, 장애 또는 상태가 있거나 또는 있을 위험이 있는 피검체를 선별하는 방법을 제공한다. 또한, 분석 방법은 다른 마커의 분석 등을 수반할 수도 있다.
따라서, 본 명세서에 기술된 방법은 또한 피검체가 주어진 질환, 장애 또는 상태를 보유하거나 또는 발생 위험이 있는지의 여부를 측정하는데 사용될 수 있다. 구체적으로, 이러한 방법은
(a) 피검체 유래의 검사 시료에서 피분석물(또는 이의 단편)의 농도 도는 양을 측정하는 단계(예컨대, 본 명세서에 기술된 방법 또는 당업계에 공지된 방법을 이용하여); 및
(b) 단계 (a)에서 측정된 피분석물(또는 이의 단편)의 농도 또는 양을 소정의 수준과 비교하는 단계를 포함하며, 상기 단계 (a)에서 측정된 피분석물의 농도 또는 양이 소정의 수준에 비해 바람직하다면, 피검체는 주어진 질환, 장애 또는 상태를 보유하지 않거나 보유할 위험이 없는 것으로 결정한다. 하지만, 단계 (a)에서 측정된 피분석물의 농도 또는 양이 소정의 수준에 비해 바람직하지 않다면, 피검체는 주어진 질환, 장애 및 상태를 보유하거나 보유할 위험이 있는 것으로 판정한다.
또한, 본 발명은 피검체 중의 질환의 진행을 모니터하는 방법을 제공한다. 가장 적합하게는, 본 방법은
(a) 피검체 유래의 검사 시료에서 피분석물의 농도 또는 양을 측정하는 단계;
(b) 피검체의 이후 검사 시료에서 피분석물의 농도 또는 양을 측정하는 단계;
(c) 단계 (b)에서 측정된 피분석물의 농도 또는 양을 단계 (a)에서 측정된 피분석물의 농도 또는 양과 비교하는 단계를 포함하고, 단계 (b)에서 측정된 농도 또는 양이 단계 (a)에서 측정된 피분석물의 농도 또는 양과 비교했을 때 변화되지 않거나 바람직하지 않은 것이라면, 이 피검체의 질환은 계속되고 있거나, 진행되고 있거나 또는 악화된 것이라 판정한다. 이에 비해, 단계 (b)에서 측정된 피분석물의 농도 또는 양이 단계 (a)에서 측정된 피분석물의 농도 또는 양에 비해 바람직한 것이라면, 피검체의 질환은 중지되거나, 퇴화되거나 개선된 것이라 판정한다.
경우에 따라, 이 방법은 추가로 단계 (b)에서 측정된 피분석물의 농도 또는 양을 소정의 수준과 비교하는 단계를 포함한다. 또한, 경우에 따라 이 방법은 비교 결과 단계 (b)에서 측정된 피분석물의 농도 또는 양이 예컨대 소정의 수준에 비해 바람직하지 않게 변경된 것으로 나타나면 일정 시간 동안 하나 이상의 약제학적 조성물로 검체를 치료하는 단계를 포함한다.
또한, 본 방법은 하나 이상의 약제학적 조성물로 치료를 받는 피검체의 치료를 모니터하는데 사용될 수 있다. 구체적으로, 이 방법은 피검체에게 하나 이상의 약제학적 조성물을 투여하기 전에 피검체로부터 제1 검사 시료를 준비하는 단계를 포함한다. 다음, 피분석물의 피검체로부터 제1 검사 시료에서 농도 또는 양을 측정한다(예컨대, 본 명세서에 기술된 방법 또는 당업계에 공지된 방법을 이용하여). 피분석물의 농도 또는 양이 측정된 후, 경우에 따라 피분석물의 농도 또는 양을 소정의 수준과 비교한다. 제1 검사 시료에서 측정된 피분석물의 농도 또는 양이 소정의 수준보다 낮다면, 피검체는 하나 이상의 약제학적 조성물로 치료하지 않는다. 하지만, 제1 검사 시료에서 측정된 피분석물의 농도 또는 양이 소정의 수준보다 높다면, 피검체를 일정 기간 동안 하나 이상의 약제학적 조성물로 치료한다. 피검체가 하나 이상의 약제학적 조성물로 처리되는 기간은 당업자라면 결정할 수 있다(예컨대, 기간은 약 7일 내지 약 2년, 바람직하게는 약 14일 내지 약 1년일 수 있다).
하나 이상의 약제학적 조성물로 치료하는 과정 동안 제2 및 후속 검사 시료를 피검체로부터 수득한다. 검사 시료의 수 및 피검체로부터 검사 시료를 수득하는 시기는 중요하지 않다. 예컨대, 제2 검사 시료는 하나 이상의 약제학적 조성물을 피검체에게 처음 투여한 후 7일 후에 수득할 수 있고, 제3 검사 시료는 하나 이상의 약제학적 조성물을 피검체에게 처음 투여한 후 2주 후에 수득할 수 있으며, 제4 검사 시료는 하나 이상의 약제학적 조성물을 피검체에게 처음 투여한 후 3주 후에 수득할 수 있으며, 제5 검사 시료는 하나 이상의 약제학적 조성물을 피검체에게 처음 투여한 후 4주 후에 수득하는 등으로 할 수 있다.
각 제2 또는 후속 검사 시료를 피검체로부터 수득한 후, 제2 또는 후속 검사 시료 중의 피분석물의 농도 또는 양을 측정한다(예컨대, 본 명세서에 기술된 방법 또는 당업계에 공지된 방법을 이용하여). 제2 검사 시료 또는 후속 검사 시료 각각에서 측정된 피분석물의 농도 또는 양은 제1 검사 시료(예컨대, 초기에 선택적으로 소정의 수준과 비교했던 검사 시료)에서 측정된 피분석물의 농도 또는 양과 비교한다. 단계 (c)에서 측정된 피분석물의 농도 또는 양이 단계 (a)에서 측정된 피분석물의 농도 또는 양과 비교했을 때 바람직하다면, 피검체의 질환은 중단되거나, 퇴화되거나 개선된 것으로 판정하고, 단계 (b)의 하나 이상의 약제학적 조성물을 피검체에게 계속해서 투여해야 한다. 하지만, 단계 (c)에서 측정된 농도 또는 양이 단계 (a)에서 측정된 피분석물의 농도 도는 양에 비해 바람직하지 않다면, 피검체의 질환은 계속되고 있거나, 진행되거나 또는 악화된 것으로 판정하고, 피검체는 단계 (b)에서 피검체에게 투여했던 하나 이상의 약제학적 조성물을 더 높은 농도로 치료하거나, 또는 피검체는 단계 (b)에서 피검체에게 투여했던 하나 이상의 약제학적 조성물과 다른 하나 이상의 약제학적 조성물로 치료해야 한다. 구체적으로, 피검체는 이 피검체의 피분석물 수준을 감소시키거나 저하시키기 위해 종래 수용했던 하나 이상의 약제학적 조성물과 다른 하나 이상의 약제학적 조성물로 치료할 수 있다.
일반적으로, 반복 검사가 수행될 수 있는 분석(예컨대, 질환 진행 및/또는 치료에 대한 반응의 모니터링 시)에서, 제2 또는 후속 검사 시료는 피검체로부터 제1 검사 시료를 수득한 후 일정 시간 후에 수득한다. 구체적으로, 피검체로부터 제2 검사 시료는 피검체로부터 제1 검사 시료를 수득한 후 수분, 수시간, 수일, 수주 또는 수년 후에 수득할 수 있다. 예를 들어, 제2 검사 시료는 피검체로부터 제1 검사 시료를 수득한 후 약 1분, 약 5분, 약 10분, 약 15분, 약 30분, 약 45분, 약 60분, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 6시간, 약 7시간, 약 8시간, 약 9시간, 약 10시간, 약 11시간, 약 12시간, 약 13시간, 약 14시간, 약 15시간, 약 16시간, 약 17시간, 약 18시간, 약 19시간, 약 20시간, 약 21시간, 약 22시간, 약 23시간, 약 24시간, 약 2일, 약 3일, 약 4일, 약 5일, 약 6일, 약 7일, 약 2주, 약 3주, 약 4주, 약 5주, 약 6주, 약 7주, 약 8주, 약 9주, 약 10주, 약 11주, 약 12주, 약 13주, 약 14주, 약 15주, 약 16주, 약 17주, 약 18주, 약 19주, 약 20주, 약 21주, 약 22주, 약 23주, 약 24주, 약 25주, 약 26주, 약 27주, 약 28주, 약 29주, 약 30주, 약 31주, 약 32주, 약 33주, 약 34주, 약 35주, 약 36주, 약 37주, 약 38주, 약 39주, 약 40주, 약 41주, 약 42주, 약 43주, 약 44주, 약 45주, 약 46주, 약 47주, 약 48주, 약 49주, 약 50주, 약 51주, 약 52주, 약 1.5년, 약 2년, 약 2.5년, 약 3.0년, 약 3.5년, 약 4.0년, 약 4.5년, 약 5.0년, 약 5.5년, 약 6.0년, 약 6.5년, 약 7.0년, 약 7.5년, 약 8.0년, 약 8.5년, 약 9.0년, 약 9.5년 또는 약 10.0년 후에 피검체로부터 수득할 수 있다.
질환 진행을 모니터하기 위해, 상기 분석법은 급성 상태를 앓고 있는 피검체에서 질환의 진행을 모니터하는데 이용할 수 있다. 급성 상태는 집중 진료 상태로도 알려진 것으로, 예컨대 심혈관계 또는 배설계에 관련된 생명을 위협하는 급성 질환 또는 다른 치명적인 의학적 상태를 의미한다. 통상, 집중진료 상태는 입원 기초 환경(예컨대, 응급실, 중환자실, 트라우마 센터 또는 다른 응급진료 환경)에서 급성 의학적 중재를 필요로 하거나, 또는 의료보조원 또는 다른 분야의 의료인에 의한 투여를 필요로 하는 상태를 의미한다. 집중 진료 상태 시, 반복 모니터링은 보통 단시간 내에, 즉, 수분, 수시간 또는 수일(예컨대, 약 1분, 약 5분, 약 10분, 약 15분, 약 30분, 약 45분, 약 60분, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 6시간, 약 7시간, 약 8시간, 약 9시간, 약 10시간, 약 11시간, 약 12시간, 약 13시간, 약 14시간, 약 15시간, 약 16시간, 약 17시간, 약 18시간, 약 19시간, 약 20시간, 약 21시간, 약 22시간, 약 23시간, 약 24시간, 약 2일, 약 3일, 약 4일, 약 5일, 약 6일 또는 약 7일) 내에 수행하고, 1차 분석은 마찬가지로 일반적으로 단기간 내에, 예컨대 질환 또는 상태 개시 후 약 수분, 수시간 또는 수일 내에 수행한다.
또한, 당해 분석은 만성 또는 비급성 상태를 앓고 있는 피검체에서 질환의 진행을 모니터하는데 사용될 수 있다. 비-집중진료 또는 비-급성 상태는 예컨대 심혈관계 또는 배설계에 관련된 생명을 위협하는 급성 질환 또는 다른 치명적인 의학적 상태 외의 다른 상태를 의미한다. 통상, 비-급성 상태는 장기간 또는 만성 기간인 상태를 포함한다. 비-급성 상태에서, 반복 모니터링은 보통 장시간, 예컨대 수시간, 수일, 수주, 수개월 또는 수년(예컨대, 약 1시간, 약 2시간, 약 3시간, 약 4시간, 약 5시간, 약 6시간, 약 7시간, 약 8시간, 약 9시간, 약 10시간, 약 11시간, 약 12시간, 약 13시간, 약 14시간, 약 15시간, 약 16시간, 약 17시간, 약 18시간, 약 19시간, 약 20시간, 약 21시간, 약 22시간, 약 23시간, 약 24시간, 약 2일, 약 3일, 약 4일, 약 5일, 약 6일, 약 7일, 약 2주, 약 3주, 약 4주, 약 5주, 약 6주, 약 7주, 약 8주, 약 9주, 약 10주, 약 11주, 약 12주, 약 13주, 약 14주, 약 15주, 약 16주, 약 17주, 약 18주, 약 19주, 약 20주, 약 21주, 약 22주, 약 23주, 약 24주, 약 25주, 약 26주, 약 27주, 약 28주, 약 29주, 약 30주, 약 31주, 약 32주, 약 33주, 약 34주, 약 35주, 약 36주, 약 37주, 약 38주, 약 39주, 약 40주, 약 41주, 약 42주, 약 43주, 약 44주, 약 45주, 약 46주, 약 47주, 약 48주, 약 49주, 약 50주, 약 51주, 약 52주, 약 1.5년, 약 2년, 약 2.5년, 약 3.0년, 약 3.5년, 약 4.0년, 약 4.5년, 약 5.0년, 약 5.5년, 약 6.0년, 약 6.5년, 약 7.0년, 약 7.5년, 약 8.0년, 약 8.5년, 약 9.0년, 약 9.5년 또는 약 10.0년) 동안 수행하고 1차 분석은 마찬가지로 일반적으로 장기간 내에, 예컨대 질환 또는 상태 개시 후 약 수시간, 수일, 수개월 또는 수년 내에 수행한다.
또한, 상기 분석은 제1 검사 시료를 한 급원, 예컨대 소변, 혈청 또는 혈장에서 수득한 경우, 피검체로부터 수득한 제1 검사 시료를 이용하여 수행할 수 있다. 경우에 따라, 상기 분석은 그 다음 다른 급원에서 제2 검사 시료를 수득한 경우, 피검체로부터 수득한 제2 검사 시료를 이용하여 반복할 수 있다. 예를 들어, 제1 검사 시료가 소변에서 수득했다면, 제2 검사 시료는 혈청 또는 혈장에서 수득할 수 있다. 제1 검사 시료 및 제2 검사 시료를 이용하여 분석에서 수득한 결과를 비교할 수 있다. 이 비교는 피검체의 질환 또는 상태의 상황을 평가하는데 이용될 수 있다.
더욱이, 본 발명은 주어진 질환, 장애 또는 상태를 앓고 있거나 취약한 피검체가 치료로부터 유익을 얻을 것인지를 측정하는 방법에 관한 것이다. 구체적으로, 본 발명은 피분석물 동반 방법 및 산물에 관한 것이다. 따라서, 본 명세서에 기술된 바와 같이 "피검체의 질환 치료를 모니터하는" 방법은 가장 적합하게는 치료 후보를 선택하거나 동정하는 방법을 포함할 수 있다.
따라서, 특정 양태에 따라 본 발명은 주어진 질환, 장애 또는 상태를 보유하거나 보유할 위험이 있는 피검체가 치료 후보인지를 판정하는 방법을 제공한다. 일반적으로, 피검체는 주어진 질환, 장애 또는 상태의 일부 증상을 겪은 자, 또는 주어진 질환, 장애 또는 상태를 보유한 것으로 또는 보유할 위험이 있는 것으로 실제 진단된 자, 및/또는 본 명세서에 기술된 피분석물 또는 이의 단편의 바람직하지 않은 농도 또는 양을 입증하는 자이다.
본 방법은 경우에 따라, 피분석물이 하나 이상의 약제학적 조성물(예컨대, 특히 피분석물을 수반하는 작용 기전에 관련이 있는 약제)로, 면역억제 요법, 또는 면역흡수 요법으로 피검체를 치료하기 전 및 치료한 후에 평가되거나, 또는 피분석물이 이러한 치료 후 평가되어 피분석물의 농도 또는 양이 소정의 수준과 비교되는, 본 명세서에 기술된 분석법을 포함한다. 치료 후 관찰된 피분석물의 바람직하지 않은 농도 또는 양은 추가 치료 또는 지속적인 치료 후에도 유익하지 않을 것이지만, 치료 후 관찰된 피분석물의 바람직한 농도 또는 양은 피검체가 추가 치료 또는 지속적인 치료 후에 유익을 얻을 것을 확인시켜준다. 이러한 확인은 임상 연구 관리 및 호전된 환자 치료 제공을 돕는다.
물론, 본 명세서의 특정 양태는 본 명세서에서 논한 주어진 질환, 장애 또는 상태를 평가하는데 이용했을 때 유리하지만, 당해 분석 및 키트는 다른 질환, 장애 및 상태의 피분석물을 평가하는 데에도 이용될 수 있다. 또한, 분석 방법은 다른 마커 등의 분석법을 수반할 수도 있다.
또한, 당해 분석방법은 주어진 질환, 장애 또는 상태를 호전시키는 화합물을 동정하는데 사용될 수도 있다. 예를 들어, 피분석물을 발현하는 세포를 후보 화합물과 접촉시킬 수 있다. 화합물과 접촉된 세포에서 피분석물의 발현 수준을 본 명세서에 기술된 분석 방법을 이용하여 대조 세포의 발현 수준과 비교할 수 있다.
II
.
키트
검사 시료에서 피분석물(또는 이의 단편)의 존재, 양 또는 농도에 대해 검사 시료를 분석하는 키트도 제공한다. 이 키트는 검사 시료를 피분석물(또는 이의 단편)에 대해 분석하기 위한 적어도 하나의 성분 및 피분석물(또는 이의 단편)에 대해 검사 시료를 분석하는 사용설명서를 포함한다. 피분석물(또는 이의 단편)에 대해 검사 시료를 분석하기 위한 적어도 하나의 성분은 경우에 따라 고상에 고정화되는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체, 또는 변형체의 단편)을 함유하는 조성물을 포함할 수 있다.
키트는 면역분석법, 예컨대 화학발광 마이크로입자 면역분석법으로 피분석물에 대해 검사 시료를 분석하기 위한 적어도 하나의 성분, 및 면역분석법, 예컨대 화학발광 마이크로입자 면역분석법으로 피분석물에 대해 검사 시료를 분석하는 사용설명서를 포함할 수 있다. 예를 들어, 키트는 피분석물에 대한 적어도 하나의 특이적 결합 파트너, 예컨대 항-피분석물, 모노클로날/폴리클로날 항체(또는 피분석물에 결합할 수 있는 단편, 피분석물에 결합할 수 있는 변형체, 또는 피분석물에 결합할 수 있는 변형체의 단편), 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)을 포함할 수 있으며, 이 둘 모두 검출가능하게 표지화될 수 있다. 대안적으로, 또는 추가로, 키트는, 고상 지지체에 고정될 수 있는, 항-피분석물 모노클로날/폴리클로날 항체(또는 피분석물에 결합할 수 있는 이의 단편, 피분석물에 결합할 수 있는 변형체, 피분석물에 결합할 수 있는 변형체의 단편) 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)에 결합하기 위해 검사 시료 중의 임의의 피분석물과 경쟁할 수 있는 검출가능하게 표지된 피분석물(또는 항-피분석물, 모노클로날/폴리클로날 항체 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체 또는 변형체의 단편)에 결합할 수 있는 단편)을 포함할 수 있다. 키트는 캘리브레이터 또는 대조군, 예컨대 분리 또는 정제된 피분석물을 포함할 수 있다. 키트는 분석을 수행하기 위한 적어도 하나의 용기(예컨대, 제1 특이적 결합 파트너로 이미 코팅되어 있을 수 있는 튜브, 미세역가 평판 또는 스트립), 및/또는 완충액, 예컨대 분석 완충액 또는 세척 완충액(이중 하나는 농축 용액으로 존재할 수 있다), 검출가능 표지(예: 효소 표지)용 기질 용액, 또는 정지 용액을 포함할 수 있다. 바람직하게는, 키트는 분석을 수행하는데 필요한 모든 성분, 즉 시약, 표준물, 완충액, 희석제 등을 포함한다. 사용설명서는 종이 형태 또는 컴퓨터 판독가능 형태, 예컨대 디스크, CD, DVD 등일 수 있다.
임의의 항체, 예컨대 항-피분석물 항체 또는 항-피분석물 DVD-Ig, 또는 추적자는 본 명세서에 기술된 검출가능 표지, 예컨대 형광단, 방사능 부분, 효소, 비오틴/아비딘 표지, 발색단, 화학발광 표지 등을 포함할 수 있고, 또는 키트는 검출가능 표지화를 수행하기 위한 시약을 포함할 수 있다. 항체, 캘리브레이터 및/또는 대조군은 별도의 용기에 제공되거나, 적당한 분석 형식, 예컨대 미세역가 평판에 사전분배될 수 있다.
경우에 따라, 키트는 특성 조절 성분(예컨대, 감응도 패널, 캘리브레이터 및 양성 대조군)을 포함한다. 특성 조절 시약의 제조는 당업계에 공지되어 있고, 다양한 면역진단 제품의 인서트 시트에 설명되어 있다. 감응도 패널 구성원은 경우에 따라 분석 성능 특징을 수집하는데 사용되고, 또한 경우에 따라 면역분석 키트 시약의 무결성 및 분석 표준화의 유용한 지시인자이다.
또한, 키트는 진단 분석을 수행하거나 특성 조절 평가를 용이하게 하는데 필요한 다른 시약, 예컨대 완충액, 염, 효소, 효소 공동인자, 효소 기질, 검출 시약 등을 포함할 수 있다. 다른 성분, 예컨대 검사 시료(예: 전처리 시약)의 분리 및/또는 치료를 위한 완충액 및 용액도 키트에 포함될 수 있다. 키트는 추가로 하나 이상의 다른 대조군을 포함할 수 있다. 키트의 하나 이상의 성분은 동결건조될 수 있고, 이러한 경우 키트는 추가로 동결건조 성분의 재구성에 적합한 시약을 포함할 수 있다.
키트의 다양한 성분은 경우에 따라 필요한 경우, 미세역가 평판과 같은 적당한 용기에 제공된다. 키트는 추가로 시료를 수용하거나 보관하기 위한 용기(예컨대, 소변 시료용 용기 또는 카트리지)를 포함할 수도 있다. 적당한 경우, 키트는 경우에 따라 반응 용기, 혼합 용기 및 검사 시료 또는 시약 제조를 용이하게 하는 다른 성분을 포함할 수 있다. 또한, 키트는 검사 시료의 수득을 돕기 위한 하나 이상의 기구, 예컨대 주사기, 피펫, 집게, 계량 스푼 등을 포함할 수도 있다.
검출가능 표지가 적어도 하나의 아크리디늄 화합물이면, 키트는 적어도 하나의 아크리디늄-9-카르복사미드, 적어도 하나의 아크리디늄-9-카르복실레이트 아릴 에스테르, 또는 이의 임의의 배합물을 포함할 수 있다. 검출가능 표지가 적어도 하나의 아크리디늄 화합물이면, 키트는 추가로 과산화수소 급원, 예컨대 완충액, 용액 및/또는 적어도 하나의 염기성 용액을 포함할 수 있다. 필요하다면, 키트는 고상, 예컨대 자성 입자, 비드, 시험관, 미세역가 평판, 큐벳, 막, 스캐폴딩 분자, 필름, 여과지, 디스크 또는 칩을 포함할 수 있다.
III
.
키트
및 방법의 개조
본 명세서에 기술된 면역분석법과 같은 분석법에 의해 검사 시료에서 피분석물의 존재, 양 도는 농도를 측정하는 방법뿐만 아니라 키트(또는 이의 성분들)는 미국 특허 5,089,424 및 5,006,309에 기술된 바와 같이 다양한 자동 시스템 및 반자동 시스템(예컨대, 고상이 마이크로입자를 포함하는 것) 또는 시판품, 예컨대 Abbott Laboratories(Abbott Park, IL)에서 판매하는 ARCHITECT®에 사용하도록 개조할 수 있다.
비자동 시스템(예: ELISA)과 비교했을 때 자동 또는 반자동 시스템 간의 일부 차이로는, 제1 특이적 결합 파트너(예컨대, 항피분석물, 모노클로날/폴리클로날 항체(또는 이의 단편, 변형체, 변형체의 단편) 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체, 또는 변형체의 단편)이 부착되고; 어떤 경우든지 샌드위치 형성 및 피분석물 반응성이 영향을 줄 수 있다)가 부착되는 기질, 및 포획, 검출 및/또는 임의의 선택적인 세척 단계의 시간 및 시기를 포함한다. 비-자동 형식, 예컨대 ELISA는 시료 및 포획 시약과 비교적 오랜 항온처리 시간을 필요로 할 수 있는 반면(예: 약 2시간), 자동 또는 반자동 형식(예: ARCHITECT®, Abbott Laboratories)은 비교적 짧은 항온시간(예컨대, ARCHITECT®의 경우 약 18분)을 필요로 할 수 있다. 이와 유사하게, 비-자동 형식, 예컨대 ELISA는 비교적 긴 항온처리 시간(예: 약 2시간) 동안 검출 항체, 예컨대 접합체 시약을 항온처리할 수 있는 반면, 자동 또는 반자동 형식(예: ARCHITECT®)은 비교적 짧은 항온처리 시간(예: ARCHITECT®의 경우 약 4분) 동안 항온처리할 수 있다.
Abbott Laboratories에서 입수할 수 있는 다른 플랫폼으로는 AxSYM®, IMx®(예컨대, 전문이 참고인용된 미국 특허 5,294,404), PRISM®, EIA(비드), 및 Quantum™ II뿐만 아니라 여타 플랫폼을 포함하지만, 이에 국한되는 것은 아니다. 또한, 분석법, 키트 및 키트 성분은 다른 형식, 예컨대 전기화학적 시스템 또는 다른 수동 또는 즉석 진단 분석 시스템에 이용될 수도 있다. 본 발명은 샌드위치 면역분석을 수행하는 시판 Abbott Point of Care(i-STAT®, Abbott Laboratories) 전기화학적 면역분석 시스템에 적용할 수 있다. 면역센서, 이의 제조방법 및 일회용 검사 장치에서의 작동에 대해서는 미국 특허 5,063,081, 미국 특허출원 공개번호 2003/0170881, 미국 특허출원 공개번호 2004/0018577, 미국 특허출원 공개번호 2005/0054078 및 미국 특허출원 공개번호 2006/0160164(이들에 대한 모든 교시내용은 전문이 첨고 인용됨)에 기술되어 있다.
특히, I-STAT® 시스템에 대한 피분석물 분석의 개조와 관련하여, 다음과 같은 구성이 바람직하다. 미세조립된 실리콘 칩을 한쌍의 금 전류법 작업 전극 및 은-염화은 참조 전극으로 제작한다. 작업 전극 중 하나에, 이 전극 상에 패턴화된 폴리비닐 알콜의 중합체 코팅에, 항-피분석물, 모노클로날/폴리클로날 항체(또는 이의 단편, 변형체 또는 변형체의 단편) 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체, 변형체의 단편)이 고정화된 폴리스티렌 비드(0.2mm 직경)를 부착시킨다 이 칩을 면역분석에 적합한 유체소자 형식인 I-STAT® 카트리지에 조립시킨다. 이 카트리지의 시료 수용 챔버의 벽 한 부분에, 검출가능하게 표지화될 수 있는 피분석물, 예컨대 항-피분석물, 모노클로날/폴리클로날 항체(또는 이의 단편, 변형체 또는 피분석물에 결합할 수 있는 변형체의 단편) 또는 항-피분석물 DVD-Ig(또는 이의 단편, 변형체 또는 피분석물에 결합할 수 있는 변형체의 단편)의 특이적 결합 파트너를 함유하는 층이 존재한다. 카트리지의 유체 파우치 내에는 p-아미노페놀 포스페이트를 포함하는 수성 시약이 존재한다.
작업 시, 피분석물을 함유할 것으로 의심되는 시료를 검사 카트리지의 수용 챔버에 첨가하고, 카트리지를 I-STAT® 판독기에 삽입한다. 피분석물의 특이적 결합 파트너를 시료에 용해한 후, 카트리지 내의 펌프 요소가 칩 함유 도관 내로 시료를 강제 유입시킨다. 이 때, 샌드위치의 형성을 촉진하기 위해 진동시킨다. 분석의 끝에서 두번째 단계에서, 유체는 파우치에서 도관 내로 강제 배출시켜 시료를 칩에서 세척해내고 폐기 챔버로 이동시킨다. 분석의 최종 단계에서, 알칼리성 포스파타제 표지는 p-아미노페놀 포스페이트와 반응하여 포스페이트 기를 절단하고, 방출된 p-아미노페놀은 작업 전극에서 전기화학적으로 산화되게 한다. 측정 전류에 기초하여, 판독기는 탑재된 알고리듬 및 공장-측정된 교정 곡선을 이용하여 시료 중의 피분석물의 양을 계산할 수 있다.
또한, 본 명세서에 기술된 방법 및 키트는 면역분석을 수행하는 다른 시약 및 방법을 반드시 포함한다는 것은 말할 것도 없다. 예를 들어, 당업계에 공지되고/되거나 쉽게 제조할 수 있거나, 예컨대 세척을 위해 접합체 희석제, 마이크로입자 희석제 및/또는 캘리브레이터 희석제로 이용하기 위해 최적화할 수 있는 다양한 완충액이 포함된다. 접합체 희석제의 예로는 특정 키트(Abbott Laboratories, Abbott Park, IL)에 이용되고 2-(N-모르폴리노)에탄설폰산(MES), 염, 단백질 차단제, 항미생물제 및 계면활성제를 함유하는 ARCHITECT® 접합체 희석제이다. 캘리브레이터 희석제의 예는 특정 키트(Abbott Laboratories, Abbott Park, IL)에 이용되는 ARCHITECT® 사람 캘리브레이터 희석제로, MES, 다른 염, 단백질 차단제 및 항미생물제를 함유한다. 또한, 미국 특허출원번호 61/142,048(2008.12.31)에 기술된 바와 같이, 시그널 증폭제로서 시그널 항체에 결합된 핵산 서열을 이용하면 I-Stat 카트리지 형식 등에서 시그널 발생이 향상될 수 있다.
실시예
실시예
1:
DVD
-
Ig
의 디자인,
작제
및 분석
실시예
1.1: 모 항체 및
DVD
-
Ig
의 동정 및 특성규명에 사용되는 분석법
다음 분석법들은 다른 언급이 없는 한 모 항체 및 DVD-Ig을 동정 및 특성규명하기 위해 본 실시예 전반에 사용되었다.
실시예
1.1.1: 모 항체 및
DVD
-
Ig
의 이들의 표적 항원(들)에 대한 결합 및 친화성을 측정하는데 사용되는 분석법
실시예
1.1.1A:
ELISA
분석
원하는 표적 항원에 결합하는 항체를 선별하기 위한 효소 결합 면역흡착 분석법(ELISA)은 다음과 같이 수행했다.
방법 1
ELISA 평판(Corning Costar, Acton, MA)은 5㎍/ml의 염소 항-마우스 IgG FC 특이성 항체(Pierce #31170, Rockford, IL)를 함유한 인산염 완충 식염수(PBS) 50 ㎕/웰로 4℃에서 밤새 코팅했다. 평판을 0.05% Tween 20을 함유하는 PBS로 1회 세척했다. 평판에 200 ㎕/ml 차단 용액(PBS에 2%로 희석됨, BioRad #170-6404, Hercules, CA)을 첨가하여 실온에서 1시간 동안 차단했다. 0.05% Tween 20을 함유하는 PBS로 차단한 후 평판을 1회 세척했다.
전술한 바와 같이 준비한 ELISA 평판에, 0.1% 소혈청알부민(BSA)(Sigma, St. Louis, MO) 함유 PBS로 희석한, 예컨대 마우스 혈청, 하이브리도마 상청액 또는 항체 또는 DVD-Ig 제조물을 50 ㎕/웰 첨가하고 실온에서 1시간 동안 항온처리했다. 웰은 0.05% Tween-20을 함유하는 PBS로 3회 세척했다. 각 웰에, 0.1% BSA 함유 PBS로 100ng/ml로 희석한 비오틴화된 재조합 정제된 표적 항원 50 ㎕를 첨가하고, 실온에서 1시간 동안 항온처리했다. 평판은 0.05% Tween-20을 함유하는 PBS로 3회 세척했다. 스트렙타비딘 HRP(Pierce #21126, Rockland, IL)는 0.1% BSA 함유 PBS로 1:20000으로 희석하고; 50㎕/웰을 첨가하고, 평판을 실온에서 1시간 동안 항온처리했다. 평판은 0.05% Tween-20을 함유하는 PBS로 3회 세척했다. 각 웰에 TMB 용액(Sigma #T0440, St. Louis, MO) 50 ㎕를 첨가하고, 실온에서 10분 동안 항온처리했다. 이 반응은 1N 황산을 첨가하여 정지시켰다. 평판은 450nm 파장에서 분광광도계로 판독한다.
방법 2
프로스타글란딘 E2에 결합하는 항-PGE2 항체 또는 항-PGE2 함유 DVD-Ig 분자를 선별하기 위한 효소면역분석법은 다음과 같이 수행했다. ELISA 평판(Costar 3369, Corning, NY)은 PBS(Invitrogen Carlsbad, CA)에 2㎍/ml인 항-숙주 Fc IgG(Sigma, St. Louis, MO) 50 ㎕로 코팅했다. 4℃에서 밤새 항온처리한 후, 평판은 200 ㎕ Superblock(Pierce #37535, Rockford, IL)으로 차단했다. IgG 또는 DVD-Ig 함유 시료는 분석 완충액(0.05% Surfactamps(Pierce #37535, Rockford, IL) 함유 PBS 중의 10% Superblock)에 1 ㎍/ml로 희석하고 50㎕/웰씩 평판에서 실온에서 1시간 동안 항온처리했다. 항온처리 후, 평판은 TTBS(Tween-Tris 완충 용액)로 4회 세척했다. PGE2 결합을 위해, PGE2-비오틴아미드(Cayman Chemicals, Ann Arbor, MI)는 30nM로 희석하고 분석 완충액에 연속 희석했다. 각 IgG 또는 DVD-Ig 시료 50 ㎕/웰 용적에 적정 커브를 첨가하고 실온에서 1시간 동안 항온처리했다. 평판은 전술한 바와 같이 세척하고 분석 완충액 중의 스트렙타비딘 polyhrp40(Fitzgerald Industries, Concord, MA) 1:5000 희석물 50 ㎕/웰을 첨가하고, 실온에서 45분 동안 항온처리했다. 최종 세척 단계를 수행하고, 평판은 1단계 TMB 시스템(Sigma #T8665, St. Louis, MO) 및 2N H2SO4로 발색시켰다. 평판은 Molecular Devices Spectramax 평판 판독기(Sunnyvale, CA)로 450nm에서 판독했다. EC50은 GraphPad Prism 5(GraphPad Software, La Jolla, CA)를 이용하여 측정했다(도 2).
방법 3
대안적으로, 항체 또는 DVD-Ig 분자의 프로스타글란딘 결합 선별은 3H-PGE2 ELISA를 이용하여 측정할 수 있다. 평판은 PBS 중의 5㎕/ml의 염소 항-사람 IgG(Fc)(Thermo Scientific # 31170, NH) 또는 염소 항-마우스 IgG(Fc)(Thermo Scientific #31125, Hudson, NH) 50 ㎕/웰로 코팅하고 4℃에서 밤새 항온처리했다. 다음날, 평판은 톡톡 치고 압지로 건조했다. 그 다음, 평판은 200 ㎕/웰의 Superblock(Thermo Scientific #37515, Hudson, NH)으로 실온에서 1시간 동안 차단했다. 평판을 톡톡 치고 압지로 건조했다. 모노클로날 항체는 PBST(Abbott Bioresearch Center, Worcester, MA)/10% Superblock에 0.04 ㎍/ml로 희석하고 사전차단된 ELISA 평판의 각 웰에 2ng/웰씩 각 항체 또는 DVD-Ig 50㎕를 첨가하고 실온에서 1시간 동안 항온처리했다. 웰은 PBS + 0.1% Tween-20으로 3회 세척했다. 3H-PGE2(Perkin-Elmer # NET-428, Waltham, MA) 연속 3배 적정물은 PBST + 10% Superblock에 준비했다. 3H-PGE2 용액 50 ㎕를 평판의 각 웰에 첨가하고, 실온에서 1시간 동안 항온처리했다. 웰은 PBST + 10% Superblock으로 6회 세척하고 신틸레이션 유체(Perkin Elmer #6013621, Waltham, MA) 50㎕를 각 웰에 첨가했다. 평판은 5분 계수 지연을 두고TopCount 판독기(Perkin Elmer, Waltham, MA)로 판독했다. EC50 수는 GraphPad Prism 5(GraphPad Software, La Jolla, CA)로 측정했다
실시예
1.1.1.B: 경쟁
ELISA
경쟁 효소면역분석법은 프로스타글란딘 E2에 결합하는 항-PGE2 항체 또는 항-PGE2 함유 DVD-Ig 분자에 대한 프로스타글란딘 결합 특이성을 측정하기 위해 다음과 같이 수행했다.
방법 1
ELISA 평판(Costar 3369, Corning, NY)은 PBS(Invitrogen, Carlsbad, CA) 중의 2㎍/ml인 항-숙주 Fc IgG(Sigma, St.Louis, MO) 50 ㎕/웰로 코팅했다. 4℃에서 밤새 항온처리한 후, 평판은 200 ㎕ Superblock(Pierce #37535, Rockford, IL)으로 차단했다. IgG 시료는 분석 완충액(0.05% Surfactamps(Pierce #37535, Rockford, IL) 함유 PBS 중의 10% Superblock)에 6㎍/ml로 희석했다. PGE2 결합을 위해, PGE2-비오틴아미드를 분석 완충액에 3nM로 희석했다. 분석 완충액 중의 적정 곡선은 300 nM부터 시작해서 1:10 연속 희석으로 준비한 프로스타글란딘 PGA2(Cayman Chemicals, Ann Arbor, MI), PGD2(Cayman Chemicals, Ann Arbor, MI) 및 PGE2(Cayman Chemicals, Ann Arbor, MI)에 대해 제조했다. 시약은 튜브에 각각 50 ㎕/웰의 용적으로 첨가하고, 실온에서 1시간 동안 예비항온처리했다. 예비항온처리 후, 혼합물은 차단된 평판으로 옮기고 실온에서 1시간 동안 항온처리했다. 다음날, 평판은 Tween20-Tris 완충 용액(TTBS)으로 4회 세척했다. 그 다음, 분석 완충액(Fitzgerald Industries, Concord, MA)에 1:5000 희석율인 스트렙타비딘 polyhrp40을 웰에 첨가하고, 실온에서 45분 동안 항온처리했다. 최종 세척 단계를 수행하고, 평판은 1단계 TMB 시스템((Sigma #T8665, St. Louis, MO) 및 2N H2SO4로 발색시켰다. 평판은 Molecular Devices Spectramax 평판 판독기(Sunnyvale, CA)로 450nm에서 판독했다. 미표지된 프로스타글란딘이 PGE2-비오틴아미드와 결합 경쟁하는 웰은 시그널의 감소를 나타냈다. IC50 수는 GraphPad Prism 5(GraphPad Software, La Jolla, CA)를 이용하여 측정했다. 그 다음, 교차반응성 지수는 다른 프로스타글란딘(들)의 PGE2/IC50의 IC50으로 계산했다.
방법 2
대안적으로, 목표 선택성은 3H-PGE2 경쟁 ELISA로 측정했다. 평판은 PBS 중의 5㎍/ml 염소 항-사람 IgG(Fc)(Thermo Scientific #31170, Hudson, NH) 또는 염소 항-마우스 IgG(Fc)(Thermo Scientific #31125, Hudson, NH) 50 ㎕/웰로 코팅하고 4℃에서 밤새 항온처리했다. 다음날 평판은 톡톡 치고 압지로 건조했다. 그 다음, 평판은 200 ㎕/웰의 Superblock(Thermo Scientific #37515, Hudson, NH)으로 실온에서 1시간 동안 차단했다. 평판은 톡톡 치고 압지로 건조했다. 모노클로날 항체는 PBST(Abbott Bioresearch Center, Worcester, MA) + 10% Superblock 중에 0.04 ㎍/ml로 희석하고, 각각 50 ㎕씩 사전-차단된 ELISA 평판의 각 웰에 첨가하고(2ng/웰), 실온에서 1시간 동안 항온처리했다. 웰은 PBS + 0.1% Tween 20으로 3회 세척했다. 3H-PGE2(Perkin Elmer # NET-428, Waltham, MA)는 PBST + 10% Superblock에 6nM(2X 스톡)로 희석했다. 각 프로스타글란딘(Cayman Chemicals, Ann Arbor, MI)은 PBST + 10% Superblock에 2000 μM(2X 스톡) 내지 0.00004 μM(2X) 범위의 다양한 농도로 준비했다. 3H-PGE2 용액 및 각 프로스타글란딘 희석물의 동등 용적을 혼합했다. 이 혼합물 50 ㎕를 평판의 각 웰에 첨가하고 실온에서 1시간 동안 항온처리했다. 웰은 PBST/10% Superblock으로 6회 수작업으로 세척하고, 50㎕의 신틸레이션 유체(Perkin Elmer #6013621, Waltham, MA)를 각 웰에 첨가했다. 평판은 5분 계수 지연을 두고 TopCount 판독기(Perkin Elmer, Waltham, MA)로 판독했다. IC50 수는 GraphPad Prism 5(GraphPad Software, La Jolla, CA)로 측정했다. 그 다음, 교차 반응성 지수는 다른 프로스타글란딘(들)의 PGE2/IC50의 IC50로 계산했다.
실시예
1.1.1.C:
BIAcore
분석을 이용한 친화성 측정
BIACORE 분석(BIAcore, Inc., Piscataway, NJ)은 온-속도 및 오프-속도 상수의 속도론적 측정을 이용하여 항체 또는 DVD-Ig의 친화성을 측정한다. 목표 항원(예컨대, 정제된 재조합 목표 항원)에 대한 항체 또는 DVD-Ig의 결합은 HBS-EP(10mM HEPES[pH 7.4], 150mM NaCl, 3mM EDTA 및 0.005% 계면활성제 P20)를 이용하는 BIAcore® 3000 기구(BIAcore® AB, Uppsala, Sweden)로 25℃에서 표면 플라스몬 공명-기반 측정을 통해 결정했다. 모든 화학물질은 BIAcore® AB(Uppsala, Sweden)에서 수득하거나, 본 명세서에 기술된 다른 공급원에서 수득했다. 예를 들어, 10 mM 아세트산나트륨(pH 4.5)에 희석한 염소 항-마우스 IgG(Fcγ), 단편 특이적 폴리클로날 항체(Pierce Biotechnology Inc., Rockford, IL) 약 5000 RU는 제조업자의 지시 및 절차에 따라 표준 아민 커플링 키트를 이용하여 CM5 연구용급 바이오센서 칩을 따라 25㎍/ml씩 직접 고정시켰다. 바이오센서 표면 상의 미반응 모이어티는 에탄올아민으로 차단했다. 플로셀 2 및 4의 변형 카르복시메틸 덱스트란 표면은 반응 표면으로 사용했다. 플로 셀 1 및 3의 염소 항-마우스 IgG 없는 미변형 카르복시메틸 덱스트란은 참조 표면으로 사용했다. 속도론적 분석을 위해, 1:1 랭뮤어 결합 모델 유래의 속도 방정식은 총 8회 주입물의 결합 및 해리 상에 Biaevaluation 4.0.1 소프트웨어를 이용하여 동시에 일치시켰다(global fit 분석 이용). 정제된 항체 또는 DVD-Ig은 염소 항-마우스 IgG 특이적 반응 표면을 따라 포획을 위해 HEPES-완충 식염수에 희석한다. 리간드(25 ㎍/ml)로서 포획될 항체는 반응 매트릭스 상에 5 ㎕/분의 유속으로 주입했다. 결합 및 해리 속도 상수 kon(M-1s-1) 및 koff(s-1)는 연속적인 유속 25 ㎕/분 하에 결정된다. 속도 상수는 10 내지 200 nM 범위 또는 1.25 내지 1000 mM 범위 내에서 10가지 다른 항원 농도로 속도론적 결합 측정을 실시하여 유도된다. 항체 또는 DVD-Ig과 목표 항원 간에 반응의 평형 해리 상수(M)는 식 KD = koff/kon에 의해 속도론적 속도 상수로부터 계산했다. 결합은 시간의 함수로 기록하고 속도론적 속도 상수를 계산했다. 이 분석에서 106M-1s-1 만큼 빠른 온-속도 및 10-6s-1만큼 느린 오프-속도가 측정될 수 있다.
실시예
1.1.2: 모 항체 및
DVD
-
Ig
의 기능적 활성을 측정하기 위해 사용한 분석
실시예
1.1.2.A:
EP4
생물학적 정량
PGE2의 세포 반응을 억제하는 항-PGE2 항체 및 항-PGE2 함유 DVD-Ig 분자의 능력은 사람 EP4 수용체로 안정하게 형질감염된 HEK293 Gα16 세포에서 Ca++ 유속 분석으로 결정된다. 세포는 검정색/투명 폴리-D-리신 평판(Corning #3667, Corning, NY)에서 평판배양하고 Ca++-민감성 염료(Molecular Devices)와 90분 동안 항온배양했다. 스톡 PGE2(200 프루프 에탄올 중)는 FLIPR 완충액(1X HBSS(Invitrogen, Carlsbad, CA), 20mM HEPES(Invitrogen, Carlsbad, CA), 0.1% BSA(Sigma, St. Louis, MO) 및 2.5mM 프로베네시드(Sigma, St.Louis, MO) 함유)으로 희석했다. 또한, 항-PGE2 항체, DVD-Ig 분자 또는 이소타입 부합성 대조 항체는 FLIPR 완충액에 사전희석했다. 세포가 예비평판배양된 웰에 PGE2 또는 예비항온처리된 PGE2/항체 혼합물 또는 예비항온처리된 PGE2/DVD-Ig 분자 혼합물을 25 ㎕ 첨가했다. PGE2의 용량 반응은 PGE2의 연속 적정으로 수행하고 FLIPR1 또는 Tetra(Molecular Devices)로 결정했다. EC50은 GraphPad Prism 5(GraftPad Software, La Jolla, CA)로 측정했다. 항체와 DVD-Ig 분자를 검사하기 위해, EC50 농도의 PGE2를 다양한 농도의 검사물 또는 이소타입 부합성 항체(음성 대조군)와 20분 동안 항온처리하고, HEK293 Gα16 세포 중의 염료-로딩된 사람 EP4에 첨가했다. Ca++ 유속은 FLIPR1로 모니터하고 데이터는 GraphPad Prism 5로 분석했다.
실시예
1.1.2.B:
3
H-
PGE
2
를 이용한 항 프로스타글란딘
E
2
항체에 의한
PGE
2
수용체에 대한
PGE
2
결합의 경쟁적 저해
항-PGE2 항체에 의한 PGE2 수용체, 예컨대 EP4 또는 EP3에 대한 PGE2 결합의 경쟁적 저해는 3H-PGE2(프로스타글란딘 E2, [5,6,8,11,12,14,15-3H(N)], Perkin Elmer, Waltham, MA. Cat# NET428250UC)를 이용하여 세포-기반 또는 막-기반의 수용체 결합 분석을 통해 결정한다.
EP4 수용체를 내인적으로 발현하거나 안정하게 과잉발현하는 세포(즉, EP4 생물학적 정량에 사용된 HEK293-EP4 세포 또는 HEK293-EP4-Gα16 세포)는 24웰 평판의 DMEM 배지(Invitrogen, Carlsbad, CA)/10% FCS(Sigma #T8665, Sigma, St. Louis, MO)에서 밤새 증식시켰다. 배지를 제거하고 100 ㎕ 결합 완충액(FCS 없는 배지)을 첨가했다. 이 평판은 얼음 상에 10분 동안 방치했다. 비-방사능 PGE2(0-1 μM)는 100 ㎕ 용적의 추적자(40 pM의 3H-PGE2)와 함께 첨가했다. 평형 수용체 결합은 4℃에서 90분 동안 수행했다. 배지는 제거하고 세포는 200 ㎕ 저온 배지로 4회 세척했다. 세포는 20 ㎕ 0.5M NaOH를 첨가하여 수확했다. 용해물을 액체 신틸레이션 평판으로 옮겼다. 각 웰에 100 ㎕ Aquasafe 500(Zinsser Analytic, Frankfurt, Germany) + LSC 칵테일(Lumac LSC, Groningen, The Netherlands)을 첨가하고 혼합했다. 세포-결합된 방사능은 액체 신틸레이션 계수로 결정했다. 대부분의 작용제-수용체 상호반응에서, 작용제(PGE2)에 의한 수용체 결합 저해는 한-부위(one-site) 모델을 따르는 것으로 추정된다. EC50, Ki 및 Kd 값은 GraphPad Prism 5(GraphPad Software, La Jolla, CA)를 이용하여 계산했다.
EP3 수용체에 대한 3H-PGE2(프로스타글란딘 E2, [5,6,8,11,12,14,15-3H(N)], Perkin Elmer, Watham, MA, Cat# NET428250UC)의 결합에 있어서 항-PGE 항체에 의한 저해는 EP3 수용체를 과잉발현하는 세포의 막 제조물을 이용하여 수행했다(Millipore, Billerica, MA). 결합 분석 전에, 0.3% 폴리에틸렌이민(PEI)(Sigma, St. Louis, MO) 50㎕/웰를 Unifilter-96 GF/B 필터 평판(Perkin Elmer, Watham, MA)에 첨가하고 사용 전까지 4℃에서 1시간 동안 방치했다. 항체의 1:3 희석물은 결합 완충액(50mM HEPES, pH 7.0, 10mM MgCl2, 1mM EDTA, 0.2% BSA)에 2X 농도로 제조했다. 3H-PGE2 역시 결합 완충액에 2X 농도로 제조했다. 그 다음, 항체 연속 희석물 50 ㎕를 200 pM 3H-PGE2 50 ㎕를 함유하는 각 웰에 첨가하고, 잘 혼합한 뒤, 실온에 10분 동안 두었다. 동결된 막은 해동하고 결합 완충액에 재현탁시켰다. 막 5㎍을 각 웰에 첨가했다. 혼합물은 Packard 96 웰 수확기를 이용하여 사전처리된 GF/B 여과 판 상에 여과하기 전에 60분 동안 실온에서 항온처리했다. 그 다음, 평판은 Microscint™ 20(Perkin Elmer, Waltham, MA)을 첨가하기 전에 1시간 동안 건조했다. 그 다음, 평판을 밀봉하고 TopCount 판독기(Perkin Elmer, Waltham, MA)로 계수했다. 비특이적 결합은 100 μM 저온 PGE2의 존재 하에 결정했다. 측정된 방사능(cpm)은 Graphpad Prism(GraphPad Software, La Jolla, CA)을 이용해 IC50 값을 측정하는데 사용했다.
실시예
1.1.2.C:
L929
분석
L929 세포(ATCC #CCL-1)의 TNFα 유도사(induced death)를 저해하는 항-TNFα 항체 및 항-TNFα DVD-Ig 분자의 능력은 다음과 같이 분석했다. L929 세포는 수거하고 4㎍/ml 악티노마이신을 함유하는 RPMI 분석 배지에서 1 x 106 세포/ml로 재현탁시켰다. 세포는 1일째 96웰 평판(Costar)의 50 ㎕/웰에 최종 농도 5 x 104 세포/웰로 접종했다. DVD-Ig 분자는 RPMI 분석 배지(악티노마이신 무첨가)로 연속 희석하여 검사를 위해 준비했다. 희석 시료는 그 다음 50 ㎕/웰의 용적으로 96웰 평판에 첨가했다. 쥐 TNFα(A-846899.0)는 연속 희석하여 표준 곡선을 작도하고 표준 곡선 웰에 50 ㎕를 첨가했다. 이 곡선의 최종 농도는 3 ng/ml 내지 0.0014 ng/ml 범위였다. 중화를 위해, 쥐 TNFα는 50 ㎕의 DVD 시료 웰에 최종 농도 100 pg/ml로 첨가했다. 이 웰을 200 ㎕/웰의 최종 용적으로 만들고 37℃, 5% CO2 에서 18시간 동안 항온처리했다. 항온처리 후, 평판은 1200 rpm에서 원심분리하고 웰에서 100 ㎕를 분리했다. WST-1(Roche)은 10 ㎕/웰씩 세포에 첨가하고 평판은 37℃, 5% CO2에서 4시간 동안 항온처리했다. 이 평판은 1200 rpm으로 원심분리하고 웰에서 75㎕를 꺼내어 ELISA 평판(Costar 3369)으로 옮기고 Molecular Devices Spectramax 평판 판독기로 420 내지 600 nm에서 판독했다. 중화성 DVD는 세포가 사멸하지 않도록 보호했고, 밝은 오렌지색을 나타냈다.
실시예
1.1.2.D:
사이토킨
생물학적분석
항-사이토킨 모 항체 또는 항-사이토킨 서열을 함유하는 DVD-Ig이 목표 사이토킨 생체활성을 저해하거나 중화하는 능력은 항체 또는 DVD-Ig의 저해능을 측정하여 분석한다. 예를 들어, IL-4 매개의 IgE 생산을 저해하는 항-IL-4 항체의 능력을 사용할 수 있다. 예를 들어, 사람 순수 B 세포는 말초 혈액과 백혈구 연층으로부터 각각 피콜-파크(Ficoll-paque) 밀도 원심분리, 그 다음 사람 sIgD FITC 표지된 염소 F(ab)2 항체에 특이적인 MACS 비드(Miltenyi Biotec), 그 다음 항-FITC MACS 비드를 이용한 자성 분리에 의해 분리한다. 자성 분리된 순수 B 세포는 XV15 중에 ml 당 3 x 105 세포로 조정하고, 평판의 중앙에 6x6 배열로 96웰 평판 웰당 100㎕씩 주입하고, 그 주위 웰에는 PBS를 주입하고 5% CO2 존재 하에 37℃에서 10일 동안 배양했다. 검사할 항체마다 하나의 평판은 미유도 대조군 및 유도 대조군 각각 3웰과 50 ㎕ 4배 농축된 예비희석액에 첨가된 7㎍/ml부터 3배 희석률로 29ng/ml 최종 농도까지 희석된 항체 적정물의 5중 반복물로 구성되게 준비했다. IgE 생산을 유도하기 위해, 20 ng/ml의 rhIL-4 및 0.5㎍/ml 최종 농도의 항-CD40 모노클로날 항체(Novartis)를 각각 50㎕씩 각 웰에 첨가하고, 표준 샌드위치 ELISA법으로 배양 기간 마지막에 IgE 농도를 측정했다.
실시예
1.1.2.E:
사이토킨
방출 분석
사이토킨 방출을 유발하는 모 항체 또는 DVD-Ig의 능력을 분석했다. 건강한 3명의 공여자로부터 정맥천자에 의해 헤파린처리된 진공시험관 내로 말초혈액을 뽑아냈다. 전 혈액을 RPMI-1640 배지로 1:5배로 희석하고, 24웰 조직배양판에 웰당 0.5ml씩 주입했다. 항-사이토킨 항체(예: 항-IL-4)를 RPMI-1640으로 희석하고 평판에 0.5ml/웰씩 최종 농도가 200, 100, 50, 10 및 1 ㎍/ml이 되게 첨가했다. 배양판에 존재하는 전 혈액의 최종 희석률은 1:10이다. LPS 및 PHA는 사이토킨 방출의 양성 대조군으로서 2 ㎍/ml 및 5 ㎍/ml 최종 농도로 각 웰에 첨가한다. 폴리클로날 사람 IgG는 음성 대조용 항체로 사용한다. 실험은 2반복으로 수행했다. 평판은 5% CO2 하에 37℃에서 항온처리했다. 24시간 후, 웰의 내용물을 시험관에 옮겨 1200rpm에서 5분 동안 회전시켰다. 세포 제거된 상청액을 수집하여 사이토킨 분석을 위해 동결시켰다. 평판과 시험관에 남은 세포는 용해 용액 0.5ml로 용해시키고, -20℃에 넣어 둔 다음 해동시켰다. 배지 0.5ml를 첨가하고(용적을 세포 제거된 상청액 시료와 동일 수준으로 맞추기 위해), 세포 제조물을 수집하여 사이토킨 분석을 위해 동결시켰다. 세포 제거된 상청액 및 세포 용해물은 사이토킨 수준, 예컨대 IL-8, IL-6, IL-1β, IL-1RA 또는 TNF-α 수준에 대해 ELISA로 분석했다.
실시예
1.1.2.F:
사이토킨
교차반응성 연구
당해의 사이토킨(들)에 대해 지향성인 항-사이토킨 모 항체 또는 DVD-Ig이 다른 사이토킨과 교차반응하는 능력을 분석했다. 모 항체 또는 DVD-Ig은 Biacore 바이오센서 매트릭스 위에 고정시켰다. 이 매트릭스 위의 카르복시 기를 100mM N-하이드록시석신이미드(NHS) 및 400mM N-에틸-N'-(3-디메틸아미노프로필)-카르보디이미드 하이드로클로라이드(EDC)로 1차 활성화시켜, 항-사람 Fc mAb를 덱스트란 매트릭스에 유리 아민 기를 통해 공유 결합시켰다. pH 4.5의 아세트산나트륨으로 희석한 25 ㎍/ml 농도의 각 항체 또는 DVD-Ig 제조물을 약 50㎕씩 활성화된 바이오센서를 따라 주입하고, 단백질 상의 유리 아민을 활성화된 카르복시 기에 직접 결합시켰다. 일반적으로, 5000 공명 단위(RU)가 고정된다. 미반응 매트릭스 EDC-에스테르는 1M 에탄올아민을 주입하여 실활시켰다. 참조 표준으로, 2차 플로셀을 표준 아민 커플링 키트를 이용하여 사람 IgG1/K를 고정시켜 제조했다. SPR 측정은 CM 바이오센서 칩을 이용하여 수행했다. 바이오센서 표면에서 분석될 모든 항원은 0.01% P20을 함유하는 HBS-EP 전개 완충액에 희석했다.
사이토킨 결합 특이성을 조사하기 위해, 과량의 당해 사이토킨(100nM, 예컨대, 가용성 재조합 사람)을 항-사이토킨 모 항체 또는 DVD-Ig 고정된 바이오센서 표면을 따라 주입했다(접촉 시간 5분). 당해 사이토킨을 주입하기 전 및 직후에는 HBS-EP 완충액만을 각 플로셀을 통해 유동시킨다. 기준선과 사이토킨 주입 완료 후 약 30초에 해당하는 지점 사이에 시그널의 최종 차이는 최종 결합값을 나타낸다. 다시 반응은 공명 단위로 측정한다. 바이오센서 매트릭스는 결합 사건이 관찰된 경우 다음 시료를 주입하기 전에 10mM HCl로 재생시키고, 그렇지 않으면 매트릭스 위에 전개 완충액을 주입했다. 또한, 동시에 사람 사이토킨(예: IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-22, IL-23, IL-27, TNF-α, TNF-β 및 IFN-γ)을 고정된 마우스 IgG1/K 참조 표면에 주입하여 임의의 비특이적 결합 배경을 기록했다. 참조 표면과 반응 표면을 준비하면, Biacore는 굴절률 변화 및 주입 노이즈의 대부분을 없애기 위해 반응 표면 데이터로부터 참조 표면 데이터를 자동 공제할 수 있다. 따라서, 실제 결합 반응이 항-사이토킨 항체 또는 DVD-Ig 결합 반응에 기인하는 것인지 확인이 가능하다.
당해 사이토킨이 고정된 항-사이토킨 항체를 따라 주입되었을 때, 유의적인 결합이 관찰된다. 10mM HCl 재생은 모든 미공유결합된 단백질을 완전하게 제거한다. 센서그램 조사는, 고정된 항-사이토킨 항체 또는 DVD-Ig의 가용성 사이토킨에 대한 결합이 강하고 확고함을 보여준다. 당해 사이토킨에 의한 예상 결과를 확인한 후, 나머지 재조합 사람 사이토킨 패널을 각 항체 또는 DVD-Ig에 대해 각각 검사했다. 각 주입 사이클마다 항-사이토킨 항체 또는 DVD-Ig 결합된 사이토킨 또는 미결합된 사이토킨의 양을 기록한다. 각 항체 또는 DVD-Ig의 특이성 프로필을 측정하기 위해 3가지 독립 실험의 결과를 이용한다. 당해 사이토킨에는 예상 결합을 나타내고 다른 임의의 사이토킨에는 결합하지 않는 항체 또는 DVD-Ig을 선택한다.
실시예
1.1.2.G: 조직 교차반응성
조직 교차반응성 연구는 3단계로 실시하며, 제1 단계는 32개 조직의 동결절편을 포함하고, 제2 단계는 38개 이하의 조직을 포함하며, 3 단계는 이하에 기술된 바와 같이 3명의 무관련 성인 유래의 추가 조직을 포함한다. 연구는 2가지 용량 수준에서 통상적으로 수행한다.
단계 1: 사람 조직의 동결절편(약 5㎛)(한 사람 공여자로부터 부검 또는 생검에서 수득되는 32개 조직(일반적으로: 부신, 위장관, 전립선, 방광, 심장, 골격근, 혈액세포, 신장, 피부, 골수, 간, 척수, 유방, 폐, 비장, 소뇌, 림프절, 고환, 대뇌피질, 난소, 흉선, 결장, 췌장, 갑상선, 내피, 부갑상선, 수뇨관, 눈, 뇌하수체, 자궁, 나팔관 및 태반))을 대물경에 고정시키고 건조시켰다. 조직절편의 퍼옥시다제 염색은 아비딘-비오틴 시스템으로 수행했다.
단계 2: 사람 조직 38개 조직의 동결절편(약 5 ㎛)(3명의 무관련 성인으로부터 부검 또는 생검에서 수득되는 부신, 혈액, 혈관, 골수, 소뇌, 대뇌, 자궁경부, 식도, 눈, 심장, 신장, 대장, 간, 폐, 림프절, 유방 유선, 난소, 난관, 췌장, 부갑상선, 말초 신경, 뇌하수체, 태반, 전립선, 타액선, 피부, 소장, 척수, 비장, 위, 횡문근, 고환, 흉선, 갑상선, 편도선, 수뇨관, 방광 및 자궁 포함)을 대물경에 고정시키고 건조시켰다. 조직절편의 퍼옥시다제 염색은 아비딘-비오틴 시스템으로 수행했다.
단계 3: 사이노몰거스 원숭이 조직(3마리 무관련 성숙 원숭이로부터 부검 또는 생검에 의해 수득한 38가지 조직, 예컨대 부신, 혈액, 혈관, 골수, 소뇌, 대뇌, 자궁경부, 식도, 눈, 심장, 신장, 대장, 간, 폐, 림프절, 유방 유선, 난소, 난관, 췌장, 부갑상선, 말초 신경, 뇌하수체, 태반, 전립선, 타액선, 피부, 소장, 척수, 비장, 위, 횡문근, 고환, 흉선, 갑상선, 편도선, 수뇨관, 방광 및 자궁 포함)의 동결절편(약 5 ㎛)을 대물경에 고정시키고 건조시켰다. 조직절편의 퍼옥시다제 염색은 아비딘-비오틴 시스템으로 수행했다.
항체 또는 DVD-Ig은 2차 비오티닐화된 항-사람 IgG와 항온처리하고 면역 복합체로 발색시켰다. 항체 또는 DVD-Ig의 최종 농도가 2 및 10 ㎍/ml인 면역 복합체는 대물경 상의 조직 절편 위에 첨가하고, 그 후 조직 절편을 아비딘-비오틴-퍼옥시다제 키트와 30분 동안 반응시켰다. 이어서, 퍼옥시다제 반응의 기질인 DAB(3,3'-디아미노벤지딘)를 조직 염색을 위해 4분 동안 적용했다. 항원-세파로스 비드는 양성 대조용 조직 절편으로 사용했다. 표적 항원 및 사람 혈청 차단 연구는 추가 대조군으로 제공했다. 항체 또는 DVD-Ig 최종 농도가 2 및 10 ㎍/ml인 면역 복합체는 표적 항원(최종 농도 100 ㎍/ml) 또는 사람 혈청(최종 농도 10%)과 30분 동안 예비항온처리하고, 그 후 대물경 상의 조직 절편에 첨가한 뒤, 이 조직 절편을 아비딘-비오틴-퍼옥시다제 키트와 30분 동안 반응시켰다. 이어서, 퍼옥시다제 반응의 기질인 DAB(3,3'-디아미노벤지딘)를 조직 염색을 위해 4분 동안 적용했다.
임의의 특이적 염색은 당해 표적 항원의 공지된 발현에 기초하여 예상된 반응성(예컨대, 항원 발현과 일치함)이거나 예상치 못한 반응성인 것으로 판단한다. 특이적인 것으로 판단된 임의의 염색은 강도 및 빈도로 채점한다. 단계 2(사람 조직) 및 단계 3(사이노몰거스 원숭이 조직) 간에 조직 염색은 유사하거나 상이한 것으로 판단한다.
실시예
1.1.2.H:
시험관내
모 항체 또는
DVD
-
Ig
의 항종양 효과
종양 세포 상의 표적 항원에 결합하는 모 항체 또는 DVD-Ig은 항종양 활성에 대해 분석될 수 있다. 간략히 설명하면, 모 항체 또는 DVD-Ig은 D-PBS-BSA(0.1% BSA 함유 Dulbecco's 인산염 완충 식염수)에 희석하고, 최종 농도 0.01 ㎍/ml 내지 100 ㎍/ml로 사람 종양 세포에 첨가했다. 평판을 가습 5% CO2 대기에서 37℃로 3일 동안 항온배양했다. 각 웰의 생 세포수는 MTS 시약을 이용하여 제조업체의 지시(Promega, Madison, WI)에 따라 정량분석하여 종양 증식 억제율을 측정했다. 항체 처리되지 않은 웰은 0% 억제율의 대조군으로 이용하고 세포가 없는 웰은 100% 억제율을 나타내는 것으로 간주했다.
아폽토시스의 평가를 위해, 카스파제-3 활성화는 다음과 같은 프로토콜에 따라 측정했다: 96웰 평판에서 항체-처리된 세포를 1x 용해 완충액(1.67mM Hepes, pH 7.4, 7mM KCl, 0.83mM MgCl2, 0.11mM EDTA, 0.11mM EGTA, 0.57% CHAPS, 1mM DTT, 1x 프로테아제 억제제 칵테일 정제; EDTA 무함유; Roche Pharmaceuticals, Nutley, NJ) 120㎕에서 실온 하에 20분 동안 진탕시키면서 용해했다. 세포 용해 후, 카스파제-3 반응 완충액(48mM Hepes, pH 7.5, 252mM 수크로오스, 0.1% CHAPS, 4mM DTT 및 20 μM Ac-DEVD-AMC 기질; Biomol Research Labs, Inc., Plymouth Meeting, PA) 80㎕를 첨가하고, 평판을 37℃에서 2시간 동안 항온배양했다. 평판은 다음과 같이 세팅된 1420 VICTOR Multilabel Counter(Perkin Elmer Life Sciences, Downers Grove, IL)에서 판독했다: 여기 = 360/40, 방출 = 460/40. 이소타입 항체 대조군-처리된 세포 대비 항체-처리된 세포 유래의 형광 단위의 증가는 아폽토시스를 나타낸다.
실시예
1.1.2.I:
시험관내
항체 또는
DVD
-
Ig
의 수용체 활성화 억제
세포 수용체 또는 이의 리간드에 결합하는 모 항체 또는 DVD-Ig은 수용체 활성화 억제에 대해 검사할 수 있다. D-PBS-BSA(0.1% BSA를 보유한 둘베코 인산염 완충 식염수)에 희석된 모 항체 또는 DVD-Ig을 최종 농도 0.01 ㎍/ml 내지 100 ㎍/ml로 사람 암종 세포에 첨가했다. 평판은 가습된 5% CO2 대기에서 37℃ 하에 1시간 동안 항온배양했다. 수용체(예, IGF1R) 자가인산화를 자극하기 위해 세포에 성장인자(예, IGF1 또는 IGF2)를 1 내지 100 ng/ml 농도로 5 내지 15분 동안 첨가했다. 항체 처리하지 않은 웰은 억제율이 0%인 대조군으로 이용했고, 성장인자 자극하지 않은 웰은 100% 억제율을 나타내는 것으로 간주했다. 세포 용해물은 세포 추출 완충액(10mM Tris, pH7.4, 100mM NaCl, 1mM EDTA, 1mM EGTA, 1mM NaF, 1mM 나트륨 오르토바나데이트, 1% Triton X-100, 10% 글리세롤, 0.1% SDS 및 프로테아제 저해제 칵테일)과 항온처리하여 제조했다. 이러한 세포 용해물 중의 포스포-IGF1R은 R&D System(Minneapolis, MN)에서 구입한 특이적 ELISA 키트를 이용하여 측정했다.
실시예
1.1.2.J: 사람
암종
이종이식편(피하 옆구리,
동소성
또는 자발적 전이)의 성장에 미치는 항-종양 세포 항원 항체 또는
DVD
-
Ig
단독 처리 또는 화학요법과의 병용 처리 효능
사람 암세포는 조직 배양 플라스크에서 99% 생육력, 85% 융합도로 시험관내 증식시킨다. SCID 암컷 또는 수컷 마우스(Charles Rivers Labs)(19 내지 25g)의 귀에 태그를 붙이고 면도했다. 그 다음, 마우스의 오른쪽 옆구리에 0.2ml의 2 x 106 사람 종양 세포(1:1 마트리겔)를 연구 0일째 피하 접종했다. 평균 종양 용적이 약 150 내지 200 ㎣인 마우스를 우리에 크기별로 분리한 후 비히클(PBS), 항체 또는 DVD-Ig의 투여(IP, Q3D/주), 및/또는 화학요법을 개시했다. 종양은 접종 후 약 10일부터 주당 2회씩 한 쌍의 캘리퍼스로 측정하고, 종양 용적은 식 V = L x W2/2 (V: 용적, ㎣; L: 길이, mm; W: 폭, mm)에 따라 계산했다. 종양 용적의 감소는 비히클 또는 이소타입 대조군 mAb만을 투여한 동물의 종양과 비교하여 항체 또는 DVD-Ig 단독 처리 동물 또는 화학요법과 병용 처리된 동물에서 관찰되었다.
실시예
1.1.2.K:
유세포측정으로
평가 시, 사람 종양 세포주의 표면에 대한
모노클로날
항체의 결합
당해의 세포 표면 항원 또는 사람 종양 세포주를 과발현하는 안정한 세포주는 조직배양 플라스크에서 수거하고 5% 소 태아 혈청 함유 인산염 완충 식염수(PBS/FCS)에 재현탁시켰다. 염색하기 전에 사람 종양 세포주는 PBS/FCS 중의 200 ㎍/ml의 사람 IgG과 얼음 상에서 항온처리했다. 1-5 x 105 세포는 PBS/FCS 중의 항체 또는 DVD-Ig(1-2 ㎍/ml)과 얼음 상에서 30 내지 60분 동안 항온처리했다. 세포는 2회 세척하고, 염소 항-마우스 IgG-피코에리트린(PBS/BSA 중에 1:300 희석물)(Jackson ImmunoResearch, West Grove, PA, Cat. # 115-115-164) 100 ㎕를 첨가했다. 얼음에서 30분간 항온처리한 후, 세포는 2회 세척하고, PBS/FCS에 재현탁시켰다. 형광은 Becton Dickinson FACSCalibur(Becton Dickinson, San Jose, CA)를 이용하여 측정했다.
실시예
1.2: 당해 사람 항원에 대한 모
모노클로날
항체의 생성 및 특성규명
당해 사람 항원에 결합하고 이를 중화시킬 수 있는 모 마우스 mAb 및 이의 변형체는 다음과 같이 수득했다:
실시예
1.2.1:
당해의
사람 항원을 이용한 마우스의 면역화
완전 프로인트 보강제 또는 Immunoeasy 보강제(Qiagen, Valencia, CA)와 혼합한 20㎍의 재조합 정제된 사람 항원(예: IGF1,2)을 5마리의 6 내지 8주령 Balb/C, 5마리의 C57B/6 마우스, 및 5마리의 AJ 마우스에 1일째 피하 주사했다. 24일, 38일 및 49일에, 같은 마우스에게 불완전 프로인트 보강제 또는 Immunoeasy 보강제와 혼합된 재조합 정제된 사람 항원 변형체 20㎍을 피하 주사했다. 84일 또는 112일 또는 114일에, 마우스에게 당해 재조합 정제된 사람 항원 1㎍을 정맥내 주사했다.
실시예
1.2.2:
하이브리도마의
생성
실시예 1.2.A에 기술된 면역화된 마우스로부터 수득한 비장세포를 하이브리도마의 생성을 위해 문헌[Kohler, G. and Milstein (1975) Nature, 256:495]에 기술된 기존 방법에 따라 SP2/O-Ag-14 세포와 5:1의 비율로 융합시켰다. 융합 산물은 웰당 2.5x106 비장 세포의 밀도로 96웰 평판에서 아자세린 및 하이포잔틴 함유 선택 배지 중에서 평판배양했다. 융합 후 7일 내지 10일째, 육안으로 하이브리도마 콜로니가 관찰되었다. 하이브리도마 콜로니를 함유하는 각 웰의 상청액을 당해 항원에 대한 항체의 존재에 대해 ELISA로 검사했다(실시예 1.2.A에 기술되어 있음). 항원-특이적 활성을 나타내는 상청액은 그 다음 활성에 대해 검사했다(실시예 1.1.2의 분석법에 기술된 것, 예컨대 실시예 1.1.2.A에 기술된 바와 같은 생물학적 정량에서 당해 항원을 중화하는 능력).
실시예
1.2.3: 당해 사람 표적 항원에 대한
모노클로날
모 항체의 특성규명
실시예
1.2.3.1:
모노클로날
모 항체 중화 활성 분석
하이브리도마 상청액은 당해 항원에 결합하고 당해 항원의 변형체("항원 변형체")에 결합할 수 있는 모 항체의 존재에 대해 분석했다. 두 분석에서 양성인 항체를 보유한 상청액은 그 다음 예컨대 실시예 1.1.2의 사이토킨 생물학적 정량에서와 같이 항원 중화 효능에 대해 검사했다. 생물학적 정량에서 IC50 값이 1000 pM 미만, 한 양태에서 100 pM 미만인 항체를 생산하는 하이브리도마를 증량시키고 한계 희석으로 클로닝했다. 하이브리도마 세포는 10% 저농도 IgG 소 태아 혈청(Hyclone #SH30151, Logan, UT) 함유 배지에서 증식시켰다. 평균적으로 각 하이브리도마 상청액(클론 집단에서 유래된 것) 250 ml를 수거하고 농축한 뒤, 단백질 A 친화성 크로마토그래피로 문헌[Harlow, E. and Lane, D. 1988 "Antibodies: A Laboratory Manual"]에 기술된 바와 같이 정제했다. 정제된 mAb가 표적 항원의 활성을 억제하는 능력은, 예컨대 실시예 1.1.2에 기술된 바와 같은 사이토킨 생물학적 정량을 이용하여 측정한다.
실시예
1.2.3.2: 당해
사이노몰거스
표적 항원에 대한
모노클로날
모 항체 교차반응성 분석
본 명세서에 기술된 선택된 mAb가 당해의 사이노몰거스 항원을 인식하는지를 측정하기 위해, BIACORE 분석을 재조합 사이노몰거스 표적 항원을 이용하여 본 명세서에 기술된 바와 같이(실시예 1.1.1.C) 수행했다. 또한, 당해 재조합 사이노몰거스 항원에 대한 mAb의 중화 효능은 사이토킨 생물학적 정량으로 측정할 수도 있다(실시예 1.1.2). 양호한 사이노 교차반응성(한 양태에 따르면, 사람 항원에 대한 반응성의 5배 이내)을 갖는 mAb를 향후 특성규명을 위해 선택했다.
실시예
1.2.4: 각 쥐 항-사람
모노클로날
항체의 가변 영역의 아미노산 서열의 결정
재조합 항-사람 마우스 mAb의 cDNA의 분리, 발현 및 특성규명은 다음과 같이 수행했다. 각 아미노산 서열 결정을 위해, 약 1x106 하이브리도마 세포를 원심분리로 분리하고 총 RNA 분리를 위해 트리졸(Trizol)(Gibco BRL/Invitrogen, Carlsbad, CA)로 제조업체의 지시에 따라 처리했다. 총 RNA는 SuperScript First-Strand Synthesis System(Invitrogen, Carlsbad, CA)을 제조업체의 지시에 따라 이용하여 제1 가닥 DNA 합성 처리했다. 올리고(dT)는 폴리(A)+ RNA의 선택을 위해 제1 가닥 합성을 프라이밍하는데 사용된다. 제1 가닥 cDNA 산물은 그 다음, 쥐 면역글로불린 가변 영역의 증폭을 위해 설계한 프라이머(Ig-프라이머 세트, Novagen, Madison, WI)를 이용하여 PCR로 증폭시켰다. PCR 산물은 아가로스 겔에서 분리하고, 절제하여, 정제한 뒤, TOPO 클로닝 키트로 pCR2.1-TOPO 벡터(Invitrogen, Carlsbad, CA)에 서브클로닝하고, TOP10 화학적 컴피턴트(chemically competent) 이.콜라이(E. coli)(Invitrogen, Carlsbad, CA)에 형질전환시켰다. 이 형질전환체에 콜로니 PCR을 수행하여 삽입체 함유 콜로니를 동정했다. 플라스미드 DNA는 QIAprep Miniprep 키트(Qiagen, Valencia, CA)를 이용하여 삽입체 함유 클론으로부터 분리했다. 플라스미드 내의 삽입체는 양 가닥을 서열분석하여, M13 정방향 및 M13 역방향 프라이머(Fermentas Life Sciences, Hanover MD)를 이용해 가변 중쇄 또는 가변 경쇄 DNA 서열을 결정했다. mAb의 가변 중쇄 및 경쇄 서열을 동정했다. 한 양태에서, 다음 단계 개발(사람화)을 위해 주도 mAb 패널에 대한 선택 기준으로는 다음을 포함한다:
· 항체는 CH2 내의 기준 부위 외에, 어떠한 N-결합 글리코실화 부위(NXS)도 포함하지 않는다.
· 항체는 모든 항체 내의 정상 시스테인 외에 어떠한 초과 시스테인을 포함하지 않는다.
· 항체 서열은 VH 및 VL에 대해 가장 근접한 사람 생식계열 서열과 정렬해서, 어떤 특이한 아미노산이 다른 천연 사람 항체에 존재하는지 점검해야 한다.
· N-말단 글루타민(Q)은 항체 활성에 영향을 미치지 않는다면 글루탐산(E)으로 변화시킨다. 이것은 Q의 폐환으로 인한 불균질성을 감소시킬 것이다.
· 효과적인 시그널 서열 절단은 질량분광광도계로 확인한다. 이것은 COS 세포 또는 293 세포 물질로 수행할 수 있다.
· 단백질 서열은 활성 상실을 초래할 수 있는 Asn의 탈아미드화 위험에 대해 점검한다.
· 항체는 낮은 응집도를 나타낸다.
· 항체는 >5 내지 10mg/ml의 용해도를 나타낸다(연구 단계에서); >25mg/ml
· 항체는 동적 광산란(DLS)에 의해 정상 크기(5-6nm)를 갖고 있다.
· 항체는 하전 불균질성이 낮다.
· 항체는 사이토킨 방출 결여성이다(실시예 1.1.2.E 참조)
· 항체는 의도한 사이토킨에 대한 특이성을 나타낸다(실시예 1.1.2.F 참조).
· 항체는 예상치 않은 조직 교차반응성이 없다(실시예 1.1.2.G 참조).
· 항체는 사람과 사이노몰거스 조직 교차반응성 간에 유사성을 나타낸다(실시예 1.1.2.G 참조).
실시예
1.3: 재조합
사람화된
모 항체의 생성 및 특성규명
실시예
1.3.1: 재조합
키메라
항 사람 모 항체의
작제
및 발현
쥐 항-사람 모 mAb의 중쇄 불변 영역을 암호화하는 DNA는 세균에서 상동 재조합에 의해 2개의 힌지(hinge) 영역 아미노산 돌연변이를 함유하는 사람 IgG1 불변 영역을 암호화하는 cDNA 단편으로 교체했다. 이 돌연변이는 위치 234(EU 넘버링)에서 류신의 알라닌으로의 변화 및 위치 235에서 류신의 알라닌으로의 변화이다(Lund et al., 1991, J. Immunol., 147: 2657). 이 항체들 각각의 경쇄 불변 영역은 사람 카파 불변 영역으로 교체했다. pBOS 발현 플라스미드에 연결된 키메라 중쇄 및 경쇄 cDNA의 공동형질감염으로 전체 길이 키메라 항체를 COS 세포에서 일시적으로 발현시킨다(Mizushima and Nagata, Nucleic Acids, Research 1990, Vol 18, pg 5322). 재조합 키메라 항체를 함유하는 세포 상청액은 단백질 A 세파로스 크로마토그래피로 정제하고 결합된 항체는 산 완충액을 첨가하여 용출시켰다. 항체는 중화시키고 PBS에 투석했다.
키메라 mAb를 암호화하는 중쇄 cDNA는 이의 키메릭 경쇄 cDNA(둘다 pBOS 벡터에 연결됨)와 함께 COS 세포에 공동형질감염시켰다. 재조합 키메라 항체를 함유하는 세포 상청액은 단백질 A 세파로스 크로마토그래피로 정제하고 결합된 항체는 산 완충액을 첨가하여 용출시켰다. 항체는 중화시키고 PBS에 투석했다.
정제된 키메라 항-사람 모 mAb는 그 다음 결합능(Biacore에 의한) 및 기능적 활성, 예컨대 실시예 1.1에 기술된 바와 같이 IgE의 사이토킨 유도된 생산을 억제하는 활성에 대해 검사한다. 모 하이브리도마 mAb의 활성을 유지하는 키메라 mAb를 추가 개발을 위해 선택한다.
실시예
1.3.2:
사람화된
항 사람 모 항체의
작제
및 발현
실시예
1.3.2.1: 사람 항체
프레임워크의
선택
각 쥐 가변 중쇄 및 가변 경쇄 유전자 서열은 44가지 사람 면역글로불린 생식계열 가변 중쇄 또는 46가지 생식계열 가변 경쇄 서열(NCBI Ig Blast 웹사이트 http://www.ncbi.nlm.nih.gov/igblast/retrieveig.html로부터 유도됨)에 대해 Vector NTI 소프트웨어를 이용해 각각 정렬시킨다.
사람화는 아미노산 서열 상동성, CDR 클러스터 분석, 발현된 사람 항체 중에서 사용 빈도 및 사람 항체의 결정 구조에 대한 이용가능한 정보에 기초한다. 항체 결합, VH-VL 짝짓기 및 다른 요인들에 미치는 가능한 영향을 고려하여, 몇개는 제외하고 쥐와 사람 프레임워크 잔기가 상이한 경우, 쥐 잔기를 사람 잔기로 돌연변이시킨다. 추가 사람화 전략은 쥐 항체 가변 영역의 실제 아미노산 서열과 고도의 상동성, 즉 서열 유사성을 보유하는 사람 생식계열 항체 서열 또는 이의 서브그룹에 대한 분석을 기초로 하여 설계한다.
상동성 모델링은 항체 결합 부위, CDR의 구조에 중요한 것으로 생각되는 쥐 항체 서열에 독특한 잔기를 동정하는데 사용된다. 상동성 모델링은 단백질에 대한 대략적인 3차원 좌표가 수득되는 계산적 방법이다. 초기 좌표의 급원 및 이들의 추가 개선을 위한 안내자는 3차원 좌표가 알려져 있고 서열이 제1 단백질 서열과 관련이 있는 참조 단백질인 제2 단백질이다. 두 단백질의 서열 간에 관계는 참조 단백질과 바람직한 좌표의 단백질, 즉 표적 단백질 사이에 상응성을 만들어내는데 사용된다. 참조 단백질과 표적 단백질의 1차 서열은 참조 단백질로부터 표적 단백질로 직접 전이된 두 단백질의 동일한 부분의 좌표를 이용하여 정렬한다. 잔기 돌연변이, 삽입 또는 결실로부터 두 단백질의 부정합된 부위의 좌표는 이미 전이된 모델 좌표와 일치하도록 개선된 일반적인 구조 주형과 에너지로부터 작제한다. 이 계산적 단백질 구조는 추가 개선되거나 또는 모델링 연구에 직접 이용될 수 있다. 모델 구조의 성질은 참조 단백질과 표적 단백질이 관련이 있다는 논쟁의 정확성 및 서열 정렬이 구축되는 정밀성에 의해 결정된다.
쥐 mAb의 경우, BLAST 조사 및 육안 검사의 조합은 적당한 참조 구조를 동정하는데 사용된다. 참조 아미노산 서열과 표적 아미노산 서열 간에 25%의 서열 동일성은 상동성 모델링 실행을 시도하는데 필요한 최소값인 것으로 생각된다. 서열 정렬은 수작업으로 구축하고 모델 좌표는 프로그램 Jackal(Petrey, D. et al.(2003) Proteins 53(Suppl. 6):430-435)로 수득한다.
선택된 항체의 쥐 및 사람 프레임워크 영역의 1차 서열은 상당한 동일성을 공유한다. 상이한 잔기 위치는 쥐 항체의 관찰된 결합능을 유지시키기 위해 사람화된 서열에 포함시켜야 할 쥐 잔기의 후보이다. 사람 및 쥐 서열 간에 상이한 프레임워크 잔기의 목록은 수작업으로 구축한다.
주어진 프레임워크 잔기가 항체의 결합성에 영향을 미칠 가능성은 CDR 잔기에 대한 근접성에 좌우된다. 따라서, 모델 구조를 이용하여, 쥐 및 사람 서열간에 상이한 잔기는 CDR 내의 임의의 원자로부터의 거리에 따라 순위를 매긴다. 임의의 CDR 원자의 4.5Å 내에 속하는 잔기는 가장 중요한 것으로 확인되며 사람화된 항체에서 유지되어야 하는 쥐 잔기의 후보로 권장된다(즉, 역돌연변이).
컴퓨터 모의(in silico) 작제된 사람화된 항체는 올리고뉴클레오타이드를 이용하여 작제한다. 각 가변 영역 cDNA를 위해, 각각 60 내지 80개 뉴클레오타이드의 6가지 올리고뉴클레오타이드는 각 올리고뉴클레오타이드의 5' 및/또는 3' 말단에서 20개 뉴클레오타이드가 서로 중첩하도록 설계한다. 어닐링 반응에서, 6가지 올리고뉴클레오타이드를 전부 배합하고, 비등가열한 후, dNTP의 존재 하에 어닐링한다. 중첩 올리고뉴클레오타이드 간에 약 40bp 갭을 채우기 위해 DNA 폴리머라제 I, Large(Klenow) 단편(New England Biolabs #M0210, Beverley, MA.)을 첨가한다. PCR은 변형된 pBOS 벡터에서 다중 클로닝 부위에 상보적인 오버행 서열을 함유하는 최외각 프라이머를 이용하여 전체 가변 영역 유전자를 증폭시키기 위해 수행한다(Mizushima, S. and Nagata, S.(1990) Nucleic Acids Res. 18:17). 각 cDNA 어셈블리로부터 유도되는 PCR 산물은 아가로스 겔에서 분리하고, 예상 가변 영역 cDNA 크기에 해당하는 밴드를 잘라 정제한다. 가변 중쇄 영역은 세균에서 상동 재조합에 의해 2개의 힌지 영역 아미노산 돌연변이를 함유하는 사람 IgG1 불변 영역을 암호화하는 cDNA 단편에 인프레임(in-frame)식으로 삽입한다. 이 돌연변이는 위치 234(EU 넘버링)에서 류신의 알라닌으로의 변화 및 위치 235에서 류신의 알라닌으로의 변화를 포함한다(Lund et al.(1991) J. Immunol. 147: 2657). 가변 경쇄 영역은 상동 재조합에 의해 사람 카파 불변영역과 인프레임식으로 삽입된다. 세균 콜로니를 분리하고 플라스미드 DNA를 추출했다. cDNA 삽입체의 전체 서열을 분석했다. 각 항체에 상응하는 정확한 사람화된 중쇄 및 경쇄 서열을 이용하여 COS 세포를 공동형질감염시켜 전체 길이의 사람화된 항-사람 항체를 일시적으로 생산했다. 재조합 키메라 항체를 함유하는 세포 상청액은 단백질 A 세파로스 크로마토그래피로 정제하고 결합된 항체는 산 완충액을 첨가하여 용출시켰다. 항체를 중화하고 PBS 내로 투석했다.
실시예
1.3.3:
사람화된
항체의 특성규명
기능적 활성을 억제하는 정제된 사람화된 항체의 능력은 예컨대 실시예 1.1.2에 기술된 바와 같은 사이토킨 생물학적 정량을 이용해서 측정했다. 재조합 사람 항원에 대한 사람화된 항체의 결합 친화성은 실시예 1.1.1.C에 기술된 바와 같이 표면 플라스몬 공명(Biacore®)을 이용하여 측정했다. 생물학적 정량에서 IC50 값 및 사람화된 항체의 친화성을 순위를 매겼다. 모 하이브리도마 mAb의 활성을 완전하게 유지하는 사람화된 mAb를 향후 개발을 위한 후보로서 선택했다. 최상위 2 내지 3개의 가장 유리한 사람화된 mAb를 추가로 특성규명했다.
실시예
1.3.3.1:
사람화된
항체의 약동학 분석
약동학 연구는 Sprague-Dawley 래트 및 사이노몰거스 원숭이에서 수행했다. 수컷 및 암컷 래트 및 사이노몰거스 원숭이에게 4mg/kg mAb 단회 용량을 정맥내 또는 피하로 용량투여하고, 시료를 항원 포획 ELISA로 분석하고, 약동학 파라미터는 비구획(noncompartmental) 분석으로 측정했다. 간략히 설명하면, ELISA 평판은 염소 항-비오틴 항체(5mg/ml, 4℃, 밤새)와 코팅하고, Superblock(Pierce)으로 차단하고, 10% Superblock TTBS 중의 50ng/ml의 비오티닐화된 사람 항원과 실온에서 2시간 동안 항온처리했다. 혈청 시료를 연속 희석(TTBS 중의 5% 혈청, 10% Superblock)하고 평판에서 실온 하에 30분 동안 항온처리했다. 검출은 HRP-표지화된 염소 항 사람 항체로 실시하고, 표준 곡선의 도움으로 4가지 파라미터 로지스틱 적합을 이용하여 측정했다. 약동학 파라미터의 값은 비구획 모델로 WinNonlin 소프트웨어(Pharsight Corporation, Mountain View, CA)를 이용하여 측정했다. 약동학 프로필이 양호한 사람화된 mAb(T1/2이 8 내지 13일 또는 그 이상이고, 제거율이 낮고 우수한 생체이용률 50-100% 보유)를 선택한다.
실시예
1.3.3.2:
사람화된
모노클로날
항체의 이화학적 및
시험관내
안정성 연구
실시예
1.3.3.2.A: 크기 배제 크로마토그래피
항체는 물로 2.5mg/ml로 희석하고, 20ml를 TSK 겔 G3000 SWXL 컬럼(Tosoh Bioscience, cat# k5539-05k)을 이용하여 Shimadzu HPLC 시스템으로 분석했다. 시료는 211mM 황산나트륨, 92mM 인산나트륨 pH 7.0으로 0.3ml/분의 유속으로 컬럼으로부터 용출시켰다. HPLC 시스템의 작동 조건은 다음과 같다:
이동상: 211mM Na2SO4, 92mM Na2HPO4*7H2O, pH 7.0
구배: 단일용매
유속: 0.3ml/분
검출기 파장: 280nm
오토샘플러 냉각기 온도: 4℃
컬럼 오븐 온도: 상온
실행 시간: 50분
실시예
1.3.3.2.B:
SDS
-
PAGE
항체는 환원 및 비환원 조건 하에 나트륨 도데실 설페이트-폴리아크릴아미드 겔 전기영동(SDS-PAGE)으로 분석한다. 아달리무마브 로트 AFP04C는 대조군으로 사용했다. 환원 조건 하에, 시료는 100mM DTT 함유 2X 트리스 글리신 SDS-PAGE 시료 완충액(Invitrogen, cat#LC2676, lot# 1323208)과 1:1로 혼합하고 60℃에서 30분 동안 가열했다. 비환원 조건 하에서, 시료는 시료 완충액과 1:1로 혼합하고 100℃에서 5분 동안 가열했다. 환원 시료(레인당 10mg)는 12% 사전주조된 트리스-글리신 겔(Invitrogen, cat# EC6005box, 로트#6111021) 위에 로딩하고, 비환원 시료(레인당 10mg)는 8% 내지 16% 사전주조된 트리스-글리신 겔(Invitrogen, cat# EC6045box, lot#6111021) 위에 로딩했다. SeeBlue Plus 2(Invitrogen, cat#LC5925, lot#1351542)는 분자량 마커로 사용했다. 겔은 XCell SureLock 미니 셀 겔 박스(Invitrogen, cat#EI0001)에서 진행시키고 단백질은 먼저 겔에 시료를 적재하기 위해 전압 75를 가한 다음, 염료 시작부가 겔 바닥에 이를 때까지 125의 일정한 전압을 가해 분리했다. 사용된 전개 완충액은 10X 트리스 글리신 SDS 완충액(ABC, MPS-79-080106)으로 제조한 1X 트리스 글리신 SDS 완충액이다. 겔은 밤새 콜로이드성 청색 염료(Invitrogen cat#46-7015, 46-7016)로 염색하고 Milli-Q 물로 배경이 투명해질 때가지 탈색시켰다. 염색된 겔은 그 다음 Epson Expression 스캐너(모델 1680, S/N DASX003641)로 스캔했다.
실시예
1.3.3.2.C: 침전 속도 분석
항체는 3개의 표준 2섹터 카본 에폰 센터피스 각각의 시료 챔버에 로딩했다. 이 센터피스는 광경로 길이가 1.2cm로, 사파이어 창으로 제작된 것이다. PBS는 참조 완충액으로 사용했고, 각 챔버는 140 ㎕를 함유했다. 모든 샘플은 Beckman ProteomeLab XL-I 분석 초원심분리기(시리얼 #PL106C1)에서 4-홀(AN-60Ti) 로터를 이용해 동시에 조사했다.
진행 조건을 프로그램화하고 원심분리 조절은 ProteomeLab(v5.6)으로 수행했다. 시료와 로터는 분석하기 전에 1시간 동안 열평형시켰다(20.0±0.1℃). 적당한 세포 로딩의 확인은 3000 rpm에서 수행하고, 각 셀마다 단회 스캔을 기록했다. 침전 속도 조건은 다음과 같다:
시료 셀 용적: 420ml
참조 셀 용적: 420ml
온도: 20℃
로터 속도: 35,000 rpm
시간: 8:00 시간
UV 파장: 280nm
래디얼 스텝(radial step) 크기: 0.003cm
데이터 수집: 시그널 평균화 없이 단계별 1개의 데이터 포인트
총 스캔 수: 100
실시예
1.3.3.2.D:
무손상
항체의
LC
-
MS
분자량 측정
무손상 항체의 분자량은 LC-MS로 분석했다. 각 항체는 물로 약 1mg/ml로 희석한다. 단백질 마이크로트랩을 보유한 1100 HPLC(Agilent) 시스템(Michrom Bioresources, Inc., cat# 004/25109/03)을 이용하여 탈염하고 API Qstar pulsar i 질량 분광계(Applied Biosystems)에 시료 5mg을 유입시켰다. 시료의 용출에 짧은 구배를 이용했다. 구배는 이동상 A(HPLC 물 중의 0.08% FA, 0.02% TFA) 및 이동상 B(아세토니트릴 중의 0.08% FA 및 0.02% TFA)로 50ml/분의 유속으로 전개시킨다. 질량 분광분석계는 2000 내지 3500 질량 대 하전 비의 스캔 범위 하에 4.5 킬로볼트의 분무 전압에서 작동시킨다.
실시예
1.3.3.2.E: 항체
경쇄
및
중쇄의
LC
-
MS
분자량 측정
항체 경쇄(LC) 및 중쇄(HC) 및 탈글리코실화된 HC의 분자량은 LC-MS로 분석했다. 항체는 물로 1 mg/mL로 희석하고 샘플은 최종 농도 10 mM DTT로 30분 동안 37℃에서 LC 및 HC로 환원시켰다. 항체의 탈글리코실화를 위해, 항체 100 mg을 총 용적 100 mL 중의 PNGase F 2mL, 10% N-옥틸글루코시드 5mL로 밤새 37℃에서 항온처리했다. 탈글리코실화 후, 샘플은 최종 농도 10 mM DTT로 30분 동안 37℃에서 환원시켰다. C4 컬럼이 장착된 Agilent 1100 HPLC 시스템(Vydac, cat# 214TP5115, S/N 060206537204069)을 사용하여 샘플(5 mg)을 탈염시키고 API Qstar pulsar i 질량 분광계(Applied Biosystems)에 유입시켰다. 시료의 용출에 짧은 구배를 이용했다. 구배는 이동상 A(HPLC 물 중의 0.08% FA, 0.02% TFA) 및 이동상 B(아세토니트릴 중의 0.08% FA 및 0.02% TFA)로 50ml/분의 유속으로 전개시킨다. 질량 분광분석계는 800 내지 3500 질량 대 하전 비의 스캔 범위 하에 4.5 킬로볼트의 분무 전압에서 작동시킨다.
실시예
1.3.3.2.F:
펩타이드
맵핑
항체는 75mM 중탄산암모늄 중의 6M 구아니딘 염산염을 최종 농도로 하여 실온에서 15분 동안 변성시킨다. 변성된 시료를 최종 농도 10mM DTT로 37℃에서 60분 동안 환원시킨 뒤, 암실에서 50mM 요오도아세트산(IAA)으로 37℃에서 30분 동안 알킬화한다. 알킬화 후, 시료를 10mM 중탄산암모늄 4 리터에 대해 4℃에서 밤새 투석한다. 투석된 시료를 10mM 중탄산나트륨 pH 7.8로 1mg/ml로 희석하고 항체 100mg을 트립신(Promega, cat# V5111) 또는 Lys-C(Roche, cat# 11 047 825 001)로 1:20(w/w) 트립신/Lys-C:항체 비 하에 37℃에서 4시간 동안 분해했다. 분해물을 1N HCl 1ml로 반응정지시켰다. 질량 분광계 검출을 이용한 펩타이드 맵핑을 위해, 분해물 40ml를 Agilent 1100 HPLC 시스템을 이용한 C18 컬럼(Vydac, cat# 218TP51, S/N NE9606 10.3.5) 상에서 역상 고성능 액체 크로마토그래피(RPHPLC)로 분리했다. 펩타이드 분리는 이동상 A(HPLC 등급 물 중의 0.08% FA 및 0.02% TFA) 및 이동상 B(아세토니트릴 중의 0.08% FA 및 0.02% TFA)를 이용한 구배로 50ml/분의 유속으로 전개시킨다. API QSTAR Pulsar i 질량 분광분석계는 800 내지 2500 질량 대 하전 비의 스캔 범위 하에 4.5 킬로볼트의 분무 전압에서 포지티브 모드로 작동시킨다.
실시예
1.3.3.2.G:
이황화
결합
맵핑
항체를 변성시키기 위해, 항체 100ml를 100mM 중탄산암모늄 중의 8M 구아니딘 HCl 300ml와 혼합했다. pH는 7 내지 8 사이가 되도록 점검하고, 시료는 6M 구아니딘 HCl의 최종 농도로 실온에서 15분 동안 변성시켰다. 변성된 시료 일부(100ml)를 Milli-Q 물 600ml로 희석하여 구아니딘-HCl을 최종 1M 농도로 제공했다. 시료(220mg)를 트립신(Promega, cat#V5111, lot#22265901) 또는 Lys-C(Roche, cat#11047825001, lot#12808000)를 1:50 트립신 또는 1:50 Lys-C:항체(w/w)비(4.4mg 효소: 220mg 시료)로 사용하여 37℃에서 약 16시간 동안 분해했다. 추가로 트립신 또는 Lys-C 5mg을 시료에 첨가하고, 37℃에서 추가 2시간 동안 분해를 진행했다. 분해는 각 시료에 TFA 1ml를 첨가하여 정지시켰다. 분해된 시료는 Agilent HPLC 시스템에서 C18 컬럼(Vydac, cat#218TP51 S/N NE020630-4-1A)을 이용하여 RPHPLC로 분리한다. 분리는 펩타이드 맵핑 시에 사용했던 동일 구배로 이동상 A(HPLC 물 중의 0.08% FA, 0.02% TFA) 및 이동상 B(아세토니트릴 중의 0.08% FA 및 0.02% TFA)를 50ml/분의 유속으로 이용하여 형성시킨다. HPLC 작업 조건은 펩타이드 맵핑 시에 사용했던 것과 동일하다. API QSTAR Pulsar i 질량 분광계는 800 내지 2500 질량 대 하전 비의 스캔 범위 하에 4.5 킬로볼트의 분무 전압에서 포지티브 모드로 작동했다. 디설파이드 결합은 펩타이드의 관측된 MW를 디설파이드 결합에 의해 연결된 트립신 또는 Lys-C 펩타이드의 예측된 MW와 매치시켜 배정했다.
실시예
1.3.3.2.H: 유리
설프하이드릴
측정
항체에 존재하는 유리 시스테인을 정량분석하는데 사용한 방법은 특징적인 발색단 산물, 5-티오-(2-니트로벤조산)(TNB)을 발생시키는 설프하이드릴 기(SH)와 엘만(Ellman) 시약, 5,5¢-디티오-비스(2-니트로벤조산)(DTNB)의 반응을 기초로 한다. 이 반응은 다음 반응식으로 설명된다:
DTNB + RSH ® RS-TNB + TNB- + H+
TNB-의 흡광도는 Cary 50 분광광도계를 이용하여 412nm에서 측정한다. 흡광도 곡선은 유리 SH 표준물로서 2-머캅토에탄올(β-ME)의 희석물을 이용하여 플로팅하고 단백질에 존재하는 유리 설프하이드릴 기의 농도는 시료의 412nm에서의 흡광도로부터 측정한다.
β-ME 표준 스톡은 14.2M β-ME를 HPLC 등급 물로 0.142mM의 최종 농도로 연속 희석하여 준비했다. 그 다음, 각 농도마다 3반복의 표준물을 제조했다. 항체는 아미콘 울트라 10,000 MWCO 원심분리 필터(Millipore, cat#UFC801096, lot#L3KN5251)를 이용하여 10mg/ml로 농축하고 완충액은 아달리무마브용 조제 완충액(5.57mM 인산나트륨 일염기성, 8.69mM 인산나트륨 이염기성, 106.69mM NaCl, 1.07mM 시트르산나트륨, 6.45mM 시트르산, 66.68mM 만니톨, pH 5.2, 0.1%(w/v) Tween)으로 교환했다. 시료는 실온에서 20분 동안 진탕기에서 혼합했다. 그 후, 각 시료 및 표준물에 100mM Tris 완충액(pH 8.1) 180ml를 첨가하고, 그 다음 10mM 인산염 완충액(pH 8.1) 중의 2mM DTNB 300ml를 첨가했다. 충분히 혼합한 후, 시료와 표준물을 Cary 50 분광광도계에서 412nm에서의 흡광도를 측정했다. 표준 곡선은 유리 SH의 양과 β-ME 표준물의 OD412 nm를 플로팅하여 수득했다. 시료의 유리 SH 함량은 블랭크를 공제한 후 상기 곡선에 기초하여 계산했다.
실시예
1.3.3.2.I: 약 양이온 교환 크로마토그래피
항체는 10mM 인산나트륨(pH 6.0)으로 1mg/ml로 희석했다. 하전 비균질성은 WCX-10 ProPac 분석 컬럼(Dionex, cat#054993, S/N 02722)을 보유한 Shimadzu HPLC 시스템으로 분석했다. 시료는 80% 이동상 A(10mM 인산나트륨, pH 6.0) 및 20% 이동상 B(10mM 인산나트륨, 500mM NaCl, pH 6.0)에서 컬럼 위에 로딩하고 1.0ml/분의 유속으로 용출시켰다.
실시예
1.3.3.2.J:
올리고사카라이드
프로파일링
항체를 PNGase F 처리한 후 방출된 올리고사카라이드는 2-아미노벤즈아미드(2-AB) 표지화 시약으로 유도체화했다. 형광-표지된 올리고사카라이드는 정상상 크로마토그래피(NPHPLC)로 분리하고, 공지 표준물과 체류 시간 비교를 기초로 하여 여러 형태의 올리고사카라이드를 특성규명했다.
항체는 먼저 PNGaseF로 분해하여 중쇄의 Fc 부로부터 N-결합된 올리고사카라이드를 절단했다. 이 항체(200mg)를 2ml PNGase F 및 3ml의 10% N-옥틸글루코사이드와 함께 500ml 에펜도르프 튜브에 넣었다. 인산염 완충 식염수를 최종 용적이 60ml가 되도록 첨가했다. 시료는 에펜도르프 가열혼합기 세트에서 700 RPM 하에 37℃에서 밤새 항온처리했다. 아달리무마브 로트 AFP04C는 또한 대조군으로서 PNGase F로 분해했다.
PNGase F 처리 후, 시료는 에펜도르프 가열혼합기 세트에서 750RPM 하에 95℃에서 5분 동안 항온처리하여 단백질을 침전시키고, 그 다음 시료를 에펜도르프 원심분리기에 넣고 10,000 RPM 하에 2분 동안 침전 단백질을 스핀다운시켰다. 올리고사카라이드를 함유하는 상청액은 500ml 에펜도르프 튜브로 옮기고 65℃, 스피드백(speed-vac)에서 건조시켰다.
올리고사카라이드는 프로자임(Prozyme, cat#GKK-404, lot# 132026)에서 구입한 2AB 표지화 키트를 이용하여 2AB로 표지화했다. 표지화 시약은 제조업체의 지시에 따라 제조했다. 아세트산(150ml, 키트에 구비된 것)은 DMSO 바이알(키트에 구비된 것)에 첨가하고 용액을 위아래로 여러번 피펫팅하여 혼합했다. 아세트산/DMSO 혼합물(100ml)을 2-AB 염료 바이알로 옮기고(사용 직전에) 염료가 완전 용해될 때까지 혼합했다. 그 다음, 염료 용액을 환원제(키트에 구비된 것) 바이알에 첨가하고 잘 혼합했다(표지화 시약). 표지화 시약(5ml)을 각각 건조된 올리고사카라이드 시료 바이알에 첨가하고, 충분히 혼합했다. 반응 바이알을 에펜도르프 가열혼합기 세트에 넣고 65℃, 700-800 RPM에서 2시간 동안 반응시켰다.
표지화 반응 후, 과량의 형광 염료는 프로자임의 GlycoClean S Cartridge(cat# GKI-4726)를 이용해 제거했다. 시료를 첨가하기 전에 카트리지는 milli-Q 물 1ml로 세척하고, 그 다음 30% 아세트산 용액 1ml로 5회 세척했다. 시료를 첨가하기 직전에 아세토니트릴 (Burdick and Jackson, cat# AH015-4) 1ml를 카트리지에 첨가했다.
카트리지를 통해 아세토니트릴을 모두 통과시킨 후, 시료를 갓 세척한 디스크 중심에 점적하고, 디스크 위에 10분 동안 흡착시켰다. 이 디스크를 1ml 아세토니트릴로 세척한 뒤, 96% 아세토니트릴 1ml로 5회 세척했다. 카트리지를 1.5ml 에펜도르프 튜브 위에 놓고 2-AB 표지된 올리고사카라이드를 milli Q 물로 3회(각 400ml) 용출시켰다.
올리고사카라이드는 Glycosep N HPLC(cat# GKI-4728) 컬럼을 Shimadzu HPLC 시스템과 연결시켜 분리했다. Shimadzu HPLC 시스템은 시스템 제어기, 탈기장치, 이원 펌프, 시료 냉각기와 오토샘플러, 형광 검출기로 구성되어 있다.
실시예
1.3.3.2.K:
승온에서의
안정성
항체의 완충액은 5.57mM 일염기성 인산나트륨, 8.69mM 이염기성 인산나트륨, 106.69mM NaCl, 1.07mM 시트르산나트륨, 6.45mM 시트르산, 66.68mM 만니톨, 0.1%(w/v) Tween, pH 5.2; 또는 10mM 히스티딘, 10mM 메티오닌, 4% 만니톨, pH 5.9로, Amicon 초원심분리 필터를 이용하여 제조했다. 항체의 최종 농도는 적당한 완충액으로 2mg/ml로 조정했다. 항체 용액은 그 다음 필터 멸균하고 멸균 조건 하에 0.25ml 일정량을 준비했다. 일정량을 1, 2 또는 3주 동안 -80℃, 5℃, 25℃ 또는 40℃에서 방치했다. 항온처리 기간 마지막에 시료를 크기 배제 크로마토그래피 및 SDS-PAGE로 분석했다.
안정성 시료는 환원 및 비환원 조건 하에 SDS-PAGE로 분석했다. 사용된 절차는 본 명세서에 기술된 바와 같다. 겔은 콜로이드성 청색 염료(Invitrogen cat# 46-7015, 46-7016)로 밤새 염색하고 배경이 투명해질 때까지 Milli-Q 물로 탈색했다. 염색된 겔은 그 다음 Epson Expression 스캐너(모델 1680, S/N DASX003641)로 스캔했다. 우수한 감도를 얻기 위해, 시료 겔을 은 염색 키트(Owl Scientific)로 은 염색하고 제조업체가 권장하는 절차를 이용했다.
실시예
1.3.3.2.L: 시차주사열량측정(
DSC
)
수용액 중의 단백질은 천연(폴딩된) 입체형태와 변성(언폴딩된) 입체형태 간에 평형을 이루고 있다. 천연 상태의 안정성은 시스템의 깁스 자유 에너지(DG)의 크기 및 엔탈피(DH)와 엔트로피(DS) 변화 사이의 열역학적 관계를 기초로 한다. 양의 DG는 천연 상태가 변성 상태보다 더 안정하다는 것을 나타내고, DG의 양의 값이 클수록 안정성이 커진다. 단백질이 언폴딩하기 위해서는 안정화 힘이 파괴되어야 한다. 입체형태 엔트로피는 엔트로피가 지배적이 되는 온도에서 안정화 힘을 능가하여 단백질을 언폴딩시킨다. 시차주사열량측정(DSC)은 열 변성으로 인한 단백질 언폴딩의 DH를 측정한다. 일반적으로, 전이 중간점(Tm)이 높을수록, 단백질은 저온에서 더욱 안정하다. 동일한 실험 동안 DSC는 또한 단백질 변성을 위한 열용량(DCp)의 변화를 측정한다. 단백질 언폴딩과 관련이 있는 열용량 변화는 주로 천연 상태에서 묻혀있다가 변성 상태에서 용매 노출되는 측쇄의 수화가 변화하기 때문이다. DSC는 단백질 및 다른 생물학적 거대분자의 액체 제형 안정성의 예측인자이다(Remmele, R.L. et al.(2000) BioPharm 13: 36-46; Remmele, R.L. et al.(1998) Pharm. Res. 15:200-208).
DSC의 다른 용도는 다양한 모노클로날 항체, 예컨대 아달리무마브(Humira), 트라스투주마드(Herceptin), 베바시주마브(Avastin) 및 여타 항체들에서 입증된 것처럼 단백질 구조의 특성규명이다(Ionescu, R. et al.(2008) J. Pharmaceut. Sci. 97(4): 1414-1426). IgG 항체는 일반적으로 3가지 언폴딩 전이(Tm)를 나타낸다: 순수 항체의 언폴딩은 Fc 단편의 CH2 도메인의 용융, Fc 단편의 CH3 도메인의 용융 및 Fab 단편의 용융과 관련이 있다(Ionescu, R. et al.(2008) J.Pharmaceut. Sci. 97(4): 1414-1426)(도 5 및 7).
DSC 분석 전에, 단백질은 슬라이드-A-라이저 카세트를 이용한 적당한 완충 시스템 내로 투석한다. 이 완충 시스템(10mM 인산염, 10mM 시트르산염)은 또한 DSC 측정의 참조/대조군으로 사용된다. 모 항체 및 DVD-Ig 분자는 모두 2mg/ml로 분석한다. 캐필러리 셀(Microcal) DSC 기구를 이용한 자동 VP-DSC를 이용한다. 분자의 언폴딩은 25℃ 내지 95℃ 온도 범위에서 1℃/분 스캔 속도로 연구했다. 다른 측정 파라미터는 다음과 같다: 피팅 기간: 16 sec, 예비스캔 대기시간: 10분, 피드백 모드: 없음.
실시예
1.4:
DVD
-
Ig
의 생성
2개의 항원에 결합할 수 있는 DVD-Ig 분자는 본 명세서에 기술된 바와 같이 선택한 2개의 모노클로날 모 항체(하나는 사람 항원 A에 대한 것이고, 다른 하나는 사람 항원 B에 대한 것이다)를 이용하여 작제했다.
실시예
1.4.1: 2개의 링커 길이를 가진
DVD
-
Ig
의 제조
ADCC/CDC 이펙터 기능을 없애기 위해 234 및 235에 돌연변이를 보유한 μ1 Fc를 함유하는 불변 영역을 사용했다. 4가지 다른 항-A/B DVD-Ig 작제물을 다음과 같이 제조했다: 각각 2가지 다른 도메인 배향, 즉 VA-VB-C 및 VB-VA-C를 갖는 짧은 링커를 보유한 2가지 및 긴 링커를 보유한 2가지(표 3 참조). 사람 Cl/Ck 또는 CH1 도메인의 N-말단 서열 유래의 링커 서열은 다음과 같다:
DVDAB 작제물의 경우:
경쇄(항-A가 λ를 보유한다면): 짧은 링커: QPKAAP(서열번호 15); 긴 링커: QPKAAPSVTLFPP(서열번호 16)
경쇄(항-A가 κ를 보유한다면): 짧은 링커: TVAAP(서열번호 13); 긴 링커: TVAAPSFIFPP(서열번호 14)
중쇄(γ1): 짧은 링커: ASTKGP(서열번호 21); 긴 링커: ASTKGPSVFPLAP(서열번호 22)
DVDBA 작제물의 경우:
경쇄(항-B가 λ를 보유한다면): 짧은 링커: QPKAAP(서열번호 15); 긴 링커: QPKAAPSVTLFPP(서열번호 16)
경쇄(항-B가 κ를 보유한다면): 짧은 링커: TVAAP(서열번호 13); 긴 링커: TVAAPSFIFPP(서열번호 14)
중쇄(γ1): 짧은 링커: ASTKGP(서열번호 21); 긴 링커: ASTKGPSVFPLAP(서열번호 22)
중쇄 및 경쇄 작제물은 pBOS 발현 벡터에 서브클로닝하고 COS 세포에서 발현시킨 뒤, 단백질 A 크로마토그래피로 정제했다. 정제된 물질은 SDS-PAGE 및 SEC 분석으로 처리했다.
표 3은 각 항-A/B DVD-Ig 단백질을 발현하는데 사용된 중쇄 및 경쇄 작제물을 설명한다.
실시예
1.4.2:
DVDABSL
및
DVDABLL
의
DNA
작제물의
분자
클로닝
중쇄 작제물 DVDABHC-LL 및 DVDABHC-SL을 제조하기 위해, A 항체의 VH 도메인을 특정 프라이머(3' 프라이머는 SL/LL 작제물을 위해 각각 짧은/긴 라이너(liner) 서열을 함유한다)을 이용해 PCR 증폭시키고; 반면 B 항체의 VH 도메인은 특정 프라이머(5' 프라이머는 SL/LL 작제물을 위해 짧은/긴 라이너 서열을 함유한다)를 이용하여 증폭시켰다. PCR 반응은 모두 표준 PCR 기술과 절차에 따라 수행했다. 두 PCR 산물은 겔 정제하고, 후속 중첩성 PCR 반응을 위한 중첩성 주형으로 함께 사용했다. 중첩성 PCR 산물은 Srf I 및 Sal I 이중 절단된 pBOS-hCγ1,z non-a 포유동물 발현 벡터(Abbott)에 표준 상동 재조합 시도를 이용해 서브클로닝했다.
경쇄 작제물 DVDABLC-LL 및 DVDABLC-SL을 제조하기 위해 A 항체의 VL 도메인을 특정 프라이머(3' 프라이머는 SL/LL 작제물을 위해 각각 짧은/긴 라이너 서열을 함유한다)을 이용해 PCR 증폭시키고; 반면 B 항체의 VL 도메인은 특정 프라이머(5' 프라이머는 SL/LL 작제물을 위해 짧은/긴 라이너 서열을 함유한다)를 이용하여 증폭시켰다. PCR 반응은 모두 표준 PCR 기술과 절차에 따라 수행했다. 두 PCR 산물은 겔 정제하고, 표준 PCR 조건을 이용하여 후속 중첩성 PCR 반응을 위한 중첩성 주형으로 함께 사용했다. 중첩성 PCR 산물은 Srf I 및 Not I 이중 절단된 pBOS-hCk 포유동물 발현 벡터(Abbott)에 표준 상동 재조합 시도를 이용해 서브클로닝했다. 유사한 시도를 이용하여 이하에 기술된 바와 같이 DVDBASL 및 DVDBALL을 제조했다:
실시예
1.4.3:
DVDBASL
및
DVDBALL
의
DNA
작제물의
분자
클로닝
중쇄 작제물 DVDBAHC-LL 및 DVDBAHC-SL을 제조하기 위해, 항체 B의 VH 도메인을 특정 프라이머(3' 프라이머는 SL/LL 작제물을 위해 각각 짧은/긴 라이너 서열을 함유한다)을 이용해 PCR 증폭시키고; 반면 A 항체의 VH 도메인은 특정 프라이머(5' 프라이머는 SL/LL 작제물을 위해 짧은/긴 라이너 서열을 함유한다)를 이용하여 증폭시켰다. 두 PCR 반응은 표준 PCR 기술과 절차에 따라 수행했다. 두 PCR 산물은 겔 정제하고, 표준 PCR 조건 하에 후속 중첩성 PCR 반응을 위한 중첩성 주형으로 함께 사용했다. 중첩성 PCR 산물은 Srf I 및 Sal I 이중 절단된 pBOS-hCγ1,z non-a 포유동물 발현 벡터(Abbott)에 표준 상동 재조합 시도를 이용해 서브클로닝했다.
경쇄 작제물 DVDBALC-LL 및 DVDBALC-SL을 제조하기 위해, 항체 B의 VL 도메인을 특정 프라이머(3' 프라이머는 SL/LL 작제물을 위해 각각 짧은/긴 라이너 서열을 함유한다)을 이용해 PCR 증폭시키고; 반면 A 항체의 VL 도메인은 특정 프라이머(5' 프라이머는 SL/LL 작제물을 위해 짧은/긴 라이너 서열을 함유한다)를 이용하여 증폭시켰다. PCR 반응은 모두 표준 PCR 기술과 절차에 따라 수행했다. 두 PCR 산물은 겔 정제하고, 표준 PCR 조건 하에 후속 중첩성 PCR 반응을 위한 중첩성 주형으로 함께 사용했다. 중첩성 PCR 산물은 Srf I 및 Not I 이중 절단된 pBOS-hCk 포유동물 발현 벡터(Abbott)에 표준 상동 재조합 시도를 이용해 서브클로닝했다.
실시예
1.4.4.:
DVD
-
Ig
벡터
작제물의
제조
DVD-Ig에 포함시키기 위한, 특정 항원 또는 이의 에피토프를 인식하는 특정 항체를 위한 모 항체 아미노산 서열은 전술한 바와 같이 하이브리도마를 제조해서 또는 공지의 항체 단백질 또는 핵산을 서열분석하여 수득할 수 있다. 또한, 공지된 서열은 문헌으로부터 수득할 수 있다. 서열은 표준 DNA 합성 또는 증폭 기술을 이용해 핵산을 합성하고, 세포에서 발현시키기 위해 표준 재조합 DNA 기술로 발현 벡터에 목적 항체 단편을 어셈블링하여 핵산을 합성하는데 사용될 수 있다.
예를 들어, 핵산 코돈은 아미노산 서열로부터 결정했고, 올리고뉴클레오타이드 DNA는 Blue Heron Biotechnology, Inc.(www.blueheronbio.com)(Bothell, WA USA)에서 합성했다. 이 올리고뉴클레오타이드들을 300-2,000 염기쌍 이본쇄 DNA 단편에 어셈블리하고, 플라스미드 벡터에 클로닝한 뒤, 서열 확인했다. 클로닝된 단편은 효소 과정을 이용해 완전한 유전자로 어셈블리하고 발현 벡터에 서브클로닝했다(7,306,914; 7,297,541; 7,279,159; 7,150,969; 20080115243; 20080102475; 20080081379; 20080075690; 20080063780; 20080050506; 20080038777; 20080022422; 20070289033; 20070287170; 20070254338; 20070243194; 20070225227; 20070207171; 20070150976; 20070135620; 20070128190; 20070104722; 20070092484; 20070037196; 20070028321; 20060172404; 20060162026; 20060153791; 20030215458; 20030157643 참조).
pHybE 벡터 그룹(미국 특허출원 일련번호 61/021,282)은 모 항체 및 DVD-Ig 클로닝에 사용했다. pJP183 유래의 V1; pHybE-hCg1,z,non-a V2는 야생형 불변 영역을 보유하는 항체 및 DVD 중쇄의 클로닝에 사용했다. pJP191 유래의 V2; pHybE-hCk V2는 카파 불변 영역을 보유하는 항체 및 DVD 경쇄의 클로닝에 사용했다. pJP192 유래의 V3; pHybE-hC1 V2는 람다 불변 영역을 보유하는 항체 및 DVD 경쇄의 클로닝에 사용했다. 람다 시그널 펩타이드 및 카파 불변 영역으로 제작된 V4는 람다-카파 하이브리드 V 도메인을 보유하는 DVD 경쇄의 클로닝에 사용했다. 카파 시그널 펩타이드 및 람다 불변 영역으로 제조된 V5는 카파-람다 하이브리드 V 도메인을 보유하는 DVD 경쇄의 클로닝에 사용했다. pJP183 유래의 V7; pHybE-hCg1,z,non-a V2는 (234,235 AA) 돌연변이 불변 영역을 보유하는 항체 및 DVD 중쇄의 클로닝에 사용했다.
표 4를 참조하여, 다수의 벡터를 모 항체 및 DVD-Ig VH 및 VL 쇄의 클로닝에 사용했다.
실시예
1.4.4.2: 293 세포에서의 형질감염 및 발현
DVD-Ig 벡터 작제물은 DVD-Ig 단백질을 생산하기 위한 293 세포에 형질감염시켰다. 사용된 293 일시적 형질감염 절차는 문헌(Durocher et al.(2002) Nucleic Acids Res. 30(2): E9 및 Pham et al.(2005) Biotech. Bioengineering 90(3): 332-44)에 공개된 방법의 변법이다. 형질감염에 사용된 시약으로는 다음을 포함했다:
· HEK 293-6E 세포(EBNA1을 안정하게 발현하는 사람 배아 신장 세포주; National Research Council Canada에서 입수), 가습 항온배양기 세트에서 일회용 에를렌마이어(Erlenmeyer) 플라스크에서 130rpm, 37℃ 및 5% CO2 하에 배양함.
· 배양 배지: FreeStyle 293 발현 배지(Invitrogen 12338-018) + 25 ㎍/ml 제네티신(G418)(Invitrogen 10131-027) 및 0.1% Pluronic F-68(Invitrogen 24040-032).
· 형질감염 배지: FreeStyle 293 발현 배지 + 10mM HEPES(Invitrogen 15630-080).
· 폴리에틸렌이민(PEI) 스톡: 1mg/ml 멸균 스톡 용액, pH 7.0, 선형 25kDa PEI(Polysciences)로 제조되고 -15℃ 이하에서 보관됨.
· 트립톤 공급물 배지: FreeStyle 293 발현 배지에 트립톤 N1의 5% w/v 멸균 스톡(Organotechnie, 19554).
형질감염용 세포 제조: 형질감염하기 약 2 내지 4시간 전에, HEK 293-6E 세포를 원심분리하여 수거하고, 배양 배지에 ml당 약 1백만 생세포의 세포 밀도로 재현탁시켰다. 각 형질감염을 위해, 세포 현탁액 40ml를 일회용 250ml 에를렌마이어 플라스크로 옮기고 2 내지 4시간 동안 항온배양했다.
형질감염: 형질감염 배지 및 PEI 스톡은 실온(RT)으로 예온시켰다. 각 형질감염을 위해, 플라스미드 DNA 25㎍ 및 폴리에틸렌이민(PEI) 50㎍을 형질감염 배지 5ml에서 배합하여 RT에서 15 내지 20분 동안 항온처리하여 DNA:PEI 복합체를 형성시켰다. BR3-Ig 형질감염을 위해, BR3-Ig 플라스미드 25㎍을 형질감염마다 사용했다. 각 5ml DNA:PEI 복합체 혼합물을 사전에 준비한 40ml 배양물에 첨가하고, 130 rpm, 37℃ 및 5% CO2 하의 가습 항온배양기로 복귀시켰다. 20 내지 28 시간 후, 트립톤 공급물 배지 5ml를 각 형질감염에 첨가하고, 배양을 6일 동안 계속했다.
실시예
1.4.5: A/B
DVD
-
Ig
의 특성규명 및 주요 선택
항-A/B DVD-Ig의 결합 친화성은 단백질 A 및 단백질 B에 대하여 Biacore에서 분석했다. DVD-Ig의 4가 성질은 Biacore에서 다중 결합 연구를 통해 조사했다. 반면, 단백질 A 및 단백질 B에 대한 DVD-Ig의 중화 효능은 본 명세서에 기술된 생물학적 정량으로 각각 평가했다. 초기 모 mAb의 친화성 및 효능을 가장 잘 유지하는 DVD-Ig 분자는 각 mAb마다 본 명세서에 기술된 심도있는 이화학적 및 생체분석학적(래트 PK) 특성규명을 위해 선택했다. 분석 수집물을 기초로 하여, 최종 주요 DVD-Ig을 CHO 안정한 세포주 개발로 진행시키고, CHO-유래 물질을 안정성, 약동학 및 사이노몰거스 원숭이에서의 효능 연구, 및 예비제형 활성에 이용했다.
실시예
2: 항-쥐
TNF
α/항-
PGE
2
이원 가변 도메인 면역글로불린(
DVD
-
Ig
)의
작제
, 발현 및 정제
쥐 TNFα 및 PGE2에 결합할 수 있는 DVD-Ig을 제조했다. 간략히 설명하면, 모 mAb는 2개의 높은 친화성 쥐 Ab, 항-TNFα(클론 8C11) 및 항-PGE2(클론 2B5-8.0)을 각각 포함한다. 항-TNFα 모노클로날 항체 클론 8C11 하이브리도마의 VL/VH 유전자는 마우스 Ig Primer Kit(Novagen, Madison, WI)를 이용하여 RT-PCR로 분리했다. 2B5-8.0의 VL/VH 단백질 서열은 실시예 1.2.4에 기술된 바와 같이 수득하고 DNA 서열로 변환시켰다. 두 가변 도메인 간에 각각 다른 링커가 경쇄(예, ADAAP) 및 중쇄(예, AKTTPP)에 사용되었다. 이러한 링커 서열은 쥐 Ck 및 CH1의 N-말단에서 선택된 것으로, 가변 도메인의 천연 연장 서열이고, 여러 Fab 결정 구조 분석을 기반으로 한 유의적인 2차 구조 없이 유연한 입체형태를 나타낸다. PCR 클로닝의 상세한 절차는 이하에 설명한다:
실시예
2.2.1: 쥐 링커를 보유한 쥐 항-쥐
TNF
α/항-
PGE
2
DVD
-
Ig
의 분자
클로닝
DVD-Ig 분자를 제조하는 방법은 미국 특허 공개번호 20070071675에 기술되어 있다. PGE2에 특이적인 다양한 재조합 항체의 VH 및 VL 영역의 아미노산 서열은 표 5에 제시했다. 오버래핑 PCR을 이용하여 마우스 링커(mNL)가 없거나, 쥐 짧은 링커(mSL) 또는 쥐 긴 링커(mLL)를 보유한 6개의 쥐 항-쥐 TNFα/항-PGE2 DVD-Ig 분자를 제조했고, VH 및 VL의 단백질 서열은 이하 표 6에 열거했다. DVD-Ig 분자의 VH를 암호화하는 DNA는 마우스 중쇄 IgG1 불변 영역에 융합시키고, DVD-Ig 분자의 VL을 암호화하는 DNA는 마우스 경쇄 k 불변 영역에 각각 융합시켰다. DVD-Ig 분자의 단백질 발현 및 정제는 실시예 1.3 및 미국 특허 공개번호 20070071675에 기술된 바와 거의 같다.
도 2는 직접 결합 ELISA에서 PGE2-비오틴에 대한 표 5의 항체의 결합을 나타낸 것이다. 도 3은 EP4 결합 분석에서 PGE2에 대한 세포 반응의 저해를 나타낸다.
실시예
2.2.2: 사람 링커를 보유한 쥐 항-쥐
TNF
α/항-
PGE
2
DVD
-
Ig
의 분자 클로닝
DVD-Ig 분자를 제조하는 방법은 미국 특허 공개번호 20070071675에 기술되어 있다. 오버래핑 PCR을 이용하여 사람 링커(hNL)가 없거나, 사람 짧은 링커(hSL) 또는 사람 긴 링커(hLL)를 보유한 6개의 쥐 항-쥐 TNFα/항-PGE2 DVD-Ig 분자를 제조했고, VH 및 VL의 단백질 서열은 이하 표 7에 열거했다. DVD-Ig 분자의 VH를 암호화하는 DNA는 사람 중쇄 IgG1 불변 영역에 융합시키고, DVD-Ig 분자의 VL을 암호화하는 DNA는 사람 경쇄 k 불변 영역에 각각 융합시켰다. DVD-Ig 분자의 단백질 발현 및 정제는 실시예 1.3 및 미국 특허 공개번호 20070071675에 기술된 바와 거의 같다.
실시예
2.2.3: 사람 링커를 보유한 쥐 항-쥐
TNF
α/항-
PGE
2
DVD
-
Ig
의 특성규명
실시예
2.2.3.1: 사람 링커를 보유한 항-쥐
TNF
α/항-
PGE
2
DVD
-
Ig
분자의 PGE
2
결합
활성을 동정하는 분석
사람 링커를 보유한 항-쥐 TNFα/항-PGE2 DVD-Ig의 PGE2 결합 활성을 동정 및 특성규명하는데 사용된 분석, 예컨대 3H-PGE2 ELISA는 다른 언급이 없는 한 실시예 1에 기술된 바와 같다. 2B5-8.0, 2B5-huSL-8C11 및 2B5-hLL-8C11과 PGE2의 KD 값은 각각 334, 238, 383 pM이었다.
실시예
2.2.3.2: 사람 링커를 보유한 항-쥐
TNF
α/항-
PGE
2
DVD
-
Ig
분자의 항-
PGE
2
중화 활성을 동정하는 분석
사람 링커를 보유한 항-쥐 TNFα/항-PGE2 DVD-Ig의 PGE2 중화 활성을 동정 및 특성규명하는데 사용된 분석, 예컨대 EP4 분석은 다른 언급이 없는 한 실시예 1에 기술된 바와 같다. 2B5-8.0, 2B5-huSL-8C11 및 2B5-hLL-8C11은 각각 20, 20, 64 pM의 IC50 값으로 PGE2를 중화시켰다.
실시예
2.2.3.3: 사람 링커를 보유한 마우스
TNF
α/항-
PGE
2
DVD
-
Ig
분자의 항-
TNF
α 결합 활성을 동정하는 분석
사람 링커를 보유한 항-쥐 TNFα/항-PGE2 DVD-Ig의 TNFα 결합 활성을 동정 및 특성규명하는데 사용된 분석, 예컨대 ELISA는 다른 언급이 없는 한 실시예 1에 기술된 바와 같다. 8C11, 2B5-huSL-8C11 및 2B5-hLL-8C11은 각각 201, 234, 256 pM의 IC50 값으로 PGE2를 중화시켰다.
실시예
2.2.3.4: 사람 링커를 보유한 쥐
TNF
α/항-
PGE
2
DVD
-
Ig
분자의 항-
TNF
α 중화 활성을 동정하는 분석
사람 링커를 보유한 항-쥐 TNFα/항-PGE2 DVD-Ig의 TNFα 중화 활성을 동정 및 특성규명하는데 사용된 분석, 예컨대 L929 분석은 다른 언급이 없는 한 실시예 1에 기술된 바와 같다. 8C11, 2B5-huSL-8C11 및 2B5-hLL-8C11은 각각 5852, 4389 및 88 pM의 IC50 값으로 PGE2를 중화시켰다. 2B5-hLL-8C11이 쥐 TNFα를 중화하는 활성이 훨씬 더 강력한 정확한 이유는 불분명하지만, 쥐 TNFα와 DVD-Ig 분자의 복합체 형성의 속도론 및 크기와 관련이 있을 수 있다.
실시예
2.3: 항-사람
TNF
α/항-
PGE
2
DVD
-
Ig
분자의
작제
및 특성규명
이원 가변 도메인 면역글로불린(DVD-Ig) 분자는 2개의 다른 모 mAb 유래의 2개의 다른 경쇄 가변 도메인이 직접 또는 짧은 링커를 통해 재조합 DNA 기술에 의해 일렬로 결합되고 그 다음 경쇄 불변 도메인이 결합되도록 설계했다. 이와 마찬가지로, 중쇄는 미국 특허 공개번호 2070071675에 개시된 방법을 이용하여 일렬로 결합된 2개의 다른 중쇄 가변 도메인(VH)과 그 다음 불변 도메인 CH1 및 Fc 영역을 포함한다. 사람 DVD-Ig 분자의 불변 영역은 사람 IgG1, IgG2, IgG3, IgG4일 수 있다.
사람 항-TNFα, D2E7 및 HU2B5.7을 빌딩 블록으로 이용하여, 4개의 항-TNFα/PGE2 DVD-Ig 분자를 작제했다: 두 변형체는 TNFα- 또는 PGE2-결합 도메인을 N-말단에 보유하고 각각 두 항원 결합 도메인의 중쇄 및 경쇄를 가교하기 위해 짧은(SL) 또는 긴(LL) 링커를 보유한다.
사람 TNFα 및 PGE2에 결합할 수 있는 DVD-Ig을 제조하는데 사용된 두 모 항체의 VH 및 VL 도메인은 표 8에 정리했다. 간략히 설명하면, 모 mAb는 2개의 고 친화성 쥐 Ab, 항-사람 TNFα(D2E7) 및 사람화된 항-PGE2(HU2B5.7)를 각각 포함한다. 항-TNFα 모노클로날 항체 D2E7의 VL/VH 유전자는 미국 특허 6,258,562에 기술된 바와 같이 D2E7의 DNA 서열을 암호화하는 플라스미드로부터 PCR로 증폭시켰다. HU2B5.7의 VL/VH 유전자는 실시예 2.3에 예시된 바와 같이 HU2B5.7의 DNA 서열을 암호화하는 플라스미드로부터 수득했다. 모든 DVD2-Ig 분자는 경쇄 및 중쇄 모두에서 2개의 가변 도메인 사이에 링커를 보유하는 것을 제외하고는 유사하게 작제되었다. 이러한 링커 서열은 사람 Ck 및 CH1의 N-말단에서 선택된 것으로, 가변 도메인의 천연 연장 서열이고 여러 Fab 결정 구조 분석을 기반으로 할 때 뚜렷한 2차 구조 없이 유연한 입체형태를 나타낸다. PCR 클로닝의 상세한 절차는 이하에 설명한다:
실시예
2.3.1: 사람 항-사람
TNF
α/항-
PGE
2
DVD
-
Ig
의 분자
클로닝
DVD-Ig 분자의 일반적인 작제는 미국 특허 공개번호 20070071675에 기술되어 있다. 오버래핑 PCR을 이용하여 사람 짧은 링커(SL) 및 사람 긴 링커(LL)를 보유한 4개의 사람 항-사람 TNFα/항-PGE2 DVD-Ig 분자를 제조했고, VH 및 VL의 단백질 서열은 이하 표 8에 열거했다. DVD-Ig 분자의 VH를 암호화하는 DNA는 사람 중쇄 IgG1 불변 영역에 융합시키고, DVD-Ig 분자의 VL을 암호화하는 DNA는 사람 경쇄 k 불변 영역에 각각 융합시켰다. DVD-Ig 분자의 단백질 발현 및 정제는 실시예 1.3 및 미국 특허 공개번호 20070071675에 기술된 바와 거의 같다.
실시예
2.3.2: 항-사람
TNF
α/항-
PGE
2
DVD
-
Ig
분자를 특성규명하는 분석
항-사람 TNFα/항-PGE2 DVD-Ig 분자를 동정 및 특성규명하는데 사용되는 분석, 예컨대 ELISA, 경쟁 ELISA, 3H-PGE2 ELISA 및/또는 3H-PGE2 경쟁 ELISA, 수용체 차단 분석은 다른 언급이 없는 한 실시예 1.1에 기술된 것이다.
PGE2에 대한 친화성은 3H-PGE2 ELISA로 측정했다. D2E7-SL-Hu2B5.7, D2E7-LL-Hu2B5.7 및 Hu2B5.7-SL-D2E7-SL 분자는 PGE2에 대해 비슷한 결합 친화성을 유지했다(표 10).
항-TNFα/PGE2 DVD-Ig 분자의 프로스타글란딘 결합 특이성은 3H-PGE2 경쟁 ELISA를 이용하여 평가했고, 표 11에 정리했다.
실시예
2.3.3: 사람
TNF
α/항-
PGE2
DVD
-
Ig
분자의 항-
PGE2
활성의 기능적 활성
항-사람 TNFα/항-PGE2 DVD-Ig 분자의 기능적 활성을 특성규명하는데 사용된 분석, 예컨대 EP4 생물학적 정량은 다른 언급이 없는 한 실시예 1.1에 기술된 것이다. 총 4개의 DVD-Ig 분자는 PGE2에 대해 세포 분석에서 비슷한 결합 중화능을 유지했다(표 10).
실시예
2.3.4: 항-사람
TNF
α/항-
PGE2
DVD
-
Ig
분자의
TNF
α에 대한 친화성
항-사람 TNFα/항-PGE2 DVD-Ig 분자의 항-TNF 활성을 동정 및 특성규명하는데 사용되는 분석법, 예컨대 ELISA 및 BIAcore 분석법은 다른 언급이 없는 한 실시예 1.1에 기술된 것과 거의 동일하다. DVD-Ig 분자, 즉 N-말단에 D2E7을 보유한 D2E7-SL-HU2B5.7 및 D2E7-LL-HU2B5.7은 비슷한 TNFα 결합 친화성을 유지하는 반면, C-말단에 D2E7을 보유하는 HU2B5.7-SL-D2E7 및 HU2B5.7-LL-D2E7은 현저히 감소된 TNFα 결합 친화성을 나타낸다(표 10).
다양한 종 유래의 TNFα에 대한 D2E7-SL-Hu2B5.7의 TNFα 결합 속도론은 표 12에 정리했다.
실시예
2.3.5: 항-
TNF
α 항체의 기능적 활성 및 항-
TNF
α/항-
PGE2
DVD
-
Ig
분자의 항-
TNF
α 활성
항-사람 TNFα/항-PGE2 DVD-Ig 분자의 기능적 항-사람 TNFα 활성을 특성규명하는데 사용한 L929 분석법은 다른 언급이 없는 한 실시예 1.1.2.C에 기술된 것과 거의 동일하다. DVD-Ig 분자, 즉 N-말단에 D2E7을 보유한 D2E7-SL-HU2B5.7 및 D2E7-LL-HU2B5.7은 비슷한 TNFα 중화 활성을 유지하는 반면, C-말단에 D2E7을 보유하는 HU2B5.7-SL-D2E7 및 HU2B5.7-LL-D2E7은 현저히 감소된 TNFα 중화 활성을 나타낸다(표 10).
다양한 종 유래의 TNFα에 대한 D2E7-SL-Hu2B5.7의 TNFα 중화 활성은 표 12에 정리했다.
실시예
2.3.6: 항-
TNF
α/항-
PGE2
DVD
-
Ig
분자의 항원 결합의 상호 방해
D2E7-SL-HU2B5.7이 TNFα 및 PGE2를 동시에 중화할 수 있는지를 결정하기 위해, D2E7-SL-HU2B5.7은 먼저 한 항원으로 사전포화시키고, 그 다음 제2 항원의 중화에 대해 검사했다. D2E7-SL-HU2B5.7은 TNFα에 사전결합된 경우에도 EP4 분석에서 PGE2에 대한 중화 효능의 임의의 감소를 나타내지 않았고, PGE2에 사전결합된 경우에도 L929 분석에서 TNFα에 대한 중화 효능의 임의의 감소를 나타내지 않았다.
실시예
2.3.7:
EP3
수용체 경쟁 저해 분석
항-사람 TNFα/항-PGE2 DVD-Ig 분자의 항-사람 항-PGE2 활성의 기능적 활성을 특성규명하는데 사용한 EP3 수용체 경쟁 저해 분석은 다른 언급이 없는 한 실시예 1에 기술된 바와 같다. D2E7-SL-HU2B5.7이 EP 수용체에 대한 3H-PGE2 결합을 차단하는데 IC50 값은 70-120 pM 범위였다.
실시예
2.3.8: 사람
사이토킨
교차반응성
D2E7-SL-HU2B5.7의 사이토킨 선택성은 실시예 1에 기술된 바와 같이 ELISA로 평가했다. 26가지 용해성 사람 사이토킨의 패널은 고정화된 비오틴화된 TNFα에 대한 결합에 있어서 D2E7-SL-HU2B5.7과의 경쟁성에 대해 검사했다. 특이적 경쟁 결합은 TNFα와만 일어났고, 다른 사이토킨들은 비오틴화된 TNFα에 대한 결합에 있어서 D2E7-SL-HU2B5.7과 경쟁성을 나타내지 않았다. 이 데이터는 D2E7-SL-HU2B5.7이 TNFα에 매우 특이적이라는 것을 시사한다.
실시예
2.3.9: 사람 혈액과
D2E7
-
SL
-
HU2B5
.7의 항온처리
사람 혈액 세포와 D2E7-Hu-2B5.7의 상호작용은 실시예 1에 기술된 바와 같이 사이토킨 방출 및 세포 표면 결합을 결정하는 분석으로 조사했다. 이 분석은 D2E7-Hu-2B5.7이 염증 세포의 활성화를 유발하는지, 또는 혈액 내의 의도치 않은 세포 표면 단백질에 결합하는지를 평가하는데 도움이 된다. CHO 세포-유래의 D2E7-Hu-2B5.7과 사람 말초 혈액 세포의 항온처리는 임의의 사이토킨 방출을 임의의 대조군 값 이상으로 유도하지 않았고, 이는 염증 세포의 활성화를 유발하지 않는다는 것을 시사한다.
실시예
2.3.10:
카라기난
-유도된 발바닥 부종 모델에서 사람
TNF
α/항-
PGE
2
DVD
-
Ig
분자의 항-
PGE
2
활성의
생체내
효능
카라기난-유도 발바닥 부종은 선천적 면역 기능의 급성 설치류 모델이다. 염증 인자의 피부내(ID) 주사는 호중구의 고속 유입 및 유체 부종(약 4시간째 최고점)을 유발하고, 그 다음 대식세포 및 단핵구의 유입(약 48시간째 최고점)을 유발한다. C57.BL/6 마우스(8 내지 10주령, Jackson Laboratories, Bar Harbor, ME)는 뒷발 발바닥에 ID로 PBS(왼쪽) 또는 PBS 중에 5.0mg/ml(150 ㎍/마우스) 농도의 λ-카라기난(Sigma Aldrich, St.Louis, MO)(오른쪽)을 30 ㎕씩 주사맞았다. 뒷발 발바닥 두께는 기준선(시간=0) 및 카라기난 항원공격 후 4시간째 Dyer 스프링 캘리퍼 모델 #310-119로 측정했다. 스튜던트 양측 t-검정에서 비히클에 대한 각 처리 그룹의 평균 발 종창을 비교하여 측정했다.
마우스는 카라기난 항원공격하기 18시간 전에 사람 항-TNFα/PGE2 DVD-Ig 분자 D2E7-SL-Hu2B5.7 또는 항-PGE2 항체(2B5-8.0)의 용량 적정, 또는 항원 공격 2시간 전에 PO로 인도메타신의 용량 적정을 받았다. 측정된 종점은 치료 4시간 후 오른쪽 및 왼쪽 발 사이에 발 종창(부종)의 차이였다. 항-PGE2 항체는 용량 의존적으로 발 종창을 억제했고, 인도메타신에 의해 달성되는 최대 억제율과 비슷하게 10mg/kg에서 최대 40 내지 50%의 발 부종 억제를 제공했다. D2E7-SL-Hu2B5.7을 이용한 2가지 독립 실험은 매우 유사한 억제를 입증했다. 최대 억제(10mg/kg에서)를 제공한 D2E7-SL-Hu2B5.7의 혈청 농도는 용량투여 후 22시간째 약 50㎍/ml였고, 이 수준은 항-PGE2 mAb에서 관찰되는 것과 유사했다. 이 결과는 D2E7-SL-Hu2B5.7 DVD-Ig의 항-PGE2 결합 도메인이 생체내에서 완전하게 기능적이라는 것을 시사했다(표 13).
실시예
2.3.11: 사람
TNF
α/항-
PGE
2
DVD
-
Ig
분자는
LPS
-D-
갈락토사민
-유도 치명성을 구제한다.
D2E7-SL-Hu2B5.7은 멸균 식염수(Baxter lot C755694)에 제조하고, LPS 항원공격하기 18시간 전에 암컷 C57BL6/N 마우스(n=10)(8 내지 10주령, Jackson Laboratories, Bar Harbor, ME)에게 100, 30, 10, 3, 1mg/kg씩 i.p.로 주사했다. 식염수만은 음성 대조군으로 사용했다. 다른 그룹은 양성 대조군으로 항-마우스 TNF 모노클로날 항체 8C11-1E10 mg/kg을 투여받았다.
항원공격 시에, 마우스는 100ng/마우스 LPS(Sigma L4130, lot 095K4056, St.Louis, MO) 및 20mg/마우스 D-갈락토사민(Sigma G-0500, lot 048K1547, St.Louis, MO)을 함유하는 식염수 500 ㎕ 용량 용적을 i.p.로 주사맞았다. 그 다음, 마우스는 48시간 동안 1일 2회씩 치명성에 대해 모니터했다. 48시간째, 나머지 생존 마우스는 희생시키고 혈장 항체 수준을 위해 채혈했다.
결과는 표 14에 제시했다. 100mg/kg의 D2E7-SL-Hu2B5.7은 90%의 마우스를 치명성으로부터 보호했다. 보호는 307.7±26.1 ㎍/ml의 평균(평균 ± SD) 노출 시에 달성되었다. 다른 용량 그룹은 모두 보호를 거의 또는 전혀 제공하지 않았다. 12mg/kg의 마우스 항-마우스 항-TNF-항체(8C11-1E10)는 양성 대조군으로 사용했고, LPS/D-gal-유도 치명성으로부터 100% 보호를 제공했다. 8C11 항체에 의한 이러한 효능은 65 ± 4.0 ㎍/ml의 평균(평균±SD) 노출에서 달성되었다.
실시예
2.3.12: 사람
TNF
α
유전자변이
유도 관절염 모델에서 사람
TNF
α/항-PGE2
DVD
-
Ig
분자가 나타내는 항-사람
TNF
α 활성의
생체내
효능
실시예
2.2.12.1: 사람
TNF
α
유전자변이
유도된 관절염 모델
4주령 사람 TNFα 유전자변이 B6.Cg(SJL)-Tg(TNF)N21+ 마우스(수컷 40마리 및 암컷 40마리)(Taconic, Hudson, NY)는 마우스 8마리(수컷 4마리 및 암컷 4마리/그룹)로 이루어진 10개 그룹으로 나누었다. 5주령부터 12주령까지 매주 마우스의 뒷발 발목 관절의 형태를 평가하고 관절염의 징후 및 증상에 대해 점수를 매겼다. 관절염 점수는 다음과 같은 평가했다:
0 = 관절염 없음(정상 외관 및 굽힘)
1 = 미세한 관절염(관절 비틀림)
2 = 중간 관절염(종창, 관절 변형); 및
3 = 중증 관절염(굽힘 시에 검출되는 관절강직 및 심한 운동 부전)
동물은 증상의 첫 징후를 나타내는 9주째 모든 그룹에서 대략 유사한 평균 관절염 점수(MAS)를 나타내는 것으로 무작위 선발했다. 그 다음, 동물은 10주령째부터 12주령까지 매주 2회씩 i.p.로 처리했다. 미처리 대조군으로 삼은 그룹 1의 마우스에게는 PBS를 투여했다. 그룹 2와 3의 동물에게는 각각 30mg/kg 및 10mg/kg의 항-TNFα(D2E7) mAb 처리를 실시하고, 그룹 4 및 5의 동물에게는 각각 30mg/kg 및 10mg/kg의 항-PGE2(2B5-8.0) mAb 처리를 실시했다. 그룹 6 및 7의 동물은 각각 30mg/kg 및 10mg/kg씩 항-TNFα(D2E7) 및 항-PGE2(2B5-8.0) mAb로 처리했다. 그룹 8, 9 및 10 동물은 각각 40, 13.3 및 4mg/kg의 D2E7-SL-Hu2B5.7 DVD-Ig으로 처리했다. 도 4는 2B5-8.0, D2E7 또는 2B5-8.0과 D2E7의 배합물로 처리한 동물의 평균 관절염 점수를 나타낸다.
실시예
2.3.12.2: 사람
TNF
α
유전자변이
유도된 관절염 모델에서의
생체내
효능
다중 기전에 의해 유도되는 질환인 콜라겐-유도 관절염 모델과 달리, 사람 TNFα 유전자변이 마우스 모델에서의 질환은 사람 TNFα의 과발현에 의해 주로 유도된다. 질환의 증상은 일반적으로 9주령 내지 10주령째 분명하고 20주령이 되어 완전하게 발달한다. 이 마우스들을 10주와 12주 사이에 매주 2회씩 동등 용량의 D2E7-SL-Hu2B5.7, D2E7 또는 항-PGE2 mAb 2B5-8.0으로 치료했다. 9주부터 매주 질환의 점수를 매기고 평균 관절염 점수의 AUC 억제율로 나타냈다. D2E7-SL-Hu2B5.7은 3mg/kg(30%) 및 10mg/kg(63%) 그룹에서 용량 의존적 방식으로 관절염을 감소시켰다. 10mg/kg(63%) 및 30mg/kg(60%) 등가 용량에서 달성되는 최대 효능은 30mg/kg에서 항-사람 TNFα mAb D2E7의 최대 효능(59%)과 비슷했다. 이 모델에서는 2B5-8.0에 의한 PGE2 차단으로부터 질병 진행에 미치는 효과는 크게 없었고, 그 이유는 이 모델에서의 관절염이 주로 사람 TNFα에 의해 유도되기 때문이다. 전체적으로, 이러한 결과들은 항-TNFα 결합 도메인의 생체내 활성을 입증했다.
실시예
2.3.13:
D2E7
-
SL
-
hu2B5
.7-
DVD
-
Ig
의 약동학 분석
D2E7-SL-Hu2B5.7-DVD-Ig의 약동학 연구는 스프라그 돌리 래트 및 사이노몰거스 원숭이에서 수행했다. 수컷 및 암컷 래트에게는 D2E7-SL-Hu2B5.7-DVD-Ig을 4mg/kg(래트) 또는 5mg/kg(원숭이)씩 1회 용량으로 정맥내 또는 피하 주사하고, 항원 포획을 기반으로 한 화학발광 MSD(Meso Scale Discovery) 방법을 이용하여 혈청 시료를 분석했다. 약동학 파라미터는 WinNonlin을 이용한 비-구획 분석으로 계산했다.
실시예
2.3.13.1:
PK
혈청 시료에서
D2E7
-
SL
-
hu2B5
.7-
DVD
-
Ig
을 정량분석에 사용한 분석법
다음 MSD 분석은 래트에서 DVD-Ig 농도를 측정하는데 사용했다. MSD 스트렙트아비딘 평판(Meso Scale Discovery)은 0.05% Tween-20을 함유하는 인산염 완충 식염수(10X PBS로 희석한 것, Abbott Bioresearch Center, Media Room, Worcester, MA 및 Tween-20, Sigma, St.Louis, MO)로 세척했다. 평판은 250 ㎕/웰 차단 용액(MSD Block, Meso Scale Discovery, PBS에 3% 최종 농도로 희석한 것)으로 1시간 동안 차단하고, 덮개를 덮어서 실온에서 진탕(600 rpm) 처리했다.
분석 전에, 래트 시료는 얼음 상에서 해동시키고, 부드럽게 혼합하고, 에펜도르프 원심분리기에서 14,000 rpm으로 4℃에서 3분 동안 원심분리했다. 표준 곡선 및 대조 시료는 래트 혈청으로 준비했다. 연구 시료, 표준 곡선 시료, 블랭크 및 품질 대조 시료는 다른 2ml 깊이의 96웰 평판(Corning, Corning, NY)에서 비오틴화된 TNFα(A-923884.0 Lot no. 1346920, Abbott Bioresearch Center Biologics Pharmacy, Worcester, MA; 분석 완충액 중에 0.1 ㎍/ml) 및 설포-태그화된 염소 항-사람 IgG(Meso Scale Discovery, 분석 완충액 중에 1 ㎍/ml)과 1:1:1 = V:V:V 비율로 실온에서 1시간 동안 용액 중에서 항온처리했다. 그 다음, 시료는 MSD 평판으로 옮기고 실온에서 1시간 더 진탕(600rpm) 하에 항온처리했다. MSD 평판은 세척하고 2x Read 완충액(Meso Scale Discovery)으로 발색시켰다. 화학발광은 MSD Sector Imager 6000 상에서 10분 내에 측정했다.
표준 곡선은 4개-파라미터 로지스틱 핏을 이용하여 분석하고 시료 농도는 XLfit4 소프트웨어 버전 2.2.1 Build 16(Microsoft Corporation, Redmond, WA)으로 계산했다. 약동학 파라미터는 각 동물마다 Winonlin 소프트웨어 버전 5.0.1(Pharsight Corporation, Mountain View, CA)을 이용하여 비구획 분석으로 계산했다(표 15).
실시예
2.3.13.2:
SD
래트에서
수행된 약동학 연구
외과적으로 변경된(목정맥 캐뉼라삽입된, JVC) 및 보통 수컷 및 암컷 스프라그-돌리 래트(약 7주됨, 체중 240-390g)는 찰스 리버 레보러토리스(Wilmington, MA)에서 구입했다. 동물들은 12시간 주/야 사이클 하에 일정한 온도와 습도가 유지되는 방에 가두고 정상 설치류 사료를 공급하고 음식과 물은 마음대로 먹게 했다. 동물의 수분공급 및 임상 상태는 매일 모니터했다.
혈액 시료는 다양한 시점에 수집하고(래트로부터 0.2ml 및 원숭이로부터 0.5ml), 실온에서 30분 동안 응고시키고, 13,200 rpm에서 8분 동안 원심분리하고, 혈청은 에펜도르프 튜브로 옮기고 -80℃에서 동결하여 보관했다.
래트에게 정맥내 투여한 후, D2E7-SL-2B5.7 DVD-Ig은 항체 전형적인 이-지수 붕괴를 나타냈다. D2E7-SL-2B5.7 DVD-Ig 제거율 및 분포 용적은 낮았고, 다른 치료용 사람 모노클로날 항체와 비슷한 10일의 긴 반감기를 나타냈다. 래트에게 피하 투여한 후, 흡수는 느렸고, 약 25 내지 31 ㎍/ml의 높은 Cmax가 3일이 지나서 도달했다. ADA 없는 동물에서 반감기는 길었고(T1/2 약 12일), 생체이용률은 높았다(F: 87-98%)(표 15).
실시예
2.4: 항-
TNF
α/항-
PGE
2
DVD
-
Ig
의 생리화학적 분석
실시예
2.4.1: 크기 배제 크로마토그래피
D2E7-SL-Hu2B5.7-DVD-Ig 시료는 PBS로 1mg/ml로 희석하고, TSK 겔 G3000 SWXL 컬럼(Tosoh Bioscience, cat# 08541)을 구비한 시마즈 HPLC 시스템 상에 20 ㎕를 주입했다. 시료는 컬럼으로부터 100m 황산나트륨, 100mM 인산나트륨, 1mM 아지화나트륨, pH 6.8로 0.5ml/분의 유속으로 용출시켰다. HPLC 시스템 작동 조건은 다음과 같다:
이동상: 100mM 인산나트륨, 100m 황산나트륨, 1mM 아지화나트륨, pH 6.8,
구배: 등용매
유속: 0.5ml/분
검출기 파장: 280nm
자동샘플러 냉각기 온도: 4℃
컬럼 오븐 온도: 상온
실행 시간: 30분
주 피크는 약 16분 정도에 용출되었다. 약 13분째 용출된 피크는 응집물과 관련이 있었다. 단량체 피크는 99.7%였고, 응집물 피크는 0.3%였다.
실시예
2.4.2.B:
SDS
-
PAGE
D2E7-SL-Hu2B5.7 DVD-Ig 시료는 환원 및 비환원 조건 하에서 나트륨 도데실 설페이트-폴리아크릴아미드 겔 전기영동(SDS-PGAE)로 분석했다. 환원 조건을 위해, 시료는 200mM DTT를 보유한 2X Tris-Glycine SDS 시료 완충액(Invitrogen, cat# LC2676)과 1:1로 혼합했고, 70℃로 15분 동안 가열했다. 비환원 조건에서는, 시료는 2X Tris-Glycine SDS 시료 완충액과 1:1로 혼합하고 75℃에서 15분 동안 가열했다. 환원 및 비환원 시료는 모두 8%-16% 예비주조된 Tris-Glycine 겔(Invitrogen, cat# EC6045box) 상에 로딩했다. Mark 12 미염색 표준물(Invitrogen, cat#LC5677)은 분자량 마커로 사용했다. 겔은 XCell SureLock 미니 셀 겔 박스(Invitrogen, cat# EI0001)에서 진행시키고 단백질은 염료 전방이 겔 바닥에 도달할 때까지 125 v의 전압을 가해 분리했다. 사용한 진행 완충액은 10X 트리스-글리신 SDS 완충액(ABC, MPS-79-080106)으로 제조한 1X 트리스-글리신 SDS 완충액이었다. 겔은 콜로이드성 청색 염료(Invitrogen cat# 46-7015, 46-7016)로 밤새 염색하고 배경이 투명해질 때가지 Milli-Q 물로 탈색했다. 염색된 겔은 그 다음 플랫베드(flatbed) 농도계(Bio-Rad, cat# GS-800)로 스캐닝했다.
비환원 조건 하에서는 D2E7-SL-Hu2B5.7 DVD-Ig의 예상 분자량(약 200 kDa)과 일치하는 하나의 주요 밴드가 관찰되었다. 이 주요 밴드는 일반 IgG1보다 높은 위치로 이동했고, 이것은 E7-SL-Hu2B5.7 DVD-Ig의 추가 도메인과 일치했다. 환원 조건 하에서는 중쇄(62.5kDa) 및 경쇄(37.5kDa)의 예상 분자량과 일치하는 2개의 주요 밴드가 각각 관찰되었다.
실시예
2.4.3: 침강 속도 분석
D2E7-SL-Hu2B5.7 DVD-Ig 시료는 PBS에 대하여 밤새 투석했다. 시료는 분석용 원심분리기의 1.2cm 행로 길이의 셀에서 280nm에서의 대략적인 흡광도 값이 1.0이 되도록 PBS에 희석했다. 이러한 희석은 약 0.5mg/ml의 최종 농도를 초래했다. PBS는 대조 셀에 사용했다. 용액 밀도, 점도 및 v-bar 값은 SEDINTERP(v1.09)를 이용하여 계산했다. 각 DVD-Ig 시료는 독립적으로 분석하고 각 시료마다 3개의 동일한 반복물을 가지고 실험했다. 시료 용액 및 대조 블랭크는 1.2cm 광행로 길이, 사파이어 창 및 카본 에폰 중심부를 보유한 표준 2-섹터 셀에 로딩했다. 모든 시료는 벡크만 프로테옴랩 XL-1 분석용 초원심분리기(serial # PL106C01)에서 4-홀(AN-60 Ti) 로터를 이용하여 동시에 조사했다.
진행 조건은 프로그래밍하고, 원심분리 대조군은 ProteomeLab(v5.6)을 이용하여 수행했다. 흡광 데이터는 분석에 사용했다.
시료 및 로터는 실험을 시작하기 전에 2시간 이상 동안 열적 평형화시켰다(20.0±0.1℃). 적당한 셀 로딩의 확인은 3000 rpm에서 수행하고, 각 셀마다 1회 스캔을 기록했다. 침강 속도 조건은 다음과 같다:
시료 셀 용적: 420 ㎕
참조 셀 용적: 420 ㎕
온도: 20℃
로터 속도: 35,000 rpm
시간: 8:00 시간
UV 파장: 280 nm
방사형 단계 크기: 0.003cm
데이터 수집: 시그널 평균화없이 단계마다 1 데이터 점.
총 스캔 수: 100
침강 속도 분석 초원심분리 결과, D2E7-SL-Hu2B5.7-DVD-Ig이 용액에서 주로 단량체(99.58%)이고 소량이 응집물인 것으로 나타난다. 단량체의 침강 계수(7.5 S)는 종래 사람 IgG1 분자에서 측정되는 전형적인 값인 6-6.5S보다 컸다. 이와 같이 D2E7-SL-Hu2B5.7 DVD-Ig에서 측정된 큰 침강 계수는 이원 가변성 도메인으로부터 초래되는 큰 수력학적 크기의 결과이다. 또한, 마찰 비(1.64)는 일반적으로 재조합 사람화된 IgG에서 관찰되는 것보다 컸다. 대부분의 항체는 마찰비가 1.4 내지 1.5이다.
실시예
2.4.4:
SDS
-
CE
D2E7-SL-Hu2B5.7 DVD-Ig의 비환원 및 환원 SDS-CE가 수득되었다. D2E7-SL-Hu2B5.7 DVD-Ig 시료는 Milli-Q 물로 2mg/ml로 희석하고 SDS-CE 시료 완충액과 1:1로 혼합했다. 비환원 시료에는 단백질 시료의 1/10 용적의 0.5M 요오도아세트아미드(Sigma A3221-1VL)를 첨가했다. 환원 시료에는 대신에 1/10 단백질 용적의 β-머캅토에탄올(Sigma M-7154)을 첨가했다. 시료는 볼텍싱하고 70℃ 수조로 옮겼다. 시료는 15분 동안 항온처리한 후, 실온의 수조로 이동시켰다. 시료 바이엘은 저속 순간 원심분리시키고 볼텍싱하여 바닥에 시료 액체를 수집했다. 시료는 PCR 바이엘로 옮기고 분석용 바이엘 랙에 적재했다. SDS-CE 분석을 위해 ProteomeLab PA800 캐필러리 전기영동 시스템(Beckman Coulter) 및 미코팅된 노출 융합된-실리카 캐필러리(Beckman Coulter, P/N 10663의 일부)를 이용했다.
비환원 SDS-CE는 완전한 D2E7-SL-Hu2B5.7 DVD-Ig과 일치하는 주 피크를 나타냈다. 이 주 피크의 피크 면적 백분율은 95.3%였다. 이 주 피크보다 빨리 이동하는 부(minor) 피크도 있었다. 이 부 피크는 DVD-Ig 분자의 단편일 가능성이 있고, 이 중 일부는 시료 제조 동안의 열 처리에 의해 유발된 것이다. 환원 SDS-CE는 각각 경쇄(36.1%) 및 중쇄(60.8%)에 해당하는 2개의 주 피크를 나타냈다. 중쇄 피크(0.5%) 후에 이동하는 부 피크는 불완전 환원으로 인한 것일 가능성이 크다. 또한, 환원 SDS-CE는 중쇄 피크 앞에 작은 피크(2.2%)도 보여주었다. 이 피크는 비-글리코실화된 중쇄와 관련이 있다.
실시예
2.4.5: 동적
광산란
D2E7-SL-Hu2B5.7 DVD-Ig 시료 및 2개의 모 분자 D2E7 및 Hu2B5.7은 PBS(GIBCO 20012)로 2mg/ml로 희석했다. 시료는 DynaPro-801 동적 광산란 시스템으로 측정하기 전에 10분 동안 10,000 RPM으로 원심분리했다. D2E7-SL-Hu2B5.7 DVD-Ig의 수력학적 반경은 6.43nm였다. D2E7 및 Hu2B5.7의 평균 수력학적 반경은 각각 5.46nm 및 5.36nm였다. 이 결과는 D2E7-SL-Hu2B5.7 DVD-Ig이 두 모 분자의 수력학적 반경보다 큰 수력학적 반경을 보유하며, 이는 D2E7-SL-Hu2B5.7 DVD-Ig이 통상의 IgG1 분자외에 추가 도메인을 보유한다는 사실과 일치한다.
실시예
2.4.6:
LC
-
MS
분자량 측정
D2E7-SL-Hu2B5.7 DVD-Ig 시료의 완전한 분자량 및 탈글리코실화된 분자량은 LC-MS로 분석했다. 각 시료는 물로 약 1mg/ml로 희석했다. 희석한 시료 0.5 ㎕를 Poroshell 300SB-C3 컬럼(Agilent, cat# 661750-909)을 구비한 Agilent 6510 Q-TOF LC/MS 시스템(Agilent G6510A, 시리얼 번호 US65020122) 위에 주입했다. 시료의 용출을 위해 짧은 구배(표 16)를 이용했다. 구배는 이동상 A(0.1% 포름산 수용액, J.T.Baker, cat# 9834-03) 및 이동상 B(아세토니트릴 중의 0.1% 포름산, J.T.Baker, cat# 9832-03)로 50 ㎕/분 유속 하에 진행시켰다. 질량분광분석계는 5kv 스프레이 전압 하에 작동시키고 스캔 범위는 600 내지 3200 질량 대 전하 비 범위였다. 탈글리코실화된 D2E7-SL-Hu2B5.7 DVD-Ig에 대해서는 DVD-Ig 시료 50 ㎍을 10% N-옥틸글루코사이드(Sigma, cat# O8001) 2.5 ㎕ 및 PNGase F(Prozyme, cat# GKE5006A) 1 ㎕와 혼합했다. 총 용적이 50 ㎕가 되도록 각 시료에 Milli-Q 물을 첨가했다. 시료는 37℃에서 17시간 동안 항온처리했다. 탈글리코실화된 분자량을 수득하기 위해, 완전한 분자량을 획득하는데 사용했던 것과 같은 HPLC 및 질량분광분석 조건을 이용했다(표 16).
D2E7-SL-Hu2B5.7 DVD-Ig의 완전한 분자량은 200,574 달톤이었고, c-DNA 서열 유래의 아미노산과 추가 2개의 N-결합 올리고사카라이드 변형 NGA2F를 기반으로 할 때의 이론적 값인 200,569와 5 달톤의 차이가 있었다. 또한, 200,736 달톤 및 200,894 달톤의 분자량도 관찰되었고, 이는 다른 올리고사카라이드 변형에 대응하는 것이다. 탈글리코실화 후, DVD-Ig의 분자량은 197,684 달톤으로 측정되었고, 이론적 값인 197,679와 5 달톤의 차이를 나타냈다. 또한, 197,810 달톤 및 197,936 달톤의 분자량을 가진 소량의 피크도 관찰되었는데, 이는 C-말단 리신을 보유한 탈글리코실화된 분자량에 대응하는 것이다.
실시예
2.4.7:
경쇄
및
중쇄의
LC
-
MS
분자량 측정
D2E7-SL-Hu2B5.7 DVD-Ig 경쇄(LC), 중쇄 및 탈글리코실화된 HC의 분자량 측정은 LC-MS로 분석했다. DVD-Ig 시료는 물로 약 1mg/ml로 희석하고, 이 시료는 최종 농도가 25mM인 DTT로 37℃에서 30분 동안 처리하여 LC 및 HC로 환원시켰다. 희석한 시료 0.5 ㎕를 Poroshell 300SB-C3 컬럼(Agilent, cat# 661750-909)을 구비한 Agilent 6510 Q-TOF LC/MS 시스템(Agilent G6510A, 시리얼 번호 US65020122) 위에 주입했다. 구배(표 17)는 이동상 A(0.1% 포름산 수용액, J.T.Baker, cat# 9834-03) 및 이동상 B(아세토니트릴 중의 0.1% 포름산, J.T.Baker, cat# 9832-03)로 50 ㎕/분 유속 하에 진행시켰다. 질량분광분석계는 5kv 스프레이 전압 하에 작동시키고 스캔 범위는 600 내지 3200 질량 대 전하 비 범위였다. 탈글리코실화된 DVD-Ig은 최종 농도가 25mM인 DTT로 37℃에서 30분 동안 처리하여 환원시켰다. 탈글리코실화된 중쇄 분자량은 전술한 바와 같은 조건 하에 획득했다.
DVD-Ig의 경쇄 분자량은 36,193 달톤이었고, 이론적 값인 36,193 달톤에 부합했다. 중쇄 분자량은 64,097 달톤으로, 아미노산 서열과 추가 2개의 N-결합 올리고사카라이드 NGA2F를 기반으로 할 때의 이론적 값인 64,096과 1 달톤의 차이가 있었다. 또한, 64,260 달톤 및 64,423 달톤의 분자량도 관찰되었고, 이는 NA1F 및 NA2F의 N-결합 올리고사카라이드 변형을 각각 보유하는 중쇄에 대응하는 것이다. 탈글리코실화 후, 경쇄 분자량은 변화하지 않았고, 이는 경쇄에 올리고사카라이드 변형이 존재하지 않음을 시사한다. 중쇄 분자량은 62,653 달톤으로, 이론적 값인 62,651과 2 달톤의 차이가 있었다. 소량의 C-말단 리신 변이체도 62,781 달톤의 분자량으로 관찰되었다.
실시예
2.4.8:
펩타이드
맵핑
D2E7-SL-Hu2B5.7 DVD-Ig의 펩타이드 맵핑은 다음과 같이 수행했다: DVD-Ig 시료 200㎍을 50mM 중탄산암모늄(Mallinckrodt cat# 0155)으로 1mg/ml로 희석하고, 10mM DTT(EM Sciences, cat# 3810) 및 6M 구아니딘 HCl(Pierce, produce no. 24115) 중에서 37℃에서 30분 동안 환원 및 변성시켰다. 10㎕의 1M 요오도아세트산(Sigma cat# 14386-100G)을 첨가하고, 이 시료는 37℃ 암실에서 30분 동안 항온처리했다. 환원, 변성 및 알킬화된 시료는 먼저 슬라이드-A-라이저(Pierce, 제품 번호 66333)를 이용하여 4℃에서 30분 동안 50mM 중탄산암모늄 4L에 대해 투석하고, 그 다음 50mM 중탄산암모늄 4L에 대해 밤새 투석했다. 이 시료를 회수하고 1:20 효소 대 단백질 비(w/w)의 트립신(Promega, cat# V511A)으로 37℃에서 4시간 동안 분해했다. 분해는 TFA(J.T.Baker, cat#9470-01) 2㎕를 첨가하여 정지시켰다. 이 시료는 LC/MS 분석을 위해 HPLC 바이엘로 옮겼다. 시료 5㎕를 주입했고, 시료는 Agilent 1200 캐필러리 HPLC 시스템 상의 Vydac C18 컬럼(Vydac, cat#218MS51)을 이용한 역상 HPLC로 분리했다. 컬럼 히터는 60℃로 고정시켰다. 분리는 완충액 A(0.1% FA 수용액, J.T.Baker, cat#9834-03) 및 완충액 B(아세토니트릴 중의 0.1% FA, J.T.Baker, cat#9832-03)를 50㎕/분의 유속으로 이용하여 표 18에 제시한 구배 하에 진행시켰다. Agilent 6510 Q-TOF LC/MS 시스템(Agilent cat# G6510A, 시리얼 번호 US65020122)은 양의 전기분무 방식으로 작동시켰다. 질량 분광분석계는 5.0kv 스프레이 전압 하에 작동시키고 스캔 범위는 200 내지 3000 질량 대 전하 비 범위였다.
이론적으로, D2E7-SL-Hu2B5.7 DVD-Ig 분자는 경쇄에 332개 아미노산과 중쇄에 573개 아미노산을 보유한다. LC-MS에 의한 펩타이드 맵은 관찰된 아미노산과 이의 서열을 보고한다. 표 20 내지 22는 경쇄 및 중쇄 펩타이드의 LC/MS 결과이다. DVD-Ig 경쇄 및 중쇄 아미노산 전부가 검출되었다. 관찰된 질량은 모두 이론적 질량과 잘 맞았고, 차이는 0.02 달톤 미만이었다. 전체 서열 회수율은 DVD-Ig 100%였다. C-말단 리신 잔기는 중쇄에서 암호화되었지만, 숙주 세포에 의해 발현되는 내인성 카르복시펩티다제 B에 의해 해독후 제거될 수 있다. LC-MS 펩타이드 맵은 C-말단 리신이 존재했지만, C-말단 펩타이드의 대부분은 리신이 없음을 증명한다.
실시예
2.4.9:
이황화
결합
맵핑
이황화 결합 맵핑은 비환원 조건 하에서 D2E7-SL-Hu2B5.7 DVD-Ig의 펩타이드 맵에 의해 수행되었다. 2개의 DVD-Ig 시료 분취량을 50mM 중탄산나트륨으로 0.5mg/ml로 희석하고, 0.1% RapiGest SF(Waters Corporation, Part no. 186001861)에서 65℃ 하에 1시간 동안 변성시켰다. 각 시료의 총 용적은 100㎕였다. 시료는 각각 트립신(Promega, cat# V511A) 및 Lys-C(Roche Diagnostics, cat#. 11 047 825 001)로 분해했다. 트립신 분해물은 효소 대 단백질 비(w/w) 1:6.25 하에 수행했고, Lys-C 분해는 효소 대 단백질 비 1:20(w/w) 하에 37℃에서 약 17시간 동안 수행했다. 분해는 1㎕ TFA를 첨가하여 정지시켰다. 시료는 37℃에서 30분 동안 항온처리했다. 약간의 혼탁이 관찰되었다. 시료는 그 다음 13,000 RPM에서 10분 동안 원심분리했다. 가수분해성 RapiGest SF 부산물은 수 비혼화성이었고, 약간의 침전이 관찰되었다. 상청액을 시료 바이엘에 옮겨 LC/MS 분석을 실시했다. 시료는 Agilent 1200 캐필러리 HPLC 시스템 상의 Vydac C18 컬럼을 이용하여 역상 HPLC로 분리했다. 컬럼 히터는 60℃로 고정시켰다. 분리는 표 18에 제시한 펩타이드 맵에 사용했던 동일한 구배 하에 완충액 A(0.1% FA 수용액) 및 완충액 B(아세토니트릴 중의 0.1% FA)를 50㎕/분의 유속으로 이용하여 진행시켰다. Agilent 6510 Q-TOF LC/MS 시스템은 양의 전기분무 방식으로 작동시켰다. 질량분광분석계는 5.0kv 스프레이 전압 하에 작동시키고 스캔 범위는 200 내지 3000 질량 대 전하 비였다. 이황화 결합은 이황화 결합에 의해 연결된 트립신 또는 Lys-C 펩타이드의 예상 분자량과 펩타이드의 관측 분자량의 부합에 의해 지정되었다.
D2E7-SL-Hu2B5.7 DVD-Ig은 통상의 IgG1 분자에 비해 경쇄 및 중쇄 모두에 추가 가변 도메인을 보유하고 있다. DVD-Ig의 이황화 결합 맵핑의 실험 결과는 표 23에 정리했다. 트립신 분해 및 Lys-C 분해 결과를 조합해보면, 모든 이론적 이황화 결합된 펩타이드가 관찰되었다.
실시예
2.4.10: 유리
설프하이드릴
결정
D2E7-SL-Hu2B5.7 DVD-Ig 중에 유리 시스테인을 정량분석하는데 사용한 방법은 특징적인 발색단 산물, 5-티오-(2-니트로벤조산)(TNB)을 유발시키는 설프하이드릴 기(SH)를 가진 5,5¢-디티오-비스(2-니트로벤조산)(DTNB)인 엘만 시약의 반응을 기초로 했다. 이 반응은 다음 식으로 예시된다:
DTNB + RSH ® RS-TNB + TNB- + H+
TNB-의 흡광도는 SPECTRA max Plus 384(Molecular Devices) 평판 판독기를 이용하여 412nm에서 측정했다. 흡광도 곡선은 유리 SH 표준물로서 2-머캅토에탄올(β-ME)의 희석물을 이용하여 플로팅하고 단백질에 존재하는 유리 설프하이드릴 기의 농도는 시료의 412nm에서의 흡광도로부터 측정한다.
β-ME(Pierce, cat# 35602) 표준 스톡은 14.2M β-ME를 HPLC 등급 물로 0.142mM의 최종 농도로 연속 희석하여 준비했다. 그 다음, 각 농도마다 3반복의 표준물을 제조했다. 시료는 실온에서 20분 동안 진탕기에서 혼합했다(표 24). 철저히 혼합한 후, 각 시료 및 표준물에 100mM Tris 완충액(pH 8.1) 54㎕, 및 2mM DTNB(Sigma, D8130) 90㎕를 첨가했다. OD는 412nm에서의 흡광도로 측정했다. 표준 곡선은 유리 SH의 양과 β-ME 표준물의 OD412 nm를 플로팅하여 수득했다. 시료의 유리 SH 함량은 블랭크를 공제한 후 상기 곡선에 기초하여 계산했다.
유리 설프하이드릴 농도 측정을 위한 표준 곡선은 412nm에서 0.002 내지 1.347 OD에 해당하는 흡광도 범위를 포함했다. 피팅된 데이터의 상관계수는 0.994였다. DVD-Ig의 2반복 시료를 제조하여 분석했다. 2반복 시료의 유리 설프하이드릴 농도는 각각 0.35% 및 0.63%였다.
실시예
2.4.10: 약 양이온 교환 크로마토그래피
D2E7-SL-Hu2B5.7 DVD-Ig 시료는 완충액 A(10mM 인산나트륨 이염기성(pH 7.5))으로 1mg/ml로 희석하고, ProPac WCX-10 컬럼(Dionex, ProPac WCX-10, 제품 번호 054993, 4 mm x 250 mm)을 이용한 약 양이온 교환 HPLC 방법으로 분석했다. 표 25는 WCX-10 분석의 HPLC 시스템 작동 조건을 나타낸다. 결과는 DVD-Ig이 19.3%가 산성 종이고 65.2% 주 피크이며 15.5%가 염기성 종인 것이라는 것을 나타냈다.
실시예
2.4.11:
캐필러리
구역 전기영동
캐필러리 구역 전기영동은 캐필러리가 완충액으로만 충전된 캐필러리 전기영동법이다. 분리 기전은 피분석물의 전기영동성 이동성의 차이를 기초로 한다. 분자의 전기영동적 이동성은 전사 대 크기 비와 관련이 있다. Beckman-Coulter ProteomeLab PA800은 CZE 분석에 사용했다. 중성 캐필러리(eCAP 중성, 56cm 총 길이, 50 ㎛ I.D. Beckman-Coulter, P/N 477441)를 이용했다. 이 방법은 시료 도입구로부터 20.2cm에 검출 창을 보유한 30.2cm 캐필러리를 이용한다. 진행 완충액은 5mM 시트르산염/MES 완충액(Beckman Coulter, cat# 477443)과 0.5ml 1% MC 용액(Convergent Biosciences, cat#101876)을 혼합하고 10,000 RPM에서 2분 동안 원심분리하여 제조했다.
결과는 주 피크 전에 이동하는 2개의 염기성 피크를 나타낸다. 이 피크는 리신 변이체에 대응하는 것이었다. 주 피크는 산성 측에 테일링을 나타냈고, 이는 주 피크에서 잘 분리되지 않는 산성 종에 의한 것이다.
실시예
2.4.12:
올리고사카라이드
프로파일링
항체를 PNGase F 처리한 후 방출된 올리고사카라이드는 2-아미노벤즈아미드(2-AB) 표지화 시약으로 유도체화했다. 형광-표지된 올리고사카라이드는 정상상 크로마토그래피(NPHPLC)로 분리하고, 공지 표준물과 체류 시간 비교를 기초로 하여 여러 형태의 올리고사카라이드를 특성규명했다.
D2E7-SL-Hu2B5.7 DVD-Ig은 먼저 PNGaseF로 분해하여 중쇄의 Fc 부로부터 N-결합된 올리고사카라이드를 절단했다. 이 DVD-Ig(200㎍)을 2.5㎕ 10% N-옥틸글루코사이드(Sigma, cat# O8001) 존재하에 3㎕ PNGase F(Prozyme: cat# GKE5006D)로 분해했다. Milli-Q 물을 최종 용적이 50㎕가 되도록 첨가했다. 시료는 37℃로 고정된 가열혼합기에서 700-800 RPM 하에 17시간 동안 항온처리했다.
탈글리코실화 후, 단백질은 95℃에서 6분 동안 침전시켰다. 시료 튜브는 10,000 RPM에서 5분 동안 원심분리했다. 상청액은 마이크로원심분리 튜브에 넣고 가속 진공 원심분리기에 넣었다. 용액은 건조시켰다. 온도는 실온으로 고정하거나 공정의 가속을 위해 최고 30℃로 고정시켰다.
표지화 단계를 위해 2-AB 표지화 키트(Prozyme)를 사용했다. 시약을 제조하기 위해, 아세트산(바이엘 C) 150㎕를 DMSO 바이엘(바이엘 B)에 첨가하고 볼텍싱으로 잘 혼합했다. 그 다음, 아세트산/DMSO 혼합물 100 ㎕를 2-AB 염료 바이엘(바이엘 A)에 첨가하고, 염료가 용해할 때까지 볼텍싱했다. 이 바이엘의 전체 내용물을 환원제 바이엘(바이엘 D)에 첨가했다. 바이엘은 용해될 때까지 65℃로 가열하고, 그 후 내용물이 완전 용해될 때까지 볼텍싱으로 혼합했다. 이것은 표지화 시약이었다. 표지화 시약 10 ㎕를 각각 건조된 올리고사카라이드 시료에 첨가했다. 건조된 올리고사카라이드가 용액이 될 때까지 시료 튜브를 볼텍싱했다. 이 튜브를 빠르게 원심분리하여 전 용량을 바닥에 모았다. 그 후, 65℃, 750 RPM으로 고정된 가열혼합기에 넣어 2시간 동안 혼합했다.
시료를 표지화한 후, 유리 형광 시약은 GlycoClean S 카트리지를 이용해 제거했다. 각 카트리지는 Milli-Q 물 1ml로 세척한 뒤, 철저하게 배수시켰다. 물 세척 후, 30% 아세트산 1ml로 5회 세척하고, 철저하게 배수시켰다. 이 카트리지를 아세토니트릴 1ml로 2회 세척하고 철저하게 배수시켰다.
올리고사카라이드를 표지화한 후, 각 튜브는 빠르게 원심분리하여 전체 용량을 튜브 바닥에 모았다. 모든 튜브는 실온으로 냉각했다. 각 시료는 GlycoClean S 카트리지의 갓 세척된 막 위에 점적했고, 시료는 전체 막 표면 위로 확산되었다. 각 시료 튜브는 20 ㎕ 아세토니트릴로 세정했고, 이 용량을 해당 카트리지 막에 첨가했다. 각 GlycoClean S 카트리지는 실온에서 최소 15분 동안 방치하여 표지화된 올리고사카라이드를 막 위에 흡착시켰다.
각 카트리지는 100% 아세토니트릴 1ml로 세척하고 철저하게 배수시켰다. 96% 아세토니트릴 용액 1ml를 5회 첨가했고, 각 분취량은 다음 분취량을 첨가하기 전에 배출시켰다. 관류물은 폐기 처분했다. 카트리지 데드(dead) 용적은 시료를 용출하기 전에 카트리지 기저부로부터 제거했다. 각 카트리지는 적당히 표지화된 1.5ml 마이크로원심분리 튜브 위에 놓았다. 2-AB 표지화된 올리고사카라이드가 3 x 400 ㎕ Milli-Q 물에 의해 용출되었다.
각 시료는 아세토니트릴로 3.3x 희석했다. 용출된 2-AB 표지화된 올리고사카라이드 시료 150 ㎕를 아세토니트릴 350 ㎕와 혼합했다. HPLC 분석을 위해 200 ㎕를 주입했다.
올리고사카라이드는 시마즈 HPLC 시스템에 연결된 Glycosep N HPLC(cat# GKI-4728) 컬럼을 이용하여 분리했다. 시마즈 HPLC 시스템은 시스템 제어기, 탈기장치, 이중 펌프, 시료 냉각기를 구비한 자동샘플러 및 형광 검출기로 구성되어 있다.
D2E7-SL-Hu2B5.7 DVD-Ig의 올리고사카라이드 프로파일링 결과는 표 26에 제시했다.
실시예
2.4.13:
원편광
이색성
분광측정법
D2E7-SL-Hu2B5.7 DVD-Ig 시료는 5mM 인산나트륨 pH 6.8로 0.3mg/ml가 되게 희석했다. 이 시료 500 ㎕를 먼저 5mM 인산나트륨(pH 6.8)에 대해 4℃에서 20분 동안 투석하고, 그 다음 동일 완충액에 대해 4℃에서 밤새 투석했다. Slide-A-Lyzer 카세트로부터 시료를 회수한 후, A280 단백질 흡광도를 측정했다. 시료를 다시 투석물로 0.15mg/ml로 희석하고, 최종 A280 값이 0.221 OD가 되게 했다. 배경 공제를 위한 대조 블랭크로는 5mM 인산나트륨 완충액(pH 6.8)을 사용했다.
원자외선 스펙트럼은 20℃로 자동온도조절되는 하우징을 이용해 Jasco J-810 분광편광계에서 획득했다. 각 CD 측정값은 184 내지 260nm의 3 파장 스캔값의 수정된 평균으로 나타냈다. 큐벳 챔버는 실험 동안 질소로 계속 플러싱했다. 검출기 전압 HT[V]는 PMT 포화를 피하기 위해 600 볼트 이하로 유지시켰다.
단백질 2차 구조의 차이는 원자외선 영역에서 독특한 원편광 이색성 스펙트럼을 기반으로 하여 측정했다. α-나선 구조는 약 190nm에서 강한 양의 밴드와 약 208nm와 222nm 사이의 음의 밴드를 특징으로 한다. β-시트 구조는 약 200nm에서의 양의 밴드와 약 216nm에서의 음의 밴드를 특징으로 한다. 랜덤 코일은 약 195nm에 음의 밴드와 약 220nm에 양의 밴드를 보유한다. DVD-Ig의 CD 스펙트럼은 약 200nm에서 양의 밴드와 약 216nm에서 음의 밴드를 나타내는데, 이것은 β-시트 구조의 특징적인 표시이다. 이러한 결과는 DVD-Ig이 β-시트 2차 구조를 보유한다는 것을 입증한다. 230nm와 240nm 사이에는 작은 양의 타원율이 있다. 이러한 양의 타원율은 또한 모 분자 중 하나인 Hu2B5.7에서도 관찰되지만, 다른 모 분자인 D2E7에서는 관찰되지 않는다. 이러한 양의 타원율은 분자의 항-PGE-2 부분의 폴딩과 관련이 있을 가능성이 있다.
실시예
2.4.14: 시차주사열량측정(
DSC
)
시차주사열량측정(DSC)은 D2E7 및 D2E7-SL-Hu2B5.7 DVD-Ig에 대해 실시예 1.3.3.2.L의 방법에 따라 수행했다. 종래 항체와 달리, DVD-Ig은 이론적으로 언폴딩할 수 있는 하나의 추가 도메인, 즉 하나의 추가 VH1 및 VL1 도메인을 함유하고 있다. 다양한 도메인의 언폴딩 전이 온도(Tm)는 모두 중첩되지 않는 것으로 추정되고, 이에 따라 4개의 언폴딩 전이가 DSC 분석에 의해 특징화될 수 있을 것으로 생각된다. D2E7-SL-Hu2B5.7 DVD-Ig은 58.8℃, 68.6℃, 75.0℃ 및 83.4℃에서 측정될 수 있는 4개의 전이를 보유했다(도 6). 더욱이, 이 데이터는 생물학적제제 제품의 권장 보관 온도보다 훨씬 높은(아달리무마브의 Tm 값인 56.9℃, 67.4℃ 및 76.75℃에 비해) 58.8℃ 이전에 언폴딩하는 DVD-분자의 도메인이 없기 때문에, DVD-Ig 분자가 성공적인 제품 개발에 있어서 매우 양호한 후보가 되게 하는 고유의 입체형태 안정성이 우수하다는 것을 입증했다.
실시예
3: 항-
TNF
/항-
PGE
2
DVD
-
Ig
의 제형 분석 개발
실시예
3.1: 생물이화학적 특성규명 및 제형 개발을 위한 방법
검사 기준은 일반 품질 파라미터(예, 단백질 함량, pH), 고유 안정성을 나타내는 파라미터(DSC), 물리적 안정성(예, 입자 오염 및 불용성 응집물 및 육안 조사로 모니터되는 침전물 형성 및 광 차폐 입자 계수, SEC로 모니터하는 단편화 및 응집을 포함하는 순도), 및 단백질 화학적 안정성을 나타내는 파라미터(예, 탈아미드화, 산화, 일반적 화학안정성을 위한 IEC; SEC)를 포함한다. 또한, 고농도 용액의 점도와 같은 우수한 생물제제 투약 형태에 중요한 특징을 다양한 온도에서 측정했다(원추-평판 점도계).
가시성이하(subvisible) 입자는 미국 약전(USP)에 따른 광봉쇄법(light blockage method)으로 모니터했다. 또한, 제형의 이화학적 안정성은 단편 및 응집물의 검출을 가능하게 하는 SEC로 평가했다. 화학적 안정성을 모니터하기 위해, 크기 배제 고압 액체 크로마토그래피(SE-HPLC)(단편 및 가수분해 표본의 검출) 및 CEX-HPLC(양이온 교환 HPLC)를 적용했다. CEX-HPLC는 보관 중에 형성되었을 수 있는 분해 산물(예, 탈아미드화 및 산화된 종) 및 다른 리신 이소폼을 분리한다.
실시예
3.1.1: 크기 배제 크로마토그래피(
SEC
)
크기 배제 크로마토그래피는 크기를 기준으로 단백질을 분리하는데 사용된다. 단백질은 수성 이동상에서 컬럼에 충진된 다공성 고정상 수지를 통해 운반된다. 컬럼 내의 체류 시간은 단백질의 수력학적 크기 및 충진된 수지 베드 내의 기공 크기의 함수이다. 작은 분자는 수지 내의 작은 기공 내로 침투할 수 있고 큰 분자보다 더 오래 보유된다. 컬럼에서 용출 후, 단백질은 UV 흡광도로 검출한다. SEC 방법은 TSK 겔 가드(TOSOH Biosciences, Montgomeryville, PA, cat.no. 08543) 및 TSK 겔 G3000SWxL(TOSOH Biosciences, Montgomeryville, PA, cat.no. 08541)을 이용했다. 이동상은 100mM Na2HPO4, 200mM Na2SO4, pH 7.0이었다. 유속은 0.3ml/분이었다. 주입 용량은 1mg/ml 시료 20㎕였다. 컬럼 온도는 실온이었다. 자동샘플러 온도는 2 내지 8℃였다. 총 진행 시간은 50분이었다. 검출은 밴드 폭이 100nm인 360nm의 대조 파장을 이용하여 8nm 밴드 폭으로 고정된 214nm 파장에서의 UV 흡광도를 기반으로 했다.
실시예
3.1.2: 이온 교환 크로마토그래피(
IEC
)
Dionex Propac WCX-10 4x250mm 컬럼, p/n 054993; 4x50mM 가드, p/n 054994. 완충액 A: 10mM Na2HPO4, pH7.5, 완충액 B 10mM Na2HPO4, 500mM NaCl, pH 5.5. 280nm에서 검출, 컬럼 온도 35℃, 유속 1ml/분.
실시예
3.1.3:
가시성이하
입자 농도의 측정
가시성이하 입자의 수는 미국 약전의 권장에 따라 KLOTZ 광 엄폐 입자 계수기로 측정했다. 라미나 기류 조건 하에 3.5ml 시료를 5ml 둥근바닥 튜브에 충전하고, 각 시료마다 1차 0.8ml 세정 후 n=3 방식(1회 측정당 0.8ml)으로 측정을 수행했다. 표에 제시한 입자 농도는 단백질 용액 ml당 입자 수를 의미한다.
실시예
3.1.4: 육안 조사
단백질 용액은 흐림, 혼탁 및 입자 형성과 같은 단백질 물리적 불안정성을 나타내는 징후에 대해 흑색 및 백색 배경 모두에 대해서 조심스럽게 조사했다.
실시예
3.1.5: 용해성
단백질 용해성은 단백질은 100 mg/ml로 농축시켜 pH 6(15mM 히스티딘) 완충액에서 평가했다.
실시예
3.1.6: 단백질 점도
단백질 점도는 8 내지 25℃ 사이에서 100/s의 전단속도로 브룩필드 원추-평판 유량계에서 평가했다.
실시예
3.1.7:
DSC
열안정성은 DSC 기구를 이용해 평가했다. DSC 기구는 Capillary Cell(Microcal)을 보유한 자동 VP-DSC를 사용했다. 분자의 언폴딩은 1mg/ml 시료에 대해 25℃-95℃ 온도 범위에서 1℃/분의 스캔 속도로 조사했다. 다른 측정 파라미터는 다음과 같다: 피팅 시간: 16초, 예비스캔 대기 시간: 10분, 피드백 모드: 없음. 각 측정마다, 시료/블랭크 420㎕를 DSC 측정 시료 홀더에 이하에 제시한 평판 충진 계획에 따라 충진했다. 이와 같이 수득되는 온도기록도를, 예컨대 다른 전이의 중간점 온도 및 엔탈피를 수득하기 위한 비-2상 모델(non-two state model)에 피팅시켰다.
실시예
3.2:
E2E7
-
SL
-
Hu2B5
.7
DVD
-
Ig
의 제형 분석 개발
실시예
3.2.1: 권장 및 가속 보관 조건에서 광범한
pH
범위에서의
D2E7
-
SL
-Hu2B5.7 DVD-Ig 용액의 안정성
단백질 안정성은 pH 범위가 pH 4 내지 pH 9 내인 10mM 인산염, 10mM 시트르산염 완충 시스템에서 2mg/ml에서 평가했다. 안정성 연구는 권장 보관 온도(2-8℃) 및 가속 조건(40℃)에서 적어도 3개월 이하로 수행했다. 일반적으로, 단백질의 이화학적 안정성은 단백질이 보관 및/또는 조제되는 pH 및 온도 조건에 매우 의존적이다. 이러한 스트레스 조건은 보관 동안 응집, 탈아미드화 등과 같은 불안정성을 초래할 수 있고, 안전성, 효능 및 일반적인 제품의 질에 상당한 영향을 미칠 수 있다. 큰 단백질을 주성분으로 하는 안정하고 안전한 약제 산물의 제공은 해결해야할 과제이며, 흔히 단백질 불안정성은 장기간 동안 안정성을 유지하기 위해 산물의 동결건조를 필요로 한다는 것은 일반적으로 받아들여지고 있다. 예비임상 모델에서 매우 전망있는 생물 개발 후보가 부적당한 안정성으로 인해 임상 개발되지 못한 사례는 드물지 않다.
표 29 및 30은 D2E7-SL-Hu2B5.7 DVD-Ig을 최고 3개월간 보관하는 동안 매우 광범한 pH 프로필 상에서 SEC 및 IEX 안정성 검사한 결과로서, 시간 경과에 따른 단량체 및 주 이소폼 종 각각의 농도를 보여준다. 표 29는 D2E7-SL-Hu2B5.7 DVD-Ig이 pH 4 내지 pH 9 범위의 용액 pH에서 사실상 동일한 단량체 농도를 나타낸다는 것을 증명해 보이고 있다. 모든 제형은 분명하게 90% 단량체 품질 농도 이상으로 단량체 농도를 나타낸다(3개월의 실시간 검사 동안에도 매우 양호한 안정성을 나타낸다). 이 제형은 실제로 90%를 초과하는 실시간 안정성 검사를 위한 극히 엄중한 품질 사양도 충족할 수 있을 정도로 D2E7-SL-Hu2B5.7 DVD-Ig 장기간 안정성을 유지한다. 이와 마찬가지로, 안정성을 나타내는 주 이소폼의 감소는 광범한 pH 범위 상에서 3개월 보관 후에 5% 미만이다. 따라서, 본 발명의 제형은 매우 광범한 D2E7-SL-Hu2B5.7 DVD-Ig 농도 범위 상에서, 또한 단량체 수준에 대해서도 장시간 동안 이화학적 안정성을 제공할 수 있다. 이것은, 과학계에서는 물리적 불안정성(단량체 감소를 초래함)이 용액 pH에 의해 강한 영향을 받고 단백질이 일반적으로 매우 좁은 pH 범위 내에서만 안정하다는 인식이 있기 때문에 매우 놀라운 것이다.
실시예
3.2.2: 동결-해동 과정 동안 광범한
pH
범위 상에서의
D2E7
-
SL
-Hu2B5.7 DVD-Ig 용액의 안정성
단백질 안정성은 표준 절차에 따라 수행되는 동결 해동 연구를 이용하여, 다양한 pH 값의 1mg/ml 10mM 인산염, 10mM 시트르산염 완충액 시스템에서 평가했다. 동결은 시료를 -80℃에서 적어도 6시간 동안 유지시켜 수행했다. 해동은 수조에서 30℃에서 수행했다. 일반적으로, 단백질은 동결 과정 동안 발생되는 얼음-물 계면에서 일어날 수 있는 변성, 또는 저온 변성 및/또는 저온농축과 같은 다양한 다른 파라미터들로 인해 응집 및 가시성이하 입자 형성과 같은 물리적 불안정성에 민감하다. 단백질은 보통 벌크 약물 물질 및 동결건조된 약물 산물과 같은 동결 형태로 보관되기 때문에(1차 공정 단위 조작으로 동결을 포함한다), 동결/해동 처리 안정성은 제조 작업 및 일반적인 안정성 요건에 따라 갖춰야 할 단백질 안정성 특징의 필수 부분이다.
동결/해동 처리는 실질적인 단백질 변성 및 응집을 초래할 수 있는 것으로 공지되어 있고, 결과적으로 용해성 및 불용성 응집물을 형성시킨다(Parborji et al., Pharm Res 11(5) 1994). 심지어 최소량의 단백질(<0.1%)이 침전의 원인인 것으로 알려져 있다(Hoffman, Analytical methods and stability testing of biopharmaceuticals, in Protein formulation and delivery, ed. by McNally, E.J., 3(2000) 71-110). 여기에 제시된 모든 제형은 반복 동결 해동 처리를 받았고, 그 결과 제형들이 반복된 동결/해동 사이클(-80℃/30℃)에 전혀 민감하지 않은 것으로 증명되었다. D2E7-SL-Hu2B5.7 DVD-Ig 제형은 모두 유사하게 D2E7-SL-Hu2B5.7 DVD-Ig의 pI에 가까운 제형의 높은 pH에도 불구하고 pH에 무관하게 안정했다(모두 초기 값과 비교했을 때 유의적인 변화가 없었다). 놀랍게도, D2E7-SL-Hu2B5.7 DVD-Ig 제형은 최고 적어도 4회의 동결 해동 사이클 동안(모든 시료는 90% 농도를 초과하는 품질의 단량체 농도를 나타냈다), 가시성이하 입자 수준(모든 시료는 저용량 비경구 투약 형태에 대한 미국 및 유럽 약전에 기술된 가시성이하 입자 수 요건을 만족시켰다), 및 육안 조사 데이터(모든 시료는 입자 및 물리적 불안정성이 없는 것으로 관찰되었다)에 있어서 물리적으로 안정했다.
실시예
3.2.3:
DSC
측정 동안 선택된 다양한 제형
에서
항-
TNF
-항-
PGE2
DVD-IgG 용액의 안정성
pH 4 내지 pH 8 사이에서 1mg/ml 항-TNF-항-PGE2 DVD-IgG의 열안정성은 DSC 기구로 평가했다. DSC로 평가된 열안정성은 보관 동안 단백질 분자의 속도론적 안정성과 관련이 있다.
짧은 링커 및 긴 링커 항-TNF/항-PGE2 DVD-IgG 분자에도 불구하고, 항-TNF/항-PGE2 DVD-IgG의 도메인의 강제 언폴딩을 유도하는 데에는 고온(항-TNF/항-PGE2 DVD-IgG 산물의 권장 보관 온도보다 훨씬 높은 온도)이 필요하다는 것을 알 수 있었다.
실시예
3.2.4: 동결-해동 처리 동안 10
mg
/
ml
의
D2E7
-
SL
-
Hu2B5
.7
DVD
-
Ig
용액의 안정성
동결/해동 스트레스 동안 D2E7-SL-Hu2B5.7 DVD-Ig 안정성은 또한 pH 6(15mM 히스티딘) 완충액 중의 10mg/ml 농도에서 평가했다. 시료는 -80℃에서 동결하고 30℃ 수조에서 해동시켰다.
여기에 제시된 제형은 반복 동결 해동 처리되었고, 결과는 D2E7-SL-Hu2B5.7 DVD-Ig이 10mg/ml 농도에서 반복 동결/해동 사이클(-80℃/30℃)의 결과로서 불안정성에 민감하지 않다는 것을 증명해 보였다. 항-TNF-항-PGE2 DVD-IgG 제형은 10mg/ml에서 적어도 3회의 동결 해동 사이클까지 물리적 안정성(모든 시료의 단량체 농도는 90%를 초과하는 품질인 것으로 나타났다) 및 육안 조사 데이터(모든 시료는 입자와 물리적 불안정성이 없는 것으로 관찰되었다) 면에서 안정하다는 것을 입증해보였다.
실시예
3.2.5: 권장 및 가속 보관 조건에서 다양한 제형 중의
D2E7
-SL-Hu2B5.7
DVD
-
Ig
의 안정성
D2E7-SL-Hu2B5.7 DVD-Ig 안정성은 다양한 제형 조건 하에 pH 6, 2mg/ml 농도에서 평가했다. 안정성 연구는 2-8℃ 및 40℃에서 수행했다.
표 37은 선택된 제형에서 항-TNF-항-PGE2 DVD-Ig을 최고 3개월간 보관하는 동안 SEC 검사한 결과로서, 시간 경과에 따른 단량체의 농도를 보여준다. 표 37은 항-TNF-항-PGE2 DVD-IgG 제형이 모든 제형이 분명하게 90% 단량체 품질 농도 이상으로 단량체 농도를 나타내기 때문에(3개월의 실시간 검사 동안에도 매우 양호한 안정성을 나타낸다) 높은 안정성과 제형 강건함을 시사하는 사실상 동일한 단량체 농도를 나타낸다는 것을 증명해 보이고 있다. 이 제형은 실제로 90%를 초과하는 실시간 안정성 검사를 위한 극히 엄중한 품질 사양도 충족할 수 있을 정도로 D2E7-SL-Hu2B5.7 DVD-Ig 장기간 안정성을 유지한다.
고온(항-TNF-항-PGE2 DVD-IgG 산물의 권장 보관 온도보다 훨씬 높은 온도)은 항-TNF-항-PGE2 DVD-IgG 제형의 도메인의 강제 언폴딩을 유도하는데 필요하다.
실시예
4:
PGE2
및 제2 표적에 특이적인 추가 이원 가변 도메인 면역글로불린(
DVD
-Ig)의 제조 및 특성규명
아미노산 서열이 공지된 모 항체를 이용한 이원 가변 도메인 면역글로불린(DVD-Ig)은 DVD-Ig 가변 중쇄 및 DVD-Ig 가변 경쇄 서열을 암호화하는 폴리뉴클레오타이드 단편을 합성하고 이 단편을 실시예 1.4.4.1에 따른 pHybC-D2 벡터에 클로닝하여 제조했다. 이 DVD-Ig 작제물은 실시예 1.4.4.2에 기술된 바와 같이 293 세포에 클로닝하여 발현시켰다. 이 DVD-Ig 단백질은 표준 방법에 따라 정제했다. 기능적 특성은 실시예 1.1.1 및 1.1.2에 기술된 방법에 따라 측정했다.
이하 실시예는 각각 2개의 표를 포함한다. 각 실시예에서 첫번째 표는 DVD-Ig을 제조하는데 사용된 2개의 모 항체의 VH 및 VL 서열을 함유한다. 각 실시예의 두번째 표는 첫번째 표의 서열로부터 작제된 DVD-Ig VH 및 VL 쇄의 서열을 함유한다.
실시예
4.1:
VEGF
및
PGE2
의 제조
표 39
실시예
4.2:
NGF
및
PGE2
DVD
-
Ig
의 생성
표 40
실시예
4.3:
IL
-17A 및
PGE2
DVD
-
Ig
의 생성
표 41
실시예
4.4:
IL
-1b 및
PGE2
(서열 1)
DVD
-
Ig
의 생성
표 42
실시예
4.5:
IL
-6 및
PGE2
DVD
-
Ig
의 생성
표 43
실시예
4.6:
Abeta
(서열 1) 및
PGE2
DVD
-
Ig
의 생성
표 44
실시예
4.7:
Abeta
(서열 2) 및
PGE2
DVD
-
Ig
의 생성
표 45
실시예
4.8:
Abeta
(서열 3) 및
PGE2
DVD
-
Ig
의 생성
표 46
실시예
4.9:
IL
-18 및
PGE2
DVD
-
Ig
의 생성
표 47
실시예
4.10:
IL
-15 및
PGE2
DVD
-
Ig
의 생성
표 48
실시예
4.11:
S1P
및
PGE2
DVD
-
Ig
의 생성
표 49
실시예
4.12:
IL
-6R 및
PGE2
DVD
-
Ig
의 생성
표 50
실시예
4.13: 모 항체 및
DVD
-
Ig
서열을
클로닝하는데
사용된
클로닝
벡터 서열
표 51
실시예
5: 모 항체 및
DVD
-
Ig
을 동정 및
특성규명하는데
사용한 분석법
다음 분석법은 다른 언급이 없는 한 모 항체 및 DVD-Ig을 동정 및 특성규명하는데 사용했다.
실시예
5.1: 표적 항원(들)에 대한 모 항체 및
DVD
-
Ig
의 결합 및 친화성을 측정하는데 사용된 분석법
실시예
5.1.1: 직접 결합
ELISA
원하는 표적 항원에 결합하는 항체를 선별하기 위한 효소면역분석법은 다음과 같이 수행했다. 고 결합 ELISA 평판(Corning Costar #3369, Acton, MA)은 인산염 완충 식염수(10X PBS, Abbott Bioresearch Center, Media Prep# MPS-073, Worcester, MA) 중의 10 ㎍/ml의 원하는 표적 항원(R&D Systems, Minneapolis, MN) 또는 원하는 표적 항원 세포외 도메인/FC 융합 단백질(R&D Systems, Minneapolis, MN) 또는 모노클로날 마우스 항-폴리히스티딘 항체(R&D Systems # MAB050, Minneapolis, MN) 100 ㎕/웰로 4℃에서 밤새 코팅했다. 평판은 0.02% Tween 20을 함유하는 PBS로 4회 세척했다. 평판은 300 ㎕/웰 차단 용액(탈지분유, 다양한 공급업체, PBS 중에 2%로 희석됨)을 첨가하여 1/2시간 동안 실온에서 차단시켰다. 평판은 0.02% Tween20을 함유하는 PBS로 차단한 후 4회 세척했다.
또는, 전술한 바와 같이 모노클로날 마우스 항-폴리히스티딘 항체로 코팅된 ELISA 평판에 10 ㎍/ml 히스티딘(His) 태그화된 원하는 목표 항원(R&D Systems, Minneapolis, MN)을 100 ㎕/웰씩 첨가하고 실온에서 1시간 동안 항온처리했다. 웰은 0.02% Tween 20을 함유하는 PBS로 4회 세척했다.
전술한 바와 같은 차단 용액에 희석한 항체 또는 DVD-Ig 제조물 100㎕를 전술한 바와 같이 제조한 원하는 표적 항원 평판 또는 원하는 표적 항원/FC 융합 평판 또는 항-폴리히스티딘 항체/Hig 태그화된 원하는 표적 항원 평판에 첨가하고, 실온에서 1시간 동안 항온처리했다. 웰은 0.02% Tween 20을 함유하는 PBS로 4회 세척했다.
원하는 표적 항원 평판 또는 항-폴리히스티딘 항체/히스티딘 태그화된 원하는 표적 항원 평판의 각 웰에 10ng/ml 염소 항-사람 IgG-Fc 특이적인 HRP 접합 항체(Southern Biotech #2040-05, Birmingham, AL) 100 ㎕를 첨가했다. 대안적으로, 원하는 표적 항원/Fc 융합 평판의 각 웰에 10ng/ml 염소 항-사람 IgG-카파 경쇄 특이적 HRP 접합 항체(Southern Biotech #2060-05 Birmingham, AL) 100 ㎕를 첨가하고 실온에서 1시간 동안 항온처리했다. 평판은 0.02% Tween 20을 함유하는 PBS로 4회 세척했다.
강화된 TMB 용액(Neogen Corp. #308177, K Blue, Lexington, KY) 100㎕를 각 웰에 첨가하고 실온에서 10분 동안 항온처리했다. 1N 황산 50 ㎕를 첨가하여 반응을 정지시켰다. 평판은 450nm 파장에서 분광광도계로 판독했다.
표 52는 직접 결합 분석에 사용된 항원 목록이다.
표 53은 직접 결합 ELISA 분석에서 검사한 항체 및 DVD-Ig 항체의 EC50(nM)로 나타낸 결합 데이터이다.
직접 결합 ELISA에서, 결합은 때로 관찰되지 않는데, 그 이유는 플라스틱 표면에 코팅될 때 표적 항원 상의 항체 결합 부위가 "은폐"되거나 항원이 "비틀어지기" 때문이다. 또한, 표적에 대한 DVD-Ig의 결합 불능은 직접 결합 ELISA 방식에서 DVD-Ig 상에 부과되는 입체 제한때문일 수 있다. 직접 결합 ELISA 방식에서 결합하지 않은 모 항체 및 DVD-Ig은 FACS, Biacore 또는 생물학적 정량과 같은 다른 ELISA 방식에서 표적 항원에 결합했다. DVD-Ig의 비-결합도 앞에서 보여준 것처럼 DVD-Ig의 2개의 가변 도메인 간에 링커 길이를 조정함으로써 복원되었다.
모든 DVD 작제물의 결합은 유지되었고 모 항체와 비슷했다. 모든 N-말단 가변 도메인은 모 항체와 유사한 높은 친화성으로 결합했다.
실시예
5.1.2:
BIACORE
기술을 이용한 친화성 측정
BIACORE
방법:
BIACORE 분석(Biacore, Inc, Piscataway, NJ)은 온-속도 및 오프-속도 상수의 속도론적 측정으로 항체 또는 DVD-Ig의 친화성을 결정한다. 표적 항원(예, 정제된 재조합 표적 항원)에 대한 항체 또는 DVD-Ig의 결합은 Biacore® 1000 또는 3000 기구(Biacore® AB, Uppsala, Sweden)로 진행 HBS-EP(10mM HEPES[pH 7.4], 150mM NaCl, 3mM EDTA 및 0.005% 계면활성제 P20)를 이용해 25℃에서 수행한 표면 플라스몬 공명-기반의 측정을 통해 결정한다. 모든 화학물질은 Biacore® AB(Uppsala, Sweden) 또는 본 명세서에 기술된 다른 공급원에서 입수했다. 예를 들어, 약 5000 RU의 염소 항-마우스 IgG, (Fcγ), 단편 특이적 폴리클로날 항체(Pierce Biotechnology Inc, Rockford, IL)를 10mM 아세트산나트륨(pH 4.5)에 희석한 희석물은 표준 아민 커플링 키트를 제조업체의 지시 및 절차에 따라 이용하여 CM5 연구용급 바이오센서 칩을 따라 25㎍/ml씩 직접 고정시켰다. 바이오센서 표면 상의 미반응 모이어티는 에탄올아민으로 차단했다. 플로셀 2와 4에서 미변형 카르복시메틸 덱스트란 표면은 반응 표면으로 사용했다. 염소 항-마우스 IgG가 없는 미변형 카르복시메틸 덱스트란은 플로셀 1 및 3에서 대조 표면으로 사용했다. 속도론 분석을 위해, 1:1 랭뮤어 결합 모델 유래의 속도 방정식은 총 8회 주입물의 결합 및 해리 상에 Biaevaluation 4.0.1 소프트웨어를 이용하여 동시에 일치시켰다(global fit 분석 이용). 정제된 항체 또는 DVD-Ig은 염소 항-마우스 IgG 특이적 반응 표면을 따라 포획을 위해 HEPES-완충 식염수에 희석한다. 리간드(25 ㎍/ml)로서 포획될 항체 또는 DVD-Ig은 반응 매트릭스 상에 5 ㎕/ml의 유속으로 주입했다. 결합 및 해리 속도 상수 kon(M-1s-1) 및 koff(s-1)는 연속적인 유속 25 ㎕/분 하에 결정된다. 속도 상수는 10 내지 200 nM 범위 내의 다른 항원 농도로 속도론적 결합 측정을 실시하여 유도된다. 항체 또는 DVD-Ig과 목표 항원 간에 반응의 평형 해리 상수(M)는 식 KD = koff/kon에 의해 속도론적 속도 상수로부터 계산했다. 결합은 시간의 함수로 기록하고 속도론적 속도 상수를 계산했다. 이 분석에서 106M-1s-1 만큼 빠른 온-속도 및 10-6s-1만큼 느린 오프-속도가 측정될 수 있다.
Biacore 기술에 의해 특성규명된 모든 DVD-Ig 작제물의 결합은 유지되었고 모 항체와 비슷했다. 모든 N-말단 가변 도메인은 모 항체와 유사한 높은 친화성으로 결합했다.
실시예
5.1.3:
IL
-1α/β 생물학적정량 및 중화 분석
MRC5 세포는 100 ㎕ 용적 중에 웰당 1.5-2 x 104 세포로 평판배양하고 37℃, 5% CO2에서 밤새 항온배양했다. 20㎍/ml 작업 스톡의 항체(4x 농축)는 완전 MEM 배지에 제조했다. 마쉬 희석 평판에서 완전 MEM을 이용하여 8회 연속 희석을 수행했다(5 ㎍/ml-0.0003 ㎍/ml). 각 항체 희석물 65 ㎕/웰를 96웰 v-바닥(Costar# 3894) 평판에 4반복으로 첨가하고, 200 pg/ml 용액의 IL-1α 또는 IL-1β 65 ㎕ 또는 50 pg/ml 용액의 IL-1α 및 IL-1β를 함유하는 혼합 용액 65㎕를 첨가했다. 대조 웰에는 65㎕ 200 pg/ml의 IL-α 또는 IL-1β, 또는 50 pg/ml 혼합 IL-1α/β(4x 농축) + 65㎕ MEM 배지를 첨가하고, 배지 대조용 웰에는 배지 130㎕를 첨가했다. 1시간 항온처리 후, Ab/Ag 혼합물 100㎕를 MRC5 세포에 첨가했다. 모든 웰의 용적은 200㎕로 동일했다. 모든 평판 시약은 그 다음 1x 농축했다. 16-20시간 항온처리 후, 웰 내용물(150㎕)은 96웰 둥근바닥 평판(Costar# 3799)으로 옮기고 -20℃ 동결기에 넣었다. 상청액은 사람 IL-8 ELISA 키트(R&D Systems, Minneapolis, MN) 또는 MSD hIL-8(화학발광 키트)를 이용하여 hIL-8 농도에 대해 검사했다. 중화 효능은 IL-1α, IL-1β 또는 IL-1α/β 단독 대조 값 대비 억제율을 계산하여 결정했다.
N-말단 또는 C-말단 위치에 AB032 유래의 VD를 함유하는 모든 DVD-Ig은 MRC5 IL-1α/β 중화 분석에서 중화 효과를 나타냈다.
실시예
5.1.4:
IL
-17 생물학적정량 및 중화 분석
사람 HS27 세포주(ATCC #CTL-1634)는 IL-17에 대한 반응으로 IL-6을 분비한다. IL-17 유도된 IL-6 분비는 중화성 항-IL-17 항체에 의해 억제된다(예컨대, J.Imm.155:5483-5486, 1995 또는 Cytokine 9: 794-800, 1997 참조).
HS27 세포는 분석 배지[DMEM 고농도 글루코스 배지(Gibco #11965) - 10% 소태아 혈청(Gibo #26140), 4mM L-글루타민, 1mM 피루브산 나트륨, 페니실린 G(100U/500ml) 및 스트렙토마이신(100 ㎍/500ml) 함유]에서 생육시켰다. 세포는 T150 플라스크에서 분석 일에 약 80-90% 융합성일 때까지 증식시켰다. 사람 IL-17(R&D Systems, #317-IL/CF)은 동결 보관 후 사용하기 위해 갓 해동한 Ca2 + 및 Mg2 + 없는 멸균 PBS에서 복원시키고 분석 배지로 40ng/ml(4X)로 희석했다. 다른 평판에 항체의 연속 희석물을 제조하고(4X 농축), 동량의 40ng/ml(4X) hu IL-17과 혼합하고 37℃에서 1시간 동안 항온처리했다. HS27 세포(보통 50 ㎕ 분석 배지 중에 약 20,000개 세포)는 96웰 평면 바닥 조직 배양 평판(Costar #3599)의 각 웰에 첨가하고, 그 후 예비항온처리된 항체 + IL-17 혼합물 50 ㎕를 첨가했다. IL-17의 최종 농도는 10ng/ml였다. 세포는 37℃에서 약 24시간 동안 항온배양했다. 그 다음, 배지 상청액을 수집했다. IL-17 중화 수준은 시판 Meso Scale Discovery 키트를 제조업체의 지시에 따라 이용하여 상청액 중의 IL-6의 함량을 측정함으로써 계측했다. IC50 값은 항체 대 IL-6 함량 가변 기울기 피트의 로그값을 이용하여 수득했다(표 57).
N-말단 또는 C-말단 위치에 AB029 유래의 VD를 함유하는 모든 DVD-Ig은 IL-17 중화 분석에서 중화 효과를 나타냈다.
실시예
5.1.5: 항-
PGE
2
항체 또는 항-
PGE
2
함유
DVD
-
Ig
분자의
PGE
2
결합능을
측정하기 위한 효소면역분석법
프로스타글란딘 E2에 결합하는 항-PGE2 항체 또는 항-PGE2 함유 DVD-Ig 분자를 선별하기 위한 효소면역분석법은 다음과 같이 수행했다.
ELISA 평판(Costar 3369, Corning, NY)은 PBS(Invitrogen, Carlsbad, CA)에 2㎍/ml인 항-숙주 Fc IgG(Sigma, St.Louis, MO) 50㎕로 코팅했다. 4℃에서 밤새 항온처리한 후, 평판은 200㎕ Superblock(Pierce #37535, Rockford, IL)으로 차단했다. IgG 함유 시료는 분석 완충액(0.05% Surfactamps(Pierce #37535, Rockford, IL) 함유 PBS 중의 10% Superblock)에 1㎍/ml로 희석하고, 50 ㎕/웰씩 평판에 주입하여 실온에서 1시간 동안 항온처리했다. 항온처리한 후, 평판은 TTBS(Tween-Tris 완충 용액)로 4회 세척했다. PGE2-비오틴아미드(Cayman Chemicals, Ann Arbor, MI)는 30nM로 희석하고 분석 완충액에 연속 희석했다. 적정 곡선은 각 IgG 시료에 50 ㎕/웰의 용적으로 첨가하고, 실온에서 1시간 동안 항온처리했다. 평판은 전술한 바와 같이 세척하고, 분석 완충액 중에 1:5000 희석율의 스트렙트아비딘 polyhrp40 (Fitzgerald Industries, Concord, MA) 50 ㎕/웰을 첨가하고 실온에서 45분 동안 항온처리했다. 최종 세척 단계를 수행하고, 평판은 1단계 TMB 시스템(Sigma #T8665, St. Louis, MO) 및 2N H2SO4를 이용하여 발색시켰다. 평판은 Molecular Devices Spectramax 평판 판독기(Sunnyvale, CA)에서 450nm로 판독했다. EC50은 GraphPad Prism 5(GraphPad Software, La Jolla, CA)를 이용하여 측정했다.
모든 DVD-Ig의 결합은 유지되었고 모 항체와 비슷했다.
실시예
5.5.6: 항-
PGE
2
항체 또는 항-
PGE
2
함유
DVD
-
Ig
분자의
PGE
2
중화능을
측정하기 위한
EP4
생물학적정량
PGE2의 세포 반응을 억제하는 항-PGE2 항체 및 항-PGE2 함유 DVD-Ig 분자의 능력은 사람 EP4로 안정하게 형질감염된 HEK293 Gα16 세포에서 Ca++ 유속 분석으로 결정된다. 세포는 검정색/투명 폴리-D-리신 평판(Corning #3667)에서 평판배양하고 Ca++-민감성 염료(Molecular Devices)와 90분 동안 항온배양했다. 스톡 PGE2(200 프루프 에탄올 중)는 FLIPR 완충액(1X HBSS, 20mM HEPES, 0.1% BSA 및 2.5mM 프로베네시드 함유)으로 희석했다. 또한, 항-PGE2 항체, DVD-Ig 분자 또는 이소타입 부합성 대조 항체는 FLIPR 완충액에 사전희석했다. 세포가 예비평판배양된 웰에 PGE2 또는 예비항온처리된 PGE2/항체 혼합물 또는 예비항온처리된 PGE2/DVD-Ig 분자 혼합물을 25 ㎕ 첨가했다. PGE2의 용량 반응은 PGE2의 연속 적정으로 수행하고 FLIPR1 또는 Tetra(Molecular Devices)로 결정했다. EC50은 GraphPad Prism 5로 측정했다. 항체와 DVD-Ig 분자를 검사하기 위해, EC50 농도의 PGE2를 다양한 농도의 검사물 또는 이소타입 부합성 항체(음성 대조군)와 20분 동안 항온처리하고, HEK293 Gα16 세포 중의 염료-로딩된 사람 EP4에 첨가했다. Ca++ 유속은 FLIPR1로 모니터하고 데이터는 GraphPad Prism 5로 분석했다.
DVD-Ig은 PGE2에 대한 세포 반응을 억제하는 능력을 유지했고 모 항체와 비슷했다.
실시예
5.5.7:
사람화된
모노클로날
항체의 이화학적 및
시험관내
안정성 분석
크기 배제 크로마토그래피
항체는 물로 2.5mg/ml로 희석하고 20ml를 TSK 겔 G300 SWXL 컬럼(Tosoh Bioscience, cat# k5539-05k)을 이용하는 시마즈 HPLC 시스템에서 분석했다. 시료는 211 mM 황산나트륨, 92mM 인산나트륨 pH 7.0으로 0.3ml/분의 유속으로 컬럼으로부터 용출시켰다. HPLC 시스템 작동 조건은 다음과 같다:
이동상: 211mM Na2SO4, 92mM Na2HPO4*7H2O, pH 7.0
구배: 등용매
유속: 0.3ml/분
검출기 파장: 280nm
자동샘플러 냉각기 온도: 4℃
컬럼 오븐 온도: 상온
진행 시간: 50분
표 60은 단량체 백분율(예상 분자량의 미응집 단백질)로 나타낸 모 항체 및 DVD-Ig 작제물의 순도 데이터이다.
DVD-Ig은 대부분의 DVD-Ig이 >90% 단량체를 나타내는 우수한 SEC 프로필을 나타냈다. 이 DVD-Ig 프로필은 모 항체에서 관찰된 것과 유사하다.
실시예
5.5.8:
유세포측정으로
평가 시, 사람 종양 세포주의 표면에 대한
모노클로날
항체의 결합
당해의 세포 표면 항원 또는 사람 종양 세포주를 과발현하는 안정한 세포주는 조직배양 플라스크에서 수거하고 5% 소 태아 혈청 함유 인산염 완충 식염수(PBS/FBS)에 재현탁시켰다. 염색하기 전에 사람 종양 세포는 PBS/FCS 중의 5 ㎍/ml의 사람 IgG(100 ㎕)과 얼음 상에서 항온처리했다. 1-5 x 105 세포는 PBS/FBS 중의 항체 또는 DVD-Ig(2 ㎍/ml)과 얼음 상에서 30 내지 60분 동안 항온처리했다. 세포는 2회 세척하고, F(ab')2 염소 항-사람 IgG, Fcγ-피코에리트린(PBS 중에 1:200 희석물)(Jackson ImmunoResearch, West Grove, PA, Cat. # 109-116-170) 100 ㎕를 첨가했다. 얼음에서 30분간 항온처리한 후, 세포는 2회 세척하고, PBS/FBS에 재현탁시켰다. 형광은 Becton Dickinson FACSCalibur(Becton Dickinson, San Jose, CA)를 이용하여 측정했다.
표 61은 DVD-Ig 작제물의 FACS 데이터이다. 기하 평균은 형광 시그널의 곱셈값의 n제곱근이다(a1 x a2 x a3...an). log-변환된 데이터와 함께 기하 평균은 데이터 분포의 가중치를 정규화하는데 사용한다. 다음 표는 모 항체 및 DVD-Ig 작제물의 FACS 기하 평균이다.
모든 DVD는 세포 표면 표적에 결합하는 것으로 나타났다. DVD의 N-말단 도메인은 모 항체만큼 또는 그 이상으로 세포 표면 상의 표적에 결합했다. 결합은 링커 길이를 조정하여 복원 또는 향상시킬 수 있다.
실시예
5.5.9: 293 세포에서의 형질감염 및 발현
대조 항체 및 DVD의 발현은 HEK293(EBNA) 세포를 대응 경쇄(LC) 및 중쇄(HC) 유전자를 함유하는 플라스미드로 일시적으로 공동형질감염시켜 달성했다. HEK293(EBNA) 세포는 플라스크(2L Corning Cat#431198)에서 0.5L 용량의 Freestyle 293 배지(Invitrogen, Carlsbad CA)에서 CO2 항온배양기(8% CO2, 125 RPM, 37℃)에서 진탕시키면서 증식시켰다. 배양물이 1x106 세포/ml의 밀도에 이르면, 세포는 형질감염 복합체로 형질감염시켰다. 형질감염 복합체는 먼저 150 ㎍ LC-플라스미드와 100 ㎍ HC-플라스미드를 25ml Freestyle 배지에서 함께 혼합하고, 그 후 500 ㎕ PEI 스톡 용액[스톡 용액: 1mg/ml(pH 7.0) 선형 25kDa PEI, Polysciences Cat# 23966]을 첨가하여 제조했다. 형질감염 복합체는 역위 혼합하고 세포 배양물에 첨가하기 전에 10분 동안 실온에서 항온처리했다. 형질감염 후, 배양물은 CO2 항온배양기(8% CO2, 125RPM, 37℃)에서 계속 증식시켰다. 형질감염 24시간 후, 배양물은 10% 트립톤 N1 용액(Organo Technie, La Courneuve France Cat# 19553) 25ml를 보충했다. 형질감염 9일 후, 세포는 원심분리(16,000g, 10분)하여 배양물로부터 제거하고, 남은 상청액은 멸균 여과(Millipore HV Durapore Stericup, 0.45㎛)하고 정제 단계를 개시할 때까지 4℃에서 보관했다.
각 항체 또는 DVD-Ig은 MabSelect SuRe 수지(GE Healthcare)를 함유하는 1회용 1ml 충진 컬럼(Orochem Technologies에 의해 충진됨)을 이용하여 각각 정제했다. 컬럼은 PBS로 예비평형화시키고, 그 후 수거한 0.55L 시료를 밤새(15시간) 1ml/분의 속도로 로딩하고, 관류물은 공급 용기로 재순환시켰다. 로딩 단계 후, 컬럼은 20ml PBS로 세척하고, 단백질은 용출 완충액[50mM 시트르산 pH 3.5]을 4ml/분의 속도로 공급하여 용출시키고 분획(1ml)은 미리 1.5M Tris pH8.2(최종 pH가 약 6.0이 되도록)를 0.2ml 담아 놓은 튜브에 수집했다. 항체 함유 분획은 크로마토그램에 기초하여 수집하고 최종 보관 완충액[10mM 시트르산, 10mM Na2HPO4, pH 6.0]에 투석했다. 투석 후, 시료는 0.22 ㎛ Steriflip(Millipore)를 통해 여과하고 단백질 농도는 흡광도[Hewlett Packard 8453 다이오드 어레이 분광광도계]로 측정했다.
SDS-PAGE 분석은 분석 시료(환원 및 비환원)를 가지고 수행하여 최종 순도를 평가하고 적당한 크기의 중쇄 및 경쇄 밴드의 존재를 입증하고 유의적인 함량의 유리(즉, 미복합체) 경쇄(비환원 시료 중)의 부재를 확인했다.
표 62는 293 세포에서 리터당 mg으로 나타낸 모 항체 또는 DVD-Ig 작제물의 수율 데이터이다.
모든 DVD는 293 세포에서 잘 발현되었다. DVD는 단백질 A 컬럼 상에서 쉽게 정제될 수 있다. 대부분의 경우에 >5mg/L의 정제된 DVD-Ig이 293 세포의 상청액으로부터 쉽게 수득될 수 있다.
실시예
5.5.10: A/B
DVD
-
Ig
의 특성규명 및 주 선택
항-A/B DVD-Ig의 결합 친화성은 단백질 A 및 단백질 B 모두에 대하여 Biacore로 분석했다. DVD-Ig의 4가 성질은 Biacore에서의 다중 결합 연구로 조사했다. 한편, 단백질 A 및 단백질 B에 대한 DVD-Ig의 중화 효능은 각각 전술한 바와 같이 생물학적정량으로 평가했다. 본래의 모 mAb의 친화성 및 효능을 가장 잘 보유하는 DVD-Ig 분자는 각 mAb에 대해 전술한 바와 같이 면밀한 이화학적 및 생물분석학적(래트 PK) 특성규명을 위해 선택한다. 분석 수집데이터를 토대로, 최종 주 DVD-Ig을 CHO 안정한 세포주 개발에 사용하고 CHO-유래의 물질을 사이노몰거스 원숭이에서 안정성, 약동학 및 효능 연구, 및 예비제형 활성에 이용한다.
본 발명은 분자 생물학 및 약물 전달 분야에 익히 공지된 기술을 전체적으로 참고 인용한다. 이 기술들은 다음 문헌들에 기술된 기술을 포함하나, 이에 국한되는 것은 아니다:
참고 인용
본 출원에 인용될 수 있는 모든 인용문헌(문헌 참조, 특허, 특허출원, 데이터베이스 및 웹사이트 포함)의 내용은 본원에 인용된 문헌인 바, 전문이 참고인용된 것이 분명하다. 본 발명의 실시는 다른 언급이 없는 한, 당업계에 익히 공지된 면역학, 분자생물학 및 세포생물학의 통상의 기술을 이용할 것이다.
등가물
본 발명은 이의 취지 또는 필수 특성에서 벗어남이 없이 다른 특정 형태로 구현될 수 있다. 따라서, 전술한 구체예들은 모든 면에서 본 명세서에 기술된 본 발명을 제한하기 보다는 예시하는 것으로 생각되어야 한다. 따라서, 본 발명의 범위는 상기 상세한 설명보다는 이하 특허청구범위에 의해 표시되며, 이에 따라 특허청구범위의 등가 범위 및 의미에 속하는 모든 변화는 본 발명에 포함되는 것으로 간주된다.
<110> Abbott Laboratories
<120> Prostaglandin E2 dual variable domain immunoglobulins and uses
thereof
<130> 9264.WO.O1
<150> US 61/134,284
<151> 2008-07-08
<150> US 61/191,711
<151> 2008-09-11
<160> 182
<170> KopatentIn 1.71
<210> 1
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 1
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1 5 10 15
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 2
Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg
1 5 10 15
Val
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 3
Ala Lys Thr Thr Pro Lys Leu Gly Gly
1 5
<210> 4
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 4
Ser Ala Lys Thr Thr Pro Lys Leu Gly Gly
1 5 10
<210> 5
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 5
Ser Ala Lys Thr Thr Pro
1 5
<210> 6
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 6
Arg Ala Asp Ala Ala Pro
1 5
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 7
Arg Ala Asp Ala Ala Pro Thr Val Ser
1 5
<210> 8
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 8
Arg Ala Asp Ala Ala Ala Ala Gly Gly Pro Gly Ser
1 5 10
<210> 9
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 9
Arg Ala Asp Ala Ala Ala Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 10
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 10
Ser Ala Lys Thr Thr Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala
1 5 10 15
Arg Val
<210> 11
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 11
Ala Asp Ala Ala Pro
1 5
<210> 12
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 12
Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro
1 5 10
<210> 13
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 13
Thr Val Ala Ala Pro
1 5
<210> 14
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 14
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
1 5 10
<210> 15
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 15
Gln Pro Lys Ala Ala Pro
1 5
<210> 16
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 16
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro
1 5 10
<210> 17
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 17
Ala Lys Thr Thr Pro Pro
1 5
<210> 18
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 18
Ala Lys Thr Thr Pro Pro Ser Val Thr Pro Leu Ala Pro
1 5 10
<210> 19
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 19
Ala Lys Thr Thr Ala Pro
1 5
<210> 20
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 20
Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala Pro
1 5 10
<210> 21
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 21
Ala Ser Thr Lys Gly Pro
1 5
<210> 22
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 22
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
1 5 10
<210> 23
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 23
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 24
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 24
Gly Glu Asn Lys Val Glu Tyr Ala Pro Ala Leu Met Ala Leu Ser
1 5 10 15
<210> 25
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 25
Gly Pro Ala Lys Glu Leu Thr Pro Leu Lys Glu Ala Lys Val Ser
1 5 10 15
<210> 26
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 26
Gly His Glu Ala Ala Ala Val Met Gln Val Gln Tyr Pro Ala Ser
1 5 10 15
<210> 27
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 27
Gly Gly Gly Gly Ser
1 5
<210> 28
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 29
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 29
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 30
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 31
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 31
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 32
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 32
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ile Gly Tyr
20 25 30
Asp Leu Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Trp Gly Asp Gly Thr Thr Asp Tyr Asn Ser Ala Val Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Gly Tyr Trp Tyr Ala Thr Ser Tyr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 33
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 33
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Asn
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Phe His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Glu His Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 34
<211> 127
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 34
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 35
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 35
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg
100 105
<210> 36
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 36
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 37
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 37
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg
100 105
<210> 38
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 38
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Asn
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Glu Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Thr Asn Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Arg Ile Ile Tyr Asp Val Glu Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 39
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 39
Gln Ile Val Leu Ile Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Gly Tyr Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 40
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 40
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Arg Ser Gly Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Tyr Asp His Tyr Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 41
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 41
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 42
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 42
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile His Asn Arg Gly Thr Ile Phe Tyr Leu Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Thr
85 90 95
Arg Gly Arg Ser Asn Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 43
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 43
Asp Val Leu Val Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Thr Gln Thr Leu Val His Arg
20 25 30
Asn Gly Asp Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Ser Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 44
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 44
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 45
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 45
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 46
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 46
Glu Val Gln Leu Val Gln Ser Gly Thr Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Val Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Tyr Pro Gly Asp Ser Glu Thr Arg Tyr Ser Pro Thr Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Phe Asn Thr Ala Phe
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Ser Gly Trp Tyr Pro Tyr Thr Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 47
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 47
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Ile Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Phe Ile
35 40 45
Tyr Thr Ala Ser Thr Arg Ala Thr Asp Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Ser
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg
100 105
<210> 48
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 48
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 49
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 49
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 50
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 50
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Val Ser Gly Tyr Phe Phe Thr Thr Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Tyr Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Asn Trp Asn Cys Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 51
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 51
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Arg Tyr Gly Ser Ser His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Ser Arg
100 105
<210> 52
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 52
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Gln Ser Phe Gly Tyr Ile Phe Ile Asp His
20 25 30
Thr Ile His Trp Met Arg Gln Met Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Ser Pro Arg His Asp Ile Thr Lys Tyr Asn Glu Met Phe
50 55 60
Arg Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Phe Cys
85 90 95
Ala Arg Gly Gly Phe Tyr Gly Ser Thr Ile Trp Phe Asp Phe Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 53
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 53
Glu Thr Thr Val Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Thr Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Phe Gln Gln Glu Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Ile Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Lys Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 54
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 54
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser
115
<210> 55
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 55
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 56
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 56
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Val Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Thr Trp Ile Arg Gln Ser Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly His Ile Tyr Tyr Ser Gly Asn Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Ile Asp Thr Ser Lys Thr Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Ile Tyr Tyr
85 90 95
Cys Val Arg Asp Arg Val Thr Gly Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 57
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln His Phe Asp His Leu Pro Leu
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 58
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 58
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Gly Gly Asn Thr Asp Tyr Asn Thr Pro Phe Thr
50 55 60
Ser Arg Leu Ser Ile Asn Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ser Asn Asp Thr Ala Ile Tyr Tyr Cys Ala
85 90 95
Arg Ala Leu Thr Tyr Tyr Asp Tyr Glu Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 59
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 59
Asp Ile Leu Leu Thr Gln Ser Pro Val Ile Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Val Ser Phe Ser Cys Arg Ala Ser Gln Ser Ile Gly Thr Asn
20 25 30
Ile His Trp Tyr Gln Gln Arg Thr Asn Gly Ser Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Glu Ser Ile Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn Ser Val Glu Ser
65 70 75 80
Glu Asp Ile Ala Asp Tyr Tyr Cys Gln Gln Asn Asn Asn Trp Pro Thr
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 60
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 60
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Thr Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Arg Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Leu Gly Trp Ser Asp Ser Tyr Tyr Tyr Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 61
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 61
Asp Ile Gln Met Thr Gln Phe Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Asp
20 25 30
Leu Gly Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Arg Leu Ile
35 40 45
Tyr Ala Ala Ser Arg Leu His Arg Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln His Asn Ser Tyr Pro Cys
85 90 95
Ser Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 62
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 63
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 63
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 64
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 64
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 65
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 65
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 66
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 66
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 67
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 67
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 68
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 68
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 69
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 69
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 70
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 70
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 71
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 71
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 72
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 72
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 73
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 73
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 74
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 74
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 75
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 75
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 76
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 76
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 77
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 77
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 78
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 78
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 79
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 79
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 80
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 80
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 81
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 81
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 82
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 82
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 83
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 83
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 84
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 84
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Tyr Gly Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 85
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 85
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 86
<211> 237
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 86
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Gln Val Gln Leu Gln Gln Ser
115 120 125
Gly Pro Glu Leu Val Arg Pro Gly Ser Ser Val Lys Ile Ser Cys Lys
130 135 140
Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Lys Gln
145 150 155 160
Arg Pro Gly His Gly Leu Glu Trp Ile Gly Asp Ile Tyr Pro Gly Tyr
165 170 175
Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Lys Ala Thr Leu Thr
180 185 190
Val Asp Thr Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr
195 200 205
Ser Glu Asp Ser Ala Ile Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser
210 215 220
Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
225 230 235
<210> 87
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 87
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 88
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 88
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 89
<211> 220
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 89
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Asp Val Leu Met Thr
100 105 110
Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile
115 120 125
Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr
130 135 140
Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile
145 150 155 160
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
165 170 175
Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
180 185 190
Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr
195 200 205
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
210 215 220
<210> 90
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 90
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
100 105
<210> 91
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 91
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 92
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 92
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Gln
115 120 125
Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser Ser
130 135 140
Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr Met
195 200 205
Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ala
<210> 93
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 93
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala Pro
100 105 110
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
115 120 125
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
130 135 140
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
145 150 155 160
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
165 170 175
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
180 185 190
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
195 200 205
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
210 215 220
Arg
225
<210> 94
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 94
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Ala Lys Thr Thr Ala Pro Ser
115 120 125
Val Tyr Pro Leu Ala Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu
130 135 140
Leu Val Arg Pro Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly
145 150 155 160
Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly
165 170 175
His Gly Leu Glu Trp Ile Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr
180 185 190
His Tyr Asn Glu Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Thr
195 200 205
Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
210 215 220
Ser Ala Ile Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp
225 230 235 240
Gly Gln Gly Thr Leu Val Thr Val Ser Ala
245 250
<210> 95
<211> 232
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 95
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ala Asp Ala Ala Pro
100 105 110
Thr Val Ser Ile Phe Pro Pro Asp Val Leu Met Thr Gln Thr Pro Leu
115 120 125
Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Thr Ser
130 135 140
Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr
145 150 155 160
Leu Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser
165 170 175
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
180 185 190
Thr Val Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly
195 200 205
Val Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly
210 215 220
Gly Thr Lys Leu Glu Ile Lys Arg
225 230
<210> 96
<211> 237
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 96
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val
115 120 125
Lys Pro Gly Ala Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser
130 135 140
Phe Thr Asp Tyr Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser
145 150 155 160
Leu Glu Trp Val Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr
165 170 175
Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser
180 185 190
Ser Thr Ala Tyr Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala
195 200 205
Val Tyr Tyr Cys Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe
210 215 220
Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser Ser
225 230 235
<210> 97
<211> 220
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 97
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro
115 120 125
Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr
130 135 140
Met His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile
145 150 155 160
Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
165 170 175
Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala
180 185 190
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu
195 200 205
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg
210 215 220
<210> 98
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 98
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Ala Lys Thr Thr Ala Pro Glu Phe Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Arg Ile Ser Cys
130 135 140
Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr Asn Met Asn Trp Val Lys
145 150 155 160
Gln Ser Asn Gly Lys Ser Leu Glu Trp Val Gly Val Ile Asn Pro Asn
165 170 175
Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu
180 185 190
Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr Met Gln Leu Asn Ser Leu
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Lys Trp Gly Gln
210 215 220
Leu Gly Arg Gly Phe Phe Asp Val Trp Gly Thr Gly Thr Thr Val Thr
225 230 235 240
Val Ser Ser
<210> 99
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 99
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Gln Ile Val Leu Ser Gln Ser Pro Ala Ile
115 120 125
Leu Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser
130 135 140
Ser Ser Val Ser Tyr Met His Trp Phe Gln Gln Lys Pro Gly Ser Ser
145 150 155 160
Pro Lys Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro
165 170 175
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
180 185 190
Ser Arg Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp
195 200 205
Ser Ser Ser Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
210 215 220
Arg
225
<210> 100
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 100
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Ala Lys Thr Thr Ala Pro Ser Val Tyr Pro Leu Ala
115 120 125
Pro Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly
130 135 140
Ala Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp
145 150 155 160
Tyr Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp
165 170 175
Val Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys
180 185 190
Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala
195 200 205
Tyr Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp
225 230 235 240
Gly Thr Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 101
<211> 232
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 101
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Ala Asp Ala Ala Pro Thr Val Ser Ile Phe Pro Pro Gln Ile Val
115 120 125
Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly Glu Lys Val
130 135 140
Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met His Trp Phe
145 150 155 160
Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr Ala Thr Ser
165 170 175
Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
180 185 190
Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu Asp Ala Ala
195 200 205
Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr Phe Gly Ala
210 215 220
Gly Thr Lys Leu Glu Leu Lys Arg
225 230
<210> 102
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 102
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Gln
115 120 125
Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser Ser
130 135 140
Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr Met
195 200 205
Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ala
<210> 103
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 103
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
115 120 125
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
130 135 140
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
145 150 155 160
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
165 170 175
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
180 185 190
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
195 200 205
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
210 215 220
Arg
225
<210> 104
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 104
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Val
35 40 45
Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp Gly
100 105 110
Thr Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Gln Val Gln Leu Gln Gln Ser Gly Pro Glu
130 135 140
Leu Val Arg Pro Gly Ser Ser Val Lys Ile Ser Cys Lys Ala Ser Gly
145 150 155 160
Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Lys Gln Arg Pro Gly
165 170 175
His Gly Leu Glu Trp Ile Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr
180 185 190
His Tyr Asn Glu Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Thr
195 200 205
Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
210 215 220
Ser Ala Ile Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp
225 230 235 240
Gly Gln Gly Thr Leu Val Thr Val Ser Ala
245 250
<210> 105
<211> 232
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 105
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Asp Val Leu Met Thr Gln Thr Pro Leu
115 120 125
Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Thr Ser
130 135 140
Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr
145 150 155 160
Leu Gln Arg Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser
165 170 175
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
180 185 190
Thr Val Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly
195 200 205
Val Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly
210 215 220
Gly Thr Lys Leu Glu Ile Lys Arg
225 230
<210> 106
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 106
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Glu Phe Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Arg Ile Ser Cys
130 135 140
Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr Asn Met Asn Trp Val Lys
145 150 155 160
Gln Ser Asn Gly Lys Ser Leu Glu Trp Val Gly Val Ile Asn Pro Asn
165 170 175
Tyr Gly Ser Ser Thr Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu
180 185 190
Thr Val Asp Gln Ser Ser Ser Thr Ala Tyr Met Gln Leu Asn Ser Leu
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Lys Trp Gly Gln
210 215 220
Leu Gly Arg Gly Phe Phe Asp Val Trp Gly Thr Gly Thr Thr Val Thr
225 230 235 240
Val Ser Ser
<210> 107
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 107
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Gln Ile Val Leu Ser Gln Ser Pro Ala Ile
115 120 125
Leu Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser
130 135 140
Ser Ser Val Ser Tyr Met His Trp Phe Gln Gln Lys Pro Gly Ser Ser
145 150 155 160
Pro Lys Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro
165 170 175
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
180 185 190
Ser Arg Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp
195 200 205
Ser Ser Ser Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
210 215 220
Arg
225
<210> 108
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 108
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ser
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly
130 135 140
Ala Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp
145 150 155 160
Tyr Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp
165 170 175
Val Gly Val Ile Asn Pro Asn Tyr Gly Ser Ser Thr Tyr Asn Gln Lys
180 185 190
Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Gln Ser Ser Ser Thr Ala
195 200 205
Tyr Met Gln Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Lys Trp Gly Gln Leu Gly Arg Gly Phe Phe Asp Val Trp
225 230 235 240
Gly Thr Gly Thr Thr Val Thr Val Ser Ser
245 250
<210> 109
<211> 232
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 109
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Val Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Gln Ile Val
115 120 125
Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly Glu Lys Val
130 135 140
Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met His Trp Phe
145 150 155 160
Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr Ala Thr Ser
165 170 175
Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
180 185 190
Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu Asp Ala Ala
195 200 205
Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Ser Pro Leu Thr Phe Gly Ala
210 215 220
Gly Thr Lys Leu Glu Leu Lys Arg
225 230
<210> 110
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 110
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 111
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 111
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 112
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 112
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 113
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 113
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 114
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 114
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Thr Trp Asn
165 170 175
Ser Gly His Ile Asp Tyr Ala Asp Ser Val Glu Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Val Ser Tyr Leu
210 215 220
Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 115
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 115
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
115 120 125
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
130 135 140
Gln Gly Ile Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
145 150 155 160
Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val
165 170 175
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
180 185 190
Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg
195 200 205
Tyr Asn Arg Ala Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 116
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 116
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
130 135 140
Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp
145 150 155 160
Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Val Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser
180 185 190
Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu
195 200 205
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp
225 230 235 240
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 117
<211> 233
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 117
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Asp Ile Gln
115 120 125
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
130 135 140
Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr Leu Ala Trp
145 150 155 160
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
165 170 175
Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
180 185 190
Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val
195 200 205
Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr Thr Phe Gly
210 215 220
Gln Gly Thr Lys Val Glu Ile Lys Arg
225 230
<210> 118
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 118
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 119
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 119
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 120
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 120
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu
130 135 140
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
145 150 155 160
Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Arg Gln Ala Pro Gly
165 170 175
Gln Gly Leu Glu Trp Met Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr
180 185 190
His Tyr Asn Glu Lys Phe Lys Asp Arg Val Thr Leu Thr Thr Asp Thr
195 200 205
Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp
210 215 220
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp
225 230 235 240
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
245 250
<210> 121
<211> 233
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Asp Val Leu Met Thr Gln Thr Pro
115 120 125
Leu Ser Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr
130 135 140
Ser Ser Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp
145 150 155 160
Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val
165 170 175
Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser
180 185 190
Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val
195 200 205
Gly Val Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly
210 215 220
Gly Gly Thr Lys Val Glu Ile Lys Arg
225 230
<210> 122
<211> 330
<212> PRT
<213> Homo sapiens
<400> 122
Ala Ser Thr Lys Gly Pro Ser Val Phe Phe Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 123
<211> 330
<212> PRT
<213> Homo sapiens
<400> 123
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 124
<211> 106
<212> PRT
<213> Homo sapiens
<400> 124
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 125
<211> 105
<212> PRT
<213> Homo sapiens
<400> 125
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 126
<211> 332
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 126
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
225 230 235 240
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
245 250 255
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
260 265 270
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
275 280 285
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
290 295 300
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
305 310 315 320
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 127
<211> 573
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 127
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
245 250 255
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
260 265 270
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
275 280 285
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
290 295 300
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
305 310 315 320
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
325 330 335
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
465 470 475 480
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
565 570
<210> 128
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 128
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe
50 55 60
Lys Arg Arg Phe Thr Phe Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Tyr Pro His Tyr Tyr Gly Ser Ser His Trp Tyr Phe Asp Val
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
130 135 140
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys
145 150 155 160
Tyr Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
165 170 175
Met Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys
180 185 190
Phe Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala
195 200 205
Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 129
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Val Leu Ile
35 40 45
Tyr Phe Thr Ser Ser Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Thr Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 130
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 130
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Tyr Thr Phe Thr Asn Tyr Gly Met Asn Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Trp Ile Asn Thr Tyr
165 170 175
Thr Gly Glu Pro Thr Tyr Ala Ala Asp Phe Lys Arg Arg Phe Thr Phe
180 185 190
Ser Leu Asp Thr Ser Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Tyr Pro His Tyr
210 215 220
Tyr Gly Ser Ser His Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 131
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 131
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
115 120 125
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ser Ala Ser
130 135 140
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
145 150 155 160
Ala Pro Lys Val Leu Ile Tyr Phe Thr Ser Ser Leu His Ser Gly Val
165 170 175
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
180 185 190
Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
195 200 205
Tyr Ser Thr Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 132
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 132
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ile Gly Tyr
20 25 30
Asp Leu Asn Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Trp Gly Asp Gly Thr Thr Asp Tyr Asn Ser Ala Val Lys
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Gly Tyr Trp Tyr Ala Thr Ser Tyr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 133
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 133
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Asn Asn
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Phe His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Glu His Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 134
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 134
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Gln Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Lys Pro Ser Glu Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Phe Ser Leu Ile Gly Tyr Asp Leu Asn Trp Ile Arg
145 150 155 160
Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Ile Ile Trp Gly Asp
165 170 175
Gly Thr Thr Asp Tyr Asn Ser Ala Val Lys Ser Arg Val Thr Ile Ser
180 185 190
Lys Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Leu Ser Ser Val Thr
195 200 205
Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Gly Gly Tyr Trp Tyr
210 215 220
Ala Thr Ser Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 135
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 135
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
115 120 125
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
130 135 140
Gln Ser Ile Ser Asn Asn Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
145 150 155 160
Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Phe His Ser Gly Val
165 170 175
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
180 185 190
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
195 200 205
Glu His Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
210 215 220
Lys Arg
225
<210> 136
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 136
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
130 135 140
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
145 150 155 160
Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln
165 170 175
Gly Leu Glu Trp Met Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His
180 185 190
Tyr Asn Glu Lys Phe Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser
195 200 205
Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 137
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 137
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr
115 120 125
Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val
130 135 140
His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly
145 150 155 160
Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly
165 170 175
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
180 185 190
Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe
195 200 205
Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
210 215 220
Ile Lys Arg
225
<210> 138
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 138
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Trp Met Asn Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ala Ile Asn Gln Asp
165 170 175
Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val Lys Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg Asp Tyr Tyr Asp
210 215 220
Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp Tyr Phe Asp Leu Trp Gly
225 230 235 240
Arg Gly Thr Leu Val Thr Val Ser Ser
245
<210> 139
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 139
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
115 120 125
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
130 135 140
Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
145 150 155 160
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly
165 170 175
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
180 185 190
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
195 200 205
Gln Tyr Gly Ser Ser Pro Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu
210 215 220
Ile Lys Arg
225
<210> 140
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 140
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu
115 120 125
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Tyr
165 170 175
Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Arg Val
180 185 190
Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg
195 200 205
Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Asp
210 215 220
Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 141
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 141
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 142
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 142
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Gln Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr Gly Met Asn Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ile Ile Trp Tyr Asp
165 170 175
Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Gly Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asp Leu Arg Thr
210 215 220
Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 143
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 143
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Glu Ile Val Leu Thr Gln Ser Pro Asp Phe
115 120 125
Gln Ser Val Thr Pro Lys Glu Lys Val Thr Ile Thr Cys Arg Ala Ser
130 135 140
Gln Ser Ile Gly Ser Ser Leu His Trp Tyr Gln Gln Lys Pro Asp Gln
145 150 155 160
Ser Pro Lys Leu Leu Ile Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val
165 170 175
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
180 185 190
Ile Asn Ser Leu Glu Ala Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln
195 200 205
Ser Ser Ser Leu Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile
210 215 220
Lys Arg
225
<210> 144
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 144
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Asn
20 25 30
Gly Met Gly Val Ser Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Tyr Trp Asp Glu Asp Lys Arg Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Thr Asn Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Arg Ile Ile Tyr Asp Val Glu Asp Tyr Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
130 135 140
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys
145 150 155 160
Tyr Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
165 170 175
Met Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys
180 185 190
Phe Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala
195 200 205
Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr
210 215 220
Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser
245
<210> 145
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 145
Gln Ile Val Leu Ile Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Gly Tyr Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
115 120 125
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
130 135 140
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
145 150 155 160
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
165 170 175
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
180 185 190
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
195 200 205
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
210 215 220
Arg
225
<210> 146
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 146
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Gln Val Thr Leu Lys Glu
115 120 125
Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln Thr Leu Ser Leu Thr Cys
130 135 140
Ser Phe Ser Gly Phe Ser Leu Ser Thr Asn Gly Met Gly Val Ser Trp
145 150 155 160
Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu Trp Leu Ala His Ile Tyr
165 170 175
Trp Asp Glu Asp Lys Arg Tyr Asn Pro Ser Leu Lys Ser Arg Leu Thr
180 185 190
Ile Ser Lys Asp Thr Ser Asn Asn Gln Val Phe Leu Lys Ile Thr Asn
195 200 205
Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr Cys Ala Arg Arg Arg Ile
210 215 220
Ile Tyr Asp Val Glu Asp Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr
225 230 235 240
Leu Thr Val Ser Ser
245
<210> 147
<211> 225
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 147
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Gln Ile Val Leu Ile Gln Ser Pro Ala Ile
115 120 125
Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser
130 135 140
Ser Ser Val Ser Tyr Met Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser
145 150 155 160
Pro Arg Leu Leu Ile Tyr Asp Thr Ser Asn Leu Ala Ser Gly Val Pro
165 170 175
Val Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile
180 185 190
Ser Arg Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp
195 200 205
Ser Gly Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
210 215 220
Arg
225
<210> 148
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 148
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile Arg Ser Gly Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Tyr Asp His Tyr Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln
115 120 125
Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys
130 135 140
Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile
165 170 175
Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Arg
180 185 190
Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu
195 200 205
Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser
210 215 220
Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 149
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 149
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser
130 135 140
Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn
165 170 175
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly
210 215 220
Thr Lys Val Glu Ile Lys Arg
225 230
<210> 150
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 150
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Leu Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr Gly Met Ser Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile Arg Ser Gly
165 170 175
Gly Gly Arg Thr Tyr Tyr Ser Asp Asn Val Lys Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Arg Tyr Asp His Tyr
210 215 220
Ser Gly Ser Ser Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 151
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 151
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Val Val Met Thr Gln Ser Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser
130 135 140
Gln Ser Leu Leu Asp Ser Asp Gly Lys Thr Tyr Leu Asn Trp Leu Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Gln Arg Leu Ile Tyr Leu Val Ser Lys
165 170 175
Leu Asp Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Trp Gln Gly Thr His Phe Pro Arg Thr Phe Gly Gln Gly
210 215 220
Thr Lys Val Glu Ile Lys Arg
225 230
<210> 152
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 152
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ser Ile His Asn Arg Gly Thr Ile Phe Tyr Leu Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Arg Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Thr
85 90 95
Arg Gly Arg Ser Asn Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu
115 120 125
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Tyr
165 170 175
Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Arg Val
180 185 190
Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg
195 200 205
Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Asp
210 215 220
Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 153
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 153
Asp Val Leu Val Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Thr Gln Thr Leu Val His Arg
20 25 30
Asn Gly Asp Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Ser Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser
130 135 140
Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn
165 170 175
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly
210 215 220
Thr Lys Val Glu Ile Lys Arg
225 230
<210> 154
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 154
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Lys Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Ala Met Ser Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ser Ile His Asn Arg
165 170 175
Gly Thr Ile Phe Tyr Leu Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
180 185 190
Arg Asp Asn Val Arg Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg
195 200 205
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg Gly Arg Ser Asn Ser
210 215 220
Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
225 230 235 240
<210> 155
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 155
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Val Leu Val Thr Gln Ser Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Thr
130 135 140
Gln Thr Leu Val His Arg Asn Gly Asp Thr Tyr Leu Glu Trp Tyr Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Gln Ser Leu Ile Tyr Lys Val Ser Asn
165 170 175
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Tyr Thr Phe Gly Gln Gly
210 215 220
Thr Lys Leu Glu Ile Lys Arg
225 230
<210> 156
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 156
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu
115 120 125
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
130 135 140
Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp Val Arg Gln Ala Pro Gly
145 150 155 160
Gln Gly Leu Glu Trp Met Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr
165 170 175
His Tyr Asn Glu Lys Phe Lys Asp Arg Val Thr Leu Thr Thr Asp Thr
180 185 190
Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp
195 200 205
Thr Ala Val Tyr Tyr Cys Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp
210 215 220
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230
<210> 157
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 157
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser
130 135 140
Gln Asn Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn
165 170 175
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Phe Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly
210 215 220
Thr Lys Val Glu Ile Lys Arg
225 230
<210> 158
<211> 234
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 158
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr Gly Met Ser Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Leu Val Ala Ser Ile Asn Ser Asn
165 170 175
Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ser Gly Asp Tyr Trp
210 215 220
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230
<210> 159
<211> 231
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 159
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Ile Val Met Thr Gln Ser Pro Leu Ser
115 120 125
Leu Pro Val Thr Pro Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser
130 135 140
Gln Ser Leu Val Tyr Ser Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu
145 150 155 160
Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn
165 170 175
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
180 185 190
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val
195 200 205
Tyr Tyr Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Gly Gly
210 215 220
Thr Lys Val Glu Ile Lys Arg
225 230
<210> 160
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 160
Glu Val Gln Leu Val Gln Ser Gly Thr Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Val Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Phe Ile Tyr Pro Gly Asp Ser Glu Thr Arg Tyr Ser Pro Thr Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Phe Asn Thr Ala Phe
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Ser Gly Trp Tyr Pro Tyr Thr Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 161
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 161
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Ile Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Phe Ile
35 40 45
Tyr Thr Ala Ser Thr Arg Ala Thr Asp Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Trp Pro Ser
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr
115 120 125
Pro Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val
130 135 140
His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly
145 150 155 160
Gln Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly
165 170 175
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
180 185 190
Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe
195 200 205
Gln Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
210 215 220
Ile Lys Arg
225
<210> 162
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 162
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Gln
115 120 125
Ser Gly Thr Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys
130 135 140
Lys Gly Ser Gly Tyr Thr Val Thr Ser Tyr Trp Ile Gly Trp Val Arg
145 150 155 160
Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly Phe Ile Tyr Pro Gly
165 170 175
Asp Ser Glu Thr Arg Tyr Ser Pro Thr Phe Gln Gly Gln Val Thr Ile
180 185 190
Ser Ala Asp Lys Ser Phe Asn Thr Ala Phe Leu Gln Trp Ser Ser Leu
195 200 205
Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala Arg Val Gly Ser Gly
210 215 220
Trp Tyr Pro Tyr Thr Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr
225 230 235 240
Val Ser Ser
<210> 163
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 163
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Glu Ile Val Met Thr Gln Ser Pro Ala Thr
115 120 125
Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
130 135 140
Glu Ser Ile Ser Ser Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
145 150 155 160
Ala Pro Arg Leu Phe Ile Tyr Thr Ala Ser Thr Arg Ala Thr Asp Ile
165 170 175
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
180 185 190
Ile Ser Ser Leu Gln Ser Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln
195 200 205
Tyr Asn Asn Trp Pro Ser Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu
210 215 220
Ile Lys Arg
225
<210> 164
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 164
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Val Ser Gly Tyr Phe Phe Thr Thr Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Tyr Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Asn Trp Asn Cys Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu
115 120 125
Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys Val
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly Trp
145 150 155 160
Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile Tyr
165 170 175
Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Arg Val
180 185 190
Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu Arg
195 200 205
Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Asp
210 215 220
Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 165
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 165
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Arg Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Arg Tyr Gly Ser Ser His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Ser Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 166
<211> 240
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 166
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Gln
115 120 125
Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys
130 135 140
Lys Val Ser Gly Tyr Phe Phe Thr Thr Tyr Trp Ile Gly Trp Val Arg
145 150 155 160
Gln Met Pro Gly Lys Gly Leu Glu Tyr Met Gly Ile Ile Tyr Pro Gly
165 170 175
Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Ile
180 185 190
Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu
195 200 205
Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala Arg Gly Gly Asn Trp
210 215 220
Asn Cys Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
<210> 167
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 167
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Glu Ile Val Leu Thr Gln Ser Pro Gly Thr
115 120 125
Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser
130 135 140
Gln Ser Val Ser Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly
145 150 155 160
Gln Ala Pro Arg Leu Leu Ile Tyr Gly Ala Ser Arg Arg Ala Thr Gly
165 170 175
Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
180 185 190
Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
195 200 205
Arg Tyr Gly Ser Ser His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
210 215 220
Ser Arg
225
<210> 168
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 168
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Gln Ser Phe Gly Tyr Ile Phe Ile Asp His
20 25 30
Thr Ile His Trp Met Arg Gln Met Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Ile Ser Pro Arg His Asp Ile Thr Lys Tyr Asn Glu Met Phe
50 55 60
Arg Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Phe Cys
85 90 95
Ala Arg Gly Gly Phe Tyr Gly Ser Thr Ile Trp Phe Asp Phe Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp
145 150 155 160
Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys
180 185 190
Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser
<210> 169
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 169
Glu Thr Thr Val Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ile Thr Thr Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Phe Gln Gln Glu Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Ile Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Lys Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Ser Asp Asn Leu Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 170
<211> 243
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 170
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Val Gln
115 120 125
Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys
130 135 140
Gln Ser Phe Gly Tyr Ile Phe Ile Asp His Thr Ile His Trp Met Arg
145 150 155 160
Gln Met Pro Gly Gln Gly Leu Glu Trp Met Gly Ala Ile Ser Pro Arg
165 170 175
His Asp Ile Thr Lys Tyr Asn Glu Met Phe Arg Gly Gln Val Thr Ile
180 185 190
Ser Ala Asp Lys Ser Ser Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu
195 200 205
Lys Ala Ser Asp Thr Ala Met Tyr Phe Cys Ala Arg Gly Gly Phe Tyr
210 215 220
Gly Ser Thr Ile Trp Phe Asp Phe Trp Gly Gln Gly Thr Met Val Thr
225 230 235 240
Val Ser Ser
<210> 171
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 171
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Glu Thr Thr Val Thr Gln Ser Pro Ser Phe
115 120 125
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Ile Thr Thr
130 135 140
Thr Asp Ile Asp Asp Asp Met Asn Trp Phe Gln Gln Glu Pro Gly Lys
145 150 155 160
Ala Pro Lys Leu Leu Ile Ser Glu Gly Asn Ile Leu Arg Pro Gly Val
165 170 175
Pro Ser Arg Phe Ser Ser Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr
180 185 190
Ile Ser Lys Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln
195 200 205
Ser Asp Asn Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
210 215 220
Lys Arg
225
<210> 172
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 172
Glu Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Arg Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp
20 25 30
His Ala Trp Ser Trp Val Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp
35 40 45
Ile Gly Tyr Ile Ser Tyr Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Val Thr Met Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser
65 70 75 80
Leu Arg Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Ala Arg Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Ser Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln
115 120 125
Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser Val Lys
130 135 140
Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr Trp Leu Gly
145 150 155 160
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Asp Ile
165 170 175
Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe Lys Asp Arg
180 185 190
Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr Met Glu Leu
195 200 205
Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser
210 215 220
Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 173
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 173
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro
115 120 125
Gly Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His
130 135 140
Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln
145 150 155 160
Ser Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val
165 170 175
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys
180 185 190
Ile Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln
195 200 205
Val Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 174
<211> 241
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 174
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Lys Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Tyr Asp Tyr Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Ser Ser Thr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Glu Val Gln Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Arg Pro Ser Gln Thr Leu Ser Leu Thr Cys
130 135 140
Thr Val Ser Gly Tyr Ser Ile Thr Ser Asp His Ala Trp Ser Trp Val
145 150 155 160
Arg Gln Pro Pro Gly Arg Gly Leu Glu Trp Ile Gly Tyr Ile Ser Tyr
165 170 175
Ser Gly Ile Thr Thr Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Met
180 185 190
Leu Arg Asp Thr Ser Lys Asn Gln Phe Ser Leu Arg Leu Ser Ser Val
195 200 205
Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ser Leu Ala Arg
210 215 220
Thr Thr Ala Met Asp Tyr Trp Gly Gln Gly Ser Leu Val Thr Val Ser
225 230 235 240
Ser
<210> 175
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polypeptide
<400> 175
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Thr Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Val
85 90 95
Ser His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Asp Ile Gln Met Thr Gln Ser Pro Ser Ser
115 120 125
Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser
130 135 140
Gln Asp Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys
145 150 155 160
Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Arg Leu His Ser Gly Val
165 170 175
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
180 185 190
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln
195 200 205
Gly Asn Thr Leu Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
210 215 220
Lys Arg
225
<210> 176
<211> 7185
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 176
gcgtcgacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgcgaggag 720
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tccgggtaaa tgagcggccg ctcgaggccg gcaaggccgg 1020
atcccccgac ctcgacctct ggctaataaa ggaaatttat tttcattgca atagtgtgtt 1080
ggaatttttt gtgtctctca ctcggaagga catatgggag ggcaaatcat ttggtcgaga 1140
tccctcggag atctctagct agaggatcga tccccgcccc ggacgaacta aacctgacta 1200
cgacatctct gccccttctt cgcggggcag tgcatgtaat cccttcagtt ggttggtaca 1260
acttgccaac tgggccctgt tccacatgtg acacgggggg ggaccaaaca caaaggggtt 1320
ctctgactgt agttgacatc cttataaatg gatgtgcaca tttgccaaca ctgagtggct 1380
ttcatcctgg agcagacttt gcagtctgtg gactgcaaca caacattgcc tttatgtgta 1440
actcttggct gaagctctta caccaatgct gggggacatg tacctcccag gggcccagga 1500
agactacggg aggctacacc aacgtcaatc agaggggcct gtgtagctac cgataagcgg 1560
accctcaaga gggcattagc aatagtgttt ataaggcccc cttgttaacc ctaaacgggt 1620
agcatatgct tcccgggtag tagtatatac tatccagact aaccctaatt caatagcata 1680
tgttacccaa cgggaagcat atgctatcga attagggtta gtaaaagggt cctaaggaac 1740
agcgatatct cccaccccat gagctgtcac ggttttattt acatggggtc aggattccac 1800
gagggtagtg aaccatttta gtcacaaggg cagtggctga agatcaagga gcgggcagtg 1860
aactctcctg aatcttcgcc tgcttcttca ttctccttcg tttagctaat agaataactg 1920
ctgagttgtg aacagtaagg tgtatgtgag gtgctcgaaa acaaggtttc aggtgacgcc 1980
cccagaataa aatttggacg gggggttcag tggtggcatt gtgctatgac accaatataa 2040
ccctcacaaa ccccttgggc aataaatact agtgtaggaa tgaaacattc tgaatatctt 2100
taacaataga aatccatggg gtggggacaa gccgtaaaga ctggatgtcc atctcacacg 2160
aatttatggc tatgggcaac acataatcct agtgcaatat gatactgggg ttattaagat 2220
gtgtcccagg cagggaccaa gacaggtgaa ccatgttgtt acactctatt tgtaacaagg 2280
ggaaagagag tggacgccga cagcagcgga ctccactggt tgtctctaac acccccgaaa 2340
attaaacggg gctccacgcc aatggggccc ataaacaaag acaagtggcc actctttttt 2400
ttgaaattgt ggagtggggg cacgcgtcag cccccacacg ccgccctgcg gttttggact 2460
gtaaaataag ggtgtaataa cttggctgat tgtaaccccg ctaaccactg cggtcaaacc 2520
acttgcccac aaaaccacta atggcacccc ggggaatacc tgcataagta ggtgggcggg 2580
ccaagatagg ggcgcgattg ctgcgatctg gaggacaaat tacacacact tgcgcctgag 2640
cgccaagcac agggttgttg gtcctcatat tcacgaggtc gctgagagca cggtgggcta 2700
atgttgccat gggtagcata tactacccaa atatctggat agcatatgct atcctaatct 2760
atatctgggt agcataggct atcctaatct atatctgggt agcatatgct atcctaatct 2820
atatctgggt agtatatgct atcctaattt atatctgggt agcataggct atcctaatct 2880
atatctgggt agcatatgct atcctaatct atatctgggt agtatatgct atcctaatct 2940
gtatccgggt agcatatgct atcctaatag agattagggt agtatatgct atcctaattt 3000
atatctgggt agcatatact acccaaatat ctggatagca tatgctatcc taatctatat 3060
ctgggtagca tatgctatcc taatctatat ctgggtagca taggctatcc taatctatat 3120
ctgggtagca tatgctatcc taatctatat ctgggtagta tatgctatcc taatttatat 3180
ctgggtagca taggctatcc taatctatat ctgggtagca tatgctatcc taatctatat 3240
ctgggtagta tatgctatcc taatctgtat ccgggtagca tatgctatcc tcatgataag 3300
ctgtcaaaca tgagaatttt cttgaagacg aaagggcctc gtgatacgcc tatttttata 3360
ggttaatgtc atgataataa tggtttctta gacgtcaggt ggcacttttc ggggaaatgt 3420
gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc cgctcatgag 3480
acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga gtattcaaca 3540
tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc 3600
agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat 3660
cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc 3720
aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgtg ttgacgccgg 3780
gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc 3840
agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat 3900
aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga 3960
gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc 4020
ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg cagcaatggc 4080
aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt 4140
aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc 4200
tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc 4260
agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca 4320
ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca 4380
ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa aacttcattt 4440
ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta 4500
acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg 4560
agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc 4620
ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag 4680
cagagcgcag ataccaaata ctgttcttct agtgtagccg tagttaggcc accacttcaa 4740
gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc 4800
cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc 4860
gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta 4920
caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag 4980
aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct 5040
tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga 5100
gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc 5160
ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt 5220
atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg 5280
cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg 5340
caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctggcacg acaggtttcc 5400
cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg agttagctca ctcattaggc 5460
accccaggct ttacacttta tgcttccggc tcgtatgttg tgtggaattg tgagcggata 5520
acaatttcac acaggaaaca gctatgacca tgattacgcc aagctctagc tagaggtcga 5580
gtccctcccc agcaggcaga agtatgcaaa gcatgcatct caattagtca gcaaccatag 5640
tcccgcccct aactccgccc atcccgcccc taactccgcc cagttccgcc cattctccgc 5700
cccatggctg actaattttt tttatttatg cagaggccga ggccgcctcg gcctctgagc 5760
tattccagaa gtagtgagga ggcttttttg gaggcctagg cttttgcaaa aagctttgca 5820
aagatggata aagttttaaa cagagaggaa tctttgcagc taatggacct tctaggtctt 5880
gaaaggagtg ggaattggct ccggtgcccg tcagtgggca gagcgcacat cgcccacagt 5940
ccccgagaag ttggggggag gggtcggcaa ttgaaccggt gcctagagaa ggtggcgcgg 6000
ggtaaactgg gaaagtgatg tcgtgtactg gctccgcctt tttcccgagg gtgggggaga 6060
accgtatata agtgcagtag tcgccgtgaa cgttcttttt cgcaacgggt ttgccgccag 6120
aacacaggta agtgccgtgt gtggttcccg cgggcctggc ctctttacgg gttatggccc 6180
ttgcgtgcct tgaattactt ccacctggct gcagtacgtg attcttgatc ccgagcttcg 6240
ggttggaagt gggtgggaga gttcgaggcc ttgcgcttaa ggagcccctt cgcctcgtgc 6300
ttgagttgag gcctggcctg ggcgctgggg ccgccgcgtg cgaatctggt ggcaccttcg 6360
cgcctgtctc gctgctttcg ataagtctct agccatttaa aatttttgat gacctgctgc 6420
gacgcttttt ttctggcaag atagtcttgt aaatgcgggc caagatctgc acactggtat 6480
ttcggttttt ggggccgcgg gcggcgacgg ggcccgtgcg tcccagcgca catgttcggc 6540
gaggcggggc ctgcgagcgc ggccaccgag aatcggacgg gggtagtctc aagctggccg 6600
gcctgctctg gtgcctggcc tcgcgccgcc gtgtatcgcc ccgccctggg cggcaaggct 6660
ggcccggtcg gcaccagttg cgtgagcgga aagatggccg cttcccggcc ctgctgcagg 6720
gagctcaaaa tggaggacgc ggcgctcggg agagcgggcg ggtgagtcac ccacacaaag 6780
gaaaagggcc tttccgtcct cagccgtcgc ttcatgtgac tccacggagt accgggcgcc 6840
gtccaggcac ctcgattagt tctcgagctt ttggagtacg tcgtctttag gttgggggga 6900
ggggttttat gcgatggagt ttccccacac tgagtgggtg gagactgaag ttaggccagc 6960
ttggcacttg atgtaattct ccttggaatt tgcccttttt gagtttggat cttggttcat 7020
tctcaagcct cagacagtgg ttcaaagttt ttttcttcca tttcaggtgt cgtgaggaat 7080
tctctagaga tccctcgacc tcgagatcca ttgtgcccgg gcgccaccat ggagtttggg 7140
ctgagctggc tttttcttgt cgcgatttta aaaggtgtcc agtgc 7185
<210> 177
<211> 6521
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 177
acggtggctg caccatctgt cttcatcttc ccgccatctg atgagcagtt gaaatctgga 60
actgcctctg ttgtgtgcct gctgaataac ttctatccca gagaggccaa agtacagtgg 120
aaggtggata acgccctcca atcgggtaac tcccaggaga gtgtcacaga gcaggacagc 180
aaggacagca cctacagcct cagcagcacc ctgacgctga gcaaagcaga ctacgagaaa 240
cacaaagtct acgcctgcga agtcacccat cagggcctga gctcgcccgt cacaaagagc 300
ttcaacaggg gagagtgttg agcggccgct cgaggccggc aaggccggat cccccgacct 360
cgacctctgg ctaataaagg aaatttattt tcattgcaat agtgtgttgg aattttttgt 420
gtctctcact cggaaggaca tatgggaggg caaatcattt ggtcgagatc cctcggagat 480
ctctagctag aggatcgatc cccgccccgg acgaactaaa cctgactacg acatctctgc 540
cccttcttcg cggggcagtg catgtaatcc cttcagttgg ttggtacaac ttgccaactg 600
ggccctgttc cacatgtgac acgggggggg accaaacaca aaggggttct ctgactgtag 660
ttgacatcct tataaatgga tgtgcacatt tgccaacact gagtggcttt catcctggag 720
cagactttgc agtctgtgga ctgcaacaca acattgcctt tatgtgtaac tcttggctga 780
agctcttaca ccaatgctgg gggacatgta cctcccaggg gcccaggaag actacgggag 840
gctacaccaa cgtcaatcag aggggcctgt gtagctaccg ataagcggac cctcaagagg 900
gcattagcaa tagtgtttat aaggccccct tgttaaccct aaacgggtag catatgcttc 960
ccgggtagta gtatatacta tccagactaa ccctaattca atagcatatg ttacccaacg 1020
ggaagcatat gctatcgaat tagggttagt aaaagggtcc taaggaacag cgatatctcc 1080
caccccatga gctgtcacgg ttttatttac atggggtcag gattccacga gggtagtgaa 1140
ccattttagt cacaagggca gtggctgaag atcaaggagc gggcagtgaa ctctcctgaa 1200
tcttcgcctg cttcttcatt ctccttcgtt tagctaatag aataactgct gagttgtgaa 1260
cagtaaggtg tatgtgaggt gctcgaaaac aaggtttcag gtgacgcccc cagaataaaa 1320
tttggacggg gggttcagtg gtggcattgt gctatgacac caatataacc ctcacaaacc 1380
ccttgggcaa taaatactag tgtaggaatg aaacattctg aatatcttta acaatagaaa 1440
tccatggggt ggggacaagc cgtaaagact ggatgtccat ctcacacgaa tttatggcta 1500
tgggcaacac ataatcctag tgcaatatga tactggggtt attaagatgt gtcccaggca 1560
gggaccaaga caggtgaacc atgttgttac actctatttg taacaagggg aaagagagtg 1620
gacgccgaca gcagcggact ccactggttg tctctaacac ccccgaaaat taaacggggc 1680
tccacgccaa tggggcccat aaacaaagac aagtggccac tctttttttt gaaattgtgg 1740
agtgggggca cgcgtcagcc cccacacgcc gccctgcggt tttggactgt aaaataaggg 1800
tgtaataact tggctgattg taaccccgct aaccactgcg gtcaaaccac ttgcccacaa 1860
aaccactaat ggcaccccgg ggaatacctg cataagtagg tgggcgggcc aagatagggg 1920
cgcgattgct gcgatctgga ggacaaatta cacacacttg cgcctgagcg ccaagcacag 1980
ggttgttggt cctcatattc acgaggtcgc tgagagcacg gtgggctaat gttgccatgg 2040
gtagcatata ctacccaaat atctggatag catatgctat cctaatctat atctgggtag 2100
cataggctat cctaatctat atctgggtag catatgctat cctaatctat atctgggtag 2160
tatatgctat cctaatttat atctgggtag cataggctat cctaatctat atctgggtag 2220
catatgctat cctaatctat atctgggtag tatatgctat cctaatctgt atccgggtag 2280
catatgctat cctaatagag attagggtag tatatgctat cctaatttat atctgggtag 2340
catatactac ccaaatatct ggatagcata tgctatccta atctatatct gggtagcata 2400
tgctatccta atctatatct gggtagcata ggctatccta atctatatct gggtagcata 2460
tgctatccta atctatatct gggtagtata tgctatccta atttatatct gggtagcata 2520
ggctatccta atctatatct gggtagcata tgctatccta atctatatct gggtagtata 2580
tgctatccta atctgtatcc gggtagcata tgctatcctc atgataagct gtcaaacatg 2640
agaattttct tgaagacgaa agggcctcgt gatacgccta tttttatagg ttaatgtcat 2700
gataataatg gtttcttaga cgtcaggtgg cacttttcgg ggaaatgtgc gcggaacccc 2760
tatttgttta tttttctaaa tacattcaaa tatgtatccg ctcatgagac aataaccctg 2820
ataaatgctt caataatatt gaaaaaggaa gagtatgagt attcaacatt tccgtgtcgc 2880
ccttattccc ttttttgcgg cattttgcct tcctgttttt gctcacccag aaacgctggt 2940
gaaagtaaaa gatgctgaag atcagttggg tgcacgagtg ggttacatcg aactggatct 3000
caacagcggt aagatccttg agagttttcg ccccgaagaa cgttttccaa tgatgagcac 3060
ttttaaagtt ctgctatgtg gcgcggtatt atcccgtgtt gacgccgggc aagagcaact 3120
cggtcgccgc atacactatt ctcagaatga cttggttgag tactcaccag tcacagaaaa 3180
gcatcttacg gatggcatga cagtaagaga attatgcagt gctgccataa ccatgagtga 3240
taacactgcg gccaacttac ttctgacaac gatcggagga ccgaaggagc taaccgcttt 3300
tttgcacaac atgggggatc atgtaactcg ccttgatcgt tgggaaccgg agctgaatga 3360
agccatacca aacgacgagc gtgacaccac gatgcctgca gcaatggcaa caacgttgcg 3420
caaactatta actggcgaac tacttactct agcttcccgg caacaattaa tagactggat 3480
ggaggcggat aaagttgcag gaccacttct gcgctcggcc cttccggctg gctggtttat 3540
tgctgataaa tctggagccg gtgagcgtgg gtctcgcggt atcattgcag cactggggcc 3600
agatggtaag ccctcccgta tcgtagttat ctacacgacg gggagtcagg caactatgga 3660
tgaacgaaat agacagatcg ctgagatagg tgcctcactg attaagcatt ggtaactgtc 3720
agaccaagtt tactcatata tactttagat tgatttaaaa cttcattttt aatttaaaag 3780
gatctaggtg aagatccttt ttgataatct catgaccaaa atcccttaac gtgagttttc 3840
gttccactga gcgtcagacc ccgtagaaaa gatcaaagga tcttcttgag atcctttttt 3900
tctgcgcgta atctgctgct tgcaaacaaa aaaaccaccg ctaccagcgg tggtttgttt 3960
gccggatcaa gagctaccaa ctctttttcc gaaggtaact ggcttcagca gagcgcagat 4020
accaaatact gttcttctag tgtagccgta gttaggccac cacttcaaga actctgtagc 4080
accgcctaca tacctcgctc tgctaatcct gttaccagtg gctgctgcca gtggcgataa 4140
gtcgtgtctt accgggttgg actcaagacg atagttaccg gataaggcgc agcggtcggg 4200
ctgaacgggg ggttcgtgca cacagcccag cttggagcga acgacctaca ccgaactgag 4260
atacctacag cgtgagctat gagaaagcgc cacgcttccc gaagggagaa aggcggacag 4320
gtatccggta agcggcaggg tcggaacagg agagcgcacg agggagcttc cagggggaaa 4380
cgcctggtat ctttatagtc ctgtcgggtt tcgccacctc tgacttgagc gtcgattttt 4440
gtgatgctcg tcaggggggc ggagcctatg gaaaaacgcc agcaacgcgg cctttttacg 4500
gttcctggcc ttttgctggc cttttgctca catgttcttt cctgcgttat cccctgattc 4560
tgtggataac cgtattaccg cctttgagtg agctgatacc gctcgccgca gccgaacgac 4620
cgagcgcagc gagtcagtga gcgaggaagc ggaagagcgc ccaatacgca aaccgcctct 4680
ccccgcgcgt tggccgattc attaatgcag ctggcacgac aggtttcccg actggaaagc 4740
gggcagtgag cgcaacgcaa ttaatgtgag ttagctcact cattaggcac cccaggcttt 4800
acactttatg cttccggctc gtatgttgtg tggaattgtg agcggataac aatttcacac 4860
aggaaacagc tatgaccatg attacgccaa gctctagcta gaggtcgagt ccctccccag 4920
caggcagaag tatgcaaagc atgcatctca attagtcagc aaccatagtc ccgcccctaa 4980
ctccgcccat cccgccccta actccgccca gttccgccca ttctccgccc catggctgac 5040
taattttttt tatttatgca gaggccgagg ccgcctcggc ctctgagcta ttccagaagt 5100
agtgaggagg cttttttgga ggcctaggct tttgcaaaaa gctttgcaaa gatggataaa 5160
gttttaaaca gagaggaatc tttgcagcta atggaccttc taggtcttga aaggagtggg 5220
aattggctcc ggtgcccgtc agtgggcaga gcgcacatcg cccacagtcc ccgagaagtt 5280
ggggggaggg gtcggcaatt gaaccggtgc ctagagaagg tggcgcgggg taaactggga 5340
aagtgatgtc gtgtactggc tccgcctttt tcccgagggt gggggagaac cgtatataag 5400
tgcagtagtc gccgtgaacg ttctttttcg caacgggttt gccgccagaa cacaggtaag 5460
tgccgtgtgt ggttcccgcg ggcctggcct ctttacgggt tatggccctt gcgtgccttg 5520
aattacttcc acctggctgc agtacgtgat tcttgatccc gagcttcggg ttggaagtgg 5580
gtgggagagt tcgaggcctt gcgcttaagg agccccttcg cctcgtgctt gagttgaggc 5640
ctggcctggg cgctggggcc gccgcgtgcg aatctggtgg caccttcgcg cctgtctcgc 5700
tgctttcgat aagtctctag ccatttaaaa tttttgatga cctgctgcga cgcttttttt 5760
ctggcaagat agtcttgtaa atgcgggcca agatctgcac actggtattt cggtttttgg 5820
ggccgcgggc ggcgacgggg cccgtgcgtc ccagcgcaca tgttcggcga ggcggggcct 5880
gcgagcgcgg ccaccgagaa tcggacgggg gtagtctcaa gctggccggc ctgctctggt 5940
gcctggcctc gcgccgccgt gtatcgcccc gccctgggcg gcaaggctgg cccggtcggc 6000
accagttgcg tgagcggaaa gatggccgct tcccggccct gctgcaggga gctcaaaatg 6060
gaggacgcgg cgctcgggag agcgggcggg tgagtcaccc acacaaagga aaagggcctt 6120
tccgtcctca gccgtcgctt catgtgactc cacggagtac cgggcgccgt ccaggcacct 6180
cgattagttc tcgagctttt ggagtacgtc gtctttaggt tggggggagg ggttttatgc 6240
gatggagttt ccccacactg agtgggtgga gactgaagtt aggccagctt ggcacttgat 6300
gtaattctcc ttggaatttg ccctttttga gtttggatct tggttcattc tcaagcctca 6360
gacagtggtt caaagttttt ttcttccatt tcaggtgtcg tgaggaattc tctagagatc 6420
cctcgacctc gagatccatt gtgcccgggc gcaccatgga catgcgcgtg cccgcccagc 6480
tgctgggcct gctgctgctg tggttccccg gctcgcgatg c 6521
<210> 178
<211> 6513
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 178
caacccaagg ctgccccctc ggtcactctg ttcccgccct cctctgagga gcttcaagcc 60
aacaaggcca cactggtgtg tctcataagt gacttctacc cgggagccgt gacagtggcc 120
tggaaggcag atagcagccc cgtcaaggcg ggagtggaga ccaccacacc ctccaaacaa 180
agcaacaaca agtacgcggc cagcagctac ctgagcctga cgcctgagca gtggaagtcc 240
cacagaagct acagctgcca ggtcacgcat gaagggagca ccgtggagaa gacagtggcc 300
cctacagaat gttcatgagc ggccgctcga ggccggcaag gccggatccc ccgacctcga 360
cctctggcta ataaaggaaa tttattttca ttgcaatagt gtgttggaat tttttgtgtc 420
tctcactcgg aaggacatat gggagggcaa atcatttggt cgagatccct cggagatctc 480
tagctagagg atcgatcccc gccccggacg aactaaacct gactacgaca tctctgcccc 540
ttcttcgcgg ggcagtgcat gtaatccctt cagttggttg gtacaacttg ccaactgggc 600
cctgttccac atgtgacacg gggggggacc aaacacaaag gggttctctg actgtagttg 660
acatccttat aaatggatgt gcacatttgc caacactgag tggctttcat cctggagcag 720
actttgcagt ctgtggactg caacacaaca ttgcctttat gtgtaactct tggctgaagc 780
tcttacacca atgctggggg acatgtacct cccaggggcc caggaagact acgggaggct 840
acaccaacgt caatcagagg ggcctgtgta gctaccgata agcggaccct caagagggca 900
ttagcaatag tgtttataag gcccccttgt taaccctaaa cgggtagcat atgcttcccg 960
ggtagtagta tatactatcc agactaaccc taattcaata gcatatgtta cccaacggga 1020
agcatatgct atcgaattag ggttagtaaa agggtcctaa ggaacagcga tatctcccac 1080
cccatgagct gtcacggttt tatttacatg gggtcaggat tccacgaggg tagtgaacca 1140
ttttagtcac aagggcagtg gctgaagatc aaggagcggg cagtgaactc tcctgaatct 1200
tcgcctgctt cttcattctc cttcgtttag ctaatagaat aactgctgag ttgtgaacag 1260
taaggtgtat gtgaggtgct cgaaaacaag gtttcaggtg acgcccccag aataaaattt 1320
ggacgggggg ttcagtggtg gcattgtgct atgacaccaa tataaccctc acaaacccct 1380
tgggcaataa atactagtgt aggaatgaaa cattctgaat atctttaaca atagaaatcc 1440
atggggtggg gacaagccgt aaagactgga tgtccatctc acacgaattt atggctatgg 1500
gcaacacata atcctagtgc aatatgatac tggggttatt aagatgtgtc ccaggcaggg 1560
accaagacag gtgaaccatg ttgttacact ctatttgtaa caaggggaaa gagagtggac 1620
gccgacagca gcggactcca ctggttgtct ctaacacccc cgaaaattaa acggggctcc 1680
acgccaatgg ggcccataaa caaagacaag tggccactct tttttttgaa attgtggagt 1740
gggggcacgc gtcagccccc acacgccgcc ctgcggtttt ggactgtaaa ataagggtgt 1800
aataacttgg ctgattgtaa ccccgctaac cactgcggtc aaaccacttg cccacaaaac 1860
cactaatggc accccgggga atacctgcat aagtaggtgg gcgggccaag ataggggcgc 1920
gattgctgcg atctggagga caaattacac acacttgcgc ctgagcgcca agcacagggt 1980
tgttggtcct catattcacg aggtcgctga gagcacggtg ggctaatgtt gccatgggta 2040
gcatatacta cccaaatatc tggatagcat atgctatcct aatctatatc tgggtagcat 2100
aggctatcct aatctatatc tgggtagcat atgctatcct aatctatatc tgggtagtat 2160
atgctatcct aatttatatc tgggtagcat aggctatcct aatctatatc tgggtagcat 2220
atgctatcct aatctatatc tgggtagtat atgctatcct aatctgtatc cgggtagcat 2280
atgctatcct aatagagatt agggtagtat atgctatcct aatttatatc tgggtagcat 2340
atactaccca aatatctgga tagcatatgc tatcctaatc tatatctggg tagcatatgc 2400
tatcctaatc tatatctggg tagcataggc tatcctaatc tatatctggg tagcatatgc 2460
tatcctaatc tatatctggg tagtatatgc tatcctaatt tatatctggg tagcataggc 2520
tatcctaatc tatatctggg tagcatatgc tatcctaatc tatatctggg tagtatatgc 2580
tatcctaatc tgtatccggg tagcatatgc tatcctcatg ataagctgtc aaacatgaga 2640
attttcttga agacgaaagg gcctcgtgat acgcctattt ttataggtta atgtcatgat 2700
aataatggtt tcttagacgt caggtggcac ttttcgggga aatgtgcgcg gaacccctat 2760
ttgtttattt ttctaaatac attcaaatat gtatccgctc atgagacaat aaccctgata 2820
aatgcttcaa taatattgaa aaaggaagag tatgagtatt caacatttcc gtgtcgccct 2880
tattcccttt tttgcggcat tttgccttcc tgtttttgct cacccagaaa cgctggtgaa 2940
agtaaaagat gctgaagatc agttgggtgc acgagtgggt tacatcgaac tggatctcaa 3000
cagcggtaag atccttgaga gttttcgccc cgaagaacgt tttccaatga tgagcacttt 3060
taaagttctg ctatgtggcg cggtattatc ccgtgttgac gccgggcaag agcaactcgg 3120
tcgccgcata cactattctc agaatgactt ggttgagtac tcaccagtca cagaaaagca 3180
tcttacggat ggcatgacag taagagaatt atgcagtgct gccataacca tgagtgataa 3240
cactgcggcc aacttacttc tgacaacgat cggaggaccg aaggagctaa ccgctttttt 3300
gcacaacatg ggggatcatg taactcgcct tgatcgttgg gaaccggagc tgaatgaagc 3360
cataccaaac gacgagcgtg acaccacgat gcctgcagca atggcaacaa cgttgcgcaa 3420
actattaact ggcgaactac ttactctagc ttcccggcaa caattaatag actggatgga 3480
ggcggataaa gttgcaggac cacttctgcg ctcggccctt ccggctggct ggtttattgc 3540
tgataaatct ggagccggtg agcgtgggtc tcgcggtatc attgcagcac tggggccaga 3600
tggtaagccc tcccgtatcg tagttatcta cacgacgggg agtcaggcaa ctatggatga 3660
acgaaataga cagatcgctg agataggtgc ctcactgatt aagcattggt aactgtcaga 3720
ccaagtttac tcatatatac tttagattga tttaaaactt catttttaat ttaaaaggat 3780
ctaggtgaag atcctttttg ataatctcat gaccaaaatc ccttaacgtg agttttcgtt 3840
ccactgagcg tcagaccccg tagaaaagat caaaggatct tcttgagatc ctttttttct 3900
gcgcgtaatc tgctgcttgc aaacaaaaaa accaccgcta ccagcggtgg tttgtttgcc 3960
ggatcaagag ctaccaactc tttttccgaa ggtaactggc ttcagcagag cgcagatacc 4020
aaatactgtt cttctagtgt agccgtagtt aggccaccac ttcaagaact ctgtagcacc 4080
gcctacatac ctcgctctgc taatcctgtt accagtggct gctgccagtg gcgataagtc 4140
gtgtcttacc gggttggact caagacgata gttaccggat aaggcgcagc ggtcgggctg 4200
aacggggggt tcgtgcacac agcccagctt ggagcgaacg acctacaccg aactgagata 4260
cctacagcgt gagctatgag aaagcgccac gcttcccgaa gggagaaagg cggacaggta 4320
tccggtaagc ggcagggtcg gaacaggaga gcgcacgagg gagcttccag ggggaaacgc 4380
ctggtatctt tatagtcctg tcgggtttcg ccacctctga cttgagcgtc gatttttgtg 4440
atgctcgtca ggggggcgga gcctatggaa aaacgccagc aacgcggcct ttttacggtt 4500
cctggccttt tgctggcctt ttgctcacat gttctttcct gcgttatccc ctgattctgt 4560
ggataaccgt attaccgcct ttgagtgagc tgataccgct cgccgcagcc gaacgaccga 4620
gcgcagcgag tcagtgagcg aggaagcgga agagcgccca atacgcaaac cgcctctccc 4680
cgcgcgttgg ccgattcatt aatgcagctg gcacgacagg tttcccgact ggaaagcggg 4740
cagtgagcgc aacgcaatta atgtgagtta gctcactcat taggcacccc aggctttaca 4800
ctttatgctt ccggctcgta tgttgtgtgg aattgtgagc ggataacaat ttcacacagg 4860
aaacagctat gaccatgatt acgccaagct ctagctagag gtcgagtccc tccccagcag 4920
gcagaagtat gcaaagcatg catctcaatt agtcagcaac catagtcccg cccctaactc 4980
cgcccatccc gcccctaact ccgcccagtt ccgcccattc tccgccccat ggctgactaa 5040
ttttttttat ttatgcagag gccgaggccg cctcggcctc tgagctattc cagaagtagt 5100
gaggaggctt ttttggaggc ctaggctttt gcaaaaagct ttgcaaagat ggataaagtt 5160
ttaaacagag aggaatcttt gcagctaatg gaccttctag gtcttgaaag gagtgggaat 5220
tggctccggt gcccgtcagt gggcagagcg cacatcgccc acagtccccg agaagttggg 5280
gggaggggtc ggcaattgaa ccggtgccta gagaaggtgg cgcggggtaa actgggaaag 5340
tgatgtcgtg tactggctcc gcctttttcc cgagggtggg ggagaaccgt atataagtgc 5400
agtagtcgcc gtgaacgttc tttttcgcaa cgggtttgcc gccagaacac aggtaagtgc 5460
cgtgtgtggt tcccgcgggc ctggcctctt tacgggttat ggcccttgcg tgccttgaat 5520
tacttccacc tggctgcagt acgtgattct tgatcccgag cttcgggttg gaagtgggtg 5580
ggagagttcg aggccttgcg cttaaggagc cccttcgcct cgtgcttgag ttgaggcctg 5640
gcctgggcgc tggggccgcc gcgtgcgaat ctggtggcac cttcgcgcct gtctcgctgc 5700
tttcgataag tctctagcca tttaaaattt ttgatgacct gctgcgacgc tttttttctg 5760
gcaagatagt cttgtaaatg cgggccaaga tctgcacact ggtatttcgg tttttggggc 5820
cgcgggcggc gacggggccc gtgcgtccca gcgcacatgt tcggcgaggc ggggcctgcg 5880
agcgcggcca ccgagaatcg gacgggggta gtctcaagct ggccggcctg ctctggtgcc 5940
tggcctcgcg ccgccgtgta tcgccccgcc ctgggcggca aggctggccc ggtcggcacc 6000
agttgcgtga gcggaaagat ggccgcttcc cggccctgct gcagggagct caaaatggag 6060
gacgcggcgc tcgggagagc gggcgggtga gtcacccaca caaaggaaaa gggcctttcc 6120
gtcctcagcc gtcgcttcat gtgactccac ggagtaccgg gcgccgtcca ggcacctcga 6180
ttagttctcg agcttttgga gtacgtcgtc tttaggttgg ggggaggggt tttatgcgat 6240
ggagtttccc cacactgagt gggtggagac tgaagttagg ccagcttggc acttgatgta 6300
attctccttg gaatttgccc tttttgagtt tggatcttgg ttcattctca agcctcagac 6360
agtggttcaa agtttttttc ttccatttca ggtgtcgtga ggaattctct agagatccct 6420
cgacctcgag atccattgtg cccgggcgcc accatgactt ggaccccact cctcttcctc 6480
accctcctcc tccactgcac aggaagctta tcg 6513
<210> 179
<211> 6515
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 179
acggtggctg caccatctgt cttcatcttc ccgccatctg atgagcagtt gaaatctgga 60
actgcctctg ttgtgtgcct gctgaataac ttctatccca gagaggccaa agtacagtgg 120
aaggtggata acgccctcca atcgggtaac tcccaggaga gtgtcacaga gcaggacagc 180
aaggacagca cctacagcct cagcagcacc ctgacgctga gcaaagcaga ctacgagaaa 240
cacaaagtct acgcctgcga agtcacccat cagggcctga gctcgcccgt cacaaagagc 300
ttcaacaggg gagagtgttg agcggccgct cgaggccggc aaggccggat cccccgacct 360
cgacctctgg ctaataaagg aaatttattt tcattgcaat agtgtgttgg aattttttgt 420
gtctctcact cggaaggaca tatgggaggg caaatcattt ggtcgagatc cctcggagat 480
ctctagctag aggatcgatc cccgccccgg acgaactaaa cctgactacg acatctctgc 540
cccttcttcg cggggcagtg catgtaatcc cttcagttgg ttggtacaac ttgccaactg 600
ggccctgttc cacatgtgac acgggggggg accaaacaca aaggggttct ctgactgtag 660
ttgacatcct tataaatgga tgtgcacatt tgccaacact gagtggcttt catcctggag 720
cagactttgc agtctgtgga ctgcaacaca acattgcctt tatgtgtaac tcttggctga 780
agctcttaca ccaatgctgg gggacatgta cctcccaggg gcccaggaag actacgggag 840
gctacaccaa cgtcaatcag aggggcctgt gtagctaccg ataagcggac cctcaagagg 900
gcattagcaa tagtgtttat aaggccccct tgttaaccct aaacgggtag catatgcttc 960
ccgggtagta gtatatacta tccagactaa ccctaattca atagcatatg ttacccaacg 1020
ggaagcatat gctatcgaat tagggttagt aaaagggtcc taaggaacag cgatatctcc 1080
caccccatga gctgtcacgg ttttatttac atggggtcag gattccacga gggtagtgaa 1140
ccattttagt cacaagggca gtggctgaag atcaaggagc gggcagtgaa ctctcctgaa 1200
tcttcgcctg cttcttcatt ctccttcgtt tagctaatag aataactgct gagttgtgaa 1260
cagtaaggtg tatgtgaggt gctcgaaaac aaggtttcag gtgacgcccc cagaataaaa 1320
tttggacggg gggttcagtg gtggcattgt gctatgacac caatataacc ctcacaaacc 1380
ccttgggcaa taaatactag tgtaggaatg aaacattctg aatatcttta acaatagaaa 1440
tccatggggt ggggacaagc cgtaaagact ggatgtccat ctcacacgaa tttatggcta 1500
tgggcaacac ataatcctag tgcaatatga tactggggtt attaagatgt gtcccaggca 1560
gggaccaaga caggtgaacc atgttgttac actctatttg taacaagggg aaagagagtg 1620
gacgccgaca gcagcggact ccactggttg tctctaacac ccccgaaaat taaacggggc 1680
tccacgccaa tggggcccat aaacaaagac aagtggccac tctttttttt gaaattgtgg 1740
agtgggggca cgcgtcagcc cccacacgcc gccctgcggt tttggactgt aaaataaggg 1800
tgtaataact tggctgattg taaccccgct aaccactgcg gtcaaaccac ttgcccacaa 1860
aaccactaat ggcaccccgg ggaatacctg cataagtagg tgggcgggcc aagatagggg 1920
cgcgattgct gcgatctgga ggacaaatta cacacacttg cgcctgagcg ccaagcacag 1980
ggttgttggt cctcatattc acgaggtcgc tgagagcacg gtgggctaat gttgccatgg 2040
gtagcatata ctacccaaat atctggatag catatgctat cctaatctat atctgggtag 2100
cataggctat cctaatctat atctgggtag catatgctat cctaatctat atctgggtag 2160
tatatgctat cctaatttat atctgggtag cataggctat cctaatctat atctgggtag 2220
catatgctat cctaatctat atctgggtag tatatgctat cctaatctgt atccgggtag 2280
catatgctat cctaatagag attagggtag tatatgctat cctaatttat atctgggtag 2340
catatactac ccaaatatct ggatagcata tgctatccta atctatatct gggtagcata 2400
tgctatccta atctatatct gggtagcata ggctatccta atctatatct gggtagcata 2460
tgctatccta atctatatct gggtagtata tgctatccta atttatatct gggtagcata 2520
ggctatccta atctatatct gggtagcata tgctatccta atctatatct gggtagtata 2580
tgctatccta atctgtatcc gggtagcata tgctatcctc atgataagct gtcaaacatg 2640
agaattttct tgaagacgaa agggcctcgt gatacgccta tttttatagg ttaatgtcat 2700
gataataatg gtttcttaga cgtcaggtgg cacttttcgg ggaaatgtgc gcggaacccc 2760
tatttgttta tttttctaaa tacattcaaa tatgtatccg ctcatgagac aataaccctg 2820
ataaatgctt caataatatt gaaaaaggaa gagtatgagt attcaacatt tccgtgtcgc 2880
ccttattccc ttttttgcgg cattttgcct tcctgttttt gctcacccag aaacgctggt 2940
gaaagtaaaa gatgctgaag atcagttggg tgcacgagtg ggttacatcg aactggatct 3000
caacagcggt aagatccttg agagttttcg ccccgaagaa cgttttccaa tgatgagcac 3060
ttttaaagtt ctgctatgtg gcgcggtatt atcccgtgtt gacgccgggc aagagcaact 3120
cggtcgccgc atacactatt ctcagaatga cttggttgag tactcaccag tcacagaaaa 3180
gcatcttacg gatggcatga cagtaagaga attatgcagt gctgccataa ccatgagtga 3240
taacactgcg gccaacttac ttctgacaac gatcggagga ccgaaggagc taaccgcttt 3300
tttgcacaac atgggggatc atgtaactcg ccttgatcgt tgggaaccgg agctgaatga 3360
agccatacca aacgacgagc gtgacaccac gatgcctgca gcaatggcaa caacgttgcg 3420
caaactatta actggcgaac tacttactct agcttcccgg caacaattaa tagactggat 3480
ggaggcggat aaagttgcag gaccacttct gcgctcggcc cttccggctg gctggtttat 3540
tgctgataaa tctggagccg gtgagcgtgg gtctcgcggt atcattgcag cactggggcc 3600
agatggtaag ccctcccgta tcgtagttat ctacacgacg gggagtcagg caactatgga 3660
tgaacgaaat agacagatcg ctgagatagg tgcctcactg attaagcatt ggtaactgtc 3720
agaccaagtt tactcatata tactttagat tgatttaaaa cttcattttt aatttaaaag 3780
gatctaggtg aagatccttt ttgataatct catgaccaaa atcccttaac gtgagttttc 3840
gttccactga gcgtcagacc ccgtagaaaa gatcaaagga tcttcttgag atcctttttt 3900
tctgcgcgta atctgctgct tgcaaacaaa aaaaccaccg ctaccagcgg tggtttgttt 3960
gccggatcaa gagctaccaa ctctttttcc gaaggtaact ggcttcagca gagcgcagat 4020
accaaatact gttcttctag tgtagccgta gttaggccac cacttcaaga actctgtagc 4080
accgcctaca tacctcgctc tgctaatcct gttaccagtg gctgctgcca gtggcgataa 4140
gtcgtgtctt accgggttgg actcaagacg atagttaccg gataaggcgc agcggtcggg 4200
ctgaacgggg ggttcgtgca cacagcccag cttggagcga acgacctaca ccgaactgag 4260
atacctacag cgtgagctat gagaaagcgc cacgcttccc gaagggagaa aggcggacag 4320
gtatccggta agcggcaggg tcggaacagg agagcgcacg agggagcttc cagggggaaa 4380
cgcctggtat ctttatagtc ctgtcgggtt tcgccacctc tgacttgagc gtcgattttt 4440
gtgatgctcg tcaggggggc ggagcctatg gaaaaacgcc agcaacgcgg cctttttacg 4500
gttcctggcc ttttgctggc cttttgctca catgttcttt cctgcgttat cccctgattc 4560
tgtggataac cgtattaccg cctttgagtg agctgatacc gctcgccgca gccgaacgac 4620
cgagcgcagc gagtcagtga gcgaggaagc ggaagagcgc ccaatacgca aaccgcctct 4680
ccccgcgcgt tggccgattc attaatgcag ctggcacgac aggtttcccg actggaaagc 4740
gggcagtgag cgcaacgcaa ttaatgtgag ttagctcact cattaggcac cccaggcttt 4800
acactttatg cttccggctc gtatgttgtg tggaattgtg agcggataac aatttcacac 4860
aggaaacagc tatgaccatg attacgccaa gctctagcta gaggtcgagt ccctccccag 4920
caggcagaag tatgcaaagc atgcatctca attagtcagc aaccatagtc ccgcccctaa 4980
ctccgcccat cccgccccta actccgccca gttccgccca ttctccgccc catggctgac 5040
taattttttt tatttatgca gaggccgagg ccgcctcggc ctctgagcta ttccagaagt 5100
agtgaggagg cttttttgga ggcctaggct tttgcaaaaa gctttgcaaa gatggataaa 5160
gttttaaaca gagaggaatc tttgcagcta atggaccttc taggtcttga aaggagtggg 5220
aattggctcc ggtgcccgtc agtgggcaga gcgcacatcg cccacagtcc ccgagaagtt 5280
ggggggaggg gtcggcaatt gaaccggtgc ctagagaagg tggcgcgggg taaactggga 5340
aagtgatgtc gtgtactggc tccgcctttt tcccgagggt gggggagaac cgtatataag 5400
tgcagtagtc gccgtgaacg ttctttttcg caacgggttt gccgccagaa cacaggtaag 5460
tgccgtgtgt ggttcccgcg ggcctggcct ctttacgggt tatggccctt gcgtgccttg 5520
aattacttcc acctggctgc agtacgtgat tcttgatccc gagcttcggg ttggaagtgg 5580
gtgggagagt tcgaggcctt gcgcttaagg agccccttcg cctcgtgctt gagttgaggc 5640
ctggcctggg cgctggggcc gccgcgtgcg aatctggtgg caccttcgcg cctgtctcgc 5700
tgctttcgat aagtctctag ccatttaaaa tttttgatga cctgctgcga cgcttttttt 5760
ctggcaagat agtcttgtaa atgcgggcca agatctgcac actggtattt cggtttttgg 5820
ggccgcgggc ggcgacgggg cccgtgcgtc ccagcgcaca tgttcggcga ggcggggcct 5880
gcgagcgcgg ccaccgagaa tcggacgggg gtagtctcaa gctggccggc ctgctctggt 5940
gcctggcctc gcgccgccgt gtatcgcccc gccctgggcg gcaaggctgg cccggtcggc 6000
accagttgcg tgagcggaaa gatggccgct tcccggccct gctgcaggga gctcaaaatg 6060
gaggacgcgg cgctcgggag agcgggcggg tgagtcaccc acacaaagga aaagggcctt 6120
tccgtcctca gccgtcgctt catgtgactc cacggagtac cgggcgccgt ccaggcacct 6180
cgattagttc tcgagctttt ggagtacgtc gtctttaggt tggggggagg ggttttatgc 6240
gatggagttt ccccacactg agtgggtgga gactgaagtt aggccagctt ggcacttgat 6300
gtaattctcc ttggaatttg ccctttttga gtttggatct tggttcattc tcaagcctca 6360
gacagtggtt caaagttttt ttcttccatt tcaggtgtcg tgaggaattc tctagagatc 6420
cctcgacctc gagatccatt gtgcccgggc gcaccatgac ttggacccca ctcctcttcc 6480
tcaccctcct cctccactgc acaggaagct tatcg 6515
<210> 180
<211> 6519
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 180
caacccaagg ctgccccctc ggtcactctg ttcccgccct cctctgagga gcttcaagcc 60
aacaaggcca cactggtgtg tctcataagt gacttctacc cgggagccgt gacagtggcc 120
tggaaggcag atagcagccc cgtcaaggcg ggagtggaga ccaccacacc ctccaaacaa 180
agcaacaaca agtacgcggc cagcagctac ctgagcctga cgcctgagca gtggaagtcc 240
cacagaagct acagctgcca ggtcacgcat gaagggagca ccgtggagaa gacagtggcc 300
cctacagaat gttcatgagc ggccgctcga ggccggcaag gccggatccc ccgacctcga 360
cctctggcta ataaaggaaa tttattttca ttgcaatagt gtgttggaat tttttgtgtc 420
tctcactcgg aaggacatat gggagggcaa atcatttggt cgagatccct cggagatctc 480
tagctagagg atcgatcccc gccccggacg aactaaacct gactacgaca tctctgcccc 540
ttcttcgcgg ggcagtgcat gtaatccctt cagttggttg gtacaacttg ccaactgggc 600
cctgttccac atgtgacacg gggggggacc aaacacaaag gggttctctg actgtagttg 660
acatccttat aaatggatgt gcacatttgc caacactgag tggctttcat cctggagcag 720
actttgcagt ctgtggactg caacacaaca ttgcctttat gtgtaactct tggctgaagc 780
tcttacacca atgctggggg acatgtacct cccaggggcc caggaagact acgggaggct 840
acaccaacgt caatcagagg ggcctgtgta gctaccgata agcggaccct caagagggca 900
ttagcaatag tgtttataag gcccccttgt taaccctaaa cgggtagcat atgcttcccg 960
ggtagtagta tatactatcc agactaaccc taattcaata gcatatgtta cccaacggga 1020
agcatatgct atcgaattag ggttagtaaa agggtcctaa ggaacagcga tatctcccac 1080
cccatgagct gtcacggttt tatttacatg gggtcaggat tccacgaggg tagtgaacca 1140
ttttagtcac aagggcagtg gctgaagatc aaggagcggg cagtgaactc tcctgaatct 1200
tcgcctgctt cttcattctc cttcgtttag ctaatagaat aactgctgag ttgtgaacag 1260
taaggtgtat gtgaggtgct cgaaaacaag gtttcaggtg acgcccccag aataaaattt 1320
ggacgggggg ttcagtggtg gcattgtgct atgacaccaa tataaccctc acaaacccct 1380
tgggcaataa atactagtgt aggaatgaaa cattctgaat atctttaaca atagaaatcc 1440
atggggtggg gacaagccgt aaagactgga tgtccatctc acacgaattt atggctatgg 1500
gcaacacata atcctagtgc aatatgatac tggggttatt aagatgtgtc ccaggcaggg 1560
accaagacag gtgaaccatg ttgttacact ctatttgtaa caaggggaaa gagagtggac 1620
gccgacagca gcggactcca ctggttgtct ctaacacccc cgaaaattaa acggggctcc 1680
acgccaatgg ggcccataaa caaagacaag tggccactct tttttttgaa attgtggagt 1740
gggggcacgc gtcagccccc acacgccgcc ctgcggtttt ggactgtaaa ataagggtgt 1800
aataacttgg ctgattgtaa ccccgctaac cactgcggtc aaaccacttg cccacaaaac 1860
cactaatggc accccgggga atacctgcat aagtaggtgg gcgggccaag ataggggcgc 1920
gattgctgcg atctggagga caaattacac acacttgcgc ctgagcgcca agcacagggt 1980
tgttggtcct catattcacg aggtcgctga gagcacggtg ggctaatgtt gccatgggta 2040
gcatatacta cccaaatatc tggatagcat atgctatcct aatctatatc tgggtagcat 2100
aggctatcct aatctatatc tgggtagcat atgctatcct aatctatatc tgggtagtat 2160
atgctatcct aatttatatc tgggtagcat aggctatcct aatctatatc tgggtagcat 2220
atgctatcct aatctatatc tgggtagtat atgctatcct aatctgtatc cgggtagcat 2280
atgctatcct aatagagatt agggtagtat atgctatcct aatttatatc tgggtagcat 2340
atactaccca aatatctgga tagcatatgc tatcctaatc tatatctggg tagcatatgc 2400
tatcctaatc tatatctggg tagcataggc tatcctaatc tatatctggg tagcatatgc 2460
tatcctaatc tatatctggg tagtatatgc tatcctaatt tatatctggg tagcataggc 2520
tatcctaatc tatatctggg tagcatatgc tatcctaatc tatatctggg tagtatatgc 2580
tatcctaatc tgtatccggg tagcatatgc tatcctcatg ataagctgtc aaacatgaga 2640
attttcttga agacgaaagg gcctcgtgat acgcctattt ttataggtta atgtcatgat 2700
aataatggtt tcttagacgt caggtggcac ttttcgggga aatgtgcgcg gaacccctat 2760
ttgtttattt ttctaaatac attcaaatat gtatccgctc atgagacaat aaccctgata 2820
aatgcttcaa taatattgaa aaaggaagag tatgagtatt caacatttcc gtgtcgccct 2880
tattcccttt tttgcggcat tttgccttcc tgtttttgct cacccagaaa cgctggtgaa 2940
agtaaaagat gctgaagatc agttgggtgc acgagtgggt tacatcgaac tggatctcaa 3000
cagcggtaag atccttgaga gttttcgccc cgaagaacgt tttccaatga tgagcacttt 3060
taaagttctg ctatgtggcg cggtattatc ccgtgttgac gccgggcaag agcaactcgg 3120
tcgccgcata cactattctc agaatgactt ggttgagtac tcaccagtca cagaaaagca 3180
tcttacggat ggcatgacag taagagaatt atgcagtgct gccataacca tgagtgataa 3240
cactgcggcc aacttacttc tgacaacgat cggaggaccg aaggagctaa ccgctttttt 3300
gcacaacatg ggggatcatg taactcgcct tgatcgttgg gaaccggagc tgaatgaagc 3360
cataccaaac gacgagcgtg acaccacgat gcctgcagca atggcaacaa cgttgcgcaa 3420
actattaact ggcgaactac ttactctagc ttcccggcaa caattaatag actggatgga 3480
ggcggataaa gttgcaggac cacttctgcg ctcggccctt ccggctggct ggtttattgc 3540
tgataaatct ggagccggtg agcgtgggtc tcgcggtatc attgcagcac tggggccaga 3600
tggtaagccc tcccgtatcg tagttatcta cacgacgggg agtcaggcaa ctatggatga 3660
acgaaataga cagatcgctg agataggtgc ctcactgatt aagcattggt aactgtcaga 3720
ccaagtttac tcatatatac tttagattga tttaaaactt catttttaat ttaaaaggat 3780
ctaggtgaag atcctttttg ataatctcat gaccaaaatc ccttaacgtg agttttcgtt 3840
ccactgagcg tcagaccccg tagaaaagat caaaggatct tcttgagatc ctttttttct 3900
gcgcgtaatc tgctgcttgc aaacaaaaaa accaccgcta ccagcggtgg tttgtttgcc 3960
ggatcaagag ctaccaactc tttttccgaa ggtaactggc ttcagcagag cgcagatacc 4020
aaatactgtt cttctagtgt agccgtagtt aggccaccac ttcaagaact ctgtagcacc 4080
gcctacatac ctcgctctgc taatcctgtt accagtggct gctgccagtg gcgataagtc 4140
gtgtcttacc gggttggact caagacgata gttaccggat aaggcgcagc ggtcgggctg 4200
aacggggggt tcgtgcacac agcccagctt ggagcgaacg acctacaccg aactgagata 4260
cctacagcgt gagctatgag aaagcgccac gcttcccgaa gggagaaagg cggacaggta 4320
tccggtaagc ggcagggtcg gaacaggaga gcgcacgagg gagcttccag ggggaaacgc 4380
ctggtatctt tatagtcctg tcgggtttcg ccacctctga cttgagcgtc gatttttgtg 4440
atgctcgtca ggggggcgga gcctatggaa aaacgccagc aacgcggcct ttttacggtt 4500
cctggccttt tgctggcctt ttgctcacat gttctttcct gcgttatccc ctgattctgt 4560
ggataaccgt attaccgcct ttgagtgagc tgataccgct cgccgcagcc gaacgaccga 4620
gcgcagcgag tcagtgagcg aggaagcgga agagcgccca atacgcaaac cgcctctccc 4680
cgcgcgttgg ccgattcatt aatgcagctg gcacgacagg tttcccgact ggaaagcggg 4740
cagtgagcgc aacgcaatta atgtgagtta gctcactcat taggcacccc aggctttaca 4800
ctttatgctt ccggctcgta tgttgtgtgg aattgtgagc ggataacaat ttcacacagg 4860
aaacagctat gaccatgatt acgccaagct ctagctagag gtcgagtccc tccccagcag 4920
gcagaagtat gcaaagcatg catctcaatt agtcagcaac catagtcccg cccctaactc 4980
cgcccatccc gcccctaact ccgcccagtt ccgcccattc tccgccccat ggctgactaa 5040
ttttttttat ttatgcagag gccgaggccg cctcggcctc tgagctattc cagaagtagt 5100
gaggaggctt ttttggaggc ctaggctttt gcaaaaagct ttgcaaagat ggataaagtt 5160
ttaaacagag aggaatcttt gcagctaatg gaccttctag gtcttgaaag gagtgggaat 5220
tggctccggt gcccgtcagt gggcagagcg cacatcgccc acagtccccg agaagttggg 5280
gggaggggtc ggcaattgaa ccggtgccta gagaaggtgg cgcggggtaa actgggaaag 5340
tgatgtcgtg tactggctcc gcctttttcc cgagggtggg ggagaaccgt atataagtgc 5400
agtagtcgcc gtgaacgttc tttttcgcaa cgggtttgcc gccagaacac aggtaagtgc 5460
cgtgtgtggt tcccgcgggc ctggcctctt tacgggttat ggcccttgcg tgccttgaat 5520
tacttccacc tggctgcagt acgtgattct tgatcccgag cttcgggttg gaagtgggtg 5580
ggagagttcg aggccttgcg cttaaggagc cccttcgcct cgtgcttgag ttgaggcctg 5640
gcctgggcgc tggggccgcc gcgtgcgaat ctggtggcac cttcgcgcct gtctcgctgc 5700
tttcgataag tctctagcca tttaaaattt ttgatgacct gctgcgacgc tttttttctg 5760
gcaagatagt cttgtaaatg cgggccaaga tctgcacact ggtatttcgg tttttggggc 5820
cgcgggcggc gacggggccc gtgcgtccca gcgcacatgt tcggcgaggc ggggcctgcg 5880
agcgcggcca ccgagaatcg gacgggggta gtctcaagct ggccggcctg ctctggtgcc 5940
tggcctcgcg ccgccgtgta tcgccccgcc ctgggcggca aggctggccc ggtcggcacc 6000
agttgcgtga gcggaaagat ggccgcttcc cggccctgct gcagggagct caaaatggag 6060
gacgcggcgc tcgggagagc gggcgggtga gtcacccaca caaaggaaaa gggcctttcc 6120
gtcctcagcc gtcgcttcat gtgactccac ggagtaccgg gcgccgtcca ggcacctcga 6180
ttagttctcg agcttttgga gtacgtcgtc tttaggttgg ggggaggggt tttatgcgat 6240
ggagtttccc cacactgagt gggtggagac tgaagttagg ccagcttggc acttgatgta 6300
attctccttg gaatttgccc tttttgagtt tggatcttgg ttcattctca agcctcagac 6360
agtggttcaa agtttttttc ttccatttca ggtgtcgtga ggaattctct agagatccct 6420
cgacctcgag atccattgtg cccgggcgcc accatggaca tgcgcgtgcc cgcccagctg 6480
ctgggcctgc tgctgctgtg gttccccggc tcgcgatgc 6519
<210> 181
<211> 7185
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic polynucleotide
<400> 181
gcgtcgacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaagc cgcgggggga 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgcgaggag 720
atgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tccgggtaaa tgagcggccg ctcgaggccg gcaaggccgg 1020
atcccccgac ctcgacctct ggctaataaa ggaaatttat tttcattgca atagtgtgtt 1080
ggaatttttt gtgtctctca ctcggaagga catatgggag ggcaaatcat ttggtcgaga 1140
tccctcggag atctctagct agaggatcga tccccgcccc ggacgaacta aacctgacta 1200
cgacatctct gccccttctt cgcggggcag tgcatgtaat cccttcagtt ggttggtaca 1260
acttgccaac tgggccctgt tccacatgtg acacgggggg ggaccaaaca caaaggggtt 1320
ctctgactgt agttgacatc cttataaatg gatgtgcaca tttgccaaca ctgagtggct 1380
ttcatcctgg agcagacttt gcagtctgtg gactgcaaca caacattgcc tttatgtgta 1440
actcttggct gaagctctta caccaatgct gggggacatg tacctcccag gggcccagga 1500
agactacggg aggctacacc aacgtcaatc agaggggcct gtgtagctac cgataagcgg 1560
accctcaaga gggcattagc aatagtgttt ataaggcccc cttgttaacc ctaaacgggt 1620
agcatatgct tcccgggtag tagtatatac tatccagact aaccctaatt caatagcata 1680
tgttacccaa cgggaagcat atgctatcga attagggtta gtaaaagggt cctaaggaac 1740
agcgatatct cccaccccat gagctgtcac ggttttattt acatggggtc aggattccac 1800
gagggtagtg aaccatttta gtcacaaggg cagtggctga agatcaagga gcgggcagtg 1860
aactctcctg aatcttcgcc tgcttcttca ttctccttcg tttagctaat agaataactg 1920
ctgagttgtg aacagtaagg tgtatgtgag gtgctcgaaa acaaggtttc aggtgacgcc 1980
cccagaataa aatttggacg gggggttcag tggtggcatt gtgctatgac accaatataa 2040
ccctcacaaa ccccttgggc aataaatact agtgtaggaa tgaaacattc tgaatatctt 2100
taacaataga aatccatggg gtggggacaa gccgtaaaga ctggatgtcc atctcacacg 2160
aatttatggc tatgggcaac acataatcct agtgcaatat gatactgggg ttattaagat 2220
gtgtcccagg cagggaccaa gacaggtgaa ccatgttgtt acactctatt tgtaacaagg 2280
ggaaagagag tggacgccga cagcagcgga ctccactggt tgtctctaac acccccgaaa 2340
attaaacggg gctccacgcc aatggggccc ataaacaaag acaagtggcc actctttttt 2400
ttgaaattgt ggagtggggg cacgcgtcag cccccacacg ccgccctgcg gttttggact 2460
gtaaaataag ggtgtaataa cttggctgat tgtaaccccg ctaaccactg cggtcaaacc 2520
acttgcccac aaaaccacta atggcacccc ggggaatacc tgcataagta ggtgggcggg 2580
ccaagatagg ggcgcgattg ctgcgatctg gaggacaaat tacacacact tgcgcctgag 2640
cgccaagcac agggttgttg gtcctcatat tcacgaggtc gctgagagca cggtgggcta 2700
atgttgccat gggtagcata tactacccaa atatctggat agcatatgct atcctaatct 2760
atatctgggt agcataggct atcctaatct atatctgggt agcatatgct atcctaatct 2820
atatctgggt agtatatgct atcctaattt atatctgggt agcataggct atcctaatct 2880
atatctgggt agcatatgct atcctaatct atatctgggt agtatatgct atcctaatct 2940
gtatccgggt agcatatgct atcctaatag agattagggt agtatatgct atcctaattt 3000
atatctgggt agcatatact acccaaatat ctggatagca tatgctatcc taatctatat 3060
ctgggtagca tatgctatcc taatctatat ctgggtagca taggctatcc taatctatat 3120
ctgggtagca tatgctatcc taatctatat ctgggtagta tatgctatcc taatttatat 3180
ctgggtagca taggctatcc taatctatat ctgggtagca tatgctatcc taatctatat 3240
ctgggtagta tatgctatcc taatctgtat ccgggtagca tatgctatcc tcatgataag 3300
ctgtcaaaca tgagaatttt cttgaagacg aaagggcctc gtgatacgcc tatttttata 3360
ggttaatgtc atgataataa tggtttctta gacgtcaggt ggcacttttc ggggaaatgt 3420
gcgcggaacc cctatttgtt tatttttcta aatacattca aatatgtatc cgctcatgag 3480
acaataaccc tgataaatgc ttcaataata ttgaaaaagg aagagtatga gtattcaaca 3540
tttccgtgtc gcccttattc ccttttttgc ggcattttgc cttcctgttt ttgctcaccc 3600
agaaacgctg gtgaaagtaa aagatgctga agatcagttg ggtgcacgag tgggttacat 3660
cgaactggat ctcaacagcg gtaagatcct tgagagtttt cgccccgaag aacgttttcc 3720
aatgatgagc acttttaaag ttctgctatg tggcgcggta ttatcccgtg ttgacgccgg 3780
gcaagagcaa ctcggtcgcc gcatacacta ttctcagaat gacttggttg agtactcacc 3840
agtcacagaa aagcatctta cggatggcat gacagtaaga gaattatgca gtgctgccat 3900
aaccatgagt gataacactg cggccaactt acttctgaca acgatcggag gaccgaagga 3960
gctaaccgct tttttgcaca acatggggga tcatgtaact cgccttgatc gttgggaacc 4020
ggagctgaat gaagccatac caaacgacga gcgtgacacc acgatgcctg cagcaatggc 4080
aacaacgttg cgcaaactat taactggcga actacttact ctagcttccc ggcaacaatt 4140
aatagactgg atggaggcgg ataaagttgc aggaccactt ctgcgctcgg cccttccggc 4200
tggctggttt attgctgata aatctggagc cggtgagcgt gggtctcgcg gtatcattgc 4260
agcactgggg ccagatggta agccctcccg tatcgtagtt atctacacga cggggagtca 4320
ggcaactatg gatgaacgaa atagacagat cgctgagata ggtgcctcac tgattaagca 4380
ttggtaactg tcagaccaag tttactcata tatactttag attgatttaa aacttcattt 4440
ttaatttaaa aggatctagg tgaagatcct ttttgataat ctcatgacca aaatccctta 4500
acgtgagttt tcgttccact gagcgtcaga ccccgtagaa aagatcaaag gatcttcttg 4560
agatcctttt tttctgcgcg taatctgctg cttgcaaaca aaaaaaccac cgctaccagc 4620
ggtggtttgt ttgccggatc aagagctacc aactcttttt ccgaaggtaa ctggcttcag 4680
cagagcgcag ataccaaata ctgttcttct agtgtagccg tagttaggcc accacttcaa 4740
gaactctgta gcaccgccta catacctcgc tctgctaatc ctgttaccag tggctgctgc 4800
cagtggcgat aagtcgtgtc ttaccgggtt ggactcaaga cgatagttac cggataaggc 4860
gcagcggtcg ggctgaacgg ggggttcgtg cacacagccc agcttggagc gaacgaccta 4920
caccgaactg agatacctac agcgtgagct atgagaaagc gccacgcttc ccgaagggag 4980
aaaggcggac aggtatccgg taagcggcag ggtcggaaca ggagagcgca cgagggagct 5040
tccaggggga aacgcctggt atctttatag tcctgtcggg tttcgccacc tctgacttga 5100
gcgtcgattt ttgtgatgct cgtcaggggg gcggagccta tggaaaaacg ccagcaacgc 5160
ggccttttta cggttcctgg ccttttgctg gccttttgct cacatgttct ttcctgcgtt 5220
atcccctgat tctgtggata accgtattac cgcctttgag tgagctgata ccgctcgccg 5280
cagccgaacg accgagcgca gcgagtcagt gagcgaggaa gcggaagagc gcccaatacg 5340
caaaccgcct ctccccgcgc gttggccgat tcattaatgc agctggcacg acaggtttcc 5400
cgactggaaa gcgggcagtg agcgcaacgc aattaatgtg agttagctca ctcattaggc 5460
accccaggct ttacacttta tgcttccggc tcgtatgttg tgtggaattg tgagcggata 5520
acaatttcac acaggaaaca gctatgacca tgattacgcc aagctctagc tagaggtcga 5580
gtccctcccc agcaggcaga agtatgcaaa gcatgcatct caattagtca gcaaccatag 5640
tcccgcccct aactccgccc atcccgcccc taactccgcc cagttccgcc cattctccgc 5700
cccatggctg actaattttt tttatttatg cagaggccga ggccgcctcg gcctctgagc 5760
tattccagaa gtagtgagga ggcttttttg gaggcctagg cttttgcaaa aagctttgca 5820
aagatggata aagttttaaa cagagaggaa tctttgcagc taatggacct tctaggtctt 5880
gaaaggagtg ggaattggct ccggtgcccg tcagtgggca gagcgcacat cgcccacagt 5940
ccccgagaag ttggggggag gggtcggcaa ttgaaccggt gcctagagaa ggtggcgcgg 6000
ggtaaactgg gaaagtgatg tcgtgtactg gctccgcctt tttcccgagg gtgggggaga 6060
accgtatata agtgcagtag tcgccgtgaa cgttcttttt cgcaacgggt ttgccgccag 6120
aacacaggta agtgccgtgt gtggttcccg cgggcctggc ctctttacgg gttatggccc 6180
ttgcgtgcct tgaattactt ccacctggct gcagtacgtg attcttgatc ccgagcttcg 6240
ggttggaagt gggtgggaga gttcgaggcc ttgcgcttaa ggagcccctt cgcctcgtgc 6300
ttgagttgag gcctggcctg ggcgctgggg ccgccgcgtg cgaatctggt ggcaccttcg 6360
cgcctgtctc gctgctttcg ataagtctct agccatttaa aatttttgat gacctgctgc 6420
gacgcttttt ttctggcaag atagtcttgt aaatgcgggc caagatctgc acactggtat 6480
ttcggttttt ggggccgcgg gcggcgacgg ggcccgtgcg tcccagcgca catgttcggc 6540
gaggcggggc ctgcgagcgc ggccaccgag aatcggacgg gggtagtctc aagctggccg 6600
gcctgctctg gtgcctggcc tcgcgccgcc gtgtatcgcc ccgccctggg cggcaaggct 6660
ggcccggtcg gcaccagttg cgtgagcgga aagatggccg cttcccggcc ctgctgcagg 6720
gagctcaaaa tggaggacgc ggcgctcggg agagcgggcg ggtgagtcac ccacacaaag 6780
gaaaagggcc tttccgtcct cagccgtcgc ttcatgtgac tccacggagt accgggcgcc 6840
gtccaggcac ctcgattagt tctcgagctt ttggagtacg tcgtctttag gttgggggga 6900
ggggttttat gcgatggagt ttccccacac tgagtgggtg gagactgaag ttaggccagc 6960
ttggcacttg atgtaattct ccttggaatt tgcccttttt gagtttggat cttggttcat 7020
tctcaagcct cagacagtgg ttcaaagttt ttttcttcca tttcaggtgt cgtgaggaat 7080
tctctagaga tccctcgacc tcgagatcca ttgtgcccgg gcgccaccat ggagtttggg 7140
ctgagctggc tttttcttgt cgcgatttta aaaggtgtcc agtgc 7185
<210> 182
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic peptide
<400> 182
Asp Glu Val Asp
1
Claims (76)
- 폴리펩타이드 쇄를 포함하는 결합 단백질로서, 상기 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 중쇄 가변 도메인이고;
VD2는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이고;
n은 0 또는 1이고;
상기 결합 단백질은 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 항원 쌍에 결합할 수 있는, 결합 단백질. - 제1항에 있어서, VD1 및 VD2가 서열번호 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 87, 90, 110 및 112로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하는, 결합 단백질.
- 폴리펩타이드 쇄를 포함하는 결합 단백질로서, 상기 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 경쇄 가변 도메인이고;
VD2는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않으며;
n은 0 또는 1이고;
상기 결합 단백질은 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 항원 쌍에 결합할 수 있는, 결합 단백질. - 제3항에 있어서, 상기 VD1 및 VD2 경쇄 가변 도메인이 서열번호 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 88, 91, 111 및 113으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하는, 결합 단백질.
- 제1항 또는 제3항에 있어서, n이 0인 결합 단백질.
- 제1 폴리펩타이드 쇄와 제2 폴리펩타이드 쇄를 포함하는 결합 단백질로서,
상기 제1 폴리펩타이드 쇄가 제1 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 중쇄 가변 도메인이고;
VD2는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이며;
상기 제2 폴리펩타이드 쇄가 제2 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 경쇄 가변 도메인이고;
VD2는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않고;
n은 0 또는 1이며,
상기 결합 단백질은 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 항원 쌍에 결합할 수 있는, 결합 단백질. - 제6항에 있어서, 상기 VD1 및 VD2 중쇄 가변 도메인이 서열번호 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 87, 90, 110 및 112로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하고, 상기 VD1 및 VD2 경쇄 가변 도메인이 서열번호 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 88, 91, 111 및 113으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, X1 또는 X2가 서열번호 1 내지 26으로 이루어진 그룹 중에서 선택되는 아미노산 서열인 결합 단백질.
- 제6항에 있어서, 상기 결합 단백질이 2개의 제1 폴리펩타이드 쇄와 2개의 제2 폴리펩타이드 쇄를 포함하는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 Fc 영역이 천연 서열 Fc 영역 및 변이체 서열 Fc 영역으로 이루어진 그룹 중에서 선택되는, 결합 단백질.
- 제10항에 있어서, 상기 Fc 영역이 IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE 및 IgD 유래의 Fc 영역으로 이루어진 그룹 중에서 선택되는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 제1 폴리펩타이드 쇄의 VD1 및 상기 제2 폴리펩타이드 쇄의 VD1이 동일한 제1 및 제2 모 항체 각각, 또는 이의 항원결합부로부터 수득되는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 제1 폴리펩타이드 쇄의 VD1 및 상기 제2 폴리펩타이드 쇄의 VD1이 상이한 제1 및 제2 모 항체 각각, 또는 이의 항원결합부로부터 수득되는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 제1 폴리펩타이드 쇄의 VD2 및 상기 제2 폴리펩타이드 쇄의 VD2가 동일한 제1 및 제2 모 항체 각각, 또는 이의 항원결합부로부터 수득되는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 제1 폴리펩타이드 쇄의 VD2 및 상기 제2 폴리펩타이드 쇄의 VD2가 상이한 제1 및 제2 모 항체 각각, 또는 이의 항원결합부로부터 수득되는, 결합 단백질.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 제1 모 항체 및 상기 제2 모 항체가 상기 항원 상의 상이한 에피토프에 결합하는, 결합 단백질.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부는, 상기 제2 모 항체 또는 이의 항원결합부가 상기 제2 항원에 결합하는 효능과 상이한 효능으로 상기 제1 항원에 결합하는, 결합 단백질.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부는, 상기 제2 모 항체 또는 이의 항원결합부가 상기 제2 항원에 결합하는 친화성과 상이한 친화성으로 상기 제1 항원에 결합하는, 결합 단백질.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부, 및 상기 제2 모 항체 또는 이의 항원결합부가 사람 항체, CDR 이식된 항체 및 사람화된 항체로 이루어진 그룹 중에서 선택되는, 결합 단백질.
- 제13항 내지 제15항 중 어느 한 항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부, 및 상기 제2 모 항체 또는 이의 항원결합부가 Fab 단편; F(ab')2 단편; 힌지(hinge) 영역에서 이황화 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편; VH 및 CH1 도메인으로 이루어진 Fd 단편; 항체의 단일 아암(arm)의 VL 및 VH 도메인으로 이루어진 Fv 단편; dAb 단편; 분리된 상보성 결정 영역(CDR); 단일 쇄 항체; 및 디아바디(diabody)로 이루어진 그룹 중에서 선택되는, 결합 단백질.
- 제1항, 제3항 및 제6항 중 어느 한 항에 있어서, 상기 결합 단백질이 상기 제1 모 항체 또는 이의 항원결합부, 또는 상기 제2 모 항체 또는 이의 항원결합부에 의해 나타나는 적어도 하나의 목적 성질을 보유하는, 결합 단백질.
- 제2항에 있어서, 상기 목적 성질이 하나 이상의 항체 파라미터 중에서 선택되는, 결합 단백질.
- 제21항에 있어서, 상기 항체 파라미터가 항원 특이성, 항원에 대한 친화성, 효능, 생물학적 기능, 에피토프 인식, 안정성, 가용성, 생산 효율, 면역원성, 약동학, 생체이용률, 조직 교차반응성 및 이종상동성(orthologous) 항원 결합으로 이루어진 그룹 중에서 선택되는, 결합 단백질.
- 4개의 폴리펩타이드 쇄를 포함하는, 2개의 항원에 결합할 수 있는 결합 단백질로서, 여기서 2개의 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 중쇄 가변 도메인이고;
VD2는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이며;
2개의 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 경쇄 가변 도메인이고;
VD2는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않고;
n은 0 또는 1이며; 상기 VD1 및 VD2 중쇄 가변 도메인이 서열번호 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 87, 90, 110 및 112로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하고, 상기 VD1 및 VD2 경쇄 가변 도메인이 서열번호 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 88, 91, 111 및 113으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하는, 결합 단백질. - 4개의 폴리펩타이드 쇄를 포함하는, 2개의 항원에 결합할 수 있는 결합 단백질로서, 여기서 2개의 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 중쇄 가변 도메인이고;
VD2는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이고;
n은 0 또는 1이고;
2개의 폴리펩타이드 쇄가 VD1-(X1)n-VD2-C-(X2)n을 포함하고, 여기서
VD1은 제1 경쇄 가변 도메인이고;
VD2는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않고;
n은 0 또는 1이며;
상기 DVD-Ig이 프로스타글란딘 E2(PGE2), 아밀로이드 베타(Abeta)(서열 1), Abeta(서열 2), Abeta(서열 3), 종양 괴사 인자 알파(TNF-α), 인터류킨 1β(IL-1β), 인슐린-유사 성장인자 수용체(IGFR), 인터류킨 17A(IL-17A), 인터류킨 6(IL-6), 인터류킨 6 수용체(IL-6R), 인터류킨 15(IL-15), 인터류킨 18(IL-18), 신경성장인자(NGF), 표피성장인자 수용체(EGFR)(서열 1), EGFR(서열 2), 혈관 내피성장인자(VEGF) 및 S1P로 이루어진 그룹 중에서 선택되는 적어도 하나의 항원에 결합하는, 결합 단백질. - 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 있어서, 상기 결합 단백질이, 표면 플라스몬 공명으로 측정했을 때, 적어도 약 102 M-1s-1, 적어도 약 103 M-1s-1, 적어도 약 104 M-1s-1, 적어도 약 105 M-1s-1, 및 적어도 약 106 M-1s-1로 이루어진 그룹 중에서 선택되는 상기 하나 이상의 표적에 대한 온 속도(on rate) 상수(Kon)를 보유하는, 결합 단백질.
- 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 있어서, 상기 결합 단백질이, 표면 플라스몬 공명으로 측정했을 때, 최대 약 10-3s-1, 최대 약 10-4s-1, 최대 약 10-5s-1, 및 최대 약 10-6s- 1으로 이루어진 그룹 중에서 선택되는 상기 하나 이상의 표적에 대한 오프 속도(off rate) 상수(Koff)를 보유하는, 결합 단백질.
- 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 있어서, 상기 결합 단백질이, 최대 약 10-7M; 최대 약 10-8M; 최대 약 10-9M; 최대 약 10-10M; 최대 약 10-11M; 최대 약 10-12M; 및 최대 약 10-13M로 이루어진 그룹 중에서 선택되는 상기 하나 이상의 표적에 대한 해리 상수(KD)를 보유하는, 결합 단백질.
- 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 따른 결합 단백질을 포함하고, 면역접착 분자, 영상화제, 치료제 및 세포독성제로 이루어진 그룹 중에서 선택되는 제제를 추가로 포함하는, 결합 단백질 접합체.
- 제29항에 있어서, 상기 제제가 방사능표지, 효소, 형광 표지, 발광 표지, 생물발광 표지, 자성 표지 및 비오틴으로 이루어진 그룹 중에서 선택되는 영상화제인 결합 단백질 접합체.
- 제30항에 있어서, 상기 영상화제가 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho 및 153Sm으로 이루어진 그룹 중에서 선택되는 방사능표지인 결합 단백질 접합체.
- 제30항에 있어서, 상기 제제가 항대사산물, 알킬화제, 항생제, 성장 인자, 사이토킨, 항혈관형성제, 항유사분열제, 안트라사이클린, 독소 및 아폽토시스제로 이루어진 그룹 중에서 선택되는 치료제 또는 세포독성제인 결합 단백질 접합체.
- 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 있어서, 상기 결합 단백질이, 결정화된 결합 단백질인, 결합 단백질.
- 제33항에 있어서, 상기 결정이 무담체 약제학적 제어 방출 결정인 결합 단백질.
- 제33항에 있어서, 상기 결합 단백질이 상기 결합 단백질의 가용성 대응물보다 긴 생체내 반감기를 나타내는, 결합 단백질.
- 제33항에 있어서, 상기 결합 단백질이, 생물학적 활성을 보유하는, 결합 단백질.
- 제1항, 제3항, 제6항, 제24항 및 제25항 중 어느 한 항에 따른 결합 단백질 아미노산 서열을 암호화하는, 분리된 핵산.
- 제37항에 따른 분리된 핵산을 포함하는 벡터.
- 제38항에 있어서, 상기 벡터가 pcDNA, pTT, pTT3, pEFBOS, pBV, pJV, pcDNA3.1 TOPO, pEF6 TOPO 및 pBJ로 이루어진 그룹 중에서 선택되는 벡터.
- 제38항에 따른 벡터를 포함하는 숙주 세포.
- 제40항에 있어서, 상기 숙주 세포가 원핵 세포인 숙주 세포.
- 제41항에 있어서, 상기 숙주 세포가 이.콜라이(E. coli)인 숙주 세포.
- 제40항에 있어서, 상기 숙주 세포가 진핵 세포인 숙주 세포.
- 제43항에 있어서, 상기 진핵 세포가 원생생물 세포, 동물 세포, 식물 세포 및 진균 세포로 이루어진 그룹으로부터 선택되는 숙주 세포.
- 제43항에 있어서, 상기 진핵 세포가 포유동물 세포, 조류 세포 및 곤충 세포로 이루어진 그룹 중에서 선택되는 동물 세포인 숙주 세포.
- 제45항에 있어서, 상기 숙주 세포가 CHO 세포인 숙주 세포.
- 제45항에 있어서, 상기 숙주 세포가 COS인 숙주 세포.
- 제43항에 있어서, 상기 숙주 세포가 효모 세포인 숙주 세포.
- 제48항에 있어서, 상기 효모 세포가 사카로마이세스 세레비지애(Saccharomyces cerevisiae)인 숙주 세포.
- 제45항에 있어서, 상기 숙주 세포가 곤충 Sf9 세포인 숙주 세포.
- 제40항 내지 제50항 중 어느 한 항에 따른 숙주 세포를, 상기 결합 단백질을 생산하기에 충분한 조건 하에 배양 배지에서 배양함을 포함하여, 결합 단백질을 생산하는 방법.
- 제51항에 있어서, 생산된 상기 결합 단백질의 50% 내지 75%가 이원 특이적 4가 결합 단백질인 방법.
- 제51항에 있어서, 생산된 상기 결합 단백질의 75% 내지 90%가 이원 특이적 4가 결합 단백질인 방법.
- 제51항에 있어서, 생산된 상기 결합 단백질의 90% 내지 95%가 이원 특이적 4가 결합 단백질인 방법.
- 제51항에 따른 방법에 따라 생산된 단백질.
- 제1항 내지 제36항 및 제55항 중 어느 한 항에 따른 결합 단백질 및 약제학적으로 허용되는 담체를 포함하는 약제학적 조성물.
- 제56항에 있어서, 적어도 하나의 추가의 치료제를 추가로 포함하는 약제학적 조성물.
- 제57항에 있어서, 상기 추가의 치료제가 치료제, 영상화제, 세포독성 제제, 혈관형성 저해제; 키나제 저해제; 공동 자극 분자 차단제; 부착 분자 차단제; 항-사이토킨 항체 또는 이의 기능성 단편; 메토트렉세이트; 사이클로스포린; 라파마이신; FK506; 검출가능한 표지 또는 리포터; TNF 길항제; 항류마티스제; 근육 이완제, 마약류, 비스테로이드 소염 약물(NSAID), 진통제, 마취제, 진정제, 국소 마취제, 신경근 차단제, 항 미생물성 제제, 건선치료제, 코르티코스테로이드, 동화작용 스테로이드, 에리트로포이에틴, 면역화제, 면역글로불린, 면역억제제, 성장 호르몬, 호르몬 대체 약물, 방사선 약제, 항우울증제, 항정신병제, 자극제, 천식 약물, 베타 작용제, 흡입 스테로이드, 에피네프린 또는 유사체, 사이토킨 및 사이토킨 길항제로 이루어진 그룹으로부터 선택되는 약제학적 조성물.
- 제1항 내지 제36항 및 제55항 중 어느 한 항에 따른 결합 단백질을 치료가 달성되도록 피검체에게 투여하여 질환 또는 장애에 대해 피검체를 치료하는 방법.
- 제59항에 있어서, 상기 장애가 류마티스성 관절염, 골관절염, 연소성 만성 관절염, 패혈성 관절염, 라임 관절염, 건선 관절염, 반응성 관절염, 척추관절증, 전신 홍반성 낭창, 크론 질환, 궤양 대장염, 장 염증 질환, 인슐린 의존성 진성 당뇨병, 갑상선염, 천식, 알레르기성 질환, 건선, 피부경화증, 이식편 대 숙주 질환, 기관 이식 거부, 기관 이식과 관련된 급성 또는 만성 면역 질환, 유육종증, 동맥경화증, 파종성 혈관내 응고, 가와사키병, 그레이브병, 신증후군, 만성 피로 증후군, 베게너 육아종증, 헤노흐-쇤라인 자반증, 신장의 현미경적 혈관염, 만성 활성 간염, 포도막염, 패혈성 쇼크, 독소 쇼크 증후군, 패혈증 증후군, 악액질, 감염성 질환, 기생충 질환, 후천성 면역결핍 증후군, 급성 횡단성 척수염, 헌팅톤 무도병, 파킨슨병, 알츠하이머병, 뇌졸중, 원발성 담즙성 간경변, 용혈성 빈혈, 악성 종양, 심부전증, 심근경색, 애디슨병, 산발성 질환, 다분비선 제I형 결핍증 및 다분비선 제II형 결핍증, 슈미트 증후군, 성인성(급성) 호흡 곤란 증후군, 탈모증, 원형 탈모증, 혈청반응 음성 관절증, 관절증, 라이터병, 건선성 관절증, 궤양성 대장염성 관절증, 장병증성 활막염, 클라미디아증, 예르시니아 및 살모넬라 관련 관절증, 척추관절증, 죽종 질환/동맥경화증, 아토피성 알레르기, 자가면역 수포성 질환, 심상성 천포창, 낙엽성 천포창, 유천포창, 선상 IgA 질환, 자가면역 용혈성 빈혈, 크움즈 양성 용혈성 빈혈, 후천성 악성 빈혈, 연소성 악성 빈혈, 근통성 뇌염/로얄 프리(Royal Free) 질환, 만성 점막 피부 칸디다증, 거세포 동맥염, 원발성 경화성 간염, 잠복성 자가면역 간염, 후천성 면역결핍 질환 증후군, 후천성 면역결핍 관련 질환, B형 간염, C형 간염, 공통 가변성 면역결핍증(공통 가변성 감마글로불린저혈증), 확장형 심근증, 여성 불임증, 난소 부전증, 조숙 난소부전, 섬유성 폐 질환, 잠복성 섬유조직 폐포염, 후-염증성 간질성 폐질환, 간질성 폐렴, 결합 조직 질환 관련 간질성 폐 질환, 조합성 결합 조직 질환 관련 폐 질환, 전신성 경화증 관련 간질성 폐 질환, 류마티스성 관절염 관련 간질성 폐 질환, 전신 홍반성 낭창 관련 폐 질환, 피부근염/다발성 근염 관련 폐 질환, 쇼그렌 질환 관련 폐 질환, 강직성 척추염 관련 폐 질환, 혈관염 범발성 폐 질환, 혈철증 관련 폐 질환, 약물-유도된 간질성 폐 질환, 섬유증, 방사선 섬유증, 폐색성 세기관지염, 만성 호산구성 폐렴, 림프구성 침윤성 폐 질환, 감염후 간질성 폐 질환, 통풍성 관절염, 자가면역 간염, 1형 자가면역 간염(전형적 자가면역 또는 루포이드 간염), 2형 자가면역 간염(항-LKM 항체 간염), 자가면역 매개된 저혈당증, 흑색 극세포증에 따른 B형 인슐린 내성, 부갑상선 기능저하증, 기관 이식과 관련된 급성 면역 질환, 기관 이식과 관련된 만성 면역 질환, 골관절증, 원발성 경화성 담관염, 1형 건선, 2형 건선, 특발성 백혈구감소증, 자가면역 호중구감소증, 신장 질환 NOS, 사구체신염, 신장의 현미경적 혈관염, 라임병, 원판양 홍반성 낭창, 남성 불임증 특발증 또는 NOS, 정자 자가면역, 다발성 경화증(모든 아형), 교감성 안염, 결합 조직 질환에 속발성인 폐 고혈압증, 구드패스튜어 증후군, 결절성 다발성 동맥염의 폐 징후, 급성 류마티스성 열, 류마티스성 척추염, 스틸씨 병, 전신성 경화증, 쇼그렌 증후군, 다카야스 병/동맥염, 자가면역 혈소판감소증, 특발성 혈소판감소증, 자가면역 갑상선 질환, 갑상선 기능항진증, 갑상선종증 자가면역 갑상선 기능저하증(하시모토 병), 위축성 자가 면역 갑상선 기능저하증, 원발성 점액수종, 수정체성 포도막염, 원발성 혈관염, 백반증 급성 간 질환, 만성 간질환, 알콜성 경변, 알콜 유도 간 손상, 콜레오사타티스(choleosatatis), 특이체질성 간 질환, 약물 유도 간염, 비알콜성 지방간염, 알레르기 및 천식, B 그룹 스트렙토코커스 (GBS) 감염, 정신 장애(예를 들어, 우울증 및 정신분열증), Th2 형 및 Th1 형 매개 질환, 급성 및 만성 통증(상이한 형태의 통증), 및 폐암, 유방암, 위암, 방광암, 결장암, 췌장암, 난소암, 전립선암 및 직장암과 같은 암종 및 조혈 악성종양(백혈병 및 림프종), 아베타지방단백질혈증, 말초청색증, 급성 및 만성 기생충성 또는 감염성 과정, 급성 백혈병, 급성 림프성 모구성 백혈병 (ALL), 급성 골수 백혈병(AML), 급성 또는 만성 세균 감염, 급성 췌장염, 급성 신부전증, 선암종, 공기 이소성 심방박동, AIDS 치매 합병증, 알콜 유도 간염, 알레르기성 결막염, 알레르기성 접촉 피부염, 알레르기성 비염, 동종이식 거부, 알파-1-안티트립신 결핍, 근위축성 측삭 경화증, 빈혈, 앙기나 협심증, 전각 세포 퇴화, 항 cd3 치료, 항 인지질 증후군, 항-수용체 과민성 반응, 대동맥 및 말초 결찰증, 대동맥 해부, 동맥 고혈압, 동맥경화증, 동정맥 누공, 운동실조증, 심방세동 (지연 또는 발작성), 심방조동, 동정맥 막힘, B 세포 림프종, 골 이식 거부, 골수 이식 (BMT) 거부, 좌각차단, 버키트 림프종, 화상, 심장성 부정맥, 심장성 기절 증후군, 심장 종양, 심근증, 심폐 우회 염증 반응, 연골 이식 거부, 소뇌피질 퇴화, 소뇌 장애, 혼란 또는 다초점 심방 빈맥, 화학치료 관련 장애, 만성 골수성 백혈병(CML), 만성 알콜증, 만성 염증 병리, 만성 림프성 백혈병(CLL), 만성 폐쇄 폐 질환(COPD), 만성 살리실레이트 중독, 결장직장 암종, 울혈성 심부전, 결막염, 접촉성 피부염, 폐 심장, 관상 동맥 질환, 크로이츠펠트-야콥(Creutzfeldt-Jakob) 질환, 배양 음성 패혈증, 낭섬유증, 사이토킨 치료 관련 장애, 권투선수치매(Dementia pugilistica), 탈수초성 질환, 댕기 출혈열, 피부염, 피부학적 증상, 당뇨병, 진성 당뇨병, 당뇨병성 동맥경화 질환, 광범위 루이체 질환, 확장성 울혈성 심근증, 기저핵 장애, 중년 다운 증후군, CNS 도파민 수용체 차단 약물에 의해 유도된 약물 유도 운동 장애, 약물 과민증, 습진, 뇌척수염, 심내막염, 내분비질환, 후두개염, 엡스타인-바르 바이러스 감염, 피부홍통증, 추체외로 및 소뇌 장애, 가족성 적혈구잠식성 림프조직구증, 태아 흉선 이식 거부, 프리드리히 운동실조증, 기능성 말초 동맥 장애, 진균 패혈증, 가스괴저, 위궤양, 사구체신염, 임의의 기관 또는 조직 이식 거부, 그람 음성 패혈증, 그람 양성 패혈증, 세포내 기관으로 인한 육아종, 모발 세포 백혈병, 할레로르덴-스파츠 질환(Hallerrorden-Spatz disease), 하시모토 갑상선염, 고초열, 심장 이식 거부, 혈색소증, 혈액투석, 용혈성 요독증후군/혈전성 혈소판 감소성 자반증, 출혈, 간염(A), 히스 다발 부정맥, HIV 감염/HIV 신경병증, 호지킨 질환, 과운동성 장애, 과민성 반응, 과민성 폐렴, 고혈압, 운동 부족 장애, 시상하부-뇌하수체-부신피질계 평가, 특발성 애디슨 질환, 특발성 폐 섬유증, 항체 매개 세포독성, 무력증, 유아 척추 근육 위축증, 대동맥 염증, 인플루엔자 a, 이온화 방사선 노출, 홍채섬모체염/자궁염/광학적 신경근염, 허혈 관류 손상, 허혈 뇌졸중, 연소성 류마티스 관절염, 연소성 척추 근육 위축증, 카포시 육종, 신장 이식 거부, 레지오넬라, 리슈마니아증, 나병, 피질척수계 병변, 지방부종, 간 이식 거부, 림프피부종, 말라리아, 악성 림프종, 악성 조직구증, 악성 흑색종, 수막염, 수막염 균혈증, 대사/특발성 질환, 편두통, 미토콘드리아 다중 시스템 장애, 복합 연결 조직 질환, 모노클로날 감마글로불린혈증, 다발성 골수종, 다발성 시스템 퇴화(만셀 데제린-토마스 쉬-드라거 및 마차도-조셉), 중증 근무력증, 세포내 마이코박테리움 감염증, 마이코박테리움 결핵, 골수이형성증후군, 심근 경색, 심근 허혈 장애, 비인두 암종, 신생아 만성 폐 질환, 신염, 신증, 신경퇴행성 질환, 신경성 I 근육 위축증, 호중구감소성 발열, 비-호지킨 림프종, 복부 대동맥 및 이의 지류 폐색, 폐색성 동맥 질환, okt3 치료, 고환염/부고환염, 고환염/혈관절제술 반전 과정, 기비대, 골다공증, 췌장 이식 거부, 췌장 암종, 부수종양성 증후군/악성 고칼슘혈증, 부갑상선 이식 거부, 골반 염증 질환, 다년성 비염, 심막 질환, 말초 동맥경화 질환, 말초 혈관 장애, 복막염, 악성빈혈, 폐포자충 폐렴, 폐렴, POEMS 증후군 (다발신경병증, 장기비대, 내분비질환, 모노클로날 감마글로불린혈증, 및 피부 변화 증후군), 관류후 증후군, 펌프후 증후군, MI 후 심장절개 증후군, 자간전증, 전진적 상핵 마비, 원발성 폐 고혈압, 방사선 치료, 레이노드 현상 및 질환, 레이노드 질환, 레프섬 질환, 일반 협소 QRS 심근증, 신혈관성고혈압, 재관류 손상, 제한성 심근병증, 육종, 피부경화증, 노인 무도병, 루이체형 노인성 치매, 혈청음성 관절병증, 쇼크, 겸상적혈구 빈혈증, 피부 동종이식 거부, 피부 변화 증후군, 소장 이식 거부, 고형 종양, 특이적 부정맥, 척수운동실조, 척수소뇌 퇴화, 스트렙토코커스 근염, 소뇌 구조적 병변, 아급성 경화성 범뇌염, 실신, 심혈관계 매독, 전신 아나팔락시스, 전신 염증 반응 증후군, 전신 개시 연소성 류마티스 관절염, T-세포 또는 FAB ALL, 말초혈관 확장증, 폐색성 혈전 혈관염, 혈소판감소증, 독성, 이식, 외상/출혈, III형 과민성 반응, IV형 과민성, 불안정 앙기나, 요독증, 요로패혈증, 두드러기, 승모판 심장 질환, 하지 정맥, 혈관염, 정맥동 질환, 정맥종 혈전증, 심실 세동, 바이러스 및 진균 감염, 바이탈 뇌염/무균성 수막염, 바이탈-연관 적혈구식작용 증후군, 베르니케-코르사코프 증후군, 윌슨 질환, 임의의 기관 또는 조직의 이종이식 거부, 급성 관상동맥 증후군, 급성 특발성 다발신경염, 급성 염증성 탈수초성 다발성신경병증, 급성 허혈, 성인 스틸씨병, 원형 탈모증, 아나필락시스, 항-인지질 항체 증후군, 재생불량성 빈혈, 동맥경화증, 아토피성 습진, 아토피성 피부염, 자가면역 피부염, 스트렙토코커스 감염과 관련된 자가면역 장애, 자가면역 장병증, 자가면역 청각 상실, 자가면역 림프증식 증후군(ALPS), 자가면역 심근염, 자가면역 조숙 난소 부전, 안검염, 기관지확장증, 수포성 유천포창, 심혈관 질환, 격변성 항인지질 증후군, 셀리악병, 경부척추증, 만성 허혈, 흉터성 유천포창, 다발경화증의 위험이 있는 임상 분리 증후군(cis), 결막염, 유년기 개시 정신병, 만성 폐색성 폐질환(COPD), 누낭염, 피부근염, 당뇨 신장병, 진성 당뇨병, 추간판 헤르니아, 추간판 탈출증, 약물 유도 면역 용혈성 빈혈, 심내막염, 자궁내막증, 안구내염, 상공막염, 다형홍반, 주요 다형홍반, 임신성 유천포창, 길랑-바레 증후군(GBS), 건초열, 휴그 증후군, 특발성 파킨슨병, 특발성 사이질 폐렴, IgE-매개 알레르기, 면역 용혈성 빈혈, 봉입체 근염, 감염성 눈 염증, 염증성 탈수초성 질환, 염증성 심장 질환, 염증성 신장 질환, IPF/UIP, 홍채염, 각막염, 건성각막결막염, 쿠스마울 질환 또는 쿠스마울-마이어 질환, 랜드리 마비, 랑게르한스 세포 조직구증, 망상피반, 황반변성, 현미경적 다발혈관염, 베크테레브병, 운동 신경 장애, 점막 유천포창, 다발 기관 손상, 중증근무력증, 골수형성이상 증후군, 심근염, 신경근 장애, 신경병, 비-A 비-B 간염, 시각신경염, 골용해, 난소암, 소수관절 JRA, 말초 동맥 폐색 질환(PAOD), 말초 혈관 질환(PVD), 말초 동맥 질환(PAD), 정맥염, 결절성 다발동맥염(또는 결절성 동맥주위염), 다발연골염, 류마티스성 다발근육통, 백모증, 다관절 JRA, 다중내분비 결핍 증후군, 다발근육염, 류마티스성 다발근육통(PMR), 펌프 후 증후군, 원발성 파킨슨증, 전립선 및 직장 암 및 조혈성 악성종양(백혈병 및 림프종), 전립선염, 진정적혈구계 무형성, 부신피질부전, 재발 시신경척수염, 재협착증, 류마티스성 심장 질환, sapho(윤활막염, 여드름, 농포증, 골과다증 및 골염), 피부경화증, 2차 아밀로이드증, 쇼크 폐, 공막염, 좌골신경통, 2차 부신부전, 실리콘 관련 결합조직 질환, 스네던-윌킨슨 피부병, 강직 척추염, 스티븐슨-존슨 증후군(SJS), 전신 염증 반응 증후군, 관자동맥염, 톡소플라스마성 비염, 독소 표피 괴사용해, 횡단성 골수염, TRAPS(종양 괴사 인자 수용체, 1형 알레르기 반응, II형 당뇨병, 두드러기, 일반 사이질폐렴(UIP), 혈관염, 봄철 결막염, 바이러스 비염, 보그트-코야나기-하라다 증후군(VKH 증후군), 젖은 황반 변성, 상처 치유, 예르시니아 및 살모넬라 관련 관절병을 포함하는 그룹으로부터 선택되는 방법.
- 제60항에 있어서, 상기 피검체로의 투여가 비경구, 피하, 근육내, 정맥내, 관절내, 기관지내, 복강내, 관절낭내, 연골내, 강내, 체강내, 소뇌내, 소뇌심실내, 결장내, 경부내, 위내, 간내, 심근내, 골내, 골반내, 심장주위내, 복강내, 흉막내, 전립선내, 폐내, 직장내, 신장내, 망막내, 척추내, 활막내, 흉부내, 자궁내, 방광내, 일시주사, 질내, 직장, 협측, 설하, 비내 및 경피로부터 선택되는 하나 이상의 방식에 의한 것인 방법.
- 2개의 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린(Dual Variable Domain Immunoglobulin)을 생성하는 방법으로서,
a) 제1 항원에 결합할 수 있는 제1 모 항체 또는 이의 항원결합부를 수득하는 단계;
b) 제2 항원에 결합할 수 있는 제2 모 항체 또는 이의 항원결합부를 수득하는 단계;
c) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제1 및 제3 폴리펩타이드 쇄를 작제하는 단계로서, 여기서
VD1은 상기 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고;
VD2는 상기 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이고;
n은 0 또는 1인 단계;
d) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제2 및 제4 폴리펩타이드 쇄를 작제하는 단계로서, 여기서
VD1은 상기 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고;
VD2는 상기 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않고;
n은 0 또는 1인 단계; 및
e) 상기 제1, 제2, 제3 및 제4 폴리펩타이드 쇄를 발현하는 단계를 포함하여,
상기 제1 및 상기 제2 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린이 생성되고, 상기 결합 단백질이 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 항원 쌍에 결합할 수 있는, 방법. - 제62항에 있어서, 상기 VD1 및 VD2 중쇄 가변 도메인이 서열번호 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 87, 90, 110 및 112로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하고, 상기 VD1 및 VD2 경쇄 가변 도메인이 서열번호 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 88, 91, 111 및 113으로 이루어진 그룹 중에서 선택되는 아미노산 서열을 포함하는, 방법.
- 제62항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부, 및 상기 제2 모 항체 또는 이의 항원결합부가 사람 항체, CDR 이식된 항체 및 사람화된 항체로 이루어진 그룹 중에서 선택되는, 방법.
- 제62항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부, 및 상기 제2 모 항체 또는 이의 항원결합부가 Fab 단편; F(ab')2 단편; 힌지 영역에서 이황화 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편; VH 및 CH1 도메인으로 이루어진 Fd 단편; 항체의 단일 아암의 VL 및 VH 도메인으로 이루어진 Fv 단편; dAb 단편; 분리된 상보성 결정 영역(CDR); 단일 쇄 항체; 및 디아바디로 이루어진 그룹 중에서 선택되는, 방법.
- 제62항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부가 상기 이원 가변 도메인 면역글로불린에 의해 나타나는 적어도 하나의 목적 성질을 보유하는, 방법.
- 제62항에 있어서, 상기 제2 모 항체 또는 이의 항원결합부가 상기 이원 가변 도메인 면역글로불린에 의해 나타나는 적어도 하나의 목적 성질을 보유하는, 방법.
- 제62항에 있어서, 상기 Fc 영역이 천연 서열 Fc 영역 및 변이체 서열 Fc 영역으로 이루어진 그룹 중에서 선택되는, 방법.
- 제62항에 있어서, 상기 Fc 영역이 IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgE 및 IgD 유래의 Fc 영역으로 이루어진 그룹 중에서 선택되는, 방법.
- 제66항에 있어서, 상기 목적 성질이 하나 이상의 항체 파라미터 중에서 선택되는, 방법.
- 제67항에 있어서, 상기 목적 성질이 하나 이상의 항체 파라미터 중에서 선택되는, 방법.
- 제70항에 있어서, 상기 항체 파라미터가 항원 특이성, 항원에 대한 친화성, 효능, 생물학적 기능, 에피토프 인식, 안정성, 가용성, 생산 효율, 면역원성, 약동학, 생체이용률, 조직 교차반응성 및 이종상동성 항원 결합으로 이루어진 그룹 중에서 선택되는, 방법.
- 제71항에 있어서, 상기 항체 파라미터가 항원 특이성, 항원에 대한 친화성, 효능, 생물학적 기능, 에피토프 인식, 안정성, 가용성, 생산 효율, 면역원성, 약동학, 생체이용률, 조직 교차반응성 및 이종상동성 항원 결합으로 이루어진 그룹 중에서 선택되는, 방법.
- 제62항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부는, 상기 제2 모 항체 또는 이의 항원결합부가 상기 제2 항원에 결합하는 친화성과 상이한 친화성으로 상기 제1 항원에 결합하는, 방법.
- 제62항에 있어서, 상기 제1 모 항체 또는 이의 항원결합부는, 상기 제2 모 항체 또는 이의 항원결합부가 상기 제2 항원에 결합하는 효능과 상이한 효능으로 상기 제1 항원에 결합하는, 방법.
- 목적 성질을 가진, 2개의 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린을 생성하는 방법으로서,
a) 제1 항원에 결합할 수 있고 상기 이원 가변 도메인 면역글로불린에 의해 나타나는 적어도 하나의 목적 성질을 보유하는, 제1 모 항체 또는 이의 항원결합부를 수득하는 단계;
b) 제2 항원에 결합할 수 있고 상기 이원 가변 도메인 면역글로불린에 의해 나타나는 적어도 하나의 목적 성질을 보유하는, 제2 모 항체 또는 이의 항원결합부를 수득하는 단계;
c) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제1 및 제3 폴리펩타이드 쇄를 작제하는 단계로서, 여기서
VD1은 상기 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 중쇄 가변 도메인이고;
VD2는 상기 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 중쇄 가변 도메인이며;
C는 중쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역이고;
n은 0 또는 1인 단계;
d) VD1-(X1)n-VD2-C-(X2)n을 포함하는 제2 및 제4 폴리펩타이드 쇄를 작제하는 단계로서, 여기서
VD1은 상기 제1 모 항체 또는 이의 항원결합부로부터 수득되는 제1 경쇄 가변 도메인이고;
VD2는 상기 제2 모 항체 또는 이의 항원결합부로부터 수득되는 제2 경쇄 가변 도메인이며;
C는 경쇄 불변 도메인이고;
X1은 링커이며, 단, X1이 CH1은 아니고;
X2는 Fc 영역을 포함하지 않으며;
n은 0 또는 1인 단계; 및
e) 상기 제1, 제2, 제3 및 제4 폴리펩타이드 쇄를 발현하는 단계를 포함하여,
목적 성질을 가진, 상기 제1 및 상기 제2 항원에 결합할 수 있는 이원 가변 도메인 면역글로불린이 생성되고, 상기 결합 단백질이 TNF 및 PGE2, NGF 및 PGE2, IL-17A 및 PGE2, IL-1b 및 PGE2, IL-6 및 PGE2, IL-6R 및 PGE2, VEGF 및 PGE2, Abeta(서열 1) 및 PGE2, Abeta(서열 2) 및 PGE2, Abeta(서열 3) 및 PGE2, IL-18 및 PGE2, PGE2 및 PGE2, IL-15 및 PGE2, S1P 및 PGE2, EGFR(서열 1) 및 PGE2, EGFR(서열 2) 및 PGE2, 및 IGFR 및 PGE2로 이루어진 그룹 중에서 선택되는 항원 쌍에 결합할 수 있게 되는, 방법.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13428408P | 2008-07-08 | 2008-07-08 | |
| US61/134,284 | 2008-07-08 | ||
| US19171108P | 2008-09-11 | 2008-09-11 | |
| US61/191,711 | 2008-09-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110031369A true KR20110031369A (ko) | 2011-03-25 |
Family
ID=41507708
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117002816A KR20110031369A (ko) | 2008-07-08 | 2009-07-08 | 프로스타글란딘 e2 이원 가변 도메인 면역글로불린 및 이의 용도 |
Country Status (15)
| Country | Link |
|---|---|
| US (2) | US8822645B2 (ko) |
| EP (1) | EP2321422A4 (ko) |
| JP (1) | JP5674654B2 (ko) |
| KR (1) | KR20110031369A (ko) |
| CN (1) | CN102149825B (ko) |
| AU (1) | AU2009268585C1 (ko) |
| BR (1) | BRPI0915448A2 (ko) |
| CA (1) | CA2729949A1 (ko) |
| IL (1) | IL210160A0 (ko) |
| MX (1) | MX2010014574A (ko) |
| NZ (2) | NZ590074A (ko) |
| RU (1) | RU2011104348A (ko) |
| SG (1) | SG192489A1 (ko) |
| TW (1) | TW201012475A (ko) |
| WO (1) | WO2010006060A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160113711A (ko) * | 2014-02-02 | 2016-09-30 | 메디뮨 리미티드 | Ngf 길항제 도메인 및 tnfa 길항제 도메인으로 구성된 키메라 단백질 |
Families Citing this family (128)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7981420B2 (en) | 2000-12-22 | 2011-07-19 | Max-Planck-Gesellschaft Zur Foederung Der Wissenschaften E.V. | Therapeutic use of antibodies directed against repulsive guidance molecule (RGM) |
| US8981061B2 (en) | 2001-03-20 | 2015-03-17 | Novo Nordisk A/S | Receptor TREM (triggering receptor expressed on myeloid cells) and uses thereof |
| AU2011201157C1 (en) * | 2002-12-24 | 2017-09-07 | Rinat Neuroscience Corp. | Anti-NGF antibodies and methods using same |
| GB0426146D0 (en) | 2004-11-29 | 2004-12-29 | Bioxell Spa | Therapeutic peptides and method |
| WO2007039256A2 (de) | 2005-09-30 | 2007-04-12 | Abbott Gmbh & Co. Kg | Bindungsdomänen von proteinen der repulsive guidance molecule (rgm) proteinfamilie und funktionale fragmente davon sowie deren verwendung |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| US8962803B2 (en) | 2008-02-29 | 2015-02-24 | AbbVie Deutschland GmbH & Co. KG | Antibodies against the RGM A protein and uses thereof |
| US20100260668A1 (en) * | 2008-04-29 | 2010-10-14 | Abbott Laboratories | Dual Variable Domain Immunoglobulins and Uses Thereof |
| KR20110014607A (ko) | 2008-04-29 | 2011-02-11 | 아보트 러보러터리즈 | 이원 가변 도메인 면역글로불린 및 이의 용도 |
| CN102112494A (zh) * | 2008-06-03 | 2011-06-29 | 雅培制药有限公司 | 双重可变结构域免疫球蛋白及其用途 |
| EP2297209A4 (en) * | 2008-06-03 | 2012-08-01 | Abbott Lab | IMMUNOGLOBULINS WITH TWO VARIABLE DOMAINS AND USES THEREOF |
| WO2010006060A2 (en) | 2008-07-08 | 2010-01-14 | Abbott Laboratories | Prostaglandin e2 dual variable domain immunoglobulins and uses thereof |
| US20100233079A1 (en) * | 2008-12-04 | 2010-09-16 | Abbott Laboratories | Dual Variable Domain Immunoglobulins and Uses Thereof |
| UY32808A (es) * | 2009-07-29 | 2011-02-28 | Abbott Lab | Inmunoglobulinas como dominio variable dual y usos de las mismas |
| BR112012004546A8 (pt) | 2009-08-29 | 2017-12-05 | Abbott Lab | Terapêutica por proteínas ligantes dll4-ligantes |
| CN102612524A (zh) | 2009-09-01 | 2012-07-25 | 雅培制药有限公司 | 双重可变结构域免疫球蛋白及其用途 |
| AU2010306677B2 (en) | 2009-10-15 | 2013-05-23 | Abbvie Inc. | Dual variable domain immunoglobulins and uses thereof |
| UY32979A (es) * | 2009-10-28 | 2011-02-28 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| KR20120118002A (ko) | 2009-12-08 | 2012-10-25 | 애보트 게엠베하 운트 콤파니 카게 | 망막 신경 섬유 층 변성의 치료에 사용하기 위한 rgm a 단백질에 대한 모노클로날 항체 |
| CN105037543B (zh) | 2010-03-02 | 2020-11-03 | Abbvie 公司 | 治疗性dll4结合蛋白 |
| EP2585607A4 (en) * | 2010-06-24 | 2014-01-22 | Abbvie Inc | VARIABLE DOUBLE DOMAIN IMMUNOGLOBULINS AND USES THEREOF |
| UY33543A (es) | 2010-08-03 | 2012-02-29 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| BR112013004581A2 (pt) * | 2010-08-26 | 2017-06-27 | Abbvie Inc | imunoglobulinas de domínio variável dual e seus usos |
| TW201302793A (zh) | 2010-09-03 | 2013-01-16 | Glaxo Group Ltd | 新穎之抗原結合蛋白 |
| AR083672A1 (es) * | 2010-11-02 | 2013-03-13 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| LT3111954T (lt) | 2010-11-05 | 2019-07-10 | Novartis Ag | Ankilozuojančio spondilito gydymo būdai, naudojant anti-il-17 antikūnus |
| AU2014259526B2 (en) * | 2010-11-05 | 2016-02-04 | Novartis Ag | Methods of treating ankylosing spondylitis using IL-17 antagonists |
| US9067988B2 (en) | 2010-12-01 | 2015-06-30 | Alderbio Holdings Llc | Methods of preventing or treating pain using anti-NGF antibodies |
| US11214610B2 (en) | 2010-12-01 | 2022-01-04 | H. Lundbeck A/S | High-purity production of multi-subunit proteins such as antibodies in transformed microbes such as Pichia pastoris |
| US8728473B2 (en) | 2010-12-01 | 2014-05-20 | Alderbio Holdings Llc | Methods of preventing or treating pain using anti-NGF antibodies |
| US9884909B2 (en) | 2010-12-01 | 2018-02-06 | Alderbio Holdings Llc | Anti-NGF compositions and use thereof |
| US9539324B2 (en) | 2010-12-01 | 2017-01-10 | Alderbio Holdings, Llc | Methods of preventing inflammation and treating pain using anti-NGF compositions |
| US9078878B2 (en) | 2010-12-01 | 2015-07-14 | Alderbio Holdings Llc | Anti-NGF antibodies that selectively inhibit the association of NGF with TrkA, without affecting the association of NGF with p75 |
| AR084210A1 (es) * | 2010-12-08 | 2013-05-02 | Abbott Lab | PROTEINAS DE UNION AL TNF-a |
| WO2012088290A2 (en) * | 2010-12-22 | 2012-06-28 | Abbott Laboratories | Tri-variable domain binding proteins and uses thereof |
| DK2663579T3 (en) | 2011-01-14 | 2017-07-31 | Univ California | THERAPEUTIC ANTIBODIES AGAINST ROR-1 PROTEIN AND PROCEDURES FOR USE THEREOF |
| AR085404A1 (es) | 2011-02-28 | 2013-09-25 | Hoffmann La Roche | Proteinas de union a antigeno |
| MX342034B (es) | 2011-02-28 | 2016-09-12 | Hoffmann La Roche | Proteinas monovalentes que se unen a antigenos. |
| AU2012362326A1 (en) | 2011-12-30 | 2014-07-24 | Abbvie Inc. | Dual variable domain immunoglobulins against IL-13 and/or IL-17 |
| EP2807192B1 (en) | 2012-01-27 | 2018-04-18 | Abbvie Deutschland GmbH & Co. KG | Composition and method for diagnosis and treatment of diseases associated with neurite degeneration |
| US9550830B2 (en) | 2012-02-15 | 2017-01-24 | Novo Nordisk A/S | Antibodies that bind and block triggering receptor expressed on myeloid cells-1 (TREM-1) |
| EP2814842B1 (en) | 2012-02-15 | 2018-08-22 | Novo Nordisk A/S | Antibodies that bind peptidoglycan recognition protein 1 |
| PT2814844T (pt) | 2012-02-15 | 2017-09-18 | Novo Nordisk As | Anticorpos que se ligam e bloqueiam recetor de acionamento expresso em células mieloides-1 (trem-1) |
| WO2013169382A1 (en) * | 2012-05-07 | 2013-11-14 | DePuy Synthes Products, LLC | Methods and devices for treating intervertebral disc disease |
| JOP20200308A1 (ar) | 2012-09-07 | 2017-06-16 | Novartis Ag | جزيئات إرتباط il-18 |
| JP6401702B2 (ja) | 2012-09-07 | 2018-10-10 | ザ・ガバナーズ・オブ・ザ・ユニバーシティー オブ・アルバータ | 炎症性肝疾患の診断のための方法および組成物 |
| MX2015005495A (es) * | 2012-11-01 | 2016-01-22 | Abbvie Inc | Formulaciones de proteina de inmunoglobulina del dominio variable dual estable. |
| AR093311A1 (es) | 2012-11-01 | 2015-05-27 | Abbvie Inc | Inmunoglobulinas de dominio variable dual contra el factor de crecimiento endotelial vascular (vegf) y el ligando involucrado en la señalizacion celula a celula a traves del receptor notch (dll4) |
| CA2890455A1 (en) | 2012-12-04 | 2014-06-12 | Abbvie, Inc. | Blood-brain barrier (bbb) penetrating dual specific binding proteins |
| WO2014106001A2 (en) * | 2012-12-28 | 2014-07-03 | Abbvie, Inc. | Dual specific binding proteins having a receptor sequence |
| CA2904407A1 (en) * | 2013-03-15 | 2014-09-18 | Abbvie Inc. | Dual specific binding proteins directed against tnf.alpha. |
| WO2014144280A2 (en) | 2013-03-15 | 2014-09-18 | Abbvie Inc. | DUAL SPECIFIC BINDING PROTEINS DIRECTED AGAINST IL-1β AND / OR IL-17 |
| RU2652880C2 (ru) * | 2013-04-07 | 2018-05-03 | Дженрикс (Шанхай) Байофармасертикал Ко., Лтд. | Антитело против рецептора эпидермального фактора роста |
| EP3757130A1 (en) | 2013-09-26 | 2020-12-30 | Costim Pharmaceuticals Inc. | Methods for treating hematologic cancers |
| CA2924520C (en) * | 2013-11-01 | 2023-09-26 | Ibc Pharmaceuticals, Inc. | Bispecific antibodies that neutralize both tnf-alpha and il-6: novel therapeutic agent for autoimmune disease |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| JOP20200096A1 (ar) | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| EP3104854B1 (en) | 2014-02-10 | 2020-04-08 | Respivant Sciences GmbH | Mast cell stabilizers for lung disease treatment |
| SI3104853T1 (sl) | 2014-02-10 | 2020-03-31 | Respivant Sciences Gmbh | Zdravljenje s stabilizatorji mastocitov za sistemske motnje |
| WO2015191934A2 (en) | 2014-06-11 | 2015-12-17 | Abbvie Inc. | Blood-brain barrier (bbb) penetrating dual specific binding proteins for treating brain and neurological diseases |
| US9840553B2 (en) | 2014-06-28 | 2017-12-12 | Kodiak Sciences Inc. | Dual PDGF/VEGF antagonists |
| KR102465120B1 (ko) | 2014-07-17 | 2022-11-10 | 노보 노르디스크 에이/에스 | 점도를 감소시키기 위한 trem-1 항체의 부위 지정 돌연변이유발 |
| WO2016014725A1 (en) | 2014-07-22 | 2016-01-28 | The University Of Notre Dame Du Lac | Molecular constructs and uses thereof |
| CN106573986A (zh) * | 2014-07-29 | 2017-04-19 | 豪夫迈·罗氏有限公司 | 多特异性抗体 |
| EP3191576A4 (en) * | 2014-09-12 | 2018-04-18 | Anthrogenesis Corporation | Methods for quantifying particulates in cell culture |
| BR112017004826A2 (pt) | 2014-09-13 | 2017-12-12 | Novartis Ag | terapias de combinação de inibidores de alk |
| US9616114B1 (en) | 2014-09-18 | 2017-04-11 | David Gordon Bermudes | Modified bacteria having improved pharmacokinetics and tumor colonization enhancing antitumor activity |
| US10093733B2 (en) | 2014-12-11 | 2018-10-09 | Abbvie Inc. | LRP-8 binding dual variable domain immunoglobulin proteins |
| TW201710286A (zh) | 2015-06-15 | 2017-03-16 | 艾伯維有限公司 | 抗vegf、pdgf及/或其受體之結合蛋白 |
| US10265296B2 (en) | 2015-08-07 | 2019-04-23 | Respivant Sciences Gmbh | Methods for the treatment of systemic disorders treatable with mast cell stabilizers, including mast cell related disorders |
| US10238625B2 (en) | 2015-08-07 | 2019-03-26 | Respivant Sciences Gmbh | Methods for the treatment of mast cell related disorders with mast cell stabilizers |
| US11066465B2 (en) | 2015-12-30 | 2021-07-20 | Kodiak Sciences Inc. | Antibodies and conjugates thereof |
| PE20231050A1 (es) | 2016-03-02 | 2023-07-11 | Eisai Randd Man Co Ltd | Conjugados de anticuerpo y farmaco basados en eribulina y metodos para su uso |
| CN107537098B (zh) * | 2016-06-23 | 2020-06-23 | 中国辐射防护研究院 | 小鼠急性放射性十二指肠炎模型的建立方法 |
| CA3035528A1 (en) | 2016-08-31 | 2018-03-08 | Respivant Sciences Gmbh | Cromolyn compositions for treatment of chronic cough due to idiopathic pulmonary fibrosis |
| CN109803724A (zh) | 2016-10-07 | 2019-05-24 | 瑞思皮万特科学有限责任公司 | 用于治疗肺纤维化的色甘酸组合物 |
| US11129906B1 (en) | 2016-12-07 | 2021-09-28 | David Gordon Bermudes | Chimeric protein toxins for expression by therapeutic bacteria |
| US11180535B1 (en) | 2016-12-07 | 2021-11-23 | David Gordon Bermudes | Saccharide binding, tumor penetration, and cytotoxic antitumor chimeric peptides from therapeutic bacteria |
| JOP20180027A1 (ar) | 2017-03-28 | 2019-01-30 | Cell Design Labs Inc | بوليبيبتيدات مخلطة و طرق لتغيير موضع الغشاء فيها |
| UY37758A (es) | 2017-06-12 | 2019-01-31 | Novartis Ag | Método de fabricación de anticuerpos biespecíficos, anticuerpos biespecíficos y uso terapéutico de dichos anticuerpos |
| EA202091509A1 (ru) | 2017-12-19 | 2020-09-22 | Акуос, Инк. | Aav-опосредованная доставка терапевтических антител во внутреннее ухо |
| EP3728322A1 (en) | 2017-12-22 | 2020-10-28 | Cell Design Labs, Inc. | Single- and multi-chain chimeric antigen receptors |
| US20200384030A1 (en) | 2018-02-21 | 2020-12-10 | Cell Design Labs, Inc. | Chimeric transmembrane receptors and uses thereof |
| SG11202008242XA (en) | 2018-03-02 | 2020-09-29 | Kodiak Sciences Inc | Il-6 antibodies and fusion constructs and conjugates thereof |
| PE20201343A1 (es) | 2018-04-02 | 2020-11-25 | Bristol Myers Squibb Co | Anticuerpos anti-trem-1 y usos de los mismos |
| US20200041518A1 (en) | 2018-08-03 | 2020-02-06 | CellMax Life, Inc. | Lipid vesicle-coated magnetic beads and uses of the same |
| KR20210070287A (ko) | 2018-08-30 | 2021-06-14 | 에이치씨더블유 바이올로직스, 인크. | 다중-사슬 키메라 폴리펩타이드 및 이의 용도 |
| AU2019328313B2 (en) | 2018-08-30 | 2024-11-28 | Immunitybio, Inc. | Single-chain chimeric polypeptides and uses thereof |
| JP7449292B2 (ja) | 2018-08-30 | 2024-03-13 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 加齢関連障害の治療法 |
| CN109613276A (zh) * | 2018-12-20 | 2019-04-12 | 北京贝尔生物工程股份有限公司 | 一种高灵敏度、宽检测范围的人抗缪勒管激素测定试剂盒 |
| KR20220004104A (ko) | 2019-04-23 | 2022-01-11 | 사노피 | 안정한 저점도 항체 제제 및 이의 용도 |
| JP2022534808A (ja) | 2019-06-06 | 2022-08-03 | ミシック セラピューティクス インコーポレイテッド | 抗原結合タンパク質構築物およびその使用 |
| AU2020287378A1 (en) | 2019-06-06 | 2022-02-03 | Mythic Therapeutics, Inc. | Antigen-binding protein constructs and uses thereof |
| AU2020289477A1 (en) | 2019-06-07 | 2022-02-03 | Mythic Therapeutics, Inc. | Antigen-binding protein constructs and uses thereof |
| US11738052B2 (en) | 2019-06-21 | 2023-08-29 | HCW Biologics, Inc. | Multi-chain chimeric polypeptides and uses thereof |
| CN117683133A (zh) * | 2019-09-03 | 2024-03-12 | 百奥泰生物制药股份有限公司 | 一种抗tigit免疫抑制剂及应用 |
| US20220306751A1 (en) | 2019-09-13 | 2022-09-29 | Mythic Therapeutics, Inc. | Antigen-binding protein constructs and uses thereof |
| JP2022551844A (ja) | 2019-10-04 | 2022-12-14 | ミシク セラピューティクス, インコーポレイテッド | 抗原結合タンパク質構築物およびその使用 |
| EP4041312A4 (en) | 2019-10-10 | 2023-12-20 | Kodiak Sciences Inc. | METHOD FOR TREATING AN EYE DISORDER |
| WO2021141996A1 (en) | 2020-01-06 | 2021-07-15 | Cytomx Therapeutics, Inc. | Single- and multi-chain polypeptides that bind specifically to cd3 epsilon |
| JP2023513573A (ja) | 2020-02-11 | 2023-03-31 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 加齢性および炎症性疾患を治療する方法 |
| US20210277054A1 (en) | 2020-02-11 | 2021-09-09 | HCW Biologics, Inc. | Chromatography resin and uses thereof |
| EP4103599A1 (en) | 2020-02-11 | 2022-12-21 | HCW Biologics, Inc. | Methods of activating regulatory t cells |
| US20230118517A1 (en) | 2020-03-26 | 2023-04-20 | Seagen Inc. | Methods of treating multiple myeloma |
| EP4143231A1 (en) | 2020-04-29 | 2023-03-08 | HCW Biologics, Inc. | Anti-cd26 proteins and uses thereof |
| US12024545B2 (en) | 2020-06-01 | 2024-07-02 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| JP2023527869A (ja) | 2020-06-01 | 2023-06-30 | エイチシーダブリュー バイオロジックス インコーポレイテッド | 加齢関連障害の治療法 |
| WO2021247003A1 (en) | 2020-06-01 | 2021-12-09 | HCW Biologics, Inc. | Methods of treating aging-related disorders |
| KR20230039734A (ko) | 2020-07-23 | 2023-03-21 | 오타이르 프로테나 리미티드 | 항-Aβ 항체 |
| WO2022119839A1 (en) | 2020-12-01 | 2022-06-09 | Akouos, Inc. | Anti-vegf antibody constructs and related methods for treating vestibular schwannoma associated symptoms |
| JP2024510435A (ja) | 2021-03-18 | 2024-03-07 | シージェン インコーポレイテッド | 生体活性化合物の内部移行複合体からの選択的薬物放出 |
| EP4320157A1 (en) | 2021-04-07 | 2024-02-14 | Mythic Therapeutics, Inc. | Antigen-binding protein constructs and antibodies and uses thereof |
| US20230125173A1 (en) | 2021-08-11 | 2023-04-27 | HCW Biologics, Inc. | Multi-chain chimeric polypeptides and use thereof in the treatment of liver diseases |
| TW202327650A (zh) | 2021-09-23 | 2023-07-16 | 美商思進公司 | 治療多發性骨髓瘤之方法 |
| TW202342525A (zh) | 2022-02-02 | 2023-11-01 | 美商阿科奧斯公司 | 用於治療前庭神經鞘瘤相關症狀之抗vegf抗體構築體及相關方法 |
| KR20240156626A (ko) | 2022-03-02 | 2024-10-30 | 이뮤니티바이오, 인크. | 췌장암의 치료 방법 |
| WO2023192606A2 (en) | 2022-04-01 | 2023-10-05 | Cytomx Therapeutics, Inc. | Cd3-binding proteins and methods of use thereof |
| AU2023254108A1 (en) | 2022-04-13 | 2024-10-03 | Immunitybio, Inc. | Multi-chain chimeric polypeptide for use in the treatment of circardian clock gene disorder |
| AU2023254210A1 (en) | 2022-04-13 | 2024-10-03 | Immunitybio, Inc. | Multi-chain chimeric polypeptide for use in the treatment of treating neuroinflammatory disorder |
| AU2023272168A1 (en) | 2022-05-19 | 2024-11-21 | Mythic Therapeutics, Inc. | Ptk7-binding proteins with ph-dependent binding and uses thereof |
| TW202424184A (zh) | 2022-08-01 | 2024-06-16 | 美商Cytomx生物製藥公司 | 蛋白酶可切割部分及其使用方法 |
| AR130078A1 (es) | 2022-08-01 | 2024-10-30 | Cytomx Therapeutics Inc | Substratos escindibles por proteasas, y métodos de uso de los mismos |
| AR130079A1 (es) | 2022-08-01 | 2024-10-30 | Cytomx Therapeutics Inc | Restos escindibles por proteasas, y métodos de uso de los mismos |
| AR130080A1 (es) | 2022-08-01 | 2024-10-30 | Cytomx Therapeutics Inc | Restos escindibles por proteasas, y métodos de uso de los mismos |
| WO2024030850A1 (en) | 2022-08-01 | 2024-02-08 | Cytomx Therapeutics, Inc. | Protease-cleavable substrates and methods of use thereof |
| CN115753699B (zh) * | 2022-08-27 | 2024-05-03 | 吉林大学 | 一种水中四环素类抗生素的可视化检测方法 |
| WO2024081729A2 (en) | 2022-10-12 | 2024-04-18 | Mythic Therapeutics, Inc. | Lrrc-15-binding protein constructs and uses thereof |
| WO2024206815A2 (en) | 2023-03-29 | 2024-10-03 | Mythic Therapeutics, Inc. | Trop2-binding proteins and uses thereof |
Family Cites Families (312)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| DE3378250D1 (en) * | 1982-04-22 | 1988-11-24 | Ici Plc | Continuous release formulations |
| US4816567A (en) * | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4753894A (en) * | 1984-02-08 | 1988-06-28 | Cetus Corporation | Monoclonal anti-human breast cancer antibodies |
| US4943533A (en) * | 1984-03-01 | 1990-07-24 | The Regents Of The University Of California | Hybrid cell lines that produce monoclonal antibodies to epidermal growth factor receptor |
| US5128326A (en) * | 1984-12-06 | 1992-07-07 | Biomatrix, Inc. | Drug delivery systems based on hyaluronans derivatives thereof and their salts and methods of producing same |
| DE3587814T2 (de) | 1985-03-30 | 1994-11-10 | Marc Ballivet | Verfahren zum erhalten von dns, rns, peptiden, polypeptiden oder proteinen durch dns-rekombinant-verfahren. |
| US6492107B1 (en) * | 1986-11-20 | 2002-12-10 | Stuart Kauffman | Process for obtaining DNA, RNA, peptides, polypeptides, or protein, by recombinant DNA technique |
| US4980286A (en) | 1985-07-05 | 1990-12-25 | Whitehead Institute For Biomedical Research | In vivo introduction and expression of foreign genetic material in epithelial cells |
| US5618920A (en) | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| US4699784A (en) | 1986-02-25 | 1987-10-13 | Center For Molecular Medicine & Immunology | Tumoricidal methotrexate-antibody conjugate |
| US5225539A (en) * | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| IL85035A0 (en) * | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| WO1988007089A1 (en) * | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| US5258498A (en) | 1987-05-21 | 1993-11-02 | Creative Biomolecules, Inc. | Polypeptide linkers for production of biosynthetic proteins |
| WO1989006692A1 (en) | 1988-01-12 | 1989-07-27 | Genentech, Inc. | Method of treating tumor cells by inhibiting growth factor receptor function |
| CA1340288C (en) | 1988-09-02 | 1998-12-29 | Robert Charles Ladner | Generation and selection of novel binding proteins |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| WO1990005183A1 (en) | 1988-10-31 | 1990-05-17 | Immunex Corporation | Interleukin-4 receptors |
| ES2052027T5 (es) | 1988-11-11 | 2005-04-16 | Medical Research Council | Clonacion de secuencias de dominio variable de inmunoglobulina. |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| CA2016842A1 (en) | 1989-05-16 | 1990-11-16 | Richard A. Lerner | Method for tapping the immunological repertoire |
| EP0478627A4 (en) | 1989-05-16 | 1992-08-19 | William D. Huse | Co-expression of heteromeric receptors |
| CA2016841C (en) | 1989-05-16 | 1999-09-21 | William D. Huse | A method for producing polymers having a preselected activity |
| AU6430190A (en) | 1989-10-10 | 1991-05-16 | Pitman-Moore, Inc. | Sustained release composition for macromolecular proteins |
| AU642932B2 (en) | 1989-11-06 | 1993-11-04 | Alkermes Controlled Therapeutics, Inc. | Protein microspheres and methods of using them |
| US5859205A (en) * | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5780225A (en) * | 1990-01-12 | 1998-07-14 | Stratagene | Method for generating libaries of antibody genes comprising amplification of diverse antibody DNAs and methods for using these libraries for the production of diverse antigen combining molecules |
| AU7247191A (en) | 1990-01-11 | 1991-08-05 | Molecular Affinities Corporation | Production of antibodies using gene libraries |
| WO1996033735A1 (en) | 1995-04-27 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| EP0463151B1 (en) | 1990-01-12 | 1996-06-12 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| ES2139598T3 (es) | 1990-07-10 | 2000-02-16 | Medical Res Council | Procedimientos para la produccion de miembros de parejas de union especifica. |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| WO1992002551A1 (en) * | 1990-08-02 | 1992-02-20 | B.R. Centre Limited | Methods for the production of proteins with a desired function |
| DE69130647T2 (de) | 1990-08-24 | 1999-05-06 | Ixsys, Inc., San Diego, Calif. | Verfahren zur herstellung von oligonukleotiden mit regellosen codonen |
| US5698426A (en) | 1990-09-28 | 1997-12-16 | Ixsys, Incorporated | Surface expression libraries of heteromeric receptors |
| CA2405246A1 (en) | 1990-12-03 | 1992-06-11 | Genentech, Inc. | Enrichment method for variant proteins with alterred binding properties |
| US5780279A (en) | 1990-12-03 | 1998-07-14 | Genentech, Inc. | Method of selection of proteolytic cleavage sites by directed evolution and phagemid display |
| WO1992011272A1 (en) | 1990-12-20 | 1992-07-09 | Ixsys, Inc. | Optimization of binding proteins |
| ES2330052T3 (es) | 1991-03-01 | 2009-12-03 | Dyax Corporation | Proteina quimerica que comprende micro-proteinas que tienen dos o mas puentes disulfuro y relaizaciones de las mismas. |
| CA2082160C (en) | 1991-03-06 | 2003-05-06 | Mary M. Bendig | Humanised and chimeric monoclonal antibodies |
| US6277969B1 (en) * | 1991-03-18 | 2001-08-21 | New York University | Anti-TNF antibodies and peptides of human tumor necrosis factor |
| ATE201234T1 (de) | 1991-03-18 | 2001-06-15 | Univ New York | Für menschlichen tumornekrose-faktor spezifische monoklonale und chimäre antikörper |
| EP1471142B1 (en) | 1991-04-10 | 2008-11-19 | The Scripps Research Institute | Heterodimeric receptor libraries using phagemids |
| EP0628639B1 (en) | 1991-04-25 | 1999-06-23 | Chugai Seiyaku Kabushiki Kaisha | Reconstituted human antibody against human interleukin 6 receptor |
| AU666852B2 (en) * | 1991-05-01 | 1996-02-29 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | A method for treating infectious respiratory diseases |
| DE69233482T2 (de) | 1991-05-17 | 2006-01-12 | Merck & Co., Inc. | Verfahren zur Verminderung der Immunogenität der variablen Antikörperdomänen |
| DE4118120A1 (de) | 1991-06-03 | 1992-12-10 | Behringwerke Ag | Tetravalente bispezifische rezeptoren, ihre herstellung und verwendung |
| ATE255131T1 (de) | 1991-06-14 | 2003-12-15 | Genentech Inc | Humanisierter heregulin antikörper |
| AU2238292A (en) | 1991-06-14 | 1993-01-12 | Xoma Corporation | Microbially-produced antibody fragments and their conjugates |
| DE4122599C2 (de) | 1991-07-08 | 1993-11-11 | Deutsches Krebsforsch | Phagemid zum Screenen von Antikörpern |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| CA2119930C (en) | 1991-09-23 | 2002-10-01 | Hendricus R. J. M. Hoogenboom | Production of chimeric antibodies - a combinatorial approach |
| ES2241710T3 (es) | 1991-11-25 | 2005-11-01 | Enzon, Inc. | Procedimiento para producir proteinas multivalentes de union a antigeno. |
| WO1993011236A1 (en) | 1991-12-02 | 1993-06-10 | Medical Research Council | Production of anti-self antibodies from antibody segment repertoires and displayed on phage |
| JP4157160B2 (ja) * | 1991-12-13 | 2008-09-24 | ゾーマ テクノロジー リミテッド | 改変抗体可変領域の調製のための方法 |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| US5912015A (en) * | 1992-03-12 | 1999-06-15 | Alkermes Controlled Therapeutics, Inc. | Modulated release from biocompatible polymers |
| US5733743A (en) * | 1992-03-24 | 1998-03-31 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| WO1994002602A1 (en) | 1992-07-24 | 1994-02-03 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| US5736137A (en) * | 1992-11-13 | 1998-04-07 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| ES2091684T3 (es) * | 1992-11-13 | 1996-11-01 | Idec Pharma Corp | Aplicacion terapeutica de anticuerpos quimericos y radiomarcados contra el antigeno de diferenciacion restringida de los linfocitos b humanos para el tratamiento del linfoma de las celulas b. |
| US5934272A (en) | 1993-01-29 | 1999-08-10 | Aradigm Corporation | Device and method of creating aerosolized mist of respiratory drug |
| AU6132994A (en) | 1993-02-02 | 1994-08-29 | Scripps Research Institute, The | Methods for producing antibody libraries using universal or randomized immunoglobulin light chains |
| US6491916B1 (en) | 1994-06-01 | 2002-12-10 | Tolerance Therapeutics, Inc. | Methods and materials for modulation of the immunosuppresive activity and toxicity of monoclonal antibodies |
| WO1995001997A1 (en) | 1993-07-09 | 1995-01-19 | Smithkline Beecham Corporation | RECOMBINANT AND HUMANIZED IL-1β ANTIBODIES FOR TREATMENT OF IL-1 MEDIATED INFLAMMATORY DISORDERS IN MAN |
| WO1995009917A1 (en) | 1993-10-07 | 1995-04-13 | The Regents Of The University Of California | Genetically engineered bispecific tetravalent antibodies |
| EP0659766A1 (en) | 1993-11-23 | 1995-06-28 | Schering-Plough | Human monoclonal antibodies against human cytokines and methods of making and using such antibodies |
| US5565352A (en) | 1993-11-24 | 1996-10-15 | Arch Development Corporation | Deubiquitinating enzyme: compositions and methods |
| AU696293B2 (en) | 1993-12-08 | 1998-09-03 | Genzyme Corporation | Process for generating specific antibodies |
| GB9401182D0 (en) | 1994-01-21 | 1994-03-16 | Inst Of Cancer The Research | Antibodies to EGF receptor and their antitumour effect |
| PT1231268E (pt) | 1994-01-31 | 2005-11-30 | Univ Boston | Bancos de anticorpos policlonais |
| ZA95960B (en) | 1994-03-14 | 1995-10-10 | Genetics Inst | Use of interleukin-12 antagonists in the treatment of autoimmune diseases |
| ATE232902T1 (de) | 1994-03-17 | 2003-03-15 | Merck Patent Gmbh | Anti-egfr einkettige fvs und anti-egfr antikoerper |
| IL109632A (en) | 1994-05-11 | 2007-03-08 | Yeda Res & Dev | Modulators of the function of tnf receptors |
| US5516637A (en) * | 1994-06-10 | 1996-05-14 | Dade International Inc. | Method involving display of protein binding pairs on the surface of bacterial pili and bacteriophage |
| AU3272695A (en) | 1994-08-12 | 1996-03-07 | Immunomedics Inc. | Immunoconjugates and humanized antibodies specific for b-cell lymphoma and leukemia cells |
| ATE252894T1 (de) | 1995-01-05 | 2003-11-15 | Univ Michigan | Oberflächen-modifizierte nanopartikel und verfahren für ihre herstellung und verwendung |
| GB9504344D0 (en) * | 1995-03-03 | 1995-04-19 | Unilever Plc | Antibody fragment production |
| US6091001A (en) | 1995-03-29 | 2000-07-18 | Abgenix, Inc. | Production of antibodies using Cre-mediated site-specific recombination |
| US6130364A (en) | 1995-03-29 | 2000-10-10 | Abgenix, Inc. | Production of antibodies using Cre-mediated site-specific recombination |
| US5641870A (en) * | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US6019968A (en) | 1995-04-14 | 2000-02-01 | Inhale Therapeutic Systems, Inc. | Dispersible antibody compositions and methods for their preparation and use |
| AU705616B2 (en) | 1995-04-21 | 1999-05-27 | Cell Genesys, Inc. | Generation of large genomic DNA deletions |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| EP0831880A4 (en) | 1995-06-07 | 2004-12-01 | Imclone Systems Inc | ANTIBODIES AND FRAGMENTS OF ANTIBODIES INHIBITING TUMOR GROWTH |
| US7060808B1 (en) * | 1995-06-07 | 2006-06-13 | Imclone Systems Incorporated | Humanized anti-EGF receptor monoclonal antibody |
| EP0850051A2 (en) * | 1995-08-31 | 1998-07-01 | Alkermes Controlled Therapeutics, Inc. | Composition for sustained release of an agent |
| US5989830A (en) * | 1995-10-16 | 1999-11-23 | Unilever Patent Holdings Bv | Bifunctional or bivalent antibody fragment analogue |
| US6090382A (en) * | 1996-02-09 | 2000-07-18 | Basf Aktiengesellschaft | Human antibodies that bind human TNFα |
| US6331431B1 (en) | 1995-11-28 | 2001-12-18 | Ixsys, Inc. | Vacuum device and method for isolating periplasmic fraction from cells |
| PT929578E (pt) * | 1996-02-09 | 2003-09-30 | Abbott Lab Bermuda Ltd | Anticorpos humanos que se ligam a tnfalfa humano |
| US5985320A (en) | 1996-03-04 | 1999-11-16 | The Penn State Research Foundation | Materials and methods for enhancing cellular internalization |
| US5714352A (en) * | 1996-03-20 | 1998-02-03 | Xenotech Incorporated | Directed switch-mediated DNA recombination |
| CA2250166A1 (en) * | 1996-03-28 | 1997-10-02 | The Johns Hopkins University | Soluble divalent and multivalent heterodimeric analogs of proteins |
| JP2000508892A (ja) | 1996-04-04 | 2000-07-18 | ユニリーバー・ナームローゼ・ベンノートシャープ | 多価および多特異的抗原結合タンパク |
| US5985309A (en) | 1996-05-24 | 1999-11-16 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| US5855913A (en) * | 1997-01-16 | 1999-01-05 | Massachusetts Instite Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US5874064A (en) * | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US6699658B1 (en) | 1996-05-31 | 2004-03-02 | Board Of Trustees Of The University Of Illinois | Yeast cell surface display of proteins and uses thereof |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| US6986890B1 (en) * | 1996-11-21 | 2006-01-17 | Kyowa Hakko Kogyo Co., Ltd. | Anti-human VEGF receptor Flt-1 monoclonal antibody |
| CA2722378C (en) | 1996-12-03 | 2015-02-03 | Amgen Fremont Inc. | Human antibodies that bind tnf.alpha. |
| CA2277801C (en) | 1997-01-16 | 2002-10-15 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| EP0971946B1 (en) | 1997-01-21 | 2006-07-05 | The General Hospital Corporation | Selection of proteins using rna-protein fusions |
| US6057098A (en) | 1997-04-04 | 2000-05-02 | Biosite Diagnostics, Inc. | Polyvalent display libraries |
| EP1325932B9 (en) * | 1997-04-07 | 2006-07-19 | Genentech, Inc. | Anti-vegf antibodies |
| US6884879B1 (en) * | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| WO1999006834A2 (en) | 1997-08-04 | 1999-02-11 | Ixsys, Incorporated | Methods for identifying ligand specific binding molecules |
| US5989463A (en) | 1997-09-24 | 1999-11-23 | Alkermes Controlled Therapeutics, Inc. | Methods for fabricating polymer-based controlled release devices |
| SE512663C2 (sv) | 1997-10-23 | 2000-04-17 | Biogram Ab | Inkapslingsförfarande för aktiv substans i en bionedbrytbar polymer |
| BR9813276A (pt) | 1997-10-27 | 2000-08-22 | Unilever Nv | Proteìna multivalente de ligação de antìgeno, sequências de nucleotìdeos, vetor de expressão, célula hospedeira, processo para preparação de proteìna multivalente de ligação de antìgeno, e, uso da mesma |
| US7179892B2 (en) * | 2000-12-06 | 2007-02-20 | Neuralab Limited | Humanized antibodies that recognize beta amyloid peptide |
| KR20010034554A (ko) | 1998-03-03 | 2001-04-25 | 레이몬드, 엠. 위티 | 치료제로서의 cd147 결합 분자 |
| US20020029391A1 (en) | 1998-04-15 | 2002-03-07 | Claude Geoffrey Davis | Epitope-driven human antibody production and gene expression profiling |
| EP2261229A3 (en) | 1998-04-20 | 2011-03-23 | GlycArt Biotechnology AG | Glycosylation engineering of antibodies for improving antibody-dependent cellular cytotoxicity |
| JP2002518432A (ja) | 1998-06-24 | 2002-06-25 | アドバンスト インハレーション リサーチ,インコーポレイテッド | 吸入器から放出される大多孔性粒子 |
| JP2002522063A (ja) | 1998-08-17 | 2002-07-23 | アブジェニックス インコーポレイテッド | 増加した血清半減期を有する改変された分子の生成 |
| US6660843B1 (en) | 1998-10-23 | 2003-12-09 | Amgen Inc. | Modified peptides as therapeutic agents |
| KR100617337B1 (ko) | 1998-12-23 | 2006-08-31 | 화이자 인크. | Ctla-4에 대한 인간 단일클론 항체 |
| WO2000042072A2 (en) | 1999-01-15 | 2000-07-20 | Genentech, Inc. | Polypeptide variants with altered effector function |
| US6914128B1 (en) | 1999-03-25 | 2005-07-05 | Abbott Gmbh & Co. Kg | Human antibodies that bind human IL-12 and methods for producing |
| CN101333256A (zh) | 1999-03-25 | 2008-12-31 | 艾博特股份有限两合公司 | 结合人il-12的人抗体及其生产方法 |
| DK2270150T4 (da) | 1999-04-09 | 2019-08-26 | Kyowa Hakko Kirin Co Ltd | Fremgangsmåde til at kontrollere aktiviteten af immunologisk funktionelt molekyle. |
| CN1119415C (zh) | 1999-06-04 | 2003-08-27 | 长春迈灵生物工程有限公司 | 抗ca125双功能基因工程抗体的克隆与表达 |
| US6531580B1 (en) | 1999-06-24 | 2003-03-11 | Ixsys, Inc. | Anti-αvβ3 recombinant human antibodies and nucleic acids encoding same |
| DK2283866T3 (en) | 1999-06-25 | 2015-05-18 | Genentech Inc | METHODS OF TREATMENT USING ANTI-ERBB ANTIBODY-MAYTANSINOID CONJUGATES |
| EP1230269A2 (en) | 1999-11-03 | 2002-08-14 | Maxygen, Inc. | Antibody diversity generation |
| PL356836A1 (en) | 2000-02-10 | 2004-07-12 | Abbott Laboratories | Antibodies that bind human interleukin-18 and methods of making and using |
| CA2399255A1 (en) | 2000-02-24 | 2001-08-30 | Genentech, Inc. | Caspase activated prodrugs therapy |
| CA2400868C (en) | 2000-02-25 | 2012-12-04 | Ira Pastan | Anti-egfrviii scfvs with improved cytotoxicity and yield, immunotoxins based thereon, and methods of use thereof |
| WO2001071005A2 (en) | 2000-03-24 | 2001-09-27 | Micromet Ag | Multifunctional polypeptides comprising a binding site to an epitope of the nkg2d receptor complex |
| ES2528794T3 (es) | 2000-04-11 | 2015-02-12 | Genentech, Inc. | Anticuerpos multivalentes y usos de los mismos |
| EP1278778A2 (en) | 2000-05-03 | 2003-01-29 | Amgen Inc., | Modified peptides, comprising an fc domain, as therapeutic agents |
| AU2001258567A1 (en) | 2000-05-19 | 2001-11-26 | Scancell Limited | Humanised antibodies to the epidermal growth factor receptor |
| DE60114830T2 (de) | 2000-06-28 | 2006-08-03 | Glycofi, Inc. | Verfahren zur herstellung modifizierter glycoproteine |
| US7449308B2 (en) | 2000-06-28 | 2008-11-11 | Glycofi, Inc. | Combinatorial DNA library for producing modified N-glycans in lower eukaryotes |
| PE20020132A1 (es) * | 2000-06-29 | 2002-03-04 | Abbott Lab | Anticuerpos de especificidad doble y metodos para la elaboracion y el uso de los mismos |
| WO2002002781A1 (en) | 2000-06-30 | 2002-01-10 | Vlaams Interuniversitair Instituut Voor Biotechnologie Vzw | Heterodimeric fusion proteins |
| US20090081234A1 (en) * | 2000-08-07 | 2009-03-26 | George Heavner | Anti-tnf antibodies, compositions, methods and uses for treatment of depression and related conditions |
| GB0020685D0 (en) | 2000-08-22 | 2000-10-11 | Novartis Ag | Organic compounds |
| US6699473B2 (en) * | 2000-10-13 | 2004-03-02 | Uab Research Foundation | Human anti-epidermal growth factor receptor single-chain antibodies |
| US6818392B2 (en) | 2000-12-06 | 2004-11-16 | Abbott Laboratories | Monoclonal antibodies to human immunodeficiency virus and uses thereof |
| KR20100031769A (ko) | 2000-12-28 | 2010-03-24 | 알투스 파마슈티컬스 인코포레이티드 | 전항체 및 이의 단편의 결정과 이의 제조 및 사용 방법 |
| MY143465A (en) | 2001-01-05 | 2011-05-13 | Pfizer | Antibodies to insulin-like growth factor i receptor |
| US7667004B2 (en) * | 2001-04-17 | 2010-02-23 | Abmaxis, Inc. | Humanized antibodies against vascular endothelial growth factor |
| US20100056762A1 (en) | 2001-05-11 | 2010-03-04 | Old Lloyd J | Specific binding proteins and uses thereof |
| CA2448956C (en) * | 2001-05-30 | 2017-10-03 | Genentech, Inc. | Anti-ngf antibodies for the treatment of various disorders |
| AU2002314825A1 (en) | 2001-05-30 | 2002-12-09 | Centocor, Inc. | Anti-p40 immunoglobulin derived proteins, compositions, methods and uses |
| CN100497389C (zh) | 2001-06-13 | 2009-06-10 | 根马布股份公司 | 表皮生长因子受体(egfr)的人单克隆抗体 |
| ATE524495T1 (de) | 2001-07-31 | 2011-09-15 | Ono Pharmaceutical Co | Pd-1-spezifische substanz |
| EP1432444A4 (en) | 2001-08-17 | 2005-11-02 | Lilly Co Eli | ANTI-BETA ANTIBODIES |
| US7247304B2 (en) | 2001-08-23 | 2007-07-24 | Genmab A/S | Methods of treating using anti-IL-15 antibodies |
| US7241873B2 (en) * | 2001-09-25 | 2007-07-10 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | Recombinant anti-osteopontin antibody and use thereof |
| JP4578098B2 (ja) | 2001-10-01 | 2010-11-10 | ダイアックス、コープ | 多重鎖真核ディスプレイベクターとその使用 |
| CN100423777C (zh) | 2001-10-25 | 2008-10-08 | 杰南技术公司 | 糖蛋白组合物 |
| WO2003039486A2 (en) | 2001-11-09 | 2003-05-15 | Idec Pharmaceuticals Corporation | Anti-cd80 antibody having adcc activity for adcc mediated killing of b cell lymphoma cells alone or in combination with other therapies |
| BRPI0214168B8 (pt) | 2001-11-14 | 2021-05-25 | Centocor Inc | anticorpos anti-il-6, moléculas de ácido nucleico codificando os mesmos, vetores compreendendo as referidas moléculas, composições e formulações compreendendo os referidos anticorpos, bem como métodos de produção dos mesmos |
| AU2002351353A1 (en) * | 2001-12-19 | 2003-09-02 | Genentech, Inc. | Stabilizing polypeptides which have been exposed to urea |
| CA2473144C (en) | 2002-02-05 | 2013-05-28 | Genentech, Inc. | Protein purification |
| CA2472922A1 (en) | 2002-02-11 | 2003-08-21 | Genentech, Inc. | Antibody variants with faster antigen association rates |
| US7317091B2 (en) * | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| EP1499352A4 (en) | 2002-04-12 | 2006-10-11 | Medimmune Inc | ANTI-INTERLEUKIN-9 RECOMBINANT ANTIBODIES |
| AU2003222664A1 (en) | 2002-04-18 | 2003-11-03 | Genencor International, Inc. | Production of functional antibodies in filamentous fungi |
| CA2478925C (en) | 2002-04-26 | 2016-06-07 | Robert Lee Fahrner | Non-affinity purification of proteins |
| US20030206898A1 (en) | 2002-04-26 | 2003-11-06 | Steven Fischkoff | Use of anti-TNFalpha antibodies and another drug |
| WO2003093317A1 (fr) | 2002-04-30 | 2003-11-13 | Kyowa Hakko Kogyo Co., Ltd. | Anticorps pour facteur de croissance humain semblable a l'insuline |
| EP2316921B1 (en) | 2002-05-24 | 2014-05-14 | Merck Sharp & Dohme Corp. | Neutralizing human anti-IGFR antibody |
| US9321832B2 (en) | 2002-06-28 | 2016-04-26 | Domantis Limited | Ligand |
| US20040033228A1 (en) | 2002-08-16 | 2004-02-19 | Hans-Juergen Krause | Formulation of human antibodies for treating TNF-alpha associated disorders |
| CA2496419A1 (en) * | 2002-08-19 | 2004-02-26 | Abgenix, Inc. | Antibodies directed to monocyte chemo-attractant protein-1 (mcp-1) and uses thereof |
| ES2347239T3 (es) | 2002-12-02 | 2010-10-27 | Amgen Fremont Inc. | Anticuerpos dirigidos al factor de necrosis tumoral y usos de los mismos. |
| DK2289936T3 (en) * | 2002-12-16 | 2017-07-31 | Genentech Inc | IMMUNGLOBULIN VARIATIONS AND APPLICATIONS THEREOF |
| ATE553128T1 (de) | 2002-12-24 | 2012-04-15 | Rinat Neuroscience Corp | Anti-ngf-antikörper und verfahren zu ihrer verwendung |
| US7569364B2 (en) | 2002-12-24 | 2009-08-04 | Pfizer Inc. | Anti-NGF antibodies and methods using same |
| EP1585768A2 (en) | 2003-01-23 | 2005-10-19 | Genentech, Inc. | Methods for producing humanized antibodies and improving yield of antibodies or antigen binding fragments in cell culture |
| JP3803790B2 (ja) | 2003-02-17 | 2006-08-02 | 株式会社東北テクノアーチ | 新規なダイアボディ型二重特異性抗体 |
| US20060104968A1 (en) | 2003-03-05 | 2006-05-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminogly ycanases |
| PL2405015T3 (pl) | 2003-03-05 | 2016-09-30 | Rozpuszczalna glikoproteina o aktywności hialuronizady (sHASEGP), sposób jej wytwarzania, jej zastosowania i zawierające ją kompozycje farmaceutyczne | |
| WO2005016970A2 (en) | 2003-05-01 | 2005-02-24 | Imclone Systems Incorporated | Fully human antibodies directed against the human insulin-like growth factor-1 receptor |
| WO2004106381A1 (en) * | 2003-05-31 | 2004-12-09 | Micromet Ag | Pharmaceutical compositions comprising bispecific anti-cd3, anti-cd19 antibody constructs for the treatment of b-cell related disorders |
| TWI476206B (zh) * | 2003-07-18 | 2015-03-11 | Amgen Inc | 對肝細胞生長因子具專一性之結合劑 |
| DK3095793T3 (da) * | 2003-07-28 | 2020-05-25 | Genentech Inc | Reducering af udvaskning af protein A under en protein A-affinitetskromatografi |
| US20050026881A1 (en) * | 2003-07-31 | 2005-02-03 | Robinson Cynthia B. | Combination of dehydroepiandrosterone or dehydroepiandrosterone-sulfate with an anti-IgE antibody for treatment of asthma or chronic obstructive pulmonary disease |
| WO2005044853A2 (en) | 2003-11-01 | 2005-05-19 | Genentech, Inc. | Anti-vegf antibodies |
| US20050106667A1 (en) | 2003-08-01 | 2005-05-19 | Genentech, Inc | Binding polypeptides with restricted diversity sequences |
| US7662928B2 (en) * | 2003-08-08 | 2010-02-16 | The Research Foundation Of State University Of New York | Anti-FcRn antibodies for treatment of auto/allo immune conditions |
| US20050042664A1 (en) | 2003-08-22 | 2005-02-24 | Medimmune, Inc. | Humanization of antibodies |
| JP2007503206A (ja) * | 2003-08-22 | 2007-02-22 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 変更されたエフェクター機能を有する改良された抗体およびその抗体を産生する方法 |
| US20060134105A1 (en) | 2004-10-21 | 2006-06-22 | Xencor, Inc. | IgG immunoglobulin variants with optimized effector function |
| US20050095246A1 (en) * | 2003-10-24 | 2005-05-05 | Medtronic, Inc. | Techniques to treat neurological disorders by attenuating the production of pro-inflammatory mediators |
| US7968684B2 (en) | 2003-11-12 | 2011-06-28 | Abbott Laboratories | IL-18 binding proteins |
| CA2545653C (en) * | 2003-11-21 | 2014-07-08 | Anp Technologies, Inc. | Asymmetrically branched polymer conjugates and microarray assays |
| CA2548817A1 (en) | 2003-12-04 | 2005-06-23 | Xencor, Inc. | Methods of generating variant proteins with increased host string content and compositions thereof |
| US7235641B2 (en) | 2003-12-22 | 2007-06-26 | Micromet Ag | Bispecific antibodies |
| ITRM20030601A1 (it) | 2003-12-24 | 2005-06-25 | Lay Line Genomics Spa | Metodo per l'umanizzazione di anticorpi e anticorpi umanizzati con esso ottenuti. |
| EP1755673B1 (en) | 2004-04-12 | 2014-07-23 | MedImmune, LLC | Anti-il-9 antibody formulations and uses thereof |
| CN1950496B (zh) | 2004-04-15 | 2015-02-04 | 格利科菲公司 | 在低等真核生物中产生半乳糖基化糖蛋白 |
| EP1786918A4 (en) | 2004-07-17 | 2009-02-11 | Imclone Systems Inc | NEW BISPECIFIC ANTIBODY TETRAVALENT |
| WO2006015373A2 (en) | 2004-08-04 | 2006-02-09 | Amgen Inc | Antibodies to dkk-1 |
| BRPI0513666A (pt) * | 2004-08-05 | 2008-05-13 | Genentech Inc | anticorpos, anticorpos anti c-met humanizados, método de inibição de proliferação celular de c-met ativado, método de modulação de uma doença associada com descontrole de sinalização de hgf/c-met, método para o tratamento de um sujeito com cáncer, método para o tratamento de um distúrbio proliferativo, ácido nucléico, célula hospedeira e composição |
| GB0417487D0 (en) | 2004-08-05 | 2004-09-08 | Novartis Ag | Organic compound |
| JP2008510466A (ja) | 2004-08-19 | 2008-04-10 | ジェネンテック・インコーポレーテッド | エフェクター機能が変更しているポリペプチド変異体 |
| GB0419424D0 (en) | 2004-09-02 | 2004-10-06 | Viragen Scotland Ltd | Transgene optimisation |
| KR101364276B1 (ko) * | 2004-09-03 | 2014-02-20 | 제넨테크, 인크. | 인간화 항-베타7 길항제 및 그의 용도 |
| EP1805222B1 (en) * | 2004-10-01 | 2011-02-02 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Antibodies directed to the mammalian eag1 ion channel protein |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| WO2006047350A2 (en) | 2004-10-21 | 2006-05-04 | Xencor, Inc. | IgG IMMUNOGLOBULIN VARIANTS WITH OPTIMIZED EFFECTOR FUNCTION |
| NZ554520A (en) * | 2004-10-22 | 2010-03-26 | Amgen Inc | Methods for refolding of recombinant antibodies |
| US20060253100A1 (en) | 2004-10-22 | 2006-11-09 | Medtronic, Inc. | Systems and Methods to Treat Pain Locally |
| US7423128B2 (en) | 2004-11-03 | 2008-09-09 | Amgen Fremont Inc. | Anti-properdin antibodies, and methods for making and using same |
| TW200635608A (en) | 2004-12-15 | 2006-10-16 | Neuralab Ltd | Aβ antibodies for use in improving cognition |
| ES2371083T3 (es) | 2004-12-21 | 2011-12-27 | Medimmune Limited | Anticuerpos dirigidos contra la angiopoyetina-2 y usos de los mismos. |
| ES2395953T3 (es) | 2005-01-26 | 2013-02-18 | Amgen Fremont Inc. | Anticuerpos frente a interleucina-1 beta |
| DK1853718T3 (en) | 2005-02-15 | 2015-11-09 | Univ Duke | ANTI-CD19 ANTIBODIES AND THEIR USE IN ONCOLOGY |
| EP1860119B1 (en) * | 2005-02-28 | 2011-08-03 | Institute for Antibodies Co., Ltd. | ANTI-IgSF4 ANTIBODY AND UTILIZATION OF THE SAME |
| UA94707C2 (en) | 2005-03-24 | 2011-06-10 | Тромбоджиникс Н.В. | Antigen-binding molecule capable of binding to plgf |
| CA2604032C (en) | 2005-04-06 | 2017-08-22 | Ibc Pharmaceuticals, Inc. | Methods for generating stably linked complexes composed of homodimers, homotetramers or dimers of dimers and uses |
| AR053067A1 (es) | 2005-04-25 | 2007-04-18 | Pfizer | Anticuerpos contra miostatina |
| US7592429B2 (en) * | 2005-05-03 | 2009-09-22 | Ucb Sa | Sclerostin-binding antibody |
| AU2006244445B2 (en) * | 2005-05-05 | 2013-04-18 | Duke University | Anti-CD19 antibody therapy for autoimmune disease |
| LT2460831T (lt) | 2005-05-27 | 2016-12-12 | Biogen Ma Inc. | Tweak rišantys antikūnai |
| ITRM20050290A1 (it) | 2005-06-07 | 2006-12-08 | Lay Line Genomics Spa | Uso di molecole in grado di inibire il legame tra ngf e il suo recettore trka come analgesici ad effetto prolungato. |
| TW200738256A (en) | 2005-06-24 | 2007-10-16 | Novozymes As | Lipases for pharmaceutical use |
| LT2452694T (lt) | 2005-06-30 | 2019-02-25 | Janssen Biotech, Inc. | Anti-il-23 antikūnai, kompozicijos, būdai ir panaudojimai |
| US20090215992A1 (en) | 2005-08-19 | 2009-08-27 | Chengbin Wu | Dual variable domain immunoglobulin and uses thereof |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| JP5364870B2 (ja) * | 2005-08-19 | 2013-12-11 | アッヴィ・インコーポレイテッド | 二重可変ドメイン免疫グロブリン及びその使用 |
| US20070041905A1 (en) * | 2005-08-19 | 2007-02-22 | Hoffman Rebecca S | Method of treating depression using a TNF-alpha antibody |
| KR101379568B1 (ko) * | 2005-08-26 | 2014-04-08 | 로슈 글리카트 아게 | 변형된 세포 신호 활성을 가진 개질된 항원 결합 분자 |
| US7906116B2 (en) | 2005-09-01 | 2011-03-15 | Parkash Gill | Methods for using and identifying modulators of Delta-like 4 |
| EP1933714B1 (en) * | 2005-09-21 | 2020-03-18 | The Regents of The University of California | Systems and compositions for local imaging and treatment of pain |
| EP2230256A1 (en) * | 2005-09-23 | 2010-09-22 | Walter Reed Army Institute of Research (WRAIR) | Antibodies with simultaneous subsite specificities to protein and lipid epitopes |
| ES2856451T3 (es) | 2005-10-11 | 2021-09-27 | Amgen Res Munich Gmbh | Composiciones que comprenden anticuerpos específicos para diferentes especies, y usos de las mismas |
| JP2009513608A (ja) | 2005-10-28 | 2009-04-02 | ノボ・ノルデイスク・エー/エス | エフェクターリンパ球と標的細胞とを結合する融合タンパク質 |
| UA96139C2 (uk) | 2005-11-08 | 2011-10-10 | Дженентек, Інк. | Антитіло до нейропіліну-1 (nrp1) |
| TW200736277A (en) | 2005-11-14 | 2007-10-01 | Amgen Inc | RANKL antibody-PTH/PTHrP chimeric molecules |
| US7820165B2 (en) | 2005-11-21 | 2010-10-26 | Merck Serono, S.A. | Compositions and methods of producing hybrid antigen binding molecules and uses thereof |
| ES2524984T3 (es) | 2005-11-30 | 2014-12-16 | Abbvie Inc. | Anticuerpos anti-globulómero a?, porciones de unión a antígeno de estos, hibridomas correspondientes, ácidos nucleicos, vectores, células huésped, métodos para producir dichos anticuerpos, composiciones que comprenden dichos anticuerpos, usos de dichos anticuerpos, y métodos para usar dichos anticuerpos |
| RS52357B (en) | 2005-12-13 | 2012-12-31 | Medimmune Limited | BINDING PROTEINS SPECIFIC TO INSULIN SIMILAR GROWTH FACTORS AND THEIR USE |
| AR056857A1 (es) | 2005-12-30 | 2007-10-24 | U3 Pharma Ag | Anticuerpos dirigidos hacia her-3 (receptor del factor de crecimiento epidérmico humano-3) y sus usos |
| WO2007117749A2 (en) | 2006-01-31 | 2007-10-18 | Novartis Ag | Il-17 antagonistic antibodies fpr treating cancer |
| JP5374359B2 (ja) * | 2006-03-17 | 2013-12-25 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | 安定化されたポリペプチド化合物 |
| JP2009530423A (ja) | 2006-03-21 | 2009-08-27 | ワイス | アミロイド生成性疾患を予防および処置するための方法 |
| US20070232556A1 (en) * | 2006-03-31 | 2007-10-04 | Montine Thomas J | Methods and compositions for the treatment of neurological diseases and disorders |
| EP2010213A4 (en) | 2006-04-10 | 2010-08-11 | Abbott Biotech Ltd | USE AND COMPOSITIONS FOR THE TREATMENT OF JUVENIL RHEUMATOID ARTHRITIS |
| NZ571757A (en) | 2006-04-21 | 2012-01-12 | Novartis Ag | Antagonist anti-CD40 antibody pharmaceutical compositions comprising arginine-HCl and a citrate or citric acid buffer |
| US20080118978A1 (en) * | 2006-04-28 | 2008-05-22 | Takashi Sato | Anti-tumor agent |
| CN101058609B (zh) | 2006-05-26 | 2011-04-13 | 神州细胞工程有限公司 | 人源抗体及其表达 |
| EP2380908A1 (en) * | 2006-06-02 | 2011-10-26 | Aveo Pharmaceuticals, Inc. | Hepatocyte growth factor (hgf) binding proteins |
| CL2007001623A1 (es) | 2006-06-06 | 2008-01-18 | Genentech Inc | Anticuerpo anti-dll4; polinucleotido que lo codifica; vector y celula huesped que comprenden dicho polinucleotido; metodo para elaborar el anticuerpo e inmunojugado; metodo de deteccion de dll4 y metodo diagnostico de un trastorno asociado a dll4; composicion que comprende al anticuerpo. |
| US20080014196A1 (en) * | 2006-06-06 | 2008-01-17 | Genentech, Inc. | Compositions and methods for modulating vascular development |
| EP2035456A1 (en) | 2006-06-22 | 2009-03-18 | Novo Nordisk A/S | Production of bispecific antibodies |
| US20080112888A1 (en) * | 2006-06-30 | 2008-05-15 | Schering Corporation | Igfbp2 biomarker |
| KR101605207B1 (ko) | 2006-07-14 | 2016-03-22 | 에이씨 이뮨 에스.에이. | 아밀로이드 베타에 대해 인간화된 항체 |
| PT2383297E (pt) | 2006-08-14 | 2013-04-15 | Xencor Inc | Anticorpos otimizados que visam cd |
| UA102503C2 (en) | 2006-09-08 | 2013-07-25 | Эбботт Леборетриз | Interleukin-13 binding proteins |
| EP2066694B1 (en) | 2006-09-29 | 2015-11-04 | Oncomed Pharmaceuticals, Inc. | Compositions and methods for diagnosing and treating cancer |
| CN106084054A (zh) * | 2006-11-02 | 2016-11-09 | 健泰科生物技术公司 | 人源化的抗‑d因子抗体 |
| EP2120996A2 (en) | 2006-12-20 | 2009-11-25 | Vasgene Therapeutics, Inc. | Methods for using and identifying modulators of delta-like 4 |
| US7919594B2 (en) | 2007-02-14 | 2011-04-05 | Vaccinex, Inc. | Human anti-CD100 antibodies |
| EP2647388A1 (en) | 2007-02-16 | 2013-10-09 | Merrimack Pharmaceuticals, Inc. | Antibodies Against ERBB3 and Uses Thereof |
| HUE041818T2 (hu) * | 2007-03-22 | 2019-05-28 | Biogen Ma Inc | Kötõ proteinek, beleértve az antitesteket, CD154-et specifikusan kötõ antitest származékokat és antitest fragmenseket is, és alkalmazásaik |
| CA2685123A1 (en) * | 2007-04-23 | 2008-10-30 | Wyeth | Methods and compositions for treating and monitoring treatment of il-13-associated disorders |
| GB0708002D0 (en) * | 2007-04-25 | 2007-06-06 | Univ Sheffield | Antibodies |
| EP1997832A1 (en) | 2007-05-29 | 2008-12-03 | Ganymed Pharmaceuticals AG | Monoclonal antibodies against Claudin-18 for treatment of cancer |
| AU2008260135A1 (en) | 2007-05-30 | 2008-12-11 | Lpath, Inc. | Compositions and methods for binding lysophosphatidic acid |
| EP2167961A4 (en) * | 2007-06-27 | 2010-07-21 | Univ Leland Stanford Junior | BETA2-MICROGLOBULIN AND C-REACTIVE PROTEIN (CRP) AS BIOMARKERS FOR PERIPHERAL ARTERY DISEASE |
| AU2008282218A1 (en) * | 2007-07-31 | 2009-02-05 | Medimmune, Llc | Multispecific epitope binding proteins and uses thereof |
| CA2697163A1 (en) * | 2007-08-08 | 2009-02-12 | Abbott Laboratories | Compositions and methods for crystallizing antibodies |
| US9624309B2 (en) | 2007-08-15 | 2017-04-18 | Bayer Intellectual Property Gmbh | Monospecific and multispecific antibodies and method of use |
| JP5848006B2 (ja) | 2007-10-19 | 2016-01-27 | アボット・ラボラトリーズAbbott Laboratories | Ngalの検出用イムノアッセイ及びキット |
| BRPI0822049B1 (pt) | 2007-12-17 | 2021-11-16 | Pfizer Limited | Composiqao farmaceutica compreendendo anticorpo antagonista anti-ngf, kit e uso de um anticorpo antingf |
| DK2235064T3 (en) | 2008-01-07 | 2016-01-11 | Amgen Inc | A process for the preparation of heterodimeric Fc molecules using electrostatic control effects |
| US8962803B2 (en) * | 2008-02-29 | 2015-02-24 | AbbVie Deutschland GmbH & Co. KG | Antibodies against the RGM A protein and uses thereof |
| US20100260668A1 (en) | 2008-04-29 | 2010-10-14 | Abbott Laboratories | Dual Variable Domain Immunoglobulins and Uses Thereof |
| KR20110014607A (ko) | 2008-04-29 | 2011-02-11 | 아보트 러보러터리즈 | 이원 가변 도메인 면역글로불린 및 이의 용도 |
| EP2500361B1 (en) | 2008-05-09 | 2016-03-30 | AbbVie Deutschland GmbH & Co KG | Antibodies to receptor of advanced glycation end products (RAGE) and uses thereof |
| EP2297209A4 (en) * | 2008-06-03 | 2012-08-01 | Abbott Lab | IMMUNOGLOBULINS WITH TWO VARIABLE DOMAINS AND USES THEREOF |
| CN102112494A (zh) | 2008-06-03 | 2011-06-29 | 雅培制药有限公司 | 双重可变结构域免疫球蛋白及其用途 |
| US8741287B2 (en) | 2008-06-18 | 2014-06-03 | Abbott Laboratories | PlGF-1 assay and kits and components thereof |
| WO2010006060A2 (en) | 2008-07-08 | 2010-01-14 | Abbott Laboratories | Prostaglandin e2 dual variable domain immunoglobulins and uses thereof |
| CN104829718A (zh) * | 2008-07-08 | 2015-08-12 | 艾伯维公司 | 前列腺素e2结合蛋白及其用途 |
| US9273136B2 (en) * | 2008-08-04 | 2016-03-01 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Fully human anti-human NKG2D monoclonal antibodies |
| CA2737035A1 (en) * | 2008-09-30 | 2010-04-08 | Abbott Laboratories | Improved method of rna display |
| US20100233079A1 (en) | 2008-12-04 | 2010-09-16 | Abbott Laboratories | Dual Variable Domain Immunoglobulins and Uses Thereof |
| RU2015132478A (ru) | 2009-03-05 | 2015-12-10 | Эббви Инк. | Связывающие il-17 белки |
| NZ596711A (en) | 2009-05-01 | 2013-11-29 | Dual variable domain immunoglobulins and uses thereof | |
| SG175426A1 (en) | 2009-05-01 | 2011-12-29 | Abbott Lab | Dual variable domain immunoglobulins and uses thereof |
| UY32808A (es) | 2009-07-29 | 2011-02-28 | Abbott Lab | Inmunoglobulinas como dominio variable dual y usos de las mismas |
| CN102612524A (zh) * | 2009-09-01 | 2012-07-25 | 雅培制药有限公司 | 双重可变结构域免疫球蛋白及其用途 |
| AU2010306677B2 (en) * | 2009-10-15 | 2013-05-23 | Abbvie Inc. | Dual variable domain immunoglobulins and uses thereof |
| CN102655880A (zh) * | 2009-10-15 | 2012-09-05 | 雅培制药有限公司 | Il-1结合蛋白 |
| UY32979A (es) | 2009-10-28 | 2011-02-28 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| CN105037543B (zh) | 2010-03-02 | 2020-11-03 | Abbvie 公司 | 治疗性dll4结合蛋白 |
| EP2585607A4 (en) | 2010-06-24 | 2014-01-22 | Abbvie Inc | VARIABLE DOUBLE DOMAIN IMMUNOGLOBULINS AND USES THEREOF |
| UY33492A (es) * | 2010-07-09 | 2012-01-31 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| UY33543A (es) * | 2010-08-03 | 2012-02-29 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| BR112013004581A2 (pt) * | 2010-08-26 | 2017-06-27 | Abbvie Inc | imunoglobulinas de domínio variável dual e seus usos |
| AR083672A1 (es) | 2010-11-02 | 2013-03-13 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| WO2012061558A2 (en) | 2010-11-04 | 2012-05-10 | Abbott Laboratories | Dual variable domain immunoglobulins and uses thereof |
| MX2014004977A (es) | 2011-10-24 | 2014-09-11 | Abbvie Inc | Inmunoaglutinantes dirigidos contra esclerostina. |
| TW201333039A (zh) | 2011-12-30 | 2013-08-16 | Abbvie Inc | 雙可變域免疫球蛋白及其用途 |
| WO2013101972A2 (en) | 2011-12-30 | 2013-07-04 | Abbvie Inc. | Dual variable domain immunoglobulins and uses thereof |
| AU2012362326A1 (en) | 2011-12-30 | 2014-07-24 | Abbvie Inc. | Dual variable domain immunoglobulins against IL-13 and/or IL-17 |
-
2009
- 2009-07-08 WO PCT/US2009/049954 patent/WO2010006060A2/en active Application Filing
- 2009-07-08 BR BRPI0915448A patent/BRPI0915448A2/pt not_active IP Right Cessation
- 2009-07-08 JP JP2011517572A patent/JP5674654B2/ja not_active Expired - Fee Related
- 2009-07-08 SG SG2013052725A patent/SG192489A1/en unknown
- 2009-07-08 NZ NZ590074A patent/NZ590074A/xx not_active IP Right Cessation
- 2009-07-08 MX MX2010014574A patent/MX2010014574A/es not_active Application Discontinuation
- 2009-07-08 TW TW098123110A patent/TW201012475A/zh unknown
- 2009-07-08 CA CA2729949A patent/CA2729949A1/en not_active Abandoned
- 2009-07-08 US US12/499,652 patent/US8822645B2/en active Active
- 2009-07-08 EP EP20090795128 patent/EP2321422A4/en not_active Withdrawn
- 2009-07-08 CN CN200980135186.9A patent/CN102149825B/zh not_active Expired - Fee Related
- 2009-07-08 NZ NZ603698A patent/NZ603698A/en not_active IP Right Cessation
- 2009-07-08 KR KR1020117002816A patent/KR20110031369A/ko not_active Application Discontinuation
- 2009-07-08 RU RU2011104348/10A patent/RU2011104348A/ru not_active Application Discontinuation
- 2009-07-08 AU AU2009268585A patent/AU2009268585C1/en not_active Ceased
-
2010
- 2010-12-21 IL IL210160A patent/IL210160A0/en unknown
-
2014
- 2014-07-09 US US14/327,306 patent/US20150017095A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20160113711A (ko) * | 2014-02-02 | 2016-09-30 | 메디뮨 리미티드 | Ngf 길항제 도메인 및 tnfa 길항제 도메인으로 구성된 키메라 단백질 |
Also Published As
| Publication number | Publication date |
|---|---|
| TW201012475A (en) | 2010-04-01 |
| AU2009268585C1 (en) | 2014-10-02 |
| RU2011104348A (ru) | 2012-08-20 |
| CN102149825B (zh) | 2015-07-22 |
| MX2010014574A (es) | 2011-04-27 |
| WO2010006060A3 (en) | 2010-06-03 |
| AU2009268585A1 (en) | 2010-01-14 |
| SG192489A1 (en) | 2013-08-30 |
| AU2009268585B2 (en) | 2014-06-19 |
| IL210160A0 (en) | 2011-03-31 |
| EP2321422A2 (en) | 2011-05-18 |
| JP5674654B2 (ja) | 2015-02-25 |
| BRPI0915448A2 (pt) | 2015-11-10 |
| US20150017095A1 (en) | 2015-01-15 |
| JP2011527580A (ja) | 2011-11-04 |
| US8822645B2 (en) | 2014-09-02 |
| CA2729949A1 (en) | 2010-01-14 |
| CN102149825A (zh) | 2011-08-10 |
| NZ590074A (en) | 2012-12-21 |
| NZ603698A (en) | 2014-03-28 |
| EP2321422A4 (en) | 2013-06-19 |
| US20100074900A1 (en) | 2010-03-25 |
| WO2010006060A2 (en) | 2010-01-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103517921B (zh) | IL‑1‑α和‑β双特异性双重可变结构域免疫球蛋白及其用途 | |
| JP5674654B2 (ja) | プロスタグランジンe2二重可変ドメイン免疫グロブリンおよびその使用 | |
| JP5723769B2 (ja) | 二重可変ドメイン免疫グロブリン及びその使用 | |
| TWI541021B (zh) | Il-17結合蛋白 | |
| KR20110014607A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130139884A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20140015139A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20140015145A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20120047274A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20120060877A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130105601A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130004563A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130100118A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20110097913A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20110016958A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130118892A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20130043168A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 | |
| KR20120044294A (ko) | 이원 가변 도메인 면역글로불린 및 이의 용도 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| WITB | Written withdrawal of application |