KR20090005015A - 11-베타-hsd-1로서의 피라졸 - Google Patents
11-베타-hsd-1로서의 피라졸 Download PDFInfo
- Publication number
- KR20090005015A KR20090005015A KR1020087025604A KR20087025604A KR20090005015A KR 20090005015 A KR20090005015 A KR 20090005015A KR 1020087025604 A KR1020087025604 A KR 1020087025604A KR 20087025604 A KR20087025604 A KR 20087025604A KR 20090005015 A KR20090005015 A KR 20090005015A
- Authority
- KR
- South Korea
- Prior art keywords
- carboxylic acid
- adamantan
- pyrazole
- trans
- amide
- Prior art date
Links
- 0 CCOC(c1c(N)[n](*)nc1)=O Chemical compound CCOC(c1c(N)[n](*)nc1)=O 0.000 description 10
- QUCYJSIUSVCLRW-MUWCQWAASA-N CC(C)(C)[n]1ncc(C(/N=C(/C2C3)\C(CC4)CC4C[C@]23O)O)c1C(F)(F)F Chemical compound CC(C)(C)[n]1ncc(C(/N=C(/C2C3)\C(CC4)CC4C[C@]23O)O)c1C(F)(F)F QUCYJSIUSVCLRW-MUWCQWAASA-N 0.000 description 1
- LBPZUNLSYYEDFB-UHFFFAOYSA-N CC(C)(C)[n]1ncc(C(O)=O)c1C(F)(F)F Chemical compound CC(C)(C)[n]1ncc(C(O)=O)c1C(F)(F)F LBPZUNLSYYEDFB-UHFFFAOYSA-N 0.000 description 1
- HHFZBJYZWSBZLI-UHFFFAOYSA-N CC(CC1C2C3)CC3CC2C1NC(c1c(NCCO)[n](C)nc1)=O Chemical compound CC(CC1C2C3)CC3CC2C1NC(c1c(NCCO)[n](C)nc1)=O HHFZBJYZWSBZLI-UHFFFAOYSA-N 0.000 description 1
- XGGSWGFAZQLHDU-UHFFFAOYSA-N CCC(C)(C1)CN(C(C)(C)C)C(Cl)=C1C(O)=O Chemical compound CCC(C)(C1)CN(C(C)(C)C)C(Cl)=C1C(O)=O XGGSWGFAZQLHDU-UHFFFAOYSA-N 0.000 description 1
- MYLCLHCKBABUTD-UHFFFAOYSA-N CCOC(c(cn[n]1C)c1-[n]1cccc1)=O Chemical compound CCOC(c(cn[n]1C)c1-[n]1cccc1)=O MYLCLHCKBABUTD-UHFFFAOYSA-N 0.000 description 1
- CONQKDVJXJWLCT-NZXDIKEKSA-N COCCOCC[n]1ncc(C(N[C@@H](C(C2)C3)C(C4)C2C[C@@]34O)=O)c1-[n]1nccc1 Chemical compound COCCOCC[n]1ncc(C(N[C@@H](C(C2)C3)C(C4)C2C[C@@]34O)=O)c1-[n]1nccc1 CONQKDVJXJWLCT-NZXDIKEKSA-N 0.000 description 1
- HVOLMMKQGYDNND-UHFFFAOYSA-N C[n]1ncc(C(O)=O)c1-[n]1cccc1 Chemical compound C[n]1ncc(C(O)=O)c1-[n]1cccc1 HVOLMMKQGYDNND-UHFFFAOYSA-N 0.000 description 1
- DNARPQQGWXMWJN-UHFFFAOYSA-N NC(C(C1)N1C1)C(CC2)CC12O Chemical compound NC(C(C1)N1C1)C(CC2)CC12O DNARPQQGWXMWJN-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/4155—1,2-Diazoles non condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/12—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/16—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/02—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings
- C07D231/10—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D231/14—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D231/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
Abstract
Description
본 발명은 11β-하이드록시스테로이드 탈수소효소의 억제제에 관한 것이다. 상기 억제제는 예컨대, 피라졸 및 그의 유도체를 포함하고, 제 II형 진성 당뇨병 및 대사 증후군과 같은 질환의 치료에 유용하다.
하기에 인용되거나 의거한 모든 문헌은 본원에서 명시적으로 참고문헌으로 인용된다.
진성 당뇨병은 전세계적으로 점점 많은 사람들에게 영향을 주는 중병이다. 그 발병률은 많은 국가에서의 비만 증가 경향과 일치하게 증가하고 있다. 상기 질환의 심각한 결과는 뇌졸중, 심장 질환, 신장 손상, 실명 및 사지절단의 위험 증가를 포함한다. 당뇨병은 인슐린 분비의 감소 및/또는 인슐린에 반응하는 말초 조직 능력의 손상을 특징으로 하며, 그 결과 혈당 농도를 증가시킨다. 두 형태의 당뇨병: 인슐린-의존성 및 비-인슐린-의존성이 존재하고, 당뇨병 환자중 다수는 제 2형 당뇨병 또는 비-인슐린-의존성 진성 당뇨병(NIDDM)으로 알려진 비-인슐린-의존성 형태의 당뇨병을 앓고 있다. 심각한 결과 때문에, 당뇨병을 제어할 절박한 필요성 이 있다.
NIDDM의 치료는 일반적으로 체중 감소, 건강식 및 운동 프로그램으로 시작된다. 이들 요인은 당뇨병과 관련된 심혈관 위험 증가를 해결하는데 특히 중요하지만, 일반적으로 질환 그 자체의 제어에 있어서는 비효과적이다. 인슐린, 메트포르민(metformin), 설폰일우레아, 아카보즈(acarbose) 및 티아졸리딘다이온을 비롯하여 이용할 수 있는 많은 약물 치료법이 있다. 그러나, 이들 치료법 각각은 단점을 갖고 있으며, 당뇨병을 치료하기 위한 신규한 약제가 여전히 필요하다.
메트포르민은, 단식(fasting) 혈당 농도를 감소시키고 말초 조직의 인슐린 민감도를 증가시키는 효과적인 제제이다. 메트포르민은 포도당이 저장되는 중합성 형태인 글리코겐의 합성 증가를 비롯하여 생체내에서 많은 효과를 갖는다[알.에이. 드 프론조(R.A. De Fronzo), 약물(Drugs) 1999, 58 Suppl. 1, 29]. 메트포르민은 또한 지질 프로파일에 유익한 효과를 가지며 심혈관 건강에 좋은 결과를 가져다 주어서, 메트포르민에 의한 치료는 LDL 콜레스테롤 및 트리글리세라이드의 농도를 감소시킨다[에스.이. 인주치(S.E. Inzucchi), JAMA 2002, 287, 360]. 그러나, 여러 해에 걸쳐, 메트포르민은 그 유효성을 상실하고[알. 씨. 터너(R. C. Turner) 등, JAMA 1999, 281, 2005], 결과적으로 당뇨병에 대한 신규한 치료법이 필요하다.
티아졸리딘다이온은 핵수용체 퍼옥시좀-증식제 활성화 수용체-γ의 활성화제이다. 이들은 혈당 농도를 감소시키는데 효과적이며, 이들의 효능은 주로 골격근에서의 인슐린 내성의 감소에 기인하였다[엠. 타다이이온(M. Tadayyon) 및 에스. 에이. 스미쓰(S. A. Smith), Expert Opin. Investig. Drugs 2003, 12, 307]. 티아 졸리딘다이온의 사용과 관련된 하나의 단점은 체중 증가이다.
설폰일우레아는 췌장 베타 세포상의 설폰일우레아 수용체에 결합되고, 인슐린 분비를 자극하며, 결과적으로 혈당 농도를 감소시킨다. 체중 증가가 또한 설폰일우레아의 사용과 관련되고[에스.이. 인주치, JAMA 2002, 287, 360], 메트포르민처럼, 시간 경과에 따라 효능이 감소된다[알.씨. 터너 등, JAMA 1999, 281, 2005]. 설폰일우레아로 치료된 환자가 종종 겪는 그 밖의 문제점은 저혈당증이다[엠. 샐러스(M. Salas) 및 제이.제이. 카로(J.J. Caro), Adv. Drug React. Tox. Rev. 2002, 21, 205-217]. 아카보즈는 효소 알파-글루코시다아제의 억제제로, 장에 있는 이당류 및 복합 탄수화물을 분해시킨다. 이것은 메트포르민 또는 설폰일우레아보다 낮은 효능을 가지며, 장 불쾌감 및 설사를 일으켜서 종종 그 사용 중단으로 이어진다[에스.이. 인주치, JAMA 2002, 287, 360].
대사 증후군은 환자가 다음 징후중 둘 이상을 나타내는 증상이다: 비만, 고중성지방혈증, 저 농도의 HDL-콜레스테롤, 고혈압 및 증가된 단식 포도당 농도. 상기 징후는 종종 제 2형 당뇨병의 전조이며, 24%의 추정 유병율을 가지며 미국에서 높은 유병률을 갖는다[이.에스.포드(E.S.Ford) 등, JAMA 2002, 287, 356]. 대사 증후군을 개선시키는 치료제는 제 2형 당뇨병으로의 진행을 잠재적으로 늦추거나 중지시키는데 유용할 것이다.
간에서, 포도당은 2가지 다른 과정: 새로운 포도당이 피루베이트로부터 일련의 효소 반응에서 생성되는 당신생, 및 중합체 글리코겐의 분해에 의해 포도당이 생성되는 해당에 의해 생성된다.
당신생 과정의 주요 효소중 2가지는 옥살아세테이트의 포스포엔올피루베이트로의 전환을 촉진시키는 포스포엔올피루베이트 카르복시키나아제(PEPCK), 및 포도당-6-포스페이트의 가수분해를 촉진하여 유리 포도당을 제공하는 포도당-6-포스파타아제(G6Pase)이다. PEPCK에 의해 촉진되는 옥살아세테이트로부터 포스포엔올피루베이트로의 전환은 당신생에서의 속도-제한 단계이다. 단식시에, PEPCK 및 G6Pase 둘다가 상향조절되어서 당신생 속도를 증가시킨다. 이들 효소의 농도는 코르티코스테로이드 호르몬(인간의 경우에는 코르티솔이고 마우스의 경우에는 코르티코스테론)에 의해 부분적으로 제어된다. 코르티코스테로이드가 코르티코스테로이드 수용체에 결합될 때, 상기 효소의 상향 조절을 발생시키는 신호 과정(signaling cascade)이 시작된다.
코르티코스테로이드 호르몬은 글루코코르티코이드 수용체에서 활성을 갖지 않는 이들의 산화된 11-탈수소 대응물(인간 및 마우스에서 각각 코르티손 및 11-디하이드로코르티코스테론)과 함께 체내에서 발견된다. 상기 호르몬의 작용은 코르티코스테로이드 수용체가 발현되는 조직에서의 국소 농도에 좌우된다. 조직에서의 산화환원 효소의 작용 때문에, 상기 국소 농도는 혈장에서의 호르몬 순환 농도와 다를 수 있다. 호르몬의 산화 상태를 변경시키는 효소는 11베타-하이드록시스테로이드 탈수소효소 I 및 II 형태이다. I 형태(11β-HSD1)는 생체내에서 코르티손을 코르티솔로 환원시키는데 책임이 있는 반면, II 형태(11β-HSD2)는 코르티솔을 코르티손으로 산화시키는데 책임이 있다. 상기 효소는 낮은 상동관계를 가지며, 다른 조직에서 발현된다. 11β-HSD1은 간, 지방 조직 및 뇌를 비롯한 많은 조직에서 많이 발현되는 반면, 11β-HSD2는 신장 및 결장과 같은 전해질코르티코이드 표적 조직에서 많이 발현된다. 11β-HSD2는 코르티솔이 전해질코르티코이드 수용체에 결합되는 것을 막고, 상기 효소의 결핍은 가사(apparent) 전해질코르티코이드 과량(AME) 증후군과 관련된 것으로 밝혀졌다.
11β-하이드록시스테로이드의 코르티코스테로이드 수용체로의 결합은 PEPCK를 상향 조절하여서 혈당 농도를 증가시키므로, 11β-HSD1의 억제는 당뇨병 치료를 위한 유망한 접근법이다. 상기 생화학적 검토 이외에, 형질전환 마우스 및 인간의 소규모 임상 연구로부터, 11β-HSD1 억제의 치료 가능성을 확인시켜 주는 증거가 있다.
형질전환 마우스를 사용한 실험은 11β-HSD1 활성도의 조절이 당뇨병 및 대사증후군에서 유익한 치료 효과를 가질 수 있음을 나타낸다. 예컨대, 11β-HSD1 유전자가 마우스에서 유전자결손(knock-out)될 때, 단식은 G6Pase 및 PEPCK 농도의 일반적인 증가로 이어지지 않고, 상기 동물은 스트레스- 또는 비만-관련된 고혈당증에 걸리지 않는다. 또한, 고 지방식을 섭취하여 비만으로 된 유전자결손 동물이 대응하는 체중의 대조군보다 상당히 낮은 단식 포도당 농도를 갖는다[와이.코톨레프체프(Y.Kotolevtsev) 등. Proc. Natl. Acad. Sci. USA 1997, 94, 14924]. 11β-HSD1 유전자결손 마우스는 또한 개선된 지질 프로파일, 인슐린 민감도 및 내당능을 갖는 것으로 밝혀졌다[엔.엠.모튼(N.M.Morton) 등, J. Biol. Chem. 2001, 276, 41293]. 마우스에서 11β-HSD1 유전자의 과발현 효과가 또한 연구되어 왔다. 이들 형질전환 마우스는 지방 조직에서 증가된 11β-HSD1 활성도를 나타내었으며, 또 한 대사증후군과 관련된 내장 비만을 나타내었다. 코르티코스테론 농도가 지방 조직에서 증가하였으나, 혈청에서는 증가하지 않았고, 마우스는 특히 고 지방식을 섭취할 때에 증가된 비만 수준을 가졌다. 저 지방식을 섭취한 마우스는 고혈당 및 고인슐린을 가졌고, 또한 당내인성 장애 및 인슐린 저항을 나타내었다[에이치.마스자키(H.Masuzaki) 등, 사이언스(Science), 2001, 294, 2166].
비선택적인 11β-하이드록시스테로이드 탈수소효소 억제제, 카벤옥솔론의 효과가 많은 소규모 인간 임상 실험에서 연구되었다. 한 연구에서, 카벤옥솔론은 전신 인슐린 민감도를 증가시키는 것으로 밝혀졌고, 이러한 증가는 간 포도당 생성의 감소에 기인하였다[비.알.워커(B. R. Walker) 등, J. Clin. Endocrinol. Metab. 1995, 80, 3155]. 또 다른 연구에서, 글루카곤 투여(glucagon challenge)에 반응한 감소된 포도당 생성 및 글리코겐 분해가 당뇨병 피험자에서 관찰되었으나, 건강한 피험자에서는 관찰되지 않았다[알.씨.앤드류즈(R.C.Andrews) 등, J. Clin. Enocrinol. Metab. 2003, 88, 285]. 최종적으로, 카벤옥솔론은 건강한 노인 및 제 2형 당뇨병 환자의 인지 기능을 향상시키는 것으로 밝혀졌다[티. 씨. 샌딥(T. C. Sandeep) 등, Proc. Natl. Acad. Sci USA 2004, 101, 6734].
글리시레틴산, 아비에트산 및 카르벤옥솔론을 비롯한 11β-HSD1 및 11β-HSD2의 많은 비-특이적 억제제가 규명되었다. 또한, 케노디옥시콜린산, 플라바논 및 2'-하이드록시플라바논을 비롯한 11β-HSD1의 많은 선택적 억제제가 밝혀졌다[에스. 디에드리츠(S. Diederich) 등, Eur. J. Endocrinol, 2000, 142, 200; 및 알. 에이. 에스. 슈바이처(R. A. S. Schweizer) 등, Mol. Cell. Endocrinol. 2003, 212, 41].
제 II형 진성 당뇨병 및 대사 증후군과 같은 질환의 치료에 효능을 갖는 11β-HSD1 억제제가 당업계에서 필요하다. 또한, 약 1μM 미만의 IC50 값을 갖는 11β-HSD1 억제제가 당업계에서 필요하다.
본 발명의 한 양태에서, 하기 화학식 I의 화합물 및 그의 약학적으로 허용가능한 염이 제공된다:
R1은 수소이고,
R2는 하이드록시, 알콕시, 할로겐, 아미노, 저급알킬-아실아미노 또는 저급알킬설폰일아미노에 의해 치환된 또는 비치환된 아다만테인(adamantane)이며,
R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개의 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)OH, -(CH2)O(CH2)nCH3, -(CH2)O(CH2)n-알킬 -(CH2)O(CH2)n-사이클로알킬, 또는 N, O 및 S로부터 선택된 1 내지 3개의 헤테로 원자를 갖고 저급 알킬, 하이드록시, 하이드록시 페닐, -(CH2)n-페닐, -CH2(CH2)nOH 또는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클이고,
R4는 하이드록실에 의해 치환된 또는 비치환된 분지형 또는 비분지형 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C6)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH, 또는 N, O 또는 S로부터 선택된 1 또는 2개 원자를 갖는 4- 내지 6-원 포화 헤테로사이클릴 고리이며,
R5는 수소, 또는 할로겐에 의해 치환된 또는 비치환된 저급 알킬이고,
n은 0, 1, 2 또는 3이며,
m은 0, 1 또는 2이고,
p는 1, 2 또는 3이다.
본 발명의 또 다른 양태에서, 치료 유효량의 화학식 I의 화합물 또는 그의 약학적으로 허용가능한 염 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물이 제공되어 있다.
본 발명의 추가적인 양태에서, 치료 유효량의 화학식 I의 화합물을 대상 장애의 치료가 필요한 환자에게 투여하는 단계를 포함하는 대사 장애의 치료 방법이 제공되어 있다.
본 발명은 11β-HSD1의 억제제에 관한 것이다. 바람직한 양태에서, 본 발명은 11β-HSD1의 억제제로 유용한, 화학식 I의 피라졸 뿐만 아니라 그의 약학적으로 허용가능한 염을 포함하는 약학 조성물을 제공한다:
화학식 I
본원에서 이용되는 용어는 특정한 양태를 기술하기 위한 목적이고, 제한하기 위함이 아님을 이해한다. 또한, 본원에 기재된 것과 유사한 또는 동등한 임의의 방법, 장치 및 물질이 본 발명의 실시 또는 시험에서 이용될 수 있으나, 바람직한 방법, 장치 및 방법이 여기에 기재되어 있다.
본 명세서에서 "아릴"이란 용어는, 고리가 탄소환일 수 있거나 또는 고리가 O, S 및 N으로부터 선택된 하나 이상의 원자를 함유할 수 있고 전형적으로 헤테로아릴 고리라고 지칭되는 단환 또는 다환 방향족 고리 시스템을 의미하기 위해 이용된다. 아릴 기의 예는 페닐, 피리딜, 벤즈이미다졸릴, 벤조푸란일, 벤조티아졸릴, 벤조티오페닐, 신놀린일, 푸릴, 이미다조[4,5-c]피리딘일, 이미다졸릴, 인돌릴, 이소퀸올린일, 이속사졸릴, 나프틸, [1,7]나프티리딘일, 옥사디아졸릴, 옥사졸릴, 프 탈라진일, 푸린일, 피리다진일, 피라졸릴, 피리도[2,3-d]피리미딘일, 피리미딘일, 피리미도[4,5-d]피리미딘일, 피롤로[2,3-d]피리미딘일, 피롤릴, 퀸아졸린일, 퀸올린일, 퀸옥살린일, 테트라졸릴, 티아디아졸릴, 티아졸릴, 티오페닐, 트리아졸릴 등이다.
본원에서 사용될 때, "알킬"이란 용어는 치환된 또는 비치환된, 예컨대, 분지형 또는 비분지형, 환형 또는 비환형, 포화 또는 불포화된(예: 알켄일 또는 알카인일) 하이드로카빌 라디칼을 의미한다. 환형인 경우, 알킬 기는 바람직하게는 C3 내지 C12, 더욱 바람직하게는 C5 내지 C10, 더욱 바람직하게는 C5 내지 C7이다. 비환형인 경우, 알킬 기는 바람직하게는 C1 내지 C10, 더욱 바람직하게는 C1 내지 C6, 더욱 바람직하게는 메틸, 에틸, 프로필(n-프로필 또는 이소프로필), 부틸(n-부틸, 이소부틸, 2급-부틸 또는 3급-부틸) 또는 펜틸(n-펜틸 및 이소펜틸 포함), 더욱 바람직하게는 메틸이다. 따라서, 본원에서 사용되는 "알킬"이란 용어는 알킬(분지형 또는 비분지형), 치환된 알킬(분지형 또는 비분지형), 알켄일(분지형 또는 비분지형), 치환된 알켄일(분지형 또는 비분지형), 알카인일(분지형 또는 비분지형), 치환된 알카인일(분지형 또는 비분지형), 사이클로알킬, 치환된 사이클로알킬, 사이클로알켄일, 치환된 사이클로알켄일, 사이클로알카인일 및 치환된 사이클로알카인일을 포함한다.
"헤테로사이클릴"이란 용어는 질소, 산소 및/또는 황으로부터 선택된 1개, 2개 또는 3개 원자를 포함할 수 있는 포화된 또는 부분 불포화된 5- 또는 6-원 고리 를 말한다. 헤테로사이클릴 고리의 예는 피페리딘일, 피페라진일, 아제핀일, 피롤리딘일, 피라졸리딘일, 이미다졸린일, 이미다졸리딘일, 옥사졸리딘일, 이속사졸리딘일, 모폴린일, 티아졸리딘일, 이소티아졸리딘일, 티아디아졸릴리딘일, 다이하이드로푸릴, 테트라하이드로푸릴, 다이하이드로피란일, 테트라하이드로피란일 및 티오모폴린일을 포함한다.
본원에서 사용되는 "저급 알킬"이란 용어는 예컨대, 분지형 또는 비분지형, 환형 또는 비환형, 포화 또는 불포화된(예: 알켄일 또는 알카인일) 하이드로카빌 라디칼을 의미하고, 이때 상기 환형 저급 알킬 기는 C3, C4, C5, C6, C7, C8, C9 또는 C10, 바람직하게는 C3, C4, C5, C6 또는 C7이고, 상기 비환형 저급 알킬 기는 C1, C2, C3, C4, C5, C6 또는 C7이고, 바람직하게는 C1, C2, C3, C4, 예컨대 메틸, 에틸, 프로필(n-프로필 또는 이소프로필) 또는 부틸(n-부틸, 2급-부틸, 이소부틸 또는 3급-부틸)이다. 따라서, 본원에서 사용될 때 "저급 알킬"이란 용어는 저급 알킬(분지형 또는 비분지형), 저급 알켄일(분지형 또는 비분지형), 저급 알카인일(분지형 또는 비분지형), 사이클로 저급알킬, 사이클로 저급알켄일 및 사이클로 저급알카인일을 포함함을 이해한다.
알킬 및 아릴 기는 치환되거나 치환되지 않을 수 있다. 치환되는 경우, 일반적으로 예컨대, 1 내지 3개 치환기, 바람직하게는 1개의 치환기가 존재한다. 치환기는 예컨대 알킬, 아릴, 아릴알킬과 같은 탄소-함유 기(예: 치환된 및 비치환된 페닐, 치환된 및 비치환된 벤질); 할로겐 원자, 및 할로알킬과 같은 할로겐-함유 기(예: 트리플루오로메틸); 알코올과 같은 산소-함유 기(예: 하이드록시, 하이드록시알킬, 아릴(하이드록시)알킬), 에테르(예: 알콕시, 아릴옥시, 알콕시알킬, 아릴옥시알킬), 알데하이드(예: 카르복스알데하이드), 케톤(예: 알킬카르본일, 알킬카르본일알킬, 아릴카르본일, 아릴알킬카르본일, 아릴카르본일알킬), 산(예: 카르복시, 카르복시알킬), 에스테르와 같은 산 유도체(예: 알콕시카르본일, 알콕시카르본일알킬, 알킬카르본일옥시, 알킬카르본일옥시알킬), 아마이드(예: 아미노카르본일, 모노- 또는 다이-알킬아미노카르본일, 아미노카르본일알킬, 모노- 또는 다이-알킬아미노카르본일알킬, 아릴아미노카르본일), 카밤에이트(예: 알콕시카르본일아미노, 아릴옥시카르본일아미노, 아미노카르본일옥시, 모노- 또는 다이-알킬아미노카르본일옥시, 아릴아미노카르본일옥시) 및 우레아(예: 모노- 또는 다이-알킬아미노카르본일아미노 또는 아릴아미노카르본일아미노); 아민(예: 아미노, 모노- 또는 다이-알킬아미노, 아미노알킬, 모노- 또는 다이-알킬아미노알킬), 아자이드, 니트릴(예: 시아노, 시아노알킬), 니트로와 같은 질소-함유 기; 티올, 티오에테르, 설폭사이드 및 설폰과 같은 황-함유 기(예: 알킬티오, 알킬설핀일, 알킬설폰일, 알킬티오알킬, 알킬설핀일알킬, 알킬설폰일알킬, 아릴티오, 아릴설핀일, 아릴설폰일, 아릴티오알킬, 아릴설핀일알킬, 아릴설폰일알킬); 및 하나 이상, 바람직하게는 하나의 헤테로원자를 함유하는 헤테로환형 기(예: 티엔일, 푸란일, 피롤릴, 이미다졸릴, 피라졸릴, 티아졸릴, 이소티아졸릴, 옥사졸릴, 옥사디아졸릴, 티아디아졸릴, 아지리딘일, 아제티딘일, 피롤리딘일, 피롤린일, 이미다졸리딘일, 이미다졸린일, 피라졸리딘일, 테트라하이드로푸란일, 피란일, 피론일, 피리딜, 피라진일, 피리다진일, 피페리딜, 헥사하이드로아제핀일, 피페라진일, 모폴린일, 티아나프틸, 벤조푸란일, 이소벤조푸란일, 인돌릴, 옥시인돌릴, 이소인돌릴, 인다졸릴, 인돌린일, 7-아자인돌릴, 벤조피란일, 쿠마린일, 이소쿠마린일, 퀸올린일, 이소퀸올린일, 나프트리딘일, 신놀린일, 퀸아졸린일, 피리도피리딜, 벤족사진일, 퀸옥살린일, 크로멘일, 크로만일, 이소크로만일, 프탈라진일 및 카볼린일)를 포함할 수 있다.
저급 알킬 기는 치환되거나 치환되지 않을 수 있고, 바람직하게는 치환되지 않을 수 있다. 치환되는 경우, 일반적으로 예컨대, 1 내지 3개의 치환기가 존재하고, 바람직하게는 1개의 치환기가 존재한다.
본원에서 사용될 때, "알콕시"란 용어는 예컨대, 알킬-O-를 의미하고, "알코일"은 예컨대, 알킬-CO-를 의미한다. 알콕시 치환기 또는 알콕시-함유 치환기는 예컨대, 하나 이상의 알킬 기에 의해 치환될 수 있다.
본원에서 사용될 때, "할로겐"이란 용어는 예컨대 불소, 염소, 브롬 또는 요오드 라디칼을 의미하고, 바람직하게는 불소, 염소 또는 브롬 라디칼을 의미하며, 더욱 바람직하게는 불소 또는 염소 라디칼을 의미한다.
본원에서 사용될 때 "약학적으로 허용가능한 염"이란 용어는 화학식 I의 화합물의 임의의 약학적으로 허용가능한 염을 의미한다. 염은 무기 및 유기 산 및 염기를 비롯하여 약학적으로 허용가능한 비-독성 산 및 염기로부터 제조될 수 있다. 상기 산은 예컨대, 아세트산, 벤젠설폰산, 벤조산, 캄포설폰산, 시트르산, 에텐설폰산, 다이클로로아세트산, 포름산, 푸마르산, 글루콘산, 글루탐산, 히푸르산, 브롬산, 염산, 이세티온산, 락트산, 말레산, 말산, 만델산, 메테인설폰산, 점액산, 질산, 옥살산, 파모산, 판토텐산, 인산, 숙신산, 황산, 타르타르산, 옥살산, p-톨루엔설폰산 등을 포함한다. 푸마르산, 염산, 브롬산, 인산, 숙신산, 황산 및 메테인설폰산이 특히 바람직하다. 허용가능한 염기 염은 알칼리금속(예: 나트륨, 칼륨), 알칼리토금속(예: 칼슘, 마그네슘) 및 알루미늄 염을 포함한다.
화학식 I의 화합물은 그의 약학적으로 허용가능한 에스테르를 포함한다. "약학적으로 허용가능한 에스테르"는 화학식 I의 화합물이 생체내에서 모 화합물로 다시 전환될 수 있는 유도체를 제공하도록 작용기에서 유도화될 수 있음을 의미한다. 이러한 화합물의 예는 생리학적으로 허용가능하고 대사적으로 불안정한(labile) 에스테르 유도체, 예컨대 메톡시메틸 에스테르, 메틸티오메틸 에스테르 및 피발로일옥시메틸 에스테르를 포함한다. 부가적으로, 생체내에서 화학식 I의 모 화합물을 생성시킬 수 있으며 대사적으로 불안정한 에스테르와 유사한 화학식 I의 화합물의 임의의 생리학적으로 허용가능한 등가물이 본 발명의 범주내에 있다.
보다 상세하게, 예컨대, 약학적으로 이용가능한 에스테르는 예컨대, 하이드록시 기가 에스테르화될 수 있는 화학식 I의 화합물이다. 이러한 에스테르의 예는 포름에이트, 아세테이트, 프로피온에이트, 부티레이트, 이소부티레이트, 발레레이트, 2-메틸부티레이트, 이소발레레이트 및 N,N-다이메틸아미노아세테이트이다.
화학식 I의 화합물은 하나 이상의 비대칭 탄소원자를 가질 수 있고, 광학적 순수 거울상 이성체, 예컨대 라세미체와 같은 거울상 이성체의 혼합물, 광학적 순수 부분입체 이성체, 부분입체 이성체의 혼합물, 부분입체 이성체의 라세미체, 또는 부분입체 이성체의 라세미체의 혼합물의 형태로 존재할 수 있다. 광학적 활성 형태는 예컨대, 라세미체의 분해(resolution)에 의해, 비대칭 합성 또는 비대칭 크로마토그래피(키랄 흡착제 또는 용출액에 의한 크로마토그래피)에 의해 수득될 수 있다. 본 발명은 이들 형태를 전부 포함한다.
본 발명에서 화학식 I의 화합물은 생체내에서 모 화합물로 다시 전환될 수 있는 유도체를 제공하도록 작용기에서 유도화될 수 있음을 이해한다. 생체내에서 화학식 I의 모 화합물을 생성시킬 수 있으며 생리학적으로 허용가능하고 대사적으로 불안정한 유도체가 본 발명의 범주내에 있다.
R2는 비치환된 아다만테인이고, R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)nOH, -(CH2)nO(CH2)nCH3, 또는 N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 저급 알킬, 하이드록시, 하이드록시페닐, -(CH2)n-페닐, -(CH2)nOH 또는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클인 화학식 I의 화합물이 바람직하다.
R2는 하이드록시, 할로겐, 아미노, 아세틸아미노 또는 메테인 설폰일아미노에 의해 치환된 아다만테인이고, R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할 로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)nOH, -(CH2)nO(CH2)nCH3, 또는 N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 저급 알킬, 하이드록시, 하이드록시페닐, -(CH2)n-페닐, -(CH2)nOH 또는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클인 화학식 I의 화합물이 더욱 바람직하다.
R2는 비치환된 아다만테인이고, R4는 분지형 또는 비분지형의 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C5)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH인 화학식 I의 화합물이 또한 바람직하다.
본 발명의 또 다른 바람직한 측면은 R2가 하이드록시, 할로겐, 아미노, 아세틸아미노 또는 메테인 설폰일아미노에 의해 치환된 아다만테인이고, R4는 분지형 또는 비분지형의 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C5)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH인 화학식 I에 따른 화합물이다.
본 발명의 또 다른 바람직한 측면은 R2가 트랜스-하이드록시 아다만테인인 화학식 I의 화합물이다.
R3이 트리플루오로메틸 기인 화학식 I의 화합물이 더욱 바람직하다.
또 다른 바람직한 측면은 R3이 피라졸, 트리아졸, 피페리딘, 피롤리딘, 하이드록시메틸 피페리딘, 벤질피페라진, 하이드록시피롤리딘, 3급-부틸 피롤리딘, 하이드록시에틸 피페라진, 하이드록시피페리딘 또는 티오모폴린 기인 화학식 I의 화합물이다.
R4가 사이클로프로필, 3급-부틸, -CH(CH3)2CH2OH, 메틸, -CF3 또는 -(CH2)nCF3 기이고, 이때 n이 1 또는 2인 화학식 I의 화합물이 바람직하다.
R5가 트리플루오로메틸 기인 화학식 I의 화합물이 더욱 바람직하다.
하기 화합물들로부터 선택된 화학식 I의 화합물이 또한 바람직하다:
메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;
메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드;
시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드;
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
5-클로로-1-메틸-3-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-클로로-1,3-다이메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
메틸-5-(4-메틸-피페라진-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(2-하이드록시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
메틸-5-[1,2,4]트리아졸-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
메틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(4-하이드록시-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-[(2-하이드록시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(2-하이드록시-프로필아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
메틸-5-모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(2-메톡시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-이소프로필아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(4-하이드록시메틸-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(4-벤질-피페라진-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-(R-3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-다이에틸아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
3급-부틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-[4-(2-하이드록시-에틸)-피페라진-1-일]-1-메틸-1H-피라졸-4-카르복실산 아다만탄일아마이드;
5-[(2-메톡시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아 마이드;
2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
3급-부틸-5-(3-하이드록시-피롤리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
3급-부틸-5-(4-하이드록시-피페리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
5-아제판-1-일-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
메틸-5-티오모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
3급-부틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-플루오로-아다만탄-2-일)-아마이드;
트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드;
트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드;
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;
트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일-아마이드;
트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일-아마이드;
트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산(5-하이드록시아다만탄-2-일)-아마이드;
트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-4-브로모-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드; 및
트랜스-4-클로로-2'-(2-메톡시-에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드.
하기로부터 선택되는 화학식 I의 화합물이 더욱 바람직하다:
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;
1-메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2- 일)-아마이드;
1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드; 및
1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드.
하기로 이루어진 군으로부터 선택되는 화학식 I의 화합물이 또 다른 바람직한 측면이다:
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드; 및
트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드.
치료 유효량의 화학식 I의 화합물 또는 그의 약학적으로 허용가능한 염, 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물이 더욱 바람직하다.
또한, 치료 유효량의 화학식 I의 화합물을 대사 장애의 치료가 필요한 환자에게 투여하는 단계를 포함하는 대사 장애의 치료 방법이 바람직하다.
유효량의 화학식 I의 화합물을 투여하는 단계를 포함하는 당뇨병, 비만 또는 대사 증후군의 치료 방법이 더욱 바람직하다.
치료 활성 물질로서 사용되는, 화학식 I의 화합물이 본 발명의 또 다른 바람직한 측면이다.
대사 장애 치료용 약제의 제조를 위한 화학식 I의 화합물이 또한 바람직하다.
당뇨병, 비만 또는 대사 증후군 치료용 약제의 제조를 위한 화학식 I의 화합물의 용도가 바람직하다.
본 발명에 따른 화합물의 일반적인 합성
본 발명의 화합물의 합성에 대한 하나의 일반적인 접근 방법이 반응식 1에 나타나 있다. 상기 공정에 따르면, 화학식 2의 β-케토-에스테르는 X가 다이알킬 아미노(예: 다이메틸아미노) 또는 저급-알콕시(예: 에톡시)를 나타내는 화학식 3의 화합물로 전환되고, 이어서 화학식 3의 화합물은 하이드라진과 반응하여서 화학식 4의 화합물을 제공한다. 이어서, 화학식 4의 화합물중 에스테르 보호기가 절단되고, 생성된 카르복실산은 식 HNR1R2의 아민과 커플링되어서 목적하는 화학식 1의 화합물을 제공한다. 화학식 3의 화합물을 제공하기 위한 화학식 2의 화합물의 반응은 당업계에 널리 알려진 조건을 이용하여 실시될 수 있다. 예컨대, X가 다이메틸아미노를 나타내는 경우에, 화학식 3의 화합물은 약 50℃ 내지 약 100℃의 온도에서 방향족 탄화수소(예: 톨루엔)와 같은 불활성 용매중에서 화학식 2의 화합물을 N,N-다이메틸포름아마이드 다이메틸 아세탈로 처리함으로써 제조될 수 있다. 상기 반응의 조건의 예는 예컨대, 문헌[에이치. 에이치. 바서만(H. H. Wassermann) 등, Tetrahedron Lett. 1984, 25, 3743-3746; 에스. 겔린(S. Gelin) 등, 합성(Synthesis) 1983, 566-568; 및 제이. 스티브(J. Steve) 등, 합성, 1990, 70-72]에서 찾을 수 있다. X가 에톡시를 나타내는 경우에, 화학식 3의 화합물은 환류 온도에서 아세트산 무수물의 존재하에 트리에틸오르토포름에이트에 의해 화학식 2의 화합물을 처리함으로써 제조될 수 있다. 상기 반응의 조건의 예는 예컨대 문헌[엘. 클라이젠(L. Claisen) Liebigs Ann. Chem. 1897, 297, 1-18; 엘. 크롬비(L. Crombie) 등, J. Chem. Soc. Perkin Trans. I 1979, 464-471; 엠. 에스. 에스. 팔란키(M. S. S. Palanki) 등, J. Med. Chem. 2000, 43, 3995-4004; 및 엠. 티. 헤레로(M. T. Herrero) 등, Tetrahedron 2002, 58, 8581-8589]에서 찾을 수 있다.
중간물질 4의 합성에 대한 또 다른 접근 방법이 또한 반응식 1에 나타나 있다. X가 다이메틸아미노인 보고된 바와 같은(PCT 국제출원 2003/051820호) 상기 방법에서, 시판되는 3-다이메틸아미노-아크릴산 에틸 에스테르(화학식 2b)가 톨루엔중에서 트리플루오로아세트산 무수물에 의해 처리되어서, 그 결과 화학식 2c로 표시되는 중간물질을 발생시킨다. 알킬 하이드라진에 의해 화학식 2c의 중간물질을 처리하여 화학식 4의 화합물을 발생시킨다.
화학식 3의 화합물과 하이드라진의 반응은 각종 조건하에서 실시될 수 있다. 예컨대, 화학식 3의 화합물은 알코올(예: 에탄올)과 같은 불활성 용매중에서 하이드라진 또는 하이드라진의 산 부가염과 반응할 수 있다. 하이드라진의 산 부가염이 사용되는 경우에, 상기 반응은 3급 알킬아민(예: 트리에틸아민 또는 다이이소프로필에틸아민)과 같은 염기의 부가적인 존재하에 실시된다. 상기 반응은 편리하게는 약 -20℃ 내지 약 80℃의 온도에서 실시된다. 상기 반응을 위한 조건의 예는 예컨대, 문헌[제이. 알. 벡(J. R. Beck) 등, J. Heterocycl. Chem. 1987, 24, 739-740; 지. 메노지(G. Menozzi) 등, J. Heterocycl. Chem. 1987, 24, 1669-1676; 에프. 알. 부시(F. R. Busch) 등, PCT 국제출원 WO 2003/051845호; 제이. 에프. 램버르트(J. F. Lambert) 등, PCT 국제출원 WO 2002/044133호; 에이치. 시모토리(H. Shimotori) 등, US 4,792,565호; 및 에이치. 오키(H. Ohki) 등, Bioorg. Med. Chem. Lett. 2002, 12, 3191-3193]에서 찾을 수 있다.
화학식 4의 화합물의 상응하는 카르복실산으로의 절단은 유기 합성 분야에 널리 알려진 반응 조건을 이용하여 실시되며, 이중 다수는 문헌[유기 합성에서의 보호기(Protective Groups in Organic Synthesis), 티. 더블유. 그리느(T. W. Greene) 및 피. 지. 엠. 우츠(P. G. M. Wuts), 제2판, 존 윌리 앤드 손즈(John Wiley & Sons), 뉴욕, 1991]에 개략되어 있다. 예컨대, R4가 메틸 또는 에틸을 나타내는 경우, 상기 반응은 테트라하이드로푸란, 메탄올 및 물의 혼합물과 같은 적합한 용매중에서 수산화 칼륨, 수산화 나트륨 또는 수산화 리튬, 바람직하게는 수산화 리튬과 같은 알칼리 금속 수산화물 1당량에 의해 상기 화합물을 처리함으로써 편리하게 이루어질 수 있다. 상기 반응은 약 0℃ 내지 약 실온, 바람직하게는 약 실온에서 실시될 수 있다. 다른 예로, R4가 3급 부틸 기와 같이 산성 조건하에서 절단될 수 있는 기를 나타내는 경우, 상기 에스테르는 강한 무기산, 예컨대 염산 또는 브롬산과 같은 할로겐화 수소산, 또는 강한 유기산, 예컨대 트리플루오로아세트산 등과 같은 할로겐화 알케인 카르복실산으로 처리될 수 있다. 상기 반응은 불활성 유기 용매(예: 다이클로로메테인)의 존재하에 약 0℃ 내지 약 실온, 바람직하게는 약 실온의 온도에서 편리하게 실시된다. 최종(그러나, 비제한적인) 예로, R4가 촉매적 수소화에 의해 절단될 수 있는 기를 나타내고 분자의 나머지가 상기 조건에 안정한 추가의 조건을 갖는 경우에, 상기 반응은 대략 실온에서 대기압하에 불활성 용매(예: 에탄올과 같은 알코올)의 존재하에 탄소상 팔라듐과 같은 귀금속 촉매의 존재하에 수소화에 의해 실시될 수 있다.
반응식 1에 따라 R4가 수소를 나타내는 화학식 4의 카르복실산과 식 HNR1R2의 아민의 커플링은 당업계의 숙련자들에게 널리 알려진 방법을 이용하여 이루어질 수 있다. 예컨대, 변환(transformation)은 필요시에 다수의 예가 펩타이드 화학에서 그 자체로 널리 알려져 있는 커플링제의 존재하에 R4가 수소를 나타내는 화학식 4의 카르복실산 또는 활성화 에스테르와 같은 그의 적절한 유도체와 식 HNR1R2의 아민 또는 상응하는 산 부가 염(예: 염산 염)의 반응에 의해 실시될 수 있다. 상기 반응은 약 0℃ 내지 약 실온의 온도, 바람직하게는 약 실온의 온도에서 염소화 탄화수소(예: 다이클로로메테인) 또는 N,N-다이메틸포름아마이드 또는 N-메틸피롤리딘온과 같은 불활성 용매중에서 다이이소프로필에틸아민과 같은 적절한 염기, O-(벤조트리아졸-1-일)-1,1,3,3-테트라메틸우로늄 헥사플루오로포스페이트 또는 TSTU와 같은 커플링제의 존재하에, 또한 1-하이드록시벤조트리아졸 또는 1-하이드록시-7-아자벤조트리아졸과 같이 반응 속도를 증가시키는 물질의 선택적인 부가적인 존재하에서 R4가 수소를 나타내는 화학식 4의 카르복실산을 식 HNR1R2의 아민의 염산염으로 처리함으로써 편의적으로 실시된다. 택일적으로, 상기 반응은 R4가 수소를 나타내는 화학식 4의 카르복실산을 활성화 에스테르 유도체, 예컨대 N-하이드록시 숙신이마이드 에스테르로 전환시키고, 후속적으로 이를 식 HNR1R2의 아민 또는 그의 상응하는 산 부가 염과 반응시켜서 실시될 수 있다. 상기 반응 순서는 약 0℃ 내지 대략 실온의 온도에서 테트라하이드로푸란과 같은 불활성 용매중에서 N,N'-다이사이클로헥실카보디이마이드와 같은 커플링제의 존재하에 R4가 수소를 나타내는 화학식 4의 카르복실산과 N-하이드록시숙신이마이드를 반응시켜서 실시될 수 있다. 이어서, 생성된 N-하이드록시숙신이마이드 에스테르는 대략 실온에서 N,N-다이메틸포름아마이드와 같은 적합한 불활성 용매중에서 유기 염기(예: 트리에틸아민 또는 다이이소프로필에틸아민 등)와 같은 염기의 존재하에 식 HNR1R2의 아민 또는 상응하는 산 부가 염으로 처리된다.
반응식 1에 도시된 반응 순서는 X가 중합체-결합된 아미노 기를 나타내는 경우에 고상(solid-phase) 합성을 이용하여 실시될 수도 있다. 이러한 접근 방법을 따르면, 화학식 2의 화합물은 대략 80℃의 온도에서 N,N-다이메틸포름아마이드와 같은 불활성 용매중에서 캄포-설폰산과 같은 산 촉매의 존재하에 아닐린-작용기를 갖는 셀룰로즈 유도체와 같은 중합체-결합된 아민(예컨대, 4-아미노-페닐-설폰일-에톡시-셀룰로즈, 이온토소브, 우스티 앤드 라벰(Iontosorb, Usti and Labem)에서 구입가능, 체코) 및 N-포르밀이미다졸 다이메틸 아세탈로 처리되어서, X가 중합체-결합된 아닐린을 나타내는 화학식 3의 화합물을 제공한다. 이어서, 화학식 3의 화합물은 용매의 비점 부근의 온도에서 알코올(예: 이소프로판올)과 같은 불활성 용매중에서 하이드라진으로 처리함으로써 화학식 4의 화합물로 전환된다. 상기 반응을 위한 조건의 예는 예컨대, 문헌[엘. 드 루카(L. De Luca) 등, J. Comb. Chem. 2003, 5, 465-471]에서 찾을 수 있다.
R5가 수소인 화학식 1의 피라졸-4-카르복스아마이드는 반응식 2에 따라 제조될 수 있으며, 이때 화학식 6의 β-케토-아마이드는 X가 다이알킬아미노(예: 다이메틸아미노) 또는 저급-알콕시(예: 에톡시)를 나타내는 화학식 7의 화합물로 전환되고, 이어서 화학식 7의 화합물은 하이드라진과 반응하여서 화학식 1의 화합물을 제공한다. 화학식 7의 화합물을 제공하기 위한 화학식 6의 화합물의 반응은 당업계에 널리 알려진 조건을 이용하여 실시될 수 있다. 예컨대, X가 다이메틸아미노를 나타내는 경우, 화학식 7의 화합물은 약 50℃ 내지 약 100℃의 온도에서 방향족 탄화수소(예: 톨루엔)와 같은 불활성 용매중에서 N,N-다이메틸포름아마이드 다이메틸 아세탈에 의해 화학식 6의 화합물을 처리함으로써 제조될 수 있다. 상기 반응을 위한 조건의 예는 예컨대, 문헌[알. 주펫(R. Zupet) 등, J. Heterocycl. Chem. 1991, 28, 1731-1740; 디. 이. 세이츠(D. E. Seitz) 등, Tetrahedron Lett. 1995, 36, 1413-1416; 에이. 브이. 라마 라오(A. V. Rama Rao) 등, Tetrahedron Lett. 1990, 31, 1439-42; 피. 코시엔스키(P. Kocienski) 등, Tetrahedron Lett. 1988, 29, 4481-4]에서 찾을 수 있다. X가 에톡시를 나타내는 경우, 화학식 7의 화합물은 환류 온도에서 아세트산 무수물의 존재하에 트리에틸오르토포름에이트에 의해 화학식 6의 화합물을 처리함으로써 제조될 수 있다. 상기 반응을 위한 조건의 예는 예컨대, 문헌[제이. 에이치. 드워(J. H. Dewar) 등, J. Chem. Soc. 1961, 3254-3260]에서 찾을 수 있다.
화학식 7의 화합물과 하이드라진의 반응은 다양한 조건하에서 실시될 수 있다. 예컨대, 화학식 7의 화합물은 알코올(예컨대, 에탄올)과 같은 불활성 용매중에서 하이드라진 또는 하이드라진의 산 부가염과 반응할 수 있다. 하이드라진의 산 부가염이 이용되는 경우, 반응은 3급 알킬아민(예: 트리에틸아민 또는 다이이소프로필에틸아민)과 같은 염기의 부가적인 존재하에 실시된다. 상기 반응은 약 -20℃ 내지 약 80℃의 온도에서 편의상 실시된다. 상기 반응을 위한 조건의 예는 예컨대, 문헌[에이. 엑스. 왕(A. X. Wang) 등, Bioorg. Med. Chem. Lett. 1998, 8, 2787-2792; 티. 에이. 엘마티(T. A. Elmaati) 등, Pol. J. Chem. 2002, 76, 945-952 Chemical Abstracts AN 2002: 501464; 및 지. 지아코멜리(G. Giacomelli) 등, Eur. J. Org. Chem. 2003, 537-541]에서 찾을 수 있다.
반응식 2에 도시된 반응 순서는 또한 X가 아닐린을 나타내는 경우에 실시될 수 있다. 따라서, 화학식 7의 화합물은 약 125℃ 내지 약 140℃의 승온에서 케로센과 같은 불활성 용매의 선택적인 존재하에 N-(알콕시메틸렌)-아닐린에 의해 처리함으로써 화학식 6의 화합물로부터 제조될 수 있다. 상기 반응을 위한 조건의 예는 예컨대 문헌[에프. 비. 데인즈(F. B. Dains) Chem. Ber. 1902, 35, 2496-2500; 에프. 비. 데인즈 등, J. Am. Chem. Soc. 1909, 31, 1148-1157; 에프. 비. 데인즈 등, J. Am. Chem. Soc. 1918, 40, 562-569; 및 오. 에스. 울프바이스(O. S. Wolfbeis) Chem. Ber. 1981, 114, 3471-3484]에서 찾을 수 있다. 이어서, 화학식 7의 화합물은 용매의 환류 온도 부근의 온도에서 에탄올과 같은 불활성 용매중에서 하이드라진에 의해 처리함으로써 화학식 1의 화합물로 전환될 수 있다. 상기 반응을 위한 조건의 예는 에컨대, 문헌[에프. 비. 데인즈 등, J. Am. Chem. Soc. 1909, 31, 1148-1157; 에프. 비. 데인즈 등, J. Am. Chem. Soc. 1916, 38, 1515; 에프. 비. 데인즈 등, J. Am. Chem. Soc. 1918, 40, 562-569; 및 에이. 엔. 보리세비츠(A. N. Borisevich) 등, Ukrainskii Khimicheskii Zhurnal 1986, 52, 641-7 Chemical Abstracts AN 1987:458919]에서 찾을 수 있다.
R5가 트리플루오로메틸과 같은 저급 할로알킬을 비롯한 저급 알킬을 나타내는 본 발명의 화합물이 반응식 3에 나타낸 화학 작용에 따라 제조될 수 있다. 이 방법에 따라, EP 1067121A2호에서 R5가 트리플루오로메틸을 나타내는 경우에 대해 기재된 바와 같이, 에틸 시아노아세테이트와 같은 알킬 시아노아세테이트가 에탄올중 소듐 에톡사이드와 같은 염기의 존재하에 에틸 트리플루오로아세테이트와 같은 에스테르에 의해 처리된다. 이어서, 생성된 나트륨 염 부가물(10)이 메틸하이드라진과 같은 알킬 하이드라진에 의해 처리되어서 5-아미노-1-알킬피라졸(11)로 환형 화된다. 이어서, 5-아미노 기는 할로겐과 같은 다른 기로 변환될 수 있다(하기 참고).
반응식 4에 도시된 바와 같이, 화학식 14의 1-알킬-5-피롤릴-피라졸-4-카르복실산 유도체는 화학식 12의 3-알콕시-2-시아노-아크릴산 에스테르로부터 출발하여 식 RNHNH2의 하이드라진과의 반응에 의해 화학식 13의 5-아미노-피라졸 중간물질을 제공하고, 이어서 2,5-다이메톡시-테트라하이드로푸란과 반응하여 화학식 14의 5-피롤릴-피라졸을 제공할 수 있다. 이는 반응식 1과 관련하여 상기에서 검토된 반응과 유사한 반응에 의해 본 발명의 카르복스아마이드로 전환될 수 있다. 피라졸을 형성하는 환형화 반응은 환류 온도에서 에탄올과 같은 불활성 용매중에서 식 RNHNH2의 하이드라진에 의해 화학식 12의 3-알콕시-2-시아노-아크릴산 에스테르(예: 3-에톡시-2-시아노-아크릴산 에틸 에스테르)를 처리함으로써 편리하게 실시될 수 있다. 피롤 고리를 형성하는 후속적인 환형화는 약 100℃의 온도에서 아세트산과 같은 유기 산중에서 2,5-다이메톡시-테트라하이드로푸란과 함께 5-아미노-피라졸 중간물질을 가열함으로써 편의상 실시된다. 상기 공정에 적합한 조건의 예는 예컨대, 문헌[엠. 코프(M. Kopp) 등, J. Heterocycl. Chem. 2001, 38, 1045-1050]에서 찾을 수 있다. 5-아미노-1-아릴-피라졸-4-카르복실레이트 에스테르의 제조를 위한 절차의 추가적인 예는 문헌[제이. 스베트릭(J. Svetlik) Heterocycles 1984, 22, 2513-2516; 제이. 알. 벡크(J. R. Beck) 등, J. Heterocycl. Chem. 1987, 24, 267-270; 및 티. 뤼버스(T. Luebbers) 등, Bioorg. Med. Chem. Lett. 2000, 10, 821-826]에서 찾을 수 있다. 이어서, 화학식 14의 카르복실레이트 에스테르는 상응하는 카르복실산으로 가수분해될 수 있고, 화학식 4의 카르복실레이트 에스테르를 화학식 1의 본 발명의 화합물로 전환시키기 위해 전술된 절차와 유사한 절차를 이용하여 식 HNR1R2의 아민과 커플링될 수 있다.
반응식 5에 도시된 바와 같이, 화학식 18의 1-알킬-5-아릴-피라졸-4-카르복실산 유도체는 화학식 15의 5-아미노-피라졸-4-카르복실레이트 에스테르로부터 출발하여 브롬화 구리(II)와 같은 할로겐화제의 존재하에 아미노 기를 다이아조화 반응시킴으로써 제조될 수 있다. 상기 반응은 브롬, 브롬화 구리(II), 다이브로모메테인 또는 브로모포름과 같은 브롬 공급원의 존재하에 약 50℃의 온도에서 할로겐화 탄화수소(예: 사염화탄소)와 같은 불활성 용매중에서 아질산 3급-부틸 또는 아질산 이소아밀과 같은 아질산 알킬에 의해 화학식 15의 화합물을 처리함으로써 편 리하게 실시된다. 택일적으로, C-5 위치의 염소화는 브롬 공급원을 염화 구리(II)와 같은 염소 공급원으로 치환시킴으로써 이루어질 수 있다. 상기 반응에 적절한 조건은 예컨대, 문헌[제이. 알. 벡크 및 엠. 피. 린츠(M. P. Lynch) 미국특허 제4,620,865호; 및 에이치. 미즈가와(H. Mizukawa) 일본특허 제2002003410호]에서 찾을 수 있다. 화학식 16의 에스테르의 화학식 17의 아마이드로의 전환은 상기 검토된 바와 같이 화학식 4의 화합물을 화학식 1의 화합물로 전환시키는 것과 유사하고, 유사한 반응을 이용하여 실시될 수 있다. 화학식 17의 화합물의 화학식 18의 본 발명의 화합물로의 전환은 아릴-보론산 또는 그의 에스테르와 같은 유기붕소 중간물질과의 스즈키(Suzuki) 반응을 이용하여 실시될 수 있으며, 상기 반응은 당업계의 평균 숙련자들에게 널리 알려져 있다. 예컨대, 상기 반응은 약 실온 내지 약 100℃의 온도, 바람직하게는 약 실온 내지 약 50℃의 온도에서 촉매량의 포스핀 리간드, 예컨대 트리-o-톨릴포스핀 또는 트리-3급-부틸포스핀의 선택적인 부가적인 존재하에, 또는 택일적으로는 비스(트리-사이클로헥실-포스핀)팔라듐과 같은 포스핀 리간드와 팔라듐(0)의 예비 형성된 착물의 존재하에, 또한 무기 염기, 예컨대 알칼리 금속 카본에이트, 바이카본에이트, 하이드록사이드 또는 포스페이트(예: 인산 칼륨, 탄산 나트륨 또는 수산화 나트륨)의 존재하에, 촉매량의 팔라듐(O) 착물(예: 테트라키스(트리페닐포스핀) 팔라듐(0)) 또는 동일 반응계에서 환원되어 팔라듐(0)을 제공할 수 있는 화합물(예컨대, 팔라듐(II) 아세테이트 또는 비스(트리페닐포스핀)-팔라듐(II) 클로라이드)의 존재하에 극성 비양성자성 용매(예: N,N-다이메틸포름아마이드) 또는 에테르(예: 다이옥세인) 또는 물과 같은 편리한 불활성 용 매중에서 아릴-보론산과 화학식 17의 화합물을 반응시킴으로써 편리하게 실시될 수 있다. 상기 반응에 적절한 조건은 예컨대, 문헌[엑스. 제이. 왕(X. J. Wang) 및 케이. 그로징거(K. Grozinger) Tetrahedron Lett. 2000, 41, 4713-4716]에서 찾을 수 있다. 화학식 15의 출발 물질은 화학식 13의 화합물의 제조에 대해 전술된 반응과 유사한 반응에 의해, 화학식 12의 3-알콕시-2-시아노-아크릴산 에스테르로부터 알킬-하이드라진과의 반응에 의해 제조될 수 있다. 상기 반응에 적절한 조건은 예컨대 문헌[에프. 본다발리(F. Bondavalli) 등, J. Med. Chem. 2002, 45, 4875-4887; 에스. 셰논(S. Schenone) 등, Bioorg. Med. Chem. Lett. 2001, 11, 2529-2531; 엠. 코프 등, J. Heterocycl. Chem. 2001, 38, 1045-1050; 및 피. 세네시(P. Seneci) 등, Synth. Commun. 1999, 29, 311-341]에서 찾을 수 있다.
반응식 6에 도시된 바와 같이, 극초단파 가열 조건하에서 화학식 21의 5-브로모-피라졸을 아민으로 치환시켜서 화학식 22의 화합물을 생성시킬 수 있다.
반응식 7에 도시된 바와 같이, R1이 저급 알킬을 나타내는 화학식 24의 화합물은 실온에서 불활성 용매(예: 다이메틸 포름아마이드)중에서 강염기(예: 수소화나트륨)와의 반응에 의해 화학식 23의 화합물로부터 제조되어서 상응하는 음이온을 제공할 수 있다. 이어서, 이는 단리없이 다시 실온에서 식 R1X의 저급-알킬 할로겐화물과 반응하여서 R1이 저급 알킬을 나타내는 화학식 24의 목적하는 화합물을 제공할 수 있다.
화학식 2의 많은 β-케토-에스테르의 제조에 적합한 방법이 각종 합성 방법을 이용하며 문헌에 알려져 있다. 이들 방법중 다수의 목록은 문헌[총괄적인 유기 변환: 작용기 제조 지침서(Comprehensive Organic Transformations: A Guide to Functional Group Preparations"), 알. 씨. 라록(R. C. Larock), VCH 퍼블리셔즈 인크(VCH Publishers, Inc.), 뉴욕, 1989, 685, 694-695 및 768쪽]에서 찾을 수 있다. 화학식 2의 많은 β-케토-에스테르의 제조에 적합한 합성 방법의 추가적인 예를 문헌[응용 유기 화학(Advanced Organic Chemistry), J. March, 제3판, 존 윌리 앤드 손즈, 인크, 뉴욕, 1985, 437-439쪽 및 823-824쪽]에서 찾을 수 있다. 또한, 100개보다 많은 화학식 2의 β-케토-에스테르가 유기 합성 업계에서 숙련자들에게 널리 알려진 문헌[입수가능한 화학물질 자료집(the Available Chemicals Directory)]에 시판되는 것으로 열거되고 있다.
화학식 2의 β-케토-에스테르를 제조하는 방법의 한 예가 반응식 8에 개략되어 있다. 멜드럼(Meldrum) 산(25)이 할로겐화 탄화수소(예: 메틸렌 클로라이드 또는 다이클로로에테인)와 같은 무수 불활성 용매중에서 식 R3COCl의 염화 아실에 의해 처리된다. 상기 반응은 대략 실온에서 피리딘, 트리에틸아민 또는 다이이소프로필에틸아민과 같은 무수 유기 염기의 존재하에 실시된다.
상기 반응에 적합한 조건을 예컨대, 문헌[에이치. 엠테내스(H. Emtenas) 등, J. Org. Chem. 2001, 26, 6756-6761]에서 찾을 수 있다. 이어서, 생성된 화학식 26의 중간물질을 용매로 알코올(예컨대, 하기 알코올이 메탄올 또는 에탄올인 경우) 또는 벤젠과 같은 불활성 용매(예컨대, 하기 알코올이 벤질 알코올 또는 3급-부틸 알코올인 경우)를 이용하여 식 HOR4의 알코올과 함께 가열한다. 상기 반응은 편리하게는 약 60℃ 내지 약 80℃의 온도에서 실시된다. 상기 반응에 적합한 조건은 예컨대, 문헌[와이. 오이카와(Y. Oikawa) 등, J. Org. Chem. 1978, 43, 2087-2088]에서 찾을 수 있다.
화학식 27의 β-케토-아마이드는 환류 온도에서 톨루엔과 같은 적합한 불활성 용매중에서 화학량론적 양의 식 HNR1R2의 아민으로 처리하여서 화학식 26의 중간물질로부터 제조될 수 있다. 상기 반응에 적합한 조건은 예컨대, 문헌[씨. 에스. 팍(C. S. Pak) 등, Synthesis 1992, 1213-1214]에서 찾을 수 있다.
화학식 5의 일치환된 하이드라진의 공급원
화학식 5의 많은 일치환된 하이드라진은 구입되거나, 또는 하기에 개략된 바와 같이 유기 화학 분야에 널리 알려진 각종 합성 절차중 하나를 이용하여 제조될 수 있다.
100개 이상의 하이드라진이 알드리츠 케미칼, 인크(Aldrich Chemical, Inc.: 위스콘신주 밀워키 소재); 티씨아이 아메리카(TCI America: 오레곤주 포틀랜드); 랑카스터 신테시트 리미티드(Lancaster Synthesis Ltd: 영국 랑카셔어), 에이에스디아이 인크(ASDI Inc.: 델라웨어주 뉴웍); 라이언 사이언티픽(Ryan Scientific: 사우쓰 캐롤라이나주 팜즈 아일); 오크우드 프러덕츠, 인크(Oakwood Products, Inc.: 사우쓰 캐놀라이나주 웨스트 콜럼비아); 알파 아이사(Alfa Aesar: 매사츄세츠주 워드 힐)와 같은 공급업체로부터 시중에서 구입가능하며, 이중 일부는 화학식 5의 본 발명에 유용할 수 있다. 많은 다른 예는 문헌[입수가능한 화학물질 자료 집, 엠디엘 인포메이션 시스템즈(MDL Information Systems), 캘리포니아주 샌 린드로 소재; SciFinder, 케미칼 앱스트랙츠 써비스이즈(Chemical Abstracts Services), 오하이오주 콜럼버스 소재]을 참고함으로써 찾을 수 있다.
하이드라진을 제조하기 위한 각종 방법이 알려져 있으며, 문헌[하이드라조, 아조 및 아족시 기의 화학성질. 1부(The Chemistry of the Hydrazo, Azo and Azoxy Groups. Part 1), 제이. 팀버레이크(J. Timberlake) 및 제이. 스토웰(J. Stowell); 에스. 파타이 편집; 존 윌리 앤드 손즈, 리미티드. 런던 1975, 69-107]에 검토되어 있다. 또한, 치환된 하이드라진의 제조를 위한 여러 방법이 문헌[유. 라그나르슨(U. Ragnarsson) Che. Soc. Rev. 2001, 30, 205-213]에 개략되어 있다.
하기에 상세히 개략된 절차 이외에, 알킬-하이드라진을 제조하기 위해 하기의 공정이 이용되어 왔다: 알데하이드 또는 케톤과 하이드라자이드의 반응, 이어서 환원 및 가수분해[CH 307629, Chem. Abs. 51:25623; 엔. 아이. 갈리(N.I.Ghali) 등, 유기화학저널. 1981, 46, 5413-5414]; 요소의 호프만 반응[제이. 비렛(J. Viret) 등, Tetrahedron 1987, 43, 891-894]; 알킬-아민의 친전자성 아민화[엘. 에프. 오드리트(L. F. Audrieth) 및 엘. 에이치. 다이아몬드(L. H. Diamond), J. Am. Chem. Soc. 1954, 76, 4869-4871; 에이. 코지아라(A. Koziara) 등, Synth. Commun. 1995, 25, 3805, 3812]; 알코올과 N-3급-부톡시카르본일아미노프탈이마이드의 미츠노부 반응, 이어서 가수분해[엔. 브로스(N. Brosse) 등, Tetrahedron Lett. 2000, 41, 205-207]; 알킬-아민의 상응하는 N-알킬시드논으로의 전환, 이어서 가수분해[제이. 퍼거(J. Fugger) 등, J. Am. Chem. Soc. 1955, 77, 1843-1848]; 브롬화 알 킬과 N'-이소프로필리덴-포스포로하이드라지드산 다이에틸 에스테르 또는 다이페닐포스핀 하이드라자이드의 반응, 이어서 탈보호[에스. 자와드즈키(S. Zawadzki) 등, Synthesis 1987, 485-487; 비. 믈로트코우스카(B. Mlotkowska) 및 지. 즈와이어작(Z. Zwierzak) Tetrahedron Lett. 1978, 19, 4731-4734].
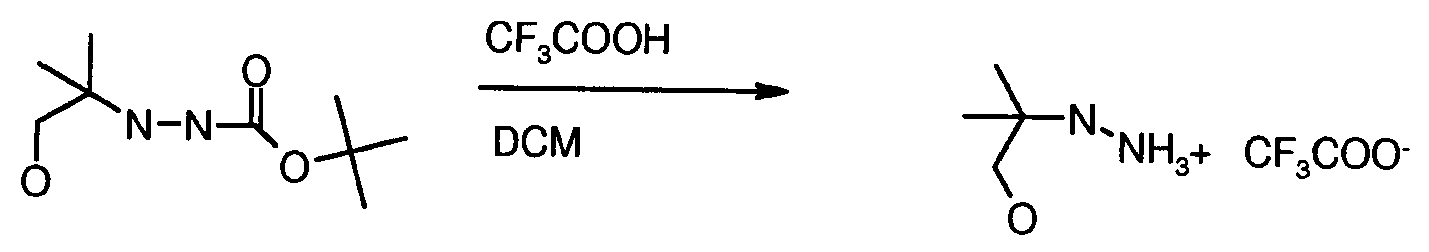
화학식 5의 일치환된 하이드라진은 반응식 10에 도시된 바와 같이 적합한 이탈기를 갖는 화합물의 친핵성 치환에 의해 제조될 수 있다. 적합한 이탈기는 본 발명의 화합물을 제조하는데 이용되는 반응 조건과 양립할 수 있는 것이다. 이러한 기의 예는 p-톨루엔설폰에이트(OTos), 또는 브롬화물, 염화물 및 불화물, 바람직하게는 브롬화물 및 염화물을 비롯한 할로겐 기이다. 예컨대, 화학식 5의 화합물은 대략 실온 또는 이용되는 용매의 환류 온도에서 메탄올, 에탄올 또는 1-부탄올과 같은 알코올계 용매중에서 화학식 28의 할로겐화 화합물을 하이드라진 수화물로 처리함으로써 화학식 28의 화합물로부터 제조될 수 있다.
화학식 5의 알킬하이드라진은 반응식 11에 도시된 바와 같이 화학식 29의 상 응하는 아민으로부터 제조될 수 있다. 반응은 수산화칼륨과 같은 무기 염기 및 물의 존재하에 얼음물중에서 화학식 29의 아민을 하이드록실아민-O-설폰산으로 처리함으로써 실시될 수 있다. 합성은 대략 환류 온도에서 이루어진다. 하이드록실아민-O-설폰산은 시판된다.
택일적으로, 화학식 5의 화합물은 수산화칼륨의 존재하에 화학식 29의 아민에 클로르아민을 천천히 첨가함으로써 제조될 수 있다. 생성된 혼합물을 수시간동안 정치되도록 하고, 필요시에는 여과하여서 침전된 아민 하이드로클로라이드 및/또는 염화 암모늄으로부터 반응 혼합물을 유리시킨다. 화학식 5의 알킬하이드라진은 증류에 의해 정제된다. 클로르아민은 염소와 암모니아의 반응에 의해 제조될 수 있다.
일부 화학식 5의 알킬하이드라진은 화학식 30의 케톤 또는 알데하이드로부터 화학식 32의 3급-부틸 알킬리딘카바제이트의 형성에 의해 반응식 12에 따라 수득될 수 있고, 이는 추가로 환원될 수 있고, 가수분해되어서 화학식 5의 화합물의 염산염을 제공할 수 있다. 제 1 반응은 단기간동안 환류 온도에서 헥세인과 같은 불활 성 용매중에서 화학식 30의 카르본일 화합물을 화학식 31의 3급-부틸 카바제이트로 처리함으로써 실시될 수 있다. 이어서, 생성된 중간물질(32)은 대략 실온에서 무수 조건하에 테트라하이드로푸란중 다이보레인에 의해 환원되어서 화학식 33의 카바제이트 중간물질을 제공할 수 있다. 화학식 33의 카바제이트의 가수분해는 약 100℃에서 염산과 같은 희석된 산에 의해 이루어져서 화학식 5의 알킬하이드라진의 염산염을 제공할 수 있다. 알킬하이드라진을 제조하기 위한 본 공정의 이용의 예는 문헌[엔. 아이. 갈리 등, 유기화학저널. 1981, 46, 5413]에서 찾을 수 있다.
시중에서 구입할 수 없는 많은 알킬 하이드라진 유도체를 위해, 반응식 13이 이들을 합성시키는 일반적인 절차를 나타낸다. 3급-부틸 이소프로필리덴 카바제이트는 테트라-부틸암모늄 바이설페이트와 같은 상 전이 촉매의 존재하에 80℃에서 톨루엔중에서 수산화칼륨 및 할로겐화 알킬에 의한 처리와 같이 염기성 알킬화 조건하에서 처리된다. 알킬화 이후에, 이소프로필리덴 및 Boc 보호기는 산 가수분해에 의해 제거되고, 목적하는 하이드라진을 염산염으로 제공한다. 3급-부틸 이소프로필리덴 카바제이트의 제조 및 그의 알킬화가 문헌[Synlett 2004, 2355-2356]에 보고되어 있다.
택일적으로, 화학식 5의 알킬하이드라진은 반응식 14에 따라 화학식 30의 케톤 또는 알데하이드로부터 화학식 36의 하이드라존 중간물질의 형성, 이어서 화학식 5의 화합물을 제공하기 위한 환원 반응에 의해 제조될 수 있다. 용매의 환류 온도에서 메탄올, 에탄올, 이소프로판올 또는 다이옥세인과 같은 용매중에서 알데하이드 또는 케톤(화학식 30)과 과량의 하이드라진 수화물을 반응시켜서 화학식 36의 화합물을 제조할 수 있다.
화학식 36의 하이드라존 중간물질의 수소화는 60psi의 압력하에서 대략 실온에서 아세트산의 존재하에 알코올계 용매(예: 메탄올, 에탄올)중에서 촉매로서 담체(예: 활성탄)상 팔라듐 또는 수산화팔라듐을 이용함으로써 실시될 수 있다.
합성을 위한 부가적인 방법은 화학식 37의 Boc-보호된 아민으로부터 시작되고, 이는 아세토니트릴과 같은 비양성자성 용매중에서 피리딘의 존재하에 NOBF4로 처리되어서 화학식 38의 N-니트로소-N-Boc-알킬 아민을 제공한다. 메탄올과 같은 용매중에서 -78℃와 같은 저온에서 화학식 38의 N-니트로소-N-Boc-알킬 아민을 진한 HCl 및 활성화 아연 분말로 처리할 때, 화학식 5의 알킬 하이드라진이 생성된다(반응식 15). 이 방법은 과학 문헌[알. 쿠앙(R. Kuang) 등, Tetrahedron Lett. 2000, 41, 9575-9579]에 보고되었다.
식 HNR1R2의 많은 아민이 시판되고 있으며, 당업계의 숙련자들에게 알려져 있다. 또한, 식 HNR1R2의 아민을 합성하기 위한 당업계의 숙련자들에게 알려진 각종 방법이 있다. 이러한 방법중 다수는 문헌[아미노 기의 화학성질(The Chemistry of the Amino Group), 엠. 에스. 깁슨(M. S. Gibson), 에스. 파타이 편집, 존 윌리 앤드 손즈, 리미티드, 런던, 1968, 37-77; 응용 유기 화학, 제이. 마아치, 제3판, 존 윌리 앤드 손즈, 인크. 뉴욕, 1985, 1153-1154쪽; 및 총괄적인 유기 변환: 작용기 제조 지침서, 알. 씨. 라록, VCH 퍼블리셔즈 인크, 뉴욕, 1989, 1061-1063쪽]에 열거되어 있다. 식 HNR1R2의 아민의 제조의 한 예로, 아밀 알코올과 같은 알코올중에서 (1R)-(+)-캄포로부터 유도된 옥심의 용액이 약 4시간과 같은 장기간에 걸쳐 소량씩 첨가되는 나트륨에 의해 처리된다. 반응은 용매의 환류 온도에서 실시되고, 생성물은 R1이 수소를 나타내고 R2가 보르닐 잔기를 나타내는 식 HR1R2의 화합물인 (-)-엔도-보르닐아민 하이드로클로라이드이다. 상기 반응을 실시하기에 완벽한 조건은 예컨대, 문헌[엘. 에이. 파퀘트(L. A. Paquette) 및 알. 에프. 도너, 주니어(R. F. Doehner, Jr.), 유기화학저널, 1980, 45, 5105-5113]에서 찾을 수 있다. 1-하이드록시아다만탄-4-온은 수성 수산화나트륨의 존재하에 환류 에탄올중에서 하 이드록실아민 염산염과 반응하여서 1-하이드록시아다만탄-4-온 옥심을 제공한다. 이어서, 이는 환류 온도에서 테트라하이드로푸란과 같은 불활성 용매중에서 수소화 알루미늄 리튬에 의해 환원되어서 4-아미노아다만탄-1-올을 제공하고, 이는 편리하게 단리되고 염산염으로 규명된다. 상기 반응을 위한 조건은 예컨대, 문헌[에이치. 더블유. 겔루크(H. W. Geluk) 및 제이. 엘. 엠. 에이. 슐라트만(J. L. M. A. Schlatmann) Tetrahedron 1968, 24, 5369-5377]에서 찾을 수 있다.
또한, 3-단계 절차에서 4-아미노아다만탄-1-올의 시스- 및 트랜스-이성체를 제조할 수 있다. 먼저, 시판되는 1-하이드록시아다만탄-4-온은 환원성 아민화 조건(12시간 이상동안 실온에서 아세트산 및 다이클로로메테인중 트리아세톡시보로하이드라이드 나트륨)하에서 (S)-(-)-1-페닐에틸아민과 반응한다. 이어서, 1-페닐에틸 아민 환원성 아민화 생성물의 시스- 및 트랜스-이성체를 크로마토그래피에 의해 분리할 수 있다. 이어서, 4-아미노아다만탄-1-올 이성체의 시스- 및 트랜스-이성체를 하기 반응식 16에 도시된 바와 같이 별도의 가수소분해 조건하에서 수득한다.
하이드록시아다만트-아마이드의 유도체는 하기 반응식 17에 도시된 바와 같이 형성될 수 있다. 화학식 43의 3급 하이드록시 기는 메틸렌 클로라이드과 같은 비극성 용매중에서 (다이에틸아미노) 황 트리플루오라이드(DAST)와 같은 적절한 시약을 이용하여 플루오로에 의해 치환될 수 있다. 화합물(43)은 클로로아세토니트릴과의 리터(Ritter) 유형 반응, 이어서 화합물(45)을 제공하기 위해 티오우레아를 이용한 열분해를 비롯한 두 단계 순서에서 아민 유도체(45)로 전환될 수도 있다. 유사한 리터 반응 조건을 이용하여 화합물(43)은 N-아세틸 유도체(46)로 전환될 수 있다.
반응식 18에 개략된 바와 같이, 중간물질인 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(즉, 49)를 제조할 수 있다. 트랜스 화합물(41)의 1급 아미노 기의 보호, 이어서 리터 반응은 중간물질(48)을 제공하고, 이는 탈보호되어서 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(49)를 제공한다. 택일적으로, 화합물(49)은 트리플루오로아세트산중 니트릴과 함께 가열, 이어서 염기성 조건하에서 가수분해에 의해 트랜스 화합물(41)(중간물질 2)로부터 직접 제조될 수 있다.
반응식 19에 개략된 바와 같이, 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(즉, 53)를 제조할 수도 있다. FMOC-보호된 아다만틸 알코올 중간물질(47)은 리터 반응 조건을 이용하여 클로로메틸아세트아마이드 중간물질(50)로 전환될 수 있다. 알코올계 용매 및 아세트산중에서 가열하의 화합물(50)과 티오우레아의 반응은 아민(51)을 제공한다. 화합물(47)의 화합물(51)로의 전환을 실시하기 위한 반응 조건은 문헌[저겐슨즈, 에이(Jirgensons, A), 카우스, 브이(Kauss, V), 칼빈시, 아이(Kalvinsh, I), 골드, 엠. 알(Gould, M. R.), 합성, 2000, 12, 1709-1712]에서 찾을 수 있다. 메테인설폰일클로라이드와 같은 적합한 설폰일클로라이드를 이용하는 염기성 조건하에서 화합물(51)의 설폰일화, 이어서 탈보호는 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(53)를 제공한다.
이어서, 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(즉, 49), 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(즉, 53) 또는 트랜스-4-아미노-아다만탄-1-올(중간물질 2)은 화합물(54)과 같은 적합한 피라졸 카르복실산으로 커플링되어서 중간물질 아다만틸 아마이드(55)를 제공할 수 있다. 화합물(55)의 클로로 기의 치환은 가열하에 염기성 조건하에서 피라졸 또는 치환된 피라졸과 같은 각종 친핵체에 의해 이루어져서 생성물(56)을 제공할 수 있다.
반응식 21에 개략된 바와 같이, 1-알킬-5-알콕시메틸-피라졸-4-카르복실산(60)은 1-알킬-5-메틸-피라졸-4-카르복실산 에스테르(57)로부터, N-브로모숙신이마이드에 의해 브롬화시켜서 중간물질 브로모메틸 유도체(58)를 제공하여서 제조할 수 있다. 상기 브롬화 반응을 실시하는데 적합한 조건의 예는 문헌[백크, 제이. 등, J. Heterocycl. Chem. 1987, 24, 693-695]에서 찾을 수 있다. 적합한 알콕사이드에 의한 브롬의 치환 및 부수적인 에스테르 교환은 상응하는 나트륨 염과 함께 알코올계 용매중에서 중간물질(58)을 가열함으로써 실시될 수 있다. 상기 변환을 실시하기 위한 조건의 한 예를 문헌[오노데라, 지(Onodera, G) 등, Organic Letters 2005, 18, 4029]에서 찾을 수 있다. 시중에서 구입할 수 없을 때, 소듐 알콕사이드 염은 적합한 알코올을 수소화 나트륨으로 처리함으로써 쉽게 제조될 수 있다. 화합물(59)의 에스테르 기의 가수분해는 중간물질 산(60)을 제공하고, 이는 이어서 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(즉, 49), 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(즉, 53) 또는 트랜스-4-아미노-아다만탄-1-올(중간물질 2)에 커플링되어서 화학식 61의 화합물을 제공할 수 있다.
반응식 22에 개략된 바와 같이, 화학식 65의 이속사졸 치환된 화합물은 화합물(62)로부터 출발하여 제조될 수 있다. 적합한 하이드라진(5)과 함께 화합물(62)의 가열, 이어서 에스테르 기의 가수분해는 카르복실산(64) 중간물질을 제공한다. 이어서, 화합물(64)은 이어서 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(즉, 49), 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(즉, 53) 또는 트랜스-4-아미노-아다만탄-1-올(중간물질 2)에 커플링되어서 화학식 65의 화합물을 제공할 수 있다.
식 HNR1R2의 아민의 합성의 비제한적인 최종 예로서, 2급 아민은 유기 합성 분야의 평균 숙련자들에게 널리 알려져 있는 환원성 아민화에 의해 제조될 수 있으며, 그 결과 아민은 케톤에 의해 처리되어서 이민을 제공하고, 이는 많은 환원제중 하나에 의해 환원된다. 상기 반응에 사용될 수 있는 조건의 많은 예가 문헌[총괄적인 유기 변환: 작용기 제조 지침서, 알. 씨. 라록, VCH 퍼블리셔즈, 인크, 뉴욕, 1989, 421-423]에 열거되어 있다. 예컨대, 아민 및 케톤은 대략 실온에서 메탄올계 염산의 존재하에 할로겐화 탄화수소(예: 다이클로로메테인)와 같은 불활성 용매중에서 테트라부틸암모늄 시아노보로하이드라이드와 같은 환원제에 의해 처리될 수 있다.
화학식 12의 출발 물질은 80 내지 160℃에서 아세트산 무수물과 같은 산 무 수물 촉매의 존재하에 트리알킬 오르토포름에이트에 의해 시아노아세테이트를 처리함으로써 편리하게 제조된다. 상기 반응을 위한 조건은 예컨대, 문헌[알. 지. 존스(R. G. Jones) J. Am. Chem. Soc. 1952, 74, 4889-4891; 엔. 제이. 쿠삭(N. J. Cusack) 등, J. Chem. Soc. C 1971, 1501-1507; 및 오. 액커만(O. Ackermann) 등, 미국특허 제4,277,418호]에서 찾을 수 있다.
본 발명의 방법의 실시에서, 유효량의 본 발명의 화합물의 임의의 하나 또는 본 발명의 화합물의 임의의 혼합물 또는 그의 약학적으로 허용가능한 염이 단독으로 또는 혼합되어 당업계에 알려진 일반적인 허용가능한 임의의 방법을 통해 투여된다. 따라서, 화합물 또는 조성물은 경구(예: 구강), 설하, 비경구(예: 근육내, 정맥내 또는 피하내), 직장내(예: 좌제 또는 세척액에 의해), 경피내(예: 피부 전기천공)로 또는 흡입에 의해(예: 에어로졸에 의해), 정제 및 현탁액을 비롯한 고체, 액체 또는 기체 투약 형태로 투여될 수 있다. 투여는 지속적인 치료법에 의해 단일 단위 복용량 형태로 또는 일회 투약 치료법에서 임의로 실시될 수 있다. 치료 조성물은 또한 파모산과 같은 친유성 염을 갖는 오일 유화액 또는 분산액의 형태이거나 또는 피하내 또는 근육내 투여를 위한 생분해성 서방형 조성물의 형태일 수 있다.
본원의 조성물의 제조에 유용한 약학적 담체는 고체, 액체 또는 기체일 수 있다; 따라서, 조성물은 정제, 알약, 캡슐, 좌제, 분말, 장용 피복된 또는 다른 보호된 배합물(예: 이온 교환 수지에 결합되거나 지단백질 소낭(vesicle)에 포장됨), 서방형 배합물, 용액, 현탁액, 엘릭시르(elixir), 에어로졸 등의 형태를 가질 수 있다. 담체는 석유, 동물, 식물 또는 합성 기원의 것을 비롯한 다양한 오일, 예컨대, 낙화생유, 대두유, 광유, 호마유 등으로부터 선택될 수 있다. 물, 염수, 수성 덱스트로즈 및 글리콜이 특히 주사용 용액을 위한(혈액과 등장성일 때) 바람직한 액체 담체이다. 예컨대, 정맥내 투여를 위한 배합물은 고체 활성 성분(들)을 물에 용해시켜서 수용액을 생성시키고 상기 용액을 무균화함으로써 제조되는 활성 성분(들)의 무균 수용액을 포함한다. 적합한 약학적 부형제는 전분, 셀룰로오즈, 활석, 글루코즈, 락토오즈, 젤라틴, 맥아, 쌀, 밀가루, 석회가루, 실리카, 마그네슘 스테아레이트, 소듐 스테아레이트, 글리세롤 모노스테아레이트, 염화나트륨, 탈지분유, 글리세롤, 프로필렌 글리콜, 물, 에탄올 등을 포함한다. 조성물은 보존제, 안정화제, 습윤 또는 유화 제제, 삼투압 조정을 위한 염, 완충액 등과 같은 통상적인 약학 첨가제를 포함할 수 있다. 적합한 약학 담체 및 이들의 배합물이 문헌[레밍톤의 약학과학(Remington's Pharmaceutical Sciences), 이. 더블유. 마틴(E. W. Martin)]에 기재되어 있다. 상기 조성물은 수용인(recipient)에게 적절히 투여되도록 적절한 투약형태를 제조하기 위해 임의의 경우에 유효량의 활성 화합물을 적합한 담체와 함께 함유한다.
본 발명의 화합물의 투약량은 예컨대, 투여 방식, 피험자의 연령 및 체중, 및 치료되는 피험자의 증상과 같은 수많은 요인에 의해 좌우되며, 궁극적으로는 담당 의사 또는 수의사에 의해 결정된다. 담당 의사 또는 수의사에 의해 결정되는 활성 화합물의 양이 본원 및 청구의 범위에서 "유효량"이라고 지칭된다. 예컨대, 본 발명의 화합물의 투약량은 전형적으로 1일에 약 1 내지 약 1000mg 범위이다.
본 발명은 하기 실시예에 추가로 기재되어 있으며, 이는 본 발명의 범위를 단지 예시하고자 하는 것이며 제한하려는 것이 아니다.
시약을 알드리츠, 시그마(Sigma), 메이브릿지(Maybridge), 어드밴스트 켐테크(Advanced ChemTech) 및 랑카스터(Lancaster) 및 하기에 기재된 바와 같은 다른 공급업체로부터 구입하여, 추가의 정제없이 사용하였다. 하기 시스템을 이용하여 LC/MS(액체 크로마토그래피/질량 분광법) 스펙트럼을 기록하였다. 질량 스펙트럼의 측정을 위해, 상기 시스템은 마이크로매스 플랫폼(Micromass Platform) II 분광계: 양의 모드의 ES 이온화(질량 범위: 150 내지 1200amu)로 이루어졌다. 동시에 일어나는 크로마토그래피 분리는 하기의 HPLC 시스템: ES 인더스트리즈 크로메가본드(ES Industries Chromegabond) WR C-18 3u 120Å(3.2 x 30mm) 컬럼 카트릿지; 이동상 A: 물(0.02% TFA) 및 상 B: 아세토니트릴(0.02% TFA); 3분후 10% B 내지 90% B의 구배; 1분의 평형 시간; 2ml/분의 유속으로 이루어졌다.
초임계 유체 크로마토그래피 분리는 하기의 전형적인 조건: 100바아, 30℃, 2.0ml/분으로 초임계 유체 CO2중 40% MeOH에 의해 12mm AD 컬럼을 용출시키며 메틀러-톨레도 미니그램(Mettler-Toledo Minigram) 시스템을 이용하여 실시하였다. 염기성 아미노 기를 갖는 분석물질의 경우에, 0.2% 이소프로필 아민이 메탄올 개질기에 첨가되었다.
바람직한 합성 중간물질의 제조방법
중간물질 1: 4-아미노-아다만탄-1-올(시스/트랜스 혼합물)
1 단계: 5-하이드록시-아다만탄-2-온 옥심
5-하이드록시-2-아다만탄온(15g, 90.2mmol, CAS#: 20098-14-0, TCI로부터 구입)을 EtOH(100ml)에 용해시키고, 1N NaOH(80ml)중 하이드록실아민 하이드로클로라이드(10g, 143.9mmol)의 용액에 첨가하였다. 혼합물을 2시간동안 100℃로 가열하였다. EtOH를 증발시키고, 물 및 다이클로로메테인을 첨가하였다. 생성된 혼합물을 10분동안 교반하고, 이어서 여과하였다. 고형물을 수거하였다. 생성된 혼합물을 분리하였다. 수성 층을 다이클로로메테인에 의해 2회 추가로 추출하였다. 유기상을 합하여 고 진공하에서 농축시켰다. 생성된 잔류물을 여과로부터의 고형물과 합하였다. EtOAc로부터 결정화하여 5-하이드록시-아다만탄-2-온 옥심(12g, 73%)을 제공하였다. 질량 스펙트럼: m/z: 182(M+1).
2 단계: 4-아미노-아다만탄-1-올
Rh/Al2O3(2.3g, 5중량%, 1.1mmol)를 파르 수소화 용기에서 EtOH(100ml)중 5-하이드록시-아다만탄-2-온 옥심(10g, 55mmol)의 혼합물에 첨가하였다. 수소화 반응을 48시간동안 50℃에서 55psi 수소압으로 파르 수소화 장비에서 실시하였다. 출발 물질이 사라지고 생성물이 생성되는 것을 LC-MS에 의해 검출하였다. 혼합물 을 셀라이트를 통해 여과하고, 진공하에 건고 상태로 농축시켜서 4-아미노-아다만탄-1-올(약 9g, 약 98%)을 제공하였고, 이를 추가의 정제없이 다음 단계를 위해 사용하였다. 질량 스펙트럼: m/z: 168.1(M+1).
중간물질 2: 4-아미노-아다만탄-1-올(트랜스)
1 단계: 4-(S-1-페닐-에틸아미노)-아다만탄-1-올
탄소상 수산화 팔라듐(2.54g, 50중량% 물, 건조 기준으로 20중량% Pd, 4.8mmol)을 질소 분위기하에 파르 용기(350ml)에 첨가하였다. 5-하이드록시-2-아다만탄온(15g, 90.2mmol), 알루미늄 이소프로폭사이드(18.43g, 90.2mmol), (S)-(-)-1-페닐-에틸아민(99+%, 99% ee, 10.94g, 90.3mmol) 및 톨루엔(150ml)을 질소 분위기하에 차례로 첨가하였다. 혼합물을 수 분동안 충분히 진탕시키고, 이어서 실온에서 5시간동안 H2(55psi)에 의해 수소화시켰다. 이어서, 1N NaOH 용액(200ml)을 첨가하고, 반응 혼합물을 충분히 혼합하였다. 셀라이트를 통해 여과하고 MeOH로 세척한 후에 여액을 농축시켜서 유기 용매를 제거하였다. 나머지 염기성 수성 혼합물을 다이클로로메테인(3 x 200ml)으로 추출하였다. 유기 상을 합하여 하우스(house) 진공하에 농축시키고, 이어서 고 진공하에 농축시켜서 4-(S-1-페닐-에틸아미노)-아다만탄-1-올(21.65g, 88%)을 오일로 제공하였다. 100:5의 트랜스 대 시스 비를 조도 1H NMR로부터 결정하였다. 질량 스펙트럼: m/z: 272.2(M+1).
2 단계: 4-아미노-아다만탄-1-올(트랜스)
탄소상 10% 팔라듐(1.7g, 1.6mmol)을 350ml들이 파르 용기에 조심스럽게 첨가하였다. 에탄올(150ml)중 트랜스-4-(S-1-페닐-에틸아미노)-아다만탄-1-올(추가의 정제없이 상기 단계로부터, 21.65g, 79.8mmol)의 용액을 아르곤 분위기하에 파르 용기에 조심스럽게 첨가하였다. 반응 혼합물을 실온에서 밤새 H2(55psi)와 함께 파르 스테이션(Parr station)에서 수소화시켰다. 반응 혼합물을 아르곤하에 셀라이트를 통해 여과하고, 셀라이트를 에탄올로 세척하고, 여액을 합하여 고 진공하에 농축시켜서 점착성있는 고형물(15g)을 제공하였다. 아세토니트릴(60ml)을 첨가하고, 용액을 동결건조하여 트랜스-4-아미노-아다만탄-1-올(13.8g, 정량적)을 분말로 제공하였다. 질량 스펙트럼: m/z: 168.1(M+1).
5-하이드록시-아다만탄-2-온으로부터 출발하여 중간물질 2을 제조하기 위한 바람직한 방법이 하기에 개략되어 있다.
1 단계: 4-아미노-아다만탄-1-올
5-하이드록시-아다만탄-2-온(15g, 90.24mmol, 인터내셔날 스페셜티(International Specialty)) 및 Pd/C(1.498g, 데그싸(Degussa) 19985880, 5%, 50% 물)을 파르 반응기에 첨가하고, 이어서 메탄올 용액중 암모니아(7N, 300.4ml, 2.1mol)을 첨가하였다. 반응기를 18시간동안 200 내지 250psi으로 수소에 의해 가압시켰다. 이어서, 혼합물을 셀라이트 패드에 여과시키고, 진공에서 농축시켜서 4-아미노-아다만탄-1올(15.15g, NMR-D2O에 의해 4/1=트랜스/시스)을 백색 고형물로 제공하였다. 상기 물질을 추가의 정제없이 바로 사용하였다.
2 단계: 트랜스-4-아미노-아다만탄-1-올-하이드로클로라이드
4-아미노-아다만탄-1-올(15.15g, 4/1=트랜스/시스 혼합물로 90.58mmol)을 메탄올에 현탁시키고, 0℃로 냉각시켰다. 트리메틸실릴 클로라이드(12.16ml, 95.11mmol)를 천천히 첨가하고, 그 동안 내부 온도를 7℃ 미만으로 유지하였다. 생성된 혼합물을 1시간동안 0℃에서 교반하고, 이어서 실온까지 가온시키고, 6시간동안 환류 온도에서 분쇄시켰다. 현탁액을 실온으로 냉각시키고, 13시간동안 교반하였다. 이어서, 고형물을 여과하고, 18시간동안 진공에서 60℃에서 건조시켰다. 트랜스-4-아미노-아다만탄-1-올-하이드로클로라이드(12.7g)를 백색 고형물(기체 크로마토그래피에 의거 95.15% 순도, NMR-D2O에 의거 순수한 트랜스)로 수득하였다.
중간물질 3: 1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산
메탄올(100ml) 및 물(100ml)중 1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 에틸 에스테르(20g, 91.2mmol; 부트 파크 리미티드(Butt Park Ltd.)에서 구입가능, 영국 콘월 카멜포드)의 용액에 LiOH(2.4g, 100mmol)을 첨가하였다. 반응 혼합물을 4시간동안 환류 온도에서 교반하고, 이어서 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl(9ml)에 의해 pH 2로 산성화시키고, 에틸 아세테이트로 추출하였다. 추출물을 합하여 진공에서 증발시켜서 1-메틸-5-피롤- 1-일-1H-피라졸-4-카르복실산을 제공하고, 이를 추가의 정제없이 사용하였다.
중간물질 4: 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트
트리플루오로아세트산 무수물(10.1g, 48/1mmol)을 톨루엔(10ml)중 에틸 N,N-다이메틸아미노아크릴레이트(6.9g, 48.2mmol)의 혼합물에 약 20분동안 적가하고, 이를 아세톤-얼음 중탕(약 -10℃)에서 냉각시켰다. 이어서, 반응 혼합물을 실온까지 다시 승온시키고, 1시간동안 교반하였다. 반응 혼합물을 다이클로로메테인(100ml) 및 물(80ml)로 희석하였다. 혼합물을 15분동안 교반하고, 유기 상을 분리하였다. 수성 상을 다이클로로메테인으로 3회 추출하였다. 유기 상을 합하여 진공하에 건조시키고, 0 내지 40% 에틸 아세테이트/헥세인의 구배, 이어서 40% 에틸 아세테이트/헥세인으로 용출시키며 실리카 겔 크로마토그래피로 정제하여서 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트 10.2g(89%)를 제공하였다.
중간물질 5: 사이클로프로필하이드라진 하이드로클로라이드
1 단계: N-(3급-부톡시카르본일)사이클로프로필아민
얼음물 중탕에서 0℃에서 다이클로로메테인(50ml)중 사이클로프로필아 민(12.4g, 252.2mmol)의 용액에 다이클로로메테인(100ml)중 다이-3급-부틸 다이카본에이트(43.7g, 200mmol)의 용액을 첨가하였다. 이어서, 반응 혼합물을 18시간동안 실온에서 교반하였다. 용매를 진공하에 증발시켜서 N-(3급-부톡시카르본일)사이클로프로필아민(31g, 99%)을 제공하였다.
2 단계: N-니트로소-N-(3급-부톡시카르본일)아미노-사이클로프로페인
니트로소듐 테트라플루오로보레이트(9.32g, 79.8mmol)를 무수 아세토니트릴(150ml)중 N-(3급-부톡시카르본일)사이클로프로필아민(9.57g, 60.9mmol) 및 무수 피리딘(11.7ml)의 냉각된(-30℃) 용액에 여러 번에 걸쳐 조심스럽게 첨가하였다. 용액을 30분동안 -30℃, 이어서 2시간동안 0℃에서 교반하였다. 얼음물 및 EtOAc를 첨가하고, 유기상을 분리하고, 1N HCl에 의해 신속하게 세척하여서 피리딘을 제거하였다. 유기상을 1N NaHCO3 및 염수로 세척하고, 건조(MgSO4)시키고, 여과하고, 40℃ 미만의 물 중탕 온도에서 고 진공하에 증발시켜서 N-니트로소-N-(3급-부톡시카르본일)아미노-사이클로프로페인(12.1g, 정량적)을 오일로 제공하였다.
3 단계: 사이클로프로필 하이드라진 하이드로클로라이드
N-니트로소-N-(3급-부톡시카르본일)아미노-사이클로프로페인(12g, 약 60.9mmol)을 MeOH(600ml)에 용해시키고, 아세톤/드라이아이스 중탕에서 -78℃로 냉각시켰다. -78℃에서, 진한 HCl(54ml)을 교반되는 반응 혼합물에 천천히 첨가하였다. 이어서, 활성화 아연(33.7g, 516mmol; 알드리츠로부터의 나노크기의 활성화 분말)을 교반되는 반응 혼합물에 -78℃에서 천천히 첨가하였다. 반응 혼합물을 8 시간동안 -78℃에서 교반하였다. 이어서, 반응 혼합물을 셀라이트를 통해 여과하였다. 여액을 40℃ 미만의 물 중탕 온도에서 고 진공하에 농축시켜서 조질의 사이클로프로필 하이드라진 하이드로클로라이드를 점착성 반고형물로 제공하였다.
중간물질 6: 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산
1 단계: 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르
트리에틸아민(2.2g, 21.7mmol) 및 사이클로프로필 하이드라진 하이드로클로라이드(추가의 정제없이 중간물질 5, 0.8g, 7.4mmol)를 에탄올(12ml)중 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트(중간물질 4, 1.76g, 7.4mmol)의 용액에 차례로 첨가하였다. 생성된 현탁액을 충분히 혼합하고, 3개의 10ml-크기의 개인 화학실험용 극초단파 처리 시험관(바이오타지(Biotage) AB, 스웨덴)에 동량으로 나누었다. 상기 시험관을 격벽으로 밀봉하고, 30분동안 160℃에서 개인 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 150W 극초단파를 조사(irradiation)하였다. 3개 시험관내의 반응 혼합물을 합하고, 에탄올을 감압하에 증발시켰다. 나머지 혼합물을 다이클로로메테인과 물 사이에서 분배시키고, 수상을 다이클로로메테인으로 3회 추출하였다. 유기상을 합하고, 진공에서 농축시키고, 0 내지 20% 에틸 아세테이트/헥세인의 구배, 이어서 20% 에틸 아세테이트/헥세인으로 용출시키며 실리카 크로마토그래피에 의해 정제하여서 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(140mg, 8%)를 제공하였다. 질량 스펙트럼: m/z: 249.1(M+1).
2 단계: 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산
CH3OH(2ml) 및 물(2ml)중 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(140mg, 0.56mmol)의 용액에 LiOH(16mg, 0.67mmol)을 첨가하였다. 반응 혼합물을 환류 온도에서 밤새 교반하고, 이어서 용액을 감압하에 농축하여서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl에 의해 용액을 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트로 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축하여서 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산(130mg, 정량적)을 제공하고, 이를 추가의 정제없이 사용하였다.
중간물질 7: 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산
CH3OH(45ml) 및 물(45ml)중 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(5g, 21.2mmol, 바이오네트(Bionet)로부터 구입)의 용액에 LiOH(0.54g, 22.5mmol)를 첨가하였다. 반응 혼합물을 4시간동안 환류 온도에서 교반하고, 이어서 용액을 감압하에 농축하여서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl로 상기 용액을 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트로 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축하여서 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(4.02g, 80%)을 제공하고, 이를 추가의 정제없이 사용하였다.
중간물질 8: 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산
1 단계: 5-클로로-1-메틸-1H-피라졸-4-카르복실산 에틸 에스테르
아질산 t-부틸(29.5ml, 248mmol), 염화 제일구리(17.6g, 177.8mmol) 및 무수 아세토니트릴(490ml)의 혼합물에 5-아미노-1-메틸-1H-피라졸-4-카르복실산 에틸 에스테르(25g, 148mmol)에 여러 번에 걸쳐 30분동안 0℃에서 첨가하였다. 반응 혼합물을 1시간동안 실온에서 교반하고, 이어서 1시간동안 65℃에서 교반하였다. 이어서, 혼합물을 6N HCl(600ml)에 붓고, 다이클로로메테인으로 추출하였다. 수성 상을 다이클로로메테인으로 3회 추출하였다. 유기 상을 합하여 진공에서 농축시키고, 조질의 잔류물을 0 내지 20% 에틸 아세테이트/헥세인의 구배, 이어서 20% 에틸 아세테이트/헥세인으로 용출시키는 플래시 크로마토그래피로 정제하여서 5-클로로- 1-메틸-1H-피라졸-4-카르복실산 에틸 에스테르(18g, 64%)를 제공하였다.
2 단계: 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 에틸 에스테르
수소화 나트륨(오일중 60%, 767mg, 19mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(40ml)중 피라졸(1.36g, 20mmol)의 용액에 첨가하고, 혼합물을 1시간동안 40℃까지 가열하였다. 5-클로로-1-메틸-1H-피라졸-4-카르복실산 에틸 에스테르(1.89g, 10mmol)를 첨가하고, 혼합물을 밤새 100℃까지 가열하고, 이어서 냉각시켰다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 수성 상을 EtOAc로 3회 추출하였다. 유기 상을 합하여 진공에서 농축시키고, 잔류물을 0 내지 20% 에틸 아세테이트/헥세인의 구배, 이어서 20% 에틸 아세테이트/헥세인으로 용출시키는 플래시 실리카 크로마토그래피로 정제하여서 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 에틸 에스테르(0.2g, 9%)를 제공하였다.
3 단계: 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산
CH3OH(5ml) 및 물(55ml)중 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 에틸 에스테르(340mg, 1.54mmol)의 용액에 LiOH(41mg, 1.71mmol)을 첨가하였다. 반응 혼합물을 4시간동안 환류 온도에서 교반하고, 이어서 용액을 감압하에 농축하여서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 상기 용액을 진한 HCl에 의해 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트로 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축하여서 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(300mg, 정량적)을 제공하고, 이를 추가의 정제없이 사용하였다.
중간물질 9: 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산
1 단계: 5-아미노-1-3급-부틸-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올 100ml중 t-부틸하이드라진 하이드로클로라이드 염(10g, 80.3mmol), 에틸(에톡시메틸렌)-시아노아세테이트(13.6g, 80.4mmol) 및 무수 아세트산 나트륨(8.2g, 100mmol)을 함유하는 용액을 교반하고, 16시간동안 환류시켰다. 용액을 얼음물에 부었다. 분리된 수성 상을 다이클로로메테인으로 3회 추출하였다. 유기 상을 합하여 물 및 포화된 염수 용액으로 연속하여 세척하고, 황산 나트륨으로 건조시켰다. 용매를 진공에서 제거하여 5-아미노-1-3급-부틸-1H-피라졸-4-카르복실산 에틸 에스테르(13g, 77%)를 제공하였다.
2 단계: 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 에틸 에스테르
아질산 t-부틸(7.2ml, 60.5mmol), 염화제일구리(4.8g, 48.5mmol) 및 무수 아세토니트릴(120ml)의 혼합물에 0℃에서 30분동안 여러 번에 걸쳐 5-아미노-1-3급-부틸-1H-피라졸-4-카르복실산 에틸 에스테르(8.4g, 39.8mmol)를 첨가하였다. 반응 혼합물을 실온에서 1시간동안, 이어서 65℃에서 1시간동안 교반하였다. 이어서, 혼합물을 6N HCl(120ml)에 붓고, 다이클로로메테인으로 추출하였다. 수성 상을 다이클로로메테인에 의해 3회 추출하였다. 유기 상을 합하여 진공에서 농축한 후에, 조질의 잔류물을 0 내지 20% 에틸 아세테이트/헥세인의 구배, 이어서 20% 에틸 아세테이트/헥세인으로 용출시키는 플래시 크로마토그래피로 정제하여서 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 에틸 에스테르(5.5g, 39%)를 제공하였다.
3 단계: 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산
메탄올(50ml) 및 물(50ml)중 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 에틸 에스테르(5g, 21.7mmol)의 용액에 LiOH(0.63g, 26.3mmol)을 첨가하였다. 반응 혼합물을 환류 온도에서 밤새 교반하고, 이어서 감압하에 농축하여서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl(4ml)에 의해 pH 2로 산성화시키고, 에틸 아세테이트로 추출하였다. 유기 추출물을 진공에서 증발시켜서 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(4g, 91%)을 제공하고, 이를 추가의 정제없이 사용하였다.
본 발명의 바람직한 화합물의 제조방법
실시예 1
메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산(중간물질 3, 38mg, 0.2mmol)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.14ml, 0.8mmol) 및 TSTU(72mg, 0.22mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 4-아미노-아다만탄-1-올(33mg, 0.2mmol)을 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 실시예 1: 1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(44mg, 65%)를 제공하였다. 질량 스펙트럼: m/z: 341.2(M+1).
실시예 2
트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
메틸-5-피롤-1-일-1H-피라졸-4-카르복실산(중간물질 3, 2.66g, 13.9mmol)을 무수 다이클로로메테인(40ml) 및 무수 DMF(10ml)의 혼합물에 용해시켰다. DIPEA(14.5ml, 83.2mmol) 및 TSTU(5.02g, 15.2mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 4-아미노-아다만탄-1-올(2.32g, 13.9mmol)을 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 25 내지 35%의 구배로 C-18 역상 예비-HPLC에 의해 정제하였다. 실시예 2, 트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 질량 스펙트럼: m/z = 341.2(M+1)에 상응하는 제 2 피크로 단리시켰다.
실시예 3
2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드
2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(중간물질 8, 50mg, 0.26mmol)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.23ml, 1.3mmol) 및 TSTU(93mg, 0.28mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(58mg, 0.31mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드(65mg, 77%)를 제공하였다. 질량 스펙트럼: m/z: 362.2(M+1).
실시예 4
메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(77mg, 0.4mmol, CAS# 119083-00-0, 바이오네트로부터 구입)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.28ml, 1.6mmol) 및 TSTU(145mg, 0.44mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(75mg, 0.4mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 1-메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(85mg, 65%)를 제공하였다. 질량 스펙트럼: m/z: 328.2(M+1).
실시예 5
5-클로로-1-메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
5-클로로-1-메틸-1H-피라졸-4-카르복실산(64mg, 0.4mmol, CAS#54367-66-7, 오크우드(Oakwood)로부터 구입)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.28ml, 1.6mmol) 및 TSTU(145mg, 0.44mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(75mg, 0.4mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(70mg, 60%)를 제공하였다. 질량 스펙트럼: m/z: 294.1(M+1).
실시예 6
3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 7. 61mg, 0.26mmol)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.23ml, 1.3mmol) 및 TSTU(93mg, 0.28mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(58mg, 0.31mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기 층을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(62mg, 65%)를 제공하였다. 질량 스펙트럼: m/z: 370.2(M+1).
실시예 7 및 8
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드 및 시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드
3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 7, 3.28g, 13.9mmol)을 무수 다이클로로메테인(40ml) 및 무수 DMF(10ml)의 혼합물에 용해시켰다. DIPEA(14.5ml, 83.4mmol) 및 TSTU(5g, 16.7mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 4-아미노-아다만탄-1-올(2.32g, 13.9mmol)을 첨가하였다. 4시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기층을 합하여 진공에서 건조시키고, 0 내지 60% 에틸 아세테이트/헥세인의 구배, 이어서 60% 에틸 아세테이트/헥세인으로 용출시키는 실리카 크로마토그래피로 정제하여서 시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드(실시예 8, 1.75g, 33%) 및 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드(실시예 7, 0.85g, 16%)를 제공하였다. 시스 이성체후에 트랜스 이성체가 용출되었다. 화합물 둘다는 질량 스펙트럼 m/z: 386.2(M+1)을 특징으로 하였다.
실시예 9
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2- 일)-아마이드
2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(중간물질 8, 296mg, 1.54mmol)을 무수 다이클로로메테인(24ml) 및 무수 DMF(6ml)의 혼합물에 용해시켰다. DIPEA(1.6ml, 9.2mmol) 및 TSTU(556mg, 1.68mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 4-아미노-아다만탄-1-올(258mg, 1.54mmol)을 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 15 내지 20% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 먼저 시스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드(100mg, 19%, 질량 스펙트럼: m/z: 342.2(M+1)), 이어서 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 제공하였다.
실시예 10
5-클로로-1-메틸-3-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
5-클로로-1-메틸-3-트리플루오로메틸-1H-피라졸-4-카르복실산(91mg, 0.4mmol, CAS#: 128455-63-0, 메이브릿지에서 구입)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.28ml, 1.6mmol) 및 TSTU(145mg, 0.44mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(75mg, 0.4mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 5-클로로-1-메틸-3-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(55mg, 38%)를 제공하였다. 질량 스펙트럼: m/z: 362.1(M+1).
실시예 11
5-클로로-1,3-다이메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
5-클로로-1,3-다이메틸-1H-피라졸-4-카르복실산(69mg, 0.4mmol, CAS#: 27006-82-2, 메이브릿지로부터 구입)을 무수 다이클로로메테인(3.2ml) 및 무수 DMF(0.8ml)의 혼합물에 용해시켰다. DIPEA(0.28ml, 1.6mmol) 및 TSTU(145mg, 0.4mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(75mg, 0.4mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기상을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 5-클로로-1,3-다이메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(72mg, 58%)를 제공하였다. 질량 스펙트럼: m/z: 308.1(M+1).
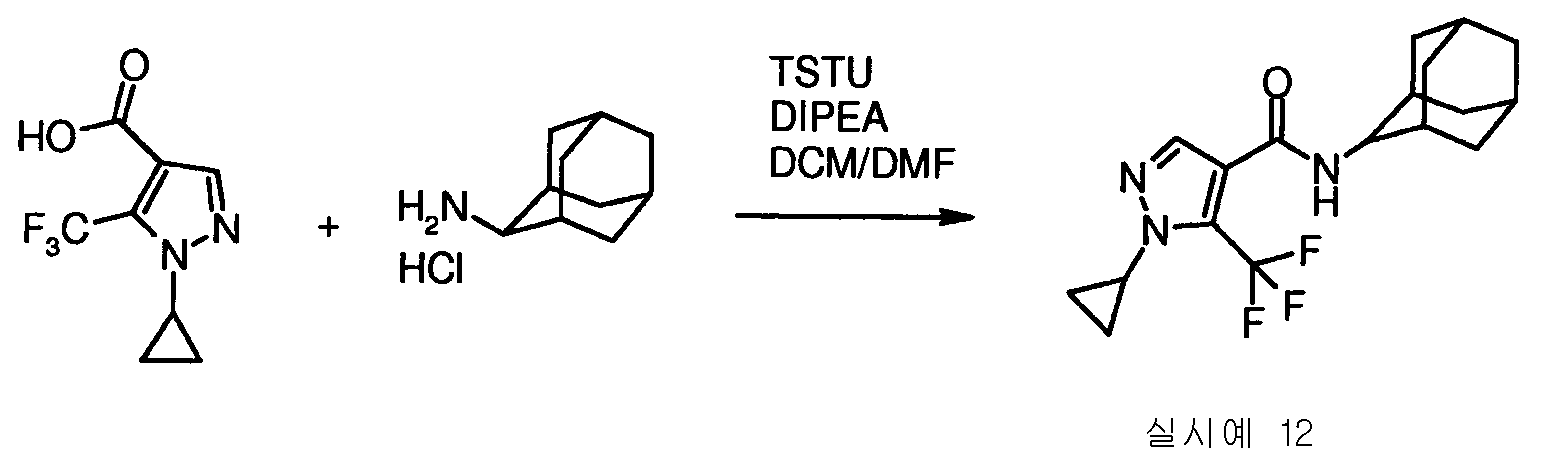
실시예 12
사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 6, 20mg, 0.09mmol)을 무수 다이클로로메테인(1.6ml) 및 무수 DMF(0.2ml)의 혼합물에 용해시켰다. DIPEA(0.1ml, 0.57mmol) 및 TSTU(33mg, 0.11mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(17mg, 0.09mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기 층을 합하여 진공하에서 건조시키고, 0 내지 40% 에틸 아세테이트/헥세인의 구배, 이어서 40% 에틸 아세테이트/헥세인으로 용출시키는 실리카 크로마토그래피에 의해 정제하여서 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(18mg, 56%)를 제공하였다. 질량 스펙트럼: m/z: 354.2(M+1).
실시예 13
사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 6, 100mg, 0.45mmol)을 무수 다이클로로메테인(4ml) 및 무수 DMF(1ml)의 혼합물에 용해시켰다. DIPEA(0.5ml, 2.9mmol) 및 TSTU(165mg, 0.5mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 4-아미노-아다만탄-1-올(77mg, 0.46mmol)을 첨가하였다. 4 시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기 층을 합하여 진공하에서 건조시켰다. 조질의 혼합물을 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(79mg, 48%)를 제공하였다. 질량 스펙트럼: m/z: 370.2(M+1).
실시예 14
메틸-5-(4-메틸-피페라진-1-일)-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
N-메틸피롤리딘온(0.8ml)중 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 59mg, 0.20mmol) 및 1-메틸피페라진(0.47ml, 4.2mmol)의 용액을 2시간동안 극초단파 조사하에 밀봉된 바이알에서 230℃까지 가열하였다. 혼합물을 실온으로 냉각시키고, 조질의 생성물을 역상 HPLC에 의해 정제하여서 메틸-5-(4-메틸-피페라진-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(41mg, 57%)를 회백색 고형물로 제공하였다. ES-HRMS m/e C20H32N5O(M+H+)의 계산치 358.2602, 실측치 358.2597.
실시예 15
5-(2-하이드록시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14, 2단계에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 59mg, 0.20mmol) 및 에탄올아민(0.20ml, 3.3mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(2-하이드록시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(26mg, 41%)를 백색 분말로 제공하였다. ES-HRMS m/e C17H27N4O2(M+H+)의 계산치 319.2129, 실측치 319.2127.
실시예 16
메틸-5-[1,2,4]트리아졸-1-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 4시간동안 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol), 트리에틸아민(0.22ml, 1.56mmol) 및 1,2,4-트리아졸(0.21g, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 1-메틸-5-[1,2,4]트리아졸-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(11mg, 11%)를 회백색 분말로 제공하였다. ES-HRMS m/e C17H22N6O(M+H+)의 계산치 327.1928, 실측치 327.1924.
실시예 17
메틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 피롤리딘(0.25ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 1-메틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(60mg, 61%)를 회백색 분말로 제공하였다. ES-HRMS m/e C19H29N4O(M+H+)의 계산치 329.2336, 실측치 329.2334.
실시예 18
5-(3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 DL-3-피롤리딘올(0.25ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(68mg, 66%)를 회백색 분말로 제공하였다. ES-HRMS m/e C19H29N4O2(M+H+)의 계산치 345.2285, 실측치 345.2281.
실시예 19
5-(4-하이드록시-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 4-하이드록시피페리딘(0.31ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(4-하이드록시-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일 아마이드(87mg, 81%)를 회백색 분말로 제공하였다. ES-HRMS m/e C20H31N4O2(M+H+)의 계산치 359.2442, 실측치 359.2437.
실시예 20
5-[(2-하이드록시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 2-(메틸아미노)에탄올(0.25ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-[(2-하이드록시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(29mg, 29%)를 회백색 분말로 제공하였다. ES-HRMS m/e C18H29N4O2(M+H+)의 계산치 333.2285, 실측치 333.2282.
실시예 21
5-(2-하이드록시-프로필아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 1-아미노-2-프로판올(0.25ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(2-하이드록시-프로필아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(65mg, 65%)를 회백색 분말로 제공하였다. ES-HRMS m/e C18H29N4O2(M+H+)의 계산치 333.2285, 실측치 333.2282.
실시예 22
메틸-5-모폴린-4-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 4시간동안 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 모폴린(0.26ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 1-메틸-5-모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(76mg, 74%)를 회백색 분말로 제공하였다. ES-HRMS m/e C19H28N4O2(M+H+)의 계산치 345.2285, 실 측치 345.2282.
실시예 23
5-(2-메톡시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 2-메톡시에틸아민(0.26ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(2-메톡시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(65mg, 65%)를 회백색 분말로 제공하였다. ES-HRMS m/e C18H29N4O2(M+H+)의 계산치 333.2285, 실측치 333.2282.
실시예 24
5-이소프로필아미노-1-메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 6시간동안 극초단파 조사하에 5-클로로-1- 메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol), 트리에틸아민(0.43ml, 3.1mmol) 및 2-아미노이소부티르산(320mg, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-이소프로필아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(28mg, 29%)를 회백색 분말로 제공하였다. ES-HRMS m/e C18H29N4O(M+H+)의 계산치 317.2336, 실측치 317.2334.
실시예 25
메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 피페리딘(0.31ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(52mg, 51%)를 회백색 분말로 제공하였다. ES-HRMS m/e C20H31N4O(M+H+)의 계산치 343.2493, 실측치 343.2489.
실시예 26
5-(4-하이드록시메틸-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 피페리딘(0.31ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에 5-(4-하이드록시메틸-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(40mg, 36%)를 회백색 분말로 제공하였다. ES-HRMS m/e C21H33N4O2(M+H+)의 계산치 373.2598, 실측치 373.2597.
실시예 27
5-(4-벤질-피페라진-1-일)-1-메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 N-벤질피페라진(0.54ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 5-(4-벤질-피페라진-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(50mg, 38%)를 회백색 분말로 제공하였다. ES-HRMS m/e C26H35N5O(M+H+)의 계산치 434.2915, 실측치 434.2910.
실시예 28
5-(R-3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 (R)-(+)-3-하이드록시피롤리딘(0.26ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 5-(R-3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(56mg, 54%)를 회백색 분말로 제공하였다. ES-HRMS m/e C19H29N4O2(M+H+)의 계산치 345.2285, 실측치 345.2283.
실시예 29
5-다이에틸아미노-1-메틸-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 다이에틸아민(0.32ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 5-다이에틸아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(16mg, 16%)를 회백색 분말로 제공하였다. ES-MS m/e C19H31N4O(M+H+)의 계산치 331, 실측치 331.
실시예 30
3급-부틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 37, 5 단계에 기재된 절차에 따라 극초단파 조사하에 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(100mg, 0.30mmol) 및 피롤리딘(0.25ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 1-3급-부틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(14mg, 16%)를 백색 고형물로 제공하였다. ES-HRMS m/e C22H34N4O(M+H+)의 계산치 371.2806, 실측치 371.2801.
실시예 31
5-[4-(2-하이드록시-에틸)-피페라진-1-일]-1-메틸-1H-피라졸-4-카르복실산 아다만탄일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 1-(2-하이드록시에틸)피페라진(0.38ml, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 5-[4-(2-하이드록시-에틸)-피페라진-1-일]-1-메틸-1H-피라졸-4-카르복실산 아다만탄일아마이드(71mg, 61%)를 회백색 분말로 제공하였다. ES-HRMS m/e C21H34N5O2(M+H+)의 계산치 388.2707, 실측치 388.2702.
실시예 32
5-[(2-메톡시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 5, 88mg, 0.30mmol) 및 (2-메톡시-에틸)-메틸-아민(276mg, 3.1mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 5-[(2-메톡시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(61mg, 59%)를 회백색 분말로 제공하였다. ES-HRMS m/e C19H31N4O2(M+H+)의 계산치 347.2442, 실측치 347.2438.
실시예 33
2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산
아다만탄
-2-
일아마이드
개인 화학실험용 극초단파 처리 시험관(바이오타지 AB, 스웨덴)에 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 36, 100mg, 0.30mmol), 피라졸(41mg, 0.60mmol), KF(35mg, 0.60mmol) 및 DMSO(2ml)을 충분히 혼합하였다. 상기 시험관을 격벽으로 밀봉하고, 20분동안 230℃에서 개인 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 150W 극초단파를 조사하였다. 반응 혼합물을 에틸 아세테이트와 물 사이에서 분배시키고, 수성 상을 에틸 아세테이트로 3회 추출하였다. 유기 상을 합하고, 진공에서 농축시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드(45mg, 41%)를 제공하였다. 질량 스펙트럼: m/z: 368.2(M+1).
실시예 34
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드
1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(중간물질 9, 2g, 9.87mmol)을 무수 다이클로로메테인(40ml) 및 무수 DMF(10ml)의 혼합물에 용해시켰다. DIPEA(10.3ml, 59.1mmol) 및 TSTU(3.6g, 10.9mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 4-아미노-아다만탄-1-올(1.65g, 9.9mmol)을 첨가하였다. 4시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기 상을 합하여 진공하에서 건조시켰다. 조질의 혼합물을 0 내지 60% 에틸 아세테이트/헥세인의 구배, 이어서 60% 에틸 아세테이트/헥세인으로 용출시키는 실리카 크로마토그래피로 먼저 정제하고, 이어서 25 내지 50% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 추가로 정제하여서 시스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(실시예 34, 900mg, 26%, 질량 스펙트럼: m/z: 352.2(M+1)), 이어서 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(1400mg, 40%)를 제공하였다.
실시예 35
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만 탄-2-일)-아마이드
수소화 나트륨(오일중 60%, 420mg, 10.5mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(140ml)중 피라졸(714mg, 10.5mmol)의 용액에 첨가하고, 상기 혼합물을 1시간동안 40℃까지 가열하였다. 트랜스-5-클로로-1-3급-부틸-1H-피라졸-4-카르복실산 에틸 에스테르 (5-하이드록시-아다만탄-2-일)-아마이드(실시예 34, 1.89g, 5.4mmol)를 첨가하고, 상기 혼합물을 밤새 110℃에서 가열하고, 이어서 냉각시켰다. 물 및 에틸 아세테이트를 첨가하고, 유기 층을 분리하고, 수성 상을 EtOAc로 3회 추출하였다. 유기 상을 합하여 진공에서 농축시키고, 잔류물을 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 예비 HPLC에 의해 정제하여서 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(500mg, 24%)를 제공하였다. 질량 스펙트럼: m/z: 384.2(M+1).
에틸-3,3-다이에톡시프로피온에이트로부터 출발하여 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 제조하기 위한 바람직한 방법이 하기에 개략되어 있다.
1 단계: 2-포르밀-3-옥소-프로피온산 에틸 에스테르
에틸 3,3-다이에톡시프로피온에이트(100g, 525.7mmol)를 실온에서 THF(360ml)에 용해시켰다. 에틸 포름에이트(175.1ml, 2.1mol)를 실온에서 첨가하였다. 용액을 얼음 중탕에서 0℃까지 냉각시키고, tBuOK(THF중 1M 용액, 1,156ml, 1.156mol)를 30분에 걸쳐 천천히 적하 깔때기를 통해 첨가하고, 내부 온도를 5℃ 미만으로 유지하였다. 색상이 무색에서 진한 오렌지색으로 즉시 변하였다. 반응 혼합물을 실온까지 가온시키고, 2시간동안 교반하였다. 반응물을 18시간동안 실온에서 교반시켰다. 반응 혼합물을 진공에서 농축시키고, 용매 1ℓ를 제거하였다. 백색 고형물이 포함되어 있는 나머지 갈색 용액을 얼음 중탕에서 냉각시키고, 염산(6N, 200ml)을 첨가하여 pH 3으로 조정하고, 그 동안 내부 온도를 20℃ 미만으로 유지하였다. 이어서, 생성된 황갈색 현탁액을 실온까지 가온시키고, 1시간동안 교반하였다. 추가적인 용매 700ml를 실온에서 진공하에 제거하였다. 물(400ml)을 첨가하여서 백색 고형물을 전부 용해시키고, 에틸 아세테이트(500ml)를 첨가하고, 혼합물을 분별 깔때기로 옮겼다. 수성 층을 에틸 아세테이트(200ml)로 1회 추출하였다. 유기 추출물을 합하여 염수(100ml)로 1회 세척하였다. MgSO4상에서 건조시키고 진공에서 농축시킨 후에, 2-포르밀-3-옥소-프로피온산 에틸 에스테르(75.85g)를 황색 오일로 수득하였다.
2 단계: 1-3급-부틸-1H-피라졸-4-카르복실산
포르밀-3-옥소-프로피온산 에틸 에스테르(75.85g, 525.6mmol)를 실온에서 에탄올(1ℓ)에 용해시켰다. 3급-부틸하이드라진 하이드로클로라이드(65.5g, 525.6mmol)를 실온에서 첨가하고, 반응 온도를 점차 32℃까지 상승시켰다. 이어서, 플라스크를 얼음 중탕에 놓아 다시 20℃로 냉각시켰다. t-부틸하이드라진이 완전히 용해되는데 약 1시간이 걸렸다. 용액을 3시간동안 실온에서 교반하였다. 반응 혼합물을 얼음 중탕에서 냉각시켰다. 수산화나트륨(4N, 152.4g)을 첨가하여 염산을 중화시켰다. 이어서, 대부분의 에탄올을 진공에서 제거하고, 메탄올(300ml), 이어서 추가적인 수산화나트륨(4N, 304.8g, 1.05mol)을 첨가하였다. 내부 온도를 점차 32℃까지 상승시켰다. 이어서, 반응 플라스크를 물 중탕에 놓아서 다시 실온으로 냉각시키고, 반응물을 실온에서 18시간동안 교반하였다. 이어서, 물 중탕 온도를 30℃ 미만으로 하면서 메탄올(300ml)을 진공에서 제거하였다. 이어서, 반응 혼합물을 0℃로 냉각시키고, 염산(6N, 190ml)을 천천히 첨가하여 내부 온도를 15℃ 미만으로 유지시켰다. 상기 용액을 pH 2로 조정하였다. 생성된 현탁액을 얼음 중탕에서 2시간동안 교반하고, 고형물을 여과하였다. 2.5일동안 진공에서 60℃에서 건조한 후에, 회백색 고형물인 1-3급-부틸-1H-피라졸-4-카르복실산(56.06g)을 수거하였다. 모액을 다이클로로메테인(200ml x 3)으로 3회 추출하였다. 유기층을 합하여 염수(100ml)로 1회 세척하고, 황산 마그네슘상에서 건조시켰다. 진공에서 농축하고 건조시킨 후에, 황색 고형물 16.5g을 수거하였다. 조질의 물질을 고온 이소-프로필 아세테이트(25ml) 및 헵테인(25ml)에서 결정화하였다. 실온으로 냉각한 후에, 고형물을 여과하고, 케이크(cake)를 이소프로필 아세테이트 및 헵테인의 혼합된 용매(1/1 (v/v, 14ml))로 세척하고, 5시간동안 진공에서 60℃로 오븐에서 건조시켰다. 1-3급-부틸-1H-피라졸-4-카르복실산의 제 2 수확물(7g)을 백색 고형물로 수거하였다.
3 단계: 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산
3급-부틸-1H-피라졸-4-카르복실산(5g, 29.73mmol)을 실온에서 테트라하이드로푸란(50ml)에 용해시켰다. 별도의 플라스크에 n-부틸리튬(헥세인중 2.5M 용액, 29.73ml, 74.33mmol)을 첨가하고, -15℃로 냉각시켰다. 1-3급-부틸-1H-피라졸-4-카르복실산 용액을 n-부틸리튬 용액에 적가하고, 내부 온도를 -10℃ 미만으로 유지하였다. 전체 첨가 시간은 30분동안 지속되었다. 생성된 갈색빛 현탁액을 교반하고, 40분동안 -10℃ 내지 -15℃로 유지시켰다. 이어서, 반응물을 -15℃ 내지 -20℃로 냉각시켰다. 내부 온도를 -10℃ 미만으로 유지시키면서 테트라하이드로푸 란(50ml)중 헥사클로로에테인(14.08g, 59.46mmol)의 용액을 적가하였다. 전체 첨가 시간은 20분이 지속되었다. 첨가후에, 생성된 암갈색 용액을 30분동안 -10℃ 내지 -15℃에서 교반하고, 1시간에 걸쳐 실온까지 가온시켰다. 이어서, 반응 혼합물을 15℃로 냉각시키고, 내부 온도를 20℃ 미만으로 유지시키면서 물(50ml)을 천천히 첨가하였다. 유기 용매 120ml를 25℃ 물 중탕에서 감압하에 증류하여서 현탁액이 되도록 하였다. 헵테인(50ml)을 첨가하여 투명한 갈색 2상 용액이 되도록 하였다. 15분동안 실온에서 교반한 후에, 수성 층(pH 11.8)을 분리하였다. 유기 층을 NaOH(1N, 20ml)로 1회 추출하였다. 수성 상을 합하여 헵테인(25ml)으로 세척하고, 얼음 중탕에서 냉각시켰다. 내부 온도를 20℃ 미만으로 유지시키면서 염산(6N)을 첨가하여 pH 2로 조정하였다. 현탁액을 1시간동안 0 내지 5℃로 얼음 중탕에서 교반하고, 고형물을 여과하고 물(40ml)로 세척하였다. 18시간동안 60℃로 진공에서 건조한 후에, 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(5.28g)을 연황색 고형물로 수득하였다.
4 단계: 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드
3급-부틸-5-클로로-1H-피라졸-4-카르복실산(5g, 24.67mmol)을 실온에서 톨루엔(50ml)에 현탁시켰다. 다이메틸포름아마이드(12㎕)를 첨가하고, 반응 플라스크를 물 중탕에 놓았다. 현탁액에 옥살릴 클로라이드(3.3ml, 37mmol)를 10분에 걸쳐 적가하였다. 약간의 발열이 있어서, 내부 온도가 21℃에서 23℃로 상승하였다. 현탁액을 실온에서 5시간동안 교반시켰다. 톨루엔(25ml)을 21℃ 중탕 온도에서 진 공에서 제거하여서 과량의 옥살릴 클로라이드를 제거하였다. 생성된 톨루엔 용액중 아실 클로라이드에 테트라하이드로푸란(25ml)을 첨가하여서 투명한 진한 오렌지색 용액을 만들었다. 별도의 반응 플라스크에 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드 염(5.28g, 25.91mmol, 중간물질 2) 및 수산화나트륨 용액(1N, 49.34ml, 49.34mmol)을 첨가하여서 유백색 용액을 제공하였다. 이 용액을 물 중탕에 놓았다. 상기 아실 클로라이드 용액을 적하 깔때기를 통해 수용액에 20분에 걸쳐 첨가하였고, 그 동안 내부 온도를 25℃ 미만으로 유지하였다. 첨가후에, 생성된 현탁액을 18시간동안 실온에서 교반시켰다. 고형물을 여과하고, 18시간동안 진공에서 60℃로 건조시켰다. 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(5.92g)를 백색 고형물로 수거하였다. 모액에 헵테인(50ml)을 첨가하고, 생성된 현탁액을 1시간동안 실온에서 교반하였다. 고형물을 다시 여과하였다. 18시간동안 진공에서 60℃로 건조한 후에, 제 2 수확물 1.7g을 수거하였다. HPLC 순도는 96.92%이었다.
5 단계: 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
3급-부틸-5-클로로-1H-피라졸-4-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드(20g, 56.84mmol) 및 피라졸(7.74g, 113.7mmol)을 N-메틸피롤리딘온(400ml)에 첨가하고, 실온에서 교반하였다. 수산화나트륨 용액(50%, 18.19g, 227.4mmol)을 첨가하였다. 현탁액을 120℃까지 가열하여서 황색 용액을 제공하였다. 이어서, 반응물을 10시간동안 120℃에서 가열하였다. 추가적인 피라졸(3.87g, 56.84mol) 및 수산화나트륨 용액(50%, 4.55g, 56.84mmol)을 첨가하였다. 반응물을 6시간동안 120℃에서 지속하였다. 이어서, 반응 혼합물을 얼음 중탕에서 5℃까지 냉각시켰다. 물(500ml) 및 포화된 염화 암모늄 용액(500ml)을 첨가하고, 그 동안 내부 온도를 20℃ 미만으로 유지하였다. 생성된 현탁액을 2시간동안 얼음 중탕에서 교반하고, 이어서 고형물을 여과하고, 물(300ml)로 세척하고, 18시간동안 진공에서 50℃로 오븐에서 건조시켰다. 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(16.81g)를 백색 고형물로 수득하였다.
실시예 36
3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
3급-부틸-5-클로로-1H-피라졸-4-카르복실산(중간물질 9, 0.5g, 2.47mmol)을 무수 다이클로로메테인(12ml) 및 무수 DMF(3ml)의 혼합물에 용해시켰다. DIPEA(2.6ml, 14.9mmol) 및 TSTU(0.9g, 2.7mmol)을 상기 혼합물에 첨가하였다. 혼합물을 1시간동안 교반한 후에, 활성 에스테르의 발생을 LC-MS에 의해 검출하였다. 이어서, 2-아미노아다만테인 하이드로클로라이드(0.44g, 2.34mmol)를 첨가하였다. 2시간 더 지난 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로 로메테인으로 2회 추출하였다. 유기 상을 합하여 진공하에서 건조시키고, 10 내지 100% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(650mg, 83%)를 제공하였다. 질량 스펙트럼: m/z: 336.2(M+1).
실시예 37
3급-부틸-5-(3-하이드록시-피롤리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
1 내지 3 단계:
중간물질 9에 대해 이전에 기재된 절차에 따라 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산을 제조하였다.
4 단계: 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드의 제조
실온에서 N,N-다이메틸포름아마이드/메틸렌 클로라이드(1:4 비, 20ml)중 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(3.040g, 15.0mmol)의 교반중인 용액에 다이이소프로필에틸아민(21.2ml, 120.4mmol)을 첨가하였다. 이어서, TSTU(5.420g, 18.0mmol)을 첨가하였다. 생성된 혼합물을 2시간동안 실온에서 교반하고, 이어서 2-아다만틸아민 하이드로클로라이드(2.844g, 15.0mmol)를 첨가하였다. 혼합물을 실온에서 주말동안 교반시키고, 이어서 진공에서 농축시켰다. 잔류물을 에틸 아세테이트 및 물 사이에서 분배시켰다. 유기층을 염수로 세척하고, 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하였다. 생성된 연황색 고무(gum)를 다이에틸 에테르로 분쇄시켜서 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(4.02g, 80%)를 백색 분말로 제공하였다.
5 단계: 1-3급-부틸-5-(3-하이드록시-피롤리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드의 제조
N-메틸피롤리딘온(1ml)중 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 36, 101mg, 0.30mmol) 및 피롤리딘-3-올(+/-)(0.25ml, 3.0mmol)의 혼합물을 4시간동안 극초단파 조사하에 밀봉된 바이알에서 250℃까지 가열하였다. 혼합물을 실온으로 냉각시키고, 조질의 생성물을 역상 HPLC에 의해 정제하여서 1-3급-부틸-5-(3-하이드록시-피롤리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(25mg, 22%)를 회백색 고형물로 제공하였다. ES-HRMS m/e C22H35N4O2(M+H+)의 계산치 358.2602, 실측치 358.2602.
실시예 38
3급-부틸-5-(4-하이드록시-피페리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 37, 5 단계에 기재된 절차에 따라 극초단파 조사하에 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 36, 101mg, 0.30mmol) 및 피페리딘-4-올(303mg, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 1-3급-부틸-5-(4-하이드록시-피페리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(14mg, 12%)를 회백색 분말로 제공하였다. ES-HRMS m/e C23H37N4O2(M+H+)의 계산치 357.2649, 실측치 357.2650.
실시예 39
5-아제판-1-일-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일 아마이드(실시예 5, 60mg, 0.20mmol) 및 아제페인(0.23ml, 2.0mmol)의 혼합물을 250℃까지 가열하고 역상 HPLC에 의해 정제한 후에, 5-아제판-1-일-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(41mg, 58%)를 회백색 분말로 제공하였다. ES-HRMS m/e C21H33N4O(M+H+)의 계산치 357.2649, 실측치 357.2644.
실시예 40
메틸-5-티오모폴린-4-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 14에 기재된 절차에 따라 극초단파 조사하에 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일 아마이드(실시예 5, 60mg, 0.20mmol) 및 티오모폴린(0.20ml, 2.0mmol)의 혼합물을 250℃까지 가열하고 역상 HPLC에 의해 정제한 후에, 1-메틸-5-티오모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(15mg, 21%)를 연갈색 분말로 제공하였다. ES-HRMS m/e C19H29N4OS4(M+H+)의 계산치 361.2057, 실측치 361.2053.
실시예 41
3급-부틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산
아다만탄
-2-
일아마이드
실시예 37, 5 단계에 기재된 절차에 따라 극초단파 조사하에 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(실시예 36, 101mg, 0.30mmol) 및 피페리딘(0.30ml, 3.0mmol)의 혼합물을 가열하고 역상 HPLC에 의해 정제한 후에, 1-3급-부틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드(19mg, 16%)를 회백색 분말로 제공하였다. ES-HRMS m/e C23H37N4O(M+H+)의 계산치 385.2962, 실측치 385.2958.
실시예 42
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-플루오로-아다만탄-2-일)-아마이드
1 단계: 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산의 제조
메탄올/물(1:1 비, 50ml)중 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(3.000g, 11.4mmol)의 교반중인 혼합물에 실온에서 수산화 리튬(0.383g, 16.0mmol)을 첨가하였다. 혼합물을 2시간동안 환류 온도까지 가열하고, 실온으로 냉각하고, 원래 부피의 약 1/2로 농축시켰다. 생성된 혼합물을 1N HCl에 의해 약 pH 1로 산성화시키고, 메틸렌 클로라이드로 추출하였다. 추출물을 황산 나트륨상에서 건조시키고, 여과하고, 농축시켜서 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(2.47g, 92%)을 제공하였다.
2 단계: 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 제조
실온에서 N,N-다이메틸포름아마이드/메틸렌 클로라이드(1:4 비, 15ml)중 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(2.334g, 9.88mmol)의 교반중인 용액에 다이이소프로필에틸아민(9.00ml, 51.13mmol)을 첨가하였다. 이어서, TSTU(5.420g, 18.0mmol)을 첨가하였다. 생성된 혼합물을 2시간동안 실온에서 교반하고, 이어서 2-아다만틸아민(1.654g, 9.89mmol)을 첨가하였다. 혼합물을 실온에서 밤새 교반하고, 이어서 진공에서 농축시켰다. 잔류물을 에틸 아세테이트 및 물 사이에서 분배시켰다. 유기층을 0.5N HCl, 포화 중탄산나트륨, 이어서 염수에 의해 차례로 세척하고, 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 생성물을 연갈색 고형물로 제공하였다. 컬럼 크로마토그래피(RediSep-120g 실리카 겔, 10% 내지 100% 에틸 아세테이트/헥세인)에 의해 정제하여서 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 목적하는 트랜스-이성체(1.23g, 32%)를 백색 고형물로 제공하였다. 생성된 연황색 고무를 다이에틸 에테르로 분쇄하여서 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산-아다만탄-2-일아마이드(4.02g, 80%)를 백색 분말로 제공하였다. 시스-이성체를 또한 단리시켰다(1.58g, 41%).
3 단계: 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-플루오로-아다만탄-2-일)-아마이드
질소하에 0℃로 냉각된 무수 메틸렌 클로라이드(2ml)중 트랜스-1-3급-부틸- 5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(트랜스-이성체)(60mg, 0.16mmol)의 교반중인 용액에 DAST 시약을 주사기를 통해 적가하였다. 이어서, 혼합물을 실온까지 가온하였다. 1시간후에, 반응 혼합물을 포화 중탄산 나트륨 용액(0.5ml)으로 반응 중지시켰다. 생성된 혼합물을 메틸렌 클로라이드로 희석시켰다. 유기 층을 황산 나트륨상에서 건조시키고, 여과하고, 농축시켜서 조질의 생성물을 제공하였다. 역상 HPLC 정제하여서 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-플루오로-아다만탄-2-일)-아마이드(28mg, 45%)를 백색 고형물로 제공하였다. ES-HRMS m/e C19H26F4N3O(M+H+)의 계산치 385.2962, 실측치 385.2963.
실시예 43
트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드
1 단계: 트랜스-(5-하이드록시-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르
다이클로로메테인(800ml)중 4-아미노-아다만탄올 하이드로클로라이드(중간물질 2, 26.48g, 130.0mmol)의 슬러리에 트리에틸아민(92.0ml, 656.8mmol)을 첨가하였다. 이 혼합물에 FMOC-OSu(65.78g, 195mmol)을 15분동안 여러 번으로 나누어 첨가하였다. 생성된 슬러리를 실온에서 아르곤하에 교반하였다. 20시간후에, 트리 에틸아민(20ml, 199mmol), FMOC-OSu(21.92g, 65.0mmol) 및 다이클로로메테인(300ml)을 첨가하엿다. 추가적인 20시간후에, 반응 혼합물을 0℃로 냉각시키고, 4N HCl(400ml)을 교반하에 천천히 첨가하고, 실온으로 가온시켰다. 유기 상을 분리하고, 물(300ml), 포화 중탄산 나트륨(300ml) 및 포화 염화나트륨 용액(300m)에 의해 차례로 세척하였다. 유기 층을 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 생성물 86.8g을 제공하였다. 이 물질을 헥세인(2 x 300ml)에 의해 2회 분쇄하고, 고형 물질을 여과하고, 헥세인(총 300ml)에 의해 여러 회 세척하고, 공기 건조하여서 트랜스-(5-하이드록시-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르 40.6g를 회백색 고형물로 제공하였다.
2 단계: 트랜스-(5-아세틸아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르
0℃로 냉각시킨 트랜스-(5-하이드록시-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르(11.69g, 30.0mmol), 아세토니트릴(23ml) 및 빙초산(30ml)의 교반중인 슬러리에 진한 황산(30ml)을 20분에 걸쳐 천천히 첨가하였다. 이어서, 혼합물을 실온으로 가온시키고, 30시간동안 교반하고, 이어서 밤새(20시간) 냉동고에 보관하였다. 이어서, 반응 혼합물을 조각 얼음/물(500ml)에 붓고, 2시간동안 실온으로 가온시켰다. 생성된 혼합물을 에틸 아세테이트에 의해 추출하였다. 추출물을 물, 포화 중탄산나트륨 용액, 최종적으로 포화 염화나트륨 용액으로 차례로 세척하였다. 이어서, 추출물을 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 트랜스-(5-아세틸아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르 10.23g을 황색 포움으로 제공하였다.
3 단계: 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드
무수 다이메틸포름아마이드(30ml)중 트랜스-(5-아세틸아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르(10.21g, 23.7mmol)의 교반중인 용액에 피페리딘(8ml)을 첨가하였다. 45분후에 반응 혼합물을 진공에서 농축하였다. 생성된 잔류물을 물(100ml)에 현탁시키고, 1시간동안 실온에서 교반하였다. 생성된 슬러리를 여과하고, 고형 물질을 물 100ml에 의해 세척하였다. 여액을 합하고, 세척액을 분별 깔때기로 옮기고, 다이에틸 에테르로 세척하였다. 이어서, 수성 상을 진공에서 농축하여서 점성의 액체를 제공하고, 이를 동결 건조하여서 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드 3.28g를 희미한 황색 고형물로 제공하였다. 이 물질을 추가의 정제없이 사용하였다.
트랜스-4-아미노-아다만탄-1-올-하이드로클로라이드(중간물질 2)로부터 출발하여 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드를 제조하는 바람직한 방법이 하기에 기재되어 있다.
1 단계: N-(5-아세틸아미노-아다만탄-2-일)-2,2,2-트리플루오로-아세트아마이드
트랜스-4-아미노-아다만탄-1-올-하이드로클로라이드(120g, 589.1mmol)를 반응 플라스크에 첨가하고, 이어서 아세토니트릴(1.5ℓ) 및 트리플루오로아세트산(1ℓ, 12.85mol)을 첨가하였다. 6일동안 실온에서 교반한 후에, 반응 혼합물을 진공에서 농축시켰다. 이어서, 내용물을 에틸 아세테이트(4ℓ)에 넣고, 포화 중탄산나트륨 용액(2 x 3ℓ) 및 물(1 x 3ℓ)로 차례로 세척하였다. 이어서, 유기상을 분리 하고, 소결 깔때기를 통해 여과하였다. 여액을 진공에서 농축하여서 고형물 150g을 제공하였다. 상기 고형물을 에틸 아세테이트(1ℓ)에 넣고, 1시간동안 교반하였다. 농축하는 동안, 용매를 헵테인(1ℓ)으로 교환하고, 생성된 현탁액을 여과하였다. 고형물을 에틸 아세테이트-헵테인의 혼합 용매(1/4, 500ml)로 세척하였다. 이어서, 고형물을 여과하고, 18시간동안 진공에서 45℃로 오븐에서 건조시켜서 N-(5-아세틸아미노-아다만탄-2-일)-2,2,2-트리플루오로-아세트아마이드(135g)를 백색 고형물로 제공하였다.
2 단계: N-(4-아미노-아다만탄-1-일)-아세트아마이드 하이드로클로라이드
N-(5-아세틸아미노-아다만탄-2-일)-2,2,2-트리플루오로-아세트아마이드(135g, 443.6mmol)을 반응 플라스크에 첨가하고, 이어서 에탄올(2ℓ) 및 수산화나트륨(37g, 913.8mmol)을 첨가하였다. 반응 혼합물을 50 내지 55℃까지 가열하고, 주말동안 교반하였다. 이어서, 반응 혼합물을 실온으로 냉각하고, 빙초산(100ml, 1.748mmol)을 첨가하였다. 이어서, 생성된 혼합물을 진공에서 농축시켜서 백색 고형물을 제공하였다. 고형물을 에테르(1ℓ)에 현탁시키고, 1시간동안 교반하였다. 이어서, 고형물을 여과하고, 에테르(200ml)로 세척하고, 45℃로 18시간동안 오븐에서 건조시켜서 고형물 240g을 제공하였다. 고형물을 메탄올(500ml)에 넣었다. 교반하에, 염산(다이옥세인중 4N 용액, 500ml)을 첨가하고, 이어서 에테르 2ℓ을 적가하였다. 이어서, 혼합물을 진공에서 농축시켜서 백색 고형물을 제공하였다. 고형물을 메탄올(1ℓ)에 넣고, 1시간동안 교반하였다. 고형물을 여과하고, 폐기하였다. 여액이 결정으로 석출되기 시작할 때까지 여액을 진공에서 농축시켰다(약 500ml). 비중이 적은(light) 현탁액을 플라스크로 옮겼다. 교반하에, 에테르(2ℓ)를 적가하여 백색 고형물의 비중이 큰(heavy) 현탁액을 제공하였다. 고형물을 여과하고, 에테르로 세척하였다. 45℃로 18시간동안 오븐에서 건조시킨 후에, N-(4-아미노-아다만탄-1-일)-아세트아마이드 하이드로클로라이드(96g)를 백색 고형물로 수득하였다.
실시예 44
트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드
1 단계: 트랜스-[5-(2-클로로-아세틸아미노)-아다만탄-2-일]-카밤산 9H-플루오렌-9-일메틸 에스테르
0℃로 냉각된 트랜스-(5-하이드록시-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르(11.69g, 30.0mmol), 클로로아세토니트릴(20ml) 및 빙초산(25ml)의 교반중인 혼합물에 진한 황산(25ml)을 첨가하였다. 생성된 혼합물을 실온으로 가온시켰다. 7시간후에, 혼합물을 -20℃로 밤새 냉동고에서 보관하고, 이어서 실온으로 6시간동안 가온시켰다. 이어서, 반응 혼합물을 조각 얼음/물(600ml)에 붓고, 교반하에 3시간동안 실온으로 가온시켰다. 이어서, 혼합물을 에틸 아세테이트(550ml)에 의해 추출하였다. 추출물을 물, 포화 중탄산 나트륨 및 포화 염화나트륨 용액으로 차례로 세척하였다. 이어서, 유기층을 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 트랜스-[5-(2-클로로-아세틸아미노)-아다만탄- 2-일]-카밤산 9H-플루오렌-9-일메틸 에스테르 6.18g을 황색 포움으로 제공하였다.
2 단계: 트랜스-(5-아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르
에탄올(10ml)중 트랜스-[5-(2-클로로-아세틸아미노)-아다만탄-2-일]-카밤산 9H-플루오렌-9-일메틸 에스테르(1.017g, 2.19mmol)의 교반중인 용액에 티오우레아(206mg, 2.67mmol), 이어서 빙초산(2ml)을 첨가하였다. 생성된 용액을 밀봉된 시험관에서 21시간동안 80℃까지 가열하고, 이어서 실온에서 72시간동안 정치시켰다. 이어서, 혼합물을 건조 질소 스트림하에서 1/2 부피로 농축시킨 후에 다이에틸 에테르에 현탁시키고, 고형 물질을 여과에 의해 제거하였다. 고형물을 다이에틸 에테르로 세척하여서 트랜스-(5-아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르 1.14g를 백색 고형물로 제공하였다.
3 단계: 트랜스-(5-메테인설폰일아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일 메틸 에스테르
에틸 아세테이트(100ml)중 트랜스-(5-아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일메틸 에스테르(991mg, 2.33mmol)의 교반중인 용액에 포화 중탄산나트륨 용액(75ml), 이어서 물(25ml)을 첨가하였다. 이어서, 메테인설폰일클로라이드(2.0ml, 25.7mmol)를 5분동안 적가하고, 1.5시간동안 교반을 지속하였다. 이 때, 탄산나트륨(5.83g)을 반응 혼합물에 천천히 첨가하고, 이어서 메테인설폰일 클로라이드(2.0ml)를 첨가하고, 혼합물을 20시간동안 실온에서 교반하였다. 탄산나트륨(18.2g), 이어서 메테인설폰일 클로라이드(4.0ml)를 천천히 첨가하는 것을 반복하고, 혼합물을 다시 24시간동안 실온에서 교반하였다. 유기층을 3N 염산 용액, 이어서 포화 중탄산나트륨 용액, 최종적으로 포화 염화나트륨 용액으로 여러회 세척하였다. 유기층을 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축시켜서 조질의 생성물 722mg을 회백색 고형물로 제공하였다. 조질의 생성물을 크로마토그래피(ISCO 세트 시스템(companion system), RS-40g 실리카 겔 컬럼, 용출액: 에틸 아세테이트/헥세인; 0 내지 100% 구배; 40ml/분 유속)로 추가 정제하여서 트랜스-(5-메테인설폰일아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일 메틸 에스테르 660mg을 백색 포움으로 제공하였다.
4 단계: 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드
N,N-다이메틸포름아마이드(4ml)중 트랜스-(5-메테인설폰일아미노-아다만탄-2-일)-카밤산 9H-플루오렌-9-일 메틸 에스테르(1.73g, 3.71mmol)의 용액에 피페리딘(1.0ml)을 첨가하였다. 몇 분후에 혼합물이 점성을 갖게 되었고, 다이메틸포름아마이드 4ml 및 피페리딘 1.0ml을 더 첨가하여 교반을 용이하게 하였다. 생성된 슬러리를 실온에서 2시간동안 교반하고, 이어서 진공에서 농축시켰다. 잔류물을 다이에틸 에테르 및 물 사이에서 분배시켰다. 이어서, 수성층을 가온하면서 진공에서 농축시키교, 연황색 지성 잔류물을 동결 건조시켜서 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드 741mg을 희미한 황색 고형물로 제공하였다.
실시예 45
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
0℃로 냉각된 아세토니트릴(3ml) 및 빙초산(0.10ml)중 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(103mg, 0.30mmol, 실시예 9에서 제조됨)의 교반중인 용액에 진한 황산(0.10ml)을 적가하였다. 이어서, 얼음 중탕을 제거하고, 혼합물을 실온으로 가온시켰다. 4시간후에, 빙초산(0.5ml) 및 진한 황산(0.50ml)을 첨가하고, 혼합물을 실온에서 70시간동안 교반하였다. 이어서, 반응 혼합물을 건조 질소 스트림하에서 농축시켜서 아세토니트릴을 제거하고, 이어서 얼음(15ml)을 반응 혼합물에 첨가하였다. 혼합물을 1시간동안 실온에서 교반시켰다. 이어서, 혼합물을 여과하고, 백색 고형물을 포화 중탄산 나트륨 용액, 이어서 물로 여러 번 세척하고, 고형물을 밤새 공기 건조시켜서 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 93mg을 백색 고형물로 제공하였다. ES-HRMS m/e C20H26N6O2Na(M+Na+)의 계산치 405.2009, 실측치 405.2007
실시예 46
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2- 일)-아마이드
N,N-다이메틸포름아마이드(1.0ml)중 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(중간물질 9; 134mg, 0.66mmol)의 용액에 N,N-다이이소프로필에틸아민(0.63ml, 3.60mmol), 이어서 TSTU(253mg, 0.84mmol)을 첨가하였다. 1시간후에 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨, 125mg, 0.60mmol)를 첨가하고, 혼합물을 실온에서 18시간동안 교반하였다. 이어서, 반응 혼합물을 건조 질소 스트림하에서 농축시키고, 에틸 아세테이트에 넣고, 0.5N 염산, 포화 중탄산 나트륨 용액, 물 및 포화 염화나트륨 용액으로 차례로 세척하였다. 유기층을 건조(황산 나트륨)시키고, 여과하고, 농축시켜서 조질의 베이지색 고형물을 제공하였다. 조질의 생성물을 역상 HPLC로 정제하여서 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 104mg을 백색 고형물로 제공하였다. ES-HRMS m/e C20H30N4O2Cl(M+H+)의 계산치 393.2052, 실측치 393.2053.
실시예 47
트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드
실시예 46에 기재된 절차에 따라 TSTU을 이용하여 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산(중간물질 9; 100mg, 0.50mmol) 및 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(실시예 44에서 제조됨, 110mg, 0.45mmol)을 커플링하고 역상 HPLC 후에 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드 63mg을 백색 고형물로 제공하였다. ES-HRMS m/e C19H30N4O3ClS(M+H+)의 계산치 429.1722, 실측치 429.1722.
실시예 48
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
실시예 46에 기재된 절차에 따라 TSTU을 이용하여 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 7; 52mg, 0.26mmol) 및 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨, 125mg, 0.60mmol)을 커플링하고 역상 HPLC에 의해 정제한 후에 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 43mg을 백색 분말로 제공하였다. ES-HRMS m/e C21H30N4O2F3(M+H+)의 계산치 427.2316, 실측치 427.2314.
실시예 49
트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드
실시예 46에 기재된 절차에 따라 TSTU을 이용하여 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 7; 62mg, 0.22mmol) 및 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(실시예 44에서 제조됨, 61mg, 0.25mmol)을 커플링하고 역상 HPLC에 의해 정제한 후에 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드 44mg을 백색 분말로 제공하였다. ES-HRMS m/e C20H30N4O3F3S(M+H+)의 계산치 463.1985, 실측치 463.1982.
실시예 50
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
실온에서 아르곤하에 N,N-다이메틸포름아마이드(25.0ml)중 수소화나트륨(601mg, 15.03mmol)의 교반중인 용액에 피라졸(1.255g, 18.06mmol)을 첨가하였다. 수소 기체발생이 중지되면, 혼합물을 1시간동안 밀봉 압력 시험관에서 40℃까지 가온하였다. 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(실시예 46에서 제조됨, 589mg, 1.50mmol)를 첨가하고, 생성된 혼합물을 밀봉 압력 시험관에서 17시간동안 110℃까지 가열하였다. 이어서, 반응 혼합물을 가온하에 진공에서 농축시켰다. 잔류물을 물(50ml)에 현탁시키고, 1N 염산에 의해 pH 1로 산성화시키고, 물 100ml로 희석하였다. 이어서, 혼합물을 에틸 아세테이트로 추출하였다. 유기층을 포화 염화나트륨 용액으로 세척하고, 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축시켰다. 잔류물을 다이에틸 에테르에 의해 분쇄시켜서 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 593mg를 회백색 분말로 제공하였다. ES-HRMS m/e C23H33N6O2(M+H+)의 계산치 425.2660, 실측치 425.2660.
실시예 51
트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드
과량의 피라졸(102mg, 1.47mmol) 및 수소화나트륨(50mg, 1.24mmol)과 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드(실시예 47에서 제조됨, 50mg, 0.12mmol)의 반응하고, 메틸렌 클로라이드에 의해 산성화된 수성 혼합물을 추출하고, 이어서 다이에틸 에테르에 의해 조질의 생성물을 분쇄하여서 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드 51mg를 회백색 분말로 제공하였다. ES-HRMS m/e C22H33N6O3S(M+H+)의 계산치 461.2330, 실측치 461.2329.
실시예 52
트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
실시예 46에 기재된 절차에 따라 TSTU을 이용하여 1-메틸-5-클로로-1H-피라졸-4-카르복실산(CAS# 54367-66-7, 오크우드(Oakwood)에서 구입, 2.00g, 12.46mmol) 및 트랜스-4-아미노-아다만탄-1-올(중간물질 2, 2.84g, 14.00mmol)을 커플링 반응하고, 다이에틸 에테르에 의해 조질의 생성물을 분쇄한 후에 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 1.44g를 백색 고형물로 제공하였다.
2 단계: 트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
N-메틸피롤리딘온(10ml)중 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(500mg, 1.62mmol) 및 피페리딘(1.29ml, 13.0mmol)의 혼합물을 3시간동안 극초단파 조사하에 밀봉된 압력 시험관에서 250℃까지 가열하였다. 혼합물을 실온으로 냉각시키고, 과량의 피페리딘 대부분을 고 진공하에서 제거하였다. 생성된 용액을 역상 HPLC에 의해 정제하여서 트랜스-1-메 틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 545mg을 백색 분말로 제공하였다.
3 단계: 트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
실온에서 아세토니트릴(1.0ml) 및 빙초산(0.20ml)중 트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(70mg, 0.20mmol)의 교반중인 용액에 진한 황산(0.40ml)을 적가하였다. 22시간후에, 반응 혼합물을 포화 중탄산나트륨 용액으로 중화시켰다. 이어서, 혼합물을 에틸 아세테이트로 추출하고, 추출물을 건조(황산 나트륨)시키고, 여과하고, 진공에서 농축시켰다. 조질의 생성물을 역상 HPLC에 의해 정제하여서 트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 35mg를 백색 분말로 제공하였다. ES-HRMS m/e C22H34N5O2(M+H+)의 계산치 400.2707, 실측치 400.2708.
실시예 53
트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드
1 단계: 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-메틸-아다만탄-2-일)-아마이드
실시예 46에 기재된 절차에 따라 TSTU을 이용하여 1-메틸-5-클로로-1H-피라졸-4-카르복실산(CAS#54367-66-7, 오크우드로부터 구입, 80mg, 0.50mmol) 및 트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드(실시예 44에서 제조됨, 110mg, 0.45mmol)을 커플링 반응하고 역상 HPLC에 의해 조질의 생성물을 정제한 후에 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-메틸-아다만탄-2-일)-아마이드 60mg을 백색 고형물로 제공하였다.
2 단계: 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드
실시예 50에 기재된 절차를 이용하여 과량의 피라졸(71mg, 1.02mmol) 및 수소화나트륨(39mg, 0.97mmol)과 트랜스-5-클로로-1-메틸-1H-피라졸-4-카르복실산 (5-메틸-아다만탄-2-일)-아마이드(46mg, 0.12mmol)를 반응시키고 산성화된 수성 혼합물을 메틸렌 클로라이드로 추출하고, 이어서 다이에틸 에테르에 의해 조질의 생성물을 분쇄하여 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인 설폰일아미노-아다만탄-2-일)-아마이드 43mg를 회백색 분말로 제공하였다. ES-LRMS m/e C19H27N6O3S(M+H+)의 계산치 419, 실측치 419.
실시예 54
트랜스-1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 2-다이메틸아미노메틸렌-3-옥소-부티르산 메틸 에스테르
메틸 아세토아세테이트(5.0ml, 46.33mmol) 및 N,N-다이메틸포름아마이드 다이메틸아세탈(6.8ml, 47.95mmol)의 용액을 2.3시간동안 80℃까지 가열하였다. 이 때, 반응을 25℃로 냉각시키고, 이어서 진공에서 농축시켜서 2-다이메틸아미노메틸렌-3-옥소-부티르산 메틸 에스테르(7.43g, 94%)를 적색/흑색 고형물로 제공하였다. 이 물질을 추가의 정제없이 사용하였다.
2 단계: 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 메틸 에스테르
무수 에탄올(70ml)중 2-다이메틸아미노메틸렌-3-옥소-부티르산 메틸 에스테르(7.43g, 43.40mmol)의 용액을 3급-부틸하이드라진 하이드로클로라이드(5.52g, 44.29mmol) 및 아세트산 나트륨(4.42g, 53.88mmol)으로 처리하였다. 생성된 혼합 물을 18시간동안 90℃까지 가열하였다. 이 때, 반응을 25℃로 냉각시켰다. 이동을 돕기 위한 다이클로로메테인(50ml)을 이용하여 반응물을 얼음위에 부었다. 혼합물을 분별 깔때기로 옮기고, 이 때 상기 층들을 진탕시키고, 분리시켰다. 수성 층을 다이클로로메테인(1 x 50ml)으로 추가로 추출하였다. 유기물을 합하여 포화 중탄산나트륨 수용액(1 x 50ml), 물(1 x 50ml) 및 포화된 염화나트륨 수용액(1 x 50ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. ISCO 콤비플래시(120g 컬럼, 0 내지 10% 에틸 아세테이트/헥세인)하여서 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 메틸 에스테르(6.04g, 71%)를 황색 오일로 제공하였다.
3 단계: 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산
0℃로 냉각된 메탄올(6.8ml)중 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 메틸 에스테르(2.0g, 10.19mmol)의 용액을 4N 수산화나트륨 수용액(5.1ml, 20.4mmol)으로 적가 처리하였다. 반응물을 25℃로 천천히 가온하였다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 진공에서 농축시켜서 메탄올을 제거하였다. 잔류물을 물(25ml)로 희석하고, 이어서 에틸 아세테이트(1 x 25ml)로 추출하였다. 이어서, 수성 층을 3N 염산 수용액으로 pH 1로 산성화시켰다. 생성된 침전물을 여과에 의해 수거하고, 물 및 헥세인으로 세척하고, 이어서 진공에서 건조시켜서 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산(1.43g, 78%)을 백색 고형물로 제공하였다.
4 단계: 트랜스-1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만 탄-2-일)-아마이드
질소 분위기하에 N,N-다이메틸포름아마이드(8.0ml, 0.34M)중 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산(500mg, 2.74mmol), 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(590mg, 2.89mmol), 1-하이드록시벤조트리아졸(450mg, 3.33mmol) 및 O-(벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트(1.25g, 3.29mmol)의 용액을 0℃로 냉각시키고, 35분동안 0℃에서 교반하였다. 이 때, 반응물을 적하 깔때기를 통해 N,N-다이이소프로필에틸아민(1.9ml, 10.90mmol)과 함께 적가 처리하였다. 반응물을 점차 25℃까지 가온하였다. 반응물을 밤새 25℃에서 교반하였다. 이 때, 반응물을 0℃로 냉각시키고, 2N 수산화나트륨 수용액(4.2ml, 8.40mmol)으로 적가 처리하였다. 생성된 혼합물을 3시간동안 점차 25℃로 가온하였다. 이 때, 반응물을 다이클로로메테인(25ml)으로 처리하였다. 생성된 용액을 추가의 1.5시간동안 25℃로 교반하였다. 이 때, 반응물을 물(25ml) 및 다이클로로메테인(25ml) 사이에서 분배시켰다. 수성 층을 다이클로로메테인(1 x 25ml)으로 추가로 추출하였다. 유기물을 합하여 포화된 염화나트륨 수용액(1 x 25ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. ISCO 콤비플래시(40g 컬럼; 50 내지 100% 에틸 아세테이트/헥세인)하여 트랜스-1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(75.3mg, 8%)를 백색 고형물로 제공하였다. ES+-HRMS m/e C19H29N3O2(M+H+)의 계산치 332.2333, 실측치 332.2333.
유사한 방식으로, 하기 물질을 수득하였다.
4-메톡시-3-옥소-부티르산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 연갈색 고형물(494.6mg, 58.2%)로 제공하였다. ES+-HRMS m/e C20H31N3O3(M+H+)의 계산치 362.2438, 실측치 362.2437.
4,4,5,5,5-펜타플루오로-3-옥소-펜타노산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-펜타플루오로에틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(13.1mg, 29%)로 제공하였다. ES+-HRMS m/e C20H26F5N3O2(M+H+)의 계산치 436.2018, 실측치 436.2018.
5-메톡시-3-옥소-펜타노산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-(2-메톡시-에틸)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(389mg, 47%)로 제공하였다. ES+-HRMS m/e C21H33N3O3(M+H+)의 계산치 376.2595, 실측치 376.2595.
3-옥소-헥사노산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(698.2mg, 81.6%)로 제공하였다. ES+-HRMS m/e C21H33N3O2(M+H+)의 계산치 360.2646, 실측치 360.2645.
3-옥소-펜타노산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-에틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(683.9mg, 77.9%)로 제공하였다. ES+-HRMS m/e C20H31N3O2(M+H+)의 계산치 346.2489, 실측치 346.2490.
4-메틸-3-옥소-펜타노산 메틸 에스테르로부터 트랜스-1-3급-부틸-5-이소프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(94.5mg, 28%)로 제공하였다. ES+-HRMS m/e C21H33N3O2(M+H+)의 계산치 360.2646, 실측치 360.2646.
실시예 55
트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르
25℃에서 사염화탄소(12.2ml, 1.41M)중 1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 메틸 에스테르(3.38g, 17.22mmol)(실시예 54, 2 단계에 기재된 바와 같음)의 용액을 N-브로모숙신이마이드(3.10g, 17.41mmol)로 처리하였다. 반응 플라스크 에 환류 응축기를 장착시켰다. 장치를 알루미늄 호일로 싸고, 이어서 250와트 태양등으로 3시간동안 비추었다. 이 때, 반응물을 여과시키고, 사염화탄소로 세정하였다. 여액을 분별 깔때기로 옮기고, 물(1 x 50ml) 및 포화 염화나트륨 수용액(1 x 50ml)으로 세척하였다. 유기물을 황산 마그네슘상에서 건조시키고, 여과하고, 사염화탄소로 세정하고, 진공에서 연한 황색 오일이 되게 농축시켰다. ISCO 콤비플래시 크로마토그래피(120g, 0 내지 10% 에틸 아세테이트/헥세인)하여서 5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르(4.51g, 95%)를 투명 오일로 제공하였다. 상기 물질을 추가의 정제없이 사용하였다.
2 단계: 1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올(4.0ml, 0.2M)중 5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르(220mg, 0.79mmol)의 용액을 소듐 에톡사이드(65.4mg, 0.96mmol)로 처리하였다. 반응 혼합물을 2.5시간동안 교반하면서 90℃까지 가온하였다. 이 때, 반응물을 진공에서 농축시켰다. 잔류물을 에틸 아세테이트(75ml) 및 물(50ml) 사이에서 분배시켰다. 유기물을 포화 중탄산나트륨 수용액(1 x 50ml) 및 포화 염화나트륨 수용액(1 x 50ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켜서 1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 에틸 에스테르(102.8mg, 51%)를 오렌지색 오일로 제공하였다. 이 물질을 추가의 정제없이 사용하였다.
3 단계: 1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산
25℃에서 메탄올(0.5ml) 및 물(0.5ml)중 1-3급-부틸-5-에톡시메틸-1H-피라졸 -4-카르복실산 에틸 에스테르(99.8mg, 0.39mmol)의 용액을 수산화리튬 일수화물(20.2mg, 0.48mmol)로 처리하였다. 반응 혼합물에 환류 응축기를 장착시키고, 이어서 2시간동안 100℃까지 가열하였다. 이 때, 반응물을 진공에서 농축시켰다. 생성된 잔류물을 1N 염산 수용액에 의해 pH 1로 산성화시켰다. 탁한 혼합물이 발생되었다. 1N 수산화나트륨 수용액으로 처리하여 상기 물질을 염기성 pH로 만들었다. 이 용액을 에틸 아세테이트(1 x 10ml)로 추출하였다. 이들 유기물을 폐기하였다. 수성 층을 1N 염산 수용액으로 pH 1로 재산성화시켰다. 이 용액을 에틸 아세테이트(2 x 10ml)로 추출하였다. 이들 유기물을 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켜 1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산(77.5mg, 87%)을 황색 고형물로 제공하였다. 상기 물질을 추가의 정제없이 사용하였다.
4 단계: 트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산
질소 분위기하에 N,N-다이메틸포름아마이드(1.0ml, 0.34M)중 1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산(76.8mg, 0.33mmol), 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(71.3mg, 0.35mmol), 1-하이드록시벤조트리아졸(55.8mg, 0.41mmol) 및 O-(벤조트리아졸-1-일)-N,N,N',N'-테트라메틸우로늄 헥사플루오로포스페이트(155.1g, 0.40mmol)의 용액을 0℃로 냉각시키고, 35분동안 0℃에서 교반하였다. 이 때, 반응물을 N,N-다이이소프로필에틸아민(0.23ml, 1.34mmol)으로 적가처리하였다. 반응물을 25℃로 점차 가온시켰다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 0℃로 냉각시키고, 2N 수산화나트륨 수용액(0.55ml, 1.1mmol)으로 적가 처리하였다. 생성된 혼합물을 5시간동안 25℃까지 점차 가온시켰다. 이 때, 반응물을 다이클로로메테인(5ml)으로 처리하였다. 생성된 용액을 추가의 1.5시간동안 25℃로 교반하였다. 이 때, 반응물을 물(25ml) 및 다이클로로메테인(25ml) 사이에서 분배시켰다. 수성층을 다이클로로메테인으로 추가 추출하였다. 유기물을 합하여 포화 염화나트륨 수용액(1 x 25ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. ISCO 콤비플래시(4g 컬럼, 0.5 내지 4% 메탄올/다이클로로메테인)하여 트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(66.2mg, 52%)를 회백색 고형물로 제공하였다. ES+-HRMS m/e C21H33N3O3(M+H+)의 계산치 376.2595, 실측치 376.2595.
유사한 방식으로, 하기 물질을 수득하였다.
5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르 및 프로판-2-올로부터 트랜스-1-3급-부틸-5-이소프로폭시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(274.7mg, 68%)로 수득하였다. ES+-HRMS m/e C22H35N3O3(M+H+)의 계산치 390.2751, 실측치 390.2751.
5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르 및 2-메틸-프로판-1-올로부터 트랜스-1-3급-부틸-5-이소부톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(130.5mg, 41%)로 수득하 였다. ES+-HRMS m/e C23H37N3O3(M+H+)의 계산치 404.2908, 실측치 404.2905.
5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르 및 사이클로프로필-메탄올로부터 트랜스-1-3급-부틸-5-사이클로프로필메톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(153.4mg, 61%)로 수득하였다. ES+-HRMS m/e C23H35N3O3(M+H+)의 계산치 402.2751, 실측치 402.2753.
실시예 56
트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산
소듐 메톡사이드(23.8ml, 11.9mmol, 메탄올중 0.5M 용액)중 5-브로모메틸-1-3급-부틸-1H-피라졸-4-카르복실산 메틸 에스테르(1.51g, 5.48mmol)(실시예 55, 1 단계에서 제조됨)의 용액을 2.5시간동안 교반하면서 90℃까지 가온하였다. 이 때, 반응물을 진공에서 농축시켰다. 생성된 백색 고형물을 물(100ml)에 넣고, 에틸 아세테이트(1 x 150ml)로 추출하였다. 이어서, 유기물을 포화 중탄산나트륨 수용 액(1 x 100ml), 물(1 x 100ml) 및 포화 염화나트륨 수용액(1 x 100ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. 생성물이 유기 추출물에 존재하지 않음을 발견했을 때, 수성 층을 합하고 진한 수성 염산으로 pH 1로 산성화시키고, 이어서 다이클로로메테인(1 x 150ml)으로 추출하였다. 상기 유기물을 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축하여서 1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산(1.03g, 88%)을 백색 고형물로 제공하였다. 물질을 추가의 정제없이 사용하였다.
2 단계: 트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
다이클로로메테인(8.5ml, 0.18M)중 1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산(317.9mg, 1.49mmol)의 용액을 N,N-다이이소프로필에틸아민(1.6ml, 9.18mmol) 및 N,N,N',N'-테트라메틸-O-(N-숙신이미딜)우로늄테트라플루오로보레이트(539.5mg, 1.79mmol)로 처리하였다. 생성된 혼합물을 2.6시간동안 25℃에서 교반하였다. 이 때, 반응물을 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드 하이드로클로라이드(476.8mg, 1.94mmol)(실시예 43에서 제조됨)로 처리하였다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 물(100ml) 및 다이클로로메테인(100ml) 사이에서 분배시켰다. 수성 층을 다이클로로메테인(1 x 100ml)으로 추가로 추출하였다. 유기물을 합하여 물(4 x 100ml) 및 포화 염화나트륨 수용액(1 x 100ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. ISCO 콤비플래시(40g 컬럼, 0.5 내지 5% 메탄올/다이클로로메테인)하여 트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(428.7mg, 71%)를 백색 고형물로 제공하였다. ES+-HRMS m/e C22H34N4O3(M+H+)의 계산치 403.2704, 실측치 403.2706.
실시예 57
트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 3-다이메틸아미노-2-(5-메틸-이속사졸-3-카르본일)-아크릴산 에틸 에스테르
0℃로 냉각된 다이클로로메테인(27.53ml, 1.0M)중 5-메틸-이속사졸-3-카르복실산(3.5g, 27.53mmol)의 용액을 옥살릴 클로라이드(5.63ml, 63.33mmol. 98%)로 처리하고, 이어서 N,N-다이메틸포름아마이드 몇 방울로 처리하였다. 반응물을 30분동안 0℃에서 교반하였다. 이 때, 25℃까지 점차 가온시켰다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 진공에서 농축시키고, 이어서 1.5시간동안 고 진공하에서 건조시켰다. 이어서, 생성된 고형물을 톨루엔(21.2ml, 1.3M)과 함께 25℃에서 슬러리화시키고, 이어서 트리에틸아민(8.02ml, 57.55mmol)중 에틸-(3-다 이메틸아미노)아크릴레이트(3.98g, 27.81mmol)의 용액으로 적가 처리하였다. 생성된 흑색 반응 혼합물을 밤새 120℃까지 가열하였다. 이 때, 반응물을 25℃로 냉각시키고, 이어서 물(150ml) 및 다이클로로메테인(3 x 100ml) 사이에서 분배시켰다. 유기물을 합하여 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축시켜서 3-다이메틸아미노-2-(5-메틸-이속사졸-3-카르본일)-아크릴산 에틸 에스테르(정량적 수율로 추정, 27.53mmol)를 흑색 오일로 제공하였다. 상기 물질을 추가의 정제없이 사용하였다.
2 단계: 1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 메틸 에스테르
무수 에탄올(41.7ml)중 3-다이메틸아미노-2-(5-메틸-이속사졸-3-카르본일)-아크릴산 에틸 에스테르(27.53mmol)의 용액을 3급-부틸하이드라진 하이드로클로라이드(3.57g, 28.63mmol) 및 아세트산 나트륨(2.80g, 34.13mmol)으로 처리하였다. 생성된 혼합물을 18시간동안 90℃까지 가열하였다. 이 때, 반응물을 25℃로 냉각시켰다. 반응물을 물(200ml)로 희석시키고, 이어서 다이클로로메테인(3 x 150ml)으로 추출하였다. 유기물을 합하여 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 메틸 에스테르(7.37g, 96%)를 흑색 고형물로 제공하였다. 상기 물질을 추가의 정제없이 사용하였다.
3 단계: 1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산
0℃로 냉각된 메탄올(17.7ml, 1.5M)중 1-3급-부틸-5-(5-메틸-이속사졸-3- 일)-1H-피라졸-4-카르복실산 메틸 에스테르(7.37g, 26.59mmol)의 용액을 4N 수산화나트륨 수용액(13.3ml, 53.15mmol)으로 적가 처리하였다. 반응물을 천천히 25℃까지 가온시켰다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 진공에서 농축시켜서 메탄올을 제거하였다. 잔류물을 물(150ml)로 희석하고, 이어서 다이클로로메테인(3 x 150ml)으로 추출하였다. 상기 유기물을 폐기하였다. 이어서, 수성 층을 2N 염산 수용액에 의해 pH 1로 산성화시켰다. 상기 용액을 90/10 다이클로로메테인/메탄올 용액(3 x 150ml)으로 추출하였다. 유기물을 합하여 황산 나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산(5.42g, 82%)을 갈색 고형물로 제공하였다. 상기 물질을 추가의 정제없이 사용하였다.
4 단계: 트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
다이클로로메테인(7.8ml, 0.18M)중 1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산(350mg, 1.40mmol)의 용액을 N,N-다이이소프로필에틸아민(1.49ml, 8.60mmol) 및 N,N,N',N'-테트라메틸-O-(N-숙신이미딜)우로늄테트라플루오로보레이트(507.2mg, 1.68mmol)로 처리하였다. 생성된 혼합물을 2시간동안 25℃에서 교반하였다. 이 때, 반응물을 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드 하이드로클로라이드(446.7mg, 1.82mmol)(실시예 43에서 제조됨)로 처리하였다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 물(150ml) 및 다이클로로메테인(3 x 100ml) 사이에서 분배시켰다. 유기물을 합하여 황산나트륨상에서 건조시키고, 여과하고, 진공에서 농축시켰다. 바이오타지 크로마토그래피(40M 컬럼, 2 내지 4% 메탄올/다이클로로메테인)하여 트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(330.8mg, 54%)를 회백색 고형물로 제공하였다. ES+-HRMS m/e C24H33N5O3(M+H+)의 계산치 440.2656, 실측치 440.2656.
유사한 방식으로 하기 물질을 수득하였다.
1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 및 트랜스-4-아미노-아다만탄-1-올로부터, 트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(193.4mg, 60%)로 수득하였다. ES+-HRMS m/e C22H30N4O3(M+H+)의 계산치 399.2391, 실측치 399.2387.
실시예 58
트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 2-(5-클로로-이속사졸-3-카르본일)-3-다이메틸아미노-아크릴산 에틸 에스 테르
0℃로 냉각된 다이클로로메테인(27.2ml, 0.2M)중 5-클로로-이속사졸-3-카르복실산(791mg, 5.43mmol)(WO 03093250 A2호에 기재된 제조방법)의 용액을 옥살릴 클로라이드(0.71ml, 8.15mmol, 98%)로 처리하고, 이어서 N,N-다이메틸포름아마이드 몇 방울로 처리하였다. 반응물을 천천히 25℃까지 가온시켰다. 반응물을 25℃로 밤새 교반하였다. 이 때, 반응물을 진공에서 농축시켰다. 생성된 잔류물을 다이클로로메테인에 용해시키고, 2회 재농축시켜서 잔류 옥살릴 클로라이드를 제거하였다. 이어서, 잔류물을 다이클로로메테인(16ml, 0.34M)에 용해시키고, 트리에틸아민(1.6ml, 11.47mmol)중 에틸-3-(다이메틸아미노)아크릴레이트(0.79g, 5.51mmol) 용액으로 적가 처리하였다. 생성된 적색/오렌지색 반응용액을 밤새 60℃까지 가열하였다. 이 때, 반응물을 25℃로 냉각시키고, 이어서 물(50ml) 및 다이클로로메테인(100ml) 사이에서 분배시켰다. 이어서, 유기물을 물(50ml) 및 포화 염화나트륨 수용액(50ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. 바이오타지 크로마토그래피(40M 컬럼, 50 내지 60% 에틸 아세테이트/헥세인)하여 2-(5-클로로-이속사졸-3-카르본일)-3-다이메틸아미노-아크릴산 에틸 에스테르(300.6mg, 20%)를 적색 오일로 제공하였다.
2 단계: 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 에틸 에스테르
무수 에탄올(1.4ml, 0.77M)중 2-(5-클로로-이속사졸-3-카르본일)-3-다이메틸아미노-아크릴산 에틸 에스테르(294.8mg, 1.08mmol)의 용액을 3급-부틸하이드라진 하이드로클로라이드(137.3mg, 1.10mmol) 및 아세트산 나트륨(108.6mg, 1.32mmol)으로 처리하였다. 생성된 혼합물을 밤새 90℃까지 가열하였다. 이 때, 반응물을 25℃로 냉각시키고, 진공에서 농축시켰다. 반응물을 물(200ml) 및 다이클로로메테인(2 x 50ml) 사이에서 분배시켰다. 유기물을 합하여 포화 염화나트륨 수용액으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. 바이오타지 크로마토그래피(40S 컬럼 60% 에틸 아세테이트/헥세인), 이어서 ISCO 콤비플래시(4g 컬럼 0 내지 20% 에틸 아세테이트/헥세인)하여 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 에틸 에스테르(67.4g, 21%)를 황색 오일로 제공하였다.
3 단계: 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산
무수 에탄올(0.93ml, 0.2M)중 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 에틸 에스테르(55.3mg, 0.18mmol)의 용액을 2M 수산화리튬 수용액(0.18ml, 0.37mmol)으로 처리하였다. 반응물을 25℃로 1.5시간동안 교반하고, 이어서 1시간동안 100℃까지 가열하였다. 이 때, 반응물을 25℃로 냉각시키고, 25℃에서 밤새 교반하였다. 이 때, 반응물을 진공에서 농축시켰다. 잔류물을 물로 처리하고, 1N 염산 수용액에 의해 pH 1로 산성화시켰다. 생성된 형성된 침전물을 여과에 의해 수거하고, 물 및 헥세인으로 세척하고, 진공에서 건조시켜서 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산(38.7mg, 77%)을 회백색 고형물로 제공하였다.
4 단계: 트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
다이클로로메테인(0.54ml) 및 N,N-다이메틸포름아마이드(0.13ml)중 1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산(36.2mg, 0.13mmol)의 용액을 25℃에서 N,N-다이이소프로필에틸아민(0.18ml, 1.03mmol) 및 N,N,N',N'-테트라메틸-O-(N-숙신이미딜)우로늄테트라플루오로보레이트(48.3mg, 0.16mmol)으로 처리하였다. 생성된 혼합물을 25℃에서 6.5시간동안 교반하였다. 이 때, 반응물을 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(중간물질 2, 35.3mg, 0.17mmol)로 처리하였다. 반응물을 25℃에서 밤새 교반하였다. 이 때, 반응물을 물(25ml) 및 다이클로로메테인(3 x 25ml) 사이에서 분배시켰다. 유기물을 합하여 포화 염화나트륨 수용액(1 x 25ml)으로 세척하고, 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켰다. ISCO 콤비플래시(4g 컬럼, 0 - 44 - 100% 에틸 아세테이트/헥세인)하여 트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(12.8mg, 23%)를 회백색 고형물로 제공하였다. ES+-HRMS m/e C21H27ClN4O3(M+H+)의 계산치 419.1845, 실측치 419.1844.
실시예 59
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 5-아미노-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르
사이클로헥실하이드라진 하이드로클로라이드(3.057g, 20.29mmol, CAS#24214-73-1, 알드리츠로부터 구입)를 에탄올 30ml중 에틸 (에톡시메틸렌)-시아노아세테이트(3.390g, 20.04mmol) 및 무수 아세트산나트륨(2.080g, 25.36mmol)과 합쳤다. 혼합물을 70℃에서 16시간동안 가열하고, 이어서 실온으로 냉각하고 농축시켰다. 잔류물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 분리된 수성 상을 메틸렌 클로라이드 제 2 분획물로 추출하였다. 유기상을 물 및 염수로 연속하여 세척하고, 이어서 합하고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 잔류물을 25 내지 70% 에틸 아세테이트/헥세인의 구배로 용출시키며 플래시 크로마토그래피로 정제하여서 5-아미노-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르(4.42g, 92%)를 제공하였다. 질량 스펙트럼: m/z: 238.1(M+H).
2 단계: 5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르
염화구리(I)(2.500g, 25.25mmol)를 7.0ml 차가운(얼음/아세톤 중탕) 무수 아세토니트릴에 현탁시켰다. 아질산 t-부틸(5.75ml, 90%, 43.56mmol)을 첨가하고, 이어서 아세토니트릴 27.0ml중 5-아미노-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르(4.408g, 18.58mmol)의 현탁액을 첨가하였다. 혼합물을 실온에서 45분동안 교반하고, 이어서 1.25시간동안 70℃로 교반하였다. 혼합물을 실온으로 냉 각시키고, 천천히 6N HCl(17.5ml)에 첨가하고, 이어서 메틸렌 클로라이드로 추출하였다. 유기상을 물 및 염수로 차례로 세척하였다. 수성 상을 메틸렌 클로라이드 제 2 분획물로 역 추출하였다. 두 유기상을 합하고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 10 내지 50% 에틸 아세테이트/헥세인의 구배로 용출시키며 조질의 잔류물을 플래시 크로마토그래피로 크로마토그래피하여서 5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르(1.98g, 42%)를 제공하였다. 질량 스펙트럼: m/z: 257.3(M+H).
3 단계: 5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산
5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 에틸 에스테르(1.969g, 7.67mmol)를 메탄올(11.5ml)에 용해시켰다. 수산화리튬(0.250g, 10.44mmol) 및 물(11.5ml)을 첨가하였다. 혼합물을 1.5시간동안 80 내지 85℃로 가열하고, 실온으로 냉각시키고, 진공에서 농축하여서 메탄올을 제거하였다. 잔류물을 테트라하이드로푸란으로 희석하고, 다시 농축하여서 메탄올을 완전히 제거하였다. 이어서, 이러한 잔류물을 물로 희석하고, 6N HCl(1.80ml)에 의해 pH 2 내지 2.5로 산성화시켰다. 용액으로부터 침전된 고형물을 여과에 의해 수거하고, 물로 세척하고, 감압하에 100℃에서 건조시켜서 5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산(1.676g, 96%)을 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 229.0(M+H).
4 단계: 트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산(0.152g, 0.66mmol)을 무수 N,N-다이메틸포름아마이드(2.6ml) 및 무수 메틸렌 클로라이드(0.7ml)의 혼합물에 용해시켰다. N,N-다이이소프로필-N-에틸아민(0.91ml, 5.26mmol) 및 TSTU(0.238g, 0.79mmol)을 상기 용액에 첨가하고, 용액을 아르곤하에 3.5시간동안 교반하였다. 이 때, LC-MS는 활성 에스테르가 형성되었음을 나타내고, 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(0.136g, 0.67mmol, 중간물질 2)를 첨가하였다. 실온에서 아르곤하에 44시간동안 교반을 지속하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 유기상을 합하고, 물, 이어서 염수로 2회 세척하고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 60 내지 100% 에틸 아세테이트/헥세인 구배로 용출시키며 플래시 크로마토그래피로 조질의 잔류물을 정제하였다. 생성물을 함유한 분획물을 진공에서 농축시키고, 잔류물을 에틸 아세테이트-헥세인과 함께 분쇄하여서 트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(0.179g, 71%)로 제공하였다. HR-MS (ES) m/e C20H28ClN3O2(M+H+)의 계산치 378.1943, 실측치 378.1943.
실시예 60
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(117mg, 0.310mmol, 실시예 59) 및 피라졸(66mg, 0.969mmol)을 1-메틸-2-피롤리딘온(2.1ml)에서 합하였다. 50% 수성 수산화나트륨(135mg, 1.688mmol)을 첨가하고, 혼합물을 10 내지 11시간동안 120℃에서 가열하였다. 혼합물을 얼음물 중탕에서 냉각하고, 물(2.62ml) 및 포화 염화암모늄 수용액(2.62ml)을 차례로 첨가하였다. 생성물이 침전되기 전에 투명한 용액이 잠시 발생하였다. 1.5시간동안 저온에서 교반한 후에 여과하여 고형물을 수거하고, 물로 세척하고, 고 진공에서 100℃로 건조하여서 트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(107.5mg, 85%)를 제공하였다. HR-MS (ES) m/e C23H31N5O2(M+H+)의 계산치 410.2551, 실측치 410.2550.
실시예 61
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산(0.213g, 0.93mmol, 실시예 59, 3 단계에서 제조됨)을 무수 N,N-다이메틸포름아마이드(3.6ml) 및 무수 메틸렌 클로라이드(0.9ml)의 혼합물에 용해시켰다. N,N-다이이소프로필-N-에틸아민(1.25ml, 7.22mmol) 및 TSTU(0.334g, 1.11mmol)를 첨가하고, 상기 용액을 아르곤하에 3시간동안 실온에서 교반하였다. 이 때, LC-MS는 활성 에스테르가 형성되었음을 나타내었다. 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(0.194g, 0.93mmol, 실시예 43에서 제조됨)를 첨가하였다. 실온에서 밤새 교반을 지속하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 각각의 유기상을 물 및 염수에 의해 세척하였다. 유기상을 합하고, 황산 나트륨상에서 건조시키고, 진공에서 농축하였다. 조질의 잔류물을 0 내지 40% 메탄올/메틸렌 클로라이드 구배로 용출시키며 플래시 크로마토그래피하여 정제하였다. 생성물-함유한 분획물을 진공에서 농축시켰다. 고온 에틸 아세테이트/헥세인을 이용하여 잔류물을 결정화하고, 고 진공하에서 100℃로 건조하여서 트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드를 백색 고형물(0.194g, 50%)로 제공하였다. HR-MS (ES) m/e C22H31ClN4O2(M+H+)의 계산치 419.2209, 실측치 419.2207.
실시예 62
트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(151.8mg, 0.362mmol, 실시예 61) 및 피라졸(77mg, 1.131mmol)을 1-메틸-2-피롤리딘온(2.4ml)에서 합하였다. 50% 수성 수산화나트륨(158mg, 1.975mmol)을 첨가하고, 혼합물을 120℃에서 11시간동안 가열하였다. 혼합물을 얼음물 중탕에서 냉각시키고, 물(3.2ml) 및 포화 수성 염화암모늄(3.2ml)을 첨가하였다. 잠시동안 투명한 용액이 수득되었고, 이어서 생성물이 침전되었다. 혼합물을 약 2시간동안 저온에서 교반하고, 이어서 고형물을 여과에 의해 수거하고, 물로 세척하고, 고 진공에서 100℃로 건조시켜서 트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(139.1mg, 84%)를 제공하였다. HR-MS (ES) m/e C25H34N6O2(M+H+)의 계산치 451.2816, 실측치 451.2816.
실시예 63
트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: N'-(테트라하이드로-피란-4-일리덴)-하이드라진카르복실산 3급-부틸 에스테르
테트라하이드로-4H-피란-4-온(1.002g, 10.01mmol, CAS# 29943-42-8, 플루카에서 구입)을 헥세인(10ml)중에서 3급-부틸 카바제이트(1.322g, 10.00mmol)과 합쳤다. 혼합물을 오일 중탕에서 65 내지 70℃로 75분동안 가열하였다. 새로운 침전물이 용액으로부터 침전되기 시작한 후에 카바제이트가 완전히 용액으로 사라졌다. 혼합물이 고형 침전물로 가득하게 되었다. 추가의 헥세인으로 희석하고, 15분 더 가열하였다. 혼합물을 실온으로 냉각하고, 진공에서 농축시켰다. 이소프로판올을 잔류물에 첨가하고, 혼합물을 5분동안 격렬하게 교반하고, 이어서 에테르로 희석하고, 급냉시켰다. 고형물을 여과에 의해 수거하고, 진공에서 건조시켜서 N'-(테트라하이드로-피란-4-일리덴)-하이드라진카르복실산 3급-부틸 에스테르(1.326g, 62%)를 제공하였다. 제 2 수확물(0.373g, 17%)을 모액으로부터 수거하였다.
2 단계: (테트라하이드로-피란-4-일)-하이드라진 하이드로클로라이드
N'-(테트라하이드로-피란-4-일리덴)-하이드라진카르복실산 3급-부틸 에스테르(5.210g, 24.32mmol)을 무수 테트라하이드로푸란(22ml) 및 무수 메탄올(30ml)의 혼합물에 용해시켰다. 소듐 시아노보로하이드라이드를 상기 용액에 첨가하여 비등을 발생시켰다. 비등이 가라앉을 때, 혼합물을 5 내지 10분동안 환류 온도까지 가 열하였다. 실온으로 냉각한 후에 6N HCl(10.5ml)을 천천히 첨가하고, 이어서 혼합물을 환류 온도까지 20분동안 가열하였다. 실온으로 냉각한 후에 용매를 진공에서 제거하였다. 잔류물을 고온 이소프로판올과 함께 분쇄한 후에 실온으로 냉각시키고, 에테르로 희석하고, 급냉시켰다. 고형물을 여과에 의해 수거하고, 환원된 물질로 발견되었으나, 완전히 탈보호되지는 않았다. 고형물을 동일한 THF-메탄올 혼합물에 용해시키고, 6N HCl(10.5ml)로 환류 온도에서 1.5시간 더 처리하였다. 실온으로 냉각한 후에, 반응 혼합물을 여과하여서 소량의 불용성 물질을 제거하였다. 이어서, 여액을 진공에서 농축하였다. 이소프로판올을 잔류물에 첨가하고, 고형물이 신속히 용액으로부터 결정화되기 시작하였다. 밤새 급냉시킨 후에 에테르를 첨가하고, 이어서 추가로 급냉시켰다. 이어서, 고형물을 여과에 의해 수거하고, 에테르로 세척하고, 진공에서 건조하여서 (테트라하이드로-피란-4-일)-하이드라진 하이드로클로라이드(2.22g, 60%)를 제공하였다.
3 단계: 5-아미노-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르
(테트라하이드로-피란-4-일)-하이드라진 하이드로클로라이드(1.975g, 12.94mmol), 에틸 (에톡시메틸렌)-시아노아세테이트(1.958g, 11.57mmol) 및 아세트산 나트륨(1.370g, 16.70mmol)을 에탄올(16ml)에서 합하였다. 혼합물을 17시간동안 80 내지 85℃에서 가열하였다. 실온으로 냉각한 후에 반응물을 농축시키고, 잔류물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 유기상을 분리하고, 물, 이어서 염수로 세척하였다. 각각의 수성 상을 메틸렌 클로라이드에 의해 역추출하 였다. 2 유기상을 합치고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 조질의 물질을 60 내지 100% 에틸 아세테이트/헥세인으로 용출시키며 플래시 크로마토그래피로 정제하여서 5-아미노-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르(2.554g, 92%)를 제공하였다.
4 단계: 5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르
염화구리(I)(1.700g, 17.17mmol)를 차가운(얼음물 중탕) 아세토니트릴(5ml)에 현탁시켰다. 아질산 t-부틸(2.35ml, 90%, 17.80mmol)을 상기 현탁액에 첨가하고, 이어서 아세토니트릴(19ml)중 5-아미노-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르(3.157g, 13.19mmol)의 용액을 적가하였다. 냉각 중탕을 제거하고, 혼합물을 실온에서 1시간동안 교반하고, 이어서 1시간동안 70℃로 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 6N HCl(12.5ml)에 첨가하였다. 15분동안 교반한 후에 혼합물을 메틸렌 클로라이드에 의해 추출하였다. 유기상을 물 및 염수로 차례로 세척하였다. 이어서, 각각의 수성 상을 메틸렌 클로라이드로 한번에 역세척하였다. 두 유기상을 합하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 40 내지 100% EtOAc-헥세인의 구배로 용출시키며 플래시 크로마토그래피로 정제하여서 5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르(2.205g, 63%)를 제공하였다. 질량 스펙트럼: m/z: 259.30(M+H).
5 단계: 5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산
5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 에틸 에스테르(2.194g(98%), 8.31mmol)를 메탄올(12.5ml)에 용해시켰다. 수산화리튬(0.274g, 11.44mmol) 및 물(12.5ml)을 첨가하고, 혼합물을 1시간동안 80℃에서 가열하였다. 실온으로 냉각한 후에, 혼합물을 농축시켜서 메탄올을 제거하였다. 테트라하이드로푸란을 잔류물에 첨가하고, 진공에서 제거하여서 메탄올을 완전히 제거하였다. 수성 잔류물을 6N HCl(1.88ml)로 처리하여서 점성있는 유백색 고형물을 침전시켰다. 고형물을 여과에 의해 수거하고, 물로 세척하고, 고 진공하에 열로 건조시켜서 5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산(1.900g, 99%)을 제공하였다. 질량 스펙트럼: m/z: 231.30(M+H).
6 단계: 트랜스-5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산(124.5mg, 0.540mmol)을 무수 N,N-다이메틸포름아마이드(2.1ml) 및 무수 메틸렌 클로라이드(0.5ml)의 혼합물에 용해시켰다. N,N-다이이소프로필-N-에틸아민(0.75ml, 4.335mmol) 및 TSTU(193.8mg, 0.644mmol)를 상기 용액에 차례로 첨가하였다. 2시간후에, LC-MS는 활성 에스테르가 형성되었음을 나타내었다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(113.0mg, 0.555mmol, 중간물질 2)를 첨가하고, 혼합물을 아르곤하에 45시간동안 실온에서 교반하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 두 유기층을 합하고, 물로 2회, 이어서 염수로 1회 세척하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 5 내지 10% 메탄올-메틸렌 클로라이드 구배로 용출시키면서 플래시 크로마토그래피하고, 이어서 에틸 아세테이트-헥세인으로부터 결정화하여서 트랜스-5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(138mg(96% 순도), 65%)를 제공하였다. HR-MS (ES) m/e C19H26ClN3O3(M+H+)의 계산치 380.1736, 실측치 380.1733.
7 단계: 트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-(테트라하이드로-피란-4-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(78.3mg, 96%, 0.198mmol)를 1-메틸-2-피롤리딘온중 피라졸(46mg, 0.676mmol) 및 50% 수성 수산화나트륨(105.0mg, 1.313mmol)과 합하였다. 혼합물을 12시간동안 120℃에서 가열하고, 이어서 6시간동안 실온에서 교반하였다. 생성된 점성의 불균질 혼합물을 물(1.74ml) 및 포화 수성 염화암모늄(1.74ml)으로 차례로 처리하였다. 고형물이 용액으로부터 다시 침전되기 시작하기 전에 투명한 용액이 잠시 수득되었다. 혼합물을 2시간동안 저온에서 교반하고, 이어서 여과하고, 물로 세척하고, 고 진공하에서 열로 건조시켜서 트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(59.3mg, 73%)를 제공하였다. HR-MS (ES) m/e C22H29N5O3(M+H+)의 계산치 412.2343, 실측치 412.2343.
실시예 64
트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: N'-사이클로펜틸-하이드라진카르복실산 3급-부틸 에스테르
사이클로펜탄온(5.000g, 59.44mmol, CAS# 120-92-3, 알드리츠로부터 구입)을 헥세인(90ml)에 용해시켰다. t-부틸 카바제이트(7.860g, 59.47mmol)를 첨가하고, 혼합물을 1시간동안 65 내지 70℃에서 가열하였다. 혼합물을 냉각시키고, 진공에서 농축시켰다. 잔류물을 이소프로판올(25ml)-에테르(25ml)-헥세인(50ml)에 넣고, 급냉시켰다. 결정질 물질을 여과에 의해 수거하여서 N'-사이클로펜틸-하이드라진카르복실산 3급-부틸 에스테르(5.51g, 47%)를 제공하였다. 두번째 수확물(2.62g, 22%)을 모액으로부터 수거하였다.
2 단계: 사이클로펜틸-하이드라진 하이드로클로라이드
N'-사이클로펜틸-하이드라진카르복실산 3급-부틸 에스테르(5.448g, 27.48mmol)를 무수 테트라하이드로푸란(25ml) 및 무수 메탄올(34ml)에 용해시켰다. 소듐 시아노보로하이드라이드(2.044g, 32.53mmol)를 여러 번으로 나누어 첨가하고, 이어서 혼합물을 아르곤하에 10분동안 환류시켰다. 실온으로 냉각한 후에, 6N HCl(12ml)을 첨가하고, 혼합물을 1.5시간동안 환류시켰다. 이 때의 분액의 NMR은 일부 BOC-보호된 물질이 여전히 존재함을 나타내었다. 추가의 6N HCl을 첨가하고, 혼합물을 3시간 더 환류시킨 후 실온으로 냉각하고 밤새 교반하였다. 혼합물을 여과하여 불용성 물질을 제거하고, 농축시키고, 톨루엔과 함께 3회 공비시켜서 물을 제거하였다. 잔류물을 고온의 이소프로판올에 용해시키고, 실온으로 냉각시키고, 에테르로 희석하고 급냉시켰다. 여과하여 사이클로펜틸-하이드라진 하이드로클로라이드(3.903g, 103%)를 제공하고, 이를 임의의 추가의 정제없이 사용하였다.
3 단계: 5-아미노-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르
사이클로펜틸-하이드라진 하이드로클로라이드(1.000g, 7.32mmol), 에틸(에톡시메틸렌)-시아노아세테이트(1.026g, 6.61mmol) 및 무수 아세트산 나트륨(0.644g, 7.85mmol)을 에탄올(10ml)에서 합하고, 20시간동안 70℃에서 가열하였다. 실온으로 냉각한 후에, 에탄올을 진공에서 제거하고, 잔류물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 유기상을 물 및 염수로 차례로 세척하였다. 각각의 수성 상을 메틸렌 클로라이드로 한번에 역추출하였다. 두 유기상을 합하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 10 내지 40% EtOAc/헥세인으로 용출시키는 플래시 크로마토그래피로 정제하여서 5-아미노-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르(1.170g, 73%)를 제공하였다. 질량 스펙트럼: m/z: 224.1(M+H).
4 단계: 5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르
5-아미노-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르(1.164g, 4.96mmol)를 아세토니트릴(10.0ml)에 용해시켰다. 염화구리(I)(0.722g, 7.29mmol) 및 빙초산(0.60ml, 10.48mmol)을 첨가하고, 혼합물을 얼음물 중탕에서 냉각시켰다. 아질산 t-부틸의 제 1 분액(0.29ml, 90%, 2.20mmol)을 첨가하였다. 냉각 중탕을 제거하고, 혼합물을 실온까지 가온시켰다. 아질산 t-부틸의 제 2 분액(0.58ml, 4.39mmol)을 첨가하고, 혼합물을 실온에서 1시간동안 교반하였다. 반응물을 물로 급냉시키고, 에틸 아세테이트로 희석하였다. 격렬하게 교반한 후에 상기 층들을 분리하였다. 유기상을 염수로 세척하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 20:80 에틸 아세테이트-헥세인 구배로 용출시키는 플래시 크로마토그래피로 정제하여서 5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.710g, 61%)를 제공하였다. 질량 스펙트럼: m/z: 243.1(M+H).
5 단계: 5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산
5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.710g, 2.93mmol)를 메탄올(4.3ml)에 용해시켰다. 물(4.3ml) 및 수산화리튬(0.097g, 4.05mmol)을 첨가하고, 혼합물을 80℃로 2시간동안 가열하였다. 실온으로 냉각한 후에 메탄올을 진공에서 제거하였다. 테트라하이드로푸란을 잔류물에 첨가한 후에 진공에서 제거하여서 메탄올을 완전히 제거하였다. 잔류물을 물로 희석하고, 6N HCl에 의해 pH 2 내지 3으로 처리하여서 유백색 고형물을 침전시켰다. 고형물을 수거하고, 물로 세척하고 하우스 진공하에 45℃에서 건조시켜서 5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산(0.580g, 91%)을 제공하였다. 상기 물질은 추가로 정제되지 않은 상태로 사용하였다.
6 단계: 트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산(0.225g, 1.05mmol)을 무수 N,N-다이메틸포름아마이드(4.0ml) 및 무수 메틸렌 클로라이드(1.0ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(1.45ml, 8.38mmol) 및 TSTU(0.359g, 1.19mmol)을 상기 용액에 차례로 첨가하고, 아르곤하에 2.5시간동안 실온에서 교반을 지속하고, 이 때 활성화 에스테르로의 반응이 완료된 것으로 LC-MS에 의해 나타났다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(0.224g, 1.10mmol, 중간물질 2)를 첨가하고, 혼합물을 실온에서 아르곤하에 밤새 교반하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 각각의 유기상을 물, 이어서 염수로 세척하였다. 두 유기상을 합치고, 황산 나트륨상에서 건조시키고 농축시켰다. 플래시 크로마토그래피(50 내지 100% 에틸 아세테이트-헥세인 구배로 용출)로 정제한 후에 에틸 아세테이트-헥세인으로부터 결정화하여서 트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(0.174g, 46%)를 제공하였다. HR-MS (ES) m/e C19H26ClN3O2(M+H+)의 계산치 364.1787, 실측치 364.1785.
실시예 65
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(137mg, 0.376mmol, 실시예 64)를 1-메틸-2-피롤리딘온(2.5ml)중에서 피라졸(82.8mg, 1.216mmol) 및 50% 수성 수산화나트륨(164mg, 2.050mmol)과 합치고, 11시간동안 120℃로 가열하였다. 이어서, 혼합물을 실온으로 냉각시키고, 8시간동안 교반하였다. 물(3.0ml) 및 포화 염화암모늄 수용액(3.0ml)을 차례로 첨가하였다. 새로운 고형물이 용액으로부터 침전되기 이전에 투명한 용액이 잠시 보였다. 혼합물을 2시간동안 얼음물 중탕에서 교반한 후에 여과하고, 물로 세척하고 고 진공하에 100℃로 건조시켜서 트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(126.5mg, 84%)를 제공하였다. HR-MS (ES) m/e C22H29N5O2(M+H+)의 계산치 418.2213, 실측치 418.2213.
실시예 66
트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산(0.334g, 1.56mmol, 실시예 64, 5 단계에서 제조됨)을 무수 N,N-다이메틸포름아마이드(6.0ml) 및 무수 메틸렌 클로라이드(1.5ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(2.15ml, 12.43mmol) 및 TSTU(0.563g, 1.87mmol)를 상기 용액에 차례로 첨가하고, 아르곤하에 3시간동안 실온에서 교반을 지속하고, LC-MS에 의해 활성 에스테르로의 반응이 완료된 것으로 나타났다. 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(0.330g, 1.58mmol, 실시예 43에서 제조됨)를 첨가하고, 혼합물을 22시간동안 실온에서 교반하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드로 2회 추출하였다. 두 유기상을 합하고, 물로 2회, 염수로 1회 세척하고, 황산 나트륨상에서 건조시키고 농축시켰다. 조질의 물질을 플래시 크로마토그래피 및 고온의 메틸렌 클로라이드-에테르-헥세인으로부터의 결정화를 병용하여 정제하여서 트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(0.417g, 66%)를 제공하였다. HR-MS (ES) m/e C21H29ClN4O2(M+H+)의 계산치 405.2052, 실측치 405.2052.
2 단계: 트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(150.0mg, 0.333mmol)를 1-메틸-2-피롤리딘온(2.2ml)중 피라졸(69.2mg, 1.016mmol) 및 50% 수산화나트륨 수용액(148mg, 1.850mmol)과 합하였다. 혼합물을 120℃로 가열한 다음, 실온으로 냉각시키고, 5시간동안 교반하였다. 물(2.8ml) 및 포화 수성 염화암모늄(2.8ml)을 상기 점성 혼합물에 첨가하였다. 고형물이 용액으로부터 침전되기 시작하기 전에 투명한 용액이 잠시 관찰되었다. 혼합물을 상기 중탕에서 1.5시간동안 교반한 다음, 여과하고, 물로 세척하고, 고 진공하에 100℃로 건조시켰다. 조질의 고형물을 메틸렌 클로라이드-에테르-헥세인으로부터 재결정화하여서 트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(103mg, 71%)를 제공하였다. HR-MS (ES) m/e C24H32N6O2(M+H+)의 계산치 437.2660, 실측치 437.2660.
실시예 67
트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: N'-[4-(3급-부틸-다이메틸-실란일옥시)-사이클로헥실리덴]-하이드라진카르복실산 3급-부틸 에스테르
3급-부틸다이메틸실릴옥시-사이클로헥산온(3.146g, 97%, 13.36mmol, CAS#55145-45-4, 알드리츠로부터 구입)을 헥세인(24ml)에 용해시켰다. 3급-부틸 카바제이트(1.80g, 98%, 13.35mmol)를 첨가하고, 혼합물을 3시간동안 70℃로 가열하였다. 실온으로 냉각시에 백색 고형물이 용액으로부터 침전되었다. 고형물을 여과에 의해 수거하고, 헥세인으로 세척하고, 건조시켜서 N'-[4-(3급-부틸-다이메틸-실란일옥시)-사이클로헥실리덴]-하이드라진카르복실산 3급-부틸 에스테르(4.12g, 90%)를 제공하였다.
2 단계: 4-하이드라진오-사이클로헥산올 하이드로클로라이드
N'-[4-(3급-부틸-다이메틸-실란일옥시)-사이클로헥실리덴]-하이드라진카르복실산 3급-부틸 에스테르(4.103g, 11.98mmol)를 무수 테트라하이드로푸란(11.5ml) 및 무수 메탄올(15.0ml)에 용해시켰다. 소듐 시아노보로하이드라이드(0.945g, 14.29mmol)를 여러 번으로 나누어 첨가하였다. 비등이 가라앉을 때, 혼합물을 1.5시간동안 환류시켰다. 이 때, 추가적인 소량의 소듐 시아노보로하이드라이드(0.047g, 0.75mmol)를 첨가하고, 30분 더 환류를 지속하여서 완전히 반응하도록 하였다. 실온으로 냉각된 후에 6N HCl(10ml)을 첨가하여서 백색 고형물을 침전시켰다. 혼합물을 6시간동안 70℃에서 가열하고, 이어서 실온으로 냉각하고, 12시간동안 교반하였다. 반응 혼합물을 농축시키고, 톨루엔과 함께 공비하여서 물을 거의 모두 제거하였다. 이어서, 잔류물을 고온의 이소프로판올에 용해시키고, 실온 으로 다시 냉각시켰다. 임의의 불용성 물질을 여과에 의해 제거하였다. 여액을 에테르로 희석하고, 급냉시켰다. 상기 물질이 용액으로부터 오일/고무로 침강하였다. 윗물을 따라내어 모액을 제거하였다. 이어서, 오일/고무를 에테르로 세척하고, 진공에서 건조하여서 4-하이드라진오-사이클로헥산올 하이드로클로라이드(1.920g, 96%)를 제공하였다. 두번째 수확물(0.261g, 13%)을 모액으로부터 수거하였다. 내포된(trapped) 용매 및 작은 불순물이 존재하기 때문에 수율은 이론치보다 더 컸다. 상기 물질을 임의의 추가적인 정제없이 사용하였다.
3 단계: 5-아미노-1-(4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르
하이드라진오-사이클로헥산올 하이드로클로라이드(1.920g, 9.79mmol)를 고온 에탄올에 용해시키고, 이어서 약간 냉각시켰다. 에틸 (에톡시메틸렌)-시아노아세테이트(1.520g, 8.98mmol) 및 무수 아세트산나트륨(2.013g, 24.54mmol)을 첨가하고, 혼합물을 15시간동안 70℃로 가열하였다. 실온으로 냉각한 후에, 혼합물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 수성 상을 메틸렌 클로라이드 제 2 분획물로 세척하였다. 두 유기상을 합치고, 염수로 세척하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 0 내지 20% 메탄올/에틸 아세테이트 구배로 용출시키며 플래시 크로마토그래피하여 이성체의 시스-트랜스 혼합물중 큰 비율을 분리하였다. 크로마토그래피후에 각각의 이성체의 순수 분획물을 합하고, EtOAc-헥세인으로부터 결정화하여서 5-아미노-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르(0.511g, 23%(수확물 1); 0.121g, 5%(수확물 2)) 및 5-아미노-1- (트랜스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르(0.625g, 28%)를 제공하였다.
4 단계: 5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르
염화구리(I)(126mg, 1.273mmol) 및 아질산 t-부틸(180㎕, 1.364mmol)을 차가운(얼음물 중탕) 아세토니트릴(2.0ml)에서 합하였다. 5-아미노-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르(230mg, 0.908mmol)를 여러 번으로 나누어 첨가하였다. 냉각 중탕을 제거하고, 혼합물을 실온에서 30분동안 교반하고, 이어서 30분동안 70℃에서 교반하였다. 실온으로 냉각한 후에 혼합물을 6N HCl(0.9ml)로 처리하고, 메틸렌 클로라이드로 4회 추출하였다. 유기상을 합하고, 물 및 염수로 세척하고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 50 내지 100% 에틸 아세테이트/헥세인으로 용출시키는 플래시 크로마토그래피로 정제하여서 5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르(137mg, 55%)를 제공하였다.
5 단계: 5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산
클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 에틸 에스테르(183mg, 0.631mmol)를 메탄올(1.2ml)에 용해시켰다. 수산화리튬(20.8mg, 0.869mmol) 및 물(1.2ml)을 첨가하고, 혼합물을 1시간동안 80℃로 가열하였다. 반응물을 농축시킨 후에 테트라하이드로푸란으로부터 다시 농축시켜서 메탄올을 완전히 제거하였다. 잔류물을 물로 희석하고, 6N HCl(160㎕)로 처리하여서 고형물을 침전시켰다. 여과에 의해 고형물을 수거하고, 물로 세척하고, 고 진공하에 50℃로 건조시켜서 5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산(140mg, 91%)을 제공하였다. 질량 스펙트럼: m/z: 245.0(M+H).
6 단계: 트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산(52.4mg, 0.214mmol)을 무수 N,N-다이메틸포름아마이드(0.8ml) 및 무수 메틸렌 클로라이드(0.2ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(0.30ml, 1.734mmol) 및 TSTU(73mg, 0.242mmol)를 상기 용액에 차례로 첨가하고, 실온에서 3시간동안 교반을 지속시키고, 이 때 LC-MS에 의해 활성화 에스테르로의 반응이 완료된 것으로 나타났다. 트랜스-4-아미노-아다만탄-1-올-하이드로클로라이드(45mg, 0.221mmol, 중간물질 2)를 첨가하고, 실온에서 아르곤하에 밤새 교반을 지속하였다. 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드로 2회 추출하였다. 2 유기상을 합치고, 물 및 염수로 차례로 세척하고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 플래시 크로마토그래피(0 내지 20% 메탄올 - 에틸 아세테이트로 용출시킴)로 정제한 후에 고온 에틸 아세테이트-헥세인으로부터 결정화하여서 트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(42.4mg, 65%)을 제공하였다. HR-MS (ES) m/e C20H28ClN3O3(M+H+)의 계산치 394.1892, 실측치 394.1894.
실시예 68
트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(143mg, 97%, 0.352mmol, 실시예 67)를 1-메틸-2-피롤리딘온(2.4ml)중 피라졸(75mg, 1.102mmol) 및 50% 수성 수산화나트륨(156mg, 1.950mmol)과 합하였다. 혼합물을 12시간동안 120℃에서 가열한 후에 5시간동안 실온에서 교반하였다. 이어서, 혼합물을 얼음물 중탕에서 냉각시켰다. 물(3.0ml) 및 포화 수성 염화암모늄(3.0ml)을 차례로 첨가하였다. 생성물이 용액으로부터 침전되기 전에 반응 혼합물이 잠시 투명한 용액이 되었다. 2시간동안 저온에서 교반한 후에, 고형물을 여과에 의해 수거하고, 물로 세척하고, 고 진공하에 100℃에서 건조시켜서 트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(115mg, 77%)를 제공하였다. HR-MS (ES) m/e C23H31N5O3(M+H+)의 계산치 426.2500, 실측치 426.2500.
실시예 69
트랜스-1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시 -아다만탄-2-일)-아마이드
1 단계: 1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르
사이클로펜틸-하이드라진 하이드로클로라이드(0.250g, 1.83mmol, 실시예 64, 2 단계), 2-다이메틸아미노메틸렌-4,4,4-트리플루오로-3-옥소-부티르산 에틸 에스테르(0.403g, 1.68mmol) 및 무수 아세트산 나트륨(0.163g, 1.99mmol)을 에탄올(2.5ml)중에서 합치고, 17시간동안 70℃로 가열하였다. 실온으로 냉각한 후에 반응 혼합물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 유기상을 물 및 염수로 세척하였다. 각각의 수성 상을 메틸렌 클로라이드 제 2 분획물로 역 추출하였다. 두 유기상을 합치고, 황산 나트륨상에서 건조시키고, 진공에서 농축시켰다. 10 내지 40% 에틸 아세테이트-헥세인 구배로 용출시키는 플래시 크로마토그래피로 정제하여서 1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.244g, 52%)를 제공하였다. 질량 스펙트럼: m/z: 277.1(M+H).
2 단계: 1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산
사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.237g, 0.858mmol)를 메탄올(2.0ml)에 용해시켰다. 물(2.0ml) 및 수산화리튬(0.027g, 1.127mmol)을 첨가하고, 혼합물을 2시간동안 80℃로 가열하였다. 실온 으로 냉각한 후에 메탄올을 진공에서 제거하였다. THF를 잔류물에 첨가한 다음, 진공에서 제거하여서 메탄올을 완전히 제거하였다. 6N HCl(0.2ml)을 수성 잔류물에 pH 2 내지 3으로 첨가하여서 백색 고형물을 침전시켰다. 고형물을 여과에 의해 수거하고, 물로 세척하고, 고 진공하에 100℃에서 건조시켜서 1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(0.134g, 63%)을 제공하였다.
3 단계: 트랜스-1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(125mg, 0.504mmol)을 무수 N,N-다이메틸포름아마이드(2.0ml) 및 무수 메틸렌 클로라이드(0.5ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(0.70ml, 4.046mmol) 및 TSTU(181mg, 0.601mmol)을 상기 용액에 차례로 첨가하고, 실온에서 3시간동안 교반을 지속하고, 이 때 LC-MS에 의해 활성화 에스테르로의 반응이 완료된 것으로 나타났다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(107.8mg, 0.529mmol, 중간물질 2)를 첨가하고, 아르곤하에 17시간동안 실온에서 교반을 지속하였다. 조질의 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 각각의 유기상을 물 및 염수로 차례로 세척하였다. 두 유기상을 합하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 플래시 크로마토그래피로 정제한 후에 에틸 아세테이트-헥세인으로부터 결정화하여서 트랜스-1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(133mg, 66%)를 제공하였다. HR-MS (ES) m/e C20H26F3N3O2(M+H+)의 계산치 398.2050, 실측치 398.2050.
실시예 70
트랜스-1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르
사이클로헥실-하이드라진 하이드로클로라이드(0.276g, 1.59mmol, CAS#24214-73-1, 알드리츠로부터 구입), 2-다이메틸아미노메틸렌-4,4,4-트리플루오로-3-옥소-부티르산 에틸 에스테르(0.459g, 1.67mmol) 및 무수 아세트산 나트륨(0.188g, 2.29mmol)을 에탄올(2.9ml)에서 합하고, 15시간동안 70℃로 가열하였다. 실온으로 냉각한 후에 반응 혼합물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 유기상을 물 및 염수로 세척하였다. 각각의 수성 상을 메틸렌 클로라이드 제 2 분획물로 역 추출하였다. 두 유기 상을 합하고, 황산 나트륨상에서 건조시키고 진공에서 농축시켰다. 5 내지 40% 에틸 아세테이트-헥세인 구배로 용출시키는 플래시 크로마토그래피로 정제하여서 1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복 실산 에틸 에스테르(0.270g, 55%)를 제공하였다. 질량 스펙트럼: m/z: 291.3(M+H).
2 단계: 1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산
사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.265g, 0.91mmol)를 메탄올(1.4ml)에 용해시켰다. 물(1.4ml) 및 수산화리튬(0.029g, 1.21mmol)을 첨가하고, 혼합물을 1.5시간동안 80℃에서 가열하였다. 실온으로 냉각한 후에 메탄올을 진공에서 제거하였다. 테트라하이드로푸란을 잔류물에 첨가한 다음, 진공에서 제거하여 메탄올을 완전히 제거하였다. 6N HCl을 수성 잔류물에 pH 2 내지 3까지 첨가하여서 고형물을 침전시켰다. 여과에 의해 고형물을 수거하고, 물로 세척하고, 고 진공하에 100℃에서 건조하여서 1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산(0.206g, 86%)을 제공하였다. 질량 스펙트럼: m/z: 263.3(M+H).
3 단계: 트랜스-1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산(196mg, 0.747mmol)을 무수 N,N-다이메틸포름아마이드(2.9ml) 및 무수 메틸렌 클로라이드(0.7ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(1.00ml, 5.78mmol) 및 TSTU(270mg, 0.897mmol)를 상기 용액에 차례로 첨가하고, 아르곤하에 3시간동안 실온에서 교반을 지속하고, 이 때 LC-MS에 의해 활성화 에스테르로의 반응이 완료된 것으로 나타났다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(160mg, 0.785mmol, 중간물질 2)를 첨가하고, 실온에서 밤새 교반을 지속하였다. 조질의 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드로 2회 추출하였다. 각각의 유기상을 물 및 염수로 차례로 세척하였다. 두 유기상을 합하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 플래시 크로마토그래피로 정제한 후에 에틸 아세테이트-헥세인으로부터 결정화하여서 트랜스-1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(208mg, 67%)를 제공하였다. HR-MS (ES) m/e C21H28F3N3O2(M+H+)의 계산치 412.2207, 실측치 412.2206.
실시예 71
트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르
4-하이드라진오-사이클로헥산올, 하이드로클로라이드(0.255g, 1.53mmol, 실시예 67, 2 단계에서 제조됨), 2-다이메틸아미노메틸렌-4,4,4-트리플루오로-3-옥소-부티르산 에틸 에스테르(0.272g, 1.14mmol) 및 무수 아세트산 나트륨(0.256g, 3.12mmol)을 에탄올(2.0ml)에서 합치고, 아르곤하에 14시간동안 70℃로 가열하였 다. 실온으로 냉각한 후에, 반응 혼합물을 메틸렌 클로라이드 및 물 사이에서 분배시켰다. 수성 상을 메틸렌 클로라이드에 의해 2회 세척하였다. 2 유기상을 합하고, 염수로 세척하고, 황산 나트륨상에 건조시키고 진공에서 농축시켰다. 플래시 크로마토그래피(40 내지 100% 에틸 아세테이트-헥세인 구배로 용출시킴)로 정제하여서 시스-트랜스 이성체를 연속적으로 분리하여서 시스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(96.1mg, 27%) 및 트랜스 1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(63.5mg, 18%)를 제공하였다.
2 단계: 시스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산
시스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(94.7mg, 0.309mmol)를 메탄올(0.5ml)에 용해시켰다. 수산화리튬(10.3mg, 0.430mmol) 및 물(0.5ml)을 첨가하고, 혼합물을 1시간동안 80℃로 가열하였다. 실온으로 냉각한 후에 메탄올을 진공에서 제거하였다. 테트라하이드로푸란을 첨가하고, 진공에서 제거하여 메탄올을 완전히 제거하였다. 잔류물을 물로 희석하고, 6N HCl(75㎕, pH 1.5 내지 2)로 산성화하였다. 용액으로부터 침전된 고형물을 여과에 의해 수거하고, 물로 세척하고, 고 진공하에 50℃에서 건조시켜서 시스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(70mg, 81%)을 제공하였다. 질량 스펙트럼: m/z: 279.1(M+H).
3 단계: 트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라 졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
시스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(67mg, 0.241mmol)을 무수 N,N-다이메틸포름아마이드(1.0ml) 및 무수 메틸렌 클로라이드(0.2ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(0.33ml, 1.907mmol) 및 TSTU(82mg, 0.272mmol)을 차례로 상기 용액에 첨가하고, 3시간동안 아르곤하에 실온에서 교반을 지속하고, 이 때 LC-MS에 의해 활성화 에스테르로의 반응이 완료된 것으로 나타났다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(50mg, 0.245mmol, 중간물질 2)를 첨가하고, 실온에서 아르곤하에 밤새 교반을 지속하였다. 조질의 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드로 2회 추출하였다. 두 유기상을 합하고, 물 및 염수로 차례로 세척하고, 황산 나트륨상에 건조시키고 농축시켰다. 플래시 크로마토그래피(0 내지 20% 메탄올-에틸 아세테이트 구배로 용출시킴)로 정제하고, 이어서 에틸 아세테이트-에테르로부터 결정화하여서 트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(44.9mg, 43%)를 제공하였다. HR-MS (ES) m/e C21H28F3N3O3(M+H+)의 계산치 428.2156, 실측치 428.2157.
실시예 72
트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 트랜스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산
트랜스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(62.3mg, 0.203mmol, 실시예 71, 1 단계에서 제조됨)를 메탄올(0.3ml)에 용해시켰다. 수산화리튬(7.1mg, 0.297mmol) 및 물(0.3ml)을 첨가하고, 혼합물을 1시간동안 80℃로 가열하였다. 실온으로 냉각시킨 후에 메탄올을 진공에서 제거하였다. 테트라하이드로푸란을 첨가하고, 진공에서 제거하여서 메탄올을 완전히 제거하였다. 잔류물을 물로 희석하고, 6N HCl로 산성화하였다. 고형물이 초기에 용액으로부터 침전되었으나, 신속히 오일/고무내로 사라졌다. 혼합물을 메틸렌 클로라이드로 2회 추출하였다. 두 유기상을 합치고, 물로 세척하고, 황산 나트륨상에서 건조시키고 농축시켜서 트랜스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(35.8mg, 63%)을 제공하였다. 질량 스펙트럼: m/z: 277.1(M-H).
2 단계: 트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
트랜스-1-(4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카 르복실산(31.6mg, 0.114mmol)을 무수 N,N-다이메틸포름아마이드(0.5ml) 및 무수 메틸렌 클로라이드(0.1ml)에 용해시켰다. N,N-다이이소프로필-N-에틸아민(155㎕, 0.896mmol) 및 TSTU(39mg, 0.130mmol)을 차례로 상기 용액에 첨가하고, 실온에서 아르곤하에 5시간동안 교반을 지속하였다. 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(24mg, 0.118mmol, 중간물질 2)를 첨가하고, 실온에서 아르곤하에 23시간동안 교반을 지속하였다. 조질의 반응 혼합물을 물에 첨가하고, 메틸렌 클로라이드에 의해 2회 추출하였다. 2 유기상을 합하고, 물(3x) 및 염수로 차례로 세척하고, 황산 나트륨상에서 건조시키고, 농축시켰다. 0 내지 20% 메탄올-에틸 아세테이트 구배로 용출시키는 플래시 크로마토그래피로 정제한 후에 에틸 아세테이트-에테르로부터 결정화하여서 트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(30.4mg, 63%)를 제공하였다. HR-MS (ES) m/e C21H28F3N3O3(M+H+)의 계산치 428.2156, 실측치 428.2156.
실시예 73
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드)
1 단계: (2-메톡시에틸)-하이드라진의 제조방법
얼음물 중탕에서 0℃에서 에탄올(7ml)중 하이드라진 일수화물(22ml, 453.5mmol)의 용액에 1-브로모-2-메톡시 에테인(4.0ml, 42.44mmol)을 20분동안 적가 첨가하였다. 이어서, 반응물을 실온으로 가온시키고, 40분동안 교반한 후에 12시간동안 예열된 오일 중탕에서 45℃까지 가열하였다. 이어서, 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 나머지 수성 층을 메틸렌 클로라이드(2 x 100ml) 및 다이에틸 에테르(2 x 100ml)로 추출하였다. 유기 층을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고 농축시켜서 (2-메톡시에틸)-하이드라진을 무색 오일(2.35g, 61%)로 제공하였다.
2 단계: 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르의 제조방법
에탄올(40ml)중 (2-메톡시에틸)-하이드라진(2.35g, 26.07mmol)의 용액에 에틸(에톡시메틸렌)시아노 아세테이트(4.40g, 26.48mmol)를 첨가하였다. 상기 용액을 3시간동안 예열된 오일 중탕(90℃)에서 환류 온도까지 가열하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(약 100ml)에 용해시키고, 물(10ml) 및 염수(10ml)로 세척하였다. 유기 층을 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(5.3g, 95%)를 오렌지색 오일로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 214.0(M+1).
3 단계: 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르의 제조방법
아질산 t-부틸(5.3ml, 40.10mmol), 무수 염화제일구리(4.10g, 41.41mmol) 및 무수 아세토니트릴(100ml)의 혼합물에 0℃에서 10분에 걸쳐 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(17.8g, 83.4mmol)를 첨가하였다. 반응 혼합물을 1시간동안 실온에서 교반한 다음, 2시간동안 60℃에서 교반하고, 이어서 실온에서 밤새 교반하였다. 이어서, 혼합물을 실온으로 냉각시키고, 6.0N 수성 HCl(100ml)로 조심스럽게 부었다. 수성 상을 메틸렌 클로라이드(3 x 300ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르를 오렌지색 오일(4.6g, 80%)로 수득하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 233.0(M+1).
4 단계: 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산의 제조방법
메탄올(32ml) 및 물(32ml)중 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(4.60g, 19.77mmol)의 용액에 수산화리튬(1.10g, 26.22mmol)을 첨가하였다. 반응 혼합물을 3시간동안 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(3 x 50ml)에 의해 추출하였다. 유기 추출물을 합하여 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공 에서 농축시켜서 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산을 백색 고형물(1.27g, 31%)로 제공하였다. 질량 스펙트럼: m/z: 205.3(M+1).
5 단계: 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 제조방법
5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산(1.270g, 6.207mmol)을 무수 메틸렌 클로라이드(5ml) 및 무수 N,N-다이메틸포름아마이드(6ml)의 혼합물에 용해시켰다. 상기 용액에 다이이소프로필에틸아민(9.0ml, 51.67mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(2.30g, 7.64mmol)를 첨가하였다. 상기 용액을 4시간동안 실온에서 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-4-아미노-아다만탄-1-올 염산(중간물질 2에서 제조됨, 1.30g, 6.382mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 조질의 물질을 실리카 겔상에서(에틸 아세테이트 내지 10% 메탄올/에틸 아세테이트의 구배로 용출시킴) 컬럼 크로마토그래피로 정제하여서 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 회백색 고형물(0.756g, 34.5%)을 제공하였다. ES-HRMS m/e C17H24ClN3O3(M+H+)의 계산치 353.1579, 실측치 353.1576.
6 단계: 트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드의 제조방법
무수 N,N-다이메틸포름아마이드(26ml)중 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(0.177g, 0.500mmol) 및 피라졸(0.280g, 4.113mmol)의 용액에 60% 수소화나트륨(0.160g, 4mmol)을 첨가하였다. 상기 용액을 20시간동안 예열된 오일 중탕에서 120℃까지 가열하였다. 용액을 실온으로 냉각하고, 물(1ml) 및 수성 NH4Cl(1ml)로 반응을 중지시켰다. 침전이 발생되지 않았으므로, 수성 상을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 가열하에(약 100℃) 진공에서 농축하여서 과량의 N,N-다이메틸포름아마이드를 제거하였다. 생성물을 실리카 겔상에서 (5% 메탄올/메틸렌 클로라이드로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(0.125g, 65%)로 제공하였다. ES-HRMS m/e C20H27N5O3(M+H+)의 계산치 408.2006, 실측치 408.2003.
실시예 74
트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: (2-메톡시에틸)-하이드라진의 제조방법
얼음물 중탕에서 0℃에서 에탄올(7ml)중 하이드라진 일수화물(22ml, 453.5mmol)의 용액에 1-브로모-2-메톡시 에테인(4.0ml, 42.44mmol)을 20분동안 적가하였다. 이어서, 반응물을 실온으로 가온시키고, 40분동안 교반한 후에 12시간동안 예열된 오일 중탕에서 45℃까지 가열하였다. 이어서, 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 나머지 수성 층을 메틸렌 클로라이드(2 x 100ml) 및 다이에틸 에테르(2 x 100ml)로 추출하였다. 유기 층을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고 농축시켜서 (2-메톡시에틸)-하이드라진을 무색 오일(2.35g, 61%)로 제공하였다.
2 단계: 1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르의 제조방법
에탄올(2ml)중 (2-메톡시에틸)-하이드라진(0.104, 1.15mmol)의 용액에 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트(중간물질 4, 0.261mg, 1.09mmol)를 첨가하였다. 생성된 용액을 160℃에서 0.5시간동안 극초단파 처리하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(50ml)에 용해시키고, 물(20ml) 및 염수(10ml)로 세척하였다. 유기 층을 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(296.1mg, 99%)를 갈색 오일로 수득하고, 추가의 정제없이 사용하였다.
3 단계: 1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산의 제조방법
메탄올(3ml) 및 물(3ml)중 1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(0.291g, 1.09mmol)의 용액이 수산화리튬(0.072g, 1.73mmol)을 첨가하였다. 반응 혼합물을 환류 온도에서 2시간동안 교반하고, 이어서 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(3 x 25ml)로 추출하였다. 유기 추출물을 합하여 무수 MgSO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산을 오렌지색 오일(0.183g, 71%)로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 239.0(M+1).
4 단계: 트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 제조방법
1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(0.180g, 0.756mmol)을 무수 메틸렌 클로라이드(4ml) 및 무수 N,N-다이메틸포름아마이드(1ml)의 혼합물에 용해시켰다. 상기 용액에 다이이소프로필에틸아민(1.1ml, 6.31mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이 트(0.280g, 0.93mmol)를 첨가하였다. 용액을 실온에서 3시간동안 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-4-아미노-아다만탄-1-올 염산(중간물질 2, 0.160g, 0.785mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 물(2 x 20ml) 및 염수(20ml)로 세척하고, 무수 MgSO4 상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 오렌지색 오일로 제공하였다. 조질의 물질을 실리카 겔상에서 (메틸렌 클로라이드로부터 5% 내지 10% 메탄올/에틸 아세테이트의 구배로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(0.073g, 25%)로 제공하였다. ES-HRMS m/e C18H24F3N3O3(M+H+)의 계산치 410.1662, 실측치 410.1662.
실시예 75
트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: (2-메톡시에틸)-하이드라진
얼음물 중탕에서 0℃에서 에탄올(120ml)중 하이드라진 일수화물(89.4ml, 8.00mol)의 용액에 1-브로모-2-메톡시 에테인(18.8ml, 0.20mol)을 20분동안 적가하였다. 이어서, 반응물을 실온으로 가온시키고, 40분동안 교반한 후에 12시간동안 예열된 오일 중탕에서 45℃까지 가열하였다. 이어서, 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 나머지 수성 층을 메틸렌 클로라이드(2 x 100ml) 및 다이에틸 에테르(2 x 100ml)로 추출하였다. 유기 층을 합치고, 무수 Na2SO4상에서 건조시키고, 여과하고 농축시켜서 (2-메톡시에틸)-하이드라진을 무색 오일(8.0g, 50%)로 제공하였다.
2 단계: 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올(170ml)중 (2-메톡시에틸)-하이드라진(9.0g, 99.9mmol)의 용액에 에틸(에톡시메틸렌)시아노 아세테이트(14.36g, 84.9mmol)를 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕(90℃)에서 환류 온도까지 가열하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(약 100ml)에 용해시키고, 물(10ml) 및 염수(10ml)로 세척하였다. 유기층을 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(17.8g, 98%)를 적색 오일로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 214.0(M+1).
3 단계: 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르
아질산 t-부틸(17.6ml, 133.4mmol), 무수 염화제일구리(13.55g, 136.9mmol) 및 무수 아세토니트릴(160ml)의 혼합물에 5-아미노-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(17.8g, 83.4mmol)를 10분동안 0℃에서 첨가하였다. 반응 혼합물을 실온에서 1시간동안 교반하고, 이어서 2시간동안 70℃에서 교반하였다. 이어서, 혼합물을 실온으로 냉각시키고, 6.0N 수성 HCl(85ml)에 조심스럽게 부었다. 수성 상을 메틸렌 클로라이드(3 x 150ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 조질의 물질을 녹색 오일로 제공하였다. 생성물을 실리카 겔상에서 (3:7 내지 1:0의 구배를 이용하는 에틸 아세테이트/헥세인으로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르를 연황색 오일(8.51g, 44%)로 제공하였다. 질량 스펙트럼: m/z: 233.0(M+1).
4 단계: 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산
메탄올(37ml) 및 물(37ml)중 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 에틸 에스테르(8.51g, 36.6mmol)의 용액에 수산화리튬(1.21g, 50.4mmol)을 첨가하였다. 반응 혼합물을 3시간동안 환류 온도에서 교반한 후에 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(3 x 50ml)로 추출하였다. 유기 추출물을 합하여 무수 Na2SO4상에서 건조시키고, 여과하고 진공에서 농축시켜서 5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산을 백색 고형물(6.93g, 92%)로 제공하였다. 질량 스펙트럼: m/z: 205.3(M+1).
5 단계: 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산(178mg, 0.870mmol)을 무수 메틸렌 클로라이드(1ml) 및 무수 N,N-다이메틸포름아마이드(3.5ml)의 혼합물에 용해시켰다. 상기 용액에 N,N-다이이소프로필에틸아민(1.21ml, 7.00mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(289mg, 0.960mmol)을 첨가하였다. 용액을 실온에서 4시간동안 교반한 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨, 200mg, 0.960mmol)를 첨가하였다. 상기 용액을 24시간동안 교반한 후에 물(20ml)에 의해 반응을 중지시켰다. 수성층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 조질의 물질을 제공하였다. 실리카 겔상에서 (메틸렌 클로라이드 내지 4% 메탄올/메틸렌 클로라이드의 구배로 용출시켜서) 컬럼 크로마토그래피로 조질의 물질을 정제하여서 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드를 회백색 고형물(174mg, 50%)로 제공하였다. ES-HRMS m/e C19H27ClN4O3(M+H+)의 계산치 395.1842, 실측치 395.1845.
6 단계: 트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일-아마이드
N-메틸피롤리딘온(1.5ml)중 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(116mg, 0.300mmol) 및 피라졸(61mg, 0.90mmol)의 용액에 수성 수산화나트륨(0.100ml, 1.20mmol, 50%w/w)을 첨가하였다. 12시간동안 예열된 오일 중탕에서 상기 용액을 120℃까지 가열하였다. 상기 용액을 실온으로 냉각시키고, 물(1ml) 및 수성 NH4Cl(1ml)로 반응을 중지시켰다. 침전이 일어나지 않았기 때문에, 수성 상을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 가열하에(약 100℃) 농축하여서 과량의 NMP를 제거하였다. 실리카 겔상에서 (5% 메탄올/메틸렌 클로라이드로 용출시켜서) 컬럼 크로마토그래피로 생성물을 정제하여서 트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일-아마이드를 백색 고형물(77mg, 60%)로 제공하였다. 일부 예에서, 고 진공하에 100℃까지 가열하거나 또는 잔류물을 에틸 아세테이트에 용해시키고, 물로 세정하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시킴으로써 잔류 NMP를 제거하였다. ES-HRMS m/e C22H30N6O3(M+H+)의 계산치 427.2452, 실측치 427.2451.
실시예 76
트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: [2-(2-메톡시에톡시)-에틸]-하이드라진
얼음물 중탕에서 0℃에서 에탄올(75ml)중 하이드라진 일수화물(44.0ml, 1.00mol)의 용액에 1-(2-브로모에톡시)-2-메톡시에테인(13.6ml, 0.100mol)을 20분동안 적가하였다. 이어서, 반응물을 실온으로 가온시키고, 5분동안 교반하고, 이어서 12시간동안 예열된 오일 중탕에서 40℃까지 가열하였다. 이어서, 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 나머지 수성 층을 메틸렌 클로라이드(2 x 100ml) 및 다이에틸 에테르(2 x 100ml)로 추출하였다. 유기 층을 합하고, 무수 Na2SO4 상에서 건조시키고, 여과하고, 농축시켜서 [2-(2-메톡시에톡시)-에틸]-하이드라진을 연황색 오일(10.29g, 85%)로 제공하였다.
2 단계: 5-아미노-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올(77ml)중 [2-(2-메톡시에톡시)-에틸]-하이드라진(6.0g, 44.7mmol)의 용액에 에틸(에톡시메틸렌)시아노 아세테이트(6.43g, 37.99mmol)를 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕(90℃)에서 환류 온도까지 가열하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(약 100ml)에 용해시키고, 물(20ml) 및 염수(10ml)로 세척하였다. 유기 층을 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시켜서 5-아미노-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 에틸 에스테르(10.38g, 99%)를 오렌지색 오일로 수득하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 258.0(M+1).
3 단계: 5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 에틸 에스테르
아질산 t-부틸(8.5ml, 64.5mmol), 무수 염화제일구리(6.54g, 66.1mmol) 및 무수 아세토니트릴(80ml)의 혼합물에 5-아미노-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 에틸 에스테르(10.38g, 40.3mmol)를 10분동안 0℃에서 첨가하였다. 반응 혼합물을 실온에서 1시간동안 교반한 다음 2시간동안 70℃에서 교반하였다. 이어서, 혼합물을 실온으로 냉각시키고, 6.0N 수성 HCl(45ml)에 조심스럽게 부었다. 수성 상을 메틸렌 클로라이드(3 x 150ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 오일로 제공하였다. 생성물을 실리카 겔상에서 (에틸 아세테이트/헥세인에 의해 1:3 내지 1:0의 구배를 이용하여 용출시켜서) 컬럼 크로마토그래피로 정제하여 5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 에틸 에스테르를 연황색 오일(3.43g, 30%)로 제공하였다. 질량 스펙트럼: m/z: 277.0(M+1).
4 단계: 5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산
메탄올(12ml) 및 물(12ml)중 5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라 졸-4-카르복실산 에틸 에스테르(3.43g, 12.39mmol)의 용액에 수산화리튬(415mg, 17.3mmol)을 첨가하였다. 반응 혼합물을 3시간동안 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(3 x 50ml)에 의해 추출하였다. 유기 추출물을 합하여 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시켜서 5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산을 백색 고형물(2.65g, 86%)로 제공하였다. 질량 스펙트럼: m/z: 249.0(M+1).
5 단계: 트랜스-5-클로로-1-[2-(메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
5-클로로-1-[2-(2-메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산(497mg, 2.00mmol)을 무수 메틸렌 클로라이드(2ml) 및 무수 N,N-다이메틸포름아마이드(8ml)의 혼합물에 용해시켰다. 상기 용액에 N,N-다이이소프로필에틸아민(2.8ml, 16.0mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(722mg, 2.40mmol)를 첨가하였다. 상기 용액을 3시간동안 실온에서 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-4-아미노-아다만탄-1-올 염산(중간물질 2, 489mg, 2.40mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 물(2 x 20ml) 및 염수(20ml)로 세척하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 조질의 물질을 실리카 겔상에서 (에틸 아세테이트 내지 5%, 이어서는 10% 메탄올/에틸 아세테이트의 구배로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 트랜스-5-클로로-1-[2-(메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(460mg, 58%)로 제공하였다. ES-HRMS m/e C19H28ClN3O4(M+H+)의 계산치 398.1841, 실측치 398.1842.
6 단계: 트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
N-메틸피롤리딘온(3ml)중 5-클로로-1-[2-(메톡시에톡시)-에틸]-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(200mg, 0.500mmol) 및 피라졸(103mg, 1.5mmol)의 용액에 수성 수산화나트륨(0.200ml, 3.79mmol, 50% w/w)을 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕에서 120℃까지 가열하였다. 상기 용액을 실온으로 냉각하고, 물(2ml) 및 수성 NH4Cl(2ml)로 반응 중지시켰다. 침전이 일어나지 않았으므로, 수성 상을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 가열하에(약 100℃) 진공에서 농축하여서 과량의 NMP를 제공하였다. 생성물을 실리카 겔상에서 (5% 메탄올/메틸렌 클로라이드로 용출시켜서) 컬럼 크로마토그래피로 정제 하여서 트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시아다만탄-2-일)-아마이드를 무색 오일(142mg, 66%)로 제공하였다. ES-HRMS m/e C22H31N5O4(M+H+)의 계산치 430.2449, 실측치 430.2449.
실시예 77
트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 2-(2-브로모에톡시)-2-메틸프로페인
교반기를 갖춘 고압 플라스크에 2-브로모에탄올(14.1ml, 200mmol), 메틸렌 클로라이드(35ml) 및 진한 황산(1ml)을 첨가하였다. 플라스크를 드라이아이스/아세톤 중탕에서 -78℃로 냉각하였다. -78℃로 냉각시킨 별도의 플라스크에서 2-메틸프로펜(약 50ml)을 응축시켰다. 이어서, 2-브로모에탄올을 함유한 플라스크에 2-메틸프로펜을 첨가하였다. 플라스크를 밀봉하고, 실온에서 48시간동안 교반하였다. 이 때, 플라스크를 드라이아이스/아세톤 중탕에서 -78℃로 냉각시켰다. 플라스크를 열고, 포화 중탄산나트륨 수용액(100ml)에 조심스럽게 부었다. 수성 층을 메틸렌 클로라이드(2 x 50ml) 및 헥세인(1 x 50ml)으로 추출하였다. 유기 층을 합하고, 무수 황산 나트륨상에 건조시키고, 여과하고, 농축하여서 2-(2-브로모에톡 시)-2-메틸프로페인을 무색 오일(35g, 97%)로 제공하였다.
2 단계: (2-3급-부톡시에틸)-하이드라진
얼음물 중탕에서 0℃에서 에탄올(70ml)중 하이드라진 일수화물(36.0ml, 0.750mol)의 용액에 2-(2-브로모에톡시)-2-메틸프로페인(12.1ml, 0.075mol)을 20분동안 적가하였다. 이어서, 반응물을 실온으로 가온시키고, 5분동안 교반한 후에 4시간동안 예열된 오일 중탕에서 40℃까지 가열하였다. 이어서, 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 플라스크에 물(20ml)을 첨가하고, 수성 층을 다이에틸 에테르(2 x 100ml)로 추출하였다. 유기 층을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고 농축시켜서 (2-3급-부톡시에틸)-하이드라진을 무색 오일(6.05g, 61%)로 제공하였다.
3 단계: 1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올(4ml)중 (2-3급-부톡시에틸)-하이드라진(260mg, 1.96mmol)의 용액에 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트(중간물질 4, 400mg, 1.67mmol)를 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕(90℃)에서 환류 온도까지 가열하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(50ml)에 용해시키고, 물(20ml) 및 염수(10ml)로 세척하였다. 유기 층을 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실 산 에틸 에스테르(620mg, >99%)를 오렌지색 오일로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 309.2(M+1).
4 단계: 1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산
메탄올(2ml) 및 물(2ml)중 1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(620mg, 2.0mmol)의 용액에 수산화리튬(67mg, 2.8mmol)을 첨가하였다. 반응 혼합물을 4시간동안 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(2 x 30ml)에 의해 추출하였다. 유기 추출물을 합하여 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시켜서 1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산을 적색 오일(425mg, 75%)로 수득하고, 이를 추가의 정제없이 사용하였다.
5 단계: 트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(425mg, 1.51mmol)을 무수 메틸렌 클로라이드(1.5ml) 및 무수 N,N-다이메틸포름아마이드(6ml)의 혼합물에 용해시켰다. 상기 용액에 N,N-다이이소프로필에틸아민(2.1ml, 12.0mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(548mg, 1.82mmol)를 첨가하였다. 상기 용액을 3시간동안 실온에서 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(중간물질 2, 370mg, 1.82mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 물(2 x 20ml) 및 염수(20ml)로 세척하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 조질의 물질을 실리카 겔상에서 (메틸렌 클로라이드로부터 5% 내지 10% 메탄올/메틸렌 클로라이드의 구배로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물로 제공하였다. 백색 고형물을 고온의 다이에틸 에테르, 메틸렌 클로라이드 및 메탄올(99/1/0.1)로부터 재결정시켜서 목적 생성물을 백색 고형물(135mg, 21%)로 제공하였다. ES-HRMS m/e C21H30F3N3O3(M+H+)의 계산치 430.2312, 실측치 430.2314.
실시예 78
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 하이드라진카르복실산 3급-부틸 에스테르
아세톤(75ml, 1.0mol)중 3급-부틸 카바제이트(10.0g, 75.6mmol)의 용액에 무수 황산 마그네슘(약 2.0g) 및 빙초산 10방울을 첨가하엿다. 상기 용액을 1시간동안 예열된 오일 중탕(약 85℃)에서 환류 온도까지 가열하였다. 상기 용액을 실온으로 냉각시키고, 여과하고, 진공에서 농축시켜서 하이드라진카르복실산 3급-부틸 에스테르를 백색 고형물(12.0g, 92%)로 제공하였다. 질량 스펙트럼: m/z: 173.3(M+1).
2 단계: N'-이소프로필리덴-N-(3-메톡시프로필)-하이드라진카르복실산 3급-부틸 에스테르
톨루엔(90ml)중 하이드라진카르복실산 3급-부틸 에스테르(4.67g, 27.16mmol)의 용액에 분쇄된 수산화칼륨(1.98g, 35.3mmol) 및 테트라부틸암모늄 하이드로겐설페이트(904mg, 2.72mmol)를 첨가하였다. 용액을 예열된 오일 중탕에서 50℃까지 가열하고, 1-브로모-3-메톡시프로페인(3.67ml, 32.6mmol)을 45분동안 적가하였다. 이어서, 용액을 3시간동안 80℃까지 가열하였다. 상기 용액을 실온으로 냉각시키고, 수층이 중성이 될 때까지 물(3 x 150ml)로 세척하였다. 유기 층을 무수 황산 마그네슘상에서 건조시키고, 여과하고, 진공에서 농축시켜서 N'-이소프로필리덴-N-(3-메톡시프로필)-하이드라진카르복실산 3급-부틸 에스테르를 점성 오일(6.49g, 98%)로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 245.4(M+1).
3 단계: (3-메톡시프로필)-하이드라진 다이하이드로클로라이드
테트라하이드로푸란(50ml)중 N'-이소프로필리덴-N-(3-메톡시프로필)-하이드라진카르복실산 3급-부틸 에스테르(6.49g, 26.6mmol)의 용액에 2.0N 염산(27ml)을 첨가하였다. 상기 용액을 3시간동안 예열된 오일 중탕에서 환류 온도(약 80℃)까지 가열하였다. 상기 용액을 실온으로 냉각시키고, 진공에서 농축시켜서 테트라하이드로푸란을 제거하였다. 수성 층에 톨루엔(200ml)을 첨가하고, 진공에서 농축시켜(2회 더 반복) 물을 제거하여서 (3-메톡시프로필)-하이드라진 다이하이드로클로라이드(4.65g, 96%)을 연황색 점성 고형물로 수득하고, 이를 추가의 정제없이 사용하였다.
4 단계: 5-아미노-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르
에탄올(38ml)중 (3-메톡시프로필)-하이드라진 다이하이드로클로라이드(4.5g, 25.4mmol) 및 아세트산 나트륨(4.6g, 56.0mmol)의 용액에 에틸(에톡시메틸렌)시아노 아세테이트(3.89g, 23.0mmol)를 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕(90℃)에서 환류 온도까지 가열하였다. 반응물을 실온으로 냉각시키고, 농축시켜서 에탄올을 제거하였다. 잔류물을 메틸렌 클로라이드(약 100ml)에 용해시키고, 물(30ml)로 세척하였다. 유기층을 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축시켜서 5-아미노-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르(5.01g, 96%)를 오렌지색 오일로 제공하고, 이를 추가의 정제없이 사용하였다. 질량 스펙트럼: m/z: 228.4(M+1).
5 단계: 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르
무수 아세토니트릴(46ml)중 5-아미노-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르(5.22g, 23.0mmol)의 혼합물에 무수 염화제일구리(3.73g, 37.7mmol) 및 아세트산(2.6ml, 46.0mmol)을 첨가하였다. 혼합물을 얼음물 중탕에서 0℃로 냉각시킨 후에 아질산 3급-부틸(4.9ml, 36.8mmol)을 10분동안 첨가하였다. 상기 용액을 실온으로 가온시키고, 4시간동안 교반하였다. 상기 용액에 6.0N 염산(20ml)을 조심스럽게 부었다. 수성 층을 메틸렌 클로라이드(2 x 100ml)로 추출하였다. 유기 층을 합하고, 무수 황산나트륨상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 생성물을 실리카 겔상에서 (에틸 아세테이트/헥세인 1:1로 용출시켜) 컬럼 크로마토그래피로 정제하여 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르(1.71g, 30%)를 오렌지색 오일로 제공하였다. 질량 스펙트럼: m/z: 247.3(M+1).
6 단계: 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산
메탄올(7ml) 및 물(7ml)중 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 에틸 에스테르(1.71g, 7.0mmol)의 용액에 수산화리튬(235mg, 9.8mmol)을 첨가하였다. 반응 혼합물을 3시간동안 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 이어서, 잔류물을 6.0N 수성 HCl에 의해 조심스럽게 산성화시켰다. 생성된 혼합물을 메틸렌 클로라이드(2 x 50ml)에 의해 추출하였다. 유기 추출물을 합하여 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시켜서 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산을 오렌지색 고형 물(1.35g, 88%)로 제공하였다. 질량 스펙트럼: m/z: 219.3(M+1).
7 단계: 트랜스-5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산(500mg, 2.29mmol)을 무수 메틸렌 클로라이드(2.3ml) 및 무수 N,N-다이메틸포름아마이드(9ml)의 혼합물에 용해시켰다. 상기 용액에 N,N-다이이소프로필에틸아민(3.2ml, 18.32mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(827mg, 2.75mmol)를 첨가하였다. 상기 용액을 3시간동안 실온에서 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음을 나타내었다. 이어서, 트랜스-4-아미노-아다만탄-1-올 염산(중간물질 2, 606mg, 2.97mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 물(2 x 20ml) 및 염수(20ml)로 세척하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 조질의 물질을 실리카 겔상에서 (75% 메탄올/에틸 아세테이트 내지 에틸 아세테이트의 구배로 용출시켜서) 컬럼 크로마토그래피로 정제하여서 트랜스-5-클로로-(3-메톡시프로필)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(452mg, 53%)로 제공하였다. ES-HRMS (ES) m/e C18H26ClN3O3(M+H+)의 계산치 368.1736, 실측치 368.1733.
8 단계: 트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
N-메틸피롤리딘온(3.5ml)중 5-클로로-1-(3-메톡시프로필)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(200mg, 0.544mmol) 및 피라졸(74mg, 1.09mmol)의 용액에 수산화나트륨(87mg, 2.18mmol) 및 물(0.1ml)을 첨가하였다. 상기 용액을 16시간동안 예열된 오일 중탕에서 120℃까지 가열하였다. 상기 용액을 실온으로 냉각하고, 물(1ml) 및 수성 NH4Cl(1ml)로 반응을 중지시켰다. 침전이 발생되지 않았으므로, 수성 상을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합치고, 무수 Na2SO4상에서 건조시키고, 여과하고, 가열하에(약 100℃) 진공에서 농축하여서 과량의 NMP를 제공하였다. 생성물을 실리카 겔상에서 (5% 메탄올/메틸렌 클로라이드로 용출시켜) 컬럼 크로마토그래피로 정제하여서 트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시아다만탄-2-일)-아마이드를 백색 고형물(108mg, 50%)로 제공하였다. 일부 경우에서, 잔류 NMP는 고 진공하에 100℃까지 가열함으로써 또는 에틸 아세테이트에 잔류물을 용해시키고, 물로 세정하고 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시킴으로써 제거하였다. ES-HRMS m/e C21H29N5O3(M+H+)의 계산치 400.2343, 실측치 400.2342.
실시예 79
트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 트랜스-5-클로로-1-(2-메톡시프로필)-1H-피라졸-4-카르복실산 (5-에틸아세틸아미노-아다만탄-2-일)-아마이드
5-클로로-1-(2-메톡시프로필)-1H-피라졸-4-카르복실산(실시예 78, 6 단계에서 제조됨, 190mg, 0.872mmol)을 무수 메틸렌 클로라이드(1ml) 및 무수 N,N-다이메틸포름아마이드(4ml)의 혼합물에 용해시켰다. 상기 용액에 다이이소프로필에틸아민(1.4ml, 8.00mmol) 및 O-(N-숙신이미딜)-1,1,3,3-테트라메틸우로늄 테트라플루오로보레이트(290mg, 0.960mmol)를 첨가하였다. 상기 용액을 3시간동안 실온에서 교반하고, 그 후에 분액을 LC-MS에 의해 분석하여서 활성화 에스테르로 완전히 전환되었음이 나타났다. 이어서, 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨, 200mg, 0.960mmol)을 첨가하였다. 상기 용액을 24시간동안 교반하고, 그 후에 물(20ml)에 의해 반응을 중지시켰다. 수성 층을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 진공에서 농축하여서 조질의 물질을 제공하였다. 조질의 물질을 실리카 겔상에서 (메틸렌 클로라이드 내지 5% 메탄올/메틸렌 클로라이드의 구배 로 용출시켜) 컬럼 크로마토그래피로 정제하여서 트랜스-5-클로로-1-(2-메톡시프로필)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드를 솜털같은(fluffy) 백색 고형물(200mg, 56%)로 제공하였다. ES-HRMS m/e C20H29ClN4O3(M+H+)의 계산치 409.2001, 실측치 409.2002.
2 단계: 트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
N-메틸피롤리딘온(2.5ml)중 5-클로로-1-(2-메톡시프로필)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(232mg, 0.57mmol) 및 피라졸(155mg, 2.27mmol)의 용액에 수성 수산화나트륨(0.300ml, 5.68mmol, 50% w/w)을 첨가하였다. 상기 용액을 24시간동안 예열된 오일 중탕에서 120℃까지 가열하였다. 상기 용액을 실온으로 냉각시키고, 물(1ml) 및 수성 NH4Cl(1ml)로 반응 중지시켰다. 침전이 일어나지 않았으므로, 수성 상을 메틸렌 클로라이드(2 x 50ml)로 추출하였다. 유기 추출물을 합하고, 무수 Na2SO4상에서 건조시키고, 여과하고, 가열하에(약 100℃) 진공에서 농축하여서 과량의 NMP를 제거하였다. 생성물을 실리카 겔상에서 (5% 메탄올/메틸렌 클로라이드로 용출시켜) 컬럼 크로마토그래피로 정제하여서 트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미도-아다만탄-2-일)-아마이드를 백색 고형물(170mg, 69%)로 제공하였다. 일부 경우에, 잔류 NMP는 고 진공하에 100℃까지 가열함으로써 또는 에틸 아세테이트 에 잔류물을 용해시키고, 물로 세정하고 무수 Na2SO4 상에서 건조시키고, 여과하고, 진공에서 농축시킴으로써 제거하였다. ES-HRMS m/e C23H32N6O3(M+H+)의 계산치 441.2609, 실측치 441.2609.
실시예 80
트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산(중간물질 6, 291mg, 1.33mmol)을 무수 다이클로로메테인(12ml) 및 무수 DMF(3ml)의 혼합물에 용해시키고, TSTU(481mg, 1.6mmol)을 첨가하였다. 이어서, DIPEA(1.4ml, 8mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올(268mg, 1.6mmol, 중간물질 2)을 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기 층을 합하고 진공에서 건조시켰다. 조질의 혼합물을 C-18 역상 예비-HPLC에 의해 10 내지 100% 아세토니트릴/물의 구배로 정제하여서 트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(254mg, 52%)를 제공하였다. LRMS m/z C18H22F3N3O2(M+H)의 계산치 370.2, 실측치 370.2.
실시예 81
트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 5-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르의 혼합물의 합성
에탄올 60ml중 사이클로프로필 하이드라진 하이드로클로라이드(추가의 정제없이 중간물질 5, 3.65g, 33.67mmol), 에틸 (에톡시메틸렌)-시아노아세테이트(5.69g, 33.67mmol) 및 무수 아세트산 나트륨(2.03g, 33.67mmol)을 함유하는 혼합물을 교반하고, 밤새 환류시켰다. 상기 용액을 실온으로 냉각시키고, 물 및 다이클로로메테인을 첨가하였다. 분리된 수성 상을 다이클로로메테인으로 3회 추출하였다. 유기 상을 합하여 물 및 염수 용액으로 연속하여 세척하고, 황산 나트륨에 의해 건조시키고, 여과하였다. 용매를 진공에서 제거하고, 조질의 잔류물을 0 내지 2% 메탄올/다이클로로메테인의 구배로 용출시키는 플래시 크로마토그래피에 의해 정제하여서 5-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르(처음에 용출됨) 및 3-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르(조금 나중에 용출됨)의 혼합물(2 이성체: 총 2.03g, 31%)을 제공하고, 이를 추가의 분리없이 혼합물로 사용하였다. LRMS m/z C9H13N3O2(M+H)의 계산치 196.1, 실측치 196.1.
2 단계: 5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르의 혼합물의 합성
아질산 t-부틸(2.03ml, 15.38mmol), 염화제일구리(1.52g, 15.38mmol) 및 무수 아세토니트릴(30ml)의 혼합물에 0℃에서 무수 아세토니트릴(20ml)중 5-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-아미노-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르(마지막 단계로부터)의 혼합물의 용액을 첨가하였다. 반응 혼합물을 1시간동안 실온에서 교반하고, 이어서 2시간동안 60℃에서 교반하였다. 혼합물을 실온으로 냉각시키고, 6N HCl(20ml)에 붓고, 다이클로로메테인으로 추출하였다. 수성 상을 다이클로로메테인으로 3회 추출하였다. 유기 상을 합치고 진공에서 농축시킨 후에, 조질의 잔류물을 10 내지 20% 에틸 아세테이트/헥세인, 이어서 20% 에틸 아세테이트/헥세인의 구배로 용출시키며 플래시 크로마토그래피로 정제하여서 5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르(처음 용출됨, 296mg, 13%) 및 3-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 에틸 에스테르(나중에 용출됨, 159mg, 7%)를 제공하였다. LRMS m/z C9H11ClN2O2(M+H)의 계산치 215.1, 실측치 215.1.
3 단계: 5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산의 합성
메탄올(15ml) 및 물(15ml)중 5-클로로-1-사이클로프로필-1H-피라졸-4-카르복 실산 에틸 에스테르(296mg, 1.38mmol)의 용액에 LiOH(40mg, 1.66mmol)을 첨가하였다. 반응 혼합물을 환류 온도에서 밤새 교반하고, 이어서 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl에 의해 pH 2로 산성화시키고, 에틸 아세테이트로 추출하였다. 유기 추출물을 진공에서 증발시키고, 5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산(242mg, 93%)을 제공하고, 이를 추가의 정제없이 사용하였다.
4 단계: 트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 합성
5-클로로-사이클로프로필-1H-피라졸4-카르복실산(242mg, 1.3mmol)을 무수 다이클로로메테인(8ml) 및 무수 DMF(2ml)의 혼합물에 용해시키고, TSTU(318mg, 1.56mmol)을 첨가하였다. 이어서, DIPEA(1.4ml, 7.8mmol)를 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(318mg, 1.56mmol, 중간물질 2)를 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기층을 합하여 진공에서 건조시켰다. 조질의 혼합물을 C-18 역상 예비-HPLC에 의해 10 내지 90% 아세토니트릴/물의 구배로 정제하여서 트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(200mg, 46%)를 제공하였다. LRMS m/z C17H22ClN3O2(M+H)의 계산치 336.1, 실측치 336.1.
실시예 82
트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
수소화 나트륨(광유중 60% 분산액, 115mg, 2.86mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(25ml)중 피라졸(195mg, 2.86mmol)의 용액에 첨가하고, 상기 혼합물을 1시간동안 40℃까지 가열하였다. 트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(120mg, 0.36mmol)를 첨가하고, 혼합물을 48시간동안 110℃에서 가열한 다음 냉각시켰다. DMF를 진공에서 증발시킨 후에 물 및 에틸 아세테이트를 첨가하였다. 유기 층을 분리시키고, 수성 상을 에틸 아세테이트에 의해 3회 추출하였다. 유기상을 합하여 진공에서 농축시키고, 잔류물을 C-18 역상 예비 HPLC에 의해 10 내지 60% 아세토니트릴/물의 구배로 정제하여서 트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(126mg, 95%)를 제공하였다. LRMS m/z C20H25N5O2(M+H)의 계산치 368.2, 실측치 368.2.
실시예 83
트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
수소화 나트륨(오일중 60%, 57mg, 1.43mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(25ml)중 4-클로로-피라졸(148mg, 1.43mmol)의 용액에 첨가하고, 상기 혼합물을 1시간동안 40℃까지 가열하였다. 트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(60mg, 0.18mmol)를 첨가하고, 혼합물을 밤새 110℃로 가열한 다음 냉각시켰다. DMF를 진공에서 증발시킨 후에 물 및 다이클로로메테인을 첨가하였다. 유기 층을 분리시키고, 수성 상을 다이클로로메테인에 의해 3회 추출하였다. 유기상을 합하여 진공에서 농축시키고, 잔류물을 C-18 역상 예비 HPLC에 의해 10 내지 90% 아세토니트릴/물의 구배로 정제하여서 트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(56mg, 77%)를 제공하였다. LRMS m/z C20H24ClN5O2(M+H)의 계산치 402.2, 실측치 402.2.
실시예 84
트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 사이클로프로필메틸-하이드라진의 합성
브로모메틸-사이클로프로페인(7.5g, 55.6mmol)을 실온에서 20분에 걸쳐 교반하에 하이드라진 수화물(13.9g, 277mmol)에 적가하였다. 교반을 실온에서 1시간동안 지속하였다. 이어서, 혼합물을 50℃까지 가열하고, 1시간동안 교반하였다. 반응 혼합물을 실온으로 냉각시키고, 에테르로 3회 추출하였다. 에테르 층을 합하고, 진공에서 농축시켜서 사이클로프로필메틸-하이드라진(3.2g, 67%)을 무색 오일로 제공하고, 이를 추가의 정제없이 사용하였다.
2 단계: 1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르의 합성
트리에틸아민(0.35ml, 2.52mmol) 및 사이클로프로필메틸-하이드라진(72mg, 0.84mmol)을 10ml들이 개인 화학실험용 극초단파 처리 시험관(바이오타지 AB, 스웨덴)에서 에탄올(4ml)중 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트(중간물질 4, 200mg, 0.84mmol)의 용액에 차례로 첨가하였다. 시험관을 격벽에 의해 밀봉하고, 개인 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 160℃에서 30분동안 150W 극초단파 조사하였다. 에탄올을 감압하에 증발시켰다. 나머지 혼합물을 다이클로로메테인과 물 사이에서 분배시키고, 수상을 다이클로로메테인으로 3회 추출하였다. 유기상을 합하고, 진공에서 농축시키고, C-18 역상 HPLC에 의해 10 내지 90% 아세토니트릴/물의 구배로 정제하여서 1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테 르(120mg, 54%)를 제공하였다. LRMS m/z C11H14F3N2O2(M+)의 계산치 263.1, 실측치 263.1.
3 단계: 1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산의 합성
메탄올(5ml) 및 물(5ml)중 1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(120mg, 0.46mmol)의 용액에 LiOH(13mg, 0.54mmol)을 첨가하였다. 반응 혼합물을 밤새 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl에 의해 용액을 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트에 의해 3회 추출하였다. 유기 층을 합하여 진공에서 농축시켜서 1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(100mg, 93%)을 수득하고, 이를 추가의 정제없이 사용하였다.
4 단계: 트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 합성
사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(100mg, 0.43mmol)을 무수 다이클로로메테인(12ml) 및 무수 DMF(3ml)의 혼합물에 용해시키고, TSTU(151mg, 0.52mmol)을 첨가하였다. 이어서, DIPEA(0.45ml, 2.58mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올(87mg, 0.53mmol, 중간물질 2)을 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인에 의해 2회 추출하였 다. 유기 층을 합하여 진공에서 건조시켰다. 조질의 혼합물을 C-18 역상 예비-HPLC에 의해 2 내지 60% 아세토니트릴/물의 구배로 정제하여서 트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(26mg, 16%)를 제공하였다. LRMS m/z C19H24F3N3O2(M+H)의 계산치 384.2, 실측치 384.2.
실시예 85
트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: N'-(2-하이드록시-1,1-다이메틸-에틸)-하이드라진카르복실산 3급-부틸 에스테르의 합성
무수 다이에틸 에테르(20ml)중 N-(3급-부톡시카르본일)-3-(4-시아노페닐)-옥사지리딘(CAS#: 150884-56-3, 아크로스(Acros)에서 구입, 5.17g, 21mmol)의 용액을 실온에서 무수 다이에틸 에테르(20ml)중 2-아미노-2-메틸-프로판-1-올(1.78g, 20mmol)의 용액에 첨가하였다. 반응 혼합물을 실온에서 2시간동안 교반하였다. 다이에틸 에테르를 감압하에 증발시키고, 잔류물을 3 내지 5% 메탄올/다이클로로메테인의 구배로 용출시키는 플래시 크로마토그래피로 정제하여서 N'-(2-하이드록시-1,1-다이메틸-에틸)-하이드라진카르복실산 3급-부틸 에스테르(1.63g, 40%)를 제공하고, 이를 추가의 정제없이 사용하였다.
2 단계: 2-하이드라진오-2-메틸-프로판-1-올 트리플루오로-아세트산 염의 합성
트리플루오로아세트산(4ml)을 다이클로로메테인(4ml)중 N'-(2-하이드록시-1,1-다이메틸-에틸)-하이드라진카르복실산 3급-부틸 에스테르(490mg, 2.4mmol)의 용액에 첨가하였다. 혼합물을 1시간동안 실온에서 교반하였다. 반응 혼합물을 진공에서 농축하여서 2-하이드라진오-2-메틸-프로판-1-올의 트리플루오로아세트산 염(520mg, 정량적)을 제공하고, 이를 추가의 정제없이 사용하였다.
3 단계: 1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르의 합성
트리에틸아민(1.6ml, 12mmol) 및 2-하이드라진오-2-메틸-프로판-1-올의 트리플루오로아세트산 염(520mg, 2.4mmol)을 25ml들이 개인 화학실험용 극초단파 처리 시험관(바이오타지 AB, 스웨덴)에서 에탄올(8ml)중 에틸 3-N,N-다이메틸아미노-2- 트리플루오로아세틸아크릴레이트(중간물질 4, 574mg, 2.4mmol)의 용액에 차례로 첨가하였다. 상기 시험관을 격벽에 의해 밀봉하고, 개인 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 160℃에서 1시간동안 150W 극초단파 조사하였다. 에탄올을 감압하에 증발시켰다. 나머지 혼합물을 다이클로로메테인과 물 사이에서 분배시키고, 수상을 다이클로로메테인으로 3회 추출하였다. 유기층을 합하고, 진공에서 농축시키고, 플래시 크로마토그래피에 의해 0 내지 40% 에틸 아세테이트/헥세인, 이어서 40% 에틸 아세테이트/헥세인의 구배로 정제하여서 1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(328mg, 49%)를 제공하였다. LRMS m/z C11H15F3N2O3(M+H)의 계산치 281.1, 실측치 281.1.
4 단계: 1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산의 합성
메탄올(5ml) 및 물(5ml)중 1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(328mg, 1.17mmol)의 용액에 LiOH(34mg, 1.4mmol)을 첨가하였다. 반응 혼합물을 밤새 환류 온도에서 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 상기 용액을 진한 HCl에 의해 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트에 의해 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축시켜서 1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실 산(280mg, 95%)을 수득하고, 이를 추가의 정제없이 사용하였다.
5 단계: 트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 합성
1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산(280mg, 1.1mmol)을 무수 다이클로로메테인(12ml) 및 무수 DMF(3ml)의 혼합물에 용해시키고, TSTU(403mg, 1.3mmol)을 첨가하였다. 이어서, DIPEA(1.2ml, 6.6mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올(217mg, 1.3mmol, 중간물질 2)을 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인에 의해 2회 추출하였다. 유기 층을 합하여 진공에서 건조시켰다. 조질의 혼합물을 C-18 역상 예비-HPLC에 의해 10 내지 40% 아세토니트릴/물의 구배로 정제하여서 트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(230mg, 52%)를 제공하였다. LRMS m/z C19H26F3N3O3(M+H)의 계산치 402.2, 실측치 402.2.
실시예 86
트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: 2-사이클로프로페인카르본일-3-다이메틸아미노-아크릴산 메틸 에스테르의 합성
3-사이클로프로필-3-옥소-프로피오산 메틸 에스테르(15g, 106mmol) 및 N,N-다이메틸포름아마이드 다이메틸아세탈(14.7ml, 111mmol)의 혼합물을 2시간동안 75℃에서 가열하였다.
조질의 혼합물을 고 진공하에 농축시켜서 조질의 2-사이클로프로페인카르본일-3-다이메틸아미노-아크릴산 메틸 에스테르(20.4g, 91%)를 제공하고, 이를 추가의 정제없이 사용하였다.
2 단계: 1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 메틸 에스테르의 합성
트리에틸아민(4.8ml, 34.2mmol) 및 3급-부틸 하이드라진 하이드로클로라이드(1.4g, 11.4mmol)을 에탄올(24ml)중 조질의 2-사이클로프로페인카르본일-3-다이메틸아미노-아크릴산 메틸 에스테르(2.4g, 11.4mmol)의 용액에 차례로 첨가하였다. 생성된 현탁액을 충분히 혼합하고, 25ml들이 개인 화학실험용 극초단파 처리 시험관(바이오타지 AB, 스웨덴)에 동량으로 나누었다. 상기 시험관을 격벽으로 밀봉하고, 개인 화학실험용 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 160℃에서 30분동안 150W 극초단파 조사하였다. 2 시험관에 있는 반응 혼합물을 합하고, 에탄올을 감압하에 증발시켰다. 나머지 혼합물을 다이클로로메테인과 물 사이에서 분배시키고, 수상을 다이클로로메테인으로 3회 추출하였다. 유기상을 합하고, 진공에서 농축시키고, 10 내지 20% 에틸 아세테이트/헥세인, 이어서 20% 에틸 아세테이트/헥세인의 구배로 용출시키면서 실리카 크로마토그래피에 의해 정제하여서 1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 메틸 에스테르(921mg, 36%)를 제공하였다. LRMS m/z C12H18N2O2(M+H)의 계산치 223.1, 실측치 223.1.
3 단계: 1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산의 합성
메탄올(15ml) 및 물(15ml)중 1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 메틸 에스테르(921mg, 4.14mmol)의 용액에 LiOH(119mg, 4.97mmol)을 첨가하였다. 반응 혼합물을 밤새 환류하에 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 상기 용액을 진한 HCl에 의해 pH 2로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트에 의해 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축시켜서 1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산(789mg, 92%)을 수득하고, 이를 추가의 정제없이 사용하였다.
4 단계: 트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드의 합성
3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산(200mg, 0.96mmol)을 무수 다이클로로메테인(8ml) 및 무수 DMF(2ml)의 혼합물에 용해시키고, TSTU(349mg, 1.16mmol)을 첨가하였다. 이어서, DIPEA(1ml, 5.76mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(236mg, 1.16mmol, 중간물질 2)를 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인에 의해 2회 추출하였다. 유기 층을 합하여 진공에서 건조시켰다. 조질의 혼합물을 2 내지 70% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (트랜스-5-하이드록시-아다만탄-2-일)-아마이드(129mg, 38%)를 제공하였다. LRMS m/z C21H31N3O2(M+H)의 계산치 358.3, 실측치 358.2.
실시예 87
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
1 단계: N'-사이클로부틸리덴-하이드라진카르복실산 3급-부틸 에스테르의 합성
헥세인(225ml)중 사이클로부탄온(15g, 214mmol) 및 하이드라진카르복실산 3급-부틸 에스테르(28.3g, 214mmol)의 반응 혼합물을 2시간동안 환류 온도까지 가열 하였다. 냉각 후에 침전물이 형성되었고, 고형물을 진공하에 여과하였다. 이소프로판올(10ml) 및 헥세인(100ml)을 상기 고형물에 첨가하고, 슬러리가 발생될 때까지 혼합물을 진공하에 회전 증발기상에 놓았다. 여과후에 고형물을 헥세인에 의해 2회 세척하고, 진공에서 건조시켜서 N'-사이클로부틸리덴-하이드라진카르복실산 3급-부틸 에스테르(32g, 81%)를 백색 고형물로 제공하고, 이를 추가의 정제없이 사용하였다.
2 단계: 사이클로부틸하이드라진 하이드로클로라이드의 합성
무수 메탄올(12ml) 및 무수 THF(9ml)중 N'-사이클로부틸리덴-하이드라진카르복실산 3급-부틸 에스테르(2g, 10.8mmol)의 혼합물에 소듐 시아노보로하이드라이드(860mg, 13mmol)를 첨가하였다. 반응 혼합물을 30분동안 환류 온도까지 가열하고, 이어서 실온으로 냉각시키고, 20분동안 교반하였다. 6N HCl(4.6ml)을 반응 혼합물에 적가하였다. 이어서, 혼합물을 30분동안 환류시켰다. 혼합물을 냉각시키고, 염을 여과에 의해 제거하였다. 생성된 여액을 진공에서 농축시켰다. 잔류물을 이소프로판올과 함께 슬러리화시키고, 얼음물 중탕에 의해 급냉시켰다. 이어서, 헥세인을 첨가하고, 슬러리가 발생될 때까지 혼합물을 진공하에 회전 증발기상에 놓았다. 여과하고 헥세인으로 세척한 후에, 사이클로부틸하이드라진 하이드로클로라이드(1.26g, 95%)를 백색 고형물로 수득하고, 추가의 정제없이 사용하였다.
3 단계: 1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르의 합성
트리에틸아민(0.35ml, 2.52mmol) 및 사이클로부틸하이드라진 하이드로클로라이드(200mg, 0.84mmol)를 10ml들이 개인 화학실험용 극초단파 처리 시험관(바이오타지 AB, 스웨덴)에서 에탄올(4ml)중 에틸 3-N,N-다이메틸아미노-2-트리플루오로아세틸아크릴레이트(중간물질 4, 200mg, 0.84mmol)의 용액에 차례로 첨가하였다. 상기 시험관을 격벽에 의해 밀봉하고, 개인 화학실험용 극초단파 합성 시스템(바이오타지 AB, 스웨덴)을 이용하여 160℃에서 30분동안 150W 극초단파 조사하였다. 에탄올을 감압하에 증발시켰다. 나머지 혼합물을 다이클로로메테인과 물 사이에서 분배시키고, 수층을 다이클로로메테인으로 3회 추출하였다. 유기층을 합하고, 진공에서 농축시키고, 40 내지 80% 아세토니트릴/물의 구배로 C-18 역상 HPLC에 의해 정제하여서 1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(117mg, 53%)를 제공하였다. LRMS m/z C11H14F3N2O2(M+)의 계산치 263.1, 실측치 263.1.
4 단계: 1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산의 합성
메탄올(5ml) 및 물(5ml)중 1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 에틸 에스테르(117mg, 0.45mmol)의 용액에 LiOH(13mg, 0.54mmol)을 첨가하였다. 반응 혼합물을 밤새 환류하에 교반한 다음, 용액을 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl에 의해 용액을 pH 2 로 산성화시켰다. 이어서, 생성된 혼합물을 에틸 아세테이트에 의해 3회 추출하였다. 유기 추출물을 합하여 진공에서 농축시켜서 1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(93mg, 89%)을 수득하고, 이를 추가의 정제없이 사용하였다.
5 단계: 트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(73mg, 0.31mmol)을 무수 다이클로로메테인(8ml) 및 무수 DMF(2ml)의 혼합물에 용해시키고, TSTU(205mg, 0.68mmol)을 첨가하였다. 이어서, DIPEA(0.32ml, 1.86mmol)을 상기 혼합물에 첨가하였다. 혼합물을 2시간동안 교반한 후에, 트랜스-4-아미노-아다만탄-1-올 하이드로클로라이드(77mg, 0.38mmol, 중간물질 2)을 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인에 의해 2회 추출하였다. 유기 층을 합하여 진공에서 농축시켰다. 조질의 혼합물을 10 내지 75% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(54mg, 45%)를 제공하였다. LRMS m/z C19H24F3N3O2(M+H)의 계산치 384.2, 실측치 384.2.
실시예 88
트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미 노-아다만탄-2-일)-아마이드
사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산(실시예 87, 4 단계, 100mg, 0.43mmol)을 무수 다이클로로메테인(8ml) 및 무수 DMF(2ml)의 혼합물에 용해시키고, TSTU(285mg, 0.95mmol)을 첨가하였다. 이어서, DIPEA(0.45ml, 2.58mmol)을 상기 혼합물에 첨가하였다. 혼합물을 3시간동안 교반한 후에 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(107mg, 0.51mmol, 실시예 43에서 제조됨)를 첨가하였다. 밤새 교반한 후에, 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기층을 합하여 진공에서 농축시켰다. 조질의 혼합물을 10 내지 90% 아세토니트릴/물의 구배로 C-18 역상 예비 HPLC에 의해 정제하여서 트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(104mg, 57%)를 제공하였다. LRMS m/z C21H27F3N4O2(M+H)의 계산치 425.2, 실측치 425.2.
실시예 89
트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
1 단계: 사이클로부틸-하이드라진의 합성
무수 메탄올(180ml) 및 무수 THF(120ml)중 N'-사이클로부틸리덴-하이드라진카르복실산 3급-부틸 에스테르(24g, 130mmol)의 혼합물에 소듐 시아노보로하이드라이드(10.3g, 156mmol)를 첨가하였다. 반응 혼합물을 1시간동안 환류 온도까지 가열한 다음 실온으로 냉각시키고 30분동안 교반하였다. 6N HCl(56ml)을 반응 혼합물에 적가하였다. 이어서, 혼합물을 1시간동안 환류시켰다. 혼합물을 냉각시키고, 여과에 의해 고형물을 제거하였다. 생성된 여액을 진공에서 농축시켰다. 잔류물을 트리에틸아민으로 처리하여서 약염기성 혼합물을 형성하고, 상기 혼합물을 물로 희석하고, 에틸 아세테이트로 추출하였다. 분리된 수성 층을 에틸 아세테이트에 의해 3회 추출하였다. 유기 층을 합하여 진공에서 농축시켜서 조질의 사이클로부틸-하이드라진(11g, 98%)을 오일로 수득하고, 이를 추가의 정제없이 사용하였다.
2 단계: 5-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르의 혼합물의 합성
에탄올(140ml)중 조질의 사이클로부틸-하이드라진(추가의 정제없이 마지막 단계로부터; 3.5g, 40.8mmol) 및 에틸 (에톡시메틸렌)-시아노아세테이트(6.9g, 40.8mmol)를 함유하는 혼합물을 교반하고, 밤새 환류시켰다. 상기 용액을 실온으로 냉각시키고, 물 및 다이클로로메테인으로 혼합물을 희석시켰다. 분리된 수성 층을 다이클로로메테인으로 3회 추출하였다. 유기 층을 합하여 물 및 염수 용액으로 세척하고, 황산 나트륨에 의해 건조시키고, 여과하였다. 용매를 진공에서 제거하고, 조질의 잔류물을 0 내지 2% 메탄올/다이클로로메테인의 구배로 용출시키는 플래시 크로마토그래피에 의해 정제하여서 5-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(처음에 용출됨) 및 3-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(조금 나중에 용출됨)의 혼합물(두 이성체: 총 5.4g, 63%)을 제공하고, 이를 추가의 분리없이 혼합물로 사용하였다. LRMS m/z C10H15N3O2(M+H)의 계산치 210.1, 실측치 210.1.
3 단계: 5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-클로로-1-사이클로-1H-피라졸-4-카르복실산 에틸 에스테르의 합성
아질산 t-부틸(5.1ml, 38.7mmol), 염화제일구리(3.8g, 38.7mmol) 및 무수 아세토니트릴(100ml)의 혼합물에 0℃에서 무수 아세토니트릴(50ml)중 5-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르 및 3-아미노-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(추가의 정제없이 마지막 단계로부터)의 혼합물을 첨가하였다. 반응 혼합물을 1시간동안 실온에서 교반하고, 이어서 2시간동안 60℃에서 교반하였다. 혼합물을 실온으로 냉각시키고, 이어서 6N HCl(50ml)에 붓고, 다이클로로메테인으로 추출하였다. 수성 층을 다이클로로메테인으로 3회 추출하였다. 유기 층을 합하고 진공에서 농축시킨 후에, 조질의 잔류물을 10 내지 20% 에틸 아세테이트/헥세인, 이어서 20% 에틸 아세테이트/헥세인의 구배로 용출시키는 플래시 크로마토그래피로 정제하였다. 목적하는 분획물을 진공에서 농축시키고, 진공하에 건조하여서 5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(처음 용출됨, 610mg, 10.3%) 및 3-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(나중에 용출됨, 147mg, 2.5%)를 제공하였다. LRMS m/z C10H13ClN2O2(M+H)의 계산치 229.1, 실측치 229.1.
4 단계: 5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산의 합성
메탄올(8ml) 및 물(8ml)중 5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 에틸 에스테르(182mg, 0.79mmol)의 용액에 LiOH(23mg, 0.96mmol)을 첨가하였다. 반응 혼합물을 환류 온도에서 4시간동안 교반하고, 이어서 감압하에 농축시켜서 메탄올을 제거하였다. 잔류물을 물로 희석하고, 진한 HCl에 의해 pH 2로 산성화시키고, 에틸 아세테이트로 추출하였다. 유기 층을 진공에서 증발시켜서 5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산(148mg, 94%)을 제공하고, 이를 추가의 정제없이 사용하였다.
5 단계: 트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드의 합성
5-클로로-1-사이클로부틸-1H-피라졸4-카르복실산(74mg, 0.37mmol)을 무수 다이클로로메테인(8ml) 및 무수 DMF(2ml)의 혼합물에 용해시키고, TSTU(245mg, 0.81mmol)을 첨가하였다. 이어서, DIPEA(0.39ml, 2.22mmol)를 상기 혼합물에 첨가하였다. 혼합물을 2.5시간동안 교반한 후에, 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(92mg, 0.44mmol, 실시예 43에서 제조됨)를 첨가하였다. 밤새 교반한 후에 물을 첨가하고, 유기 층을 분리하였다. 수성 층을 다이클로로메테인으로 2회 추출하였다. 유기층을 합하여 진공에서 농축시켰다. 조질의 혼합물을 10 내지 90% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하여서 트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(120mg, 83%)를 제공하였다. LRMS m/z C20H27ClN4O2(M+H)의 계산치 391.2, 실측치 391.2.
실시예 90
트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
수소화 나트륨(광유중 60% 분산액, 58mg, 1.44mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(18ml)중 피라졸(98mg, 1.44mmol)의 용액에 첨가하고, 상기 혼합물을 1시간동안 40℃까지 가열하였다. 트랜스-1-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(70mg, 0.18mmol)를 첨가하고, 혼합물을 48시간동안 110℃에서 가열한 다음 실온으로 냉각시켰다. DMF를 진공에서 증발시킨 후에 물 및 에틸 아세테이트를 첨가하였다. 유기 층을 분리시키고, 수성 층을 에틸 아세테이트에 의해 3회 추출하였다. 유기층을 합하여 진공에서 농축시키고, 잔류물을 10 내지 90% 아세토니트릴/물의 구배로 C-18 역상 예비 HPLC에 의해 정제하였다. 목적하는 분획물을 진공하에 농축시키고 진공하에 건조하여서 트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(38mg, 50%)를 제공하였다. LRMS m/z C23H30N6O2(M+H)의 계산치 423.3, 실측치 423.2.
실시예 91
트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시- 아다만탄-2-일)-아마이드
수소화 나트륨(광유중 60% 분산액, 180mg, 4.6mmol)을 얼음물 중탕에서 0℃에서 무수 DMF(30ml)중 4-메틸 피라졸(380㎕, 4.6mmol)의 용액에 천천히 첨가하였다. 상기 혼합물을 10분동안 아르곤하에 교반하고, 이어서 혼합물을 1.5시간동안 40℃까지 가열하였다. 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(실시예 34, 200mg, 0.57mmol)를 첨가하고, 혼합물을 3일동안 밤새 110℃에서 가열한 다음 냉각시켰다. 용매를 진공에서 제거하였다. 생성된 혼합물을 물로 희석하고, 클로로포름(2회)으로 추출하였다. 유기 층을 합하고, 물, 이어서 포화 염화나트륨 수용액으로 3회 세척하였다. 유기 층을 황산 마그네슘에 의해 건조시키고, 여과하고, 진공에서 농축시켰다. 생성된 혼합물을 실리카 겔을 이용하며 석유 에테르중 60 내지 70% 에틸 아세테이트를 용출시키는 컬럼 크로마토그래피로 정제하였다. 목적하는 분획물을 진공에서 농축시켜서 트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드를 백색 고형물(53mg, 23%)로 제공하였다; ES(+)-HRMS m/z C22H31N5O2(M+H)의 계산치 398.2551, 실측치 398.2546.
실시예 92
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록 시-아다만탄-2-일)-아마이드
4-메틸 피라졸 대신에 4-클로로 피라졸을 사용하는 것을 제외하고 실시예 91(이전 실시예)에 기재된 방법과 유사한 방법에 의해 표제 화합물을 제조하여서 트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(53%)를 회백색 고형물로 제공하였다: LRMS m/z C21H28ClN5O2(M+H)의 계산치 418.20, 실측치 418.33.
실시예 93
트랜스-4-브로모-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드
4-메틸 피라졸 대신에 4-브로모 피라졸을 사용하는 것을 제외하고 실시예 91에 기재된 방법과 유사한 방법에 의해 표제 화합물을 제조하여서 트랜스-4-브로모-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(23%)를 백색 고형물로 제공하였다: ES(+)-HRMS m/z C21H28BrN5O2(M+H)의 계산치 462.1499, 실측치 462.1497.
실시예 94
트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
수소화 나트륨(오일중 60%, 220mg, 5.5mmol)을 얼음물 중탕에서 0℃에서 무수 DMF(40ml)중 4-클로로-피라졸(710mg, 6.9mmol)의 용액에 천천히 첨가하였다. 상기 혼합물을 아르곤하에 10분동안 교반하고, 이어서 혼합물을 2시간동안 40℃까지 가열하였다. 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(270mg, 0.69mmol)를 첨가하고, 혼합물을 2일동안 밤새 110℃로 가열한 다음 냉각시켰다. 용매를 진공에서 제거하였다. 생성된 혼합물을 물로 희석하고, 에틸 아세테이트로 추출하였다(2x). 유기 층을 합하여 황산 마그네슘과 함께 건조시키고, 여과하고 진공에서 농축시켰다. 고형물을 에테르에서 슬러리화시키고, 여과하고, 고 진공하에 건조시켜서 트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드를 백색 고형물(237mg, 74%)로 제공하였다. ES(+)-HRMS m/z C23H31ClN6O2(M+H)의 계산치 459.2270, 실측치 459.2268.
실시예 95
트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세 틸아미노-아다만탄-2-일)-아마이드
수소화 나트륨(오일중 60%, 49mg, 1.23mmol)을 얼음물 중탕에서 0℃에서 질소하에 무수 DMF(16ml)중 4-클로로-피라졸(126mg, 1.23mmol)의 용액에 첨가하고, 상기 혼합물을 1시간동안 40℃까지 가열하였다. 트랜스-1-5-클로로-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(60mg, 0.15mmol)를 첨가하고, 혼합물을 48시간동안 110℃로 가열한 다음 실온으로 냉각시켰다. DMF를 진공에서 증발한 후에 물과 에틸 아세테이트를 첨가하였다. 유기 층을 분리하고, 수성 층을 에틸 아세테이트에 의해 3회 추출하였다. 유기 층을 합하여 진공에서 농축시키고, 잔류물을 10 내지 90% 아세토니트릴/물의 구배로 C-18 역상 예비-HPLC에 의해 정제하였다. 목적하는 분획물을 진공하에 농축시키고, 진공하에 건조시켜서 트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드(42mg, 62%)를 제공하였다. LRMS m/z C23H29ClN6O2(M+)의 계산치 456.2, 실측치 456.2.
실시예 96
트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
중간물질 2를 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨)로 대체하는 것을 제외하고 트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(실시예 82)와 유사한 방식으로 상기 화합물을 제조하였다.
실시예 97
트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
중간물질 2를 트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드(실시예 43에서 제조됨)로 대체하는 것을 제외하고 트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드(실시예 83)와 유사한 방식으로 표제 화합물을 제조하였다.
실시예 98
트랜스-4-클로로-2'-(2-메톡시-에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드
피라졸이 4-클로로피라졸로 대체되는 것을 제외하고는 트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일-아마이드(실시예 75)와 유사한 방식으로 표제 화합물을 제조하였다.
실시예 99
본 발명의 화합물의 생체외 시험
본 발명의 화합물에 의한 11β-HSD1의 생체외 억제를 하기 세포 어세이 프로토콜(cellular assay protocol)에 의해 증명하였다.
인간 Hek 어세이:
전체-길이 인간 11β-HSD1 cDNA에 의해 안전하게 트랜스펙션(transfection)시킨 HEK-293 세포를 10% FCS(인비트로겐(Invitrogen) Cat# 10082-147), 펜(pen)/스트렙(strep)(10㎍/ml) 및 제네티신(geneticin)(10㎍/ml)으로 보충된 DMEM 고 글루코즈 배지(인비트로겐 Cat# 11995-065)에서 증식시키고 증량시켰다. 어세이 하루전에, 트립신/EDTA를 이용하여 플라스크로부터 세포를 떼어내고, 원심분리하고, 평판 배지(DMEM 고 글루코즈, 페놀 레드를 갖지 않음, 인비트로겐 Cat# 21063-029, 2% 차콜 스트립핑된 FCS로 보충됨, 게미니(Gemini) Cat# A22311P)로 세척하였다. 평판 배지중 250,000세포/ml 현탁액으로부터 세포 200㎕을 96-웰 코팅된 플레이트(바이오코트(BioCoat) Cat# 356461)의 각 웰에 씨딩하고, 37℃에서 밤새 배양하였 다. 이튿날, DMSO에 용해된 연속 희석된 11β-HSD1 억제제 화합물을, BSA(최종 2mg/ml)으로 보충된 평판 배지에 첨가하였다. 최종 DMSO 농도는 1%이었다. 배지를 플레이트로부터 흡입시키고, 배지중 화합물을 각각의 웰에 첨가하였다. 플레이트를 1시간동안 37℃에서 배양하여서 화합물의 세포 흡수를 가능하게 하였다. 이어서, 기질(코르티손) 10㎕을 각 웰(100nM 최종 농도)에 첨가하고, 37℃에서 1시간동안 배양하였다. 이어서, 플레이트를 얼음으로 이동시키고, 배지 80㎕를 96-웰 플레이트로 이동시키고, -30℃에서 보관하였다.
엘리사-라이트(ELISA-Light)(트로픽스(Tropix) Cat# T10206/EL100S4), 항-코르티솔 EIA 항체(어세이 디자인스, 인크(Assay Designs, Inc.). Cat# 80-1148) 및 코르티솔-효소 접합체(어세이 디자인스, 인크. Cat# 80-1147)를 이용하는 경쟁 ELISA에 의해 세포 배지중 코르티솔의 정량을 실시하였다. 밤새 4℃에서 웰당 0.9% NaCl(5mg/ml) 50㎕에 현탁된 항-마우스 IgG(시그마 Cat# M-1397)으로 384-웰 플레이트(팔콘 Cat# 3988)를 예비 코팅하였다. 플레이트를 PBS, 0.1% 트윈(Tween)-20로 세척하고, 이어서 PBS만으로 세척하였다. 실온에서 2시간동안 블록킹 버퍼(Blocking Buffer)(트로픽스 Cat# AI075)로 플레이트를 차단하였다. 이어서, 플레이트를 전술한 바와 같이 세척하였다. 어세이 샘플을 해동시키고, DMEM, 2mg/ml BSA, 1% DMSO에서 1:4로 희석하고 24㎕을 예비-코팅되었고 다양한 양의 코르티솔 표준물을 갖는 384-웰 플레이트의 웰에 이동시켰다. 각 웰에 코르티솔-접합체 12㎕ 및 항-코르티솔 EIA 항체 12㎕를 첨가하고, 오비탈 플레이트 진탕기상에서 실온으로 2시간을 배양하였다. 이어서, 뒤집어서 웰을 비우고, 와시 버 퍼(Wash Buffer)(트로픽스) 100㎕로 3회 세척하고, 이어서 어세이 버퍼(트로픽스) 100㎕로 2회 세척하였다. CDP-STAR(트로픽스) 60㎕을 각 웰에 첨가하고, 실온에서 10분을 배양하였다. 빅터 V 리더(Victor V Reader)(퍼킨 엘머(Perkin Elmer))를 이용하여 화학발광을 측정하였다. 각 샘플에 있는 코르티솔을, 공지된 양의 코르티솔에 의해 발생된 표준 곡선에 삽입하였다. IC50 값은 곡선 정합(fitting) 소프트웨어 XLFit3(IDBS)를 이용하여 계산하였다.
인간 H4IIE 어세이:
세포:
인간 11β-HSD1 cDNA(humH4IIe)에 의해 안전하게 트랜스펙션된 H4IIe 세포를, 가습 분위기(95% 공기, 5% CO2)에서 37℃에서 페니실린(100IU/ml) 및 스트렙토마이신(100㎍/ml), 제네티신(800㎍/ml) 및 L-글루타민(2mM)을 함유한 10% 우태혈청(FBS) + 둘베코스 변형 필수 배지(Dulbeccos Modified Essential Medium:DMEM)에서 유지시켰다.
어세이를 위한 세포 준비:
225㎠ 플라스크에서 80% 콘플루언스(confluence)로 humH4IIe를 PBS로 세척하고, 이어서 따뜻한 트립신/EDTA로 분리하였다. 세포를 계수하고, 2% 스트립핑된 혈청을 함유하며 페놀 레드를 갖지 않는 둘베코스 변형 필수 배지(DMEM)에 200㎕당 100,000세포의 농도로 재현탁시키고, 96-웰 세포 배양 플레이트(폴리-라이신으로 예비-코팅됨)에서 평판 배양하였다. 세포를 밤새 37℃에서 가습 분위기(95% 공기, 5% CO2)에서 배양하였다.
스테로이드 전환 어세이:
96-웰 플레이트를 씨딩한지 하루후에 전환 어세이를 실시하였다. 배지를 제거하고, 2mg/ml 우혈청 알부민(BSA) + 1% DMSO 또는 DMSO에 용해된 시험 화합물을 함유하며 페놀 레드를 갖지 않는 100ul 둘베코스 변형 필수 배지(DMEM)로 대체하였다.
세포를 가습 분위기(95% 공기, 5% CO2)에서 37℃에서 60분동안 시험 화합물과 함께 배양하였다. 60분후에 코르티손을 200nM 최종까지 첨가하고, 세포를 가습 분위기(95% 공기, 5% CO2)에서 37℃에서 120분동안 배양하였다.
비어있는 96-웰 플레이트에 배지 80㎕을 이동시켜서 반응을 중지시켰다. ELISA 방법을 이용하여 코르티솔 농도에 대해 어세이할 때까지 샘플을 -20℃로 보관하였다.
본 발명의 대표적 화합물에 의한 11β-HSD1의 생체외 억제의 증거를 제공하는 세포 어세이 결과가 하기에 나타나있다.
| 실시예 | 명칭 | humHEK (IC50, μM) | HumH4IIe (IC50, μM) |
| 1 | 1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0399 | ND |
| 2 | 트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0222 | ND |
| 5 | 5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.1888 | ND |
| 6 | 1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0098 | ND |
| 7 | 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.6009 | ND |
| 8 | 시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0202 | ND |
| 9 | 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0386 | ND |
| 12 | 1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0222 | ND |
| 14 | 1-메틸-5-(4-메틸-피페라진-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0233 | ND |
| 22 | 1-메틸-5-모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0166 | ND |
| 23 | 5-(2-메톡시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0715 | ND |
| 32 | 5-[(2-메톡시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드 | 0.0262 | ND |
| 33 | 2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드 | 0.0068 | ND |
| 34 | 1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0192 | 0.0056 |
| 35 | 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.020 | 0.0005 |
| 45 | 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0482 | 0.0059 |
| 46 | 트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 | 0.0662 | 0.0085 |
| 48 | 트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 | 0.0181 | 0.0003 |
| 50 | 트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드 | 0.0238 | 0.008 |
| 53 | 트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드 | 0.0769 | 0.006 |
| 73 | 트랜스-5-클로로-1-(2-메톡시에틸)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | 0.0229 | 0.0006 |
| 76 | 트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시아다만탄-2-일)-아마이드 | ND | 0.0153 |
| 77 | 트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드 | ND | 0.0046 |
본 발명의 특정한 양태의 변형이 이루어질 수 있고 여전히 첨부된 청구의 범위의 범주에 속하기 때문에, 본 발명은 전술한 본 발명의 특정한 양태에 제한되지 않음을 이해한다.
Claims (20)
- 하기 화학식 I의 화합물 또는 그의 약학적으로 허용가능한 염:화학식 I상기 식에서,R1은 수소이고,R2는 하이드록시, 알콕시, 할로겐, 아미노, 저급알킬-아실아미노 또는 저급알킬설폰일아미노에 의해 치환된 또는 비치환된 아다만테인(adamantane)이며,R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개의 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)OH, -(CH2)O(CH2)nCH3, -(CH2)O(CH2)n-알킬, -(CH2)O(CH2)n-사이클로알킬, 또는 N, O 및 S로부터 선택된 1 내지 3개의 헤테로 원자를 갖고 저급 알킬, 하이드록시, 하이드록시 페닐, -(CH2)n-페닐, -CH2(CH2)nOH 또 는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클이고,R4는 하이드록실에 의해 치환된 또는 비치환된 분지형 또는 비분지형 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C6)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH, 또는 N, O 또는 S로부터 선택된 1 또는 2개 원자를 갖는 4- 내지 6-원 포화 헤테로사이클릴 고리이며,R5는 수소, 또는 할로겐에 의해 치환된 또는 비치환된 저급 알킬이고,n은 0, 1, 2 또는 3이며,m은 0, 1 또는 2이고,p는 1, 2 또는 3이다.
- 제 1 항에 있어서,R2는 비치환된 아다만테인이고,R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)nOH, -(CH2)nO(CH2)nCH3, 또는 N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 저급 알킬, 하이드록시, 하이드록시페닐, -(CH2)n-페닐, -(CH2)nOH 또는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클인, 화합물.
- 제 1 항 또는 제 2 항에 있어서,R2는 하이드록시, 할로겐, 아미노, 아세틸아미노 또는 메테인 설폰일아미노에 의해 치환된 아다만테인이고,R3은 분지형 또는 비분지형 저급 알킬, 할로겐, 할로-저급 알킬, N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 할로겐 또는 저급 알킬에 의해 치환된 또는 비치환된 3- 내지 8-원 헤테로아릴, -NH(CH2)nOH, -NH(CH2)nOCH3, -NHCH(CH3)2, -NH(CH2)nCH3OH, -NH(CH3)(CH2)nOCH3, -NH(CH3)(CH2)nOH, -NCH2CH(CH3)OH, -NH(CH2)nO(CH2)nCH3, -N(CH2CH3)2, -(CH2)nOH, -(CH2)nO(CH2)nCH3, 또는 N, O 및 S로부터 선택된 1 내지 3개 헤테로원자를 갖고 저급 알킬, 하이드록시, 하이드록시페닐, -(CH2)n-페닐, -(CH2)nOH 또는 할로겐에 의해 치환된 또는 비치환된 3- 내지 8-원 일환 헤테로사이클인, 화합물.
- 제 1 항 내지 제 3 항중 어느 한 항에 있어서,R2는 비치환된 아다만테인이고,R4는 분지형 또는 비분지형 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C5)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH인, 화합물.
- 제 1 항 내지 제 4 항중 어느 한 항에 있어서,R2는 하이드록시, 할로겐, 아미노, 아세틸아미노 또는 메테인 설폰일아미노에 의해 치환된 아다만테인이고,R4는 분지형 또는 비분지형 저급 알킬, 하이드록시 또는 저급 알킬에 의해 치환된 또는 비치환된 -(CH2)m-(C3-C5)사이클로알킬, 할로-알킬, 하이드록시알킬, -(CH2)nO(CH2)nCH3, -(CH2)nO(CH2)pO(CH2)nCH3, -(CH2)nOC(CH3)3 또는 -CH(CH3)2(CH2)nOH인, 화합물.
- 제 1 항 내지 제 5 항중 어느 한 항에 있어서,R2가 트랜스-하이드록시 아다만테인인, 화합물.
- 제 1 항 내지 제 6 항중 어느 한 항에 있어서,R3이 트리플루오로메틸 기인, 화합물.
- 제 1 항 내지 제 7 항중 어느 한 항에 있어서,R3이 피라졸, 트리아졸, 피페리딘, 피롤리딘, 하이드록시메틸 피페리딘, 벤질피페라진, 하이드록시피롤리딘, 3급-부틸 피롤리딘, 하이드록시에틸 피페라진, 하이드록시피페리딘 또는 티오모폴린 기인, 화합물.
- 제 1 항 내지 제 8 항중 어느 한 항에 있어서,R4가 사이클로프로필, 3급-부틸, -CH(CH3)2CH2OH, 메틸, -CF3 또는 -(CH2)nCF3 기이고, 이때 n이 1 또는 2인, 화합물.
- 제 1 항 내지 제 9 항중 어느 한 항에 있어서,R5가 트리플루오로메틸 기인, 화합물.
- 제 1 항 내지 제 10 항중 어느 한 항에 있어서,하기 화합물들로부터 선택된 화합물:메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-클로로-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드;시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아마이드;트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;5-클로로-1-메틸-3-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-클로로-1,3-다이메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;메틸-5-(4-메틸-피페라진-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(2-하이드록시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;메틸-5-[1,2,4]트리아졸-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;메틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(4-하이드록시-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-[(2-하이드록시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(2-하이드록시-프로필아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;메틸-5-모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(2-메톡시-에틸아미노)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-이소프로필아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(4-하이드록시메틸-피페리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(4-벤질-피페라진-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-(R-3-하이드록시-피롤리딘-1-일)-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-다이에틸아미노-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;3급-부틸-5-피롤리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-[4-(2-하이드록시-에틸)-피페라진-1-일]-1-메틸-1H-피라졸-4-카르복실산 아다만탄일아마이드;5-[(2-메톡시-에틸)-메틸-아미노]-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;3급-부틸-5-클로로-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;3급-부틸-5-(3-하이드록시-피롤리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;3급-부틸-5-(4-하이드록시-피페리딘-1-일)-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;5-아제판-1-일-1-메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;메틸-5-티오모폴린-4-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;3급-부틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-플루오로-아다만탄-2-일)-아마이드;트랜스-N-(4-아미노-아다만탄-1-일)-아세트아마이드;트랜스-N-(4-아미노-아다만탄-1-일)-메테인설폰아마이드;트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;트랜스-1-메틸-5-피페리딘-1-일-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로헥실-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로펜틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-(시스-4-하이드록시-사이클로헥실)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로펜틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로헥실-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일-아마이드;트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일-아마이드;트랜스-2'-[2-(2-메톡시에톡시)-에틸]-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시아다만탄-2-일)-아마이드;트랜스-1-(2-3급-부톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-4-브로모-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드; 및트랜스-4-클로로-2'-(2-메톡시-에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드.
- 제 1 항 내지 제 11 항중 어느 한 항에 있어서,하기 화합물들로부터 선택된 화합물:트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산(5-하이드록시-아다만탄-2-일)-아마이드;1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-메틸-5-피롤-1-일-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드;1-메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 아다만탄-2-일아마이드;트랜스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;시스-1-3급-부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 아다만탄-2-일아마이드; 및1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드.
- 제 1 항 내지 제 12 항중 어느 한 항에 있어서,하기 화합물들로부터 선택된 화합물:트랜스-1-3급-부틸-5-클로로-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-메테인설폰일아미노 -아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-에톡시메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-메톡시메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-(5-메틸-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-(5-클로로-이속사졸-3-일)-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로헥실-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-(테트라하이드로-피란-4-일)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로펜틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-(시스-4-하이드록시-사이클로헥실)-2'H-[1,3']바이피라졸릴-4'-카르복실 산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(시스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(트랜스-4-하이드록시-사이클로헥실)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(2-메톡시에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(2-메톡시에틸)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-(3-메톡시프로필)-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-1-사이클로프로필-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시- 아다만탄-2-일)-아마이드;트랜스-4-클로로-2'-사이클로프로필-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로프로필메틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-(2-하이드록시-1,1-다이메틸-에틸)-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-3급-부틸-5-사이클로프로필-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-1-사이클로부틸-5-트리플루오로메틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-5-클로로-1-사이클로부틸-1H-피라졸-4-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-메틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록시-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-하이드록 시-아다만탄-2-일)-아마이드;트랜스-2'-3급-부틸-4-클로로-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드; 및트랜스-4-클로로-2'-사이클로부틸-2'H-[1,3']바이피라졸릴-4'-카르복실산 (5-아세틸아미노-아다만탄-2-일)-아마이드.
- 치료 유효량의 제 1 항 내지 제 13 항중 어느 한 항에 따른 화합물 또는 그의 약학적으로 허용가능한 염, 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물.
- 치료 유효량의 제 1 항 내지 제 13 항중 어느 한 항에 따른 화합물을 대사 장애의 치료가 필요한 환자에게 투여하는 단계를 포함하는 대사 장애의 치료 방법.
- 유효량의 제 1 항 내지 제 13 항중 어느 한 항에 따른 화합물을 투여하는 단계를 포함하는 당뇨병, 비만 또는 대사 증후군의 치료 방법.
- 제 1 항 내지 제 13 항중 어느 한 항에 있어서,치료 활성 물질로서 사용되는 화합물.
- 제 1 항 내지 제 13 항중 어느 한 항에 있어서,대사 장애 치료용 약제의 제조를 위한 화합물.
- 당뇨병, 비만 또는 대사 증후군 치료용 약제의 제조를 위한, 제 1 항 내지 제 13 항중 어느 한 항에 따른 화합물의 용도.
- 전술한 바와 같은 발명.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US78483106P | 2006-03-22 | 2006-03-22 | |
| US60/784,831 | 2006-03-22 | ||
| US87527406P | 2006-12-15 | 2006-12-15 | |
| US60/875,274 | 2006-12-15 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107029250A Division KR20110007258A (ko) | 2006-03-22 | 2007-03-12 | 11-베타-hsd-1로서의 피라졸 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20090005015A true KR20090005015A (ko) | 2009-01-12 |
| KR101077366B1 KR101077366B1 (ko) | 2011-10-26 |
Family
ID=38430507
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107029250A KR20110007258A (ko) | 2006-03-22 | 2007-03-12 | 11-베타-hsd-1로서의 피라졸 |
| KR1020087025604A KR101077366B1 (ko) | 2006-03-22 | 2007-03-12 | 11-베타-hsd-1로서의 피라졸 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107029250A KR20110007258A (ko) | 2006-03-22 | 2007-03-12 | 11-베타-hsd-1로서의 피라졸 |
Country Status (30)
| Country | Link |
|---|---|
| US (1) | US7728029B2 (ko) |
| EP (2) | EP1999114B1 (ko) |
| JP (1) | JP5031817B2 (ko) |
| KR (2) | KR20110007258A (ko) |
| CN (1) | CN101405270B (ko) |
| AR (1) | AR059983A1 (ko) |
| AU (1) | AU2007228887B2 (ko) |
| BR (1) | BRPI0708974A2 (ko) |
| CA (1) | CA2645856C (ko) |
| CR (1) | CR10288A (ko) |
| DK (1) | DK1999114T3 (ko) |
| EC (1) | ECSP088747A (ko) |
| ES (1) | ES2548002T3 (ko) |
| HK (1) | HK1130780A1 (ko) |
| HR (1) | HRP20151078T1 (ko) |
| HU (1) | HUE026011T2 (ko) |
| IL (1) | IL193900A (ko) |
| MA (1) | MA30344B1 (ko) |
| MX (1) | MX2008012017A (ko) |
| MY (1) | MY149622A (ko) |
| NO (1) | NO341746B1 (ko) |
| NZ (1) | NZ570973A (ko) |
| PL (1) | PL1999114T3 (ko) |
| PT (1) | PT1999114E (ko) |
| RS (1) | RS54216B1 (ko) |
| RU (2) | RU2470016C2 (ko) |
| SG (1) | SG155961A1 (ko) |
| SI (1) | SI1999114T1 (ko) |
| TW (2) | TW201103916A (ko) |
| WO (1) | WO2007107470A2 (ko) |
Families Citing this family (47)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2630665C (en) | 2005-11-21 | 2011-03-15 | Shionogi & Co., Ltd. | Heterocyclic compound having inhibitory activity on 11-.beta.-hydroxysteroid dehydrogenase type i |
| EP2610241A1 (en) * | 2006-11-02 | 2013-07-03 | Shionogi & Co., Ltd. | Process for production of hydroxyadamantaneamine |
| TW200827346A (en) | 2006-11-03 | 2008-07-01 | Astrazeneca Ab | Chemical compounds |
| US20100144717A1 (en) * | 2006-12-15 | 2010-06-10 | Janelle Comita-Prevoir | 2-quinolinone and 2-quinoxalinone-derivatives and their use as antibacterial agents |
| TW200836719A (en) | 2007-02-12 | 2008-09-16 | Astrazeneca Ab | Chemical compounds |
| CN103288738B (zh) * | 2007-05-18 | 2016-03-16 | 盐野义制药株式会社 | 具有11β-羟基类固醇脱氢酶I型抑制活性的含氮杂环衍生物 |
| RU2440989C2 (ru) * | 2007-07-17 | 2012-01-27 | Ф.Хоффманн-Ля Рош Аг | ИНГИБИТОРЫ 11β-ГИДРОКСИСТЕРОИДНОЙ ДЕГИДРОГЕНАЗЫ |
| EP2025674A1 (de) | 2007-08-15 | 2009-02-18 | sanofi-aventis | Substituierte Tetrahydronaphthaline, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| EP2072497A1 (de) * | 2007-12-21 | 2009-06-24 | Bayer CropScience AG | Verfahren zum Herstellen von 2-Fluoracyl-3-amino-acrylsäure-Derivaten |
| US7951833B2 (en) * | 2008-02-04 | 2011-05-31 | Astrazeneca Ab | Crystalline forms of 4-[4-(2-adamantylcarbamoyl)-5-tert-butyl-pyrazol-1-yl]Benzoic acid 471 |
| CN102300851A (zh) * | 2009-01-30 | 2011-12-28 | 阿斯利康(瑞典)有限公司 | 制备含羧基的吡唑酰氨基化合物597的新方法 |
| EP2243479A3 (en) | 2009-04-20 | 2011-01-19 | Abbott Laboratories | Novel amide and amidine derivates and uses thereof |
| US8871208B2 (en) * | 2009-12-04 | 2014-10-28 | Abbvie Inc. | 11-β-hydroxysteroid dehydrogenase type 1 (11β-HSD1) inhibitors and uses thereof |
| EP2518051A4 (en) * | 2009-12-22 | 2013-10-16 | Shionogi & Co | ADAMANTANAMINE DERIVATIVE |
| CN102127583A (zh) * | 2010-01-19 | 2011-07-20 | 上海博康精细化工有限公司 | 一种反式对氨基金刚烷醇的制备方法 |
| WO2011107494A1 (de) | 2010-03-03 | 2011-09-09 | Sanofi | Neue aromatische glykosidderivate, diese verbindungen enthaltende arzneimittel und deren verwendung |
| US8680098B2 (en) | 2010-03-05 | 2014-03-25 | Janssen Pharmaceutica, Nv | Substituted aza-bicyclic imidazole derivatives useful as TRPM8 receptor modulators |
| EP2582709B1 (de) | 2010-06-18 | 2018-01-24 | Sanofi | Azolopyridin-3-on-derivate als inhibitoren von lipasen und phospholipasen |
| US8530413B2 (en) | 2010-06-21 | 2013-09-10 | Sanofi | Heterocyclically substituted methoxyphenyl derivatives with an oxo group, processes for preparation thereof and use thereof as medicaments |
| TW201215388A (en) | 2010-07-05 | 2012-04-16 | Sanofi Sa | (2-aryloxyacetylamino)phenylpropionic acid derivatives, processes for preparation thereof and use thereof as medicaments |
| TW201221505A (en) | 2010-07-05 | 2012-06-01 | Sanofi Sa | Aryloxyalkylene-substituted hydroxyphenylhexynoic acids, process for preparation thereof and use thereof as a medicament |
| TW201215387A (en) | 2010-07-05 | 2012-04-16 | Sanofi Aventis | Spirocyclically substituted 1,3-propane dioxide derivatives, processes for preparation thereof and use thereof as a medicament |
| CN103209957A (zh) | 2010-08-09 | 2013-07-17 | 盐野义制药株式会社 | 氨基金刚烷氨基甲酸酯衍生物的制备方法 |
| JP5605104B2 (ja) * | 2010-09-10 | 2014-10-15 | セントラル硝子株式会社 | ピラゾール化合物の製造方法 |
| EP2683704B1 (de) | 2011-03-08 | 2014-12-17 | Sanofi | Verzweigte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| US8871758B2 (en) | 2011-03-08 | 2014-10-28 | Sanofi | Tetrasubstituted oxathiazine derivatives, method for producing them, their use as medicine and drug containing said derivatives and the use thereof |
| WO2012120054A1 (de) | 2011-03-08 | 2012-09-13 | Sanofi | Di- und trisubstituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| EP2683699B1 (de) | 2011-03-08 | 2015-06-24 | Sanofi | Di- und trisubstituierte oxathiazinderivate, verfahren zu deren herstellung, ihre verwendung als medikament sowie sie enthaltendes arzneimittel und deren verwendung |
| US8901114B2 (en) | 2011-03-08 | 2014-12-02 | Sanofi | Oxathiazine derivatives substituted with carbocycles or heterocycles, method for producing same, drugs containing said compounds, and use thereof |
| US8471027B2 (en) | 2011-04-06 | 2013-06-25 | Hoffmann-La Roche Inc. | Adamantyl compounds |
| CH706864B1 (de) | 2011-06-22 | 2016-03-31 | Central Glass Co Ltd | Verfahren zur Herstellung einer Pyrazol-Verbindung. |
| JP5915004B2 (ja) * | 2011-06-22 | 2016-05-11 | セントラル硝子株式会社 | ピラゾール化合物の製造方法 |
| JP2013023476A (ja) * | 2011-07-22 | 2013-02-04 | Sagami Chemical Research Institute | 5−フルオロ−1h−ピラゾール−4−カルボン酸類の製造方法 |
| WO2013037390A1 (en) | 2011-09-12 | 2013-03-21 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| WO2013045413A1 (en) | 2011-09-27 | 2013-04-04 | Sanofi | 6-(4-hydroxy-phenyl)-3-alkyl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| JP5992054B2 (ja) | 2011-11-29 | 2016-09-14 | ノバルティス アーゲー | ピラゾロピロリジン化合物 |
| AR089656A1 (es) | 2011-11-30 | 2014-09-10 | Bayer Ip Gmbh | Derivados de n-bicicloalquil- y n-tricicloalquil-(tio)-carboxamida fungicidas |
| CN102633659B (zh) * | 2012-02-23 | 2013-12-04 | 浙江普洛康裕制药有限公司 | 一种反式4-氨基-1-羟基金刚烷盐酸盐的合成方法 |
| NO2953942T3 (ko) | 2013-02-06 | 2018-03-24 | ||
| KR101763284B1 (ko) | 2013-07-24 | 2017-07-31 | 볼보 컨스트럭션 이큅먼트 에이비 | 건설기계용 유압회로 |
| EP3083566B1 (en) * | 2013-11-27 | 2022-12-21 | Bayer Animal Health GmbH | Process for the preparation of 5-fluoro-1h-pyrazoles |
| MX2016006977A (es) | 2013-11-27 | 2016-09-07 | Bayer Cropscience Ag | Proceso para la preparacion de 5-fluoro-1h-pirazoles. |
| MX2016008653A (es) | 2014-01-03 | 2016-09-26 | Bayer Animal Health Gmbh | Nuevas pirazolil-heteroarilamidas como agentes plaguicidas. |
| CN105315284A (zh) * | 2014-07-23 | 2016-02-10 | 上海医药工业研究院 | 阿拉格列汀中间体的制备方法 |
| CN104961698A (zh) * | 2015-07-13 | 2015-10-07 | 佛山市赛维斯医药科技有限公司 | 末端硝基取代的三氮唑亚砜类化合物、其制备方法及其用途 |
| KR101759874B1 (ko) * | 2015-08-07 | 2017-07-21 | 코스맥스 주식회사 | 11β-hydroxysteroid dehydrogenase type 1의 활성을 저해하는 화합물을 포함하는 화장료 조성물 또는 피부 외용제 조성물 |
| EP3976599A1 (en) * | 2019-05-24 | 2022-04-06 | Fmc Corporation | Pyrazole-substituted pyrrolidinones as herbicides |
Family Cites Families (57)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH307629A (de) | 1952-05-23 | 1955-06-15 | Ag J R Geigy | Verfahren zur Herstellung eines monosubstituierten Hydrazins. |
| DE2635841C2 (de) | 1976-08-10 | 1983-02-24 | Dynamit Nobel Ag, 5210 Troisdorf | Verfahren zur Herstellung von Alkoxymethylenmalonsäurenitrilen |
| US4620865A (en) | 1983-11-07 | 1986-11-04 | Eli Lilly And Company | Herbicidal and algicidal 1,5-disubstituted-1H-pyrazole-4-carboxamides |
| US4742074A (en) | 1984-10-29 | 1988-05-03 | Sumitomo Chemical Company, Limited | Pyrazolecarboxamide derivative and fungicide containing it as active ingredient |
| US4792565A (en) | 1986-04-24 | 1988-12-20 | Mitsui Toatsu Chemicals, Inc. | Pyrazolecarbonylamine derivatives and agricultural and horticultural fungicides containing said compounds |
| DE4010797A1 (de) | 1990-04-04 | 1991-10-10 | Hoechst Ag | Substituierte azole, verfahren zu deren herstellung, diese enthaltende mittel und deren verwendung |
| US6020121A (en) | 1995-09-29 | 2000-02-01 | Microcide Pharmaceuticals, Inc. | Inhibitors of regulatory pathways |
| DE19615976A1 (de) | 1996-04-22 | 1997-10-23 | Basf Ag | Mittel und Verfahren zur Bekämpfung von Schadpilzen |
| WO1998041519A1 (en) | 1997-03-18 | 1998-09-24 | Smithkline Beecham Corporation | Novel cannabinoid receptor agonists |
| JP4398088B2 (ja) | 1997-12-18 | 2010-01-13 | ビーエーエスエフ ソシエタス・ヨーロピア | アミド化合物及びモルホリン又はピペリジン誘導体を基礎とする殺菌剤混合物 |
| WO1999067235A1 (fr) | 1998-06-25 | 1999-12-29 | Sumitomo Pharmaceuticals Co., Ltd. | Composes cycliques a cinq elements |
| GB9824310D0 (en) | 1998-11-05 | 1998-12-30 | Univ London | Activators of soluble guanylate cyclase |
| DE19853827A1 (de) | 1998-11-21 | 2000-05-25 | Aventis Cropscience Gmbh | Kombinationen aus Herbiziden und Safenern |
| US20010044445A1 (en) | 1999-04-08 | 2001-11-22 | Bamaung Nwe Y. | Azole inhibitors of cytokine production |
| US6331539B1 (en) | 1999-06-10 | 2001-12-18 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| IL136360A (en) | 1999-06-18 | 2004-08-31 | Mitsui Chemicals Inc | History 5 - Aminopyrazole-4 - Carboxylate and processes for their preparation |
| KR100743262B1 (ko) | 1999-07-20 | 2007-07-27 | 다우 아그로사이언시즈 엘엘씨 | 살균성 헤테로고리 방향족 아미드 및 그 조성물, 사용 및제조방법 |
| WO2001014339A2 (en) | 1999-08-20 | 2001-03-01 | Dow Agrosciences Llc | Fungicidal heterocyclic aromatic amides and their compositions, methods of use and preparation |
| AU780572B2 (en) | 1999-10-18 | 2005-04-07 | University Of Connecticut, The | Pyrazole derivatives as cannabinoid receptor antagonists |
| US6096898A (en) | 1999-10-22 | 2000-08-01 | Dow Agrosciences Llc | One pot synthesis of 1,2,4-triazoles |
| US6569885B1 (en) | 1999-12-23 | 2003-05-27 | Icos Corporation | Cyclic AMP-specific phosphodiesterase inhibitors |
| JP2002003410A (ja) | 2000-06-27 | 2002-01-09 | Fuji Photo Film Co Ltd | 芳香族ハロゲン化物の製造方法。 |
| WO2002044133A1 (en) | 2000-11-28 | 2002-06-06 | Pfizer Products Inc. | Preparation of sodium-hydrogen exchanger type-1 inhibitors |
| PE20020870A1 (es) | 2001-02-13 | 2002-11-18 | Aventis Pharma Gmbh | 6,7,8,9-tetrahidro-5h-benzocicloheptenil aminas aciladas |
| TWI243164B (en) | 2001-02-13 | 2005-11-11 | Aventis Pharma Gmbh | Acylated indanyl amines and their use as pharmaceuticals |
| PE20020856A1 (es) | 2001-02-13 | 2002-11-11 | Aventis Pharma Gmbh | 1,2,3,4-tetrahidronaftil aminas aciladas |
| WO2003028641A2 (en) | 2001-10-01 | 2003-04-10 | Taisho Pharmaceutical Co., Ltd. | Mch receptor antagonists |
| CA2465207C (en) | 2001-11-01 | 2011-01-04 | Icagen, Inc. | Pyrazole-amides and -sulfonamides |
| DE10161978A1 (de) | 2001-12-17 | 2003-06-26 | Bayer Ag | Verfahren zur Herstellung von 2-Halogenacyl-3-amino-acrylsäure-derivate |
| MXPA04004685A (es) | 2001-12-19 | 2004-08-12 | Pfizer Prod Inc | Procedimientos para preparar inhibidores de tipo-1 de intercambiador sodio-hidrogeno. |
| US6818772B2 (en) | 2002-02-22 | 2004-11-16 | Abbott Laboratories | Antagonists of melanin concentrating hormone effects on the melanin concentrating hormone receptor |
| WO2003070244A1 (en) | 2002-02-22 | 2003-08-28 | Abbott Laboratories | Antagonist of melanin concentrating hormone and their uses |
| US20030236287A1 (en) | 2002-05-03 | 2003-12-25 | Piotrowski David W. | Positive allosteric modulators of the nicotinic acetylcholine receptor |
| EP1388535A1 (en) | 2002-08-07 | 2004-02-11 | Aventis Pharma Deutschland GmbH | Acylated arylcycloalkylamines and their use as pharmaceuticals |
| CN1703395A (zh) | 2002-08-09 | 2005-11-30 | 特兰斯泰克制药公司 | 芳基和杂芳基化合物以及调节凝血的方法 |
| RU2360910C2 (ru) * | 2002-12-20 | 2009-07-10 | Мерк Энд Ко., Инк. | Производные триазола как ингибиторы 11-бета-гидроксистероиддегидрогеназы-1 |
| KR100729878B1 (ko) | 2003-02-17 | 2007-06-18 | 에프. 호프만-라 로슈 아게 | 피페리딘-벤젠설폰아마이드 유도체 |
| WO2004089416A2 (en) | 2003-04-11 | 2004-10-21 | Novo Nordisk A/S | Combination of an 11beta-hydroxysteroid dehydrogenase type 1 inhibitor and an antihypertensive agent |
| EP1615698B1 (en) * | 2003-04-11 | 2010-09-29 | High Point Pharmaceuticals, LLC | New amide derivatives and pharmaceutical use thereof |
| EP1615667A2 (en) | 2003-04-11 | 2006-01-18 | Novo Nordisk A/S | Combinations of an 11-beta-hydroxysteroid dehydrogenase type 1 inhibitor and a glucocorticoid receptor agonist |
| PL1618092T3 (pl) | 2003-05-01 | 2011-02-28 | Bristol Myers Squibb Co | Związki amidopirazolowe z podstawnikami arylowymi jako inhibitory kinazy |
| US20040220170A1 (en) | 2003-05-01 | 2004-11-04 | Atkinson Robert N. | Pyrazole-amides and sulfonamides as sodium channel modulators |
| WO2005000793A1 (ja) | 2003-06-26 | 2005-01-06 | Taisho Pharmaceutical Co., Ltd. | 2位置換シクロアルキルカルボン酸誘導体 |
| CA2526455C (en) | 2003-06-26 | 2012-10-09 | Novartis Ag | 5-membered heterocycle-based p38 kinase inhibitors |
| CA2534221A1 (en) | 2003-08-07 | 2005-02-24 | Merck & Co., Inc. | Pyrazole carboxamides as inhibitors of 11-beta-hydroxysteroid dehydrogenase-1 |
| CA2535265C (en) | 2003-08-22 | 2014-01-28 | Dendreon Corporation | Compositions and methods for the treatment of disease associated with trp-p8 expression |
| US7750160B2 (en) | 2003-11-13 | 2010-07-06 | Ambit Biosciences Corporation | Isoxazolyl urea derivatives as kinase modulators |
| CN101367748B (zh) | 2004-01-28 | 2014-03-12 | 三井化学株式会社 | 酰胺衍生物及其制备方法和作为杀虫剂的使用方法 |
| CN1976905A (zh) | 2004-03-30 | 2007-06-06 | 大正制药株式会社 | 嘧啶衍生物以及与其应用有关的治疗方法 |
| DE102004023635A1 (de) | 2004-05-10 | 2006-04-13 | Grünenthal GmbH | Heteroarylsubstituierte Cyclohexyl-1,4-diamin-Derivate |
| WO2006007864A1 (en) | 2004-07-17 | 2006-01-26 | Max Planck Geselllschaft Zur Förderung Der Wissenschaft | Treating neurodegenerative conditions |
| GB0417910D0 (en) | 2004-08-11 | 2004-09-15 | Novartis Ag | Organic compounds |
| WO2006031806A2 (en) | 2004-09-10 | 2006-03-23 | Atherogenics, Inc. | 2-thiopyrimidinones as therapeutic agents |
| US20080090863A1 (en) | 2004-09-30 | 2008-04-17 | Taisho Pharmaceutical Co., Ltd. | Pyridine Derivatives and Their Use as Medicaments for Treating Diseases Related to Mch Receptor |
| GB0506133D0 (en) | 2005-03-24 | 2005-05-04 | Sterix Ltd | Compound |
| AU2006232660B2 (en) * | 2005-04-05 | 2010-03-25 | F. Hoffmann-La Roche Ag | 1H-Pyrazole 4-Carboxylamides, their preparation and their use as 11Beta-hydroxysteroid dehydrogenase |
| CA2630665C (en) * | 2005-11-21 | 2011-03-15 | Shionogi & Co., Ltd. | Heterocyclic compound having inhibitory activity on 11-.beta.-hydroxysteroid dehydrogenase type i |
-
2007
- 2007-03-12 RU RU2010119648/04A patent/RU2470016C2/ru not_active IP Right Cessation
- 2007-03-12 PT PT77267839T patent/PT1999114E/pt unknown
- 2007-03-12 RU RU2008141434/04A patent/RU2402517C2/ru not_active IP Right Cessation
- 2007-03-12 MX MX2008012017A patent/MX2008012017A/es active IP Right Grant
- 2007-03-12 KR KR1020107029250A patent/KR20110007258A/ko not_active Application Discontinuation
- 2007-03-12 JP JP2009500818A patent/JP5031817B2/ja not_active Expired - Fee Related
- 2007-03-12 ES ES07726783.9T patent/ES2548002T3/es active Active
- 2007-03-12 PL PL07726783T patent/PL1999114T3/pl unknown
- 2007-03-12 NZ NZ570973A patent/NZ570973A/en not_active IP Right Cessation
- 2007-03-12 AU AU2007228887A patent/AU2007228887B2/en not_active Ceased
- 2007-03-12 HU HUE07726783A patent/HUE026011T2/en unknown
- 2007-03-12 CA CA2645856A patent/CA2645856C/en not_active Expired - Fee Related
- 2007-03-12 BR BRPI0708974-0A patent/BRPI0708974A2/pt not_active Application Discontinuation
- 2007-03-12 SG SG200906335-5A patent/SG155961A1/en unknown
- 2007-03-12 DK DK07726783.9T patent/DK1999114T3/en active
- 2007-03-12 CN CN2007800097486A patent/CN101405270B/zh not_active Expired - Fee Related
- 2007-03-12 EP EP07726783.9A patent/EP1999114B1/en active Active
- 2007-03-12 RS RS20150580A patent/RS54216B1/en unknown
- 2007-03-12 WO PCT/EP2007/052269 patent/WO2007107470A2/en active Application Filing
- 2007-03-12 EP EP10175020A patent/EP2295411A1/en not_active Withdrawn
- 2007-03-12 MY MYPI20083704A patent/MY149622A/en unknown
- 2007-03-12 KR KR1020087025604A patent/KR101077366B1/ko not_active IP Right Cessation
- 2007-03-12 SI SI200731685T patent/SI1999114T1/sl unknown
- 2007-03-14 US US11/717,996 patent/US7728029B2/en not_active Expired - Fee Related
- 2007-03-19 TW TW099133403A patent/TW201103916A/zh unknown
- 2007-03-19 TW TW096109371A patent/TWI351403B/zh not_active IP Right Cessation
- 2007-03-20 AR ARP070101126A patent/AR059983A1/es not_active Application Discontinuation
-
2008
- 2008-09-04 IL IL193900A patent/IL193900A/en not_active IP Right Cessation
- 2008-09-09 NO NO20083863A patent/NO341746B1/no not_active IP Right Cessation
- 2008-09-16 CR CR10288A patent/CR10288A/es unknown
- 2008-09-18 EC EC2008008747A patent/ECSP088747A/es unknown
- 2008-10-20 MA MA31307A patent/MA30344B1/fr unknown
-
2009
- 2009-09-24 HK HK09108733.6A patent/HK1130780A1/xx not_active IP Right Cessation
-
2015
- 2015-10-12 HR HRP20151078TT patent/HRP20151078T1/hr unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101077366B1 (ko) | 11-베타-hsd-1로서의 피라졸 | |
| KR100931411B1 (ko) | 1h-피라졸 4-카복실아미드, 이의 제조 방법, 및 이의 11베타-하이드록시스테로이드 탈수소효소로서의 용도 | |
| CA2693457C (en) | Inhibitors of 11b-hydroxysteroid dehydrogenase | |
| KR101654529B1 (ko) | 안드로겐 수용체 조절 화합물 | |
| US20060241125A1 (en) | Compounds useful in therapy | |
| JP7324450B2 (ja) | 抗マラリア剤 | |
| UA91415C2 (en) | Pyrazoles as 11-beta-hsd-1 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| A107 | Divisional application of patent | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20140929 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20150930 Year of fee payment: 5 |
|
| FPAY | Annual fee payment |
Payment date: 20160929 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20170929 Year of fee payment: 7 |
|
| LAPS | Lapse due to unpaid annual fee |