JP3936734B2 - プリン類の製造 - Google Patents
プリン類の製造 Download PDFInfo
- Publication number
- JP3936734B2 JP3936734B2 JP52673895A JP52673895A JP3936734B2 JP 3936734 B2 JP3936734 B2 JP 3936734B2 JP 52673895 A JP52673895 A JP 52673895A JP 52673895 A JP52673895 A JP 52673895A JP 3936734 B2 JP3936734 B2 JP 3936734B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- group
- amino
- compound represented
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000004519 manufacturing process Methods 0.000 title claims description 7
- 235000011962 puddings Nutrition 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 20
- 238000000034 method Methods 0.000 claims description 12
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 claims description 6
- JNTOCHDNEULJHD-UHFFFAOYSA-N Penciclovir Chemical compound N1C(N)=NC(=O)C2=C1N(CCC(CO)CO)C=N2 JNTOCHDNEULJHD-UHFFFAOYSA-N 0.000 claims description 5
- GGXKWVWZWMLJEH-UHFFFAOYSA-N famcyclovir Chemical compound N1=C(N)N=C2N(CCC(COC(=O)C)COC(C)=O)C=NC2=C1 GGXKWVWZWMLJEH-UHFFFAOYSA-N 0.000 claims description 5
- 229960004396 famciclovir Drugs 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 239000001257 hydrogen Substances 0.000 claims description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 2
- 238000006114 decarboxylation reaction Methods 0.000 claims description 2
- 125000000217 alkyl group Chemical group 0.000 claims 3
- 125000003277 amino group Chemical group 0.000 claims 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims 2
- AFINAILKDBCXMX-PBHICJAKSA-N (2s,3r)-2-amino-3-hydroxy-n-(4-octylphenyl)butanamide Chemical compound CCCCCCCCC1=CC=C(NC(=O)[C@@H](N)[C@@H](C)O)C=C1 AFINAILKDBCXMX-PBHICJAKSA-N 0.000 claims 1
- 125000002252 acyl group Chemical group 0.000 claims 1
- 125000004185 ester group Chemical group 0.000 claims 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims 1
- 229910052736 halogen Inorganic materials 0.000 claims 1
- 150000002367 halogens Chemical class 0.000 claims 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims 1
- 125000004356 hydroxy functional group Chemical group O* 0.000 claims 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims 1
- 125000006239 protecting group Chemical group 0.000 claims 1
- 150000003839 salts Chemical class 0.000 claims 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- 239000000047 product Substances 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 7
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 6
- 239000011541 reaction mixture Substances 0.000 description 6
- 239000000203 mixture Substances 0.000 description 5
- RYYIULNRIVUMTQ-UHFFFAOYSA-N 6-chloroguanine Chemical compound NC1=NC(Cl)=C2N=CNC2=N1 RYYIULNRIVUMTQ-UHFFFAOYSA-N 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 3
- -1 4-Acetoxy-3-acetoxymethylbut-1-yl Chemical group 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 3
- 235000019253 formic acid Nutrition 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 2
- KXPSHSVVYGZKAV-UHFFFAOYSA-N [2-(acetyloxymethyl)-4-(2-amino-6-chloropurin-9-yl)butyl] acetate Chemical compound N1=C(N)N=C2N(CCC(COC(=O)C)COC(C)=O)C=NC2=C1Cl KXPSHSVVYGZKAV-UHFFFAOYSA-N 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 229960001179 penciclovir Drugs 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- ISTBVJOFZNQWJF-UHFFFAOYSA-N 2-(hydroxyamino)-3,7-dihydropurin-6-one Chemical compound O=C1NC(NO)=NC2=C1NC=N2 ISTBVJOFZNQWJF-UHFFFAOYSA-N 0.000 description 1
- MWBWWFOAEOYUST-UHFFFAOYSA-N 2-aminopurine Chemical compound NC1=NC=C2N=CNC2=N1 MWBWWFOAEOYUST-UHFFFAOYSA-N 0.000 description 1
- ZKBQDFAWXLTYKS-UHFFFAOYSA-N 6-Chloro-1H-purine Chemical compound ClC1=NC=NC2=C1NC=N2 ZKBQDFAWXLTYKS-UHFFFAOYSA-N 0.000 description 1
- IBNZSTZXZYZALO-UHFFFAOYSA-N 6-chloro-7H-purin-2-amine 7H-purine Chemical compound NC1=NC(=C2NC=NC2=N1)Cl.N1=CN=C2N=CNC2=C1 IBNZSTZXZYZALO-UHFFFAOYSA-N 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000010779 crude oil Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229910000033 sodium borohydride Inorganic materials 0.000 description 1
- 239000012279 sodium borohydride Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 238000005292 vacuum distillation Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Saccharide Compounds (AREA)
- Chemical Treatment Of Metals (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
式:
で示される化合物2−アミノ−6−クロロプリン(ACP)は、各々EP−A−141927(実施例1)およびEP−A−182024(実施例2)に記載されているペンシクロヴィル(penciclovir)(従来、BRL 39123として知られている)およびファムシクロヴィル(famciclovir)(従来、BRL 42810として知られている)のようなヌクレオシド類似抗ウイルス薬の製造における有用な中間体である。該中間体は、適切な側鎖前駆体で9−置換された後、6−クロロ部分をヒドロキシ(グアニン)または水素(2−アミノプリン)に転換している。
ACPからのプロセスは、EP−A−302644およびUS特許第5175288号に開示されており、今、この刊行物に特に開示されているプロセスよりも改良されたプロセスが見いだされた。重要な差異は、オリジナルプロセスでは、プリン分子の6位の塩素基が、まず、該プロセスの初期に除去されているという点である(反応スキーム1を参照)。有意な収率およびプロセシング長所は、該プロセスを通して分子の6−クロロ置換基を保持し、最終段階でのみそれを除去することによって得られる(反応スキーム2を参照)。生成プロセスとしての経路欠点を与えていたプロセス段階の簡素化およびカラムクロマトグラフィー工程の除去により、全収率は、10.6%から41%に増加した。
したがって、本発明は、脱炭酸および加水分解工程の後に6−クロロ置換基を除去することを特徴とする、EP−302644に開示されているACPからのペンシクロヴィル/ファムシクロヴィルの製造方法を提供するものである。
カップリング工程で生成物を沈殿させるために水性希釈液を用いないので、大きな容量利益があり、多量の水からの分離を必要としないので、ジメチルホルムアミドがより容易に回収される。
該プロセスにおいて、より大きな全容量効率がある。
以下の実施例は、本発明を説明する。
実施例1
(ステージ1生成物)
2−アミノ−6−クロロ−9−(メチル2−カルボメトキシブタノアート−4−イル)プリンの製造
2−アミノ−6−クロロプリン(9.18g、53.1mmol)、3−ブロモプロパン−1,1,1−トリカルボン酸トリエチル(20.33g、57.3mmol)、炭酸カリウム(11.1g、80.3mmol)およびジメチルホルムアミド(190ml)の混合物を一緒に60℃〜63℃で22時間撹拌した。この後、反応混合物をセライト床を介して熱濾過し、ケーキをジメチルホルムアミド(30ml)で洗浄した。濾液および洗液を合わせ、高真空蒸留下、溶媒を除去して、赤味がかった茶色の粗製油状物を得た。これをメタノール(140ml)に溶解させ、20℃に冷却し、次いで、撹拌しつつ、ナトリウムメトキシド(1.2g)のメタノール(40ml)中溶液を添加した。約20分後、沈殿物が形成され、撹拌を合計1時間続けた。次いで、反応混合物を15℃に冷却し、この温度で30分間維持した。該生成物を濾過し、メタノール(10ml)で洗浄し、真空下、40℃で16時間乾燥させた。
収量:純度95%の物質12.0g。
実施例2
(ステージ2生成物)
9−(4−アセトキシ−3−アセトキシメチルブタ−1−イル)−2−アミノ−6−クロロプリンの製造
2−アミノ−6−クロロ−9−(メチル2−カルボメトキシブタノアート−4−イル)プリン(32.7g、0.1mol)、ホウ水素化ナトリウム(11.5g、0.3mol)およびメチレンジクロリド(125ml)の混合物を20℃で撹拌した。メタノール(75ml)を2.0時間かけて滴下し、この間、冷却しつつ反応温度を20−22℃に維持した。該反応混合物をさらに1.5時間撹拌した。水(100ml)を添加し、次いで、反応温度を20−22℃に維持しつつ、濃塩酸(20−22ml)をpH6.7〜7.0に滴下した。150mlの反応容量が得られるまで、メチレンジクロリドおよびメタノールを真空除去した。該反応混合物を5℃に冷却し、この温度で30分間撹拌した。得られた沈殿物を濾過し、生成ケーキを冷水(20ml)で洗浄した。得られた湿気を帯びた固体(40−50g)をメチレンジクロリド(250ml)中のトリエチルアミン(15ml)、4−ジメチルアミノピリジン(1.0g)と一緒に撹拌した。無水酢酸(75ml、0.79mol)を、還流を制御するような速度で、20〜30分間かけて滴下した。該反応混合物を、還流下、さらに1.5時間加熱した。該反応を20℃に冷却し、20%w/w水酸化ナトリウムでpH6.4−6.5に中和した。メチレンジクロリド層を分離し、水性層をメチレンジクロリド(100ml)で抽出した。合わせたメチレンジクロリド相を蒸発乾固させた。湿気を帯びた粗製固体を3:1メタノール:水(7ml)から再結晶し、沈殿物を−5℃に1時間冷却した後、濾過した。生成物を冷たい3:1メタノール:水(0℃)で洗浄し、真空オーブン中、40℃で16時間乾燥させた。
収量:純度97%〜98%の物質23g。
実施例3
(ステージ3生成物)
a)9−(4−アセトキシ−3−アセトキシメチルブタ−1−イル)−2−アミノプリン−ファムシクロヴィル
9−(4−アセトキシ−3−アセトキシメチルブタ−1−イル)−2−アミノ−6−クロロプリン(15.4g、43mmol)、5%パラジウム−炭(6.16g)、トリエチルアミン(6.6ml、47mmol)および酢酸エチル(77ml)の混合物を、オートクレーブ中、1バール圧下、水素雰囲気下、50℃で3〜5時間撹拌した。該反応が完了した後、該混合物をオートクレーブから取り出し、これを酢酸エチル(30ml)で洗浄し、洗液を50℃で保持した。主要反応混合物を、セライト床を通して、次いで、洗液および最後に酢酸エチル(30ml)で濾過した。合わせた酢酸エチル濾液+洗液に水(46ml)を添加した。酢酸エチルを蒸発乾固させて、粗製の白色固体を得た。これをn−ブタノール(62ml)から再結晶させ、0〜5℃で3時間、冷却した溶液を撹拌した後、濾過した。該生成物を濾過し、母液で洗浄した。固体をn−ヘプタン(50ml)中で再スラリー化し、30分間撹拌し、濾過した。該生成物を、真空下、40℃で16時間乾燥させた。
収量:11−11.3g。
b)9−(4−ヒドロキシ−3−ヒドロキシメチルブタ−1−イル)グアニン−ペンシクロヴィル
9−(4−アセトキシ−3−アセトキシメチルブタ−1−イル)−2−アミノ−6−クロロプリン(10g、28.1mmol)、ギ酸(96%、6.3ml)および水(55ml)の混合物を撹拌し、約4時間、加熱還流した。冷却後、該溶液を、水酸化ナトリウム(12.5M、27ml)と混合することによって塩基性化し、得られた溶液を1.5時間撹拌した。該溶液を、ギ酸の添加によって中和した。得られたスラリーを加熱還流し(約105℃)、次いで、40−45℃に冷却し、約3時間撹拌した。次いで、粗製生成物を単離し、水(20ml)で洗浄した。単離した生成物を水酸化ナトリウム溶液(3M、80ml)に溶解させた。炭素(約1.5g)を添加し、該スラリーを約1時間撹拌し、次いで、炭素を濾去し、水(20ml)で洗浄した。該溶液を、ギ酸の添加により中和し、得られた沈殿物を、約100℃に加熱することによって再溶解し、次いで、冷却した。沈殿した生成物を約3時間撹拌し、次いで、単離し、水(2×20ml)で洗浄した後、乾燥させた。
収量:5.3−5.5g。
Claims (6)
- 式(A):
[式中、Xは水素またはヒドロキシであり、RaおよびRbは水素またはそのアシルもしくはリン酸誘導体である]
で示される化合物の製造方法であって、
(i)式(II):
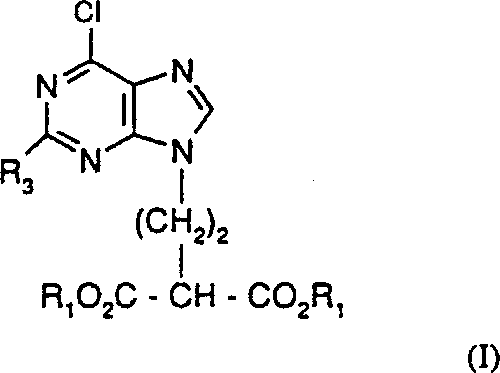
[式中、R3は下記式(I)についての定義と同じである]
で示される化合物を式(V):
[式中、Lは離脱基であり、R1は下記式(I)についての定義と同じである]で示される化合物と反応させて、式(VI):
[式中、R1とR3は下記式(I)についての定義と同じである]
で示される化合物を得、次いで、式(VI)で示される化合物を脱炭酸により式(I)で示される化合物に転換させ、所望により可変基R1をその別の基に転換することにより、式(I):
[式中、R1はC1-6アルキルまたはフェニルC1-6アルキルであり、R3はアミノ基または保護アミノ基である]
で示される化合物を製造する工程と、
(ii)式(I)で示される化合物を、可変基R3がアミノ保護基である場合に必要であればアミノ基に転換させ、エステル基CO2R1をCH2OHに還元し、所望によりアシルまたはそのリン酸誘導体を形成させ、そして式(I)で示される化合物におけるClを式(A)で示される化合物における可変基Xに転換させることにより、式(A)で示される化合物を製造する工程
を含むことを特徴とする方法。 - R3が請求項1における定義と同じである式(II)で示される化合物を、R1がC1-4アルキルであり、Lがハロゲンである式(V)で示される化合物と反応させ、得られた式(VI)で示される化合物を脱炭酸し、所望により得られた式(I)で示される化合物の基R1を請求項1で定義された基R1の他の基に転換することを特徴とする、請求項1記載の式(I)で示される化合物の製造方法。
- 2−アミノ−6−クロロ−9−(メチル2−カルボメトキシブタノアート−4−イル)プリン。
- 式(A)で示される化合物が9−(4−アセトキシ−3−アセトキシメチルブタ−1−イル)−2−アミノプリン(ファムシクロヴィル)である、請求項1または2記載の製造方法。
- 式(A)で示される化合物が9−(4−ヒドロキシ−3−ヒドロキシメチルブタ−1−イル)グアニン(ペンシクロヴィル)である、請求項1または2記載の製造方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9407698.1 | 1994-04-19 | ||
| GB9407698A GB9407698D0 (en) | 1994-04-19 | 1994-04-19 | Pharmaceuticals |
| PCT/EP1995/001840 WO1995028402A2 (en) | 1994-04-19 | 1995-04-19 | Preparation of purines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH09512000A JPH09512000A (ja) | 1997-12-02 |
| JP3936734B2 true JP3936734B2 (ja) | 2007-06-27 |
Family
ID=10753741
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52673895A Expired - Lifetime JP3936734B2 (ja) | 1994-04-19 | 1995-04-19 | プリン類の製造 |
Country Status (39)
| Country | Link |
|---|---|
| US (2) | US6846927B1 (ja) |
| EP (1) | EP0756597B1 (ja) |
| JP (1) | JP3936734B2 (ja) |
| KR (1) | KR100327147B1 (ja) |
| CN (1) | CN1045963C (ja) |
| AP (2) | AP582A (ja) |
| AT (1) | ATE201209T1 (ja) |
| AU (1) | AU691000B2 (ja) |
| BG (1) | BG63464B1 (ja) |
| BR (1) | BR9507494A (ja) |
| CA (1) | CA2188181C (ja) |
| CZ (1) | CZ287674B6 (ja) |
| DE (1) | DE69520945T2 (ja) |
| DK (1) | DK0756597T3 (ja) |
| DZ (1) | DZ1872A1 (ja) |
| EG (1) | EG20938A (ja) |
| ES (1) | ES2158948T3 (ja) |
| FI (1) | FI119691B (ja) |
| GB (1) | GB9407698D0 (ja) |
| GR (1) | GR3036338T3 (ja) |
| HU (1) | HU226209B1 (ja) |
| IL (1) | IL113409A (ja) |
| IN (1) | IN183830B (ja) |
| MA (1) | MA23518A1 (ja) |
| MX (1) | MX9604942A (ja) |
| MY (1) | MY128846A (ja) |
| NO (1) | NO315000B1 (ja) |
| NZ (1) | NZ287858A (ja) |
| OA (1) | OA10376A (ja) |
| PL (1) | PL181219B1 (ja) |
| PT (1) | PT756597E (ja) |
| RO (1) | RO118950B1 (ja) |
| RU (1) | RU2158266C2 (ja) |
| SA (1) | SA95150619B1 (ja) |
| SK (1) | SK283193B6 (ja) |
| TW (1) | TW311138B (ja) |
| UA (1) | UA47401C2 (ja) |
| WO (1) | WO1995028402A2 (ja) |
| ZA (1) | ZA953110B (ja) |
Families Citing this family (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9615276D0 (en) * | 1996-07-20 | 1996-09-04 | Smithkline Beecham Plc | Pharmaceuticals |
| GB9615253D0 (en) * | 1996-07-20 | 1996-09-04 | Smithkline Beecham Plc | Pharmaceuticals |
| GB9807114D0 (en) * | 1998-04-02 | 1998-06-03 | Smithkline Beecham Plc | Novel process |
| GB9807116D0 (en) * | 1998-04-02 | 1998-06-03 | Smithkline Beecham Plc | Novel process |
| US20040097528A1 (en) * | 2002-08-26 | 2004-05-20 | Ben-Zion Dolitzky | Crystalline solid famciclovir forms I, II, III and preparation thereof |
| WO2004099208A1 (en) * | 2003-04-30 | 2004-11-18 | Teva Pharmaceutical Industries Ltd. | Process for the preparation of famciclovir |
| US20050143400A1 (en) * | 2003-09-04 | 2005-06-30 | Genny Shamai | Process for preparing famciclovir |
| US7458839B2 (en) * | 2006-02-21 | 2008-12-02 | Fci Americas Technology, Inc. | Electrical connectors having power contacts with alignment and/or restraining features |
| US20050215787A1 (en) * | 2004-03-26 | 2005-09-29 | Joshi Ramesh A | An improved process for the preparation of purines |
| KR20080091298A (ko) | 2004-05-18 | 2008-10-09 | 테바 파마슈티컬 인더스트리즈 리미티드 | 결정성 고체 팜시클로버의 제조를 위한 건조방법 |
| GB2426247A (en) * | 2005-05-20 | 2006-11-22 | Arrow Int Ltd | Methods of preparing purine derivatives such as famciclovir |
| CN102070636B (zh) * | 2011-01-17 | 2012-05-23 | 浙江大学 | 喷昔洛韦的制备方法 |
| CN104086552B (zh) * | 2014-07-31 | 2016-01-13 | 济南兆康医药科技有限公司 | 一种喷昔洛韦的精制方法 |
| CN104496991A (zh) * | 2014-11-04 | 2015-04-08 | 常州康丽制药有限公司 | 高品质2-氨基-6-氯-9-(4-羟基-3–羟甲基丁基)嘌呤的制备方法 |
| CN104744472A (zh) * | 2015-03-12 | 2015-07-01 | 常州康丽制药有限公司 | 高品质2-氨基-6-氯-9-(4-羟基-3-羟甲基丁基)嘌呤的制备方法 |
| CN108314685B (zh) * | 2018-03-16 | 2020-08-25 | 上药康丽(常州)药业有限公司 | 一种2-氨基-6-氯-9-(4-乙酰氧基-3-乙酰氧甲基丁基)嘌呤的制备方法 |
| CN110713490A (zh) * | 2018-07-12 | 2020-01-21 | 浙江医药股份有限公司新昌制药厂 | 一种喷昔洛韦的制备方法 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ZM7883A1 (en) * | 1982-10-14 | 1985-06-21 | Wellcome Found | Antiviral compounds |
| DE3485225D1 (de) * | 1983-08-18 | 1991-12-05 | Beecham Group Plc | Antivirale guanin-derivate. |
| EP0182024B1 (en) * | 1984-09-20 | 1991-04-03 | Beecham Group Plc | Purine derivatives and their pharmaceutical use |
| US5175268A (en) * | 1986-12-24 | 1992-12-29 | Takeda Chemical Industries, Ltd. | DNA encoding recombinant human lymphotoxin |
| ES2098219T3 (es) * | 1987-08-01 | 1997-05-01 | Beecham Group Plc | Compuestos de purina y su preparacion. |
| GB8817607D0 (en) * | 1988-07-23 | 1988-09-01 | Beecham Group Plc | Novel process |
| GB8822236D0 (en) * | 1988-09-21 | 1988-10-26 | Beecham Group Plc | Chemical process |
| GB8922076D0 (en) * | 1989-09-28 | 1989-11-15 | Beecham Group Plc | Novel process |
-
1994
- 1994-04-19 GB GB9407698A patent/GB9407698D0/en active Pending
-
1995
- 1995-04-12 DZ DZ950040A patent/DZ1872A1/fr active
- 1995-04-13 AP APAP/P/1995/000730A patent/AP582A/en active
- 1995-04-17 MA MA23846A patent/MA23518A1/fr unknown
- 1995-04-17 TW TW084103750A patent/TW311138B/zh not_active IP Right Cessation
- 1995-04-17 MY MYPI95000990A patent/MY128846A/en unknown
- 1995-04-18 ZA ZA953110A patent/ZA953110B/xx unknown
- 1995-04-18 IN IN705DE1995 patent/IN183830B/en unknown
- 1995-04-18 IL IL11340995A patent/IL113409A/xx not_active IP Right Cessation
- 1995-04-19 CA CA002188181A patent/CA2188181C/en not_active Expired - Lifetime
- 1995-04-19 WO PCT/EP1995/001840 patent/WO1995028402A2/en not_active Ceased
- 1995-04-19 EP EP95921751A patent/EP0756597B1/en not_active Expired - Lifetime
- 1995-04-19 AU AU26706/95A patent/AU691000B2/en not_active Expired
- 1995-04-19 RO RO96-02001A patent/RO118950B1/ro unknown
- 1995-04-19 JP JP52673895A patent/JP3936734B2/ja not_active Expired - Lifetime
- 1995-04-19 MX MX9604942A patent/MX9604942A/es active IP Right Grant
- 1995-04-19 PL PL95316943A patent/PL181219B1/pl unknown
- 1995-04-19 HU HU9602891A patent/HU226209B1/hu unknown
- 1995-04-19 BR BR9507494A patent/BR9507494A/pt unknown
- 1995-04-19 KR KR1019960705948A patent/KR100327147B1/ko not_active Expired - Lifetime
- 1995-04-19 AP APAP/P/1996/000870A patent/AP703A/en active
- 1995-04-19 EG EG32695A patent/EG20938A/xx active
- 1995-04-19 SK SK1332-96A patent/SK283193B6/sk not_active IP Right Cessation
- 1995-04-19 ES ES95921751T patent/ES2158948T3/es not_active Expired - Lifetime
- 1995-04-19 CN CN95193489A patent/CN1045963C/zh not_active Expired - Lifetime
- 1995-04-19 RU RU96121936/04A patent/RU2158266C2/ru active
- 1995-04-19 UA UA96103899A patent/UA47401C2/uk unknown
- 1995-04-19 AT AT95921751T patent/ATE201209T1/de active
- 1995-04-19 CZ CZ19963053A patent/CZ287674B6/cs not_active IP Right Cessation
- 1995-04-19 NZ NZ287858A patent/NZ287858A/en not_active IP Right Cessation
- 1995-04-19 DK DK95921751T patent/DK0756597T3/da active
- 1995-04-19 PT PT95921751T patent/PT756597E/pt unknown
- 1995-04-19 DE DE69520945T patent/DE69520945T2/de not_active Expired - Lifetime
- 1995-04-26 SA SA95150619A patent/SA95150619B1/ar unknown
-
1996
- 1996-10-15 NO NO19964395A patent/NO315000B1/no not_active IP Right Cessation
- 1996-10-18 OA OA60905A patent/OA10376A/en unknown
- 1996-10-18 FI FI964193A patent/FI119691B/fi not_active IP Right Cessation
- 1996-10-18 BG BG100926A patent/BG63464B1/bg unknown
-
1999
- 1999-03-11 US US09/265,926 patent/US6846927B1/en not_active Expired - Fee Related
-
2001
- 2001-08-07 GR GR20010401190T patent/GR3036338T3/el unknown
-
2004
- 2004-12-14 US US11/011,352 patent/US7355043B2/en not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3936734B2 (ja) | プリン類の製造 | |
| US6057445A (en) | Purine compounds having PDE IV inhibitory activity and methods of synthesis | |
| JP3906488B2 (ja) | プリン誘導体の製造方法 | |
| GB2097785A (en) | Novel purine derivatives | |
| EP1883639B1 (en) | Preparation of famciclovir and other purine derivatives | |
| JP2825132B2 (ja) | 化合物の新規な製造方法 | |
| CN111574463B (zh) | 一种利格列汀中间体化合物ⅳ | |
| CA2243650C (en) | Process for preparing purine derivatives | |
| JP4223408B2 (ja) | 2,6−ジハロプリンの製造方法 | |
| EP1831214A1 (en) | A process for preparation of 4-amino-1-isobutyl-1h-imidazo[4,5-c]-quinoline (imiquimod) | |
| HK1012348B (en) | Preparation of purines | |
| CN115785081A (zh) | 一种雷替曲塞的制备方法 | |
| MXPA97005481A (en) | Procedure to prepare penciclovir or famciclo | |
| JPH03240788A (ja) | シクロブタン誘導体の新規製造法及び中間体 | |
| EP0882050A1 (en) | Process for preparing purine derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060725 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20060711 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20061024 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20061211 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070125 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20070313 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20070326 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110330 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110330 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120330 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130330 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130330 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140330 Year of fee payment: 7 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |