JP3866293B2 - 有機el素子 - Google Patents
有機el素子 Download PDFInfo
- Publication number
- JP3866293B2 JP3866293B2 JP51057898A JP51057898A JP3866293B2 JP 3866293 B2 JP3866293 B2 JP 3866293B2 JP 51057898 A JP51057898 A JP 51057898A JP 51057898 A JP51057898 A JP 51057898A JP 3866293 B2 JP3866293 B2 JP 3866293B2
- Authority
- JP
- Japan
- Prior art keywords
- group
- layer
- light emitting
- light
- emitting layer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 150000001875 compounds Chemical class 0.000 claims description 149
- 238000002347 injection Methods 0.000 claims description 85
- 239000007924 injection Substances 0.000 claims description 85
- -1 quinacridone compound Chemical class 0.000 claims description 72
- 125000003118 aryl group Chemical group 0.000 claims description 56
- CFNMUZCFSDMZPQ-GHXNOFRVSA-N 7-[(z)-3-methyl-4-(4-methyl-5-oxo-2h-furan-2-yl)but-2-enoxy]chromen-2-one Chemical compound C=1C=C2C=CC(=O)OC2=CC=1OC/C=C(/C)CC1OC(=O)C(C)=C1 CFNMUZCFSDMZPQ-GHXNOFRVSA-N 0.000 claims description 44
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 claims description 44
- 125000000217 alkyl group Chemical group 0.000 claims description 40
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 35
- 239000002019 doping agent Substances 0.000 claims description 30
- 230000005525 hole transport Effects 0.000 claims description 29
- 238000006243 chemical reaction Methods 0.000 claims description 17
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 17
- 150000004696 coordination complex Chemical class 0.000 claims description 8
- 125000000623 heterocyclic group Chemical group 0.000 claims description 8
- 125000003342 alkenyl group Chemical group 0.000 claims description 6
- 238000000605 extraction Methods 0.000 claims description 6
- 125000001769 aryl amino group Chemical group 0.000 claims description 5
- 125000005504 styryl group Chemical group 0.000 claims description 5
- 125000002252 acyl group Chemical group 0.000 claims description 4
- 125000004185 ester group Chemical group 0.000 claims description 4
- 125000003367 polycyclic group Chemical group 0.000 claims description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 3
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 3
- 239000010410 layer Substances 0.000 description 497
- 239000000463 material Substances 0.000 description 75
- 229910052757 nitrogen Inorganic materials 0.000 description 58
- 238000000295 emission spectrum Methods 0.000 description 49
- 239000010408 film Substances 0.000 description 44
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 37
- 238000000151 deposition Methods 0.000 description 33
- 230000008021 deposition Effects 0.000 description 32
- 125000001424 substituent group Chemical group 0.000 description 27
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 24
- 239000000758 substrate Substances 0.000 description 22
- 230000006870 function Effects 0.000 description 21
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 20
- 230000006798 recombination Effects 0.000 description 19
- 238000005215 recombination Methods 0.000 description 19
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 17
- 239000012299 nitrogen atmosphere Substances 0.000 description 17
- 230000000052 comparative effect Effects 0.000 description 16
- 238000000034 method Methods 0.000 description 15
- 150000002894 organic compounds Chemical class 0.000 description 13
- 239000010409 thin film Substances 0.000 description 13
- 230000008859 change Effects 0.000 description 12
- 229910052782 aluminium Inorganic materials 0.000 description 11
- 238000007740 vapor deposition Methods 0.000 description 11
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 10
- 239000011521 glass Substances 0.000 description 10
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 9
- 230000004888 barrier function Effects 0.000 description 9
- 238000001704 evaporation Methods 0.000 description 9
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- 239000007983 Tris buffer Substances 0.000 description 8
- 125000005015 aryl alkynyl group Chemical group 0.000 description 8
- 229910052799 carbon Inorganic materials 0.000 description 8
- 125000004432 carbon atom Chemical group C* 0.000 description 8
- 230000008020 evaporation Effects 0.000 description 8
- 125000001624 naphthyl group Chemical group 0.000 description 8
- CAMPQFALWQQPAZ-UHFFFAOYSA-N 1-n-(4-methylphenyl)-4-n-[4-[4-(n-[4-(n-(4-methylphenyl)anilino)phenyl]anilino)phenyl]phenyl]-1-n,4-n-diphenylbenzene-1,4-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(C)=CC=1)C1=CC=CC=C1 CAMPQFALWQQPAZ-UHFFFAOYSA-N 0.000 description 7
- 239000012300 argon atmosphere Substances 0.000 description 7
- 238000004020 luminiscence type Methods 0.000 description 7
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 7
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 7
- 125000005037 alkyl phenyl group Chemical group 0.000 description 6
- 125000003277 amino group Chemical group 0.000 description 6
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 6
- 125000000732 arylene group Chemical group 0.000 description 6
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical compound C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 description 6
- 239000013078 crystal Substances 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 6
- 229960003540 oxyquinoline Drugs 0.000 description 6
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 6
- 239000011347 resin Substances 0.000 description 6
- 229920005989 resin Polymers 0.000 description 6
- 238000012546 transfer Methods 0.000 description 6
- 0 CC(CC(*C1C2)C1C2C(CC1)CC1C(C)C1(C)CC1)C1=*2C11C2C*1 Chemical compound CC(CC(*C1C2)C1C2C(CC1)CC1C(C)C1(C)CC1)C1=*2C11C2C*1 0.000 description 5
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 5
- 125000005577 anthracene group Chemical group 0.000 description 5
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 5
- 125000005605 benzo group Chemical group 0.000 description 5
- 238000009835 boiling Methods 0.000 description 5
- 238000004140 cleaning Methods 0.000 description 5
- 150000004775 coumarins Chemical class 0.000 description 5
- 239000003599 detergent Substances 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 230000007935 neutral effect Effects 0.000 description 5
- 239000011241 protective layer Substances 0.000 description 5
- 238000001771 vacuum deposition Methods 0.000 description 5
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 4
- NRCMAYZCPIVABH-UHFFFAOYSA-N Quinacridone Chemical compound N1C2=CC=CC=C2C(=O)C2=C1C=C1C(=O)C3=CC=CC=C3NC1=C2 NRCMAYZCPIVABH-UHFFFAOYSA-N 0.000 description 4
- 125000003545 alkoxy group Chemical group 0.000 description 4
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 4
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 4
- 125000004104 aryloxy group Chemical group 0.000 description 4
- 239000011230 binding agent Substances 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 238000013461 design Methods 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- 230000003287 optical effect Effects 0.000 description 4
- 230000001681 protective effect Effects 0.000 description 4
- 150000003248 quinolines Chemical class 0.000 description 4
- 238000007789 sealing Methods 0.000 description 4
- 239000002356 single layer Substances 0.000 description 4
- 238000001228 spectrum Methods 0.000 description 4
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 4
- BRSRUYVJULRMRQ-UHFFFAOYSA-N 1-phenylanthracene Chemical class C1=CC=CC=C1C1=CC=CC2=CC3=CC=CC=C3C=C12 BRSRUYVJULRMRQ-UHFFFAOYSA-N 0.000 description 3
- 239000011358 absorbing material Substances 0.000 description 3
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 229910003437 indium oxide Inorganic materials 0.000 description 3
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 3
- 125000005647 linker group Chemical group 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 239000000203 mixture Substances 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- 125000004433 nitrogen atom Chemical group N* 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 125000001725 pyrenyl group Chemical group 0.000 description 3
- 238000010791 quenching Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000004528 spin coating Methods 0.000 description 3
- 238000004544 sputter deposition Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 3
- 125000003944 tolyl group Chemical group 0.000 description 3
- DXBHBZVCASKNBY-UHFFFAOYSA-N 1,2-Benz(a)anthracene Chemical compound C1=CC=C2C3=CC4=CC=CC=C4C=C3C=CC2=C1 DXBHBZVCASKNBY-UHFFFAOYSA-N 0.000 description 2
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 2
- HONWGFNQCPRRFM-UHFFFAOYSA-N 2-n-(3-methylphenyl)-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C(=CC=CC=2)N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 HONWGFNQCPRRFM-UHFFFAOYSA-N 0.000 description 2
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 2
- XMMFBHHBHIVCBP-UHFFFAOYSA-N 4-(4-aminophenyl)-2-(1-phenylcyclohexa-2,4-dien-1-yl)aniline Chemical compound C1(CC=CC=C1)(C1=CC=CC=C1)C=1C=C(C=CC=1N)C1=CC=C(N)C=C1 XMMFBHHBHIVCBP-UHFFFAOYSA-N 0.000 description 2
- YFIJJNAKSZUOLT-UHFFFAOYSA-N Anthanthrene Chemical compound C1=C(C2=C34)C=CC=C2C=CC3=CC2=CC=CC3=CC=C1C4=C32 YFIJJNAKSZUOLT-UHFFFAOYSA-N 0.000 description 2
- BYWBCSRCPLBDFU-CYBMUJFWSA-N [3-[4-(aminomethyl)-6-(trifluoromethyl)pyridin-2-yl]oxyphenyl]-[(3R)-3-aminopyrrolidin-1-yl]methanone Chemical compound NCC1=CC(=NC(=C1)C(F)(F)F)OC=1C=C(C=CC=1)C(=O)N1C[C@@H](CC1)N BYWBCSRCPLBDFU-CYBMUJFWSA-N 0.000 description 2
- 230000009102 absorption Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 125000005036 alkoxyphenyl group Chemical group 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- 229940027991 antiseptic and disinfectant quinoline derivative Drugs 0.000 description 2
- 239000012298 atmosphere Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- JTRPLRMCBJSBJV-UHFFFAOYSA-N benzo[a]tetracene Chemical compound C1=CC=C2C3=CC4=CC5=CC=CC=C5C=C4C=C3C=CC2=C1 JTRPLRMCBJSBJV-UHFFFAOYSA-N 0.000 description 2
- 239000004305 biphenyl Substances 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 2
- 238000010549 co-Evaporation Methods 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- VPUGDVKSAQVFFS-UHFFFAOYSA-N coronene Chemical compound C1=C(C2=C34)C=CC3=CC=C(C=C3)C4=C4C3=CC=C(C=C3)C4=C2C3=C1 VPUGDVKSAQVFFS-UHFFFAOYSA-N 0.000 description 2
- 229960000956 coumarin Drugs 0.000 description 2
- 235000001671 coumarin Nutrition 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- 230000006866 deterioration Effects 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- 230000020169 heat generation Effects 0.000 description 2
- QSQIGGCOCHABAP-UHFFFAOYSA-N hexacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC6=CC=CC=C6C=C5C=C4C=C3C=C21 QSQIGGCOCHABAP-UHFFFAOYSA-N 0.000 description 2
- 150000002430 hydrocarbons Chemical class 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Chemical compound C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 150000004866 oxadiazoles Chemical class 0.000 description 2
- 238000007254 oxidation reaction Methods 0.000 description 2
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 2
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000168 pyrrolyl group Chemical group 0.000 description 2
- 238000006862 quantum yield reaction Methods 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 150000001651 triphenylamine derivatives Chemical class 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- QGKMIGUHVLGJBR-UHFFFAOYSA-M (4z)-1-(3-methylbutyl)-4-[[1-(3-methylbutyl)quinolin-1-ium-4-yl]methylidene]quinoline;iodide Chemical class [I-].C12=CC=CC=C2N(CCC(C)C)C=CC1=CC1=CC=[N+](CCC(C)C)C2=CC=CC=C12 QGKMIGUHVLGJBR-UHFFFAOYSA-M 0.000 description 1
- ZKSVYBRJSMBDMV-UHFFFAOYSA-N 1,3-diphenyl-2-benzofuran Chemical compound C1=CC=CC=C1C1=C2C=CC=CC2=C(C=2C=CC=CC=2)O1 ZKSVYBRJSMBDMV-UHFFFAOYSA-N 0.000 description 1
- IWJZBMFUKKZWAF-UHFFFAOYSA-N 1,3-oxazole;zinc Chemical compound [Zn].C1=COC=N1 IWJZBMFUKKZWAF-UHFFFAOYSA-N 0.000 description 1
- KLCLIOISYBHYDZ-UHFFFAOYSA-N 1,4,4-triphenylbuta-1,3-dienylbenzene Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)=CC=C(C=1C=CC=CC=1)C1=CC=CC=C1 KLCLIOISYBHYDZ-UHFFFAOYSA-N 0.000 description 1
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 description 1
- XFYQEBBUVNLYBR-UHFFFAOYSA-N 12-phthaloperinone Chemical class C1=CC(N2C(=O)C=3C(=CC=CC=3)C2=N2)=C3C2=CC=CC3=C1 XFYQEBBUVNLYBR-UHFFFAOYSA-N 0.000 description 1
- MVWPVABZQQJTPL-UHFFFAOYSA-N 2,3-diphenylcyclohexa-2,5-diene-1,4-dione Chemical class O=C1C=CC(=O)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 MVWPVABZQQJTPL-UHFFFAOYSA-N 0.000 description 1
- YLYPIBBGWLKELC-RMKNXTFCSA-N 2-[2-[(e)-2-[4-(dimethylamino)phenyl]ethenyl]-6-methylpyran-4-ylidene]propanedinitrile Chemical compound C1=CC(N(C)C)=CC=C1\C=C\C1=CC(=C(C#N)C#N)C=C(C)O1 YLYPIBBGWLKELC-RMKNXTFCSA-N 0.000 description 1
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 description 1
- PDVGPRKWYIVXGR-UHFFFAOYSA-N 4-phenylcyclohexa-2,4-diene-1,1-diamine Chemical group C1=CC(N)(N)CC=C1C1=CC=CC=C1 PDVGPRKWYIVXGR-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 1
- HSUPJUFFIDMSDY-UHFFFAOYSA-N C(C1C2)C1C1C2C2C3C1C23 Chemical compound C(C1C2)C1C1C2C2C3C1C23 HSUPJUFFIDMSDY-UHFFFAOYSA-N 0.000 description 1
- NAZWDPYPNNKBSK-UHFFFAOYSA-N CC(C)CCC1(CC2)C3C2C3C1 Chemical compound CC(C)CCC1(CC2)C3C2C3C1 NAZWDPYPNNKBSK-UHFFFAOYSA-N 0.000 description 1
- GEAWIEHMRCPFGJ-UHFFFAOYSA-N CC(C)SC(C1=C(C)c2ccc3nc(C)[s]c3c2C(C)C1C=C1)=C1N Chemical compound CC(C)SC(C1=C(C)c2ccc3nc(C)[s]c3c2C(C)C1C=C1)=C1N GEAWIEHMRCPFGJ-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KLIHYVJAYWCEDM-UHFFFAOYSA-N Dibenz[a,j]anthracene Chemical compound C1=CC=CC2=C(C=C3C4=CC=CC=C4C=CC3=C3)C3=CC=C21 KLIHYVJAYWCEDM-UHFFFAOYSA-N 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- QSXKLVDRUZCYPO-UHFFFAOYSA-N NC=1C(=C(C=CC1N)C1=CC=C(N)C=C1)C1=CC=C(C=C1)C1=CC=CC=C1 Chemical compound NC=1C(=C(C=CC1N)C1=CC=C(N)C=C1)C1=CC=C(C=C1)C1=CC=CC=C1 QSXKLVDRUZCYPO-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229910006404 SnO 2 Inorganic materials 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- SLGBZMMZGDRARJ-UHFFFAOYSA-N Triphenylene Natural products C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 1
- 238000007239 Wittig reaction Methods 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 1
- 125000004653 anthracenylene group Chemical group 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 150000008378 aryl ethers Chemical class 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- TUAHORSUHVUKBD-UHFFFAOYSA-N benzo[c]phenanthrene Chemical compound C1=CC=CC2=C3C4=CC=CC=C4C=CC3=CC=C21 TUAHORSUHVUKBD-UHFFFAOYSA-N 0.000 description 1
- XJHABGPPCLHLLV-UHFFFAOYSA-N benzo[de]isoquinoline-1,3-dione Chemical class C1=CC(C(=O)NC2=O)=C3C2=CC=CC3=C1 XJHABGPPCLHLLV-UHFFFAOYSA-N 0.000 description 1
- GDUFLCCHLCZVCJ-UHFFFAOYSA-N benzo[f][1]benzothiole-4,9-dione Chemical compound O=C1C2=CC=CC=C2C(=O)C2=C1SC=C2 GDUFLCCHLCZVCJ-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- YXVFYQXJAXKLAK-UHFFFAOYSA-N biphenyl-4-ol Chemical compound C1=CC(O)=CC=C1C1=CC=CC=C1 YXVFYQXJAXKLAK-UHFFFAOYSA-N 0.000 description 1
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 1
- 125000004063 butyryl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000609 carbazolyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 238000005266 casting Methods 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000010406 cathode material Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 125000004986 diarylamino group Chemical group 0.000 description 1
- 238000007598 dipping method Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 1
- 238000002189 fluorescence spectrum Methods 0.000 description 1
- 239000007850 fluorescent dye Substances 0.000 description 1
- 150000002222 fluorine compounds Chemical class 0.000 description 1
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 238000004770 highest occupied molecular orbital Methods 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 239000003230 hygroscopic agent Substances 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000000990 laser dye Substances 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 1
- 239000008204 material by function Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 239000000434 metal complex dye Substances 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 239000002052 molecular layer Substances 0.000 description 1
- WIEPDSSPRKYIHN-UHFFFAOYSA-N n-(4-tert-butylphenyl)-4-[4-(n-(4-tert-butylphenyl)anilino)phenyl]-n-phenylaniline Chemical compound C1=CC(C(C)(C)C)=CC=C1N(C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C(C)(C)C)C1=CC=CC=C1 WIEPDSSPRKYIHN-UHFFFAOYSA-N 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- JAUCCASEHMVMPM-UHFFFAOYSA-N naphtho[2,1-e][1,3]benzoxazole Chemical compound C1=CC2=CC=CC=C2C2=C1C(N=CO1)=C1C=C2 JAUCCASEHMVMPM-UHFFFAOYSA-N 0.000 description 1
- ACIUFBMENRNYHI-UHFFFAOYSA-N naphtho[2,1-f]isoquinoline Chemical compound C1=CN=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 ACIUFBMENRNYHI-UHFFFAOYSA-N 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 150000002815 nickel Chemical class 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical class N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000128 polypyrrole Polymers 0.000 description 1
- 229920000123 polythiophene Polymers 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004307 pyrazin-2-yl group Chemical group [H]C1=C([H])N=C(*)C([H])=N1 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 229940083082 pyrimidine derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- QEVBPWGFJKJQHA-UHFFFAOYSA-N quinolino[6,5-f]quinoline Chemical compound C1=CC=NC2=CC=C(C=3C(=NC=CC=3)C=C3)C3=C21 QEVBPWGFJKJQHA-UHFFFAOYSA-N 0.000 description 1
- 230000009103 reabsorption Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical class [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 230000007480 spreading Effects 0.000 description 1
- 238000003892 spreading Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 238000005979 thermal decomposition reaction Methods 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 125000005580 triphenylene group Chemical group 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 238000004506 ultrasonic cleaning Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
- C09K2211/1051—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms with sulfur
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2102/00—Constructional details relating to the organic devices covered by this subclass
- H10K2102/10—Transparent electrodes, e.g. using graphene
- H10K2102/101—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO]
- H10K2102/103—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO] comprising indium oxides, e.g. ITO
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/125—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers specially adapted for multicolour light emission, e.g. for emitting white light
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Organic Chemistry (AREA)
- Electroluminescent Light Sources (AREA)
Description
本発明は、有機EL(電界発光)素子に関し、詳しくは、有機化合物からなる薄膜に電界を印加して光を放出する素子に関する。
背景技術
有機EL素子は、蛍光性有機化合物を含む薄膜を、陰極と陽極とで挟んだ構成を有し、前記薄膜に電子および正孔を注入して再結合させることにより励起子(エキシトン)を生成させ、このエキシトンが失活する際の光の放出(蛍光・燐光)を利用して発光する素子である。
有機EL素子の特徴は、10V程度の低電圧で100〜100000cd/m2程度の高輝度の面発光が可能であり、また蛍光物質の種類を選択することにより青色から赤色までの発光が可能なことである。
一方、有機EL素子の問題点は、発光寿命が短く、保存耐久性、信頼性が低いことであり、この原因としては、
▲1▼ 有機化合物の物理的変化
(結晶ドメインの成長などにより界面の不均一化が生じ、素子の電荷注入能の劣化・短絡・絶縁破壊の原因となる。特に分子量500以下の低分子化合物を用いると結晶粒の出現・成長が起こり、膜性が著しく低下する。また、ITO等の界面が荒れていても、顕著な結晶粒の出現・成長が起こり、発光効率の低下や、電流のリークを起こし、発光しなくなる。また、部分的非発光部であるダークスポットの原因にもなる。)
▲2▼ 陰極の酸化・剥離
(電子の注入を容易にするために仕事関数の小さな金属としてNa・Mg・Li・Ca・K・Alなどを用いてきたが、これらの金属は大気中の水分や酸素と反応したり、有機層と陰極の剥離が起こり、電荷注入ができなくなる。特に高分子化合物などを用い、スピンコートなどで成膜した場合、成膜時の残留溶媒や分解物が電極の酸化反応を促進し、電極の剥離が起こり部分的な非発光部を生じさせる。)
▲3▼ 発光効率が低く、発熱量が多いこと
(有機化合物中に電流を流すので、高い電界強度下に有機化合物を置かねばならず、発熱からは逃れられない。その熱のため、有機化合物の溶融・結晶化・熱分解などにより素子の劣化・破壊が起こる。)
▲4▼有機化合物層の光化学的変化・電気化学的変化
などが挙げられる。
有機EL素子用の蛍光性物質としてクマリン化合物が提案されている(特開昭63−264692号、特開平2−191694号、特開平3−792号、特開平5−202356号、特開平6−9952号、特開平6−240243号等)。クマリン化合物は、このもののみで発光層に用いられたり、トリス(8−キノリノラト)アルミニウムのようなホスト化合物とともに、ゲスト化合物あるいはドーパントとして発光層に用いられている。このような有機EL素子において発光層と組み合わせられる正孔注入層や正孔輸送層あるいは正孔注入輸送層には、N,N’−ジフェニル−N,N’−ビス(3−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミンのように、1,1’−ビフェニル−4,4−ジアミン骨格を有し、ジアミンの2個の窒素原子にフェニル基または置換フェニル基を有するようなテトラフェニルジアミン誘導体が用いられている。しかし、このような有機EL素子では発光寿命および耐熱性などの信頼性が十分でなく、ホスト化合物に用いられている場合は高輝度な素子は得られていない。
一方、有機EL素子の多色発光化に対応するものとして、積層型白色発光有機EL素子が提案されている[佐藤佳晴、信学技報、OME94−78(1995−03)]。この場合の発光層は、亜鉛のオキサゾール錯体を用いた青色発光層、トリス(8−キノリノラト)アルミニウムを用いた緑色発光層およびトリス(8−キノリノラト)アルミニウムに赤色の蛍光色素(P−660、DCM1)をドープした赤色発光層を積層したものである。
このように、赤色発光層には発光種をドーピングすることで、赤色発光を可能にしている。他の層にはドーピングは行われていない。緑色発光層・青色発光層はホスト材料のみで発光するように選ばれているが、ここで材料選定および発光色の調整自由度が大きく制限されることになる。
一般に、有機EL素子の発光色を変えるのに発光種の微量添加、すなわちドーピングが行われる。メリットとして、ドーピングの種類を変えることで容易に発光種を変えることが可能なためである。したがって、多色発光の方法としては、数種類の発光種をドーピングすることで原理的には可能であるが、単一のホストの中にそれら全ての発光種を一様にドーピングすると、ドーピングした発光種の内、一種類しか発光しない場合や、何種類かが発光しない場合がある。要するに、一つのホストに全てを混合してドーピングしても全てが発光することは困難である。これは特定の発光種にのみエネルギーが移動してしまうためである。
このような理由で、現在までには2種以上の発光種をドーピングにより安定に発光させた例はなかった。
ところで、一般に有機EL素子の輝度半減寿命は発光輝度とトレードオフの関係にある。トリス(8−キノリノラト)アルミニウムまたはN,N’−ジフェニル−N,N’−ビス(3−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミンにルブレンをドーピングすることで長寿命化が図られ、初期輝度500cd/m2程度、輝度半減寿命3500時間程度のレベルのものが得られることが報告されている[筒井哲夫、応用物理 第66巻 第2号(1997)]。しかし、このものは発光色が黄色(560nm付近)に限られている。また更なる長寿命化が望まれている。
発明の開示
本発明の目的は、特に物理的変化や光化学的変化、電気化学的変化の少ない光・電子機能材料を用い、信頼性および発光効率の高い種々の発光色を持った有機EL素子を実現することである。特に、分子量の大きな化合物を蒸着法で形成した有機薄膜を用い、素子の駆動時の駆動電圧上昇や輝度の低下、電流のリーク、部分的な非発光部の出現・成長を抑えた高信頼性かつ、高輝度発光素子を実現することである。さらには多色発光への対応が可能であり、発光スペクトルの調整が可能である有機EL素子を提供することであり、これに加えて高輝度で長寿命の有機EL素子を提供することである。
このような目的は、下記(1)〜(7)の本発明により達成される。
(1) 正孔注入輸送性化合物と電子注入輸送性化合物とを含有する混合層に、さらに下記式(I)で示されるクマリン誘導体、下記式(III)で示されるキナクリドン化合物または下記式(IV)で示されるスチリル系アミン化合物をドーパントとしてドープした発光層を有する有機EL素子。
[式(I)中、R1、R2およびR3は各々水素原子、シアノ基、カルボキシル基、アルキル基、アリール基、アシル基、エステル基または複素環基を表し、これらは同一でも異なるものであってもよく、R1〜R3は各々互いに結合して環を形成してもよい。R4およびR7は各々水素原子、アルキル基またはアリール基を表し、R5およびR6は各々アルキル基またはアリール基を表し、R4とR5、R5とR6およびR6とR7は各々互いに結合して環を形成してもよい。]
[式(III)中、R21およびR22は各々水素原子、アルキル基またはアリール基を表し、これらは同一でも異なるものであってもよい。R23およびR24は各々アルキル基またはアリール基を表し、tおよびuは各々0または1〜4の整数である。tまたはuが2以上であるとき、隣接するR23同士またはR24同士は互いに結合して環を形成してもよい。]
[式(IV)中、R31は水素原子またはアリール基を表す。R32およびR33は水素原子、アリール基またはアルケニル基を表し、これらは同一でも異なるものであってもよい。R34はアリールアミノ基またはアリールアミノアリール基を表し、vは0または1〜5の整数である。]
(2) 前記正孔注入輸送性化合物が芳香族三級アミンであり、前記電子注入輸送性化合物がキノリノナト金属錯体である(1)の有機EL素子。
(3) 2層以上の発光層を有し、この2層以上の発光層の発光特性が互いに異なる(1)または(2)の有機EL素子。
(4) 前記芳香族三級アミンが、下記式(II)で示されるテトラアリールジアミン誘導体である(2)または(3)の有機EL素子。
[式(II)中、Ar1、Ar2、Ar3およびAr4は各々アリール基を表し、Ar1〜Ar4のうちの少なくとも1個は、2個以上のベンゼン環を有する縮合環または環集合から誘導される多環のアリール基である。R11およびR12は各々アルキル基を表し、pおよびqは各々0または1〜4の整数である。R13およびR14は各々アリール基を表し、rおよびsは各々0または1〜5の整数である。]
(5) 前記発光層が、少なくとも1層の正孔注入性および/または正孔輸送性の層と少なくとも1層の電子注入性および/または電子輸送性の層とで挟持される(1)〜(4)のいずれかの有機EL素子。
(6) 前記正孔注入性および/または輸送性の層に、さらにルブレンがドーパントとしてドープされた(5)の有機EL素子。
(7) 光の取り出し側にカラーフィルターおよび/または蛍光変換フィルターを配置し、カラーフィルターおよび/または蛍光変換フィルターを通して光を取り出すように構成した(1)〜(6)のいずれかの有機EL素子。
本発明の有機EL素子は、正孔注入輸送性化合物と電子注入輸送性化合物との混合層に式(I)のクマリン誘導体、式(II)のキナクリドン化合物、式(III)のスチリル系アミン化合物をドープして発光層としているため、100000cd/m2程度、あるいはそれ以上の高輝度が安定して得られる。また、式(I)のクマリン誘導体に対し、耐久性が高いホスト材料を選ぶことで、素子電流密度30mA/cm2程度でも長時間の安定した駆動が可能である。
上記化合物の蒸着膜はいずれも安定なアモルファス状態なので、薄膜性が良好となりムラがなく均一な発光が可能である。また、大気下で一年以上安定であり結晶化を起こさない。
また、本発明の有機EL素子は、低駆動電圧・低駆動電流で効率よく発光する。なお、本発明の有機EL素子の発光極大波長は、480〜640nm程度である。例えば特開平6−240243号には、ホスト物質にトリス(8−キノリノラト)アルミニウムを用い、本発明の式(I)で示されるクマリン誘導体に包含される化合物をゲスト物質に用いた発光層を有する有機EL素子が開示されている。しかし、正孔輸送層に用いられているのは、N,N’−ジフェニル−N,N’−ビス(3−メチルフェニル)−1,1’−ビフェニル−4,4’−ジアミンであり、本発明の式(II)で示される化合物とは異なるものである。また、混合層タイプの発光層に式(I)のクマリン誘導体、式(II)のキナクリドン化合物あるいは式(III)のスチリル系アミン化合物をドープした例は知られていない。
さらに、本発明では、各発光層のキャリア輸送能を変化させ2種以上の発光を可能にするため、発光層を2層以上とし、これらの発光層のうち少なくとも1層をバイポーラ型、好ましくは混合層タイプのものとし、バイポーラ型発光層同士、好ましくは混合層同士、あるいはバイポーラ型発光層、好ましくは混合層と、このバイポーラ型発光層、好ましくは混合層より陽極側に設けられた正孔輸送性の発光層および/または陰極側に設けられた電子輸送性の発光層との組合せとし、さらに好ましくは発光層に各々ドーパントをドープしている。
このなかで、特に好ましい態様である混合層を設けドーピングする場合について考えると、混合層を設けてドーピングすることによって、再結合領域が混合層全域および混合層と正孔輸送性の発光層の界面近傍ないし混合層と電子輸送性の発光層の界面近傍に広がり、励起子が生成され、各発光層のそれぞれのホストから、最も近い発光種にエネルギー移動し、2種以上の発光種(ドーパント)の発光が可能になる。また、混合層とする場合、正孔(ホール)および電子の注入に対して安定な化合物を選択することで、混合層自体の電子耐性・ホール耐性を飛躍的に向上させることができる。これに対し、バイポーラ型発光層である混合層なしで、正孔輸送性の発光層と電子輸送性の発光層とを組み合わせても2種以上の発光種の発光は可能になるが、発光層等のコントロールが難しく、2種の強度比率等がすぐに変化したり、ホールおよび電子の両方に対する耐性が低いので、寿命が短く実用に耐えない。また、発光層のホスト材料の組合せ、バイポーラ型発光層である混合層におけるホスト材料の組合せや量比、あるいは膜厚比などを調整することによって電子および正孔のキャリア供給能を調整することが可能になる。このため、発光スペクトルの調整が可能になる。したがって多色発光型の有機EL素子への対応が可能になる。さらにはルブレン等のナフタセン骨格を有する化合物をドープした発光層(特に混合層)を設けることによってルブレン等のドープ層のキャリアトラップ層としての機能などにより、隣接層(例えば電子輸送層や正孔輸送層)へのキャリア注入が減り、これらの層の劣化が抑制されるため、高輝度(1000cd/m2程度)で長寿命(輝度の半減期50000時間程度)となる。また、発光スペクトルの発光極大波長が長波長域にある発光層を陽極側に設けることによって、光学的干渉効果が利用でき、各々の発光の光取り出し効果が向上し、高輝度化が可能になる。
なお、信学技報、OME94−78(1995−03)には、白色発光の有機EL素子が提案されているが、本発明と異なり、バイポーラ型発光層、特に混合層を含む2層以上の発光層に各々ドーピングすることについては全く示されていない。
【図面の簡単な説明】
第1図は本発明の有機EL素子の一例を示す概略構成図であり、第2図は有機EL素子の発光スペクトルを示すグラフであり、第3図は有機EL素子の発光スペクトルを示すグラフであり、第4図は有機EL素子の発光スペクトルを示すグラフであり、第5図は有機EL素子の発光スペクトルを示すグラフであり、第6図は有機EL素子の発光スペクトルを示すグラフであり、第7図は有機EL素子の発光スペクトルを示すグラフであり、第8図は有機EL素子の発光スペクトルを示すグラフであり、第9図は有機EL素子の発光スペクトルを示すグラフであり、第10図は有機EL素子の発光スペクトルを示すグラフであり、第11図は有機EL素子の発光スペクトルを示すグラフであり、第12図は有機EL素子の発光スペクトルを示すグラフであり、第13図は有機EL素子の発光スペクトルを示すグラフであり、第14図は有機EL素子の発光スペクトルを示すグラフである。
発明を実施するための最良の形態
以下、本発明の実施の形態について詳細に説明する。
本発明の有機EL素子は、式(I)で示されるクマリン誘導体を含有する発光層と式(II)で示されるテトラアリールジアミン誘導体を含有する正孔注入性および/または輸送性の層とを有するものである。
式(I)について説明すると、式(I)中、R1〜R3は各々水素原子、シアノ基、カルボキシル基、アルキル基、アリール基、アシル基、エステル基または複素環基を表し、これらは同一でも異なるものであってもよい。
R1〜R3で表されるアルキル基としては、炭素数1〜5のものが好ましく、直鎖状であっても分岐を有するものであってもよく、置換基(ハロゲン原子等)を有していてもよい。アルキル基の具体例としては、メチル基、エチル機、(n−,i−)プロピル基、(n−,i−,s−,t−)ブチル基、n−ペンチル基、イソペンチル基、t−ペンチル基、トリフルオロメチル基等が挙げられる。
R1〜R3で表されるアリール基としては、単環のものが好ましく、炭素数は6〜24であることが好ましく、置換基(ハロゲン原子、アルキル基等)を有していてもよい。具体的にはフェニル基等が挙げられる。
R1〜R3で表されるアシル基としては、炭素数は2〜10のものが好ましく、具体的にはアセチル基、プロピオニル基、ブチリル基等が挙げられる。
R1〜R3で表されるエステル基としては、炭素数2〜10のものが好ましく、具体的にはメトキシカルボニル基、エトキシカルボニル基、ブトキシカルボニル基等が挙げられる。
R1〜R3で表される複素環基としては、ヘテロ原子として窒素原子(N)、酸素原子(O)、硫黄原子(S)を有するものが好ましく、ベンゼン環あるいはナフタレン環に縮合した5員複素環から誘導される基が好ましい。また縮合環としてベンゼン環を有する含窒素6員複素環から誘導される基も好ましい。具体的には、好ましくはそれぞれ2−イルの、ベンゾチアゾリル基、ベンゾオキサゾリル基、ベンゾイミダゾリル基、ナフトチアゾリル基や、2−ピリジル基、3−ピリジル基、4−ピリジル基、2−ピラジニル基、2−キノリル基、7−キノリル基等であり、これらは置換基を有するものであってもよく、このときの置換機としてはアルキル基、アリール基、アルコキシ基、アリーロキシ基等が挙げられる。
以下に、R1〜R3で表される複素環基の好適例を示す。
式(I)中、R1〜R3は各々互いに結合して環を形成してもよく、形成される環としてはシクロペンテン等の炭素環が挙げられる。
R1〜R3は同時に水素原子とはならないことが好ましく、特にR1が上記のような複素環基であるものが好ましい。
式(I)中、R4およびR7は各々水素原子、アルキル基(メチル基等)またはアリール基(フェニル基、ナフチル基等)を表す。R5およびR6は各々アルキル基またはアリール基を表し、これらは同一でも異なるものであってもよいが、通常同一であり、特にはアルキル基が好ましい。
R4〜R7で表されるアルキル基としてはR1〜R3のところのものと同じものを挙げることができる。
R4とR5、R5とR6およびR6とR7は各々互いに結合して環を形成してもよく、特にR4とR5、R6とR7が各々互いに結合して炭素原子(C)、窒素原子(N)とともに6員環を同時に形成することが好ましい。このようにして一部水素化したキノリジン環を形成する場合の構造式としては下記式(Ia)で示されるものが好ましい。特に、クマリン化合物同士の相互作用による蛍光濃度消光を防止し蛍光量子収率が向上する。
式(Ia)中、R1〜R3は式(I)におけるものと同義のものである。R41、R42、R71およびR72は水素原子またはアルキル基を表し、このときのアルキル基としてはR1〜R3のところのものと同じものを挙げることができる。
以下に式(I)に示されるクマリン誘導体の具体例を挙げるが、本発明はこれらに限定されるものではない。以下では式(I)、式(Ia)中のR1等の組合せで表示する。なお、以下において、Phはフェニル基を表わす。
これらの化合物は特開平6−9952号、Ger.Offen.1098125号等に記載の方法で合成することができる。
式(I)のクマリン誘導体は1種のみを用いても2種以上を併用してもよい。
次に、正孔注入性および/または輸送性の層に用いられる式(II)のテトラアリールジアミン誘導体について説明する。
式(II)中、Ar1、Ar2、Ar3およびAr4は各々アリール基を表し、Ar1〜Ar4のうちの少なくとも1個は2個以上のベンゼン環を有する縮合環または環集合から誘導される多環のアリール基である。
Ar1〜Ar4で表されるアリール基としては、置換基を有していてもよく、総炭素数6〜24のものが好ましい。単環のアリール基としては、フェニル基、トリル基等が挙げられ、多環のアリール基としては、2−ビフェニリル基、3−ビフェニリル基、4−ビフェニリル基、1−ナフチル基、2−ナフチル基、アントリル基、フェナントリル基、ピレニル基、ペリレニル等が挙げられる。
式(II)において、Ar1、Ar2が結合して得られるアミノ基部分とAr3、Ar4が結合して得られるアミノ基部分とは同一であることが好ましい。
式(II)中、R11およびR12は各々アルキル基を表し、pおよびqは各々0または1〜4の整数である。
R11、R12で表されるアルキル基としては式(I)のR1〜R3のところのものと同様のものを挙げることができ、メチル基等が好ましい。p、qは0または1であることが好ましい。
式(II)中、R13およびR14は各々アリール基を表し、rおよびsは各々0または1〜5の整数である。
R13、R14で表されるアリール基としては式(I)のR1〜R3のところのものと同様のものを挙げることができ、フェニル基等が好ましい。r、sは0または1であることが好ましい。
以下に式(II)で示されるテトラアリールジアミン誘導体の具体例を示すが、本発明はこれらに限定されるものではない。以下では式(IIa)中のAr1等の組合せを用いて示している。またR51〜R58、R59〜R68ではすべてのHのときはHで示し、置換基があるときは置換基のみを示している。
これらの化合物はEP0650955A1(対応特願平7−43564号)等に記載の方法で合成することができる。
これらの化合物は、1000〜2000程度の分子量をもち、融点は200〜400℃程度、ガラス転移温度は130〜200℃程度である。このため、通常の真空蒸着等により透明で室温以上でも安定なアモルファス状態を形成し、平滑で良好な膜として得られ、しかもそれが長期間に渡って維持される。また、バインダー樹脂を用いることなく、それ自体で薄膜化することができる。
式(II)のテトラアリールジアミン誘導体は1種のみを用いても2種以上を併用してもよい。
本発明の有機EL素子は、式(I)のクマリン誘導体を発光層に、また式(II)のテトラアリールジアミン誘導体を正孔注入輸送層等の正孔注入性および/または輸送性の層に用いたものである。
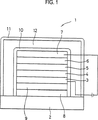
本発明の有機EL素子の構成例を図1に示す。同図に示される有機EL素子1は、基板2上に、陽極3、正孔注入輸送層4、発光層5、電子注入輸送層6、陰極7を順次有し、基板2側から発光光を取り出すものである。そして、基板2と陽極3との間には、発光色をコントロールするために、基板2側からカラーフィルター膜8および蛍光変換フィルター膜9が設けられている。さらに、有機EL素子1には、これらの各層4〜6、8、9および電極3、7を覆う封止層10が設けられており、これら全体がガラス基板2と一体化されたケーシング11中に配置されている。また、封止層10とケーシング11との間には気体あるいは液体12が充填されている。封止層10はテフロン等の樹脂で形成されており、ケーシング11の材質はガラスやアルミニウム等とすればよく、光硬化性樹脂接着剤等で基板2等と接合することができる。気体あるいは液体12としては乾燥空気、N2、Arなどの不活性気体、フロン系化合物などの不活性液体や吸湿剤等が用いられる。
発光層は、正孔(ホール)および電子の注入機能、それらの輸送機能、正孔と電子の再結合により励起子を生成させる機能を有する。発光層にはバイポール(電子およびホール)に安定な化合物で、かつ蛍光強度の強い化合物を用いることが好ましい。正孔注入輸送層は、陽極からの正孔の注入を容易にする機能、正孔を安定に輸送する機能および電子の輸送を低下させる機能を有し、電子注入輸送層は、陰極からの電子の注入を容易にする機能、電子を安定に輸送する機能をよび正孔の輸送を低下させる機能を有するものであり、これらの層は、発光層へ注入される正孔や電子を閉じ込めさせて正孔や電子の密度を増大させて再結合確立を向上させ、再結合領域を最適化させ、発光効率を改善する。正孔注入輸送層および電子注入輸送層は、発光層に用いる化合物の正孔注入、正孔輸送、電子注入、電子輸送の各機能の高さを考慮し、必要に応じて設けられる。例えば、発光層に用いる化合物の正孔注入輸送機能または電子注入輸送機能が高い場合には、正孔注入輸送層または電子注入輸送層を設けずに、発光層が正孔注入輸送層または電子注入輸送層を兼ねる構成とすることができる。また、場合によっては正孔注入輸送層および電子注入輸送層のいずれも設けなくてよい。また、正孔注入輸送層および電子注入輸送層は、それぞれにおいて、注入機能を持つ層と輸送機能を持つ層とに別個に設けてもよい。
発光層の厚さ、正孔注入輸送層の厚さおよび電子注入輸送層の厚さは特に限定されず、形成方法によっても異なるが、通常、5〜1000nm程度、特に10〜200nmとすることが好ましい。
正孔注入輸送層の厚さおよび電子注入輸送層の厚さは、再結合・発光領域の設計によるが、発光層の厚さと同程度もしくは1/10〜10倍程度とすればよい。電子もしくは正孔の、各々の注入層と輸送層を分ける場合は、注入層は1nm以上、輸送層は20nm以上とするのが好ましい。このときの注入層、輸送層の厚さの上限は、通常、注入層で1000nm程度、輸送層で100nm程度である。このような膜厚については注入輸送層を2層設けるときも同じである。
また、組み合わせる発光層や電子注入輸送層や正孔注入輸送層のキャリア移動度やキャリア密度(イオン化ポテンシャル・電子親和力により決まる)を考慮し、膜厚をコントロールすることで、再結合領域・発光領域を自由に設計することが可能であり、発光色の設計や、両電極の光の干渉効果による発光輝度・発光スペクトルの制御や、発光の空間分布の制御を可能にでき、所望の色純度や素子や高効率な素子を得ることができる。
式(I)のクマリン誘導体は、高い蛍光強度をもつ化合物なので発光層に用いることが好ましい化合物であり、発光層におけるその含有量は0.01wt%以上、さらには1.0wt%以上であることが好ましい。
本発明において、発光層には式(I)のクマリン誘導体のほかの蛍光物質を用いることができ、こうした蛍光物質としては、例えば、特開昭63−264692号公報に開示されているような化合物、例えばキナクリドン、ルブレン、スチリル系色素等の化合物から選択される少なくとも1種が挙げられる。また、トリス(8−キノリノラト)アルミニウム等の8−キノリノールないしその誘導体を配位子とする金属錯体色素などのキノリン誘導体、テトラフェニルブタジエン、アントラセン、ペリレン、コロネン、12−フタロペリノン誘導体等が挙げられる。さらには、特開平8−12600号のフェニルアントラセン誘導体、特開平8−12969号のテトラアリールエテン誘導体等も挙げられる。
特に、式(I)のクマリン誘導体はホスト材料、特にそれ自体で発光が可能なホスト材料と組み合わせて使用することが好ましく、ドーパントとしての使用が好ましい。このような場合の発光層におけるクマリン誘導体の含有量は0.01〜10wt%、さらには0.1〜5wt%であることが好ましい。ホスト材料と組み合わせて使用することによって、ホスト材料の発光波長特性を変化させることができ、長波長に移行した発光が可能になるとともに、素子の発光効率や安定性が向上する。
実際には、要求される輝度・寿命・駆動電圧によりドープ濃度を決めればよく、1wt%以上では、高輝度な素子が得られ、1.5wt%以上6wt%以下では高輝度でかつ駆動電圧上昇が小さく、発光寿命の長い素子が得られる。
式(I)のクマリン誘導体をドープするホスト材料としては、キノリン誘導体が好ましく、さらには8−キノリノールないしその誘導体を配位子とするキノリノナト金属錯体、特にアルミニウム錯体が好ましい。このときの8−キノリノールの誘導体は、8−キノリノールにハロゲン原子やアルキル基等が置換したもの、ベンゼン環が縮合したものなどである。このようなアルミニウム錯体としては、特開昭63−264692号、特開平3−255190号、特開平5−70733号、特開平5−258859号、特開平6−215874号等に開示されているものを挙げることができる。これらの化合物は電子輸送性のホスト材料である。
具体的には、まず、トリス(8−キノリノラト)アルミニウム、ビス(8−キノリノラト)マグネシウム、ビス(ベンゾ{f}−8−キノリノラト)亜鉛、ビス(2−メチル−8−キノリノラト)アルミニウムオキシド、トリス(8−キノリノラト)インジウム、トリス(5−メチル−8−キノリノラト)アルミニウム、8−キノリノラトリチウム、トリス(5−クロロ−8−キノリノラト)ガリウム、ビス(5−クロロ−8−キノリノラト)カルシウム、5,7−ジクロル−8−キノリノラトアルミニウム、トリス(5,7−ジブロモ−8−ヒドロキシキノリノラト)アルミニウム、ポリ[亜鉛(II)−ビス(8−ヒドロキシ−5−キノリニル)メタン]、等がある。
また、8−キノリノールないしその誘導体のほかに他の配位子を有するアルミニウム錯体であってもよく、このようなものとしては、ビス(2−メチル−8−キノリノラト)(フェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(オルト−クレゾラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(メタークレゾラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(パラ−クレゾラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(オルト−フェニルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(メタ−フェニルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(パラ−フェニルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,3−ジメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,6−ジメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(3,4−ジメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(3,5−ジメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(3,5−ジ−tert−ブチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,6−ジフェニルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,4,6−トリフェニルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,3,6−トリメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2,3,5,6−テトラメチルフェノラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(1−ナフトラト)アルミニウム(III)、ビス(2−メチル−8−キノリノラト)(2−ナフトラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)(オルト−フェニルフェノラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)(パラ−フェニルフェノラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)(メタ−フェニルフェノラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)(3,5−ジメチルフェノラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)(3,5−ジ−tert−ブチルフェノラト)アルミニウム(III)、ビス(2−メチル−4−エチル−8−キノリノラト)(パラ−クレゾラト)アルミニウム(III)、ビス(2−メチル−4−メトキシ−8−キノリノラト)(パラ−フェニルフェノラト)アルミニウム(III)、ビス(2−メチル−5−シアノ−8−キノリノラト)(オルト−クレゾラト)アルミニウム(III)、ビス(2−メチル−6−トリフルオロメチル−8−キノリノラト)(2−ナフトラト)アルミニウム(III)等がある。
このほか、ビス(2−メチル−8−キノリノラト)アルミニウム(III)−μ−オキソ−ビス(2−メチル−8−キノリノラト)アルミニウム(III)、ビス(2,4−ジメチル−8−キノリノラト)アルミニウム(III)−μ−オキソ−ビス(2,4−ジメチル−8−キノリノラト)アルミニウム(III)、ビス(4−エチル−2−メチル−8−キノリノラト)アルミニウム(III)−μ−オキソ−ビス(4−エチル−2−メチル−8−キノリノラト)アルミニウム(III)、ビス(2−メチル−4−メトキシキノリノラト)アルミニウム(III)−μ−オキソ−ビス(2−メチル−4−メトキシキノリノラト)アルミニウム(III)、ビス(5−シアノ−2−メチル−8−キノリノラト)アルミニウム(III)−μ−オキソ−ビス(5−シアノ−2−メチル−8−キノリノラト)アルミニウム(III)、ビス(2−メチル−5−トリフルオロメチル−8−キノリノラト)アルミニウム(III)−μ−オキソ−ビス(2−メチル−5−トリフルオロメチル−8−キノリノラト)アルミニウム(III)等であってもよい。
これらのなかでも、本発明では、特にトリス(8−キノリノラト)アルミニウムを用いることが好ましい。
このほかのホスト材料としては、特開平8−12600号に記載のフェニルアントラセン誘導体や特開平8−12969号に記載のテトラアリールエテン誘導体なども好ましい。
フェニルアントラセン誘導体は、下記式(V)で表されるものである。
式(V)
A1−L1−A2 (V)
式(V)において、A1およびA2は、各々モノフェニルアントリル基またはジフェニルアントリル基を表し、これらは同一でも異なるものであってもよい。
A1、A2で表されるモノフェニルアントリル基またはジフェニルアントリル基は、無置換でも置換基を有するものであってもよく、置換基を有する場合の置換基としては、アルキル基、アリール基、アルコキシ基、アリーロキシ基、アミノ基等が挙げられ、これらの置換基はさらに置換されていてもよい。また、このような置換基の置換位置は特に限定されないが、アントラセン環ではなく、アントラセン環に結合したフェニル基であることが好ましい。また、アントラセン環におけるフェニル基の結合位置はアントラセン環の9位、10位であることが好ましい。
式(V)において、L1は単結合またはアリーレン基を表す。L1で表されるアリーレン基としては、無置換であることが好ましく、具体的にはフェニレン基、ビフェニレン基、アントリレン基等の通常のアリーレン基の他、2個ないしそれ以上のアリーレン基が直接連結したものが挙げられる。L1としては、単結合、p−フェニレン基、4,4′−ビフェニレン基等が好ましい。
また、L1で表されるアリーレン基は、2個ないしそれ以上のアリーレン基がアルキレン基、−O−、−S−または−NR−が介在して連結するものであってもよい。ここで、Rはアルキル基またはアリール基を表す。アルキル基としてはメチル基、エチル基等が挙げられ、アリール基としてはフェニル基等が挙げられる。なかでも、アリール基が好ましく、上記のフェニル基のほか、A1、A2であってもよく、さらにはフェニル基にA1またはA2が置換したものであってもよい。また、アルキレン基としてはメチレン基、エチレン基等が好ましい。
また、テトラアリールエテン誘導体は下記式(VI)で表されるものである。
式(VI)において、Ar1、Ar2およびAr3は、各々芳香族残基を表し、これらは同一でも異なるものであってもよい。
Ar1〜Ar3で表される芳香族残基としては、芳香族炭化水素基(アリール基)、芳香族複素環基が挙げられる。芳香族炭化水素基としては、単環もしくは多環の芳香族炭化水素基であってよく、縮合環や環集合も含まれる。芳香族炭化水素基は、総炭素数が6〜30のものが好ましく、置換基を有するものであってもよい。置換基を有する場合の置換基としては、アルキル基、アリール基、アルコキシ基、アリーロキシ基、アミノ基等が挙げられる。芳香族炭化水素基としては、例えばフェニル基、アルキルフェニル基、アルコキシフェニル基、アリールフェニル基、アリーロキシフェニル基、アミノフェニル基、ビフェニル基、ナフチル基、アントリル基、ピレニル基、ペリレニル基などが挙げられる。
また、芳香族複素環基としては、ヘテロ原子としてO、N、Sを含むものが好ましく、5員環であっても6員環であってもい。具体的には、チエニル基、フリル基、ピローリル基、ピリジル基などが挙げられる。
Ar1〜Ar3で表される芳香族基としては、特にフェニル基が好ましい。
nは2〜6の整数であり、特に2〜4の整数であることが好ましい。
L2はn価の芳香族残基を表すが、特に芳香族炭化水素、芳香族複素環、芳香族エーテルまたは芳香族アミンから誘導される2〜6価、特に2〜4価の残基であることが好ましい。これらの芳香族残基は、さらに置換基を有するものであってもよいが、無置換のものが好ましい。
式(V)、(VI)の化合物は基の組合せ等によって電子輸送性あるいは正孔輸送性のホスト材料となりうる。
式(I)のクマリン誘導体を用いる発光層としては、上記のホスト材料と組み合わせるものとする他、少なくとも一種以上の正孔注入輸送性化合物と少なくとも1種以上の電子注入輸送性化合物との混合層とすることも好ましく、この混合層中に式(I)の化合物をドーパントとして含有させることが好ましい。このような混合層における式(I)のクマリン誘導体の含有量は、0.01〜20wt%、さらには0.1〜15wt%とすることが好ましい。
混合層では、両キャリアのホッピング伝導パスができるため、各キャリアは極性的に優勢な物質中を移動し、逆の極性のキャリア注入は起こりにくくなるので、混合する各化合物をキャリアに対して安定な化合物とすることで、有機化合物がダメージを受けにくくなり、素子寿命がのびるという利点があるが、式(I)のクマリン誘導体をこのような混合層に含有させることにより、キャリアに対して安定なまま混合層自体のもつ発光波長を変化させることができ、発光波長を主に長波長に移行させることができるとともに、発光強度を高め、かつ素子の安定性が向上する。
混合層に用いられる正孔注入輸送性化合物および電子注入輸送性化合物は、各々、後記の正孔注入輸送層等用の化合物および電子注入輸送層等用の化合物の中から選択すればよい。なかでも、正孔注入輸送性化合物としては芳香族三級アミンを用いることが好ましく、具体的には式(II)のテトラアリールジアミン誘導体、N,N’−ビス(−3−メチルフェニル)−N,N’−ジフェニル−4,4’−ジアミノビフェニル、N,N’−ビス(−3−ビフェニル)−N,N’−ジフェニル−4,4’−ジアミノビフェニル、N,N’−ビス(−4−t−ブチルフェニル)−N,N’−ジフェニル−1,1’−ビフェニル−4,4’−ジアミン、N,N,N’,N’−テトラキス(−3−ビフェニル)−1,1’−ビフェニル−4,4’−ジアミン、N,N’−ジフェニル−N,N’−ビス−(−4’−(N−3(メチルフェニル)−N−フェニル)アミノビフェニル−4−イル)ベンジジンなど、特開昭63−295695号、特開平5−234681号、EP0650955A1(対応特願平7−43564号)等に記載の化合物が挙げられ、なかでも式(II)のテトラアリールジアミン誘導体が好ましい。また、電子注入輸送性化合物としては、キノリン誘導体、さらには8−キノリノールないしその誘導体を配位子とする金属錯体、特にトリス(8−キノリノラト)アルミニウムを用いることが好ましい。
この場合の混合比は、キャリア密度、キャリア移動度により混合比を決めることが好ましい。正孔注入輸送性化合物/電子注入輸送性化合物の重量比が、1/99〜99/1、さらには20/80〜80/20、特には30/70〜70/30程度となるようにすることが好ましい。ただし、素子における材料の組合せによってはこの制限は受けない。
ここで、正孔注入輸送性化合物とは、1μm程度のこの化合物の単層膜を陰極と陽極の間に設けた単層膜素子を用い、正孔(ホール)と電子の電流密度を測定したとき、正孔の電流密度が電子の電流密度に比べ2倍を超えるもの、好ましくは6倍以上、より好ましくは10倍以上になるものである。一方電子注入輸送性化合物とは、同様に構成した単層膜素子を用いて正孔(ホール)と電子の電流密度を測定したとき、電子の電流密度が正孔の電流密度に比べ2倍を超えるもの、好ましくは6倍以上、より好ましくは10倍以上になるものである。なお、上記で用いる陰極および陽極は、実際に用いるものと同一のものである。
また、混合層の厚さは、分子層一層に相当する厚みから、有機化合物層の膜厚未満とすることが好ましく、具体的には1〜85nmとすることが好ましく、さらには5〜60nm、特には5〜50nmとすることが好ましい。
なお、上記のような混合層においては、式(I)のクマリン誘導体のほか、式(III)のキナクリドン化合物または式(IV)のスチリル系アミン化合物をドーパントとして用いることができる。この場合のドープ量は式(I)のクマリン誘導体と同様である。
式(III)について説明すると、式(III)中、R21およびR22は水素原子、アルキル基またはアリール基を表し、これらは同一でも異なるものであってもよい。R21、R22で表されるアルキル基としては、炭素数1〜5のものが好ましく、置換基を有していてもよい。具体的には、メチル基、エチル基、プロピル基、ブチル基等が挙げられる。
R21、R22で表されるアリール基としては、置換基を有していてもよく、総炭素数1〜30のものが好ましく、具体的にはフェニル基、トリル基、ジフェニルアミノフェニル基等が挙げられる。
R23、R24は各々アルキル基またはアリール基を表し、これらの具体例としては、R21、R22のところのものと同様のものを挙げることができる。tおよびuは各々0または1〜4の整数であり、0であることが好ましい。t,uが2以上であるとき、隣接するR23同士、R24同士は互いに結合して環を形成してもよく、このような環としてはベンゼン環、ナフタレン環等の炭素環が挙げられる。
式(III)のキナクリドン化合物の具体例を以下に示す。具体例は下記式(IIIa)のR21等の組合せで示している。また、両端の縮合ベンゼン環には1−位〜5−位の位置を示し、これらにさらに縮合ベンゼン環がつく場合の位置がわかるようにされている。
これらの化合物は公知の方法、例えば米国特許第2821529号、同第2821530号、同第2844484号、同第2844485号等によって合成でき、市販品を用いることもできる。
式(IV)について説明すると、式(IV)中、R31は水素原子またはアリール基を表す。R31で表されるアリール基としては置換基を有するものであってもよく、総炭素数6〜30のものが好ましく、例えばフェニル基等が挙げれられる。
R32およびR33は各々水素原子、アリール基またはアルケニル基を表し、これらは同一でも異なるものであってもよい。
R32、R33で表されるアリール基としては置換基を有するものであってもよく、総炭素数6〜70のものが好ましい。具体的にはフェニル基、ナフチル基、アントリル基等が挙げられ、置換基としてはアリールアミノ基、アリールアミノアリール基等が好ましい。また置換基にはスチリル基が含まれることも好ましく、このような場合式(IV)で示される化合物から誘導される一価の基同士が、それ自体でまたは連結基を介して結合したような構造であることも好ましい。
R32、R34で表されるアルケニル基としては置換基を有するものであってもよく、総炭素数2〜50のものが好ましく、ビニル基等が挙げられ、ビニル基とともにスチリル基を形成していることが好ましく、このような場合、式(IV)で示される化合物から誘導される一価の基同士が、それ自体でまたは連結基を介して結合したような構造であることも好ましい。
R34はアリールアミノ基またはアリールアミノアリール基を表し、これらにはスチリル基を含んでいてもよく、このような場合、上記の同じく、式(IV)で示される化合物から誘導される一価の基同士がそれ自体でまたは連結基を介して結合したような構造であることも好ましい。
式(IV)のスチリル系アミン化合物の具体例を以下に示す。
これらの化合物は公知の方法、例えばトリフェニルアミン誘導体をWittig反応させる、あるいはNi(O)錯体を用いてハロゲン化トリフェニルアミン誘導体を(ホモ・ヘテロ)カップリングさせることによって合成でき、市販品を用いることもできる。
なお、混合層におけるドーパントは、1種のみを用いても、2種以上を併用してもよい。
混合層の形成方法としては、異なる蒸着源より蒸発させる共蒸着が好ましいが、蒸気圧(蒸発温度)が同程度あるいは非常に近い場合には、予め同じ蒸着ボード内で混合させておき、蒸着することもできる。混合層は化合物同士が均一に混合している方が好ましいが、場合によっては、化合物が島状に存在するものであってもよい。発光層は、一般的には、有機蛍光物質を蒸着するか、あるいは溶液として直接スピンコート等するか、あるいは樹脂バインダー中に分散させてコーティングすることにより、発光層を所定の厚さに形成する。
本発明では、少なくとも1層の正孔注入性および/または輸送性の層、すなわち正孔注入輸送層、正孔注入層、正孔輸送層のうちの少なくとも1層を設け、特に発光層が混合層タイプでない場合、少なくとも1層に式(II)のテトラアリールジアミン誘導体を含有させる。このような層中の式(II)のテトラアリールジアミン誘導体の含有量は10wt%以上であることが好ましい。また同層中あるいは別層中で式(II)のテトラアリールジアミン誘導体と併用できる正孔注入性および/または輸送性の層用の化合物としては、特開昭63−295695号公報、特開平2−191694号公報、特開平3−792号公報等に記載されている各種有機化合物、例えば芳香族三級アミン、ヒドラゾン誘導体、カルバゾール誘導体、トリアゾール誘導体、イミダゾール誘導体、アミノ基を有するオキサジアゾール誘導体、ポリチオフェン等が挙げられる。これらの化合物は2種以上を混合して用いてもよく、また積層して用いることができる。なお、混合層タイプの発光層と組み合わせる場合、必ずしも式(II)のテトラアリールジアミン誘導体に限定されず広く用いることができるが、素子の設計によっては発光層に隣接する正孔注入輸送層や正孔輸送層に、混合層に用いた正孔注入輸送性化合物を用いることが好ましいこともある。
正孔注入輸送層を正孔注入層と正孔輸送層とに分けて設置する場合は、正孔注入輸送層用の化合物のなかから好ましい組合せを選択して用いることができる。このとき、陽極(スズドープ酸化インジウム:ITO等)側からイオン化ポテンシャルの小さい化合物の層の順に積層することが好ましく、陽極に接して正孔注入層、発光層に接して正孔輸送層を設けることが好ましい。また陽極表面には薄膜性の良好な化合物を用いることが好ましい。このようなイオン化ポテンシャルと積層順の関係については、正孔注入輸送層を2層以上設けるときも同様である。このような積層順とすることによって、駆動電圧が低下し、電流リークの発生やダークスポットの発生・成長を防ぐことができる。また、素子化する場合、蒸着を用いているので1〜10nm程度の薄い膜も、均一かつピンホールフリーとすることができるため、正孔注入層にイオン化ポテンシャルが小さく、可視部に吸収をもつような化合物を用いても、発光色の色調変化や再吸収による効率の低下を防ぐことができる。
式(II)のテトラアリールジアミン誘導体は、一般に発光層側の層に用いることが好ましい。
本発明では、電子注入性および/または輸送性の層として電子注入輸送層を設けてもよい。電子注入輸送層には、トリス(8−キノリノラト)アルミニウム等の8−キノリノールなしいその誘導体を配位子とする有機金属錯体などのキノリン誘導体、オキサジアゾール誘導体、ペリレン誘導体、ピリジン誘導体、ピリミジン誘導体、キノキサリン誘導体、ジフェニルキノン誘導体、ニトロ置換フルオレン誘導体等を用いることができる。電子注入輸送層は発光層を兼ねたものであってもよく、このような場合はトリス(8−キノリノラト)アルミニウム等を使用することが好ましい。電子注入輸送層の形成は発光層と同様に蒸着等によればよい。
電子注入輸送層を電子注入層と電子輸送層とに分けて設層する場合は、電子注入輸送層用の化合物のなかから好ましい組合せを選択して用いることができる。このとき、陰極側から電子親和力の値の大きい化合物の層の順に積層することが好ましく、陰極に接して電子注入層、発光層に接して電子輸送層を設けることが好ましい。電子親和力と積層順との関係については電子注入輸送層を2層以上設けるときも同様である。
本発明では、上記の発光層や正孔注入輸送層や電子注入輸送層などのような有機化合物層に、一重項酸素クエンチャーとして知られているような化合物を含有させてもよい。このようなクエンチャーとしては、ルブレンやニッケル錯体、ジフェニルイソベンゾフラン、三級アミン等が挙げられる。
特に正孔注入輸送層、正孔注入層あるいは正孔輸送層において、式(II)のテトラアリールジアミン誘導体等の芳香族三級アミンとルブレンとの併用は好ましく、この場合のルブレンの使用量は式(II)のテトラアリールジアミン誘導体等の芳香族三級アミンの0.1〜20wt%であることが好ましい。このようなルブレンについては、EP065095A1(対応特願平7−43564号)等の記載を参照することができる。ルブレンを正孔輸送層等に含有させることで正孔輸送層等の中の化合物を電子注入から守ることができる。さらには、再結合領域をトリス(8−キノリノラト)アルミニウムのような電子注入輸送性化合物を含有する層中の界面近傍から芳香族三級アミンのような正孔注入輸送性化合物を含有する層中の界面近傍にずらすことで正孔注入からトリス(8−キノリラト)アルミニウム等を守ることができる。なお、ルブレンに限らず、電子親和力が正孔注入輸送性化合物よりも低く、電子注入と正孔注入に対して安定な化合物であれば同様に用いることができる。
本発明において、陰極には、仕事関数の小さい材料、例えば、Li、Na、Mg、Al、Ag、Inあるいはこれらの1種以上を含む合金を用いることが好ましい。また、陰極は結晶粒が細かいことが好ましく、特に、アモルファス状態であることが好ましい。陰極の厚さは10〜1000nm程度とすることが好ましい。また、電極形成の最後にAlや、フッ素化合物を蒸着、スパッタすることで封止効果が向上する。
有機EL素子を面発光させるためには、少なくとも一方の電極が透明ないし半透明である必要があり、上記したように陰極の材料には制限があるので、好ましくは発光光の透過率が80%以上となるように陽極の材料および厚さを決定することが好ましい。具体的には、例えば、ITO(スズドープ酸化インジウム)、IZO(亜鉛ドープ酸化インジウム)、SnO2、Ni、Au、Pt、Pd、ドーパントをドープしたポリピロールなどを陽極に用いることが好ましい。また、陽極の厚さは10〜500nm程度とすることが好ましい。また、素子の信頼性を向上させるために駆動電圧が低いことが必要であるが、好ましいものとして10〜30Ω/cm2または10Ω/cm2以下(通常0.1〜10Ω/cm2)のITO(厚み10〜300nm)が挙げられる。実際には、ITO両界面と陰電極面での光の多重反射による光干渉効果が、高い光取り出し効率、高い色純度を満足できるようにITOの膜厚、光学定数を設計してやればよい。またディスプレイのような大きいデバイスにおいては、ITOの抵抗が大きくなるのでAl等の配線をしてもよい。
基板材料に特に制限はないが、図示例では基板側から発光光を取り出すため、ガラスや樹脂等の透明ないし半透明材料を用いる。また、基板には、図示のように、カラーフィルター膜や蛍光物質を含む蛍光変換フィルター膜、あるいは誘電体反射膜を用いて発光色をコントロールしてもよい。
なお、基板に不透明な材料を用いる場合には、図1に示される積層順序を逆にしてもよい。
本発明では、発光層に式(I)の種々のクマリン誘導体を用いることによって例えば緑(λmax 490〜550nm)、青(λmax 440〜490nm)、赤(λmax 580〜660nm)の発光を得ることができ、特にλmax 480〜640nmの発光を好ましく得ることができる。
このときの緑、青、赤のCIE色度座標は、好ましくは現行CRTの色純度と同等以上またはNTSC標準の色純度と同等であればよい。
上記の色度座標は一般的な色度測定機で測定することができる。本発明ではトプコン社製の測定機BM−7、SR−1などを用いて測定している。
本発明における好ましいλmax、CIE色度座標のx、y値の発光は、カラーフィルター膜や蛍光変換フィルター膜などを設けることによって得てもよい。
カラーフィルター膜には、液晶ディスプレイ等で用いられているカラーフィルターを用いてもよいが、有機ELの発光する光に合わせてカラーフィルターの特性を調整し、取り出し効率・色純度を最適化すればよい。また、EL素子材料や蛍光変換層が光吸収するような短波長の光をカットできるカラーフィルターを用いることが好ましく、これにより素子の耐光性・表示のコントラストも向上する。このときカットする光は緑の場合560nm以上の波長の光および480nm以下の波長の光であり、青の場合490nm以上の波長の光であり、赤の場合580nm以下の波長の光である。このようなカラーフィルターを用いることにより、CIE色度座標において好ましいx、y値が得られる。カラーフィルター膜の厚さは0.5〜20μm程度とすればよい。
また、誘電体多層膜のような光学薄膜を用いてカラーフィルターの代わりにしてもよい。
蛍光変換フィルター膜は、EL発光を吸収し、蛍光変換膜中の蛍光体から光を放出させることで発光色の色変換を行うものであるが、バインダー、蛍光材料、光吸収材料の三つから形成される。
蛍光材料は、基本的には蛍光量子収率が高いものを用いればよく、EL発光波長域に吸収が強いことが望ましい。具体的には蛍光スペクトルの発光極大波長λmaxが緑の場合490〜550nm、青の場合440〜480nm、赤の場合580〜640nmであり、λmax付近のスペクトルの半値幅がいずれの場合にも10〜100nmである蛍光物質が好ましい。実際には、レーザー用色素などが適しており、ローダミン系化合物、ペリレン系化合物、シアニン系化合物、フタロシアニン系化合物(サブフタロシアニン等も含む)、ナフタロイミド系化合物、縮合環炭化水素系化合物、縮合複素環系化合物、スチリル系化合物等を用いればよい。
バインダーは基本的に蛍光を消光しないような材料を選べばよく、フォトリソグラフィー、印刷等で微細なパターニングができるようなものが好ましい。また、ITOの成膜時にダメージを受けないような材料が好ましい。
光吸収材料は、蛍光材料の光吸収が足りない場合に用いるが、必要のない場合は用いなくてもよい。また、光吸収材料は、蛍光材料の蛍光を消光しないような材料を選べばよい。
このような蛍光変換フィルター用いることによって、CIE色度座標において好ましいx、y値が得られる。また、蛍光変換フィルター膜の厚さは0.5〜20μm程度とすればよい。
本発明では図示例のようにカラーフィルター膜と蛍光変換フィルター膜とを併用してもよく、好ましくは発光光を取り出す側に特定波長の光をカットするようなカラーフィルター膜を配置すればよい。
また、カラーフィルター膜や蛍光変換フィルター膜の上には保護膜を設けることが好ましい。保護膜の材質はガラス、樹脂等であってよく、フィルター膜のダメージが防止でき、後工程での問題が起きないような材料を選択すればよく、その厚さは1〜10μm程度である。保護膜を設けることにより、フィルター膜のダメージを防止でき、表面をフラット化でき、屈折率や膜厚の調整、光取り出し効率の向上等を図ることができる。
これらのカラーフィルター膜、蛍光変換フィルター膜、保護膜の材料は、市販品をそのまま用いることができ、これらの膜は塗布法、電解重合法、気相成長法(蒸着、スパッタ、CVD)等によって形成することができる。
次に、本発明の有機EL素子の製造方法を説明する。
陰極および陽極は、蒸着法やスパッタ法等の気相成長法により形成することが好ましい。
正孔注入輸送層、発光層および電子注入輸送層の形成には、均質な薄膜が形成できることから真空蒸着法を用いることが好ましい。真空蒸着法を用いた場合、アモルファス状態または結晶粒径が0.1μm以下(通常、下限値は0.001μm程度である。)の均質な薄膜が得られる。結晶粒径が0.1μmを超えていると、不均一な発光となり、素子の駆動電圧を高くしなければならなくなり、電荷の注入効率も著しく低下する。
真空蒸着の条件は特に限定されないが、10-3Pa(10-5Torr)以下の真空度とし、蒸着速度は0.001〜1nm/sec程度とすることが好ましい。また、真空中で連続して各層を形成することが好ましい。真空中で連続して形成すれば、各層の界面に不純物が吸着することを防げるため、高特性が得られる。また、素子の駆動電圧を低くすることができる。
これら各層の形成に真空蒸着法を用いる場合において、1層に複数の化合物を含有させる場合、化合物を入れた各ボートを個別に温度制御して共蒸着することが好ましいが、予め混合してから蒸着してもよい。またこの他、溶液塗布法(スピンコート、ディップ、キャスト等)、ラングミュア・ブロジェット(LB)法などを用いることもできる。溶液塗布法では、ポリマー等のマトリックス物質中に各化合物を分散させる構成としてもよい。
以上においては、単一色発光の有機EL素子について述べてきたが、本発明では2種以上の発光種を発光させることが可能な有機EL素子を構成することができる。このような有機EL素子では、バイポーラ型発光層を含む2層以上の発光層を設け、2層以上の発光層をバイポーラ型発光層同士の組合せ、バイポーラ型発光層とこれより陽極側の正孔輸送性の発光層との組合せ、バイポーラ型発光層とこれより陰極側の電子輸送性の発光層との組合せのいずれかとするものである。
ここで、バイポーラ型発光層は、発光層内での電子注入・輸送とホール注入・輸送が同じ程度あり、電子とホールが発光層全体に分布することで再結合ポイントおよび発光ポイントが発光層内全体に拡がっている発光層である。
さらに説明すると電子輸送性層から注入される電子による電流密度とホール輸送性層から注入されるホールによる電流密度が同程度のオーダー、すなわち両キャリアの電流密度の比が1/10〜10/1、好ましくは1/6〜6/1、より好ましくは1/2〜2/1である発光層である。
この場合の両キャリアの電流密度の比は、具体的には、実際に使用するものと同じ電極を用い、発光層の単層膜を1μm程度の厚さに成膜し、この電流密度の測定値から求めればよい。
一方、正孔輸送性の発光層は、ホールの電流密度がバイポーラ型よりも高いものであり、電子輸送性のものは、電子の電流密度がバイポーラ型より高いものである。
さらに、バイポーラ型発光層を主体にして説明する。
一般には電流密度はキャリア濃度とキャリア移動度の積で決まる。
すなわち、発光層でのキャリア密度は、各界面での障壁で決まる。例えば、電子については電子注入される発光層界面での電子の障壁の大きさ(電子親和力の差)で決まり、ホールについてはホール注入される発光層界面でのホールの障壁の大きさ(イオン化ポテンシャルの差)で決まる。また、キャリア移動度は発光層に用いる材料の種類で決まる。
これらの値により、発光層内の電子とホールの分布が決まり、発光領域も決まる。
実際には、電極・電子輸送性層・ホール輸送性層でのキャリア濃度・キャリア移動度が十分大きければ上記のように界面の障壁だけで問題は片ずくが、電子輸送性層・ホール輸送性層に有機化合物を用いた場合、発光層に対してキャリア輸送性層の輸送能力が不十分になるため、発光層のキャリア濃度はキャリア注入電極のエネルギーレベルとキャリア輸送性層のキャリア輸送性(キャリア移動度・エネルギーレベル)にも依存する。このため、発光層への各キャリア電流密度は、用いる各層の有機化合物の特性に大きく依存する。
ここで比較的単純な場合を用いてさらに説明する。
例えば、陽極/ホール輸送性層/発光層/電子輸送性層/陰極の構成において、発光層界面での各キャリア輸送性層でのキャリア密度が一定の場合を考える。
この場合ホール輸送性層から発光層へのホールに対する障壁と電子輸送性層から発光層への電子に対する障壁が等しい時もしくは、非常に近い値(<0.2V)であれば発光層への各キャリア注入量は同程度となり、発光層各界面近傍での電子濃度とホール濃度は等しいか非常に近い濃度となる。ここで発光層の各キャリアの移動度が等しければ、発光層内で再結合が(キャリアの突き抜けがない場合)効率的に起こり高輝度・高効率な素子が得られる。しかしながら、電子とホールの衝突確率が高く局所的な領域で再結合が起こる場合や、発光層内に大きなキャリアの障壁(>0.2eV)等がある場合は、発光領域が拡がらず、複数の異なる発光波長の発光分子を同時に発光させることができなくなるので、バイポーラ発光層には向かない。適当な電子とホールの衝突確率を持たせて再結合領域を狭めるような大きなキャリアの障壁のない発光層を作ることがバイポーラ型発光層には必要である。
また、発光層からの各キャリアの突き抜けを防止するため、ホール輸送性層の電子ブロック機能や電子輸送性層のホールブロック機能も効率の向上に有効である。さらにこのような機能は、複数層の発光層を持つ構成においては、それぞれのブロック層が再結合ポイントおよび発光ポイントとなり、複数の発光層を発光させるバイポーラ型発光層を設計する上で重要である。
次に発光層内での各キャリア移動度が異なる場合、発光層界面での各キャリア輸送性層でのキャリア密度を調整することで、上記のような単純な場合と同様なバイポーラ型発光層と同様な状態を形成できる。当然発光層でのキャリア移動度の低い方のキャリア注入性層界面のキャリア濃度を高めてやらねばならない。
さらに、発光層界面での各キャリア輸送性層でのキャリア密度が異なる場合、発光層内での各キャリア移動度を調整することで上記のような単純な場合と同様なバイポーラ型発光層と同様な状態を形成できる。
ただし、調整には限界があり、理想的には発光層の各キャリア移動度と各キャリア濃度が等しいか、ほぼ同程度であることが望ましい。
上記のようなバイポーラ型発光層を設けることで、複数の発光層を持つ発光素子が得られるが、各発光層の発光安定性を得るには、発光層を、物理的・化学的・電気化学的・光化学的に安定化しなければならない。
特に発光層は、電子の注入・輸送、ホールの注入・輸送、再結合、発光などの機能が要求されるが、特に電子・ホールの注入輸送する状態は、アニオンラジカル・カチオンラジカルもしくは、それに近い状態に相当し、有機固体薄膜材料に対してこのような電気化学的状態での安定性が要求される。
また、有機ELの原理は電気的分子励起状態からの光放出による失活であり、電気的に蛍光発光させることである。すなわち、固体薄膜中で蛍光を失活させるような劣化物が微量でも生成すると発光寿命は致命的に短くなり、実用に耐えない。
素子の発光安定性を得るには上記のような安定性を持つ化合物・素子構成、特に電気化学的に安定な化合物・素子構成を持つことが必要である。
上記の条件を全て満足するような化合物等を用いて発光層を形成してやればよいが、一つの化合物で、バイポーラ型発光層を形成するのは難しい。より簡便な方法として、各キャリアに安定なホール輸送性化合物と電子輸送性化合物との混合層とすることで安定なバイポーラ型発光層を得ることができる。また、蛍光性を強めることで高輝度とするために混合層に高蛍光性ドーパントをドーピングしてもよい。
したがって、本発明におけるバイポーラ型発光層としては、混合層タイプのものが好ましく、2層以上の発光層はすべて混合層であることが好ましい。また、2層以上の発光層のうち少なくとも1層にはドーパントがドープされていることが好ましく、さらに好ましくはすべての発光層にドーパントがドープされていることである。
本発明の好ましい素子構成について説明すると、ドーパントをドープした混合層タイプの発光層のほかに、さらにドーパントをドープした発光層を設け、ドーピングした発光層を2層以上とするものである。ドーピングした発光層の組合せとしては、混合層同士、混合層とこれより陽極側に設けられた正孔輸送性の発光層および/または陰極側に設けられた電子輸送性の発光層であり、長寿命化を図る上では、特に混合層同士の組合せが好ましい。
この場合の混合層は、前記と同様に、正孔注入輸送性化合物と電子注入輸送性化合物とを含有する層であり、これらの混合物をホスト材料として用いたものである。また正孔輸送性の発光層は正孔注入輸送性化合物を、電子輸送性の発光層は電子注入輸送性化合物を各々ホスト材料として用いたものである。
次に、このような特に好ましい有機EL素子における発光過程について説明する。
i)まず、混合層同士の組合せ、例えば混合層が2層の場合を説明する。正孔注入性および/または輸送性の層(「正孔層」と略す)側の混合層を混合第1層、電子注入性および/または輸送性の層(「電子層」と略す)側の混合層を混合第2層とすると、正孔層から注入された正孔(ホール)は混合第1層を通過し混合第2層へ、電子層から注入された電子は混合第2層を通過し混合第1層へと進むことが可能である。再結合確率は電子濃度、ホール濃度および電子ホール衝突確率によって決まるが、再結合領域は混合第1、第2層、界面等の障壁がないので広く分散する。したがって、混合第1、第2層でそれぞれ励起子が生成され、それぞれのホストから、最も近い発光種にエネルギー移動する。混合第1層で生成された励起子はこの層中の発光種(ドーパント)へ、混合第2層ではこの層中の発光種(ドーパント)へエネルギー移動することにより、2種の発光種が発光可能になっている。
このような現象は混合層が3層以上であっても同様である。
ただし、ドーパントがキャリアトラップとして働く場合、トラップの深さを考慮する必要がある。
ii)次に、正孔輸送性の発光層と混合発光層の組合せについて、例えば正孔層側から正孔輸送性の発光層、混合発光層の順に2層設けた場合を説明する。正孔層から注入されたホールは正孔輸送性の発光層を通過し、電子層から注入された電子は、混合発光層中を進み、正孔輸送性の発光層と混合発光層の界面近傍、および混合発光層中に拡がって再結合する。正孔輸送性の発光層の界面近傍、および混合発光層中で、それぞれ励起子が生成され、それぞれのホストから、励起子のマイグレーションできる範囲にあるエネルギーギャップの一番小さい発光種にエネルギー移動する。この際正孔輸送性の層の界面近傍で生成された励起子はこの層中の発光種(ドーパント)へ、混合層ではこの層中の発光種(ドーパント)へエネルギー移動することにより、2種の発光種が発光可能になっている。また、正孔輸送性の層のドーパントLUMO準位において電子が運ばれ、正孔輸送性発光層中で再結合し発光することで2種の発光が可能になる。
iii)さらに、電子輸送性の発光層と混合発光層の組合せについて、例えば電子層側から電子輸送性の発光層、混合発光層の順に2層設けた場合を説明する。電子層から注入された電子は、電子輸送性の発光層中を通過し混合層へ進み、正孔層から注入されたホールは混合層へ入る。混合層と電子輸送性の発光層の界面近傍、および混合発光層中に拡がって再結合する。電子輸送性の発光層の界面近傍、および混合発光層中で、それぞれ励起子が生成され、それぞれのホストから、励起子のマイグレーションギャップの一番小さい発光種にエネルギー移動する。この際、電子輸送性の発光層界面で生成された励起子はこの層中の発光種(ドーパント)へ、混合発光層ではこの層中の発光種(ドーパント)へエネルギー移動すること、または電子輸送性の層のドーパントHOMO準位においてホールが運ばれ、電子輸送性発光層中で再結合することにより、2種の発光種が発光可能になっている。
ii)、iii)については、これらの組合せ、あるいはこれらにおいて発光層を3層以上としたときも同様の現象が起きる。
混合層におけるホスト材料としての正孔注入輸送性化合物と電子注入輸送性化合物との混合比は目的とするホストのキャリア輸送性によって変化させればよく、通常体積比で5/95〜95/5の範囲のなかから選択される。正孔注入輸送性化合物比率の高い場合にはホール輸送量が多く再結合領域は陽極側にシフトし、電子注入輸送性化合物比率の高い場合には電子輸送量が多く再結合域は陰極側にシフトする。それに伴って混合層の発光強度のバランスが変化する。このように、混合層型ホストのキャリア輸送性を変えることにより各発光層での発光強度を変えることができる。
また、本発明では、ホスト材料の種類を変えることによってもキャリア輸送性を変えることができる。
このように本発明で、2層以上の発光層の発光特性をそれぞれの層について調整可能とすることができる。したがって、発光層のキャリア輸送性と構成を最適にすることができる。このとき、一層に2種以上の発光種があってもよい。
このような多色発光に対応した発光層の1層当たりの厚さは5〜100nm、さらには10〜80nmであることが好ましく、発光層の合計厚さは60〜400nmであることが好ましい。なお、混合層1層当たりの厚さは5〜100nm、さらには10〜60nmであることが好ましい。
このように複数の発光特性の異なる発光層を設ける場合、発光極大波長が長波長側の発光層を陽極側に設けることが好ましい。また、長寿命化を図る上ではドーパントとしてルブレン等のナフタセン骨格を有する化合物を発光層(特に混合層)にドープすることが好ましい。
次に、このような多色発光に対応した有機EL素子に用いるホスト材料およびドーパントについて説明する。ドーパントとしては、すでに述べた式(I)で示されるクマリン誘導体、式(III)で示されるキナクリドン化合物、式(VI)で示されるスチリル系アミン化合物、ルブレン等のナフタセン骨格を有する化合物を用いることができる。このほか、前記の発光材料となりうる化合物も用いることができる。さらには、式(VII)で示される縮合多環化合物を用いることができる。式(VII)について説明する。式(VII)には前記のルブレンも包含される。
(Ar)m−L (VII)
式(VII)において、Arは芳香族残基を表し、mは2〜8の整数であり、各々のArは同一でも異なるものであってもよい。
芳香族残基としては、芳香族炭化水素残基、芳香族複素環残基が挙げられる。芳香族炭化水素残基としては、ベンゼン環を含む炭化水素基のいずれであってもよく、例えば単環もしくは多環の芳香族炭化水素残基が挙げられ、縮合環や環集合も含まれる。
芳香族炭化水素残基は、総炭素数が6〜30のものが好ましく、置換基を有するものであってもよい。置換基を有する場合の置換基としては、アルキル基、アルコキシ基、アリール基、アリールオキシ基、アミノ基、複素環基等が挙げられる。芳香族炭化水素残基としては、フェニル基、アルキルフェニル基、アルコキシフェニル基、アリールフェニル基、アリールオキシフェニル基、アルケニルフェニル基、アミノフェニル基、ナフチル基、アントリル基、ピレニル基、ペリレニル基などが挙げられる。また、アルキニルアレーン(アリールアルキン)から誘導されるアリールアルキニル基であってもよい。
芳香族複素環残基としてはヘテロ原子としてO、N、Sを含むものが好ましく、5員環でも6員環でもよい。具体的には、チエニル基、フリル基、ピローリル基、ピリジル基などが挙げられる。
Arとしては、芳香族炭化水素残基が好ましく、特に、フェニル基、アルキルフェニル基、アリールフェニル基、アルケニルフェニル基、アミノフェニル基、ナフチル基、アリールアルキニル基等が好ましい。
アルキルフェニル基としては、アルキル部分の炭素数が1〜10のものが好ましく、アルキル基は直鎖状であっても分岐を有するものであってもよく、メチル基、エチル基、(n,i)−プロピル基、(n,i,sec,tert)−ブチル基、(n,i,neo,tert)−ペンチル基、(n,i,neo)−ヘキシル基等のアルキル基が挙げられ、これらのアルキル基のフェニル基における置換位置はo,m,p位のいずれであってもよい。このようなアルキルフェニル基の具体例としては、(o,m,p)−トリル基、4−n−ブチルフェニル基、4−t−ブチルフェニル基、等が挙げられる。
アリールフェニル基としては、アリール部分がフェニル基であるものが好ましく、このようなフェニル基は置換されていてもよく、このときの置換基はアルキル基であることが好ましく、具体的には上記のアルキルフェニル基のところで例示したアルキル基を挙げることができる。さらには、アリール部分は、フェニル基等のアリール基が置換したフェニル基であってもよい。このようなアリールフェニル基の具体例としては、(o,m,p)−ビフェニリル基、4−トリルフェニル基、3−トリルフェニル基、テレフェニリル基等が挙げられる。
アルケニルフェニル基としては、アルケニル部分の総炭素数が2〜20のものが好ましく、アルケニル基としてはトリアリールアルケニル基が好ましく、例えばトリフェニルビニル基、トリトリルビニル基、トリビフェニルビニル基等が挙げられる。このようなアルケニルフェニル基の具体例としては、トリフェニルビニルフェニル基等が挙げられる。
アミノフェニル基としては、アミノ部分がジアリールアミノ基であるものが好ましく、アリールアミノ基としてはジフェニルアミノ基、フェニルトリルアミノ基等が挙げられる。このようなアミノフェニル基の具体例としては、ジフェニルアミノフェニル基、フェニルトリルアミノフェニル基等が挙げられる。
ナフチル基としては、1−ナフチル基、2−ナフチル基等であってよい。
アリールアルキニル基としては、総炭素数8〜20のものが好ましく、フェニルエチニル基、トリルエチニル基、ビフェニリルエチニル基、ナフチルエチニル基、ジフェニルアミノフェニルエチニル基、N−フェニルトリルアミノフェニルエチニル基、フェニルプロピニル基等が挙げられる。
また、式(VII)におけるLは環数3〜10、好ましくは3〜6の縮合多環芳香族のm(2〜8)価の残基を表す。縮合環とは、環の構成原子のうち2個以上の原子が他の環と共有して結合している炭素環や複素環などにより形成された環式構造をいう。縮合多環芳香族としては、縮合多環芳香族炭化水素、縮合多環芳香族複素環が挙げられる。
縮合多環芳香族炭化水素としては、アントラセン、フェナントレン、ナフタセン、ピレン、クリセン、トリフェニレン、ベンゾ[c]フェナントレン、ベンゾ[a]アントラセン、ペンタセン、ペリレン、ジベンゾ[a,j]アントラセン、ジベンゾ[a,h]アントラン、ベンゾ[a]ナフタセン、ヘキサセン、アンタントレンなどが挙げられる。
縮合多環芳香族複素環としては、ナフト[2,1−f]イソキノリン、α−ナフタフェナントリジン、フェナントロオキサゾール、キノリノ[6,5−f]キノリン、ベンゾ[b]チオファントレン、ベンゾ[g]チオファントレン、ベンゾ[i]チオファントレン、ベンゾ[b]チオファントラキノンなどが挙げられる。
特には、縮合多環芳香族炭化水素が好ましく、Lはこれらの縮合多環芳香族炭化水素から誘導される2〜8価、さらには2〜6価の残基であることが好ましい。
このような縮合多環芳香族の2〜8価の残基Lの具体例を以下に示す。
なお、Lで表される縮合多環芳香族の2〜8価の残基は、さらに置換基を有していてもよい。
特に、Lとしては、ベンゼン環が直鎖状に縮合したナフタセン、ペンタセンまたはヘキサセンから誘導される2〜8価、特に2〜6価の残基が好ましい。とりわけナフタセンから誘導されるもの、すなわちナフタセン骨格を有する化合物を構成するものが好ましい。
また、Lとしてはアントラセンから誘導される2〜6価、さらには2〜4価の残基が好ましい。ただし、Lがアントラセンから誘導される2または3価の残基であるとき、2個または3個存在するArのうち、少なくとも1個はアルキニルアレーン(アリールアルキン)から誘導される残基である。さらには、Arのうち2個以上がこのような残基であることが好ましい。そして、特にはLはアントラセンから誘導される3価の残基が好ましく、式(VII)の化合物としては、このようなLであって、2個のArがアリールアルキニル基、1個のArがビス(アリールアルキニル)アントリル基であるものが好ましく、特には式(VII−A)で表されるものが好ましい。
(Ar11)2−L1−L2−(Ar12)2 (VII−A)
式中、L1およびL2は各々アントラセンから誘導される3価の残基を表し、これらは通常同一であるが、異なっていてもよい。Ar11およびAr12は各々アリールアルキニル基を表し、これらは通常同一であるが、異なっていてもよい。なお、アリールアルキニル基のアントラセンにおける結合位置は、アントラセンの9,10位であることが好ましく、アントラセン同士は1位または2位で結合することが好ましい。また、アリールアルキニル基は具体的には前記と同様のものが挙げられる。
以下に、式(VIII)で表される化合物の具体例を示すが、本発明はこれらに限定されるものではない。ここでは、式(VII−1)〜(VII−8)を用いて、これらR01等の組み合わせで示している。なお、R01〜R04等のようにまとめて示しているものについては、特にことわらないかぎり、Hであることを示し、すべてHであるときはHで示している。
ドーパントのドープ量は、発光層の0.01〜10体積%であることが好ましい。
一方、発光層に用いるホスト材料としては、前記のホスト材料、正孔注入輸送性化合物、電子注入輸送性化合物として列挙したもののなかから選択することができる。
正孔注入輸送性化合物である正孔輸送性のホスト材料としては、式(II)で示されるテトラアリールジアミン誘導体を含む芳香族三級アミンが好ましいものとして挙げられる。
以下に、前記の化合物に包含ないし重複するものがあるが、正孔輸送性のホスト材料を列挙する。ここでは、式(H−1)〜(H−12)に従うΦ1等の組合せで示している。なお、式(H−6a)〜(H−6c)、式(H−7a)〜(H−7e)では組合せが共通であるため、H−6、H−7としてまとめて示している。
一方、電子注入輸送性化合物である電子輸送性のホスト材料としては、前記のキノリノラト金属錯体が好ましい。
以下に、前記の化合物に包含ないし重複する化合物もあるが、電子輸送性のホスト材料を列挙する。ここでは式(E−1)〜(E−14)に従うΦ101等の組合せで示している。
発光層における正孔輸送性のホスト材料および電子輸送性のホスト材料は各々1種のみ用いても2種以上を併用してもよい。
このような有機EL素子においては、発光層を挟持する形で陽極側に正孔注入性および輸送性の層、および陰極側に電子注入性および/または輸送性の層が設けられている。この場合の正孔注入性および/または輸送性の層、電子注入性および/または輸送性の層、陽極、陰極等は前記と同様である。
また、混合層をはじめとする有機化合物層の形成方法等の有機EL素子の製造方法についても前記と同様である。
本発明の有機EL素子は、通常、直流駆動型のEL素子として用いられるが、交流駆動またはパルス駆動することもできる。印加電圧は、通常、2〜20V程度とされる。
実施例
以下、本発明の具体的実施例を示し、本発明をさらに詳細に説明する。
〈参照例1〉
厚さ100nmのITO透明電極(陽極)を有するガラス基板を、中性洗剤、アセトン、エタノールを用いて超音波洗浄し、煮沸エタノール中から引き上げて乾燥し、UVオゾン洗浄後、蒸着装置の基板ホルダーに固定して、1×10-6torrまで減圧した。
次いで、4,4’,4”−トリス(−N−(−3−メチルフェニル)−N−フェニルアミノ)トリフェニルアミン(MTDATA)を蒸着速度2nm/secで50nmの厚さに蒸着し、正孔注入層とした。
例示化合物II−102のN,N’−ジフェニル−N,N’−ビス−(−4’−(N−(m−ビフェニル)−N−フェニル)アミノビフェニル−4−イル)ベンジジンを、蒸着速度2nm/secで20nmの厚さに蒸着し、正孔輸送層とした。
次いで、例示化合物I−201とトリス(8−キノリノラト)アルミニウム(A1Q3)を重量比で2:100の比率で、50nmの厚さに蒸着し、発光層とした。
次いで、減圧状態を保ったまま、電子注入輸送層として、トリス(8−キノリノラト)アルミニウムを蒸着速度0.2nm/secで10nmの厚さに蒸着した。
さらに、減圧状態を保ったまま、MgAg(重量比10:1)を蒸着速度0.2nm/secで200nmの厚さに蒸着して陰極とし、保護層としてAlを100nm蒸着しEL素子を得た。
このEL素子に電圧を印加して電流を流したところ、14V・800mA/cm2で103800cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.28y=0.68)の発光が確認され、この発光は乾燥アルゴン雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で890時間(初期輝度1288cd/m2、駆動電圧上昇1.5V)、初期輝度300cd/m2では4500時間であった。
〈参照例2〉
参照例1と同様に素子を作製した。ただし、正孔輸送層に、例示化合物II−102の代わりに例示化合物II−101のN,N’−ジフェニル−N、N’−ビス−(4’−(N,N−ビス(m−ビフェニル)アミノビフェニル−4−イル)ベンジジンを用いた。
このEL素子に電圧を印加して電流を流したところ、14V・753mA/cm2で100480cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.31y=0.66)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で680時間(1433cd/m2、駆動電圧上昇1.5V)初期輝度300cd/m2では4000時間であった。
〈参照例3〉
参照例1と同様に素子を作製した。ただし、発光層に、例示化合物I−201の代わりに例示化合物I−203を用いた。
このEL素子に電圧を印加して電流を流したところ、13V・553mA/cm2で69500cd/m2の緑色(発光極大波長λmax=515nm、色度座標x=0.26y=0.66)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で600時間(1078cd/m2、駆動電圧上昇1.5V)初期輝度300cd/m2では4000時間であった。
〈参照例4〉
参照例1と同様に素子を作製した。ただし、発光層に、例示化合物I−201の代わりに例示化合物I−202を用いた。
このEL素子に電圧を印加して電流を流したところ、14V・753mA/cm2で71700cd/m2の緑色(発光極大波長λmax=515nm、色度座標x=0.29y=0.64)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で800時間(998cd/m2、駆動電圧上昇1.5V)初期輝度300cd/m2では5000時間であった。
〈参照例5〉
参照例1と同様に素子を作製した。ただし、発光層に、例示化合物I−201の代わりに例示化合物I−103を用いた。
このEL素子に電圧を印加して電流を流したところ、16V・980mA/cm2で61400cd/m2の緑色(発光極大波長λmax=510nm、色度座標x=0.23y=0.63)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で3000時間(730cd/m2、駆動電圧上昇8.0V)初期輝度300cd/m2では10000時間であった。
〈参照例6〉
参照例1と同様に素子を作製した。ただし、発光層に、例示化合物I−201の代わりに例示化合物I−104を用いた。
このEL素子に電圧を印加して電流を流したところ、12V、625mA/cm2で40300cd/m2の緑色(発光極大波長λmax=500nm、色度座標x=0.23y=0.58)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で800時間(680cd/m2、駆動電圧上昇2.5V)初期輝度300cd/m2では4000時間であった。
〈比較例1〉
参照例1と同様に素子を作製した。ただし、正孔輸送層に、例示化合物II−102の代わりにN,N’−ビス(−3−メチルフェニル)−N,N’−ジフェニル−4,4’−ジアミノビフェニル(TPD001)を用いた。
このEL素子に電圧を印加して電流を流したところ、13V・518mA/cm2で71700cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.29y=0.66)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で65時間(1281cd/m2、駆動電圧上昇1.5V)初期輝度300cd/m2では800時間であった。
〈比較例2〉
参照例1と同様に素子を作製した。ただし、正孔輸送層に、例示化合物II−102の代わりにN,N’−ビス(−3−ビフェニル)−N,N’−ジフェニル−4,4’−ジアミノビフェニル(TPD006)を用いた。
このEL素子に電圧を印加して電流を流したところ、14V・532mA/cm2で81000cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.32y=0.65)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で68時間(1730cd/m2、駆動電圧上昇2.0V)初期輝度300cd/m2では800時間であった。
〈比較例3〉
参照例1と同様に素子を作製した。ただし、正孔輸送層に、例示化合物II−102の代わりにN,N’−ビス(−3−t−ブチルフェニル)−N,N’−ジフェニル−1,1’−ビフェニル−4,4’−ジアミン(TPD008)を用いた。
このEL素子に電圧を印加して電流を流したところ、13V・508mA/cm2で79300cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.30y=0.66)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で29時間(1749cd/m2、駆動電圧上昇1.4V)初期輝度300cd/m2では500時間であった。
〈比較例4〉
参照例1と同様に素子を作製した。ただし、正孔輸送層に、例示化合物II−102の代わりにN,N,N’,N’−テトラキス(−m−ビフェニル)−1,1’−ビフェニル−4,4’−ジアミン(TPD005)を用いた。
このEL素子に電圧を印加して電流を流したところ、14V・643mA/cm2で102700cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.28y=0.68)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で115時間(1842cd/m2、駆動電圧上昇1.8V)初期輝度300cd/m2では1600時間であった。
〈比較例5〉
参照例1と同様に素子を作製した。ただし、正孔注入層に、例示化合物II−102の代わりにN,N’−ジフェニル−N,N’−ビス−(−4’−(N−(3−メチルフェニル)−N−フェニル)アミノビフェニル−4−イル)ベンジジン(TPD017)を用いた。
このEL素子に電圧を印加して電流を流したところ、14V・715mA/cm2で75600cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.32y=0.66)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で197時間(1156cd/m2、駆動電圧上昇2.3V)初期輝度300cd/m2では2000時間であった。
〈比較例6〉
参照例1と同様に素子を作製した。ただし発光層に例示化合物I−201の代わりに下記のキナクリドン(例示化合物III−1)を用い0.75wt%となるように含有させた。
このEL素子に電圧を印加して電流を流したところ、16V・840mA/cm2で60000cd/m2の黄緑色(発光極大波長λmax=540nm、色度座標x=0.37y=0.60)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で100時間(800cd/m2、駆動電圧上昇3.2V)初期輝度300cd/m2では500時間であった。
以上の参照例1〜6、比較例1〜6の有機EL素子の特性等を表1、2にまとめて示す。
上記結果より、式(I)のクマリン誘導体と式(II)のテトラアリールジアミン誘導体とを組み合わせた本発明のEL素子は発光寿命が長いことがわかる。
〈参照例7〉
ガラス基板上にカラーフィルター膜を富士ハント製CR−2000を用いて塗布により1μm厚に形成し、この上に赤色蛍光変換膜を富士ハント製CT−1にBASF製Lumogen F Red 300を2wt%溶解したものを用いて塗布しベークして5μm厚に形成し、さらにこの上にオーバーコートを富士ハント製CT−1を用いて塗布しベークして1μm厚に形成した。この上に、厚さ100nmのITOをスパッタし陽極付赤色素子基板を作製した。この基板を用い、参照例1と同様に素子を作製した。
上記のカラーフィルター材料は580nm以下の波長の光をカットするものであり、赤色蛍光変換材料は発光極大波長λmaxが630nmであり、λmax付近のスペクトルの半値幅は50nmであった。
このEL素子に電圧を印加して電流を流したところ、15V・615mA/cm2で9000cd/m2の赤色(発光極大波長λmax=600nm、色度座標x=0.60y=0.38)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。
〈参照例8〉
参照例1において、正孔輸送層を例示化合物II−102とルブレンとを10:1(重量比)で用い、共蒸着により形成するほかは同様にして素子を作製した。
このEL素子に電圧を印加して電流を流したところ、14V・750mA/cm2で79800cd/m2の緑色(発光極大波長λmax=525nm、555nm、色度座標x=0.38y=0.57)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で700時間(1173cd/m2、駆動電圧上昇2.5V)、初期輝度300cd/m2では4500時間であった。
〈実施例1〉
参照例1において、発光層を、正孔注入輸送性化合物としてN,N,N’,N’−テトラキス(−m−ビフェニル)−1,1’−ビフェニル−4,4’−ジアミン(TPD005)、電子注入輸送性化合物としてトリス(8−キノリノラト)
アルミニウム(AlQ3)を各々用い、ほぼ同じ蒸着速度0.5nm/secで蒸着し、それと同時に例示化合物I−103も蒸着速度約0.007nm/secで蒸着して40nm厚の混合層として形成した。混合層において、TPD005:AlQ3:例示化合物I−103=50:50:0.7(膜厚比)である。そのほかは参照例1と同様にして素子を作製した。ただし、MTDATAを用いた正孔注入輸送層は50nm厚、TPD005を用いた正孔輸送層は10nm厚、AlQ3を用いた電子注入輸送層は40nm厚とした。
このEL素子に電圧を印加して電流を流したところ、18V・600mA/cm2で54000cd/m2の緑色(発光極大波長λmax=510nm、色度座標x=0.30y=0.60)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で6000時間(1030cd/m2、駆動電圧上昇2.0V)、初期輝度300cd/m2では20000時間であった。
比較例4の混合層を用いない構成の素子に比べ格段と特性が向上することがわかった。
〈実施例2〉
参照例1において、正孔注入層を40nm厚に形成し、正孔輸送層をTPD005とルブレン(7wt%)とを用いて20nm厚に形成し、この上に発光層を実施例1と同様にTPD005とAlQ3と例示化合物I−103とを用いて形成するほかは同様にして素子を作製した。
このEL素子に電圧を印加して電流を流したところ、12V・650mA/cm2で67600cd/m2の緑色(発光極大波長λmax=510nm、550nm、色度座標x=0.38y=0.56)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で6500時間(900cd/m2、駆動電圧上昇2.0V)、初期輝度300cd/m2では25000時間であった。
〈実施例3〉
参照例1において、発光層を、正孔注入輸送性化合物として例示化合物II−102、電子注入輸送性化合物としてトリス(8−キノリノラト)アルミニウム(AlQ3)を各々用い、ほぼ同じ蒸着速度0.5nm/secで蒸着し、それと同時に例示化合物I−201も蒸着速度約0.015nm/secで蒸着して40nm厚の混合層として形成した。混合層において、例示化合物II−102:AlQ3:例示化合物I−201=50:50:1.5(膜厚比)である。そのほかは参照例1と同様にして素子を作製した。ただし、MTDATAを用いた正孔注入輸送層は50nm厚、II−102を用いた正孔輸送層は10nm厚、AlQ3を用いた電子注入輸送層は20nm厚とした。
このEL素子に電圧を印加して電流を流したところ、13V・750mA/cm2で98000cd/m2の緑色(発光極大波長λmax=525nm、色度座標x=0.29y=0.67)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で4000時間(1100cd/m2、駆動電圧上昇2.0V)、初期輝度300cd/m2では18000時間であった。
〈実施例4〉
参照例1において、正孔注入層を40nm厚に形成し、正孔輸送層を例示化合物II−102とルブレンとを用いて20nm厚に形成し、この上に発光層を実施例1と同様に例示化合物II−102とAlQ3と例示化合物I−201とを用いて形成するほかは同様にして素子を作製した。
このEL素子に電圧を印加して電流を流したところ、13V・900mA/cm2で80000cd/m2の黄緑色(発光極大波長λmax=525nm、560nm、色度座標x=0.40y=0.55)の発光が確認され、この発光は乾燥窒素雰囲気中で10000時間以上安定していた。輝度の半減期は10mA/cm2の定電流駆動で6000時間(1050cd/m2、駆動電圧上昇1.5V)、初期輝度300cd/m2では25000時間であった。
〈実施例5〉
実施例1、2において、例示化合物I−103の代わりに、例示化合物III−1(キナクリドン)を用いて同様に素子を作製し、特性を調べたところ、良好な特性を得た。
〈実施例6〉
実施例1、2において、例示化合物I−103の代わりに、例示化合物IV−1(スチリル系アミン化合物)を用いて同様に素子を作製し、特性を調べたところ、良好な特性を得た。
〈実施例7〉
実施例3、4において、例示化合物I−201の代わりに、例示化合物III−1(キナクリドン)を用いて同様に素子を作製し、特性を調べたところ、良好な特性を得た。
〈実施例8〉
実施例3、4において、例示化合物I−201の代わりに、例示化合物IV−1(スチリル系アミン化合物)を用いて同様に素子を作製し、特性を調べたところ、良好な特性を得た。
次に多色発光に対応した有機EL素子の実施例を示す。まず、これらの実施例等に用いた正孔注入層用の化合物HIM、正孔輸送層用の化合物および正孔輸送性のホスト材料として用いられるTPD005は以下に示すものである。
次いで、クマリン誘導体(例示化合物I−103)、ルブレン(例示化合物1−22)およびトリス(8−キノリノラト)アルミニウム(AlQ3)の発光スペクトルを参考例として示す。
<参考例1>
クマリン誘導体の発光スペクトルを図2に示す。このときの発光スペクトルは以下に示すような構成の有機EL素子を用いて測定したものである。
有機EL素子の作製
厚さ100nmのITO透明電極(陽極)を有するガラス基板(1.1mm厚)を、中性洗剤、アセトン、エタノールを用いて超音波洗浄し、煮沸エタノール中から引き上げて乾燥し、UVオゾン洗浄後、蒸着装置の基板ホルダーに固定して、1×10-6Torrまで減圧した。
次いで、N,N'-ジフェニル-N,N'-ビス[N-フェニル-N-4-トリル(4-アミノフェニル)]ベンジジン(HIM)を蒸着速度2nm/secで50nmの厚さに蒸着し、正孔注入層とした。
N,N,N',N'-テトラキス(-3-ビフェニル-1-イル)ベンジジン(TPD005)を蒸着速度2nm/secで10nmの厚さに蒸着し、正孔輸送層とした。
さらにトリス(8-キノリノラト)アルミニウム(AlQ3)とクマリン誘導体とを蒸着速度2nm/secと0.02nm/secで共蒸着し、クマリン誘導体が1.0vol%となる電子輸送性発光層を70nmの厚さに形成した。
さらに、減圧状態を保ったまま、MgAg(重量比10:1)を蒸着速度0.2nm/secで200nmの厚さに蒸着して陰極とし、保護層としてAlを100nm蒸着し有機EL素子を得た。
図2からわかるように、クマリン誘導体は510nm付近に発光極大波長を有する。発光スペクトルの半値巾(ピーク強度の半分の点の巾)は70nmであった。
<参考例2>
ルブレンの発光スペクトルを図3に示す。このときの発光スペクトルは以下に示すような構成の有機EL素子を用いて測定したものである。
有機EL素子の作製
厚さ100nmのITO透明電極(陽極)を有するガラス基板(1.1mm厚)を、中性洗剤、アセトン、エタノールを用いて超音波洗浄し、煮沸エタノール中から引き上げて乾燥し、UVオゾン洗浄後、蒸着装置の基板ホルダーに固定して、1×10-6Torrまで減圧した。
次いで、N,N'-ジフェニル-N,N'-ビス[N-フェニル-N-4-トリル(4-アミノフェニル)]ベンジジン(HIM)を蒸着速度2nm/secで15nmの厚さに蒸着し、正孔注入層とした。
N,N,N',N'-テトラキス-(-3-ビフェニル-1-イル)ベンジジン(TPD005)を蒸着速度2nm/secで15nmの厚さに蒸着し、正孔輸送層とした。
さらに、TPD005とトリス(8-キノリノラト)アルミニウム(AlQ3)とを体積比が1:1となるように、かつルブレン(例示化合物1−20)を2.5vol%含むように40nmの厚さに共蒸着し、混合層タイプの第1の発光層とした。このときの蒸着速度は、順に0.05nm/sec、0.05nm/sec、0.00025nm/secとした。
次いで、減圧状態を保ったまま、電子注入輸送発光層として、トリス(8-キノリノラト)アルミニウム(AlQ3)を蒸着速度0.2nm/secで55nmの厚さに蒸着した。
さらに、減圧状態を保ったまま、MgAg(重量比10:1)を蒸着速度0.2nm/secで200nmの厚さに蒸着して陰極とし、保護層としてAlを100nm蒸着し有機EL素子を得た。
図3からわかるように、ルブレンは560nm付近に発光極大波長を有する。発光スペクトルの半値巾は75nmであった。
<参考例3>
クマリン誘導体の発光スペクトルを図2に示す。このときの発光スペクトルは以下に示すような構成の有機EL素子を用いて測定したものである。
有機EL素子の作製
トリス(8-キノリノラト)アルミニウム(AlQ3)の発光スペクトルを図4に示す。このときの発光スペクトルは以下に示すような構成の有機EL素子を用いて測定したものである。
有機EL素子の作製
厚さ100nmのITO透明電極(陽極)を有するガラス基板(1.1mm厚)を、中性洗剤、アセトン、エタノールを用いて超音波洗浄し、煮沸エタノール中から引き上げて乾燥し、UVオゾン洗浄後、蒸着装置の基板ホルダーに固定して、1×10-6torrまで減圧した。
次いで、4,4’,4”−トリス(−N−(−3−メチルフェニル)−N−フェニルアミノ)トリフェニルアミン(MTDATA)を蒸着速度2nm/secで40nmの厚さに蒸着し、正孔注入層とした。
N,N,N’,N’−テトラキス(−3−ビフェニル−1−イル)ベンジジン(TPD005)を、蒸着速度2nm/secで15nmの厚さに蒸着し、正孔輸送層とした。
次いで、減圧状態を保ったまま、電子注入輸送性の発光層として、トリス(8−キノリノラト)アルミニウムを蒸着速度0.2nm/secで70nmの厚さに蒸着した。
さらに、減圧状態を保ったまま、MgAg(重量比10:1)を蒸着速度0.2nm/secで200nmの厚さに蒸着して陰極とし、保護層としてAlを100nm蒸着しEL素子を得た。
図4からわかるように、トリス(8-キノリノラト)アルミニウム(AlQ3)は540nm付近に発光極大波長を有する。発光スペクトルの半値巾は110nmであった。
<実施例9>
厚さ100nmのITO透明電極(陽極)を有するガラス基板(1.1mm厚)を、中性洗剤、アセトン、エタノールを用いて超音波洗浄し、煮沸エタノール中から引き上げて乾燥し、UVオゾン洗浄後、蒸着装置の基板ホルダーに固定して、1×10-6Torrまで減圧した。
次いで、N,N'-ジフェニル-N,N'-ビス[N-フェニル-N-4-トリル(4-アミノフェニル)]ベンジジン(HIM)を蒸着速度2nm/secで50nmの厚さに蒸着し、正孔注入層とした。
N,N,N',N'-テトラキス-(-3-ビフェニル-1-イル)ベンジジン(TPD005)を蒸着速度2nm/secで15nmの厚さに蒸着し、正孔輸送層とした。
さらに、TPD005とトリス(8-キノリノラト)アルミニウム(AlQ3)とを体積比が1:1となるように、かつルブレン(例示化合物1−22)を2.5vol%含むように20nmの厚さに共蒸着し、混合層タイプの第1の発光層とした。このときの蒸着速度は順に0.05nm/sec、0.05nm/sec、0.0025nm/secとした。
また、TPD005とAlQ3とを体積比が1:1となるように、かつクマリン誘導体の例示化合物I−103を1.0vol%含むように20nmの厚さに共蒸着し、混合層タイプの第2の発光層とした。このときの蒸着速度は順に0.05nm/sec、0.05nm/sec、0.001nm/secとした。
次いで、減圧状態を保ったまま、電子注入輸送発光層として、トリス(8-キノリノラト)アルミニウム(AlQ3)を蒸着速度0.2nm/secで50nmの厚さに蒸着した。
さらに、減圧状態を保ったまま、MgAg(重量比10:1)を蒸着速度0.2nm/secで200nmの厚さに蒸着して陰極とし、保護層としてAlを100nm蒸着し有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、10V・50mA/cm2で5000cd/m2の黄緑色(発光極大波長λmax=560nm、500nm、色度座標x=0.39y=0.55)の発光が確認され、この発光は乾燥アルゴン雰囲気中で1000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で40000hr(初期輝度1000cd/m2、初期駆動電圧7.2V、駆動電圧上昇3.0V)であった。
図5に発光スペクトルを示す。図5より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/R、クマリン誘導体(510nm)/ルブレン(560nm)は0.65であった。また、発光スペクトルの半値巾(最大ピークの強度の半分の点の巾)は120nmであり、クマリン誘導体、ルブレンともに発光していることがわかる。また、実施例1に比べ著しく寿命が延びている。したがって、ルブレンを含む混合層が長寿命化に寄与していることがわかる。
<比較例7>
実施例9において、TPD005の正孔輸送層を形成したのち、AlQ3とルブレンとクマリンとを各蒸着速度0.1nm/sec、0.0025nm/sec、0.001nm/secで共蒸着し、ルブレンを2.5vol%、クマリン誘導体を1.0vol%含む電子輸送性の発光層を40nm厚に形成し、その後AlQ3の電子注入輸送層を50nm厚に形成するほかは同様にして有機EL素子を得た。
この発光スペクトルを図6に示す。図6からルブレンのみが発光していることがわかる。このときのC/Rは0であり、発光スペクトルの半値巾は70nmであった。
<比較例8>
比較例7において、発光層のホスト材料をAlQ3のかわりにTPD005とした正孔輸送性の発光層を形成するほかは同様にして有機EL素子を得た。
この発光スペクトルを図7に示す。図7からルブレンのみが発光していることがわかる。このときのC/Rは0であり、発光スペクトルの半値巾は70nmであった。
<比較例9>
実施例9において、TPD005の正孔輸送層を形成したのち、AlQ3とルブレンを各蒸着速度0.1nm/sec、0.0025nm/secで共蒸着し、ルブレンを2.5vol%含む電子輸送性の発光層を20nm厚に形成し、さらにこの上にAlQ3とクマリン誘導体を各蒸着速度0.1nm/sec、0.001nm/secで共蒸着し、クマリン誘導体を1.0vol%含む電子輸送性の発光層を20nm厚に形成し、その後AlQ3の電子注入輸送層を50nm厚に形成するほかは同様にして有機EL素子を得た。
この発光スペクトルを図8に示す。図8からルブレンのみの発光であることがわかる。このときのC/Rは0であり、発光スペクトルの半値巾は70nmであった。
<比較例10>
比較例9において、2層構成の発光層のホスト材料をともにTPD005とした正孔輸送性の発光層を2層形成するほかは同様にして有機EL素子を得た。
この発光スペクトルを図9に示す。図9からクマリン誘導体とAlQ3の発光になっていることがわかる。このときのスペクトルの半値巾は90nmであった。
<比較例11>
実施例9において、TPD005の正孔輸送層を形成したのち、TPD005とルブレンを各蒸着速度0.1nm/sec、0.0025nm/secで共蒸着し、ルブレンを2.5vol%含む正孔輸送性の発光層を20nm厚に形成し、次いでAlQ3とクマリン誘導体を各蒸着速度0.1nm/sec、0.001nm/secで共蒸着し、クマリン誘導体を1.0vol%含む電子輸送性の発光層を20nm厚に形成し、その後AlQ3の電子注入輸送層を50nm厚に形成するほかは同様にして有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、12V・50mA/cm2で4500cd/m2の黄緑色(発光極大波長λmax=560nm、510nm、色度座標x=0.42y=0.54)の発光が確認され、この発光は乾燥アルゴン雰囲気中で10時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で100hr(初期輝度1000cd/m2、初期駆動電圧6.5V、駆動電圧上昇3.0V)であった。
図10に発光スペクトルを示す。図10より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/Rは0.5であった。また半値巾は80nmであった。
このものでは、クマリン誘導体とルブレンの発光がみられるが、発光寿命が短く実用的でないことがわかった。
<実施例10>
実施例9において、TPD005の正孔輸送層を形成したのち、TPD005とAlQ3とルブレンを各蒸着速度0.05nm/sec、0.05nm/sec、0.0025nm/secで共蒸着し、TPD005:AlQ3が1:1となり、ルブレンが2.5vol%含まれる混合層タイプの発光層を20nm厚に形成した。次いでAlQ3とクマリン誘導体を各蒸着速度0.1nm/sec、0.001nm/secで共蒸着し、クマリン誘導体を1.0vol%含む電子輸送性の発光層を20nm厚に形成し、その後AlQ3の電子注入輸送層を50nm厚に形成するほかは同様にして有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、12V・50mA/cm2で4000cd/m2の黄緑色(発光極大波長λmax=510nm、560nm、色度座標x=0.42y=0.54)の発光が確認され、この発光は乾燥アルゴン雰囲気中で1000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で40000hr(初期輝度1000cd/m2、初期駆動電圧6.9V、駆動電圧上昇3.0V)であった。
図11に発光スペクトルを示す。図11より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/Rは0.42であった。また半値巾は130nmであった。
<実施例11>
実施例9において、混合層タイプの第1および第2の発光層のホスト材料のTPD005とAlQ3の体積比をTPD005/AlQ3=75/25となるようにするほかは同様にして有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、12V・50mA/cm2で4100cd/m2の黄緑色(発光極大波長λmax=510nm、560nm、色度座標x=0.32y=0.58)の発光が確認され、この発光は乾燥アルゴン雰囲気中で1000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で30000hr(初期輝度900cd/m2、初期駆動電圧7.2V、駆動電圧上昇2.5V)であった。
図12に発光スペクトルを示す。図12より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/Rは1.4であった。また半値巾は120nmであった。このように混合層のホスト材料の比率をかえることにより実施例9とは異なるC/R比が得られることがわかる。
<実施例12>
実施例9において、混合層タイプの第1および第2の発光層のホスト材料のTPD005とAlQ3の体積比をTPD005/AlQ3=66/33となるようにするほかは同様にして有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、12V・50mA/cm2で3500cd/m2の黄緑色(発光極大波長λmax=510nm、560nm、色度座標x=0.34y=0.57)の発光が確認され、この発光は乾燥アルゴン雰囲気中で1000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で20000hr(初期輝度900cd/m2、初期駆動電圧7.3V、駆動電圧上昇2.5V)であった。
図13に発光スペクトルを示す。図13より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/Rは1.4であった。また半値巾は130nmであった。このように混合層のホスト材料の比率をかえることにより実施例9とは異なるC/R比が得られることがわかる。
<実施例13>
実施例9において、混合層タイプの第1および第2の発光層のホスト材料のTPD005とAlQ3の体積比をTPD005/AlQ3=25/75となるようにするほかは同様にして有機EL素子を得た。
この有機EL素子に電圧を印加して電流を流したところ、12V・50mA/cm2で4200cd/m2の黄緑色(発光極大波長λmax=510nm、560nm、色度座標x=0.47y=0.51)の発光が確認され、この発光は乾燥アルゴン雰囲気中で1000時間以上安定していた。部分的非発光部の出現および成長は全くなかった。輝度の半減期は10mA/cm2の定電流駆動で15000hr(初期輝度900cd/m2、初期駆動電圧7.5V、駆動電圧上昇2.5V)であった。
図14に発光スペクトルを示す。図14より、クマリン誘導体とルブレンがともに発光していることがわかる。この場合の発光スペクトル比C/Rは0.25であった。また半値巾は80nmであった。このように、混合層のホスト材料の比率をかえることにより実施例9とは異なるC/R比が得られることがわかる。
実施例9〜13の結果から、発光層のホスト材料をかえることにより、発光特性の変化がみられることがわかる。
また、比較例7〜11の結果を併せて考えると、多色発光の方法として、発光層のホストのキャリア輸送特性を本発明の範囲にすればよいことがわかる。
以上より、積層する発光層のキャリア輸送特性を本発明のように選ぶことによって(好ましくは、例えばバイポーラ型発光層として、混合層タイプの発光層を含む2層以上の発光層を設けることによって)、2種以上の発光種の発光が実用レベルで得られることがわかった。したがって多色発光が可能なことが確認された。
さらに、バイポーラ型である混合層のホスト材料の混合比を変えることで2層以上ある各発行層からの寄与を変化させることが可能になることがわかる。また、混合比は各層で独立に変えることもでき、これによる変化も期待できる。このようなバイポーラ型ホスト材料としては混合タイプのみならず、単一種のバイポーラ型材料とすることも可能である。本発明のポイントは積層する発光層のキャリア輸送性を選ぶことであり、キャリア輸送性を変えるには材料を変える必要がある。
産業上の利用可能性
以上より本発明の化合物を用いた有機EL素子は高輝度な発光が可能であり、連続発光時の輝度低下および駆動電圧上昇の小さい信頼性の高い素子であることは明らかである。また、複数の蛍光物質をそれぞれ安定に発光させ、広いスペクトル領域にわたる発光を得ることができ、多色発光が可能になる。さらに、多色発光のスペクトルを自由に設計することができる。
Claims (7)
- 正孔注入輸送性化合物と電子注入輸送性化合物とを含有する混合層に、さらに下記式(I)で示されるクマリン誘導体、下記式(III)で示されるキナクリドン化合物または下記式(IV)で示されるスチリル系アミン化合物をドーパントとしてドープした発光層を有する有機EL素子。
[式(I)中、R1、R2およびR3は各々水素原子、シアノ基、カルボキシル基、アルキル基、アリール基、アシル基、エステル基または複素環基を表し、これらは同一でも異なるものであってもよく、R1〜R3は各々互いに結合して環を形成してもよい。R4およびR7は各々水素原子、アルキル基またはアリール基を表し、R5およびR6は各々アルキル基またはアリール基を表し、R4とR5、R5とR6およびR6とR7は各々互いに結合して環を形成してもよい。]
[式(III)中、R21およびR22は各々水素原子、アルキル基またはアリール基を表し、これらは同一でも異なるものであってもよい。R23およびR24は各々アルキル基またはアリール基を表し、tおよびuは各々0または1〜4の整数である。tまたはuが2以上であるとき、隣接するR23同士またはR24同士は互いに結合して環を形成してもよい。]
[式(IV)中、R31は水素原子またはアリール基を表す。R32およびR33は水素原子、アリール基またはアルケニル基を表し、これらは同一でも異なるものであってもよい。R34はアリールアミノ基またはアリールアミノアリール基を表し、vは0または1〜5の整数である。] - 前記正孔注入輸送性化合物が芳香族三級アミンであり、前記電子注入輸送性化合物がキノリノナト金属錯体である請求項1の有機EL素子。
- 2層以上の発光層を有し、この2層以上の発光層の発光特性が互いに異なる請求項1または2の有機EL素子。
- 前記発光層が、少なくとも1層の正孔注入性および/または正孔輸送性の層と少なくとも1層の電子注入性および/または電子輸送性の層とで挟持される請求項1〜4のいずれかの有機EL素子。
- 前記正孔注入性および/または輸送性の層に、さらにルブレンがドーパントとしてドープされた請求項5の有機EL素子。
- 光の取り出し側にカラーフィルターおよび/または蛍光変換フィルターを配置し、カラーフィルターおよび/または蛍光変換フィルターを通して光を取り出すように構成した請求項1〜6のいずれかの有機EL素子。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP23589896 | 1996-08-19 | ||
| PCT/JP1997/002869 WO1998008360A1 (fr) | 1996-08-19 | 1997-08-19 | Dispositif electroluminescent organique |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006029059A Division JP4227995B2 (ja) | 1996-08-19 | 2006-02-06 | 有機el素子 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP3866293B2 true JP3866293B2 (ja) | 2007-01-10 |
Family
ID=16992882
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP51057898A Expired - Lifetime JP3866293B2 (ja) | 1996-08-19 | 1997-08-19 | 有機el素子 |
| JP2008282235A Expired - Lifetime JP4835677B2 (ja) | 1996-08-19 | 2008-10-31 | 有機el素子 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2008282235A Expired - Lifetime JP4835677B2 (ja) | 1996-08-19 | 2008-10-31 | 有機el素子 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US6285039B1 (ja) |
| EP (3) | EP1992672A1 (ja) |
| JP (2) | JP3866293B2 (ja) |
| DE (2) | DE69739752D1 (ja) |
| WO (1) | WO1998008360A1 (ja) |
Families Citing this family (120)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6344283B1 (en) * | 1996-12-28 | 2002-02-05 | Tdk Corporation | Organic electroluminescent elements |
| US20070200096A1 (en) * | 1998-02-12 | 2007-08-30 | Poopathy Kathirgamanathan | Doped lithium quinolate |
| KR100805451B1 (ko) * | 1998-09-09 | 2008-02-20 | 이데미쓰 고산 가부시키가이샤 | 유기 전자발광 소자 및 페닐렌디아민 유도체 |
| JP4381504B2 (ja) * | 1998-11-06 | 2009-12-09 | 新日鐵化学株式会社 | 有機エレクトロルミネッセンス素子 |
| JP2001052870A (ja) * | 1999-06-03 | 2001-02-23 | Tdk Corp | 有機el素子 |
| US8853696B1 (en) | 1999-06-04 | 2014-10-07 | Semiconductor Energy Laboratory Co., Ltd. | Electro-optical device and electronic device |
| KR100331800B1 (ko) * | 1999-07-02 | 2002-04-09 | 구자홍 | 퀴나크리돈(Quinacridone) 화합물을 발광물질로서사용하는 유기전계발광소자 |
| JP3589960B2 (ja) | 1999-09-16 | 2004-11-17 | 株式会社デンソー | 有機el素子 |
| JP4255610B2 (ja) * | 1999-12-28 | 2009-04-15 | 出光興産株式会社 | 白色系有機エレクトロルミネッセンス素子 |
| JP4434411B2 (ja) * | 2000-02-16 | 2010-03-17 | 出光興産株式会社 | アクティブ駆動型有機el発光装置およびその製造方法 |
| JP4631122B2 (ja) * | 2000-02-21 | 2011-02-16 | Tdk株式会社 | 有機el素子 |
| EP1262469B1 (en) * | 2000-02-29 | 2012-01-11 | Japan Science and Technology Agency | Polyacene derivatives and production thereof |
| KR20010104215A (ko) * | 2000-05-12 | 2001-11-24 | 야마자끼 순페이 | 발광장치 제작방법 |
| US7019457B2 (en) * | 2000-08-03 | 2006-03-28 | Semiconductor Energy Laboratory Co., Ltd. | Light emitting device having both electrodes formed on the insulating layer |
| JP4788078B2 (ja) * | 2000-09-20 | 2011-10-05 | コニカミノルタホールディングス株式会社 | 有機エレクトロルミネッセンス素子、有機エレクトロルミネッセンス素子材料および表示装置 |
| JP5142307B2 (ja) * | 2000-11-28 | 2013-02-13 | 独立行政法人産業技術総合研究所 | 有機色素を光増感剤とする半導体薄膜電極、光電変換素子 |
| SG115435A1 (en) * | 2000-12-28 | 2005-10-28 | Semiconductor Energy Lab | Luminescent device |
| TW545080B (en) | 2000-12-28 | 2003-08-01 | Semiconductor Energy Lab | Light emitting device and method of manufacturing the same |
| TW518909B (en) * | 2001-01-17 | 2003-01-21 | Semiconductor Energy Lab | Luminescent device and method of manufacturing same |
| TW519770B (en) * | 2001-01-18 | 2003-02-01 | Semiconductor Energy Lab | Light emitting device and manufacturing method thereof |
| CN100430515C (zh) | 2001-02-01 | 2008-11-05 | 株式会社半导体能源研究所 | 沉积装置和沉积方法 |
| SG118110A1 (en) | 2001-02-01 | 2006-01-27 | Semiconductor Energy Lab | Organic light emitting element and display device using the element |
| US20030010288A1 (en) * | 2001-02-08 | 2003-01-16 | Shunpei Yamazaki | Film formation apparatus and film formation method |
| TW582121B (en) * | 2001-02-08 | 2004-04-01 | Semiconductor Energy Lab | Light emitting device |
| TW550672B (en) * | 2001-02-21 | 2003-09-01 | Semiconductor Energy Lab | Method and apparatus for film deposition |
| SG118118A1 (en) | 2001-02-22 | 2006-01-27 | Semiconductor Energy Lab | Organic light emitting device and display using the same |
| US6627111B2 (en) * | 2001-03-06 | 2003-09-30 | International Business Machines Corp. | Organic light emitting displays and new fluorescent compounds |
| EP1374320B1 (en) * | 2001-03-14 | 2020-05-06 | The Trustees Of Princeton University | Materials and devices for blue phosphorescence based organic light emitting diodes |
| US6984546B2 (en) * | 2001-03-15 | 2006-01-10 | Delta Optoelectronics, Inc. | Method for forming a thin film light emitting device |
| JP4329305B2 (ja) | 2001-08-27 | 2009-09-09 | 株式会社デンソー | 有機el素子 |
| KR100439648B1 (ko) * | 2001-08-29 | 2004-07-12 | 엘지.필립스 엘시디 주식회사 | 유기전계발광소자 |
| JP3823312B2 (ja) * | 2001-10-18 | 2006-09-20 | 日本電気株式会社 | 有機薄膜トランジスタ |
| US7488986B2 (en) * | 2001-10-26 | 2009-02-10 | Semiconductor Energy Laboratory Co., Ltd. | Light emitting device |
| KR100577179B1 (ko) * | 2001-10-30 | 2006-05-10 | 엘지전자 주식회사 | 유기 전계 발광 소자 |
| US6773830B2 (en) * | 2001-11-08 | 2004-08-10 | Xerox Corporation | Green organic light emitting devices |
| US6759146B2 (en) * | 2001-11-08 | 2004-07-06 | Xerox Corporation | Organic devices |
| KR100459134B1 (ko) * | 2002-01-26 | 2004-12-03 | 엘지전자 주식회사 | 황색 발광 물질용 화합물 및 이를 포함한 유기 전계 발광소자 |
| KR100563675B1 (ko) * | 2002-04-09 | 2006-03-28 | 캐논 가부시끼가이샤 | 유기 발광소자 및 유기 발광소자 패키지 |
| US6931132B2 (en) * | 2002-05-10 | 2005-08-16 | Harris Corporation | Secure wireless local or metropolitan area network and related methods |
| US20040001969A1 (en) * | 2002-06-27 | 2004-01-01 | Eastman Kodak Company | Device containing green organic light-emitting diode |
| JP4025137B2 (ja) * | 2002-08-02 | 2007-12-19 | 出光興産株式会社 | アントラセン誘導体及びそれを利用した有機エレクトロルミネッセンス素子 |
| CN101628847B (zh) | 2002-08-23 | 2013-05-29 | 出光兴产株式会社 | 有机电致发光器件和蒽衍生物 |
| JP4287198B2 (ja) | 2002-11-18 | 2009-07-01 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| JP4152173B2 (ja) * | 2002-11-18 | 2008-09-17 | 出光興産株式会社 | 有機エレクトロルミネッセンス素子 |
| KR100650046B1 (ko) * | 2002-11-20 | 2006-11-27 | 엘지전자 주식회사 | 고효율의 유기 전계 발광 소자 |
| US20040140758A1 (en) * | 2003-01-17 | 2004-07-22 | Eastman Kodak Company | Organic light emitting device (OLED) display with improved light emission using a metallic anode |
| US20040142207A1 (en) * | 2003-01-17 | 2004-07-22 | Wen-Chun Wang | Organic electoluminescent device with improved performance |
| JPWO2004068913A1 (ja) | 2003-01-28 | 2006-05-25 | 株式会社半導体エネルギー研究所 | 発光素子およびその作製方法 |
| KR100560785B1 (ko) * | 2003-02-03 | 2006-03-13 | 삼성에스디아이 주식회사 | 저전압에서 구동되는 유기 전계 발광 소자 |
| JP3650101B2 (ja) * | 2003-02-04 | 2005-05-18 | 三洋電機株式会社 | 有機エレクトロルミネッセンス装置およびその製造方法 |
| JP2004265623A (ja) * | 2003-02-12 | 2004-09-24 | Denso Corp | 有機電界発光素子 |
| JP2004288624A (ja) * | 2003-03-03 | 2004-10-14 | Sanyo Electric Co Ltd | エレクトロルミネッセンス表示装置 |
| KR100501702B1 (ko) * | 2003-03-13 | 2005-07-18 | 삼성에스디아이 주식회사 | 유기 전계 발광 디스플레이 장치 |
| JP4487587B2 (ja) | 2003-05-27 | 2010-06-23 | 株式会社デンソー | 有機el素子およびその製造方法 |
| KR100527194B1 (ko) * | 2003-06-24 | 2005-11-08 | 삼성에스디아이 주식회사 | 도핑된 정공수송층 및/또는 정공주입층을 갖는유기전계발광소자 |
| US7092206B2 (en) * | 2003-06-25 | 2006-08-15 | Hitachi Global Storage Technologies Netherlands B.V. | Magnetic head with magnetic layers of differing widths and third pole with reduced thickness |
| JP4198086B2 (ja) * | 2003-06-25 | 2008-12-17 | オリンパス株式会社 | 蛍光観察用装置 |
| EP1652410A1 (de) | 2003-08-05 | 2006-05-03 | Technische Universität Braunschweig | Verwendung einer schicht aus hydrophoben, linear oder zweidimensional polyzyklischen aromaten als sperrschicht oder kapselung und mit einer derartigen schicht aufgebaute elektrische bauelemente mit organischen polymeren |
| JP2005063763A (ja) * | 2003-08-08 | 2005-03-10 | Seiko Epson Corp | 有機el装置とその製造方法、及び電子機器 |
| JP2005100921A (ja) * | 2003-08-22 | 2005-04-14 | Sony Corp | 有機el素子および表示装置 |
| KR101246247B1 (ko) * | 2003-08-29 | 2013-03-21 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 전계발광소자 및 그것을 구비한 발광장치 |
| JP4636239B2 (ja) * | 2003-12-26 | 2011-02-23 | 株式会社ファインラバー研究所 | Led用蛍光組成物、led用蛍光部材及び半導体発光装置 |
| JP4631386B2 (ja) * | 2004-02-25 | 2011-02-16 | 株式会社デンソー | 有機el素子 |
| US7662485B2 (en) * | 2004-03-16 | 2010-02-16 | Eastman Kodak Company | White organic light-emitting devices with improved performance |
| JP2005277065A (ja) * | 2004-03-24 | 2005-10-06 | Pioneer Electronic Corp | 回路素子およびその製造方法 |
| JP4393249B2 (ja) * | 2004-03-31 | 2010-01-06 | 株式会社 日立ディスプレイズ | 有機発光素子,画像表示装置、及びその製造方法 |
| US7622200B2 (en) | 2004-05-21 | 2009-11-24 | Semiconductor Energy Laboratory Co., Ltd. | Light emitting element |
| JPWO2005117500A1 (ja) * | 2004-05-27 | 2008-04-03 | 出光興産株式会社 | 白色系有機エレクトロルミネッセンス素子 |
| DE102004031000A1 (de) * | 2004-06-26 | 2006-01-12 | Covion Organic Semiconductors Gmbh | Organische Elektrolumineszenzvorrichtungen |
| JP4782791B2 (ja) * | 2004-09-22 | 2011-09-28 | ドーサン・コーポレーション | 三原色光を利用する白色有機電界発光素子 |
| KR100683737B1 (ko) * | 2004-12-13 | 2007-02-15 | 삼성에스디아이 주식회사 | 전계발광 디스플레이 장치 |
| US7351999B2 (en) * | 2004-12-16 | 2008-04-01 | Au Optronics Corporation | Organic light-emitting device with improved layer structure |
| JP2006347945A (ja) * | 2005-06-15 | 2006-12-28 | Idemitsu Kosan Co Ltd | 特定の芳香族アミン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR100713989B1 (ko) * | 2005-07-15 | 2007-05-04 | 삼성에스디아이 주식회사 | 백색 유기 발광 소자 및 그의 제조방법 |
| KR101369864B1 (ko) * | 2005-08-12 | 2014-03-05 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 반도체장치 및 그 제조방법 |
| US8101941B2 (en) * | 2005-09-26 | 2012-01-24 | Osram Opto Semiconductors Gmbh | Interface conditioning to improve efficiency and lifetime of organic electroluminescence devices |
| JP2007115419A (ja) * | 2005-10-18 | 2007-05-10 | Fuji Electric Holdings Co Ltd | 有機発光素子 |
| US8956738B2 (en) * | 2005-10-26 | 2015-02-17 | Global Oled Technology Llc | Organic element for low voltage electroluminescent devices |
| US20070126347A1 (en) * | 2005-12-01 | 2007-06-07 | Eastman Kodak Company | OLEDS with improved efficiency |
| JP4770699B2 (ja) * | 2005-12-16 | 2011-09-14 | ソニー株式会社 | 表示素子 |
| KR100759562B1 (ko) * | 2005-12-22 | 2007-09-18 | 삼성에스디아이 주식회사 | 디스플레이 장치용 섀시 조립체 및 이를 구비한 디스플레이장치 |
| KR100670383B1 (ko) | 2006-01-18 | 2007-01-16 | 삼성에스디아이 주식회사 | 유기 발광 소자 및 이를 구비한 평판 표시 장치 |
| JP4843321B2 (ja) * | 2006-01-31 | 2011-12-21 | Jnc株式会社 | クマリン系化合物、発光素子用材料及び有機電界発光素子 |
| KR100872692B1 (ko) * | 2006-03-06 | 2008-12-10 | 주식회사 엘지화학 | 신규한 안트라센 유도체 및 이를 이용한 유기 전자 소자 |
| US9112170B2 (en) * | 2006-03-21 | 2015-08-18 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, and electronic device |
| KR20070101984A (ko) * | 2006-04-13 | 2007-10-18 | 삼성에스디아이 주식회사 | 전하분리층을 구비한 유기 전기발광 소자 |
| US20070252515A1 (en) * | 2006-04-27 | 2007-11-01 | Eastman Kodak Company | Electroluminescent device including an anthracene derivative |
| EP1863105B1 (en) * | 2006-06-02 | 2020-02-19 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, and electronic device |
| DE102006051745B4 (de) * | 2006-09-28 | 2024-02-08 | OSRAM Opto Semiconductors Gesellschaft mit beschränkter Haftung | LED-Halbleiterkörper und Verwendung eines LED-Halbleiterkörpers |
| TWI323826B (en) * | 2006-11-15 | 2010-04-21 | Ether Precision Inc | The manufacturing process of the combine of optical lens and chip |
| US7911135B2 (en) | 2006-11-29 | 2011-03-22 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light emitting device, electronic appliance, and method of manufacturing the same |
| US8299787B2 (en) * | 2006-12-18 | 2012-10-30 | Konica Minolta Holdings, Inc. | Multicolor phosphorescent organic electroluminescent element and lighting system |
| US8283724B2 (en) * | 2007-02-26 | 2012-10-09 | Semiconductor Energy Laboratory Co., Ltd. | Memory element and semiconductor device, and method for manufacturing the same |
| KR100858816B1 (ko) * | 2007-03-14 | 2008-09-17 | 삼성에스디아이 주식회사 | 안트라센 유도체 화합물을 포함하는 유기막을 구비하는유기 발광 소자 |
| EP1972625B1 (en) * | 2007-03-20 | 2013-08-21 | Semiconductor Energy Laboratory Co., Ltd. | Oxadiazole derivative and light-emitting element, light-emitting device, and electronic device in which the oxadiazole derivative is used |
| JP5530608B2 (ja) * | 2007-09-13 | 2014-06-25 | 株式会社半導体エネルギー研究所 | 発光素子および発光装置 |
| CN102017799B (zh) * | 2008-05-19 | 2012-12-12 | 夏普株式会社 | 有机电致发光元件、显示装置和照明装置 |
| JP5003594B2 (ja) * | 2008-05-23 | 2012-08-15 | 株式会社デンソー | 有機el素子 |
| KR101551207B1 (ko) * | 2008-09-04 | 2015-09-08 | 롬엔드하스전자재료코리아유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고 있는 유기 발광 소자 |
| JP2010103082A (ja) * | 2008-09-26 | 2010-05-06 | Toppan Printing Co Ltd | 有機エレクトロルミネッセンス素子及びその製造方法 |
| DE102008063490B4 (de) * | 2008-12-17 | 2023-06-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtung und Verfahren zum Einstellen des Farbortes einer weiß emittierenden Elektrolumineszenzvorrichtung |
| US8367222B2 (en) * | 2009-02-27 | 2013-02-05 | Idemitsu Kosan Co., Ltd. | Organic electroluminescent device |
| WO2010137509A1 (en) | 2009-05-29 | 2010-12-02 | Semiconductor Energy Laboratory Co., Ltd. | Light-emitting element, light-emitting device, lighting device, and electronic appliance |
| JP2011009205A (ja) * | 2009-05-29 | 2011-01-13 | Semiconductor Energy Lab Co Ltd | 発光素子、発光装置及びその作製方法 |
| TWI488941B (zh) * | 2009-09-02 | 2015-06-21 | 葛來西雅帝史派有限公司 | 新穎有機電場發光化合物及使用該化合物之有機電場發光裝置 |
| US20120283622A1 (en) * | 2009-11-10 | 2012-11-08 | Nath Guenther | Dermatological treatment device |
| JP2011139044A (ja) | 2009-12-01 | 2011-07-14 | Semiconductor Energy Lab Co Ltd | 発光素子、発光装置、電子機器、および照明装置 |
| KR20120005793A (ko) * | 2010-07-09 | 2012-01-17 | 삼성모바일디스플레이주식회사 | 표시 장치 |
| US20180175319A1 (en) | 2016-12-15 | 2018-06-21 | Universal Display Corporation | Spectral emission modification using localized surface plasmon of metallic nanoparticles |
| JP2020518107A (ja) | 2017-04-26 | 2020-06-18 | オーティーアイ ルミオニクス インコーポレーテッドOti Lumionics Inc. | 表面上のコーティングをパターン化する方法およびパターン化されたコーティングを含むデバイス |
| US11751415B2 (en) | 2018-02-02 | 2023-09-05 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| JP7325731B2 (ja) | 2018-08-23 | 2023-08-15 | 国立大学法人九州大学 | 有機エレクトロルミネッセンス素子 |
| CN109148728B (zh) * | 2018-08-31 | 2019-10-29 | 昆山国显光电有限公司 | 一种显示面板及显示装置 |
| US11158831B2 (en) * | 2019-02-22 | 2021-10-26 | Samsung Display Co., Ltd. | Organic light-emitting device |
| US11730012B2 (en) | 2019-03-07 | 2023-08-15 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| KR20220009961A (ko) | 2019-04-18 | 2022-01-25 | 오티아이 루미오닉스 인크. | 핵 생성 억제 코팅 형성용 물질 및 이를 포함하는 디바이스 |
| US12069938B2 (en) | 2019-05-08 | 2024-08-20 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| US11985888B2 (en) * | 2019-08-12 | 2024-05-14 | The Regents Of The University Of Michigan | Organic electroluminescent device |
| KR20210072209A (ko) * | 2019-12-06 | 2021-06-17 | 삼성디스플레이 주식회사 | 유기 전계 발광 소자 및 유기 전계 발광 소자용 아민 화합물 |
| WO2022123431A1 (en) | 2020-12-07 | 2022-06-16 | Oti Lumionics Inc. | Patterning a conductive deposited layer using a nucleation inhibiting coating and an underlying metallic coating |
Family Cites Families (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2844484A (en) | 1955-07-22 | 1958-07-22 | Du Pont | Organic pigments |
| US2844485A (en) | 1955-07-22 | 1958-07-22 | Du Pont | Organic pigments |
| US2821529A (en) | 1955-07-22 | 1958-01-28 | Du Pont | Process for the preparation of linear quinacridones |
| US2821530A (en) | 1956-01-04 | 1958-01-28 | Du Pont | Tetrahalogen substituted quinacridones |
| CH390250A (de) | 1958-06-19 | 1965-07-30 | Geigy Ag J R | Verfahren zur Herstellung von fluoreszierenden Farbstoffen |
| DE3119653C2 (de) | 1981-05-16 | 1985-05-09 | Grundig E.M.V. Elektro-Mechanische Versuchsanstalt Max Grundig holländ. Stiftung & Co KG, 8510 Fürth | Verfahren zur dynamischen Cross-Color-Unterdrückung, vorzugsweise in Codern von Farbfernsehsignalquellen |
| US4720432A (en) | 1987-02-11 | 1988-01-19 | Eastman Kodak Company | Electroluminescent device with organic luminescent medium |
| JP2814435B2 (ja) | 1987-03-02 | 1998-10-22 | イーストマン・コダック・カンパニー | 改良薄膜発光帯をもつ電場発光デバイス |
| US4769292A (en) | 1987-03-02 | 1988-09-06 | Eastman Kodak Company | Electroluminescent device with modified thin film luminescent zone |
| JP2869446B2 (ja) * | 1989-01-13 | 1999-03-10 | 株式会社リコー | 電界発光素子 |
| JP2651233B2 (ja) | 1989-01-20 | 1997-09-10 | 出光興産株式会社 | 薄膜有機el素子 |
| JPH02210790A (ja) * | 1989-02-08 | 1990-08-22 | Ricoh Co Ltd | 電界発光素子 |
| JP2869447B2 (ja) * | 1989-02-08 | 1999-03-10 | 株式会社リコー | 電界発光素子 |
| JP2772019B2 (ja) * | 1989-02-17 | 1998-07-02 | パイオニア株式会社 | 電界発光素子 |
| JPH03792A (ja) | 1989-02-17 | 1991-01-07 | Pioneer Electron Corp | 電界発光素子 |
| US5126214A (en) * | 1989-03-15 | 1992-06-30 | Idemitsu Kosan Co., Ltd. | Electroluminescent element |
| JP2795932B2 (ja) * | 1989-11-09 | 1998-09-10 | 出光興産株式会社 | エレクトロルミネッセンス素子 |
| JP2879080B2 (ja) * | 1989-03-23 | 1999-04-05 | 株式会社リコー | 電界発光素子 |
| JPH03190088A (ja) * | 1989-12-20 | 1991-08-20 | Sanyo Electric Co Ltd | 有機el素子 |
| JP2815472B2 (ja) | 1990-01-22 | 1998-10-27 | パイオニア株式会社 | 電界発光素子 |
| JPH04334894A (ja) * | 1991-05-10 | 1992-11-20 | Ricoh Co Ltd | 有機薄膜型電界発光素子 |
| JPH0570733A (ja) | 1991-06-14 | 1993-03-23 | Dainippon Ink & Chem Inc | 水性塗料組成物およびそれを用いた塗装方法 |
| JPH05202356A (ja) | 1991-09-11 | 1993-08-10 | Pioneer Electron Corp | 有機エレクトロルミネッセンス素子 |
| JPH05182762A (ja) * | 1991-12-27 | 1993-07-23 | Fuji Electric Co Ltd | 有機薄膜発光素子 |
| US5294869A (en) | 1991-12-30 | 1994-03-15 | Eastman Kodak Company | Organic electroluminescent multicolor image display device |
| JP3476855B2 (ja) * | 1992-01-07 | 2003-12-10 | 株式会社東芝 | 有機el素子 |
| JP3142378B2 (ja) | 1992-06-22 | 2001-03-07 | ティーディーケイ株式会社 | 有機el素子 |
| JPH06158038A (ja) * | 1992-11-17 | 1994-06-07 | Pioneer Electron Corp | 有機エレクトロルミネッセンス素子 |
| DE4300185A1 (de) | 1993-01-07 | 1994-07-14 | Huels Chemische Werke Ag | Lagerstabile Lösungen eines Gemisches aus carbonisiertem Magnesiummethylat, carbonisiertem Magnesiumethylat und deren carbonisiertem Mischalkoxid in einem Gemisch aus Methanol und Ethanol sowie deren Herstellung und Verwendung |
| JPH06215874A (ja) | 1993-01-20 | 1994-08-05 | Idemitsu Kosan Co Ltd | 有機エレクトロルミネッセンス素子 |
| JPH06240243A (ja) | 1993-02-19 | 1994-08-30 | Pioneer Electron Corp | 有機エレクトロルミネッセンス素子 |
| JP3237282B2 (ja) * | 1993-03-18 | 2001-12-10 | 住友化学工業株式会社 | 有機エレクトロルミネッセンス素子 |
| JPH0743564A (ja) | 1993-06-29 | 1995-02-14 | Ricoh Co Ltd | 光ファイバ付き光信号伝送装置及びそのガイド基板の作製方法 |
| DE69412567T2 (de) | 1993-11-01 | 1999-02-04 | Hodogaya Chemical Co., Ltd., Tokio/Tokyo | Aminverbindung und sie enthaltende Elektrolumineszenzvorrichtung |
| JP3451680B2 (ja) * | 1993-11-15 | 2003-09-29 | 三菱化学株式会社 | 有機電界発光素子 |
| JP3828595B2 (ja) * | 1994-02-08 | 2006-10-04 | Tdk株式会社 | 有機el素子 |
| EP0666298A3 (en) * | 1994-02-08 | 1995-11-15 | Tdk Corp | Organic electroluminescent element and compound used therein. |
| JP3816969B2 (ja) | 1994-04-26 | 2006-08-30 | Tdk株式会社 | 有機el素子 |
| JP3642606B2 (ja) | 1994-04-28 | 2005-04-27 | Tdk株式会社 | 有機el素子 |
| JPH0878163A (ja) * | 1994-09-07 | 1996-03-22 | Kemipuro Kasei Kk | 有機エレクトロルミネッセンス素子およびその製法 |
| JP3449020B2 (ja) * | 1995-03-20 | 2003-09-22 | 松下電器産業株式会社 | 電界発光素子 |
| KR100251649B1 (ko) | 1997-04-22 | 2000-04-15 | 윤종용 | 반도체장치제조공정용초순수의제조를위한살균조성물 및 이를이용한초순수제조장치의살균방법 |
| US6172458B1 (en) | 1997-04-30 | 2001-01-09 | Tdk Corporation | Organic electroluminescent device with electrode of aluminum-lithium alloy |
| JPH10321374A (ja) | 1997-05-20 | 1998-12-04 | Tdk Corp | 有機el素子 |
| JP4142782B2 (ja) | 1998-06-26 | 2008-09-03 | Tdk株式会社 | 有機el素子 |
| JP2000100575A (ja) | 1998-07-24 | 2000-04-07 | Tdk Corp | 有機el素子 |
| JP2000208276A (ja) | 1999-01-13 | 2000-07-28 | Tdk Corp | 有機el素子 |
| JP2000208277A (ja) | 1999-01-13 | 2000-07-28 | Tdk Corp | 有機el素子 |
| JP3824798B2 (ja) | 1999-01-21 | 2006-09-20 | Tdk株式会社 | 有機el素子 |
| JP2000223272A (ja) | 1999-01-27 | 2000-08-11 | Tdk Corp | 有機el素子 |
| JP2000268965A (ja) | 1999-03-16 | 2000-09-29 | Tdk Corp | 有機el素子 |
| JP4543446B2 (ja) | 1999-04-05 | 2010-09-15 | Tdk株式会社 | 有機el素子 |
-
1997
- 1997-08-19 US US09/051,479 patent/US6285039B1/en not_active Expired - Lifetime
- 1997-08-19 DE DE69739752T patent/DE69739752D1/de not_active Expired - Lifetime
- 1997-08-19 EP EP08013827A patent/EP1992672A1/en not_active Withdrawn
- 1997-08-19 EP EP03013023A patent/EP1342769B1/en not_active Expired - Lifetime
- 1997-08-19 WO PCT/JP1997/002869 patent/WO1998008360A1/ja active IP Right Grant
- 1997-08-19 DE DE69729931T patent/DE69729931T2/de not_active Expired - Lifetime
- 1997-08-19 JP JP51057898A patent/JP3866293B2/ja not_active Expired - Lifetime
- 1997-08-19 EP EP97935819A patent/EP0857007B1/en not_active Expired - Lifetime
-
2001
- 2001-03-14 US US09/805,244 patent/US6603140B2/en not_active Expired - Lifetime
-
2008
- 2008-10-31 JP JP2008282235A patent/JP4835677B2/ja not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| DE69739752D1 (de) | 2010-03-18 |
| JP4835677B2 (ja) | 2011-12-14 |
| DE69729931T2 (de) | 2005-06-30 |
| JP2009081447A (ja) | 2009-04-16 |
| DE69729931D1 (de) | 2004-08-26 |
| EP0857007A4 (ja) | 1998-09-02 |
| EP0857007A1 (en) | 1998-08-05 |
| EP1992672A1 (en) | 2008-11-19 |
| EP1342769A1 (en) | 2003-09-10 |
| US20020038867A1 (en) | 2002-04-04 |
| EP1342769B1 (en) | 2010-01-27 |
| US6285039B1 (en) | 2001-09-04 |
| EP0857007B1 (en) | 2004-07-21 |
| WO1998008360A1 (fr) | 1998-02-26 |
| US6603140B2 (en) | 2003-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3866293B2 (ja) | 有機el素子 | |
| JP4623223B2 (ja) | 有機el素子 | |
| JP3712760B2 (ja) | 有機el素子 | |
| JP4810687B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP4036041B2 (ja) | 有機エレクトロルミネッセンス素子及び表示装置 | |
| JP4364130B2 (ja) | 有機el素子 | |
| JP3974720B2 (ja) | 有機el素子 | |
| JP3793607B2 (ja) | クマリン誘導体を用いた有機el素子 | |
| JP4300788B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP4103442B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP3871396B2 (ja) | 有機el素子 | |
| JP4227995B2 (ja) | 有機el素子 | |
| JP3742176B2 (ja) | 有機el素子用化合物および有機el素子 | |
| JP4726384B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP4656111B2 (ja) | 有機エレクトロルミネッセンス素子 | |
| JP4200152B2 (ja) | 有機el素子 | |
| JP4129599B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP5040671B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP4183016B2 (ja) | 有機エレクトロルミネッセンス素子および表示装置 | |
| JP4743186B2 (ja) | 有機エレクトロルミネッセンス素子及び表示装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD01 | Notification of change of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7421 Effective date: 20040601 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20051206 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060206 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060530 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060731 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20060919 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20061005 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20091013 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101013 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111013 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121013 Year of fee payment: 6 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121013 Year of fee payment: 6 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121013 Year of fee payment: 6 |
|
| R360 | Written notification for declining of transfer of rights |
Free format text: JAPANESE INTERMEDIATE CODE: R360 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121013 Year of fee payment: 6 |
|
| R370 | Written measure of declining of transfer procedure |
Free format text: JAPANESE INTERMEDIATE CODE: R370 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131013 Year of fee payment: 7 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131013 Year of fee payment: 7 |
|
| R370 | Written measure of declining of transfer procedure |
Free format text: JAPANESE INTERMEDIATE CODE: R370 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131013 Year of fee payment: 7 |
|
| S111 | Request for change of ownership or part of ownership |
Free format text: JAPANESE INTERMEDIATE CODE: R313113 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131013 Year of fee payment: 7 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |