JP2014510078A - 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 - Google Patents
3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 Download PDFInfo
- Publication number
- JP2014510078A JP2014510078A JP2013557904A JP2013557904A JP2014510078A JP 2014510078 A JP2014510078 A JP 2014510078A JP 2013557904 A JP2013557904 A JP 2013557904A JP 2013557904 A JP2013557904 A JP 2013557904A JP 2014510078 A JP2014510078 A JP 2014510078A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- patient
- compound
- cell
- lymphoma
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/18—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by applying electromagnetic radiation, e.g. microwaves
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/196—Carboxylic acids, e.g. valproic acid having an amino group the amino group being directly attached to a ring, e.g. anthranilic acid, mefenamic acid, diclofenac, chlorambucil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/475—Quinolines; Isoquinolines having an indole ring, e.g. yohimbine, reserpine, strychnine, vinblastine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/10—Laxatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/18—Antioxidants, e.g. antiradicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Abstract
【選択図】なし
Description
本明細書で提供されるのは、癌を治療、予防、及び/又は管理する方法であって、患者に、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形を投与することを含む、方法である。
(2.1 癌の病理生物学)
癌は、主として、所与の正常組織に由来する異常細胞の数の増加、これらの異常細胞による隣接組織の浸潤、又は悪性細胞の所属リンパ節及び離れた部位へのリンパ行性もしくは血行性拡散(転移)を特徴とする。臨床データ及び分子生物学的研究により、癌は、特定の条件下で新生物形成へと進行し得る微小な前新生物性変化から始まる多段階プロセスであることが示されている。新生物性病変は、クローン性に発達することができ、特に、新生物性細胞が宿主の免疫監視を逃れる条件下で、浸潤、成長、転移、及び異質性の能力の増大を進展させることができる。Roitt,I., Brostoff,J及びKale,D.の文献、Immunology, 17.1-17.12(第3版, Mosby, St. Louis, Mo., 1993)。
現在の癌療法は、患者の新生物性細胞を根絶するための外科手術、化学療法、ホルモン療法、及び/又は放射線治療を含み得る(例えば、Stockdaleの文献、1998, Medicine, 第3巻, Rubenstein及びFederman編, 第12章, 第IV節を参照されたい)。最近、癌療法は、生物療法又は免疫療法も含み得る。これらの手法は全て、患者にとって重大な欠点をもたらし得る。例えば、外科手術は、患者の健康が原因で禁忌となり得るか、又は患者にとって許容し得ないものとなり得る。さらに、外科手術では、新生物性組織を完全には除去することができない。放射線療法は、新生物性組織が放射線に対して正常組織よりも高い感受性を示す場合にしか効果的でない。放射線療法はまた、深刻な副作用を誘発することがしばしばある。ホルモン療法は、単剤として施されることが稀である。ホルモン療法は効果的であり得るが、それは、他の治療によって癌細胞の大部分が除去された後に、癌の再発を予防するか又は遅延させるために用いられることが多い。特定の生物療法及び他の療法は、数が限られており、発疹もしくは腫脹、発熱、悪寒、及び疲労を含むインフルエンザ様症状、消化管障害、又はアレルギー反応などの副作用をもたらし得る。
タンパク質セレブロン(CRBN)は、植物からヒトまで保存されている442アミノ酸のタンパク質である。ヒトでは、CRBN遺伝子は、常染色体劣性非症候群性精神遅滞(ARNSMR)の候補遺伝子として同定されている。Higgins, J.J.らの文献、Neurology, 2004, 63:1927-1931を参照されたい。CRBNは、当初は、ラット脳のカルシウム活性化型カリウムチャネルタンパク質(SLO1)と相互作用する新規のRGS含有タンパク質と特徴付けられ、後に、AMPK7及びDDB1とともに網膜の電位依存性クロライドチャネル(CIC-2)と相互作用することが示された。Jo, S.らの文献、J. Neurochem, 2005, 94:1212-1224; Hohberger B.らの文献、FEBS Lett, 2009, 583:633-637; Angers S.らの文献、Nature, 2006, 443:590-593を参照されたい。DDB1は、最初、損傷DNA結合タンパク質2(DDB2)と会合するヌクレオチド除去修復タンパク質として同定された。その活性欠損は、色素性乾皮症相補群E(XPE)を有する患者において修復欠損を引き起こす。DDB1は、ユビキチン化、及びその後の標的タンパク質のプロテアソーム分解を媒介する多くの異なるDCX(DDB1-CUL4-X-ボックス)E3ユビキチン-タンパク質リガーゼ複合体の構成要素として機能するようにも見える。CRBNはまた、大脳皮質の疾患に対する治療剤の開発の標的として同定されている。WO 2010/137547 A1号を参照されたい。
本明細書で提供されるのは、原発性癌及び転移性癌、並びに従来の化学療法に不応性又は抵抗性である癌を含む、癌を治療及び予防する方法であって、そのような治療又は予防を必要としている患者に、治療的又は予防的有効量の、式Iの構造:
(i)3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンによる治療に感受性のあるリンパ腫、非ホジキンリンパ腫、多発性骨髄腫、白血病、AML、又は固形腫瘍を有する患者を特定すること;及び
(ii)該患者に、治療的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその医薬として許容し得る塩もしくは溶媒和物(例えば、水和物)を投与することを含む、方法である。
本明細書で提供されるのは、癌を治療、管理、又は予防する方法であって、そのような治療、管理、又は予防を必要としている患者に、治療的又は予防的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形を、単剤として又は組合せ療法の一部として投与することを含む、方法である。
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB経路の活性を測定すること;及び
(iii)該生体試料中のNF-κB活性のレベルを非活性化B細胞リンパ腫サブタイプの生体試料のNF-κB活性のレベルと比較すること;
を含む、方法であり、
ここで、非活性化B細胞サブタイプのリンパ腫細胞と比べたNF-κB活性のレベルの増加は、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン治療に対する効果的な患者腫瘍応答の可能性を示す。
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB活性のレベルを測定すること;
(iii)治療的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物を該患者に投与すること;
(iv)第二の生体試料を該患者から得ること;
(v)該第二の生体試料中のNF-κB活性のレベルを測定すること;及び
(vi)該第一の生体試料中のNF-κB活性のレベルを該第二の生体試料中のNF-κB活性のレベルと比較すること;
を含む、方法であり
ここで、該第一の生体試料と比べた該第二の生体試料中のNF-κB活性のレベルの減少は、効果的な患者腫瘍応答の可能性を示す。
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB活性のレベルを測定すること;及び
(iii)該生体試料中のNF-κB活性のレベルを対照未治療試料と比較すること;
を含む、方法であり、
ここで、該対照と比べた該生体試料中のNF-κB活性のレベルの減少は、薬物治療プロトコルの患者コンプライアンスを示す。
(i)生体試料を該患者から得ること;
(ii)該生体試料由来の細胞を培養すること;
(iii)RNAを該培養細胞から精製すること;及び
(iv)非ホジキンリンパ腫の対照非活性化B細胞表現型と比べた非ホジキンリンパ腫の活性化B細胞表現型と関連する遺伝子の発現の増加を同定すること;
を含む、方法であり、
ここで、非ホジキンリンパ腫の活性化B細胞表現型と関連する遺伝子の発現の増加は、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン治療に対する効果的な患者腫瘍応答の可能性を示す。
(i)3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンによる治療に感受性のある非ホジキンリンパ腫を有する患者を特定すること;及び
(ii)該患者に、治療的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその医薬として許容し得る塩、溶媒和物、もしくは水和物を投与することを含む、方法である。
(i)活性化B細胞サブタイプ細胞の生存に必要とされる造血系特異的Etsファミリー転写因子SPIBの過剰発現;
(ii)GCBサブタイプ細胞よりも高い構成的IRF4/MUM1発現;
(iii)第3トリソミーによって上方調節される、より高い構成的FOXP1発現;
(iv)より高い構成的Blimp1(すなわち、PRDM1)発現;及び
(v)より高い構成的CARD11遺伝子発現;並びに
(vi)非活性化B細胞サブタイプDLBCL細胞と比べたNF-κB活性のレベルの増加
のうちの1つ又は複数によって特徴付けられる。
(i)固体支持体;及び
(ii)生体試料中の非ホジキンリンパ腫の活性化B細胞表現型のバイオマーカーの発現を検出する手段
を含む、キットである。
本明細書に記載の開示を理解しやすくするために、いくつかの用語を以下に定義する。
「全生存」は、無作為化から全原因による死亡までの時間と定義され、かつ包括解析集団(intent-to-treat population)において測定される。全生存は、無作為化対照試験で評価されるべきである。全生存の統計的に有意な改善の立証は、毒性プロファイルが許容し得るものである場合、臨床的に意義があるものとみなすことができ、これにより、新薬の承認がしばしば支持されてきた。
本明細書で提供される方法での使用に好適な化合物は、式I:
本明細書で提供される化合物、例えば、式Iの化合物、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形は、本明細書で提供される方法及び組成物において1以上の他の薬理学的活性化合物(「第二の活性剤」)と組み合わせることができる。特定の組合せは、特定のタイプの癌、並びに望ましくない血管新生と関連するか、又はそれを特徴とする特定の疾患及び状態の治療において相乗的に作用すると考えられる。本明細書で提供される式Iの化合物は、特定の第二の活性剤と関連する有害作用を緩和するように作用することもでき、また、いくつかの第二の活性剤を用いて、本明細書で提供される式Iの化合物と関連する有害作用を緩和することができる。
本明細書で提供されるのは、癌療法の有効性を確かめるための、mRNA又はタンパク質のバイオマーカーとしての使用に関連する方法である。mRNA又はタンパク質レベルを用いて、特定の物質が、特定のタイプの癌、例えば、非ホジキンリンパ腫の治療において成功する可能性が高いかどうかを決定することができる。
一実施態様において、本明細書で提供されるのは、癌を治療及び予防する方法であって、患者に、本明細書で提供される化合物、例えば、式Iの化合物、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形を投与することを含む、方法である。
式Iの化合物、又はそのエナンチオマーもしくはエナンチオマーの混合物;或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形は、本明細書に記載の癌の治療及び/又は予防において有用な他の治療剤と組み合わせるか、又はそれと組み合わせて使用することもできる。
本明細書で提供される式Iの化合物を用いて、移植片対宿主病(GVHD)のリスクを軽減することができる。したがって、本明細書に包含されるのは、癌を治療、予防、及び/又は管理する方法であって、式Iの化合物、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形を、移植療法と併せて投与することを含む、方法である。
ある実施態様において、本発明で提供される予防剤又は治療剤は、患者に周期的に投与される。周期的療法は、一定期間の活性剤の投与、その後の一定期間の休止、及びこの連続的投与の反復を含む。周期的療法は、1以上の療法に対する抵抗性の発生を低下させ、該療法のうちの1つの副作用を回避もしくは軽減し、及び/又は治療の効力を向上させることができる。
一実施態様において、本明細書で提供されるのは、式Iの化合物、又はそのエナンチオマーもしくはエナンチオマーの混合物、或いはこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、又は多形を含む医薬組成物及び剤形である。別の実施態様において、医薬組成物及び剤形は、1以上の賦形剤をさらに含む。
ある実施態様において、経口投与に好適である本明細書で提供される医薬組成物は、個別剤形として製剤化され、その例としては、錠剤(例えば、チュアブル錠)、カプレット剤、カプセル剤、及び液体(例えば、フレーバーシロップ)が挙げられるが、これらに限定されない。そのような剤形は、所定量の活性成分を含有しており、いつくかの公知の薬学の方法によって調製することができる。一般に、レミントンの医薬科学(Remington's Pharmaceutical Sciences), 第18版, Mack Publishing社, Easton PA(1990)を参照されたい。
ある実施態様において、本明細書で提供される活性成分は、制御放出手段によるか、又は送達装置によって投与される。例としては、その各々がその全体として引用により本明細書中に組み込まれている、米国特許第:3,845,770号;第3,916,899号;第3,536,809号;第3,598,123号;第4,008,719号、第5,674,533号、第5,059,595号、第5,591,767号、第5,120,548号、第5,073,543号、第5,639,476号、第5,354,556号、及び第5,733,566号に記載されているものが挙げられるが、これらに限定されない。ある実施態様において、そのような剤形を用いて、例えば、所望の放出プロファイルを提供するためにヒドロプロピルメチルセルロース、他のポリマーマトリックス、ゲル、透過膜、浸透圧系、多層コーティング、微粒子、リポソーム、ミクロスフェア、又はこれらの組合せを様々な割合で用いて、1以上の活性成分の低速又は制御放出を提供する。本明細書に包含されるのは、限定されないが、制御放出に適している錠剤、カプセル剤、ゲルキャップ剤、及びカプレット剤を含む、経口投与に好適な単一単位剤形である。
非経口剤形は、限定されないが、皮下、静脈内(ボーラス注射を含む)、筋肉内、及び動脈内を含む、様々な経路によって患者に投与することができる。その投与は、通常、汚染物質に対する患者の自然防御を回避するので、非経口剤形は、滅菌性であるか、又は患者に投与する前に滅菌することができることが好ましい。非経口剤形の例としては、注射にそのまま利用可能な液剤、注射のための医薬として許容し得るビヒクルにすぐに溶解又は懸濁させることができる乾燥品、注射にそのまま利用可能な懸濁剤、及び乳濁剤が挙げられるが、これらに限定されない。
本明細書で提供される局所及び粘膜剤形としては、スプレー剤、エアゾール剤、液剤、乳濁剤、懸濁剤、点眼薬もしくは他の眼科調製物、又は当業者に公知の他の形態が挙げられるが、これらに限定されない。例えば、レミントンの薬科学(Remington's Pharmaceutical Sciences), 第16版及び第18版, Mack Publishing社, Easton PA(1980 & 1990);及び医薬剤形入門(Introduction to Pharmaceutical Dosage Forms), 第4版, Lea & Febiger社, Philadelphia(1985)を参照されたい。口腔内の粘膜組織を治療するのに好適な剤形は、マウスウォッシュ又はオーラルゲルとして製剤化することができる。
ある実施態様において、本明細書で提供される活性成分は、患者に、同時に投与されることも、同じ投与経路で投与されることもない。したがって、本明細書に包含されるのは、医療実践者が使用するときに、患者への適量の活性成分の投与を簡略化することができるキットである。
本発明の特定の実施態様を以下の非限定的な実施例によって説明する。
(6.2.1 PMBCにおけるTNFα阻害アッセイ)
正常ドナー由来の末梢血単核細胞(PBMC)を、Ficoll Hypaque(Pharmacia社, Piscataway, NJ, USA)密度遠心分離法によって得る。細胞を、10%AB+ヒト血清(Gemini Bio-products社, Woodland, CA, USA)、2mM L-グルタミン、100U/mLペニシリン、及び100μg/mLストレプトマイシン(Life Technologies社))を補充したRPMI 1640(Life Technologies社, Grand Island, NY, USA)中で培養する。
MM細胞株の増殖をもたらす化合物の能力をインビトロ試験で調べた。H929 MM細胞による[3H]-チミジンの取込み、並びにいくつかのMM細胞株(H929、U266B1、Anbl-6、KMS-34、OPM-2、DF-15、DF15/R、CAG、MM1.S、及びLP-1)における7-AAD取込みを細胞増殖の指標として測定した。細胞を化合物の存在下で72時間([3H]-チミジンをインキュベーション期間の最後の6時間含めた)又は5日間インキュベートし、その後、7-AADを取り込ませて、生細胞を測定及び計数した。
T細胞を、RosetteSep(登録商標)T細胞濃縮カクテルを用いて、陰性選択によりバフィーコートから単離した。それに応じて、製造業者の手順に従った。全ての96ウェルプレートに、100μlの1×PBS中の3μg/mlの抗ヒトCD3抗体を37℃で4時間プレコーティングした。これらのプレートをT細胞アッセイの前にRPMI-1640完全培地で3回洗浄した。その後、T細胞を、180μlのRPMI-1640完全培地中2.5×105細胞/ウェルの密度で、CD3プレコートプレートにプレーティングした。これらの細胞を、20μlの10、1、0.1、0.01、0.001、0.0001、及び0.00001μMの10×滴定化合物で処理した。最終DMSO濃度は0.25%であった。これらのプレートを37℃、5%CO2で48時間インキュベートした。48時間後、上清を回収し、マルチプレックスサイトメトリックビーズアレイ(CBA)アッセイによって、以下のサイトカイン/ケモカイン:IL-2、IL-3、IL-5、IL-10、IL-13、IL-15、IL-17a、GM-CSF、G-SCF、IFN-γ、TNF-α、及びRANTESについて試験した。CBAプレートをLuminex IS100機器で解析した。
全ての96ウェルプレートに、100μLの1×PBS中の3μg/mLの抗ヒトCD3抗体を37℃で4時間プレコーティングした。これらのプレートをT細胞アッセイの前にRPMI-1640完全培地で3回洗浄した。その後、T細胞を、180μlのRPMI-1640完全培地中2.5×105細胞/ウェルの密度で、抗CD3プレコートプレートにプレーティングした。これらの細胞を、20μlの10、1、0.1、0.01、0.001、0.0001、及び0.00001μMの10×滴定Celgene化合物で二連で処理した。最終DMSO濃度は0.25%であった。これらのプレートを37℃、5%CO2で48時間インキュベートした。48時間後、上清を回収し、マルチプレックスサイトメトリックビーズアレイ(CBA)アッセイによって、以下のサイトカイン/ケモカイン:IL-2、IL-3、IL-5、IL-10、IL-13、IL-15、IL-17A、GM-CSF、G-CSF、IFN-γ、TNF-α、及びRANTESについて試験した。CBAプレートをLuminex IS100機器で解析した。
細胞株Farage、DOHH2、及びRec-1をアメリカン・タイプ・カルチャー・コレクション(Manassas, VA, USA)から入手した。細胞傷害性アッセイを3日間のATP産生アッセイで以下の通りに測定した:
細胞をDMSO又はある量の本明細書で提供される化合物で48時間処理した。細胞周期についてのヨウ化プロピジウム染色を、製造業者のプロトコルに従ってCycleTEST PLUS(Becton Dickinson社)を用いて行なった。染色後、細胞を、ModFit LTソフトウェア(Becton Dickinson社)を用いて、FACSCaliburフローサイトメーターにより解析した。
細胞をDMSO又はある量の本明細書で提供される化合物で様々な時点で処理し、その後、アネキシン-V洗浄バッファー(BD Biosciences社)で洗浄した。細胞をアネキシン-V結合タンパク質及びヨウ化プロピジウム(BD Biosciences社)とともに10分間インキュベートした。試料をフローサイトメトリーを用いて解析した。
96ウェル平底プレートに100μg/mLのヒトIgG(Sigma社)を4℃で一晩コーティングした。翌日、未結合のIgGを冷1×PBSで洗い流した。その後、NK細胞を、IgGコート96ウェルプレートに、180μLのRPMI-1640培地中、1ウェル当たり2×105細胞でプレーティングし、10ng/mLのrhIL-2(R & D Systems社, MN)を添加した。被験化合物を20μL DMSOの容量で添加した。被験化合物の最終濃度は、0.0001、0.001、0.01、0.1、1、又は10μMであった。最終DMSO濃度は、0.25%であった。48時間後、上清を回収し、ELISAによりIFN-γ産生について解析した。
式Iの化合物の生体活性を表1〜5にまとめる。上記の抗CD3刺激ヒトT細胞アッセイにおいて、式Iの化合物は、0.01〜10μMの濃度で、IL-2、IL-3、IL-5、IL-10、IL-15、GM-CSF、INF-γ、RANTES、及びTNF-αの産生を増強した。本化合物によるIL-2、IL-3、IL-13、GM-CSF、TNF-α、及びRANTESの増強は、濃度依存的であった。0.1μMの式Iの化合物の濃度では、IL-2及びIL-13の産生は、対照細胞のレベルのそれぞれ14倍及び7倍のレベルまで増強された。1μMの式Iの化合物の濃度では、IL-2及びIL-13の産生は、対照細胞のレベルのそれぞれ17倍及び8倍のレベルまで増強された。本化合物は、低い濃度(≦0.01μM)でIL-10産生を2倍増強させたが、1及び10μMではIL-10産生を阻害した。本化合物は、IL-5産生を、それぞれ0.01及び0.1μMで3倍及び4倍増大させ、より低い濃度とより高い濃度の両方でのより少ない増強を示した。
式Iの化合物が、ヒト血漿において、230分のt1/2を有することが観察された。マウス、ラット、及びサルにおける経口薬物動態パラメータを表5〜7にまとめる。式Iの化合物の曝露(AUC(0-t))は、SCIDマウス、CD-IDSラット、及び雄のサルにおいて、用量比例的な様式で、30mg/kgまで増加した。式Iの化合物は、10μMでは巨核球前駆細胞を阻害しなかった。
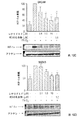
様々な細胞遺伝学的特徴の一連のDLBCL細胞株を、式Iの化合物の抗増殖活性に対するそれらの感受性について試験した(図2)。細胞を式Iの化合物で37℃で5日間処理し;細胞の増殖を、3H-チミジン取込み法を用いて決定した。3回の独立した実験の結果を図2に示す(平均±SD)。0.1〜1μMから開始した化合物は、DLBCL細胞のいくつかの株、特に、ABCサブタイプ細胞、例えば、Riva、U2932、TMD8、OCI-Ly3、及びOCI-Ly10細胞の増殖を有意に(p<0.05)阻害した。ABCサブタイプ細胞は、GCB-DLBCL及びPMBL細胞を含む他のサブタイプ細胞よりも抗増殖効果に対する感受性が高いように思われる。
DLBCL細胞を式Iの化合物又はIKK1/2二重阻害剤(陽性阻害剤対照として使用)で2日間処理した。NFκB活性を、処理後の細胞由来の核抽出物を用いて、Active Motif転写因子アッセイで調べた。結果を図1に示す(平均±SD)。式Iの化合物は、0.1μM、1μM、及び10μMの濃度で、NFκB p65及びp50活性を有意に阻害した。式Iの化合物は、ABCサブタイプのいくつかのDLBCL株、例えば、U2932及びOCI-Ly10細胞で、NFκB活性を阻害することが分かった。これらの結果から、NFκBシグナル伝達への影響が、ABC-DLBCL細胞に対する式Iの化合物の抗増殖活性に関与し得るということ、及びベースラインのNFκB活性が、本化合物による治療に対するリンパ腫腫瘍応答の予測バイオマーカーとなり得ることが示唆される。
OCI-Ly10細胞サブタイプに対する式Iの化合物の効力をインビボマウス異種移植モデルで調べる。6〜12週齢の雌CB.17 SCIDマウスに、100%Matrigel中の約0.2mL/マウスの1×107個のOCI-Ly10腫瘍細胞を脇腹に皮下注射する。腫瘍が100〜150mgの平均サイズに達したら、式Iの化合物による処置が開始される。体重を5/2で、その後、本研究の終了まで隔週で測定する。腫瘍のカリパス測定を隔週で行なう。本研究のエンドポイントは、腫瘍成長の遅延(TGD)である。TGD率を計算する。動物を個別にモニタリングする。本研究のエンドポイントは、約1000m3の腫瘍体積又は60日の、どちらか先に生じる方である。治療に対する応答者を、より長期にわたって追跡調査してもよい。
3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンが癌細胞成長を阻害する能力を、いくつかの多発性骨髄腫(MM)細胞株で、インビトロ法及びインビボ法を用いて評価した(図5A及び5B)。3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンは、いくつかの細胞株でMM細胞増殖を阻害することが示された(図5A、5B、及び6)。例えば、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンの抗増殖効果は、N929異種移植モデルで証明された(図6)。
様々な癌細胞株の増殖、細胞周期進行、及び/又は細胞浸潤を阻害する式Iの化合物の効力に対するタンパク質セレブロン(CRBN)の効果を検討した。式Iの化合物は、内在性骨髄腫CRBNと用量依存的な様式で相互作用することが分かった。式Iの化合物は、HepG2 HCC CRBNとも用量依存的な様式で相互作用する。さらに、式Iの化合物は、208.7μMのIC50でCRBNのユビキチン化を阻害することが分かった。
セレブロンの発現は、ABC-DLBCL細胞株の増殖に対する式Iの化合物の効力を調節することが分かった(図7A〜7C)。セレブロンは、IRF4発現、NFκB活性、及び細胞増殖の各々の阻害に必要とされた。
H929骨髄腫細胞におけるセレブロンの効果も評価した。H929細胞に、模擬物、陰性対照siRNA、及びCRBN-siRNA-7を、24、48、72、及び96時間トランスフェクトした。トランスフェクションの24時間後、細胞をDMSO(0.1%)又は式Iの化合物で1、2、3日間処理し、細胞周期及び増殖に対する効果を調べた。式Iの化合物は、72時間の処理の後、対照模擬物及び陰性対照siRNAをトランスフェクトした細胞において、S期の細胞数の減少として測定される細胞周期進行の遅延を誘導した(図8)。CRBNのノックダウンは、式Iの化合物の65から22%へのH929細胞における細胞周期進行の薬物誘導性遅延を顕著に無効化した。
セレブロンの発現は、HCT-15結腸直腸癌細胞における式Iの化合物の抗浸潤活性も調節する(図11)。式Iの化合物がHCT-15細胞の浸潤を阻害する能力は、siCRBNによって低下させられた。
式Iの化合物を、種々の組織構造(例えば、乳房、卵巣、結腸直腸、HCC)の固形腫瘍細胞株に対するその効果について評価した。式Iの化合物は、多くのそのような固形腫瘍細胞株における低酸素誘導性HIF1-α発現を阻害する(図12A〜12I)。さらに、式Iの化合物は、様々な程度に固形腫瘍細胞の浸潤を阻害し(表10)、また、細胞コロニー形成を阻害する(表11)。固形腫瘍細胞コロニー形成の阻害を、1日目の式Iの化合物(10μM)の単回高濃度処理、その後、10〜20日間にわたる細胞コロニー形成のモニタリングによって検討した(表11、図13A及び13B)。
式Iの化合物を、2〜6人のドナーから得られたリポ多糖刺激ヒト末梢血単核細胞(hPBMC)を用いる、11種(11)のサイトカイン及びケモカイン、すなわち、インターロイキン(IL)-1β、IL-6、IL-8、顆粒球マクロファージコロニー刺激因子(GM-CSF)、マクロファージ由来ケモカイン(MDC)、マクロファージ炎症性タンパク質-1α(MIP-1α)、マクロファージ炎症性タンパク質-1β(MIP-1β)、腫瘍壊死因子-α(TNF-α)、IL-10、単球走化性タンパク質-1(MCP-1)、及びRANTES(正常T細胞の活性化によって調節され、発現され、分泌される)の活性プロファイリングのために選択した。
式Iの化合物は、ヒト臍血管内皮細胞(HUVEC)浸潤のインビトロアッセイで強力な阻害活性を示した。式Iの化合物は、血管内皮成長因子(VEGF)、塩基性線維芽細胞成長因子(bFGF)、及び肝細胞成長因子(HGF)誘導性の浸潤を強く阻害し、VEGF及びbFGF誘導性のHUVEC管形成及び遊走を弱く阻害し、成長因子誘導性HUVEC増殖の増殖を増強するか、又はそれを阻害しないかのいずれかであった。VEGF誘導性HUVEC浸潤の阻害のIC50値は、0.29nMであった。bFGF誘導性HUVEC浸潤の阻害のIC50値は、5.5nMであった。HGF誘導性HUVEC浸潤の阻害のIC50値は、110nMであった。式Iの化合物は、VEGF及びbFGF誘導性遊走を、1μMの濃度でそれぞれ38%及び28%阻害した。
進行性固形腫瘍、非ホジキンリンパ腫、又は多発性骨髄腫を有する対象に経口投与したときの式Iの化合物の安全性、忍容性、薬物動態、及び効力を決定するための第1a/1b相の臨床試験を提供する。非忍容用量(NTD)、最大忍容用量(MTD)、及び推奨される第2相用量(RP2D)を本研究で定義することになる。腫瘍生検の処置前及び処置中の血管新生のバイオマーカーに対する化合物の効果を評価する。
本研究は、2つのパート:用量漸増(パートA)及び用量拡大(パートB)からなる第1a/1b相試験としてデザインされる。パートAでは、対象に、単回及び複数回の上昇用量の式Iの化合物を投与して、薬物動態(PK)を測定し、最大忍容用量(MTD)及び推奨される第2相用量(RP2D)を同定する。標準用量(3+3)漸増デザイン(Simonらの文献、1997)を用いて、初期毒性を同定する。グレード3以上の毒性の最初の例が、第一周期において薬物関連であると疑われるまで、3人の対象の初期コホートに式Iの化合物(0.5mg、1日1回)を100%の用量増分で投与し、疑いのあった時点で、特定のコホートを合計6人の対象にまで拡大する。この標準的漸増スケジュールは、非忍容用量(NTD)及びMTDを確立するために開始される。より小さい増分、及び用量コホート内の追加の対象を安全性について評価することもできる。約20〜40人の対象をパートAで処置し、評価する;しかしながら、パートAの対象の総数は、MTDの確立に必要とされる用量コホートの数によって決まる。コホート中の6人の評価可能な対象のうちの2人以上が第1周期で薬物関連用量制限毒性(DLT)を経験したとき、用量はNTDとみなされる。NTDが確立されたときに、用量漸増を中止する。MTDは、6人の評価可能な対象のうちの0又は1人が第1周期でDLTを経験する、NTDに満たない最後の用量レベルと定義される。中間用量(すなわち、NTDとNTDの前の最後の用量レベルとの間の用量)又は任意の用量コホート内の追加の対象が、MTD及びRP2Dをより正確に決定するために必要とされる場合がある。
進行性固形腫瘍(ST)、非ホジキンリンパ腫(NHL)、多発性骨髄腫(MM)、又は進行性切除不能固形腫瘍を有する18歳以上の男女、標準療法で進行した(もしくは標準療法に耐えることができなかった)対象、又はその人に対する標準抗癌療法が存在しない対象を含む。選択された腫瘍タイプとしては、転移性乳癌(mBC)、多形性膠芽腫(GBM)、肝細胞癌(HCC)、びまん性大細胞型B細胞リンパ腫(DLBCL)、及び多発性骨髄腫(MM)が挙げられる。
最初の周期では、パートAにおいてのみ、各対象に、単回1日用量の式Iの化合物を1日目に投与し、その後、48時間の観察及びPKサンプリング期間があり、その後、1日目から毎日中断なく28日間投与する(第1周期=30日)。その後のパートA周期では、対象を28日周期で1日目〜28日目まで連続投与で処置する。式Iの化合物を、初回用量において0.1、0.5、1、2、4、5、7.5、10、20、25、又は50mgの用量で1日に1回又は2回投与する。用量は、1日に1回投与される0.1、0.5、1、2、4、5、7.5、10mgであってもよい。用量は、1日に2回投与される50、25、又は10mgであってもよい。用量は、処置中に、出発用量から上下に調整してもよい。上記のように、必要であれば、薬物を周期的な様式で投与してもよい。
Celgene社は、式Iの化合物(HCl)を、経口投与用の0.1mg、0.5mg、1mg、及び3mgカプセル剤として供給する。本化合物は、薬物を含む箱の中でボトルに28日間包装される。
対象を、毎2周期後に、効力について評価する。一次効力変数は応答である。腫瘍応答は、固形腫瘍の応答評価基準(RECIST 1.1)、NHLの国際ワークショップ基準(IWC)、多発性骨髄腫の国際統一応答基準(IURC)(付録A、第18.1節)、又はGBMに関する神経腫瘍学(RANO)ワーキンググループの応答評価に基づく。
この研究の安全性変数は、有害事象、臨床検査変数、12誘導ECG(中心的に精査される)、LVEF評価、身体検査、及びバイタルサインである。
式Iの化合物及びその代謝産物のPKプロファイルを連続的な採血及び採尿から第一の治療周期中に決定する。可能ならば、これらを薬力学的(PD)転帰と相関させる。
Claims (62)
- 前記癌が、進行悪性腫瘍、アミロイドーシス、神経芽腫、髄膜腫、血管周囲細胞腫、多発性脳転移、多形性膠芽腫、膠芽腫、脳幹神経膠腫、予後不良悪性脳腫瘍、悪性神経膠腫、未分化星状細胞腫、未分化希突起膠腫、神経内分泌腫瘍、直腸腺癌、デュークスC及びD結腸直腸癌、切除不能結腸直腸癌、転移性肝細胞癌、カポジ肉腫、核型急性骨髄芽球性白血病、ホジキンリンパ腫、非ホジキンリンパ腫、皮膚T細胞リンパ腫、皮膚B細胞リンパ腫、びまん性大細胞型B細胞リンパ腫、低悪性度濾胞性リンパ腫、悪性黒色腫、悪性中皮腫、悪性胸水中皮腫症候群、腹膜癌、漿液性乳頭状癌、婦人科肉腫、軟部組織肉腫、強皮症、皮膚血管炎、ランゲルハンス細胞組織球増加症、平滑筋肉腫、進行性骨化性線維異形成症、ホルモン不応性前立腺癌、切除されている高リスク軟部組織肉腫、切除不能肝細胞癌、ワルデンシュトレームマクログロブリン血症、くすぶり型骨髄腫、無症候性骨髄腫、卵管癌、アンドロゲン非依存性前立腺癌、アンドロゲン依存性ステージIV非転移性前立腺癌、ホルモン非感受性前立腺癌、化学療法非感受性前立腺癌、甲状腺乳頭癌、濾胞性甲状腺癌、甲状腺髄様癌、又は平滑筋腫である、請求項1記載の方法。
- 前記癌が、血行性腫瘍である、請求項1記載の方法。
- 前記癌が、骨髄腫又はリンパ腫である、請求項1記載の方法。
- 前記癌が、固形腫瘍である、請求項1記載の方法。
- 前記癌が、乳癌、結腸直腸癌、卵巣癌、前立腺癌、膵癌、又は腎癌である、請求項1記載の方法。
- 前記癌が、肝細胞癌、前立腺癌、卵巣癌、又は膠芽腫である、請求項1記載の方法。
- 前記癌が、非ホジキンリンパ腫である、請求項1記載の方法。
- 前記非ホジキンリンパ腫が、びまん性大細胞型B細胞リンパ腫である、請求項8記載の方法。
- 前記びまん性大細胞型B細胞リンパ腫が、活性化B細胞表現型である、請求項9記載の方法。
- 前記びまん性大細胞型B細胞リンパ腫が、RIVA、U2932、TMD8、又はOCI-Ly10細胞株で過剰発現される1以上のバイオマーカーの発現によって特徴付けられる、請求項10記載の方法。
- 前記癌が、再発性又は不応性である、請求項1〜11のいずれか一項記載の方法。
- 前記癌が薬物抵抗性である、請求項1〜12のいずれか一項記載の方法。
- 非ホジキンリンパ腫を治療又は管理する方法であって:
(i)3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオンによる治療に感受性のある非ホジキンリンパ腫を有する患者を特定すること;及び
(ii)該患者に、治療的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその医薬として許容し得る塩、溶媒和物、もしくは水和物を投与することを含む、前記方法。 - 前記非ホジキンリンパ腫が、びまん性大細胞型B細胞リンパ腫である、請求項14記載の方法。
- 前記非ホジキンリンパ腫が、活性化B細胞表現型である、請求項14記載の方法。
- 前記びまん性大細胞型B細胞リンパ腫が、活性化B細胞表現型である、請求項15記載の方法。
- 前記びまん性大細胞型B細胞リンパ腫が、RIVA、U2932、TMD8、又はOCI-Ly10細胞株で過剰発現される1以上のバイオマーカーの発現によって特徴付けられる、請求項17記載の方法。
- 3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物による治療に感受性のある非ホジキンリンパ腫を有する患者を特定することが、活性化B細胞サブタイプとしての該患者の非ホジキンリンパ腫の表現型の特徴付けを含む、請求項14記載の方法。
- 前記非ホジキンリンパ腫の表現型が、びまん性大細胞型B細胞リンパ腫の活性化B細胞サブタイプと特徴付けられる、請求項19記載の方法。
- 前記非ホジキンリンパ腫の表現型が、RIVA、U2932、TMD8、又はOCI-Ly10細胞株で過剰発現される1以上のバイオマーカーの発現によって特徴付けられる、請求項19記載の方法。
- 前記非ホジキンリンパ腫の表現型の特定が、リンパ腫を有する患者由来の生体試料を得ることを含む、請求項14記載の方法。
- 前記生体試料が、リンパ節生検、骨髄生検、又は末梢血腫瘍細胞の試料である、請求項22記載の方法。
- 3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物による治療に感受性のある非ホジキンリンパ腫を有する患者を特定することが、活性化B細胞表現型と関連する遺伝子の同定を含む、請求項14記載の方法。
- 前記活性化B細胞表現型と関連する遺伝子が、IRF4/MUM1、FOXP1、SPIB、CARD11、及びBLIMP/PDRM1からなる群から選択される、請求項24記載の方法。
- 3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物による治療に感受性のある非ホジキンリンパ腫を有する患者を特定することが、該患者から得られる生体試料中のNF-κB活性のレベルを測定することを含む、請求項14記載の方法。
- 前記生体試料が、リンパ節生検、骨髄生検、又は末梢血腫瘍細胞の試料である、請求項26記載の方法。
- 活性化B細胞サブタイプとしての前記患者の非ホジキンリンパ腫の表現型の特徴付けが、以下のもの:
(i)活性化B細胞サブタイプ細胞の生存に必要とされる造血系特異的Etsファミリー転写因子SPIBの過剰発現;
(ii)GCBサブタイプ細胞よりも高い構成的IRF4/MUM1発現;
(iii)第3トリソミーによって上方調節される、より高い構成的FOXP1発現;
(iv)より高い構成的Blimp1(すなわち、PRDM1)発現;
(v)より高い構成的CARD11遺伝子発現;及び
(vi)非活性化B細胞サブタイプDLBCL細胞と比べた、NF-κB活性のレベルの増加
のうちの1つ又は複数の測定を含む、請求項19記載の方法。 - 前記化合物が、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン塩酸塩、又はその塩、溶媒和物、もしくは水和物である、請求項1〜28のいずれか一項記載の方法。
- 1以上の追加の活性剤の治療的有効量の投与をさらに含む、請求項1〜29のいずれか一項記載の方法。
- 前記追加の活性剤が、アルキル化剤、アデノシン類似体、グルココルチコイド、キナーゼ阻害剤、SYK阻害剤、PDE3阻害剤、PDE7阻害剤、ドキソルビシン、クロラムブシル、ビンクリスチン、ベンダムスチン、フォルスコリン、及びリツキシマブからなる群から選択される、請求項30記載の方法。
- 前記追加の活性剤がリツキシマブである、請求項31記載の方法。
- 3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその医薬として許容し得る塩、溶媒和物、もしくは水和物が、1日当たり約0.5〜約50mgの量で投与される、請求項1〜32のいずれか一項記載の方法。
- 前記化合物が、1日当たり約0.5〜約5mgの量で投与される、請求項33記載の方法。
- 前記化合物が、1日当たり約0.5、1、2、4、5、10、15、20、25、又は50mgの量で投与される、請求項33記載の方法。
- 前記化合物が経口投与される、請求項33記載の方法。
- 前記化合物が、カプセル剤又は錠剤に入れて投与される、請求項33記載の方法。
- 前記化合物が、10mg又は25mgのカプセル剤に入れて投与される、請求項37記載の方法。
- 前記びまん性大細胞型B細胞リンパ腫が、従来の療法に対して再発性、不応性、又は抵抗性である、請求項1〜38のいずれか一項記載の方法。
- 前記化合物が、21日間の投薬、それに続く7日間の休薬の28日周期で投与される、請求項1〜39のいずれか一項記載の方法。
- 非ホジキンリンパ腫患者の治療に対する腫瘍応答を予測する方法であって:
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB活性のレベルを測定すること;及び
(iii)該生体試料中のNF-κB活性のレベルを、非活性化B細胞性リンパ腫サブタイプの生体試料のNF-κB活性のレベルと比較すること
を含み、
ここで、非活性化B細胞サブタイプのリンパ腫細胞と比べた、NF-κB活性のレベルの増加が、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン治療に対する効果的な患者腫瘍応答の可能性を示す、前記方法。 - 非ホジキンリンパ腫患者の治療に対する腫瘍応答をモニタリングする方法であって:
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB活性のレベルを測定すること;
(iii)治療的有効量の3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物を該患者に投与すること;
(iv)第二の生体試料を該患者から得ること;
(v)該第二の生体試料中のNF-κB活性のレベルを測定すること;及び
(vi)第一の生体試料中のNF-κB活性のレベルを、第二の生体試料中のNF-κB活性のレベルと比較すること
を含み、
ここで、第一の生体試料と比べた、第二の生体試料中のNF-κB活性のレベルの減少が、効果的な患者腫瘍応答の可能性を示す、前記方法。 - 非ホジキンリンパ腫患者における薬物治療プロトコルの患者コンプライアンスをモニタリングする方法であって:
(i)生体試料を該患者から得ること;
(ii)該生体試料中のNF-κB活性のレベルを測定すること;及び
(iii)該生体試料中のNF-κB活性のレベルを、対照未治療試料と比較すること
を含み、
ここで、該対照と比べた、該生体試料中のNF-κB活性のレベルの減少が、該薬物治療プロトコルの患者コンプライアンスを示す、前記方法。 - 前記非ホジキンリンパ腫が、びまん性大細胞型B細胞リンパ腫である、請求項41〜43のいずれか一項記載の方法。
- 前記NF-κB活性のレベルが、酵素連結免疫吸着アッセイによって測定される、請求項41〜44のいずれか一項記載の方法。
- 非ホジキンリンパ腫患者における治療に対する腫瘍応答を予測する方法であって:
(i)生体試料を該患者から得ること;
(ii)タンパク質又はRNAを該試料から精製すること;及び
(iii)対照非ホジキンリンパ腫の非活性化B細胞表現型と比べた、非ホジキンリンパ腫の活性化B細胞表現型と関連する遺伝子の発現の増加を同定すること
を含み、
ここで、非ホジキンリンパ腫の活性化B細胞表現型と関連する遺伝子の発現の増加が、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン治療に対する効果的な患者腫瘍応答の可能性を示す、前記方法。 - 前記生体試料が腫瘍組織である、請求項46記載の方法。
- 発現の増加が、約1.5倍、2.0倍、3倍、5倍、又はそれを上回る増加である、請求項46記載の方法。
- 前記活性化B細胞表現型と関連する遺伝子が、IRF4/MUM1、FOXP1、SPIB、CARD11、及びBLIMP/PDRM1からなる群から選択される、請求項41〜46のいずれか一項記載の方法。
- 前記非ホジキンリンパ腫の活性化B細胞表現型と関連する遺伝子の発現の同定が、定量的リアルタイムPCRによって行なわれる、請求項41〜46のいずれか一項記載の方法。
- 非ホジキンリンパ腫患者における3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、又はその塩、溶媒和物、もしくは水和物による治療に対する腫瘍応答を予測するキットであって:
(i)固体支持体;及び
(ii)生体試料中の非ホジキンリンパ腫の活性化B細胞表現型のバイオマーカーの発現を検出する手段
を含む、前記キット。 - 前記バイオマーカーがNF-κBである、請求項51記載のキット。
- 前記バイオマーカーが、活性化B細胞表現型と関連する遺伝子であり、かつIRF4/MUM1、FOXP1、SPIB、CARD11、及びBLIMP/PDRM1からなる群から選択される、請求項51記載のキット。
- 癌患者の群を、該癌におけるCRBN発現のレベル、又はDDB1、DDB2、IRF4、もしくはNFκB発現のレベルに基づいて、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、その立体異性体、又はこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、もしくは多形の投与に対する、臨床応答を予測するか、臨床応答をモニタリングするか、又は患者コンプライアンスをモニタリングする目的で選択する方法であって;該癌患者が、多発性骨髄腫、非ホジキンリンパ腫、びまん性大細胞型B細胞リンパ腫、黒色腫、及び固形腫瘍患者から選択される、前記方法。
- 前記癌患者が多発性骨髄腫患者である、請求項54記載の方法。
- 前記癌患者が非ホジキンリンパ腫患者である、請求項54記載の方法。
- 前記癌患者の群を選択する方法が、該癌におけるDDB1発現のレベルに基づく、請求項54記載の方法。
- 前記癌患者の群を選択する方法が、該癌におけるDDB2発現のレベルに基づく、請求項54記載の方法。
- 前記癌患者の群を選択する方法が、該癌におけるIRF4発現のレベルに基づく、請求項54記載の方法。
- 前記癌患者の群を選択する方法が、該癌におけるNFκB発現のレベルに基づく、請求項54記載の方法。
- 3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、その立体異性体、又はこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、もしくは多形による治療に応答する癌患者の群を:該患者のT細胞、B細胞、又は形質細胞におけるCRBN発現のレベル、又はDDB1、DDB2、IRF4、もしくはNFκB発現のレベルに基づいて、3-(5-アミノ-2-メチル-4-オキソ-4H-キナゾリン-3-イル)-ピペリジン-2,6-ジオン、その立体異性体、又はこれらの医薬として許容し得る塩、溶媒和物、水和物、共結晶、包摂化合物、もしくは多形の投与に対する、臨床応答を予測するか、臨床応答をモニタリングするか、又は患者コンプライアンスをモニタリングする目的で選択する方法。
- 前記癌患者が、多発性骨髄腫、非ホジキンリンパ腫、びまん性大細胞型B細胞リンパ腫、黒色腫、及び固形腫瘍患者から選択される、請求項61記載の方法。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161451995P | 2011-03-11 | 2011-03-11 | |
| US61/451,995 | 2011-03-11 | ||
| US201161480272P | 2011-04-28 | 2011-04-28 | |
| US61/480,272 | 2011-04-28 | ||
| PCT/US2012/028498 WO2012125459A1 (en) | 2011-03-11 | 2012-03-09 | Methods of treating cancer using 3-(5-amino-2-methyl-4-oxo-4h-quinazolin-3-yl)-piperidine-2,6-dione |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017009923A Division JP6348192B2 (ja) | 2011-03-11 | 2017-01-24 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014510078A true JP2014510078A (ja) | 2014-04-24 |
| JP2014510078A5 JP2014510078A5 (ja) | 2015-04-23 |
Family
ID=45876915
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013557916A Expired - Fee Related JP6118273B2 (ja) | 2011-03-11 | 2012-03-09 | 免疫関連疾患及び炎症性疾患の治療における3−(5−アミノ−2−メチル−4−オキソキナゾリン−3(4h)−イル)ピペリジン−2,6−ジオンの使用 |
| JP2013557904A Withdrawn JP2014510078A (ja) | 2011-03-11 | 2012-03-09 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
| JP2016248598A Pending JP2017081959A (ja) | 2011-03-11 | 2016-12-22 | 免疫関連疾患及び炎症性疾患の治療における3−(5−アミノ−2−メチル−4−オキソキナゾリン−3(4h)−イル)ピペリジン−2,6−ジオンの使用 |
| JP2017009923A Expired - Fee Related JP6348192B2 (ja) | 2011-03-11 | 2017-01-24 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
| JP2018103019A Withdrawn JP2018168159A (ja) | 2011-03-11 | 2018-05-30 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013557916A Expired - Fee Related JP6118273B2 (ja) | 2011-03-11 | 2012-03-09 | 免疫関連疾患及び炎症性疾患の治療における3−(5−アミノ−2−メチル−4−オキソキナゾリン−3(4h)−イル)ピペリジン−2,6−ジオンの使用 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016248598A Pending JP2017081959A (ja) | 2011-03-11 | 2016-12-22 | 免疫関連疾患及び炎症性疾患の治療における3−(5−アミノ−2−メチル−4−オキソキナゾリン−3(4h)−イル)ピペリジン−2,6−ジオンの使用 |
| JP2017009923A Expired - Fee Related JP6348192B2 (ja) | 2011-03-11 | 2017-01-24 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
| JP2018103019A Withdrawn JP2018168159A (ja) | 2011-03-11 | 2018-05-30 | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 |
Country Status (29)
| Country | Link |
|---|---|
| US (6) | US8906932B2 (ja) |
| EP (3) | EP3025715A1 (ja) |
| JP (5) | JP6118273B2 (ja) |
| KR (2) | KR20140019364A (ja) |
| CN (3) | CN103561743A (ja) |
| AR (1) | AR085651A1 (ja) |
| AU (4) | AU2012229300B2 (ja) |
| BR (2) | BR112013023277A2 (ja) |
| CA (2) | CA2829592A1 (ja) |
| CY (1) | CY1117430T1 (ja) |
| DK (1) | DK2683384T3 (ja) |
| EA (2) | EA201391319A1 (ja) |
| ES (2) | ES2659205T3 (ja) |
| HK (1) | HK1191858A1 (ja) |
| HR (1) | HRP20160056T1 (ja) |
| HU (1) | HUE027481T2 (ja) |
| IL (2) | IL227990B (ja) |
| MX (2) | MX2013010153A (ja) |
| NI (2) | NI201300082A (ja) |
| PL (1) | PL2683384T3 (ja) |
| PT (1) | PT2683384E (ja) |
| RS (1) | RS54553B1 (ja) |
| RU (3) | RU2017120977A (ja) |
| SG (2) | SG192947A1 (ja) |
| SI (1) | SI2683384T1 (ja) |
| SM (1) | SMT201600034B (ja) |
| TW (2) | TW201700100A (ja) |
| WO (2) | WO2012125459A1 (ja) |
| ZA (2) | ZA201306148B (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014514579A (ja) * | 2011-04-29 | 2014-06-19 | セルジーン コーポレイション | セレブロンを予測因子として使用する癌及び炎症性疾患の治療方法 |
| JP2016521280A (ja) * | 2013-05-03 | 2016-07-21 | セルジーン コーポレイション | 併用療法を用いて癌を治療する方法 |
| JP2020172502A (ja) * | 2015-07-02 | 2020-10-22 | セルジーン コーポレイション | 血液がん及び固形腫瘍の治療のための併用療法 |
| JP2022502355A (ja) * | 2018-09-07 | 2022-01-11 | メッドシャイン ディスカバリー インコーポレイテッド | 三環式縮合フラン置換ピペリジンジオン系化合物 |
Families Citing this family (41)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DK2420497T3 (en) | 2006-09-26 | 2016-03-07 | Celgene Corp | 5-substituted quinazolinone derivatives as anticancer agents |
| WO2010137547A1 (ja) | 2009-05-25 | 2010-12-02 | 国立大学法人東京工業大学 | 中枢神経細胞の増殖及び分化に係る中核因子を含む医薬組成物 |
| MX2013010360A (es) | 2011-03-11 | 2014-04-14 | Celgene Corp | Formas solidas sde 3-(5-amino-2-metil-4-oxo-4h-quinazolin-3-il)-pi peridin-2,6-diona, y sus composiciones farmaceuticas y usos. |
| EP2699091B1 (en) | 2011-03-28 | 2017-06-21 | DeuteRx, LLC | 2',6'-dioxo-3'-deutero-piperdin-3-yl-isoindoline compounds |
| WO2014004990A2 (en) | 2012-06-29 | 2014-01-03 | Celgene Corporation | Methods for determining drug efficacy using cereblon-associated proteins |
| CN108245518B (zh) * | 2012-08-09 | 2021-08-31 | 细胞基因公司 | 利用3-(4-((4-(吗啉代甲基)苯甲基)氧基)-1-氧代异二氢吲哚-2-基)哌啶-2,6- 二酮治疗癌症的方法 |
| US9587281B2 (en) | 2012-08-14 | 2017-03-07 | Celgene Corporation | Cereblon isoforms and their use as biomarkers for therapeutic treatment |
| ES2814952T3 (es) | 2012-09-04 | 2021-03-29 | Celgene Corp | Isotopólogos de 3-(5-amino-2-metil-4-oxoquinazolin-3(4H)-il) piperidina-2-6-diona y métodos de preparación de los mismos |
| KR20150054962A (ko) | 2012-09-10 | 2015-05-20 | 셀진 코포레이션 | 국소 진행성 유방암의 치료방법 |
| US9540340B2 (en) | 2013-01-14 | 2017-01-10 | Deuterx, Llc | 3-(5-substituted-4-oxoquinazolin-3(4H)-yl)-3-deutero-piperidine-2,6-dione derivatives and compositions comprising and methods of using the same |
| EP2968334A4 (en) | 2013-03-14 | 2016-08-03 | Deuterx Llc | 3- (SUBSTITIERTES-4-OXO-quinazolin-3 (4H) -yl) -3-deutero-PIPERIDINE-2,6-DIONE DERIVATIVES |
| CA2908742C (en) * | 2013-04-17 | 2021-06-01 | Signal Pharmaceuticals, Llc | Combination therapy comprising a tor kinase inhibitor and a cytidine analog for treating cancer |
| CA2909625C (en) * | 2013-04-17 | 2021-06-01 | Signal Pharmaceuticals, Llc | Combination therapy comprising a tor kinase inhibitor and a 5-substituted quinazolinone compound for treating cancer |
| MX363652B (es) * | 2013-05-01 | 2019-03-28 | Celgene Corp | Sintesis de 3-(5-amino-2-metil-4-oxoquinazolin-3(4h)-il)piperidin- 2,6-diona. |
| US20160282354A1 (en) | 2013-11-08 | 2016-09-29 | The Broad Institute, Inc. | Compositions and methods for selecting a treatment for b-cell neoplasias |
| EP3077548B1 (en) * | 2013-12-06 | 2021-11-10 | Celgene Corporation | Methods for determining drug efficacy for the treatment of diffuse large b-cell lymphoma, multiple myeloma, and myeloid cancers |
| AR099385A1 (es) * | 2014-01-15 | 2016-07-20 | Celgene Corp | Formulaciones de 3-(5-amino-2-metil-4-oxo-4h-quinazolin-3-il)-piperidina-2,6-diona |
| JP6640126B2 (ja) | 2014-06-27 | 2020-02-05 | セルジーン コーポレイション | セレブロン及び他のe3ユビキチンリガーゼの立体構造の変化を誘導するための組成物及び方法 |
| EP3166635A1 (en) * | 2014-07-11 | 2017-05-17 | Celgene Corporation | Combination therapy for cancer |
| RS64038B1 (sr) | 2014-08-22 | 2023-04-28 | Celgene Corp | Postupci za lečenje multiplog mijeloma imunomodulatornim jedinjenjima u kombinaciji sa antitelima |
| CN113559075A (zh) | 2014-11-17 | 2021-10-29 | 康泰科思特生物制药公司 | 奥那司酮延长释放组合物和方法 |
| TW201642857A (zh) * | 2015-04-06 | 2016-12-16 | 西建公司 | 以組合療法治療肝細胞癌 |
| US9809603B1 (en) | 2015-08-18 | 2017-11-07 | Deuterx, Llc | Deuterium-enriched isoindolinonyl-piperidinonyl conjugates and oxoquinazolin-3(4H)-yl-piperidinonyl conjugates and methods of treating medical disorders using same |
| EA201890585A1 (ru) | 2015-08-27 | 2018-11-30 | Селджин Корпорейшн | Составы 3-(5-амино-2-метил-4-оксо-4h-хиназолин-3-ил)пиперидин-2,6-диона |
| WO2017044793A1 (en) * | 2015-09-11 | 2017-03-16 | The Brigham And Women's Hospital, Inc. | Methods of characterizing resistance to modulators of cereblon |
| AU2016326657B2 (en) | 2015-09-25 | 2019-10-24 | Context Biopharma, Inc. | Methods of making onapristone intermediates |
| US10159675B2 (en) * | 2015-12-02 | 2018-12-25 | Celgene Corporation | Cycling therapy using 3-(5-amino-2-methyl-4-oxo-4H-quinazolin-3-yl)-piperidine-2,6-dione |
| US10548905B2 (en) | 2015-12-15 | 2020-02-04 | Context Biopharma Inc. | Amorphous onapristone compositions and methods of making the same |
| WO2017117118A1 (en) | 2015-12-28 | 2017-07-06 | Celgene Corporation | Compositions and methods for inducing conformational changes in cereblon and other e3 ubiquitin ligases |
| JP6930748B2 (ja) | 2016-01-14 | 2021-09-01 | カンプ・バイオファーマスーティカルズ、リミテッドKangpu Biopharmaceuticals,Ltd | キナゾリン誘導体、そのための調製方法、医薬組成物、および適用 |
| MX2018011216A (es) * | 2016-03-16 | 2019-08-29 | H Lee Moffitt Cancer Ct & Res | Moléculas pequeñas contra cereblon para mejorar la función efectora de los linfocitos t. |
| WO2018102369A1 (en) | 2016-11-30 | 2018-06-07 | Arno Therapeutics, Inc. | Methods for onapristone synthesis dehydration and deprotection |
| WO2018165142A1 (en) * | 2017-03-07 | 2018-09-13 | Celgene Corporation | Solid forms of 3-(5-amino-2-methyl-4-oxo-4h-quinazolin-3-yl)-piperidine-2,6-dione, and their pharmaceutical compositions and uses |
| CN110996955A (zh) * | 2017-06-22 | 2020-04-10 | 细胞基因公司 | 以乙型肝炎病毒感染为特征的肝细胞癌的治疗 |
| WO2019077968A1 (en) | 2017-10-18 | 2019-04-25 | Canon Kabushiki Kaisha | PACKAGING CONTAINER AND PACKAGE |
| EP3774815A1 (en) * | 2018-03-30 | 2021-02-17 | Biotheryx Inc. | Thienopyrimidinone compounds |
| US11730726B2 (en) | 2018-07-11 | 2023-08-22 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Dimeric immuno-modulatory compounds against cereblon-based mechanisms |
| SG11202103141YA (en) | 2018-10-01 | 2021-04-29 | Celgene Corp | Combination therapy for the treatment of cancer |
| JP7300687B2 (ja) * | 2019-03-22 | 2023-06-30 | ユニヴァーシティー オブ ウルサン ファウンデイション フォー インダストリー コーオペレイション | 肝細胞癌診断用バイオマーカーセレブロンと、これに特異的な新規なモノクローナル抗体 |
| EP4126847A1 (en) * | 2020-03-30 | 2023-02-08 | ENYO Pharma | Quinazolinone derivatives and uses thereof for treating a cancer |
| WO2024040036A2 (en) * | 2022-08-16 | 2024-02-22 | iTeos Belgium SA | Adenosine receptor antagonists and compositions thereof for use in the treatment of disease associated with expression of at least one antibody-secreting cell marker |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010504973A (ja) * | 2006-09-26 | 2010-02-18 | セルジーン・コーポレーション | 5−置換キナゾリノン誘導体、それを含む組成物、及びその使用方法 |
| JP2011505807A (ja) * | 2007-12-07 | 2011-03-03 | セルジーン コーポレイション | キナゾリノン化合物による治療をモニタリングするためのバイオマーカー |
Family Cites Families (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3536809A (en) | 1969-02-17 | 1970-10-27 | Alza Corp | Medication method |
| US3598123A (en) | 1969-04-01 | 1971-08-10 | Alza Corp | Bandage for administering drugs |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US4008719A (en) | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| KR890002631B1 (ko) | 1984-10-04 | 1989-07-21 | 몬산토 캄파니 | 생물학적으로 활성인 소마토트로핀을 지속적으로 유리하는 조성물 |
| IE58110B1 (en) | 1984-10-30 | 1993-07-14 | Elan Corp Plc | Controlled release powder and process for its preparation |
| US5391485A (en) | 1985-08-06 | 1995-02-21 | Immunex Corporation | DNAs encoding analog GM-CSF molecules displaying resistance to proteases which cleave at adjacent dibasic residues |
| JPS63500636A (ja) | 1985-08-23 | 1988-03-10 | 麒麟麦酒株式会社 | 多分化能性顆粒球コロニー刺激因子をコードするdna |
| US4810643A (en) | 1985-08-23 | 1989-03-07 | Kirin- Amgen Inc. | Production of pluripotent granulocyte colony-stimulating factor |
| US5073543A (en) | 1988-07-21 | 1991-12-17 | G. D. Searle & Co. | Controlled release formulations of trophic factors in ganglioside-lipsome vehicle |
| IT1229203B (it) | 1989-03-22 | 1991-07-25 | Bioresearch Spa | Impiego di acido 5 metiltetraidrofolico, di acido 5 formiltetraidrofolico e dei loro sali farmaceuticamente accettabili per la preparazione di composizioni farmaceutiche in forma a rilascio controllato attive nella terapia dei disturbi mentali organici e composizioni farmaceutiche relative. |
| PH30995A (en) | 1989-07-07 | 1997-12-23 | Novartis Inc | Sustained release formulations of water soluble peptides. |
| US5120548A (en) | 1989-11-07 | 1992-06-09 | Merck & Co., Inc. | Swelling modulated polymeric drug delivery device |
| KR0166088B1 (ko) | 1990-01-23 | 1999-01-15 | . | 수용해도가 증가된 시클로덱스트린 유도체 및 이의 용도 |
| US5733566A (en) | 1990-05-15 | 1998-03-31 | Alkermes Controlled Therapeutics Inc. Ii | Controlled release of antiparasitic agents in animals |
| US5580578A (en) | 1992-01-27 | 1996-12-03 | Euro-Celtique, S.A. | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| TW333456B (en) | 1992-12-07 | 1998-06-11 | Takeda Pharm Ind Co Ltd | A pharmaceutical composition of sustained-release preparation the invention relates to a pharmaceutical composition of sustained-release preparation which comprises a physiologically active peptide. |
| US5360352A (en) | 1992-12-24 | 1994-11-01 | The Whitaker Corporation | Wire retainer for current mode coupler |
| US5591767A (en) | 1993-01-25 | 1997-01-07 | Pharmetrix Corporation | Liquid reservoir transdermal patch for the administration of ketorolac |
| US6087324A (en) | 1993-06-24 | 2000-07-11 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| IT1270594B (it) | 1994-07-07 | 1997-05-07 | Recordati Chem Pharm | Composizione farmaceutica a rilascio controllato di moguisteina in sospensione liquida |
| EP0835101B1 (en) | 1995-06-27 | 2004-06-09 | Takeda Chemical Industries, Ltd. | Method of producing sustained-release preparation |
| TW448055B (en) | 1995-09-04 | 2001-08-01 | Takeda Chemical Industries Ltd | Method of production of sustained-release preparation |
| JP2909418B2 (ja) | 1995-09-18 | 1999-06-23 | 株式会社資生堂 | 薬物の遅延放出型マイクロスフイア |
| US5980945A (en) | 1996-01-16 | 1999-11-09 | Societe De Conseils De Recherches Et D'applications Scientifique S.A. | Sustained release drug formulations |
| US6264970B1 (en) | 1996-06-26 | 2001-07-24 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| US6419961B1 (en) | 1996-08-29 | 2002-07-16 | Takeda Chemical Industries, Ltd. | Sustained release microcapsules of a bioactive substance and a biodegradable polymer |
| CA2217134A1 (en) | 1996-10-09 | 1998-04-09 | Sumitomo Pharmaceuticals Co., Ltd. | Sustained release formulation |
| DE69730093T2 (de) | 1996-10-31 | 2006-07-20 | Takeda Pharmaceutical Co. Ltd. | Zubereitung mit verzögerter Freisetzung |
| US6197350B1 (en) | 1996-12-20 | 2001-03-06 | Takeda Chemical Industries, Ltd. | Method of producing a sustained-release preparation |
| US5891474A (en) | 1997-01-29 | 1999-04-06 | Poli Industria Chimica, S.P.A. | Time-specific controlled release dosage formulations and method of preparing same |
| US6613358B2 (en) | 1998-03-18 | 2003-09-02 | Theodore W. Randolph | Sustained-release composition including amorphous polymer |
| KR19990085365A (ko) | 1998-05-16 | 1999-12-06 | 허영섭 | 지속적으로 약물 조절방출이 가능한 생분해성 고분자 미립구 및그 제조방법 |
| US6248363B1 (en) | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| JP2004526419A (ja) | 2000-10-16 | 2004-09-02 | フィロス インク. | 抗体模倣物および他の結合タンパク質のためのタンパク質骨格 |
| JP2004525869A (ja) * | 2000-12-06 | 2004-08-26 | アプライド・リサーチ・システムズ・エイアールエス・ホールディング・ナムローゼ・フェンノートシャップ | 硬皮症の治療及び/又は予防のためのsarp−1の使用 |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| US20030133939A1 (en) | 2001-01-17 | 2003-07-17 | Genecraft, Inc. | Binding domain-immunoglobulin fusion proteins |
| WO2002088171A2 (en) | 2001-04-26 | 2002-11-07 | Avidia Research Institute | Combinatorial libraries of monomer domains |
| US7498171B2 (en) | 2002-04-12 | 2009-03-03 | Anthrogenesis Corporation | Modulation of stem and progenitor cell differentiation, assays, and uses thereof |
| US7968569B2 (en) | 2002-05-17 | 2011-06-28 | Celgene Corporation | Methods for treatment of multiple myeloma using 3-(4-amino-1-oxo-1,3-dihydro-isoindol-2-yl)-piperidine-2,6-dione |
| US7393862B2 (en) | 2002-05-17 | 2008-07-01 | Celgene Corporation | Method using 3-(4-amino-1-oxo-1,3-dihydro-isoindol-2-yl)-piperidine-2,6-dione for treatment of certain leukemias |
| MX2007005884A (es) | 2004-11-16 | 2008-02-12 | Amgen Mountain View Inc | Andamios de proteina y usos de los mismos. |
| US20080051379A1 (en) | 2004-12-01 | 2008-02-28 | Trustees Of Boston University | Compositions and Methods for the Treatment of Peripheral B-Cell Neoplasms |
| GB0709092D0 (en) * | 2007-05-11 | 2007-06-20 | Borrebaeck Carl | Diagnosis and method of disease |
| WO2009042177A1 (en) * | 2007-09-26 | 2009-04-02 | Celgene Corporation | 6-, 7-, or 8-substituted quinazolinone derivatives and compositions comprising and methods of using the same |
| WO2010137547A1 (ja) | 2009-05-25 | 2010-12-02 | 国立大学法人東京工業大学 | 中枢神経細胞の増殖及び分化に係る中核因子を含む医薬組成物 |
| AU2012249491B2 (en) * | 2011-04-29 | 2016-12-15 | Celgene Corporation | Methods for the treatment of cancer and inflammatory diseases using cereblon as a predictor |
-
2012
- 2012-03-09 CA CA 2829592 patent/CA2829592A1/en not_active Abandoned
- 2012-03-09 JP JP2013557916A patent/JP6118273B2/ja not_active Expired - Fee Related
- 2012-03-09 TW TW105111258A patent/TW201700100A/zh unknown
- 2012-03-09 WO PCT/US2012/028498 patent/WO2012125459A1/en active Application Filing
- 2012-03-09 US US13/417,088 patent/US8906932B2/en not_active Expired - Fee Related
- 2012-03-09 EP EP15197498.7A patent/EP3025715A1/en not_active Withdrawn
- 2012-03-09 AU AU2012229300A patent/AU2012229300B2/en not_active Ceased
- 2012-03-09 AR ARP120100782 patent/AR085651A1/es unknown
- 2012-03-09 ES ES12710411.5T patent/ES2659205T3/es active Active
- 2012-03-09 RU RU2017120977A patent/RU2017120977A/ru not_active Application Discontinuation
- 2012-03-09 CN CN201280022744.2A patent/CN103561743A/zh active Pending
- 2012-03-09 ES ES12710836.3T patent/ES2562332T3/es active Active
- 2012-03-09 MX MX2013010153A patent/MX2013010153A/es active IP Right Grant
- 2012-03-09 SI SI201230451A patent/SI2683384T1/sl unknown
- 2012-03-09 EP EP12710411.5A patent/EP2683383B1/en not_active Not-in-force
- 2012-03-09 KR KR20137026402A patent/KR20140019364A/ko not_active Application Discontinuation
- 2012-03-09 KR KR20137026403A patent/KR20140025374A/ko not_active Application Discontinuation
- 2012-03-09 CN CN201280022778.1A patent/CN103561744A/zh active Pending
- 2012-03-09 RU RU2013145524/15A patent/RU2013145524A/ru not_active Application Discontinuation
- 2012-03-09 MX MX2013010217A patent/MX2013010217A/es active IP Right Grant
- 2012-03-09 AU AU2012229316A patent/AU2012229316B2/en not_active Ceased
- 2012-03-09 TW TW101108231A patent/TWI542349B/zh not_active IP Right Cessation
- 2012-03-09 RS RS20160067A patent/RS54553B1/en unknown
- 2012-03-09 RU RU2013145556/15A patent/RU2013145556A/ru not_active Application Discontinuation
- 2012-03-09 PT PT127108363T patent/PT2683384E/pt unknown
- 2012-03-09 SG SG2013064373A patent/SG192947A1/en unknown
- 2012-03-09 CA CA 2829593 patent/CA2829593A1/en not_active Abandoned
- 2012-03-09 EA EA201391319A patent/EA201391319A1/ru unknown
- 2012-03-09 PL PL12710836T patent/PL2683384T3/pl unknown
- 2012-03-09 BR BR112013023277A patent/BR112013023277A2/pt not_active IP Right Cessation
- 2012-03-09 US US13/984,833 patent/US20140148473A1/en not_active Abandoned
- 2012-03-09 HU HUE12710836A patent/HUE027481T2/en unknown
- 2012-03-09 EA EA201691939A patent/EA201691939A1/ru unknown
- 2012-03-09 WO PCT/US2012/028538 patent/WO2012125475A1/en active Application Filing
- 2012-03-09 CN CN201710232755.8A patent/CN107375293A/zh active Pending
- 2012-03-09 DK DK12710836.3T patent/DK2683384T3/da active
- 2012-03-09 BR BR112013023280A patent/BR112013023280A2/pt not_active IP Right Cessation
- 2012-03-09 JP JP2013557904A patent/JP2014510078A/ja not_active Withdrawn
- 2012-03-09 EP EP12710836.3A patent/EP2683384B1/en active Active
- 2012-03-09 SG SG2013066840A patent/SG193320A1/en unknown
-
2013
- 2013-08-15 IL IL227990A patent/IL227990B/en active IP Right Grant
- 2013-08-15 ZA ZA2013/06148A patent/ZA201306148B/en unknown
- 2013-08-21 ZA ZA2013/06305A patent/ZA201306305B/en unknown
- 2013-09-01 IL IL228230A patent/IL228230A/en not_active IP Right Cessation
- 2013-09-09 NI NI201300082A patent/NI201300082A/es unknown
- 2013-09-09 NI NI201300081A patent/NI201300081A/es unknown
-
2014
- 2014-05-28 HK HK14105035.0A patent/HK1191858A1/zh not_active IP Right Cessation
- 2014-11-05 US US14/533,941 patent/US20150126538A1/en not_active Abandoned
-
2016
- 2016-01-12 US US14/993,998 patent/US20160136167A1/en not_active Abandoned
- 2016-01-18 HR HRP20160056TT patent/HRP20160056T1/hr unknown
- 2016-02-02 CY CY20161100088T patent/CY1117430T1/el unknown
- 2016-02-09 SM SM201600034T patent/SMT201600034B/xx unknown
- 2016-12-22 JP JP2016248598A patent/JP2017081959A/ja active Pending
-
2017
- 2017-01-24 JP JP2017009923A patent/JP6348192B2/ja not_active Expired - Fee Related
- 2017-02-22 US US15/439,879 patent/US20170165266A1/en not_active Abandoned
- 2017-04-11 US US15/484,850 patent/US20180055844A1/en not_active Abandoned
- 2017-06-28 AU AU2017204402A patent/AU2017204402A1/en not_active Abandoned
- 2017-08-04 AU AU2017210633A patent/AU2017210633A1/en not_active Abandoned
-
2018
- 2018-05-30 JP JP2018103019A patent/JP2018168159A/ja not_active Withdrawn
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010504973A (ja) * | 2006-09-26 | 2010-02-18 | セルジーン・コーポレーション | 5−置換キナゾリノン誘導体、それを含む組成物、及びその使用方法 |
| JP2011505807A (ja) * | 2007-12-07 | 2011-03-03 | セルジーン コーポレイション | キナゾリノン化合物による治療をモニタリングするためのバイオマーカー |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014514579A (ja) * | 2011-04-29 | 2014-06-19 | セルジーン コーポレイション | セレブロンを予測因子として使用する癌及び炎症性疾患の治療方法 |
| JP2017037081A (ja) * | 2011-04-29 | 2017-02-16 | セルジーン コーポレイション | セレブロンを予測因子として使用する癌及び炎症性疾患の治療方法 |
| JP2016521280A (ja) * | 2013-05-03 | 2016-07-21 | セルジーン コーポレイション | 併用療法を用いて癌を治療する方法 |
| JP2020172502A (ja) * | 2015-07-02 | 2020-10-22 | セルジーン コーポレイション | 血液がん及び固形腫瘍の治療のための併用療法 |
| JP2022502355A (ja) * | 2018-09-07 | 2022-01-11 | メッドシャイン ディスカバリー インコーポレイテッド | 三環式縮合フラン置換ピペリジンジオン系化合物 |
| JP7323603B2 (ja) | 2018-09-07 | 2023-08-08 | メッドシャイン ディスカバリー インコーポレイテッド | 三環式縮合フラン置換ピペリジンジオン系化合物 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6348192B2 (ja) | 3−(5−アミノ−2−メチル−4−オキソ−4h−キナゾリン−3−イル)−ピペリジン−2,6−ジオンを用いる癌の治療方法 | |
| US20190388429A1 (en) | Methods of treating cancer using 3-(4-((4-(morpholinomethyl)benzyl)oxy)-1-oxoisoindolin-2-yl)piperidine-2,6-dione | |
| EP2892537A1 (en) | Methods for the treatment of locally advanced breast cancer | |
| NZ614493B2 (en) | Methods of treating cancer using 3-(5-amino-2-methyl-4-oxo-4h-quinazolin-3-yl)-piperidine-2,6-dione |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150305 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150305 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151201 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160229 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160502 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20160502 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161025 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170120 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20170301 |