ES2767136T3 - Derivados de prostaglandinas - Google Patents
Derivados de prostaglandinas Download PDFInfo
- Publication number
- ES2767136T3 ES2767136T3 ES15194684T ES15194684T ES2767136T3 ES 2767136 T3 ES2767136 T3 ES 2767136T3 ES 15194684 T ES15194684 T ES 15194684T ES 15194684 T ES15194684 T ES 15194684T ES 2767136 T3 ES2767136 T3 ES 2767136T3
- Authority
- ES
- Spain
- Prior art keywords
- compound
- formula
- ono
- pharmaceutical composition
- general formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 150000003180 prostaglandins Chemical class 0.000 title description 12
- 150000001875 compounds Chemical class 0.000 claims abstract description 78
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 9
- 150000003839 salts Chemical class 0.000 claims abstract description 8
- 229960002368 travoprost Drugs 0.000 claims abstract description 5
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 4
- 150000002367 halogens Chemical class 0.000 claims abstract description 4
- MKPLKVHSHYCHOC-AHTXBMBWSA-N travoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)COC1=CC=CC(C(F)(F)F)=C1 MKPLKVHSHYCHOC-AHTXBMBWSA-N 0.000 claims abstract description 4
- 125000001424 substituent group Chemical group 0.000 claims abstract description 3
- 125000003259 prostaglandin group Chemical group 0.000 claims abstract 2
- 238000006243 chemical reaction Methods 0.000 claims description 36
- 238000000034 method Methods 0.000 claims description 22
- 239000000203 mixture Substances 0.000 claims description 22
- 239000000243 solution Substances 0.000 claims description 21
- 238000011282 treatment Methods 0.000 claims description 12
- 239000003814 drug Substances 0.000 claims description 11
- 239000000460 chlorine Substances 0.000 claims description 8
- 239000008194 pharmaceutical composition Substances 0.000 claims description 8
- 125000006239 protecting group Chemical group 0.000 claims description 7
- 229910002651 NO3 Inorganic materials 0.000 claims description 6
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 claims description 6
- 150000002828 nitro derivatives Chemical class 0.000 claims description 6
- 206010018307 Glaucoma and ocular hypertension Diseases 0.000 claims description 5
- 239000002876 beta blocker Substances 0.000 claims description 5
- 229940097320 beta blocking agent Drugs 0.000 claims description 5
- 229910052801 chlorine Inorganic materials 0.000 claims description 4
- 125000001893 nitrooxy group Chemical group [O-][N+](=O)O* 0.000 claims description 4
- 239000003981 vehicle Substances 0.000 claims description 4
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 3
- 125000002947 alkylene group Chemical group 0.000 claims description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 3
- 229910052794 bromium Inorganic materials 0.000 claims description 3
- 239000003489 carbonate dehydratase inhibitor Substances 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical compound O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 claims description 2
- 239000000048 adrenergic agonist Substances 0.000 claims description 2
- 239000000839 emulsion Substances 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 229960004605 timolol Drugs 0.000 claims description 2
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 claims description 2
- 229940122072 Carbonic anhydrase inhibitor Drugs 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 238000011200 topical administration Methods 0.000 claims 1
- 229910004679 ONO2 Inorganic materials 0.000 abstract 4
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 abstract 2
- -1 Prostaglandin nitro derivatives Chemical class 0.000 description 57
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 38
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 27
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 27
- 238000003786 synthesis reaction Methods 0.000 description 22
- 230000015572 biosynthetic process Effects 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 18
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 17
- HNPFPERDNWXAGS-LZCJLJQNSA-N (e)-7-[3,5-dihydroxy-2-(3-hydroxy-5-phenylpentyl)cyclopentyl]hept-5-enoic acid Chemical compound C=1C=CC=CC=1CCC(O)CCC1C(O)CC(O)C1C\C=C\CCCC(O)=O HNPFPERDNWXAGS-LZCJLJQNSA-N 0.000 description 16
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- 235000019439 ethyl acetate Nutrition 0.000 description 15
- 230000004410 intraocular pressure Effects 0.000 description 15
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 12
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 10
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 10
- 239000003480 eluent Substances 0.000 description 10
- 238000002360 preparation method Methods 0.000 description 10
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 10
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- 208000010412 Glaucoma Diseases 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- ZOOGRGPOEVQQDX-UHFFFAOYSA-N cyclic GMP Natural products O1C2COP(O)(=O)OC2C(O)C1N1C=NC2=C1NC(N)=NC2=O ZOOGRGPOEVQQDX-UHFFFAOYSA-N 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 229960001160 latanoprost Drugs 0.000 description 9
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 8
- 239000003208 petroleum Substances 0.000 description 8
- KSEBMYQBYZTDHS-HWKANZROSA-M (E)-Ferulic acid Natural products COC1=CC(\C=C\C([O-])=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-M 0.000 description 7
- 235000001785 ferulic acid Nutrition 0.000 description 7
- 229940114124 ferulic acid Drugs 0.000 description 7
- KSEBMYQBYZTDHS-UHFFFAOYSA-N ferulic acid Natural products COC1=CC(C=CC(O)=O)=CC=C1O KSEBMYQBYZTDHS-UHFFFAOYSA-N 0.000 description 7
- 238000003818 flash chromatography Methods 0.000 description 7
- 239000012074 organic phase Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- QURCVMIEKCOAJU-UHFFFAOYSA-N trans-isoferulic acid Natural products COC1=CC=C(C=CC(O)=O)C=C1O QURCVMIEKCOAJU-UHFFFAOYSA-N 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- 239000002253 acid Substances 0.000 description 6
- 125000000217 alkyl group Chemical group 0.000 description 6
- KSEBMYQBYZTDHS-HWKANZROSA-N ferulic acid Chemical compound COC1=CC(\C=C\C(O)=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-N 0.000 description 6
- OKDQKPLMQBXTNH-UHFFFAOYSA-N n,n-dimethyl-2h-pyridin-1-amine Chemical compound CN(C)N1CC=CC=C1 OKDQKPLMQBXTNH-UHFFFAOYSA-N 0.000 description 6
- 239000003960 organic solvent Substances 0.000 description 6
- 230000000699 topical effect Effects 0.000 description 6
- IKDHVMDABUMCLO-UHFFFAOYSA-N 4-bromobutyl nitrate Chemical compound [O-][N+](=O)OCCCCBr IKDHVMDABUMCLO-UHFFFAOYSA-N 0.000 description 5
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 5
- GGXICVAJURFBLW-CEYXHVGTSA-N latanoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1CC[C@@H](O)CCC1=CC=CC=C1 GGXICVAJURFBLW-CEYXHVGTSA-N 0.000 description 5
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 5
- 229910001961 silver nitrate Inorganic materials 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 210000001742 aqueous humor Anatomy 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 125000004432 carbon atom Chemical group C* 0.000 description 4
- 239000012442 inert solvent Substances 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- HJUGFYREWKUQJT-UHFFFAOYSA-N tetrabromomethane Chemical compound BrC(Br)(Br)Br HJUGFYREWKUQJT-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 3
- SIJLYRDVTMMSIP-UHFFFAOYSA-N 4-Bromo-1-butanol Chemical compound OCCCCBr SIJLYRDVTMMSIP-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- AIGRXSNSLVJMEA-UHFFFAOYSA-N EPN Chemical compound C=1C=CC=CC=1P(=S)(OCC)OC1=CC=C([N+]([O-])=O)C=C1 AIGRXSNSLVJMEA-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 3
- 206010030043 Ocular hypertension Diseases 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Natural products CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 150000004820 halides Chemical class 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 3
- 150000007530 organic bases Chemical class 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 201000004569 Blindness Diseases 0.000 description 2
- 229940126062 Compound A Drugs 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 229940006133 antiglaucoma drug and miotics carbonic anhydrase inhibitors Drugs 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- 239000012300 argon atmosphere Substances 0.000 description 2
- 125000001246 bromo group Chemical group Br* 0.000 description 2
- ZCCIPPOKBCJFDN-UHFFFAOYSA-N calcium nitrate Chemical compound [Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ZCCIPPOKBCJFDN-UHFFFAOYSA-N 0.000 description 2
- 229960001631 carbomer Drugs 0.000 description 2
- 229910052799 carbon Inorganic materials 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 230000001713 cholinergic effect Effects 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 150000002009 diols Chemical class 0.000 description 2
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical class [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 201000001881 impotence Diseases 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- IIPYXGDZVMZOAP-UHFFFAOYSA-N lithium nitrate Chemical compound [Li+].[O-][N+]([O-])=O IIPYXGDZVMZOAP-UHFFFAOYSA-N 0.000 description 2
- YIXJRHPUWRPCBB-UHFFFAOYSA-N magnesium nitrate Chemical compound [Mg+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O YIXJRHPUWRPCBB-UHFFFAOYSA-N 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 238000003760 magnetic stirring Methods 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 229910017604 nitric acid Inorganic materials 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000012429 reaction media Substances 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- VWDWKYIASSYTQR-UHFFFAOYSA-N sodium nitrate Chemical compound [Na+].[O-][N+]([O-])=O VWDWKYIASSYTQR-UHFFFAOYSA-N 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Substances ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- ONDPHDOFVYQSGI-UHFFFAOYSA-N zinc nitrate Chemical compound [Zn+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ONDPHDOFVYQSGI-UHFFFAOYSA-N 0.000 description 2
- GCKBVYBCFQGKGP-UHFFFAOYSA-N (3-hydroxyphenyl)methyl nitrate Chemical compound OC1=CC=CC(CO[N+]([O-])=O)=C1 GCKBVYBCFQGKGP-UHFFFAOYSA-N 0.000 description 1
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- KIHQZLPHVZKELA-UHFFFAOYSA-N 1,3-dibromopropan-2-ol Chemical compound BrCC(O)CBr KIHQZLPHVZKELA-UHFFFAOYSA-N 0.000 description 1
- VSOJWGJCPFPODA-UHFFFAOYSA-N 1,3-dinitropropane-1,2,3-triol Chemical class [O-][N+](=O)C(O)C(O)C(O)[N+]([O-])=O VSOJWGJCPFPODA-UHFFFAOYSA-N 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical group CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- WEGOLYBUWCMMMY-UHFFFAOYSA-N 1-bromo-2-propanol Chemical compound CC(O)CBr WEGOLYBUWCMMMY-UHFFFAOYSA-N 0.000 description 1
- VCUXVXLUOHDHKK-UHFFFAOYSA-N 2-(2-aminopyrimidin-4-yl)-4-(2-chloro-4-methoxyphenyl)-1,3-thiazole-5-carboxamide Chemical compound ClC1=CC(OC)=CC=C1C1=C(C(N)=O)SC(C=2N=C(N)N=CC=2)=N1 VCUXVXLUOHDHKK-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- LDLCZOVUSADOIV-UHFFFAOYSA-N 2-bromoethanol Chemical compound OCCBr LDLCZOVUSADOIV-UHFFFAOYSA-N 0.000 description 1
- VZIQXGLTRZLBEX-UHFFFAOYSA-N 2-chloro-1-propanol Chemical compound CC(Cl)CO VZIQXGLTRZLBEX-UHFFFAOYSA-N 0.000 description 1
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 1
- DFRAKBCRUYUFNT-UHFFFAOYSA-N 3,8-dicyclohexyl-2,4,7,9-tetrahydro-[1,3]oxazino[5,6-h][1,3]benzoxazine Chemical compound C1CCCCC1N1CC(C=CC2=C3OCN(C2)C2CCCCC2)=C3OC1 DFRAKBCRUYUFNT-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- RQFUZUMFPRMVDX-UHFFFAOYSA-N 3-Bromo-1-propanol Chemical compound OCCCBr RQFUZUMFPRMVDX-UHFFFAOYSA-N 0.000 description 1
- FCMCSZXRVWDVAW-UHFFFAOYSA-N 6-bromo-1-hexanol Chemical compound OCCCCCCBr FCMCSZXRVWDVAW-UHFFFAOYSA-N 0.000 description 1
- GDUANFXPOZTYKS-UHFFFAOYSA-N 6-bromo-8-[(2,6-difluoro-4-methoxybenzoyl)amino]-4-oxochromene-2-carboxylic acid Chemical compound FC1=CC(OC)=CC(F)=C1C(=O)NC1=CC(Br)=CC2=C1OC(C(O)=O)=CC2=O GDUANFXPOZTYKS-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- XYLJNLCSTIOKRM-UHFFFAOYSA-N Alphagan Chemical compound C1=CC2=NC=CN=C2C(Br)=C1NC1=NCCN1 XYLJNLCSTIOKRM-UHFFFAOYSA-N 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 201000002862 Angle-Closure Glaucoma Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- 102000003846 Carbonic anhydrases Human genes 0.000 description 1
- 108090000209 Carbonic anhydrases Proteins 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical class ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 206010051625 Conjunctival hyperaemia Diseases 0.000 description 1
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- 206010014418 Electrolyte imbalance Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 206010015946 Eye irritation Diseases 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 206010030348 Open-Angle Glaucoma Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 1
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 1
- 208000012641 Pigmentation disease Diseases 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- 208000027418 Wounds and injury Diseases 0.000 description 1
- RDHSYXFAOVTAEH-UHFFFAOYSA-N [4-(bromomethyl)phenyl]methanol Chemical compound OCC1=CC=C(CBr)C=C1 RDHSYXFAOVTAEH-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical class [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 229960002610 apraclonidine Drugs 0.000 description 1
- IEJXVRYNEISIKR-UHFFFAOYSA-N apraclonidine Chemical compound ClC1=CC(N)=CC(Cl)=C1NC1=NCCN1 IEJXVRYNEISIKR-UHFFFAOYSA-N 0.000 description 1
- 230000004509 aqueous humor production Effects 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229960004324 betaxolol Drugs 0.000 description 1
- CHDPSNLJFOQTRK-UHFFFAOYSA-N betaxolol hydrochloride Chemical compound [Cl-].C1=CC(OCC(O)C[NH2+]C(C)C)=CC=C1CCOCC1CC1 CHDPSNLJFOQTRK-UHFFFAOYSA-N 0.000 description 1
- AQOKCDNYWBIDND-FTOWTWDKSA-N bimatoprost Chemical compound CCNC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)CCC1=CC=CC=C1 AQOKCDNYWBIDND-FTOWTWDKSA-N 0.000 description 1
- 229960002470 bimatoprost Drugs 0.000 description 1
- 238000011325 biochemical measurement Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 230000036471 bradycardia Effects 0.000 description 1
- 208000006218 bradycardia Diseases 0.000 description 1
- 229960003679 brimonidine Drugs 0.000 description 1
- 229960000722 brinzolamide Drugs 0.000 description 1
- HCRKCZRJWPKOAR-JTQLQIEISA-N brinzolamide Chemical compound CCN[C@H]1CN(CCCOC)S(=O)(=O)C2=C1C=C(S(N)(=O)=O)S2 HCRKCZRJWPKOAR-JTQLQIEISA-N 0.000 description 1
- 229940124630 bronchodilator Drugs 0.000 description 1
- 239000000168 bronchodilator agent Substances 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 201000005682 chronic closed-angle glaucoma Diseases 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid group Chemical class C(CC(O)(C(=O)O)CC(=O)O)(=O)O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 1
- 229940125904 compound 1 Drugs 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000002993 cycloalkylene group Chemical group 0.000 description 1
- 125000004956 cyclohexylene group Chemical group 0.000 description 1
- 125000004979 cyclopentylene group Chemical group 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 239000012024 dehydrating agents Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000002526 effect on cardiovascular system Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 231100000013 eye irritation Toxicity 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000003126 guanylate cyclase inhibitor Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 125000005842 heteroatom Chemical group 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
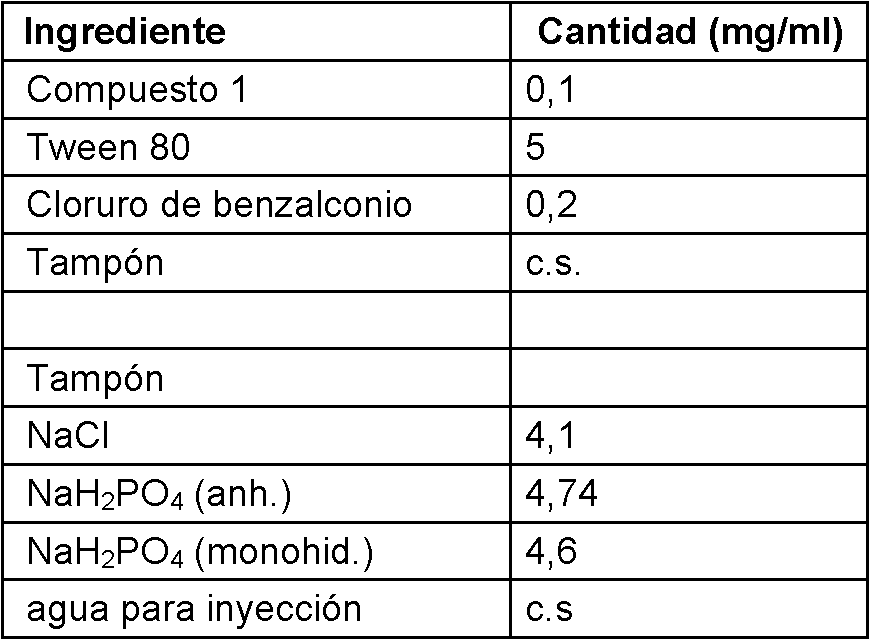
- 239000004615 ingredient Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 150000002497 iodine compounds Chemical class 0.000 description 1
- 201000004614 iritis Diseases 0.000 description 1
- MVFCKEFYUDZOCX-UHFFFAOYSA-N iron(2+);dinitrate Chemical compound [Fe+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O MVFCKEFYUDZOCX-UHFFFAOYSA-N 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 229960000831 levobunolol Drugs 0.000 description 1
- IXHBTMCLRNMKHZ-LBPRGKRZSA-N levobunolol Chemical compound O=C1CCCC2=C1C=CC=C2OC[C@@H](O)CNC(C)(C)C IXHBTMCLRNMKHZ-LBPRGKRZSA-N 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 208000018769 loss of vision Diseases 0.000 description 1
- 231100000864 loss of vision Toxicity 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- FJQXCDYVZAHXNS-UHFFFAOYSA-N methadone hydrochloride Chemical compound Cl.C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 FJQXCDYVZAHXNS-UHFFFAOYSA-N 0.000 description 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N methanol Substances OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 230000003547 miosis Effects 0.000 description 1
- YGBMCLDVRUGXOV-UHFFFAOYSA-N n-[6-[6-chloro-5-[(4-fluorophenyl)sulfonylamino]pyridin-3-yl]-1,3-benzothiazol-2-yl]acetamide Chemical compound C1=C2SC(NC(=O)C)=NC2=CC=C1C(C=1)=CN=C(Cl)C=1NS(=O)(=O)C1=CC=C(F)C=C1 YGBMCLDVRUGXOV-UHFFFAOYSA-N 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 150000002826 nitrites Chemical class 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000001328 optic nerve Anatomy 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 125000003431 oxalo group Chemical group 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Chemical group 0.000 description 1
- 208000035824 paresthesia Diseases 0.000 description 1
- 125000004817 pentamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 238000003359 percent control normalization Methods 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 230000019612 pigmentation Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 235000010333 potassium nitrate Nutrition 0.000 description 1
- 239000004323 potassium nitrate Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 150000003165 prostaglandin E1 derivatives Chemical class 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010344 sodium nitrate Nutrition 0.000 description 1
- 239000004317 sodium nitrate Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005207 tetraalkylammonium group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000002211 ultraviolet spectrum Methods 0.000 description 1
- TVHAZVBUYQMHBC-SNHXEXRGSA-N unoprostone Chemical compound CCCCCCCC(=O)CC[C@H]1[C@H](O)C[C@H](O)[C@@H]1C\C=C/CCCC(O)=O TVHAZVBUYQMHBC-SNHXEXRGSA-N 0.000 description 1
- 229960004317 unoprostone Drugs 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C405/00—Compounds containing a five-membered ring having two side-chains in ortho position to each other, and having oxygen atoms directly attached to the ring in ortho position to one of the side-chains, one side-chain containing, not directly attached to the ring, a carbon atom having three bonds to hetero atoms with at the most one bond to halogen, and the other side-chain having oxygen atoms attached in gamma-position to the ring, e.g. prostaglandins ; Analogues or derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C405/00—Compounds containing a five-membered ring having two side-chains in ortho position to each other, and having oxygen atoms directly attached to the ring in ortho position to one of the side-chains, one side-chain containing, not directly attached to the ring, a carbon atom having three bonds to hetero atoms with at the most one bond to halogen, and the other side-chain having oxygen atoms attached in gamma-position to the ring, e.g. prostaglandins ; Analogues or derivatives thereof
- C07C405/0008—Analogues having the carboxyl group in the side-chains replaced by other functional groups
- C07C405/0016—Analogues having the carboxyl group in the side-chains replaced by other functional groups containing only hydroxy, etherified or esterified hydroxy groups
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/04—Nitro compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/5575—Eicosanoids, e.g. leukotrienes or prostaglandins having a cyclopentane, e.g. prostaglandin E2, prostaglandin F2-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Ophthalmology & Optometry (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Hydrogenated Pyridines (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
Abstract
Un compuesto de fórmula general (I) o una sal o estereoisómero farmacéuticamente aceptable del mismo R-X-Y-ONO2 (I) en la que R es el residuo de prostaglandina de Travoprost de fórmula (II):**Fórmula** X es -O- o -S; Y es un radical bivalente que tiene el siguiente significado: a) - alquileno C1-C20 lineal o ramificado, estando opcionalmente sustituido con uno o más de los sustituyentes seleccionados entre el grupo que consiste en: átomos de halógeno, hidroxi, -ONO2 o T, en el que T es -OC(O)(alquilo C1-C10)-ONO2 o -O(alquilo C1-C10)-ONO2.
Description
DESCRIPCIÓN
Derivados de prostaglandinas
La presente invención se refiere a nuevos derivados de prostaglandinas. Más en particular, la presente invención se refiere a nitrooxiderivados de prostaglandinas, a composiciones farmacéuticas que los contienen y a su uso como fármacos para el tratamiento del glaucoma y la hipertensión ocular.
El glaucoma es la lesión del nervio óptico, con frecuencia asociado al aumento de la presión intraocular (PIO), que conduce a la pérdida de la visión progresiva e irreversible.
Casi 3 millones de personas en los Estados Unidos y 14 millones de personas en todo el mundo tienen glaucoma; esta es la tercera causa destacada de ceguera en todo el mundo.
El glaucoma se produce cuando un desequilibrio en la producción y el drenaje de líquido en el ojo (humor acuoso) aumentan la presión del ojo a niveles no saludables.
Se sabe que la PIO elevada puede controlarse al menos parcialmente mediante la administración de fármacos que o bien reducen la producción de humor acuoso dentro del ojo o bien aumentan el drenaje de líquido, tales como betabloqueantes, a-agonistas, agentes colinérgicos, inhibidores de la anhidrasa carbónica o análogos de prostaglandinas.
Se asocian varios efectos secundarios a los fármacos utilizados convencionalmente para tratar el glaucoma.
Los betabloqueantes tópicos muestran efectos secundarios pulmonares graves, depresión, fatiga, confusión, impotencia, pérdida de cabello, insuficiencia cardíaca y bradicardia.
Los a-agonistas tópicos tienen una incidencia bastante alta de reacciones alérgicas o tóxicas; los agentes colinérgicos tópicos (mióticos) pueden causar efectos secundarios visuales.
Los efectos secundarios asociados a los inhibidores de la anhidrasa carbónica orales incluyen fatiga, anorexia, depresión, parestesias y alteraciones de electrolitos en suero (The Merck Manual of Diagnosis and Therapy, Decimoséptima Edición, Editores M. H. Beers y R. Berkow, Sec. 8 , Cap. 100).
Por último, los análogos de prostaglandinas tópicos (bimatoprost, latanoprost, travoprost y unoprostona) utilizados en el tratamiento del glaucoma, pueden producir efectos secundarios oculares, tales como aumento de la pigmentación del iris, irritación ocular, hiperemia conjuntival, iritis, uveítis y edema macular (Martindale, Trigésimo Tercera edición, p. 1445).
La Patente de los EE.UU. N.° 3.922.293 describe monocarboxiacilatos de prostaglandinas de tipo F y sus isómeros 15p, en la posición C-9, y procedimientos para prepararlos; la Patente de los EE.UU. N.° 6.417.228 desvela 13-aza prostaglandinas que tienen actividad agonista del receptor PGF2a y su uso en el tratamiento del glaucoma y la hipertensión ocular.
El documento WO 90/02553 desvela el uso de derivados de prostaglandinas de PGA, PGB, PGE y PGF, en los que la cadena omega contiene una estructura de anillo, para el tratamiento del glaucoma o la hipertensión ocular.
El documento WO 00/51978 describe prostaglandinas nitrosadas y/o nitrosiladas novedosas, en particular derivados de PGE1 novedosos, composiciones novedosas y su uso para el tratamiento de disfunciones sexuales.
La Patente de los EE.UU. N.° 5.625.083 desvela ésteres de dinitroglicerol de prostaglandinas que pueden usarse como vasodilatadores, agentes cardiovasculares antihipertensivos o broncodilatadores.
La Patente de los EE.UU. N.° 6.211.233 desvela compuestos de fórmula general A-X1-NO2 , en la que A contiene un resto de prostaglandina, en particular PGE1, y X1 es un puente de conexión bivalente, y su uso para tratar la impotencia.
Es un objeto de la presente invención proporcionar nuevos derivados de prostaglandinas capaces no solo de eliminar o al menos reducir los efectos secundarios asociados a estos compuestos, sino también de poseer una actividad farmacológica mejorada. Se ha descubierto sorprendentemente que los nitroderivados de prostaglandinas tienen un perfil global significativamente mejorado en comparación con las prostaglandinas nativas en términos tanto de actividad farmacológica más amplia como de tolerabilidad potenciada. En particular, se ha reconocido que los nitroderivados de prostaglandinas de la presente invención pueden emplearse para el tratamiento del glaucoma y la hipertensión ocular. Los compuestos de la presente invención están indicados para la reducción de la presión intraocular en pacientes con glaucoma de ángulo abierto o con glaucoma de ángulo cerrado crónico que se sometieron a iridotomía periférica o iridoplastia por láser.
Son un objeto de la presente invención, por tanto, nitroderivados de travoprost de fórmula general (I) y sales o estereoisómeros farmacéuticamente aceptables de los mismos
r-x -y -o n o 2 (i)
en la que R es el residuo de travoprost de fórmula (II):
X es -O- o -S-;
Y es un radical bivalente que tiene los siguientes significados:
a)
- alquileno C1-C20 lineal o ramificado, preferentemente C1-C10, estando opcionalmente sustituido con uno o más de los sustituyentes seleccionados entre el grupo que consiste en: átomos de halógeno, hidroxi, -ONO2 o T, en el que T es -OC(O)(alquilo C1-C10)-ONO2 o -O(alquilo C1-C10)-ONO2.
La expresión “alquileno C1-C20” como se usa en el presente documento se refiere a un hidrocarburo C1-C20 de cadena lineal o ramificada, que tiene preferentemente de 1 a 10 átomos de carbono, tal como metileno, etileno, propileno, isopropileno, n-butileno, pentileno, n-hexileno y similares.
La expresión “alquilo C1-C10” como se usa en el presente documento se refiere a grupos alquilo de cadena lineal o ramificada que comprenden de uno a diez átomos de carbono, incluyendo metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, t-butilo, pentilo, hexilo, octilo y similares.
El término “cicloalquileno” como se usa en el presente documento se refiere a un anillo que tiene de 5 a 7 átomos de carbono incluyendo, pero no limitado a, ciclopentileno, ciclohexileno opcionalmente sustituido con cadenas laterales tales como alquilo-(C1-C10) lineal o ramificado, preferentemente CH3.
El término “heterocíclico” como se usa en el presente documento se refiere a un anillo de 5 o 6 miembros saturado, insaturado o aromático, que contiene uno o más heteroátomos seleccionados entre nitrógeno, oxígeno, azufre, tal como, por ejemplo, piridina, pirazina, pirimidina, pirrolidina, morfolina, imidazol y similares.
Como se ha indicado anteriormente, la invención incluye también las sales farmacéuticamente aceptables de los compuestos de fórmula (I) y los estereoisómeros de los mismos.
Son ejemplos de sales farmacéuticamente aceptables ya sea aquellas con bases inorgánicas, tales como hidróxidos de sodio, potasio, calcio y aluminio, o con bases orgánicas, tales como lisina, arginina, trietilamina, dibencilamina, piperidina y otras aminas orgánicas aceptables.
Los compuestos de acuerdo con la presente invención, cuando contienen en la molécula un átomo de nitrógeno salificable, pueden transformarse en las sales correspondientes mediante la reacción en un disolvente orgánico tal como acetonitrilo, tetrahidrofurano, con los ácidos orgánicos o inorgánicos correspondientes.
Son ejemplos de ácidos orgánicos: ácidos oxálico, tartárico, maleico, succínico, cítrico. Son ejemplos de ácidos inorgánicos: ácidos nítrico, clorhídrico, sulfúrico, fosfórico. Se prefieren las sales con ácido nítrico.
Los compuestos de la invención que tienen uno o más átomos de carbono asimétricos pueden existir como enantiómeros ópticamente puros, diastereómeros puros, mezclas de enantiómeros, mezclas de diastereómeros, mezclas racémicas de enantiómeros, racematos o mezclas de racematos. Dentro del ámbito de la invención también están todos los posibles isómeros, estereoisómeros y sus mezclas de los compuestos de fórmula (I), incluyendo las mezclas enriquecidas en un isómero particular.
Los siguientes son compuestos preferidos de acuerdo con la presente invención:
Como se ha mencionado anteriormente, son también objetos de la presente invención las composiciones farmacéuticas que contienen al menos un compuesto de la presente invención de fórmula (I) junto con adyuvantes atóxicos y/o vehículos habitualmente empleados en el campo farmacéutico.
La vía preferida de administración es la tópica.
Los compuestos de la presente invención pueden administrarse como soluciones, suspensiones o emulsiones (dispersiones) en un vehículo oftálmicamente aceptable. La expresión “vehículo oftálmicamente aceptable” como se usa en el presente documento se refiere a cualquier sustancia o combinación de sustancias que no son reactivas con los compuestos y son adecuadas para la administración al paciente.
Se prefieren los vehículos acuosos adecuados para su aplicación tópica en los ojos del paciente.
Otros ingredientes que puede ser deseable usar en las composiciones oftálmicas de la presente invención incluyen los antimicrobianos, conservantes, cosolventes, tensioactivos y agentes potenciadores de la viscosidad.
La invención también se refiere a los compuestos de la presente invención para su uso en un procedimiento para el tratamiento del glaucoma o la hipertensión ocular, consistiendo dicho procedimiento en poner en contacto una cantidad que reduce la presión intraocular eficaz de una composición con el ojo para reducir la presión ocular y mantener dicha presión en un nivel reducido.
Las dosis de nitroderivados de prostaglandinas pueden determinarse mediante técnicas clínicas convencionales y están en el mismo intervalo o son inferiores a las descritas para los compuestos de prostaglandinas disponibles en el mercado no derivatizados correspondientes, como se presenta en el: Physician’s Desk Reference, Medical Economics Company, Inc., Oradell, N. J., 58a Ed, 2004; The pharmacological basis of therapeutics, Goodman y Gilman, J. G. Hardman, L. E. Limbird, Décima Ed.
Las composiciones contienen 0,1-0,30 |jg, especialmente 1-10 |jg, por aplicación del compuesto activo.
El tratamiento puede realizarse ventajosamente administrando una gota de la composición, correspondiente a aproximadamente 30 jl, aproximadamente 1 a 2 veces al día en el ojo del paciente.
Se considera además que los compuestos de la presente invención puedan usarse con otros medicamentos que se sabe que son útiles en el tratamiento del glaucoma o la hipertensión ocular, ya sea por separado o en combinación. Por ejemplo, los compuestos de la presente invención pueden combinarse con (i) beta bloqueantes, tales como timolol, betaxolol, levobunolol y similares (véase la Patente de los EE.UU. N.° 4.952.581.); (ii) inhibidores de la anhidrasa carbónica, tales como brinzolamida; (iii) agonistas adrenérgicos incluyendo los derivados de clonidina, tales como apraclonidina o brimonidina (véase la Patente de los EE.UU. N.° 5.811.443. También se considera la combinación con nitrooxiderivados de los compuestos presentados anteriormente, por ejemplo nitrooxiderivados de beta-bloqueantes tales como los desvelados en la Patente de los EE.U. N.° 6.242.432.
Los compuestos de la presente invención pueden sintetizarse de la siguiente manera.
Procedimiento de síntesis
Los compuestos de fórmula general (I) como se han definido anteriormente, pueden obtenerse:
i) haciendo reaccionar un compuesto de fórmula (III)
en la que
L es como se ha definido anteriormente; P es H o un grupo protector de hidroxi tal como éteres de sililo, tales como trimetilsililo, terc-butil-dimetilsililo o acetilo y los descritos en T. W. Greene "Protective Groups in Organic Synthesis", Harvard University Press, 1980, 2a edición, p. 14-118; W es -OH, Cl o -OC(O)Ri en la que R1 es un alquilo C1-C5 lineal o ramificado;
con un compuesto de fórmula (IV) Z-Y-Q en la que Y es como se ha definido anteriormente, Z es HX o Z1, siendo X como se ha definido anteriormente y seleccionándose Z1 entre el grupo que consiste en: cloro, bromo, yodo, mesilo, tosilo;
Q es -ONO2 o Z1 y
ii) cuando Q es Z1, convirtiendo el compuesto obtenido en la etapa i) en un nitroderivado mediante la reacción con una fuente de nitrato tal como nitrato de plata, nitrato de litio, nitrato de sodio, nitrato de potasio, nitrato de magnesio, nitrato de calcio, nitrato de hierro, nitrato de zinc o nitrato de tetraalquilamonio (en el que el alquilo es alquilo C1-C10) en un disolvente orgánico adecuado tal como acetonitrilo, tetrahidrofurano, metil etil cetona, acetato de etilo, DMF, la reacción se realiza, en la oscuridad, a una temperatura desde la temperatura ambiente hasta la temperatura de ebullición del disolvente. La fuente de nitrato preferida es el nitrato de plata y iii) desprotegiendo opcionalmente los compuestos obtenidos en la etapa i) o ii) como se describe en T. W. Greene “Protective Groups in Organic Synthesis", Harvard University Press, 1980, 2a edición, p. 68-86. El ion fluoruro es el procedimiento preferido para retirar el grupo protector éter de sililo.
- La reacción de un compuesto de fórmula (III) en la que W = -OH, P y X1 son como se han definido anteriormente, con un compuesto de fórmula (IV) en la que Y y Q son como se han definido anteriormente, Z es HX puede realizarse en presencia de un agente deshidratante como diciclohexilcarbodiimida (DCC) o clorhidrato de N'-(3-dimetilaminopropil)-N-etilcarbodiimida (EDAC) y un catalizador, tal como N,N-dimetilamino piridina (DMAP). La reacción se realiza en un disolvente inerte orgánico seco tal como N,N'-dimetilformamida, tetrahidrofurano, benceno, tolueno, dioxano, un hidrocarburo alifático polihalogenado a una temperatura de -20 °C a 40 °C. La reacción se completa dentro de un intervalo de tiempo de 30 minutos a 36 horas.
Los compuestos de fórmula (III) en la que W = -OH y P = H están disponibles en el mercado;
Los compuestos de fórmula (III) en la que W = -OH y P es un grupo protector de hidroxi pueden prepararse a partir de los compuestos correspondientes en los que P = H como es bien sabido en la técnica, por ejemplo como se describe en T. W. Greene “Protective Groups in Organic Synthesis", Harvard University Press, 1980, 2a edición, p.
14-118.
- La reacción de un compuesto de fórmula (III) en la que W = -OC(O)R1 en la que R1 es como se ha definido anteriormente y P = H o un grupo protector hidroxílico, con un compuesto de fórmula (IV) en la que Y es como se ha definido anteriormente, Z es -OH y Q es -ONO2 puede realizarse en presencia de un catalizador, tal como N,N-dimetilamino piridina (DMAP). La reacción se realiza en un disolvente orgánico inerte tal como N,N'-dimetilformamida, tetrahidrofurano, benceno, tolueno, dioxano, un hidrocarburo alifático polihalogenado a una temperatura de -20 °C a 40 °C. La reacción se completa dentro de un intervalo de tiempo de 30 minutos a 36 horas.
Los compuestos de fórmula (III) en la que W = -OC(O)R1 y P = H pueden obtenerse a partir de los ácidos
correspondientes en los que W = -OH mediante la reacción con un cloroformiato tal como cloroformiato de isobutilo, cloroformiato de etilo en presencia de una base no nucleófila tal como trietilamina en un disolvente orgánico inerte tal como N,N'-dimetilformamida, tetrahidrofurano, un hidrocarburo alifático polihalogenado a una temperatura de -20 °C a 40 °C. La reacción se completa dentro de un intervalo de tiempo de 1 a 8 horas.
- La reacción de un compuesto de fórmula (III) en la que W = -OH y P = H, con un compuesto de fórmula (IV) en la que Y es como se ha definido anteriormente, Z es Zi y Q es -ONO2 puede realizarse en presencia de una base orgánica tal como 1,8-diazabiciclo[5.4.0]undec-7-eno (DBU), N,N-diisopropiletilamina, diisopropilamina o una base inorgánica tal como un carbonato o hidróxido de metal alcalinotérreo, carbonato de potasio, carbonato de cesio, en un disolvente orgánico inerte tal como N,N'-dimetilformamida, tetrahidrofurano, acetona, metil etil cetona, acetonitrilo, un hidrocarburo alifático polihalogenado a una temperatura de -20 °C a 40 °C, preferentemente de 5 °C a 25 °C. La reacción se completa dentro de un intervalo de tiempo de 1 a 8 horas. Cuando Zi se elige entre cloro o bromo, la reacción se realiza en presencia de un compuesto de yodo tal como KI.
- La reacción de un compuesto de fórmula (III) en la que W = Cl y P es como se ha definido anteriormente, con un compuesto de fórmula (IV) en la que Y es como se ha definido anteriormente, Z es -OH y Q es -ONO2 puede realizarse en presencia de una base orgánica tal como N,N-dimetilamino piridina (DMAP), trietilamina, piridina. La reacción se realiza en un disolvente orgánico inerte tal como N,N'-dimetilformamida, tetrahidrofurano, benceno, tolueno, dioxano, un hidrocarburo alifático polihalogenado a una temperatura de -20 °C a 40 °C. La reacción se completa dentro de un intervalo de tiempo de 30 minutos a 36 horas.
Los compuestos de fórmula (III) en la que W = Cl pueden obtenerse a partir de los ácidos correspondientes en los que W = -OH mediante la reacción con un cloruro de tionilo u oxalilo, haluros de PIN o PV en disolventes inertes tales como tolueno, cloroformo, DMF.
Los compuestos de fórmula HO-Y-ONO2, en la que Y es como se ha definido anteriormente pueden obtenerse de la siguiente manera. El derivado de diol correspondiente, disponible en el mercado, o sintetizado mediante reacciones bien conocidas, se convierte en HO-Y-Zi, en el que Zi es como se ha definido anteriormente, mediante reacciones bien conocidas, por ejemplo mediante la reacción con cloruro de tionilo u oxalilo, haluros de PIN o PV, cloruro de mesilo, cloruro de tosilo en disolventes inertes tales como tolueno, cloroformo, DMF, etc. La conversión en el nitroderivado se realiza como se ha descrito anteriormente. Como alternativa, el derivado de diol puede nitrarse mediante la reacción con ácido nítrico y anhídrido acético en un intervalo de temperatura de -50 °C a 0 °C de acuerdo con procedimientos bien conocidos en la bibliografía.
Los compuestos de fórmula Z1-Y-ONO2, en la que Y y Zi son como se han definido anteriormente pueden obtenerse a partir del derivado de halógeno Zi-Y-Hal, disponible en el mercado o sintetizado de acuerdo con procedimientos bien conocidos en la bibliografía, mediante la conversión en el nitroderivado como se ha descrito anteriormente. Los compuestos de fórmula H-X-Y-Zi, en la que X, Y y Z son como se han definido anteriormente pueden obtenerse a partir del derivado de hidroxilo H-X-Y-OH, disponible en el mercado o sintetizado de acuerdo con procedimientos bien conocidos en la bibliografía, mediante reacciones bien conocidas, por ejemplo mediante la reacción con cloruro de tionilo u oxalilo, haluros de PIN o PV, cloruro de mesilo, cloruro de tosilo en disolventes inertes tales como tolueno, cloroformo, DMF, etc.
Los siguientes ejemplos son para ilustrar adicionalmente la invención sin limitarla.
Ejemplo 1 (de referencia)
Síntesis del éster 4-(nitrooxi)butílico del ácido [iR-[ia(Z),2a(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentili-5-heptenoico (compuesto i )
I Vía de Síntesis
11.1 Preparación de 4-bromobutanol
Se cargó tetrahidrofurano (12,5 g - 173°mmol) en atmósfera de nitrógeno en un reactor enfriado a 5-10 °C. Después, se añadió bromuro de hidrógeno (7 g - 86,5°mmol) lentamente y el medio de reacción se agitó durante un periodo de 4,5 horas a 5-10 °C. La mezcla se diluyó con 22,5 g de agua fría y el pH de esta solución se ajustó a pH = 5-7 mediante la adición de hidróxido de sodio al 27,65% (2,0 g) manteniendo la temperatura a 5-10 °C. Después, la solución se extrajo dos veces con diclorometano (13,25 g). Las fases orgánicas combinadas se lavaron con salmuera al 25 % (7,5 g), se ajustaron a pH = 6-7 con hidróxido de sodio al 27,65 % y se secaron sobre sulfato de magnesio. El diclorometano se retiró por destilación y se obtuvo 4-bromobutanol en bruto (10,3 g - 66,9°mmol) con un rendimiento de aproximadamente el 77 %.
11.2 Preparación de nitrato de 4-bromobutilo
En un reactor enfriado a -5 a 5 °C, se añadió ácido nítrico fumante (8,5 g - 135°mmol) lentamente a una solución de ácido sulfúrico al 98% (13,0 g - 130°mmol) en diclorometano (18,0 g - 212°mmol). Después se añadió 4-bromobutanol (10,2 g - 66,6°mmol) a esta mezcla y el medio de reacción se agitó a -5 a 5 °C durante un periodo de 2-5 horas. La mezcla se vertió en agua fría (110 g) manteniendo la temperatura entre -5 °C y 3 °C. Después de la decantación, la fase acuosa superior se extrajo con diclorometano y las fases orgánicas combinadas se lavaron con agua, se ajustaron a pH = 6-7 mediante la adición de hidróxido de sodio al 27,65 %, se lavaron con salmuera y se secaron sobre sulfato de magnesio. El diclorometano se retiró por destilación al vacío y se recuperó 4-bromobutilnitrato en bruto (12,7 g - 64,1°mmol) con un rendimiento de aproximadamente el 96 %.
11.3 Preparación de éster 4-(nitrooxi)butíl¡co del ácido r1R-r1a(Z).2B(R*).3a.5a11-7-r3,5-d¡h¡drox¡-2-(3-h¡drox¡-5-fen¡lpentil)c¡clopent¡l1-5-hepteno¡co
Se disolvió ácido de latanoprost (al 97,7 %, isómero S <1 %) (213 mg, 0,54°mmol) en 5,0 g de DMF anhidro. Se añadieron K2CO3 (206 mg, 1,49°mmol), KI (77 mg, 0,46°mmol) y 4-bromobutilnitrato (805 mg, al 25 % p/p en cloruro de metileno, 1,02°mmol). La mezcla de reacción se calentó y se agitó en un evaporador giratorio a 45-50 °C.
Después de 1,5 horas, la CCF (Si, CH2Cl2-MeOH, al 5 %) no mostró nada de ácido de partida.
La mezcla de reacción se diluyó con 100 ml de acetato de etilo, se lavó con salmuera (50 ml, 3 veces), se secó sobre MgSO4 y se evaporó para proporcionar un aceite de color amarillento (420 mg).
La RMN 1H/RMN 13C mostró la molécula objetivo como producto principal junto con algo de 4-bromobutilnitrato de partida y DMF.
La HPLC no mostró nada de ácido de partida. El disolvente residual, el 4-bromobutilnitrato y el éster objetivo fueron los picos principales. El éster de butilnitrato mostró un espectro UV similar al del latanoprost y el tiempo de retención relativo fue como se esperaba.
Instrumento: Bruker 300 MHz
Disolvente: CDCh
RMN-1H (CDCla) 8: 7,29-7,19 (5H, m, Ar); 5,45 (1H, m, CH=CH); 5,38 (1H, m, CH=CH); 4,48 (2H, t, CH2-ONO2); 4,18 (1H, m, CH-OH); 4,10 (2H, t, COOCH2); 3,95 (1H, m, CH-OH); 3,68 (1H, m, CH-OH); 2,87-2,60 (2H, m); 2,35 (2H, t); 2,25 (2H, m); 2,13 (2H, m); 1,90-1,35 (16H, m).
RMN-13C (CDCla) ppm: 173,94 (C=O); 142,14; 129,55 (C5); 129,50 (C6); 128,50; 125,93 78,80 (C11); 74,50 (C9); 72,70 (C-ONO2); 71,39 (C15); 63,57; 52,99 (C12); 51,99 (Ce); 41,30 (C10); 39,16 (C16); 33,66; 32,21; 29,73; 27,04; 26,70; 25,04; 24,91; 23,72; 15,37.
Ejemplo 2 (de referencia)
Síntesis del éster [2-metoxi-4-[2-propeno¡lox¡(4-n¡troox¡but¡l)]]feníl¡co del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5
dihidroxi-2-(3-hidroxi-5-fenilpentil)cidopentil]-5-heptenoico (compuesto 11)
A) Preparación de éster 4-(bromo)butílico del ácido Ferúlico
A una solución de ácido ferúlico (1 g, 5,15 mmol) en tetrahidrofurano (40 ml), se le añadieron trifenilfosfina (2,7 g, 10,3°mmol) y tetrabromometano (3,41 g, 10,3°mmol). La mezcla se agitó a temperatura ambiente durante 4 horas. La mezcla se filtró y el disolvente se evaporó al vacío. El residuo en bruto se purificó mediante cromatografía en gel de sílice, eluyente n-hexano/acetato de etilo 7/3. El producto (0,77 g) se obtuvo en forma de un sólido de color amarillo. (Rendimiento del 46 %) P.f. = 83-88 °C
B) Preparación de éster 4-(nitrooxi)butíl¡co del ácido Ferúlico
Una solución del compuesto A (0,8 g, 2,43°mmol) y nitrato de plata (1,2 g, 7,29 mmol) en acetonitrilo (50 ml) se agitó a 40 °C, en la oscuridad, durante 16 horas. El precipitado (sales de plata) se retiró por filtración y el disolvente se evaporó al vacío. El residuo se purificó mediante cromatografía ultrarrápida, eluyente n-hexano/acetato de etilo 75/25. El producto (0,4 g) se obtuvo en forma de un polvo de color blanco (rendimiento del 53 %) P.f. = 63-64 °C C) Preparación de éster [2-metoxi-4-[2-propenoiloxi(4-nitrooxibutil)11fenílico del ácido [1R-[1a(Z),2B(R*),3a,5a11-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil1-5-heptenoico
A una solución de ácido de latanoprost (0,2 g, 0,51°mmol) en tetrahidrofurano seco (10 ml), en atmósfera inerte, se le añadieron éster 4-(nitrooxi)butílico del ácido ferúlico (0,32 g, 1,02°mmol) y DMAP (cantidad cat.). La reacción se enfrió a 0 °C y se añadió EDAC (0,14 g, 0,76°mmol). La reacción se agitó a temperatura ambiente durante 24 horas. La solución se trató con agua y cloroformo, las fases orgánicas se anhidraron con sulfato de sodio y se concentraron a presión reducida. El residuo se purificó mediante cromatografía ultrarrápida, eluyente n-hexano/acetato de etilo 3/7. Se obtuvo el producto (0,2 g).
RMN-1H (CDCla) 8: 7,55 (1H, d, CH=CHCO); 7,30-7,03 (8H, m, Ar); 6,35 (1H, d, CH=CHCO); 5,48 (2H, m, CH=CH); 4,52 (2H, t, CH2-ONO2); 4,25 (2H, t, COO-CH2); 4,17 (1H, m, CH-OH); 3,95 (1H, m, CH-OH); 3,85 (3H, s, OCH3); 3,65 (1H, m, CH-OH); 2,75 (2H, m); 2,61 (2H, t); 2,48-2,20 (5H, m); 1,9-1,20 (19H, m).
RMN-13C (CDCla): ppm: 171,62 (C=O); 166,69 (C=O); 151,40; 144,36; 142,04; 141,55; 133,21; 129,62; 129,41; 128,40; 125,85, 123,27; 121,27; 117,96; 111,32; 78,81; 74,84; 72,64 (C-ONO2); 71,32; 63,61; 55,94; 52,99; 51,91; 42,54; 39,08; 35,79; 33,37; 32,12; 29,68; 27,03; 26,53; 25,09; 24,90; 23,73.
Ejemplo 3 (de referencia)
Síntesis de éster 3-(nitrooximetil)fenílico del ácido [1R-[1a(Z),2p(R*),3a,5a11-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil1-5-heptenoico (compuesto 4)
1. Preparación de 3-[(Bromo)metil1fenol
Se disolvió 3-[(hidroxi)metil1fenol en acetonitrilo (300 ml) y diclorometano (900 ml) y la mezcla resultante se vertió en el matraz mantenido en atmósfera de argón; se estableció agitación magnética. Después, la solución se enfrió con un baño de hielo y se añadieron tetrabromuro de carbono y trifenilfosfina. Esta última se añadió en pequeñas porciones para mantener la temperatura a aproximadamente 2-3 °C.
La solución se agitó durante 1 hora a 2-3 °C y después durante una hora adicional a temperatura ambiente.
Después de este periodo, la reacción de conversión (comprobada mediante CCF, usando EtOAc/éter de petróleo 3/7 como eluyente) era completa. La mezcla obtenida se evaporó a presión reducida y se añadieron 500 ml de éter de petróleo y 500 ml de EtOAc al aceite espeso de color amarillo resultante en un matraz redondo de 2 l. Se formó un sólido oscuro. La mezcla se mantuvo en agitación a temperatura ambiente durante la noche y, posteriormente, se filtró y se concentró a presión reducida, proporcionando aproximadamente 50 g de un residuo oleoso. El aceite se purificó mediante cromatografía ultrarrápida sobre 600 g de gel de sílice, usando EtOAc/éter de petróleo 2/8 como eluyente. La purificación adicional se logró mediante la cristalización del bromuro resultante en éter de petróleo. Se obtuvo un sólido de color blanco (24 g, 64 %).
Análisis
CCF: (EtOAc/éter de petróleo 3/7) fR = 0,4
Pureza por HPLC: > 98 %
TF-IR (KBr, cm'1): 3252, 1589, 1479, 1392, 1270, 1208, 1155, 952, 880, 791,741,686.
2. Preparación de 3-[(N¡troox¡)met¡l1fenol
Se disolvió 3-[(bromo)metil1fenol en 30 ml de acetonitrilo y se vertieron en el matraz, se mantuvieron lejos de fuentes de luz a 0-5 °C en atmósfera de argón; se estableció agitación magnética. Después, se añadió nitrato de plata en estas condiciones, manteniendo la temperatura por debajo de 5 °C. El curso de la reacción se siguió por CCF
(EtOAc/éter de petróleo 3/7 como eluyente). Después de 4 horas y 30 minutos la conversión era completa. Después, la mezcla de reacción se filtró, el sólido precipitado se lavó con Et2O y el filtrado se separó en dos lotes. El primer lote (15 ml) se mantuvo en atmósfera de argón y en solución de acetonitrilo a -20 °C. El segundo lote (15 ml) se trató de la siguiente manera. La solución de acetonitrilo se concentró a presión reducida y el aceite resultante se disolvió en diclorometano (15 ml) y se lavó con salmuera (15 ml). La fase orgánica se separó y la fase acuosa se extrajo dos veces con diclorometano (25 ml, 2 veces). Las fases orgánicas combinadas se secaron sobre MgSO4, se filtraron y se evaporaron. El residuo se purificó mediante cromatografía ultrarrápida sobre 40 g de gel de sílice usando EtOAc/éter de petróleo 2/8 como eluyente. El nitrato se obtuvo en forma de un aceite (0,6 g, 67 %).
Análisis
CCF: (EtOAc/éter de petróleo 3/7) fR = 0,35
Pureza por HPLC: > 98 %
EM (IEN-): 168 (M+-1)
TF-IR (aceite puro, cm-1): 3365, 1632, 1599, 1459, 1282, 1160, 923, 867, 793, 757.
RMN 1H (CDCla, 300 MHz) 85,31 (2H, s), 5,45 (1H, s a), 6,78-6,84 (2H, m), 6,87-6,92 (1H, m), 7,17-7,24 (1H, m). 3. Preparación de éster 3-(nitroox¡met¡l)fenílico del ácido r1R-í1a(Z).2B(R*).3a.5a11-7-r3,5-d¡h¡drox¡-2-(3-h¡drox¡-5-fenilpent¡l)c¡clopent¡l1-5-hepteno¡co
A una solución de ácido de latanoprost (0,11 g, 0,28°mmol) en cloroformo (20 ml), en atmósfera inerte, se le añadieron 3-(nitrooximetil)fenol (0,01 g, 0,56°mmol) y DMAP (cantidad cat.). La reacción se enfrió a 0 °C y se añadió EDAC (0,08 g, 0,42°mmol). La reacción se agitó a temperatura ambiente durante 24 horas. La solución se trató con agua, las fases orgánicas se anhidraron con sulfato de sodio y se concentraron a presión reducida. El residuo se purificó mediante cromatografía ultrarrápida, eluyente n-hexano/acetato de etilo 3/7. Se obtuvo el producto (0,1 g). RMN-1H (CDCla) 8: 7,41 (1H, t, Ar); 7,31-7,10 (8H, m, Ar); 5,48 (2H, m, CH=CH); 5,43 (2H, s, CH2-ONO2); 4,16 (1H, m, CH-OH); 3,95 (1H, m, CH-OH); 3,65 (1H, m, CH-OH); 2,75 (2H, m); 2,61 (2H, t); 2,48-2,20 (5H, m); 1,9-1,20 (11H, m).
Ejemplo 4 (de referencia)
Síntesis de éster 4-(nitrooximetil)bencílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidrox¡-2-(3-h¡drox¡-5-fenilpentil)ciclopentil1-5-heptenoico (compuesto 9)
A) éster 4-(bromometil)bencílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidrox¡-2-(3-h¡drox¡-5-fenilpentil)ciclopentil1-5-heptenoico
A una solución de ácido de latanoprost (0,5 g, 1,2°mmol) en cloroformo (50 ml), en atmósfera inerte, se añadieron alcohol 4-(bromometil)bencílico (0,4 g, 1,92 mmol) y DMAP (cantidad cat.). La reacción se enfrió a 0 °C y se añadió EDAC (0,37 g, 1,92 mmol). La reacción se agitó a temperatura ambiente durante 5 horas. La solución se trató con agua, las fases orgánicas se anhidraron con sulfato de sodio y se concentraron a presión reducida. El residuo se purificó mediante cromatografía ultrarrápida, eluyente n-hexano/acetato de etilo 3/7. Se obtuvo el producto (0,47 g). B) éster 4-(nitrooximetil)bencílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidrox¡-2-(3-h¡drox¡-5-fenilpentil)ciclopentil]-5-heptenoico
Una solución del compuesto A (0,4 g, 0,7°mmol) y nitrato de plata (0,23 g, 1,4°mmol) en acetonitrilo (50 ml) se agitó a 40 °C, en la oscuridad, durante 4 horas. El precipitado (sales de plata) se retiró por filtración y el disolvente se evaporó al vacío. El residuo se purificó mediante cromatografía ultrarrápida, eluyente n-hexano/acetato de etilo 7/3. El producto (0,15 g) se obtuvo en forma de aceite.
RMN-1H 8: 7,39 (4H, s, Ar); 7,31-7,17 (5H, m, Ar); 5,44 (2H, m, CH=CH); 5,42 (2H, s, CH2-ONO2); 5,30 (2H, s, O-CH2-Ar); 4,15 (1H, m, CH-OH); 3,95 (1H, m, CH-OH); 3,67 (1H, m, CH-OH); 2,75 (2H, m); 2,41 (2H, t); 2,48-1,20 (16H, m).
Ejemplo 5 (de referencia)
Síntesis de éster 3-(nitrooxi)propílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidrox¡-2-(3-h¡drox¡-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 78).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 3-bromopropanol.
Ejemplo 6 (de referencia)
Síntesis de éster 2-(nitrooxi)etílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidrox¡-2-(3-h¡drox¡-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 77).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 2-bromoetanol.
Ejemplo 7 (de referencia
Síntesis de éster 6-(nitrooxi)hexílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)cidopentil]-5-heptenoico (compuesto 79).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 6-bromohexanol.
Ejemplo 8 (de referencia)
Síntesis de éster 2-(nitrooxi)-1 -metiletílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 80).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 1-bromo-2-propanol.
Ejemplo 9 (de referencia)
Síntesis de éster 2-(nitrooxi)propílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 81).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 2-cloro-1-propanol.
Ejemplo 10 (de referencia)
Síntesis de éster 2-(nitrooxi)-1-(nitrooximetil)etílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 82).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y 1,3-dibromo-2-propanol.
Ejemplo 11 (de referencia)
Síntesis de éster [2-metoxi-4-[2-propenoiloxi-(2-nitrooxietil)]]fenílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 83).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 2 partiendo de ácido de latanoprost y éster 2-(nitrooxi)etílico del ácido ferúlico.
Ejemplo 12 (de referencia)
Síntesis de éster 2-metoxi-4-[2-propenoiloxi-(3-nitrooximetilfenil)]]fenílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 84).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 2 partiendo de ácido de latanoprost y éster 3-(nitrooximetil)fenílico del ácido ferúlico.
Ejemplo 13 (de referencia)
Síntesis de éster 2-metoxi-4-[2-propenoiloxi-(4-nitrooximetilbencil)]]fenílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 85).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 2 partiendo de ácido de latanoprost y éster 4-(nitrooximetil)bencílico del ácido ferúlico.
Ejemplo 14 (de referencia)
Síntesis de éster (4-nitrooximetil)fenílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 6).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y éster 4-(clorometil)fenílico.
Ejemplo 15 (de referencia)
Síntesis de éster (3-nitrooximetil)bencílico del ácido [1R-[1a(Z),2p(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 8).
El compuesto se sintetizó usando el procedimiento descrito en el EJEMPLO 4 partiendo de ácido de latanoprost y éster 4-(bromometil)bencílico.
Ejemplo 16 (de referencia)
Preparación de una composición oftálmica usando
éster 4-(nitrooxi)butílico del ácido [1R-[1a(Z),2a(R*),3a,5a]]-7-[3,5-dihidroxi-2-(3-hidroxi-5-fenilpentil)ciclopentil]-5-heptenoico (compuesto 1).
Ejemplo 17 (de referencia)
Evaluación de la actividad mediada por óxido nítrico
La formación de 3',5'-monofosfato de guanosina cíclico (GMPc) en células del ojo está implicada en la regulación del flujo del humor acuoso. Por tanto, la elevación de los niveles de GMPc conduce a la producción de humor acuoso disminuida y a la reducción de la presión intraocular.
Se midieron los efectos de los fármacos de ensayo sobre la formación de GMPc en un ensayo celular bien establecido.
Se usaron células de feocromocitoma indiferenciadas (PC12). Las células en monocapa se incubaron durante 45 minutos en Solución Salina Equilibrada de Hank enriquecida con Hepes 10°mM, MgCh 5 mM y ácido ascórbico al 0,05% al pH final de 7,4 y que contenía 100° |j M del inhibidor de la fosfodiesterasa, isometil-butil-xantina (IBMX), 30° |j M del inhibidor de la guanilil ciclasa, YC-1 y los fármacos de ensayo a la concentración apropiada.
La reacción se finalizó mediante la retirada del tampón de incubación, seguida de la adición de 50 l de etanol al 100 % enfriado con hielo. Después, la placa se secó después en corriente de aire caliente y el residuo se disolvió, se extrajo y se analizó usando el kit de inmunoensayo de enzima de GMPc cíclico disponible en el mercado.
Los resultados se presentan en la Tabla 1. La aplicación simultánea de diferentes concentraciones de los diversos nitroderivados de Latanoprost (1-50°j M) provocó la acumulación de GMPc de una manera dependiente de la concentración.
Estos efectos no fueron compartidos por el fármaco original Latanoprost lo que sugiere que dichos efectos son dependientes de la liberación de NO exógeno.
Tabla 1
Ejemplo 18 (de referencia)
Evaluación de la eficacia del nitroderivado de Latanoprost sobre la presión intraocular.
En este estudio se usaron conejos NZW macho que van desde 3-5 kg de peso corporal. En resumen, se ensayó la capacidad del nitroderivado de Latanoprost (compuesto 4, EJEMPLO 3) para reducir la presión intraocular (PIO) en animales tratados previamente con inyección intracameral de instilación de solución de carbómero al 0,25 % hasta después de que se alcanzara un aumento estable de la presión intraocular. En este estudio particular, los fármacos de ensayo se administraron a un ojo con la pauta de dosificación de 1 gota/ojo/día durante 5 días a la semana con una solución fisiológica que contenía el 0,005 % de control o compuestos de ensayo. La PIO se controló 3 h después de la aplicación del fármaco, dos-tres veces a la semana durante un total de 4 semanas. Se eligió esta concentración ya que refleja la de éster isopropílico de latanoprost que se usa actualmente en clínica para tratar el aumento de la PIO observado en pacientes con glaucoma. Además, en cada visita, se recogieron aproximadamente 200 |jl de humor acuoso usando una aguja de calibre 30 de ambos ojos con anestesia de lidocaína para la evaluación bioquímica adicional de los contenidos de GMPc, AMPc y nitrito/nitrato.
La instilación de solución de carbómero al 0,25 % en el ojo dio como resultado un profundo aumento de la PIO a aproximadamente 40°mmHg que permanecieron estables después de eso. Sin embargo, la administración del compuesto 4 (EX. 3) con la pauta de dosis esbozada en la sección de procedimiento, disminuyó la presión intraocular de estos animales aproximadamente en un 50 % a los 7 días de tratamientos repetidos y en más de un 65% al final del estudio (Véase la Tabla 2). En cambio, ni el ácido de Latanoprost (datos no mostrados) ni su derivado isopropílico provocaron ningún cambio apreciable (véase la Tabla 2). Dada la bibliografía disponible que documenta que el Latanoprost es prácticamente ineficaz en conejos, es probable que los efectos observados se atribuyan a la presencia del resto de óxido nítrico (NO) en el nitroderivado de Latanoprost más que al compuesto original.
Las mediciones bioquímicas de GMPc, AMPc y NOx en el humor acuoso intraocular respaldaron adicionalmente el papel del NO en la disminución de la PIO de estos animales. De hecho, como se muestra en la Tabla 3, el alcance de GMPc y NOx aumentó tras la aplicación del compuesto 4 (EX. 3) a lo largo del tratamiento de 4 semanas. Estos efectos resultan ser altamente específicos ya que la cantidad de AMPc intraocular permaneció inalterada en estos animales. El éster isopropílico de Latanoprost no afectó significativamente a los niveles ni de GMPc, cAMP ni de nitritos cuando se administró en dosis equimolares a las del nitroderivado respectivo (véase la Tabla 3).
Tabla 2
Tabla 3
Claims (11)
1. Un compuesto de fórmula general (I) o una sal o estereoisómero farmacéuticamente aceptable del mismo R-X-Y-ONO2 (I)
en la que R es el residuo de prostaglandina de Travoprost de fórmula (II):
X es -O- o -S;
Y es un radical bivalente que tiene el siguiente significado:
a)
- alquileno C1-C20 lineal o ramificado, estando opcionalmente sustituido con uno o más de los sustituyentes seleccionados entre el grupo que consiste en: átomos de halógeno, hidroxi, -ONO2 o T, en el que T es -OC(O)(alquilo C1-C10)-ONO2 o -O(alquilo C1-C10)-ONO2.
3. Un proceso para preparar un compuesto de fórmula general (I) como se define en la reivindicación 1, comprendiendo dicho proceso:
i) hacer reaccionar un compuesto de fórmula (III)
en la que
P es H o un grupo protector de hidroxi y W es -OH, Cl o -OC(O)Ri en el que Ri es un alquilo C1-C5 lineal o ramificado;
con un compuesto de fórmula (IV) Z-Y-Q en la que Y es como se ha definido en la reivindicación 1, Z es HX o Z1, siendo X como se ha definido en la reivindicación 1 y seleccionándose Z1 entre el grupo que consiste en: cloro, bromo, yodo, mesilo, tosilo;
Q es -ONO2 o Z1 y
ii) cuando Q es Z1, convertir el compuesto obtenido en la etapa i) en un derivado nitro mediante la reacción con una fuente de nitrato y
iii) desprotegiendo opcionalmente los compuestos obtenidos en la etapa i) o ii).
4. Un compuesto de fórmula general (I) de acuerdo con las reivindicaciones 1 o 2 para su uso como un medicamento.
5. Un compuesto de acuerdo con las reivindicaciones 1 o 2 para su uso en el tratamiento del glaucoma y la hipertensión ocular.
6. Una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable y una cantidad farmacéuticamente eficaz de un compuesto de fórmula general (I) y/o una sal o estereoisómero del mismo como se ha definido en las reivindicaciones 1 o 2.
7. Una composición farmacéutica de acuerdo con la reivindicación 6 en una forma adecuada para la administración tópica.
8. Una composición farmacéutica de acuerdo con las reivindicaciones 6 o 7, en la que el compuesto de fórmula general (I) se administra en forma de una solución, suspensión o emulsión en un vehículo oftálmicamente aceptable.
9. Una composición farmacéutica de acuerdo con las reivindicaciones 6 a 8 para su uso en el tratamiento de glaucoma e hipertensión ocular.
10. Una composición farmacéutica que comprende una mezcla de un compuesto de fórmula (I) como se ha definido en la reivindicación 1 y (i) un beta bloqueante o (ii) un inhibidor de la anhidrasa carbónica o (iii) un agonista adrenérgico o un nitrooxiderivado de los mismos.
11. Una composición farmacéutica que comprende una mezcla de un compuesto de fórmula (I) como se ha definido en la reivindicación 1 y timolol o un nitrooxiderivado del mismo.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP04100001 | 2004-01-05 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2767136T3 true ES2767136T3 (es) | 2020-06-16 |
Family
ID=34778199
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES04804405.1T Expired - Lifetime ES2566800T3 (es) | 2004-01-05 | 2004-12-27 | Nitrooxiderivados de prostaglandinas |
| ES15194684T Expired - Lifetime ES2767136T3 (es) | 2004-01-05 | 2004-12-27 | Derivados de prostaglandinas |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES04804405.1T Expired - Lifetime ES2566800T3 (es) | 2004-01-05 | 2004-12-27 | Nitrooxiderivados de prostaglandinas |
Country Status (39)
| Country | Link |
|---|---|
| US (5) | US7273946B2 (es) |
| EP (3) | EP1704141B1 (es) |
| JP (1) | JP3984283B2 (es) |
| KR (2) | KR100850133B1 (es) |
| CN (1) | CN100469765C (es) |
| AP (1) | AP2006003638A0 (es) |
| AR (2) | AR047081A1 (es) |
| AU (1) | AU2004313688B2 (es) |
| BR (1) | BRPI0418245B8 (es) |
| CA (1) | CA2551409C (es) |
| CR (2) | CR8498A (es) |
| CY (1) | CY1117417T1 (es) |
| DK (1) | DK1704141T3 (es) |
| EA (1) | EA010595B1 (es) |
| EC (1) | ECSP066684A (es) |
| ES (2) | ES2566800T3 (es) |
| GE (1) | GEP20094780B (es) |
| GT (1) | GT200500293A (es) |
| HR (1) | HRP20160500T1 (es) |
| HU (1) | HUE027357T2 (es) |
| IL (1) | IL176416A (es) |
| MA (1) | MA28284A1 (es) |
| ME (1) | ME02433B (es) |
| MX (1) | MXPA06007678A (es) |
| MY (1) | MY147181A (es) |
| NO (2) | NO337217B1 (es) |
| NZ (1) | NZ548271A (es) |
| OA (1) | OA13356A (es) |
| PA (1) | PA8620901A1 (es) |
| PE (1) | PE20051052A1 (es) |
| PL (1) | PL1704141T3 (es) |
| RS (1) | RS54717B1 (es) |
| SI (1) | SI1704141T1 (es) |
| TN (1) | TNSN06210A1 (es) |
| TW (1) | TWI337994B (es) |
| UA (1) | UA84726C2 (es) |
| UY (1) | UY28709A1 (es) |
| WO (1) | WO2005068421A1 (es) |
| ZA (1) | ZA200605354B (es) |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3984283B2 (ja) | 2004-01-05 | 2007-10-03 | ニコックス,ソシエテ アノニム | プロスタグランヂンニトロオキシ誘導体 |
| JP2009501150A (ja) * | 2005-06-29 | 2009-01-15 | ファイザー・インク | プロスタグランジン誘導体 |
| CA2613010A1 (en) * | 2005-06-29 | 2007-01-04 | Pfizer Inc. | Fluoroprostaglandins nitroderivatives |
| CA2647859C (en) * | 2006-03-29 | 2016-01-05 | Nitromed, Inc. | Nitric oxide enhancing prostaglandin compounds, compositions and methods of use |
| US20090238763A1 (en) | 2006-07-09 | 2009-09-24 | Chongxi Yu | High penetration compositions and uses thereof |
| US20090221703A1 (en) | 2006-07-09 | 2009-09-03 | Chongxi Yu | High penetration composition and uses thereof |
| DE102006052755A1 (de) * | 2006-11-08 | 2008-05-15 | N-Zyme Biotec Gmbh | Michaelsysteme als Transglutaminaseinhibitoren |
| WO2008071421A1 (en) * | 2006-12-15 | 2008-06-19 | Nicox S.A. | Nitrate esters of carbonic anhydrase inhibitors |
| CA2671137A1 (en) | 2006-12-15 | 2008-06-26 | Nicox S.A. | Carbonic anhydrase inhibitors derivatives |
| EP2170826B1 (en) | 2007-06-04 | 2022-04-27 | Techfields Inc | Pro-drugs of nsaias with very high skin and membranes penetration rates and their new medicinal uses |
| WO2009035565A1 (en) * | 2007-09-07 | 2009-03-19 | Qlt Plug Delivery, Inc | Prostaglandin analogues for implant devices and methods |
| US20090111761A1 (en) * | 2007-10-31 | 2009-04-30 | Pamela Lipkin | Prostaglandin Analog Compositions And Methods To Treat Epithelial-Related Conditions |
| AR076731A1 (es) * | 2008-05-09 | 2011-07-06 | Pfizer | Prostamidas donadoras de oxido nitrico, uso de los mismos y composiciones farmaceuticas |
| US7807716B2 (en) * | 2008-09-24 | 2010-10-05 | Oral Delivery Technology Ltd. | Nitric oxide amino acid ester compound, compositions for increasing nitric oxide levels and method of use |
| KR20210123406A (ko) | 2008-12-04 | 2021-10-13 | 충시 위 | 고투과력을 가진 조성물 및 이의 적용 |
| US8637558B2 (en) | 2008-12-30 | 2014-01-28 | Industry-Academic Cooperation Foundation, Chosun University | Thiazolidinedione derivative and use thereof |
| US9162969B2 (en) | 2009-09-15 | 2015-10-20 | Dsm Ip Assets B.V. | Nitrooxyesters, their preparation and use |
| CN101885684B (zh) * | 2010-07-01 | 2013-10-30 | 南京中医药大学 | 带有一氧化氮供体的芳香酸前体药物及其制备方法和其应用 |
| ES2611807T3 (es) | 2011-08-29 | 2017-05-10 | Mati Therapeutics Inc. | Administración por liberación sostenida de agentes activos para tratar glaucoma e hipertensión ocular |
| HU231203B1 (hu) * | 2011-12-21 | 2021-10-28 | CHINOIN Gyógyszer és Vegyészeti Termékek Gyára Zrt. | Új eljárás travoprost előállítására |
| JP6213560B2 (ja) | 2012-05-03 | 2017-10-18 | マティ セラピューティクス,インク. | 薬剤送達システムならびに開放隅角緑内障および高眼圧症を治療する方法 |
| ES2841993T3 (es) * | 2012-10-23 | 2021-07-12 | Nicox Sa | Compuestos donantes de óxido nítrico a base de quinona para uso oftálmico |
| JP6306148B2 (ja) * | 2013-04-18 | 2018-04-04 | ニコックス サイエンス アイルランド | 点眼用のキノン系一酸化窒素供与性化合物 |
| CA2935957C (en) | 2014-01-10 | 2023-01-03 | Manistee Partners Llc | Treatment of migraines using topical administration of prostaglandin f2alpha analogs |
| AR102283A1 (es) * | 2014-10-15 | 2017-02-15 | Novartis Ag | Conjugados de prostaglandina y derivados para tratar el glaucoma y la hipertensión ocular |
| US10280138B2 (en) | 2015-03-31 | 2019-05-07 | Nicox S.A. | Nitric oxide donating derivatives of fluprostenol |
| US10047047B2 (en) | 2015-03-31 | 2018-08-14 | Nicox S.A. | Nitric oxide donating derivatives of latanoprost free acid |
| EP3088388A1 (en) | 2015-04-30 | 2016-11-02 | NicOx S.A. | Nitric oxide donating derivatives of prostaglandins |
| HK1256721A1 (zh) | 2015-09-22 | 2019-10-04 | 灰色视觉公司 | 用於治疗眼部病症的化合物和组合物 |
| HU231175B1 (hu) * | 2015-12-04 | 2021-06-28 | CHINOIN Gyógyszer és Vegyészeti Termékek Gyára Zrt. | Tetszőleges, előre meghatározott minőségű Latanoprostene bunod előállítása gravitációs kromatográfiával |
| CA3043000A1 (en) * | 2016-11-08 | 2018-05-17 | Bausch & Lomb Incorporated | Nitric oxide releasing prostaglandin derivatives for treating normal tension glaucoma |
| KR102069205B1 (ko) * | 2017-08-09 | 2020-01-22 | 연성정밀화학(주) | 라타노프로스틴 부노드의 제조 방법 및 그를 위한 중간체 |
| RU2718744C2 (ru) | 2018-05-17 | 2020-04-14 | Общество с ограниченной ответственностью "Гурус БиоФарм" | Производные простагландина F2альфа для снижения внутриглазного давления |
| CN109988089B (zh) * | 2018-05-29 | 2022-04-26 | 上海凡秦医药科技有限公司 | 一种前列腺素化合物、制备方法及其用途 |
| CN108892624B (zh) * | 2018-06-20 | 2020-12-15 | 重庆威鹏药业有限公司 | 沙库巴曲硝基氧衍生物及其制备方法和应用 |
| US11332433B2 (en) * | 2020-07-24 | 2022-05-17 | Chirogate International Inc. | Process for the preparation of latanoprostene bunod and intermediate thereof and compositions comprising the same |
| CN119350280A (zh) * | 2021-11-18 | 2025-01-24 | 广州楷石医药有限公司 | 一种氧化氮供体型贝前列素类衍生物及其药物组合物和用途 |
| CN116444377A (zh) * | 2022-01-07 | 2023-07-18 | 广州楷石医药有限公司 | 一种氧化氮供体型曲前列尼尔类衍生物及其药物组合物和用途 |
| CA3195291A1 (en) * | 2022-04-13 | 2023-10-13 | Caravel Therapeutics, Inc. | Preservative-free ophthalmic pharmaceutical emulsion and its application |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3922293A (en) | 1971-12-30 | 1975-11-25 | Upjohn Co | Prostaglandin F-type 9-monoacylates |
| US4952581A (en) | 1987-04-03 | 1990-08-28 | The Trustees Of Columbia University In The City Of New York | Use of a prostaglandin in combination with an adrenergic blocking agent for reduction of intraocular pressure |
| ATE101342T1 (de) | 1988-09-06 | 1994-02-15 | Kabi Pharmacia Ab | Prostaglandinderivate zur behandlung des gruenen stars oder einer okularen hypertension. |
| EP0664707B1 (en) | 1992-10-13 | 1997-06-04 | Alcon Laboratories, Inc. | Combinations of prostaglandins and clonidine derivatives for the treatment of glaucoma |
| US5328933A (en) * | 1992-10-28 | 1994-07-12 | Allergan, Inc. | Cyclopentane heptenylnitro and heptanylnitro-2-aliphatic or aryl aliphatic derivatives and homologues |
| US5625083A (en) | 1995-06-02 | 1997-04-29 | Bezuglov; Vladimir V. | Dinitroglycerol esters of unsaturated fatty acids and prostaglandins |
| IT1295694B1 (it) | 1996-11-14 | 1999-05-27 | Nicox Sa | Nitrossi derivati per la preparazione di medicamenti ad attivita antitrombinica |
| IT1292377B1 (it) * | 1997-06-19 | 1999-02-08 | Nicox Sa | Composizioni farmaceutiche a base di prostaglandine |
| US6417228B1 (en) | 1998-11-02 | 2002-07-09 | Alcon Manufacturing, Ltd.. | 13-Aza prostaglandins for the treatment of glaucoma and ocular hypertension |
| AU3713600A (en) | 1999-03-01 | 2000-09-21 | Nitromed, Inc. | Nitrosated and nitrosylated prostaglandins, compositions and metods of use |
| US20030018079A1 (en) | 2000-11-13 | 2003-01-23 | Richardson Helene | Treatment |
| EP1386611A4 (en) * | 2001-04-19 | 2009-05-13 | Teika Pharmaceutical Co Ltd | MEDICAL DEVICES AND MEDICAL SETS |
| JP3984283B2 (ja) * | 2004-01-05 | 2007-10-03 | ニコックス,ソシエテ アノニム | プロスタグランヂンニトロオキシ誘導体 |
-
2004
- 2004-12-27 JP JP2006546105A patent/JP3984283B2/ja not_active Expired - Lifetime
- 2004-12-27 HU HUE04804405A patent/HUE027357T2/en unknown
- 2004-12-27 GE GEAP20049494A patent/GEP20094780B/en unknown
- 2004-12-27 BR BRPI0418245A patent/BRPI0418245B8/pt not_active IP Right Cessation
- 2004-12-27 OA OA1200600221A patent/OA13356A/en unknown
- 2004-12-27 ES ES04804405.1T patent/ES2566800T3/es not_active Expired - Lifetime
- 2004-12-27 EP EP04804405.1A patent/EP1704141B1/en not_active Expired - Lifetime
- 2004-12-27 CA CA2551409A patent/CA2551409C/en not_active Expired - Lifetime
- 2004-12-27 ME MEP-2016-79A patent/ME02433B/me unknown
- 2004-12-27 RS RS20160251A patent/RS54717B1/sr unknown
- 2004-12-27 EP EP19196238.0A patent/EP3643702A1/en not_active Withdrawn
- 2004-12-27 CN CNB2004800398051A patent/CN100469765C/zh not_active Expired - Lifetime
- 2004-12-27 DK DK04804405.1T patent/DK1704141T3/en active
- 2004-12-27 NZ NZ548271A patent/NZ548271A/en not_active IP Right Cessation
- 2004-12-27 AU AU2004313688A patent/AU2004313688B2/en not_active Expired
- 2004-12-27 SI SI200432309T patent/SI1704141T1/sl unknown
- 2004-12-27 MX MXPA06007678A patent/MXPA06007678A/es active IP Right Grant
- 2004-12-27 UA UAA200607454A patent/UA84726C2/ru unknown
- 2004-12-27 EP EP15194684.5A patent/EP3002277B1/en not_active Expired - Lifetime
- 2004-12-27 AP AP2006003638A patent/AP2006003638A0/xx unknown
- 2004-12-27 EA EA200601099A patent/EA010595B1/ru not_active IP Right Cessation
- 2004-12-27 HR HRP20160500TT patent/HRP20160500T1/hr unknown
- 2004-12-27 KR KR1020067013440A patent/KR100850133B1/ko not_active Expired - Lifetime
- 2004-12-27 ES ES15194684T patent/ES2767136T3/es not_active Expired - Lifetime
- 2004-12-27 PL PL04804405T patent/PL1704141T3/pl unknown
- 2004-12-27 KR KR1020087000325A patent/KR100854838B1/ko not_active Expired - Lifetime
- 2004-12-27 WO PCT/EP2004/014820 patent/WO2005068421A1/en not_active Ceased
- 2004-12-31 TW TW093141786A patent/TWI337994B/zh not_active IP Right Cessation
-
2005
- 2005-01-03 AR ARP050100012A patent/AR047081A1/es active IP Right Grant
- 2005-01-03 MY MYPI20050009A patent/MY147181A/en unknown
- 2005-01-04 UY UY28709A patent/UY28709A1/es not_active Application Discontinuation
- 2005-01-04 PE PE2005000037A patent/PE20051052A1/es active IP Right Grant
- 2005-01-04 PA PA20058620901A patent/PA8620901A1/es unknown
- 2005-01-05 US US11/029,698 patent/US7273946B2/en not_active Expired - Lifetime
- 2005-10-18 GT GT200500293A patent/GT200500293A/es unknown
-
2006
- 2006-06-19 IL IL176416A patent/IL176416A/en active IP Right Grant
- 2006-06-28 ZA ZA200605354A patent/ZA200605354B/xx unknown
- 2006-06-29 EC EC2006006684A patent/ECSP066684A/es unknown
- 2006-06-30 CR CR8498A patent/CR8498A/es unknown
- 2006-07-04 TN TNP2006000210A patent/TNSN06210A1/fr unknown
- 2006-07-05 MA MA29169A patent/MA28284A1/fr unknown
- 2006-08-07 NO NO20063567A patent/NO337217B1/no unknown
-
2007
- 2007-08-20 US US11/841,628 patent/US7449469B2/en not_active Expired - Lifetime
-
2008
- 2008-09-15 US US12/210,975 patent/US7629345B2/en not_active Expired - Lifetime
-
2009
- 2009-11-06 US US12/613,985 patent/US7910767B2/en not_active Expired - Lifetime
-
2011
- 2011-02-11 US US13/025,740 patent/US8058467B2/en active Active
- 2011-03-11 CR CR20110131A patent/CR20110131A/es unknown
-
2014
- 2014-12-22 AR ARP140104875A patent/AR098931A2/es not_active Application Discontinuation
-
2015
- 2015-10-08 NO NO20151341A patent/NO339685B1/no unknown
-
2016
- 2016-04-26 CY CY20161100340T patent/CY1117417T1/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2767136T3 (es) | Derivados de prostaglandinas | |
| US7718656B2 (en) | Prostaglandin derivatives | |
| JP2009500315A (ja) | フルオロプロスタグランジンのニトロ誘導体 | |
| HK1096084B (en) | Prostaglandin nitrooxyderivatives |