KR100850133B1 - 프로스타글란딘 나이트로옥시 유도체 - Google Patents
프로스타글란딘 나이트로옥시 유도체 Download PDFInfo
- Publication number
- KR100850133B1 KR100850133B1 KR1020067013440A KR20067013440A KR100850133B1 KR 100850133 B1 KR100850133 B1 KR 100850133B1 KR 1020067013440 A KR1020067013440 A KR 1020067013440A KR 20067013440 A KR20067013440 A KR 20067013440A KR 100850133 B1 KR100850133 B1 KR 100850133B1
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- acid
- compounds
- reaction
- delete delete
- Prior art date
Links
- 150000003180 prostaglandins Chemical class 0.000 title description 15
- 206010018307 Glaucoma and ocular hypertension Diseases 0.000 claims abstract description 7
- 150000001875 compounds Chemical class 0.000 claims description 74
- 238000000034 method Methods 0.000 claims description 24
- 239000000203 mixture Substances 0.000 claims description 24
- 239000000243 solution Substances 0.000 claims description 21
- 239000003814 drug Substances 0.000 claims description 9
- 150000003839 salts Chemical class 0.000 claims description 9
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- 239000002876 beta blocker Substances 0.000 claims description 5
- 229940097320 beta blocking agent Drugs 0.000 claims description 5
- 239000003489 carbonate dehydratase inhibitor Substances 0.000 claims description 4
- 125000001893 nitrooxy group Chemical group [O-][N+](=O)O* 0.000 claims description 4
- 239000003981 vehicle Substances 0.000 claims description 3
- TWBNMYSKRDRHAT-RCWTXCDDSA-N (S)-timolol hemihydrate Chemical compound O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 TWBNMYSKRDRHAT-RCWTXCDDSA-N 0.000 claims description 2
- 239000000839 emulsion Substances 0.000 claims description 2
- 239000000725 suspension Substances 0.000 claims description 2
- 229960004605 timolol Drugs 0.000 claims description 2
- 229940122072 Carbonic anhydrase inhibitor Drugs 0.000 claims 1
- 239000000464 adrenergic agent Substances 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 238000011200 topical administration Methods 0.000 claims 1
- 230000000144 pharmacologic effect Effects 0.000 abstract description 4
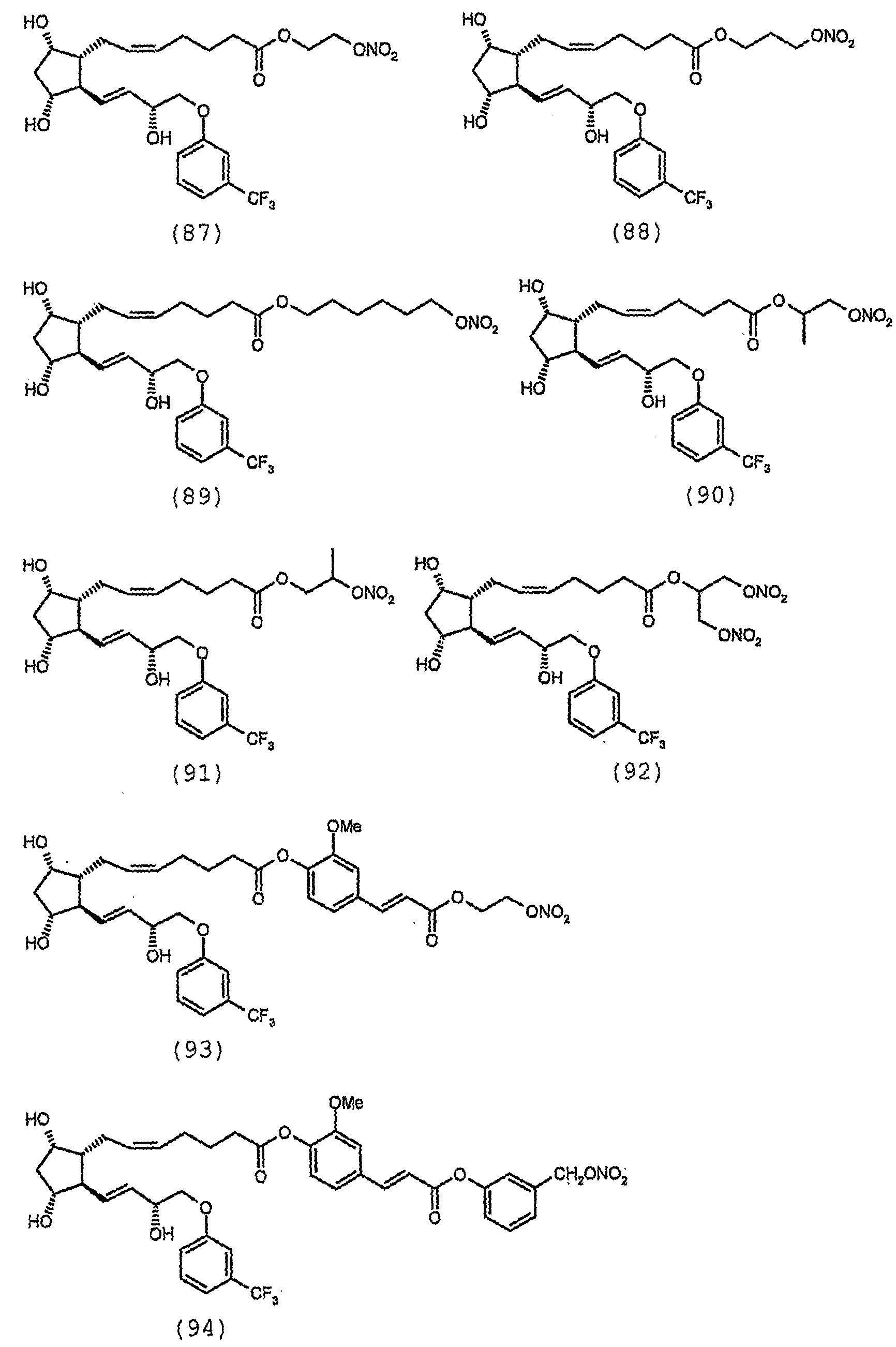
- -1 6 Chemical class 0.000 description 58
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 36
- 238000006243 chemical reaction Methods 0.000 description 32
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 27
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 27
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 18
- 238000003786 synthesis reaction Methods 0.000 description 18
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 17
- 230000004410 intraocular pressure Effects 0.000 description 17
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 16
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 16
- 230000000694 effects Effects 0.000 description 14
- 235000019439 ethyl acetate Nutrition 0.000 description 14
- 230000015572 biosynthetic process Effects 0.000 description 13
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 12
- 229960001160 latanoprost Drugs 0.000 description 11
- 150000003254 radicals Chemical class 0.000 description 11
- HNPFPERDNWXAGS-LZCJLJQNSA-N (e)-7-[3,5-dihydroxy-2-(3-hydroxy-5-phenylpentyl)cyclopentyl]hept-5-enoic acid Chemical compound C=1C=CC=CC=1CCC(O)CCC1C(O)CC(O)C1C\C=C\CCCC(O)=O HNPFPERDNWXAGS-LZCJLJQNSA-N 0.000 description 10
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 10
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 10
- 125000000217 alkyl group Chemical group 0.000 description 10
- 239000003480 eluent Substances 0.000 description 10
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 10
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- 208000010412 Glaucoma Diseases 0.000 description 9
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 9
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- ZOOGRGPOEVQQDX-UHFFFAOYSA-N cyclic GMP Natural products O1C2COP(O)(=O)OC2C(O)C1N1C=NC2=C1NC(N)=NC2=O ZOOGRGPOEVQQDX-UHFFFAOYSA-N 0.000 description 9
- GGXICVAJURFBLW-CEYXHVGTSA-N latanoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1CC[C@@H](O)CCC1=CC=CC=C1 GGXICVAJURFBLW-CEYXHVGTSA-N 0.000 description 9
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 8
- 239000003208 petroleum Substances 0.000 description 8
- 125000002947 alkylene group Chemical group 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 238000003818 flash chromatography Methods 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- KSEBMYQBYZTDHS-HWKANZROSA-M (E)-Ferulic acid Natural products COC1=CC(\C=C\C([O-])=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-M 0.000 description 6
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 6
- 125000004432 carbon atom Chemical group C* 0.000 description 6
- 239000000460 chlorine Substances 0.000 description 6
- 235000001785 ferulic acid Nutrition 0.000 description 6
- 229940114124 ferulic acid Drugs 0.000 description 6
- KSEBMYQBYZTDHS-UHFFFAOYSA-N ferulic acid Natural products COC1=CC(C=CC(O)=O)=CC=C1O KSEBMYQBYZTDHS-UHFFFAOYSA-N 0.000 description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- OKDQKPLMQBXTNH-UHFFFAOYSA-N n,n-dimethyl-2h-pyridin-1-amine Chemical compound CN(C)N1CC=CC=C1 OKDQKPLMQBXTNH-UHFFFAOYSA-N 0.000 description 6
- 239000003960 organic solvent Substances 0.000 description 6
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 6
- 230000000699 topical effect Effects 0.000 description 6
- QURCVMIEKCOAJU-UHFFFAOYSA-N trans-isoferulic acid Natural products COC1=CC=C(C=CC(O)=O)C=C1O QURCVMIEKCOAJU-UHFFFAOYSA-N 0.000 description 6
- IKDHVMDABUMCLO-UHFFFAOYSA-N 4-bromobutyl nitrate Chemical compound [O-][N+](=O)OCCCCBr IKDHVMDABUMCLO-UHFFFAOYSA-N 0.000 description 5
- 229910002651 NO3 Inorganic materials 0.000 description 5
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 5
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 5
- 239000003054 catalyst Substances 0.000 description 5
- 150000002828 nitro derivatives Chemical class 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 5
- 229910001961 silver nitrate Inorganic materials 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000005160 1H NMR spectroscopy Methods 0.000 description 4
- YURNCBVQZBJDAJ-UHFFFAOYSA-N 2-heptenoic acid Chemical compound CCCCC=CC(O)=O YURNCBVQZBJDAJ-UHFFFAOYSA-N 0.000 description 4
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- 239000012267 brine Substances 0.000 description 4
- 125000000753 cycloalkyl group Chemical group 0.000 description 4
- 239000012074 organic phase Substances 0.000 description 4
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- SIJLYRDVTMMSIP-UHFFFAOYSA-N 4-Bromo-1-butanol Chemical compound OCCCCBr SIJLYRDVTMMSIP-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 206010030043 Ocular hypertension Diseases 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 229940006133 antiglaucoma drug and miotics carbonic anhydrase inhibitors Drugs 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Natural products CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 150000004820 halides Chemical class 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 239000012442 inert solvent Substances 0.000 description 3
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 3
- 229910017604 nitric acid Inorganic materials 0.000 description 3
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 229910052760 oxygen Inorganic materials 0.000 description 3
- 239000001301 oxygen Chemical group 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 125000000475 sulfinyl group Chemical group [*:2]S([*:1])=O 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 239000011593 sulfur Chemical group 0.000 description 3
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Substances ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 3
- GCKBVYBCFQGKGP-UHFFFAOYSA-N (3-hydroxyphenyl)methyl nitrate Chemical compound OC1=CC=CC(CO[N+]([O-])=O)=C1 GCKBVYBCFQGKGP-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- JHQONOCFAYZOEQ-UHFFFAOYSA-N 3-(bromomethyl)phenol Chemical compound OC1=CC=CC(CBr)=C1 JHQONOCFAYZOEQ-UHFFFAOYSA-N 0.000 description 2
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 201000004569 Blindness Diseases 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 229940126062 Compound A Drugs 0.000 description 2
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical group C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 2
- 208000010228 Erectile Dysfunction Diseases 0.000 description 2
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 2
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- IOVCWXUNBOPUCH-UHFFFAOYSA-M Nitrite anion Chemical compound [O-]N=O IOVCWXUNBOPUCH-UHFFFAOYSA-M 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- AZFGQSNPKOVWDN-UHFFFAOYSA-N [N+](=O)([O-])OCC(C)OC(C=CCCCC)=O Chemical compound [N+](=O)([O-])OCC(C)OC(C=CCCCC)=O AZFGQSNPKOVWDN-UHFFFAOYSA-N 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- ZCCIPPOKBCJFDN-UHFFFAOYSA-N calcium nitrate Chemical compound [Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ZCCIPPOKBCJFDN-UHFFFAOYSA-N 0.000 description 2
- 229960001631 carbomer Drugs 0.000 description 2
- 230000001713 cholinergic effect Effects 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 150000002009 diols Chemical class 0.000 description 2
- KPUWHANPEXNPJT-UHFFFAOYSA-N disiloxane Chemical compound [SiH3]O[SiH3] KPUWHANPEXNPJT-UHFFFAOYSA-N 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 150000002430 hydrocarbons Chemical class 0.000 description 2
- 201000001881 impotence Diseases 0.000 description 2
- 150000007529 inorganic bases Chemical class 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- IIPYXGDZVMZOAP-UHFFFAOYSA-N lithium nitrate Chemical group [Li+].[O-][N+]([O-])=O IIPYXGDZVMZOAP-UHFFFAOYSA-N 0.000 description 2
- YIXJRHPUWRPCBB-UHFFFAOYSA-N magnesium nitrate Chemical compound [Mg+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O YIXJRHPUWRPCBB-UHFFFAOYSA-N 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 238000003760 magnetic stirring Methods 0.000 description 2
- 238000002844 melting Methods 0.000 description 2
- 230000008018 melting Effects 0.000 description 2
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 2
- 150000007522 mineralic acids Chemical class 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 150000007530 organic bases Chemical class 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000012429 reaction media Substances 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- VWDWKYIASSYTQR-UHFFFAOYSA-N sodium nitrate Chemical compound [Na+].[O-][N+]([O-])=O VWDWKYIASSYTQR-UHFFFAOYSA-N 0.000 description 2
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- HJUGFYREWKUQJT-UHFFFAOYSA-N tetrabromomethane Chemical compound BrC(Br)(Br)Br HJUGFYREWKUQJT-UHFFFAOYSA-N 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 229960002368 travoprost Drugs 0.000 description 2
- MKPLKVHSHYCHOC-AHTXBMBWSA-N travoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)COC1=CC=CC(C(F)(F)F)=C1 MKPLKVHSHYCHOC-AHTXBMBWSA-N 0.000 description 2
- ONDPHDOFVYQSGI-UHFFFAOYSA-N zinc nitrate Chemical compound [Zn+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O ONDPHDOFVYQSGI-UHFFFAOYSA-N 0.000 description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- 125000000008 (C1-C10) alkyl group Chemical group 0.000 description 1
- 125000006832 (C1-C10) alkylene group Chemical group 0.000 description 1
- KIHQZLPHVZKELA-UHFFFAOYSA-N 1,3-dibromopropan-2-ol Chemical compound BrCC(O)CBr KIHQZLPHVZKELA-UHFFFAOYSA-N 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical group CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- WEGOLYBUWCMMMY-UHFFFAOYSA-N 1-bromo-2-propanol Chemical compound CC(O)CBr WEGOLYBUWCMMMY-UHFFFAOYSA-N 0.000 description 1
- VCUXVXLUOHDHKK-UHFFFAOYSA-N 2-(2-aminopyrimidin-4-yl)-4-(2-chloro-4-methoxyphenyl)-1,3-thiazole-5-carboxamide Chemical compound ClC1=CC(OC)=CC=C1C1=C(C(N)=O)SC(C=2N=C(N)N=CC=2)=N1 VCUXVXLUOHDHKK-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- LDLCZOVUSADOIV-UHFFFAOYSA-N 2-bromoethanol Chemical compound OCCBr LDLCZOVUSADOIV-UHFFFAOYSA-N 0.000 description 1
- VZIQXGLTRZLBEX-UHFFFAOYSA-N 2-chloro-1-propanol Chemical compound CC(Cl)CO VZIQXGLTRZLBEX-UHFFFAOYSA-N 0.000 description 1
- YOETUEMZNOLGDB-UHFFFAOYSA-N 2-methylpropyl carbonochloridate Chemical compound CC(C)COC(Cl)=O YOETUEMZNOLGDB-UHFFFAOYSA-N 0.000 description 1
- DFRAKBCRUYUFNT-UHFFFAOYSA-N 3,8-dicyclohexyl-2,4,7,9-tetrahydro-[1,3]oxazino[5,6-h][1,3]benzoxazine Chemical compound C1CCCCC1N1CC(C=CC2=C3OCN(C2)C2CCCCC2)=C3OC1 DFRAKBCRUYUFNT-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- RQFUZUMFPRMVDX-UHFFFAOYSA-N 3-Bromo-1-propanol Chemical compound OCCCBr RQFUZUMFPRMVDX-UHFFFAOYSA-N 0.000 description 1
- OKVJCVWFVRATSG-UHFFFAOYSA-N 3-hydroxybenzyl alcohol Chemical compound OCC1=CC=CC(O)=C1 OKVJCVWFVRATSG-UHFFFAOYSA-N 0.000 description 1
- IWKLPOJPPIBQHO-FNORWQNLSA-N 4-bromobutyl (e)-3-(4-hydroxy-3-methoxyphenyl)prop-2-enoate Chemical compound COC1=CC(\C=C\C(=O)OCCCCBr)=CC=C1O IWKLPOJPPIBQHO-FNORWQNLSA-N 0.000 description 1
- FCMCSZXRVWDVAW-UHFFFAOYSA-N 6-bromo-1-hexanol Chemical compound OCCCCCCBr FCMCSZXRVWDVAW-UHFFFAOYSA-N 0.000 description 1
- GDUANFXPOZTYKS-UHFFFAOYSA-N 6-bromo-8-[(2,6-difluoro-4-methoxybenzoyl)amino]-4-oxochromene-2-carboxylic acid Chemical compound FC1=CC(OC)=CC(F)=C1C(=O)NC1=CC(Br)=CC2=C1OC(C(O)=O)=CC2=O GDUANFXPOZTYKS-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- 206010002091 Anaesthesia Diseases 0.000 description 1
- 201000002862 Angle-Closure Glaucoma Diseases 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 0 C*1CC*(C)(C)CC1 Chemical compound C*1CC*(C)(C)CC1 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 206010051625 Conjunctival hyperaemia Diseases 0.000 description 1
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- 206010014418 Electrolyte imbalance Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 206010015946 Eye irritation Diseases 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 208000001344 Macular Edema Diseases 0.000 description 1
- 206010025415 Macular oedema Diseases 0.000 description 1
- 206010030348 Open-Angle Glaucoma Diseases 0.000 description 1
- 208000030768 Optic nerve injury Diseases 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 201000001880 Sexual dysfunction Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 206010046851 Uveitis Diseases 0.000 description 1
- RDHSYXFAOVTAEH-UHFFFAOYSA-N [4-(bromomethyl)phenyl]methanol Chemical compound OCC1=CC=C(CBr)C=C1 RDHSYXFAOVTAEH-UHFFFAOYSA-N 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000048 adrenergic agonist Substances 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical class [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000037005 anaesthesia Effects 0.000 description 1
- 208000022531 anorexia Diseases 0.000 description 1
- 230000003276 anti-hypertensive effect Effects 0.000 description 1
- 229940006138 antiglaucoma drug and miotics prostaglandin analogues Drugs 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 210000001742 aqueous humor Anatomy 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 208000010668 atopic eczema Diseases 0.000 description 1
- 229960004324 betaxolol Drugs 0.000 description 1
- CHDPSNLJFOQTRK-UHFFFAOYSA-N betaxolol hydrochloride Chemical compound [Cl-].C1=CC(OCC(O)C[NH2+]C(C)C)=CC=C1CCOCC1CC1 CHDPSNLJFOQTRK-UHFFFAOYSA-N 0.000 description 1
- 229960002470 bimatoprost Drugs 0.000 description 1
- AQOKCDNYWBIDND-FTOWTWDKSA-N bimatoprost Chemical compound CCNC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1\C=C\[C@@H](O)CCC1=CC=CC=C1 AQOKCDNYWBIDND-FTOWTWDKSA-N 0.000 description 1
- 238000011325 biochemical measurement Methods 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 230000036471 bradycardia Effects 0.000 description 1
- 208000006218 bradycardia Diseases 0.000 description 1
- 229960000722 brinzolamide Drugs 0.000 description 1
- HCRKCZRJWPKOAR-JTQLQIEISA-N brinzolamide Chemical compound CCN[C@H]1CN(CCCOC)S(=O)(=O)C2=C1C=C(S(N)(=O)=O)S2 HCRKCZRJWPKOAR-JTQLQIEISA-N 0.000 description 1
- 229940124630 bronchodilator Drugs 0.000 description 1
- 239000000168 bronchodilator agent Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000002327 cardiovascular agent Substances 0.000 description 1
- 229940125692 cardiovascular agent Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000002993 cycloalkylene group Chemical group 0.000 description 1
- 125000004956 cyclohexylene group Chemical group 0.000 description 1
- 125000004979 cyclopentylene group Chemical group 0.000 description 1
- 238000010908 decantation Methods 0.000 description 1
- 206010061428 decreased appetite Diseases 0.000 description 1
- 239000012024 dehydrating agents Substances 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- CHNUOJQWGUIOLD-NFZZJPOKSA-N epalrestat Chemical compound C=1C=CC=CC=1\C=C(/C)\C=C1/SC(=S)N(CC(O)=O)C1=O CHNUOJQWGUIOLD-NFZZJPOKSA-N 0.000 description 1
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 231100000013 eye irritation Toxicity 0.000 description 1
- KSEBMYQBYZTDHS-HWKANZROSA-N ferulic acid Chemical compound COC1=CC(\C=C\C(O)=O)=CC=C1O KSEBMYQBYZTDHS-HWKANZROSA-N 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000003126 guanylate cyclase inhibitor Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 230000003676 hair loss Effects 0.000 description 1
- 208000024963 hair loss Diseases 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 229910001867 inorganic solvent Inorganic materials 0.000 description 1
- 239000003049 inorganic solvent Substances 0.000 description 1
- 150000002497 iodine compounds Chemical class 0.000 description 1
- MVFCKEFYUDZOCX-UHFFFAOYSA-N iron(2+);dinitrate Chemical compound [Fe+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O MVFCKEFYUDZOCX-UHFFFAOYSA-N 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000010230 macular retinal edema Diseases 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- FJQXCDYVZAHXNS-UHFFFAOYSA-N methadone hydrochloride Chemical compound Cl.C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 FJQXCDYVZAHXNS-UHFFFAOYSA-N 0.000 description 1
- OKKJLVBELUTLKV-UHFFFAOYSA-N methanol Substances OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- YGBMCLDVRUGXOV-UHFFFAOYSA-N n-[6-[6-chloro-5-[(4-fluorophenyl)sulfonylamino]pyridin-3-yl]-1,3-benzothiazol-2-yl]acetamide Chemical compound C1=C2SC(NC(=O)C)=NC2=CC=C1C(C=1)=CN=C(Cl)C=1NS(=O)(=O)C1=CC=C(F)C=C1 YGBMCLDVRUGXOV-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 125000004817 pentamethylene group Chemical group [H]C([H])([*:2])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[*:1] 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 238000003359 percent control normalization Methods 0.000 description 1
- 230000008447 perception Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 208000028591 pheochromocytoma Diseases 0.000 description 1
- 239000002571 phosphodiesterase inhibitor Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 230000019612 pigmentation Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 235000010333 potassium nitrate Nutrition 0.000 description 1
- 239000004323 potassium nitrate Substances 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 150000003165 prostaglandin E1 derivatives Chemical class 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 231100000872 sexual dysfunction Toxicity 0.000 description 1
- 238000010898 silica gel chromatography Methods 0.000 description 1
- 239000002356 single layer Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010344 sodium nitrate Nutrition 0.000 description 1
- 239000004317 sodium nitrate Substances 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- IMCGHZIGRANKHV-AJNGGQMLSA-N tert-butyl (3s,5s)-2-oxo-5-[(2s,4s)-5-oxo-4-propan-2-yloxolan-2-yl]-3-propan-2-ylpyrrolidine-1-carboxylate Chemical compound O1C(=O)[C@H](C(C)C)C[C@H]1[C@H]1N(C(=O)OC(C)(C)C)C(=O)[C@H](C(C)C)C1 IMCGHZIGRANKHV-AJNGGQMLSA-N 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000001981 tert-butyldimethylsilyl group Chemical group [H]C([H])([H])[Si]([H])(C([H])([H])[H])[*]C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005207 tetraalkylammonium group Chemical group 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000002211 ultraviolet spectrum Methods 0.000 description 1
- JABYJIQOLGWMQW-UHFFFAOYSA-N undec-4-ene Chemical compound CCCCCCC=CCCC JABYJIQOLGWMQW-UHFFFAOYSA-N 0.000 description 1
- 229960004317 unoprostone Drugs 0.000 description 1
- TVHAZVBUYQMHBC-SNHXEXRGSA-N unoprostone Chemical group CCCCCCCC(=O)CC[C@H]1[C@H](O)C[C@H](O)[C@@H]1C\C=C/CCCC(O)=O TVHAZVBUYQMHBC-SNHXEXRGSA-N 0.000 description 1
- 229940124549 vasodilator Drugs 0.000 description 1
- 239000003071 vasodilator agent Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000004393 visual impairment Effects 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C405/00—Compounds containing a five-membered ring having two side-chains in ortho position to each other, and having oxygen atoms directly attached to the ring in ortho position to one of the side-chains, one side-chain containing, not directly attached to the ring, a carbon atom having three bonds to hetero atoms with at the most one bond to halogen, and the other side-chain having oxygen atoms attached in gamma-position to the ring, e.g. prostaglandins ; Analogues or derivatives thereof
- C07C405/0008—Analogues having the carboxyl group in the side-chains replaced by other functional groups
- C07C405/0016—Analogues having the carboxyl group in the side-chains replaced by other functional groups containing only hydroxy, etherified or esterified hydroxy groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C405/00—Compounds containing a five-membered ring having two side-chains in ortho position to each other, and having oxygen atoms directly attached to the ring in ortho position to one of the side-chains, one side-chain containing, not directly attached to the ring, a carbon atom having three bonds to hetero atoms with at the most one bond to halogen, and the other side-chain having oxygen atoms attached in gamma-position to the ring, e.g. prostaglandins ; Analogues or derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/04—Nitro compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
- A61K31/5575—Eicosanoids, e.g. leukotrienes or prostaglandins having a cyclopentane, e.g. prostaglandin E2, prostaglandin F2-alpha
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Ophthalmology & Optometry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Hydrogenated Pyridines (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
Abstract
Description
Claims (20)
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 제 1 항에 있어서,약제로 사용하기 위한 화합물.
- 삭제
- 약학적으로 허용되는 담체 및 제 1 항에 정의된 바와 같은 화합물, 그의 염 또는 입체이성질체, 또는 이들 모두의 약학적 유효량을 포함하는, 녹내장 및 고안압증 치료용 약학 조성물.
- 제 14 항에 있어서,국소 투여에 적합한 형태의 약학 조성물.
- 삭제
- 제 15 항에 있어서,화합물이 안과적으로 허용되는 비히클 중의 용액, 현탁액 또는 유화액으로 투여되는 약학 조성물.
- 삭제
- 제 1 항에 정의된 바와 같은 화합물과 (i) 베타-차단제 또는 (ii) 탄산 탈수효소 억제제 또는 (iii) 아드레날린성 약제 또는 그의 나이트로옥시 유도체의 혼합물을 포함하는, 녹내장 및 고안압증 치료용 약학 조성물.
- 제 1 항에 정의된 바와 같은 화합물과 티몰올 또는 그의 나이트로옥시 유도체의 혼합물을 포함하는, 녹내장 및 고안압증 치료용 약학 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP04100001.9 | 2004-01-05 | ||
| EP04100001 | 2004-01-05 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087000325A Division KR100854838B1 (ko) | 2004-01-05 | 2004-12-27 | 프로스타글란딘 나이트로옥시 유도체 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20060113753A KR20060113753A (ko) | 2006-11-02 |
| KR100850133B1 true KR100850133B1 (ko) | 2008-08-04 |
Family
ID=34778199
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087000325A KR100854838B1 (ko) | 2004-01-05 | 2004-12-27 | 프로스타글란딘 나이트로옥시 유도체 |
| KR1020067013440A KR100850133B1 (ko) | 2004-01-05 | 2004-12-27 | 프로스타글란딘 나이트로옥시 유도체 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087000325A KR100854838B1 (ko) | 2004-01-05 | 2004-12-27 | 프로스타글란딘 나이트로옥시 유도체 |
Country Status (40)
| Country | Link |
|---|---|
| US (5) | US7273946B2 (ko) |
| EP (3) | EP3002277B1 (ko) |
| JP (1) | JP3984283B2 (ko) |
| KR (2) | KR100854838B1 (ko) |
| CN (1) | CN100469765C (ko) |
| AP (1) | AP2006003638A0 (ko) |
| AR (2) | AR047081A1 (ko) |
| AU (1) | AU2004313688B2 (ko) |
| BR (1) | BRPI0418245B8 (ko) |
| CA (1) | CA2551409C (ko) |
| CR (2) | CR8498A (ko) |
| CY (1) | CY1117417T1 (ko) |
| DK (1) | DK1704141T3 (ko) |
| EA (1) | EA010595B1 (ko) |
| EC (1) | ECSP066684A (ko) |
| ES (2) | ES2767136T3 (ko) |
| GE (1) | GEP20094780B (ko) |
| GT (1) | GT200500293A (ko) |
| HK (1) | HK1096084A1 (ko) |
| HR (1) | HRP20160500T1 (ko) |
| HU (1) | HUE027357T2 (ko) |
| IL (1) | IL176416A (ko) |
| MA (1) | MA28284A1 (ko) |
| ME (1) | ME02433B (ko) |
| MX (1) | MXPA06007678A (ko) |
| MY (1) | MY147181A (ko) |
| NO (2) | NO337217B1 (ko) |
| NZ (1) | NZ548271A (ko) |
| OA (1) | OA13356A (ko) |
| PA (1) | PA8620901A1 (ko) |
| PE (1) | PE20051052A1 (ko) |
| PL (1) | PL1704141T3 (ko) |
| RS (1) | RS54717B1 (ko) |
| SI (1) | SI1704141T1 (ko) |
| TN (1) | TNSN06210A1 (ko) |
| TW (1) | TWI337994B (ko) |
| UA (1) | UA84726C2 (ko) |
| UY (1) | UY28709A1 (ko) |
| WO (1) | WO2005068421A1 (ko) |
| ZA (1) | ZA200605354B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010077101A2 (ko) | 2008-12-30 | 2010-07-08 | 조선대학교산학협력단 | 신규한 티아졸리딘디온 유도체 및 그의 용도 |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3002277B1 (en) | 2004-01-05 | 2019-11-06 | Nicox S.A. | Prostaglandin derivatives |
| CA2613748A1 (en) * | 2005-06-29 | 2007-01-04 | Pfizer Inc. | Prostaglandin derivatives |
| CA2613010A1 (en) * | 2005-06-29 | 2007-01-04 | Pfizer Inc. | Fluoroprostaglandins nitroderivatives |
| WO2007126609A1 (en) * | 2006-03-29 | 2007-11-08 | Nitromed, Inc. | Nitric oxide enhancing prostaglandin compounds, compositions and methods of use |
| US20090238763A1 (en) | 2006-07-09 | 2009-09-24 | Chongxi Yu | High penetration compositions and uses thereof |
| US20090221703A1 (en) | 2006-07-09 | 2009-09-03 | Chongxi Yu | High penetration composition and uses thereof |
| DE102006052755A1 (de) * | 2006-11-08 | 2008-05-15 | N-Zyme Biotec Gmbh | Michaelsysteme als Transglutaminaseinhibitoren |
| US20100063035A1 (en) | 2006-12-15 | 2010-03-11 | Nicox S.A. | Carbonic anhydrase inhibitors derivatives |
| WO2008071421A1 (en) * | 2006-12-15 | 2008-06-19 | Nicox S.A. | Nitrate esters of carbonic anhydrase inhibitors |
| JP2010529101A (ja) | 2007-06-04 | 2010-08-26 | テックフィールズ インコーポレイテッド | 非常に速い皮膚及び膜浸透速度を有するnsaiaプロドラッグ及びその新規医薬使用 |
| WO2009035565A1 (en) * | 2007-09-07 | 2009-03-19 | Qlt Plug Delivery, Inc | Prostaglandin analogues for implant devices and methods |
| RU2010121880A (ru) * | 2007-10-31 | 2011-12-10 | Памела ЛИПКИН (US) | Композиции аналогов простагландина и способы лечения состояний, затрагивающих эпителий |
| AR076731A1 (es) * | 2008-05-09 | 2011-07-06 | Pfizer | Prostamidas donadoras de oxido nitrico, uso de los mismos y composiciones farmaceuticas |
| US7807716B2 (en) * | 2008-09-24 | 2010-10-05 | Oral Delivery Technology Ltd. | Nitric oxide amino acid ester compound, compositions for increasing nitric oxide levels and method of use |
| MX362949B (es) | 2008-12-04 | 2019-02-27 | Yu Chongxi | Composiciones de alta penetracion y sus aplicaciones. |
| WO2011032936A1 (en) * | 2009-09-15 | 2011-03-24 | Dsm Ip Assets B.V. | Nitrooxyesters, their preparation and use |
| CN101885684B (zh) * | 2010-07-01 | 2013-10-30 | 南京中医药大学 | 带有一氧化氮供体的芳香酸前体药物及其制备方法和其应用 |
| EP3290024B1 (en) | 2011-08-29 | 2019-04-17 | Mati Therapeutics Inc. | Sustained release delivery of active agents to treat glaucoma and ocular hypertension |
| HU231203B1 (hu) * | 2011-12-21 | 2021-10-28 | CHINOIN Gyógyszer és Vegyészeti Termékek Gyára Zrt. | Új eljárás travoprost előállítására |
| WO2013164671A1 (en) | 2012-05-03 | 2013-11-07 | Qlt Inc. | Drug delivery system and methods of treating open angle glaucoma and ocular hypertension |
| ES2841993T3 (es) * | 2012-10-23 | 2021-07-12 | Nicox Sa | Compuestos donantes de óxido nítrico a base de quinona para uso oftálmico |
| WO2014170264A1 (en) * | 2013-04-18 | 2014-10-23 | Nicox Science Ireland | Quinone based nitric oxide donating compounds for ophthalmic use |
| US9913849B2 (en) | 2014-01-10 | 2018-03-13 | Manistee Partners Llc | Treatment of migraines |
| CN112022856A (zh) * | 2014-10-15 | 2020-12-04 | 爱尔康公司 | 用于治疗青光眼和眼压过高的前列腺素偶联物和衍生物 |
| WO2016156104A1 (en) | 2015-03-31 | 2016-10-06 | Nicox S.A. | Nitric oxide donating derivatives of latanoprost free acid |
| US10280138B2 (en) | 2015-03-31 | 2019-05-07 | Nicox S.A. | Nitric oxide donating derivatives of fluprostenol |
| EP3088388A1 (en) | 2015-04-30 | 2016-11-02 | NicOx S.A. | Nitric oxide donating derivatives of prostaglandins |
| MX2018003462A (es) | 2015-09-22 | 2018-09-06 | Graybug Vision Inc | Compuestos y composiciones para el tratamiento de trastornos oculares. |
| HU231175B1 (hu) * | 2015-12-04 | 2021-06-28 | CHINOIN Gyógyszer és Vegyészeti Termékek Gyára Zrt. | Tetszőleges, előre meghatározott minőségű Latanoprostene bunod előállítása gravitációs kromatográfiával |
| BR112019009330A2 (pt) | 2016-11-08 | 2019-07-30 | Bausch & Lomb | composto |
| KR102069205B1 (ko) * | 2017-08-09 | 2020-01-22 | 연성정밀화학(주) | 라타노프로스틴 부노드의 제조 방법 및 그를 위한 중간체 |
| RU2718744C2 (ru) * | 2018-05-17 | 2020-04-14 | Общество с ограниченной ответственностью "Гурус БиоФарм" | Производные простагландина F2альфа для снижения внутриглазного давления |
| CN109988089B (zh) * | 2018-05-29 | 2022-04-26 | 上海凡秦医药科技有限公司 | 一种前列腺素化合物、制备方法及其用途 |
| CN108892624B (zh) * | 2018-06-20 | 2020-12-15 | 重庆威鹏药业有限公司 | 沙库巴曲硝基氧衍生物及其制备方法和应用 |
| US11332433B2 (en) | 2020-07-24 | 2022-05-17 | Chirogate International Inc. | Process for the preparation of latanoprostene bunod and intermediate thereof and compositions comprising the same |
| CN113943266A (zh) * | 2021-11-18 | 2022-01-18 | 广州楷石医药有限公司 | 一种氧化氮供体型贝前列素类衍生物及其药物组合物和用途 |
| CN116444377A (zh) * | 2022-01-07 | 2023-07-18 | 广州楷石医药有限公司 | 一种氧化氮供体型曲前列尼尔类衍生物及其药物组合物和用途 |
| CA3195291A1 (en) * | 2022-04-13 | 2023-10-13 | Caravel Therapeutics, Inc. | Preservative-free ophthalmic pharmaceutical emulsion and its application |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5328933A (en) * | 1992-10-28 | 1994-07-12 | Allergan, Inc. | Cyclopentane heptenylnitro and heptanylnitro-2-aliphatic or aryl aliphatic derivatives and homologues |
| US5625083A (en) * | 1995-06-02 | 1997-04-29 | Bezuglov; Vladimir V. | Dinitroglycerol esters of unsaturated fatty acids and prostaglandins |
| US6211233B1 (en) * | 1997-06-19 | 2001-04-03 | Nicox S.A. | Prostaglandin pharmaceutical compositions |
| KR20080007415A (ko) * | 2004-01-05 | 2008-01-18 | 니콕스 에스. 에이. | 프로스타글란딘 나이트로옥시 유도체 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3922293A (en) | 1971-12-30 | 1975-11-25 | Upjohn Co | Prostaglandin F-type 9-monoacylates |
| US4952581A (en) | 1987-04-03 | 1990-08-28 | The Trustees Of Columbia University In The City Of New York | Use of a prostaglandin in combination with an adrenergic blocking agent for reduction of intraocular pressure |
| JP2721414B2 (ja) | 1988-09-06 | 1998-03-04 | フアーマシア・アンド・アツプジヨン・アー・ベー | 縁内障または眼圧亢進の治療のためのプロスタグランジン誘導体 |
| ATE153855T1 (de) | 1992-10-13 | 1997-06-15 | Alcon Lab Inc | Zusammensetzungen zur behandlung von glaukoma die prostaglandine und clonidinderivate enthalten |
| IT1295694B1 (it) | 1996-11-14 | 1999-05-27 | Nicox Sa | Nitrossi derivati per la preparazione di medicamenti ad attivita antitrombinica |
| US6417228B1 (en) | 1998-11-02 | 2002-07-09 | Alcon Manufacturing, Ltd.. | 13-Aza prostaglandins for the treatment of glaucoma and ocular hypertension |
| WO2000051978A1 (en) | 1999-03-01 | 2000-09-08 | Nitromed, Inc. | Nitrosated and nitrosylated prostaglandins, compositions and metods of use |
| AR035541A1 (es) | 2000-11-13 | 2004-06-16 | Pharmacia Ab | Un metodo de tratamiento para pacientes que sufren de glaucoma severo o necesitan una reduccion de la presion intraocular (pio) y el uso de una combinacion de agentes reductores de la pio |
| BR0209063A (pt) | 2001-04-19 | 2004-08-10 | Teika Pharmaceutical Co Ltd | Medicamentos e kits de uso medicinal |
-
2004
- 2004-12-27 EP EP15194684.5A patent/EP3002277B1/en active Active
- 2004-12-27 DK DK04804405.1T patent/DK1704141T3/en active
- 2004-12-27 OA OA1200600221A patent/OA13356A/en unknown
- 2004-12-27 CN CNB2004800398051A patent/CN100469765C/zh active Active
- 2004-12-27 NZ NZ548271A patent/NZ548271A/en unknown
- 2004-12-27 EP EP19196238.0A patent/EP3643702A1/en not_active Withdrawn
- 2004-12-27 JP JP2006546105A patent/JP3984283B2/ja active Active
- 2004-12-27 HU HUE04804405A patent/HUE027357T2/en unknown
- 2004-12-27 EA EA200601099A patent/EA010595B1/ru not_active IP Right Cessation
- 2004-12-27 WO PCT/EP2004/014820 patent/WO2005068421A1/en active Application Filing
- 2004-12-27 RS RS20160251A patent/RS54717B1/en unknown
- 2004-12-27 SI SI200432309T patent/SI1704141T1/sl unknown
- 2004-12-27 AU AU2004313688A patent/AU2004313688B2/en active Active
- 2004-12-27 UA UAA200607454A patent/UA84726C2/ru unknown
- 2004-12-27 ES ES15194684T patent/ES2767136T3/es active Active
- 2004-12-27 AP AP2006003638A patent/AP2006003638A0/xx unknown
- 2004-12-27 KR KR1020087000325A patent/KR100854838B1/ko active IP Right Grant
- 2004-12-27 ME MEP-2016-79A patent/ME02433B/me unknown
- 2004-12-27 PL PL04804405T patent/PL1704141T3/pl unknown
- 2004-12-27 KR KR1020067013440A patent/KR100850133B1/ko active IP Right Grant
- 2004-12-27 GE GEAP20049494A patent/GEP20094780B/en unknown
- 2004-12-27 BR BRPI0418245A patent/BRPI0418245B8/pt active IP Right Grant
- 2004-12-27 EP EP04804405.1A patent/EP1704141B1/en active Active
- 2004-12-27 CA CA2551409A patent/CA2551409C/en active Active
- 2004-12-27 ES ES04804405.1T patent/ES2566800T3/es active Active
- 2004-12-27 MX MXPA06007678A patent/MXPA06007678A/es active IP Right Grant
- 2004-12-31 TW TW093141786A patent/TWI337994B/zh active
-
2005
- 2005-01-03 MY MYPI20050009A patent/MY147181A/en unknown
- 2005-01-03 AR ARP050100012A patent/AR047081A1/es active IP Right Grant
- 2005-01-04 UY UY28709A patent/UY28709A1/es not_active Application Discontinuation
- 2005-01-04 PA PA20058620901A patent/PA8620901A1/es unknown
- 2005-01-04 PE PE2005000037A patent/PE20051052A1/es active IP Right Grant
- 2005-01-05 US US11/029,698 patent/US7273946B2/en active Active
- 2005-10-18 GT GT200500293A patent/GT200500293A/es unknown
-
2006
- 2006-06-19 IL IL176416A patent/IL176416A/en active IP Right Grant
- 2006-06-28 ZA ZA200605354A patent/ZA200605354B/xx unknown
- 2006-06-29 EC EC2006006684A patent/ECSP066684A/es unknown
- 2006-06-30 CR CR8498A patent/CR8498A/es unknown
- 2006-07-04 TN TNP2006000210A patent/TNSN06210A1/fr unknown
- 2006-07-05 MA MA29169A patent/MA28284A1/fr unknown
- 2006-08-07 NO NO20063567A patent/NO337217B1/no unknown
-
2007
- 2007-03-30 HK HK07103447.6A patent/HK1096084A1/xx unknown
- 2007-08-20 US US11/841,628 patent/US7449469B2/en active Active
-
2008
- 2008-09-15 US US12/210,975 patent/US7629345B2/en active Active
-
2009
- 2009-11-06 US US12/613,985 patent/US7910767B2/en active Active
-
2011
- 2011-02-11 US US13/025,740 patent/US8058467B2/en active Active
- 2011-03-11 CR CR20110131A patent/CR20110131A/es unknown
-
2014
- 2014-12-22 AR ARP140104875A patent/AR098931A2/es not_active Application Discontinuation
-
2015
- 2015-10-08 NO NO20151341A patent/NO339685B1/no unknown
-
2016
- 2016-04-26 CY CY20161100340T patent/CY1117417T1/el unknown
- 2016-05-11 HR HRP20160500TT patent/HRP20160500T1/hr unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5328933A (en) * | 1992-10-28 | 1994-07-12 | Allergan, Inc. | Cyclopentane heptenylnitro and heptanylnitro-2-aliphatic or aryl aliphatic derivatives and homologues |
| US5625083A (en) * | 1995-06-02 | 1997-04-29 | Bezuglov; Vladimir V. | Dinitroglycerol esters of unsaturated fatty acids and prostaglandins |
| US6211233B1 (en) * | 1997-06-19 | 2001-04-03 | Nicox S.A. | Prostaglandin pharmaceutical compositions |
| KR20080007415A (ko) * | 2004-01-05 | 2008-01-18 | 니콕스 에스. 에이. | 프로스타글란딘 나이트로옥시 유도체 |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010077101A2 (ko) | 2008-12-30 | 2010-07-08 | 조선대학교산학협력단 | 신규한 티아졸리딘디온 유도체 및 그의 용도 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100850133B1 (ko) | 프로스타글란딘 나이트로옥시 유도체 | |
| US7718656B2 (en) | Prostaglandin derivatives | |
| JP2009500315A (ja) | フルオロプロスタグランジンのニトロ誘導体 | |
| WO2018087092A1 (en) | Nitric oxide releasing prostaglandin derivatives for treating normal tension glaucoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| J201 | Request for trial against refusal decision | ||
| A107 | Divisional application of patent | ||
| AMND | Amendment | ||
| E90F | Notification of reason for final refusal | ||
| B701 | Decision to grant | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20130719 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20140708 Year of fee payment: 7 |
|
| FPAY | Annual fee payment |
Payment date: 20150630 Year of fee payment: 8 |
|
| FPAY | Annual fee payment |
Payment date: 20160630 Year of fee payment: 9 |
|
| FPAY | Annual fee payment |
Payment date: 20170628 Year of fee payment: 10 |
|
| FPAY | Annual fee payment |
Payment date: 20180627 Year of fee payment: 11 |
|
| FPAY | Annual fee payment |
Payment date: 20190621 Year of fee payment: 12 |