-
HINTERGRUND DER ERFINDUNG
-
Gebiet der
Erfindung
-
Die
vorliegende Erfindung betrifft den OB-Rezeptor und -Liganden und
Verwendungen dieser Moleküle.
-
Beschreibung
des Standes der Technik
-
A. HÄMATOPOESE
-
Der
Prozess der Blutzellbildung, wodurch rote und weiße Blutzellen
durch die Teilung von Zellen, die im Knochenmark vorhanden sind,
ersetzt werden, wird als Hämatopoese
bezeichnet. Eine Beschreibung der Hämatopoese ist in Dexter & Spooncer (Ann.
Rev. Cell Biol. 3, 423–441
(1987)) zu finden.
-
Es
gibt viele verschiedene Arten von Blutzellen, die unterschiedlichen
Zellstammbäumen
angehören. In
jedem Stammbaum gibt es Zellen in verschiedenen Reifestadien. Reife
Blutzellen sind für
verschiedene Funktionen spezialisiert. Beispielsweise sind Erythrozyten
in O2- und CO2-Transport
eingebunden; T- und B-Lymphozyten sind in Zell- bzw. Antikörper-vermittelte
Immunantworten eingebunden; Blutplättchen sind zur Blutgerinnung
erforderlich; und die Granulozyten und Makrophagen wirken als allgemeine
Phagozyten und Nebenzellen. Granulozyten können weiter in Basophile, Eosinophile,
Neutrophile und Mastzellen unterteilt werden.
-
Jede
dieser verschiedenen Blutzelltypen entsteht aus pluripotenten oder
totipotenten Stammzellen, die in der Lage sind, Selbsterneuerung
zu erfahren oder Vorläuferzellen
oder koloniebildende Einheiten (KBE) entstehen zu lassen, die eine
kleinere Gruppe an Zelltypen ergeben. Da Stammzellen schrittweise
ihre Fähigkeit
zur Selbsterneuerung verlieren, wird ihr Stammbaum immer stärker eingeschränkt. Es
wurde gezeigt, dass sich Stammzellen zu multipotenten Zellen (die
von Dexter & Spooncer,
s.o., als "CFC-Mix" bezeichnet werden) entwickeln
können.
Manche der CFC-Mix-Zellen können
Erneuerung erfahren, während
andere zu Stammbaumeingeschränkten
Vorläufern
führen,
die sich schließlich
zu reifen Knochenmarkszellen entwickeln (z.B. Neutrophile, Megakaryozyten,
Makrophagen und Basophile). In ähnlicher
Weise sind pluripotente Stammzellen in der Lage, PreB- und PreT-Lymphoidzellstammbäume entstehen
zu lassen, die sich zu reifen B- bzw. T-Lymphozyten differenzieren. Vorläufer sind
durch ihre Nachkommenschaft definiert, z.B. Granulozyten/Makrophagen-koloniebildende
Vorläuferzellen
(GM-CFU) differenzieren sich zu Neutrophilen oder Makrophagen; primitive
Erythroid-Burst-Forming-Units
(BFU-E) differenzieren sich zu Erythroid-koloniebildenden Einheiten (CFU-E),
die reife Erythrozyten entstehen lassen. In ähnlicher Weise sind Meg-CFU-,
Eos-CFU- und Bas-CFU-Vorläufer in
der Lage, sich in Megakaryozyten, Eosinophile bzw. Basophile zu
differenzieren.
-
Für hämatopoetische
Wachstumsfaktoren (siehe Andrea, NEJM 330(12), 839–846 (1994))
wurde gezeigt, dass sie Wachstum und/oder Differenzierung von Blutzellen über Aktivierung
von Rezeptoren, die an der Oberfläche von Blutvorläuferzellen
des Knochenmarks vorhanden sind, steigern. Während manche dieser Wachstumsfaktoren
Proliferation von eingeschränkten
Stammbäumen
von Blutzellen stimulieren, steigern andere die Proliferation von
Mehrfach-Stammbäumen
von Blutzellen. Beispielsweise unterstützt Erythropoietin (EPO) die
Proliferation von Erythrozyten, während Interleukin-3 (IL-3)
die Proliferation von Erythrozyten- und Knochenmarksstammbäumen induziert
und daher als ein Multi-Stammbaumfaktor betrachtet wird.
-
In
den vergangenen Jahren wurden mehrere hämatopoetische Wachstumsfaktorrezeptoren
isoliert. Durch ihre geringe Häufigkeit
und ihre Existenz sowohl in hochaffinen als auch in niederaffinen
Formen wurde die biochemische Charakterisierung dieser Rezeptoren
bisher behindert.
-
Cytokinrezeptoren
ordnen sich häufig
zu Mehrfachuntereinheit-Komplexen an. Manchmal ist die α-Untereinheit
dieses Komplexes in die Bindung des zugehörigen Wachstumsfaktors eingebunden,
und die β-Untereinheit
kann über
eine Fähigkeit verfügen, ein
Signal zur Zelle zu transduzieren. Diese Rezeptoren wurden je nach
gebildeten Komplexen drei Unterfamilien zugeordnet. Unterfamilie
1 umfasst die Rezeptoren für
Erythropoietin (EPO), Granulozyten-Koloniewachstum stimulierenden
Faktor (G-CSF), Interleukin-4 (IL-4), Interleukin-7 (IL-7), Wachstumshormon
(GH) und Prolactin (PRL). Von Ligandenbindung an Rezeptoren, die
zu dieser Unterfamilie gehören,
wird angenommen, dass sie in Homodimerisierung des Rezeptors resultiert.
Unterfamilie 2 umfasst Rezeptoren für IL-3, Granulozyten-Makrophagen-Koloniewachstum stimulierenden
Faktor (GM-CSF), Interleukin-5 (IL-5), Interleukin-6 (IL-6), Leukämie inhibierenden
Faktor (LIF), Oncostatin M (OSM) und ciliary neurotrophic factor
(CNTF). Unterfamilie-2-Rezeptoren sind Heterodimere mit einer α-Untereinheit für Ligandenbindung
und einer β-Untereinheit
(entweder die gemeinsame β-Untereinheit
der IL-3-, GM-CSF- und IL-5-Rezeptoren oder die gp130-Untereinheit der
IL-6-, LIF-, OSM- und CNTF-Rezeptoren) für Signaltransduktion. Unterfamilie
3 enthält
nur den Interleukin-2- (IL-2-) Rezeptor. Die β- und γ-Untereinheiten des IL-2-Rezeptorkomplexes
sind Cytokin-Rezeptorpolypeptide, die sich mit der α-Untereinheit
des nicht verwandten Tac-Antigens assoziieren.
-
B. Obesität
-
Obesität ist die
häufigste
Ernährungsstörung, die
jüngsten
epidemiologischen Studien zufolge etwa ein Drittel aller Amerikaner
im Alter von 20 Jahren oder mehr betrifft. Kuczmarski et al., J.
Am. Med. Assoc. 272, 205–211
(1994). Obesität
ist für
zahlreiche verschiedene schwerwiegende Gesundheitsprobleme verantwortlich,
einschließlich
kardiovaskulärer
Störungen,
Typ-II-Diabetes, Insulinresistenz, Bluthochdruck, Hypertriglyceridämie, Dysliporoteinämie und
mancher Formen von Krebs. F. Pi-Sunyer, Anns. Int. Med. 119, 655–660 (1993);
G. Colfitz, Am. J. Clin. Nutr. 55, 503S–507S (1992). Von einer Einzelgen-Mutation
(die Obesität-
oder "ob"-Mutation) wurde
gezeigt, dass sie bei Mäusen
zu Obesität
und Typ-II-Diabetes führt.
Friedman, Genomics 11, 1054–1062
(1991).
-
Zhang
et al., Nature 372, 425–431
(1994), berichteten erst jüngst
vom Klonieren und Sequenzieren des Maus-ob-Gens und seines menschlichen
Homologs und schlugen vor, dass das ob-Genprodukt, Leptin oder OB-Protein,
als Teil eines Signalstoff-Stoffwechselweges
aus Fettgewebe funktionieren kann, dessen Wirkung die Regulation
der Größe des Körperfettdepots
darstellt. Parabiose-Versuche, die vor über 20 Jahren durchgeführt worden
waren, sagten voraus, dass genetisch adipöse Mäuse, die zwei mutierte Kopien
des ob-Gens (ob/ob-Maus) enthalten, keinen Sättigungsfaktor produzieren,
der ihre Nahrungsmittelaufnahme reguliert, während die diabetische (db/db)
Maus den Sättigungsfaktor
zwar produziert, jedoch nicht darauf reagiert. Coleman & Hummal, Am. J.
Physiol. 217, 1298–1304
(1969); Coleman, Diabetol 9, 294–298 (1973). Jüngste Berichte
von drei voneinander unabhängigen
Forschungsteams zeigten, dass tägliche
Injektionen von rekombinantem OB-Protein Nahrungsmittelaufnahme
hemmen und Körpergewicht
und -fett bei stark adipösen ob/ob-Mäusen reduzieren,
jedoch nicht bei db/db-Mäusen
(Pelleymounter et al., Science 269, 540–543 (1995); Halaas et al.,
Science 269, 543–546
(1995); Campfield et al., Science 269, 546–549 (1995)), was darauf schließen lässt, dass
das OB-Protein solch ein Sättigungsfaktor
ist, wie er in den frühen
Kreuzzirkulations-Studien erwogen wurde.
-
Forscher
schlugen vor, dass zumindest ein OB-Rezeptor im Gehirn angeordnet
ist. Über
die Identifikation und das Expressionsklonieren eines Leptin-Rezeptors
(OB-R) wurde von Tartaglia et al., Cell 83, 1263–1271 (1995), berichtet. Verschiedene
Isoformen eines OB-Rezeptors werden von Cioffi et al., Nature 2, 585–589 (1996),
beschrieben. Siehe auch die WO 96/08510.
-
Das
Maus-db-Gen wurde erst jüngst
kloniert (Lee et al., Nature 379, 632 (1996), und Chen et al., Cell 84,
491–495
(1996)). Ältere
Daten schlugen vor, dass das db-Gen für den Rezeptor des Obesität- (ob-)
Genprodukts, Leptin, kodierte (Coleman et al., Diebetologia 9, 294–298 (1973),
und Coleman et al., Diebetologia 14, 141–148 (1978)). Erst jüngst wurde
bestätigt,
dass die db/db-Maus aus einer trunkierten Spleißvariante des OB-Rezeptors
entsteht, der wahrscheinlich den Rezeptor für Signaltransduktion defekt
macht (Lee et al., Nature 379, 632 (1996), und Chen et al., Cell
84, 491–495
(1996)).
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft den OB-Cytokinrezeptor, der hierin
als WSX-Rezeptor
bezeichnet wird.
-
Die
Erfindung stellt in einem Aspekt Verfahren zur Identifikation eines
Moleküls
bereit, das sich an den WSX-Rezeptor gemäß den Ansprüchen 16 oder 17 bindet oder
diesen aktiviert. Dies ist nützlich
zur Entdeckung von Molekülen
(wie z.B. Peptiden, Antikörpern
und kleinen Molekülen),
die Agonisten des WSX-Rezeptors sind. Solche Verfahren umfassen
im Allgemeinen das Aussetzen eines immobilisierten WSX-Rezeptors gegenüber einem
Molekül,
von dem angenommen wird, dass es sich daran bindet, und das Bestimmen
der Bindung des Moleküls
an den immobilisierten WSX-Rezeptor und/oder das Bewerten, ob das
Molekül
den WSX-Rezeptor aktiviert oder nicht. Um solche WSX-Liganden zu
identifizieren, kann der WSX-Rezeptor an der Oberfläche einer
Zelle exprimiert und verwendet werden, um Bibliotheken von synthetischen
Verbindungen und natürlich
vorkommenden Verbindungen (z.B. endogene Quellen solcher natürlich vorkommenden
Verbindungen, wie beispielsweise Serum) zu screenen.
-
In
weiteren Ausführungsformen
stellt die Erfindung Antikörper
bereit, die sich spezifisch an den WSX-Rezeptor binden. Bevorzugte
Antikörper
sind monoklonale Antikörper,
die in Menschen nicht-immunogen sind und sich an ein Epitop in der
extrazellulären
Domäne
des Rezeptors binden. Bevorzugte Antikörper binden den WSX-Rezeptor mit einer
Affinität
von zumindest etwa 106 L/mol, noch bevorzugter
107 L/mol.
-
Antikörper, die
sich an den WSX-Rezeptor binden, können gegebenenfalls an ein
heterologes Polypeptid fusioniert sein, und der Antikörper oder
die Fusion davon kann verwendet werden, um WSX-Rezeptor aus einer
Quelle des Rezeptors zu isolieren oder zu reinigen.
-
Basierend
auf der vorliegenden Beobachtung, dass CD34+-Zellen WSX-Rezeptor
aufweisen, wird die Verwendung von WSX-Antikörpern zur Identifikation und/oder
Anreicherung von Stammzellpopulationen (auf eine ähnliche
Weise wie zur Zeit CD34-Antikörper
verwendet werden) in Betracht gezogen.
-
Für bestimmte
Anwendungen ist es wünschenswert,
einen Agonistenantikörper
zu haben, auf den wie hierin beschrieben gescreent werden kann.
Solche Agonistenantikörper
sind nützlich
zur Aktivierung des WSX-Rezeptors für In-vitro-Verwendungen, wobei
eine Steigerung von Proliferation und/oder Differenzierung einer
Zelle, die den Rezeptor umfasst, erwünscht ist. Weiters können diese
Antikörper
verwendet werden, um Leiden zu behandeln, bei denen ein wirksames
Ausmaß an
WSX-Rezeptor-Aktivierung
zu einem therapeutischen Nutzen im damit behandelten Säugetier
führt.
Beispielsweise kann der Agonistenantikörper verwendet werden, um Proliferation
und/oder Differenzierung einer Zelle zu steigern, die den WSX-Rezeptor
gemäß Anspruch
12 umfasst. Insbesondere können
Agonistenantikörper
und andere WSX-Liganden
verwendet werden, um Proliferation von Stammzellen/Vorläuferzellen
entweder in vitro oder in vivo zu stimulieren.
-
Für therapeutische
Anwendungen ist es wünschenswert,
eine Zusammensetzung herzustellen, die den Agonistenantikörper und
einen physiologisch annehmbaren Träger umfasst. Gegebenenfalls
kann solch eine Zusammensetzung weiters ein oder mehrere Cytokine
umfassen.
-
Zusätzlich zu
oben Genanntem werden hierin isolierte Nucleinsäuremoleküle, Expressionsvektoren und
Wirtszellen offenbart, die für
den WSX-Rezeptor kodieren und die zur rekombinanten Herstellung
von WSX-Rezeptor wie hierin beschrieben verwendet werden können. Die
isolierten Nucleinsäuremoleküle und Vektoren
sind auch für
Gentherapieanwendungen zur Behandlung von Patienten mit WSX-Rezeptor- defekten und/oder
zur Steigerung der Reaktionsfähigkeit
von Zellen auf WSX-Liganden
nützlich.
-
Diese
Anwendung betrifft auch Agonistenantikörper, die sich spezifisch an
den WSX-Rezeptor
binden und eine oder mehrere biologische Aktivitäten von natürlich vorkommendem WSX-Liganden,
OB-Protein, nachahmen. Bevorzugte Antikörper sind jene mit einer starken
Bindungsaffinität
für menschlichen
WSX-Rezeptor (z.B. mit einer Kd von nicht mehr als etwa 1 × 108 M; und vorzugsweise von nicht mehr als
etwa 1 × 109 M). In bevorzugten Ausführungsformen bindet sich der
Agonistenantikörper
sowohl an menschlichen als auch an Maus-WSX-Rezeptor.
-
Antikörper mit
definierter Agonistenaktivität
in einem Biotest, dem KIRA-ELISA, sind hierin offenbart. Bevorzugte
Antikörper
weisen einen IC50 im KIRA-ELISA von etwa 0,5 μg/ml oder weniger, vorzugsweise
von etwa 0,2 μg/ml
oder weniger, und am meisten bevorzugt von etwa 0,1 μg/ml oder
weniger auf.
-
Die
Agonistenantikörper,
die hierin von Interesse sind, können
eine oder mehrere biologische Eigenschaften von Antikörper 2D7,
1G4, 1E11 oder 1C11 (siehe Beispiel 13) oder von Klonen 3, 4 oder
17 (siehe Beispiel 14) aufweisen. Beispielsweise kann sich der Antikörper an
das Epitop durch jeden dieser Antikörper binden und/oder kann manche
oder alle der Reste der hypervariab en Region dieser Antikörper aufweisen.
-
Der
Agonistenantikörper
kann einer sein, der Körpergewicht
und/oder Fettdepotgewicht und/oder Nahrungsmittelaufnahme bei einem
adipösen
Tier (z.B. einer ob/ob-Maus)
senkt. Der bevorzugte Agonistenantikörper ist einer, der eine fettreduzierende
Wirkung bei einem adipösen
Säugetier
(z.B. einer ob/ob-Maus) ausübt,
die größer ist
als jene, die durch eine Reduktion der Nahrungsaufnahme induziert
wird (Levin et al., Proc. Natl. Acad. Sci. USA 93, 1726–1730 (1996)).
-
Der
Agonistenantikörper
kann auch die Eigenschaft besitzen, Differenzierung und/oder Proliferation und/oder Überleben
von hämatopoetischen
Vorläuferzellen
zu induzieren. Beispielsweise kann der Agonistenantikörper Lymphopoese,
Erythropoese und/oder Myelopoese induzieren.
-
Die
Erfindung offenbart hierin eine Zusammensetzung, die den Agonistenantikörper und
einen physiologisch annehmbaren Träger umfasst. Die Zusammensetzung
zur therapeutischen Verwendung ist steril und kann lyophilisiert
werden. Zur Verwendung bei Blutbildung kann die Zusammensetzung
beispielsweise weiters ein Cytokin umfassen.
-
In
einem anderen Aspekt stellt die Erfindung ein Verfahren zur Aktivierung
des WSX-Rezeptors
bereit, das das Aussetzen des WSX-Rezeptors gegenüber einer
Menge an Agonisten-Anti-WSX-Rezeptorantikörper umfasst, die zur Aktivierung
des WSX-Rezeptors
wirksam ist. Insbesondere stellt die Erfindung ein Verfahren zur
Steigerung von Proliferation und/oder Differenzierung einer Zelle
bereit, die den WSX-Rezeptor
an ihrer Zelloberfläche
exprimiert, umfassend das Aussetzen der Zelle gegenüber einer
Menge an exogenem Agonisten-Anti-WSX-Rezeptorantikörper, die
zur Steigerung von Proliferation und/oder Differenzierung der Zelle
wirksam ist.
-
In
einem weiteren Aspekt betrifft die vorliegende Erfindung die hierin
dargestellte Entdeckung, dass WSX-Liganden, wie z.B. Obesität- (OB-)
Protein, über
Signalabgabe durch den WSX-Rezeptor eine Rolle bei der Blutbildung
spielen. Die Rolle des WSX-Rezeptor-Liganden-Signalstoff-Stoffwechselweges
scheint auf der Ebene des frühen
hämatopoetischen
Vorläufers
zu liegen, wie aus der Fähigkeit
von OB-Protein,
Myelopoese, Erythropoese (z.B. Milz-Erythropoese) und, am stärksten,
Lymphopoese, zu stimulieren, eindeutig hervorgeht. Demgemäß können WSX-Liganden verwendet
werden, um Proliferation und/oder Differenzierung und/oder Überleben
von hämatopoetischen
Vorläuferzellen
in vitro zu stimulieren.
-
Somit
stellt die Erfindung ein Verfahren zur Stimulation von Proliferation
und/oder Differenzierung einer Zelle bereit, die den WSX-Rezeptor
(insbesondere die WSX-Rezeptor-Variante
13.2, für
die hierin gezeigt wird, dass sie die Fähigkeit besitzt, ein Proliferationssignal
zu übertragen)
an ihrer Zelloberfläche
exprimiert, umfassend den Schritt des Kontaktierens des WSX-Rezeptors
mit einer Menge an WSX-Liganden, die zur Stimulation von Proliferation
und/oder OB-Proteindifferenzierung der Zelle wirksam ist. In bevorzugten
Ausführungsformen
ist die Zelle, die dem WSX-Liganden ausgesetzt wird, ein hämatopoetischer
Vorläufer,
z.B. eine CD34+-Zelle. Der WSX-Ligand
kann ein Agonistenantikörper
sein, der sich an den WSX-Rezeptor bindet. Das hierin erwogene Verfahren
kann zu einer Steigerung der Proliferation und/oder Differenzierung
von Lymph-, Knochenmark- und/oder Erythrozyten-Blutzellstammbäumen führen und umfasst sowohl In-vitro-
als auch In-vivo-Verfahren.
Bei In-vitro-Verwendungen kann die den WSX-Rezeptor aufweisende
Zelle in Zellkultur vorhanden sein. Bei In-vivo-Verfahren kann die
Zelle in einem Säugetier,
insbesondere in einem Menschen (z.B. einem, der unter reduzierter
Blutkonzentration leidet und der von einer Steigerung der verschiedenen
Blutzellen profitieren könnte),
vorhanden sein. Potenzielle Patienten umfassen jene, die Chemo-
oder Strahlungstherapie oder auch Knochenmarktransplantations-Therapie
unterzogen wurden. Somit stellt die Erfindung ein Verfahren zur
Repopulation von Blutzellen (z.B. Erythrozyten-, Knochenmark- und/oder
Lymphblutzellen) in einem Säugetier
bereit, umfassend das Verabreichen einer therapeutisch wirksamen
Menge eines WSX-Liganden
an das Säugetier.
-
Säugetiere,
die von einer Steigerung von Lymphopoese profitieren können, umfassen
jene, die eine Veranlagung zu einem der folgenden Beispielleiden
aufweisen oder an einem dieser Leiden erkrankt sind: Lymphozytopenie;
Lymphorrhoe; Lymphostase; Immunschwäche (z.B. HIV und AIDS); Infektionen
(einschließlich
z.B. opportunistische Infektionen und Tuberkulose (TB)); Lupus;
und andere Störungen,
die durch einen Mangel an Lymphozyten charakterisiert sind. Eine
wirksame Menge des WSX-Liganden kann in einem Verfahren von Immunopotenzierung
oder zur Verbesserung von Immunfunktion in einem Säugetier
verwendet werden.
-
Andererseits
können
WSX-Rezeptor- oder WSX-Ligandenantagonisten (wie z.B. WSX-Rezeptor-ECD oder
-Immunoadhäsin
und WSX-Rezeptor- oder OB-Proteinneutralisierende Antikörper) bei
der Behandlung von jenen Störungen
verwendet werden, bei denen nicht annehmbare Lymphozytenkonzentrationen
im Säugetier
vorhanden sind, insbesondere, wenn dies durch übermäßige Aktivierung des WSX-Rezeptors verursacht
wird. Beispiele für
Leiden, bei denen Verabreichung eines solchen Antagonisten nützlich sein
könnte, umfassen:
neoplastische Störungen
(wie z.B. Hodgkin-Krankheit; Lymphosarkom; Lympohblastom; lymphozytische
Leukämie;
und Lymphom) und Lymphozytose.
-
Erkrankungen
oder Störungen,
bei denen eine Steigerung der Erythropoese einen Nutzen darstellen kann,
umfassen, sind jedoch nicht beschränkt auf: Erythrozytopenie;
erythrodegenerative Störungen;
Enthroblastopenie; Leukoerythroblastose; Erythroklasie; Thalassämie; und
Anämie
(z.B. hämolytische
Anämie,
wie z.B. erworbene, Autoimmun- oder mikroangiopathische hämolytische
Anämie;
aplastische Anämie;
angeborene Anämie;
z.B. angeborene dyserythropoetische Anämie, angeborene hämolytische
Anämie
oder angeborene hypoplastische Anämie; dyshämopoetische Anämie; Faconi-Anämie; genetische
Anämie;
hämorrhagische Anämie; hyperchrome
oder hypochrome Anämie;
Anämie
entstehend aus Ernährungsmangel,
Eisenmangel oder hypoferrische Anämie; hypoplastische Anämie; infektiöse Anämie; Bleianämie; lokale
Anämie;
makrozytäre
oder mikrozytäre
Anämie;
maligne oder perniziöse
Anämie;
megaloblastische Anämie;
molekulare Anämie;
normozytäre
Anämie;
physiologische Anämie;
traumatische oder posthämorrhagische
Anämie;
refraktäre Anämie; Bestrahlungsanämie; Sichelzellenanämie; Anaemia
splenica; und toxische Anämie).
-
Eine
Steigerung von Myelopoese kann bei jeder der zuvor genannten Erkrankungen
oder Störungen sowie
im Falle der folgenden beispielhaften Leiden von Nutzen sein: Myelofibrose;
Thrombozytopenie; Hypoplasie; disseminierte intravaskuläre Gerinnung
(DIC); Immun- (Autoimmun-) thrombozytopenischer Purpura (ITP); HIV-induzierter ITP;
Myelodysplasie; thrombozytischen Erkrankungen und Thrombozytose.
-
Das
Verfahren kann weiters die Schritte des Aussetzens blutbildender
Zellen (unabhängig
davon, ob sie in Zellkultur oder in einem Säugetier sind) gegenüber einem
oder mehreren anderen Cytokine (z.B. Stammbaum-spezifischen Cytokinen)
umfassen, und dies kann zu einer synergistischen Steigerung der
Proliferation und/oder Differenzierung der Zellen führen. Beispiele
für Cytokine
umfassen Thrombopoietin (TPO); Erythropoietin (EPO); Makrophagen-koloniestimulierenden
Faktor (M-CSF); Granulozyten-Makrophagen-CSF (GM-CSF); Granulozyten-CSF
(G-CSF); Interleukin-1 (IL-1); 1L-1α; IL-2; IL-3; IL-4; IL-5; IL-6;
IL-7; IL-8; IL-9; IL-10; IL-11; IL-12; Leukämie inhibierenden Faktor (LIF)
oder KIT-Ligand (KL). In dieser Ausführungsform kann Aussetzung
gegenüber
Cytokin der Aussetzung gegenüber
WSX-Liganden vorangehen, gleichzeitig damit stattfinden oder nachfolgen.
Vorzugsweise werden der WSX-Ligand und ein oder mehrere Cytokine
dem Patienten gleichzeitig verabreicht (sofern das Verfahren ein
In-vivo-Verfahren ist) und werden, gegebenenfalls, kombiniert, um
eine pharmazeutische Zusammensetzung zu bilden.
-
Zur
Verwendung in den obigen Verfahren wird hierin ein Herstellungsgegenstand
beschrieben, umfassend: ein Behältnis;
eine Markierung am Behältnis;
und eine Zusammensetzung, die einen Wirkstoff umfasst, innerhalb
des Behältnisses;
worin die Zusammensetzung zur Steigerung der Proliferation und/oder
Differenzierung von Zellen, einschließlich des WSX-Rezeptors in
einem Säugetier,
wirksam ist, die Markierung am Behältnis angibt, dass die Zusammensetzung
zur Steigerung von Proliferation und/oder Differenzierung dieser Zellen
verwendet werden kann, und der Wirkstoff in der Zusammensetzung
ein WSX-Ligand ist. Gegebenenfalls umfasst der Herstellungsartikel
ein oder mehrere Behältnisse,
die (ein) weitere(s) Cytokin(e) umfassen, in einer verpackten Kombination
mit dem Behältnis,
das den WSX-Liganden enthält.
-
In
einer anderen Ausführungsform
kann eine wirksame Menge des WSX-Liganden verwendet werden, um Transplantatakzeptanz
bei Knochenmarktransplantation zu verbessern oder um Mobilisierung
von blutbildenden Stammzellen in einem Säugetier vor dem Ernten von
hämatopoetischen
Vorläufern
aus dem peripheren Blut von diesem zu stimulieren.
-
KURZBESCHREIBUNG
DER ZEICHNUNGEN
-
Die 1A bis 1H zusammen
stellen das doppelsträngige
Nucleotid (Seq.-ID Nr. 1) und die abgeleitete Aminosäuresequenz
(Seq.-ID Nr. 2), die für
die menschliche Volllängen-WSX-Rezeptorvariante
13.2 kodiert, dar. Die Nucleotide sind am Beginn des Sense-Strangs
nummeriert. Aminosäurereste
sind am Beginn der Aminosäuresequenz
nummeriert. Restriktionsenzymstellen sind über der Nucleotidsequenz dargestellt.
-
Die 2A bis 2B zusammen
stellen einen Aminosäuresequenzabgleich
von menschlichen Volllängen-WSX-Rezeptorvarianten
6.4 (Seq.-ID Nr. 3), 12.1 (Seq.-ID Nr. 4) bzw. 13.2 dar. Homologe
Reste sind umrahmt. WSX-Rezeptorvarianten 6.4, 12.1 und 13.2 sind
menschliche Nativsequenz-WSX-Rezeptorvarianten, die, ohne hier eine
Einschränkung
auf eine bestimmte Theorie zu beabsichtigen, durch alterniertes
Spleißen
von WSX-Rezeptor-mRNA gebildet zu sein scheinen. Die mutmaßlichen
Signalpeptid-, Transmembran-, Box-1-, Box-2- und Box-3-Domänen sind
angegeben. Die extrazellulären
und zytoplasmatischen Domänen sind
amino- bzw. carboxy-terminal zur Transmembrandomäne. Die gezeigten Box-1-3-Domänen entsprechen den
Motiven von Box 1-3, die in Baumann et al., Mol. Cell. Biol. 14(1),
138–146
(1994), beschrieben sind.
-
Die 3A bis 3E zusammen
zeigen einen Abgleich der Nucleotidsequenzen, die für menschliche
WSX-Rezeptorvarianten 6.4 (Seq.-ID Nr. 5), 12.1 (Seq.-ID Nr. 6)
bzw. 13.2 kodieren.
-
Die 4A bis 4B zeigen
einen Abgleich der menschlichen Volllängen-WSX-Rezeptorvariante-13.2-Aminosäuresequenz
(oben) mit jener einer teilweisen Maus-WSX-Rezeptor-Extrazellulärdomänensequenz
(unten) (Seq.-ID Nr. 7), die wie in Beispiel 7 beschrieben erhalten
wurde. Das mutmaßliche
Maus-Signalpeptid ist mit einem Pfeil bezeichnet.
-
Die 5A bis 5F zeigen
einen Abgleich der Nucleotidsequenzen, die für menschliche WSX-Rezeptorvariante
13.2 (unten) bzw. teilweise Maus-WSX-Rezeptor-Extrazellulärdomäne (oben) (Seq.-ID Nr. 8) kodieren.
-
6 ist
ein Säulendiagramm,
das die Resultate des Thymidin-Inkorporationstests, der in Beispiel
5 beschrieben wird, zeigt. Es wird 3H-Thymidininkorporation
(cpm) in parentalen Baf3-Zellen oder Baf3-Zellen gezeigt, die mit
GH/WSX-Variante-13.2-Chimäre in Gegenwart
von variierenden Konzentrationen von menschlichem Wachstumshormon
(GH) Elektrophorese unterzogen wurden.
-
7 zeigt
die menschlichen oder Maus-Oligonucleotide (Seq.-ID Nr. 9–38), die
für den
in Beispiel 8 beschriebenen Antisense-Versuch verwendet wurden.
-
Die 8 und 9 zeigen
Thymidin-Inkorporationstests an Baf-3-Zellen. Für diese Tests wurde Zellen
IL-3 16–18
Stunden lang entzogen (in RPMI 1640, ergänzt mit 10% fötalem Rinderserum
(FCS)). Zellen wurden in serumfreiem RPMI 1640 gewaschen und bei
50.000 Zellen pro Well in 0,2 ml serumfreiem RPMI 1640, ergänzt mit
der angegebenen Konzentration von menschlichem GH oder menschlichem
OB-Protein, ausplattiert.
Die Zellen wurden 24 Stunden lang stimuliert, und Thymidininkorporation
wurde wie beschrieben bestimmt (Zeigler et al., Blood 84, 2422–2430 (1994)).
Die Tests wurden in dreifacher Ausführung durchgeführt, und
die Resultate wurden in drei voneinander unabhängigen Versuchen bestätigt.
-
In 8 wurden
chimäre
Proteine von GH-Rezeptor-WSX-Rezeptorvariante 12.1 oder 13.2 in Baf-3-Zellen
wie in Beispiel 5 beschrieben exprimiert. Diese transfizierten Zellen
und die parentale Baf-3-Linie wurden mit hGH stimuliert, und die
Inkorporation von titriertem Thymidin wurde bestimmt.
-
In 9 wurden
Baf-3-Zellen stabil mit WSX-Rezeptorvariante 13.2 transfiziert.
Thymidininkorporation wurde dann in diesen Zelllinien nach Stimulation
mit menschlichem OB-Protein bestimmt.
-
In
den 10A bis 10C wurden
fötale
Maus-Leber-AA4+Sca+Kit+- (flASK-) Stammzellen in Suspensionskultur
oder Methylcellulose kultiviert. In 10A wurden
flASK-Zellen in
Suspensionskultur, die Serum mit Kit-Liganden (KL) oder Kit-Liganden
und OB-Protein enthielt, kultiviert. Zellzählungen und Cytospin-Analysen
wurden 7 Tage später
durchgeführt.
In 10B wurden flASK-Zellen in
Methylcellulose entweder unter Knochenmark- oder Lymphbedingungen
wie in Beispiel 10 beschrieben ausgesät. Koloniezählungen wurden 14 Tage später durchgeführt. Für Kolonien,
die unter Lymphbedingungen hergestellt wurden, zeigte die FACS-Analyse,
dass die große
Mehrheit der Zellen B220-positiv war. In 10C wurden
flASK-Zellen in Methylcellulose, die Kit-Liganden enthielt, ausgesät. Zu diesem
Basismedium wurden Erythropoietin (EPO) oder Erythropoietin und
OB-Protein zugesetzt. Die resultierenden Kolonien wurden 14 Tage
später
gezählt. FACS-Analyse
zeigte, dass etwa 95% dieser Kolonien TER-119-positiv waren. Alle
Tests wurden in dreifacher Ausführung
durchgeführt
und in zumindest drei voneinander unabhängigen Versuchen bestätigt.
-
11 veranschaulicht Methylcellulosetests zur Bestimmung
des Koloniebildungspotenzials von db/db-, ob/ob- und dem entsprechenden
ausgesät,
und die resultierenden Kolonien wurden nach 14 Tagen gezählt. Tests
wurden unter Verwendung von sowohl Knochenmark- als auch Lymphbedingungen
durchgeführt. Die
Tests wurden in dreifacher Ausführung
durchgeführt
und die Versuche wurden mindestens dreimal wiederholt.
-
Die 12A bis 12B zeigen
Knochenmark-Zellprofile in Misty-Gray-Wildtyp-Homozygoten-, Misty-Gray/db-Heterozygoten-
und Homozygoten-db/db-Mäusen.
Gesamt-Zellularität
im db/db-Knochenmark war im Vergleich zu den Kontrollen unverändert. 12A zeigt Zellprofile, die unter Verwendung von
Anti-B220-, Anti-CD43-
und Anti-TER119-Antikörpern
bestimmt wurden. 12B zeigt Zellprofile der Milzen
der oben genannten Gruppen.
-
Die 13A bis 13C stellen
eine Analyse von peripherem Blut in db/db-Homozygoten, Misty-Gray-db/db-Heterozygoten
und Misty-Gray-Homozygoten dar. 40 μl peripheres Blut wurden über Blutabnahme
aus der Orbita entnommen und an einem Serrono-Baker-System 9018
analysiert. Alle durch die Kästchen beschriebenen
Bereiche stehen für
das Mittel ± Standardabweichung
der zwei Parameter.
-
14 ist ein Vergleich der peripheren Lymphozyt-Zählungen
und Blutglucosekonzentrationen. In fünf Gruppen an Tieren, Misty-Gray-,
Misty-Gray/db-, db/db-, Interferon-α-transgene und Glucokinase-transgene heterozygote
Mäuse (gLKa),
wurden mittels Blutabnahme hinter der Orbita Proben gezogen. Blutglucosekonzentrationen
in diesen Mäusen
wurden bestimmt. Alle durch die Kästchen beschriebenen Bereiche
stehen für das
Mittel ± Standardabweichung
der zwei Parameter.
-
In
den 15A bis 15C wurden
Misty-Gray-Homozygoten-, db/Misty-Gray-Heterozygoten- und homozygote db/db-Mäuse subletaler
Bestrahlung ausgesetzt, und die Genesungskinetik des peripheren
Bluts wurde mittels Blutabnahmen aus dem retroorbitalen Bereich
bestimmt.
-
Die 16A bis 16Q zeigen
zusammen die Nucleotidsequenz (Seq.-ID Nr. 46) und die Aminosäuresequenz
(Seq.-ID Nr. 47) der menschlichem OB-Immunglobulinchimäre im Plasmid
aus Beispiel 11.
-
17 zeigt Bindung von Anti-WSX-Rezeptoragonisten-Antikörpern an
menschlichen WSX-Rezeptor. Die in Beispiel 13 gebildeten Anti-WSX-Rezeptoragonisten-Antikörper (2D7
und 1G4) und eine IgG-Isotopenkontrolle wurden auf ihre Fähigkeit,
sich an menschlichen WSX-Rezeptor zu binden, durch Einfang-ELISA bewertet.
-
18 zeigt die Aktivität von mAbs 2D7 und 1G4 sowie
von OB-Protein im KIRA-ELISA
(siehe Beispiel 13). Absorption bei 490 nm gegenüber Konzentration von Antikörper oder
Liganden in diesem Test sind dargestellt.
-
19 zeigt Bindung von Anti-WSX-Rezeptoragonisten-Antikörpern an
Maus-WSX-Rezeptor.
Die Anti-WSX-Rezeptoragonisten-Antikörper (2D7 und 1G4) und IgG-Isotopenkontrolle
wurden durch Einfang-ELISA auf ihre Fähigkeit bewertet, sich an Maus-WSX-Rezeptor
zu binden.
-
Die 20A bis 20B zeigen
die Resultate von Epitop-Kartierung der Agonisten-Anti-WSX-Rezeptor-Antikörper, die
wie in Beispiel 13 beschrieben hergestellt wurden. 20A zeigt die Blockierungsfähigkeit von Anti-WSX-Rezeptorantikörpern auf
Epitop A unter Verwendung von biotinyliertem 2D7. 20B zeigt Blockierungsfähigkeit von Anti-WSX-Rezeptorantikörpern auf
Epitop B unter Verwendung von biotinylier tem 1C11. Basierend auf
dem Konkurrenzbindungs-ELISA band sich 2D7 an ein anderes Epitop
als 1E11, 1C11 und 1G4.
-
21 zeigt einen Abgleich der Aminosäuresequenzen
von menschlicher Volllängen-WSX-Rezeptorvariante
6.4 (hWSXR) (Seq.-ID Nr. 3) und Maus-WSX-Rezeptor (mWSXR) (Seq.-ID
Nr. 51).
-
22 ist eine Standardkurve für menschliches OB-Protein im
KIRA-ELISA, die schematisch innerhalb des Diagramms das KIRA-ELISA-Panning
von WSX-Rezeptor mit scFv-Phagen wie in Beispiel 14 beschrieben
zeigt.
-
23 zeigt die Aktivität von Klon Nr. 3, Nr. 4 und
Nr. 17 von scFv-Phagen aus Beispiel 14 und Anti-HER2-scFv-Phagen-Kontrolle
(Her2-Klon) im KIRA-ELISA. Absorption gegenüber Phagentiter ist gezeigt.
-
24 zeigt die Aktivität von Klon Nr. 3, Nr. 4 und
Nr. 17 von scFv aus Beispiel 14, Anti-HER2-scFv-Kontrolle (Her2-Klon)
und OB-Protein im KIRA-ELISA. Absorption gegenüber Antikörperkonzentration ist gezeigt.
-
25 gleicht die Aminosäuresequenzen von Agonistenantikörper-Klon
Nr. 3 (3.scFv) (Seq.-ID Nr. 48), Klon Nr. 4 (4.scFv) (Seq.-ID Nr.
49) und Klon Nr. 17 (Seq.-ID
Nr. 50) ab, die wie in Beispiel 14 beschrieben erhalten wurden.
Reste der komplementaritätsbestimmenden
Region (CDR) gemäß Kabat
et al., Sequences of Proteins of Immunological Interest, 5. Auflage,
Public Health Service, National Institutes of Health, Bethesda,
MD (1991), sind unterstrichen, und hypervariable Schleifenreste
(Chothia et al., Nature 342, 8767 (1989)) sind kursiv geschrieben.
-
DETAILLIERTE BESCHREIBUNG
DER BEVORZUGTEN AUSFÜHRUNGSFORMEN
-
I. Definitionen
-
Bei
der Beschreibung der vorliegenden Erfindung werden die folgenden
Bezeichnungen verwendet, die sind wie nachstehend definiert zu verstehen
sind.
-
Die
Bezeichnungen "WSX-Rezeptor" oder "WSX-Rezeptorpolypeptid", wenn hierin verwendet,
umfassen Nativsequenz-WSX-Rezeptor; WSX-Rezeptorvarianten; extrazelluläre WSX-Domäne; und
chimären WSX-Rezeptor
(die alle hierin definiert sind). Gegebenenfalls ist der WSX-Rezeptor
nicht mit nativer Glykosylierung assoziiert. "Native Glykosylierung" bezieht sich auf
die Kohlenhydratgruppierungen, die kovalent an WSX-Rezeptor gebunden
sind, wenn dieser in der Säugetierzelle
gebildet wird, von der er natürlicherweise
abstammt. Demgemäß ist menschlicher
WSX-Rezeptor, der in einer nicht-menschlichen Zelle produziert wird,
ein Beispiel für
einen WSX-Rezeptor,
der "nicht mit nativer
Glykosylierung assoziiert" ist.
Manchmal ist der WSX-Rezeptor
unglykosyliert (z.B. als ein Resultat seiner rekombinanten Bildung
in einem Prokaryoten).
-
"WSX-Ligand" ist ein Molekül, das sich
an einen Nativsequenz-WSX-Rezeptor (insbesondere WSX-Rezeptorvariante
13.2) bindet und diesen aktiviert. Die Fähigkeit eines Moleküls, sich
an WSX-Rezeptor zu binden, kann durch die Fähigkeit eines mutmaßlichen
WSX-Liganden bestimmt werden, sich an WSX-Rezeptor-Immunoadhäsin (siehe
Beispiel 2), ausplattiert auf einer Testplatte beispielsweise, zu
binden. Der Thymidin-Inkorporationstest liefert ein Mittel zum Screenen
auf WSX-Liganden,
die den WSX-Rezeptor aktivieren. Beispiele für WSX-Liganden umfassen Anti-WSX-Rezeptoragonisten-Antikörper und
OB-Protein (z.B. in Zhang et al., Nature 372, 425–431 (1994),
beschrieben).
-
Die
Bezeichnungen "OB-Protein" und "OB" sind hierin synonym
verwendet und beziehen sich auf Nativsequenz-OB-Proteine (auch als "Leptine" bekannt) und ihre
funktionellen Derivate.
-
Ein "Nativsequenz"-Polypeptid ist eines,
das dieselbe Aminosäuresequenz
wie ein Polypeptid (z.B. WSX-Rezeptor oder OB-Protein) aufweist,
das aus einer natürlichen
Quelle abstammt. Solche Nativsequenz-Polypeptide können aus
der Natur isoliert oder können
durch Rekombinations- oder Synthesemittel gebildet werden. Somit
kann ein Nativsequenz-Polypeptid die Aminosäuresequenz von natürlich vorkommendem,
menschlichem Polypeptid, Maus-Polypeptid oder Polypeptid aus jeder
anderen Säugetierspezies
aufweisen.
-
Die
Bezeichnung "Nativsequenz-WSX-Rezeptor" umfasst insbesondere
natürlich
vorkommende, trunkierte Formen des WSX-Rezeptors, natürlich vorkommende
Variantenformen (z.B. alternativ gespleißte Formen wie beispielsweise
die hierin beschriebenen WSX-Rezeptorvarianten 6.4, 12.1 und 13.2)
und natürlich vorkommende
Allelvarianten des WSX-Rezeptors. Der bevorzugte Nativsequenz-WSX-Rezeptor
ist ein reifer, menschlicher Nativsequenz-WSX-Rezeptor, wie z.B.
menschliche WSX-Rezeptorvariante
6.4, menschliche WSX-Rezeptorvariante 12.1 oder menschliche WSX-Rezeptorvariante
13.2 (die alle in den 2A–2B gezeigt
sind). Am meisten bevorzugt ist die reife menschliche WSX-Rezeptorvariante
13.2.
-
Die
Bezeichnung "Nativsequenz-OB-Protein" umfasst jene OB-Proteine
aus jeder beliebigen Tierspezies (z.B. von Mensch, Maus, Kaninchen,
Katze, Rind, Schaf, Huhn, Schwein, Pferd usw.), wie sie in der Natur auftreten.
Die Definition umfasst insbesondere Varianten mit oder ohne Glutamin
an Aminosäureposition
49 unter Verwendung der Aminosäure-Nummerierung
nach Zhang et al., s.o. Die Bezeichnung "Nativsequenz-OB-Protein" umfasst die nativen
Proteine mit oder ohne dem/das initiierende(n) N-terminale(n) Methionin
(Met) und mit oder ohne der/die Signalsequenz, entweder in monomerer
oder in dimerer Form. Die auf dem Gebiet der Erfindung bekannten
menschlichen oder Maus-Nativsequenz-OB-Proteine sind 167 Aminosäuren lang,
enthalten zwei konservierte Cysteine und weisen die Eigenschaften
eines sekretierten Proteins auf. Das Protein ist großteils hydrophil,
und die vorhergesagte Signalsequenz-Spaltungsstelle liegt an Position
21 unter Verwendung der Aminosäure-Nummerierung
nach Zhang et al., s.o. Die gesamte Sequenzhomologie der menschlichen
und Maus-Sequenzen beträgt
etwa 84%. Die zwei Proteine zeigen eine höhere Identität in der N-terminalen
Region des reifen Proteins mit nur vier konservativen und drei nicht-konservativen
Substitutionen unter den Resten zwischen der Signalsequenz-Spaltungsstelle
und dem konservierten Cys an Position 117. Das Molekulargewicht
von OB-Protein beträgt
etwa 16 kD in einer monomeren Form.
-
Die "extrazelluläre WSX-Rezeptordomäne" (ECD) ist eine Form
des WSX-Rezeptors, die im Wesentlichen frei von den Transmembran-
und Zytoplasmadomänen
des WSX-Rezeptors ist, d.h. weniger als 1% solcher Domänen, vorzugsweise
0,5 bis 0% solcher Domänen,
und noch bevorzugter 0,1 bis 0% solcher Domänen, aufweist. Üblicherweise
hat die WSX-Rezeptor-ECD eine Aminosäuresequenz mit zumindest etwa
95% Aminosäuresequenzidentität mit der
Aminosäuresequenz
der ECD von WSX-Rezeptor, die in den 2A–B für menschliche
WSX-Rezeptorvarianten
6.4, 12.1 und 13.2 angegeben sind, vorzugsweise zumindest etwa 98%,
noch bevorzugter zumindest etwa 99% Aminosäuresequenzidentität, und umfasst
somit WSX-Rezeptorvarianten wie nachstehend definiert.
-
Eine
Polypeptid-"Variante" bezeichnet ein biologisch
aktives Polypeptid wie nachstehend definiert mit weniger als 100%
Sequenzidentität
mit einem Nativsequenz-Polypeptid
(z.B. WSX-Rezeptor mit der in den 1A–H gezeigten,
abgeleiteten A-minosäuresequenz
für menschliche
WSX-Rezeptorvariante 13.2). Solche Varianten umfassen Polypeptide,
worin ein oder mehrere Aminosäurereste
am N- oder C-Terminus
oder innerhalb der Nativsequenz hinzugefügt sind; etwa ein bis dreißig Aminosäurereste
deletiert und gegebenenfalls durch einen oder mehrere Aminosäurereste
substituiert sind; und Derivate der obigen Polypeptide, worin ein
Aminosäurerest
kovalent modifiziert wurde, sodass das resultierende Produkt eine
nicht-natürlich
vorkommende Aminosäure
aufweist. Üblicherweise
weist eine biologisch aktive WSX-Rezeptorvariante eine Aminosäuresequenz
mit zumindest etwa 90% Aminosäurensequenzidentität mit der
in den 1A–H gezeigten menschlichen WSX- Rezeptorvariante
13.2 auf, vorzugsweise zumindest etwa 95%, insbesondere zumindest etwa
99%. Üblicherweise
weist eine biologisch aktive OB-Proteinvariante eine Aminosäuresequenz
mit zumindest 90% Aminosäurensequenzidentität mit einem
Nativsequenz-OB-Protein, vorzugsweise zumindest etwa 95%, noch bevorzugter
zumindest etwa 99%, auf.
-
Ein "chimäres" OB-Protein oder
ein "chimärer" WSX-Rezeptor ist
ein Polypeptid, das OB-Protein oder Volllängen-WSX-Rezeptor oder eine
oder mehrere Domänen
davon (z.B. die extrazelluläre
Domäne
des WSX-Rezeptors), fusioniert oder gebunden an heterologes Polypeptid,
umfasst. Der chimäre
WSX-Rezeptor hat im Allgemeinen zumindest eine biologische Eigenschaft
mit der menschlichen WSX-Rezeptorvariante 13.2 gemeinsam. Das chimäre OB-Protein
hat im Allgemeinen eine biologische Eigenschaft mit einem Nativsequenz-OB-Protein
gemeinsam. Beispiele für
chimäre
Polypeptide umfassen Immunoadhäsine
und Epitop-markierte Polypeptide.
-
Die
Bezeichnung "WSX-Immunoadhäsin" wird synonym mit
der Bezeichnung "WSX-Rezeptor-Immunglobulinchimäre" verwendet und bezeichnet
ein chimäres
Molekül,
das einen Teil des WSX-Rezeptors (im Allgemeinen die extrazelluläre Domäne davon)
mit einer Immunglobulinsequenz kombiniert. In ähnlicher Weise bezieht sich
ein "OB-Protein-Immunoadhäsin" oder eine "OB-Immunglobulinchimäre" auf ein chimäres Molekül, das OB-Protein
(oder einen Teil davon) mit einer Immunglobulinsequenz kombiniert.
Die Immunglobulinsequenz ist vorzugsweise, jedoch nicht notwendigerweise,
eine konstante Immunglobulindomäne.
Die Immunglobulingruppierung in den Chimären der vorliegenden Erfindung
kann von IgG1-, IgG2-, IgG3- oder IgG4-Untertypen, IgA, IgE, IgD oder IgM,
jedoch vorzugsweise IgG1 oder IgG3, gewonnen werden.
-
Die
Bezeichnung "Epitop-markiert", wenn hierin verwendet,
bezieht sich auf ein chimäres
Polypeptid, das WSX-Rezeptor oder OB-Protein, fusioniert an ein "Markierungs-Polypeptid", umfasst. Das Markierungs-Polypeptid
weist genug Reste auf, um ein Epitop bereitzustellen, gegen das
ein Antikörper
hergestellt werden kann, ist jedoch stets kurz genug, um die biologische
Aktivität
des WSX-Rezeptors oder OB- Proteins nicht
zu stören.
Das Markierungs-Polypeptid ist vorzugsweise auch eher einmalig,
sodass der Antikörper
hiergegen im Wesentlichen nicht mit anderen Epitopen kreuzreagiert.
Geeignete Markierungs-Polypeptide weisen im Allgemeinen sechs Aminosäurereste
und üblicherweise
etwa 8 bis 50 Aminosäurereste
(vorzugsweise etwa 9 bis 30 Reste) auf.
-
"Isolierter" WSX-Rezeptor (oder "isoliertes" OB-Protein) bezeichnet
WSX-Rezeptor (oder OB-Protein), der/das aus einer WSX-Rezeptor-
(oder OB-Protein-) Quelle gereinigt wurde oder durch Rekombinations-
oder Syntheseverfahren hergestellt wurde und ausreichend frei von
anderen Peptiden oder Proteinen ist, (1) um zumindest 15 und vorzugsweise
20 Aminosäurereste
der N-terminalen oder einer inneren Aminosäuresequenz unter Verwendung
eines Zentrifugenröhrchensequenzierers
oder des besten, im Handel erhältlichen
Aminosäuresequenzierers,
wie am Markt erhältlich
oder wie durch bis zum Datum dieser Anmeldung veröffentlichte Verfahren
modifiziert, zu erhalten oder (2) um Homogenität durch SDS-PAGE unter nicht
reduzierenden oder reduzierenden Bedingungen unter Verwendung von
Coomassie-Blau- oder, vorzugsweise, Silberfärbung zu erreichen. Homogenität bedeutet
hier weniger als etwa 5% Verunreinigung mit anderen Quellenproteinen.
-
Ein "im Wesentlichen reines" Protein bezeichnet
eine Zusammensetzung, die zumindest etwa 90 Gew.-%, vorzugsweise
zumindest etwa 95 Gew.-%, Protein, bezogen auf das Gesamtgewicht
der Zusammensetzung, umfasst. Ein "im Wesentlichen homogenes" Protein bezeichnet
eine Zusammensetzung, die zumindest etwa 99 Gew.-% Protein, bezogen
auf das Gesamtgewicht der Zusammensetzung, umfasst.
-
"Biologische Eigenschaft", wenn in Verbindung
mit entweder "WSX-Rezeptor" oder "isoliertem WSX-Rezeptor" verwendet, bedeutet,
dass dieser Rezeptor eine Effektor- oder Antigenfunktion oder -aktivität aufweist,
die direkt oder indirekt durch Nativsequenz-WSX-Rezeptor verursacht
oder ausgeführt
wird (unabhängig
davon, ob in seiner nativen oder denaturierten Konformation). Effektorfunktionen
umfassen Ligandenbindung; und Steigerung von Überleben, Differenzierung und/oder
Proliferation von Zellen (insbesondere Proliferation von Zellen).
Effektorfunktionen umfassen je doch nicht Besitz einer Epitop- oder
Antigenstelle, die in der Lage ist, mit Antikörpern, die gegen Nativsequenz-WSX-Rezeptor
gezüchtet
werden, zu kreuzreagieren.
-
"Biologische Eigenschaft", wenn in Verbindung
mit entweder "OB-Protein" oder "isoliertem OB-Protein" verwendet, bedeutet,
dass das Protein eine Effektorfunktion aufweist, die direkt oder
indirekt durch Nativsequenz-OB-Protein verursacht oder ausgeführt wird.
Effektorfunktionen von Nativsequenz-OB-Protein umfassen WSX-Rezeptorbindung und
-aktivierung; und Steigerung von Differenzierung und/oder Proliferation
von Zellen, die diesen Rezeptor exprimieren (wie im Thymidin-Inkorporationstest
beispielsweise bestimmt wird). Ein "biologisch aktives" OB-Protein ist eines, das eine biologische
Eigenschaft von Nativsequenz-OB-Protein aufweist.
-
Ein "funktionelles Derivat" eines Nativsequenz-OB-Proteins
ist eine Verbindung mit einer qualitativen biologischen Eigenschaft,
die sie mit einem Nativsequenz-OB-Protein gemeinsam hat. "Funktionelle Derivate" umfassen, sind jedoch
nicht beschränkt
auf, Fragmente von Nativsequenz-OB-Proteinen und Derivate von Nativsequenz-OB-Proteinen
und ihre Fragmente, mit der Maßgabe,
dass sie eine gemeinsame biologische Aktivität mit einem entsprechenden
Nativsequenz-OB-Protein aufweisen. Die Bezeichnung "Derivat" umfasst sowohl Aminosäuresequenz-Varianten
von OB-Protein als auch kovalente Modifikationen davon.
-
Die
Bezeichnung "lange
Halbwertszeit",
sofern sie in Verbindung mit OB-Derivaten verwendet wird, bezieht
sich auf OB-Derivate mit einer längeren
Plasma-Halbwertszeit
und/oder langsamerer Clearance als ein entsprechendes Nativsequenz-OB-Protein.
Die Derivate mit langer Halbwertszeit weisen vorzugsweise eine Halbwertszeit
auf, die zumindest etwa 1,5-mal länger ist als jene eines nativen
OB-Proteins; noch
bevorzugter zumindest etwa 2-mal länger ist als jene eines nativen
OB-Proteins, und noch bevorzugter zumindest etwa 3-mal länger ist
als jene eines nativen OB-Proteins. Das native OB-Protein ist vorzugsweise
jenes von der zu behandelnden Person.
-
Eine "antigene Funktion" bezeichnet den Besitz
einer Epitop- oder Antigenstelle, die in der Lage ist, mit Antikörpern, die
gegen Nativsequenz-WSX-Rezeptor gezüchtet wurden, zu kreuzreagieren.
Die grundlegende antigene Funktion eines WSX-Rezeptors ist, dass er sich mit einer
Affinität
von zumindest etwa 106 L/mol an einen Antikörper bindet,
der gegen Nativsequenz-WSX-Rezeptor gezüchtet wurde. Üblicherweise bindet
sich das Polypeptid mit einer Affinität von zumindest etwa 107 L/mol. Die zur Definition von "antigener Funktion" verwendeten Antikörper sind
polyklonale Kaninchenantikörper,
die durch Formulieren des WSX-Rezeptors in komplettem Freundschem
Adjuvans, subkutane Injektion der Formulierung und Boosten der Immunantwort
durch intraperitoneale Injektion der Formulierung, bis der Titer
von Anti-WSX-Rezeptor oder Antikörper
Sättigung
erreicht hat, gezüchtet
wurden.
-
"Biologisch aktiv", wenn in Verbindung
mit entweder "WSX-Rezeptor" oder "isoliertem WSX-Rezeptor" verwendet, beschreibt
ein WSX-Rezeptorpolypeptid, das eine Effektorfunktion von Nativsequenz-WSX-Rezeptor
aufweist oder eine Effektorfunktion mit ihm gemeinsam hat und das
zusätzlich
eine antigene Funktion besitzen kann (jedoch nicht muss). Eine hauptsächliche
Effektorfunktion des WSX-Rezeptors ist seine Fähigkeit, Proliferation von
menschlichen CD34+-Nabelschnurblutzellen im in Beispiel 8 beschriebenen
Kolonietest zu induzieren.
-
"Antigenisch aktiver" WSX-Rezeptor ist
definiert als ein Polypeptid, das eine antigene Funktion von WSX-Rezeptor
besitzt und das darüber
hinaus eine Effektorfunktion besitzen kann (jedoch nicht muss).
-
"Prozent Aminosäuresequenzidentität" ist hierin definiert
als der Prozentsatz von Aminosäureresten
in der Kandidatensequenz, die mit den Resten in der Nativsequenz
nach Abgleich der Sequenzen und Einführen von Lücken, sofern erforderlich,
um den maximalen Prozentsatz an Sequenzidentität zu erreichen und ohne Betrachtung
der konservativen Substitutionen als Teil der Sequenzidentität, identisch
sind. N-terminale,
C-terminale oder innere Extensionen, Deletionen oder Insertionen
in die Kandidatensequenz sind alle nicht als eine Beeinflussung
der Sequenzidentität
oder -homologie zu sehen.
-
Ein "Thymidin-Inkorporationstest" kann verwendet werden,
um auf Moleküle
zu screenen, die den WSX-Rezeptor aktivieren. Um diesen Test durchzuführen, werden
IL-3-abhängige
Baf3-Zellen (Palacios et al., Cell 41, 727–734 (1985)) stabil mit Volllängen-Nativsequenz-WSX-Rezeptor
wie in Beispiel 4 beschrieben transfiziert. Den so gebildeten WSX-Rezeptor/Baf3-Zellen
wird IL-3 z.B. 24 Stunden lang in einem befeuchteten Inkubator bei
37°C in
5% CO2 und Luft entzogen. Nach IL-3-Entzug
werden die Zellen in 96-Well-Kulturplatten mit oder ohne eine(r)
Testprobe, die einen potenziellen Agonisten enthält (solche Testproben sind
gegebenenfalls verdünnt),
ausplattiert und 24 Stunden lang in einem Zellkulturinkubator kultiviert.
20 μl serumfreies
RPMI-Medium, das 1 μCi 3H-Thymidin enthält, werden zu jedem Well zumindest
6–8 Stunden
lang zugesetzt. Die Zellen werden dann in 96-Well-Filterplatten
geerntet und mit Wasser gewaschen. Die Filter werden dann beispielsweise
unter Verwendung eines "Packard
Top Count Microplate Scintillation Counter" gezählt. Von
Agonisten wird erwartet, dass sie eine statistisch signifikante
Steigerung (zu einem P-Wert von 0,05) der 3H-Aufnahme
in Bezug auf die Kontrolle induzieren. Bevorzugte Agonisten führen zu
einer Steigerung der 3H-Aufnahme, die dann
zumindest das Doppelte der Aufnahme der Kontrolle beträgt.
-
Ein "isoliertes" WSX-Rezeptor-Nucleinsäuremolekül ist ein
Nucleinsäuremolekül, das identifiziert
und von zumindest einem verunreinigenden Nucleinsäuremolekül getrennt
ist, mit dem es üblicherweise
in der natürlichen
Quelle der WSX-Rezeptornucleinsäure assoziiert
ist. Ein isoliertes WSX-Rezeptornucleinsäuremolekül weist eine andere Form oder
Anordnung auf als jene, in der es in der Natur zu finden ist. Isolierte
WSX-Rezeptor-Nucleinsäuremoleküle werden
daher vom WSX-Rezeptor-Nucleinsäuremolekül, wie es
in natürlichen Zellen
besteht, unterschieden. Ein isoliertes WSX-Rezeptor-Nucleinsäuremolekül umfasst
jedoch WSX-Rezeptor-Nucleinsäuremoleküle, die
in Zellen enthalten sind, die üblicherweise
WSX-Rezeptor exprimieren, worin sich beispielsweise das Nucleinsäuremolekül an einer
anderen chromosomalen Stelle als in natürlichen Zellen befindet.
-
Die
Bezeichnung "Kontrollsequenzen" bezieht sich auf
DNA-Sequenzen, die für
die Expression von operabel gebundener Kodiersequenz in einem bestimmten
Wirtsor ganismus erforderlich sind. Die Kontrollsequenzen, die für Prokaryoten
beispielsweise geeignet sind, umfassen einen Promotor, gegebenenfalls
eine Operatorsequenz, eine Ribosombindungsstelle und möglicherweise
noch andere Sequenzen, die bisher noch kaum erforscht wurden. Eukaryotische
Zellen sind bekannt dafür,
Promotoren, Polyadenylierungssignale und Enhancer zu verwenden.
-
Nucleinsäure ist "operabel gebunden", wenn sie in eine
funktionelle Beziehung mit einer anderen Nucleinsäuresequenz
gebracht wird. Beispielsweise ist DNA für eine Präsequenz oder einen Sekretionsleader operabel
an DNA für
ein Polypeptid gebunden, wenn es als ein Präprotein exprimiert wird, das
an der Sekretion des Polypeptids teilnimmt; ein Promotor oder Enhancer
ist operabel an eine Kodiersequenz gebunden, wenn er die Transkription
der Sequenz beeinflusst; oder eine Ribosombindungsstelle ist operabel
an eine Kodiersequenz gebunden, wenn sie so angeordnet ist, dass
sie Translation erleichtert. Im Allgemeinen bedeutet "operabel gebunden", dass die gebundenen
DNA-Sequenzen zusammenhängend
sind und, im Fall eines Sekretionsleaders, zusammenhängend sind
und in Lesephase stehen. Enhancer müssen jedoch nicht zusammenhängend sein.
Bindung erfolgt durch Ligation an passenden Restriktionsstellen.
Sind solche Stellen nicht vorhanden, so werden die synthetischen
Oligonucleotidadaptoren oder -linker gemäß der herkömmlichen Praxis verwendet.
-
Wie
hierin verwendet, werden die Bezeichnungen "Zelle", "Zelllinie" und "Zellkultur" synonym verwendet,
und alle diese Bezeichnungen beziehen Nachkommenschaft mit ein.
Somit umfassen die Termini "Transformanten" und "transformierte Zellen" die primär bearbeitete
Zelle und die davon abgeleiteten Kulturen, ohne Berücksichtigung
der Anzahl der Transfers. Es gilt auch zu verstehen, dass die gesamte
Nachkommenschaft aufgrund von beabsichtigen oder unbeabsichtigten
Mutationen nicht exakt identisch bezüglich DNA-Gehalt sein kann.
Mutierte Nachkommenschaft, die gewisse Funktionen oder biologische
Aktivität,
auf die in der ursprünglich
transformierten Zelle gescreent wurden, aufweisen, sind eingebunden.
Sind spezifische Bezeichnungen beabsichtigt, so wird dies aus dem
Zusammenhang hervorgehen.
-
Die
Bezeichnung "Antikörper" wird im weitesten
Sinn verwendet und bezieht sich insbesondere auf monoklonale Antikörper, Antikörperzusammensetzungen
mit polyepitopischer Spezifität,
bispezifische Antikörper,
Diabodies und einkettige Moleküle
sowie Antikörperfragmente
(z.B. Fab, F(ab')2 und Fv), solange sie die erwünschte biologische
Aktivität
aufweisen.
-
Die
Bezeichnung "monoklonaler
Antikörper" wie hierin verwendet
bezieht sich auf einen Antikörper, der
aus einer Population von im Wesentlichen homogenen Antikörpern gewonnen
wurde, d.h. dass die einzelnen Antikörper, aus denen die Population
besteht, bis auf mögliche
natürlich
vorkommende Mutationen, die in geringen Mengen vorhanden sein können, identisch
sind. Monoklonale Antikörper
sind hochspezifisch, da sie gegen eine einzige antigene Stelle gerichtet
sind. Darüber
hinaus ist, im Gegensatz zu herkömmlichen
(polyklonalen) Antikörperpräparaten,
die typischerweise verschiedene Antikörper umfassen, die gegen verschiedene
Determinanten (Epitope) gerichtet sind, jeder monoklonale Antikörper gegen
eine einzige Determinante am Antigen gerichtet. Zusätzlich zu
ihrer Spezifität
weisen die monoklonalen Antikörper
darin einen Vorteil auf, dass sie durch die Hybridomkultur synthetisiert
werden, unkontaminiert von anderen Immunglobulinen. Das Adjektiv "monoklonal" beschreibt die Eigenschaft
des Antikörpers,
aus einer im Wesentlichen homogenen Population von Antikörpern gewonnen
worden zu sein, und ist nicht als ein Erfordernis zu verstehen,
den Antikörper
mittels eines bestimmten Verfahrens herzustellen. Beispielsweise
können
die monoklonalen Antikörper,
die gemäß der vorliegenden
Erfindung zu verwenden sind, mittels des Hybridomverfahrens hergestellt
werden, das als erstes von Kohler et al., Nature 256, 495 (1975),
beschrieben wurde, oder sie können
durch DNA-Rekombinationsverfahren hergestellt werden (siehe z.B.
das US-Patent Nr. 4.816.567 (Cabilly et al.)). Die "monoklonalen Antikörper" können auch
aus Phagen-Antikörperbibliotheken
unter Verwendung der von Clackson et al., Nature 352, 624–628 (1991)
und Marks et al., J. Mol. Biol. 222, 581–597 (1991), beschriebenen
Verfahren isoliert werden.
-
Die
monoklonalen Antikörper
hierin umfassen insbesondere "chimäre" Antikörper (Immunglobuline), in
denen ein Teil der schweren und/oder leichten Ketten mit den entsprechenden
Sequenzen in Antikörpern, die
von einer bestimmten Spezies abstammen oder zu einer bestimmten
Antikörperklasse
oder -subklasse gehören,
identisch oder zu diesen homolog sind, während der Rest der Kette(n)
mit den entsprechenden Sequenzen in Antikörpern, die von einer anderen
Spezies abgeleitet sind oder zu einer anderen Antikörperklasse
oder -subklasse gehören,
identisch oder zu diesen homolog sind, sowie Fragmente solcher Antikörper, solange
sie die erwünschte
biologische Aktivität
aufweisen (Cabilly et al., s.o.; Morrison et al., Proc. Natl. Acad.
Sci. USA 81, 6851–6855
(1984)).
-
"Humanisierte" Formen von nicht-menschlichen
(z.B. Maus-) Antikörpern
sind chimäre
Immunglobuline, Immunglobulinketten oder Fragmente davon (wie z.B.
Fv, Fab, Fab', F(ab')2 oder
andere Antigen-bindende Subsequenzen von Antikörpern), die eine Minimalsequenz
enthalten, die von nicht-menschlichem Immunglobulin abstammt. Im
Großteil
der Fälle
sind humanisierte Antikörper
menschliche Immunglobuline (Rezipienten-Antikörper), in denen Reste aus einer
komplementaritätsbestimmenden
Region (CDR) des Rezipienten durch Reste aus einer CDR einer nicht-menschlichen
Spezies (Donor-Antikörper)
wie z.B. Maus, Ratte oder Kaninchen mit der erwünschten Spezifität, Affinität und Kapazität ersetzt
werden. In manchen Fällen
werden Fv-Gerüstregion-
(FR-) Reste des menschlichen Immunglobulins durch entsprechende
nicht-menschliche Reste ersetzt. Darüber hinaus können humanisierte
Antikörper
Reste umfassen, die weder im Rezipientenantikörper noch in den importierten
CDR- oder Gerüstsequenzen
zu finden sind. Diese Modifikationen werden vollzogen, um Antikörperleistung
weiter zu verfeinern und optimieren. Im Allgemeinen umfasst der
humanisierte Antikörper
im Wesentlichen alle von zumindest einer, vorzugsweise zwei, variablen
Domäne(n),
in der/denen alle oder im Wesentlichen alle der CDR-Regionen jenen eines
nicht-menschlichen Immunglobulins entsprechen und alle oder im Wesentlichen
alle der FR-Regionen jene einer menschlichen Immunglobulinsequenz
sind. Der humanisierte Antikörper
umfasst im Optimalfall auch zumindest einen Teil einer konstanten Immunglobulinregion
(Fc), typischerweise jenen eines menschlichen Immunglobulins. Nähere Details
sind in Jones et al., Nature 321, 522–525 (1986); Reichmann et al.,
Nature 332, 323–329
(1988); und Presta, Curr. Op. Struct. Biol. 2, 593–596 (1992),
zu finden. Der humanisierte Antikörper umfasst einen PrimatizedTM-Antikörper,
worin die Antigen-Bindungsregion des Antikörpers von einem Antikörper abstammt,
der durch Immunisieren von Makakenaffen mit dem Antigen von Interesse
gebildet wird.
-
Die
Bezeichnung "hypervariable
Region", wenn hierin
verwendet, bezieht sich auf die Aminosäurereste eines Antikörpers, der
für Antigen-Bindung
verantwortlich ist. Die hypervariable Region umfasst Aminosäurereste
aus einer "komplementaritätsbestimmenden
Region" oder "CDR" (d.h. Reste 24–34 (L1),
50–56
(L2) und 89–97
(L3) in der variablen Leichtkettendomäne und 31–35 (H1), 50–65 (H2)
und 95–102
(H3) in der variablen Schwerkettendomäne; Kabat et al., Sequences
of Proteins of Immunological Interest, 5. Auflage, Public Health
Service, National Institutes of Health, Bethesda, MD (1991)) und/oder
Reste aus einer "hypervariablen Schleife" (d.h. Reste 26–32 (L1),
50–52
(L2) und 91–96
(L3) in der variablen Leichtkettendomäne und 26–32 (H1), 53–55 (H2)
und 96–101
(H3) in der variablen Schwerkettendomäne; Chothia & Lesk, J. Mol.
Biol. 196, 901–917
(1987)). "Gerüst"- oder "FR"-Reste sind jene
Reste der variablen Domäne,
die nicht die Reste der hypervariablen Region wie hierin definiert
sind.
-
"Nicht-immunogen in
einem Menschen" bedeutet,
dass bei Kontaktieren des Polypeptids von Interesse in einem physiologisch
annehmbaren Träger
und in einer therapeutisch wirksamen Menge mit dem geeigneten Gewebe
eines Menschen kein Zustand von Empfindlichkeit oder Resistenz gegenüber dem
Polypeptid von Interesse bei der zweiten Verabreichung des Polypeptids
von Interesse nach einer geeigneten Latenzzeit (z.B. 8 bis 14 Tage)
erkennbar ist.
-
Unter "Agonistenantikörper" wird ein Antikörper verstanden,
der in der Lage ist, Nativsequenz-WSX-Rezeptor zu aktivieren. Der
Agonistenantikörper
von besonderem Interesse hierin ist einer, der eine oder mehrere
(z.B. alle) biologischen Eigenschaften des natürlich vorkommenden WSX-Liganden, OB-Proteins
nachahmt. In bevorzugten Ausführungsformen
weist der Agonistenantikörper
eine quantitative biologische Eigenschaft von OB-Protein auf, die
innerhalb von zwei Größenordnungen,
und vorzugsweise innerhalb einer Größenordnung, von jener des OB-Proteins
liegt. Der Agonistenantikörper
kann sich an WSX-Rezeptor binden und diesen aktivieren und dadurch
Proliferation und/oder Differenzierung und/oder Reifung und/oder Überleben
einer Zelle stimulieren, die den WSX-Rezeptor exprimiert (z.B. WSX-Rezeptor-Variante 13.2). In
dieser Ausführungsform
der Erfindung kann der Agonistenantikörper einer sein, der Proliferation und/oder
Differenzierung einer hämatopoetischen
Vorläuferzelle
fördert,
die den WSX-Rezeptor an ihrer Zelloberfläche exprimiert; der Proliferation
und/oder Differenzierung von Lymphblutzellstammbäumen fördert; der Proliferation und/oder
Differenzierung von Knochenmarkblutzellstammbäumen fördert; und/oder der Proliferation
und/oder Differenzierung von Erythrozytenblutzellstammbäumen fördert. Der
Agonistenantikörper
kann Agonistenaktivität
bei Bindung an einen chimären
Rezeptur, der die WSX-Rezeptor-Extrazellulärdomäne umfasst, im KIRA-ELISA aufweisen.
Der Agonistenantikörper
kann 3H-Aufnahme im Thymidin-Inkorporationstest unter
Verwendung eines Signalgebungs-WSX-Rezeptors stimulieren (siehe oben);
er kann Körpergewicht und/oder
Fettdepotgewicht und/oder Nahrungsmittelaufnahme in einem adipösen Säugetier
(z.B. in der ob/ob-Maus) reduzieren; er kann Ca2+-Influx
in Adipozyten bewirken; und/oder stromab-liegende signalgebende
Moleküle
von OB-Protein aktivieren.
-
Ein "neutralisierender
Antikörper" ist einer, der in
der Lage ist, eine Effektorfunktion von Nativsequenz-WSX-Rezeptor
oder -OB-Protein zu blockieren oder signifikant zu reduzieren. Beispielsweise
kann ein neutralisierender Antikörper
WSX-Rezeptoraktivierung
durch einen WSX-Liganden, wie er im Thymidin-Inkorporationstest
oder in einem KIRA-ELISA bestimmt wird, inhibieren oder reduzieren.
-
Die
Bezeichnung "zytotoxisches
Mittel", wie hierin
verwendet, bezieht sich auf eine Substanz, die die Funktion von
Zellen inhibiert oder unterbindet und/oder Zerstörung von Zellen verursacht.
Die Bezeichnung soll radioaktive Isotope (z.B. I131,
I125, Y90 und Re186), chemotherapeutische Mittel und Toxine,
wie z.B. enzymatisch aktive Toxine bakteriellen, pflanzlichen oder
tierischen Ursprungs oder von Pilzen, oder Fragmente davon umfassen.
-
Ein "chemotherapeutisches
Mittel" ist eine
chemische Verbindung, die zur Behandlung von Krebs nützlich ist.
Beispiele für
chemotherapeutische Mittel umfassen Adriamycin, Doxorubicin, 5-Fluoruracil,
Cytosinarabinosid ("Ara-C"), Cyclophosphamid,
Thiotepa, Taxotere (Docetaxel), Busulfan, Cytoxin, Taxol, Methotrexat,
Cisplatin, Melphalan, Vinblastin, Bleomycin, Etoposid, Ifosfamid,
Mitomycin C, Mitoxantron, Vincreistin, Vinorelbin, Carboplatin,
Teniposid, Daunomycin, Carminomycin, Aminopterin, Dactinomycin,
Mitomycine, Esperamicine (siehe das US-Patent Nr. 4.675.187), Melphalan
und andere verwandte N-Losts.
-
Die
Bezeichnung "Prodrug" wie in dieser Anmeldung
verwendet bezieht sich auf eine Vorläufer- oder Derivatform einer
pharmazeutisch aktiven Substanz; die weniger zytotoxisch gegenüber Tumorzellen
ist als der verwandte Wirkstoff und in der Lage ist, enzymatisch
aktiviert oder zur aktiveren verwandten Form umgesetzt zu werden.
Siehe z.B. Wilman, "Prodrugs
in Cancer Chemotherapy",
Biochemical Society Transactions 14, 375–382, 615th Meeting
Belfast (1986), und Stella et al., "Prodrugs: A Chemical Approach to Targeted
Drug Delivery",
Directed Drug Delivery, Borchardt et al. (Hrsg.), 247–267, Humana
Press (1985). Die Prodrugs dieser Erfindung umfassen, sind jedoch
nicht beschränkt
auf, Phosphat-hältige
Prodrugs, Thiophosphat-hältige Prodrugs,
Sulfat-hältige
Prodrugs, Peptid-hältige
Prodrugs, D-Aminosäure-modifizierte Prodrugs,
glykosylierte Prodrugs, β-Lactam-hältige Prodrugs,
gegebenenfalls substituierte Phenoxyacetamid-hältige Prodrugs oder gegebenenfalls
substituierte Phenylacetamid-hältige
Prodrugs, 5-Fluorcytosin und andere 5-Fluoruridin-Prodrugs, die zum
aktiveren zytotoxischen, freien Wirkstoff umgesetzt werden können. Beispiele
für zytotoxische Wirkstoffe,
die zu einer Prodrug-Form zur Verwendung in dieser Erfindung derivatisiert
werden können,
umfassen jene chemotherapeutischen Mittel, die zuvor beschrieben
wurden, sind jedoch nicht beschränkt
darauf.
-
Ein "Antagonist" des WSX-Rezeptors
und/oder OB-Proteins ist ein Molekül, das Bindung und/oder Aktivierung
des WSX-Rezeptors oder OB-Proteins unterbindet oder stört. Solche
Moleküle
können
beispielsweise auf ihre Fähigkeit
gescreent werden, kompetitiv WSX-Rezeptoraktivierung durch OB-Protein
im hierin offenbarten Thymi din-Inkorporationstest zu inhibieren.
Beispiele für
solche Moleküle
umfassen: WSX-Rezeptor-ECD;
WSX-Rezeptor-Immunoadhäsin;
neutralisierende Antikörper
gegen WSX-Rezeptor oder OB-Protein; kleine Moleküle und Peptidantagonisten;
und Antisense-Nucleotide gegen den WSX-Rezeptor oder das ob-Gen.
-
Die
Phrase "Fördern von
Proliferation einer Zelle" umfasst
den Schritt der Steigerung des Ausmaßes an Wachstum und/oder Reproduktion
der Zelle in Bezug auf eine nicht-behandelte Zelle entweder in vitro
oder in vivo. Eine Steigerung der Zellproliferation in Zellkultur
kann durch Zählen
der Anzahl an Zellen vor und nach dem Aussetzen gegenüber einem
Molekül
von Interesse nachgewiesen werden. Das Ausmaß an Proliferation kann mittels
mikroskopischer Untersuchung des Konfluenzgrades quantifiziert werden.
Zellproliferation kann auch unter Verwendung des hierin beschriebenen
Thymidin-Inkorporationstests quantifiziert werden.
-
Unter "Fördern von Differenzierung einer
Zelle" wird das
Steigern des Ausmaßes
des Erwerbens oder des Verfügens über eine(r)
oder mehrere(r) Eigenschaften oder Funktionen verstanden, die sich
von jenen der ursprünglichen
Zelle unterscheiden (d.h. Zellspezialisierung). Dies kann durch
Screenen auf eine Veränderung des
Phänotyps
der Zelle (z.B. Identifizieren morphologischer Veränderungen
in der Zelle) nachgewiesen werden.
-
Eine "hämatopoetische Vorläuferzelle" oder "primitive blutbildende
Zelle" ist eine,
die in der Lage ist, sich zu differenzieren, um einen genauer definierten
oder reiferen Blutzelltyp zu bilden.
-
"Lymphblutzellstammbäume" sind jene hämatopoetischen
Vorläuferzellen,
die in der Lage sind, sich zu differenzieren, um Lymphozyten (B-Zellen
oder T-Zellen) zu bilden. In ähnlicher
Weise stellt "Lymphopoese" die Bildung von
Lymphozyten dar.
-
"Erythrozytenblutzellstammbäume" sind jene hämatopoetischen
Vorläuferzellen,
die in der Lage sind, sich zu differenzieren, um Erythrozyten (rote
Blutzellen) zu bilden, und "Erythropoese" steht für die Bildung
von Erythrozyten.
-
Die
Bezeichnung "Knochenmarkblutzellstammbäume" umfasst für die Zwecke
hierin alle hämatopoetischen
Vorläuferzellen,
die keine Lymph- und Erythrozytenblutzellstammbäume wie zuvor definiert sind,
und "Myelopoese" umfasst die Bildung
von Blutzellen (die keine Lymphozyten und Erythrozyten sind).
-
Eine "CD34+-Zellpopulation" ist an hämatopoetischen
Stammzellen angereichert. Eine CD34+-Zellpopulation kann beispielsweise
aus Nabelschnurblut oder Knochenmark gewonnen werden. Menschliche
Nabelschnurblut-CD34+-Zellen können
zur Verwendung von immunomagnetischen Perlen, die von Miltenyi (Kalifornien)
vertrieben werden, gemäß den Anweisungen
des Herstellers selektiert werden.
-
"Physiologisch annehmbare" Träger, Arzneimittelträger oder
Stabilisatoren sind Substanzen, die gegenüber der Zelle oder dem Säugetier,
das dieser Substanz ausgesetzt wird, bei den verwendeten Dosierungen
und Konzentrationen nicht toxisch sind. Häufig ist der physiologisch
annehmbare Träger
eine wässrige, pH-gepufferte
Lösung.
Beispiele für
physiologisch annehmbare Träger
umfassen Puffer wie z.B. Phosphat, Citrat und andere organische
Säuren;
Antioxidanzien einschließlich
Ascorbinsäure;
niedermolekulare Polypeptide (mit weniger als 10 Resten); Proteine,
wie z.B. Serumalbumin, Gelatine oder Immunglobuline; hydrophile Polymere
wie z.B. Polyvinylpyrrolidon; Aminosäuren wie z.B. Glycin, Glutamin,
Asparagin, Arginin oder Lysin; Monosaccharide, Disaccharide und
andere Kohlenhydrate einschließlich
Glucose, Mannose oder Dextrine; Chelatbildner wie z.B. EDTA; Zuckeralkohole
wie z.B. Mannit oder Sorbit; salzbildende Gegenionen wie z.B. Natrium;
und/oder nichtionische Tenside wie z.B. Tween, Pluronics oder Polyethylenglykol
(PEG).
-
Wie
hierin verwendet bezieht sich die Bezeichnung "Salvage-Rezeptorbindungsepitop" auf ein Epitop der
Fc-Region eines IgG-Moleküls
(z.B. IgG1, IgG2, IgG3 und IgG4), das für die Steigerung der In-vivo-Serumhalbwertszeit
des IgG-Moleküls
verantwortlich ist. Beispiele für
Salvage-Rezeptorbindungsepitop-Sequenzen umfassen HQNLSDGK (Seq.-ID
Nr. 39); HQNISDGK (Seq.-ID Nr. 40); HQSLGTQ (Seq.-ID Nr. 41); VISSHLGQ (Seq.-ID
Nr. 42) und PKNSSMISNTP (Seq.-ID Nr. 43).
-
Die
Bezeichnung "Cytokin" ist eine generische
Bezeichnung für
Proteine, die von einer Zellpopulation freigesetzt werden und auf
eine andere Zelle als interzelluläre Mediatoren wirken. Beispiele
für solche
Cytokine sind Lymphokine, Monokine und herkömmliche Polypeptidhormone.
Cytokine umfassen OB-Protein; Wachstumshormone wie z.B. menschliches
Wachstumshormon, menschliches N-Methionylwachstumshormon und Rinderwachstumshormon;
Parathormon; Thyroxin; Insulin; Proinsulin, Relaxin; Prorelaxin;
Glycoproteinhormone wie z.B. Follitropin (FSH), Thyreotropin (TSH)
und Luteotropin (LH); Leberwachstumsfaktor; Fibroblastenwachstumsfaktor;
Prolactin; Placenta-Lactogen; Tumornekrosefaktor-α und -β; Müller-inhibierende
Substanz (MIS); Maus-Gonadotropin-assoziiertes Peptid; Inhibin;
Activin; Gefäßendothelwachstumsfaktor;
Integrin; Thrombopoietin (TPO); Nervenwachstumsfaktoren wie z.B.
NGF-β; Plättchen-Wachstumsfaktor;
transformierende Wachstumsfaktoren (TGFs) wie z.B. TGF-α und TGF-β; Insulin-ähnlicher
Wachstumsfaktor-I und -II; Erythropoietin (EPO); osteoinduktive
Faktoren; Interferone wie z.B. Interferon-α, -β und -γ; koloniestimulierende Faktoren
(CSFs) wie z.B. Makrophagen-CSF (M-CSF); Granulozyten-Makrophagen-CSF
(GM-CSF); und Granulozyten-CSF (G-CSF); Interleukine (ILs) wie z.B.
IL-1, IL-1α,
IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12; und andere Polypeptidfaktoren
einschließlich
Leukämie
inhibierenden Faktor (LIF) und Kit-Ligand (KL). Wie hierin verwendet
umfasst die Bezeichnung Cytokin Proteine aus natürlichen Quellen oder aus rekombinanter
Zellkultur und biologisch aktive Äquivalente der Nativsequenzcytokine.
-
Ein "Stammbaum-spezifisches
Cytokin" ist eines,
das auf relativ genau definierte Zellen in der Blutbildungskaskade
wirkt und eine Vermehrung von Blutzellen in einem einzelnen Stammbaum
auslöst.
Beispiele für
solche Cytokine umfassen EPO, TPO und G-CSF.
-
"Behandlung" bezieht sich sowohl
auf therapeutische Behandlung als auch auf prophylaktische oder präventive
Maßnahmen.
Jene, die einer Behandlung bedürfen,
umfassen jene, die bereits die Störung aufweisen, sowie jene,
bei denen es die Störung
zu unterbinden gilt.
-
Die
Bezeichnung "Obesität" wird verwendet,
um ein Leiden in Verbindung mit Übergewicht
zu beschreiben, das mit übermäßigem Körperfett
zusammenhängt.
Das wünschenswerte
Gewicht für
eine bestimmte Person hängt
von zahlreichen Faktoren einschließlich Geschlecht, Größe, Alter,
Körperbau
usw. ab. Dieselben Faktoren bestimmen, wann eine Person als adipös zu betrachten
ist. Die Bestimmung eines optimalen Körpergewichts für eine bestimmte
Person liegt durchwegs im Kompetenzbereich eines gewöhnlichen
Arztes.
-
"Säugetier" für
die Zwecke der Erfindung bezieht sich auf jedes beliebige Tier,
das als ein Säugetier klassifiziert
ist, einschließlich
Menschen, Haus- und Nutztiere und Zoo-, Sport- oder Kleintiere,
wie z.B. Hunde, Pferde, Katzen, Rinder usw. Vorzugsweise ist das
Säugetier
ein Mensch.
-
Unter "Festphase" ist eine nicht-wässrige Matrix
zu verstehen, an der ein Reagens von Interesse (z.B. der WSX-Rezeptor
oder ein Antikörper
hiergegen) anhaften kann. Beispiele für Festphasen, die hierin eingebunden
sind, umfassen jene, die teilweise oder vollständig aus Glas (z.B. Controlled
Pore Glass), Polysacchariden (z.B. Agarose), Polyacrylamiden, Polystyrol,
Polyvinylalkohol und Silikonen gebildet sind. In bestimmten Ausführungsformen,
je nach Zusammenhang, kann die Festphase den Well einer Testplatte
umfassen; in anderen ist sie eine Reinigungssäule (z.B. eine Affinitätschromatographiesäule). Diese
Bezeichnung umfasst auch eine diskontinuierliche Festphase aus diskreten
Teilchen, wie z.B. im US-Patent Nr. 4.275.149 beschrieben wird.
-
II. Arten der Durchführung der
Erfindung
-
Die
vorliegende Erfindung basiert auf der Entdeckung des WSX-Rezeptors.
Die hierin beschriebenen Versuche zeigen, dass dieses Molekül ein Cytokinrezeptor
ist, der bei der Förderung
von Proliferation und/oder Differenzierung von blutbildenden Zellen
eine Rolle zu spielen scheint. Insbesondere wurde für diesen
Rezeptor erkannt, dass er in angereicherten menschlichen Stammzellpopulationen
vorhanden ist, was darauf hinweist, dass WSX-Liganden, wie z.B.
Agonistenantikörper,
verwendet wer den können,
um Proliferation von blutbildenden Stammzellen/Vorläuferzellen
zu stimulieren. Andere Verwendungen für diesen Rezeptor werden sich
anhand der folgenden Erläuterungen
zeigen. Es folgt eine Beschreibung, wie WSX-Rezeptor oder OB-Proteine
hergestellt werden können.
-
a. Herstellung von WSX-Rezeptor
oder OB-Protein
-
Verfahren,
die zur Herstellung von WSX-Protein oder OB-Protein geeignet sind,
sind auf dem Gebiet der Erfindung bekannt und umfassen das Isolieren
von WSX-Rezeptor
oder OB-Protein aus einer endogenen Quelle des Polypeptids, Peptidsynthese
(unter Verwendung eines Peptidsynthesegeräts) und Rekombinationsverfahren
(oder jegliche Kombination dieser Verfahren). Das bevorzugte Verfahren
zur Herstellung von WSX-Rezeptor oder OB-Protein ist ein Rekombinationsverfahren,
das nachstehend beschrieben wird.
-
Der
Großteil
der nachstehenden Erläuterungen
betrifft Rekombinationsherstellung von WSX-Rezeptor oder OB-Protein
durch Kultivieren der Zellen, die mit einem Vektor transformiert
sind, der WSX-Rezeptor- oder OB-Protein-Nucleinsäure enthält, und Gewinnen des Polypeptids
aus der Zellkultur. Weiters wird in Betracht gezogen, dass der WSX-Rezeptor
oder das OB-Protein dieser Erfindung mittels homologer Rekombination hergestellt
werden kann, wie es in der WO 91/06667, veröffentlicht am 16. Mai 1991,
dargestellt wird.
-
Kurz
zusammengefasst umfasst dieses Verfahren die Transformation menschlicher
Primärzellen,
die ein für
einen WSX-Rezeptor oder für
ein OB-Protein kodierendes Gen enthalten, mit einem Konstrukt (d.h.
einem Vektor), das ein amplifizierbares Gen (wie z.B. Dihydrofolatreductase
(DHFR) oder andere, die nachstehend noch erläutert werden) und zumindest
eine flankierende Region mit einer Länge von zumindest etwa 150 bp
umfasst, die mit einer DNA-Sequenz am Locus der Kodierregion des
WSX-Rezeptor- oder OB-Protein-Gens homolog ist, um für Amplifikation
des WSX-Rezeptor-
oder OB-Protein-Gens zu sorgen. Die Transformation wird so durchge führt, dass
das Konstrukt homolog in das Genom der Primärzellen integriert wird, um eine
amplifizierbare Region zu definieren.
-
Primärzellen,
die das Konstrukt umfassen, werden dann mittels des amplifizierbaren
Gens oder eines anderen Markers, der im Konstrukt vorhanden ist,
selektiert. Die Gegenwart des Markergens zeigt die Gegenwart und
Integration des Konstrukts im bzw. in das Wirtsgenom auf. Keine
weitere Selektion der Primärzellen müssen durchgeführt werden,
da Selektion im zweiten Wirt erfolgt. Sofern erwünscht, kann das Auftreten des homologen
Rekombinationsereignisses durch Einsatz von PCR und entweder Sequenzieren
der resultierenden amplifizierten DNA-Sequenzen oder Bestimmen der
geeigneten Länge
des PCR-Fragments bestimmt werden, wenn DNA aus korrekten homologen
Integranten vorhanden ist, und Vermehren nur jener Zellen, die solche
Fragmente enthalten. Sofern erwünscht,
können
die selektierten Zellen auch zu diesem Zeitpunkt durch Beanspruchung
der Zellen mit dem geeigneten amplifizierenden Mittel (wie z.B.
Methotrexat, sofern das amplifizierbare Gen DHFR ist) amplifiziert
werden, sodass Mehrfachkopien des Zielgens erhalten werden. Vorzugsweise
wird der Amplifikationsschritt jedoch nicht vor der nachstehend
beschriebenen, zweiten Transformation durchgeführt.
-
Nach
dem Selektionsschritt werden DNA-Abschnitte des Genoms, die ausreichend
groß sind,
dass sie die gesamte, amplifizierbare Region umfassen, aus den selektierten
Primärzellen
isoliert. Sekundäre
Säugetier-Expressionswirtszellen
werden dann mit diesen genomischen DNA-Abschnitten transformiert
und kloniert, und jene Klone werden selektiert, die die amplifizierbare
Region enthalten. Die amplifizierbare Region wird dann mittels eines
Amplifikationsmittels amplifiziert, sofern sie nicht bereits in
den Primärzellen
amplifiziert wurde. Schließlich
werden die sekundären
Expressionswirtszellen, die nun Mehrfachkopien der amplifizierbaren
Region enthalten, die WSX-Rezeptor oder OB-Protein enthält, so gezüchtet, dass
sie das Gen exprimieren und das Protein produzieren.
-
i. Isolierung von DNA,
die für
WSX-Rezeptor oder OB-Protein kodiert
-
Die
für WSX-Rezeptor
oder OB-Protein kodierende DNA kann von jeder beliebigen cDNA-Bibliothek erhalten
werden, die aus Gewebe hergestellt wird, von dem angenommen wird,
dass es die WSX-Rezeptor- oder OB-Protein-mRNA aufweist und diese
in einer nachweisbaren Konzentration exprimiert. Demgemäß kann WSX-Rezeptor- oder OB-Protein-DNA
leicht aus einer cDNA-Bibliothek, die aus fötaler Säugetierleber erstellt wurde,
gewonnen werden. Das für
WSX-Rezeptor oder OB-Protein
kodierende Gen kann auch aus einer genomischen Bibliothek oder durch
Oligonucleotidsynthese gewonnen werden.
-
Bibliotheken
werden mit Sonden (wie z.B. Antikörper gegen den WSX-Rezeptor
oder das OB-Protein, oder Oligonucleotide mit etwa 20–80 Basen)
gescreent, die darauf abzielen, das Gen von Interesse oder das Protein,
für das
dieses Gen kodiert, zu identifizieren. Screenen der cDNA oder der
genomischen Bibliothek mit der selektierten Sonde kann unter Verwendung
von Standardverfahren wie in den Kapiteln 10–12 von Sambrook et al., Molecular
Cloning: A Laboratory Manual (Cold Spring Harbor Laboratory Press,
New York (1989)), beschrieben durchgeführt werden. Ein alternatives
Mittel, um das für
WSX-Rezeptor oder OB-Protein kodierende Gen zu isolieren, ist die
Verwendung von PCR-Methodik gemäß der Beschreibung
in Abschnitt 14 von Sambrook et al., s.o.
-
Ein
bevorzugtes Verfahren zur Durchführung
dieser Erfindung ist die Verwendung sorgfältig selektierter Oligonucleotidsequenzen,
um cDNA-Bibliotheken aus verschiedenen menschlichen Geweben, vorzugsweise
aus fötaler
Menschenleber, zu screenen. Die als Sonden selektierten Oligonucleotidsequenzen
sollten ausreichend lang und ausreichend unzweideutig sein, sodass
falsche Positive minimiert werden können.
-
Das
Oligonucleotid muss markiert sein, sodass es bei seiner Hybridisierung
an DNA in der gescreenten Bibliothek nachgewiesen kann. Das bevorzugte
Markierungsverfahren ist die Verwendung von 32P-markiertem
ATP mit Polynucleotidkinase, wie auf dem Gebiet der Erfindung bekannt
ist, um das Oligonucleotid radioaktiv zu markieren. Allerdings können auch
andere Verfahren verwendet werden, um das Oligonucleotid zu markieren,
einschließlich,
jedoch nicht beschränkt
auf, Biotinylierung oder Enzymmarkierung.
-
Aminosäuresequenz-Varianten
von WSX-Rezeptor oder OB-Protein werden durch Einführen geeigneter
Nucleotidveränderungen
in die WSX-Rezeptor- oder OB-Protein-DNA
oder durch Synthese des erwünschten
WSX-Rezeptors oder OB-Proteins
hergestellt. Solche Varianten weisen Insertionen, Substitutionen und/oder
spezifizierte Deletionen von Resten innerhalb der oder an einem
oder beiden Enden der Aminosäuresequenz
eines natürlich
vorkommenden, menschlichen WSX-Rezeptors
oder OB-Proteins auf, wie beispielsweise die WSX-Rezeptorvarianten,
die in den 2A bis 2B gezeigt
sind, oder das menschliche OB-Protein von Zhang et al., s.o. Vorzugsweise
stellen diese Varianten Insertionen und/oder Substitutionen innerhalb der
oder an einem oder beiden Enden der reifen Sequenz und/oder Insertionen,
Substitutionen und/oder spezifizierte Deletionen innerhalb der oder
an beiden Enden der Signalsequenz des WSX-Rezeptors oder OB-Proteins
dar. Jegliche Kombination von Insertion, Substitution und/oder spezifizierter
Deletion wird vollzogen, um das Endkonstrukt zu erlangen, mit der
Maßgabe,
dass das Endkonstrukt die erwünschte
biologische Aktivität wie
hierin definiert aufweist. Die Aminosäureänderungen können auch posttranslationale
Prozesse des WSX-Rezeptors oder OB-Proteins verändern, wie z.B. durch die Änderung
der Anzahl oder Position von Glykosylierungsstellen, durch Veränderung
der Membran-Verankerungseigenschaften und/oder durch Änderung der
intrazellulären
Platzierung des WSX-Rezeptors oder OB-Proteins durch Insertieren, Deletieren
oder eine andere Art der Beeinflussung der Leadersequenz des WSX-Rezeptors
oder OB-Proteins.
-
Variationen
in der Nativsequenz wie zuvor beschrieben können unter Verwendung eines
beliebigen der Verfahren und beliebiger Richtlinien für konservative
und nicht-konservative
Mutationen, die im US-Patent Nr. 5.364.934 beschrieben sind, vollzogen
werden. Diese umfassen Oligonucleotid-vermittelte (ortsgerichtete) Mutagenese,
Alaninscanning und PCR-Mutagenese. Siehe auch beispielsweise Tabelle
I hierin und die Erläuterung
in Bezug auf diese Tabelle als Richtlinie zur Selektion von Aminosäuren, die
es zu ändern,
hinzuzufügen oder
deletieren gilt.
-
ii. Insertion von Nucleinsäure in replizierbaren
Vektor
-
Die
Nucleinsäure
(z.B. cDNA oder genomische DNA), die für den WSX-Rezeptor oder das
OB-Protein kodiert, wird in einen replizierbaren Vektor zum weiteren
Klonieren (Amplifikation der DNA) oder zur Expression insertiert.
Zahlreiche Vektoren sind verfügbar.
Die Vektorkomponenten umfassen im Allgemeinen, sind jedoch nicht
beschränkt
auf, eine oder mehrere der folgenden Komponenten: eine Signalsequenz,
einen Replikationsursprung, ein oder mehrere Markergene, ein Enhancer-Element,
einen Promotor und eine Transkriptionsterminationssequenz.
-
(1) Signalsequenzkomponente
-
Der
WSX-Rezeptor oder die OB-Proteine dieser Erfindung können rekombinant
nicht nur direkt, sondern auch als ein Fusionspolypeptid mit einem
heterologen Polypeptid hergestellt werden, das vorzugsweise eine
Signalsequenz oder ein anderes Polypeptid mit einer spezifischen
Spaltungsstelle am N-Terminus des reifen Proteins oder Polypeptids
ist. Im Allgemeinen kann die Signalsequenz eine Komponente des Vektors
sein, oder sie kann ein Teil der WSX-Rezeptor- oder OB-Protein-DNA
darstellen, die in den Vektor insertiert wird. Die vorzugsweise
selektierte heterologe Signalsequenz ist eine, die durch die Wirtszelle
erkannt und verarbeitet (z.B. durch eine Signalpeptidase gespaltet)
wird. Bei prokaryotischen Wirtszellen, die die native WSX-Rezeptor- oder OB-Protein-Signalsequenz
nicht erkennen und verarbeiten, wird die Signalsequenz durch eine
selektierte prokaryotische Signalsequenz substituiert, beispielsweise
eine aus der Gruppe der alkalischen Phosphatase, Penicillinase,
Ipp oder wärmestabilen
Entrotoxin-II-Leader. Zur Hefesekretion kann die native Signalsequenz
durch z.B. den Hefe-Invertaseleader, α-Faktorleader (einschließlich Saccharomyces-
und Kluyveromyces-α-Faktorleader,
wobei Letztere im US-Patent Nr. 5.010.182, ausgegeben am 23. April
1991, beschrieben sind) oder saure Phosphata se-Leader, den C.-albicans-Glucoamylase-Leader
(
EP 362.179 , veröffentlicht am
4. April 1990) oder das in der WO 90/13646, veröffentlicht am 15. November
1990, beschriebene Signal substituiert werden. Bei der Säugetier-Zellexpression
ist die native Signalsequenz (z.B. die WSX-Rezeptor- oder OB-Protein-Präsequenz,
die normalerweise Sekretion von WSX-Rezeptor oder OB-Protein aus
menschlichen Zellen in vivo steuert) zufrieden stellend, obwohl
andere Säugetier-Signalsequenzen
auch geeignet sein können,
wie z.B. Signalsequenzen aus anderen Tier-WSX-Rezeptoren oder – OB-Proteinen
und Signalsequenzen aus sekretierten Polypeptiden derselben oder
einer verwandten Spezies sowie virale Sekretionsleader, beispielsweise
das Herpes-Simplex-gD-Signal.
-
Die
DNA für
solch eine Vorläuferregion
wird in Leseraster an DNA, die für
den reifen WSX-Rezeptor oder das reife OB-Protein kodiert, ligiert.
-
(2) Komponente des Replikationsursprungs
-
Sowohl
Expressions- als auch Kloniervektoren enthalten eine Nucleinsäuresequenz,
die es dem Vektor ermöglicht,
sich in einer oder mehreren selektierten Wirtszellen zu replizieren.
Im Allgemeinen ist diese Sequenz in Kloniervektoren eine, die dem
Vektor die Fähigkeit
verleiht, sich unabhängig
von der chromosomalen Wirts-DNA zu replizieren, und umfasst Replikationsursprünge oder
autonom replizierende Sequenzen. Solche Sequenzen sind für zahlreiche
verschiedene Bakterien, Hefe und Viren bekannt. Der Replikationsursprung
aus dem Plasmid pBR322 ist für
die meisten Gram-negativen Bakterien geeignet, der 2 μ-Plasmidursprung
ist für Hefe
geeignet, und verschiedene virale Ursprünge (SV40, Polyoma, Adenovirus,
VSV oder BPV) sind für
Kloniervektoren in Säugetierzellen
nützlich.
Im Allgemeinen bedarf es der Replikationsursprungskomponente bei Säugetier-Expressionsvektoren
nicht (der SV40-Ursprung kann typischerweise nur verwendet werden,
da er den frühen
Promotor enthält).
-
Die
meisten Expressionsvektoren sind "Shuttle"-Vektoren, d.h. sie sind zur Replikation
in zumindest einer Klasse von Organismen in der Lage, können jedoch
in andere Organismen zur Expression transfiziert werden. Beispielsweise
wird ein Vektor in E. coli kloniert, und derselbe Vektor wird in
Hefe- oder Säugetierzellen
zur Expression transfiziert, obwohl er nicht in der Lage ist, sich
unabhängig
vom Wirtszellen-Chromosom zu
replizieren.
-
DNA
kann auch durch Insertion in das Wirtsgenom amplifiziert werden.
Dies erfolgt leicht unter Verwendung von Bacillus-Spezies als Wirte,
beispielsweise durch Einbinden einer DNA-Sequenz in den Vektor, die
zu einer Sequenz, die in genomischer Bacillus-DNA zu finden ist,
komplementär
ist. Transfektion von Bacillus mit diesem Vektor resultiert in homologer
Rekombination mit dem Genom und Insertion von WSX-Rezeptor- oder
OB-Protein-DNA. Die Gewinnung von genomischer DNA jedoch, die für WSX-Rezeptor
oder OB-Protein kodiert, ist komplexer als jene eines exogen replizierten
Vektors, da mittels Restriktionsenzymverdau die WSX-Rezeptor- oder OB-Protein-DNA
erst ausgeschnitten werden muss.
-
(3) Selektionsgenkomponente
-
Expressions-
und Kloniervektoren sollten ein Selektionsgen enthalten, das auch
als selektierbarer Marker bezeichnet wird. Dieses Gen kodiert für ein Protein,
das für
das Überleben
oder das Wachstum transformierter Wirtszellen, die in einem selektiven
Kulturmedium wachsen, erforderlich ist. Wirtszellen, die nicht mit dem
das Selektionsgen enthaltenden Vektor transformiert sind, überleben
im Kulturmedium nicht. Typische Selektionsgene kodieren für Proteine,
die (a) Resistenz gegenüber
Antibiotika oder anderen Toxinen, z.B. Ampicillin, Neomycin, Methotroxat
oder Tetracyclin, verleihen, (b) auxotrophe Mängel komplementieren oder (c) essenzielle
Nährstoffe
liefern, die aus komplexem Medium nicht erhältlich sind, z.B. das für D-Alaninracemase kodierende
Gen für
Bacilli.
-
Ein
Beispiel für
ein Selektionsschema verwendet einen Wirkstoff, um Wachstum einer
Wirtszelle anzuhalten. Jene Zellen, die erfolgreich mit einem heterologen
Gen transformiert wurden, produzieren ein Protein, das Wirkstoffresistenz
verleiht, und überleben
somit das Selektionsschema. Beispiele für solche dominierende Selektion
verwenden die Wirkstoffe Neomycin, Mycophenolsäure und Hygromycin.
-
Ein
anderes Beispiel für
geeignete selektierbare Marker für
Säugetierzellen
sind jene, die die Identifikation von Zellen ermöglichen, die in der Lage sind,
die WSX-Rezeptor-
oder OB-Protein-Nucleinsäure
aufzunehmen, wie z.B. DHFR oder Thymidinkinase. Die Säugetierzell-Transformanten
werden unter Selektionsdruck gesetzt, den nur die Transformanten
durch ihre Beschaffenheit überleben
können,
da sie den Marker in sich aufgenommen haben. Selektionsdruck wird
durch Kultivieren der Transformanten unter Bedingungen auferlegt,
unter denen die Konzentration an Selektionsmittel im Medium ausreichend
verändert
ist, um zur Amplifikation sowohl von Selektionsgen als auch von
DNA, die für
WSX-Rezeptor oder OB-Protein kodiert, zu führen. Amplifikation ist der
Prozess, durch den Gene, an denen größerer Bedarf zur Produktion
eines Proteins besteht, das für
Wachstum maßgeblich
ist, in Tandem innerhalb der Chromosome aufeinander folgender Generationen
von rekombinanten Zellen reiteriert werden. Gesteigerte Mengen an
WSX-Rezeptor oder OB-Protein werden aus der amplifizierten DNA synthetisiert.
Andere Beispiele für
amplifizierbare Gene umfassen Metallothionein-I und -II, vorzugsweise
Primaten-Metallothionein-Gene,
Adenosindesaminase, Ornithindecarboxylase usw.
-
Zellen,
die mit dem DHFR-Selektionsgen transformiert sind, werden beispielsweise
zuerst durch Kultivieren aller Transformanten in einem Kulturmedium
identifiziert, das Methotrexat (Mtx), einen kompetitiven Antagonisten
von DHFR, enthält.
Eine geeignete Wirtszelle, wenn Wildtyp-DHFR verwendet wird, ist
die Chinahamster-Eierstock- (CHO-)
Zelllinie, der DHFR-Aktivität
fehlt, hergestellt und vermehrt wie von Urlaub et al., Proc. Natl.
Acad. Sci. USA 77, 4216 (1980), beschrieben. Die transformierten
Zellen werden dann erhöhten Konzentrationen
von Methotrexat ausgesetzt. Dies führt zur Synthese von Mehrfachkopien
des DHFR-Gens und gleichzeitig zu Mehrfachkopien anderer DNA, die
die Expressionsvektoren enthält,
wie z.B. DNA, die für WSX-Rezeptor oder OB-Protein
kodiert. Dieses Amplifikationsverfahren kann mit jeglichem, sonst
geeignetem Wirt, z.B. ATCC-Nr. CCL61 CHO-K1, verwendet werden, ungeachtet
der Gegenwart von endogener DHFR, wenn beispielsweise ein mutiertes
DHFR-Gen, das gegenüber
Mtx hochresistent ist, verwendet wird (
EP 117.060 ).
-
Alternativ
dazu können
Wirtszellen (insbesondere Wildtyp-Wirte, die endogene DHFR enthalten),
die mit DNA-Sequenzen, die für
WSX-Rezeptor oder OB-Protein kodieren, Wildtyp-DHFR-Protein und
anderen selektierbaren Markern wie z.B. Aminoglycosid-3'-phosphotransferase
(APH) transformiert oder co-transformiert sind, durch Zellwachstum
in Medium, das ein Selektionsmittel für den selektierbaren Marker,
wie z.B. ein aminoglykosidisches Antibiotikum, z.B. Kanamycin, Neomycin
oder G418, enthält,
selektiert werden. Siehe das US-Patent Nr. 4.965.199.
-
Ein
geeignetes Selektionsgen zur Verwendung in Hefe ist das trp-1-Gen,
das im Hefeplasmid YRp7 vorhanden ist (Stinchcomb et al., Nature
282, 39 (1979)). Das trp1-Gen
liefert einen Selektionsmarker für
einen mutierten Hefestamm, dem die Fähigkeit fehlt, in Tryptophan
zu wachsen, beispielsweise ATCC-Nr. 44076 oder PEP4-1. Jones, Genetics
85, 12 (1977). Die Gegenwart der trp1-Läsion im Hefe-Wirtszellgenom
sorgt dann für
eine wirksame Umgebung zur Detektion von Transformation durch Wachstum
in Abwesenheit von Tryptophan. In ähnlicher Weise werden Leu2-defiziente Hefestämme (ATCC
20.622 oder 38.626) durch bekannte Plasmide, die Leu2-Gen in sich
tragen, komplementiert.
-
Darüber hinaus
können
Vektoren, die vom ringförmigen
1,6-μm-Plasmid
pKD1 abstammen, zur Transformation von Kluyveromyces-Hefen verwendet
werden. Bianchi et al., Curr. Genet. 12, 185 (1987). In noch jüngerer Vergangenheit
wurde über
ein Expressionssystem zur großtechnischen
Herstellung von rekombinantem Rinder-Chymosin für K. lactis berichtet. Van
den Berg, Bio/Technology 8, 135 (1990). Stabile Mehrfachkopien-Expressionsvektoren
zur Sekretion von reifem rekombinantem menschlichem Serumalbumin
durch industrielle Stämme
von Kluyveromyces wurden auch bereits offenbart. Fleer et al., Bio/Technology
9, 968–975 (1991).
-
(4) Promotorkomponente
-
Expressions-
und Kloniervektoren enthalten üblicherweise
einen Promotor, der vom Wirtsorganismus erkannt wird und operabel
an die WSX-Rezeptor- oder OB-Protein-Nucleinsäure gebunden ist. Promotoren sind
untranslatierte Sequenzen, die stromauf (5') zum Startcodon eines strukturellen
Gens (im Allgemeinen innerhalb etwa 100 bis 1.000 bp) liegen und
die Transkription und Translation einer bestimmten Nucleinsäuresequenz,
wie z.B. der WSX-Rezeptor- oder OB-Protein-Nucleinsäuresequenz,
an die sie operabel gebunden sind, steuern. Solche Promotoren sind
typischerweise einer von zwei Klassen zuzuordnen: den induzierbaren und
konstitutiven Promotoren. Induzierbare Promotoren sind Promotoren,
die erhöhte
Transkriptionsniveaus von der DNA unter ihrer Kontrolle in Reaktion
auf gewisse Änderungen
der Kulturbedingungen, z.B. Gegenwart oder Abwesenheit eines Nährstoffes
oder Änderung
der Temperatur, bewirken. Aktuell sind zahlreiche Promotoren, die
durch eine Vielzahl an verschiedenen potenziellen Wirtszellen erkannt
werden, bekannt. Diese Promotoren sind durch Entfernung des Promotors
aus der Quellen-DNA durch Restriktionsenzymverdau und Insertieren
der isolierten Promotorsequenz in den Vektor operabel an die für WSX-Rezeptor
oder OB-Protein kodierende DNA gebunden. Sowohl die native WSX-Rezeptor-
oder OB-Protein-Promotorsequenz als auch zahlreiche heterologe Promotoren
können
zur direkten Amplifikation und/oder Expression der WSX-Rezeptor- oder OB-Protein-DNA
verwendet werden. Heterologe Promotoren sind jedoch bevorzugt, da
sie im Allgemeinen im Vergleich zu nativem WSX-Rezeptor- oder OB-Protein-Promotor
höhere
Transkription und größere Ausbeuten
an WSX-Rezeptor
oder OB-Protein ermöglichen.
-
Promotoren,
die zur Verwendung mit prokaryotischen Wirten geeignet sind, umfassen
die β-Lactamase-
und Lactose-Promotorsysteme (Chang et al., Nature 275, 615 (1978);
Goeddel et al., Nature 281, 544 (1979)), alkalische Phosphatase,
ein Tryptophan- (trp-) Promotorsystem (Goeddel, Nucleic Acids Res.
8, 4057 (1980);
EP 36.776 )
und Hybridpromotoren wie z.B. den tac-Promotor. deBoer et al., Proc.
Natl. Acad. Sci. USA 80, 21–25
(1983). Es sind jedoch auch andere bakterielle Promotoren geeignet.
Ihre Nucleotidsequenzen wurden bereits veröffentlicht, wodurch Fachleute die
Möglichkeit
haben, sie operabel mit DNA, die für WSX-Rezeptor oder OB-Protein
kodiert, unter Verwendung von Linkern oder Adaptoren, um jegliche
erforderlichen Restriktionsstellen bereitzustellen, zu ligieren
(Siebenlist et al., Cell 20, 269 (1980)). Promotoren zur Verwendung in
bakteriellen Systemen enthalten auch eine Shine-Dalgarno- (S.D.-) Sequenz, die operabel
an die für WSX-Rezeptor
oder OB-Protein kodierende DNA gebunden ist.
-
Promotorsequenzen
sind für
Eukaryoten bekannt. Praktisch alle eukaryotischen Gene weisen eine AT-reiche
Region auf, die etwa 25 bis 30 Basen stromauf von der Stelle, an
der Transkription initiiert wird, liegt. Eine andere Sequenz, die
70 bis 80 Basen stromauf vom Transkriptionsstart zahlreicher Gene
liegt, ist eine CXCAAT-Region,
worin X für
jedes beliebige Nucleotid stehen kann. Am 3'-Ende der meisten eukaryotischen Gene
liegt eine AATAAA-Sequenz, die das Signal für Addition des Poly-A-Fortsatzes
an das 3'-Ende der
Kodiersequenz darstellen kann. Alle diese Sequenzen werden auf geeignete
Weise in eukaryotische Expressionsvektoren insertiert.
-
Beispiele
für geeignete
Promotorsequenzen zur Verwendung mit Hefewirten umfassen die Promotoren
für 3-Phosphoglyceratkinase
(Hitzeman et al., J. Biol. Chem. 225, 2073 (1980)) oder andere glykolytische Enzyme
(Hess et al., J. Adv. Enzyme Reg. 7, 149 (1968); Holland, Biochemistry
17, 4900 (1978)), wie beispielsweise Enolase, Glyceraldehyd-3-phosphatdehydrogenase,
Hexokinase, Pyruvatdecarboxylase, Phosphofructokinase, Glucose-6-phosphatisomerase,
3-Phosphoglyceratmutase, Pyruvatkinase, Triosephosphatisomerase,
Phosphoglucoseisomerase und Glucokinase.
-
Andere
Hefepromotoren, die induzierbare Promotoren mit dem zusätzlichen
Vorteil von durch Wachstumsbedingungen gesteuerter Transkription
sind, sind die Promotorregionen für Alkoholdehydrogenase 2, Isocytochrom
C, saure Phosphatase, degradative Enzyme, die mit Stickstoffmetabolismus
assoziiert sind, Metallothionein, Glyceraldehyd-3-phosphatdehydrogenase
und Enzyme, die für
Maltose- und Galactoseverwendung verantwortlich sind. Geeignete
Vektoren und Promotoren zur Ver wendung bei Hefeexpression werden näher in der
EP 73.657 beschrieben. Hefe-Enhancer werden auch
vorteilhafterweise mit Hefepromotoren verwendet.
-
WSX-Rezeptor-
oder OB-Protein-Transkription aus Vektoren in Säugetier-Wirtszellen wird beispielsweise
durch Promotoren gesteuert, die aus den Genomen von Viren wie z.B.
Polyomavirus, Geflügelpockenvirus
(
UK 2.211.504 , veröffentlicht
am 5. Juli 1989), Adenovirus (wie z.B. Adenovirus 2), Rinder-Papillomavirus, Vogel-Sarkomvirus, Zytomegalie-Virus,
einem Retrovirus, Hepatitis-B-Virus und, am meisten bevorzugt, Affenvirus
40 (SV 40), aus heterologen Säugetierpromotoren,
z.B. dem Actinpromotor oder einem Immunglobulinpromotor, aus Hitzeschock-Promotoren und aus
dem Promotor, der normalerweise mit der WSX-Rezeptor- oder OB-Proteinsequenz
assoziiert ist, erhalten werden, vorausgesetzt, solche Promotoren
sind mit den Wirtszellsystemen kompatibel.
-
Die
frühen
und späten
Promotoren des SV40-Virus werden leicht aus einem SV40-Restriktionsfragment
erhalten, das auch den viralen SV40-Replikationsursprung enthält. Fiers
et al., Nature 273, 113 (1978); Mulligan et al., Science 209, 1422–1427 (1980);
Pavlakis et al., Proc. Natl. Acad. Sci. USA 78, 7398–7402 (1981).
Der unmittelbar frühe
Promotor des menschlichen Zytomegalie-Virus ist leicht als ein HindIII-E-Restriktionsfragment
zu erhalten. Greenaway et al., Gene 18, 355–360 (1982). Ein System zur
Expression von DNA in Säugetierwirten
unter Verwendung des Rinderpapillomavirus als Vektor ist im US-Patent
Nr. 4.419.446 offenbart. Eine Modifikation dieses Systems ist im
US-Patent Nr. 4.601.978 beschrieben. Siehe auch Gray et al., Nature
295, 503–508
(1982), zum Thema Expression von cDNA, die für Immuninterferon kodiert,
in Affenzellen; Reyes et al., Nature 297, 598–601 (1982), zum Thema Expression
von menschlicher β-Interferon-cDNA in
Mauszellen unter der Steuerung eines Thymidinkinase-Promotors aus
Herpes-Simplex-Virus; Canaani et al., Proc. Natl. Acad. Sci. USA
79, 5166–5170
(1982), zum Thema Expression des menschlichen Interferon-β1-Gens in
kultivierten Maus- und Kaninchenzellen; und Gorman et al., Proc.
Natl. Acad. Sci. USA 79, 6777–6781
(1982), zum Thema Expression von bakteriellen CAT-Sequenzen in CV-1-Affennierenzellen,
embryonalen Hühner fibroblasten,
Chinahamster-Eierstockzellen, HeLa-Zellen und Maus-NIH-3T3-Zellen
unter Verwendung der langen terminalen Wiederholung des Rous-Sarkomvirus
als Promotor.
-
(5) Enhancerelement-Komponente
-
Transkription
einer DNA, die für
WSX-Rezeptor oder OB-Protein dieser Erfindung kodiert, durch höhere Eukaryoten
wird häufig
durch Insertieren einer Enhancersequenz in den Vektor gesteigert.
Enhancer sind cis-wirkende Elemente von DNA, üblicherweise etwa 10 bis 300
bp lang, die auf einen Promotor wirken, um seine Transkription zu
steigern. Enhancer sind relativ ausrichtungs- und positionsunabhängig, was
daraus geschlossen wird, dass sie 5' (Laimins et al., Proc. Natl. Acad.
Sci. USA 78, 993 (1981)) und 3' (Lusky
et al., Mol. Cell Biol. 3, 1108 (1983)) zur Transkriptionseinheit,
innerhalb eines Introns (Banerji et al., Cell 33, 729 (1983)) sowie
innerhalb der Kodiersequenz selbst gefunden wurden. Osborne et al.,
Mol. Cell Bio. 4, 1293 (1984). Zahlreiche Enhancersequenzen sind
nun aus Säugetiergenen
(Globin, Elastase, Albumin, α-Fetoprotein
und Insulin) bekannt. Typischerweise wird jedoch ein Enhancer aus
einem eukaryotischen Zellvirus verwendet. Beispiele umfassen den
SV40-Enhancer an der späten
Seite des Replikationsursprungs (bp 100–270), die frühen Promotorenhancer
des Zytomegalie-Virus, der Polyoma-Enhancer an der späten Seite
des Replikationsursprungs und Adenovirus-Enhancer. Siehe auch Yaniv,
Nature 297, 17–18
(1982), bezüglich
Enhancerelemente zur Aktivierung von eukaryotischen Promotoren.
Der Enhancer kann in den Vektor an einer Position 5' oder 3' zur WSX-Rezeptor-
oder OB-Protein-Kodiersequenz gespleißt werden, liegt jedoch vorzugsweise
an einer Stelle 5' vom
Promotor.
-
(6) Transkriptionsterminations-Komponente
-
Expressionsvektoren,
die in eukaryotischen Wirtszellen (Hefe, Pilze, Insekt, Pflanze,
Tier, Mensch oder kernhaltigen Zellen aus anderen mehrzelligen Organismen)
verwendet werden, enthalten auch Sequenzen, die zur Termination
von Transkription und zur Stabilisierung der mRNA erforderlich sind.
Solche Sequenzen sind üblicher weise
aus den untranslatierten 5'-,
und gegebenenfalls 3'-,
Regionen von eukaryotischen oder viralen DNAs oder cDNAs erhältlich.
Diese Regionen enthalten Nucleotidsegmente, die als polyadenylierte Fragmente
in den untranslatierten Abschnitt der mRNA, die für WSX-Rezeptor
oder OB-Protein kodiert, transkribiert werden.
-
(7) Konstruktion und Analyse
von Vektoren
-
Zur
Konstruktion geeigneter Vektoren, die eine oder mehrere der oben
genannten Komponenten enthalten, werden herkömmliche Ligationsverfahren
eingesetzt. Isolierte Plasmide oder DNA-Fragmente werden gespaltet,
zugeschnitten und in der erwünschten
Form neuerlich ligiert, um die erforderten Plasmide zu bilden.
-
Zur
Analyse, um korrekte Sequenzen in konstruierten Plasmiden zu bestätigen, werden
die Ligationsgemische verwendet, um E.-coli-K12-Stamm 294 (ATCC
31.446) zu transformieren, und erfolgreiche Transformanten werden
durch Ampicillin- oder Tetracyclinresistenz, je nach Erfordernis,
selektiert. Plasmide aus den Transformanten werden hergestellt,
durch Restriktionsendonucleaseverdau analysiert und/oder durch das Verfahren
nach Messing et al., Nucleic Acids Res. 9, 309 (1981), oder durch
das Verfahren nach Maxam et al., Methods in Enzymology 65, 499 (1980),
sequenziert.
-
Vektoren zur
vorübergehenden
Expression
-
Besonders
nützlich
zur praktischen Durchführung
dieser Erfindung sind Expressionsvektoren, die für die vorübergehende Expression von DNA,
die für
WSX-Rezeptor oder OB-Protein kodieren, in Säugetierzellen sorgen. Im Allgemeinen
umfasst vorübergehende
Expression die Verwendung eines Expressionsvektors, der in der Lage
ist, in einer Wirtszelle effizient zu replizieren, sodass die Wirtszelle
zahlreiche Kopien des Expressionsvektors akkumuliert und ihrerseits
hohe Konzentrationen an einem erwünschten Polypeptid, für das der Expressionsvektor
kodiert, synthetisiert. Sambrook et al., s.o., 16.17–16.22.
Vorübergehende
Expressionssysteme, die einen geeigneten Expressionsvektor und eine
Wirtszelle umfassen, ermöglichen
die einfache positive Identifikation von Polypeptiden, für die klonierte
DNAs kodieren, sowie rasches Screenen solcher Polypeptide auf erwünschte biologische
oder physiologische Eigenschaften. Somit sind Systeme zur vorübergehenden Expression
in der Erfindung besonders nützlich
für Zwecke
wie die Identifikation von Analoga und Varianten von WSX-Rezeptor
oder OB-Protein, die biologisch aktive WSX-Rezeptoren oder OB-Proteine
sind.
-
(8) Geeignete Beispiele
für Wirbeltierzellvektoren
-
Andere
Verfahren, Vektoren und Wirtszellen, die zur Adaptation an die Synthese
von WSX-Rezeptor oder OB-Protein in rekombinanter Wirbeltierzellkultur
geeignet sind, werden in Gething et al., Nature 293, 620–625 (1981);
Mantei et al., Nature 281, 40–46
(1979);
EP 117.060 und
EP 117.058 beschrieben. Ein
besonders nützliches
Plasmid für
Säugetier-Zellkulturexpression
von WSX-Rezeptor oder OB-Protein ist pRK5 (
EP 307.247 ) oder pSV16B. WO 91/08291,
veröffentlicht
am 13. Juni 1991.
-
iii. Selektion und Transformation
von Wirtszellen
-
Geeignete
Wirtszellen zum Klonieren oder Exprimieren der DNA in den Vektoren
hierin sind die zuvor beschriebenen Prokaryoten-, Hefe- oder höheren Eukaryotenzellen.
Geeignete Prokaryoten für
diesen Zweck umfassen Eubakterien, wie z.B. Gram-negative oder Gram-positive
Organismen, beispielsweise Enterobacteriaceae wie Escherichia, z.B.
E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella,
z.B. Salmonella typhimurium, Serratia, z.B. Serratia marcescans,
und Shigella sowie Bacilli wie z.B. B. subtilis und B. licheniformis
(z.B. B. licheniformis 41P, offenbart in DD 266.710, veröffentlicht
am 12. April 1989), Pseudomonas wie z.B. P. aeruginosa und Streptomyces.
Ein bevorzugter E.-coli-Klonierwirt ist E. coli 294 (ATCC 31.446),
obwohl andere Stämme
wie beispielsweise E. coli B, E. coli X1776 (ATCC 31.537) und E.
coli W3110 (ATCC 27.325) geeignet sind. Diese Beispiele dienen zur
Veranschaulichung und stellen keine Einschränkung dar. Stamm W3110 ist
ein besonders bevorzugter Wirt oder Elternwirt, da er ein gemeiner
Wirtsstamm für
Fermentationen von DNA-Rekombinationsprodukten ist. Vorzugsweise
sollte die Wirtszelle geringe Mengen an proteolytischen Enzymen
sekretieren. Beispielsweise kann Stamm W3110 so modifiziert werden,
dass er eine genetische Mutation in den Genen, die für Proteine
kodieren, bewirkt, wobei Beispiele für solche Wirte E. coli W3110
Stamm 27C7 umfassen. Der vollständige
Genotypus von 27C7 ist tonA Δptr3
phoA ΔE15 Δ(argF-lac)169
ompTΔ degP41kanr. Stamm 27C7 wurde am 30. Oktober 1991 bei
der American Type Culture Collection als ATCC Nr. 55.244 hinterlegt.
Alternativ dazu kann der Stamm von E. coli mit mutierter periplasmatischer
Protease, offenbart im US-Patent Nr. 4.946.783, ausgegeben am 7.
August 1990, verwendet werden. Wiederum alternativ dazu sind Verfahren
zum Klonieren, z.B. PCR oder andere Nucleinsäure-Polymerasereaktionen, geeignet.
-
Zusätzlich zu
Prokaryoten sind eukaryotische Mikroben wie z.B. Fadenpilze oder
Hefe geeignete Klonier- oder Expressionswirte für WSX-Rezeptor- oder OB-Proteinkodierende
Vektoren. Saccharomyces cerevisiae, oder gewöhnliche Bäckerhefe, wird unter niedereren
eukaryotischen Wirts-Mikroorganismen am häufigsten verwendet. Es sind
jedoch auch zahlreiche andere Gattungen, Spezies und Stämme allgemein
erhältlich und
hierin nützlich,
wie z.B. Schizosaccharomyces pombe (Beach et al., Nature 290, 140
(1981);
EP 139.383 , veröffentlicht
am 2. Mai 1985); Kluyveromyces-Wirte (US-Patent Nr. 4.943.529; Fleer
et al., s.o.) wie z.B. K. lactis (MW98-8C, CBS683, CBS4574), K.
fragilis (ATCC 12.424), K. bulgaricus (ATCC 16.045), K. wickeramii (ATCC
24.178), K. waltii (ATCC 56.500), K. drosophilarum (ATCC 36.906;
Van den Berg et al., s.o.), K. thermotolerans und K. marxianus;
Yarrowia (
EP 402.226 );
Pichia pastoris (
EP 183.070 ;
Sreekrishna et al., J. Basic Microbiol. 28, 265–278 (1988)); Candida; Trichoderma
reesia (
EP 244.234 );
Neurospora crassa (Case et al., Proc. Natl. Acad. Sci. USA 76, 5259–5263 (1979));
Schwanniomyces wie z.B. Schwanniomyces occidentalis (
EP 394.538 , veröffentlicht am 31. Oktober 1990);
und Fadenpilze wie z.B. Neurospora, Penicillium, Tolypocladium (WO
91/00357, veröffentlicht
am 10. Jänner
1991) und Aspergillus-Wirte wie z.B. A. nidulans (Ballance et al.,
Biochem. Biophys. Res. Commun. 112, 284–289 (1983); Tilburn et al.,
Gene 26, 205–221
(1983); Yelton et al., Proc. Natl. Acad. Sci. USA 81, 1470–1474 (1984))
und A. niger. Kelly et al., EMBO J. 4, 475–479 (1985).
-
Geeignete
Wirtszellen für
die Expression von glykosyliertem WSX-Rezeptor oder OB-Protein stammen
von vielzelligen Organismen. Solche Wirtszellen sind zu komplexen
Verarbeitungs- und Glykosylierungsaktivitäten fähig. Prinzipiell ist jede beliebige,
höhere
eukaryotische Zellkultur verarbeitbar, unabhängig davon, ob sie aus einer
Wirbeltier- oder Wirbellosenkultur abstammt. Beispiele für Zellen
von Wirbellosen umfassen Pflanzen- und Insektenzellen. Zahlreiche
Baculovirus-Stämme
und – Varianten
und entsprechende permissive Insektenwirtszellen von Wirten wie
z.B. Spodoptera frugiperda (Raupe), Aedes aegypti (Stechmücke), Aedes albopictus
(Stechmücke),
Drosophila melanogaster (Fruchtfliege) und Bombyx mori wurden bereits
identifiziert. Siehe z.B. Luckow et al., Bio/Technology 6, 47–55 (1988);
Miller et al., in: Genetic Engineering, Setlow et al. (Hrsg.), Bd.
6, Plenum Publishing, 277–279
(1986); und Maeda et al., Nature 315, 592–594 (1985). Zahlreiche Virusstämme zur
Transfektion sind öffentlich
erhältlich,
z.B. die L-1-Variante von Autographa californica NPV und der Bm-5-Stamm
von Bombyx mori NPV, und solche Viren können als das Virus hierin gemäß der vorliegenden
Erfindung, insbesondere zur Transfektion von Spodoptera-frugiperda-Zellen,
verwendet werden.
-
Pflanzen-Zellkulturen
von Baumwolle, Kukuruz (Mais), Erdäpfel (Kartoffel), Sojabohne,
Petunie, Paradeiser (Tomate) und Tabak können als Wirte verwendet werden.
Typischerweise werden Pflanzenzellen durch Inkubation mit bestimmten
Stämmen
des Bakteriums Agrobacterium tumefaciens transfiziert, das davor
manipuliert wurde, um die für
WSX-Rezeptor oder OB-Protein kodierende DNA zu enthalten. Während der
Inkubation der Pflanzenzellkultur mit A. tumefaciens wird die für den WSX-Rezeptor oder das
OB-Protein kodierende DNA auf den Pflanzenzellwirt übertragen,
sodass dieser transfiziert ist, und unter geeigneten Bedingungen
die für
WSX-Rezeptor oder
OB-Protein kodierende DNA exprimiert. Darüber hinaus sind Regulations-
und Signalsequenzen, die mit Pflanzenzellen kompatibel sind, wie
z.B. der Nopalinsynthase-Promotor und Polyadenylierungssignalsequenzen,
erhältlich.
Depicker et al., J. Mol. Appl. Gen. 1, 561 (1982). Weiters sind
DNA-Segmente, die aus der Stromauf-Region des T-DNA-780-Gens isoliert
sind, in der Lage, Transkriptionsniveaus von in Pflanzen exprimierbaren
Genen in rekombinantem, DNA-hältigem Pflanzengewebe
zu aktivieren oder zu steigern.
EP
321.196 , veröffentlicht
am 21. Juni 1989.
-
Das
Interesse war jedoch stets für
Wirbeltierzellen am größten, und
die Vermehrung von Wirbeltierzellen in Kultur (Gewebekultur) ist
zu einem Routineverfahren geworden. Siehe z.B. Tissue Culture, Academic Press,
Kruse & Patterson
(Hrsg.) (1973). Beispiele für
nützliche
Säugetier-Wirtszelllinien
sind Affennieren-CV1-Linie, transformiert durch SV40 (COS-7, ATCC
CRL 1651); menschliche embryonale Nierenlinie (293 oder 293-Zellen,
für Wachstum
in Suspensionskultur subkloniert, Graham et al., J. Gen Virol. 36,
59 (1977)); Babyhamster-Nierenzellen (BHK, ATCC CCL 10); Chinahamster-Eierstockzellen/-DHFR
(CHO; Urlaub et al., Proc. Natl. Acad. Sci. USA 77, 4216 (1980));
Maus-Sertolizellen (TM4, Mather, Biol. Reprod. 23, 243–251 (1980));
Affennierenzellen (CV1 ATCC CCL 70); Nierenzellen der afrikanischen
grünen
Meerkatze (VERO-76, ATCC CRL 1587); menschliche Zervixkarzinomzellen
(HELA, ATCC CCL 2); Hundenierenzellen (MDCK, ATCC CCL 34); Büffelrattenleberzellen
(BRL 3A, ATCC CRL 1442); menschliche Lungenzellen (W138, ATCC CCL
75); menschliche Leberzellen (Hep G2, HB 8065); Maus-Brusttumor
(MMT 060562, ATCC CCL 51); TRI-Zellen (Mather et al., Annals N.Y.
Acad. Sci. 383, 44–68
(1982)); MRC-5-Zellen; FS4-Zellen; und eine menschliche Hepatomlinie
(Hep G2).
-
Wirtszellen
werden transfiziert und vorzugsweise mit den zuvor beschriebenen
Expressions- und Kloniervektoren zur WSX-Rezeptor- oder OB-Protein-Herstellung
transformiert und in herkömmlichem
Nährmedium,
modifiziert je nach Bedarf zur Induktion von Promotoren, Selektion
von Transformanten oder Amplifikationen der Gene, die für die erwünschten
Sequenzen kodieren, kultiviert.
-
Transfektion
bezieht sich auf die Aufnahme eines Expressionsvektors durch eine
Wirtszelle, unabhängig
davon, ob eine Kodiersequenz tatsächlich exprimiert wird oder
nicht. Zahlreiche Transfektionsverfahren sind durchschnittlichen
Fachleuten bekannt, beispielsweise CaPO4 und
Elektroporation. Erfolgreiche Transfektion wird im Allgemeinen daran
erkannt, wenn irgendein Hinweis auf die Wirkung dieses Vektors innerhalb
der Wirtszelle auftritt.
-
Transformation
bedeutet das Einführen
von DNA in einen Organismus, sodass die DNA replizierbar ist, entweder
als ein extrachromosomales Element oder als chromosomaler Bestandteil.
Je nach verwendeter Wirtszelle erfolgt Transformation unter Verwendung
von Standardverfahren, die für
solche Zellen geeignet sind. Die Calciumbehandlung unter Verwendung
von Calciumchlorid, wie sie im Abschnitt 1.82 von Sambrook et al.,
s.o., beschrieben ist, oder Elektroporation wird im Allgemeinen
für Prokaryoten
oder andere Zellen, die wesentliche Zellwandbarrieren aufweisen,
verwendet. Infektion mit Agrobacterium tumefaciens wird zur Transformation
bestimmter Pflanzenzellen verwendet, wie von Shaw et al., Gene 23,
315 (1983), und in der WO 89/05859, veröffentlicht am 29. Juni 1989,
beschrieben wird. Darüber
hinaus können
Pflanzen unter Verwendung von Ultraschallbehandlung, wie in der
WO 91100358, veröffentlicht
am 10. Jänner
1991, beschrieben wird, transfiziert werden.
-
Für Säugetierzellen
ohne solche Zellwände
wird das Calciumphosphat-Fällverfahren
von Graham et al., Virology 52, 456–457 (1978), bevorzugt. Allgemeine
Aspekte von Transformationen von Säugetier-Wirtszellsystemen werden
im US-Patent Nr. 4.399.216, ausgegeben am 16. August 1983, beschrieben.
Transformationen in Hefe werden typischerweise gemäß dem Verfahren
von Van Solingen et al., J. Bact. 130, 946 (1977), und Hsiao et
al., Proc. Natl. Acad. Sci. USA 76, 3829 (1979), durchgeführt. Es
können
jedoch auch andere Verfahren zur Einführung von DNA in Zellen verwendet
werden, wie beispielsweise mittels Nuklearmikroinjektion, Elektroporation
oder bakterieller Protoplastenfusion mit intakten Zellen oder mittels
Polykationen, z.B. Polybren, Polyornithin usw. Für verschiedene Verfahren zur
Transformation von Säugetierzellen
siehe Keown et al., Methods in Enzymology 185, 527–537 (1990),
und Mansour et al., Nature 336, 348–352 (1988).
-
iv. Kultivieren der Wirtszellen
-
Prokaryotische
Zellen zur Herstellung von WSX-Rezeptor oder OB-Protein dieser Erfindung
werden in geeigneten Medien wie allgemein in Sambrook et al., s.o.,
beschrieben verwendet.
-
Die
zur Herstellung von WSX-Rezeptor oder OB-Protein dieser Erfindung
verwendeten Säugetierzellen
können
in zahlreichen verschiedenen Medien kultiviert werden. Handelsübliche Medien
wie z.B. Ham's F10 (Sigma),
Minimal Essential Medium ((MEM), Sigma), RPMI-1640 (Sigma) und Dulbecco's Modified Eagle's Medium ((DMEM),
Sigma) sind zur Kultivierung der Wirtszellen geeignet. Weiters können sämtliche
Medien, die in Ham et al., Meth. Enz. 58, 44 (1979); Barnes et al.,
Anal. Biochem. 102, 255 (1980); in den US-Patenten Nr. 4.767.704,
4.657.866, 4.927.762, 4.560.655 oder 5.122.469; WO 90/03430, WO
87/00195; oder US-Patent Re. 30.985 beschrieben werden, als Kulturmedium
für die
Wirtszellen verwendet werden. Jegliches dieser Medien kann, je nach
Bedarf, mit Hormonen und/oder anderen Wachstumsfaktoren (wie z.B.
Insulin, Transferrin oder epidermalem Wachstumsfaktor), Salzen (wie
z.B. Natriumchlorid, Calcium, Magnesium und Phosphat), Puffern (wie
z.B. HEPES), Nucleosiden (wie z.B. Adenosin und Thymidin), Antibiotika
(wie z.B. Wirkstoff GENTAMYCINTM), Spurenelementen
(definiert als anorganische Verbindungen, die üblicherweise in Endkonzentrationen
im mikromolaren Bereich vorhanden sind) und Glucose oder einer äquivalenten
Energiequelle ergänzt werden.
Auch jegliche anderen erforderlichen Ergänzungen können bei geeigneten Konzentrationen
eingebunden werden, die Fachleuten bekannt sein werden. Die Kulturbedingungen
wie Temperatur, pH und dergleichen sind jene, die davor für die zur
Expression selektierte Wirtszelle verwendet wurden, und werden durchschnittlichen
Fachleuten ersichtlich sein.
-
Im
Allgemeinen sind Grundlagen, Arbeitsvorschriften und praktische
Verfahren zur Maximierung der Produktivität von Säugetier-Zellkulturen in Mammalian
Cell Biotechnology: a Practical Approach, M. Butler (Hrsg.), IRL
Press (1991), zu finden.
-
Die
Wirtszellen, auf die in dieser Offenbarung Bezug genommen wird,
umfassen Zellen in Kultur sowie Zellen, die innerhalb eines Wirtstiers
vorhanden sind.
-
v. Detektion von Genamplifikation/-expression
-
Genamplifikation
und/oder -expression kann in einer Probe direkt, beispielsweise
durch herkömmliches
Southern-Blotting oder Northern-Blotting zur Quantifizierung der
Transkription von mRNA (Thomas, Proc. Natl. Acad. Sci. USA 77, 5201–5205 (1980)),
Dot-Blotting (DNA-Analyse) oder In-situ-Hybridisierung unter Verwendung
einer geeignet markierten Sonde, basierend auf den hierin bereitgestellten
Sequenzen, gemessen werden. Verschiedene Markierungen können verwendet
werden, am üblichsten
Radioisotope, insbesondere 32P. Es können jedoch
auch andere Verfahren eingesetzt werden, wie beispielsweise die
Verwendung von Biotin-modifizierten Nucleotiden zur Einführung in
ein Polynucleotid. Das Biotin dient dann als Bindungsstelle an Avidin
oder Antikörper,
die mit zahlreichen verschiedenen Markierungen markiert sein können, wie
z.B. Radionucliden, fluoreszierenden Substanzen, Enzymen und dergleichen.
Alternativ dazu können
Antikörper
verwendet werden, die spezifische Duplices erkennen können, einschließlich DNA-Duplices,
RNA-Duplices und DNA-RNA-Hybridduplices oder DNA-Protein-Duplices.
Die Antikörper
können
nun markiert sein, und der Test kann durchgeführt werden, wenn der Duplex
an eine Oberfläche
gebunden ist, sodass bei Bildung des Duplex an der Oberfläche die
Gegenwart eines Antikörpers,
der an den Duplex gebunden ist, nachgewiesen werden kann.
-
Genexpression
kann alternativ dazu durch immunologische Verfahren wie z.B. immunhistochemisches
Färben
von Gewebeschnitten und Tests an Zellkultur oder Körperflüssigkeiten
gemessen werden, um die Expression von Genprodukt direkt zu quantifizieren.
Bei immunhistochemischen Färbungsverfahren
wird eine Zellprobe hergestellt, typischerweise durch Dehydratisierung
und Fixation, gefolgt von Umsetzung mit markierten Antikörpern, die
für das
gebundene Genprodukt spezifisch sind, worin die Markierungen üblicherweise
sichtbar nachweisbar sind, wie z.B. enzymatische Markierungen, fluoreszierende
Markierungen, lumineszierende Markierungen und dergleichen. Ein
besonders empfindliches Färbungsverfahren,
das zur Verwendung in der vorliegenden Erfindung geeignet ist, wird
in Hsu et al., Am. J. Clin. Path. 75, 734–738 (1980), beschrieben.
-
Antikörper, die
zum immunhistochemischen Färben
und/oder Testen von Probenflüssigkeiten
nützlich sind,
können
entweder monoklonal oder polyklonal sein und können wie hierin beschrieben
hergestellt werden.
-
vi. Reinigung von WSX-Rezeptor
oder OB-Protein
-
WSX-Rezeptor
(z.B. WSX-Rezeptor-ECD) oder OB-Protein wird vorzugsweise aus dem
Kulturmedium als ein sekretiertes Polypeptid gewonnen, obwohl er/es
ebenfalls aus Wirtszelllysaten gewonnen werden kann. Ist der WSX-Rezeptor
membrangebunden, so kann er aus der Membran unter Verwendung einer
geeigneten Detergenslösung
(z.B. Triton-X 100) freigesetzt werden.
-
Wird
WSX-Rezeptor oder OB-Protein in einer rekombinanten Zelle hergestellt,
die nicht menschlichen Ursprungs ist, so ist der WSX-Rezeptor oder
das OB-Protein vollständig
frei von Proteinen oder Polypeptiden menschlichen Ursprungs. Es
ist jedoch erforderlich, WSX-Rezeptor oder OB-Protein von rekombinanten
Zellproteinen oder -polypeptiden zu reinigen, um Präparate zu
erhalten, die im Wesentlichen homogen zu WSX-Rezeptor oder OB-Protein
sind. In einem ersten Schritt wird das Kulturmedium oder -lysat
zentrifugiert, um partikuläre
Zelltrümmer
zu entfernen. WSX-Rezeptor
oder OB-Protein wird hiernach von verunreinigenden löslichen
Proteinen und Polypeptiden gereinigt, wobei die folgenden Verfahren
Beispiele für
geeignete Reinigungsverfahren hierzu sind: Fraktionierung an einer
Ionenaustauschsäule;
Ethanolfällung;
Umkehrphasen-HPLC; Chromatographie auf Kieselgel oder auf einem
Kationenaustauschharz wie z.B. DEAE; Chromatofokussierung; SDS-PAGE;
Ammoniumsulfatfällung;
Gelfiltration unter Verwendung von beispielsweise Sephadex G-75TM;
und Protein-A-SepharoseTM-Säulen, um
Verunreinigungen wie IgG zu entfernen.
-
WSX-Rezeptor-
oder OB-Protein-Varianten, in denen Reste deletiert, insertiert
oder substituiert wurden, werden auf dieselbe Weise wie Nativsequenz-WSX-Rezeptor
oder -OB-Protein gewonnen, wobei jegliche wesentliche Änderungen
von Eigenschaften, die durch die Variation hervorgerufen werden,
berücksichtigt
werden. Im munoaffinitätssäulen wie
z.B. eine Säule
für polyklonalen/s
Kaninchen-Anti-WSX-Rezeptor
oder -OB-Protein kann verwendet werden, um die WSX-Rezeptor- oder
OB-Protein-Variante durch Bindung an zumindest ein verbleibendes
Immunepitop zu absorbieren.
-
Ein
Proteaseinhibitor wie z.B. Phenylmethylsulfonylfluorid (PMSF) kann
auch nützlich
sein, um proteolytischen Abbau während
der Reinigung zu hemmen, und Antikörper können eingebunden werden, um
das Wachstum von zufällig
hinzugekommenen Kontaminanten zu unterbinden.
-
vii. Kovalente Modifikationen
-
Kovalente
Modifikationen von WSX-Rezeptor oder OB-Protein sind in den Schutzumfang
dieser Erfindung eingebunden. Sowohl Nativsequenz-WSX-Rezeptor oder
-OB-Protein als
auch Aminosäuresequenzvarianten
des WSX-Rezeptors oder OB-Proteins
können
kovalent modifiziert sein. Ein Typ von kovalenter Modifikation des
WSX-Rezeptors oder OB-Proteins wird in das Molekül durch Umsetzen von Target-Aminosäureresten
des WSX-Rezeptors oder OB-Proteins mit einem organischen derivatisierenden
Mittel, das in der Lage ist, mit ausgewählten Seitenketten oder den
N-oder C-terminalen
Resten des WSX-Rezeptors oder OB-Proteins zu reagieren, eingeführt.
-
Cysteinylreste
werden üblicherweise
mit α-Halogenacetaten
(und entsprechenden Aminen), wie z.B. Chloressigsäure oder
Chloracetamid, umgesetzt, um Carboxymethyl- oder Carboxyamidomethyl-Derivate
zu ergeben. Cysteinylreste werden auch durch Umsetzung mit Bromtrifluoraceton, α-Brom-β-(5-imidozoyl)propionsäure, Chloracetylphosphat,
N-Alkylmaleinimid, 3-Nitro-2-pyridyldisulfid, Methyl-2-pyridyldisulfid,
p-Chlormercuribenzoat, 2-Chlormercuri-4-nitrophenol oder Chlor-7-nitrobenzo-2-oxa-1,3-diazol derivatisiert.
-
Histidylreste
werden durch Umsetzung mit Diethylpyrocarbonat bei pH 5,5–7,0 derivatisiert,
da dieses Mittel relativ spezifisch für die Histidylseitenkette ist.
Para-Bromphenacylbromid
ist auch nützlich;
die Reaktion wird vorzugsweise in 0,1 M Natriumcacodylat bei pH
6,0 durchgeführt.
-
Lysinyl-
und Amino-terminale Reste werden mit Bernsteinsäure- oder anderen Carbonsäureanhydriden
umgesetzt. Derivatisierung mit diesen Mitteln hat die Wirkung, die
Ladung der Lysinylreste umzukehren. Andere geeignete Reagenzien
zur Derivatisierung von α-Amino-hältigen Resten
umfassen Imidoester wie z.B. Methylpicolinimidat, Pyridoxalphosphat,
Pyridoxal, Chlorborhydrid, Trinitrobenzolsulfonsäure, O-Methylisoharnstoff, 2,4-Pentandion und
Transaminase-katalysierte Reaktion mit Glyoxylat.
-
Arginylreste
werden durch Umsetzung mit einem oder mehreren herkömmlichen
Reagenzien modifiziert, darunter Phenylglyoxal, 2,3-Butandion, 1,2-Cyclohexandion
und Ninhydrin. Derivatisierung von Argininresten erfordert aufgrund
des hohen pKa der funktionellen Guanidingruppe,
dass die Umsetzung unter alkalischen Bedingungen erfolgt. Weiters
können
diese Reagenzien mit den Lysingruppen sowie mit den Arginin-ε-Aminogruppen
reagieren.
-
Die
spezifische Modifikation von Tyrosylresten kann mit besonderem Interesse
an der Einführung
von Spektralmarkierungen in Tyrosylreste durch Umsetzung mit aromatischen
Diazoniumverbindungen oder Tetranitromethan erfolgen. Am üblichsten
werden N-Acetylimidizol und Tetranitromethan verwendet, um O-Acetyltyrosylspezies
bzw. 3-Nitro-Derivate zu bilden. Tyrosylreste werden unter Verwendung
von 125I oder 131I
iodiert, um markierte Proteine zur Verwendung in Radioimmuntests
herzustellen, wozu das Chloramin-T-Verfahren geeignet ist.
-
Carboxyl-Seitengruppen
(Aspartyl oder Glutamyl) werden selektiv durch Umsetzung mit Carbodiimiden
(R-N=C=N-R') modifiziert,
worin R und R' verschiedene
Alkylgruppen sind, wie beispielsweise 1-Cyclohexyl-3-(2-morpholinyl-4-ethyl)carbodiimid
oder 1-Ethyl-3-(4-azonia-4,4-dimethylpentyl)carbodiimid. Weiters werden
Aspartyl- und Glutamylreste zu Asparaginyl- und Glutaminylresten
durch Reaktion mit Ammoniumionen umgesetzt.
-
Derivatisierung
mit bifunktionellen Mitteln ist zum Vernetzen von WSX-Rezeptor oder
OB-Protein zu einer wasserunlöslichen
Trägermatrix
oder -oberfläche
zur Verwendung im Verfahren zur Reinigung von Anti-WSX-Rezeptor-
oder -OB-Protein-Antikörpern nützlich,
und umgekehrt. Üblicherweise
verwendete Vernetzungsmittel umfassen z.B. 1,1-Bis(diazoacetyl)-2-phenylethan,
Glutaraldehyd, N-Hydroxysuccinimidester, beispielsweise Ester mit
4-Azidosalicylsäure,
homobifunktionelle Imidoester einschließlich Disuccinimidylester wie
3,3'-Dithiobis(succinimidylpropionat)
und bifunktionelle Maleinimide wie Bis-N-maleinimido-1,8-octan.
Derivatisierungsmittel wie Methyl-3-((p-azidophenyl)dithio)propioimidat
ergeben photoaktivierbare Zwischenprodukte, die in der Lage sind,
Vernetzungen in Gegenwart von Licht zu bilden. Alternativ dazu werden
reaktive, wasserunlösliche
Matrizen wie beispielsweise Cyanogenbromid-aktivierte Kohlenhydrate
und die reaktiven Substrate, die in den US-Patenten Nr. 3.969.287; 3.691.016; 4.195.128;
4.247.642; 4.229.537; und 4.330.440 beschrieben sind, zur Proteinimmobilisierung
verwendet.
-
Glutaminyl-
und Asparaginylreste werden häufig
zu den entsprechenden Glutamyl- bzw.
Aspartylresten desamidiert. Diese Reste werden unter neutralen oder
basischen Bedingungen desamidiert. Die desamidierte Form dieser
Reste liegt im Schutzumfang dieser Erfindung.
-
Andere
Modifikationen umfassen Hydroxylierung von Prolin und Lysin, Phosphorylierung
von Hydroxylgruppen von Seryl- oder Threonylresten, Methylierung
der α-Aminogruppen von
Lysin-, Arginin- und Histidin-Seitenketten (T. E. Creighton, Proteins:
Structure and Molecular Properties, W. H. Freeman & Co., San Francisco,
79–86
(1983)), Acetylierung des N-terminalen Amins und Amidierung jeglicher
C-terminalen Carboxylgruppe.
-
Ein
anderer Typ von kovalenter Modifikation des WSX-Rezeptors oder OB-Proteins,
der im Schutzumfang dieser Erfindung liegt, umfasst das Ändern des
nativen Glykosylierungsmusters des Polypeptids. Durch Ändern wird
das Deletieren von einer oder mehreren Kohlenhydratgruppierungen
verstanden, die im nativen WSX-Rezeptor oder OB-Protein vorhanden
sind, und/oder das Hinzufügen
einer oder mehrerer Glykosylierungsstellen, die im nativen WSX-Rezeptor
oder OB-Protein nicht vorhanden sind.
-
Glykosylierung
von Polypeptiden ist typischerweise entweder N-gebunden oder O-gebunden. N-gebunden
bezieht sich auf die Anbindung der Kohlenhydratgruppierung an der
Seitenkette eines Asparaginrests. Die Tripeptidsequenzen Asparagin-X-Serin
und Asparagin-X-Threonin, worin X jede beliebige Aminosäure außer Prolin
ist, sind die Erkennungssequenzen für enzymatische Anbindung der
Kohlenhydratgruppierung an die Asparaginseitenkette. Somit schafft
die Gegenwart von einer dieser Tripeptidsequenzen in einem Polypeptid
eine mögliche
Glykosylierungsstelle. O-gebundene
Glykosylierung bezieht sich auf die Anbindung eines der Zucker N-Acetylgalactosamin,
Galactose oder Xylose an eine Hydroxylaminosäure, am häufigsten Serin oder Threonin,
obwohl 5-Hydroxyprolin oder 5-Hydroxylysin auch verwendet werden
kann.
-
Hinzufügen von
Glykosylierungsstellen zum WSX-Rezeptor oder OB-Protein wird leicht
durch Ändern der
Aminosäuresequenz
erreicht, sodass sie eine oder mehrere der zuvor beschriebenen Tripeptidsequenzen (für N-gebundene
Glykosylierungsstellen) enthält.
Die Änderung
kann auch durch das Hinzufügen
von, oder die Substitution durch, einem/einen oder mehreren/mehrere
Serin- oder Threoninresten/Threoninreste zur/an der nativen WSX-Rezeptor-
oder OB-Protein-Sequenz (für
O-gebundene Glykosylierung) erfolgen. Aus praktischen Gründen wird
die Aminosäuresequenz
des WSX-Rezeptors oder OB-Proteins vorzugsweise durch Änderungen
auf DNA-Niveau geändert,
insbesondere durch Mutieren der DNA, die für den WSX-Rezeptor oder das
OB-Protein kodiert, an vorausgewählten
Basen, sodass Codons gebildet werden, die zu den erwünschten Aminosäuren translatieren.
Die DNA-Mutation(en) kann/können
unter Verwendung von Verfahren erfolgen, die zuvor und im US-Patent
Nr. 5.364.934, s.o., beschrieben wurden.
-
Ein
anderes Mittel zur Steigerung der Anzahl an Kohlenhydratgruppierungen
am WSX-Rezeptor oder OB-Protein erfolgt durch chemisches oder enzymatisches
Binden von Glykosiden an das Polypeptid. Diese Verfahren sind darin
von Vorteil, dass sie keine Produktion des Polypeptids in einer
Wirtszelle erfordern, die über
Glykosylierungsfähigkeiten
für N-
oder O-gebundene Glykosylierung verfügt. Je nach verwendeter Bindungsart
können
die Zucker (kann der Zucker) an (a) Arginin und Histidin, (b) freie
Carboxylgruppen, (c) freie Sulfhydrylgruppen wie jene von Cystein,
(d) freie Hydroxylgruppen wie jene von Serin, Threonin oder Hydroxyprolin,
(e) aromatische Reste wie jene von Phenylalanin, Tyrosin oder Tryptophan
oder (f) die Amidgruppe von Glutamin gebunden werden. Diese Verfahren
werden in der WO 87/05330, veröffentlicht
am 11. September 1987, und in Aplin et al., CRC Crit. Rev. Biochem.,
259–306
(1981), beschrieben.
-
Entfernung
von Kohlenhydratgruppierungen, die am WSX-Rezeptor oder OB-Protein
vorhanden sind, kann chemisch oder enzymatisch erfolgen. Chemische
Deglykosylierung erfordert die Aussetzung des Polypeptids gegenüber der
Verbindung Trifluormethansulfonsäure
oder einer äquivalenten
Verbindung. Diese Behandlung resultiert in der Spaltung der meisten
oder aller Zucker unter Ausnahme des verbindenden Zuckers (N-Acetylglucosamin
oder N-Acetylgalactosamin), während
das Polypeptid intakt bleibt. Chemische Glykosylierung wird von
Hakimuddin et al., Arch. Biochem. Biophys. 259, 52 (1987), und von
Edge et al., Anal. Biochem. 118, 131 (1981), beschrieben. Enzymatische
Spaltung von Kohlenhydratgruppierungen an Polypeptiden kann durch
die Verwendung zahlreicher verschiedener Endo- und Exoglykosidasen,
wie von Thotakura et al., Meth. Enzymol. 138, 350 (1987), beschrieben,
erreicht werden.
-
Glykosylierung
an potenziellen Glykosylierungsstellen kann durch die Verwendung
der Verbindung Tunicamycin, wie von Duskin et al., J. Biol. Chem.
257, 3105 (1982), beschrieben, unterbunden werden. Tunicamycin blockiert
die Bildung von Protein-N-Glykosid-Bindungen.
-
Ein
anderer Typ von kovalenter Modifikation von WSX-Rezeptor oder OB-Protein
umfasst das Binden des WSX-Rezeptors oder OB-Proteins an eines von
zahlreichen verschiedenen, nicht-proteinhältigen Polymeren, z.B. Polyethylenglykol,
Polypropylenglykol oder Polyoxyalkylene, auf eine Weise, wie sie
in den US-Patenten Nr. 4.640.835; 4.496.689; 4.301.144; 4.670.417;
4.791.192 oder 4.179.337 beschrieben ist.
-
Da
es häufig
schwierig ist, die Eigenschaften einer WSX-Rezeptor- oder OB-Protein-Variante vorherzusagen,
wird verständlich
sein, dass gewisses Screenen der gewonnenen Variante erforderlich
sein wird, um die optimale Variante zu selektieren. Eine Veränderung
der immunologischen Eigenschaft des WSX-Rezeptor- oder OB-Protein-Moleküls, wie
z.B. Affinität
zu einem bestimmten Antikörper,
kann auch durch einen Immuntest vom kompetitiven Typ gemessen werden.
Die WSX-Rezeptorvariante
wird auf Veränderungen
der Fähigkeit
des Proteins getestet, Zellproliferation im Kolonietest aus Beispiel
8 zu induzieren. Andere potenzielle Modifikationen von Protein-
oder Polypeptideigenschaften wie z.B. Redox- oder Wärmestabilität, Hydrophobizität, Empfindlichkeit
gegenüber
proteolytischem Abbau oder Neigung zur Aggregation mit Trägern oder
zu Multimeren werden durch Verfahren, die auf dem Gebiet der Erfindung
bekannt sind, getestet.
-
viii. Epitop-markierter/s
WSX-Rezeptor oder OB-Protein
-
Diese
Erfindung betrifft chimäre
Polypeptide, die WSX-Rezeptor oder OB-Protein, fusioniert an ein
heterologes Polypeptid, umfassen. Ein chimärer WSX-Rezeptor oder ein chimäres OB-Protein
ist ein Typ von WSX-Rezeptor- oder OB-Protein-Variante wie hierin
definiert. In einer bevorzugten Ausführungsform umfasst das chimäre Polypeptid
eine Fusion des WSX-Rezeptors oder OB-Proteins mit einem Markierungs-Polypeptid, das ein
Epitop bereitstellt, an das sich ein Anti-Markierungs-Antikörper selektiv
binden kann. Die Epitopmarkierung ist im Allgemeinen am Amino- oder
Car boxylterminus des WSX-Rezeptors oder OB-Proteins bereitgestellt.
Solche Epitop-markierten
Formen des WSX-Rezeptors oder OB-Proteins sind wünschenswert, da die Gegenwart
davon unter Verwendung eines markierten Antikörpers gegen das Markierungs-Polypeptid
nachgewiesen werden kann. Auch ermöglicht die Bereitstellung der
Epitopmarkierung, dass der WSX-Rezeptor oder das OB-Protein leicht
durch Affinitätsreinigung
unter Verwendung des Anti-Markierungs-Antikörpers gereinigt werden kann.
Affinitätsreinigungsverfahren
und Diagnosetests, die Antikörper
einbinden, werden später hierin
beschrieben.
-
Markierungs-Polypeptide
und ihre jeweiligen Antikörper
sind auf dem Gebiet der Erfindung bekannt. Beispiele umfassen das
flu-HA-Markierungspolypeptid und seinen Antikörper 12CA5 (Field et al., Mol.
Cell. Biol. 8, 2159–2165
(1988)); die c-myc-Markierung
und die 8F9-, 3C7-, 6E10-, G4-, B7- und 9E10-Antikörper hiergegen
(Evan et al., Molecular and Cellular Biology 5, 3610–3616 (1985));
und Herpes-Simplex-Virus-Glykoprotein-D-
(-gD-) Markierung und ihre Antikörper.
Paborsky et al., Protein Engineering 3(6), 547–553 (1990). Andere Markierungspolypeptide
wurden bereits offenbart. Beispiele umfassen das Flag-Peptid (Hopp
et al., BioTechnology 6, 1204–1210
(1988)); das KT3-Epitoppeptid (Martin et al., Science 255, 192–194 (1992));
und α-Tubulin-Epitoppeptid
(Skinner et al., J. Biol. Chem. 266, 15163–15166 (1991)); und die T7-Gen-10-Proteinpeptidmarkierung.
Lutz-Freyermuth et al., Proc. Natl. Acad. Sci. USA 87, 6393–6397 (1990).
Nachdem das Markierungspolypeptid ausgewählt wurde, kann ein Antikörper hiergegen
unter Verwendung der hierin offenbarten Verfahren gebildet werden.
-
Die
allgemeinen Verfahren, die zur Konstruktion und Produktion von Epitop-markiertem WSX-Rezeptor
oder OB-Protein geeignet sind, sind dieselben wie jene, die hier
zuvor offenbart wurden. WSX-Rezeptor- oder OB-Protein-Markierungspolypeptid-Fusionen
werden am einfachsten mittels Fusionieren der cDNA-Sequenz, die
für den
WSX-Rezeptor- oder OB-Protein-Abschnitt in Raster kodiert, an die
Markierungspolypeptid-DNA-Sequenz und Exprimieren des resultierenden
DNA-Fusionskonstrukts
in geeigneten Wirtszellen konstruiert. Üblicherweise wird bei der Herstellung
der WSX-Rezeptor- oder OB-Protein-Markierungspolypeptid-Chimären der
vorliegenden Erfindung Nucleinsäure,
die für
den WSX-Rezeptor oder das OB-Protein
kodiert, an seinem 3'-Ende
an Nucleinsäure
fusioniert, die für
den N-Terminus des
Markierungspolypeptids kodiert, wobei jedoch auch 5'-Fusionen möglich sind.
-
Epitop-markierter/s
WSX-Rezeptor oder OB-Protein kann mittels Affinitätschromatographie
unter Verwendung des Anti-Markierungs-Antikörpers leicht gereinigt werden.
Die Matrix, an die der Affinitätsantikörper angebunden
ist, ist meistens Agarose, doch auch andere Matrizen sind erhältlich (z.B.
Controlled Pore Glass oder Poly(styroldivinyl)benzol). Der Epitop-markierte
WSX-Rezeptor oder das Epitop-markierte
OB-Protein kann aus der Affinitätssäule durch
Variieren des Puffer-pH oder der Ionenstärke oder durch Zusatz von chaotropen
Mitteln beispielsweise eluiert werden.
-
ix. WSX-Rezeptor- oder
OB-Protein-Immunoadhäsine
-
Chimären, die
aus einer Rezeptorsequenz konstruiert werden, die an eine geeignete
Immunglobulin-Konstantdomänensequenz
gebunden ist, sind auf dem Gebiet der Erfindung bekannt. Immunoadhäsine, über die
in der Literatur berichtet wurde, umfassen Fusionen des T-Zellrezeptors*
(Gascoigne et al., Proc. Natl. Acad. Sci. USA 84, 2936–2940 (1987));
CD4* (Capon et al., Nature 337, 525–531 (1989); Traunecker et
al., Nature 339, 68–70
(1989); Zettmeissl et al., DNA Cell Biol. USA 9, 347–353 (1990);
Byrn et al., Nature 344, 667–670
(1990)); L-Selectin (homing-Rezeptor) (Watson et al., J. Cell Biol.
110, 2221–2229
(1990); Watson et al., Nature 249, 164–167 (1991)); CD44* (Aruffo
et al., Cell 61, 1303–1313
(1990)); CD28* und B7* (Linsley et al., J. Exp. Med. 173, 721–730 (1991));
CTLA-4* (Lisley et al., J. Exp. Med. 174, 561–569 (1991)); CD22* (Stamenkovic
et al., Cell 66, 1133–1144
(1991)); TNF-Rezeptor (Ashkenazi et al., Proc. Natl. Acad. Sci.
USA 88, 10535–10539
(1991); Lesslauer et al., Eur. J. Immunol. 27, 2883–2886 (1991);
Peppel et al., J. Exp. Med. 174, 1483–1489 (1991)); NP-Rezeptoren
(Bennett et al., J. Biol. Chem. 266, 23060–23067 (1991)); und IgE-Rezeptor α* (Ridgway
et al., J. Cell. Biol. 115, Abstr. 1448 (1991)), worin die Sternchen
(*) angeben, dass der Rezeptor Mitglied der Immunglobulin-Oberfamilie ist.
-
Das
einfachste und unkomplizierteste Immunoadhäsin-Design kombiniert die Bindungsregion(en)
des "Adhäsin"-Proteins mit den
Gelenks- und Fc-Regionen einer Immunglobulin-Schwerkette. Üblicherweise
wird bei der Herstellung der WSX-Rezeptor-
oder OB-Immunglobulinchimären
der vorliegenden Erfindung Nucleinsäure, die für OB-Protein oder die extrazelluläre Domäne des WSX-Rezeptors
kodiert, C-terminal an Nucleinsäure,
die für
den N-Terminus einer Immunglobulin-Konstantdomänensequenz kodiert, fusioniert,
wobei jedoch auch N-terminale Fusionen möglich sind. Im Fall von OB-Immunglobulinchimären kann
ein OB-Proteinfragment,
das die Fähigkeit
beibehält,
sich an den WSX-Rezeptor zu binden, verwendet werden.
-
Typischerweise
behält
in solchen Fusionen das kodierte chimäre Polypeptid zumindest funktionell
aktive Gelenks-, CH2- und CH3-Domänen der konstanten Region eines
Immunglobulin-Schwerkette bei. Fusionen können auch an den C-Terminus
des Fc-Abschnittes einer konstanten Domäne oder unmittelbar N-terminal
zur CH1-Region der
schweren Kette oder der entsprechenden Region der leichten Kette
erfolgen.
-
Die
präzise
Stelle, an der die Fusion erfolgt, ist nicht maßgeblich; bestimmte Stellen
sind bekannt und können
ausgewählt
werden, um die biologische Aktivität, Sekretions- oder Bindungseigenschaften
der WSX-Rezeptor- oder OB-Immunglobulinchimären zu optimieren.
-
In
manchen Ausführungsformen
werden die WSX-Rezeptor- oder OB-Immunglobulin-Chimären als Monomere
oder Hetero- oder Homomultimere assembliert, und insbesondere als
Dimere oder Rotamere, im Wesentlichen wie es die WO 91/08298 veranschaulicht.
-
In
einer bevorzugten Ausführungsform
wird die OB-Proteinsequenz oder WSX-Rezeptor-Extrazellulärdomänensequenz an den N-Terminus
des C-terminalen Abschnitts eines Antikörpers (insbesondere der Fc-Domäne), der
die Effektorfunktionen eines Immunglobulins, z.B. Immunglobulin
G1 (IgG1), umfasst, fusioniert. Es ist möglich, die gesamte Schwerketten-Konstantregion
an die Sequenz der extrazellulären
Domäne des
OB-Proteins oder WSX-Rezeptors zu fusionieren. Bevorzugter wird
jedoch eine Sequenz, die in der Gelenksregion unmittelbar stromauf
der Papain-Spaltungsstelle
(die IgG-Fc chemisch definiert; Rest 216, wenn der erste Rest der
Schwerketten-Konstantregion als 114 angenommen wird, oder analoge
Stellen anderer Immunglobuline) beginnt, in der Fusion verwendet.
In einer besonders bevorzugten Ausführungsform wird die OB-Protein-
oder WSX-Rezeptor-Aminosäuresequenz
an die Gelenksregion, CH2- und CH3- oder die CH1-, Gelenks-, CH2-
und CH3-Domänen einer
IgG1-, IgG2- oder IgG3-Schwerkette fusioniert. Die präzise Stelle, an
der die Fusion stattfindet, ist nicht maßgeblich, und die optimale
Stelle kann mittels routinemäßiger Versuche
bestimmt werden.
-
In
manchen Ausführungsformen
werden die WSX-Rezeptor- oder OB-Immunglobulinchimären als Multimere
assembliert, und insbesondere als Homodimere oder -tetramere. Im
Allgemeinen weisen diese assemblierten Immunglobuline bekannte Einheitsstrukturen
auf. Eine vierkettige Basisstruktureinheit ist die Form, in der
IgG, IgD und IgE bestehen. Eine Vierereinheit kommt in den höhermolekularen
Immunglobulinen wiederholt vor; IgM besteht im Allgemeinen als ein
Pentamer aus Basis-Vierereinheiten, die durch Disulfidbindungen
zusammengehalten werden. IgA-Globulin,
und gegebenenfalls IgG-Globulin, können auch in multimerer Form
in Serum bestehen. Im Fall von Multimeren kann jede Vierereinheit
die gleiche oder eine andere sein.
-
Verschiedene
Beispiele für
assemblierte WSX-Rezeptor- oder OB-Immunglobulinchimären innerhalb des
Schutzumfangs der vorliegenden Erfindung sind nachstehend schematisch
dargestellt:
- (a) ACL-ACL;
- (b) ACH-(ACH,
ACL-ACH, ACL-VHCH oder
VLCL-ACH);
- (c) ACL-ACH-(ACL-ACH, ACL-VHCH,
VLCL-ACH oder
VLCL-VHCH);
- (d) ACL-VHCH-(ACH oder ACL-VHCH oder
VLCL-ACH);
- (e) VLCL-ACH-(ACL-VHCH oder VLCL-ACH); und
- (f) (A-Y)n-(VLCL-VHCH)2,
worin
jedes A für gleiche
oder verschiedene OB-Protein- oder WSX-Rezeptor-Aminosäuresequenzen steht;
VL eine variable Immunglobulin-Leichtkettendomäne ist;
VH eine variable Immunglobulin-Schwerkettendomäne ist;
CL eine konstante Immunglobulin-Leichtkettendomäne ist;
CH eine konstante Immunglobulin-Schwerkettendomäne ist;
n
eine Ganzzahl größer als
1 ist;
Y den Rest eines kovalenten Vernetzers bezeichnet.
-
Um
die Darstellung so einfach wie möglich
zu gestalten, stellen die obigen Strukturen nur Schlüsseleigenschaften
dar; sie geben weder Bindungs- (J-) oder andere Domänen der
Immunglobuline an, noch sind Disulfidbindung gezeigt. Sind jedoch
solche Domänen
für Bindungsaktivität erforderlich,
so gilt es, diese an den üblichen
Positionen, die sie in den Immunglobulinmolekülen einnehmen, als vorhanden
zu verstehen.
-
Alternativ
dazu kann die Sequenz der extrazellulären Domäne des OB-Proteins oder WSX-Rezeptors zwischen
Immunglobulin-Schwerketten- und -Leichtketten-Sequenzen insertiert werden, sodass
ein Immunglobulin, das eine chimäre
Schwerkette umfasst, erhalten wird. In dieser Ausführungsform
wird die OB-Protein- oder WSX-Rezeptorsequenz an das 3'-Ende einer Immunglobulinschwerkette
in jedem Arm eines Immunglobulins fusioniert, entweder zwischen
der Gelenks- und der CH2-Domäne oder
zwischen den CH2- und CH3-Domänen. Ähnliche
Konstrukte wurden von Hoogenboom et al., Mol. Immunol. 28, 1027–1037 (1991), berichtet.
-
Obwohl
die Gegenwart einer Immunglobulinleichtkette nicht in Immunoadhäsinen der
vorliegenden Erfindung erforderlich ist, kann eine Immunglobulinleichtkette
entweder kovalent an ein OB-Protein- oder WSX-Rezeptor-Immunglobulinschwerketten-Fusionspolypeptid
assoziiert sein oder direkt an die WSX-Rezeptor-Extrazellulärdomäne oder
das OB-Protein fusioniert sein. Im erstgenannten Fall wird DNA,
die für
eine Immunglobulinleichtkette kodiert, mit der DNA, die für das OB-Protein-
oder WSX-Rezeptor-Immunglobulinschwerketten-Fusionsprotein kodiert,
co-exprimiert. Bei Sekretion werden die hybride Schwerkette und
die leichte Kette kovalent assoziiert, um eine Immunglobulin-ähnliche
Struktur bereitzustellen, die zwei Disulfid-gebundene Immunglobulin-Schwerketten-Leichtketten-Paare
aufweist. Verfahren, die zur Herstellung solcher Strukturen geeignet
sind, werden beispielsweise im US-Patent Nr. 4.816.567, ausgegeben am
28. März
1989, offenbart.
-
In
einer bevorzugten Ausführungsform
stammen die Immunglobulinsequenzen, die zur Konstruktion der Immunoadhäsine der
vorliegenden Erfindung verwendet werden, aus einer konstanten IgG-Immunglobulin-Schwerkettendomäne. Für menschliches
Immunoadhäsin
wird die Verwendung von menschlichen IgG1- und IgG3-Immunglobulinsequenzen
bevorzugt. Ein großer
Vorteil der Verwendung von IgG1 ist, dass IgG1-Immunoadhäsine wirksam
an immobilisiertem Protein A gereinigt werden können. Im Gegensatz dazu erfordert Reinigung
von IgG3 Protein G, ein signifikant weniger vielseitiges Medium.
Dennoch sollten auch andere strukturelle und funktionelle Eigenschaften
von Immunglobulinen in Erwägung
gezogen werden, wenn der Ig-Fusionspartner für eine bestimmte Immunoadhäsinkonstruktion
ausgewählt
wird. Beispielsweise ist das IgG3-Gelenk länger und flexibler, sodass
es größere Adhäsindomänen aufnehmen
kann, die sich nicht korrekt falten oder funktionieren können, wenn
sie an IgG1 fusioniert sind. Eine andere Erwägung kann sich auf die Wertigkeit
beziehen; IgG-Immunoadhäsine
sind zweiwertige Homodimere, während
Ig-Subtypen wie IgA und IgM dimere bzw. pentamere Strukturen der
Basis-Ig-Homodimereinheit
hervorbringen können.
Für Immunoadhäsine, die
zur In-vivo-Anwendung
konzipiert sind, sind die pharmakokinetischen Eigenschaften und
die Effektorfunktionen, die durch die Fc-Region spezifiziert werden,
ebenfalls wichtig. Obwohl IgG1, IgG2 und IgG4 In-vivo-Halbwertszeiten
von 21 Tagen aufweisen, sind ih re relativen Wirksamkeiten zur Aktivierung
des Komplementsystems unterschiedlich. IgG4 aktiviert Komplement
nicht, und IgG2 weist signifikant schwächere Komplementaktivierung
auf als IgG1. Darüber
hinaus bindet sich IgG2 im Gegensatz zu IgG1 nicht an Fc-Rezeptoren
an mononuklearen Zellen oder Neutrophilen. Während IgG3 optimal für Komplementaktivierung
ist, beträgt
seine In-vivo-Halbwertszeit etwa ein Drittel der anderen IgG-Isotypen.
Eine andere wichtige Überlegung im
Zusammenhang mit Immunoadhäsinen,
die als menschliche Therapeutika verwendet werden sollen, ist die Anzahl
an allotypischen Varianten des bestimmten Isotyps. Im Allgemeinen
werden IgG-Isotypen mit weniger serologisch definierten Allotypen
bevorzugt. Beispielsweise weist IgG1 nur vier serologisch definierte
allotypische Stellen auf, von denen zwei (G1m und 2) in der Fc-Region
angeordnet sind; eine dieser Stellen G1m1 ist nicht-immunogen. Dahingegen
gibt es 12 serologisch definierte Allotypen in IgG3, die alle in
der Fc-Region liegen; nur drei dieser Stellen (G3m5, 11 und 21)
haben einen Allotypus, der nicht-immunogen ist. Somit ist die potenzielle
Immunogenität
eines γ3-Immunoadhäsins größer als
jene eines γ1-Immunoadhäsins.
-
In
Bezug auf das parentale Immunglobulin liegt ein nützlicher
Verbindungspunkt unmittelbar stromauf der Cysteine des Gelenks,
das die Disulfidbindungen zwischen den zwei schweren Ketten bildet.
In einem häufig
verwendeten Design liegt das Codon für den C-terminalen Rest des
WSX-Reeztpor- oder OB-Proteinteils des Moleküls direkt stromauf der Codons
für die
Sequenz DKTHTCPPCP (Seq.-ID Nr. 44) der IgG1-Gelenksregion.
-
Die
allgemeinen Verfahren, die für
die Konstruktion und Expression von Immunoadhäsinen geeignet sind, sind dieselben,
wie hierin zuvor in Bezug auf WSX-Rezeptor und OB-Protein offenbart
wurden. Immunoadhäsine
werden sehr leicht durch Fusionieren der cDNA-Sequenz, die für den WSX-Rezeptor-
oder OB-Proteinabschnitt in Raster kodiert, an eine Ig-cDNA-Sequenz
hergestellt. Es kann jedoch auch Fusion an genomische Ig-Fragmente
verwendet werden (siehe z.B. Gascoigne et al., Proc. Natl. Acad.
Sci. USA 84, 2936–2940 (1987);
Aruffo et al., Cell 61, 1303–1313
(1990); Stamenkovic et al., Cell 66, 1133–1144 (1991)). Der letztgenannte
Fusionstyp erfordert die Gegenwart von Ig-Regulationssequenzen zur
Expression. cDNAs, die für konstante
IgG-Schwerkettenregionen kodieren, können basierend auf veröffentlichten
Sequenzen aus cDNA-Bibliotheken aus Milz oder peripherem Blutlymphozyten,
durch Hybridisierungs- oder Polymerasekettenreaktions- (PCR-) Verfahren
isoliert werden. Die für
den WSX-Rezeptor oder das OB-Protein kodierenden cDNAs und Ig-Teile des Immunoadhäsins werden
im Tandem in einen Plasmidvektor insertiert, der wirksame Expression
in den ausgewählten
Wirtszellen steuert. Zur Expression in Säugetierzellen können pRK5-basierte
Vektoren (Schall et al., Cell 61, 361–370 (1990)) und CDM8-basierte
Vektoren (Seed, Nature 329, 840 (1989)) verwendet werden. Die exakte
Verbindung kann durch Entfernen der zusätzlichen Sequenzen zwischen
den entworfenen Verbindungscodons unter Verwendung von Oligonucleotid-gerichteter
Deletionsmutagenese (Zoller et al., Nucleic Acids Res. 10, 6487
(1982); Capon et al., Nature 337, 525–531 (1989)) geschaffen werden.
Synthetische Oligonucleotide können
verwendet werden, worin jede Hälfte
zur Sequenz an einer Seite der erwünschten Verbindung komplementär ist; im
Idealfall sind dies 36- bis 48-mere. Alternativ dazu können PCR-Verfahren
verwendet werden, um die zwei Teile des Moleküls in Raster mit einem geeigneten
Vektor zu verbinden.
-
Die
Auswahl der Wirtszelllinie für
die Expression des Immunoadhäsins
hängt hauptsächlich vom
Expressionsvektor ab. Eine andere Überlegung betrifft die Menge
an erforderlichem Protein. mg-Mengen können oft mittels vorübergehender
Transfektion hergestellt werden. Beispielsweise kann die durch Adenovirus
E1A transformierte, menschliche embryonale Nierenzelllinie mit pRK5-basierten
Vektoren durch eine Modifikation des Calciumphosphatverfahrens vorübergehend
transfiziert werden, um wirksame Immunoadhäsinexpression zu ermöglichen.
CDM8-basierte Vektoren können
verwendet werden, um COS-Zellen durch das DEAE-Dextranverfahren
zu transfizieren (Aruffo et al., Cell 61, 1303–1313 (1990); Zettmeissl et
al., DNA Cell Biol. US 9, 347–353
(1990)). Sind größere Mengen
an Protein erwünscht,
so kann Immunoadhäsin
nach stabiler Transfektion einer Wirtszelllinie exprimiert werden.
Beispielsweise kann ein pRK5-basierter Vektor in Chinahamster-Eierstock-
(CHO-) Zellen in Gegenwart eines zusätzlichen Plasmids, das für Dihydrofolatreductase
(DHFR) kodiert und G418-Resistenz verleiht, eingeführt werden.
Klone, die gegenüber
G418 resistent sind, können
in Kultur selektiert werden; diese Klone werden in der Gegen wart
steigender Konzentrationen an DHFR-Inhibitor Methotrexat gezüchtet; Klone,
in denen die Anzahl an Genkopien, die für die DHFR- und Immunoadhäsinsequenzen
kodieren, co-amplifiziert wird, werden selektiert. Enthält das Immunoadhäsin eine
hydrophobe Leadersequenz an seinem N-Terminus, so ist es wahrscheinlich,
dass es durch die transfizierten Zellen verarbeitet und sekretiert
wird. Die Expression von Immunoadhäsinen mit komplexeren Strukturen
kann ausschließlich dafür geeignete
Wirtszellen erfordern; beispielsweise können Komponenten wie z.B. Leichkette
oder J-Kette durch bestimmte Myelom- oder Hybridom-Zellwirte bereitgestellt
werden (Gascoigne et al. (1987), s.o., Martin et al., J. Virol.
67, 3561–3568
(1993)).
-
Immunoadhäsine können einfach
durch Affinitätschromatographie
gereinigt werden. Die Eignung von Protein A als ein Affinitätsligand
hängt von
der Spezies und dem Isotyp der Immunglobulin-Fc-Domäne ab, die in
der Chimäre
verwendet wird. Protein A kann verwendet werden, um Immunoadhäsine zu
reinigen, die auf menschlichen γ1-, γ2- oder γ-4-Schwerketten
aufbauen (Lindmark et al., J. Immunol. Meth. 62, 1–13 (1983)). Protein
G wird für
alle Maus-Isotypen und für
menschliches γ3
empfohlen (Guss et al., EMBO J. 5, 1567–1575 (1986)). Die Matrix,
an die der Affinitätsligand
gebunden ist, ist sehr häufig
Agarose, wobei jedoch auch andere Matrizen erhältlich sind. Mechanisch stabile
Matrizen wie z.B. Controlled Pore Glass oder Poly(styroldivinyl)benzol
ermöglichen
raschere Durchflussgeschwindigkeiten und kürzere Verarbeitungszeiten als
mit Agarose erreicht werden können.
Die Bedingungen für
Bindung eines Immunoadhäsins
an die Protein-A- oder -G-Affinitätssäule werden zur Gänze durch
die Eigenschaften der Fc-Domäne
bestimmt; das heißt
von ihrer Spezies und ihrem Isotyp. Im Allgemeinen tritt wirksame
Bindung, wenn der richtige Ligand ausgewählt wurde, direkt aus nicht-konditionierter
Kulturflüssigkeit
auf. Eine unterscheidende Eigenschaft von Immunoadhäsinen ist,
dass im Fall von menschlichen γ1-Molekülen die
Bindungskapazität
für Protein
A verglichen mit einem Antikörper
desselben Fc-Typs gemindert ist. Gebundenes Immunoadhäsin kann
wirksam entweder bei sauerm pH (bei oder über 3,0) oder in einem neutralen
pH-Puffer, der ein leicht chaotropes Salz enthält, eluiert werden. Dieser
Affinitätschromatographieschritt
kann in einem Immunoadhäsinpräparat resultieren,
das zu > 95% rein ist.
-
Andere
Verfahren, die auf dem Gebiet der Erfindung bekannt sind, können anstelle
von oder zusätzlich zu
Affinitätschromatographie
an Protein A oder G zur Reinigung von Immunoadhäsinen verwendet werden. Immunoadhäsine verhalten
sich ähnlich
wie Antikörper
bei thiophiler Gel-Chromatographie (Hutchens et al., Anal. Biochem.
159, 217–226
(1986)) und immobilisierter Metallchelat-Chromatographie (Al-Mashikhi
et al., J. Dairy Sci. 71, 1756–1763
(1988)). Im Gegensatz zu Antikörpern
jedoch wird ihr Verhalten an Ionenaustauschsäulen nicht nur durch ihre isoelektrischen
Punkte, sondern auch durch einen Ladungsdipol, der in den Molekülen aufgrund
ihrer chimären
Natur bestehen kann, bestimmt.
-
Sofern
erwünscht,
können
die Immunoadhäsine
bispezifisch gemacht werden. So können die Immunoadhäsine der
vorliegenden Erfindung eine WSX-Rezeptor-Extrazellulärdomäne und eine Domäne, wie
beispielsweise die extrazelluläre
Domäne,
einer anderen Cytokinrezeptor-Untereinheit kombinieren. Beispiele
für Cytokinrezeptoren,
aus denen solche bispezifischen Immunoadhäsinmoleküle hergestellt werden können, umfassen
TPO- (oder mpl-Ligand-), EPO-, G-CSF-, IL-4-, IL-7-, GH-, PRL-,
IL-3-, GM-CSF-, IL-5-, IL-6-, LIF-, OSM-, CNTF- und IL-2-Rezeptoren.
Alternativ dazu kann eine OB-Proteindomäne mit einem anderen Cytokin, wie
beispielsweise jenen, die hierin als Beispiele aufgelistet wurden,
zur Bildung eines bispezifischen Immunoadhäsins kombiniert werden. Für bispezifische
Moleküle
sind trimere Moleküle,
zusammengesetzt aus einer Hybridantikörper-Schwerkette in einem Arm
und einem Hybridantikörper-Schwerketten-Leichtketten-Paar
im anderen Arm ihrer Antikörper-ähnlichen
Struktur, aufgrund ihrer einfachen Reinigungsmöglichkeiten von Vorteil. Im
Gegensatz zu Antikörper-bildenden
Quadromen, die üblicherweise
zur Herstellung von bispezifischen Immunoadhäsinen verwendet wurden, die
ein Gemisch aus zehn Tetrameren produzieren, bilden Zellen, die mit
Nucleinsäure
transfiziert sind, die für
die drei Ketten einer trimeren Immunoadhäsinstruktur kodiert, ein Gemisch
aus nur drei Molekülen,
wodurch Reinigung des erwünschten
Produkts aus diesem Gemisch entsprechend einfacher ist.
-
x. Derivate von OB-Protein
mit langer Halbwertszeit
-
Bevorzugte
funktionelle OB-Proteinderivate zur Verwendung in den Verfahren
der vorliegenden Erfindung umfassen OB-Immunglobulinchimären (Immunoadhäsine) und
andere Moleküle
mit längerer
Halbwertszeit. Verfahren zur Bildung von OB-Protein-Immunoadhäsinen wurden bereits oben beschrieben.
Das bevorzugte OB-Immunoadhäsin wird
gemäß den in
Beispiel 11 nachstehend beschriebenen Verfahren hergestellt.
-
Andere
Derivate der OB-Proteine, die eine längere Halbwertszeit besitzen
als die nativen Moleküle, umfassen
die OB-Protein- oder eine OB-Immunglobulinchimäre, die kovalent an ein nicht-proteinhältiges Polymer
gebunden ist. Das nicht-proteinhältige
Polymer ist üblicherweise
ein hydrophiles synthetisches Polymer, d.h. ein Polymer, das sonst
nicht in der Natur zu finden ist. Polymere, die in der Natur vorkommen
und durch Rekombinations- oder In-vitro-Verfahren hergestellt werden,
sind jedoch auch nützlich,
wie auch Polymere, die aus nativen Quellen isoliert werden. Hydrophile
Polyvinylpolymere fallen in den Schutzumfang dieser Erfindung, z.B.
Polyvinylalkohol und Polyvinylpyrrolidon. Besonders nützlich sind
Polyalkylenether wie Polyethylenglykol (PEG); Polyelkylene wie Polyoxyethylen,
Polyoxypropylen und Block-Copolymere
von Polyoxyethylen und Polyoxypropylen (PluronicsTM);
Polymethacrylate, Carbomere; verzweigte oder unverzweigte Polysaccharide,
die die Saccharidmonomere D-Mannose, D- und L-Galactose, Fucose,
Fructose, D-Xylose, L-Arabinose, D-Glucuronsäure, Sialsäure, D-Galacturonsäure, D-Mannuronsäure (z.B.
Polymannuronsäure
oder Alginsäure),
D-Glucosamin, D-Galactosamin, D-Glucose und Neuraminsäure umfassen,
einschließlich
Homopolysaccharide und Heteropolysaccharide, wie z.B. Lactose, Amylopectin,
Stärke,
Hydroxyethylstärke,
Amylose, Dextransulfat, Dextran, Dextrine, Glykogen oder die Polysaccharid-Untereinheit
von sauren Mucopolysacchariden, z.B. Hyaluronsäure; Polymere von Zuckeralkoholen
wie z.B. Polysorbit und Polymannit; Heparin oder Heparon. Das Polymer
muss, bevor es vernetzt wird, nicht wasserlöslich sein, ist es aber vorzugsweise,
doch das Endkonjugat muss wasserlöslich sein. Darüber hinaus
sollte das Polymer in der konjugierten Form nicht hoch immunogen
sein, und auch sollte es keine Viskosität besitzen, die mit in travenöser Infusion
oder Injektion inkompatibel ist, sofern dieses Polymer für derartige
Wege der Verabreichung konzipiert ist.
-
Vorzugsweise
enthält
das Polymer nur eine einzelne Gruppe, die reaktiv ist. Dies trägt dazu
bei, Vernetzung von Proteinmolekülen
zu unterbinden. Es liegt jedoch im Schutzumfang der vorliegenden
Erfindung, Reaktionsbedingungen zu optimieren, um Vernetzung zu
reduzieren, oder die Reaktionsprodukte durch Gelfiltration oder
chromatographische Siebe zu reinigen, um im Wesentlichen homogene
Derivate zu gewinnen.
-
Das
Molekulargewicht des Polymers kann wünschenswerterweise im Bereich
von etwa 100 bis 500.000, und vorzugsweise von etwa 1.000 bis 20.000,
liegen. Die Auswahl des Molekulargewichts hängt von der Beschaffenheit
des Polymers und dem Grad an Substitution ab. Im Allgemeinen gilt,
dass je größer die Hydrophilie
des Polymers und je höher
der Grad an Substitution sind, desto geringer kann das verwendete
Molekulargewicht sein. Optimale Molekulargewichte werden mittels
Routine-Versuchen
bestimmt.
-
Das
Polymer ist durch einen multifunktionellen Vernetzer, der mit dem
Polymer und einem oder mehreren Aminosäure- oder Zuckerresten der
zu bindenden OB-Protein- oder
OB-Immunglobulinchimäre
reagiert, kovalent an die OB-Protein- oder die OB-Immunglobulin-Chimäre gebunden.
Es liegt jedoch im Schutzumfang der Erfindung, das Polymer durch
Umsetzen eines derivatisierten Polymers mit dem Hybrid oder umgekehrt direkt
zu vernetzen.
-
Die
kovalente Vernetzungsstelle an der OB-Protein- oder OB-Immunglobulinchimäre umfasst
die N-terminate Aminogruppe und epsilon-Aminogruppen, die an Lysinresten
zu finden sind, sowie andere Amino-, Imino-, Carboxyl-, Sulfhydryl-,
Hydroxyl- oder andere hydrophile Gruppen. Das Polymer kann ohne
Verwendung eines multifunktionellen (üblicherweise bifunktionellen)
Vernetzungsmittels kovalent direkt an das Hybrid gebunden sein.
Kovalente Bindung an Aminogruppen erfolgt mittels bekannter Chemieverfahren
basierend auf Cyanurchlorid, Carbonyldiimidazol, reaktiven Al dehydgruppen
(PEG-Alkoxid plus Diethylacetal von Bromacetaldehyd; PEG plus DMSO
und Essigsäureanhydrid;
oder PEG-Chlorid plus Phenoxid von 4-Hydroxybenzaldehyd, Succinimidyl-aktive
Ester, aktiviertes Dithiocarbonat-PEG, 2,4,5-Trichlorophenylchloroformiat-
oder P-Nitrophenylchlorofarmiat-aktiviertes PEG). Carboxylgruppen
werden durch Binden von PEG-Amin unter Verwendung von Carbodiimid
derivatisiert.
-
Polymere
werden an Oligosaccharidgruppen durch Oxidation unter Verwendung
von Chemikalien, z.B. Metaperiodat, oder Enzymen, z.B. Glucose-
oder Galactoseoxidase (die beide das Aldehydderivat des Kohlenhydrats
produzieren), konjugiert, gefolgt von Reaktion mit Hydrazid- oder
Amino-derivatisierten Polymeren auf dieselbe Weise, wie von Heitzmann
et al., P.N.A.S. 71, 3537–3541
(1974), oder von Bayer et al., Methods in Enzymology 62, 310 (1979),
beschrieben wird, zur Markierung von Oligosacchariden mit Biotin
oder Avidin. Weiters sind andere chemische oder enzymatische Verfahren,
die hierfür
verwendet wurden, um Oligosaccharide zu binden, von besonderem Vorteil,
da im Allgemeinen weniger Substitutionen als Aminosäurestellen
zur Derivatisierung vorhanden sind, wodurch die Oligosaccharidprodukte
homogener sind. Die Oligosaccharid-Substituenten werden gegebenenfalls
vor der Polymerderivatisierung auch durch Enzymverdau modifiziert,
um Zucker zu entfernen, z.B. durch Neuraminidaseverdau.
-
Das
Polymer trägt
eine Gruppe, die direkt mit einer Aminosäureseitenkette oder dem N-
oder C-Terminus des gebundenen Polypeptids reaktiv ist oder die
mit dem multifunktionellen Vernetzer reaktiv ist. Im Allgemeinen
sind Polymere, die solche reaktiven Gruppen tragen, für die Herstellung
von immobilisierten Proteinen bekannt. Um solche chemischen Verfahren
hierin zu verwenden, sollte ein wasserlösliches Polymer eingesetzt
werden, das im Übrigen
auf dieselbe Weise derivatisiert wird wie unlösliche Polymere, die bisher
für Proteinimmobilisierung
verwendet wurden. Cyanogenbromid-Aktivierung ist ein besonders nützliches
Verfahren zum Vernetzen von Polysacchariden.
-
"Wasserlöslich" in Bezug auf das
Ausgangspolymer bedeutet, dass das Polymer oder sein reaktives Zwischenprodukt,
das zur Konjugation verwendet wird, ausreichend wasserlöslich ist,
um in einer Derivatisierungsreaktion mitzuwirken.
-
"Wasserlöslich" in Bezug auf das
Polymerkonjugat bedeutet, dass das Konjugat in physiologischen Flüssigkeiten
wie z.B. Blut löslich
ist.
-
Der
Substitutionsgrad bei solch einem Polymer variiert je nach der Anzahl
an reaktiven Stellen am Protein, unabhängig davon, ob das gesamte
Protein oder ein Fragment davon verwendet wird, ob das Protein eine Fusion
mit einem heterologen Protein (z.B. einer OB-Immunglobulinchimäre) ist,
je nach Molekulargewicht, Hydrophilie und anderen Eigenschaften
des Polymers sowie je nach den besonderen Proteinderivatisierungsstellen,
die ausgewählt
werden. Im Allgemeinen enthält
das Konjugat etwa 1 bis 10 Polymermoleküle, obwohl jede beliebige,
heterologe Sequenz mit einer im Wesentlichen uneingeschränkten Anzahl
an Polymermolekülen
substituiert sein kann, solange die erwünschte Aktivität nicht
signifikant negativ beeinflusst wird. Der optimale Vernetzungsgrad
ist leicht durch eine Versuchsmatrix zu bestimmen, in der Dauer,
Temperatur und andere Reaktionsbedingungen variiert werden, um den
Substitutionsgrad zu verändern,
wonach die Fähigkeit
der Konjugate, auf die erwünschte
Weise zu funktionieren, bestimmt wird.
-
Das
Polymer, z.B. PEG, wird mittels zahlreicher verschiedener Verfahren,
die an sich für
die kovalente Modifikation von Proteinen mit nicht-proteinhältigen Polymeren
wie PEG bekannt sind, vernetzt. Bestimmte von diesen Verfahren werden
jedoch für
die vorliegenden Zwecke nicht bevorzugt. Cyanurchlorid-Chemie führt zu zahlreichen
Nebenreaktionen, einschließlich
Proteinvernetzung. Weiters führen
sie sehr wahrscheinlich zur Inaktivierung von Proteinen, die Sulfhydrylgruppen
enthalten. Carbonyldiimidazol-Chemie (Beauchamp et al., Anal. Biochem.
131, 25–33
(1983)) erfordert einen hohen pH (> 8,5),
der Proteine deaktivieren kann. Weiters ist ein sehr großer molarer Überschuss
an "aktiviertem
PEG" gegenüber Protein
erforderlich, da das "aktivierte PEG"-Zwischenprodukt
mit Wasser reagieren kann. Die hohen Konzentrationen an PEG, die
für die
Carbonyldiimidazol-Chemie erforderlich sind, führten auch zu Problemen bei
der Reinigung, da sowohl Gelfiltrationschromatographie als auch
Hydrophil-Chromatographie dadurch negativ beeinflusst werden. Weiters
können die
hohen Konzentrationen an "aktiviertem
PEG" Protein fällen, ein
Problem, das an sich bereits zuvor erkannt wurde (Davis, US-Patent
Nr. 4.179.337). Andererseits ist die Aldehyd-Chemie (Royer, US-Patent
Nr. 4.002.531) effizienter, da sie nur einen 40fachen molaren Überschuss
von PEG und eine 1- bis 2-tündige
Inkubation erfordert. Das von Royer zur Herstellung des PEG-Aldehyd
vorgeschlagene Mangandioxid ist jedoch aufgrund der ausgeprägten Neigung
von PEG, Komplexe mit metall-basierten
Oxidationsmitteln zu bilden, problematisch (Harris et al., J. Polym.
Sci. Polym. Chem. Ed. 22, 341–352
(1984)). Die Verwendung einer Moffatt-Oxidation unter Einsatz von
DMSO und Essigsäureanhydrid
umgeht dieses Problem. Darüber
hinaus muss das von Royer vorgeschlagene Natriumborhydrid bei hohem
pH verwendet werden und weist eine signifikante Neigung auf, Disulfidbindungen
zu reduzieren. Im Gegensatz dazu wird Natriumcyanoborhydrid, das
bei neutralem pH wirksam ist und eine sehr geringe Neigung aufweist,
Disulfidbindungen zu reduzieren, bevorzugt.
-
Funktionalisierte
PEG-Polymere zur Modifikation der OB-Protein- oder OB-Immunglobulinchimären der
vorliegenden Erfindung sind bei Shearwater Polymers, Inc. (Huntsville,
AL), erhältlich.
Solche handelsüblichen
PEG-Derivate umfassen, sind jedoch nicht beschränkt auf, Amino-PEG, PEG-Aminosäureester, PEG-Hydrazid, PEG-Thiol,
PEG-Succinat, carboxymethyliertes PEG, PEG-Propionsäure, PEG-Aminosäuren, PEG-Succinimidylsuccinat,
PEG-Succinimidylpropionat, Succinimidylester von carboxymethyliertem
PEG, Succinimidylcarbonat von PEG, Succinimidylester von Aminosäure-PEGs,
PEG-Oxycarbonylimidazol, PEG-Nitrophenylcarbonat, PEG-Tresylat,
PEG-Glycidylether, PEG-Aldehyd, PEG-Vinylsulfon, PEG-Maleinimid, PEG-Orthopyridyldisulfid,
heterofunktionelle PEGs, PEG-Vinylderivate, PEG-Silane und PEG-Phospholide.
Die Reaktionsbedingungen zur Bindung dieser PEG-Derivate hängen vom
Protein, von dem erwünschten PEGylierungsgrad
und vom verwendeten PEG-Derivat ab. Manche in die Auswahl von PEG-Derivaten
eingebundene Faktoren umfassen: den erwünschten Anbindungspunkt (Lysin
oder Cystein), hydrolytische Stabilität und Reaktivität der Derivate,
Stabilität,
Toxizität
und Antigenität
der Bindung, Eignung zur Analyse usw. Spezifische Anweisungen für die Verwendung
jedes beliebigen Derivats sind vom Hersteller erhältlich.
-
Die
Konjugate mit langer Halbwertszeit dieser Erfindung werden durch
Gelfiltration aus den nicht umgesetzten Ausgangsmaterialien getrennt.
Heterologe Spezies der Konjugate werden voneinander auf dieselbe Weise
gereinigt. Das Polymer kann auch wasserunlöslich in Form eines hydrophilen
Gels vorliegen.
-
Die
Konjugate können
auch durch Ionenaustauschchromatographie gereinigt werden. Die chemischen
Eigenschaften von zahlreichen, elektrophil aktivierten PEGs resultieren
in einer Reduktion von Aminogruppenladung des PEGylierten Produkts.
Somit kann Ionenaustauschchromatographie mit hoher Auflösung verwendet
werden, um die freien und konjugierten Proteine voneinander zu trennen
und um Spezies mit verschiedenen Graden an PEGylierung aufzulösen. Auch
ist die Auflösung
verschiedener Spezies (z.B. jene, die einen oder zwei PEG-Reste
enthalten) aufgrund der unterschiedlichen ionischen Eigenschaften
der nicht umgesetzten Aminosäuren
möglich.
-
C. Nicht-therapeutische
Verwendungen für
den WSX-Rezeptor
-
WSX-Rezeptor-Nucleinsäure ist
für die
Herstellung von WSX-Rezeptorpolypeptid durch hierin dargestellte
Rekombinationsverfahren nützlich,
das dann zur Herstellung von Anti-WSX-Rezeptorantikörper mit
verschiedenen, nachstehend beschriebenen Nützlichkeiten verwendet werden
kann.
-
Der
WSX-Rezeptor (Polypeptid oder Nucleinsäure) kann verwendet werden,
um Proliferation und/oder Differenzierung von Zellen in vitro zu
induzieren. Insbesondere wird erwogen, dass dieses Molekül verwendet werden
kann, um Proliferation von Stammzellen/Vorläuferzellen-Populationen (z.B.
CD34+-Zellpopulationen, die wie in Beispiel 8 nachstehend beschrieben
erhalten werden) zu induzieren. Diese Zellen, die ex vivo zu züchten sind,
können
gleichzeitig anderen bekannten Wachstumsfaktoren oder Cytokinen,
wie jenen, die hierin beschrieben sind, ausgesetzt werden.
-
Dies
resultiert in Proliferation und/oder Differenzierung der Zellen,
die den WSX-Rezeptor
aufweisen.
-
In
wiederum einem anderen Aspekt der Erfindung kann der WSX-Rezeptor
für Affinitätsreinigung
von WSX-Liganden verwendet werden. Kurz beschrieben umfasst dieses
Verfahren: (a) das Kontaktieren einer Quelle von WSX-Liganden mit
einem immobilisierten WSX-Rezeptor unter Bedingungen, unter denen
der zu reinigende WSX-Ligand selektiv am immobilisierten Rezeptor
adsorbiert wird; (b) das Waschen des immobilisierten WSX-Rezeptors
und seines Trägers,
um nicht-adsorbiertes Material zu entfernen; und (c) das Eluieren der
WSX-Ligandenmoleküle
aus dem immobilisierten WSX-Rezeptor, an den sie adsorbiert sind,
mit einem Elutionspuffer. In einer besonders bevorzugten Ausführungsform
von Affinitätsreinigung
bindet sich der WSX-Rezeptor kovalent an eine inerte und poröse Matrix
(z.B. Agarose, die mit Cyanogenbromid umgesetzt ist). Besonders
bevorzugt ist ein WSX-Rezeptorimmunoadhäsin, das
an eine Protein-A-Säule
immobilisiert ist. Eine Lösung,
die WSX-Liganden enthält,
wird dann durch das chromatographische Material durchgeführt. Der WSX-Ligand
adsorbiert an die Säule
und wird in weiterer Folge durch Änderung der Elutionsbedingungen
(z.B. durch Ändern
des pH oder der Ionenstärke)
freigesetzt.
-
Der
WSX-Rezeptor kann für
kompetitives Screenen von potenziellen Agonisten auf Bindung an
den WSX-Rezeptor verwendet werden. Solche Agonisten können potenzielle
Therapeutika zur Behandlung von Leiden darstellen, die durch unzulängliche
WSX-Rezeptoraktivierung gekennzeichnet sind.
-
Das
bevorzugte Verfahren zur Identifikation von Molekülen, die
sich an den WSX-Rezeptor
binden, verwendet einen chimären
Rezeptor (z.B. Epitop-markierten WSX-Rezeptor oder WSX-Rezeptor-Immunoadhäsin), gebunden
an eine Festphase wie z.B. den Well einer Testplatte. Bindung von
Molekülen,
die gegebenenfalls markiert (z.B. radioaktiv markiert) sind, an
den immobilisierten Rezeptor kann bewertet werden.
-
Um
WSX-Rezeptoragonisten zu identifizieren, kann der Thymidin-Inkorporationstest
verwendet werden.
-
Die
WSX-Rezeptorpolypeptide sind auch als Molekulargewichtsmarker nützlich.
Um ein WSX-Rezeptorpolypeptid als einen Molekulargewichtsmarker
zu verwenden, werden Gelfiltrationschromatographie oder SDS-PAGE
beispielsweise verwendet, um Protein(e) zu trennen, für die erwünscht ist,
ihr Molekulargewicht auf im Wesentlichen normale Weise zu bestimmen.
Der WSX-Rezeptor und andere Molekulargewichtsmarker werden als Standards
verwendet, um einen Bereich an Molekulargewichten bereitzustellen.
Beispielsweise können
Phosphorylase b (MG = 97.400), Rinderserumalbumin (MG = 68.000),
Ovalbumin (MG = 46.000), WSX-Rezeptor (MG = 44.800), Trypsininhibitor
(MG = 20.100) und Lysozym (MG = 14.400) als MG-Marker verwendet werden. Die anderen,
hierin erwähnten
Molekulargewichtsmarker sind im Handel bei Amersham Corporation,
Arlington Heights, IL, erhältlich.
Die Molekulargewichtsmarker sind im Allgemeinen markiert, um die
Detektion davon zu erleichtern. Beispielsweise können die Marker biotinyliert
sein und können
nach Trennung mit Streptavidin-Meerrettichperoxidase inkubiert werden,
sodass die verschiedenen Marker durch Lichtdetektion nachgewiesen
werden können.
-
Der
gereinigte WSX-Rezeptor und die für ihn kodierende Nucleinsäure können auch
als Reagenzien für
Mechanismusstudien zum WSX-Rezeptor und seinen Liganden verkauft
werden, um die Rolle des WSX-Rezeptors und des WSX-Liganden bei
normalem Wachstum und normaler Entwicklung sowie anormalem Wachstum
und anormaler Entwicklung, z.B. im Fall von Malignitäten, zu
untersuchen.
-
WSX-Rezeptorvarianten
sind als Standards oder Kontrollen in Tests für den WSX-Rezeptor, beispielsweise für ELISA,
RIA oder RRA, nützlich,
vorausgesetzt, sie werden durch das eingesetzte analytische System,
z.B. einen Anti-WSX-Rezeptorantikörper, erkannt.
-
D. WSX-Rezeptorantikörper-Herstellung
-
1. Polyklonale Antikörper
-
Polyklonale
Antikörper
werden im Allgemeinen in Tieren durch multiple subkutane (sk) oder
intraperitoneale (ip) Injektionen des relevanten Antigens und eines
Adjuvans gezüchtet.
Dadurch, dass das bevorzugte Epitop in der ECD des WSX-Rezeptors liegt,
ist es wünschenswert,
WSX-Rezeptor-ECD oder ein Molekül,
das die ECD umfasst (z.B. WSX-Rezeptorimmunoadhäsin), als das Antigen zur Bildung
von polyklonalen und monoklonalen Antikörpern zu verwenden. Es kann
nützlich
sein, das relevante Antigen an ein Protein, das in den zu immunisierenden
Spezies immunogen ist, z.B. Schlüssellochnapfschnecken-Hämocyanin,
Serumalbumin, Rinderthyroglobulin oder Sojabohnentrypsininhibitor,
unter Verwendung eines bifunktionellen oder derivatisierenden Mittels,
beispielsweise Maleinimidobenzoylsulfosuccinimidester (Konjugation
durch Cysteinreste), N-Hydroxysuccinimid (durch Lysinreste), Glutaraldehyd,
Bernsteinsäureanhydrid,
SOCl2 oder R1N=C=NR,
worin R und R1 verschiedene Alkylgruppen
sind, zu konjugieren.
-
Tiere
werden gegen das Antigen, immunogene Konjugate oder Derivate durch
Kombinieren von 1 mg oder 1 μg
des Peptids oder Konjugats (für
Kaninchen bzw. Mäuse)
mit 3 Volumina komplettem Freundschem Adjuvans und intradermales
Injizieren der Lösung
an mehreren Stellen immunisiert. Einen Monat später werden die Tiere mit 1/5
bis 1/10 der ursprünglichen
Menge von Peptid oder Konjugat in komplettem Freundschem Adjuvans
durch subkutane Injektion an mehreren Stellen geboostet. Sieben
bis 14 Tage später
wird den Tieren Blut abgenommen, und das Serum wird auf Antikörpertiter
getestet. Die Tiere werden geboostet, bis der Titer gesättigt ist.
Vorzugsweise wird das Tier mit dem Konjugat desselben Antigens,
das jedoch an ein anderes Protein und/oder durch einen anderen Vernetzer
konjugiert ist, geboostet. Konjugate können auch in rekombinanter
Zellkultur als Proteinfusionen hergestellt werden. Auch werden geeigneterweise
aggregierende Mittel wie z.B. Alaun verwendet, um die Immunantwort
zu steigern.
-
2. Monoklonale
Antikörper
-
Monoklonale
Antikörper
werden aus einer Population von im Wesentlichen homogenen Antikörpern gewonnen,
d.h. dass die einzelnen Antikörper,
aus denen die Population besteht, bis auf mögliche, natürlich vorkommende Mutationen,
die in geringen Mengen vorhanden sein können, identisch sind. Somit
bezeichnet das Adjektiv "monoklonal" die Eigenschaft
des Antikörpers,
kein Gemisch aus unterschiedlichen Antikörpern darzustellen.
-
Beispielsweise
können
die monoklonalen Antikörper
unter Verwendung des Hybridomverfahrens, das als erstes von Kohler
et al., Nature 256, 495 (1975), beschrieben wurde, hergestellt werden
oder können
durch DNA-Rekombinationsverfahren (Cabilly et al., s.o.) hergestellt
werden.
-
Im
Hybridomverfahren wird eine Maus oder ein anderes, geeignetes Wirtstier,
wie z.B. ein Hamster, wie hierin zuvor beschrieben immunisiert,
um Lymphozyten hervorzubringen, die Antikörper produzieren oder in der
Lage sind, diese zu produzieren, die sich spezifisch an das zur
Immunisierung verwendete Protein binden. Alternativ dazu können Lymphozyten
in vitro immunisiert werden. Lymphozyten werden dann mit Myelomzellen
unter Verwendung eines geeigneten Fusionsmittels, wie z.B. Polyethylenglykol,
fusioniert, um eine Hybridomzelle zu bilden (Goding, Monoclonal
Antibodies: Principles and Practice, Academic Press, 59–103 (1986)).
-
Die
so hergestellten Hybridomzellen werden überimpft und in einem geeigneten
Kulturmedium, das vorzugsweise eine oder mehrere Substanzen enthält, die
das Wachstum oder Überleben
der nicht fusionierten, parentalen Myelomzellen inhibieren, gezüchtet. Fehlt
beispielsweise den parentalen Myelomzellen das Enzym Hypoxanthinguaninphosphoribosyltransferase
(HGPRT oder HPRT), so umfasst das Kulturmedium für die Hybridome typischerweise
Hypoxanthin, Aminopterin und Thymidin (HAT-Medium), Substanzen,
die das Wachstum von HGPRT-defizienten Zellen unterbinden.
-
Bevorzugte
Myelomzellen sind jene, die wirksam fusionieren, stabile, hochgradige
Produktion von Antikörper
durch die ausgewählten
Antikörper-produzierenden
Zellen unterstützen
und gegenüber
einem Medium wie beispielsweise HAT-Medium empfindlich sind. Zu
diesen bevorzugten Myelomzelllinien zählen Maus-Myelomlinien, wie
z.B. jene, die von MOPC-21- und MPC-11-Maustumoren abstammen, die
beim Salk Institute Cell Distribution Center, San Diego, Kalifornien,
USA, erhältlich
sind, und SP-2-Zellen, die bei der American Type Culture Collection,
Rockville, Maryland, USA, erhältlich
sind. Menschliche Myelom- und Maus-Mensch-Heteromyelom-Zelllinien
wurden auch bereits zur Herstellung von menschlichen monoklonalen Antikörpern beschrieben
(Kozbor, J. Immunol. 133, 3001 (1984); Brodeur et al., Monoclonal
Antibody Production Techniques and Applications, Marcel Dekker,
Inc., New York, 51–63
(1987)).
-
Kulturmedium,
in dem Hybridomzellen wachsen, wird auf Produktion von monoklonalen
Antikörpern, die
gegen das Antigen gerichtet sind, getestet. Vorzugsweise wird die
Bindungsspezifität
von monoklonalen Antikörpern,
die durch Hybridomzellen produziert werden, mittels Immunfällung oder
durch einen In-vitro-Bindungstest, wie z.B. Radioimmuntest (RIA)
oder enzymgekoppelte Immunadsorptionsbestimmung (ELISA), bestimmt.
-
Die
Bindungsaffinität
des monoklonalen Antikörpers
kann beispielsweise durch die Scatchard-Analyse von Munson et al.,
Anal. Biochem. 107, 220 (1980), bestimmt werden.
-
Nachdem
Hybridomzellen identifiziert wurden, die Antikörper mit der erwünschten
Spezifität,
Affinität und/oder
Aktivität
produzieren, können
die Klone durch Grenzverdünnungsverfahren
subkloniert und mittels herkömmlicher
Verfahren gezüchtet
werden (Goding, s.o.). Geeignete Kulturmedien für diesen Zweck umfassen beispielsweise
D-MEM- oder RPMI-1640-Medium. Weiters können die Hybridomzellen in
vivo als Ascites-Tumoren in einem Tier gezüchtet werden.
-
Die
monoklonalen Antikörper,
die von den Subklonen sekretiert werden, werden geeigneterweise
aus dem Kulturmedium, der Ascites-Flüssigkeit oder dem Serum durch
herkömmliche
Immunglobulinreinigungsverfahren, wie beispielsweise Protein-A-Sepharose, Hydroxylapatitchromatographie,
Gelelektrophorese, Dialyse oder Affinitätschromatographie, getrennt.
-
DNA,
die für
die monoklonalen Antikörper
kodiert, wird leicht und unter Verwendung von herkömmlichen
Verfahren (z.B. unter Verwendung von Oligonucleotidsonden, die in
der Lage sind, sich spezifisch an Gene, die für die Schwer- und Leichtketten
von Maus-Antikörpern
kodieren, zu binden) isoliert und sequenziert. Die Hybridomzellen
dienen als eine bevorzugte Quelle für solche DNA. Nachdem sie isoliert
wurde, kann DNA in Expressionsvektoren platziert werden, die dann
in Wirtszellen wie beispielsweise E.-coli-Zellen, Affen-COS-Zellen,
Chinahamster-Eierstock- (CHO-) Zellen oder Myelomzellen transfiziert
werden, die sonst kein Immunglobulinprotein produzieren, um die
Synthese von monoklonalen Antikörpern
in den rekombinanten Wirtszellen zu erreichen. Artikel, die einen Überblick über rekombinante
Expression in Bakterien von DNA, die für den Antikörper kodiert, geben, umfassen
Skerra et al., Curr. Opinion in Immunol. 5, 256–262 (1993), und Plückthun,
Immunol. Revs. 130, 151–188
(1992).
-
In
einer weiteren Ausführungsform
können
Antikörper
oder Antikörperfragmente
aus Antikörperphagenbibliotheken
isoliert werden, die unter Verwendung von Verfahren erstellt wurden,
welche in McCafferty et al., Nature 348, 552–554 (1990), beschrieben sind.
Clackson et al., Nature 352, 624–628 (1991), und Marks et al.,
J. Mol. Biol. 222, 581–597
(1991), beschreiben das Isolieren von Maus- bzw. menschlichen Antikörpern unter
Verwendung von Phagenbibliotheken. Nachfolgende Publikationen beschreiben
die Herstellung von menschlichen Hochaffinitäts- (im nM-Bereich) Antikörpern durch
Ketten-Shuffling (Mark et al., Bio/Technology 10, 779–783 (1992))
sowie kombinatorische Infektion und In-vivo-Rekombination als eine
Vorgehensweise zur Konstruktion von sehr großen Phagenbibliotheken (Waterhouse
et al., Nuc. Acids. Res. 21, 2265–2266 (1993)). Somit sind diese
Verfahren gut einsetzbare Alternativen zu herkömmlichen Verfahren für monoklonale Antikörperhybridome
zur Isolierung von monoklonalen Antikörpern.
-
Die
DNA kann auch beispielsweise durch Substituieren der Kodiersequenz
für menschliche
konstante Schwerketten- und Leichtkettendomänen anstelle der homologen
Maussequenzen (Cabilly et al., s.o.; Morrison et al., Proc. Nat.
Acad. Sci. USA 81, 6851 (1984)) oder durch kovalentes Binden der
gesamten Kodiersequenz für
ein Nicht-Immunglobulin-Poylpeptid oder eines Teils davon an die
für Immunglobulin
kodierende Sequenz modifiziert werden.
-
Typischerweise
werden solche Nicht-Immunglobulin-Polypeptide anstelle der konstanten
Domänen
eines Antikörpers
substituiert, oder sie werden anstelle der variablen Domänen einer
Antigen-Kombinationsstelle eines Antikörpers eingesetzt, um einen
chimären,
zweiwertigen Antikörper
zu schaffen, der eine Antigen-Kombinationsstelle
mit Spezifität
für ein
Antigen und eine andere Antigen-Kombinationsstelle
mit Spezifität
für ein
anderes Antigen umfasst.
-
Chimäre oder
hybride Antikörper
können
auch in vitro unter Verwendung von Verfahren, die auf dem Gebiet
der Protein-Synthesechemie bekannt sind, einschließlich jener,
die Vernetzungsmittel einbinden, hergestellt werden. Beispielsweise
können
Immunotoxine unter Verwendung einer Disulfid-Austauschreaktion oder
durch Bilden einer Thioetherbindung konstruiert werden. Beispiele
für geeignete
Reagenzien für
diesen Zweck umfassen Iminothiolat und Methyl-4-mercaptobutyrimidat.
-
3. Humanisierte
und menschliche Antikörper
-
Verfahren
zur Humanisierung von nicht-menschlichen Antikörpern sind auf dem Gebiet der
Erfindung bekannt. Im Allgemeinen weist ein humanisierter Antikörper einen
oder mehrere Aminosäurereste
auf, die aus einer Quelle, die nicht-menschlich ist, in ihn eingeführt wurden.
Diese nicht-menschlichen Aminosäurereste werden
häufig
als "Import"-Reste bezeichnet,
die typischerweise von einer variablen "Import"-Domäne
bezogen werden. Humanisierung kann im Wesentlichen gemäß dem Verfahren
von Winter und Mitarbeitern (Jones et al., Nature 321, 522–525 (1986);
Riechmann et al., Nature 332, 323–327 (1988); Verhoeyen et al.,
Science 239, 1534–1536
(1988)) durch Substituieren von Nagetier-CDRs oder CDR-Sequenzen
anstelle der entsprechenden Sequenzen eines menschlichen Antikörpers erfolgen.
Demgemäß sind solche "humanisierten" Antikörper chimäre Antikörper (Cabilly
et al., s.o.), worin im Wesentlichen weniger als eine intakte menschliche
variable Domäne
durch die entsprechende Sequenz aus einer nicht-menschlichen Spezies
substituiert ist. In der Praxis sind humanisierte Antikörper typischerweise
menschliche Antikörper,
in denen manche CDR-Reste und möglicherweise
manche FR-Reste durch Reste aus analogen Stellen in Nagetier-Antikörpern substituiert
wurden.
-
Die
Auswahl der menschlichen variablen Domänen, sowohl der leichten als
auch der schweren, die bei der Herstellung der humanisierten Antikörper zu
verwenden sind, ist sehr wichtig, um Antigenität zu reduzieren. Gemäß der so
genannten "Methode
der optimalen Anpassung" wird
die Sequenz der variablen Domäne
eines Nagetier-Antikörpers gegen
die gesamte Bibliothek bekannter Sequenzen menschlicher variabler
Domänen
gescreent. Die menschliche Sequenz, die jener des Nagetiers am ähnlichsten
ist, wird dann als das menschliche Gerüst (FR) für die humanisierten Antikörper ausgewählt (Sims
et al., J. Immunol. 151, 2296 (1993); Chothia et al., J. Mol. Biol.
196, 901 (1987)). Ein anderes Verfahren verwendet ein bestimmtes
Gerüst, das
von der Consensus-Sequenz aller menschlichen Antikörper einer
bestimmten Untergruppe von Leicht- oder Schwerketten abgeleitet
ist. Dasselbe Gerüst
kann für
mehrere unterschiedliche humanisierte Antikörper verwendet werden (Carter
et al., Proc. Natl. Acad. Sci. USA 89, 4285 (1992); Presta et al.,
J. Immunol. 151, 2623 (1993)).
-
Weiters
ist es wichtig, dass Antikörper
unter Beibehaltung von hoher Affinität zum Antigen und anderer günstiger
biologischer Eigenschaften humanisiert werden. Um dieses Ziel zu
erreichen, werden gemäß einem bevorzugten
Verfahren humanisierte Antikörper
mittels eines Verfahrens der Analyse der parentalen Sequenzen und
verschiedener konzeptueller humanisierter Produkte unter Verwendung
von dreidimensionalen Modellen der parentalen und humanisierten
Sequenzen hergestellt. Dreidimensionale Immunglobulinmodelle sind üblicherweise
erhältlich
und sind Fachleuten bekannt. Auch sind Computerprogramme verfügbar, die
mögliche dreidimensionale
Konformationsstrukturen ausgewählter
Kandidaten-Immunglobulinsequenzen veranschaulichen und darstellen.
Eine Untersuchung dieser Darstellungen ermöglicht die Analyse der wahrscheinlichen Rolle
der Reste, die sie bei der Funktion der Kandidaten-Immunglobulinsequenz
spielen, d.h. die Analyse von Resten, die die Fähigkeit des Kandidaten-Immunglobulins
beeinflussen, sich an sein Antigen zu binden. Auf diese Weise können FR-Reste
selektiert und aus den Consensus- und Importsequenzen kombiniert
werden, sodass die erwünschte
Antikörpereigenschaft,
wie z.B. gesteigerte Affinität
für Targetantigen(e),
erlangt wird. Im Allgemeinen spielen die CDR-Reste eine direkte
und sehr wesentliche Rolle bei der Beeinflussung der Antigenbindung.
-
Alternativ
dazu ist es nun möglich,
transgene Tiere (z.B. Mäuse)
herzustellen, die in der Lage sind, bei Immunisierung ein vollständiges Repertoire
an menschlichen Antikörpern
ohne endogener Immunglobulinproduktion zu produzieren. Beispielsweise
wurde beschrieben, dass die homozygote Deletion des Antikörper-Schwerketten-Bindungsregions-
(JH-) Gens bei chimären und Keimlinien-mutierten
Mäusen
zu einer vollständigen
Inhibition endogener Antikörperproduktion
führt.
Transfer der menschlichen Keimlinien-Immunglobulin-Genanordnung
in solchen Keimlinien-mutierten Mäusen resultiert in der Produktion
von menschlichen Antikörpern
bei Antigen-Provokation.
Siehe z.B. Jakobovits et al., Proc. Natl. Acad. Sci. USA 90, 2551
(1993); Jakobovits et al., Nature 362, 255–258 (1993); Bruggermann et
al., Year in Immuno. 7, 33 (1993). Menschliche Antikörper können auch
in Phagendisplay-Biblitoheken
produziert werden (Hoogenboom et al., J. Mol. Biol. 227, 381 (1991);
Marks et al., J. Mol. Biol. 222, 581 (1991)).
-
4. Bispezifische Antikörper
-
Bispezifische
Antikörper
(BsAbs) sind Antikörper,
die Bindungsspezifitäten
für zumindest
zwei verschiedene Antigene aufweisen. BsAbs können als Tumor-Targeting- oder -Bildgebungs-Mittel
verwendet werden und können
verwendet werden, um Enzyme oder Toxine auf eine Zelle, die den
WSX-Rezeptor aufweist, zu richten. Solche Antikörper können von Volllängenantikörpern oder
Antikörperfragmenten
(z.B. F(ab')2-bispezifische Antikörper) abstammen. Gemäß der vorliegenden
Erfindung kann der BsAb einen Arm aufweisen, der den WSX-Rezeptor
bindet, und einen anderen Arm, der ein Cytokin oder einen anderen
Cytokinrezeptor (oder eine Untereinheit davon), wie z.B. die Rezeptoren
für TPO,
EPO, G-CSF, IL-4, IL-7, GH, PRL; die α- oder β-Untereinheiten der IL-3-, GM-CSF-,
IL-5-, IL-6-, LIF-, OSM- und CNTF-Rezeptoren; oder die α-, β- oder γ-Untereinheiten
des IL-2-Rezeptorkomplexes, bindet. Beispielsweise kann der BsAb
WSX-Rezeptor und gp130 binden.
-
Verfahren
zur Herstellung bispezifischer Antikörper sind auf dem Gebiet der
Erfindung bekannt. Herkömmliche
Herstellung von bispezifischen Volllängen-Antikörpern basiert auf der Coexpression
von zwei Immunglobulin-Schwerketten-Leichtketten-Paaren, worin die zwei Ketten verschiedene
Spezifitäten
aufweisen (Millstein et al., Nature 305, 537–539 (1983)). Aufgrund der
zufälligen
Zusammenstellung von Immunglobulin-Schwer- und -Leichtketten produzieren
diese Hybridome (Quadrome) ein potenzielles Gemisch aus 10 verschiedenen
Antikörpermolekülen, von
denen nur eines die korrekte bispezifische Struktur aufweist. Reinigung des
korrekten Moleküls,
die üblicherweise
mittels Affinitätschromatographieschritten
erfolgt, ist eher aufwendig, und die Produktausbeuten sind gering. Ähnliche
Verfahren sind in der WO 93/08829, veröffentlicht am 13. Mai 1993,
und in Traunecker et al., EMBO J. 10, 3655–3659 (1991), offenbart.
-
Gemäß einem
anderen und noch bevorzugteren Ansatz werden variable Antikörper-domänen mit
erwünschten
Bindungsspezifitäten
(Antikörper-Antigen-Kombinationsstellen)
an Immunglobulin-Konstantdomänensequenzen
fusioniert. Die Fusion erfolgt vorzugsweise mit einer konstanten
Immunglobulin-Schwerkettendomäne,
die zumindest einen Teil der Gelenks-, CH2- und CH3-Regionen umfasst.
Es wird bevorzugt, dass sie die erste konstante Schwerkettenregion
(CH1), die die für
Leichtkettenbindung erforderliche Stelle enthält, in zumindest einer der
Fusionen enthält.
DNAs, die für
die Immunglobulin-Schwerkettenfusionen und, sofern erwünscht, die
Immunglobulinleichtkette kodieren, werden in getrennte Expressionsvektoren
insertiert und in einen geeigneten Wirtsorganismus co-transfiziert.
Dies sorgt für
große
Flexibilität
beim Einstellen der gegenseitigen Anteile der drei Polypeptidfragmente
in Ausführungsformen,
in denen ungleiche Verhältnisse
der drei Polypeptidketten, die zur Konstruktion verwendet werden,
die optimalen Ausbeuten liefern. Es ist jedoch möglich, die Kodiersequenzen
für zwei
oder alle drei Polypeptidketten in einen Expressionsvektor zu insertieren, wenn
die Expression von zumindest zwei Polypeptidketten in gleichen Verhältnissen
zu höheren
Ausbeuten führt
oder wenn die Verhältnisse
keinen signifikanten Einfluss haben.
-
In
einer bevorzugten Ausführungsform
dieses Ansatzes setzen sich die bispezifischen Antikörper aus einer
Hybridimmunglobulin-Schwerkette mit einer ersten Bindungsspezifität in einem
Arm und einem Hybridimmunglobulin-Schwerketten-Leichtkettenpaar (das eine zweite bispezifische
Bindung bereitstellt) im anderen Arm zusammen. Es wurde erkannt,
dass diese asymmetrische Struktur die Trennung der erwünschten
bispezifischen Verbindung von unerwünschten Immunglobulinkettenkombinationen
erleichtert, da die Gegenwart einer Immunglobulin-Leichtkette in
nur einer Hälfte
des bispezifischen Moleküls
für einen
leichten Trennungsvorgang sorgt. Dieser Ansatz ist in der WO 94104690,
veröffentlicht
am 3. März
1994, offenbart. Weitere Details zur Herstellung bispezifischer
Antikörper
sind beispielsweise in Suresh et al., Methods in Enzymology 121,
210 (1986), zu finden.
-
Bispezifische
Antikörper
umfassen vernetzte oder "Heterokonjugat"-Antikörper. Beispielsweise
kann einer der Antikörper
im Heterokonjugat an Avidin, der andere an Biotin gebunden sein.
Solche Antikörper
wurden beispielsweise vorgeschlagen, um Immunsystemzellen auf unerwünschte Zellen
zu richten (US-Patent Nr. 4.676.980), und wurden auch zur Behandlung
von HIV-Infektion vorgeschlagen (WO 91/00360, WO 92/200373 und
EP 03089 ). Heterokonjugat-Antikörper können unter
Verwendung jedes herkömmlichen
Vernetzungsverfahrens hergestellt werden. Geeignete Vernetzungsmittel
sind auf dem Gebiet der Erfindung bekannt und werden im US-Patent Nr. 4.676.980
zusammen mit zahlreichen Vernetzungsverfahren offenbart.
-
Verfahren
zur Herstellung bispezifischer Antikörper aus Antikörperfragmenten
werden auch in der Literatur beschrieben. Die folgenden Verfahren
können
ebenfalls zur Herstellung zweiwertiger Antikörperfragmente verwendet werden,
die nicht notwendigerweise bispezifisch sind. Gemäß diesen
Verfahren können Fab'-SH-Fragmente aus
E. coli gewonnen werden, die chemisch gebunden werden können, um
zweiwertige Antikörper
zu bilden. Shalaby et al., J. Exp. Med. 175, 217–225 (1992), beschreiben die
Herstellung eines vollständig
humanisierten BsAb-F(ab')2-Moleküls.
Jedes Fab'-Fragment
wurde getrennt aus E. coli sekretiert und gerichteter chemischer
Bindung in vitro unterzogen, um den BsAb zu bilden. Der so gebildete
BsAb war in der Lage, sich an Zellen zu binden, die den HER2-Rezeptor
und normale menschliche T-Zellen überexprimieren, sowie
die lytische Aktivität
von menschlichen zytotoxischen Lymphozyten gegen menschliche Brusttumor-Targets
auszulösen.
Siehe auch Rodrigues et al., Int. J. Cancers (Beilage) 7, 45–50 (1992).
-
Verschiedene
Verfahren zur Herstellung und Isolierung zweiwertiger Antikörperfragmente
direkt aus rekombinanter Zellkultur wurden ebenfalls bereits beschrieben.
Beispielsweise wurden zweiwertige Heterodimere unter Verwendung
von Leucinzippern hergestellt. Kostelny et al., J. Immunol. 148(5),
1547–1553
(1992). Die Leucinzipper-Peptide
aus den Fos- und Jun-Proteinen wurden an die Fab'-Abschnitte von zwei verschiedenen Antikörpern mittels
Genfusion gebunden. Die Antikörper-Homodimere
wurden an der Gefenksregion reduziert, um Monomere zu bilden, und
dann reoxidiert, um die Antikörper-Heterodimere
zu bilden. Die "Diabody"-Technologie, die
von Hollinger et al. in Proc. Natl. Acad. Sci. USA 90, 6444–6448 (1993),
beschrieben wird, stellt einen alternativen Mechanismus zur Herstellung
von BsAb-Fragmenten bereit. Die Fragmente umfassen eine variable
Schwerkettendomäne
(VH), gebunden an eine variable Leichtkettendomäne (VL) über
einen Linker, der zu kurz ist, um Paarbildung zwischen den zwei
Domänen
an derselben Kette zu ermöglichen.
Demgemäß werden
die VH- und VL-Domänen eines
Fragments gezwungen, mit den komplementären VL-
und VH-Domänen eines anderen Fragments
Paare zu bilden, wodurch zwei Antigen-Bindungsstellen gebildet werden. Auch
von einer anderen Vorgehensweise zur Herstellung von BsAb-Fragmenten
durch die Verwendung von ein kettigen Fv- (sFv-) Dimeren wurde bereits
berichtet. Siehe Gruber et al., J. Immunol. 152, 5368 (1994).
-
5. Antikörper-Screenen
-
Es
kann wünschenswert
sein, Antikörper
mit einer starken Bindungsaffinität für den WSX-Rezeptor zu selektieren.
Antikörperaffinitäten können beispielsweise
durch Sättigungsbindung;
enzymgekoppelte Immunadsorptionsbestimmung (ELISA); und Konkurrenztests
(z.B. RIAs) bestimmt werden. Der Antikörper mit einer starken Bindungsaffinität kann den
WSX-Rezeptor mit einem Bindungsaffinitäts- (Kd-)
Wert von nicht mehr als etwa 1 × 10–7 M,
vorzugsweise nicht mehr als etwa 1 × 10–8 M,
und am meisten bevorzugt von nicht mehr als etwa 1 × 10–9 M
(z.B. bis etwa 1 × 10–12 M),
binden.
-
In
einer anderen Ausführungsform
kann auf einen Antikörper
gescreent werden, der ein WSX-Rezeptorepitop von Interesse bindet.
Beispielsweise kann ein Antikörper,
der sich an das Epitop bindet, das durch den Antikörper 2D7,
1G4, 1E11 oder 1C11 (siehe Beispiel 13) oder Antikörperklon
Nr. 3, Nr. 4 oder Nr. 17 (siehe Beispiel 14) gebunden ist, identifiziert
werden. Um auf Antikörper
zu screenen, die sich an das Epitop am WSX-Rezeptor binden, das
durch einen Antikörper
von Interesse gebunden ist (z.B. jene, die Bindung von jedem beliebigen
der oben genannten Antikörper
an WSX-Rezeptor blockieren), kann ein routinemäßiger Kreuzblockierungs-Test,
wie jener, der in Antibodies, A Laboratory Manual, Cold Spring Harbor
Laboratory, Ed Harlow & David
Lane (1988), beschrieben wird, durchgeführt werden. Alternativ dazu
kann Epitop-Kartierung, z.B. wie in Champe et al., J. Biol. Chem.
270, 1388–1394
(1995), beschrieben wird, durchgeführt werden, um zu bestimmen,
ob der Antikörper
ein Epitop von Interesse bindet.
-
In
einer besonders bevorzugten Ausführungsform
der Erfindung werden Agonistenantikörper ausgewählt. Verschiedene Verfahren
zur Selektion von Agonistenantikörpern
sind verfügbar.
In einer Ausführungsform
werden die Agonisten-Eigenschaften
des Antikörpers
bei Bindung an einen chimären
Rezeptor, der die ext razelluläre
WSX-Rezeptordomäne
umfasst, in einem Test, der als enzymgekoppelte Immunadsorptionsbestimmung
durch Kinase-Rezeptor-Aktivierung (KIRA-ELISA) bezeichnet wird,
beschrieben in der WO 95/14930 (hierin ausdrücklich durch Verweis aufgenommen),
bewertet.
-
Um
den KIRA-ELISA durchzuführen,
wird ein chimärer
Rezeptor, der die extrazelluläre
Domäne
des WSX-Rezeptors und die Transmembran- und intrazelluläre Domäne von Rse-Rezeptor
umfasst (Mark et al., Journal of Biological Chemistry 269(14), 10720–10728 (1994)),
mit einer Carboxyl-terminalen Herpes-Simplex-Virus-Glykoprotein-D- (gD-)
Markierung hergestellt, und dp12.CHO-Zellen werden hiermit wie in
Beispiel 4 der WO 95/14930 beschrieben transformiert.
-
Die
WSX/Rse.gD-transformierten dp12.CHO-Zellen werden in die Wells einer
Flachboden-96-Well-Kulturplatte in 100 μl Medium überimpft (3 × 104 pro Well) und über Nacht bei 37°C in 5% CO2 kultiviert. Am darauf folgenden Morgen
werden die Well-Überstände entfernt,
und verschiedene Konzentrationen des Antikörpers werden zu den einzelnen
Wells zugesetzt. Die Zellen werden bei 37°C 30 min lang stimuliert, die
Well-Überstände werden
dekantiert. Um die Zellen zu lysieren und die chimären Rezeptoren
löslich zu
machen, werden 100 μl
von Lysepuffer zu jedem Well zugesetzt. Die Platte wird dann auf
einem Plattenschüttler
(Bellco Instruments, Vineland, NJ) 60 min lang bei Raumtemperatur
leicht geschüttelt.
-
Während die
Zellen solubilisiert werden, wird eine ELISA-Mikrotiterplatte (Nunc
Maxisorp, Inter Med, Dänemark),
die über
Nacht bei 4°C
mit dem monoklonalen 5B6-Anti-gD-Antikörper (5,0 μg/ml in 50
mM Carbonatpuffer, pH 9,6, 100 μl/Well)
beschichtet wurde, dekantiert und mit 150 μl/Well Block-Buffer 60 min lang bei
Raumtemperatur blockiert. Nach 60 Minuten wird die Anti-gD-5B6-beschichtete
Platte sechsmal mit Waschpuffer (PBS mit 0,05% TWEEN 20TM und
0,01% Thimerosal) gewaschen.
-
Das
solubilisiertes WSX/Rse.gD enthaltende Lysat aus dem Zellkultur-Mikrotiterwell
wird (85 μl/Well) zu
Anti-gD-5B6-beschichtetem und blockiertem ELISA-Well transfe riert
und 2 h lang bei Raumtemperatur inkubiert. Das ungebundene WSX/Rse.gD
wird durch Waschen mit Waschpuffer entfernt, und 100 μl biotinyliertes
4G10 (Anti-Phosphotyrosin),
verdünnt
1:18.000 in Verdünnungspuffer
(PBS, die 0,5% BSA, 0,05% Tween-20, 5 mM EDTA und 0,01% Thimerosal
enthält),
d.h. 56 ng/ml, werden zu jedem Well zugesetzt. Nach 2-stündiger Inkubation
bei Raumtemperatur wird die Platte gewaschen, und HRPO-konjugiertes
Streptavidin (Zymed Laboratories, S. San Francisco, CA) wird zu
jedem Well zugesetzt. Die Platte wird 30 min lang bei Raumtemperatur
unter leichtem Schütteln
inkubiert. Das freie Avidin-Konjugat wird abgewaschen, und 100 μl frisch
hergestellte Substratlösung
(Tetramethylbenzidin (TMB); 2-Komponenten-Substratset; Kirkegaard & Perry, Gaithersburg,
MD) werden zu jedem Well zugesetzt. Die Reaktion wird 10 min lang
laufen gelassen, wonach die Farbentwicklung durch den Zusatz von
1,0 M H3PO4, 100 μl/Well, gestoppt
wird. Die Absorption bei 450 nm wird mit einer Bezugswellenlänge von
650 nm (ABS450/650) unter Verwendung eines νmax-Plattenlesers (Molecular
Devices, Palo Alto, CA), gesteuert durch einen Macintosh Centris
650 (Apple Computers, Cupertino, CA) und DeltaSoft-Software (BioMetallics,
Inc., Princton, NJ), abgelesen.
-
Jene
Antikörper,
die einen IC50 im KIRA-ELISA von etwa 0,5 μg/ml oder weniger (z.B. von
etwa 0,5 μg/ml
bis etwa 0,001 μg/ml),
vorzugsweise von etwa 0,2 μg/ml
oder weniger und am meisten bevorzugt von etwa 0,1 μg/ml oder
weniger, aufweisen, sind bevorzugte Agonisten.
-
In
einer anderen Ausführungsform
wird auf Antikörper
gescreent, die Stromab-Signalgebungsmoleküle für OB-Protein
aktivieren. Beispielsweise kann die Fähigkeit des Antikörpers, Signal-Transduktoren
und -Aktivatoren von Transkription (STATs) zu aktivieren, bewertet
werden. Der Agonistenantikörper
von Interesse kann beispielsweise Bildung von STAT-1- und STAT-3-Komplexen
stimulieren. Um auf solche Antikörper
zu screenen, kann der in Rosenblum et al., Endocrinology 137(11),
5178–5181
(1996), beschriebene Test durchgeführt werden.
-
Alternativ
dazu kann ein Antikörper,
der Proliferation und/oder Differenzierung von blutbildenden Zellen
stimuliert, selektiert werden. Beispielsweise können die Häma topoese-Tests aus Beispiel
10 durchgeführt werden.
Maus-Fötalleber-flASK-Zellen
können
beispielsweise aus der fötalen
Leber mittleren Gestationsalters, wie in Zeigler et al., Blood 84,
2422–2430
(1994), beschrieben wird, isoliert und in Stammzellen-Suspensionskultur
oder Methylcellulosetests untersucht werden. Für die Stammzellen-Suspensionskulturen
werden 20.000 flASK-Zelten in einzelne Wells in einem 12-Well-Format
in DMEM-4.5/F12-Medium, ergänzt
mit 10% hitzedeaktiviertem fötalem
Kälberserum
(Hyclone, Logan, UT) und L-Glutamin, überimpft. Wachstumsfaktoren werden
in den folgenden Konzentrationen zugesetzt: Kit-Ligand (KL) bei
25 ng/ml, Interleukin-3 (IL-3) bei 25 ng/ml, Interleukin-6 (IL-6)
bei 50 ng/ml, G-CSF
bei 100 ng/ml, GM-CSF bei 100 ng/ml, EPO bei 2 U/ml, Interleukin-7
(IL-7) bei 100 ng/ml (alle Wachstumsfaktoren von R and D Systems,
Minneapolis, MN). Der Agonistenantikörper wird dann zugesetzt, und
die Fähigkeit
des Antikörpers,
die in Suspensionskultur gezüchteten flASK-Zellen
auszubreiten, wird getestet. Methylcellulosetests werden wie zuvor
beschrieben (Zeiger et al., s.o.) durchgeführt. Kurz zusammengefasst werden
Methylcellulosekolonietests unter Verwendung von "komplettem" Methylcellulose-
oder Prä-B-Methylcellulosemedium
(Stem Cell Technologies, Vancouver, British Columbia, Kanada) unter
Zusatz von 25 ng/ml KL (R and D Systems, Minneapolis, MN) durchgeführt. Cytospin-Analysen
der resultierenden Kolonien werden wie zuvor in Zeigler et al. beschrieben
durchgeführt.
Die Fähigkeit
des Agonistenantikörpers,
Knochenmark-, Lymph- und Erythrozyten-Koloniebildung zu steigern, wird bewertet.
Auch kann die Wirkung des Agonistenantikörpers auf die Maus-Knochenmark-Stammzellenpopulation,
LinIoSca+, bewertet
werden.
-
Es
kann ein Agonistenantikörper
selektiert werden, der eine statistisch signifikante Reduktion des
Körpergewichts
und/oder Fettdepotgewichts und/oder der Nahrungsmittelaufnahme bei
einem adipösen
Säugetier
(z.B. bei einer ob/ob-Maus) induziert. Verfahren zum Screenen auf
solche Moleküle
werden beispielsweise in Levin et al., Proc. Natl. Acad. Sci. USA
93, 1726–1730
(1996), beschrieben. Bevorzugte Agonistenantikörper sind jene, die fettreduzierende
Wirkungen bei einem adipösen
Säugetier
wie z.B. der ob/ob-Maus zeigen, die stärkere Wirkungen sind als jene,
die durch reduzierte Nahrungsmittelaufnahme induziert werden.
-
Der
Antikörper
von Interesse kann die Reste einer hypervariablen Region von einem
der Antikörper aus
den Beispielen 13 und 14 aufweisen. Auch umfasst die Erfindung "affinitätsgereifte" Formen dieser Antikörper, in
denen Reste der hypervariablen Region dieser Antikörper modifiziert
wurden. Solche affinitätsgereiften
Antikörper
weisen vorzugsweise eine biologische Aktivität auf, die dieselbe oder eine
bessere ist als jene des ursprünglichen
Antikörpers.
Die affinitätsgereiften
Antikörper
können
etwa 1–10,
z.B. 5–10,
Deletionen, Insertionen oder Substitutionen (jedoch vorzugsweise
Substitutionen) in den hypervariablen Regionen davon aufweisen.
Ein nützliches
Verfahren zur Bildung von affinitätsgereiften Antikörpern wird
als "Alanin-Scanning-Mutagenese" bezeichnet (Cunningham & Wells, Science
244, 1081–1085
(1989)). Hierin werden ein oder mehrere Rest(e) der hypervariablen
Region durch Alanin- oder Polyalaninrest(e) ersetzt, um die Wechselwirkung
der Aminosäuren
mit dem WSX-Rezeptor zu beeinflussen. Jene(r) Rest(e) hypervariabler
Regionen, der/die funktionelle Empfindlichkeit gegenüber Substitution
aufweist/aufweisen, wird/werden dann durch Einführen weiterer oder anderer
Mutationen an oder anstelle der Substitutionsstellen verfeinert.
Die auf diese Weise produzierten ala-Mutanten werden auf ihre biologische
Aktivität
wie hierin beschrieben gescreent. Ein anderes Verfahren ist Affinitätsmutation
unter Verwendung von Phagendisplay (Hawkins et al., J. Mol. Biol.
254, 889–896
(1992), und Lowman et al., Biochemistry 30(45), 10832–10837 (1991)).
Kurz zusammengefasst werden Stellen hypervariabler Regionen (z.B.
6–7 Stellen)
mutiert, um alle möglichen
Amino-Substitutionen an jeder Stelle zu bilden. Die so gebildeten
Antikörper-Mutanten
werden einwertig aus filamentösen
Phagenpartikeln als Fusionen an das Gen-III-Produkt von M13, gepackt
innerhalb jedes einzelnen Partikels, dargestellt. Die mittels Phagendisplay
dargestellten Mutanten werden dann auf ihre biologische Aktivität (z.B.
Bindungsaffinität)
gescreent.
-
6. Antikörpermodifikationen
-
Es
kann wünschenswert
sein, den Antikörper
für verschiedene
Anwendungen spezifisch zu gestalten. Beispiele für Antikörpermodifikationen werden nachstehend
beschrieben.
-
In
bestimmten Ausführungsformen
der Erfindung kann es wünschenswert
sein, ein Antikörperfragment zu
verwenden, und nicht einen intakten Antikörper. In diesem Fall kann es
wünschenswert
sein, das Antikörperfragment
zu modifizieren, um seine Serum-Halbwertszeit zu steigern. Dies
kann beispielsweise durch Inkorporation eines Salvage-Rezeptorbindungsepitops
in das Antikörperfragment
erreicht werden. Siehe die WO 96/32478, veröffentlicht am 17. Oktober 1996.
Alternativ dazu kann der Antikörper
an ein nicht-proteinhältiges Polymer
konjugiert werden, wie beispielsweise jene, die zuvor für die Herstellung
von OB-Proteinderivaten mit langer Halbwertszeit beschrieben wurden.
-
Ist
der Antikörper
zu verwenden, um beispielsweise Krebs zu behandeln, so werden verschiedene
Modifikationen des Antikörpers
(z.B. eines neutralisierenden Antikörpers), die die Wirksamkeit
des Antikörpers
zur Behandlung von Krebs steigern, hierin in Erwägung gezogen. Beispielsweise
kann es wünschenswert
sein, den Antikörper
der Erfindung hinsichtlich der Effektorfunktion zu modifizieren.
Beispielsweise können
Cysteinrest(e) in die Fc-Region eingeführt werden, wodurch Zwischenketten-Disulfidbindungsbildung
in dieser Region ermöglicht
wird. Der so gebildete homodimere Antikörper kann verbesserte Internalisierungsfähigkeit
und/oder gesteigertes Komplement-vermitteltes Zelltöten und
Antikörper-abhängige zelluläre Cytotoxizität (ADCC)
aufweisen. Siehe Caron et al., J. Exp. Med. 176, 1191–1195 (1992),
und B. Shopes, J. Immunol. 148, 2918–2922 (1992). Homodimere Antikörper mit
gesteigerter Anti-Tumoraktivität
können
auch unter Verwendung von heterobifunktionellen Vernetzern wie in
Wolff et al., Cancer Research 53, 2560–2565 (1993), beschrieben hergestellt
werden. Alternativ dazu kann ein Antikörper gebildet werden, der duale
Fc-Regionen aufweist und dadurch verbesserte Komplementen-Lyse-
und ADCC-Fähigkeiten
besitzen kann. Siehe Stevenson et al., Anti-Cancer Drug Design 3,
219–230
(1989).
-
Die
Erfindung betrifft auch Immunokonjugate, die den hierin beschriebenen
Antikörper,
konjugiert an ein zytotoxisches Mittel wie beispielsweise ein chemotherapeutisches
Mittel, Toxin (z.B. ein enzymatisch aktives Toxin bakteriellen,
pflanzlichen oder tierischen Ursprungs oder von Pilzen) oder ein
radioaktives Isotop (d.h. ein Radiokonjugat), umfassen.
-
Chemotherapeutische
Mittel, die zur Bildung solcher Immunkonjugate nützlich sind, wurden bereits
zuvor beschrieben. Enzymatisch aktive Toxine und Fragmente davon,
die verwendet werden können,
umfassen Diphtherie-A-Kette, nicht-bindende aktive Fragmente von
Diphtherie-Toxin, Exotoxin-A-Kette (aus Pseudomonas aeruginosa),
Ricin-A-Kette, Abrin-A-Kette, Modeccin-A-Kette, α-Sarcin, Aleurites-fordii-Proteine,
Dianthin-Proteine, Phytolaca-americana-Proteine (PAPI, PAPII und
PAP-S), Momordica-charantia-Inhibitor, Curcin, Crotin, Sapaonaria,
Officinalis-Inhibitor, Gelonin, Mitogellin, Restrictocin, Phenomycin,
Enomycin und die Tricothecene. Eine Vielzahl von Radionucliden zur
Herstellung von Radiokonjugat-Antikörpern sind erhältlich. Beispiele
umfassen 212Bi, 131I, 131In, 90Y und 186Re.
-
Konjugate
aus dem Antikörper
und dem zytotoxischen Mittel werden unter Verwendung zahlreicher verschiedener
bifunktioneller Protein-Bindungsmittel, wie beispielsweise N-Succinimidyl-3-(2-pyridyldithiol)propionat
(SPDP), Iminothiolan (IT), bifunktioneller Derivate von Imidoestern
(wie z.B. Dimethyladipimidat HCL), aktiver Ester (wie z.B. Disuccinimidylsuberat),
Aldehyden (wie z.B. Glutaraldehyd), Bis-azido-Verbindungen (wie z.B. Bis(p-azidobenzoyl)hexandiamin),
Bis-diazoniumderivaten (wie z.B. Bis-(p-diazoniumbenzoyl)ethylendiamin),
Diisocyanaten (wie z.B. Toluol-2,6-diisocyanat)
und Bis-aktiven Fluorverbindungen (wie z.B. 1,5-Difluor-2,4-dinitrobenzol), hergestellt.
Beispielsweise kann ein Ricin-Immunotoxin wie in Vitetta et al.,
Science 238, 1098 (1987), beschrieben hergestellt werden. 14C-markierte 1-Isothiocyanatobenzyl-3-methyldiethylentriaminpentaessigsäure (MX-DTPA)
ist ein Beispiel für
Chelatbildner zur Konjugation von Radionucleotid an den Antikörper. Siehe
die WO 94/11026.
-
In
einer anderen Ausführungsform
kann der Antikörper
an einen "Rezeptor" (wie Streptavidin)
zur Verwendung bei Tumor-Prätargeting
verwendet werden, worin das Antikörper-Rezeptor-Konjugat dem
Patienten verabreicht wird, woraufhin Entfernung von ungebundenem
Konjugat aus dem Blutkreislauf unter Verwendung eines Klä rungsmittels
und anschließende
Verabreichung eines "Liganden" (z.B. Avidin), der
an ein zytotoxisches Mittel gebunden ist (z.B. ein Radionucleotid),
folgt.
-
Der
Antikörper
kann auch als ein Immunoliposom formuliert werden. Liposomen, die
den Antikörper enthalten,
werden durch auf dem Gebiet der Erfindung bekannte Verfahren hergestellt,
wie sie beispielsweise in Epstein et al., Proc. Natl. Acad. Sci.
USA 82, 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77,
4030 (1980); und in den US-Patenten Nr. 4.485.045 und 4.544.545
beschrieben werden. Liposomen mit erhöhter Blutkreislaufdauer sind
im US-Patent Nr. 5.013.556 offenbart.
-
Besonders
nützliche
Liposomen können
durch das Umkehrphasen-Verdampfungsverfahren mit einer Lipidzusammensetzung,
die Phosphatidylcholin, Cholesterin und PEG-derivatisiertes Phosphatidylethanolamin
(PEG-PE) umfasst, gebildet werden. Liposomen werden durch Filter
mit definierter Porengröße extrudiert, um
Liposomen mit dem erwünschten
Durchmesser zu ergeben. Fab'-Fragmente
des Antikörpers
der vorliegenden Erfindung können
an die Liposomen, wie in Martin et al., J. Biol. Chem. 257, 286–288 (1982),
beschrieben wird, über
eine Disulfid-Wechselwirkungsreaktion konjugiert werden. Ein chemotherapeutisches
Mittel (wie beispielsweise Doxorubicin) ist gegebenenfalls im Liposom
enthalten. Siehe Gabizon et al., J. National Cancer Inst. 81(19),
1484 (1989).
-
Der
Antikörper
der vorliegenden Erfindung kann auch in ADEPT durch Konjugieren
des Antikörpers
an ein Prodrug-aktivierendes Enzym, das ein Prodrug (z.B. ein chemotherapeutisches
Peptidyl-Mittel, siehe die WO 81/01145) zu einem aktiven Antikrebs-Wirkstoff
umsetzt, verwendet werden. Siehe beispielsweise die WO 88/07378
und das US-Patent Nr. 4.97.5.278.
-
Die
Enzymkomponente des Immunokonjugats, die für ADEPT nützlich ist, umfasst jedes beliebige
Enzym, das in der Lage ist, auf ein Prodrug auf solche Weise zu
wirken, dass es dieses zu seiner aktiveren, zytotoxischen Form umsetzt.
-
Enzyme,
die im Verfahren dieser Erfindung nützlich sind, umfassen, sind
jedoch nicht beschränkt
auf, alkalische Phosphatase, die zur Umsetzung von Phosphat-hältigen Prodrugs
zu freien Wirkstoffen nützlich
ist; Arylsulfatase, die zur Umsetzung von Sulfat-hältigen Prodrugs
zu freien Wirkstoffen nützlich
ist; Cytosindesaminase, die zur Umsetzung von nicht-toxischem 5-Fluorcytosin
zum Antikrebs-Wirkstoff 5-Fluoruracil nützlich ist; Proteasen, wie
z.B. Serratia-Protease, Thermolysin, Subtilisin, Carboxypeptidasen
und Cathepsine (wie z.B. Cathepsine B und L), die zur Umsetzung
von Peptid-hältigen
Prodrugs zu freien Wirkstoffen nützlich
sind; D-Alanylcarboxypeptidasen,
die zur Umsetzung von Prodrugs nützlich
sind, die D-Aminosäuresubstituenten enthalten;
Kohlenhydrat-spaltende Enzyme wie z.B. β-Galactosidase und Neuraminidase, die
zur Umsetzung von glykosylierten Prodrugs zu freien Wirkstoffen
nützlich
sind; β-Lactamase,
die zur Umsetzung von Wirkstoffen, die mit β-Lactamen derivatisiert sind,
zu freien Wirkstoffen nützlich
ist; und Penicillin-Amidasen,
wie z.B. Penicillin-V-Amidase oder Penicillin-G-Amidase, die zur
Umsetzung von Wirkstoffen, die an ihren Amin-Stickstoffen mit Phenoxyacetyl-
bzw. Phenylacetylgruppen derivatisiert sind, zu freien Wirkstoffen
nützlich
sind. Alternativ dazu können
Antikörper
mit enzymatischer Aktivität,
die auch als "Abzyme" bekannt sind, verwendet werden,
um die Prodrugs der Erfindung zu freien aktiven Wirkstoffen umzusetzen
(siehe z.B. Massey, Nature 328, 457–458 (1987)). Antikörper-Abzym-Konjugate können wie
hierin für
die Zufuhr des Abzyms zu einer Tumorzellpopulation hergestellt werden.
-
Die
Enzyme dieser Erfindung können
kovalent an die Antikörpermutante
mittels Verfahren, die auf dem Gebiet der Erfindung bekannt sind,
wie beispielsweise mittels der Verwendung der heterobifunktionellen Vernetzer
wie zuvor erläutert,
gebunden werden. Alternativ dazu können Fusionsproteine, die zumindest
die Antigen-Bindungsregion
eines Antikörpers
der Erfindung, gebunden an zumindest einen funktionell aktiven Abschnitt
eines Enzyms der Erfindung, umfasst, unter Verwendung von DNA-Rekombinationsverfahren,
die auf dem Gebiet der Erfindung bekannt sind (siehe z.B. Neuberger
et al., Nature 312, 604–608
(1984)), konstruiert werden.
-
In
anderen Ausführungsformen
kann der Antikörper
kovalent modifiziert werden; Beispiele für solche Modifikationen wurden
bereits oben beschrieben.
-
E. Therapeutische Verwendungen
für WSX-Rezeptorliganden
und -antikörper
-
In
einer Ausführungsform
können
die WSX-Liganden (wie z.B. Agonisten-WSX-Rezeptorantikörper) der vorliegenden Erfindung
verwendet werden, um Repopulation von reifen Blutzellstammbäumen in
Säugetieren,
die einer Chemo- oder Bestrahlungstherapie oder Knochenmarktransplantation
unterzogen wurden, zu fördern.
Im Allgemeinen wirken die Liganden über eine Förderung der Proliferation und/oder
Differenzierung (jedoch insbesondere Proliferation) von primitiven
hämatopoetischen
Zellen. Die Liganden können
auf ähnliche
Weise nützlich
zur Behandlung von Erkrankungen sein, die durch eine Abnehme der
Blutzellen charakterisiert sind. Beispiele für diese Erkrankungen umfassen:
Anämie
(einschließlich
makrozytäre
Anämie
und aplastische Anämie),
Thrombozytopenie; Hypoplasie; Immun- (Autoimmun-) thrombozytopenische
Purpura (ITP); und HIV-induzierte ITP. Auch können die Liganden verwendet
werden, um einen Patienten zu behandeln, der eine Hämorrhagie
erlitten hat. WSX-Liganden können
auch verwendet werden, um Stoffwechselstörungen wie z.B. Obesität und Diabetes
mellitus zu behandeln oder um Nieren-, Leber- oder Lungenwachstum und/oder -wiederherstellung
(z.B. bei Nierenversagen) zu fördern.
-
Die
WSX-Rezeptorliganden und -antikörper
können
alleine oder zusammen mit einem oder mehreren Cytokinen verabreicht
werden. Weiters werden hierin als eine alternative zur Verabreichung
des WSX-Ligandenproteins auch Gentherapieverfahren erwogen.
-
Bei
Anwendungen im Rahmen von Gentherapie werden Gene in Zellen eingeführt, um
In-vivo-Synthese eines therapeutisch wirksamen genetischen Produkts
zu erzielen, beispielsweise zur Ersetzung eines defekten Gens. "Gentherapie" umfasst sowohl herkömmliche
Gentherapie, bei der eine anhaltende Wirkung durch eine einzel ne
Behandlung erzielt wird, als auch die Verabreichung von gentherapeutischen
Mitteln, die eine einmalige oder wiederholte Verabreichung einer
therapeutisch wirksamen DNA oder mRNA einbindet. Antisense-RNAs
und -DNAs können
als therapeutische Mittel zum Blockieren von Expression bestimmter
Gene in vivo verwendet werden. Es wurde bereits gezeigt, dass kurze
Antisense-Oligonucleotide in Zellen importiert werden können, wo
sie trotz ihrer geringen intrazellulären Konzentrationen, die durch
die eingeschränkte
Aufnahme durch die Zellmembran verursacht werden, als Inhibitoren
wirken (Zamecnik et al., Proc. Natl. Acad. Sci. USA 83, 4143–4146 (1986)).
Die Oligonucleotide können
modifiziert werden, um ihre Aufnahme zu steigern, z.B. durch Substituieren
ihrer negativ geladenen Phosphodiestergruppen durch ungeladene Gruppen.
-
Es
gibt zahlreiche verschiedene Verfahren, die zur Einführung von
Nucleinsäuren
in lebensfähige
Zellen verfügbar
sind. Die Verfahren variieren je nachdem, ob die Nucleinsäure in kultivierte
Zellen in vitro oder in vivo in die Zellen des beabsichtigten Wirts
transferiert wird. Verfahren, die für den Transfer von Nucleinsäuren in
Säugetierzellen
in vitro geeignet sind, umfassen die Verwendung von Liposomen, Elektroporation,
Mikroinjektion, Zellfusion, DEAE-Dextran, Calciumphosphat-Fällungsverfahren usw. Die zur
Zeit bevorzugten In-vivo-Gentransferverfahren umfassen Transfektion
mit viralen (typischerweise retroviralen) Vektoren und Virus-Hüllprotein-Liposomen-vermittelte
Transfektion (Dzau et al., Trends in Biotechnology 11, 205–210 (1993)). In
manchen Situationen ist es wünschenswert,
die Nucleinsäurequelle
mit einem Mittel zu versehen, das auf die Target-Zellen gerichtet
ist, wie z.B. mit einem Antikörper,
der spezifisch für
ein Zelloberflächenmembranprotein
oder die Targetzelle ist, mit einem Liganden für einen Rezeptor an der Targetzelle
usw. Werden Liposomen eingesetzt, so können Proteine, die sich an
eine Zelloberflächenmembran
binden, die mit Endozytose assoziiert ist, zum Targeting und/oder
zur Erleichterung von Aufnahme verwendet werden, z.B. Capsidproteine oder
Fragmente davon, die für
einen bestimmten Zelltyp tropisch sind, Antikörper für Proteine, die Internalisierung
bei Zyklierung erfahren, und Proteine, die auf intrazelluläre Lokalisation
gerichtet sind und intrazelluläre Halbwertszeit
steigern. Das Verfahren von Rezeptor-vermittelter Endozytose wird
beispielsweise von Wu et al., J. Biol. Chem. 262, 4429–4432 (1987);
und Wagner et al., Proc. Natl. Acad. Sci. USA 87, 3410–3414 (1990), beschrieben.
Einen Überblick über die
zur Zeit bekannten Genmarkierungs- und Gentherapie-Arbeitsvorschriften
bietet Anderson et al., Science 256, 808–813 (1992).
-
Für therapeutische
Anwendungen werden die WSX-Rezeptorliganden und -antikörper der
Erfindung einem Säugetier,
vorzugsweise einem Menschen, in einer physiologisch annehmbaren
Dosierungsform verabreicht, einschließlich jener, die einem Menschen
intravenös
in Form eines Bolus oder durch kontinuierliche Infusion über eine
bestimmte Zeitspanne hinweg, intramuskulär, intraperitoneal, intracerebrospinal,
subkutan, intraartikulär,
intrasynovial, intrathekal, oral, topisch oder über Inhalation verabreicht
werden können.
Die WSX-Rezeptorliganden und -antikörper werden auch geeigneterweise
intratumoral, peritumoral, intraläsionell oder periläsionell
oder in die Lymphe verabreicht, um örtliche wie auch systemische
therapeutische Wirkungen zu erzielen.
-
Solche
Dosierungsformen umfassen physiologisch annehmbare Träger, die
in sich nicht-toxisch und nicht-therapeutisch sind. Beispiele für solche
Träger
umfassen Ionenaustauscher, Aluminiumoxid, Aluminiumstearat, Lecithin,
Serumproteine wie z.B. menschliches Serumalbumin, Puffersubstanzen
wie z.B. Phosphate, Glycin, Sorbinsäure, Kaliumsorbat, partielle
Glyceridgemische von gesättigten
pflanzlichen Fettsäuren,
Wasser, Salze oder Elektrolyte wie Protaminsulfat, Dinatriumhydrogenphosphat,
Kaliumhydrogenphosphat, Natriumchlroid, Zinksalze, kolloidales Siliciumdioxid,
Magnesiumtrisilicat, Polyvinylpyrrolidon, Cellulose-basierte Substanzen
und PEG. Träger
für topische
oder gelbasierte Formen von WSX-Rezeptorantikörpern umfassen Polysaccharide
wie z.B. Natriumcarboxymethylcellulose oder Methylcellulose, Polyvinylpyrrolidon,
Polyacrylate, Polyoxyethylen-Polyoxypropylen-Blockpolymere, PEG
und Holzwachsalkohole. Für
alle Verabreichungen werden geeigneterweise herkömmliche Lagerformen verwendet.
Solche Formen umfassen Mikrokapseln, Nano-Kapseln, Liposome, Pflaster,
Inhalationsformen, Nasensprays, sublinguale Tabletten und Retard-Präparate.
Der WSX-Rezeptorligand oder -antikörper wird typi scherweise in
solchen Vehikeln in einer Konzentration von etwa 0,1 mg/ml bis 100
mg/ml formuliert.
-
Geeignete
Beispiele für
Retard-Präparate
umfassen semipermeable Matrizen aus festen hydrophoben Polymeren,
die den WSX-Rezeptorliganden oder -antikörper enthalten, wobei diese
Matrizen in Form eines Formstücks,
z.B. in Form von Folien oder Mikrokapseln, vorliegen. Beispiele
für Retard-Matrizen
umfassen Polyester, Hydrogele, beispielsweise Poly(2-hydroxyethylmethacrylat),
wie beispielsweise von Langer et al., J. Biomed. Mater. Res. 15,
167–277
(1981), und Langer, Chem. Tech. 12, 98–105 (1982), beschrieben wird,
oder Poly(vinylalkohol), Polylactide (US-Patent Nr. 3.773.919),
Copolymere von L-Glutaminsäure
und γ-Ethyl-L-Glutamat
(Sidman et al., Biopolymers 22, 547–556 (1983)), nicht abbaubares
Ethylenvinylacetat (Langer et al., s.o.), abbaubare Milchsäure-Glykolsäure-Copolymere
wie z.B. Lupron DepotTM (injizierbare Mikrokügelchen,
zusammengesetzt aus Milchsäure-Glykolsäure-Copolymer und Leuprolidacetat)
und Poly-D-(–)-3-hydroxybuttersäure. Während Polymere
wie z.B. Ethylenvinylacetat und Milchsäure-Glykolsäure die Freisetzung von Molekülen über eine
Zeitspanne von 100 Tagen ermöglichen,
setzen bestimmte Hydrogele Proteine im Laufe kürzerer Zeitspannen frei. Bleiben
eingekapselte WSX-Rezeptorantikörper für eine lange Zeit
im Körper,
so können
sie infolge der Aussetzung gegenüber
Feuchtigkeit bei 37°C
denaturieren oder aggregieren, was zu einem Verlust an biologischer
Aktivität
und möglichen Änderungen
in Bezug auf Immunogenität
führt.
Zweckmäßige Vorgehensweisen
können
zur Stabilisierung je nach dem eingebundenen Mechanismus entworfen
werden. Wird beispielsweise erkannt, dass der Aggregationsmechanismus
intermolekulare S-S-Bindungsbildung durch Thio-Disulfid-Austausch ist, so kann Stabilisierung
durch Modifizieren von Sulfhydrylresten, Lyophilisieren aus sauren
Lösungen,
Steuern des Feuchtigkeitsgehaltes, Verwendung geeigneter Additive
und Entwickeln spezifischer Polymermatrixzusammensetzungen erreicht
werden.
-
Retard-WSX-Rezeptorliganden-
oder -antikörperzusammensetzungen
umfassen auch liposomal eingeschlossene Antikörper. Liposomen, die den WSX-Rezeptorliganden
oder -antikörper
enthalten, werden durch Verfahren hergestellt, die auf dem Gebiet
der Erfindung bekannt sind und beispielsweise in Epstein et al.,
Proc. Natl. Acad. Sci. USA 82, 3688 (1985); Hwang et al., Proc.
Natl. Acad. Sci. USA 77, 4030 (1980); und den US-Patenten Nr. 4.485.045
und 4.544.545 beschrieben sind. Üblicherweise
sind die Liposomen vom kleinen (etwa 200–800 Å) unilamellaren Typ, in dem
der Lipidgehalt über
etwa 30 Mol-% Cholesterin liegt, wobei der ausgewählte Anteil
auf die optimale WSX-Rezeptorliganden- oder -antikörpertherapie
abgestimmt wird. Liposomen mit gesteigerter Blutkreislaufdauer sind
im US-Patent Nr. 5.013.556 offenbart.
-
Zur
Prävention
oder Behandlung von Erkrankungen hängt die geeignete Dosierung
von WSX-Rezeptorliganden oder -antikörper vom zu behandelnden Erkrankungstyp,
wie zuvor definiert, der Schwere und dem Verlauf der Erkrankung
ab, davon, ob die Antikörper
zu präventiven
oder therapeutischen Zwecken verabreicht werden, von früheren Therapien,
der Anamnese des Patienten und der Reaktion auf den WSX-Rezeptorliganden
oder -antikörper
und unterliegt dem Ermessen des behandelnden Arztes. Der WSX-Rezeptorligand
oder -antikörper
wird geeigneterweise dem Patienten einmalig oder im Rahmen einer
Reihe von Behandlungen verabreicht.
-
Je
nach Typ und Schwere der Erkrankung stellen etwa 1 μg/kg bis
15 mg/kg WSX-Rezeptorligand
oder -antikörper
eine anfängliche,
mögliche
Dosierung zur Verabreichung an den Patienten dar, die entweder beispielsweise
durch eine oder mehrere getrennte Verabreichungen oder durch kontinuierliche
Infusion zugeführt wird.
Eine typische Tagesdosierung kann je nach den zuvor erwähnten Faktoren
im Bereich von etwa 1 μg/kg bis
100 μg/kg
(z.B. 1–50 μg/kg) oder
mehr liegen. Beispielsweise kann die Dosierung dieselbe wie jene
für andere
Cytokine wie z.B. G-CSF, GM-CSF und EPO sein. Für wiederholte Verabreichungen über mehrere
Tage hinweg oder sogar länger,
je nach Leiden, wird die Behandlung fortgesetzt, bis eine erwünschte Unterdrückung der
Erkrankungssymptome eintritt. Es können jedoch auch andere Dosierungspläne nützlich sein.
Der Fortschritt dieser Therapie kann auf einfache Weise mittels
herkömmlicher
Verfahren und Tests beobachtet werden.
-
Werden
ein oder mehrere Cytokine mit dem WSX-Rezeptorliganden zusammen
verabreicht, so können
geringere Dosen des WSX-Liganden verwendet werden. Geeignete Dosen
eines Cytokins liegen im Bereich von etwa 1 μg/kg bis etwa 15 mg/kg Cytokin.
Eine typische Tagesdosis von Cytokin kann im Bereich von etwa 1 μg/kg bis
100 μg/kg
(z.B. 1–50 μg/kg) oder
mehr liegen. Beispielsweise kann die Dosis dieselbe sein wie jene
für andere
Cytokine wie z.B. G-CSF, GM-CSF und EPO. Das Cytokin oder die Cytokine
kann/können vor,
gleichzeitig mit oder nach der Verabreichung des WSX-Liganden verabreicht
werden. Das/Die Cytokine) und der WSX-Ligand können kombiniert werden, um
eine pharmazeutische Zusammensetzung für gleichzeitige Verabreichung
an das Säugetier
zu bilden. In bestimmten Ausführungsformen
sind die Mengen an WSX-Ligand und Cytokin so beschaffen, dass eine
synergistische Repopulation von Blutzellen (oder synergistische
Steigerung von Proliferation und/oder Differenzierung blutbildender
Zellen) im Säugetier
bei Verabreichung des WSX-Liganden und Cytokins eintritt. In anderen
Worten ist die koordinierte Wirkung der zwei oder mehreren Mittel
(d.h. des WSX-Liganden und des/der Cytokins/e) in Bezug auf Repopulation
von Blutzellen (oder Proliferation/Differenzierung blutbildender
Zellen) stärker
als die Summe der einzelnen Wirkungen dieser Moleküle.
-
F. Herstellungsartikel
-
Ein
Herstellungsartikel, der Materialien enthält, die für die Behandlung der zuvor
beschriebenen Leiden nützlich
sind, wird ebenfalls bereitgestellt. Der Herstellungsartikel umfasst
ein Behältnis
und eine Markierung. Geeignete Behältnisse umfassen beispielsweise
Flaschen, Phiolen, Spritzen und Teströhrchen. Die Behältnisse
können
aus zahlreichen verschiedenen Materialien wie z.B. Glas oder Kunststoff
gebildet sein. Das Behältnis
trägt eine
Zusammensetzung, die wirksam zur Behandlung des Leidens ist, und
kann eine sterile Zugangsöffnung
aufweisen (beispielsweise kann das Behältnis ein Lösungsbeutel zur intravenösen Verabreichung
oder eine Phiole mit einem Septum sein, das mit einer subkutanen
Injektionsnadel durchstochen werden kann). Der Wirkstoff in der
Zusammensetzung ist der WSX-Ligand. Die Markierung am Behältnis oder
in Verbindung mit dem Behältnis
gibt an, dass die Zusammensetzung zur Behandlung des bestimmten
Leidens verwendet wird. Der Her stellungsartikel kann weiters ein
zweites Behältnis
umfassen, das ein Cytokin zur Co-Verabreichung
mit dem WSX-Liganden enthält.
Weitere(s) Behältnis(se)
kann/können
mit dem Herstellungsartikel bereitgestellt werden, das/die beispielsweise
einen pharmazeutisch annehmbaren Puffer, wie z.B. phosphatgepufferte
Kochsalzlösung,
Ringer-Lösung
oder Dextrose-Lösung,
enthält/enthalten.
Der Herstellungsartikel kann weiters andere Materialien einbinden,
die aus handelstechnischer Sicht und aus der Sicht des Benutzers
wünschenswert
sind, umfassend andere Puffer, Verdünnungsmittel, Filter, Nadeln,
Spritzen und Packungsbeilagen mit Gebrauchsanweisungen.
-
G. Nicht-therapeutische
Verwendungen für
WSX-Rezeptorliganden und -antikörper
-
WSX-Rezeptorliganden
und -antikörper
können
zur Detektion und/oder zur Anreicherung von hämatopoetischen Stammzell/Vorläuferzellpopulationen
auf ähnliche
Weise, wie zur Zeit CD34-Antikörper
eingesetzt werden, verwendet werden. Für Stammzellenanreicherung können die
WSX-Rezeptorantikörper
in den auf dem Gebiet der Erfindung bekannten Verfahren wie z.B.
Immun-Panning, Durchflusszytometrie oder in immunomagnetischen Perlen
verwendet werden.
-
Gemäß einer
In-vitro-Anwendung der WSX-Liganden werden den WSX-Rezeptor umfassende
Zellen bereitgestellt und in ein Zellkulturmedium gegeben. Beispiele
für solche
WSX-Rezeptor-hältigen
Zellen umfassen hämatopoetische
Vorläuferzellen
wie z.B. CD34+-Zellen.
-
Geeignete
Gewebekulturmedien sind Fachleuten bekannt und umfassen, sind jedoch
nicht beschränkt auf,
Minimal Essential Medium (MEM), RPMI-1640 und Dulbecco's Modified Eagle's Medium (DMEM).
Diese Gewebekulturmedien sind im Handel bei Sigma Chemical Company
(St. Louis, MO) und GIBCO (Grand Island, NY) erhältlich. Die Zellen werden in
Zellkulturmedium unter Bedingungen kultiviert, die für die Zellen
ausreichend sind, dass sie lebensfähig bleiben und in Gegenwart
einer wirksamen Menge an WSX-Liganden und, gegebenenfalls, weiteren
Cytokinen und Wachstums faktoren wachsen. Die Zellen können auf
zahlreiche verschiedene Wege kultiviert werden, einschließlich Kultivieren
in einer Koagulum-, Agar- oder Flüssigkultur.
-
Die
Zellen werden bei einer physiologisch annehmbaren Temperatur wie
z.B. 37°C
in Gegenwart einer wirksamen Menge an WSX-Liganden kultiviert. Die
Menge an WSX-Liganden kann variieren, liegt jedoch vorzugsweise
im Bereich von etwa 10 ng/ml bis etwa 1 mg/ml. Der WSX-Ligand kann
natürlich
der Kultur in einer von Fachleuten ohne übermäßiges Experimentieren empirisch
festgelegten Dosis zugesetzt werden. Die Konzentration von WSX-Ligand
in der Kultur hängt
von verschiedenen Faktoren ab, wie beispielsweise den Bedingungen,
unter denen die Zellen und der WSX-Ligand kultiviert werden. Die
spezifische Temperatur und Dauer der Inkubation sowie andere Kulturbedingungen,
können
je nach solchen Faktoren variiert werden, z.B. der Konzentration
des WSX-Liganden und dem Typ der Zellen und des Mediums.
-
Es
wird erwogen, dass die Verwendung von WSX-Ligand zur Steigerung
von Zellproliferation und/oder -differenzierung in vitro auf verschiedene
Arten nützlich
ist. Beispielsweise können
hämatopoetische
Zellen, die in vitro in Gegenwart von WSX-Liganden kultiviert werden, in ein Säugetier,
das an reduzierten Konzentrationen der Zellen leidet, infundiert
werden. Auch können
die kultivierten, blutbildenden Zellen zum Gentransfer bei Gentherapieanwendungen
verwendet werden. Stabile In-vitro-Kulturen können auch zum Isolieren zellspezifischer
Faktoren und zur Expression von endogenen oder rekombinant eingeführten Proteinen
in der Zelle verwendet werden. WSX-Ligand kann auch verwendet werden,
um Zellüberleben,
Proliferation und/oder Differenzierung von Zellen, die das Wachstum
und/oder die Differenzierung anderer Zellen in Zellkultur unterstützen, zu
steigern.
-
Die
hierin offenbarten WSX-Rezeptorantikörper sind auch als Affinitätsreinigungsmittel
nützlich.
In diesem Verfahren werden die Antikörper gegen WSX-Rezeptor an
einem geeigneten Träger,
wie z.B. einem Sephadex-Harz oder Filterpapier, unter Verwendung
von auf dem Gebiet der Erfindung bekannten Verfahren immobilisiert.
Der immobilisierte Antikörper
wird dann mit einer Probe kontaktiert, die den zu reinigen den WSX-Rezeptor
enthält,
und hiernach wird der Träger
mit einem geeigneten Lösungsmittel
gewaschen, das im Wesentlichen das gesamte Material unter Ausnahme
des WSX-Rezeptors, der an den immobilisierten Antikörper gebunden
ist, entfernt. Schließlich
wird der Träger
mit einem anderen geeigneten Lösungsmittel
wie z.B. Glycinpuffer, pH 5,0, gewaschen, das den WSX-Rezeptor vom
Antikörper
freisetzt.
-
WSX-Rezeptorantikörper können auch
in diagnostischen Tests für
WSX-Rezeptor nützlich
sein, z.B. zur Detektion seiner Expression in spezifischen Zellen,
Geweben oder Serum. Für
diagnostische Anwendungen werden Antikörper typischerweise mit einer
nachweisbaren Gruppierung markiert. Die nachweisbare Gruppierung
kann jede sein, die in der Lage ist, entweder direkt oder indirekt
ein nachweisbares Signal zu produzieren. Beispielsweise kann die
nachweisbare Gruppierung ein Radioisotop, wie z.B. 3H, 14C, 32P, 35S oder 125I; eine
fluoreszierende oder chemilumineszierende Verbindung, wie z.B. Fluoresceinisothiocyanat,
Rhodamin oder Luciferin; radioaktive isotopische Markierungen, wie
z.B. 125I, 32P, 14C oder 3H; oder
ein Enzym wie z.B. alkalische Phosphatase, β-Galactosidase oder Meerrettichperoxidase
sein.
-
Jedes
beliebige, auf dem Gebiet der Erfindung bekannte Verfahren zum separaten
Konjugieren der Polypeptidvariante mit der nachweisbaren Gruppierung
kann verwendet werden, einschließlich jener Verfahren, die
von Hunter et al., Nature 144, 945 (1962); David et al., Biochemistry
13, 1014 (1974); Pain et al., J. Immunol. Meth. 40, 219 (1981);
und Nygren, J. Histochem. and Cytochem. 30, 407 (1982), beschrieben
werden.
-
Die
hierin offenbarten Antikörper
können
in jedem beliebigen bekannten Testverfahren, wie z.B. kompetitiven
Bindungstests, direkten und indirekten Sandwichtests und Immunfällungstests,
eingesetzt werden. Zola, Monoclonal Antibodies: A Manual of Techniques,
147–158,
CRC Press, Inc. (1987).
-
Kompetitive
Bindungstests beruhen auf der Fähigkeit
eines markierten Standards, mit dem Testprobenanalyt um Bindung
mit einer eingeschränkten
Menge an Antikörper
zu konkurrieren. Die Menge an WSX-Rezeptor in der Testprobe ist
umgekehrt proportional zur Menge des Standards, der an die Antikörper gebunden
wird. Um die Bestimmung der Menge an Standard, der gebunden werden
soll, zu erleichtern, werden die Antikörper im Allgemeinen vor oder
nach der Konkurrenz unlöslich
gemacht, sodass der Standard und der Analyt, die an die Antikörper gebunden
sind, von dem Standard und Analyt, die ungebunden bleiben, leicht getrennt
werden können.
-
Sandwichtests
umfassen die Verwendung von zwei Antikörpern, von denen jeder in der
Lage ist, sich an einen anderen immunogenen Abschnitt, oder ein
Epitop, des nachzuweisenden Proteins zu binden. In einem Sandwichtest
wird der Testprobenanalyt durch einen ersten Antikörper gebunden,
der an einen festen Träger
immobilisiert ist, und hiernach bindet sich ein zweiter Antikörper an
den Analyt, wodurch ein unlöslicher, dreiteiliger
Komplex gebildet wird. Siehe z.B. das US-Patent Nr. 4.376.110. Der
zweite Antikörper
kann selbst mit einer nachweisbaren Gruppierung markiert sein (direkter
Sandwichtest) oder kann unter Verwendung eines Anti-Immunglobulin-Antikörpers, der
mit einer nachweisbaren Gruppierung markiert ist, gemessen werden
(indirekter Sandwichtest). Ein Typ von Sandwichtest ist beispielsweise
ein ELISA-Test, wobei hier die nachweisbare Gruppierung ein Enzym
ist.
-
H. Hinterlegung von Materialien
-
Die
folgenden biologischen Materialien wurden bei der American Type
Culture Collection, 12301 Parklawn Drive, Rockville, MD, USA (ATCC),
hinterlegt:
-
-
Diese
Hinterlegungen wurden gemäß den Vorschriften
des Budapester Vertrages über
die internationale Anerkennung der Hinterlegung von Mikroorganismen
für die
Zwecke von Patentverfahren und den darunter gültigen Bestimmungen (Budapester
Vertrag) vorgenommen. Dies stellt die Aufrechterhaltung einer lebensfähigen Kultur
30 Jahre vom Datum der Hinterlegung an sicher. Jede der hinterlegten
Kulturen wird von der ATCC unter den Bestimmungen des Budapester
Vertrages verfügbar
gemacht und unterliegt einem Abkommen zwischen Genentech, Inc.,
und ATCC, das sicherstellt, dass (a) der Zugang zur Kultur während der
Anhängigkeit
der Patentanmeldung einer vom Präsident
des Patentamtes der Vereinigten Staaten bestimmten Person zugänglich gemacht
wird, die hierzu gemäß 37 CFR §1.14 und
35 USC §122
befugt ist, und (b) dass alle Einschränkungen in Bezug auf die Verfügbarkeit
der so hinterlegten Kultur für
die Öffentlichkeit
unwiderruflich mit der Vergabe des Patents ausgeräumt werden.
-
Der
Abtretungsempfänger
der vorliegenden Anmeldung hat sich einverstanden erklärt, dass,
sofern irgendeine der hinterlegten Kulturen trotz Kultivierung unter
geeigneten Bedingungen sterben sollte oder verloren gehen oder zerstört werden
sollte, diese unverzüglich
nach Bekanntgabe mit einem lebensfähigen Muster derselben Kultur
ersetzt wird. Verfügbarkeit
der hinterlegten Zelllinien gilt nicht als eine Lizenz zur Praktizierung der
Erfindung im Widerspruch zu den Rechten zu verstehen, die unter
der Autorität
jeder beliebigen Regierung gemäß ihren
Patentgesetzen zuerkannt werden.
-
Die
obige ausformulierte Beschreibung wird als ausreichend erachtet,
um Fachleuten die Möglichkeit zu
geben, die Erfindung praktisch durchzuführen. Die vorliegende Erfindung
ist durch keine der hinterlegten Kulturen in ihrem Schutzumfang
eingeschränkt,
da es die hinterlegte Ausführungsform
als eine Veranschaulichung eines Aspektes der Erfindung zu verstehen
gilt, und jede Kultur, die funktionell äquivalent ist, liegt ebenfalls
innerhalb des Schutzumfangs dieser Erfindung. Die Materialhinterlegung
hierin kommt nicht einem Eingeständnis
gleich, dass die hierin bereitgestellte ausformulierte Beschreibung
nicht geeignet ist, um die praktische Durchführung jedes beliebigen Aspekts
der Erfindung, einschließlich
der besten Ausführungsform hiervon,
zu ermöglichen,
noch ist sie als Einschränkung
des Schutzumfanges der Ansprüche
auf die spezifische Darstellung, der sie darstellt, zu verstehen.
Tatsächlich
werden verschiedene Modifikationen der Erfindung zusätzlich zu
jenen, die hierin gezeigt und beschrieben wurden, Fachleuten durch
die obige Beschreibung ersichtlich sein und fallen ebenfalls in
den Schutzumfang der beiliegenden Patentansprüche.
-
III. Experimenteller Teil
-
Nachstehend
werden spezifische Ausführungsformen
zur Durchführung
der vorliegenden Erfindung beschrieben. Die Beispiele sind ausschließlich zu
Zwecken der Veranschaulichung bereitgestellt und sollen in keiner
Weise den Schutzumfang der vorliegenden Erfindung einschränken.
-
BEISPIEL 1
-
Klonieren
von menschlichem WSX-Rezeptor
-
Eine
Oligonucleotidsonde, die als WSX.6#1 bezeichnet wird, wurde basierend
auf der T73849-EST-Sequenz sequenziert. Die WSX.6#1-Sonde war ein
51-mer mit der folgenden Sequenz:
-
-
Die
radioaktiv markierte WSX.6#1-Sonde wurde verwendet, um 1,2 × 106 Klone aus einer zufälligen und Oligo-dT-geprimten λgt10-Fötalleberbibliothek
(Clontech, Palo Alto, CA) zu sondieren. Nach Hybridisierung über Nacht
bei 42°C
wurden die Filter bei 50°C
in 0,5 × SSC
und 0,1% NaDodSO4 (SDS) gewaschen. Aus dem
anfänglichen
Screen wurden 10 Klone selektiert, und bei nachfolgendem Screenen
wurden 5 einzelne Plaque-reine Klone isoliert. Von diesen 5 einzelnen
Klonen wurden vier Klone, die als Klon 1, 5, 6 und 9 bezeichnet
wurden, in pBSSK– (Stratagene) nach EcoRI-Verdau
subkloniert. Sequenzanalyse zeigte, dass Klon 5 und Klon 9 das mutmaßliche Initiationsmethionin
und Signalpeptid enthielten. Klon 6 (bezeichnet als 6.4) enthielt
den Großteil
von 3'-Sequenz und
wurde daraufhin für
weiteres Screenen verwendet.
-
Um
das Volllängengen
zu erhalten, wurde Klon 6.4 (Fragment Nsi-HindIII) radioaktiv markiert
und verwendet, um 1,2 × 106 Klone aus einer λgt10-Bibliothek, die aus einer
Hepatom-Hep3B-Zelllinie erstellt wurde, zu screenen. Dieser Screen
resultierte in 24 positiven Klonen. Nach PCR-Analyse der Klone unter
Verwendung von λgt10-Primern (F und R)
wurden die vier längsten
Klone 12.1, 13.2, 22.3 und 24.3 isoliert. Diese Klone wurden in
pBSSK– unter
Verwendung der EcoRI-Stelle subkloniert, und nach Untersuchung mittels
Restriktionsenzymverdau wurden die Klone 12.1 und 13.2 Sequenzierung
unterzogen. DNA-Sequenzierung wurde mit dem Taq-Farbstoff-Desoxynucleotidterminatorzyklus-Sequenzierungsset
an einem automatisierten DNA-Sequenzierer
von Applied Biosystems durchgeführt.
-
Die
assemblierte, zusammenhängende
Sequenz aus allen isolierten Klonen kodierte für einen Consensus-Aminoterminus
für das
neu identifizierte Polypeptid, das als WSX-Rezeptor bezeichnet wird.
Sequenzanalyse zeigte jedoch auf, dass zumindest drei natürlich vorkommende
Varianten des WSX-Rezeptors bestehen, die unterschiedliche zytoplasmatische
Regionen aufweisen. Diese Varianten scheinen am Lysinrest an Position
891 unterschiedlich gespleißt
zu sein. Klon 6.4 endet 5 Aminosäuren
nach Lys 891. Klon 12.1 unterscheidet sich von 13.2 und 6.4 nach
Lys 891 und kodiert für
eine mutmaßliche
Box-2-Region, die sich von jener unterscheidet, für die Klon
13.2 kodiert. Klon 13.2 enthält
eine potenzielle Box-1-Region und kodiert nach Lys 891 für mutmaßliche Box-2-
und Box-3-Motive. Siehe Baumann et al., Mol. Cell. Biol. 14(1),
138–146
(1994).
-
Das
Volllängen-WSX-Gen
basierend auf der Klon-13.2-Zytoplasmaregion kodiert mutmaßlich für ein 1165-Aminosäure-Transmembranprotein.
Die 841-Aminosäure-extrazellulärdomäne (ECD)
enthält
zwei WSXWS-Domänen.
Der ECD folgt eine 24-Aminosäure-Transmembrandomäne und eine
300-Aminosäure-Zytoplasmaregion.
-
BEISPIEL 2
-
WSX-Rezeptor-Immunoadhäsin
-
Unter
Verwendung von Polymerasekettenamplifikation wurde ein WSX-Rezeptor-Immunoadhäsin durch
Bearbeiten einer In-Raster-Fusion der extrazellulären Domäne des WSX-Rezeptorgens
(WSX.ECD) mit menschlichem CH2CH3(Fc)IgG (Bennett et al., J. Biol.
Chem. 266(34), 23060–23067
(1991)) am C-Terminus der ECD geschaffen und in pBSSK– (Strategene)
kloniert. Zur Expression wurde die WSX-Fc mit ClaI und BstEII ausgeschnitten
und in den pRKS.HuIF.grbhlgG-Genenase-I-Vektor (Beck et al., Molecular
Immunology 31(17), 1335–1344
(1994)) ligiert, um das Plasmid pRK5.WSX-IgG-Genenase I zu schaffen.
Dieses Plasmid wurde vorübergehend
in 293-Zellen unter Verwendung von Standard-Calciumphosphat-Transfektionsverfahren
transfiziert. Die transfizierten Zellen wurden bei 37°C in 5% CO2 in DMEM F12 50:50, ergänzt mit 10% FBS, 100 mM HEPES
(pH 7,2) und 1 mM Glutamin kultiviert. Das WSX-Rezeptor-Immunoadhäsin wurde
unter Verwendung einer ProSepATM-Protein-A-Säule gereinigt.
-
BEISPIEL 3
-
Antikörperherstellung
-
Um
Antikörper
gegen den WSX-Rezeptor zu züchten,
wurde das WSX-Rezeptor-Immunoadhäsin aus Beispiel
2 verwendet, um Kaninchen zu inokulieren, um polyklonale Antikörper zu
züchten,
und um Mäuse
zu inokulieren, um monoklonale Antikörper zu züchten, unter Verwendung herkömmlicher
Verfahren.
-
BEISPIEL 4
-
Bildung einer Zelllinie,
die WSX-Rezeptor exprimiert
-
Die
für Volllängen-WSX-Rezeptorvariante
13.2 kodierende Nucleinsäure
wurde in das pRKtkNeo-Plasmid (Holmes et al., Science 253, 1278–1280 (1991))
insertiert. 100 μg
des so gebildeten pRKtkNeo.WSX-Plasmids wurden linearisiert, Ethanolgefällt und
in 100 μl
RPMI 1640 resuspendiert. 7 × 106 Baf3-Zellen (5 × 105/ml)
wur den in 900 μl
RPMI suspendiert und zum linearisierten Plasmid zugesetzt. Nach Elektroporation
bei 325 V, 1180 μF
unter Verwendung einer BRL-Elektroporationsvorrichtung wurden die
Zellen in 15 ml RPMI 1640, das 5% WEHI3B-konditioniertes Medium
und 15% Serum enthielt, ausplattiert. 48 h später wurden Zellen in 2 mg/ml
G418 selektiert.
-
Um
die Baf3/WSX-Zelllinie, die WSX-Rezeptorvariante 13.2 exprimiert,
zu erhalten, wurden die G418-selektierten Klone durch FACS unter
Verwendung der polyklonalen Kaninchen-Antiseren, die gegen das WSX-Fc-Hybridprotein
wie zuvor beschrieben gezüchtet
wurden, analysiert. Der am stärksten
exprimierende Klon (bezeichnet als E6) wurde mittels FACS sortiert,
um eine Population mit einem hohen Grad an WSX-Rezeptorexpression zu erhalten.
-
BEISPIEL 5
-
Rolle von
WSX-Rezeptor bei Zellproliferation
-
Die
proliferativen Potenziale von WSX-Rezeptorvarianten 13.2 und 12.1
wurden durch Konstruieren menschlicher Wachstumshormonrezeptor-WSX-Rezeptor-
(GH-WSX-) Fusionen,
die für
chimäre
Proteine, bestehend aus extrazellulären GH-Rezeptordomänen und GH-Rezeptor-Transmembrandomänen und
den intrazellulären
Domänen
der WSX-Rezeptorvarianten 13.2 oder 12.1, kodieren, getestet. Diese
chimären
Genfusionen wurden in die IL-3-abhängige Zelllinie Baf3 transfiziert.
Die Fähigkeit
der GH-WSX-transfizierten Baf3-Zellen, auf exogenes Wachstumshormon
(GH) zu reagieren, wurde in einem Thymidininkorporationstest getestet.
Wie in den 6 und 8 zu sehen
ist, war die GH-WSX-Rezeptorvariante-13.2-Chimäre in der Lage, Thymidinaufnahme
in den transfizierten Baf3-Zellen zu steigern, was auf das proliferative
Potenzial der WSX-Rezeptorvariante 13.2 hinweist. Die WSX-Rezeptorvariante
12.1 war jedoch nicht in der Lage, ein proliferatives Signal in
diesem Versuch zu übertragen
(8).
-
Materialien
und Verfahren
-
Rekombinante
PCR wurde verwendet, um die chimären
Rezeptoren, die die extrazellulären
und transmembranen Domänen
des hGH-Rezeptors und die zytoplasmatische Domäne entweder von WSX-Rezeptorvariante
12.1 oder 13.2 enthalten, zu bilden. Kurz zusammengefasst wurde
die zytoplasmatische Domäne
entweder von Variante 12.1 oder 13.2, die mit Arg an Aminosäure 866
beginnt und sich bis zu Aminosäure
958 bzw. Anmosäure
1165 erstreckt, in Raster durch sequenzielle PCR an die extrazelluläre und transmembrane Domäne von hGH-Rezeptor,
die mit Met an Aminosäure
18 beginnt und sich bis zu Arg an Aminosäure 274 erstreckt, fusioniert.
Die GH-WSX-Chimäre
wurde zuerst unter Verwendung von PCR zur Bildung der extrazellulären und
transmembranen Domäne
des menschlichen GH-Rezeptors konstruiert. Der 3'-End-Primer, der für diese PCR verwendet wurde,
enthielt 20 Nucleotide am 5'-Ende
des Primers, was den ersten 20 Nucleotiden der WSX-Zytoplasmadomäne entspricht.
Das 3'-Ende der
Chimäre
wurde unter Verwendung von PCR gebildet, worin der 5'-End-Primer die letzten
19 Nucleotide der menschlichen GH-Rezeptortransmembrandomäne enthielt.
Um die Volllängenchimäre zu bilden,
wurde das 5'-Ende
des menschlichen GH-Rezeptorprodukts mit dem 3'-End-WSX-Rezeptorzytoplasma-PCR-Produkt
kombiniert und daraufhin amplifiziert, um eine Fusion der zwei Produkte
zu bilden.
-
Diese
chimäre
Fusion wurde mit ClaI und XbaI verdaut und an pRKtkNeo ligiert (Holmes
et al., Science 253, 1278–1280
(1991)), um den chimären
Expressionsvektor zu schaffen. Die IL-3-abhängige Zelllinie Baf3 wurde
dann mit diesem hGH/WSX-Hybridexpressionsvektor
elektroporiert.
-
Kurz
zusammengefasst wurden 100 μg
pRKtkNeo/GH.WSX-Plasmid linearisiert, Ethanol-gefällt und in
100 μl RPMI
1640 resuspendiert. 7 × 106 Baf3-Zellen (5 × 105/ml)
wurden in 900 μl
RPMI suspendiert und zum linearisierten Plasmid zugesetzt. Nach
Elektroporation bei 325 V, 1180 μF
unter Verwendung einer BRL-Elektroporationsvorrichtung wurden die
Zellen in 15 ml RPMI 1640, das 5% WEHI-konditioniertes Medium und
15% Serum enthielt, ausplattiert. 48 h später wurden Zellen in 2 mg/ml
G418 selektiert.
-
Um
die Baf3/GH.WSX-Zelllinien zu erhalten, wurden die G418-selektierten
Zellen unter Verwendung eines Anti-Mensch-GH-mAb (3B7) bei 1 μg/ml FACS-sortiert.
Die obersten 10% der exprimierenden Zellen wurden selektiert und
vermehrt.
-
BEISPIEL 6
-
Expressionsanalyse des
WSX-Rezeptors
-
Das
Expressionsprofil des WSX-Rezeptors wurde anfänglich mittels Northern-Analyse untersucht. Northern-Blots
von menschlicher fötaler
oder erwachsener Gewebe-mRNA wurde von Clontech (Palo Alto, Kalifornien)
erhalten. Ein Transkript von etwa 6 kb wurde in menschlicher fötaler Lunge,
Leber und Niere nachgewiesen. In der erwachsenen Probe wurde ein
geringer Grad an Expression in zahlreichen verschiedenen Geweben
einschließlich
Leber, Placenta, Lungenskelettmuskel, Niere, Ovarien, Prostata und
Dünndarm
nachgewiesen.
-
PCR-Analyse
von menschlichem Nabelschnurblut identifizierte Transkripte in CD34+-Subfraktion. PCR-Analyse
zeigte, dass alle drei Varianten des WSX-Rezeptors in CD34+-Zellen vorhanden waren. Die CD34+-Subfraktion schien bei derselben PCR-Analyse negativ zu
sein.
-
Mittels
PCR-Analyse waren sowohl Variante 6.4 als auch Variante 13.2 in
der AA4+Sca+Kit+- (flASK-) Zellpopulation, isoliert von
der fötalen
Leber mittleren Gestationsalters wie von Zeigler et al., Blood 84, 2422–2430 (1994),
beschrieben, eindeutig zu erkennen.
-
Menschliche
B-Zellen, isoliert aus peripherem Blut unter Verwendung von Anti-CD19/20-Antikörpern, waren
auch für
Rezeptor-mRNA-Expression kurzer Form (6.4-Variante) und langer Form (13.2-Variante)
positiv.
-
Der
WSX-Rezeptor scheint sowohl an Vorläufer- als auch an reiferen
blutbildenden Zellen exprimiert zu werden.
-
BEISPIEL 7
-
Klonieren
von Maus-WSX-Rezeptor
-
Der
menschliche WSX-Rezeptor wurde als eine Sonde verwendet, um Maus-WSX-Rezeptor zu isolieren.
Das pRKtkNeo.WSX-Plasmid aus Beispiel 4 wurde unter Verwendung von
Ssp1 verdaut. Dieses Ssp1-Fragment (1624 bp) wurde isoliert und
radioaktiv markiert und weiters verwendet, um eine Maus-Leber-λgt10-Bibliothek
(Clontech) zu screenen. Dies resultierte in 4 positiven Klonen;
die isoliert und nach Subklonieren in pBSSK– über EcoRI-Verdau
sequenziert wurden. Die resultierenden Klone, bezeichnet als 1,
2, 3, 4, zeigten Homologie zur extrazellulären Domäne des menschlichen WSX-Rezeptors;
die zusammenhängenden
Sequenzen, die aus diesen Klonen resultierten, erstreckten sich
vom Initiations-Methionin bis zu Tryptophan an Position 783. Die
Gesamtähnlichkeit
von menschlichem WSX-Rezeptor und Maus-WSX-Rezeptor beträgt 73% über diese
Region der jeweiligen extrazellulären Domänen (siehe die 4A–B).
-
BEISPIEL 8
-
Die Rolle
von WSX-Rezeptor bei Proliferation hämatopoetischer Zellen
-
Die
Gegenwart des WSX-Rezeptors in der angereicherten menschlichen Stammzellenpopulation CD34+ aus Nabelschnurblut ist ein Hinweis auf
eine potenzielle Rolle dieses Rezeptors bei Stammzellen/Vorläuferzellen-Proliferation.
Die Proliferation von menschlichen CD34+-Blutzellen
in Methylcellulosemedium (Stem Cell Technologies) wurde in Gegenwart
oder Abwesenheit von WSX-Rezeptor-Antisense-Oligonucleotiden bestimmt.
Diese Versuche wurden auch im Maus-Hämatopoesesystem unter Verwendung
von AA4+Sca+Kit+-Stammzellen aus der fötalen Mausleber wiederholt.
In beiden Fällen
inhibierten die Antisense-Oligonucleotide in statistisch signifikantem
Ausmaß Koloniebildung
aus den hämatopoetischen
Vorläuferzellen.
Siehe Tabelle 1 unten. Die anti-proliferativen Wirkungen waren unter
Verwendung der –20- Antisense- und der
+85-Antisense-Oligonucleotidkonstrukte am stärksten ausgeprägt. Diese
Inhibition war nicht Stammbaum-spezifisch für irgendeinen bestimmten Knochenmarkstammbaum,
der aus der Vorläufervermehrung
resultierte. Die grundlegende Wirkung der Antisense-Oligonucleotide
war eine Reduktion der Gesamt-Kolonieanzahl.
Die Größe der einzelnen
Kolonien wurde auch reduziert.
-
Antisense-Oligonucleotidversuche
unter Verwendung sowohl von menschlichen als auch von Maus-Stammzellen
zeigten eine Inhibition von Knochenmarkkoloniebildung. Dennoch konnte
die Reduktion von Myelopoese, die in diesen Tests beobachtet wurde,
durch die zusätzliche
Einbindung von G-CSF und GM-CSF im Kulturmedium unterbunden werden.
Diese Daten dienen zur Veranschaulichung der Redundanz an Cytokinwirkung
im myelopoetischen Kompartiment.
-
-
Materialien
und Verfahren
-
Menschliche
Stammzellen: Menschliches Nabelschnurblut wurde in PBS/Heparin (1.000 μ/ml) gesammelt.
Die mononukleare Fraktion wurde unter Verwendung eines Dextrangradienten
getrennt, und jegliche verbleibenden roten Blutzellen wurden in
20 mM NH4Cl lysiert. CD34+-Zellen
wurden unter Verwendung von CD34+-immunomagnetischen
Perlen (Miltenyi, CA) isoliert. Diese isolierten CD34+-Zellen
wurden mittels FACS-Analyse als 90–97% CD34+ erkannt.
-
Maus-Stammzellen:
Fötale
Leber mittleren Gestationsalters wurde geerntet und positiv für das AA4–-Antigen
durch Immun-Panning selektiert. Die AA4–-positive
Fraktion wurde dann weiter an Stammzellengehalt durch FACS-Isolierung
der AA4+Sca+Kit+-Fraktion
angereichert.
-
Antisense-Versuche:
Oligodesoxynucleotide wurden gegen Regionen der menschlichen oder Maus-WSX-Rezeptoren
synthetisiert. Für
jedes ausgewählte
Oligonucleotid wurden Antisense- (AS-), Sense- (S-) und ungeordnete
(SCR-) Versionen synthetisiert (siehe 7). +
oder – bezeichnet
die Position in Bezug auf das Initiations-Methionin des WSX-Rezeptors. CD34+- oder AA4+Sca+Kit+-Zellen wurden
in einer Konzentration von 103/ml in 50:50-DMEM/F12-Medium,
ergänzt
mit 10% FBS, L-Glutamin
und GIBCOTM-Lipidkonzentrat, das entweder
Sense-, Antisense- oder ungeordnete Oligonucleotide in einer Konzentration
von 70 μg/ml enthielt,
inkubiert. Nach 16 h wurde eine zweite Aliquote des jeweiligen Oligonucleotids
zugesetzt (35 μg/ml), und
die Zellen wurden weitere 6 h lang inkubiert.
-
Kolonietests:
5.000 Zellen aus jeder der oben genannten Bedingungen wurden in
5 ml Methylcellulose (Stem Cell Technologies), die Kit-Liganden
(KL) (25 ng/ml), Interleukin-3 (IL-3) (25 ng/ml) und Interleukin-6 (IL-6)
(50 ng/ml) enthielt, in Aliquoten aufgeteilt. Die Methylcellulosekulturen
wurden dann 14 Tage lang bei 37°C
inkubiert, und die resultierenden Kolonien wurden gezählt und
phänotypisiert.
Alle Tests wurden in dreifacher Ausführung durchgeführt.
-
BEISPIEL 9
-
WSX-Rezeptorvariante 13.2
ist ein Rezeptor für
OB-Protein
-
Die
WSX-Rezeptorvariante 13.2 weist im Wesentlichen dieselbe Aminosäuresequenz
wie der jüngst klonierte
Leptin- (OB-) Rezeptor auf. Siehe Tartaglia et al., Cell 83, 1263–1271 (1995).
OB-Protein war in der Lage, Thymidininkorporation in Baf3-Zellen, die mit WSX-Rezeptorvariante
13.2, wie in Beispiel 4 beschrieben (siehe 9), transfiziert
sind, zu stimulieren.
-
Es
wurde die OB-Proteinexpression in hämatopoetischen Zellen untersucht.
Oligonucleotidprimer, die spezifisch gegen das OB-Protein entworfen
waren, veranschaulichten die Gegenwart dieses Liganden in fötaler Leber
und fötalem
Gehirn sowie in zwei fötalen
Leberstromazelllinien, die als 10-6 und 7-4 bezeichnet sind. Für beide
dieser sich unbegrenzt vermehrenden Stromazelllinien wurde gezeigt,
dass sie sowohl Knochenmark- als auch Lymphproliferation von Stammzellpopulationen
unterstützen
(Zeigler et al., Blood 84, 2422–2430
(1994)).
-
BEISPIEL 10
-
Die Rolle
von OB-Protein bei Hämatopoese
-
Um
die hämatopoetische
Aktivität
von OB-Protein zu untersuchen, wurden viele verschiedene In-vitro-Tests
durchgeführt.
-
Fötale Mausleber-flASK-Stammzellen
wurden aus der fötalen
Leber mittleren Gestationsalters wie in Zeigler et al., Blood 84,
2422–2430
(1994), beschrieben isoliert und in Stammzellen-Suspensionskultur
oder Methylcellulosetests untersucht.
-
Aus
den Stammzellen-Suspensionskulturen wurden 20.000 der flASK-Zellen
in einzelne Wells in einem 12-Well-Format in DMEM-4.5/F12-Medium,
ergänzt
mit 10% hitzeinaktiviertem fötalem
Kälberserum
(Hyclone, Logan, UT) und L-Glutamin, überimpft. Wachstumsfaktoren
wurden in den folgenden Konzentrationen zugesetzt: Kit-Ligand (KL) bei 25
ng/ml, Interleukin-3 (IL-3) bei 25 ng/ml, Interleukin-6 (IL-6) bei 50
ng/ml, G-CSF bei 100 ng/ml, GM-CSF bei 100 ng/ml, EPO bei 2 U/ml,
Interleukin-7 (IL-7)
bei 100 ng/ml (alle Wachstumsfaktoren von R and D Systems, Minneapolis,
MN). OB-Protein wurde bei 100 ng/ml, außer anders angegeben, zugesetzt.
Rekombinantes OB-Protein wurde wie in Levin et al., Proc. Natl.
Acad. Sci. (USA) 93, 1726–1730
(1996), beschrieben hergestellt.
-
In
Einklang mit seiner Fähigkeit,
ein proliferatives Signal in Baf3-Zellen zu transduzieren (siehe
obiges Beispiel), stimulierte OB-Protein auf drastische Weise die
Vermehrung von flASK-Zellen, die in Suspensionskultur in Gegenwart
von Kit-Liganden gezüchtet
wurden (10A). Der Zusatz von OB-Protein
alleine zu diesen Suspensionskulturen war nicht in der Lage, Überleben
der hämatopoetischen
Stammzellen (HSCs) zu bewirken. Wurden zahlreiche verschiedene hämatopoetische
Wachstumsfaktoren in Suspensionskulturtests getestet, so schien
sich die Hauptsynergie von OB-Protein mit KL, GM-CSF und IL-3 zu
zeigen (Tabelle 2). Keine bevorzugte Vermehrung irgendeines bestimmten
Stammbaums wurde aus der Cytospinanalyse der resultierenden Kulturen
erkannt.
-
-
flASK-Zellen
wurden isoliert. 20.000 Zellen wurden in Suspensionskultur mit der
relevanten Wachstumsfaktorkombination ausplattiert. Die Zellen wurden
nach 7 Tagen geerntet und gezählt.
Die Zellanzahlen sind × 103 dargestellt. Tests wurden in dreifacher
Ausführung
durchgeführt
und in zwei unabhängigen
Versuchen wiederholt.
-
Methylcellulosetests
wurden wie zuvor beschrieben (Zeigler et al., s.o.) durchgeführt. Kurz
zusammengefasst wurden Methylcellulosekolonietests unter Verwendung
von "komplettem" Methylcellulose-
oder Prä-B-Methylcellulosemedium
(Stem Cell Technologies, Vancouver, British Columbia, Kanada) mit
dem Zusatz von 25 ng/ml KL (R and D Systems, Minneapolis, MN) durchgeführt. Cytospinanalysen
der resultierenden Kolonien erfolgten wie zuvor bereits in Zeigler
et al. beschrieben.
-
Wenn
diese Methylcellulosetests verwendet wurden, erhöhte OB-Protein die Knochenmarkkoloniebildung
und erhöhte
die Lymphozten- und Erythrozytenkolonie-Bildung drastisch (10B und 10C),
was zeigt, dass das OB-Protein auf sehr frühe Zellen des hämatopoetischen
Stammbaumes wirken kann. Es ist wichtig, dass die hämatopoetische
Aktivität
von OB-Protein nicht auf fötale
Leberstammzellen, die Maus-Knochenmark-Stammzellpopulation, eingeschränkt war;
LinIoSca+ proliferierte
auch in Reaktion auf OB-Protein (KL: 5fache Vermehrung, KL und OB-Protein:
10fache Vermehrung).
-
Weitere
hämatopoetische
Analyse der Rolle des WSX-Rezeptors wurde durch Untersuchen hämatopoetischer
Defekte in der db/db-Maus durchgeführt.
-
Diese
Defekte wurden durch Messen des proliferativen Potenzials von db/db-homozygotem mutiertem Knochenmark
getestet. Unter Bedingungen, die entweder Knochenmark- (Humphries
et al., Proc. Natl. Acad. Sci. (USA) 78, 3629–3633 (1981)) oder Lymphozyten-
(McNiece et al., J. Immunol. 146, 3785–3790 (1991)) Vermehrung begünstigten,
wurde das koloniebildende Potenzial des db/db-Knochenmarks im Vergleich
zum Kontroll-Wildtypknochenmark signifikant reduziert (11). Dies wurde besonders deutlich, wenn der Vergleich
unter Prä-B-Methylcellulosebedingungen
durchgeführt
wurde, worin KL und IL-7 verwendet wurden, um Lymphopoese voranzutreiben
(McNiece et al., s.o.). Entsprechende Analyse der komplementären Mausmutation
ob/ob, die bezüglich
der Produktion von OB-Protein defizient ist (Zhang et al., Nature
372, 425–431 (1994)),
zeigte auch, dass die lymphoproliferative Kapazität in Abwesenheit
eines funktionellen OB-Protein-Signalstoff-Stoffwechsel weges beeinträchtigt ist
(11). Diese Reduktion war jedoch weniger als die
unter Verwendung von db/db-Knochenmark beobachtete Reduktion.
-
Eine
Analyse des Zellprofils des db/db- und Wildtyp-Knochenmarks zeigte
signifikante Unterschiede zwischen den beiden auf. Gesamtzellularität des db/db-Knochenmarks war
unverändert.
Wurden jedoch verschiedene B-Zellpopulationen im db/db-Knochenmark
untersucht, so wurden erniedrigte Konzentrationen sowohl für B220+- als auch für B220+/CD43+-Zellen gefunden. B220+-Zellen
repräsentierten
alle B-Zell-Stammbäume,
während
bezüglich
CD43 erwogen wird, dass es vorzugsweise an den frühesten Zellen
der B-Zellhierarchie exprimiert wird (Hardy et al., J. Exp. Med.
173, 1213–1225
(1991)). Keine Unterschiede wurden zwischen den CD4/CD8-Färbungsprofilen der zwei Gruppen
beobachtet. Die TER119- (ein roter Zellstammbaum-Marker) Population
war im db/db-Knochenmark erhöht
(12A).
-
Ein
Vergleich von Milzen aus den zwei Gruppen zeigte einen signifikanten
Rückgang
sowohl des Gewebegewichts als auch der Zellularität der db/db-Mäuse im Vergleich
zu den homozygoten Misty-Gray-Kontrollen (0,063 ± 0,009 g vs. 0,037 ± 0,006
g und 1,10 × 107 ± 1 × 104 vs. 4,3 × 106 ± 103 Zellen > p0,05).
Diese herabgesetzte Zellularität
in der db-Milz spiegelte sich in einer ausgeprägten Reduktion von TER119-Färbung wider
(12B). Dieses Resultat scheint die Synergie zu
bestätigen,
die zwischen OB-Protein
und EPO gezeigt wurde, und weist auf eine Rolle des OB-Proteins
bei der Regulierung von Erythropoese hin.
-
Die
Untersuchung des hämatopoetischen
Kompartiments der db/db-Maus in vivo zeigte eine signifikante Reduktion
der peripheren Blutlymphozyten im Vergleich zu heterozygoten oder
Wildtyp-Kontrollen. Db/db-Mäuse
können
Blut-Glucosekonzentrationen nicht regulieren und werden in einem
Alter von etwa 6–8 Wochen
diabetisch; daher wurden Zählungen
peripheren Bluts im Laufe der Reifung der Tiere verfolgt.
-
Zur
Beschaffung von Blutproben vor dem Versuch und zu den Zeitpunkten
während
der Studie wurden 40 μl
Blut aus der Orbitahöhle
entnommen und unverzüglich
in 10 ml Verdünnungsmittel
verdünnt,
um Gerinnung zu unterbinden. Die vollständige Blutzählung aus jeder Blutprobe wurde
an einem System-9018-Blutanalysegerät von Serrono Baker innerhalb
von 60 min nach Blutabnahme gemessen. Nur der Hälfte der Tiere in jeder Dosierungsgruppe
wurde an einem bestimmten Tag Blut abgenommen, wodurch jedem Tier
zu wechselnden Zeitpunkten Blut abgenommen wurde. Blut-Glucosekonzentrationen
wurden in Blutproben aus der Orbitahöhle unter Verwendung von One-Touch-Glucosemetern
und Teststreifen (Johnson & Johnson)
gemessen. Die Resultate dieser Versuche sind in den 13A–C
gezeigt.
-
Diese
Analyse zeigte, dass Lymphozyten aus peripherem Blut zu allen Zeitpunkten
im Vergleich zu Kontrolltieren signifikant reduziert sind und dass
sich die periphere Lymphozytenpopulation der db/db-Maus mit dem
Alter nicht signifikant ändert.
FACS-Analyse zeigte auf, dass die reduzierte Lymphozytenpopulation einen
Rückgang
sowohl an B220+-Zellen als auch an CD4/CD8-Zellen
aufwies. Sowohl Erythrozyten als auch Blutplättchen weisen während der
gesamten untersuchten Zeitspanne Wildtyp-Konzentrationen auf. Die
Lymphozytenkonzentrationen in peripherem Blut in homozygoten mutierten
ob/ob-Mäusen
blieben im Vergleich zu Wildtyp-Kontrollen unverändert.
-
Hämatopoetische
Analyse der db/db-Maus kann durch das Einsetzen von Diabetes verkompliziert werden.
Daher wurde die Auswirkung von hohen Glucosekonzentrationen auf
Lymphopoese durch Vergleichen der peripheren Blutprofile und der
Blutglucosekonzentrationen in zwei anderen diabetischen Modellen, der
heterozygoten Glucokinase-Knockout-Maus (Grupe et al., Cell 83,
69–78
(1995)) und der IFN-α-transgenen Maus (Stewart
et al., Science 260, 1942–1946
(1993)), untersucht. Der Vergleich von peripheren Lymphozyten und
Blutglucose in db/db-Mäusen,
ihre geeigneten Kontrollen und die Modelle mit hoher Glucosekonzentration
zeigten keinen Zusammenhang zwischen Blutglucose- und Lymphozytenzählungen
(14). Diese Resultate lassen daher darauf schließen, dass
die Lymphoiddefekte, die in der db/db-Maus zu beobachten sind, direkt
der hämatopoetischen
Funktion des OB-Protein-Signalstoff-Stoffwechselweges
zuzuschreiben ist.
-
Um
die Kapazität
des db/db-hämatopoetischen
Kompartiments, auf Provokation zu reagieren, zu testen, wurden die
db/db-Mäuse
und die Kontrollen subletaler Bestrahlung unterzogen. C57BLKS/J-db/db-, C57BLKS/Jm+/db- und C57BLKS/J-+m/+m-Mäuse wurden
subletaler Ganzkörperbestrahlung
(750 cGy, 190 cGy/min) in Form einer Einzeldosis aus einer 137Cs-Quelle unterzogen. Die Tiere wurden
pro Versuchsgruppe verwendet. Die Kinetik der hämatopoetischen Erholung wurde
dann durch Beobachten des peripheren Bluts während der Erholungsphase verfolgt.
Dieser Versuch veranschaulichte die Unfähigkeit des hämatopoetischen
db/db-Systems, das lymphopoetische Kompartiment des peripheren Bluts
35 Tage nach der Bestrahlung vollständig wiederherzustellen. Blutplättchen-Konzentrationen
in diesen Mäusen
folgten derselben Erhohlungskinetik wie bei den Kontrolltieren,
wobei jedoch die Reduktion an Erythrozyten 7–10 Tage hinter den Kontrollen
zurückblieb.
Diese Erkenntnis kann eventuell die gesteigerte TER-119-Population
widerspiegeln, die im Knochenmark der db/db-Mäuse zu finden ist (12A).
-
Materialien
und Verfahren
-
Knochenmark,
Milzen und peripheres Blut wurden aus den diabetischen Mausstämmen: C57BLKS/J-db/db
(Mutante), C57BLKS/Jm+/db (magere heterozygote Kontroll-Wurfgeschwister), C57BLKS/J+m/+m
(magere homozygote Misty-Gray-Hülle-Kontroll-Wurfgeschwister)
und den adipösen Mausstämmen: C57BL/6J-ob/ob
(Mutante) und C57BL/6J-ob/+ (magere Wurfgeschwister-Kontrolle) geerntet. Alle
Stämme
stammen aus dem Jackson Laboratory, Bar Harbor, ME. Ein Minimum
von fünf
Tieren wurde pro Versuchsgruppe verwendet. Femurknochen wurden mit "Hank's balanced salt solution" (HBSS) plus 2% FCS gewaschen,
und eine Einzelzellsuspension wurde aus den Knochenmarkzellen hergestellt.
Milzen wurden geerntet, und die Milzkapsel wurde aufgebrochen und
durch ein Nylonnetz filtriert. Peripheres Blut wurde durch die retroorbitale
Höhle in
phosphatgepufferter Kochsalzlösung
(PBS) mit 10 U/ml Heparin und 1 mmol EDTA gesammelt und wie zuvor
beschrieben verarbeitet. Das Knochenmark, Splenozyten und peripheres
Blut wurden dann mit den monoklonalen Antikörpern gegen die folgenden Antigene
gefärbt:
B220/CD45R- (Pan-B-Zelle)
FITC-Antimaus, TER-119/Erythrozyten-R-PE-Antimaus, CD4 (L3T4), FITC- Antimaus, CD8 (Ly
3.2), FITC-Antimaus und sIgM (Igh-6b), FITC-Antimaus (alle monoklonalen
Antikörper
wurden von Pharmigen, San Diego, CA bezogen). Die geeigneten Isotyp-Kontrollen
wurden in jeden Versuch eingebunden. Für Methylcellulosetests wurde
das Knochenmark aus fünf
Tieren pro Gruppe gesammelt, und 100.000 Zellaliquoten aus jeder
Gruppe wurden für
jeden Testpunkt verwendet.
-
BEISPIEL 11
-
Expression von OB-Immunoadhäsin
-
Unter
Verwendung von Protein-Verarbeitungsverfahren wurde das menschliche
OB-Protein als eine Fusion
mit den Gelenks-, CH2- und CH3-Domänen von IgG1 exprimiert. DNA-Konstrukte,
die für
die Chimäre des
menschlichen OB-Proteins und die IgG1-Fc-Domänen kodieren, wurden mit den
Fc-Regionklonen von menschlichem IgG1 hergestellt. Menschliche OB-cDNA
wurden durch PCR aus menschlicher Fettzellen-dscDNA (Clontech Buick-Clone
cDNA-Produkt) gewonnen. Die Quelle der IgG1-cDNA war das Plasmid
pBSSK-CH2CH3. Die Chimäre
enthielt die Kodiersequenz des Volllängen-OB-Proteins (Aminosäuren 1–167 in 16) und menschliche IgG1-Sequenzen, beginnend
bei Asparaginsäure
216 (wobei Aminosäure
114 als der erste Rest der konstanten Schwerkettenregion angenommen
wird) (Kabat et al., Sequences of Proteins of Immunological Interest,
4. Auflage (1987)), die der erste Rest des IgG1-Gelenks nach dem
Cysteinrest ist, der in Schwer-Leichtkettenbindung eingebunden ist,
und endend mit Resten 441, um die CH2- und CH3-Fc-Domänen von
IgG1 einzubinden. Zwischen dem OB-Protein und den IgG1-Kodiersequenzen
war ein Insert von Codons für
drei Aminosäuren
(GlyValThr) vorhanden. Sofern erforderlich, konnte diese kurze Linkersequenz leicht
deletiert werden, beispielsweise durch ortsgerichtete Deletionsmutagenese,
um eine exakte Verbindung zwischen den Kodiersequenzen des OB-Proteins
und der IgG1-Gelenksregion zu schaffen. Die Kodiersequenz des OB-IgG1-Immunoadhäsins wurde
für vorübergehende
Expression in 293-Zellen unter Verwendung des Calciumphosphatverfahrens
(Suva et al., Science 237, 893–896
(1987)) in den pRK5-basierten Vektor pRK5tk-neo, der einen Neomycin-selektierbaren
Marker enthält,
subkloniert. 293-Zellen wurden in "HAM's: Low
Glucose DMEM"-Medium
(50:50), das 10% FBS und 2 mM L-Gln enthält, kultiviert.
-
Zur
Reinigung von OB-IgG1-Chimären
wurden Zellen in serumfreies Produktionsmedium PS24 am Tag nach
der Transfektion getauscht, und das Medium wurde nach drei Tagen
gesammelt. Das Kulturmedium wurde filtriert.
-
Der
filtrierte 293-Zellüberstand
(400 ml), der rekombinantes menschliches OB-IgG1 enthielt, wurde
1 mM in Phenylmethylsulfonylfluorid und 2 μg/ml in Aprotinin gemacht. Dieses
Material wurde bei 4°C
auf eine 1-x-4,5-cm-Protein-A-Agarosesäule (Pierce, Katalog-Nr. 20365), äquilibriert
in 100 mM HEPES, pH 8, geladen. Die Durchflussgeschwindigkeit betrugt
75 ml/h. Nachdem die Probe geladen war, wurde die Säule mit Äquilibrierungspuffer
gewaschen, bis die A280-Basislinie erreicht
war. Das OB-IgG1-Protein wurde mit 3,5 M MgCl2 +
2% Glycerin (nicht gepuffert) bei einer Durchflussgeschwindigkeit
von 15 ml/h eluiert. Das Eluat wurde bei gelegentlichem Mischen
in 10 ml von 100 mM HEPES, pH 8, gesammelt, um die MgCl2-Konzentration um
etwa die Hälfte
zu reduzieren und den pH zu erhöhen.
Das eluierte Protein wurde dann in phosphatgepufferte Kochsalzlösung dialysiert,
konzentriert, sterilfiltriert und entweder bei 4°C oder gefroren bei –70°C gelagert.
Das durch dieses Verfahren hergestellte OB-IgG1-Immunoadhäsin wird
mittels SDS-PAGE auf eine Reinheit von über 90% geschätzt.
-
BEISPIEL 12
-
Herstellung von PEG-OB
-
Die
PEG-Derivate des menschlichen OB-Proteins wurden durch Reaktion
von hOB-Protein,
gereinigt durch Umkehrphasenchromatographie, mit einem Succinimidylderivat
von PEG-Propionsäure
(SPA-PEG) mit einem nominalen Molekulargewicht von 10 kD, das von
Shearwater Polymers, Inc. (Huntsville, AL), erhalten worden war,
hergestellt. Nach Reinigung des hOB-Proteins durch Umkehrphasenchromatographie
wurde eine etwa 1–2-mg/ml-Lösung des
Proteins in 0,1% Trifluoressigsäure
und etwa 40% Acetonitril mit 1/3 bis 1/2 Volumen von 0,2 M Boratpuffer
verdünnt
und der pH auf 8,5 mit NaOH eingestellt. SPA-PEG wurde zum Reaktionsgemisch
zugesetzt, um Molverhältnisse
von 1:1 und 1:2 von Protein zu SPA-PEG herzustellen, und das Gemisch
wurde 1 h lang bei Raumtemperatur inkubieren gelassen.
-
Nach
Reaktion und Reinigung durch Gelelektrophorese oder Ionenaustauschchromatographie
wurden die Proben ausführlich
gegen phosphatgepufferte Kochsalzlösung dialysiert und durch Filtration
durch ein 0,22-μm-Filter sterilisiert.
Proben wurden bei 4°C
gelagert. Unter diesen Bedingungen bestand das aus der Reaktion
mit 1:1-Molverhältnis
zwischen Protein und SPA-PEG resultierende PEG-hOB primär aus Molekülen mit einem
10-kD-PEG, gebunden an geringere Mengen von 2 PEG enthaltenden Spezies.
Das PEG-hOB aus der Reaktion mit Molverhältnis 1:2 bestand aus etwa
gleichen Mengen von 2 und 3 PEGs, gebunden an hOB, wie mittels SDS-Gelelektrophorese
bestimmt wurde. In beiden Reaktionen wurden auch geringe Mengen
an nicht umgesetztem Protein nachgewiesen. Dieses nicht umgesetzte
Protein kann durch Gelfiltration- oder Ionenaustausch-Verfahrensschritte,
je nach Bedarf, wirksam entfernt werden. Die PEG-Derivate des menschlichen OB-Proteins
können
auch im Wesentlichen gemäß dem chemischen
Verfahren mit Aldehyd, das in der
EP 372.752 ,
veröffentlicht
am 13. Juni 1990, beschrieben wird, hergestellt werden.
-
BEISPIEL 13
-
Maus-Agonistenantikörper
-
Mäuse wurden
fünfmal
mit 20 μg
WSX-Rezeptor-Immunoadhäsin
(siehe Beispiel 2 oben), resuspendiert in MPL-TDM (Monophosphoryllipid
A/Trehalosedicorynomycolat; Rabi, Immunochemical Research Inc.), in
jeden Pfotenballen immunisiert. 3 Tage nach der letzten Immunisierung
wurden Lymphzellen aus der Kniekehle mit Mausmyelomzellen, X63-Ag8.8.653-Zellen,
unter Verwendung von 50% Polyethylenglykol wie beschrieben (Laskov
et al., Cell. Immunol. 55, 251 (1980)) fusioniert.
-
Das
anfängliche
Screenen von Hybridomkulturüberständen erfolgte
unter Verwendung eines Einfang-ELISA. Für den Einfang-ELISA wurden
Mikrotiterplatten (Maxisorb; Nunc, Kamstrup, Dänemark) mit 50 μl/Well von
2 μg/ml
Ziegen-Antikörpern,
die spezifisch für
den Fc-Abschnitt von menschlichem IgG sind (Ziege-Anti-hIgG-Fc;
Cappel), in PBS über
Nacht bei 4°C
beschichtet und mit 2 × BSA
1 h lang bei Raumtemperatur blockiert. Dann wurden 50 μl/Well von
2 μg/ml
von WSX-Rezeptor- Immunoadhäsin zu jedem
Well 1 h lang zugesetzt. Die verbleibenden Anti-Fc-Bindungsstellen wurden
mit PBS, die 3% menschliches Serum und 10 μg/ml CD4-IgG enthielt, 1 h lang blockiert. Die
Platten wurden mit 50 μl/Well
von 2 μg/ml
monoklonalem Anti-WSX-Rezeptor-Antikörper (oder Hybridomkulturüberstand)
1 h lang inkubiert. Die Platten wurden dann mit 50 μl/Well HRP-Ziege-Anti-Maus-IgG
inkubiert. Das gebundene Enzym wurde durch den Zusatz des Substrats (OPD)
nachgewiesen, und die Platten wurden bei 490 nM mit einem ELISA-Plattenleser
gelesen. Zwischen jedem Schritt wurden die Platten in Waschpuffer
(PBS, die 0,05% TWEEN 20TM enthielt) gewaschen.
-
Agonistenantikörper wurden
unter Verwendung des KIRA-ELISA, der in der WO 95/14930 beschrieben
ist, gescreent. Ein chimärer
Rezeptor, der die extrazelluläre
Domäne
des WSX-Rezeptor und die Transmembran- und intrazelluläre Domäne von Rse-Rezeptor
(Mark et al., Journal of Biological Chemistry 269(14), 10720–10728 (1994))
mit einer Carboxyl-terminalen Herpes-Simplex-Virus-Glykoprotein-D-
(gD-) Markierung umfasst, wurde hergestellt, und dp12.CHO-Zellen
wurden hiermit wie in Beispiel 4 der WO 95/14930 beschrieben transformiert.
-
Die
WSX/Rse.gD-transformierten dp12.CHO-Zellen wurden in den Wells einer
flachbödigen 96-Well-Kulturplatte
in 100 μl
Medium überimpft
(3 × 104 pro Well) und über Nacht bei 37°C in 5% CO2 kultiviert. Am darauf folgenden Morgen
wurden die Well-Überstände entfernt,
und verschiedene Konzentrationen von gereinigtem mAb wurden zu einzelnen
Wells zugesetzt. Die Zellen wurden bei 37°C 30 min lang stimuliert, und die
Well-Überstände wurden
dekantiert. Um die Zellen zu lysieren und die chimären Rezeptoren
löslich
zu machen, wurden 100 μl
Lysepuffer zu jedem Well zugesetzt. Die Platte wurde dann auf einem
Plattenschüttler (Bellco
Instruments, Vineland, NJ) 60 min lang bei Raumtemperatur sanft
geschüttelt.
-
Während die
Zellen löslich
gemacht wurden, wurde eine ELISA-Mikrotiterplatte (Nunc Maxisorp,
Inter Med, Dänemark),
beschichtet über
Nacht bei 4°C
mit monoklonalem 5B6-Anti-gD-Antikörper (5,0 μg/ml in 50 mM Carbonatpuffer,
pH 9,6, 100 μl/Well),
dekantiert und mit 150 μl/Well
Block-Buffer, der 2% BSA enthielt, 60 min lang bei Raumtemperatur
blockiert. Nach 60 min wurde die Anti-gD-5B6-beschichtete Platte
sechsmal mit Waschpuffer (PBS, die 0,05% TWEEN 20TM und
0,01% Thimerosal enthielt) gewaschen.
-
Das
Lysat, das löslich
gemachtes WSX/Rse.gD aus dem Zellkultur-Mikrotiterwell enthielt,
wurde (85 μl/Well)
zu dem Anti-gD-5B6-beschichteten und blockierten ELISA-Well transferiert
und 2 h lang bei Raumtemperatur inkubiert. Das ungebundene WSX/Rse.gD
wurde durch Waschen mit Waschpuffer und 100 μl biotinyliertem 4G10 (Anti-Phosphotyrosin),
verdünnt
1:18.000 in Verdünnungspuffer
(PBS mit 0,5% BSA, 0,05% Tween-20, 5 mM EDTA und 0,01% Thimerosal),
d.h. 56 ng/ml wurden pro Well zugesetzt, entfernt. Nach zweistündiger Inkubation
bei Raumtemperatur wurde die Platte gewaschen, und HRPO-konjugiertes
Streptavidin (Zymed Laboratories, S. San Francisco, CA) wurde zu
jedem Well zugesetzt. Die Platte wurde 30 min lang bei Raumtemperatur
unter sanftem Schütteln
inkubiert. Das freie Avidin-Konjugat
wurde abgewaschen, und 100 μl
frisch zubereitete Substratlösung
(Tetramethylbenzidin (TMB); 2-Komponenten-Substratset; Kirkegaard & Perry, Gaithersburg,
MD) wurden zu jedem Well zugesetzt. Die Reaktion wurde 10 min lang
laufen gelassen, wonach die Farbentwicklung durch den Zusatz von
1,0 M H3PO4, 100 μl/Well, gestoppt
wurde. Die Absorption bei 450 nm wurde bei einer Bezugswellenlänge von
650 nm (ABS450/650) unter Verwendung eines νmax-Plattenlesers
(Molecular Devices, Palo Alto, CA), gesteuert durch einen Macintosh
Centris 650 (Apple Computers, Cupertino, CA) und DeltaSoft-Software
(BioMetallics, Inc., Princeton, NJ), abgelesen.
-
Vier
der 25 monoklonalen Anti-WSX-Rezeptor-Antikörper aktivierten den chimären WSX/Rse-Rezeptor
im KIRA-ELISA. Die Antikörper
wurden wie folgt benannt: 2D7, 1G4, 1E11 und 1C11.
-
Um
zu bestimmen, ob die vier Agonisten-Anti-WSX-Rezeptor-mAbs dieselben
oder unterschiedliche Epitope erkannten, wurde ein Konkurrenzbindungs-ELISA
gemäß der Beschreibung
in Kim et al., J. Immunol. Method 156, 9–17 (1992), unter Verwendung
von biotinylierten mAbs (Bio-mAb) durchgeführt. Bio-mAbs wurden unter
Ver wendung von N-Hydroxylsuccinimid, wie in Antibodies, A Laboratory
Manual, Cold Spring Harbor Laboratory, E. Harlow & D. Lane (Hrsg.),
341 (1988), beschrieben wird, hergestellt. Mikrotiterwells wurden
mit 50 μl
Ziege-Anti-hIgG-Fc beschichtet und über Nacht bei 4°C gehalten,
mit 2% BSA 1 h lang blockiert und mit 25 μl/Well menschlichem WSX-Rezeptor-Immunoadhäsin (1 μg/ml) 1 h
lang bei Raumtemperatur inkubiert. Nach dem Waschen wurde ein Gemisch
mit einer vorbestimmten optimalen Konzentration von Bio-mAb, gebunden
an einen tausendfachen Überschuss
an nicht markiertem mAb, zu jedem Well zugesetzt. Nach einstündiger Inkubation
bei Raumtemperatur wurden die Platten gewaschen, und die Menge an
Bio-mAb wurde durch den Zusatz von HRP-Streptavidin nachgewiesen.
Nach Waschen der Platten wurde das gebundene Enzym durch den Zusatz
des Substrats o-Phenylendiamindihydrochlorid (OPD) nachgewiesen,
und die Platten wurden bei 490 nm mit einem ELISA-Plattenleser gelesen.
-
Die
Fähigkeit
der mAbs, Maus-WSX-Rezeptor zu erkennen, wurde in einem Einfang-ELISA bestimmt. Maus-WSX-Rezeptor
(21), fusioniert an eine gD-Markierung
(siehe oben), wurde durch eine Anti-gD- (5B6-) beschichtete ELISA-Platte
eingefangen. Nach dem Waschen wurden verschiedene Konzentrationen von
biotinylierten mAbs zu jedem Well zugesetzt. Biotinylierte mAbs,
gebunden an WSX-Rezeptor-gD, wurden unter Verwendung von HRP-Streptavidin
wie zuvor beschrieben nachgewiesen.
-
Um
zu bestimmen, ob die Antikörper
membrangebundenen Rezeptor banden, wurde FACS-Analyse unter Verwendung
von 293-Zellen, transfiziert mit WSX-Rezeptor, durchgeführt. 105 WSX-Rezeptor-transfizierte 293-Zellen wurden
in 100 μl
PBS plus 1% fötales
Kälberserum
(FSC) resuspendiert und mit 2D7- oder 1G4-Hybridomzellüberstand 30 min lang auf Eis
inkubiert. Nach dem Waschen wurden die Zellen mit 100 μl FITC-Ziege-Anti-Maus-IgG
30 min lang bei 4°C
inkubiert. Die Zellen wurden zweimal gewaschen, in 150 μl PBS plus
1% FCS resuspendiert und mittels FACscan (Becton Dickinson, Mountain
View, CA) analysiert. Die Antikörper
2D7 und 1G4 banden sich gemäß der FACS-Analyse
an Membran-WSX-Rezeptor.
-
Die
Eigenschaften von Agonistenantikörpern
2D7 und 1G4 sind in der folgenden Tabelle zusammengefasst. TABELLE
2
- a Für diese
mAbs wurde mittels kompetitivem Bindungs-ELISA gezeigt, dass sie
verschiedene Epitope erkennen.
- b Diese Resultate wurden mittels ELISA
bestimmt (hWSXR steht für
menschlicher WSX-Rezeptor und mWSXR für Maus-WSX-Rezeptor).
- c Die agonistischen Aktivitäten wurden
durch KIRA-ELISA bestimmt.
-
BEISPIEL 14
-
Menschliche Agonistenantikörper
-
Einkettige
Fc- (scFv-) Fragmente, die sich an den menschlichen WSX-Rezeptor
(hWSXR) binden, wurden aus einer großen menschlichen scFv-Bibliothek
(Vaughan et al., Nature Biotechnology 14, 309–314 (1996)) unter Verwendung
von Antigen, das auf Immunoröhrchen
plattiert war, oder von biotinyliertem Antigen in Verbindung mit
Streptavidin-beschichteten magnetischen Perlen (Griffiths et al.,
EMBO J. 13, 3245–3260 (1994);
und Vaughan et al. (1996)) isoliert. Kurz zusammengefasst wurden
die Immunoröhrchen,
die über Nacht
mit 10 μg/ml
menschlichem WSX-Rezeptor-Immunoadähsin (siehe
Beispiel 2 oben) in phosphatgepufferter Kochsalzlösung (PBS)
beschichtet wurden, für
drei Panning-Durchgänge
verwendet. Der humanisierte Antikörper, huMAb4D5-8 (Carter et
al., Proc. Natl. Acad. Sci. USA 89, 4285–4289 (1992)), wurde verwendet, um
auf Antikörper,
die sich an das Fc des Immunoadhäsins
binden, mittels Gegenauswahl zu selektieren. Dies erfolgte unter
Verwendung von 1 mg/ml huMAb4D5-8 in Lösung für die Panning-Schritte. Weiters
wurde die extrazelluläre
Domäne
von menschlichem WSX-Rezeptor (gespaltet aus dem WSX- Rezeptor-Immunoadhäsin mit
Genenase (Carter et al., Proteins: Structure, Function and Genetics
6, 240–248
(1989))) biotinyliert und für drei
Panning-Durchgänge
verwendet. Einzelne Phagen wurden nach zwei oder drei Panning-Durchgängen durch
Antigen-Bindungs-ELISA charakterisiert (Tabellen 3 und 4). TABELLE
3 Panning
mit Immunoröhrchen,
beschichtet mit menschlichem WSX-Rezeptor-Immunoadhäsin
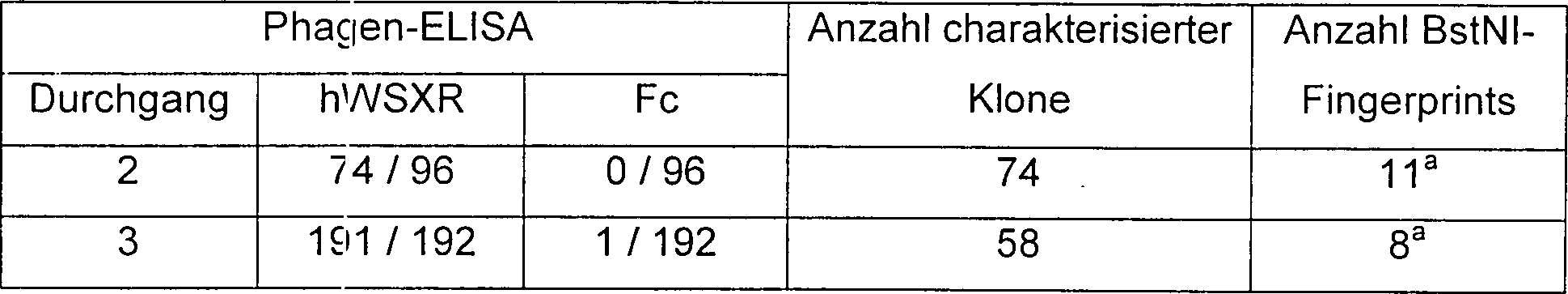
- a Gesamtzahl
von 11 verschiedenen identifizierten Klonen
TABELLE
4 Panning
mit biotinyliertem menschlichem WSX-Rezeptor - a Gesamtzahl
von 7 verschiedenen identifizierten Klonen.
-
Klone,
die sich an menschlichen WSX-Rezeptor binden, wurden durch BstNI-Fingerprinting eines PCR-Fragments,
das für
das scFv kodiert, näher
charakterisiert. Eine Gesamtzahl an 18 Klonen wurden identifiziert:
11 aus dem Panning unter Verwendung von Immunoröhrchen und 7 aus dem Panning
unter Verwendung von bioti nyliertem Antigen (es gab keine Überlappung
zwischen diesen Gruppen). Die DNA für alle 18 Klone wurde sequenziert.
-
Die
wie zuvor beschrieben erhaltenen Anti-huWSXR-Klone wurden auf Agonistenaktivität in einem
KIRA-ELISA-Test analysiert (siehe oben und 22),
zuerst als scFv-Phage
und dann als scFv. Der scFv-Phage wurde PEG-gefällt (Carter et al., Mutagenesis:
A Practical Approach, M. McPherson (Hrsg.), IRL Press, Oxford, UK,
Kapitel 1, 1–25
(1991)) und vor dem Screenen in PBS resuspendiert. Um das scFv herzustellen,
wurde DNA aus den Klonen zu 33D3-Zellen transformiert (ein Nicht-Suppressor-Stamm zur Expression
von löslichem Protein).
Die Zellen wurden auf 2YT/2% Glucose/50 μg pro ml Carbenicillin ausplattiert
und bei 37°C über Nacht
inkubiert. Eine 5-ml-Kultur (2YTG:2YT, 2% Glucose, 50 μg/ml Carbenicillin)
wurde inokuliert und bei 30°C über Nacht
wachsen gelassen. Am darauf folgenden Morgen wurde die 5-ml-Kultur in 500 ml
2YTG-Medium verdünnt
und bei 30°C
wachsen gelassen, bis eine OD550 ~ 0,3 erreicht war. Dann wurde
das Medium von 2YTG zu 2YT/50 μg/ml
Carbenicillin/2 mM IPTG gewechselt und bei 30°C 4–5 h lang zur scFv-Produktion wachsen
gelassen. Die Kultur wurde geerntet, und das Zellpellet wurde bei –20°C eingefroren.
Zur Reinigung wurde das Zellpellet in 10 ml Shockate-Puffer (50
mM TrisCHI, pH 8,5, 20% Saccharose, 1 mM EDTA) resuspendiert und
bei 4°C
1 h lang gerührt.
Die Zelltrümmer
wurden zentrifugiert, und der Überstand
wurde genommen, um an einer Ni-NTA-Superose-Säule (Qiagen) gereinigt zu werden.
MgCl2 wurde zum Überstand bis 5 mM zugesetzt
und auf 0,5-ml-Ni-NTA-Superose, gepackt in eine Einwegsäule, geladen.
Die Säule
wurde dann mit 2 × 5
ml Waschpuffer 1 (50 mM Natriumphosphat, 300 mM NaCl, 25 mM Imidazol,
pH 8,0) gewaschen, gefolgt von 2 × 5 ml Waschpuffer 2 (50 mM
Natriumphosphat, 300 mM NaCl, 50 mM Imidazol, pH 8,0). Das scFv
wurde dann mit 2,5 ml Elutionspuffer (50 mM Natriumphosphat, 300
mM NaCl, 250 mM Imidazol, pH 8,0) eluiert. Der eluierte Pool wurde
in PBS mit einer NAP5-Säule
(Pharmacia) pufferausgetauscht und bei 4°C gelagert.
-
Für die Klone
Nr. 3, 4 und 17 wurde erkannt, dass sie Agonistenaktivität als Phage
und als scFv aufwiesen (siehe die 23 und 24).
Die Sequenzen dieser Agonistenklone sind in 25 gezeigt.
Die Aktivität
der Antikörper
als F(ab')2 im KIRA- ELISA
wurde getestet, wobei Klon Nr. 4 und Klon Nr. 17 erhöhte Aktivität als F(ab')2 zeigten.
Die Fähigkeit
der Antikörper,
Maus-WSX-Rezeptor in einem Einfang-ELISA zu binden (siehe Beispiel
13), wurde getestet. Klon Nr. 4 und Klon Nr. 17 banden Maus-WSX-Rezeptor
in diesem Test.
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
























































