DE60009574T2 - Chondroitinsulfat aus lachsen - Google Patents
Chondroitinsulfat aus lachsen Download PDFInfo
- Publication number
- DE60009574T2 DE60009574T2 DE60009574T DE60009574T DE60009574T2 DE 60009574 T2 DE60009574 T2 DE 60009574T2 DE 60009574 T DE60009574 T DE 60009574T DE 60009574 T DE60009574 T DE 60009574T DE 60009574 T2 DE60009574 T2 DE 60009574T2
- Authority
- DE
- Germany
- Prior art keywords
- chondroitin sulfate
- galactosamine
- acetyl
- disaccharide unit
- galnac
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 title claims description 74
- 229920001287 Chondroitin sulfate Polymers 0.000 title claims description 73
- 229940059329 chondroitin sulfate Drugs 0.000 title claims description 70
- 241000972773 Aulopiformes Species 0.000 title claims description 10
- 235000019515 salmon Nutrition 0.000 title claims description 10
- OVRNDRQMDRJTHS-CBQIKETKSA-N N-Acetyl-D-Galactosamine Chemical class CC(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-CBQIKETKSA-N 0.000 claims description 17
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 16
- 238000000034 method Methods 0.000 claims description 16
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 claims description 11
- 239000002244 precipitate Substances 0.000 claims description 9
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 claims description 6
- 239000003729 cation exchange resin Substances 0.000 claims description 6
- 238000000227 grinding Methods 0.000 claims description 6
- 210000002184 nasal cartilage Anatomy 0.000 claims description 6
- 239000000463 material Substances 0.000 claims description 5
- 108010059712 Pronase Proteins 0.000 claims description 4
- 239000003513 alkali Substances 0.000 claims description 3
- 238000005238 degreasing Methods 0.000 claims description 3
- 229940121363 anti-inflammatory agent Drugs 0.000 claims description 2
- 239000002260 anti-inflammatory agent Substances 0.000 claims description 2
- 125000000600 disaccharide group Chemical group 0.000 claims 8
- 239000003906 humectant Substances 0.000 claims 1
- 239000011344 liquid material Substances 0.000 claims 1
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical class CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 25
- 210000000845 cartilage Anatomy 0.000 description 19
- 150000002016 disaccharides Chemical group 0.000 description 16
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid group Chemical group S(O)(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 11
- 239000000203 mixture Substances 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 9
- 241000251730 Chondrichthyes Species 0.000 description 9
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 9
- 229920002683 Glycosaminoglycan Polymers 0.000 description 8
- 230000002378 acidificating effect Effects 0.000 description 8
- 241000283153 Cetacea Species 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- 238000009826 distribution Methods 0.000 description 6
- 239000003349 gelling agent Substances 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 102000008186 Collagen Human genes 0.000 description 5
- 108010035532 Collagen Proteins 0.000 description 5
- 229920001436 collagen Polymers 0.000 description 5
- 239000008367 deionised water Substances 0.000 description 5
- 229910021641 deionized water Inorganic materials 0.000 description 5
- 150000002337 glycosamines Chemical class 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 239000002537 cosmetic Substances 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 235000013373 food additive Nutrition 0.000 description 4
- 239000002778 food additive Substances 0.000 description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 4
- 239000007788 liquid Substances 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 229920001467 poly(styrenesulfonates) Polymers 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 230000019635 sulfation Effects 0.000 description 4
- 238000005670 sulfation reaction Methods 0.000 description 4
- 239000000080 wetting agent Substances 0.000 description 4
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 3
- 230000003110 anti-inflammatory effect Effects 0.000 description 3
- 238000000921 elemental analysis Methods 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 239000006210 lotion Substances 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- 239000002994 raw material Substances 0.000 description 3
- 239000011347 resin Substances 0.000 description 3
- 229920005989 resin Polymers 0.000 description 3
- 239000011593 sulfur Substances 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 229920002567 Chondroitin Polymers 0.000 description 2
- 241000725303 Human immunodeficiency virus Species 0.000 description 2
- 210000000988 bone and bone Anatomy 0.000 description 2
- VSGNNIFQASZAOI-UHFFFAOYSA-L calcium acetate Chemical compound [Ca+2].CC([O-])=O.CC([O-])=O VSGNNIFQASZAOI-UHFFFAOYSA-L 0.000 description 2
- 239000001639 calcium acetate Substances 0.000 description 2
- 235000011092 calcium acetate Nutrition 0.000 description 2
- 229960005147 calcium acetate Drugs 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 229940094517 chondroitin 4-sulfate Drugs 0.000 description 2
- KXKPYJOVDUMHGS-OSRGNVMNSA-N chondroitin sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](OS(O)(=O)=O)[C@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](C(O)=O)O1 KXKPYJOVDUMHGS-OSRGNVMNSA-N 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 150000004676 glycans Chemical class 0.000 description 2
- 210000003128 head Anatomy 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 235000013372 meat Nutrition 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 230000001766 physiological effect Effects 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 239000012488 sample solution Substances 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- -1 sulfate ester Chemical class 0.000 description 2
- 238000006277 sulfonation reaction Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 1
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- 238000005084 2D-nuclear magnetic resonance Methods 0.000 description 1
- OHXPGWPVLFPUSM-KLRNGDHRSA-N 3,7,12-trioxo-5beta-cholanic acid Chemical compound C1CC(=O)C[C@H]2CC(=O)[C@H]3[C@@H]4CC[C@H]([C@@H](CCC(O)=O)C)[C@@]4(C)C(=O)C[C@@H]3[C@]21C OHXPGWPVLFPUSM-KLRNGDHRSA-N 0.000 description 1
- 102000016284 Aggrecans Human genes 0.000 description 1
- 108010067219 Aggrecans Proteins 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101710132601 Capsid protein Proteins 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000005598 Chondroitin Sulfate Proteoglycans Human genes 0.000 description 1
- 108010059480 Chondroitin Sulfate Proteoglycans Proteins 0.000 description 1
- 102000037716 Chondroitin-sulfate-ABC endolyases Human genes 0.000 description 1
- 108090000819 Chondroitin-sulfate-ABC endolyases Proteins 0.000 description 1
- 102000011413 Chondroitinases and Chondroitin Lyases Human genes 0.000 description 1
- 108010023736 Chondroitinases and Chondroitin Lyases Proteins 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 229920000045 Dermatan sulfate Polymers 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 238000005033 Fourier transform infrared spectroscopy Methods 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102000004157 Hydrolases Human genes 0.000 description 1
- 108090000604 Hydrolases Proteins 0.000 description 1
- AEMOLEFTQBMNLQ-HNFCZKTMSA-N L-idopyranuronic acid Chemical group OC1O[C@@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-HNFCZKTMSA-N 0.000 description 1
- 102000004317 Lyases Human genes 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- OVRNDRQMDRJTHS-UHFFFAOYSA-N N-acelyl-D-glucosamine Natural products CC(=O)NC1C(O)OC(CO)C(O)C1O OVRNDRQMDRJTHS-UHFFFAOYSA-N 0.000 description 1
- OVRNDRQMDRJTHS-FMDGEEDCSA-N N-acetyl-beta-D-glucosamine Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O OVRNDRQMDRJTHS-FMDGEEDCSA-N 0.000 description 1
- MBLBDJOUHNCFQT-LXGUWJNJSA-N N-acetylglucosamine Natural products CC(=O)N[C@@H](C=O)[C@@H](O)[C@H](O)[C@H](O)CO MBLBDJOUHNCFQT-LXGUWJNJSA-N 0.000 description 1
- 108010025020 Nerve Growth Factor Proteins 0.000 description 1
- 102000007072 Nerve Growth Factors Human genes 0.000 description 1
- 102000016611 Proteoglycans Human genes 0.000 description 1
- 108010067787 Proteoglycans Proteins 0.000 description 1
- 241000700584 Simplexvirus Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical group O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-WAXACMCWSA-N alpha-D-glucuronic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-WAXACMCWSA-N 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 description 1
- 229940107200 chondroitin sulfates Drugs 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 229960002997 dehydrocholic acid Drugs 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- AVJBPWGFOQAPRH-FWMKGIEWSA-L dermatan sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@H](OS([O-])(=O)=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@H](C([O-])=O)O1 AVJBPWGFOQAPRH-FWMKGIEWSA-L 0.000 description 1
- 229940051593 dermatan sulfate Drugs 0.000 description 1
- 229960002086 dextran Drugs 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000012041 food component Nutrition 0.000 description 1
- 239000005417 food ingredient Substances 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 229920002674 hyaluronan Polymers 0.000 description 1
- 229960003160 hyaluronic acid Drugs 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000031891 intestinal absorption Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- 229950006780 n-acetylglucosamine Drugs 0.000 description 1
- 239000003900 neurotrophic factor Substances 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000005518 polymer electrolyte Substances 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 210000001116 retinal neuron Anatomy 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000010414 supernatant solution Substances 0.000 description 1
- 241000712461 unidentified influenza virus Species 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
- C08B37/0063—Glycosaminoglycans or mucopolysaccharides, e.g. keratan sulfate; Derivatives thereof, e.g. fucoidan
- C08B37/0069—Chondroitin-4-sulfate, i.e. chondroitin sulfate A; Dermatan sulfate, i.e. chondroitin sulfate B or beta-heparin; Chondroitin-6-sulfate, i.e. chondroitin sulfate C; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
- A61K31/737—Sulfated polysaccharides, e.g. chondroitin sulfate, dermatan sulfate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/72—Cosmetics or similar toiletry preparations characterised by the composition containing organic macromolecular compounds
- A61K8/73—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/16—Emollients or protectives, e.g. against radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P19/00—Preparation of compounds containing saccharide radicals
- C12P19/04—Polysaccharides, i.e. compounds containing more than five saccharide radicals attached to each other by glycosidic bonds
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Dermatology (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Molecular Biology (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Polymers & Plastics (AREA)
- General Chemical & Material Sciences (AREA)
- Materials Engineering (AREA)
- Zoology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biotechnology (AREA)
- Pain & Pain Management (AREA)
- Microbiology (AREA)
- Rheumatology (AREA)
- Toxicology (AREA)
- General Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Birds (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Cosmetics (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
- Fachgebiet
- Die vorliegende Erfindung betrifft ein neuartiges Chondroitinsulfat, von dem eine Nützlichkeit für verschiedene Zwecke in den Bereichen von Arzneimitteln, Kosmetika und Nahrungsmittelzusätzen erwartet wird.
- Hintergrund
- Bei einem Chondroitinsulfat handelt es sich um ein saures Mucopolysaccharid, das im Bindegewebe von Tieren enthalten ist. Es besteht aus einer wiederkehrenden Disaccharid-Struktur der D-Glucuronsäure und einem sulfierten N-Acetylgalactosamin, und es existieren verschiedene Isomere in Abhängigkeit von der Sulfierung einer Hydroxylgruppe des Zuckerbestandteils.
- Bei den zu sulfierenden Stellen handelt es sich um die Hydroxylgruppen in den 2- und 3-Positionen der Glucuronsäure, einer Hydroxylgruppe in der 2-Position der Iduronsäure und den Hydroxylgruppen in den 4- und 6-Positionen des N-Acetylgalactosamins. Bei einer Chondroitinsulfatkette handelt es sich um ein lineares Polysaccharid mit einem Molekulargewicht von 104 bis 105, welches als ein Proteogulykan in kovalenter Bindung an ein Kernprotein vorliegt. Generell kommt als eine natürlich vorkommende Chondroitinsulfatkette eine aus einer sich wiederholenden Einheit lediglich eines Typs von sulfiertem Disaccharid bestehende kaum jemals vor, sondern enthält diese vielmehr verschiedene Arten von sulfierten oder nicht-sulfierten Disacchariden in unterschiedlichen Verhältnissen.
- Bei Chondroitinsulfat handelt es sich um eine Substanz, die zuerst bei sauren Mucopolysacchariden gefunden wurde. Im Jahre 1886 wurde sie von Fischer und Boedeker aus Knorpel isoliert und zunächst als Chondroitsäure bezeichnet. Später wurde festgestellt, dass diese einen Sulfatester enthält, und wurde daraufhin als Chondroitinsulfat bezeichnet. Dann wurde im Jahre 1951 von Meyer et al. festgestellt, dass ein Chondroitinsulfat drei Typen (A, B und C) umfasst und dass A und C in Knorpel vorhanden sind.
- Als ein Proteoglykan mit einer Chondroitinsulfatkette existieren Aggrecan, Versican, Decholin und ähnliche. Ihre Funktionen sind jedoch in vielen Fällen unbekannt. Obschon die Wirksamkeit des Aglykans in der Kontrolle der Knorpelgewebefunktion oder die Anti-Zelladhäsions-Aktivität von Versican durch eine Chondrokinase-Behandlung vollständig verlorengeht, wird die Chondroitinsulfatkette nichtsdestotrotz als diese Aktivitäten aufweisend erachtet. Weiterhin wurde ein Chondroitinsulfat-Proteoglykan als ein neurotropher Faktor der Netzhaut-Neuronen und als ein Axon-verlängernder Faktor isoliert. Diese Aktivitäten gingen ebenfalls durch Chondrokinase-Behandlung verloren. Vor kurzem wurde auch berichtet, dass ein von einem Chondroitinsulfat stammendes Disaccharid die Aktivierung natürlicher Killerzellen unterdrückt. Darüber hinaus war schon vor dem Auftauchen des humanen Immunschwäche-Virus (HIV) bekannt, dass sulfierte Polysaccharide wie Chondroitinsulfate, Karrageen, Dextransulfate und ähnliches die Infizierung von Zellen mit einer großen Zahl von Viren wie dem Influenza-Virus, Herpes simplex-Virus und ähnlichen hemmen.
- Da demnach verschiedenartige physiologische Aktivitäten und Eigenschaften beim Chondroitinsulfat festgestellt wurden, wurde es in Arzneimitteln wie entzündungshemmenden Mitteln und ähnlichem, außerdem in Kosmetika oder Augenlotionen als Benetzungsmittel und in Nahrungsmittelzusätzen, z.B. als Gelbildner, Geliermittel und ähnliches, verwendet. In Molkereiprodukten ist es bei einem unerwartet breiten Bereich zu finden. Über diese herkömmlichen Anwendungen hinaus wird aufgrund seiner Eigenschaften ein latenter Nutzwert als Arzneimittel für verschiedene Zwecke erwartet.
- Das derzeit in der ärztlichen Versorgung oder ähnlichen Bereichen verwendete Chondroitinsulfat umfasst ein aus Walknorpel extrahiertes Chondroitinsulfat A (ChS-A, Chondroitin-4-sulfat), und ein aus einer Haifischflosse extrahiertes Chondroitinsulfat C (ChS-C, Chondroitin-6-sulfat). In letzter Zeit hat sich aufgrund des Walfangverbots der Schwerpunkt von ChS-A zu ChS-C verlagert. Allerdings steigt der Preis für Haifischflossen als einem Nahrungsmittelbestandteil der chinesischen Küche. Aus diesem Grund besteht Bedarf nach einem Rohstoff und einem Verfahren, mittels dessen das Chondroitinsulfat in großer Menge bei geringeren Kosten gewonnen werden kann. Takeda et al. (J. JPN. SOC. Nutr. Food Sci. 51, 213–217 (1990) beschreibt die Gewinnung von Chondroitinsulfat und seinem Oligosaccharidgemisch aus Lachsnasenknorpel und untersuchte die Wirkungen auf die Darmabsorption von Glucose.
- Demgemäß richtet sich die Erfindung auf die Bereitstellung eines neuartigen Chondroitinsulfats, welches in einer großen Menge bei geringeren Kosten gewonnen werden kann und welches als für verschiedene Zwecke nützlich zu erachten ist, als auch einer Methode zur Gewinnung desselben.
- Beschreibung der Erfindung
- Die Erfindung betrifft ein Chondroitinsulfat, welches eine Disaccharid-Einheit umfasst, die ein nicht-sulfiertes N-Acetyl-D-galactosamin (im folgenden als nicht-sulfiertes GalNAc abgekürzt) zu 11,0 ± 3,3% enthält, eine Disaccharid-Einheit, die ein C6-monosulfiertes N-Acetyl-D-galactosamin (im folgenden als C6-monosulfiertes GalNAc abgekürzt) zu 52,8 ± 15,8% enthält, eine Disaccharid-Einheit, die ein C4-sulfiertes N-Acetyl-D-galactosamin (im folgenden als C4-monosulfiertes GalNAc abgekürzt) zu 28,4 ± 8,5% enthält und eine Disaccharid-Einheit, die ein C4,C6-disulfiertes N-Acetyl-D-galactosamin (im folgenden als C4,C6-desulfiertes GalNAc abgekürzt) zu 7,8 ± 2,3% enthält, ein Verfahren zur Herstellung des Chondroitinsulfats, welches das Mahlen von Lachsnasenknorpel bei einer niedrigen Temperatur, das Entfetten des gemahlenen Materials, dann sein Behandeln mit einem Alkali und einer Pronase, das Zentrifugieren des resultierenden flüssigen verdauten Materials und dann sein Ausfällen mit Ethanol umfasst, als auch ein Verfahren zur Herstellung des Chondroitinsulfats, welches außerdem das Behandeln des resultierenden Präzipitats mit einem Kationenaustauscherharz umfasst. Darüber hinaus betrifft die Erfindung ein entzündungshemmendes Mittel und ein Benetzungsmittel, das das Chondroitinsulfat enthält.
- Beste Ausführungsform der Erfindung
- Das Chondroitinsulfat der Erfindung wird in großer Menge zum Beispiel aus Lachsnasenknorpel erhalten.
- Nachfolgend wird das Verfahren skizziert, wobei zunächst ein Produkt, das durch Entfernung der Haut, der harten Knochen, der Fleischteilchen vom während der Verarbeitung eines Lachses abgetrennten Kopf erhalten wird, wobei lediglich herausgetrennter und bei –120°C gemahlener Nasenknorpel als ein Rohmaterial verwendet wird. Durch das Mahlen bei einer niedrigen Temperatur kann der Abbau und die Oxidation des Produkts aufgrund der Wärmeerzeugung beim Mahlen vermieden werden. Außerdem wird durch das Mahlen bei normaler Temperatur eine Feinvermahlung zu einer Kleinstgröße ermöglicht und außerdem eine gleichförmige Teilchengröße erhalten. Ein saures Mucopolysaccharid wird aus dem Knorpelpulver extrahiert und dieses mit einem Protonenaustauscherharz behandelt, um die Chondroitinsulfat-Fraktion zu erhalten. Die Vorgehensweise kann auf einem Verfahren zum Extrahieren eines Chondroitinsulfats aus Wal- oder Haifischknorpel basieren.
- Die Herstellung eines gereinigten Chondroitinsulfats aus dem Knorpelpulver wird nachstehend ausführlicher beschrieben und im Überblick wiedergegeben.
- Das Knorpelpulver wird zunächst mit einem organischen Lösungsmittel wie Aceton entfettet. Dann wird dieses mit einer alkalischen wässrigen Lösung, z.B. einer wässrigen Natriumhydroxidlösung, behandelt, neutralisiert und dann mit einer Pronase wie Actinase E verdaut. Anschließend wird das flüssige verdaute Material zentrifugiert und der pH-Wert mit Essigsäure auf einen Säurewert verändert. Dann wird Ethanol zur Bildung eines Präzipitats zugegeben. Das resultierende Präzipitat wird durch zentrifugale Abtrennung abgesammelt und mit Ethanol gewaschen und daraufhin vakuumgetrocknet.
- Das derart erhaltene saure Mucopolysaccharid wird in einer geringen Menge an entionisiertem Wasser gelöst und in dieser Form mit einem Kationenaustauscherharz wie DOWEX 50WX2 behandelt. Das Eluat wird dann neutralisiert und gegen entionisiertes Wasser dialysiert. Die derart erhaltene Lösung wird konzentriert, zum Beispiel durch einen Membranfilter filtriert und dann gefriergetrocknet, um ein gereinigtes Produkt des Chondroitinsulfats zu erhalten.
- Das vorhandene Verhältnis der Disaccharide, aus denen das Chondroitinsulfat der Erfindung besteht, beträgt gewöhnlich:
nicht-sulfiertes GalNAc (%): 11,0 ± 3,3
C6-monosulfiertes GalNAc (%): 52,8 ± 15,8
C4-monosulfiertes GalNAc (%): 28,4 ± 8,5
C4,C6-disulfiertes GalNAc (%): 7,8 ± 2,3
vorzugsweise
nicht-sulfiertes GalNAc (%): 11,0 ± 2,2
C6-monosulfiertes GalNAc (%): 52,8 ± 10,6
C4-monosulfiertes GalNAc (%): 28,4 ± 5,7
C4,C6-disulfiertes GalNAc (%): 7,8 ± 1,6. - Dieses vorhandene Verhältnis der Disaccharide, aus denen das Chondroitinsulfat besteht, war bisher unbekannt.
- Bei einem bisher bekannten, aus Walknorpel stammendem Chondroitinsulfat beläuft sich das C4-monosulfiertes GalNAc auf etwa 70%, während das C4,C6-disulfierte GalNAc lediglich 1% oder weniger beträgt. Außerdem beträgt bei einem bisher bekannten, von Haifischknorpel stammendem Chondroitinsulfat der C6-monosulfierte GalNAc-Anteil etwa 70%, während der C4-monosulfierte GalNAc-Anteil lediglich gut 10% ausmacht.
- Bezüglich der Verteilung der Schwefelsäuregruppe weist das Chondroitinsulfat der Erfindung eine willkürlichere Struktur als die gewöhnlichen auf. Das heißt, es weist eine Struktur auf, bei der eine nicht-sulfiertes GalNAc enthaltende Disaccharid-Einheit, eine C6-monosulfiertes GalNAc enthaltende Disaccharid-Einheit, eine C4-monosulfiertes GalNAc enthaltende Disaccharid-Einheit und eine C4,C6-disulfiertes GalNAc enthaltende Disaccharid-Einheit willkürlich angeordnet sind.
- Das Chondroitinsulfat der Erfindung kann, ähnlich wie die herkömmlichen, in Arzneistoffen wie einem entzündungshemmenden Mittel und ähnlichem, außerdem in Kosmetika oder Augenlotionen als einem Benetzungsmittel und in Nahrungsmittelzusätzen, z.B. als Gelbildner und Geliermittel, verwendet werden.
- Da darüber hinaus das Chondroitinsulfat eine hohe physiologische Viskosität aufweist, wird eine verlängernde Wirkung auf die lokale Verweildauer von Kombinationswirkstoffen durch Mischen der Wirkstoffe für die künftige Entwicklung erwogen. Außerdem wurde berichtet, dass das Chondroitinsulfat die Stabilisierung der Collagenfasern der Hornhaut fördert und in der Aufrechterhaltung der Funktion des Augengewebes wirksam ist. Entsprechend wird seine Anwendung als ein in hohem Maße funktionelles Hautsurrogat durch Mischen mit Collagenen wie den aus Lachshaut, Rinderhaut extrahierten ebenfalls erwogen. Da es darüber hinaus nicht nur physiologische und pharmazeutische Aktivitäten aufweist, sondern auch Eigenschaften als ein polymeres Elektrolyt, ist seine industrielle Anwendung ebenfalls möglich. Da das Chondroitinsulfat der Erfindung eine Zwischenstruktur zwischen dem von Wal stammenden Chondroitinsulfat und dem von Haifisch stammenden Chondroitinsulfat aufweist, steht zu erwarten, dass es relativ breite Akzeptanz finden wird.
- Beispiele
- Die Erfindung wird im folgenden unter Bezugnahme auf Beispiele spezifischer erläutert werden. Allerdings ist die Erfindung in keinster Weise auf diese Beispiele beschränkt.
- Beispiel 1
- (1) Entfetten von Knorpel
- Ein Produkt, das durch Entfernen der Haut, der harten Knochen, der Fleischteilchen vom während der Verarbeitung eines Lachses abgetrennten Kopf erhalten wurde, wobei lediglich Nasenknorpel herausgetrennt und bei –120°C unter flüssigem Stickstoff gemahlen wurde, wurde als ein Rohmaterial verwendet.
-
- 1) Etwa 100 mg des Knorpelpulvers wurden in einen 2.000-Millimeter-Erlenmeierkolben eingebracht und dem 700 ml Aceton zugegeben. Das Gemisch wurde 10 Minuten lang gerührt.
- 2) Das Reaktionsgemisch wurde 5 Minuten lang stehengelassen und die Überstandslösung entfernt.
- 3) Die Vorgehensweise aus 1)–2) wurde weitere drei Male wiederholt.
- 4) Das verbliebene Präzipitat wurde mit einem Vakuumtrockner getrocknet.
- 5) Die resultierende Probe wurde bei –30°C gelagert.
- (2) Alkalibehandlung
-
- 1) Fünf Gramm des entfetteten Knorpelpulvers wurden in 80 ml an 0,2 M NaOH gelöst.
- 2) Das Gemisch wurde in einem Wasserbad von 37°C für 3 Stunden gerührt.
- 3) Das Reaktionsgemisch wurde auf pH 7,0 mit Essigsäure neutralisiert.
- (3) Pronase-Verdau
-
- 1) Zehn Milliliter einer 0,2 M Tris-HCl-Pufferlösung (pH 7,8) wurden zugegeben.
- 2) Calciumacetat wurde zu einer Endkonzentration von 0,02 M zugegeben.
- 3) Zur Konservierung wurden 5 ml Methanol zugegeben.
- 4) Fünfzig Milligramm Actinase E wurden zugegeben.
- 5) Das Gemisch wurde in einem Wasserbad von 37°C 48 Stunden lang langsam gerührt.
- (4) Ethanol-Ausfällung
-
- 1) Das flüssige verdaute Material wurde bei 10.000 UpM und 4°C für 30 Minuten zentrifugiert.
- 2) Der Überstand wurde unter Verwendung eines 0,45-Mikrometer-Membranfilters saugfiltriert.
- 3) Ein Calciumacetat-Äquivalent zu 5% wurde dem Filtrat zugegeben.
- 4) Das Gemisch wurde auf pH 4,5 mit Essigsäure eingestellt.
- 5) Ein zweifache Menge an Ethanol wurde zugegeben und das Gemisch 48 Stunden lang stehengelassen.
- (5) Waschen und Trocknen des Präzipitats
-
- 1) Die Ethanollösung wurde bei 7.000 UpM und 4°C für 30 Minuten zentrifugiert.
- 2) Das Präzipitat wurde rückgewonnen und dem 300 ml an 80% Ethanol zugegeben. Die Lösung wurde 12 Stunden lang langsam gerührt.
- 3) Die Lösung wurde bei 10.000 UpM und 4°C für 30 Minuten zentrifugiert.
- s4) Die Vorgehensweise aus 2)–3) wurde wiederholt.
- 5) Dem Präzipitat wurden 200 ml an 100% Ethanol zugegeben und das Gemisch 6 Stunden lang langsam gerührt.
- 6) Das Reaktionsgemisch wurde bei 10.000 UpM und 4°C für 30 Minuten zentrifugiert.
- 7) Das derart erhaltene Präzipitat (saures Mucopolysaccharid) wurde mit einem Vakuumtrockner getrocknet. (Scheinbare Ausbeute aus dem entfetteten Knorpelpulver: 44,0%).
- (6) Reinigung des Chondroitinsulfats
- (6-1) Vorbehandlung
-
- 1) Einhundert Milliliter eines Kationenaustauscherharzes DOWEX 50WX2 wurden in 3 N HCl 2 Stunden lang gerührt, mit Wasser gewaschen und dann in 2 N NaOH für 2 Stunden gerührt.
- 2) Die vorangegangene Verfahrensweise wurde dreimal wiederholt und daraufhin das Reaktionsgemisch mit Wasser gewaschen.
- 3) Eine Saugwatte wurde unter eine Säule von 2,4 × 40 cm gepackt und ein Harz eingebracht, um den Durchtritt von Luft zu verhindern.
- (6-2) Behandlung mit dem Kationenaustauscherharz DOWEX 50WX2
-
- 1) Das oben in (5) erhaltene saure Mucopolysaccharid wurde in einer ziemlich kleinen Menge an entionisiertem Wasser gelöst.
- 2) Das Produkt aus 1) wurde durch eine Säule geschickt und 20 Minuten lang stehengelassen.
- 3) Durch die Säule wurden 400 ml (etwa das Vierfache des Volumens des Harzes) an entionisiertem Wasser geschickt.
- 4) Das Eluat wurde sofort mit 1 N NaOH neutralisiert.
- (6-3) Reinigung
-
- 1) Die neutralisierte Lösung wurde 3 Tage lang gegen entionisiertes Wasser dialysiert.
- 2) Die resultierende Lösung wurde mit einem Verdampfer auf 20 ml konzentriert.
- 3) Das Produkt wurde mit einem 0,22-Mikrometer-Membranfilter filtriert und dann zum Erhalt einer trockenen Probe gefriergetrocknet. (Scheinbare Ausbeute aus dem entfetteten Knorpelpulver: 24,0%).
- Ergebnisse der Analyse
- Die Ergebnisse und die Betrachtungen zur Analyse des oben erhaltenen Chondroitinsulfats (im folgenden als ChS-S abgekürzt) der Erfindung sind nachstehend beschrieben. Übrigens wurden bei der Analyse der Zusammensetzung, ihrer Struktur und ähnlichem, die Bestimmungen des Aminozuckers und der Uronsäure mittels der Morgan-Elson-Methode und der Bitter-Muir-Methode vorgenommen. Ferner wurde der Grad der Substitution der Schwefelsäuregruppe mittels der Rhodizonat-Methode und der Elementaranalyse gemessen. Beim Messen des Molekulargewichts und der Reinheit von ChS-S wurden die GPC, FT-IR und Celluloseacetat-Elektrophorese in korrekter Weise angewendet. Bei der Strukturanalyse wurde die 13C-NMR (100 MHz) und 1H-NMR (400 MHz) angewendet. Außerdem wurde die Bestimmung der Position für die Substitution der Schwefelsäure und ihre Verteilung mittels HPLC eines ungesättigten Disaccharids durchgeführt, wie durch einen zweischrittigen Lyase-Abbau von ChS-S mit Chondroitinase ABC und Chondroitinase ACII und einer zweidimensionalen NMR-(COSY 1H-NMR-Wasserstoffkern-Verschiebungskorrelation oder ähnliches)-Analyse erhalten. Als Kontrollproben wurde handelsübliches Chondroitin-4-sulfat (ChS-A, von Walknorpel stammend) und Chondroitin-6-sulfat (ChS-C, von Haifischknorpel stammend) (beide hergestellt von Seikagaku Kogyo K.K.) verwendet.
- (1) Quantitative Bestimmung der Uronsäure
- Das Verhältnis von in jeder Probenlösung enthaltener Uronsäure und dem aus diesem Wert erhaltenen Chondroitinsulfat-Gehalt (Reinheit) wurden in Tabelle 1 zusammengefasst; der Einfluss der Behandlung mit dem Kationenaustauscherharz (DOWEX 50WX2) (im folgenden als Protonenaustausch-Behandlung abgekürzt) auf die Reinheit bzw. Ausbeute sind in Tabelle 2 gezeigt. Übrigens beträgt der Uronsäuregehalt bei standardmäßigem Chondroitinsulfat 37%.
- Aus diesen Ergebnissen wurde befunden, dass mittels dieses Verfahrens ein Chondroitinsulfat von recht hoher Reinheit erhalten wurde. Außerdem ist die Reinheit nach der Protonenaustausch-Behandlung im Vergleich zu der vor der Protonenaustausch-Behandlung viel höher. Aus dieser Tatsache wird in Erwägung gezogen, dass andere saure Mucopolysaccharide wie Hyaluronsäure, Dermatansulfat und ähnliches durch die Protonenaustausch-Behandlung vollständig entfernt werden können.
- (2) Analyse des Aminozuckers
- Der Gehalt N-Acetylgalactosamin (GalNAc) jeder Probenlösung ist in Tabelle 3 gezeigt. Obschon etwa 0,3% N-Acetylglucosamin vom sauren Mucopolysaccharid vor der Protonenaustausch-Behandlung nachgewiesen wurden, war dieses in ChS-S, ChS-A und ChS-C überhaupt nicht identifizierbar. Keiner der anderen Aminozucker war darin enthalten. Aus dieser Tatsache ist erkennbar, dass der im Chondroitinsulfat vorhandene Aminozucker lediglich N-Acetylgalactosamin war und das andere Aminozucker durch die Protonenaustausch-Behandlung vollständig entfernt werden konnten.
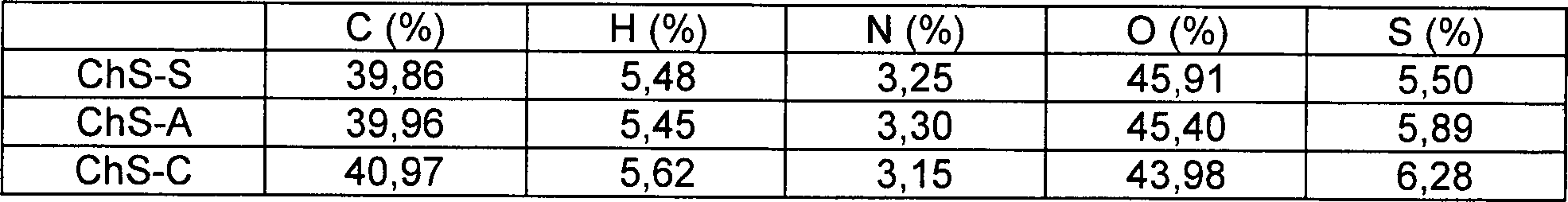
- (3) Elementaranalyse
- Das Gewichtsverhältnis von in jeder Probe enthaltenem Kohlenstoff, Wasserstoff, Stickstoff, Sauerstoff und Schwefel und der Grad der Sulfierung sind in Tabellen 4 bzw. 5 gezeigt. Aus Tabelle 4 ist erkennbar, dass alle Proben dieselbe Zusammensetzung aufwiesen. Aus Tabelle 5 wurde als Ergebnis erhalten, dass das von Haifischknorpel stammende Chondroitinsulfat den höchsten Sulfierungsgrad aufwies und dass das Chondroitinsulfat der Erfindung einen geringfügig niedrigeren Sulfierungsgrad im Vergleich zu den anderen aufwies.
- (4) Quantitative Bestimmung der Schwefelsäuregruppe
- Die in jeder Probe enthaltene Schwefelsäuregruppe und das daraus errechnete Verhältnis an Schwefel sind in Tabelle 6 gezeigt. Aus den Ergebnissen wurde befunden, dass ChS-C einen geringfügig höheren Gehalt an der Schwefelsäuregruppe aufwies und dass ChS-S und ChS-A etwa denselben Gehalt davon zeigten. Weiterhin stimmten die Ergebnisse mit den Ergebnissen der oben bei (3) beschriebenen Elementaranalyse überein.
- (5) Messung des Molekulargewichts
- Das mittlere Molekulargewicht und die Molekulargewichts-Verteilung jeder Probe sind in Tabelle 7 gezeigt. Das mittlere Molekulargewicht des Chondroitinsulfats der Erfindung betrug 173.000. Zwar ist dieser Wert etwas höher als bei den anderen, doch sind die Molekulargewichts-Verteilungen nahezu dieselben. Es ist allgemein bekannt, dass das Molekulargewicht eines Chondroitinsulfats sich mittels der Extraktionsmethode auf 50.000 bis 300.000 beläuft. Die hier erhaltene Molekulargewichts-Verteilung des Chondroitinsulfats stimmte ebenfalls damit überein.
- (6) HPLC
- Das vorhandene Verhältnis der Disaccharide, aus denen das Chondroitinsulfat besteht, wie durch Fraktionieren des einer Enzymolyse unterzogenen Chondroitinsulfats unter Verwendung einer Kombination aus zwei Arten von Chondroitinhydrolyasen durch HPLC und Durchführen der quantitativen Bestimmung erhalten, ist in Tabelle 8 gezeigt. Der Sulfierungsgrad (Anzahl der Schwefelsäuregruppen pro Molekül GalNAc) des daraus erhaltenen Chondroitinsulfats ist in Tabelle 9 gezeigt.
- Aus Tabelle 9 ist feststellbar, dass das Chondroitinsulfat der Erfindung eine Intermediärstruktur zwischen dem von Wal stammendem Chondroitinsulfat und dem von Haifisch stammendem Chondroitinsulfat aufwies. Entsprechend wird davon ausgegangen, dass das Chondroitinsulfat der Erfindung auf einen relativ breiten Bereich anwendbar ist.
-
-
- ΔDi-0S:
- nicht-sulfiertes GalNAc
- ΔDi-6S:
- C6-monosulfiertes GalNAc
- ΔDi-4S:
- C4-monosulfiertes GalNAc
- ΔDi-di4, 6S:
- C4,C6-disulfiertes GalNAc
- Industrielle Anwendbarkeit
- Das Chondroitinsulfat der Erfindung weist eine Intermediärstruktur zwischen dem bisher bekannten, vom Wal stammenden Chondroitinsulfat und vom Haifisch stammenden Chondroitinsulfat auf. Entsprechend ist die Möglichkeit sehr hoch, dass es auf einen relativ breiten Bereich anwendbar ist. Wie die herkömmlichen Produkte kann es in Arzneimitteln wie einem entzündungshemmenden Mittel und ähnlichem, außerdem in Kosmetika oder Augenlotionen als einem Benetzungsmittel und in Nahrungsmittelzusätzen, z.B. als Gelbildner und Geliermittel, verwendet werden. Da außerdem das mittlere Molekulargewicht höher ist als bei den herkömmlichen, wird davon ausgegangen, dass die physiologische Viskosität höher als bei den herkömmlichen ist. Durch Mischen mit Kombinationswirkstoffen kann eine die lokale Verweildauer der Wirkstoffe verlängernde Wirkung erwartet werden. Außerdem liegt ein Bericht aus der letzten Zeit über Chondroitinsulfat vor, der angibt, dass es die Stabilisierung der Collagenfasern der Hornhaut fördert und in der Aufrechterhaltung der Funktion des Augengewebes wirksam ist. Daher kann auch die Anwendung als ein in hohem Maße funktionelles Hautsurrogat durch Mischen mit Collagenen erwartet werden, wie zum Beispiel den aus Lachshaut und Rinderhaut extrahierten Collagenen. Da es nicht nur physiologische und pharmazeutische Wirksamkeiten zeigt, sondern auch Eigenschaften als ein polymeres Elektrolyt aufweist, steht auch eine industrielle Anwendung zu erwarten.
Claims (7)
- Chondroitinsulfat, das eine Disaccharid-Einheit, welche ein nicht-sulfiertes N-Acetyl-D-galactosamin enthält: (11,0 ± 3,3%), eine Disaccharid-Einheit, welche ein C6-monosulfiertes N-Acetyl-D-Galactosamin enthält: (52,8 ± 15,8%), eine Disaccharid-Einheit, welche ein C4-sulfiertes N-Acetyl-D-Galactosamin enthält: (28,4 + 8,5%) und eine Disaccharid-Einheit, welche ein C4,C6-disulfiertes N-Acetyl-D-Galactosamin enthält: (7,8 ± 2,3%), umfasst.
- Chondroitinsulfat nach Anspruch 1, welches eine Struktur aufweist, bei der eine Disaccharid-Einheit, welche ein nicht-sulfiertes N-Acetyl-D-Galactosamin enthält, eine Disaccharid-Einheit, welche ein C6-monosulfiertes N-Acetyl-D-Galactosamin enthält, eine Disaccharid-Einheit, welche ein C4-monosulfiertes N-Acetyl-D-Galactosamin enthält und eine Disaccharid-Einheit, welche ein C4,C6-disulfiertes N-Acetyl-D-Galactosamin enthält, willkührlich angeordnet sind.
- Chondroitinsulfat nach Anspruch 1, welches aus Lachs-Nasenknorpel erhalten wird.
- Verfahren zum Herstellen eines Chondroitinsulfats nach Anspruch 1, welches das Mahlen von Lachs-Nasenknorpel bei einer niedrigen Temperatur, das Entfetten des gemahlenen Materials, dann dessen Behandeln mit einem Alkali und einer Pronase, das Zentrifugieren des resultierenden flüssigverdauten Materials und dann sein Ausfällen mit Ethanol umfasst.
- Verfahren zum Herstellen des Chondroitinsulfats nach Anspruch 4, welches außerdem das Behandeln des resultierenden Präzipitats mit einem Kationenaustauscherharz umfasst.
- Entzündungshemmendes Mittel, das das Chondroitinsulfat nach Anspruch 1 enthält.
- Feuchthaltemittel, das das Chondroitinsulfat nach Anspruch 1 enthält.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000057688A JP2001247602A (ja) | 2000-03-02 | 2000-03-02 | 鮭由来のコンドロイチン硫酸 |
| JP2000057688 | 2000-03-02 | ||
| PCT/JP2000/008894 WO2001064756A1 (fr) | 2000-03-02 | 2000-12-15 | Sulfate de chondroitine tire du saumon |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60009574D1 DE60009574D1 (de) | 2004-05-06 |
| DE60009574T2 true DE60009574T2 (de) | 2004-12-30 |
Family
ID=18578428
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60009574T Expired - Fee Related DE60009574T2 (de) | 2000-03-02 | 2000-12-15 | Chondroitinsulfat aus lachsen |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20030162744A1 (de) |
| EP (1) | EP1270599B1 (de) |
| JP (1) | JP2001247602A (de) |
| KR (1) | KR20020086594A (de) |
| CA (1) | CA2401704A1 (de) |
| DE (1) | DE60009574T2 (de) |
| NO (1) | NO20024146L (de) |
| WO (1) | WO2001064756A1 (de) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002076475A2 (en) * | 2001-03-23 | 2002-10-03 | Bioparken As | Glycosaminoglycan anticoagulants derived from fish |
| JP2003292433A (ja) * | 2002-02-01 | 2003-10-15 | Masayoshi Kachi | 化粧料 |
| JP2003299497A (ja) * | 2002-02-05 | 2003-10-21 | Masayoshi Kachi | ムコ多糖類及びその製造方法 |
| JP2004143155A (ja) * | 2002-10-01 | 2004-05-20 | Taisho Pharmaceut Co Ltd | 眼科用剤 |
| JP2004149736A (ja) * | 2002-11-01 | 2004-05-27 | Nippon Barrier Free:Kk | コンドロイチン硫酸Na,コンドロイチン硫酸含有物及びそれらの製造方法 |
| JP3448710B1 (ja) | 2002-12-10 | 2003-09-22 | 有限会社バイオケム | コンドロイチン硫酸ナトリウムの製造方法 |
| JP2005255727A (ja) * | 2004-03-09 | 2005-09-22 | Tokuyama Corp | 高純度化されたムコ多糖の製造方法 |
| JP4580688B2 (ja) * | 2004-05-27 | 2010-11-17 | 株式会社日本バリアフリー | コンドロイチン硫酸の製造方法 |
| WO2006068146A1 (ja) * | 2004-12-20 | 2006-06-29 | Seikagaku Corporation | 新規コンドロイチン硫酸画分 |
| JP2006182933A (ja) * | 2004-12-28 | 2006-07-13 | Nippon Barrier Free:Kk | ムコ多糖類粉末の製造方法 |
| WO2006077634A1 (ja) * | 2005-01-19 | 2006-07-27 | Japan Clinic Co., Ltd. | カキ肉エキスの製造方法 |
| KR100706294B1 (ko) * | 2005-03-18 | 2007-04-11 | 한국식품연구원 | 연골어류의 연골로부터 얻은 저분자 콘드로이틴 황산 및 이의 제조방법 |
| US8017162B2 (en) | 2005-10-26 | 2011-09-13 | Oryza Oil & Fat Chemical Co., Ltd. | Anti-inflammatory agent |
| KR100906559B1 (ko) | 2007-08-27 | 2009-07-07 | 한국농축산영농조합 | 콘도로이틴 황산 올리고당의 제조 |
| WO2011007885A1 (ja) * | 2009-07-16 | 2011-01-20 | サンスター株式会社 | プロテオグリカン含有物 |
| BR112012023693A2 (pt) * | 2010-03-19 | 2017-10-03 | Otsuka Pharma Co Ltd | Matriz de microagulha contendo proteoglicana |
| EP2564858A4 (de) * | 2010-04-28 | 2013-10-30 | Nihon Pharmaceutical Co Ltd | Zusammensetzung zur behandlung von asthenopie |
| US8664196B2 (en) * | 2011-05-20 | 2014-03-04 | Gnosis S.P.A. | Shark-like chondroitin sulphate and process for the preparation thereof |
| RU2478652C1 (ru) * | 2011-11-25 | 2013-04-10 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Мурманский государственный технический университет" (ФГБОУВПО "МГТУ") | Электрохимический способ очистки хондроитина сульфата |
| CN103665189A (zh) * | 2013-12-10 | 2014-03-26 | 淮安麦德森制药有限公司 | 高岭土载体法沉淀硫酸软骨素的方法 |
| JP2016138062A (ja) * | 2015-01-28 | 2016-08-04 | 一丸ファルコス株式会社 | 特定分子結合単位が分子内の末端部位に存在する高分子糖鎖化合物とその利用 |
| JP2016138061A (ja) * | 2015-01-28 | 2016-08-04 | 一丸ファルコス株式会社 | 特定分子結合単位が分子内の末端部位に存在する高分子糖鎖化合物とその利用 |
| JP2017155004A (ja) * | 2016-03-02 | 2017-09-07 | 地方独立行政法人青森県産業技術センター | 低分子化プロテオグリカン |
| JP6782463B2 (ja) * | 2016-03-25 | 2020-11-11 | 日本薬品株式会社 | コンドロイチン硫酸プロテオグリカン及びコンドロイチン硫酸グリコサミノグリカンの分別・定量方法 |
| JP2018035281A (ja) * | 2016-08-31 | 2018-03-08 | 国立大学法人千葉大学 | コンドロイチン/デルマタン硫酸並びにこれを含む抗炎症剤、保湿剤及び抗血液凝固剤 |
| JP7780177B2 (ja) * | 2021-10-06 | 2025-12-04 | 国立大学法人 和歌山大学 | プロテオグリカン及びコンドロイチン硫酸の製造方法 |
| CN117801136A (zh) * | 2023-12-29 | 2024-04-02 | 福建恒杰生物科技有限公司 | 一种硫酸软骨素钠生产制备方法及设备 |
| KR102860729B1 (ko) * | 2024-07-02 | 2025-09-16 | 순천향대학교 산학협력단 | 연어 가공 부산물 가수분해물을 유효성분으로 포함하는 피부 건강 증진용 조성물 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS4382B1 (de) * | 1962-06-21 | 1968-01-05 | ||
| US5888984A (en) * | 1994-05-12 | 1999-03-30 | Dermal Research Laboratories, Inc. | Pharmaceutical composition of complex carbohydrates and essential oils and methods of using the same |
| JPH09291011A (ja) * | 1996-04-24 | 1997-11-11 | Kose Corp | 外用に適する組成物 |
| JP4034024B2 (ja) * | 2000-02-22 | 2008-01-16 | 株式会社日本バリアフリー | 機能性食品 |
-
2000
- 2000-03-02 JP JP2000057688A patent/JP2001247602A/ja not_active Abandoned
- 2000-12-15 KR KR1020027011406A patent/KR20020086594A/ko not_active Withdrawn
- 2000-12-15 CA CA002401704A patent/CA2401704A1/en not_active Abandoned
- 2000-12-15 US US10/220,539 patent/US20030162744A1/en not_active Abandoned
- 2000-12-15 DE DE60009574T patent/DE60009574T2/de not_active Expired - Fee Related
- 2000-12-15 EP EP00981747A patent/EP1270599B1/de not_active Expired - Lifetime
- 2000-12-15 WO PCT/JP2000/008894 patent/WO2001064756A1/ja not_active Ceased
-
2002
- 2002-08-30 NO NO20024146A patent/NO20024146L/no not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| EP1270599B1 (de) | 2004-03-31 |
| EP1270599A1 (de) | 2003-01-02 |
| KR20020086594A (ko) | 2002-11-18 |
| JP2001247602A (ja) | 2001-09-11 |
| NO20024146L (no) | 2002-10-28 |
| WO2001064756A1 (fr) | 2001-09-07 |
| DE60009574D1 (de) | 2004-05-06 |
| CA2401704A1 (en) | 2001-09-07 |
| NO20024146D0 (no) | 2002-08-30 |
| US20030162744A1 (en) | 2003-08-28 |
| EP1270599A4 (de) | 2003-05-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE60009574T2 (de) | Chondroitinsulfat aus lachsen | |
| DE68917009T2 (de) | Sulfaminoderivate von Chondroitinsulfat, Dermatansulfat und Hyaluronsäure und ihre pharmakologischen Eigenschaften. | |
| DE3645191C2 (de) | ||
| DE69518333T2 (de) | Polysaccharide mit hohem anteil an iduronsäure | |
| DE69023957T2 (de) | Sulfatierte Polysaccharide, Antikoagulierungs- und Antikomplementärmittel, hergestellt aus Fukanen aus braunen Algen, und Verfahren zu deren Herstellung. | |
| DE69533370T2 (de) | Heparinähnliche sulfatierte Polysaccharide | |
| DE60125154T2 (de) | Teildesulfatierte glykosaminoglykanderivate mit antiangiogenischer aktivität und ohne antikoagulierender wirkung | |
| DE3854604T2 (de) | Antientzündungsmittel und zusammensetzungen. | |
| DE69903351T3 (de) | Vernetzte hyaluronsäure und ihre medizinischen verwendungen | |
| DE3750036T2 (de) | Verfahren zur Depolymerisierung von Heparin zum Erhalten eines Heparins mit niedrigem Molekulargewicht und einer antithrombotischen Aktivität. | |
| DE69228362T2 (de) | Hochmolekulare, N,O-sulfatierte Heparosane; Verfahren zu deren Herstellung und diese enthaltende Arzneimittel | |
| DE3422407A1 (de) | Verwendung von heparinderivaten zur selektiven extrakorporalen praezipitation von low-density-lipoproteinen aus vollserum oder plasma | |
| DE69733493T2 (de) | Dermatandisulfat,ein hemmer von thrombinerzeugung und komplementaktivierung | |
| DE60219653T2 (de) | Pharmazeutische zusammensetzung mit chito-oligomeren | |
| DE3520008A1 (de) | Hyaluronsaeure-gele und -mischgele sowie verfahren zu deren herstellung | |
| DE69016383T2 (de) | Supersulfatierte Heparine. | |
| DE3850795T2 (de) | Polysaccharid und Verfahren zu seiner Herstellung. | |
| DE60113398T2 (de) | Polysaccharidester von n-derivaten der glutaminsäure | |
| DE60221227T2 (de) | Xanthangummi enthaltende reepithelialisierende pharmazeutische Zubereitungen | |
| DE69724923T2 (de) | Niedermolekulare Fukane mit blutgerinnungshemmender, antithrombinischer und antithrombotischer Wirkung | |
| DD285606A5 (de) | Verfahren zur herstellung von selektiv o-azylierten glucosaminoglycanen | |
| DE68910577T2 (de) | Mittel gegen den AIDS-Virus. | |
| DE60208528T2 (de) | Hochsulfatierte derivate von k5-polysacchariden und ihre herstellung | |
| DE69513767T2 (de) | Pharmazeutische Zusammensetzung in Form eines Gels mit Chondroitinsulfat in Salzform zur oralen Verabreichung | |
| DE69023708T2 (de) | Anti-hiv-heilmittel. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |