CN1486698A - 含有二甲双胍和格列本脲的固体口服剂型 - Google Patents
含有二甲双胍和格列本脲的固体口服剂型 Download PDFInfo
- Publication number
- CN1486698A CN1486698A CNA031092314A CN03109231A CN1486698A CN 1486698 A CN1486698 A CN 1486698A CN A031092314 A CNA031092314 A CN A031092314A CN 03109231 A CN03109231 A CN 03109231A CN 1486698 A CN1486698 A CN 1486698A
- Authority
- CN
- China
- Prior art keywords
- glibenclamide
- dosage form
- solid oral
- metformin
- oral dosage
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- ZNNLBTZKUZBEKO-UHFFFAOYSA-N glyburide Chemical compound COC1=CC=C(Cl)C=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZNNLBTZKUZBEKO-UHFFFAOYSA-N 0.000 title claims abstract description 139
- 229960004580 glibenclamide Drugs 0.000 title claims abstract description 135
- 239000007787 solid Substances 0.000 title claims description 45
- 238000002360 preparation method Methods 0.000 title claims description 19
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 claims abstract description 66
- 229960003105 metformin Drugs 0.000 claims abstract description 49
- 239000002245 particle Substances 0.000 claims abstract description 14
- 239000006186 oral dosage form Substances 0.000 claims description 44
- 239000000203 mixture Substances 0.000 claims description 40
- 239000008187 granular material Substances 0.000 claims description 23
- 238000000034 method Methods 0.000 claims description 20
- 239000002552 dosage form Substances 0.000 claims description 14
- 238000011282 treatment Methods 0.000 claims description 8
- 239000002775 capsule Substances 0.000 claims description 7
- 150000003839 salts Chemical class 0.000 claims description 6
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims description 6
- 239000008194 pharmaceutical composition Substances 0.000 claims 6
- 244000287680 Garcinia dulcis Species 0.000 claims 2
- 201000001421 hyperglycemia Diseases 0.000 claims 1
- OETHQSJEHLVLGH-UHFFFAOYSA-N metformin hydrochloride Chemical compound Cl.CN(C)C(=N)N=C(N)N OETHQSJEHLVLGH-UHFFFAOYSA-N 0.000 description 17
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 14
- 229960004329 metformin hydrochloride Drugs 0.000 description 14
- 238000012360 testing method Methods 0.000 description 12
- 239000011248 coating agent Substances 0.000 description 10
- 238000000576 coating method Methods 0.000 description 10
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 9
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 9
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 9
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 8
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 7
- 235000019359 magnesium stearate Nutrition 0.000 description 7
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 7
- 239000008108 microcrystalline cellulose Substances 0.000 description 7
- 229940016286 microcrystalline cellulose Drugs 0.000 description 7
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 6
- 239000001768 carboxy methyl cellulose Substances 0.000 description 6
- 238000004132 cross linking Methods 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 6
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 6
- 238000002560 therapeutic procedure Methods 0.000 description 6
- 239000003814 drug Substances 0.000 description 5
- 102000004877 Insulin Human genes 0.000 description 4
- 108090001061 Insulin Proteins 0.000 description 4
- 229940100389 Sulfonylurea Drugs 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- -1 hydrobromate Chemical class 0.000 description 4
- 229940125396 insulin Drugs 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 4
- 229940123208 Biguanide Drugs 0.000 description 3
- 150000004283 biguanides Chemical class 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 229940095884 glucophage Drugs 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 206010018873 Haemoconcentration Diseases 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000017531 blood circulation Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 230000003203 everyday effect Effects 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 230000003345 hyperglycaemic effect Effects 0.000 description 2
- 230000002218 hypoglycaemic effect Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 229940127017 oral antidiabetic Drugs 0.000 description 2
- 230000036470 plasma concentration Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 239000008213 purified water Substances 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- SODPIMGUZLOIPE-UHFFFAOYSA-N (4-chlorophenoxy)acetic acid Chemical class OC(=O)COC1=CC=C(Cl)C=C1 SODPIMGUZLOIPE-UHFFFAOYSA-N 0.000 description 1
- BOVGTQGAOIONJV-BETUJISGSA-N 1-[(3ar,6as)-3,3a,4,5,6,6a-hexahydro-1h-cyclopenta[c]pyrrol-2-yl]-3-(4-methylphenyl)sulfonylurea Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1C[C@H]2CCC[C@H]2C1 BOVGTQGAOIONJV-BETUJISGSA-N 0.000 description 1
- LLJFMFZYVVLQKT-UHFFFAOYSA-N 1-cyclohexyl-3-[4-[2-(7-methoxy-4,4-dimethyl-1,3-dioxo-2-isoquinolinyl)ethyl]phenyl]sulfonylurea Chemical compound C=1C(OC)=CC=C(C(C2=O)(C)C)C=1C(=O)N2CCC(C=C1)=CC=C1S(=O)(=O)NC(=O)NC1CCCCC1 LLJFMFZYVVLQKT-UHFFFAOYSA-N 0.000 description 1
- RKWGIWYCVPQPMF-UHFFFAOYSA-N Chloropropamide Chemical compound CCCNC(=O)NS(=O)(=O)C1=CC=C(Cl)C=C1 RKWGIWYCVPQPMF-UHFFFAOYSA-N 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical class Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 208000013016 Hypoglycemia Diseases 0.000 description 1
- JLRGJRBPOGGCBT-UHFFFAOYSA-N Tolbutamide Chemical compound CCCCNC(=O)NS(=O)(=O)C1=CC=C(C)C=C1 JLRGJRBPOGGCBT-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 229960001761 chlorpropamide Drugs 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 238000011262 co‐therapy Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 1
- 208000016097 disease of metabolism Diseases 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 229950005627 embonate Drugs 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 229960000346 gliclazide Drugs 0.000 description 1
- 229960001381 glipizide Drugs 0.000 description 1
- ZJJXGWJIGJFDTL-UHFFFAOYSA-N glipizide Chemical compound C1=NC(C)=CN=C1C(=O)NCCC1=CC=C(S(=O)(=O)NC(=O)NC2CCCCC2)C=C1 ZJJXGWJIGJFDTL-UHFFFAOYSA-N 0.000 description 1
- 229960003468 gliquidone Drugs 0.000 description 1
- 230000004110 gluconeogenesis Effects 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 230000001050 lubricating effect Effects 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 238000012797 qualification Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 229960002277 tolazamide Drugs 0.000 description 1
- OUDSBRTVNLOZBN-UHFFFAOYSA-N tolazamide Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)NN1CCCCCC1 OUDSBRTVNLOZBN-UHFFFAOYSA-N 0.000 description 1
- 229960005371 tolbutamide Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- 238000005550 wet granulation Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/64—Sulfonylureas, e.g. glibenclamide, tolbutamide, chlorpropamide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
Abstract
本发明涉及含有二甲双胍和格列本脲联合的固体口服剂型,其中格列本脲的颗粒大小是这样的,即能够使格列本脲的生物利用度相当于分开服用二甲双胍和格列本脲所获得的格列本脲生物利用度。
Description
本申请是申请日为1999年7月12日的中国专利申请99801362.5的分案申请。
本发明涉及治疗非胰岛素依赖型糖尿病的固体口服剂型。
非胰岛素依赖型糖尿病是一种特征为血糖过多的代谢性疾病,血糖过多的出现是由于胰岛素的缺乏、胰岛素的耐性和降低了的葡萄糖耐受性引起的。
目前可得到的口服抗糖尿病的药物有两大类:它们是磺酰脲类和双胍类。磺酰脲类是通过刺激胰岛素的释放起作用的并且这样只对一些残余的胰腺β-细胞的活性有效。可得到的磺酰脲类的例子有格列本脲、格列齐特、甲苯磺丁脲、格列吡嗪、甲磺氮卓脲、格列喹酮和氯磺丙脲。双胍类如二甲双胍是通过降低葡糖异生作用并且增加葡萄糖的外周利用率起作用的,当它们需要内源性胰岛素时,它们仅对一些残余的胰岛细胞活性有效。
最初对非胰岛素依赖性糖尿病的疗法包括饮食控制和锻炼。只有在这些疗法不够时使用口服抗糖尿病药物。用口服抗糖尿病药物的单一疗法能够有效治疗许多年。但是,随着时间疗效下降。由于磺酰脲类和双胍类具有互补的作用机理,现在联合疗法是一种已经建立起来治疗非胰岛素依赖性糖尿病的治疗形式。
为了改善患者的适应性,联合片剂将会是有益的。本发明涉及含有二甲双胍和格列本脲(又称优降糖)联合的固体口服剂型。
WO97/17975中已经公开了以特定比例的二甲双胍和格列本脲联合使用治疗II型糖尿病,这种特定的比例为了获得理想的治疗作用是必需的。这篇现有技术把盐酸二甲双胍与格列本脲的理想疗效比例限定为100∶1,例如在单一剂量单位中有500mg的盐酸二甲双胍和5mg的格列本脲。这种比例考虑到了每日剂量的范围,以增加每天所服用的片数为基础,这样避免了当需要共同给药时任何一种组份服用不够的较差病情控制,并且也避免了当这样共同给药时过量服用任何一种组份引起的低血糖。对希望用联合制剂治疗患者的医生来说确保临床中的可操作性是主要的要求,而这种可操作性将来自于使产品具有格列本脲组份的适当生物利用度。适当的生物利用度意思是相对于相同强度的单一完整制剂把格列本脲给药时同时二甲双胍也以单一完整制剂给药时,与二甲双胍一起配制到联合片中的5mg的格列本脲会被吸收到可接受的相似程度,并且是以可比较的速率吸收的。
这篇现有技术没有教导怎样与格列本脲一起配制二甲双胍的联合产品以确保格列本脲组份的适当生物利用度。在盐酸二甲双胍高水溶性情况下而在这方面没有说明并因此也没有进一步讨论联合制剂的二甲双胍的生物利用度。但是,考虑到格列本脲是溶解性较差的药物(在25℃下水中的溶解度为0.1mg/ml-按USP定义是不溶的),所以这是非常重要的需考虑方面。
因此,在剂型给药后它的溶解速率将会影响整个药物进入血流中的速率和程度(生物利用度)。对适当的治疗作用来说,控制整个药剂进入血流中的速率和程度是重要的。
总之,文献公开了两种活性成分在单一剂型中的适当比例,目的是设计怎样使两种单个组份能理想地共同给药(基于按照与当前可得到的单一完整制剂相关的通常实践应当怎样把它们给药),它没有教导就格列本脲的生物利用度方面怎样确保这种联合制剂将会实现。这种生物利用度应当尽可能地与共同服用相当剂量的两种单一完整剂型时的相似。
此外,当用标准制剂步骤制备的联合片中用联合片剂中的常规一般格列本脲进行使用时,相对于共同处方的情况下降的生物利用度是显而易见的。
现通过体外和体内试验发现降低的生物利用度是与格列本脲的颗粒大小和颗粒大小的分布有关。现已发现太小的颗粒会导致格列本脲的高血液浓度,造成低血糖的危险并且太大的颗粒不能足够快速溶解从而给出与共同处方情况的相当生物利用度。所以,在联合形式中具有一个狭窄限定的颗粒大小分布是必需的。
选择特殊大小部分的格列本脲能够生产出含有二甲双胍和格列本脲的固体口服剂型,特别是片剂,当通过体内分析曲线下区域判断时,该剂型具有与分开服用二甲双胍和格列本脲所得到的生物利用度相当的格列本脲生物利用度。
本发明具体提供了含有二甲双胍和格列本脲联合的片剂,该片剂具有与一起服用片剂相当的格列本脲生物利用度。
在第一个实施例中,本发明的固体剂型如片剂含有联合的格列本脲和二甲双胍,其中格列本脲的大小是这样的,即至多10%的颗粒大小小于2μm并且至多10%的颗粒大于60μm。优选格列本脲的大小是这样的,即至多10%的颗粒大小小于3μm并且至多10%的颗粒大于40μm。这种特殊颗粒大小范围的格列本脲可以通过筛选或空气喷射磨得到。
在第二个实施例中,固体口服剂型含有联合的二甲双胍和格列本脲,其中格列本脲的大小是这样的,即至多25%的颗粒小于11μm并且至多25%的颗粒大于46μm。
优选的是,50%的颗粒小于23μm。
二甲双胍可以用其一种盐,如盐酸盐、延胡索酸盐、氢溴酸盐、对氯苯氧基乙酸盐或双羟萘酸盐。二甲双胍盐与格列本脲的重量比应当优选在50/1到250/1。
下列表中给出了优选的口服剂型组分,提供的是组份的范围:
| 组份用量 每片mg | |||
| 产品的一致性 | 500/5 | 500/2.5 | 250/1.25 |
| 组份 | |||
| 盐酸二甲双胍 | 500.0 | 500.0 | 250.0 |
| 格列本脲 | 5.00 | 2.50 | 1.25 |
| 交联羧甲基纤维素钠 | 6.0-30.0 | 6.0-30.0 | 3.0-15.0 |
| 微晶纤维素 | 30.0-120.0 | 30.0-120.0 | 15.0-60.0 |
| 聚乙烯吡咯烷酮 | 6.0-36.0 | 6.0-36.0 | 3.0-18.0 |
| 硬脂酸镁 | 0.6-15.0 | 0.6-15.0 | 0.3-7.5 |
| 包衣膜* | 9.0-24.0 | 9.0-24.0 | 4.5-12.0 |
*使用商业上可得到的包衣膜组合物,如Opadry(Colorcon,UK)。
下列是特别优选的组合物:
| 组份用量 每片mg | |||
| 产品的一致性 | 500/5 | 500/2.5 | 250/1.25 |
| 组份 | |||
| 盐酸二甲双胍 | 500.0 | 500.0 | 250.0 |
| 格列本脲 | 5.00 | 2.50 | 1.25 |
| 交联羧甲基纤维素钠 | 14.0 | 14.0 | 7.0 |
| 微晶纤维素 | 54.0 | 56.5 | 28.25 |
| 聚乙烯吡咯烷酮 | 20.0 | 20.0 | 10.0 |
| 硬脂酸镁 | 1.2-12.0 | 1.2-12.0 | 0.6-6.0 |
| 包衣膜* | 9.0-24.0 | 9.0-24.0 | 4.5-12.0 |
*使用商业上可得到的包衣膜组合物,如Opadry(Colorcon,UK)。
本发明的片剂可以通过下列步骤获得,其包括:
a)把二甲双胍和格列本脲混合物用湿制粒法制成颗粒;
b)用片剂助剂和稀释剂混合进颗粒中,并且
c)把这样得到的混合物压制成片。
有益的是用来形成颗粒的混合物含有颗粒粘合剂。这种颗粒粘合剂特别是聚乙烯吡咯烷酮如具有分子量为45,000的聚乙烯吡咯烷酮。可以使用最终片剂重量的2到4%的聚乙烯吡咯烷酮。
制粒步骤后,把颗粒筛分并干燥。
然后把颗粒与稀释剂和片剂助剂混合。稀释剂可以是制片中常用的任何物质如微晶纤维素。片剂助剂可以是制片常用的任何物质如硬脂酸镁。
然后把这样得到的片用亲水的纤维素聚合物和滑石粉包衣。亲水的纤维素聚合物可以是2-羟丙基甲基纤维素。
下列实施例和试验用来进一步说明本发明。
实施例1
现已按照下列方法制备了二甲双胍/格列本脲片:
用搅拌器把66.6g的聚乙烯吡咯烷酮与246g纯化水混合。在制粒机中混合1500g盐酸二甲双胍、7.5g格列本脲(10-90%的大小范围在2到60μm)、42g交联羧甲基纤维素钠和284.4g微晶纤维素。向制粒机中加入聚乙烯吡咯烷酮溶液并制成湿团块。挤压该颗粒通过1mm目。把该颗粒注入预热的流化床干燥器上并干燥颗粒。用转式混合机把97.5g微晶纤维素混合到颗粒中。把12g硬脂酸镁加入到转式混合机中混合。用适当的压片机压制颗粒混合物成片。在包衣机中用2%羟丙基甲基纤维素包衣剂给片包衣。
实施例2
现已按照下列方法制备二甲双胍/格列本脲片:
把5.83g格列本脲(10-90%的大小范围在2到60μm)与32.67g的交联羧甲基纤维素钠预混合。伴随搅拌把46.67g聚乙烯吡咯烷酮与93.33g纯化水混合。在制粒机中混合格列本脲-交联羧甲基纤维素钠混合物和1166.6g盐酸二甲双胍。向制粒机中加入聚乙烯吡咯烷酮溶液并制成湿颗粒。把颗粒倒入预热的流化床干燥器中干燥颗粒。通过让颗粒通过1mm目来降低颗粒的大小。在制粒机中把131.83g微晶纤维素混入颗粒中。向制粒机中加入16.3g硬脂酸镁并混合。用适当的压片机把颗粒混合物压制成片。在包衣机中用2%羟丙基甲基纤维素包衣剂包衣片。
试验1
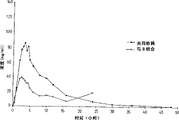
用实施例2中制备的两批格列本脲片进行体内生物利用度试验。这两批具有下列10到90%颗粒大小的范围:
A批:3.47-38.08μm
B批:15.63-91.6μm。
图1中详细说明了A和B两批颗粒大小的分布。
把这两批片给健康患者服用并与共同服用格列本脲(市售商标Daonil)和盐酸二甲双胍(每组16名患者)比较。
图2和3分别显示了格列本脲在含有二甲双胍分别和A批和B批的格列本脲联合及共服用的片剂中的对照浓度。
下面是曲线(AUC)下区域:
AUC(ng/ml/h)
与A批联合 790.5
与B批联合 353.0
共同服用 869.3
这显示了使用与A批组合时,AUC实际上与共同服用时的相同,其中使用与B批组合时,AUC较明显地不同。
试验2
一系列的盐酸二甲双胍和格列本脲结合的片剂(用制剂Combo 1、2、3和4区分)除了所用的格列本脲的颗粒大小特征外制剂都是一样的。将它们给药后,仔细检测患者血液中格列本脲的浓度,与商业上可得到的一起给药的盐酸二甲双胍(GlucophageTM,Bristol-MyersSquibb)和格列本脲(MicronaseTM,Upjohn)参照制剂相比,可以确定确保联合制剂中格列本脲组份的适当生物利用度的格列本脲颗粒特征。这指的是在使用现有的单一药物之一治疗的医生知识基础上,当患者首次用这种联合制剂治疗时疾病的控制是可以预料的。
或者,如果患者已经通过 MicronaseTM的商品治疗加上用GlucophageTM的现存治疗(或者相反)稳定了它们的疾病的话,然后进行更方便的单一片剂的联合治疗(且确保优降糖组份的适当生物利用度)将会导致维持的疾病控制的理想水平。
来自用不同颗粒大小特征配置的盐酸二甲双胍/格列本脲片试验中的数据可以开发出药物颗粒大小和体内性能之间的关系。所用的一系列联合片剂中使用许多优降糖的特性显示在下表中:
| 格列本脲颗粒大小 (微米) | |||
| 片剂批量 | 25%下面大小的 | 50%下面大小的 | 75%下面大小的 |
| Combo 1 | 15 | 33 | 62 |
| Combo 2 | 28 | 58 | 88 |
| Combo 3 | 10 | 25 | 52 |
| Combo 4 | 6 | 11 | 19 |
当用这些多种格列本脲的每种制备四种组合-相同的单批盐酸二甲双胍/优降糖500/2.5mg的片并给人服用时,对格列本脲血浆浓度-时间曲线的分析发现了下列药物动力学参数:
| 格列本脲的药物动力学参数 | ||||
| 片剂批量 | Cmax(ng/ml,几何平均值) | AUC(ng/ml/hr,几何平均值) | Cmax(ng/ml,数学平均值) | AUC(ng/ml/hr,数学平均值) |
| Combo 1 | 71 | 478 | 76 | 493 |
| Combo 2 | 52 | 345 | 54 | 339 |
| Combo 3 | 64 | 513 | 67 | 531 |
| Combo 4 | 88 | 642 | 93 | 716 |
能够得出颗粒大小和所达到的格列本脲最大几何平均血浆浓度,Cmax之间的合理的相互关系以及颗粒大小与格列本脲血浆浓度-时间曲线AUC下几何平均值区域之间合理的相互关系。
从这些相互关系中,对用于体内试验研究中的参照格列本脲制剂MicronaseTM的批量来说可给出预期的Cmax和AUC值±25%的平均值的优降糖的颗粒大小可被界定:
25%颗粒大小的限
50%颗粒大小的限
75%颗粒大小的限
Cmax <0-18微米 <0-37微米 <0-63微米
AUC <0-11微米 <0-25微米 <0-46微米
适应Cmax和AUC的要求,设计的界限变为:
25%颗粒大小的限
50%颗粒大小的限
75%颗粒大小的限
≤11微米 ≤23微米 ≤46微米
具有这些颗粒大小特征的格列本脲粉末的表面区数值在1.7到2.2m2g-1的范围,这正如用氮吸收法所测定的。所以,如试验中所述配制时这些特征的物质不同于US3,979,520中所公开的物质,在US3,979,520中要求格列本脲的粉末表面区域数值大于3m2g-1(优选5到10m2g-1)以得到适当的格列本脲生物利用度。在试验中格列本脲颗粒大小特征已经详细描述,当按照这里所述的配制能够产生使人适当的格列本脲生物利用度,这正如在下列试验中所述的。
试验3
按照下列方法制备一批盐酸二甲双胍-格列本脲片500/5g。把上述所定义的大小的格列本脲(1.0kg)与2.8kg的交联羧甲基纤维素钠滚动混合,然后在高速剪切混合机中把该混合物与已经向其中加入0.5%(重量)硬脂酸镁的盐酸二甲双胍(100g)混合。
在高速剪切混合机中把该干燥混合物用12.1kg聚乙烯吡咯烷酮的水溶液(含有4kg聚乙烯吡咯烷酮)制成湿颗粒。在60℃的流化床干燥器中干燥该湿颗粒到规定的湿度含量。在振摇器(1.0mm筛孔)中把干燥(干燥损失2-3%w/w)颗粒大小减小,然后与10.8kg微晶纤维素滚动混合,接着与0.9kg片剂润滑剂硬脂酸镁混合。用16mm×8mm胶囊形状的工具把润滑过的颗粒压制并用专卖的膜包衣物质Opadry 32920给片芯包膜得到最终的黄色、胶囊状的片。在人的药物动力学研究中,给自愿者或者服用这些片中的一种或者用一种疗法,即共同服用500mg GlucophageTM片加5mg MicronaseTM片。给药后分析格列本脲的血浆浓度并发现该组份的下列药物动力学:
| 疗法 | 参数 | 平均值 | 调节的几何平均值 | 平均值之比(评估分) |
| 联合片500/5 | Cmax | 122 | 116 | 1.14 |
| AUC(0-T) | 859 | 831 | 1.07 | |
| Glucophage+Micronase | Cmax | 113 | 101 | - |
| AUC(0-T) | 842 | 780 | - |
从联合片中得到的格列本脲的生物利用度相当于从参照的格列本脲制剂MicronaseTM中获得的。这将使得患者更方便地服用联合片剂来替代现在疗法中共用的两种片,并且不用担心将会造成较低的格列本脲血液浓度的结果,这种结果可能在现有制剂中出现并导致疾病控制的失败。
实施例3
把按照试验3所制备的颗粒填入大小为00号胶囊中来替代压制成片,从而提供盐酸二甲双胍/格列本脲500mg/5mg的产品或者提供500mg/2.5mg的产品。把颗粒填入大小为1号胶囊以提供250mg/2.5mg的产品。
这些胶囊具有可接受的生理特性并提供了片剂外的另一种选择。在WO97/17975中所述的制剂中由于按照他们的描述,制剂使用了大量的赋型剂而不能填入对大多数患者可接受的大小的胶囊。
Claims (31)
1.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,格列本脲的生物利用度与通过口服给予人类单独的固体口服剂型所获得的格列本脲的生物利用度具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量。
2.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,格列本脲的CMAX和AUC与通过口服给予人类单独的固体口服剂型所获得的格列本脲的CMAX和AUC具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量。
3.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,格列本脲的CMAX和AUC分别为通过口服给予人类单独的固体口服剂型所获得的格列本脲的CMAX和AUC的+25%,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量。
4.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,对于5mg单位剂量的格列本脲而言,平均CMAX和平均AUC值分别为113ng/ml的+25%以及842ng/ml/hr的+25%,或对于较高或较低单位剂量的格列本脲而言,分别成比例地具有较高或较低的值。
5.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,对于5mg单位剂量的格列本脲而言,调节几何平均CMAX和调节几何平均AUC值分别为101ng/ml的+25%以及780ng/ml/hr的+25%,或对于较高或较低单位剂量的格列本脲而言,分别成比例地具有较高或较低的值。
6.包含含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型的药物组合物,其中将所述的组合物口服给予人类后,格列本脲的CMAX和AUC与通过口服给予人类单独的固体口服剂型所获得的格列本脲的CMAX和AUC具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量,在所述的单一剂型中的格列本脲的粒径不为使之能够单独获得所述可比的生物利用度。
7.权利要求1-6任一项所述的组合物,其中二甲双胍与格列本脲的重量比为50/1-250/1。
8.权利要求1-6任一项所述的组合物,其中二甲双胍与格列本脲的重量比为100/1。
9.权利要求1-6任一项所述的组合物,其中二甲双胍与格列本脲的重量比为200。
10.权利要求1-6任一项所述的组合物,其中二甲双胍的单位剂量为500mg或为250mg。
11.权利要求10所述的组合物,其中格列本脲的单位剂量为5、2.5或1.25mg。
12.权利要求1-6任一项所述的以片剂或胶囊形式存在的组合物。
13.权利要求3所述的组合物,其中所述的单一固体口服剂型中所述的格列本脲的CMAX和AUC值分别为所述的单独的格列本脲的固体口服剂型中格列本脲的CMAX和AUC值的+20%。
14.权利要求3所述的组合物,其中所述的单一固体口服剂型中所述的格列本脲的CMAX和AUC值分别为所述的单独的格列本脲的固体口服剂型中格列本脲的CMAX和AUC值的+15%。
15.权利要求3所述的组合物,其中所述的单一固体口服剂型中所述的格列本脲的CMAX和AUC值分别为所述的单独的格列本脲的固体口服剂型中格列本脲的CMAX和AUC值的+10%。
16.权利要求3所述的组合物,其中所述的单一固体口服剂型中所述的格列本脲的CMAX和AUC值分别为所述的单独的格列本脲的固体口服剂型中格列本脲的CMAX和AUC值的+5%。
17.权利要求4或5所述的组合物,其中所述的CMAX和AUC值为所述数字范围的+20%。
18.权利要求4或5所述的组合物,其中所述的CMAX和AUC值为所述数字范围的+15%。
19.权利要求4或5所述的组合物,其中所述的CMAX和AUC值为所述数字范围的+10%。
20.权利要求4或5所述的组合物,其中所述的CMAX和AUC值为所述数字范围的+5%。
21.治疗非胰岛素依赖型糖尿病或高糖血症的方法,其包含给予需要这种治疗的患者权利要求1-6任一项中所述的组合物。
22.当口服给予含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型后在人体内获得格列本脲生物利用度的方法,所述的生物利用度与通过口服给予人类单独的固体口服剂型所获得的格列本脲的生物利用度具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量,该方法包括将格列本脲和二甲双胍配制成所述的单一固体口服剂型以保证所述的可比的生物利用度。
23.当口服给予含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型后在人体内获得格列本脲的生物利用度的方法,所述的生物利用度与通过口服给予人类单独的固体口服剂型所获得的格列本脲的生物利用度具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量,该方法包括将格列本脲和二甲双胍配制成所述的单一固体口服剂型以保证所述的可比的生物利用度,所述的配制不唯一由格列本脲粒径的选择而获得。
24.当口服给予含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型后增加人体内格列本脲的生物利用度的方法,以使所述增加的生物利用度与通过口服给予人类单独的固体口服剂型所获得的格列本脲的生物利用度具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量,该方法包括将格列本脲和二甲双胍配制成所述的单一固体口服剂型以保证所述的可比的生物利用度。
25.当口服给予含有有效剂量二甲双胍和有效剂量格列本脲的单一固体口服剂型后增加人体内格列本脲的生物利用度的方法,以使所述的增加的生物利用度与通过口服给予人类单独的固体口服剂型所获得的格列本脲的生物利用度具有可比性,所述的单独的固体口服剂型中一个含有格列本脲且另一个含有二甲双胍,其分别具有与所述单一口服剂型中相同的有效量,该方法包括将格列本脲和二甲双胍配制成所述的单一固体口服剂型以保证所述的可比的生物利用度,所述的配制不唯一由格列本脲粒径的选择而获得。
26.权利要求23或25所述的方法,其中所述的配制不唯一由格列本脲粒径的选择而获得。
27.权利要求1-6任一项所述的组合物,其中的二甲双胍以二甲双胍盐的形式存在。
28.权利要求22-25任一项所述的方法,其中的二甲双胍以二甲双胍盐的形式存在。
29.权利要求21所述的方法,其中的二甲双胍以二甲双胍盐的形式存在。
30.权利要求26所述的方法,其中的二甲双胍以二甲双胍盐的形式存在。
31.权利要求4所述的固体口服剂型,其中50%的颗粒小于15μm。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP98401781.4 | 1998-07-15 | ||
| EP98401781A EP0974356B1 (en) | 1998-07-15 | 1998-07-15 | Tablets comprising a combination of metformin and glibenclamide |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB998013625A Division CN1146427C (zh) | 1998-07-15 | 1999-07-12 | 含有二甲双胍和格列本脲的固体口服剂型 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1486698A true CN1486698A (zh) | 2004-04-07 |
Family
ID=8235441
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA031092314A Pending CN1486698A (zh) | 1998-07-15 | 1999-07-12 | 含有二甲双胍和格列本脲的固体口服剂型 |
| CNB998013625A Expired - Lifetime CN1146427C (zh) | 1998-07-15 | 1999-07-12 | 含有二甲双胍和格列本脲的固体口服剂型 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB998013625A Expired - Lifetime CN1146427C (zh) | 1998-07-15 | 1999-07-12 | 含有二甲双胍和格列本脲的固体口服剂型 |
Country Status (27)
| Country | Link |
|---|---|
| US (2) | US6303146B1 (zh) |
| EP (4) | EP0974356B1 (zh) |
| JP (2) | JP2002520371A (zh) |
| KR (2) | KR20040053177A (zh) |
| CN (2) | CN1486698A (zh) |
| AP (1) | AP1450A (zh) |
| AR (2) | AR013052A1 (zh) |
| AT (1) | ATE250418T1 (zh) |
| AU (2) | AU753604B2 (zh) |
| BR (1) | BR9906600A (zh) |
| CA (1) | CA2303537C (zh) |
| DE (1) | DE69818444T2 (zh) |
| DK (1) | DK0974356T3 (zh) |
| DZ (1) | DZ2846A1 (zh) |
| ES (1) | ES2206868T3 (zh) |
| ID (1) | ID25784A (zh) |
| MA (1) | MA24930A1 (zh) |
| MY (1) | MY129552A (zh) |
| NZ (1) | NZ503248A (zh) |
| OA (1) | OA11400A (zh) |
| PT (1) | PT974356E (zh) |
| RU (2) | RU2226396C2 (zh) |
| SI (1) | SI0974356T1 (zh) |
| TW (2) | TWI245632B (zh) |
| UY (1) | UY25611A1 (zh) |
| WO (1) | WO2000003742A2 (zh) |
| ZA (1) | ZA200001159B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101094657B (zh) * | 2004-12-31 | 2012-01-04 | 韩美药品株式会社 | 用于糖尿病药物的口服给药的控释复合制剂及其制备方法 |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040102486A1 (en) * | 1998-11-12 | 2004-05-27 | Smithkline Beecham Corporation | Novel method of treatment |
| US20040081697A1 (en) * | 1998-11-12 | 2004-04-29 | Smithkline Beecham P.L.C. | Pharmaceutical composition for modified release of an insulin sensitiser and another antidiabetic agent |
| US6586438B2 (en) * | 1999-11-03 | 2003-07-01 | Bristol-Myers Squibb Co. | Antidiabetic formulation and method |
| CA2389928C (en) | 1999-11-03 | 2010-03-23 | Bristol-Myers Squibb Company | Method for treating diabetes |
| US20010036479A1 (en) | 2000-01-14 | 2001-11-01 | Gillian Cave | Glyburide composition |
| FR2816840B1 (fr) | 2000-11-17 | 2004-04-09 | Flamel Tech Sa | Medicament a base de microcapsules d'anti-hyperclycemiant a liberation prolongee et son procede de preparation |
| FR2816841B1 (fr) * | 2000-11-22 | 2004-02-06 | Lipha | Nouvelles compositions pharmaceutiques a action antidiabetique et leur procede de preparation |
| CA2434169C (en) * | 2001-01-12 | 2011-03-15 | Sun Pharmaceutical Industries Limited | Spaced drug delivery system |
| FR2825023B1 (fr) * | 2001-05-23 | 2005-04-15 | Flamel Tech Sa | Forme pharmaceutique orale antidiabetique "une prise par jour"comprenant une biguanide et au moins un autre principe actif |
| US20050271737A1 (en) * | 2001-06-07 | 2005-12-08 | Chinea Vanessa I | Application of a bioactive agent to a substrate |
| US7767249B2 (en) * | 2001-06-07 | 2010-08-03 | Hewlett-Packard Development Company, L.P. | Preparation of nanoparticles |
| US8206753B2 (en) * | 2001-06-20 | 2012-06-26 | Metaproteomics, Llc | Anti-inflammatory botanical products for the treatment of metabolic syndrome and diabetes |
| EP1413309B1 (en) | 2001-07-30 | 2007-11-14 | Mitsubishi Pharma Corporation | Drugs for ameliorating postcibal hyperglycemia |
| US8101209B2 (en) | 2001-10-09 | 2012-01-24 | Flamel Technologies | Microparticulate oral galenical form for the delayed and controlled release of pharmaceutical active principles |
| ITFI20010230A1 (it) * | 2001-11-29 | 2003-05-29 | Menarini Int Operations Lu Sa | Composizioni farmaceutiche per il trattamento del diabete mellito di tipo ii |
| US7183321B2 (en) * | 2001-12-17 | 2007-02-27 | Bristol-Myers Squibb Company | Antidiabetic formulation and method |
| ES2284829T3 (es) * | 2002-01-25 | 2007-11-16 | Laboratorios Silanes, S.A. De C.V. | Composicion farmaceutica que se usa para controlar la glucosa en sangre en pacientes con diabetes de tipo 2. |
| ES2627842T3 (es) * | 2002-02-21 | 2017-07-31 | Valeant Pharmaceuticals Luxembourg S.À.R.L. | Formas de dosificación de liberación controlada |
| US20030187074A1 (en) * | 2002-03-04 | 2003-10-02 | Javed Hussain | Oral compositions for treatment of diabetes |
| US20030219482A1 (en) * | 2002-03-21 | 2003-11-27 | Chaudhari Sunil Sudhakar | Multiparticulate compositions for once-a-day administration |
| IL164221A0 (en) | 2002-04-09 | 2005-12-18 | Flamel Tech Sa | Oral pharmaceutical formulation in the form of aqueous suspension of microcapsules for modified release of amoxicillim |
| MXPA04009968A (es) | 2002-04-09 | 2004-12-13 | Flamel Tech Sa | Formulacion farmaceutica oral bajo forma de suspension acuosa de microcapsulas que permiten la liberacion modificada de principio (s) activo (s). |
| KR100897890B1 (ko) | 2002-06-17 | 2009-05-18 | 인벤티아 헬스케어 피브이티. 엘티디. | 티아졸리딘디온 및 바이구아나이드를 함유하는 다층 정제및 그의 제조 방법 |
| US7445796B2 (en) * | 2002-08-19 | 2008-11-04 | L. Perrigo Company | Pharmaceutically active particles of a monomodal particle size distribution and method |
| EP1562607A1 (en) * | 2002-11-15 | 2005-08-17 | Ranbaxy Laboratories, Ltd. | Pharmaceutical dosage forms of biguanide-sulfonylurea combinations |
| FR2853831A1 (fr) * | 2003-03-05 | 2004-10-22 | Usv Ltd | Forme posologique solide a usage oral de metformine et de glyburide et son procede de preparation |
| JPWO2004091661A1 (ja) * | 2003-04-15 | 2006-07-06 | 中外製薬株式会社 | 糖尿病治療剤 |
| US20060121108A1 (en) * | 2004-12-02 | 2006-06-08 | Prasad C K | System and method for producing a directly compressible, high-potency formulation of metformin hydrochloride |
| CN100341495C (zh) * | 2004-12-29 | 2007-10-10 | 三九医药股份有限公司 | 格列本脲固体分散体、口服组合物及其制备方法 |
| PE20061245A1 (es) * | 2005-03-30 | 2007-01-06 | Generex Pharm Inc | Composiciones para la transmision transmucosa oral de la metformina |
| US8529537B2 (en) * | 2005-08-05 | 2013-09-10 | Kimberly-Clark Worldwide, Inc. | Absorbent article with enclosures |
| MXPA05009633A (es) * | 2005-09-08 | 2007-03-07 | Silanes Sa De Cv Lab | Composicion farmaceutica estable de glimepirida de liberacion inmediata y metformina de liberacion prolongada. |
| WO2008002591A2 (en) | 2006-06-26 | 2008-01-03 | Amgen Inc | Methods for treating atherosclerosis |
| WO2008062273A2 (en) * | 2006-11-20 | 2008-05-29 | Cadila Pharmaceuticals Limited | Solid oral dosage form having antidiabetic drug combination |
| JO3272B1 (ar) | 2007-07-19 | 2018-09-16 | Takeda Pharmaceuticals Co | مستحضر صلب يشمل ألوجليبتين وميتفورمين هيدروكلوريد |
| EA201070187A1 (ru) | 2007-07-26 | 2010-08-30 | Эмджен Инк. | Модифицированные ферменты лецитин-холестерин ацилтрансферазы |
| US20110009347A1 (en) | 2009-07-08 | 2011-01-13 | Yin Liang | Combination therapy for the treatment of diabetes |
| US20130108699A1 (en) * | 2010-04-26 | 2013-05-02 | Jose Antonio Matji Tuduri | Highly dispersible granulate for the preparation of formulations of high dosage active substances and procedure for obtaining high dosage active substances thereof |
| RU2451506C1 (ru) | 2011-06-02 | 2012-05-27 | Сергей Юрьевич Лешков | Комбинация для лечения сахарного диабета и его осложнений |
| CN104220460A (zh) | 2011-12-08 | 2014-12-17 | 安姆根有限公司 | 激动人lcat抗原结合蛋白和它们在疗法中的用途 |
| CN104127424A (zh) * | 2014-07-30 | 2014-11-05 | 沈阳药科大学 | 格列本脲衍生物及其制备方法和应用 |
| CN105030793A (zh) * | 2015-08-25 | 2015-11-11 | 瑞阳制药有限公司 | 二甲双胍格列本脲胶囊及其制备方法 |
| WO2019070109A1 (es) * | 2017-10-03 | 2019-04-11 | Infinite Clinical Research International, S.A. De C.V. | Triconjugado para el tratamiento de diabetes mellitus |
| KR102484756B1 (ko) * | 2020-11-13 | 2023-01-06 | 한국생산기술연구원 | 용해성 증대 및 취급용이성을 갖는 파우더 배지의 과립화 방법 |
| CN113143940A (zh) * | 2020-12-30 | 2021-07-23 | 成都恒瑞制药有限公司 | 一种抗糖尿病药物组合物的制备方法 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE362704C (de) * | 1921-08-09 | 1922-11-02 | Naamlooze Vennootschap Interna | Vorrichtung zum Senken einer Last, insbesondere eines Rettungsbootes |
| US3174901A (en) | 1963-01-31 | 1965-03-23 | Jan Marcel Didier Aron Samuel | Process for the oral treatment of diabetes |
| US4060634A (en) * | 1973-09-26 | 1977-11-29 | Boehringer Mannheim G.M.B.H. | Rapidly resorbable glibenclamide |
| DE2348334C2 (de) | 1973-09-26 | 1982-11-11 | Boehringer Mannheim Gmbh, 6800 Mannheim | Neue Zubereitungsform des N-4-[2-(5-Chlor-2-methoxybenzamido)äthyl]- phenyl-sulfonyl-N'-cyclohexylharnstoffs |
| US4916163A (en) | 1985-06-04 | 1990-04-10 | The Upjohn Company | Spray-dried lactose formulation of micronized glyburide |
| DE3833439A1 (de) | 1988-10-01 | 1991-09-12 | Hoechst Ag | Verfahren zur mikronisierung von glibenclamid |
| DK36392D0 (da) | 1992-03-19 | 1992-03-19 | Novo Nordisk As | Anvendelse af kemisk forbindelse |
| DE4323636A1 (de) | 1993-07-15 | 1995-01-19 | Hoechst Ag | Arzneistoffzubereitungen aus umhüllten, schwerstwasserlöslichen Arzneistoffen für Inhalationsarzneiformen und Verfahren zu ihrer Herstellung |
| TWI238064B (en) | 1995-06-20 | 2005-08-21 | Takeda Chemical Industries Ltd | A pharmaceutical composition for prophylaxis and treatment of diabetes |
| IT1276130B1 (it) * | 1995-11-14 | 1997-10-27 | Gentili Ist Spa | Associazione glibenclamide-metformina, composizioni farmaceutiche che la contengono e loro uso nel trattamento del diabete mellito di tipo |
| KR100666591B1 (ko) | 1997-06-18 | 2007-01-11 | 스미스클라인비이참피이엘시이 | 티아졸리딘디온 및 메트포르민을 사용한 당뇨병의 치료 |
| US6544564B1 (en) * | 2001-11-27 | 2003-04-08 | Michael Donald Farley | Cytotoxic pharmaceutical composition |
-
1998
- 1998-07-15 AT AT98401781T patent/ATE250418T1/de not_active IP Right Cessation
- 1998-07-15 PT PT98401781T patent/PT974356E/pt unknown
- 1998-07-15 DK DK98401781T patent/DK0974356T3/da active
- 1998-07-15 ES ES98401781T patent/ES2206868T3/es not_active Expired - Lifetime
- 1998-07-15 EP EP98401781A patent/EP0974356B1/en not_active Revoked
- 1998-07-15 DE DE69818444T patent/DE69818444T2/de not_active Revoked
- 1998-07-15 SI SI9830517T patent/SI0974356T1/xx unknown
-
1999
- 1999-07-12 CN CNA031092314A patent/CN1486698A/zh active Pending
- 1999-07-12 NZ NZ503248A patent/NZ503248A/xx not_active IP Right Cessation
- 1999-07-12 CN CNB998013625A patent/CN1146427C/zh not_active Expired - Lifetime
- 1999-07-12 EP EP10185329A patent/EP2269613A3/en not_active Ceased
- 1999-07-12 KR KR10-2004-7005583A patent/KR20040053177A/ko active Search and Examination
- 1999-07-12 AU AU54179/99A patent/AU753604B2/en not_active Expired
- 1999-07-12 WO PCT/EP1999/005571 patent/WO2000003742A2/en active IP Right Grant
- 1999-07-12 JP JP2000559876A patent/JP2002520371A/ja active Pending
- 1999-07-12 CA CA002303537A patent/CA2303537C/en not_active Expired - Lifetime
- 1999-07-12 RU RU2000109583/15A patent/RU2226396C2/ru active
- 1999-07-12 EP EP99940114A patent/EP1011684A2/en not_active Ceased
- 1999-07-12 KR KR10-2000-7002714A patent/KR100478347B1/ko not_active IP Right Cessation
- 1999-07-12 EP EP04008415A patent/EP1435240A3/en not_active Ceased
- 1999-07-12 BR BR9906600-9A patent/BR9906600A/pt not_active Application Discontinuation
- 1999-07-12 RU RU2003126257/15A patent/RU2286788C2/ru active
- 1999-07-12 ID IDW20000482D patent/ID25784A/id unknown
- 1999-07-12 AP APAP/P/2000/001757A patent/AP1450A/en active
- 1999-07-13 MA MA25681A patent/MA24930A1/fr unknown
- 1999-07-14 MY MYPI99002968A patent/MY129552A/en unknown
- 1999-07-14 DZ DZ990146A patent/DZ2846A1/xx active
- 1999-07-14 US US09/353,141 patent/US6303146B1/en not_active Expired - Lifetime
- 1999-07-14 TW TW092113257A patent/TWI245632B/zh not_active IP Right Cessation
- 1999-07-14 TW TW088111959A patent/TW555560B/zh not_active IP Right Cessation
- 1999-07-15 AR ARP990103470A patent/AR013052A1/es not_active Application Discontinuation
- 1999-07-15 UY UY25611A patent/UY25611A1/es not_active Application Discontinuation
-
2000
- 2000-03-07 ZA ZA200001159A patent/ZA200001159B/xx unknown
- 2000-03-15 OA OA1200000076A patent/OA11400A/en unknown
-
2002
- 2002-12-27 US US10/329,426 patent/USRE38629E1/en not_active Expired - Lifetime
-
2003
- 2003-03-31 JP JP2003094873A patent/JP2003292443A/ja active Pending
- 2003-11-11 AU AU2003261560A patent/AU2003261560A1/en not_active Abandoned
-
2008
- 2008-04-07 AR ARP080101435A patent/AR065970A2/es not_active Application Discontinuation
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101094657B (zh) * | 2004-12-31 | 2012-01-04 | 韩美药品株式会社 | 用于糖尿病药物的口服给药的控释复合制剂及其制备方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1146427C (zh) | 含有二甲双胍和格列本脲的固体口服剂型 | |
| KR20080007357A (ko) | 압축성이 열등한 치료학적 화합물을 갖는 조성물을제조하는 압출방법 | |
| CN1562024A (zh) | 一种治疗心血管疾病含盐酸雷诺嗪的口服制剂 | |
| CN1276718A (zh) | 快速崩解的甲基纤维素片剂 | |
| CN1635894A (zh) | 糖尿病治疗剂型 | |
| CN1617728A (zh) | 抗糖尿病的药物制剂及方法 | |
| CN103301084B (zh) | 一种盐酸小檗碱片及其制备方法 | |
| CN1023191C (zh) | 生产持续释放异丁丙苯酸制剂的方法 | |
| CN102188429A (zh) | 一种治疗糖尿病的药物组合物 | |
| US20030104059A1 (en) | Controlled release tablets of metformin | |
| WO2006123213A1 (en) | Modified release formulations of gliclazide | |
| CN101167731A (zh) | 含有二甲双胍和格列本脲的分散片及其制备方法 | |
| GR1009644B (el) | Φαρμακευτικο σκευασμα που περιλαμβανει βιλνταγλιπτινη και μετφορμινη και μεθοδος για την παρασκευη αυτου | |
| JP2004525109A (ja) | 安定化された甲状腺ホルモン医薬組成物、及びその製法 | |
| CN1742730A (zh) | 高溶出度的盐酸二甲双胍格列吡嗪胶囊的制备方法 | |
| CN100455279C (zh) | 口服延迟释放锭剂组成物及其制法 | |
| CN101045039A (zh) | 糖尿病治疗剂型 | |
| WO2004091587A1 (en) | Multiple release anti-diabetic drugs and process of production thereof | |
| MXPA00002568A (en) | Solid oral dosage form comprising a combination of metformin and glibenclamide | |
| CN1712015A (zh) | 司他夫定缓释片及制备工艺 | |
| AU2002348712A1 (en) | Dosage form for treatment of diabetes mellitus |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C12 | Rejection of a patent application after its publication | ||
| RJ01 | Rejection of invention patent application after publication |