RU2535667C2 - Энантиомеры спиро-оксиндольных соединений и их применение в качестве терапевтических средств - Google Patents
Энантиомеры спиро-оксиндольных соединений и их применение в качестве терапевтических средств Download PDFInfo
- Publication number
- RU2535667C2 RU2535667C2 RU2012102896/04A RU2012102896A RU2535667C2 RU 2535667 C2 RU2535667 C2 RU 2535667C2 RU 2012102896/04 A RU2012102896/04 A RU 2012102896/04A RU 2012102896 A RU2012102896 A RU 2012102896A RU 2535667 C2 RU2535667 C2 RU 2535667C2
- Authority
- RU
- Russia
- Prior art keywords
- enantiomer
- pain
- present
- disease
- compound
- Prior art date
Links
- NEBUOXBYNAHKFV-NRFANRHFSA-N O=C1N(Cc2ccc(C(F)(F)F)[o]2)c2ccccc2[C@@]11c(cc2OCOc2c2)c2OC1 Chemical compound O=C1N(Cc2ccc(C(F)(F)F)[o]2)c2ccccc2[C@@]11c(cc2OCOc2c2)c2OC1 NEBUOXBYNAHKFV-NRFANRHFSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/12—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains three hetero rings
- C07D491/20—Spiro-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/407—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with other heterocyclic ring systems, e.g. ketorolac, physostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/02—Stomatological preparations, e.g. drugs for caries, aphtae, periodontitis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/04—Drugs for skeletal disorders for non-specific disorders of the connective tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P23/00—Anaesthetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/06—Antiarrhythmics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B57/00—Separation of optically-active compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/22—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains four or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07B—GENERAL METHODS OF ORGANIC CHEMISTRY; APPARATUS THEREFOR
- C07B2200/00—Indexing scheme relating to specific properties of organic compounds
- C07B2200/07—Optical isomers
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Pain & Pain Management (AREA)
- Physical Education & Sports Medicine (AREA)
- Diabetes (AREA)
- Urology & Nephrology (AREA)
- Cardiology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Heart & Thoracic Surgery (AREA)
- Psychiatry (AREA)
- Epidemiology (AREA)
- Anesthesiology (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Ophthalmology & Optometry (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Dermatology (AREA)
- Emergency Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Pulmonology (AREA)
- Immunology (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к новому соединению, а именно (S)-энантиомеру 1′-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3′-индол]-2′(1′Н)-она формулы (I), и способу его получения, который является полезным для лечения заболеваний или состояний, таких как боль, интенсивность которых можно уменьшить или облегчить путем модуляции потенциал-зависимых воротных натриевых каналов. Изобретение относится также к фармацевтической композиции на основе этого соединения, способам лечения и способу уменьшения ионного потока через воротный калиевый канал в клетке. 8 н. и 2 з.п. ф-лы, 5 табл., 6 ил., 11 пр.
Description
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение направлено на определенный энантиомер спиро-оксиндольного соединения, в частности, на применение энантиомера в терапевтическом лечении человека или в ветеринарии, для лечения заболеваний или состояний у млекопитающих, предпочтительно человека, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Опубликованная патентная заявка PCT No. WO 2006/110917, раскрытие которой включено в полном объеме в настоящую заявку в качестве ссылки, раскрывает определенные спиро-оксиндольные соединения, в частности, 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он, то есть соединение следующей формулы (I):
Эти соединения, раскрываются в указанной заявке как полезные для лечения заболеваний или состояний, таких как боль, у млекопитающих, предпочтительно у человека, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на установление того, что (S)-энантиомер и (R)-энантиомер следующего соединения формулы (I):
демонстрируют различие в степени ингибирования активности потенциал-зависимого воротного натриевого канала.
Соответственно, в одном аспекте изобретение обеспечивает (S)-энантиомер 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она, то есть (S)-энантиомер, имеющий следующую формулу (I-S):
или его фармацевтически приемлемый сольват или пролекарство. Предпочтительно, (S)-энантиомер практически не содержит (R)-энантиомер.
В другом аспекте, изобретение обеспечивает фармацевтическую композицию, включающую (S)-энантиомер или его фармацевтически приемлемый сольват или пролекарство, как указано выше, предпочтительно практически не содержащий (R)-энантиомер, и один или несколько фармацевтически приемлемых эксципиентов.
В одном варианте воплощения, настоящее изобретение относится к фармацевтической композиции, включающей (S)-энантиомер или его фармацевтически приемлемый сольват или пролекарство, как указано выше, предпочтительно практически не содержащей (R)-энантиомер, в фармацевтически приемлемом носителе и в количестве, эффективном для лечения заболеваний или состояний, связанных с болью, при введении животному, предпочтительно млекопитающему, наиболее предпочтительно человеку.
В другом аспекте, изобретение обеспечивает фармацевтическую терапию в сочетании с (S)-энантиомером, или его фармацевтически приемлемым сольватом или пролекарством, как указано выше, предпочтительно практически не содержащим (R)-энантиомер, и одной или несколькими другими существующими терапиями, или в виде любого их сочетания, для повышения эффективности существующей или перспективной лекарственной терапии или для уменьшения побочных эффектов, связанных с существующей или перспективной лекарственной терапией. В одном варианте воплощения настоящее изобретение относится к фармацевтической композиции, сочетающей (S)-энантиомер или его фармацевтически приемлемый сольват или пролекарство, как указано выше, предпочтительно практически не содержащей (R)-энантиомер, с существующими или перспективными терапевтическими способами лечения для показаний, перечисленных в настоящем изобретении.
В другом аспекте изобретение обеспечивает способ лечения заболевания или состояния у млекопитающего, предпочтительно человека, где заболевание или состояние выбрано из группы, включающей боль, депрессию, сердечно-сосудистые заболевания, респираторные заболевания, психические заболевания, неврологические заболевания и судороги, и их сочетания, где способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера, указанного выше, или его фармацевтически приемлемого сольвата или пролекарства.
В другом аспекте, изобретение обеспечивает способ лечения боли у млекопитающего, предпочтительно человека, где способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера, или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер.
В другом аспекте настоящее изобретение обеспечивает способ лечения или уменьшения тяжести заболевания, состояния или расстройства, где активация или гиперактивность одного или нескольких белков потенциал-зависимых воротных натриевых каналов, включая, но не ограничиваясь этим, NaV1.1, NaV1.2, NaV1.3, NaV1.4, NaV1.5, NaV1.6, NaV1.7, NaV1.8 или NaV1.9 потенциал-зависимый воротный натриевый канал, непосредственно связана с заболеванием, состоянием или расстройством, где способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер.
В другом аспекте изобретение обеспечивает способ лечения заболеваний или состояний у млекопитающих, предпочтительно у человека, которые связаны с активностью потенциал-зависимых воротных натриевых каналов. Таким образом, изобретение обеспечивает способ лечения заболеваний или состояний у млекопитающих, предпочтительно у человека, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов. Примеры таких заболеваний или состояний включают, но не ограничиваются этим, боль любой природы и происхождения, боль, связанную с ВИЧ, индуцированную лечением ВИЧ невропатию, невралгию тройничного нерва, постгерпетическую невралгию, диабетическую невропатию, комплексный региональный болевой синдром (CRPS), пароксизмальное сильное болевое расстройство (PEPD), эвдинию, чувствительность к теплу, саркоидоз, синдром раздраженной толстой кишки, болезнь Крона; боль, связанную с рассеянным склерозом (MS); двигательные нарушения, связанные с рассеянным склерозом; амиотрофический боковой склероз (ALS), зуд, гиперхолестеринемию, доброкачественную гиперплазию предстательной железы, периферическую невропатию, артрит, ревматоидный артрит, остеоартрит, пароксизмальную дистонию, периодический паралич, миастенические синдромы, миотонию, злокачественную гипертермию, кистозный фиброз, псевдоальдостеронизм, острый некроз скелетных мышц, биполярную депрессию, тревогу, шизофрению; заболевание, вызванное воздействием инсектицидов или других средств, которые вызывают повышенную возбудимость нейронов или мышц; наследственную эритермалгию, вторичную эритермалгию, наследственную ректальную боль, наследственную лицевую боль, мигрень, головную боль, невралгическую головную боль, наследственную гемиплегическую мигрень; состояния, связанные с головной болью; синусовую головную боль, тензионную головную боль, фантомные боли в ампутированных конечностях, травму периферического нерва, рак, эпилепсию, парциальные и общие тонические судороги, синдром беспокойных ног, аритмию, фибромиалгию; нейропротекцию при ишемических состояниях, вызванных инсультом; глаукому или невральную травму, тахиаритмии, мерцательную аритмию и фибрилляцию желудочков, где способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер.
В другом аспекте изобретение обеспечивает способ лечения заболевания или состояния у млекопитающего, предпочтительно у человека, путем ингибирования потока ионов через потенциал-зависимый воротный натриевый канал у млекопитающего, где способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер.
В другом аспекте изобретение обеспечивает способ снижения потока ионов через потенциал-зависимый воротный натриевый канал в клетке млекопитающего, где способ включает контактирование клетки с (S)-энантиомером или его фармацевтически приемлемым сольватом или пролекарством, указанным выше, предпочтительно практически не содержащим (R)-энантиомер.
Настоящее изобретение также обеспечивает применение (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер, для получения лекарственной композиции для лечения заболевания или состояния, которое связано с активностью потенциал-зависимого воротного натриевого канала. Таким образом, изобретение обеспечивает применение (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, указанного выше, предпочтительно практически не содержащего (R)-энантиомер, для получения лекарственной композиции для лечения заболевания или состояния, улучшение или облегчение которого достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимого воротного натриевого канала.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Следующие рисунки составляют часть описания настоящего изобретения и включены для демонстрации некоторых аспектов настоящего изобретения. Изобретение может быть лучше понято со ссылкой на один или несколько из этих рисунков в сочетании с подробным описанием конкретных вариантов воплощения, представленных в настоящей заявке.
Фиг. 1 показывает зависимость концентрация-ответ для (S)- и (R)-энантиомеров в анализе притока гуанидина из Биологического примера 1 в настоящей заявке.
Фиг. 2 показывает сравнение эффективности (S)- и (R)-энантиомеров с пероральным введением в модели воспалительной боли из Биологического примера 3 в настоящей заявке.
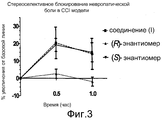
Фиг. 3 показывает сравнение эффективности (S)- и (R)-энантиомеров с местным введением в модели невропатической боли из Биологического примера 3 в настоящей заявке.
Фиг. 4 показывает зависимость от времени гистамин-индуцированного зуда у необработанных мышей в анализе in vivo, описанном в Биологическом примере 7. Данные представлены как количество реакций зуда, среднее значение ± стандартное отклонение.
Фиг. 5 показывает эффективность мази против индуцированного гистамином зуда, применяемой местным путем, содержащей 8%(масс/об) (S)-энантиомера. Данные представлены в виде среднего значения ± стандартное отклонение реакции зуда.
Фиг. 6 показывает эффективность (S)-энантиомера против зуда, индуцированного гистамином, при приеме внутрь, а не местно. Данные представлены как количество реакций зуда, среднее значение ± стандартное отклонение.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
При использовании в описании и формуле изобретения, если не указано иное, следующие термины имеют указанные далее значения:
"Аналгезия" относится к отсутствию боли в ответ на раздражитель, который, как правило, является болезненным.
"Аллодиния" относится к состоянию, при котором обычно безобидные ощущения, такие как давление или легкое прикосновение, воспринимаются как болезненные.
"Энантиомеры" относятся к асимметричным молекулам, которые могут существовать в двух разных изомерных формах, которые имеют разные конфигурации в пространстве. Другие термины, используемые для обозначения или относящиеся к энантиомерам, включают "стереоизомеры" (из-за разного расположения или стереохимии вокруг хирального центра; хотя все энантиомеры являются стереоизомерами, не все стереоизомеры являются энантиомерами) или "оптические изомеры" (из-за оптической активности чистых энантиомеров, которая представляет собой способность различных чистых энантиомеров вращать плоско-поляризованный свет в разных направлениях). Поскольку они не имеют плоскости симметрии, энантиомеры не идентичны их зеркальным отображениям; молекулы, которые существуют в двух энантиомерных формах, являются хиральными, это означает, что их можно рассматривать как присутствующие в "левосторонней" и в "правосторонней" формах. Наиболее частой причиной хиральности в органических молекулах является наличие тетраэдрального углерода, связанного с четырьмя различными заместителями или группами. Такой углерод называется хиральным центром или стереогенным центром. Способ указания трехмерного расположения атомов (или конфигурации) у стереогенного центра соотносится с порядком приоритета групп, когда группа с низшим приоритетом ориентирована в сторону от гипотетического наблюдателя: при расположении остальных трех групп с приоритетом от более высокого до более низкого по часовой стрелке стереогенный центр имеет "R" (или "D") конфигурацию; при их расположении против часовой стрелки стереогенный центр имеет "S" (или "L") конфигурацию.
Энантиомеры имеют одинаковую эмпирическую химическую формулу и, как правило, являются химически идентичными по их реакциям, их физическим свойствам и их спектроскопическим свойствам. Однако энантиомеры демонстрируют разную химическую активность по отношению к другим асимметричным соединениям и по-разному реагируют на асимметричные физические отклонения. Наиболее распространенное асимметричное отклонение представляет собой поляризованный свет.
Энантиомер может вращать плоско-поляризованный свет; таким образом, энантиомер является оптически активным. Два различных энантиомера одного и того же соединения будут вращать плоско-поляризованный свет в противоположном направлении; таким образом, свет может вращаться налево или против часовой стрелки для гипотетического наблюдателя (это левовращающий или "l", или минус, или "-") или он может вращаться направо или по часовой стрелке (это правовращающий или "d", или плюс, или "+"). Знак оптического вращения (+) или (-) не связан с обозначением R,S. Смесь равных количеств двух хиральных энантиомеров называется рацемической смесью или рацематом, и обозначается либо символом (+/-), либо при помощи префикса "d,l" для обозначения смеси правовращающей и левовращающей форм. Соединение формулы (I), как оно описано в настоящей заявке, представляет собой рацемат. Рацематы или рацемические смеси показывают нулевое оптическое вращение, поскольку присутствуют равные количества (+) и (-) форм. Как правило, присутствие одного единственного энантиомера вращает поляризованный свет только в одном направлении; таким образом, одиночный энантиомер называется оптически чистым.
Обозначения "R" и "S" используются для обозначения абсолютной конфигурации молекулы вокруг ее хирального центра (центров). Обозначения могут быть в виде префикса или в виде суффикса; они могут быть отделены дефисом, или не отделены, от названия энантиомера; они могут быть указаны через дефис или без использования дефиса; и они могут быть заключены в скобки или указаны без скобок.
Обозначения или префиксы "(+) и (-)" используются в настоящей заявке для обозначения знака вращения плоско-поляризованного света соединением, при этом знак (-) означает, что соединение является левовращающим (вращает в левую сторону). Соединение с префиксом (+) является правовращающим (вращает в правую сторону).
"Разделение" или "разделяющий", при использовании в отношении рацемического соединения или смеси, относится к разделению рацемата на две его энантиомерные формы (то есть (+) и (-); (R) и (S) формы).
"Энантиомерный избыток" или "эи" относится к продукту, в котором один энантиомер присутствует в избытке по отношению к другому и определяется как абсолютная разница в мольной доле каждого энантиомера. Энантиомерный избыток обычно выражают как процент энантиомера, присутствующего в смеси, относительно другого энантиомера. В целях настоящего изобретения (S)-энантиомер по настоящему изобретению считается "практически не содержащим" (R)-энантиомера, когда (S)-энантиомер присутствует в энантиомерном избытке больше чем 80%, предпочтительно больше чем 90%, более предпочтительно больше чем 95% и наиболее предпочтительно больше чем 99%.
Протокол химического наименования и структурные схемы, используемые в настоящей заявке, представляют собой модифицированную форму системы номенклатуры I.U.P.A.C. (Международный союз теоретической и прикладной химии), с использованием программного обеспечения ACD/Name версия 9.07 Например, соединение формулы (I), как указано выше в разделе “Краткое описание изобретения”, названо в настоящей заявке как 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он. Соответствующий (S)-энантиомер, то есть (S)-энантиомер формулы (I-S), как указано выше в разделе “Краткое описание изобретения”, назван в настоящей заявке как (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1 'H)-он. Соответствующий (R)-энантиомер, (R)-энантиомер следующей формулы (I-R):
или его фармацевтически приемлемый сольват или пролекарство, названы в настоящей заявке как (R)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он.
"Пролекарства" означают соединение, которое может быть преобразовано в физиологических условиях или путем сольволиза в биологически активное соединение по настоящему изобретению. Таким образом, термин "пролекарство" относится к метаболическому предшественнику соединения по настоящему изобретению, которое является фармацевтически приемлемым. Пролекарство может быть неактивным при введении субъекту, нуждающемуся в этом, но преобразовано in vivo в активное соединение по настоящему изобретению. Пролекарства, как правило, быстро преобразуются in vivo с обеспечением исходного соединения по настоящему изобретению, например, путем гидролиза в крови. Пролекарственное соединение часто имеет преимущества в растворимости, тканевой совместимости или замедленном высвобождении в организме млекопитающих (смотри, Bundgard, H., Design of Prodrugs (1985), pp. 7-9, 21-24 (Elsevier, Amsterdam)). Обсуждение пролекарств представлено в Higuchi, T., et al., "Pro-drugs as Novel Delivery Systems", A.C.S. Symposium Series, Vol. 14, и в Bioreversible Carriers in Drug Design, Ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987, обе публикации включены в полном объеме в настоящую заявку посредством ссылки.
Термин "пролекарство" также включает любые ковалентно связанные носители, которые высвобождают in vivo активное соединение по настоящему изобретению при введении такого пролекарства млекопитающему субъекту. Пролекарства соединения по настоящему изобретению могут быть получены путем модификации функциональных групп, присутствующих в соединении по настоящему изобретению, таким образом, чтобы такие модификации расщеплялись, либо путем обычной манипуляции либо in vivo, обеспечивая исходное соединение по настоящему изобретению. Пролекарства включают соединения по настоящему изобретению, в которых гидрокси, амино или меркаптогруппа связана с любой группой таким образом, чтобы при введении пролекарства соединения по настоящему изобретению млекопитающему она отщеплялась с образованием свободной гидрокси, свободной амино или свободной меркаптогруппы, соответственно. Примеры пролекарств включают, но не ограничиваются этим, ацетатные, формиатные и бензоатные производные спиртовых или амидных производных аминных функциональных групп в соединениях по настоящему изобретению и т.п.
Изобретение, раскрытое в настоящей заявке, также охватывает (S)-энантиомер и (R)-энантиомер, раскрытые в настоящей заявке, являющиеся изотопно-меченными, где один или несколько атомов замещены атомом, имеющим другую атомную массу или массовое число. Примеры изотопов, которые могут быть включены в раскрываемые соединения, включают изотопы водорода, углерода, азота, кислорода, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17О, 18O и 18F, соответственно. Эти радиоактивно меченные соединения могут быть полезны как помогающие определить или измерить эффективность соединения, характеризуя, например, расположение или механизм действия на потенциал-зависимые воротные натриевые каналы или связывающую способность с фармакологически значимым местом приложения действия на потенциал-зависимые воротные натриевые каналы. Изотопно-меченные соединения являются полезными в исследованиях распределения лекарственного средства и/или тканевого субстрата. Радиоактивные изотопы, такие как тритий, то есть 3Н, и углерод-14, то есть 14С, особенно полезны для этой цели в виду простоты их включения и существующих средств обнаружения. Радиолиганд, включающий тритий (3Н), особенно полезен для стадий связывания лиганда с мембранами, которые содержат потенциал-зависимые воротные натриевые каналы, потому, что литий имеет длительный период полураспада и излучение с относительно низкой энергией, и по этой причине радиоизотоп относительно безопасен. Радиолиганд, как правило, получают путем обмена трития с водородом в немеченом соединении. Идентификация активных и неактивных энантиомеров конкретного рацемата полезна для анализа связывания лиганда, поскольку немеченный неактивный энантиомер можно использовать в анализе для снижения, отщепления или, в иных случаях, контроля неспецифического связывания обработанного тритием активного энантиомера.
Замещение более тяжелыми изотопами, такими как дейтерий, то есть 2H, может предоставить определенные терапевтические преимущества, обусловленные более высокой метаболической стабильностью, например, увеличение in vivo периода полураспада или снижение требуемой дозировки и, следовательно, может быть предпочтительным при определенных обстоятельствах.
Замещение позитрон-излучающими изотопами, такими как 11C, 18F, 15O и 13N, может быть полезным в исследованиях позитрон-эмиссионной томографии (PET) для изучения степени занятости рецептора субстратом. Изотопно-меченные энантиомеры по настоящему изобретению, как правило, могут быть получены обычными способами, известными специалистам в данной области, или способами, аналогичными описанным в настоящей заявке, с использованием подходящего изотопно-меченного реагента вместо немеченного реагента, применяемого ранее.
Изобретение, раскрываемое в настоящей заявке, также охватывает in vivo продукты метаболизма раскрываемых энантиомеров. Такие продукты могут быть результатом, например, окисления, восстановления, гидролиза, амидирования, этерификации и т.п. вводимого соединения, в основном, за счет ферментативных процессов. Таким образом, изобретение включает продукты метаболизма, образуемые способом, включающим контактирование энантиомера по настоящему изобретению с млекопитающим в течение времени, достаточного для образования продукта метаболизма. Такие продукты метаболизма могут быть определены путем введения радиоактивно меченного энантиомера по настоящему изобретению в обнаруживаемой дозе животному, такому как крыса, мышь, морская свинка, обезьяна, или человеку, обеспечивая достаточное время для осуществления метаболизма, с выделением метаболического продукта из мочи, крови и других биологических образцов.
"Селективность" и "селективный", как это используется в настоящей заявке, является относительным показателем тенденции соединения по настоящему изобретению связываться преимущественно с одним веществом в противоположность другому (или группе других), например, из или среди потенциал-зависимых воротных натриевых каналов. Например, селективность можно определить путем сравнительных измерений кинетики и сродства к равновесному связыванию и/или функциональных измерений ионного транспорта через потенциал-зависимые воротные натриевые каналы. Тенденцию соединения связываться с потенциал-зависимым воротным натриевым каналом можно измерить различными способами, и многие виды связывания известны специалистам в данной области, как описано далее в настоящей заявке. Селективность означает, что в определенном типе связывания, измеренном определенным образом, соединение демонстрирует тенденцию или предпочтение к связыванию с одним потенциал-зависимым воротным натриевым каналом в отличие от одного или нескольких других потенциал-зависимых воротных натриевых каналов. Это связывание(ассоциация) может быть разным для разных видов анализов или различных способов измерения.
"Стабильный энантиомер" и "стабильная структура" указывают соединение, которое является достаточно устойчивым к сохранению при выделении до полезной степени чистоты из реакционной смеси и формулировании в эффективное терапевтическое средство.
"Млекопитающее" включает людей и как домашних животных, таких, как лабораторные животные и домашние животные (например, кошки, собаки, свиньи, крупный рогатый скот, овцы, козы, лошади и кролики), так и не-домашних животных, таких как дикие животные и подобные.
"Фармацевтически приемлемый носитель, разбавитель или эксципиент" включает, без ограничения, любой адъювант, носитель, эксципиент, регулятор сыпучести, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса и аромата, поверхностно-активное вещество, увлажняющее вещество, диспергатор, суспендирующее вещество, стабилизатор, изотонический агент, растворитель или эмульгатор, который был одобрен, в качестве неограничивающего примера, Управлением по контролю за продуктами питания и лекарственными средствами США, Министерством здравоохранения Канады или Европейским агенством по контролю за оборотом лекарственных средств, как приемлемые для применения для человека или домашних животных.
"Фармацевтическая композиция" относится к составу, включающему соединение по настоящему изобретению и среду, общепринятую в данной области для доставки биологически активного соединения млекопитающим, например, людям. Таким образом, такая среда включает все фармацевтически приемлемые носители, разбавители или наполнители.
Фармацевтические композиции по настоящему изобретению включают один или несколько фармацевтически приемлемых эксципиентов, которые включают, но не ограничиваются этим, любой растворитель, адъювант, усилитель биодоступности, носитель, регулятор сыпучести, подсластитель, разбавитель, консервант, краситель/красящее вещество, усилитель вкуса, поверхностно-активное вещество, увлажняющее вещество, диспергатор, суспендирующее вещество, стабилизатор, изотонический агент, буфер и/или эмульгатор, одобренный, в качестве неограничивающего примера, Управлением по контролю за продуктами питания и лекарственными средствами США, Министерством здравоохранения Канады или Европейским агенством по контролю за оборотом лекарственных средств, как приемлемый для использования для человека или домашних животных. Примеры фармацевтически приемлемых наполнителей включают, но не ограничиваются этим, следующие:
бензиловый спирт
бензилбензоат
каприлокапроилмакроголглицериды (например, Labrasol®)
диметиламин ("DMA")
этанол
2-(2-этоксиэтокси)этанол (например, Transcutol®)
глюкоза (раствор)
комплекс глицерилкаприлат/капрат и PEG-8 (полиэтиленгликоль) каприлат/капрат (например, Labrasol®)
изопропиловый спирт
Лауроил Макрогол-32 Глицериды (например, Gelucire® 44/14)
макрогол-15 гидроксистеарат (например, Solutol® HS15)
триглицерид со средней длиной цепи (например, Miglyol® 810, Miglyol® 840 или Miglyol® 812)
арахисовое масло
полисорбат 80 (например, Tween® 80)
полиэтиленгликоль (PEG)
полиэтиленгликоль 400 (PEG400, например, Lutrol® E 400)
полиэтиленгликоль 6000
полиоксил 35 касторовое масло (например, Cremophor® EL)
полиоксил 40 гидрогенизованное касторовое масло (например, Cremophor® RH 40)
пропиленгликоль (ПГ)
пропиленгликольмонокаприлат (Capryol® 90)
соевое масло
сульфобутилэфир-β-циклодекстрин (например, Capitsol®)
TПГС (α-токоферолполиэтиленгликольсукцинат)
вода
Дополнительные фармацевтически приемлемые наполнители раскрыты в настоящей заявке.
Часто при кристаллизации образуется сольват соединения по настоящему изобретению. Как он используется в настоящей заявке, термин "сольват" относится к агрегату, который включает одну или несколько молекул соединения по настоящему изобретению с одной или несколькими молекулами растворителя. Растворителем может быть вода, в этом случае сольват может представлять собой гидрат. Альтернативно, растворитель может быть органическим растворителем. Таким образом, соединения по настоящему изобретению могут существовать в виде гидрата, включая моногидрат, дигидрат, полугидрат, полуторагидрат, тригидрат, тетрагидрат и подобные, а также в соответствующих сольватированных формах. Соединение по настоящему изобретению может быть истинным сольватом, в то время как в других случаях, соединение по настоящему изобретению может лишь удерживать сопутствующую воду или представлять собой смесь с водой плюс некоторое количество сопутствующего растворителя.
"Терапевтически эффективное количество" относится к такому количеству соединения по настоящему изобретению, которое, при введении млекопитающему, предпочтительно человеку, является достаточным для осуществления лечения, как определено ниже, представляющего интерес заболевания или состояния у млекопитающего, предпочтительно человека. Количество соединения по настоящему изобретению, которое составляет "терапевтически эффективное количество" будет варьироваться в зависимости от соединения, состояния и его тяжести, способа введения и возраста млекопитающего, подвергаемого лечению, но его может определить рутинным путем специалист в данной области на основании своих собственных знаний и настоящего раскрытия.
"Лечить" или "лечение", как этот термин используется в настоящей заявке, относится к лечению представляющего интерес заболевания или состояния у млекопитающего, предпочтительно человека, имеющего заболевание или состояние, представляющее интерес, и включает:
(i) предотвращение возникновения заболевания или состояния у млекопитающего, в частности, когда такое млекопитающее предрасположено к состоянию, но оно еще не диагностировано у него;
(ii) ингибирование заболевания или состояния, то есть остановку его развития;
(iii) облегчение заболевания или состояния, то есть вызывая регрессию заболевания или состояния; или
(iv) облегчение симптомов, являющихся результатом заболевания или состояния, то есть ослабление боли, влияя или нет при этом на лежащее в основе заболевание или состояние.
Как они используются в настоящей заявке, термины "улучшение", "улучшенный", "облегчение" или "облегченный" следует рассматривать как имеющие их общепринятые определения. Например, "улучшать" главным образом означает сделать лучше или исправить состояние относительно того состояния, которое предшествовало принятию мер по его улучшению. "Облегчать" главным образом означает сделать состояние легче переносимым относительно того состояния, которое предшествовало принятию мер по его облегчению. Как используется в настоящей заявке, "улучшение" или "улучшенный" может относиться к заболеванию или состоянию, которое стало лучше или нормализовалось при введении соединения по настоящему изобретению. Как используется в настоящей заявке, "облегчение" или "облегченный" может относиться к заболеванию или состоянию, которое стало переносимым при введении соединения по настоящему изобретению. Например, "облегчение" боли включает снижение тяжести или количества боли.
Как они используются в настоящей заявке, термины "заболевание", "расстройство" и "состояние" могут быть использованы взаимозаменяемо или могут отличаться друг от друга тем, что болезнь или состояние может не иметь известного возбудителя (так, что этиология еще не определена), и поэтому еще не признаны как заболевание, а только как нежелательное состояние или синдром, где лечащий врач выявил более или менее определенный набор симптомов.
ПРИМЕНЕНИЕ И ИСПЫТАНИЕ СОЕДИНЕНИЙ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
Настоящее изобретение относится к (S)-энантиомеру 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она, к фармацевтическим композициям и способам применения (S)-энантиомера по настоящему изобретению и к фармацевтическим композициям для лечения заболеваний или состояний, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов, предпочтительно заболеваний и состояний, относящихся к боли и зуду; состояний центральной нервной системы, таких как эпилепсия, синдром беспокойных ног, тревога, депрессия и биполярное заболевание; сердечно-сосудистых состояний, таких как аритмия, мерцательная аритмия и фибрилляция желудочков; нервно-мышечных состояний, таких как паралич мышц, миотония или столбняк; нейропротекции против инсульта, невральной травмы и рассеянного склероза; и каналопатий, таких как эритромелалгия и синдром наследственной ректальной боли, путем введения пациенту, нуждающемуся в таком лечении, эффективного количества блокатора, модулирующего, в частности, ингибирующего потенциал-зависимый воротный натриевый канал, предпочтительно энантиомеров по настоящему изобретению.
В общем, настоящее изобретение обеспечивает способ лечения млекопитающего, предпочтительно человека, или защищающий млекопитающего, предпочтительно человека, от развития, заболевания или состояния, которое связано с активностью потенциал-зависимых воротных натриевых каналов, особенно боли, где способ включает введение млекопитающему терапевтически эффективного количества (S)-энантиомера или его фармацевтически приемлемого сольвата или пролекарства, как указано выше в разделе “Краткое описание изобретения”, где (S)-энантиомер модулирует, предпочтительно ингибирует, активность одного или нескольких потенциал-зависимых воротных натриевых каналов.
Семейство белков потенциал-зависимых воротных натриевых каналов было тщательно исследовано, и было показано, что они вовлечены в ряд жизненно важных функций организма. Исследования в этой области выявили варианты альфа-субъединиц, которые приводят к существенным изменениям в функции и активности каналов, что может в конечном счете привести к серьезным патофизиологическим состояниям. Кроме того, избыточный приток натрия может возникать косвенным образом через возбуждающие агенты или факторы, которые приводят к повышенной возбудимости. Как связанные с функцией, это семейство белков считается основными точками для терапевтического вмешательства. Белки потенциал-зависимых воротных натриевых каналов NaV1.1 и NaV1.2 в большом количестве экспрессируются в головном мозге (Raymond, C.K., et al., J. Biol. Chem. (2004), 279(44):46234-41) и являются жизненно важными для нормальной функции мозга.
У человека мутации в NaV1.1 и NaV1.2 приводят к эпилептическим состояниям и, в некоторых случаях, к снижению умственных способностей и мигреням (Rhodes, T.H., et al., Proc. Natl. Acad. Sci. USA (2004), 101 (30): 11147-52; Kamiya, K., et al., J. Biol. Chem. (2004), 24(11):2690-8; Pereira, S., et al., Neurology (2004), 63(1):191-2; Meisler, M.H. et al., J. Physiol. (Lond.) (в печати). В связи с этим, оба канала считаются подтвержденными мишенями для лечения эпилепсии (смотри патентную публикацию PCT № WO 01/38564).
NaV1.3 экспрессируется преимущественно в центральной нервной системе новорожденных животных и на низких уровнях в организме взрослых (Raymond, C.K., et al., op. cit). Было продемонстрировано, что его экспрессия активируется в сенсорных нейронах спинного рога крыс после повреждения нервной системы (Hains, B.D., et al., J. Neurosci. (2003), 23(26): 8881-92). Многие эксперты в данной области считают NaV1.3 подходящей мишенью для терапевтического лечения боли, поскольку его экспрессия индуцируется повреждением нерва (Lai, J., et al., Curr. Opin. Neurobiol. (2003), (3):291 -72003; Wood, J.N., et al., J. Neurobiol. (2004), 61(1):55-71; Chung, J.M., et al., Novartis Found Symp. (2004), 261:19-27; обсуждение 27-31, 47-54; Priest, BT., Curr. Opin. Drug Discov. Devel. (2009) 12:682-693).
Экспрессия Nav1.4, по существу, ограничивается мышцами (Raymond, C.K., et al., op. cit). Мутации в этом гене, как было показано, имеют сильный эффект, влияющий на мышечную функцию, включая паралич (Tamaoka A., Intern. Med. (2003), (9):769-70). Таким образом, этот канал считается мишенью для лечения периодического паралича, миотонии, аномальной сократительной способности мышц, спазм или паралича.
Сердечный потенциал-зависимый воротный натриевый канал NaV1.5 экспрессируется преимущественно в сердечных миоцитах (Raymond, C.K., et al., op. cit), и может быть обнаружен в предсердиях, желудочках, синусно-предсердном узле, атрио-вентрикулярном узле и клетках Пуркинье. Быстрый скачок вверх потенциала действия сердца и быстрое проведение импульса через сердечную ткань происходит в результате открытия NaV1.5. Таким образом, NaV1.5 вовлечен в сердечную аритмию. Мутации в человеческом NaV1.5 приводят к множественным аритмическим синдромам, включая, например, длинный QT3 (LQT3), синдром Бругада (BS), наследственный дефект сердечной проводимости, синдром внезапной неожиданно смерти во сне (SUNDS) и синдром внезапной смерти младенцев (SIDS) (Liu, H. et al., Am. J. Pharmacogenomics (2003), 3(3): 173-9; Ruan, Y et al., Nat. Rev. Cardiol. (2009) 6: 337-48). Терапию с использованием блокаторов потенциал-зависимых воротных натриевых каналов широко используют для лечения сердечной аритмии. Первое лекарственное средство против аритмии, хинидин, открытое в 1914 году, классифицируют как блокатор натриевых каналов.
NaV1.6 кодирует присутствующий в избытке, широко распространенный потенциал-зависимый воротный натриевый канал, распространенный в центральной и периферической нервной системах, скопление которого обнаружено в узлах Ранвье нервных аксонов (Caldwell, J. H., et al., Proc. Natl. Acad. Sci USA (2000), 97(10): 5616-20). Мутации с потерей функции у мышей приводят к атаксии и судорогам (Papale, L.A. et al., Human Mol. Genetics (2009) 18, 1633-1641). Хотя никаких мутаций у человека обнаружено не было, считается, что NaV1.6 играет определенную роль в проявлении симптомов, связанных с рассеянным склерозом, и его считают мишенью для лечения этого заболевания (Craner, M. J., et al., Proc. Natl. Acad. Sci USA (2004), 101(21):8168-73).
NaV1.7 экспрессируется преимущественно в периферической нервной системе как в сенсорных, так и в симпатетических нейронах (Raymond, C. K., et al., op. cit). Мутации с потерей функции у человека вызывают конгенитальную индифферентность к боли (CIP) без нарушения когнитивной или двигательной функции (Cox, J.J. et al., Nature (2006) 444 (7121), 894-8; Goldberg, YP. et al., Clin. Genet. (2007) 71 (4), 311-9). Субъекты с CIP не испытывают воспалительной или невропатической боли, и это говорит о том, что селективное блокирование NaV1.7 может устранять различные формы хронической и острой боли, без неблагоприятного эффекта на центральную или периферическую нервную систему или на мышцы. Кроме того, полиморфизм отдельных нуклеотидов (R1150W), который имеет слабо выраженные эффекты на время- и потенциал-зависимость воротного механизма NaV1.7, имеет сильные эффекты на ощущение боли (Reimann, F. et al., Proc. Natl. Acad. Sci USA ( 2010), 107 (11), 5148-53). Около 10% пациентов с различными болевыми состояниями являются гетерозиготными для аллеля, сообщающего бульшую чувствительность к боли. Участие NaV1.7 в опосредовании болевых ответов также подтверждается мутациями с приобретением функции, которые приводят к эритромелалгии или пароксизмальному сильному болевому расстройству (Dib-Hajj S. D. et al., Adv. Genet. (2009) 63: 85-110). Хотя NaV1.7 экспрессируется преимущественно в периферической нервной системе, точечная мутация в NaV1.7 вызывает судороги при высокой лихорадке, указывая на роль этого канала в ЦНС. Таким образом, блокаторы потенциал-зависимых воротных натриевых каналов могут быть полезными в качестве противосудорожных средств.
Экспрессия NaV1.8 имеет место преимущественно в дорсальных корешковых ганглиях (DRG) (Raymond, C.K., et al., op. cit). Скачок вверх потенциала действия в сенсорных нейронах из DRG преимущественно происходит за счет тока через NaV1.8, таким образом, блокирование этого тока должно блокировать болевые ответы (Blair, NT и Bean, BP, J. Neurosci. 22: 10277-90). В соответствии с этим открытием, «нок-даун» NaV1.8 у крыс достигается с использованием антисмысловой ДНК или малых интерферирующих РНК, и практически полное инвертирование невропатической боли достигалось в моделях лигирования спинального нерва и хронического констрикционного поражения. Селективный блокатор NaV1.8 был описан в литературе, и он является эффективным в блокировании как невропатической, так и воспалительной боли (Jarvis, M. F. et al., Proc. Natl. Acad. Sci USA (2007), 704 (20), 8520-5). Опубликованная патентная заявка PCT № WO03/037274A2 описывает пиразол-амиды и сульфонамиды для лечения состояний центральной или периферической нервной системы, в частности, боли и хронической боли путем блокирования натриевых каналов, связанных с началом развития или рецидивов указанных состояний. Опубликованная патентная заявка PCT № WO03/037890A2 описывает пиперидины для лечения состояний центральной или периферической нервной системы, в частности, боли и хронической боли путем блокирования натриевых каналов, связанных с началом развития или рецидивом указанных состояний. Соединения, композиции и способы в соответствии с этими изобретениями особенно полезны для лечения невропатической или воспалительной боли путем ингибирования ионного потока через канал, который включает PN3 (NaV1.8) субъединицу.
Было показано, что потенциал-зависимый воротный натриевый канал Nav1.9 периферической нервной системы, раскрытый Dib-Hajj, S.D., et al. (см. Dib-Hajj, S.D., et al., Proc. Natl. Acad. Sci USA (1998), 95(15):8963-8), экспрессируется в дорсальных корешковых ганглиях. Было показано, что NaV1.9 лежит в основе нейротрофин (BDNF)-индуцируемой деполяризации и возбуждения. Ограниченная картина экспрессии этого канала сделала его кандидатом в качестве мишени для лечения боли (Lai, J, et al., op. cit; Wood, J. N., et al., op. cit.; Chung, J. M. et al., op. cit).
NaX представляет собой предполагаемый натриевый канал, который не был подтвержден как являющийся потенциал-зависимым. Помимо экспрессии в легких, сердце, дорсальных корешковых ганглиях и клетках Шванна периферической нервной системы, NaX обнаружен в нейронах и эпендимальных клетках в ограниченных областях ЦНС, в частности, в околовентрикулярных органах, которые вовлечены в гомеостаз жидкостей организма (Watanabe, E., et al., J. Neurosci. (2000), 20(20):7743-51). Мыши с дефицитом NaX показали аномальное поглощение гипертонического солевого раствора при состояниях водо- и солеистощения. Эти открытия говорят о том, что NaX играет важную роль в центральном ощущении уровня натрия в жидкостях организма и регуляции поведения потребления соли. Картина его экспрессии и функция говорят о том, что он может быть мишенью для лечения кистозного фиброза и других связанных с регуляцией соли заболеваний.
Исследования с использованием блокатора потенциал-зависимых воротных натриевых каналов тетродотоксина (TTX) для снижения нейронной активности в некоторых областях головного мозга указывают на его потенциальное применение в лечении зависимости. Объединенные с наркотиком стимулы вызывают непреодолимое стремление к наркотику и рецидив поведения, связанного с зависимостью и поиском наркотика у крыс. Функциональная целостность базолатеральной мозжечковой миндалины (BLA) необходима для восстановления кокаин-ищущего поведения, индуцированного кокаин-обусловленными стимулами, но не кокаином как таковым. BLA играет подобную роль в восстановлении героин-ищущего поведения. TTX-induced inactivation of BLA on conditioned and heroin-primed reinstatement of extinguished heroin-seeking behavior in a rat model (Fuchs, R.A. and See, R.E., Psychopharmacology (2002) 160(4):425-33).
Подгруппа C волокон опосредует ответы на вызывающие зуд агенты, особенно на зуд, вызываемый гистамином, активаторами PAR-2 рецепторов, холестазом и вирусными инфекциями (Steinhoff, M. et al., J. Neurosci. 23:6176-80; Twycross, R. et al., Q. J. Med. 96: 7-26). Потенциал-зависимые воротные натриевые каналы экспрессируются в и опосредуют C-волоконные нервные импульсы.
Общую оценку (S)-энантиомера по настоящему изобретению в модуляции, особенно в ингибировании, ионного потока в потенциал-зависимых воротных натриевых каналах можно определить с использованием анализов, описанных ниже в разделе “Биологические анализы”. Альтернативно, общую оценку (S)-энантиомера по настоящему изобретению в лечении состояний и заболеваний можно определить в промышленно используемых стандартных животных моделях для демонстрации эффективности соединений в лечении боли. Были разработаны животные модели состояний невропатической боли у человека, которые приводят к воспроизводимым сенсорным дефицитам (аллодиния, гипералгезия и спонтанная боль) в течение продолжительного периода времени, которые можно оценить путем сенсорного испытания. Путем установления степени присутствующей механически, химически и термически индуцированной аллодинии и гипералгезии можно смоделировать некоторые психопатологические состояния, наблюдаемые у человека, позволяющие оценить фармакотерапии.
В крысиных моделях травмы периферического нерва эктопическая активность в поврежденном нерве коррелирует с поведенческими признаками боли. В этих моделях, внутривенное применение (S)-энантиомера по настоящему изобретению и местного анестетика лидокаина может подавлять эктопическую активность и обеспечивать обратное развитие тактильной аллодинии при концентрациях, которые не влияют на общее поведение и двигательную функцию (Mao, J. and Chen, L.L, Pain (2000), 87:7-17). Аллиметрическое определение масштаба доз, эффективных в этих крысиных моделях, переводят в дозы, подобные тем, которые были определены как эффективные для человека (Tanelian, D.L. and Brose, W.G., Anesthesiology (1991), 74(5):949-951). Кроме того, Lidoderm®, лидокаин, применяемый в форме кожного пластыря, представляет собой одобренное FDA лечение постгерпетической невралгии (Devers, A. and Glaler, B.S., Clin. J. Pain (2000), 16(3):205-8).
Блокаторы потенциал-зависимых воротных натриевых каналов имеют клинические применения помимо боли. Эпилепсия и сердечные аритмии часто являются мишенями для блокаторов натриевых каналов. Недавно полученные подтверждения от животных моделей говорят о том, что блокаторы потенциал-зависимых воротных натриевых каналов также могут быть полезными для нейропротекции при ишемических состояниях, вызванных инсультом или неврологической травмой и у пациентов с рассеянным склерозом (MS) (Clare, JJ. et al., op. cit. and Anger, T. et al., op. cit.).
(S)-энантиомер по настоящему изобретению модулирует, предпочтительно ингибирует, ионный поток через потенциал-зависимый воротный натриевый канал у млекопитающего, в частности, у человека. Любую такую модуляцию, которая может представлять собой частичное или полное ингибирование или предотвращение ионного потока, иногда указывают в настоящей заявке как "блокирование", а соответствующие соединения как "блокаторы" или "ингибиторы". Как правило, соединение по настоящему изобретению модулирует активность потенциал-зависимого воротного натриевого канала в сторону понижения, ингибирует зависимую от напряжения активность потенциал-зависимого воротного натриевого канала и/или снижает или предотвращает поток натриевых ионов через клеточную мембрану путем предотвращения активности потенциал-зависимого воротного натриевого канала, такой как ионный поток.
(S)-энантиомер по настоящему изобретению является блокатором натриевых каналов и поэтому является полезным для лечения заболеваний и состояний у млекопитающих, предпочтительно у человека, и других организмов, включая все те человеческие заболевания и состояния, которые являются результатом аберрантной биологической активности потенциал-зависимых воротных натриевых каналов или которые можно лечить или облегчить путем модуляции, предпочтительно ингибирования, биологической активности потенциал-зависимых воротных натриевых каналов.
Как определено в настоящей заявке, заболевание или состояние, интенсивность которого можно уменьшить или которое можно облегчить путем модуляции, предпочтительно ингибирования, потенциал-зависимого воротного натриевого канала, относится к заболеванию или состоянию, интенсивность которого уменьшается или которое облегчается при модуляции, предпочтительно ингибировании, потенциал-зависимого воротного натриевого канала, и включает, но не ограничивается этим, боль и зуд; состояния центральной нервной системы, такие как эпилепсия, тревога, депрессия (Morinville et al., J. Comp. Neurol., 504:680-689 (2007)) и биполярное заболевание (Ettinger and Argoff, Neurotherapeutics, 4:75-83 (2007)); сердечно-сосудистые состояния, такие как аритмия, мерцательная аритмия и фибрилляция желудочков; нервно-мышечные состояния, такие как синдром беспокойных ног и паралич мышц или столбняк; нейропротекцию против инсульта, неврологической травмы и рассеянного склероза; и каналопатии, такие как эритромелалгия и наследственный ректальный болевой синдром.
Дополнительные заболевания и состояния включают боль, связанную с ВИЧ, индуцированной лечением ВИЧ невропатией, невралгию тройничного нерва, глоссофарингеальную невралгию, невропатию вторичную к метастатической инфильтрации, болезненное ожирение, таламические повреждения, гипертензию, аутоиммунное заболевание, астму, наркотическую зависимость (например, опиат, бензодиазепин, амфетамин, кокаин, спирт, ингаляция бутана), болезнь Альцгеймера (Kim DY, Carey et al., Nat. Cell Biol. 9(7):755-764 (2007)), деменцию, возрастные нарушения памяти, синдром Корсакова, рестеноз, расстройство мочеиспускания, недержание, болезнь Паркинсона (Do and Bean, Neuron 39:109-120 (2003); Puopolo et al., J. Neurosci. 27:645-656 (2007)), сердечно-сосудистую ишемию, невроз, желудочно-кишечное заболевание, серповидно-клеточную анемию, серповидно-клеточную болезнь, отторжение трансплантата, сердечную недостаточность, инфаркт миокарда, реперфузионное поражение, перемежающуюся хромоту, стенокардию, судороги, респираторные расстройства, ишемические заболевания мозга или миокарда, синдром длинного-QT, катехолминергическую полиморфную вентрикулярную тахикардию, глазные заболевания, мышечную спастичность, спастическую параплегию, миопатии, злокачественную миастению, парамиотонию congentia, гиперкалемический периодический паралич, гипокалемический периодический паралич, алопецию, тревожные расстройства, психотические расстройства, маниакальный синдром, пананойю, сезонное аффективное расстройство, паническое расстройство, обсессивно-компульсивное расстройство (OCD), фобии, аутизм, синдром Аспергерса, синдром Ретса, дезинтегративное расстройство, синдром дефицита внимания, агрессивность, расстройства импульсного контроля, тромбоз, преклампсию, застойную сердечную недостаточность, остановку сердца, атаксию Фридриха, спинномозговую и мозжечковую атаксию, тремор, мышечную слабость, миелопатию, радикулопатию, системную красную волчанку, грануломатозное заболевание, оливо-понто-мозжечковую атрофию, спинномозговую и мозжечковую атаксию, эпизодическую атаксию, миокимию, прогрессирующую паллидарную атрофию, прогрессирующий супрануклеарный паралич и мышечную спастичность, травматическое поражение головного мозга, отек головного мозга, гидроцефалию, поражение спинного мозга, нервную анорексию, булимию, синдром Прадера-Вилли, ожирение, глазной неврит, катаракту, ретинальное кровоизлияние, ишемическую ретинопатию, пигментный ретинит, острую и хроническую глаукому, дегенерацию желтого пятна, окклюзию ретинальной артерии, хорею, болезнь Гентингтона, хорею Гентингтона, отек головного мозга, проктит, постгерпетическую невралгию, эвдинию, чувствительность к теплу, саркоидоз, синдром раздраженной толстой кишки, синдром Тоуретта, синдром Леша-Найхана, синдром Бругадо, синдром Лиддла, болезнь Крона, рассеянный склероз и боль, связанную с рассеянным склерозом (MS), боковой амиотрофический склероз (ALS), диссеминированный склероз, диабетическую невропатию, периферическую невропатию, синдром Шарко-Мари-Тута, артрит, ревматоидный артрит, остеоартрит, хондрокальциноз, пароксизмальную дистонию, миастенические синдромы, миотонию, миотоническую дистрофию, мышечную дистрофию, злокачественную гипертермию, кистозный фиброз, псевдоальдостеронизм, острый некроз скелетных мышц, mental handicap, биполярную депрессию, тревогу, шизофрению, заболевание, связанное с токсином натриевого канала, семейную эритромелалгию, первичную эритромелалгию, ректальную боль, рак, эпилепсию, парциальные и общие тонические судороги, судороги при высокой лихорадке, малые эпилептические припадки (petit mal), миоклонические судороги, атонические судороги, клонические судороги, Lennox Gastaut, West Syndome (детские спазмы), синдром слабости синусового узла (Haufe V, Chamberland C, Dumaine R, J. Mol. Cell Cardiol. 42(3):469-477 (2007)), полирезистентные судороги, профилактику судорог (противоэпилептическую), семейный синдром средиземноморской лихорадки, подагру, синдром беспокойных ног, аритмию, фибромиалгию, нейропротекцию при ишемических состояниях, вызванных инсультом или неврологической травмой, тахиаритмию, мерцательную аритмию и фибрилляцию желудочков, и в качестве общего или местного анестетика.
Как используется в настоящей заявке, термин "боль" относится ко всем категориям боли, независимо от ее природы или происхождения, и этот термин включают, но не ограничивается этим, невропатическую боль, воспалительную боль, ноцицептивную боль, идиопатическую боль, невралгическую боль, орофасциальную боль, ожоговую боль, хроническую костную боль, боль в пояснице, шейную боль, абдоминальную боль, синдром жжения во рту, соматическую боль, висцеральную боль (включая абдоминальную), миофасциальную боль, зубную боль, раковую боль, боль, вызванную химиотерапией, миофасциальный болевой синдром, комплексный региональный болевой синдром (CRPS), височно-нижнечелюстную суставную боль, травматическую боль, пароксизмальное сильное болевое расстройство, хирургическую боль, пост-хирургическую боль, боль при родах, рефлекс симпатетическую дистрофию, боль в результате разрыва плечевого сплетения, нейрогенный мочевой пузырь, острую боль, мышечно-скелетную боль, послеоперационную боль, хроническую боль, персистентную боль, периферически- опосредованную боль, центрально-опосредованную боль, хроническую головную боль, головную боль при давлении, кластерную головную боль, мигреневую головную боль, наследственную гемиплегическую мигрень, состояния, связанные с головной болью, синусовую головную боль, головную боль при давлении, фантомные боли в ампутированных конечностях, травму периферического нерва, боль после инсульта, таламические повреждения, радикулопатию, вызванную ВИЧ боль, пост-герпетическую боль, не-сердечную боль в области грудной клетки, синдром раздраженной толстой кишки и боль, связанную с кишечными расстройствами и диспепсией, и их сочетания.
Настоящее изобретение также относится к соединениям, фармацевтическим композициям и способам применения соединений и фармацевтических композиций для лечения или профилактики заболеваний или состояний, таких как доброкачественная гиперплазия предстательной железы (BPH), гиперхолестеринемия, рак и зуд (чесотка).
Доброкачественная гиперплазия предстательной железы (BPH), также известна как доброкачественная гипертрофия простаты, является одним из наиболее распространенных заболеваний, поражающих стареющих мужчин. BPH представляет собой прогрессирующее состояние, которое характеризуется нодозным увеличением ткани предстательной железы, приводящим к обструкции уретры. Последствия BPH могут включать гипертрофию гладких мышц мочевого пузыря, декомпенсацию мочевого пузыря, острую задержку мочи и повышение вероятности инфекции мочевых путей.
BPH имеет большое значение для здравоохранения и является одной из наиболее распространенных причин для хирургического вмешательства среди пожилых мужчин. Были предприняты попытки для выяснения этиологии и патогенеза и, в результате, были разработаны экспериментальные модели. Спонтанные животные модели ограничиваются шимпанзе и собакой. BPH у мужчины и собаки имеет общие характерные признаки. У обоих видов развитие BPH происходит спонтанно с достижением пожилого возраста, и его можно предотвратить путем ранней/препубертантной кастрации. Медицинская альтернатива хирургической операции является чрезвычайно желательной для лечения BHP и последствий.
Эпителиальная гиперплазия предстательной железы как у человека, так и у собаки является андроген-чувствительной, претерпевающая инволюцию с депривацией андрогена и возобновлением эпителиальной гиперплазии при замещении андрогена. Клетки, происходящие из предстательной железы, как было показано, экспрессируют высокие уровни потенциал-зависимых натриевых каналов, исследования с использованием иммунной метки представили явные доказательства присутствия потенциал-зависимых натриевых каналов в тканях предстательной железы (Prostate Cancer Prostatic Dis. 2005; 8(3):266-73). Ингибирование функции потенциал-зависимых воротных натриевых каналов тетродотоксином, являющимся селективным блокатором, ингибирует миграцию клеток, происходящих из рака предстательной железы и молочной железы (Brackenbury, W.J. and Djamgoz, M.B.A., J. Physiol. (Lond) (2006) 573: 343-56; Chioni, A-M. et al., Int. J. Biochem. Cell Biol. (2009) 41: 1216-1227).
Гиперхолестеринемия, то есть повышенный уровень холестерина в крови, представляет собой установленный фактор риска в развитии, например, атеросклероза, заболевания коронарных артерий, гиперлипидемии, инсульта, гиперинсулинемий, гипертензии, ожирения, диабета, сердечно-сосудистых заболеваний (CVD), ишемического заболевания миокарда и сердечного приступа. Таким образом, снижение уровней общего холестерина в сыворотке у субъектов с высокими уровнями холестерина известно как снижающее риск этих заболеваний. Снижение уровня холестерина липопротеинов низкой плотности, в частности, является существенным шагом в предотвращении CVD. Хотя существуют различные способы терапевтического лечения гиперхолестеринемии, в этой области все еще остается потребность в альтернативных терапиях и продолжается их поиск.
Изобретение обеспечивает соединения, которые являются полезными в качестве средств против гиперхолестеринемии и связанных с этим состояний. Соединения по настоящему изобретению могут действовать различными путями. Не желая привязывать это к какому-либо конкретному механизму действия, соединения могут быть прямыми или косвенными ингибиторами фермента ацил CoA: холестеринацилтрансферазы (ACAT), что приводит к ингибированию этерификации и транспорта холестерина через стенки кишечника. Другая возможность может состоять в том, что соединения по настоящему изобретению могут быть прямыми или косвенными ингибиторами биосинтеза холестерина в печени. Возможно, что некоторые соединения по настоящему изобретению могут действовать как прямые, так и косвенные ингибиторы ACAT и биосинтеза холестерина.
Зуд, обычно известный как чесотка, представляет собой широко распространенное дерматологическое состояние. Существует две широкие категории чесотки, основанные на этиологии: воспалительная кожная чесотка и невропатическая чесотка (Binder et al., Nature Clinical Practice, 4:329-337, 2008). В первом случае воспалительные медиаторы активируют кожные рецепторы зуда, представляющие собой подгруппу кожных афферентных нервных волокон, преимущественно немиелинизированных C волокон. Лечения этого типа чесотки состоит либо в блокировании рецепторов для воспалительных агентов (таких как антигистамины), либо в блокировании вытекающей из этого электрической активности. Потенциал-зависимые воротные натриевые каналы играют центральную роль в трансмиссии электрической активности в нейронах, и модуляция потенциал-зависимых воротных натриевых каналов представляет собой общепринятое средство для модуляции этой сигнальной активности. Хотя причины невропатического зуда являются комплексными и менее изучены, существует общепринятое доказательство центральной сенсибилизации и гиперчувствительности входа от сенсорных нейронов C волокон в коже. Что касается воспалительной чесотки, натриевые каналы по-видимому являются существенными для распространения электрических сигналов от кожи к ЦНС. Передача импульсов зуда приводит к неприятному ощущению, которое вызывает желание или рефлекс чесаться.
Как воспалительную, так и невропатическую чесотку можно блокировать при помощи известных блокаторов потенциал-зависимых воротных натриевых каналов, из которых наиболее широко используемым является лидокаин (Villamil et al., American Journal of Medicine 118: 1160-1163, 2005; Inan et al., Euorpean Journal of Pharmacology 616: 141-146, 2009; Fishman et al., American Journal of Medicine 102: 584-585, 1997; Ross et al., Neuron 65: 886-898, 2010). Дозы лидокаина, необходимые для облегчения зуда, сопоставимы с дозами, эффективными для лечения боли. Обе сенсорные схемы имеют общие для них медиаторы и соответствующие нейронные пути (Ikoma et al., Nature Reviews Neuroscience, 7:535-547, 2006). Однако другие лечения боли неэффективны против зуда и могут усилить зуд, а не облегчить его. Например, опиоиды, в частности, являются эффективными для ослабления боли, но при этом могут вызывать сильный зуд. Таким образом, блокирование потенциал-зависимых воротных натриевых каналов представляет собой особенно многообещающую терапию для лечения боли и зуда.
Соединения по настоящему изобретению, как было показано, обладают анальгетическими эффектами в различных животных моделях при пероральных дозах в пределах от 1 мг/кг до 100 мг/кг. Соединения по настоящему изобретению также могут быть полезными для лечения зуда.
Типы зуда или кожного раздражения включают, но не ограничиваются этим:
a) псориатический зуд, зуд из-за гемодиализа, агвагенный зуд и зуд, вызванный кожными расстройствами (например, контактным дерматитом), системными расстройствами, невропатией, спихогенными факторами, либо их сочетанием;
b) зуд, вызванный аллергическими реакциями, укусами насекомых, гиперчувствительностью (например, сухая кожа, акне, экзема, псориаз), воспалительными состояниями или травмой;
c) зуд, связанный с вестибулитом вульвы;
d) кожное раздражение или воспалительный эффект от введения другого терапевтического средства, такого как, например, антибиотики, противовирусные средства и антигистаминные средства; и
e) зуд из-за активации связанных с PAR-2 G-белком рецепторов.
(S)-энантиомер по настоящему изобретению модулирует, предпочтительно ингибирует, ионный поток через потенциал-зависимый натриевый канал. Предпочтительно, (S)-энантиомер по настоящему изобретению представляет собой зависимый от состояния или частоты модификатора потенциал-зависимых воротных натриевых каналов, обладающий низким сродством к состоянию покоя/закрытому состоянию и высоким сродством к инактивированному состоянию. Не желая привязывать это к какому-либо конкретному механизму действия, (S)-энантиомер по настоящему изобретению вероятно взаимодействует с перекрывающимися сайтами, расположенными во внутренней полости натрий-проводящей поры канала, подобно тому, как описано для других зависимых от состояния блокаторов натриевых каналов (Cestele, S., et al., op. cit). (S)-энантиомер по настоящему изобретению также вероятно взаимодействует с сайтами за пределами внутренней полости и имеет аллостерические эффекты на проводимость натриевых ионов через пору канала.
В предпочтительном варианте воплощения настоящего изобретения, (S)-энантиомер по настоящему изобретению модулирует, предпочтительно ингибирует, активность Nav1.7. В другом предпочтительном варианте воплощения настоящего изобретения, (S)-энантиомер по настоящему изобретению селективно модулирует, предпочтительно ингибирует, активность Nav1.7 по сравнению с модуляцией или ингибированием других потенциал-зависимых воротных натриевых каналов (т.е Nav1.1-Nav1.6 и Nav1.8-Nav1.9). Поскольку большинство других натриевых каналов вовлечены в другие важные физиологические процессы, такие как частота и ритмичность сердечных сокращений (Nav1.5), сокращение скелетных мышц (Nav1.4) и проводимость электрической активности в ЦНС и двигательных нейронах (Nav1.1, Nav1.2 и Nav1.6), желательно, чтобы (S)-энантиомер по настоящему изобретению избегал существенной модуляции указанных выше других натриевых каналов.
Любые из этих последствий, в конечном счете, могут быть ответственными за общую терапевтическую пользу, обеспечиваемую (S)-энантиомером по настоящему изобретению.
Обычно, успешное терапевтическое средство по настоящему изобретению должно отвечать некоторым или всем из следующих критериев. Пероральная доступность должна быть на уровне или выше 20%. Эффективность в животных моделях должна составлять от меньше чем около 0,1 мкг до около 100 мг/кг массы тела, и целевая доза для человека должна ходиться в пределах от 0,1 мкг до около 100 мг/кг массы тела, хотя дозы вне этого диапазона могут быть приемлемыми ("мг/кг" означает миллиграммы соединения на килограмм массы тела субъекта, которому вводят дозы). Терапевтический индекс (или отношение токсичной дозы к терапевтической дозе) должен быть больше чем 100. Активность (выраженная как значение ИК50) должна быть меньше чем 10 мкМ, предпочтительно ниже 1 мкМ, и наиболее предпочтительно ниже 50 нМ. Значение ИК50 ("Ингибирующая Концентрация - 50%") является показателем количества (S)-энантиомера по настоящему изобретению, необходимого для достижения 50% ингибирования ионного потока через натриевый канал в течение определенного периода времени в анализе по настоящему изобретению.
Другой аспект настоящего изобретения относится к ингибированию активности Nav1.1, Nav1.2, Nav1.3, Nav1.4, Nav1.5, Nav1.6, Nav1.7, Nav1.8, или Nav1.9 в биологическом образце или в организме млекопитающего, предпочтительно человека, при этом способ включает введение млекопитающему, или контактирование с этим биологического образца, (S)-энантиомера по настоящему изобретению или композиции, включающей (S)-энантиомер по настоящему изобретению. Термин "биологический образец", как он используется в настоящей заявке, включает, без ограничения, клеточные культуры или их экстракты; взятое у млекопитающего путем биопсии вещество или его экстракты; и кровь, слюна, моча, фекалии, семенная жидкость, слезы или другие жидкости организма или их экстракты.
Помимо указанных выше применений (S)-энантиомера по настоящему изобретению, соединение также может быть полезным для модуляции, предпочтительно ингибирования, активности потенциал-зависимого воротного натриевого канала в биологическом образце для различных целей, которые известны специалистам в данной области. Примеры таких целей включают, но не ограничиваются этим, исследования потенциал-зависимых натриевых ионных каналов в биологических и патологических явлениях; и сравнительную оценку новых или других модуляторов потенциал-зависимых натриевых ионных каналов.
(S)-энантиомер по настоящему изобретению также можно использовать для лечения отличных от человека млекопитающих (то есть в ветеринарных способах лечения) от заболеваний или состояний, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов, в частности, для лечения воспаления и боли. Считается, что такое лечение представляет особый интерес для домашних животных, таких как собаки и кошки.
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ И ВВЕДЕНИЕ
Настоящее изобретение также относится к фармацевтической композиции, содержащей (S)-энантиомер по настоящему изобретению. В одном варианте воплощения настоящее изобретение относится к композиции, включающей (S)-энантиомер по настоящему изобретению в фармацевтически приемлемом носителе и в количестве, эффективном для модулирования, предпочтительно ингибирования, ионного потока через потенциал-зависимый воротный натриевый канал для лечения заболеваний, таких как боль, при введении пациенту животному, предпочтительно млекопитающему, наиболее предпочтительно человеку.
Введение (S)-энантиомера по настоящему изобретению, в чистой форме или в подходящей фармацевтической композиции, можно осуществить любым приемлемым путем введения средств для подобных целей. Фармацевтические композиции по настоящему изобретению можно получить путем сочетания соединения по настоящему изобретению с подходящим фармацевтически приемлемым носителем, разбавителем или эксципиентом, и можно сформулировать в препараты в твердой, полутвердой, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, суппозитории, препараты для инъекций, препараты для ингаляции, гели, микросферы и аэрозоли. Типичные пути введения таких фармацевтических композиций включают, без ограничения, пероральный, местный, чрескожный, через ингаляцию, парентеральный, сублигвальный, ректальный, вагинальный и интраназальный. Термин “парентеральный”, как он используется в настоящей заявке, включает подкожные инъекции, внутривенные, внутримышечные, интрастернальные инъекции или инфузии. Фармацевтические композиции по настоящему изобретению формулируют таким образом, чтобы активные ингредиенты, содержащиеся в них, были биодоступны при введении композиции пациенту. Композиции, которые предназначены для введения субъекту или пациенту, предпочтительно млекопитающему, более предпочтительно человеку, принимают форму одной или нескольких единиц дозирования, например, таблетка может представлять собой одну единицу дозирования, а контейнер, включающий соединение по настоящему изобретению в аэрозольной форме, может содержать множество единиц дозирования. Практические способы получения таких лекарственных форм известны или будут очевидны специалистам в данной области; например, см. The Science and Practice of Pharmacy, 20th Edition (Philadelphia College of Pharmacy and Science, 2000). Композиция, предназначенная для введения в любом случае должна содержать терапевтически эффективное количество соединения по настоящему изобретению или его фармацевтически приемлемой соли для лечения заболевания или состояния, представляющего интерес, в соответствии со способами по настоящему изобретению.
Фармацевтические композиции, полезные в настоящем изобретении, также содержат фармацевтически приемлемый носитель, включая любой подходящий разбавитель или эксципиент, который включает любое используемое в фармацевтике вещество, которое само не вызывает продукцию антител, вредных для субъекта, принимающего композицию, и которое можно вводить без нежелательной токсичности. Фармацевтически приемлемые носители включают, но не ограничиваются этим, жидкости, такие как вода, физиологический раствор, глицерин и этанол и подобные. Подробное обсуждение фармацевтически приемлемых носителей, разбавителей и других эксципиентов представлено в REMINGTON'S PHARMACEUTICAL SCIENCES (Mack Pub. Co., N.J., current edition).
Фармацевтическая композиция по настоящему изобретению может быть в форме твердого вещества или жидкости. В одном аспекте, носитель(носители) находится в форме частиц, таким образом, композиции имеют форму, например, таблеток или порошка. Носитель(носители) может быть жидким, при этом композиции представляют собой, например, пероральный сироп, жидкость для инъекций или аэрозоль, который является полезным, например, для введения путем ингаляции.
Когда она предназначается для перорального введения, фармацевтическая композиция предпочтительно находится либо в твердой, либо в жидкой форме, при этом полутвердые, полужидкие формы, суспензии и гели включены в формы, рассматриваемые в настоящем изобретении как твердые или жидкие.
В качестве твердой композиции для перорального введения, фармацевтическая композиция может быть сформулирована в виде порошка, гранулы, прессованной таблетки, пилюли, капсулы, жевательной резинки, облатки или подобной формы. Такая твердая композиция типично содержит один или несколько инертных разбавителей или пищевых носителей. Кроме того, может присутствовать одно или несколько из следующих веществ: связующие, такие как карбоксиметилцеллюлоза, этилцеллюлоза, микрокристаллическая целлюлоза, камедь трагаканта или желатин; эксципиенты, такие как крахмал, лактоза или декстрины, разрыхлители, такие как альгиновая кислота, альгинат натрия, Примогель, кукурузный крахмал и подобные; смазывающие вещества, такие как стеарат магния или Sterotex; регуляторы сыпучести, такие как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; отдушка, такая как перечная мята, метилсалицилат или апельсиновая отдушка; и краситель.
Когда фармацевтическая композиция имеет форму капсулы, например, желатиновой капсулы, она может содержать, помимо веществ указанного выше типа, жидкий носитель, такой как полиэтиленгликоль или масло.
Фармацевтическая композиция может быть в форме жидкости, например, эликсира, сиропа, раствора, эмульсии или суспензии. Жидкость может быть предназначена для перорального введения или для доставки путем инъекции, в качестве двух примеров. В случае перорального введения, предпочтительные композиции содержат, помимо (S)-энантиомера по настоящему изобретению, один или несколько веществ, выбранных из подсластителя, консервантов, красителя/красящего вещества и усилителя вкуса. В композицию, предназначенную для введения путем инъекции, могут быть включены одно или несколько веществ, таких как поверхностно-активное вещество, консервант, увлажняющее средство, диспергирующий агент, суспендирующее средство, буфер, стабилизатор и изотонический агент.
Жидкие фармацевтические композиции по настоящему изобретению, находятся ли они в форме растворов, суспензий или другой подобной форме, могут включать один или несколько из следующих адъювантов: стерильные разбавители, такие как вода для инъекций, солевой раствор, предпочтительно физиологический раствор, раствор Рингера, изотонический раствор хлорида натрия, нелетучие масла, такие как синтетические моно- или диглицериды, которые могут служить в качестве растворителя или среды для суспендирования, полиэтиленгликоли, глицерин, пропиленгликоль или другие растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие вещества, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и вещества для регулирования тоничности, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или многодозовые флаконы из стекла или пластика. Физиологический раствор является предпочтительным адъювантом. Фармацевтическая композиция для инъекций предпочтительно является стерильной.
Жидкая фармацевтическая композиция по настоящему изобретению, предназначенная для парентерального или перорального введения, должна содержать такое количество (S)-энантиомера по настоящему изобретению, которое обеспечит получение подходящей дозы. Типично, это количество составляет, по меньшей мере, 0,01% (S)-энантиомера по настоящему изобретению в композиции. Когда композиция предназначается для перорального введения, это количество может варьировать в пределах от 0,1 до около 70% от массы композиции. Предпочтительные пероральные фармацевтические композиции содержат от около 4% до около 50% (S)-энантиомера по настоящему изобретению. Предпочтительные фармацевтические композиции и препараты в соответствии с настоящим изобретением получают таким образом, чтобы парентеральная единица дозирования содержала от 0,01 до 10% масс. (S)-энантиомера по настоящему изобретению до разбавления.
Фармацевтическая композиция по настоящему изобретению может быть предназначена для местного введения, в этом случае носитель может подходящим образом включать раствор, эмульсию, основу для мази или геля. Основа, например, может включать одно или несколько из следующих веществ: вазелин, ланолин, полиэтиленгликоли, пчелиный воск, минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. Загуститель может присутствовать в фармацевтической композиции для местного введения. Если композиция предназначена для чрескожного введения, она может включать чрескожный пластырь или устройство для ионофореза. Композиции для местного введения могут содержать (S)-энантиомер по настоящему изобретению в концентрации от около 0,1 до около 10% масс/об (масса на единицу объема).
Для местного применения, предпочтительно введение эффективного количества фармацевтической композиции в соответствии с изобретением на целевой участок, например, кожные поверхности, слизистые оболочки и т.п., которые находятся в непосредственной близости к периферическим нейронам, подлежащим лечению. Это количество, как правило, находится в пределах от около 0,0001 мг до около 1 г (S)-энантиомера по настоящему изобретению в расчете на применение, в зависимости от участка, подлежащего лечению, независимо от того является ли применение диагностическим, профилактическим или терапевтическим, тяжести симптомов и природы используемого местного носителя. Предпочтительный местный препарат представляет собой мазь, где используют от около 0,001 до около 50 мг активного ингредиента на см3 основы для мази. Фармацевтическая композиция может быть сформулирована в виде чрескожной композиции или устройств для чрескожной доставки ("пластыри"). Такие композиции включают, например, подложку, резервуар с активным соединением, контролирующую мембрану, прокладку и контактный адгезив. Такие чрескожные пластыри можно использовать для обеспечения непрерывной пульсирующей доставки, или доставки по требованию соединений по настоящему изобретению, как это желательно.
Фармацевтическая композиция по настоящему изобретению может быть предназначена для ректального введения, например, в форме суппозитория, который плавится в прямой кишке и высвобождает лекарственное средство. Композиция для ректального введения может содержать масляную основу в качестве подходящего нераздражающего эксципиента. Такие основы включают, без ограничения, ланолин, масло какао и полиэтиленгликоль.
Типичная композиция для внутримышечного или интратекального введения состоит из суспензии или раствора активного вещества в масле или раствора активного ингредиента в масле, например, арахисовом масле или кунжутном масле. Типичная композиция для внутривенного или интратекального введения состоит из стерильного изотонического водного раствора, содержащего, например, активный ингредиент и декстрозу или хлорид натрия, или смесь декстрозы и хлорида натрия.
Композиции по настоящему изобретению могут быть сформулированы таким образом, чтобы обеспечивать быстрое, пролонгированное или замедленное высвобождение активного ингредиента, т.е. (S)-энантиомера по настоящему изобретению, после введения пациенту, с использованием процедур, известных из уровня техники. Системы доставки с контролируемым высвобождением лекарственного средства включают систему осмотического насоса и растворяющиеся системы, содержащие резервуары с полимерным покрытием или композиции лекарственное средство-полимерная матрица. Примеры систем контролируемого высвобождения представлены в Патентах США №№ 3845770 и 4326525, а также в P. J. Kuzma et al., Regional Anesthesia 22 (6): 543-551 (1997), которые все включены в настоящую заявку посредством ссылки.
Композиции по настоящему изобретению также могут доставляться через интраназальные системы доставки лекарственного средства для местного, системного лечения и доставки через нос к мозгу. Метод контролируемой дисперсии частиц (CPD)™, традиционные бутыли для назального спрея, ингаляторы или распылители известны специалистам в данной области как обеспечивающие эффективную местную и системную доставку лекарственных средств путем таргетирования обонятельной области и параназальных синусов.
Изобретение также относится к интравагинальному устройству доставки лекарственного средства в виде оболочки или ядра, подходящему для введения человеку или животному женского пола. Такое устройство может состоять из активного фармацевтического ингредиента в полимерной матрице, окруженного оболочкой, и способно высвобождать (S)-энантиомер по настоящему изобретению, по существу, в режиме нулевого порядка раз в день, подобно устройствам, используемым для нанесения тестотерона, как описано в опубликованной патентной заявке PCT № WO 98/50016.
Существующие способы для глазной доставки включают препараты для местного введения (глазные капли), субконъюнктивальные инъекции, периокулярные инъекции, интравитриальные инъекции, хирургические имплантаты и препараты для ионофореза (использование слабого электрического тока для транспортировки ионизированных лекарственных средств в и через ткани организма). Специалисты в данной области смогут объединить наиболее подходящие эксципиенты с (S)-энантиомером по настоящему изобретению для безопасного и эффективного внутриглазного введения.
Наиболее подходящий путь введения зависит от природы и тяжести состояния, подлежащего лечению. Специалистам в данной области также известно как определить способ введения (например, пероральный, внутривенный, путем ингаляции, подкожный, ректальный и т.п.), лекарственные формы, подходящие фармацевтические эксципиенты и другие вещества, подходящие для доставки (S)-энантиомера по настоящему изобретению субъекту, нуждающемуся в этом.
Фармацевтическая композиция по настоящему изобретению может включать различные вещества, которые модифицируют физическую форму твердой или жидкой единицы дозирования. Например, композиция может включать вещества, которые образуют покрытие или оболочку вокруг активных ингредиентов. Вещества, которые образуют покрытие или оболочку, типично являются инертными и могут быть выбраны из, например, сахара, щеллака и других энтеросолюбильных веществ для покрытия. Альтернативно, активные ингредиенты могут быть заключены в желатиновую капсулу.
Фармацевтическая композиция по настоящему изобретению в твердой или жидкой форме может включать вещество, которое связывается с (S)-энантиомером по настоящему изобретению и, таким образом, способствует доставке соединения. Подходящие вещества, которые могут действовать таким образом, включают моноклональное или поликлональное антитело, белок или липосому.
Фармацевтическая композиция по настоящему изобретению может состоять из единиц дозирования, которые можно вводить в виде аэрозоля. Термин “аэрозоль” используют для обозначения различных систем от тех, которые имеют коллоидную природу, до систем, включающих находящиеся под давлением упаковки. Доставку можно осуществлять при помощи сжиженного или сжатого газа или с использованием подходящей системы насоса, которая распределяет активные ингредиенты. Аэрозоли (S)-энантиомера по настоящему изобретению могут доставляться в однофазных, бифазных или трехфазных системах, предназначенных для доставки активного ингредиента(ингредиентов). Доставка аэрозоля включает необходимый контейнер, активаторы, клапаны, субконтейнеры и т.п., которые вместе могут составлять набор. Специалист в данной области, без излишнего экспериментирования, может определить предпочтительные аэрозоли.
Фармацевтические композиции по настоящему изобретению можно получить способами, хорошо известными в области фармацевтики. Например, фармацевтическую композицию, предназначенную для введения путем инъекции, можно получить путем сочетания (S)-энантиомера по настоящему изобретению со стерильной дистиллированной водой таким образом, чтобы получить раствор. Можно добавить поверхностно-активное вещество для облегчения образования гомогенного раствора или суспензии. Поверхностно-активные вещества представляют собой соединения, которые нековалентно взаимодействуют с (S)-энантиомером по настоящему изобретению таким образом, чтобы способствовать растворению или получению гомогенной суспензии соединения в водной системе доставки.
(S)-энантиомер по настоящему изобретению следует вводить в терапевтически эффективном количестве, которое варьирует в зависимости от различных факторов, включая активность конкретного используемого соединения; метаболическую стабильность и продолжительность действия (S)-энантиомера по настоящему изобретению; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; способ и время введения; скорость выведения из организма; сочетание лекарственных средств; тяжесть конкретного расстройства или состояния; и субъекта, принимающего лечение. Как правило, терапевтически эффективная суточная доза (S)-энантиомера по настоящему изобретению составляет (для млекопитающего с массой тела 70 кг) от около 0,001 мг/кг (то есть 0,07 мг) до около 100 мг/кг (то есть 7,0 г); предпочтительно терапевтически эффективная доза составляет (для млекопитающего с массой тела 70 кг) от около 0,01 мг/кг (то есть 0,70 мг) до около 50 мг/кг (то есть 3,5 г); и более предпочтительно терапевтически эффективная доза составляет (для млекопитающего с массой тела 70 кг) от около 1 мг/кг (то есть 70 мг) до около 25 мг/кг (то есть 1,75 г).
Пределы эффективных доз, указанные в настоящей заявке, не следует рассматривать как ограничивающие, и они представляют предпочтительные диапазоны доз. Однако наиболее предпочтительную дозу можно подобрать для конкретного субъекта, как это должно быть понятно и возможно для специалиста в данной области (см., например, Berkowef al., eds., The Merck Manual, 16th edition, Merck и Co., Rahway, NJ., 1992; Goodmanetna., eds., Goodman and Cilman's The Pharmacological Basis of Therapeutics, 10th edition, Pergamon Press, Inc., Elmsford, N.Y., (2001); Avery's Drug Treatment: Principles and Practice of Clinical Pharmacology and Therapeutics, 3rd edition, ADIS Press, LTD., Williams and Wilkins, Baltimore, MD. (1987), Ebadi, Pharmacology, Little, Brown and Co., Boston, (1985); Osolci al., eds., Remington's Pharmaceutical Sciences, 18th edition, Mack Publishing Co., Easton, PA (1990); Katzung, Basic and Clinical Pharmacology, Appleton and Lange, Norwalk, CT (1992)).
Общую дозу, требуемую для каждого лечения, можно вводить с использованием нескольких дробных доз или в виде разовой дозы в течение суток, как это желательно. Как правило, лечение начинают с более низких доз, которые меньше чем оптимальная доза соединения. Затем дозу увеличивают с малыми приращениями вплоть до достижения оптимального эффекта в данных обстоятельствах. Диагностическое фармацевтическое соединение или композицию можно вводить отдельно или в сочетании с другими диагностическими средствами и/или фармацевтическими веществами, направленными на патологию или направленными на другие симптомы патологии. Эффективные количества (S)-энантиомера по настоящему изобретению или композиции по настоящему изобретению составляют от около 0,1 мкг до около 100 мг/кг массы тела, которые вводят с интервалами 4-72 часов, в течение периода времени от 2 часов до 1 года, и/или с использованием любого диапазона или значения в пределах указанных, например, 0,0001-0,001, 0,001-0,01, 0,01-0,1, 0,1-1,0, 1,0-10, 5-10, 10-20, 20-50 и 50-100 мг/кг, с интервалами 1-4, 4-10, 10-16, 16-24, 24-36, 24-36, 36-48, 48-72 часов, в течение периода времени 1-14, 14-28 или 30-44 дней, или 1-24 недель, или с использованием любого диапазона или значения в пределах указанных.
Реципиенты введения (S)-энантиомера по настоящему изобретению и/или композиций по настоящему изобретению могут представлять собой любое животное, такое как млекопитающие. Из млекопитающих предпочтительными реципиентами являются млекопитающие отряда приматов (включая человека и обезьян), Arteriodactyla (включая лошадей, коз, коров, овец, свиней), грызунов (включая мышей, крыс, кроликов и хомяков) и хищников (включая кошек и собак). Из птиц предпочтительными реципиентами являются индюки, куры и другие члены этого отряда. Наиболее предпочтительными реципиентами являются люди.
КОМБИНИРОВАННАЯ ТЕРАПИЯ
(S)-энантиомер по настоящему изобретению полезно использовать вместе с одним или несколькими другими терапевтическими средствами, или в виде любого их сочетания, для лечения заболеваний и состояний у млекопитающих, предпочтительно у человека, улучшение или облегчение которых достигается посредством модуляции, предпочтительно ингибирования, потенциал-зависимых воротных натриевых каналов. Например, (S)-энантиомер по настоящему изобретению можно вводить одновременно, последовательно или отдельно в сочетании с другими терапевтическими средствами, включающими, но не ограничивающимися этим:
• опиатные анальгетики, например, морфин, героин, кокаин, оксиморфин, леворфанол, леваллорфан, оксикодон, кодеин, дигидрокодеин, пропоксифен, налмефен, фентанил, гидрокодон, гидроморфон, мерипидин, метадон, налорфин, налоксон, налтрексон, бупренорфин, буторфанол, налбуфин и пентазоцин;
• не-опиатные анальгетики, например, ацетоменифен, салицилаты (например, аспирин);
• нестероидные противовоспалительные лекарственные средства (НСПВЛС), например, ибупрофен, напроксен, фенопрофен, кетопрофен, целекоксиб, диклофенак, дифлусинал, этодолак, фенбуфен, фенопрофен, флуфенисал, флурбипрофен, ибупрофен, индометацин, кетопрофен, кеторолак, меклофенамовая кислота, мефенамовая кислота, мелоксикам, набуметон, напроксен, нимесулид, нитрофлурбипрофен, олсалазин, оксапрозин, фенилбутазон, пироксикам, сульфасалазин, сулиндак, толметин и зомепирак;
• противосудорожные средства, например, карбамазепин, окскарбазепин, ламотригин, валпроат, топирамат, габапентин и прегабалин;
• антидепрессанты, такие как трициклические антидепрессанты, например, амитриптилин, кломипрамин, деспрамин, имипрамин и нортриптилин;,
• селективные ингибиторы COX-2, например, целекоксиб, рофекоксиб, парекоксиб, валдекоксиб, деракоксиб, эторикоксиб и лумиракоксиб;
• альфа-адренергетики, например, доксазоцин, тамсулозин, клонидин, гуанфацин, дексметатомидин, модафинил и 4-амино-6,7-диметокси-2-(5-метансульфонамидо-1,2,3,4-тетрагидроизохинол-2-ил)-5-(2-пиридил)хиназолин;
• седативные средства на основе барбитуратов, например, амобарбитал, апробарбитал, бутабарбитал, бутабитал, мефобарбитал, метарбитал, метогекситал, пентобарбитал, фенобартитал, секобарбитал, талбутал, теамилал и тиопентал;
• антагонист тахикинина (NK), в частности, антагонист NK-3, NK-2 или NK-1, например, (αR,9R)-7-[3,5-бис(трифторметил)бензил)]-8,9,10,11-тетрагидро-9-метил-5-(4- метилфенил)-7H-[1,4]диазоцино[2,1-g][1,7]-нафтиридин-6-13-дион (TAK-637), 5-[[2R3S)-2-[(1R)-1-[3,5-бис(трифторметилфенил]этокси-3-(4-фторфенил)-4-морфолинил]-метил]-1,2-дигидро-3Н-1,2,4-триазол-3-он (MK-869), апрепитант, ланепитант, дапитант или 3-[[2-метокси-5-(трифторметокси)фенил]-метиламино]-2-фенилпиперидин (2S,3S);
• каменноугольные анальгетики, в частности, парацетамол;
• ингибиторы повторного поглощения серотонина, например, пароксетин, сертралин, норфлуоксетин (метаболит флуоксетин дезметила), метаболит деметилсертралина, '3 флувоксамин, пароксетин, циталопрам, циталопрамовый метаболит дезметилциталопрам, эсциталопрам, d,l-фенфлурамин, фемоксетин, ифоксетин, цианодотиепин, литоксетин, дапоксетин, нефазодон, церикламин, тразодон и флуоксетин;
• ингибиторы повторного поглощения норадреналина (норэпинефрина), например, мапротилин, лофепрамин, митразепин, оксапротилин, фезоламин, томоксетин, миансерин, бупроприон, бупроприоновый метаболит гидроксибупроприон, номифенсин и вилоксазин (Vivalan®)), особенно селективный ингибитор повторного поглощения норадреналина, такой как ребоксетин, в частности, (S,S)-ребоксетин, и нейролептические седативные/анксиолитические средства венлафаксин дулоксетин;
• обладающие двойным действием ингибиторы повторного поглощения серотонина-норадреналина, такие как венлафаксин, венлафаксиновый метаболит O-десметилвенлафаксин, кломипрамин, кломипраминовый метаболит десметилкломипрамин, дулоксетин, милнаципран и имипрамин;
• ингибиторы ацетилхолинэстеразы, такие как донепезил;
• антагонисты 5-HT3, такие как ондансетрон;
• антагонисты метаботропного глутаматного рецептора (mGluR) или агонисты или аллостерические активаторы глутамата на mGluR рецепторах;
• местный анестетик, такой как мексилетин и лидокаин;
• кортикостероид, такой как дексаметазон;
• средства против аритмии, например, мексилетин и фенитоин;
• мускариновые антагонисты, например, толтеродин, пропиверин, тропсиум t хлорид, дарифенацин, солифенацин, темиверин и ипратропиум;
• мускариновые агонисты или аллостерические активаторы ацетилхолина на мускариновых рецепторах;
• каннабиноиды или аллостерические активаторы эндорфинов на каннабиноидных рецепторах;
• агонисты валлилоидного рецептора (например, резинфератоксин) или антагонисты (например, капсазепин);
• седативные средства, например, глутетимид, мепробамат, метаквалон и дихлоралфеназон;
• анксиолитические средства, такие как бензодиазепины,
• антидепрессанты, такие как миртазепин,
• местные средства (например, лидокаин, капсацин и резиниферотоксин);
• мышечные релаксанты, такие как бензодиазепины, баклофен, карисопродол, хлорзоксазон, циклобензаприн, метокарбамол и орфенадин;
• антигистаминные средства или антагонисты H1;
• антагонисты NМDA рецептора;
• агонисты/антагонисты 5-HT рецептора;
• ингибиторы PDEV;
• Трамадол®;
• холинергические (никотиновые) анальгетики;
• альфа-2-дельта лиганды;
• антагонисты простагландина E2 подтипа;
• антагонисты лейкотриена B4;
• ингибиторы 5-липоксигеназы; и
• антагонисты 5-HT3.
Заболевания и состояния, которые можно лечить и/или предотвратить с использованием таких сочетаний, включают, но не ограничиваются этим, боль, центрально и периферически опосредованную, острую, хроническую, невропатические заболевания, а также другие заболевания с сопровождающей их болью и другими расстройствами центральной нервной системы, такими как эпилепсия, тревога, депрессия и биполярное заболевание; или сердечно-сосудистые расстройства, такие как аритмия, мерцательная аритмия и фибрилляция желудочков; нервно-мышечные расстройства, такие как синдром беспокойных ног и паралич мышц или столбняк (Hamann M, Meisler MH, Richter, Exp. Neurol. 184(2):830-838 (2003)); нейропротекцию против инсульта, неврологической травмы и рассеянного склероза; и каналопатии, такие как эритромелалгия и синдром наследственной ректальной боли.
Термин "сочетание", как он используется в настоящей заявке, относится к любой смеси или перетановке (S)-энантиомера по настоящему изобретению с одним или несколькими дополнительными терапевтическими средствами. Если из контекста явно не следует иное, "сочетание" может включать одновременную или последовательную доставку (S)-энантиомера по настоящему изобретению с одним или несколькими терапевтическими средствами. Если из контекста явно не следует иное, "сочетание" может включать лекарственные формы (S)-энантиомера по настоящему изобретению с другим терапевтическим средством. Если из контекста явно не следует иное, "сочетание" может включать пути введения (S)-энантиомера по настоящему изобретению с другим терапевтическим средством. Если из контекста явно не следует иное, "сочетание" может включать композиции (S)-энантиомера по настоящему изобретению с другим терапевтическим средством. Лекарственные формы, пути введения и фармацевтические композиции включают, но не ограничиваются этим, те, которые описаны в настоящей заявке.
Одна комбинированная терапия по настоящему изобретению включает местное применение (S)-энантиомера по настоящему изобретению с пероральным средством. Местное применение (S)-энантиомера по настоящему изобретению имеет очень низкое системное воздействие и обладает активностью, которая является аддитивной с рядом пероральных анальгетических средств. Другая возможная комбинированная терапия включает пероральную дозу (S)-энантиомера по настоящему изобретению с пероральным средством. Еще одна комбинированная терапия по настоящему изобретению включает местное применение (S)-энантиомера по настоящему изобретению со средством для местного применения.
(S)-энантиомер по настоящему изобретению может быть включен в композиции для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны, сосудистые имплантаты, стенты и катетеры. Таким образом, настоящее изобретение, еще в одном аспекте, включает композицию для покрытия имплантируемого устройства, включающую соединение по настоящему изобретению, описанное выше, и носитель, подходящие для покрытия имплантируемого устройства. В следующем аспекте, настоящее изобретение включает имплантируемое устройство, покрытое композицией, включающей (S)-энантиомер по настоящему изобретению и носитель, подходящий для покрытия имплантируемого устройства. Подходящие покрытия и общие способы получения имплантируемых устройств с покрытиями описаны в Патентах США №№ 6099562; 5886026; и 5304121.
НАБОРЫ
Настоящее изобретение также обеспечивает наборы, которые содержат фармацевтическую композицию по настоящему изобретению. Набор также включает инструкции по применению фармацевтической композиции для модуляции активности ионных каналов, для лечения боли, в также других применений, раскрытых в настоящей заявке. Предпочтительно, коммерческая упаковка содержит одну или несколько стандартных доз фармацевтической композиции. Например, такая стандартная доза может представлять собой количество, достаточное для приготовления внутривенной инъекции. Специалистам должно быть очевидно, что такие композиции, которые чувствительны к воздействию света и/или воздуха, требуют специальной упаковки и/или формулирования. Например, можно использовать упаковку, которая не пропускает свет и/или герметично защищена от контакта с окружающей атмосферой, и/или препарат, сформулированный с подходящими покрытиями или эксципиентами.
ПОЛУЧЕНИЕ (S)-ЭНАНТИОМЕРА ПО НАСТОЯЩЕМУ ИЗОБРЕТЕНИЮ
(S)-энантиомер по настоящему изобретению и соответствующие (R)-энантиомер получают путем выделения соединения формулы (I), как указано выше в разделе “Краткое описание изобретения”, с использованием либо способов хиральной высокоэффективной жидкостной хроматографии, либо способов хроматографии с псевдодвижущимся слоем, как описано ниже в следующей схеме реакций, где "хиральная ВЭЖХ" относится к хиральной высокоэффективной жидкостной хроматографии, и "SMB" относится к хроматографии с псевдодвижущимся слоем:
СХЕМА РЕАКЦИЙ
Соединение формулы (I) можно получить способами, раскрытыми в опубликованной патентной заявке PCT № WO 2006/110917, способами, раскрытыми в настоящей заявке, или способами, известными специалистам в данной области.
Специалистам в данной области должны быть понятны изменения в представленной выше Схеме реакций, которые являются подходящими для выделения индивидуальных энантиомеров.
Альтернативно, (S)-энантиомер формулы (I-S) и (R)-энантиомер формулы (I-R) можно синтезировать из исходных веществ, которые известны или могут быть легко получены с использованием способов, аналогичных тем, которые известны.
Предпочтительно, (S)-энантиомер по настоящему изобретению, полученный с использованием способов выделения, раскрытых в настоящей заявке, практически не содержит (R)-энантиомер или содержит только следовые количества (R)-энантиомера.
Следующие Примеры синтеза служат для иллюстрации способов выделения, раскрытых выше в Схеме реакций, и не предназначены для ограничения объема настоящего изобретения.
ПРИМЕР СИНТЕЗА 1
Синтез 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она (Соединение формулы (I))
К суспензии спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она (1,0 г, 3,6 ммоль), который можно получить в соответствии со способами, раскрытыми в опубликованной патентной заявке PCT № WO 2006/110917, и карбоната цезия (3,52 г, 11 ммоль) в ацетоне (50 мл) добавляли 2-бромметил-5-трифторметилфуран (1,13 г, 3,9 ммоль) одной порцией и реакционную смесь перемешивали при 55-60°C в течение 16 часов. После охлаждения до температуры окружающей среды реакционную смесь фильтровали и фильтрат упаривали при пониженном давлении. Остаток подвергали колоночной хроматографии, элюируя смесью этилацетат/гексан (1/9-1/1), с получением 1'-{[5- (трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-она, то есть соединения формулы (I), (1,17 г, 76%) в виде белого твердого вещества: т.пл. 139-141°C;
1Н ЯМР (300 МГц,CDCl3) δ 7,32-6,97 (м, 5Н), 6,72 (д, J=3,3 Гц, 1Н) 6,66 (с, 1Н),6,07 (с 1Н), 5,90-5,88 (м, 2Н), 5,05, 4,86 (ABq, JАВ=16,1 Гц, 2Н), 4,91 (д, J=9,0 Гц; 1Н), 4,66 (д, J=9,0 Гц, 1Н); 13С ЯМР (75 MГц, CDCl3) δ 176,9, 153,5 148,8, 142,2, 141,9, 140,8, 140,2, 139,7, 139,1, 132,1, 129,2, 124,7, 124,1, 123,7, 121,1, 120,1, 117,6, 114,5, 114,4, 110,3, 109,7, 103,0, 101,9, 93,8, 80,0, 57,8, 36,9.
MS(ES+) m/z 430,2 (М+1), 452,2, (М+23);
Рассчитано для C22H14F3NO5: C, 61,54%; H, 3,29%; N, 3,26%; Найдено: C, 61,51%; H, 3,29%; N, 3,26%.
ПРИМЕР СИНТЕЗА 2
Выделение соединения формулы (I) методом хиральной ВЭЖХ
Соединение формулы (I) разделяли на (S)-энантиомер по настоящему изобретению и соответствующий (R)-энантиомер методом хиральной ВЭЖХ с использованием следующих условий:
Колонка: Chiralcel ® OJ-RH; 20 мм в.д. ×250 мм, 5 мкм; Lot: OJRH CJ-EH001 (Daicel Chemical Industries, Ltd)
Элюент: Ацетонитрил/Вода (60/40, об/об, изократн.)
Скорость потока: 10 мл/мин
Время эксперимента: 60 мин
Загрузка: 100 мг соединения формулы (I) в 1 мл ацетонитрила
Температура: температура окружающей среды
В указанных выше условиях хиральной ВЭЖХ, (R)-энантиомер соединения формулы (I), то есть (R)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]-бензодиоксол-7,3'-индол]-2'(1'Н)-он, выделяли в качестве первой фракции в виде белого твердого вещества; эи (энантиомерный избыток) >99% (аналитическая OJ-RH, 55% ацетонитрила в воде); т.пл. 103-105°C;
1Н ЯМР (300 МГц, DMSO-d6) δ 7,32-6,99 (м, 5Н), 6,71 (д, J=3,4 Гц, 1Н), 6,67 (с, 1Н), 6,05 (с, 1Н), 5,98 (д, J=6,2 Гц, 2Н), 5,13, 5,02 (AB кв, JАВ=16,4 Гц, 2Н), 4,82 4,72 (AB кв, JАВ=9,4 Гц; 2Н), 13С ЯМР (75 МГц, CDCl3) δ 177,2, 155,9, 152,0, 149,0, 142,4, 142,0, 141,3 132,0 129,1 123,9 120,6 119,2, 117,0, 112,6, 109,3, 108,9, 103,0, 101,6, 93,5, 80,3, 58,2, 36,9.
MS (ES+) m/z 430,2 (М+1), [α]D-17,46° (с 0,99, DMSO).
(S)-энантиомер соединения формулы (I), то есть (S)- 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]-бензодиоксол-7,3'-индол]-2'(1'Н)-он выделяли в качестве второй фракции в виде белого твердого вещества; эи >99% (аналитическая OJ-RH, 55% ацетонитрила в воде); т.пл. 100-102°C; MS (ES+)
1Н ЯМР (300 МГц, DMSO-d6) δ 7,32-6,99 (м, 5Н), 6,71 (д, J=3,4 Гц, 1Н), 6,67 (с, 1Н), 6,05 (с, 1Н), 5,89 (д, J=6,3 Гц, 2Н), 5,12, 5,02 (AB кв, JАВ=16,4 Гц, 2Н), 4,82, 4,72 (AB кв, JАВ=9,4 Гц, 2Н); 13С ЯМР (75 МГц, CDCl3) δ 177,2, 155,9, 149,0, 142,4, 142,0, 141,3, 132,0, 129,1, 123,9, 120,6, 119,2, 117,0, 112,6, 109,3, 108,9, 103,0, 101,6, 93,5, 80,3 58,2, 36,9.
MS (ES+) m/z 430,2 (М+1), [α]D+14,04° (с 0,99, DMSO).
ПРИМЕР СИНТЕЗА 3
Выделение соединения формулы (I) методом SMB хроматографии
Соединение формулы (I) разделяли на (S)-энантиомер по настоящему изобретению и соответствующий (R)-энантиомер методом SMB хроматографии с использованием следующих условий:
Экстракт: 147,05 мл/мин
Рафинат: 76,13 мл/мин
Элюент: 183,18 мл/мин
Подача: 40 мл/мин
Рециклинг: 407,88 мл/мин
Время эксперимента: 0,57 мин
Температура: 25°C
Давление: 46 бар
Подаваемый раствор (25 г соединения формулы (I) в 1,0 л подвижной фазы (25:75:0,1 (об:об:об) смесь ацетонитрил/метанол/трифторуксусная кислота)) инжектировали непрерывно в SMB систему (Novasep Licosep Lab Unit), которая была снабжена восемью идентичными колонками в 2-2-2-2 конфигурации, содержащими 110 г (в расчете на колонку, 9,6 см, 4,8 см в.д.) ChiralPAK-AD в качестве неподвижной фазы. Первый элюирующий энантиомер ((R)-энантиомер соединения формулы (I)) содержался в потоке рафината, а второй элюирующий энантиомер ((S)-энантиомер соединения формулы (I)) содержался в потоке экстракта. Характеристики (S)-энантиомера и (R)-энантиомера, полученных методом SMB разделения, были идентичны тем, которые были получены выше с использованием хиральной ВЭЖХ.
Соединение формулы (I) разделяли на составляющие его энантиомеры на автоматической системе очистки Waters preparative LCMS. Первый элюирующий энантиомер из хиральной колонки был бромирован (на участке, легко удаляемом из стереогенного центра) с получением соответствующего 5'-бром производного, которое затем кристаллизовали с получением монокристалла, подходящего для рентгеновской кристаллографии. Определяли структуру кристалла этого бромированного производного первого элюирующего энантиомера, и было обнаружено, что его абсолютная конфигурация была такой же, как у (R)-энантиомера по настоящему изобретению. Следовательно, второй элюирующий энантиомер из хиральной колонки представлял собой (S)-энантиомер по настоящему изобретению. Кроме того, вещество, полученное из потока экстракта при SMB разделении, имело удельное оптическое вращение того же знака (положительное, т.е. правовращающий), как у вещества, полученного при описанном выше LC разделении.
БИОЛОГИЧЕСКИЕ АНАЛИЗЫ
Различные методы известны в данной области техники для испытания активности соединений по настоящему изобретению или определения их растворимости в известных фармацевтически приемлемых эксципиентах. Для того чтобы изобретение, описанное в настоящей заявке, было более понятно, далее описаны следующие биологические анализы. Должно быть понятно, что эти примеры предназначены только для иллюстративных целей, и их не следует рассматривать как ограничивающие каким-либо образом настоящее изобретение.
БИОЛОГИЧЕСКИЙ ПРИМЕР 1
Анализ притока гуанидина (in vitro анализ)
Этот пример описывает in vitro анализ для испытания и профилирования испытываемых веществ против потенциал-зависимых воротных натриевых каналов человека или крысы, стабильно экспрессируемых в клетках либо эндогенного или гетерологичного происхождения. Анализ также является полезным для определения значения ИК50 для соединения, модулирующего (предпочтительно блокирующего) потенциал-зависимый воротный натриевый канал. Анализ основан на анализе притока гуанидина, который описан Reddy, N.L., et al., J. Med. Chem. (1998), 41(17):3298-302.
Анализ притока гуанидина представляет собой анализ притока радиоактивного индикатора, используемого для определения активности ионного потока потенциал-зависимых воротных натриевых каналов в высокопроизводительном формате с использованием микропланшета. В анализе используют 14C-гуанидин гидрохлорид в сочетании с различными известными модуляторами потенциал-зависимых воротных натриевых каналов, которые обеспечивают поддерживаемый приток, для анализа активности испытываемого вещества. Активность определяли путем расчета значения ИК50. Селективность определяли путем сравнения активности соединения в отношении представляющего интерес потенциал-зависимого воротного натриевого канала с его активностью против других потенциал-зависимых воротных натриевых каналов (также называют 'определением профиля селективности').
Каждое из испытываемых веществ анализировали против клеток, которые экспрессируют представляющие интерес потенциал-зависимые воротные натриевые каналы. Потенциал-зависимые воротные натриевые каналы характеризуются как TTX чувствительные или нечувствительные. Это свойство является полезным при определении активности представляющего интерес потенциал-зависимого воротного натриевого канала, когда он присутствует в смешанной популяции с другими потенциал-зависимыми воротными натриевыми каналами. Ниже в Таблице 1 представлены клеточные линии, полезные для тестирования некоторой активности потенциал-зависимых воротных натриевых каналов в присутствии или в отсутствие TTX.
| ТАБЛИЦА 1 | ||
| Клеточная линия | Экспрессия мРНК | Функциональные характеристики |
| CHO-K1(клетки яичников китайского хомячка; рекомендованная клеточная линия-хозяин) АТТС номер доступа CCL-61 |
•экспрессия Nav1.4 была показана при помощи RT-PCR •не было обнаружено никакой экспрессии других Nav |
•18-20-кратное увеличение притока [14C]гуанидина было полностью блокировано с использованием ТТХ. (Nav1.4 является ТТХ-чувствительным каналом) |
| L6 (миобласты крысы) АТТС номер CRL-1458 | • экспрессия Nav1.4 и 1.5 | •10-15-кратное увеличение притока [14C]гуанидина было лишь частично блокировано с использованием ТТХ при концентрации 100 нМ (Nav1.5 является ТТХ-резистентным) |
| SH-SY5Y (нейробластома человека) АТТС номер CRL-2266 | • экспрессия Nav1.9 и Nav1.7 описана в опубликованном документе (Blum et al.) | •10-16-кратное увеличение притока [14C]гуанидина выше фонового значения было частично блокировано с использованием ТТХ (Nav1.9 является ТТХ-резистентным) |
| SK-N-BE2C (клеточная линия нейробластомы человека АТТС номер CRL-2268) | • экспрессия Nav1.8 | •стимуляция ВЕ2С клеток пиретроидами приводит к 6-кратному увеличению притока [14C]гуанидина выше фонового значения •ТТХ частично блокирует приток (Nav1.8 является ТТХ-резистентным) |
| РС12 (феохромоцитома крысы) АТТС номер CRL-1721 | • экспрессия Nav1.2 и Nav1.7 | •8-12-кратное увеличение притока [14C]гуанидина было полностью блокировано с использованием ТТХ. (Nav1.2 и Nav1.7 являются ТТХ-чувствительными каналами) |
| НЕК293 (почка человеческого эмбриона) АТТС номер CRL-1573 | • экспрессия Nav1.7 | Nav1.7 является ТТХ-чувствительным каналом. ТТХ ИК50 в функциональном анализе с использованием гуанидиния составляет 8 нМ. |
Также можно использовать иммортализованные клеточные линии, которые гетерологичным образом экспрессируют потенциал-зависимые воротные натриевые каналы. Клонирование, стабильная трансфекция и размножение таких клеточных линий известны специалистам в данной области (см., например, Klugbauer, N, et al., EMBO J. (1995), 14(6): 1084-90; и Lossin, C1 et al., Neuron (2002), 34, pp. 877- 884).
Клетки, экспрессирующие представляющий интерес потенциал-зависимый воротный натриевый канал, выращивали в соответствии с указаниями поставщика или, в случае рекомбинантных клеток, в присутствии селективной питательной среды, такой как G418 (Gibco/Invitrogen). Клетки отделяли от чашек для культивирования с использованием ферментного раствора (1X) Трипсин/EDTA (Gibco/Invitrogen) и анализировали для определения плотности и жизнеспособности с использованием гемоцитометра (Neubauer). Отделенные клетки промывали и ресуспендировали в их питательной среде затем высевали в покрытые Поли-D-Лизином планшеты Scintiplates (Perkin Elmer) (приблизительно 100000 клеток/лунка) и инкубировали при 37°C/5% CO2 в течение 20-24 часов. После тщательной промывки HEPES-забуференным солевым раствором с низким содержанием натрия (LNHBSS) (150 мМ Холин Хлорида, 20 нМ HEPES (Sigma), 1 мМ Хлорида Кальция, 5 мМ Хлорида Калия, 1 мМ Хлорида Магния, 10 мМ Глюкозы) испытываемое вещество разбавляли при помощи LNHBSS и затем добавляли в каждую лунку при желаемой концентрации. (Можно использовать меняющиеся концентрации испытываемого вещества). Активирующая/содержащая радиоактивную метку смесь содержала алкалоид, такой как вератридин или Аконитин (Sigma), или пиретроид, такой как дельтаметрин, яд скорпиона Leiurus quinquestriatus hebraeus (Sigma) и 14C-гуанидин гидрохлорид (ARC) для измерения потока через потенциал-зависимые воротные натриевые каналы.
После нагрузки клеток испытываемым веществом и активирующей/содержащей радиоактивную метку смесью, покрытые Поли-D-Лизином планшеты Scintiplates инкубировали при температуре окружающей среды. После инкубации покрытые Поли-D-Лизином планшеты Scintplates тщательно промывали при помощи LNHBSS, дополненного Гуанидином (Sigma). Покрытые Поли-D-Лизином планшеты Scintiplates сушили и затем считывали с использованием Wallac MicroBeta TriLux (Perkin-Elmer Life Sciences). Способность испытываемого вещества блокировать активность потенциал-зависимых воротных натриевых каналов определяли путем сравнения количества 14C-гуанидина, присутствующего внутри клетки, экспрессирующей разные потенциал-зависимые воротные натриевые каналы. На основании этих данных, различные подсчеты, указанные в настоящем описании, можно использовать для определения является или нет испытываемое вещество селективным в отношении конкретного потенциал-зависимого воротного натриевого канала.
Значение ИК50 для испытываемого вещества в отношении конкретного потенциал-зависимого воротного натриевого канала можно определить с использованием описанного выше общего способа. Значение ИК50 можно определить с использованием 3, 8, 10, 12 или 16-точечной кривой в двух или трех повторах с использованием исходной концентрации 1, 5 или 10 мкМ для серийного разведения с получением конечной концентрации, достигающей суб-наномолярных, наномолярных и низких микромолярных пределов. Типично среднеточечная концентрация испытываемого вещества устанавливается при 1 мкМ, и используют последовательно полученные бóльшие или меньшие концентрации Ѕ разбавлений (например, 0,5 мкМ; 5 мкМ и 0,25 мкМ; 10 мкМ и 0,125 мкМ; 20 мкМ и т.п.). ИК50 кривую рассчитывали с использованием логистической модели с 4 параметрами или формулу сигмоидальной модели доза-ответ (подгонка=(A+((B-A)/(1+((C/x)ΛD)))).
Кратную селективность, фактор селективности или кратное селективности рассчитывали путем деления значения ИК50 для испытываемого потенциал-зависимого воротного натриевого канала на стандартный(ссылочный) потенциал-зависимый воротный натриевый канал, например, Nav1.5.
Таким образом, соединение формулы (I), (S)-энантиомер соединения формулы (I), то есть (S)-энантиомер по настоящему изобретению, и (R)-энантиомер соединения формулы (I) при испытании в этом анализе продемонстрировали активность блокирования потенциал-зависимого воротного натриевого канала против hNav1.7, как указано ниже в Таблице 2:
| ТАБЛИЦА 2 | ||
| Соединение | Химическое название | ИК50 (мкМ) |
| (I) | 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 0,007 |
| (I-R) | (R)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 4,200 |
| (I-S) | (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 0,003 |
Взаимосвязь концентрация-ответ для (S)-энантиомера по настоящему изобретению и (R)-энантиомера показана на Фиг. 1. Сплошные кривые указывают наилучший подбор методом наименьших квадратов к 1:1 изотерме связывания; значения ИК50, которые описывают эти кривые, представлены в Таблице 2. (S)-энантиомер по настоящему изобретению продемонстрировал значительно более высокую (т.е. >1000-кратно) активность ингибирования против Nav1.7 в этой модели по сравнению с активностью ингибирования соответствующего (R)-энантиомера.
Эти результаты говорят в пользу использования (S)-энантиомера по настоящему изобретению в отличие от (R)-энантиомера или соединения формулы (I) (рацемат) для целей, описанных в настоящей заявке, т.к. более высокая фармакологическая активность достигается при более низких уровнях доз с возможностью меньших побочных эффектов. Кроме того, (R)-энантиомер представляет собой очень важный инструмент для исследований безопасности, поскольку он позволяет разграничивать основанные на механизме эффекты (те, которые опосредованы блокированием натриевых каналов) и активности вне мишени, которые могут быть устранены в аналогах, не снижая при этом эффективность. Если неблагоприятный эффект основан на механизме действия, тогда (S)-энантиомер будет намного более активным, чем (R)-энантиомер, поскольку второстепенные участки действия вряд ли будут иметь идентичную стереоселективность, и эти два энантиомера вряд ли будут иметь одинаковые эффекты, включая активность, на второстепенных участках действия.
БИОЛОГИЧЕСКИЙ ПРИМЕР 2
Электрофизиологический анализ (In vitro анализ)
HEK293 клетки, экспрессирующие hNav1.7, культивировали в питательной среде DMEM (Gibco) с 0,5 мг/мл G418, +/-1% PSG и 10% термоинактивированной фетальной бычьей сывороткой при 37°C и 5% CO2. Для электрофизиологических регистраций клетки высевали на 10 мм чашки.
Регистрации в конфигурации «целая клетка» исследовали общепринятым методом фиксации потенциала в конфигурации «целая клетка» (Bean et al., op. cit.) с использованием Axopatch 200B усилителя и программы Clampex (Axon Instruments, Union City, CA). Все эксперименты осуществляли при температуре окружающей среды. Электроды полировали пламенем до сопротивлений 2-4 MОм. Ошибки напряжения и электрической емкости минимизировали путем серии компенсаций сопротивления и компенсации электрической емкости, соответственно. Данные получали при 40 кГц и фильтровали при 5 кГц. Внешний раствор (в ванночке) состоял из: NaCl (140 мМ), KCl (5 мМ), CaCl2 (2 мМ), MgCl2 (1 мМ), HEPES (10 мМ) при pH 7,4. Внутренний раствор (в пипетке) состоял из (в мМ): NaCl (5), CaCl2 (0,1), MgCl2 (2), CsCl (10), CsF (120), HEPES (10), EGTA (10), при pH 7,2.
Для оценки установившегося сродства соединений в отношении состояния покоя и инактивированного состояния канала (Kr и Ki, соответственно), 12,5 мсек испытываемые импульсы для деполяризации напряжений от -60 до +90 мВ от исходного потенциала -120 мВ использовали для построения взаимозависимостей ток-напряжение (I-V кривые). Напряжение около пика I-V-кривой (-30 до 0 мВ) использовали в качестве испытываемого импульса в остальной части эксперимента. Кривые инактивации в стабильном состоянии (доступности) затем строили путем измерения тока, активируемого в течение 8,75-мсек испытываемого импульса после 1-сек преобразующих импульсов до напряжений от -120 до -10 мВ.
Стационарную потенциал-зависимость связывания соединения с потенциал-зависимым воротным натриевым каналом определяли путем измерения блокады ионного тока при двух исходных потенциалах. Связывание с находящимися в состоянии покоя каналами определяли с использованием исходного потенциала -120 мВ, таким образом, обеспечивали максимальную доступность. Связывание с находящимися в инактивированном состоянии каналами оценивали при исходном потенциале, таким образом, около 10% каналов были доступны для открытия. Мембранный потенциал поддерживали при этом напряжении, по меньшей мере, в течение 10 секунд для уравновешивания связывания с лекарственным средством.
Кажущуюся константу диссоциации при каждом напряжении расcчитывали с использованием уравнения:
% ингибирования=[Лекарственное средство]×100
([Лекарственное средство]+Kd)
где Kd представляет собой константу диссоциации (либо Kr либо Ki) и [Лекарственное средство] представляет собой концентрацию испытываемого соединения.
Таким образом, соединение формулы (I), (S)-энантиомер соединения формулы (I), то есть (S)-энантиомер по настоящему изобретению, и (R)-энантиомер соединения формулы (I) при испытании в этой модели продемонстрировали сродство в отношении состояния покоя/закрытого состояния и инактивированного состояния hNav1.7, как указано ниже в Таблице 3:
| ТАБЛИЦА 3 | |||
| Соединение | Химическое название | Ki(мкМ) | Kr(мкМ) |
| (I) | 1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 0,142 | >10 мкМ |
| (I-R) | (R)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 0,869 | >10 мкМ |
| (I-S) | (S)-1'-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3'-индол]-2'(1'H)-он | 0,161 | >10 мкМ |
Как показали эти результаты, (S)-энантиомер по настоящему изобретению представляет собой зависимый от состояния или напряжения модификатор hNav1.7, обладающий низким сродством в отношении состояния покоя/закрытого состояния и высоким сродством в отношении инактивированного состояния. Результаты показали, что (S)-энантиомер был примерно в 5 раз более активным в связывании с находящимся в инактивированном состоянии hNav1.7 по сравнению с (R)-энантиомером. Кроме того, результаты показали, что (S)-энантиомер преимущественно отвечает за активность рацемата, то есть соединения формулы (I).
БИОЛОГИЧЕСКИЙ ПРИМЕР 3
In vivo Анализы
Острая боль (формалиновое испытание)
Формалиновое испытание используют в качестве животной модели острой боли. В формалиновом испытании животных быстро приучали к камере для испытаний из прексигласа в день, предшествующий эксперименту, в течение 20 минут. В день испытания животным рандомизированно вводили испытываемые вещества путем инъекции. Через 30 минут после введения лекарственного средства вводили 50 мкл 10% раствора формалина путем подкожной инъекции в подошвенную поверхность левой задней лапы крысы. Сбор видео данных начинали сразу после введения формалина и осуществляли в течение 90 минут.
Изображения получали с использованием программы Actimetrix Limelight, которая сохраняет файлы при *IIii расширении и затем преобразует путем MPEG-4 кодирования. Видео данные затем анализировали с использованием программы анализа поведения "The Observer 5,1", (Version 5.0, Notdus Information Technology, Wageningen, The Netherlands). Видео анализ осуществляли путем наблюдения за поведением животных и оценки каждого в соответствии с его типом, с определением продолжительности этого поведения (Dubuisson and Dennis, 1977). Оценки поведения включают: (1) нормальное поведение, (2) не опирается на лапу, (3) поднятие лапы, (4) облизывание/покусывание или почесывание лапы. Усиление, расположенность к этому или чрезмерное облизывание, покусывание и почесывание лапы, в которую вводили инъекцию, указывают на болевой ответ. На анальгетический ответ или защиту при помощи соединений указывало такое поведение, когда обе лапы спокойно касались пола при отсутствии явного поведения чрезмерного облизывания, покусывания или почесывания лапы, в которую вводили инъекцию.
Анализ данных формалинового испытания осуществляли в соответствии с двумя факторами: (1) Процент Максимального Потенциал-Ингибирующего Эффекта (%MPIE) и (2) оценка боли. %MPIE рассчитывали постадийно, где первым шагом было суммирование продолжительности не-нормальных поведений (поведения 1,2,3) каждого животного. Единственное значение для группы введения носителя получали путем усреднения всех оценок в группе обработки носителем. Следующий расчет дает значение MPIE для каждого животного:
MPIE (%)=100-[(сумма обработки/среднее значение для обработки носителем)×100%]
Оценку боли рассчитывали по шкале веса, как описано выше. Длительность поведения умножали на массу (оценка тяжести ответа) и делили на общую продолжительность наблюдения для определения оценки боли для каждого животного. Расчет представлен следующей формулой:
Оценка боли=[0(To)+1(T1)+2(T2)+3(T3)]/(To+T1+T2+T3)
CFA-индуцированная хроническая воспалительная боль
В этом испытании тактильную аллодинию оценивали при помощи калиброванных волокон фон Фрея. После акклиматизации в течение недели в виварии, 150 мкл "Полного Адъюванта Фрейнда" (CFA) в виде эмульсии (эмульсия CFA, суспендированного в масле/солевом растворе (1:1) при концентрации 0,5 мг/мл) вводили путем подкожной инъекции в подошвенную поверхность левой задней лапы крысы при легкой анестезии изофлураном. Животным давали восстановиться от анестезии, и базовые термальные и механические ноцицептивные пороги всех животных оценивали через неделю после введения CFA. Всех животных приучали к экспериментальному оборудованию в течение 20 минут в день перед началом эксперимента. Животным вводили испытываемые и контрольные вещества, и ноцицептивные пороги измеряли в определенных точках времени после введения лекарственного средства для определения анальгетических ответов на каждую из шести обработок. Используемые точки времени были определены заранее для демонстрации наивысшего анальгетического эффекта для каждого испытываемого соединения.
(S)-энантиомер по настоящему изобретению и соответствующий (R)-энантиомер сравнивали с использованием как перорального, так и местного введения. Фиг. 2 показывает сравнение эффективности (S)-энантиомера по настоящему изобретению и (R)-энантиомера при пероральном введении. Каждый энантиомер вводили при дозе 10, 30, 100 или 200 мг/кг. Также определяли концентрацию в плазме, достигаемую при каждой дозе, и инвертирование болевого ответа (как % повышения от базового порога) наносили на график как функцию от концентрации в плазме.
(S)-энантиомер имел более высокий максимальный эффект при введении в дозе 200 мг/кг. (R)-энантиомер достигал значительно более высокой концентрации в плазме при эквивалентных дозах. Это было неожиданным и необычным открытием. Как следствие, использование рацемата, то есть соединения формулы (I), даст примерно 10-кратный избыток неактивного энантиомера, то есть (R)-энантиомера. Таким образом, использование (S)-энантиомера по настоящему изобретению существенно повысит вероятность достижения эффективности при минимальной вероятности не направленных на мишень активностей, которые не являются стереоселективными.
(S)-энантиомер по настоящему изобретению также вводили местным путем животным в разных дозах (1%, 2%, 4% и 8% (масс/об)), и ноцицептивные пороги измеряли в определенных точках времени после введения лекарственного средства для определения анальгетических ответов на каждую из обработок. Используемые точки времени были определены заранее для демонстрации наивысшего анальгетического эффекта для каждого испытываемого соединения.
Пороги ответов животных на тактильные раздражители измеряли с использованием анестезиометра Model 2290 Electrovonfrey (HTC Life Science, Woodland Hills, CA) после испытания по методу Hargreaves. Животных помещали в приподнятое ограждение из плексигласа, установленное на поверхности из проволочной сетки. После 15-минутного привыкания к этим условиям, предварительно откалиброванный волосок фон Фрея прилагали перпендикулярно к подошвам ипсилатеральных задних лап животных с достаточной силой, измеряемой в граммах, чтобы вызвать явно выраженный ответ лапы. Ответ выражался в отдергивании от болезненного стимула и составлял конечную точку эффективности. Испытание продолжали до тех пор, пока не определяли наименьшую силу, при которой волосок вызывал быстрое облизывание лапы, или пока не достигали силы отсечки приблизительно 20 г. Эту силу отсечки использовали, поскольку она представляет приблизительно 10% массы тела животных и служит для предотвращения поднятия всей конечности из-за использования более жестких волосков, которые могут изменить природу стимула. Данные выражали как процент повышения от базового порога, измеряемого в граммах.
(S)-энантиомер по настоящему изобретению при испытании в этой модели продемонстрировал анальгетический эффект, как указано ниже в Таблице 4.
| ТАБЛИЦА 4 | ||||
| % повышения от базовой линии (CFB) | ||||
| Соединение | 1% местно | 2% местно | 4% местно | 8% местно |
| (I-S) | 0,62 | 16,71 | 28,79 | 45,06 |
(S)-энантиомер по настоящему изобретению при 2%, 4% и 8% (масс/об) показал повышения механических порогов отдергивания лапы в испытании по методу фон Фрея, выраженные как процент повышения от базовой линии (IFB), что указывает на анальгетический эффект. Анальгетический эффект для (S)-энантиомера повышался с увеличением доз до наивысшей испытываемой дозы 8% (масс/об), которая показала максимальный процент IFB при +45,1%. Однако группа введения 1% (масс/масс) дозы не показала заметного повышения механического порога отдергивания лапы в испытании по методу фон Фрея. Результаты показывают, что (S)-энантиомер обладает анальгетическими эффектами в модели CFA-индуцированной воспалительной боли в пределах 2%-8% (масс/об).
Послеоперационные модели ноцицепции
В этой модели гипералгезию, вызванную интрапланарным разрезом в лапе, измеряли путем приложения усиленных тактильных раздражителей к лапе до тех пор, пока животное не отдергивало лапу от приложенного раздражителя. Пока животные находились под анестезией 3,5% изофлуораном, который вводили через носовой проход, делали 1-см продольный разрез с использованием скальпельного лезвия № 10 в подошвенной области левой задней лапы через кожу и фасцию, начиная на расстоянии 0,5 см от проксимального конца пятки и дальше по направлению к пальцам стопы. После разрезания кожу соединяли наложением 2, 3-0 стерилизованных шелковых швов. Поврежденный участок покрывали полиспорином и бетадином. Животных возвращали в их клетки для восстановления в течение ночи.
Пороги отдергивания лапы животных в ответ на тактильные стимулы как для оперированных (ипсилатеральные), так и неоперированных (контралатеральные) лап можно измерить с использованием анестезиометра Model 2290 Electrovonfrey (IITC Life Science, Woodland Hills, CA).
Животных помещали в приподнятое ограждение из плексигласа, установленное на поверхности из проволочной сетки. После 10-минутного привыкания к этим условиям, предварительно откалиброванный волосок фон Фрея прилагали перпендикулярно к подошвенной поверхности обоих лап животных в порядке увеличения, начиная с 10 г волоска, с достаточной силой, чтобы вызвать небольшое сгибание волоска, прилагаемого к лапе. Испытание продолжали до тех пор, пока не определяли наименьшую силу, при которой волосок вызывал быстрое облизывание лапы, или пока не достигали силы отсечки приблизительно 20 г. Эту силу отсечки использовали, поскольку она представляет приблизительно 10% массы тела животных и служит для предотвращения поднятия всей конечности из-за использования более жестких волосков, которые могут изменить природу стимула.
Модель невропатической боли; хроническое констрикционное поражение
В этой модели делали примерно 3-см разрез через кожу и фасцию на уровне середины бедра левой задней лапы животных с использованием скальпельного лезвия № 10. Левый седалищный нерв обнажали путем рассечения через двуглавую бедренную мышцу, осторожно, чтобы кровотечение было минимальным. Накладывали четыре свободные лигатуры вдоль седалищного нерва с использованием 4-0 неразрушающихся стерилизованных шелковых швов на расстоянии 1-2 мм друг от друга. Натяжение свободных лигатур было достаточным, чтобы вызвать слабую констрикцию седалищного нерва, при наблюдении через препаровальную лупу при 4-кратном увеличении. У ложно оперированного животного левый седалищный нерв обнажали без дальнейших манипуляций. Антибактериальную мазь наносили непосредственно в рану и мышцу закрывали с использованием стерилизованного шовного материала. Бетадин наносили на мышцу и ее окружение, с последующим стягиванием кожи хирургическими зажимами.
Пороги ответов животных на тактильные стимулы измеряли с использованием анестезиометра Model 2290 Electrovonfrey (IITC Life Science, Woodland Hills, CA). Животных помещали в приподнятое ограждение из плексигласа, установленное на поверхности из проволочной сетки. После 10-минутного привыкания к этим условиям, предварительно откалиброванный волосок фон Фрея прилагали перпендикулярно к подошвенной поверхности обоих лап животных в порядке увеличения, начиная с 0,1 г волоска, с достаточной силой, чтобы вызвать небольшое сгибание волоска, прилагаемого к лапе. Испытание продолжали до тех пор, пока не определяли наименьшую силу, при которой волосок вызывал быстрое облизывание лапы, или пока не достигали силы отсечки приблизительно 20 г. Эту силу отсечки использовали, поскольку она представляет приблизительно 10% массы тела животных и служит для предотвращения поднятия всей конечности из-за использования более жестких волосков, которые могут изменить природу стимула.
Термальные ноцицептивные пороги животных оценивали в испытании по методу Hargreaves. После измерения тактильных порогов животных помещали в ограждение из плексигласа, установленное на приподнятой стеклянной платформе с нагревательными элементами. Стеклянную платформу термостатически контролировали при температуре приблизительно 24-26°C для всех контрольных испытаний. Животным давали привыкнуть к этим условиям в течение 10 минут после помещения их в ограждение вплоть до прекращения их разведочного поведения. Устройство для измерения аналгезии при стимуляции подошвы/хвоста модели 226 (IITC, Woodland Hills, CA) использовали для приложения лучевого нагрева снизу от стеклянной платформы к подошвенным поверхностям задних лап. В процессе всех контрольных испытаний холостую интенсивность и активную интенсивность источника тепла устанавливали при 1 и 55 соответственно, и время отсечки 20 секунд использовали для предотвращения поражения ткани.
(S)-энантиомер сравнивали с соответствующим (R)-энантиомером и рацематом (соединение формулы (I)) в этой CCI модели с использованием местного нанесения лекарственного средства, как описано для CFA модели (см. Фиг. 3). Каждое испытываемое соединение вводили в виде мази, содержащей 2% (масс/об). В соответствии с тем, что эти два энантиомера имеют разную активность как ингибиторы потенциал-зависимых воротных натриевых каналов, только (S)-энантиомер по настоящему изобретению обеспечивал обратное развитие болевых ответов, тогда как (R)-энантиомер не показал какого-либо значительного повышения от базовой линии. (S)-энантиомер и рацемат оба показали одинаковый процент повышения от базовой линии, и это говорит о том, что (S)-энантиомер является ответственным за анальгетический эффект.
БИОЛОГИЧЕСКИЙ ПРИМЕР 4
Анализ аконитин-индуцированной аритмии
Антиаритмическая активность соединений по настоящему изобретению была продемонстрирована в следующем испытании. Аритмию провоцировали путем внутривенного введения аконитина (2,0 мкг/кг), растворенного в физиологическом солевом растворе. Испытываемые соединения по настоящему изобретению внутривенно вводили через 5 минут после введения аконитина. Оценку анти-аритмической активности осуществляли путем измерения времени от введения аконитина до возникновения экстрасистолы (ES) и времени от введения аконитина до возникновения вентрикулярной тахикардии (VT).
У крыс, находящихся под анестезией изофлураном (1/4-1/3 2%), осуществляли трахеотомию, делая сначала разрез в шейной области, затем изолируя трахею и делая 2-мм разрез для введения трахеальной трубки 2 см в трахею таким образом, чтобы отверстие трубки было расположено сверху рта. Трубку закрепляли при помощи швов и соединяли с вентилятором на время эксперимента.
Разрезы (2,5 см) затем делали в бедренных областях и использовали тупой зонд для рассечения, бедренные сосуды изолировали. Обе бедренные вены канюлировали, одну для поддержания анестезии пентобарбиталом (0,02-0,05 мл), и одну для инфузии и инъекции лекарственного средства и носителя. Бедренную артерию канюлировали с использованием гелевого катетера и датчика давления.
ЭКГ электроды подсоединяли к торакальной мышце в положении электродов II (верхнее правое/выше сердце - белый электрод, и нижнее левое/ниже сердце - красный электрод). Электроды закрепляли путем наложения швов.
Все хирургические участки покрывали марлей, смоченной 0,9% физиологическим раствором. Физиологический раствор (1-1,5 мл 0,9% раствора) подавали для смачивания участков после хирургической операции. ЭКГ животных и вентиляцию уравновешивали, по меньшей мере, в течение 30 минут.
Аритмию индуцировали инфузией 2 мкг/кг/мин аконитина в течение 5 минут. В это время осуществляли запись ЭКГ и непрерывный контроль.
БИОЛОГИЧЕСКИЙ ПРИМЕР 5
Анализ индуцированной ишемией аритмии
Модели вентрикулярной аритмии у грызунов, как в острой кардиоверсии, так и в превентивных парадигмах, использовали в испытании потенциальных терапевтических средств как для атриальной, так и вентрикулярной аритмии у человека. Сердечная ишемия, приводящая к инфаркту миокарда, является распространенной причиной заболеваемости и смертности. Способность соединения предотвращать ишемически-индуцированную вентрикулярную тахикардию и фибрилляцию представляет собой общепринятую модель для определения эффективности соединения в клинических условиях как в отношении атриальной, так и вентрикулярной тахикардии и фибрилляции.
Анестезию сначала индуцировали пентобарбиталом (внутрибрюшинно) и поддерживали при помощи внутривенной болюсной инфузии. У самцов SD крыс трахея была канюлирована для искусственной вентиляции комнатным воздухом при систолическом объеме 10 мл/кг, 60 ударов/минута. Правую бедренную артерию и вену канюлировали с использованием трубки из PE50 для регистрации среднего артериального давления (MAP) и внутривенного введения соединений, соответственно.
Грудную клетку раскрывали между 4-м и 5-м ребрами с образованием 1,5-см отверстия, чтобы видеть сердце. Каждую крысу помещали на платформу с выемками(зубчатую) и металлические ограничители зацепляли крючками на ребрах, окружающих открытую полость грудной клетки. Хирургическую иглу использовали для входа в желудочек непосредственно под приподнятым предсердием и выхода из желудочка в направлении вниз по диагонали, чтобы получить >30%-<50% зону окклюзии (OZ). Положение выхода находится ~0,5 см ниже, где аорта соединяется с левым желудочком. Шов затягивали таким образом, чтобы получить свободную петлю (обтуратор) вокруг ответвления артерии. Грудную клетку затем закрывали концом обтуратора доступным за пределами грудной клетки.
Электроды помещали в положение электродов II (правое предсердие к апексу) для ЭКГ измерений следующим образом: один электрод вставляли в правую переднюю лапу, а другой электрод вставляли в левую заднюю лапу.
Температуру тела, среднее артериальное давление (MAP), ЭКГ и частоту сердечных сокращений постоянно регистрировали на протяжении всего эксперимента. После того как критические параметры стабилизировались, осуществляли 1-2-минутную регистрацию для установления базовых значений. Инфузию соединения по настоящему изобретению или контрольного вещества начинали сразу после установления базовых значений. После 5-минутной инфузии соединения или контроля шов туго затягивали для лигирования LCA и создания ишемии в левом желудочке. Критические параметры непрерывно регистрировали в течение 20 минут после лигирования, если только MAP не достигало критического уровня 20-30 мм рт.ст. в течение по меньшей мере, 3 минут, в этом случае регистрацию прекращали, поскольку животное считали заболевшим, и его затем умерщвляли. Способность соединений по настоящему изобретению предотвращать аритмию и поддерживать MAP и HR около нормы оценивали и сравнивали с контролем.
БИОЛОГИЧЕСКИЙ ПРИМЕР 6
По сравнению с рацематом, то есть соединением формулы (I), (S)-энантиомер, практически не содержащий (R)-энантиомера, имеет лучший профиль растворимости в различных фармацевтически приемлемых эксципиентах. Таким образом, можно осуществлять формулирование (S)-энантиомера с получением меньшего количества единиц дозирования по сравнению с рацематом. Это свойство облегчает введение пациентам при более высоком уровне, если это необходимо, для достижения эффективности. Примеры различий в растворимости показаны в Таблице 5 ниже:
| ТАБЛИЦА 5 | ||
| Эксципиент | Соединение формулы (I) (рацемат) | (S)-энантиомер |
| Labrasol® | 72,5 мг/мл | 231 мг/мл |
| Пропиленгликоль | 2,7 мг/мл | 9,8 мг/мл |
| ПЭГ 400 | <50 мг/мл | >55 мг/мл |
| Capriol® 90 | 18,1 мг/мл | 96 мг/мл |
| Tween® 80 | 64 мг/мл | >123 мг/мл |
| Этанол | 10,0 мг/мл | 36,4 мг/мл |
| Labrasol®/ПЭГ 400 60/40 | 70,4 мг/мл | 182 мг/мл |
| Labrasol®/Capriol®90 60/40 | 44,4 мг/мл | 191 мг/мл |
| Labrasol®/Transcutol® 60/40 | 74,2 мг/мл | 186 мг/мл |
БИОЛОГИЧЕСКИЙ ПРИМЕР 7
In Vivo Анализ для лечения зуда
Гистамин индуцирует зуд (чесотку) у человека. Таким образом, этот анализ оценивает эффективность местного и перорального введения (S)-энантиомера по настоящему изобретению на гистамин-индуцированный зуд у самцов ICR мышей.
Животных рандомизированно разделяли на группы испытания, включающие необработанную группу, группу обработки фармацевтической композицией для местного применения с 8% (масс/об) (S)-энантиомера и группу обработки пероральной фармацевтической композицией, содержащей 50 мг/кг (S)-энантиомера. За день до начала испытания скапулярные области на теле животных выбривали машинкой для стрижки волос. В день испытания животных приучали в течение 60 минут к условиям камеры для испытаний, которая представляла собой прозрачную пластиковую трубку, расположенную вертикально на плоской поверхности. После периода привыкания животных извлекали из пластиковой трубки, помещали в зажимное приспособление и вводили путем инъекции гистамин на выбритом скапулярном участке. Инъекции вводили внутрикожным путем в кожу небольшими объемами (10 мкл) с использованием шприца Гамильтона. Растворы для инъекций состояли из гистамина, растворенного в физиологическом растворе при концентрации 100 мкг/10 мкл (или 10 мг/мл). 10 мкг раствора вводили путем инъекции каждой мыши. Сразу после инъекций животных возвращали в камеры для испытаний и наблюдали при помощи фотокамеры, расположенной выше камер для испытаний, всего в течение 50 минут. Фотокамеры были соединены с компьютером, который создавал, сохранял и анализировал цифровые видеофайлы.
Количество приступов зуда подсчитывали в течение 40 минут. "Приступ зуда" определяли поднятием задней лапы, использованием ее для почесывания скапулярной области и затем помещением ее обратно на пол. Альтернативно, если вместо помещения задней лапы обратно на пол было замечено, что мышь лижет лапу, тогда эти два действия считали приступом зуда.
Что касается необработанной группа, животных (n=7) приучали в течение 60 минут к условиям камеры для испытаний перед инъекцией гистамина. Для оценки местного применения (S)-энантиомера при гистамин-индуцированном зуде, животных (n=16/группа) приучали к условиям камеры для испытаний в течение 30 минут, с последующим местным нанесением 50 мг 8% (масс/об) (S)-энантиомера или носителя на выбритые области на спине. Животных возвращали в камеру для испытаний для привыкания еще в течение 30 минут перед инъекцией гистамина. Для оценки перорального (S)-энантиомера, животным (n=8/группа) вводили через желудочный зонд 50 мг/кг (S)-энантиомера или носителя с последующим периодом привыкания к камере для испытаний в течение 60 минут перед инъекцией гистамина.
Данные анализировали с использованием программы статистического анализа GraphPad Prism 5, и непарный критерий Стьюдента использовали для одномерного анализа. Результаты выражали как среднее значение ±SEM(средняя стандартная ошибка). Значения, которые достигали p<0,05 уровня значимости, считали статистически значимыми.
Результаты
Инъекция гистамина в кожу вызывала у животных чесотку со спорадическими приступами зуда, которые продолжались 1-2 секунд. В необработанной группе, приступы зуда начинались сразу после инъекции и продолжались после этого примерно 40 минут (см. Фиг. 4). Группа обработки 8% (масс/об) (S)-энантиомером для местного применения показала значительное уменьшение зуда (см. Фиг. 5). Животные, которых обрабатывали только носителем, имели в целом 134,3±13,31 (n=16) приступов зуда, тогда как мыши, которых обрабатывали (S)-энантиомером для местного применения, имели 89,00±10,51 (n=16) приступов зуда. Разница между этими группами была статистически значимой, при значении p=0,0122. Группа, которую обрабатывали 50 мг/кг пероральным (S)-энантиомером, также показала значительное уменьшение зуда (см. Фиг. 6). Животные, которых обрабатывали только носителем, имели в целом 42,88±6,667 (n=8) приступов зуда, тогда как мыши, которых обрабатывали (S)-энантиомером, имели 17,25±6,310 (n=8) приступов зуда. Разница между перорально-обработанными группами также была статистически значимой, при значении p=0,0144. Результаты показали, что вводимый перорально и местным путем (S)-энантиомер уменьшал зуд. Кроме того, очевидно, что два общепринятых пути доставки лекарственного средства, пероральный и местный, можно использовать для доставки (S)-энантиомера с достижением такого терапевтического эффекта.
БИОЛОГИЧЕСКИЙ ПРИМЕР 8
Клиническое испытание лечения первичной/наследственной эритромелалгии (IEM) у человека
Первичная/наследственная эритромелалгия (IEM) представляет собой редкое наследственное болевое состояние. Причины, лежащие в основе IEM, могут включать одну или несколько мутаций с приобретением функции в Nav1.7 потенциал-зависимых воротных натриевых каналах, которые, как было показано, ингибирует (S)-энантиомер по настоящему изобретению.
Люди, являющиеся пациентами с IEM, имеют повторяющиеся эпизоды сильной жгучей боли, связанные с покраснением и жжением ладоней и ступней, но, в конечном счете, боль становится постоянной. Боль облегчается при охлаждении, но является в значительной степени резистентной к фармакологическому вмешательству. Однако есть сообщения о том, что блокаторы потенциал-зависимых воротных натриевых каналов демонстрируют облегчение боли в степени от умеренной до сильной при этом состоянии.
Клиническое испытание для определения эффективности (S)-энантиомера по настоящему изобретению в уменьшении интенсивности или облегчении IEM может быть разработано как включающее три периода, двойное слепое, многодозовое и перекрестное испытание для сведения к минимуму количества участников, бросающих испытание, и при этом следует учитывать, что пациенты, согласившиеся принять участие в испытании, будут доступны только в течение 10-дневного испытания. Каждый пациент, участвующий в испытании, будет служить в качестве собственного контроля, принимая как плацебо, так и 400 мг (S)-энантиомера по настоящему изобретению два раза в день попеременно.
БИОЛОГИЧЕСКИЙ ПРИМЕР 9
Клиническое испытание лечения зубной боли у человека
Целью этого клинического испытания было сравнение безопасности и эффективности (начало, продолжительность периода облегчения и общая эффективность) разовой 500 мг дозы (S)-энантиомера по настоящему изобретению против введения плацебо для облегчения боли после извлечения ретинированного третьего большого коренного зуба.
Количество участников испытания было 61. Средний возраст участников составлял 20,4 года, и все субъекты были мужского пола. Большинство субъектов принадлежали к европиоидной расе (95,1%).
Тяжесть и облегчение боли измеряли с использованием 11-точечной шкалы цифровой оценки интенсивности боли (оценки от 0 = отсутствие боли, до 10 = самая сильная вообразимая боль) (PINRS) и 5-точечной шкалы категорий облегчения боли (REL). Субъекты заполняли PINRS после хирургической операции, но до введения (S)-энантиомера по настоящему изобретению. Показатели эффективности получали из REL и PINRS оценок, и они включали полное облегчение боли (TOTPAR), разницу в интенсивности боли (PID) и суммарную разницу в интенсивности боли (SPID), и оценку осуществляли в точках времени 4, 6, 8 и 12 часов после введения (S)-энантиомера по настоящему изобретению.
Однако основная и все второстепенные конечные точки показали последовательную анальгетическую тенденцию с явным отличием (S)-энантиомера от плацебо. Эти результаты говорят о том, что (S)-энантиомер обладает анальгетическими свойствами, но статистической значимости от плацебо не достигал по двум основным причинам: (1) относительно высокая скорость ответа плацебо, и (2) медленное начало действия (S)-энантиомера. Используемая зубная модель предназначена и лучше всего подходит для оценки лекарственных средств с быстрым началом действия, таких как NSAID класс противовоспалительных средств. Было очевидно из этого испытания, что (S)-энантиомер по настоящему изобретению не имел такого быстрого начала действия, как у NSAID. Однако облегчение боли, продемонстрированное теми субъектами, которые принимали (S)-энантиомер, было выше по сравнению с теми субъектами, которые принимали только плацебо, достаточно для того, чтобы общая популяция эффективности показала последовательный анальгетический сигнал для всех оцениваемых конечных точек.
БИОЛОГИЧЕСКИЙ ПРИМЕР 10
Клиническое испытание безопасности (S)-энантиомера по настоящему изобретению для человека
Это клиническое испытание представляло собой Фазу 1, рандомизированное, двойное слепое, плацебо-контролируемое испытание здоровых субъектов для оценки безопасности и фармакокинетических свойств мази для местного применения, содержащей (S)-энантиомер по настоящему изобретению.
Содержащую (S)-энантиомер мазь наносили ежедневно в течение 21 последовательного дня для определения местного токсичного/раздражающего кожу действия (S)-энантиомера. Системные фармакокинетические свойства и местные уровни лекарственного средства в коже также оценивали. Оценивали системное воздействие (S)-энантиомера после местных нанесений и местное раздражение кожи после нескольких доз мази, содержащей (S)-энантиомер. Каждый субъект получал 5 обработок в течение 21 последовательного дня: (S)-энантиомер в виде мази с 4% и 8% (масс/масс) (1×100 мкл; обработки А и B, соответственно), плацебо в виде мази (обработка C), физиологический (0,9%) раствор (1×100 мкл; отрицательный контроль; обработка D) и лаурилсульфат натрия (SLS) 0,1% раствор (1×100 мкл; положительный контроль; обработка E). Обработки наносили на разные участки верхней части спины каждому субъекту окклюдированным образом (пять обработок) и частично окклюдированным образом (первые три обработки). Место для каждой обработки на каждом участке (обработки A, B, C, D и E на окклюдированном участке, и обработки A, B и C на частично окклюдированном участке) выбирали рандомизированно. Субъекты находились под постоянным наблюдением для клинических исследований, начиная приблизительно за 18 часов до первого введения дозы в День 1 вплоть до приблизительно 8 часов после введения 2-й дозы (День 2). Субъекты приходили каждый день в течение 19 последовательных дней (Дни с 3 по 21) для введения доз и процедур исследования.
Не сообщалось ни о каких серьезных неблагоприятных эффектах (SAE) или смертях. Неблагоприятные эффекты (AE) все были слабой или средней степени тяжести, при этом большинство AE относилось к местным кожным реакциям от хирургического клея, используемого для адгезии окклюзивных повязок. Все субъекты реагировали на положительный контроль. Положительный контроль был остановлен у всех субъектов в День 4 после жалоб субъектов на чрезмерный дискомфорт. Оценки кожного раздражения были низкими для всех обработок (максимальная оценка 3 по шкале от 0 до 7), указывая на то, что (S)-энантиомер в форме мази был хорошо переносимым местно. Никакой разницы не наблюдали между кумулятивными оценками раздражения для (S)-энантиомера 4% (масс/масс), (S)-энантиомера 8% (масс/масс), плацебо в форме мазей и отрицательного контроля (0,9% физиологический раствор). Признаки раздражения полностью исчезали к Дню 28 (7 дней после конечной дозы) у большинства субъектов.
Электрокардиографические записи не показали клинически значимых изменений частоты пульса, латентного состояния покоя, или QTс интервалов у субъектов, и не наблюдали никаких клинически значимых изменений от базовой линии у субъектов, что касается основных показателей состояния организма, физических обследований или лабораторных оценок. Системное воздействие (S)-энантиомера было незначительным, поскольку концентрации (S)-энантиомера в плазме были ниже нижнего предела определения (LLOQ) (0,1 нг/мл или 100 пг/мл) в большинстве образцов (489 из 546=~90%). Самый высокий уровень (S)-энантиомера, который наблюдали у одного субъекта в период введения доз (День 22), был 994 пг/мл. На основании минимального местного раздражения и благоприятного профиля безопасности, вместе с низким системным воздействием (S)-энантиомера, было сделано заключение, что (S)-энантиомер по настоящему изобретению является переносимым и безопасным в качестве местного анальгетика.
БИОЛОГИЧЕСКИЙ ПРИМЕР 11
Клиническое испытание для лечения постгерпетической невралгии у человека
Пост-герпетическая невралгия (PHN) является установившейся и общепризнанной моделью для исследования невропатической боли. Кроме того, PHN демонстрирует надежное подтверждение эффективности блокатора натриевых каналов. Следующее испытание представляет собой рандомизированное, двойное слепое, плацебо-контролируемое, включающее две обработки, два периода перекрестного испытания для оценки безопасности, переносимости, предварительной эффективности и системного воздействия (S)-энантиомера по настоящему изобретению, вводимого местно пациентам с PHN. Основными целями были: (a) сравнение безопасности и эффективности мази, содержащей (S)-энантиомер, с плацебо для облегчения боли у пациентов с PHN, и (b) оценка степени системного воздействия (S)-энантиомера после местного применения (S)-энантиомера у пациентов с PHN. Обработки включают (S)-энантиомер 8% (масс/масс) в форме мази и используемую для сравнения мазь плацебо.
Испытание включает следующие четыре периода:
1. Первоначальный скрининг и период вымывания (до 3 недель);
2. Период одностороннего слепого испытания, введение плацебо (1 неделя);
3. Период перекрестной обработки, который состоит из 2 периодов обработки, каждый из которых продолжается в течение 3 недель, в промежутке между которыми 2 недельный период вымывания/одностороннего слепого испытания с введением плацебо (всего 8 недель); и
4. Завершающий период оценки безопасности (2 недели).
Все патенты США, публикации патентных заявок США, патентные заявки США, иностранные патенты, иностранные патентные заявки и непатентные публикации, на которые ссылаются в настоящем описании, включены в настоящую заявку посредством ссылки во всей их полноте.
Хотя представленное выше изобретение было описано в некоторых деталях, чтобы облегчить его понимание, должно быть понятно, что практически можно использовать некоторые изменения и модификации в объеме прилагаемой формулы изобретения. Таким образом, описанные варианты воплощения следует рассматривать как иллюстративные, а не ограничивающие, и изобретение не ограничивается деталями, описанными в настоящей заявке, но может быть модифицировано в пределах объема и эквивалентов прилагаемой формулы изобретения.
Claims (10)
2. Фармацевтическая композиция, предназначенная для лечения заболевания или состояния, выбранного из группы, включающей боль, депрессию, сердечно-сосудистые заболевания, респираторные заболевания, психические заболевания, неврологические заболевания и судороги, и их сочетания, включающая фармацевтически приемлемый эксципиент и (S)-энантиомер по п.1.
3. Способ лечения заболевания или состояния у млекопитающего, выбранного из группы, включающей боль, депрессию, сердечно-сосудистые заболевания, респираторные заболевания, психические заболевания, неврологические заболевания и судороги, и их сочетания, где указанный способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера по п.1.
4. Способ по п.3, где указанное заболевание или состояние выбрано из группы, включающей невропатическую боль, воспалительную боль, висцеральную боль, раковую боль, зубную боль, боль, вызванную химиотерапией, боль, вызванную травмой, боль, вызванную хирургическим вмешательством, боль при родах, нейрогенный мочевой пузырь, язвенный колит, хроническую боль, персистентную боль, периферически-опосредованную боль, центрально-опосредованную боль, хроническую головную боль, мигреневую головную боль, синусовую головную боль, тензионную головную боль, фантомную боль в ампутированных конечностях, травму периферического нерва и их сочетания.
5. Способ по п.3, где указанное заболевание или состояние выбрано из группы, включающей боль, связанную с ВИЧ, лечением ВИЧ-индуцированной невропатии, невралгию тройничного нерва, постгерпетическую невралгию, эвдинию, чувствительность к теплу, саркоидоз, синдром раздраженной толстой кишки, болезнь Крона, боль, связанную с рассеянным склерозом, боковым амиотрофическим склерозом, зуд, гиперхолестеринемию, доброкачественную гиперплазию предстательной железы, диабетическую невропатию, периферическую невропатию, артрит, ревматоидный артрит, остеоартрит, пароксизмальную дистонию, миастенические синдромы, миотонию, злокачественную гипертермию, кистозный фиброз, псевдоальдостеронизм, острый некроз скелетных мышц, биполярную депрессию, тревогу, шизофрению, заболевания, связанные с токсином натриевых каналов, наследственную эритермалгию, первичную эритромелалгию, наследственную ректальную боль, пароксизмальное эпизодическое болевое расстройство, рак, эпилепсию, парциальные и общие тонические судороги, синдром беспокойных ног, аритмию, фибромиалгию, нейропротекцию при ишемических состояниях, вызванных инсультом или неврологической травмой, тахиаритмию, мерцательную аритмию и фибрилляцию желудочков.
6. Способ лечения заболевания или состояния у млекопитающего путем ингибирования ионного потока через потенциал-зависимый воротный натриевый канал у млекопитающего, где указанный способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера по п.1.
7. Способ уменьшения ионного потока через потенциал-зависимый воротный натриевый канал в клетке у млекопитающего, включающий контактирование клетки с (S)-энантиомером по п.1.
8. Применение (S)-энантиомера по п.1 для получения лекарственного средства для лечения заболевания или состояния, которое можно улучшить или облегчить путем ингибирования потенциал-зависимого воротного натриевого канала у млекопитающего.
9. Способ лечения зуда у млекопитающего, где указанный способ включает введение млекопитающему, нуждающемуся в этом, терапевтически эффективного количества (S)-энантиомера по п.1.
10. Способ получения (S)-энантиомера 1′-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3′-индол]-2′(1′Н)-она, имеющего следующую формулу (I-S):
включающий:
(а) обработку соединения следующей формулы:
2-бромметил-5-трифторметилфураном в условиях, обеспечивающих образование соединения формулы (I):
; и
(b) выделение (S)-энантиомера 1′-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3′-индол]-2′(1′Н)-она методом хиральной высокоэффективной жидкостной хроматографии или методом хроматографии с псевдодвижущимся слоем.
включающий:
(а) обработку соединения следующей формулы:
2-бромметил-5-трифторметилфураном в условиях, обеспечивающих образование соединения формулы (I):
; и
(b) выделение (S)-энантиомера 1′-{[5-(трифторметил)фуран-2-ил]метил}спиро[фуро[2,3-f][1,3]бензодиоксол-7,3′-индол]-2′(1′Н)-она методом хиральной высокоэффективной жидкостной хроматографии или методом хроматографии с псевдодвижущимся слоем.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22142409P | 2009-06-29 | 2009-06-29 | |
| US61/221,424 | 2009-06-29 | ||
| PCT/US2010/040187 WO2011002708A1 (en) | 2009-06-29 | 2010-06-28 | Enantiomers of spiro-oxindole compounds and their uses as therapeutic agents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012102896A RU2012102896A (ru) | 2013-08-10 |
| RU2535667C2 true RU2535667C2 (ru) | 2014-12-20 |
Family
ID=42416878
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012102896/04A RU2535667C2 (ru) | 2009-06-29 | 2010-06-28 | Энантиомеры спиро-оксиндольных соединений и их применение в качестве терапевтических средств |
Country Status (35)
| Country | Link |
|---|---|
| US (4) | US8450358B2 (ru) |
| EP (3) | EP2789617B1 (ru) |
| JP (3) | JP2012532107A (ru) |
| KR (1) | KR101751378B1 (ru) |
| CN (2) | CN102471347B (ru) |
| AR (1) | AR077252A1 (ru) |
| AU (1) | AU2010266549B2 (ru) |
| BR (1) | BRPI1012129A2 (ru) |
| CA (1) | CA2764878C (ru) |
| CL (1) | CL2011003335A1 (ru) |
| CO (1) | CO6470866A2 (ru) |
| CY (1) | CY1117776T1 (ru) |
| DK (1) | DK2448943T3 (ru) |
| EC (1) | ECSP11011512A (ru) |
| ES (2) | ES2578779T3 (ru) |
| HK (2) | HK1203192A1 (ru) |
| HR (2) | HRP20110946A2 (ru) |
| HU (1) | HUE029658T2 (ru) |
| IL (3) | IL217285A (ru) |
| MA (1) | MA33552B1 (ru) |
| MX (2) | MX342298B (ru) |
| MY (1) | MY159099A (ru) |
| NZ (1) | NZ596903A (ru) |
| PE (2) | PE20120413A1 (ru) |
| PH (1) | PH12015502323A1 (ru) |
| PL (2) | PL2448943T3 (ru) |
| PT (1) | PT2448943T (ru) |
| RU (1) | RU2535667C2 (ru) |
| SG (1) | SG176307A1 (ru) |
| SI (1) | SI2448943T1 (ru) |
| SM (1) | SMT201600203B (ru) |
| TN (1) | TN2011000664A1 (ru) |
| TW (1) | TWI465452B (ru) |
| WO (1) | WO2011002708A1 (ru) |
| ZA (1) | ZA201108960B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2744766C2 (ru) * | 2015-07-16 | 2021-03-15 | Эббви С.А.Р.Л. | Замещенные трициклические соединения и способ применения |
Families Citing this family (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9278088B2 (en) | 2002-02-19 | 2016-03-08 | Xenon Pharmaceuticals Inc. | Methods for identifying analgesic agents |
| MY144968A (en) | 2005-04-11 | 2011-11-30 | Xenon Pharmaceuticals Inc | Spiro-oxindole compounds and their uses as therapeutic agents |
| MY145694A (en) * | 2005-04-11 | 2012-03-30 | Xenon Pharmaceuticals Inc | Spiroheterocyclic compounds and their uses as therapeutic agents |
| EP2073806B1 (en) | 2006-10-12 | 2012-02-15 | Xenon Pharmaceuticals Inc. | Use of spiro-oxindole compounds as therapeutic agents |
| US20110294842A9 (en) * | 2006-10-12 | 2011-12-01 | Xenon Pharmaceuticals Inc. | Spiro (furo [3, 2-c] pyridine-3-3' -indol) -2' (1'h)-one derivatives and related compounds for the treatment of sodium-channel mediated diseases, such as pain |
| CN106928247A (zh) | 2008-10-17 | 2017-07-07 | 泽农医药公司 | 螺羟吲哚化合物及其作为治疗剂的用途 |
| EP2350091B1 (en) * | 2008-10-17 | 2015-06-03 | Xenon Pharmaceuticals Inc. | Spiro-oxindole compounds and their use as therapeutic agents |
| AR077252A1 (es) | 2009-06-29 | 2011-08-10 | Xenon Pharmaceuticals Inc | Enantiomeros de compuestos de espirooxindol y sus usos como agentes terapeuticos |
| SI2448938T1 (sl) | 2009-06-29 | 2014-08-29 | Incyte Corporation Experimental Station | Pirimidinoni kot zaviralci pi3k |
| US20110086899A1 (en) * | 2009-10-14 | 2011-04-14 | Xenon Pharmaceuticals Inc. | Pharmaceutical compositions for oral administration |
| PE20170202A1 (es) | 2009-10-14 | 2017-03-24 | Xenon Pharmaceuticals Inc | Metodos sinteticos para compuestos espiro-oxoindol |
| WO2011075643A1 (en) | 2009-12-18 | 2011-06-23 | Incyte Corporation | Substituted heteroaryl fused derivatives as pi3k inhibitors |
| MA34083B1 (fr) | 2010-02-26 | 2013-03-05 | Xenon Pharmaceuticals Inc | Compositions pharmaceutques de composé spiro-oxindole pour administration topique et leur utilisation en tant qu'agents thérapeutiques |
| US9193721B2 (en) | 2010-04-14 | 2015-11-24 | Incyte Holdings Corporation | Fused derivatives as PI3Kδ inhibitors |
| US9062055B2 (en) | 2010-06-21 | 2015-06-23 | Incyte Corporation | Fused pyrrole derivatives as PI3K inhibitors |
| WO2012049555A1 (en) | 2010-10-13 | 2012-04-19 | Lupin Limited | Spirocyclic compounds as voltage-gated sodium channel modulators |
| ES2764848T3 (es) | 2010-12-20 | 2020-06-04 | Incyte Holdings Corp | N-(1-(fenilo sustituido)etilo)-9H-purina-6-aminas como inhibidores de PI3K |
| US9108984B2 (en) | 2011-03-14 | 2015-08-18 | Incyte Corporation | Substituted diamino-pyrimidine and diamino-pyridine derivatives as PI3K inhibitors |
| WO2012135009A1 (en) | 2011-03-25 | 2012-10-04 | Incyte Corporation | Pyrimidine-4,6-diamine derivatives as pi3k inhibitors |
| HUE030869T2 (en) | 2011-09-02 | 2017-06-28 | Incyte Holdings Corp | Heterocyclic amines as inhibitors of PI3K |
| EP2638908A1 (en) * | 2012-03-16 | 2013-09-18 | Phytotox SpA | Paralytic Shellfish Poison |
| AR090548A1 (es) | 2012-04-02 | 2014-11-19 | Incyte Corp | Azaheterociclobencilaminas biciclicas como inhibidores de pi3k |
| US9487535B2 (en) * | 2012-04-12 | 2016-11-08 | Xenon Pharmaceuticals Inc. | Asymmetric syntheses for spiro-oxindole compounds useful as therapeutic agents |
| GB201209015D0 (en) * | 2012-05-22 | 2012-07-04 | Convergence Pharmaceuticals | Novel compounds |
| WO2014127116A1 (en) * | 2013-02-13 | 2014-08-21 | Novartis Ag | Topical ocular analgesic agents |
| SG11201604477SA (en) | 2013-12-13 | 2016-07-28 | Vertex Pharma | Prodrugs of pyridone amides useful as modulators of sodium channels |
| UY35981A (es) | 2014-02-05 | 2015-08-31 | Ivax Int Gmbh | Métodos para tratar el dolor asociado a la osteoartritis en una articulación con una formulación tópica de un compuesto de espirooxindol |
| MA39778A (fr) | 2014-03-29 | 2017-02-08 | Lupin Ltd | Composés sulfonamides comme modulateurs des canaux sodiques potentiel-dépendants |
| WO2015191677A1 (en) | 2014-06-11 | 2015-12-17 | Incyte Corporation | Bicyclic heteroarylaminoalkyl phenyl derivatives as pi3k inhibitors |
| WO2016109795A1 (en) | 2014-12-31 | 2016-07-07 | Concert Pharmaceuticals, Inc. | Deuterated funapide and difluorofunapide |
| US9682033B2 (en) | 2015-02-05 | 2017-06-20 | Teva Pharmaceuticals International Gmbh | Methods of treating postherpetic neuralgia with a topical formulation of a spiro-oxindole compound |
| TWI748941B (zh) | 2015-02-27 | 2021-12-11 | 美商英塞特公司 | Pi3k抑制劑之鹽及製備方法 |
| WO2016183063A1 (en) | 2015-05-11 | 2016-11-17 | Incyte Corporation | Crystalline forms of a pi3k inhibitor |
| WO2016183060A1 (en) | 2015-05-11 | 2016-11-17 | Incyte Corporation | Process for the synthesis of a phosphoinositide 3-kinase inhibitor |
| TW201722938A (zh) | 2015-09-04 | 2017-07-01 | 魯賓有限公司 | 作為電位閘控鈉通道調節子之磺醯胺化合物 |
| KR20180095598A (ko) | 2015-12-18 | 2018-08-27 | 머크 샤프 앤드 돔 코포레이션 | 전압-게이팅 나트륨 채널에서 선택적 활성을 갖는 히드록시알킬아민- 및 히드록시시클로알킬아민-치환된 디아민-아릴술폰아미드 화합물 |
| JP2019518058A (ja) | 2016-06-16 | 2019-06-27 | ゼノン・ファーマシューティカルズ・インコーポレイテッドXenon Pharmaceuticals Inc. | スピロ−オキシインドール化合物の固体状態形 |
| WO2017218920A1 (en) | 2016-06-16 | 2017-12-21 | Teva Pharmaceuticals International Gmbh | Asymmetric synthesis of funapide |
| WO2018163077A1 (en) | 2017-03-08 | 2018-09-13 | Lupin Limited | Indanyl compounds as voltage gated sodium channel modulators |
| WO2018163216A1 (en) | 2017-03-10 | 2018-09-13 | Council Of Scientific & Industrial Research | Spirooxindole compounds as gsk3β inhibitors and process for preparation thereof |
| WO2018213426A1 (en) | 2017-05-16 | 2018-11-22 | Vertex Pharmaceuticals Incorporated | Deuterated pyridone amides and prodrugs thereof as modulators of sodium channels |
| JOP20200001A1 (ar) | 2017-07-11 | 2022-10-30 | Vertex Pharma | كاربوكسأميدات بوصفها معدلات لقنوات الصوديوم |
| EP3694510A4 (en) | 2017-10-10 | 2021-06-30 | Biogen Inc. | SPIRO DERIVATIVE PREPARATION PROCESS |
| EP3752152A1 (en) | 2018-02-12 | 2020-12-23 | Vertex Pharmaceuticals Incorporated | A method of treating pain |
| JP2021531256A (ja) | 2018-07-09 | 2021-11-18 | リーバー インスティチュート インコーポレイテッドLieber Institute, Inc. | NaV1.8を阻害するピリダジン化合物 |
| MX2021001636A (es) | 2018-09-10 | 2021-05-12 | Kaken Pharma Co Ltd | Derivado de amida heteroaromatico y medicamento que contiene el mismo. |
| US20220110923A1 (en) | 2019-01-10 | 2022-04-14 | Vertex Pharmaceuticals Incorporated | Esters and carbamates as modulators of sodium channels |
| WO2020146682A1 (en) | 2019-01-10 | 2020-07-16 | Vertex Pharmaceuticals Incorporated | Carboxamides as modulators of sodium channels |
| US11162356B2 (en) | 2019-02-05 | 2021-11-02 | Motive Drilling Technologies, Inc. | Downhole display |
| WO2020176763A1 (en) | 2019-02-27 | 2020-09-03 | Vertex Pharmaceuticals Incorporated | Dosage form comprising prodrug of na 1.8 sodium channel inhibitor |
| WO2020219867A1 (en) | 2019-04-25 | 2020-10-29 | Vertex Pharmaceuticals Incorporated | Pyridone amide co-crystal compositions for the treatment of pain |
| TW202128675A (zh) | 2019-12-06 | 2021-08-01 | 美商維泰克斯製藥公司 | 作為鈉通道調節劑之經取代四氫呋喃 |
| WO2022192427A1 (en) | 2021-03-10 | 2022-09-15 | Pacira Therapeutics, Inc. | Sustained release thermosetting gels comprising sodium channel blockers and the methods of making the same |
| PE20241335A1 (es) | 2021-06-04 | 2024-07-03 | Vertex Pharma | N-(hidroxialquil (hetero)aril) tetrahidrofurano carboxamidas como moduladores de canales de sodio |
| KR20240031299A (ko) | 2021-06-04 | 2024-03-07 | 버텍스 파마슈티칼스 인코포레이티드 | (2r,3s,4s,5r)-4-[[3-(3,4-디플루오로-2-메톡시-페닐)-4,5-디메틸-5-(트리플루오로메틸)테트라하이드로푸란-2-카르보닐]아미노]피리딘-2-카르복사미드를 포함하는 고체 투여 형태 및 투여 요법 |
| CA3221938A1 (en) | 2021-06-04 | 2022-12-08 | Vertex Pharmaceuticals Incorporated | Substituted tetrahydrofuran analogs as modulators of sodium channels |
| CA3221960A1 (en) | 2021-06-04 | 2022-12-08 | Vertex Pharmaceuticals Incorporated | Hydroxy and (halo)alkoxy substituted tetrahydrofurans as modulators of sodium channels |
| CA3221788A1 (en) | 2021-06-04 | 2022-12-08 | Vertex Pharmaceuticals Incorporated | Substituted tetrahydrofuran-2-carboxamides as modulators of sodium channels |
| CN117794919A (zh) | 2021-06-04 | 2024-03-29 | 沃泰克斯药物股份有限公司 | N-(羟烷基(杂)芳基)四氢呋喃甲酰胺类似物作为钠通道调节剂 |
| RU2763140C1 (ru) * | 2021-06-29 | 2021-12-27 | Федеральное государственное автономное образовательное учреждение высшего образования "Пермский государственный национальный исследовательский университет" (ПГНИУ) | 4-[2-(гидроксиметил)-фениламино]-6',6'-диметил-1'-(2-фторфенил)-3-(4-хлорбензоил)-6',7'-дигидро-5Н-спиро[фуран-2,3'-индол]-2',4',5(1'H,5'H)-трион в качестве средства, обладающего противомикробной активностью |
| TW202404969A (zh) | 2022-04-22 | 2024-02-01 | 美商維泰克斯製藥公司 | 用於治療疼痛之雜芳基化合物 |
| US20230382910A1 (en) | 2022-04-22 | 2023-11-30 | Vertex Pharmaceuticals Incorporated | Heteroaryl compounds for the treatment of pain |
| WO2023205468A1 (en) | 2022-04-22 | 2023-10-26 | Vertex Pharmaceuticals Incorporated | Heteroaryl compounds for the treatment of pain |
| WO2023205465A1 (en) | 2022-04-22 | 2023-10-26 | Vertex Pharmaceuticals Incorporated | Heteroaryl compounds for the treatment of pain |
| WO2024123815A1 (en) | 2022-12-06 | 2024-06-13 | Vertex Pharmaceuticals Incorporated | Process for the synthesis of substituted tetrahydrofuran modulators of sodium channels |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU97112188A (ru) * | 1994-12-22 | 1999-05-27 | Смитклайн Бичам П.Л.С. | Тетрациклические спиросоединения, способ их получения и их применение в качестве антагонистов рецепторов 5ht1d |
| WO2006110917A2 (en) * | 2005-04-11 | 2006-10-19 | Xenon Pharmaceuticals Inc. | Spiro-oxindole compounds and their uses as therapeutic agents |
| RU2006123424A (ru) * | 2003-12-02 | 2008-01-10 | Экселиксис, Инк. (Us) | Производные азепиноиндола в качестве фармацевтических средств |
Family Cites Families (145)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3189617A (en) | 1961-02-03 | 1965-06-15 | Sterling Drug Inc | 1-aryloxindoles and their preparation |
| DE1956237A1 (de) | 1969-11-08 | 1971-05-13 | Basf Ag | Spiro-pyrrolizidon-oxindole |
| DE2113343A1 (de) | 1971-03-19 | 1972-09-21 | Thiemann Chem Pharm Fab | Indolo[2,3-b] chinolone und Verfahren zu ihrer Herstellung |
| US3723459A (en) | 1971-04-23 | 1973-03-27 | Mc Neil Labor Inc | 2-oxospiro (indoline -3,4{40 -thiochroman) derivatives |
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| SE400966B (sv) | 1975-08-13 | 1978-04-17 | Robins Co Inc A H | Forfarande for framstellning av 2-amino-3-(eller 5-)bensoyl-fenylettiksyror |
| US4670566A (en) | 1979-07-12 | 1987-06-02 | A. H. Robins Company, Incorporated | 3-methyl-hio-4-(5-, 6-, or 7-)phenylindolindolin-2-ones |
| US4326525A (en) | 1980-10-14 | 1982-04-27 | Alza Corporation | Osmotic device that improves delivery properties of agent in situ |
| US4440785A (en) | 1980-10-30 | 1984-04-03 | A. H. Robins Company, Inc. | Methods of using 2-aminobiphenylacetic acids, esters, and metal salts thereof to treat inflammation |
| US4438130A (en) | 1981-11-12 | 1984-03-20 | The Upjohn Company | Analgesic 1-oxa-, aza- and thia-spirocyclic compounds |
| JPS60142984A (ja) | 1983-12-28 | 1985-07-29 | Kyorin Pharmaceut Co Ltd | 新規なスピロピロリジン−2,5−ジオン誘導体およびその製造法 |
| US4569942A (en) | 1984-05-04 | 1986-02-11 | Pfizer Inc. | N,3-Disubstituted 2-oxindole-1-carboxamides as analgesic and antiinflammatory agents |
| JPS6130554A (ja) | 1984-07-23 | 1986-02-12 | Ono Pharmaceut Co Ltd | プロスタグランジン類似化合物のある特定の立体配置を有する異性体及びそれらを有効成分として含有する治療剤 |
| US4690943A (en) | 1984-09-19 | 1987-09-01 | Pfizer Inc. | Analgesic and antiinflammatory 1,3-diacyl-2-oxindole compounds |
| US4721721A (en) | 1984-12-18 | 1988-01-26 | Rorer Pharmaceutical Corporation | 6-(4-thiazole) compounds, cardiotonic compositions including the same, and their uses |
| DE3608088C2 (de) | 1986-03-07 | 1995-11-16 | Schering Ag | Pharmazeutische Präparate, enthaltend Cyclodextrinclathrate von Carbacyclinderivaten |
| WO1993012786A1 (en) | 1986-07-10 | 1993-07-08 | Howard Harry R Jr | Indolinone derivatives |
| ES2054860T5 (es) | 1987-07-17 | 2003-11-01 | Schering Ag | Derivados de 9-halogeno-(z)-prostaglandinas, procedimiento para su preparacion y su utilizacion como medicamentos. |
| US5182289A (en) | 1988-06-14 | 1993-01-26 | Schering Corporation | Heterobicyclic compounds having antiinflammatory activity |
| ES2110965T3 (es) | 1989-07-25 | 1998-03-01 | Taiho Pharmaceutical Co Ltd | Derivado de oxoindol. |
| DE3932953A1 (de) | 1989-10-03 | 1991-04-11 | Boehringer Mannheim Gmbh | Neue 2-bicyclo-benzimidazole, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel |
| DE3935514A1 (de) | 1989-10-25 | 1991-05-02 | Boehringer Mannheim Gmbh | Neue bicyclo-imidazole, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel |
| US5304121A (en) | 1990-12-28 | 1994-04-19 | Boston Scientific Corporation | Drug delivery system making use of a hydrogel polymer coating |
| US5023265A (en) | 1990-06-01 | 1991-06-11 | Schering Corporation | Substituted 1-H-pyrrolopyridine-3-carboxamides |
| US5484778C1 (en) | 1990-07-17 | 2001-05-08 | Univ Cleveland Hospitals | Phthalocynine photosensitizers for photodynamic therapy and methods for their use |
| EP0558521A1 (en) | 1990-11-22 | 1993-09-08 | Janssen Pharmaceutica N.V. | Isonicotinic acid derivatives and related spiro compounds with herbicidal action |
| US5116854A (en) | 1991-06-28 | 1992-05-26 | Pfizer Inc. | Anti-inflammatory 1-heteroaryl-3-acyl-2-oxindoles |
| US5849780A (en) | 1992-01-30 | 1998-12-15 | Sanofi | 1-benzenesulfonyl-1-1,3-dihydroindol-2-one derivatives, their preparation and pharmaceutical compositions in which they are present |
| FR2708605A1 (fr) | 1993-07-30 | 1995-02-10 | Sanofi Sa | Dérivés du N-sulfonylindol-2-one, leur préparation, les compositions pharmaceutiques en contenant. |
| FR2686878B1 (fr) | 1992-01-30 | 1995-06-30 | Sanofi Elf | Derives du n-sulfonyl oxo-2 indole, leur preparation, les compositions pharmaceutiques en contenant. |
| US5663431A (en) | 1992-01-30 | 1997-09-02 | Sanofi | 1-benzenesulfonyl-1,3-dihydro-indol-2-one derivatives, their preparation and pharmaceutical compositions in which they are present |
| US5686624A (en) | 1992-01-30 | 1997-11-11 | Sanofi | 1-benzenesulfonyl-1,3-dihydro-indol-2-one derivatives, their preparation and pharmaceutical compositions in which they are present |
| US5314685A (en) | 1992-05-11 | 1994-05-24 | Agouron Pharmaceuticals, Inc. | Anhydrous formulations for administering lipophilic agents |
| AU672224B2 (en) | 1992-08-06 | 1996-09-26 | Warner-Lambert Company | 2-thioindoles (selenoindoles) and related disulfides (selenides) which inhibit protein tyrosine kinases and whichhave antitumor properties |
| US5278162A (en) | 1992-09-18 | 1994-01-11 | The Du Pont Merck Pharmaceutical Company | 3,3'-disubstituted-1,3-dihydro-2H-pyrrolo[2,3-b]heterocyclic-2-one useful in the treatment of cognitive disorders of man |
| US5296478A (en) | 1992-10-07 | 1994-03-22 | The Dupont Merck Pharmaceutical Co. | 1-substituted oxindoles as cognition enhancers |
| US5776936A (en) | 1992-11-13 | 1998-07-07 | Pharmacia & Upjohn Company | Marcfortine/paraherquamide derivatives useful as antiparasitic agents |
| DE4242451A1 (de) | 1992-12-16 | 1994-06-23 | Basf Ag | Verfahren zur Herstellung von 5-Ringheterocyclen |
| US5298522A (en) | 1993-01-22 | 1994-03-29 | Pfizer Inc. | 6-chloro-5-fluoro-3-(2-thenoyl)-2-oxindole-1-carboxamide as an analgesic and anti-inflammatory agent while maintaining a normal urine protein/creatinine ratio |
| US5716981A (en) | 1993-07-19 | 1998-02-10 | Angiogenesis Technologies, Inc. | Anti-angiogenic compositions and methods of use |
| FR2708606B1 (fr) | 1993-07-30 | 1995-10-27 | Sanofi Sa | Dérivés du N-phénylalkylindol-2-one, leur préparation, les compositions pharmaceutiques en contenant. |
| US5502072A (en) | 1993-11-26 | 1996-03-26 | Pfizer Inc. | Substituted oxindoles |
| AT400950B (de) | 1994-02-04 | 1996-04-25 | Immodal Pharmaka Gmbh | Verfahren zur technischen herstellung definierter isomerengemische aus verbindungen mit spirozyklischen - aminocarboxyl- und/oder spirozyklischen - aminocarbonyl-systemen |
| WO1995027712A1 (fr) | 1994-04-07 | 1995-10-19 | Cemaf | Nouveaux derives de spiro[indole-pyrrolidine] agonistes melatoninergiques, leur procede de preparation et leur utilisation a titre de medicament |
| FR2722195B1 (fr) | 1994-07-07 | 1996-08-23 | Adir | Nouveaux derives de 1,3-dihydro-2h-pyrrolo(2,3-b) pyridin-2-ones et oxazolo(4,5-b) pyridin-2(3h)-ones, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| US5618819A (en) | 1994-07-07 | 1997-04-08 | Adir Et Compagnie | 1,3-dihydro-2H-pyrrolo[2,3-b]pyridin-2-one and oxazolo[4,5-b]pyridin-2-(3H)-one compounds |
| WO1996019477A1 (en) | 1994-12-22 | 1996-06-27 | Smithkline Beecham Plc | Tetracyclic spiro compounds, process for their preparation and their use as 5ht1d receptor antagonists |
| US6099562A (en) | 1996-06-13 | 2000-08-08 | Schneider (Usa) Inc. | Drug coating with topcoat |
| FR2740136B1 (fr) | 1995-10-24 | 1998-01-09 | Sanofi Sa | Derives d'indolin-2-one, procede pour leur preparation et les compositions pharmaceutiques les contenant |
| CA2235686C (en) | 1995-10-24 | 2007-06-26 | Sanofi | Indolin-2-one derivatives, process for their production and the pharmaceutical compositions containing them |
| HUP9600855A3 (en) | 1996-04-03 | 1998-04-28 | Egyt Gyogyszervegyeszeti Gyar | Process for producing tenidap |
| JPH1095766A (ja) | 1996-09-19 | 1998-04-14 | Sanwa Kagaku Kenkyusho Co Ltd | アセトアミド誘導体、及びその用途 |
| FR2757157B1 (fr) | 1996-12-13 | 1999-12-31 | Sanofi Sa | Derives d'indolin-2-one, procede pour leur preparation et compositions pharmaceutiques les contenant |
| ATE467418T1 (de) | 1997-01-20 | 2010-05-15 | Immodal Pharmaka Gmbh | Verfahren und stoffe zur freisetzung eines wachstumsfaktors aus endothelzellen, und nach dem verfahren freigesetzter wachstumsfaktor sowie seine verwendung |
| NO317155B1 (no) | 1997-02-04 | 2004-08-30 | Ono Pharmaceutical Co | <omega>-cykloalkyl-prostagladin-E<N>2</N>-derivater |
| DK1008588T3 (da) | 1997-02-10 | 2003-07-28 | Ono Pharmaceutical Co | 11,15-O-dialkylprostaglandin E derivater, fremgangsmåder til fremstilling deraf og farmaceutiske sammensætninger, der omfatter dem som virksom bestanddel |
| IL132702A0 (en) | 1997-05-07 | 2001-03-19 | Galen Chemicals Ltd | Intravaginal drug delivery devices for the administration of testosterone and testosterone precursors |
| DE69821987T2 (de) | 1997-12-25 | 2004-12-16 | Ono Pharmaceutical Co. Ltd. | Omega-cycloalkyl-prostaglandin e2 derivate |
| JP4087938B2 (ja) | 1998-02-04 | 2008-05-21 | 高砂香料工業株式会社 | ヒノキチオ−ル類の分岐サイクロデキストリン包接化合物からなる抗菌剤およびそれを含有する組成物 |
| ES2217742T3 (es) | 1998-04-01 | 2004-11-01 | Cardiome Pharma Corp. | Compuestos de amino ciclohexil eter y usos del mismo. |
| US20040038970A1 (en) | 1998-06-12 | 2004-02-26 | Societe De Conseils De Recherches Etd' Application Scientifiques, S.A.S. A Paris, France Corp. | Beta-carboline compounds |
| US6235780B1 (en) | 1998-07-21 | 2001-05-22 | Ono Pharmaceutical Co., Ltd. | ω-cycloalkyl-prostaglandin E1 derivatives |
| WO2000006556A1 (en) | 1998-07-27 | 2000-02-10 | Abbott Laboratories | Substituted oxazolines as antiproliferative agents |
| SE9900100D0 (sv) | 1999-01-15 | 1999-01-15 | Astra Ab | New compounds |
| US6355648B1 (en) | 1999-05-04 | 2002-03-12 | American Home Products Corporation | Thio-oxindole derivatives |
| US6407101B1 (en) | 1999-05-04 | 2002-06-18 | American Home Products Corporation | Cyanopyrroles |
| MXPA01011832A (es) | 1999-05-21 | 2002-06-21 | Squibb Bristol Myers Co | Inhibidores de cinasas, de pirrolotriazina. |
| JP3833532B2 (ja) | 1999-07-21 | 2006-10-11 | ベーリンガー インゲルハイム ファーマシューティカルズ インコーポレイテッド | 炎症性疾患の治療において有用な小分子 |
| EP1202994B1 (en) | 1999-07-21 | 2004-04-14 | AstraZeneca AB | New compounds |
| US6566372B1 (en) | 1999-08-27 | 2003-05-20 | Ligand Pharmaceuticals Incorporated | Bicyclic androgen and progesterone receptor modulator compounds and methods |
| WO2001038564A2 (en) | 1999-11-26 | 2001-05-31 | Mcgill University | Loci for idiopathic generalized epilepsy, mutations thereof and method using same to assess, diagnose, prognose or treat epilepsy |
| FR2807038B1 (fr) | 2000-04-03 | 2002-08-16 | Sanofi Synthelabo | Nouveaux derives d'indolin-2-one, leur preparation et les compositions pharmaceutiques les contenant |
| AU2002213204A1 (en) | 2000-10-13 | 2002-04-22 | Bristol-Myers Squibb Company | Selective maxi-K- potassium channel openers functional under conditions of high intracellular calcium concentration, methods and uses thereof |
| US6825220B2 (en) | 2000-11-10 | 2004-11-30 | Eli Lilly And Company | 3-Substituted oxindole β 3 agonists |
| US6670357B2 (en) | 2000-11-17 | 2003-12-30 | Bristol-Myers Squibb Company | Methods of treating p38 kinase-associated conditions and pyrrolotriazine compounds useful as kinase inhibitors |
| US20030078278A1 (en) | 2001-06-26 | 2003-04-24 | Pfizer Inc. | Spiropiperidine compounds as ligands for ORL-1 receptor |
| DE60211199T2 (de) | 2001-08-14 | 2007-02-01 | Eli Lilly And Co., Indianapolis | 3-substituierte oxindol-beta-3-agonisten |
| CA2465328C (en) | 2001-11-01 | 2011-06-14 | Michael Francis Gross | Piperidines |
| ES2338539T3 (es) | 2001-11-01 | 2010-05-10 | Icagen, Inc. | Pirazolamidas para uso en el tratamiento del dolor. |
| JP2005514366A (ja) | 2001-11-20 | 2005-05-19 | イーライ・リリー・アンド・カンパニー | 3−置換オキシインドールβ3アゴニスト |
| SE0104341D0 (sv) | 2001-12-20 | 2001-12-20 | Astrazeneca Ab | New use |
| EP1470126A1 (en) | 2002-01-28 | 2004-10-27 | Pfizer Inc. | N-substituted spiropiperidine compounds as ligands for orl-1 receptor |
| US6995144B2 (en) | 2002-03-14 | 2006-02-07 | Eisai Co., Ltd. | Nitrogen containing heterocyclic compounds and medicines containing the same |
| JP2006508893A (ja) | 2002-03-15 | 2006-03-16 | イーライ・リリー・アンド・カンパニー | ステロイドホルモン核内レセプターモジュレーターとしてのジヒドロインドール−2−オン誘導体 |
| GB0213715D0 (en) | 2002-06-14 | 2002-07-24 | Syngenta Ltd | Chemical compounds |
| JP2005535625A (ja) | 2002-06-25 | 2005-11-24 | ワイス | 皮膚障害の治療におけるチオオキシインドール誘導体の使用 |
| IL165395A0 (en) | 2002-06-25 | 2006-01-15 | Wyeth Corp | Use of thio-oxubdile derivatives in treatment of hormone-related conditions |
| US7256218B2 (en) | 2002-11-22 | 2007-08-14 | Jacobus Pharmaceutical Company, Inc. | Biguanide and dihydrotriazine derivatives |
| KR20130066701A (ko) | 2003-02-24 | 2013-06-20 | 미쓰비시 타나베 파마 코퍼레이션 | 테나토프라졸의 거울상 이성질체 및 치료를 위한 그 용도 |
| JP2007516955A (ja) | 2003-05-16 | 2007-06-28 | ファイザー・プロダクツ・インク | 双極性障害および関連症候の治療 |
| EP1633361A1 (en) | 2003-05-16 | 2006-03-15 | Pfizer Products Inc. | Anxiety treatments with ziprasidone |
| EP1633360A1 (en) | 2003-05-16 | 2006-03-15 | Pfizer Products Incorporated | Treatment of psychotic and depressive disorders |
| CA2625837A1 (en) | 2003-05-16 | 2004-11-25 | Pfizer Products Inc. | Method for enhancing cognition using ziprasidone |
| BRPI0412348A (pt) | 2003-07-30 | 2006-09-05 | Xenon Pharmaceuticals Inc | derivados de piperazina e seu uso como agentes terapêuticos |
| DE10337184A1 (de) | 2003-08-13 | 2005-03-10 | Gruenenthal Gmbh | Substituierte 3-Pyrrolidin-Indol-Derivate |
| WO2005016913A1 (en) | 2003-08-19 | 2005-02-24 | Pfizer Japan, Inc. | Tetrahydroisoquinoline or isochroman compounds as orl-1 receptor ligands for the treatment of pain and cns disorders |
| WO2005035498A1 (ja) | 2003-10-08 | 2005-04-21 | Dainippon Sumitomo Pharma Co., Ltd. | 含窒素二環性化合物の摂食調節剤としての用途 |
| EP1557166A1 (en) | 2004-01-21 | 2005-07-27 | Newron Pharmaceuticals S.p.A. | Alpha-aminoamide derivatives useful in the treatment of lower urinary tract disorders |
| US7507760B2 (en) | 2004-01-22 | 2009-03-24 | Neuromed Pharmaceuticals Ltd. | N-type calcium channel blockers |
| GB0406867D0 (en) | 2004-03-26 | 2004-04-28 | F2G Ltd | Antifungal agents |
| WO2005097136A1 (en) | 2004-03-29 | 2005-10-20 | Merck & Co., Inc. | Biaryl substituted pyrazinones as sodium channel blockers |
| WO2005092858A2 (en) | 2004-03-29 | 2005-10-06 | Pfizer Japan Inc. | Alpha aryl or heteroaryl methyl beta piperidino propanamide compounds as orl1-receptor antagonist |
| WO2005099689A1 (en) | 2004-04-01 | 2005-10-27 | Case Western Reserve University | Topical delivery of phthalocyanines |
| GT200500063A (es) | 2004-04-01 | 2005-10-14 | Metodo para tratar la esquizofrenia y/o anormalidades glucoregulatorias | |
| US20070299102A1 (en) | 2004-04-08 | 2007-12-27 | Topo Target A/S | Diphenyl Ox-Indol-2-One Compounds and Their Use in the Treatment of Cancer |
| AU2005237520B2 (en) | 2004-04-27 | 2012-01-19 | Wyeth | Purification of progesterone receptor modulators |
| JP2007536283A (ja) | 2004-05-05 | 2007-12-13 | ユニバイオスクリーン エス.アー. | ナフタルイミド誘導体、それらの製造方法、およびそれらの医薬組成物 |
| TWI350168B (en) | 2004-05-07 | 2011-10-11 | Incyte Corp | Amido compounds and their use as pharmaceuticals |
| MXPA06011658A (es) | 2004-05-14 | 2006-12-14 | Pfizer Prod Inc | Derivados de pirimidina para el tratamiento del crecimiento celular anormal. |
| AU2005267331A1 (en) | 2004-06-24 | 2006-02-02 | Incyte Corporation | Amido compounds and their use as pharmaceuticals |
| GT200500186A (es) | 2004-07-07 | 2006-03-02 | Regimenes anticonceptivos con antagonistas del receptor de progesterona y kits | |
| GT200500183A (es) | 2004-08-09 | 2006-04-10 | Moduladores del receptor de progesterona que comprenden derivados de pirrol-oxindol y sus usos | |
| GT200500185A (es) | 2004-08-09 | 2006-04-10 | Moduladores del receptor de progesterona que comprenden derivados de pirrol-oxindol y sus usos | |
| JP4677323B2 (ja) | 2004-11-01 | 2011-04-27 | キヤノン株式会社 | 画像処理装置及び画像処理方法 |
| MX2007005820A (es) | 2004-11-18 | 2007-07-18 | Incyte Corp | Inhibidores de deshidrogenasa esteroide hidroxilo 11-beta tipo 1 y metodos de uso de los mismos. |
| DE102005007694A1 (de) | 2005-02-18 | 2006-09-21 | Henkel Kgaa | Mittel zum Färben von keratinhaltigen Fasern |
| MX2007010272A (es) | 2005-02-22 | 2008-03-12 | Univ Michigan | Inhibidores de moleculas pequenas de mdm2 y usos de los mismos. |
| MY145694A (en) | 2005-04-11 | 2012-03-30 | Xenon Pharmaceuticals Inc | Spiroheterocyclic compounds and their uses as therapeutic agents |
| AR056317A1 (es) | 2005-04-20 | 2007-10-03 | Xenon Pharmaceuticals Inc | Compuestos de oxindol y composicion farmaceutica |
| AR053713A1 (es) | 2005-04-20 | 2007-05-16 | Xenon Pharmaceuticals Inc | Compuestos heterociclicos y sus usos como agentes terapeuticos |
| WO2006118955A2 (en) | 2005-04-29 | 2006-11-09 | Wyeth | Process for preparing 3,3-disubstituted oxindoles and thio-oxindoles |
| AR057023A1 (es) | 2005-05-16 | 2007-11-14 | Gilead Sciences Inc | Compuestos heterociclicos con propiedades inhibidoras de hiv-integrasa |
| DK1924264T5 (en) | 2005-09-01 | 2014-03-24 | Hoffmann La Roche | Diaminopyrimidines as P2X3- and P2X2 / 3 modulators |
| AU2007258675A1 (en) | 2006-06-09 | 2007-12-21 | Merck Sharp & Dohme Corp. | Benzazepinones as sodium channel blockers |
| WO2008046083A2 (en) | 2006-10-12 | 2008-04-17 | Xenon Pharmaceuticals Inc. | Use of oxindole compounds as therapeutic agents |
| EP2073806B1 (en) * | 2006-10-12 | 2012-02-15 | Xenon Pharmaceuticals Inc. | Use of spiro-oxindole compounds as therapeutic agents |
| WO2008046082A2 (en) | 2006-10-12 | 2008-04-17 | Xenon Pharmaceuticals Inc. | Use of heterocyclic compounds as therapeutic agents |
| WO2008046084A2 (en) | 2006-10-12 | 2008-04-17 | Xenon Pharmaceuticals Inc. | Spiroheterocyclic compounds and their uses as therapeutic agents |
| US20110237567A9 (en) | 2006-10-12 | 2011-09-29 | Xenon Pharmaceuticals Inc. | Tricyclic spiro-oxindole derivatives and their uses as therapeutic agents |
| WO2008046087A2 (en) | 2006-10-12 | 2008-04-17 | Xenon Pharmaceuticals Inc. | Spiro compounds and their uses as therapeutic agents |
| US20110294842A9 (en) | 2006-10-12 | 2011-12-01 | Xenon Pharmaceuticals Inc. | Spiro (furo [3, 2-c] pyridine-3-3' -indol) -2' (1'h)-one derivatives and related compounds for the treatment of sodium-channel mediated diseases, such as pain |
| AR063277A1 (es) | 2006-10-12 | 2009-01-14 | Xenon Pharmaceuticals Inc | Compuestos espiroheterociclicos y usos como agentes terapeuticos |
| GB0704846D0 (en) | 2007-03-13 | 2007-04-18 | Futura Medical Dev Ltd | Topical pharmaceutical formulation |
| WO2008117050A1 (en) | 2007-03-27 | 2008-10-02 | Astrazeneca Ab | Pyrazolyl-amino-substituted pyrazines and their use for the treatment of cancer |
| CA2689137C (en) * | 2007-05-29 | 2017-05-02 | Intrexon Corporation | Chiral diacylhydrazine ligands for modulating the expression of exogenous genes via an ecdysone receptor complex |
| EP2350091B1 (en) | 2008-10-17 | 2015-06-03 | Xenon Pharmaceuticals Inc. | Spiro-oxindole compounds and their use as therapeutic agents |
| CN106928247A (zh) | 2008-10-17 | 2017-07-07 | 泽农医药公司 | 螺羟吲哚化合物及其作为治疗剂的用途 |
| WO2010053998A1 (en) | 2008-11-05 | 2010-05-14 | Xenon Pharmaceuticals, Inc. | Spiro-condensed indole derivatives as sodium channel inhibitors |
| WO2010078307A1 (en) | 2008-12-29 | 2010-07-08 | Xenon Pharmaceuticals Inc. | Spiro-oxindole-derivatives as sodium channel blockers |
| WO2010132352A2 (en) | 2009-05-11 | 2010-11-18 | Xenon Pharmaceuticals Inc. | Spiro compounds and their use as therapeutic agents |
| AR077252A1 (es) | 2009-06-29 | 2011-08-10 | Xenon Pharmaceuticals Inc | Enantiomeros de compuestos de espirooxindol y sus usos como agentes terapeuticos |
| PE20170202A1 (es) | 2009-10-14 | 2017-03-24 | Xenon Pharmaceuticals Inc | Metodos sinteticos para compuestos espiro-oxoindol |
| US20110086899A1 (en) | 2009-10-14 | 2011-04-14 | Xenon Pharmaceuticals Inc. | Pharmaceutical compositions for oral administration |
| MA34083B1 (fr) | 2010-02-26 | 2013-03-05 | Xenon Pharmaceuticals Inc | Compositions pharmaceutques de composé spiro-oxindole pour administration topique et leur utilisation en tant qu'agents thérapeutiques |
| US9487535B2 (en) | 2012-04-12 | 2016-11-08 | Xenon Pharmaceuticals Inc. | Asymmetric syntheses for spiro-oxindole compounds useful as therapeutic agents |
-
2010
- 2010-06-25 AR ARP100102282A patent/AR077252A1/es unknown
- 2010-06-28 EP EP14000690.9A patent/EP2789617B1/en active Active
- 2010-06-28 PL PL10731662.2T patent/PL2448943T3/pl unknown
- 2010-06-28 ES ES10731662.2T patent/ES2578779T3/es active Active
- 2010-06-28 CN CN201080029572.2A patent/CN102471347B/zh active Active
- 2010-06-28 ES ES14000690.9T patent/ES2600160T3/es active Active
- 2010-06-28 PE PE2011002098A patent/PE20120413A1/es not_active Application Discontinuation
- 2010-06-28 PE PE2015002585A patent/PE20160216A1/es not_active Application Discontinuation
- 2010-06-28 EP EP16001748.9A patent/EP3156407A1/en not_active Withdrawn
- 2010-06-28 CN CN201510007582.0A patent/CN104650106A/zh active Pending
- 2010-06-28 HU HUE10731662A patent/HUE029658T2/en unknown
- 2010-06-28 RU RU2012102896/04A patent/RU2535667C2/ru not_active IP Right Cessation
- 2010-06-28 JP JP2012517823A patent/JP2012532107A/ja not_active Withdrawn
- 2010-06-28 DK DK10731662.2T patent/DK2448943T3/en active
- 2010-06-28 EP EP10731662.2A patent/EP2448943B1/en active Active
- 2010-06-28 MX MX2013008427A patent/MX342298B/es unknown
- 2010-06-28 MX MX2012000028A patent/MX2012000028A/es active IP Right Grant
- 2010-06-28 US US12/825,168 patent/US8450358B2/en active Active
- 2010-06-28 PT PT107316622T patent/PT2448943T/pt unknown
- 2010-06-28 BR BRPI1012129A patent/BRPI1012129A2/pt not_active IP Right Cessation
- 2010-06-28 SI SI201031198A patent/SI2448943T1/sl unknown
- 2010-06-28 CA CA2764878A patent/CA2764878C/en active Active
- 2010-06-28 WO PCT/US2010/040187 patent/WO2011002708A1/en active Application Filing
- 2010-06-28 SG SG2011090081A patent/SG176307A1/en unknown
- 2010-06-28 KR KR1020117031238A patent/KR101751378B1/ko active IP Right Grant
- 2010-06-28 MY MYPI2011006363A patent/MY159099A/en unknown
- 2010-06-28 AU AU2010266549A patent/AU2010266549B2/en active Active
- 2010-06-28 NZ NZ596903A patent/NZ596903A/en unknown
- 2010-06-28 PL PL14000690T patent/PL2789617T3/pl unknown
- 2010-06-29 TW TW099121292A patent/TWI465452B/zh not_active IP Right Cessation
-
2011
- 2011-12-06 CO CO11168005A patent/CO6470866A2/es not_active Application Discontinuation
- 2011-12-06 ZA ZA2011/08960A patent/ZA201108960B/en unknown
- 2011-12-09 EC EC2011011512A patent/ECSP11011512A/es unknown
- 2011-12-16 MA MA34459A patent/MA33552B1/fr unknown
- 2011-12-16 HR HR20110946A patent/HRP20110946A2/hr not_active Application Discontinuation
- 2011-12-23 TN TNP2011000664A patent/TN2011000664A1/en unknown
- 2011-12-28 CL CL2011003335A patent/CL2011003335A1/es unknown
- 2011-12-29 IL IL217285A patent/IL217285A/en not_active IP Right Cessation
-
2012
- 2012-09-14 US US13/619,915 patent/US8883840B2/en not_active Expired - Fee Related
- 2012-09-28 HK HK15103646.5A patent/HK1203192A1/xx not_active IP Right Cessation
- 2012-09-28 HK HK12109607.2A patent/HK1168854A1/zh unknown
-
2014
- 2014-10-09 US US14/510,634 patent/US9480677B2/en active Active
- 2014-11-20 JP JP2014235262A patent/JP2015038153A/ja not_active Withdrawn
-
2015
- 2015-10-07 PH PH12015502323A patent/PH12015502323A1/en unknown
- 2015-10-08 IL IL241985A patent/IL241985A/en not_active IP Right Cessation
-
2016
- 2016-06-24 HR HRP20160732TT patent/HRP20160732T1/hr unknown
- 2016-06-28 CY CY20161100581T patent/CY1117776T1/el unknown
- 2016-06-29 SM SM201600203T patent/SMT201600203B/it unknown
- 2016-09-28 US US15/278,759 patent/US20170073351A1/en not_active Abandoned
- 2016-10-07 JP JP2016198877A patent/JP2017002085A/ja not_active Withdrawn
-
2017
- 2017-01-26 IL IL250314A patent/IL250314A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU97112188A (ru) * | 1994-12-22 | 1999-05-27 | Смитклайн Бичам П.Л.С. | Тетрациклические спиросоединения, способ их получения и их применение в качестве антагонистов рецепторов 5ht1d |
| RU2006123424A (ru) * | 2003-12-02 | 2008-01-10 | Экселиксис, Инк. (Us) | Производные азепиноиндола в качестве фармацевтических средств |
| WO2006110917A2 (en) * | 2005-04-11 | 2006-10-19 | Xenon Pharmaceuticals Inc. | Spiro-oxindole compounds and their uses as therapeutic agents |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2744766C2 (ru) * | 2015-07-16 | 2021-03-15 | Эббви С.А.Р.Л. | Замещенные трициклические соединения и способ применения |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2535667C2 (ru) | Энантиомеры спиро-оксиндольных соединений и их применение в качестве терапевтических средств | |
| EP2752417B1 (en) | Spiro-oxindole compounds and their uses as therapeutic agents | |
| JP2010522690A (ja) | 三環式スピロオキシインドール誘導体および治療薬としてのその使用 | |
| WO2008134553A1 (en) | Methods of using bicyclic compounds in treating sodium channel-mediated diseases | |
| CN101166744A (zh) | 螺杂环化合物及其作为治疗剂的用途 | |
| BRPI0719857A2 (pt) | Compostos espiro-oxindol úteis no tratamento de doenças ou condições mediadas por canal de sódio. | |
| JP2008536942A (ja) | 2−ピロリドン誘導体および炎症状態および疼痛の治療のためのその使用 | |
| WO2008109856A2 (en) | Methods of using diazepinone compounds in treating sodium channel-mediated diseases or conditions | |
| AU2015224493B2 (en) | Enantiomers of spiro-oxindole compounds and their uses as therapeutic agents | |
| WO2008134547A1 (en) | Methods of using hydroxycyclohexane and hydroxypiperidine compounds in treating sodium channel-mediated diseases or conditions | |
| WO2008121859A1 (en) | Methods of using tricyclic compounds in treating sodium channel-mediated diseases or conditions | |
| WO2008106633A1 (en) | Methods of using benzodioxine compounds in treating sodium channel-mediated diseases or conditions |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20180629 |