RU2321401C2 - Лекарственное средство против гиперактивного мочевого пузыря, включающее производное анилида уксусной кислоты в качестве активного ингредиента - Google Patents
Лекарственное средство против гиперактивного мочевого пузыря, включающее производное анилида уксусной кислоты в качестве активного ингредиента Download PDFInfo
- Publication number
- RU2321401C2 RU2321401C2 RU2005117367/15A RU2005117367A RU2321401C2 RU 2321401 C2 RU2321401 C2 RU 2321401C2 RU 2005117367/15 A RU2005117367/15 A RU 2005117367/15A RU 2005117367 A RU2005117367 A RU 2005117367A RU 2321401 C2 RU2321401 C2 RU 2321401C2
- Authority
- RU
- Russia
- Prior art keywords
- drug
- bladder
- test
- compound
- overactive bladder
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/02—Drugs for disorders of the urinary system of urine or of the urinary tract, e.g. urine acidifiers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/38—Nitrogen atoms
- C07D277/40—Unsubstituted amino or imino radicals
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Urology & Nephrology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Thiazole And Isothizaole Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Изобретение относится к лекарственным средствам и касается лекарственного средства для лечения гиперактивного мочевого пузыря, включающего анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль в качестве активного ингредиента. Изобретение позволяет расширить арсенал средств для лечения гиперактивного мочевого пузыря. 2 н. и 8 з.п. ф-лы, 5 ил., 5 табл.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к лекарственному средству против гиперактивного мочевого пузыря, включающему анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]-этил]уксусной кислоты или его соль в качестве активного ингредиента.
Предпосылки создания изобретения
Мочевой пузырь млекопитающих находится под двойным контролем пучка вегетативных нервных волокон и сжимателя, расслабляющегося через β-адреналиновый рецептор путем стимуляции симпатического нерва после мочеиспускания, тогда как во время выделения мочи он сокращается через мускариновый рецептор путем стимуляции парасимпатического нерва. В качестве лекарственного средства против гиперактивного мочевого пузыря, возникающего тогда, когда двойной контроль как таковой разбалансирован, в настоящее время используют главным образом антихолинергические агенты, такие как пропиверингидрохлорид и оксибутинингидрохлорид. Однако имеются трудноизлечимые случаи заболевания, при которых проявляется резистентность к таким соединениям, и имеются побочные эффекты, вызываемые антихолинергическими агентами, такие как дисфункция мочеиспускания и ксеростомия, следовательно, имеется "текущее" состояние, при котором не всегда достигают удовлетворительных клинических результатов.
Далее как результат увеличения у населения людей пожилого возраста в последние годы, количество пациентов, страдающих от гиперактивного мочевого пузыря, возрастает каждый год и, с точки зрения качества жизни пациентов, существует настоятельная потребность в нахождении новых лекарственных средств.
Авторы настоящего изобретения в примере 41 в публикации Международной патентной заявки WO-99/20607 сообщают, что дигидрохлорид анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]-уксусной кислоты обладает как стимулирующим воздействием на секрецию инсулина, так и усиливающим воздействием в отношении чувствительности к инсулину, и, далее, обладает действием против ожирения и антигиперлипемическим действием, вследствие чего является пригодным соединением для лечения сахарного диабета, однако не приводится ни указания, ни раскрытия в отношении терапевтического использования для лечения гиперактивного мочевого пузыря (см. патентный документ 1).
Между тем, в публикации Международной патентной заявки WO-98/07445 в качестве агента для профилактики и лечения частоты мочеиспускания и недержания мочи, включающего лекарственное средство, обладающее стимулирующим воздействием на β3-адреналиновый рецептор, в качестве активного ингредиента указан CGP-12,177A нижеследующей химической структурной формулы, обладающий релаксирующим воздействием на мочевой пузырь (см. патентный документ 2). CGP-12,177A известен как селективное лекарственное средство, оказывающее стимулирующее воздействие на β3-адреналиновый рецептор (см. непатентные документы 1 и 2).
В публикации Международной патентной заявки WO-99/31045 указываются соединения, отвечающие нижеследующей формуле, как обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 3).
(В формуле R1 означает гидроксильную группу, низшую алкильную группу, аралкоксильную группу, аминогруппу и т.д.; R2 означает гидроксильную группу или низшую алкильную группу; R3 означает атом водорода или атом галогена; R4 и R5, каждый, означает атом водорода, атом галогена или низшую алкильную группу; и А означает низшую алкиленовую группу.)
В публикации Международной патентной заявки WO-99/52856 указываются соединения нижеследующей формулы, обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 4).
(В формуле R1 означает атом водорода, низшую алкильную группу или аралкильную группу; R2 означает атом водорода, низшую алкильную группу или атом галогена; А означает атом кислорода или иминогруппу.)
В публикации Международной патентной заявки WO-00/02846 указываются соединения нижеследующей формулы, обладающие стимулирующим воздействием на β3-адреналиновый рецептор и в качестве средства для предотвращения или лечения заболеваний, вызванных ожирением, гипергликемией и ускорением действия кишечника, и заболеваний, вызываемых частотой мочеиспускания или недержанием мочи, меланхолией, желчным конкрементом или ускорением действия желчных протоков (см. патентный документ 5).
(В формуле R1 означает гидроксильную группу и т.д.; один из R2 и R3 означает атом водорода, атом галогена и т.д., а другой означает атом водорода; и R4 означает атом галогена и т.д.)
Патентный документ 1: публикация Международной патентной заявки WO-99/20607.
Патентный документ 2: публикация Международной патентной заявки WO-98/07445.
Патентный документ 3: публикация Международной патентной заявки WO-99/31045.
Патентный документ 4: публикация Международной патентной заявки WO-99/52856.
Патентный документ 5: публикация Международной патентной заявки WO-00/02846.
Непатентный документ 1: Drugs of the Future, 1993, том 18, № 6, с. 542.
Непатентный документ 2: The American Society for Pharmacology and Experimental Therapeutics, 1993, том 44, с. 1100.
Раскрытие изобретения
Авторами настоящего изобретения проведены интенсивные исследования в отношении выявления новых фармакологических воздействий анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соли (в дальнейшем называется как "активный ингредиент согласно настоящему изобретению"), который пригоден в качестве лекарственного средства для лечения сахарного диабета, и в результате ими было найдено, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства особенно для лечения гиперактивного мочевого пузыря. Согласно настоящему изобретению гиперактивный мочевой пузырь определяют как заболевание, при котором часто возникает позыв на мочеиспускание. Хотя доброкачественная гиперплазия предстательной железы служит примером одной из причин гиперактивного мочевого пузыря, имеется много случаев, где причина неясна, и их называют идиопатическим гиперактивным мочевым пузырем. Хотя гиперактивный мочевой пузырь иногда сопровождается частотой мочеиспускания и недержанием мочи, это не ограничивается заболеванием, которое всегда сопровождается частотой мочеиспускания и недержанием мочи. Так, в случае слабо гиперактивного мочевого пузыря пациент чувствителен в отношении ощущения желания к мочеиспусканию и часто имеет ощущение позыва на мочеиспускание, однако на самом деле он/она в состоянии удерживать свою мочу в течение промежутка времени. Однако, даже в случае слабо гиперактивного мочевого пузыря решительно требуется его положительная динамика, принимая во внимание качество жизни пациента. С другой стороны, "тяжелый" гиперактивный мочевой пузырь иногда сопровождается частотой мочеиспускания и недержанием мочи. Частота мочеиспускания представляет собой состояние, при котором число раз мочеиспускания больше, чем обычный один раз, и показано, что должно быть не меньше, чем примерно два раза ночью, и не меньше, чем примерно 8 раз в течение 24 часов. При недержании мочи происходит непроизвольное истечение мочи и это определяют как состояние, где имеется проблема в социальном или гигиеническом отношении и классифицируется как недержание мочи при напряжении, которое наблюдается, когда прикладывается внутрибрюшное давление, такое как кашель и чиханье; неотложное недержание мочи, при котором внезапно проявляется позыв на мочеиспускание и моча подтекает до достижения туалета; и недержание мочи смешанного типа, при котором присутствуют как недержание мочи, так и при напряжении неотложное недержание мочи.
Отличительным признаком настоящего изобретения является то, что активный ингредиент согласно настоящему изобретению главным образом уменьшает частое появление позывов на мочеиспускание у пациента и число раз мочеиспускания и нормализует состояние мочеиспускания. Это происходит без указания на то, что гиперактивный мочевой пузырь согласно настоящему изобретению включает не только тот, который возникает в результате доброкачественной гиперплазии предстательной железы, но и также тот, который сопровождается позывом на мочеиспускание, недержанием мочи и поллакиурией.
В соответствии с патентным документом 1 активный ингредиент согласно настоящему изобретению пригоден в дополнение к лечению диабета в качестве средства для профилактики и лечения других заболеваний, где улучшение в отношении симптома может быть достигнуто путем уменьшения симптома ожирения и гиперлипемии, такого как артериосклероз, ишемического заболевания сердца, такого как инфаркт сердца и стенокардия, артериального склероза головного мозга, такого как инфаркт мозга, аневризма и т.д. Однако совершенно не приводится ни описания, ни указания на то, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря.
В патентном документе 2 также не указывается на использование для лечения гиперактивного мочевого пузыря. В патентном документе 2 приводится описание того, что только CGP-12,177A оказывает релаксирующее воздействие на мочевой пузырь как соединение, обладающее селективным стимулирующим воздействием на β3-адреналиновый рецептор. Однако по сравнению с CGP-12,177A активный игредиент согласно настоящему изобретению обладает намного более сильным релаксирующим воздействием на мочевой пузырь. Кроме того, в патентном документе 2 не приводится описание тестов in vivo, показывающих полезность для лечения гиперактивного мочевого пузыря, таких как "тест на определение ритмичного сокращения мочевого пузыря крысы" и "тест на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крыс".
Далее, в патентных документах 3-5 также не указывается на использование против гиперактивного мочевого пузыря. Соединения, указанные в патентных документах 3-5, и активный ингредиент согласно настоящему изобретению различаются по их основным структурам в том отношении, что соединения, указанные в документах, всегда содержат фенольный цикл, однако не включают тиазольного цикла и также не содержат амидной связи. Кроме того, в патентных документах 3-5 нет описания тестов in vivo, показывающих полезность для лечения гиперактивного мочевого пузыря, таких как "тест на определение ритмичного сокращения мочевого пузыря крысы" и "тест на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крысы".
Настоящее изобретение теперь будет подробно пояснено ниже.
Согласно настоящему изобретению активным ингредиентом является анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль. Отличительным признаком настоящего изобретения является то, что найдено, что активный ингредиент согласно настоящему изобретению пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря, что представляет собой его новое применение.
В особенности предпочтительно, что активный ингредиент согласно настоящему изобретению представляет собой свободное вещество, не являющееся солью. Однако он может образовывать соль с кислотой, и примерами соли являются аддитивные соли с неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, и с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфокислота, этансульфокислота и глутаминовая кислота. Активный ингредиент согласно настоящему изобретению, являющийся солью, может быть легко получен из свободного вещества путем обычной реакции солеобразования. Активный ингредиент, согласно настоящему изобретению, далее включает гидрат, сольват и обладает полиморфизмом. Активный ингредиент согласно настоящему изобретению далее еще включает фармакологически приемлемое пролекарство. Что касается группы для образования пролекарства, то примером может служить указанное в Prog. Med., 5, 2157-2161 (1985) и "Iyakuhin no Kaihatsu" (Разработка лекарств)(Hirokawa Shoten, 1990), том 7, Molecule Design, 163-198.
Лекарственное средство, содержащее активный ингредиент, согласно настоящему изобретению может быть в любой из форм для перорального введения, как таблетки, пилюли, капсулы, гранулы, разбавляемые порошки и т.д., и для парентерального введения, как лекарственная форма для ингаляции и т.д. В качестве твердой композиции для перорального введения используют таблетки, разбавляемые порошки, гранулы и т.д. В твердой композиции, как таковой, один или более активных ингредиентов смешаны по меньшей мере с одним инертным эксципиентом, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон и метасиликаталюминат магния. Композиция обычно может содержать инертную добавку, такую как смазывающее вещество (например, стеарат магния), дезинтегрирующий агент (например, натриевая соль карбоксиметилкрахмала), солюбилизирующий агент и т.д. Таблетки и пилюли, если необходимо, могут быть покрыты оболочкой из сахара или средством, дающим внутрижелудочно- или энтеросолюбильную оболочку. Доза может быть соответственно определена для каждого случая, принимая во внимание симптом, возраст и пол субъекта, которому должна быть введена, и т.д. Обычно она составляет от примерно 0,01 мг/кг до 100 мг/кг в сутки для взрослого в случае перорального введения и вводится либо один раз, либо путем разделения на количество частей от двух до четырех.
Активный ингредиент согласно настоящему изобретению может быть легко получен способом, указанным в патентном документе 1, однако так как способ получения свободного вещества, которое является предпочтительным в качестве активного ингредиента согласно настоящему изобретению, там конкретно не указан, такой способ получения представлен в примерах получения. Схема получения поясняется нижеследующим образом.
Примеры получения (способ получения активного ингредиента согласно настоящему изобретению)
Стадия 1
К смеси 5,90 кг моногидрохлорида 4-нитрофенилэтиламина, 4,43 кг (R)-миндальной кислоты, 2,94 кг триэтиламина и 22 л N,N-диметилформамида добавляют 3,93 кг гидроксибензтриазола и 5,58 кг моногидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), после чего перемешивают примерно при комнатной температуре в течение 2 часов. Затем туда добавляют 0,28 кг EDC, и смесь перемешивают примерно при комнатной температуре в течение одной ночи. Реакционный раствор разбавляют с помощью 10 л воды и экстрагируют этилацетатом (60 л, 30 л). Органический слой последовательно промывают с помощью 60 л 1 М хлористоводородной кислоты, 60 л 20%-ного водного раствора карбоната калия и воды (60 л, 60 л) и концентрируют в вакууме при температуре от 10°С до 19°С. Остаток растворяют в 35 л толуола при нагревании до 87°С, охлаждают и перемешивают при температуре 20°С в течение одной ночи. Полученные в результате кристаллы отфильтровывают и промывают с помощью 10 л толуола. Их высушивают в вакууме, получая 7,66 кг (R)-2-гидрокси-N-[2-(4-нитрофенил)этил]-2-фенилацетамида в виде кристаллов слегка желтого цвета.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=2,87(2Н, т, J=7,2 Гц), 3,30-3,46 (2Н, м), 4,85(1Н, д, J=4,8 Гц), 6,12(1Н, д, J=4,8 Гц), 7,20-7,33(5Н, м), 7,40 (2Н, д, J=8,0 Гц), 8,04-8,12 (3Н, м).
Масс-спектр (FAB (ионизация бомбардировкой быстрыми атомами)) m/z: 301 (М+Н)+.
Стадия 2
Смесь 7,51 кг (R)-2-гидрокси-N-[2-(4-нитрофенил)этил]-2-фенилацетамида, 23 л 1,3-диметил-2-имидазолидинона и 23 л тетрагидрофурана охлаждают до температуры -18°С и к смеси прикапывают 49,4 кг 1 М раствора борана в тетрагидрофуране при температуре не выше чем -7°С. После этого температуру смеси повышают до 70°С с последующим перемешиванием в течение 5 часов. Реакционную смесь охлаждают до температуры -12°С и добавляют 2,9 кг метанола и 5,9 кг концентрированной соляной кислоты при температуре не выше чем 5°С. После перемешивания при температуре 68°С в течение 1 часа смесь концентрируют в вакууме вплоть до объема, составляющего 50 л. Туда добавляют 60 кг 30%-ного водного раствора К2СО3 и 6 л воды, после чего экстрагируют с помощью 75 л этилацетата. Органический слой промывают с помощью 75 л воды и концентрируют в вакууме. К остатку добавляют 75 л изопропанола, смесь растворяют при температуре 40°С и добавляют 2,46 кг концентрированной соляной кислоты для кристаллизации при последующем перемешивании при температуре 23°С в течение одной ночи. Кристаллы отфильтровывают и промывают с помощью 38 л изопропанола. Их высушивают в вакууме, получая 7,29 кг (R)-2-[[2-(4-нитрофенил)этил]амино]-1-фенилэтанолмоногидрохлорида.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=3,00-3,08 (1Н, м), 3,15-3,30 (5Н, м), 5,00-5,05 (1Н, м), 6,23 (1Н, д, J=4,0 Гц), 7,29-7,35 (1Н, м), 7,36-7,43 (4Н, м), 7,57 (2Н, д, J=8,4 Гц), 8.21 (2Н, д, J=8,4 Гц), 9,12 (2Н, ушир.).
Масс-спектр (FAB) m/z: 287 (М+Н)+.
Стадия 3
Смесь 11,0 кг (R)-2-[[2-(4-нитрофенил)этил]амино]-1-фенилэтанолмоногидрохлорида, 110 л метанола и 1,20 кг влажного 10 %-ного палладия-на-угле (степень смачивания: 54,2%) перемешивают в атмосфере водорода вплоть до прекращения поглощения водорода. Реакционный раствор отфильтровывают и фильтрат концентрируют в вакууме. К остатку добавляют 40 л метанола для растворения при температуре 40°С и осуществляют кристаллизацию путем добавления к полученному раствору 220 л диизопропилового эфира при последующем перемешивании при температуре 20°С в течение одной ночи. Кристаллы отфильтровывают и промывают с помощью 30 л диизопропилового эфира. Их высушивают в вакууме, получая 9,43 кг (R)-2-[[2-(4-аминофенил)этил]амино]-1-фенилэтанол-моногидрохлорида.
1Н-ЯМР (ДМСО-d6, 400 МГц)δ(м.д.)=2,76-2,90 (2Н, м), 2,95-3,16 (4Н, м), 4,95-5,11 (3Н, м), 6,20 (1Н, д, J=4,0 Гц), 6,53 (2Н, д, J=8,4 Гц), 6,89 (2Н, д, J=8,4 Гц), 7,28-7,43 (5Н, м), 8,97 (1Н, ушир.), 9,29 (1Н, ушир.).
Масс-спектр (FAB) m/z: 257 (М+Н)+.
Стадия 4
К смеси 8,00 г (R)-2-[[2-(4-аминофенил)этил]амино]-1-фенилэтанолмоногидрохлорида, 4,32 г 2-аминотиазол-4-илуксусной кислоты, 2,64 г концентрированной соляной кислоты и 120 мл воды при комнатной температуре добавляют 5,76 г моногидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), после чего перемешивают в течение 1 часа. Для кристаллизации к реакционному раствору прикапывают смешанный раствор 2,40 г гидроксида натрия и 40 мл воды. Полученные кристаллы отфильтровывают, промывают водой и высушивают в вакууме, получая 9,93 г анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты (в дальнейшем называется как "соединение А").
1Н-ЯМР (ДМСО-d6, 500 МГц)δ(м.д.)=1,60 (1Н, с), 2,59-2,66 (4Н, м), 2,68-2,80 (2Н, м), 3,45 (2Н, с), 4,59 (1Н, ушир.), 5,21 (1Н, ушир.), 6,30 (1Н, с), 6,89 (2Н, с), 7,11 (2Н, д, J=8,5 Гц), 7,19-7,23 (1Н, м), 7,27-7,33 (4Н, м), 7,49 (2Н, д, J=8,5 Гц), 9,99 (1Н, с).
Масс-спектр (FAB) m/z: 397 (М+Н)+.
Наилучший вариант осуществления изобретения
Настоящее изобретение теперь конкретно будет пояснено путем нижеследующих примеров, однако настоящее изобретение не ограничивается содержанием этих примеров.
Пример 1
(Тест на гладкомышечную релаксацию изолированного мочевого пузыря крысы)
Методика осуществления теста
Тест осуществляли согласно The Journal of Urology, 1999, том 161, с. 680.
Самцов крыс линии Wistar в возрасте от 10 до 11 недель умерщвляли путем обескровливания, мочевой пузырь целиком извлекали путем лапаротомии и секции мочевого пузыря, каждую размером примерно 3х10 мм, препарировали в питательном растворе, который был оксигенирован 95% О2 и 5% СО2 (раствор Кребса-Хенселейта (118,4 мМ NaCl, 4,7 мМ KCl, 1,2 мМ КН2РО4, 1,2 мМ MgSO4, 2,5 мМ CaCl2, 25,0 мМ NaHCO3 и 11,1 мМ глюкозы)). Секцию подвешивали в пробирке Magnus, в которой питательный раствор (раствор Кребса-Хенселейта) при температуре 37°С, в который аэрировали 95% О2 и 5% СО2, стабилизировали в течение 30-60 минут с нагрузкой 1 г и туда неоднократно вводили 10-6 М карбахола (CCh) или 40 мМ хлорида калия (KCl) до тех пор, пока не убеждались, что реакционная способность в отношении CCh или KCl становилась почти постоянной. После того как было индуцировано сокращение с помощью 10-6 М CCh или 40 мМ KCl и было стабилизировано генерируемое напряжение, тестируемое лекарственное средство - соединение А или (CGP-12,177A) кумулятивно вводили в 10-кратном соотношении с интервалами примерно 10 минут и наблюдали реакцию релаксации. После завершения наблюдения реакции релаксации при максимальной концентрации тестируемого лекарственного средства добавляли 10-4 М папаверина для индуцирования максимальной релаксации и рассчитывали степень релаксации, где реакцию релаксации определяли как 100%.
Результаты
Как результат вышеуказанного теста соединение А, которое представляет собой активный ингредиент, согласно настоящему изобретению показало сильное релаксирующее воздействие при испытании на антагонизм к сокращению с помощью карбахола и при испытании на антагонизм к сокращению за счет хлорида калия в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы. Кроме того, соединение А проявило значительно более сильное релаксирующее воздействие по сравнению с CGP-12,177A (контрольное соединение).
Степени релаксации для концентрации лекарственного средства - соединения А, которое представляет собой активный ингредиент согласно настоящему изобретению, и контрольного соединения - представлены на фиг.1 (тест на антагонизм к сокращению с помощью карбахола) и на фиг.2 (тест на антагонизм к сокращению с помощью хлорида калия) соответственно. Далее, ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью карбахола представлены в таблице 1, тогда как сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A представлено в таблице 2. Соединение А показывает 270-кратную силу воздействия по сравнению с CGP-12,177A (контрольное соединение). Подобным образом ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью хлорида калия представлены в таблице 3, тогда как сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A представлено в таблице 4. Соединение А показывает 383-кратную силу воздействия по сравнению с CGP-12,177A (контрольное соединение).
| Таблица 1 | ||
| ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью карбахола | ||
| Тестируемое лекарственное средство | ЕС50 (М) | Максимальная степень релаксации (%) |
| Соединение А (активный ингредиент согласно настоящему изобретению) | 5,2х10-6 | 94,0 |
| CGP-12,177A (контрольное соединение) | >10-4 | 15,7 |
| Таблица 2 | ||
| Сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A в тесте на антагонизм к сокращению с помощью карбахола | ||
| Тестируемое лекарственное средство | Концентрация (М) | Сравнение силы воздействия* |
| Соединение А (активный ингредиент согласно настоящему изобретению) | 3,7х10-7 | 270 |
| CGP-12,177A (контрольное соединение) | 10-4 | 1 |
| *: сравнение по концентрации, где соединение проявляет степень релаксации 15,7% | ||
| Таблица 3 | ||
| ЕС50 и максимальная степень релаксации тестируемого лекарственного средства в тесте на антагонизм к сокращению с помощью хлорида калия | ||
| Тестируемое лекарственное средство | ЕС50 (М) | Максимальная степень релаксации (%) |
| Соединение А (активный ингредиент согласно настоящему изобретению) | 1,1х10-5 | 69,1 |
| CGP-12,177A (контрольное соединение) | >10-4 | 17,4 |
| Таблица 4 | ||
| Сравнение по концентрации соединения А, проявляющего максимальную степень релаксации, и CGP-12,177A в тесте на антагонизм к сокращению с помощью хлорида калия | ||
| Тестируемое лекарственное средство | Концентрация (М) | Сравнение силы воздействия* |
| Соединение А (активный ингредиент согласно настоящему изобретению) | 2,6х10-7 | 383 |
| CGP-12,177A (контрольное соединение) | 10-4 | 1 |
| *: сравнение по концентрации, где соединение проявляет степень релаксации 17,4% | ||
Пример 2
(Тест на определение ритмичного сокращения
мочевого пузыря крысы)
Тест осуществляли согласно Eropean Journal of Pharmacology, 2000, том 407, с. 175
1. Методика определения
Для теста использовали самок крыс (225-290 г) линии Wistar. Под анестезией с помощью уретана правый и левый мочеточники лигировали и отрезали и после этого вставляли полиэтиленовую канюлю в наружное отверстие мочеиспускательного канала и фиксировали. Один конец фиксированной канюли соединяли с датчиком давления через трехходовой краник и измеряли давление в мочевом пузыре. Другой конец канюли соединяли со шприц-насосом и физиологический раствор вливали с постоянной скоростью в мочевой пузырь до тех пор, пока не индуцировали ритмичное сокращение мочевого пузыря. Непрерывное вливание физиологического раствора прекращали после того, как отмечали ритмичное сокращение мочевого пузыря. После стабилизации ритмичного сокращения мочевого пузыря вводили лекарственное средство или носитель через катетер для введения лекарственного средства, вставленный в бедренную вену.
2. Лекарственное средство
Соединение А вводили внутривенно в увеличиваемых дозах, где соотношение составляло 3 (0,03, 0,1, 0,3, 1 и 3 мг/кг). Группу, которой вводили носитель, использовали в качестве контрольной группы.
3. Оцениваемые пункты и статистический анализ
Параметрами для оценки были число раз и давление сокращения мочевого пузыря, сокращение в течение 10 минут спустя 5-15 минут после введения лекарственного средства, и каждая группа состояла из n = 5. Результат представляли в виде среднего значения ± стандартная погрешность, и для сравнения между двумя группами служил t - критерий Стьюдента.
Результаты
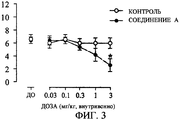
За счет внутривенного введения соединения А частота ритмичного сокращения мочевого пузыря уменьшалась зависимым от дозы образом (фиг. 3). Воздействие в отношении уменьшения частоты сокращения за счет внутривенной инъекции 3 мг/кг соединения А было значительным по сравнению с контрольной группой. С другой стороны, соединение А не ухудшало давления сокращения вплоть до внутривенного введения 3 мг/кг (фиг. 4). Факт отсутствия влияния на давление сокращения представляет собой предпочтительное свойство с той точки зрения, что задержка мочи не индуцируется или что остаточная моча не выходит после мочеиспускания.
Полагают, что подавляющее воздействие на частоту сокращения с помощью соединения А обусловлено увеличением объема мочевого пузыря за счет стимуляции соединением А β3-рецептора, находящегося в мочевом пузыре. Полагают, что увеличение функционального объема мочевого пузыря, показывающее объем мочи, которым может быть наполнен мочевой пузырь, является клинически пригодным для лечения пациентов, страдающих от гиперактивного мочевого пузыря, и, следовательно, полагают, что соединение А является клинически эффективным в качестве лекарственного средства против гиперактивного мочевого пузыря.
Пример 3
(Тест на определение функции мочеиспускания в случае служащей в качестве модели крысы, страдающей от гиперактивного мочевого пузыря, индуцированного циклофосфамидом)
Служащих моделью крыс с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, получали согласно British Journal of Pharmacology, 2000, том 130, с. 331, и проводили следующий тест.
Методика осуществления теста
1. Методика определения
Для теста использовали самок крыс (220-230 г) линии Wistar. Под анестезией с помощью натрийпентобарбитала катетер для вливания физиологического раствора и для измерения давления в мочевом пузыре вставляли в мочевой пузырь, в верхнюю часть мочевого пузыря и фиксировали, тогда как катетер для введения лекарственного средства вставляли в каротидную вену и фиксировали. Циклофосфамид (CYP) вводили в брюшную полость и после приведения в норму крыс возвращали в клетки для кормления. На следующий день после операции один конец катетера, вставленного в мочевой пузырь крысы, соединяли с шприц-насосом через трехходовой краник и непрерывно вливали физиологический раствор, индуцируя рефлекс мочеиспускания. Другой конец соединяли с датчиком давления и измеряли давление в мочевом пузыре. После стабилизации рефлекса мочеиспускания вводили 1 мг/кг соединения А через катетер для введения лекарственного средства, который вставлен в каротидную вену.
2. Оцениваемые пункты и статистический анализ
Параметром для оценки являлся средний интервал мочеиспускания от введения лекарственного средства вплоть до 30 минут после этого. Результат представлен в виде среднего интервала мочеиспускания после введения лекарственного средства по отношению к среднему интервалу мочеиспускания до введения лекарственного средства, где средний интервал мочеиспускания в течение 30 минут до введения лекарственного средства принимали за 100% и выражали в виде среднего значения для n=3.
Результаты
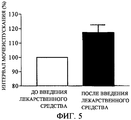
Как результат внутривенного введения соединения А (1 м/кг), интервал мочеиспускания в случае служащих моделью крыс с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, удлинен на 17,3% (фиг. 5). Отсюда полагают, что соединение А, которое пролонгирует интервал мочеиспускания в случае служащих в качестве модели крыс, является клинически эффективным как лекарственное средство против гиперактивного мочевого пузыря.
Таким образом, активный ингредиент согласно настоящему изобретению, проявляет сильное релаксирующее воздействие на мочевой пузырь в "тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы", уменьшает частоту ритмичного сокращения мочевого пузыря зависимым от дозы образом в "тесте на определение ритмичного сокращения мочевого пузыря крысы" и пролонгирует интервал мочеиспускания в "тесте на определение функции мочеиспускания на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крыс", вследствие чего он клинически пригоден в качестве лекарственного средства против гиперактивного мочевого пузыря. В дополнение к гиперактивному мочевому пузырю как результату доброкачественной гиперплазии предстательной железы он также может быть использован в качестве лекарственного средства против гиперактивного мочевого пузыря, сопровождающегося позывом на мочеиспускание, недержанием мочи и поллакиурией.
Пример 4
(Пример приготовления лекарственного средства)
Пример приготовления лекарственного средства в качестве перорального агента
| Таблица 5 | |
| Состав | |
| Таблетка: | |
| активный ингредиент согласно настоящему изобретению | 100,0 мг |
| лактоза | 199,5 мг |
| кукурузный крахмал | 40,0 мг |
| гидроксипропилцеллюлоза | 9,0 мг |
| стеарат магния | 1,5 мг |
| промежуточная сумма: | 350 мг |
| Покрытие: | |
| гидроксипропилметилцеллюлоза 2910 | 8,7 мг |
| полиэтиленгликоль 6000 | 1,2 мг |
| диоксид титана | 4,8 мг |
| тальк | 0,3 мг |
| промежуточная сумма: | 15 мг |
| итоговая сумма: | 365 мг |
Таблетка массой 100 мг
200,0 г Активного ингредиента согласно настоящему изобретению и 399,0 лактозы смешивают в полиэтиленовом пакете. Смесь перемешивают и дезинтегрируют в обычной мельнице (выпускается фирмой Hosokawa Vicron). Дезинтегрированную смесь в количестве 450,0 г и 60,1 г кукурузного крахмала гомогенно смешивают в аппарате для нанесения покрытия при гранулировании в псевдоожиженном слое (выпускается фирмой Ogawara Seisakusho). После этого 192 г 10%-ного раствора гидроксипропилцеллюлозы наносят путем распыления на гранулят. После высушивания вышеполученный гранулят пропускают через сито 20 меш, к нему добавляют 2,3 г стеарата магния и из смеси получают таблетки, причем каждая включает 350 мг, с помощью ротационной таблетировочной машины (выпускается фирмой Hata Tekkosho), используя ступку 9,0 мм х 10,8 R. Таблетки опрыскивают с помощью 150 г раствора для нанесения покрытия, содержащего 8,7 г гидроксипропилметилцеллюлозы, 1,2 г полиэтиленгликоля 6000, 4,8 г диоксида титана и 0,3 г талька, в аппарате для нанесения покрытия (выпускается фирмой Freund Sangyo), получая покрытые пленкой таблетки, причем каждая имеет покрытие массой 15 мг.
Промышленная применимость
Как указано выше в данном контексте, анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]-уксусной кислоты или его соль, который является активным ингредиентом согласно настоящему изобретению, проявляет значительно более сильное релаксирующее воздействие по сравнению с контрольным соединением в "тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы". Далее, он уменьшает частоту ритмичного сокращения мочевого пузыря зависимым от дозы образом в "тесте на определение ритмичного сокращения мочевого пузыря крысы". Кроме того, он пролонгирует интервал мочеиспускания у служащей моделью крысы с гиперактивным мочевым пузырем, индуцированным циклофосфамидом, в "тесте на определение функции мочеиспускания в случае служащей в качестве модели крысы с гиперактивным мочевым пузырем, индуцированным циклофосфамидом".
Следовательно, анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль, который является активным ингредиентом, согласно настоящему изобретению может быть использован в качестве лекарственного средства для лечения гиперактивного мочевого пузыря. В дополнение к гиперактивному мочевому пузырю как результату доброкачественной гиперплазии предстательной железы он также может быть использован в качестве лекарственного средства для лечения гиперактивного мочевого пузыря, сопровождающегося позывом на мочеиспускание, недержанием мочи и поллакиурией.
Краткое описание рисунков
Фиг. 1: Воздействия соединения А и контрольного соединения в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы (тест на антагонизм к сокращению с помощью карбахола).
Фиг. 2: Воздействия соединения А и контрольного соединения в тесте на гладкомышечную релаксацию изолированного мочевого пузыря крысы (тест на антагонизм к сокращению с помощью хлорида калия).
Фиг. 3: Воздействие соединения А на ритмичное сокращение мочевого пузыря крысы (воздействие на частоту сокращения (*:р<0,05)).
Фиг. 4: Воздействие соединения А на ритмичное сокращение мочевого пузыря крысы (воздействие на давление сокращения).
Фиг. 5: Воздействие соединения А на функцию мочеиспускания служащей на модели гиперактивного мочевого пузыря, индуцированного циклофосфамидом у крысы (интервал мочеиспускания после введения лекарственного средства, причем интервал мочеиспускания до введения лекарственного средства принимают за 100%).
Claims (10)
1. Лекарственное средство для лечения гиперактивного мочевого пузыря, включающее анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его соль в качестве активного ингредиента.
2. Лекарственное средство по п.1, где оно представляет собой лекарственное средство для лечения гиперактивного мочевого пузыря как результата доброкачественной гиперплазии предстательной железы.
3. Лекарственное средство по п.1, где оно представляет собой лекарственное средство против неотложного позыва к мочеиспусканию.
4. Лекарственное средство по п.1, где оно представляет собой лекарственное средство против недержания мочи.
5. Лекарственное средство по п.1, где оно представляет собой лекарственное средство против поллакиурии.
6. Лекарственное средство для лечения гиперактивного мочевого пузыря, включающее анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]-уксусной кислоты в качестве активного ингредиента.
7. Лекарственное средство по п.6, где оно представляет собой лекарственное средство для лечения гиперактивного мочевого пузыря как результата доброкачественной гиперплазии предстательной железы.
8. Лекарственное средство по п.6, где оно представляет собой лекарственное средство против неотложного позыва к мочеиспусканию.
9. Лекарственное средство по п.6, где оно представляет собой лекарственное средство против недержания мочи.
10. Лекарственное средство по п.6, где оно представляет собой лекарственное средство против поллакиурии.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002-323792 | 2002-11-07 | ||
| JP2002323792 | 2002-11-07 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2005117367A RU2005117367A (ru) | 2006-01-20 |
| RU2321401C2 true RU2321401C2 (ru) | 2008-04-10 |
Family
ID=32310425
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2005117367/15A RU2321401C2 (ru) | 2002-11-07 | 2003-11-04 | Лекарственное средство против гиперактивного мочевого пузыря, включающее производное анилида уксусной кислоты в качестве активного ингредиента |
Country Status (28)
| Country | Link |
|---|---|
| US (5) | USRE44872E1 (ru) |
| EP (1) | EP1559427B1 (ru) |
| JP (1) | JP3815496B2 (ru) |
| KR (1) | KR100967070B1 (ru) |
| CN (1) | CN100406011C (ru) |
| AT (1) | ATE500827T1 (ru) |
| AU (1) | AU2003284700B2 (ru) |
| BE (1) | BE2013C040I2 (ru) |
| BR (1) | BR0316080A (ru) |
| CA (1) | CA2503570C (ru) |
| CY (2) | CY1111399T1 (ru) |
| DE (1) | DE60336334D1 (ru) |
| DK (1) | DK1559427T3 (ru) |
| ES (1) | ES2360353T3 (ru) |
| FR (1) | FR13C0032I2 (ru) |
| HU (1) | HUS1300027I1 (ru) |
| IL (1) | IL168121A (ru) |
| LU (1) | LU92218I2 (ru) |
| MX (1) | MXPA05004925A (ru) |
| NL (1) | NL300599I2 (ru) |
| NO (2) | NO334948B1 (ru) |
| NZ (1) | NZ539577A (ru) |
| PL (1) | PL211687B1 (ru) |
| PT (1) | PT1559427E (ru) |
| RU (1) | RU2321401C2 (ru) |
| SI (1) | SI1559427T1 (ru) |
| WO (1) | WO2004041276A1 (ru) |
| ZA (1) | ZA200503510B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2550968C1 (ru) * | 2013-11-29 | 2015-05-20 | Федеральное государственное бюджетное учреждение "Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения Российской Федерации | Комплексный способ лечения пациенток с хроническими рецидивирующими циститами и рефрактерным гиперактивным мочевым пузырем |
Families Citing this family (46)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE10351271A1 (de) * | 2003-10-31 | 2005-06-02 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Pharmazeutische Zusammensetzung zur Behandlung der Stressinkontinenz und/oder Mischinkontinenz |
| WO2009057685A1 (ja) | 2007-11-02 | 2009-05-07 | Astellas Pharma Inc. | 過活動膀胱治療用医薬組成物 |
| JPWO2009081837A1 (ja) * | 2007-12-21 | 2011-05-06 | アステラス製薬株式会社 | 下部尿路症状の改善用医薬組成物 |
| PE20091825A1 (es) * | 2008-04-04 | 2009-12-04 | Merck & Co Inc | Hidroximetil pirrolidinas como agonistas del receptor adrenergico beta 3 |
| TWI478712B (zh) | 2008-09-30 | 2015-04-01 | Astellas Pharma Inc | 釋控性醫藥組成物 |
| EP2363397A4 (en) * | 2008-11-07 | 2012-07-11 | Dainippon Sumitomo Pharma Co | NEW THERAPEUTIC AGENT USEFUL FOR SYMPTOM OF LOWER URINARY TRACT |
| US8586760B2 (en) * | 2009-06-15 | 2013-11-19 | Auspex Pharmaceuticals, Inc. | Aminothiazole modulators of beta-3-adrenoreceptor |
| JP5849946B2 (ja) * | 2010-03-29 | 2016-02-03 | アステラス製薬株式会社 | 放出制御医薬組成物 |
| US20120070465A1 (en) | 2010-03-29 | 2012-03-22 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
| EP2709993A4 (en) | 2011-05-18 | 2015-02-25 | Reddys Lab Ltd Dr | AMORPHIC MIRABEGRON AND METHOD FOR CRYSTALLINE FORMS OF MIRABEGRON |
| US9655885B2 (en) | 2011-05-18 | 2017-05-23 | Dr. Reddy's Laboratories Ltd. | Amorphous mirabegron and processes for crystal forms of mirabegron |
| EP2832730A4 (en) | 2012-03-30 | 2015-09-09 | Astellas Pharma Inc | MIRABEGRAPHIC PHARMACEUTICAL COMPOSITION |
| CA2883270A1 (en) | 2012-08-31 | 2014-03-06 | Astellas Pharma Inc. | Orally administered medical composition |
| WO2014132270A2 (en) * | 2013-02-27 | 2014-09-04 | Msn Laboratories Limited | Process for the preparation of 2-(2-aminothiazol-4-yl)-n-[4-(2-{[(2r)-2-hydroxy-2-phenyl ethyl]amino}ethyl)phenyl]acetamide monohydrochloride, its intermediates and polymorph thereof |
| CN103193730A (zh) * | 2013-04-17 | 2013-07-10 | 苏州永健生物医药有限公司 | 一种米拉贝隆的合成方法 |
| CN103232368B (zh) * | 2013-04-18 | 2015-08-12 | 苏州永健生物医药有限公司 | 一种(r)-4-硝基苯乙基-(2-羟基-2-苯乙基)-氨基甲酸叔丁酯的合成方法 |
| CN103193658A (zh) * | 2013-04-18 | 2013-07-10 | 苏州永健生物医药有限公司 | 一种(r)-2-对硝基苯乙胺基-1-苯乙醇及其盐的合成方法 |
| CN103232352B (zh) * | 2013-05-11 | 2015-12-23 | 苏州永健生物医药有限公司 | (r)-4-(2-(2-羟基-2-苯乙胺基)乙基)苯胺基甲酸叔丁基酯 |
| MX2016001030A (es) * | 2013-07-23 | 2016-10-07 | Allergan Inc | Métodos y composiciones que comprenden desmopresina en combinación con un agonista del receptor beta 3-adrenérgico. |
| ITMI20131653A1 (it) * | 2013-10-07 | 2015-04-08 | Dipharma Francis Srl | Forme cristalline di un agonista adrenergico |
| WO2015155664A1 (en) * | 2014-04-08 | 2015-10-15 | Suven Life Sciences Limited | An improved process for the preparation of 2-(2-aminothiazol-4-yl)-n-[4-(2-[[(2r)-2-hydroxy-2- phenylethyl]amino]-ethyl)phenyl]acetamide |
| WO2015162536A1 (en) * | 2014-04-22 | 2015-10-29 | Calyx Chemicals And Pharmaceuticals Ltd. | Novel process for preparation of mirabegron and it's intermediate |
| CN104016943A (zh) * | 2014-05-23 | 2014-09-03 | 苏州凯瑞医药科技有限公司 | 一种米拉贝隆的合成方法 |
| CN104016877B (zh) * | 2014-06-13 | 2017-02-15 | 南京海融制药有限公司 | 一种苯基乙酰胺类化合物及在制备米拉贝隆中的应用 |
| CN104230840A (zh) * | 2014-09-05 | 2014-12-24 | 安徽联创药物化学有限公司 | 米拉贝隆的合成方法 |
| ES2923438T3 (es) | 2014-11-20 | 2022-09-27 | Serenity Pharmaceuticals Llc | Composiciones que comprenden bajas dosis de desmopresina en combinación con un antagonista del receptor alfaadrenérgico |
| CN104496841B (zh) * | 2014-11-26 | 2017-01-25 | 南京工业大学 | 一种米拉贝隆中间体的合成方法 |
| CN104744292A (zh) * | 2015-03-11 | 2015-07-01 | 南京工业大学 | (r)-2-((4-硝基苯乙基)氨基)-2-氧代-1-苯乙基乙酸酯或其衍生物的制备方法 |
| JP2018090490A (ja) * | 2015-03-31 | 2018-06-14 | アステラス製薬株式会社 | ミラベグロン含有医薬組成物 |
| JP6618736B2 (ja) | 2015-09-01 | 2019-12-11 | 沢井製薬株式会社 | ミラベグロン含有錠剤、ミラベグロン含有製剤の製造方法及びミラベグロン含有造粒物の製造方法 |
| CN106278909B (zh) * | 2016-08-12 | 2022-07-15 | 浙江华海药业股份有限公司 | 一种米拉贝隆中间体的后处理方法 |
| PT3360866T (pt) | 2017-02-14 | 2019-02-19 | Tiefenbacher Alfred E Gmbh & Co Kg | Pró-fármacos de mirabegrom |
| KR102051132B1 (ko) * | 2017-03-17 | 2019-12-02 | 주식회사 종근당 | 미라베그론 또는 이의 염을 포함하는 방출조절용 약제학적 조성물 |
| KR101868438B1 (ko) | 2017-04-13 | 2018-06-20 | (주) 성운파마코피아 | 아미드 유도체의 제조방법 |
| US11123320B2 (en) | 2017-05-31 | 2021-09-21 | Sbi Pharmaceuticals, Co., Ltd. | Prophylactic or therapeutic agent for hyperaciive bladder |
| BR112019025636A2 (pt) | 2017-06-06 | 2020-08-25 | Urovant Sciences Gmbh | método para tratar bexiga hiperativa, método para aumentar relaxamento de músculo liso da bexiga, e composição de dosagem unitária farmacêutica |
| KR102398639B1 (ko) | 2017-06-20 | 2022-05-17 | (주) 성운파마코피아 | 아미드 유도체의 염 및 그 제조방법 |
| KR101937713B1 (ko) | 2017-07-14 | 2019-01-14 | 주식회사 대웅제약 | 약제학적 제제 및 그 제조방법 |
| WO2019013583A2 (ko) | 2017-07-14 | 2019-01-17 | 주식회사 대웅제약 | 약제학적 제제 및 그 제조방법 |
| KR20200117091A (ko) | 2019-04-02 | 2020-10-14 | 제이투에이치바이오텍 (주) | 미라베그론 전구체 약물 화합물 및 이의 과민성 방광 질환의 치료 또는 개선을 위한 의약 용도 |
| EP3722285B1 (en) | 2020-04-08 | 2022-03-30 | Alfred E. Tiefenbacher (GmbH & Co. KG) | Process for preparing mirabegron enacarbil |
| CN113816864B (zh) * | 2020-06-18 | 2024-03-29 | 南京正大天晴制药有限公司 | 一种(r)-2-羟基-n-[2-(4-氨基苯基)乙基]-2-苯乙胺的制备方法 |
| KR20220081033A (ko) | 2020-12-08 | 2022-06-15 | 주식회사 한서켐 | 미라베그론 α형 결정의 제조방법 |
| EP4338729A1 (en) | 2022-09-19 | 2024-03-20 | Sanovel Ilac Sanayi Ve Ticaret A.S. | A tablet comprising mirabegron |
| EP4410279A1 (en) | 2023-01-25 | 2024-08-07 | Sanovel Ilac Sanayi Ve Ticaret A.S. | A film tablet comprising mirabegron |
| US12097189B1 (en) | 2024-02-09 | 2024-09-24 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07119189B2 (ja) | 1989-09-28 | 1995-12-20 | 北陸製薬株式会社 | 光学活性なベンジルアルコール誘導体及びその用途 |
| GB9107827D0 (en) | 1991-04-12 | 1991-05-29 | Fujisawa Pharmaceutical Co | New ethanolamine derivatives,processes for the preparation thereof and pharmaceutical composition comprising the same |
| IL104567A (en) | 1992-02-03 | 1997-03-18 | Fujisawa Pharmaceutical Co | Ethanolamine derivatives, processes for the preparation thereof and pharmaceutical compositions containing the same |
| JPH06293664A (ja) | 1993-04-05 | 1994-10-21 | Fujisawa Pharmaceut Co Ltd | β3−アドレナリン作動薬の新規医薬用途 |
| WO1994025427A1 (en) | 1993-04-26 | 1994-11-10 | Fujisawa Pharmaceutical Co., Ltd. | Ethanolamine derivatives useful for the treatment of gastrointestinal disorders |
| JPH07228543A (ja) | 1994-02-16 | 1995-08-29 | Fujisawa Pharmaceut Co Ltd | β3−アドレナリン作動薬の新規医薬用途 |
| JP3926390B2 (ja) | 1995-10-26 | 2007-06-06 | 三菱ウェルファーマ株式会社 | β3作業薬として有用なフェニルエタノールアミン化合物、その製法およびその製造における中間体 |
| EP0932401A1 (en) | 1996-07-01 | 1999-08-04 | Sepracor, Inc. | Methods and compositions for treating urinary incontinence using enantiomerically enriched (r,r)-glycopyrrolate |
| AU731391B2 (en) | 1996-08-19 | 2001-03-29 | Kissei Pharmaceutical Co. Ltd. | Drug for the prevention or treatment of pollakiuria and urinary incontinence |
| CA2302496C (en) * | 1997-08-28 | 2009-12-08 | Afferon Corporation | Urinary incontinence therapy |
| JP3193706B2 (ja) * | 1997-10-17 | 2001-07-30 | 山之内製薬株式会社 | アミド誘導体又はその塩 |
| JP4156799B2 (ja) | 1997-12-18 | 2008-09-24 | キッセイ薬品工業株式会社 | フェニルアミノアルキルカルボン酸誘導体およびそれを含有する医薬組成物 |
| KR100576131B1 (ko) | 1998-04-14 | 2006-05-03 | 깃세이 야쿠힌 고교 가부시키가이샤 | 2메틸프로피온산유도체 및 그 유도체를 함유하는의약조성물 |
| MY126489A (en) | 1998-07-08 | 2006-10-31 | Kissei Pharmaceutical | Phenoxyacetic acid derivatives and medicinal compositions containing the same |
| AU779411B2 (en) * | 1999-02-12 | 2005-01-20 | Serono Genetics Institute S.A. | Biallelic markers derived from genomic regions carrying genes involved in arachidonic acid metabolism |
| GB2356197A (en) | 1999-10-12 | 2001-05-16 | Merck & Co Inc | Amide derivatives as beta 3 agonists |
| JP2001114736A (ja) | 1999-10-19 | 2001-04-24 | Kissei Pharmaceut Co Ltd | 2−アミノプロパノール誘導体 |
| US20030018061A1 (en) | 2000-01-28 | 2003-01-23 | Kohei Ogawa | Novel remedies with the use of beta 3 agonist |
| AUPQ585000A0 (en) * | 2000-02-28 | 2000-03-16 | Fujisawa Pharmaceutical Co., Ltd. | Aminoalcohol derivatives |
| AUPQ841300A0 (en) | 2000-06-27 | 2000-07-20 | Fujisawa Pharmaceutical Co., Ltd. | New aminoalcohol derivatives |
| AR035605A1 (es) * | 2000-12-11 | 2004-06-16 | Bayer Corp | Derivados de aminometil cromano di-sustituidos, un metodo para su preparacion, composiciones farmaceuticas y el uso de dichos derivados para la manufactura de medicamentos utiles como agonistas beta-3-adreno-receptores |
| US7342117B2 (en) | 2001-10-30 | 2008-03-11 | Astellas Pharma Inc. | α-form or β-form crystal of acetanilide derivative |
| CA2646729A1 (en) | 2005-03-21 | 2006-09-28 | Dov Pharmaceutical, Inc. | Methods and compositions for the treatment of urinary incontinence |
-
2003
- 2003-11-04 MX MXPA05004925A patent/MXPA05004925A/es active IP Right Grant
- 2003-11-04 US US13/542,308 patent/USRE44872E1/en not_active Expired - Lifetime
- 2003-11-04 PT PT03770134T patent/PT1559427E/pt unknown
- 2003-11-04 CN CNB2003801028894A patent/CN100406011C/zh not_active Expired - Lifetime
- 2003-11-04 ES ES03770134T patent/ES2360353T3/es not_active Expired - Lifetime
- 2003-11-04 RU RU2005117367/15A patent/RU2321401C2/ru active
- 2003-11-04 AU AU2003284700A patent/AU2003284700B2/en not_active Expired
- 2003-11-04 US US10/534,290 patent/US7750029B2/en not_active Ceased
- 2003-11-04 KR KR1020057008158A patent/KR100967070B1/ko active IP Right Review Request
- 2003-11-04 EP EP03770134A patent/EP1559427B1/en not_active Expired - Lifetime
- 2003-11-04 WO PCT/JP2003/014065 patent/WO2004041276A1/ja active Application Filing
- 2003-11-04 AT AT03770134T patent/ATE500827T1/de active
- 2003-11-04 ZA ZA200503510A patent/ZA200503510B/en unknown
- 2003-11-04 CA CA2503570A patent/CA2503570C/en not_active Expired - Lifetime
- 2003-11-04 BR BR0316080-7A patent/BR0316080A/pt not_active Application Discontinuation
- 2003-11-04 NZ NZ539577A patent/NZ539577A/en not_active IP Right Cessation
- 2003-11-04 DK DK03770134.9T patent/DK1559427T3/da active
- 2003-11-04 US US10/534,290 patent/US20060115540A1/en active Granted
- 2003-11-04 PL PL376771A patent/PL211687B1/pl unknown
- 2003-11-04 JP JP2004549600A patent/JP3815496B2/ja not_active Expired - Lifetime
- 2003-11-04 SI SI200331996T patent/SI1559427T1/sl unknown
- 2003-11-04 DE DE60336334T patent/DE60336334D1/de not_active Expired - Lifetime
-
2005
- 2005-04-19 IL IL168121A patent/IL168121A/en active IP Right Grant
- 2005-06-06 NO NO20052691A patent/NO334948B1/no not_active IP Right Cessation
-
2008
- 2008-12-12 US US12/333,357 patent/US20090093529A1/en not_active Abandoned
-
2011
- 2011-04-18 CY CY20111100395T patent/CY1111399T1/el unknown
- 2011-05-27 US US13/117,638 patent/US8835474B2/en not_active Expired - Lifetime
-
2013
- 2013-06-17 LU LU92218C patent/LU92218I2/fr unknown
- 2013-06-19 CY CY2013023C patent/CY2013023I1/el unknown
- 2013-06-19 HU HUS1300027C patent/HUS1300027I1/hu unknown
- 2013-06-19 FR FR13C0032C patent/FR13C0032I2/fr active Active
- 2013-06-20 NL NL300599C patent/NL300599I2/nl unknown
- 2013-06-20 BE BE2013C040C patent/BE2013C040I2/fr unknown
-
2015
- 2015-01-19 NO NO2015001C patent/NO2015001I2/no unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2550968C1 (ru) * | 2013-11-29 | 2015-05-20 | Федеральное государственное бюджетное учреждение "Научный центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Министерства здравоохранения Российской Федерации | Комплексный способ лечения пациенток с хроническими рецидивирующими циститами и рефрактерным гиперактивным мочевым пузырем |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2321401C2 (ru) | Лекарственное средство против гиперактивного мочевого пузыря, включающее производное анилида уксусной кислоты в качестве активного ингредиента | |
| KR100866820B1 (ko) | 지질 풍부 플라크 퇴축제 | |
| CA2449922C (en) | Pharmaceutical composition for therapy of interstitial cystitis | |
| EP2716302B1 (en) | Prophylactic or therapeutic agent for neuropathic pain associated with guillain-barre syndrome | |
| JPH10130144A (ja) | アルツハイマー病の治療および予防用の医薬を製造するための非ペプチドのブラジキニンアンタゴニストの使用 | |
| JP2010510273A (ja) | 毛細管動脈疾患治療用医薬組成物 | |
| KR20110010689A (ko) | 심부전의 치료 및/또는 예방을 위한 옥사졸리디논 | |
| WO2006115140A1 (ja) | 腸疾患の予防若しくは治療剤 | |
| JP2012006918A (ja) | イソキノリンスルホニル誘導体を有効成分として含有する網脈絡膜変性疾患の予防または治療剤 | |
| US20070054901A1 (en) | Dihydrothiazine prodrugs of thiazolium agents | |
| WO2006123674A1 (ja) | アミン誘導体を有効成分として含む血管新生阻害剤 | |
| WO2010029995A1 (ja) | 疼痛治療剤 | |
| RU2271350C2 (ru) | Производные ацилфенилмочевины, фармацевтическая композиция и способ ее получения | |
| KR20040106345A (ko) | 트로폴론 유도체를 사용한 경구투여용 빈뇨ㆍ요실금의치료제 또는 예방제 혹은 경구투여용 수면도입제 | |
| WO2007123126A1 (ja) | 慢性心不全における運動耐容能低下の改善剤 | |
| WO2000041728A1 (fr) | Compositions pour le traitement de la miction frequente et de l'incontinence d'urine |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RZ4A | Other changes in the information about an invention |