KR20190044647A - 신경변성 질환과 관련된 신경-염증에서 대식세포/미세아교세포 - Google Patents
신경변성 질환과 관련된 신경-염증에서 대식세포/미세아교세포 Download PDFInfo
- Publication number
- KR20190044647A KR20190044647A KR1020197008717A KR20197008717A KR20190044647A KR 20190044647 A KR20190044647 A KR 20190044647A KR 1020197008717 A KR1020197008717 A KR 1020197008717A KR 20197008717 A KR20197008717 A KR 20197008717A KR 20190044647 A KR20190044647 A KR 20190044647A
- Authority
- KR
- South Korea
- Prior art keywords
- compound
- day
- cromolyn
- cells
- beta
- Prior art date
Links
- 230000004770 neurodegeneration Effects 0.000 title claims description 8
- 210000000274 microglia Anatomy 0.000 title description 42
- 210000002540 macrophage Anatomy 0.000 title description 18
- 208000036110 Neuroinflammatory disease Diseases 0.000 title description 10
- 230000003959 neuroinflammation Effects 0.000 title description 10
- 208000015122 neurodegenerative disease Diseases 0.000 title description 4
- 229960000265 cromoglicic acid Drugs 0.000 claims abstract description 53
- 208000024827 Alzheimer disease Diseases 0.000 claims abstract description 48
- 238000000034 method Methods 0.000 claims abstract description 40
- 230000001537 neural effect Effects 0.000 claims abstract description 21
- 208000027866 inflammatory disease Diseases 0.000 claims abstract description 16
- 208000032382 Ischaemic stroke Diseases 0.000 claims abstract description 6
- 208000024777 Prion disease Diseases 0.000 claims abstract description 4
- 208000018737 Parkinson disease Diseases 0.000 claims abstract 5
- 208000023105 Huntington disease Diseases 0.000 claims abstract 2
- 150000001875 compounds Chemical class 0.000 claims description 87
- 238000011282 treatment Methods 0.000 claims description 24
- 206010061218 Inflammation Diseases 0.000 claims description 23
- 230000004054 inflammatory process Effects 0.000 claims description 23
- 230000003110 anti-inflammatory effect Effects 0.000 claims description 13
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 claims description 11
- 230000008685 targeting Effects 0.000 claims description 11
- 239000003795 chemical substances by application Substances 0.000 claims description 10
- 239000002253 acid Substances 0.000 claims description 4
- FTALBRSUTCGOEG-UHFFFAOYSA-N Riluzole Chemical compound C1=C(OC(F)(F)F)C=C2SC(N)=NC2=C1 FTALBRSUTCGOEG-UHFFFAOYSA-N 0.000 claims description 3
- 108020004459 Small interfering RNA Proteins 0.000 claims description 3
- 102000008221 Superoxide Dismutase-1 Human genes 0.000 claims description 3
- 108010021188 Superoxide Dismutase-1 Proteins 0.000 claims description 3
- 108091070501 miRNA Proteins 0.000 claims description 3
- 239000003607 modifier Substances 0.000 claims description 3
- 229960004181 riluzole Drugs 0.000 claims description 3
- 208000034799 Tauopathies Diseases 0.000 claims 1
- 206010002022 amyloidosis Diseases 0.000 claims 1
- 239000008394 flocculating agent Substances 0.000 claims 1
- 230000002518 glial effect Effects 0.000 claims 1
- 201000010901 lateral sclerosis Diseases 0.000 claims 1
- 208000005264 motor neuron disease Diseases 0.000 claims 1
- -1 cromolyn derivative compound Chemical class 0.000 abstract description 21
- IMZMKUWMOSJXDT-UHFFFAOYSA-N cromoglycic acid Chemical compound O1C(C(O)=O)=CC(=O)C2=C1C=CC=C2OCC(O)COC1=CC=CC2=C1C(=O)C=C(C(O)=O)O2 IMZMKUWMOSJXDT-UHFFFAOYSA-N 0.000 abstract 1
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 123
- 210000004027 cell Anatomy 0.000 description 106
- 230000002025 microglial effect Effects 0.000 description 63
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 45
- VLARUOGDXDTHEH-UHFFFAOYSA-L disodium cromoglycate Chemical compound [Na+].[Na+].O1C(C([O-])=O)=CC(=O)C2=C1C=CC=C2OCC(O)COC1=CC=CC2=C1C(=O)C=C(C([O-])=O)O2 VLARUOGDXDTHEH-UHFFFAOYSA-L 0.000 description 45
- 239000000203 mixture Substances 0.000 description 25
- 230000004913 activation Effects 0.000 description 24
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- 239000013543 active substance Substances 0.000 description 20
- 230000000694 effects Effects 0.000 description 20
- 102000004127 Cytokines Human genes 0.000 description 19
- 108090000695 Cytokines Proteins 0.000 description 19
- 230000001965 increasing effect Effects 0.000 description 19
- 239000011734 sodium Substances 0.000 description 18
- 241000699670 Mus sp. Species 0.000 description 17
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 16
- 239000003814 drug Substances 0.000 description 16
- 229910052708 sodium Inorganic materials 0.000 description 16
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 14
- 210000004556 brain Anatomy 0.000 description 13
- 230000001404 mediated effect Effects 0.000 description 13
- 238000010521 absorption reaction Methods 0.000 description 12
- 230000007170 pathology Effects 0.000 description 11
- 239000003981 vehicle Substances 0.000 description 11
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 10
- 210000001616 monocyte Anatomy 0.000 description 10
- 108090000765 processed proteins & peptides Proteins 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 108010090849 Amyloid beta-Peptides Proteins 0.000 description 9
- 102000013455 Amyloid beta-Peptides Human genes 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 230000014509 gene expression Effects 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 230000006724 microglial activation Effects 0.000 description 9
- 239000002904 solvent Substances 0.000 description 9
- 102000003814 Interleukin-10 Human genes 0.000 description 8
- 108090000174 Interleukin-10 Proteins 0.000 description 8
- 102000004388 Interleukin-4 Human genes 0.000 description 8
- 108090000978 Interleukin-4 Proteins 0.000 description 8
- WEVYAHXRMPXWCK-UHFFFAOYSA-N methyl cyanide Natural products CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 8
- 238000002965 ELISA Methods 0.000 description 7
- 229940076144 interleukin-10 Drugs 0.000 description 7
- 210000002569 neuron Anatomy 0.000 description 7
- 229940124597 therapeutic agent Drugs 0.000 description 7
- 101150053137 AIF1 gene Proteins 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 6
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 238000003556 assay Methods 0.000 description 6
- 230000001419 dependent effect Effects 0.000 description 6
- 230000008021 deposition Effects 0.000 description 6
- 239000002552 dosage form Substances 0.000 description 6
- 231100000673 dose–response relationship Toxicity 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 229960001680 ibuprofen Drugs 0.000 description 6
- 238000011534 incubation Methods 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 231100000331 toxic Toxicity 0.000 description 6
- 230000002588 toxic effect Effects 0.000 description 6
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 6
- 208000037259 Amyloid Plaque Diseases 0.000 description 5
- 238000008157 ELISA kit Methods 0.000 description 5
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 5
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 241000699660 Mus musculus Species 0.000 description 5
- 230000002776 aggregation Effects 0.000 description 5
- 238000004220 aggregation Methods 0.000 description 5
- 108010064539 amyloid beta-protein (1-42) Proteins 0.000 description 5
- 125000003118 aryl group Chemical group 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 210000001320 hippocampus Anatomy 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000002757 inflammatory effect Effects 0.000 description 5
- 230000007246 mechanism Effects 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 238000011830 transgenic mouse model Methods 0.000 description 5
- 206010061818 Disease progression Diseases 0.000 description 4
- 238000012286 ELISA Assay Methods 0.000 description 4
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 4
- 230000032683 aging Effects 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 239000013592 cell lysate Substances 0.000 description 4
- 238000003776 cleavage reaction Methods 0.000 description 4
- 239000013058 crude material Substances 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 230000005750 disease progression Effects 0.000 description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 210000004498 neuroglial cell Anatomy 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000007017 scission Effects 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- 231100000419 toxicity Toxicity 0.000 description 4
- 230000001988 toxicity Effects 0.000 description 4
- 229920002554 vinyl polymer Polymers 0.000 description 4
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 108010002352 Interleukin-1 Proteins 0.000 description 3
- 102000000589 Interleukin-1 Human genes 0.000 description 3
- 102000029797 Prion Human genes 0.000 description 3
- 108091000054 Prion Proteins 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 3
- 230000003941 amyloidogenesis Effects 0.000 description 3
- 229940121363 anti-inflammatory agent Drugs 0.000 description 3
- 239000002260 anti-inflammatory agent Substances 0.000 description 3
- 230000033228 biological regulation Effects 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 210000000170 cell membrane Anatomy 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 239000000975 dye Substances 0.000 description 3
- 239000002158 endotoxin Substances 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 229920006008 lipopolysaccharide Polymers 0.000 description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 3
- 231100000189 neurotoxic Toxicity 0.000 description 3
- 230000010287 polarization Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 239000000377 silicon dioxide Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- BLXLFBOGYMXMHO-UHFFFAOYSA-N 1-[2-[3-(2-acetyl-3-hydroxyphenoxy)-2-fluoropropoxy]-6-hydroxyphenyl]ethanone Chemical compound CC(=O)C1=C(O)C=CC=C1OCC(F)COC1=CC=CC(O)=C1C(C)=O BLXLFBOGYMXMHO-UHFFFAOYSA-N 0.000 description 2
- RVMGXWBCQGAWBR-UHFFFAOYSA-N 4-oxo-1-benzopyran-2-carboxylic acid Chemical compound C1=CC=C2OC(C(=O)O)=CC(=O)C2=C1 RVMGXWBCQGAWBR-UHFFFAOYSA-N 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 231100000416 LDH assay Toxicity 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 206010029350 Neurotoxicity Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 2
- 206010044221 Toxic encephalopathy Diseases 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 102100040247 Tumor necrosis factor Human genes 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 208000029560 autism spectrum disease Diseases 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 239000012876 carrier material Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- GGRHYQCXXYLUTL-UHFFFAOYSA-N chloromethyl 2,2-dimethylpropanoate Chemical compound CC(C)(C)C(=O)OCCl GGRHYQCXXYLUTL-UHFFFAOYSA-N 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 238000004624 confocal microscopy Methods 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000003492 excitotoxic effect Effects 0.000 description 2
- 210000002744 extracellular matrix Anatomy 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 102000056982 human CD33 Human genes 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229940028885 interleukin-4 Drugs 0.000 description 2
- 238000002843 lactate dehydrogenase assay Methods 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 210000004980 monocyte derived macrophage Anatomy 0.000 description 2
- 230000000877 morphologic effect Effects 0.000 description 2
- 210000002161 motor neuron Anatomy 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 230000003962 neuroinflammatory response Effects 0.000 description 2
- 230000004112 neuroprotection Effects 0.000 description 2
- 230000002887 neurotoxic effect Effects 0.000 description 2
- 231100000228 neurotoxicity Toxicity 0.000 description 2
- 230000007135 neurotoxicity Effects 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229950010765 pivalate Drugs 0.000 description 2
- 230000036470 plasma concentration Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 230000001850 reproductive effect Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 159000000000 sodium salts Chemical class 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- YPTJKHVBDCRKNF-UHFFFAOYSA-N 2',6'-Dihydroxyacetophenone Chemical compound CC(=O)C1=C(O)C=CC=C1O YPTJKHVBDCRKNF-UHFFFAOYSA-N 0.000 description 1
- YEROQAQOWDWNLZ-UHFFFAOYSA-N 2-(2-hydroxyethyl)-5-[2-hydroxy-3-[2-(2-hydroxyethyl)-4-oxochromen-5-yl]oxypropoxy]chromen-4-one Chemical compound OC(COC1=C2C(C=C(OC2=CC=C1)CCO)=O)COC1=C2C(C=C(OC2=CC=C1)CCO)=O YEROQAQOWDWNLZ-UHFFFAOYSA-N 0.000 description 1
- JRMAQQQTXDJDNC-UHFFFAOYSA-M 2-ethoxy-2-oxoacetate Chemical compound CCOC(=O)C([O-])=O JRMAQQQTXDJDNC-UHFFFAOYSA-M 0.000 description 1
- PSDMGFYQPXEGFQ-UHFFFAOYSA-N 2-fluoropropane-1,1-diol Chemical compound CC(F)C(O)O PSDMGFYQPXEGFQ-UHFFFAOYSA-N 0.000 description 1
- 102100037839 Acidic mammalian chitinase Human genes 0.000 description 1
- 101710178876 Acidic mammalian chitinase Proteins 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- WSVLPVUVIUVCRA-KPKNDVKVSA-N Alpha-lactose monohydrate Chemical compound O.O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O WSVLPVUVIUVCRA-KPKNDVKVSA-N 0.000 description 1
- 102000002659 Amyloid Precursor Protein Secretases Human genes 0.000 description 1
- 108010043324 Amyloid Precursor Protein Secretases Proteins 0.000 description 1
- 102000009091 Amyloidogenic Proteins Human genes 0.000 description 1
- 108010048112 Amyloidogenic Proteins Proteins 0.000 description 1
- 238000009020 BCA Protein Assay Kit Methods 0.000 description 1
- PIKMBGPLMVNPBL-UHFFFAOYSA-N C(CC)(O)(O)O.CC1=CC=C(C=C1)S(=O)(=O)O Chemical compound C(CC)(O)(O)O.CC1=CC=C(C=C1)S(=O)(=O)O PIKMBGPLMVNPBL-UHFFFAOYSA-N 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 1
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 102000009058 Death Domain Receptors Human genes 0.000 description 1
- 108010049207 Death Domain Receptors Proteins 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- UUSYRFWMUZILHI-UHFFFAOYSA-N FC(C(O)O)C.CC1=CC=C(C=C1)S(=O)(=O)O Chemical compound FC(C(O)O)C.CC1=CC=C(C=C1)S(=O)(=O)O UUSYRFWMUZILHI-UHFFFAOYSA-N 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 206010016654 Fibrosis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 101000599951 Homo sapiens Insulin-like growth factor I Proteins 0.000 description 1
- 101000950695 Homo sapiens Mitogen-activated protein kinase 8 Proteins 0.000 description 1
- 101000946889 Homo sapiens Monocyte differentiation antigen CD14 Proteins 0.000 description 1
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 1
- LELOWRISYMNNSU-UHFFFAOYSA-N Hydrocyanic acid Natural products N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102100037852 Insulin-like growth factor I Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 208000026139 Memory disease Diseases 0.000 description 1
- 102100037808 Mitogen-activated protein kinase 8 Human genes 0.000 description 1
- 102100035877 Monocyte differentiation antigen CD14 Human genes 0.000 description 1
- NSGDYZCDUPSTQT-UHFFFAOYSA-N N-[5-bromo-1-[(4-fluorophenyl)methyl]-4-methyl-2-oxopyridin-3-yl]cycloheptanecarboxamide Chemical compound Cc1c(Br)cn(Cc2ccc(F)cc2)c(=O)c1NC(=O)C1CCCCCC1 NSGDYZCDUPSTQT-UHFFFAOYSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 102000000874 Pyrin Domain-Containing 3 Protein NLR Family Human genes 0.000 description 1
- 108010001946 Pyrin Domain-Containing 3 Protein NLR Family Proteins 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 102000004874 Synaptophysin Human genes 0.000 description 1
- 108090001076 Synaptophysin Proteins 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108700012920 TNF Proteins 0.000 description 1
- 108010060804 Toll-Like Receptor 4 Proteins 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 108010060888 Toll-like receptor 2 Proteins 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- XSTXAVWGXDQKEL-UHFFFAOYSA-N Trichloroethylene Chemical compound ClC=C(Cl)Cl XSTXAVWGXDQKEL-UHFFFAOYSA-N 0.000 description 1
- 238000010162 Tukey test Methods 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 1
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 210000001642 activated microglia Anatomy 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000000556 agonist Substances 0.000 description 1
- 230000003942 amyloidogenic effect Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 230000000045 anti-neurotoxic effect Effects 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000012131 assay buffer Substances 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000013629 beta-amyloid clearance Effects 0.000 description 1
- 230000004193 beta-amyloid degradation Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 125000001246 bromo group Chemical group Br* 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 208000037887 cell injury Diseases 0.000 description 1
- 230000006727 cell loss Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 239000002771 cell marker Substances 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 125000001309 chloro group Chemical group Cl* 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 230000006720 chronic neuroinflammation Effects 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000006735 deficit Effects 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- CSJLBAMHHLJAAS-UHFFFAOYSA-N diethylaminosulfur trifluoride Substances CCN(CC)S(F)(F)F CSJLBAMHHLJAAS-UHFFFAOYSA-N 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 239000003596 drug target Substances 0.000 description 1
- 230000008519 endogenous mechanism Effects 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 231100000318 excitotoxic Toxicity 0.000 description 1
- 231100000063 excitotoxicity Toxicity 0.000 description 1
- 238000013401 experimental design Methods 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000004761 fibrosis Effects 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 238000001476 gene delivery Methods 0.000 description 1
- 230000007277 glial cell activation Effects 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 231100000171 higher toxicity Toxicity 0.000 description 1
- 230000000971 hippocampal effect Effects 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000037456 inflammatory mechanism Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 230000037041 intracellular level Effects 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001375 lactose Drugs 0.000 description 1
- 229960001021 lactose monohydrate Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 210000002864 mononuclear phagocyte Anatomy 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000031990 negative regulation of inflammatory response Effects 0.000 description 1
- 210000004126 nerve fiber Anatomy 0.000 description 1
- 230000006762 neuroinflammatory activation Effects 0.000 description 1
- 230000000324 neuroprotective effect Effects 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 238000006384 oligomerization reaction Methods 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000008807 pathological lesion Effects 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 230000007505 plaque formation Effects 0.000 description 1
- GHKGUEZUGFJUEJ-UHFFFAOYSA-M potassium;4-methylbenzenesulfonate Chemical compound [K+].CC1=CC=C(S([O-])(=O)=O)C=C1 GHKGUEZUGFJUEJ-UHFFFAOYSA-M 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000001012 protector Effects 0.000 description 1
- 239000003642 reactive oxygen metabolite Substances 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 238000002390 rotary evaporation Methods 0.000 description 1
- 230000009758 senescence Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 208000020431 spinal cord injury Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- JADVWWSKYZXRGX-UHFFFAOYSA-M thioflavine T Chemical compound [Cl-].C1=CC(N(C)C)=CC=C1C1=[N+](C)C2=CC=C(C)C=C2S1 JADVWWSKYZXRGX-UHFFFAOYSA-M 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 238000012301 transgenic model Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 102000003390 tumor necrosis factor Human genes 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000031836 visual learning Effects 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/35—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom
- A61K31/352—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having six-membered rings with one oxygen as the only ring hetero atom condensed with carbocyclic rings, e.g. methantheline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/428—Thiazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/22—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/22—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4
- C07D311/24—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring with oxygen or sulfur atoms directly attached in position 4 with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
Abstract
치료학적 유효량의 크로몰린 또는 크로몰린 유도체 화합물을 투여하는 것을 포함하여, 신경세포 염증 질환 예를 들어, 알츠하이머병, 파킨슨병, 헌팅톤병, 허혈성 뇌졸중 및 프리온병을 치료하는 방법이 본원에 기술되어 있다.
Description
관련 출원
본 출원은 2016년 8월 31일 출원된 미국 특허 가출원 일련 번호 62/382,192에 대한 우선권의 이익을 주장하며, 그 전문이 본원에 참조로 통합된다.
분야
본 발명은 치료학적 유효량의 하기 화학식을 갖는 적어도 하나의 화합물을 신경세포 염증 질환의 치료가 필요한 환자에게 투여하는 것을 포함하여, 신경세포 염증 질환을 치료하는 방법을 포함한다:
배경
단핵구 및 미세아교세포 활성을 조절하는 전략, 특히, 미세아교세포-매개된 신경독성에 대해 보호할 수 있는 전략이 연구되었다. (문헌 [Zhao et al., “Protective effects of an anti-inflammatory cytokine, interleukin-4, on motoneuron toxicity induced by activated microglia,” J. Neurochem . 2006, 99:1176-1187; Heneka et al., “NLRP3 is activated in Alzheimer's disease and contributes to pathology in APP/PS1 mice,” Nature, 2013, 493(7434):674-8; Thriault, et al., “The dynamics of monocytes and microglia in Alzheimer’s disease,” Alzheimers Res Ther., 2015, 7:41; Nau et al., “Strategies to increase the activity of microglia as efficient protectors of the brain against infections,” Front Cell Neurosci., 2014, 8:138] 참조). 전반적으로, 각각의 염증 상태가 알츠하이머병(AD) 또는 근위축측삭 경화증(ALS)과 같은 신경변성 질환의 병리를 어떻게 조절할 수 있는지를 더 잘 규명하기 위해 더욱 집중적인 연구가 필요하다는 것은 분명하다. 단핵구 및 미세아교세포의 조기 활성화는 신경변성을 악화시킬 수 있는 염증유도(pro-inflammatory) 사이토킨의 분비를 촉발시키지 않으면서 단핵구 및 미세아교세포의 내재성 포식 능력을 증가시키기 위해 면역 반응을 조절함으로써 신경변성 진행을 둔화시킬 수 있는 잠재력을 갖는다.
뇌에서 아밀로이드 플라크 및 신경섬유 매듭 및 AD의 병리에서 이의 관련 신경세포 손실의 존재하에 신경-염증 반응의 역할은 잘 확립되어 있으며 광범위하게 연구된다. 문헌 [Walker et al., “Immune phenotypes of microglia in human neurodegenerative disease: challenges to detecting microglial polarization in human brains,” Alzheimers Res Ther., 2015, 7:56; Theerialut et al., 2015; Wilcock, DM, “A Changing Perspective on the Role of Neuroinflammation in Alzheimer’s Disease,” International Journal of Alzheimer’s Disease, 2012, Article ID 495243; McGeer et al., “Targeting microglia for the treatment of Alzheimer's disease,” Expert Opin Ther Targets, 2015, 19(4):497-506)] 참조. 수 많은 연구는 미세아교세포-매개된 염증이 AD의 진행에 기여하고 있으며, 미세아교세포와 아밀로이드 β(Aβ) 침착과의 밀접한 관계가 발견됨을 보여준다. (문헌 [Mandrekar, et al., “Microglia and Inflammation in Alzheimer’s Disease,” CNS Neurol Disord Drug Targets, 2010, 9(2): 156-167] 참조).
미세아교세포 - 뇌에 상주하는 대식세포 -의 특성 변화가 이들의 미세환경(예를 들어, 사이토킨)에서의 다양한 자극에 대한 반응으로서, 다양한 표현형을 발생시키는 이들의 반응에 의존적이라는 것은 알려져 있다. 사이토킨, 수용체 및 다른 마커의 발현 변화에 기초하여, 단핵구 및 대식세포 상태는 고전적 활성화(M1), 선택적 활성화(M2a), 타입 II 선택적 활성화(M2b), 및 획득성 탈활성화(M2c)로서 규정되었다. (문헌 [Walker et al., 2015; Martinez et al., “Alternative activation of macrophages: an immunologic functional perspective,” Annu Rev Immunol. 2009, 27:451-83; Mantovani et al., “The chemokine system in diverse forms of macrophage activation and polarization,” Trends Immunol., 2004, 25:677-686; Sternberg, EM., “Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens,” Nat Rev Immunol., 2006, 6(4):318-28] 참조). 최근, AD 뇌에서 이러한 표현형의 역할을 설명하고, 이러한 세포가 AD-관련 신경-염증에 기여하는 메카니즘을 결정하기 위해 많은 연구가 시도되었다. (문헌 [Mandrekar et al. 2012; McGeer et al., 2015; and Wilcock, 2012] 참조).
미세아교세포와 원섬유 Aβ의 상호작용은 이들의 표현형 활성화로 이어지며, 최근 신경 보호에서 역할을 담당한다는 설이 제기되었다. (문헌 [Zhao et al., 2006; Figueiredo et al., “Neuron-microglia crosstalk up-regulates neuronal FGF-2 expression which mediates neuroprotection against excitotoxicity via JNK1/2,” J. Neurochem., 2008 Oct.,107(1):73-85] 참조). 마우스 및 인간 둘 모두에서, 아교 세포가 이들의 형태학적 특성을 변화시키고, 많은 세포 표면 수용체를 발현시키고, 병변을 둘러쌈으로써 AD 병리학적 병변(플라크 및 매듭)의 존재에 반응한다는 것이 많은 연구에서 밝혀졌다. (문헌 [Perlmutter et al., “Morphologic association between microglia and senile plaque amyloid in Alzheimer’s disease,” Neurosci Lett., 1990, 119:1, 32-36; Combs, et al., “Identification of microglial signal transduction pathways mediating a neurotoxic response to amyloidogenic fragments of β-amyloid and prion proteins,” J. Neurosci., 1999,19:3, 928-939] 참조). 다른 한편, AD 뇌에서 세포 파편에 대한 반응으로 대식세포 및 미세아교세포 활성화, 및 염증-유도 사이토킨의 후속 방출은 가속화된 신경변성으로 이어진다. 이는 결국, 더 많은 세포 파편을 만들고 질병 진행을 가속화한다. (문헌 [Rubio-Perez et al., “A Review: Inflammatory Process in Alzheimer's Disease, Role of Cytokines,” Scientific World Journal, 2012, 756357; McGeer, et al., “The importance of inflammatory mechanisms in Alzheimer disease,” Exp . Gerontol. 1998, 33:5, 371-378; Akiyama, et al., “Inflammation and Alzheimer's disease,” Neurobiol Aging, 2000, 21(3), 383-421; Liu, et al., “TLR2 is a primary receptor for Alzheimer's amyloid β peptide to trigger neuroinflammatory activation,” J. Immunol. 2012, 188(3):1098-107] 참조).
몇몇 연구는 미세아교세포 활성화, 및 뇌에서 아밀로이드 침착 감소로 이어지는 AD 병변의 청소에서 이의 역할에 초점을 맞추었다. (문헌 [DiCarlo, et al., “Intrahippocampal LPS injections reduce Aβ load in APP+PS1 transgenic mice,” Neurobiol of Aging, 2001, 22:6, 1007-1012; Herber, et al., “Time-dependent reduction in Aβ levels after intracranial LPS administration in APP transgenic mice,” Exp . Neurol., 2004, 190(1):245-53; Liu, et al., 2012] 참조). Aβ 플라크를 둘러싸는 상주하는 미세아교세포는 새로 침투한 대식세포 또는 단핵구 만큼 Aβ를 분해하는데 효과적이지 않지만(문헌 [Thriault, et al., 2015; Varnum, et al., “The classification of microglial activation phenotypes on neurodegeneration and regeneration in Alzheimer's disease brain,” Arch. Immunol . Ther . Exp . (Warsz), 2012, 60(4):251-66] 참조), 미세아교세포는 실제로 원섬유 및 가용성 Aβ를 내재화시킬 수 있으며, 그러나, 이들 펩티드를 처리할 수 없는 것으로 밝혀졌다. (문헌 [Chung, et al., “Uptake, degradation, and release of fibrillar and soluble forms of Alzheimer's amyloid beta-peptide by microglial cells,” J. Biol. Chem., 1999, 274:32301-8] 참조).
또한, 미세아교세포는 노화 동안 M2-로부터 M1-에 치우친 활성화 표현형 전환을 겪는 것으로 가정되었다. (문헌 [Heneka et al., 2013; Varnum, et al., 2012; Gratchev, et al., “Mphi1 and Mphi2 can be re-polarized by Th2 or Th1 cytokines, respectively, and respond to exogenous danger signals,” Immunobiology, 2006, 211(6-8):473-486; Colton, et al., “Expression profiles for macrophage alternative activation genes in AD and in mouse models of AD,” J. Neuroinflammation, 2006, 3:27] 참조). 그러나, 뇌에서의 면역 반응이 AD에서 어떻게 작동되는지는 여전히 논란의 여지가 있으며, 특히 신경염증이 연령-관련 전신 염증에 의해 촉발될 수 있는지에 대한 여부가 더욱 그렇다. (문헌 [Thriault, et al., 2015] 참조). 미세아교세포의 자극은 Aβ를 더욱 효과적으로 분해하는 이들의 내재성 포식 용량을 향상시킬 있음이 밝혀졌다; 미세아교세포 반응을 조절하기 위한 많은 전략이 제안되었다. (문헌 [Mandrekar, 2010; Kiyota, et al., “CNS expression of anti- inflammatory cytokine interleukin-4 attenuates Alzheimer’s disease-like pathogenesis in APP +PS1 bigenic mice,” FASEB J. 2010, 24:3093-3102; He, et al., “Deletion of tumor necrosis factor death receptor inhibits amyloid beta generation and prevents learning and memory deficits in Alzheimer’s mice,” J. Cell Biol., 2007, 178:829-841; Varnum, et al., 2012] 참조).
미세아교세포가 세포외 침착된 Aβ 펩티드에 의해 활성화된다는 것이 밝혀졌다(Lotz, et al., “Amyloid beta peptide 1-40 enhances the action of Toll-like receptor-2 and -4 agonists but antagonizes Toll-like receptor-9-induced inflammation in primary mouse microglial cell cultures,” J. Neurochem ., 2005, 94:289-298; Reed-Geaghan, et al., “CD14 and toll-like receptors 2 and 4 are required for fibrillar Aβ-stimulated microglial activation,” J. Neurosci., 2009, 29:11982- 11992). 이는 인터페론-γ(IFNγ), T 세포로부터의 종양 괴사 인자 알파(TNFα), 또는 항원-제시 세포의 존재에 대한 반응으로서의 미세아교세포 활성화와 유사하다. M1 활성화된 미세아교세포는 반응성 산소 종을 생성할 수 있으며, TNFα 및 인터류킨(IL)-1β와 같은 염증-유도 사이토킨의 증가된 생성을 초래할 수 있다.
미세아교세포의 M1-타입 반응은 아밀로이드 부하를 저하시키지만, 신경원섬유 매듭 병리를 악화시키는 것으로 밝혀졌다. 샤프텔 등(Shaftel, et al., “Sustained hippocampal IL-1β overexpression mediates chronic neuroinflammation and ameliorates Alzheimer plaque pathology,” J. Clin . Invest., 2007, 117(6):1595-604)은 IL-1β 발현이 AD에서 유익한 신경염증 반응의 기초가 될 수 있으며, APP/PS1 형질전환 마우스의 해마에서 IL-1β 과발현은 아밀로이드 부담을 감소시킴을 입증하였다. 저자는 미세아교세포의 IL-1β-매개된 활성화가 아밀로이드 침착 감소를 위한 메카니즘임을 암시한다. 또한, 몬트고메리 등(Montgomery, et al., “Ablation of TNF-RI/RII expression in Alzheimer's disease mice leads to an unexpected enhancement of pathology: implications for chronic pan-TNF-α suppressive therapeutic strategies in the brain,” Am. J. Pathol., 2011, 179(4):2053-70)은 무손상 TNF-수용체 신호전달이 세포외 아밀로이드-펩티드의 미세아교세포-매개된 흡수에 중요하다는 것을 밝혀냈다. M1 염증 표현형이 많은 연구에서 아밀로이드 병리를 개선시키는 것으로 나타난 반면, 타우 유전자이식 마우스 또는 세포 배양에서 M1 표현형의 도입은 타우 병리의 악화를 초래한다. (문헌 [Kitazawa, et al., “Lipopolysaccharide-induced inflammation exacerbates tau pathology by a cyclin-dependent kinase 5- mediated pathway in a transgenic model of Alzheimer’s disease,” J. Neurosci ., 2005, 28;25(39):8843-53.; Li, et al., “Interleukin-1 mediates pathological effects of microglia on tau phosphorylation and on synaptophysin synthesis in cortical neurons through a p38-MAPK pathway,” J. Neurosci ., 2003, 1;23(5):1605-11] 참조).
대식세포 M2 활성화는 항-염증 작용 및 세포외 기질의 재구성에 기여하는 것으로 알려진 매개체와 관련이 있다(Zhu, et al., “Acidic mammalian chitinase in asthmatic Th2 inflammation and IL-13 pathway activation”, Science, 2004, 304(5677):1678-82; Walker, et al., 2015; Wilcock, et al., 2012). M2a 표현형을 갖는 미세아교세포는 증가된 포식작용을 가지며, 인슐린-유사 성장 인자-1과 같은 성장 인자 및 IL-10과 같은 항-염증 사이토킨을 생성한다. IL-4 및/또는 IL-13에 의한 대식세포의 자극은 때때로 상처-치유 대식세포로 불리는 M2a 상태를 유도하며(Edwards, et al., “Biochemical and functional characterization of three activated macrophage populations,” J. Leukoc Biol., 2006, 80(6):1298-307), 이는 일반적으로 염증-유도 사이토킨(IL-1, TNF 및 IL-6)의 낮은 생성을 특징으로 한다. M2a 반응은 알레르기 반응, 세포외 기질 침착 및 리모델링에서 주로 관찰된다.
M2b 대식세포는 M1 활성화의 특징인 높은 수준의 염증-유도 사이토킨을 발현하면서도 높은 수준의 항-염증 사이토킨 IL-10을 발현한다는 점에서 독특하다. (문헌 [Moser DM., “The many faces of macrophage activation,” J. Leukoc Biol., 2003, 73(2):209-12] 참조).
마지막으로, M2c 대식세포 상태는 IL-10에 의해 자극되고, 때로는 조절 대식세포로 언급된다. M2c 대식세포는 고전적인 염증-유도 반응 없이 세포 파편의 포식작용에서 역할을 담당하는 항-염증 활성을 갖는다(문헌 [Moser DM., 2003] 참조). 이들 세포는 기질 단백질뿐만 아니라 TGFβ 및 높은 IL-10을 발현한다. (문헌 [Mantovani, et al., “The chemokine system in diverse forms of macrophage activation and polarization,” Trends Immunol., 2004, 25:677-686; Wilcock, et al., 2012] 참조). 플런켓 등(Plunkett, et al., “Effects of interleukin-10 (IL-10) on pain behavior and gene expression following excitotoxic spinal cord injury in the rat,” Exp . Neurol., 2001; 168:144-154)은 IL-10 매개된 항-염증 반응이 아교세포 활성화 및 염증-유도 사이토킨 생성을 감소시킴을 포함한다는 것을 보고하였다.
그러나, M2 미세아교세포 활성화 및 AD와 플라크 병리에서 수행하는 이의 역할의 메카니즘은 여전히 잘 이해되고 있지 않다. (문헌 [Mandrekar, et al., 2010] 참조). 또한, 많은 연구는 질병 진행에 대한 반응으로서 미세아교세포 활성화 상태의 전환이 존재함을 시사하였다(Colton, et al., 2006; Jimenez, et al., “Inflammatory response in the hippocampus of PS1M146L/ APP751SL mouse model of Alzheimer’s disease: age-dependent switch in the microglial phenotype from alternative to classic,” J. Neurosci., 2008, 28:11650-11661). 동물 연구에서 미세아교세포 활성화 표현형이 질병 진행 동안 M2에서 M1으로 전환됨이 보고되었으며(Jimenez, et al., 2008; Nolan, et al., “Role of interleukin-4 in regulation of age-related inflammatory changes in the hippocampus,” J. Biol. Chem., 2005; 280:9354-9362; Maher, et al., “Downregulation of IL-4-induced signalling in hippocampus contributes to deficits in LTP in the aged rat,” Neurobiol. Aging, 2005, 26:717-728), 이는 노화에 따라 선택적 표현형 대비 고전적 활성화 표현형이 증가함을 시사한다. 세포외 침착된 Aβ에 의해 활성화된 미세아교세포가 항-염증/향신경성 M2 활성화를 촉발시킴으로써 그리고, 포식작용을 통한 Aβ 청소에 의해 신경세포를 보호한다는 것이 일반적으로 동의되고 있다. 이는 새로운 치료학적 목표에 대한 잠재적인 방향이다. (문헌 [He, et al., 2007; Yamamoto, et al., “Interferon-gamma and tumor necrosis factor-alpha regulate amyloid-beta plaque deposition and beta- secretase expression in Swedish mutant APP transgenic mice,” Am. J. Pathol., 2007, 170:680-692; Yamamoto, et al., “Cytokine-mediated inhibition of fibrillar amyloid-beta peptide degradation by human mononuclear phagocytes,” J. Immunol ., 2008, 181:3877-3886] 참조).
만토바니 등(Mantovani, et al., 2004)은 M2a 미세아교세포 활성화의 중요한 조절인자로서 IL-4의 효과를 연구하였다. APP+PS1 마우스로의 IL-4의 유전자 전달이 해마에서 아교세포 축적을 부분적으로 억제하고, 신경생성을 직접적으로 향상시키고, 손상된 공간 학습을 회복시키고, 또한 Aβ 침착을 감소시킨다는 것이 밝혀졌다(Kiyota, et al., 2010).
야마모토 등(Yamamoto, et al., 2007, 2008)은 일차 배양된 인간 단핵구-유래된 대식세포(MDM) 및 미세아교세포에서 염증-유도 및 항-염증 사이토킨을 사용한 대식세포-매개된 Aβ 분해를 조사하였다. 이들 연구는 항-염증 및 조절 사이토킨이 M2a 또는 M2c 활성화 증가 및 향상된 Aβ 청소로 이어짐을 보여주었다. 키요타 등(Kiyota et al., 2011)은 IL-4의 지속된 발현이 별아교/미세아교세포증, 아밀로이드-β 펩티드(Aβ) 올리고머화 및 침착을 감소시키며, 신경생성을 향상시킴을 밝혀냈다.
AD 치료를 위한 잠재적인 목표로서 미세아교세포 활성화를 조절하는 몇 가지 접근법이 제안되었다. (문헌 [Thriault, et al., 2015; Cherry, et al., “Neuroinflammation and M2 microglia: the good, the bad, and the inflamed,” J. Neuroinflammation, 2014, 11:98; Mandrekar, et al., 2010; Vernum, et al., 2012] 참조). AD의 진행을 중단시키기 위해 비-스테로이드성 항-염증 약물(NSAID)과 같은 항-염증 약물의 사용은 내인성 분자에 의한 염증-유도 및 항-염증 활성화 둘 모두를 억제하여, M2 미세아교세포 기능의 유익한 효과 및 플라크 청소의 내인성 메카니즘을 불활성화시킬 수 있다는 의견이 제시되었다. (문헌 [Wilcock, et al., 2012, Cherry, et al., 2014; Thriault, et al., 2015] 참조).
연구는 주로 두 영역에 초점을 맞추었다: 염증-유도 사이토킨의 독성 효과를 완화시키는 항-염증제; 및 이러한 M1 상태에서 독성 효과가 감소되고 Aβ에 대한 이들의 포식작용 활성이 강화된 M2 상태로의 미세아교세포 전환. 질병 진행 초기에 잠재적 치료가 시행되어야 한다는 의견이 제시되었다(McGreer, et al., 2012).
단핵구 및 미세아교세포 활성을 조절하는 전략이 연구되었으며, 특히 미세아교세포-매개된 신경독성에 대해 보호할 수 있는 전략이 연구되었다(Zhao, et al., 2006; Heneka, et al., 2013; Therlaut, et al., 2015; Nau, et al., 2014). 전반적으로, 각 염증 상태가 AD의 병리를 어떻게 조절할 수 있는지를 더욱 잘 확립하기 위해 보다 집중적인 연구가 수행되어야 할 필요가 있음이 분명하다. 단핵구 및 미세아교세포의 조기 활성화는 AD를 악화시킬 수 있는 염증 유도 사이토킨의 분비를 촉발시키지 않으면서 단핵구 및 미세아교세포의 내재성 포식 능력을 증가시키기 위해 면역 반응을 조절함으로써 AD 진행을 둔화시킬 수 있는 가능성을 갖는다는 의견이 일반적으로 받아들여지고 있다.
개요
특정 구체예에서, 본 발명은 치료학적 유효량의 하기 화학식을 갖는 적어도 하나의 화합물을 신경세포 염증 질환의 치료가 필요한 환자에게 투여하는 것을 포함하는 신경세포 염증 질환을 치료하는 방법을 포함한다:
기타 구체예에서, 상기 방법은 하기 화합물을 사용한다:
크로몰린 디소듐;
F-크로몰린 이산;
ET-크로몰린;
F-ET-크로몰린;
트리올-크로몰린;
F-트리올-크로몰린;
Ac-트리올-크로몰린;
POM-크로몰린; 또는
기타 다른 구체예에서, 신경세포 염증 질환은 ALS, AD, 허혈성 뇌졸중 또는 프리온병 중 적어도 하나이다. 한 구체예에서, 화합물은 복강내(IP) 및/또는 정맥내(IV)로 투여될 수 있다. 화합물은 하루에 약 1 mg 내지 약 1000 mg의 용량으로 투여될 수 있다. 투여 방법은 경피로 또는 흡입에 의해 이루어질 수 있다.
또 다른 구체예에서, 방법은 CD4+; siRNA; ALS를 개선시키는 miRNA; 아교세포 형태 조절제; SOD1 조정제; 릴루졸(Riluzole); 또는 신경염증을 조정하는 또 다른 M1;M2 전환 활성 약물을 공동-투여하는 것을 추가로 포함하는 ALS 치료 방법이다.
특정 구체예에서, 본 발명은 본원에 기술된 방법 중 임의의 방법에 관한 것으로서, 단 화합물이 크로몰린 디소듐인 방법에 관한 것이다. 특정 구체예에서, 본 발명은 본원에 기술된 방법 중 임의의 방법에 관한 것으로서, 단 신경세포 염증 질환이 AD인 경우, 화합물은 크로몰린 디소듐, F-크로몰린 디소듐, ET-크로몰린 또는 F-ET-크로몰린이 아닌 방법에 관한 것이다.
특정 구체예에에서, 본 발명은 하기 화합물 중 어느 한 화합물에 관한 것이다:
트리올-크로몰린;
F-트리올-크로몰린;
Ac-트리올-크로몰린;
POM-크로몰린; 또는
도 1a는 PBS 또는 증량의 크로몰린 소듐으로의 처리 후 1주째에 Aβx -40 및 Aβx -42의 혈장 수준의 정량화를 예시한다(n = 3-5마리 마우스/군).
도 1b는 7일 동안 매일 크로몰린 소듐(3.15 mg/kg) 또는 PBS로 처리된 마우스에서 아밀로이드 침착(6E10) 및 미세아교세포(Iba1)의 국소화의 대표적인 이미지를 예시한다. 막대 그림은 각 동물에 대한 플라크 분석으로부터의 결과를 예시한다. 스케일 바 = 10 μM.
도 1c는 시험관 내에서 미세아교세포 Aβ 흡수에 대한 크로몰린 소듐의 효과를 예시하며, 여기에서 인큐베이션 후, 배지 중 Aβx -40(도 1c 왼쪽) Aβx -42(도 1c, 오른쪽)의 농도는 Aβ ELISA를 사용하여 측정되었다.
도 2는 실시예 2 연구의 Tg-2576 마우스에 이러함 침착을 둘러싸고 있는 미세아교세포 및 플라크를 예시한다. 이 도면은 아밀로이드 침착 및 Iba-1 양성 미세아교세포의 대표적인 사진을 보여준다.
도 3은 크로몰린 및 크로몰린과 이부프로펜으로 처리된 BV2 미세아교세포의 결과가 비히클로 처리된 BV2 미세아교세포 대비 증가된 Aβ42 흡수 수준을 나타냄을 예시한다.
도 4는 본원에 기술된 다양한 화합물을 사용한 Aβ 응집 억제 검정의 결과를 예시한다.
도 5는 크로몰린이 뇌 TBS 가용성 Aβ의 수준 및 Aβ의 비율(42:40)에 현저한 영향을 미침을 그래프로 예시한다.
도 6a는 16h 동안 DMSO(대조군)로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다. 인큐베이션 후, 세포를 혈장 막 염료(PM)로 라벨링시키고, 이미지화시켰다.
도 6b는 16h 동안 DMSO(대조군)로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다.
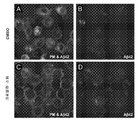
도 6c는 16시간 동안 크로몰린 소듐(500 μM)으로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다. 인큐베이션 후, 세포를 혈장 막 염료(PM)로 라벨링시키고, 이미지화시켰다.
도 6d는 16시간 동안 크로몰린 소듐(500 μM)으로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다.
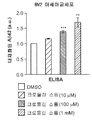
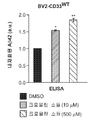
도 7a는 크로몰린 소듐이 미세아교세포 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2 미세아교세포를 16시간 동안 DMSO 또는 다양한 농도의 크로몰린 소듐으로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 소듐과 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 크로몰린 소듐으로 처리된 나이브 BV2 및 BV2-CD33WT 미세아교세포 둘 모두는 비히클(DMSO)로 처리된 세포와 비교하여 증가된 Aβ42 흡수 수준을 나타내었다.
도 7b는 크로몰린 소듐이 미세아교세포 Aβ42 흡수를 촉진함을 그래프로 예시한다. CD33을 안정적으로 발현하는 BV2 세포(BV2-CD33WT)를 16시간 동안 DMSO 또는 다양한 농도의 크로몰린 소듐으로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 소듐과 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 크로몰린 소듐으로 처리된 나이브 BV2 및 BV2-CD33WT 미세아교세포 둘 모두는 비히클(DMSO)로 처리된 세포와 비교하여 증가된 Aβ42 흡수 수준을 나타내었다.
도 8은 LDH 검정시 100 μM 또는 더 높은 농도에서 평가할 때 화합물 C8이 독성을 나타냄을 그래프로 예시한다. 나이브 BV2 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체 또는 DMSO로 처리하였다. C1, C2, C5, C6, C7 및 C8을 10, 50, 100 및 150 μM에서 평가한 반면, C3 및 C4는 DMSO에서의 용해 한도로 인해 5, 25, 50 및 75 μM에서 평가하였다. 이 후, 세포를 2시간 동안 가용성의 태깅되지 않은 Aβ42 펩티드 및 DMSO 또는 크로몰린 유도체와 인큐베이션하였다. 처리 말기에, 세포 배지를 수집하고, 화합물 독성을 락테이트 데하이드로게나제(LDH) 검정으로 평가하였다. 크로몰린 유도체 C8로 처리된 BV2 미세아교세포는 비히클(DMSO) 처리된 세포와 비교하여 100 및 150 μM에서 증가된 독성을 나타내었다.
도 9는 화합물 C4가 나이브 BV2 미세아교세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2 세포를 3시간 동안 5 내지 150 μM 범위의 다양한 농도의 크로몰린 유도체 또는 DMSO(비히클)로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 유도체와 추가로 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 75 μM의 크로몰린 유도체 C4로 처리된 BV2 미세아교세포는 비히클 처리된 세포와 비교하여 현저하게 증가된 Aβ42 흡수 수준을 나타내었다.
도 10은 화합물 C4가 BV2-CD33WT 미세아교세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. CD33WT를 안정적으로 발현하는 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체(C1, C3-8) 또는 대조군으로서의 DMSO로 처리하였다. 이 후, 세포를 Aβ42 펩티드의 존재하에 추가로 2시간 동안 크로몰린 유도체 또는 DMSO와 인큐베이션하였다. 세포 용해물을 Aβ42-특이적 ELISA 키트를 사용하여 Aβ42의 세포내 수준에 대해 분석하였다. 75 μM의 크로몰린 유도체 C4로의 처리는 DMSO 처리와 비교하여 BV2-CD33WT 세포에서 Aβ42의 증가된 흡수로 이어지며, 50 μM에서 용량-의존적 효과를 나타내었다.
도 11은 화합물 C4가 BV2-CD33WT 세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2-CD33WT 세포를 3시간 동안 다양한 농도의 크로몰린 유도체(C1, C2 및 C4-7) 또는 DMSO(비히클)로 처리하였다. 이 후, 세포를 2시간 동안 DMSO 또는 크로몰린 유도체 및 가용성 Aβ42 펩티드로 처리하였다. 세포 용해물을 Aβ42-특이적 ELISA 키트를 사용하여 분석하고, 세포내 Aβ42 수준을 정량화하였다. 크로몰린 유도체 C4는 DMSO로 처리된 세포와 비교하여 50 및 75 μM에서 BV2-CD33WT 세포에서의 Aβ42 흡수를 효과적으로 유도하였다.
도 1b는 7일 동안 매일 크로몰린 소듐(3.15 mg/kg) 또는 PBS로 처리된 마우스에서 아밀로이드 침착(6E10) 및 미세아교세포(Iba1)의 국소화의 대표적인 이미지를 예시한다. 막대 그림은 각 동물에 대한 플라크 분석으로부터의 결과를 예시한다. 스케일 바 = 10 μM.
도 1c는 시험관 내에서 미세아교세포 Aβ 흡수에 대한 크로몰린 소듐의 효과를 예시하며, 여기에서 인큐베이션 후, 배지 중 Aβx -40(도 1c 왼쪽) Aβx -42(도 1c, 오른쪽)의 농도는 Aβ ELISA를 사용하여 측정되었다.
도 2는 실시예 2 연구의 Tg-2576 마우스에 이러함 침착을 둘러싸고 있는 미세아교세포 및 플라크를 예시한다. 이 도면은 아밀로이드 침착 및 Iba-1 양성 미세아교세포의 대표적인 사진을 보여준다.
도 3은 크로몰린 및 크로몰린과 이부프로펜으로 처리된 BV2 미세아교세포의 결과가 비히클로 처리된 BV2 미세아교세포 대비 증가된 Aβ42 흡수 수준을 나타냄을 예시한다.
도 4는 본원에 기술된 다양한 화합물을 사용한 Aβ 응집 억제 검정의 결과를 예시한다.
도 5는 크로몰린이 뇌 TBS 가용성 Aβ의 수준 및 Aβ의 비율(42:40)에 현저한 영향을 미침을 그래프로 예시한다.
도 6a는 16h 동안 DMSO(대조군)로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다. 인큐베이션 후, 세포를 혈장 막 염료(PM)로 라벨링시키고, 이미지화시켰다.
도 6b는 16h 동안 DMSO(대조군)로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다.
도 6c는 16시간 동안 크로몰린 소듐(500 μM)으로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다. 인큐베이션 후, 세포를 혈장 막 염료(PM)로 라벨링시키고, 이미지화시켰다.
도 6d는 16시간 동안 크로몰린 소듐(500 μM)으로 처리된 나이브 BV2 미세아교세포를 보여준다. 이 후, 세포를 2시간 동안 형광-라벨링된 Aβ42 및 DMSO 또는 크로몰린 소듐과 인큐베이션하였다.
도 7a는 크로몰린 소듐이 미세아교세포 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2 미세아교세포를 16시간 동안 DMSO 또는 다양한 농도의 크로몰린 소듐으로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 소듐과 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 크로몰린 소듐으로 처리된 나이브 BV2 및 BV2-CD33WT 미세아교세포 둘 모두는 비히클(DMSO)로 처리된 세포와 비교하여 증가된 Aβ42 흡수 수준을 나타내었다.
도 7b는 크로몰린 소듐이 미세아교세포 Aβ42 흡수를 촉진함을 그래프로 예시한다. CD33을 안정적으로 발현하는 BV2 세포(BV2-CD33WT)를 16시간 동안 DMSO 또는 다양한 농도의 크로몰린 소듐으로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 소듐과 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 크로몰린 소듐으로 처리된 나이브 BV2 및 BV2-CD33WT 미세아교세포 둘 모두는 비히클(DMSO)로 처리된 세포와 비교하여 증가된 Aβ42 흡수 수준을 나타내었다.
도 8은 LDH 검정시 100 μM 또는 더 높은 농도에서 평가할 때 화합물 C8이 독성을 나타냄을 그래프로 예시한다. 나이브 BV2 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체 또는 DMSO로 처리하였다. C1, C2, C5, C6, C7 및 C8을 10, 50, 100 및 150 μM에서 평가한 반면, C3 및 C4는 DMSO에서의 용해 한도로 인해 5, 25, 50 및 75 μM에서 평가하였다. 이 후, 세포를 2시간 동안 가용성의 태깅되지 않은 Aβ42 펩티드 및 DMSO 또는 크로몰린 유도체와 인큐베이션하였다. 처리 말기에, 세포 배지를 수집하고, 화합물 독성을 락테이트 데하이드로게나제(LDH) 검정으로 평가하였다. 크로몰린 유도체 C8로 처리된 BV2 미세아교세포는 비히클(DMSO) 처리된 세포와 비교하여 100 및 150 μM에서 증가된 독성을 나타내었다.
도 9는 화합물 C4가 나이브 BV2 미세아교세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2 세포를 3시간 동안 5 내지 150 μM 범위의 다양한 농도의 크로몰린 유도체 또는 DMSO(비히클)로 처리하였다. 그 후, 세포를 가용성의 태깅되지 않은 Aβ42 및 DMSO 또는 크로몰린 유도체와 추가로 2시간 동안 인큐베이션하고, ELISA 분석을 위해 수집하였다. 75 μM의 크로몰린 유도체 C4로 처리된 BV2 미세아교세포는 비히클 처리된 세포와 비교하여 현저하게 증가된 Aβ42 흡수 수준을 나타내었다.
도 10은 화합물 C4가 BV2-CD33WT 미세아교세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. CD33WT를 안정적으로 발현하는 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체(C1, C3-8) 또는 대조군으로서의 DMSO로 처리하였다. 이 후, 세포를 Aβ42 펩티드의 존재하에 추가로 2시간 동안 크로몰린 유도체 또는 DMSO와 인큐베이션하였다. 세포 용해물을 Aβ42-특이적 ELISA 키트를 사용하여 Aβ42의 세포내 수준에 대해 분석하였다. 75 μM의 크로몰린 유도체 C4로의 처리는 DMSO 처리와 비교하여 BV2-CD33WT 세포에서 Aβ42의 증가된 흡수로 이어지며, 50 μM에서 용량-의존적 효과를 나타내었다.
도 11은 화합물 C4가 BV2-CD33WT 세포에서 Aβ42 흡수를 촉진함을 그래프로 예시한다. BV2-CD33WT 세포를 3시간 동안 다양한 농도의 크로몰린 유도체(C1, C2 및 C4-7) 또는 DMSO(비히클)로 처리하였다. 이 후, 세포를 2시간 동안 DMSO 또는 크로몰린 유도체 및 가용성 Aβ42 펩티드로 처리하였다. 세포 용해물을 Aβ42-특이적 ELISA 키트를 사용하여 분석하고, 세포내 Aβ42 수준을 정량화하였다. 크로몰린 유도체 C4는 DMSO로 처리된 세포와 비교하여 50 및 75 μM에서 BV2-CD33WT 세포에서의 Aβ42 흡수를 효과적으로 유도하였다.
상세한 설명
허혈성 뇌졸중, 알츠하이머병(AD), 근위축성측삭경화증(ALS 또는 루게릭병), 프리온 및 기타 신경변성 장애는 단핵구 및 염증을 강화시키는 독성 사이토킨 및 파편의 공격을 생성하는 다른 세포 유형뿐만 아니라 미세아교세포 활성화 및 비만 세포 이동과 관련이 있다. 특정 구체예에서, 본 발명은 미세아교세포를 염증-유도 M1 상태로부터 독성 효과가 감소되고, 아밀로이드증, 타우병증 및 기타 세포독성 사건에 대한 이들의 포식 활성이 강화되는 M2 상태로 전환시킴으로써 염증-유도 사이토킨의 독성 효과를 감소시키기 위한 항-염증 화합물을 포함한다. 특정 구체예에서, 본 발명은 또한, 질병 과정 초기에 치료에 영향을 미치는 화합물의 용도를 포함한다.
항-염증제로서 사용된 많은 약물은 M1으로부터 M2로의 미세아교세포의 전환에 효능을 나타내지 않았으며, 이들은 M1으로부터 M2로의 미세아교세포의 조절을 강화시키지도 않았다. 본 출원인이 아는 한, 본원에 기술된 화합물이 M1으로부터 M2로의 활성을 나타내는 유일한 효과적인 비-사이토킨(예를 들어, IL-10) 화합물이다. 따라서, 특정 구체예에서, 본 발명은 치료적 유효량의 화합물 중 적어도 하나를 투여함에 의해 신경세포 염증 질환을 치료하기 위한 방법 및 화합물을 포함한다.
특정 구체예에서, 본 발명의 화합물은 하기 화학식을 갖는 화합물 및 이들의 유사체 및 이성질체를 포함한다:
또한, X는 비제한적으로, 할라이드 및 OCO(C1-C8 알킬)을 포함할 수 있다. 알킬 기는 비제한적으로, 메틸, 에틸, 프로필, 이소프로필, 부틸, 이소부틸, 3차-부틸 및 펜틸을 포함한다. 할라이드는 플루오로, 클로로, 브로모 및 아이오도를 포함한다. Y는 비제한적으로, -CH2OH, -CH2OAc 또는 -CH2OMe를 포함할 수 있다. 바람직하게는, 본 발명의 화합물은 5번 위치에 부착된 화합물을 포함한다.
본 발명의 범위내의 특정 화합물은 하기를 포함한다:
크로몰린 디소듐;
F-크로몰린 이산;
ET-크로몰린;
F-ET-크로몰린;
트이올-크로몰린;
F-트리올-크로몰린;
Ac-트리올-크로몰린; 또는
POM-크로몰린; 또는
특정 구체예에서, 화합물은 또한, 5-[3-(2-카르복시-4-옥소크로멘-5-일)옥시-2-하이드록시프로폭시]-4-옥소크로멘-2-카르복실산 유도체 및 이성질체 형태를 포함한다.
특정 구체예에서, 본 발명은 다양한 신경세포 염증 질환을 치료하는 방법을 포함한다. 신경세포 염증 질환은 비제한적으로, ALS, 자폐 스펙트럼 장애(ASD), 허혈성 뇌졸중 및 프리온병을 포함한다. 특정 구체예에서, 화합물은 비제한적으로, ALS의 진행을 감속시키거나 중단시키는 것을 포함하여, ALS를 치료하는데 사용될 수 있다. 특정 구체예에서, 화합물은 ALS의 진행성 및 치명적 결과의 확산을 제어하기 위해 다른 항-염증제와 조합되어 투여될 수 있다.
특정 구체예에서, 본 발명은 상기 화학식의 약물과 같은 신경염증을 제어하는 M1,M2 전환 활성 약물과 CD4+, siRNA, ALS를 개선시키는 miRNA, 아교세포 형태 조절제, SOD1 조정제 또는 ALS에 대해 유일하게 승인된 약물인 릴루졸과 같은 다른 면역 표적화 요법제의 ALS를 위한 조합 치료를 포함한다.
기타 구체예에서, 화합물은 뇌 줄기 및/또는 척수에 위치하는 신경세포, 신경세포, 또는 자발적 몸 근육에 영향을 끼치는 운동 신경세포에 대한 신경세포 손상을 늦추거나 중단시킬 것이다.
특정 구체예에서, 화합물은 약물 투여를 위해 공지된 방법을 이용하여 예를 들어, IP, IV, 경피, 흡입에 의해 투여될 수 있다. 특정 구체예에서, 본 발명은 AD, 허혈성 뇌졸중, ALS 또는 프리온과 같은 신경 질환의 공격적인 진행을 치료하거나 늦추는 방법에 관한 것이며, 화합물은 주입 또는 복강내 투여에 의해 투여될 수 있다.
특정 구체예에서, 본 발명은 또한, 약학적으로 허용되는 담체와 함께 본원에 기술된 하나 이상의 화합물을 포함하는 약학적 조성물을 제공한다. 바람직하게는, 이들 조성물은 경구, 비경구, 비내, 설하 또는 직장 투여를 위한 또는 흡입 또는 통기 투여를 위한 정제, 환약, 캡슐, 분말, 과립, 멸균 비경구 용액 또는 현탁액, 계량 에어로졸 또는 액체 스프레이, 점적, 앰플, 자율주입 장치 또는 좌약과 같은 단위 투여 형태로 존재한다. 화합물이 적절한 양의 약물을 연속 방식으로 전달하도록 설계된 경피 패치로 혼입될 수 있음이 또한 예상된다.
분말 및 정제와 같은 고형 조성물을 제조하는데 있어서, 주요 활성 성분은 균질 혼합물을 함유하는 고형의 예비제형 조성물을 형성하기 위해 약학적으로 허용되는 담체 예를 들어, 통상적인 정제화 성분 예컨대, 옥수수 전분, 락토스, 수크로스, 소르비톨, 탈크, 스테아르산, 마그네슘 스테아레이트, 디칼슘 포스페이트 또는 검, 및 기타 약학적 희석제 예를 들어, 물과 혼합된다. 이러한 예비제형화 조성물을 균질한 것으로 언급할 경우, 이는 활성 성분이 조성물 전반에 걸쳐 균일하게 분산되어 조성물이 균등하게 효과적인 단위 투여 형태로 용이하게 세분화될 수 있음을 의미한다.
일부 구체예에서, 건조 분말 조성물은 폐로의 흡입을 위해 미세화된다. 예를 들어, 그 전문이 본원에 참조로 분명히 통합된, 특히 본원에 기술된 건조 분말 크로몰린 제형에 대한 미국 특허 출원 공개 2016/0263257 참조. 다른 구체예에서, 건조 분말 조성물은 적어도 하나의 부형제를 추가로 포함한다. 특정 구체예에서, 적어도 하나의 부형제는 락토스 모노하이드레이트 및/또는 마그네슘 스테아레이트를 포함한다.
특정 구체예에서, 화합물은 특정 적응증을 치료하는 용량으로 투여될 수 있다. 특히, 용량은 약물이 M1에서 M2로의 조절제로서 작용하게 하는 혈액, 뇌 및 CSF 농도로 유도되도록 특별히 맞춤화된다. 이러한 용량은 하루에 약 1 mg 내지 약 1000 mg을 포함할 수 있다.
활성제의 투여량은 일반적으로, 화합물의 약물동력학적 특징, 화합물의 투여 방식 및 경로, 치료되는 환자의 건강 상태, 요망되는 치료 범위, 존재하는 경우, 병용 요법의 성질 및 종류, 및 치료 빈도와 요망되는 효과의 성질을 포함하는 많은 인자에 의존적일 것이다. 일반적으로, 화합물의 투여량 범위는 종종 하루에 약 0.001 내지 약 250 mg/kg 체중 범위이다. 약 70 kg 체중을 갖는 정상 성인에 있어서, 투여량은 약 0.1 내지 약 25 mg/kg 체중의 범위일 수 있다. 그러나, 이러한 일반적인 투여량 범위의 일부 가변성이 치료되는 대상체의 연령 및 체중, 의도된 투여 경로, 투여되는 특정 제제, 및 기타 등등에 따라 요구될 수 있다. 중요하게는, 특정 포유동물을 위한, 본 기재내용의 이점을 갖는 투여량 범위 및 최적 투여량의 결정은 또한 충분히 당업자의 능력 범위 내에 있다.
화합물의 투여량은 5ng/d 만큼 낮을 수 있다. 특정 구체예에서, 약 10 ng/일, 약 15 ng/일, 약 20 ng/일, 약 25 ng/일, 약 30 ng/일, 약 35 ng/일, 약 40 ng/일, 약 45 ng/일, 약 50 ng/일, 약 60 ng/일, 약 70 ng/일, 약 80 ng/일, 약 90 ng/일, 약 100 ng/일, 약 200 ng/일, 약 300 ng/일, 약 400 ng/일, 약 500 ng/일, 약 600 ng/일, 약 700 ng/일, 약 800 ng/일, 약 900 ng/일, 약 1μg/일, 약 2 μg/일, 약 3μg/일, 약 4 μg/일, 약 5 μg/일, 약 10 μg/일, 약 15 μg/일, 약 20 μg/일, 약 30 μg/일, 약 40 μg/일, 약 50 μg/일, 약 60 μg/일, 약 70 μg/일, 약 80 μg/일, 약 90 μg/일, 약 100 μg/일, 약 200 μg/일, 약 300 μg/일, 약 400 μg/일, 약 500 μg/일, 약 600 μg/일, 약 700 μg/일, 약 800 μg/일, 약 900 μg/일, 약 1 mg/일, 약 2 mg/일, 약 3 mg/일, 약 4 mg/일, 약 5 mg/일, 약 10 mg/일, 약 15 mg/일, 약 20 mg/일, 약 30 mg/일, 약 40 mg/일 또는 약 50 mg/일의 화합물이 투여된다.
활성제의 투여량 범위는 5 ng/d 내지 100 mg/일일 수 있다. 특정 구체예에서, 활성제의 투여량 범위는 약 5 ng/일 내지 약 10 ng/일, 약 15 ng/일, 약 20 ng/일, 약 25 ng/일, 약 30 ng/일, 약 35 ng/일, 약 40 ng/일, 약 45 ng/일, 약 50 ng/일, 약 60 ng/일, 약 70 ng/일, 약 80 ng/일, 약 90 ng/일, 약 100 ng/일, 약 200 ng/일, 약 300 ng/일, 약 400 ng/일, 약 500 ng/일, 약 600 ng/일, 약 700 ng/일, 약 800 ng/일, 또는 약 900 ng/일일 수 있다. 특정 구체예에서, 화합물에 대한 투여량 범위는 약 1μg/일 내지 약 2 μg/일, 약 3μg/일, 약 4 μg/일, 약 5 μg/일, 약 10 μg/일, 약 15 μg/일, 약 20 μg/일, 약 30 μg/일, 약 40 μg/일, 약 50 μg/일, 약 60 μg/일, 약 70 μg/일, 약 80 μg/일, 약 90 μg/일, 약 100 μg/일, 약 200 μg/일, 약 300 μg/일, 약 400 μg/일, 약 500 μg/일, 약 600 μg/일, 약 700 μg/일, 약 800 μg/일, 또는 약 900 μg/일일 수 있다. 특정 구체예에서, 활성제의 투여량 범위는 약 1 mg/일 내지 약 2 mg/일, 약 3 mg/일, 약 4 mg/일, 약 5 mg/일, 약 10 mg/일, 약 15 mg/일, 약 20 mg/일, 약 30 mg/일, 약 40 mg/일, 약 50 mg/일, 약 60 mg/일, 약 70 mg/일, 약 80 mg/일, 약 90 mg/일, 약 100 mg/일, 약 200 mg/일, 약 300 mg/일, 약 400 mg/일, 약 500 mg/일, 약 600 mg/일, 약 700 mg/일, 약 800 mg/일, 또는 약 900 mg/일일 수 있다.
특정 구체예에서, 화합물은 pM 또는 nM 농도로 투여된다. 특정 구체예에서, 화합물은 약 1 pM, 약 2 pM, 약 3 pM, 약 4 pM, 약 5 pM, 약 6 pM, 약 7 pM, 약 8 pM, 약 9 pM, 약 10 pM, 약 20 pM, 약 30 pM, 약 40 pM, 약 50 pM, 약 60 pM, 약 70 pM, 약 80 pM, 약 90 pM, 약 100 pM, 약 200 pM, 약 300 pM, 약 400 pM, 약 500 pM, 약 600 pM, 약 700 pM, 약 800 pM, 약 900 pM, 약 1 nM, 약 2 nM, 약 3 nM, 약 4 nM, 약 5 nM, 약 6 nM, 약 7 nM, 약 8 nM, 약 9 nM, 약 10 nM, 약 20 nM, 약 30 nM, 약 40 nM, 약 50 nM, 약 60 nM, 약 70 nM, 약 80 nM, 약 90 nM, 약 100 nM, 약 300 nM, 약 400 nM, 약 500 nM, 약 600 nM, 약 700 nM, 약 800 nM, 또는 약 900 nM 농도로 투여된다.
특정 구체예에서, 투여 형태는 고체 투여 형태이며, 투여 형태의 화합물 크기가 중요하다. 특정 구체예에서, 화합물의 직경은 약 3 μM 미만, 약 2 μM 미만 또는 약 1 μM 미만이다. 특정 구체예에서, 활성제의 직경은 약 0.1 μM 내지 약 3.0 μM이다. 특정 구체예에서, 활성제의 직경은 약 0.5 μM 내지 약 1.5 μM이다. 특정 구체예에서, 활성제의 직경은 약 0.2 μM, 약 0.3 μM, 약 0.4 μM, 약 0.5 μM, 약 0.6 μM, 약 0.7 μM, 약 0.8 μM, 약 0.9 μM, 약 1.0 μM, 약 1.1 μM, 약 1.2 μM, 약 1.3 μM, 약 1.4 μM 또는 약 1.5 μM이다.
예를 들어, 인간으로의 경구 투여로 의도된 제형은 전체 조성물의 약 5%에서 약 95%까지 다양한 적절하고 편리한 담체 물질과 화합된 약 0.1 mg 내지 약 5g의 활성제 (또는 화합물)을 함유할 수 있다. 단위 투여량은 일반적으로 약 0.5 mg 내지 약 1500 mg의 활성제를 함유할 것이다. 투여량은 다음과 같을 수 있다: 약 1 mg, 2 mg, 3 mg, 4 mg, 5 mg, 6 mg, 7 mg, 8 mg, 9 mg, 10 mg, 11 mg, 12 mg, 13 mg, 14 mg, 15 mg, 16 mg, 17 mg, 18 mg, 19 mg, 20 mg, 21 mg, 22 mg, 23 mg, 24 mg 25 mg, 26 mg, 27 mg, 28 mg, 29 mg, 30 mg, 31 mg, 32 mg, 33 mg, 34 mg 35 mg, 36 mg, 37 mg, 38 mg, 39 mg, 40 mg, 41 mg, 42 mg, 43 mg, 44 mg, 45 mg, 46 mg, 47 mg, 48 mg, 49 mg, 50 mg, 55 mg, 60 mg, 65, mg, 70 mg, 75 mg, 80 mg, 85 mg, 90 mg, 95 mg, 100 mg, 200 mg, 300 mg, 400 mg, 500 mg, 600 mg, 800 mg 또는 100 mg, 등등 내지 약 1500 mg의 화합물.
특정 구체예에서, 본 발명은 두 활성제의 조합물에 관한 것이다. 특정 구체예에서, 약학적 조합물은 제2 성분 대비 상대적으로 대량의 제1 성분을 포함하는 것이 유리할 수 있다. 특정 경우, 제1 활성제 대 제2 활성제의 비율은 약 200:1, 190:1, 180:1, 170:1, 160:1, 150:1, 140:1, 130:1, 120:1, 110:1, 100:1, 90:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1, 20:1, 15:1, 10:1, 9:1, 8:1, 7:1, 6:1 또는 5:1이다. 또한, 약학적 제제의 더욱 균등한 분포를 갖는 것이 바람직할 수 있다. 특정 경우에, 제1 활성제 대 제2 활성제의 비율은 약 4:1, 3:1, 2:1, 1:1, 1:2, 1:3 또는 1:4이다. 또한, 약학적 조합물은 제1 성분 대비 상대적으로 대량의 제2 성분을 갖는 것이 유리할 수 있다. 특정 경우에, 제2 활성제 대 제1 활성제의 비율은 약 200:1, 190:1, 180:1, 170:1, 160:1, 150:1, 140:1, 130:1, 120:1, 110:1, 100:1, 90:1, 80:1, 70:1, 60:1, 50:1, 40:1, 30:1, 20:1, 15:1, 10:1, 9:1, 8:1, 7:1, 6:1 또는 5:1이다. 제1 치료제 및 제2 치료제의 상기 확인된 조합물 중 임의의 조합물을 포함하는 조성물이 하루에 약 1, 2, 3, 4, 5, 6회 이상의 횟수의 분할된 용량으로 또는 요망되는 결과를 달성하는데 효과적인 방출 속도를 제공하는 형태로 투여될 수 있다. 투여 형태는 제1 활성제 및 제2 활성제 둘 모두를 함유할 수 있다. 투여 형태는 제1 활성제와 제2 활성제 둘 모두를 함유하는 경우 하루에 한번 투여될 수 있다.
예를 들어, 인간으로의 경구 투여로 의도된 제형은 약 0.1 mg 내지 약 5g의 제1 치료제 및 약 0.1 내지 약 5g의 제2 치료제를 함유할 수 있는데, 이 둘 모두는 전체 조성물의 약 5%에서 약 95%까지 다양한 적절하고 편리한 담체 물질과 화합된다. 단위 투여량은 일반적으로 약 0.5 mg 내지 약 1500 mg의 제1 치료제 및 0.5 mg 내지 1500 mg의 제2 치료제를 함유할 것이다. 투여량은 약 25 mg, 50 mg, 100 mg, 200 mg, 300 mg, 400 mg, 500 mg, 600 mg, 800 mg, 또는 100 mg, 등등 내지 약 1500 mg의 제1 치료제일 수 있다. 투여량은 약 25 mg, 50 mg, 100 mg, 200 mg, 300 mg, 400 mg, 500 mg, 600 mg, 800 mg, 또는 100 mg, 등등 내지 약 1500 mg의 제2 치료제일 수 있다.
특정 구체예에서, 본 발명은 알츠하이머병의 치료가 필요한 환자에게 하루에 약 1 mg 내지 100 mg의 크로몰린 디소듐을 포함하는 미세화된 건조 분말을 흡입 투여하는 것을 포함하여 알츠하이머병을 치료하는 방법에 관한 것이다.
실시예
실시예
1
PS1/PSS 동물 모델에서 본 발명자들의 연구는 크로몰린 소듐이 미세아교세포와 아밀로이드 침착과의 상호작용에 영향을 미쳤고, 결국 미세아교세포에 의한 Aβ 청소에 영향을 끼침을 보여주었다. 본 발명자들은 먼저 PBS 또는 가장 높은 용량의 크로몰린 소듐(3.15 mg/kg)으로 처리된 마우스의 뇌 부분에서 Aβ와 미세아교세포 마커 Iba1사이의 이중 면역염색을 수행하였다. 두 염색 사이의 중첩의 체계적 분석은, 크로몰린 소듐이 투여된 동물이 아밀로이드와 겹치는 더 높은 백분율의 Iba1 면역활성을 보인다는 것을 드러냈으며(도 1b), 이는 이 화합물에 의해 유도된 플라크 주변의 적당하게 증가된 미세아교세포의 동원을 나타낼 수 있다.
이러한 메커니즘에 대한 본 발명자들의 이해를 더 발전시키기 위해, 그리고 미세아교세포 기능의 변화를 평가하는 것이 생체내에서 어렵다는 것을 고려하여, 본 발명자들은 Aβ 미세아교세포 흡수의 추가적인 시험관내 시스템을 이용하였다. 합성 Aβ40 및 Aβ42 펩티드를 크로몰린 소듐의 존재 또는 부재하에 배양물 중의 미세아교세포에 적용하였다.
16시간 인큐베이션 후, 본 발명자들은 크로몰린 소듐의 존재하에 Aβ40 및 Aβ42 수준의 용량 의존적 감소를 관찰하였으며, 이는 크로몰린 소듐이 Aβ 응집 메커니즘에 끼치는 영향이 미세아교세포 흡수에 의한 Aβ 청소를 촉진할 수 있음을 나타낸다(도 1c). 이러한 생체내 및 시험관내 결과의 조합은 Aβ 섬유화 억제 외에도, 크로몰린 소듐이 미세아교세포 활성화 및 Aβ 청소에 영향을 끼침을 시사할 수 있다.
크로몰린 소듐은 혈장 중 Aβ의 수준에 영향을 미치지 않으나, 미세아교세포 Aβ 청소를 촉진한다. 도 1a는 PBS 또는 증량의 크로몰린 소듐으로의 처리 후 1주째에 Aβx -40 및 Aβx -42의 혈장 수준의 정량화를 예시한다(n = 3-5마리 마우스/군). 도 1b는 7일 동안 매일 크로몰린 소듐(3.15 mg/kg) 또는 PBS로 처리된 마우스에서 아밀로이드 침착(6E10) 및 미세아교세포(Iba1)의 국소화의 대표적인 이미지를 예시한다. Iba1 양성 과정에 의해 점유된 아밀로이드의 백분율을 각 침착에 대해 계산하였으며, 크로몰린 소듐으로 처리 후 Aβ와 Iba1 사이의 증가된 중첩을 보여줬다(PBS의 경우 n=3마리 마우스 및 크로몰린 소듐의 경우 n=5마리 마우스). 각 동물별로 20 내지 20개 플라크를 평가하였다). 스케일 바 = 10 μM. 도 1c는 시험관내에서 미세아교세포 Aβ 흡수에 대한 크로몰린 소듐의 효과를 예시한다. 미세아교세포를 배양하고, 50nM의 합성 Aβ40 또는 Aβ42 및 0, 10 nM, 10 μM 또는 1 mM의 크로몰린 소듐과 16시간 동안 인큐베이션하였다. 인큐베이션 후, 배지 중 Aβx -40(도 1c 왼쪽) Aβx -42 (도 1c, 오른쪽)의 농도를 Aβ ELISA를 사용하여 측정하고, PBS 대조군 조건에 따라 미세아교세포 수로 표준화하였다. (n=3 실험; *,P<0.05, **, P<0.01)
실시예 2
미세아교세포 활성화 및 M1,M2 전환의 다른 동물 연구는 크로몰린이 시험한 많은 약물 중 이러한 변화를 가져오고, 포식 활성을 나타내는 유일한 약물임을 보여주었다. 도 2는 연구의 Tg-2576 마우스에서 이러함 침착을 둘러싸고 있는 미세아교세포 및 모든 플라크 중 대표적인 플라크를 예시한다. 플라크를 둘러싸는 Iba-1 신호의 전체 양 대 아밀로이드 염색과 공존하는 Iba-1 양성 과정의 백분율을 조사한 이미지 분석은, 마우스를 임의의 다른 군과 대조적으로 크로몰린 소듐으로 처리한 경우 더 많은 Iba-1/아밀로이드 공존이 존재하였음을 입증하였다. 이러한 결과는 본 발명자들의 실시예 1의 결과 및 본 발명자들의 시험관내 데이터와 관련이 있다.
이부프로펜이 아닌 크로몰린은 미세아교세포 Aβ42의 흡수를 촉진하며, 이들의 조합은 이부프로펜 또는 크로몰린 단독 대비 흡수를 향상시켰다. BV2 미세아교세포 배양물을 16시간 동안 크로몰린 및/또는 이부프로펜(10 μM, 100 μM, 1mM)으로 처리하였다. 이 후, 세포를 가용성 Aβ42 및 본 화합물과 3시간 동안 인큐베이션하였다. 인큐베이션 후, 세포를 ELISA 분석을 위해 수집하였다. 크로몰린(100 μM, 1mM), 및 크로몰린과 이부프로펜(각 화합물에 있어서 100 μM, 1 mM)으로 처리된 BV2 미세아교세포는 비히클로 처리된 BV2 미세아교세포 대비 증가된 Aβ42 흡수 수준을 나타낸다. 결과는 3가지 독립적인 실험으로부터 도출되었다; **p < 0.01, ***p < 0.001, 일원 ANOVA, Tukey 시험). 데이터는 평균 ± SEM으로 나타내었다. 도 3은 크로몰린, 및 크로몰린과 이부프로펜으로 처리된 BV2 미세아교세포의 결과가 비히클로 처리된 BV2 미세아교세포 대비 증가된 Aβ42 흡수 수준을 나타냄을 그래프로 예시한다.
실시예
3: 화합물 합성
5,5'-[
(2-하이드록시-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-카르복실산
디에틸
에스테르
EtOH(100 mL) 및 진한 HCl(1mL) 중의 크로몰린 소듐 염(1.0g, 2mmol)의 현탁액을 밀폐된 반응기 튜브에서 24시간 동안 100℃에서 가열하였다. 백색 고형물을 용해시켜 고온의 투명 무색 용액을 제공하였다. 이를 실온으로 냉각되게 하고, NaHCO3(1.0 g)을 첨가하였다. 30분 동안 25℃에서 교반한 후, 용매를 회전-증발에 의해 제거하였다. 5:95 메탄올/메틸렌 클로라이드를 사용하여 미정제 물질을 실리카 겔 상에서 크로마토그래피하여 디에틸 에스테르를 생성시켰다(0.8 g, 76% 수율); mp 154-156℃; 1H NMR (CDCl3, 300 MHz) δ 1.42 (t, 3H, J=7.1 Hz, CH3), 2.73 (br s, 1H, OH), 4.44 (q, 4H, J=7.1 Hz, 2OCH2CH3), 4.32-4.59 (m, 5H, CHOH, 2OCH2), 6.80 (s, 2H, 2 비닐-H), 6.99 (d, 2H, J=8.24Hz, 2Aro-H), 7.12 (d, 2H, J=8.24Hz, 2Aro-H), 7.17 (d, 2H, J=8.24Hz, 2Aro-H), 7.71 (t, 2H, J=8.24 2Aro-H).
5,5'-[
(2-플루오로-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-카르복실산
디에틸
에스테르
3-비스(4-메틸벤젠설포네이트)-2-플루오로프로판디올
0-5℃에서 메틸렌 클로라이드(20 mL) 중의 1,3-비스(4-메틸베젠설포네이트 프로판트리올(2.7 g, 6.78 mmol)의 용액을 DAST(2.18 g, 13.6 mmol)로 처리하였다. 그 후, 혼합물을 0-5℃에서 30분 동안 교반하고, 25℃로 가온되게 하고, 16hr 동안 교반하였다. 혼합물을 포화된 중탄산나트륨 용액(30 mL)에 붓고, 층을 분리하였다. 메틸렌 클로라이드 층을 건조시켰다(소듐 설페이트). 용매 제거 후, 미정제 물질을 실리카 겔(메틸렌 클로라이드) 상에서 크로마토그래피하여 0.82 g(30%)의 고형물을 생성시켰다; mp 99-102℃; 1H NMR (CDCl3), δ 2.5 (s, 6H, CH3), 4.15 (dd, 4H, J=12.3, 4.6 Hz,CH2, 4.8 (dq, 1H, J=47, 4.6, CHF), 7.45 (d, 4H, J=8.1Hz, Aro-H), 7.75 (d, 4H, J=8.4Hz, Aro-H).
5,5'-
(2-플루오로프로판-1,3-디일)비스(옥시)비스
(4-옥소-4
H
-
크로멘
-2-
카르복실산
)
1,3-비스(2-아세틸-3-하이드록시페녹시)-2-플루오로프로판
아세토니트릴(40 mL) 중의 3-비스(4-메틸벤젠설포네이트)-2-플루오로프로판디올(1.0, 2.5 mmol), 2,6-디하이드록시아세토페논(0.76 g, 5.0 mmol) 및 포타슘 카보네이트(0.69 g)의 혼합물을 16hr 동안 환류하에 가열하였다. 혼합물을 여과하고, 여과물을 증발시켰다. 미정제 물질을 실리카 겔(아세토니트릴/메틸렌 클로라이드 5:95) 상에서 크로마토그래피하여 0.57 g(40%)의 생성물을 생성시켰다; mp 162-165℃; 1H NMR (d6-DMSO), δ 2.5 (s, 6H, 2CH3), 4.38 (m, 4H, 2CH2), 5.22 (br d 1H, J=49Hz, CHF), 6.45 (m, 4H, 4Aro-H), 7.28 (t, 2H, J=4.55Hz, 2Aro-H).
5,5'-[
(2-플루오로-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-카르복실산
디에틸
에스테르
1,3-비스(2-아세티-3-하이드록시페녹시)-2-플루오로프로판(200 mg, 0.52 mmol)과 에틸 옥살레이트(2 mL)의 혼합물을 에탄올(10mL)과 벤젠(10mL) 중의 소듐 에톡사이드(87 mg Na)의 용액에 첨가하였다. 혼합물을 환류하에 16hr 동안 가열하고, 냉각시키고, 에테르(50mL)로 희석하였다. 침전된 소듐 염을 여과하고, 에테르로 세척하고 건조시켰다. 그 후, 물에 용해시키고, 10% HCl로 산성화시켜 끈적이는 고형물을 수득하였다. 고형물을 에탄올(20 mL) 중에서 촉매량의 36% HCL과 1hr 동안 환류시켰다. 혼합물을 50 mL의 물에 붓고, 메틸렌 클로라이드(50 mL)로 2회 추출하였다. 추출물을 합치고 건조시켰다. 용매 제거 후, 미정제 물질을 실리카 겔(아세토니트릴/메틸렌 클로라이드 10:90) 상에서 크로마토그래피하여 0.12 g(45%)의 생성물을 생성시켰다; mp 166-170℃; 1H NMR (CDCl3), δ 1.42 (t, 6H, J=7.14Hz, 2CH3), 4.58 (q, 4H, J=7.14Hz 2CH2), 4.65 (m, 4H, 2CH2), 5.35 (dq, 1H, J=46Hz, J=4.4HZ, CHF), 6.90 (s, 2H, 비닐-H), 6.95 (d, 2H, J=8.24Hz, 2Aro-H), 7.13(d, 2H, J=8.24Hz, 2Aro-H),7.17 (d, 2H, J=8.24Hz, 2Aro-H) 7.6 (t, 2H, J=8.24 2Aro-H).
5,5'-[
(2-플루오로-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-벤조피란-2-카르복실산
메탄올(20mL) 및 1M 수산화나트륨(2mL) 중의 5,5'-[(2-플루오로-1,3-프로판디일)비스(옥시)]비스[4-옥소-4H-1-벤조피란-2-카르복실산 디에틸 에스테르(100 mg, 0.19 mmol)의 현탁액을 1hr 동안 80℃에서 가열하였다. 용액을 10% HCl로 산성화시키고, 휘발물질을 제거하였다. 메탄올/메틸렌 클로라이드(50:50)의 용액을 고형물에 첨가하고, 혼합물을 여과하였다. 증발하여 76 mg(85%)의 생성물을 제공하였다; 1H NMR (d6-DMSO), δ 4.65 (m, 4H, 2CH2), 5.32 (br d, 1H, J=46Hz, CHF), 6.80 (s, 2H, 2비닐-H), 7.2 (d, 2H, J=8.24Hz, 2Aro-H), 7.71 (t, 2H, J=8.24 2Aro-H).
5,5'-[
(2-하이드록시-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-에탄올
메탄올(60 ml) 및 메틸렌 클로라이드(40 mL) 중의 5,5'-(2-하이드록시트리메틸렌디옥시)비스(4-옥소크로멘-2-카르복실산) 디에틸 에스테르(1.0 g, 1.86 mmol)의 현탁액에 NaBH4(0.14 g, 3.72 mmol)을 1h 기간에 걸쳐 나누어서 첨가하였다. 혼합물을 25℃에서 투명해질 때까지(약 5h) 교반하고, 이 시점에서 용액을 산성이 될 때까지 1M HCl을 적가하여 켄칭시켰다. 용매를 증발시키고, 잔류물을 메틸렌 클로라이드로 추출하였다. 합친 유기 추출물을 물로 세척하고, 무수성 소듐 설페이트 상에서 건조시켰다. 증발 후, 잔류물을 칼럼 크로마토그래피 (5:95 메탄올/메틸렌 클로라이드)에 의해 정제하여 0.5g(50%)의 트리올을 생성시켰다; 1H NMR (DMSO-d6, 300 MHz) δ 2.73 ( s, 3H, OH), 4.25-4.36 (m, 9H, 2OCH2, CH-O), 6.13 (s, 2H, 2 비닐 H), 7.04 (d, 2H, J = 8.4 Hz, 방향족 H), 7.07 (d, 2H, J = 8.4 Hz, 방향족 H), 7.63 (t, 2H, J = 8.2 Hz, 방향족 H).
5,5'-[
(2-플루오로-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-에탄올
5,5'-(2-하이드록시트리메틸렌디옥시)비스(4-옥소크로멘-2-에탄올)을 위한 상기 절차를 사용하였다. 1H NMR (DMSO-d6, 300 MHz) δ 2.73 (s, 3H, OH), 4.25-4.36 (m, 8H, 2OCH2, CH-O), 5.35 (br d, 1H, J=46Hz, CHF), 6.13 (s, 2H, 2 비닐 H), 7.04 (d, 2H, J = 8.4 Hz, 방향족 H), 7.07 (d, 2H, J = 8.4 Hz, 방향족 H), 7.63 (t, 2H, J = 8.2 Hz, 방향족 H).
5,5'-[
(2-하이드록시-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4H-1-
벤조피란
-2-카르복실산 비스[(2,2-디메틸-1-옥소프로폭시)메틸]에스테르
20mL의 DMF 중의 크로몰린 이산(1.0 g, 2.7 mm)의 교반된 용액에 디이소프로필아민(0.7mL) 및 1.0g(6.5mmol) 클로로메틸피발레이트를 첨가하였다. 반응 혼합물을 4hr 동안 60℃에서 교반하고, 물을 첨가하고, 혼합물을 분리하여 추출하고, 건조시키고(MgSO4), 용매를 진공하에 제거하였다. 용매를 제거하고, 잔류물을 메틸렌 클로라이드 중의 4% 메탄올의 실리카 상에서 크로마토그래피하여 1.2g(65%)의 피발레이트 화합물을 제공하였다; mp 135-140℃; H1 NMR (CDCl), δ 1.24 (s, 18 H, CH3), 4.36 (m, 2 H, OCH2), 4.49 (m, 1 H, CHOH), 4.51 (m, 2H, OCH2), ), 6.00 (s, 4H, CH-O-CO), 6.98 (m, 4H, 2비닐-H, 2Aro-H), 7.13 (d, 2H, J=8.24Hz, 2Aro-H), 7.61 (t, 2H, J=8.24 2Aro-H).
5,5'-[
(2-플루오로-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-카르복실산 비스[(2,2-디메틸-1-옥소프로폭시)메틸]에스테르
20mL의 DMF 중의 5,5'-[(2-플루오로-1,3-프로판디일)비스(옥시)]비스[4-옥소-4H-1-벤조피란-2-카르복실산 (1.0 g, 2.1 mmol)의 교반된 용액에 이소프로필아민(0.7mL) 및 1.0g(6.5mmol) 클로로메틸피발레이트를 첨가하였다. 반응 혼합물을 4hr 동안 60℃에서 교반하고, 물을 첨가하고, 혼합물을 분리하여 추출하고, 건조시키고(MgSO4), 용매를 진공하에 제거하였다. 용매를 제거하고, 잔류물을 메틸렌 클로라이드 중의 2% 메탄올을 사용하는 실리카 상에서 크로마토그래피하여 1.0g(70%)의 피발레이트 화합물을 제공하였다; mp 130-133℃; δ 1.21 (s, 18 H, CH3), 4.36 (m, 4 m, 2OCH2), 4.49 (br d, 1H, J=46Hz, CHF), 6.00 (s, 4H, CH-O-CO), 6.98 (m, 4H, 2비닐-H, 2Aro-H), 7.13 (d, 2H, J=8.24Hz, 2Aro-H), 7.61 (t, 2H, J=8.24 2Aro-H).
5,5'-[
(2-하이드록시-1,3-프로판디일)비스(옥시)
]
비스
[4-옥소-4
H
-1-
벤조피란
-2-에탄올의 트리아세테이트
아세트산 무수물(0.5 g, 4.6 mmol)을 0-5℃로 냉장된 피리딘(20mL) 중의 5,5'-[(2-하이드록시-1,3-프로판디일)비스(옥시)]비스[4-옥소-4H-1-벤조피란-2-에탄올(0.5 g, 1.14 mmol)의 혼합물에 서서히 첨가하였다. 혼합물을 3hr 동안 0-5℃에서 교반시키고, 이어서 실온으로 가온되게 하였다. TLC는 반응이 완료되었음을 나타내었다. 메틸렌 클로라이드를 첨가하고, 혼합물을 수성 상이 산성이 될 때까지 10% HCl로 세척하였다. 메틸렌 클로라이드 층을 무수성 소듐 설페이트 상에서 건조시키고, 용매를 증발시켰다. 메틸렌 클로라이드 중의 3% 메탄올을 사용한 실리카 상에서의 크로마토그래피는 0.45g(72%)의 트리아세테이트 화합물을 제공하였다; mp 122-125℃; H1 NMR (CDCl3), δ 2.16 (s, 9 H, CH3), 4.58 (m, 2 H, CH2OH), 4.66 (m, 2H, CH2OH), 4.94 (s, 4 H, CH2OH), 5.66 (m, 1 H, CHOH), 6.15 (s, 2H, 2비닐-H), 6.94 (d, 2H, 2Aro-H), 6.97 (d, 2H, J=8.24Hz, 2Aro-H), 7.52 (t, 2H, J=8.24, 2Aro-H).
실시예
4:
Aβ
응집 억제 검정.
실험 설계. 3-개월령 Tg2576 마우스를 2개월 동안 적응시키고, 그 후 무작위로 다양한 처리 군에 할당하였다. 이들은 비히클 처리의 대조군(n=10), 저용량 크로몰린 군 및 고용량 크로몰린 군을 포함하였다. 처리는 0.1 mL/30 g 체중을 기준으로 하여 추가 3개월 동안 주 당 3회 PBS로의 IP 주입을 통해 수행하였다. 모든 마우스는 8-개월령때 희생시켰다. 조직을 채취하고, 사후 분석을 위해 처리하였다.
최종 5uM의 합성 Aaβ42를 10, 100, 1,000 nM의 시험 화합물과 1시간 동안 인큐베이션하였다. 응집은 0.5 mg/ml의 최종 농도의 헤파린으로 개시시켰다. 검정 완충액은 pH를 7.4로 조절하기 위해 125 mM NaCl, 2.5 mM KCl, 1 mM mgCl2, 1.25 mM Na2H2PO4, 2 mM CaCl2, 25 mM 글루코스 및 NaHCO3로 구성되었다. 검정 완충액을 대조군으로서 사용하였다. 응집은 티오플라빈 T 결합의 강도에 의해 측정하였으며, 상기 강도는 동적 모드에서 450 nm/480 nm의 형광 여기/방출에 의해 검출되었다(스펙트럼 Max M3 플레이트 리더, Molecular Devices). 동력이 플레이트 리더 소프트웨어에 의해 Vmax로서 계산될 때 응집이 기록되었다. 검정은 삼중으로 수행하였으며, 표준 평균 ± SD로서 나타내었다. 청색 점선은 검정 완충액 대조군을 나타낸다. 도 4는 검정 결과를 예시한다.
실시예
5
크로몰린은 뇌 TBS 가용성 Aβ의 수준 및 Aβ의 비율(42:40)에 현저하게 영향을 미친다. A-B. MSD(Aβ 42, 40 및 38을 측정하기 위한 질량 척도(mess scale)) Aβ 분석을 뇌 TBS 가용성 샘플에 적용하였다. 다양한 처리군을 비교하여 Aβ 수준 및 Aβ의 비율(42:40)에서의 차이를 분석하였다. * p<0.05; **p < 0.01, ***p < 0.001, 일원 ANOVA, Tukey 평가; 평균 ± SEM은 낮은 용량 및 높은 용량에 대한 크로몰린과 이부프로펜 조합물, Aβ 42/40의 더 높은 상대적 수준 및 플라크 형성에 관련되지 않은 더 높은 Aβ38을 보여준다. 도 5는 Aβ 수준 및 Aβ의 비율(42:40)에서의 차이의 일원 분석의 결과를 그래프로 예시한다.
실시예
6 - 미세아교세포에서
Aβ42
흡수에 대한
크로몰린
소듐의 효과
공초점 현미경 및 ELISA 검정을 이용하여 미세아교세포에서 Aβ42 흡수에 대한 크로몰린 및 이의 유도체 화합물의 효과를 평가하였다. 외인성-첨가된 Aβ42를 효과적으로 흡수하여 분해하는 것으로 종래 밝혀진 BV2 미세아교세포주를 사용하였다(Jiang, Q., et al. (2008) Neuron 58, 681-693; Mandrekar et al., 2009 J. Neurosci. 29, 4252-4262). 화합물을 나이브 BV2 미세아교세포에서 평가하여 이들이 Aβ 흡수를 조절하는지의 여부를 조사하였다. 전장 인간 CD33을 안정적으로 발현하는 BV2 세포(BV2-CD33WT)에서 화합물의 효과를 평가하여 이들이 Aβ 흡수의 CD33-매개된 억제를 역전시키는지의 여부를 분석하였다(Griciuc et al., 2013, Neuron 78, 631-643).
화합물 번호, 분자량 및 원액의 농도를 표 1에 요약하였다. 크로몰린 유도체 C3 및 C4는 C1, C2, C5, C6, C7 및 C8과 비교하여 DMSO에서 더 낮은 용해도를 나타내었다. 따라서, C3 및 C4를 제외한 모든 화합물에 대해 25mM 원액을 제조하였다. C3 및 C4에 대한 원액을 각각 5mM 및 7.5mM으로 제조하였다. C1은 모 화합물 - 크로몰린 디소듐이다.
표 1: 미세아교세포에서 평가된 화합물의 개요
미세아교세포에서 Aβ42 흡수에 대한 크로몰린 소듐의 효과를 조사하기 위해, 나이브 BV2 세포를 16시간 동안 500 μM의 크로몰린 또는 DMSO(대조군)으로 처리하였다. 이 후, 세포를 PBS로 세척하고, 2시간 동안 형광-태깅된 Aβ42(400nM, 적색)의 존재하에 크로몰린 또는 DMSO로 처리하였다. 처리 말기에, 세포를 세척하고, 이를 혈장 막 염료(녹색)로 라벨링하였다. 적색 채널에서 형광 신호 및 공초점 현미경을 사용하여, 세포내 Aβ42 펩티드의 수준을 정량화하였다. ImageJ 소프트웨어를 사용하여 블라인드 관찰자에 의해 모든 정량화를 수행하였다. 놀랍게도, 크로몰린 소듐은 나이브 BV2 미세아교세포에서 Aβ42의 증가된 흡수를 유도하였다(도 6a-도 6d).
게다가, 크로몰린 소듐이 나이브 BV2 미세아교세포에서 Aβ42 흡수를 조절하는지의 여부를 ELISA 검정을 사용하여 결정하였다. 추가로, 크로몰린 소듐이 전장 인간 CD33을 안정하게 발현하는 BV2(BV2-CD33WT)에서 증가된 Aβ42 흡수 수준을 유도하는지의 여부를 결정하였다. 이러한 목적을 위해, 나이브 BV2 및 BV2-CD33WT 세포주 둘 모두를 16시간 동안 상이한 농도의 크로몰린 또는 DMSO(대조군)로 처리하였다. 그 후, 세포를 PBS로 세척하고, 2시간 동안 DMSO 또는 크로몰린 및 가용성의 태깅되지 않은 Aβ42 펩티드(400 nM)로 처리하였다. 수집된 세포 용해물을 Wako로부터의 Aβ42-특이적 ELISA 키트를 사용하여 Aβ42 흡수 수준에 대해 분석하였다. ELISA 결과를 BCA 검정을 사용하여 이전에 정량화되었던 단백질 농도 수준으로 표준화시켰다.
크로몰린 소듐은 100 μM 및 1 mM에서 나이브 BV2 미세아교세포에서 증가된 Aβ42 흡수를 유도하였으며(도 7a), 따라서, ELISA 검정에 의해 면역형광 결과를 확인하였다. 또한, 크로몰린 소듐은 10 μM 및 500 μM에서 BV2-CD33WT 세포에서 내재화된 Aβ42의 증가된 수준을 유도하였으며(도 7b, ELISA 검정), 미세아교세포에서 Aβ42 흡수의 CD33-매개된 억제를 역전시켰다. 결론적으로, 크로몰린 소듐으로의 처리는 나이브 BV2 및 BV2-CD33WT 세포주에서 Aβ42 흡수 수준을 조절하는데 있어서 용량-의존적 효과를 보여주었다.
실시예 7 - 미세아교세포에서 Aβ42 흡수에 대한 크로몰린 유도체의 효과
미세아교세포에서 Aβ42 흡수에 대한 크로몰린 유도체의 효과를 조사하기 위해, 나이브 BV2 또는 BV2-CD33WT 세포를 증식 배지에 플레이팅시켰다. 다음 날, 세포를 3시간 동안 증식 배지 중에서 다양한 농도의 화합물 또는 DMSO(대조군)로 처리하였다. C1, C2, C5, C6, C7 및 C8을 10, 50, 100 및 150 μM에서 평가한 반면, C3 및 C4는 DMSO에서의 용해 한도로 인해 5, 25, 50 및 75 μM에서 평가하였다. 이 후, 세포를 PBS로 세척하고, 2시간 동안 DMEM 배지 중에서 태깅되지 않은 Aβ42 (400nM)의 존재하에 DMSO 또는 화합물로 처리하였다. CytoTox-ONETM 락테이트 데하이드로게나제(LDH) 검정으로의 처리 말기에 수집된 배지에서 화합물 독성을 평가하였다. 플레이트에 잔존하는 세포를 냉 PBS로 세척하고, 프로테아제 및 포스파타제 억제제가 보충된 RIPA 완충액으로 용해시켰다. 용해물 상청액 중의 단백질 농도는 PierceTM BCA 단백질 검정 키트를 사용하여 결정하고, 각 용해물로부터의 2-3μg/웰의 총 단백질을 Wako로부터의 Aβ42 ELISA 키트를 사용하여 Aβ42 흡수에 대해 분석하였다. 독성 화합물 농도는 추가 연구에서 배제시켰다.
크로몰린 유도체가 더 높은 용량에서 세포독성을 유도하는지의 여부를 조사하기 위해, 나이브 BV2 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체 또는 DMSO(비히클)와 인큐베이션하였다. 그 후, 세포를 세척하고, DMSO 또는 화합물 및 가용성의 태깅되지 않은 Aβ42와 추가 2시간 동안 인큐베이션하였다. 이후, 세포 배지를 수집하고, 세포용해를 유도하는 화합물을 확인하기 위해 손상된 세포에 의해 방출된 LDH를 측정하였다. LDH 검정은 크로몰린 유도체 C8이 100 및 150 μM로 평가되는 경우 독성을 보이는 유일한 화합물임을 보여주었다(도 8). 따라서, C8에 있어서는 100 및 150 μM 농도는 Aβ42 흡수 검정에서 제외시켰다.
실시예 8 - 크로몰린 유도체에 의한 미세아교세포에서 Aβ42 흡수의 조절
크로몰린 유도체가 Aβ42 흡수를 조절하는지의 여부를 시험하기 위해, 나이브 BV2 미세아교세포를 3시간 동안 다양한 농도의 크로몰린 유도체 화합물 또는 DMSO(대조군)로 처리하였다. 이 후, 세포를 세척하고, 태깅되지 않은 Aβ42 펩티드의 존재하에 2시간 동안 화합물 또는 DMSO로 처리하였다. 처리 말기에, 세포 용해물을 수집하였다. Aβ42-특이적 ELISA 키트를 사용하여 세포내 Aβ42 수준에 대한 분석을 수행하였다. 모 화합물 C1(크로몰린 소듐)은 100 및 150 μM에서 BV2세포에서 Aβ42 흡수의 약간 증가를 유도하였다. 다른 크로몰린 유도체로 처리된 C1 분취액은 처음으로 본 발명자들에게 전달된 C1 분취액(크로몰린 유도체 비함유)보다 DMSO에서 더 낮은 용해도를 나타내었다. 흥미롭게도, 화합물 C6는 BV2 미세아교세포에서 Aβ42 흡수의 강력한 억제를 유도하였다. 놀랍게도, 크로몰린 유도체 C4는 75 μM에서 나이브 BV2 미세아교세포에서 Aβ42 펩티드의 증가된 흡수를 유도하였다(도 9).
또한, 크로몰린 유도체가 BV2-CD33WT 세포에서 Aβ42 흡수 및 청소에 영향을 미치는지의 여부는 두 개의 독립적인 세트의 실험에 의해 결정되었다. BV2-CD33WT 세포를 5 내지 150 μM 범위의 다양한 농도의 크로몰린 유도체 또는 DMSO(대조군)로 처리하였다.
제1 실험 세트에서, 크로몰린 유도체 C1 및 C3-8을 시험하였다. 화합물 C2는 제2 실험 세트에서 다른 크로몰린 유도체로 시험하였다. 75 μM의 화합물 C4로의 처리는 DMSO 처리와 비교하여 Aβ42 흡수를 2배 증가시켰으며, 50 μM에서 용량 의존적인 효과를 나타내었다(도 10). GraphPad Prism 7소프트웨어를 사용하여, C4에 대한 IC50은 BV2-CD33WT 세포에서 54.7 μM이었다. 화합물 C6은 DMSO 처리와 비교할 경우 BV2-CD33WT 세포에서 Aβ42 흡수의 억제를 매개하는데 있어서 용량 의존적 효과를 나타낸다.
제2 실험 세트에서, BV2-CD33WT 세포에서 크로몰린 유도체 C1, C2 및 C4-7을 시험하였다. 이들 결과는, 화합물 C4가 75 μM에서 Aβ42 흡수를 증가시키는데 가장 효과적이며, DMSO 처리와 비교할 경우 더 낮은 농도에서 용량 의존적인 효과를 나타내었다(도 11)는 이전 결과를 확인시켜 주었다. 따라서, 이러한 결과는 화합물 C4가 BV2-CD33WT 세포에서 증가된 Aβ42 흡수 수준을 유도하였으고, Aβ 흡수 및 청소의 CD33-매개된 억제를 역전시켰음을 시사한다(도 10 및 11).
이러한 결과는, 크로몰린 유도체 C4가 Aβ42의 미세아교세포 흡수 및 청소를 유도하고, 신경독성/염증-유도로부터 신경보호/포식-유도 활성화 표현형으로의 미세아교세포의 편향을 강화시켰음을 시사한다.
Claims (22)
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 근위축측삭경화증(ALS)인 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 AD인 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증이 헌팅톤병인 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증이 파킨슨병(PD)인 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 허혈성 뇌졸중인 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 프리온병과 관련된 방법.
- 제3항에 있어서, 화합물이 복강내(IP) 및/또는 정맥내(IV)를 통해 투여되는 방법.
- 제1항 내지 제8항 중의 어느 한 항에 있어서, 화합물이 경피 투여되는 방법.
- 제1항 내지 제8항 중의 어느 한 항에 있어서, 화합물이 흡입 투여되는 방법.
- 제1항 내지 제11항 중의 어느 한 항에 있어서, 화합물이 하루에 약 1 mg 내지 약 1000 mg의 용량으로 투여되는 방법.
- 제1항 내지 제11항 중의 어느 한 항에 있어서, 화합물이 하루에 약 10, 약 20, 약 30, 약 50, 약 100 또는 약 500 mg의 용량으로 투여되는 방법.
- 제3항에 있어서, CD4+; siRNA; ALS를 개선시키는 miRNA; 아교세포 형태 조절제(glial morphology modifier); SOD1 조정제; 및 릴루졸(Riluzole)로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제3항에 있어서, AD에 대한 표적화 약물 및 항-응집 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 AD이며, AD를 개선시키는 항체 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 AD이며, AD를 개선시키는 항-염증 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제1항 또는 제2항에 있어서, 신경세포 염증 질환이 AD이며, AD를 개선시키는 타우 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제3항에 있어서, ALS를 개선시키는 항체 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제3항에 있어서, ALS를 개선시키는 항-염증 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제1항 내지 제13항 중의 어느 한 항에 있어서, 아밀로이드증 또는 타우병증과 관련된 신경변성을 개선시키는 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
- 제6항에 있어서, PD를 개선시키는 알파 시누클레인 표적화 약물 및 PD를 개선시키는 파킨슨병 표적화 약물로부터 선택되는 제2 화합물을 공동-투여하는 것을 추가로 포함하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662382192P | 2016-08-31 | 2016-08-31 | |
| US62/382,192 | 2016-08-31 | ||
| PCT/US2017/049702 WO2018045217A1 (en) | 2016-08-31 | 2017-08-31 | Macrophages/microglia in neuro-inflammation associated with neurodegenerative diseases |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190044647A true KR20190044647A (ko) | 2019-04-30 |
Family
ID=61309436
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197008717A KR20190044647A (ko) | 2016-08-31 | 2017-08-31 | 신경변성 질환과 관련된 신경-염증에서 대식세포/미세아교세포 |
Country Status (8)
| Country | Link |
|---|---|
| US (3) | US20190240194A1 (ko) |
| EP (1) | EP3506894B1 (ko) |
| JP (2) | JP2019524865A (ko) |
| KR (1) | KR20190044647A (ko) |
| CN (2) | CN109922800B (ko) |
| AU (1) | AU2017321782B2 (ko) |
| CA (1) | CA3033079A1 (ko) |
| WO (1) | WO2018045217A1 (ko) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9925282B2 (en) | 2009-01-29 | 2018-03-27 | The General Hospital Corporation | Cromolyn derivatives and related methods of imaging and treatment |
| JP6499077B2 (ja) | 2012-10-25 | 2019-04-10 | ザ ジェネラル ホスピタル コーポレイション | アルツハイマー病と関連疾患の治療のための併用療法 |
| US10525005B2 (en) | 2013-05-23 | 2020-01-07 | The General Hospital Corporation | Cromolyn compositions and methods thereof |
| CN106102737B (zh) | 2013-10-22 | 2019-06-14 | 综合医院公司 | 色甘酸衍生物以及成像和治疗的相关方法 |
| CA3005909A1 (en) * | 2015-11-23 | 2017-06-01 | Aztherapies, Inc. | Compositions and methods for treating ischemic stroke |
| US20190240194A1 (en) | 2016-08-31 | 2019-08-08 | The General Hospital Corporation | Macrophages/microglia in neuro-inflammation associated with neurodegenerative diseases |
| US20200206187A1 (en) * | 2017-07-08 | 2020-07-02 | Rudolph E. Tanzi | Screening platform to identify therapeutic drugs or agents for treatment of alzheimer's disease |
| CA3070386A1 (en) | 2017-07-20 | 2019-01-24 | Aztherapies, Inc. | Powdered formulations of cromolyn sodium and ibuprofen |
| JP2021521122A (ja) * | 2018-04-09 | 2021-08-26 | ザ ジェネラル ホスピタル コーポレイション | 筋萎縮性側索硬化症および関連障害の治療のための併用療法 |
| JP2021529771A (ja) | 2018-07-02 | 2021-11-04 | ザ ジェネラル ホスピタル コーポレイション | クロモリンナトリウムおよびα−ラクトースの粉末製剤 |
| KR20210071974A (ko) * | 2018-09-05 | 2021-06-16 | 더 제너럴 하스피탈 코포레이션 | 사이토카인 방출 증후군을 치료하는 방법 |
| JP2022515293A (ja) * | 2018-12-10 | 2022-02-17 | ザ ジェネラル ホスピタル コーポレイション | クロモリンエステルおよびそれらの使用 |
| CN112375058A (zh) * | 2020-11-11 | 2021-02-19 | 杭州卢普生物科技有限公司 | 色甘酸二乙酯和色甘酸钠的制备方法 |
| US20240067635A1 (en) * | 2020-12-28 | 2024-02-29 | David R. Elmaleh | Cromolyn derivatives and uses thereof |
| WO2022178278A1 (en) * | 2021-02-19 | 2022-08-25 | The Trustees Of Columbia University In The City Of New York | Compositions and methods for modeling human microglia |
Family Cites Families (128)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3686412A (en) | 1965-03-25 | 1972-08-22 | Colin Fitzmaurice | Compositions containing bis-chromonyl compounds for inhibiting antigen-antibody reactions |
| GB1144905A (en) | 1965-03-25 | 1969-03-12 | Fisons Pharmaceuticals Ltd | Substituted bis-(2-carboxy-chromonyl-oxy) derivatives and preparation and pharmaceutical compositions thereof |
| US3957965A (en) | 1967-08-08 | 1976-05-18 | Fisons Limited | Sodium chromoglycate inhalation medicament |
| GB1242211A (en) | 1967-08-08 | 1971-08-11 | Fisons Pharmaceuticals Ltd | Pharmaceutical composition |
| GB1257162A (ko) | 1968-02-16 | 1971-12-15 | ||
| US4405598A (en) | 1976-01-30 | 1983-09-20 | Fisons, Limited | Composition for treating asthma |
| DE3104294A1 (de) | 1981-02-07 | 1982-08-19 | Hoechst Ag, 6000 Frankfurt | Substituierte diazaspirodecane, ihre herstellung, ihre verwendung als stabilisatoren fuer organische polymere, sowie die so stabilisierten polymeren |
| US4429545A (en) | 1981-08-03 | 1984-02-07 | Ocean & Atmospheric Science, Inc. | Solar heating system |
| BE897058A (fr) | 1982-06-25 | 1983-12-16 | Sandoz Sa | Utilisation d'un derive du spiro-succinimide dans le traitement de la demence du type alzheimer |
| US4996296A (en) | 1983-07-27 | 1991-02-26 | Yeda Research & Development Co., Ltd. | Cromolyn binding protein in highly purifed form, and methods for the isolation thereof |
| US4919915A (en) | 1987-03-03 | 1990-04-24 | Paul Averback | Method for detecting the ability to prevent red-to-green congophilic birefringence |
| US5231170A (en) | 1986-08-27 | 1993-07-27 | Paul Averback | Antibodies to dense microspheres |
| JPH05501505A (ja) | 1989-04-28 | 1993-03-25 | ライカー ラボラトリーズ,インコーポレイティド | 乾燥粉末吸入装置 |
| US5376386A (en) | 1990-01-24 | 1994-12-27 | British Technology Group Limited | Aerosol carriers |
| DE4405387A1 (de) | 1994-02-19 | 1995-08-24 | Hoechst Ag | Verfahren zur Herstellung von Polyalkyl-1-oxa-diazaspirodecan-Verbindungen |
| US6168776B1 (en) | 1994-07-19 | 2001-01-02 | University Of Pittsburgh | Alkyl, alkenyl and alkynyl Chrysamine G derivatives for the antemortem diagnosis of Alzheimer's disease and in vivo imaging and prevention of amyloid deposition |
| CA2174583A1 (en) | 1995-05-05 | 1996-11-06 | Alexander Chucholowski | Sulfuric acid esters of sugar alcohols |
| US6026809A (en) | 1996-01-25 | 2000-02-22 | Microdose Technologies, Inc. | Inhalation device |
| US6126919A (en) | 1997-02-07 | 2000-10-03 | 3M Innovative Properties Company | Biocompatible compounds for pharmaceutical drug delivery systems |
| US6309623B1 (en) | 1997-09-29 | 2001-10-30 | Inhale Therapeutic Systems, Inc. | Stabilized preparations for use in metered dose inhalers |
| US6565885B1 (en) | 1997-09-29 | 2003-05-20 | Inhale Therapeutic Systems, Inc. | Methods of spray drying pharmaceutical compositions |
| AU750567B2 (en) | 1997-09-29 | 2002-07-25 | Novartis Ag | Stabilized preparations for use in nebulizers |
| US5904937A (en) | 1997-10-03 | 1999-05-18 | Fmc Corporation | Taste masked pharmaceutical compositions |
| TWI239847B (en) | 1997-12-02 | 2005-09-21 | Elan Pharm Inc | N-terminal fragment of Abeta peptide and an adjuvant for preventing and treating amyloidogenic disease |
| CN1202876C (zh) | 1998-06-12 | 2005-05-25 | 微量技术公司 | 干粉吸入器和吸入装置 |
| US6197963B1 (en) | 1998-08-13 | 2001-03-06 | The Trustees Of The University Of Pennsylvania | Non-peptide peptidomimetics |
| EP2266548B1 (de) | 1998-11-13 | 2020-05-20 | Jagotec AG | Trockenpulver zur inhalation |
| IL143899A0 (en) | 1998-12-24 | 2002-04-21 | Janssen Pharmaceutica Nv | Controlled release galantamine composition |
| JP2001151673A (ja) | 1999-09-06 | 2001-06-05 | Nikken Chem Co Ltd | 吸入用粉末製剤の製造方法 |
| US20020107173A1 (en) | 1999-11-04 | 2002-08-08 | Lawrence Friedhoff | Method of treating amyloid beta precursor disorders |
| US20020009491A1 (en) | 2000-02-14 | 2002-01-24 | Rothbard Jonathan B. | Compositions and methods for enhancing drug delivery across biological membranes and tissues |
| EP1259251B1 (en) | 2000-02-21 | 2005-10-19 | Pharmexa A/S | Novel method for down-regulation of amyloid |
| CA2406383A1 (en) | 2000-04-13 | 2001-10-25 | Mayo Foundation For Medical Education And Research | A.beta.42 lowering agents |
| US20080021085A1 (en) | 2000-04-13 | 2008-01-24 | Mayo Foundation For Medical Education And Research | Method of reducing abeta42 and treating diseases |
| PE20011227A1 (es) | 2000-04-17 | 2002-01-07 | Chiesi Farma Spa | Formulaciones farmaceuticas para inhaladores de polvo seco en la forma de aglomerados duros |
| AR035642A1 (es) | 2000-05-26 | 2004-06-23 | Pharmacia Corp | Uso de una composicion de celecoxib para el alivio rapido del dolor |
| US20020016359A1 (en) | 2000-06-29 | 2002-02-07 | Hellberg Mark R. | Compositions and methods of treating neurodegenerative diseases |
| US8519005B2 (en) | 2000-07-27 | 2013-08-27 | Thomas N. Thomas | Compositions and methods to prevent toxicity of antiinflammatory agents and enhance their efficacy |
| FR2815030A1 (fr) | 2000-10-05 | 2002-04-12 | Lipha | Derives nitroso de la diphenylamine, compositions pharmaceutiques les contenant et leur utilisation pour la preparation de medicaments |
| US6511960B2 (en) | 2001-01-05 | 2003-01-28 | Alphamed Pharmaceuticals Corp | Cromolyn for eye and ear infections |
| WO2002085903A2 (en) | 2001-04-23 | 2002-10-31 | The Trustees Of The University Of Pennsylvania | Amyloid plaque aggregation inhibitors and diagnostic imaging agents |
| JP5196701B2 (ja) | 2001-11-29 | 2013-05-15 | エミスフィアー テクノロジーズ インコーポレイテッド | クロモリンナトリウムの経口投与用製剤 |
| ES2337350T3 (es) | 2002-05-10 | 2010-04-23 | Oriel Therapeutics, Inc. | Inhalador de polvo seco para uso con medios de dispensacion activados por polimeros piezoelectricos y envases de blisteres asociado que comprende un material polimerico piezoelectrico. |
| WO2004071532A1 (en) * | 2003-02-13 | 2004-08-26 | Licentia Oy | Use of a mast cell activation or degranulation blocking agent in the manufacture of a medicament for the treatment of a patient subjected to thrombolyses |
| EP1601380A1 (en) | 2003-02-13 | 2005-12-07 | Licentia OY | Use of a mast cell activation or degranulation blocking agent in the manufacture of a medicament for the treatment of cerebral ischemia |
| US20040223918A1 (en) | 2003-05-07 | 2004-11-11 | Chrysalis Technologies Incorporated | Aerosolization of cromolyn sodium using a capillary aerosol generator |
| GB0321607D0 (en) | 2003-09-15 | 2003-10-15 | Vectura Ltd | Manufacture of pharmaceutical compositions |
| CA2543482A1 (en) | 2003-10-28 | 2005-05-19 | Glaxo Group Limited | Inhalable pharmaceutical formulations employing lactose anhydrate and methods of administering the same |
| GB0326632D0 (en) | 2003-11-14 | 2003-12-17 | Jagotec Ag | Dry powder formulations |
| DE10355559A1 (de) | 2003-11-21 | 2005-06-23 | Orthogen Ag | Transskin |
| WO2005063732A1 (en) | 2003-12-23 | 2005-07-14 | Microbia, Inc. | Compounds and methods for the treatment of asthma |
| WO2005077394A1 (en) | 2004-02-11 | 2005-08-25 | Ramot At Tel-Aviv University Ltd | Compositions for treatment of cancer and inflammation with curcumin and at least one nsaid |
| US20050182044A1 (en) | 2004-02-17 | 2005-08-18 | Bruinsma Gosse B. | Combinatorial therapy with an acetylcholinesterase inhibitor and (3aR)-1,3a,8-trimethyl-1,2,3,3a,8,8a-hexahydropyrrolo[2,3,-b]indol-5-yl phenylcarbamate |
| US20070293538A1 (en) | 2004-04-13 | 2007-12-20 | Myriad Genetics, Incorporated | Pharmaceutical Composition And Methods For Treating Neurodegenerative Disorders |
| CA2562585A1 (en) | 2004-04-23 | 2005-11-10 | Cydex, Inc. | Dpi formulation containing sulfoalkyl ether cyclodextrin |
| CN101035541B (zh) | 2004-08-30 | 2012-05-30 | 柳署弘 | 溶解的udca在局灶缺血模型中的神经保护作用 |
| DE602005025391D1 (de) * | 2004-11-01 | 2011-01-27 | Seo Hong Yoo | Verfahren und zusammensetzungen zur verringerung der neurodegeneration bei amyotrophischer lateralsklerose |
| GB0426146D0 (en) | 2004-11-29 | 2004-12-29 | Bioxell Spa | Therapeutic peptides and method |
| CN101203242A (zh) | 2005-04-22 | 2008-06-18 | 健泰科生物技术公司 | 用cd20抗体治疗痴呆或阿耳茨海默氏病的方法 |
| CA2609980C (en) | 2005-05-27 | 2015-10-13 | Queen's University At Kingston | Treatment of protein folding disorders |
| US20070178166A1 (en) | 2005-12-15 | 2007-08-02 | Acusphere, Inc. | Processes for making particle-based pharmaceutical formulations for pulmonary or nasal administration |
| US8263645B2 (en) | 2006-02-03 | 2012-09-11 | Pari Pharma Gmbh | Disodium cromoglycate compositions and methods for administering same |
| AR059356A1 (es) | 2006-02-14 | 2008-03-26 | Astrazeneca Ab | Nuevos radioligandos |
| EP1994011B1 (en) | 2006-03-06 | 2010-10-13 | RaQualia Pharma Inc | Sulfonyl benzimidazole derivatives |
| NZ571181A (en) | 2006-03-09 | 2011-12-22 | Waratah Pharmaceuticals Inc | A cyclohexane polyalcohol formulation for treatment of disorders of protein aggregation |
| WO2009017467A1 (en) | 2007-07-27 | 2009-02-05 | Elan Pharma International Limited | Treatment of amyloidogenic diseases |
| US7700616B2 (en) | 2006-05-08 | 2010-04-20 | Molecular Neuroimaging, Llc. | Compounds and amyloid probes thereof for therapeutic and imaging uses |
| US8445437B2 (en) | 2006-07-27 | 2013-05-21 | The Brigham And Women's Hospital, Inc. | Treatment and prevention of cardiovascular disease using mast cell stabilizers |
| US20100173960A1 (en) | 2006-09-21 | 2010-07-08 | Antonio Cruz | The Combination of a Cyclohexanehexol and a NSAID for the Treatment of Neurodegenerative Diseases |
| WO2008061373A1 (en) | 2006-11-24 | 2008-05-29 | Waratah Pharmaceuticals Inc. | Combination treatments for alzheimer's disease and similar diseases |
| JP2011526240A (ja) | 2007-04-18 | 2011-10-06 | ヤンセン アルツハイマー イミュノセラピー | 脳アミロイド血管症の予防および治療 |
| WO2008128981A1 (en) | 2007-04-18 | 2008-10-30 | Probiodrug Ag | Nitrovinyl-diamine derivatives as glutaminyl cyclase inhibitors |
| WO2008134618A2 (en) | 2007-04-27 | 2008-11-06 | The General Hospital Corporation | Novel imaging tracers for early detection and treatment of amyloid plaques caused by alzheimer's disease and related disorders |
| US20090110679A1 (en) | 2007-07-13 | 2009-04-30 | Luk-Chiu Li | Methods and compositions for pulmonary administration of a TNFa inhibitor |
| GB0714134D0 (en) | 2007-07-19 | 2007-08-29 | Norton Healthcare Ltd | Dry-powder medicament |
| JO3076B1 (ar) | 2007-10-17 | 2017-03-15 | Janssen Alzheimer Immunotherap | نظم العلاج المناعي المعتمد على حالة apoe |
| CN104974024B (zh) | 2008-03-21 | 2017-11-14 | 综合医院公司 | 检测和治疗阿尔茨海默病和相关疾病的化合物和组合物 |
| EP2285374B1 (en) | 2008-04-29 | 2019-09-18 | Pharnext | Combination compositions for treating alzheimer disease and related disorders with zonisamide and acamprosate |
| CN102292328A (zh) | 2009-01-22 | 2011-12-21 | 拉夸里亚创药株式会社 | 具有cb2受体激动活性的n-取代饱和杂环砜化合物 |
| US8381454B1 (en) | 2009-01-23 | 2013-02-26 | Markus R. Robinson | Segmented, elongated, expandable, 4-season, double-walled, low-cost, rigid extruded plastic panel structures |
| ES2733214T3 (es) * | 2009-01-29 | 2019-11-28 | Massachusetts Gen Hospital | Derivados de cromolina y métodos relacionados de formación de imágenes y tratamiento |
| US9925282B2 (en) | 2009-01-29 | 2018-03-27 | The General Hospital Corporation | Cromolyn derivatives and related methods of imaging and treatment |
| TWI541021B (zh) | 2009-03-05 | 2016-07-11 | 艾伯維有限公司 | Il-17結合蛋白 |
| JP2012520311A (ja) | 2009-03-11 | 2012-09-06 | プレキシコン インコーポレーテッド | Rafキナーゼの阻害のためのピロロ[2,3−b]ピリジン誘導体 |
| US8377947B2 (en) | 2009-03-16 | 2013-02-19 | Chien-Hung Chen | Treating alzheimer's disease and osteoporosis and reducing aging |
| EP2248517B1 (en) | 2009-05-08 | 2014-03-26 | PARI Pharma GmbH | Concentrated mast cell stabilizing pharmaceutical formulations |
| CN102573500A (zh) * | 2009-08-06 | 2012-07-11 | 纽拉尔图斯制药公司 | 巨噬细胞相关疾病的治疗 |
| PL3792254T3 (pl) | 2009-09-24 | 2024-02-12 | Wista Laboratories Ltd. | Krystaliczne hydraty chlorku metylotioniny |
| EP2322163A1 (en) | 2009-11-03 | 2011-05-18 | Pharnext | New therapeutics approaches for treating alzheimer disease |
| US20110262442A1 (en) | 2009-11-06 | 2011-10-27 | Adenios, Inc. | Compositions for treating cns disorders |
| AU2010324835B2 (en) | 2009-11-30 | 2015-06-18 | Adare Pharmaceuticals, Inc. | Compressible-coated pharmaceutical compositions and tablets and methods of manufacture |
| US20110256064A1 (en) | 2010-04-16 | 2011-10-20 | Ac Immune, S.A. | Novel Compounds for the Treatment of Diseases Associated with Amyloid or Amyloid-like Proteins |
| WO2011136754A1 (en) | 2010-04-26 | 2011-11-03 | Mahmut Bilgic | A medicament developed for the treatment of respiratory diseases |
| CA2808189A1 (en) * | 2010-08-12 | 2012-02-16 | Revalesio Corporation | Compositions and methods for treatment of taupathy |
| KR101886987B1 (ko) | 2010-09-30 | 2018-08-08 | 키에시 파르마슈티시 엣스. 피. 에이. | 흡입용 건조 분말 제제 내 마그네슘 스테아레이트의 용도 |
| US20120121656A1 (en) | 2010-11-15 | 2012-05-17 | Revalesio Corporation | Methods and compositions for protecting against neurotoxicity of a neurotoxic agent, and improving motor coordination associated with a neurodegenerative condition or disease |
| LT2673266T (lt) | 2011-02-11 | 2016-10-10 | Wista Laboratories Ltd. | Fenotiazino diaminio druskos ir jų panaudojimas |
| BR112014024287A2 (pt) | 2012-03-27 | 2018-05-08 | Duke University | composições e métodos para a prevenção e tratamento do derrame vascular induzido por mastócitos |
| KR20150011807A (ko) | 2012-05-25 | 2015-02-02 | 질리어, 인크. | 자일리톨계 항-점액성 조성물과 관련 방법 및 조성물 |
| EP2890788A1 (en) * | 2012-08-31 | 2015-07-08 | The General Hospital Corporation | Biotin complexes for treatment and diagnosis of alzheimer's disease |
| EP2913053A4 (en) | 2012-10-23 | 2016-05-25 | Teijin Pharma Ltd | THERAPEUTIC OR PROPHYLACTIC AGENT FOR TUMOR LYING SYNDROME |
| JP6499077B2 (ja) | 2012-10-25 | 2019-04-10 | ザ ジェネラル ホスピタル コーポレイション | アルツハイマー病と関連疾患の治療のための併用療法 |
| US10058530B2 (en) | 2012-10-25 | 2018-08-28 | The General Hospital Corporation | Combination therapies for the treatment of Alzheimer's disease and related disorders |
| US10525005B2 (en) | 2013-05-23 | 2020-01-07 | The General Hospital Corporation | Cromolyn compositions and methods thereof |
| CA2913235C (en) * | 2013-05-23 | 2021-07-13 | Aztherapies, Inc. | Methods for delivering cromolyn |
| CN106102737B (zh) | 2013-10-22 | 2019-06-14 | 综合医院公司 | 色甘酸衍生物以及成像和治疗的相关方法 |
| ES2762806T3 (es) | 2014-02-10 | 2020-05-25 | Respivant Sciences Gmbh | Tratamiento utilizando estabilizadores de mastocitos para trastornos sistémicos |
| CA2938996A1 (en) * | 2014-02-10 | 2015-08-13 | Patara Pharma, LLC | Methods for the treatment of lung diseases with mast cell stabilizers |
| WO2016081466A1 (en) | 2014-11-21 | 2016-05-26 | Biohaven Pharmaceutical Holding Company Ltd. | Sublingual administration of riluzole |
| US11723864B2 (en) | 2015-05-29 | 2023-08-15 | The Texas A&M University System | Antimicrobial and anti-inflammatory compositions |
| EP3331522A1 (en) | 2015-08-07 | 2018-06-13 | Patara Pharma LLC | Methods for the treatment of mast cell related disorders with mast cell stabilizers |
| WO2017027402A1 (en) | 2015-08-07 | 2017-02-16 | Patara Pharma, LLC | Methods for the treatment of systemic disorders treatable with mast cell stabilizers, including mast cell related disorders |
| US20180311236A1 (en) * | 2015-10-28 | 2018-11-01 | Ab Science | Use of masitinib and other mast cell inhibitors for treatment of parkinson's disease |
| CN108472393A (zh) * | 2015-11-19 | 2018-08-31 | 阿尔茨治疗方法公司 | 用于治疗阿尔茨海默病和有关病症的方法 |
| CA3005909A1 (en) | 2015-11-23 | 2017-06-01 | Aztherapies, Inc. | Compositions and methods for treating ischemic stroke |
| DK3240538T3 (da) * | 2016-03-25 | 2021-12-06 | Ab Science | Anvendelse af masitinib til behandling af en underpopulation af patienter med amyotrofisk lateralsklerose |
| US20190240194A1 (en) | 2016-08-31 | 2019-08-08 | The General Hospital Corporation | Macrophages/microglia in neuro-inflammation associated with neurodegenerative diseases |
| BR112019004496A2 (pt) | 2016-09-08 | 2019-05-28 | Emergo Therapeutics Inc | estabilizantes de mastócitos para tratamento de hipercitocinemia e infecção viral |
| CA3070386A1 (en) | 2017-07-20 | 2019-01-24 | Aztherapies, Inc. | Powdered formulations of cromolyn sodium and ibuprofen |
| CN108164409B (zh) | 2018-01-24 | 2021-06-18 | 温州医科大学 | 一种2-亚苄基-1-茚酮类似物及应用 |
| JP2021521122A (ja) | 2018-04-09 | 2021-08-26 | ザ ジェネラル ホスピタル コーポレイション | 筋萎縮性側索硬化症および関連障害の治療のための併用療法 |
| CN108403708B (zh) | 2018-05-22 | 2019-06-14 | 滨州医学院 | 秦皮苷在制备预防或治疗急性呼吸窘迫综合征药物中的应用 |
| JP2021529771A (ja) | 2018-07-02 | 2021-11-04 | ザ ジェネラル ホスピタル コーポレイション | クロモリンナトリウムおよびα−ラクトースの粉末製剤 |
| KR20210071974A (ko) | 2018-09-05 | 2021-06-16 | 더 제너럴 하스피탈 코포레이션 | 사이토카인 방출 증후군을 치료하는 방법 |
| JP2022515293A (ja) | 2018-12-10 | 2022-02-17 | ザ ジェネラル ホスピタル コーポレイション | クロモリンエステルおよびそれらの使用 |
| EP4132507A1 (en) | 2020-04-06 | 2023-02-15 | The General Hospital Corporation | Methods of treatment of coronavirus-induced inflammation conditions |
| US20230226017A1 (en) | 2020-06-04 | 2023-07-20 | The General Hospital Corporation | Methods of treating a coronavirus infection |
| US20240067635A1 (en) | 2020-12-28 | 2024-02-29 | David R. Elmaleh | Cromolyn derivatives and uses thereof |
-
2017
- 2017-08-31 US US16/328,956 patent/US20190240194A1/en not_active Abandoned
- 2017-08-31 EP EP17847576.0A patent/EP3506894B1/en active Active
- 2017-08-31 CN CN201780051052.3A patent/CN109922800B/zh active Active
- 2017-08-31 KR KR1020197008717A patent/KR20190044647A/ko active IP Right Grant
- 2017-08-31 AU AU2017321782A patent/AU2017321782B2/en active Active
- 2017-08-31 CA CA3033079A patent/CA3033079A1/en active Pending
- 2017-08-31 WO PCT/US2017/049702 patent/WO2018045217A1/en unknown
- 2017-08-31 CN CN202310692160.6A patent/CN116889562A/zh active Pending
- 2017-08-31 JP JP2019511620A patent/JP2019524865A/ja active Pending
-
2021
- 2021-05-18 US US17/323,514 patent/US11679095B2/en active Active
-
2022
- 2022-08-17 JP JP2022130220A patent/JP2022171666A/ja active Pending
-
2023
- 2023-06-16 US US18/210,992 patent/US20240082207A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3506894A4 (en) | 2020-07-29 |
| WO2018045217A8 (en) | 2019-03-14 |
| CN109922800A (zh) | 2019-06-21 |
| JP2019524865A (ja) | 2019-09-05 |
| US11679095B2 (en) | 2023-06-20 |
| US20190240194A1 (en) | 2019-08-08 |
| EP3506894B1 (en) | 2023-08-23 |
| WO2018045217A1 (en) | 2018-03-08 |
| US20220079914A1 (en) | 2022-03-17 |
| AU2017321782B2 (en) | 2022-03-10 |
| EP3506894A1 (en) | 2019-07-10 |
| US20240082207A1 (en) | 2024-03-14 |
| CA3033079A1 (en) | 2018-03-08 |
| CN116889562A (zh) | 2023-10-17 |
| EP3506894C0 (en) | 2023-08-23 |
| AU2017321782A1 (en) | 2019-03-07 |
| CN109922800B (zh) | 2023-06-13 |
| JP2022171666A (ja) | 2022-11-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20190044647A (ko) | 신경변성 질환과 관련된 신경-염증에서 대식세포/미세아교세포 | |
| JP6982004B2 (ja) | ソベチロム誘導体 | |
| CN113727986A (zh) | 环状泛硫醇衍生物及其用途 | |
| JP2022003063A (ja) | 置換n−アセチル−l−システイン誘導体及び関連化合物 | |
| US20220226270A1 (en) | Very-long-chain polyunsaturated fatty acids, elovanoid hydroxylated derivatives, and methods of use | |
| JP2016210814A (ja) | カルボン酸フェニルケトン化合物およびその薬学的使用 | |
| JP2021512060A (ja) | 神経系疾患を治療するための化合物及びその応用 | |
| WO2020182144A1 (zh) | 用于治疗神经退行性疾病的化合物 | |
| JP2022551270A (ja) | ミトコンドリア病の治療のためのキノン類似体、ヒドロキノン類似体及びナフトキノン類似体 | |
| WO2005005366A1 (ja) | 分枝鎖カルボン酸化合物およびその用途 | |
| WO2014180321A1 (zh) | 间苯三酚类衍生物及其在治疗神经退行性疾病中的用途 | |
| JP7295145B2 (ja) | 神経変性疾患を治療するための医薬及びその使用 | |
| WO2003055521A1 (fr) | Remedes contre les troubles cognitifs legers | |
| RU2799454C2 (ru) | Терапевтический препарат для лечения нейродегенеративных заболеваний и его применение | |
| KR20210123321A (ko) | 류코트리엔 합성 억제제 | |
| WO2016191323A1 (en) | Lithium co-crystals for treatment of neuropsychiatric disorders | |
| JP2021520412A (ja) | タンパク質ミスフォールディング疾患のための療法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| AMND | Amendment | ||
| E902 | Notification of reason for refusal | ||
| AMND | Amendment | ||
| E601 | Decision to refuse application | ||
| X091 | Application refused [patent] | ||
| AMND | Amendment | ||
| X701 | Decision to grant (after re-examination) |