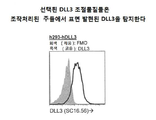
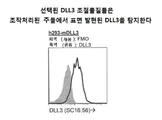
KR20150003169A - Dll3 조절물질들 및 사용 방법 - Google Patents
Dll3 조절물질들 및 사용 방법 Download PDFInfo
- Publication number
- KR20150003169A KR20150003169A KR1020147026844A KR20147026844A KR20150003169A KR 20150003169 A KR20150003169 A KR 20150003169A KR 1020147026844 A KR1020147026844 A KR 1020147026844A KR 20147026844 A KR20147026844 A KR 20147026844A KR 20150003169 A KR20150003169 A KR 20150003169A
- Authority
- KR
- South Korea
- Prior art keywords
- antibody
- dll3
- antibodies
- cells
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
- A61K31/551—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole having two nitrogen atoms, e.g. dilazep
- A61K31/5513—1,4-Benzodiazepines, e.g. diazepam or clozapine
- A61K31/5517—1,4-Benzodiazepines, e.g. diazepam or clozapine condensed with five-membered rings having nitrogen as a ring hetero atom, e.g. imidazobenzodiazepines, triazolam
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6807—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug or compound being a sugar, nucleoside, nucleotide, nucleic acid, e.g. RNA antisense
- A61K47/6809—Antibiotics, e.g. antitumor antibiotics anthracyclins, adriamycin, doxorubicin or daunomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6813—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin the drug being a peptidic cytokine, e.g. an interleukin or interferon
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
- A61K47/6819—Plant toxins
- A61K47/6825—Ribosomal inhibitory proteins, i.e. RIP-I or RIP-II, e.g. Pap, gelonin or dianthin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/6811—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a protein or peptide, e.g. transferrin or bleomycin
- A61K47/6817—Toxins
- A61K47/6829—Bacterial toxins, e.g. diphteria toxins or Pseudomonas exotoxin A
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6843—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6855—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from breast cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6857—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from lung cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6859—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from liver or pancreas cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6861—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from kidney or bladder cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6865—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from skin, nerves or brain cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6867—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from a cell of a blood cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6869—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from a cell of the reproductive system: ovaria, uterus, testes, prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6889—Conjugates wherein the antibody being the modifying agent and wherein the linker, binder or spacer confers particular properties to the conjugates, e.g. peptidic enzyme-labile linkers or acid-labile linkers, providing for an acid-labile immuno conjugate wherein the drug may be released from its antibody conjugated part in an acidic, e.g. tumoural or environment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6891—Pre-targeting systems involving an antibody for targeting specific cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K51/00—Preparations containing radioactive substances for use in therapy or testing in vivo
- A61K51/02—Preparations containing radioactive substances for use in therapy or testing in vivo characterised by the carrier, i.e. characterised by the agent or material covalently linked or complexing the radioactive nucleus
- A61K51/04—Organic compounds
- A61K51/08—Peptides, e.g. proteins, carriers being peptides, polyamino acids, proteins
- A61K51/10—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody
- A61K51/1093—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody conjugates with carriers being antibodies
- A61K51/1096—Antibodies or immunoglobulins; Fragments thereof, the carrier being an antibody, an immunoglobulin or a fragment thereof, e.g. a camelised human single domain antibody or the Fc fragment of an antibody conjugates with carriers being antibodies radioimmunotoxins, i.e. conjugates being structurally as defined in A61K51/1093, and including a radioactive nucleus for use in radiotherapeutic applications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/16—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3023—Lung
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57423—Specifically defined cancers of lung
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/35—Valency
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/54—F(ab')2
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/626—Diabody or triabody
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Toxicology (AREA)
- Microbiology (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Hospice & Palliative Care (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Reproductive Health (AREA)
- Pulmonology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Botany (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
Abstract
증식성 질환들을 치료하기 위한 항체들 및 그것들의 유도체들을 포함하는 새로운 조절물질들과 상기 조절물질들을 사용하는 방법들이 제공된다.
Description
관련출원
본 출원은 2012년 2월 24일에 출원된 미국 가출원 제61/603,173호와 2012년 10월 29일에 출원된 미국 가출원 제61/719,803호의 우선권을 주장한 것으로 각각은 그 전체가 본원에 참조로 포함된다.
서열 목록
본 출원은 전자출원시스템-웹(EFS-Web)을 통해 ASCII 포맷으로 제출되었던 서열 목록을 포함하고 있으며 그 전체가 참조로 본원에 포함되어 있다. 상기 ASCII 사본은, 2013년 2월 19일에 만들어진 것으로, 11200.0013-00304_SL.txt라고 명명되며 381,637 바이트의 크기이다.
기술분야
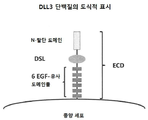
본 출원은 전반에 걸쳐 증식성 질환들과 그것들의 모든 확장, 재발, 도짐 또는 전이를 진단하고, 예방하고, 치료하거나 개선하는 데 사용하는 새로운 화합물들, 조성물들 그리고 그것들을 사용하는 방법들에 관한 것이다. 폭넓은 관점에서, 본 발명은 항-DLL6 항체들 및 융합 작제물들 등의 델타-유사 리간드 3 (delta-like ligand 3, DLL3) 조절물질들의 종양 질환들의 치료, 진단 또는 예방을 위한 용도에 관한 것이다. 본 발명의 선택된 실시형태들은 바람직하게는 종양 개시 세포 출현빈도의 감소를 포함하는 악성종양들의 면역요법 치료를 위한, 항체 약물 접합체 등을 포함하는, 상기 DLL3 조절물질들의 용도를 제공한다.
줄기 및 전구 세포 분화 및 세포 증식은 기관형성 동안의 조직 성장 및 모든 살아있는 유기체들의 일생 동안의 대부분 조직들의 세포 교체와 수리를 지탱하기 위해 협력해서 작용하는 정상적으로 계속 진행되는 과정들이다. 정상적인 발생하는 사건들의 과정에서 세포 분화와 증식은 세포 운명 결정과 조직 구성을 유지하기 위해 일반적으로 균형을 맞추고 있는 수많은 인자들과 신호들에 의해 조절이 이루어지고 있다. 따라서, 크게 보아 세포 분열과 조직 성숙을 조절하는 것은 유기체의 필요에 따라 신호들을 적절하게 발생시키고 있는 이러한 통제되는 마이크로환경이다. 이 점에서 세포 증식과 분화는 손상되었거나 죽어가는 세포들의 교체에 혹은 성장에 필요할 때에만 정상적으로 일어나는 것이다. 불행하게도, 세포 증식 및/또는 분화의 파괴는, 예를 들면, 각종의 신호전달 화학물질들의 과소 또는 과다, 변화된 마이크로환경들의 존재, 유전자 돌연변이들 또는 그것들의 어떤 조합 등을 포함하는 무수한 인자들에서 기인할 수가 있다. 정상 세포의 증식 및/또는 분화가 교란 당하거나 어떤 이유로든 파괴되면 암과 같은 증식성 질환 등의 각종 질병이나 질환에 이르게 될 수가 있다.
암의 종래 치료법들에는 화학요법, 방사선요법, 수술, 면역요법 (예를 들면, 생물학적 반응 조절물질들, 백신들 또는 표적 치료제들) 또는 그것들의 조합들 등이 있다. 블행하게도, 어떤 암들은 그러한 치료법들에 반응하지 않거나 극히 미미하게 반응한다. 예를 들면, 어떤 환자들에서 종양들은 선택된 치료법들의 광범한 효력에도 불구하고 종양들을 반응없는 상태로 만드는 유전자 돌연변이들을 보이고 있다. 게다가, 암의 종류 및 그것이 취한 형태에 따라서는 몇몇 이용가능한 치료법들, 이를 테면 수술 등은 실행가능한 대안들이 아닐 수 있다. 현재 기준의 치료 요법에 고유한 한계들은 전에 치료들을 받고 이후 재발한 환자들을 치료하려고 할 때 특히 명백하다. 상기한 경우들에서 실패한 치료 요법과 그로 인한 환자 악화는 결국에는 치료불능으로 판명되는 종종 비교적 침범적인 질병으로 드러내는 난치성 종양들의 원인이 될 수 있다. 여러 해에 걸쳐 암의 진단과 치료에 커다란 개선들이 있었지만, 많은 고형 종양들의 전체적인 생존율은 기존 요법들이 도짐, 종양 재발과 전이들을 막지 못하고 있기 때문에 크게 변화되지 않았다. 따라서, 증식성 질환들의 더욱 표적화된 그리고 강력한 치료요법들을 개발하려는 도전은 여전히 남아 있다.
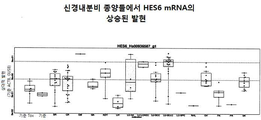
상기 목적 및 그 밖의 목적들은, 넓은 의미에서, DLL3 관련 질환들(예를 들면, 증식성 질환들 또는 종양성 질환들)의 치료에 사용될 수 있는 방법들, 화합물들, 조성물들 그리고 제조 물품들에 관한 본 발명에 의해 제공된다. 그 목적을 위해, 본 발명은 종양 세포들 및/또는 암 줄기 세포들을 효과적으로 표적화하며 광범하게 다양한 악성종양들에 걸린 환자들을 치료하는 데 사용될 수 있는 새로운 델타-유사 리간드 3 (또는 DLL3) 조절물질들을 제공한다. 본원에 더욱 자세하게 논하게 되겠지만, 적어도 두 가지의 본래 존재하는 DLL3 아이소형(isoform)들 또는 변이형(variant)들이 있으며 개시된 조절물질들은 한쪽의 아이소형 또는 다른 하나의 아이소형 또는 둘 다를 포함하거나 선택적으로 회합할 수 있다. 게다가, 어떤 실시형태들에서 개시된 DLL3 조절물질들은 하나 이상의 DLL 패밀리 멤버(예를 들면, DLL1 또는 DLL4)들과 더 반응할 수 있으며 또는, 다른 실시형태들에서는, 하나 이상의 DLL3 아이소형들과 배타적으로 회합하거나 반응하기 위해 생성되고 선택될 수 있다. 어떠한 경우에도 상기 조절물질들은, DLL3 유전자형 또는 표현형 결정인자 (또는 그것의 단편)를 인식하거나, 경쟁하거나, 작용하거나, 반대작용하거나, 상호작용하거나, 결합하거나 또는 회합하는 임의의 화합물을 포함할 수 있으며 하나 이상의 생리적 경로들 상의 DLL3 단백질의 영향을 조절하거나, 조정하거나, 부분변경하거나, 통제하거나, 변경하거나 또는 변형시키며 그리고/또는 DLL3관련 세포들을 제거하는 임의의 화합물을 포함할 수 있다. 따라서, 넓은 의미에서 본 발명은 대체로 단리된 DLL3 조절물질들과 그것의 용도들에 관한 것이다. 바람직한 실시형태들에서 본 발명은 더욱 구체적으로, 특히 바람직한 실시형태들에서는, 하나 이상의 세포독성제들과 회합되거나 접합된 항체들 (예를 들면, DLL3의 적어도 하나의 아이소형과 면역선택적으로 결합하고, 반응하거나 회합하는 항체들)을 포함하는 단리된 DLL3 조절물질들에 관한 것이다. 게다가, 아래에 광범위하게 논의되는 바와 같이, 상기 조절물질들은 암을 포함하는 증식성 질환들의 예방, 진단 또는 치료에 유용한 약제 조성물들을 제공하는 데 사용될 수 있다.
본 발명의 선택된 실시형태들에서, DLL3 조절물질들은, 단리된 형태이거나 또는 다른 물질들과 융합 또는 회합된 상태거나 (예를 들면, Fc-DLL3, PEG-DLL3 또는 표적 물질과 회합한 DLL3) 둘 중 하나인 DLL3 폴리펩타이드 또는 그것의 단편들을 포함할 수 있다. 다른 선택된 실시형태들에서 DLL3 조절물질들은, 본 출원의 목적들을 위하여, DLL3을 인식하거나, 경쟁하거나, 상호작용하거나, 결합하거나 또는 회합하며 종양 개시 세포들을 포함하는 종양 세포들의 성장을 중화시키거나, 제거하거나, 축소하거나, 감작(感作)하기 쉽게 만들거나, 재프로그램화하거나, 억제하거나 또는 통제하는 임의의 작제물 또는 화합물을 의미하는 것으로 간주될 DLL3 길항제들을 포함할 수 있다. 바람직한 실시형태들에서 본 발명의 DLL3 조절물질들은 종양 세포들의 생존, 재발, 재생 및/또는 전이를 전파시키거나, 유지하거나, 확장하거나, 증식하거나 또는 달리 촉진하는 종양 개시 세포들의 능력을 침묵시키거나, 중화하거나, 축소시키거나, 줄이거나, 고갈시키거나, 누그러지게 하거나, 감소시키거나, 재프로그램화하거나, 제거하거나, 또는 달리 억제하는 것으로 예기치 않게 밝혀진 항-DLL3 항체들, 또는 그것들의 단편들 또는 유도체들을 포함한다. 특히 바람직한 실시형태들에서 상기 항체들 또는 면역반응 단편들은 하나 이상의 항암제(예를 들면, 세포독성제)들과 회합하거나, 또는 접합할 수 있다.
상기 조절물질들에 관련하여 적합한 항체들은 예를 들면, 폴리클론성 및 모노클론성 항체들, 키메라성, CDR 이식형, 인간화 및 인간 항체들 그리고 상기 각각의 면역반응 단편들 및/또는 변이형들을 포함하는 여러 가지 형태들 가운데 어느 하나를 취할 수 있음을 알게 될 것이다. 바람직한 실시형태들에서는 인간화 또는 완전한 인간 작제물들과 같은 비교적 비면역성인 항체들을 포함할 것이다. 물론, 본 발명 개시의 관점에서 본 발명의 기술분야에 숙달된 사람이라면 필요 이상의 실험작업 없이도 DLL3 항체 조절물질들의 중쇄 및 경쇄 가변 영역들과 회합하는 하나 이상의 상보성 결정 영역(complementarity determining regions, CDR)들을 용이하게 확인하며 그 CDR들을 사용하여 키메라성, 인간화 또는 CDR 이식형 항체들을 조작처리하거나 제조할 수가 있을 것이다. 그래서, 어떤 바람직한 실시형태들에서 DLL3 조절물질은 도 11a 내지 도 11ad와 도 11b 내지 도 11bd에서 정의된 그리고 본원에 제시된 경쇄(도 11a 내지 도 11ad) 또는 중쇄(도 11b 내지 도 11bd) 연속 쇄 뮤린 가변 영역(서열번호 20 내지 203)들에서 유래된 하나 이상의 상보성 결정 영역(CDR)들을 포함한 항체를 포함한 것이다. 상기 CDR 이식형 가변 영역들도 또한 서열번호 204 내지 213을 포함하는 도 11에 나타나 있다. 바람직한 실시형태들에서 상기 항체들은 모노클론성 항체들을 포함할 것이며, 더욱 더 바람직한 실시형태들에서는, 키메라성, CDR 이식형 또는 인간화 항체들을 포함할 것이다.
도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 제시된 아미노산 서열들의 각각을 암호화하는 예시적인 핵산 서열들은 본원의 서열 목록에 첨부되어 있으며, 서열번호 220 내지 413을 포함한다. 이 점에서 본 발명은 더 나아가 첨부된 서열 목록에 제시된 것들을 포함하는 개시된 항체 가변 영역 아미노산 서열들을 암호화하는 핵산 분자들 (및 관련 작제물들, 벡터들 그리고 숙주 세포들)을 포함한다는 것도 알게 될 것이다. 더욱 구체적으로는 선택된 실시형태들에서 적합한 DLL3 조절물질들은 경쇄 가변 영역 및 중쇄 가변 영역을 갖는 항체를 포함할 수 있는데, 여기서 상기 경쇄 가변 영역은 서열번호 20, 서열번호 22, 서열번호 24, 서열번호 26, 서열번호 28, 서열번호 30, 서열번호 32, 서열번호 34, 서열번호 36, 서열번호 38, 서열번호 40, 서열번호 42, 서열번호 44, 서열번호 46, 서열번호 48, 서열번호 50, 서열번호 52, 서열번호 54, 서열번호 56, 서열번호 58, 서열번호 60, 서열번호 62, 서열번호 64, 서열번호 66, 서열번호 68, 서열번호 70, 서열번호 72, 서열번호 74, 서열번호 76, 서열번호 78 서열번호 80, 서열번호 82, 서열번호 84, 서열번호 86, 서열번호 88, 서열번호 90, 서열번호 92, 서열번호 94, 서열번호 96, 서열번호 98, 서열번호 100, 서열번호 102, 서열번호 104, 서열번호 106, 서열번호 108, 서열번호 110, 서열번호 112, 서열번호 114, 서열번호 116, 서열번호 118, 서열번호 120, 서열번호 122, 서열번호 124, 서열번호 126, 서열번호 128, 서열번호 130, 서열번호 132, 서열번호 134, 서열번호 136, 서열번호 138, 서열번호 140, 서열번호 142, 서열번호 144, 서열번호 146, 서열번호 148, 서열번호 150, 서열번호 152, 서열번호 154, 서열번호 156, 서열번호 158, 서열번호 160, 서열번호 162 서열번호 164, 서열번호 166, 서열번호 168, 서열번호 170, 서열번호 172, 서열번호 174, 서열번호 176, 서열번호 178, 서열번호 180, 서열번호 182, 서열번호 184, 서열번호 186, 서열번호 188, 서열번호 190, 서열번호 192, 서열번호 194, 서열번호 196, 서열번호 198, 서열번호 200 및 서열번호 202에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60%의 동일성을 갖는 아미노산 서열을 포함하며 상기 중쇄 가변 영역은 서열번호 21, 서열번호 23, 서열번호 25, 서열번호 27, 서열번호 29, 서열번호 31, 서열번호 33, 서열번호 35, 서열번호 37, 서열번호 39, 서열번호 41, 서열번호 43, 서열번호 45, 서열번호 47, 서열번호 49, 서열번호 51 , 서열번호 53, 서열번호 55, 서열번호 57, 서열번호 59, 서열번호 61, 서열번호 63, 서열번호 65, 서열번호 67, 서열번호 69, 서열번호 71, 서열번호 73, 서열번호 75, 서열번호 77, 서열번호 79, 서열번호 81, 서열번호 83, 서열번호 85, 서열번호 87, 서열번호 89, 서열번호 91, 서열번호 93, 서열번호 95, 서열번호 97, 서열번호 99, 서열번호 101, 서열번호 103, 서열번호 105, 서열번호 107, 서열번호 109, 서열번호 111, 서열번호 113 , 서열번호 115, 서열번호 117, 서열번호 119, 서열번호 121, 서열번호 123, 서열번호 125, 서열번호 127, 서열번호 129, 서열번호 131, 서열번호 133, 서열번호 135, 서열번호 137, 서열번호 139, 서열번호 141, 서열번호 143, 서열번호 145, 서열번호 147, 서열번호 149, 서열번호 151, 서열번호 153, 서열번호 155, 서열번호 157, 서열번호 159, 서열번호 161, 서열번호 163, 서열번호 165, 서열번호 167, 서열번호 169, 서열번호 171, 서열번호 173, 서열번호 175, 서열번호 177, 서열번호 179, 서열번호 181, 서열번호 183, 서열번호 185, 서열번호 187, 서열번호 189, 서열번호 191, 서열번호 193, 서열번호 195, 서열번호 197, 서열번호 199, 서열번호 201 및 서열번호 203에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60% 동일성을 갖는 아미노산 서열을 포함한 것이다. 다른 바람직한 실시형태들에서 선택된 조절물질들은 앞서 언급한 뮤린 서열들과 65, 70, 75 또는 80% 동일성을 포함하는 중쇄 및 경쇄 가변 영역들을 포함할 것이다. 또 다른 바람직한 실시형태들에서 상기 조절물질들은 개시된 뮤린 서열들과 85, 90 또는 95%까지 동일성을 포함하는 중쇄 및 경쇄 가변 영역들을 포함할 것이다.
다른 바람직한 실시형태들에서 선택된 조절물질들은 상기한 경쇄 및 중쇄 가변 영역 아미노산 서열들의 임의의 것으로부터 얻은 하나 이상의 CDR들을 포함할 것이다. 따라서, 본 발명의 선택된 실시형태들은 서열번호 20 내지 203의 어느 하나로부터 하나 이상의 CDR들을 포함하고 있는 DLL3 조절물질을 포함한다. 또 다른 실시형태들에서 본 발명의 조절물질들은 앞서 말한 조절물질들의 임의의 것과 결합하기 위해 경쟁하는 임의의 항체 또는 그것의 면역반응 단편을 포함할 것이다.
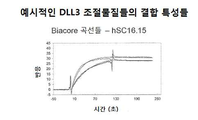
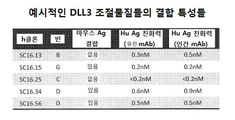
본 발명의 또 다른 면은 SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로부터 얻은 또는 유래된 조절물질들을 포함한다. 다른 실시형태들에서 본 발명은 앞서 말한 조절물질들의 임의의 것으로부터 하나 이상의 CDR들을 갖는 DLL3 조절물질을 포함할 것이다.
또 다른 적합한 실시형태들에서 본 발명은 CDR 이식형 또는 인간화 DLL3 조절물질들 hSC16.13, hSC16.15, hSC16.25, hSC16.34 및 hSC16.56을 포함할 것이다. 또 다른 실시형태들은 인간화 항체를 포함하는 DLL3 조절물질에 관한 것인데, 여기서 상기 인간화 항체는 경쇄 가변 영역과 중쇄 가변 영역을 포함한 것으로 상기 경쇄 가변 영역은 서열번호 204, 서열번호 206, 서열번호 208, 서열번호 210 및 서열번호 212에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60% 동일성을 갖는 아미노산 서열을 포함하며 상기 중쇄 가변 영역은 서열번호 205, 서열번호 207, 서열번호 209, 서열번호 211 및 서열번호 213에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60% 동일성을 갖는 아미노산 서열을 포함한 것이다. 더욱이, 방금 기술된 바와 같이 인간화된 중쇄 및 경쇄 가변 영역들을 암호화하는 핵산 서열들은 첨부된 서열 목록에 서열번호 404 내지 413으로 제시되어 있다.
상기한 면들 외에도, 본 발명의 다른 바람직한 실시형태들은 (단독으로 또는 다른 약리활성제들과의 조합으로) 증식성 질환들을 치료하는 데 특히 효과적일 수 있는 조절물질 접합체들을 제공할 수 있는 하나 이상의 약물들과 회합하거나 접합하는 DLL3 조절물질들을 포함할 것이다. 더욱 일반적으로는, 본 발명의 조절물질들이 일단 제조되어 선택되었으면 그것들은 약리활성 또는 진단 물질들 또는 생체적합 조절물질들과 연결되거나, 융합되거나, (예를 들면, 공유결합으로 또는 비공유결합으로) 접합하거나 달리 회합될 수 있다. 본원에 사용되는 용어 "접합체(conjugate)" 또는 "조절물질 접합체(modulator conjugate)" 또는 "항체 접합체(antibody conjugate)"는 폭넓게 사용될 것이며 회합 방법에 관계없이 개시된 조절물질들과 회합하는 임의의 생물활성 또는 탐지가능 분자 또는 약물을 의미하는 것으로 간주될 것이다. 이 점에서 상기 접합체들은, 개시된 조절물질들에 더하여, 펩타이드들, 폴리펩타이드들, 단백질들, 생체 내에서(in vivo) 활성제로 대사되는 전구약물들, 폴리머들, 핵산 분자들, 작은 분자들, 결합제들, 모방제들, 합성 약물들, 무기 분자들, 유기 분자들 및 방사성동위원소들을 포함할 수 있음을 이해할 수 있을 것이다. 더욱이, 상기 나타낸 바와 같이 선택된 접합체는 조절물질과 공유결합으로 또는 비공유결합으로 회합되거나, 또는 연결될 수 있으며, 적어도 부분적으로는, 접합을 달성하는 데 사용된 방법에 따라 다양한 화학정량관계학적 몰비들을 나타낸다.
본 발명의 특히 바람직한 면들은 증식성 질환들의 진단 및/또는 치료에 사용될 수 있는 항체 조절물질 접합체들 또는 항체-약물 접합체들을 포함할 것이다. 상기 접합체들은 식 M-[L-D]n으로 표시될 수 있는데, 여기서 M은 개시된 조절물질 또는 표적 결합 물질을 나타내고, L은 임의의 링커 또는 링커 단위이고, D는 적합한 약물 또는 전구약물이며 n은 약 1에서 약 20까지의 정수이다. 문맥에서 달리 지시하지 않는 한, 용어들 "항체-약물 접합체(antibody-drug conjugate)" 또는 "ADC" 또는 식 M-[L-D]n은 치료 및 진단 물질들 둘 다를 포함하는 접합체들을 망라하는 것으로 간주될 것임도 알게 될 것이다. 상기 실시형태들에서 항체-약물 접합체 화합물들은 전형적으로는 조절물질 단위(M)로서 항-DLL3, 치료 또는 진단 물질(D), 그리고 선택에 따라서는 약물과 항원결합제를 연결시켜 주는 링커(L)를 포함할 것이다. 바람직한 실시형태에서, 항체는 상기한 중쇄 및 경쇄 가변 영역들의 적어도 하나의 CDR을 포함하는 DLL3 mAb이다.
이전에 진술한 대로 본 발명의 한 가지 면은 DLL3 폴리펩타이드들의 암 줄기 세포들과의 예기치 않은 치료학적 회합을 포함할 수 있다. 따라서, 어떤 다른 실시형태들에서 본 발명은 대상에게 투여시 종양 개시 세포들의 출현빈도를 감소시키는 DLL3 조절물질을 포함할 것이다. 바람직하게는 출현빈도 감소는 시험관 내 또는 생체 내 한계 희석 분석법을 사용하여 측정될 것이다. 특히 바람직한 실시형태들에서 상기 분석법은 살아있는 인간 종양 세포들의 면역손상 마우스들 속으로의 이식을 포함하는 생체 내 한계 희석 분석법을 사용하여 수행될 수 있다 (예를 들면, 아래 실시예 17 참조). 다른 선택으로는, 살아있는 인간 종양 세포들의 시험관 내 콜로니 지지 상태들 속으로의 한계 희석 분석을 포함하는 시험관 내 한계 희석 분석법을 사용하여 수행될 수 있다. 둘 중 어느 경우에서도, 출현빈도 감소의 분석, 계산 또는 정량화는 바람직하게는 정확한 계산을 제공하기 위한 뿌아송(Poisson) 분포 통계학의 사용을 포함할 것이다. 상기 정량화 방법들이 바람직하지만, 유동 세포분석법 또는 면역조직화학과 같은 다른, 덜 노동 집중적인 방법론들도 원하는 값들을 제공하는 데 사용될 수 있으며, 따라서, 본 발명의 범위 내에 속하는 것으로 명백히 생각될 수 있음을 이해할 수 있을 것이다. 상기의 경우들에서 출현빈도 감소는 종양 개시 세포들에 대하여 농후하게 되는 것으로 알려진 종양 세포 표면 마커들에 대한 유동 세포계산 분석이나 면역조직화학적 탐지를 이용하여 측정될 수 있다.
이와 같이, 본 발명의 또 다른 바람직한 실시형태는 DLL3 관련 질환 치료를 필요로 하는 대상에게 치료유효량의 DLL3 조절물질을 투여하여 종양 개시 세포들의 출현빈도를 감소시키는 단계를 포함하는 DLL3 관련 질환을 치료하는 방법을 포함한다. 바람직하게는 DLL3 관련 질환은 종양 질환을 포함한다. 다시, 종양 개시 세포 출현빈도의 감소는 바람직하게는 시험관 내 또는 생체 내 한계 희석 분석을 사용하여 측정될 것이다.
이 점에서 본 발명은 DLL3 면역원들이 종양을 포함하는 각종 증식성 질환들의 원인론에 연루되어 있는 종양 영속화 세포들 (즉, 암 줄기 세포들)에 치료상 연관되어 있다는 발견에, 적어도 일부분, 기초한 것임을 알게 될 것이다. 더욱 구체적으로, 본 출원은 각종의 예시적인 DLL3 조절물질들의 투여로 종양 개시 세포들에 의한 종양발생 신호전달을 매개하거나, 감소시키거나, 고갈시키거나, 억제하거나 또는 제거할 수가 있다 (즉, 종양 개시 세포들의 출현빈도를 감소시킬 수가 있다)는 사실을 예기치 않게 증명한 것이다. 이 감소된 신호전달은, 종양 개시 세포들의 고갈, 중화, 감소, 제거, 재프로그래밍 또는 침묵에 의한 것이든 또는 종양 세포 형태학 (예를 들면, 분화 유도, 공간환경 파괴)을 부분변화시킨 것이든 간에, 그 다음에는 종양형성, 종양 유지, 확장 및/또는 전이와 재발을 억제함으로써 DLL3 관련 질환들의 더욱 효과적인 치료를 가능케 한다.
앞서 말한 암 줄기 세포들과의 연관 이외에도, DLL3 아이소형들이 신경내분비 특성들 또는 결정인자(유전자형 또는 표현형)들을 포함하거나 나타내는 종양들의 성장, 재발 또는 전이 잠재성과 관련되어 있을 수 있다는 증거가 있다. 본 발명의 목적들을 위하여 상기 종양들은 신경내분비 종양들 및 가성(pseudo) 신경내분비 종양들을 포함할 것이다. 본원에 기술된 새로운 DLL3 조절물질들을 사용하여 상기 종양형성 세포들의 증식에 시술함으로써, 한 가지 보다 많은 메커니즘 (예를 들면, 종양 개시 세포 축소 및 종양발생 경로 신호전달의 파괴)에 의한 질환을 개선시키거나 치료하여 부가적이거나 상승적인 효과들을 제공할 수 있다. 또 다른 바람직한 실시형태들은 조절물질 매개성 항암제를 전달하기 위한 세포 표면 DLL3 단백질의 세포 내재화를 이용할 수 있다. 이 점에서 본 발명은 (각종 종양을 포함하는) DLL3 관련 질환들을 치료할 수 있는 어떤 특정한 작용 메커니즘에 한정되어 있는 것은 아니고 그보다는 개시된 조절물질들의 광범위한 용도를 망라한 것임을 알게 될 것이다.
따라서, 다른 실시형태들에서 본 발명은 개시된 조절물질들을 필요로 하는 대상에서 내분비 특성들을 포함하고 있는 종양들을 치료하기 위한 그것들의 용도를 포함할 것이다. 물론 상기 조절물질들은 상기 종양들의 예방, 예후, 진단, 치료진단, 억제 또는 유지 요법에 사용될 수 있다.
본 발명의 다른 면들은 종양발생 경로(예를 들면, 노치(Notch))들을 파괴할 가능성이 있으면서 동시에 종양 개시 세포들을 침묵화하는 개시된 조절물질들의 능력을 개발한 것이다. 그러한 접합-활성 DLL3 조절물질들(예를 들면, DLL3 길항제들)은 치료 항암제들 또는 용적축소제들의 용인된 표준과 조합하여 사용하면 특히 효과적임이 증명될 수 있다. 그래서 본 발명의 바람직한 실시형태들은 개시된 조절물질들을 초기 치료들에 이은 유지 요법을 위한 항-전이제들로 사용하는 것을 포함한다. 게다가, 둘 이상의 DLL3 길항제들(예를 들면, DLL3상의 두 개의 구별되는 에피토프들에 특이하게 결합하는 항체들)을 본 발명의 교시들에 따라 조합하여 사용할 수 있다. 또한, 아래에 다소 상세하게 논의되겠지만, 본 발명의 DLL3 조절물질들은 접합형 또는 비접합형 상태로 그리고, 선택에 따라서는, 감작제(感作劑)로서 각종의 화학적, 생물학적 항암제들과 조합하여 사용될 수 있다.
따라서 본 발명의 또 다른 바람직한 실시형태는 항암제에 의한 치료 대상의 종양을 감작시키는 방법을 포함한 것으로 상기 대상에게 DLL3 조절물질을 투여하는 단계를 포함한다. 다른 실시형태들은 치료 이후의 전이 또는 종양 재발을 감소시키는 방법을 포함한 것으로 필요로 하는 대상에게 DLL3 조절물질을 투여하는 단계를 포함한다. 본 발명의 특히 바람직한 면에서 DLL3 조절물질은 특히 시험관 내 또는 생체 내 한계 희석 분석법을 사용하여 측정되는 종양 개시 세포 출현빈도의 감소라는 결과를 가져다 줄 것이다.
본 발명의 더욱 일반적으로 바람직한 실시형태들은 필요로 하는 대상에서 DLL3 관련 질환을 치료하는 방법을 포함한 것으로 대상에게 DLL3 조절물질을 투여하는 단계를 포함한다. 특히 바람직한 실시형태들에서 DLL3 조절물질은 항암제와 회합 (예를 들면, 접합)되어 있을 것이다. 또 다른 실시형태들에서 DLL3 조절물질은 세포 표면상의 또는 표면 부근의 DLL3와 회합하거나 결합한 이후 내재화할 것이다. 또한, 신호전달 경로들의 어떠한 파괴 및 부수적인 이로움 등을 포함하는, 본 발명의 유익한 면들은 대상 종양 조직이 정상의 인접한 조직과 비교하여 상승된 DLL3 수준들을 나타내든 감소된 또는 억압된 DLL3 수준들을 나타내든 간에 달성될 수 있다. 특히 바람직한 실시형태들은 정상 조직 또는 비종양형성 세포들과 비교하여 종양형성 세포들 상에 상승된 DLL3 수준들을 나타내는 질환들의 치료를 포함할 것이다.
또 다른 면에서 본 발명은 종양 질환에 걸린 대상을 치료하는 방법을 포함하는 것으로 치료유효량의 적어도 하나의 내재화 DLL3 조절물질을 투여하는 단계를 포함할 것이다. 바람직한 실시형태들은 조절물질들이 세포독성제와 접합되어 있거나 회합되어 있는 내재화하는 항체 조절물질들의 투여를 포함할 것이다.
다른 실시형태들은 DLL3 관련 질환에 걸린 대상을 치료하는 방법에 관한 것으로 치료유효량의 적어도 하나의 고갈시키는 DLL3 조절물질을 투여하는 단계를 포함한다.
또 다른 실시형태에서 본 발명은 개시된 활성조절물질들 또는 조절물질들을 종양 덩어리의 적어도 일부분을 제거하기 위해 설계된 초기 절차 (예를 들면, 화학요법약제, 방사선 또는 수술) 이후의 기간에 걸쳐 투여하는 유지 요법의 방법을 제공한다. 그러한 치료 유지 처방계획은 몇 주, 몇 달 또는 심지어 몇 년의 기간에 걸쳐 투여될 수 있는데, DLL3 조절물질들이 병을 예방하도록 작용하여 전이 및/또는 재발을 억제할 수 있다. 또 다른 실시형태들에서 개시된 조절물질들은 전이, 종양 유지 또는 재발을 막거나 저지하기 위해 알려진 용적축소 처방계획과 협력하여 투여될 수 있다.
이전에 언급하였듯이 본 발명의 DLL3 조절물질들은 DLL3의 아이소형들 둘 다 또는 그 단백질의 단 한 개의 아이소형과 반응하도록 제조되고/제조되거나 선택될 수 있으며, 또는, 역으로, DLL3에 더하여 적어도 하나의 추가된 DLL 패밀리 멤버와도 반응하거나 회합하는 범(汎)-DLL 조절물질을 포함할 수 있다. 더욱 구체적으로, 항체들과 같은 바람직한 조절물질들은 DLL3에서만 나타나는 도메인들 (또는 그 안의 에피토프들)과 또는 다수의 또는 모든 DLL 패밀리 멤버들에 걸쳐 적어도 어느 정도 보존되어 있는 영역들과 반응하도록 생성되거나 선택될 수 있다.
또 다른 바람직한 실시형태들에서 조절물질들은 DLL3의 특정 에피토프, 부분, 모티프 또는 도메인에 회합하거나 결합할 것이다. 아래에 다소 상세하게 논의되겠지만, DLL3 아이소형들은 둘 다 적어도 N-말단 도메인, DSL (Delta/Serrate/lag-2) 도메인 및 여섯 개의 EGF-유사 도메인들(즉, EGF1 - EGF6)을 포함하는 동일한 세포외 영역을 함유하고 있다 (도 1f 참조). 따라서, 어떤 실시형태들에서 조절물질들은 DLL3의 N-말단 도메인 (즉, 성숙 단백질의 아미노산들 27-175)과 결합하거나 회합할 것이고 다른 선택된 실시형태들에서 조절물질들은 DSL 도메인 (즉, 아미노산들 176-215) 또는 그 안의 에피토프와 회합할 것이다. 본 발명의 다른 면들은 DLL3의 특별한 EGF-유사 도메인에 소재한 특정 에피토프에 회합하거나 결합하는 조절물질들을 포함한다. 이 점에서 상기 특별한 조절물질은 EGF1 (아미노산들 216-249), EGF2 (아미노산들 274-310), EGF3 (아미노산들 312-351), EGF4 (아미노산들 353-389), EGF5 (아미노산들 391-427) 또는 EGF6 (아미노산들 429-465)에 소재한 에피토프에 회합하거나 결합할 수 있다. 물론 앞서 말한 도메인들의 각각은 하나보다 많은 에피토프 및/또는 하나보다 많은 빈(bin)을 포함할 수 있음을 알게 될 것이다. 특히 바람직한 실시형태들에서 본 발명은 DSL 도메인 또는 그 안의 에피토프와 결합하거나, 반응하거나 회합하는 조절물질을 포함할 것이다. 다른 바람직한 실시형태들에서 본 발명은 특정한 EGF-유사 도메인 또는 그 안의 에피토프와 결합하거나, 반응하거나 회합하는 조절물질들을 포함할 것이다. 또 다른 바람직한 실시형태들에서 조절물질들은 N-말단 도메인 또는 그 안의 에피토프와 결합하거나, 반응하거나 회합할 것이다.
조절물질 또는 항체 "빈(bin)"들에 관해서는 DLL3 항원이 그 단백질 상에 또는 따라 소재한 특정 빈들을 정의할 수 있는 당해 분야에서 인정되고 있는 기술들을 사용하는 경쟁 항체 결합을 통해 분석되거나 맵핑될 수 있음을 이해할 수 있을 것이다. 본원에 더욱 상세하게 논의되며 아래에 실시예들 9 및 10에서 나타나지만, 두 개의 항체들이 (그 중 하나는 "기준 항체(reference antibody)", "빈 겨냥 항체(bin delineating antibody)" 또는 "겨냥 항체(delineating antibody)"라 부를 수 있음) 표적 항원에 결합하기 위해 서로 경쟁한다면 그것들은 동일한 빈에 속하는 것으로 간주될 수 있다. 그러한 경우들에서 양쪽 항체들 둘 다가 항원에의 결합이 입체공간적으로나 또는 정전기학적으로 억제되거나 차단될 만큼 대상 항체 에피토프들은 동일하거나 실질적으로 동일하거나 (그것들이 몇 개 아미노산들로 구별되는 선형적인 의미에서나 형태적으로나 어느 쪽이든) 충분히 밀접한 것일 수 있다. 상기 정의된 빈들은 일반적으로 어떤 일정한 DLL3 도메인들과 회합될 수 있지만 (예를 들면 기준 항체는 특정 도메인에 포함되어 있는 에피토프와 결합할 것이다) 그 상관관계가 항상 정확한 것은 아니다 (예를 들면, 하나의 도메인에 하나보다 많은 빈이 있을 수 있거나 빈이 형태적으로 정의되어 하나보다 많은 도메인을 포함할 수 있다). 본 발명의 기술분야에 숙달된 사람이라면 DLL3 도메인들과 경험적으로 결정된 빈들 사이의 관계를 용이하게 결정할 수가 있음을 이해할 수 있을 것이다.
본 발명에 관해서는 당해 분야에서 인정되고 있는 기술들을 사용하는 경쟁 결합 분석 (예를 들면, ELISA, 표면 플라즈몬 공명 또는 바이오-층 간섭분석법)으로 적어도 아홉 개의 구별되는 빈들이 정의되었고, 그 각각은 다수의 항체 조절물질들을 포함하는 것으로 밝혀졌다. 본 발명 개시의 목적들을 위하여 아홉 개의 빈들은 bin A부터 bin I로 명명되었다. 따라서, 선택된 실시형태들에서 본 발명은 bin A, bin B, bin C, bin D, bin E, bin F, bin G, bin H 및 bin I로 이루어진 군에서 선택된 빈에 존재하는 조절물질을 포함할 것이다. 다른 실시형태들에서 본 발명은 SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에서 선택된 기준 항체에 의해 정의된 빈에 존재하는 조절물질을 포함한다. 또 다른 실시형태들에서 본 발명은 bin A 유래의 조절물질들, bin B 유래의 조절물질들, bin C 유래의 조절물질들, bin D 유래의 조절물질들, bin E 유래의 조절물질들, bin F 유래의 조절물질들, bin G 유래의 조절물질들, bin H 유래의 조절물질들 또는 bin I 유래의 조절물질들을 포함할 것이다. 또 다른 바람직한 실시형태들은 기준 항체 조절물질과 기준 항체와 경쟁하는 어떠한 항체를 포함할 것이다.
개시된 조절물질들의 맥락에서 사용될 때의 용어 "경쟁하다(compete)" 또는 "경쟁하는 항체(competing antibody)"는 기준 항체 또는 면역학적으로 기능하는 단편이 공통 항원에 대한 시험 항체의 특이 결합을 (예를 들면, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% 또는 90%보다 더 크게) 실질적으로 막거나 억제하는 분석평가에 의해 측정된 항체들 간의 결합 경쟁을 의미한다. 그러한 경쟁을 측정하는 적합한 방법들은, 예를 들면, 바이오-층 간섭분석법, 표면 플라즈몬 공명, 유동 세포분석법, 경쟁 ELISA 등과 같은 기술들로 알려진 기술을 포함한다.
앞서 말한 조절물질들 외에도, 선택된 실시형태들에서 본 발명은 DLL3 및 적어도 하나의 다른 DLL 패밀리 멤버와 회합하는 범-DLL 조절물질을 포함한다. 다른 선택된 실시형태들에서 본 발명은 하나 이상의 DLL3 아이소형과 면역특이적으로 회합하나 그 밖의 다른 DLL 패밀리 멤버와는 면역특이적으로 회합하지 않는 DLL3 조절물질을 포함한다. 또 다른 실시형태들에서 본 발명은 치료유효량의 범-DLL 조절물질을 투여하는 단계를 포함하는 그것을 필요로 하는 대상을 치료하는 방법을 포함한 것이다. 또 다른 실시형태들은 하나 이상의 DLL3 아이소형들과 면역특이적으로 회합하나 그 밖의 다른 DLL 패밀리 멤버와는 면역특이적으로 회합하지 않는 치료유효량의 DLL3 조절물질을 투여하는 단계를 포함하는 그것을 필요로 하는 대상을 치료하는 방법을 포함한다.
상기 논의된 치료적 용도들을 넘어서 본 발명의 조절물질들은 DLL3 관련 질환들과, 특히, 증식성 질환들을 탐지하거나, 진단하거나 분류하는 데 사용될 수 있음도 또한 이해할 수 있을 것이다. 그것들은 또한 상기 질환들의 예후 및/또는 치료진단에도 사용될 수 있다. 어떤 실시형태들에서 조절물질들은 대상에게 생체 내 투여될 수 있으며 탐지되거나 감시될 수 있다. 본 발명의 기술분야에 숙달된 사람들이라면 그러한 조절물질들은 아래에 개시된 활성조절물질들, 마커들 또는 리포터들로 표지되거나 회합될 수 있으며 몇몇 표준 기술들(예를 들면, MRI, CAT scan, PET scan 등)의 어느 하나를 이용하여 탐지될 수 있음을 이해할 수 있을 것이다.
따라서, 어떤 실시형태들에서 본 발명은 DLL3 조절물질을 투여하는 단계를 포함하는 그것을 필요로 하는 대상에서 DLL3 관련 질환을 생체 내 진단하거나, 탐지하거나 감시하는 방법을 포함할 것이다.
다른 경우들에서 조절물질들은 당해 분야에서 인정되고 있는 절차(예를 들면, 면역조직화학 또는 IHC)들을 사용하는 시험관 내 진단 세팅에 사용될 수 있다. 이와 같이, 바람직한 실시형태는:
a. 상기 대상으로부터 조직 샘플을 얻는 단계;
b. 조직 샘플을 적어도 하나의 DLL3 조절물질과 접촉시키는 단계; 그리고
c. 샘플과 회합한 DLL3 조절물질을 탐지하거나 정량화하는 단계
를 포함하는 그것을 필요로 하는 대상에서 과다증식성 질환을 진단하는 방법을 포함한다.
상기 방법들은 본 출원에 관련하여 쉽게 식별가능하며 자동 플레이트 판독기들, 전용 리포터 시스템들 등과 같은 일반적으로 이용가능한 상용 과학기술을 사용하여 용이하게 이행될 수 있다. 선택된 실시형태들에서 DLL3 조절물질은 샘플 속에 존재하는 종양 영속화 세포들 (즉, 암 줄기 세포들)과 회합할 것이다. 다른 바람직한 실시형태들에서 탐지하거나 정량화하는 단계는 본원에 기술된 대로 감시될 수 있는 종양 개시화 세포 출현빈도의 감소를 포함할 것이다.
유사한 맥락에서 본 발명은 또한 암과 같은 DLL3 관련 질환들의 진단 및 감시에 유용한 키트들 또는 장치들과 관련 방법들을 제공한다. 이를 위하여 본 발명은 바람직하게는 DLL3 관련 질환을 치료하거나, 감시하거나 진단하기 위한 목적의 DLL3 조절물질을 함유하는 용기와 상기 DLL3 조절물질을 사용하기 위한 교육 자료를 포함하는 DLL3 관련 질환들을 탐지하거나 진단하거나 치료하는 데에 유용한 제조 물품을 제공한다. 선택된 실시형태들에서 장치들과 관련 방법들은 적어도 하나의 순환하는 종양 세포를 접촉시키는 단계를 포함할 것이다.
본 발명의 다른 바람직한 실시형태들은 또한 개시된 조절물질들의 성질들을 면역조직화학, 형광 활성화 세포 분류(FACS) 또는 레이저 매개 분할 등을 포함하는 유동 세포계산 분석과 같은 방법들을 통해 종양 개시 세포들의 개체군들 또는 부분모집단들을 확인하거나, 특성평가하거나, 분리하거나, 분할하거나 풍부하게 하는 데 유용한 수단으로 이용한다.
이와 같이, 본 발명의 또 다른 바람직한 실시형태는 종양 개시 세포들의 개체군을 확인하거나, 분리하거나, 분할하거나 풍부하게 하는 방법에 관한 것으로 상기 종양 개시 세포들을 DLL3 조절물질과 접촉시키는 단계를 포함한다.
상기한 것은 요약이며 따라서, 부득이, 단순화한 것들, 일반화한 것들, 그리고 상세한 설명의 생략을 포함하고 있다; 그러므로, 본 기술분야에 숙달된 사람들이라면 요약은 설명적인 것일 뿐이며 어떤 식으로도 한정적인 것을 의미하는 것이 아님을 이해할 수 있을 것이다. 본원에 기술된 다른 면들, 특징들, 그리고 방법들의 이점들, 조성물들 및/또는 장치들 및/또는 그 밖의 요지는 본원에 설명된 교시들에서 명백해 질 것이다. 요약은 선택된 개념들을 단순화한 형태로 소개하기 위해 제공된 것으로 아래의 상세한 설명에서 더욱 기술된다. 이러한 요약은 특허청구되는 요지의 핵심 특징들 또는 본질적 특징들을 밝혀 주기 위한 목적으로 쓴 것도 아니고, 특허청구되는 요지의 범위를 결정하는 데 도움되는 자료로 사용되는 것도 아니다.
도 1a - 도 1f는 핵산 또는 아미노산 서열들을 포함하는 DLL3의 여러 가지 표시들로서 DLL3 아이소형들을 암호화하는 ORF들 (줄친 부분)을 포함하는 표준형 mRNA들이 도 1a 및 도 1b(서열번호 1 및 2)에 도시되어 있고, 도 1c 및 도 1d는 각 단백질 아이소형의 예측된 막관통 걸침 도메인을 나타내는 줄친 잔기들을 가진, 각각, 도 1a 및 도 1b(서열번호 3 및 4)에 표시된 ORF들의 번역을 제공한 것이고, 도 1e는 각 아이소형의 세포질 말단들의 서열 차이들을 예시하기 위한 두 개의 단백질 아이소형들의 정렬을 도시한 것으로, 또한 줄친 잔기들은 예측된 막관통 걸침 도메인을 나타낸 것이며 도 1f는 여러 가지 도메인들의 위치들을 예시하는 DLL3 단백질의 세포외 영역의 도식적 표시를 제공한 것이다;
도 2a 및 2B는 인간 유전체 안의 DLL3 및 그 밖의 델타-유사 패밀리 멤버들 (도 2a), 또는 가장 가까운 인간 아이소형의 DLL3와 리서스 원숭이, 마우스 및 래트 DLL3 단백질들 (도 2b) 간의 단백질 수준에서의 동일성 비율의 표로 만든 표시들이다;
도 3은 신경내분비의 또는 비(non)-신경내분비의 어느 하나의 표현형들에 이르는 세포 운명 선택들에 관련된 여러 가지 "마스터(master)" 유전자들 간의 유전학적 상호작용들을 도식적으로 예시한 것으로 (화살표들은 유전자 발현의 촉진을 나타내고 가로대가 있는 화살표들은 유전자 발현의 억제를 나타냄), 여기서 전사 인자 ASCL1의 발현은 신경내분비 표현형에 이르는 유전자 캐스케이드(백색 화살표)를 개시할 뿐만 아니라 동시에 DLL3을 활성화하게도 하는데, 이는 그 다음 차례로 노치1(NOTCH1)과 그것의 활성조절물질 헤스1(HES1)을 억압하며, 그 둘은 정상적으로는 ASCL1의 억압과 비-신경내분비 표현형에 이르는 유전자 캐스케이드들의 활성화를 책임지고 있다;
도 4a 및 도 4b는 종양 세포 부분모집단들 또는 정상 조직들에서 유래된 RNA의 완전 전사체 (SOLiD) 서열분석을 이용하여 측정되는 DLL3 및, 도 4a에서는, 다른 노치 경로 유전자들 또는 신경내분비 표현형과 관련된 유전자들의 유전자 발현 수준들의 표로 만든 (도 4a) 및 그래프를 사용한 (도 4b) 도시들이다;
도 5는 폐암들에서 유래된 선택된 비전통적인 이종이식 (NTX) 종양들에서의 완전 전사체 (SOLiD) 서열분석으로 측정되는 DLL3 mRNA 전사물 변이형들 1 및 2의 상대적 발현 수준들의 그래프를 사용한 도시이다;
도 6a - 도 6d는 신경내분비 특징들을 나타내는 종양들의 유전자 발현 데이터와 집단화를 보여준 것으로 도 6a는 선택된 종양들과 정상 대조표준 조직들을 포함하는 46개의 종양주들과 2개의 정상 조직들에 대한 마이크로어레이 프로파일들의 자율 집단화를 도시한 것이고, 도 6b와 도 6c는 신경내분비 표현형들 (도 6b) 또는 노치 신호전달 경로 (도 6c)에 관련된 선택된 유전자들의 상대적 발현 수준들에 상응하는 표준화 세기 값들의 표로 만든 표시들로서 그늘지지 않은 세포들 및 비교적 작은 숫자들은 발현이 거의 내지 전혀 없음을 가리키고 더 어두운 세포들 및 비교적 큰 숫자들은 더 높은 발현 수준들을 가리키며 도 6d는 qRT-PCR을 사용하여 측정되는 각종 종양들 및 정상 조직들에서의 헤스6(HES6) mRNA의 상대적 발현 수준들을 보여주는 그래프를 사용한 표시다;
도 7은 정상 조직들, 원발성의, 통과되지 않은 환자 종양 피검물들 ("p0"으로 표시됨), 또는 폐, 신장 및 난소 종양에서 유래된 덩치 NTX 종양들에서 단리된 다양한 RNA 샘플들에서 qRT-PCR에 의해 측정되는 DLL3 전사물들의 상대적 발현 수준들을 보여주는 그래프를 사용한 표시로 여기서 특정 NTX 폐종양들은 소(小)세포 폐암(SCLC)과 비-소세포 폐암(NSCLC)로 분류되어 있고 (마우스들을 통한 계대수를 반영하기 위해 p1, p2, p3 또는 p4로 표시됨), 종양 종류들은 상기 설명된 약어들을 사용하여 표시되어 있다;
도 8a - 도 8c는 열여덟 가지의 서로 다른 고형 종양 종류들 중 하나를 가진 환자들로부터 완전 종양 피검물 (회색 점) 또는 짝지은 정상 인접 조직(normal adjacent tissue, NAT; 백색 점)의 qRT-PCR에 의해 측정되는 인간 DLL3의 상대적 (도 8a) 또는 절대적 (도 8b) 유전자 발현 수준들을 보여주는 한편 도 8c는 전기화학발광 샌드위치 ELISA 분석평가를 사용하여 측정되는 인간 DLL3의 상대적 단백질 발현을 보여주는 그래프를 사용한 표시들이다;
도 9는 신장, 난소 및 소세포 폐 NTX 종양들에서 유래된 개개의 인간 종양 세포 개체군들에서의 여러 가지의 노치 수용체들과 리간드들 (예를 들면, DLL1, DLL4)의 표면 단백질 발현의 유동 세포분석을 기초로 하는 측정의 그래프를 사용한 표시들을 제공한 것으로, 평균 형광 세기(mean fluorescence intensity, MFI)들이 표시된 형광 마이너스 원(fluorescence minus one, FMO) 아이소형-대조표준 염색된 개체군 (온통 회색)에 참고상 배열된 히스토그램 도표들 (흑색 선)로 나타나 있다;
도 10a - 도 10d는, 각각, 렌티바이러스 발현 벡터 속으로 클론된 성숙 뮤린 DLL3 단백질을 암호화하는 cDNA 서열 (도 10a; 서열번호 5) 및 아미노산 서열 (도 10b; 서열번호 6)와 렌티바이러스 발현 벡터 속으로 클론된 성숙 사이노몰거스 DLL3 단백질을 암호화하는 cDNA 서열 (도 10c; 서열번호 7) 및 아미노산 서열 (도 10d; 서열번호 8) 를 제공한 것으로 벡터들은 뮤린 및 사이노몰거스 DLL3를 과다발현하는 세포들을 생산하기 위해 사용된 것이다;
도 11a 내지 도 11ad 및 도 11b 내지 도 11bd는 본 명세서의 실시예들에서 기술된 바와 같이 분리, 클론 및 조작처리된 몇몇의 예시적인 뮤린 및 인간화 DLL3 조절물질들의 경쇄 및 중쇄 가변 영역들의 연속적인 아미노산 서열들(서열번호 20 내지 213)을, 표의 형식으로 하여, 제공한 것이다;
도 12는 예시적인 DLL3 조절물질들의 생화학적, 면역학적 성질들을, 뿐만 아니라 표의 형식으로 나타낸 대로 시험관 내에서 KDY66 NTX 세포를 죽일 수 있는 능력을 설명한 것이다;
도 13a - 도 13c는 선택된 조절물질들의 결합 특성들을 예시한 것으로 도면들 도 13a 및 도 13b는 표면 플라즈몬 공명을 사용하여 선택의 뮤린 조절물질과 인간화 조절물질의 비교상의 결합 특성들을 보여주는 한편 도 13c는 인간화 작제물들의 어떤 성질들을 표의 형식으로 하여 제공한 것이다;
도 14a 및 도 14b는, 각각 도식 및 그래프의 형식으로 하여, 본 명세서의 실시예들에서 기술된 대로 분리, 클론 및 조작처리된 예시적인 DLL3 조절물질들의 도메인 수준 맵핑 분석의 결과들 (도 14a) 및 선택된 조절물질들의 결합 도메인과 시험관 내에서 DLL3를 발현하는 KDY66 NTX 세포들을 죽일 수 있는 능력 간의 상관관계 (도 14b)를 도시한 것이다;
도 15a - 도 15c는 조작처리되지 않은 293 세포들 (도 15a), 인간 DLL3 단백질들을 과다-발현하도록 조작처리된 293 세포들 (h293-hDLL3; 도 15b) 또는 뮤린 DLL3 단백질을 과다-발현하도록 조작처리된 293 세포들 (h293-mDLL3; 도 15c)에서 예시적인 항-DLL3 조절물질 SC16.56을 사용하여 DLL3 발현을 보여주는 유동 세포분석 히스토그램들이다;
도 16a - 도 16f는, 각각, 난소 (OV26; 도 16a), 신장 (KDY66; 도 16b) 및 폐 대(大)세포 신경내분비 암종 (LU37; 도 16c) NTX 종양들로부터의 살아있는 인간 세포들에서 예시적인 항-DLL3 조절물질 SC16.56을 사용하여 DLL3의 비교적 높은 표면 발현 및 각종 NTX 종양들 (도 16d)과 원발성 소세포 암종 (도 16f) 종양 세포들에서의 DLL3 단백질의 발현을 예시하는 한편 정상 조직들은 DLL3 발현이 결여되어 있음을 증명하는 (도 16e) 유동 세포분석 히스토그램들 (도 16a - 도 16c)과 면역조직화학 결과들을 표의 형식으로 (도 16d - 도 16f) 포함한 것이다;
도 17a 내지 도 17c는 세포독성 적재물을 DLL3를 발현하는 세포들 앞으로 효과적으로 작용하게 할 수 있는 개시된 조절물질들의 능력을 예시한 것으로 도 17a 내지 도 17aa는 KDY66 NTX 종양들 또는 hDLL3을 과다발현하는 293 세포들을 죽일 수 있는 예시적인 조절물질들의 능력을 기록한 것이며, 도 17b 및 도 17c는 OV26 (도 17b) 및 LU37 (도 17c)에 세포독성 적재물들을 전달할 수 있는 개시된 조절물질들의 능력을 보여준 것으로 아래로 향한 기울어진 곡선은 내재화한 세포독소를 통한 세포 살해를 나타낸다;
도 18a - 도 18e는 개시된 조절물질들의 여러 가지 성질들을 예시한 것으로 도 18a 및 도 18c는 DLL3 NSHP KDY66 및 조작처리되지 않은 KDY66은 DLL3을 발현하는 한편 DLL3의 발현이 DLL3HP2 KDY66 세포들에서는 효과적으로 해체되었음을 유동 세포분석으로 증명한 것이고, 도 18b는 DLL3HP2 종양 세포들의 성장이 조작처리되지 않은 KDY66 세포들보다 뒤짐을 보여준 것이며 도 18d 및 18e는 본 발명의 접합 실시형태들은 DLL3을 발현하는 KDY66 종양 세포들을 면역특이적으로 겨냥하여 죽이나 DLL3 유전자기능 해체된 KDY66 세포를 죽이지 못함을 증명한 것이다;
도 19a - 도 19c는 생체 내에서 예시적인 폐 종양형성 세포들을 죽이고/죽이거나 그것들의 성장을 억압할 수 있는 본 발명의 선택된 접합 실시형태들의 능력을 보여준다;
도 20a - 도 20f는 생체 내에서 종양들을 실질적으로 박멸하고 종양 재발을 막을 수 있는 본 발명의 접합 조절물질들의 능력을 도시한 것으로 - 예시적인 난소 (도 20a), 폐 (도 20b - 도 20d) 및 신장 (도 20e 및 도 20f) 종양들을 이식시킨 면역결핍 마우스들에서 지속적인 소실들을 얻고 있다; 그리고
도 21a - 도 21f는 본 발명의 접합 조절물질들이 두 개의 예시적인 소세포 폐 종양들, LU95 (도 21a - 도 21c) 및 LU64 (도 21d - 도 21f)에 대해 한계 희석 분석 (LDA)에 의해 측정되는 암 줄기 세포들의 출현빈도를 감소시킴을 증명한 것으로 도 21a 및 도 21d는 종양 성장에 미치는 접합체들의 효과를 보여주고, 도 21b 및 도 21e는 LDA의 결과들을 보여주며 도 21c 및 도 21f는 선택된 항-DLL3 항체 접합체에 의한 치료로 달성된 암 줄기 세포 출현빈도의 감소를 그래프를 사용하여 제공한 것이다.
도 2a 및 2B는 인간 유전체 안의 DLL3 및 그 밖의 델타-유사 패밀리 멤버들 (도 2a), 또는 가장 가까운 인간 아이소형의 DLL3와 리서스 원숭이, 마우스 및 래트 DLL3 단백질들 (도 2b) 간의 단백질 수준에서의 동일성 비율의 표로 만든 표시들이다;
도 3은 신경내분비의 또는 비(non)-신경내분비의 어느 하나의 표현형들에 이르는 세포 운명 선택들에 관련된 여러 가지 "마스터(master)" 유전자들 간의 유전학적 상호작용들을 도식적으로 예시한 것으로 (화살표들은 유전자 발현의 촉진을 나타내고 가로대가 있는 화살표들은 유전자 발현의 억제를 나타냄), 여기서 전사 인자 ASCL1의 발현은 신경내분비 표현형에 이르는 유전자 캐스케이드(백색 화살표)를 개시할 뿐만 아니라 동시에 DLL3을 활성화하게도 하는데, 이는 그 다음 차례로 노치1(NOTCH1)과 그것의 활성조절물질 헤스1(HES1)을 억압하며, 그 둘은 정상적으로는 ASCL1의 억압과 비-신경내분비 표현형에 이르는 유전자 캐스케이드들의 활성화를 책임지고 있다;
도 4a 및 도 4b는 종양 세포 부분모집단들 또는 정상 조직들에서 유래된 RNA의 완전 전사체 (SOLiD) 서열분석을 이용하여 측정되는 DLL3 및, 도 4a에서는, 다른 노치 경로 유전자들 또는 신경내분비 표현형과 관련된 유전자들의 유전자 발현 수준들의 표로 만든 (도 4a) 및 그래프를 사용한 (도 4b) 도시들이다;
도 5는 폐암들에서 유래된 선택된 비전통적인 이종이식 (NTX) 종양들에서의 완전 전사체 (SOLiD) 서열분석으로 측정되는 DLL3 mRNA 전사물 변이형들 1 및 2의 상대적 발현 수준들의 그래프를 사용한 도시이다;
도 6a - 도 6d는 신경내분비 특징들을 나타내는 종양들의 유전자 발현 데이터와 집단화를 보여준 것으로 도 6a는 선택된 종양들과 정상 대조표준 조직들을 포함하는 46개의 종양주들과 2개의 정상 조직들에 대한 마이크로어레이 프로파일들의 자율 집단화를 도시한 것이고, 도 6b와 도 6c는 신경내분비 표현형들 (도 6b) 또는 노치 신호전달 경로 (도 6c)에 관련된 선택된 유전자들의 상대적 발현 수준들에 상응하는 표준화 세기 값들의 표로 만든 표시들로서 그늘지지 않은 세포들 및 비교적 작은 숫자들은 발현이 거의 내지 전혀 없음을 가리키고 더 어두운 세포들 및 비교적 큰 숫자들은 더 높은 발현 수준들을 가리키며 도 6d는 qRT-PCR을 사용하여 측정되는 각종 종양들 및 정상 조직들에서의 헤스6(HES6) mRNA의 상대적 발현 수준들을 보여주는 그래프를 사용한 표시다;
도 7은 정상 조직들, 원발성의, 통과되지 않은 환자 종양 피검물들 ("p0"으로 표시됨), 또는 폐, 신장 및 난소 종양에서 유래된 덩치 NTX 종양들에서 단리된 다양한 RNA 샘플들에서 qRT-PCR에 의해 측정되는 DLL3 전사물들의 상대적 발현 수준들을 보여주는 그래프를 사용한 표시로 여기서 특정 NTX 폐종양들은 소(小)세포 폐암(SCLC)과 비-소세포 폐암(NSCLC)로 분류되어 있고 (마우스들을 통한 계대수를 반영하기 위해 p1, p2, p3 또는 p4로 표시됨), 종양 종류들은 상기 설명된 약어들을 사용하여 표시되어 있다;
도 8a - 도 8c는 열여덟 가지의 서로 다른 고형 종양 종류들 중 하나를 가진 환자들로부터 완전 종양 피검물 (회색 점) 또는 짝지은 정상 인접 조직(normal adjacent tissue, NAT; 백색 점)의 qRT-PCR에 의해 측정되는 인간 DLL3의 상대적 (도 8a) 또는 절대적 (도 8b) 유전자 발현 수준들을 보여주는 한편 도 8c는 전기화학발광 샌드위치 ELISA 분석평가를 사용하여 측정되는 인간 DLL3의 상대적 단백질 발현을 보여주는 그래프를 사용한 표시들이다;
도 9는 신장, 난소 및 소세포 폐 NTX 종양들에서 유래된 개개의 인간 종양 세포 개체군들에서의 여러 가지의 노치 수용체들과 리간드들 (예를 들면, DLL1, DLL4)의 표면 단백질 발현의 유동 세포분석을 기초로 하는 측정의 그래프를 사용한 표시들을 제공한 것으로, 평균 형광 세기(mean fluorescence intensity, MFI)들이 표시된 형광 마이너스 원(fluorescence minus one, FMO) 아이소형-대조표준 염색된 개체군 (온통 회색)에 참고상 배열된 히스토그램 도표들 (흑색 선)로 나타나 있다;
도 10a - 도 10d는, 각각, 렌티바이러스 발현 벡터 속으로 클론된 성숙 뮤린 DLL3 단백질을 암호화하는 cDNA 서열 (도 10a; 서열번호 5) 및 아미노산 서열 (도 10b; 서열번호 6)와 렌티바이러스 발현 벡터 속으로 클론된 성숙 사이노몰거스 DLL3 단백질을 암호화하는 cDNA 서열 (도 10c; 서열번호 7) 및 아미노산 서열 (도 10d; 서열번호 8) 를 제공한 것으로 벡터들은 뮤린 및 사이노몰거스 DLL3를 과다발현하는 세포들을 생산하기 위해 사용된 것이다;
도 11a 내지 도 11ad 및 도 11b 내지 도 11bd는 본 명세서의 실시예들에서 기술된 바와 같이 분리, 클론 및 조작처리된 몇몇의 예시적인 뮤린 및 인간화 DLL3 조절물질들의 경쇄 및 중쇄 가변 영역들의 연속적인 아미노산 서열들(서열번호 20 내지 213)을, 표의 형식으로 하여, 제공한 것이다;
도 12는 예시적인 DLL3 조절물질들의 생화학적, 면역학적 성질들을, 뿐만 아니라 표의 형식으로 나타낸 대로 시험관 내에서 KDY66 NTX 세포를 죽일 수 있는 능력을 설명한 것이다;
도 13a - 도 13c는 선택된 조절물질들의 결합 특성들을 예시한 것으로 도면들 도 13a 및 도 13b는 표면 플라즈몬 공명을 사용하여 선택의 뮤린 조절물질과 인간화 조절물질의 비교상의 결합 특성들을 보여주는 한편 도 13c는 인간화 작제물들의 어떤 성질들을 표의 형식으로 하여 제공한 것이다;
도 14a 및 도 14b는, 각각 도식 및 그래프의 형식으로 하여, 본 명세서의 실시예들에서 기술된 대로 분리, 클론 및 조작처리된 예시적인 DLL3 조절물질들의 도메인 수준 맵핑 분석의 결과들 (도 14a) 및 선택된 조절물질들의 결합 도메인과 시험관 내에서 DLL3를 발현하는 KDY66 NTX 세포들을 죽일 수 있는 능력 간의 상관관계 (도 14b)를 도시한 것이다;
도 15a - 도 15c는 조작처리되지 않은 293 세포들 (도 15a), 인간 DLL3 단백질들을 과다-발현하도록 조작처리된 293 세포들 (h293-hDLL3; 도 15b) 또는 뮤린 DLL3 단백질을 과다-발현하도록 조작처리된 293 세포들 (h293-mDLL3; 도 15c)에서 예시적인 항-DLL3 조절물질 SC16.56을 사용하여 DLL3 발현을 보여주는 유동 세포분석 히스토그램들이다;
도 16a - 도 16f는, 각각, 난소 (OV26; 도 16a), 신장 (KDY66; 도 16b) 및 폐 대(大)세포 신경내분비 암종 (LU37; 도 16c) NTX 종양들로부터의 살아있는 인간 세포들에서 예시적인 항-DLL3 조절물질 SC16.56을 사용하여 DLL3의 비교적 높은 표면 발현 및 각종 NTX 종양들 (도 16d)과 원발성 소세포 암종 (도 16f) 종양 세포들에서의 DLL3 단백질의 발현을 예시하는 한편 정상 조직들은 DLL3 발현이 결여되어 있음을 증명하는 (도 16e) 유동 세포분석 히스토그램들 (도 16a - 도 16c)과 면역조직화학 결과들을 표의 형식으로 (도 16d - 도 16f) 포함한 것이다;
도 17a 내지 도 17c는 세포독성 적재물을 DLL3를 발현하는 세포들 앞으로 효과적으로 작용하게 할 수 있는 개시된 조절물질들의 능력을 예시한 것으로 도 17a 내지 도 17aa는 KDY66 NTX 종양들 또는 hDLL3을 과다발현하는 293 세포들을 죽일 수 있는 예시적인 조절물질들의 능력을 기록한 것이며, 도 17b 및 도 17c는 OV26 (도 17b) 및 LU37 (도 17c)에 세포독성 적재물들을 전달할 수 있는 개시된 조절물질들의 능력을 보여준 것으로 아래로 향한 기울어진 곡선은 내재화한 세포독소를 통한 세포 살해를 나타낸다;
도 18a - 도 18e는 개시된 조절물질들의 여러 가지 성질들을 예시한 것으로 도 18a 및 도 18c는 DLL3 NSHP KDY66 및 조작처리되지 않은 KDY66은 DLL3을 발현하는 한편 DLL3의 발현이 DLL3HP2 KDY66 세포들에서는 효과적으로 해체되었음을 유동 세포분석으로 증명한 것이고, 도 18b는 DLL3HP2 종양 세포들의 성장이 조작처리되지 않은 KDY66 세포들보다 뒤짐을 보여준 것이며 도 18d 및 18e는 본 발명의 접합 실시형태들은 DLL3을 발현하는 KDY66 종양 세포들을 면역특이적으로 겨냥하여 죽이나 DLL3 유전자기능 해체된 KDY66 세포를 죽이지 못함을 증명한 것이다;
도 19a - 도 19c는 생체 내에서 예시적인 폐 종양형성 세포들을 죽이고/죽이거나 그것들의 성장을 억압할 수 있는 본 발명의 선택된 접합 실시형태들의 능력을 보여준다;
도 20a - 도 20f는 생체 내에서 종양들을 실질적으로 박멸하고 종양 재발을 막을 수 있는 본 발명의 접합 조절물질들의 능력을 도시한 것으로 - 예시적인 난소 (도 20a), 폐 (도 20b - 도 20d) 및 신장 (도 20e 및 도 20f) 종양들을 이식시킨 면역결핍 마우스들에서 지속적인 소실들을 얻고 있다; 그리고
도 21a - 도 21f는 본 발명의 접합 조절물질들이 두 개의 예시적인 소세포 폐 종양들, LU95 (도 21a - 도 21c) 및 LU64 (도 21d - 도 21f)에 대해 한계 희석 분석 (LDA)에 의해 측정되는 암 줄기 세포들의 출현빈도를 감소시킴을 증명한 것으로 도 21a 및 도 21d는 종양 성장에 미치는 접합체들의 효과를 보여주고, 도 21b 및 도 21e는 LDA의 결과들을 보여주며 도 21c 및 도 21f는 선택된 항-DLL3 항체 접합체에 의한 치료로 달성된 암 줄기 세포 출현빈도의 감소를 그래프를 사용하여 제공한 것이다.
I. 서론
본 발명은 여러 가지 다른 형태들로 구현될 수 있지만, 본원에 개시된 것은 그것들의 특정의 예시적인 실시형태들로서 본 발명의 원리들을 예시해 주는 것이다. 강조되어야 할 사실은 본 발명은 예시된 특정의 실시형태들에 한정되는 것이 아니라는 것이다. 게다가, 본원에 사용된 어떠한 항목 제목들은 구성상의 목적들만을 위한 것이며 기술된 요지를 한정하는 것으로 해석되어서는 아니 된다. 마지막으로, 본 발명 개시의 목적들을 위하여 모든 확인되는 서열 수탁 번호(sequence Accession number)들은 달리 언급되지 않는 한 NCBI Reference Sequence (RefSeq) 데이터베이스 및/또는 NCBI GenBank® 기록 서열 데이터베이스에서 찾아 볼 수 있다.
상기 논의된 바와 같이 DLL3 유전자형 및/또는 표현형 결정인자들이, 신경내분비 특징들을 나타내는 종양 등을 포함한, 각종 증식성 질환들과 연관되어 있으며, DLL3 및 그것의 변이형들 또는 아이소형들은 관련 질병들의 치료에 이용될 수 있는 유용한 종양 마커들을 제공한다는 사실을 발견한 것은 놀라운 일이었다. 게다가, 본 출원에서 보여지는 바와 같이 세포 표면 DLL3 단백질과 같은 DLL3 마커들 또는 결정인자들이 암 줄기 세포들 (종양 영속화 세포들로 알려져 있기도 함)에 치료상 연관이 있으며 암 줄기 세포들을 제거하거나 침묵시키는 데 효과적으로 이용될 수 있다는 사실을 발견한 것도 예기치 못한 일이었다. 암 줄기 세포들을 (예를 들면, 접합 DLL3 조절물질들의 사용을 통해) 선택적으로 축소시키거나 제거할 수 있는 능력은 그런 세포들은 일반적으로 많은 종래의 치료들에 저항적인 것으로 알려져 있는 점에서 특히 놀라운 것이었다. 즉, 전통적인, 뿐만 아니라 더욱 최근의 표적화 치료 방법들의 효과는 이들 다양한 치료 방법들에도 불구하고 종양 성장을 영속화할 수 있는 저항성 암 줄기 세포들의 존재 및/또는 출현으로 제한적인 경우가 많다. 더욱이, 암 줄기 세포들과 연관된 결정인자들은 낮거나 일관성이 없는 발현, 종양형성 세포와의 회합 상태 유지불능 또는 세포 표면에 존재 불능 때문에 치료 표적들로는 불충분한 경우가 많다. 종래 기술의 교시들에 뚜렷하게 대조적이게도, 지금 개시된 화합물들과 방법들은 이런 고유한 저항성을 효과적으로 극복한 것이며 상기 암 줄기 세포들의 분화를 특이적으로 제거하거나, 고갈시키거나, 침묵케 하거나 촉진케 함으로써 암 줄기 세포들의 근원적인 종양 성장을 유지하거나 재유도할 수 있는 능력을 없애게 한다. 게다가, DLL3 단백질의 발현은 주로 골지(Golgi)와 같은 세포내 위치들에 관련지어 생각되어 왔으므로, 표현형 결정인자들을 본원에 교시된 것과 같은 치료 표적으로 성공적으로 이용할 수가 있을지는 불확실하였다.
따라서, 본원에 개시된 것들과 같은 그런 DLL3 조절물질들이 필요로 하는 대상들에서 선택된 증식성 (예를 들면, 종양성) 질환들의 예후, 진단, 치료진단, 치료 및/또는 예방에 유리하게 사용될 수 있다는 것은 특히 주목할 만한 것이다. 본 발명의 바람직한 실시형태들이, 특히 개개의 도메인들, 영역들 또는 에피토프들의 측면에서 또는 신경내분비 특징들과 개시된 조절물질들과의 상호작용들을 포함하는 암 줄기 세포들 또는 종양들의 맥락에서, 아래에 광범하게 논의될 것이지만, 본 기술분야에 숙달된 사람들이라면 본 발명의 범위가 그러한 예시적인 실시형태들에 의하여 한정되는 것이 아님을 알고 있을 것이다. 오히려, 본 발명과 첨부된 특허청구범위들의 가장 광범위한 실시형태들은 폭넓고도 분명하게, 어떠한 특별한 작용 메커니즘이나 특이 표적화된 종양, 세포 수준이나 분자 수준의 성분에 관계없이, DLL3 조절물질들 (접합 조절물질들 포함)과 그것들의, 종양 또는 세포 증식성 질환들을 포함하는, 다양한 DLL3 관련 또는 매개 질환들의 예후, 진단, 치료진단, 치료 및/또는 예방에 쓰이는 용도에 관한 것이다.
그것 때문에, 그리고 본 출원에서 증명하고 있는 바와 같이, 개시된 DLL3 조절물질들이 증식성 또는 종양형성 세포들을 표적화하여 제거하거나 달리 무능력하게 만들며 DLL3 관련 질환들 (예를 들면, 종양)을 치료하는 데 효과적으로 사용될 수 있음을 예기치 않게 발견한 것이었다. 본원에 사용되고 있는 대로 "DLL3 관련 질환(DLL3 associated disorder)"은 질병 또는 질환의 경과 또는 원인연구 동안에 DLL3 유전자 성분들 또는 발현 ("DLL3 결정인자(DLL3 determinant)"의 표현형 또는 유전자형 이상으로 표시되고, 진단되고, 탐지되거나 확인되는 (증식성 질환들을 포함하는) 어떠한 질환 또는 질병을 의미하는 것으로 간주될 것이다. 이 점에 관해서는 DLL3 표현형 이상 또는 결정인자는, 예를 들면, DLL3 단백질 발현의 상승하였거나 하강한 수준들, 어떤 정의할 수 있는 세포 개체군들 상에서의 비정상적인 DLL3 단백질 발현 또는 세포 생명주기의 부적합한 국면 또는 단계에서의 비정상적인 DLL3 단백질 발현 등을 포함할 수 있다. 물론, DLL3의 유전자형 결정인자들 (예를 들면, mRNA 전사 수준들)의 유사한 발현 패턴들도 또한 DLL3 질환들을 분류하고, 탐지하거나 치료하는 데에 사용될 수 있음도 알게 될 것이다.
본원에 사용되고 있는 용어 "결정인자(determinant)" 또는 "DLL3 결정인자(DLL3 determinant)"는 DLL3 관련 질병 또는 질환에 걸린 조직, 세포 또는 세포 개체군 속에 또는 표면에서 확인되는 것들을 포함하는 특정한 세포, 세포 개체군 또는 조직과 연관이 있는 것으로 동일함을 증명할 수 있거나, 또는 그 속에 또는 표면에 특이적으로 발견되는 어떠한 탐지할 수 있는 특성, 성질, 마커 또는 인자를 의미할 것이다. 선택된 바람직한 실시형태들에서 DLL3 조절물질들은 DLL3 결정인자 (예를 들면, 세포 표면 DLL3 단백질 또는 DLL3 mRNA)와 직접 회합하거나, 결합하거나 또는 반응함으로써 질환을 개선할 수 있다. 더욱 일반적으로 결정인자들은 실제로는 형태학적이거나, 기능적이거나 또는 생화학적일 수 있으며 유전자형이거나 표현형일 수 있다. 다른 바람직한 실시형태들에서 결정인자는 특정 세포 종류들 (예를 들면, 암 줄기 세포들)에 따라 또는 어떤 조건들 하의 세포들 (예를 들면, 세포 주기의 특정 지점들 동안 또는 특정한 공간환경 속의 세포들)에 따라 차별적으로 또는 유리하게 발현되는 (또는 그렇지 않은) 세포 표면 항원 또는 유전자 성분이다. 또 다른 바람직한 실시형태들에서 결정인자는 특정한 세포 또는 별개의 세포 개체군에서 다르게 (상향 또는 하향) 조절되는 유전자 또는 유전자 실체, 유전자의 물리적 구조와 화학적 조성에 대하여 차별적으로 변형되는 유전자 또는 차별적인 화학적 변형들을 보여주는 유전자와 물리적으로 회합하는 단백질 또는 단백질들의 집합을 포함할 수 있다. 본원에서 고찰하는 결정인자들은 구체적으로 양성 또는 음성으로 판단하며 그것의 존재 (양성) 또는 부재 (음성)로 세포, 세포 개체군 또는 조직 (예를 들면, 종양들)을 표시할 수 있다.
유사한 맥락에서 본 발명의 "DLL3 조절물질(DLL3 modulator)"들은 폭넓게는 DLL3 변이형 또는 아이소형 (또는 그것의 특정 도메인들, 영역들 또는 에피토프들) 또는 그것의 유전자 성분을(과) 인식하거나, 반응하거나, 경쟁하거나, 길항작용하거나, 상호작용하거나, 결합하거나, 작용하거나, 또는 회합하는 어떠한 화합물을 포함한다. 이러한 상호작용들에 의해, DLL3 조절물질들은 종양형성 세포들 (예를 들면, 종양 영속화 세포들 또는 종양 줄기 세포들)의 출현빈도, 활성, 재발, 전이 또는 이동을 유리하게 제거하거나, 감소시키거나 또는 완화할 수 있다. 본원에 개시된 예시적인 조절물질들은 누클레오타이드들, 올리고누클레오타이드들, 폴리누클레오타이드들, 펩타이드들 또는 폴리펩타이드들을 포함한다. 어떤 바람직한 실시형태들에서 선택된 조절물질들은 DLL3 단백질 아이소형 또는 그것의 면역반응 단편들 또는 유도체들에 대한 항체들을 포함할 것이다. 상기 항체들은 실제로는 길항작용적이거나 작용적일 수 있으며 선택에 따라서는 치료제 또는 진단제와 접합되거나 회합될 수 있다. 게다가, 상기 항체들 또는 항체 단편들은 고갈화, 중화 또는 내재화 항체들을 포함할 수 있다. 다른 실시형태들에서, 본 발명의 범위 내의 조절물질들은 DLL3 아이소형 또는 그것의 반응 단편을 포함하는 DLL3 작제물을 구성할 것이다. 상기 작제물들은 융합 단백질을 포함할 수 있으며 면역글로불린들 또는 생체반응조절물질들과 같은 다른 폴리펩타이드들의 반응 도메인들을 포함할 수가 있음을 알게 될 것이다. 또 다른 면들에서, DLL3 조절물질은 유전체 수준에서 바라던 대로의 효과들을 가하는 핵산 물질 (예를 들면 miRNA, siRNA, shRNA, 안티센스 작제물들 등)을 포함할 것이다. 본 발명의 교시들과 부합하는 또 다른 조절물질들은 아래에 상세하게 논의될 것이다.
더욱 일반적으로 본 발명의 DLL3 조절물질들은 폭넓게는 세포 표면 DLL3 단백질을 포함하는 DLL3 결정인자 (유전자형 또는 표현형)를(와) 인식하거나, 반응하거나, 경쟁하거나, 길항작용하거나, 상호작용하거나, 결합하거나, 작용하거나, 또는 회합하는 어떠한 화합물을 포함한다. 궁극적으로 선택되는 조절물질의 형태가 어느 것이든 대상 속으로 도입되기 전에 분리되어 정제된 상태가 바람직할 것이다. 이와 관련하여 용어 "단리된 DLL3 조절물질(isolated DLL3 modulator)" 또는 "단리된 DLL3 항체(isolated DLL3 antibody)"는 폭넓은 의미에서 그리고 표준 제약 실제에 따라 바람직하지 않은 오염물질들 (생물학적 약제 및 기타)이 실질적으로 없는 상태의 조절물질을 포함하는 어떠한 제제 또는 조성물을 의미하는 것으로 해석될 것이다. 게다가 이들 제제들은 여러 가지의 당해 분야에서 인정되고 있는 기술들을 사용하여 원하는 대로 정제되어 제제될 수 있다. 물론, 상기 "단리된(isolated)" 제제들을 계획적으로 제제하거나 원하는 대로 불활성 또는 활성 성분들과 조합하여 최종 산물의 상업적, 제조적인 또는 치료적인 측면들을 개선할 수 있으며 약제 조성물들을 제공할 수 있음을 알게 될 것이다. 더욱 폭 넓은 의미에서 똑같은 일반적인 고찰들을 "단리된" DLL3 아이소형 또는 변이형 또는 이것들을 암호화하는 "단리된" 핵산에도 적용할 수 있다.
더욱이, 놀랍게도 특정한 DLL3 도메인들, 모티프들 또는 에피토프들에 상호작용하거나, 회합하거나 결합하는 조절물질들이 종양형성 세포들을 제거하는 데에 그리고/또는 종양 성장 또는 전파에 대한 암 줄기 세포 영향력들을 침묵시키거나 약화시키는 데에 특히 효과적이라는 사실도 발견되었다. 즉, 세포 표면에 가까운 도메인들 (예를 들면, EGF-유사 도메인들의 하나)과 반응하거나 회합하는 조절물질들이 종양형성 세포들을 고갈시키거나 중화하는 데에 효과적인 동시에 세포 표면과 비교적 더욱 멀리 있는 도메인들, 모티프들 또는 영역들에 회합하거나 결합하는 조절물질들도 종양형성 세포들을 제거하거나, 중화하거나, 고갈시키거나 침묵화하는 데에 역시 효과적이라는 사실이 발견된 것은 예기치 않은 일이었다. 특히, 그리고 첨부된 실시예들에 나타나 있는 바와 같이, DLL3 단백질의 DSL 또는 N-말단 영역들에 반응하거나, 회합하거나 결합하는 조절물질들은 신경내분비 특징들을 나타내는 것들을 포함하는 종양형성 세포들 및/또는 암 줄기 세포들을 제거하거나 중화하는 데에 놀랍게도 효과적이라는 사실이 발견되었다. 이것은, 예를 들면, 세포독성제를 포함한 항-DLL3 항체 약물 접합체들과 같은 접합 조절물질들에 특히 해당한다. 이와 같이, 본 발명의 어떤 바람직한 실시형태들은 DSL 도메인 및 N-말단 영역을 포함하는 DLL3의 비교적 멀리 있는 부분과 회합하거나, 결합하거나 또는 반응하는 DLL3 조절물질들을 포함하는 화합물들, 조성물들 및 방법들에 관한 것임을 알게 될 것이다.
본 발명은 명백히, 종양의 어떠한 종류를 포함하는, 어떠한 DLL3 질환의 치료에서의 어떠한 DLL3 조절물질의 사용을 고찰하고 있지만, 특히 바람직한 실시형태들에서 개시된 조절물질들은 신경내분비 종양들을 포함하는 신경내분비 특성들 (유전자형 또는 표현형)을 포함하는 종양들을 예방하거나, 치료하거나 진단하는 데에 사용될 수 있다. 진성의 또는 "전형적인 신경내분비 종양(canonical neuroendocrine tumor)"(NET)들은 분산성 내분비계에서 발생하며 전형적으로는 아주 공격성이다. 신경내분비 종양들은 신장, 비뇨생식기관 (방광, 전립선, 난소, 자궁경부, 및 자궁내막), 위장관 (위, 결장), 갑상선 (수질성 갑상선암), 그리고 폐 (소세포 폐 암종 및 대세포 신경내분비 암종)에 나타난다. 게다가, 개시된 조절물질들은 전형적인 신경내분비 종양들과 공통의 특성들을 유전자형으로나 표현형으로나 모방하거나, 포함하거나, 닮았거나 나타내는 가성 신경내분비 종양(pNET)들을 치료하거나, 예방하거나 진단하는 데에 유리하게 사용될 수 있다. "가성 신경내분비 종양(Pseudo neuroendocrine tumor)"들은 확산성 신경내분비계의 세포들에서 또는 종양발생 과정 동안 신경내분비 분화 캐스케이드가 비정상적으로 재활성화된 세포들에서 발생하는 종양들이다. 그러한 pNET들은 전통적으로 정의된 신경내분비 종양들과 어떤 유전자형, 표현형 또는 생화학적 특성들을 흔히 공유하고 있는데, 부분집합적인 생물학적 활성 아민들, 신경전달물질들, 및 펩타이드 호르몬들을 생성할 수 있는 능력 등을 포함하고 있다. 따라서, 본 발명의 목적들을 위하여 문구들 "신경내분비 특징들을 포함하는 종양(tumor comprising neuroendocrine features)"들 또는 "신경내분비 특징들을 나타내는 종양(tumor exhibiting neuroendocrine features)"들은 문맥에 의해 달리 지시하지 않는 한 신경내분비 종양들과 가성 신경내분비 종양들 둘 다를 포함하는 것으로 간주될 것이다.
상기 일반적으로 논의된 종양들과의 회합 외에도, 선택된 종양 개시 세포들 (TIC)과 DLL3 결정인자들 간의 표현형 또는 유전자형 회합의 징후들도 존재한다. 이 점에 관련하여서 선택된 TIC들 (예를 들면, 암 줄기 세포들)은 정상 조직 및 비-종양형성 세포들 (NTG)과 비교하여 DLL3 단백질의 상승된 수준들을 발현할 수 있는데, 이는 통틀어 전형적으로는 고형 종양의 대부분을 포함한다. 따라서, DLL3 결정인자들은 종양 관련 마커 (또는 항원 또는 면역원)을 포함할 수 있으며 개시된 조절물질들은 세포 표면들 상의 또는 종양 마이크로환경에서의 단백질들의 변화된 수준들로 인하여 TIC와 관련 종양의 탐지 및 억압을 위한 효과적인 작용제들을 제공할 수 있다. 따라서, 단백질들과 회합하거나, 결합하거나 반응하는 면역반응 길항제들 및 항체들을 포함하여, DLL3 조절물질들은 종양 개시 세포들의 출현빈도를 효과적으로 감소시킬 수 있으며 이들 종양-개시 세포들의 분화를 제거하는 데, 고갈시키는 데, 무력화하는 데, 감소시키는 데, 촉진하는 데, 또는 달리 이들 종양-개시 세포들의 환자 속에서 휴지 상태로 있고/있거나 종양 성장, 전이 또는 재발을 계속 자극할 수 있는 능력을 차단하거나 제한하는 데에 유용한 것일 수 있다. 이 점에 관련하여서 본 기술분야에 숙달된 사람들이라면 본 발명은 더 나아가 DLL3 조절물질들과 그것들의 종양 개시 세포들의 출현빈도를 감소시키는 데 사용되는 용도를 제공하는 것임을 이해할 것이다.
II. DLL3 생리학
노치 신호전달 경로는, 시. 엘레간스(C. elegans) 및 드로소필라(Drosophila)에서 처음 확인되어 이후 무척추동물들에서부터 척추동물들에 이르기까지 진화상 보존되어 있는 것이 밝혀졌는데, 정상 배아 발달, 성숙 조직 항상성, 및 줄기 세포 유지 등을 포함하는 일련의 기본적인 생물학적 과정들에 참여하고 있다 (D'Souza et al., 2010; Liu et al., 2010). 노치 신호전달은 특수화(specification), 패턴화 및 형태형성 동안 다양한 세포 종류들에 결정적인 것이다. 종종, 이것은 수평적 억제(lateral inhibition)의 메커니즘을 통해 일어나는데, 이 메커니즘에서는 노치 리간드를(들을) 발현하는 세포들이 디폴트 세포 운명(default cell fate)을 취하지만, 노치 신호전달의 자극을 통해 인접한 세포들에서는 이 운명을 억압한다 (Sternberg, 1988, Cabrera 1990). 노치 신호전달에 의해 매개되는 이러한 두 경로 세포 운명 선택은 발달 신경계 (de la Pompa et al., 1997), 혈액생성 및 면역계들 (Bigas and Espinosoa, 2012; Hoyne et al, 2011; Nagase et al., 2011), 소화기관 (Fre et al., 2005; Fre et al., 2009), 내분비 췌장 (Apelqvist et al., 1999; Jensen et al., 2000), 뇌하수체 (Raetzman et al., 2004), 그리고 확산성 신경내분비계 (Ito et al., 2000; Schonhoff et al, 2004) 등을 포함하는, 수많은 조직들에서 역할을 하는 것이 밝혀진다. 이 두 경로 스위치를 구현하기 위한 일반 메커니즘은 노치가 역할을 하는 발달계들의 폭넓은 범위에도 불구하고 보존되어 있는 것으로 보인다-- 디폴트 세포 운명 선택이 염기성 나선-고리-나선 (basic helix-loop-helix, bHLH) 단백질들로 알려진 전사 조절인자들에 의해 결정되는 세포들에서는, 노치 신호전달이 노치 반응성 유전자들의 활성화를 이끄는데, 이는 그 다음에 bHLH 단백질들의 활성을 억압한다 (Ball, 2004). 이러한 두 경로 결정들은 노치 신호전달이 증식을 초래하거나 억제하고, 자기-재생을 일으키거나 억제하는 발달상의, 신호전달 자극들의 더욱 폭넓은 상황에서 일어난다.
드로소필라에서, 노치 신호전달은 하나의 노치 수용체 유전자와, 세레이트(Serrate) 및 델타(Delta)로 알려진, 두 개의 리간드 유전자들에 의해 주로 매개된다 (Wharton et al, 1985; Rebay et al., 1991). 인간들에서는, 네 개의 알려진 노치 수용체들과 다섯 개의 DSL (델타-세레이트 LAG2) 리간드들, 즉 재기드1(Jagged1) 및 재기드 2(Jagged 2)로 알려진, 세레이트의 두 개의 상동체들, 그리고 델타-유사 리간드들 또는 DLL1, DLL3 및 DLL4라 부르는, 델타의 세 개의 상동체들이 있다. 일반적으로, 신호-수용 세포의 표면 상에 있는 노치 수용체들은 (트란스-상호작용(trans-interaction)이라고 부르는) 대립하는, 신호-전송 세포의 표면 상에 발현되는 리간드들과의 상호작용들에 의해 활성화된다. 이들 트란스-상호작용들이 노치 수용체의 일련의 프로테아제(protease) 매개성 절단반응들을 이끄는 것이다. 따라서, 노치 수용체 세포내 도메인은 막에서 핵으로 자유로이 위치를 바꿀 수 있으며, 거기에서 CSL 패밀리의 전사 인자들 (인간들에서는 RBPJ)과 파트너가 되어 그것들을 전사 억압인자들로부터 노치 반응성 유전자들의 활성인자들로 전환시킨다.
인간 노치 리간드들 중에서, DLL3은 트란스-상호작용들을 통하여 노치 수용체를 활성화할 능력이 없는 것으로 보이는 점에서 다르다 (Ladi et al., 2005). 노치 리간드들은 또한 노치 수용체들과 (같은 세포 상의) 시스형으로 상호작용하여 노치 신호의 억제로 이끌 수 있으나, 시스-억제(cis-inhibition)의 정확한 메커니즘은 여전히 불분명하며 리간드에 따라 달라질 수 있다 (예를 들면, Klein et al., 1997; Ladi et al., 2005; Glittenberg et al., 2006 참조). 두 가지 가설의 억제 방식들은 세포 표면에서 트란스-상호작용들을 방해함으로써 노치 신호전달을 조절하는 단계를 포함하고 있는데, 즉 내형질 세망 또는 골지에서 수용체의 처리를 교란시킴으로써 또는 수용체의 억류를 물리적으로 야기함으로써 세포 표면 상의 노치 수용체의 양을 감소시켜 조절한다는 것이다 (Sakamoto et al., 2002; Dunwoodie, 2009). 하지만, 이웃하는 세포들 상의 노치 수용체들과 리간드들의 발현의 추측상의 차이들은 전사 및 비-전사 과정들 둘 다를 통해 증폭될 수가 있으며, 시스- 및 트란스-상호작용들의 미묘한 균형들에 의해 이웃하는 조직들에서의 갈라지는 세포 운명들의 노치 매개 윤곽의 미세한 조율이 이루어진 것은 분명하다 (Sprinzak et al., 2010).
(델타-유사 3 또는 SCDO1로도 알려져 있는) DLL3은 노치 DSL 리간드들의 델타-유사 패밀리의 한 멤버다. 대표적인 DLL3 단백질 이종상동체(ortholog)들은 인간 (Accession Nos. NP_058637 및 NP_982353), 침팬지 (Accession No. XP_003316395), 마우스 (Accession No. NP_031892), 그리고 래트 (Accession No. NP_446118) 등을 포함하고 있으나, 이들에 한정되는 것은 아니다. 인간들에서, DLL3 유전자는 염색체 19q13 상에 위치한 9.5 kBp에 걸쳐 있는 8개의 엑손들로 이루어져 있다. 마지막 엑손 안쪽의 선택적 스플라이싱은 두 개의 가공처리 전사물들을 생기게 하는데, 2389 염기들의 전사물 (Accession No. NM_016941; 도 1a, 서열번호 1)과 2052 염기들의 전사물 (Accession No. NM_203486; 도 1b, 서열번호 2)이다. 전자의 전사물은 618개 아미노산 단백질 (Accession No. NP_058637; 도 1c, 서열번호 3)을 암호화하는 반면, 후자는 587개 아미노산 단백질 (Accession No. NP_982353; 도 1d, 서열번호 4)을 암호화한다. DLL3의 이들 두 가지 단백질 아이소형들은 자신들의 세포외 도메인들과 막관통 도메인들의 전역에서 전체적으로 100% 동일성을 공유하며, 더 긴 쪽의 아이소형이 단백질의 카르복시 말단에 32개 잔기들을 더 포함하는 확장된 세포질 꼬리를 포함하는 점에서만 다를 뿐이다 (도 1e). 아이소형들의 생물학적 관련성은 불확실하나, 둘 다의 아이소형들은 종양 세포들에서 탐지될 수가 있다 (도 5). 인간들에서 델타-유사 패밀리의 단백질들의 멤버들 각각에 대한 동일성 비율들이 도 2a에 나타나 있고, 뿐만 아니라 종 상호간의 동일성 비율들은 도 2b에 나타나 있다.
일반적으로, DSL 리간드들은 일련의 구조적 도메인들로 구성되어 있다: 독특한 N-말단 도메인, 이어서 보존성 DSL 도메인, 다중 직렬 상피성장인자(EGF)-유사 반복부위들, 막관통 도메인, 그리고 독특한 E3 유비퀴틴 리가아제들에 의한 유비퀴틴화의 잠재적 자리들인 여러 개의 라이신 잔기들을 포함한 것을 제외한 리간드들 상호간에 고도로 보존되어 있지 않은 세포질 도메인. DSL 도메인은 노치 수용체들과의 상호작용들에 필요하나 충분한 것은 아닌 축퇴성 EGF-도메인이다 (Shimizu et al., 1999). 게다가, 대부분 DSL 리간드들의 처음 두 개의 EGF-유사 반복부위들은 노치 신호전달을 활성화할 때 DSL 도메인과 협동적으로 상호작용하는 DOS 도메인으로 알려진 더 작은 단백질 서열 모티프를 포함하고 있다.
도 1f는 DLL3 단백질의 세포외 영역의 도식적 그림을 제공한 것으로, 여섯 개의 EGF-유사 도메인들, 단 한 개의 DSL 도메인 그리고 N-말단 도메인의 일반적인 병치 상태를 예시한 것이다. 일반적으로, EGF 도메인들은 hDLL3(서열번호 3 및 4)의 대체로 아미노산 잔기들 216 내지 249(도메인 1), 274 내지 310(도메인 2), 312 내지 351(도메인 3), 353 내지 389(도메인 4), 391 내지 427(도메인 5) 및 429 내지 465(도메인 6)에서 존재하는 것으로 인지되고, DSL 도메인은 대체로 아미노산 잔기들 176 내지 215에 그리고 N-말단 도메인은 대체로 아미노산 잔기들 27 내지 175에 있는 것으로 인지된다. 본원에 더욱 상세히 논의되고 아래 실시예 10에서 보여지는 바와 같이, EGF-유사 도메인들, DSL 도메인 그리고 N-말단 도메인의 각각은 구별되는 아미노산 서열로 정의되는 DLL3 단백질의 부분을 포함한다. 본 발명 개시의 목적들을 위하여 각각의 EGF-유사 도메인들은 EGF1에서 EGF6까지로 부를 수 있고 EGF1이 단백질의 N-말단 부분에 가장 가까운 것임을 주목하라. 단백질의 구조적 조성에 관해서 본 발명의 한 가지 중요한 면은 개시된 DLL3 조절물질들은 선택된 도메인, 모티프 또는 에피토프와 반응할 수 있도록 생성되거나, 제조되거나, 조작처리되거나 선택될 수 있다는 것이다. 어떤 경우들에서 그러한 자리 특이성 조절물질들은 그것들의 주요한 작용 방식에 따라 향상된 반응성 및/또는 효력을 제공할 수 있다.
본원에 사용되는 용어들 "성숙 단백질(mature protein)" 또는 "성숙 폴리펩타이드(mature polypeptide)"는 포유동물 세포에서의 발현에 의해 생성된 단백질 형태를(들을) 가리키는 것임을 주목하라. 성장하는 단백질 쇄의 거친 내형질 세망을 가로지르는 유출이 일단 개시되었으면, 포유동물 세포들에 의해 분비된 단백질들은 신호 펩타이드(signal peptide, SP) 서열을 갖는데, 이것은 완전한 폴리펩타이드로부터 절단되어 "성숙" 형태의 단백질을 내놓게 된다는 가설이 일반적으로 세워져 있다. DLL3의 둘 다의 아이소형들에서 성숙 단백질은 세포 표면 발현 이전에 잘라질 수 있는 26개 아미노산들의 신호 펩타이드를 포함하고 있다. 따라서, 성숙 단백질들에서 N-말단 도메인은 단백질의 27번 위치에서부터 DSL 도메인의 시작까지 연장될 것이다. 물론, 단백질이 이런 식으로 가공처리되지 않는다면 N-말단 도메인은 서열번호 3 및 4의 1번 위치까지 연장되는 것으로 간주될 것이다.
여러 가지의 델타-유사 리간드들 중에서, DLL3이 패밀리의 다른 것들로부터 가장 벗어나 있는데, 이는 축퇴성 DSL 도메인을 포함하고, DOS 모티프들이 없으며, 라이신 잔기들이 결여된 세포내 도메인을 포함하고 있기 때문이다. 축퇴성 DSL과 DOS 모티프들의 결여는 DLL3가 (세포들 간의) 트란스형 노치 신호전달을 일으킬 수 없음과 일치하는데, 이는 DLL3은, DLL1 또는 DLL4와 달리, 노치 신호전달의 억제인자로서만 작용한다는 것을 시사한 것이다 (Ladi et al., 2005). 연구들은 DLL3이 주로 시스-골지에 상주하는 것임을 밝혔는데 (Geffers et al., 2007), 이는 노치 수용체를 세포내에 유지하려는, 즉 노치 수용체들의 가공처리를 방해하여, 세포 표면으로의 유출을 막고 대신 그것을 라이소솜으로 새로운 목표로 향하게 한다는 가설에 입각한 능력과 일치할 수 있을 것이다 (Chapman et al., 2011). 일부 DLL3 단백질은, 하지만, 단백질이 모델 시스템들에서 인위적으로 과다발현되면, 세포 표면에 나타날 수 있는데 (Ladi et al., 2005), 그러나 이것이 정상적인 생물학적 상황들에서의 경우인지 아니면 DLL3 MRNA 전사물이 상승되는 종양들에서의 경우인지는 분명하지 않다; 다소 놀랍게도, 본원에 개시된 종양 종류들에서 탐지된 단백질 수준들은 의미있는 DLL3 단백질이 각종 종양들의 세포 표면으로 흘러 나가고 있음을 나타낸다.
DLL3 유전자의 결함들은 인간들에서 척추늑골 뼈발생이상에 관련되어 왔는데, 이것은 비정상 척추 형성과 늑골 기형들을 유발하는 중증의 선천성 출생 결함이다 (Dunwoodie, 2009). 이것은 올바른 발달을 위해 노치, 윈트(Wnt), 및 FGF 신호전달 경로들간의 미세한 조절성의 변동하는 상호작용을 필요로 하는 척추동물의 배아 전구체들인, 체절(體節)들의 극성 및 패턴화를 결정짓는 데 결정적인 역할을 하는 것으로 알려진, 노치 신호전달의 이상들과 관련되어 있다 (Kageyama et al., 2007; Goldbeter and Pourquie, 2008). 비록 DLL1과 DLL3은 전형적으로는 발달하는 마우스 배아 내부의 유사한 장소들에서 발현되지만, 유전자도입 마우스들을 이용한 실험들은 DLL3이 DLL1을 보충해 주는 것이 아님을 입증했다 (Geffers et al., 2007). DLL1 유전자파괴 마우스들은 배아 치사적이나, DLL3 돌연변이체 마우스들은 살아 남지만 척추늑골 뼈발생이상을 가진 인간들에서 발견되는 것과 유사한 표현형을 보여준다 (Kusumi et al., 1998; Shinkai et al., 2004). 이러한 결과들의 데이터는 정상적인 발달에 중대한 노치 트란스- 및 시스-상호작용들의 미묘한 상호작용과 일치하는 것이다.
또한, 상기 논의된 바와ㅏ같이 노치 신호전달은 신경내분비 세포들과 신경내분비 특징들을 나타내는 종양들의 발달과 유지에 역할을 담당한다. 이 점에서 노치 신호전달은 정상 내분비 기관들에서 그리고 확산성 신경내분비계에서의 폭넓은 범위의 세포 운명 결정들에 연루되어 있다. 예를 들면, 췌장에서, 노치 신호전달은 bHLH 전사 인자 NGN3에 의해 매개되는 디폴트 내분비 표현형의 발달을 억압하는 데에 요구된다 (Habener et al, 2005). 내분비 세포 운명들의 유사한 노치 매개성 억압은 장(腸)내분비 세포들 (Schonhoff et al., 2004), 갑상선 소포주변 세포들 (Cook et al., 2010)에서 일어나고, 뇌하수체 (Dutta et al., 2011)에서 신경내분비 세포 종류들의 상대 비율들을 지정할 때 일어나며, 신경내분비 또는 비-신경내분비 표현형을 택하려는 폐들 내부의 세포들의 결정들에 연루되어 있을 것 같다 (Chen et al., 1997; Ito et al., 2000; Sriuranpong et al., 2002). 따라서 여러 조직들에서, 노치 신호전달의 억압은 신경내분비 표현형들에 관련되어 있는 것은 분명하다.
발달상의 신호전달 경로들의 부적절한 재활성화 또는 정상 신호전달 경로들의 조절이상은 종양들에서 흔히 관찰되며, 노치 신호전달의 경우에서는, 수많은 종양 종류들과 관련되어 왔다 (Koch and Radtke, 2010; Harris et al., 2012). 노치 경로는 림프종들, 직장결장의, 췌장의, 그리고 어떤 종류들의 비-소세포 폐암의 종양유전자로서 연구되어 왔다 (Zarenczan and Chen, 2010 및 그 속의 참고문헌들 참조). 대조적이게도, 노치는 신경내분비 특징들을 가진 종양들에서는 종양 억압인자로 작용한다고 보고되고 있다 (상기 Zarenczan and Chen, 2010 참조). 신경내분비 특징들을 가진 종양들은 가끔 폭넓은 범위의 원발성 위치들에서 발생하며, 그것들의 철저한 분류는 의문의 여지가 있지만 (Yao et al., 2008; Klimstra et al., 2010; Klㆆppel, 2011), 그것들은 크게 네 종류들로 분류될 수 있다: 저등급 양성 카르시노이드들, 악성 성질이 있는 저등급 고분화 신경내분비 종양들, 신경내분비 및 상피 특징들이 혼합된 종양들, 그리고 고등급 저분화 신경내분비 암종들. 이러한 분류들 중에서, 소세포 폐암(SCLC)과 작은 집합들의 비-소세포 폐암(NSCLC)을 포함하는, 저분화 신경내분비 암종들은, 무서운 예후들을 가진 암 종류들이다. SCLC는 기원이 기관지유래성이며 일부는 폐 신경내분비 세포들에서 발생하는 것으로 가정되어 왔다 (Galluzzo and Bocchetta, 2011). 신경내분비 표현형을 가진 이들 종양들 각각의 기원의 구체적인 세포 공급원이 무엇이든 간에, 노치 신호전달의 억압이, 노치 경로 유전자들 자체들에서의 직접적인 손상들에 의해서든, 또는 노치 신호전달을 억압하는 다른 유전자들의 활성화에 의해서든, 이들 종양들의 내분비 표현형 획득의 원인이 될 수 있는 것으로 예상할 수 있다. 나아가, 노치 경로의 교란을 유발하는 유전자들은 신경내분비 표현형들을 가진 종양들의 치료를 위한, 특히 현재 임상 결과들이 좋지 않은 징후들의 치료 표적들이 될 수 있다.
ASCL1은 DLL3을 통해 노치 신호전달 경로와 상호작용하는 것으로 보이는 그런 한 가지 유전자다. 여러 신경내분비 종양들이 낮은 분화도의 (즉 부분적으로 완전한) 내분비 표현형을 보이는 것은 분명하다; 예를 들면, 각종 내분비 단백질들과 폴리펩타이드들 (예를 들면 크로모그라닌 A, CHGA; 칼시토닌, CALCA; 프로피오멜라노코린, POMC; 소마토스타틴, SST), 분비성 소포들과 회합하는 단백질들 (예를 들면, 시냅토파이신, SYP), 및 생리활성 아민들의 합성을 책임지는 생화학적 경로들에 관여하는 유전자들 (예를 들면, 도파 디카르복실라제, DDC)의 뚜렷한 상승 또는 발현. 아마도 놀랄 정도는 아니겠지만, 이들 종양들은 신경 및 신경내분비 표현형들로 이어지는 유전자 캐스케이드들을 전개하는 데 역할을 하는 것으로 알려진 전사 인자인, (마우스들에서 mASH1, 또는 인간들에서 hASH1로도 알려져 있는) ASCL1을 종종 과다-발현한다. 상기 캐스케이드의 분자 수준의 구체적인 상세한 내용들은 여전히 분명치 않지만, 어떤 세포 종류들의 경우, 특히 갑상선 소포주변 세포들 (Kameda et al., 2007), 부신 수질의 크로마핀 세포들 (Huber et al., 2002) 그리고 폐의 확산성 신경내분비계에서 발견되는 세포들 (Chen et al., 1997; Ito et al., 2000; Sriuranpong et al., 2002)의 경우, ASCL1은 섬세하게 조율되는 발달상의 조절 고리의 일부로서 세포 운명 선택들이 ASCL1-매개성 및 노치-매개성 유전자 발현 캐스케이드들의 균형에 의해 매개되고 있다는 것은 점점 분명하다 (도 3). 예를 들면, ASCL1은 정상 마우스 폐 신경내분비 세포들에서 발현되는 것으로 밝혀졌고, 노치 신호 활성조절물질 헤스1은, 폐의 비-신경내분비 세포들에서 발현되었다 (Ito et al., 2000). 이들 두 캐스케이드들이 잠재적으로 교차-조절하는 미묘한 균형에 있다는 것은 점점 이해되고 있다. 노치 활성조절물질 헤스1은 ASCL1 발현을 하향조절하는 것으로 밝혀졌다 (Chen et al., 1997; Sriuranpong et al., 2002). 이러한 결과들은 노치 신호전달이 신경내분비 분화를 억압할 수가 있음을 분명히 보여준다. 하지만, DLL3 프로모터에 대한 ASCL1 결합이 DLL3 발현을 활성화한다는 증명 (Henke et al., 2009)과 DLL3이 노치 신호전달을 약화시킨다는 관찰결과 (Ladi et al., 2005)는 신경내분비와 비-신경내분비 표현형들 간의 세포 운명 선택들의 유전자 회로를 닫아 준다.
노치 신호전달은 이웃하는 세포들 간의 미묘한 차이들을 증폭시켜 뚜렷하게 경계를 접하고 있는 조직 영역들이 분기하는 분화 경로들을 가질 수 있도록 (예를 들면, 상기한 바의 "수평적 억제") 진화하여 온 것으로 보이는 점을 고려하면, 상기 데이터는 종합해 볼 때 섬세하게 조율되는 발달상의 조절 고리 (도 3)가 신경내분비 표현형들을 가진 암들에서 재활성화되었으며 조절이상이 있었음을 시사해 준다. DLL3이 세포의 안쪽 막성 구획들 내부에 정상 소재함 (Geffers et al., 2007)과 그 속의 노치와의 추정된 상호작용들을 가정하면 항체 치료제들의 개발을 위한 적합한 세포 표면 표적을 제공할 수 있을지 명백하지 않지만, 신경내분비 종양들에서 결과로서 생기는 DLL3 발현의 상승이 신경내분비 표현형을 가진 종양들 (예를 들면, NET들과 pNET들)의 독특한 치료 표적을 제공할 수 있다는 것은 가능하다. 실험실 시스템들에서 단백질들의 엄청난 과다발현은 세포 내부의 과다발현된 단백질의 위치착각을 야기할 수 있다는 것이 일반적으로 관찰되고 있다. 그러므로 종양들에서 DLL3의 과다발현은 단백질의 어떤 세포 표면 발현의 원인이 될 수 있으며, 그 때문에 항체 치료제들의 개발을 위한 표적을 제공할 수 있는 것은 합리적인 가설이나, 실험적 입증 없이는 명백하지 않다.
III. 암 줄기 세포들
상기 언급한 대로 (유전자형 및/또는 표현형의) 비정상적인 DLL3 발현이 각종의 종양형성 세포 부분모집단들과 연관 있음이 발견된 것은 놀라운 일이었다. 이 점에서 본 발명은 그런 세포들, 특히 종양 영속화 세포들을 표적화함으로써, 종양 질환들의 치료, 관리 또는 예방을 용이하게 하기에 특히 유용할 수 있는 DLL3 조절물질들을 제공한 것이다. 따라서, 바람직한 실시형태들에서 (표현형 또는 유전자형의) DLL3 결정인자들의 조절물질들은 본 발명의 교시들에 따라 종양 개시 세포 출현빈도를 감소시킴으로써 증식성 질환들의 치료 또는 관리를 용이하게 하는 데에 유리하게 사용될 수 있다.
본 출원의 목적들을 위하여 용어 "종양 개시 세포(tumor initiating cell)" (TIC)는 "종양 영속화 세포(tumor perpetuating cell)"(TPC; 즉, 암 줄기 세포 또는 CSC)들과 고도 증식성의 "종양 전구 세포(tumor progenitor cell)"(TProg라 부름)들 둘 다를 망라한 것으로, 이 둘이 합쳐져 일반적으로는 덩치 종양 또는 덩어리의 독특한 부분모집단 (즉, 0.1-40%)을 구성한다. 본 발명 개시의 목적들을 위하여 용어들 "종양 영속화 세포(tumor perpetuating cell)"들과 "암 줄기 세포(cancer stem cell)"들 또는 "종양 줄기 세포(neoplastic stem cell)"들은 같은 뜻이며 본원에서는 서로 바꾸어 사용될 수 있다. TPC는 적은 수의 단리된 세포들의 연속 이식(마우스들을 통한 두 번 이상의 통과들)에 의해 증명되는 바와 같이 TPC가 종양 내부에 존재하는 종양 세포들의 조성을 완전히 발생반복하여 무제한의 자기-재생 능력을 가질 수가 있는 반면, TProg는 무제한의 자기-재생 능력을 보여줄 수 없다는 점에서 TProg와 다르다.
본 기술분야에 숙달된 사람들이라면 적합한 세포 표면 마커들을 사용하는 형광-활성화 세포 분류(FACS)가, 적어도 어느 정도, 단일 세포들과 세포들의 덩어리들 (즉 이중체들 등)간을 구별할 수 있는 능력 때문에 고도의 농축된 암 줄기 세포 부분모집단들을 (예를 들면, > 99.5% 순도로) 분리할 수 있는 신뢰할 수 있는 방법인 것을 이해할 것이다. 그런 기술들을 사용하면 적은 세포 갯수들의 고도 정제된 TProg 세포들이 면역손상된 마우스들 속으로 이식되었을 때 그것들은 1차 이식에서 종양 성장을 자극할 수가 있음이 밝혀졌다. 하지만, 정제된 TPC 부분모집단들과 달리 TProg에 의해 발생된 종양들은 표현형 세포 이질성에서 모체 종양들을 완전히 반영하지 못하며 후속 이식들에서 연속 종양형성을 재개시하기에는 명백히 비효과적이다. 그와 대조적으로, TPC 부분모집단들은 모체 종양들의 세포 이질성을 완전히 재구성하며 연속적으로 분리 및 이식될 때 종양들을 효과적으로 개시시킬 수가 있다. 따라서, 본 기술분야에 숙달된 사람들이라면 TPC와 TProg 간의 결정적인 차이가, 비록 둘 다는 1차 이식들에서 종양을 발생시킬 수 있지만, 적은 세포로 연속 이식시 이질성의 종양 성장을 영속적으로 자극할 수 있는 TPC의 독특한 능력임을 인식할 것이다. TPC의 특성을 밝힐 수 있는 다른 일반적인 접근방법들은 세포 표면 마커들의 형태학과 검사, 전사 프로파일, 그리고 약물 반응 등을 포함하고 있지만 마커 발현은 배양 조건들에 따라 그리고 시험관 내에서의 세포주 통과에 따라 변할 수 있다.
그래서, 본 발명의 목적들을 위하여 종양 영속화 세포들은, 정상 조직에서 세포적 계층구조를 유지하는 정상 줄기 세포들과 마찬가지로, 바람직하게는 다계통 분화의 능력을 유지하면서도 무한히 자기-재생할 수 있는 능력으로 정의된다. 종양 영속화 세포들은 따라서 종양형성 자손 (즉, 종양 개시 세포들: TPC와 TProg)과 비-종양형성(NTG) 자손 둘 다를 발생시킬 수 있다. 본원에 사용되고 있는 바와 같이 "비-종양형성 세포(non-tumorigenic cell)" (NTG)는 종양 개시 세포들에서 발생하나, 그 자신은 자기-재생하거나 종양을 포함하는 종양 세포들의 이질 계통들을 발생시킬 수 있는 능력을 갖지 않은 종양 세포를 가리킨다. 실험적으로, NTG 세포들은 과도한 세포 수들을 이식하였을 때조차도, 마우스들에서 재현가능할 정도로 종양들을 형성하지는 못한다.
언급한 바와 같이, TProg는 마우스들에서 종양들을 발생시킬 수 있는 한정된 능력 때문에 종양 개시 세포들 (또는 TIC)로 분류되기도 한다. TProg는 TPC의 자손이며 전형적으로는 유한한 횟수의 비-자기-재생 세포 분열들을 할 수 있다. 게다가, TProg 세포들은 초기 종양 전구 세포들 (ETP)과 후기 종양 전구 세포들 (LTP)로 더 나누어질 수 있는데, 그 각각은 표현형 (예를 들면, 세포 표면 마커들)과 종양 세포 구성을 반복할 수 있는 다른 능력들로 구별될 수 있다. 그러한 기술적 차이들에도 불구하고, ETP와 LTP 둘 다는 그것들이 적은 세포 개수로 이식하였을 때 종양들을 연속적으로 재구성할 능력이 일반적으로 떨어지며 전형적으로는 모체 종양의 이질성을 반영하지 못하는 점에서 TPC와 기능적으로 다르다. 상기의 차이점들에도 불구하고, 각종 TProg 개체군들은, 드물게, 정상적으로는 줄기 세포들에 속하는 자기-재생 능력들을 획득하여 그들 자신이 TPC (또는 CSC)가 될 수가 있음도 또한 밝혀졌다. 아무튼 종양-개시 세포들의 종류 둘 다는 단일 환자의 전형적인 종양 덩어리에 나타날 가능성이 있으며 본원에 개시된 조절물질들을 이용한 치료가 필요하다. 즉, 개시된 조성물들은 종양에 나타난 특별한 형태나 혼합비율에 관계없이 상기 DLL3 양성 종양 개시 세포들의 출현빈도를 감소시키거나 항암제민감성을 변화시키는 데 일반적으로 효과가 있다.
본 발명의 맥락에서, TPC는 종양의 대부분을 포함하는 TProg (ETP와 LTP 둘 다), NTG 세포들 그리고 종양-침윤 비-TPC 유래 세포들 (예를 들면, 섬유아세포들/스트로마, 내피 및 조혈 세포들)보다 더욱 종양유발적이고, 비교적 더 침묵적이며 종종 더욱 항암제저항적이다. 종래의 요법들과 처방계획들은, 대부분, 종양들의 크기를 축소시킬 뿐 아니라 빠르게 증식하는 세포들을 공격하도록 설계되었음을 고려하면, TPC는 더 빠르게 증식하는 TProg 및 그 밖의 덩치 종양 세포 개체군들보다 종래 요법들 및 처방계획들에 더욱 저항적일 가능성이 있다. 더욱이, TPC는 자신들을 종래 요법들에 비교적 항암제저항적이게 만들어 주는 다른 특성들을 종종 발현하기도 하는데, 이를 테면, 다-약제 저항성 트랜스포터들의 발현 증가, DNA 수리 메커니즘들과 항-아폽토시스(세포자살사) 단백질들의 증대 등이다. 이러한 성질들은, 그 각각이 TPC의 약제 내성에 기여하는 것인데, 진행된 단계 종양을 가진 대부분 환자들에게 장기에 걸친 혜택을 보장할 수 있는 표준적인 종양학 치료 처방계획들의 실패의 중요한 이유기도 하다; 즉, 계속되는 종양 성장과 재발을 자극하는 세포들 (즉 TPC 또는 CSC)을 적절히 표적화하고 근절하지 못라는 중요한 이유다.
많은 종래 기술의 치료들과 달리, 본 발명의 새로운 조성물들은 선택된 조절물질의 형태나 특정 표적 (예를 들면, 유전 물질, DLL3항체 또는 리간드 융합 작제물)에 관계없이 대상에게 투여시 바람직하게는 종양 개시 세포들의 출현빈도를 감소시킨다. 상기 언급한 바와 같이, 종양 개시 세포 출현빈도의 감소는 a) 종양 개시 세포들의 제거, 고갈, 감작, 침묵화 또는 억제; b) 종양 개시 세포들의 성장, 확장 또는 재발을 통제함; c) 종양 개시 세포들의 개시, 전파, 유지, 또는 증식을 차단함; 또는 d) 다르게는 종양 개시 세포들의 생존, 재생 및/또는 전이를 방해함의 결과로서 일어날 수 있다. 어떤 실시형태들에서, 종양 개시 세포들의 출현빈도의 감소는 하나 이상의 생리학적 경로들에서의 변화의 결과로 일어난다. 경로상의 변화는, 종양 개시 세포들의 축소 또는 제거에 의한 것이거나 또는 종양 환경 또는 다른 세포들에 영향을 미칠 수 있는 그것들의 잠재력 (예를 들면, 분화의 유도, 공간환경 파괴)을 부분변화시키거나 또는 다르게는 그것들의 능력을 간섭함에 의한 것이든 간에, 다음에는 종양형성, 종양 유지 및/또는 전이와 재발을 억제함으로써 DLL3 관련 질환들의 더욱 효과적인 치료를 가능케 한다.
종양 개시 세포들의 그러한 출현빈도 감소를 평가하는 데 사용될 수가 있는 당해 분야에서 인정되고 있는 방법들 중에는 시험관 내에서의 또는 생체 내에서의 한계 희석 분석이 있는데, 이는 바람직하게는 생체 내에서든 아니든 종양들을 발생시킬 수 있는 능력과 같은 미리 정의된 명확한 결과들에 대해 뿌아송 분포 통계학을 사용하는 또는 그 출현빈도를 평가하는 계수를 수반한다. 그러한 한계 희석 분석은 종양 개시 세포 출현빈도 감소를 계산하는 바람직한 방법들을 포함하지만 다른, 덜 힘든 방법들도, 비록 약간 덜 정확하지만, 원하는 값들을 효과적으로 측정하는 데 사용될 수 있으며 본원의 교시들에 완전히 적합한 것이다. 따라서, 본 기술분야에 숙달된 사람들이라면 이해할 수 있는 바와 같이, 잘 알려진 유동 세포분석 또는 면역조직화학적 수단을 통해 출현빈도 감소 값들을 측정하는 것도 또한 가능하다. 앞에 언급한 방법들 모두에 대하여는, 참조 예를 들면, Dylla et al. 2008, PMID: 18560594 & Hoey et al. 2009, PMID: 19664991; 그 각각은 그 전부가, 특히, 개시된 방법들에 대해, 참조로 본원에 포함된다.
한계 희석 분석에 대하여, 종양 개시 세포 출현빈도의 시험관 내 계수는 분획된 또는 분획되지 않은 인간 종양 세포들 (예를 들면, 각각, 치료된 그리고 미치료된 종양들로부터의)을 콜로니 형성을 촉진하는 시험관 내 성장 조건들에 놓음으로써 이루어질 수 있다. 이런 식으로, 콜로니 형성 세포들은 단순 집계 및 콜로니들의 특성평가로, 또는, 예를 들면, 인간 종양 세포들의 연속 희석으로 플레이트들에 놓고, 도포 후 적어도 10일째의 콜로니 형성에 대한 각각의 웰을 양성 또는 음성의 어느 쪽으로 평가하는 단계로 이루어진 분석으로 계수될 수 있을 것이다. 생체 내 한계 희석 실험들 또는 분석들은, 종양 개시 세포 출현빈도를 측정하는 능력면에서 일반적으로 더욱 정확한 것인데, 미치료된 대조표준 또는 치료된 개체군들로부터 인간 종양 세포들의, 예를 들면, 연속 희석하의 면역손상 마우스들 속으로의 이식 그리고 이어서 이식 후 적어도 60일째의 종양 형성에 대한 각각의 마우스의 양성 또는 음성의 어느 쪽으로 평가하는 단계를 망라하고 있다. 시험관 내 또는 생체 내 한계 희석 분석에 의한 세포 출현빈도 값들의 도출은 바람직하게는 뿌아송 분포 통계학을 양성 및 음성 경우들의 알려진 출현빈도에 적용하여, 그것에 의해 양성 결과의 정의를 충족시키는 결과들에 대하여 출현빈도를 제공함으로써 이루어진다; 이 경우에는, 각각, 콜로니 또는 종양 형성.
종양 개시 세포 출현빈도를 계산하는 데에 사용될 수 있는 본 발명에 적합한 다른 방법들에 대하여는, 가장 흔한 것이 정량화할 수 있는 유동 세포분석 기술들과 면역조직화학 염색 절차들을 포함한 것이다. 비록 바로 위에 기술된 한계 희석 분석 기술들만큼 정확하지 않다 하더라도, 이들 절차들은 훨씬 덜 노동 집약적이며 비교적 짧은 기간에 합리적인 값들을 제공해 준다. 따라서, 숙달된 기술자라면 종양 개시 세포들에 대하여 증대되는 것으로 알려진 당해 분야에서 인정되고 있는 세포 표면 단백질(예를 들면, 그 전부가 본원에 포함되어 있는 PCT 출원 제2012/031280호에 제시된 잠재적으로 적합한 마커)들을 결합시켜 그것에 의해 각종 샘플들의 TIC 수준들을 측정하는 하나 이상의 항체들 또는 시약들을 사용하는 유동 세포분석 세포 표면 마커 프로파일 측정을 이용할 수 있음을 이해할 것이다. 또 다른 적합한 방법에서 본 기술분야에 숙달된 사람이라면 상기 세포들을 구별해 주는 것으로 생각되는 세포 표면 단백질들을 결합할 수 있는 하나 이상의 항체들 또는 시약들을 이용하는 면역조직화학에 의해서 제 자리에서의( in situ )(즉, 조직 구획에서의) TIC 출현빈도를 계수할 수 있을 것이다.
본 기술분야에 숙달된 사람들이라면 수많은 마커들 (혹은 그것들의 부재)이 각종 암 줄기 세포들의 개체군들과 연관이 있으며 종양 세포 부분모집단들을 분리하거나 특성평가하는 데에 사용되어 왔음을 인식할 것이다. 이 점에서 예시적인 암 줄기 세포 마커들은 OCT4, 나노그(Nanog), STAT3, EPCAM, CD24, CD34, NB84, TrkA, GD2, CD133, CD20, CD56, CD29, B7H3, CD46, 트랜스페린 수용체, JAM3, 카르복시펩티다제 M, ADAM9, 옹코스타틴(oncostatin) M, Lgr5, Lgr6, CD324, CD325, 네스틴(nestin), Sox1, Bmi-1, eed, easyh1, easyh2, mf2, yy1, smarcA3, smarckA5, smarcD3, smarcE1, mllt3, FZD1, FZD2, FZD3, FZD4, FZD6, FZD7, FZD8, FZD9, FZD10, WNT2, WNT2B, WNT3, WNT5A, WNT10B, WNT16, AXIN1, BCL9, MYC, (TCF4) SLC7A8, IL1RAP, TEM8, TMPRSS4, MUC16, GPRC5B, SLC6A14, SLC4A11, PPAP2C, CAV1, CAV2, PTPN3, EPHA1, EPHA2, SLC1A1, CX3CL1, ADORA2A, MPZL1, FLJ10052, C4.4A, EDG3, RARRES1, TMEPAI, PTS, CEACAM6, NID2, STEAP, ABCA3, CRIM1, IL1R1, OPN3, DAF, MUC1, MCP, CPD, NMA, ADAM9, GJA1, SLC19A2, ABCA1, PCDH7, ADCY9, SLC39A1, NPC1, ENPP1, N33, GPNMB, LY6E, CELSR1, LRP3, C20orf52, TMEPAI, FLVCR, PCDHA10, GPR54, TGFBR3, SEMA4B, PCDHB2, ABCG2, CD166, AFP, BMP-4, 베타-카테닌(β-catenin), CD2, CD3, CD9, CD14, CD31, CD38, CD44, CD45, CD74, CD90, CXCR4, 데코린(decorin), EGFR, CD105, CD64, CD16, CD16a, CD16b, GLI1, GLI2, CD49b, 및 CD49f를 포함한다. 예를 들면, 그 각각이 참조로 본원에 포함된, Schulenburg et al., 2010, PMID: 20185329, U.S.P.N. 7,632,678 그리고 U.S.P.Ns. 2007/0292414, 2008/0175870, 2010/0275280, 2010/0162416 및 2011/0020221을 참조하라. 게다가 상기 마커들 각각은 본 발명의 이중특이 또는 다중특이 항체들의 맥락에서 이차 표적 항원으로 사용될 수 있음도 또한 이해할 것이다.
마찬가지로, 어떤 종양 종류들의 암 줄기 세포들과 연관된 세포 표면 표현형들의 비제한적인 예들에는 본 기술분야에서 알려져 있는 다른 암 줄기 세포 표면 표현형들 뿐 아니라 CD44hiCD24low, ALDH+, CD133+, CD123+, CD34+CD38-, CD44+CD24-, CD46hiCD324+CD66c-, CD133+CD34+CD10-CD19-, CD138-CD34-CD19+, CD133+RC2+, CD44+α2 β1 hiCD133+, CD44+CD24+ESA+, CD271+, ABCB5+ 등도 있다. 참조예를 들면, 그 각각이 참조로 그 전체가 본원에 포함된, Schulenburg et al., 2010, 상기, Visvader et al., 2008, PMID: 18784658 및 U.S.P.N. 2008/0138313. 본 기술분야에 숙달된 사람들이라면 바로 위에 예시된 것들과 같은 마커 표현형들을 표준의 유동 세포계측 분석 및 세포 분류 기술과 함께 사용하여 후속 분석을 위한 TIC 및/또는 TPC 세포들 또는 세포 개체군들을 특성평가하거나, 분리하거나, 정제하거나 또는 증대시킬 수 있음을 이해할 것이다. 본 발명에 관련하여 중요한 것으로 CD46, CD324 그리고, 선택에 따라, CD66c는, 분석하고자 하는 종양 피검물들이 일차 환자 종양 피검물들인지 또는 환자-유래의 NTX 종양들인지 관계없이, 많은 인간 직장결장 ("CR"), 유방 ("BR"), 비-소세포 폐 (NSCLC), 소세포 폐 (SCLC), 췌장 ("PA"), 멜라노마 ("Mel"), 난소 ("OV"), 그리고 두경부암 ("HN") 종양 세포들의 표면상에 고도로 발현되거나 이질적으로 발현되고 있다.
본 기술분야에 알려진 (그리고 아래의 실시예 17에 보여진) 상기 언급한 방법들과 선택된 마커들의 어떠한 것을 사용하면 본원의 교시들에 따라 (세포독성제들과 접합한 것들을 포함하는) 개시된 DLL3 조절물질들에 의해서 제공되는 TIC (또는 그 속의 TPC)의 출현빈도 감소를 정량화하는 것이 가능하다. 어떤 경우들에서, 본 발명의 화합물들은 (제거, 분화의 유도, 공간환경 파괴, 침묵화 등 상기 언급한 다양한 메커니즘들에 의해) TIC 또는 TPC의 출현빈도를 10%, 15%, 20%, 25%, 30% 또는 35%까지도 감소시킬 수 있다. 다른 실시형태들에서, TIC 또는 TPC의 출현빈도 감소는 대략 40%, 45%, 50%, 55%, 60% 또는 65%일 수 있다. 어떤 실시형태들에서, 개시된 화합물들은 TIC 또는 TPC의 출현빈도를 70%, 75%, 80%, 85%, 90% 또는 95%까지도 감소시킬 수 있다. 물론 TIC 또는 TPC의 출현빈도의 어떠한 감소는 아마 종양의 종양형성, 지속, 재발 및 공격성의 상응하는 감소로 귀착될 것임도 이해될 것이다.
IV. DLL3 조절물질들
아무튼, 본 발명은 여러 가지의 DLL3 관련 악성종양들의 어떠한 것도 포함하는 각종 질환들의 진단, 치료진단, 치료 및/또는 예방을 위한, DLL3 길항제들을 포함하는, DLL3 조절물질들의 용도에 관한 것이다. 개시된 조절물질들은 단독으로 또는 화학요법 또는 면역요법 작용제들 (예를 들면, 치료 항체들) 또는 생체 반응 조절물질들과 같은 폭넓게 다양한 항암 화합물들과 함께 사용될 수 있다. 다른 선택된 실시형태들에서, 둘 이상의 구별되는 DLL3 조절물질들은 조합하여 사용되어 증대된 항-종양 효과들을 제공할 수 있거나 또는 다중특이 작제물들을 제조하는 데에 사용될 수 있다.
어떤 실시형태들에서, 본 발명의 DLL3 조절물질들은 누클레오타이드들, 올리고누클레오타이드들, 폴리누클레오타이드들, 펩타이드들 또는 폴리펩타이드들을 포함할 것이다. 더욱 구체적으로, 본 발명의 예시적인 조절물질들은 항체들과 항원-결합 단편들 또는 그것들의 유도체들, 단백질들, 펩타이드들, 글라이코프로테인들, 글라이코펩타이드들, 글라이코리피드들, 폴리사카라이드들, 올리고사카라이드들, 핵산들, 안티센스 작제물들, siRNA, miRNA, 생체유기 분자들, 펩타이드모방체들, 약리활성제들과 그것들의 대사물질들, 전사 및 번역 제어 서열들 등을 포함할 수 있다. 어떤 실시형태들에서 조절물질들은 용해성 DLL3 (sDLL3) 또는, 예를 들어, DLL3 융합 작제물들 (예를 들면, DLL3-Fc, DLL3-표적화 물질 등) 또는 DLL3-접합체들 (예를 들면, DLL3-PEG, DLL3-세포독성제, DLL3-brm 등)을 포함하는, 그것의 형태, 변이형, 유도체 또는 단편을 포함할 것이다. 다른 바람직한 실시형태들에서 DLL3 조절물질들은 항체들 또는 그것들의 면역반응 단편들 또는 유도체들을 포함한다. 특히 바람직한 실시형태들에서 본 발명의 조절물질들은 중화시키거나, 고갈시키거나 또는 내재화하는 항체들 또는 그것들의 유도체들 또는 단편들을 포함할 것이다. 게다가, 상기한 융합 작제물들과 마찬가지로, 그러한 항체 조절물질들은 선택된 세포독성제들, 폴리머들, 생체 반응 조절물질(BRM)들 등과 접합되거나, 연결되거나 또는 달리 회합되어 다양한 (그리고 선택에 따라서는 다수의) 작용 메커니즘들을 가진 유도 면역요법들을 제공할 수 있다. 상기 언급한 바와 같이 그러한 항체들은 범-DLL 항체들일 수 있으며 둘 이상의 DLL 패밀리 멤버들과 회합하거나 또는, 대안으로, DLL3 아이소형들의 하나 또는 둘 다와 선택적으로 반응하는 항원 결합 분자들을 포함할 수 있다. 또 다른 바람직한 실시형태들에서 조절물질들은 유전자 수준에서 작동할 수 있으며 DLL3 결정인자의 유전자형 성분과 상호작용하거나 또는 회합하는 안티센스 작제물들, siRNA, miRNA 등등으로 화합물들을 포함할 수 있다.
또한 개시된 DLL3 조절물질들은, 예를 들면, DLL3 조절물질의 형태, 어떠한 회합 적재물 또는 투여용량 및 전달 방법에 따라, 선택된 경로들을 자극하거나 길항작용하거나 또는 특정 세포들을 제거하는 등의 다양한 메커니즘들을 통해 TPC, 및/또는 회합된 종양을 포함하는, 종양 세포들의 성장, 전파 또는 생존을 고갈시키거나, 침묵시키거나, 중화하거나, 제거하거나 또는 억제할 수 있음도 이해될 것이다. 따라서, 본원에 개시된 바람직한 실시형태들은 종양 영속화 세포들과 같은 특정 종양 세포 부분집합들의 고갈, 억제 또는 침묵화에 관한 것이거나 또는 특정 에피토프 또는 도메인과 상호작용하는 조절물질들에 관한 것이지만, 상기 실시형태들은 단지 예시적인 것이며 결코 제한하는 것이 아님을 강조하여야 하겠다. 오히려, 첨부된 특허청구범위들에 기재된 바와 같이, 본 발명은 폭넓게는 어떠한 특별한 메커니즘, 결합 영역 또는 표적 종양 세포 개체군에 관계없이 DLL3 조절물질들과 그것들의 다양한 DLL3 관련 질환들의 치료, 관리 또는 예방에 쓰이는 용도에 관한 것이다.
선택된 조절물질의 형태에 관계없이 선택된 화합물은 실제로 길항작용적일 수 있음이 이해될 것이다. 본원에 사용되고 있는 바와 같이 "길항제(antagonist)"는 리간드들에 대한 수용체들의 결합이나 효소들의 기질들과의 상호작용들을 포함하는, 특별한 또는 특정된 표적 (예를 들면, DLL3)의 활성들을 중화하거나, 차단하거나, 억제하거나, 파기시키거나, 감소시키거나 또는 간섭할 수 있는 분자를 가리킨다. 이 점에서 본 발명의 DLL3 길항제들은 DLL3 단백질 또는 그것의 단편을 인식하거나, 반응하거나, 결합하거나, 화합하거나, 경쟁하거나, 회합하거나 또는 달리 상호작용하는 그리고 덩치 종양 또는 NTG 세포들을 포함하는 종양 개시 세포들 또는 그 밖의 종양 세포들의 성장을 제거하거나, 침묵시키거나, 감소시키거나, 억제하거나, 방해하거나, 제한하거나 또는 통제하는 어떠한 리간드, 폴리펩타이드, 펩타이드, 융합 단백질, 항체 또는 면역활성 단편 또는 그것들의 유도체를 포함할 수 있음이 이해될 것이다. 적합한 길항제들은 또한 DLL3 유전자형 또는 표현형 결정인자를 인식하거나 또는 회합하는 소분자 억제물질들, 앱타머들, 안티센스 작제물들, siRNA, miRNA 등등, 수용체 또는 리간드 분자들 그리고 그것들의 유도체들도 포함할 수 있는데, 그 결과 발현 패턴들을 변화시키거나 또는 기질, 수용체 또는 리간드와의 그것의 결합 또는 상호작용을 봉쇄하는 것이다.
본원에 사용되어 둘 이상의 분자들 또는 화합물들에 적용되고 있는 바와 같이, 용어들 "인식하다(recognizes)" 또는 "회합하다(associates)"는 한 분자가 다른 분자에 효과를 미치는 분자들의, 공유결합 또는 비공유결합으로, 반응, 결합, 특이 결합, 화합, 상호작용, 연결, 연관, 통합, 합체, 합병 또는 접합을 의미하는 것으로 간주될 것이다.
게다가, 본원의 실시예들에 증명되어 있는 바와 같이 (예를 들어, 도 2b 참조), 인간 DLL3의 몇몇 조절물질들은, 어떤 경우들에서는, 인간 아닌 다른 종 (예를 들면, 뮤린) 유래의 DLL3과 교차-반응할 수 있다. 다른 경우들에서 예시적인 조절물질들은 인간 DLL3의 하나 이상의 아이소형들에 특이적일 수 있으며 다른 종 유래의 DLL3 이종상동유전자들과 교차-반응성을 나타내지 않을 것이다. 물론, 본원의 교시들에 관련하여 상기 실시형태들은 단일 종 유래의 둘 이상의 DLL 패밀리 멤버들과 회합하는 범-DLL 항체들 또는 DLL3과 배타적으로 회합하는 항체들을 포함할 수 있다.
아무튼, 그리고 아래에 더욱 상세하게 논의되는 바와 같이, 본 기술분야에 숙달된 사람들이라면 개시된 조절물질들이 접합 또는 비접합 형태로 사용될 수 있음을 이해할 것이다. 즉, 조절물질은 약리활성 화합물들, 생체 반응 조절물질들, 항암제들, 세포독성 또는 세포증식억제성 약제들, 진단 물질들 또는 생체적합성 조절물질들과 (예를 들면 공유결합으로 또는 비공유결합으로) 회합하거나 또는 접합할 수 있다. 이 점에서 상기 접합체들은 펩타이드들, 폴리펩타이드들, 단백질들, 융합 단백질들, 핵산 분자들, 소분자들, 모방제들, 합성 약물들, 무기 분자들, 유기 분자들 및 방사성동위원소들을 포함할 수 있는 것임이 이해될 것이다. 게다가, 본원에 언급한 바와 같이 선택된 접합체는, 적어도 부분적으로는, 접합을 달성하기 위해 사용된 방법에 따라 여러 가지 몰비율들로 DLL3 조절물질에 공유결합으로 또는 비공유결합으로 연결될 수 있다.
V. 조절물질 제조와 공급
A.
항체 조절물질들
1.
개관
앞서 언급하였던 바와 같이 본 발명의 특히 바람직한 실시형태들은 DLL3 단백질 아이소형의 하나 이상의 도메인들 그리고, 선택에 따라서는, 다른 DLL 패밀리 멤버들과 선택적으로 회합하는 항체들의 형태로 DLL3 조절물질들을 포함한다. 본 기술분야에 통상의 기술을 가진 사람들이라면, 예를 들면, 각각이 그 전체가 참조로 본원에 포함된, Abbas et al., 세포분자면역학(Cellular and Molecular Immunology), 6th ed., W.B. Saunders Company (2010) 또는 Murphey et al., 제인웨이 면역생물학(Janeway's Immunobiology), 8th ed., Garland Science (2011)에 설명된 것과 같은 항체들에 기초한 잘 다듬어진 지식을 이해할 것이다.
용어 "항체(antibody)"는 돌연변이단백질들과 그것들의 변이형들을 포함하는, 폴리클론성 항체들, 멀티클론성 항체들, 모노클론성 항체들, 키메라성 항체들, 인간화 및 영장류화 항체들, 인간 항체들, 재조합 제조 항체들, 내부체(intrabody)들, 다중특이성 항체들, 이중특이성 항체들, 일가 항체들, 다가 항체들, 항-유전자형 항체들, 합성 항체들; Fab 단편들, F(ab') 단편들, 단일-쇄 FvFc, 단일-쇄 Fv와 같은 항체 단편들; 및 Fc 융합체들과 그 밖의 변형체들을 포함하는 그것들의 유도체들, 그리고 바라던 대로의 생물학적 활성 (즉, 항원 회합 또는 결합)을 나타내는 한 그 밖의 어떠한 면역활성 분자를 망라하는 것으로 의미된다. 게다가, 이 용어는 더 나아가 모든 종류의 항체들 (즉 IgA, IgD, IgE, IgG, 및 IgM)과 모든 아이소형들 (즉, IgG1, IgG2, IgG3, IgG4, IgA1, 및 IgA2), 그리고 문맥상 달리 드러내지 않는 한 그것들의 변이형들까지도 포함한다. 다른 종류들의 항체들에 상응하는 중쇄 불변 도메인들은, 각각, 상응하는 소문자 그리스 문자 α, δ, ε, γ, 및 μ로 표시된다. 어떠한 척추동물종 유래 항체들의 경쇄들은 그것들의 불변 도메인들의 아미노산 서열들에 기초하여, 카파 (κ) 및 람다 (λ)라 부르는, 두 개의 분명하게 구별되는 종류들의 하나에 할당될 수가 있다.
상기의 모든 항체들이 본 발명의 범위 내에 있지만, IgG 클래스의 면역글로불린을 포함하는 바람직한 실시형태들은 오로지 예시의 목적으로 본원에서 다소 상세하게 논할 것이다. 상기 개시는, 그러나, 예시적인 조성물들과 본 발명을 실시하는 방법들을 단지 명시하는 것이며 본 발명의 범위나 본원에 첨부된 특허청구범위들을 결코 한정하는 것이 아님이 이해될 것이다.
잘 알려져 있는 바와 같이, 경쇄(VL) 및 중쇄(VH) 부분들 둘 다의 가변 도메인들은 항원 인식 및 특이성을 결정지으며 경쇄(CL) 및 중쇄(CH1, CH2 또는 CH3)의 불변 도메인들은 분비, 경태반성 이동(transplacental mobility), 순환 반감기, 보체 결합 등과 같은 중요한 생물학적 특성들을 부여하고 조절한다.
"가변(variable)" 영역 경쇄와 중쇄 가변 도메인들 둘 다에서 보통 상보성 결정 영역(CDR)들이라고 부르는 세 개의 분절들로 나타나는 고도변이 자리들을 포함하고 있다. CDR들의 측면에 위치하는 가변 도메인들의 더욱 고도의 보존적인 부분들은 프레임워크 영역(FR)들이라고 부른다. 예를 들면, 본래 존재하는 모노머성 면역글로불린 G (IgG) 항체들에서, "Y"의 각각의 아암(arm)에 존재하는 여섯 개의 CDR들은 짧은데, 항체가 수성 환경에서 삼차원 배열을 취할 때 항원 결합 자리를 형성하도록 특이적으로 배치되는 비연속적인 아미노산 서열들이다. 따라서, 각각의 본래 존재하는 IgG 항체는 Y의 각각의 아암의 아미노-말단에 근접한 두 개의 동일한 결합 자리들을 포함한다.
CDR들의 위치는 표준 기술들을 사용하는 본 기술분야에 통상의 기술을 가진 사람들에 의해서 쉽게 확인될 수가 있음이 이해될 것이다. 본 기술분야의 사람들에게 또한 익숙한 것이기도 한 것이 Kabat et al. (1991, NIH Publication 91-3242, National Technical Information Service, Springfield, Va.)에서 기술된 번호부여 시스템이다. 이에 관련하여 Kabat 등은 어떠한 항체에도 적용할 수 있는 가변 도메인 서열들에 대한 번호부여 시스템을 정의하였다. 본 기술분야에 통상의 기술을 가진 사람이라면 이러한 "Kabat 번호부여(Kabat numbering)" 시스템을 어떠한 가변 도메인 서열에도, 서열 그 자체 이상의 어떠한 실험 데이터에 대한 의지 없이, 분명하게 할당할 수가 있다. 달리 지정하지 않는 한, 항체에서 특정 아미노산 잔기 위치들의 번호부여에 대한 언급들은 Kabat 번호부여 시스템에 따른 것이다.
따라서, Kabat에 따르면, VH에서, 잔기들 31-35는 CDR1을 구성하고, 잔기들 50-65는 CDR2를 구성하며, 95-102는 CDR3을 구성하는 한편, VL에서는, 잔기들 24-34가 CDR1을 구성하고, 50-56은 CDR2를 구성하며, 89-97은 CDR3을 구성한다. 전후관계상, VH에서, FR1은 아미노산들 1-30을 망라하는 가변 영역 도메인에 해당하고; FR2는 아미노산들 36-49를 망라하는 가변 영역 도메인에 해당하고; FR3은 아미노산들 66-94를 망라하는 가변 영역 도메인에 해당하며, FR4는 가변 영역의 아미노산들 103에서부터 끝까지의 가변 영역 도메인에 해당한다. 경쇄의 FR들도 마찬가지로 경쇄 가변 영역 CDR들 각각에 의해서 분리되어 있다.
CDR들은 항체마다 상당히 다르다는 사실을 주목하라 (그리고 자명한 일로서 Kabat 공통 서열들과의 상동성을 나타내지 않을 것이다). 게다가, 어떠한 주어진 Kabat 자리 번호의 어떤 개별 잔기들의 동일성은 종간(種間)의 또는 대립유전자의 갈라짐 때문에 항체 쇄마다 다를 수 있다. 다른 방식의 번호부여가 Chothia et al., J. Mol . Biol . 196:901-917 (1987) 및 MacCallum et al., J. Mol . Biol . 262:732-745 (1996)에 기재되어 있지만, Kabat에서와 마찬가지로, FR 경계들은 상기한 바와 같이 각각의 CDR 말단들에 의해서 분리되어 있다. 또한, 그 정의들을 서로에 대하여 비교할 때 부분적으로 중복되는 또는 부분집합들의 아미노산 잔기들을 포함하고 있는, Chothia et al., Nature 342, pp. 877-883 (1989) 및 S. Dubel, ed., Handbook of Therapeutic Antibodies, 3rd ed., WILEY-VCH Verlag GmbH and Co. (2007)를 참조하라. 상기한 참고문헌들 각각은 전부 참조로 본원에 포함되어 있으며 상기 인용된 참고문헌들 각각에서 정의된 결합 영역들 또는 CDR들을 포함하는 아미노산 잔기들이 아래에 비교를 위하여 기재되어 있다.
본 발명의 맥락에서 도 11a 내지 도 11ad 또는 도 11b 내지 도 11bd에 제시된 뮤린 가변 영역 아미노산 서열들 유래의 개시된 경쇄 및 중쇄 CDR들의 어느 것이라도 본 발명의 교시에 따라 화합시키거나 재배열하여 최적화된 항-DLL3 (예를 들면 인간화 또는 키메라성 항-hDLL3) 항체들을 제공할 수 있음을 이해할 수 있을 것이다. 좀 더 정확히 말하면, 도 11a 내지 도 11ad(서열번호 20 내지 202, 짝수 번호들)에 제시된 연속적인 경쇄 가변 영역 아미노산 서열들 또는 도 11b 내지 도 11bd(서열번호 21 내지 203, 홀수 번호들)에 제시된 연속적인 중쇄 가변 영역 아미노산 서열들에서 유래된 하나 이상의 CDR들은 DLL3 조절물질에 그리고, 특히 바람직한 실시형태들에서는, 하나 이상의 DLL3 아이소형들과 면역특이적으로 회합하는 CDR 이식형 또는 인간화 항체에 삽입될 수 있다. 그러한 인간화 조절물질들의 경쇄(서열번호 204 내지 212, 짝수 번호들) 및 중쇄(서열번호 205 내지 213, 홀수 번호들) 가변 영역 아미노산 서열들의 예들이 또한 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 제시되어 있다. 종합하면 이들 새로운 아미노산 서열들은 본 발명에 따른 아흔 두 개의 뮤린 유래 및 다섯 개의 인간화형의 예시적인 조절물질들을 도시한 것이다. 게다가, 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 제시된 아흔 두 개의 예시적인 뮤린 조절물질들과 다섯 개의 인간화 조절물질들 각각의 상응하는 핵산 서열들은 본 출원에 덧붙인 서열 목록 (서열번호 220 내지 413)에 포함되어 있다.
도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에서 주석이 달린 CDR들은 Chothia 번호부여를 사용하여 정의된다. 하지만, 본원에서 논하면서 아래 실시예 8에서 입증하였듯이, 본 기술 분야에 숙달된 사람이라면 도 11a 내지 도 11ad 또는 도 11b 내지 도 11bd에 제시된 각각의 중쇄 및 경쇄 서열에 대해 Kabat 등, Chothia 등 또는 MacCallum 등이 정의한 CDR들을 쉽게 정의, 확인, 도출 및/또는 계수할 수가 있을 것이다. 따라서, 상기 모든 명명법에 의해 정의된 CDR들을 포함하는 대상 CDR들과 항체들의 각각은 본 발명의 범위 안에 명백히 포함된다. 더욱 폭넓게는, 용어들 "가변 영역 CDR 아미노산 잔기(variable region CDR amino acid residue)" 또는 더 간단하게 "CDR"은 상기 제시된 어떠한 서열 또는 구조를 바탕으로 한 방법을 사용하여 확인되는 CDR 안의 아미노산들을 포함한 것이다.
2. 항체 조절물질 생성
a.
폴리클론성 항체들
래빗들, 마우스들, 래트들 등을 포함하는, 각종 숙주 동물들에서의 폴리클론성 항체들의 생성은 본 기술분야에 잘 알려져 있다. 어떤 실시형태들에서, 폴리클론성 항-DLL3 항체를 포함하는 혈청은 동물을 출혈시키거나 죽임으로써 얻어진다. 혈청은 동물로부터 얻어진 형태로 연구 목적으로 사용될 수 있으며 또는, 다른 선택으로는, 항-DLL3 항체들을 부분적으로 또는 완전히 정제하여 면역글로불린 분획들이나 동일 항체 제제물들을 제공할 수 있다.
간단히 말해 선택된 동물을 예를 들면, 선택된 아이소형들, 도메인들 및/또는 펩타이드들을 포함할 수 있는 DLL3 면역원 (예를 들면, 용해성 DLL3 또는 sDLL3), 또는 DLL3 또는 그것의 면역반응 단편들을 발현하는 살아 있는 세포들 또는 세포 제제물들로 면역시킨다. 접종된 종에 따라, 면역 반응을 증가시키는 데 사용될 수 있는 본 기술분야에 알려진 보조제들은 프로인트(Freund's) 보조제 (완전 및 불완전형), 알루미늄 하이드록시드와 같은 미네랄 젤들, 라이솔레시틴, 플루로닉 폴리올들, 다가음이온들, 펩타이드들, 오일 이멀션들, 키홀 림핏 헤모사이아닌들, 다이나이트로페놀, 그리고 BCG (칼메뜨-게랭 세균(bacille Calmette-Guerin))나 코리네박테리움 파르붐(corynebacterium parvum)과 같은 잠재적으로 유용한 인간 보조제들과 같은 표면 활성 물질들 등이 있으나, 이들에 한정되는 것은 아니다. 상기 보조제들은 항원을 국소 저장장소(local deposit)에 격리함으로써 항원이 빨리 분산되는 것을 보호할 수 있으며, 또는 그것들은 숙주를 자극하여 면역 시스템의 대식세포들과 그 밖의 구성요소들에 화학주성적인 인자들을 분비케 하는 물질들을 포함할 수 있다. 바람직하게는 면역화 일정에는 선택된 면역원을 미리 결정된 기간에 걸쳐 두 번 이상의 투여로 퍼뜨리는 것이 수반될 것이다.
도 1c 또는 도 1d에 보여진 DLL3 단백질의 아미노산 서열은 항체들을 생성시키기 위한 DLL3 단백질 특정 영역들을 선택하기 위하여 분석될 수가 있다. 예를 들면, DLL3 아미노산 서열의 소수성(疏水性) 및 친수성(親水性) 분석들이 DLL3 구조 속의 친수성 영역들을 확인하는 데에 사용된다. 다른 영역들 및 도메인들뿐 아니라, 면역형성 구조를 보여주는 DLL3 단백질 영역들은 본 기술분야에 알려진 각종의 다른 방법들, 이를 테면 Chou-Fasman, Garnier-Robson, Kyte-Doolittle, Eisenberg, Karplus-Schultz 또는 Jameson-Wolf 분석을 사용하여 쉽게 확인될 수가 있다. 평균 유연성 프로파일들은 Bhaskaran R., Ponnuswamy P. K., 1988, Int. J. Pept. Protein Res. 32:242-255의 방법을 사용하여 생성될 수가 있다. 베타-회전(Beta-turn) 프로파일들은 Deleage, G., Roux B., 1987, Protein Engineering 1:289-294의 방법을 사용하여 생성될 수가 있다. 따라서, 이러한 프로그램들이나 방법들의 어떠한 것에 의해 확인되는 각각의 DLL3 영역, 도메인 또는 모티프는 본 발명의 범위 내에 있으며 원하는 성질들을 포함하는 조절물질들을 생기게 하는 면역원들을 제공하기 위하여 분리되거나 조작처리될 수 있다. DLL3 항체들의 생성을 위한 바람직한 방법들은 본원에 제공된 실시예들을 통해 더욱 예시된다. 면역원으로 사용하기 위한 단백질 또는 폴리펩타이드를 제조하기 위한 방법들은 본 기술분야에 잘 알려져 있다. 또한 본 기술분야에 잘 알려진 것으로 BSA, KLH 또는 그 밖의 운반체 단백질과 같은, 운반체를 가진 단백질의 면역형성 접합체들을 제조하기 위한 방법들이 있다. 어떤 경우들에서는, 예를 들면, 카르보다이이마미드 시약들을 사용하는 직접 접합이 사용된다; 다른 경우들에서는 결합 시약들이 효과적이다. DLL3 면역원의 투여는, 본 기술분야에 이해되어 있는 바와 같이, 적당한 기간의 주사 및 적당한 보조제의 사용으로 실시되는 경우가 많다. 면역화 일정 동안에, 항체들의 역가들을 아래의 실시예들에서 기술된 대로 취하여 항체 형성의 타당성을 측정할 수가 있다.
b. 모노클론성 항체들
게다가, 본 발명은 모노클론성 항체들의 사용을 고찰한 것이기도 하다. 본 기술분야에 알려져 있는 바와 같이, 용어 "모노클론성 항체(monoclonal antibody)" (또는 mAb)는 실질적으로 동일한 항체들의 개체군으로부터 얻어진 항체를 가리키는 것으로, 즉, 개체군을 구성하는 개개의 항체들은 미량으로 존재할 수 있는, 가능한 돌연변이들 (예를 들면, 본래 존재하는 돌연변이들)을 제외하고는 동일하다. 어떤 실시형태들에서, 그러한 모노클론성 항체는 항원과 결합하거나 회합하는 폴리펩타이드 서열을 포함하는 항체를 포함하는 것인이데, 이 항원-결합 폴리펩타이드 서열은 다수의 폴리펩타이드 서열들로부터 단 하나의 표적 결합 폴리펩타이드 서열을 선택하는 단계를 포함하는 과정에 의해 얻어진 것이었다.
더욱 일반적으로, 그리고 본원의 실시예 6에 예시되어 있는 바와 같이, 모노클론성 항체들은 하이브리도마, 재조합 기술들, 파지 디스플레이 과학기술들, 유전자이식 동물들 (예를 들면, XenoMouse®) 또는 그것들의 어떤 조합을 포함하는 본 기술분야에 알려진 폭넓게 다양한 기술들을 사용하여 제조될 수가 있다. 예를 들면, 각각 참조로 그 전체가 본원에 포함된, An, Zhigiang (ed.) Therapeutic Monoclonal Antibodies: From Bench to Clinic, John Wiley and Sons, 1st ed. 2009; Shire et. al. (eds.) Current Trends in Monoclonal Antibody Development and Manufacturing, Springer Science + Business Media LLC, 1st ed. 2010; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. 1988; Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)에서 더욱 상세하게 기술되어 있는 것과 같은 하이브리도마 및 당해 분야에서 인정되고 있는 생화학적, 유전공학적 기술들을 사용하여 모노클론성 항체들을 제조할 수가 있다. 선택된 결합 서열을 더 변경시켜서, 예를 들면, 표적에 대한 친화력을 개선시키고, 표적 결합 서열을 인간화하고, 세포 배양 속의 그것의 생성을 개선시키고, 생체 내에서 그것의 면역형성력을 축소시키고, 다중특이성 항체 등을 만들어 낼 수가 있으며 변경된 표적 결합 서열을 포함하는 항체도 본 발명의 항체임을 이해할 필요가 있다.
c. 키메라성 항체들
또 다른 실시형태에서, 본 발명의 항체는 적어도 둘의 다른 종들이나 종류의 항체들의 단백질 분절들의 공유결합에 의한 연결에서 유래된 키메라성 항체들을 포함할 수 있다. 본 기술분야에 알려져 있는 바와 같이, 용어 "키메라성(chimeric)" 항체들은 중쇄 및/또는 경쇄의 일부가 특정한 종 유래의 또는 특정한 항체 클래스 또는 서브클래스에 속하는 항체들의 상응하는 서열들과 동일하거나 상동적이고, 그 쇄(들)의 나머지는, 항체들이 바라던 대로의 생물학적 활성을 나타내는 한, 또 다른 종 유래의 또는 또 다른 항체 클래스 또는 서브클래스에 속하는 항체들과 이 항체들의 단편들의 상응하는 서열들과 동일하거나 상동적인 작제물들에 관한 것이다 (U.S. P.N. 4,816,567; Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)).
한 실시형태에서, 본원의 교시들에 따른 키메라성 항체들은 뮤린 VH 및 VL 아미노산 서열들과 인간 유래의 불변 영역들을 포함할 수 있다. 다른 적합한 실시형태들에서 본 발명의 키메라성 항체는 아래 기술되는 인간화 항체를 포함할 수 있다. 또 다른 실시형태에서, 이른바 "CDR-이식형(CDR-grafted)" 항체, 이 항체는 특정한 종 유래의 또는 특정한 항체 클래스 또는 서브클래스에 속하는 하나 이상의 CDR들을 포함하고, 항체 쇄(들)의 나머지는 또 다른 종 유래의 또는 또 다른 항체 클래스 또는 서브클래스에 속하는 항체들의 상응하는 서열과 동일하거나 상동적이다. 인간들에서의 사용상, 선택되는 설치류 CDR들은 인간 항체 속으로 이식되어, 인간 항체의 하나 이상의 본래 존재하는 가변 영역들 또는 CDR들을 치환할 수 있다. 이러한 작제물들은 일반적으로 충분한 세기의 조절물질 기능들 (예를 들면, CDC (보체 의존성 세포독성), ADCC (항체-의존성 세포-매개 세포독성) 등)을 제공하고 동시에 대상에서 항체에 대한 바람직스럽지 않은 면역 반응들을 축소시켜 주는 이점들을 갖고 있다.
d. 인간화 항체들
CDR-이식형 항체와 유사한 것이 "인간화(humanized)" 항체다. 본원에 사용되고 있는 바와 같이, "인간화(humanized)" 형태들의 비인간 (예를 들면, 뮤린) 항체들은 하나 이상의 비인간 면역글로불린들에서 유래된 최소한도의 서열을 포함하는 키메라성 항체들이다. 한 실시형태에서, 인간화 항체는 인간 면역글로불린 (수용자 또는 수락자 항체)으로서 수용자 CDR의 잔기들이 원하는 특이성, 친화력, 및/또는 능력을 갖는 마우스, 래트, 래빗, 또는 비인간 영장류와 같은 비인간 종 (제공체 항체) CDR 잔기들로 치환된 것이다. 어떤 바람직한 실시형태들에서는, 인간 면역글로불린의 가변 도메인에 있는 하나 이상의 FR들의 잔기들이 제공체 항체의 상응하는 비인간 잔기들로 치환되어 이식된 CDR(들)의 적합한 삼차원 배열상태를 유지하게 도와주고 있으며 그 결과 친화력이 개선된다. 더욱이, 인간화 항체들은 수용자 항체에서나 제공체 항체에서나 발견되지 않는 잔기들을 포함하여, 예를 들어, 항체 성능을 더 다듬을 수 있다.
CDR 이식과 인간화 항체들은, 예를 들면, U.S.P.Ns. 6,180,370 및 5,693,762에 기술되어 있다. 인간화 항체는 선택에 따라서는 면역글로불린 Fc, 전형적으로는 인간 면역글로불린의 적어도 일부를 또한 포함할 수 있다. 더 자세한 사항들에 대해서는, 참조예를 들면, Jones et al., Nature 321:522-525 (1986); 그리고 U.S.P.Ns. 6,982,321 및 7,087,409. 또 다른 방법으로, 예를 들면, U.S.P.N. 2005/0008625에 기술된 "인간공학(humaneering)"이라고 부르는 것이 있다. 아울러, 비인간 항체도 인간 T-세포 에피토프들의 특이적 결실 또는 WO 98/52976 및 WO 00/34317에 개시된 방법들에 의한 "비면역(deimmunization)"에 의하여 또한 변형될 수 있다. 상기 참고문헌들 각각은 그 전체가 본원에 포함되어 있다.
또한 인간화 항체들은 중쇄 또는 경쇄의 적어도 하나로부터 면역글로불린 가변 영역들의 전부 또는 일부를 암호화하는 핵산 서열들을 분리하고, 조작하며, 발현시키는 것과 같은 통상의 분자생물학 기술들을 사용하여 생물공학적으로 처리될 수 있기도 하다. 상기한 그런 출처들의 핵산뿐 아니라, 인간 생식선 서열들도, 예를 들면, Tomlinson, I. A. et al. (1992) J. Mol. Biol. 227:776-798; Cook, G. P. et al. (1995) Immunol. Today 16: 237-242; Chothia, D. et al. (1992) J. Mol. Biol. 227:799-817; 및 Tomlinson et al. (1995) EMBO J 14:4628-4638에 개시된 대로 이용가능하다. V-BASE 디렉토리 (VBASE2 - Retter et al., Nucleic Acid Res. 33; 671-674, 2005)는 인간 면역글로불린 가변 영역 서열들의 종합 목록을 제공해 준다 (Tomlinson, I. A. 등에 의해 자료수집. MRC Centre for Protein Engineering, Cambridge, UK). 컨센서스 인간 FR들도 또한, 예를 들면, U.S.P.N. 6,300,064에 기술된 대로 사용될 수가 있다.
선택된 실시형태들에서, 그리고 아래 실시예 8에서 상세히 설명된 대로, 인간화 또는 CDR 이식형 항체 중쇄 또는 경쇄 가변 영역 아미노산 잔기들의 적어도 60%, 65%, 70%, 75%, 또는 80%가 수용자 인간 FR 및 CDR 서열들의 잔기들에 해당할 것이다. 다른 실시형태들에서는 인간화 항체 가변 영역 잔기들의 적어도 85% 또는 90%가 수용자 FR 및 CDR 서열들의 잔기들에 해당할 것이다. 더욱 바람직한 실시형태에서는, 인간화 항체 가변 영역 잔기들의 95% 초과가 수용자 FR 및 CDR 서열들의 잔기들에 해당할 것이다.
e. 인간 항체들
또 다른 실시형태에서, 항체들은 완전히 인간 항체들을 포함할 수 있다. 용어 "인간 항체(human antibody)"는 인간에 의해 생성된 및/또는 인간 항체들을 만들기 위한 기술들의 어느 것을 사용하여 만들어진 항체의 아미노산 서열에 해당하는 아미노산 서열을 가진 항체를 가리킨다.
인간 항체들은 본 기술분야에 알려진 각종 기술들을 사용하여 제조될 수가 있다. 한 가지 기술이 파지 디스플레이로서 (바람직하게는 인간) 항체들의 라이브러리를 파지들 상에서 합성하고, 그 라이브러리를 관심의 항원 또는 그것의 항체-결합 부분으로 스크린하며, 그 항원을 결합하는 파지를 분리하는 것인데, 그것으로부터 우리가 면역반응 단편들을 얻을 수 있다는 것이다. 상기 라이브러리들을 제조하고 스크린하는 방법들은 본 기술분야에 잘 알려진 것이며 파지 디스플레이 라이브러리들을 생성시키기 위한 키트들이 상업적으로 입수가능하다(예를 들면, Pharmacia Recombinant Phage Antibody System, 카탈로그 번호 27-9400-01; 및 Stratagene SurfZAPTM 파지 디스플레이 키트, 카탈로그 번호 240612). 또한 항체 디스플레이 라이브러리들을 생성시키고 스크린하는 데에 사용될 수가 있는 다른 방법들과 시약들도 있다 (참조예를 들면, U.S.P.N. 5,223,409; PCT Publication Nos. WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690; 그리고 Barbas et al., Proc. Natl. Acad. Sci. USA 88:7978-7982 (1991)).
한 실시형태에서, 재조합 인간 항체들은 상기한 대로 제조된 재조합체 조합 항체 라이브러리를 스크린함으로써 분리될 수 있다. 한 실시형태에서, 라이브러리는 B-세포들로부터 단리된 mRNA로부터 제조된 인간 VL 및 VH cDNA들을 사용하여 생성된, scFy 파지 디스플레이 라이브러리다.
실험된 일 없는 라이브러리들에 의해서 제조된 항체들은 (천연이든 합성이든) 친화력이 그리 높지 않을 수가 있으나 (Ka 약 106 to 107 M-1), 본 기술분야에 기술된 대로 이차 라이브러리들을 구성하여 재선별함으로써 친화력 성숙을 또한 시험관 내에서 모방할 수가 있다. 예를 들면, 오류 유발성(error-prone) 폴리머라제를 사용하여 돌연변이를 시험관 내에서 무작위로 도입할 수가 있다 (Leung et al., Technique, 1: 11-15 (1989)에서 보고됨). 게다가, 친화력 성숙은 하나 이상의 CDR들을 무작위로 돌연변이시킴으로써 실행될 수가 있는데, 예를 들면, 선택된 개개의 Fv 클론들에서, 관심의 CDR에 걸치는 무작위 서열을 가진 프라이머들을 가지고 PCR을 사용하여 더 높은 친화력의 클론들을 스크린하는 것이다. WO 9607754는 면역글로불린 경쇄의 CDR에서 돌연변이생성을 유도하여 경쇄 유전자들의 라이브러리를 만들 수 있는 방법을 기술하였다. 또 다른 효과적인 접근방법은 파지 디스플레이에 의해 선택된 VH 또는 VL 도메인들을 면역되지 않은 제공체들로부터 얻어진 본래 존재하는 V 도메인 변이형들의 모든 범위(레퍼토리)들과 재조합하여 Marks et al., Biotechnol., 10: 779-783 (1992)에 기술된 쇄 재셔플링(chain reshuffling) 몇 차례로 친화력이 보다 높은 것을 스크린하는 것이다. 이 기술을 통해 약 10-9 M 이하의 해리 상수 KD (koff/kon)를 가진 항체들과 항체 단편들을 생성할 수 있다.
다른 실시형태들에서는, 자신들의 표면에 결합 쌍들을 발현하는 유핵 세포들 (예를 들면, 이스트)로 이루어진 라이브러리들을 이용한 유사한 절차들을 사용할 수 있다. 참조예를 들면, U.S.P.N. 7,700,302와 U.S.S.N. 12/404,059. 한 실시형태에서, 인간 항체는 파지 라이브러리에서 선택되는데, 그 파지 라이브러리는 인간 항체들을 발현하는 것이다 (Vaughan et al. Nature Biotechnology 14:309-314 (1996): Sheets et al. Proc. Natl. Acad. Sci. USA 95:6157-6162 (1998). 다른 실시형태들에서, 인간 결합 쌍들은 이스트와 같은 유핵 세포들에서 만들어진 조합 항체 라이브러리들에서 분리될 수 있다. 참조예를 들면, U.S.P.N. 7,700,302. 그러한 기술들은 유리하게는 많은 수의 후보 조절물질들의 스크리닝을 가능하게 하며 후보 서열들의 (예를 들면, 친화력 성숙 또는 재조합체 재셔플링에 의한) 비교적 쉬운 조작을 제공해 준다.
인간 항체들은 또한 인간 면역글로불린 유전자자리를 유전자이식 동물들, 예를 들면, 마우스들 속에 도입함으로써 만들어질 수가 있는데, 여기서 내생성 면역글로불린 유전자들이 부분적으로 또는 완전히 불활성화되어 인간 면역글로불린 유전자들이 도입된 것이다. 실험도전 중에, 인간 항체 생성이 관찰되는데, 이것은 유전자 재배열, 어셈블리, 및 항체 레퍼토리 등을 포함하는, 모든 점들에서 인간들에서 보여지는 것과 아주 유사한 것이다. 이러한 접근방법은, 예를 들면, U.S.P.Ns. 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,661,016, 및 XenoMouse®과학기술에 대하여는 U.S.P.Ns. 6,075,181과 6,150,584; 그리고 Lonberg and Huszar, Intern. Rev. Immunol. 13:65-93 (1995)에 기술되어 있다. 다른 방법으로는, 표적 항원을 향한 항체를 생성하는 인간 B 림프구들의 불멸화를 통해 인간 항체를 제조할 수 있다 (그러한 B 림프구들은 종양 질환에 걸린 개인으로부터 회수된 것일 수 있거나 또는 시험관 내에서 면역시켰을 수 있다). 참조예를 들면, Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol, 147 (l):86-95 (1991); 그리고 U.S.P.N. 5,750,373.
3. 더 추가된 처리
어떻게 얻어졌든 간에, 조절물질-생산 세포들 (예를 들면, 하이브리도마, 이스트 콜로니들 등)은 선택, 클론된 다음에는, 예를 들면, 활발한 성장, 높은 항체 생산 그리고, 아래에 더욱 상세하게 논의되듯이, 바람직한 항체 특성들을 포함하는, 바람직한 특성들을 가졌는지에 대해 더 시험할 수 있다. 하이브리도마들은 공통유전자형 동물들에서 생체 안에서, 면역계가 결핍된 동물들, 예를 들면, 누드 마우스들에서, 또는 시험관 내 세포 배양물에서 확장될 수가 있다. 각각이 하나의 구별되는 항체 종들을 생성하는, 하이브리도마들 및/또는 콜로니들을 선택, 클로닝 및 확장하는 방법들은 본 기술분야의 통상의 기술을 가진 사람들에게는 잘 알려진 것이다.
A. 재조합체 조절물질 제조
1.
개관
일단 공급원이 완전한 것이면 바라던 DLL3 조절물질들을 암호화하는 DNA는 (예를 들면, 항체 중쇄 및 경쇄들을 암호화하는 유전자들에 특이적으로 결합할 수 있는 올리고누클레오타이드 탐침(probe)들을 사용하는) 종래의 절차들을 사용하여 용이하게 분리하고 서열을 결정할 수 있다. 단리된 그리고 서브클로닝된 하이브리도마 세포들은 (또는 파지 또는 이스트 유래 콜로니들은) 조절물질이 항체라면 그러한 DNA의 바람직한 공급원으로 소용될 수 있다. 원한다면, 핵산을 본원에 기술된 바와 같이 더 조작하여 융합 단백질들, 또는 키메라성, 인간화 또는 완전한 인간 항체들을 포함하는 약제들을 만들어 낼 수가 있다. 더욱 구체적으로, (변형될 수 있는) 단리된 DNA는 제조 항체들을 위한 불변 및 가변 영역 서열들을 클로닝하는 데에 사용될 수가 있다.
그래서, 예시적인 실시형태들에서 항체들은 (Al-Rubeai; An, and Shire et. al. 모두 상기, 그리고 Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002)에 제시된 절차들과 같은) 종래의 절차들을 사용하여, 재조합체로 제조될 수 있는 것으로서, 분리 및 서브클로닝된 하이브리도마 세포들은 (또는 파지 또는 이스트 유래의 콜로니들은) 핵산 분자들의 바람직한 공급원으로 소용된 것이다.
용어 "핵산 분자(nucleic acid molecule)"는, 본원에 사용되고 있는 바와 같이, 단일-가닥이든 이중-가닥이든, DNA 분자들과 RNA 분자들 그리고 그것들의 인위적인 변이형들 (예를 들면, 펩타이드 핵산들)을 포함하는 것으로 간주된다. 핵산들은 본 발명의 항체의 쇄 하나 또는 양쪽 쇄들, 또는 그것들의 단편 또는 유도체를 암호화할 수 있다. 본 발명의 핵산 분자들은 또한 폴리펩타이드를 암호화하는 폴리누클레오타이드를 확인하거나, 분석하거나, 돌연변이시키거나 또는 증폭시키기 위한 혼성화(hybridization) 탐침들, PCR 프라이머들 또는 서열분석 프라이머들로 사용하기에 충분한 폴리누클레오타이드들; 폴리누클레오타이드의 발현을 억제시키기 위한 안티-센스 핵산들, 그리고 뿐만 아니라 상보적인 서열들도 포함한다. 핵산들은 어떠한 길이도 될 수가 있다. 그것들은, 예를 들면, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 75, 100, 125, 150, 175, 200, 250, 300, 350, 400, 450, 500, 750, 1,000, 1,500, 3,000, 5,000 또는 그 이상의 누클레오타이드들의 길이일 수가 있고/있거나, 하나 이상의 부가 서열들, 예를 들면, 조절성 서열들을 포함할 수가 있고/있거나, 더 큰 핵산, 예를 들면, 벡터의 일부일 수가 있다. 그러한 핵산 서열들을 더 조작하여 키메라성, 인간화 또는 완전한 인간항체들을 포함하는 조절물질들을 만들어 낼 수가 있음이 이해될 것이다. 더욱 구체적으로, (변형될 수 있는) 단리된 핵산 분자들은 U.S.P.N. 7,709,611에 기술된 제조 항체들을 위한 불변 및 가변 영역 서열들을 클로닝하는 데에 사용될 수가 있다.
용어 "단리된 핵산(isolated nucleic acid)"은 핵산이 (i) 시험관 내에서, 예를 들면 폴리머라제 연쇄 반응 (PCR)에 의해서, 증폭되었거나, (ii) 클로닝에 의해서 재조합체로 제조되었거나, (iii) 예를 들면 절단반응 및 젤-전기영동 분획에 의해서, 정제되었거나, 또는 (iv) 예를 들면 화학적 합성에 의해서, 합성된 것임을 의미한다. 단리된 핵산은 재조합 DNA 기술들에 의한 조작에 이용가능한 핵산이다.
항체의 원하는 면역반응 부분을 암호화하는 핵산의 공급원이 파지 디스플레이 과학기술, 이스트 라이브러리들, 하이브리도마-기반 과학기술로부터 얻어진 것이거나 유도된 것이든 또는 합성에 의한 것이든 간에, 본 발명은 항체들 또는 항원-결합 단편들 또는 그것들의 유도체들을 암호화하는 핵산 분자들 및 서열들을 망라한 것임을 이해할 필요가 있다. 게다가, 본 발명은 그러한 핵산 분자들을 포함하는 벡터들 및 숙주 세포들에 관한 것이기도 하다.
2. 혼성화와 서열 동일성
언급한 바와 같이, 본 발명은 더 나아가 특정한 혼성화 조건들 하에 다른 핵산들과 혼성화하는 핵산들을 제공한다. 더욱 구체적으로 본 발명은 보통의 또는 고도의 엄중도 혼성화 조건들 하에 (예를 들면, 아래에 정의된 대로), 본 발명의 핵산 분자들과 혼성화하는 핵산 분자들을 망라한 것이다. 핵산들의 혼성화 방법들은 본 기술분야에 잘 알려져 있다. 잘 알려져 있는 대로, 보통의 엄중한 혼성화 조건들은 5x 소듐 클로라이드/소듐 시트레이트(SSC)를 함유하는 예비세척 용액, 0.5% SDS, 1.0 mM EDTA (pH 8.0), 약 50% 포름아미드의 혼성화 완충제, 6xSSC, 및 혼성화 온도 55°C (또는 약 50% 포름아미드를 함유하는 용액과 같은, 다른 유사한 혼성화 용액들은, 혼성화 온도 42°C로), 그리고 0.5xSSC, 0.1% SDS에서 60°C의 세척 조건들을 포함한다. 비교를 위하여 고도의 엄중한 혼성화 조건들 하의 혼성화는 45°C에서 6xSSC에 의한 세척, 이어서 68°C에서 0.1xSSC, 0.2% SDS의 한 번 이상의 세척을 포함하고 있다. 더욱이, 본 기술분야에 숙달된 사람이라면 혼성화의 반응조건(엄중도)을 증가시키거나 감소시킬 수 있는 혼성화 및/또는 세척 조건들을 조작할 수가 있어서 서열 서로에 대해 적어도65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% 또는 99%가 동일한 누클레오티드 서열들을 포함하는 핵산들은 전형적으로는 서로에 혼성화된 상태를 유지할 수 있다.
본 발명은 또한 기술된 핵산 분자들과 "실질적으로 동일한(substantially identical)" 핵산 분자들도 포함한 것이다. 한 실시형태에서, 핵산 서열에 관련하여 용어 실질적으로 동일한이 의미하는 것은 적어도 약 65%, 70%, 75%, 80%, 85%, 또는 90% 서열 동일성을 나타내는 핵산 분자들의 서열로 해석될 수 있다. 다른 실시형태들에서, 핵산 분자들은 기준 핵산 서열과 95% 또는 98% 서열 동일성을 나타낸다.
혼성화 조건들의 선택에 영향을 주는 기본 매개변수들과 적당한 조건들을 궁리하는 지침은 예를 들면, Sambrook, Fritsch, 그리고 Maniatis (1989, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., chapters 9 and 11; and Current Protocols in Molecular Biology, 1995, Ausubel et al., eds., John Wiley & Sons, Inc., sections 2.10 and 6.3-6.4)에 의해 제시되어 있으며, 본 기술분야에 통상의 기술을 가진 사람들이 예를 들면, 핵산의 길이 및/또는 염기 조성에 기초하여 용이하게 결정할 수가 있는 것이다.
폴리펩타이드들의 서열 유사성은, 또한 서열 동일성이라고 부르기도 하는데, 전형적으로는 서열 분석 소프트웨어를 사용하여 측정된다. 단백질 분석 소프트웨어는 보존성 아미노산 치환들을 포함하여, 여러 가지 치환들, 결실들, 그리고 그 밖의 변형들에 할당된 유사성의 척도들을 사용하여 유사한 서열들을 비교한 것이다. 예를 들면, 서열 분석 도구 GCG (Accelrys Software Inc.)는 디폴트 매개변수들을 사용하여 서로 다른 종의 유기체들 유래의 상동 폴리펩타이드들과 같은, 가깝게 관련된 폴리펩타이드들 간의 또는 야생형 단백질과 그것의 돌연변이단백질간의 서열 상동성 또는 서열 동일성을 측정하는 데 이용될 수가 있는 "GAP"과 "BEST-FIT"과 같은 프로그램들을 포함하고 있다. (참조예를 들면, GCG Version 6.1 or Durbin et. Al., Biological Sequence Analysis: Probabilistic models of proteins and nucleic acids., Cambridge Press (1998)).
폴리펩타이드 서열들은 또한 GCG Version 6.1의 한 프로그램인, 디폴트 또는 추천된 매개변수들을 사용하는 FASTA를 사용하여 비교될 수가 있다. FASTA (예를 들면, FASTA2와 FASTA3)는 조회 및 탐색 서열들 간의 최대 중복 영역들의 정렬들 및 서열 동일성 비율을 제공해 준다 (상기 Pearson (2000)). 본 발명의 서열을 서로 다른 종들의 많은 수의 서열들을 포함하고 있는 데이터베이스에 비교하는 또 다른 바람직한 알고리즘은 애초 매개변수들을 사용하는 컴퓨터 프로그램 BLAST, 특히 blastp 또는 tblastn이다. 참조예를 들면, Altschul et al. (1990) J. Mol. Biol. 215: 403 410과 Altschul et al. (1997) Nucleic Acids Res. 25:3389 402인데, 그 각각이 본원에 참조로 포함되어 있다.
이 점에서 본 발명은 또한 항체 가변 영역 폴리펩타이드 서열 (예를 들면, 제공체의 경쇄 또는 중쇄 가변 영역이거나 수용자의 경쇄 또는 중쇄 가변 영역이거나)에 대하여 "실질적으로 동일한" 폴리펩타이드들을 암호화하는 핵산 분자들을 포함한 것이기도 하다. 그러한 폴리펩타이들에 적용하고 있는 대로, 용어 "실질적 동일성(substantial identity)" 또는 "실질적으로 동일한(substantially identical)"은 두 개의 펩타이드 서열들이, 최적으로 정렬되었을 때, 이를 테면 디폴트 불일치 가중치들을 사용하는 GAP 또는 BEST-FIT 프로그램들로, 적어도 60% 또는 65% 서열 동일성을, 바람직하게는 적어도 70%, 75%, 80%, 85%, 또는 90% 서열 동일성을, 한층 더 바람직하게는 적어도 93%, 95%, 98% 또는 99% 서열 동일성을 공유함을 의미한다. 바람직하게는, 동일하지 않은 잔기 자리들은 보존성 아미노산 치환들만큼 차이가 있는 것이다. "보존성 아미노산 치환(conservative amino acid substitution)"은 아미노산 잔기가 화학적 성질들 (예를 들면, 전하 또는 소수성)이 유사한 측쇄(R기)를 가진 또 다른 아미노산 잔기로 치환된 것이다. 일반적으로, 보존성 아미노산 치환은 단백질의 기능적 성질들을 실질적으로 변화시키지 않을 것이다. 둘 이상의 아미노산 서열들이 보존성 치환들만큼 서로 차이가 나는 경우들에서는, 서열 동일성 비율 또는 유사성의 정도가 상향 조정되어 치환의 보존적 성질을 보정할 수 있다.
3. 발현
재조합 발현, 즉, RNA의 또는 RNA 및 단백질/펩타이드의 제조의 다양한 과정들은 예를 들면, Berger and Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology volume 152 Academic Press, Inc., San Diego, Calif.; Sambrook et al., Molecular Cloning-A Laboratory Manual (3rd Ed.), Vol. 1-3, Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y., (2000); 및 Current Protocols in Molecular Biology, F. M. Ausubel et al., eds., Current Protocols, a joint venture between Greene Publishing Associates, Inc. and John Wiley & Sons, Inc., (2006년까지 보충됨) 등에 제시된 대로 잘 알려진 것이다.
중요한 몇몇 용어들에 "발현 제어 서열(expression control sequence)" 등이 있는데 이것은 유전자의 전사 또는 mRNA의 번역을 조절하는 프로모터들, 라이보솜 결합 자리들, 인핸서들 그리고 그 밖의 통제 요소들로 구성되어 있다. 잘 알려져 있는 대로, "프로모터(promoter)" 또는 "프로모터 영역(promoter region)"는 일반적으로 발현하고자 하는 핵산 서열의 상류 (5')에 위치하고 있고 RNA-폴리머라제를 위한 인식 및 결합 자리를 제공함으로써 그 서열의 발현을 통제하는 핵산 서열에 관련된 것이다.
본 발명에 따른 적합한 예시적인 프로모터들에는 SP6, T3 및 T7 폴리머라제를 위한 프로모터들, 인간 U6 RNA 프로모터, CMV 프로모터, 그리고 한 부분 또는 여러 부분들이 예를 들면 인간 GAPDH (글리세르알데하이드-3-포스페이트 디하이드로게나제)와 같은, 다른 세포성 단백질들의 유전자들의 프로모터들의 한 부분 또는 여러 부분들에 융합된, 그리고 추가의 인트론(들)을 포함하거나 포함하지 않은 그것들의 인위적인 혼성체 프로모터들 (예를 들면 CMV)이 있다.
어떤 실시형태들에서, 핵산 분자는 그 핵산의 발현을 통제하는, 프로모터가 있는 적합한 벡터 속에 존재할 수 있다. 잘 알려진 용어 "벡터(vector)"는 핵산을 위한 어떠한 중간 운반체를 구성한 것으로 상기 핵산이 예를 들면, 무핵 세포 및/또는 유핵 세포들 속으로 도입되는 것을 가능케 하며, 적합한 경우에는, 유전체 속으로 통합되는 것을 가능케 해준다. 포유동물 세포들을 형질전환하는 방법들은 본 기술분야에 잘 알려진 것이다. 참조예를 들면, U.S.P.Ns. 4,399,216, 4,912,040, 4,740,461, 그리고 4,959,455. 벡터들은 조작가능하게 프로모터에 연결된, 본 발명의 항체 (예를 들면, 완전 항체, 항체의 중쇄 또는 경쇄, 항체의 VH 또는 VL, 또는 그것들의 일부, 또는 중쇄- 또는 경쇄- CDR, 단일 쇄 Fv, 또는 그것들의 단편들 또는 변이형들)를 암호화하는 누클레오타이드 서열을 포함할 수 있다 (참조예를 들면, PCT Publication WO 86/05807; PCT Publication WO 89/01036; 그리고 U.S.P.N. 5,122,464).
다양한 숙주-발현 벡터 시스템들이 상업적으로 입수가능하고, 많은 것들은 본원의 교시들에 적합한 것이며 본 발명의 조절물질들을 발현시키는 데에 사용될 수 있다. 그러한 시스템들에는 조절물질 암호 서열들이 포함된 재조합 박테리오파지 DNA, 플라스미드 DNA 또는 코스미드 DNA 발현 벡터들로 형질전환시킨 박테리움들 (예를 들면, 이. 콜라이(E. coli), 비. 서브틸리스(B. subtilis), 스트렙토마이세스(Streptomyces))과 같은 미생물들; 조절물질 암호 서열들이 포함된 재조합 이스트 발현 벡터들로 형질감염시킨 이스트 (예를 들면, 사카로마이세스(Saccharomyces), 피치아(Pichia)); 조절물질 암호 서열들이 포함된 재조합 바이러스 발현 벡터들 (예를 들면, 바쿨로바이러스)로 감염시킨 곤충 세포 시스템들; 조절물질 암호 서열들이 포함된 재조합 바이러스 발현 벡터들 (예를 들면, 콜리플라워 모자이크 바이러스(cauliflower mosaic virus); 담배 모자이크 바이러스(tobacco mosaic virus))로 감염시키거나 재조합 플라스미드 발현 벡터들 (예를 들면, Ti 플라스미드)로 형질감염시킨 식물 세포 시스템들 (예를 들면, 니코티아나(Nicotiana), 아라비돕시스(애기장대, Arabidopsis), 오리잡초, 옥수수, 밀, 감자 등); 또는 포유동물 세포들의 유전체에서 유래된 (예를 들면, 메탈로티오네인 프로모터) 또는 포유동물 바이러스들에서 유래된 (예를 들면, 아데노바이러스 후기 프로모터; 우두 바이러스 7.5K 프로모터) 프로모터들이 포함된 재조합 발현 작제물들을 품은 포유동물 세포 시스템들 (예를 들면, COS, CHO, BHK, 293, 3T3 세포 등) 등이 있으나, 이들에 한정되는 것은 아니다.
본원에 사용되고 있는 바와 같이, 용어 "숙주 세포(host cell)"는 공학적으로 설계하여 본 발명의 폴리펩타이드들 및 항원-결합 분자들을 생성시킬 수가 있는 어떠한 종류의 세포 시스템을 망라한다. 한 실시형태에서, 숙주 세포는 변형된 글라이코형(glycoform)들을 가진 항원 결합 분자의 생성이 가능하도록 공학적으로 설계된 것이다. 바람직한 실시형태에서, 항원 결합 분자, 또는 변이형 항원 결합 분자는 항체, 항체 단편, 또는 융합 단백질이다. 어떤 실시형태들에서, 숙주 세포들은 N-아세틸글루코사미닐트랜스퍼라제 III (GnTI11) 활성을 가진 하나 이상의 폴리펩타이드들의 수준들이 증가 발현되도록 더욱 조작처리되었다. 적합한 숙주 세포들에는 배양 세포들, 예를 들면, CHO 세포들, BHK 세포들, NSO 세포들, SP2/0 세포들, YO 골수종 세포들, P3X63 마우스 골수종 세포들, PER 세포들, PER.C6 세포들 또는 하이브리도마 세포들과 같은 포유동물 배양 세포들, 이스트 세포들, 곤충 세포들, 그리고 식물 세포들 등이 있으나, 아주 약간 언급한 것으로, 유전자이식 동물, 유전자이식 식물 또는 배양 식물 또는 동물 조직 안에 포함된 세포들도 있다.
재조합 단백질들의 장기간의, 고-수율 생성을 위해서는 안정된 발현이 바람직하다. 따라서, 선택된 조절물질을 안정되게 발현하는 세포주들을 표준의 당해 분야에서 인정되고 있는 기술들을 사용하여 공학적으로 설계할 수 있다. 바이러스성 복제 원점들이 포함된 발현 벡터들을 사용하기 보다는, 적합한 발현 통제 요소들 (예를 들면, 프로모터, 인핸서, 서열들, 전사 종결인자들, 폴리아데닐화 자리들 등)에 의해 통제되는 DNA, 및 선별 마커로 숙주 세포들을 형질전환시킬 수가 있다. 본 기술분야에 잘 알려진 선별 시스템들의 어떠한 것이라도 사용할 수 있는데, 어떤 일정한 조건들 하에 발현을 증대시키기에 효율적인 접근방법을 제공해 주는 글루타민 신테타제(synthetase) 유전자 발현 시스템 (GS 시스템) 등이 있다. GS 시스템은 EP 특허들 0 216 846, 0 256 055, 0 323 997과 0 338 841 그리고 U.S.P.N.s 5,591,639와 5,879,936에 관련하여 전부 또는 일부 논의되어 있는 데, 그 각각이 참조로 본원에 포함되어 있다. 또 다른 바람직한 발현 시스템으로, Life Technologies (카탈로그 번호 A13696-01)에 의해서 상업적으로 공급되고 있는 Freedom™ CHO-S Kit도 조절물질 제조에 사용될 수 있는 안정된 세포주들의 개발을 가능하게 한다.
그러한 숙주-발현 시스템들은 관심의 암호 서열들을 제조하고 이후 정제할 수 있는 운반체들을 나타낼 뿐 아니라, 적합한 누클레오타이드 암호 서열들로 형질전환 또는 형질감염시켰을 때, 본 발명의 분자를 제 자리에서(in situ) 발현할 수 있는 세포들을 나타내는 것이기도 하다. 숙주 세포는 본 발명의 두 가지 발현 벡터들, 예를 들면, 중쇄 유래 폴리펩타이드를 암호화하는 제1 벡터와 경쇄 유래 폴리펩타이드를 암호화하는 제2 벡터로 동시-형질감염될 수 있다.
따라서, 어떤 실시형태들에서, 본 발명은 항체들 또는 그것들의 부분들의 발현을 가능하게 해 주는 재조합 숙주 세포들을 제공한다. 그러한 재조합 숙주 세포들에서의 발현에 의해 생성된 항체들은 본원에서 재조합 항체들이라고 부른다. 본 발명은 또한 그러한 숙주 세포들의 자손 세포들, 그리고 그것들에 의해 생성된 항체들을 제공한 것이기도 하다.
A. 화학적 합성
또한, 조절물질들은 본 기술분야에 알려진 기술들을 사용하여 화학적으로 합성될 수 있다 (참조예를 들면, Creighton, 1983, Proteins: Structures and Molecular Principles, W.H. Freeman & Co., N.Y., 그리고 Hunkapiller, M., et al., 1984, Nature 310:105-111). 게다가, 원한다면, 비고전적인 아미노산들 또는 화학적 아미노산 유사체들 (이를 테면 공통 아미노산들의 D-이성질체들, 2,4-다이아미노부티르산, a-아미노 아이소부티르산, 4-아미노부티르산 등등)을 폴리펩타이드 서열 속으로 치환 또는 부가 형태로 도입할 수가 있다.
B. 유전자이식 시스템들
다른 실시형태들에서 조절물질들은 면역글로불린의 중쇄 및 경쇄 서열들과 같은 재조합 분자들의 유전자가 이식된 그리고 회수가능한 형태의 바라던 대로의 화합물들을 생성하는 포유동물 또는 식물의 제조를 통한 유전자이식으로 생산될 수 있다. 이것에는 예를 들면, 염소들, 소들, 또는 다른 포유동물들의 우유 상태의, 단백질 조절물질들 (예, 항체들)의 생산, 및 그로부터 회수 등이 있다. 참조예를 들면, U.S.P.Ns. 5,827,690, 5,756,687, 5,750,172, 그리고 5,741,957. 어떤 실시형태들에서, 인간 면역글로불린 유전자자리를 포함한 비인간 유전자이식 동물들은 항체들을 생산하도록 면역시킨 것이다.
다른 유전자이식 기술들은 Hogan et al., Manipulating the Mouse Embryo: A Laboratory Manual 2nd ed., Cold Spring Harbor Press (1999); Jackson et al., Mouse Genetics and Transgenics: A Practical Approach, Oxford University Press (2000); 및 Pinkert, Transgenic Animal Technology: A Laboratory Handbook, Academic Press (1999) 그리고 U.S. P.N. 6,417,429에 제시되어 있다. 어떤 실시형태들에서, 비인간 동물들은 마우스들, 래트들, 양들, 돼지들, 염소들, 소들 또는 말들이며, 원하는 산물은 혈액, 우유, 오줌, 침, 눈물, 점액 그리고 다른 체액들의 상태로 생산되는데 이로부터 기당해 분야에서 인정되고 있는 정제 기술들을 사용하여 용이하게 얻을 수 있는 것이다.
다른 적합한 생산 시스템들에는 예를 들면, U.S.P.Ns. 6,046,037과 5,959,177에 기술된 것과 같은 식물들에서 항체들을 만들기 위한 방법들이 있는데, 상기 기술들에 관련하여 (그 내용이) 본원에 포함되어 있다.
C. 분리/정제
일단 본 발명의 조절물질이 재조합 발현 또는 다른 어떠한 개시된 기술들에 의해서 생산되었으면, 면역글로불린들 또는 단백질들의 정제를 위한 본 기술분야에 알려진 어떠한 방법에 의해서 정제될 수 있다. 이 점에서 조절물질은 "분리될(isolated)" 수 있는데, 이는 그것이 확인되어 분리되었고/분리되었거나 그것의 본래 환경의 성분에서 회수된 것을 의미한다. 그것의 본래 환경의 오염물질 성분들은 폴리펩타이드의 진단적 또는 치료적 사용들을 방해할 수 있는 물질들이며 효소들, 호르몬들, 그리고 다른 단백질성 또는 비단백질성 용질들 등이 포함될 수 있다. 단리된 조절물질들에는 폴리펩타이드의 본래 환경의 적어도 한 가지 성분이 존재하지 않을 것이기 때문에 재조합 세포들 속의 제 자리의 조절물질 등이 포함된다.
만일 원하는 분자가 세포내에서 생성되면, 제1 단계로서, 미세 입자가, 숙주 세포들이든 용해된 단편들이든, 예를 들면, 원심분리 또는 초미세여과에 의해서 제거될 수 있다. 조절물질이 매질 속으로 분비되는 경우에는, 그러한 발현 시스템들의 상층액들을 일반적으로는 상업적으로 입수가능한 단백질 농축 필터, 예를 들면, Amicon 또는 Pellicon 초미세여과 장치 (Millipore Corp.)를 사용하여 먼저 농축한다. 일단 불용성의 오염물질들이 제거되면 조절물질 준비물을 예를 들면, 하이드록실아파타이트 크로마토그래피, 젤 전기영동, 투석, 및 친화력 크로마토그래피와 같은 표준 기술들을 사용하여 더 정제할 수 있는데, 친화력 크로마토그래피가 특히 중요하다. 이에 관련하여 단백질 A를 사용하여 인간 IgG1, IgG2 또는 IgG4의 중쇄들에 기초하는 항체들을 정제할 수가 있고 (Lindmark, et al., J Immunol Meth 62:1 (1983)) 단백질 G는 모든 마우스 아이소형들과 인간 IgG3에 추천된다 (Guss, et al., EMBO J 5:1567 (1986)). 이온-교환 칼럼 상의 분획, 에탄올 침전, 역상 HPLC, 실리카 상의 크로마토그래피, 헤파린 상의 크로마토그래피, (폴리아스파르트산 칼럼과 같은) 음이온 또는 양이온 교환 수지 상의 세파로오스 크로마토그래피, 크로마토포커싱, SDS-PAGE 및 암모늄 설페이트 침전과 같은 단백질 정제를 위한 다른 기술들도 또한 회수하고자 하는 항체에 따라 이용가능하다. 특히 바람직한 실시형태들에서 본 발명의 조절물질들은, 적어도 부분적으로, 단백질 A 또는 단백질 G 친화력 크로마토그래피를 사용하여 정제될 것이다.
VI. DLL3 조절물질 단편들 및 유도체들
어떤 발생 및 제조 방법론들이 선택되던지, 본 발명의 조절물질들은 표적 결정인자(예를 들면, 항원)과 반응, 결합, 조합, 접합, 연결, 부착, 접합, 상호작용 또는 그렇지 않으면 회합함으로써, 원하는 결과를 제공할 것이다. 조절물질이 항체 또는 단편, 작제물 또는 이들의 유도체를 포함하는 경우, 상기 회합들은 항체 상에서 발현된 1개 이상의 "결합 영역들" 또는 "결합성분들"을 통해 이루어질 수 있으며, 결합 영역은 본 발명의 표적 분자 또는 항원에 선택적으로 결합하기 위해 반응할 수 있는 폴리펩타이드의 영역을 포함한다. 결합 도메인은 적어도 하나의 결합 영역을 포함한다(예를 들면, 온전한 IgG 항체는 2개의 결합도메인과 2개의 결합 영역들을 가질 것이다). 결합도메인들의 예로는 항체 가변성 도메인, 리간드의 수용체-결합 도메인, 수용체의 리간드-결합 도메인 또는 효소 도메인이 포함된다.
A. 항체들
위에 기술된 바와 같이, 용어 "항체"는 적어도 폴리클론성 항체들, 멀티클론성 항체들, 키메라성 항체들, CDR 이식형 항체들, 인간화 및 영장류화 항체들, 인간 항체들, 재조합으로 제조된 항체들, 내부체들, 다중특이성 항체들, 이중특이성 항체들, 1가 항체들, 다가 항체들, 항-유전자형 항체들뿐만 아니라 합성 항체들을 포함하는 것으로 간주된다.
B. 단편들
어떤 형태의 조절물질(예를 들면, 키메라성, 인간화 등)이 본 발명을 실시하기 위해 선택되는 것과 무관하게, 본원에 교시된 내용에 따라, 동일한 면역반응 단편들이 사용될 수 있음을 알 것이다. "항체 단편"은 온전한 항체의 적어도 일부를 포함한다. 본 명세서에 사용된 바와 같이, 용어 항체분자의 "단편"은 항체의 항원-결합 단편들을 포함하며, 및 용어 "항원-결합 단편"은 선택된 항원 또는 그의 면역원 결정인자와 면역특이적으로 결합 또는 반응하거나, 단편들이 특이적 항원결합을 위해 유도된 온전한 항체와 경쟁하는 면역글로불린 또는 항체의 폴리펩타이드 단편을 의미한다.
단편의 예로는 VL, VH, scFv, F(ab')2 단편, Fab 단편, Fd 단편, Fv 단편, 단일 도메인 항체 단편들, 이중항체들, 선형 항체, 단일-쇄 항체 분자들 및 항체 단편들로부터 형성된 다중특이적 항체들이 포함된다. 게다가, 활성 단편은 항원/기질 또는 수용체들과 상호반응하고, (다소 낮은 효력을 갖고 있음에도 불구하고) 온전한 항체의 방법과 유사한 방법으로 그들을 변형시킬 수 있는 능력을 갖는 항체의 일부를 포함한다.
다른 실시형태에서, 항체 단편은 Fc 영역을 포함하는 단편 및 FcRn 결합, 항체 반감기 조절, ADCC 기능 및 보완 결합과 같은, 온전한 항체내에 존재할 때 Fc 영역과 정상적으로 회합되는 생물학적 기능들 중 적어도 하나를 보유하는 단편이다. 예를 들면, 상기 항체 단편은 단편에 생체내 안정성을 부여할 수 있는 Fc 서열에 연결된 항원결합 아암을 포함할 수 있다.
당업자들에게 잘 알려져 있는 바와 같이, 단편들은 온전한 또는 완전한 항체 또는 항체 쇄의 화학적 또는 효소적 처리(예를 들면, 파파인 또는 펩신)를 통해, 또는 재조합 수단들에 의해 얻어질 수 있다. 예를 들면, 항체 단편들에 대한 보다 상세한 설명을 위해, Fundamental Immunology, W. E. Paul, ed., Raven Press, N.Y. (1999)를 참조한다.
C. 유도체들
본 발명은 면역반응 조절물질 유도체들, 및 1개 이상의 변형들을 포함하는 항원결합 분자들을 추가로 포함한다.
1. 다가 항체들
한 실시형태에서, 본 발명의 조절물질들은 1가 또는 다가(예를 들면, 2가, 3가 등)이다. 본 명세서에 사용된 바와 같이, 용어 "결합가"는 항체와 회합되는 잠재적인 표적 결합 영역들을 의미한다. 각 표적 결합 영역은 1개의 표적 분자 또는 표적 분자 상의 특정 위치 또는 장소에 특이적으로 결합한다. 항체가 1가인 경우, 분자의 각 결합 영역은 단일 항원 위치 또는 에피토프와 특이적으로 결합할 것이다. 항체가 1개 이상의 표적 결합 영역(다가)를 포함하는 경우, 각 표적 결합 영역은 동일하거나 상이한 분자에 특이적으로 결합할 수 있다(예를 들면, 상이한 리간드 또는 상이한 항원들, 또는 동일한 항원 상의 상이한 에피토프들 또는 위치들에 결합할 수 있음). 예를 들면 미국특허 2009/0130105를 참조한다. 각 경우에, 결합 영역들 중 적어도 하나는 DLL3 아이소형과 회합된 에피토프, 모티프 또는 도메인을 포함할 것이다.
한 실시형태에서, 조절물질들은 Millstein et al., 1983, Nature, 305:537-539에 설명된 바와 같이, 2개의 쇄들이 다른 특이성을 갖는 이중특이성 항체이다. 다른 실시형태들은 삼중특이성 항체들과 같은 추가의 특이성들을 갖는 항체들을 포함한다. 다른 보다 정교한 적합한 다중특이성 작제물들 및 이들의 제조방법들은 미국특허 2009/0155255, 뿐만 아니라 WO 94/04690; Suresh et al., 1986, Methods in Enzymology, 121:210; 및 WO96/27011에 개시되어 있다.
상기 언급되어 있는 바와 같이, 다가 항체들은 원하는 표적 분자의 상이한 에피토프들에 면역특이적으로 결합할 수 있거나, 이질성 폴리펩타이드 또는 고체 지지체 물질과 같은 이질성 에피토프 뿐만 아니라 표적 분자 모두에 면역특이적으로 결합할 수 있다. 항-DLL3 항체들의 바람직한 실시형태들은 오직 2개의 항원들(즉, 이중특이성 항체들)과 결합하는 반면, 삼중특이성 항체들과 같은 추가의 특이성들을 갖는 항체들도 본 발명에 의해 포함된다. 이중특이성 항체들은 또한, 교차-결합된 또는 "헤테로접합된(heteroconjugate)" 항체들을 포함한다. 예를 들면, 헤테로접합체 속의 항체들 중 하나는 아비딘에 결합될 수 있으며, 나머지 하나는 바이오틴에 결합될 수 있다. 상기 항체들은 예를 들면, 원치않는 세포들에 면역계 세포들을 표적시키기 위해(미국특허 제4,676,980호), 및 HIV 감염을 치료하기 위해(WO 91/00360, WO 92/200373, 및 EP 03089), 제안되어 왔다. 헤테로접합체 항체들은 편리한 교차-결합 방법들을 사용하여 제조될 수 있다. 적당한 교차-결합제들은 당 분야에 잘 알려져 있으며, 여러 개의 교차결합 기술들을 따라 미국특허 제4,676,980호에 개시되어 있다.
또다른 실시형태에서, 원하는 결합 특이성을 갖는 항체 가변성 도메인(항체-항원 결합 영역)들은 당 분야에 통상의 기술을 가진 자들에게 잘 알려진 방법들을 사용하여, 힌지, CH2, 및/또는 CH3 영역들의 적어도 일부를 포함하는 면역글로불린 중쇄 불변 도메인과 같은 면역글로불린 불변 도메인 서열에 융합된다.
2. Fc 영역 변형들
상기 개시된 조절물질들 (예를 들면, Fc-DLL3 또는 항-DLL3 항체들)의 가변 또는 결합 영역에 대한 다양한 변형들, 치환들, 부가들 또는 결실들에 더해, 당업자들은 본 발명의 선택된 실시형태들이 불변 영역(즉, Fc 영역)의 치환들 또는 변형들도 포함할 수 있음을 알 것이다. 더욱 구체적으로, 본 발명의 DLL3 조절물질들은 무엇보다도 1개 이상의 아미노산 잔기 치환들, 돌연변이 및/또는 변형들을 함유할 수 있으며, 이들은 변경된 약동학, 증가된 혈청 반감기, 증가된 결합친화력, 감소된 면역원성, 증가된 생산성, Fc 수용체(RcR)에 대한 변경된 Fc 리간드 결합력, 개선된 또는 감소된 "ADCC"(항체-의존성 세포매개 세포독성) 또는 "CDC" (보체-의존성 세포독성) 활성, 변경된 글라이코실화 및/또는 다이설파이드 결합들 및 변형된 결합 특이성을 포함하는 바람직한 특성들을 갖는 화합물을 생성시키며, 여기에 제한되지 않는다. 이 관점에서, 상기 Fc 변이형들은 본 조절물질들의 효과적인 항-종양 특성들을 개선시키기 위해, 유리하게 사용될 수 있음을 알 것이다.
이 때문에, 본 발명의 특정 실시형태는 Fc 영역의 치환 또는 변형, 예를 들면, 1개 이상의 아미노산 잔기의 부가, 개선된 또는 바람직한 Fc 활성조절물질 기능들을 갖는 화합물을 생성하기 위한 치환, 돌연변이 및/또는 변형을 포함할 수 있다. 예를 들면, Fc 도메인과 Fc 수용체(예를 들면, FcγRI, FcγRIIA 및 B, FcγRIII 및 FcRn) 사이의 상호반응에 포함된 아미노산 잔기들의 변화들은 세포독성을 증가시키고/증가시키거나 증가된 혈청 반감기와 같은 약동학들을 변경시킬 수 있다(예를 들면, Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); and de Haas et al., J. Lab. Clin. Med. 126:330-41 (1995) 참조, 이들 각각은 본원에 참조로 반영된다).
선택된 실시형태에서, 증가된 생체내 반감기들을 갖는 항체들은 Fc 도메인과 FcRn 수용체 사이의 상호반응에 포함된 것으로 확인된 아미노산 잔기들을 변경(예를 들면, 치환, 결실, 또는 부가)시킴으로써 생성될 수 있다 (예를 들면, 국제공보 WO 97/34631; WO 04/029207; U.S.P.N. 6,737,056 및 U.S.P.N. 2003/0190311 참조). 상기 실시형태들과 관련하여, Fc 변이형들은 포유동물, 바람직하게 인간에서 5일 이상, 10일 이상, 15일 이상, 바람직하게 20일 이상, 25일 이상, 30일 이상, 35일 이상, 40일 이상, 45일 이상, 2개월 이상, 3개월 이상, 4개월 이상, 또는 5개월 이상의 반감기를 제공할 수 있다. 반감기가 증가됨으로써, 혈청 역가가 높아져서, 항체들의 투여 빈도를 감소시키고/시키거나 투여되는 항체들의 농도를 감소시킨다. 생체내 인간 FcRn에 대한 결합 및 인간 FcRN 고친화력 결합 폴리펩타이드의 혈청 반감기는 예를 들면, 변이 Fc 영역을 갖는 폴리펩타이드들이 투여되는 영장류에서, 또는 유전자이식 마우스 또는 인간 FcRn을 발현하는 형질감염 인간 세포주에서 분석될 수 있다. WO 2000/42072에는 FcRn들에 대한 결합을 개선 또는 감소시킨 항체 변이형들이 기술되어 있다. 예를 들면, Shields et al. J. Biol. Chem. 9(2):6591-6604 (2001)을 참조한다.
다른 실시형태에서, Fc 변형은 ADCC 또는 CDC 활성을 개선 또는 감소시킬 수 있다. 당 분야에 알려져 있는 바와 같이, CDC는 보체의 존재하에 표적 세포의 융해(lysis)를 의미하며, 및 ADCC는 특정 세포독성 세포(예를 들면, 자연살해세포들, 호중구, 및 대식세포)들 상에 존재하는 FcR들 위에 결합된 분비된 Ig이 상기 세포독성 활성조절물질 세포들을 항원-포함 표적 세포에 특이적으로 결합할 수 있게 하여, 세포독소들을 갖는 표적 세포를 살해할 수 있는 세포독성의 형태를 의미한다. 본 발명의 맥락에서, 항체 변이형들은 "변경된" FcR 결합 친화력을 가지며, 이는 천연형 서열 FcR을 포함하는 항체 또는 모 항체 또는 비변성 항체와 비교하여, 개선된 또는 감소된 결합력을 가진다. 감소된 결합력을 나타내는 상기 변이형들은 당 분야에 잘 알려진 기술들에 의해 측정되는 바와 같이, 천연형 서열과 비교하여, FcR에 대하여 약한 또는 작은 결합력, 예를 들면 0-20% 결합력을 가질 수 있다. 다른 실시형태에서, 변이형은 천연 면역글로불린 Fc 도메인과 비교하여, 개선된 결합력을 나타낼 것이다. 이러한 종류의 Fc 변이형들은 본 발명의 항체들의 효과적인 항-종양 특성들을 개선시키기 위해 유리하게 사용될 수 있음을 알 것이다. 또다른 실시형태에서, 상기 변형들은 결합 친화력을 증가시키고, 면역원성을 감소시키며, 생산력을 증가시키고, 글라이코실화 및/또는 다이설파이드 결합(예를 들면, 접합 자리들)을 변형시키고, 결합 특이성을 변형시키고, 포식세포를 증가시키고/증가시키거나; 세포표면 수용체(예를 들면, B 세포 수용체; BCR)들을 하향 조절시킨다.
3. 변형 글라이코실화
또다른 실시형태들은 1개 이상의 조작처리된 글라이코형, 즉 단백질에 공유결합된 변형 탄수화물 조성물 또는 변형된 글라이코실화 패턴을 포함하는 DLL3 조절물질을 포함한다. 예를 들면, Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740을 참고한다. 조작처리된 글라이코형은 활성조절물질 기능을 개선 또는 감소시키는 것, 표적에 대한 조절물질의 친화력을 증가시키는 것 또는 조절물질의 생성을 용이하게 하는 것을 포함하지만, 여기에 제한되지 않는 여러 목적들을 위해 사용될 수 있다. 감소된 활성조절물질 기능을 목적으로 하는 특정 실시형태에서, 비글라이코실화 형태를 발현하도록 분자가 조작처리될 수 있다. 1개 이상의 가변 영역 프레임워크 글라이코실화 부위들을 제거하여, 그 부위에서의 글라이코실화를 제거할 수 있는 치환들은 잘 알려져 있다 (예를 들면, 미국특허 제5,714,350호 및제6,350,861호 참조). 역으로, 개선된 활성조절물질 기능 또는 개선된 결합력은 1개 이상의 추가의 글라이코실화 부위들을 조작함으로써 Fc함유 분자에 부여될 수 있다.
다른 실시형태들은 감소된 양의 푸코실 잔기들을 갖는 하이포푸퓨코실화(hypofucosylated) 항체 또는 증가된 2등분 GlcNAc 구조들을 갖는 항체와 같은, 변형된 글라이코실화 조성물을 갖는 Fc 변이형을 포함한다. 상기 변형된 글라이코실화 패턴들은 항체들의 ADCC 능력을 증가시키는 것으로 입증되어 왔다. 조작처리된 글라이코형들은 당 분야에 통상의 지식을 가진 자들에게 공지된 방법으로, 예를 들면 조작처리된 또는 변이형 발현변종들을 사용하여, 1개 이상의 효소(예를 들면, N-아세틸글루코사미닐트랜스퍼라제 III(GnTI11))들과 함께 동시-발현함으로써, 여러 유기체들의 Fc 영역 또는 여러 유기체들로부터의 세포주들을 포함하는 분자를 발현시킴으로써, 또는 Fc 영역을 포함하는 분자가 발현된 후, 탄수화물(들)을 변형시킴으로써 생성될 수 있다(예를 들면, WO 2012/117002 참조).
4. 추가 처리
조절물질은 글라이코실화, 아세틸화, 인산화, 아미드화, 공지된 보호/차단 기들에 의한 유도체화, 단백질분해 제거, 항체 분자에 대한 결합 또는 다른 세포성 리간드 등에 의해 제조 중에 또는 제조 후에 별도로 변형될 수 있다. 수많은 화학적 변형들 중 어느 것이나, 사이아노겐 브로마이드, 트립신, 카이모트립신, 파파인, V8 프로테아제, NaBH4에 의한 특정 화학적 제거, 아세틸화, 포르밀화, 산화, 환원, 튜니카마이신의 존재하 대사합성을 포함하지만 여기에 제한되지 않는 공지된 기술들에 의해 실시될 수 있다.
본 발명에 의해 포함되는 여러가지의 번역후 변형들은 예를 들면N-연결형된 또는O-연결형 탄수화물 쇄들, N-말단 또는 C-말단 끝의 처리, 아미노산 백본에 대한 화학적 물질들의 부착, N-연결형 또는 O-연결형 탄수화물 쇄들의 화학적 변형, 및, 무핵 숙주 세포 발현의 결과로서 N-말단 메티오닌 잔기의 부가 및 결실을 포함한다. 게다가, 조절물질들은 조절물질의 검출 및 분리를 위해, 효소성, 형광성, 방사성동위원소성 또는 친화성 표지와 같은 검출가능한 표지에 의해 변형될 수도 있다.
VII. 조절물질 특성들
얻은 방법이 무엇이든, 또는 상기 형태들 중 조절물질이 어떤 형태를 취했는지와 무관하게, 본 조절물질들의 다양한 실시형태들이 특정 특성들을 나타낼 수 있다. 선택된 실시형태에서, 항체-생성 세포(예를 들면, 하이브리도마 또는 이스트 콜로니)들은 강한 성장, 높은 조절물질 생산력 및 하기에 상술된 바와 같이, 바람직한 조절물질 특성들을 포함하는 바람직한 특성들을 위해, 선택, 클로닝 및 추가 선별될 수 있다. 다른 경우, 조절물질의 특성들은 동물의 접종을 위한 표적 항원의 면역반응 단편 또는 특정 항원(예를 들면, 특정 DLL3 아이소형)을 선택함으로써 부여받거나 또는 영향을 받을 수 있다. 또다른 실시형태에서, 선택된 조절물질들은 친화력 또는 약동학과 같은 면역화학적 특성들을 개선 또는 개량하기 위해 상기와 같이 조작될 수 있다.
A. 중화 조절물질들
특정 실시형태에서, 조절물질은 "중화" 항체들 또는 이들의 유도체들 또는 단편들을 포함할 것이다. 즉, 본 발명은 특정 도메인들, 모티프들 또는 에피토프들을 결합하고, 및 DLL3의 생물학적 활성을 차단, 감소 또는 억제할 수 있는 항체 분자들을 포함할 수 있다. 일반적으로, 용어 "중화 항체"는 표적 분자 또는 리간드에 결합하거나 상호반응하고, 수용체 또는 기질과 같은 결합 파트너에 표적 분자의 결합 또는 회합을 방해함으로써, 분자들의 상호반응으로부터 얻어지는 생물학적 반응을 방해하는 항체를 의미한다.
당 분야에 공지된 경쟁적 결합 분석법은 항체 또는 면역기능 단편 또는 그의 유도체의 결합 및 특이성을 평가하기 위해 사용될 수 있음을 알 것이다. 본 발명과 관련하여, 항체 또는 단편은 노치 수용체 활성 또는 시험관내 경쟁적 결합 분석법에 의해 측정되는 바와 같이, 과량의 항체가 DLL3에 결합된 결합 파트너의 정량을 적어도 약 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% 또는 그 이상까지 감소시킬 때, 결합 파트너 또는 기질에 대한 DLL3의 결합을 억제 또는 감소시키기 위해 유지될 것이다. DLL3에 대한 항체들의 경우, 중화 항체 또는 길항제는 적어도 약 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 99% 또는 그 이상까지 노치 수용체 활성을 바람직하게 변경시킬 것이다. 이 변형된 활성은 당 분야에 공지된 기술들을 사용하여 직접 측정될 수 있거나 충격에 의해 측정될 수 있고, 변형된 활성이 하류영역 (예를 들면, 종양형성, 세포생존 또는 노치 반응성 유전자들의 활성화 또는 억제)을 갖는 것을 알 것이다. 바람직하게는, DLL3 활성을 중화할 수 있는 항체의 능력은 노치 수용체에 대한 DLL3 결합을 억제함으로써, 또는 노치 신호전달의 DLL3 매개 억압을 완화시킬 수 있는 능력을 평가함으로써 평가된다.
B. 내재화 조절물질
발현된 DLL3 단백질의 실질적인 부분은 발암세포 표면과 회합함으로써, 본 조절물질을 국소화 및 내재화시킨다는 증거가 있다. 바람직한 실시형태에서, 상기 조절물질들은 내재화시에 세포를 살해하는 세포독성 물질들과 같은 항암제들과 회합 또는 접합될 수 있다. 특히 바람직한 실시형태에서, 조절물질은 내재화 항체 약물 접합체를 포함할 것이다.
본 명세서에 사용된 바와 같이 "내재화하는" 조절물질은 회합된 항원 또는 수용체에 결합할 때 세포에 의해 (어떤 적재물과 함께) 흡수되는 물질이다. 잘 평가되고 있는 바와 같이, 내재화 조절물질은 바람직한 실시형태에서, 항체 접합체뿐만 아니라 항체 단편들 및 이들의 유도체들을 포함하는 항체를 포함한다. 내재화는 시험관내 또는 생체내에서 일어날 수 있다. 치료적 용도를 위해, 필요로 하는 대상의 생체내에서 내재화가 바람직하게 일어날 것이다. 내재화된 항체 분자들의 수는 항원-발현 세포, 특히 항원-발현 암 줄기세포를 죽이기에 충분하거나 적당할 수 있다. 어떤 경우, 항체 또는 항체 접합체의 효능에 따라, 항체가 결합하는 표적 세포를 죽이기 위해 세포로 단일 항체분자가 흡수되면 충분하다. 예를 들면, 특정 독소들은 매우 높은 강해서, 항체에 접합된 독소의 적은 분자들의 내재화가 종양세포를 죽이기에 충분하다. 포유동물 세포에 결합할 때 항체가 내재화하는지의 여부는 하기 실시예에 설명된 것을 포함한 다양한 분석법들에 의해 측정될 수 있다 (예를 들면, 실시예 12 및 15-17). 항체가 세포로 내재화하는지의 여부를 측정하는 방법은 미국특허 제7,619,068호에 설명되어 있으며, 이는 본원에 전부 참조로 반영된다.
C. 고갈화 조절물질들
다른 실시형태에서, 항체들은 고갈화 항체들 또는 이들의 유도체들 또는 단편들을 포함할 것이다. 용어 "고갈화" 항체는 세포표면 상에서 또는 부근에서 항원과 결합 또는 회합하는 항체를 의미하며, (예를 들면, 세포독성제의 CDC, ADCC 또는 도입에 의한) 세포의 사망 또는 제거를 유도, 촉진 또는 유발한다. 어떤 실시형태에서, 선택된 고갈화 항체들은 세포독성제에 회합 또는 접합될 것이다.
바람직하게, 고갈화 항체는 정해진 세포개체군내 DLL3 종양형성 세포들의 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, 97%, 또는 99%를 제거, 무력화, 제거 또는 살해할 수 있을 것이다. 어떤 실시형태에서, 세포 개체군은 증대된, 절개된, 정제된 또는 단리된 종양 영속화 세포들을 포함할 수 있다. 다른 실시형태에서, 세포 개체군은 종양 영속화 세포들을 포함하는 이질성 종양추출물 또는 전체 종양 샘플들을 포함할 수 있다. 당업자들은 하기 실시예 (예를 들면, 실시예 13 및 14)에 설명된 표준 생화학 기술들이 본 명세서에 설명된 내용에 따라 종양형성세포들 도는 종양영속화 세포들의 고갈화를 모니터링하고 정량화하는데 사용될 수 있음을 알 것이다.
D. 빈화(binning) 및 에피토프 결합
본 명세서에 개시된 항-DLL3 항체 조절물질들이 선택된 표적 또는 이들의 단편에 의해 제공된 별도의 에피토프 또는 면역성 결정인자들과 회합하거나 결합할 것을 추가로 알 것이다. 특정 실시형태에서, 에피토프 또는 면역성 결정인자들은 아미노산, 당 측쇄, 포스포릴기 또는 설포닐기와 같은 분자들의 화학적으로 활성인 표면 배치들을 포함하며, 특정 실시형태에서, 특정 3차원 구조적 특성들 및/또는 특정 전하 특성들을 가질 수 있다. 따라서, 본 명세서에 사용된 바와 같이, 용어 "에피토프"는 면역글로불린 또는 T-세포 수용체와 특이적으로 결합하거나, 그렇지 않으면 분자와 상호작용할 수 있는 단백질 결정인자를 포함한다. 특정 실시형태에서, 항체는 단백질 및/또는 거대분자들의 접합 혼합물에서 그의 표적 항원을 우선적으로 인지할때, 항원과 특이적으로 결합(또는 면역특이적으로 결합 또는 반응)하는 것이라고 한다. 바람직한 실시형태에서, 항체는 평형해리상수(KD)가 10-6M 이하 또는 10-7M 이하일 때, 보다 바람직하게 평형해리상수가 10-8M 이하 및 보다 더 바람직하게 10-9M 이하일 때 항원과 특이적으로 결합한다고 한다.
보다 직접적으로, 용어 "에피토프"는 일반적인 생화학적 의미로 사용되며, 특정 항체 조절물질에 의해 인지되고, 특이적으로 결합될 수 있는 표적 항원의 일부를 의미한다. 항원이 DLL3과 같은 폴리펩타이드일 때, 에피토프들은 인접한 아미노산 및 단백질의 삼차 폴딩(folding)에 의해 병치된 비인접한 아미노산들 둘 다로부터 일반적으로 형성될 수 있다("입체구조적 에피토프"). 상기 입체구조적 에피토프에서, 상호반응의 지점은 서로로부터 선형으로 단리된 단백질 상에 아미노산 잔기들을 지나 일어난다. (때로는 "선형" 또는 "연속성" 에피토프라고도 하는) 인접한 아미노산들로부터 형성된 에피토프들은 일반적으로 단백질 변성시에 보유되는 반면, 삼차 폴딩에 의해 형성된 에피토프들은 단백질 변성시에 일반적으로 손실된다. 어느 경우에나, 항체 에피토프는 일반적으로 특별한 공간적인 구조내에 적어도 3개, 및 보다 일반적으로 적어도 5개 또는 8개 내지 10개의 아미노산들을 포함한다.
이러한 측면에서, 특정 실시형태에서 에피토프가 DLL3 단백질의 1개 이상의 영역들, 도메인들 또는 모티프들 (예를 들면, 아이소형 1의 아미노산 1-618)과 회합될 수 있다. 본 명세서에 상술된 바와 같이, DLL3 단백질의 세포외 영역은 6개의 EGF-유사 도메인들 및 DSL 도메인을 포함하는 일련의 일반적으로 인지된 도메인들을 포함한다. 본 명세서의 목적을 위해, 용어 "도메인"은 일반적으로 허용된 의미로 사용될 것이며, 독특한 2차 구조 내용물을 나타내는 단백질내 인식가능한 또는 정의할 수 있는 보존된 구조적 실체를 의미할 것이다. 많은 경우, 일반적인 기능을 갖는 상동 도메인들은 일반적으로 서열 유사성을 나타내며, 여러 이질적인 단백질(예를 들면, EGF-유사 도메인은 보고에 따르면 적어도 471개의 다른 단백질들에서 발견됨)들에서 발견될 것이다. 이와 유사하게, 당 분야에 인지된 용어 "모티프"는 그의 일반적인 의미에 따라 사용될 것이며, 보통 10 내지 20개의 인접한 아미노산 잔기들인 단백질의 짧은 보존된 영역을 의미할 것이다. 전체적으로 논의된 바와 같이, 선택된 실시형태들은 DLL3의 특정 영역, 도메인 또는 모티프들내 에피토프와 회합 또는 결합하는 조절물질들을 포함한다.
어느 경우에나 항원 상의 목적하는 에피토프가 결정되면, 본 발명에 설명된 기술들을 사용하여 에피토프를 포함하는 펩타이드에 의해 면역화함으로써, 에피토프에 대한 항체를 생성시킬 수 있다. 선택적으로, 발견과정 중에, 항체들의 생성 및 특성평가는 특정 도메인 또는 모티프내에 위치된 바람직한 에피토프들에 대한 정보를 설명할 수 있다. 이 정보로부터, 동일한 에피토프에 대하여 결합하기 위한 항체들을 경쟁적으로 선별할 수 있다. 이를 달성하기 위한 접근법은 서로 경쟁적으로 결합하는 항체들, 즉 항원에 결합하기 위해 경쟁하는 항체들을 발견하기 위한 경쟁 연구를 진행하는 것이다. 교차-경쟁에 근거한 항체들을 빈화하기 위한 고성능 방법은 WO 03/48731에 설명되어 있다. 이스트 상의 항원단편 발현 또는 조절물질 경쟁을 포함하는 에피토프 맵핑 또는 빈화 또는 도메인 수준의 다른 방법들은 하기 실시예 9 및 10에 개시되어 있다.
본 명세서에 사용된 바와 같이, 용어 "빈화"은 그들의 항원결합 특성 및 경쟁에 기초하여 항체들을 그룹화 또는 분류하는데 사용된 방법들을 의미한다. 이 기술들이 본 발명의 조절물질들을 정의하고 범주화하기 위해 사용가능한 반면, 빈들은 에피토프들과 항상 직접 서로 연관되어 있지 않으며, 에피토프 결합의 상기 초기 결정들은 본 명세서에 기술된 다른 분야-인지된 방법론에 의해 추가로 개선 및 확인될 수 있다. 그러나, 하기 실시예에 설명 및 도시된 바와 같이, 각 빈들에 대한 항체 조절물질들의 경험적 할당은 본 조절물질들의 치료적 잠재력의 지표가 될 수 있는 정보를 제공한다.
보다 구체적으로는, 당 분야에 공지되고, 하기 실시예에 개시된 방법들을 사용하여, 선택된 기준 항체 (또는 그의 단편)가 2차 시험 항체와 결합하기 위해 동일한 에피토프에 결합하는지 또는 교차 경쟁하는지의 여부를 측정할 수 있다. 한 실시형태에서, 기준 항체는 포화 조건하에 DLL3 항원과 회합되며, DLL3에 결합할 수 있는 2차 또는 시험 항체 조절물질의 능력은 표준 면역화학 기술들을 사용하여 측정된다. 시험 항체가 기준의 항-DLL3 항체와 동시에 DLL3에 실질적으로 결합할 수 있다면, 그후 2차 또는 시험 항체는 1차 또는 기준 항체와 다른 에피토프에 결합한다. 그러나, 시험 항체가 DLL3과 실질적으로 동시에 결합할 수 없다면, 그후 시험 항체는 동일한 에피토프, 오버랩핑 에피토프, 또는 1차 항체에 의해 결합된 에피토프에 (적어도 입체구조적으로) 매우 가까운 에피토프와 결합한다. 즉, 시험 항체는 항원결합을 위해 경쟁하며, 기준 항체로서 동일한 빈에 있다.
용어 "경쟁하다" 또는 "경쟁 항체"는 본 조절물질의 맥락에 사용될 때, 시험에서 시험 항체 또는 면역기능 단편이 일반적인 항원에 대한 기준 항체의 특이적 결합을 방해 또는 억제하는, 분석법에 의해 측정된, 항체들 사이의 경쟁을 의미한다. 일반적으로, 상기 분석법은 비표지된 시험 면역글로불린 및 표지된 기준 면역글로불린 중 하나를 함유하는 고체 표면 또는 세포들에 결합된 정제 항원 (예를 들면, DLL3 또는 도메인 또는 이들의 단편)을 포함한다. 경쟁적 억제는 시험 면역글로불린의 존재하에서 고체 표면 또는 세포들에 결합된 표지의 양을 결정함으로써 측정된다. 일반적으로, 시험 면역글로불린은 과량으로 존재하고/하거나 첫번째로 결합된다. 경쟁 분석법(경쟁 항체들)에 의해 확인된 항체들은 발생할 입체 장해를 위해 기준 항체에 의해 결합된 에피토프에 충분히 근접한 인접 에피토프에 결합하는 기준 항체 및 항체들로서 동일한 에피토프에 결합하는 항체들을 포함한다. 경쟁적 결합을 측정하기 위한 방법과 관련된 추가의 상세한 설명들은 하기 실시예에 제공되어 있다. 보통, 경쟁하는 항체가 과량 존재할 때, 일반적인 항원에 대한 기준 항체의 특이적 결합을 적어도 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% 또는 75%까지 억제할 것이다.
역으로, 기준 항체가 결합될 때, 이후에 첨가된 시험 항체 (즉, DLL3 항조절물질)의 결합을 적어도 30%, 40%, 45%, 50%, 55%, 60%, 65%, 70% 또는 75%까지 억제할 것이다. 일부 경우, 시험 항체의 결합은 적어도 80%, 85%, 90%, 95%, 또는 97%, 또는 그 이상까지 억제된다.
본 발명과 관련하여, 그리고 하기 실시에 9 및 10에 개시된 바와 같이, DLL3의 세포외 도메인이 일명 "빈 A" 내지 "빈 I"의 경쟁적 결합에 의해 적어도 9개의 빈들을 정의함을 (표면 플라즈몬 공명 또는 바이오-층 간섭분석법을 통해) 결정할 수 있었다. 조절물질 빈화 기술들에 의해 제공된 해결을 고려해볼 때, 상기 9개의 빈들은 DLL3 단백질의 세포외 영역내에 존재하는 대다수의 빈들을 포함한다고 믿어진다.
이런 측면에서, 그리고 당 분야에 알려진 바와 같이, 및 하기 실시에에 설명된 바와 같이, 원하는 빈화 또는 경쟁적 빈화 데이터는 고체상 직접적 또는 간접적 방사면역분석법(RIA), 고체상 직접 또는 간접 효소 면역분석법(EIA 또는 ELISA), 샌드위치 경쟁분석법, Biacore™ 2000 시스템(즉 표면 플라즈몬 공명-GE Healthcare), ForteBio® 분석기(즉, 바이오-층 간섭분석법-ForteBio, Inc.) 또는 유동 세포측정방법을 사용하여 얻어질 수 있다. 본 명세서에 사용된 용어 "표면 플라즈몬 공명"은 본 명세서에 사용된 바와 같이, 바이오센서 매트릭스내 단백질 농도 변화를 검출함으로써, 실시간 특이적 상호반응을 분석하기 위한 시각현상을 의미한다. 용어 "바이오-층 간섭분석법"은 바이오센서 팁 상의 고정단백질 층 및 내부 참조층의 두 층들로부터 반사된 백색 광의 간섭 패턴을 분석하는 시각적 분석기술을 의미한다. 바이오센서 팁에 결합된 여러 분자들의 변화는 실시간 측정될 수 있는 간섭 패턴의 이동을 야기한다. 특히 바람직한 실시형태에서, 분석(표면 플라즈몬 공명, 바이오-층 간섭분석법 또는 유동 세포측정법)은 하기 실시예에 입증된 바와 같이 Biacore 또는 ForteBio 장비 또는 유동 세포측정기(예를 들면, FACSAria II)를 사용하여 수행된다.
개시된 DLL3 항체 조절물질이 회합하거나 결합하는 에피토프를 추가로 특성평가하기 위해, 도메인-수준 에피토프 맵핑은 Cochran et al. (J Immunol Methods. 287 (1-2):147-158 (2004) (참조로 본원에 반영됨)에 의해 기술된 프로토콜의 변형을 사용하여 수행되었다. 간단히, 특정 아미노산 서열들을 포함하는 DLL3의 각 도메인들은 이스트 표면상에서 발현되었으며, 유동 세포측정법을 통해 각 DLL3 항체에 의한 결합이 측정되었다. 결과는 하기 실시예 10에 논의되어 있으며, 도 14a 및 도 14b에 도시되어 있다.
다른 적합한 에피토프 맵핑 기술들은 알라닌 스캐닝 돌연변이, 펩타이드 블롯(Reineke (2004) Methods Mol Biol 248:443-63) (전부 본원에 참조로 반영됨), 또는 펩타이드 제거분석법을 포함한다. 그리고, 상기 에피토프 적출, 에피토프 추출 및 항원의 화학적 변형과 같은 방법들이 사용될 수 있다 (Tomer (2000) Protein Science 9: 487-496) (전부 본원에 참조로 반영된다). 다른 실시형태에서, 항원구조-계 항체 프로파일링(ASAP)이라고도 알려져 있는 변형-보조 프로파일링(MAP)은, 화학적으로 또는 효소적으로 변형된 항원 표면들에 대한 각 항체의 결합 프로필의 유사성에 따라 동일한 항원에 대한 다수의 모노클론성 항체(mAb)들을 카테고리화하는 방법을 제공한다 (미국특허 2004/0101920, 전부 본원에 참조로 반영된다). 각 카테고리는 다른 카테고리에 의해 나타낸 에피토프와 뚜렷하게 상이하거나, 또는 부분적으로 오버랩핑된 것을 반영할 수 있다. 이 기술은 유전적으로 동일한 항체들을 급속하게 여과시켜서, 특성평가가 유전적으로 구별되는 항체들 상에서 집중될 수 있다. MAP가 본 발명의 hDLL3 항체 조절물질들을 다른 에피토프들을 결합하는 항체들의 그룹들로 분류하는데 사용될 수 있음을 알 것이다.
고정된 항원의 구조를 변경시키기 위해 사용가능한 제제들은 단백질분해 효소 (예를 들면, 트립신, 엔도프로테이나제 Glu-C, 엔도프로테이나제 Asp-N, 카이모트립신 등)와 같은 효소들을 포함한다. 고정된 항원의 구조를 변경시키기 위해 사용가능한 제제들은 화학작용제, 예를 들면 숙신이미딜 에스테르 및 이들의 유도체, 1차 아민-함유 화합물, 하이드라진 및 카르보하이드라진, 자유 아미노산 등일 수 있다.
항원 단백질은 바이오센서 칩 표면 또는 폴리스티렌 비드 상에서 고정될 수 있다. 후자는 예를 들면 멀티플렉스 LUMINEX™ 검출 분석법(Luminex Corp.)과 같은 분석법으로 처리될 수 있다. 100개 이하의 다른 종류의 비드들에 의해 멀티플렉스 분석을 취급할 수 있는 LUMINEX의 용량때문에, LUMINEX는 다양하게 변형된 거의 무제한의 항원표면을 제공하여, 바이오센터 분석 동안 항체 에피토프 프로파일링에서 개선된 해결을 얻는다.
A. 조절물질 결합 특성들
에피토프 특이성 외에, 본 항체는 예를 들면, 결합 친화도와 같은 물리적 특성들을 사용하여 특성평가될 수 있다. 이와 관련하여, 본 발명은 1개 이상의 DLL3 아이소형들, 또는 범-항체의 경우, 1개 이상의 DLL 패밀리 멤버에 대한 높은 결합친화력을 갖는 항체들을 사용하는 것을 추가로 포함한다.
본 명세서에 사용된 용어 "KD"는 특정 항체-항원 상호반응의 해리상수를 의미하는 것으로 간주된다. 본 발명의 항체는 해리상수 KD (koff/kon)가 10-7M 이하일 때 그의 표적 항원에 면역특이적으로 결합한다고 한다. 항체는 KD가 5x10-9M 이하일 때 항원과 높은 친화력으로, 및 KD가 5x10-10M 이하일 때 더 높은 친화력으로 특이적으로 결합한다. 본 발명의 한 실시형태에서, 항체는 10-9M 이하의 KD 및 약 1x10-4/sec의 해리-속도를 갖는다. 본 발명의 한 실시형태에서, 해리-속도는 1x10-5/sec 미만이다. 본 발명의 다른 실시형태에서, 항체는 약 10-7M 내지 10-10M의 KD를 갖는 DLL3에 결합할 것이며, 또다른 실시형태에서, 2x10-10M 이하의 KD를 갖는 DLL3과 결합할 것이다. 본 발명의 또다른 선택된 실시형태들은 10-2M 미만, 5x10-2M 미만, 10-3M 미만, 5x10-3M 미만, 10-4M 미만, 5x10-4M 미만, 10-5M 미만, 5x10-5M 미만, 10-6M 미만, 5x10-6M 미만, 10-7M 미만, 5x10-7M 미만, 10-8M 미만, 5x10-8M 미만, 10-9M 미만, 5x10-9M 미만, 10-10M 미만, 5x10-10M 미만, 10-11M 미만, 5x10-11M 미만, 10-12M 미만, 5x10-12M 미만, 10-13M 미만, 5x10-13M 미만, 10-14M 미만, 5x10-14M 미만, 10-15M 미만 또는 5x10-15M 미만의 해리 상수 또는 KD (koff/kon)를 갖는 항체들을 포함한다.
특정 실시형태에서, DLL3과 면역특이적으로 결합하는 본 발명의 항체는 해리 속도 상수 또는 적어도 105M-ls-l, 적어도 2x105M-ls-l, 적어도 5x105M-ls-l, 적어도 106M-ls-l, 적어도 5x106M-ls-l, 적어도 107M-ls-l, 적어도 5x107M-ls-l, 또는 적어도 108M-ls-l 의 k on (또는 k a) 속도 (DLL3 (Ab) + 항원 (Ag)k on←Ab-Ag)를 갖는다.
다른 실시형태에서, DLL3와 면역특이적으로 결합하는 본 발명의 항체는 해리 속도 상수 또는 l0-ls- l 미만, 5xl0-ls- l 미만, l0-2s- l 미만, 5xl0-2s- l 미만, l0-3s- l 미만, 5xl0-3s- l 미만, l0-4s- l 미만, 5xl0-4s- l 미만, l0-5s- l 미만, 5xl0-5s- l 미만, l0-6s- l 미만, 5xl0-6s- l 미만, l0-7s- l 미만, 5xl0-7s- l 미만, l0-8s- l 미만, 5xl0-8s- l 미만, l0-9s- l 미만, 5xl0-9s- l 미만 또는 l0-10s- l 미만의 k off (또는 k d) 속도 (DLL3 (Ab) + 항원 (Ag)k off←Ab-Ag)를 갖는다.
본 발명의 다른 선택된 실시형태에서, 항-DLL3 항체들은 친화력 상수 또는 적어도 102M-1, 적어도 5x102M-1, 적어도 103M-1, 적어도 5x103M-1, 적어도 104M-1, 적어도 5x104M-1, 적어도 105M-1, 적어도 5x105M-1, 적어도 106M-1, 적어도 5x106M-1, 적어도 107M-1, 적어도 5x107M-1, 적어도 108M-1, 적어도 5x108M-1, 적어도 109M-1, 적어도 5x109M-1, 적어도 1010M-1, 적어도 5x1010M-1, 적어도 1011M-1, 적어도 5x1011M-1, 적어도 1012M-1, 적어도 5x1012M-1, 적어도 1013M-1, 적어도 5x1013M-1, 적어도 1014M-1, 적어도 5x1014M-1, 적어도 1015M-1 또는 적어도 5x1015M-1의 Ka (kon/koff)를 가질 것이다.
상기 조절물질 특성들 외에, 본 발명의 항체들은 예를 들면 열 안정성 (즉, 용융 온도; Tm) 및 등전점을 포함하는 또다른 물리적 특성들을 사용하여 추가로 특성평가될 수 있다 (예를 들면, Bjellqvist et al., 1993, Electrophoresis 14:1023; Vermeer et al., 2000, Biophys. J. 78:394-404; Vermeer et al., 2000, Biophys. J. 79: 2150-2154 참조하며, 이들 각각은 전부 본원에 참조로 반영된다).
VIII
. 접합 조절물질들
A.
개관
본 발명의 조절물질이 본 발명의 내용에 따라 생성 및/또는 제조, 및 선택되면, 이들은 약리학적으로 활성이거나 진단용 물질 또는 생체적합한 변형제들과 연결되거나, 융합되거나, 접합되거나 (예를 들면, 공유결합 또는 비공유결합) 또는 그렇지 않으면 회합될 수 있다. 본 명세서에 사용된 용어 "접합체" 또는 "조절물질 접합체" 또는 "항체 접합체"는 광범위하게 사용될 것이며, 회합 방법과 무관하게 본 조절물질들과 회합된 생물학적으로 활성인 또는 검출가능한 분자 또는 약물을 의미할 것이다. 본 측면에서, 상기 접합체들은 본 조절물질들에 더해, 펩타이드, 폴리펩타이드, 단백질, 생체내 활성제로 대사작용되는 전구약물, 폴리머, 핵산분자들, 소분자들, 결합제, 모방제, 합성 약물, 무기 분자들, 유기 분자들 및 방사성동위원소들을 포함할 수 있다고 이해될 것이다. 게다가, 상기 설명한 바와 같이, 선택된 접합체는 조절물질과 공유 또는 비공유 회합되거나, 연결되고, 접합을 실시하는데 사용되는 방법에 적어도 부분적으로 의존하여, 다양한 화학정량관계학적 몰비율을 나타낼 수 있다.
본 발명의 특히 바람직한 면들은 증식성 질환들의 진단 및/또는 치료에 사용될 수 있는 항체 조절물질 접합체 또는 항체-약물 접합체를 포함한다. 명세서에 명시되어 있지 않는한, 용어 "항체-약물 접합체" 또는 "ADC" 또는 화학식 M-[L-D]n 은 치료물질 및 진단물질을 모두 포함하는 접합체를 의미하는 것으로 이해될 것이다. 상기 실시형태에서, 항체-약물 접합체 화합물은 조절물질 또는 세포결합단위 (본원에서는 CBA, M, 또는 Ab로 약칭함)로서 DLL3 조절물질 (일반적으로 항-DLL3 항체), 치료제 (예를 들면, 항암제) 또는 진단 물질(D), 및 선택적으로 약물 및 항원결합제와 결합하는 링커(L)를 포함할 것이다. 본 발명의 목적을 위해, "n"은 1 내지 20의 정수를 의미한다. 바람직한 실시예에서, 조절물질은 상기 설명한 바와 같이 중쇄 가변 영역 및 경쇄 가변 영역으로부터 적어도 하나의 CDR을 포함하는 DLL3 mAb이다.
당업자들은 결합제에 대한 치료 또는 진단 물질들 및/또는 링커들을 부착 또는 회합하기 위해 많은 다른 반응들이 사용될 수 있음을 알 것이다. 선택된 실시형태에서, 이는 결합제의 아미노산 잔기들, 예를 들면 라이신의 아민기, 글루탐산 및 아스파르트산의 자유 카르복시산, 시스테인의 설프하이드릴기 및 방향족 아미노산의 여러 물질들을 포함하는 항체 분자의 반응에 의해 수행될 수 있다. 공유 부착의 가장 일반적으로 사용되는 비-특이적 방법들 중 하나는 항체의 아미노(또는 카르복시)기에 카르복시(또는 아미노)기를 연결시키기 위한 카르보다이이미드 반응이다. 또한, 다이알데하이드 또는 이미도에스테르와 같은 이중기능(bifunctional) 작용제들은 항체분자의 아미노기에 화합물의 아미노기를 연결하기 위해 사용되어 왔다. 또한, 결합제에 약물을 부착하기 위해, 쉬프(Schiff) 염기 반응이 사용될 수 있다. 이 방법은 결합제와 반응되는 알데하이드를 형성시키는, 글라이콜 또는 하이드록시기를 함유하는 약물의 과요오드산염 산화반응을 포함한다. 부착반응은 결합제의 아미노기에 의해 쉬프 염기를 형성시킴으로써 일어난다. 아이소티오사이아네이트 및 아즐락톤은 결합제들에 약물을 공유결합하기 위한 결합제로서 사용될 수도 있다.
다른 실시형태에서, 본 발명의 개시된 조절물질들은 선택된 특징들을 부여하는 단백질, 폴리펩타이드 또는 펩타이드 (예를 들면, 바이오독소, 바이오마커, 정제 태그 등)와 접합 또는 회합될 수 있다. 어떤 바람직한 실시형태에서, 본 발명은 이종 단백질 또는 펩타이드에 재조합 융합 또는 화학적으로 접합된 (공유 및 비공유 접합 포함) 조절물질 또는 그의 단편들을 포함하며, 상기 단백질 또는 펩타이드는 적어도 10, 적어도 20, 적어도 30, 적어도 40, 적어도 50, 적어도 60, 적어도 70, 적어도 80, 적어도 90 또는 적어도 100개의 아미노산들을 포함한다. 작제물은 반드시 직접 연결될 필요는 없지만, 아미노산 링커 서열들을 통해 일어날 수 있다. 예를 들면, 항체들은 2중특이성 작제물을 제공하기 위해, 특정 세포표면 수용체에 대하여 특이적인 항체에 본 발명의 조절물질들을 융합 또는 접합함으로써 시험관내 또는 생체내에서 DLL3을 발현하는 특정 세포타입에 이종 폴리펩타이드를 표적화하기 위해 사용될 수 있다. 게다가, 이종 폴리펩타이드에 융합 또는 접합된 조절물질들은 시험관내 면역분석법에 사용될 수도 있으며, 당 분야에 알려져 있는 바와 같이 정제 방법론 (예를 들면, his-태그들)과 특히 호환될 수 있다. 예를 들면, 국제공보 제WO 93/21232호; 유럽특허 EP 439,095; Naramura et al., 1994, Immunol. Lett. 39:91-99; 미국특허 제5,474,981호; Gillies et al., 1992, PNAS 89:1428-1432; 및 Fell et al., 1991, J. Immunol. 146:2446-2452를 참조한다.
B. 링커
상기 펩타이드 링커들 또는 스페이서들 외에, 다수의 다른 변이형들 또는 링커들 종류들이 약리활성 또는 진단 물질들 또는 생체적합 조절물질들과 융합하는데 사용될 수 있음을 이해할 수 있을 것이다. 어떤 실시형태에서, 링커는 세포내 조건하에서 분열될 수 있어서, 링커 분열이 세포내 환경에서 항체로부터 약물 단위를 방출시킨다. 또다른 실시형태에서, 링커 단위는 분열될 수 없으며, 예를 들면 항체 분해에 의해 약물이 방출된다.
ADC의 링커들은 바람직하게 세포외적으로 안정적이며, ADC 분자들의 응집을 막고, 수성 매질 및 모노머 상태에서 ADC가 자유롭게 가용성이도록 유지해준다. 세포로 수송 또는 전달하기 전에, 항체-약물 접합체(ADC)는 바람직하게 안정적이며, 온전하게 남아 있으며, 즉 항체가 약물 물질에 결합된 상태로 있다. 링커들은 표적 세포 외부에서 안정적이며, 세포내에서 일부 유효비율로 제거될 수 있다. 효과적인 링커는 (i) 항체의 특이결합 특성들을 유지하며; (ii) 접합체 또는 약물 물질을 세포내로 전달시키고; (iii) 접합체가 그의 표적 영역으로 전달 또는 수송될 때까지 안정적이고 온전하며, 즉 분열되지 않으며; 및 (iv) PBD 약물 물질의 세포독성, 세포-살해 효과 또는 세포분열억제 효과를 유지할 것이다. ADC의 안정성은 질량분석법, HPLC 및 분리/분석 기술 LC/MS와 같은 표준 분석기술들에 의해 측정될 수 있다. 항체 및 약물 물질의 공유결합은 2개의 반응성 작용기들을 갖기 위해, 즉 반응성 반응에서 2가를 갖기 위해, 링커를 필요로 한다. 펩타이드들, 핵산들, 약물들, 독소들, 항체들, 합텐들 및 리포터 기들과 같은 2개 이상의 작용성 또는 생물학적 활성 물질들을 결합하기 위해 사용가능한 2가 링커 시약들은 공지되어 있으며, 방법들은 그들의 결과 접합체들을 설명하고 있다 (Hermanson, G.T. (1996) Bioconjugate Techniques; Academic Press: New York, p 234-242).
이 때문에, 본 발명의 어떤 실시형태는 세포내 환경 (예를 들면, 리소좀 또는 엔도솜 또는 포낭내)에 존재하는 절단제에 의해 절단가능한 링커를 사용하는 것을 포함한다. 링커는 리소좀 또는 엔도솜 프로테아제를 포함하나, 여기에 한정되지 않는 세포내 펩티다제 또는 프로테아제 효소에 의해 절단되는, 예를 들면 펩타이딜 링커일 수 있다. 어떤 실시형태에서, 펩타이딜 링커는 적어도 2개의 아미노산 또는 적어도 3개의 아미노산 길이이다. 절단제는 카텝신 B 및 D 및 플라스킨을 포함할 수 있으며, 이들 각각은 표적 세포들 안으로 활성 약물을 방출시키는, 다이펩타이드 약물 유도체들을 가수분해하는 것으로 알려져 있다. 카텝신-B는 암조직에서 많이 발현되는 것으로 밝혀져 있으므로, 티올-의존성 프로테아제 카텝신-B에 의해 절단가능한 예시적인 펩타이딜 링커들은 Phe-Leu를 포함하는 펩타이드이다. 상기 링커들의 다른 예들은 미국특허 제6,214,345호 및 미국특허 제2012/0078028호에 설명되어 있으며, 이들 각각은 전부 참조로 본원에 반영되어 있다. 특히 바람직한 실시형태에서, 세포내 프로테아제에 의해 절단가능한 펩타이딜 링커는 미국특허 제6,214,345호에 설명되어 있는 바와 같은, Val-Cit 링커, Ala-Val 링커 또는 Phe-Lys 링커이다. 치료제의 세포내 단백질분해 방출을 사용하는 것의 한가지 잇점은 접합될 때 치료제가 일반적으로 약화되고, 접합체의 혈청 안정성이 일반적으로 높다는 점이다.
다른 실시형태에서, 절단성 링커는 pH-민감성이며, 즉 특정 pH 값에서 가수분해에 대하여 민감성이다. 일반적으로, pH-민감성 링커는 산성 조건하에 가수분해할 수 있다. 예를 들면, 리소좀에서 가수분해할 수 있는 산-불안정한 링커 (예를 들면, 하이드라존, 옥심, 세미카르바존, 티오세미카르바존, 시스-아코니트산 아미드, 오르토에스테르, 아세탈, 케탈 등)가 사용될 수 있다 (예를 들면, 미국특허 제5,122,368호; 제5,824,805호; 제5,622,929호). 상기 링커들은 혈액내 조건들과 같은, 중성의 pH 조건하에서 비교적 안정하지만, 리소좀의 pH와 비슷한, pH 5.5 또는 5.0 이하에서 불안정하다.
또다른 실시형태에서, 링커는 환원조건하에서 절단가능하다 (예를 들면, 다이설파이드 링커). 예를 들면, SATA(N-숙신이미딜-S-아세틸티오아세테이트), SPDP(N-숙신이미딜-3-(2-피리딜다이티오)프로피오네이트), SPDB(N-숙신이미딜-3-(2-피리딜다이티오)뷰티레이트) 및 SMPT(N-숙신이미딜-옥시카르보닐-알파-메틸-알파-(2-피리딜-다이티오)톨루엔)을 사용하여 형성될 수 있는 링커들을 포함하여, 다양한 다이설파이드 링커들이 당 분야에 공지되어 있다. 또다른 특정 실시형태에서, 링커는 말로네이트 링커 (Johnson et al., 1995, Anticancer Res. 15:1387-93), 말레이미도벤조일 링커 (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1299-1304), 또는 3′-N-아미드 유사체 (Lau et al., 1995, Bioorg-Med-Chem. 3(10):1305-12)이다. 또다른 실시형태에서, 링커 단위는 절단될 수 없으며, 항체 분해에 의해 약물이 방출된다. (모든 목적들을 위해, 전부 참조로본원에 반영되어 있는 미국 공보 제 2005/0238649호 참조).
특히, 바람직한 실시형태에서 (전부 참조로본원에 반영되어 있는 미국특허 제2011/0256157호에 개시되어 있음), 호환성 링커는 하기를 포함할 것이다:
구조식에서, 별표는 세포독성제에 부착된 지점을 가리키며, CBA는 세포결합제/조절물질이며, L1은 링커이며, A는 세포결합제에 L1을 연결하는 연결기이며, L2는 공유결합이거나, -OC(=O)-와 함께 자기-희생 링커를 형성하며, L1 또는 L2는 절단가능한 링커이다.
L1은 바람직하게는 절단가능한 링커이며, 절단을 위한 링커를 활성화시키기 위한 촉발제로서 언급될 수 있다.
존재하는 경우, L1 및 L2는 매우 다양할 수 있다. 상기 기들은 그들의 절단 특성들을 기준으로 선택되며, 이는 접합체가 전달되는 영역의 조건에 의해 지시될 수 있다. pH의 변화(예를 들면, 산 또는 염기 불안정), 온도 또는 조사 (예를 들면, 광불안정)에 의해 절단가능한 링커들도 또한 사용될 수 있지만, 효소들의 동작에 의해 절단되는 상기 링커들이 바람직하다. 환원 또는 산화 조건하에 절단가능한 링커들은 본 발명에서의 용도를 찾아볼 수 있다.
L1은 아미노산의 인접한 서열을 포함할 수 있다. 아미노산 서열은 효소절단을 위한 표적 기질이며, 이에 의해, N10 위치로부터 R10을 방출시킨다.
한 실시형태에서, L1은 효소의 동작에 의해 절단가능하다. 한 실시형태에서, 효소는 에스테라제 또는 펩티다제이다.
한 실시형태에서, L2가 존재하며, -C(=O)O-와 함께 자기-희생 링커를 형성한다. 한 실시형태에서, L2는 효소활성을 위한 기질이며, 이에 의해 N10 위치로부터 R10을 방출시킨다.
한 실시형태에서, L1은 효소 작용에 의해 절단가능하며, L2가 존재하고, 효소가 L1과 L2 사이의 결합을 절단한다.
L1 및 L2는 존재하는 경우, 하기로부터 선택된 결합에 의해 연결된다:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, 및 -NHC(=O)NH-.
L2에 연결하는 L1의 아미노기는 아미노산의 N-말단이거나, 아미노산 측쇄, 예를 들면, 라이신 아미노산 측쇄의 아미노기로부터 유도될 수 있다.
L2에 연결하는 L1의 카르복실이기는 아미노산의 C-말단이거나, 아미노산 측쇄, 예를 들면 글루탐산 아미노산 측쇄의 카르복실기로부터 유도될 수 있다.
L2에 연결하는 L1의 하이드록실기는 아미노산 측쇄, 예를 들면 세린 아미노산 측쇄의 하이드록실기로부터 유도될 수 있다.
용어 "아미노산 측쇄"는 (i) 본래 존재하는 아미노산, 예를 들면 알라닌, 아르기닌, 아스파라긴, 아스파르트산, 시스테인, 글루타민, 글루탐산, 글라이신, 히스티딘, 아이소루신, 루신, 라이신, 메티오닌, 페닐알라닌, 프롤린, 세린, 트레오닌, 트립토판, 타이로신 및 발린; (ii) 마이너 아미노산, 예를 들면 오르니틴 및 시트룰린; (iii) 본래 존재하는 아미노산의 불포화 아미노산, 베타-아미노산, 합성 유사체 및 유도체들; 및 (iv) 이들의 모든 거울상이성질체, 부분입체이성질체, 이성질체 풍부한, 동위원소 표지된 (예를 들면, 2H, 3H, 14C, 15N), 보호된 형태 및 라세믹 혼합물에서 발견되는 상기 기들을 포함한다.
한 실시형태에서, -C(=O)O- 및 L2는 함께 하기의 기를 형성한다:
상기 구조식에서, 별표는 약물에 대한 부착점 또는 세포독성제 위치를 나타내며, 물결선은 링커 L1에 대한 부착점을 나타내며, Y는 -N(H)-, -O-, -C(=O)N(H)- 또는 -C(=O)O- 이며, 및 n은 0 내지 3이다. 페닐렌 고리는 본 명세서에 설명된 1개, 2개 또는 3개의 치환체들에 의해 선택적으로 치환된다. 한 실시형태에서, 페닐렌기는 할로, NO2, R 또는 OR에 의해 선택적으로 치환된다.
한 실시형태에서, Y는 NH이다.
한 실시형태에서, n은 0 또는 1이다. 바람직하게는, n은 0이다.
Y가 NH이고, n이 0인 경우, 자기-희생 링커는 p-아미노벤질카르보닐 링커(PABC)로서 언급될 수 있다.
자기-희생 링커는 원격 영역이 활성화될 때, 보호된 화합물을 방출시킬 것이며, 하기에 나타낸 선을 따라 진행한다 (n=0인 경우):
상기 구조식에서, L*은 링커의 남은 영역의 활성화 형태이다. 상기 기들은 보호된 화합물로부터 활성화 영역을 분리하는 잇점을 가진다. 위에 설명한 바와 같이, 페닐렌기는 선택적으로 치환될 수 있다.
본 명세서에 설명된 한 실시형태에서, 기 L*은 본 명세서에 설명된 바와 같이 링커 L1이며, 이는 다이펩타이드기를 포함할 수 있다.
다른 실시형태에서, -C(=O)O- 및 L2는 하기로부터 선택되는 기를 함께 형성한다:
상기 구조식에서 별표, 물결선, Y 및 n은 상기 정의된 바와 같다. 각 페닐렌 고리는 본 명세서에 설명된 바와 같이, 1개, 2개 또는 3개의 치환체들에 의해 선택적으로 치환된다. 한 실시형태에서, Y 치환체를 갖는 페닐렌 고리는 선택적으로 치환되며, Y 치환체를 갖지 않는 페닐렌 고리는 치환되지 않는다. 한 실시형태에서, Y 치환체를 갖는 페닐렌 고리는 치환되지 않으며, Y 치환체를 갖지 않는 페닐렌 고리는 선택적으로 치환된다.
다른 실시형태에서, -C(=O)O- 및 L2는 함께 하기로부터 선택된 기를 형성한다:
상기 구조식에서, 별표, 물결선, Y 및 n은 상기 정의된 바와 같으며, E는 O, S 또는 NR이며, D는 N, CH 또는 CR이고, 및 F는 N, CH 또는 CR이다.
한 실시형태에서, D는 N이다.
한 실시형태에서, D는 CH이다.
한 실시형태에서, E는 O 또는 S이다.
한 실시형태에서, F는 CH이다.
바람직한 실시형태에서, 링커는 카텝신에 불안정한 링커이다.
한 실시형태에서, L1은 다이펩타이드를 포함한다. 다이펩타이드는 -NH-X1-X2-CO-를 나타내며, -NH- 및 -CO-는 아미노산 기 X1 및 X2의 N-말단 및 C-말단을 각각 나타낸다. 다이펩타이드내 아미노산은 천연 아미노산들의 조합일 수 있다. 링커가 카텝신에 불안정한 링커인 경우, 다이펩타이드는 카텝신-매개 절단을 위한 동작영역일 수 있다.
추가로, 카르복실 또는 아미노 측쇄 작용기, 예를 들면 Glu 및 Lys를 각각 갖는 상기 아미노산 기에 대하여, CO 및 NH는 측쇄 작용기를 나타낼 수 있다.
한 실시형태에서, 다이펩타이드내 기 -X1-X2-, -NH-X1-X2-CO-는 하기로부터 선택된다:
-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys-, -Val-Cit-, -Phe-Cit-, -Leu-Cit-, -Ile-Cit-, -Phe-Arg- 및 -Trp-Cit-, 여기에서 Cit는 시트룰린이다.
바람직하게는, 다이펩타이드내 기 -X1-X2-, -NH-X1-X2-CO-는 하기로부터 선택된다:
-Phe-Lys-, -Val-Ala-, -Val-Lys-, -Ala-Lys-, 및 -Val-Cit-.
가장 바람직하게는, 다이펩타이드내 기 -X1-X2-, -NH-X1-X2-CO-는 -Phe-Lys- 또는 -Val-Ala-이다.
다른 다이펩타이드 조합들도 사용될 수 있으며, Dubowchik et al., Bioconjugate Chemistry, 2002, 13,855-869에 설명된 것들을 포함하며, 이는 전부 참조로본원에 반영되어 있다.
한 실시형태에서, 적당한 곳에서 아미노산 측쇄가 유도된다. 예를 들면, 아미노산 측쇄의 아미노기 또는 카르복실기가 유도될 수 있다.
한 실시형태에서, 라이신과 같은 측쇄 아미노산의 아미노기 NH2는 NHR 및 NRR'로 구성된 그룹에서 선택된 유도된 형태이다.
한 실시형태에서, 아스파르트산과 같은 측쇄 아미노산의 카르복시기 COOH는 COOR, CONH2, CONHR 및 CONRR'로 구성된 그룹에서 선택되는 유도된 형태이다.
한 실시형태에서, 아미노산 측쇄는 적당한 곳에서 화학적으로 보호된다. 측쇄 보호기는 기 RL와 관련되어 이하에 논의된 기일 수 있다. 보호된 아미노산 서열은 효소에 의해 절단가능하다. 예를 들면, Boc 측쇄-보호된 Lys 잔기를 포함하는 다이펩타이드 서열이 카텝신에 의해 절단가능하다고 인정된다.
아미노산의 측쇄를 위한 보호기들은 당 분야에 잘 알려져 있으며, Novabiochem 카탈로그에 설명되어 있다. 추가의 보호기 전략들은 Protective Groups in Organic Synthesis, Greene and Wuts에 정리되어 있다.
가능한 측쇄 보호기들은 반응성 측쇄 작용기를 갖는 상기 아미노산들에 대하여 하기에 나타나 있다:
Arg: Z, Mtr, Tos;
Asn: Trt, Xan;
Asp: Bzl, t-Bu;
Cys: Acm, Bzl, Bzl-OMe, Bzl-Me, Trt;
Glu: Bzl, t-Bu;
Gln: Trt, Xan;
His: Boc, Dnp, Tos, Trt;
Lys: Boc, Z-Cl, Fmoc, Z, Alloc;
Ser: Bzl, TBDMS, TBDPS;
Thr: Bz;
Trp: Boc;
Tyr: Bzl, Z, Z-Br.
한 실시형태에서, 측쇄 보호는 존재하는 곳에서, 캡핑기로서 또는 캡핑기의 일부로서 제공되는 기에 대하여 직교로 선택된다. 따라서, 측쇄 보호기의 제거는 캡핑기, 또는 캡핑기의 일부인 보호기 작용기를 제거하지 않는다.
본 발명의 다른 실시형태에서, 선택된 아미노산들은 반응성 측쇄 작용기를 갖지 않는 것들이다. 예를 들면, 아미노산은 Ala, Gly, Ile, Leu, Met, Phe, Pro, 및 Val 로부터 선택될 수 있다.
한 실시형태에서, 다이펩타이드는 자기-희생 링커와 조합하여 사용된다. 자기-희생 링커는 -X2-에 연결될 수 있다.
자기-희생 링커가 존재하는 경우, -X2-는 자기-희생 링커에 직접 연결된다. 바람직하게는, 기 -X2-CO-는 Y에 연결되며, 여기에서 Y는 NH이며, 이에 의해 기 -X2-CO-NH-를 형성한다.
NH-X1-은 A에 직접 연결된다. A는 작용기 -CO-를 포함함으로써, -X1-과 아미드를 형성할 수 있다.
한 실시형태에서, L1 및 L2는 -OC(=O)-와 함께, 기 NH-X1-X2-CO-PABC-를 포함한다. PABC 기는 세포독성제에 직접 연결된다. 바람직하게는, 자기-희생 링커 및 다이펩타이드는 함께 기 -NH-Phe-Lys-CO-NH-PABC-를 형성하며, 이는 하기에 도시되어 있다:
상기 구조식에서 별표는 선택된 세포독성 물질에 대한 부착점을 나타내며, 및 물결선은 링커 L1의 남은 부분에 대한 부착점 또는 A에 대한 부착점을 나타낸다. 바람직하게는, 물결선은 A에 대한 부착점을 나타낸다. Lys 아미노산의 측쇄는 예를 들면, 상기 설명한 바와 같이 Boc, Fmoc 또는 Alloc에 의해 보호될 수 있다.
선택적으로, 자기-희생 링커 및 다이펩타이드는 함께 기 -NH-Val-Ala-CO-NH-PABC-를 형성하며, 이는 하기에 도시되어 있다:
상기 구조식에서, 별표 및 물결선은 상기 정의된 바와 같다.
선택적으로, 자기-희생 링커 및 다이펩타이드는 함께 기 -NH-Val-Cit-CO-NH-PABC-를 형성하며, 이는 하기에 도시되어 있다:
상기 구조식에서 별표 및 물결선은 상기 정의된 바와 간다.
본 발명의 어떤 실시형태에서, 약물 물질이 탈보호 이민 결합을 함유한다면, 예를 들면 물질 B가 존재한다면, 링커가 자유 아미노산(H2N-)기를 함유하지 않는 것이 바람직할 수 있다. 따라서, 링커가 구조 -A-L1-L2-를 가진다면, 이는 자유 아미노산을 함유하지 않는 것이 바람직하다. 상기 우선권은 예를 들면, L1로서 링커가 다이펩타이드를 함유할 때 특히 관련되어 있으며; 이 실시형태에서, 2개의 아미노산들 중 하나는 라이신으로부터 선택되지 않는 것이 바람직하다.
이론에 구애받지 않으면서, 약물 물질내 탈보호 이민 결합과 링커내 자유 아미노산의 조합은 약물-링커 물질의 다이머화를 일으킬 수 있어서, 상기 약물-링커 물질이 항체에 대한 접합을 방해할 수 있다. 강산 (예를 들면, TFA)이 자유 아미노산을 탈보호하는데 사용된 경우와 같이, 자유 아미노기가 암모늄 이온(H3N+-)으로서 존재하는 경우에, 상기 기들의 교차결합 반응이 촉진될 수 있다.
한 실시형태에서, A는 공유결합이다. 따라서, L1 및 세포결합제가 직접 연결된다. 예를 들면, L1이 인접한 아미노산 서열을 포함하는 경우, 서열의 말단은 세포결합제에 직접 연결될 수 있다.
따라서, A가 공유결합인 경우, 세포결합제와 L1 사이의 연결은 하기로부터 선택될 수 있다:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -C(=O)NHC(=O)-, -S-, -S-S-, -CH2C(=O)-, 및 =N-NH-.
DLL3 조절물질에 연결하는 L1의 아미노기는 아미노산의 N-말단일 수 있거나, 아미노산 측쇄, 예를 들면 라이신 아미노산 측쇄의 아미노기로부터 유도될 수 있다.
조절물질에 연결하는 L1의 카르복실기는 아미노산의 C-말단일 수 있거나, 아미노산 측쇄, 예를 들면 글루탐산 아미노산 측쇄의 카르복실기로부터 유도될 수 있다.
세포결합제에 연결하는 L1의 하이드록실기는 아미노산 측쇄, 예를 들면 세린 아미노산 측쇄의 티올기로부터 유도될 수 있다.
L1의 아미노기, 카르복실기, 하이드록실기 및 티올기와 관련된 상기 코멘트들은 세포결합제에도 적용된다.
한 실시형태에서, L2는 -OC(=O)-와 함께 하기를 나타낸다:
상기 구조식에서, 별표는 N10 위치에 대한 부착점을 나타내며, 물결선은 L1에 대한 부착점을 나타내고, n은 0 내지 3이며, Y는 공유결합 또는 작용기이며, 및 E는 예를 들면 효소활성 또는 빛에 의해 활성화 가능하여, 자기-희생 구성단위를 생성할 수 있는 기이다. 페닐렌 고리는 본 명세서에 설명된 바와 같이, 1개, 2개 또는 3개의 치환체들에 의해 선택적으로 추가 치환된다. 한 실시형태에서, 페닐렌기는 할로, NO2, R 또는 OR에 의해 선택적으로 추가 치환된다. 바람직하게는, n은 0 또는 1, 가장 바람직하게는 0이다.
E는 예를 들면, 빛 또는 효소활성에 의해 기가 활성화되기 쉽도록 선택된다. E는 -NO2 또는 글루코론산일 수 있다. 전자는 나이트로리덕타제의 작용에 민감할 수 있으며, 후자는 β-글루코로니다제의 작용에 민감할 수 있다.
본 실시형태에서, 자기-희생 링커는 E가 활성화될 때 보호 화합물을 방출시킬 것이며, 하기 도시된 선을 따라 진행한다 (n=0인 경우):
상기 구조식에서, 별표는 N10 위치에 대한 부착점을 나타내며, E*는 E의 활성화 형태이며, 및 Y는 상기 설명된 바와 같다. 상기 기들은 보호된 화합물로부터 활성화 영역을 분리시킨다는 잇점을 가진다. 상기 설명된 바와 같이, 페닐렌기는 선택적으로 추가 치환될 수 있다.
기 Y는 L1에 공유결합될 수 있다.
기 Y는 하기로부터 선택되는 작용기일 수 있다:
-C(=O)-, -NH-, -O-, -C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -NHC(=O)NH, -C(=O)NHC(=O)-, 및 -S-.
L1이 다이펩타이드인 경우, Y는 -NH- 또는 -C(=O)-이며, 이에 의해 L1 및 Y 사이의 아미드 결합을 형성하는 것이 바람직하다. 본 실시형태에서, 다이펩타이드 서열은 효소활성을 위한 기질이 될 필요가 없다.
다른 실시형태에서, A는 스페이서 기이다. 따라서, L1 및 세포결합제는 간접연결된다.
L1 및 A는 하기로부터 선택되는 결합에 의해 연결될 수 있다:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, 및 -NHC(=O)NH-.
바람직하게는, 링커는 조절물질 상의 친핵성 작용기와 반응하기 위한 친전자성 작용기를 함유한다. 항체 상의 친핵성 기는 (i) N-말단 아민기, (ii) 측쇄 아민기, 예를 들면 라이신, (iii) 측쇄 티올기, 예를 들면 시스테인, 및 (iv) 당 하이드록실 또는 아미노기를 포함하며, 이 경우 항체는 글라이코실화되며, 여기에 제한되지 않는다. 아민, 티올, 및 하이드록실이기는 친핵성이며, (i) 말레이미드기, (ii) 활성화 다이설파이드, (iii) 활성 에스테르, 예를 들면 NHS(N-하이드록시숙신이미드) 에스테르, HOBt (N-하이드록시벤조트라이아졸) 에스테르, 할로포르메이트 및 산 할로겐화물; (iv) 알킬 및 벤질 할로겐화물, 예를 들면 할로아세트아미드; 및 (v) 알데하이드, 케톤, 카르복실 및 하기 예시된 것들 중 일부를 포함하는 링커 물질들 및 링커 제제들 상의 친전자성 기와 공유결합을 형성하기 위해 반응할 수 있다:
특정 항체들은 환원성 쇄간 다이설파이드, 즉 시스테인 브릿지를 가진다. 항체들은 DTT(다이티오트레이톨)와 같은 환원제에 의해 치료함으로써 링커 제제와 접합을 위해 반응성이 될 수 있다. 따라서, 각 시스테인 브릿지는 이론적으로 2개의 반응성 티올 친핵체들을 형성할 것이다. 추가의 친핵성 기들은 라이신을 2-이미노티올란(트라우트 제제(Traut's reagent))과 반응시켜 항체에 도입될 수 있으며, 그 결과 아민을 티올로 전환시킬 수 있다. 반응성 티올기는 1개, 2개, 3개, 4개 또는 그 이상의 시스테인 잔기들을 도입함으로써 (예를 들면, 1개 이상의 비-천연 시스테인 아미노산 잔기들을 포함하는 돌연변이 항체들을 제조함으로써), 항체 (또는 그의 단편)로 도입될 수 있다. 미국특허 제7521541호는 반응성 시스테인 아미노산의 도입에 의해 항체들을 조작하는 것을 교시하고 있다.
어떤 실시형태에서, 링커는 항체 상에 존재하는 친전자성 기와 반응성인 반응성 친핵성 기를 가진다. 항체 상의 사용가능한 친전자성 기들은 알데하이드 및 케톤 카르보닐기를 포함하지만, 여기에 제한되지 않는다. 링커의 친핵성 기의 헤테로원자는 항체 상의 친전자성 기와 반응할 수 있으며, 항체 단위에 대하여 공유결합을 형성할 수 있다. 링커 상의 사용가능한 친핵성 기들은 히드라지드, 옥심, 아미노, 하이드록실, 하이드라진, 티오세미카르바존, 하이드라진 카르복실레이트 및 아릴하이드라지드를 포함하지만, 여기에 제한되지 않는다. 항체 상의 친전자성 기는 링커에 대하여 부착을 위한 편리한 영역을 제공한다.
한 실시형태에서, 기 A는 하기이다:
상기 구조식에서 별표는 L1에 대한 부착점을 나타내며, 물결선은 세포결합제에 대한 부착점을 나타내고, n은 0 내지 6이다. 한 실시형태에서, n은 5이다.
한 실시형태에서, 기 A는 하기이다:
상기 구조식에서, 별표는 L1에 대한 부착점을 나타내며, 물결선은 세포결합제에 대한 부착점을 나타내고, n은 0 내지 6이다. 한 실시형태에서, n은 5이다.
한 실시형태에서, 기 A는 하기이다:
상기 구조식에서, 별표는 L1에 대한 부착점을 나타내며, 물결선은 세포결합제에 대한 부착점을 나타내고, n은 0 또는 1이며, m은 0 내지 30이다. 바람직한 실시형태에서, n은 1이며, m은 0 내지 10, 1내지 8, 바람직하게는 4 내지 8, 및 가장 바람직하게는 4 또는 8이다. 다른 실시형태에서, m은 10 내지 30, 및 바람직하게는 20 내지 30이다. 선택적으로, m은 0 내지 50이다. 본 실시형태에서, m은 바람직하게는 10 내지 40이며, n은 1이다.
한 실시형태에서, 기 A는 하기이다:
상기 구조식에서, 별표는 L1에 대한 부착점을 나타내며, 물결선은 세포결합제에 대한 부착점을 나타내고, n은 0 또는 1이며, m은 0 내지 30이다. 바람직한 실시형태에서, n은 1이며, m은 0 내지 10, 1내지 8, 바람직하게는 4 내지 8, 및 가장 바람직하게는 4 또는 8이다. 다른 실시형태에서, m은 10 내지 30, 및 바람직하게는 20 내지 30이다. 선택적으로, m은 0 내지 50이다. 본 실시형태에서, m은 바람직하게는 10 내지 40이며, n은 1이다.
한 실시형태에서, 세포결합제와 A 사이의 연결은 세포결합제의 티올 잔기 및 A의 말레이미드기를 통해 이루어진다.
한 실시형태에서, 세포결합제와 A 사이의 연결은 하기이다:
상기 구조식에서, 별표는 A의 남은 부분에 대한 부착점을 나타내며, 물결선은 세포결합제의 남은 부분에 대한 부착점을 나타낸다. 본 실시형태에서, S 원자는 일반적으로 조절물질로부터 유도된다.
상기 각 실시형태에서, 대체가능한 작용기는 하기 도시된 말레이미드-유도된 기 대신에 사용될 수 있다:
상기 구조식에서, 물결선은 예전과 같이 세포결합제에 대한 부착점을 나타내며, 별점은 A 기의 남은 부분에 대한 결합을 나타낸다.
한 실시형태에서, 말레이미드-유도된 기는 하기 기로 대체된다:
상기 구조식에서, 물결선은 세포결합제에 대한 부착점을 나타내며, 별점은 A 기의 남은 부분에 대한 결합을 나타낸다.
한 실시형태에서, 말레이미드-유도된 기는 선택적으로 세포결합제와 함께, 하기로부터 선택되는 기로 대체된다:
-C(=O)NH-, -C(=O)O-, -NHC(=O)-, -OC(=O)-, -OC(=O)O-, -NHC(=O)O-, -OC(=O)NH-, -NHC(=O)NH-, -NHC(=O)NH, -C(=O)NHC(=O)-, -S-, -S-S-, -CH2C(=O)-, -C(=O)CH2-, =N-NH- 및 -NH-N=.
한 실시형태에서, 말레이미드-유도된 기는 선택적으로 세포결합제와 함께, 하기 기들로부터 선택되는 기로 대체된다:
상기 구조식에서, 물결선은 세포결합제에 대한 부착점 또는 A 기의 남은 부분에 대한 결합을 나타내며, 별표는 세포결합제에 대한 부착점 또는 A 기의 남은 부분에 대한 결합 중 다른 하나를 나타낸다.
선택된 조절물질에 대하여 L1을 연결하는데 적당한 다른 기들은 WO 2005/082023에 설명되어 있다.
다른 바람직한 실시형태에서, 본 발명의 조절물질들은 약물 링커 단위들을 포함하는 생체적합성 폴리머들과 회합될 수 있다. 이 점에서 상기 종류의 적합한 폴리머는 Fleximer® 폴리머(Mersana Therapeutics)를 포함한다. 상기 폴리머들은 전해진 바에 따르면 생분해성이며, 잘 관용되어 있고, 임상적으로 입증되어 있다. 게다가, 상기 폴리머들은 약동학 조절, 약물방출의 국소화 및 개선된 생체분포를 위한 여러 제작용 링커 기술 및 화학과 호환된다.
선택된 조절물질들은 직접 접합된 방사성동위원소일 수 있거나, 방사성금속 이온들을 접합하기 위해 사용가능한 거대고리 킬레이터들을 포함할 수 있다 (본 명세서에 설명된 바와 같음). 특정 실시형태에서, 거대고리 킬레이터는 링커 분자를 통해 항체에 부착될 수 있는 1,4,7,10-테트라아자사이클로도데칸-N,N',N'',N''-테트라아세트산(DOTA)이다. 상기 링커 분자들은 당 분야에 통상적으로 알려져 있으며, Denardo et al., 1998, Clin Cancer Res. 4:2483; Peterson et al., 1999, Bioconjug. Chem. 10:553; 그리고 Zimmerman et al., 1999, Nucl. Med. Biol. 26:943에 설명되어 있다.
보다 일반적으로, 조절물질들에 치료물질들 또는 세포독성제를 접합하기 위한 기술들은 잘 알려져 있다. 위에 설명된 바와 같이, 물질들은 알데하이드/쉬프 결합, 설피드릴 결합, 산-분해성 결합, 시스-아코니틸 결합, 하이드라존 결합, 효소분해성 결합을 포함하지만, 여기에 제한되지 않는 당 분야에 공지되어 있는 방법에 의해 조절물질들에 접합될 수 있다 (일반적으로 Garnett, 2002, Adv Drug Deliv Rev 53:171 참조). 또한, 예를 들면, Amon et al., "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", in Monoclonal Antibodies And Cancer Therapy, Reisfeld et al. (eds.), pp. 243-56 (Alan R. Liss, Inc. 1985); Hellstrom et al., "Antibodies For Drug Delivery", in Controlled Drug Delivery (2nd Ed.), Robinson et al. (eds.), pp. 623-53 (Marcel Dekker, Inc. 1987); Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", in Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera et al. (eds.), pp. 475-506 (1985); "Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", in Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin et al. (eds.), pp. 303-16 (Academic Press 1985), 및 Thorpe et al., 1982, Immunol. Rev. 62:119를 참조한다. 바람직한 실시형태에서, 치료물질 또는 세포독성제에 접합된 DLL3 조절물질은 세포표면과 회합된 DLL3 분자에 결합할 때 세포에 의해 내면화될 수 있어서, 치료용 적재량을 전달할 수 있다.
C. 생체적합성 변형물질
선택된 실시형태에서, 본 발명의 조절물질들은 조절물질 특성들을 원하는대로 조정, 변경, 개선 또는 조정하는데 사용될 수 있는 생체적합성 변형물질과 접합 또는 회합될 수 있다. 예를 들면, 생체내 반감기가 증가된 항체 또는 융합 작제물들은 상업적으로 입수가능한 폴리에틸렌 글라이콜(PEG) 또는 유사한 생체적합성 폴리머들과 같은 비교적 고분자량 폴리머 분자들을 부착시킴으로써 생성될 수 있다. 당 분야에 기술을 가진 자들은 항체에 특정 특성들을 부여하기 위해 선택될 수 있는 분자 구성들 및 많은 다른 분자량으로 PEG가 얻어질 수 있음을 알 것이다 (예를 들면, 반감기가 맞춰질 수 있음). PEG는 상기 항체들 또는 항체 단편들의 N-말단 또는 C-말단에 PEG를 부위-특이적 접합을 통해, 또는 라이신 잔기들 상에 존재하는 엡실론-아미노기들을 통해 다기능 링커와 함께 또는 없이 조절물질들 또는 항체 단편들 또는 유도체들에 부착될 수 있다. 생물학적 활성이 최소한으로 손실된 선형 또는 가지형 폴리머 유도가 사용될 수 있다. 접합 정도는 항체 분자들에 대한 PEG 분자들의 최적 접합을 보장하도록 SDS-PAGE 및 질량 분석법에 의해 밀접하게 모니터링될 수 있다. 비반응 PEG는 예를 들면, 크기 배제 또는 이온-교환 크로마토그래피에 의해 항체-PEG 접합체들로부터 분리될 수 있다. 유사한 방법에서, 개시된 조절물질들은 생체내에서 보다 안정한 항체 또는 항체 단편을 제조하기 위해, 또는 생체내에서 더 긴 반감기를 가지기 위해 알부민에 접합될 수 있다. 이 기술들은 당 분야에 잘 알려져 있으며, 예를 들면 국제공보 WO 93/15199, WO 93/15200, 및 WO 01/77137; 그리고 유럽특허 제0 413, 622호를 참조한다. 다른 생체적합성 접합체들은 당업자에게 분명하며, 본 명세서의 기술들에 따라 쉽게 확인될 수 있다.
D. 진단제 또는 검출제
다른 바람직한 실시형태에서, 본 발명의 조절물질들, 또는 단편들 또는 이들의 유도체들은 예를 들어, 생물학적 분자 (예를 들면, 펩타이드 또는 누클레오타이드), 소분자, 형광단 또는 방사성 동위원소일 수 있는 진단제 또는 검출제, 마커 또는 리포터에 접합된다. 표시된 조절물질들은 개시된 조절물질들 (즉, 치료진단제)을 포함하는 특정 치료법의 효능을 측정하기 위해, 또는 향후의 치료과정을 측정하기 위해, 임상실험과정의 일부로서 또는 이상증식 질병의 발병 또는 진행을 모니터링하기 위해 사용될 수 있다. 상기 마커들 또는 리포터들은 선택된 조절물질을 정제하고, 조절물질 분석 (예를 들면, 에피토프 결합 또는 항체 빈화(binning)), TIC 또는 임상전 과정들 또는 독성 연구들에서 분리 또는 격리시키는데 사용될 수도 있다.
상기 진단 분석 및.또는 검출은 예를 들면 서양고추냉이 퍼옥시다제, 알칼리성 포스파타제, 베타-갈락토시다제, 또는 아세틸콜린에스테라제를 포함하는 여러 효소들을 포함 (여기에 제한되지 않음)하는 검출가능한 물질들; 보결원자단, 예를 들면 스트렙타비딘/바이오틴 및 아비딘/바이오틴 (여기에 제한되지 않음); 형광물질, 예를 들면 엄벨리페론, 플루오레세인, 플루오레세인 아이소티오사이아네이트, 로다민, 다이클로로트라이아지닐아민 플루오레세인, 댄실 클로라이드 또는 파이코에리트린 (여기에 제한되지 않음); 발광물질들, 예를 들면 루미놀 (여기에 제한되지 않음); 생체발광물질들, 예를 들면, 루시페라제, 루시페린, 및 에쿼린 (여기에 제한되지 않음); 방사성 물질들, 예를 들면 요오드(131I, 125I, 123I, 121I,), 탄소(14C), 황(35S), 트리튬(3H), 인듐(115In, 113In, 112In, 111In,), 및 테크네튬(99Tc), 탈륨(201Ti), 갈륨(68Ga, 67Ga), 팔라듐(103Pd), 몰리브덴(99Mo), 크세논(133Xe), 불소(18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn, 및 117Tin (여기에 제한되지 않음); 다양한 양전자 방출 단층촬영을 사용한 양전자 방출금속들, 비방사성 상자성 금속 이온들 및, 방사성표시되거나 특정 방사성동위원소들에 접합된 분자들을 포함하는 검출가능한 물질들에 조절물질을 결합시킴으로써 수행될 수 있다. 상기 실시형태에서, 적당한 검출방법론이 당 분야에 잘 알려져 있으며, 수많은 상업적 공급원들로부터 쉽게 입수할 수 있다.
위에 나타낸 바와 같이, 다른 실시형태에서, 조절물질들 또는 이들의 단편들은 면역조직화학, 바이오-층 간섭측정법, 표면 플라즈몬 공명, 유동 세포분석법, 경쟁적 ELISA, FAC 등과 같은 정제법 또는 진단법 또는 분석과정들을 용이하게 하기 위해, 펩타이드 또는 형광단과 같은, 마커 서열 또는 화합물들에 융합 또는 접합될 수 있다. 바람직한 실시형태에서, 마커는 다른 것들 중에서 pQE 벡터에 의해 제공된 것과 같은 his-태그(Qiagen)을 포함하며, 이들 중 많은 것들이 상업용으로 입수가능하다. 정제에 사용가능한 다른 펩타이드 태그들은 혈구응집소 "HA" 태그를 포함하며, 여기에 제한되지 않으며, 이는 인플루엔자 혈구응집소 단백질(Wilson et al., 1984, Cell 37:767) 및 "플래그" 태그(미국특허 제4,703,004호)로부터 유도된 에피토프에 대응한다.
E. 치료 물질들
앞서 언급한 바와 같이, 조절물질들 또는 단편들 또는 이들의 유도체들은 또한, 세포독성제, 세포정지제, 항신생혈관제, 용적축소제, 화학요법제, 방사선 치료 및 방사선치료제, 표적 항암제, BRM, 치료용 항체, 암 백신, 사이토카인, 호르몬 치료법, 방사선 치료법 및 항-전이제 및 면역치료제들을 포함하는 (여기에 제한되지 않음) 항-증식 또는 항-암제와 같은 "치료물질" 또는 "약물"에 접합, 연결, 또는 융합되거나, 그렇지 않으면 회합될 수도 있다.
바람직한 예시적인 항암제들은 사이토칼라신 B, 그라미시딘 D, 브롬화 에티듐, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블라스틴, 콜키신, 독소루비신, 다우노루비신, 다이하이드록시 안트라신, 메이타시노이드들, 예를 들면 DM-1 및 DM-4 (Immunogen, Inc.), 디온, 미톡산트론, 미스라마이신, 악티노마이신 D, 1-디하이드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 퓨로마이신, 에피루비신, 및 사이클로포스파미드 및 이들의 유사체 또는 동족체들을 포함한다. 추가의 호환성 세포독소들은 돌라스타틴 및 아우리스타틴(모노메틸 아우리스타틴 E(MMAE) 및 모노메틸 아우리스타틴 F(MMAF) 포함)(Seattle Genetics, Inc.), 아마니틴, 예를 들면 α-아마니틴, β-아마니틴, γ-아마니틴 또는 ε-아마니틴(Heidelberg Pharma AG), DNA 작은틈(minor groove) 결합제, 예를 들면 듀오카르마이신 유도체들(Syntarga, B.V.) 및 변경된 피롤로벤조다이아제핀 다이머(Spirogen, Ltd.), 스플라이싱 억제제, 예를 들면 메야마이신 유사체 또는 유도체들 (예를 들면, FR901464, 미국특허 제7,825,267호에 개시됨), 관형 결합제, 예를 들면 에포틸론 유사체들 및 파클리탁셀 및 DNA 상해제, 예를 들면 칼리케마이신 및 에스페라마이신들을 포함한다. 더욱이, 특정 실시형태에서 본 발명의 DLL3 조절물질들은 세포독성 T-세포들을 모집하기 위해 항-CD3 결합 분자들과 회합될 수 있으며, 이들을 종양개시세포들을 표적으로 삼는다 (BiTE technology; 예를 들면, Fuhrmann, S. et. al. Annual Meeting of AACR Abstract No. 5625 (2010)를 참조하며, 이는 전부 참조로본원에 반영되어 있다).
여전히 또다른 적합한 항-암제들은 대사 길항제들 (예를 들면, 메토트렉세이트, 6-메르캅토퓨린, 6-티오구아닌, 시타라빈, 5-플루오로우라실 디카르바진), 알킬화제 (예를 들면, 메클로레타민, 티오에파, 클로람부실, 멜팔란, 카뮤스틴 (BCNU) 및 로뮤스틴(CCNU), 부설판, 다이브로모만니톨, 스트렙토조토신, 및 시스다이클로로다이아민 플레티늄(II)(DDP) 시스플라틴), 안트라사이클린들(예를 들면, 다우노루비신(예전에는 다우노마이신) 및 독소루비신), 항생제들 (예를 들면, 닥티노마이신(예전에는 악티노마이신), 블레오마이신, 및 안트라마이신(AMC)), 및 유사분열 방지제 (예를 들면, 빈크리스틴 및 빈블라스틴)을 포함하지만, 여기에 제한되지 않는다. 치료 물질들의 보다 광범위한 목록은 PCT 공보 WO 03/075957 및 미국 특허 제2009/0155255호에서 발견될 수 있으며, 이들 각각은 전부 참조로본원에 반영되어 있다.
위에 설명된 바와 같이, 본 발명의 선택된 실시형태들은 세포독성제로서 피롤로벤조다이아제핀(PBD)을 포함하는 항-DLL3 항체 약물 접합체들과 같은 접합된 DLL3 조절물질들에 관한 것이다. PBD가 작은 틈에 DNA를 공유결합시키고, 핵산합성을 저해함으로써, 항암활성을 나타내는 알킬화제들임을 이해할 것이다. 이 점에서 PBD는 최소의 골수 쇠약을 나타내면서 강력한 항암 특성들을 가지는 것으로 보여져 왔다. 본 발명에 적합한 PBD는 여러 종류의 링커들 중 하나(예를 들면, 자유 설프하이드릴을 갖는 말레이미도 부분을 포함하는 펩티딜 링커)를 사용하여 DLL3 조절물질에 연결될 수 있으며, 특정 실시형태에서, 다이머 형태로 있다 (즉, PBD 다이머). 본 발명의 조절물질들에 접합될 수 있는 적합한 PBD(및 임의 링커들)는 예를 들면, 미국특허 제6,362,331호, 제7,049,311호, 제7,189,710호, 제7,429,658호, 제7,407,951호, 제7,741,319호, 제7,557,099호, 제8,034,808호, 제8,163,736호, 미국특허 2011/0256157 그리고 PCT 출원 WO2011/130613, WO2011/128650 및 WO2011/130616에 설명되어 있으며, 이들 각각은 전부 참조로본원에 반영되어 있다. 따라서, 특히 바람직한 실시형태에서, 조절물질은 1개 이상의 PBD 다이머들과 접합된 또는 회합된 항 DLL3 항체 (즉, DLL3-PBD ADC)를 포함할 것이다.
특히 바람직한 실시형태에서, 본 발명의 조절물질들에 접합될 수 있는 적합한 PBD는 미국특허 2011/0256157에 설명되어 있다. 본 명세서에서, 2개의 PBD 물질들을 포함하는 다이머인 PBD 다이머들이 바람직할 수 있다. 따라서, 본 발명의 바람직한 접합체들은 하기 구조식 (AB) 또는 (AC)를 갖는 것이다:
상기 구조식에서:
점선은 C1과 C2 또는 C2와 C3 사이에 이중결합이 임의로 존재함을 보여주며;
R2는 H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R 및 COR로부터 독립적으로 선택되며, 및 선택적으로 할로 또는 다이할로로부터 추가 선택되며;
여기에서 RD는 R, CO2R, COR, CHO, CO2H, 및 할로로부터 독립적으로 선택되며;
R6 및 R9는 H, R, OH, OR, SH, SR, NH2, NHR, NRR', NO2, Me3Sn 및 할로로부터 독립적으로 선택되며;
R7은 H, R, OH, OR, SH, SR, NH2, NHR, NRR', NO2, Me3Sn 및 할로로부터 독립적으로 선택되며;
R10은 상기 설명된 바와 같은, 조절물질 또는 단편 또는 이들의 유도체에 연결된 링커이며;
Q는 O, S 및 NH로부터 독립적으로 선택되며;
R11은 H, 또는 R이거나, Q가 O인 경우 O, SO3M이며, 여기에서 M은 금속 양이온이며;
R 및 R'은 선택적으로 치환된 C1-12 알킬, C3-20 헤테로사이클릴 및 C5-20 아릴기로부터 선택되며, 및 선택적으로 기 NRR', R 및 R'과 관련하여, 질소원자와 함께, 이들이 부착되어, 선택적으로 치환된 4-, 5-, 6- 또는 7-환 헤테로사이클릭 고리를 형성한다; 및
R2", R6", R7", R9", X", Q" 및 R11"은 R2, R6, R7, R9, X, Q 및 R11 에 따라 정의된 바와 같으며, RC는 캡핑기이다.
이중결합
한 실시형태에서, C1과 C2 사이, 및 C2와 C3 사이에는 이중결합이 존재하지 않는다.
한 실시형태에서, 점선은 하기에 나타낸 바와 같이, C2와 C3 사이에 이중결합이 임의로 존재함을 보여준다:
한 실시형태에서, 상기 R2가 C5-20 아릴 또는 C1-12 알킬일 때 C2와 C3 사이에 이중결합이 존재한다.
한 실시형태에서, 점선은 하기에 도시된 바와 같이, C1과 C2 사이에 이중결합이 임의로 존재함을 보여준다:
한 실시형태에서, R2가 C5-20 아릴 또는 C1-12 알킬일 때 C1과 C2 사이에 이중결합이 존재한다.
한 실시형태에서, R2는 H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R 및 COR로부터 독립적으로 선택되며, 및 할로 또는 다이할로로부터 선택적으로 추가 선택된다.
한 실시형태에서, R2는 H, OH, =O, =CH2, CN, R, OR, =CH-RD, =C(RD)2, O-SO2-R, CO2R 및 COR로부터 독립적으로 선택된다.
한 실시형태에서, R2는 H, =O, =CH2, R, =CH-RD, 및 =C(RD)2로부터 독립적으로 선택된다.
한 실시형태에서, R2는 독립적으로 H이다.
한 실시형태에서, R2는 독립적으로 =O이다.
한 실시형태에서, R2는 독립적으로 =CH2이다.
한 실시형태에서, R2는 독립적으로 =CH-RD이다. PBD 화합물 내에서, 기 =CH-RD는 하기 도시된 구성을 가질 수 있다:
한 실시형태에서, 입체구조는 입체구조 (I)이다.
한 실시형태에서, R2는 독립적으로 =C(RD)2이다.
한 실시형태에서, R2는 독립적으로 =CF2이다.
한 실시형태에서, R2는 독립적으로 R이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 C5-20 아릴이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 C1-12 알킬이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 C5-20 아릴이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 C5-7 아릴이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 C8-10 아릴이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 페닐이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 나프틸이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 피리딜이다.
한 실시형태에서, R2는 독립적으로 선택적으로 치환된 퀴놀리닐 또는 아이소퀴놀리닐이다.
한 실시형태에서, R2는 1 내지 3개의 치환기들을 함유하며, 1 및 2개가 보다 바람직하며, 단일치환된 기들이 가장 바람직하다. 치환체들은 어떤 위치에나 있을 수 있다.
R2가 C5-7 아릴기인 경우, 화합물의 나머지에 대한 결합과 인접하지 않는 고리 원자 상에서 단일 치환체가 바람직하게 존재하며, 즉 화합물의 나머지에 대한 결합에 대하여 β 또는 γ인 것이 바람직하다. 그러므로, C5-7 아릴기가 페닐인 경우, 치환체는 메타- 또는 파라-위치에 있는 것이 바람직하며, 파라-위치에 있는 것이 보다 바람직하다.
한 실시형태에서, R2는 하기로부터 선택된다:
상기 구조식에서, 별점은 부착점을 나타낸다.
R2가 C8-10 아릴기, 예를 들면 퀴놀리닐 또는 아이소퀴놀리닐인 경우, 퀴놀린 또는 아이소퀴놀린 고리들의 어느 위치에서나 다수의 치환체들을 함유할 수 있다. 어떤 실시형태에서, 1개, 2개 또는 3개의 치환체들을 함유하며, 이들은 근위 및 원위 고리들 또는 둘 다 (1개 이상의 치환체인 경우) 상에 존재할 수 있다.
한 실시형태에서, R2는 선택적으로 치환되는 경우, 치환체들은 하기 치환 섹션에 제공된 상기 치환체들로부터 선택된다.
R이 선택적으로 치환되는 경우, 치환체들은 하기로부터 바람직하게 선택된다:
할로, 하이드록실, 에테르, 포르밀, 아실, 카르복시, 에스테르, 아실옥시, 아미노, 아미도, 아실아미도, 아미노카르보닐옥시, 우레이도, 나이트로, 사이아노 및 티오에테르.
한 실시형태에서, R 또는 R2가 선택적으로 치환되는 경우, 치환체들은 R, OR, SR, NRR', NO2, 할로, CO2R, COR, CONH2, CONHR, 및 CONRR'로 구성된 그룹으로부터 선택된다.
R2가 C1-12 알킬인 경우, 임의 치환체는 C3-20 헤테로사이클릴 및 C5-20 아릴기들을 추가로 포함할 수 있다.
R2가 C3-20 헤테로사이클릴인 경우, 임의 치환체는 C1-12 알킬 및 C5-20 아릴기들을 추가로 포함할 수 있다.
R2가 C5-20 아릴기인 경우, 임의 치환체는 C3-20 헤테로사이클릴 및 C1-12 알킬기들을 추가로 포함할 수 있다.
용어 "알킬"은 하위분류 알케닐 및 알키닐 뿐만 아니라 시클로알킬을 포함하는 것으로 이해된다. 따라서, R2가 선택적으로 치환된 C1-12 알킬인 경우, 알킬기는 1개 이상의 탄소-탄소 2중 또는 3중 결합들을 선택적으로 함유하여, 이는 접합된 시스템의 일부를 형성할 수 있다고 이해된다. 한 실시형태에서, 임의치환된 C1 -12 알킬기들은 1개 이상의 탄소-탄소 2중 또는 3중 결합을 함유하며, 이 결합은 C1과 C2 사이, 또는 C2와 C3 사이에 존재하는 2중 결합과 접합된다. 한 실시형태에서, C1 -12 알킬기는 포화 C1 -12 알킬, C2 -12 알케닐, C2 -12 알키닐 및 C3 -12 시클로알킬로부터 선택되는 기이다.
R2 상의 치환체가 할로라면, 바람직하게는 F 또는 Cl, 보다 바람직하게는 Cl이다.
R2 상의 치환체가 에테르라면, 어떤 실시형태에서는 알콕시기, 예를 들면 C1-7 알콕시기 (예를 들면, 메톡시, 에톡시)일 수 있거나, 어떤 실시형태에서는 C5-7 아릴옥시기 (예를 들면, 페녹시, 피리딜옥시, 퓨라닐옥시)일 수 있다.
R2 상의 치환체가 C1-7 알킬이라면, 바람직하게 C1-4 알킬기 (예를 들면, 메틸, 에틸, 프로필, 부틸)일 수 있다.
R2 상의 치환체가 C3-7 헤테로사이클릴이라면, 어떤 실시형태에서, 헤테로사이클릴기, 예를 들면, 모르폴리노, 티오모르폴리노, 피페리디닐, 피페라지닐을 함유하는 C6 질소일 수 있다. 상기 기들은 질소원자를 통해 PBD 물질의 나머지에 결합될 수 있다. 상기 기들은 예를 들면, C1-4 알킬기들에 의해 추가로 치환될 수 있다.
R2 상의 치환체가 비스-옥시-C1-3 알킬렌이라면, 이것은 바람직하게 비스-옥시-메틸렌 또는 비스-옥시-에틸렌이다.
R2에 대한 특히 바람직한 치환체들은 메톡시, 에톡시, 플루오로, 클로로, 사이아노, 비스-옥시-메틸렌, 메틸-피페라지닐, 모르폴리노 및 메틸-티에닐을 포함한다.
특히 바람직한 치환된 R2기들은 4-메톡시-페닐, 3-메톡시페닐, 4-에톡시-페닐, 3-에톡시-페닐, 4-플루오로-페닐, 4-클로로-페닐, 3,4-비스옥시메틸렌-페닐, 4-메틸티에닐, 4-사이아노페닐, 4-페녹시페닐, 퀴놀린-3-일 및 퀴놀린-6-yl, 아이소퀴놀린-3-일 및 아이소퀴놀린-6-일, 2-티에닐, 2-퓨라닐, 메톡시나프틸, 및 나프틸을 포함한다.
한 실시형태에서, R2는 할로 또는 다이할로다. 한 실시형태에서, R2는 -F 또는 -F2이며, 여기에서 치환체들은 하기 (III) 및 (IV)으로 각각 도시된다:
R
D
한 실시형태에서, RD는 R, CO2R, COR, CHO, CO2H, 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, RD는 독립적으로 R이다.
한 실시형태에서, RD는 독립적으로 할로이다.
R
6
한 실시형태에서, R6은 H, R, OH, OR, SH, SR, NH2, NHR, NRR', NO2, Me3Sn- 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, R6은 H, OH, OR, SH, NH2, NO2 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, R6은 H 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, R6은 독립적으로 H이다.
한 실시형태에서, R6 및 R7은 함께 기 -O-(CH2)p-O- (여기서, p는 1 또는 2임)를 형성한다.
R
7
R7은 H, R, OH, OR, SH, SR, NH2, NHR, NRR', NO2, Me3Sn 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, R7은 독립적으로 OR이다.
한 실시형태에서, R7 은 독립적으로 OR7A(여기에서, R7A는 독립적으로 임의치환된 C1-6 알킬임)이다.
한 실시형태에서, R7A는 독립적으로 임의치환된 포화 C1-6 알킬이다.
한 실시형태에서, R7A는 독립적으로 임의치환된 C2-4 알케닐이다.
한 실시형태에서, R7A 는 독립적으로 Me이다.
한 실시형태에서, R7A 는 독립적으로 CH2Ph이다.
한 실시형태에서, R7A 는 독립적으로 알릴이다.
한 실시형태에서, 화합물은 각 모노머의 R7 기들이 모노머들을 연결하는 구조식 X-R″-X를 갖는 다이머 브릿지를 함께 형성하는 다이머이다.
R
8
한 실시형태에서, 화합물은 각 모노머의 R8 기들이 모노머들을 연결하는 구조식 X-R″-X를 갖는 다이머 브릿지를 함께 형성하는 다이머이다.
한 실시형태에서, R8은 독립적으로 OR8A (여기에서, R8A은 독립적으로 임의치환된 C1-4 알킬임)이다.
한 실시형태에서, R8A는 독립적으로 임의치환된 포화 C1-6 알킬 또는 임의치환된 C2-4 알케닐이다.
한 실시형태에서, R8A는 독립적으로 Me이다.
한 실시형태에서, R8A는 독립적으로 CH2Ph이다.
한 실시형태에서, R8A는 독립적으로 알릴이다.
한 실시형태에서, R8 및 R7 은 함께 기 -O-(CH2)p-O- (여기서, p는 1 또는 2임)를 형성한다.
한 실시형태에서, R8 및 R9 은 함께 기 -O-(CH2)p-O- (여기서, p는 1 또는 2임)를 형성한다.
R
9
한 실시형태에서, R9는 H, R, OH, OR, SH, SR, NH2, NHR, NRR', NO2, Me3Sn- 및 할로로부터 독립적으로 선택된다.
한 실시형태에서, R9는 독립적으로 H이다.
한 실시형태에서, R9는 독립적으로 R 또는 OR이다.
R and R'
한 실시형태에서, R은 임의치환된 C1-12 알킬, C3-20 헤테로사이클릴 및 C5-20 아릴기들로부터 독립적으로 선택된다. 상기 기들은 하기 치환체 섹션에서 각각 정의된다.
한 실시형태에서, R은 독립적으로 임의치환된 C1-12 알킬이다.
한 실시형태에서, R은 독립적으로 임의치환된 C3-20 헤테로사이클릴이다.
한 실시형태에서, R은 독립적으로 임의치환된 C5-20 아릴이다.
한 실시형태에서, R은 독립적으로 임의치환된 C1-12 알킬이다.
R2 에 관하여 위에 설명한 것들은 바람직한 알킬기 및 아릴기 및 임의 치환체들의 정체 및 수에 관한 여러 실시형태들이다. R에 적용된 바와 같이, R2에 대하여 나타낸 선호가 적당한 경우에, 모든 다른 기들 R, 예를 들면 R6, R7, R8 또는 R9가 R인 경우에, 적용가능하다.
R에 대한 선호도 또한 R'에 적용한다.
본 발명의 어떤 실시형태에서, 치환체 기 -NRR'을 갖는 화합물이 제공된다. 한 실시형태에서, R 및 R'는 이들이 부착된 질소원자와 함께 임의치환된 4-, 5-, 6- 또는 7-환 헤테로사이클릭 고리를 형성한다. 고리는 추가의 헤테로원자, 예를 들면 N, O 또는 S를 포함할 수 있다.
한 실시형태에서, 헤테로사이클릭 고리는 기 R에 의해 자체 치환된다. 추가의 N 헤테로원자가 존재하는 경우, 치환체가 N 헤테로원자 상에 있을 수 있다.
R"
R″는 1개 이상의 헤테로원자들, 예를 들면 O, S, N(H), NMe 및/또는 고리들이 선택적으로 치환된 방향족 고리, 예를 들면 벤젠 또는 피리딘에 의해 쇄가 중단될 수 있는 C3 -12 알킬렌기이다.
한 실시형태에서, R″은 1개 이상의 헤테로원자들 및/또는 방향족 고리들, 예를 들면 벤젠 또는 피리딘에 의해 쇄가 중단될 수 있는C3-12 알킬렌기이다.
한 실시형태에서, 알킬렌기는 O, S, 및 NMe로부터 선택되는 1개 이상의 헤테로원자들 및/또는 고리들이 임의치환된 방향족 고리들에 의해 선택적으로 중단된다.
한 실시형태에서, 방향족 고리는 C5-20 아릴렌기인데, 여기에서 아릴렌은 물질이 5 내지 20개의 고리원자들을 갖는 방향족 화합물의 2개의 방향족 고리원자들로부터 2개의 수소원자들을 제거함으로써 얻어진 2가 물질을 의미한다.
한 실시형태에서, R″는 C3 -12 알킬렌기이며, 상기 쇄는 1개 이상의 헤테로원자들, 예를 들면 O, S, N(H), NMe 및/또는 고리들이 NH2에 의해 임의 치환된 방향족 고리들, 예를 들면 벤젠 또는 피리딘에 의해 중단될 수 있다.
한 실시형태에서, R″는 C3-12 알킬렌기이다.
한 실시형태에서, R″는 C3, C5, C7, C9 및 C11 알킬렌기로부터 선택된다.
한 실시형태에서, R″는 C3, C5 및 C7 알킬렌기로부터 선택된다.
한 실시형태에서, R″는 C3 및 C5 알킬렌기로부터 선택된다.
한 실시형태에서, R″는 C3 알킬렌기이다.
한 실시형태에서, R″는 C5 알킬렌기이다.
상기 열거된 알킬렌기들은 1개 이상의 헤테로원자들 및/또는 고리들이 임의치환된 방향족 고리들, 예를 들면 벤젠 또는 피리딘에 의해 선택적으로 중단될 수 있다.
상기 열거된 알킬렌기들은 1개 이상의 헤테로원자들 및/또는 방향족 고리들, 예를 들면 벤젠 또는 피리딘에 의해 선택적으로 중단될 수 있다.
상기 열거된 알킬렌 기는 비치환 직선형 지방족 알킬렌기일 수 있다.
X
한 실시형태에서, X는 S, 또는 N(H)로부터 선택된다.
바람직하게는 X 는 O이다.
R
10
상기 설명한 것들과 같은 바람직하게 적합한 링커들은 DLL3 조절물질(CBA/Ab/M)을, R10 위치 (즉, N10)에서 공유결합(들)을 통해 PBD 약물 물질에 부착한다. 링커는 1개 이상의 약물 물질(D)과 조절물질 (바람직하게는 항체)를 연결하여 항체-약물 접합체(ADC)를 형성하는데 사용될 수 있는 이중기능성 또는 다중기능성 물질이다. 링커(L)는 세포 밖에서, 즉 세포외적으로 안정적이거나, 또는 효소활성, 가수분해 또는 다른 대사조건들에 의해 제거될 수 있다. 항체-약물 접합체(ADC)는 약물 물질과 항체를 결합하기 위한 반응성 기능을 갖는 링커를 사용하여 편리하게 제조될 수 있다. 시스테인 티올, 또는 아민, 예를 들면 항체(Ab)의 N-말단 또는 아미노산 측쇄, 예를 들면 라이신은 링커 또는 스페이서 제제, PBD 약물 물질(D) 또는 약물-링커 제제(D-L)의 작용기와 결합을 형성할 수 있다.
PBD 물질의 N10 위치에 부착된 링커 상의 많은 작용기들은 세포결합제와 반응하는데 사용될 수 있다. 예를 들면, 에스테르, 티오에스테르, 아미드, 티오아미드, 카르바메이트, 티오카르바메이트, 우레아, 티오우레아, 에테르, 티오에테르 또는 다이설파이드 결합들은 링커-PBD 약물 중간물질 및 세포결합제의 반응으로부터 형성될 수 있다.
다른 실시형태에서, 링커는 응집, 용해도 또는 반응성을 조절하는 기들에 의해 치환될 수 있다. 예를 들면, 설포네이트 치환체는 ADC를 제조하기 위해 사용되는 합성경로에 의존하여, 시약의 수분 용해도를 높이고, 링커 시약과 항체 또는 약물 물질의 결합반응을 용이하게 하거나, Ab-L과 D의 결합반응 또는 D-L과 Ab의 결합반응을 용이하게 할 수 있다.
한 바람직한 실시형태에서, R10은 하기의 기이다:
상기 구조식에서, 별표는 N10 위치에 대한 부착점을 나타내며, CBA는 세포결합제/조절제이며, L1은 링커이고, A는 세포결합제에 L1을 연결하는 연결기이며, L2는 공유결합 또는 -OC(=O)-와 함께 자기-희생 링커를 형성하며, 및 L1 또는 L2는 제거가능한 링커이다.
L1은 바람직하게는 제거가능한 링커이며, 제거를 위한 링커의 작용에 대한 유발물질로서 언급될 수 있다.
상기 링커 섹션에서 설명된 바와 같이, L1 및 L2의 성질은 존재한다면, 매우 다양할 수 있다. 상기 기들은 그들의 제거 특성들을 기준으로 선택되며, 이는 접합체가 전달되는 영역의 조건에 의해 설명될 수 있다. 효소의 작용에 의해 제거되는 상기 링커들이 바람직하지만, pH (예를 들면, 산 또는 염기 불안정), 온도 또는 조사 (예를 들면 빛 불안정)의 변화에 의해 제거가능한 링커들도 사용될 수 있다. 환원 또는 산화 조건하에서 제거가능한 링커들도 또한, 본 발명에 사용될 수 있다.
L1은 아미노산의 인접한 서열을 포함할 수 있다. 아미노산 서열은 효소제거를 위한 표적 물질이며, 그럼으로써, N10 위치로부터 R10을 방출시킨다.
한 실시형태에서, L1은 효소의 작용에 의해 제거가능하다. 한 실시형태에서, 효소는 에스테라제 또는 펩티다제이다.
한 실시형태에서, L2가 존재하며, -C(=O)O-와 함께 자기-희생 링커를 형성한다. 한 실시형태에서, L2는 효소활성을 위한 물질이며, 그럼으로써, N10 위치로부터 R10을 방출시킨다.
L1이 효소작용에 의해 제거가능하고, L2가 존재하는 한 실시형태에서, 효소는 L1과 L2 사이의 결합을 제거한다.
선택된 PBD에 선택된 링커를 부착시키는 것과 관련하여, 기 RC는 N10-C11 이민 결합, 카르비놀아민, 치환된 카르비놀아민(QR11이 OSO3M임), 중아황산염 부가물, 티오카르비놀아민, 치환된 티오카르비놀아민, 또는 치환된 카르비날아민을 남기기 위해, 특정 PBD 물질들의 N10 위치로부터 제거가능하다.
한 실시형태에서, RC는 N10-C11 이민 결합, 카르비놀아민, 치환된 카르비놀아민, 또는 QR11이 OSO3M인 경우, 중아황산염 부가물을 남기기 위해 제거가능한 보호기이다. 한 실시형태에서, RC는 N10-C11 이민 결합을 남기기 위해 제거가능한 보호기이다.
기 RC는 기 R10을 제거하기 위해, 예를 들면 N10-C11 이민 결합, 카르비놀아민 등을 생성하기 위해, 상기 필요한 것과 같은 조건하에서 제거할 수 있는 것으로 여겨진다. 캡핑기는 N10 위치에서 계획된 작용성을 위한 보호기로서 작용한다. 캡핑기는 세포결합제를 향해 반응성이지 않은 것으로 여겨진다. 예를 들면, RC는 RL과 동일하지 않다.
캡핑기를 갖는 화합물은 이민 모노머를 갖는 다이머들의 합성에서 중간물질로서 사용될 수 있다. 선택적으로, 캡핑기를 갖는 화합물은 접합체로서 사용될 수 있으며, 상기 캡핑기는 목표 위치에서 제거되어, 이민, 카르비놀아민, 치환된 카르비놀아민 등을 생성한다. 따라서, 본 실시형태에서, 캡핑기는 WO 00/12507에 정의된 바와 같이, 치료용으로 제거가능한 질소보호기인 것으로 언급될 수 있다.
한 실시형태에서, 기 RC는 기 R10의 링커 RL을 제거하는 조건하에서 제거할 수 있다. 따라서, 한 실시형태에서, 캡핑기는 효소의 작용에 의해 제거가능하다.
대체 실시형태에서, 캡핑기는 조절물질에 링커 RL을 연결하기 전에 제거가능하다. 본 실시형태에서, 캡핑기는 링커 RL을 제거하지 않는 조건하에서 제거할 수 있다.
화합물이 작용기 G1을 포함하여, 세포결합제에 대한 연결을 형성한다면, 캡핑기는 G1의 첨가 또는 벗김 전에 제거할 수 있다.
캡핑기는 다이머내 모노머 구성단위들 중 하나만 세포결합제에 연결되도록 하기 위한 보호기 전략의 일부로서 사용될 수 있다.
캡핑기는 N10-C11 이민 결합을 위한 마스크로서 사용될 수 있다. 캡핑기는 이민 작용기가 화합물에 필요한 시간에 제거될 수 있다. 캡핑기는 또한, 상기 설명된 바와 같이, 카르비놀아민, 치환된 카르비놀아민 및 중아황산염 부가물을 위한 마스크이다.
한 실시형태에서, RC는 카르바메이트 보호기이다.
한 실시형태에서, 카르바메이트 보호기는 하기로부터 선택된다:
Alloc, Fmoc, Boc, Troc, Teoc, Psec, Cbz 및 PNZ.
선택적으로, 카르바메이트 보호기는 Moc로부터 추가로 선택된다.
한 실시형태에서, RC는 세포결합제에 연결하기 위한 작용기가 누락된 연결기 RL이다.
본 출원은 카르바메이트인 상기 RC 기와 특히 관련되어 있다.
한 실시형태에서, RC는 하기 기이다:
상기 구조식에서, 별표는 N10 위치에 대한 부착점을 나타내며, G2는 말단기이며, L3은 공유결합 또는 제거가능한 링커 L1이며, L2는 공유결합 또는 OC(=O)와 함께 자기-희생 링커를 형성한다.
L3 및 L2가 모두 공유결합인 경우, G2 및 OC(=O)는 상기 정의된 바와 같이 함께 카르바메이트 보호기를 형성한다.
L1은 R10과 관련하여 상기 정의된 바와 같다.
L2는 R10과 관련하여 상기 정의된 바와 같다.
다양한 말단기들이 하기에 설명되어 있으며, 잘 알려진 보호기들도 포함한다.
한 실시예에서, L3은 제거가능한 링커 L1, 및 L2이며, OC(=O)와 함께 자기-희생 링커를 형성한다. 본 실시형태에서, G2는 Ac (아세틸) 또는 Moc, 또는 하기로부터 선택된 카르바메이트 보호기이다: Alloc, Fmoc, Boc, Troc, Teoc, Psec, Cbz and PNZ. 선택적으로, 카르바메이트 보호기는 Moc로부터 추가 선택된다.
다른 실시형태에서, G2는 아실기 -C(=O)G3이며, 상기 G3는 알킬(시클로알킬, 알케닐 및 알키닐을 포함), 헤테로알킬, 헤테로사이클릴 및 아릴(헤테로아릴 및 카르보아릴을 포함)로부터 선택된다. 상기 기들은 선택적으로 치환될 수 있다. 아실기는 L3 또는 L2의 아미노기와 함께 적당한 경우, 아미드결합을 형성할 수 있다. 아실기는 L3 또는 L2의 히드록시기와 함께 적당한 경우, 에스테르 결합을 형성할 수 있다.
한 실시형태에서, G3은 헤테로알킬이다. 헤테로알킬기는 폴리에틸렌 글라이콜을 포함할 수 있다. 헤테로알킬기는 아실기에 인접한 헤테로원자, 예를 들면 O 또는 N을 가질 수 있어서, 적당한 경우 기 L3 or L2내에 존재하는 헤테로원자와 함께 적당한 경우, 카르바메이트 또는 카르보네이트기를 형성할 수 있다.
한 실시형태에서, G3은 NH2, NHR 및 NRR'로부터 선택된다. 바람직하게, G3은 NRR'이다.
한 실시형태에서, G2는 하기 기이다:
상기 구조식에서, 별표는 L3에 대한 부착점을 나타내며, n은 0 내지 6이며, 및 G4는 OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2, 및 할로로부터 선택된다. 기 OH, SH, NH2 및 NHR이 보호된다. 한 실시형태에서, n은 1 내지 6, 및 바람직하게는 n은 5이다. 한 실시형태에서, G4는 OR, SR, COOR, CONH2, CONHR, CONRR', 및 NRR'이다. 한 실시형태에서, G4는 OR, SR, 및 NRR'이다. 바람직하게 G4는 OR 및 NRR'로부터 선택되며, 가장 바람직하게는 G4는 OR이다. 가장 바람직하게는 G4는 OMe이다.
한 실시형태에서, 기 G2는 하기이다:
상기 구조식에서, 별표는 L3에 대한 부착점을 나타내며, 및 n 및 G4는 상기 정의된 바와 같다.
한 실시형태에서, 기 G2는 하기이다:
상기 구조식에서, 별표는 L3에 대한 부착점을 나타내며, n은 0 또는 1이고, m은 0 내지 50이며, 및 G4는 OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2, 및 할로로부터 선택된다. 바람직한 실시형태에서, n은 1이며, 및 m은 0 내지 10, 1 내지 2, 바람직하게 4 내지 8, 및 가장 바람직하게 4 또는 8이다. 다른 실시형태에서, n은 1이며, 및 m은 10 내지 50, 바람직하게 20 내지 40이다. 기 OH, SH, NH2 및 NHR이 보호된다. 한 실시형태에서, G4는 OR, SR, COOR, CONH2, CONHR, CONRR', 및 NRR'이다. 한 실시형태에서, G4는 OR, SR, 및 NRR'이다. 바람직하게, G4는 OR 및 NRR'로부터 선택되며, 가장 바람직하게는G4는 OR이다. 바람직하게, G4는 OMe이다.
한 실시형태에서, 기 G2는 하기이다:
상기 구조식에서, 별표는 L3에 대한 부착점을 나타내며, 및 n, m 및 G4는상기 정의된 바와 같다.
한 실시형태에서, 기 G2는 하기이다:
상기 구조식에서, n은 1-20이며, m은 0-6이며, 및 G4는 OH, OR, SH, SR, COOR, CONH2, CONHR, CONRR', NH2, NHR, NRR', NO2, 및 할로로부터 선택된다. 한 실시형태에서, n은 1-10이다. 다른 실시형태에서, n은 10 내지 50, 바람직하게 20 내지 40이다. 한 실시형태에서, n은 1이다. 한 실시형태에서, m은 1이다. 기 OH, SH, NH2 및 NHR이 보호된다. 한 실시형태에서, G4는 OR, SR, COOR, CONH2, CONHR, CONRR', 및 NRR'이다. 한 실시형태에서, G4는 OR, SR, 및 NRR'이다. 바람직하게 G4는 OR 및 NRR'로부터 선택되며, 가장 바람직하게는 G4는 OR이다. 바람직하게 G4는 OMe이다.
한 실시형태에서, 기 G2는 하기이다:
상기 구조식에서, 별표는 L3에 대한 부착점을 나타내며, 및 n, m 및 G4는 상기 정의된 바와 같다.
각 실시형태에서, 상기 G4는 OH, SH, NH2 및 NHR일 수 있다. 이들 기들은 바람직하게 보호된다.
한 실시형태에서, OH는 Bzl, TBDMS, 또는 TBDPS에 의해 보호된다.
한 실시형태에서, SH는 Acm, Bzl, Bzl-OMe, Bzl-Me, 또는 Trt에 의해 보호된다.
한 실시형태에서, NH2 또는 NHR은 Boc, Moc, Z-Cl, Fmoc, Z, 또는 Alloc에 의해 보호된다.
한 실시형태에서, 기 G2는 기 L3과 조합하여 존재하며, 이 기는 다이펩타이드다.
캡핑기는 조절물질에 연결하기 위한 것은 아니다. 따라서, 다이머내에 존재하는 다른 모노머는 링커를 통한 연결지점으로서 제공한다. 따라서, 캡핑기내에 존재하는 작용기가 조절물질과의 반응에 사용할 수 없는 것이 바람직하다. 따라서, OH, SH, NH2, COOH와 같은 반응성 작용기들이 피하는 것이 바람직하다. 그러나, 상기 작용기는 상기 설명한 바와 같이, 보호되는 캡핑기내에 존재할 수 있다.
따라서, 본 명세서의 기술내용에 따라, 본 발명의 한 실시예는 하기 화합물을 포함하는 접합체를 포함한다:
상기 구조식에서, CBA는 세포결합제/조절물질이며, 및 n은 0 또는 1이다. L1은 위에 정의된 바와 같으며, 및 RE 및 RE"는 H 또는 RD로부터 각각 독립적으로 선택된다.
다른 실시형태에서, 접합체는 하기 화합물을 포함한다:
상기 구조식에서, CBA는 세포결합제/조절물질이며, L1은 위에 정의된 바와 같으며, Ar1 및 Ar2는 각각 독립적으로 임의치환된 C5-20 아릴이며, 및 n은 0 또는 1이다.
당 분야에 통상의 기술을 가진 자들은 다른 대칭성 및 비대칭성 PBD 다이머들과 링커들이 본 발명에 적합하고, 본 발명의 기술 및 종래 기술에 근거한 과도한 실험없이 선택될 수 있음을 이해할 것이다.
본 발명의 다른 면은 방사성동위원소들을 포함하는 ADC를 포함한다. 상기 실시형태에 적합할 수 있는 방사성동위원소들의 예로는 요오드(131I, 125I, 123I, 121I,), 탄소(14C), 구리(62Cu, 64Cu, 67Cu), 황(35S), 트리튬(3H), 인듐(115In, 113In, 112In, 111In,), 비스무트(212Bi, 213Bi), 테크네튬(99Tc), 탈륨(201Ti), 갈륨(68Ga, 67Ga), 팔라듐(103Pd), 몰리브덴(99Mo), 크세논(133Xe), 불소(18F), 153Sm, 177Lu, 159Gd, 149Pm, 140La, 175Yb, 166Ho, 90Y, 47Sc, 186Re, 188Re, 142 Pr, 105Rh, 97Ru, 68Ge, 57Co, 65Zn, 85Sr, 32P, 153Gd, 169Yb, 51Cr, 54Mn, 75Se, 113Sn, 117Sn, 225Ac, 76Br, 및 211At가 포함되며, 여기에 제한되지 않는다. 다른 방사성핵종들은 진단제 및 치료제로 또한 사용가능하며, 특히 60 내지 4,000 keV의 에너지 범위에서 사용가능하다. 치료조건 및 원하는 치료 프로필에 의존하여, 당업자들은 개시된 조절물질들과 함께 사용하기 위한 적당한 방사성동위원소를 쉽게 선택할 수 있다.
본 발명의 DLL3 조절물질들은 주어진 생체 반응을 변경시키는 치료 물질 또는 약물 (예를 들면, 생체 반응 조절물질들 또는 BRM들)에 접합될 수 있다. 즉, 본 발명에 적합한 치료제 또는 물질들은 전형적인 화학치료제에 제한되는 것으로 간주되지 않는다. 예를 들면, 특히 바람직한 실시형태에서, 약물 물질은 원하는 생물학적 활성을 갖는 단백질 또는 폴리펩타이드 또는 이들의 단편일 수 있다. 상기 단백질은 예를 들면 아브린, 라이신 A, 옹코네이스 (또는 다른 세포독성 RNase), 슈도모나스 엑소톡신, 콜레라 독소, 또는 디프테리아 독소와 같은 독소; 종양인자, α-인터페론, β-인터페론, 신경성장인자, 혈소판유도 성장인자, 조직 플라스미노겐 활성인자, 세포사멸제, 예를 들면, TNF-α, TNF-β, AIM I(국제공보 No. WO 97/33899 참조), AIM II(국제공보 No. WO 97/34911호 참조), Fas 리간드 (Takahashi et al., 1994, J. Immunol., 6:1567), 및 VEGI(국제공보 WO 99/23105 참조), 트롬보 제제 또는 항-트롬보 제제 또는 항-세포사멸제, 예를 들면, 안지오스태틴 또는 엔도스태틴; 또는, 생체 반응 조절물질, 예를 들면, 림포카인(예를 들면, 인터루킨-1("IL-1"), 인터루킨-2("IL-2"), 인터루킨-6("IL-6"), 과립구 대식세포 콜로니 자극인자("GM-CSF"), 및 과립구 콜로니 자극인자("G-CSF")), 또는 성장인자 (예를 들면, 성장호르몬("GH"))를 포함할 수 있다. 위에 설명한 바와 같이, 조절물질을 폴리펩타이드 물질들에 융합하는 방법은 당 분야에 알려져 있다. 이미 개시된 주된 참고문헌들에 더해, 예를 들면, U.S.P.Ns. 5,336,603; 5,622,929; 5,359,046; 5,349,053; 5,447,851, 및 5,112,946; EP 307,434; EP 367,166; PCT Publications WO 96/04388 및 WO 91/06570; Ashkenazi et al., 1991, PNAS USA 88:10535; Zheng et al., 1995, J Immunol 154:5590; and Vil et al., 1992, PNAS USA 89:11337을 참조하며, 이들 각각은 전부 참조로본원에 반영되어 있다. 게다가, 위에 설명한 바와 같이, 조절물질을 상기 물질들과 반드시 회합시킬 필요는 없지만, 링커 서열을 통해 일어날 수는 있다. 위에서 이미 언급한 바와 같이, 상기 링커 분자들은 당 분야에 통상적으로 알려져 있으며, Denardo et al., 1998, Clin Cancer Res 4:2483; Peterson et al., 1999, Bioconjug Chem 10:553; Zimmerman et al., 1999, Nucl Med Biol 26:943; Garnett, 2002, Adv Drug Deliv Rev 53:171에 설명되어 있으며, 이들 각각은본원에 반영되어 있다.
IX. 진단 및 검사
A. 진단
다른 실시형태에서, 본 발명은 CSC를 포함하는 발암세포들을 확인하기 위해 증식성 질환들을 감지, 진단 또는 모니터링하는 시험관내 또는 생체내 방법들 및 환자로부터 세포들을 선별하는 방법들을 제공한다. 상기 방법들은 환자로부터 얻은 샘플 또는 환자를 본 명세서에 설명된 조절물질과 접촉시키는 단계 (즉, 생체내 또는 시험관내) 및 샘플내 결합된 또는 유리된 표적 분자들의 존재 또는 부재, 또는 회합 수준을 검사하는 단계를 포함하는, 암을 치료하거나 또는 암의 진행을 모니터링하기 위해, 암을 가진 개인을 확인하는 것을 포함한다. 특히 바람직한 실시형태에서, 조절물질은 본 명세서에 설명된 바와 같은 검출가능한 라벨 또는 리포터 분자를 포함할 것이다.
어떤 실시형태에서, 항체와 같은 조절물질을 샘플내 특정 세포들과 회합시키는 것은 샘플이 CSC를 함유하여, 암 환자가 본 명세서에 설명된 조절물질에 의해 효과적으로 치료될 수 있음을 보여준다는 것을 암시한다. 상기 방법은 대조표준에 대한 결합수준을 비교하는 단계를 추가로 포함할 수 있다. 역으로, 조절물질이 Fc-작제물일 경우, 결합특성은 샘플과 접촉하여 원하는 정보를 제공할 때 (직접 또는 간접, 생체내 또는 시험관내) 활용 및 모니터링될 수 있다.
적합한 분석방법들의 예로는 방사면역분석법, 효소면역분석법, 경쟁적-결합 분석법, 형광 면역분석법, 면역블롯 분석법, 웨스턴블롯 분석법, 유동세포 분석법, 및 ELISA 분석법들이 포함된다. 적합한 생체내 치료진단 또는 진단법은 당 분야에 통상의 기술을 가진 자들에게 알려져 있는 바와 같이, 자기공명영상, 컴퓨터단층촬영법(예를 들면, CAT 스캔), 양전자 단층촬영법(예를 들면, PET 스캔) 방사선촬영법, 초음파 등과 같은 공지된 영상화 기술 또는 모니터링 기술을 포함할 수 있다.
다른 실시형태에서, 본 발명은 생체내 암 진행 및/또는 발병을 분석하는 방법을 제공한다. 다른 실시형태에서, 생체내 암 진행 및/또는 발병을 분석하는 방법은 종양 진행의 정도를 측정하는 단계를 포함한다. 다른 실시형태에서, 상기 분석법은 종양을 확인하는 단계를 포함한다. 다른 실시형태에서, 종양의 진행을 분석하는 것은 1차 종양 상에서 수행된다. 다른 실시형태에서, 분석법은 당 분야에 통상의 기술을 가진 자에게 공지되어 있는 바와 같이, 암의 종류에 따라 다른 시간 동안 수행된다. 다른 실시형태에서, 1차 종양의 전이세포들로부터 유래된 2차 종양의 추가 분석은 생체내에서 분석된다. 다른 실시형태에서, 2차 종양의 크기 및 형태가 분석된다. 어떤 실시형태에서, 추가의 생체외 분석이 수행된다.
다른 실시형태에서, 본 발명은 세포 전이를 측정하거나 검출하는 단계 및 순환하는 종양세포들의 수준을 정량화하는 단계를 포함하는, 생체내 암 진행 및/또는 발병을 분석하는 방법을 제공한다. 또다른 실시형태에서, 세포전이의 분석방법은 1차 종양으로부터 불연속적인 영역에서 세포의 진행성 성장을 측정하는 단계를 포함한다. 다른 실시형태에서, 세포전이 분석의 영역은 종양이 퍼지는 경로를 포함한다. 어떤 실시형태에서, 세포들은 혈관구조를 통해, 림프샘을 통해, 체강내에서 또는 이들의 조합으로 분산될 수 있다. 다른 실시형태에서, 세포전이 분석은 세포이동, 전파, 혈관외유출, 증식 또는 이들의 조합의 관점에서 수행된다.
따라서, 특히 바람직한 실시형태에서, 본 발명의 조절물질들은 증식성 질환들을 포함하는 DLL3 관련 질병들을 발견, 진단 또는 모니터링하는데 차례로 사용될 수 있는, 환자 샘플 (예를 들면, 혈장 또는 혈액)내 DLL3 수준을 감지 및 정량화하는 데 사용될 수 있다. 관련 실시형태에서, 본 발명의 조절물질은 생체내 또는 시험관내 순환하는 종양세포들을 발견, 모니터링 및/또는 정량화하는 데 사용될 수 있다 (예를 들면, WO 2012/0128801을 참조하며, 이는 참조로본원에 반영되어 있다). 또다른 바람직한 실시형태에서, 순환하는 종양세포들은 암 줄기세포들을 포함할 수 있다.
어떤 실시예들에서, 대상의 발암세포 또는 대상의 샘플은 기준선을 정립하기 위해 치료법 또는 식이요법 이전에 개시된 조절물질들을 사용하여 평가 또는 특성평가될 수 있다. 다른 실시예에서는, 치료받은 대상으로부터 샘플을 얻는다. 일부 실시예들에서, 대상이 치료를 시작 또는 종료한 후 적어도 약 1, 2, 4, 6, 7, 8, 10, 12, 14, 15, 16, 18, 20, 30, 60, 90일, 6개월, 9개월, 12개월, 또는 12개월 이후에 대상으로부터 샘플을 얻는다. 특정 실시예에서, 특정 투여횟수 후 (예를 들면, 2, 5, 10, 20, 30 또는 그 이상의 치료량)에 발암 세포를 평가 또는 특성평가한다. 다른 실시예에서, 1회 이상의 치료 후 1주, 2주, 1개월, 2개월, 1년, 2년, 3년, 4년 또는 그 이상 후 발암 세포를 특성평가 또는 평가한다.
다른 면에서, 및 하기에 보다 상세히 설명되는 바와 같이, 본 발명은 과잉증식성 질환을 감지, 모니터링 또는 진단하고, 가능한 치료를 위해 상기 질병을 갖는 개인을 확인하거나, 또는 환자내 질병의 진행 (또는 퇴행)을 모니터링하기 위한 키트를 제공하며, 상기 키트는 본 명세서에 기술된 조절물질, 및 샘플 상에 조절물질이 미치는 충격을 검사하기 위한 시약을 포함한다.
본 발명의 또다른 면은 면역조직화학(IHC)을 위한 표시된 DLL3의 용도를 포함한다. 이 점에서, DLL3 IHC는 다양한 증식성 질환들의 진단을 돕기 위한, 및 DLL3 조절물질 치료를 포함하는 치료들에 대한 잠재적인 반응을 모니터링하기 위한 진단 도구로서 사용될 수 있다. 적합한 진단 분석법은 화학적으로 고정되고(포름알데히드, 글루테르알데히드, 오스뮴 테트록시드, 포타슘 다이크로메이트, 아세트산, 알콜, 아연 염들, 머큐릭 클로리드, 크로뮴 테트록시드 및 피크르산을 포함하며, 여기에 제한되지 않음), 심어지거나 (글라이콜 메타크릴레이트, 파라핀 및 수지를 포함하며, 여기에 제한되지 않음) 또는 동결 보존된 조직 상에서 수행된다. 하기에 보다 상세히 설명되는 바와 같이, 상기 분석법들은 치료결과를 안내하고, 투여계획 및 시기를 결정하는데 사용될 수 있다.
B. 선별
특정 실시형태에서, 조절물질은 항원 (예를 들면, 그의 유전자형 또는 표현형 성분들)과 반응함으로써, 발암세포 또는 후대의 기능 또는 활성을 변경시키는 화합물 또는 물질 (예를 들면, 약물)을 선별 또는 확인하는데 사용될 수도 있다. 상기 화합물 및 물질들은 증식성 질환을 치료하기 위해 선별되는 약물 후보군이 될 수 있다. 한 실시형태에서, 시스템 또는 방법은 DLL3을 포함하는 발암 세포들 및, 세포들 및 화합물 또는 물질이 서로 접촉하는 화합물 또는 물질 (예를 들면, 약물)을 포함한다. 상기 실시형태에서, 실험대상 세포들은 개시된 조절물질을 사용하여 확인, 모니터링 및/또는 강화될 수 있다.
또다른 실시형태에서, 방법은 발암 세포들 또는 그의 후대를 시험 시약 화합물과 직접 또는 간접적으로 접촉시키는 단계 및 시험 시약 또는 화합물이 항원-관련 발암 세포들의 활성 또는 기능을 조절하는 지를 측정하는 단계를 포함한다. 직접 반응의 한 예는 물리적 반응인 반면, 간접 반응은 기준이 되는 실체 (예를 들면, 세포 또는 세포 배양액)에 차례로 작용하는 중간물질 분자에 조성물이 작용하는 것을 포함한다. 조절될 수 있는 활성들 또는 기능들의 예는 세포 형태학 또는 생존력의 변화, 마커 발현, 분화 또는 탈분화, 세포 호흡, 마이토콘드리아 활성, 막 보전, 성숙, 증식, 생존력, 세포자멸 또는 세포사를 포함한다.
시약 및 화합물들을 선별 및 확인하는 방법들은 예정된 위치 또는 어드레스에서 선택적으로, 위치된 또는 놓여진 세포들의 어레이들 (예를 들면, 마이크로어레이들)을 포함하는, 고속대량 선별에 적당한 방법들을 포함한다. 예를 들면, 세포들은 배양접시, 튜브, 플라스크, 회전병 또는 회전판(예를 들면, 8, 16, 32, 64, 96, 384 및 1536개의 복수-웰 플레이트 또는 접시와 같은 단일 복수-웰 플레이트 또는 접시) 상에 위치하거나 놓여질(미리 심어질) 수 있다. 고속대량 로봇식 또는 수동 처리 방법들은 단시간내에 많은 유전자들의 화학적 반응을 조사하고, 발현수준을 측정할 수 있다. (예를 들면, 형광단에 의한)분자 신호들을 사용하는 기술들이 개발되고, 매우 빠른 속도로 정보를 처리하는 분석을 자동화하였다 (예를 들면, Pinhasov et al., Comb. Chem. High Throughput Screen. 7:133 (2004)를 참조). 예를 들면, 마이크로어레이 기술은 한번에 수천개의 반응들을 조사하는데 광범위하게 사용된 반면, 특정 유전자를 위한 정보를 제공한다 (예를 들면, Mocellin and Rossi, Adv. Exp. Med. Biol. 593:19 (2007) 참조).
검사될 수 있는 라이브러리들은 예를 들면, 소분자 라이브러리, 파지 디스플레이 라이브러리, 완전 인간 항체 이스트 디스플레이 라이브러리(Adimab, LLC), siRNA 라이브러리, 및 아데노바이러스 형질감염 벡터들을 포함한다.
X. 약제 제조 및 치료적 용도
A. 배합 및 투여경로
임의 접합체, 계획된 전달방법, 치료 또는 모니터링되는 질병 및 수많은 다른변수들에 따른 조절물질의 형태에 의존하여, 본 발명의 조성물은 당 분야에 공지된 기술들을 사용하여 원하는 대로 배합될 수 있다. 어떤 실시형태에서, 본 발명의 치료조성물은 깔끔하게 투여되거나, 최소량의 추가 성분들과 함께 투여될 수 있는 반면, 다른 것들은 당 분야 (예를 들면, Gennaro, Remington: The Science and Practice of Pharmacy with Facts and Comparisons: Drugfacts Plus, 20th ed. (2003); Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems, 7th ed., Lippencott Williams and Wilkins (2004); Kibbe et al., Handbook of Pharmaceutical Excipients, 3rd ed., Pharmaceutical Press (2000) 참조)에 잘 알려져 있는 부형제들 및 보조제들을 포함하는 적당한 약제학적으로 허용되는 담체들을 함유하도록 선택적으로 배합될 수 있다. 부형제, 보조제 및 희석제들을 포함하는 다양한 약제학적으로 허용되는 담체들은 많은 상업적 공급원으로부터 쉽게 입수가능하다. 게다가, pH 조정제 및 완충제, 독성 조정제, 안정화제, 습윤제 등과 같은 약리허용 보조 물질들의 종합도 또한 사용가능하다. 특정의 비-제한적인 담체들의 예로는 식염수, 완충식염수, 덱스트로오스, 물, 글리세롤, 에탄올 및 이들의 조합들이 포함된다.
더욱 특히, 어떤 실시형태에서, 본 발명의 치료조성물이 깔끔하게 또는 최소량의 추가 성분들과 함께 투여될 수 있음을 알 것이다. 역으로, 본 발명의 DLL3 조절물질들은 당 분야에 잘 알려져 있고, 조절물질의 투여를 용이하게 하거나, 작용 부위로의 전달을 위해 약제학적으로 최적화된 제제(preparation)로 되도록 가공하는 것을 도와주는 비교적 비활성의 물질들인, 부형제 및 보조제들을 포함하는 적당한 약제학적으로 허용되는 담체들을 함유하도록 선택적으로 배합될 수 있다. 예를 들면, 부형제는 형태 또는 농도를 제공할 수 있거나, 조절물질의 약동학 또는 안정성을 개선시키기 위해 작용할 수 있다. 적당한 부형제들 또는 첨가제들은 안정화제, 습윤제 및 유화제, 삼투도조절용 염, 캡슐화제, 완충제 및 피부침투 개선제들을 포함하며, 여기에 제한되지 않는다. 어떤 바람직한 실시형태에서, 약리조성물은 냉동건조된 형태로 제공되며, 투여되기 전에 예를 들면 완충식염수로 재구성될 수 있다.
전신 투여를 위한 본 발명의 조절물질들은 장내, 장관외 또는 국소 투여를 위해 배합될 수 있다. 확실히, 3종류의 모든 배합물이 동시에 사용되어, 유효성분을 전신투여할 수 있다. 장관외 및 비-장관외 약물 전달을 위한 배합물뿐만 아니라 부형제들은 Remington, The Science and Practice of Pharmacy 20th Ed. Mack Publishing (2000)에 개시되어 있다. 장관외 투여를 위한 적당한 배합물은 수용성 형태의 활성 화합물들의 수용액, 예를 들면 수용성 염을 포함한다. 게다가, 유성 주사현탁액에 적당한 활성 화합물의 현탁액이 투여될 수 있다. 적당한 친유성 용매 또는 부형제들은 지방산 오일, 예를 들면 헥실치환된 폴리(락티드), 참기름, 또는 합성 지방산 에스테르, 예를 들면 에틸 올레이트 또는 트라이글리세리드를 포함한다. 수성 주사 현탁액은 현탁액의 점도를 증가시키는 물질들을 함유할 수 있으며, 예를 들면, 소듐 카르복시메틸 셀룰로오스, 소르비톨 및/또는 덱스트란을 포함한다. 선택적으로, 현탁액은 또한, 안정화제를 함유할 수 있다. 리포좀들은 또한, 세포에 전달하기 위한 제제를 캡슐화하기 위해 사용될 수 있다.
장내 투여를 위한 적당한 배합물은 경질 또는 연질 젤라틴 캡슐, 알약, 코팅정을 포함하는 정제, 엘릭시르, 현탁액, 시럽 또는 이들의 흡입형 및 조절방출형을 포함한다.
일반적으로, DLL3 조절물질을 포함하는 본 발명의 화합물 및 조성물은 경구, 정맥내, 동맥내, 피하, 비경구, 비강내, 근육내, 두개내, 심장내, 심실내, 기관내, 구강, 직장내, 복강내, 진핀, 국소, 경피 및 척수내를 포함하는 다양한 경로들 (여기에 제한되지 않음) 또는 이식 또는 흡입에 의해 필요로 하는 피험자에게 생체내 투여될 수 있다. 주요 조성물들은 고체, 반-고체, 액체, 또는 기체 형태의 제조물로 배합될 수 있으며; 정제, 캡슐, 분말, 과립, 연고, 용액, 좌약, 관장액, 주사액, 흡입제, 및 에어로졸을 포함하며, 여기에 제한되지 않는다. 적당한 배합물 및 투여경로는 목적하는 용도 및 치료요법에 따라 선택될 수 있다.
C. 투여량
이와 유사하게, 특정 투여요법, 즉 투여량, 타이밍 및 반복은 특정 개인 및 개인의 의료 히스토리, 뿐만 아니라 약동학과 같은 경험적인 고려사항들(예를 들면, 반감기, 청소율 등)에 따라 다를 것이다. 투여 빈도는 치료과정 동안 측정 및 조정될 수 있으며, 증식세포 또는 발암세포들의 수를 감소시키고, 상기 종양세포들의 감소를 유지하고, 종양세포들의 증식을 감소시키거나, 전이 발생을 지연시키는 것에 기초한다. 다른 실시형태에서, 투여된 투여량은 잠재적인 부작용 및/또는 독성을 관리하기 위해 조정되거나 줄여질 수 있다. 또는, 대상 치료조성물의 효력 지속형 제제들이 적합할 수 있다.
일반적으로, 본 발명의 조절물질은 다양한 여러 범위로 투여될 수 있다. 이들은 투여량마다 체중 1kg 당 약 10 μg 내지 약 100 mg; 투여량마다 체중 1kg당 약 50 μg 내지 5 mg; 투여량마다 체중 1kg 당 약100 μg 내지 약 10 mg을 포함한다. 다른 범위들은 투여량마다 체중 1kg 당 약 100 μg 내지 약 20 mg 및 투여량마다 체중 약 0.5 mg 내지 약 20 mg을 포함한다. 특정 실시형태에서, 투여량은 체중 1kg당 적어도 약 100 μg, 체중 1kg당 적어도 약 250 μg, 체중 1kg 당 적어도 약 750 μg, 체중 1kg 당 적어도 약 3 mg, 체중 1kg 당 적어도 약 5 mg, 체중 1kg 당 적어도 약 10 mg이다.
선택된 실시형태에서, 조절물질들은 투여량마다 체중 1kg 당 약 10, 20, 30, 40, 50, 60, 70, 80, 90 또는 100 μg 투여될 것이다. 다른 실시형태들은 투여량마다 체중 1kg 당 200, 300, 400, 500, 600, 700, 800 또는 900 μg의 조절물질을 투여하는 것을 포함할 것이다. 다른 바람직한 실시형태에서, 개시된 조절물질은 1, 2, 3, 4, 5, 6, 7, 8, 9 또는 10 mg/kg 투여될 것이다. 또다른 실시형태에서, 조절물질은 투여량마다 체중 1kg 당 12, 14, 16, 18 또는 20 mg 투여될 수 있다. 또다른 실시형태에서, 조절물질은 투여량마다 체중 1kg 당 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 90 또는 100 mg 투여될 것이다. 본원의 교시에 따르면, 상기 투여량들은 접합되지 않은 조절물질들과 세포독성제에 접합된 조절물질들 모두에 대하여 적용할 수 있음을 이해할 수 있을 것이다. 당업자라면 임상전 동물연구, 임상관찰 및 표준 의료 및 생화학 기술 및 측정에 기초하여, 여러 접합된 및 비접합된 조절물질들에 대한 적당한 투여량을 쉽게 결정할 수 있다.
접합된 조절물질과 관련하여, 특히 바람직한 실시형태는 투여량마다 체중 1kg 당 약 50 μg 내지 약 5 mg의 투여량을 포함할 것이다. 이것과 관련하여, 접합된 조절물질들은 투여량마다 체중 1kg당 50, 75 또는 100 μg 또는 0.2, 0.3, 0.4, 0.5, 0.6, 0.7, 0.8, 0.9 또는 1 mg 투여될 수 있다. 다른 바람직한 실시형태에서, 본 발명의 접합된 조절물질들은 투여량마다 체중 1kg 당 1.25, 1.5, 1.75, 2, 2.25, 2.5, 2.75, 3, 3.25, 3.5, 3.75, 4, 4.25, 4.5, 4.75 또는 5 mg 투여될 수 있다. 특히 바람직한 실시형태에서, 상기 접합된 조절물질 투여량은 시간이 경과하는 동안 정맥내 투여될 것이다. 게다가, 상기 투여량은 정해진 치료과정 동안 여러 번 투여될 수 있다.
다른 투여계획들은 미국특허 제7,744,877호에 개시된 바와 같이 체표면적(BSA) 계산에 근거를 둘 수 있다. 잘 알려져 있는 바와 같이, BSA는 환자의 키와 체중을 이용하여 계산하며, 그(그녀)의 체표면적으로서 대상자의 사이즈 측정치를 제공한다. 특정 실시형태에서, 조절물질들은 10 mg/m2 내지 800 mg/m2, 50 mg/m2 내지 500 mg/m2의 투여량 및 100 mg/m2, 150 mg/m2, 200 mg/m2, 250 mg/m2, 300 mg/m2, 350 mg/m2, 400 mg/m2 또는 450 mg/m2의 투여량으로 투여될 수 있다.
접합된 조절물질(즉, ADC)들에 대한 적당한 투여량을 결정하기 위해, 공지된 기술들 및 경험적 기술들이 사용될 수 있음을 잘 알 것이다.
어떤 경우에나, DLL3 조절물질들 (접합된 것 및 접합되지 않은 것 모두)은 필요로 하는 대상들에게 필요에 따라 투여되는 것이 바람직하다. 투여 빈도를 결정하는 것은 치료받는 조건, 치료받는 대상의 연령, 치료받는 질환의 심각성, 치료받는 대상의 일반적인 건강상태 등을 고려하여 주치의 의사와 같은, 당업자에 의해 이루어질 수 있다. 일반적으로, 유효 투여량의 DLL3 조절물질은 1회 이상 대상에게 투여된다. 특히, 유효 투여량의 조절물질은 대상에게, 1개월에 1회, 1개월에 1회 이상 또는 1개월에 1회 미만 투여된다. 특정 실시형태에서, 유효 투여량의 DLL3 조절물질은 적어도 1개월, 적어도 6개월, 적어도 1년, 적어도 2년 또는 여러 해를 포함하는 여러 회 투여될 수 있다. 또다른 실시형태에서, 본 조절물질들의 투여 사이에, 수일(2, 3, 4, 5, 6 또는 7), 수주(1, 2, 3, 4, 5, 6, 7 또는 8) 또는 수개월(1, 2, 3, 4, 5, 6, 7 또는 8) 또는 심지어 1년 또는 여러 해가 경과될 수 있다.
어떤 바람직한 실시형태에서, 접합된 조절물질들을 포함하는 치료과정은 수주 또는 수개월 동안 다중 투여량의 선택된 약품을 포함할 것이다. 특히, 본 발명의 접합된 조절물질들은 1일에 1회, 2일에 1회, 4일에 1회, 매주, 10일에 1회, 2주에 1회, 3주에 1회, 1개월에 1회, 6주에 1회, 2개월에 1회, 10주에 1회 또는 3개월에 1회 투여될 수 있다. 이와 관련하여, 환자 반응 및 임상 실습에 기초하여, 투여량이 변경되거나, 간격이 조정될 수 있음을 이해할 수 있을 것이다.
투여량 및 치료계획은 또한, 1회 이상의 투여(들)이 주어진 개인에서 개시된 치료 조성물에 대하여 경험적으로 결정될 수도 있다. 예를 들면, 개인들은 본 명세서에 설명된 대로 제조된 치료 조성물의 증가하는 투여량이 주어질 수 있다. 선택된 실시형태에서, 투여량은 경험적으로 측정된 또는 관찰된 부작용 또는 독성에 기초하여 각각 점진적으로 증가 또는 감소 또는 감쇠될 수 있다. 선택된 조성물의 효능을 평가하기 위해, 특정 질병, 질환 또는 조건의 마커가 위에 기술한 바와 같이 뒤따를 수 있다. 개인이 암을 갖는 실시형태에서, 이들은 촉진 또는 육안 관찰을 통한 종양 크기의 직접적인 측정, x-선 또는 다른 영상 기술들에 의한 종양 크기의 간접적인 측정; 종양 샘플의 직접적인 종양 생검 및 현미경 조사에 의해 평가된 개선; 간접적인 종양 마커 (예를 들면, 전립선 암에 대하여는 PSA) 또는 본 명세서의 방법에 따라 확인된 항원, 통증 또는 마비 감소의 측정; 종양과 관련된 개선된 언어능력, 시력, 호흡 또는 다른 장애; 증가된 식욕; 또는 허용된 시험 또는 생존연장에 의해 측정된 수명의 품질 증가를 포함한다. 투여량이 개인, 종양질환의 종류, 종양질병의 단계 (종양질환이 개인의 다른 영역으로 전이가 시작되었는지의 여부), 및 사용된 과거 및 병행 치료법에 따라 다양할 것임을 당업자라면 분명히 알 것이다.
D. 병용 치료법들
병용 치료법들은 원치않는 종양세포 증식을 감소시키거나 억제하는 것, 암 발생을 감소시키는 것, 암 재발을 감소 또는 예방하는 것, 또는 암 확산 또는 전이를 감소 또는 예방하는데 특히 유용할 수 있다. 상기 경우, 본 발명의 조절물질들은 종양 덩어리를 받치고, 영속화하는 CSC를 제거함으로써, 용적축소 치료(care debulking) 또는 항암제의 현행 표준을 보다 효과적으로 사용할 수 있게 함으로써 민감성 또는 항암제민감성 작용제로서 기능할 수 있다. 즉, 본 조절물질은 특정 실시형태에서, 다른 투여된 치료제의 작용방법을 강력하게 하는 개선된 효과 (예를 들면, 본래 첨가제 또는 상승제)를 제공할 수 있다. 본 발명의 명세서에서, "병용 치료법"은 광범위하게 해석될 수 있으며, 주로 조절물질과, 세포독성제, 세포정지제, 혈관형성 억제제, 용적축소제, 화학요법제, 방사선치료 및 방사선치료제, 표적 항암제 (모노클론성 항체 및 소분자 개체들을 모두 포함), BRM들, 치료용 항체, 암 백신, 사이토카인, 호르몬 치료법, 방사선 치료법 및 항-전이제 및, 특이적 및 비특이적 접근법을 포함하는 면역치료제를 포함하는 (여기에 제한되지 않음) 1개 이상의 항암제들을 투여하는 것을 의미한다.
각 치료 (예를 들면, 항체 및 항암제)가 별도로 진행될 때 관찰된 효과들의 부가적인 병용된 결과들을 위한 조건은 없다. 적어도 부가적인 효과들이 일반적으로 바람직하지만, 단일 치료법 중 하나 이상으로 증가된 항암효과가 유익하다. 그리고, 본 발명은 상승효과를 나타내는 병용 치료를 필요로 하지 않는다. 그러나, 당 분야에 기술을 가진 자들은 바람직한 실시형태를 포함하는 특정 선택된 조합에 의해, 상승작용이 관찰될 수 있음을 알 것이다.
병용 치료법을 실시하는데 있어서, 동일하거나 상이한 투여경로들을 사용하여, 단일 조성물 또는 2개 이상의 구별된 조성물들로, 조절물질 및 항암제가 대상에게 동시에 투여된다. 또는, 조절물질은 몇분 내지 몇주 범위의 간격에 의해 항암제 치료를 선행 또는 뒤따를 수 있다. 각 전달 사이의 시간 주기는 항암제 및 조절물질이 종양에 병용 효과를 발휘할 수 있도록 한다. 적어도 한 실시형태에서, 항암제와 조절물질 둘 다 서로 약 5분 내지 약 2주 내에 투여된다. 또 다른 실시형태에서, 조절물질과 항암제 투여 사이에 수일 (2, 3, 4, 5, 6 또는 7), 수주 (1, 2, 3, 4, 5, 6, 7 또는 8) 또는 수개월 (1, 2, 3, 4, 5, 6, 7 또는 8)이 경과할 수 있다.
병용 치료법은 질환이 치료, 완화 또는 치유될 때까지 일정 시간 동안 적어도 1회, 2회 또는 3회 투여될 수 있다. 어떤 실시형태에서, 병용 치료법은 여러 번, 예를 들면 1일에 3회 내지 6개월에 1회 투여된다. 투여는 1일에 3회, 1일에, 1일에 1회, 2일에 1회, 3일에 1회, 매주 1회, 2주에 1회, 매월 1회, 2개월에1회, 3개월에 1회, 6개월에 1회와 같은 스케쥴로, 또는 미니펌프를 통해 연속투여될 수 있다. 병용 치료법은 이미 지정한 바와 같이, 특정 경로를 통해, 투여될 수 있다. 병용 치료법은 종양 영역으로부터 먼 영역에 투여될 수 있다.
한 실시형태에서, 조절물질은 필요로 하는 대상에 짧은 치료주기 동안 1개 이상의 항암제들과 조합하여 투여된다. 본 발명은 또한, 여러 차례의 부분적인 투여들로 세분화되는 불연속적 투여 또는 매일 투여를 고려한다. 조절물질 및 항암제는 격일 또는 격주로 서로 바뀌어 투여될 수 있으며; 또는 항체 치료 순서가 주어진 후, 1회 이상의 항암제 치료법 치료가 뒤따를 수 있다. 어떠한 상황에도, 당 분야에 통상의 기술을 가진 자들에게 알려져 있는 바와 같이, 적당한 투여량의 화학요법제는 임상치료에 이미 참가했던 자들에게 보통 적용될 것이며, 상기 화학요법제는 단독으로 또는 다른 화학요법제들과 함께 투여된다.
다른 바람직한 실시형태에서, 본 발명의 DLL3 조절물질은 종양 재발 후 질병의 초기 발현할 기회를 감소 또는 제거하기 위한 유지 치료법에 사용될 수 있다. 바람직하게, 질병은 치료될 것이며, 초기 종양 덩어리가 제거, 감소 또는 그렇지 않으면 경감되어, 환자는 증상이 없거나 차도가 있을 것이다. 이때, 표준 진단과정들을 사용하여 질병이 거의 없거나, 증상이 없더라도, 피험자는 약리학적으로 유효량의 본 조절물질들을 1회 이상 투여받을 수 있다. 어떤 실시형태에서, 조절물질은 일정시간동안 규칙적인 스케쥴, 예를 들면 매주, 2주에 1회, 매월, 6주에 1회, 2개월에 1회, 3개월에 1회, 6개월에 1회 또는 연간 투여될 것이다. 본 명세서에 개시된 바와 같이, 당업자는 질병 재발의 잠재성을 감소시키기 위해 바람직한 투여량 및 투여계획들을 쉽게 결정할 수 있었다. 게다가, 상기 치료는 환자 반응 및 임상변수와 진단변수들에 따라, 수주동안, 수개월동안, 수년동안 또는 무기한으로 진행될 수 있었다.
또다른 바람직한 실시형태에서, 본 발명의 조절물질은 용적축소 과정후 종양 전이의 가능성을 방지 또는 감소시키기 위한 보조제 치료법으로서 또는 예방적으로 사용될 수 있다. 본 명세서에 사용된 바와 같이, "용적축소 과정"은 종양 또는 종양 증식을 제거, 감소, 치료 또는 경감시키는 과정, 기술 또는 방법을 의미하며, 광범위하게 정의된다. 용적축소 과정들의 예로는 수술, 방사선 치료(즉, 빔 조사), 화학요법, 면역요법 또는 절개수술을 포함하며, 여기에 제한되지 않는다. 본 명세서의 관점에서 당업자에 의해 쉽게 측정되는 적당한 시간에, 본 조절물질들은 종양 덩어리를 감소시키기 위해, 임상적, 진단적 또는 치료적 과정들에 의해 제시된 대로 투여될 수 있다. 조절물질들은 표준 기술들을 사용하여 측정된 대로 약리학적으로 유효한 투여량으로 1회 이상 투여될 수 있다. 바람직하게, 투여계획은 변형시킬 적당한 진단 또는 모니터링 기술들에 의해 수행될 것이다.
본 발명의 또다른 실시형태는 증식성 질환을 발생시킬 위험에도 무증상 대상들에게 본 조절물질들을 투여하는 것을 포함한다. 즉, 본 발명의 조절물질들은 진정한 예방 차원에 사용될 수 있으며, 검사 또는 테스트받은 환자들 및, 1개 이상의 잘 알려져 있는 위험인자들 (예를 들면, 유전체 징후들, 가족력, 생체내 또는 시험관내 시험결과 등)을 가지지만, 종양형성이 발생하지 않은 환자들에게도 제공될 수 있다. 상기 경우, 당업자들은 경험적 관찰 또는 허용된 임상실습을 통해 효과적인 투여계획을 결정할 수 있다.
E. 항암제
용어 "항암제" 또는 "항-증식제"는 암과 같은 세포증식성 질환을 치료하기 위해 사용될 수 있는 치료제를 의미하며, 세포독성제, 세포정지제, 혈관신생억제제, 용적축소 치료제, 화학요법제, 방사선요법 및 방사선 치료법 치료제, 표적 항암제, BRM들, 치료용 항체들, 암 백신들, 사이토킨, 호르몬 요법들, 방사선 치료법 및 항-전이 치료제 및 면역치료제를 포함하며, 여기에 제한되지 않는다. 상기 개시된 선택된 실시형태에서, 상기 항암제들은 접합체들을 포함할 수 있으며, 투여되기 전에 조절물질들과 회합될 수 있음을 알 것이다. 특정 실시형태에서, 개시된 항암제는 DLL3 조절물질에 연결되어, 본 명세서에 개시된 바와 같이 ADC를 제공할 것이다.
본 명세서에 사용된 용어 "세포독성제"는 세포에 대하여 독성인 물질을 의미하며, 세포들의 기능을 감소 또는 억제하며/하거나, 세포들의 파괴를 야기한다. 일반적으로, 물질은 생 유기체로부터 유도된 자연발생 분자이다. 세포독성제의 예로는 세균의 소분자 독소 또는 효소활성 독소 (예를 들면, 디프테리아 독소, 슈도모나스 내독소 및 외독소, 스타필로코커스 장독소 A), 균류 (예를 들면, α-사신, 레스트릭토신(restrictocin)), 식물 (예를 들면, 아브린, 라이신, 모데신, 비스쿠민, 포크위드(pokeweed) 항바이러스 단백질, 사포린, 겔로닌, 모모리딘, 트라이코산틴, 보리 독소, 알레우리테스 포르디(Aleurites fordii) 단백질들, 다이안틴 단백질들, 파이토라카 메리카나(Phytolacca mericana) 단백질들 (PAPI, PAPII, 및 PAP-S), 모모르디카 차란티아(Momordica charantia) 억제제, 커신(curcin), 크로틴(crotin), 사포나리아 오피시날리스(saponaria officinalis) 억제제, 겔로닌, 미테겔린, 레스트릭토신(restrictocin), 페노마이신, 네오마이신 및 트리코테센(tricothecenes)) 또는 동물들 (예를 들면, 세포독성 RNases, 예를 들면, 세포외 췌장 RNases; DNase I, 이들의 단편들 및/또는 변이형들 포함)이 포함되며, 여기에 제한되지 않는다.
본 발명의 목적을 위해, "화학요법제"는 암세포들의 성장, 증식 및/또는 생존을 비특이적으로 감소 또는 억제하는 화학 화합물 (예를 들면, 세포독성제 또는 세포정지제)를 포함한다. 상기 화학치료제는 세포성장 또는 분열에 필요한 세포내 과정들에 적용되며, 따라서 일반적으로 급속하게 성장 및 분열하는 암세포들에 대하여 특히 효과적이다. 예를 들면, 빈크리스틴은 미소관들을 탈중합시켜서, 세포가 유사분열되는 것을 막는다. 일반적으로, 화학치료제는 암세포 또는 암성으로 되기 쉽거나 발암성 후대 (예를 들면, TIC)를 생성하기 쉬운 세포를 억제하거나, 억제하기 위해 설계된 화학치료제를 포함할 수 있다. 상기 치료제들은 종종 투여되며, CHOP 또는 FOLFIRI와 같은 계획으로 조합하여, 가장 효과적이다. 다시, 선택된 실시형태에서, 상기 화학치료제들은 본 조절물질들에 접합될 수 있다.
본 발명의 조절물질들과 조합(하거나 접합되어) 사용될 수 있는 항암제들의 예로는 알킬화제, 알킬 설포네이트, 아지리딘, 에틸렌이민 및 메틸아멜라민(methylamelamines), 아세토게닌(acetogenins), 캡토테신(camptothecin), 브리오스테틴(bryostatin), 칼리스테틴(callystatin), CC-1065, 크립토타이신(cryptophycins), 돌라스테틴(dolastatin), 듀오카르마이신(duocarmycin), 엘류테로빈(eleutherobin), 판크라티스테틴(pancratistatin), 사르코딕타인(a sarcodictyin), 스폰기스테틴(spongistatin), 질소 머스타드(nitrogen mustards), 항생제(antibiotics), 에네다인(enediyne) 항생제, 다이네미신(dynemicin), 비스포스포네이트(bisphosphonates), 에스페라미신(esperamicin), 크로모단백질 에네다인 항생제 발색단(chromoprotein enediyne antiobiotic chromophores), 아클라시노마이신(aclacinomysins), 악티노마이신(actinomycin), 아우트라마이신(authramycin), 아자세린(azaserine), 블레오마이신(bleomycins), 칵티노마이신(cactinomycin), 카라비신(carabicin), 카르미노마이신(carminomycin), 카르지노필린(carzinophilin), 크로모마이시니스(chromomycinis), 닥티노마이신(dactinomycin), 다우노루비신(daunorubicin), 데토루비신(detorubicin), 6-디아조-5-옥소-L-놀류신, ADRIAMYCIN® 독소루비신, 에피루비신, 에소루비신, 이다루비신, 마르셀로마이신, 미토마이신, 미코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 폿피로마이신(potfiromycin), 퓨로마이신(puromycin), 큐엘라마이신(quelamycin), 로도루비신(rodorubicin), 스트렙토니그린(streptonigrin), 스트렙토조신(streptozocin), 튜버시딘(tubercidin), 유베니멕스(ubenimex), 지노스테틴(zinostatin), 조로비신(zorubicin); 항-대사물질, 에르로티니브(erlotinib), 베무라페니브(vemurafenib), 크리조티니브(crizotinib), 소라페니브(sorafenib), 이브루티니브(ibrutinib), 엔잘루타미드(enzalutamide), 엽산 유사체, 푸린 유사체, 안드로겐, 항-아드레날, 엽산 보충물, 예를 들면 프롤린산, 아세글라톤(aceglatone), 알도포스파미드 글라이코시드(aldophosphamide glycoside), 아미노레불린산(aminolevulinic acid), 에닐우라실(eniluracil), 암사크린(amsacrine), 베스트라부실(bestrabucil), 비산트렌(bisantrene), 에다트락세이트(edatraxate), 데포파민(defofamine), 데메콜신(demecolcine), 디아지큐온(diaziquone), 엘포니틴(elfornithine), 엘립티늄 아세테이트(elliptinium acetate), 에포틸론(epothilone), 에토글루시드(etoglucid), 갈륨 나이트레이트(gallium nitrate), 하이드록시우레아(hydroxyurea), 레티난(lentinan), 로니다이닌(lonidainine), 마이탄시노이드(maytansinoids), 미토구아존(mitoguazone), 미톡산트론(mitoxantrone), 모피단몰(mopidanmol), 나이트라에린(nitraerine), 펜토스타틴(pentostatin), 페나메트(phenamet), 피라루비신(pirarubicin), 로속산트론(losoxantrone), 포도필린산(podophyllinic acid), 2-에틸하이드라지드, 프로카르바진(procarbazine), PSK® 폴리사카라이드 접합체(JHS Natural Products, Eugene, OR), 라족세인(razoxane); 리족신(rhizoxin); 시조피란(sizofiran); 스피로게르마늄(spirogermanium); 테누아존산(tenuazonic acid); 트라이아지큐온(triaziquone); 2,2',2"-트라이클로로트리에틸아민; 트라이코테센(특히 T-2 독소, 베라큐린 A, 로리딘 A 및 안귀딘); 우레탄; 빈데신(vindesine); 다카르바진(dacarbazine); 만노무스틴(mannomustine); 미토브로니톨(mitobronitol); 미톨락톨(mitolactol); 피포브로만(pipobroman); 가시토신(gacytosine); 아라비노시드("Ara-C"); 시클로포스파미드; 티오테파; 탁소이드, 클로란부실; GEMZAR® 겜시타빈(gemcitabine); 6-티오구아닌; 머캅토푸린; 메토트렉세이트; 플레티늄 유사체, 빈블라스틴; 플레티늄; 에토포시드(VP-16); 이포스파미드; 미톡산트론; 빈크리스틴; NAVELBINE® 비노렐빈; 노반트론; 테니포시드; 에다트렉세이트; 다우노마이신; 아미노프테린(aminopterin); 크셀로다(xeloda); 이반드로네이트(ibandronate); 이리노테칸(irinotecan)(Camptosar, CPT-11), 토포아이소머라제 억제제 RFS 2000; 다이플루오로메틸오르니틴; 레티노이드들; 카페시타빈(capecitabine); 콤브레타스타틴(combretastatin); 루코보린(leucovorin); 옥살리플라틴(oxaliplatin); 세포증식을 감소시키는 PKC-알파, Raf, H-Ras, EGFR 및 VEGF-A의 억제제 및 이들 중 어느 하나의 약리허용된 염들, 산 또는 유도체들이 포함되며, 여기에 제한되지 않는다. 또한, 이 정의에 종양 상에서의 호르몬 작용을 조절 또는 억제하는 항-호르몬제, 예를 들면 항-에스트로겐 및 선택적 에스트로겐 수용체 조절물질, 아드레날선에서의 에스트로겐 생성을 조절하는, 효소 아로마타제를 억제하는 아로마타제 억제제 및 항-안드로겐; 뿐만 아니라 트록사시타빈(troxacitabine)(1,3-다이옥솔란 누클레오시드 사이토신 유사체); 안티센스 올리고누클레오티드, 라이보자임, 예를 들면 VEGF 발현 억제제 및 HER2 발현 억제제; 백신, PROLEUKIN® rIL-2; LURTOTECAN® 토포아이소머라제 1 억제제; ABARELIX® rmRH; 비노렐빈(Vinorelbine) 및 에스페라미신(Esperamicins) 및 이들 중 어느 하나의 약리허용된 염, 산 또는 유도체들이 포함된다.
다른 실시형태에서, 본 발명의 조절물질들은 현재 임상실험중이거나 상업용으로 입수가능한 여러 항체들 (또는 면역요법 치료제) 중 하나와 조합하여 사용될 수 있다. 이 때문에, 본 조절물질들은 아바고보맵(abagovomab), 아데카투무맵(adecatumumab), 아푸투주맵(afutuzumab), 알렘투주맵(alemtuzumab), 알투모맵(altumomab), 아마툭시맵(amatuximab), 아나투모맵(anatumomab), 아르시투모맵(arcitumomab), 바비툭시맵(bavituximab), 벡투모맵(bectumomab), 베바시주맵(bevacizumab), 비바투주맵(bivatuzumab), 블리나투모맵(blinatumomab), 브렌툭시맵(brentuximab), 칸투주맵(cantuzumab), 카투맥소맵(catumaxomab), 세툭시맵(cetuximab), 시타투주맵(citatuzumab), 식수투무맵(cixutumumab), 클리바투주맵(clivatuzumab), 코나투무맵(conatumumab), 다라투무맵(daratumumab), 드로지투맵(drozitumab), 둘리고투맵(duligotumab), 두시기투맵(dusigitumab), 데투모맵(detumomab), 다세투주맵(dacetuzumab), 달로투주맵(dalotuzumab), 에크로멕시맵(ecromeximab), 엘로투주맵(elotuzumab), 엔시툭시맵(ensituximab), 에르투맥소맵(ertumaxomab), 에타라시주맵(etaracizumab), 팔레투주맵(farletuzumab), 피클라투주맵(ficlatuzumab), 피기투무맵(figitumumab), 플라보투맵(flanvotumab), 푸툭시맵(futuximab), 가니투맵(ganitumab), 겜투주맵(gemtuzumab), 기렌툭시맵(girentuximab), 글렘바투무맵(glembatumumab), 이브리투모맵(ibritumomab), 이고보맵(igovomab), 임가투주맵(imgatuzumab), 인다툭시맵(indatuximab), 이노투주맵(inotuzumab), 인테투무맵(intetumumab), 이플리무맵(ipilimumab), 이라투무맵(iratumumab), 라베투주맵(labetuzumab), 렉사투무맵(lexatumumab), 린투주맵(lintuzumab), 로보투주맵(lorvotuzumab), 루카투무맵(lucatumumab), 마파투무맵(mapatumumab), 마투주맵(matuzumab), 밀라투주맵(milatuzumab), 민레투모맵(minretumomab), 미투모맵(mitumomab), 목세투모맵(moxetumomab), 나르나투맵(narnatumab), 납투모맵(naptumomab), 네시투무맵(necitumumab), 니모투주맵(nimotuzumab), 노페투모맵(nofetumomabn), 오카라투주맵(ocaratuzumab), 오파투무맵(ofatumumab), 올라라투맵(olaratumab), 오나투주맵(onartuzumab), 오포투주맵(oportuzumab), 오레고보맵(oregovomab), 패니투무맵(panitumumab), 파사투주맵(parsatuzumab), 파트리투맵(patritumab), 펨투모맵(pemtumomab), 퍼투주맵(pertuzumab), 핀투모맵(pintumomab), 프리투무맵(pritumumab), 라코투모맵(racotumomab), 라드레투맵(radretumab), 릴로투무맵(rilotumumab), 리툭시맵(rituximab), 로바투무맵(robatumumab), 사투모맵(satumomab), 시브로투주맵(sibrotuzumab), 실툭시맵(siltuximab), 심투주맵(simtuzumab), 솔리토맵(solitomab), 타카투주맵(tacatuzumab), 나플리투모맵(taplitumomab), 테나투모맵(tenatumomab), 테프로투무맵(teprotumumab), 티가투주맵(tigatuzumab), 토시투모맵(tositumomab), 트라스투주맵(trastuzumab), 투코투주맵(tucotuzumab), 우블리툭시맵(ublituximab), 벨투주맵(veltuzumab), 보르세투주맵(vorsetuzumab), 보투무맵(votumumab), 잘루투무맵(zalutumumab), CC49, 3F8 및 이들의 조합으로 구성된 그룹에서 선택되는 항체와 조합하여 사용될 수 있다.
여전히 다른 특히 바람직한 실시예들은 리툭시맵(rituximab), 트라스투주맵(trastuzumab), 겜투주맵 오조감신(gemtuzumab ozogamcin), 알렘투주맵(alemtuzumab), 이브리투모맵 티욱세탄(ibritumomab tiuxetan), 토시투모맵(tositumomab), 베바시주맵(bevacizumab), 세툭시맵(cetuximab), 파니투무맵(panitumumab), 오파투무맵(ofatumumab), 이필리무맵(ipilimumab) 및 브렌툭시맵 베도틴(brentuximab vedotin)를 포함 (여기에 제한되지 않음)하는 암 치료법을 위한 인증된 항체들을 사용하는 것을 포함할 것이다. 당업자들은 본 명세서의 내용과 호환되는 추가의 항암제들을 쉽게 확인할 수 있을 것이다.
F. 방사선치료
본 발명은 방사선치료 (즉, 감마-조사, X-선, UV-조사, 마이크로파, 전자방출 등과 같이, 종양세포내에 국소로 DNA 손상을 유도하기 위한 메커니즘)에 의해 조절물질들과 조합하기 위해 제공한다. 종양 세포에 방사성동위원소를 직접 전달하는 것을 사용하는 병용 치료법도 또한 고려되며, 표적 항암제 또는 다른 표적 수단들과 관련되어 사용될 수 있다. 일반적으로, 방사선 치료법은 약 1주 내지 약 2주 동안 맥관투여된다. 방사선 치료법은 약 6 내지 7주 동안 두경부암 환자들에게 투여될 수 있다. 선택적으로, 방사선 치료법은 단일 투여량으로, 다중 투여량으로 또는 순차적인 투여량으로 투여될 수 있다.
XI. 적응증
본 발명의 조절물질은 DLL3 관련 질병 중 어느 하나의 발생 또는 재발을 진단, 치료 또는 억제하는데 사용될 수 있음을 알 것이다. 따라서, 단독으로 투여되던지, 또는 항암제 또는 방사선치료법과 조합하여 투여되든지, 본 발명의 조절물질들은 양성 또는 악성 종양들 (예를 들면, 부신, 간, 신장, 방광, 유방, 위장, 난소, 직장, 전립선, 췌장, 폐, 갑상선, 간, 자궁, 자궁내막, 식도 및 자궁 암종들; 육종들; 교아종들; 및 다양한 두경부 종양들); 백혈병 및 림프구 악성종양들; 다른 질병들, 예를 들면 뉴런, 신경교, 성상세포, 시상하부 및 다른 선, 대식세포, 상피, 기질 및 포배강 질환들; 및 염증성, 혈관신생, 면역학적 질환들 및 병원균에 의해 유발된 질환들을 포함하는 환자 또는 실험대상들의 종양질환들을 일반적으로 치료하기 위해 사용가능하다. 본 발명의 범주 내에 혈액학적 악성종양이 있더라도, 특히, 치료를 위한 중요한 표적은 고형 종양을 포함하는 종양 질환들이다. 치료되는 "대상" 또는 "환자"는 본원에 사용된 바와 같이, 특정 포유동물종들을 포함하지만, 바람직하게는, 인간일 것이다.
보다 특이적으로, 본 발명에 따른 치료되는 종양 질환들은 부신 종양, AIDS-관련 암, 포상 연부 육종, 성상세포 종양, 방광암 (편평상피암 및 이행세포암종), 골암 (법랑질종, 동맥류성 골낭종, 골연골종, 골육종), 뇌 및 척수암, 전이성 뇌종양, 유방암, 경동맥체 종양, 자궁경부암, 연골육종, 척삭종, 난염성 신장 세포 암종, 투명세포 암종, 대장암, 직장암, 피하 양성 섬유성 조직구종, 결합조직형성 소규모 원형세포종양, 상의세포종, 유잉 종양, 골외 점액성 연골육종, 골성 불완전 섬유생성증, 뼈의 섬유성골 이형성, 담낭암 및 담도암, 임신성 영양아층증, 생식세포 종양, 두경부암, 도세포 종양, 카포시 육종, 신장암(신아세포종, 유두상 신세포암), 백혈병, 지방종/양성 지방종성 종양, 지방육종/악성 지방종성 종양, 간암(간아세포종, 간세포 암종), 림프종, 폐암(소세포암종, 선암, 편평상피암, 대세포암 등), 수모세포종, 흑색종, 수막종, 접합 내분비선 신생물, 다발성 골수종, 골수 이형성 증후군, 신경아세포종, 신경내분비 종양, 난소암, 췌장암, 유두상 갑상선암, 부갑상선 종양, 소아과 암, 말초 신경초 종양, 크롬친화세포종, 뇌하수체 종양, 전립선암, 후부 포도막 흑색종(posterious unveal melanoma), 희귀 혈액학 질병, 전이 신암, 간상소체 종양, 횡문근육종, 육종, 피부암, 연질-조직 육종, 편평세포암, 위암, 활막육종, 고환암, 흉선암, 흉선종, 전이 갑상선암, 및 자궁암(자궁경부암, 자궁내막 종양 및, 평활근종)으로 구성된 그룹으로부터 선택될 수 있다.
어떤 바람직한 실시형태에서, 증식성 질환은 부신암, 간암, 신장암, 방광암, 유방암, 위암, 난소암, 자궁경부암, 자궁암, 식도암, 직장암, 전립선암, 췌장암, 폐암(소세포 및 비소세포 모두), 갑상선암, 암종, 육종, 교아종 및 여러 두경부 종양을 포함하고, 여기에 제한되지 않는 고형 종양을 포함할 것이다. 다른 바람직한 실시형태에서, 하기 실시예에 나타난 바와 같이, 개시된 조절물질들은 소세포폐암(SCLC) 및 비-소세포폐암(NSCLC) (예를 들면, 편평상피 세포 비-소세포 폐암 또는 편평상피 세포 소세포 폐암)을 치료하는데 특히 효과적이다. 한 실시형태에서, 폐암은 난치병이며, 재발되거나 플래티늄 주성분의 제제 (예를 들면, 카르보플라틴, 시스플라틴, 옥살리플라틴, 토포테칸) 및/또는 탁산 (예를 들면, 도세탁셀, 파클리탁셀, 라로탁셀 또는 카바지탁셀)에 대하여 내성을 갖는다. 그리고, 특히 바람직한 실시형태에서, 본 조절물질들은 소세포 폐암을 치료하기 위한 접합체 형태로 사용될 수 있다.
소세포 폐암과 관련하여, 특히 바람직한 실시형태는 접합된 조절물질들의 투여(ADC)를 포함할 것이다. 선택된 실시형태에서, 접합된 조절물질들은 제한된 단계 질환을 나타내는 환자들에게 투여될 것이다. 다른 실시형태에서, 본 조절물질들은 확장기 단계의 질환을 나타내는 환자들에게 투여될 것이다. 다른 바람직한 실시형태에서, 본 접합된 조절물질은 난치 환자들(즉, 초기 치료과정동안 또는 완료한 직후 재발한 환자들)에게 투여될 것이다. 또다른 실시형태는 민감한 환자들 (즉, 1차 치료후 2-3개월 이상 경과한 환자들)에게 본 조절물질을 투여하는 단계를 포함한다. 각 경우에, 적합한 조절물질들은 선택된 투여계획 및 임상 진단에 따라 접합된 또는 비접합된 상태로 될 수 있음을 이해할 수 있을 것이다.
상기 논의된 바와 같이, 본 조절물질들은 신경내분비 종양을 포함하는 신경내분비 특성들 또는 표현형들을 갖는 종양을 예방, 치료 또는 진단하기 위해 추가로 사용될 수 있다. 분산성 내분비계로부터 발생하는 진성의 또는 전형적인 신경내분비 종양(NET)들은 100,000명 당 2-5명이 발병할 정도로 비교적 희귀하지만, 매우 공격적이다. 내분비 종양은 신장, 비뇨생식관(방광, 전립선, 난소, 자궁경관 및 자궁내막), 위장관(결장, 위), 갑상선(갑상선 수질암), 및 폐(소세포 폐암종 및 대세포 신경내분비암종)에서 발생한다. 이러한 종양들은 카르시노이드 증후군으로 알려져 있는 쇠약하게 하는 증상들을 유발시킬 수 있는 세로토닌 및/또는 크로모그라닌을 포함하는 여러 호르몬들을 분비할 수 있다. 상기 종양들은 양성 면역조직화학 마커, 예를 들면 뉴런-특이적 에놀라제(NSE, 감마 에놀라제라고도 알려져 있음, 유전자 기호 = ENO2), CD56 (또는 NCAM1), 크로모그라닌 A (CHGA), 및 시냅토파이신 (SYP)에 의해, 또는 ASCL1과 같은 높은 발현을 나타내는 것으로 알려진 유전자들에 의해 나타낼 수 있다. 불행히도, 전통적인 화학치료법들은 NET를 치료하는데 특히 효과적이지 않으며, 간 전이가 일반적인 결과이다.
본 조절물질들이 신경내분비 종양들을 치료하는데 유리하게 사용될 수 있지만, 이들은 전형적인 진성 신경내분비 종양과 유전자형으로 또는 표현형으로 모방하고, 유사하거나 이 종양에 의한 일반적인 특성들을 나타내는 가성 신경내분비 종양(pNET)들을 치료, 예방 또는 진단하는데 사용될 수도 있다. 가성 신경내분비 종양 또는 신경내분비 종양 특성들을 갖는 종양들은 확산성 신경내분비 시스템의 세포들, 또는 신경내분비 분화 캐스케이드가 종양형성 과정 동안 비정상적으로 재활성된 세포들로부터 발생되는 종양들이다. 상기 pNETs는 생물학적으로 활성인 아민, 신경전달물질들 및 펩타이드 호르몬의 부분집합을 생성할 수 있는 능력을 포함하는, 일반적으로 정의된 신경내분비 종양과 특정 표현형 또는 생화학적 특성들을 보통 공유한다. 조직학적으로, 상기 종양(NET 및 pNET)들은 단조로운 세포병리학의 최소한의 세포질 및 원형 내지 타원형의 점묘형 핵과 밀접하게 연결된 소세포들을 종종 나타내는 일반적인 겉모습을 공유한다. 본 발명의 목적을 위해, 신경내분비 및 가성 신경내분비 종양을 정의하는데 사용될 수 있는, 일반적으로 발현된 조직학적 마커 또는 유전학적 마커는 크로모그라닌 A, CD56, 시냅토파이신, PGP9.5, ASCL1 및 뉴런-특이적 에놀라제(NSE)를 포함할 수 있지만, 여기에 제한되지 않는다.
따라서, 본 발명의 조절물질은 가성 신경내분비 종양 및 진성 신경내분비 종양 모두를 치료하기 위해 유익하게 사용될 수 있다. 이와 관련하여, 본 명세서에 기술된 바와 같이 조절물질들이 신장, 비뇨생식관(방광, 전립선, 난소, 자궁경관, 및 자궁내막), 위장관(직장, 위), 갑상선(갑상선 수질암), 및 폐(소세포 폐암종 및 대세포 신경내분비 암종)에서 발생하는 신경내분비 종양(NET 및 pNET 모두)을 치료하기 위해 사용될 수 있다. 게다가, 본 발명의 조절물질들은 NSE, CD56, 시냅토파이신, 크로모그라닌 A, ASCL1 및 PGP9.5 (UCHL1)로 구성된 그룹에서 선택되는 1개 이상의 마커들을 발현하는 종양들을 치료하기 위해 사용될 수 있다. 즉, 본 발명은 NSE+ 또는 CD56+ 또는 PGP9.5+ 또는 ASCL1+ 또는 SYP+ 또는 CHGA+ 또는 이들의 조합인 종양에 걸린 대상을 치료하기 위해 사용될 수 있다.
혈액 악성종양들에 관련하여, 본 발명의 화합물 및 방법들이 저급/NHL 여포성 림프종(FCC), 외투세포 림프종(MCL), 확산된 대세포성 림프종(DLCL), 소림프구(SL) NHL, 중급/난포 NHL, 중간 등급 확산된 NHL, 고급 면역아세포성 NHL, 고급 림프아세포성 NHL, 고급 소형 비-분해 세포 NHL, 벌키 질병 NHL, 발덴스트롬 마크로글로불린혈증(Waldenstrom's Macroglobulinemia), 림프형질세포성 림프종(LPL), 외투세포 림프종(MCL), 여포성 림프종(FL), 확산성 대세포 림프종 (DLCL), 버키트 림프종(Burkitt's lymphoma)(BL), AIDS-관련 림프종, 단핵구성 B세포 림프종, 혈관면역모세포 림프절병증, 소림프구성, 여포성, 확산성 대세포, 확산성 소형 분해세포, 대세포 면역모세포종 림프아세포종, 소형, 비-분해된, 버키트(Burkitt's) 및 비-버키트(non-Burkitt's), 여포성(follicular), 대부분 대세포; 여포성, 대부분 소형 분해세포; 및 여포성, 혼합된 소형 분해 및 대형 세포 림프종을 포함하는 여러 B-세포 림프종을 치료하는데 특히 효과적일 수 있음을 알 것이다. Gaidono et al., "Lymphomas", IN CANCER: PRINCIPLES & PRACTICE OF ONCOLOGY, Vol. 2: 2131-2145 (DeVita et al., eds., 5.sup.th ed. 1997)를 참조한다. 상기 림프종이 변화하는 분류시스템으로 인해 다른 이름들을 종종 가질 것이고, 다른 이름으로 분류된 림프종을 갖는 환자들도 본 발명의 병용 치료계획으로부터 이익을 얻을 수 있음이 당업자에게는 분명해 질 것이다.
본 발명은 또한, 양성 또는 전암성 종양을 나타내는 대상의 보존적 또는 예방적 치료를 위해 제공한다. DLL3 관련 질병 외에, 특정 종류의 종양 또는 증식성 질환이 본 발명을 사용한 치료로부터 배제되어야 한다고 생각되지 않는다. 그러나, 종양세포의 종류는 2차 치료제들, 특히 화학요법제 및 표적 항암제들과 조합하여 본 발명의 용도와 관련될 수 있다.
XII. 제조 물품들
1 이상의 투여량의 DLL3 조절물질을 포함하는, 1개 이상의 내용물들을 포함하는 약리용 팩 및 키트도 또한 제공된다. 특정 실시형태에서, 단위투여량이 예를 들면, 항-DLL3 항체를 포함하는 예정된 양의 조성물을 1개 이상의 부가치료제들과 함께 또는 없이, 함유하는 단위 투여량은 제공된다. 다른 실시형태를 위해, 상기 단위 투여량은 단일-용도로 미리 채워진 주사용 주사기에 공급된다. 또다른 실시형태에서, 단위 투여량내에 함유된 조성물은 식염수, 수크로오스 등; 포스페이트와 같은 완충제 등을 포함할 수 있고/있거나; 안정적이고 유효한 pH 범위 내에서 배합될 수 있다. 또는, 특정 실시형태에서, 조성물은 멸균수와 같은 적당한 액체를 첨가할 때 재구성될 수 있는 동결건조 분말로서 제공될 수 있다. 어떤 바람직한 실시형태에서, 조성물은 수크로오스 및 아르기닌을 포함하는 단백질 응집을 저해하는 1개 이상의 물질들을 포함하지만, 여기에 제한되지 않는다. 용기(들)과 관련있는 특정의 라벨은 담겨진 조성물이 선택한 질병상태를 진단 또는 치료하기 위해 사용됨을 보여준다.
본 발명은 DLL3 조절물질 및, 선택적으로 1개 이상의 항암제들의 단일-투여 또는 다중-투여 단위를 생성하기 위한 키트를 제공한다. 상기 키트는 용기 및 라벨 또는 용기와 회합되거나 패키지 삽입을 포함한다. 적당한 용기들은 예를 들면 병, 바이알, 주사기 등을 포함한다. 용기들은 유리 또는 플라스틱과 같은 다양한 재료들로 제조될 수 있으며, 접합체 또는 비접합체 형태의 본 조절물질들을 약리학적으로 유효한 양을 함유할 수 있다. 다른 바람직한 실시형태에서, 용기(들)은 멸균 접촉포트 (예를 들면, 용기는 피하주사바늘에 의해 뚫을 수 있는 스토퍼를 갖는 바이알 또는 정맥내 용액 백일 수 있음)를 포함한다. 상기 키트들은 일반적으로 적당한 용기 내에 DLL3 조절물질의 약리허용 배합물 및, 선택에 따라서는 같거나 또는 상이한 용기에 1개 이상의 항암제들을 함유할 것이다. 상기 키트들은 진단 또는 병용 치료법을 위해 다른 약리허용 배합물을 함유할 수도 있다. 예를 들면, 본 발명의 DLL3 조절물질에 더해, 상기 키트는 화학요법제 또는 방사선치료약물과 같은 항암제; 항-맥관형성제; 항-전이제; 표적화한 항암제; 세포독성제; 및/또는 다른 항암제들의 범위 중 1개 이상을 함유할 수 있다. 상기 키트들은 또한, DLL3 조절물질을 항암제 또는 진단제와 접합하기 위한 적당한 시약들을 제공할 수 있다 (예를 들면, 미국특허 제7,422,739호, 본원에 전부 참조로 반영됨).
보다 특이적으로, 키트는 추가의 성분들과 함께 또는 없이 DLL3 조절물질을 함유하는 단일 용기를 가지거나, 각 원하는 치료제를 위한 구별된 용기들을 가질 수 있다. 병용 치료제들이 접합을 위해 제공되는 경우, 단일 용액은 균등몰량 조합으로, 또는 한 성분과 과량의 다른 성분과 함께 미리 혼합될 수 있다. 또는, DLL3 조절물질 및 키트의 임의의 항암제는 환자에게 투여하기 전에 구별된 용기들 내에서 유지될 수 있다. 키트는 또한, 주사용 정균수(BWFI), 인산-완충 식염수(PBS), 링거액 및 덱스트로오스 용액과 같은 멸균의 약리허용 완충제 또는 다른 희석제를 함유하기 위한 제2/제3 용기 수단을 포함할 수 있다.
키트의 성분들이 1개 이상의 액체 용액으로 제공될 경우, 액체 용액은 수용액인 것이 바람직하며, 멸균 수용액이 특히 바람직하다. 그러나, 키트의 성분들은 건조 분말(들)로서 제공될 수 있다. 시약들 또는 성분들이 건조 분말로 제공되는 경우, 분말은 적당한 용매를 첨가함으로써 재구성될 수 있다. 용매가 다른 용기내에 제공될 수도 있다.
위에 간단하게 설명되는 바와 같이, 키트들은 동물 또는 환자에게 항체 및 임의 성분들을 투여하는 수단들, 예를 들면 1개 이상의 바늘 또는 주사기, 또는 점적기, 피펫 또는 다른 상기 유사 기구를 포함할 수도 있으며, 배합물은 동물에게 주사 또는 도입되거나, 감소된 체표면에 적용될 수 있다. 본 발명의 키트는 바이알 등을 포함하기 위한 수단들 및, 원하는 바이알 및 다른 장치들이 위치 및 보유된 주입식 또는 사출성형식 플라스틱 용기들과 같이, 상업용으로 시판되는 좁은 공간의 다른 요소를 포함할 것이다. 특정 라벨 또는 패키지 삽입물은 DLL3 조절물질 조성물이 암, 예를 들면 소세포 폐암을 치료하는데 사용됨을 보여준다.
바람직한 실시형태에서, 본 발명의 조절물질들은 증식성 질환들을 진단 또는 치료하는데 유용한 진단 또는 치료 장치들과 공동으로 또는 구성되어 사용될 수 있다. 예를 들면, 바람직한 실시형태에서, 본 발명의 화합물 및 조성물은 증식성 질환의 병인 또는 증대에 관여된 세포들 또는 마커를 검사, 모니터링, 정량화 또는 프로파일링하는데 사용될 수 있는 특정 진단장치 또는 장비와 조합될 수 있다. 선택된 실시형태를 위해, 마커 화합물은 NSE, CD56, 시냅토파이신, 크로모그라닌 A, 및 PGP9.5를 함유할 수 있다.
특히 바람직한 실시형태에서, 생체내 또는 시험관내 순환 종양세포들을 검사, 모니터링 및/또는 정량화하기 위해 장치들을 사용할 수 있다 (예를 들면, WO 2012/0128801을 참조하며, 이는 본원에 참조로 반영됨). 또다른 바람직한 실시형태에서, 그리고 상기 논의된 바와 같이, 순환하는 종양세포들은 암 줄기세포를 포함할 수 있다.
XIII. 연구 시약
본 발명의 다른 바람직한 실시형태는 또한, 유동 세포분석법, 형광 활성화 세포분류(FACS), 자기 활성화 세포분류(MACS) 또는 레이저 매개 분할과 같은 방법들을 통해 종양 개시 세포들의 개체군들 또는 부분모집단을 확인하거나, 감시하거나, 분리하거나, 분할하거나 또는 풍부하게 하는 데 유용한 수단으로 개시된 조절물질들의 특성들을 이용한다. 본 발명분야에 숙달된 사람들이라면 조절물질들이 암 줄기 세포들을 포함하는 TIC를 특성평가하고 조작하기 위한 여러 적합한 기술들에 사용될 수 있음을 이해할 것이다 (예를 들면, U.S.S.Ns. 12/686,359, 12/669,136 및 12/757,649를 참조하며, 이들은 각각 본원 참고로 반영된다).
XIV. 기타사항들
본원에서 다르게 정의되지 않는 한, 본 발명과 관련되어 사용된 과학적, 기술적 용어들은 당 분야에 통상의 기술을 가진 자들에게 일반적으로 이해되는 의미들을 가질 것이다. 그리고, 본원에서 다르게 요구되지 않는 한, 단수는 복수를 포함할 것이며, 복수는 단수를 포함할 것이다. 보다 구체적으로, 본 명세서 및 첨부된 특허청구범위에 사용된 바와 같이, 단수 형태는 다르게 명확하게 기술하지 않는 한 복수를 포함한다. 따라서, 예를 들면, "단백질"은 복수의 단백질들을 포함하며; "세포"는 세포들의 혼합물들을 포함한다. 게다가, 본 명세서 및 첨부된 특허청구범위에 제공된 범위들은 상한과 하한, 및 상한과 하한 사이의 모든 지점들을 포함한다. 그러므로, 2.0 내지 3.0의 범위는 2.0, 3.0, 및 2.0과 3.0 사이의 모든 지점들을 포함한다.
일반적으로, 본 명세서에 설명된 세포 및 조직 배양, 분자생물학, 면역학, 미생물학, 유전학 그리고 단백질 및 핵산 화학 그리고 혼성화와 관련되어 사용된 명명법들 및 기술들은 당 분야에 잘 알려진 것들이며, 당 분야에서 일반적으로 사용된 것들이다. 본 발명의 방법들 및 기술들은 당 분야에 잘 알려진 종래의 방법들에 따라, 그리고 다르게 지시되지 않는 한 본 명세서 전체에 인용 및 설명된 여러 일반적인 그리고 더욱 구체적인 참고문헌들에 기술된 바대로 수행된다. 예를 들면, Abbas et al., Cellular and Molecular Immunology, 6th ed., W.B. Saunders Company (2010); Sambrook J. & Russell D. Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (2000); Ausubel et al., Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Wiley, John & Sons, Inc. (2002); Harlow and Lane Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1998); 그리고 Coligan et al., Short Protocols in Protein Science, Wiley, John & Sons, Inc. (2003). 효소반응 및 정제기술들은 당 분야에서 일반적으로 수행되거나 본원에 설명된 바대로, 제조사의 설명서에 따라 수행된다. 본 명세서에 설명된 분석화학, 합성 유기화학, 및 의약 화학과 관련되어 사용된 명명법 및 실험과정들 및 기술들은 잘 알려져 있는 것들이며, 당 분야에 일반적으로 사용된 것들이다. 게다가, 본 명세서에 사용된 섹션 제목들은 구성적인 목적일 뿐, 본 명세서의 주제를 제한하기 위한 것은 아니다.
XV. DLL3 참고문헌들
본 명세서의 범위 안에 개시된 또는 인용된 모든 참고문헌들 또는 기록들은, 아래에 바로 제시된 것들을 포함하여, 제한 없이, 그 내용이 전부 참조로 본원에 포함되어 있다.
Apelqvist A et al. (1999). Notch signalling controls pancreatic cell differentiation. Nature. 400:877-81. PMID: 10476967.
Bigas A and Espinosa L (2012). Hematopoietic stem cells: to be or Notch to be. Blood. 2012 PMID: 22308291.
Cabrera CV (1990). Lateral inhibition and cell fate during neurogenesis in Drosophila: the interactions between scute, Notch and Delta. Development. 110:733-42. PMID: 1709404.
Chapman G et al. (2011). Notch inhibition by the ligand DELTA-LIKE 3 defines the mechanism of abnormal vertebral segmentation in spondylocostal dysostosis. Hum Mol Genet. 20:905-16. PMID: 21147753.
Chen H et al. (1997). Conservation of the Drosophila lateral inhibition pathway in human lung cancer: a hairy-related protein (HES-1) directly represses achaete-scute homolog-1 expression. Proc Natl Acad Sci U S A. 94:5355-60. PMID: 9144241.
Cook M et al., (2010). Notch in the development of thyroid C-cells and the treatment of medullary thyroid cancer. Am J Transl Res. 2:119-25. PMID: 20182588.
de la Pompa JL et al (1997). Conservation of the Notch signaling pathway in mammalian neurogenesis. Development. 124:1139-48. PMID: 9102301.
D'Souza B et al. (2010). Canonical and non-canonical Notch ligands. Curr Top Dev Biol. 92:73-129. PMID: 20816393.
Dunwoodie SL (2009). The role of Notch in patterning the human vertebral column. Curr Opin Genet Dev. 19:329-37. PMID: 19608404.
Dutta S et al., (2008). Notch signaling regulates endocrine cell specification in the zebrafish anterior pituitary. Dev Biol. 319:248-57. PubMed PMID: 18534570.
Fre S et al. (2005). Notch signals control the fate of immature progenitor cells in the intestine. Nature. 435:964-8. PMID: 15959516.
Fre S et al. (2009). Notch and Wnt signals cooperatively control cell proliferation and tumorigenesis in the intestine. Proc Natl Acad Sci U S A. 106:6309-14. PMID: 19251639.
Galluzzo P, and Bocchetta M (2011). Notch signaling in lung cancer. Expert Rev Anticancer Ther. 11:533-40. PMID: 21504320.
Geffers I et al. (2007). Divergent functions and distinct localization of the Notch ligands DLL1 and DLL3 in vivo. J Cell Biol. 178:465-76. PMID: 17664336.
Glittenberg M, et al., (2006). Role of conserved intracellular motifs in Serrate signalling, cis-inhibition and endocytosis. EMBO J. 25:4697-706. PMID: 17006545.
Goldbeter A, and Pourquie O (2008). Modeling the segmentation clock as a network of coupled oscillations in the Notch, Wnt and FGF signaling pathways. J Theor Biol. 252:574-85.PMID: 18308339.
Habener JF et al. (2005). Minireview: transcriptional regulation in pancreatic development. Endocrinology.146:1025-34. PMID: 15604203.
Harris PJ et al. (2012). Targeting embryonic signaling pathways in cancer therapy. Expert Opin Ther Targets. PMID: 22239436.
Henke RM et al. (2009). Ascl1 and Neurog2 form novel complexes and regulate Delta-like3 (DLL3) expression in the neural tube. Dev Biol. 328:529-40. PMID: 19389376.
Hoyne GF, et al. (2011). A cell autonomous role for the Notch ligand Delta-like 3 in αβ T-cell development. Immunol Cell Biol. 89:696-705. PMID: 21151194.
Huber K et al., (2002). Development of chromaffin cells depends on MASH1 function. Development. 129:4729-38. PMID: 12361965.
Ito T et al. (2000). Basic helix-loop-helix transcription factors regulate the neuroendocrine differentiation of fetal mouse pulmonary epithelium. Development. 127:3913-21. PMID: 10952889.
Jensen J et al. (2000). Control of endodermal endocrine development by Hes-1. Nat Genet. 24:36-44. PMID: 10615124.
Kageyama R, et al. (2007). Oscillator mechanism of Notch pathway in the segmentation clock. Dev Dyn. 236:1403-9. PMID: 17366573.
Kameda Y et al. (2007). Mash1 regulates the development of C cells in mouse thyroid glands. Dev Dyn. 236:262-70. PMID: 17103415.
Klein T, et al. (1997). An intrinsic dominant negative activity of serrate that is modulated during wing development in Drosophila. Dev Biol. 189:123-34. PMID: 9281342.
Klimstra DS, et al. (2010). The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems. Pancreas. 39:707-12. PMID: 20664470.
Klㆆppel G. (2011). Classification and pathology of gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer. 18 Suppl 1:S1-16. PMID: 22005112.
Koch U and Radtke F (2010). Notch signaling in solid tumors. Curr Top Dev Biol. 92:411-55. PMID: 20816403.
Kusumi K et al. (1998). The mouse pudgy mutation disrupts Delta homologue DLL3 and initiation of early somite boundaries. Nat Genet. 19:274-8. PMID: 9662403.
Ladi E et al. (2005). The divergent DSL ligand DLL3 does not activate Notch signaling but cell autonomously attenuates signaling induced by other DSL ligands. J Cell Biol. 170:983-92. PMID: 16144902.
Liu J et al. (2010). Notch signaling in the regulation of stem cell self-renewal and differentiation. Curr Top Dev Biol. 92:367-409. PMID: 20816402.
Nagase H et al. (2011). γ-Secretase-regulated signaling pathways, such as notch signaling, mediate the differentiation of hematopoietic stem cells, development of the immune system, and peripheral immune responses. Curr Stem Cell Res Ther. 6:131-41. PMID: 21190540.
Raetzman LT et al. (2004). Developmental regulation of Notch signaling genes in the embryonic pituitary: Prop1 deficiency affects Notch2 expression. Dev Biol. 265:329-40. PMID: 14732396.
Rebay I, et al., (1991). Specific EGF repeats of Notch mediate interactions with Delta and Serrate: implications for Notch as a multifunctional receptor. Cell. 67:687-99. PMID: 1657403.
Sakamoto K et al. (2002). Intracellular cell-autonomous association of Notch and its ligands: a novel mechanism of Notch signal modification. Dev Biol. 241:313-26. PMID: 11784114.
Schonhoff SE et al. (2004). Minireview: Development and differentiation of gut endocrine cells. Endocrinology. 145:2639-44. PMID: 15044355.
Shimizu K et al. (1999). Mouse jagged1 physically interacts with notch2 and other notch receptors. Assessment by quantitative methods. J Biol Chem. 274:32961-9. PMID: 10551863.
Shinkai Y et al. (2004). New mutant mouse with skeletal deformities caused by mutation in delta like 3 (DLL3) gene. Exp Anim. 53:129-36. PMID: 15153675.
Schonhoff SE et al. (2004). Minireview: Development and differentiation of gut endocrine cells. Endocrinology. 145:2639-44. PMID: 15044355.
Sprinzak D etal. (2010). Cis-interactions between Notch and Delta generate mutually exclusive signalling states. Nature. 465:86-90. PMID: 20418862.
Sriuranpong V et al. (2002). Notch signaling induces rapid degradation of achaete-scute homolog 1. Mol Cell Biol. 22:3129-39. PMID: 11940670.
Sternberg PW (1988). Lateral inhibition during vulval induction in Caenorhabditis elegans. Nature. 335:551-4. PMID: 3419532.
Wharton KA, et al., (1985). Nucleotide sequence from the neurogenic locus notch implies a gene product that shares homology with proteins containing EGF-like repeats. Cell. 43:567-81. PMID: 3935325.
Yao JC et al. (2008). One hundred years after "carcinoid": epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 26:3063-72. PMID: 18565894.
Zarebczan B, Chen H (2010). Signaling mechanisms in neuroendocrine tumors as targets for therapy. Endocrinol Metab Clin North Am. 39:801-10. PMID: 21095546.
XVI. 발명의 선택된 실시형태들
본원의 개시 및 실시예들 외에도, 본 발명은 아래에 바로 구체적으로 기재된 선택된 실시형태들에 관한 것이기도 하다.
확정적이 아닌 추정되는 특허청구범위들:
1. 단리된 DLL3 조절물질.
2. 제1항에 있어서, DLL3 조절물질은 DLL3 길항제를 포함하는, 단리된 DLL3 조절물질.
3. 제1항에 있어서, DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는, 단리된 DLL3 조절물질.
4. 제3항에 있어서, 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는, 단리된 DLL3 조절물질.
5. 제4항에 있어서, 모노클론성 항체가 키메라성 항체들, 인간화 항체들 및 인간 항체들로 이루어진 군에서 선택되는, 단리된 DLL3 조절물질.
6. 제4항에 있어서, 상기 모노클론성 항체가 중화 항체를 포함하는, 단리된 DLL3 조절물질.
7. 제4항에 있어서, 상기 모노클론성 항체가 고갈화 항체를 포함하는, 단리된 DLL3 조절물질.
8. 제4항에 있어서, 상기 모노클론성 항체가 내재화 항체를 포함하는, 단리된 DLL3 조절물질.
9. 제8항에 있어서, 상기 모노클론성 항체가 세포독성제를 더 포함하는, 단리된 DLL3 조절물질.
10. 제4항에 있어서, 상기 모노클론성 항체가 세 개의 상보성 결정 영역들을 가진 경쇄 가변 영역과 세 개의 상보성 결정 영역들을 가진 중쇄 가변 영역을 포함하는 것으로 중쇄 및 경쇄의 상보성 결정 영역들은 도 11a 내지 도 11ad 또는 도 11b 내지 도 11bd에 제시된 적어도 하나의 상보성 결정 영역을 포함하는, 단리된 DLL3 조절물질.
11. 제4항에 있어서, 상기 모노클론성 항체가 경쇄 가변 영역과 중쇄 가변 영역을 포함하고, 상기 경쇄 가변 영역은 서열번호 20, 서열번호 22, 서열번호 24, 서열번호 26, 서열번호 28, 서열번호 30, 서열번호 32, 서열번호 34, 서열번호 36, 서열번호 38, 서열번호 40, 서열번호 42, 서열번호 44, 서열번호 46, 서열번호 48, 서열번호 50, 서열번호 52, 서열번호 54, 서열번호 56, 서열번호 58, 서열번호 60, 서열번호 62, 서열번호 64, 서열번호 66, 서열번호 68, 서열번호 70, 서열번호 72, 서열번호 74, 서열번호 76, 서열번호 78 서열번호 80, 서열번호 82, 서열번호 84, 서열번호 86, 서열번호 88, 서열번호 90, 서열번호 92, 서열번호 94, 서열번호 96, 서열번호 98, 서열번호 100, 서열번호 102, 서열번호 104, 서열번호 106, 서열번호 108, 서열번호 110, 서열번호 112, 서열번호 114, 서열번호 116, 서열번호 118, 서열번호 120, 서열번호 122, 서열번호 124, 서열번호 126, 서열번호 128, 서열번호 130, 서열번호 132, 서열번호 134, 서열번호 136, 서열번호 138, 서열번호 140, 서열번호 142, 서열번호 144, 서열번호 146, 서열번호 148, 서열번호 150, 서열번호 152, 서열번호 154, 서열번호 156, 서열번호 158, 서열번호 160, 서열번호 162 서열번호 164, 서열번호 166, 서열번호 168, 서열번호 170, 서열번호 172, 서열번호 174, 서열번호 176, 서열번호 178, 서열번호 180, 서열번호 182, 서열번호 184, 서열번호 186, 서열번호 188, 서열번호 190, 서열번호 192, 서열번호 194, 서열번호 196, 서열번호 198, 서열번호 200 및 서열번호 202에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60%의 동일성을 갖는 아미노산 서열을 포함하며 상기 중쇄 가변 영역은 서열번호 21, 서열번호 23, 서열번호 25, 서열번호 27, 서열번호 29, 서열번호 31, 서열번호 33, 서열번호 35, 서열번호 37, 서열번호 39, 서열번호 41, 서열번호 43, 서열번호 45, 서열번호 47, 서열번호 49, 서열번호 51 , 서열번호 53, 서열번호 55, 서열번호 57, 서열번호 59, 서열번호 61, 서열번호 63, 서열번호 65, 서열번호 67, 서열번호 69, 서열번호 71, 서열번호 73, 서열번호 75, 서열번호 77, 서열번호 79, 서열번호 81, 서열번호 83, 서열번호 85, 서열번호 87, 서열번호 89, 서열번호 91, 서열번호 93, 서열번호 95, 서열번호 97, 서열번호 99, 서열번호 101, 서열번호 103, 서열번호 105, 서열번호 107, 서열번호 109, 서열번호 111, 서열번호 113 , 서열번호 115, 서열번호 117, 서열번호 119, 서열번호 121, 서열번호 123, 서열번호 125, 서열번호 127, 서열번호 129, 서열번호 131, 서열번호 133, 서열번호 135, 서열번호 137, 서열번호 139, 서열번호 141, 서열번호 143, 서열번호 145, 서열번호 147, 서열번호 149, 서열번호 151, 서열번호 153, 서열번호 155, 서열번호 157, 서열번호 159, 서열번호 161, 서열번호 163, 서열번호 165, 서열번호 167, 서열번호 169, 서열번호 171, 서열번호 173, 서열번호 175, 서열번호 177, 서열번호 179, 서열번호 181, 서열번호 183, 서열번호 185, 서열번호 187, 서열번호 189, 서열번호 191, 서열번호 193, 서열번호 195, 서열번호 197, 서열번호 199, 서열번호 201 및 서열번호 203에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60%의 동일성을 갖는 아미노산 서열을 포함하는, 단리된 DLL3 조절물질.
12. 제11항에 있어서, 제시된 중쇄 또는 경쇄 가변 영역들의 어느 하나 유래의 CDR을 포함하는, 단리된 DLL3 조절물질.
13. 경쟁하는 항체를 포함하는 단리된 DLL3 조절물질로서, 상기 경쟁하는 항체는 제10항 또는 제11항의 단리된 DLL3 조절물질의 DLL3에의 결합을 적어도 약 40%만큼 억제하는 것인 단리된 DLL3 조절물질.
14. 제 11항의 아미노산 중쇄 가변 영역 또는 아미노산 경쇄 가변 영역을 암호화하는 핵산.
15. 제14항의 핵산을 포함하는 벡터.
16. 제1항에 있어서, 서열번호 3에 제시된 아미노산 서열 또는 그것의 단편을 포함하는, 단리된 DLL3 조절물질.
17. 제16항에 있어서, DLL3 조절물질은 면역글로불린 불변 영역의 적어도 일부를 더 함유하는, 단리된 DLL3 조절물질.
18. 제1항에 있어서, 상기 조절물질은 그것을 필요로 하는 대상에게 투여 시 종양 개시 세포들의 출현빈도를 감소시키는, 단리된 DLL3 조절물질.
19. 제18항에 있어서, 출현빈도 감소는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 유동 세포계측 분석을 이용하여 측정되는, 단리된 DLL3 조절물질.
20. 제18항에 있어서, 출현빈도 감소는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 면역조직화학적 탐지를 사용하여 측정되는, 단리된 DLL3 조절물질.
21. 제18항에 있어서, 상기 종양 개시 세포들은 종양 영속화 세포들을 포함하는, 단리된 DLL3 조절물질.
22. 제1항에 있어서, 세포독성제를 더 포함하는, 단리된 DLL3 조절물질.
23. 제1항의 단리된 DLL3 조절물질을 포함하는 약제 조성물.
24. 제23항에 있어서, 상기 단리된 DLL3 조절물질은 모노클론성 항체를 포함하는, 약제 조성물.
25. 제24항에 있어서, 상기 모노클론성 항체는 인간화 항체를 포함하는, 약제 조성물.
26. 제25항에 있어서, 상기 인간화 항체는 세포독성제를 포함하는, 약제 조성물.
27. 제26항에 있어서, 상기 세포독성제는 피롤로벤조다이아제핀을 포함하는, 약제 조성물.
28. 필요로 하는 대상에게 치료유효량의 DLL3 조절물질을 투여하는 단계를 포함하는 DLL3 관련 질환을 치료하는 방법.
29. 제28항에 있어서, 상기 DLL3 조절물질은 DLL3 길항제를 포함하는 것인 방법.
30. 제28항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 방법.
31. 제30항에 있어서, 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 방법.
32. 제31항에 있어서, 모노클론성 항체가 키메라성 항체들, 인간화 항체들 그리고 인간 항체들로 이루어진 군에서 선택되는 것인 방법.
33. 제32항에 있어서, 상기 모노클론성 항체가 경쇄 가변 영역과 중쇄 가변 영역을 포함하고, 상기 경쇄 가변 영역은 서열번호 20, 서열번호 22, 서열번호 24, 서열번호 26, 서열번호 28, 서열번호 30, 서열번호 32, 서열번호 34, 서열번호 36, 서열번호 38, 서열번호 40, 서열번호 42, 서열번호 44, 서열번호 46, 서열번호 48, 서열번호 50, 서열번호 52, 서열번호 54, 서열번호 56, 서열번호 58, 서열번호 60, 서열번호 62, 서열번호 64, 서열번호 66, 서열번호 68, 서열번호 70, 서열번호 72, 서열번호 74, 서열번호 76, 서열번호 78 서열번호 80, 서열번호 82, 서열번호 84, 서열번호 86, 서열번호 88, 서열번호 90, 서열번호 92, 서열번호 94, 서열번호 96, 서열번호 98, 서열번호 100, 서열번호 102, 서열번호 104, 서열번호 106, 서열번호 108, 서열번호 110, 서열번호 112, 서열번호 114, 서열번호 116, 서열번호 118, 서열번호 120, 서열번호 122, 서열번호 124, 서열번호 126, 서열번호 128, 서열번호 130, 서열번호 132, 서열번호 134, 서열번호 136, 서열번호 138, 서열번호 140, 서열번호 142, 서열번호 144, 서열번호 146, 서열번호 148, 서열번호 150, 서열번호 152, 서열번호 154, 서열번호 156, 서열번호 158, 서열번호 160, 서열번호 162 서열번호 164, 서열번호 166, 서열번호 168, 서열번호 170, 서열번호 172, 서열번호 174, 서열번호 176, 서열번호 178, 서열번호 180, 서열번호 182, 서열번호 184, 서열번호 186, 서열번호 188, 서열번호 190, 서열번호 192, 서열번호 194, 서열번호 196, 서열번호 198, 서열번호 200 및 서열번호 202에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60%의 동일성을 갖는 아미노산 서열을 포함하며 상기 중쇄 가변 영역은 서열번호 21, 서열번호 23, 서열번호 25, 서열번호 27, 서열번호 29, 서열번호 31, 서열번호 33, 서열번호 35, 서열번호 37, 서열번호 39, 서열번호 41, 서열번호 43, 서열번호 45, 서열번호 47, 서열번호 49, 서열번호 51 , 서열번호 53, 서열번호 55, 서열번호 57, 서열번호 59, 서열번호 61, 서열번호 63, 서열번호 65, 서열번호 67, 서열번호 69, 서열번호 71, 서열번호 73, 서열번호 75, 서열번호 77, 서열번호 79, 서열번호 81, 서열번호 83, 서열번호 85, 서열번호 87, 서열번호 89, 서열번호 91, 서열번호 93, 서열번호 95, 서열번호 97, 서열번호 99, 서열번호 101, 서열번호 103, 서열번호 105, 서열번호 107, 서열번호 109, 서열번호 111, 서열번호 113 , 서열번호 115, 서열번호 117, 서열번호 119, 서열번호 121, 서열번호 123, 서열번호 125, 서열번호 127, 서열번호 129, 서열번호 131, 서열번호 133, 서열번호 135, 서열번호 137, 서열번호 139, 서열번호 141, 서열번호 143, 서열번호 145, 서열번호 147, 서열번호 149, 서열번호 151, 서열번호 153, 서열번호 155, 서열번호 157, 서열번호 159, 서열번호 161, 서열번호 163, 서열번호 165, 서열번호 167, 서열번호 169, 서열번호 171, 서열번호 173, 서열번호 175, 서열번호 177, 서열번호 179, 서열번호 181, 서열번호 183, 서열번호 185, 서열번호 187, 서열번호 189, 서열번호 191, 서열번호 193, 서열번호 195, 서열번호 197, 서열번호 199, 서열번호 201 및 서열번호 203에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60%의 동일성을 갖는 아미노산 서열을 포함하는 것인 방법.
34. 제33항에 있어서, 상기 모노클론성 항체가 인간화 항체인 것인 방법.
35. 제31항에 있어서, 상기 모노클론성 항체가 중화 항체를 포함하는 것인 방법.
36. 제31항에 있어서, 상기 모노클론성 항체가 내재화 항체를 포함하는 것인 방법.
37. 제36항에 있어서, 상기 내재화 항체가 세포독성제를 포함하는 것인 방법.
38. 제37항에 있어서, 상기 세포독성제가 피롤로벤조다이아제핀을 포함하는 것인 방법.
39. 제38항에 있어서, 상기 DLL3 관련 질환이 종양 질환을 포함하는 것인 방법.
40. 제39항에 있어서, 상기 종양 질환이 신경내분비 특성들을 나타내는 종양을 포함하는 것인 방법.
41. 제40항에 있어서, 상기 신경내분비 특성들을 나타내는 종양은 신경내분비 종양을 포함하는 것인 방법.
42. 제39항에 있어서, 상기 종양 질환이 혈액 종양을 포함하는 것인 방법.
43. 제42항에 있어서, 상기 혈액 종양은 백혈병 또는 림프종을 포함하는 것인 방법.
44. 제39항에 있어서, 상기 종양 질환에 걸린 대상이 종양 개시 세포들을 포함하는 종양들을 나타내는 것인 방법.
45. 제44항에 있어서, 상기 대상에서 종양 개시 세포들의 출현빈도를 감소시키는 단계를 더 포함하는 것인 방법.
46. 제45항에 있어서, 출현빈도 감소는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 유동 세포계측 분석 또는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 면역조직화학적 탐지를 사용하여 측정되는 것인 방법.
47. 제45항에 있어서, 출현빈도 감소는 시험관 내 또는 생체 내 한계 희석 분석을 사용하여 결정되는 것인 방법.
48. 제47항에 있어서, 출현빈도 감소는 `면역손상된 마우스들 속으로 살아있는 인간 종양 세포들을 이식하는 단계를 포함하는 생체 내 한계 희석 분석을 사용하여 결정되는 것인 방법.
49. 제48항에 있어서, 생체 내 한계 희석 분석을 사용하여 결정되는 출현빈도 감소는 뿌아송 분포 통계학을 사용하여 종양 개시 세포 출현빈도를 정량화하는 단계를 포함하는 것인 방법.
50. 제47항에 있어서, 출현빈도 감소는 시험관 내 콜로니 지지 상태들 속으로 살아있는 인간 종양 세포들을 한계 희석 분석하는 단계를 포함하는 시험관 내 한계 희석 분석을 사용하여 결정되는 것인 방법.
51. 제50항에 있어서, 시험관 내 한계 희석 분석을 사용하여 결정되는 출현빈도 감소는 뿌아송 분포 통계학을 사용하여 종양 개시 세포 출현빈도를 정량화하는 단계를 포함하는 것인 방법.
52. 제28항에 있어서, 항암제를 투여하는 단계를 더 포함하는 것인 방법.
53. 제28항에 있어서, 상기 DLL3 조절물질은 서열번호 20 내지 203의 어느 하나로부터의 하나 이상의 CDR들을 포함하는 것인 방법.
54. 제28항에 있어서, 상기 DLL3 조절물질은 범-DLL 조절물질을 포함하는 것인 방법.
55. 필요로 하는 대상에게 DLL3 조절물질을 투여하는 단계를 포함하는 그것을 필요로 하는 상기 대상에서 종양 개시 세포들의 출현빈도를 감소시키는 방법.
56. 제55항에 있어서, 종양 개시 세포들은 종양 영속화 세포들을 포함하는 것인 방법.
57. 제56항에 있어서, 상기 종양 영속화 세포들은 CD324+ 또는 CD46+ 세포들인 것인 방법.
58. 제55항에 있어서, 상기 DLL3 조절물질은 항체를 포함하는 것인 방법.
59. 제58항에 있어서, 상기 항체는 모노클론성 항체를 포함하는 것인 방법.
60. 제59항에 있어서, 상기 모노클론성 항체는 세포독성제를 더 포함하는 것인 방법.
61. 제55항에 있어서, 대상이 부신암, 방광암, 자궁경부암, 자궁내막암, 신장암, 간암, 폐암, 난소암, 직장결장암, 췌장암, 전립선암 및 유방암으로 이루어진 군에서 선택된 종양 질환에 걸린 것인 방법.
62. 제55항에 있어서, 종양 개시 세포들의 출현빈도가 적어도 10%만큼 감소된 것인 방법.
63. 제55항에 있어서, 출현빈도 감소는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 유동 세포계측 분석 또는 종양 개시 세포들에 풍부한 것으로 알려진 종양 세포 표면 마커들의 면역조직화학적 탐지를 사용하여 측정되는 것인 방법.
64. DLL3 조절물질을 대상에게 투여하는 단계를 포함하는 혈액 종양에 걸린 상기 대상을 치료하는 방법.
65. 제64항에 있어서, 상기 DLL3 조절물질은 모노클론성 항체를 포함하는 것인 방법.
66. 대상에게 DLL3 조절물질을 투여하는 단계를 포함하는 항암제에 의한 치료를 위한 상기 대상의 종양을 감작시키는 방법.
67. 제66항에 있어서, 상기 DLL3 조절물질은 항체를 포함하는 것인 방법.
68. 제66항에 있어서, 상기 종양이 고형 종양인 것인 방법.
69. 제66항에 있어서, 상기 항암제가 화학요법제를 포함하는 것인 방법.
70. 제66항에 있어서, 상기 항암제가 면역요법제를 포함하는 것인 방법.
71. 필요로 하는 대상의 증식성 질환을 진단하는 방법으로서,
a. 상기 대상의 조직 샘플을 얻는 단계;
b. 상기 조직 샘플을 적어도 하나의 DLL3 조절물질과 접촉시키는 단계; 그리고
c. 상기 샘플과 관련된 DLL3 조절물질을 탐지하거나 또는 정량화하는 단계
를 포함하는 방법.
72. 제71항에 있어서, DLL3 조절물질은 모노클론성 항체를 포함하는 것인 방법.
73. 제72항에 있어서, 항체는 조작가능하게 리포터와 회합된 것인 방법.
74. DLL3 관련 질환들을 진단하거나 치료하는 데에 유용한 제조 물품으로서, DLL3 관련 질환을 치료하거나 진단하기 위한 목적의 DLL3 조절물질을 함유하는 용기와 상기 DLL3 조절물질을 사용하기 위한 교육 자료를 포함하는 것인 제조 물품.
75. 제74항에 있어서, 상기 DLL3 조절물질은 모노클론성 항체인 것인 제조 물품.
76. 제74항에 있어서, 용기는 판독가능 플레이트를 포함하는 것인 방법.
77. 치료유효량의 적어도 하나의 내재화 DLL3 조절물질을 투여하는 단계를 포함하는 종양 질환에 걸린 대상을 치료하는 방법.
78. 제77항에 있어서, 상기 DLL3 조절물질은 항체를 포함하는 것인 방법.
79. 제78항에 있어서, 상기 항체가 모노클론성 항체를 포함하는 것인 방법.
80. 제79항에 있어서, 모노클론성 항체가 세포독성제를 더 포함하는 것인 방법.
81. 제80항에 있어서, 항암제를 투여하는 단계를 더 포함하는 것인 방법.
82. 치료유효량의 적어도 하나의 중화 DLL3 조절물질을 투여하는 단계를 포함하는 종양 질환에 걸린 대상을 치료하는 방법.
83. 제82항에 있어서, 상기 DLL3 조절물질은 항체를 포함하는 것인 방법.
84. 제83항에 있어서, 상기 항체가 모노클론성 항체를 포함하는 것인 방법.
85. 제84항에 있어서, 상기 모노클론성 항체가 인간화 항체를 포함하는 것인 방법.
86. 제85항에 있어서, 상기 인간화 항체가 세포독성제를 더 포함하는 것인 방법.
87. 제82항에 있어서, 종양 질환이 신경내분비 특성들을 나타내는 종양을 포함하는 것인 방법.
88. 상기 종양 개시 세포들을 DLL3 조절물질과 접촉시키는 단계를 포함하는 종양 개시 세포들의 개체군을 확인하거나, 분리하거나, 분할하거나 또는 풍부하게 하는 방법.
89. 제88항에 있어서, 상기 DLL3 조절물질은 항체를 포함하는 것인 방법.
90. 인간화 항체를 포함하는 DLL3 조절물질로서, 상기 인간화 항체는 경쇄 가변 영역과 중쇄 가변 영역을 포함하고, 상기 경쇄 가변 영역은 서열번호 204, 서열번호 206, 서열번호 208, 서열번호 210 및 서열번호 212에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60% 동일성을 갖는 아미노산 서열을 포함하며 상기 중쇄 가변 영역은 서열번호 205, 서열번호 207, 서열번호 209, 서열번호 211 및 서열번호 213에 제시된 아미노산 서열들로 이루어진 군에서 선택된 아미노산 서열과 적어도 60% 동일성을 갖는 아미노산 서열을 포함하는 DLL3 조절물질.
91. 치료유효량의 DLL3 조절물질을 투여하는 단계를 포함하는 필요로 하는 대상에서 전이를 억제하거나 또는 예방하는 방법.
92. 제91항에 있어서, 대상이 DLL3 조절물질의 투여 전 또는 후에 용적축소 절차 검사를 받는 것인 방법.
93. 제92항에 있어서, 상기 용적축소 절차는 적어도 한 가지 항암제의 투여를 포함하는 것인 방법.
94. 치료유효량의 DLL3 조절물질을 투여하는 단계를 포함하는 필요로 하는 대상에 대한 유지 요법을 수행하는 방법.
95. 제94항에 있어서, 상기 대상은 DLL3 조절물질의 투여 전에 종양 질환으로 치료받았던 것인 방법.
96. DLL3 조절물질을 투여하는 단계를 포함하는 증식성 질환에 걸린 대상에서 종양 개시 세포들을 고갈화하는 방법.
97. DLL3 조절물질을 투여하는 단계를 포함하는 필요로 하는 대상에서 DLL3 관련 질환을 생체 내에서 진단하거나, 탐지하거나 또는 감시하는 방법.
98. 순환하는 종양 세포들을 DLL3 조절물질과 접촉시키는 단계를 포함하는 필요로 하는 대상에서 DLL3 관련 질환을 진단하거나, 탐지하거나 또는 감시하는 방법.
99. 제98항에 있어서, 상기 접촉하는 단계는 생체 내에서 일어나는 것인 방법.
100. 제98항에 있어서 상기 접촉하는 단계는 시험관 내에서 일어나는 것인 방법.
101. 치료유효량의 DLL3 조절물질을 투여하는 단계를 포함하는 필요로 하는 환자에서 신경내분비 특성들을 나타내는 종양을 치료하는 방법.
102. 제101항에 있어서, 상기 신경내분비 특성들을 나타내는 종양이 신경내분비 종양인 것인 방법.
103. SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에서 선택된 항체에서 파생된 DLL3 조절물질.
104. DLL3의 EGF1 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
105. 제104항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
106. 제105항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
107. 제106항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
108. 제107항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
109. 제108항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
110. DLL3의 EGF2 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
111. 제110항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
112. 제111항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
113. 제112항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
114. 제113항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
115. 제114항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
116. DLL3의 EGF3 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
117. 제116항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
118. 제117항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
119. 제118항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
120. 제119항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
121. 제120항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
122. DLL3의 EGF4 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
123. 제122항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
124. 제123항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
125. 제124항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
126. 제125항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
127. 제126항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
128. DLL3의 EGF5 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
129. 제128항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
130. 제129항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
131. 제130항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
132. 제131항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
133. 제132항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
134. DLL3의 EGF6 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
135. 제134항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
136. 제135항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
137. 제136항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
138. 제137항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
139. 제138항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
140. DLL3의 DSL 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
141. 제140항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
142. 제141항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
143. 제142항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
144. 제143항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
145. 제144항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
146. DLL3의 N-말단 도메인과 회합된 에피토프에 결합하는 단리된 DLL3 조절물질.
147. 제146항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 DLL3 조절물질.
148. 제147항에 있어서, 상기 항체 또는 그것의 면역반응 단편이 모노클론성 항체를 포함하는 것인 DLL3 조절물질.
149. 제148항에 있어서, 상기 DLL3 조절물질은 ADC를 포함하는 것인 DLL3 조절물질.
150. 제149항에 있어서, 상기 ADC가 피롤로벤조다이아제핀을 포함하는 것인 DLL3 조절물질.
151. 제150항에 있어서, 링커를 더 포함하는 것인 DLL3 조절물질.
152. bin A, bin B, bin C, bin D, bin E, bin F, bin G, bin H 및 bin I로 이루어진 군에서 선택된 빈에 존재하는 단리된 DLL3 조절물질.
153. SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에서 선택된 기준 항체에 의해 정의된 빈에 존재하는 단리된 DLL3 조절물질.
154. 식:
M-[L-D]n
의 항체 약물 접합체 또는 그것의 약제학적으로 허용되는 염으로서,
a) M은 DLL3 조절물질을 포함하고;
b) L은 임의의 링커를 포함하고;
c) D는 항증식제이며; 그리고
d) n 은 약 1 에서 약 20까지의 정수인
항체 약물 접합체 또는 그것의 약제학적으로 허용되는 염.
155. 제154항에 있어서, 상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는 것인 항체 약물 접합체.
156. 제155항에 있어서, 상기 항체는 모노클론성 항체를 포함하는 것인 항체 약물 접합체.
157. 제156항에 있어서, 상기 항체는 SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에 선택된 항체에서 파생된 것인 항체 약물 접합체.
158. 제157항에 있어서, 상기 항체는 인간화된 것인 항체 약물 접합체.
159. 제154항에 있어서, 링커는 절단가능한 링커를 포함하는 것인 항체 약물 접합체.
160. 제159항에 있어서, 상기 절단가능한 링커는 펩티딜 링커를 포함하는 것인 항체 약물 접합체.
161. 제154항에 있어서, 상기 항증식제는 세포독성제를 포함하는 것인 항체 약물 접합체.
162. 제161항에 있어서, 상기 세포독성제가 피롤로벤조다이아제핀을 포함하는 것인 항체 약물 접합체.
163. 제162항에 있어서, 상기 피롤로벤조다이아제핀은 피롤로벤조다이아제핀 다이머를 포함하는 것인 항체 약물 접합체.
164. 서열번호 20 내지 203의 어느 하나에서 유래된 CDR을 포함하는 DLL3 조절물질.
165. 제164항에 있어서, 상기 조절물질은 서열번호 20 내지 203의 어느 하나에서 유래된 다수의 CDR들을 포함하는 것인 DLL3 조절물질.
166. SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에서 선택된 기준 항체와 DLL3 단백질에의 결합을 경쟁하는 DLL3 항체 조절물질로서, DLL3 항체 조절물질의 DLL3 단백질에의 결합이 적어도 30% 만큼 억제되는 것인 DLL3 항체 조절물질.
167. 아미노산들 Q93, P94, G95, A96 및 P97 (서열번호 9)을 포함하는 DLL3 단백질 에피토프에 결합하는 DLL3 조절물질.
168. 아미노산들 G203, R205 및 P206 (서열번호 10)을 포함하는 DLL3 단백질 에피토프에 결합하는 DLL3 조절물질.
실시예
따라서, 본 발명은 하기 실시예들을 참고하여 보다 쉽게 이해될 것이며, 이는 예증의 방법으로 제공되며, 본 발명을 한정하기 위한 것은 아니다. 본 실시예들은 하기 실험예들이 모든 또는 일부의 수행된 실험들임을 나타내기 위한 것이 아니다. 특별히 다르게 지시하지 않는 한, 부는 중량부이며, 분자량은 중량평균분자량이며, 온도는 섭씨도이고, 압력은 대기압 또는 부근이다.
실시예 1
신경내분비 특성들을 갖는 선택된 종양들에서 마커 발현의 분석
분산성 내분비 시스템으로부터 발생하는 신경내분비 종양(NET)은 100,000명 당 2-5명이 발병할 정도로 희귀하지만, 매우 공격적이다. 신경내분비 종양은 부신, 신장, 비뇨생식관(방광, 전립선, 난소, 자궁경관 및 자궁내막), 췌장, 위장관(위 및 직장), 갑상선(갑상선 수질암) 및 폐(소세포 폐암종, 대세포 신경내분비 암종 및 암양종)에서 발생한다. 이러한 종양들은 카르시노이드 증후군으로 알려져 있는 쇠약증상을 유발할 수 있는 세로토닌 및/또는 크로모그라닌 A를 포함하는 여러 호르몬들을 분비할 수 있다. 이러한 종양들은 신경-특이적 에놀라제(NSE, 감마 에놀라제라고도 알려져 있음, 유전자 기호=ENO2), CD56/NCAM1 및 시냅토파이신과 같은 양성 면역조직화학적 마커들에 의해 표시될 수 있다. 전통적인 화학요법들은 NET를 치료하는데 성공적이지 못했으며, 전이성 확산으로 인한 사망률이 일반적인 결말이다. 불행히도, 대부분의 경우, 조기 발견 및 종양 전이되기 전에만, 수술이 유일한 가능한 근치적 치료법이다. 본 명세서에서, 신경내분비 특성들을 포함하는 종양들과 관련된 새로운 치료적 표적들을 확인하기 위한 작업이 착수되었다.
암환자에 존재하는 종양들을 동정 및 특성평가하기 위해, 큰 비-전통적인 이종이식(NTX) 종양 은행을 개발하고, 당 분야에 공지된 기술들을 사용하여 유지하였다. 다양한 고형 종양 악성종양들에 의해 고통받는 수많은 암환자들로부터 본래 얻어진 이질성 종양세포들의 여러 번의 배양을 통해 면역력이 약화된 마우스에 상당한 수의 별개의 종양세포주(cell line)들을 포함하는 NTX 종양 은행이 전파되었다. (본 실시예 및 도면 중 일부에서, 시험 샘플의 계대수(passage number)는 샘플 지정에 p0-p#으로 표시되며, p0은 환자 종양으로부터 직접 얻어진 비배양 샘플의 표시이며, 및 p#는 시험 전 마우스를 통해 종양이 배양된 횟수의 표시임을 노트한다.) 잘 정의된 혈통을 갖는 별도의 조기 배양 NTX 종양세포주의 대다수의 연속 유용성은 세포주로부터 정제된 세포들의 동정 및 특성평가를 용이하게 한다. 상기 작업에서, 최소로 배양된 NTX 세포주들은 생체내 실험을 간소화하며, 쉽게 증명할 수 있는 결과들을 제공한다. 게다가, 조기 배양 NTX 종양들은 이리노테칸(즉, Camptosar®)과 같은 치료제 및 시스플라틴/에토포시드 계획에 반응하며, 이들은 종양성장을 이끄는 기본 메커니즘, 현 치료법에 대한 내성 및 종양 재발로 임상적으로 적절한 통찰을 제공한다.
NTX 종양 세포주가 정립됨에 따라, 이들의 표현형은 전체적 유전자 발현을 검사하기 위한 다양한 방법으로 특성평가되었다. 뱅크내 NTX 주가 NET인지 확인하기 위해, 전체 전사체 서열분석 및/또는 마이크로어레이 분석에 의해 유전자 발현 프로파일들이 생성되었다. 특히, 이 데이터는 NET내에 높은 것으로 알려져 있고, 신경내분비 분화의 조직화학적 마커들 (예를 들면, ASCL1, NCAM1, CHGA) 뿐만 아니라 노치 신호전달의 억제의 지표인 노치 경로 유전자들의 변화(예를 들면, 노치 수용체의 수준 감소, 및 리간드 및 활성조절물질 분자들로 변화)를 갖는 종양으로서 사용된 특정 유전자들의 높은 레벨들을 발현하는 종양들을 확인하기 위해 조사되었다.
특히, 다양한 NTX 종양 세포주들을 정립할 때, 심각하게 면역에 문제있는 마우스내 인간 종양에 대하여 통상적으로 실시됨에 따라, 종양은 800 내지 2,000 mm3에 도달한 후 절제하고, 당 분야에 공지된 효소소화기술들을 사용하여 세포들을 분리하여 현탁액으로 분산시켰다 (예를 들면, 미국특허 2007/0292414를 참조하며, 이는 본원에 참조로 반영됨). 그 후, 뮤린 세포들을 감소시키고, 인간 종양 세포 부분모집단을 형광활성 세포분류에 의해 추가 분리하고, RLTplus RNA 분해 완충제(Qiagen)내에서, 상기 NTX 주로부터의 단리된 세포 제조물을 분해하였다. 그후, 이들 분해물을 사용할 때까지 -80°C에서 저장하였다. 해동할 때, 전체 RNA를 판매사의 사용설명서에 따라 RNeasy 분리 키트(Qiagen)를 사용하여 추출하고, 제조사의 프로토콜 및 권장 설비 셋팅을 사용하여 Nanodrop 분광광도계(Thermo Scientific) 및 Bioanalyzer 2100 (Agilent Technologies) 상에서 다시 정량화하였다. 얻은 총 RNA 제조물은 유전자 서열분석 및 유전자 발현 분석에 적당했다.
Applied Biosystems (ABI) SOLiD (Sequencing by Oligo Ligation/Detection) 4.5를 사용한 전체 전사체 서열분석 또는 SOLiD 5500 xl 후세대 서열분석 시스템(Life Technologies)은 NTX 주들로부터의 RNA 샘플들 상에서 수행하였다. 저투입 총 RNA 또는 Ovation RNA-Seq 시스템 V2™ (NuGEN Technologies Inc.)을 위해 디자인된 ABI제 변형된 전체 전사체(WT) 프로토콜을 사용하여 전체 RNA 샘플들로부터 cDNA가 생성되었다. 변형된 저투입 WT 프로토콜은 전체 RNA 1.0ng을 사용하여, 맵핑된 유전자 발현의 무거운 3' 편향으로 안내하는 3' 말단에서 mRNA를 증폭시키는 반면, NuGen's 시스템은 전사체 내내 보다 일관된 증폭을 하며, 무작위 헥사머를 사용하여 mRNA와 비-폴리아데닐화 전사물 모두의 증폭을 포함한다. cDNA 라이브러리를 단편화하고, 바코드 어댑터를 부가하여, 다른 샘플들로부터 단편 라이브러리들을 풀링(pooling)시켰다.
ABI's SOLiD 4.5 및 SOLiD 5500xl 후세대 서열분석 플랫폼들은 여러 NTX 주들 및 분류된 군집들로부터 전사체들의 병렬 서열분석을 가능하게 한다. 각 RNA 샘플로부터 cDNA 라이브러리를 구성하고, 단편화하고, 바코드 입력하였다. 각 단편 라이브러리의 바코드들은 여러 샘플들을 같은 농도에서 풀링시키며 함께 진행하여, 동일한 특이성을 보장한다. ABI's SOLiD™ EZ Bead™ 로봇 시스템을 사용한 에멀젼 PCR을 통해 샘플들을 취해서, 샘플 일관성을 확보한다. 풀내에 존재하는 단일 비드 상에서 각 클론 증폭된 단편에 대하여, 페어드-엔드 서열분석(Paired-end sequencing)은 5'에서 3' 방향으로 50개의 염기 리드 및 3'에서 5' 방향으로 25개의 염기 리드를 생성시킨다. 5500xl 플랫폼의 경우, 상기 방법에서 풀링된 8개의 샘플들 모든 세트에 대하여, 비드들은 단일 칩 상의 6개의 단일 채널 레인들로 균일하게 디포짓된다. 이는, 8개의 샘플들 각각에 대하여, 평균 5천만 50개의 염기 리드 및 5천만 25개의 염기 리드를 생성시킬 것이며, 종양세포내 mRNA 전사물의 매우 정확한 재현(representation)을 생성한다. 인간 유전체의 NCBI 버전 hg19.2을 사용한 RefSeq 버전 47에 의해 주석을 달거나, 대부분의 샘플내 RNA 수준의 입증할 수 있는 측정치를 제공한 바와 같이, SOLiD 플랫폼에 의해 생성된 데이터를 34,609개의 유전자들로 맵핑하였다.
SOLiD 플랫폼은 발현뿐만 아니라 SNP, 공지된 및 공지되지 않은 대체 스플라이싱 이벤트, 소형 비-암호화 RNA 및 리드 범위(coverage) (사전에 비-주석 유전체 위치로 유일하게 맵핑된 리드)에만 기초한 잠재적으로 새로운 엑손 발견들을 캡쳐할 수 있다. 따라서, 발현된 mRNA 전사물들의 특이적 스플라이싱 변이형들을 위한 차이점 및/또는 선호도뿐만 아니라 차별된 전사물 발현의 발견을 위해, 독점 데이터 분석 및 구상화 소프트웨어에 의해 페어링된 후세대 서열분석 플랫폼을 사용하게 된다. SOLiD 플랫폼으로부터의 서열분석 데이터는 표준 실습에서와 같이 기초적인 차별된 발현 분석을 가능하게 하는, 메트릭스 RPM (100만개당 리드) 및 RPKM (백만개당 킬로베이스 당 리드)를 사용하여, 전사물 발현값으로서 명목적으로 재현된다.
4개의 소세포 폐암(SCLC) 종양들(LU73, LU64, LU86 및 LU95), 1개의 난소 종양(OV26) 및 대세포 신경내분비 암종(LCNEC; LU37)을 완전 전사체 서열분석을 하면, NET에서 통상적으로 발견되는 유전자 발현 패턴이 측정되었다 (도 4a). 보다 구체적으로, 상기 종양들은 고발현의 여러 개의 NET 마커들 (ASCL1, NCAM1, CHGA) 뿐만 아니라 감소된 수준의 노치 수용체들 및 활성조절물질 분자들 (예를 들면, HES1, HEY1) 및 노치 억제의 상승된 마커들 (예를 들면, DLL3 및 HES6)을 가졌다. 이와 대조적으로 4개의 정상적인 폐 샘플들, 3개의 폐 선암종양들(LU137, LU146 및 LU153), 및 3개의 편평상피성 세포폐암종 (LU49, LU70 및 LU76)은 모두 다양한 노치 수용체 및 활성조절물질 분자들의 발현을 가지며, HES6및 DLL3과 같은 노치 억제물의 높은 발현은 나타내지 않는다.
종양 뱅크내 NTX가 NET임을 확인한 후, 비-NET와 비교할 때 NET내에서 상향조절된 강력한 치료용 표적(LU_SCC, LU_Ad, 및 정상 폐를 포함)을 발견하기 위해 완전 전사체 서열분석을 사용하여 각각 분석하였다. 정상 폐, 정상 난소, 다른 OV NTX, LU_Ad 및 LU_SCC NTX 주들의 낮은 발현 내지 비-존재 발현과 대조되는, SCLC, LCNEC, 및 OV26을 포함하는 NET NTX 종양에서 DLL3의 높은 발현이 발견되었다 (도 4b). DLL3이 노치 신호전달의 공지된 억제인자이기 때문에, 다양한 정상조직 타입과 관련된 DLL3의 높은 발현은 매우 흥미롭다. 이 경우, 및 생성된 데이터의 관점에서, DLL3은 잠재적 면역치료용 표적으로서 추가 분석을 위해 선택되었다.
DLL3이 특정 증식성 질환들을 조절 및 치료하기 위한 성공가능한 표적인 것으로 입증될 수 있다는 발견에 의해, DLL3 변이형의 발현 패턴 및 수준을 측정하기 위한 실험이 수행되었다. 위에 논의된 바와 같이, 아이소형 1이 확장된 세포내 C-말단을 가진다는 점만 다른 DLL3 암호화 단백질의 2개의 공지된 스플라이스 변이형들이 존재한다 (도 1e). 보다 구체적으로, 아이소형 2는 엑손 8a 및 8c를 함유하는 mRNA 변이형 2 (도 1b; 서열번호 2)에 의해 암호화된 587개의 아미노산 단백질(도 1d; 서열번호 4)인 반면, 아이소형 1은 엑손 8b를 함유하는 mRNA 변이형 1(도 1a; 서열번호 1)에 의해 암호화된 618개의 아미노산 단백질(도 1c; 서열번호 3)이다. 아이소형 1과 아이소형 2의 동일한 세포외 도메인(ECD)을 도시하는 모식도는 도 1f에 도시되어 있다.
다시, 위에 설명한 바와 같이 얻어진 완전 전사체 데이터를 사용하여, 확장에 의해, 두 아이소형들의 발현율을 제공하는 상기 엑손들의 발현 패턴을 측정하기 위해, 선택된 NET 종양들을 조사하였다. 도 5에 도시된 바와 같이, 두 아이소형들 사이의 특정 발현비율은 다소 다양할 수 있는 반면, 아이소형 1 발현이 각 종양에서 우선적이었음이 밝혀졌다. 이 측면에서, 위에 설명한 바와 같이, 각 시험된 종양들내 누적된 DLL3 발현 (두 아이소형 모두)이 정상적인 조직들과 관련되어 높았음을 주목하는 것이 중요하다. 따라서, 전 아이소형 비율은 특정 종양 타입들의 지표가 될 수 있으며, 유전자형 조절물질 선택과 관련될 수 있는 반면, 표현형 조절물질 계획들과 관련하여 중요하지 않다. 즉, 두 DLL3 아이소형들의 ECD 영역이 동일하기 때문에, ECD 영역에 관련된 본 발명의 표현형 조절물질 (예를 들면 항-DLL3 항체)이 아이소형과 반응할 것으로 기대된다. 따라서, 이것은 상기 계획들의 유효성에 대하여 방향을 결정하는 DLL3 ECD(아이소형과 무관)의 절대 발현 수준들이다.
실시예 2
신경내분비 특성들을 갖는 선택된 NTX 종양들에서 유전자 발현의 마이크로어레이 및 RT-PCR 분석
기존의 SOLiD 완전 전사체 데이터에 대한 것 외에, 상기 NTX 뱅크내 추가의 NET를 확인하기 위한 노력으로, 마이크로어레이 분석을 사용하여 더 큰 세트의 NTX 주들을 조사하였다. 구체적으로, 인간 유전체내 19,380개의 유전자들에 대하여 설계된 29,187개의 탐침들을 함유하는, OneArray ® 마이크로어레이 플랫폼(Phalanx Biotech Group)을 사용하여, 46개의 NTX 주들의 전체 종양들 또는 2개의 정상적인 조직들로부터 유도된 총 RNA 샘플들 2-6μg을 분석하였다. 보다 구체적으로, RNA 샘플들은 결장(CR), 흑색종(SK), 신장(KD), 폐(LU), 난소(OV), 자궁내막(EM), 유방(BR), 간(LIV), 또는 췌장(PA) 암을 포함하는 전 NTX 종양들이 유도된 46명의 환자들로부터 얻었다 (실시예 1에 설명된 바와 같음). 정상적인 결장(NormCR) 및 정상적인 췌장(NormPA) 조직은 대조표준들로 사용하였다. 보다 더 구체적으로, 폐종양은 소세포 폐암(SCLC), 편평세포암(SCC), 또는 대세포 신경내분비 암종(LCNEC)으로 추가로 하위분류되었다. 제조사의 프로토콜들을 사용하여 RNA 샘플들을 3중복제를 진행하고, 각 샘플내 주요 유전자에 대하여 얻은 측정된 강도를 표준화 및 변환하기 위한 표준 산업용 관행들을 사용하여, 상기 얻은 데이터를 분석하였다. 상기 48개의 샘플들에 대한 표준 마이크로어레이 계통수를 생성하기 위해, hclust.2라고 불리우는 패키지의 R/BioConductor 슈트에서 비편중 피어슨 스피어만 계층 클러스터링 알고리즘을 사용하였다. 당 분야에 알려져 있는 바와 같이, R/BioConductor는 학계, 재무 및 데이터 분석을 위한 약리산업에 널리 사용되는 오픈-소스 통계프로그래밍 언어이다. 일반적으로, 종양들은 유전자 발현 패턴, 발현 세기 등에 기초하여 배열 및 클러스터링되었다.
도 6a에 도시된 바와 같이, 48개의 샘플들로부터 계통수를 유도하고, 및 모든 19380개의 유전자들을 가로질러 그들의 종양타입 또는 기원조직에 기초하여 함께 NTX 주들을 클러스터링하였다. 신경내분비 표현형과 일반적으로 관련된 여러 종양들은 (1)로 표시된 가지 상에서 함께 클러스터링하였다; 이들은 피부암, 수많은 폐암들 및 다른 NET를 포함하였다. 흥미롭게는, (2)로 표시된 하위-가지는 신경내분비 특징들을 갖는 2개의 대세포 폐암들 (LU50.LCNEC and LU37.LCNEC) 및 소세포 폐암 (LU102.SCLC)이 난소(OV26) 및 신장(KD66) 종양(cluster C)에 의해 클러스터링되고, 이들 이후 종양들이 신경내분비 표현형들을 가짐을 나타냄을 보여준다. 게다가, 도 6a는 3개의 추가의 SDLC 종양들로 구성된 클러스터 D 및 그의 우측은 추가의 SCLC NTX(LU100) 및 신경내분비 자궁내막 종양(EM6)을 함유하는 소형 클러스터이고, 문헌 및 임상 병리학 실험으로부터 보통 이해되는 바와 같이, 모두 어느 정도의 신경내분비 특징들을 가지는 것으로 기대됨을 나타낸다. 폐의 편평세포암종으로 구성된 클러스터 G가 도 6a의 계통수의 완전히 다른 가지 상에서 발견될 수 있다는 사실은 클러스터링이 종양에 대한 기원의 기관에 의해 독점적으로 유도되지 않음을 보여준다.
NET와 연관된 유전자 마커들의 콜렉션을 보다 자세히 조사하는 것은 (도 6b), 이들이 클러스터 C 및 D를 포함하는 종양에서 강하게 발현되는 반면, 클러스터 G에서 종양에 최소로 발현되고 (폐의 편평세포암종), 이는 클러스터 C 및 D가 신경내분비 표현형을 갖는 NET 또는 종양을 대표함을 제시한다는 사실을 보여준다. 보다 구체적으로, 클러스터 C NET는 ASCL1, CALCA, CHGA, SST 및 NKX2-1을 높게 크게 발현하는 반면, 클러스터 D NET는 CHGA, ENO2, 및 NCAM1을 발현하고, 이는 상기 종양들의 클러스터링에 부분적으로 반응하는 상기 신경내분비 표현형 유전자들의 발현이다. 흥미있는 특징은 다른 맥락에서 종양형성과 밀접하게 관련되어 있지만, 신경내분비 종양들과 연관된 것으로 가끔 보고된 유전자인, 클러스터 D내 KIT가 강하게 발현된다는 점이다. 이는 상기 유전자들 중 어느 하나의 강한 발현이 누락된 클러스터 G에서 SCC 종양들과 대조적이다 (도 6b).
노치 신호전달과 관련하여, 클러스터 C내 종양들은 노치 신호전달에서 감소와 일치하는 표현형; 특정 노치 수용체의 발현 누락, JAG1 및 HES1 발현의 상대적인 누락, 및 강한 수준의 ASCL1 발현을 나타낸다 (도 6c). 흥미롭게는, 클러스터 D는 헤테로다이머 형성을 통해 HES1 활성을 길항작용함으로써, ASCL1 활성을 지지할 수 있는 전사 인자인, HES6의 고발현을 나타낸다. 가장 중요하게는, 상기 마이크로어레이 데이터는 클러스터 C 및 D(클러스터 G와 관련됨)의 종양내 높은 수준의 DLL3 전사를 나타내며, 이는 상기 종양타입들에서, DLL3이 NET를 치료하기 위한 매력적인 치료 표적을 제공함을 보여준다.
상기 결과의 관점에서, 제조사의 프로토콜들에 따른 Taqman 실시간 정량적 RT-PCR(qRT-PCR)을 수행하기 위해 Applied Biosystems 7900HT Machine (Life Technologies)을 사용하여 다양한 NTX 주들 및 정상 조직들로부터 HES6의 mRNA 발현을 조사하였다. 상기와 같이 RNA를 분리하고, 유전자 발현 분석에 품질이 적당하도록 체크하였다. 정상조직으로부터의 RNA는 구입하였다 (Agilent Technologies and Life Technologies). cDNA 아카이브 키트(Life Technologies)를 사용하여 cDNA 합성에 RNA 200ng을 사용하였다. HES6의 mRNA 수준을 측정하기 위한 HES6 Taqman에 포함된 Taqman 저밀도 어레이(TLDA; Life Technologies) 상에서 qRT-PCR 분석을 위해 cDNA를 사용하였다.
HES6 mRNA 수준은 내인성 대조표준으로 표준화한 후, 각 NTX 주 또는 정상 조직 샘플 (그래프 상의 단일 점)에 대하여 나타낸다. 표준화된 값들은 독성 문제의 정상조직들에서의 평균 발현과 관련하여 플롯팅한다(NormTox). 이 기술은 HES6 및 다른 관련 마커들의 측정을 통해 NTX 종양 뱅크로부터 신경내분비 특징들을 갖는 다양한 종양들을 신속하게 동정 및 특성평가한다. 도 6d는 정상조직들, 유방, 결장, 간 및 다른 선택된 종양들과 비교되는, 신경내분비 특징들을 갖는 샘플 종양들 (예를 들면, LU-SCLC, LU-LCNEC)에서 HES6의 일반적인 과잉발현을 도시하고 있다. 중요하게는, 상기 마이크로어레이 및 qPCR 데이터는 적어도 일부의 자궁내막, 신장 및 난소 종양이 신경내분비 종양 특징들을 나타낼 수 있음을 보여준다 (도 6a 및 도 6d).
실시예 3
신경내분비 특성들을 갖는 종양들에서 DLL3의 RT-PCR 분석
생성된 SOLiD 및 마이크로어레이 데이터를 확인하고, 추가의 NTX 샘플들로 분석을 확장하기 위해, 다양한 NTX 주들, 1차 생체검사 및 정상 조직들로부터의 RNA 샘플들을 사용하여 qRT-PCR에 의해 DLL3 mRNA 발현을 분석하였다. 바로 위에 설명되어 있지만 DLL3 검출에 대하여 최적화된 Applied Biosystems 7900HT Machine(Life Technologies)을 실질적으로 사용하여 분석을 다시 수행하였다. DLL3 발현은 정상 조직에서 평균 발현과 관련된 것으로 나타나며, 내인성 대조표준 유전자 ALAS1의 발현으로 표준화된다. 도 7에 도시된 바와 같이, 유전자 발현의 qRT-PCR 질문은 DLL3 mRNA가 정상 조직들에 비해 NET 군집에서 10,000,000배 이상 높음을 보여줬다. 본 실시예에서, 샘플링된 종양들은 1차 생체검사(p0)에서 유도된 다수의 RNA 샘플들뿐만 아니라 미리 시험된 샘플들 이후의 추가의 SCLC NTX 주들을 포함한다. 종합해 보면, 이러한 데이터는 DLL3 유전자 발현이 신경내분비 특징들을 나타내는 종양들에서 극적으로 상향조절됨을 입증하며, 같은 패턴이 1차 생체검사 샘플들에서 보여짐을 고려하면, 관찰된 상향조절은 마우스내에서 성장하는 인간 종양들의 인공물이 아니다.
게다가, 임상 병리학에서 정의된 NSCLC의 3개의 서브타입들은 도 7에 또한 나타나 있으며; LU25는 방추세포 폐암종이며, LU50은 대세포 신경내분비 암종(LCNEC)이며, LU85는 편평세포 암종(SCC)이다. SCC 및 방추세포 종양에서 높은 수준이 눈에 띄었지만, LCNEC 종양 LU50에서 가장 높은 DLL3 발현이 나타났다. SCLC 및 LCNEC 종양에 의한 마이크로어레이 상에서 각각 클러스터링된 KDY66 및 OV26, 신장 및 난소 종양 (도 6a)은 이들이 신경내분비 특징들을 나타내는 종양(즉, NET 또는 pNET)들을 포함하고 있음을 보여준다. 상기 결론은 두 종양 샘플들에서 보여지는 매우 높은 mRNA 수준의 DLL3에 의해 확인된다 (도 7). 모든 종양들이 정상 조직들에 대하여 DLL3 mRNA의 두드러진 상향조절을 나타내는 반면(도 7), 도 6a와 도 7에서 밝혀진 종양들의 비교는 도 7에서의 측정된 DLL3 mRNA 발현의 미묘한 차이가 도 6에서의 차별된 클러스터링에 대응하고; 예를 들면 클러스터 C가 KD66, LU50, OV26 및 LU102를 함유하며, 이들은 도 7에 나타낸 바와 같이 DLL3 발현의 가장 높은 끝부분에 있고, 반면 각각의 클러스터가 도 6a의 클러스터 C 및 D와 떨어진 LU85 및 LU100가 측정된 종양 샘플들에 대한 DLL3 발현의 가장 낮은 끝부분 중에 있음을 나타낸다. 도 6a에서 클러스터 D의 소세포 폐암 종양들(예를 들면, LU86, LU64, 및 LU95)은 중간 수준의 DLL3 mRNA 발현을 나타내며, 본 발명의 조절물질에 의한 치료에 매우 잘 민감할 수 있다.
실시예 4
다양한 종양 피검물들에서 DLL3 mRNA 및 단백질의 발현
보다 넓은 어레이의 종양 피검물들로 DLL3 발현의 분석을 확장하기 위해, Taqman qRT-PCR를 TissueScan™ qPCR (Origene Technologies) 384-웰 어레이 상에서 이전 실시예에 설명된 바와 같이 실질적으로 수행하였다. 이 어레이는 각 종양 타입 및 정상적인 인접조직에 대하여, 다수의 환자에게서 얻은 샘플들과18개의 다른 고형 종양 타입들에서 유전자 발현을 비교할 수 있게 한다.
이와 관련하여, 도 8a 및 도 8b는 18개의 다른 고형 종양 타입들을 갖는 환자들로부터, 전 종양 피검물들 (회색 점들) 또는 정상 인접 조직 (NAT; 흰색 점들)내 DLL3의 상대적 및 절대 유전자 발현 수준을 각각 나타낸다. 분석된 각 종양 타입에 대하여, NAT내 평균 유전자 발현에 대하여 도 8a에서 데이터를 표준화한다. DLL3이 검출되지 않은 피검물들은 50의 Ct 값을 할당했고, 이는 실험 프로토콜에서 최종 증폭주기를 나타낸다. 각 점은 단일 조직 피검물을 나타내며, 기하학적 평균값은 흑색선으로 나타냈다. 본 오리진 티슈스캔 어레이(Origene TissueScan Array)를 사용하면, 부신, 유방, 자궁경부, 자궁내막, 폐, 난소, 췌장, 갑상선 및 방광암의 부분집합에서 DLL3의 과잉발현이 나타났으며, 이들 중 대다수는 거의 분화되지 않은 신경내분비 표현형을 갖는 NET 또는 종양들을 나타낼 수 있다. 폐 종양의 부분집합은 DLL3의 가장 큰 과잉발현을 나타냈다. 어레이 상에서 2 LCNEC 종양들에서 최고의 발현이 관찰되었다. 도 8b에서 절대 유전자 발현에 의해 나타낸 바와 같이, 정상적인 고환은 높은 발현의 DLL3을 갖는 유일한 정상조직이다. 이는 NET 및 다른 발암세포내 DLL3 발현이 매우 다양한 종양에서 종양형성 및/또는 종양 진행에 중요한 역할을 하고 있음을 보여준다.
다양한 종양들과 관련된 높은 DLL3 전사물 수준을 제공한다면, 다른 종양들과 관련된 NET에서 DLL3 단백질의 발현에서 대응하는 증가를 입증하기 위한 작업을 수행하였다. 이 때문에, 선택된 NTX 종양 샘플들내 DLL3 발현을 검사 및 정량화하기 위해, MSD 디스커버리 플랫폼(Meso Scale Discovery, LLC)을 사용하여, DLL3 샌드위치 ELISA를 개발하였다. 간단히 말하면, NTX 종양 샘플을 분해하고, 샌드위치 ELISA 포맷에 기초한 전자화학발광 검출법을 사용하여, 분해물 내에서 DLL3 단백질 농도뿐만 아니라 총 단백질 농도를 측정하였다. 보다 구체적으로, 정제된 재조합 단백질로부터 생성된 표준 곡선을 사용하여 전자화학발광 값들로부터 샘플로부터의 DLL3 농도를 삽입하고, 도 8c에 총 단백질의 밀리그램당 DLL3의 나노그램으로 표현한다.
보다 구체적으로, 마우스로부터 NTX 종양들을 잘라내고, 드라이 아이스/에탄올 상에서 급속냉동하였다. 해동된 종양편에 단백질 추출 완충제(Biochain Institute, Inc)를 첨가하고, 조직 분해기 시스템(Qiagen)을 사용하여 종양들을 분쇄하였다. 분해물들을 원심분리(20,000g, 20분, 4°C)에 의해 맑게 하고, 바이신코닉산(BCA)을 사용하여 단백질을 정량화하였다. 단백질 분해물을 분석할 때까지 -80C에서 저장하였다.
PBS 1ml당 2μg에서, (하기 도 7에 설명된 대로 얻어진) SC16.34 항체 30μl에 의해, MSD 표준 플레이트(Meso Scale Discovery, LLC)를 4°C에서 밤새 코팅하였다. 플레이트를 PBST에서 세척하고, 150ul MSD 3% 블로커 A 용액에서 1시간 동안 블로킹하였다. 플레이트를 PBST로 다시 세척하였다. (하기 도 7에 설명된 대로 얻어진) SC16.4 항체 25μl를 MSD 설포-태그에 접합하고, MSD 1% 블로커 A 1ml당 0.5 μg에서 상기 세척된 플레이트에 첨가하였다. MSD 1% 블로커 A에서 10배 희석된 분해물 또는 10% 단백질 추출 완충제를 함유하는 MSD 1% 블로커 A내 연속희석된 재조합 DLL3 스탠다드 25 μl를 웰에 첨가하고, 2시간 동안 배양하였다. 플레이트를 PBST로 세척하였다. 계면활성제를 갖는 MSD 리더 완충제 T를 물로 1X 희석하고, 각 웰에 150μl 첨가하였다. 내삽을 통해 NTX 샘플들의 DLL3 농도를 유도하기 위해 통합 소프트웨어 분석 프로그램을 사용하여 플레이트를 MSD 섹터 영상장비 2400 상에서 리딩하였다. 그후, 총 분해물 단백질 밀리그램당 DLL3의 나노그램을 얻기 위해, 총 단백질 농도로 값들을 나누었다. 얻은 농도들은 도 8c에 개시되어 있는데, 각 점은 단일 NTX 종양 주로부터 얻은 농도들을 나타낸다. 각 점이 단일 NTX 주로부터 얻어지는 반면, 대부분의 경우 동일한 NTX 주로부터 여러 개의 생물학적 샘플들을 시험하고, 값들을 평균 내어 데이터 점을 제공하였다.
어느 경우에나, 도 8c는 DLL3의 가장 높은 발현이 SCLC, LCNEC 뿐만 아니라 선택된 신장 샘플 및 단일 난소종양을 포함하는 다른 신경내분비 종양에서 발견되었음을 보여준다. 도 8c는 특정 흑색종 NTX 주들이 높은 DLL3 단백질 발현을 나타냈음을 입증하며, 이는 상기 NTX 주들이 실시예 4에서 진행된 마이크로어레이 분석에서 NET NTX 주들 부근에서 클러스터링된다는 점에서 특히 흥미롭다(도 6a).
상기 개시된 DLL3 발현에 대한 전사 데이터와 조합된 상기 데이터는 DLL3 결정인자들이 치료적 시술을 위한 매력적인 표적을 제공한다는 제시를 크게 뒷받침한다.
실시예 5
선택된 NTX 종양 주들의 세포 표면상에서 노치 수용체들 및 델타-유사 리간드의 발현
상기 실시예 1 및 2로부터의 관찰을 보다 확장하기 위해, 클러스터 C 및 D에서 발견된 여러 개의 NTX 종양들(KDY66, OV26, LU64; 도 6a) 뿐만 아니라 SOLiD 서열분석 또는 qRT-PCR에 의해 DLL3의 높은 발현을 갖는 것으로 측정된 SCLC 종양 (LU73, 도 4 및 도 7)으로부터 단리된 세포들을, 다양한 노치 수용체들 및 다른 DLL 패밀리 멤버들에 대한 단백질 발현의 수준을 측정하기 위해 유동 세포분석법을 사용하여 분석하였다. 일반적으로 유동 세포분석법-기반 단백질 발현 데이터는 제조사의 설명서에 따라 FACSCanto II(BD Biosciences)를 사용하여 생성하였다. 도 9의 데이터는 각 종양 세포들이 히스토그램 플롯들을 나타냄을 보여주며, 아이소형 대조표준 항체들의 배경 염색은 회색으로 나타나며, 상업용으로 시판되는 항체들을 사용하여 측정된, 주요 단백질의 채워진 히스토그램 및 발현은 진한 흑색선으로 표시한다.
도 9에 그래프로 도시될 수 있는 바와 같이, 형광 마이너스 원(FMO) 아이소형-대조표준 염색된 세포들에 대하여 측정된 바와 같이, 노치 수용체들 (예를 들면, 노치I-4) 중 어느 것도 상기 종양들 중 어느 것에서 관찰되지 않았다. 이는 각 측정을 위해 보고된 평균 형광 세기(MFI)에서 숫적으로 뿐만 아니라 히스토그램에 의해 그래프로 표시된다. 이와 유사하게, 2개의 폐암 유도성 NTX 세포들은 DLL1 또는 LL4의 발현을 나타내지 않았다. 2개의 종양들에 대하여는 DLL4 단독(OV26) 또는 DLL1 및 DLL4 (KDY66)의 약한 발현이 관찰될 수 있었다. 일반적으로, 상기 종양 타입들이 노치 신호전달 경로 성분들이 거의 발현되지 않거나 또는 아예 발현되지 않음을 보여주는데, 이는 신경내분비 표현형을 갖는 약하게 분화된 종양들 또는 NET에서 노치 신호전달이 손실된 것과 일치된다는 점에서, 상기 관찰들은 상기 실시예 1 및 2에서 얻고 나타낸 결과들을 확인한다.
실시예 6
항-DLL3 조절물질의 생성
2개의 별도의 면역화 캠페인에서 재조합 인간 DLL3-Fc 또는 인간 DLL3-His (각각은 도 1c에 개시된 DLL3의 성숙 ECD를 포함; 서열번호 3)에 의해 접종함으로써, 본원의 교시내용에 따라 뮤린 항체 형태의 DLL3 조절물질들을 제조하였다. 이와 관련하여, 마우스의 3개의 계통들 (Balb/c, CD-1 및 FVB) 을 인간 재조합 DLL3에 접종하여, 높은 고친화력의 뮤린 모노클론성 항체 조절물질들을 분비하는 하이브리도마들을 제공하였다
Adipogen International(카탈로그 No. AG-40A-0113)로부터 hDLL3-Fc 융합 작제물을 얻었으며, 여기에서 이들은 제조사의 제품데이터 시트에 설명된 바와 같이, DLL3-Fc 과잉발현 HEK 293 세포들의 상층액으로부터 정제되었다. hDLL3-His를 과잉발현하도록 조작된 CHOK1 세포들의 상층액으로부터 재조합 hDLL3-His 단백질을 정제하였다. 10μg의 hDLL3-Fc 또는 hDLL3-His 면역원을 동등부피의 TITERMAX® 골드(CytRx Corporation) 또는 백반 보조제에 의해 유화시키고, 각 마우스의 면역조치를 위해 사용하였다. 그 후, 풋패드 경로를 통해, 상기 얻은 에멀젼을 3마리의 암컷 마우스들에 주사하였다 (각각 1마리당: Balb/c, CD-1 및 FVB).
인간 DLL3에 대하여 특이적인 마우스 IgG 항체들을 위한 마우스 혈청을 선별하기 위해 고체-상 ELISA 분석법을 사용하였다. 배경 이상의 양성 시그널은 DLL3에 대하여 특이적인 항체들의 지표가 되었다. 간략하게 말하면, 96개의 웰 플레이트(VWR International, Cat. #610744)들을 ELISA 코팅 완충제내 0.5μg/ml에서 재조합 DLL3-His로 하룻밤 동안 코팅하였다. 0.02% (v/v) Tween 20을 함유하는 PBS에 의해 세척한 후, 실온(RT)에서 웰을 웰당 200 μL의 PBS내 3% (w/v) BSA로 블로킹하였다. 마우스 혈청을 적정하고 (1:100, 1:200, 1:400, 및 1:800), DLL3 코팅된 플레이트에 웰당 50 μL 첨가되고, RT에서 1시간동안 배양하였다. 플레이트를 세척하고, 그후 PBS내 3% BSA-PBS 또는 2% FCS로 1:10,000 희석된 μL/웰 HRP-표지된 염소 항-마우스 IgG와 함께 RT에서 1시간동안 배양하였다. 다시, 플레이트를 세척하고, RT에서 40 μL/웰의 TMB 기질 용액(Thermo Scientific 34028)을 15분간 첨가하였다. 성장 후, 기질 성장을 정지시키기 위해 균등부피의 2N H2SO4를 첨가하고, OD 450에서 분광광도계에 의해 플레이트를 분석하였다.
혈청-양성 면역화 마우스를 희생시키고, 빼낸 림프절 (확대한다면, 슬와, 사타구니 및 안쪽 장골)을 해부하고, 항체생성세포를 위한 공급원으로서 사용하였다. B세포의 단일 세포 현탁액(228.9x106 세포들)을 비-분비 P3x63Ag8.653 골수세포들(ATCC #CRL-1580)과 전기세포융합에 의해 1:1의 비율로 융합했다. 전기세포융합은 제조사의 설명서에 따라, BTX Hybrimmune™ 시스템(BTX Harvard Apparatus)을 사용하여 수행하였다. 융합과정 후, 15% 태아 클론 I 혈청(Hyclone), 10% BM Condimed (Roche Applied Sciences), 4 mM L-글루타민, 100 IU 페니실린-스트렙토마이신 및 50 μM 2-머캅토에탄올을 함유하는 소듐 피루베이트를 갖는 고 글루코오스 DMEM 배지, 아자세린(Azaserine)(Sigma #A9666)이 보충된 하이브리도마 선택배지에 세포들을 재현탁시키고, 플라스크당 90mL 선택배지로 3개의 T225 플라스크에 플레이팅하였다. 그후, 플라스크를 5% CO2 및 95% 공기를 함유하는 가습된 37°C 인큐베이터에 6-7일동안 두었다.
6 내지 7일간 배양한 후, T225에서 벌크로 성장한 세포들로 구성된 라이브러리를 Aria I 세포 분류기를 사용하여 Falcon 96 웰 U-하부 플레이트 내에 웰당 1개의 세포로 플레이팅하였다. 그후, 15% 태아 클론 I 혈청(Hyclone), 10% BM-Condimed(Roche Applied Sciences), 1 mM 소듐 피루베이트, 4 mM L-글루타민, 100IU 페니실린-스트렙타마이신, 50μM 2-머캅토에탄올, 및 100μM 하이폭산틴을 함유하는 배양 배지 200 μL에서 상기 선택된 하이브리도마를 배양하였다. 특정의 남은 사용되지않은 하이브리도마 라이브러리 세포들을 미래의 라이브러리 테스팅을 위해 동결시켰다. 10 내지 11일간 배양한 후, 플레이팅된 세포들의 각 웰로부터 상층액을 ELISA 및 FACS 분석법에 의해 DLL3에 대하여 반응성인 항체들에 대하여 분석하였다.
ELISA에 의해 선별하기 위해, 인간 DLL3 (하기 설명된 대로 얻어짐)을 과잉발현하는 293개의 세포들의 세포 분해물 또는 변성된 인간 DLL3에 의해, 96 웰 플레이트를 탄산나트륨 완충제에서 4°C 에서 하룻밤 동안 코팅하였다. 플레이트를 세척하고, 37°C에서 1시간동안 PBS/Tween내 3% BSA에 의해 블로킹하고, 바로 사용하거나, 4°C에서 유지하였다. 비희석 하이브리도마 상층액들을 플레이트 상에서 1시간동안 RT에서 배양하였다. 플레이트를 세척하고, RT에서 1시간동안 3% BSA-PBS로 1:10,000 희석된 HRP 표지된 염소 항-마우스 IgG에 의해 조사하였다. 그 후, 플레이트를 위에 설명한 바와 같이 기질 용액과 함께 배양하고, OD 450에서 읽었다. 백그라운드 이상의 신호에 의해 측정되는, 인간 DLL3에 우선적으로 결합된 면역글로불린을 함유하는 웰들을 옮기고, 확장시켰다.
뮤린 면역글로불린을 분비하는 양성 하이브리도마 웰들을 성장시키는 것도 또한, 인간 DLL3 (h293-hDLL3), 사이노몰거스 DLL3 (h293-cDLL3), 래트 (h293-rDLL3) 또는 뮤린 DLL3 (h293-mDLL3) 단백질을 과잉발현하기 위해 조작된 293개의 세포들에 의한 유동세포분석법을 기초로 한 분석법을 사용하여, 인간 DLL3 특이성 및 사이노몰거스, 래트 및 뮤린 DLL3 교차반응성에 대하여 선별하였다. h293-hDLL3 세포들은 hDLL3 및 GFP 마커를 둘 다 발현하는 상업용 바이시트르론성 렌티바이러스 벡터(Open Biosystems)로부터 제조된 렌티바이러스를 사용한 293T 세포들의 형질도입에 의해 제조하였다. h293-mDLL3 세포들은 하기와 같이 구조된, mDLL3 및 RFP 마커를 발현하는 바이시스트론성 렌티바이러스 벡터를 사용한 293T 세포들의 형질도입에 의해 제조하였다. 성숙 뮤린 DLL3 단백질 (도 10b; 서열번호 6)을 암호화하는 DNA 단편 (도 10a; 서열번호 5)을 상업용 뮤린 DLL3 작제물(Origene)로부터 PCR 증폭에 의해 얻고, 표준 분자 클로닝 기술들을 사용하여 pCDH-EF1-MCS-IRES-RFP(System Biosciences)의 다중 클로닝 영역의 업스트림이 사전조작된 IgG K 시그널 펩타이드 서열을 서브클로닝하였다. 이와 유사하게, h293-rDLL3 세포들은 래트 DLL3 및 GFP 마커를 둘 다 발현하는 바이시스트론성 렌티바이러스 벡터를 사용한 293T 세포들의 형질도입에 의해 제조되고, 표준 분자 클로닝기술들을 사용하여 pCDH-EF1-MCS-IRES-GFP(System Biosciences)의 다중 클로닝 영역의 업스트림이 사전조작된 IgK 시그널 펩타이드 서열의 성숙 래트 DLL3 단백질(accession NP_446118.1, 잔기들 25 - 589) 다운스트림을 암호화하는 코돈-최적화 서열을 포함하는 합성 DNA 단편(GeneWiz)을 클로닝함으로써 구조되었다. 마지막으로, 대중적으로 사용가능한 필리핀 원숭이 전체-유전체 숏건 콘티그(shotgun contig)에 대한 BLAST로 인간 DLL3 서열을 사용하고, 및 유전자교차 종에서 엑손 구조의 유지를 보장하는 사이노몰거스 유전자의 엑손 서열들을 조립하여, 사이노몰거스(예를 들면, 필리핀 원숭이(Macaca fascicularis )) DLL3(cDLL3) 서열을 추정하였다. 사이노몰거스 유전체 DNA(Zyagen)으로부터 각 엑손들 2-7의 PCR 증폭 및 직접적인 서열분석은 추정된 서열이 단백질의 ECD 영역을 가로질러 정확했음을 확인하기 위해 사용되었다. cDLL3 단백질(도 10d; 서열번호 8)을 암호화하는 cDLL3 DNA 서열(도 10c; 서열번호 7)를 합성제조하고(GeneWiz), 표준 분자 클로닝 기술들을 사용하여 pCDH-EF1-MCS-IRES-GFP (System Biosciences)의 다중 클로닝 영역의 업스트림이 사전조작된 IgG K 시그널 펩타이드 서열의 다운스트림을 서브클로닝하였다. 이 벡터에 의해 293T 세포들을 형질도입하여, h293-cDLL3 세포들을 수득하였다.
유동 세포분석법을 위해, 인간, 사이노몰거스, 래트 또는 뮤린 DLL3이 각각 형질도입된 50x104 h293 세포들을 25-100 μL 하이브리도마 상층액과 30분 배양했다. 세포들을 PBS, 2% FCS로 2회 세척한 후, PBS/2%FCS 에서 1:200 희석된 DyLight 649에 접합된 2차에 특이적인 염소-항-마우스 IgG Fc 단편 50 μL와 함께 배양하였다. 15분 배양후, 세포들을 PBS/2%FCS로 2회 세척하고, DAPI와 함께 PBS/2%FCS에 재현탁하고, 제조사의 설명서에 따라 FACSCanto II를 사용하여 유동 세포분석법에 의해 분석하였다. DLL3+ GFP+ 세포들에 우선적으로 결합된 면역글로불린을 함유하는 웰들을 옮기고 확장시켰다. 결과적으로 얻은 hDLL3 특이적 클론 하이브리도마들을 CS-10 동결 배지(Biolife Solutions)에서 저온보존하고, 액체 질소에 저장하였다. h293-hDLL3, h293-cDLL3, h293-rDLL3 및/또는 h293-mDLL3세포들이 결합된 항체들은 교차-반응성인 것으로 알려져 있다 (도 12 참조). 상기 분석법에 기초하여, 뮤린 항원과 교차반응성인 선택된 조절물질들 모두 래트 항원과도 교차반응성이었다.
ELISA 및 유동 세포분석법은 대부분의 또는 모든 상기 하이브리도마로부터 정제 항체가 농도-의존성 방법으로 DLL3과 결합함을 확인한다. 각 면역조치 캠페인의 한 융합을 수행하였으며, 64개의 플레이트에 심었다 (대략 60-70% 클로닝 효율에서 6144개의 웰들). hDLL3-Fc 면역조치 캠페인 및 선별로부터, 여러 개가 뮤린 DLL3과 교차반응성인 인간 DLL3에 대하여 특이적인 대략 90개의 뮤린 항체들을 수득하였다. hDLL3-His 면역조치 캠페인은 인간 DLL3에 대하여 특이적인 50개의 추가의 뮤린 항체들을 수득하였으며, 이들 대다수는 뮤린 DLL3과 교차반응하였다.
실시예 7
뮤린 DLL3 조절물질들의 서열분석
상기 내용에 근거하여, 매우 높은 친화력을 갖는 고정 인간 DLL3 또는 h293-hDLL3 세포들과 결합하는 예시적인 구별된 수많은 모노클론성 항체들은 서열분석 및 추가의 분석을 위해 선택되었다. 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd의 표 형식에 도시된 바와 같이, 실시예 6에서 생성된 선택된 모노클론성 항체들로부터 경쇄 가변 영역(도 11a 내지 도 11ad) 및 중쇄 가변 영역(도 11b 내지 도 11bd)의 서열 분석은 많은 것이 새로운 상보성 결정 영역들을 가졌고, 종종 새로운 VDJ 배열들을 나타냈음을 확인하였다. 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 개시된 상보성 결정 영역들은 Chothia 외 다수의 문헌 서두에 정의되어 있음을 주목한다.
예시 조절물질을 서열분석하는데 있어서 제1 단계로서, 선택된 하이브리도마 세포들을 Trizol® 시약(Trizol Plus RNA Purification System, Life Technologies)에서 분해하여, RNA를 제조하였다. 이와 관련하여, 104 내지 105 의 세포들을 1 mL Trizol에 재현탁하고, 200 μL의 클로로포름을 첨가한 후 격렬하게 흔들어 주었다. 그 후, 샘플들을 4°C에서 10분간 원심분리하고, 수성상을 신선한 원심분리용 튜브로 옮겨, 거기에서 동등 용량의 아이소프로판올을 첨가하였다. 다시 튜브를 격렬하게 흔들어주었고, 4°C에서 10분간 원심분리하기 전에 RT에서 10분간 배양하였다. 결과적으로 얻은 RNA 펠릿들을 1 mL의 70% 에탄올로 1회 세척하고, 40 μL의 DEPC-처리수에 재현탁하기 전에, RT에서 간단하게 건조시켰다. RNA 제조물은 사용될 때까지 -80°C에서 저장하기 전에, 1% 아가로오스 젤로 3μL 분획화함으로써 그 품질을 측정하였다.
각 하이브리도마의 Ig 중쇄의 가변 영역은, 모든 마우스 Ig 아이소형에 대하여 특이적인 3' 마우스 Cγ 프라이머와 조합하여, 완전한 마우스 VH 레퍼토리를 표적화하기 위해 설계된, 32개의 마우스 특이적 리더 서열 프라이머들을 포함하는 5' 프라이머 믹스를 사용하여 증폭되었다. 같은 PCR 프라이머들을 사용하여 양 단으로부터 VH의 400bp PCR 단편을 서열분석하였다. 이와 유사하게 마우스 카파 불변 영역에 특이적인 단일의 역 프라이머와 조합된 Vκ 마우스과 각각을 증폭하도록 설계된 32개의 5' Vκ 리더 서열 프라이머들의 혼합물은 카파 경쇄를 증폭 및 서열분석하는데 사용되었다. 역전사효소 폴리머라제 연쇄 반응(RT-PCR)을 사용하여 VH 및 VL 전사물을 100ng 총 RNA로부터 증폭시켰다.
총 8개의 RT-PCR 반응을 각 하이브리도마에 대하여 진행하였다: 4개는 Vκ 경쇄에 대하여, 및 4개는 V 감마 중쇄(γ1)에 대하여. 원스텝 RT-PCR 키트를 증폭을 위해 사용하였다(Qiagen). 이 키트는 센시스크립트 및 옴니스크립트 역전사효소의 혼합물, HotStarTaq DNA 폴리머라제, dNTP 혼합물, 완충제 및 Q-용액, "어려운" (예를 들면, GC-풍부) 주형의 유효한 증폭을 가능하게 하는 새로운 첨가제를 제공한다. 3 μL의 RNA, 0.5의 100 μM의 중쇄 또는 카파 경쇄 프라이머들 (종종 IDT에 의해 합성됨), 5 μL의 5x RT-PCR 완충제, 1 μL dNTPs, 역전사효소 및 DNA 중합효소를 함유하는1 μL의 효소 혼합물, 및 0.4 μL의 라이보누클레아제 억제제 RNasin (1단위)을 포함하는 반응혼합물을 제조하였다. 이 반응혼합물은 역전사 및 PCR을 위해 필요한 모든 시약들을 함유한다. 열순환기 프로그램은 RT 스텝 50°C에서 30분간, 95°C에서 15분간, 30주기의 PCR (95°C에서 30초, 48°C에서 30초, 72°C에서 1분간)에서 설정하였다. 그 후, 72°C에서 10분간 최종 배양이 있었다.
직접적인 DNA 서열분석을 위한 PCR 생성물을 제조하기 위해, 제조사의 프로토콜에 따라, QIAquick™ PCR 정제 키트를 사용하여 이들을 정제하였다. 멸균수 50 μL를 사용하여 스핀으로부터 DNA를 용출하고, 양 가닥들로부터 이들을 서열분석하였다. 추출된 PCR 생성물들을 구체적인 V 영역 프라이머들을 사용하여 직접 서열분석하였다. 가장 높은 서열 상동성을 갖는 생식세포계열 V, D 및 J 유전자 멤버들을 확인하기 위해, IMGT를 사용하여 누클레오타이드 서열들을 분석하였다. V-BASE2 (Retter et al., supra)를 사용하여, 상기 유도된 서열들을 V-영역 및 J-영역들의 공지된 생식세포계열 DNA 서열들과 비교하고, VH 및 VL 유전자들을 마우스 생식세포계열 데이터베이스로 정렬하여 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 개시된 첨부된 서열들을 제공하였다.
보다 구체적으로, 도 11a 내지 도 11ad는 항-DLL3 항체들로부터의 92개의 새로운 뮤린 경쇄 가변 영역들의 연속성 아미노산 서열들(서열번호 20 내지 202, 짝수들) 및 대표적인 뮤린 경쇄들로부터 유도된 5개의 인간화 경쇄 가변 영역들 (서열번호 204 내지 212, 짝수들)을 도시하고 있다. 이와 유사하게 도 11b 내지 도 11bd는 동일한 항-DLL3 항체들로부터의 92개의 새로운 뮤린 중쇄 가변 영역들의 연속성 아미노산 서열들 (서열번호 21 내지 203, 홀수들) 및 인간화 경쇄들을 제공하는 동일한 뮤린 항체들로부터의 5개의 인간화 중쇄 가변 영역들 (서열번호 205 내지 213, 홀수들)을 도시하고 있다. 따라서, 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd는 함께, 92개의 사용될 수 있는 뮤린 항-DLL3 항체들의 첨부된 서열을 제공한다 (즉, SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150) 및 인간화 항체들 (즉, hSC16.13, hSC16.15, hSC16.25, hSC16.34 및 hSC16.56). 이러한 동일한 명칭들은 주요 항체를 생성하는 클론을 의미할 수 있으며, 상기와 같이 특정 명칭의 사용은 배경문헌의 문맥에서 해석되어야 함을 주목한다.
본 출원의 목적을 위해, 각 특정 항체의 서열 목록들은 순차적이다. 따라서, mAb SC16.3은 경쇄 및 중쇄 가변 영역들 각각에 대하여 서열번호 20 및 21을 포함한다. 이와 관련하여, SC16.4는 서열번호 22 및 23을 포함하며, SC16.5는 서열번호 24 및 25 등을 포함한다 게다가, 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에서 각 항체 아미노산 서열에 대한 대응 핵산서열들은 본 출원과 함께 제출된 서열목록로 첨부된다. 본 서열 목록에서, 포함된 핵산서열들은 200개 이상의 대응 아미노산 서열 (경쇄 또는 중쇄)인 서열번호들이다. 따라서, mAb SC16.3의 경쇄 및 중쇄 가변 영역 아미노산 서열들을 암호화하는 핵산 서열들 (즉, 서열번호 20 및 21)은 서열 목록에서 서열번호 220 및 221을 포함한다. 이와 관련하여, 인간화 작제물들을 암호화하는 서열들을 포함하는, 경쇄 및 중쇄 가변 영역 아미노산 서열들을 암호화하는 핵산 서열들은 유사하게 넘버링되어 있으며, 서열번호 220 내지 413을 포함한다.
실시예 8
DLL3 조절물질의 인간화
상기 언급된 바와 같이, 실시예 7로부터의 뮤린 항체들 중 5개를 상보성 결정 영역(CDR) 이식을 이용하여 인간화하였다. 중쇄 및 경쇄들을 위한 인간 프레임워크는 기능성 인간 생식세포계열 유전자에 관한 서열 및 구조 유사성에 기초하여 선택하였다. 이와 관련하여, 인간 후보물질에 대한 마우스 기본형 CDR 구조를 Chothia 외 다수(상기)에 설명된 동일한 기본형 구조들과 대조함으로써 구조적 유사성을 평가하였다.
특히, 뮤린 항체들 SC16.13, SC16.15, SC16.25, SC16.34 및 SC16.56은 컴퓨터-이용 CDR-그래프팅 방법(Abysis Database, UCL Business Plc.) 및 표준 분자공학기술들을 사용하여 인간화하여, hSC16.13, hSC16.15, hSC16.25, hSC16.34 및 hSC16.56 조절물질들을 제공하였다. 가변 영역들의 인간 프레임워크 영역들은 주요 마우스 프레임워크 서열 및 그의 기본형 구조에 대한 그들의 최상의 서열 상동성에 기초하여 선택하였다. 인간화 분석의 목적을 위해, CDR 도메인들의 각각에 아미노산들을 할당하는 것은 Kabat et al. 넘버링(상기 참조)에 따른다.
분자공학과정들은 당 분야에 인지된 기술들을 사용하여 진행하였다. 이를 위해, 하이브리도마들로부터 전체 mRNA를 추출하고, 바로 위 실시예 7에 개시된 바와 같이 증폭시켰다.
누클레오티드 서열 정보로부터, 주요 뮤린 항체들의 중쇄 및 경쇄들의 V, D 및 J 유전자 세그먼트들과 관련된 데이터가 얻어졌다. 서열 데이터에 기초하여, 항체들의 Ig VH 및 VK 경쇄의 리더 서열에 특이적인 새로운 프라이머 세트들을 재조합 모노클론성 항체의 클로닝을 위해 설계하였다. 계속해서, V-(D)-J 서열들을 마우스 Ig 생식세포계열 서열들과 함께 정렬하였다. 5개의 인간화 작제물들 각각을 위한 얻어진 유전자 배열들은 하기 표 1에 도시되어 있다.
| mAb | 인간 VH | 인간 DH | 인간 JH | FW 변화들 | 인간 VK | 인간 JK | FW 변화들 | |||||
| hSC16.13 | IGHV2-5 | IGHD1-1 | JH6 | 없음 | IGKV-O2 | JK1 | 없음 | |||||
| hSC16.15 | VH1-46 | IGHD2-2 | JH4 | 없음 | IGKV-L4 | JK4 | 87F | |||||
| hSC16.25 | IGHV2-5 | IGHD3-16 | JH6 | 없음 | IGVK-A10 | JK2 | 없음 | |||||
| hSC16.34 | IGHV1-3 | IGHD3-22 | JH4 | 없음 | IGVK-A20 | JK1 | 87F | |||||
| hSC16.56 | IGHV1-18 | IGHD2-21 | JH4 | 없음 | IGKV-L2 | JK2 | 없음 | |||||
표 1에 나타낸 서열들은 주요 클론들에 대하여 도 11a 내지 도 11ad 및 도 11b 내지 도 11bd에 개시된 첨부된 중쇄 및 경쇄 서열들에 대응한다. 보다 구체적으로, 상기 표 1의 목록들은 서열번호 204 및 205 (hSC16.13), 서열번호 206 및 207 (hSC16.15), 서열번호 208 및 209 (hSC16.25), 서열번호 210 및 211 (hSC16.34) 및 서열번호 212 및 213 (hSC16.56)로 개시된 연속성 가변 영역 서열들에 대응한다. 게다가, 표 1은 결합 조절물질의 바람직한 특성들을 유지하기 위해 매우 적은 프레임워크 변화가 필요함을 보여준다. 이점에서, 중쇄 가변 영역들에서 형성된 프레임워크 변화 또는 복귀 돌연변이가 없었으며, 경쇄 가변 영역들에 2개의 프레임워크 변형만 포함되었다 (즉, hSC16.15 및 hSC16.34에서 87F).
CDR 이식에 의해 상기 모든 선택된 항체들을 인간화한 후, 얻어진 경쇄 및 중쇄 가변 영역 아미노산 서열들을 분석하여 뮤린 제공체 및 인간 수락자 경쇄 및 중쇄 가변 영역들에 관한 그들의 상동성을 측정하였다. 하기 표 2에 나타낸 결과들은 인간화 작제물들이 뮤린 제공체 서열들보다 인간 수락자 서열들에 관하여 보다 높은 상동성을 일관되게 나타냄을 보여준다. 특히, 뮤린 중쇄 및 경쇄 가변 영역들은 인간화 항체들 및 제공체 하이브리도마 단백질 서열들의 상동성 (74%-83%)과 대조되는, 인간 생식세포계열 유전자들의 드러나지 않는 매치에 대하여 유사한 전체 비율 상동성 (85%-93%)을 나타낸다.
| mAb | 인간에 대한 상동성 (CDR 수용자) |
뮤린 모체에 대한 상동성 (CDR 제공체) |
| hSC16.13 HC | 93% | 81% |
| hSC16.13 LC | 87% | 77% |
| hSC16.15 HC | 85% | 83% |
| hSC16.15 LC | 85% | 83% |
| hSC16.25 HC | 91% | 83% |
| hSC16.25 LC | 85% | 79% |
| hSC16.34 HC | 87% | 79% |
| hSC16.34 LC | 85% | 81% |
| hSC16.56 HC | 87% | 74% |
| hSC16.56 LC | 87% | 76% |
시험 및 하기에 보다 상세히 논의될 때, 각 인간화 작제물들은 뮤린 모 항체들에 의해 나타낸 것들과 크게 대조되는 바람직한 결합특성들을 나타냈다.
인간화 또는 뮤린에 관계없이, 가변 영역들의 핵산 서열들이 일단 결정되면, 본 발명의 항체들은 당 분야에 인지된 기술들을 사용하여 발현 및 분리될 수 있다. 이를 위해, 선택된 중쇄 (인간화 또는 뮤린) 가변 영역의 합성 DNA 단편들은 인간 IgG1 발현 벡터 내로 클로닝되었다. 이와 유사하게, (다시 인간화된 또는 뮤린) 가변 영역 경쇄 DNA 단편은 인간 경쇄 발현 벡터 내로 클로닝되었다. 그 후, 상기 선택된 항체는 유도된 중쇄 및 경쇄 핵산 작제물을 CHO 세포들로 형질감염(형질전환)시킴으로써 발현되었다.
특히, 한가지 적합한 항체제조방법은 (PCR을 사용하여 증폭된) 뮤린 또는 인간화 가변 영역 유전자들을 선택된 인간 면역글로불린 발현벡터들로 지향성 클로닝하는 것을 포함하였다. Ig 유전자-특이적 PCR에 사용된 모든 프라이머들은 제한영역들을 포함했으며, 이는 인간 IgG1 중쇄 및 경쇄 불변 영역들을 함유하는 발현벡터로 직접 클로닝시킨다. 간단히 말하면, PCR 생성물들은 Qiaquick PCR 정제 키트(Qiagen)에 의해 정제된 후, (중쇄를 위한) AgeI 및 XhoI 및 (경쇄를 위한) XmaI 및 DraIII 각각에 의해 소화시켰다. 소화된 PCR 생성물을 발현 벡터에 결찰하기 전에 정제하였다. 200U T4-DNA 리가아제(New England Biolabs), 7.5 μL의 소화 및 정제된 유전자-특이적 PCR 생성물 및 25ng 선형화 벡터 DNA에 의해 10 μL의 총 부피로 결찰반응을 수행하였다. 42°C에서 열충격을 통해 경쟁적 E. coli DH10B 세균(Life Technologies)을 3μL 결찰생성물에 의해 변환시키고, 암피실린 플레이트(100 μg/mL)에 플레이팅하였다. VH 영역의 AgeI-EcoRI 단편을 pEE6.4HuIgG1 발현 벡터의 동일한 영역에 삽입한 반면, 합성 XmaI-DraIII VK 삽입물을 각 pEE12.4Hu-카파 발편 벡터의 XmaI-DraIII 영역 내로 클로닝하였다.
선택된 항체를 생성하는 세포들은 293펙틴을 사용하여 HEK 293 세포들을 적당한 플라스미드에 의해 형질감염시킴으로써 생성되었다. 이에 관련하여, 플라스미드 DNA를 QIAprep 스핀 컬럼(Qiagen)에 의해 정제하였다. 10% 열 불활성화 FCS, 100 μg/mL 스트렙토마이신, 100 U/mL 페니실린 G (모두 Life Technologies사제)가 보충된 Dulbecco's Modified Eagle's Medium (DMEM)에서 표준 조건하에 인간 배아 신장(HEK) 293T (ATCC No CRL-11268) 세포들을 250mm 플레이트(Falcon, Becton Dickinson)에서 배양하였다.
일시적인 형질감염을 위해, 세포들을 80% 컨플루언시(confluency)로 배양하였다. 1.5 mL opti-MEM 중의 50μL HEK 293 트랙스펙션 시약과 혼합된 1.5 mL opti-MEM에 동일한 양의 IgH 및 대응 IgL 쇄 벡터 DNA(각각 12.5μg)를 첨가하였다. 이 혼합물을 실온에서 30분간 배양하고, 배양 플레이트에 균일하게 분포시켰다. 상층액을 형질감염시키고 3일 후 수확하고, 10% FBS가 보충된 새로운 DMEM 20mL로 대체하고, 형질감염시키고 6일 후 수확하였다. 800xg 에서 10분간 원심분리하여, 배양액 상층액에서 세포파괴물을 청소하고, 4℃에서 저장하였다. 재조합 키메라성 및 인간화 항체들을 단백질 G 비드들(GE Healthcare)로 정제하고, 적당한 조건하에 저장하였다.
실시예 9
DLL3 조절물질들의 특성들
상기 개시된 바와 같이 생성된, 선택된 DLL3 조절물질들의 결합 및 면역화학적 특성들을 분석하기 위해, 다양한 방법들을 사용하였다. 구체적으로, 여러 항체 조절물질들은 유동 세포분석법을 포함한 당 분야에 공지된 방법들에 의해, 인간, 사이노몰거스, 뮤린 및 마우스 항원 인식에 관한 친화도, 키네틱스, 빈화, 결합위치 및 교차 반응성으로서 특성평가하였다 (즉, 실시예 6의 세포들 및 작제물들을 사용함). 선택된 조절물질들의 친화도 및 키네틱 상수 kon 및 koff는 제조사의 설명서에 따라 ForteBio RED(ForteBio, Inc.) 상의 바이오-층 간섭분석법 또는 Biacore 2000 상의 표면 플라즈몬 공명을 사용하여 측정되었다.
특성평가 결과는 도 12에 표 형태로 개시되어 있으며, 여기에서 선택된 조절물질들이 일반적으로, 나노몰량 범위의 비교적 높은 친화력을 나타내고, 대부분의 경우 교차-반응성임을 알 수 있다. 도 12는 하기 실시예 10에 보다 상세히 설명된 바와 같은 이스트 매개 항원 단편 발현을 사용하여 측정된 바와 같이, 주요 조절물질에 의해 결합된 DLL3 도메인뿐만 아니라 경험적으로 측정된 조절물질 빈을 추가로 개시하고 있다. 추가로, 도 12는 하기 실시예 12에 개시된 바와 같이 측정된 NTX 신장 종양주 (% 생세포)의 세포독성 유도성 세포 살해를 매개할 수 있는 조절물질의 능력을 추가로 포함한다. 종합해 보면, 이러한 데이터는 약리학적 세팅에 사용하기 위한 개시된 조절물질뿐만 아니라 그들의 포텐셜의 다양한 결합특성들을 입증하고 있다.
항체 빈화에 관해서, 동일한 또는 상이한 빈들에 결합된 경쟁 항체들을 확인하기 위해 제조사의 설명서에 따라, ForteBio RED를 사용하였다. 간단히 말하면, 기준 항체(Ab1)를 항-마우스 캡쳐 칩 상에서 캡쳐하고, 그 칩을 블로킹하기 위해 고농도의 비-결합 항체를 사용하고, 베이스라인을 수집하였다. 그후, 재조합 인간 DLL3-플래그(Adipogen International)를 특정 항체(Ab1)에 의해 캡쳐하고, 대조표준으로서 동일한 항체(Ab1)를 갖는 웰 또는 상이한 시험 항체(Ab2)를 갖는 웰로 끝을 딥핑하였다. 새로운 항체와의 추가의 결합이 관찰된다면, Ab1 및 Ab2가 다른 빈에서 측정되었다. 추가의 결합이 일어나지 않았다면, 대조표준 Ab1과의 결합수준을 비교함으로써 측정되는 바와 같이, 동일한 빈에서 Ab2가 특정되었다. 당 분야에 알려져 있는 바와 같이, 이 방법은 96-웰 플레이트에서 독특한 빈들을 나타내는 항체들의 전체 열을 사용하여 특별한 항체들의 큰 라이브러리를 선별하기 위해 확장될 수 있다. 이 경우, 상기 빈화 과정은 선별된 항체들이 DLL3 단백질 상에서 적어도 9개의 다른 빈(도 12에서 빈 A 내지 I로서 표시됨)들에 결합됨을 보여주었다. DLL3의 분명한 크기 (여기서 ECD는 대략 56kD임) 및 사용된 빈화 방법의 해결방법에 기초하여, 9개의 확인된 빈들이 DLL3 세포외 항원 상에 존재하는 대부분의 빈들을 대표한다고 믿어진다.
상기 개시된 바와 같이 예시된 조절물질들을 평가하는데 더해, 선택된 SC16 항체 조절물질들이 인간 DLL3과 면역특이적으로 연합할 수 있는지를 확인하고, 동일한 조절물질들이 사이노몰거스, 래트 및/또는 뮤린 DLL3과 교차반응하는지의 여부를 측정하기 위해 유동 세포분석법을 수행하였다. 특히, 상기 실시예 6에 설명된 바와 같이 실질적으로 뮤린, 래트, 사이노몰거스 또는 인간 DLL3 (즉, GFP를 발현하는 h293-hDLL3, h293-cDLL3, h293-rDLL3 및 h293-mDLL3)을 과잉발현하는 293개의 세포들 및 FACSCanto II를 사용한 유동 세포분석법에 의해 예시된 뮤린 조절물질들을 분석하였다. 일부 경우, 예시된 뮤린 조절물질들은 Cochran et al.(J Immunol Methods. 287 (1-2):147-158 (2004)에 설명된 방법들을 사용하여 사이노몰로거스 DLL3을 나타내는 FACSCanto II 및 이스트세포들을 사용하여 유동 세포분석법에 의해 분석하였다.
유동 세포분석법에 근거하면, 선택된 항체 조절물질은 모두 293개의 세포들 상에서 과잉-발현된 인간 DLL3에 결합하는 것으로 발견된 (도시되지 않음) 반면, 시험된 많은 항체들은 사이노몰거스 및/또는 뮤린 DLL3과 교차-반응하는 것으로 발견되었다 (마우스와 반응하는 모든 항체들은 뮤린와도 반응하였음). 이와 관련하여, 그리고 도 12에 도시된 바와 같이, 인간 DLL3과 면역특이적으로 반응하는 13개의 조절물질들 중 8개가 뮤린 (또는 래트)와도 반응하는 것으로 발견되었다. 구체적으로, mAbs SC16.4, SC16.8, SC16.15, SC16.34, SC16.39, SC16.46, SC16.51 및 SC16.56은 뮤린 DLL3과 다소 정도의 차이로 교차-반응하는 것으로 밝혀진 반면, mAbs SC16.7, SC16.10, SC16.13, SC16.25 및 SC16.65은 뮤린 DLL3과 인지할 수 있을 정도로 연합하지 않았다. 상기 결과들은 뮤린 DLL3이 인간 DLL3의 아이소형 2와 대략 83% 상동성이라는 점에서 예상치 못한 결과는 아니다 (도 2b 참조). 약물 발견 및 개발에 동물 모델들을 사용함으로써 본 발명의 문맥에서 이러한 교차-반응성이 유리하게 이용될 수 있음을 이해할 수 있을 것이다.
상기 분석들 외에, CDR 이식 방법이 결합특성들을 현저하게 변경시킬 수 있는지에 대하여 실시예 8로부터의 인간화 작제물들 hSC16.13, hSC16.15, hSC16.25, hSC16.34 및 hSC16.56을 분석하였다. 이 측면에서, 인간화 작제물들 (이식된 CDR)을 인간화 작제물들에 사용된 것과 실질적으로 균등한 인간 불변 영역 및 뮤린 모체 (또는 제공체) 중쇄 및 경쇄 가변 영역을 포함하는 "전통적인" 키메라성 항체들과 대조하였다. 이러한 작제물들에 의해, 인간화 방법에 의해 초래된 속도상수 변화에 있어서 미묘한 변화를 확인하기 위해, Biacore 2000(GE Healthcare)을 사용하여 표면 플라즈몬 공명(SPR)을 진행하였다.
시험된 조절물질들 중 하나에 대한 예시 결과(SC16.15) 및 인간화 및 키메라성 작제물들 각각에 대한 결과의 표 요약이 도 13a-도 13c에 도시되어 있다. 25 및 12.5 nM의 인간 DLL3 항원의 농도 시리즈에 기초하고 (SC16.15에 대하여 도 13a 및 도 13b에서 상부에서 하부까지 곡선을 생성함), 1:1 Langmuir 결합모델을 사용하여, 인간 DLL3에 대한 SC16.15 항체결합의 KD는 0.2 nM인 것으로 추정되었다. 그후, 다른 인간화 작제물들 및 키메라성 작제물들로 유사한 실험들을 진행하여 (도시되지 않음), 도 13c에 도시된 친화도 값을 제공하였다. 상기 결과들은 인간화 방법이 조절물질의 친화도에 실질적으로 영향을 주지 않음을 보여줬다.
실시예 10
DLL3 조절물질들의 도메인 및 에피토프 맵핑
개시된 DLL3 항체 조절물질들이 연합 또는 결합한 에피토프들을 특성평가하고 위치확인하기 위해, Cochran et al., 2004 (상기 참조)에 설명된 프로토콜의 변형을 사용하여 도메인-레벨 에피토프 맵핑을 수행하였다. 간단히 말하면, 특정 아미노산 서열들을 포함하는 DLL3의 각 도메인들은 이스트 표면상에서 발현되고, 각 DLL3 항체에 의한 결합은 유동 세포분석법을 통해 측정하였다.
보다 구체적으로, 이스트 표시 플라스미드 작제물들은 하기 작제물들의 발현을 위해 생성되었다: DLL3 세포외 도메인(아미노산 27-466); DLL3 (아미노산 220-466)의 EGF-유사 도메인 1 내지 6에 융합된 DLL1 (아미노산 22-225)의 N-말단 영역 및 DSL 도메인으로 구성된, DLL1-DLL3 키메라; DLL1 (아미노산 222-518)의 EGF-유사 도메인 1 내지 8에 융합된 DLL3 (아미노산 27-214)의 N-말단 영역 및 DSL 도메인으로 구성된, DLL3-DLL1 키메라; EGF-유사 도메인 #1 (아미노산 215-249); EGF-유사 도메인 #2 (아미노산 274-310); EGF-유사 도메인 #1 및 #2 (아미노산 215-310); EGF-유사 도메인 #3 (아미노산 312-351); EGF-유사 도메인 #4 (아미노산 353-389); EGF-유사 도메인 #5 (아미노산 391-427); 및 EGF-유사 도메인 #6 (아미노산 429-465). (도메인 정보를 위해서, 일반적으로 UniProtKB/Swiss-Prot 데이터베이스 엔트리 Q9NYJ7을 참조하며, 이는 본원에 참조로 반영된다. 아미노산 넘버링은 서열번호 3에 개시된 것과 같은 리더 서열을 갖는 비처리 DLL3 단백질을 참조한 것임을 주목한다) N-말단 영역 또는 EGF 도메인을 전체적으로 분석하기 위해, 패밀리 멤버 DLL1(DLL1-DLL3 및 DLL3-DLL1)을 갖는 키메라를 단백질 폴딩에 의한 잠재적인 문제점들을 최소화하기 위해 단편과 대조적으로 사용하였다. 도메인-맵핑된 항체들은 상기 작제물들에 대한 결합이 작제물의 DLL3 부분과의 연합을 통해 일어난다는 것을 보여주는 DLL1과 교차반응을 하지 않는 것으로 이미 보여져왔다. 이러한 플라스미드들은 이스트로 형질전환되고, 그후 Cochran et al 에 설명된 바와 같이 배양 및 유도되었다.
특정 작제물에 대한 결합을 시험하기 위해, 원하는 작제물을 발현하는 200,000개의 유도된 이스트세포들을 PBS + 1 mg/mL BSA(PBSA)로 2회 세척하고, 0.1 μg/mL로 바이오티닐 항-HA 클론 3F10 (Roche Diagnostics)을 갖는 50 μL의 PBSA에서 배양하고, 50nM 정제된 항체 또는 하이브리도마들로부터 비정제 상층액의 1:2 희석액을 7일간 배양하였다. 세포들을 아이스 상에서 90분간 배양하고, PBSA에서 2회 세척하였다. 세포들을 적당한 2차 항체들과 50 μL PBSA내에서 배양하고; 뮤린 항체들에 대하여, Alexa 488 접합된 스트렙타비딘 및 Alexa 647 접합된 염소 항마우스 (둘 다 Life Technologies)를 각각 1 μg/mL로 첨가하고, 각 인간화 또는 키메라성 항체들에 대하여, Alexa 647 접합된 스트렙타비딘(Life Technologies) 및 R-파이코에리트린 접합된 염소 항 인간(Jackson Immunoresearch)을 각각 1 μg/mL로 첨가하였다. 아이스 상에서 20분 배양한 후, 세포들을 PBSA로 2회 세척하고, FACS Canto II 상에서 분석하였다. DLL3-DLL1 키메라에 결합된 항체들은 N-말단 영역+DSL에 결합한 것으로 지정되었다. 특정 EGF-유사 도메인 상에 존재하는 에피토프에 특이적으로 결합된 항체들은 그의 각 도메인에 결합한 것으로 지정되었다 (도 14a).
입체구조적(예를 들면, 불연속적) 또는 선형으로 에피토프를 분류하기 위해, DLL3 세포외 도메인을 표시하는 이스트를 80°C에서 30분간 가열처리하고, 그후 아이스-냉각된 PBSA에서 2회 세척하였다. 변성된 항원을 나타내는 이스트(변성 이스트)를 상기와 같이 동일한 염색 프로토콜 및 유동 세포분석에 넣었다. 변성 및 천연 이스트 모두에 결합된 항체들은 선형 에피토프에 결합한 것으로 분류된 반면, 천연 이스트에는 결합되었으나 변성 이스트에는 결합하지 않은 항체들은 입체구조적인 것으로 분류하였다.
시험된 항체들의 도메인-수준 에피토프 맵핑 데이터의 모식적 요약은 도 14a에 나타나 있으며, 선형 에피토프에 결합한 항체들은 밑줄쳐져 있으며, 측정된 경우 대응하는 빈은 괄호 속에 노트했다. 도 14a의 리뷰는 에피토프로 맵핑하는 경향이 있는 대다수의 조절물질들이 DLL3의 N-말단/DSL 영역 또는 제2 EGF-유사 도메인에서 발견된다는 것을 보여준다. 상기 언급한 바와 같이, 도 12는 선택된 많은 조절물질에 대하여 빈 측정 및 도메인 맵핑와 관련된 유사 데이터를 표 형태로 나타낸다.
다른 DLL3 영역에 결합함에도 불구하고 종양형성 세포들을 효과적으로 제거할 수 있는 개시된 조절물질들의 능력을 기록하기 위해, 킬링 데이터는 도메인 결합과 서로 관련되어 있다. 특히, 도 14b는 선택된 조절물질의 결합 도메인에 대하여 플로팅된 KDY66 PDX 주의 조절물질 매개된 시험관내 살해 (하기 실시예 12에 개시된 대로 유도됨)를 보여준다. 이러한 데이터는 도메인 특이적 조절물질 살해가 상기 시험관내 살해 분석을 사용하여 측정된 바와 같이 다소 가변적임을 보여준다. 그러나, 효과적인 조절물질에 대하여, 에피토프가 1차 서열내 N-말단쪽으로 이동함에 따라, 각 도메인내 최대 살해가 증가하는 경향이 나타난다. 특히, 최대 살해 효율은 EGF6으로부터 EGF2까지 개선되며, N-말단 도메인, EGF1, 및 EGF2에 걸쳐 안정기에 접어든다. 또한, 본 분석에서 시험된 항체외에, 가장 높은 비율의 효과적인 항체들이 N-말단 도메인에 결합한다. 이것은 DLL3의 DSL 도메인 또는 N-말단 영역과 연합 또는 결합하는 조절물질들이 세포독성제를 위한 약물 또는 표적 물질로서 특히 효과적인 것으로 입증할 수 있음을 제시한다.
두 방법들 중 하나를 사용하여 선택된 항체들 상에서 미세한 에피토프 맵핑을 추가로 수행하였다. Ph.D.-12 파지를 사용한 첫번째 방법은 제조사의 설명서에 따라 사용된 펩타이드 라이브러리 키트(New England Biolabs E8110S)를 디스플레이한다. 간단하게 말하면, 에피토프 맵핑을 위한 항체를 Nunc MaxiSorp 튜브(Nunc)상에서 pH 8의 0.1M 중탄산나트륨 용액 3mL내 50 μg/mL로 하룻밤동안 코팅하였다. 이 튜브를 중탄산나트륨용액내 3% BSA 용액으로 블로킹하였다. 그후, PBS + 0.1% Tween-20 내 1011 입력 파지를 결합시켜, 0.1% Tween-20으로 10회 연속세척에 의해 비-결합 파지를 세척하였다. 남은 파지를 실온에서 조심스럽게 교반하여 10분간 1mL 0.2 M 글리신에 의해 용출시키고, pH 9의 150 μL 1M Tris-HCl로 중화하였다. 용출된 파지를 증폭시키고, 세척단계 동안 0.5% Tween-20을 사용하여, 1011 입력 파지로 다시 팬닝하여, 선택 스트린전시(stringency)를 증가시켰다. Qiaprep M13 스핀 키트(Qiagen)를 사용하여, 제2 라운드로부터 용출된 파지의 24개의 플라크로부터의 DNA를 분리하고, 서열분석하였다. ELISA 분석법을 사용하여 클론 파지의 결합을 확인하고, 맵핑 항체 또는 대조표준 항체를 ELISA 플레이트 상에 코팅하고, 블로킹하고, 각 파지 클론에 노출시켰다. 홀스래디쉬 퍼옥시다제 접합된 항-M13 항체(GE Healthcare), 및 1-스텝 터보 TMB ELISA 용액(Pierce)을 사용하여 파지 결합을 검출하였다. 항원 ECD 펩타이드 서열에 대한 벡터 NTI(Life Technologies)를 사용하여, 특이적으로 결합하는 파지로부터의 파지 펩타이드 서열을 정렬하여, 결합 에피토프를 측정하였다.
또는, 이스트 디스플레이 방법(Chao et al., Nat Protoc. 1(2): 755-768, 2007)는 에피토프 맵핑 선택 항체들에 사용되었다. 간단히 말하면, 클론당 1개의 아미노산 변이의 표적 돌연변이생성 속도를 위해, 누클레오티드 유사체 8-옥소-2'데옥시구아노신-5'-트라이포스페이트 및 2'-데옥시-p-누클레오시드-5'트라이포스페이트 (둘다 TriLink Bio제)를 사용하여 실수를 범하기 쉬운 PCR에 의해 DLL3 ECD 변이형들의 라이브러리를 생성하였다. 이들은 이스트 디스플레이 포맷으로 변형되었다. 도메인-수준 맵핑을 위해 상기 설명된 기술을 사용하여, 50nM에서 HA 및 항체결합을 위해 라이브러리를 염색하였다. FACS Aria(BD)를 사용하여, 야생형 DLL3 ECD와 비교되는 결합손실을 나타내는 클론들을 분류하였다. 이들 클론들을 재배양하고, 표적 항체에 대한 결합 손실에 대한 FACS 분류의 다른 라운드에 넣었다. Zymoprep 이스트 플라스미드 미니프렙(Miniprep) 키트(Zymo Research), 각 ECD 클론들을 분류하고 서열분석하였다. 필요한 경우, Quikchange 영역 지향적 돌연변이생성 키트(Agilent)를 사용하여 단일-변이형 ECD 클론들로 돌연변이를 개편하였다.
결합 손실이 에피토프내 변이에 의한 것인지 또는 미스폴딩(misfolding)을 야기시키는 변이에 의한 것인지 결정하기 위해, 각 ECD 클론들을 다음에 스크리닝하였다. 시스테인, 프롤린 및 정지 코돈들을 포함한 변이들은 미스폴딩 변이가 일어나기 쉬워서 자동으로 폐기하였다. 비경쟁적, 형태적으로 특이적인 항체에 결합시키기 위해, 남은 ECD 클론들을 스크리닝하였다. 비-경쟁적이고 형태적으로 특이적인 항체들에 대한 결합력을 손실한 ECD 클론들은 미스폴딩 변이를 함유할 것으로 결론된 반면, 야생형 DLL3 ECD와 동일한 결합력을 보유한 ECD 클론들은 적당하게 폴딩된 것으로 결론지었다. 후자 그룹에서 ECD 클론들의 변이는 에피토프 내에 있는 것으로 결론내었다. 결과는 바로 아래에 있는 표 3에 기록되어 있다.
| 항체 클론 | 에피토프 | 서열번호 |
| SC16.23 | Q93, P94, G95, A96, P97 | 9 |
| SC16.34 | G203, R205, P206 | 10 |
| SC16.56 | G203, R205, P206 | 10 |
특히, 항체 결합에 관여하는 아미노산 잔기들을 포함하는 유도성 에피토프들을 갖는 선택 항체들은 표 3에 요약되어 있다. 이 측면에서, SC16.34 및 SC16.56은 도 14a에 도시된 빈화 정보와 도메인 맵핑 결과들과 일치하는 일반적인 아미노산 잔기들과 분명하게 상호반응한다. 게다가, SC16.23은 구별되는 연속성 에피토프와 상호반응하는 것으로 밝혀졌으며, SC16.34 또는 SC16.56와 빈화하지 않는 것으로 밝혀졌다. 첨부한 서열 목록의 목적을 위해, 서열번호 10은 위치 204에서 플레이스홀더 아미노산을 포함할 것이다.
실시예 11
세포표면 상의 DLL3의 검사 및 종양내 면역조직화학 염색에 기초한 유동 세포분석
본 조절물질들의 면역특이적 성질을 확인하기 위해, 그들의 표면 상에서 DLL3 단백질을 발현하는 조작된 293개의 세포주들을 선택적으로 인지할 수 있는지를 측정하는 유동 세포분석법을 사용하여, 예시적인 SC16 항체 조절물질을 시험하였다. 이와 관련하여, 본 명세서에 설명된 바와 같이, DLL3을 발현하는 세포들은 실시예 6에 실질적으로 개시된 바와 같이 제조하고, 선택된 조절물질에 노출시키고, 유동 세포분석법에 의해 조사하였다. 염색 특이성을 확인하기 위해, 아이소형-염색된 및 형광 마이너스 원(FMO) 대조표준을 사용하였다. SC16.56 조절물질에 대하여 도 15에 도시된 대표적인 데이터에 의해 입증된 바와 같이, SC16 항체들 중 일부 (예를 들면, SC16.56)는 293-hDLL3 세포들 (도 15b) 및 293-mDLL3 세포들 (도 15c)의 강한 염색을 제공하지만, 비-DLL3 발현 혈통 293개의 세포들의 염색은 제공하지 않았다 (도 15a). 이러한 데이터는 조절물질들이 인간 DLL3을 면역특이적으로 인지하고, SC16.56의 경우에 뮤린 DLL3을 인지한다는 것을 유동 세포분석법을 통해 입증하였다.
이러한 발견들을 확인하고, 인간 종양세포들 상에서 DLL3 발현이 검출될 수 있음을 증명하기 위해, 선택된 NTX 종양들의 표면 상에서의 DLL3 단백질 발현은 여러 개의 예시적인 SC16 항체들을 사용한 유동 세포분석법에 의해 분석되었다. 이와 관련하여, 상기 항체들 중 하나, SC16.56, 및 3개의 특정 종양들, OV26, KDY66, 및 LU37은 도 16에 도시되어 있다. 더욱 구체적으로는, NTX 종양들을 수확하고, 분류하고, 상업용으로 시판되는 항-마우스 CD45, 항-마우스 H-2Kd, 항-인간 EpCAM 및 상기 항-인간/마우스 DLL3(SC16.56) 항체들에 의해 동시-염색하였다. 상기 293-염색 실험들과 유사하게, 비-특이적 염색의 누락을 확인하기 위해, 아이소형-염색된 것 및 형광 마이너스 원(FMO) 대조표준을 사용하였다. 도 16에 도시된 바와 같이, 난소 OV26 NTX (도 16a), 신장 KDY66 NTX (도 16b), 및 폐 LU37 NTX(도 16c) 종양세포주들에 대한, 형광 프로파일의 우측 이동, 및 평균 형광 세기(MFI)값의 변화로 표시되는 바와 같이, 항-DLL3 염색은 인간 NTX 종양세포의 분획에서 높았다. SCLC NTX 종양들은 또한, DLL3의 양성 발현과 동일한 방법으로 염색되고, 유사하게 입증되었다 (데이터는 도시되지 않음). 이러한 데이터는 DLL3 단백질이 다양한 NTX 종양들의 표면상에 발현되고, 따라서 항-DLL3 항체 타입 조절물질을 사용할 수 있다.
DLL3 단백질의 존재를 추가로 확증하고, 종양 구조 내의 국소위치 파악을 위해, 면역조직화학법(IHC)을 인간 환자 종양-유도된 NTX 종양들, 정상인 조직들 및 1차 SCLC 종양들 상에서 수행하였다. 보다 구체적으로는, IHC는 DLL3에 대한 뮤린 모노클론 1차 항체(SC16.65), 마우스 특이적 바이오틴 접합된 2차 항체들, 홀스-래디쉬 퍼옥시다제와 결합된 아비딘/바이오틴 접합체, 티라미드 신호 증폭 및 DAB 검출을 포함하는, 간접검출방법을 사용하여, 포르말린 고정된 파라핀 포매된(FFPE) 조직 섹션들 상에서 수행하였다 (Nakene PK 1968; 16:557-60). 인간 환자 종양 유도된 NTX 종양들을 염색할 때, 비-특이적 결합으로 인한 백그라운드를 감소시키기 위해 마우스 IgG 블로킹 단계를 사용하였다. SC16.65를 먼저 입증하고, 비-DLL3 발현 모체 293 세포들이 아닌, DLL3을 과잉발현하는 293개의 세포들에서 특이적 염색을 나타냄으로써 IHC에 대하여 적당한 것으로 확인되었으며, DLL3 RNA 및 단백질의 넉다운 발현으로 설계 및 입증된 DLL3-표지된 헤어핀들로 처리된 세포들내에서 염색이 감소되었음을 확인하였다 (하기 실시예 14 참조, 데이터는 도시되지 않음). 이종이식 NTX 종양들의 패널 상의 IHC는 DLL3 mRNA에 대하여 양성으로 미리 시험된 SCLC NTX 및 NET 종양들 중 많은 것의 세포질 내에 및 막 상에 DLL3이 위치됨을 보여줬다 (도 16d). 염색 세기는 양성 세포들의 기록률에 의해 염색이 없는 것(-)으로부터 높은 발현(+++)까지 점수를 매겼다. 정상인 조직들의 염색은 DLL3의 검출가능한 발현을 나타내지 않았다 (도 16e). 중요하게는, 1차 SCLC 종양 샘플들의 염색은 36/43 종양들이 DLL3에 대하여 양성임을 확인하였다 (도 16f). 크로모그라닌 A(CHGA) 염색은 또한, 종양이 확실한 SCLC 종양인지 확인하기 위해 수행하였다. DLL3이 누락된 대부분의 종양들이 CHGA 염색도 누락되었으며, 이는 이러한 섹션들이 종양조직을 함유하지 않거나, 조직이 처리 중에 손상되었음을 보여준다. DLL3에 대하여 양성으로 시험되었지만, CHGA에 대하여 음성인 2개의 종양들은 모두 말기(IIIa) SCLC 종양들이었다. 이 데이터는DLL3이 정상인 조직에서 일반적으로 발현되지 않지만, 대다수의 SCLC 종양내에 존재함에 따라 효과적인 치료용 표적을 제공한다는 사실을 제시한다.
실시예 12
DLL3 조절물질들은 세포독성제의 전달을 용이하게 한다
본 발명의 DLL3 항체 조절물질이 생세포에 세포독성제를 전달하는 것을 매개할 수 있는지를 측정하기 위해, 무작위선택된 DLL3 항체 조절제들을 사용하여 시험관내 세포 살해 분석을 수행하였다.
구체적으로, 인간 KDY66의 웰당 2,500개의 세포들, 내인성 DLL3을 발현하는 NET NTX를 단일세포 현탁액으로 분리시키고, 항체 및 독소를 첨가하기 하루 전에 당 분야에 알려져 있는 바와 같이 성장인자가 보충된 혈청 없는 배지의 BD PrimariaTM 플레이트(BD Biosciences)상에 플레이팅하였다. 실시예 6 및 7에 기술된 것과 같은, 다양한 농도의 정제된 DLL3 조절물질, 및 사포린 독소에 공유결합된 고정된 농도의 4nM 항-마우스 IgG Fab 단편(Advanced Targeting Systems, #IT-48)을 7일간 배양액에 첨가하였다. 293-hDLL3 상에서 살해하기 위해, 항체들과 독소를 첨가하기 하루 전에, 웰당 500개의 세포들을 단일 세포 현탁액에 플레이팅하고, 10% PBS를 갖는 DMEM 중의 BD 조직 배양액 플레이트 상에 플레이팅하였다. 사포린에 공유결합된 고정농도의 2nM 항-마우스 IgG Fab 단편 및 2농도의 다양한 DLL3 조절물질을 3일동안 배양액에 첨가하였다. 세포들을 내면화하고 살해할 수 있는 사포린 접합체의 능력은 제조사의 설명서에 따라, 세포 적정기(Cell Titer) Glo® (Promega)를 사용하여 생세포수를 열거함으로써 측정될 수 있었다. 사포린 Fab 단편을 갖는 세포들을 함유하는 배양액을 사용한 기초발광계수는 100% 참고범위 및 이에 맞춰 계산된 모든 다른 계수들로서 설정되었다("표준화 RLU"라고 함). 이 분석법을 사용하여, 293-hDLL3 과잉발현 세포들 상에서 250 및 25pM에서 시험된 항체들의 부분집합뿐만 아니라 500 및 50pM에서 시험한 DLL3 항체들의 부분집합이 KDY66 세포들을 살해했음이 입증되었다 (도 17a 내지 도 17aa). 아이소형 대조표준들은 그래프의 왼쪽에서 IgG2a, IgG2b, 및 MOPC 바아로 도시된 바와 같이, 세포 계수에 영향을 미치지 않았다(도 17a 내지 도 17aa).
위에 설명된 첫번째 분석법에서 유효한 살해를 나타내는 DLL3의 부분집합은 활성을 위한 EC50 값들을 측정하기 위해 희석하여 시험하였다. 상기 두 대표적인 항체들, SC16.34 및 SC16.15는 도 17b에 도시되어 있으며, 여기에서 SC16.15가 SC16.34에 의해 나타난 살해 프로파일 (예를 들면, 5.7pM)에 관해, 피코몰이하 EC50 (예를 들면, 0.14pM)에 의해, 난소 NET NTX 종양인 OV26의 유효한 살해를 나타냈다. 라이보솜을 비활성화시키는 세포질로 흡수할 때, 사포린이 세포들을 살해함에 따라, 이 분석법은 추가의 교차연결 또는 다이머화의 필요없이, 세포표면에 DLL3-특이적 항체를 결합할 때 내재화가 일어날 수 있음을 입증한다.
마지막으로, LU37은 ADC1에 접합된 인간화 SC16.15 또는 인간화 IgG1 대조표준 ADC1 (바로 아래 실시예 13에서와 같이 접합됨)에 의해 처리하였다. 구체적으로는, 접합된 항체들을 첨가하기 하루 전에 당 분야에 알려져 있는 바와 같이, 성장인자가 보충된 혈청 유리 매질에서 2,500개의 LU37 NTX 세포들을 BD PrimariaTM 플레이트(BD Biosciences)상의 각 웰내에 플레이팅하였다. 다양한 농도의 huIgG1-ADC1 또는 hSC16.15-ADC를 7일동안 배양액에 첨가하고, 살해할 수 있는 세포독성제의 능력은 (상기 설명한 바와 같이) 세포수를 열거함으로써 측정하였다. 이 분석법을 사용함으로써, hSC16.15-ADC1이 LU37을 효과적으로 살해했다는 것이 입증되었다. 대조적으로, LU37의 50%를 살해하기 위해 대조표준 ADC의 1ml 당 1,000ng 초과가 필요했으며, hSC16.15-ADC1의 1ml 당 10ng 미만이 LU37의 50%를 살해했다(도 17c).
실시예 13
DLL 항체-약물 접합체의 제조
사포린에 의한 상기 결과들에 기초하여, 및 본 발명의 다재다능성을 추가로 입증하기 위해, 항-DLL3 항체 약물 접합체(DLL3-ADC)들을 공유결합된 세포독성제들을 사용하여 제조하였다. 보다 구체적으로는, 본원에 기술되거나, 바로 아래에 참고로 반영된 링커, 및 본 조절물질들에 공유부착된 선택된 피롤로벤조다이아제핀(PBD) 다이머들을 포함하는 DLL3-ADCs를 제조하였다 (예를 들면, 미국특허 2011/0256157 및 2012/0078028 및 미국특허 제6,214,345호를 참조하며, 이들은 전부 각각 본원에 참고로 반영된다).
참고문헌들의 관점에서 당 분야에 인지된 기술들을 사용하여, PBD 약물-링커 조합을 합성하고, 정제하였다. 선택된 약물-링커 조합을 제조하기 위해, 다양한 PBD 다이머 및 링커들이 사용된 반면, 각 링커 구성단위는 자유 설프하이드릴을 갖는 말단 말레이미도 물질을 포함했다. 이러한 링커들을 사용하여, 트리스(2-카르복시에틸)-포스파인(TCEP)에 의한 mAb의 부분 환원 후, 환원된 Cys 잔기들과 말레이미도-링커 적재물의 반응에 의해 접합체들을 제조하였다.
특히, 선택된 DLL3 항체 조절물질을 25 mM Tris HCl pH 7.5 및 5 mM EDTA 완충제에서 37℃에서 2시간동안 mAb 1mol당 1.3mol TCEP에 의해 환원시켰다. 반응을 15℃로 냉각시키고, DMSO내 링커 적재물을 mAb 1mol당 2.7 mol의 비율로 첨가한 후, 6%(v/v)의 최종 농도로 추가량의 DMSO를 첨가하였다. 이 반응을 1시간 동안 진행시켰다. 비반응 약물-링커는 과량의 N-아세틸 시스테인의 첨가에 의해 캡핑되었다. 그 후, 응집된 고분자량 항체, 보조-용매 및 소분자들을 제거하기 위해, AKTA 익스플로러 FPLC 시스템 DLL3-ADC(G.E. Healthcare)를 사용한 이온교환칼럼에 의해 DLL3-ADC (또는 SC16-ADC)를 정제하였다. 그후, 용출된 ADC를 접선유도여과(TFF)에 의해 배합물 완충제로 완충제-교환하고, 그후 농도를 조정하고, 세제를 첨가하였다. 최종 ADC를 단백질 농도(UV를 측정함으로써), 응집(SEC), 역상(RP) HPLC에 의한 항체에 대한 약물의 비율(DAR), 소수성 상호작용 크로마토그래피(HIC) HPLC에 의한 비접합 항체의 존재, RP HPLC에 의한 비-단백질성 물질들 및 DLL3 발현 세포주를 사용한 시험관내 세포독성에 대하여 분석하였다.
상기 과정, 또는 실질적으로 유사한 방법을 사용하여, 다양한 DLL3 조절물질들 및 PBD 다이머들을 포함하는 다수의 ADCs(즉, M-[L-D]n)를 다양한 생체내 및 시험관내 모델들에서 생성 및 시험하였다. 상기 실시예들 및 본 명세서의 목적을 위해, 상기 ADC는 일반적으로 DLL3-ADCs 또는 SC16-ADCs로 불리운다. 별도의 ADC들은 항체 (예를 들면, SC16.13) 및 특이적 링커-세포독성제 명명 ADC1, ADC2, 등에 따라 명명할 것이다. 따라서, 본 발명에 적합한 본보기 조절물질들은 SC16.13-ADC1 또는 SC16.67-ADC2를 포함할 수 있으며, 여기에서 ADC1 및 ADC2는 각 PBD 다이머 세포독성제 (및 선택적으로 링커)를 나타낸다.
실시예 14
항-DLL3 항체-약물 접합체 매개된 독성의 특이성
항-DLL3 항체-약물 접합체들로부터의 독성이 내인성 DLL3을 발현하는 세포에 대하여 특이적임을 입증하기 위해, 짧은-헤어핀 RNA(shRNA)을 사용하여 DLL3 mRNA 및 단백질의 하향 발현(down expression)을 노킹(knocking)함으로써 DLL3 발현이 억제될 때, 내인성 DLL3 발현을 갖는 것으로 알려진 종양세포들이 시험관내 SC16-ADC에 의해 더 이상 살해되지 않음을 보여주는 실험을 진행하였다.
KDY66는 신경내분비 특징들을 나타내고, DLL3 mRNA 및 단백질을 발현하는 유두상 신세포암종으로부터의 환자-유도된 이종이식이다 (예를 들면, 도 7 및 도 16b를 참조). DLL3의 발현은 항-DLL3 shRNA를 함유하는 GIPZ 렌티바이러스성 인간 DLL3-표적된 shRNA(Thermo Fisher Scientific Inc.)에 의한 형질도입에 의해 KDY66 세포들에서 감소되었다. 보다 구체적으로는 바이러스 패키징 플라스미드의 존재하에, 항-DLL3 shRNA(DLL3HP2) 또는 대조표준 비-스플라이싱 shRNA(DLL3NSHP)을 발현하는 바이시스트론성 렌티바이러스 플라스미드에 의해 293T 세포들을 형질감염시킴으로써 렌티바이러스 벡터가 생성되었다. 상층액 내에 함유된 렌티바이러스 입자들은 초원심분리에 의해 농축 및 수확되었다. 그 후, KDY66 세포 배양액을 형질도입하고, shRNA (즉, DLL3HP2 또는 NSHP)를 도입하기 위해 상기 입자들을 사용하였으며, 여기에서 항-DLL3 shRNA는 내인성 DLL3 mRNA와 결합하며, 파괴를 위해 그것을 표적화하여, DLL3 단백질로의 번역을 막는다. 두 벡터 작제물들은 성공적인 형질도입 및 형질도입된 세포들의 선택을 확인하기 위한 독립적 GFP 발현 모듈을 함유하였다.
형질도입후, DLL3의 발현을 유동 세포분석법에 의해 평가하였다. 간단히 말하면, DLL3HP2-형질도입된 세포들의 단일 세포 현탁액을 Alexa Fluor 647(Life Technologies)에 접합된 DLL3 조절물질(SC16.34)에 의해 표시하고, 표준조건하에 FACS Canto II 유동 세포분석기에 의해 분석하였다. DLL3HP2 형질도입된 세포들의 표면상에서 DLL3 단백질 발현의 감소를 입증하기 위해, 비-반응성 대조표준 항체(647-IgG1)에 의해 염색된 KDY66 DLL3NSHP 세포들의 유사하게 제조된 샘플 및 647-DLL3에 의해 염색된 KDY66 DLL3NSHP 세포들과 형광 세기를 대조하였다. DLL3NSHP.KDY66 세포들은 미접촉 KDY66 세포들과 실질적으로 균등한 DLL3 단백질 발현을 나타내는 것으로 밝혀졌다 (데이터는 도시되지 않음). 도 18a에 나타난 바와 같이, DLL3 단백질 표면 발현은 동일한 AlexaFluor-647 표시된 항체에 의해 염색된 미접촉 세포들과 대조되는, DLL3HP2에 의해 형질도입된 세포들에서 감소되었다.
종양의 성장시에 DLL3 발현의 결과를 조사하기 위해, DLL3HP2 도입된 세포들(DLL3-) 및 미접촉 KDY66 세포들(DLL3+)을 면역결핍 마우스에 이식하였다. 상기와 같이 제조된 샘플로부터, 살아있는 인간 GFP+ 세포들을 분류하여, 항-DLL3 shRNA를 함유하는 세포들을 수집하였다. 5마리의 마우스 집단에 DLL3HP2 또는 미접촉 KDY66 세포들을 주사 (마우스당 140개의 세포들)하고, 종양성장을 매주 모니터링하였다. 각 집단으로부터, 5개의 수용체들 중 2개가 종양이 성장하였다. 2개의 DLL3HP2. KDY66 수용체에서 종양성장은 2개의 미접촉 KDY66 수용체들에서 종양성장 뒤로 거의 22일 뒤쳐졌다 (도 18b). 상기 관찰된 성장지연은 DLL3 영향받은 종양성장의 넉다운 이래로 증가된 또는 가속된 종양형성과 DLL3 발현이 연관될 수 있음을 보여준다.
무작위를 위한 적당한 부피에 도달함에 따라 (~160mm3), DLL3HP2 KDY66 종양들 및 미접촉 KDY66 종양들을 수용체 마우스로부터 수확하고, 단일 세포의 현탁액 내에 분산시켰다. DLL3HP2 세포에서 DlL3 발현(즉, 생체내 성장 동안 유도되지 않은 DLL3 발현)의 계속된 감소가 상기 유동 세포분석법에 의한 단일 종양세포들의 현탁액에서 확인되었다. 이러한 측면에서, 도 18c는 시험관내에서 성장한 DLL3HP2 형질도입된 세포들이 유사한 조건에서 성장한 미접촉 세포들과 비교할 때 DLL3 단백질의 감소된 발현을 나타냄을 보여준다.
표준 생화학 기술들을 사용하여, 96 웰 플레이트에 미접촉 KDY66 세포들 또는 DLL3HP2 KDY66 세포들을 플레이팅하고, 무혈청 매질에서 배양하였다. 상기 개시된 바에 따라 제조된 인간화 hSC16.56-ADC1(SC16-ADC1) 또는 인간화 항-합텐 IgG-ADC1(대조표준) 항체-약물 접합체들의 희석 시리즈를 세포들에 세 차례 반복으로 첨가하였다. 항체-약물 접합체에 7일 노출시킨 후, 실시예 12에 개시된 바와 같이 각 웰(Cell Titer Glo, Promega)의 세포 융해물내 ATP의 발광-계 검출에 의해 생세포들의 수량을 측정하였다.
미접촉 KDY66 세포들의 50%가 비교적 적은 투여량의 13.27 pM SC16-ADC로 살해된 반면, SC16-ADC1은 DLL3HP2. KDY66 세포들의 20%도 살해할 수 없었다 (도 18d 및 도 18e). 아주 중요하게는, 내인성 DLL3 단백질 발현의 손실로 인해, SC16-ADC1에 의한 시험관내 살해가 완전히 손실되었다. 이는 hSC16-ADC1 세포독성이 비특이적 독성을 거의 갖지 않는 DLL3-발현 세포들로 특이적으로 표적화됨을 입증한다.
실시예 15
접합된
DLL3
조절물질들에 의한 종양 성장의 억제
상기 결과들에 기초하여, 본 발명의 접합된 DLL3 조절물질이 생체내 DLL3 발현 인간 종양의 성장을 줄이고 억제한다는 입증하기 위한 작업이 착수되었다. 이와 관련하여, 다수의 선택된 뮤린 항체 조절물질들이 PBD 세포독성제와 공유연합되고, 면역결핍 마우스내 인간 NTX 종양성장을 억제할 수 있는 능력을 입증하기 위해, 상기 얻은 ADC들을 시험하였다.
이 때문에, 당 분야에 인지된 기술을 사용하여 환자-유도성 NTX 종양들을 암컷 NOD/SCID 수용체 마우스의 플랭크에서 피하 배양되었다. 종양부피 및 마우스 중량을 주 2회 모니터링하였다. 종양부피가 150-250 mm3에 도달했을 때, 치료그룹에 마우스를 무작위 할당하고, 복강내 주사를 통해, (각각 PBD 다이머 ADC2를 사용하여 상기 실시예 13에 설명된 바에 따라 실질적으로 제조된) 항-합텐 대조표준 IgG1-ADC2 또는 지시량의 SC16-ADC2를 주사했다. 마우스에 균등한 주사를 3회 제공하고, 7일에 걸쳐 균일하게 두었다. 치료후, 종양이 800 mm3을 초과하거나 마우스가 아프게 될 때까지 종양부피 및 마우스 중량을 모니터링하였다. 모든 시험을 위해, 시험된 마우스는 면역결핍 종양-포함 NOD/SCID 마우스에서 일반적으로 관찰되는 부작용 건강효과들을 나타내지 않았다.
도 19는 신경내분비 특징들 나타내는 다른 폐종양들을 함유하는 마우스내 종양 성장에 대한 ADC의 영향을 나타낸다 (신경내분비 특징들을 갖는 두 소세포 폐암 및 1개의 대세포 폐암). 이 측면에서, ADC2에 접합된 3개의 예시적인 조절물질들 (SC16.13, SC16.46 및 SC16.67)에 의해 대세포 신경내분비 폐암종인 LU37을 치료함으로써, SC16.13-ADC2 및 SC16.67-ADC2의 경우에 20일정도 종양성장억제를 지속시키고 (도 19a); 역으로, SC16.46이 종양성장을 감소시켰음에도 불구하고, 다른 시험된 조절물질들보다 작은 활성을 나타냈다. 이와 유사하게, 4개의 예시적인 조절물질들 (SC16.4, SC16.13, SC16.15 및 SC16.46)에 의해 소세포 폐암종인 LU73을 치료하면, 어떤 경우 처리 후 120일 후까지 내구성 차도가 지속되었다 (도 19b). 그러나, LU73에 대하여 시험된 항체들에 의해서, LU73에 대하여 시험된 항체들은 종양억제의 지속에 있어서 다소 다양했다. 마지막으로, 2개의 접합된 조절물질들 (SC16.46-ADC2 및 SC16.67-ADC2)에 의해 다른 소세포 폐암종인 LU86을 치료하면, 한 경우에 40일 진행에 의해 종양이 수축되었다 (SC16.67-ADC2; 도 19c). 도 19c에서, 곡선들 중 2개가 실질적으로 겹치고 (mIgG1-ADC2 및 SC16.46-ADC2) 및 구별되기 어렵다는 사실을 노트한다.
연장된 기간 동안 생체내 종양성장을 드라마틱하게 지연 또는 억제시킬 수 있는 다양한 접합된 조절물질들의 놀라운 능력은 증식성 질환들을 치료하기 위한 치료적 표적으로서 DLL3을 사용함을 입증한다.
실시예 16
인간화 DLL3-ADC 조절물질에 의한 종양성장의 억제
DLL3-ADC2에 의해 인상깊은 결과들이 주어진다면, 생체 내에서 여러 타입들의 종양들 (난소암, 폐암 및 신장암 포함)을 치료하는데 있어서 예시적인 인간화 ADC 조절물질들의 효능을 입증하기 위해 추가의 실험들을 수행하였다. 구체적으로, 선택된 인간화 항-DLL3 항체들 (상기 실시예 8에 개시된 바와 같이 제조된 hSC16.13, hSC16.15, hSC16.34 및 hSC16.56)을 상기 설명한 바와 같이 (링커 단위를 통해) 2개의 별도의 PBD 세포독성제 (ADC1 및 ADC2)에 접합하고, 대조표준들과 함께 상기 실시예에 개시된 바와 같이 NTX 종양 이식된 면역결핍 마우스에 투여하였다. 각 연구에서, 종양이 800 mm3 초과하거나 마우스가 아프게 될 때까지, 대조표준 동물들의 종양 부피 및 마우스 중량을 모니터링하였다. 이 실험들의 결과는 도 20a 내지 도 20f에 나타나 있다.
도 20a 내지 도 20f의 검토는 여러 종양 타입에서 종양 부피 감소 및 내구성 차도가 얻어졌고, 일부는 1 mg/kg hSC16-ADC에 의해 치료 후 신경내분비 특징들을 나타냄을 보여준다. 예를 들면, 주요 도면들에서 투여가 수직선으로 도시되는 치료계획들은, 신경내분비 특징들을 갖는 난소암종 (OV26, hSC16.15-ADC2, 도 20a), 신경내분비 특징들을 갖는 유두상 신장세포암종 (KDY66, hSC16.34-ADC1, 도 20e) 및 3개의 소세포 폐암종 (LU86, hSC16.13-ADC1, 도 20b), (LU64, hSC16.13-ADC1, 도 20c; LU64, hSC16.13-ADC2 + hSC16.13-ADC1, 도 20d)에서, 종양 덩어리를 완전히 및 내구성으로 제거하였다. 상기 모든 경우에 종양 재발이 100일 이상 관찰되지 않았으며, 일부 경우 치료 후 226일이 지난 후에도 마우스가 연장된 시간 동안 생존했다. 또한, 본 조절물질들에 의한 치료로 인해, 0.5 mg/kg의 낮은 투여량을 사용하여 높은 수준의 DLL3을 나타낸 클리어세포 신장세포암종 이종이식에서 종양부피가 감소하고, 성장이 억제되었다 (KDY27, hSC16.56-ADC1, 도 20f).
마지막으로, 특정의 재발한 종양들이 hSC16-ADC 독성에 대하여 민감하다는 사실을 주목해야 한다. SC16.13-ADC2에 의해 초기 치료한지 80일 후, LU64에서 재발이 관찰되었다 (도 20d). hSC16.13-ADC1에 의해 재발 종양을 치료하면, 관찰가능한 종양 덩어리 제거가 일어났으며, 이는 두번째 치료 후 100일 이상 지속되었다.
다시 이러한 결과들은 다양한 증식성 질환들을 치료하는데 있어서 본 발명의 조절물질들의 놀라운 다재다능성 및 응용성을 입증한다.
실시예 17
DLL3 항체-약물 접합체에 의한 암줄기세포 출현빈도의 감소
상기 실시예에 도시된 바와 같이, 개시된 조절물질들은 특히 ADC 형태의 종양성장을 억제하는 데 특히 효과적이다. 게다가, 상기 입증된 바와 같이, DLL3발현은 약물 내성 및 연료 종양재발 및 전이로 일반적으로 알려져 있는 암줄기세포들과 관련되어 있다. 따라서, DLL3-ADCs에 의한 치료로 NTX 주들의 재발가능성이 감소하는 것을 증명하기 위해, 생체내 한계희석분석법을 수행하여, hSC16.13-ADC1에 의한 치료 후 소세포 폐암종에서 종양-개시 세포(TIC)들의 출현빈도를 측정하였다 (도 21에 표시된 SC16-ADC).
환자-유도성 소세포 폐암 이종이식 종양(LU95 및 LU64)은 면역결핍 숙주 마우스의 피하에서 성장했다. 종양 부피 평균이 150 mm3 내지 250 mm3인 경우, 마우스를 7마리 마우스의 두 그룹으로 무작위 구분하였다. 복강내 주사를 통해, 0, 4 및 7일 (도 21a 및 도 21d, 대시 수직선)에 마우스에게, 인간 IgG1-ADC1(1mg/kg; n=7마리의 마우스)를 음성 대조표준으로서, 또는hSC16.13-ADC1(1 mg/kg; n=7마리의 마우스)를 주사하였다. 8일째에, 각 그룹으로부터 2마리의 대표 마우스들을 안락사시키고, 그들의 종양들을 회수하고, 단일-세포 현탁액에 분산시켰다. 도 21a 및 도 21d에 도시된 바와 같이, hIgG1-ADC1(IgG1-ADC)에 의해 치료된 종양이 5마리의 남은 마우스에서 성장을 계속하고 있는 반면, hSC16.13-ADC1(SC16-ADC)에 의해 치료된 종양 부피는 5마리의 남은 마우스에서 0 또는 거의 0으로 감소되었다.
표준 유동세포분석법 및 표지된 항-DLL3 항체를 사용하여, 두 처리군들 중 각각으로부터 2개의 수확된 종양들은 유사하게 양성인 DLL3 발현을 갖는 것으로 확인되었다. 그후, 각 치료군으로부터의 종양 세포들을 풀링하고, 제조사의 설명서 및 당 분야에 인지된 기술들에 따라, FACSAria III(Becton Dickenson)을 사용하여 FACS에 의해 살아있는 인간세포들을 분리하였다. 간단히 말하면, FITC 접합된 항-뮤린 H2Kd 및 항-뮤린 CD45 항체들 (둘 다 BioLegend, Inc.)에 의해 세포들을 표지하고, 1μg/ml DAPI내에 재현탁시켰다. 그 후 DAPI-, mH2Kd- 및 mCD45- 인간 세포들이 수집되고 뮤린 세포들이 폐기되는 표준 조건하에서 상기 얻어진 현탁액을 분류하였다.
그후, hSC16.13-ADC1에 의해 치료된 종양들로부터 2000, 500, 120 또는 30개의 분류된 살아있는 인간세포들에 의해 5마리 수용체 마우스 집단을 이식하였다. 대조를 위해, 대조표준 IgG1-ADC1에 의해 치료한 종양들로부터 1000, 250, 60 또는 15개의 분류된 생 인간세포들에 의해 5마리의 수용체 마우스 집단을 이식하였다. 수용체 마우스들 내 종양들을 주 1회 측정하고, 종양이 1500mm3에 도달하기 전에 각 마우스를 안락사시켰다. 종양성이 개시한 후, 추가의 마우스에 새로운 종양이 나타남 없이 연속 4주 후 연구가 종료되었다. 이때, 수용체 마우스들을 종양 성장에 대하여 양성 또는 음성으로 점수 매겼으며, 양성 성장은 100mm3을 초과하는 부피를 가졌다.
주사된 모든 세포 투여량에 거쳐, hSC16.13-ADC1 에 의해 치료된 LU95 세포들의 수용체들은 IgG1-ADC1로 치료된 LU95 세포들의 수용체들 중 12개와 대조되는 단 1개의 종양만 생성했다 (도 21b). 이와 유사하게, SC16.13-ADC1에 의해 치료된 LU64 세포들의 수용체들은 IgG1-ADC1에 의해 치료된 LU64 세포들의 수용체들 중 13개의 종양과 대조되는, 3개의 종양들을 생성했다 (도 21e).
뿌아송 분포 통계학(L-Calc 소프트웨어, Stemcell Technologies)을 사용하여, 각 군집에서 종양개시 세포들의 출현빈도를 계산하기 위해, 이식 후 18주에 종양을 갖는 수용체 및 갖지 않는 수용체의 주사된 세포투여량을 사용하였다. LU95에서 10,000개의 살아있는 인간세포들 당 TIC의 수는 IgG1-ADC에 의해 치료한 종양들에서 78.1로부터, 내지 hSC16.13-ADC1에 의해 치료한 종양들에서 0.769까지 100-배 이상 감소하였다 (도 21c, 대조표준 치료군에서 1:128 세포들, 내지 조절물질 치료군에서 1:12,998 세포들). LU64에서, TIC의 수는 IgG1-ADC1 또는 hSC16.13-ADC1에 의해 각각 치료한 종양에서 10,000개의 살아있는 인간세포들 당 47.4 TIC에서 2.86 TIC로 16.6-배 감소하였다 (도 21f, 대조표준 치료군에서 1:211 세포들, 내지 조절물질 치료군에서 1:3,500 세포들). 상기 TIC (예를 들면, 암 줄기세포) 출현빈도의 실질적인 감소는 이미 증명된 종양부피 감소에 더해, 본 발명의 조절물질이 암 줄기세포 개체군을 크게 및 특이적으로 감소시키고, 더 나아가, 종양의 재발, 전이 및 재-성장 가능성을 감소시킴을 입증하였다. 상기 재발 및 재-성장 가능성의 감소는 본 실시예들에서 관찰된 높은 종양-제거 생존율에 의해 크게 입증된다.
본원에 인용된 모든 특허, 특허출원 및 공보들, 및 전자적으로 사용가능한 자료 (예를 들면, GenBank 및 RefSeq에서 누클레오티드 서열 제출 및 예를 들면, GenBank 및 RefSeq의 첨부된 암호화 영역들로부터의 SwissProt, PIR, PRF, PBD 및 번역들)는 본원에 참조로 포함된다. 본 발명의 상세한 설명 및 실시예들은 단지 이해를 돕기 위해 제공될 뿐이다. 이로부터 불필요한 한정은 없는 것으로 이해된다. 본 발명은 특허청구범위에 의해 한정된 본 발명내에 포함될 당업자에게 분명한 변형을 위해, 개시되고 설명된 정확한 상세에 제한되지 않는다.
SEQUENCE LISTING
<110> STEM CENTRX, INC.
<120> DLL3 MODULATORS AND METHODS OF USE
<130> 11200.0013-00304
<150> US 61/603,173
<151> 2012-02-24
<150> US 61/719,803
<151> 2012-10-29
<160> 413
<170> KopatentIn 1.71
<210> 1
<211> 2387
<212> DNA
<213> Homo sapiens
<400> 1
agatataagg cttggaagcc agcagctgcg actcccgaga cccccccacc agaaggccat 60
ggtctcccca cggatgtccg ggctcctctc ccagactgtg atcctagcgc tcattttcct 120
cccccagaca cggcccgctg gcgtcttcga gctgcagatc cactctttcg ggccgggtcc 180
aggccctggg gccccgcggt ccccctgcag cgcccggctc ccctgccgcc tcttcttcag 240
agtctgcctg aagcctgggc tctcagagga ggccgccgag tccccgtgcg ccctgggcgc 300
ggcgctgagt gcgcgcggac cggtctacac cgagcagccc ggagcgcccg cgcctgatct 360
cccactgccc gacggcctct tgcaggtgcc cttccgggac gcctggcctg gcaccttctc 420
tttcatcatc gaaacctgga gagaggagtt aggagaccag attggagggc ccgcctggag 480
cctgctggcg cgcgtggctg gcaggcggcg cttggcagcc ggaggcccgt gggcccggga 540
cattcagcgc gcaggcgcct gggagctgcg cttctcgtac cgcgcgcgct gcgagccgcc 600
tgccgtcggg accgcgtgca cgcgcctctg ccgtccgcgc agcgccccct cgcggtgcgg 660
tccgggactg cgcccctgcg caccgctcga ggacgaatgt gaggcgccgc tggtgtgccg 720
agcaggctgc agccctgagc atggcttctg tgaacagccc ggtgaatgcc gatgcctaga 780
gggctggact ggacccctct gcacggtccc tgtctccacc agcagctgcc tcagccccag 840
gggcccgtcc tctgctacca ccggatgcct tgtccctggg cctgggccct gtgacgggaa 900
cccgtgtgcc aatggaggca gctgtagtga gacacccagg tcctttgaat gcacctgccc 960
gcgtgggttc tacgggctgc ggtgtgaggt gagcggggtg acatgtgcag atggaccctg 1020
cttcaacggc ggcttgtgtg tcgggggtgc agaccctgac tctgcctaca tctgccactg 1080
cccacccggt ttccaaggct ccaactgtga gaagagggtg gaccggtgca gcctgcagcc 1140
atgccgcaat ggcggactct gcctggacct gggccacgcc ctgcgctgcc gctgccgcgc 1200
cggcttcgcg ggtcctcgct gcgagcacga cctggacgac tgcgcgggcc gcgcctgcgc 1260
taacggcggc acgtgtgtgg agggcggcgg cgcgcaccgc tgctcctgcg cgctgggctt 1320
cggcggccgc gactgccgcg agcgcgcgga cccgtgcgcc gcgcgcccct gtgctcacgg 1380
cggccgctgc tacgcccact tctccggcct cgtctgcgct tgcgctcccg gctacatggg 1440
agcgcggtgt gagttcccag tgcaccccga cggcgcaagc gccttgcccg cggccccgcc 1500
gggcctcagg cccggggacc ctcagcgcta ccttttgcct ccggctctgg gactgctcgt 1560
ggccgcgggc gtggccggcg ctgcgctctt gctggtccac gtgcgccgcc gtggccactc 1620
ccaggatgct gggtctcgct tgctggctgg gaccccggag ccgtcagtcc acgcactccc 1680
ggatgcactc aacaacctaa ggacgcagga gggttccggg gatggtccga gctcgtccgt 1740
agattggaat cgccctgaag atgtagaccc tcaagggatt tatgtcatat ctgctccttc 1800
catctacgct cgggaggtag cgacgcccct tttccccccg ctacacactg ggcgcgctgg 1860
gcagaggcag cacctgcttt ttccctaccc ttcctcgatt ctgtccgtga aatgaattgg 1920
gtagagtctc tggaaggttt taagcccatt ttcagttcta acttactttc atcctatttt 1980
gcatccctct tatcgttttg agctacctgc catcttctct ttgaaaaacc tatgggcttg 2040
aggaggtcac gatgccgact ccgccagagc ttttccactg attgtactca gcggggaggc 2100
aggggaggca gaggggcagc ctctctaatg cttcctactc attttgtttc taggcctgac 2160
gcgtctcctc catccgcacc tggagtcaga gcgtggattt ttgtatttgc tcggtggtgc 2220
ccagtctctg ccccagaggc tttggagttc aatcttgaag gggtgtctgg gggaacttta 2280
ctgttgcaag ttgtaaataa tggttattta tatcctattt tttctcaccc catctctcta 2340
gaaacaccta taaaggctat tattgtgatc agttttgact aacaaaa 2387
<210> 2
<211> 2052
<212> DNA
<213> Homo sapiens
<400> 2
agatataagg cttggaagcc agcagctgcg actcccgaga cccccccacc agaaggccat 60
ggtctcccca cggatgtccg ggctcctctc ccagactgtg atcctagcgc tcattttcct 120
cccccagaca cggcccgctg gcgtcttcga gctgcagatc cactctttcg ggccgggtcc 180
aggccctggg gccccgcggt ccccctgcag cgcccggctc ccctgccgcc tcttcttcag 240
agtctgcctg aagcctgggc tctcagagga ggccgccgag tccccgtgcg ccctgggcgc 300
ggcgctgagt gcgcgcggac cggtctacac cgagcagccc ggagcgcccg cgcctgatct 360
cccactgccc gacggcctct tgcaggtgcc cttccgggac gcctggcctg gcaccttctc 420
tttcatcatc gaaacctgga gagaggagtt aggagaccag attggagggc ccgcctggag 480
cctgctggcg cgcgtggctg gcaggcggcg cttggcagcc ggaggcccgt gggcccggga 540
cattcagcgc gcaggcgcct gggagctgcg cttctcgtac cgcgcgcgct gcgagccgcc 600
tgccgtcggg accgcgtgca cgcgcctctg ccgtccgcgc agcgccccct cgcggtgcgg 660
tccgggactg cgcccctgcg caccgctcga ggacgaatgt gaggcgccgc tggtgtgccg 720
agcaggctgc agccctgagc atggcttctg tgaacagccc ggtgaatgcc gatgcctaga 780
gggctggact ggacccctct gcacggtccc tgtctccacc agcagctgcc tcagccccag 840
gggcccgtcc tctgctacca ccggatgcct tgtccctggg cctgggccct gtgacgggaa 900
cccgtgtgcc aatggaggca gctgtagtga gacacccagg tcctttgaat gcacctgccc 960
gcgtgggttc tacgggctgc ggtgtgaggt gagcggggtg acatgtgcag atggaccctg 1020
cttcaacggc ggcttgtgtg tcgggggtgc agaccctgac tctgcctaca tctgccactg 1080
cccacccggt ttccaaggct ccaactgtga gaagagggtg gaccggtgca gcctgcagcc 1140
atgccgcaat ggcggactct gcctggacct gggccacgcc ctgcgctgcc gctgccgcgc 1200
cggcttcgcg ggtcctcgct gcgagcacga cctggacgac tgcgcgggcc gcgcctgcgc 1260
taacggcggc acgtgtgtgg agggcggcgg cgcgcaccgc tgctcctgcg cgctgggctt 1320
cggcggccgc gactgccgcg agcgcgcgga cccgtgcgcc gcgcgcccct gtgctcacgg 1380
cggccgctgc tacgcccact tctccggcct cgtctgcgct tgcgctcccg gctacatggg 1440
agcgcggtgt gagttcccag tgcaccccga cggcgcaagc gccttgcccg cggccccgcc 1500
gggcctcagg cccggggacc ctcagcgcta ccttttgcct ccggctctgg gactgctcgt 1560
ggccgcgggc gtggccggcg ctgcgctctt gctggtccac gtgcgccgcc gtggccactc 1620
ccaggatgct gggtctcgct tgctggctgg gaccccggag ccgtcagtcc acgcactccc 1680
ggatgcactc aacaacctaa ggacgcagga gggttccggg gatggtccga gctcgtccgt 1740
agattggaat cgccctgaag atgtagaccc tcaagggatt tatgtcatat ctgctccttc 1800
catctacgct cgggaggcct gacgcgtctc ctccatccgc acctggagtc agagcgtgga 1860
tttttgtatt tgctcggtgg tgcccagtct ctgccccaga ggctttggag ttcaatcttg 1920
aaggggtgtc tgggggaact ttactgttgc aagttgtaaa taatggttat ttatatccta 1980
ttttttctca ccccatctct ctagaaacac ctataaaggc tattattgtg atcagttttg 2040
actaacaaaa aa 2052
<210> 3
<211> 618
<212> PRT
<213> Homo sapiens
<400> 3
Met Val Ser Pro Arg Met Ser Gly Leu Leu Ser Gln Thr Val Ile Leu
1 5 10 15
Ala Leu Ile Phe Leu Pro Gln Thr Arg Pro Ala Gly Val Phe Glu Leu
20 25 30
Gln Ile His Ser Phe Gly Pro Gly Pro Gly Pro Gly Ala Pro Arg Ser
35 40 45
Pro Cys Ser Ala Arg Leu Pro Cys Arg Leu Phe Phe Arg Val Cys Leu
50 55 60
Lys Pro Gly Leu Ser Glu Glu Ala Ala Glu Ser Pro Cys Ala Leu Gly
65 70 75 80
Ala Ala Leu Ser Ala Arg Gly Pro Val Tyr Thr Glu Gln Pro Gly Ala
85 90 95
Pro Ala Pro Asp Leu Pro Leu Pro Asp Gly Leu Leu Gln Val Pro Phe
100 105 110
Arg Asp Ala Trp Pro Gly Thr Phe Ser Phe Ile Ile Glu Thr Trp Arg
115 120 125
Glu Glu Leu Gly Asp Gln Ile Gly Gly Pro Ala Trp Ser Leu Leu Ala
130 135 140
Arg Val Ala Gly Arg Arg Arg Leu Ala Ala Gly Gly Pro Trp Ala Arg
145 150 155 160
Asp Ile Gln Arg Ala Gly Ala Trp Glu Leu Arg Phe Ser Tyr Arg Ala
165 170 175
Arg Cys Glu Pro Pro Ala Val Gly Thr Ala Cys Thr Arg Leu Cys Arg
180 185 190
Pro Arg Ser Ala Pro Ser Arg Cys Gly Pro Gly Leu Arg Pro Cys Ala
195 200 205
Pro Leu Glu Asp Glu Cys Glu Ala Pro Leu Val Cys Arg Ala Gly Cys
210 215 220
Ser Pro Glu His Gly Phe Cys Glu Gln Pro Gly Glu Cys Arg Cys Leu
225 230 235 240
Glu Gly Trp Thr Gly Pro Leu Cys Thr Val Pro Val Ser Thr Ser Ser
245 250 255
Cys Leu Ser Pro Arg Gly Pro Ser Ser Ala Thr Thr Gly Cys Leu Val
260 265 270
Pro Gly Pro Gly Pro Cys Asp Gly Asn Pro Cys Ala Asn Gly Gly Ser
275 280 285
Cys Ser Glu Thr Pro Arg Ser Phe Glu Cys Thr Cys Pro Arg Gly Phe
290 295 300
Tyr Gly Leu Arg Cys Glu Val Ser Gly Val Thr Cys Ala Asp Gly Pro
305 310 315 320
Cys Phe Asn Gly Gly Leu Cys Val Gly Gly Ala Asp Pro Asp Ser Ala
325 330 335
Tyr Ile Cys His Cys Pro Pro Gly Phe Gln Gly Ser Asn Cys Glu Lys
340 345 350
Arg Val Asp Arg Cys Ser Leu Gln Pro Cys Arg Asn Gly Gly Leu Cys
355 360 365
Leu Asp Leu Gly His Ala Leu Arg Cys Arg Cys Arg Ala Gly Phe Ala
370 375 380
Gly Pro Arg Cys Glu His Asp Leu Asp Asp Cys Ala Gly Arg Ala Cys
385 390 395 400
Ala Asn Gly Gly Thr Cys Val Glu Gly Gly Gly Ala His Arg Cys Ser
405 410 415
Cys Ala Leu Gly Phe Gly Gly Arg Asp Cys Arg Glu Arg Ala Asp Pro
420 425 430
Cys Ala Ala Arg Pro Cys Ala His Gly Gly Arg Cys Tyr Ala His Phe
435 440 445
Ser Gly Leu Val Cys Ala Cys Ala Pro Gly Tyr Met Gly Ala Arg Cys
450 455 460
Glu Phe Pro Val His Pro Asp Gly Ala Ser Ala Leu Pro Ala Ala Pro
465 470 475 480
Pro Gly Leu Arg Pro Gly Asp Pro Gln Arg Tyr Leu Leu Pro Pro Ala
485 490 495
Leu Gly Leu Leu Val Ala Ala Gly Val Ala Gly Ala Ala Leu Leu Leu
500 505 510
Val His Val Arg Arg Arg Gly His Ser Gln Asp Ala Gly Ser Arg Leu
515 520 525
Leu Ala Gly Thr Pro Glu Pro Ser Val His Ala Leu Pro Asp Ala Leu
530 535 540
Asn Asn Leu Arg Thr Gln Glu Gly Ser Gly Asp Gly Pro Ser Ser Ser
545 550 555 560
Val Asp Trp Asn Arg Pro Glu Asp Val Asp Pro Gln Gly Ile Tyr Val
565 570 575
Ile Ser Ala Pro Ser Ile Tyr Ala Arg Glu Val Ala Thr Pro Leu Phe
580 585 590
Pro Pro Leu His Thr Gly Arg Ala Gly Gln Arg Gln His Leu Leu Phe
595 600 605
Pro Tyr Pro Ser Ser Ile Leu Ser Val Lys
610 615
<210> 4
<211> 587
<212> PRT
<213> Homo sapiens
<400> 4
Met Val Ser Pro Arg Met Ser Gly Leu Leu Ser Gln Thr Val Ile Leu
1 5 10 15
Ala Leu Ile Phe Leu Pro Gln Thr Arg Pro Ala Gly Val Phe Glu Leu
20 25 30
Gln Ile His Ser Phe Gly Pro Gly Pro Gly Pro Gly Ala Pro Arg Ser
35 40 45
Pro Cys Ser Ala Arg Leu Pro Cys Arg Leu Phe Phe Arg Val Cys Leu
50 55 60
Lys Pro Gly Leu Ser Glu Glu Ala Ala Glu Ser Pro Cys Ala Leu Gly
65 70 75 80
Ala Ala Leu Ser Ala Arg Gly Pro Val Tyr Thr Glu Gln Pro Gly Ala
85 90 95
Pro Ala Pro Asp Leu Pro Leu Pro Asp Gly Leu Leu Gln Val Pro Phe
100 105 110
Arg Asp Ala Trp Pro Gly Thr Phe Ser Phe Ile Ile Glu Thr Trp Arg
115 120 125
Glu Glu Leu Gly Asp Gln Ile Gly Gly Pro Ala Trp Ser Leu Leu Ala
130 135 140
Arg Val Ala Gly Arg Arg Arg Leu Ala Ala Gly Gly Pro Trp Ala Arg
145 150 155 160
Asp Ile Gln Arg Ala Gly Ala Trp Glu Leu Arg Phe Ser Tyr Arg Ala
165 170 175
Arg Cys Glu Pro Pro Ala Val Gly Thr Ala Cys Thr Arg Leu Cys Arg
180 185 190
Pro Arg Ser Ala Pro Ser Arg Cys Gly Pro Gly Leu Arg Pro Cys Ala
195 200 205
Pro Leu Glu Asp Glu Cys Glu Ala Pro Leu Val Cys Arg Ala Gly Cys
210 215 220
Ser Pro Glu His Gly Phe Cys Glu Gln Pro Gly Glu Cys Arg Cys Leu
225 230 235 240
Glu Gly Trp Thr Gly Pro Leu Cys Thr Val Pro Val Ser Thr Ser Ser
245 250 255
Cys Leu Ser Pro Arg Gly Pro Ser Ser Ala Thr Thr Gly Cys Leu Val
260 265 270
Pro Gly Pro Gly Pro Cys Asp Gly Asn Pro Cys Ala Asn Gly Gly Ser
275 280 285
Cys Ser Glu Thr Pro Arg Ser Phe Glu Cys Thr Cys Pro Arg Gly Phe
290 295 300
Tyr Gly Leu Arg Cys Glu Val Ser Gly Val Thr Cys Ala Asp Gly Pro
305 310 315 320
Cys Phe Asn Gly Gly Leu Cys Val Gly Gly Ala Asp Pro Asp Ser Ala
325 330 335
Tyr Ile Cys His Cys Pro Pro Gly Phe Gln Gly Ser Asn Cys Glu Lys
340 345 350
Arg Val Asp Arg Cys Ser Leu Gln Pro Cys Arg Asn Gly Gly Leu Cys
355 360 365
Leu Asp Leu Gly His Ala Leu Arg Cys Arg Cys Arg Ala Gly Phe Ala
370 375 380
Gly Pro Arg Cys Glu His Asp Leu Asp Asp Cys Ala Gly Arg Ala Cys
385 390 395 400
Ala Asn Gly Gly Thr Cys Val Glu Gly Gly Gly Ala His Arg Cys Ser
405 410 415
Cys Ala Leu Gly Phe Gly Gly Arg Asp Cys Arg Glu Arg Ala Asp Pro
420 425 430
Cys Ala Ala Arg Pro Cys Ala His Gly Gly Arg Cys Tyr Ala His Phe
435 440 445
Ser Gly Leu Val Cys Ala Cys Ala Pro Gly Tyr Met Gly Ala Arg Cys
450 455 460
Glu Phe Pro Val His Pro Asp Gly Ala Ser Ala Leu Pro Ala Ala Pro
465 470 475 480
Pro Gly Leu Arg Pro Gly Asp Pro Gln Arg Tyr Leu Leu Pro Pro Ala
485 490 495
Leu Gly Leu Leu Val Ala Ala Gly Val Ala Gly Ala Ala Leu Leu Leu
500 505 510
Val His Val Arg Arg Arg Gly His Ser Gln Asp Ala Gly Ser Arg Leu
515 520 525
Leu Ala Gly Thr Pro Glu Pro Ser Val His Ala Leu Pro Asp Ala Leu
530 535 540
Asn Asn Leu Arg Thr Gln Glu Gly Ser Gly Asp Gly Pro Ser Ser Ser
545 550 555 560
Val Asp Trp Asn Arg Pro Glu Asp Val Asp Pro Gln Gly Ile Tyr Val
565 570 575
Ile Ser Ala Pro Ser Ile Tyr Ala Arg Glu Ala
580 585
<210> 5
<211> 1686
<212> DNA
<213> Mus sp.
<400> 5
gctggtgtct tcgagctaca aattcattct ttcgggccag gcccaggcct cgggacccca 60
cgctccccct gcaacgcccg aggcccttgc cgcctcttct tcagggtctg cctgaagccc 120
ggagtctccc aggaggccac cgagtccctg tgcgccctgg gcgcagcact gagcacgagc 180
gtcccggtct atacggagca ccccggagag tcagcggctg ccctgccgct gcctgatggc 240
ctcgtacgtg tgcccttccg cgatgcttgg ccgggcacct tctccctcgt cattgaaacc 300
tggagagagc agctgggaga gcatgctgga gggcccgcct ggaacctgct agcacgtgtg 360
gtcggccgta gacgcctggc ggctgggggc ccgtgggccc gcgatgtgca gcgcacaggc 420
acatgggagt tgcacttctc ctaccgcgcg cggtgcgagc cgcccgccgt cggggccgcc 480
tgcgcgcgcc tgtgccgctc acgcagtgcc ccctcgcggt gtggcccggg actgcgaccc 540
tgcacgccat tcccagacga gtgcgaagcc ccgtctgtgt gtcgaccagg ctgcagcccc 600
gagcacggct actgtgaaga gcctgatgaa tgccgttgcc tggagggctg gactggaccc 660
ctctgcacgg tccctgtctc caccagtagc tgcctgaact ccagggttcc tggtcctgcc 720
agcactggat gccttttacc tgggcctgga ccttgtgatg ggaacccatg tgccaatggg 780
ggcagctgta gtgaaacctc tggctccttt gaatgtgcct gtccccgggg attctacggg 840
cttcgatgtg aggtgagcgg ggtcacgtgc gcagatggac cctgcttcaa tggcggcttg 900
tgtgttggcg gtgaagatcc tgactctgcc tatgtctgtc attgcccacc tggtttccaa 960
ggctctaact gtgagaagag ggtggaccgc tgtagcctgc agccatgtca gaatggcggc 1020
ctctgcctgg acctgggcca cgcgttgcgc tgccgctgtc gcgcgggatt cgccgggccg 1080
cgctgcgagc acgacctgga cgactgcgcc ggccgcgcct gtgccaacgg cggcacgtgc 1140
gtggagggcg gcggctcgcg ccgctgctcc tgtgcgctgg gcttcggcgg gcgcgactgc 1200
cgagaacgcg ccgacccctg cgcctcccgc ccctgcgcgc atggaggccg ttgctacgcc 1260
cacttctctg gcctggtctg cgcctgcgcg cccggctaca tgggcgtgag atgcgagttc 1320
gctgtgcgcc cggacggcgc ggacgcggtg cccgccgccc cgcggggcct gaggcaggcg 1380
gatccacagc gctttcttct gcctcccgcc ttggggctgc tggtggccgc cggtttggct 1440
ggcgccgcac tcttggtcat ccacgttcgc cgccgaggtc ctggccagga taccgggact 1500
cgcctgcttt ctgggacccg ggagccttcg gtccacacgc tcccggatgc actcaacaac 1560
ctgaggttac aagacggtgc tggggatggc cccagttcgt cggctgactg gaatcatcct 1620
gaagatggag actctagatc catttatgtc ataccagccc cttccattta tgcacgagag 1680
gcctga 1686
<210> 6
<211> 561
<212> PRT
<213> Mus sp.
<400> 6
Ala Gly Val Phe Glu Leu Gln Ile His Ser Phe Gly Pro Gly Pro Gly
1 5 10 15
Leu Gly Thr Pro Arg Ser Pro Cys Asn Ala Arg Gly Pro Cys Arg Leu
20 25 30
Phe Phe Arg Val Cys Leu Lys Pro Gly Val Ser Gln Glu Ala Thr Glu
35 40 45
Ser Leu Cys Ala Leu Gly Ala Ala Leu Ser Thr Ser Val Pro Val Tyr
50 55 60
Thr Glu His Pro Gly Glu Ser Ala Ala Ala Leu Pro Leu Pro Asp Gly
65 70 75 80
Leu Val Arg Val Pro Phe Arg Asp Ala Trp Pro Gly Thr Phe Ser Leu
85 90 95
Val Ile Glu Thr Trp Arg Glu Gln Leu Gly Glu His Ala Gly Gly Pro
100 105 110
Ala Trp Asn Leu Leu Ala Arg Val Val Gly Arg Arg Arg Leu Ala Ala
115 120 125
Gly Gly Pro Trp Ala Arg Asp Val Gln Arg Thr Gly Thr Trp Glu Leu
130 135 140
His Phe Ser Tyr Arg Ala Arg Cys Glu Pro Pro Ala Val Gly Ala Ala
145 150 155 160
Cys Ala Arg Leu Cys Arg Ser Arg Ser Ala Pro Ser Arg Cys Gly Pro
165 170 175
Gly Leu Arg Pro Cys Thr Pro Phe Pro Asp Glu Cys Glu Ala Pro Ser
180 185 190
Val Cys Arg Pro Gly Cys Ser Pro Glu His Gly Tyr Cys Glu Glu Pro
195 200 205
Asp Glu Cys Arg Cys Leu Glu Gly Trp Thr Gly Pro Leu Cys Thr Val
210 215 220
Pro Val Ser Thr Ser Ser Cys Leu Asn Ser Arg Val Pro Gly Pro Ala
225 230 235 240
Ser Thr Gly Cys Leu Leu Pro Gly Pro Gly Pro Cys Asp Gly Asn Pro
245 250 255
Cys Ala Asn Gly Gly Ser Cys Ser Glu Thr Ser Gly Ser Phe Glu Cys
260 265 270
Ala Cys Pro Arg Gly Phe Tyr Gly Leu Arg Cys Glu Val Ser Gly Val
275 280 285
Thr Cys Ala Asp Gly Pro Cys Phe Asn Gly Gly Leu Cys Val Gly Gly
290 295 300
Glu Asp Pro Asp Ser Ala Tyr Val Cys His Cys Pro Pro Gly Phe Gln
305 310 315 320
Gly Ser Asn Cys Glu Lys Arg Val Asp Arg Cys Ser Leu Gln Pro Cys
325 330 335
Gln Asn Gly Gly Leu Cys Leu Asp Leu Gly His Ala Leu Arg Cys Arg
340 345 350
Cys Arg Ala Gly Phe Ala Gly Pro Arg Cys Glu His Asp Leu Asp Asp
355 360 365
Cys Ala Gly Arg Ala Cys Ala Asn Gly Gly Thr Cys Val Glu Gly Gly
370 375 380
Gly Ser Arg Arg Cys Ser Cys Ala Leu Gly Phe Gly Gly Arg Asp Cys
385 390 395 400
Arg Glu Arg Ala Asp Pro Cys Ala Ser Arg Pro Cys Ala His Gly Gly
405 410 415
Arg Cys Tyr Ala His Phe Ser Gly Leu Val Cys Ala Cys Ala Pro Gly
420 425 430
Tyr Met Gly Val Arg Cys Glu Phe Ala Val Arg Pro Asp Gly Ala Asp
435 440 445
Ala Val Pro Ala Ala Pro Arg Gly Leu Arg Gln Ala Asp Pro Gln Arg
450 455 460
Phe Leu Leu Pro Pro Ala Leu Gly Leu Leu Val Ala Ala Gly Leu Ala
465 470 475 480
Gly Ala Ala Leu Leu Val Ile His Val Arg Arg Arg Gly Pro Gly Gln
485 490 495
Asp Thr Gly Thr Arg Leu Leu Ser Gly Thr Arg Glu Pro Ser Val His
500 505 510
Thr Leu Pro Asp Ala Leu Asn Asn Leu Arg Leu Gln Asp Gly Ala Gly
515 520 525
Asp Gly Pro Ser Ser Ser Ala Asp Trp Asn His Pro Glu Asp Gly Asp
530 535 540
Ser Arg Ser Ile Tyr Val Ile Pro Ala Pro Ser Ile Tyr Ala Arg Glu
545 550 555 560
Ala
<210> 7
<211> 1794
<212> DNA
<213> Macaca fascicularis
<400> 7
ccccaagcca ggcccgctgg cgtgttcgaa ctgcagatcc atagcttcgg ccctggccct 60
ggacccggag cccctagaag cccttgttcc gctagaggcc cctgcagact gttcttcaga 120
gtctgcctga agcctggcct gagcgaggag gctgctgaga gcccttgtgc tctgggagct 180
gccctcagcg ctaggggccc tgtctacacc gagcaacctg aggctcccgc tcccgatctg 240
cctctcccta acggcctgct gcaggtgccc ttcagggatg cttggcccgg aaccttcagc 300
ctcatcatcg agacctggag ggaggaactc ggagaccaga ttggaggacc cgcctggtcc 360
ctgctcgcta gagtgacaag aagaagaagg ctggctgctg gcggaccttg ggctagagat 420
atccagagag ctggcgcctg ggagctcagg ttcagctaca gggccagatg tgagctccct 480
gccgtgggca ccgcttgtac caggctgtgt aggcccagat ccgccccttc cagatgtggc 540
cccggactca gaccttgcgc tcctctcgag gacgagtgtg aagctcctcc cgtctgtagg 600
gccggatgca gcctcgagca cggcttctgt gagcagcctg gcgaatgtag gtgcctcgaa 660
ggctggaccg gccctctctg tatggtgcct gtctccacct cctcctgtct cggactgagg 720
ggcccttcct ccgctacaac cggatgtctg gtccctggac ctggaccttg cgacggaaac 780
ccttgtgcca acggaggctc ctgtagcgag acccccggaa gctttgaatg tacctgcccc 840
aggggctttt acggcctcag atgcgaggtc agcggagtca catgcgccga cggaccctgc 900
tttaatggag gactctgcgt gggaggagcc gaccctgata gcgcttacat ctgtcactgt 960
ccccccggct ttcagggctc caactgcgag aagagggtcg acaggtgctc cctgcaaccc 1020
tgtagaaatg gcggcctctg cctggatctg ggacatgctc tcaggtgcag atgtagagct 1080
ggattcgccg gacccaggtg cgagcatgat ctcgacgatt gtgctggcag ggcctgcgct 1140
aatggaggaa catgtgtgga aggaggcgga gcccacagat gcagctgcgc tctcggcttc 1200
ggcggaagag actgcagaga gagggctgac ccttgtgccg ccaggccttg tgctcatggc 1260
ggaaggtgct acgcccattt ctccggactc gtgtgcgcct gcgcccctgg atatatgggc 1320
gctaggtgcg agtttcccgt ccaccctgat ggagtcagcg ctctccctgc cgctcctcct 1380
ggactgagac ctggagatcc tcagagatac ctgctccctc ctgccctcgg actcctggtc 1440
gctgctggag tcgctggagc cgctctcctc ctgggacacg tcaggagaag aggccacgcc 1500
caggatgctg gaagcagact gctggccgga acacccgagc cttccgtcca tgccctgcct 1560
gacgccctca acaacctgag gacccaggag ggccctggag atgtgcctag cagctccgtc 1620
gactggaaca gacctgagga tgtggactcc aggggcatct acgtgatcag cgccccctcc 1680
atctatgcca gggaggtcgc catgcccctc tttcctcctc tgcatacagg cagagccggc 1740
cagagacaga acctgctctt cccctacccc agcagcatcc tgtccgtgaa gtga 1794
<210> 8
<211> 597
<212> PRT
<213> Macaca fascicularis
<400> 8
Pro Gln Ala Arg Pro Ala Gly Val Phe Glu Leu Gln Ile His Ser Phe
1 5 10 15
Gly Pro Gly Pro Gly Pro Gly Ala Pro Arg Ser Pro Cys Ser Ala Arg
20 25 30
Gly Pro Cys Arg Leu Phe Phe Arg Val Cys Leu Lys Pro Gly Leu Ser
35 40 45
Glu Glu Ala Ala Glu Ser Pro Cys Ala Leu Gly Ala Ala Leu Ser Ala
50 55 60
Arg Gly Pro Val Tyr Thr Glu Gln Pro Glu Ala Pro Ala Pro Asp Leu
65 70 75 80
Pro Leu Pro Asn Gly Leu Leu Gln Val Pro Phe Arg Asp Ala Trp Pro
85 90 95
Gly Thr Phe Ser Leu Ile Ile Glu Thr Trp Arg Glu Glu Leu Gly Asp
100 105 110
Gln Ile Gly Gly Pro Ala Trp Ser Leu Leu Ala Arg Val Thr Arg Arg
115 120 125
Arg Arg Leu Ala Ala Gly Gly Pro Trp Ala Arg Asp Ile Gln Arg Ala
130 135 140
Gly Ala Trp Glu Leu Arg Phe Ser Tyr Arg Ala Arg Cys Glu Leu Pro
145 150 155 160
Ala Val Gly Thr Ala Cys Thr Arg Leu Cys Arg Pro Arg Ser Ala Pro
165 170 175
Ser Arg Cys Gly Pro Gly Leu Arg Pro Cys Ala Pro Leu Glu Asp Glu
180 185 190
Cys Glu Ala Pro Pro Val Cys Arg Ala Gly Cys Ser Leu Glu His Gly
195 200 205
Phe Cys Glu Gln Pro Gly Glu Cys Arg Cys Leu Glu Gly Trp Thr Gly
210 215 220
Pro Leu Cys Met Val Pro Val Ser Thr Ser Ser Cys Leu Gly Leu Arg
225 230 235 240
Gly Pro Ser Ser Ala Thr Thr Gly Cys Leu Val Pro Gly Pro Gly Pro
245 250 255
Cys Asp Gly Asn Pro Cys Ala Asn Gly Gly Ser Cys Ser Glu Thr Pro
260 265 270
Gly Ser Phe Glu Cys Thr Cys Pro Arg Gly Phe Tyr Gly Leu Arg Cys
275 280 285
Glu Val Ser Gly Val Thr Cys Ala Asp Gly Pro Cys Phe Asn Gly Gly
290 295 300
Leu Cys Val Gly Gly Ala Asp Pro Asp Ser Ala Tyr Ile Cys His Cys
305 310 315 320
Pro Pro Gly Phe Gln Gly Ser Asn Cys Glu Lys Arg Val Asp Arg Cys
325 330 335
Ser Leu Gln Pro Cys Arg Asn Gly Gly Leu Cys Leu Asp Leu Gly His
340 345 350
Ala Leu Arg Cys Arg Cys Arg Ala Gly Phe Ala Gly Pro Arg Cys Glu
355 360 365
His Asp Leu Asp Asp Cys Ala Gly Arg Ala Cys Ala Asn Gly Gly Thr
370 375 380
Cys Val Glu Gly Gly Gly Ala His Arg Cys Ser Cys Ala Leu Gly Phe
385 390 395 400
Gly Gly Arg Asp Cys Arg Glu Arg Ala Asp Pro Cys Ala Ala Arg Pro
405 410 415
Cys Ala His Gly Gly Arg Cys Tyr Ala His Phe Ser Gly Leu Val Cys
420 425 430
Ala Cys Ala Pro Gly Tyr Met Gly Ala Arg Cys Glu Phe Pro Val His
435 440 445
Pro Asp Gly Val Ser Ala Leu Pro Ala Ala Pro Pro Gly Leu Arg Pro
450 455 460
Gly Asp Pro Gln Arg Tyr Leu Leu Pro Pro Ala Leu Gly Leu Leu Val
465 470 475 480
Ala Ala Gly Val Ala Gly Ala Ala Leu Leu Leu Gly His Val Arg Arg
485 490 495
Arg Gly His Ala Gln Asp Ala Gly Ser Arg Leu Leu Ala Gly Thr Pro
500 505 510
Glu Pro Ser Val His Ala Leu Pro Asp Ala Leu Asn Asn Leu Arg Thr
515 520 525
Gln Glu Gly Pro Gly Asp Val Pro Ser Ser Ser Val Asp Trp Asn Arg
530 535 540
Pro Glu Asp Val Asp Ser Arg Gly Ile Tyr Val Ile Ser Ala Pro Ser
545 550 555 560
Ile Tyr Ala Arg Glu Val Ala Met Pro Leu Phe Pro Pro Leu His Thr
565 570 575
Gly Arg Ala Gly Gln Arg Gln Asn Leu Leu Phe Pro Tyr Pro Ser Ser
580 585 590
Ile Leu Ser Val Lys
595
<210> 9
<211> 5
<212> PRT
<213> Homo sapiens
<400> 9
Gln Pro Gly Ala Pro
1 5
<210> 10
<211> 4
<212> PRT
<213> Homo sapiens
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Any amino acid
<400> 10
Gly Xaa Arg Pro
1
<210> 11
<400> 11
000
<210> 12
<400> 12
000
<210> 13
<400> 13
000
<210> 14
<400> 14
000
<210> 15
<400> 15
000
<210> 16
<400> 16
000
<210> 17
<400> 17
000
<210> 18
<400> 18
000
<210> 19
<400> 19
000
<210> 20
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 20
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Val Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Phe Phe Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Phe Thr Phe Gly Ala Gly Thr Lys Leu Lys Ile Arg
100 105
<210> 21
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 21
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ala Asp Tyr Gly Gly Asp Tyr Tyr Ala Met Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 22
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 22
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Leu
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Met Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 23
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 23
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Met His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Gly Glu Pro Gly Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Tyr Asp Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 24
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Thr Arg Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 25
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 25
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Glu Gly Leu Glu
35 40 45
Trp Leu Ala Asp Ile Trp Trp Asp Asp Asn Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Thr Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Val Asn Tyr Val Tyr Asp Pro Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 26
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 26
Asn Ile Met Met Thr Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Thr Val Gln Val Glu Asp Leu Ala Val Tyr Tyr Cys His Gln
85 90 95
Tyr Leu Ser Ser Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 27
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 27
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Lys Met His Trp Val Lys Gln Ser His Val Lys Ser Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asn Pro Tyr Asn Gly Ala Thr Ser Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Asp Leu His Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Gly Asp Tyr Arg Tyr Asp Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 28
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 28
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Met Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys Gln Ala Thr Gln Asp Ile Val Lys Asn
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro Ser Phe Leu Ile
35 40 45
Tyr Tyr Ala Ile Glu Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Leu Gln Phe Tyr Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 29
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 29
Gln Ala Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Thr Gly Gly Thr Asn Tyr Asn Glu Asn Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Pro Tyr Asp Tyr His Glu Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 30
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 30
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Thr Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 31
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 31
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Ser Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Val
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Leu Val Asp Asp Leu Tyr Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 32
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 32
Asp Val Glu Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Ser Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Met Phe Gln Arg Pro Gly Arg Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Lys His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 33
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 33
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Met His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Val Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Met Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Phe
65 70 75 80
Leu Gln Ile Asn Asn Leu Glu Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Phe Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 34
Gln Ile Val Leu Thr Gln Ser Pro Ala Leu Val Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Arg Ser Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 35
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 35
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Val Ser Phe Asp Asn Asp Val Val Ser Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 36
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ala Ala Ser Val Gly
1 5 10 15
Glu Thr Val Ala Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Tyr Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Thr Ala Asn Ser Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Met Gln Pro
65 70 75 80
Glu Asp Ser Ala Thr Tyr Phe Cys Lys Gln Ala Tyr Asp Val Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 37
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 37
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Trp Ile His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Thr Thr Val Tyr Thr Glu Phe Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala Ser
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Asn Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 38
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 38
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asn Ile Ile Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Glu Arg Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 39
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 39
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Glu
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Asn Asn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys Gly Lys Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Arg
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Ala Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Ala Tyr Ser Asn Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Thr
115
<210> 40
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Phe Thr Cys Lys Ala Ser Gln Asp Ile His Lys Tyr
20 25 30
Val Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asn Asn Leu Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 41
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 41
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Ser
20 25 30
Leu Leu His Trp Val Lys Gln Arg Pro Glu Lys Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asp Pro Glu Asp Gly Glu Thr Lys Tyr Ala Pro Asn Phe
50 55 60
Gln Asp Lys Ala Thr Ile Thr Thr Asp Ser Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ile Ser Leu Thr Ser Val Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Tyr Gly Asn Tyr Val Arg His Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 42
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 42
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Met Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys Gln Ala Thr Gln Asp Ile Val Lys Asn
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro Ser Phe Leu Ile
35 40 45
Tyr Tyr Ala Thr Glu Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Tyr Ser Leu Thr Ile Arg Asn Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp His Tyr Cys Leu Gln Phe Tyr Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 43
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 43
Gln Val Gln Leu Gln Gln Ser Gly Thr Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Arg Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Gly Asn His
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Thr Gly Gly Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Arg Leu Thr Ala Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met His Leu Asn Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Pro Tyr Asp Tyr His Glu Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 44
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 44
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Ala Met Ser Val Gly
1 5 10 15
Gln Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Glu Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Val Ser Phe Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Gly Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
His Tyr Ser Ile Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 45
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 45
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ala Phe Ser Ser Ser
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Gly Asp Gly Asp Thr Asn Tyr Asn Gly Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Met Gly Ile Tyr Asn Tyr Asp Gly Ser Arg Tyr Tyr Ser Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 46
<211> 105
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 46
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Lys Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Pro Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Val His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Tyr Thr Leu Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu
100 105
<210> 47
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 47
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Tyr Gly Asn Pro Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Ser Ser Val Thr Val Ser Ser
115 120
<210> 48
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 48
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Arg
20 25 30
Tyr Leu Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Ile Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Asn Tyr Pro
85 90 95
Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 49
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 49
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Asn Thr Gly Ile Gly Trp Ile Arg Gln Pro Ser Gly Thr Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asn Asp Asp Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Glu Thr Ser Asn Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Thr Asn Val Asp Thr Ala Asp Thr Ala Ser Tyr Phe
85 90 95
Cys Val Gln Ile Gly Arg Asp Tyr Ser Asn Tyr Ala Trp Tyr Phe Asp
100 105 110
Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 50
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 50
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Ser Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 51
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 51
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Glu Gly Leu Glu
35 40 45
Trp Leu Thr Asp Ile Trp Trp Asp Asp Asn Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Asn Ile Thr Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Val Asn Tyr Tyr Tyr Asp Pro Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 52
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 52
Asp Val Glu Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Ser Asp Ser
20 25 30
Asp Gly Lys Thr Tyr Leu Asn Trp Met Phe Gln Arg Pro Gly Arg Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Lys His Phe Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 53
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 53
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
Ser Met His Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Val Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Met Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Phe
65 70 75 80
Leu Gln Ile Asn Asn Leu Glu Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Phe Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
<210> 54
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 54
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Thr Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Val Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Leu Tyr Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 55
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 55
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Gln
20 25 30
Tyr Ile Asn Trp Val Lys Gln Arg Thr Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Tyr Pro Gly Arg Gly Asn Thr Tyr Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Asp Gly Gly Tyr Asp Asp Ala Trp Phe Ala Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 56
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 56
Gln Ile Val Leu Thr Gln Ser Pro Thr Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Thr Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Phe His Arg Ser Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 57
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 57
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Lys Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Val Ser Lys Asp Thr Ser Ser Asn Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Thr Val Asp Ala Ala Asp Thr Gly Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Val Asp Gly His Pro Pro Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 58
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 58
Asp Ile Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Asn Ile Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Phe Leu Ile Tyr Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
100 105 110
<210> 59
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 59
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ser Arg Phe
20 25 30
Tyr Met His Trp Val Lys Gln Ser Pro Glu Asn Ser Leu Glu Trp Gly
35 40 45
Glu Ile Asn Pro Ser Thr Gly Gly Thr Ile Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Glu Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Gly Ser Asn Trp Tyr Phe Asp Val Trp Gly Ala Gly
100 105 110
Thr Thr Val Thr Val Ser Thr
115
<210> 60
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 60
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 61
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 61
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Arg Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Asp Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ile Gly Gly Asn Ser Pro Ser Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Leu Thr Val Ser Ser
115
<210> 62
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 62
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 63
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 63
Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser
20 25 30
Asp Tyr Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu
35 40 45
Trp Met Gly Tyr Ile Ser Tyr Ser Gly Ser Thr Ser Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Phe Leu Gln Leu Asn Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Phe Tyr Tyr Gly Ser Ser Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 64
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 64
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Val Thr Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Thr Pro Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Asn Leu Leu Ile
35 40 45
Ser Glu Gly Asn Ser Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asn Phe Val Phe Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Met Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 65
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 65
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Ser Ser Gly Tyr Thr Glu Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ser Val Tyr Tyr Cys
85 90 95
Ala Arg Lys Gly Ser Asn Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser
115
<210> 66
<211> 104
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 66
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Ile Asn Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Thr Trp Thr Phe Gly
85 90 95
Gly Gly Thr Lys Leu Glu Ile Lys
100
<210> 67
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 67
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Val Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Thr Gly Tyr Phe Glu Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 68
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 68
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Val Ile Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Arg Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Glu Arg Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 69
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 69
Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln Phe Gly Gly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile Arg Asn Lys Ala Asn Asn His Ala Thr Tyr Tyr Pro Glu
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Arg
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Ala Glu Asp Thr Gly Ile Tyr
85 90 95
Tyr Cys Thr Gly Tyr Ser Ser Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 70
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 70
Asp Val Leu Met Thr Gln Ser Pro Leu Ser Leu Ser Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Asn Ile Val His Ser
20 25 30
Asp Arg Tyr Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Gly Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Met Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Thr His Val Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 71
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 71
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Ala
20 25 30
Gly Met Gln Trp Val Gln Lys Met Pro Gly Lys Gly Phe Lys Trp Ile
35 40 45
Gly Trp Ile Asn Thr His Ser Gly Glu Pro Lys Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Asn Leu Lys Asp Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ala Pro Leu Trp Ser Asp Ser Ser Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 72
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 72
Glu Ile Gln Met Thr Gln Ser Pro Ser Ser Met Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Ile Thr Ile Thr Cys Gln Ala Thr Gln Asp Ile Val Lys Asn
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Pro Pro Ser Phe Leu Ile
35 40 45
Tyr Tyr Ala Thr Glu Leu Ala Glu Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr His Cys Leu Gln Phe Tyr Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 73
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 73
Gln Val Gln Leu Gln Gln Ser Gly Ala Asp Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Gly Thr His Tyr Asn Glu Lys Phe
50 55 60
Lys Asp Lys Ala Val Leu Thr Ala Asp Lys Ser Ser Thr Thr Ala His
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Asp Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Pro Tyr Asp Tyr Asn Asp Gly Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 74
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 74
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Asn Ile Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Lys Ser Thr Lys Ser Leu Leu Asn Ser
20 25 30
Asp Gly Phe Thr Tyr Leu Asp Trp Tyr Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Gln Phe Leu Ile Tyr Leu Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Ser
85 90 95
Asn Tyr Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
100 105 110
<210> 75
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 75
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Ser Arg Phe
20 25 30
Tyr Met His Trp Val Lys Gln Ser Pro Glu Asn Ser Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Thr Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Glu Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Tyr Gly Ser Asn Cys Tyr Phe Asp Val Trp Gly Ala Gly
100 105 110
Thr Thr Val Thr Val Ser Thr
115
<210> 76
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 76
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Thr Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 77
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 77
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Thr
1 5 10 15
Leu Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Asn Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Asn Thr Lys Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Thr Ser Leu Thr Ser Glu Asn Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Asp Tyr Asp Tyr Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 78
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 78
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Arg Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 79
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 79
Glu Val Gln Leu Val Glu Cys Gly Gly Cys Leu Val Lys Pro Gly Gly
1 5 10 15
Tyr Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ser Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Glu Ile Ser Ile Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Thr Val
50 55 60
Thr Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Glu Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Tyr Asp Tyr Asp Val Arg Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 80
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 80
Asp Ile Gln Met Ile Gln Ser Pro Ser Ser Met Phe Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Ser Leu Ser Cys Arg Ala Ser Gln Gly Ile Arg Gly Thr
20 25 30
Leu Asp Trp Tyr Gln Gln Lys Pro Asn Gly Thr Ile Lys Leu Leu Ile
35 40 45
Tyr Ser Thr Ser Asn Leu Asn Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Leu Gln Arg Asn Ala Tyr Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 81
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 81
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Ala Val Ser Gly Phe Ser Leu Thr Ser Phe
20 25 30
Ala Ile His Trp Phe Arg Lys Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Thr Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Asp Tyr Asp Asn Asn Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 82
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 82
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Asn Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 83
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 83
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Val Ser Ala Phe Thr Phe Thr Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Asn Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Met
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Ile Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Phe Tyr Tyr Asp Tyr Val Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 84
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 84
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Val Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Ala Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Ser Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Thr Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Arg
100 105
<210> 85
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 85
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Ala Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Ser
65 70 75 80
Leu Gln Ile Ile Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ile Gly Asp Ser Ser Pro Ser Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 86
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 86
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Ile Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Phe
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Ile Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Gly Thr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Lys Ile Arg
100 105
<210> 87
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 87
Glu Val Lys Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser Ser Tyr
20 25 30
Asp Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Val Arg Asp Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Arg Gln Ala Ile Gly Thr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 88
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 88
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ser Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Thr Tyr Tyr Cys Gln His His Tyr Asp Ser Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Arg
100 105
<210> 89
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 89
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Arg Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Ser Ser Asn Ile Tyr Tyr Ala Asp Thr Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Pro Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Thr Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Tyr Tyr Gly Asn Tyr Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 90
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 90
Asp Ile Val Met Thr Gln Ser Thr Ser Ser Leu Ala Met Ser Val Gly
1 5 10 15
Gln Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Ser Asn Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Glu Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Val Ser Phe Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Gly Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
His Tyr Ser Ile Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
100 105 110
Lys
<210> 91
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 91
Glu Val Leu Leu Gln Arg Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Thr Ile Pro Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met Asp Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asn Thr Tyr Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Pro Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Leu Arg Tyr Gly Gly His Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 92
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 92
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Phe
20 25 30
Leu Ser Trp Phe Gln Arg Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Gln Glu Phe Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Leu Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 93
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 93
Glu Val Met Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Gly Gly Gly Asp His Ile Tyr Tyr Pro Asp Ser Val
50 55 60
Arg Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asp Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Leu Tyr Asp Cys
85 90 95
Ala Arg Val Arg Asp Trp Tyr Phe Asp Val Trp Gly Ala Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 94
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 94
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 95
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 95
Gln Val Gln Leu Gln Gln Ser Gly Thr Glu Leu Leu Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Thr Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Met Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Thr Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Asn Ser Leu Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ala
<210> 96
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 96
Gln Ile Val Leu Thr Gln Ser Pro Ala Leu Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Val Thr Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Arg Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Arg Asn Asn Pro Phe Thr
85 90 95
Phe Gly Ser Gly Thr Lys Val Glu Ile Lys
100 105
<210> 97
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 97
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala Leu Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Ala Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Ala Ser Tyr Asp Tyr Asp Val Val Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Ser Val Ser Val Ser Ser
115 120
<210> 98
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 98
Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser Pro Gly Glu
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Ile Gln Glu Lys Pro Asp His Leu Phe Thr Gly
35 40 45
Leu Ile Gly Gly Thr Asn Asn Arg Ala Pro Gly Val Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile Thr Gly Ala
65 70 75 80
Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Gly Leu Trp Tyr Ser Asn
85 90 95
His Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 99
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 99
Glu Val Gln Leu Val Glu Thr Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Val Ser Ala Phe Thr Phe Thr Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Asn Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Ser Met
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Ile Glu Asp Thr Ala Met Tyr
85 90 95
Tyr Cys Val Phe Tyr Tyr Asp Tyr Val Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 100
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 100
Glu Thr Thr Val Thr Gln Ser Pro Ala Phe Leu Ser Val Ala Thr Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Asn Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Asn Val Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Phe Thr Ile Glu Asn Thr Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Gln Ser Asp Asn Met Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 101
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 101
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Phe Pro Gly Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Thr Ser Leu Thr Ser Gly Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Trp Gly Tyr Gly Ser Gly Leu Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 102
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 102
Glu Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Arg Ala Ser Ser Ser Val Asn Tyr Met
20 25 30
Ser Trp Tyr Gln Gln Lys Ser Asp Ala Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Tyr Thr Ser Asn Leu Ala Pro Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Asn Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Gly Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Phe Thr Ser Ser Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 103
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 103
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Arg Ser Arg Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 104
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 104
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Ser Leu Thr Cys Arg Ala Ser Gln Asp Ile Gly Tyr Ser
20 25 30
Leu Asn Trp Leu Gln Gln Glu Pro Asp Gly Thr Ile Lys Arg Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Asp Ser Gly Val Pro Lys Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ser Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Val Asp Tyr Tyr Cys Leu Gln Tyr Ala Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 105
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 105
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Asn Gly Tyr Thr Phe Ser Ser Tyr
20 25 30
Trp Ile Glu Trp Leu Arg Gln Arg Pro Gly His Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Leu Pro Gly Ser Asp Asn Ser Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Glu Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Gly Leu Arg Arg Asp Gly Ser Tyr Tyr Tyr Val Met Glu His
100 105 110
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 106
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 106
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Arg Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Asp Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 107
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 107
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Arg Tyr
20 25 30
Val Met Ser Trp Val Arg Gln Thr Pro Glu Lys Lys Leu Glu Trp Val
35 40 45
Ala Ser Ile Thr Ser Gly Gly Thr Thr Tyr Tyr Pro Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Arg Asn Ile Leu Tyr Leu
65 70 75 80
Gln Met Ser Ser Leu Arg Ser Glu Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Val Tyr Tyr His Tyr Asp Asp Ile Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 108
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 108
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Arg Thr Arg Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Lys Gln
85 90 95
Ser Tyr Asn Leu Tyr Thr Phe Gly Gly Gly Thr Lys Leu Lys Ile Lys
100 105 110
Arg
<210> 109
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 109
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Ala Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 110
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 110
Glu Thr Thr Val Thr Gln Ser Pro Ala Ser Leu Ser Met Ala Ile Gly
1 5 10 15
Glu Lys Val Thr Ile Arg Cys Ile Thr Ser Thr Asp Ile Asp Asp Asp
20 25 30
Met Ile Trp Tyr Gln Gln Lys Pro Gly Glu Pro Pro Lys Leu Leu Ile
35 40 45
Ser Glu Gly Asn Thr Leu Arg Pro Gly Val Pro Ser Arg Phe Ser Ser
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Val Phe Thr Ile Glu Asn Met Leu Ser
65 70 75 80
Glu Asp Val Ala Asp Tyr Tyr Cys Leu Lys Arg Asp Asp Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Gln Val Glu Ile Lys Arg
100 105
<210> 111
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 111
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Lys Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Ser Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Ser Gly Gly Thr Ile Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Ser Asp Tyr Pro Leu Val Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 112
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 112
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Leu Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Thr Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Arg Ile Ser Ser Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr Asn Arg Ser Pro
85 90 95
Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 113
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 113
Gln Val Gln Leu Lys Glu Ser Gly Pro Val Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Ser Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys Gln Gly Asn Phe Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 114
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 114
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Gly Lys Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Lys Lys Tyr
20 25 30
Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro Arg Leu Leu Ile
35 40 45
His Tyr Thr Ser Thr Leu Glu Pro Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser Asn Leu Glu Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp Ile Leu Trp Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 115
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 115
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Met Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Thr Met Asn Trp Val Lys Gln Ser His Gly Lys Asn Leu Glu Trp Ile
35 40 45
Gly Leu Ile Asn Pro Tyr Asn Gly Gly Thr Thr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Leu Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Gly Tyr Tyr Gly Asn Tyr Arg Arg Tyr Phe Asp Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 116
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 116
Glu Asn Val Leu Thr Gln Ser Pro Ala Ile Met Ala Ala Ser Leu Gly
1 5 10 15
Gln Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Ser Gly Ala Ser Pro Lys Pro Leu
35 40 45
Ile His Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Val Glu
65 70 75 80
Ala Glu Asp Asp Ala Thr Tyr Tyr Cys Arg Gln Trp Ser Gly Tyr Pro
85 90 95
Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 117
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 117
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Cys Thr Ser Tyr
20 25 30
Trp Met Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Ala Ile Tyr Pro Gly Asp Gly Asp Thr Arg Tyr Thr Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Arg Thr Glu Ala Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 118
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 118
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Glu Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Asn Met Glu
65 70 75 80
Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 119
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 119
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Ala Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Glu Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala His Ile Leu Asp Arg Ala Tyr Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Thr Ser
115 120
<210> 120
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 120
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ser Arg
85 90 95
Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 121
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 121
Gln Val Thr Leu Lys Glu Ser Gly Pro Gly Ile Leu Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Ile Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu Trp
35 40 45
Leu Ala His Ile Trp Trp Asp Asp Asp Lys Tyr Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Gln Leu Thr Ile Ser Lys Asp Ser Ser Arg Asn Gln Val Phe
65 70 75 80
Leu Lys Ile Thr Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Thr Ala Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 122
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 122
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Ile
20 25 30
His Trp Tyr Arg Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Pro Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 123
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 123
Gln Val Gln Leu Lys Glu Ser Gly Pro Asp Leu Val Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Phe Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Thr Met Gly Trp Asp Asp Lys Lys Tyr Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Arg Asp Thr Ser Lys Asn Gln Val Phe Leu
65 70 75 80
Lys Leu Ser Ser Leu Gln Thr Glu Asp Thr Ala Met Tyr Tyr Cys Thr
85 90 95
Arg Gly Gly Thr Gly Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser
115
<210> 124
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 124
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Lys Ala Ser Gln Asp Val Gly Thr Ala Val
20 25 30
Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr
35 40 45
Trp Ala Ser Ile Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser Glu
65 70 75 80
Asp Leu Ala Asp Tyr Phe Cys Gln Gln Tyr Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 125
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 125
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Ser Asn Gly Arg Thr Asn Tyr Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Arg Glu Leu Gly Thr Leu Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 126
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 126
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 127
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 127
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Phe Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Glu Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ser Thr Asn Tyr Asn Ser Ala Leu Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Leu Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Val
85 90 95
Arg Gly Val Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr
100 105 110
Val Ser Ser
115
<210> 128
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 128
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Gly Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 129
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 129
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Ala Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Val Ala Tyr Tyr Ser Asn Trp Gly Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 130
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 130
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Ser Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His His Tyr Gly Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 131
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 131
Gln Val Gln Leu Glu Glu Ser Gly Ala Glu Leu Ala Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ser Tyr Trp Met Gln
20 25 30
Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala Ile
35 40 45
Tyr Pro Gly Asn Gly Asp Thr Arg Tyr Thr Gln Lys Phe Lys Gly Lys
50 55 60
Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln Leu
65 70 75 80
Ser Ser Leu Ala Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Ser
85 90 95
Pro Ala Tyr Tyr Arg Tyr Gly Glu Gly Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 132
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 132
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Phe Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Thr Ala Thr Tyr Tyr Cys Gln Glu Trp Ser Gly Asn Pro Leu Thr
85 90 95
Phe Gly Asp Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 133
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 133
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Ala Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Ala Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Phe Phe Cys
85 90 95
Ala Asn Met Arg Pro Thr Arg Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Gly Thr Val Ser Ala
115
<210> 134
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 134
Asn Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 135
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 135
Glu Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Arg Thr Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Ser Cys Tyr Asn Gly Ala Thr Thr Tyr Asn Gln Asn Phe
50 55 60
Lys Gly Lys Ala Thr Phe Ile Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Phe Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Asp Gly Gly His Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 136
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 136
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ala Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Tyr Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Asn Ala Asn Ser Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Met Lys Ile Asn Ser Met Gln Pro
65 70 75 80
Glu Asp Thr Ala Thr Tyr Phe Cys Lys Gln Thr Tyr Asp Val Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 137
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 137
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Glu Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Asn Met Asn Trp Val Lys Gln Ser Asn Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Asn Ile Asp Pro Tyr Tyr Gly Gly Ser Ser Tyr Lys Gln Lys Phe
50 55 60
Glu Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Lys Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Asn Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 138
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 138
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Thr Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 139
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 139
Asp Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Pro Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Val Tyr Asp Gly Tyr Ser Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 140
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 140
Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 141
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 141
Glu Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Ala Asn Gly Asn Thr Lys Tyr Asp Pro Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Pro Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Trp Arg Asn Tyr Gly Ser Ser Phe Trp Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 142
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 142
Asp Val Val Met Thr Gln Thr Pro Leu Thr Leu Ser Val Thr Ile Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Asp Gly Thr Thr Tyr Leu Asn Trp Leu Leu Gln Arg Pro Gly Gln Ser
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Lys Leu Asp Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Trp Gln Gly
85 90 95
Thr His Phe Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 143
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 143
Asp Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Thr Met Ser Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Pro Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Thr Arg Asp Val Tyr Asp Gly Tyr Ser Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 144
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 144
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Thr Ser Ser Gln Ser Leu Leu Thr Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 145
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 145
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Arg Val Gln Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Asn
20 25 30
Gly Val Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp
35 40 45
Leu Gly Val Leu Trp Ser Gly Gly Ser Thr Asp Tyr Asn Ala Ala Phe
50 55 60
Ile Ser Arg Leu Ser Ile Ser Lys Asp Asn Tyr Lys Ser Gln Val Phe
65 70 75 80
Phe Lys Met Asn Ser Leu Gln Ala Asn Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Asn Asn Asn Arg Tyr Gly Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 146
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 146
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Val Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Gln Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 147
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 147
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Pro Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Ile Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Glu Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asn Leu Gly Pro Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 148
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 148
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp Tyr Asp
20 25 30
Gly Asp Ser Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 149
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 149
Glu Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Arg Val Asn Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ile Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Tyr Asp Tyr Ala Glu Gly Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 150
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 150
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Thr Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg
<210> 151
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 151
Glu Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Ser Tyr
20 25 30
Asn Met Tyr Trp Val Met Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Val Asp Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asn Tyr Arg Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 152
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 152
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Thr Ser Pro Lys Leu Trp Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ser Tyr Pro Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 153
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 153
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Lys Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ile Lys Ser Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Gln Asn Met
65 70 75 80
Leu Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg Gln Gly Tyr Ser Tyr Asp Trp Gly Pro Trp Phe Ala
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
115 120
<210> 154
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 154
Asp Ile Val Met Thr Gln Ser Gln Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Val Thr Cys Lys Ala Ser Gln Asn Val Gly Thr Asn
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Val Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Ala Glu Phe Phe Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 155
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 155
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Phe Trp Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Asp Gly Gly Ser Tyr Thr Tyr Phe Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Gln Asn Asn Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Thr Leu Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 156
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 156
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Met Thr Cys Thr Ala Ser Ser Ser Val Ser Ser Ser
20 25 30
Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Leu Trp
35 40 45
Ile Tyr Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu
65 70 75 80
Thr Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Tyr His Arg Ser Pro
85 90 95
Phe Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 157
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 157
Gln Val Ala Leu Lys Glu Ser Gly Pro Gly Ile Leu Gln Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ser Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Ser Gly Lys Gly Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Asn Pro Ala
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Ser Ser Gln Val
65 70 75 80
Phe Leu Lys Ile Ala Ser Val Asp Thr Ala Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Met Glu Asp Tyr Gly Ser Ser Ser Tyr Phe Asp Phe Trp
100 105 110
Gly His Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 158
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 158
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Ser Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Ser Tyr Tyr Cys Gln Gln Leu Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 159
<211> 123
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 159
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Leu Tyr Tyr Gly Asn Tyr Leu Gly Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 160
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 160
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ile Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Ser Cys Gln Gln Gly Gln Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 161
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 161
Ser Asp Val Gln Leu Gln Glu Ser Gly Pro Asp Leu Val Lys Pro Ser
1 5 10 15
Gln Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser
20 25 30
Gly Tyr Ser Trp His Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu
35 40 45
Trp Met Gly Tyr Ile His Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Phe Leu Gln Phe Lys Ser Val Thr Thr Glu Asp Ser Ala Thr Tyr Tyr
85 90 95
Cys Ala Leu Glu Gly Asn Tyr Asp Gly Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser
115
<210> 162
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 162
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 163
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 163
Gln Val Gln Met Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Ser Ser Leu Thr Asn Tyr
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Ser Thr Asn Tyr Asn Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Trp Glu Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 164
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 164
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Ser Tyr Tyr Cys Gln Gln Leu Tyr Ser Thr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 165
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 165
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Ser Gly Phe Ser Leu Thr Asp
20 25 30
Tyr Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Leu Gly Val Ile Trp Gly Gly Gly Ser Thr Tyr Tyr Asn Ser Ala Leu
50 55 60
Lys Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe
65 70 75 80
Leu Glu Leu Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Lys His Tyr Gly His Tyr Ala Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 166
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 166
Asp Ile Gln Leu Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Gly Ser Ile His Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Tyr Tyr Tyr Cys Gln His Phe Trp Thr Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 167
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 167
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Glu Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Tyr Asp Gly Tyr Ser Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Leu Thr Val Ser Ser
115 120
<210> 168
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 168
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Val Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Gln Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 169
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 169
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Gly Val Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp
35 40 45
Leu Gly Val Ile Trp Ala Gly Gly Ile Thr Asn Tyr Asn Ser Ala Leu
50 55 60
Met Ser Arg Leu Ser Ile Ser Glu Asp Asn Ser Lys Ser Gln Val Phe
65 70 75 80
Leu Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 170
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 170
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ala Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Ser Tyr Tyr Cys Gln Gln Leu Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 171
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 171
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Val Trp Gly Gly Gly Ser Thr Tyr Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Thr Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys Gln Arg Gly Gln Tyr Gly Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 172
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 172
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Cys Ala Ser Asn Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 173
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 173
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asn Tyr
20 25 30
Ala Val His Trp Val Arg Gln Ser Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ser Asp Gly Ser Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Phe
65 70 75 80
Lys Met Asn Ser Leu Gln Ala Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Lys Lys Gly Gly Trp Phe Pro Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 174
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 174
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Lys Ala Ser Gln Ser Val Asp His Ala
20 25 30
Gly Asp Ser Tyr Met Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 175
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 175
Glu Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Lys Gln Ser His Gly Lys Arg Leu Glu Trp Ile
35 40 45
Gly Arg Val Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Tyr Asp Asn Ala Glu Gly Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 176
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 176
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Arg Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 177
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 177
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Gly Thr Asn Ser Asn Glu Lys Phe
50 55 60
Lys Ala Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Ala Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Ser Asp Tyr Asp Tyr Ala Phe Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 178
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 178
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Gly Asn Ile His Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro His Leu Leu Val
35 40 45
Tyr Asn Ala Lys Thr Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Phe Trp Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 179
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 179
Glu Phe Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Ser Gly Tyr Glu Asp Tyr Tyr Gly Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120
<210> 180
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 180
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Leu Gly
1 5 10 15
Glu Glu Ile Thr Leu Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Ser Gly Thr Ser Pro Lys Leu Leu Ile Tyr
35 40 45
Ser Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Phe Tyr Ser Leu Thr Ile Ser Ser Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Asp Tyr Tyr Cys His Gln Trp Ser Ser Tyr His Thr Phe
85 90 95
Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 181
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 181
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Thr Pro Asp Lys Arg Leu Glu Trp Val
35 40 45
Ala Thr Ile Ser Ser Gly Gly Ser Tyr Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Ser Ser Leu Lys Ser Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Arg Ala Asp Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 182
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 182
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Gln Ser Ala Ser Leu Gly
1 5 10 15
Glu Ser Val Thr Ile Thr Cys Leu Ala Ser Gln Thr Ile Gly Thr Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Ser Ala Thr Ser Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Lys Phe Ser Phe Lys Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Val Ser Tyr Tyr Cys Gln Gln Leu Tyr Ser Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 183
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 183
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Tyr
20 25 30
Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Val Trp Gly Gly Gly Ser Thr Tyr Tyr Asn Ser Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Lys Gln Arg Gly Gln Tyr Gly Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 184
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 184
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Gly Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Ser Ser Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 185
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 185
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Ala Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Ala
85 90 95
Val Ala Tyr Tyr Ser Asn Trp Gly Phe Ala Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 186
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 186
Asp Ile Val Leu Thr Gln Ser Leu Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Asp Glu Asp Ala Ala Thr Tyr Tyr Cys Gln His Ser Arg
85 90 95
Glu Leu Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
<210> 187
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 187
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asn Ser Glu Thr Arg Leu Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Thr Leu Asn Val Asp Lys Ser Ser Asn Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Val Met Asp Tyr Tyr Phe Asp Tyr Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser
115
<210> 188
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 188
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 189
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 189
Gln Val Gln Leu Lys Gln Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Phe Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Ser Tyr
20 25 30
Glu Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Thr Gly Gly Ser Thr Asn Tyr Asn Ser Ala Leu Ile
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Leu Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Val
85 90 95
Arg Gly Val Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr
100 105 110
Val Ser Ser
115
<210> 190
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 190
Asp Ile Lys Met Thr Gln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala Asn Arg Leu Val Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Gln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr Tyr Cys Leu Gln Tyr Asp Glu Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 191
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 191
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asn Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Phe Phe Tyr Pro Tyr Asn Gly Asn Thr Val Tyr Ser Gln Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Asn Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Asn Trp Glu Gly Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser
115
<210> 192
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 192
Asp Val Leu Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 193
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 193
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Arg Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asn Gly Asn Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Ile Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Glu Arg Trp Leu Leu Leu Trp Phe Ala Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ala
115
<210> 194
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 194
Ser Ile Val Met Thr Gln Thr Pro Lys Phe Leu Leu Val Ser Ala Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Gly Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Asn Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Phe Thr Ile Ser Thr Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 195
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 195
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Val
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asp Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Val Gly Asp Tyr Val Gly Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Leu Thr Val Ser Ser
115
<210> 196
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 196
Asp Ile Gln Met Thr Gln Thr Ala Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Asn Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Ile Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asp Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 197
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 197
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Thr Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Leu His Trp Val Lys Gln Ala Leu Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Gly Glu Pro Ala Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Asn Asp Leu Lys Asn Glu Asp Thr Thr Thr Tyr Phe Cys
85 90 95
Gly Ile Tyr Asp Gly Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
100 105 110
Val Thr Val Ser Ser
115
<210> 198
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 198
Gln Ile Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Arg Leu Leu Ile Tyr
35 40 45
Asp Thr Ser Asn Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Met Glu Ala Glu
65 70 75 80
Asp Thr Ala Thr Tyr Tyr Cys Gln Glu Trp Ser Asn Asn Pro Leu Thr
85 90 95
Phe Gly Asp Gly Thr Lys Leu Glu Leu Lys
100 105
<210> 199
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 199
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Leu Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Arg Ile Val Tyr
65 70 75 80
Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Lys Tyr Glu Ala His Glu Gly Phe Val Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ala
115
<210> 200
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 200
Asp Ile Gln Met Asn Gln Ser Pro Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Thr Ile Thr Ile Thr Cys His Ala Ser Gln Asn Ile Asn Val Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser His Leu His Thr Gly Val Pro Ser Arg Leu Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Gly Gln Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Ser Gly Thr Thr Leu Glu Ile Lys
100 105
<210> 201
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 201
Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln
1 5 10 15
Ser Leu Ser Ile Thr Cys Ala Val Ser Gly Phe Ser Leu Thr Ser Phe
20 25 30
Gly Val His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Val Ile Trp Ala Gly Gly Ser Thr Asn Tyr Tyr Ser Ala Leu Met
50 55 60
Ser Arg Leu Ser Ile Ser Ile Asp Asn Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr Tyr Cys Ala
85 90 95
Arg Asp Trp Glu Gly Trp Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 202
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 202
Asp Ile Val Met Ser Gln Ser Pro Ser Ser Leu Thr Val Ser Val Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Met Ser Ser Gln Ser Leu Leu Tyr Ser
20 25 30
Ser Thr Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Lys Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg
<210> 203
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 203
Glu Ile Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Ser Tyr
20 25 30
Asn Met Tyr Trp Val Ser Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asp Pro Tyr Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Asn Tyr Arg Tyr Phe Asp Phe Trp Gly Gln Gly Thr Thr
100 105 110
Leu Thr Val Ser Ser
115
<210> 204
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 204
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
35 40 45
Leu Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Trp Arg Ser Asn Pro Phe Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 205
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 205
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Trp Trp Asp Asp Val Lys Arg Tyr Ser Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Val Ser Phe Asp Asn Asp Val Val Ser Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 206
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 206
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Tyr Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Thr Ala Asn Ser Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Lys Gln Ala Tyr Asp Val Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 207
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 207
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr
20 25 30
Trp Ile His Trp Ile Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Thr Thr Val Tyr Thr Glu Phe Asn Gln Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Ser Asn Phe Phe Asp Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 208
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 208
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile Lys
35 40 45
Asp Ser Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 209
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 209
Gln Ile Thr Leu Lys Glu Ser Gly Pro Thr Leu Val Lys Pro Thr Gln
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Phe Ser Gly Phe Ser Leu Ser Thr Ser
20 25 30
Gly Met Gly Val Gly Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Thr Asp Ile Trp Trp Asp Asp Asn Lys Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Thr Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Arg Val Asn Tyr Tyr Tyr Asp Pro Tyr Tyr Ala Met Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 210
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 210
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 211
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 211
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Asp Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Gly Gly Asn Ser Pro Ser Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 212
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 212
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Val Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr Thr Ser Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 213
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<400> 213
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ile Gly Asp Ser Ser Pro Ser Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 214
<400> 214
000
<210> 215
<400> 215
000
<210> 216
<400> 216
000
<210> 217
<400> 217
000
<210> 218
<400> 218
000
<210> 219
<400> 219
000
<210> 220
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 220
caaattgttc tcacccagtc tccagcaatc atgtctgtat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccaacaaaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttattttt tcacaatcag cagcatggag 240
gctgaagatg ctgccactta ttactgccac cagtatcatc gttccccatt cacgttcggc 300
gcggggacaa agttgaaaat aagac 325
<210> 221
<211> 369
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 221
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataacccag ccctgaagag ccgactaact atctccaagg atacctccag cagccaggta 240
ttcctcaaga tcgccagtgt ggacactgca gatactgcca catactactg tgctcgaata 300
gctgactatg gcggagatta ctatgctatg gactactggg gtcaaggaac ctcagtcacc 360
gtctcctca 369
<210> 222
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 222
gatatccaga tgacacagac tacatcttcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattagc aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg cgtcccatca 180
aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcaa cctggagcta 240
gaagatattg ccacttactt ttgccaacag ggtgatatgc ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 223
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 223
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctggtta taccttcaca gactattcaa tgcactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacactg agactggtga gccaggatat 180
gcagatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctat 240
ttgcagatca acaacctcaa aaatgaggac acggctacat atttctgtgc tcggtacgac 300
gggtatgcta tggactattg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 224
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 224
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgcact ggtaccagca gaagtcaggc 120
acctccccca aaagatggat ttatgacaca tccaaactgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg actagaaacc cgctcacgtt cggggctgga 300
accaagctgg agctgaaac 319
<210> 225
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 225
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccttcag gagagggtct agagtggctg gcagacattt ggtgggatga caataagtac 180
tataacccat ccctgaagag ccggctcaca atctccaagg atacctccag caaccaggta 240
ttcctcaaga tcaccagtgt ggacactgca gatactgcca cttactactg tgctcgaaga 300
gttaactatg tttacgaccc gtactatgct atggactact ggggtcaagg aacctcagtc 360
accgtctcct ca 372
<210> 226
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 226
aacattatga tgacacagtc gccatcatct ctggctgtgt ctgcaggaga aaaggtcact 60
atgagctgta agtccagtca aagtgtttta tacagttcaa atcagaagaa ctacttggcc 120
tggtaccaac agaaaccagg gcagtctcct aaactgctga tctactgggc atccactagg 180
gaatctggtg tccctgatcg cttcacaggc agtggatctg ggacagattt tactcttacc 240
atcagcactg tacaagttga agacctggca gtttattact gtcatcaata cctctcctcg 300
tggacgttcg gtggaggcac caagctggaa atcaaac 337
<210> 227
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 227
gaggtccagc tgcaacagtc tggacctgag ctggtgaagc ctggggcttc agtgaagatt 60
tcctgcaagg cttctggtta ctcattcact ggctataaaa tgcactgggt gaagcaaagc 120
catgtaaaga gccttgagtg gattggacgt attaatcctt acaatggtgc tactagctac 180
aaccagaatt tcaaggacaa ggccaccttg actgtagata agtcctccag cacagcctac 240
atggacctcc acagcctgac atctgaggac tctgcagtct atttctgtgc aagaggggac 300
tataggtacg actggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 228
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 228
gaaatccaga tgacccagtc tccatcctct atgtctgcat ctctgggaga cagaataacc 60
atcacttgcc aggcaactca agacattgtt aagaatttaa actggtatca gcagaaacca 120
gggaaacccc cttcattcct gatctattat gcaattgaac tggcagaagg ggtcccatca 180
aggttcagtg gcagtgggtc tgggtcagac tattctctga caatcagcaa cctggagtct 240
gaagattttg cagactatta ctgtctacag ttttatgagt ttccgttcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 229
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 229
caggcccagc tgcagcagtc tggagctgag ctggtaaggc ctgggacttc agtgaaggtg 60
tcctgcaagg cttctggata cgccttcact aattacttga tagagtgggt aaagcagagg 120
cctggacagg gccttgagtg gattggagtg attaatcctg gaactggtgg tactaactac 180
aatgagaact tcaagggcaa ggcaactctg actgcagaca aatcctccag tactgcctac 240
atgcagctca gcagcctgac atctgatgac tctgcggtct atttctgtgc aagatccccc 300
tatgattacc acgagggtgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 230
<211> 410
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 230
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
ccaggatcat cccccaaact ctggatttat agcacttcca acctggcttc tggagtccca 180
actcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcatggag 240
gctgaagatg ctgccactta ttactgccac cagtatcatc gttccccatt cacgttcggc 300
tcggggacaa agttggaaat aaaaccagca tggaggctga agatgctgcc acttattact 360
gccaccagta tcatcgttcc ccattcacgt tcggctcggg gacaaagttg 410
<210> 231
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 231
caggttactc tgaaagagtc tggccctggg atattgcagt cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataacccag tcctgaagag ccgactgact atctccaagg atacctccag cagccaggta 240
ttcctcaaga tcgccagtgt ggacactgca gatactgcca catactattg tgctcgatta 300
gttgatgatc tgtactactt tgactactgg ggccaaggca ccactctcac agtctcctca 360
<210> 232
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 232
gatgttgaga tgacccagac tccactcact ttgtcggtta ccattggaca accagcctcc 60
atctcttgca agtcaagtca gagcctctca gacagtgatg gaaagacata tttgaattgg 120
atgtttcaga ggccaggccg gtctccaaag cgcctaatct atctggtgtc taaactggac 180
tctggagtcc ctgacaggtt cactggcagt ggatcaggga cagatttcac actgaaaatc 240
agcagagtgg aggctgagga tttgggagtt tactattgct ggcaaggtaa acattttccg 300
tggacgttcg gtggaggcac caagctggaa atcaaac 337
<210> 233
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 233
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctggtta taccttcaca gactattcaa tgcactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacactg agactgttga gccaacatat 180
gcagatgact tcatgggacg gtttgccttc tctttggaaa cctctgccag cactgccttt 240
ttgcagatca acaacctcga aaatgaggac acggctacat atttctgtgc tagatttggt 300
tcctatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 234
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 234
caaattgttc tcacccagtc tccagcactc gtgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgtact ggtaccagca gaaaccaaga 120
tcctccccca aaccctggat ttatctcaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg cgtagtaacc cattcacgtt cggctcgggg 300
acaaagttgg aaataaaac 319
<210> 235
<211> 371
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 235
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgg 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataacccag ccctgaagag ccgactgact atctccaagg atacctccag cagccaggta 240
ttcctcaaga tcgccagtgt ggacactgca gatactgcca catactactg tgctcgcata 300
gtttcctttg ataacgacgt tgtctctgct atggactact ggggtcaagg aacctcagtc 360
accgtctcct c 371
<210> 236
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 236
gacatccaga tgactcagtc tccagcctcc ctggctgcat ctgtgggaga aactgtcgcc 60
atcacatgtc gagcaagtga gaacatttac tacaatttag catggtatca gcagaaacaa 120
gggaaatctc ctcagctcct gatctatact gcaaacagtt tggaagatgg tgtcccatcg 180
aggttcagtg gcagtggatc tgggacacag tattctttga agatcaacag catgcagcct 240
gaagattccg caacttattt ctgtaaacag gcttatgacg ttcctccgac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 237
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 237
caggtccagc ttcagcagtc tggggctgaa ctggcaaaac ctggggcctc agtgaagatg 60
tcctgtaagg cttctggcta cacctttact cgctactgga tacactggat aaaacagagg 120
cctggacagg gtctggaatg gattggatac attaatccta caactgttta tactgagttc 180
aatcagaact tcaaggacaa ggccactttg actgcagaca aatcctccac cacagcctcc 240
atgcaactga gcagcctgac atctgaggac tctgcagtct attactgtgc aagaggcggt 300
agtaacttct ttgactactg gggccaaggc accactctca cagtctcctc a 351
<210> 238
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 238
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctttgggaga cagagtcacc 60
atcagttgca gggcaagtca gaatattatc aattatttaa actggtatca gcagaagcca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tgggacagat tattctctca ccatcagcaa cctggaacct 240
gaagatattg ccacttacta ttgtcaacag tatagtgagc gtccgtacac gttcgggggg 300
gggaccaagc tggaaataaa acg 323
<210> 239
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 239
gaagtgaagc tggaggagtc aggaggaggc ttggtacaac ctggagaatc catgaaactc 60
tcttgtgctg cttctggatt cacttttagt gatgcctgga tggactgggt ccgccagtct 120
ccagagaagg gacttgagtg ggttgctgaa attagaaaca aagctaataa tcatgcaaca 180
tattatgctg agtctgtgaa agggaaattc accatctcaa gagatgattc caaaagtaga 240
gtgtacctgc aaatgaacaa cttaagagct gcagacactg gcatttatta ctgtacggcc 300
tatagtaact ttgcttactg gggccaaggg actctggtca ctgtctctac a 351
<210> 240
<211> 320
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 240
gacatccaga tgacacagtc tccatcctca ctgtctgcat ctctgggagg caaagtcacc 60
ttcacttgca aggcaagcca agacattcac aagtatgtag cttggtacca acacaagcct 120
ggaaaaggtc ctaggctgct catacattac acatctacat tacagccagg catctcatca 180
aggttcagtg gaagtgggtc tgggagagat tattccttca gcatcagcaa cctggagcct 240
gaagatattg caacttatta ttgtctacag tataataatc tgtacacgtt cggagggggg 300
accaagctgg aaataaaacg 320
<210> 241
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 241
gaggttcagc tgcagcagtc tggggctgag cttgtgaggc caggggcctc agtcaagttg 60
tcctgcacag cttctggctt caacattaaa gacagccttt tgcactgggt gaagcagagg 120
cctgaaaagg gcctggagtg gattgggtgg attgatcctg aggatggtga aactaaatat 180
gccccgaact tccaggacaa ggccactata actacagact catcctccaa cacagcctac 240
ctgcaactca tcagcctgac atctgttgac actgccatct attactgtgc ctatggtaac 300
tacgtgcggc actttgacta ctggggccaa ggcaccactc tcacagtctc ctca 354
<210> 242
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 242
gaaatccaga tgacccagtc tccatcctct atgtctgcat ctctgggaga cagaataacc 60
atcacttgcc aggcaactca agacattgtt aagaatttaa actggtatca gcagaaacca 120
gggaaacccc cttcattcct gatctattat gcaactgaac tggcagaagg ggtcccatca 180
aggttcagtg gcagtgggtc tgggtcagac tattctctga caatcaggaa cctggagtct 240
gaagactttg cagaccatta ctgtctacag ttttatgagt ttccgttcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 243
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 243
caggtccagt tgcagcagtc tggaactgag ctggtaaggc ctgggacttc agtgagggtg 60
tcctgcaagg cttctggata cgccttcggt aatcacttga ttgagtgggt gaagcagagg 120
cctggacagg gccttgagtg gattggagtg attaatcctg gaactggtgg tactcactac 180
aatgagaagt tcaaggacaa ggcaagactg accgcagaca aatcctccaa cactgcctac 240
atgcacctca acagcctgac atctgatgac tctgcggtct atttctgtgc aagatccccc 300
tatgattacc acgagggtgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 244
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 244
gacattgtga tgacacagtc tccatcctcc ctggctatgt cagtaggaca gaaggtcact 60
atgagctgca agtccagtca gagcctttta aatagtagca atcaaaagaa ttatttggcc 120
tggtatcagc aggaaccagg acagtctcct aaacttctgg tatcctttgc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactcttacc 240
atcagcggtg tgcaggctga agacctggca gtttattact gtcagcaaca ttatagcatt 300
ccgctcacgt tcggtgctgg gaccaagctg gagctgaaa 339
<210> 245
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 245
caggttcagc tacaacagtc tggacctgag ctggtgaagc ctggggcctc agtgaagatt 60
tcctgcaagg cttctggcta tgcattcagt agctcctgga tgaactgggt gaagcagagg 120
cctggaaagg gtcttgagtg gattggacgg atttatcctg gagatggaga tactaactac 180
aatgggaagt tcaagggcaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcaactca gcagcctgac atctgaggac tctgcggtct acttctgtgc aatgggtatt 300
tataactacg atggtagccg ttactattct atggactact ggggtcaagg aacctcagtc 360
accgtctcct ca 372
<210> 246
<211> 315
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 246
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattaag aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaacccct gatctactac acatcaagag tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcaa cctggagcaa 240
gaagatattg ccacttactt ttgccagcag ggttatacgc ttccattcac gttcggctcg 300
gggacaaagt tggaa 315
<210> 247
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 247
caggtccagc tgcagcagcc tggggctgaa ctggtgaagc ctggggcttc agtgaagctg 60
tcctgtaagg cttctggata caccttcact acctactgga tgcactgggt gaagcagagg 120
cctggacaag gccttgagtg gatcggagag attgatcctt ctgatagtta tacttactac 180
aatcaaaagt tcaagggcaa ggccacattg actgtagaca aatcctccag cacagcctac 240
atgcaactca gcagcctgac atctgaggac tctgcggtct attattgtgc aagaggggac 300
tatggtaacc cctatgctat ggactactgg ggtcaaggat cctcagtcac cgtctcctca 360
<210> 248
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 248
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctcctgggga gaaggtcacc 60
ttgacctgca gtgccagctc aagtgtaagt tccaggtact tgtactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccct 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcataatcag cagcatggag 240
gctgaagatg ctgcctctta tttctgccat cagtggagta attacccact cacgttcggt 300
gctgggacca agctggagct gaaac 325
<210> 249
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 249
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctaata cgggcatagg ctggattcgt 120
cagccttcag ggacgggtct ggagtggctg gcacacattt ggtggaatga tgataagtac 180
tataatccat ccctgaagag ccggctcaca atctccaagg aaacctccaa caaccaggta 240
ttcctcaaga tcaccaatgt ggacactgca gatactgcct catacttctg tgttcaaatc 300
gggcgcgact acagtaacta cgcctggtat ttcgatgtct ggggcgcagg gaccacggtc 360
accgtctcct ca 372
<210> 250
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 250
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgcact ggtaccagca gaagtcaggc 120
acctccccca aaagatggat ttatgactca tccaaactgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agtagtaacc cgctcacgtt cggtgctggg 300
accaagctgg agctgaaac 319
<210> 251
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 251
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccttcag gagagggtct agagtggctg acagacattt ggtgggatga caataagtac 180
tataacccat ccctgaagag ccggctcaca atctccaagg atacctccag caaccaggta 240
ttcctcaata tcaccagtgt ggacactgca gatactgcca cttactactg tgctcgaaga 300
gttaactatt attacgaccc gtactatgct atggactact ggggtcaagg aacctcagtc 360
accgtctcct ca 372
<210> 252
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 252
gatgttgaga tgacccagac tccactcact ttgtcggtta ccattggaca accagcctcc 60
atctcttgca agtcaagtca gagcctctca gacagtgatg gaaagacata tttgaattgg 120
atgtttcaga ggccaggccg gtctccaaag cgcctaatct atctggtgtc taaactggac 180
tctggagtcc ctgacaggtt cactggcagt ggatcaggga cagatttcac actgaaaatc 240
agcagagtgg aggctgagga tttgggagtt tactattgct ggcaaggtaa acattttccg 300
tggacgttcg gtggaggcac caagctggaa atcaaac 337
<210> 253
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 253
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctggtta ttccttcaca gactattcaa tgcactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacactg agactgttga gccaacatat 180
gcagatgact tcatgggacg gtttgccttc tctttggaaa cctctgccag cactgccttt 240
ttgcagatca acaacctcga aaatgaggac acggctacat atttctgtgc tagatttggt 300
tcctatgcta tggactactg gggtcaagga acctcag 337
<210> 254
<211> 320
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 254
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
ataacctgca gtgccagctc aagtgtaagt tacatgcact ggttccagca gaagccaggc 120
acttctccca aactctggat ttataccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtggatctgg gacctcttac tctctcacag tcagccgaat ggaggctgaa 240
gatgctgcca cttattactg ccagcaaagg agtctttatc cgtacacgtt cggagggggg 300
accaaggtgg aaataaaacg 320
<210> 255
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 255
caggttcagc tacagcagtc tggagctgag ctggcgaggc ccggggcttc agtgaagctg 60
tcctgcaagg cttcaggcta caccttcact gaccagtata taaactgggt gaagcagagg 120
actggacagg gccttgagtg gattggagag atttatcccg gaaggggtaa tacttactac 180
aatgagaagt tcaagggcaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcaactca gcagcctgac atctgaggac tctgcagtct atttctgtgc aagagaggat 300
ggtggttacg acgatgcctg gtttgcttac tggggccaag ggactctggt cactgtctct 360
gca 363
<210> 256
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 256
caaattgttc tgacccagtc tccaacaatc atgtctgcat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaact tccagttact tgcactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcatggag 240
gctgaagatg ctgccactta ttactgccac cagtttcatc gttccccatt cacgttcggc 300
tcggggacaa agttggaaat aaaac 325
<210> 257
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 257
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataaaccag ccctgaagag ccgactgact gtctccaagg atacctccag caaccaggtt 240
ttcctcaaga tcgccactgt ggacgctgca gatactggca catactactg tgctcgaatc 300
gttgatggtc accccccgtt tgcttactgg ggccaaggga ctctggtcac tgtctctgca 360
<210> 258
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 258
gacattgtgc tgacccagtc tccactctct ctgcctgtca atattggaga tcaagcctct 60
atctcttgca agtctactaa gagtcttctg aatagtgatg gattcactta tttggactgg 120
tatttgcaga ggccaggcca gtctccacaa ttcctaatat atttggtttc taatcgattt 180
tctggagttc cagacaggtt cagtggcagt gggtcaggaa cagatttcac actcaagatc 240
agcagagtgg aggctgagga tttgggagta tattattgct tccagagtaa ctatcttccg 300
ctcacgttcg gtgctgggac caagctggag ctgagac 337
<210> 259
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 259
gaggtccaac tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcagt cgtttctata tgcactgggt gaagcaaagt 120
cctgaaaata gtcttgagtg gattggagag attaatccta gcactggggg tacaagctac 180
aaccagaagt tcaagggcaa ggccacatta actgtagata aatcctccag cacagcctac 240
atgcagctca agagcctgac atctgaagag tctgcagtct attactgtac taggggttac 300
gggagcaact ggtacttcga tgtctggggc gcagggacca cggtcaccgt ctccaca 357
<210> 260
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 260
agtattgtga tgacccagac tcccaaattc ctgcttgtat cagcaggaga cagggttacc 60
ataacctgca aggccagtca gagtgtgagt aatgatgtag cttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatactat gcatccaatc gctacagtgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattatagct ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 261
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 261
cagatccagt tggtgcagtc tggacctgag ctgaagaggc ctggagagac agtcaagatc 60
tcctgcaagg cttctggata taccttcaca aactatggaa tgaactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacacgt acactggaga cccaacatat 180
gctgatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctat 240
ttgcagatca acaacctcaa aaatgaggac acggctacat atttctgtgc aagaattggc 300
ggtaatagtc cctctgatta ctggggccaa ggcacctctc tcacagtctc ctca 354
<210> 262
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 262
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattagc aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcaa cctggagcaa 240
gaagatattg ccacttactt ttgccaacag ggtaatacgc ttccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 263
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 263
tctgatgtgc agcttcagga gtcgggacct ggcctggtga aaccttctca gtctctgtcc 60
ctcacctgca ctgtcactgg ctactcaatc accagtgatt atgcctggaa ctggatccgg 120
cagtttccag gaaacaaact ggagtggatg ggctacataa gctacagtgg tagcactagc 180
tacaacccat ctctcaaaag tcgaatctct atcactcgag acacatccaa gaaccagttc 240
ttcctgcagt tgaattctgt gactactgag gacacagcca catattactg tgcaagattt 300
tactacggta gtagctatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 264
<211> 318
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 264
gaaacaactg tgacccagtc tccagcatcc ctgtccgtga ctacaggaga aaaagtcact 60
atcagatgca taaccacccc tgatattgat gatgatatga actggtacca gcagaagcca 120
ggggaacctc ctaacctcct tatttcagaa ggcaatagtc ttcgtcctgg agtcccatcc 180
cgattctcca gcagtggcta tggcacaaat tttgttttta caattgaaaa cacgctctca 240
gaagatgttg cagattacta ctgtttgcaa agtgataaca tgccattcac gttcggctcg 300
gggacaaagt tggaaata 318
<210> 265
<211> 352
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 265
caggtccagc tgcagcagtc tggggctgaa ctggcaaaac ctggggcctc agtgaagatg 60
tcctgcaagg cttctggcta cacctttact acctactgga tgcactgggt aaaacagagg 120
cctggacagg gtctggaatg gattggatac attaatccta gcagtggtta tactgagtac 180
aatcagaagt tcaaggacaa ggccacattg actgcagaca aatcctccag cacagcctac 240
atgcaactaa gcagcctgac atctgaggac tcttcagtct attactgtgc aagaaagggt 300
agtaacaggg ggtttgctta ctggggccaa gggactctgg tcactgtctc tg 352
<210> 266
<211> 313
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 266
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtataaat tacatgcact ggtaccagca gaagccaggc 120
acctccccca aaagatggat ttatgacaca tccaaactgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttat tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccatcagcgg agtacgtgga cgttcggtgg aggcaccaag 300
ctggaaatca aac 313
<210> 267
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 267
gaggttcagc tgcagcagtc tggggcagag cttgtgaagc caggggcctc agtcaagttg 60
tcctgcacag tttctggctt caacattaaa gacacctata tacactgggt gaagcagagg 120
cctgaacagg gcctggagtg gattggaagg attgatcctg cgaatggtaa tactaaatat 180
gacccgaagt tccagggcaa ggccactata acagcagaca catcctccaa cacagcctac 240
ctgcagctca gcagcctgac atctgaggac actgccgtct attactgtgc tagaccgacg 300
gggtactttg aatactgggg ccaaggcacc actctcacag tctcctca 348
<210> 268
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 268
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctttgggaga cagagtcacc 60
atcagttgca gggcaagtca ggatgttatc aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaaggt tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc taggacagat tattctctca ccatcagcaa cctggaacct 240
gaagatattg ccacttacta ttgtcagcag tatagtgagc gtccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 269
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 269
gaagtgaagc ttgaggagtc tggaggaggc ttggtgcaat ttggaggatc catgaaactc 60
tcttgtgctg cttctggatt cacttttagt gatgcctgga tggactgggt ccgccagtct 120
ccagagaagg ggcttgagtg ggttgctgaa attagaaaca aagctaataa tcatgcaaca 180
tattatcctg agtctgtgaa agggaggttc accatctcaa gagatgattc caaaagtaga 240
gtgtacctgc aaatgaacaa cttaagagct gaagacactg gcatttatta ctgtacgggt 300
tactcctcgt ttgcttactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 270
<211> 338
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 270
gatgttttga tgacacagtc tccactctcc ctgtctgtca gtcttggaga tcaagcctcc 60
atctcttgta gatctagtca gaacattgta cacagtgata gatacaccta tttagaatgg 120
tacctgcaga aaccaggcca gtcgccaaaa ctcctgatat atggggtttc caaccgattt 180
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaagatc 240
agcagagtgg aggctgagga tatgggagtt tattactgct ttcaaggtac acatgttccg 300
tacacgttcg gaggggggac caagctggaa ataaaacg 338
<210> 271
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 271
cagatccagt tggtgcagtc tggacctgaa ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctgggta taccttcaca actgctggaa tgcagtgggt gcaaaagatg 120
ccaggaaagg gttttaagtg gattggctgg ataaacaccc actctggaga gccaaaatat 180
gcagatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctat 240
ttacagataa gcaacctcaa agacgaggac acggctacgt ttttctgtgc gcccctatgg 300
tccgatagta gttttgctta ctggggccaa ggaactctgg tcactgtctc tgca 354
<210> 272
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 272
gaaatccaga tgacccagtc tccatcctct atgtctgcat ctctgggaga cagaataacc 60
atcacttgcc aggcaactca agacattgtt aagaatttaa actggtatca gcagaaacca 120
gggaaacccc cttcattcct gatctattat gcaactgaac tggcagaagg ggtcccagca 180
aggttcagtg gcagtgggtc tgggtcagac tattctctga caatcagcaa cctggagtct 240
gaagattttg cagactatca ctgtctacag ttttatgagt ttccgttcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 273
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 273
caggtccagc tgcagcagtc tggagctgac ctggtaaggc ctgggacttc agtgaaggtg 60
tcctgcaagg cttctggata ctccttcact aattacctga tagagtgggt aaagcagagg 120
ccaggacagg gccttgagtg gattggagtg attaatcctg gaagtggtgg aactcactac 180
aatgagaaat tcaaggacaa ggcagttctg actgcagaca aatcctccac tactgcccac 240
atgcagctca gcagcctgac atctgatgac tctgcggtct atttctgtgc aagatccccc 300
tatgattata acgatggtgc tatggactac tggggtcaag gaacctcagt caccgtctct 360
tca 363
<210> 274
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 274
gatgttgttc tgacccagtc tccactctct ctgcctgtca atattggaga tcaagcctct 60
atctcttgca agtctactaa gagtcttctg aatagtgatg gattcactta tttggactgg 120
tatttgcaga ggccaggcca gtctccacaa ttcctaatat atttggtttc taatcgattt 180
tctggagttc cagacaggtt cagtggcagt gggtcaggaa cagatttcac actcaagatc 240
agcagagtgg aggctgagga tttgggagta tattattgct tccagagtaa ctatcttccg 300
ctcacgttcg gtgctgggac caagctggag ctgagac 337
<210> 275
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 275
gaggtccaac tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcagt cgtttctata tgcactgggt gaagcaaagt 120
cctgaaaata gtcttgagtg gattggagag attaatccta gcactggggg tacaagctac 180
aaccagaagt tcaagggcaa ggccacatta actgtagata aatcctccag cacagcctac 240
atgcagctca agagcctgac atctgaagag tctgcagtct attactgtac taggggttac 300
gggagcaact gttacttcga tgtctggggc gcagggacca cggtcaccgt ctccaca 357
<210> 276
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 276
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agttatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcga gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcaccag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgaat ttccgctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 277
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 277
caggttcaac tgcagcagtc tggacctgag ctggtgaagc ctgggacttt agtgaagata 60
tcctgcaagg cttctggtta caccttcaca agctacgata taaactgggt gaagcagagg 120
cctggacagg gacttgaatg gattggatgg atttatcctg gagatggtaa tactaagtac 180
agtgagaaat tcaagggcaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcagctca ccagcctgac ttctgagaac tctgcagtct atttctgtgc aagagactat 300
gattaccctt ttgcttactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 278
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 278
gatatccaga tgacacagac tacatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattagc aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggtacagat tattctctca ccattagcaa cctggagcaa 240
gaagatattg ccacttactt ttgccaacag ggtaatacgc ttcggacgtt cggtggaggc 300
accaagctgg aaatcaaac 319
<210> 279
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 279
gaagtgcagc tggtggagtg tgggggatgc ttagtgaagc ctggagggta cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgcca tgtcttgggt tcgccagtct 120
ccagagaaga ggctggagtg ggtcgcagaa atcagtattg gtggtagcta cacctactat 180
ccagacactg tgacgggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctggaaatga gcagtctgag gtctgaggac acggccatgt attactgtgc aagggagggc 300
tatgattacg acgtgagagc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 280
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 280
gacatccaga tgattcagtc tccatcgtcc atgtttgcct ctctgggaga cagagtcagt 60
ctctcttgtc gggctagtca gggcattaga gggactttag actggtatca acagaaacca 120
aatggaacta ttaaactcct gatctactcc acatccaatt taaattctgg tgtcccatca 180
aggttcagtg gcagtgggtc tgggtcagat tattctctca ccatcagcag cctagagtct 240
gaagattttg cagactatta ctgtctacag cgtaatgcgt atcctctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 281
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 281
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acgtgcgctg tctctggatt ttcattaacc agctttgcaa tacactggtt tcgcaagcct 120
ccaggaaagg gtctggagtg gctgggagta atatggactg gtggaaccac aaattataat 180
tcggctctca tgtccagact gagcatcagc aaagacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccag agacgattac 300
gacaataatt atgctatgga ctactggggt caaggaacct cagtcaccgt ctcctca 357
<210> 282
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 282
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctatttaa actggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 283
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 283
gaggtgcagc ttgttgagtc tggtggagga ttggtgcagc ctaaagggtc attgaaactc 60
tcatgtgcag tctctgcatt caccttcact acctacgcca tgaactgggt ccgccaggct 120
ccaggaaagg gtttggagtg ggttgctcgc ataagaaata aaagtaataa ttatgcaaca 180
tattatgccg attcagtgaa agacaggttc accatctcca gagatgattc acaaagcatg 240
ctctatctgc aaatgaacaa cttgaaaatt gaggacacag ccatgtatta ctgtgtgttc 300
tactatgatt acgtctactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 284
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 284
agtattgtga tgacccagac tcccaaattc ctgcttgtat cagcaggaga cagggttacc 60
ataacctgca aggccagtca gagtgtgagt aatgatgtag tatggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatactat gcatccaatc gctacactgg agtccctgat 180
cgcttcgctg gcagtggata tgggacggat ttctctttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattatacct ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcag ac 322
<210> 285
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 285
cagatccagt tggtgcagtc tggacctgaa ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctgggta taccttcaca aactatggaa tgaactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatggcctgg ataaacacct acactggaga gccaacatat 180
gctgatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctct 240
ttgcagatca tcaacctcaa aaatgaggac acggctacat atttctgtgc aaggatcggc 300
gatagtagtc cctctgacta ctgggggcag ggcaccactc tcacagtctc ctca 354
<210> 286
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 286
gacattgtga tgacccagtc tcacaaattc atgtccatat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgagt atttttgtag cctggtatca acagaaacca 120
ggacaatctc ctaaactact gatttactcg gcatcctacc ggtacactgg agtccctgat 180
cgcttcactg gcagtggatc tgggacggat ttcattttca ccatcagcag tgtgcaggct 240
gaagacctgg cagtttacta ctgtcagcaa cattatggta ctccattcac gttcggctcg 300
gggacaaagt tgaaaataag ac 322
<210> 287
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 287
gaagtgaaac tggtggagtc tgggggagac ttagtgaagc ctggagggtc cctaaaactc 60
tcctgtgcag cctctggatt cgctttcagt agttatgaca tgtcttgggt tcgccagact 120
ccggagaaga gactggagtg ggtcgcaacc attagcagtg gtggtagtta cacctattat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgtcaggga caccctgtac 240
ctgcaaatga gcagtttgag gtctgaggac acggccttgt attactgtgc aagacaggca 300
attgggacgt actttgacta ctggggccaa ggcaccactc tcacagtctc ctca 354
<210> 288
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 288
gacatccaga tgactcagtc tccagcctcc ctatcttcat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtga gaatatttac agttatttag catggtatca gcagaaacag 120
ggaaaatctc ctcagctcct ggtctataat gcaaaaactt tagcagaagg tgtgccatca 180
aggttcagtg gcagtggatc aggcacacag ttttctctga agatcaacag cctgcagcct 240
gaagattttg ggacttatta ctgtcaacat cattatgatt ctccgctcac gttcggtgct 300
gggaccaagc tggagctgag ac 322
<210> 289
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 289
gatgtgcagc tggtggagtc tgggggaggc ttagtgcagc ctggagggtc ccggaaactc 60
tcctgtgcag cctctggatt cactttcagt agctttggaa tgcactgggt tcgtcaggct 120
ccagagaagg ggctggagtg ggtcgcatac attagtagtg gcagtagtaa catctactat 180
gcagacacag tgaagggccg attcaccatc tccagagaca atcccaagaa caccctgttc 240
ctgcaaatga ccagtctaag gtctgaggac acggccatgt attactgtgc aagaggctac 300
tatggtaact acgatgctat ggactactgg ggtcaaggaa cctcagtcac cgtctcctca 360
<210> 290
<211> 340
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 290
gatattgtga tgacacagtc tacatcctcc ctggctatgt cagtaggaca gaaggtcact 60
atgagctgca agtccagtca gagcctttta aatagtagca atcaaaagaa ttatttggcc 120
tggtaccagc aggaaccagg acagtctcct aaacttctgg tatcctttgc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactcttacc 240
atcagcggtg tgcaggctga agacctggca gtttattact gtcagcaaca ttatagcatt 300
ccgctcacgt tcggtgctgg aaccaagctg gagctgaaac 340
<210> 291
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 291
gaggtcctgc tccaacggtc tggacctgac ctggtgaagc ctggggcttc agtgacgata 60
ccctgcaagg cttctggata cacattcact gactacaaca tggactgggt gaagcagagc 120
catggaaaga gccttgagtg gattggaaat attaatactt acaatggtgg tactatctac 180
aaccagaagt tcaagggcaa ggccacattg actgtagaca agccctccag cacagcctac 240
atggagctcc gcagcctgac atctgaggac actgcagtct attactgtgc aagacgtcta 300
cggtatgggg gacactactt tgactactgg ggccaaggca ccgctctcac agtctcctca 360
<210> 292
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 292
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctttttaa gctggttcca gcggaaacca 120
gggaaatctc cgaagaccct gatctatcgt gcaaacagat tagtagatgg agtcccatca 180
aggttcactg gcagtggatc tgggcaagaa ttttctctca ccatcagcag cctggagtat 240
gaagatttgg gaatttatta ttgtcttcag tatgatgagt ttccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 293
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 293
gaagtgatgc tggtagagtc tgggggagac ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatgcca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcatac attagcggtg gtggtgatca catctattat 180
ccagacagtg tgaggggccg attcaccatc tccagagaca atgccaagga caccctgtac 240
ctgcaaatga gcagtctgag gtctgaggac acggccttgt atgactgtgc aagagtgaga 300
gactggtact tcgatgtctg gggcgcaggg accacggtca ccgtctcctc a 351
<210> 294
<211> 316
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 294
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtcagt tacatgtact ggtaccagca gaagtcaggc 120
acctccccca aaagatggat ttatgacaca tccaaactgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcat ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agtagtaacc cgtacacgtt cggagggggg 300
accaagctgg aaataa 316
<210> 295
<211> 342
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 295
caggttcagc tgcagcagtc tggaactgag ctgctgaggc ctggggcctc agtgaagata 60
tcctgcaagg ctactggcta cacattcagt agctactgga tggagtgggt aaagcagagg 120
cctggacatg gccttgagtg gattggagag attttacctg gaagtggtac tactcagtac 180
aatgagaagt tcaagggcaa ggccaccttc actgcagata catcctccaa cacagcctac 240
atgcatctca gcagcctgac atctgaggac tctgccgtct attactgtgc aagagggact 300
aactctctct ggggccaagg gactctggtc actgtctctg ca 342
<210> 296
<211> 304
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 296
caaattgttc tcacccagtc tccagcactc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgtcacctc aagtgtaagt tacatgtact ggtaccagca gaagcctaga 120
tcctccccca aaccctggat ttatctcaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagcgt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg aggaataacc cattcacgtt cggctcgggg 300
acaa 304
<210> 297
<211> 387
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 297
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcactcattt ggtgggatga tgtcaagcgc 180
tataatccag ccctgaagag tcgactgact atctccaagg atgcctccag cagccaggtc 240
ttcctcaaga tcgccagtgt ggacactgca gatactgcca catactactg tgctcgaata 300
gcttcctatg attacgacgt agtctatgct atggactact ggggtcaagg aacctcagtc 360
agcgtctcct caaggtggaa ataaaac 387
<210> 298
<211> 328
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 298
caggctgttg tgactcagga atctgcactc accacatcac ctggtgaaac agtcacactc 60
acttgtcgct caagtactgg ggctgttaca actagtaact atgccaactg gatccaagaa 120
aaaccagatc atttattcac tggtctaata ggtggtacca acaaccgagc tccaggtgtt 180
cctgccagat tctcaggctc cctgattgga gacaaggctg ccctcaccat cacaggggca 240
cagactgagg atgaggcaat atatttctgt ggtctatggt acagcaacca tttggtgttc 300
ggtggaggaa ccaaactgac tgtcctag 328
<210> 299
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 299
gaggtgcagc ttgttgagac tggtggagga ttggtgcagc ctaaagggtc attgaaactc 60
tcatgtgcag tctctgcatt caccttcact acctacgcca tgaactgggt ccgccaggct 120
ccaggaaagg gtttggagtg ggttgctcgc ataagaaata aaagtaataa ttatgcaaca 180
tattatgccg attcagtgaa agacaggttc accatctcca gagatgattc acaaagcatg 240
ctctatctgc aaatgaacaa cttgaaaatt gaggacacag ccatgtatta ctgtgtgttc 300
tactatgatt acgtctactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 300
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 300
gaaacaactg tgacccagtc tccagcattc ctgtccgtgg ctacaggaga aaaagtcact 60
atcagatgca taaccagcac tgatattgat gatgatatga actggtacca gcagaagcca 120
ggggaacctc ctaatgtcct tatttcagaa ggcaatactc ttcgtcctgg agtcccatcc 180
cgattctcca gcagtggcta tggcacagat tttgttttta caattgaaaa cacgctctca 240
gaagatgttg cagattacta ctgtttgcaa agtgataaca tgcctctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 301
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 301
caggtgcaac tgcagcagcc tggggctgag ctggtgaagc ctggggcctc agtgaagatg 60
tcctgcaagg cttctggcta cacatttacc aattacaata tgcactgggt aaagcagaca 120
cctggacagg gcctggaatg gattggggct atttttccag gaaatggtgg tacttcctac 180
aatcagaagt tcaaaggcaa ggccacattg actgcagaca aatcctccag cacagcctac 240
atgcagctca ccagtttgac atctggggac tctgcagtct attactgtgc aagatggggc 300
tacggtagtg gcctttatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 302
<211> 320
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 302
gaaaatgtac tcacccagtc tccagcaatc atgtctgcat ctctagggga gaaggtcacc 60
atgagctgca gggccagctc aagtgtaaat tacatgtcct ggtaccagca gaagtcagat 120
gcctccccca aactatggat ttattacaca tccaacctgg ctcctggagt cccagctcgc 180
ttcagtggca gtgggtctgg gaactcttat tctctcacaa tcagcagcat ggagggtgaa 240
gatgctgcca cttattactg ccagcagttt actagttccc cgtacacgtt cggagggggg 300
accaagctgg aaataaaacg 320
<210> 303
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 303
gaggtccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact agctatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactaagtac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccag cacagcctac 240
atggagctca gcagcctgac ctctgaggac tctgcggtct attactgtgc aagattgagg 300
tcgagggcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 304
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 304
gacatccaga tgacccagtc tccatcctcc ttatctgcct ctctgggaga gagagtcagt 60
ctcacttgtc gggcaagtca ggacattggt tatagcttaa actggcttca gcaggaacca 120
gatggaacta ttaaacgcct gatctacgcc acatccagtt tagattctgg tgtccccaaa 180
aggttcagtg gcagtaggtc tgggtcagat tattctctca ccatcagcag ccttgagtct 240
gaagattttg tagactatta ctgtctacaa tatgctagtt ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 305
<211> 369
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 305
caggtgcagc tgcagcagtc tggagctgag ctgatgaagc ctggggcctc agtgaagata 60
tcctgcaagg ctaatggcta cacattcagt agctactgga tagagtggtt aaggcagagg 120
cctggacatg gccttgagtg gattggagag attttacctg gaagtgataa tagtaattat 180
aatgagaagt tcaagggcaa ggccacattc actgcagata catcctccaa cacagcctac 240
atgcaactca gcagcctgac atctgaggaa tctgccgtct attactgtac aaggggatta 300
cgacgagacg gctcatatta ctatgttatg gaacattggg gtcaaggaac ctcagtcacc 360
gtctcctca 369
<210> 306
<211> 312
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 306
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctatttaa gctggttcca gcagaagcca 120
gggagatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggactat 240
gaagatatgg gaatttatta ttgtctacag tatgatgaat ttccattcac gttcggctcg 300
gggacaaagt tg 312
<210> 307
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 307
gaagtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcggt cgctatgtca tgtcttgggt tcgccagact 120
ccagaaaaga aactggagtg ggtcgcatcc attactagtg gtggtactac ctactatcca 180
gacagtgtga agggccgatt caccatctcc agagataatg ccaggaacat cctgtaccta 240
caaatgagca gtctgaggtc tgaggacacg gccatgtatt actgtgcaag agtctactat 300
cattacgacg acatctttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 308
<211> 338
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 308
gacattgtga tgtcacagtc tccatcctcc ctggctgtgt cagcaggaga gaaggtcact 60
atgagctgca aatccagtca gagtctgctc aacagtagaa cccgaaagaa ctacttggct 120
tggtaccagc agaaaccagg gcagtctcct aaactgctga tctactgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gcaagcaatc ttataatctt 300
tacacgttcg gaggggggac caagctgaaa ataaaacg 338
<210> 309
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 309
gaggtccagc tgcaacagtc tggacctgag ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaaga cttctggata cacattcact gaatacacca tgcactgggt gaagcagagc 120
catggaaaga gccttgagtg gattggaggt attaatccta acaatggtgg tactagctac 180
aaccagaagt tcaagggcaa ggccacattg actgtagaca agtcctccag cacagcctac 240
atggagctcc gcagcctgac atctgaggat tctgcagtct attactgtgc aaggggtccc 300
gcctggtttg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 310
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 310
gaaacaactg tgacccagtc tccagcatcc ctgtccatgg ctataggaga aaaagtcacc 60
atcagatgca taaccagcac tgatattgat gatgatatga tctggtacca gcagaagcca 120
ggggaacctc ctaagctcct tatttcagaa ggcaatactc ttcgtcctgg agtcccatcc 180
cgattctcca gcagtggcta tggtacagat tttgttttta caattgaaaa catgctctca 240
gaagatgttg ccgattacta ctgtttgaaa agggatgact tgccttacac gttcggcggg 300
gggacacagg tggaaattaa acg 323
<210> 311
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 311
gaggtccagc tgcaacagtc tggacctgag ctggtgaagc ctggaggttc aaagaagata 60
tcctgcaagg cttctggtta ctcattcact ggctacagta tgaactgggt gaagcagagc 120
catggaaaga accttgagtg gattggactt attaatcctt acagtggtgg tactatctac 180
aaccagaaat tcaagggcaa ggccacatta actgtagaca agtcatccag cacagcctac 240
atggagctcc tcagtctgac atctgaggac tctgcagtct attactgtgc aagaaggagt 300
gattacccgt tagtttactg gggccaaggg actctggtca ctgtctctgc a 351
<210> 312
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 312
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga acgggtcacc 60
ctgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
actcgcttca gtggcagtgg gtctgggacc tcttactctc tcagaatcag cagcatggag 240
gctgaagatg ctgccactta ttactgccac cagtataatc gttccccgct cacgttcggt 300
gctgggacca agctggagct gaaac 325
<210> 313
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 313
caggtgcagc tgaaggagtc aggacctgtc ctggtggcgc cctcacagag cctgtccatc 60
acttgcactg tctctgggtt ttcattaacc agctatggtg tacactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta atttgggctg gtggaagtac aaattataat 180
tcagctctca tgtccagact gagcatcagc aaagacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccaa acagggcaac 300
ttctatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 314
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 314
gacatccaga tgacacagtc tccatcctca ctgtctgcat ctctgggagg caaagtcacc 60
atcacttgca aggcaagcca agacattaag aagtatatag cttggtacca acacaagcct 120
ggaaaaggtc ctaggctact catacattac acatctacat tagagccagg catcccatca 180
aggttcagtg gaagtgggtc tgggagagat tattccttca gcatcagcaa cctggagcct 240
gaagatattg caacttatta ttgtctacaa tatgatattc tgtggacgtt cggtggaggc 300
accaagctgg aaatcaaac 319
<210> 315
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 315
gaggtccagc tgcaacagtc tggacctgag ctggtgaagc ctggagcttc aatgaagata 60
tcctgcaagg cttctggtta ctcattcact ggctacacca tgaactgggt gaagcagagc 120
catggaaaga accttgagtg gattggactt attaatcctt acaatggtgg tactacctac 180
aaccagaagt tcaagggcaa ggccacatta actgtagaca agtcatccag cacagcctac 240
atggagctcc tcagtctgac atctgaggac tctgcagtct attactgtgc attaggttac 300
tatggtaact acaggaggta cttcgatgtc tggggcgcag ggaccacggt caccgtctcc 360
tca 363
<210> 316
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 316
gaaaatgtgc tcacccagtc tccagcaata atggctgcct ctctggggca gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
tcaggcgctt cccccaaacc cttgattcat aggacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcgtggag 240
gctgaagatg atgcaactta ttactgccgg cagtggagtg gttacccgtg gacgttcggt 300
ggaggcacca agctggaaat caaac 325
<210> 317
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 317
caggttcagc tgcagcagtc tggggctgag ctggcaagac ctggggcttc agtgaagttg 60
tcctgcaagg cttctggcta cacctgtact agctactgga tgcagtgggt aaaacagagg 120
cctggacagg gtctggaatg gattggggct atttatcctg gagatggtga tactaggtac 180
actcagaagt tcaagggcaa ggccacattg actgcagata aatcctccag cacagcctac 240
atgcaactca gcagcttggc atctgaggac tctgcggtct attactgtgc aagggggagg 300
cggacggagg cctggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 318
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 318
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtga gtctgggacc tcttactctc tcacaatcag caacatggag 240
gctgaggatg ctgccactta ttactgccac cagtatcatc gttccccatt cacgttcggc 300
tcggggacaa agttggaaat aaaac 325
<210> 319
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 319
caggttactc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctggatt ttcactgagc acttctggta tgggcgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataacccag cccttaagag ccgactgact atctccaagg atgcctccag cagccaggta 240
ttcctcaaga tcgccagtgt ggacactgca gaaactgcca catactactg tgcccacatc 300
ctcgaccggg cttactactt tgactactgg ggccaaggca ccactctcac agtcacctca 360
<210> 320
<211> 334
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 320
gacattgtgc tgacacagtc tcctgcttcc ttagctgtat ctctggggca gagggccacc 60
atctcatgca gggccagcaa aagtgtcagt acatctggct atagttatat gcactggtac 120
caacagaaac caggacagcc acccaaactc ctcatctatc ttgcatccaa cctagaatct 180
ggggtccctg ccaggttcag tggcagtggg tctgggacag acttcaccct caacatccat 240
cctgtggagg aggaggatgc tgcaacctat tactgtcagc acagtaggga gcttcctctc 300
acgttcggtg ctgggaccaa gctggagctg aaac 334
<210> 321
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 321
caagttactc taaaagagtc tggccctggg atattgaagc cctcacagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtatagg ctggattcgt 120
cagccttcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgataagtac 180
tataacccat ccctgaagag ccagctcaca atctccaagg attcctccag aaaccaggtt 240
ttcctcaaga tcaccagtgt ggacactgca gatactgcca cttactactg tgctcgaaga 300
gggactgcgt actactttga ctactggggc caaggcacca ctctcacagt ctcctca 357
<210> 322
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 322
caaattgttc tctcccagtc tccagcaatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagttc aagtgtaagt tacattcact ggtaccggca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agcagtaatc cacccacgtt cggtgctggg 300
accaagctgg agctgaaac 319
<210> 323
<211> 345
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 323
caggtgcagc tgaaggagtc aggacctgac cttgtgcagc cctcacagac cctgtctctc 60
acctgcactg tctctgggtt ctcattaacc ttctatggtg ttcactgggt tcgccagcct 120
ccaggaaagg gactggagtg ggtgggaaca atgggctggg atgacaaaaa atattataat 180
tcagctctaa aatctcgact gagcatcagc agggatacct ccaagaacca ggttttctta 240
aaactgagca gtctgcaaac tgaagacaca gccatgtact actgtactag aggtgggacg 300
gggtttgact actggggcca aggcaccact ctcacagtct cctca 345
<210> 324
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 324
gacattgtga tgacccagtc gcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgggt actgctgtag cctggtatca acagaaacca 120
gggcaatctc ctaaactact gatttactgg gcatccatcc ggcacactgg agtccctgat 180
cgcttcacag gcagtggatc tgggacagat ttcactctca ccattagcaa tgtgcagtct 240
gaagacttgg cagattattt ctgtcagcaa tatagcagct atccgctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 325
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 325
caggtccaac tgcagcagcc tggggctgag cttgtgaagc ctggggcttc agtgaagctg 60
tcctgcaagg cttctggcta caccttcacc agctactgga tgcactgggt gaagcagagg 120
cctggacaag gccttgagtg gattggagtg attaatccta gcaacggtcg tactaactac 180
aatgagaagt tcaagagcaa ggccacactg actgtagaca aatcctccag cacagcctac 240
atgcaactca gcagcctgac atctgaggac tctgcggtct attactgtgc aagaagaagg 300
gaactgggaa ccctctatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 326
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 326
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 327
<211> 345
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 327
caggtgcaac tgaagcagtc aggacctggc ctggtggcgc cctcacagag cctgttcatc 60
acatgcaccg tctcagggtt ctcattaacc agctatgaaa taaactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagtg atatggactg gtggaagcac aaattataat 180
tcagctctca tatccagact gagcatcagc aaagacaact ccaagagcct agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatatatt actgtgtaag aggtgtttat 300
gctatggact actggggtca aggaacctca gtcaccgtct cctca 345
<210> 328
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 328
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgaat actgctgtag gctggtatca acagaaacca 120
ggacaatctc ctaaactact gatttactcg gcatcctacc ggtacactgg agtccctgat 180
cgcttcactg gcagtggatc tgggacggat ttcactttca ccatcagcag tgtgcaggct 240
gaagacctgg cagtttatta ctgtcagcaa cattatagta gtccgtacac gttcggaggg 300
gggaccaagg tggaaataaa acg 323
<210> 329
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 329
gaggtccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact aactatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactaaatac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccac cacagcctac 240
atggcgctca gcagcctgac ctctgaggac tctgcggtct attactgtgc agtagcctac 300
tatagtaact gggggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 330
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 330
gacatccaga tgactcagtc tccagcctcc ctatctgcat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtga gaatatttac agttatttag catggtatca gcagaaacag 120
ggaaaatctc ctcagctcct ggtctataat gcaaaaacct tagcagaagg tgtgccatca 180
aggttcagtg gcagtagatc aggctcacag ttttctctga agatcaacag cctgcagcct 240
gaagattttg ggagttatta ctgtcaacat cattatggta ctccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 331
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 331
caggttcagc tggaggagtc aggggctgag ctggcaagac ctggggcttc agtgaagttg 60
tcctgcaagg cttctggcta tagctactgg atgcagtgga taaaacagag gcctggacag 120
ggtctggaat ggattggggc tatttatcct ggaaatggtg atactaggta cactcagaag 180
ttcaagggca aggccacatt gactgcagat aaatcctcca gcacagccta catgcaactc 240
agcagcttgg catctgagga ctctgcggtc tattactgtg caagatctcc ggcctactat 300
aggtacggcg agggctactt tgactactgg ggccaaggca ccactctcac agtctcctca 360
<210> 332
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 332
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgtact ggtaccagca gaagccagga 120
tcctccccca gactcctgat ttatgacaca tccaacctgg cttctggagt ccctgttcgc 180
ttcagtggca gtgggtctgg gacctctttc tctctcacaa tcagccgaat ggaggctgaa 240
gatactgcca cttattactg ccaggagtgg agtggtaatc cgctcacgtt cggtgatggg 300
accaagctgg agctgaaac 319
<210> 333
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 333
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctgggta taccttcaca aactatggaa tgaactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacacct acactggaga gccagcatat 180
gctgatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cgctgcctat 240
ttgcagatca acaacctcaa aaatgaggac acggctactt ttttctgtgc aaatatgagg 300
cccacgaggg ggtttgctta ctgggggcaa gggactctgg gcactgtctc tgca 354
<210> 334
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 334
aatattgtga tgacccagac tcccaaattc ctgcttgtat cagcaggaga cagggttacc 60
ataacctgca aggccagtca gagtgtgagt aatgatgtag cttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatactat gcatccaatc gctacactgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattatagct ctcctccgac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 335
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 335
gaggtccagc tgcagcagtc tggacctggg ctagtgagga ctggggcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcact ggttactaca tgcactgggt caagcagagc 120
catggaaaga gccttgagtg gattggatat attagttgtt acaatggtgc tactacctac 180
aaccagaact tcaagggcaa ggccacattt attgtagaca catcctccag cacagcctac 240
atgcagttca acagcctgac atctgaggac tctgcggtct attactgtgc aagatccgac 300
ggggggcatg ctatggacta ctggggtcaa ggaacctcag tcaccgtctc ctca 354
<210> 336
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 336
gacatccaga tgactcagtc tccagcctcc ctggctgcat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtga gaacatttac tacagtttag catggtatca gcagaagcaa 120
gggaaatctc ctcagctcct gatctataat gcaaacagct tggaagatgg tgtcccatcg 180
aggttcagtg gcagtggatc tgggacacag tattctatga agatcaacag catgcagcct 240
gaagataccg caacttattt ctgtaagcag acttatgacg ttccgctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 337
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 337
gaggttcagc tgcagcagtc tggacctgag ctggagaagc ctggcgcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcact ggctacaaca tgaactgggt gaagcagagc 120
aatggaaaga gccttgagtg gattggaaat attgatcctt attatggtgg ttctagctac 180
aaacagaagt tcgagggcaa ggccacattg actgtagaca aatcctccag cacagcctac 240
atgcagctca agagcctgac atctgaggac tctgcagtct attactgtgc aagaggtggt 300
agtaacttct ttgactactg gggccaaggc accactctca cagtctcctc a 351
<210> 338
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 338
gatgttgtga tgacccagac tccactcact ttgtcggtta ccattggaca accagcctcc 60
atctcttgca agtcaagtca gagcctctta gatagtgatg gaacgacata tttgaattgg 120
ttgttacaga ggccaggcca gtctccaaag cgcctaatct atctggtgtc taaactggac 180
tctggagtcc ctgacaggtt cactggcagt ggatcaggga cagatttcac actgaaaatc 240
agcagagtgg aggctgagga tttgggagtt tattattgct ggcaaggtac acattttccg 300
ctcacgttcg gtgctgggac caagctggag ctgaaac 337
<210> 339
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 339
gacgtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatacca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcaacc attagtagtg gtggtagtta cccctactat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtac aagagatgtc 300
tatgatggtt actcctactg gggccaaggc accactctca cagtctcctc a 351
<210> 340
<211> 320
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 340
caaattgttc tctcccagtc tccagcaatc ctgtctgcat ctccagggga gaaggtcaca 60
atgacttgca gggccagctc aagtgtaagt tacatgcact ggtaccagca gaagccagga 120
tcctccccca aaccctggat ttatgccaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagcagagt ggaggctgaa 240
gatgctgcca cttattactg ccagcagtgg agtagtaacc catacacgtt cggagggggg 300
accaagctgg aaataaaacg 320
<210> 341
<211> 369
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 341
gaggttcagc tgcagcagtc tggggcagaa cttgtgaagc caggggcctc agtcaaattg 60
tcctgcacag cttctggctt caacattaaa gacacctata tacactgggt gaaacagagg 120
cctgaacagg gcctggagtg gattggaagg attgatcctg cgaatggtaa tactaaatat 180
gacccgaagt tccagggcaa ggccactata acaccagaca catcctccaa cacagcctac 240
ctgcagctca gcagcctgac atctgaggac actgccgtct attactgtgc tagaagctgg 300
cgaaactacg gtagtagttt ctggtacttc gatgtctggg gcgcagggac cacggtcacc 360
gtctcctca 369
<210> 342
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 342
gatgttgtga tgacccagac tccactcact ttgtcggtta ccattggaca accagcctcc 60
atctcttgca agtcaagtca gagcctctta gatagtgatg gaacgacata tttgaattgg 120
ttgttacaga ggccaggcca gtctccaaag cgcctaatct atctggtgtc taaactggac 180
tctggagtcc ctgacaggtt cactggcagt ggatcaggga cagatttcac actgaaaatc 240
agcagagtgg aggctgagga tttgggagtt tattattgct ggcaaggtac acattttccg 300
ctcacgttcg gtgctgggac caagctggag ctgaaac 337
<210> 343
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 343
gacgtgaagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatacca tgtcttgggt tcgccagact 120
ccggagaaga ggctggagtg ggtcgcaacc attagtagtg gtggtagtta cccctactat 180
ccagacagtg tgaagggccg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtac aagagatgtc 300
tatgatggtt actcctactg gggccaaggc accactctca cagtctcctc a 351
<210> 344
<211> 334
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 344
gacattgtga tgacacagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca cgtccagtca gagtctgtta accagtggaa atcaaaagaa ctacttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tctactgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg gaacagattt cactctcacc 240
atcagcagtt tgcaggctga agacctggca gtttattact gtcagaatga ttatagtctc 300
acgttcggtg ctgggaccaa gctggagctg aaac 334
<210> 345
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 345
caggtgcagc tgaagcagtc aggacctggc cgagtgcagc cctcacagag cctgtccatc 60
acctgcacag tctctggttt ttcattaact agcaatggtg tacactgggt tcgccagtct 120
ccaggaaagg gtctggagtg gctgggagtg ctatggagtg gtggaagcac agactataat 180
gcagctttca tatccagact gagcatcagc aaggacaatt acaagagcca agttttcttt 240
aaaatgaaca gtctgcaagc taatgacaca gccatatatt actgtgccag aaataataat 300
aggtacggag ctatggacta ctggggtcaa ggaacctcag tcaccgtctc ctca 354
<210> 346
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 346
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgtcagtca gaacattaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc ctaaactatt gatccaaaag gcttccaact tgcacacagg cgtcccctca 180
aggtttagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttacta ctgtcaacag ggtcaaagtt atccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 347
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 347
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acttgcactg tctctgggtt ttcattaacc aactatggtg tacactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta atatgggctg gtggaatcac aaattataat 180
tcggctctca tgtccagact gagcatcagc gaagacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccag aaatttaggt 300
ccctatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 348
<211> 335
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 348
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atctcctgca aggccagcca aagtgttgat tatgatggtg atagttattt gacctggtac 120
caacagaaac caggacagcc acccaaactc ctcatctatg ctgcatccaa tctagaatct 180
gggatcccag ccaggtttag tggcagtggg tctgggacag acttcaccct caacatccat 240
cctgtggagg aggaggacgc tgcaacctat tactgtcagc aaagtaatga ggatccgtac 300
acgttcggag gggggaccaa gctggaaata aaacg 335
<210> 349
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 349
gaggtccagc tgcagcagtc tggacctgac ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcact ggctactaca tgcactgggt gaagcagagc 120
catggaaaga gccttgagtg gattggacgt gttaatccta acaatggtgg tactagctac 180
aaccagaagt tcaagggcaa ggccatatta actgcagaca agtcatccag cacagcctac 240
atggagctcc gcagcctgac atctgaggac tctgcggtct attactgtgc aagagggagt 300
tatgattacg ccgagggctg gggccaaggg actctggtca ctgtctctgc a 351
<210> 350
<211> 341
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 350
gacattgtga tgtcacagtc tccatcctcc ctagctgtgt cagttggaga gaaggttact 60
atgagctgca agtccagtca gagcctttta tatagtagca ctcaaaagaa ctacttggcc 120
tggtaccagc agaaaccagg gcagtctcct aaactgctga tttactgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactctcacc 240
atcagcagtg tgaaggctga agacctggca gtttattact gtcagcaata ttatagctat 300
ccgtacacgt tcggaggggg gaccaagctg gaaataaaac g 341
<210> 351
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 351
gagatccagc tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaaggta 60
tcctgcaagg cttctggtta tgcattcact agctacaaca tgtactgggt gatgcagagc 120
catggaaaga gccttgagtg gattggatat gttgatcctt acaatggtgg tactagctac 180
aaccagaagt tcaagggcaa ggccacattg actgttgaca agtcctccag cacagcctac 240
atgcatctca acagcctgac atctgaggac tctgcagtct attactgtgc aagagaaaac 300
tataggtact ttgactactg gggccaaggc accactctca cagtctcctc a 351
<210> 352
<211> 316
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 352
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
ataacctgca gtgccagctc aagtgtaagt tacatgcact ggttccagca gaagccaggc 120
acttctccca aactctggat ttatagcaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtggatctgg gacctcttac tctctcacaa tcagccgaat ggaggctgaa 240
gatgctgcca cttattactg ccagcaaagg agtagttacc cacccacgtt cggagggggg 300
accaagctgg aaataa 316
<210> 353
<211> 372
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 353
gaggtgcagc ttgttgagtc tggtggagga ttggtgcagc ctaaagggtc attgaaactc 60
tcatgtgcag cctctggatt caccttcaat acctacgcca tgaactgggt ccgccaggct 120
ccaggaaagg gtttggaatg ggttgctcgc ataagaatta aaagtaataa ttatgcaaca 180
tattatgccg attcagtaaa agacaggttc accatctcca gagatgattc acaaaacatg 240
ctctatctgc aaatgaacaa cttgaaaact gaggacacag ccgtgtatta ctgtgtgaga 300
caaggctata gttacgactg gggaccctgg tttgcttact ggggccaagg gactctggtc 360
actgtctctg ca 372
<210> 354
<211> 320
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 354
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
ataacctgca gtgccagctc aagtgtaagt tacatgcact ggttccagca gaagccaggc 120
acttctccca aactctggat ttatagcaca tccaacctgg cttctggagt ccctgctcgc 180
ttcagtggca gtggatctgg gacctcttac tctctcacaa tcagccgaat ggaggctgaa 240
gatgctgcca cttattactg ccagcaaagg agtagttacc cacccacgtt cggagggggg 300
accaagctgg aaataaaacg 320
<210> 355
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 355
gaagtgcagc tggtggagtc tgggggaggc ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt gactattaca tgttttgggt tcgccagact 120
ccggaaaaga ggctggagtg ggtcgcaacc attagtgatg gtggtagtta cacctacttt 180
ccagacagtg tgaaggggcg attcaccatc tccagagaca atgcccagaa caacctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtgc aagagccggg 300
accctctatg ctatggacta ctggggtcaa ggaacctcag tcaccgtctc ctca 354
<210> 356
<211> 325
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 356
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga acgggtcacc 60
atgacctgca ctgccagctc aagtgtaagt tccagttact tgcactggta ccagcagaag 120
ccaggatcct cccccaaact ctggatttat agcacatcca acctggcttc tggagtccca 180
gctcgcttca gtggcagtgg gtctgggacc tcttactctc tcacaatcag cagcatggag 240
actgaagatg ctgccactta ttactgccac cagtatcatc gttccccctt cacgttcggc 300
tcggggacaa agttggaaat aaaac 325
<210> 357
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 357
caggttgctc tgaaagagtc tggccctggg atattgcagc cctcccagac cctcagtctg 60
acttgttctt tctctgggtt ttcactgagc acttctggta tgggtgtagg ctggattcgt 120
cagccatcag ggaagggtct ggagtggctg gcacacattt ggtgggatga tgtcaagcgc 180
tataacccag ccctgaagag ccgactgact atctccaagg atacctccag cagccaggta 240
ttcctcaaga tcgccagtgt ggacactgca gatactgcca catactactg tgctcgaatg 300
gaggactacg gtagtagctc ctactttgac ttctggggcc acggcaccac tctcacagtc 360
tcctca 366
<210> 358
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 358
gacattcaga tgacccagtc tcctgcctcc cagtctgcat ctctgggaga aagtgtcacc 60
atcacatgcc tggcaagtca gaccattggt acatggttag catggtatca gcagaaacca 120
gggaaatctc ctcagctcct gatttctgct gcaaccagct tggcagatgg ggtcccatca 180
aggttcagtg gtagtggatc tggcacaaaa ttttctttca agatcagcag cctacaggct 240
gaagattttg taagttatta ctgtcaacaa ctttacagta ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 359
<211> 369
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 359
gaggtccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact agctatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactaagtac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccag cacagcctac 240
atggagctca gcagcctgac ctctgaggac tctgcggtct attactgtgc aagaggggct 300
ctctactatg gtaactacct cgggtacttc gatgtctggg gcgcagggac cacggtcacc 360
gtctcctca 369
<210> 360
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 360
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgccagtca gaacattaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc ctaaactatt gatctataag gcttccatct tacacacagg cgtcccatca 180
aggtttagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttactc ctgtcaacag ggtcaaagtt atccgtacac gttcggaggg 300
gggaccaagc tggaaataaa a 321
<210> 361
<211> 355
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 361
tctgatgtgc agcttcagga gtcaggacct gacctggtga aaccttctca gtcactttca 60
ctcacctgca ctgtcactgg ctactccatc accagtggtt atagctggca ctggatccgg 120
cagtttccag gaaacaaact ggaatggatg ggctacatac actacagtgg tagcactaac 180
tacaacccat ctctcaaaag tcgaatctct atcactcgag acacatccaa gaaccagttc 240
ttcctgcagt tcaaatctgt gactactgaa gactcagcca catattactg tgccctagag 300
gggaattacg acgggtttgc ttactggggc caagggactc tggtcactgt ctctg 355
<210> 362
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 362
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgccagtca gaacataaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc ctaaactatt gatctataag gcttccaact tgcacacagg cgtcccatca 180
aggtttagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttacta ctgtcaacag ggtcaaagtt atccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 363
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 363
caggtgcaga tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acttgcactg tctctgggtc ttcattaacc aactatggtg tacactgggt tcgccagcct 120
ccaggaaagg gtctagagtg gctgggagta atatgggctg gtggaagcac aaattataat 180
tcggctctca tgtccagact gagtatcagc aaagacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccag agactgggag 300
ggctggtttg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 364
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 364
gacattcaga tgacccagtc tcctgcctcc cagtctgcat ctctgggaga aagtgtcacc 60
atcacatgcc tggcaagtca gaccattggt acatggttag catggtatca gcagaaacca 120
gggaaatctc ctcagctcct gatttatgct gcaaccagct tggcagatgg ggtcccatca 180
aggttcagtg gtagtggatc tggcacaaaa ttttctttca agatcagcag cctacaggct 240
gaagattttg taagttatta ctgtcaacaa ctttacagta ctccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 365
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 365
caggtgcagc taaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acatgcactg tctcagggtt ctcattaacc gactatggtg taagctggat tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta atatggggtg gtggaagcac atactataat 180
tcagctctca aatccagact gagcatcagc aaggacaact ccaagagcca agttttctta 240
gaactgaaca gtctgcaaac tgatgacaca gccatttact actgtgccaa acattatggt 300
cactacgctg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 366
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 366
gacatccagt tgactcagtc tccagcctcc ctatctgcat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtgg gagtattcac aattatttag catggtatca gcagaaacag 120
ggaaagtctc ctcagctcct ggtctataat gcaaaaacct tagtagatgg tgtgccatca 180
aggttcagtg gcagtggatc aggaacacaa tattctctca agatcaacag cctgcagcct 240
gaagattttg ggtattatta ctgtcaacat ttttggacta ctccgtggac attcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 367
<211> 360
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 367
gaggtccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact agctatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactgagtac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccag cacagcctac 240
atggagctca gcagcctgac ctctgaggac tctgcggtct attactgtgc aagaggggtc 300
tatgatggtt actcttactt tgactactgg ggccaaggca ccactctcac agtctcctca 360
<210> 368
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 368
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgtcagtca gaacattaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc ctaaactatt gatccaaaag gcttccaact tgcacacagg cgtcccctca 180
aggtttagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttacta ctgtcaacag ggtcaaagtt atccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 369
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 369
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acttgcactg tctctgggtt ttcattaacc aactatggtg tacactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta atatgggctg gtggaatcac aaattataat 180
tcggctctca tgtccagact gagcatcagc gaagacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccag aaatttaggt 300
ccctatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 370
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 370
gacattcaga tgacccagtc tcctgcctcc cagtctgcat ctctgggaga aagtgtcacc 60
atcacatgcc tggcaagtca gaccattggt acatggttag catggtatca gcagaaacca 120
gggaaatctc ctcagctcct gatttatgct gcaaccagct tggcagatgg ggtcccatca 180
aggttcagtg gtagtggatc tggcacaaaa ttttctttca agatcagcag cctacaggct 240
gaagattttg taagttatta ctgtcaacaa ctttacagta ctccgtggac gttcggtgga 300
ggcaccaagc tggagatcaa ac 322
<210> 371
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 371
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acatgcactg tctcagggtt ctcattaacc gactatggtg taagctggat tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta gtatggggtg gtggaagcac atactataat 180
tccgctctca aatccagact gagcatcacc aaggacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccaa acagaggggt 300
cagtacgggg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 372
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 372
agtattgtga tgacccagac tcccaaattc ctgcttgttt cagcaggaga cagggttacc 60
ataacctgca aggccagtca gagtgtgagt aatgatgtag cttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatactgt gcatccaatc gctacactgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattatagct ctccgctcac gttcggtgct 300
gggaccaagc tggagctgaa ac 322
<210> 373
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 373
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acctgcacag tctctggttt ctcattaacc aactatgctg tacactgggt tcgccagtct 120
ccaggaaagg gtctggagtg gctgggagtg atatggagtg atggaagcac agactataat 180
gcagctttca tatctagact gagcatcagc aaggacaact ccaagagcca agttttcttt 240
aagatgaaca gtctgcaagc tgatgacaca gccatgtact actgtgcccg aaagaaagga 300
ggatggtttc cctggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 374
<211> 335
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 374
gacattgtgc tgacccaatc tccagcttct ttggctgtgt ctctagggca gagggccacc 60
atctcctgca aggccagcca aagtgttgat catgctggtg atagttatat gaactggtac 120
caacagaaac caggacagcc acccaaactc ctcatctatg ctgcatccaa tctagaatct 180
gggatcccag ccaggtttag tggcagtggg tctgggacag acttcaccct caacatccat 240
cctgtggagg aggaggatgc tgcaacctat tactgtcagc aaagtaatga ggatccgtac 300
acgttcggag gggggaccaa gctggaaatc aaacg 335
<210> 375
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 375
gaggtccagc tgcagcagtc tggacctgac ctggtgaagc ctggggcttc agtgaagata 60
tcctgcaagg cttctggtta ctcattcact ggctactaca tgcactgggt gaagcagagc 120
catggaaaga ggcttgagtg gattggacgt gttaatccta acaatggtgg tactaactac 180
aaccagaaat tcaagggcaa ggccatatta actgtagaca agtcatccag cacagcctac 240
atggagctcc gcagcctgac atctgaggac tctgcggtct attactgtgc aagagggagt 300
tatgataacg ccgagggctg gggccaaggg actctggtca ctgtctctgc a 351
<210> 376
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 376
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat aggtatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 377
<211> 363
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 377
caggtccagt tgcagcagtc tggagctgag ctggtaaggc ctgggacttc agtgaaggtg 60
tcctgcaagg cttctggata cgccttcact aattacttga tagagtgggt aaagcagagg 120
cctggacagg gccttgagtg gattggggtg attaatcctg gaagtggtgg tactaactcc 180
aatgagaagt tcaaggccaa ggcaacactg actgcagaca aatcctccag cactgcctac 240
atgcagctca gcagcctgac atctgctgac tctgcggtct atttctgtgc aagatcggac 300
tatgattacg ccttctatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 360
tca 363
<210> 378
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 378
gacatccaga tgactcagtc tccagcctcc ctatctgcat ctgtgggaga aactgtcacc 60
atcacatgtc gagcaagtgg gaatattcac aattatttag catggtatca gcagaaacag 120
ggaaaatctc ctcacctcct ggtctataat gcaaaaacct tagcagatgg tgtgccatca 180
aggttcagtg gcagtggatc aggaacacaa tattctctca agatcaacag cctgcagcct 240
gaagattttg ggagttatta ctgtcaacat ttttggagta ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 379
<211> 366
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 379
gagttccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact agctatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactaagtac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccag cacagcctac 240
atggagctca gcagcctgac ctctgaggac tctgcggtct attactgtgc aagagacagg 300
tcgggctacg aagattacta tggtatggac tactggggtc aaggaacctc agtcaccgtc 360
tcctca 366
<210> 380
<211> 318
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 380
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctctagggga ggagatcacc 60
ctaacctgca gtgccagctc gagtgtaagt tacatgcact ggtaccagca gaagtcaggc 120
acttctccca aactcttgat ttatagcaca tccaacctgg cttctggagt cccttctcgc 180
ttcagtggca gtgggtctgg gaccttttat tctctcacaa tcagcagtgt ggaggctgaa 240
gatgctgccg attattactg ccatcagtgg agtagttatc acacgttcgg aggggggacc 300
aagctggaaa taaaacgg 318
<210> 381
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 381
gaggtgcagc tggtggagtc tgggggagac ttagtgaagc ctggagggtc cctgaaactc 60
tcctgtgcag cctctggatt cactttcagt agctatggca tgtcttgggt tcgccagact 120
ccagacaaga ggctggagtg ggtcgcaacc attagtagtg gtggtagtta cacctactat 180
ccagacagtg tgaaggggcg attcaccatc tccagagaca atgccaagaa caccctgtac 240
ctgcaaatga gcagtctgaa gtctgaggac acagccatgt attactgtgc aagacgaaga 300
gccgatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 382
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 382
gacattcaga tgacccagtc tcctgcctcc cagtctgcat ctctgggaga aagtgtcacc 60
atcacatgcc tggcaagtca gaccattggt acatggttag catggtatca gcagaaacca 120
gggaaatctc ctcagctcct gatttattct gcaaccagct tggcagatgg ggtcccatca 180
aggttcagtg gtagtggatc tggcacaaaa ttttctttca agatcagcag cctacaggct 240
gaagattttg taagttatta ctgtcaacaa ctttacagta ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 383
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 383
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acatgcactg tctcagggtt ctcattaacc gactatggtg taagctggat tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagta gtatggggtg gtggaagcac atactataat 180
tccgctctca aatccagact gagcatcagc aaggacaact ccaagagcca agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccaa acagaggggt 300
cagtacgggg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 384
<211> 321
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 384
gacattgtga tgacccagtc tcacaaattc atgtccacat cagtaggaga cagggtcagc 60
atcacctgca aggccagtca ggatgtgaat actgctgtag gctggtatca acagaaacca 120
ggacaatctc ctaaactact gatttactcg gcatcctacc ggtacactgg agtccctgat 180
cgcttcactg gcagtggatc tgggacggat ttcactttca ccatcagcag tgtgcaggct 240
gaagacctgg cagtttatta ctgtcagcaa cattatagta gtccgtacac gttcggaggg 300
gggaccaagc tggaaattaa a 321
<210> 385
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 385
gaggtccagc tgcagcagtc tggacctgag ctggtaaagc ctggggcttc agtgaagatg 60
tcctgcaagg cttctggata cacattcact aactatgtta tgcactgggt gaagcagaag 120
cctgggcagg gccttgagtg gattggatat attaatcctt acaatgatgg tactaaatac 180
aatgagaagt tcaaaggcaa ggccacactg acttcagaca aatcctccac cacagcctac 240
atggcgctca gcagcctgac ctctgaggac tctgcggtct attactgtgc agtagcctac 300
tatagtaact gggggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 386
<211> 335
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 386
gacattgtgc tgacacagtc tcttgcttcc ttagctgtat ctctggggca gagggccacc 60
atctcatgca gggccagcaa aagtgtcagt acatctggct atagttatat gcactggtac 120
caacagaaac caggacagcc acccaaactc ctcatttatc ttgcatcctc ggagggggga 180
ccaagctgga aataaagcga acctagaatc tggggtccct gccaggttca gtggcagtgg 240
gtctgggaca gacttcaccc tcaacatcca tcctgtggaa gacgaagatg ctgcaaccta 300
ttactgtcag cacagtaggg agcttccgtt cacgt 335
<210> 387
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 387
caggtccaac tgcagcagtc tgggcctgag ctggtgaggc ctggggcttc agtgaagatg 60
tcctgcaagg cttcaggcta taccttcacc agctactgga tgcactgggt gaaacagagg 120
cctggacaag gccttgagtg gattggcatg attgatcctt ccaatagtga aactaggtta 180
aatcagaagt tcaaggacaa ggccacattg aatgtagaca aatcctccaa cacagcctac 240
atgcagctca gcagcctgac atctgaggac tctgcagtct attactgtgc agtaatggac 300
tactactttg actactgggg ccaaggcacc actctcacag tctcctca 348
<210> 388
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 388
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat agctatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccattcac gttcggctcg 300
gggacaaagt tggaaataaa ac 322
<210> 389
<211> 345
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 389
caggtgcaac tgaagcagtc aggacctggc ctggtggcgc cctcacagag cctgttcatc 60
acatgcaccg tctcagggtt ctcattaacc agctatgaaa taaactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagtg atatggactg gtggaagcac aaattataat 180
tcagctctca tatccagact gagcatcagc aaagacaact ccaagagcct agttttctta 240
aaaatgaaca gtctgcaaac tgatgacaca gccatatatt actgtgtaag aggtgtttat 300
gctatggact actggggtca aggaacctca gtcaccgtct cctca 345
<210> 390
<211> 323
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 390
gacatcaaga tgacccagtc tccatcttcc atgtatgcat ctctaggaga gagagtcact 60
atcacttgca aggcgagtca ggacattaat aattatttaa gctggttcca gcagaaacca 120
gggaaatctc ctaagaccct gatctatcgt gcaaacagat tggtagatgg ggtcccatca 180
aggttcagtg gcagtggatc tgggcaagat tattctctca ccatcagcag cctggagtat 240
gaagatatgg gaatttatta ttgtctacag tatgatgagt ttccgtacac gttcggaggg 300
gggaccaagc tggaaataaa acg 323
<210> 391
<211> 333
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 391
gaggtccagc ttcagcagtc aggacctgag ctggtgaaac ctggggcctc agtgaagata 60
tcctgcaagg cttctggata cacattcact gactacaaca tgcactgggt gaagcagagc 120
catggaaaga gccttgagtg gattggattc ttttatcctt acaacggtaa tactgtctac 180
agccagaagt tcaagagcaa ggccacattg actgtagaca attcctccag cacagcctac 240
atggagctcc gcagcctgac atctgaggac tctgcagtct attactgtgc aagacttaac 300
tgggagggct actggggcca aggcaccacc ctc 333
<210> 392
<211> 337
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 392
gatgttttga tgacccaaac tccactctcc ctgcctgtca gtcttggaga tcaagcctcc 60
atctcttgca gatctagtca gagcattgta catagtaatg gaaacaccta tttagaatgg 120
tacctgcaga aaccaggcca gtctccaaag ctcctgatct acaaagtttc caaccgattt 180
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaagatc 240
agcagagtgg aggctgagga tctgggagtt tattactgct ttcaaggttc acatgttccg 300
ctcacgttcg gtgctgggac caagctggag ctgaaac 337
<210> 393
<211> 357
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 393
caggtccagc tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaggata 60
tcctgcaagg cttctggcta caccttcaca agctactata tacactgggt gaagcagagg 120
cctggacagg gacttgagtg gattggatgg atttatcctg gaaatggtaa tactaagtac 180
aatgagaagt tcaagggcaa ggccacactg actgcagaca aatcctccag cacagcctac 240
atgcagatca gcagcctgac ctctgaggac tctgcggtct atttctgtgc aagagagaga 300
tggttactac tatggtttgc ttactggggc caagggactc tggtcactgt ctctgca 357
<210> 394
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 394
agtattgtga tgacccagac tcccaaattc ctgcttgtat cagcaggaga cagggttacc 60
ataacctgca aggccagtca gagtgtgagt aatgatgtag gttggtacca acagaagcca 120
gggcagtctc ctaaactgct gatatactat gcatccaatc gctacaatgg agtccctgat 180
cgcttcactg gcagtggata tgggacggat ttcactttca ccatcagcac tgtgcaggct 240
gaagacctgg cagtttattt ctgtcagcag gattatagct ctccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 395
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 395
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctgggta taccttcaca aactatggaa tgaactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg ggtgggctgg ataaacacct acactggaga gccaacatat 180
gctgatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctat 240
ttgcagatcg acaacctcaa aaatgaggac acggctacat atttctgtgc aagagtgggg 300
gattacgtcg gctttgacta ctggggccaa ggcaccactc tcacagtctc ctca 354
<210> 396
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 396
gatatccaga tgacacagac tgcatcctcc ctgtctgcct ctctgggaga cagagtcacc 60
atcagttgca gggcaagtca ggacattaac aattatttaa actggtatca gcagaaacca 120
gatggaactg ttaaactcct gatctactac acatcaagat tacactcagg agtcccatca 180
aggttcagtg gcagtgggtc tggaacagat tattctctca ccattagcat cctggaacaa 240
gaagatattg ccacttactt ttgccaacag ggtgatacgc ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 397
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 397
cagatccagt tggtgcagtc tggacctgag ctgacgaagc ctggagagac agtcaagatc 60
tcctgcaagg cctctggata taccttcaca gactattcat tgcactgggt gaagcaggct 120
ctaggaaagg gtttaaagtg gatgggctgg ataaacactg agactggtga gccagcatat 180
gcagatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag cactgcctat 240
ttgcagatca acgacctcaa aaatgaggac acgactacat atttctgtgg tatttacgac 300
gggtatgcta tggactactg gggtcaagga acctcagtca ccgtctcctc a 351
<210> 398
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 398
caaattgttc tcacccagtc tccagcaatc atgtctgcat ctccagggga gaaggtcacc 60
atgacctgca gtgccagctc aagtgtaagt tacatgtact ggtaccagca gaagccagga 120
tcctccccca gactcctgat ttatgacaca tccaacctgg cttctggagt ccctgttcgc 180
ttcagtggca gtgggtctgg gacctcttac tctctcacaa tcagccgaat ggaggctgaa 240
gatactgcca cttattattg ccaggagtgg agtaataatc cgctcacgtt cggtgatggg 300
accaagctgg agctgaaac 319
<210> 399
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 399
cagatccagt tggtgcagtc tggacctgag ctgaagaagc ctggagagac agtcaagatc 60
tcctgcaagg cttctgggta taccctcaca aactatggaa tgaactgggt gaagcaggct 120
ccaggaaagg gtttaaagtg gatgggctgg ataaacacct acactggaga gccaacatat 180
gctgatgact tcaagggacg gtttgccttc tctttggaaa cctctgccag gattgtctat 240
ttgcagatca acaacctcaa aaatgaggac acggctacat atttctgtgc aaaatatgag 300
gcccacgagg ggtttgttta ttggggccaa gggactctgg tcactgtctc tgca 354
<210> 400
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 400
gacatccaga tgaaccagtc tccatccagt ctgtctgcat cccttggaga cacaattacc 60
atcacttgcc atgccagtca gaacattaat gtttggttaa gctggtacca gcagaaacca 120
ggaaatattc caaaactatt gatctataag gcttcccact tgcacacagg cgtcccatca 180
aggttgagtg gcagtggatc tggaacaggt ttcacattaa ccatcagcag cctgcagcct 240
gaagacattg ccacttacta ctgtcaacag ggtcaaagtt atccattcac gttcggctcg 300
gggacaacgt tggaaataaa ac 322
<210> 401
<211> 348
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 401
caggtgcagc tgaaggagtc aggacctggc ctggtggcgc cctcacagag cctgtccatc 60
acttgcgctg tctctgggtt ttcattaacc agctttggtg tacactgggt tcgccagcct 120
ccaggaaagg gtctggagtg gctgggagtt atatgggctg gtggaagcac aaattattat 180
tcggctctca tgtccagact gagcatcagc atagacaact ccaagagcca agttttctta 240
aagatgaaca gtctgcaaac tgatgacaca gccatgtact actgtgccag agactgggag 300
ggctggtttg cttactgggg ccaagggact ctggtcactg tctctgca 348
<210> 402
<211> 341
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 402
gacattgtga tgtcacagtc tccatcctcc ctaactgtgt cagttggaga gaaggttact 60
atgagctgca tgtccagtca gagcctttta tatagtagca ctcaaaagaa ctacttggcc 120
tggtaccagc agaaaccagg gcagtctcct aaactgctga tttactgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg ggacagattt cactctcacc 240
atcagcagtg tgaaggctga agacctggca gtttattact gtcagcaata ttatagctat 300
ccgtacacgt tcggaggggg gaccaagctg gaaataaaac g 341
<210> 403
<211> 351
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 403
gagatccagc tgcagcagtc tggacctgag ctggtgaagc ctggggcttc agtgaaggta 60
tcctgcaagg cttctggtta tgcattcact agctacaaca tgtactgggt gagtcagagc 120
catggaaaga gccttgagtg gattggatat attgatcctt acaatggtgg cactagctac 180
aaccagaagt tcaggggcaa ggccacattg actgttgaca agtcctcaag cacagcctac 240
atgcatctca acagcctgac atctgaggac tcggcagtct attattgtgc aagagagaac 300
tataggtact ttgacttctg gggccaaggc accactctca cagtctcctc a 351
<210> 404
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 404
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca gtgcaagtag cagcgttagc tatatgtatt ggtatcagca gaaaccaggg 120
aaagccccta agctcctgat ctacctcact agtaacttgg caagtggggt cccatcaagg 180
ttcagtggca gtggatctgg gacagatttc actctcacca tcagcagtct gcaacctgaa 240
gattttgcaa cttactactg tcaacagtgg cgtagtaacc cattcacgtt cggccagggg 300
acaaagttgg aaataaaac 319
<210> 405
<211> 373
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 405
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc actagtggaa tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt gcacacattt ggtgggatga tgttaagcgc 180
tacagcccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacgcata 300
gtttcctttg ataacgacgt tgtctctgct atggactact ggggtcaagg aaccctagtc 360
accgtctcct ccg 373
<210> 406
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 406
gccatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtga gaacatttat tataatttag cctggtatca gcagaaacca 120
gggaaagctc ctaagctcct gatctatact gccaatagtt tggaagatgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttattt ttgtaaacag gcttatgacg ttcctccgac gttcggtgga 300
ggcaccaagc tggaaatcaa ac 322
<210> 407
<211> 352
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 407
caggtgcagc tggtgcagtc tggggctgag gtgaagaagc ctggggcctc agtgaaggtt 60
tcctgcaagg catctggata caccttcacc aggtactgga tacactggat acgacaggcc 120
cctggacaag ggcttgagtg gatgggatac atcaacccta caactgttta tactgagttc 180
aatcagaact tcaaggacag agtcaccatg accagggaca cgtccacgag cacagtctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtgc gagaggcggt 300
agtaacttct ttgactactg gggccaaggc accactgtca cagtctcctc ag 352
<210> 408
<211> 319
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 408
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc 60
atcacctgca gtgccagtag cagtgtgagc tacatgcact ggtaccagca gaaaccagat 120
cagtctccaa agctcctcat caaggatagt tccaaactcg cctcaggggt cccctcgagg 180
ttcagtggca gtggatctgg gacagatttc accctcacca tcaatagcct ggaagctgaa 240
gatgctgcaa cgtattactg tcagcagtgg agtagtaacc cgctcacgtt cggtcagggg 300
accaagctgg agatcaaac 319
<210> 409
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 409
cagatcacct tgaaggagtc tggtcctacg ctggtgaaac ccacacagac cctcacgctg 60
acctgcacct tctctgggtt ctcactcagc actagtggaa tgggtgtggg ctggatccgt 120
cagcccccag gaaaggccct ggagtggctt acagacattt ggtgggatga taataagtac 180
tacaacccat ctctgaagag caggctcacc atcaccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca catattactg tgcacgaaga 300
gttaactatt attacgaccc gtactatgct atggactact ggggtcaagg aacc 354
<210> 410
<211> 322
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 410
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca aggcgagtca gagcgttagc aatgatgtag cctggtatca gcagaaacca 120
gggaaagttc ctaagctcct gatctattat gcatccaata ggtactcagg ggtcccatct 180
cggttcagtg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagatgttg caacttattt ctgtcagcag gattatagct ctccgtggac gttcggtgga 300
ggcaccaagg tggaaatcaa ac 322
<210> 411
<211> 355
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 411
caggtccagc ttgtgcagtc tggggctgag gtgaagaagc ctggggcctc agtgaaggtt 60
tcctgcaagg cttctggata caccttcact aactatggta tgaattgggt gcgccaggcc 120
cccggacaaa ggcttgagtg gatgggatgg atcaacactt acactggtga cccaacatat 180
gcagatgatt tcaagggcag agtcaccatt accagggaca catccgcgag cacagcctac 240
atggagctga gcagcctgag atctgaagac acggctgtgt attactgtgc gagaattggc 300
ggtaatagtc cctctgatta ctggggccaa ggcaccactg tcacagtctc ctcag 355
<210> 412
<211> 324
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 412
gagatcgtga tgacccagtc ccctgccaca ctgtccgtgt cccctggaga gagggccacc 60
ctgtcctgca aggcctccca gtccgtgtcc aacgacgtgg tgtggtacca gcagaagccc 120
ggacaggctc ccaggctgct gatctactac gcctccaaca ggtacaccgg catccctgcc 180
aggttctccg gatccggatc cggcaccgag ttcaccctga ccatctcctc cctgcagtcc 240
gaggacttcg ccgtgtacta ctgccagcag gactacacct ccccctggac ctttggccag 300
ggcaccaagc tggagatcaa gagg 324
<210> 413
<211> 353
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<400> 413
caggtgcagc tggtgcagtc cggcgccgaa gtgaagaaac ccggcgcctc cgtgaaggtg 60
tcctgcaagg cctccggcta caccttcacc aactacggca tgaactgggt gaggcaggct 120
cctggacagg gactggagtg gatgggctgg atcaacacct acaccggcga acccacctac 180
gccgacgact tcaagggcag ggtgaccatg accaccgaca cctccacctc caccgcctac 240
atggagctga ggtccctgag gtccgacgac accgccgtgt actactgcgc taggattggc 300
gactcctccc cctccgatta ctggggacag ggcaccctcg tgaccgtctc ctc 353
Claims (20)
- 단리된 DLL3 조절물질.
- 제1항에 있어서,
상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하는, 단리된 DLL3 조절물질. - 제2항에 있어서,
상기 항체 또는 그것의 면역반응 단편은 모노클론성 항체를 포함하는, 단리된 DLL3 조절물질. - 제3항에 있어서,
상기 모노클론성 항체는, 키메라성 항체들, 인간화 항체들 및 인간 항체들로 이루어진 군에서 선택되는, 단리된 DLL3 조절물질. - 제3항 또는 제4항에 있어서,
상기 모노클론성 항체 또는 그것의 면역반응 단편은 DLL3 단백질 N-말단 도메인 또는 DSL 도메인에 결합하는, 단리된 DLL3 조절물질. - 제2항 내지 제5항 중 어느 한 항의 단리된 DLL3 항체 조절물질로서, 상기 항체 또는 그것의 면역반응 단편은 세 개의 상보성 결정 영역들을 가진 경쇄 가변 영역과 세 개의 상보성 결정 영역들을 가진 중쇄 가변 영역을 포함하고, 여기서, 상기 중쇄 및 경쇄 상보성 결정 영역들은 도 11a 내지 도 11ad 또는 도 11b 내지 도 11bd에 제시된 적어도 하나의 상보성 결정 영역을 포함하는, 단리된 DLL3 항체 조절물질.
- SC16.3, SC16.4, SC16.5, SC16.7, SC16.8, SC16.10, SC16.11, SC16.13, SC16.15, SC16.18, SC16.19, SC16.20, SC16.21, SC16.22, SC16.23, SC16.25, SC16.26, SC16.29, SC16.30, SC16.31, SC16.34, SC16.35, SC16.36, SC16.38, SC16.39, SC16.41, SC16.42, SC16.45, SC16.47, SC16.49, SC16.50, SC16.52, SC16.55, SC16.56, SC16.57, SC16.58, SC16.61, SC16.62, SC16.63, SC16.65, SC16.67, SC16.68, SC16.72, SC16.73, SC16.78, SC16.79, SC16.80, SC16.81, SC16.84, SC16.88, SC16.101, SC16.103, SC16.104, SC16.105, SC16.106, SC16.107, SC16.108, SC16.109, SC16.110, SC16.111, SC16.113, SC16.114, SC16.115, SC16.116, SC16.117, SC16.118, SC16.120, SC16.121, SC16.122, SC16.123, SC16.124, SC16.125, SC16.126, SC16.129, SC16.130, SC16.131, SC16.132, SC16.133, SC16.134, SC16.135, SC16.136, SC16.137, SC16.138, SC16.139, SC16.140, SC16.141, SC16.142, SC16.143, SC16.144, SC16.147, SC16.148, SC16.149 및 SC16.150으로 이루어진 군에서 선택된 기준 항체와, DLL3 단백질에의 결합을 위해 경쟁하는 제2항 내지 제5항 중 어느 한 항의 단리된 DLL3 항체 조절물질로서, 상기 DLL3 항체 조절물질의 상기 DLL3 단백질에의 결합이 적어도 30% 만큼 억제되는, 단리된 DLL3 항체 조절물질.
- 제2항 내지 제7항 중 어느 한 항에 있어서,
상기 항체는 내재화 항체를 포함하는, 단리된 DLL3 조절물질. - 제2항 내지 제8항 중 어느 한 항에 있어서,
상기 항체는 세포독성제를 추가로 포함하는, 단리된 DLL3 조절물질. - 제1항 내지 제8항 중 어느 한 항의 항체 또는 그것의 면역반응 단편의 아미노산 중쇄 가변 영역 또는 아미노산 경쇄 가변 영역을 암호화하는, 핵산.
- 제10항의 핵산을 포함하는, 숙주 세포.
- 식: M-[L-D]n의 항체 약물 접합체 또는 그것의 약제학적으로 허용되는 염으로서,
a) M은 DLL3 조절물질을 포함하고;
b) L은 임의의 링커를 포함하고;
c) D는 항-증식제이며; 그리고
d) n은 약 1 내지 약 20의 정수인, 항체 약물 접합체 또는 그것의 약제학적으로 허용되는 염. - 제12항에 있어서,
상기 DLL3 조절물질은 항체 또는 그것의 면역반응 단편을 포함하고, 상기 항체 또는 그것의 면역반응 단편이 세 개의 상보성 결정 영역들을 가진 경쇄 가변 영역과 세 개의 상보성 결정 영역들을 가진 중쇄 가변 영역을 포함하고, 여기서, 상기 중쇄 및 경쇄 상보성 결정 영역들은 도 11a 내지 도 11ad 또는 도 11b 내지 도 11bd에 제시된 적어도 하나의 상보성 결정 영역을 포함하는, 항체 약물 접합체. - 제12항 또는 제13항에 있어서,
상기 DLL3 조절물질은 내재화 항체를 포함하는, 항체 약물 접합체. - 의료에 사용하기 위한, 제1항 내지 제9항 중 어느 한 항의 단리된 DLL3 조절물질 또는 제12항 또는 제14항의 항체 약물 접합체.
- 환자의 암 치료를 위한, 제1항 내지 제9항 중 어느 한 항의 단리된 DLL3 조절물질 또는 제12항 또는 제14항의 항체 약물 접합체로서, 상기 암은, 부신암, 방광암, 자궁경부암, 자궁내막암, 신장암, 간암, 폐암, 난소암, 직장결장암, 췌장암, 전립선암 및 유방암으로 이루어진 군에서 선택되는, 단리된 DLL3 조절물질 또는 항체 약물 접합체.
- 소세포 폐암의 치료를 필요로 하는 대상의 소세포 폐암을 치료하기 위한 의약 제조에 사용하기 위한, DLL3 조절물질의 용도.
- 제17항의 의약으로서, 상기 DLL3 조절물질은 모노클론성 항체를 포함하는, 의약.
- 제17항 또는 제18항의 의약으로서, 상기 DLL3 조절물질은 DLL3 단백질 N-말단 도메인 또는 DSL 도메인에 결합하는, 의약.
- 제17항 내지 제19항 중 어느 한 항의 의약으로서, 상기 DLL3 조절물질은 세포독성제를 포함하는, 의약.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261603173P | 2012-02-24 | 2012-02-24 | |
| US61/603,173 | 2012-02-24 | ||
| US201261719803P | 2012-10-29 | 2012-10-29 | |
| US61/719,803 | 2012-10-29 | ||
| PCT/US2013/027391 WO2013126746A2 (en) | 2012-02-24 | 2013-02-22 | Novel modulators and methods of use |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150003169A true KR20150003169A (ko) | 2015-01-08 |
Family
ID=47790544
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147026844A KR20150003169A (ko) | 2012-02-24 | 2013-02-22 | Dll3 조절물질들 및 사용 방법 |
Country Status (30)
| Country | Link |
|---|---|
| US (31) | US9089616B2 (ko) |
| EP (4) | EP3093293A1 (ko) |
| JP (4) | JP6089047B2 (ko) |
| KR (1) | KR20150003169A (ko) |
| CN (1) | CN104520324A (ko) |
| AU (3) | AU2013203459B2 (ko) |
| BR (1) | BR112014020826A8 (ko) |
| CA (2) | CA2865404C (ko) |
| CL (2) | CL2014002240A1 (ko) |
| CO (1) | CO7111274A2 (ko) |
| CY (1) | CY1119590T1 (ko) |
| DK (1) | DK2817338T3 (ko) |
| ES (2) | ES2812849T3 (ko) |
| HK (4) | HK1231488A1 (ko) |
| HR (1) | HRP20171549T1 (ko) |
| HU (1) | HUE037021T2 (ko) |
| IL (2) | IL234155B (ko) |
| LT (1) | LT2817338T (ko) |
| ME (1) | ME02928B (ko) |
| MX (2) | MX2014010074A (ko) |
| NZ (1) | NZ628804A (ko) |
| PE (2) | PE20190658A1 (ko) |
| PH (1) | PH12014501876A1 (ko) |
| PL (1) | PL2817338T3 (ko) |
| PT (1) | PT2817338T (ko) |
| RS (1) | RS56443B1 (ko) |
| RU (1) | RU2014138474A (ko) |
| SG (2) | SG11201405131XA (ko) |
| SI (1) | SI2817338T1 (ko) |
| WO (1) | WO2013126746A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3790586A4 (en) * | 2018-05-08 | 2022-01-19 | Phanes Therapeutics, Inc. | ANTI-DLL3 ANTIBODIES AND USES THEREOF |
Families Citing this family (102)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TR201806936T4 (tr) | 2010-01-29 | 2018-06-21 | Chugai Pharmaceutical Co Ltd | Anti-dll3 antikoru. |
| PL2817338T3 (pl) | 2012-02-24 | 2017-12-29 | Abbvie Stemcentrx Llc | Modulatory DLL3 i sposoby zastosowania |
| KR102134088B1 (ko) | 2012-08-24 | 2020-07-14 | 더 리젠츠 오브 더 유니버시티 오브 캘리포니아 | Ror1 암을 치료하고 전이를 저해하는데 이용을 위한 항체와 백신 |
| GB201302447D0 (en) | 2013-02-12 | 2013-03-27 | Oxford Biotherapeutics Ltd | Therapeutic and diagnostic target |
| EP3556400A1 (en) | 2013-02-22 | 2019-10-23 | AbbVie Stemcentrx LLC | Method of making antidll3-antibody pbd conjugates |
| EP3892294A1 (en) | 2013-08-28 | 2021-10-13 | AbbVie Stemcentrx LLC | Site-specific antibody conjugation methods and compositions |
| RU2016111137A (ru) * | 2013-08-28 | 2017-10-03 | ЭББВИ СТЕМСЕНТРКС ЭлЭлСи | Сконструированные конъюгаты против dll3 и способы применения |
| CN105940107B (zh) | 2013-11-11 | 2021-06-15 | 中外制药株式会社 | 含有改变了抗体可变区的抗原结合分子 |
| TWI700295B (zh) * | 2013-12-16 | 2020-08-01 | 馬來西亞商Mab探索私人有限公司 | 對會感染人類之腸病毒具有專一性之抗體 |
| MX2016010677A (es) | 2014-02-21 | 2017-04-10 | Abbvie Stemcentrx Llc | Conjugados de anticuerpos anti-drosophila similar a delta 3 (anti-dll3) y medicamentos para usarse en el tratamiento contra melanoma. |
| CA2941029C (en) | 2014-04-10 | 2021-02-16 | Obi Pharma Inc. | Antibodies, pharmaceutical compositions and uses thereof |
| JP6749312B2 (ja) | 2014-07-31 | 2020-09-02 | アムゲン リサーチ (ミュンヘン) ゲーエムベーハーAMGEN Research(Munich)GmbH | 最適化された種間特異的二重特異性単鎖抗体コンストラクト |
| IL240241B (en) * | 2014-07-31 | 2019-11-28 | Israel Institute For Biological Res | Antibodies directed to bacillus anthracis protective antigen |
| JP7125248B2 (ja) | 2014-11-11 | 2022-08-24 | 中外製薬株式会社 | 改変された抗体可変領域を含む抗原結合分子のライブラリ |
| MA41613A (fr) * | 2015-02-23 | 2018-01-02 | Abbvie Stemcentrx Llc | Récepteurs antigéniques chimériques anti-dll3 et procédés d'utilisation desdits récepteurs |
| ES2889906T3 (es) | 2015-05-21 | 2022-01-14 | Harpoon Therapeutics Inc | Proteínas de unión triespecíficas y usos médicos |
| JP2018524313A (ja) * | 2015-06-23 | 2018-08-30 | バイエル ファーマ アクチエンゲゼルシャフト | キネシンスピンドルタンパク質(ksp)阻害剤の抗b7h3抗体との抗体薬物複合体 |
| EP3322800A4 (en) * | 2015-07-13 | 2019-05-01 | University of Utah Research Foundation | PROCESS FOR THE PRODUCTION OF RED BLOOD BODIES AND BLOOD PLATES IN VITRO AND USES THEREOF |
| TWI796283B (zh) | 2015-07-31 | 2023-03-21 | 德商安美基研究(慕尼黑)公司 | Msln及cd3抗體構築體 |
| TWI829617B (zh) | 2015-07-31 | 2024-01-21 | 德商安美基研究(慕尼黑)公司 | Flt3及cd3抗體構築體 |
| TWI793062B (zh) | 2015-07-31 | 2023-02-21 | 德商安美基研究(慕尼黑)公司 | Dll3及cd3抗體構築體 |
| BR112018003269A2 (pt) * | 2015-08-20 | 2018-09-25 | Abbvie Stemcentrx Llc | conjugados de fármaco-anticorpo anti-dll3 e métodos de utilização |
| AR105910A1 (es) | 2015-09-04 | 2017-11-22 | Obi Pharma Inc | Matrices de glicano y método de uso |
| EP3383910A1 (en) | 2015-11-30 | 2018-10-10 | AbbVie Inc. | ANTI-huLRRC15 ANTIBODY DRUG CONJUGATES AND METHODS FOR THEIR USE |
| WO2017095805A1 (en) | 2015-11-30 | 2017-06-08 | Abbvie Inc. | ANTI-huLRRC15 ANTIBODY DRUG CONJUGATES AND METHODS FOR THEIR USE |
| EA039325B1 (ru) * | 2016-02-03 | 2022-01-13 | Эмджен Рисерч (Мюник) Гмбх | Конструкции биспецифических антител, связывающиеся с дпб3 (dll3) и кд3 (cd3) |
| EA039859B1 (ru) * | 2016-02-03 | 2022-03-21 | Эмджен Рисерч (Мюник) Гмбх | Биспецифические конструкты антител, связывающие egfrviii и cd3 |
| WO2017157505A1 (en) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Method for purifying poloxamers |
| TWI780045B (zh) * | 2016-03-29 | 2022-10-11 | 台灣浩鼎生技股份有限公司 | 抗體、醫藥組合物及方法 |
| US10980894B2 (en) | 2016-03-29 | 2021-04-20 | Obi Pharma, Inc. | Antibodies, pharmaceutical compositions and methods |
| CR20180529A (es) | 2016-04-04 | 2019-03-21 | Bioverativ Usa Inc | Anticuerpos anti-factor bb del complemento y usos de estos referencia cruzada |
| TWI697333B (zh) | 2016-04-22 | 2020-07-01 | 台灣浩鼎生技股份有限公司 | 經由Globo系列抗原之免疫活化或免疫調節之癌症免疫療法 |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| CN109641047A (zh) | 2016-05-20 | 2019-04-16 | 哈普恩治疗公司 | 单结构域血清白蛋白结合蛋白质 |
| WO2018005519A2 (en) | 2016-06-27 | 2018-01-04 | The Regents Of The University Of California | Cancer treatment combinations |
| AU2017302038B2 (en) | 2016-07-27 | 2024-03-21 | Obi Pharma, Inc. | Immunogenic/therapeutic glycan compositions and uses thereof |
| US11643456B2 (en) | 2016-07-29 | 2023-05-09 | Obi Pharma, Inc. | Human antibodies, pharmaceutical compositions and methods |
| AU2017307616A1 (en) | 2016-08-05 | 2019-02-28 | Allakos, Inc. | Anti-Siglec-7 antibodies for the treatment of cancer |
| US10042362B2 (en) | 2016-11-18 | 2018-08-07 | Waymo Llc | Dynamic routing for autonomous vehicles |
| WO2018094414A1 (en) | 2016-11-21 | 2018-05-24 | Obi Pharma, Inc. | Conjugated biological molecules, pharmaceutical compositions and methods |
| CA3044457A1 (en) * | 2016-11-22 | 2018-05-31 | Dendrocyte Biotech Pty Ltd | Anti-cd300f antibody and uses thereof |
| MX2019006045A (es) | 2016-11-23 | 2019-11-11 | Harpoon Therapeutics Inc | Proteinas triespecificas dirigidas a psma y metodos de uso. |
| EP3544997A4 (en) | 2016-11-23 | 2020-07-01 | Harpoon Therapeutics, Inc. | PROSTATE SPECIFIC MEMBRANE ANTIGEN BINDING PROTEIN |
| GB201700553D0 (en) | 2017-01-12 | 2017-03-01 | Genagon Therapeutics Ab | Therapeutic agents |
| US11535668B2 (en) | 2017-02-28 | 2022-12-27 | Harpoon Therapeutics, Inc. | Inducible monovalent antigen binding protein |
| JP7090347B2 (ja) | 2017-05-12 | 2022-06-24 | ハープーン セラピューティクス,インク. | メソテリン結合タンパク質 |
| CA3063362A1 (en) | 2017-05-12 | 2018-11-15 | Harpoon Therapeutics, Inc. | Msln targeting trispecific proteins and methods of use |
| US20210206882A1 (en) | 2017-08-01 | 2021-07-08 | Ab Studio Inc. | Bispecific antibodies and uses thereof |
| JP7369121B2 (ja) | 2017-10-11 | 2023-10-25 | バイオベラティブ・ユーエスエイ・インコーポレイテッド | 補体活性を誘発する方法 |
| KR102569133B1 (ko) | 2017-10-13 | 2023-08-21 | 하푼 테라퓨틱스, 인크. | 삼중특이적 단백질 및 사용 방법 |
| CR20200195A (es) | 2017-10-13 | 2020-08-14 | Harpoon Therapeutics Inc | Proteínas de unión a antigenos de maduraciòn de celulas b |
| EP3720963A4 (en) | 2017-12-05 | 2021-12-08 | Chugai Seiyaku Kabushiki Kaisha | ANTIGEN BINDING MOLECULE INCLUDING A VARIABLE REGION OF MODIFIED ANTIBODIES BINDING TO CD3 AND CD137 |
| EP3732195A4 (en) | 2017-12-28 | 2022-02-09 | Chugai Seiyaku Kabushiki Kaisha | CYTOTOXICITY-INDUCING THERAPEUTIC |
| WO2019140273A1 (en) * | 2018-01-11 | 2019-07-18 | Allakos, Inc. | Anti-siglec-7 antibodies having reduced effector function |
| US20220025037A1 (en) * | 2018-04-03 | 2022-01-27 | Dragonfly Therapeutics, Inc. | Antibody variable domains targeting dll3, and use thereof |
| WO2019195017A1 (en) * | 2018-04-03 | 2019-10-10 | Promab Biotechnologies, Inc. | Bcma-car-t cells |
| TW202016151A (zh) | 2018-06-09 | 2020-05-01 | 德商百靈佳殷格翰國際股份有限公司 | 針對癌症治療之多特異性結合蛋白 |
| US11203645B2 (en) | 2018-06-27 | 2021-12-21 | Obi Pharma, Inc. | Glycosynthase variants for glycoprotein engineering and methods of use |
| KR20210081322A (ko) | 2018-08-02 | 2021-07-01 | 다인 세라퓨틱스, 인크. | 근육 표적화 복합체 및 디스트로핀병증을 치료하기 위한 그의 용도 |
| US11911484B2 (en) | 2018-08-02 | 2024-02-27 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating myotonic dystrophy |
| KR20210081324A (ko) | 2018-08-02 | 2021-07-01 | 다인 세라퓨틱스, 인크. | 근육 표적화 복합체 및 안면견갑상완 근육 이영양증을 치료하기 위한 그의 용도 |
| CN113286817A (zh) | 2018-09-25 | 2021-08-20 | 哈普恩治疗公司 | Dll3结合蛋白及使用方法 |
| WO2020069349A1 (en) * | 2018-09-27 | 2020-04-02 | Colorado State University Research Foundation | Scfv's for live cell imaging and other uses |
| CN111647082B (zh) * | 2018-12-27 | 2023-02-17 | 中山康方生物医药有限公司 | 抗人il-4ra的抗体及其用途 |
| BR112021016984A2 (pt) | 2019-03-01 | 2021-11-30 | Allogene Therapeutics Inc | Receptores de antígeno quimérico direcionados a dll3 e agentes de ligação |
| EP3908679A1 (en) * | 2019-03-08 | 2021-11-17 | OncoLab Diagnostics GmbH | Cancer diagnosis and prognosis |
| MX2021012336A (es) * | 2019-04-08 | 2021-11-12 | Phanes Therapeutics Inc | Receptores de antigeno quimerico anti-dll3 humanizados y usos de los mismos. |
| EP3958910A4 (en) * | 2019-04-24 | 2023-08-02 | Magenta Therapeutics, Inc. | ANTI-CD45-DRUG ANTIBODY CONJUGATES AND THEIR USES |
| US20220348648A1 (en) * | 2019-07-11 | 2022-11-03 | Memorial Sloan Kettering Cancer Center | Dll3-targeting antibodies and uses thereof |
| WO2021041300A2 (en) * | 2019-08-23 | 2021-03-04 | Ab Therapeutics, Inc. | Bispecific antibodies and uses thereof |
| CN112442126B (zh) * | 2019-09-04 | 2022-07-29 | 杭州济元基因科技有限公司 | 一种抗人cs1抗原的单克隆抗体及其car-t细胞 |
| EP3819312A1 (en) * | 2019-11-10 | 2021-05-12 | Amgen, Inc | Dosing regimen for anti-dll3 agents |
| JP2023512442A (ja) * | 2020-01-10 | 2023-03-27 | ダイン セラピューティクス,インコーポレーテッド | 顔面肩甲上腕型筋ジストロフィーを処置するための筋標的化複合体およびそれらの使用 |
| EP4087876A4 (en) * | 2020-01-10 | 2024-03-27 | Dyne Therapeutics Inc | MUSCLE TARGETING COMPLEXES AND THEIR USES |
| BR112022013577A2 (pt) | 2020-01-10 | 2022-09-13 | Rhode Island Hospital | Anticorpos pfgarp para matar parasitas da malária plasmodium falciparum e proteger contra infecções e doenças severas |
| CA3163295A1 (en) * | 2020-01-10 | 2021-07-15 | Romesh R. Subramanian | Muscle targeting complexes and uses thereof for treating myotonic dystrophy |
| IL294478A (en) * | 2020-01-10 | 2022-09-01 | Dyne Therapeutics Inc | Muscle targeting complexes and their uses for the treatment of dystrophinopathy |
| WO2021150382A1 (en) * | 2020-01-24 | 2021-07-29 | Dyne Therapeutics, Inc. | Muscle-targeting complexes and uses thereof in treating muscle atrophy |
| CN115768463A (zh) | 2020-02-21 | 2023-03-07 | 哈普恩治疗公司 | Flt3结合蛋白及使用方法 |
| US11179473B2 (en) | 2020-02-21 | 2021-11-23 | Silverback Therapeutics, Inc. | Nectin-4 antibody conjugates and uses thereof |
| EP4110820A4 (en) * | 2020-02-25 | 2024-03-27 | Gensun Biopharma Inc | TRISPECIFIC T CELL CONTACTING AGENTS |
| MX2022011387A (es) | 2020-03-31 | 2022-10-10 | Chugai Pharmaceutical Co Ltd | Metodo para producir moleculas de union a antigeno multiespecificas. |
| EP4126969A1 (en) | 2020-03-31 | 2023-02-08 | Chugai Seiyaku Kabushiki Kaisha | Dll3-targeting multispecific antigen-binding molecules and uses thereof |
| AU2021261257A1 (en) | 2020-04-20 | 2022-12-22 | Genzyme Corporation | Humanized anti-complement factor Bb antibodies and uses thereof |
| CN115702003A (zh) * | 2020-04-23 | 2023-02-14 | 瑞美德生物医药科技有限公司 | 趋化因子受体4(cxcr4)拮抗剂抗体 |
| KR20230047361A (ko) | 2020-07-01 | 2023-04-07 | 아르스 파마슈티컬스 인크. | 항-asgr1 항체 접합체 및 이의 용도 |
| AU2021345124A1 (en) | 2020-09-16 | 2023-03-30 | Amgen Inc. | Methods for administering therapeutic doses of bispecific T-cell engaging molecules for the treatment of cancer |
| WO2022087316A1 (en) * | 2020-10-21 | 2022-04-28 | La Jolla Institute For Immunology | Chimeric anti-sars-cov2 nucleoprotein antibodies |
| JP2024500847A (ja) | 2020-12-18 | 2024-01-10 | センチュリー セラピューティクス,インコーポレイテッド | 適合可能な受容体特異性を有するキメラ抗原受容体システム |
| US20240115721A1 (en) | 2021-01-13 | 2024-04-11 | Memorial Sloan Kettering Cancer Center | Anti-dll3 antibody-drug conjugate |
| CN117425501A (zh) | 2021-01-13 | 2024-01-19 | 纪念斯隆凯特琳癌症中心 | 抗体-吡咯并苯二氮䓬衍生物缀合物 |
| US11633498B2 (en) | 2021-07-09 | 2023-04-25 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating myotonic dystrophy |
| US11638761B2 (en) | 2021-07-09 | 2023-05-02 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating Facioscapulohumeral muscular dystrophy |
| US11771776B2 (en) | 2021-07-09 | 2023-10-03 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating dystrophinopathies |
| CN113528583A (zh) * | 2021-07-15 | 2021-10-22 | 澳门大学 | 自动化显微注射方法、装置、系统、设备及存储介质 |
| CA3226938A1 (en) | 2021-07-30 | 2023-02-02 | Qingsong GUO | Anti-dll3 antibody and preparation method therefor, drug conjugate and application thereof |
| IL310866A (en) * | 2021-08-19 | 2024-04-01 | Adicet Therapeutics Inc | Methods for the detection of membrane-bound glypican-3 |
| WO2023053272A1 (en) | 2021-09-29 | 2023-04-06 | Chugai Seiyaku Kabushiki Kaisha | Uses of dll3-targeting multispecific antigen-binding molecules |
| US11931421B2 (en) | 2022-04-15 | 2024-03-19 | Dyne Therapeutics, Inc. | Muscle targeting complexes and formulations for treating myotonic dystrophy |
| WO2023225197A2 (en) * | 2022-05-18 | 2023-11-23 | The Brigham And Women’S Hospital, Inc. | Klrb1 binding agents and methods of use thereof |
| CN116355079B (zh) * | 2022-08-19 | 2023-12-26 | 上海迈科康生物科技有限公司 | 检测重组人轮状病毒vp8抗原(vp8 p[8])的单克隆抗体及其应用 |
| CN116966202B (zh) * | 2023-09-22 | 2023-12-01 | 再少年(北京)生物科技有限公司 | iPS诱导定向分化成的神经干细胞联合药物用于治疗阿尔茨海默症的用途 |
Family Cites Families (146)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR901464A (fr) | 1943-01-23 | 1945-07-27 | Boehringer & Soehne Gmbh | Procédé d'obtention de vanilline |
| FR2413974A1 (fr) | 1978-01-06 | 1979-08-03 | David Bernard | Sechoir pour feuilles imprimees par serigraphie |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4703004A (en) | 1984-01-24 | 1987-10-27 | Immunex Corporation | Synthesis of protein with an identification peptide |
| GB2183662B (en) | 1985-04-01 | 1989-01-25 | Celltech Ltd | Transformed myeloma cell-line and a process for the expression of a gene coding for a eukaryotic polypeptide employing same |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| US5750172A (en) | 1987-06-23 | 1998-05-12 | Pharming B.V. | Transgenic non human mammal milk |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| US5336603A (en) | 1987-10-02 | 1994-08-09 | Genentech, Inc. | CD4 adheson variants |
| IL106992A (en) | 1988-02-11 | 1994-06-24 | Bristol Myers Squibb Co | Noble hydrazonic history of anthracycline and methods for their preparation |
| GB8809129D0 (en) | 1988-04-18 | 1988-05-18 | Celltech Ltd | Recombinant dna methods vectors and host cells |
| US5879936A (en) | 1988-04-18 | 1999-03-09 | Aluguisse Holding A.G. | Recombinant DNA methods, vectors and host cells |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| KR900005995A (ko) | 1988-10-31 | 1990-05-07 | 우메모또 요시마사 | 변형 인터류킨-2 및 그의 제조방법 |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| ES2096590T3 (es) | 1989-06-29 | 1997-03-16 | Medarex Inc | Reactivos biespecificos para la terapia del sida. |
| US5112946A (en) | 1989-07-06 | 1992-05-12 | Repligen Corporation | Modified pf4 compositions and methods of use |
| FR2650598B1 (fr) | 1989-08-03 | 1994-06-03 | Rhone Poulenc Sante | Derives de l'albumine a fonction therapeutique |
| WO1991006570A1 (en) | 1989-10-25 | 1991-05-16 | The University Of Melbourne | HYBRID Fc RECEPTOR MOLECULES |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| US5633076A (en) | 1989-12-01 | 1997-05-27 | Pharming Bv | Method of producing a transgenic bovine or transgenic bovine embryo |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5314995A (en) | 1990-01-22 | 1994-05-24 | Oncogen | Therapeutic interleukin-2-antibody based fusion proteins |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| US5349053A (en) | 1990-06-01 | 1994-09-20 | Protein Design Labs, Inc. | Chimeric ligand/immunoglobulin molecules and their uses |
| EP0547065B1 (en) | 1990-06-29 | 2001-08-29 | Large Scale Biology Corporation | Melanin production by transformed microorganisms |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| ATE185601T1 (de) | 1990-07-10 | 1999-10-15 | Cambridge Antibody Tech | Verfahren zur herstellung von spezifischen bindungspaargliedern |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| ES2108048T3 (es) | 1990-08-29 | 1997-12-16 | Genpharm Int | Produccion y utilizacion de animales inferiores transgenicos capaces de producir anticuerpos heterologos. |
| ES2113940T3 (es) | 1990-12-03 | 1998-05-16 | Genentech Inc | Metodo de enriquecimiento para variantes de proteinas con propiedades de union alteradas. |
| EP0732402A3 (en) | 1990-12-14 | 1997-05-21 | Cell Genesys Inc | Chimeric chains for transduction of receptor-linked signaling pathways |
| JP4146512B2 (ja) | 1991-03-01 | 2008-09-10 | ダイアックス コープ. | 小型タンパク質 |
| EP0580737B1 (en) | 1991-04-10 | 2004-06-16 | The Scripps Research Institute | Heterodimeric receptor libraries using phagemids |
| WO1992020373A1 (en) | 1991-05-14 | 1992-11-26 | Repligen Corporation | Heteroconjugate antibodies for treatment of hiv infection |
| DE4122599C2 (de) | 1991-07-08 | 1993-11-11 | Deutsches Krebsforsch | Phagemid zum Screenen von Antikörpern |
| US5622929A (en) | 1992-01-23 | 1997-04-22 | Bristol-Myers Squibb Company | Thioether conjugates |
| US5667988A (en) | 1992-01-27 | 1997-09-16 | The Scripps Research Institute | Methods for producing antibody libraries using universal or randomized immunoglobulin light chains |
| FR2686899B1 (fr) | 1992-01-31 | 1995-09-01 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides biologiquement actifs, leur preparation et compositions pharmaceutiques les contenant. |
| FR2686901A1 (fr) | 1992-01-31 | 1993-08-06 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides antithrombotiques, leur preparation et compositions pharmaceutiques les contenant. |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| US5447851B1 (en) | 1992-04-02 | 1999-07-06 | Univ Texas System Board Of | Dna encoding a chimeric polypeptide comprising the extracellular domain of tnf receptor fused to igg vectors and host cells |
| ZA932522B (en) | 1992-04-10 | 1993-12-20 | Res Dev Foundation | Immunotoxins directed against c-erbB-2(HER/neu) related surface antigens |
| EP0656064B1 (en) | 1992-08-17 | 1997-03-05 | Genentech, Inc. | Bispecific immunoadhesins |
| EP0749475A4 (en) | 1992-08-26 | 1997-05-07 | Harvard College | USE OF THE CYTOKIN IP-10 AS AN ANTI-TUMOR AGENCY |
| RO118524B1 (ro) | 1992-11-13 | 2003-06-30 | Idec Pharmaceuticals Corp San | Metoda pentru tratarea unei tulburari legata de celulele b |
| US7744877B2 (en) | 1992-11-13 | 2010-06-29 | Biogen Idec Inc. | Expression and use of anti-CD20 Antibodies |
| WO1994019935A1 (en) | 1993-03-09 | 1994-09-15 | Genzyme Corporation | Isolation of components of interest from milk |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| US5827690A (en) | 1993-12-20 | 1998-10-27 | Genzyme Transgenics Corporatiion | Transgenic production of antibodies in milk |
| EP0776396B1 (en) | 1994-07-13 | 1998-11-11 | SCA Hygiene Paper AB | Method of producing a nonwoven material |
| MX9700764A (es) | 1994-07-29 | 1997-05-31 | Smithkline Beecham Plc | Compuestos novedosos. |
| US6046037A (en) | 1994-12-30 | 2000-04-04 | Hiatt; Andrew C. | Method for producing immunoglobulins containing protection proteins in plants and their use |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| ES2176484T3 (es) | 1995-08-18 | 2002-12-01 | Morphosys Ag | Bancos de proteinas/(poli)peptidos. |
| PT871490E (pt) | 1995-12-22 | 2003-07-31 | Bristol Myers Squibb Co | Ligantes de hidrazona ramificada |
| WO1997033899A1 (en) | 1996-03-14 | 1997-09-18 | Human Genome Sciences, Inc. | Apoptosis inducing molecule i |
| EP0904107B1 (en) | 1996-03-18 | 2004-10-20 | Board Of Regents, The University Of Texas System | Immunoglobin-like domains with increased half lives |
| CA2248868A1 (en) | 1996-03-22 | 1997-09-25 | Human Genome Sciences, Inc. | Apoptosis inducing molecule ii |
| US20030180784A1 (en) * | 1997-04-04 | 2003-09-25 | Millennium Pharmaceuticals, Inc. | Novel human Delta3 compositions and therapeutic and diagnostic uses therefor |
| EP0983303B1 (en) | 1997-05-21 | 2006-03-08 | Biovation Limited | Method for the production of non-immunogenic proteins |
| AU753157B2 (en) | 1997-11-03 | 2002-10-10 | Georgetown University Medical Center | VEGI, an inhibitor of angiogenesis and tumor growth |
| EP1034298B1 (en) | 1997-12-05 | 2011-11-02 | The Scripps Research Institute | Humanization of murine antibody |
| PT1413582E (pt) | 1998-08-27 | 2006-07-31 | Spirogen Ltd | Pirrolobenzodiazepinas dimericas |
| GB9818731D0 (en) | 1998-08-27 | 1998-10-21 | Univ Portsmouth | Compounds |
| WO2000034317A2 (en) | 1998-12-08 | 2000-06-15 | Biovation Limited | Method for reducing immunogenicity of proteins |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR100940380B1 (ko) | 1999-01-15 | 2010-02-02 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| US6908748B2 (en) | 1999-07-29 | 2005-06-21 | Kenji Sobue | Genes associated with the maintenance of differentiation of smooth muscle cells |
| WO2001012664A2 (en) | 1999-08-19 | 2001-02-22 | Chiron Corporation | Notch receptor ligands and uses thereof |
| US6703221B1 (en) | 1999-08-19 | 2004-03-09 | Chiron Corporation | Notch receptor ligands and uses thereof |
| AU2001266557A1 (en) | 2000-04-12 | 2001-10-23 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| EP1309614A2 (en) | 2000-08-11 | 2003-05-14 | Eli Lilly And Company | Novel secreted proteins and their uses |
| US7138496B2 (en) | 2002-02-08 | 2006-11-21 | Genetastix Corporation | Human monoclonal antibodies against human CXCR4 |
| EP1355919B1 (en) | 2000-12-12 | 2010-11-24 | MedImmune, LLC | Molecules with extended half-lives, compositions and uses thereof |
| US6362331B1 (en) | 2001-03-30 | 2002-03-26 | Council Of Scientific And Industrial Research | Process for the preparation of antitumor agents |
| DE10131904A1 (de) | 2001-07-04 | 2003-01-16 | Putzmeister Ag | Vorrichtung zum Fördern von fließ- oder schüttfähigem Fördergut |
| ES2307832T3 (es) | 2001-12-03 | 2008-12-01 | Amgen Fremont Inc. | Clasificacion de anticuerpos basada en las caracteristicas de union. |
| CA2478239A1 (en) | 2002-03-04 | 2003-09-18 | Medimmune, Inc. | The prevention or treatment of cancer using integrin alphavbeta3 antagonists in combination with other agents |
| EP3150630A1 (en) | 2002-09-27 | 2017-04-05 | Xencor Inc. | Optimized fc variants and methods for their generation |
| US20040101920A1 (en) | 2002-11-01 | 2004-05-27 | Czeslaw Radziejewski | Modification assisted profiling (MAP) methodology |
| GB0226593D0 (en) | 2002-11-14 | 2002-12-24 | Consultants Ltd | Compounds |
| WO2004072266A2 (en) | 2003-02-13 | 2004-08-26 | Kalobios Inc. | Antibody affinity engineering by serial epitope-guided complementarity replacement |
| US7619068B2 (en) | 2003-05-09 | 2009-11-17 | Diadexus, Inc. | Ovr110 antibody compositions and methods of use |
| EP1654383A1 (en) | 2003-08-08 | 2006-05-10 | Licentia, Ltd. | Materials and methods for colorectal cancer screening, diagnosis, and therapy |
| GB0321295D0 (en) | 2003-09-11 | 2003-10-15 | Spirogen Ltd | Synthesis of protected pyrrolobenzodiazepines |
| KR101192496B1 (ko) | 2003-11-06 | 2012-10-18 | 시애틀 지네틱스, 인크. | 리간드에 접합될 수 있는 모노메틸발린 화합물 |
| JP5064037B2 (ja) | 2004-02-23 | 2012-10-31 | ジェネンテック, インコーポレイテッド | 複素環式自壊的リンカーおよび結合体 |
| GB0404577D0 (en) | 2004-03-01 | 2004-04-07 | Spirogen Ltd | Pyrrolobenzodiazepines |
| PT2270010E (pt) | 2004-03-01 | 2012-03-12 | Spirogen Ltd | Derivados de 11-hidroxi-5h-pirrolo[2,1-c][1,4]benzodiazepin- 5-ona como intermediários chave para a preparação de pirrolobenzodiazepinas substituídas em c2 |
| US7189710B2 (en) | 2004-03-30 | 2007-03-13 | Council Of Scientific And Industrial Research | C2-fluoro pyrrolo [2,1−c][1,4]benzodiazepine dimers |
| FR2869231B1 (fr) | 2004-04-27 | 2008-03-14 | Sod Conseils Rech Applic | Composition therapeutique contenant au moins un derive de la pyrrolobenzodiazepine et la fludarabine |
| AU2005267722B2 (en) | 2004-08-04 | 2009-10-08 | Amgen Inc. | Antibodies to Dkk-1 |
| RU2412947C2 (ru) | 2004-09-23 | 2011-02-27 | Дженентек, Инк. | Антитела, сконструированные на основе цистеинов, и их конъюгаты |
| US20070123448A1 (en) | 2005-11-23 | 2007-05-31 | The Hospital For Sick Children | Novel chemical entities affecting neuroblastoma tumor-initiating cells |
| BRPI0620695A2 (pt) | 2005-12-16 | 2011-11-22 | Genentech Inc | método para tratar um tumor do tipo glioma, métodos de prognóstico e/ou diagnóstico de glioma, método de monitoramento ou diagnóstico, método para inibir o tamanho ou crescimento de um tumor do tipo glioma, métodos para tratar terapeuticamente, método para determinar o nìvel de expressão de marcadores determinantes de glioma ("gdm") de pn, prolif ou mes, método para prognosticar o tempo de sobrevida, método para diagnosticar a severidade de um tumor do tipo glioma e uso |
| EP1973945A4 (en) | 2006-01-16 | 2009-11-18 | Compugen Ltd | NEW NUCLEOTIDE AND AMINO ACID SEQUENCES AND METHOD FOR THEIR APPLICATION IN DIAGNOSIS |
| PT1813614E (pt) | 2006-01-25 | 2012-01-09 | Sanofi Sa | Agentes citotóxicos compreendendo novos derivados de tomaimicina |
| US8133857B2 (en) | 2006-03-07 | 2012-03-13 | The Brigham and Women's FHospital, Inc. | NOTCH inhibition in the treatment of atherosclerosis |
| US20070292414A1 (en) | 2006-06-06 | 2007-12-20 | Christopher Duntsch | Compositions enriched in neoplastic stem cells and methods comprising same |
| CA2923381A1 (en) | 2006-09-07 | 2008-03-13 | Arthur E. Frankel | Methods and compositions based on diphtheria toxin-interleukin-3 conjugates |
| US7825267B2 (en) | 2006-09-08 | 2010-11-02 | University Of Pittsburgh-Of The Commonwealth System Of Higher Education | Synthesis of FR901464 and analogs with antitumor activity |
| CA2666559A1 (en) | 2006-10-20 | 2008-04-24 | Forerunner Pharma Research Co., Ltd. | Pharmaceutical composition comprising anti-hb-egf antibody as active ingredient |
| EP2109668A4 (en) | 2007-01-22 | 2011-10-05 | Macrogenics West Inc | HUMAN CANCER STEM CELLS |
| EP2190481B1 (en) | 2007-07-17 | 2014-12-24 | The General Hospital Corporation | Methods to identify and enrich for populations of ovarian cancer stem cells and somatic ovarian stem cells and uses thereof |
| EP2022848A1 (en) | 2007-08-10 | 2009-02-11 | Hubrecht Institut | A method for identifying, expanding, and removing adult stem cells and cancer stem cells |
| KR20100052545A (ko) | 2007-08-28 | 2010-05-19 | 바이오겐 아이덱 엠에이 인코포레이티드 | Igf―1r의 다중 에피토프에 결합하는 조성물 |
| WO2009043051A2 (en) | 2007-09-27 | 2009-04-02 | Biogen Idec Ma Inc. | Cd23 binding molecules and methods of use thereof |
| EP2947097A1 (en) | 2008-04-07 | 2015-11-25 | Ablynx N.V. | Amino acid sequences directed against the Notch pathways and uses thereof |
| US8384551B2 (en) | 2008-05-28 | 2013-02-26 | MedHab, LLC | Sensor device and method for monitoring physical stresses placed on a user |
| US20100162416A1 (en) | 2008-09-29 | 2010-06-24 | Stemlifeline, Inc. | Multi-stage stem cell carcinogenesis |
| WO2010081171A2 (en) | 2009-01-12 | 2010-07-15 | Cyntellect, Inc. | Laser mediated sectioning and transfer of cell colonies |
| US20110020221A1 (en) | 2009-04-09 | 2011-01-27 | The Johns Hopkins University | Cancer stem cell expression patterns and compounds to target cancer stem cells |
| TR201806936T4 (tr) * | 2010-01-29 | 2018-06-21 | Chugai Pharmaceutical Co Ltd | Anti-dll3 antikoru. |
| MX2012011900A (es) | 2010-04-15 | 2013-03-21 | Seattle Genetics Inc | Conjugados de pirrolobenzodiazepina diana. |
| GB201006340D0 (en) | 2010-04-15 | 2010-06-02 | Spirogen Ltd | Synthesis method and intermediates |
| JP5875083B2 (ja) | 2010-04-15 | 2016-03-02 | メディミューン リミテッド | 増殖性疾患治療用ピロロベンゾジアゼピン |
| PE20130342A1 (es) | 2010-04-15 | 2013-04-20 | Spirogen Sarl | Pirrolobenzodiacepinas y conjugados de las mismas |
| US20130061340A1 (en) | 2011-09-02 | 2013-03-07 | Stem Centrx, Inc. | Identification and Enrichment of Cell Subpopulations |
| US9778264B2 (en) | 2010-09-03 | 2017-10-03 | Abbvie Stemcentrx Llc | Identification and enrichment of cell subpopulations |
| US20130061342A1 (en) | 2011-09-02 | 2013-03-07 | Stem Centrx, Inc. | Identification and Enrichment of Cell Subpopulations |
| WO2013119964A2 (en) | 2012-02-08 | 2013-08-15 | Stem Centrx, Inc. | Identification and enrichment of cell subpopulations |
| CN106434561A (zh) | 2010-09-03 | 2017-02-22 | 艾伯维施特姆森特克斯有限责任公司 | 细胞亚群的鉴定和富集 |
| ES2680624T3 (es) | 2010-09-29 | 2018-09-10 | Agensys, Inc. | Conjugados de anticuerpos y fármacos (CAF) que se unen a las proteínas 191P4D12 |
| SG10201510092QA (en) | 2010-12-09 | 2016-01-28 | Univ Pennsylvania | Use of chimeric antigen receptor-modified t cells to treat cancer |
| PE20141017A1 (es) | 2011-03-02 | 2014-08-25 | Roche Glycart Ag | Anticuerpos del cea |
| MX341524B (es) | 2011-09-20 | 2016-08-24 | Medimmune Ltd | Pirrolobenzodiazepinas como compuestos pbd dimericos asimetricos para inclusion en conjugados dirigidos. |
| TWI679212B (zh) | 2011-11-15 | 2019-12-11 | 美商安進股份有限公司 | 針對bcma之e3以及cd3的結合分子 |
| PT2780373T (pt) | 2011-11-16 | 2019-11-27 | Boehringer Ingelheim Int | Anticorpos anti-il-36r |
| PL2817338T3 (pl) | 2012-02-24 | 2017-12-29 | Abbvie Stemcentrx Llc | Modulatory DLL3 i sposoby zastosowania |
| GB201302447D0 (en) | 2013-02-12 | 2013-03-27 | Oxford Biotherapeutics Ltd | Therapeutic and diagnostic target |
| EP3556400A1 (en) | 2013-02-22 | 2019-10-23 | AbbVie Stemcentrx LLC | Method of making antidll3-antibody pbd conjugates |
| US9683039B2 (en) | 2013-03-14 | 2017-06-20 | New York University | Notch agonists for the treatment of cancer |
| RU2016111137A (ru) | 2013-08-28 | 2017-10-03 | ЭББВИ СТЕМСЕНТРКС ЭлЭлСи | Сконструированные конъюгаты против dll3 и способы применения |
| EP3892294A1 (en) | 2013-08-28 | 2021-10-13 | AbbVie Stemcentrx LLC | Site-specific antibody conjugation methods and compositions |
| MX2016010677A (es) | 2014-02-21 | 2017-04-10 | Abbvie Stemcentrx Llc | Conjugados de anticuerpos anti-drosophila similar a delta 3 (anti-dll3) y medicamentos para usarse en el tratamiento contra melanoma. |
| WO2016064749A2 (en) | 2014-10-20 | 2016-04-28 | Igenica Biotherapeutics, Inc. | Novel antibody-drug conjugates and related compounds, compositions, and methods of use |
| WO2018026742A1 (en) | 2016-08-01 | 2018-02-08 | Askgene Pharma Inc. | Novel antibody-albumin-drug conjugates (aadc) and methods for using them |
-
2013
- 2013-02-22 PL PL13707525T patent/PL2817338T3/pl unknown
- 2013-02-22 MX MX2014010074A patent/MX2014010074A/es unknown
- 2013-02-22 KR KR1020147026844A patent/KR20150003169A/ko not_active Application Discontinuation
- 2013-02-22 AU AU2013203459A patent/AU2013203459B2/en not_active Ceased
- 2013-02-22 EP EP16164549.4A patent/EP3093293A1/en not_active Withdrawn
- 2013-02-22 WO PCT/US2013/027391 patent/WO2013126746A2/en active Application Filing
- 2013-02-22 ES ES16164567T patent/ES2812849T3/es active Active
- 2013-02-22 BR BR112014020826A patent/BR112014020826A8/pt not_active Application Discontinuation
- 2013-02-22 PT PT137075255T patent/PT2817338T/pt unknown
- 2013-02-22 CA CA2865404A patent/CA2865404C/en active Active
- 2013-02-22 DK DK13707525.5T patent/DK2817338T3/en active
- 2013-02-22 SI SI201330800T patent/SI2817338T1/sl unknown
- 2013-02-22 RU RU2014138474A patent/RU2014138474A/ru not_active Application Discontinuation
- 2013-02-22 EP EP16164551.0A patent/EP3093294A1/en not_active Withdrawn
- 2013-02-22 LT LTEP13707525.5T patent/LT2817338T/lt unknown
- 2013-02-22 JP JP2014558882A patent/JP6089047B2/ja not_active Expired - Fee Related
- 2013-02-22 ME MEP-2017-185A patent/ME02928B/me unknown
- 2013-02-22 SG SG11201405131XA patent/SG11201405131XA/en unknown
- 2013-02-22 ES ES13707525.5T patent/ES2645272T3/es active Active
- 2013-02-22 PE PE2019000670A patent/PE20190658A1/es unknown
- 2013-02-22 CN CN201380010475.2A patent/CN104520324A/zh active Pending
- 2013-02-22 RS RS20171006A patent/RS56443B1/sr unknown
- 2013-02-22 SG SG10201806867VA patent/SG10201806867VA/en unknown
- 2013-02-22 EP EP16164567.6A patent/EP3095797B1/en active Active
- 2013-02-22 HU HUE13707525A patent/HUE037021T2/hu unknown
- 2013-02-22 PE PE2014001295A patent/PE20150090A1/es active IP Right Grant
- 2013-02-22 NZ NZ628804A patent/NZ628804A/en not_active IP Right Cessation
- 2013-02-22 CA CA3050672A patent/CA3050672A1/en not_active Abandoned
- 2013-02-22 EP EP13707525.5A patent/EP2817338B1/en active Active
-
2014
- 2014-08-17 IL IL234155A patent/IL234155B/en active IP Right Grant
- 2014-08-20 PH PH12014501876A patent/PH12014501876A1/en unknown
- 2014-08-21 MX MX2018010548A patent/MX2018010548A/es unknown
- 2014-08-22 CO CO14184798A patent/CO7111274A2/es unknown
- 2014-08-22 US US14/466,945 patent/US9089616B2/en not_active Expired - Fee Related
- 2014-08-22 US US14/466,951 patent/US9089617B2/en not_active Expired - Fee Related
- 2014-08-22 US US14/466,939 patent/US8986972B2/en active Active
- 2014-08-22 US US14/466,948 patent/US9090683B2/en not_active Expired - Fee Related
- 2014-08-22 CL CL2014002240A patent/CL2014002240A1/es unknown
- 2014-08-22 US US14/466,842 patent/US9089615B2/en not_active Expired - Fee Related
- 2014-08-22 US US14/466,941 patent/US9107961B2/en not_active Expired - Fee Related
-
2015
- 2015-01-19 HK HK17104918.2A patent/HK1231488A1/zh unknown
- 2015-01-19 HK HK15100598.9A patent/HK1200174A1/xx not_active IP Right Cessation
- 2015-01-19 HK HK17104908.4A patent/HK1231485A1/zh unknown
- 2015-01-19 HK HK17104910.0A patent/HK1231486A1/zh unknown
- 2015-06-08 US US14/733,874 patent/US9155803B1/en not_active Expired - Fee Related
- 2015-06-17 US US14/742,576 patent/US9133271B1/en not_active Expired - Fee Related
- 2015-07-23 US US14/807,789 patent/US9173959B1/en active Active
- 2015-09-18 US US14/859,242 patent/US9353182B2/en active Active
-
2016
- 2016-01-11 US US14/992,714 patent/US9334318B1/en active Active
- 2016-01-25 US US15/005,993 patent/US9358304B1/en active Active
- 2016-01-25 US US15/005,918 patent/US9345784B1/en active Active
- 2016-01-25 US US15/005,962 patent/US9352051B1/en active Active
- 2016-02-19 JP JP2016030269A patent/JP6010241B2/ja active Active
- 2016-02-19 JP JP2016030270A patent/JP2016098233A/ja active Pending
- 2016-04-21 US US15/135,546 patent/US9481727B2/en active Active
- 2016-04-21 US US15/135,517 patent/US9486537B2/en active Active
- 2016-04-21 US US15/135,542 patent/US9480757B2/en active Active
- 2016-06-22 CL CL2016001616A patent/CL2016001616A1/es unknown
- 2016-09-15 US US15/266,894 patent/US10137204B2/en active Active
- 2016-10-14 AU AU2016244333A patent/AU2016244333B2/en not_active Ceased
-
2017
- 2017-05-30 US US15/608,988 patent/US9770518B1/en active Active
- 2017-05-30 US US15/608,995 patent/US9764042B1/en active Active
- 2017-05-30 US US15/608,991 patent/US9878053B2/en active Active
- 2017-05-30 US US15/608,996 patent/US9775916B1/en active Active
- 2017-06-07 US US15/616,800 patent/US9855343B2/en active Active
- 2017-06-07 US US15/616,192 patent/US9861708B2/en active Active
- 2017-09-01 US US15/694,629 patent/US9937268B2/en not_active Expired - Fee Related
- 2017-09-01 US US15/694,602 patent/US9931420B2/en not_active Expired - Fee Related
- 2017-09-01 US US15/694,622 patent/US9867887B1/en active Active
- 2017-09-01 US US15/694,627 patent/US9931421B2/en not_active Expired - Fee Related
- 2017-10-12 HR HRP20171549TT patent/HRP20171549T1/hr unknown
- 2017-10-20 CY CY20171101098T patent/CY1119590T1/el unknown
-
2018
- 2018-05-29 JP JP2018102094A patent/JP2018162257A/ja active Pending
- 2018-10-03 IL IL262110A patent/IL262110A/en unknown
- 2018-10-25 US US16/170,848 patent/US20190046656A1/en not_active Abandoned
- 2018-12-19 AU AU2018282328A patent/AU2018282328A1/en not_active Abandoned
-
2019
- 2019-04-12 US US16/382,868 patent/US20190247510A1/en not_active Abandoned
- 2019-12-06 US US16/706,174 patent/US11033634B2/en active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3790586A4 (en) * | 2018-05-08 | 2022-01-19 | Phanes Therapeutics, Inc. | ANTI-DLL3 ANTIBODIES AND USES THEREOF |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9937268B2 (en) | Anti-DLL3 antibody drug conjugates and methods of use | |
| KR102099073B1 (ko) | 항 sez6 항체들 및 사용 방법 | |
| KR20160046914A (ko) | 신규한 sez6 조절물질 및 사용방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E90F | Notification of reason for final refusal | ||
| E601 | Decision to refuse application |