JP6479660B2 - Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン - Google Patents
Ror1癌の治療および転移の阻害に使用するための抗体およびワクチンInfo
- Publication number
- JP6479660B2 JP6479660B2 JP2015528458A JP2015528458A JP6479660B2 JP 6479660 B2 JP6479660 B2 JP 6479660B2 JP 2015528458 A JP2015528458 A JP 2015528458A JP 2015528458 A JP2015528458 A JP 2015528458A JP 6479660 B2 JP6479660 B2 JP 6479660B2
- Authority
- JP
- Japan
- Prior art keywords
- ror1
- antibody
- cells
- cancer
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 206010027476 Metastases Diseases 0.000 title claims description 107
- 230000009401 metastasis Effects 0.000 title claims description 72
- 206010028980 Neoplasm Diseases 0.000 title description 130
- 201000011510 cancer Diseases 0.000 title description 79
- 229960005486 vaccine Drugs 0.000 title description 50
- 101001103039 Homo sapiens Inactive tyrosine-protein kinase transmembrane receptor ROR1 Proteins 0.000 title description 43
- 230000002401 inhibitory effect Effects 0.000 title description 9
- 101001103036 Homo sapiens Nuclear receptor ROR-alpha Proteins 0.000 title description 4
- 102100039614 Nuclear receptor ROR-alpha Human genes 0.000 title 1
- 230000027455 binding Effects 0.000 claims description 183
- 241000282414 Homo sapiens Species 0.000 claims description 59
- 235000001014 amino acid Nutrition 0.000 claims description 28
- 150000001413 amino acids Chemical class 0.000 claims description 25
- 239000003814 drug Substances 0.000 claims description 17
- 229940124597 therapeutic agent Drugs 0.000 claims description 5
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 claims description 4
- 235000013922 glutamic acid Nutrition 0.000 claims description 4
- 239000004220 glutamic acid Substances 0.000 claims description 4
- 210000004027 cell Anatomy 0.000 description 277
- 108090000765 processed proteins & peptides Proteins 0.000 description 190
- 241000699670 Mus sp. Species 0.000 description 157
- 230000014509 gene expression Effects 0.000 description 95
- 210000004072 lung Anatomy 0.000 description 77
- 125000003275 alpha amino acid group Chemical group 0.000 description 76
- 238000000034 method Methods 0.000 description 69
- 206010006187 Breast cancer Diseases 0.000 description 66
- 208000026310 Breast neoplasm Diseases 0.000 description 65
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 59
- 102000004196 processed proteins & peptides Human genes 0.000 description 57
- 241000699666 Mus <mouse, genus> Species 0.000 description 45
- 239000000427 antigen Substances 0.000 description 44
- 108091007433 antigens Proteins 0.000 description 44
- 102000036639 antigens Human genes 0.000 description 44
- 108090000623 proteins and genes Proteins 0.000 description 44
- 102000049583 human ROR1 Human genes 0.000 description 40
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 39
- 239000002671 adjuvant Substances 0.000 description 37
- 230000004083 survival effect Effects 0.000 description 37
- 238000002347 injection Methods 0.000 description 36
- 239000007924 injection Substances 0.000 description 36
- 102000004169 proteins and genes Human genes 0.000 description 34
- 241001465754 Metazoa Species 0.000 description 33
- 230000003053 immunization Effects 0.000 description 33
- 238000002649 immunization Methods 0.000 description 32
- 239000004055 small Interfering RNA Substances 0.000 description 32
- 235000018102 proteins Nutrition 0.000 description 31
- 230000029918 bioluminescence Effects 0.000 description 29
- 238000005415 bioluminescence Methods 0.000 description 29
- 102100035071 Vimentin Human genes 0.000 description 28
- 229920001184 polypeptide Polymers 0.000 description 28
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 27
- 239000012634 fragment Substances 0.000 description 27
- 238000011282 treatment Methods 0.000 description 26
- 108010065472 Vimentin Proteins 0.000 description 24
- 230000004907 flux Effects 0.000 description 24
- 230000002163 immunogen Effects 0.000 description 24
- 210000005048 vimentin Anatomy 0.000 description 24
- 102100033420 Keratin, type I cytoskeletal 19 Human genes 0.000 description 23
- 102000037865 fusion proteins Human genes 0.000 description 23
- 108020001507 fusion proteins Proteins 0.000 description 23
- 210000000988 bone and bone Anatomy 0.000 description 22
- 210000000952 spleen Anatomy 0.000 description 20
- 108060003951 Immunoglobulin Proteins 0.000 description 19
- 238000000684 flow cytometry Methods 0.000 description 19
- 102000018358 immunoglobulin Human genes 0.000 description 19
- 108020004999 messenger RNA Proteins 0.000 description 19
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 18
- 210000001744 T-lymphocyte Anatomy 0.000 description 18
- 125000000539 amino acid group Chemical group 0.000 description 18
- 206010061289 metastatic neoplasm Diseases 0.000 description 18
- 102000039446 nucleic acids Human genes 0.000 description 18
- 108020004707 nucleic acids Proteins 0.000 description 18
- 150000007523 nucleic acids Chemical class 0.000 description 18
- 101710183399 Keratin, type I cytoskeletal 19 Proteins 0.000 description 17
- 206010025323 Lymphomas Diseases 0.000 description 17
- 241000699660 Mus musculus Species 0.000 description 17
- 239000000203 mixture Substances 0.000 description 17
- 210000001519 tissue Anatomy 0.000 description 17
- 238000011830 transgenic mouse model Methods 0.000 description 17
- 230000000694 effects Effects 0.000 description 16
- 238000001727 in vivo Methods 0.000 description 16
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 15
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 15
- 239000003937 drug carrier Substances 0.000 description 15
- 238000004458 analytical method Methods 0.000 description 14
- 239000013604 expression vector Substances 0.000 description 14
- 230000030279 gene silencing Effects 0.000 description 14
- 238000003119 immunoblot Methods 0.000 description 14
- 210000004185 liver Anatomy 0.000 description 14
- 230000005012 migration Effects 0.000 description 14
- 238000013508 migration Methods 0.000 description 14
- 241000283707 Capra Species 0.000 description 13
- 206010009944 Colon cancer Diseases 0.000 description 13
- 229940098773 bovine serum albumin Drugs 0.000 description 13
- 208000029742 colonic neoplasm Diseases 0.000 description 13
- 208000004736 B-Cell Leukemia Diseases 0.000 description 12
- 208000025321 B-lymphoblastic leukemia/lymphoma Diseases 0.000 description 12
- 206010005003 Bladder cancer Diseases 0.000 description 12
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 12
- 206010033128 Ovarian cancer Diseases 0.000 description 12
- 206010061535 Ovarian neoplasm Diseases 0.000 description 12
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 12
- 208000009052 Precursor T-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 12
- 208000017414 Precursor T-cell acute lymphoblastic leukemia Diseases 0.000 description 12
- 206010060862 Prostate cancer Diseases 0.000 description 12
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 12
- 208000000453 Skin Neoplasms Diseases 0.000 description 12
- 208000029052 T-cell acute lymphoblastic leukemia Diseases 0.000 description 12
- 208000024313 Testicular Neoplasms Diseases 0.000 description 12
- 206010057644 Testis cancer Diseases 0.000 description 12
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 12
- 208000002495 Uterine Neoplasms Diseases 0.000 description 12
- 210000003719 b-lymphocyte Anatomy 0.000 description 12
- 229940079593 drug Drugs 0.000 description 12
- 238000000338 in vitro Methods 0.000 description 12
- 208000032839 leukemia Diseases 0.000 description 12
- 238000001325 log-rank test Methods 0.000 description 12
- 201000005202 lung cancer Diseases 0.000 description 12
- 208000020816 lung neoplasm Diseases 0.000 description 12
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 12
- 230000001394 metastastic effect Effects 0.000 description 12
- 201000002528 pancreatic cancer Diseases 0.000 description 12
- 208000008443 pancreatic carcinoma Diseases 0.000 description 12
- 208000017426 precursor B-cell acute lymphoblastic leukemia Diseases 0.000 description 12
- 201000000849 skin cancer Diseases 0.000 description 12
- 201000003120 testicular cancer Diseases 0.000 description 12
- 201000005112 urinary bladder cancer Diseases 0.000 description 12
- 206010046766 uterine cancer Diseases 0.000 description 12
- 238000002965 ELISA Methods 0.000 description 11
- 201000005188 adrenal gland cancer Diseases 0.000 description 11
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 11
- 210000004881 tumor cell Anatomy 0.000 description 11
- 101100038118 Mus musculus Ror1 gene Proteins 0.000 description 10
- 241000283973 Oryctolagus cuniculus Species 0.000 description 10
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 229940126601 medicinal product Drugs 0.000 description 10
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 10
- 230000001225 therapeutic effect Effects 0.000 description 10
- 239000013598 vector Substances 0.000 description 10
- 102000000905 Cadherin Human genes 0.000 description 9
- 108050007957 Cadherin Proteins 0.000 description 9
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 9
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 238000010253 intravenous injection Methods 0.000 description 9
- 229940023041 peptide vaccine Drugs 0.000 description 9
- 238000001890 transfection Methods 0.000 description 9
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 8
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 8
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 8
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000012292 cell migration Effects 0.000 description 8
- 238000002474 experimental method Methods 0.000 description 8
- 239000000499 gel Substances 0.000 description 8
- 229940127121 immunoconjugate Drugs 0.000 description 8
- 230000009545 invasion Effects 0.000 description 8
- 239000008194 pharmaceutical composition Substances 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- 241000283690 Bos taurus Species 0.000 description 7
- 241000287828 Gallus gallus Species 0.000 description 7
- 241000700159 Rattus Species 0.000 description 7
- 108091027967 Small hairpin RNA Proteins 0.000 description 7
- 102100026457 Zinc finger E-box-binding homeobox 1 Human genes 0.000 description 7
- 239000002299 complementary DNA Substances 0.000 description 7
- 239000003623 enhancer Substances 0.000 description 7
- 239000002245 particle Substances 0.000 description 7
- 230000009261 transgenic effect Effects 0.000 description 7
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 6
- 241000282326 Felis catus Species 0.000 description 6
- 241000237858 Gastropoda Species 0.000 description 6
- 101000998011 Homo sapiens Keratin, type I cytoskeletal 19 Proteins 0.000 description 6
- 101000785626 Homo sapiens Zinc finger E-box-binding homeobox 1 Proteins 0.000 description 6
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 6
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 6
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 6
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 6
- 108010058846 Ovalbumin Proteins 0.000 description 6
- 241000009328 Perro Species 0.000 description 6
- 241000288906 Primates Species 0.000 description 6
- 238000011529 RT qPCR Methods 0.000 description 6
- 241000282898 Sus scrofa Species 0.000 description 6
- 241000282458 Ursus sp. Species 0.000 description 6
- 230000001413 cellular effect Effects 0.000 description 6
- 230000005754 cellular signaling Effects 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000010790 dilution Methods 0.000 description 6
- 239000012895 dilution Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 125000005647 linker group Chemical group 0.000 description 6
- 230000003211 malignant effect Effects 0.000 description 6
- 229940092253 ovalbumin Drugs 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000001105 regulatory effect Effects 0.000 description 6
- 238000011160 research Methods 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 5
- 210000000577 adipose tissue Anatomy 0.000 description 5
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 5
- 238000003556 assay Methods 0.000 description 5
- 230000004071 biological effect Effects 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 210000002919 epithelial cell Anatomy 0.000 description 5
- 238000011156 evaluation Methods 0.000 description 5
- 210000004700 fetal blood Anatomy 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 238000001990 intravenous administration Methods 0.000 description 5
- 238000013507 mapping Methods 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 210000000056 organ Anatomy 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 210000000130 stem cell Anatomy 0.000 description 5
- 230000008685 targeting Effects 0.000 description 5
- 238000012360 testing method Methods 0.000 description 5
- 239000012646 vaccine adjuvant Substances 0.000 description 5
- 229940124931 vaccine adjuvant Drugs 0.000 description 5
- 210000003462 vein Anatomy 0.000 description 5
- 102000007469 Actins Human genes 0.000 description 4
- 108010085238 Actins Proteins 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 208000000389 T-cell leukemia Diseases 0.000 description 4
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 4
- 101150096726 TCL1 gene Proteins 0.000 description 4
- 102100034686 Tight junction protein ZO-1 Human genes 0.000 description 4
- 102100026640 Tight junction protein ZO-3 Human genes 0.000 description 4
- 230000033115 angiogenesis Effects 0.000 description 4
- 230000001580 bacterial effect Effects 0.000 description 4
- 230000000875 corresponding effect Effects 0.000 description 4
- 238000012258 culturing Methods 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 231100000517 death Toxicity 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000018109 developmental process Effects 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 239000007850 fluorescent dye Substances 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 210000004408 hybridoma Anatomy 0.000 description 4
- 210000003292 kidney cell Anatomy 0.000 description 4
- 230000001404 mediated effect Effects 0.000 description 4
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 4
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 238000010254 subcutaneous injection Methods 0.000 description 4
- 239000007929 subcutaneous injection Substances 0.000 description 4
- 238000001356 surgical procedure Methods 0.000 description 4
- 230000003442 weekly effect Effects 0.000 description 4
- 101710132601 Capsid protein Proteins 0.000 description 3
- 102000009410 Chemokine receptor Human genes 0.000 description 3
- 108050000299 Chemokine receptor Proteins 0.000 description 3
- 101710094648 Coat protein Proteins 0.000 description 3
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 3
- 241000588724 Escherichia coli Species 0.000 description 3
- 241000724791 Filamentous phage Species 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 3
- 101000802356 Homo sapiens Tight junction protein ZO-1 Proteins 0.000 description 3
- 101000785517 Homo sapiens Tight junction protein ZO-3 Proteins 0.000 description 3
- 101001103033 Homo sapiens Tyrosine-protein kinase transmembrane receptor ROR2 Proteins 0.000 description 3
- 101000702691 Homo sapiens Zinc finger protein SNAI1 Proteins 0.000 description 3
- 101710125418 Major capsid protein Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 206010027458 Metastases to lung Diseases 0.000 description 3
- 101710141454 Nucleoprotein Proteins 0.000 description 3
- 239000004677 Nylon Substances 0.000 description 3
- 101710083689 Probable capsid protein Proteins 0.000 description 3
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 3
- 102000005435 Receptor Tyrosine Kinase-like Orphan Receptors Human genes 0.000 description 3
- 108010006700 Receptor Tyrosine Kinase-like Orphan Receptors Proteins 0.000 description 3
- 108020004511 Recombinant DNA Proteins 0.000 description 3
- 238000000692 Student's t-test Methods 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- 102100039616 Tyrosine-protein kinase transmembrane receptor ROR2 Human genes 0.000 description 3
- 102100030917 Zinc finger protein SNAI1 Human genes 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 210000004100 adrenal gland Anatomy 0.000 description 3
- 230000003321 amplification Effects 0.000 description 3
- 210000004556 brain Anatomy 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 3
- 230000002596 correlated effect Effects 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 230000013020 embryo development Effects 0.000 description 3
- 238000009472 formulation Methods 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 238000003384 imaging method Methods 0.000 description 3
- 238000003125 immunofluorescent labeling Methods 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 239000007925 intracardiac injection Substances 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 238000002493 microarray Methods 0.000 description 3
- 238000010232 migration assay Methods 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 238000003199 nucleic acid amplification method Methods 0.000 description 3
- 229920001778 nylon Polymers 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 210000003049 pelvic bone Anatomy 0.000 description 3
- 238000002823 phage display Methods 0.000 description 3
- 229920002401 polyacrylamide Polymers 0.000 description 3
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 230000009257 reactivity Effects 0.000 description 3
- 230000033300 receptor internalization Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- -1 snail-1 / 2 Proteins 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 210000004989 spleen cell Anatomy 0.000 description 3
- 210000004988 splenocyte Anatomy 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 239000003053 toxin Substances 0.000 description 3
- 231100000765 toxin Toxicity 0.000 description 3
- 108700012359 toxins Proteins 0.000 description 3
- 230000035899 viability Effects 0.000 description 3
- OSJPPGNTCRNQQC-UHFFFAOYSA-N 3-phosphoglyceric acid Chemical compound OC(=O)C(O)COP(O)(O)=O OSJPPGNTCRNQQC-UHFFFAOYSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- 102100025805 Cadherin-1 Human genes 0.000 description 2
- 102100036364 Cadherin-2 Human genes 0.000 description 2
- 108091007854 Cdh1/Fizzy-related Proteins 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 102100038423 Claudin-3 Human genes 0.000 description 2
- 108090000695 Cytokines Proteins 0.000 description 2
- 102000004127 Cytokines Human genes 0.000 description 2
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- WZUVPPKBWHMQCE-UHFFFAOYSA-N Haematoxylin Chemical compound C12=CC(O)=C(O)C=C2CC2(O)C1C1=CC=C(O)C(O)=C1OC2 WZUVPPKBWHMQCE-UHFFFAOYSA-N 0.000 description 2
- 101000714537 Homo sapiens Cadherin-2 Proteins 0.000 description 2
- 101000617130 Homo sapiens Stromal cell-derived factor 1 Proteins 0.000 description 2
- 101000633054 Homo sapiens Zinc finger protein SNAI2 Proteins 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- 238000010824 Kaplan-Meier survival analysis Methods 0.000 description 2
- 102000011782 Keratins Human genes 0.000 description 2
- 108010076876 Keratins Proteins 0.000 description 2
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 2
- 206010027452 Metastases to bone Diseases 0.000 description 2
- 108050000637 N-cadherin Proteins 0.000 description 2
- 108091034117 Oligonucleotide Proteins 0.000 description 2
- 229930040373 Paraformaldehyde Natural products 0.000 description 2
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 102100021669 Stromal cell-derived factor 1 Human genes 0.000 description 2
- 238000012338 Therapeutic targeting Methods 0.000 description 2
- 108010002321 Tight Junction Proteins Proteins 0.000 description 2
- 102000000591 Tight Junction Proteins Human genes 0.000 description 2
- 102000013814 Wnt Human genes 0.000 description 2
- 108050003627 Wnt Proteins 0.000 description 2
- 102000043366 Wnt-5a Human genes 0.000 description 2
- 108700020483 Wnt-5a Proteins 0.000 description 2
- 102100029570 Zinc finger protein SNAI2 Human genes 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000000611 antibody drug conjugate Substances 0.000 description 2
- 229940049595 antibody-drug conjugate Drugs 0.000 description 2
- 230000002238 attenuated effect Effects 0.000 description 2
- 210000000270 basal cell Anatomy 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 125000000837 carbohydrate group Chemical group 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000011712 cell development Effects 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 239000006285 cell suspension Substances 0.000 description 2
- 238000012512 characterization method Methods 0.000 description 2
- 238000007385 chemical modification Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000035605 chemotaxis Effects 0.000 description 2
- 238000000546 chi-square test Methods 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 230000004087 circulation Effects 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 238000010668 complexation reaction Methods 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- XVLXYDXJEKLXHN-UHFFFAOYSA-M dioc6 Chemical compound [I-].O1C2=CC=CC=C2[N+](CCCCCC)=C1C=CC=C1N(CCCCCC)C2=CC=CC=C2O1 XVLXYDXJEKLXHN-UHFFFAOYSA-M 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 230000004547 gene signature Effects 0.000 description 2
- 238000009650 gentamicin protection assay Methods 0.000 description 2
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 150000004820 halides Chemical class 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 238000002991 immunohistochemical analysis Methods 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000000411 inducer Substances 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 210000005229 liver cell Anatomy 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 239000006166 lysate Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 108010082117 matrigel Proteins 0.000 description 2
- 235000012054 meals Nutrition 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 230000004660 morphological change Effects 0.000 description 2
- 210000005170 neoplastic cell Anatomy 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 229920002866 paraformaldehyde Polymers 0.000 description 2
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- 238000003752 polymerase chain reaction Methods 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 210000002307 prostate Anatomy 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 239000003531 protein hydrolysate Substances 0.000 description 2
- 230000006337 proteolytic cleavage Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- 238000003753 real-time PCR Methods 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 108010054624 red fluorescent protein Proteins 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229940126577 synthetic vaccine Drugs 0.000 description 2
- 125000003396 thiol group Chemical group [H]S* 0.000 description 2
- 210000001685 thyroid gland Anatomy 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000006453 vascular barrier function Effects 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- OSJPPGNTCRNQQC-UWTATZPHSA-N 3-phospho-D-glyceric acid Chemical compound OC(=O)[C@H](O)COP(O)(O)=O OSJPPGNTCRNQQC-UWTATZPHSA-N 0.000 description 1
- VZWXNOBHWODXCW-ZOBUZTSGSA-N 5-[(3as,4s,6ar)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]-n-[2-(4-hydroxyphenyl)ethyl]pentanamide Chemical compound C1=CC(O)=CC=C1CCNC(=O)CCCC[C@H]1[C@H]2NC(=O)N[C@H]2CS1 VZWXNOBHWODXCW-ZOBUZTSGSA-N 0.000 description 1
- 108010066676 Abrin Proteins 0.000 description 1
- 244000303258 Annona diversifolia Species 0.000 description 1
- 235000002198 Annona diversifolia Nutrition 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 244000063299 Bacillus subtilis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- 102100026094 C-type lectin domain family 12 member A Human genes 0.000 description 1
- 101710188619 C-type lectin domain family 12 member A Proteins 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241001092081 Carpenteria Species 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 101000654316 Centruroides limpidus Beta-toxin Cll2 Proteins 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 241000282552 Chlorocebus aethiops Species 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- 241000251730 Chondrichthyes Species 0.000 description 1
- 108090000599 Claudin-3 Proteins 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- AHCYMLUZIRLXAA-SHYZEUOFSA-N Deoxyuridine 5'-triphosphate Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 AHCYMLUZIRLXAA-SHYZEUOFSA-N 0.000 description 1
- 108090000204 Dipeptidase 1 Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 101150029707 ERBB2 gene Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000701959 Escherichia virus Lambda Species 0.000 description 1
- 102100038595 Estrogen receptor Human genes 0.000 description 1
- 206010015866 Extravasation Diseases 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 102000030782 GTP binding Human genes 0.000 description 1
- 108091000058 GTP-Binding Proteins 0.000 description 1
- 108700004714 Gelonium multiflorum GEL Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 206010053759 Growth retardation Diseases 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000882908 Homo sapiens Claudin-3 Proteins 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 206010059282 Metastases to central nervous system Diseases 0.000 description 1
- 108090000143 Mouse Proteins Proteins 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 101001082628 Mus musculus H-2 class II histocompatibility antigen gamma chain Proteins 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 102100025803 Progesterone receptor Human genes 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 101000762949 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) Exotoxin A Proteins 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 241000700157 Rattus norvegicus Species 0.000 description 1
- 208000006265 Renal cell carcinoma Diseases 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 101100311330 Schizosaccharomyces pombe (strain 972 / ATCC 24843) uap56 gene Proteins 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 108010079723 Shiga Toxin Proteins 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- YJQCOFNZVFGCAF-UHFFFAOYSA-N Tunicamycin II Natural products O1C(CC(O)C2C(C(O)C(O2)N2C(NC(=O)C=C2)=O)O)C(O)C(O)C(NC(=O)C=CCCCCCCCCC(C)C)C1OC1OC(CO)C(O)C(O)C1NC(C)=O YJQCOFNZVFGCAF-UHFFFAOYSA-N 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 101150109862 WNT-5A gene Proteins 0.000 description 1
- 108010023606 Zinc Finger E-box-Binding Homeobox 1 Proteins 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 210000001015 abdomen Anatomy 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 150000008065 acid anhydrides Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 238000011888 autopsy Methods 0.000 description 1
- 102000015736 beta 2-Microglobulin Human genes 0.000 description 1
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 1
- 102000006635 beta-lactamase Human genes 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 208000024119 breast tumor luminal A or B Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000005773 cancer-related death Effects 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000005779 cell damage Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000009614 chemical analysis method Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000000749 co-immunoprecipitation Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 239000000562 conjugate Substances 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 229940009976 deoxycholate Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000009274 differential gene expression Effects 0.000 description 1
- 210000002249 digestive system Anatomy 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- BFMYDTVEBKDAKJ-UHFFFAOYSA-L disodium;(2',7'-dibromo-3',6'-dioxido-3-oxospiro[2-benzofuran-1,9'-xanthene]-4'-yl)mercury;hydrate Chemical compound O.[Na+].[Na+].O1C(=O)C2=CC=CC=C2C21C1=CC(Br)=C([O-])C([Hg])=C1OC1=C2C=C(Br)C([O-])=C1 BFMYDTVEBKDAKJ-UHFFFAOYSA-L 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 125000002228 disulfide group Chemical group 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 230000023117 embryonic morphogenesis Effects 0.000 description 1
- 210000001671 embryonic stem cell Anatomy 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 210000003372 endocrine gland Anatomy 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- 229940011871 estrogen Drugs 0.000 description 1
- 239000000262 estrogen Substances 0.000 description 1
- 108010038795 estrogen receptors Proteins 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 230000000763 evoking effect Effects 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 230000036251 extravasation Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 230000022244 formylation Effects 0.000 description 1
- 238000006170 formylation reaction Methods 0.000 description 1
- 238000001502 gel electrophoresis Methods 0.000 description 1
- 238000003633 gene expression assay Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 230000002414 glycolytic effect Effects 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 231100000001 growth retardation Toxicity 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000019622 heart disease Diseases 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000001571 immunoadjuvant effect Effects 0.000 description 1
- 238000010185 immunofluorescence analysis Methods 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 239000000568 immunological adjuvant Substances 0.000 description 1
- 239000012133 immunoprecipitate Substances 0.000 description 1
- 230000001024 immunotherapeutic effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000005414 inactive ingredient Substances 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000005304 joining Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000005240 left ventricle Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000005244 lower chamber Anatomy 0.000 description 1
- 210000005265 lung cell Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- CSHFHJNMIMPJST-HOTGVXAUSA-N methyl (2s)-2-[[(2s)-2-[[2-[(2-aminoacetyl)amino]acetyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoate Chemical compound NCC(=O)NCC(=O)N[C@H](C(=O)N[C@@H](CC(C)C)C(=O)OC)CC1=CC=CC=C1 CSHFHJNMIMPJST-HOTGVXAUSA-N 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 238000000491 multivariate analysis Methods 0.000 description 1
- 230000035772 mutation Effects 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 210000001672 ovary Anatomy 0.000 description 1
- 238000007500 overflow downdraw method Methods 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 210000004923 pancreatic tissue Anatomy 0.000 description 1
- 238000004091 panning Methods 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 210000004197 pelvis Anatomy 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000010412 perfusion Effects 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 210000003200 peritoneal cavity Anatomy 0.000 description 1
- 210000004303 peritoneum Anatomy 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 150000004633 phorbol derivatives Chemical class 0.000 description 1
- 239000002644 phorbol ester Substances 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 230000001817 pituitary effect Effects 0.000 description 1
- 108700028325 pokeweed antiviral Proteins 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000009596 postnatal growth Effects 0.000 description 1
- 230000001124 posttranscriptional effect Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 108090000468 progesterone receptors Proteins 0.000 description 1
- 230000004557 prognostic gene signature Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000007790 scraping Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 231100001055 skeletal defect Toxicity 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000010473 stable expression Effects 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 101150018444 sub2 gene Proteins 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 230000005100 tissue tropism Effects 0.000 description 1
- 238000000954 titration curve Methods 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000004565 tumor cell growth Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- ZHSGGJXRNHWHRS-VIDYELAYSA-N tunicamycin Chemical compound O([C@H]1[C@@H]([C@H]([C@@H](O)[C@@H](CC(O)[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C(NC(=O)C=C2)=O)O)O1)O)NC(=O)/C=C/CC(C)C)[C@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1NC(C)=O ZHSGGJXRNHWHRS-VIDYELAYSA-N 0.000 description 1
- MEYZYGMYMLNUHJ-UHFFFAOYSA-N tunicamycin Natural products CC(C)CCCCCCCCCC=CC(=O)NC1C(O)C(O)C(CC(O)C2OC(C(O)C2O)N3C=CC(=O)NC3=O)OC1OC4OC(CO)C(O)C(O)C4NC(=O)C MEYZYGMYMLNUHJ-UHFFFAOYSA-N 0.000 description 1
- 238000012762 unpaired Student’s t-test Methods 0.000 description 1
- 210000000689 upper leg Anatomy 0.000 description 1
- 210000002229 urogenital system Anatomy 0.000 description 1
- 238000002255 vaccination Methods 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 238000002689 xenotransplantation Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3015—Breast
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6031—Proteins
- A61K2039/6081—Albumin; Keyhole limpet haemocyanin [KLH]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Cell Biology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Oncology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Gastroenterology & Hepatology (AREA)
- Hematology (AREA)
- Biomedical Technology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
本出願は、米国特許法119条(e)のもと、2012年8月24日に出願された米国特許出願第61/693,230号、2012年10月2日に出願された米国特許出願第61/709,055号、および2012年10月4日に出願された米国特許出願第61/709,803号に対する優先権の利益を主張するものであり、これらの内容全体は、参照により本明細書に組み込まれる。
添付の配列表の資料は、参考によりその全体が本明細書に組み込まれる。「ST−UCSD3820−1WO_ST25.txt」という名前の添付ファイルは、2013年3月14日に作成され、33Kbである。ファイルは、Windows OSを使用したコンピュータ上でMicrosoft Wordを使用してアクセスできる。
本発明は、国立衛生研究所よって授与されたP01−CA081534およびR37−CA049870、およびカリフォルニア再生医療学会のDR1−01430の下で政府の支援により行われた。アメリカ政府は、本発明において一定の権利を有する。
本発明は、概ね、受容体チロシンキナーゼ様オーファン受容体1抗体およびワクチン、ならびに転移を阻害するための方法に関する。
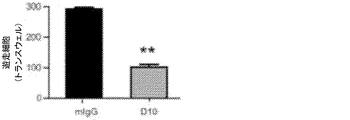
癌は、冠動脈疾患に続く人間の2番目に主要な死亡原因である。世界中で、何百万人もの人々が毎年癌で死亡している。米国だけでも、優に毎年50万人以上が癌で死亡しており、およそ毎年140万件の新しい症例が診断されている。心臓病による死亡が大幅に減少している一方で、一般的に癌に起因する死亡が増加している。受容体チロシンキナーゼ(RTK)は、細胞の分化、増殖、遊走、脈管形成、および生存において重要な役割を果たす。受容体チロシンキナーゼ様オーファン受容体1(ROR1)は、RORサブファミリーに属し、免疫グロブリン(Ig)様、フリッツルド、およびクリングルドメインを含有する細胞外ドメインを有する、進化的に保存されたI型膜タンパク質である。ROR1欠損マウスは、骨格および泌尿生殖器系内の種々の表現型の欠陥、ならびに生後の成長の遅れを示す。ROR1は、胚形成、および種々の異なる癌によって発現されるが、正常な分娩後組織によっては発現されず、腫瘍胚性表面抗原と見なすことができる。機能データは、ROR1が、悪性細胞の生存を促進するために、非カノニカルWNTシグナル伝達において機能し得ることを示唆している。さらに最近の研究は、非カノニカルWNTシグナル伝達が、乳癌転移の基底様および他のサブタイプにおいて主要な役割を果たすことを示している。ROR1ヒト乳癌の発現はまた、AKT−CREB経路の活性化および増大した腫瘍細胞の成長に関連している。
[本発明1001]
抗体99961と同じ結合特異性を有する単離された抗ROR1抗体。
[本発明1002]
hROR−1のアミノ酸130〜160に結合する、本発明1001の抗体。
[本発明1003]
ROR1アミノ酸138がhROR−1への結合のためにグルタミン酸であることを必要とする、本発明1002の抗体。
[本発明1004]
配列番号1、配列番号5、配列番号9、配列番号13、および配列番号17からなる群から選択される重鎖可変領域、および配列番号3、配列番号7、配列番号11、配列番号15、および配列番号19からなる群から選択される軽鎖可変領域を備える、本発明1001の抗体。
[本発明1005]
結合親和性を有する前記抗体が、約500pM〜約6nMの間である、本発明1001の抗体。
[本発明1006]
前記結合親和性が約800pMである、本発明1005の抗体。
[本発明1007]
99961、99961.1、99961.2、99961.3、および99961.4からなる群から選択される、本発明1001〜1006のいずれかの抗体。
[本発明1008]
転移を阻害する、本発明1001〜1007のいずれかの抗体。
[本発明1009]
ヒト、ヒト化、またはキメラ抗体である、本発明1001〜1008のいずれかの抗体。
[本発明1010]
本発明1001〜1009のいずれかの抗体をコードする単離された核酸。
[本発明1011]
ROR−1発現細胞に対するワクチンであって、抗体D10のROR−1結合領域に対して少なくとも95%の配列同一性を有するアミノ酸配列を有する、単離されたまたは合成的に産生されたペプチドの薬学的に許容される組成物を含む、ワクチン。
[本発明1012]
抗体D10の前記ROR−1結合領域のアミノ酸配列が、
である、本発明1011のワクチン。
[本発明1013]
抗体D10の前記ROR−1結合領域のアミノ酸配列が、
である、本発明1011のワクチン。
[本発明1014]
ROR−1発現細胞が癌細胞である、本発明1012のワクチン。
[本発明1015]
癌細胞が、B細胞白血病、リンパ腫、CLL、AML、B−ALL、T−ALL、卵巣癌、結腸癌、肺癌、皮膚癌、膵臓癌、精巣癌、膀胱癌、子宮癌、前立腺癌、および副腎癌からなる群から選択される、本発明1011のワクチン。
[本発明1016]
免疫原性アジュバントをさらに含む、本発明1012または1013のワクチン。
[本発明1017]
前記アジュバントは、結合ペプチドに複合体化された免疫原性担体ペプチドである、本発明1016のワクチン。
[本発明1018]
前記結合ペプチドのアミノ酸配列が、
であり、かつ前記免疫原性担体ペプチドが、キーホールリンペットヘモシアニン(KLH)、ウシ血清アルブミン、またはオボアルブミンである、本発明1017のワクチン。
[本発明1019]
前記結合ペプチドのアミノ酸配列が、
であり、かつ前記免疫原性担体ペプチドが、キーホールリンペットヘモシアニン(KLH)である、本発明1017のワクチン。
[本発明1020]
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有する、ROR1結合ペプチド。
[本発明1021]
哺乳類由来である、本発明1020の結合ペプチド。
[本発明1022]
本発明1020の結合ペプチドをコードする、単離された核酸。
[本発明1023]
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有する、ROR1結合ペプチド。
[本発明1024]
哺乳類のペプチドである、本発明1023の結合ペプチド。
[本発明1025]
本発明1023の結合ペプチドをコードする単離された核酸。
[本発明1026]
ROR−1発現癌の転移を抑制する方法であって、モノクローナル抗体99961の結合特異性を有する抗体、抗体D10のROR−1結合領域に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するペプチドから構成されるワクチン、
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチド、または
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチドを投与することによって、腫瘍細胞の上皮間葉転換を妨害することを含む、方法。
[本発明1027]
前記ROR−1発現癌が、B細胞白血病、リンパ腫、CLL、AML、B−ALL、T−ALL、卵巣癌、結腸癌、肺癌、皮膚癌、膵臓癌、精巣癌、膀胱癌、子宮癌、前立腺癌、および副腎癌からなる群から選択される、本発明1026の方法。
[本発明1028]
対象において癌を治療または予防するための方法であって、モノクローナル抗体99961の結合特異性を有する抗体、抗体D10のROR−1結合領域に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するペプチドから構成されるワクチン、
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチド、または
に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチドを前記対象に投与することを含む、方法。
[本発明1028]
癌が、B細胞白血病、リンパ腫、CLL、AML、B−ALL、T−ALL、卵巣癌、結腸癌、肺癌、皮膚癌、膵臓癌、精巣癌、膀胱癌、子宮癌、前立腺癌、および副腎癌からなる群から選択される、本発明1027の方法。
本発明は、抗ROR1抗体またはこれらの抗原結合断片、ROR1抗体免疫複合体、ROR1ペプチドワクチン、またはROR1結合ペプチドを使用して、転移を阻害する組成物および方法の発展性のある発見に関する。
本出願人は、多数の癌細胞株およびサンプル中に完全長ROR1の発現を以前発見したが、非白血病患者または正常な成人ドナーの血液もしくは脾臓リンパ球を含めた他の組織では発見せず、かつ全長ヒトROR1に対するマウス抗血清をも生成した。Fukuda et al.,Blood:ASH Annual Meeting Abstracts 2004 104,Abstract 772(2004)(参照によりその全体が本明細書に組み込まれる)。ポリペプチドおよびROR1のためのコード配列は他にも報告されており、また、この参照により本明細書に組み込まれる(例えば、受託番号NP_005003.1およびNM_005012.1を参照されたい)。CLL細胞などのWnt5aタンパク質を発現する癌細胞は、ROR1と結合するのみならず、結果として付与された生存優位性を持っている。本発明は、したがって、癌を治療または予防するために、癌細胞におけるROR−1発現の特異性を利用する手段を提供する。
ある特定の実施形態は、ヒトROR1タンパク質に対して向けられる免疫ペプチドを含む。本明細書で記載される免疫グロブリンペプチドまたは抗体は、ROR1タンパク質に結合することが示される。ROR1結合活性は、特異的であり、ROR1に対する観察された抗体の結合は、非特異的な試薬により実質的に阻止されない。これらのROR1特異的な抗体を使用して、ROR1細胞と正常な細胞との間で区別することができる。ROR1特異的な抗体はまた、ROR−1癌の治療後の応答を判定し、転移を阻害するために、ROR1癌に対する免疫療法において使用することができる。このような免疫ペプチドは、当該技術分野で既知の種々の手段で産生され得る。
ポリクローナル抗体は、ウマ、ウシ、種々の家禽、ウサギ、マウス、またはラットなどの種々の温血動物から当業者によって容易に生成され得る。簡潔に述べると、ROR1抗原は、フロイント完全または不完全アジュバントなどのアジュバントで、腹腔内注射、筋肉内注射、眼内注射、または皮下注射を介して動物を免疫化するために利用される。数回の追加免疫の後、血清のサンプルが収集され、ROR1に対する反応性について試験される。特に好ましいポリクローナル抗血清は、これらのアッセイの1つに、背景よりも少なくとも3倍大きいシグナルを与えるであろう。動物の力価は、ROR1に対するその反応性に関して安定状態に達すると、より大量の抗血清が、動物を毎週採血するかまたは放血させるかのいずれかによって容易に取得され得る。
モノクローナル抗体(mAb)技術を使用して、ROR1に対するmAbsを取得することができる。簡潔に述べると、ハイブリドーマが、ヒトROR1抗原で免疫化されたマウスからの脾臓細胞を使用して産生される。各免疫化されたマウスの脾臓細胞は、例えば、ポリエチレングリコール融合法(Galfre,G.and Milstein,C.,Methods Enzymol.,73:3−46(1981))を用いて、マウス骨髄腫Sp2/0細胞と融合される。ハイブリドーマの成長、HAT培地での選択、抗原に対するクローンのクローニングおよびスクリーニングは、標準的な手法を用いて実行される(Galfre,G.and Milstein,C.,Methods Enzymol.,73:3−46(1981))。
マウス抗体のヒト化形態は、組換えDNA技術(例えば、Queen et al.,Proc.Natl.Acad.Sci.USA 86:10029−10033,1989、および国際特許第WO90/07861号(各々が、参照により組み込まれる)を参照)によって、非ヒト抗体のCDR領域をヒト定常領域に連結することによって生成することができる。ヒト抗体は、ファージディスプレイ法を使用して取得できる(例えば、Dower et al.、国際特許第WO91/17271号、McCafferty et al.、国際特許第WO92/01047号を参照)。これらの方法で、メンバーがそれらの外表面上に異なる抗体を提示する、ファージのライブラリが産生される。抗体は、通常、FvまたはFab断片として提示される。所望の特異性を有する抗体を提示するファージは、親和性濃縮度によって選択され得る。
特定の用途のためにmAbの機能的断片を産生し使用することが所望であり得る。典型的なIgG分子の周知の基本構造は、2個の同一の軽ポリペプチド鎖(約220個のアミノ酸含有)および2個の同一の重ポリペプチド鎖(約440個のアミノ酸含有)からなる、約150,000〜200,000ダルトンの対称四量体のY字型分子である。重鎖は、少なくとも1個のジスルフィド結合により互いに連結されている。各軽鎖は、ジスルフィド結合によって隣接する重鎖に連結されている。抗原結合部位またはドメインは、Y字型の抗体分子の各腕に位置し、ジスルフィド結合された軽鎖および重鎖の各対のアミノ末端領域の間に形成される。軽鎖および重鎖のこれらのアミノ末端領域は、最初の約110個のアミノ末端のアミノ酸からなり、軽鎖および重鎖の可変領域として知られている。
本明細書に記載される抗体を組換えて産生するために、軽鎖および重鎖可変領域をコードする核酸が、任意選択により、定常領域に連結され、発現ベクターに挿入される。軽鎖および重鎖は、同じまたは異なる発現ベクター内でクローニングすることができる。例えば、配列番号1〜5の重鎖および軽鎖を、本発明に従って使用することができる。米国特許第6,287,569号(Kippsら)の教示は、その全体が参照により本明細書に組み込まれ、本明細書において提供される方法は、本発明のワクチンを作るために当業者によって容易に適合され得る。抗体鎖をコードするDNAセグメントは、抗体鎖の発現を確実にする発現ベクター(複数可)における制御配列に操作可能に連結される。このような制御配列は、シグナル配列、プロモータ、エンハンサ、および転写終結配列を含み得る。
本発明のROR1抗体またはこれらの抗原結合断片、変異体、もしくは誘導体は、「多重特異性」(例えば、二重特異性、三重特異性、またはそれ以上の多重特異性)であり得、これは、1個以上の異なる抗原(例えば、タンパク質)上に同時に存在する2個以上の異なるエピトープを認識し、それに結合することを意味する。したがって、ROR1抗体が「単一特異性」であるか、または「多重特異性」(例えば、「二重特異性」)であるかは、結合ポリペプチドが反応する異なるエピトープの数を指す。多重特異性抗体は、本明細書に記載の標的ポリペプチドの異なるエピトープに対して特異的であり得るか、または標的ポリペプチド、ならびに異種ポリペプチドまたは固体支持物質などの異種エピトープに対して特異的であり得る。
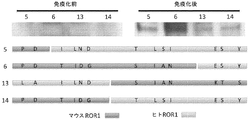
加えて、本発明は、単離または合成的に産生されたROR1結合ペプチドの薬学的に許容される組成物からなる、対象における治療のためのワクチン、癌の予防、または転移の阻害を提供する。本発明はまた、D10のROR−1結合領域に対して少なくとも95%の配列同一性を有するROR1結合ペプチドを提供する。さらなる態様において、本発明は、D10の結合領域に対して少なくとも95%、96%、97%、98%、99%、または100%配列同一性を有するROR1結合ペプチドを提供する。一態様において、D10の結合領域は、VATNGKEVVSSTGVLFVKFGPCである。追加の態様において、D10の結合領域は、EVVSSTGVLFVKFGPCである。一態様において、D10結合領域は、少なくとも22個のアミノ酸である。さらなる態様において、D10結合領域は、少なくとも10、11、12、13、14、15、16、17、18、19、20、21、または22個のアミノ酸である。
一実施形態において、本発明は、配列番号25および配列番号26からなる群から選択されるアミノ酸配列を含むROR1結合ペプチドを提供する。一態様において、ペプチドは、VATNGKEVVSSTGVLFVKFGPCに対して少なくとも95%の配列同一性を有するアミノ酸配列を有する。別の態様において、ペプチドは、EVVSSTGVLFVKFGPCに対して少なくとも95%の配列同一性を有するアミノ酸ペプチド配列を有する。別の態様において、結合ペプチドは哺乳類のものである。追加の態様において、結合ペプチドは、キメラおよび/またはヒト、マウス、ラット、ブタ、ウシ、霊長類、ネコ、イヌ、ウサギ、ヤギ、ニワトリまたはクマの起源である。
一実施形態において、本発明は、ROR−1発現癌の転移を抑制する方法を提供し、該方法は、モノクローナル抗体99961の結合特異性を有する抗体、抗体D10のROR−1結合領域に対して少なくとも95%の配列同一性を有するアミノ酸配列を有するペプチドから構成されるワクチン、VATNGKEVVSSTGVLFVKFGPCに対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチド、またはEVVSSTGVLFVKFGPCに対して少なくとも95%の配列同一性を有するアミノ酸配列を有するROR−1結合ペプチドを投与することによって腫瘍細胞の上皮間葉転換を妨害することを含む。一態様において、ROR−1発現癌は、B細胞白血病、リンパ腫、CLL、AML、B−ALL、T−ALL、卵巣癌、結腸癌、肺癌、皮膚癌、膵臓癌、精巣癌、膀胱癌、子宮癌、前立腺癌、または副腎癌である。
本明細書で使用されるとき、「治療する」または「治療」という用語は、治療的処置および予防法または予防措置の両方を指し、その目的は、癌の進行または拡大などの所望でない生理学的変化または障害を予防するまたは遅らせる(軽減する)ことである。有益なまたは所望の臨床結果としては、検出可能または検出不可能に関わらず、症状の緩和、疾患の程度の軽減、安定化した(すなわち、悪化しない)疾患の状態、疾患の進行の遅延または減速、疾患状態の改善または緩和、および寛解(部分的または全体的に関わらず)が挙げられるが、これらに限定されない。「治療」はまた、治療を受けない場合に予想される生存と比較して、延長された生存を意味し得る。治療を必要とする者としては、状態または障害を既に有する者、ならびに状態もしくは障害を有する傾向がある者、または予防されるべき状態または障害を有する者が挙げられる。
一定の治療的実施形態において、選択された抗体は典型的には、単独で、または1つ以上の組み合わせ治療剤と組み合わせて、もしくはそれと複合体化されて投与され得る抗ROR1抗体であるだろう。本明細書に記載の抗体が、治療剤として単独で投与される場合、それらは、種々の機構によって対象において有益な効果を発揮し得る。一定の実施形態において、hROR−1を特異的に結合するモノクローナル抗体は、1つ以上のhROR−1の活性を阻止するために、または1つ以上の形態のhROR−1の別の生体分子との相互作用を阻止するもしくは阻害するために、精製され、hROR−1の1つ以上の形態を中和するように患者に投与される。
元の部位から身体の遠隔領域への新生物細胞の広がりは癌関連死の90%の原因である。転移プロセスは、遠隔臓器への原発性腫瘍細胞の物理的な移動およびその後のコロニー化を含む。いくつかの悪い予後遺伝子シグネチャは、いくつかの原発性腫瘍内の細胞が、転移しやすいことを示唆している。しかしながら、転移の分子および細胞決定因子の理解は限られており、腫瘍細胞がこのイベントを体験するプロセスは、不明な点が多い。最近の注目は、現在、腫瘍の進行、運動性の獲得、浸潤性、転移、および自己複製特徴に顕著な要因と見なされる、上皮間葉転換(EMT)と呼ばれる細胞生物学的プログラムに集まっている。
582人の患者の組み合わされたコホートにおける患者から単離された乳癌細胞についてのGEOデータベースにおける、トランスクリプトームデータを調査した。これらの症例のおよそ3分の2(582人中426人)は、外科手術時点で所属リンパ節において検出可能な癌を有せず、補助療法を施与されなかった。残りの症例は、所属リンパ節において検出可能な疾患を有し、補助ホルモン療法および/または化学療法を受けた。582症例の中で、46%が再発し(n=270)、22.1ヶ月の無転移生存時間中央値を有した。我々は、患者を、彼らのROR1の相対的な癌細胞発現に基づいて3つの群に分離した。上位3分の1レベルのROR1 mRNA発現(ROR1H)を有する腫瘍を有する患者は、ROR1の下位3分の1レベル(ROR1L)または中間レベル(ROR1M)の発現を有した腫瘍を有する患者よりも、有意により短い無転移生存を有した(p<0.0001、図1A)。臓器部位別の無転移生存を検査した。ROR1H腫瘍を有する患者は、ROR1LまたはROR1M乳癌を有する患者よりも、肺(p=0.002、図45A)、骨(p=0.004、図45B)、または脳(p=0.04、図45C)へのより高い転移率を有することが見出された。ROR1H癌は、ROR1LまたはROR1Mである癌よりも、エストロゲン/プロゲステロン受容体またはHER2等の、予後良好の兆候を有する腫瘍の有意により低い割合を有した。
6個の基底細胞型乳癌細胞株および8個の管腔細胞型乳癌細胞株を含む、14個の明確に異なる乳癌上皮細胞株のROR1の発現を検査した。ROR1の発現のレベルは、基底細胞型乳癌細胞株において、概してROR1を発現しなかった管腔細胞型乳癌細胞株におけるROR1の発現のレベルと比べて、有意により高かった。その上、ROR1の相対的発現レベルは、三種陰性ERNegPRNegHER2/NeuNeg等の、攻撃的腫瘍表現型、ならびにインビトロでの高レベルの遊走能および浸潤能と相関していた。
細胞培養
乳癌細胞株MDA−MB−231、HS−578T、BT549、MDA−MB−415、MDA−MB−435s、MDA−MB−436、MDA−MB−157、MDA−MB−134、MCF7、BT−474、MDA−MB−453、SKBR3、MDA−MB−330、およびBT−483を、American Type Culture Collection(ATCC)から得、以前に記載されたように維持した(Neve et al.Cancer Cell,10:515(2006))。
ROR1のノックダウンを、以前に記載されたように(Zhang,S.Et al.,Cancer Cell,16:67(2009))、配列5′−TCC GGA TTG GAA TTC CCA TG−3′(shRNA1)、および5′−CTT TAC TAG GAG ACG CCA ATA−3′(shRNA2)を標的とすることによって達成した。非特異的なshRNA対照を、配列5′−AGC GGA CTA AGT CCA TTG C−3′を標的とすることによって作り出した。Virapower(商標)レンチウイルス発現システム(Invitrogen)を使用して、製造業者の指示に従ってshRNAを発現させた。ROR1−shRNA1およびCTRL−shRNA1構築物はまた、赤色蛍光タンパク質(RFP)もコードした。ROR1−shRNA1およびCTRL−shRNA1構築物に対するオリゴヌクレオチドを合成し(Integrated DNA Technologies)、RFP−pLKO.1ベクターに挿入した。ROR1−shRNA2およびCTRL−shRNA2構築物は、Open Biosystems(イリノイ州、ロックフォード)から購入した。乳癌細胞株の感染のためのウイルス粒子を、293−FTパッケージング細胞株のトランスフェクションによって得、トランスフェクション後48および72時間時点で細胞上清から収集した。上清を濾過し、43,000×gで遠心分離してウイルス粒子を濃縮し、それを使用して、コンフルエントに達していない培養物を、5μg/mlのポリブレンの存在下で一晩感染させた。
癌細胞を、成長因子を含まない0.2%ウシ胎仔血清(FBS)を補充したダルベッコ変法イーグル培地中で一晩馴化した。翌日、細胞をトリプシン処理し、成長因子を含まない0.2%FBS DMEM培地中に再懸濁させた。腫瘍細胞を、遊走アッセイについて1ウェル当たり25,000細胞の密度でトランスウェルインサート(3μM細孔サイズ、BD Falcon)中に、または1ウェル当たり50,000細胞の密度でマトリゲルコーティング、成長因子低減、浸潤チャンバ(8μM細孔サイズ、BD Biosciences)中に播種した。遊走アッセイについては6時間後、または浸潤アッセイについては22時間後に、ウェルをリン酸緩衝生理食塩水(PBS)で洗浄し、4%パラホルムアルデヒドで固定した。各インサートの頂端側上の細胞を、削り落とすことによって除去した。膜の基底側に遊走した細胞を染色し、ニコン倒立顕微鏡で可視化した。
総RNAを、RNeasyキット(Qiagen)を用いて精製し、2μgの各試料を使用して、高性能cDNA Reverser転写キット(ABI)を用いてcDNAを生成した。各cDNAを、ABI 7500 FastリアルタイムPCRシステム(Applied Biosystem)を使用して3系列で分析した。タンパク質発現レベルを、プロテアーゼ阻害剤(Roche)を含有する溶解緩衝液(20mM HEPES(pH 7.9)、25%グリセロール、0.5N NaCl、1mM EDTA、1%NP−40、0.5mMジチオトレイトール、および0.1%デオキシコール酸塩)中の細胞溶解物(40〜60μg)で、抗ROR1(Cell Signaling)および抗β−アクチン抗体(Cell Signaling)を使用して、免疫ブロット分析によって評価した。
乳癌細胞をフローサイトメトリーによって染色またはプール選別した。細胞を洗浄し、PBS溶液中の2%ウシ血清アルブミン(BSA)(Sigma)中に再懸濁させ、ROR1発現に対して、製造業者のプロトコルに従ってAlex488複合体化抗体(クローン4A5またはクローンD10)またはAlex488複合体化IgG2bもしくはIgG2aアイソタイプ対照を使用して染色した。フローサイトメトリーデータを、FACSCalibur血球計算器(BD Biosciences)を使用して収集し、FlowJoソフトウェアを使用して分析した。
マウス肺を4%パラホルムアルデヒドで固定し、病理組織検査のためにOCTでパラフィン包埋または凍結させた。組織切片(5μm thick)を調製し、ヘマトキシリン&エオジン(H&E)、またはp−AKT(Ser473、D9E、Cell Signaling)、p−Creb(Ser133、87G3、Cell Signaling)、CK−19(RCK108、Dako)、もしくはビメンチン(D21H3、Cell Signaling)一次抗体で染色した。画像を、Delta Vision顕微鏡を使用して収集し、SPOTソフトウェアで処理した。
メスRag−/−γ−/−マウスに、親MDA−MB−231 ROR1−shRNA1細胞(群1)、および親MDA−MB−231に対する対照shRNA細胞(群2)のプールを注射した。細胞を、100μLのPBS中、側面尾静脈を通じて静脈内注射したか(群1〜2について5×105、群3〜4について2×105)、または100μLのPBS中、心内注射によって投与した(群5〜6について1×105)。非侵襲的な生物発光撮像をIVIS 200撮像システムによって毎週行った。事前に死亡しなかったかまたは病気であるように見えなかった全てのマウスを、注射の3〜4週間後に安楽死させ、それらの肺を摘出し、10%ホルマリン中に固定した。
Pubmed GEOデータベース(GEO2603、GSE5327、GSE2034、およびGSE12276)からの582人の患者のマイクロアレイデータセットを編集した。これらのデータセットを、log2によって変換し、各マイクロアレイを全てのプローブの中央値の中心に合わせた。各患者について、無転移生存を、外科手術と転移の診断との間の時間間隔として定義した。ヒト組織におけるROR1 mRNA発現の相対レベルを、公開された遺伝子発現データセットのOncomine癌マイクロアレイデータベース分析(www.oncomine.org)によって決定した。データをlog2変換し、このうち中央値をゼロに設定し、標準偏差を1に設定した。
ROR1−shRNAまたはCTRL−shRNAがトランスフェクトされたMDA−MB−231細胞を、6〜8週齢のRag−/−γ−/−マウスに、静脈内(5×105細胞)または心内(1×105細胞)注射を介して投与して、静脈血中または動脈血中のいずれかに注射された細胞の転移可能性の差異について評価した。CTRL−shRNAがトランスフェクトされた細胞を側面尾静脈中に受けた全ての動物は、肺転移に起因して注射の32日以内に死亡した。同等の数のROR1−shRNAがトランスフェクトされた細胞を尾静脈に注射された動物は、有意により長く生存した(図4A)。CTRL−shRNAがトランスフェクトされた細胞を注射された動物は、ROR1をサイレンシングされた細胞を注射されたマウスよりも、肺においてそれぞれ21日目または28日目に19倍または60倍高い生物発光を有した(図4B)。我々はまた、別の実験において種々の時点で動物を屠殺して、転移性疾患について肺を検査した。発生期の転移巣は、CTRL−shRNAがトランスフェクトされた細胞の注射の3日後に容易に検出された一方で、ROR1がサイレンシングされた細胞を注射された動物の肺において検出することができた転移巣は、より後の時点でさえも、たとえあったとしてもほんのわずかであった(図4C〜E)。その上、CTRL−shRNAがトランスフェクトされた細胞を注射されたマウスから摘出された肺は、ROR1がサイレンシングされた細胞を注射されたマウスの肺よりも、有意により高いエクスビボ生物発光および重量中央値(それぞれ21および28日目に3倍および6倍)を有した(図4F〜G、データは図示されず)。CTRL−shRNAがトランスフェクトされた細胞を注射された動物において発達した転移巣はまた、我々がROR1がサイレンシングされた細胞を注射されたマウスにおいて検出したほんのわずかな転移巣(それはより高いレベルのCK−19およびより低いレベルのビメンチンを代わりに発現した)よりも、より高いレベルのホスホ−AKTおよびホスホ−CREBを発現し、より高い割合の増殖性細胞を有した(図47)。
ROR1の細胞外ドメインに特異的なモノクローナル抗体(mAb)を生成し、D10と指定されるものは、37℃で表面ROR1の急速な下方調節を誘導することができた(図5A)。D10によるMDA−MB−231の処理は、共焦点顕微鏡を介して評価したとき、ROR1内在化を引き起こした(図5B)。これは、ROR1の明確に異なる非交差遮断(non−cross−blocking)エピトープに特異的な異なるmAbを使用して、フローサイトメトリーを介して評価したとき、表面ROR1の有意な低減をもたらした(図5C)。D10によるMDA−MB−231の処理はまた、共免疫沈降研究においてROR1に結合した(図5E)、細胞質ビメンチンの発現も低減した(図5D)。D10による処理はまた、インビトロでMDA−MB−231の遊走および浸潤能を有意に阻害した(図5FおよびG)。D10はまた、他のROR1+癌細胞株(例えば、HS−578TおよびBT549(図9))の遊走/浸潤能を阻害することもできた。
エピトープ研究を上述のROR1抗体D10に対して行った。ヒトおよびマウスROR1の広がりを含む一連のキメラタンパク質を生成して、インビトロでROR1を下方調節し、ビメンチンの発現の低減をもたらし、癌細胞遊走(転移を形成する癌の能力の良好な代用マーカー)を阻害し得るD10によって認識される、エピトープ(複数可)をマッピングした。関与するROR1の唯一の領域は、ROR1のアミノ末端上にあるIg様ドメインである。各構築物は、キメラIg様ドメインならびにヒトCRDおよびクリングルドメイン(マウス部分は明色であり、ヒト部分は暗色である)を含有する。Ig様ドメインのみがここでは示される(図6)。これらの構築物をフリースタイル(free−style)293細胞内で発現させた。培養培地を免疫ブロットに使用し、精製タンパク質をELISAに使用した。D10 mAb抗ROR1は、ヒトROR1を認識したが、マウスROR1を認識しなかったため、これらの構築物うちのどちらが結合可能または不可能であったかを見出すことは、D10によって認識されるエピトープをマッピングする一助となり得た。結果は、抗体D10が、CRDドメインと隣接するIg様ドメインのC末端でROR1に結合することを示す(図7)。図8は、ROR1抗体4A5に対するエピトープのマッピングを示す。示されるように、4A5エピトープは、D10エピトープとは異なる。
ヒト臍帯血再構成免疫不全マウスにおいてCLL細胞に対する99961の特異的活性を実証するために、アッセイを実施した。ヒト免疫系を発生するようにヒト臍帯血(CB)細胞で再構成されたRag−/−γ−/−マウスに、新鮮なまたは凍結したCLL PBMCを腹腔内注射した。翌日、マウスに1mg/kgの99961またはD10または対照mIgGを静脈内で与えた。7日後、腹腔からのCLL PBMC細胞を採取し、フローサイトメトリーによって分析した(図13A)。データは、99961が、90%超のCLL細胞を排除し、正常なヒトB細胞またはT細胞発生には何の影響も及ぼさないことを示す(図13B、C)。
上で考察されるように、D10が、ROR1のCRDドメインに隣接するIg様ドメインのカルボキシ末端で結合することが示された。抗体4A5は、Ig様ドメイン内で異なるエピトープに結合し、生物活性を欠いている。mAbのエピトープは、ヒトとマウスのROR1との間の異なるアミノ酸のキメラROR1−細胞外および部位突然変異によって確認された。D10、4A5、および他のROR1抗体が結合するROR1の細胞外ドメインに対応するペプチド、すなわちA19、R22、およびK19を構築した。A19ペプチドは、4A5 mAbによって認識されるエピトープに対応し、R22ペプチドは、D10 mAb、99961 mAb(すなわち、VATNGKEVVSSTGVLFVKFGPC)、およびヒト化99961 mAbsによって認識されるエピトープに対応し、K19ペプチドは、ROR1特異的な他のmAbによって認識されるクリングルドメイン内の領域に対応する(図18)。3つのペプチドは各々、フロイント完全アジュバント(CFA)またはフロイント不完全アジュバント(IFA)のアジュバントにおいて、免疫化のためのキーホールリンペットヘモシアニン(KLH)とC末端で複合体化された。システイン(C)は、C末端に付加され、MBSとのKLHの複合体化のために使用された(図20)。複合体化反応は、図19に示されている。複合体化されたペプチドが、D10および99961に結合することが示される(図21)。C57BL/6およびトランスジェニックマウスは、複合体化されたペプチドで免疫化された。抗体力価は、免疫化後4週目に収集した。R22−KLHワクチンは、C57BL/6マウスまたはROR1−Tgマウスのいずれかにおいて、抗ROR1抗血清の最も高い力価を誘導した(図28)。この実験を、D10エピトープの16個のアミノ酸ペプチド、R16により再び行い、このペプチドもまた、ヒトのROR1タンパク質と反応する抗体を誘導したが、力価は一般的に、R22−KLHによって誘導されたものよりも低かった(データは示されない)。
R22−KLHを使用して、図33に示されるスキーマに従ってC57BL/6マウスを免疫化した。KLHまたはR22−KLHペプチドの第1の注射は、CFAにおいてであった。第2の注射およびその後の注射は、IFAにおいてであった。これらの動物は、紫色の矢印でマークされた日に採血された。第1の注射の日から44日後に、C57BL/6マウスは、ヒトROR1トランスジェニックマウスに由来するヒトROR1発現CLL細胞で喚起され、これはまた、T細胞白血病1(TCL1遺伝子)についてトランスジェニックであった。両方の導入遺伝子は、B細胞特異的プロモータ/エンハンサ(E−Cμ)の制御下にある。この白血病はヒトCLLに類似し、ヒト表面ROR1を発現する。
トランスジェニックマウスは、図38に示されるように、R22−KLHまたはKLHのいずれかを注射された。マウスは、B細胞特異的プロモータ/エンハンサ(E−Cμ)下でヒトROR1にトランスジェニックである。KLHまたはR22−KLHペプチドの第1の注射は、CFAにおいてであった。第2の注射およびその後の注射は、IFAにおいてであった。これらの動物は、紫色の矢印でマークされた日に採血された。第1の注射の日から44日後に、C57BL/6マウスは、ヒトROR1−Tgマウスに由来するヒトROR1発現CLL細胞で喚起され、これはまた、T細胞白血病1(TCL1遺伝子)についてトランスジェニックであった。両方の導入遺伝子は、B細胞特異的なプロモータ/エンハンサ(E−Cμ)の制御下にある。それゆえに、これらのROR1−Tgマウスは、ヒトROR1を発現するB細胞を有する。結果は、R22−KLHペプチドが、ROR1を発現するマウスにおける抗ROR1保護的免疫を誘導できることを実証し、それゆえに、自己寛容を破壊する
BALB/cマウスは、図22に示されているように、KLHまたはR22−KLHで免疫化された。このため、KLHまたはKLHと複合体化されたペプチドは各々、アジュバント(CFAまたはIFA)と乳剤を形成した。CFAは、第1の免疫化のために使用され、IFAは、その後のブーストのために使用された。採血およびペプチド注射の日が示されている。
トランスジェニックマウスは、図24に示されるように、KLHまたはR22−KLHのいずれかで免疫化された。ペプチドと複合体化されたKLHは、アジュバントと混合された(CFAまたはIFA)。CFAは、第1の免疫化のために使用され、IFAは、続くブーストのために使用された。ELISAの結果は、抗ROR1抗体の濃度は、R22−KLHで免疫化されたROR1トランスジェニックマウスに経時的に誘導されたことを示した。FACS分析は、細胞の表面上でのROR1への、R22−KLHで免疫化されたROR1トランスジェニックマウスからの抗血清の結合を確認した。
Claims (11)
- 配列番号27に示される配列を含むCDR1、配列番号28に示される配列を含むCDR2、および配列番号29に示される配列を含むCDR3を含むヒト化重鎖可変領域、ならびに配列番号30に示される配列を含むCDR1、配列番号31に示される配列を含むCDR2、および配列番号32に示される配列を含むCDR3を含むヒト化軽鎖可変領域を含む、単離された抗ROR1抗体。
- hROR−1のアミノ酸130〜160に結合する、請求項1に記載の単離された抗体。
- hROR−1アミノ酸138がhROR−1への結合のためにグルタミン酸であることを必要とする、請求項2に記載の単離された抗体。
- 配列番号5に示される配列を含むヒト化重鎖可変領域、および配列番号7に示される配列を含むヒト化軽鎖可変領域を備える、請求項1に記載の単離された抗体。
- 前記抗体が、500pM〜6nMの間の結合親和性を有する、請求項1に記載の単離された抗体。
- 転移を阻害する、請求項1〜5のいずれか一項に記載の単離された抗体。
- ヒト化抗体である、請求項1〜6のいずれか一項に記載の単離された抗体。
- 治療剤と複合体化されている、請求項1〜7のいずれか一項に記載の単離された抗体。
- IgG抗体である、請求項1〜8のいずれか一項に記載の単離された抗体。
- ヒト定常領域を含む、請求項1〜8のいずれか一項に記載の単離された抗体。
- キメラ分子である、請求項1〜8のいずれか一項に記載の単離された抗体。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261693230P | 2012-08-24 | 2012-08-24 | |
| US61/693,230 | 2012-08-24 | ||
| US201261709055P | 2012-10-02 | 2012-10-02 | |
| US61/709,055 | 2012-10-02 | ||
| US201261709803P | 2012-10-04 | 2012-10-04 | |
| US61/709,803 | 2012-10-04 | ||
| PCT/US2013/032572 WO2014031174A1 (en) | 2012-08-24 | 2013-03-15 | Antibodies and vaccines for use in treating ror1 cancers and inhibiting metastasis |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019019281A Division JP6823094B2 (ja) | 2012-08-24 | 2019-02-06 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015532644A JP2015532644A (ja) | 2015-11-12 |
| JP2015532644A5 JP2015532644A5 (ja) | 2016-06-02 |
| JP6479660B2 true JP6479660B2 (ja) | 2019-03-06 |
Family
ID=50150288
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2015528458A Active JP6479660B2 (ja) | 2012-08-24 | 2013-03-15 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
| JP2019019281A Active JP6823094B2 (ja) | 2012-08-24 | 2019-02-06 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
| JP2021001318A Active JP7138735B2 (ja) | 2012-08-24 | 2021-01-07 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
| JP2022141122A Pending JP2022174167A (ja) | 2012-08-24 | 2022-09-06 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019019281A Active JP6823094B2 (ja) | 2012-08-24 | 2019-02-06 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
| JP2021001318A Active JP7138735B2 (ja) | 2012-08-24 | 2021-01-07 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
| JP2022141122A Pending JP2022174167A (ja) | 2012-08-24 | 2022-09-06 | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン |
Country Status (20)
| Country | Link |
|---|---|
| US (4) | US9758591B2 (ja) |
| EP (3) | EP3489261B1 (ja) |
| JP (4) | JP6479660B2 (ja) |
| KR (3) | KR102134088B1 (ja) |
| CN (2) | CN104662044B (ja) |
| AU (3) | AU2013306390B2 (ja) |
| BR (1) | BR112015003757B1 (ja) |
| CA (1) | CA2881966C (ja) |
| CL (1) | CL2015000431A1 (ja) |
| DK (3) | DK2888283T3 (ja) |
| ES (2) | ES2845184T3 (ja) |
| IL (2) | IL236962B (ja) |
| MX (1) | MX362456B (ja) |
| MY (1) | MY181648A (ja) |
| NI (1) | NI201500024A (ja) |
| PH (1) | PH12015500390A1 (ja) |
| PL (2) | PL3489261T3 (ja) |
| PT (1) | PT2888283T (ja) |
| SG (1) | SG11201500730XA (ja) |
| WO (1) | WO2014031174A1 (ja) |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104662044B (zh) | 2012-08-24 | 2018-10-30 | 加利福尼亚大学董事会 | 用于治疗ror1癌症并抑制转移的抗体和疫苗 |
| EP3110429A4 (en) | 2014-02-27 | 2018-02-21 | Lycera Corporation | Adoptive cellular therapy using an agonist of retinoic acid receptor-related orphan receptor gamma & related therapeutic methods |
| JP6728061B2 (ja) | 2014-05-05 | 2020-07-22 | リセラ・コーポレイションLycera Corporation | RORγアゴニストとして用いるテトラヒドロキノリンスルホンアミド及び関連化合物ならびに疾患の治療 |
| US10189777B2 (en) | 2014-05-05 | 2019-01-29 | Lycera Corporation | Benzenesulfonamido and related compounds for use as agonists of RORγ and the treatment of disease |
| ES2876925T3 (es) * | 2014-07-29 | 2021-11-15 | Cellectis | Receptores de antígeno quiméricos específicos para ROR1 (NTRKR1) para inmunoterapia contra el cáncer |
| WO2016016343A1 (en) | 2014-07-31 | 2016-02-04 | Cellectis | Ror1 specific multi-chain chimeric antigen receptor |
| CA2959141A1 (en) | 2014-08-28 | 2016-03-03 | Bioatla, Llc | Conditionally active chimeric antigen receptors for modified t-cells |
| ES2777305T3 (es) | 2014-09-04 | 2020-08-04 | Cellectis | Receptores de antígeno quiméricos específicos de la glicoproteína trofoblástica (5T4, TPBG) para inmunoterapia contra el cáncer |
| US11952421B2 (en) | 2014-10-09 | 2024-04-09 | Bristol-Myers Squibb Company | Bispecific antibodies against CD3EPSILON and ROR1 |
| AU2016206457B2 (en) * | 2015-01-16 | 2021-11-11 | Juno Therapeutics, Inc. | Antibodies and chimeric antigen receptors specific for ROR1 |
| WO2016172726A1 (en) * | 2015-04-24 | 2016-10-27 | The Regents Of The University Of California | Modulators of ror1-ror2 binding |
| CA2982847A1 (en) | 2015-05-05 | 2016-11-10 | Lycera Corporation | Dihydro-2h-benzo[b][1,4]oxazine sulfonamide and related compounds for use as agonists of ror.gamma. and the treatment of disease |
| JP2018524284A (ja) * | 2015-05-18 | 2018-08-30 | ユーリカ セラピューティックス, インコーポレイテッド | 抗ror1抗体 |
| AU2016263513A1 (en) | 2015-05-20 | 2017-11-23 | Cellectis | Anti-GD3 specific chimeric antigen receptors for cancer immunotherapy |
| US10611740B2 (en) | 2015-06-11 | 2020-04-07 | Lycera Corporation | Aryl dihydro-2H-benzo[b][1,4]oxazine sulfonamide and related compounds for use as agonists of RORγ and the treatment of disease |
| WO2017038784A1 (ja) * | 2015-08-28 | 2017-03-09 | ロート製薬株式会社 | Ror1陽性の間葉系幹細胞及びその調製方法、ror1陽性の間葉系幹細胞を含む医薬組成物及びその調製方法、並びにror1陽性の間葉系幹細胞を用いる疾患の予防又は治療方法 |
| KR20180069067A (ko) * | 2015-10-30 | 2018-06-22 | 엔비이-테라퓨틱스 아게 | 안티-ror1 항체 |
| JP7000660B2 (ja) * | 2016-01-20 | 2022-02-04 | ザ スクリプス リサーチ インスティテュート | Ror1抗体組成物及び関連の方法 |
| MX2018008934A (es) * | 2016-01-22 | 2019-03-28 | Janssen Biotech Inc | Anticuerpos anti-ror1, anticuerpos biespecíficos ror1 x cd3 y métodos para su uso. |
| MX2018009011A (es) | 2016-02-02 | 2018-11-19 | Hutchinson Fred Cancer Res | Anticuerpos anti receptor 1 transmembrana de tirosina-proteina cinasa (ror1) y usos de los mismos. |
| US11254742B2 (en) | 2016-05-13 | 2022-02-22 | Bioatla, Inc. | Anti-Ror2 antibodies, antibody fragments, their immunoconjugates and uses thereof |
| IL299099A (en) * | 2016-06-27 | 2023-02-01 | Univ California | Combinations of cancer treatments |
| US20200338210A1 (en) * | 2016-12-22 | 2020-10-29 | Ardeagen Corporation | Anti-ror1 antibody and conjugates thereof |
| KR20200062161A (ko) * | 2017-06-23 | 2020-06-03 | 벨로스바이오 인코포레이티드 | Ror1 항체 면역접합체 |
| CN116041530A (zh) * | 2017-06-25 | 2023-05-02 | 西雅图免疫公司 | 多特异性抗体及其制备和使用方法 |
| JP7323513B2 (ja) * | 2017-06-25 | 2023-08-08 | システィミューン, インク. | 抗4-1bb抗体とその作製及び使用方法 |
| GB201710838D0 (en) | 2017-07-05 | 2017-08-16 | Ucl Business Plc | Bispecific antibodies |
| GB201710836D0 (en) | 2017-07-05 | 2017-08-16 | Ucl Business Plc | ROR1 Car T-Cells |
| GB201710835D0 (en) * | 2017-07-05 | 2017-08-16 | Ucl Business Plc | ROR1 Antibodies |
| CN111133002B (zh) | 2017-08-07 | 2024-05-24 | 恩比伊治疗股份公司 | 具有高体内耐受性的基于蒽环类药的抗体药物缀合物 |
| US20210106618A1 (en) | 2017-09-06 | 2021-04-15 | Fred Hutchinson Cancer Research Center | Methods for improving adoptive cell therapy |
| EP3697435A1 (en) | 2017-10-20 | 2020-08-26 | Fred Hutchinson Cancer Research Center | Compositions and methods of immunotherapy targeting tigit and/or cd112r or comprising cd226 overexpression |
| CN109836498A (zh) * | 2017-11-25 | 2019-06-04 | 深圳宾德生物技术有限公司 | 一种靶向ror1的单链抗体、嵌合抗原受体t细胞及其制备方法和应用 |
| GB201721802D0 (en) * | 2017-12-22 | 2018-02-07 | Almac Discovery Ltd | Ror1-specific antigen binding molecules |
| CN112041335A (zh) | 2018-02-26 | 2020-12-04 | 弗雷德哈钦森癌症研究中心 | 用于细胞免疫治疗的组合物和方法 |
| US11883492B2 (en) | 2018-03-09 | 2024-01-30 | The Regents Of The University Of California | Combination treatment of chemoresistant cancers |
| AU2019256431A1 (en) * | 2018-04-18 | 2020-11-05 | Exelixis, Inc. | Anti-ror antibody constructs |
| WO2020018964A1 (en) | 2018-07-20 | 2020-01-23 | Fred Hutchinson Cancer Research Center | Compositions and methods for controlled expression of antigen-specific receptors |
| PE20212198A1 (es) * | 2019-01-29 | 2021-11-16 | Juno Therapeutics Inc | Anticuerpos y receptores quimericos de antigenos especificos para receptor 1 huerfano tipo receptor tirosina-cinasa (ror1) |
| MX2021011494A (es) * | 2019-03-26 | 2021-12-15 | Univ California | Células t modificadas con el receptor de antígeno quimérico (t car) para el tratamiento de cánceres hematológicos y tumores sólidos. |
| BR112022015416A2 (pt) | 2020-02-07 | 2022-10-11 | Velosbio Inc | Anticorpos anti-ror1 e composições |
| CN112522206A (zh) * | 2020-12-15 | 2021-03-19 | 苏州恒康生命科学有限公司 | 一种ror1基因敲除肿瘤细胞株的构建方法及其应用 |
| GB202020154D0 (en) | 2020-12-18 | 2021-02-03 | Almac Discovery Ltd | ROR1-specific variant antigen binding molecules |
| MX2023009022A (es) | 2021-02-02 | 2023-10-23 | Numab Therapeutics AG | Anticuerpos multiespecificos con especificidad para ror1 y cd3. |
| CN117440973A (zh) * | 2021-04-09 | 2024-01-23 | 索伦托药业有限公司 | 与ror1结合的抗原结合蛋白 |
| US11806405B1 (en) | 2021-07-19 | 2023-11-07 | Zeno Management, Inc. | Immunoconjugates and methods |
| CN118043080A (zh) | 2021-08-13 | 2024-05-14 | 昆山新蕴达生物科技有限公司 | 一种基于微管抑制剂的抗体偶联药物 |
| CN117881431A (zh) | 2021-08-24 | 2024-04-12 | 昆山新蕴达生物科技有限公司 | 一种由可断裂连接子偶联的抗体偶联药物 |
| KR20240109617A (ko) | 2021-10-28 | 2024-07-11 | 라이엘 이뮤노파마, 인크. | Ror1-결합 단백질을 발현하는 세포를 배양하는 방법 |
| WO2023103854A1 (zh) | 2021-12-09 | 2023-06-15 | 昆山新蕴达生物科技有限公司 | 一种亲和力改善的抗体-药物偶联物、其制备方法及应用 |
| WO2024064952A1 (en) | 2022-09-23 | 2024-03-28 | Lyell Immunopharma, Inc. | Methods for culturing nr4a-deficient cells overexpressing c-jun |
| WO2024064958A1 (en) | 2022-09-23 | 2024-03-28 | Lyell Immunopharma, Inc. | Methods for culturing nr4a-deficient cells |
| WO2024077174A1 (en) | 2022-10-05 | 2024-04-11 | Lyell Immunopharma, Inc. | Methods for culturing nr4a-deficient cells |
Family Cites Families (217)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4474893A (en) | 1981-07-01 | 1984-10-02 | The University of Texas System Cancer Center | Recombinant monoclonal antibodies |
| US4714681A (en) | 1981-07-01 | 1987-12-22 | The Board Of Reagents, The University Of Texas System Cancer Center | Quadroma cells and trioma cells and methods for the production of same |
| US5892019A (en) | 1987-07-15 | 1999-04-06 | The United States Of America, As Represented By The Department Of Health And Human Services | Production of a single-gene-encoded immunoglobulin |
| WO1989012624A2 (en) | 1988-06-14 | 1989-12-28 | Cetus Corporation | Coupling agents and sterically hindered disulfide linked conjugates prepared therefrom |
| US4925648A (en) | 1988-07-29 | 1990-05-15 | Immunomedics, Inc. | Detection and treatment of infectious and inflammatory lesions |
| US5601819A (en) | 1988-08-11 | 1997-02-11 | The General Hospital Corporation | Bispecific antibodies for selective immune regulation and for selective immune cell binding |
| IL162181A (en) | 1988-12-28 | 2006-04-10 | Pdl Biopharma Inc | A method of producing humanized immunoglubulin, and polynucleotides encoding the same |
| US5116964A (en) | 1989-02-23 | 1992-05-26 | Genentech, Inc. | Hybrid immunoglobulins |
| US5225538A (en) | 1989-02-23 | 1993-07-06 | Genentech, Inc. | Lymphocyte homing receptor/immunoglobulin fusion proteins |
| ZA902949B (en) | 1989-05-05 | 1992-02-26 | Res Dev Foundation | A novel antibody delivery system for biological response modifiers |
| DE69029036T2 (de) | 1989-06-29 | 1997-05-22 | Medarex Inc | Bispezifische reagenzien für die aids-therapie |
| JP3068180B2 (ja) | 1990-01-12 | 2000-07-24 | アブジェニックス インコーポレイテッド | 異種抗体の生成 |
| US5314995A (en) | 1990-01-22 | 1994-05-24 | Oncogen | Therapeutic interleukin-2-antibody based fusion proteins |
| WO1991014438A1 (en) | 1990-03-20 | 1991-10-03 | The Trustees Of Columbia University In The City Of New York | Chimeric antibodies with receptor binding ligands in place of their constant region |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| US5219837A (en) | 1990-06-21 | 1993-06-15 | Trustees Of The University Of Pennsylvania | Method of stimulating myelination of cells |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| AU667460B2 (en) | 1990-10-05 | 1996-03-28 | Medarex, Inc. | Targeted immunostimulation with bispecific reagents |
| US5858725A (en) | 1990-10-10 | 1999-01-12 | Glaxo Wellcome Inc. | Preparation of chimaeric antibodies using the recombinant PCR strategy |
| ATE160379T1 (de) | 1990-10-29 | 1997-12-15 | Chiron Corp | Bispezifische antikörper, verfahren zu ihrer herstellung und deren verwendungen |
| EP1149913A1 (en) | 1990-11-09 | 2001-10-31 | GILLIES, Stephen D. | Cytokine immunoconjugates |
| WO1992019973A1 (en) | 1991-04-26 | 1992-11-12 | Surface Active Limited | Novel antibodies, and methods for their use |
| GB9115364D0 (en) | 1991-07-16 | 1991-08-28 | Wellcome Found | Antibody |
| US5843749A (en) | 1991-07-26 | 1998-12-01 | Regeneron Pharmaceuticals, Inc. | Ehk and Ror tyrosine kinases |
| CA2452130A1 (en) | 1992-03-05 | 1993-09-16 | Francis J. Burrows | Methods and compositions for targeting the vasculature of solid tumors |
| US5855885A (en) | 1993-01-22 | 1999-01-05 | Smith; Rodger | Isolation and production of catalytic antibodies using phage technology |
| US7473423B2 (en) | 1994-04-29 | 2009-01-06 | Mayo Foundation For Medical Education And Research | Human IgM antibodies, and diagnostic and therapeutic uses thereof particularly in the central nervous system |
| AU722668B2 (en) | 1994-12-30 | 2000-08-10 | King's College London | Methods for producing immunoglobulins containing protection proteins in plants and their use |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| JP4423680B2 (ja) | 1995-06-07 | 2010-03-03 | オーソ−マクニール・フアーマシユーチカル・インコーポレーテツド | Cdr−グラフト化抗組織因子抗体及びその使用 |
| US6037454A (en) | 1996-11-27 | 2000-03-14 | Genentech, Inc. | Humanized anti-CD11a antibodies |
| US6133426A (en) | 1997-02-21 | 2000-10-17 | Genentech, Inc. | Humanized anti-IL-8 monoclonal antibodies |
| AU6582698A (en) | 1997-03-19 | 1998-10-12 | Johns Hopkins University, The | Therapeutic uses of grip and grip-related molecules |
| US6287569B1 (en) | 1997-04-10 | 2001-09-11 | The Regents Of The University Of California | Vaccines with enhanced intracellular processing |
| DK1032660T3 (da) | 1997-11-17 | 2010-01-18 | Micromet Ag | Fremgangsmåde til identivicering af bindingsstedsdominans som bevarer evnen til at binde til en epitop |
| CA2325346A1 (en) | 1998-04-03 | 1999-10-14 | Chugai Seiyaku Kabushiki Kaisha | Humanized antibody against human tissue factor (tf) and process for constructing humanized antibody |
| US6897044B1 (en) | 1999-01-28 | 2005-05-24 | Biogen Idec, Inc. | Production of tetravalent antibodies |
| US6605709B1 (en) | 1999-04-09 | 2003-08-12 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to Proteus mirabilis for diagnostics and therapeutics |
| US6663863B2 (en) | 2000-03-17 | 2003-12-16 | Millennium Pharmaceuticals, Inc. | Method of inhibiting stenosis and restenosis |
| KR101155294B1 (ko) | 2000-06-16 | 2013-03-07 | 캠브리지 안티바디 테크놀로지 리미티드 | 면역특이적으로 BLyS에 결합하는 항체 |
| US6586251B2 (en) | 2000-10-31 | 2003-07-01 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US20050144655A1 (en) | 2000-10-31 | 2005-06-30 | Economides Aris N. | Methods of modifying eukaryotic cells |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US7105348B2 (en) | 2000-10-31 | 2006-09-12 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| US7214786B2 (en) | 2000-12-14 | 2007-05-08 | Kovalic David K | Nucleic acid molecules and other molecules associated with plants and uses thereof for plant improvement |
| US20090137416A1 (en) | 2001-01-16 | 2009-05-28 | Regeneron Pharmaceuticals, Inc. | Isolating Cells Expressing Secreted Proteins |
| ATE325865T1 (de) | 2001-01-16 | 2006-06-15 | Regeneron Pharma | Isolierung von sezernierte proteine exprimierenden zellen |
| US20140072980A1 (en) | 2001-01-16 | 2014-03-13 | Regeneron Pharmaceuticals, Inc. | Isolating cells expressing secreted proteins |
| US20140072979A1 (en) | 2001-01-16 | 2014-03-13 | Regeneron Pharmaceuticals, Inc. | Isolating cells expressing secreted proteins |
| WO2002096948A2 (en) | 2001-01-29 | 2002-12-05 | Idec Pharmaceuticals Corporation | Engineered tetravalent antibodies and methods of use |
| US20030020733A1 (en) | 2001-07-24 | 2003-01-30 | Yin Memphis Zhihong | Computer display having selective area magnification |
| AU2002355477B2 (en) | 2001-08-03 | 2008-09-25 | Medical Research Council | Method of identifying a consensus sequence for intracellular antibodies |
| ES2736165T3 (es) | 2001-08-23 | 2019-12-26 | Rsr Ltd | Regiones epítopo de un receptor de tirotropina (TSH), sus usos y anticuerpos para las mismas |
| US7226594B2 (en) | 2001-11-07 | 2007-06-05 | Agensys, Inc. | Nucleic acid and corresponding protein entitled 161P2F10B useful in treatment and detection of cancer |
| JP4063769B2 (ja) | 2001-12-28 | 2008-03-19 | 中外製薬株式会社 | タンパク質安定化方法 |
| ATE444308T1 (de) | 2002-02-13 | 2009-10-15 | Ludwig Inst Cancer Res | Fusionsproteine humanisierter g250-spezifischer antikörper sowie verwendungen davon |
| US7314974B2 (en) | 2002-02-21 | 2008-01-01 | Monsanto Technology, Llc | Expression of microbial proteins in plants for production of plants with improved properties |
| US7193069B2 (en) | 2002-03-22 | 2007-03-20 | Research Association For Biotechnology | Full-length cDNA |
| ES2545067T3 (es) | 2002-04-26 | 2015-09-08 | Genentech, Inc. | Purificación de proteínas basada en la no afinidad |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| WO2004009805A1 (ja) | 2002-07-19 | 2004-01-29 | Japan Science And Technology Agency | 新規抗体酵素生産方法、新規抗体酵素、およびその利用 |
| PT2891666T (pt) | 2002-10-16 | 2017-09-22 | Purdue Pharma Lp | Anticorpos que se ligam ca 125/0722p associado a células e métodos para a sua utilização |
| EP1608684A2 (en) | 2003-02-07 | 2005-12-28 | Protein Design Labs, Inc. | Amphiregulin antibodies and their use to treat cancer and psoriasis |
| US7605235B2 (en) | 2003-05-30 | 2009-10-20 | Centocor, Inc. | Anti-tissue factor antibodies and compositions |
| CA2522894C (en) | 2003-05-31 | 2013-06-25 | Micromet Ag | Pharmaceutical composition comprising a bispecific antibody specific for epcam |
| US7569389B2 (en) | 2004-09-30 | 2009-08-04 | Ceres, Inc. | Nucleotide sequences and polypeptides encoded thereby useful for modifying plant characteristics |
| WO2005035753A1 (ja) | 2003-10-10 | 2005-04-21 | Chugai Seiyaku Kabushiki Kaisha | 機能蛋白質を代替する二重特異性抗体 |
| CA2542239C (en) | 2003-10-16 | 2014-12-30 | Micromet Ag | Multispecific deimmunized cd3-binders |
| US7612179B2 (en) | 2003-11-28 | 2009-11-03 | Astrazeneca Ab | antibodies binding to a C-terminal fragment of apoliopoprotein E |
| KR20130133302A (ko) | 2003-12-10 | 2013-12-06 | 메다렉스, 인코포레이티드 | Ip―10 항체 및 그의 용도 |
| US8298532B2 (en) | 2004-01-16 | 2012-10-30 | Regeneron Pharmaceuticals, Inc. | Fusion polypeptides capable of activating receptors |
| DK1709081T3 (da) | 2004-01-16 | 2011-06-06 | Regeneron Pharma | Fusionspolypeptider, der kan aktivere receptorer |
| CA2555503C (en) | 2004-02-16 | 2018-03-27 | Micromet Ag | Humanized anti-cd3 bispecific binding molecules having reduced immunogenicity, uses and compositions relating thereto |
| CA2555820C (en) | 2004-02-19 | 2016-01-19 | Genentech, Inc. | Cdr-repaired antibodies |
| US7192709B2 (en) | 2004-03-15 | 2007-03-20 | Digigenomics Co., Ltd. | Methods for identification, assessment, prevention, and therapy of cancer |
| US7504086B2 (en) | 2004-03-31 | 2009-03-17 | Canon Kabushiki Kaisha | Structure and method for releasing substance therefrom |
| EP1735461A4 (en) * | 2004-04-06 | 2008-10-29 | Univ California | ORPHANIC RECEPTOR TYROSINE KINASE AS A TARGET IN BREAST CANCER |
| US7625561B2 (en) | 2004-04-22 | 2009-12-01 | Fraunhofer-Gesellschaft zur Förderung der angewandten Forschung e.V. | Diabody which specifically binds Streptococcus surface antigen I/II and methods of use thereof |
| WO2005105998A1 (ja) | 2004-04-27 | 2005-11-10 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | ヒト抗アミロイドβペプチド抗体およびその抗体フラグメント |
| UY28886A1 (es) | 2004-05-10 | 2005-12-30 | Boehringer Ingelheim Int | Anticuerpos que consisten en polipéptidos y derivados conprendiendo tres secuencias conteniendo respectivamente los siguientes números de seq. id: 1-3 y 4-6; 7-9 y 10-12 y 13-15 ó 16-18 |
| JP2008507592A (ja) | 2004-06-09 | 2008-03-13 | ジェネンテック・インコーポレーテッド | 環状肉芽腫又はサルコイドの治療法 |
| EP2166105A3 (en) | 2004-08-16 | 2010-04-14 | CropDesign N.V. | Plants having improved growth characteristics and method for making the same |
| TWI380996B (zh) | 2004-09-17 | 2013-01-01 | Hoffmann La Roche | 抗ox40l抗體 |
| US7910100B2 (en) | 2004-10-01 | 2011-03-22 | Max-Planck-Gesellschaft zur Forderung der Wissen | Antibodies directed to the mammalian EAG1 ion channel protein |
| AU2005318171B2 (en) | 2004-12-20 | 2011-09-29 | Crucell Holland B.V. | Binding molecules capable of neutralizing West Nile virus and uses thereof |
| MX2007008719A (es) | 2005-01-27 | 2007-09-11 | Novimmune Sa | Anticuerpos anti-interferon gamma y metodos de uso de los mismos. |
| US8088976B2 (en) | 2005-02-24 | 2012-01-03 | Monsanto Technology Llc | Methods for genetic control of plant pest infestation and compositions thereof |
| DK2143795T3 (da) | 2005-03-31 | 2011-09-19 | Biomedics Inc | Anti-CD20 monoklonalt antistof |
| JP5004154B2 (ja) | 2005-04-06 | 2012-08-22 | 一般財団法人化学及血清療法研究所 | 組換え抗ボツリヌス神経毒素抗体 |
| UA93201C2 (ru) | 2005-04-22 | 2011-01-25 | Эли Лилли Энд Компани | АНТИТЕЛО, KOTOPOE НЕЙТРАЛИЗУЕТ ЧЕЛОВЕЧЕСКИЙ TGF-b1 |
| EP1882392A4 (en) | 2005-05-10 | 2009-07-01 | Monsanto Technology Llc | GENES AND THEIR USES FOR PLANT IMPROVEMENTS |
| US7736647B2 (en) | 2005-06-15 | 2010-06-15 | Monoclonal Antibodies Therapeutics | Anti-CD71 monoclonal antibodies and uses thereof for treating malignant tumor cells |
| SG165322A1 (en) | 2005-08-31 | 2010-10-28 | Schering Corp | Engineered anti-il-23 antibodies |
| EP1948680A4 (en) | 2005-10-28 | 2010-01-13 | Univ California | METHOD AND COMPOUNDS FOR DETECTING AND ISOLATING LYMPHOMA CELLS |
| WO2008103849A2 (en) * | 2007-02-21 | 2008-08-28 | The Regents Of The University Of California | Methods and compounds for lymphoma cell detection and isolation |
| JP2009515516A (ja) | 2005-11-14 | 2009-04-16 | バイオレン・インク | 推定成熟cdrのブラスティングならびにコホートライブラリの作製およびスクリーニングによる抗体の超ヒト化 |
| CA2638801C (en) | 2006-02-14 | 2016-12-13 | Verenium Corporation | Xylanases, nucleic acids encoding them and methods for making and using them |
| WO2007102200A1 (ja) | 2006-03-07 | 2007-09-13 | Osaka University | 抗cd20モノクローナル抗体 |
| WO2007146957A2 (en) | 2006-06-13 | 2007-12-21 | Irm Llc | Ror1 as a therapeutic target for lung cancer |
| AU2007284651B2 (en) | 2006-08-09 | 2014-03-20 | Institute For Systems Biology | Organ-specific proteins and methods of their use |
| TWI454480B (zh) | 2006-08-18 | 2014-10-01 | Novartis Ag | 催乳激素受體(prlr)之專一性抗體及其用途 |
| BRPI0717431A2 (pt) | 2006-09-29 | 2013-11-12 | Oncomed Pharm Inc | Composições e métodos de diagnóstico e tratamento do câncer |
| JP5601836B2 (ja) | 2006-11-08 | 2014-10-08 | マクロジェニックス ウエスト, インコーポレイテッド | Tes7およびtes7に結合する抗体 |
| FR2909092B1 (fr) | 2006-11-24 | 2012-10-19 | Pf Medicament | Nouveaux anticorps anti-proliferation |
| WO2008076868A2 (en) | 2006-12-18 | 2008-06-26 | Abbott Laboratories | Methods and compositions related to modulation of receptor tyrosine kinase orphan receptor-1 (ror-1) |
| AU2007338670A1 (en) | 2006-12-22 | 2008-07-03 | Merck Sharp & Dohme Corp. | Antibodies to CD200R |
| WO2008097439A2 (en) | 2007-02-07 | 2008-08-14 | The Trustees Of The University Of Pennsylvania | Anti-autoimmune antibodies for treatment of pemphigus |
| US9745367B2 (en) | 2007-03-23 | 2017-08-29 | Novelmed Theraputics, Inc. | Alternative pathway specific antibodies for treating arthritis |
| US8163279B2 (en) | 2007-04-13 | 2012-04-24 | Stemline Therapeutics, Inc. | IL3Rα antibody conjugates and uses thereof |
| ATE540313T1 (de) | 2007-05-03 | 2012-01-15 | Regeneron Pharma | Identifizierung von keimbahnfähigen embryonischen stammzellen |
| EP2158215B1 (en) | 2007-05-17 | 2015-04-22 | Genentech, Inc. | Crystal structures of neuropilin fragments and neuropilin-antibody complexes |
| WO2009004822A1 (ja) | 2007-07-04 | 2009-01-08 | Forerunner Pharma Research Co., Ltd. | 抗Muc17抗体 |
| US8299318B2 (en) | 2007-07-05 | 2012-10-30 | Ceres, Inc. | Nucleotide sequences and corresponding polypeptides conferring modulated plant characteristics |
| WO2009013543A2 (en) | 2007-07-25 | 2009-01-29 | Astrazeneca Ab | Targeted binging agents directed to kdr and uses thereof - 035 |
| WO2009031230A1 (ja) | 2007-09-06 | 2009-03-12 | Osaka University | 抗cd20モノクローナル抗体 |
| US8362325B2 (en) | 2007-10-03 | 2013-01-29 | Ceres, Inc. | Nucleotide sequences and corresponding polypeptides conferring modulated plant characteristics |
| LT2211904T (lt) | 2007-10-19 | 2016-11-25 | Seattle Genetics, Inc. | Cd19 surišantys agentai ir jų panaudojimas |
| EP3211011A1 (en) | 2007-11-16 | 2017-08-30 | Nuvelo, Inc. | Antibodies to lrp6 |
| ES2834741T3 (es) | 2007-12-05 | 2021-06-18 | Chugai Pharmaceutical Co Ltd | Anticuerpo anti-NR10 y uso del mismo |
| JP5761997B2 (ja) | 2007-12-14 | 2015-08-12 | ブリストル−マイヤーズ・スクイブ・カンパニー | ヒトox40受容体に対する結合分子 |
| WO2009079585A2 (en) | 2007-12-17 | 2009-06-25 | Dyax Corp. | Compositions and methods for treating osteolytic disorders comprising mmp-14 binding proteins |
| WO2009085200A2 (en) | 2007-12-21 | 2009-07-09 | Amgen Inc. | Anti-amyloid antibodies and uses thereof |
| CN101932333A (zh) | 2007-12-26 | 2010-12-29 | 瓦西尼斯公司 | 抗c35抗体联合疗法和方法 |
| WO2009097128A1 (en) | 2008-01-29 | 2009-08-06 | Ludwig Institute For Cancer Research Ltd. | Membrane transporter napi2b (slc34a2) epitope for antibody therapy, antibodies directed thereto, and target for cancer therapy |
| US9029636B2 (en) | 2008-02-05 | 2015-05-12 | Monsanto Technology Llc | Isolated novel nucleic acid and protein molecules from soy and methods of using those molecules to generate transgenic plants with enhanced agronomic traits |
| AR070316A1 (es) | 2008-02-07 | 2010-03-31 | Merck & Co Inc | Antagonistas de pcsk9 (proproteina subtilisina-kexina tipo 9) |
| CN101970499B (zh) | 2008-02-11 | 2014-12-31 | 治疗科技公司 | 用于肿瘤治疗的单克隆抗体 |
| WO2009111450A2 (en) | 2008-03-03 | 2009-09-11 | Dyax Corp. | Metalloproteinase 9 binding proteins |
| US8168757B2 (en) | 2008-03-12 | 2012-05-01 | Merck Sharp & Dohme Corp. | PD-1 binding proteins |
| JP5608635B2 (ja) | 2008-04-07 | 2014-10-15 | カロバイオス ファーマシューティカルズ インコーポレイティッド | 心不全処置のためのgm−csfの中和方法 |
| WO2009129538A2 (en) | 2008-04-18 | 2009-10-22 | Xencor, Inc. | Human equivalent monoclonal antibodies engineered from nonhuman variable regions |
| CA2722466A1 (en) | 2008-04-29 | 2009-11-05 | Tariq Ghayur | Dual variable domain immunoglobulins and uses thereof |
| US8410251B2 (en) | 2008-06-20 | 2013-04-02 | National University Corporation Okayama University | Antibody against calcified globule and use of the same |
| EP2313435A4 (en) | 2008-07-01 | 2012-08-08 | Aveo Pharmaceuticals Inc | FIBROBLAST GROWTH FACTOR RECEPTOR 3 (FGFR3) BINDING PROTEINS |
| KR20110043643A (ko) | 2008-07-02 | 2011-04-27 | 이머전트 프로덕트 디벨롭먼트 시애틀, 엘엘씨 | 인터루킨 6 면역치료제 |
| PE20141432A1 (es) | 2008-07-16 | 2014-10-18 | Inst Research In Biomedicine | Anticuerpos neutralizantes de citomegalovirus humano |
| US8710022B2 (en) | 2008-07-18 | 2014-04-29 | National University Corporation Nagoya University | Cell proliferation inhibitor |
| MX2011000778A (es) | 2008-07-31 | 2011-03-15 | Basf Plant Science Gmbh | Plantas con caracteristicas modificadas de crecimiento y un metodo para obtenerlas. |
| WO2010021874A2 (en) | 2008-08-20 | 2010-02-25 | Centocor Ortho Biotech Inc. | Engineered anti-il-13 antibodies, compositions, methods and uses |
| CN102245773B (zh) | 2008-11-03 | 2014-08-27 | 阿莱斯亚生物疗法股份有限公司 | 特异性地阻滞肿瘤抗原的生物活性的抗体 |
| US8183346B2 (en) | 2008-12-05 | 2012-05-22 | Eli Lilly And Company | Anti-ferroportin 1 monoclonal antibodies and uses thereof |
| US9012723B2 (en) | 2009-01-16 | 2015-04-21 | Monsanto Technology Llc | Isolated novel acid and protein molecules from soy and methods of using those molecules to generate transgene plants with enhanced agronomic traits |
| US8673307B1 (en) | 2009-03-09 | 2014-03-18 | The Rockefeller University | HIV-1 anti-core neutralizing antibodies that target a conformational epitope within the ALPHA5-helix of GP120 |
| TWI466681B (zh) | 2009-03-20 | 2015-01-01 | Amgen Inc | α4β7雜二聚體專一性拮抗抗體 |
| US8524869B2 (en) | 2009-03-24 | 2013-09-03 | Teva Biopharmaceuticals Usa, Inc. | Humanized antibodies against LIGHT and uses thereof |
| HUE025726T2 (en) | 2009-03-25 | 2016-04-28 | Genentech Inc | Anti-FGFR3 antibodies and their use |
| US8722046B2 (en) | 2009-04-08 | 2014-05-13 | The United States Of America As Represented By The Secretary Of The Army | Human monoclonal antibodies protective against bubonic plague |
| ES2641612T3 (es) | 2009-04-17 | 2017-11-10 | Immunas Pharma, Inc. | Anticuerpos que se unen específicamente a oligómeros de beta A y uso de los mismos |
| US9316646B2 (en) * | 2009-04-23 | 2016-04-19 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Anti-human ROR1 antibodies |
| EP2424567B1 (en) | 2009-04-27 | 2018-11-21 | OncoMed Pharmaceuticals, Inc. | Method for making heteromultimeric molecules |
| IN2012DN01328A (ja) | 2009-08-13 | 2015-06-05 | Crucell Holland Bv | |
| JP6109571B2 (ja) | 2009-08-28 | 2017-04-05 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 複数種のCCケモカインと結合するantikine抗体 |
| WO2011038290A2 (en) | 2009-09-25 | 2011-03-31 | The U. S. A., As Represented By The Secretary, Department Of Health And Human Services | Neutralizing antibodies to hiv-1 and their use |
| US8926976B2 (en) | 2009-09-25 | 2015-01-06 | Xoma Technology Ltd. | Modulators |
| US8580714B2 (en) | 2009-10-14 | 2013-11-12 | Janssen Biotech, Inc. | Methods of affinity maturing antibodies |
| CN102596996B (zh) | 2009-10-30 | 2014-06-18 | 东丽株式会社 | 对丙型肝炎病毒(hcv)具有感染抑制活性的抗体及其用途 |
| WO2011054007A1 (en) | 2009-11-02 | 2011-05-05 | Oxford Biotherapeutics Ltd. | Ror1 as therapeutic and diagnostic target |
| KR102126964B1 (ko) | 2009-11-11 | 2020-06-25 | 가니메드 파마슈티칼스 게엠베하 | 클라우딘 6 특이적 항체 |
| ES2594893T3 (es) | 2009-12-16 | 2016-12-23 | Abbvie Biotherapeutics Inc. | Anticuerpos anti HER2 y sus usos |
| ES2635316T3 (es) | 2009-12-18 | 2017-10-03 | Kancera Ab | Anticuerpos contra ROR1 que pueden inducir muerte celular de LLC |
| EP2534257B1 (en) | 2010-02-12 | 2017-09-27 | Oncomed Pharmaceuticals, Inc. | Methods for identifying and isolating cells expressing a polypeptide |
| US8609095B2 (en) | 2010-03-04 | 2013-12-17 | Symphogen A/S | Anti-HER2 antibodies and compositions |
| JP6039428B2 (ja) | 2010-03-04 | 2016-12-07 | シムフォゲン・アクティーゼルスカブSymphogen A/S | 抗her2抗体および組成物 |
| KR101647871B1 (ko) | 2010-03-05 | 2016-08-11 | 에프. 호프만-라 로슈 아게 | 인간 csf-1r에 대한 항체 및 이의 용도 |
| WO2011123859A1 (en) | 2010-04-02 | 2011-10-06 | Skyfire Labs, Inc. | Assisted hybrid mobile browser |
| WO2011125015A2 (en) | 2010-04-05 | 2011-10-13 | Bar-Ilan University | Protease-activatable pore-forming polypeptides |
| CA2799746C (en) | 2010-05-17 | 2020-11-24 | Sai Reddy | Rapid isolation of monoclonal antibodies from animals |
| AR081434A1 (es) | 2010-06-10 | 2012-08-29 | Lilly Co Eli | Anticuerpo del peptido relacionado con el gen calcitonina (cgrp), composicion farmaceutica que lo comprende, uso de dicho anticuerpo para preparar un medicamento util para tratar dolor de osteoartritis o migranas y fragmento de union a antigeno de dicho anticuerpo |
| JP2012021943A (ja) | 2010-07-16 | 2012-02-02 | National Cancer Center | 子宮体がんの検査方法、子宮体がんの検査薬、並びに子宮体がん抗原に対する抗体 |
| US9163258B2 (en) | 2010-07-23 | 2015-10-20 | Fred Hutchinson Cancer Research Center | Method for the treatment of obesity |
| CN103221429A (zh) | 2010-09-22 | 2013-07-24 | 诺沃—诺迪斯克有限公司 | 治疗因子viii抗体 |
| WO2012045085A1 (en) | 2010-10-01 | 2012-04-05 | Oxford Biotherapeutics Ltd. | Anti-rori antibodies |
| EA201390472A1 (ru) | 2010-10-29 | 2014-02-28 | Иммьюноджен, Инк. | Новые молекулы, связывающиеся с egfr, и их иммуноконъюгаты |
| JO3756B1 (ar) | 2010-11-23 | 2021-01-31 | Regeneron Pharma | اجسام مضادة بشرية لمستقبلات الجلوكاجون |
| EP2455403A1 (en) | 2010-11-23 | 2012-05-23 | Pierre Fabre Medicament | Homogeneous humanized antibodies against JAM-A that inhibit proliferation |
| WO2012075158A1 (en) * | 2010-12-01 | 2012-06-07 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Chimeric rabbit/human ror1 antibodies |
| GB201020995D0 (en) | 2010-12-10 | 2011-01-26 | Bioinvent Int Ab | Biological materials and uses thereof |
| KR102320178B1 (ko) | 2011-01-06 | 2021-11-02 | 다케다 파머수티컬 컴패니 리미티드 | 혈장 칼리크레인 결합 단백질 |
| EP2663579B1 (en) * | 2011-01-14 | 2017-04-26 | The Regents of the University of California | Therapeutic antibodies against ror-1 protein and methods for use of same |
| EP2675478A4 (en) | 2011-02-14 | 2015-06-10 | Theraclone Sciences Inc | COMPOSITIONS AND METHODS FOR THE THERAPY AND DIAGNOSIS OF GRIP |
| WO2012118693A1 (en) | 2011-02-28 | 2012-09-07 | Northshore University Healthsystem | Methods of diagnosing clostridium difficile infection |
| DK3549949T5 (da) | 2011-04-22 | 2024-09-02 | Wyeth Llc | Sammensætninger vedrørende et mutant Clostridium-difficile-toksin og fremgangsmåder dertil |
| DK3026064T3 (en) | 2011-05-13 | 2019-01-14 | Ganymed Pharmaceuticals Gmbh | ANTIBODIES FOR TREATMENT OF CANCER EXPRESSING CLAUDIN 6 |
| WO2013019730A1 (en) | 2011-07-29 | 2013-02-07 | The Washington University | Antibodies to tip-1 and grp78 |
| CA2844289C (en) | 2011-08-12 | 2020-01-14 | Omeros Corporation | Anti-fzd10 monoclonal antibodies and methods for their use |
| US8858941B2 (en) | 2011-09-23 | 2014-10-14 | Oncomed Pharmaceuticals, Inc. | VEGF/DLL4 binding agents and uses thereof |
| BR112014009069A2 (pt) | 2011-10-13 | 2020-10-27 | Bristol-Myers Squibb Company | polipeptídeos de anticorpo que antagonizam cd40l |
| EP2589609A1 (en) | 2011-11-03 | 2013-05-08 | Pierre Fabre Medicament | Antigen binding protein and its use as addressing product for the treatment of cancer |
| EP2617319A1 (en) | 2012-01-17 | 2013-07-24 | Braun GmbH | Head portion and handle portion of an oral care device |
| CA2864864C (en) | 2012-02-21 | 2020-05-12 | Toray Industries, Inc. | Pharmaceutical composition for treatment and/or prevention of cancer |
| RU2631804C2 (ru) | 2012-02-21 | 2017-09-26 | Торэй Индастриз, Инк. | Фармацевтическая композиция для лечения или профилактики рака |
| CN104520324A (zh) | 2012-02-24 | 2015-04-15 | 施特姆森特Rx股份有限公司 | Dll3调节剂及其使用方法 |
| JP6280031B2 (ja) | 2012-03-29 | 2018-02-14 | 中外製薬株式会社 | 抗lamp5抗体およびその利用 |
| PL2832366T3 (pl) | 2012-03-30 | 2018-04-30 | Toray Industries, Inc. | Kompozycja farmaceutyczna do leczenia i/lub zapobiegania rakowi pęcherzyka żółciowego |
| ES2656620T3 (es) | 2012-03-30 | 2018-02-27 | Toray Industries, Inc. | Composición farmacéutica para el tratamiento y/o la prevención del cáncer de hígado |
| WO2013152020A1 (en) | 2012-04-03 | 2013-10-10 | Novelmed Therapeutics, Inc. | Humanized and chimeric anti-factor bb antibodies and uses thereof |
| AU2013256596A1 (en) | 2012-05-01 | 2014-10-09 | Genentech, Inc. | Anti-PMEL17 antibodies and immunoconjugates |
| WO2013172961A1 (en) | 2012-05-14 | 2013-11-21 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| CN103421113B (zh) | 2012-05-22 | 2018-01-19 | 武汉华鑫康源生物医药有限公司 | 抗BLyS抗体 |
| JO3462B1 (ar) | 2012-08-22 | 2020-07-05 | Regeneron Pharma | أجسام مضادة بشرية تجاه gfr?3 وطرق لاستخدامها |
| CN104662044B (zh) * | 2012-08-24 | 2018-10-30 | 加利福尼亚大学董事会 | 用于治疗ror1癌症并抑制转移的抗体和疫苗 |
| CN103792364B (zh) | 2012-10-31 | 2016-06-08 | 张宝弘 | 用于检测外周血中循环肿瘤细胞ror1蛋白的试剂及其应用 |
| TWI675044B (zh) | 2012-11-14 | 2019-10-21 | 美商再生元醫藥公司 | 重組細胞表面捕捉蛋白質 |
| HUE043851T2 (hu) | 2013-02-22 | 2019-09-30 | Abbvie Stemcentrx Llc | Anti-DLL3-antitest-PBD konjugátumok és alkalmazásuk |
| EP2789630A1 (en) | 2013-04-09 | 2014-10-15 | EngMab AG | Bispecific antibodies against CD3e and ROR1 |
| WO2014174111A1 (en) | 2013-04-26 | 2014-10-30 | Pierre Fabre Medicament | Axl antibody-drug conjugate and its use for the treatment of cancer |
| PE20151926A1 (es) | 2013-05-20 | 2016-01-07 | Genentech Inc | Anticuerpos de receptores de antitransferrina y metodos de uso |
| WO2015014376A1 (en) | 2013-07-31 | 2015-02-05 | Biontech Ag | Diagnosis and therapy of cancer involving cancer stem cells |
| SG11201601375VA (en) | 2013-08-28 | 2016-03-30 | Stemcentrx Inc | Engineered anti-dll3 conjugates and methods of use |
| RU2016122041A (ru) | 2013-11-06 | 2017-12-11 | ЭББВИ СТЕМСЕНТРКС ЭлЭлСи | Новые анти-клаудин антитела и способы их применения |
| RU2725520C2 (ru) | 2013-12-11 | 2020-07-02 | Регенерон Фармасьютикалс, Инк. | Способы и композиции для направленной модификации генома |
| PE20160712A1 (es) | 2013-12-13 | 2016-07-26 | Genentech Inc | Anticuerpos e inmunoconjugados anti-cd33 |
| DK3736292T3 (da) | 2013-12-17 | 2024-07-22 | Genentech Inc | Anti-CD3-antistoffer og fremgangsmåder til anvendelse |
| AU2014370404A1 (en) | 2013-12-24 | 2016-07-07 | Novelmed Therapeutics, Inc. | Compositions and methods of treating ocular diseases |
| US10308721B2 (en) | 2014-02-21 | 2019-06-04 | Abbvie Stemcentrx Llc | Anti-DLL3 antibodies and drug conjugates for use in melanoma |
| RS58627B2 (sr) | 2014-04-01 | 2022-06-30 | Biontech Cell&Gene Therapies Gmbh | Klaudin-6-specifični imuno receptori i t-ćelijski epitopi |
| ES2764110T3 (es) | 2014-04-25 | 2020-06-02 | Pf Medicament | Conjugado anticuerpo-fármaco y su utilización para el tratamiento del cáncer |
-
2013
- 2013-03-15 CN CN201380045363.0A patent/CN104662044B/zh active Active
- 2013-03-15 US US14/422,519 patent/US9758591B2/en active Active
- 2013-03-15 PT PT13831099T patent/PT2888283T/pt unknown
- 2013-03-15 MX MX2015002337A patent/MX362456B/es active IP Right Grant
- 2013-03-15 KR KR1020187037595A patent/KR102134088B1/ko active IP Right Grant
- 2013-03-15 EP EP18194705.2A patent/EP3489261B1/en active Active
- 2013-03-15 CA CA2881966A patent/CA2881966C/en active Active
- 2013-03-15 ES ES18194705T patent/ES2845184T3/es active Active
- 2013-03-15 WO PCT/US2013/032572 patent/WO2014031174A1/en active Application Filing
- 2013-03-15 EP EP20202481.6A patent/EP3838923B1/en active Active
- 2013-03-15 PL PL18194705T patent/PL3489261T3/pl unknown
- 2013-03-15 CN CN201811155306.9A patent/CN109369808B/zh active Active
- 2013-03-15 DK DK13831099.0T patent/DK2888283T3/en active
- 2013-03-15 EP EP13831099.0A patent/EP2888283B1/en active Active
- 2013-03-15 AU AU2013306390A patent/AU2013306390B2/en active Active
- 2013-03-15 PL PL13831099T patent/PL2888283T3/pl unknown
- 2013-03-15 DK DK18194705.2T patent/DK3489261T3/da active
- 2013-03-15 JP JP2015528458A patent/JP6479660B2/ja active Active
- 2013-03-15 MY MYPI2015700353A patent/MY181648A/en unknown
- 2013-03-15 KR KR1020157006420A patent/KR101935088B1/ko active IP Right Grant
- 2013-03-15 DK DK20202481.6T patent/DK3838923T3/da active
- 2013-03-15 SG SG11201500730XA patent/SG11201500730XA/en unknown
- 2013-03-15 KR KR1020207018220A patent/KR102312856B1/ko active IP Right Grant
- 2013-03-15 BR BR112015003757-7A patent/BR112015003757B1/pt active IP Right Grant
- 2013-03-15 ES ES13831099T patent/ES2702315T3/es active Active
-
2015
- 2015-01-28 IL IL236962A patent/IL236962B/en active IP Right Grant
- 2015-02-23 NI NI201500024A patent/NI201500024A/es unknown
- 2015-02-23 CL CL2015000431A patent/CL2015000431A1/es unknown
- 2015-02-23 PH PH12015500390A patent/PH12015500390A1/en unknown
-
2017
- 2017-06-09 US US15/619,119 patent/US10344096B2/en active Active
-
2018
- 2018-10-04 AU AU2018241099A patent/AU2018241099B2/en active Active
-
2019
- 2019-01-02 IL IL264057A patent/IL264057B/en active IP Right Grant
- 2019-02-06 JP JP2019019281A patent/JP6823094B2/ja active Active
- 2019-05-14 US US16/412,202 patent/US11312787B2/en active Active
-
2020
- 2020-11-10 AU AU2020267172A patent/AU2020267172A1/en not_active Abandoned
-
2021
- 2021-01-07 JP JP2021001318A patent/JP7138735B2/ja active Active
-
2022
- 2022-03-16 US US17/696,776 patent/US20230110249A1/en active Pending
- 2022-09-06 JP JP2022141122A patent/JP2022174167A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6823094B2 (ja) | Ror1癌の治療および転移の阻害に使用するための抗体およびワクチン | |
| JP5219827B2 (ja) | invivoで抗腫瘍活性を有する抗ヒトDlk−1抗体 | |
| US20030096285A1 (en) | Identifying anti-tumor targets or agents by lipid raft immunization and proteomics | |
| WO2016133059A1 (ja) | Fstl1を利用した抗がん剤・転移抑制剤およびその併用剤 | |
| US20190256609A1 (en) | Novel monoclonal antibodies prevent cell surface protein shedding and block tumor growth | |
| JPWO2002029090A1 (ja) | 1175位チロシンがリン酸化したKDR/Flk−1に対する情報伝達分子の結合を阻害する物質およびその利用方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160309 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160407 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170308 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170606 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170905 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180109 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180406 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180607 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180906 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20181204 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181206 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20190108 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20190206 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6479660 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |