JP2016041069A - ヒトil−4受容体に対する高親和性ヒト抗体 - Google Patents
ヒトil−4受容体に対する高親和性ヒト抗体 Download PDFInfo
- Publication number
- JP2016041069A JP2016041069A JP2015199976A JP2015199976A JP2016041069A JP 2016041069 A JP2016041069 A JP 2016041069A JP 2015199976 A JP2015199976 A JP 2015199976A JP 2015199976 A JP2015199976 A JP 2015199976A JP 2016041069 A JP2016041069 A JP 2016041069A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- antibody
- hil
- amino acid
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/06—Antibacterial agents for tuberculosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Epidemiology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Endocrinology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Dermatology (AREA)
- Pain & Pain Management (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Urology & Nephrology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Reproductive Health (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Transplantation (AREA)
- Neurosurgery (AREA)
Abstract
【解決手段】特定のアミノ酸配列を含むヒトインターロイキン−4受容体(hIL−4R)に特異的に結合する、抗体又はその抗原結合フラグメントであって、特定のアミノ酸配列を含む重鎖可変領域(HCVR)及び軽鎖可変領域(LCVR)を含む、上記抗体又は抗原結合フラグメント。
【選択図】なし
Description
して機能を達成するように、例えば残ったエフェクター機能をなくすように改変され得る(Reddy et al.(2000)J.Immunol.164:1925−1933)。
)に特異的に結合する抗体又はその抗原結合フラグメントを提供する。より特定の実施態様において、抗体又はその抗原結合部分は、約200pM若しくはそれ以下、約150若しくはそれ以下、約100pM若しくはそれ以下、又は約50pMのKDを示す。種々の
実施態様において、抗体又は抗原結合フラグメントは、ルシフェラーゼバイオアッセイにより測定した場合に約100pM若しくはそれ以下のIC50でhIL−4活性を遮断する。より特定の実施態様において、抗体又は抗原結合フラグメントは、STAT6ルシフェラーゼバイオアッセイにより測定した場合に約50pM若しくはそれ以下、約30pM若しくはそれ以下、又は約25pM若しくはそれ以下のIC50を示す。種々の実施態様において、抗体又は抗原結合フラグメントは、STAT6ルシフェラーゼバイオアッセイにより測定した場合に、約100pM若しくはそれ以下、約90pM若しくはそれ以下、約50pM若しくはそれ以下、又は約20pM若しくはそれ以下のIC50でhIL−13活性を遮断する。
分子は、配列番号9、19、23、33、43、47、57、67、71、81、91、95、105、115、119、129、139、143、153、163、167、177、187、191、201、211、215、225、235、239、249、259及び263からなる群より選択される配列、又は少なくとも95%の相同性を有するそれらの実質的に同一な配列である。
グメントを提供する。これらのHCDR1/HCDR2/HCDR3/LCDR1/LCDR2/LCDR3配列を有する典型的な抗体としては、H4H098P(配列番号:148/150/152/156/158/160)、H4H083P(配列番号:196/198/200/204/206/208)、及びH4H095P(配列番号:4/6/8/12/14/16)と呼ばれる抗体が挙げられる。
(ダイマー基質);及び約10pM若しくはそれ以下(25pMダイマー基質)又は約100pM若しくはそれ以下(200pMモノマー基質)のIC50を特徴とし、これはhIL−4及びhIL−13活性の両方を約30pM若しくはそれ以下のIC50(バイオアッセイで測定された場合)で遮断することができ、そしてサルIL−4Rと交差反応する。
ダイマー基質);及び約40pM若しくはそれ以下(25pMダイマー基質)又は約100pM若しくはそれ以下(200pMモノマー基質)のIC50を特徴とし、これはhIL−4及びhIL−13活性の両方を約100pM若しくはそれ以下のIC50(バイオアッセイで測定された場合)で遮断することができる。
KD(ダイマー基質);並びに約10pM若しくはそれ以下のIC50(25pMダイマー
基質)又は約90pM若しくはそれ以下のIC50(200pMモノマー基質)を特徴とし、これは、hIL−4及びhIL−13活性の両方を約25pM若しくはそれ以下のIC50(バイオアッセイで測定された場合)で遮断することができ、そしてサルIL−4Rと交差反応しない。
=Asp又はArg;X6=Asp又はSer;X7=Tyr;そしてX8=Ala又はG
lyであり;HCDR2は式X1−X2−X3−X4−X5−X6−X7−X8(配列番号266)のアミノ酸配列を含み、式中X1=Ile又はLeu、X2=Ser、X3=Gly、T
yr又はArg、X4=Ser、Asp又はThr、X5=Gly又はSer、X6=Gl
y、Ser又はVal、X7=Ser又はAsn、そしてX8=Thr、Lys又はIleであり;HCDR3は式X1−X2−X3−X4−X5−X6−X7−X8−X9−X10−X11−
X12−X13−X14−X15−X16−X17−X18(配列番号267)のアミノ酸配列を含み、式中X1=Ala、X2=Lys、X3=Asp、Glu又はTrp、X4=Gly又はArg、X5=Leu、Thr又はArg、X6=Gly、Arg又はSer、X7=Ile又
はGly、X8=Thr、Phe又はTyr、X9=Ile、Asp又はPhe、X10=Arg、Tyr又はAsp、X11=Pro、Tyrであるか又は存在せず、X12=Argであるか又は存在せず、X13=Tyrであるか又は存在せず、X14=Tyrであるか又は存在せず、X15=Glyであるか又は存在せず、X16=Leuであるか又は存在せず、X17=Aspであるか又は存在せず、そしてX18=Valであるか又は存在せず;LCDR1は式X1−X2−X3−X4−X5−X6−X7−X8−X9−X10−X11(配列番号268)の
アミノ酸配列を含み、式中X1=Gln、X2=Asp、Ser又はVal、X3=Ile
又はLeu、X4=Ser、Leu又はAsn、X5=Asn、Tyr又はIle、X6=
Trp、Ser又はTyr;X7=Ileであるか又は存在せず;X8=Glyであるか又は存在せず;X9=Tyrであるか又は存在せず;X10=Asnであるか又は存在せず;
そしてX11=Tyrであるか又は存在せず;LCDR2は式X1−X2−X3(配列番号2
69)のアミノ酸配列を含み、式中X1=Leu、Ala又はVal、X2=Ala又はGly、そしてX3=Serであり;そしてLCDR3は式X1−X2−X3−X4−X5−X6
−X7−X8−X9(配列番号270)のアミノ酸配列を含み、式中X1=Gln又はMet、X2=Gln、X3=Ala又はTyr、X4=Leu又はAsn、X5=Gln又はSer、X6=Thr、Phe又はHis、X7=Pro、X8=Tyr、Ile又はTrp、
そしてX9=Thrである。
X8(配列番号265)のアミノ酸配列を含み、式中X1=Gly;X2=Phe;X3=T
hr;X4=Phe;X5=Arg;X6=Asp又はSer;X7=Tyr;そしてX8=
Ala又はGlyであり;HCDR2は式X1−X2−X3−X4−X5−X6−X7−X8(配列番号266)のアミノ酸配列を含み、式中X1=Ile、X2=Ser、X3=Gly又
はTyr、X4=Ser又はThr、X5=Gly、X6=Gly又はSer、X7=Asn、そしてX8=Thr又はLysであり;HCDR3は式X1−X2−X3−X4−X5−X6
−X7−X8−X9−X10−X11−X12−X13−X14−X15−X16−X17−X18(配列番号
267)のアミノ酸配列を含み、式中X1=Ala、X2=Lys、X3=Asp又はGl
u、X4=Gly又はArg、X5=Leu又はArg、X6=Gly又はSer、X7=Ile又はGly、X8=Thr又はPhe、X9=Ile又はAsp、X10=Arg又はTyr、X11=Proであるか又は存在せず、X12=Argであるか又は存在せず、X13=Tyrであるか又は存在せず、X14=Tyrであるか又は存在せず、X15=Glyであるか又は存在せず、X16=Leuであるか又は存在せず、X17=Aspであるか又は存在せず、そしてX18=Valであるか又は存在せず;LCDR1は式X1−X2−X3−X4−X5−X6−X7−X8−X9−X10−X11(配列番号268)のアミノ酸配列を含み、式中X1=Gln、X2=Ser又はVal、X3=Ile又はLeu、X4=Leu又はAsn、
X5=Asn又はTyr、X6=Ser又はTyr;X7=Ileであるか又は存在せず;
X8=Glyであるか又は存在せず;X9=Tyrであるか又は存在せず;X10=Asnであるか又は存在せず;そしてX11=Tyrであるか又は存在せず;LCDR2は式X1−
X2−X3(配列番号269)のアミノ酸配列を含み、式中X1=Leu又はAla、X2=Ala又はGly、そしてX3=Serであり;そしてLCDR3は式X1−X2−X3−X4−X5−X6−X7−X8−X9(配列番号270)のアミノ酸配列を含み、式中X1=Gl
n又はMet、X2=Gln、X3=Ala又はTyr、X4=Leu又はAsn、X5=Gln又はSer、X6=Thr又はHis、X7=Pro、X8=Tyr又はTrp、そし
てX9=Thrである。
=Thr;X4=Phe;X5=Asp又はArg;X6=Asp;X7=Tyr;そしてX8=Alaであり;HCDR2は式X1−X2−X3−X4−X5−X6−X7−X8(配列番号
266)のアミノ酸配列を含み、式中X1=Ile又はLeu、X2=Ser、X3=Gl
y又はArg、X4=Ser又はThr、X5=Gly又はSer、X6=Gly又はVa
l、X7=Ser又はAsn、そしてX8=Thr又はIleであり;HCDR3は式X1
−X2−X3−X4−X5−X6−X7−X8−X9−X10−X11−X12−X13−X14−X15−X16−X17−X18(配列番号267)のアミノ酸配列を含み、式中X1=Ala、X2=Lys、X3=Asp又はTrp、X4=Gly又はArg、X5=Leu又はThr、X6=Arg又はSer、X7=Ile又はGly、X8=Thr又はTyr、X9=Ile又はP
he、X10=Arg又はAsp、X11=Pro、Tyrであるか又は存在せず、X12=Argであるか又は存在せず、X13=Tyrであるか又は存在せず、X14=Tyrであるか又は存在せず、X15=Glyであるか又は存在せず、X16=Leuであるか又は存在せず、X17=Aspであるか又は存在せず、そしてX18=Valであるか又は存在せず;LCDR1は式X1−X2−X3−X4−X5−X6−X7−X8−X9−X10−X11(配列番号26
8)のアミノ酸配列を含み、式中X1=Gln、X2=Asp又はSer、X3=Ile又
はLeu、X4=Ser又はLeu、X5=Tyr又はIle、X6=Trp又はSer;
X7=Ileであるか又は存在せず;X8=Glyであるか又は存在せず;X9=Tyrで
あるか又は存在せず;X10=Asnであるか又は存在せず;そしてX11=Tyrであるか又は存在せず;LCDR2は式X1−X2−X3(配列番号269)のアミノ酸配列を含み
、式中X1=Leu又はVal、X2=Ala又はGly、そしてX3=Serであり;そ
してLCDR3は式X1−X2−X3−X4−X5−X6−X7−X8−X9(配列番号270)
のアミノ酸配列を含み、式中X1=Gln又はMet、X2=Gln、X3=Ala、X4=Leu又はAsn、X5=Gln又はSer、X6=Thr又はPhe、X7=Pro、X8
=Tyr又はIle、そしてX9=Thrである。
本発明の方法を説明する前に、当然のことながら、本発明は記載される特定の方法及び
実験条件に限定されず、そのようなものとして方法及び条件は変動し得る。また当然のことながら、本発明の範囲は添付の特許請求の範囲によってのみ限定されるので、本明細書で使用される用語は、特定の実施態様を記載する目的のためのみのものであって、限定することを意図されない。
本明細書で使用される用語「ヒトIL4R」(hIL−4R)は、インターロイキン−4(IL−4)、IL−4Rα(配列番号274)に特異的に結合するヒトサイトカイン受容体を指すことを意図される。用語「ヒトインターロイキン−13」(hIL−13)は、IL−13受容体に特異的に結合するサイトカインを指し、そして「hIL−13/hIL−13R1複合体」は、hIL−13R1複合体にhIL−13が結合することにより形成される複合体を指し、この複合体はhIL−4受容体に結合して生物学的活性を開始する。
例えば、Holliger et al.(1993)Proc.Natl.Acad Sci.USA 90:6444−6448を参照のこと)。
及びトリプトファン;(5)塩基性側鎖:リジン、アルギニン、及びヒスチジン;(6)酸性側鎖:アスパラギン酸及びグルタミン酸が含まれ、そして(7)硫黄含有側鎖はシステイン及びメチオニンである。好ましい保存的アミノ酸置換グループは:バリン−ロイシン−イソロイシン、フェニルアラニン−チロシン、リジン−アルギニン、アラニン−バリン、グルタミン酸−アスパラギン酸及びアスパラギン−グルタミンである。あるいは、保存的置換は、Gonnet et al.(1992)Science 256:1443−1445に開示されるPAM250対数尤度行列(log−likelihood matrix)において正の値を有するいずれかの変化である。「中程度に保存的な」置換は、PAM250対数尤度行列において負でない値を有するいずれかの変化である。
ヒト抗体を生成する方法としては、例えばUS 6,596,541、Green et al.(1994) Nature Genetics 7:13−21)、US 5,545,807、US 6,787,637に記載される方法が挙げられる。
Techniques、Academic Press、CAを参照のこと)。本発明の抗体は、好ましくはVELOCIMMUNETM 技術(US6,596,541)を使用して製造される。内因性免疫グロブリン重鎖及び軽鎖可変領域が対応するヒト可変領域で置き換えられているトランスジェニックマウスを、目的の抗原で攻撃し、そして抗体を発現するマウスからリンパ球(例えばB細胞)を回収する。リンパ球を骨髄腫細胞株と融合させて不死ハイブリドーマ細胞株を製造し得、そしてこのようなハイブリドーマ細胞株をスクリーニング、そして選択し、目的の抗原に対して特異的な抗体を産生するハイブリドーマ細胞株を同定する。重鎖及び軽鎖の可変領域をコードするDNAを単離して、重鎖及び軽鎖の所望のアイソタイプ定常領域に連結し得る。このような抗体タンパク質は、CHO細胞のような細胞で産生され得る。あるいは、抗原特異的キメラ抗体又は軽鎖及び重鎖の可変領域をコードするDNAは、抗原特異的リンパ球から直接単離され得る。
域をコードするDNAに作動可能に連結する。次いでこのDNAを完全ヒト抗体を発現することができる細胞において発現させる。特定の実施態様において、細胞はCHO細胞である。
特定のエピトープに結合する抗体をスクリーニングするために、Harlow and
Lane(前出)に記載されるアッセイのような交差遮断(cross−blocking)アッセイを行うことができる。他の方法としては、アラニンスキャニング変異体、ペプチドブロット(Reineke(2004) Methods Mol Biol 248:443−63)、又はペプチド切断分析が挙げられる。さらに、エピトープ切除、エピトープ抽出及び抗原の化学的改変のような方法を使用することができる(Tomer(2000) Protein Science:9:487−496)。
ーラップしている特異エピトープを反映し得る。この技術により遺伝子学的に同一の抗体を迅速に選別することが可能となるので、遺伝子学的に異なる抗体に対して特徴付けを集中させることができる。ハイブリドーマスクリーニングに適用される場合、MAPは所望の特徴を有する稀なハイブリドーマクローンの同定を容易にし得る。MAPを使用して、本発明のhIL−4R抗体を抗体に結合する様々なエピトープのグループに選別し得る。
本発明の抗体は、単一特異性、二重特異性、又は多重特異性であり得る。多重特異性抗体は、1つの標的ポリペプチドの異なるエピトープに対して特異的でもよいし、1つより多くの標的ポリペプチドに対して特異的な抗原結合ドメインを含有していてもよい。例えば、Tutt et al.(1991)J.Immunol.147:60−69を参照のこと。ヒト抗IL−4R抗体を、別の機能的分子、例えば別のペプチド又はタンパク質に連結しても、又は別の機能的分子と同時発現(co−expressed)してもよい。例えば、抗体又はそのフラグメントは、1つ又はそれ以上の他の分子実体、例えば別の抗体又は抗体フラグメントに(例えば、化学的カップリング、遺伝子融合、非共有結合又はその他により)連結されて、第二の結合特異性を有する二重特異性又は多重特異性抗体を生じ得る。
本発明は、本発明の抗IL−4R抗体又はその抗原結合フラグメントを含む治療用組成物を提供する。本発明に従う治療用組成物の投与は、適切な担体、添加剤及び改善された輸送、送達、耐性などをもたらすために製剤に組み込まれる他の薬剤と共に投与される。多数の適切な製剤が、全ての薬剤師に知られる処方集:Remington's Pha
rmaceutical Sciences、Mack Publishing Company、Easton、PAにおいて見出され得る。これらの製剤としては、例えば、散剤、ペースト剤、軟膏、ゼリー、ろう、オイル、脂質、脂質(カチオン性又はアニオン性)含有小胞(例えばLIPOFECTINTM)、DNAコンジュゲート、無水吸収ペースト、水中油及び油中水乳剤、carbowax(種々の分子量のポチエチレングリコール)乳剤、半固形ゲル、並びにcarbowaxを含有する半固形混合物が挙げられる。Powell et al.「Compendium of excipients for parenteral formulations」 PDA(1998)J Pharm Sci Technol 52:238−311も参照のこと。
る、例えば、リポソーム中への封入、微小粒子、マイクロカプセル、変異体ウイルスを発現することができる組み換え細胞、受容体媒介エンドサイトーシス(例えば、Wu et
al.(1987)J.Biol.Chem.262:4429−4432を参照のこと)。導入方法としては、限定されないが、皮内、筋内、腹腔内、静脈内、皮下、鼻腔内、硬膜外、及び経口の経路が挙げられる。本組成物は、いずれかの都合の良い経路により、例えば注入又はボーラス注射により、上皮又は粘膜内層(例えば、口腔粘膜、直腸及び腸の粘膜など)を通した吸収により投与され得、そして他の生物学的に活性な薬剤とともに投与され得る。投与は全身でも局所的でもよい。
(1990) Science 249:1527−1533;Treat et al.(1989) Liposomes in the Therapy of Infectious Disease and Cancer、Lopez Berestein and Fidler(編)、Liss、New York、pp.353−365;Lopez−Berestein、同書、pp.317−327を参照のこと;一般的に同書を参照のこと。
Wise (編)、CRC Pres.、Boca Raton、Florida (1974)を参照のこと)。さらに別の実施態様において、制御放出系は、組成物の標的に近接して配置することができ、それ故、全身用量のごく一部しか必要としない (例えばGoodson、Medical Applications of Controlled Release、前出、vol.2、pp.115−138、1984を参照のこと)。他の制御放出系はLanger(1990)による総説Science 249:1527−1533において考察されている。
VELOCIMMUNETMマウス(Regeneron Pharmaceuticals、Inc.;US6,596,541)をヒトIL−4R(hIL−4R、配列番号274)、又はhIL−4R及びサル(Macaca fascicularis)のIL−4R(mfIL−4R、配列番号275)タンパク質若しくはDNAの組み合わせで免疫した。最適な免疫応答を得るために、続いて動物を3〜4週ごとにブーストし、そして抗抗原応答の進行を評価するために各ブーストの10日後に採血した。
25℃又は37℃のいずれかで、hIL−4Rに関して選択された抗体の結合親和性(KD)を、実時間バイオセンサー表面プラズモン共鳴アッセイ(BIACORETM200
0)を使用して決定した。手短には、抗体を、BIACORETMチップへの直接カップリングにより作出したヤギ抗hFcポリクローナル抗体表面上に捕捉して、捕捉抗体表面を形成した。種々の濃度(50nMから12.5nMの範囲)のモノマーhIL−4R(R&D Systems)又はダイマーhIL−4R−mFcを、25℃又は37℃のいずれかで捕捉抗体表面上に10μl/分で2.5分間注入した。抗体に対する抗原の結合及び結合複合体の解離を実時間でモニタリングした。平行解離定数(KD)及び解離速度定
数を、BIA評価ソフトウェアを使用して動態解析を行うことにより確認した。BIA評価ソフトウェアを、抗原/抗体複合体解離の半減期(T1/2)を計算するためにも使用し
た。結果を表1に示す。NB:抗体−抗原結合が実験条件下で観察されなかった。コントロール:完全ヒト抗IL−4R抗体(米国特許第7,186、809号;配列番号:10及び12)。
た、種々の濃度(100nMから25nMの範囲)のモノマーmfIL−4R−myc−myc−his(mfIL−4R−mmh)又はダイマーmfIL−4R−mFcを用いて前記の実時間バイオセンサー表面プラズモン共鳴アッセイを使用して決定した。抗体H4H098Pのみがモノマー及びダイマー両方のmfIL−4Rに25℃にてそれぞれ552nM及び9.08nMのKDで結合することができた。さらに、抗体H4H098P
はまた、ダイマーmfIL−4Rに37℃にて24.3nMのKDで結合した。H4H0
83PはダイマーmfIL−4Rに対して非常に弱い結合を有していた。
精製した抗hIL−4R抗体のhIL−4R仲介細胞機能を中和する能力をインビトロで決定するためにヒトSTAT6及びSTAT6ルシフェラーゼレポーターを含有するよう操作したHK293細胞株を使用するバイオアッセイを開発した。hIL−4R誘導ルシフェラーゼ活性の阻害を以下のように決定した:細胞を96ウェルプレートに培地中1×104細胞/ウェルで播種し、そして終夜37℃、5%CO2でインキュベートした。段階希釈で0〜20nMの範囲の抗体タンパク質を、10pMのhIL−4又は40pMのhIL−13のいずれかとともに細胞に加えた。次いで細胞を37℃、5%CO2で6時
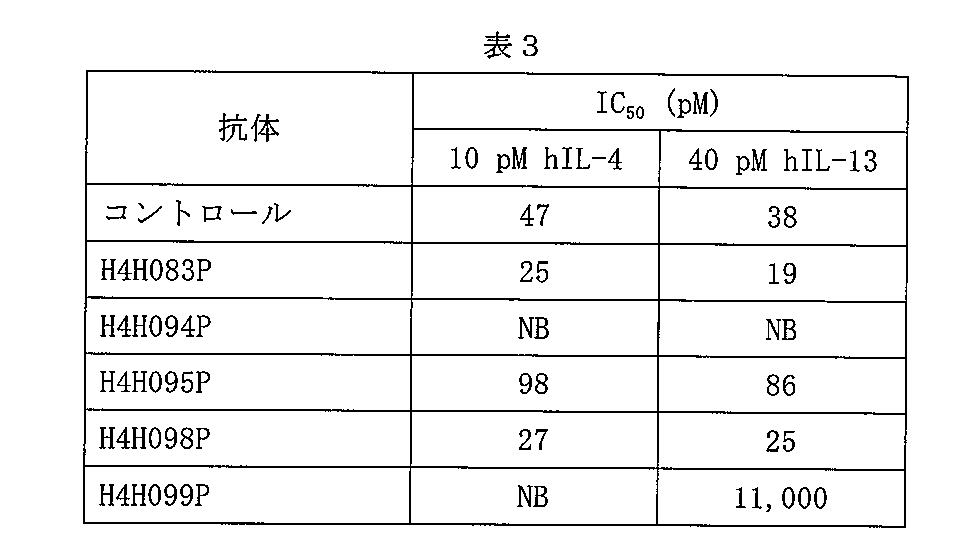
間インキュベートした。細胞応答の程度をルシフェラーゼアッセイ(Promega Biotech)で測定した。結果を表3に示す。NB:ルシフェラーゼ活性が上記の実験条件下で遮断されなかった。さらに、H4H098PはmfIL−4R仲介細胞機能を360fM mfIL−4の存在下で150nMのIC50で遮断することができた。
Claims (16)
- 重鎖可変領域(HCVR)及び軽鎖可変領域(LCVR)を含むヒトインターロイキン−4受容体(hIL−4R)(配列番号274)に特異的に結合する、抗体又はその抗原結合フラグメントであって:
(a) 約100pM若しくはそれ以下のhIL−4Rに対する親和性(KD)を特徴
とする、配列番号162に示されるアミノ酸配列を有するHCVR及び配列番号164に示されるアミノ酸配列を有するLCVR;
(b) 約300pM若しくはそれ以下のhIL−4Rに対する親和性(KD)を特徴
とする、配列番号18に示されるアミノ酸配列を有するHCVR及び配列番号20に示されるアミノ酸配列を有するLCVR;又は
(c) 約50pM若しくはそれ以下のhIL−4Rに対する親和性(KD)を特徴と
する、配列番号210に示されるアミノ酸配列を有するHCVR及び配列番号212に示されるアミノ酸配列を有するLCVR
を含む、上記抗体又は抗原結合フラグメント。 - 重鎖相補性決定領域3(HCDR3)及び軽鎖相補性決定領域3(LCDR3)を含む、ヒトインターロイキン−4受容体(hIL−4R)(配列番号274)に特異的に結合する抗体又はその抗原結合フラグメントであって:
(a) 配列番号152に示されるアミノ酸配列を有するHCDR3及び配列番号160に示されるアミノ酸配列を有するLCDR3;
(b) 配列番号8に示されるアミノ酸配列を有するHCDR3及び配列番号16に示されるアミノ酸配列を有するLCDR3;又は
(c) 配列番号200に示されるアミノ酸配列を有するHCDR3及び配列番号208に示されるアミノ酸配列を有するLCDR3;
を含む、上記抗体又は抗原結合フラグメント。 - 重鎖相補性決定領域1(HCDR1)、2(HCDR2)、3(HCDR3)及び軽鎖相補性決定領域1(LCDR1)、2(LCDR2)、3(LCDR3)を含む、ヒトIL−4Rに特異的に結合する抗体又は抗体の抗原結合フラグメントであって、
HCDR1は、式X1−X2−X3−X4−X5−X6−X7−X8(配列番号265)のアミノ酸配列を含み、式中X1=Gly;X2=Phe;X3=Thr;X4=Phe;X5=A
sp又はArg;X6=Asp又はSer;X7=Tyr;そしてX8=Ala又はGly
であり;
HCDR2は、式X1−X2−X3−X4−X5−X6−X7−X8(配列番号266)のアミノ酸配列を含み、式中、X1=Ile又はLeu、X2=Ser、X3=Gly、Tyr又
はArg、X4=Ser、Asp又はThr、X5=Gly又はSer、X6=Gly、S
er又はVal、X7=Ser又はAsn、そしてX8=Thr、Lys又はIleであり;
HCDR3は、式X1−X2−X3−X4−X5−X6-X7−X8−X9−X10−X11−X12−X13−X14−X15−X16−X17−X18(配列番号267)のアミノ酸配列を含み、式中、X1=Ala、X2=Lys、X3=Asp、Glu又はTrp、X4=Gly又はArg、X5=Leu、Thr又はArg、X6=Gly、Arg又はSer、X7=Ile又はG
ly、X8=Thr、Phe又はTyr、X9=Ile、Asp又はPhe、X10=Arg、Tyr又はAsp、X11=Pro、Tyrであるか又は存在せず、X12=Argであるか又は存在せず、X13=Tyrであるか又は存在せず、X14=Tyrであるか又は存在せず、X15=Glyであるか又は存在せず、X16=Leuであるか又は存在せず、X17=Aspであるか又は存在せず、そしてX18=Valであるか又は存在せず;
LCDR1は、式X1−X2−X3−X4−X5−X6-X7−X8−X9−X10−X11 (配列
番号268)のアミノ酸配列を含み、式中、X1=Gln、X2=Asp、Ser又はVa
l、X3=Ile又はLeu、X4=Ser、Leu又はAsn、X5=Asn、Tyr又
はIle、X6=Trp、Ser又はTyr;X7=Ileであるか又は存在せず;X8=
Glyであるか又は存在せず;X9=Tyrであるか又は存在せず;X10=Asnである
か又は存在せず;そしてX11=Tyrであるか又は存在せず;
LCDR2は、式X1−X2−X3(配列番号269)のアミノ酸配列を含み、式中、X1=Leu、Ala又はVal、X2=Ala又はGly、そしてX3=Serであり;そして
LCDR3は、式X1−X2−X3−X4−X5−X6-X7−X8−X9(配列番号270)のアミノ酸配列を含み、式中、X1=Gln又はMet、X2=Gln、X3=Ala又はT
yr、X4=Leu又はAsn、X5=Gln又はSer、X6=Thr、Phe又はHi
s、X7=Pro、X8=Tyr、Ile又はTrp、そしてX9=Thrである、
抗体又は抗体の抗原結合フラグメント。 - 重鎖及び軽鎖CDRアミノ酸配列(HCDR1、HCDR2、HCDR3、LCDR1、LCDR2、LCDR3)が、以下:
(a) 配列番号148、150、152、156、158、160;
(b) 配列番号4、6、8、12、14、16;及び
(c) 配列番号 196、198、200、204、206、208
からなる群より選択される、請求項3に記載の抗体又は抗原結合フラグメント。 - 請求項1〜4のいずれか1項に記載の抗体又は抗原結合フラグメントのHCDR1、HCDR2、HCDR3、LCDR1、LCDR2及びLCDR3配列をコードする核酸配列。
- 請求項5に記載の核酸配列を含むベクター。
- 請求項6に記載のベクターを含む、抗体又は抗体の抗原結合フラグメントの製造のための宿主ベクターシステム。
- ヒトインターロイキン−4受容体アルファ(hIL−4R)に特異的に結合する抗体又はその抗原結合フラグメントを生産する方法であって、
抗体又はフラグメントが発現する条件下で請求項7に記載の宿主ベクターシステムの細胞を増殖させること、及び発現した抗hIL−4抗体を回収することを含む、上記方法。 - 宿主細胞が原核細胞又は真核細胞である、請求項8に記載の方法。
- 宿主細胞がE.coli細胞又はCHO細胞である、請求項9に記載の方法。
- 疾患又は障害の処置のための医薬の製造における、請求項1、2、3又は4に定義される抗体又は抗原結合フラグメントの使用であって、ここで疾患又は障害がヒトインターロイキン−4(hIL−4)活性の除去、阻害又は低減により改善、軽減又は抑制される、使用。
- 疾患又は障害が、関節炎、疱疹状疾患、慢性特発性蕁麻疹、強皮症、肥厚性瘢痕化、ウィップル病、良性前立腺肥大、肺障害、喘息、炎症性障害、アレルギー反応、川崎病、鎌状赤血球症、チャーグ・ストラウス症候群、グレーブズ病、子癇前症、シェーグレン症候群、自己免疫性リンパ増殖症候群、自己免疫性溶血性貧血、バレット食道、自己免疫性ブドウ膜炎、結核、及びネフローゼからなる群より選択される、請求項11に定義される使用。
- 疾患又は障害が喘息又はアトピー性皮膚炎である、請求項11に定義される使用。
- ヒトインターロイキン−4(hIL−4)活性の除去、阻害又は低減により改善、軽減又は抑制される、疾患又は障害を処置する方法であって、請求項1〜4のいずれか1項に記載の抗体又は抗原結合フラグメントを、それを必要とする患者に投与することを含む、上記方法。
- 疾患又は障害が、関節炎、疱疹状疾患、慢性特発性蕁麻疹、強皮症、肥厚性瘢痕化、ウィップル病、良性前立腺肥大、肺障害、喘息、炎症性障害、アレルギー反応、川崎病、鎌状赤血球症、チャーグ・ストラウス症候群、グレーブズ病、子癇前症、シェーグレン症候群、自己免疫性リンパ増殖症候群、自己免疫性溶血性貧血、バレット食道、自己免疫性ブドウ膜炎、結核、及びネフローゼからなる群より選択される、請求項14に記載の方法。
- 疾患又は障害が喘息又はアトピー性皮膚炎である、請求項14に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12/260,307 US7608693B2 (en) | 2006-10-02 | 2008-10-29 | High affinity human antibodies to human IL-4 receptor |
| US12/260,307 | 2008-10-29 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013097263A Division JP5844772B2 (ja) | 2008-10-29 | 2013-05-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018209345A Division JP6608505B2 (ja) | 2008-10-29 | 2018-11-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2016041069A true JP2016041069A (ja) | 2016-03-31 |
| JP6449125B2 JP6449125B2 (ja) | 2019-01-09 |
Family
ID=41600767
Family Applications (8)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011534672A Active JP5291802B2 (ja) | 2008-10-29 | 2009-10-27 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2013097263A Active JP5844772B2 (ja) | 2008-10-29 | 2013-05-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2015199976A Active JP6449125B2 (ja) | 2008-10-29 | 2015-10-08 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2018209345A Active JP6608505B2 (ja) | 2008-10-29 | 2018-11-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2019191643A Active JP6843208B2 (ja) | 2008-10-29 | 2019-10-21 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2021024740A Active JP7100731B2 (ja) | 2008-10-29 | 2021-02-19 | ヒトil-4受容体に対する高親和性ヒト抗体 |
| JP2022105797A Active JP7442581B2 (ja) | 2008-10-29 | 2022-06-30 | ヒトil-4受容体に対する高親和性ヒト抗体 |
| JP2024022482A Pending JP2024040526A (ja) | 2008-10-29 | 2024-02-19 | ヒトil-4受容体に対する高親和性ヒト抗体 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011534672A Active JP5291802B2 (ja) | 2008-10-29 | 2009-10-27 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2013097263A Active JP5844772B2 (ja) | 2008-10-29 | 2013-05-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
Family Applications After (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018209345A Active JP6608505B2 (ja) | 2008-10-29 | 2018-11-07 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2019191643A Active JP6843208B2 (ja) | 2008-10-29 | 2019-10-21 | ヒトil−4受容体に対する高親和性ヒト抗体 |
| JP2021024740A Active JP7100731B2 (ja) | 2008-10-29 | 2021-02-19 | ヒトil-4受容体に対する高親和性ヒト抗体 |
| JP2022105797A Active JP7442581B2 (ja) | 2008-10-29 | 2022-06-30 | ヒトil-4受容体に対する高親和性ヒト抗体 |
| JP2024022482A Pending JP2024040526A (ja) | 2008-10-29 | 2024-02-19 | ヒトil-4受容体に対する高親和性ヒト抗体 |
Country Status (47)
Families Citing this family (162)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7763249B2 (en) * | 2004-04-27 | 2010-07-27 | Juridical Foundation The Chemo-Sero-Therapeutic Research Institute | Human anti-amyloid β peptide antibody and fragment of said antibody |
| US7608693B2 (en) * | 2006-10-02 | 2009-10-27 | Regeneron Pharmaceuticals, Inc. | High affinity human antibodies to human IL-4 receptor |
| CN101522716B (zh) * | 2006-10-02 | 2013-03-20 | 瑞泽恩制药公司 | 抗人il-4受体的高亲和力人抗体 |
| JO3672B1 (ar) | 2008-12-15 | 2020-08-27 | Regeneron Pharma | أجسام مضادة بشرية عالية التفاعل الكيماوي بالنسبة لإنزيم سبتيليسين كنفرتيز بروبروتين / كيكسين نوع 9 (pcsk9). |
| US20130064834A1 (en) | 2008-12-15 | 2013-03-14 | Regeneron Pharmaceuticals, Inc. | Methods for treating hypercholesterolemia using antibodies to pcsk9 |
| US9796788B2 (en) | 2010-02-08 | 2017-10-24 | Regeneron Pharmaceuticals, Inc. | Mice expressing a limited immunoglobulin light chain repertoire |
| US20120021409A1 (en) * | 2010-02-08 | 2012-01-26 | Regeneron Pharmaceuticals, Inc. | Common Light Chain Mouse |
| ES2547142T5 (es) | 2010-02-08 | 2021-12-09 | Regeneron Pharma | Cadena ligera común de ratón |
| US20130045492A1 (en) | 2010-02-08 | 2013-02-21 | Regeneron Pharmaceuticals, Inc. | Methods For Making Fully Human Bispecific Antibodies Using A Common Light Chain |
| JP5918246B2 (ja) | 2010-10-06 | 2016-05-18 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 抗インターロイキン−4受容体(il−4r)抗体を含有する安定化製剤 |
| UA111731C2 (uk) * | 2010-10-06 | 2016-06-10 | Рідженерон Фармасьютікалз, Інк. | Стабілізована композиція, яка містить антитіло до рецептора інтерлейкіну-4 (іl-4r), варіанти |
| MX347602B (es) | 2011-01-28 | 2017-05-03 | Sanofi Biotechnology | Composiciones farmaceuticas que comprenden anticuerpos humanos frente a pcsk9. |
| AR087305A1 (es) | 2011-07-28 | 2014-03-12 | Regeneron Pharma | Formulaciones estabilizadas que contienen anticuerpos anti-pcsk9, metodo de preparacion y kit |
| IL273982B2 (en) | 2011-08-05 | 2023-03-01 | Regeneron Pharma | Humanized mice possess a universal light chain |
| PL4252857T3 (pl) | 2011-09-16 | 2025-03-03 | Regeneron Pharmaceuticals, Inc. | Sposoby redukowania poziomów lipoproteiny(a) poprzez podawanie inhibitora proproteinowej konwertazy subtylizyny keksyny-9 (pcsk9) |
| WO2013094723A1 (ja) * | 2011-12-22 | 2013-06-27 | アステラス製薬株式会社 | 新規抗ヒトctgf抗体 |
| EP2825036B1 (en) | 2012-03-16 | 2018-05-02 | Regeneron Pharmaceuticals, Inc. | Histidine engineered light chain antibodies and genetically modified rodents for generating the same |
| RU2664473C2 (ru) | 2012-03-16 | 2018-08-17 | Регенерон Фармасьютикалз, Инк. | ОТЛИЧНЫЕ ОТ ЧЕЛОВЕКА ЖИВОТНЫЕ, ЭКСПРЕССИРУЮЩИЕ ЧУВСТВИТЕЛЬНЫЕ К pН ПОСЛЕДОВАТЕЛЬНОСТИ ИММУНОГЛОБУЛИНОВ |
| PT2888281T (pt) * | 2012-08-21 | 2018-12-14 | Regeneron Pharma | Métodos para tratamento ou prevenção da asma por meio de administração de um antagonista de il-4r |
| RU2690675C2 (ru) * | 2012-08-21 | 2019-06-05 | Санофи Байотекнолоджи | Способы лечения или предотвращения астмы посредством введения антагониста il-4r |
| ES2981062T3 (es) * | 2012-09-07 | 2024-10-07 | Regeneron Pharma | Métodos para el tratamiento de la dermatitis atópica administrando un antagonista de IL-4R |
| PT2892927T (pt) * | 2012-09-07 | 2018-08-02 | Regeneron Pharma | Métodos para tratamento da dermatite atópica por administração de um antagonista de il-4r |
| AR095196A1 (es) | 2013-03-15 | 2015-09-30 | Regeneron Pharma | Medio de cultivo celular libre de suero |
| US10111953B2 (en) | 2013-05-30 | 2018-10-30 | Regeneron Pharmaceuticals, Inc. | Methods for reducing remnant cholesterol and other lipoprotein fractions by administering an inhibitor of proprotein convertase subtilisin kexin-9 (PCSK9) |
| TWI697334B (zh) | 2013-06-04 | 2020-07-01 | 美商再生元醫藥公司 | 藉由投與il-4r抑制劑以治療過敏及增強過敏原-特異之免疫療法的方法 |
| EP3613432B1 (en) | 2013-06-21 | 2025-08-06 | Sanofi Biotechnology | Methods for treating nasal polyposis by administering an il-4r antagonist |
| LT3010539T (lt) * | 2013-06-21 | 2019-10-10 | Sanofi Biotechnology | Nazalinės polipozės gydymo būdai, skiriant il-4r antagonistą |
| TWI634900B (zh) | 2013-07-11 | 2018-09-11 | 再生元醫藥公司 | 藉由投與il-4r抑制劑治療嗜酸性食道炎的方法 |
| JP6616298B2 (ja) | 2013-11-12 | 2019-12-04 | サノフィ・バイオテクノロジー | Pcsk9阻害剤と共に使用するための投薬レジメン |
| US8980273B1 (en) | 2014-07-15 | 2015-03-17 | Kymab Limited | Method of treating atopic dermatitis or asthma using antibody to IL4RA |
| US8986691B1 (en) | 2014-07-15 | 2015-03-24 | Kymab Limited | Method of treating atopic dermatitis or asthma using antibody to IL4RA |
| DE112014005975T5 (de) * | 2013-12-17 | 2016-09-15 | Kymab Limited | Menschliche Ziele |
| WO2015107126A1 (en) * | 2014-01-16 | 2015-07-23 | Mondelli Mario Umberto Francesco | Neutralizing human monoclonal antibodies against hepatitis b virus surface antigen |
| IL315136A (en) | 2014-02-21 | 2024-10-01 | Sanofi Biotechnology | Methods for treating or preventing asthma by administering an il-4rantagonist |
| IL247290B (en) * | 2014-02-21 | 2021-06-30 | Sanofi Biotechnology | Methods of treating or preventing asthma by adding an il-4r antagonist |
| WO2015130975A1 (en) | 2014-02-28 | 2015-09-03 | Regeneron Pharmaceuticals, Inc. | Methods for treating skin infection by administering an il-4r antagonist |
| BR112016021572A2 (pt) | 2014-03-21 | 2017-10-03 | Regeneron Pharma | Métodos para preparar um animal não humano geneticamente modificado e para produzir proteínas de ligação, hibridoma, ácido nucleico, célula, e, proteína de ligação |
| NO2785538T3 (ja) * | 2014-05-07 | 2018-08-04 | ||
| CA2955294A1 (en) | 2014-07-16 | 2016-01-21 | Sanofi Biotechnology | Methods for treating patients with heterozygous familial hypercholesterolemia (hefh) |
| MX2017006286A (es) | 2014-11-14 | 2018-01-23 | Sanofi Biotechnology | Metodos para tratar sinusitis cronica con polipos nasales por administracion de un antagonista de il-4r. |
| EP3271403A1 (en) | 2015-03-19 | 2018-01-24 | Regeneron Pharmaceuticals, Inc. | Non-human animals that select for light chain variable regions that bind antigen |
| RU2736732C2 (ru) | 2015-04-02 | 2020-11-19 | Интервет Интернэшнл Б.В. | Антитела к альфа-рецептору собачьего интерлейкина-4 |
| TW202440903A (zh) | 2015-08-04 | 2024-10-16 | 美商再生元醫藥公司 | 補充牛磺酸之細胞培養基及用法(一) |
| US10772956B2 (en) | 2015-08-18 | 2020-09-15 | Regeneron Pharmaceuticals, Inc. | Methods for reducing or eliminating the need for lipoprotein apheresis in patients with hyperlipidemia by administering alirocumab |
| ES2983475T3 (es) | 2016-02-19 | 2024-10-23 | Regeneron Pharma | Métodos para mejorar la eficacia de una vacuna mediante la administración de un antagonista de IL-4R |
| CN107474134B (zh) * | 2016-06-08 | 2021-07-27 | 苏州康乃德生物医药有限公司 | 用于结合白细胞介素4受体的抗体 |
| EP3504328A1 (en) | 2016-08-24 | 2019-07-03 | Regeneron Pharmaceuticals, Inc. | Host cell protein modification |
| EP4442323A3 (en) | 2016-09-01 | 2025-01-01 | Regeneron Pharmaceuticals, Inc. | Methods for preventing or treating allergy by administering an il-4r antagonist |
| US10485844B2 (en) | 2016-09-22 | 2019-11-26 | Regeneron Pharmaceuticals, Inc. | Methods for treating severe atopic dermatitis by administering an IL-4R inhibitor |
| EP4345110A3 (en) | 2016-09-22 | 2024-06-12 | Regeneron Pharmaceuticals, Inc. | Methods for treating severe atopic dermatitis by administering an il-4r inhibitor |
| KR20190091290A (ko) | 2016-11-29 | 2019-08-05 | 리제너론 파아마슈티컬스, 인크. | Prlr 양성 유방암 치료 방법 |
| TWI784988B (zh) | 2016-12-01 | 2022-12-01 | 美商再生元醫藥公司 | 治療發炎症狀的方法 |
| MX2019012171A (es) | 2017-04-13 | 2019-11-25 | Regeneron Pharma | Tratamiento e inhibicion de enfermedades pulmonares inflamatorias en pacientes que tienen alelos de riesgo en los genes que codifican la il33 e il1rl1. |
| EP3967765A1 (en) | 2017-07-06 | 2022-03-16 | FrieslandCampina Nederland B.V. | Cell culture process for making a glycoprotein |
| WO2019028367A1 (en) | 2017-08-04 | 2019-02-07 | Regeneron Pharmaceuticals, Inc. | METHODS OF TREATING ESOPHAGITIS WITH ACTIVE EOSINOPHILES |
| KR20250044796A (ko) | 2017-10-30 | 2025-04-01 | 사노피 바이오테크놀로지 | Il-4r 길항제를 투여하여 천식을 치료 또는 예방하는 방법 |
| WO2019126123A1 (en) | 2017-12-22 | 2019-06-27 | Regeneron Pharmaceuticals, Inc. | System and method for characterizing drug product impurities |
| AU2019215363A1 (en) | 2018-01-31 | 2020-07-23 | Regeneron Pharmaceuticals, Inc. | System and method for characterizing size and charge variant drug product impurities |
| CN113150146B (zh) * | 2018-02-01 | 2022-07-12 | 北京凯因科技股份有限公司 | IL-4Rα抗体及其用途 |
| KR102652133B1 (ko) * | 2018-02-01 | 2024-03-29 | 베이징 카윈 테크놀로지 쉐어-홀딩 컴퍼니 리미티드 | IL-4Rα 항체 및 그 용도 |
| TW202311746A (zh) | 2018-02-02 | 2023-03-16 | 美商再生元醫藥公司 | 用於表徵蛋白質二聚合之系統及方法 |
| KR20200127979A (ko) | 2018-02-28 | 2020-11-11 | 리제너론 파마슈티칼스 인코포레이티드 | 바이러스 오염물질을 확인하기 위한 시스템 및 방법 |
| US12253490B2 (en) | 2018-03-19 | 2025-03-18 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| EP4317959A3 (en) | 2018-03-19 | 2024-03-27 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| US12259355B2 (en) | 2018-03-19 | 2025-03-25 | Regeneron Pharmaceuticals, Inc. | Microchip capillary electrophoresis assays and reagents |
| KR102879521B1 (ko) * | 2018-03-22 | 2025-11-03 | 서피스 온콜로지, 엘엘씨 | 항-il-27 항체 및 이의 용도 |
| CN108373505B (zh) * | 2018-04-20 | 2019-08-20 | 北京智仁美博生物科技有限公司 | 抗il-4r抗体及其用途 |
| TW202016125A (zh) | 2018-05-10 | 2020-05-01 | 美商再生元醫藥公司 | 用於定量及調節蛋白質黏度之系統與方法 |
| MA52624A (fr) | 2018-05-13 | 2021-03-24 | Regeneron Pharma | Méthodes de traitement de la dermatite atopique par administration d'un inhibiteur de l'il-4r |
| CN113101364B (zh) * | 2018-05-29 | 2023-12-01 | 康诺亚生物医药科技(成都)有限公司 | 一种自免疫抑制剂的开发和应用 |
| AU2019302642B2 (en) | 2018-07-10 | 2025-10-30 | Regeneron Pharmaceuticals, Inc. | Modifying binding molecules to minimize pre-existing interactions |
| ES3028305T3 (en) | 2018-08-24 | 2025-06-18 | Jiangsu Hengrui Medicine Co | Human il-4r binding antibody, antigen binding fragment thereof, and medical use thereof |
| MY204234A (en) | 2018-08-27 | 2024-08-16 | Regeneron Pharma | Use of raman spectroscopy in downstream purification |
| BR112020026348A2 (pt) | 2018-08-30 | 2021-03-30 | Regeneron Pharmaceuticals, Inc. | Método para avaliar a estequiometria e distribuição de tamanho de complexos de proteínas, para selecionar um medicamento de proteína principal e para caracterizar complexos de proteínas, e, composição farmacêutica |
| CN110872349A (zh) * | 2018-09-04 | 2020-03-10 | 三生国健药业(上海)股份有限公司 | 结合人il-4r的抗体、其制备方法和用途 |
| US12216129B2 (en) | 2018-11-09 | 2025-02-04 | Ajou University Industry-Academic Cooperation Foundation | Human antibody having high affinity to human IL-4 receptor alpha |
| US11312778B2 (en) | 2018-11-21 | 2022-04-26 | Brian C. Machler | Method for treating allergic contact dermatitis |
| CN111494626B (zh) * | 2018-12-25 | 2022-06-21 | 江苏荃信生物医药股份有限公司 | 用于治疗il-4和/或il-13介导的信号转导相关的疾病的药物组合物 |
| KR20210114927A (ko) | 2019-01-16 | 2021-09-24 | 리제너론 파마슈티칼스 인코포레이티드 | 이황화 결합을 특징 짓는 방법 |
| EP3935085A1 (en) | 2019-03-06 | 2022-01-12 | Regeneron Pharmaceuticals, Inc. | Il-4/il-13 pathway inhibitors for enhanced efficacy in treating cancer |
| PH12021552123A1 (en) | 2019-03-21 | 2022-08-22 | Regeneron Pharma | Combination of il-4/il-13 pathway inhibitors and plasma cell ablation for treating allergy |
| MX2021013519A (es) | 2019-05-13 | 2021-12-10 | Regeneron Pharma | Ensayos de union de ligandos competitivos mejorados. |
| CN111592597B (zh) * | 2019-05-29 | 2022-04-26 | 山东博安生物技术股份有限公司 | 白介素4受体(il-4r)结合蛋白及其用途 |
| CN110343666B (zh) * | 2019-07-10 | 2023-05-30 | 通化东宝药业股份有限公司 | 一种cho细胞培养的补料培养基及其制备方法和应用 |
| JP7592064B2 (ja) | 2019-07-16 | 2024-11-29 | サノフィ・バイオテクノロジー | Il-4rアンタゴニストを投与することにより喘息を治療するまたは予防するための方法 |
| US11504426B2 (en) | 2019-08-05 | 2022-11-22 | Regeneron Pharmaceuticals, Inc. | Methods for treating allergy and enhancing allergen-specific immunotherapy by administering an IL-4R antagonist |
| AU2020326713A1 (en) | 2019-08-05 | 2022-02-17 | Regeneron Pharmaceuticals, Inc. | Methods for treating atopic dermatitis by administering an il-4r antagonist |
| CN114667450B (zh) | 2019-09-24 | 2025-05-02 | 里珍纳龙药品有限公司 | 用于色谱介质的使用和再生的系统及方法 |
| US12297451B1 (en) | 2019-10-25 | 2025-05-13 | Regeneron Pharmaceuticals, Inc. | Cell culture medium |
| CN111825766B (zh) * | 2019-10-31 | 2021-05-11 | 上海洛启生物医药技术有限公司 | 抗il-4r单域抗体及其应用 |
| US11730793B2 (en) | 2019-11-25 | 2023-08-22 | Regeneron Pharmaceuticals, Inc. | Sustained release formulations using non-aqueous emulsions |
| BR112022011098A2 (pt) | 2019-12-09 | 2022-09-20 | Sanofi Biotechnology | Métodos para tratamento de distúrbios relacionados a il-4/il-13 digitalmente identificados |
| EP3992974A1 (en) | 2020-11-02 | 2022-05-04 | Sanofi Biotechnology | Methods for treating digitally-identified il-4/il-13 related disorders |
| EP4354145B1 (en) | 2020-01-21 | 2025-09-17 | Regeneron Pharmaceuticals, Inc. | Deglycosylation methods for electrophoresis of glycosylated proteins |
| EP4104858A4 (en) | 2020-02-21 | 2023-11-29 | Jiangsu Hengrui Pharmaceuticals Co., Ltd. | PHARMACEUTICAL COMPOSITION CONTAINING AN ANTI-IL-4R ANTIBODY AND ITS USE |
| CN115087673B (zh) * | 2020-02-27 | 2025-02-18 | 正大天晴药业集团股份有限公司 | 结合il4r的抗体及其用途 |
| AU2021244266A1 (en) | 2020-03-27 | 2022-12-01 | Regeneron Pharmaceuticals, Inc. | Methods for treating atopic dermatitis by administering an IL-4R antagonist |
| CN113549151A (zh) * | 2020-04-24 | 2021-10-26 | 苏州康乃德生物医药有限公司 | 与人IL-4Rα中特定表位结合的抗体及其应用 |
| IL298257A (en) | 2020-05-22 | 2023-01-01 | Regeneron Pharma | Methods for treating eosinophilic esophagitis by administering an il-4r inhibitor |
| CA3192999A1 (en) | 2020-08-31 | 2022-03-03 | Regeneron Pharmaceuticals, Inc. | Asparagine feed strategies to improve cell culture performance and mitigate asparagine sequence variants |
| AU2021357078A1 (en) | 2020-10-05 | 2023-06-15 | Regeneron Pharmaceuticals, Inc. | Methods for treating asthma in pediatric subjects by administering an il-4r antagonist |
| KR20230113280A (ko) | 2020-11-25 | 2023-07-28 | 리제너론 파마슈티칼스 인코포레이티드 | 비수성 멤브레인 유화법을 사용한 지속 방출 제형 |
| CN116710124A (zh) | 2020-12-17 | 2023-09-05 | 瑞泽恩制药公司 | 包封蛋白质的微凝胶的制造 |
| WO2022135441A1 (zh) | 2020-12-22 | 2022-06-30 | 江苏恒瑞医药股份有限公司 | 抗il-4r抗体或其抗原结合片段的复合物及医药用途 |
| US20220220211A1 (en) | 2021-01-08 | 2022-07-14 | Regeneron Pharmaceuticals, Inc. | Methods for treating peanut allergy and enhancing peanut allergen-specific immunotherapy by administering an il-4r antagonist |
| US12031151B2 (en) | 2021-01-20 | 2024-07-09 | Regeneron Pharmaceuticals, Inc. | Methods of improving protein titer in cell culture |
| AR125585A1 (es) | 2021-03-03 | 2023-08-02 | Regeneron Pharma | Sistemas y métodos para cuantificar y modificar la viscosidad de proteínas |
| MX2023010794A (es) | 2021-03-26 | 2023-10-25 | Regeneron Pharma | Metodos y sistemas para el desarrollo de protocolos de mezcla. |
| CA3220848A1 (en) | 2021-06-01 | 2022-12-08 | Timothy Riehlman | Microchip capillary electrophoresis assays and reagents |
| MX2024001189A (es) | 2021-07-26 | 2024-02-27 | Sanofi Biotechnology | Metodos para tratar la urticaria cronica espontanea por administracion de un antagonista de il-4r. |
| TWI876192B (zh) * | 2021-08-05 | 2025-03-11 | 美商美國禮來大藥廠 | 人類介白素-4受體α抗體 |
| EP4384270A1 (en) | 2021-08-10 | 2024-06-19 | Kymab Limited | Treatment of atopic dermatitis |
| AU2022333073A1 (en) | 2021-08-23 | 2024-04-04 | Regeneron Pharmaceuticals, Inc. | Methods for treating atopic dermatitis by administering an il-4r antagonist |
| CN117615785A (zh) * | 2021-08-26 | 2024-02-27 | 正大天晴药业集团股份有限公司 | 抗il4r抗体的药物组合物及其用途 |
| TW202326138A (zh) | 2021-09-08 | 2023-07-01 | 美商再生元醫藥公司 | 用於定量抗體及其他含Fc蛋白之高通量及基於質譜之方法 |
| JP2024531800A (ja) * | 2021-09-20 | 2024-08-29 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | 抗体の不均一性を制御する方法 |
| CA3230302A1 (en) | 2021-09-30 | 2023-04-06 | Regeneron Pharmaceuticals, Inc. | Reticulocalbin-3 (rcn3) variants and treatment of asthma with interleukin-4 receptor alpha (il4r) antagonists |
| KR20240090312A (ko) | 2021-10-07 | 2024-06-21 | 리제너론 파아마슈티컬스, 인크. | Ph 미터 보정 및 교정 |
| TW202323817A (zh) | 2021-10-07 | 2023-06-16 | 美商再生元醫藥公司 | Ph建模及控制之系統及方法 |
| KR20240099290A (ko) | 2021-10-20 | 2024-06-28 | 사노피 바이오테크놀로지 | Il-4r 길항제를 투여하여 결절성 양진을 치료하는 방법 |
| CA3236367A1 (en) | 2021-10-26 | 2023-05-04 | Michelle Lafond | Systems and methods for generating laboratory water and distributing laboratory water at different temperatures |
| US20230272096A1 (en) | 2021-11-11 | 2023-08-31 | Regeneron Pharmaceuticals, Inc. | Treatment Of Lung Disease Based Upon Stratification Of Polygenic Risk Score For Interleukin 33 (IL-33) |
| WO2023085978A1 (en) * | 2021-11-11 | 2023-05-19 | Joint Stock Company «Biocad» | Monoclonal antibody or antigen-binding fragment thereof that specifically binds to il-4ra, and use thereof |
| WO2023091614A2 (en) * | 2021-11-18 | 2023-05-25 | Twist Bioscience Corporation | Dickkopf-1 variant antibodies and methods of use |
| EP4441249A1 (en) | 2021-11-30 | 2024-10-09 | Regeneron Pharmaceuticals, Inc. | Treatment of lung disease based upon stratification of polygenic score relating to response to a therapeutic agent |
| WO2023130010A1 (en) | 2021-12-30 | 2023-07-06 | Regeneron Pharmaceuticals, Inc. | Methods for attenuating atopic march by administering an il-4/il-13 antagonist |
| MX2024009080A (es) | 2022-01-29 | 2024-07-30 | Shanghai Shengdi Pharmaceutical Co Ltd | Conjugado farmacologico de glucocorticoide. |
| KR20240167717A (ko) | 2022-03-02 | 2024-11-27 | 리제너론 파아마슈티컬스, 인크. | 항체 생산을 위한 세포 배양 방법 |
| JP2025508233A (ja) | 2022-03-18 | 2025-03-21 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | ポリペプチド変異体を分析するための方法およびシステム |
| WO2023191665A1 (en) * | 2022-03-31 | 2023-10-05 | Milaboratory, Limited Liability Company | ANTIBODIES TO HUMAN IL-4Rα HAVING REDUCED IMMUNOGENICITY AND APPLICATION THEREOF |
| TW202421660A (zh) | 2022-07-08 | 2024-06-01 | 美商再生元醫藥公司 | 藉由投與il-4r拮抗劑來治療嗜伊紅性食道炎的方法 |
| EP4580659A1 (en) | 2022-08-29 | 2025-07-09 | Sanofi Biotechnology | Methods for treating chronic inducible cold urticaria by administering an il-4r antagonist |
| KR20240038841A (ko) | 2022-09-16 | 2024-03-26 | 연세대학교 산학협력단 | 신규한 인간 인터류킨-4 수용체 결합 나노바디 및 이의 용도 |
| WO2024097714A1 (en) | 2022-11-01 | 2024-05-10 | Regeneron Pharmaceuticals, Inc. | Methods for treating hand and foot dermatitis by administering an il-4r antagonist |
| IL320670A (en) | 2022-11-23 | 2025-07-01 | Regeneron Pharma | Methods for enhancing bone growth by administering an IL-4R antagonist |
| WO2024130048A1 (en) | 2022-12-16 | 2024-06-20 | Regeneron Pharmaceuticals, Inc. | Methods and systems for assessing chromatographic column integrity |
| TW202445126A (zh) | 2023-01-25 | 2024-11-16 | 美商再生元醫藥公司 | 基於質譜法之體內共表現抗體之表徵 |
| US20240245779A1 (en) | 2023-01-25 | 2024-07-25 | Regeneron Pharmaceuticals, Inc. | Methods of modeling liquid protein composition stability |
| TW202445138A (zh) | 2023-02-01 | 2024-11-16 | 美商再生元醫藥公司 | 用於生物巨分子分析之具質譜法的不對稱流場流分離 |
| KR20250150541A (ko) * | 2023-02-17 | 2025-10-20 | 아포지 테라퓨틱스, 인크. | 인터류킨 4 수용체 알파에 결합하는 항체 및 사용 방법 |
| TW202446462A (zh) | 2023-02-22 | 2024-12-01 | 美商再生元醫藥公司 | 系統適用性參數及管柱老化 |
| TW202502819A (zh) | 2023-03-22 | 2025-01-16 | 法商賽諾菲生物技術公司 | 藉由投予il-4r拮抗劑治療慢性阻塞性肺病(copd)之方法 |
| KR20250164835A (ko) | 2023-03-27 | 2025-11-25 | 리제너론 파아마슈티컬스, 인크. | Il-4r 길항제를 투여하여 호산구성 위장염을 치료하는 방법 |
| WO2024199665A1 (en) | 2023-03-30 | 2024-10-03 | Sandoz Ag | Stable composition comprising a high protein concentration |
| TW202508625A (zh) | 2023-05-01 | 2025-03-01 | 美商再生元醫藥公司 | 使用苯酚或苯甲醇之多劑量抗體藥物產品 |
| KR20240170605A (ko) * | 2023-05-23 | 2024-12-04 | 연세대학교 산학협력단 | 신규한 인간 인터류킨-4 수용체 결합 나노바디 및 이를 포함하는 비강 분무 제형 |
| WO2025054406A1 (en) | 2023-09-08 | 2025-03-13 | Regeneron Pharmaceuticals, Inc. | Methods and systems for assessing chromatographic column integrity |
| US20250095773A1 (en) | 2023-09-18 | 2025-03-20 | Regeneron Pharmaceuticals, Inc. | Methods and systems for developing chromatography protocols |
| WO2025072597A2 (en) | 2023-09-29 | 2025-04-03 | Regeneron Pharmaceuticals, Inc. | Lyophilization using controlled nucleation |
| US20250108173A1 (en) | 2023-10-02 | 2025-04-03 | Regeneron Pharmaceuticals, Inc. | Drug delivery device safety system |
| US20250129117A1 (en) | 2023-10-18 | 2025-04-24 | Regeneron Pharmaceuticals, Inc. | Rapid purification of monoclonal antibody from in-process upstream cell culture material |
| WO2025096932A1 (en) | 2023-11-02 | 2025-05-08 | Regeneron Pharmaceuticals, Inc. | Methods for reducing lipase activity using stress |
| WO2025117516A1 (en) | 2023-11-30 | 2025-06-05 | Genzyme Corporation | Methods for treating cd20-related disorders |
| US20250230251A1 (en) | 2023-12-20 | 2025-07-17 | Bristol-Myers Squibb Company | Antibodies targeting il-18 receptor beta (il-18rb) and related methods |
| CN117924490B (zh) * | 2023-12-22 | 2024-10-22 | 华润生物医药有限公司 | 抗il-4r抗体及其用途 |
| WO2025166234A1 (en) * | 2024-01-31 | 2025-08-07 | Apogee Therapeutics, Inc. | Methods of administering antibodies that bind interleukin 4 receptor alpha |
| WO2025166281A1 (en) | 2024-02-01 | 2025-08-07 | Regeneron Pharmaceuticals, Inc. | Platform for charge-detection mass spectrometry analysis of aavs |
| WO2025175164A1 (en) | 2024-02-16 | 2025-08-21 | Regeneron Pharmaceuticals, Inc. | Methods of producing concentrated formulated drug substances comprising proteins, and concentrated formulated drug substance made by the methods |
| WO2025194043A1 (en) | 2024-03-15 | 2025-09-18 | Regeneron Pharmaceuticals, Inc. | Polysorbate and polyoxyethylene sorbitan as excipients for stable protein formulations |
| EP4623903A1 (en) | 2024-03-28 | 2025-10-01 | Fresenius Kabi Deutschland GmbH | Pharmaceutical composition comprising dupilumab |
| WO2025221640A1 (en) | 2024-04-15 | 2025-10-23 | Sanofi Biotechnology | Methods for treating chronic rhinosinusitis without nasal polyps by administering an il-4r antagonist |
| WO2025259840A1 (en) | 2024-06-13 | 2025-12-18 | Regeneron Pharmaceuticals, Inc. | Methods and systems for scaled chromatography |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001092340A2 (en) * | 2000-05-26 | 2001-12-06 | Immunex Corporation | Use of interleukin-4 antagonists and compositions thereof |
| WO2005047331A2 (en) * | 2003-11-07 | 2005-05-26 | Immunex Corporation | Antibodies that bind interleukin-4 receptor |
| WO2008054606A2 (en) * | 2006-10-02 | 2008-05-08 | Regeneron Pharmaceuticals, Inc. | High affinity human antibodies to human il-4 receptor |
| JP5291802B2 (ja) * | 2008-10-29 | 2013-09-18 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | ヒトil−4受容体に対する高親和性ヒト抗体 |
Family Cites Families (91)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5041381A (en) * | 1986-07-03 | 1991-08-20 | Schering Corporation | Monoclonal antibodies against human interleukin-4 and hybridomas producing the same |
| GB8808015D0 (en) * | 1988-04-06 | 1988-05-05 | Ritter M A | Chemical compounds |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| WO1990005183A1 (en) * | 1988-10-31 | 1990-05-17 | Immunex Corporation | Interleukin-4 receptors |
| EP0668774A1 (en) * | 1991-05-03 | 1995-08-30 | Seragen, Inc. | Interleukin receptor targeted molecules for treatment of inflammatory arthritis |
| AU684041B2 (en) * | 1992-02-19 | 1997-12-04 | Schering Corporation | Cloning and expression of humanized monoclonal antibodies against human interleukin-4 |
| JP3315427B2 (ja) | 1992-03-05 | 2002-08-19 | 大日本除蟲菊株式会社 | 皮膚炎治療剤 |
| NZ255101A (en) | 1992-07-24 | 1997-08-22 | Cell Genesys Inc | A yeast artificial chromosome (yac) vector containing an hprt minigene expressible in murine stem cells and genetically modified rodent therefor |
| US5714146A (en) | 1992-08-26 | 1998-02-03 | Board Of Regents Of The University Of Washington | IL-4 bone therapy |
| EP0604693A1 (en) | 1992-12-29 | 1994-07-06 | Schering-Plough | Monoclonal antibodies against the human interleukin-4 receptor and hybridomas producing the same |
| RU2162711C2 (ru) * | 1993-09-07 | 2001-02-10 | Смитклайн Бичам Корпорейшн | Рекомбинантные il4-антитела, используемые для лечения нарушений, связанных с действием il4 |
| US6387632B2 (en) * | 1998-06-11 | 2002-05-14 | Hitachi, Ltd. | Polynucleotide separation method and apparatus therefor |
| ES2259478T3 (es) | 1998-09-18 | 2006-10-01 | Dynavax Technologies Corporation | Metodos para tratar trastornos asociados con la ige y composiciones para este uso. |
| US6787637B1 (en) | 1999-05-28 | 2004-09-07 | Neuralab Limited | N-Terminal amyloid-β antibodies |
| US6949245B1 (en) | 1999-06-25 | 2005-09-27 | Genentech, Inc. | Humanized anti-ErbB2 antibodies and treatment with anti-ErbB2 antibodies |
| US7879328B2 (en) * | 2000-06-16 | 2011-02-01 | Human Genome Sciences, Inc. | Antibodies that immunospecifically bind to B lymphocyte stimulator |
| EP1304115B1 (en) | 2000-07-26 | 2007-09-12 | Hououdou Co. Ltd. | Antipruritic compositions and compositions promoting wound healing |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| JP2004522725A (ja) | 2000-12-22 | 2004-07-29 | ソシエテ デ プロデユイ ネツスル ソシエテ アノニム | 免疫寛容の誘導 |
| US20030103938A1 (en) | 2001-05-09 | 2003-06-05 | Alk-Abello A/S | Pharmaceutical compositions for preventing or treating Th1 and Th2 cell related diseases by modulating the Th1/Th2 ratio |
| CA2446108A1 (en) | 2001-05-11 | 2002-11-21 | Novartis Ag | Compositions for use in treating ige-associated disorders |
| CA2447795A1 (en) | 2001-05-23 | 2002-11-28 | Duotol Ab | Suppression of allergic reactions by transdermal administration of allergens in conjunction with or conjugated to toxin subunits or fragments thereof |
| DK1461300T3 (da) | 2001-11-30 | 2011-10-24 | Biogen Idec Inc | Antistoffer mod kemotaktiske monocytproteiner |
| PT1527100E (pt) | 2002-03-29 | 2009-08-25 | Schering Corp | Anticorpos monoclonais humanos para interleucina-5 e métodos e composições compreendendo os mesmos |
| US20040101920A1 (en) | 2002-11-01 | 2004-05-27 | Czeslaw Radziejewski | Modification assisted profiling (MAP) methodology |
| AU2004209637A1 (en) | 2003-02-01 | 2004-08-19 | Tanox, Inc. | A method for generating high affinity antibodies |
| US7923209B2 (en) | 2003-03-14 | 2011-04-12 | Anergis, S.A. | Allergen peptide fragments and use thereof |
| CA2550933A1 (en) | 2003-12-22 | 2005-07-14 | Amgen Inc. | Methods for identifying functional antibodies |
| ATE395358T1 (de) | 2004-02-27 | 2008-05-15 | Regeneron Pharma | Il-4/il-13-spezifische polypetide und deren therapeutische verwendung |
| US20090098142A1 (en) * | 2004-06-09 | 2009-04-16 | Kasaian Marion T | Methods and compositions for treating and monitoring treatment of IL-13-associated disorders |
| AR049390A1 (es) * | 2004-06-09 | 2006-07-26 | Wyeth Corp | Anticuerpos contra la interleuquina-13 humana y usos de los mismos |
| TWI307630B (en) | 2004-07-01 | 2009-03-21 | Glaxo Group Ltd | Immunoglobulins |
| PE20060560A1 (es) * | 2004-08-03 | 2006-06-27 | Novartis Ag | Anticuerpos de interleucina-4 humana |
| JP5234445B2 (ja) | 2004-10-05 | 2013-07-10 | 源一郎 杣 | 薬剤 |
| WO2006083390A2 (en) | 2004-12-07 | 2006-08-10 | Children's Hospital Medical Center | Eotaxin-3 in eosinophilic esophagitis |
| TW200902555A (en) | 2005-01-03 | 2009-01-16 | Hoffmann La Roche | Antibodies against IL-13 receptor alpha 1 and uses thereof |
| US8324192B2 (en) | 2005-11-12 | 2012-12-04 | The Regents Of The University Of California | Viscous budesonide for the treatment of inflammatory diseases of the gastrointestinal tract |
| US8679545B2 (en) | 2005-11-12 | 2014-03-25 | The Regents Of The University Of California | Topical corticosteroids for the treatment of inflammatory diseases of the gastrointestinal tract |
| AU2007209202A1 (en) | 2006-01-24 | 2007-08-02 | Domantis Limited | Ligands that bind IL-4 and/or IL-13 |
| PL2374818T3 (pl) | 2006-06-02 | 2013-05-31 | Regeneron Pharma | Przeciwciała o wysokim powinowactwie przeciw ludzkiemu receptorowi IL 6 |
| JP4221018B2 (ja) | 2006-08-31 | 2009-02-12 | トヨタ自動車株式会社 | 頭部保護エアバッグ装置 |
| NZ580553A (en) | 2007-03-22 | 2012-05-25 | Genentech Inc | Apoptotic anti- ige antibodies binding the membrane-bound ige |
| EP2022507A1 (en) | 2007-08-07 | 2009-02-11 | Universität Hamburg | Antibody compositions specific for lgE, lgG4 and lgA epitopes as tools for the design of hypoallergenic molecules for specific immunotherapy |
| US8637239B2 (en) | 2007-11-05 | 2014-01-28 | The Board Of Trustees Of The University Of Illinois | Minimally-invasive measurement of esophageal inflammation |
| EP2604628A3 (en) | 2007-12-21 | 2013-08-21 | Medimmune Limited | Binding members for interleukin-4 receptor alpha (IL-4R) - 173 |
| US8092804B2 (en) | 2007-12-21 | 2012-01-10 | Medimmune Limited | Binding members for interleukin-4 receptor alpha (IL-4Rα)-173 |
| DE202008006598U1 (de) | 2008-04-11 | 2008-10-02 | Alk-Abelló A/S | Allergie-Impfstoff-Formulierung zur mucosalen Verabreichung |
| US20090264392A1 (en) | 2008-04-21 | 2009-10-22 | Meritage Pharma, Inc. | Treating eosinophilic esophagitis |
| WO2010065557A2 (en) | 2008-12-01 | 2010-06-10 | Cincinnati Children's Hospital Medical Center | Methods of determining efficacy of glucocorticoid treatment of eosinophilic esophagitis |
| EP2414520A2 (en) | 2009-03-31 | 2012-02-08 | Altair Therapeutics, Inc. | Methods of modulating an immune response to a viral infection |
| US8497528B2 (en) | 2010-05-06 | 2013-07-30 | Taiwan Semiconductor Manufacturing Company, Ltd. | Method for fabricating a strained structure |
| CN107320722A (zh) | 2009-09-07 | 2017-11-07 | Dbv技术公司 | 治疗嗜酸细胞性食管炎的方法 |
| US8993347B2 (en) | 2009-12-17 | 2015-03-31 | Cornell University | Methods for detecting antibodies in mucosal samples and device for sampling mucosal material |
| EP2585075B8 (en) | 2010-06-24 | 2021-09-22 | ViroPharma Biologics LLC | Methods of treatment for esophageal inflammation |
| JP5918246B2 (ja) * | 2010-10-06 | 2016-05-18 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | 抗インターロイキン−4受容体(il−4r)抗体を含有する安定化製剤 |
| RU2453303C1 (ru) | 2010-12-23 | 2012-06-20 | Общество с ограниченной ответственностью "ЦитоНИР" (ООО "ЦитоНИР") | Фармацевтическая композиция для лечения атопического дерматита |
| WO2012094643A2 (en) | 2011-01-06 | 2012-07-12 | Children's Hospital Medical Center | Esophageal cytokine expression profiles in eosinophilic esophagitis |
| US20130052190A1 (en) | 2011-02-22 | 2013-02-28 | Oxagen Limited | CRTH2 Antagonists for Treatment of Eosinophilic Diseases and Conditions |
| CA2840086A1 (en) | 2011-06-21 | 2012-12-27 | Children's Hospital Medical Center | Diagnostic methods for eosinophilic esophagitis |
| WO2013051928A1 (en) | 2011-10-06 | 2013-04-11 | N.V. Nutricia | Treatment of eosinophilic esophagitis |
| JP2015500326A (ja) | 2011-12-16 | 2015-01-05 | アトピックス テラピューティクス リミテッド | 好酸球性食道炎の治療のためのcrth2拮抗薬およびプロトンポンプ阻害薬の組み合わせ |
| BR112014018471A2 (pt) | 2012-01-31 | 2017-07-04 | Genentech Inc | anticorpos anti-ige m1' e métodos para o seu uso |
| WO2013155010A1 (en) | 2012-04-09 | 2013-10-17 | Children's Hospital Medical Center | Non-invasive biomarkers for eosinophilic esophagitis |
| RU2690675C2 (ru) | 2012-08-21 | 2019-06-05 | Санофи Байотекнолоджи | Способы лечения или предотвращения астмы посредством введения антагониста il-4r |
| ES2981062T3 (es) | 2012-09-07 | 2024-10-07 | Regeneron Pharma | Métodos para el tratamiento de la dermatitis atópica administrando un antagonista de IL-4R |
| WO2014059178A1 (en) | 2012-10-10 | 2014-04-17 | Rhode Island Hospital | Differential expression of novel protein markers for the diagnosis and treatment of eosinophilic esophagitis |
| JP2016507523A (ja) | 2013-02-05 | 2016-03-10 | エンクマフ アーゲー | CD3εおよびBCMAに対する二重特異的抗体 |
| TWI697334B (zh) | 2013-06-04 | 2020-07-01 | 美商再生元醫藥公司 | 藉由投與il-4r抑制劑以治療過敏及增強過敏原-特異之免疫療法的方法 |
| EP3613432B1 (en) * | 2013-06-21 | 2025-08-06 | Sanofi Biotechnology | Methods for treating nasal polyposis by administering an il-4r antagonist |
| TWI634900B (zh) | 2013-07-11 | 2018-09-11 | 再生元醫藥公司 | 藉由投與il-4r抑制劑治療嗜酸性食道炎的方法 |
| RU2552929C1 (ru) | 2013-11-14 | 2015-06-10 | Общество С Ограниченной Ответственностью "Фарминтерпрайсез" | Фармацевтическая композиция, содержащая производные глутаримидов, и их применение для лечения эозинофильных заболеваний |
| IL315136A (en) * | 2014-02-21 | 2024-10-01 | Sanofi Biotechnology | Methods for treating or preventing asthma by administering an il-4rantagonist |
| WO2015130975A1 (en) | 2014-02-28 | 2015-09-03 | Regeneron Pharmaceuticals, Inc. | Methods for treating skin infection by administering an il-4r antagonist |
| MX2017006286A (es) * | 2014-11-14 | 2018-01-23 | Sanofi Biotechnology | Metodos para tratar sinusitis cronica con polipos nasales por administracion de un antagonista de il-4r. |
| ES2983475T3 (es) | 2016-02-19 | 2024-10-23 | Regeneron Pharma | Métodos para mejorar la eficacia de una vacuna mediante la administración de un antagonista de IL-4R |
| TWI777515B (zh) | 2016-08-18 | 2022-09-11 | 美商愛戴爾製藥股份有限公司 | 治療嗜伊紅性食道炎之方法 |
| EP4442323A3 (en) | 2016-09-01 | 2025-01-01 | Regeneron Pharmaceuticals, Inc. | Methods for preventing or treating allergy by administering an il-4r antagonist |
| EP4345110A3 (en) | 2016-09-22 | 2024-06-12 | Regeneron Pharmaceuticals, Inc. | Methods for treating severe atopic dermatitis by administering an il-4r inhibitor |
| US10485844B2 (en) | 2016-09-22 | 2019-11-26 | Regeneron Pharmaceuticals, Inc. | Methods for treating severe atopic dermatitis by administering an IL-4R inhibitor |
| WO2018151836A1 (en) | 2017-02-17 | 2018-08-23 | Fred Hutchinson Cancer Research Center | Combination therapies for treatment of bcma-related cancers and autoimmune disorders |
| EP3615068A1 (en) | 2017-04-28 | 2020-03-04 | Novartis AG | Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor |
| WO2019028367A1 (en) | 2017-08-04 | 2019-02-07 | Regeneron Pharmaceuticals, Inc. | METHODS OF TREATING ESOPHAGITIS WITH ACTIVE EOSINOPHILES |
| KR20250044796A (ko) | 2017-10-30 | 2025-04-01 | 사노피 바이오테크놀로지 | Il-4r 길항제를 투여하여 천식을 치료 또는 예방하는 방법 |
| MA52624A (fr) | 2018-05-13 | 2021-03-24 | Regeneron Pharma | Méthodes de traitement de la dermatite atopique par administration d'un inhibiteur de l'il-4r |
| PH12021552123A1 (en) | 2019-03-21 | 2022-08-22 | Regeneron Pharma | Combination of il-4/il-13 pathway inhibitors and plasma cell ablation for treating allergy |
| US11504426B2 (en) | 2019-08-05 | 2022-11-22 | Regeneron Pharmaceuticals, Inc. | Methods for treating allergy and enhancing allergen-specific immunotherapy by administering an IL-4R antagonist |
| AU2020326713A1 (en) | 2019-08-05 | 2022-02-17 | Regeneron Pharmaceuticals, Inc. | Methods for treating atopic dermatitis by administering an il-4r antagonist |
| BR112022011098A2 (pt) | 2019-12-09 | 2022-09-20 | Sanofi Biotechnology | Métodos para tratamento de distúrbios relacionados a il-4/il-13 digitalmente identificados |
| AU2021244266A1 (en) | 2020-03-27 | 2022-12-01 | Regeneron Pharmaceuticals, Inc. | Methods for treating atopic dermatitis by administering an IL-4R antagonist |
| IL298257A (en) | 2020-05-22 | 2023-01-01 | Regeneron Pharma | Methods for treating eosinophilic esophagitis by administering an il-4r inhibitor |
| US20220220211A1 (en) | 2021-01-08 | 2022-07-14 | Regeneron Pharmaceuticals, Inc. | Methods for treating peanut allergy and enhancing peanut allergen-specific immunotherapy by administering an il-4r antagonist |
-
2008
- 2008-10-29 US US12/260,307 patent/US7608693B2/en active Active
-
2009
- 2009-09-10 US US12/556,605 patent/US8075887B2/en active Active
- 2009-10-08 JO JO2009369A patent/JO2865B1/en active
- 2009-10-26 PE PE2009001202A patent/PE20100738A1/es active IP Right Grant
- 2009-10-26 AR ARP090104117A patent/AR073978A1/es active IP Right Grant
- 2009-10-27 HU HUE16161244A patent/HUE039212T2/hu unknown
- 2009-10-27 EP EP20162800.5A patent/EP3715372B1/en active Active
- 2009-10-27 EP EP13163791.0A patent/EP2636685A1/en not_active Withdrawn
- 2009-10-27 PT PT201628005T patent/PT3715372T/pt unknown
- 2009-10-27 DK DK16161244.5T patent/DK3064511T3/en active
- 2009-10-27 LT LTEP20162800.5T patent/LT3715372T/lt unknown
- 2009-10-27 EP EP12175412A patent/EP2511300A3/en not_active Withdrawn
- 2009-10-27 EP EP23216315.4A patent/EP4345111A3/en active Pending
- 2009-10-27 SI SI200931856T patent/SI3064511T1/en unknown
- 2009-10-27 UA UAA201106576A patent/UA102122C2/ru unknown
- 2009-10-27 AU AU2009311496A patent/AU2009311496B9/en active Active
- 2009-10-27 BR BRPI0919853A patent/BRPI0919853B8/pt active IP Right Grant
- 2009-10-27 KR KR1020117008418A patent/KR101599706B1/ko active Active
- 2009-10-27 SM SM20180362T patent/SMT201800362T1/it unknown
- 2009-10-27 PL PL18158965T patent/PL3351560T3/pl unknown
- 2009-10-27 FI FIEP20162800.5T patent/FI3715372T3/fi active
- 2009-10-27 ES ES18158965T patent/ES2802241T3/es active Active
- 2009-10-27 HR HRP20240492TT patent/HRP20240492T1/hr unknown
- 2009-10-27 CN CN201610697572.9A patent/CN106267190B/zh active Active
- 2009-10-27 RS RS20240418A patent/RS65385B1/sr unknown
- 2009-10-27 RU RU2011120194A patent/RU2539774C3/ru active Protection Beyond IP Right Term
- 2009-10-27 RS RS20130206A patent/RS52782B/sr unknown
- 2009-10-27 NZ NZ596093A patent/NZ596093A/xx unknown
- 2009-10-27 JP JP2011534672A patent/JP5291802B2/ja active Active
- 2009-10-27 HU HUS1800014C patent/HUS1800014I1/hu unknown
- 2009-10-27 EP EP16161244.5A patent/EP3064511B1/en active Active
- 2009-10-27 DK DK20162800.5T patent/DK3715372T5/da active
- 2009-10-27 PT PT161612445T patent/PT3064511T/pt unknown
- 2009-10-27 PL PL09744292T patent/PL2356151T3/pl unknown
- 2009-10-27 WO PCT/US2009/062168 patent/WO2010053751A1/en not_active Ceased
- 2009-10-27 MX MX2011003346A patent/MX2011003346A/es active IP Right Grant
- 2009-10-27 CA CA2737044A patent/CA2737044C/en active Active
- 2009-10-27 HR HRP20130467AT patent/HRP20130467T1/hr unknown
- 2009-10-27 ES ES09744292T patent/ES2404206T3/es active Active
- 2009-10-27 PT PT181589656T patent/PT3351560T/pt unknown
- 2009-10-27 HU HUE20162800A patent/HUE066473T2/hu unknown
- 2009-10-27 MY MYPI20111157 patent/MY152448A/en unknown
- 2009-10-27 SI SI200932193T patent/SI3715372T1/sl unknown
- 2009-10-27 ES ES20162800T patent/ES2975006T3/es active Active
- 2009-10-27 PT PT97442925T patent/PT2356151E/pt unknown
- 2009-10-27 EP EP09744292.5A patent/EP2356151B1/en active Active
- 2009-10-27 CN CN201410018529.6A patent/CN103739711B/zh active Active
- 2009-10-27 PL PL20162800.5T patent/PL3715372T3/pl unknown
- 2009-10-27 CN CN200980143007.6A patent/CN102197052B/zh active Active
- 2009-10-27 DK DK09744292.5T patent/DK2356151T3/da active
- 2009-10-27 MX MX2018007175A patent/MX388436B/es unknown
- 2009-10-27 ES ES16161244.5T patent/ES2675917T3/es active Active
- 2009-10-27 SI SI200930614T patent/SI2356151T1/sl unknown
- 2009-10-27 MX MX2015014098A patent/MX356882B/es unknown
- 2009-10-27 LT LTEP16161244.5T patent/LT3064511T/lt unknown
- 2009-10-27 EP EP18158965.6A patent/EP3351560B1/en active Active
- 2009-10-27 NZ NZ591922A patent/NZ591922A/en unknown
- 2009-10-27 PL PL16161244T patent/PL3064511T3/pl unknown
- 2009-10-27 RS RS20180811A patent/RS57522B1/sr unknown
- 2009-10-28 TW TW107145611A patent/TW201919700A/zh unknown
- 2009-10-28 TW TW105100749A patent/TWI658833B/zh active
- 2009-10-28 CL CL2009002004A patent/CL2009002004A1/es unknown
- 2009-10-28 TW TW098136389A patent/TWI538686B/zh active
- 2009-10-29 PA PA20098847001A patent/PA8847001A1/es unknown
- 2009-10-29 UY UY0001032213A patent/UY32213A/es not_active Application Discontinuation
-
2011
- 2011-03-10 ZA ZA2011/01867A patent/ZA201101867B/en unknown
- 2011-03-14 IL IL211726A patent/IL211726A/en active Protection Beyond IP Right Term
- 2011-03-18 CR CR20110148A patent/CR20110148A/es unknown
- 2011-04-01 NI NI201100064A patent/NI201100064A/es unknown
- 2011-04-13 SV SV2011003880A patent/SV2011003880A/es unknown
- 2011-04-27 CO CO11051317A patent/CO6362024A2/es active IP Right Grant
- 2011-04-28 EC EC2011011010A patent/ECSP11011010A/es unknown
- 2011-04-29 HN HN2011001210A patent/HN2011001210A/es unknown
- 2011-05-19 MA MA33857A patent/MA32802B1/fr unknown
- 2011-11-02 US US13/287,151 patent/US8337839B2/en active Active
-
2012
- 2012-11-16 US US13/678,650 patent/US8735095B2/en active Active
-
2013
- 2013-05-07 JP JP2013097263A patent/JP5844772B2/ja active Active
- 2013-06-26 SM SM201300074T patent/SMT201300074B/xx unknown
- 2013-07-05 CY CY20131100565T patent/CY1114123T1/el unknown
-
2014
- 2014-02-27 PH PH12014500462A patent/PH12014500462A1/en unknown
- 2014-04-16 US US14/254,369 patent/US20140271681A1/en not_active Abandoned
- 2014-11-26 RU RU2014147773A patent/RU2663106C2/ru active
-
2015
- 2015-10-08 JP JP2015199976A patent/JP6449125B2/ja active Active
-
2017
- 2017-12-28 LU LU00059C patent/LUC00059I2/fr unknown
-
2018
- 2018-01-11 LT LTPA2018002C patent/LTC2356151I2/lt unknown
- 2018-01-12 NL NL300922C patent/NL300922I2/nl unknown
- 2018-01-17 CY CY2018003C patent/CY2018003I1/el unknown
- 2018-01-18 US US15/874,635 patent/US20180179288A1/en not_active Abandoned
- 2018-03-06 NO NO2018009C patent/NO2018009I2/no unknown
- 2018-03-08 FR FR18C1011C patent/FR18C1011I2/fr active Active
- 2018-07-16 CY CY20181100734T patent/CY1122092T1/el unknown
- 2018-07-18 HR HRP20181148TT patent/HRP20181148T1/hr unknown
- 2018-11-07 JP JP2018209345A patent/JP6608505B2/ja active Active
-
2019
- 2019-10-21 JP JP2019191643A patent/JP6843208B2/ja active Active
-
2020
- 2020-10-06 US US17/064,393 patent/US12162943B2/en active Active
-
2021
- 2021-02-19 JP JP2021024740A patent/JP7100731B2/ja active Active
-
2022
- 2022-06-30 JP JP2022105797A patent/JP7442581B2/ja active Active
-
2023
- 2023-05-02 NO NO2023019C patent/NO2023019I1/no unknown
-
2024
- 2024-02-19 JP JP2024022482A patent/JP2024040526A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2001092340A2 (en) * | 2000-05-26 | 2001-12-06 | Immunex Corporation | Use of interleukin-4 antagonists and compositions thereof |
| WO2005047331A2 (en) * | 2003-11-07 | 2005-05-26 | Immunex Corporation | Antibodies that bind interleukin-4 receptor |
| WO2008054606A2 (en) * | 2006-10-02 | 2008-05-08 | Regeneron Pharmaceuticals, Inc. | High affinity human antibodies to human il-4 receptor |
| JP5291802B2 (ja) * | 2008-10-29 | 2013-09-18 | リジェネロン・ファーマシューティカルズ・インコーポレイテッド | ヒトil−4受容体に対する高親和性ヒト抗体 |
Non-Patent Citations (2)
| Title |
|---|
| IMMUNOL. TODAY, (1993), 14, [6], P.243-246, JPN6008055244, ISSN: 0003785907 * |
| J. MOL. BIOL., (1992), 224, [2], P.487-499, JPN6008055243, ISSN: 0003785906 * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7442581B2 (ja) | ヒトil-4受容体に対する高親和性ヒト抗体 | |
| AU2014216019B2 (en) | High affinity human antibodies to Human IL-4 receptor | |
| US20250197516A1 (en) | High affinity human antibodies to human il-4 receptor | |
| HK40102995A (en) | High affinity human antibodies to human il-4 receptor | |
| HK40036835A (en) | High affinity human antibodies to human il-4 receptor | |
| HK40036835B (en) | High affinity human antibodies to human il-4 receptor | |
| HK1250733B (en) | Medical use of high affinity human antibodies to human il-4 receptor | |
| HK1228425A1 (en) | Medical use of high affinity human antibodies to human il-4 receptor | |
| HK1228425B (en) | Medical use of high affinity human antibodies to human il-4 receptor | |
| HK1189600A (en) | High affinity human antibodies to human il-4 receptor | |
| HK1159136B (en) | High affinity human antibodies to human il-4 receptor |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160809 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20161102 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170201 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20170704 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20171004 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20171212 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180508 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20180724 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20181107 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20181113 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20181205 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6449125 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |