-
Hintergrund der Erfindung
-
Gebiet der Erfindung
-
Diese
Erfindung betrifft ein Verfahren zur Verwendung von Wasserstoffperoxid
und negativem Druck, um Artikel, wie medizinische Instrumente, zu
sterilisieren, sowie insbesondere ein Verfahren, das einen Vorbehandlungsschritt
der Artikel mit flüssigem
Wasserstoffperoxid vor der Einwirkung eines negativen Drucks oder
eines negativen Drucks kombiniert mit Plasma beinhaltet.
-
Beschreibung
des verwandten Standes der Technik
-
Medizinische
Instrumente sind herkömmlicher
Weise durch den Einsatz von entweder Hitze, beispielsweise durch
Dampf zur Verfügung
gestellt, oder einer Chemikalie, wie Formaldehyd oder Ethylenoxid
im gas- oder dampfförmigen
Zustand, sterilisiert worden. Jede dieser Methoden hat Nachteile.
Viele medizinische Geräte,
wie faseroptische Vorrichtungen, Endoskope, Kraftwerkzeuge, usw.
sind empfindlich gegenüber
Hitze, Feuchtigkeit oder beidem. Formaldehyd und Ethylenoxid sind
beides toxische Gase, die eine potentielle Gefährdung für das Pflegepersonal darstellen.
Probleme mit Ethylenoxid sind besonders ernst, da dessen Verwendung
lange Belüftungszeiten
benötigt,
um das Gas von den Artikeln, die sterilisiert worden sind, zu entfernen.
Dieses führt
zu unerwünscht
langen Sterilisatinnszykluszeiten.
-
Es
wurde gefunden, dass die Sterilisation unter Verwendung von flüssigen Wasserstoffperoxiden
eine hohe Konzentration an Sterilisationsmittel, ausgedehnte Behandlungszeiten
und/oder erhöhte
Temperaturen erfordert. Es konnte jedoch gezeigt werden, dass die
Sterilisation unter Verwendung von Wasserstoffperoxiddampf einige
Vorteile gegenüber
anderen chemischen Sterilisationsverfahren hat (siehe z. B. U.S.
Pat. Nr. US-A-4,169,123 und US-A-4,169,124). Gemäß U.S. Pat. US-A-4,643,876,
am 17. Februar 1987 für
Jacobs et al. erteilt, gehen bei der Kombination von Wasserstoffperoxid
mit einem Plasma gewisse zusätzliche
Vorteile einher. U.S. Pat. US-A-4,756,882, am 12. Juli 1988 ebenfalls
für Jacobs
et al. erteilt, offenbart die Verwendung von Wasserstoffperoxiddampf
erzeugt aus einer wässerigen
Lösung
von Wasserstoffperoxid, als eine Vorstufe einer durch einen Plasmagenerator
erzeugten reaktiven Spezies. Die Kombination von Wasserstoffperoxiddampf,
das in enger Nachbarschaft mit den zu sterilisierenden Artikeln
diffundiert, und Plasma wirkt, um die Artikel sogar innerhalb verschlossener
Verpackungen zu sterilisieren. Während
des weiteren diese Verfahren, Wasserstoffperoxiddampf mit einem
Plasma zu kombinieren, in "offenen" Systemen geeignet
sind, wurde gefunden, dass sie unzureichend sind, um eine Sterilisation
in Artikeln mit Bereichen eingeschränkter Diffusion zu bewirken,
da diese Verfahren von der Diffusion des Sterilisationsdampfes in
enger Nachbarschaft abhängen,
bevor eine Sterilisation erreicht werden kann. Diese Methoden erfordern
demgemäß eine hohe
Konzentration an Sterilisationsmitteln, ausgedehnte Behandlungszeiten
und/oder erhöhte
Temperaturen, wenn bei langen, engen Hohlkörper eingesetzt. Beispielsweise
sind Hohlkörper,
die länger
als 27 cm sind und/oder einen internen Durchmesser von weniger als
2,3 cm haben, besonders schwer zu sterilisieren. Demgemäß existiert
keine einfache, sichere, effektive Methode zur Sterilisierung schmaler
Hohlkörper
im Stand der Technik.
-
Die
Sterilisation von Artikeln, enthaltend diffusionsbeschränkte Bereiche,
wie lange enge Hohlkörper, stellt
daher eine besondere Herausforderung dar. Verfahren, die Wasserstoffperoxiddampf
verwenden, der aus einer wässerigen
Lösung
von Wasserstoffperoxid erzeugt worden ist, haben gewisse Nachteile,
weil:
- 1. Wasser verfügt über einen höheren Dampfdruck als Wasserstoffperoxid
und wird aus einer wässerigen Lösung schneller
verdampfen als Wasserstoffperoxid.
- 2. Wasser verfügt über eine
geringeres Molekulargewicht als Wasserstoffperoxid und wird schneller
in die Dampfphase diffundieren als Wasserstoffperoxid.
-
Aus
diesem Grunde wird, wenn eine wässerige
Lösung
an Wasserstoffperoxid in dem die zu sterilisierenden Gegenstände umgebenden
Bereich verdampft wird, das Wasser diese Gegenstände zuerst und in hoher Konzentration
erreichen. Der Wasserdampf stellt daher eine Barriere für die Penetration
von Wasserstoffperoxiddampf in diffusionsbeschränkte Bereiche dar, wie schmale
Spalten und lange enge Hohlkörper.
Man kann das Problem nicht durch Entfernung des Wassers aus der
wässerigen
Lösung
und durch den Einsatz an höher
konzentriertem Wasserstoffperoxid lösen, da unter anderem konzentrierte
Lösungen
an Wasserstoffperoxid größer 65 Gew.-%
bedingt durch ihre oxidierende Natur gefährlich sein können.
-
U.S.
Pat. US-A-4,952,370 von Cummings et al. offenbart ein Sterilisationsverfahren,
bei dem wässeriger
Wasserstoffperoxiddampf zunächst
auf dem zu sterilisierenden Artikel kondensiert wird und anschließend eine
Vakuumquelle an die Sterilisationskammer angeschlossen wird, um
das Wasser und Wasserstoffperoxid von dem Artikel zu verdampfen.
Dieses Verfahren ist geeignet, um Oberflächen zu sterilisieren, es ist
jedoch ineffektiv für
die schnelle Sterilisation diffusionsbeschränkter Bereiche, wie solche,
die man in Hohlkörpervorrichtungen
findet, da dieses ebenfalls von der Diffusion des Wasserstoffperoxiddampfes
des in die Hohlkörper abhängt, um
eine Sterilisation zu bewirken.
-
Die
U.S. Pat. US-A-4,943,414 (und EP-A-0 302 419), betitelt "Verfahren zur Dampfsterilisation
von Artikeln mit Hohlräumen" und für Jacobs
et al. erteilt, offenbart ein Verfahren, in dem ein Gefäß, enthaltend
eine geringe Menge an verdampfbarer flüssiger Sterilisationsmittellösung, an
dem Hohlraum befestigt ist, und das Sterilisationsmittel verdampft
und fließt
direkt in den Hohlraum des Artikels, wenn der Druck während des
Sterilisationszyklus reduziert wird. Dieses System hat den Vorteil,
dass der Wasser- und Wasserstoffperoxiddampf durch das existierende
Druckdifferential durch den Hohlraum gezogen werden, wodurch die
Sterilisationsgeschwindigkeit für
Hohlräume
gesteigert wird, hat jedoch den Nachteil, dass das Gefäß an jedem
zu sterilisierenden Hohlraum befestigt werden muß. Außerdem wird das Wasser schneller
verdampft und geht dem Wasserstoffperoxiddampf in dem Hohlraum voran.
-
In
der U.S. Pat. Nr. US-A-5,492,672 wird ein Verfahren zur Sterilisierung
schmaler Hohlkörper
offenbart. Dieses Verfahren verwendet einen mehrkomponentigen Sterilisationsmitteldampf
und erfordert alternierend aufeinander folgende Perioden des Flusses
an Sterilisationsmitteldampf sowie die Unterbrechung dieses Flusses.
Eine komplexe Vorrichtung wird eingesetzt, um dieses Verfahren auszuführen. Da
ein Durchfluss an Dampf eingesetzt wird, können geschlossenendige Hohlkörper nicht
ohne weiteres mit diesem Verfahren sterilisiert werden.
-
Demgemäß verbleibt
ein Bedarf nach einer einfachen und wirksamen Methode zur Dampfsterilisation von
Artikeln mit Bereichen, in denen die Diffusion dieses Dampfes eingeschränkt ist,
wie bei langen, schmalen Hohlkörper.
-
Zusammenfassung
der Erfindung
-
Ein
Aspekt der vorliegenden Erfindung betrifft ein Verfahren zur Sterilisation
des Inneren einer Vorrichtung mit Bereichen eingeschränkter Diffusion,
wie bei einer Vorrichtung mit einem Hohlraum. Das Verfahren umfasst
die Schritte des Kontaktierens des Inneren der Vorrichtung mit einer
wässerigen
Lösung,
enthaltend Wasserstoffperoxid, und der Einwirkung von negativem
Druck auf die Vorrichtung für
eine Zeitdauer, die ausreicht, um eine vollständige Sterilisation zu bewirken.
In einer Ausführungsform
stellt die flüssige
Lösung
Peressigsäure
dar. Wenn der Einwirkungsschritt für 1 Stunde bei 40°C und 10
torr durchgeführt
wird, hält
der Bereich eingeschränkter
Diffusion vorzugsweise 0,17 mg/L oder mehr Wasserstoffperoxid zurück, oder
hält 17% oder
mehr an darin plaziertem Wasserstoffperoxid nach dem Einwirkschritt
zurück.
In gewissen bevorzugten Ausführungsformen
hat der diffusionsbeschränkte
Bereich dieselbe oder eine größere Diffusionsbeschränkung als
die, welche durch einen Hohlraum mit einer Länge von 27 cm und einem internen
Durchmesser von 3 mm zur Verfügung
gestellt wird, oder hat dieselbe oder eine größere Diffusionsbeschränkung als
eine solche, die durch einen Hohlraum mit einem Länge-zu-Innendurchmesser-Verhältnis größer als
50 zur Verfügung
gestellt. Die Lösung
verfügt
vorzugsweise über
eine Konzentration von weniger als 25 Gew.-%. Der Kontaktierschritt
kann über
einen Zufluss via einer Methode wie der Injektion, dem stationären Einweichen,
dem Flüssigdurchfluss
oder einem Aerosolspray durchgeführt
werden. In einer bevorzugten Ausführungsform verfügt der Bereich
mit eingeschränkter
Diffusion über
einen Hohlraum mit einer Länge
von wenigstens 27 cm und einem Innendurchmesser von nicht mehr als
3 mm, besonders bevorzugt über
einen Innendurchmesser von nicht mehr als 1 mm. Der Einwirkschritt
wird vorzugsweise für
60 Minuten oder weniger durchgeführt
und wird vorzugsweise bei einem Druck durchgeführt, der geringer ist als der
Dampfdruck von Wasserstoffperoxid. Demgemäß liegt der bevorzugte Druckbereich
unter den Bedingungen der vorliegenden Erfindung zwischen 0 und 100
torr. In einer besonders bevorzugten Ausführungsform ist der Druck ungefähr 10 torr,
und der Einwirkschritt wird bei einer Temperatur von ungefähr 23°C bis ungefähr 28°C durchgeführt. Der
Einwirkschritt kann den Schritt des Aufheizens des Artikels beinhalten,
beispielsweise durch Aufheizen der Kammer, in der der Einwirkschritt
stattfindet. Die Kammer kann auf etwa 40°C bis etwa 45°C aufgeheizt
werden. Alternativ kann die Lösung
aufgeheizt werden, beispielsweise auf eine Temperatur von etwa 40°C bis etwa
45°C. Optional
kann der Schritt des Einwirkens eines Plasmas auf die Vorrichtung
während
des Schritts des Einwirkens von negativem Druck auf die Vorrichtung
vorgenommen werden. In einer Ausführungsform, bei der die Einwirkung
von Plasma zum Einsatz kommt, wird das Verfahren in einer ersten
Kammer durchgeführt
und das Plasma wird in einer zweiten, separaten Kammer erzeugt.
Diese Ausführungsform
umfasst ferner den Schritt des Fließens des Plasmas in die erste
Kammer. Vorteilhafterweise können
die Kontaktier- und Einwirkschritte des Verfahrens ein- oder mehrmals
wiederholt werden.
-
Ein
weiterer Aspekt der vorliegenden Erfindung betrifft ein Verfahren
zur Sterilisierung des Inneren und des Äußeren eines Artikels. Dieses
Verfahren beinhaltet die folgenden Schritte: Kontaktieren des Artikels
mit einer wässerigen
Lösung,
enthaltend Wasserstoffperoxid; und Platzieren des Artikels in einer
Umgebung mit eingeschränkter
Diffusion. Die Kontaktier- und Platzierschritte können in
jedweder Reihenfolge durchgeführt werden.
An diese Schritte schließt
sich ein Einwirken von negativem Druck auf die Umgebung mit eingeschränkter Diffusion
für eine
Zeitdauer, die ausreicht, um eine vollständige Sterilisation zu bewirken,
an. Der Kontaktierschritt kann sowohl vor als auch nach dem Platzierschritt
durchgeführt
werden. Wenn der Einwirkschritt bei 40°C und 10 torr durchgeführt wird,
hält die
Umgebung mit eingeschränkter
Diffusion vorzugsweise 0,17 mg/L oder mehr Wasserstoffperoxid nach
dem Einwirkschritt zurück,
oder hält
17% oder mehr an darin nach dem Einwirkschritt plaziertem Wasserstoffperoxid
zurück.
Der Einwirkschritt kann den Schritt des Erhitzens des Artikels beinhalten,
beispielsweise durch Erhitzen der Kammer, in der der Einwirkschritt
stattfindet, oder durch Erhitzen der flüssigen Lösung. In gewissen bevorzugten
Ausführungsformen
verfügt
die Umgebung mit eingeschränkter
Diffusion über
dieselbe oder eine größere Diffusionsbeschränkung als
jene, die durch eine einzige Eingangs- und Ausgangsöffnung mit
einem Innendurchmesser von 9 mm oder weniger und einer Länge größer 1 cm
erzeugt wird, oder ist hinreichend diffusionseingeschränkt, um
eine Klinge aus rostfreiem Stahl in einem 2,2 cm × 60 cm
Glasrohr mit einem Gummistopfen mit einem 1 mm × 50 cm Ausgangsrohr aus rostfreiem
Stahl darin bei einem Vakuum von 10 torr für 1 Stunde bei 40°C vollständig zu
sterilisieren. Die Lösung kann
Peressigsäure
sein. Der Kontaktierschritt kann den Zufluss via einer Methode wie
der Injektion, dem stationären
Einweichen, dem Flüssigdurchfluss
oder dem Aerosolspray darstellen. Ebenfalls kann Plasma während des
Schritts des Einwirkens von negativem Druck auf den Hohlkörper verwendet
werden. Wenn Plasma verwendet wird, kann das Verfahren in einer
verschlossenen Kammer durchgeführt
werden und das Plasma wird innerhalb des Behälters erzeugt. Demgemäß kann das
Verfahren in einer ersten Kammer durchgeführt und das Plasma in einer
zweiten, separaten Kammer erzeugt werden, und das Plasma fließt in die
erste Kammer. Der Behälter
mit eingeschränkter
Diffusion kann wenigstens über
ein Ausgangsrohr verfügen,
beispielsweise eines, das über
eine Länge
von mindestens 1 cm verfügt
und einen Innendurchmesser von 9 mm oder weniger aufweist. Das Ausgangsrohr
kann ebenfalls einen Filter beinhalten. In einer bevorzugten Ausführungsform
reicht der Filter aus, um den Eintritt von Bakterien aus der Umgebung
in den Behälter
zu verhindern. Die Lösung
kann eingesetzt werden mit einer Konzentration von weniger als 25
Gew.-%. Der Einwirkschritt wird vorzugsweise für 60 Minuten oder weniger durchgeführt. Das
Verfahren kann einhergehen mit dem Schritt des Erhitzens des Artikels,
während
der Einwirkschritt durchgeführt
wird. Demgemäß kann der
Einwirkschritt in einer Kammer durchgeführt und die Kammer während des
Einwirkschritts erhitzt werden. Der Einwirkschritt kann bei einem
negativem Druck zwischen 0 und 100 torr durchgeführt werden. Vorteilhafterweise
können
die verschiedenen Schritte dieses Verfahrens ebenfalls ein oder
mehrere Male wiederholt werden.
-
Kurze Beschreibung
der Abbildungen
-
1 stellt eine Querschnittsansicht
eines Hohlraums dar, enthaltend eine Klinge aus angeimpftem rostfreien
Stahl in einem Glasrohr mit nur einer schmalen Öffnung, um eine Umgebung mit
eingeschränkter Diffusion
zwecks Testens des Sterilisationsverfahrens der vorliegenden Erfindung
zu erzeugen.
-
2 stellt eine Querschnittsansicht
einer angeimpften Klinge aus rostfreiem Stahl dar, die direkt in einem
Glasrohr platziert ist, das nur eine schmale Öffnung aufweist, um eine ausgewechselte
Umgebung mit eingeschränkter
Diffusion zwecks Testens des Sterilisationsverfahrens der vorliegenden
Erfindung zur erzeugen.
-
3 stellt eine Querschnittsansicht
einer angeimpften Klinge aus rostfreiem Stahl dar, direkt platziert in
einem Glasrohr mit einem an seiner schmalen Öffnung platzierten Filter,
um eine ausgewechselte Umgebung mit eingeschränkter Diffusion zwecks Testens
des Sterilisationsverfahrens der vorliegenden Erfindung zu erzeugen.
-
Detaillierte Beschreibung
der bevorzugten Ausführungsform
-
Die
Sterilisation der Innenseite von Hohlraumvorrichtungen hat immer
eine Herausforderung für
Sterilisationssysteme dargestellt. Eine schnelle Sterilisation von
Vorrichtungen mit Hohlräumen
oder anderen Artikeln mit eingeschränkter Diffusion bei geringen
Temperaturen und geringen Konzentrationen an Sterilisationsmittel
zu erreichen, stellt eine nochmals größere Herausforderung dar. Mit
der vorliegenden Erfindung werden die Mängel der Sterilisationssysteme
des Standes der Technik durch Vorbehandlung der zu sterilisierenden
Artikel mit einer wässerigen
Lösung
von Wasserstoffperoxid (d. h. einer Lösung, umfassend sowohl Wasser
wie auch Wasserstoffperoxid) vor dem Einwirken eines Vakuums oder,
optional, Plasma behoben. Das Verfahren der vorliegenden Erfindung
besorgt eine schnelle Sterilisation von Artikeln mit Hohlräumen und
ohne Hohlräume
unter Bedingungen, die die Artikel weder schädigen noch toxische Rückstände auf
dem sterilisierten Artikel belassen.
-
Gemäß dem Verfahren
der vorliegenden Erfindung werden verdünnte wässerige Lösungen von Wasserstoffperoxid
in direktem Kontakt mit dem zu sterilisierenden Artikel gebracht.
Im Fall einer Vorrichtung mit einem Hohlraum wird die Lösung direkt
in den Hohlraum eingebracht. Im Fall eines Artikels mit einem Bereich, in
dem die Diffusion von Dampf eingeschränkt ist, wird die Lösung in
das Innere des Bereichs mit eingeschränkter Diffusion eingebracht.
Die Wasserstoffperoxidlösung
wird in den Hohlraum eingebracht oder in Kontakt mit dem zu sterilisierenden
Artikel gebracht durch Mittel wie beispielsweise der direkten Einbringung, einem
stationären
Einweichprozess, einem Flüssigdurchflussprozess
oder mittels Aerosolspray. Die wässerigen
Lösungen
von Wasserstoffperoxid können
relativ verdünnt
sein, beispielsweise so gering wie bis 1 bis 3 Gew.-% oder weniger,
da die Sterilisation nicht erreicht wird durch Kontakt mit der Wasserstoffperoxidlösung, sondern
vielmehr erreicht wird bei tiefen Temperaturen und in kurzen Zeitabschnitten
bei Einwirkung von Wasserstoffperoxiddampf unter Vakuum oder unter
Vakuum kombiniert mit Plasma. Dieses Verfahren der vorliegenden
Erfindung ist besonders wirksam bei Artikeln mit unzugänglichen
oder schwierig zu erreichenden Plätzen. Derartige Artikel umfassen
lange, schmale Hohlräume,
Gelenke und andere Artikel mit Räumen,
bei denen die Diffusion von Dämpfen
eingeschränkt
ist.
-
Die
generelle Vorgehendweise einer Ausführungsform eines Verfahrens
der vorliegenden Erfindung, die geeignet ist zur Sterilisation der
Innenseite von langen, schmalen Hohlräumen, stellt sich wie folgt
dar:
- 1. Der zu sterilisierende Hohlraum wird
einer wässerigen
Lösung
von verdünntem
Wasserstoffperoxid ausgesetzt. Die wässerige Lösung kann als eine geringe
Menge direkt in den Hohlraum eingebracht werden oder mittels stationären Einweichens,
Flüssigdurchfluss
oder Aerosolspray.
- 2. Der zu sterilisierende Hohlraum wird in einer Kammer platziert,
und die Kammer wird verschlossen und evakuiert. (Peroxide können ebenfalls
innerhalb des Artikels eingebracht werden nach Platzierung des Artikels
in der Kammer.)
- 3. Der Hohlraum wird einem Vakuum für eine Zeitdauer und bei einer
Temperatur, die ausreicht, die Sterilisation zu bewirken, ausgesetzt.
- 4. Der sterile Hohlraum wird aus der Kammer entfernt.
-
Gemäß einer
alternativen Ausführungsform
des Verfahrens der vorliegenden Erfindung wird ein ähnliches
Verfahren eingesetzt, um sowohl das Innere als auch das Äußere eines
Artikels zu sterilisieren. Gemäß dieser
alternativen Ausführungsform
wird der zu sterilisierende Artikel in einer Umgebung mit eingeschränkter Diffusion
platziert. Falls der zu sterilisierende Artikel selber diffusionsbeschränkt ist,
beispielsweise ein langer, schmaler Hohlkörper, wird Peroxid in das Innere
des Artikels eingeführt.
Bei Artikeln, die nicht diffusionsbeschränkt sind, kann das Peroxid
irgendwo innerhalb der Umgebung mit eingeschränkter Diffusion eingeführt werden.
Peroxid kann entweder vor oder nach der Platzierung des Artikels
in der Umgebung mit eingeschränkter
Diffusion eingeführt
werden. Die den zu sterilisierenden Artikel enthaltende Umgebung
mit eingeschränkter Diffusion
wird dann in der Kammer plaziert, einem Vakuum ausgesetzt und entfernt
gemäß obigen
Schritten 2 bis 4.
-
In
noch einer weiteren alternativen Ausführungsform der vorliegenden
Erfindung wird der zu sterilisierende Artikel einem Vakuum ausgesetzt,
gefolgt durch ein Tieftemperaturplasma für eine Zeit, die ausreicht, um
eine Sterilisation zu bewirken. Wenn in der vorliegenden Beschreibung
und den Ansprüchen
verwendet, ist beabsichtigt, dass der Begriff "Plasma" jeglichen Anteil des Gases oder Dampfes
umfasst, der Elektronen, Ionen, freie Radikale, dissozierte und/oder
angeregte Atome oder Moleküle,
hergestellt als ein Ergebnis eines angewendeten elektrischen Feldes,
einschließlich
jeder begleitenden Strahlung, die erzeugt werden könnte, enthält. Das
angewendete Feld kann einen breiten Frequenzbereich abdecken; jedoch
werden eine Radiofrequenz oder Mikrowellen gewöhnlich eingesetzt.
-
Das
Sterilisationsverfahren der vorliegenden Erfindung kann ebenfalls
verwendet werden mit Plasmen, erzeugt durch das in der kürzlich genannten
U.S. Pat. US-A-4,643,876 offenbarte Verfahren. Alternativ kann es
mit in den U.S. Patenten US-A-5,115,166 oder US-A-5,087,418 beschriebenen Verfahren
verwendet werden, gemäß denen
der zu sterilisierende Artikel in einer Kammer lokalisiert wird,
die von der Plasmaquelle getrennt ist.
-
Die
vorliegende Erfindung stellt mehrere Vorteile gegenüber früheren Dampfsterilisationssystemen bereit,
beispielsweise: (1) die schnelle Sterilisation von Vorrichtungen
mit Hohlräumen
und von Artikeln mit eingeschränkter
Diffusion kann schnell bei tiefen Temperaturen erreicht werden;
(2) der Einsatz konzentrierter, potentiell gefährlicher Lösungen von anti-mikrobiellen
[Substanzen] wird verhindert; (3) die Notwendigkeit, ein spezielles
Gefäß, um Sterilisationsmitteldämpfe in
lange, schmale Hohlräume
einzubringen, ist eliminiert; (4) es verbleiben keine toxischen
Rückstände; (5)
da das Produkt am Ende des Verfahrens trocken ist, kann ein steriles
Lagern dieser Artikel erreicht werden; (6) geschlossenendige Hohlräume können sterilisiert
werden; und (7) das Verfahren kann wie gewünscht ohne unzulässige Wirkungen
wiederholt werden. Das Verfahren der vorliegenden Erfindung stellt
daher ein hochwirksames, nicht gefährliches und relativ kostengünstiges
Sterilisationsverfahren zur Verfügung.
-
Um
die Wirksamkeit des Sterilisationsverfahrens der vorliegenden Erfindung
zu bestimmen, wurden zunächst
erste vorbereitende Tests durchgeführt, um die Wirkung verdünnter Wasserstoffperoxidlösungen auf kontaminierte
Oberflächen
in einer offenen Umgebung mit nicht eingeschränkter Diffusion abzuschätzen. Diese
Tests werden unten in Beispiel 1 beschrieben.
-
Beispiel 1
-
Um
die Sterilisationswirksamkeit der verdünnten Wasserstoffperoxidlösung alleine
zu ermitteln, wurde eine biologische Probe, bestehend aus 2,5 × 106 Bacillus stearothermophilus-Sporen auf einer
Skalpellklinge aus rostfreiem Stahl eingesetzt. Angeimpfte Klingen
wurden in 40 ml Wasserstoffperoxidlösung in einem 100 ml Becher
eingetaucht. Vier verschiedene Konzentrationen an Wasserstoffperoxidlösungen wurden
verwendet: 3, 6, 9 und 12 Gew.-%. Den Klingen wurde gestattet, in
den Peroxidlösungen
für unterschiedliche
Zeitabschnitte einzuweichen. Die Klingen wurden anschließend aus
der Lösung
entfernt und auf Sterilität
getestet. Die Ergebnisse dieses Tests werden in Tabelle 1 als Verhältnis der
Anzahl an angeimpften Klingen, die nach der Behandlung kontaminiert
bleiben, zu der Anzahl an getesteten angeimpften Klingen aufgelistet.
-
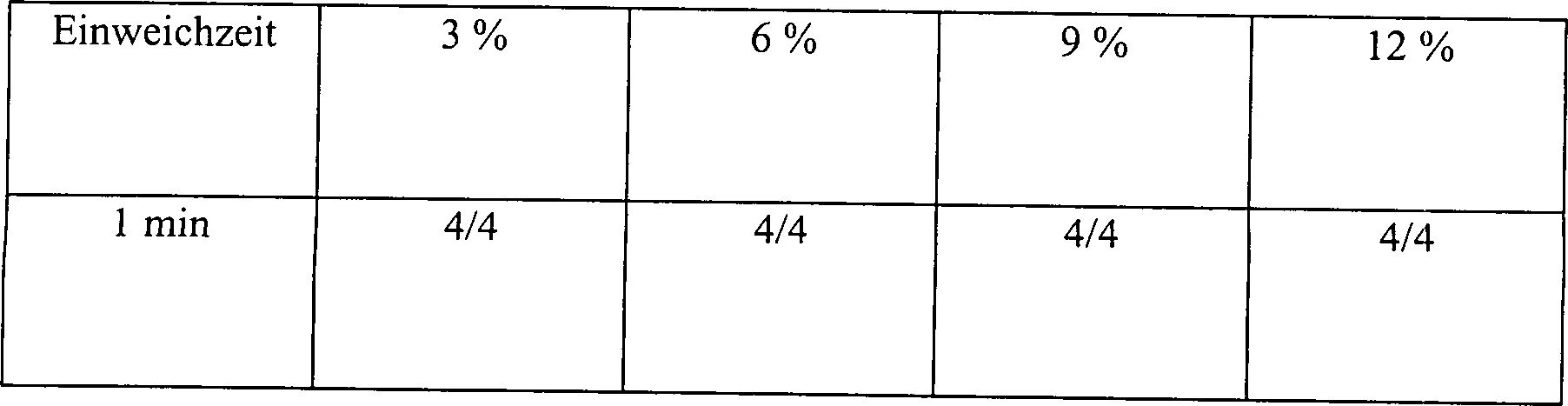
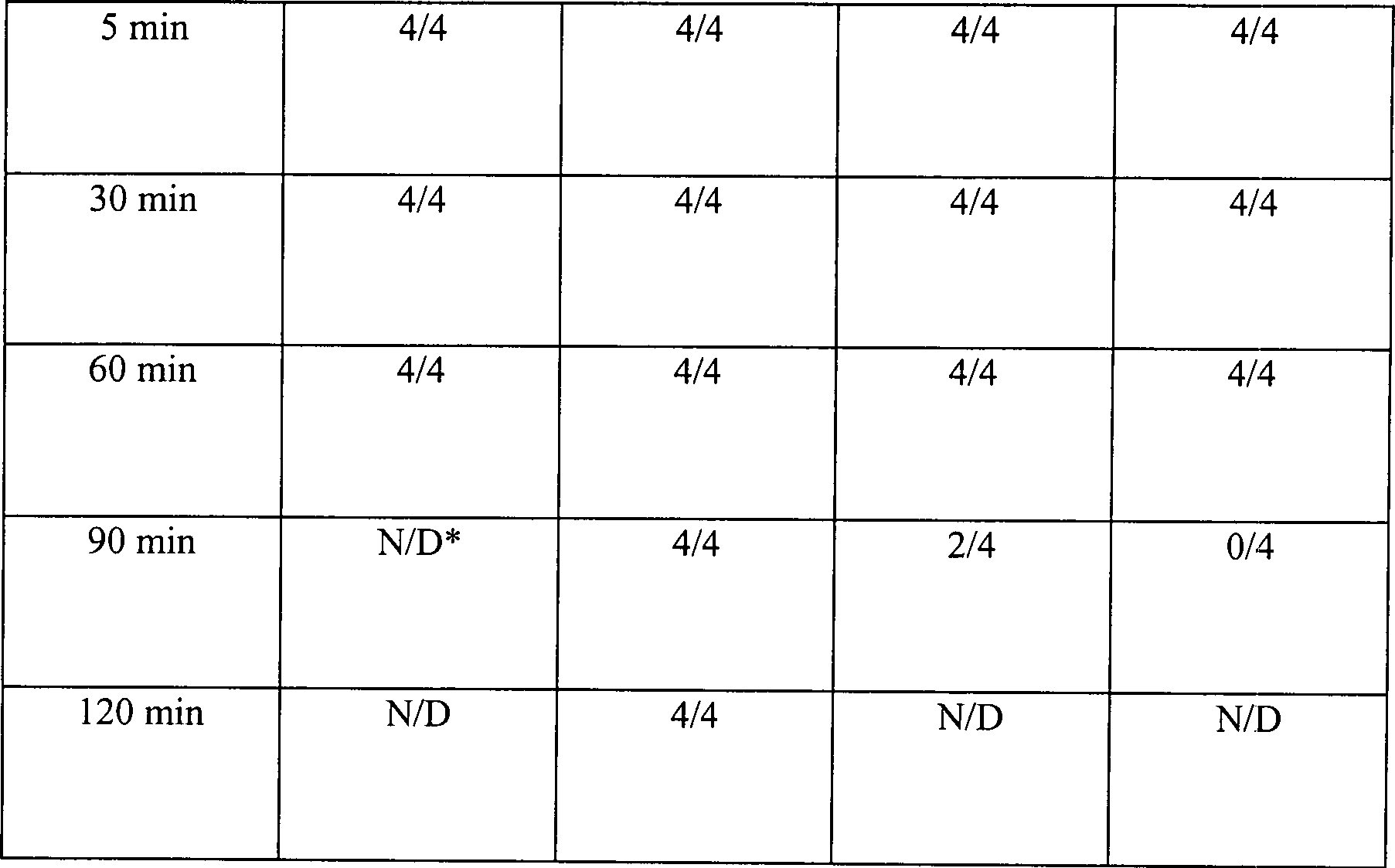
Tabelle
1
Wirkung der H
2O
2-Konzentration
und Einweichzeiten auf die sporizide Aktivität der H
2O
2-Lösung
Konzentration
der H
2O
2 Lösung
-
-
Die
vollständige
Sterilisation wurde nicht bewirkt, bis nachdem die Klingen für wenigstens
90 Minuten in einer 12% Wasserstoffperoxidlösung eingeweicht worden waren.
Ferner wurde keine der getesteten Klingen nach 2 Stunden in 6% Wasserstoffperoxidlösung sterilisiert.
Aus diesen Daten wird klar, dass der alleinige Kontakt mit verdünnter Wasserstoffperoxidlösung unwirksam
ist, um eine Sterilisation zu bewirken, wenn nicht ausgedehnte Einweichzeiten
und konzentrierte Lösungen
eingesetzt werden.
-
Als
nächstes
wurde ein Test durchgeführt,
um die Wirkung eines Vorbehandlungsschritts auf die Sterilisation
von langen, schmalen Hohlräumen
abzuschätzen,
gemäß dem die
zu sterilisierenden Hohlräume
vor der Einwirkung eines Vakuums einer Wasserstoffperoxidlösung ausgesetzt
werden. Der Test ermittelte die Wirksamkeit der Wasserstoffdampfsterilisation
innerhalb der Hohlräume.
Der Test wird detailliert unten in Beispiel 2 dargestellt.
-
Beispiel 2
-
Eine
biologische Probe, bestehend aus 1,9 × 106 B.
stearothermophilus-Sporen auf einer Skalpellklinge aus einem rostfreien
Stahl, wurde verwendet. Einige angeimpfte Klingen wurden mit einer
Lösung
von wässerigem
Wasserstoffperoxid vorbehandelt. Andere angeimpfte Klingen, ausgewiesene
Kontrollklingen, erhielten keine Vorbehandlung mit Wasserstoffperoxid.
Die Vorbehandlung bestand aus 5 Minuten statischem Einweichens in
Peroxidlösung.
Die vorbehandelten Klingen wurden trocken getupft, und jede Klinge
wurde anschließend
in einem Hohlkörper
aus rostfreiem Stahl, 3 mm Innendurchmesser (ID) × 50 Länge, platziert.
Der Hohlkörper
wies ein zentrales Stück
mit 1,3 cm ID und 5 cm Länge
auf. Die vorbehandelte Klinge wurde in diesem zentralem Stück platziert,
und zusätzliche
Wasserstoffperoxidlösung
wurde in unterschiedlichen Mengen in das zentrale Stück eingegeben.
Kontrollklingen wurden identisch behandelt, abgesehen davon, dass
sie keine Vorbehandlung mit Wasserstoffperoxidlösung erhielten. Die Hohlkörper wurden
in einer Vakuumkammer platziert, und die Kammer auf 1 torr evakuiert
und dort für
15 Minuten gehalten, während
welcher Zeit die Temperatur von ungefähr 23°C auf ungefähr 28°C anstieg. Der Einwirkung des
Vakuums folgend wurde die Kammer belüftet und die Klingen wurden
aus der Kammer entfernt und auf Sterilität untersucht. Die Ergebnisse
waren wie folgt:
-
Tabelle
2
Wirkung der Vorbehandlung und Wasserstoffperoxidkonzentration
auf die Sterilisation des Inneren von Hohlkörpern
(A) mit 1% Wasserstoffperoxidlösung und
Vakuum
-
-
(B)
mit 3% Wasserstoffperoxidlösung
und Vakuum
-
-
(C)
mit 6% Wasserstoffperoxidlösung
und Vakuum
-
-
Wie
an diesen Ergebnissen zu sehen ist, kann die Sterilisation durch
Verwendung relativ verdünnter Lösungen an
Peroxid und Einwirkung von negativem Druck bewirkt werden. Wenn
das Vakuum angewendet wurde, wurde das zu dem zentralen Stück des Hohlkörpers hinzugefügte Peroxid
verdampft und kontaktierte die Klinge, was genügte, um eine Sterilisation
zu bewirken. Anhand dieser Angaben kann gesehen werden, dass die
Vorbehandlung die Wirksamkeit steigert, dass jedoch die Vorbehandlung
unnötig
ist, solange das Peroxid aus dem Inneren nach außen defundiert.
-
Die
Sterilisation innerhalb unterschiedlicher Hohlkörpergrößen nach der Vorbehandlung
mit Peroxid wurde mit der Sterilisation innerhalb der Hohlkörper ohne
Vorbehandlungsschritt verglichen. Dieser Test ist im Detail im Beispiel
3 wiedergegeben.
-
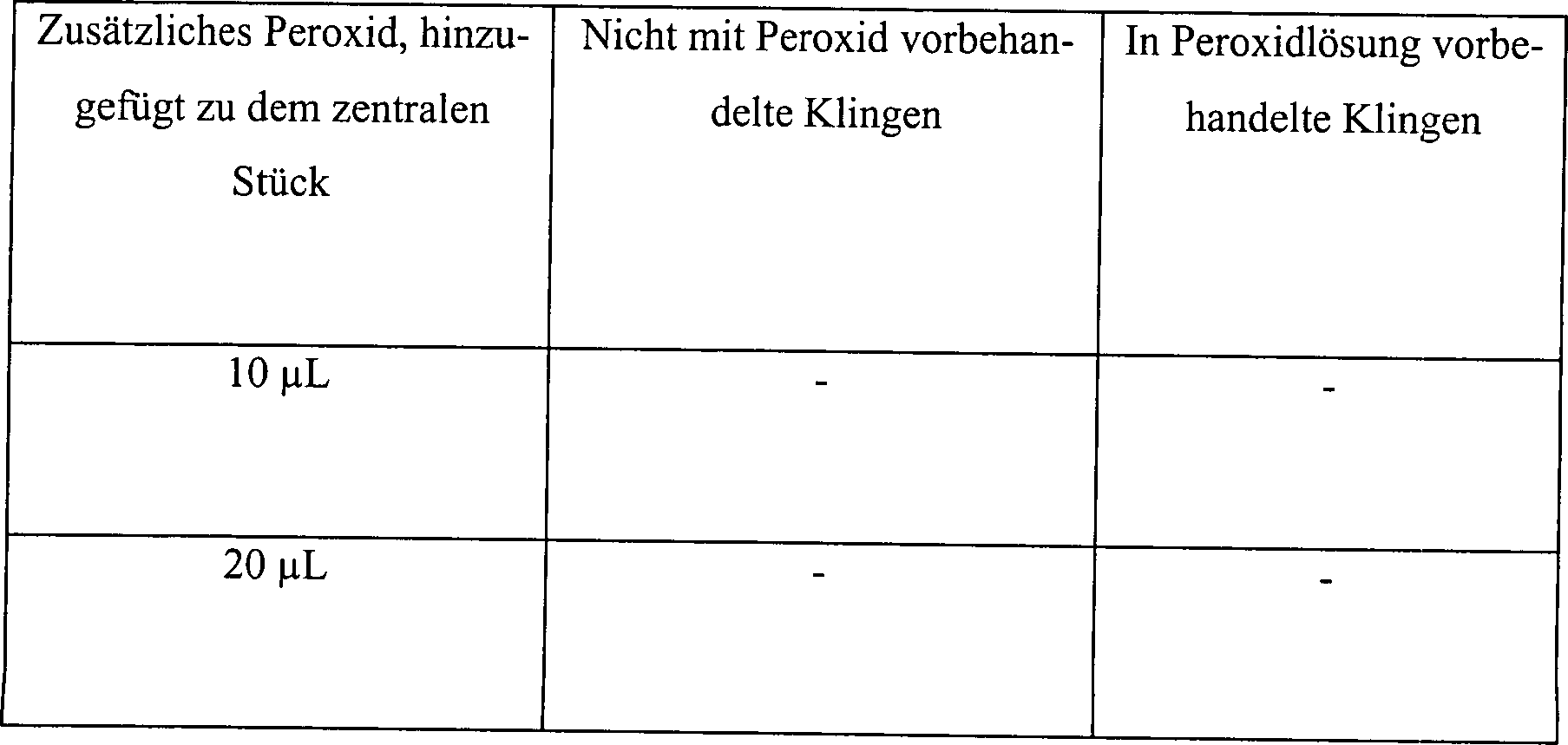
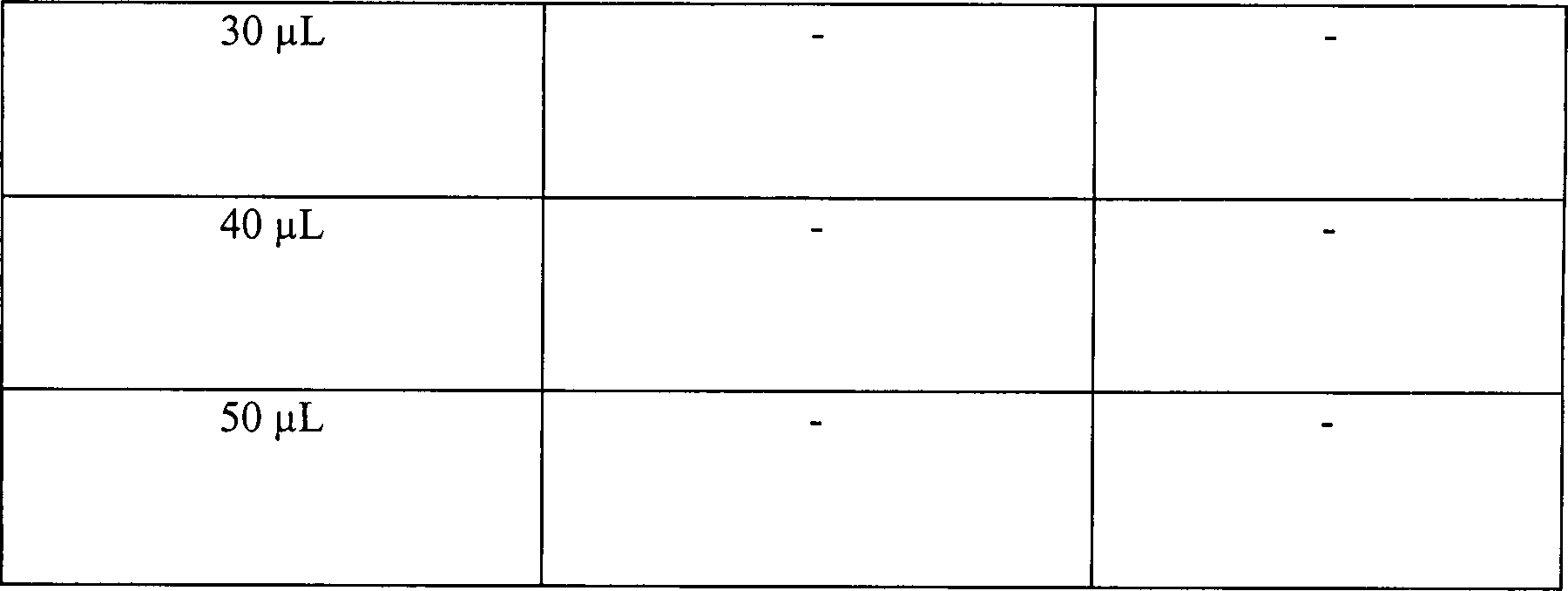
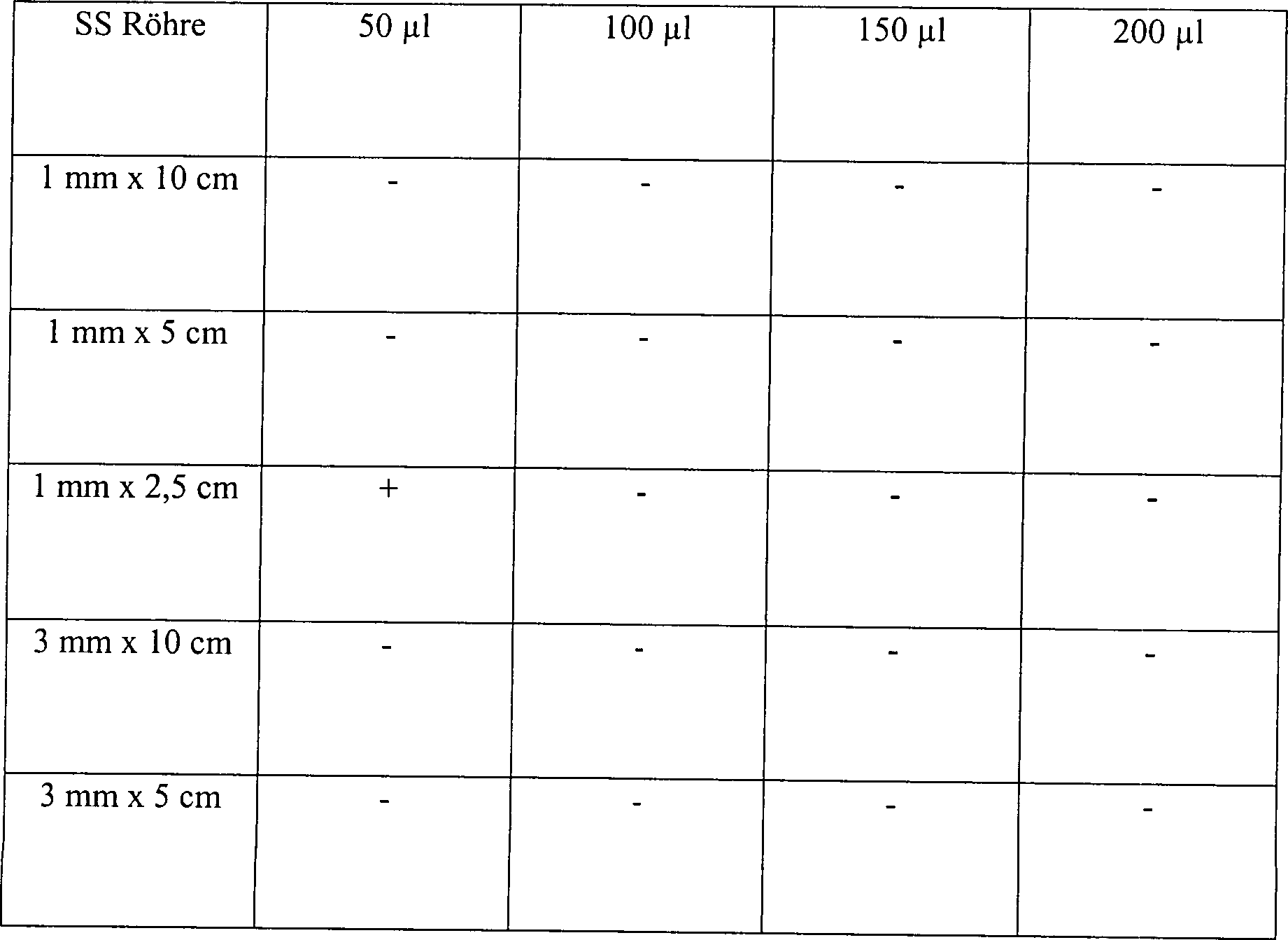
Beispiel 3
-
Eine
biologische Probe, bestehend aus 1,9 × 106 B.
stearothermophilus-Sporen auf einer Skalpellklinge aus rostfreiem
Stahl, wurde eingesetzt. Der Test A in Tabelle 3 unten bestand aus
angeimpften Klingen, die mit einer Lösung an 3% wässerigem
Wasserstoffperoxid vorbehandelt waren. Die Vorbehandlung bestand
aus 5 Minuten statischem Einweichen in der Peroxidlösung. Die
vorbehandelten Klingen wurden trocken getupft, sodann in das zentrale
Stück des
Hohlkörpers
aus einem rostfreien Stahl, der in seiner Größe variierte, zusammen mit
10 μl an
3% Wasserstoffperoxidlösung
platziert. Das zentrale Stück
verfügte über 1,3
cm ID und eine Länge
von 5 cm. Der Test B in Tabelle 3 unten bestand aus identischen,
ange impften Kontrollklingen, die keine Vorbehandlung mit Wasserstoffperoxid
erhielten. Jede angeimpfte Kontrollklinge wurde direkt in dem zentralen Stück des Hohlkörpers aus
einem rostfreien Stahl zusammen mit 10 μl aus 3% Wasserstoffperoxidlösung platziert.
Das zentrale Stück
verfügte über Abmessungen
identisch zu denen in Test A. Hohlräume unterschiedlicher Dimensionierung
wurden eingesetzt, um die Auswirkung des Innendurchmessers und der
Länge des Hohlraums
auf die Sterilisation zu ermitteln. Die Hohlräume wurden in einer Vakuumkammer
platziert und die Kammer wurde für
15 Minuten auf 1 Torr evakuiert. Während des 15 minütigem Sterilisationszyklus
nahm die Temperatur von etwa 23°C
auf etwa 28°C
zu. Der Einwirkung des Vakuums folgend wurde die Kammer belüftet und
die Klingen wurden aus der Kammer entfernt und auf Sterilität getestet.
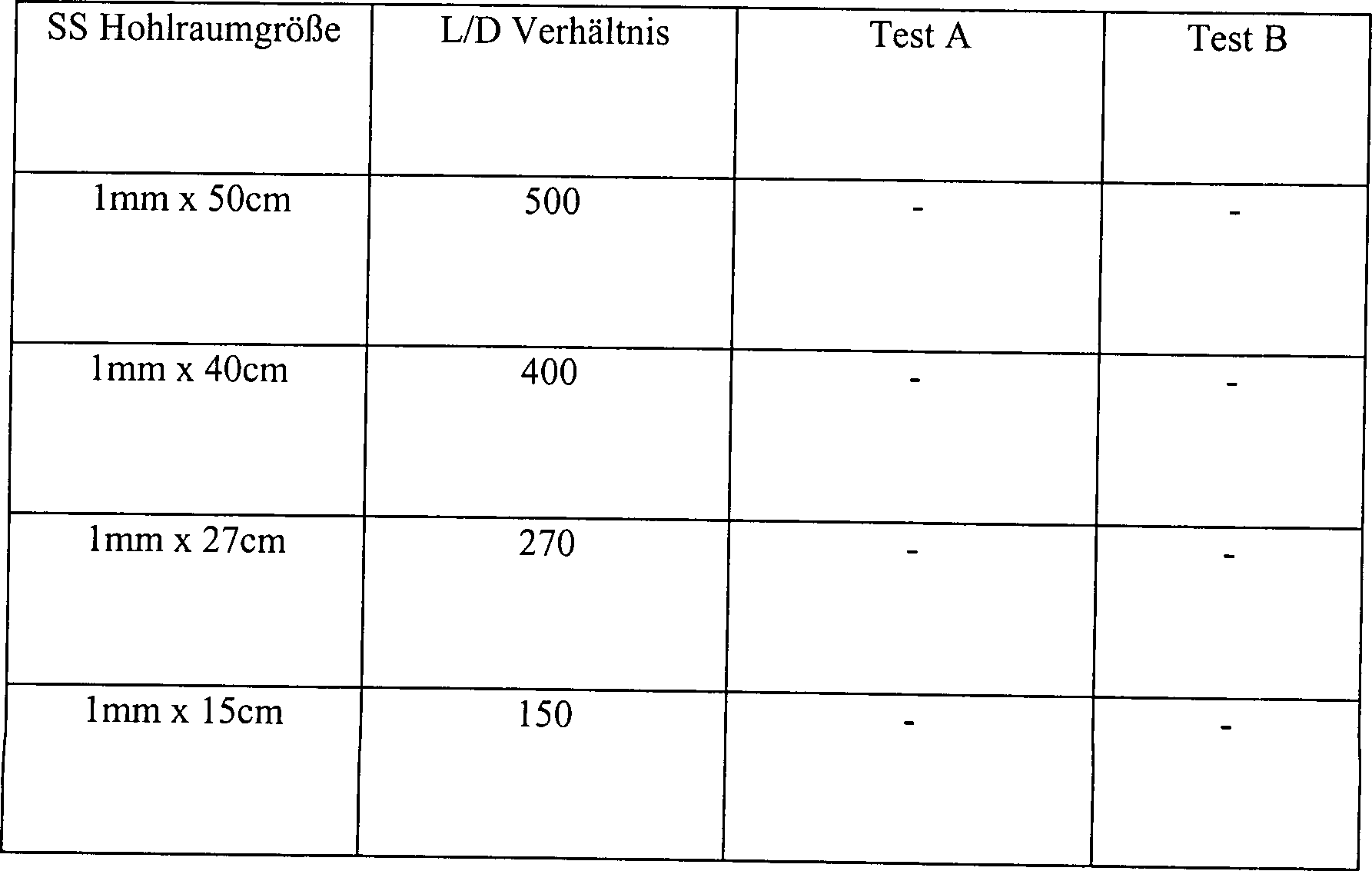
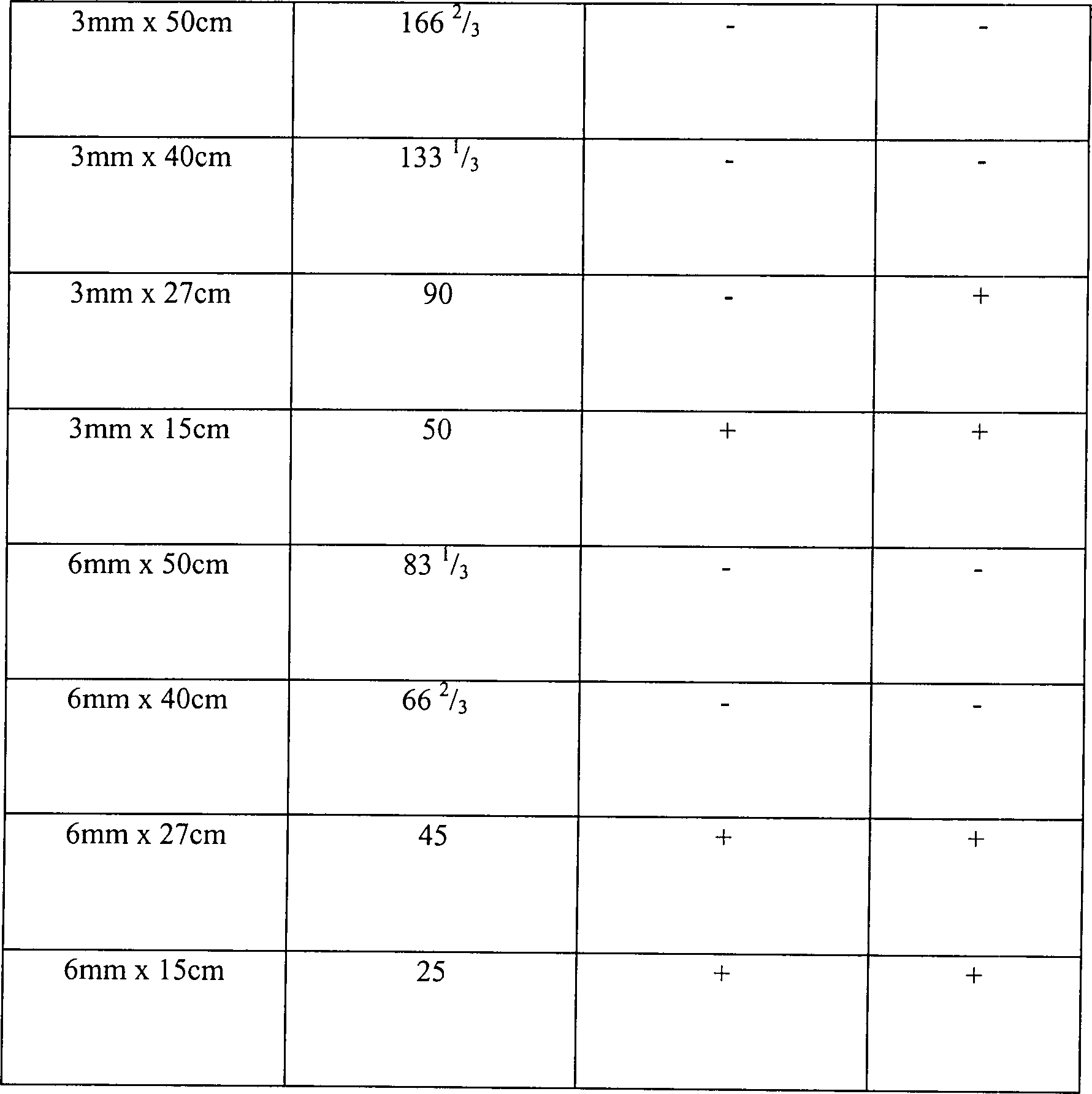
Die Ergebnisse sind in Tabelle 3 dargestellt, wo "L/D-Verhältnis" das Verhältnis von
Länge zu
Innendurchmesser anzeigt.
-
Tabelle
3
Wirkung der Vorbehandlung mit verdünntem Wasserstoffperoxid in
Hohlräumen
unterschiedlicher Größe
-
-
Alle
Hohlräume
mit einem L/D-Verhältnis
größer als
50, die unter den Bedingungen des Tests A des Beispiels 3 getestet
wurden, waren hinreichend diffusionseingeschränkt, um in diesem System sterilisiert
zu werden. Demgemäß wird angenommen,
dass andere Hohlräume
mit einem L/D-Verhältnis
größer als
50 ebenfalls ein hinreichendes Niveau an Diffusionsbeschränkung zur
Sterilisation im Einklang mit der vorliegenden Erfindung bereitstellen.
Dieser Test zeigt, dass in direktem Kontrast zu den Verfahren des
Standes der Technik Sterilität
vermittels der Diffusion von Wasserstoffperoxiddampf aus dem Inneren
des Artikels zu dem Äußeren des
Artikels leichter in längeren,
schmaleren Hohlräumen
zu erreichen ist als in kürzeren,
breiteren Hohlräumen.
Es wird angenommen, dass dieses dadurch bedingt wird, dass die größeren Hohlräume zuviel
Wasserstoffperoxiddampf gestatten, während des Sterilisationsprozesses
aus dem Inneren des Hohlraums zu verdampfen. Der Dampf kontaktiert demgemäß nicht
die internen Oberflächen
für einen
Zeitraum, der ausreicht oder mit einer Konzentration, die ausreicht,
um eine Sterilisation zu bewirken.
-
Wie
oben erörtert,
sind Verfahren zur Wasserstoffperoxiddampfsterilisation von Hohlräumen nach
dem Stand der Technik grundsätzlich
begrenzt auf den Einsatz in relativ kurzen und breiten Hohlräumen. Im
Gegensatz zu diesen Verfahren nach dem Stand der Technik ist das
Verfahren der vorliegenden Erfindung in dem Inneren von langen,
schmalen Hohlräumen
wirksam, umfassend jene, die länger
als 27 cm in der Länge
sind und/oder einen Innendurchmesser von weniger als 3 mm haben.
Um zu bestimmen, ob die Fähigkeit
des Sterilisationsmitteldampfes, innerhalb des Systems zu verdampfen,
ein kritischer Faktor bei der Erreichung von Sterilität ist, wurden
zusätzliche
Tests durchgeführt,
um diffusionsbeschränkte
und offene, nicht diffusionsbeschränkte Systeme zu vergleichen.
Ein nicht diffusionsbeschränktes
System ist eines, in dem die Diffusion von Dämpfen in und um den Artikel
nicht durch eine enge Öffnung,
lange, schmale Hohlräume
oder dergleichen beschränkt
ist. Wie hierin verwendet, bezieht sich "diffusionsbeschränkt" auf jede einzelne oder mehrere der folgenden
Eigenschaften: (1) die Fähigkeit
eines innerhalb eines Sterilisationssystems der vorliegenden Erfindung
plazierten Artikels 0,7 mg/L oder mehr Wasserstoffperoxidlösung nach
1 Stunde bei 40°C
und 10 torr zurückzubehalten;
(2) über
die gleiche oder größere Diffusionsbeschränkung zu
verfügen
als die durch eine einzelne Eingangs- und Ausgangsöffnung mit
einem Innendurchmesser von 9 mm oder weniger und einer Länge von
1 cm oder mehr zu erzeugen; (3) über
dieselbe oder größere Diffusionsbeschränkung zu
verfügen
als die durch einen Hohlraum mit einer Länge von 27 cm und einem Innendurchmesser
von 3 mm erzeugte; (4) über dieselbe
oder größere Diffusionsbeschränkung zu
verfügen
als die durch einen Hohlraum mit einem Längen-zu-Innendurchmesser-Verhältnis größer als
50 erzeugte; (5) die Fähigkeit
eines in einem Sterilisationssystem der vorliegenden Erfindung platzierten
Artikels 17% oder mehr an darin platzierter Wasserstoffperoxidlösung nach
1 Stunde bei 40°C
und 10 torr zurückzuhalten;
oder (6) hinreichend diffusionsbeschränkt zu sein, um eine Klinge
aus rostfreiem Stahl in einem 2,2 cm × 60 cm Glasrohr mit einem
Gummistopfen mit einem 1 mm × 50
cm Austrittsrohr aus rostfreiem Stahl darin bei einem Vakuum von
10 torr für
1 Stunde bei 40°C
im Einklang mit der vorliegenden Erfindung vollständig zu
sterilisieren. Es wird anerkannt, dass die Eigenschaften (1) und
(5) in Abhängigkeit
von der Anfangskonzentration an in dem Artikel plazierten Wasserstoffperoxid
variieren werden; jedoch kann dieses auf einfache Weise durch einen
Fachmann bestimmt werden.
-
Wie
diskutiert in dem Kapitel Hintergrund der Erfindung, sind Artikel
mit diffusionsbeschränkten
Bereichen bei Einsatz bekannter Verfahren der Wasserstoffperoxiddampfsterilisation
schwierig zu sterilisieren, da die Verfahren von der Diffusion der
Peroxiddämpfe
von außerhalb
des Artikels in das Innere des Artikels abhängig sind. Ein Test, durchgeführt, um
die Bedeutung der Sterilisationsmitteldampfdiffusion zu ermitteln,
wird in Beispiel 4 beschrieben.
-
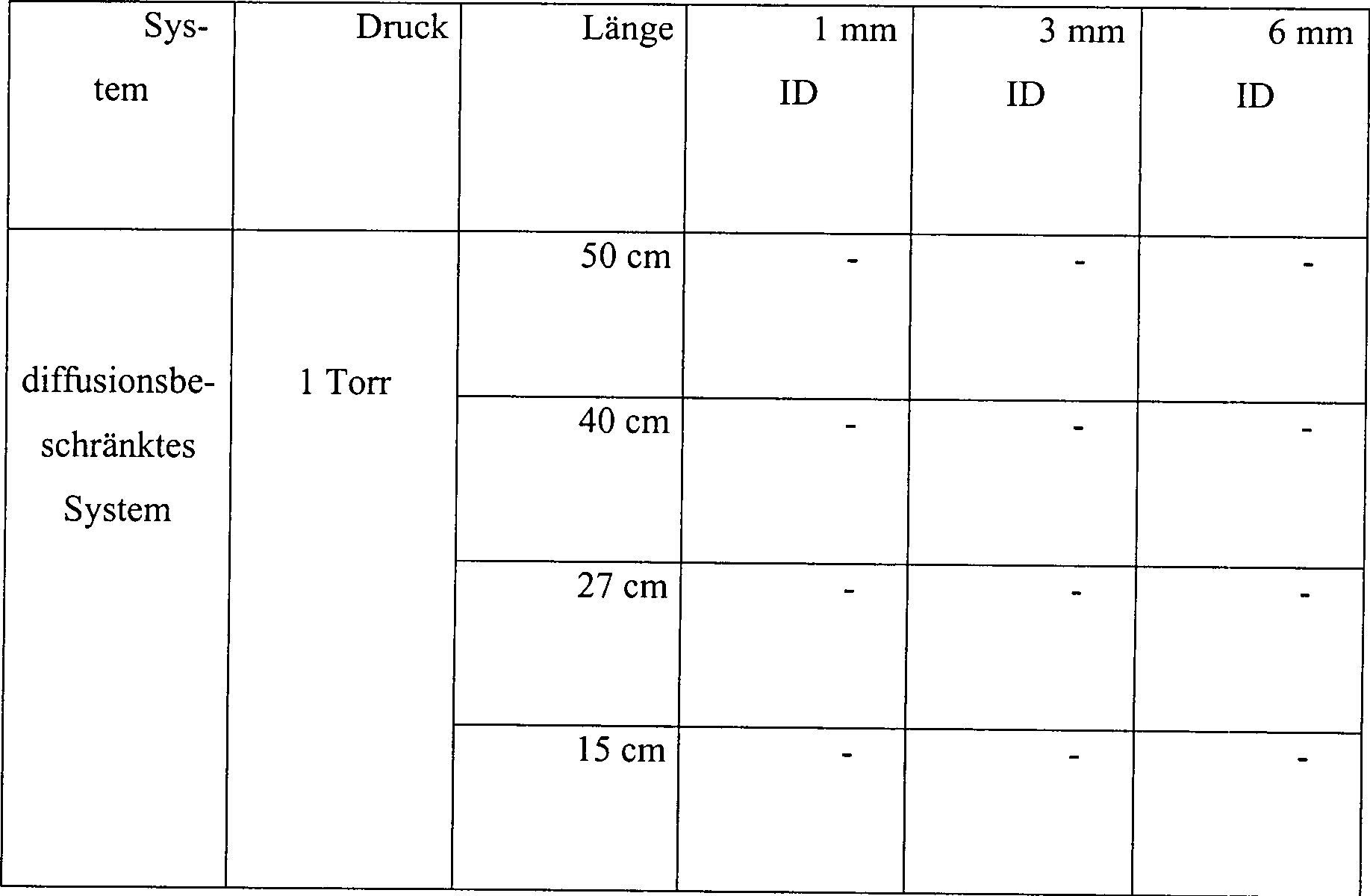
Beispiel 4
-
Die
Wasserstoffperoxiddampfsterilisation wurde sowohl in offenen als
auch in diffusionsbeschränkten Systemen
getestet. Das offene System bestand aus Hohlkörpern aus rostfreiem Stahl
mit Innendurchmessern von 1, 3 und 6 mm und Längen von 15, 27, 40 und 50
cm. Skalpellklingen aus rostfreiem Stahl wurden angeimpft mit 1,9 × 106 B. stearothermophilus-Sporen, und die Klingen
wurden in dem zentralen Stück
des Hohlkörpers
zusammen mit 10 μl
an 3% Wasserstoffperoxidlösung
platziert. Die Abmessungen des zentralen Stückes betrugen 1,3 ID, 5 cm
Länge und
6,6 cc an Volumen.
-
Das
diffusionsbeschränkte
System ist in 1 veranschaulicht.
Auf identische Weise angeimpfte Skalpellklingen 5 wurden
in den zentralen Stücken 10 der
Hohlkörper 15 platziert
mit Abmessungen identisch denen, wie oben beschrieben. 10 μl an 3% Wasserstoffperoxidlösung wurde
ebenfalls zu dem zentralen Stück 10 des
Hohlkörpers 15 hinzugefügt. Der
Hohlkörper 15 wurde
dann in einem 2,2 cm × 60
cm Glasrohr 20 platziert. Das Rohr 20 wurde an
einem Ende verschlossen, und das offene Ende wurde mit einem Gummistopfen 25 mit
einem 1 mm × 10
cm Rohr 30 aus rostfreiem Stahl, das durch den Stopfen 25 geführt war,
gestöpselt. Demgemäß konnten
Gase nur durch diese 1 mm × 10
cm Öffnung
in das Glasrohr 20 hinein- oder hinaustreten.
-
Das
offene Hohlkörpersystem
und das diffusionsbeschränkte
System wurden innerhalb einer Vakuumkammer platziert. Die Kammer
wurde auf einen Druck von 1 torr evakuiert, der für 15 Minuten
gehalten wurde, während
welcher Zeit die Temperatur von ungefähr 23°C auf ungefähr 28°C zunahm. Die Kammer wurde dann belüftet, und
die Klingen wurden aus dem Hohlkörper
entfernt und auf Sterilität
untersucht. Die Ergebnisse sind wie folgt:
-
Tabelle
4
Wasserstoffperoxiddampfsterilisation in offenen und diffusionsbeschränkten Systemen
-
Unter
den Testbedingungen von Beispiel 4 wurde die Sterilisation in den
kürzeren,
breiteren Hohlkörpern
bei dem offenen System nicht erreicht ohne Vorbehandlung mit Was serstoffperoxyd.
Vorbehandlung und andere Testbedingungen, wie höhere Peroxydkonzentration oder
längere
Behandlungszeiten, würden
wahrscheinlich die Sterilisation von 27 cm × 3 mm Hohlkörpern erlauben,
die ein L/D-Verhältnis
von größer als
50 haben. In diffusionseingeschränkten
Systemen wurden die Klingen in allen Höhlkörpergrößen unter Verwendung einer
dreiprozentigen Wasserstoffperoxydlösung sterilisiert.
-
Diese
Ergebnisse deuten an, dass die zur Verfügungstellung einer Wasserstoffperoxydquelle
in einer Umgebung mit beschränkter
Diffusion innerhalb des Systems die vollständige Sterilisation erlaubt.
Es ist die Beschränkung
der Dampfdiffusion in dem System, nicht die Länge oder der Innendurchmesser
des Hohlkörpers
per se, die die Wirksamkeit der Wasserstoffperoxyddampfsterilisation
bestimmt. Allerdings zeigen diese Daten wiederum, dass anders als
bei Verfahren der Wasserstoffperoxyddampfsterilisation von Höhlkörpern nach
dem Stand der Technik das Verfahren der vorliegenden Erfindung sogar
bei nicht diffusionsbeschränkten Artikeln
wirksam ist, wenn in einer diffusionsbeschränkten Umgebung platziert.
-
Um
weiter die Idee zu testen, dass die Beschränkung der Diffusion von Dampf
in einem System die Fähigkeit
beeinflusst, das System zu sterilisieren, wurde das folgende Experiment
durchgeführt.
-
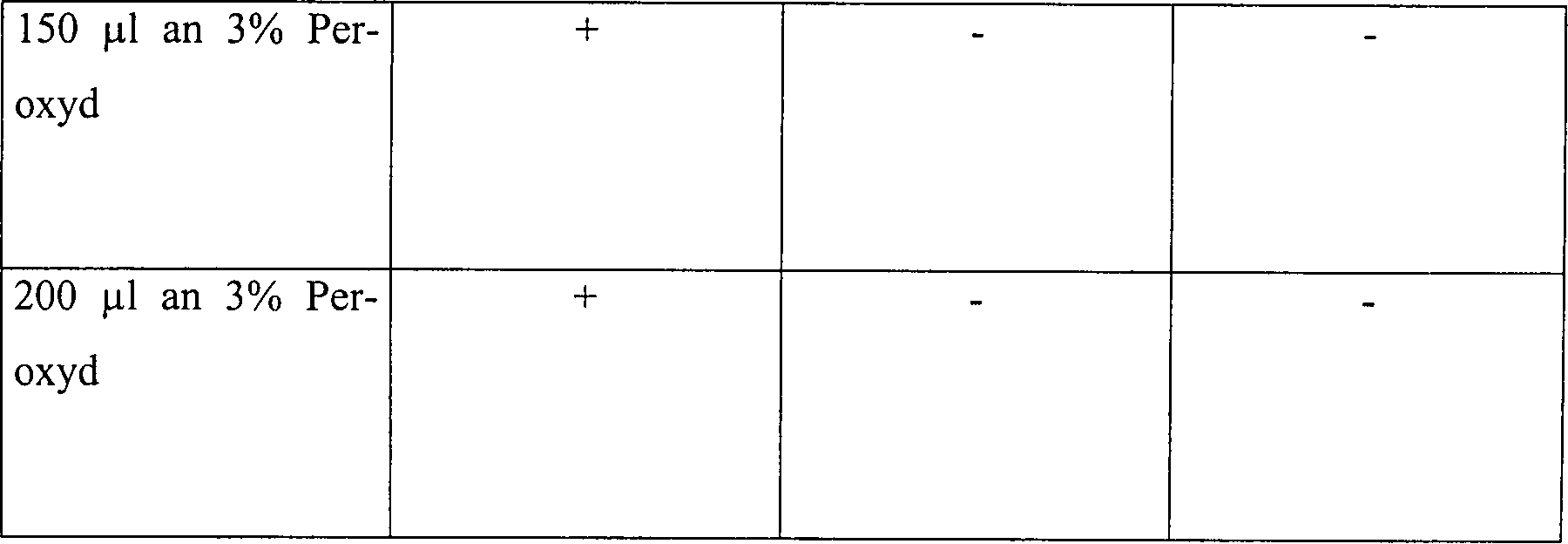
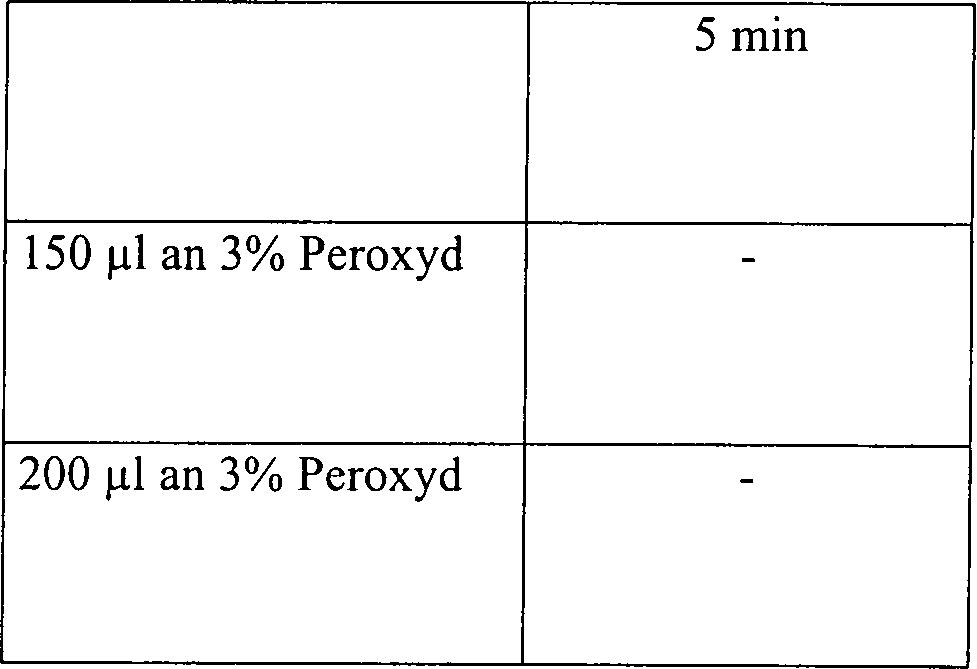
Beispiel 5
-
Eine
Skalpellklinge 5 aus rostfreiem Stahl wurde in einem 2,2
cm × 60
cm Glasrohr 20, das an einem Ende verschlossen war, platziert,
wie in 2 veranschaulicht.
Jede Klinge 5 war mit 1,9 × 106 B.
stearothermophilus-Sporen angeimpft worden. Für einige Tests wurde das Glasrohr 20 an
einem Ende offen gelassen, um ein offenes System zur Verfügung zu
stellen. Um eine diffusionsbeschränkte Umgebung zu erzeugen,
wurde das offene Ende des Glasrohres 20 mit einem Gummistopfen 25,
enthaltend ein 1 mm × 10
cm Rohr 30 aus rostfreiem Stahl durch seine Mitte, versiegelt.
Sowohl in dem offenen als auch in dem diffusionsbeschränkten System
wurde eine Wasserstoffperoxydlösung
mit einer Konzentration von entweder 3% oder 6% zu dem Glasrohr 20 in
Mengen von 50, 100, 150 oder 200 μl
hinzugefügt,
zusammen mit der angeimpften Klinge 5. Das Rohr 20 wurde
in einer Vakuumkammer platziert, und die Kammer wurde für 15 Minuten
auf 1 Torr evakuiert, während
welcher Zeit die Temperatur von etwa 23°C auf etwa 28°C anstieg.
Das diffusionsbeschränkte System
wurde ebenfalls für
30 Minuten bei 1 Torr getestet, während welcher Zeit die Temperatur
von etwa 23°C auf
etwa 33°C
anstieg. Die Vakuumkammer wurde anschließend belüftet, und die Klingen 5 wurden
aus dem Rohr 20 entfernt und auf Sterilität getestet.
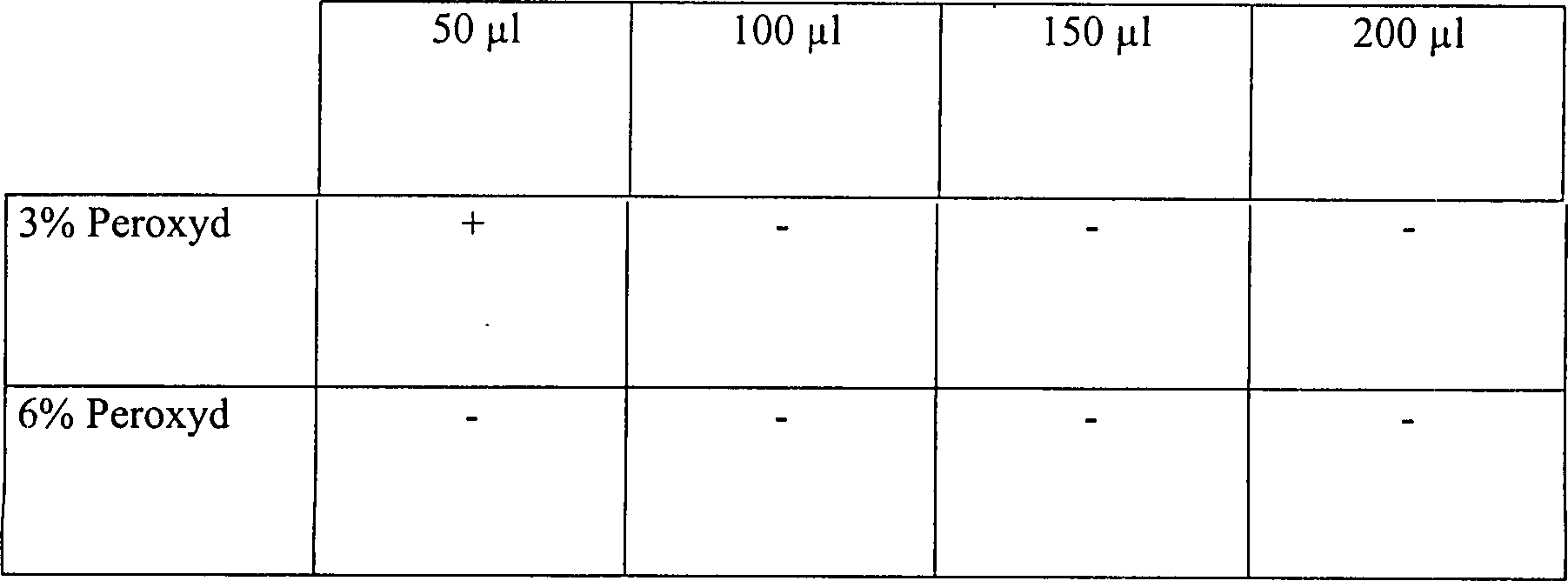
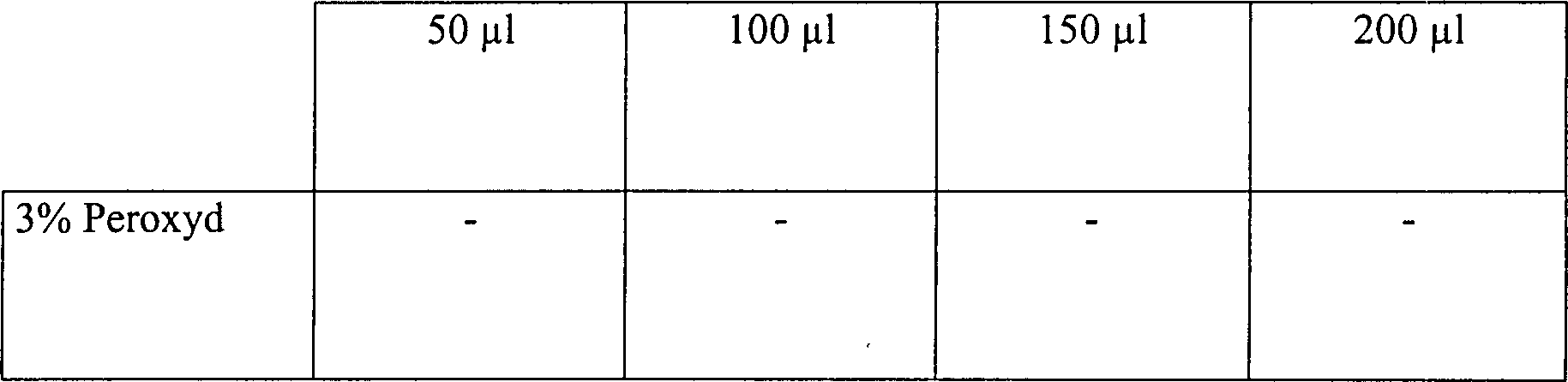
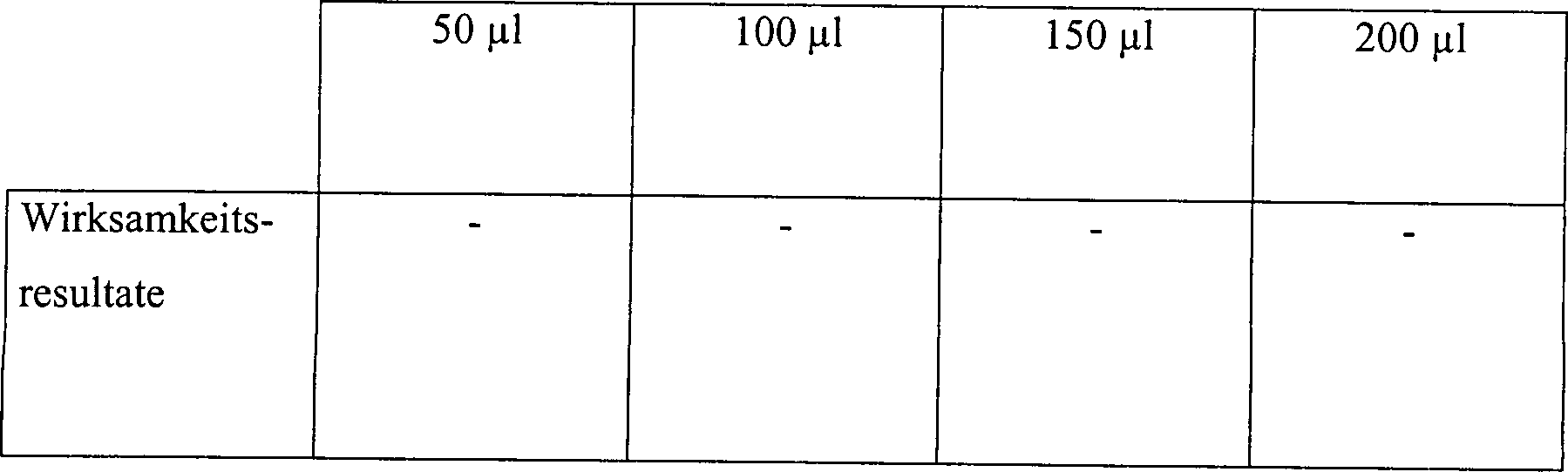
Die Ergebnisse sind in der nachfolgenden Tabelle 5 aufgelistet.
-
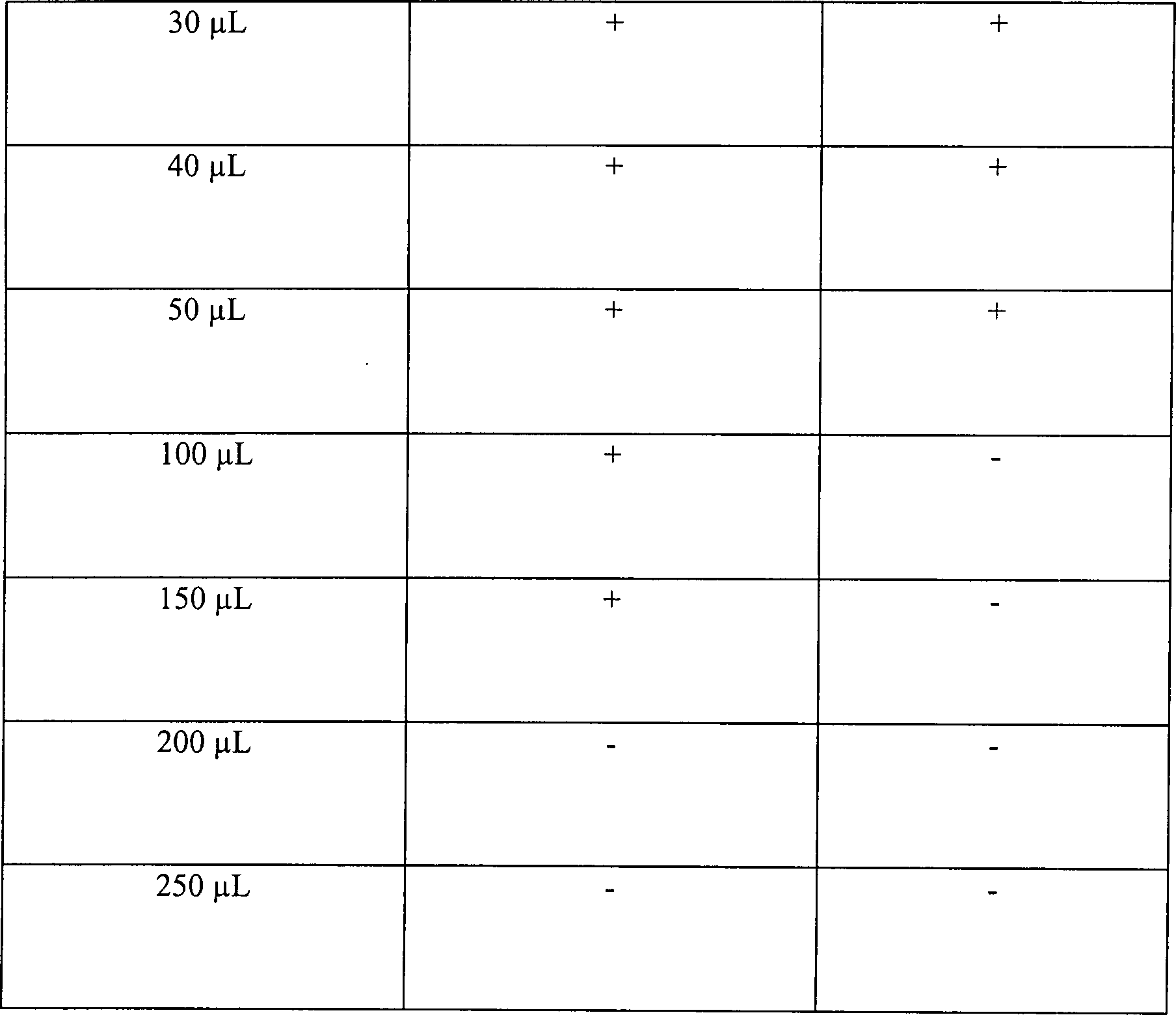
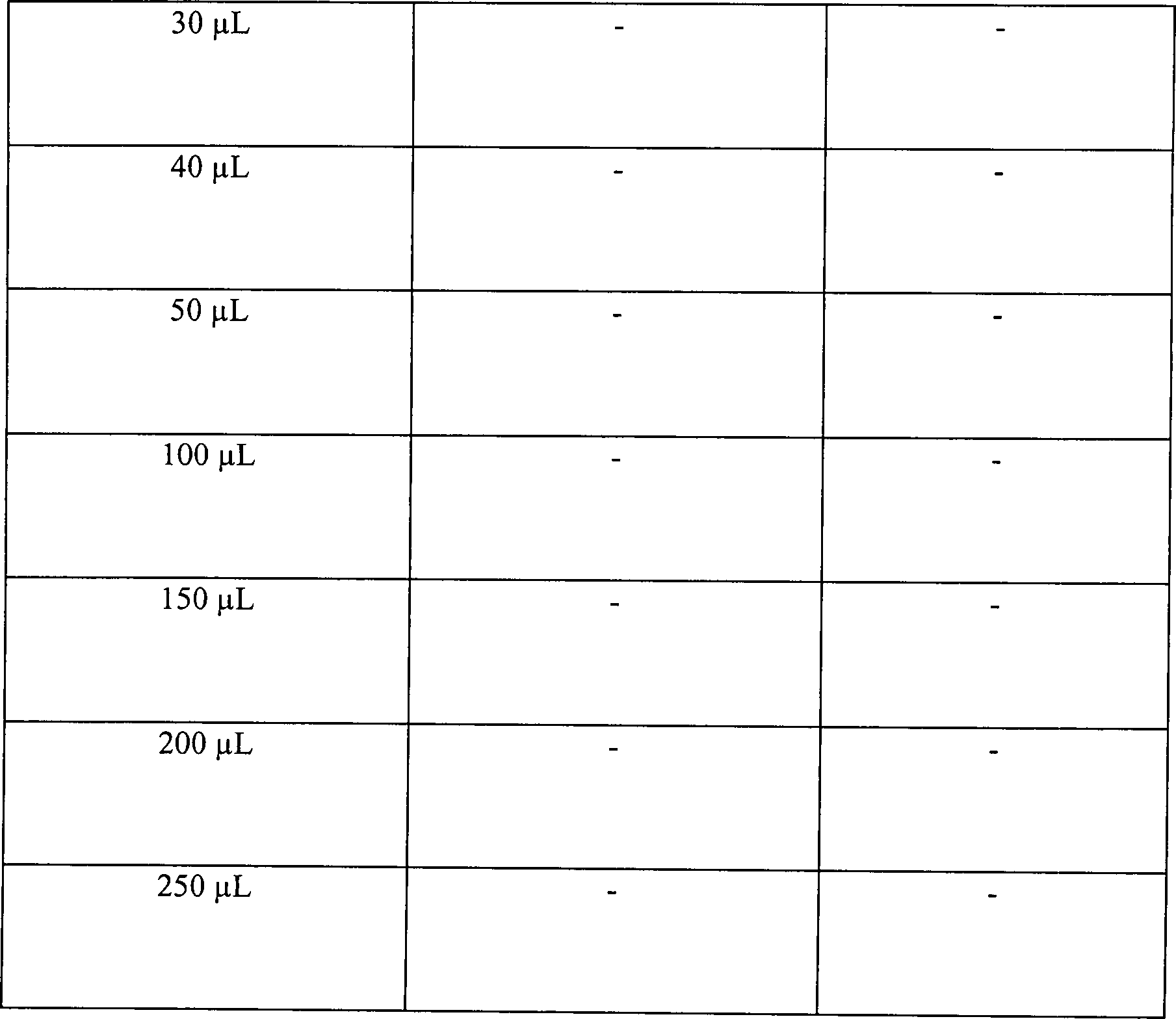
Tabelle
5
Wasserstoffperoxyddampfsterilisation in offenen und diffusionsbeschränkten Systemen
Offenes
System, 15 Minuten Vakuum bei 1 Torr
-
Diffusionsbeschränktes System,
15 Minuten Vakuum bei 1 Torr
-
Diffusionsbeschränktes System,
30 Minuten Vakuum bei 1 Torr
-
Diese
Ergebnisse zeigen, dass die Zugabe von Wasserstoffperoxydlösung, gefolgt
durch Vakuumwirkung, unwirksam ist, um eine schnelle Sterilisation
in einem offenen System zu erhalten. Die identische Behandlung in
einem diffusionsbeschränkten
System resultiert im Vergleich in einer vollständigen Sterilisation, abgesehen
von der schwächsten
Konzentration an Wasserstoffperoxydlösung in einer Menge von nur
50 μl. Die
Sterilisatian kann jedoch bewirkt werden durch Steigerung der Vakuumeinwirkung.
-
Demgemäß stellt
das Verfahren der vorliegenden Erfindung, bei dem geringe Mengen
an Wasserstoffperoxydlösung
vor der Vakuumeinwirkung zu dem zu sterilisierenden Artikel gebracht
werden, ein wirksames Sterilisationsverfahren dar. Das Verfahren
hängt nicht
von der Diffusion des Sterilisationsmitteldampfes in den Artikel,
der sterilisiert wird, ab. Vielmehr wird der Wasserstoffperoxyddampf
durch das Vakuum in dem System erzeugt. Dieser Dampf wird daran
gehindert, das System zu schnell zu verlassen, da die Diffusion
des Sterilisationsmitteldampfes von der Innenseite des Artikels
zu der Außenseite
des Artikels verlangsamt ist. In einer Umgebung mit beschränkter Diffusion
kontaktiert der Dampf daher den zu sterilisierenden Artikel für eine Zeitdauer,
die ausreicht, eine vollständige
Sterilisation zu bewirken. Anders als bei Verfahren nach dem Stand
der Technik, bei denen Wasser aus der Peroxydlösung zuerst verdampft und zu
einer Barriere für
die Penetration des Peroxyddampfes wird, entfernt das Verfahren
der vorliegenden Erfindung außerdem
zuerst das Wasser aus dem System, wodurch der in dem System verbleibende
Wasserstoffperoxyddampf konzentriert wird. Wichtiger noch in der
vorliegenden Erfindung ist, dass die Dampfdiffusion nicht von außen nach
innen gemäß dem Stand
der Technik, sondern von innen nach außen stattfindet. Als Ergebnis
dient die Diffusionsbeschränkung in
der vorliegenden Erfindung nicht dazu, die Wirksamkeit zu verringern,
wie im Stand der Technik, sondern die Wirksamkeit der Sterilisation
zu erhöhen.
-
Um
den Effekt verschiedener Drücke
auf ein diffusionsbeschränktes
Sterilisationssystem zu bestimmen, wurde das folgende Experiment
durchgeführt.
-
Beispiel 6
-
Eine
Skalpellklinge 5 aus rostfreiem Stahl wurde in einem 2,2
cm × 60
cm Glasrohr 20, das an einem Ende verschlossen war, platziert,
wie in 2 gezeigt. Jede
Klinge 5 wurde mit 1,9 × 106 B.
stearothermophilus-Sporen angeimpft. Um eine diffusionsbeschränkte Umgebung
zu erzeugen, wurde das offene Ende des Glasrohres 20 mit
einem Gummistopfen 25, enthaltend ein 1 mm × 10 cm
Rohr 30 aus rostfreiem Stahl in seiner Mitte, versiegelt.
Wasserstoffperoxydlösung
mit einer Konzentration von 3% wurde zu dem Glasrohr 20 in Mengen
von 50, 100, 150 oder 200 μl
hinzugefügt,
zusammen mit der angeimpften Klinge 5. Das Rohr 20 wurde
in der Vakuumkammer platziert und für 15 Minuten unterschiedlichen
Drücken
ausgesetzt, während
welcher Zeit die Temperatur von etwa 23°C auf etwa 28°C zunahm.
Um den Effekt einer erhöhten
Temperatur auf das System zu bestimmen, wurde in einem weiteren
Experiment das Rohr 20 zunächst auf 45°C erwärmt und anschließend für 15 Minuten
einem Druck von 50 Torr ausgesetzt. Die Ergebnisse waren wie folgt.
-
Tabelle
6
Die Wirkung der Temperatur und des Druckes auf ein diffusionsbeschränktes System
15
Minuten Vakuum mit 3%iger Wasserstoffperoxydlösung
-
15
Minuten Vakuum mit 3%igem Wasserstoffperoxyd bei 45°C
-
Diese
Daten zeigen, dass die Sterilisation in diffusionsbeschränkten Umgebungen
bei einem Druck von etwa 25 Torr bei 28°C erreicht werden kann. Bei
Drücken
von 30 Torr und höher
wurde keine Sterilisation erreicht; es wird angenommen, dass dieses
bedingt ist durch die Tatsache, dass der Dampfdruck von Wasserstoffperoxyd
bei 28°C
ungefähr
28 Torr beträgt.
Demgemäß wurde
bei höheren
Drücken
das flüssige
Wasserstoffperoxyd in dem Glasrohr nicht verdampft. Dieses wurde
bestätigt
durch den beim Druck von 50 Torr bei 45°C durchgeführten Test, bei dem eine Sterilisation
erreicht wurde. Der Dampfdruck von Wasserstoffperoxyd nimmt bei
45°C zu,
weshalb Wasserstoffperoxyd bei 50 Torr verdampft wurde und wodurch
die in dem Rohr platzierte Klinge wirksam sterilisiert wurde.
-
Um
die Sterilisation bei Verwendung des Verfahrens der vorliegenden
Erfindung zu erreichen, sollten folglich die Temperatur und der
Druck in der Vakuumkammer derart sein, dass eine Verdampfung der
wässrigen
Wasserstoffperoxydlösung
erreicht wird, d. h. das System sollte vorzugsweise unterhalb des
Dampfdrucks von Wasserstoffperoxyd betrieben werden. Es ist nötig, dass
der Druck unterhalb des Dampfdrucks von Wasserstoffperoxyd ist,
so dass die in dem System vorliegende Wasserstoffperoxydlösung verdampft
wird und von dem Inneren der diffusionsbeschränkten Umgebung nach außen diffundiert.
Alternativ kann das Wasserstoffperoxyd lokal verdampft werden, wo
das System über
dem Dampfdruck bleibt, mittels Einbringens von Energie an die Stelle
des Peroxyds, beispielsweise mittels Mikrowellen, Radiowellen oder
anderer Energiequellen.
-
Um
des weiteren die Wirkung variierender Drücke und Temperaturen in dem
in Beispiel 6 beschriebenen diffusionsbeschränkten System zu bestimmen,
wurden die folgenden Experimente durchgeführt.
-
Beispiel 7
-
Eine
Skalpellklinge 5 aus rostfreiem Stahl wurde in ein 2,2
cm × 60
cm Glasrohr, das an einem Ende verschlossen war, platziert, wie
in 2 veranschaulicht.
Jene Klinge 5 war mit 1,9 × 106 B.
stearothermophilus-Sporen angeimpft worden. Um eine diffusionsbeschränkte Umgebung
zu erzeugen, wurde das offene Ende des Glasrohres 20 mit
einem Gummistopfen 25, enthaltend ein 1 mm × 10 cm
Röhre 30 aus
rostfreiem Stahl durch seine Mitte, versiegelt. Wasserstoffperoxydlösung mit
einer Konzentration von 3% wurde zu dem Glasrohr 20 in
Mengen von 50, 100, 150 oder 200 μl
zusammen mit der angeimpften Klinge 5 gegeben. Das Rohr 20 wurde
in einer Vakuumkammer platziert, und die Kammer wurde auf 5 Torr
evakuiert. Um den Druck in der Kammer zu variieren, wurde das Ventil
zu der Vakuumpumpe verschlossen, so dass der Druck in der Kammer von
5 Torr auf 6,15 Torr in 15 Minuten anstieg, während welcher Zeit die Temperatur
von etwa 23°C
auf etwa 28°C
zunahm. In einem zweiten Test wurde das Rohr 20 in einer
Kammer platziert, und die Kammer wurde auf 50 Torr evakuiert. Die
Temperatur des Glasrohres 20 wurde, nachdem die Evakuierung
der Kammer vollständig war,
auf 45°C
angehoben. Das Rohr 20 wurde für 15 Minuten behandelt. Die
Ergebnisse dieser Test sind unten darstellt.
-
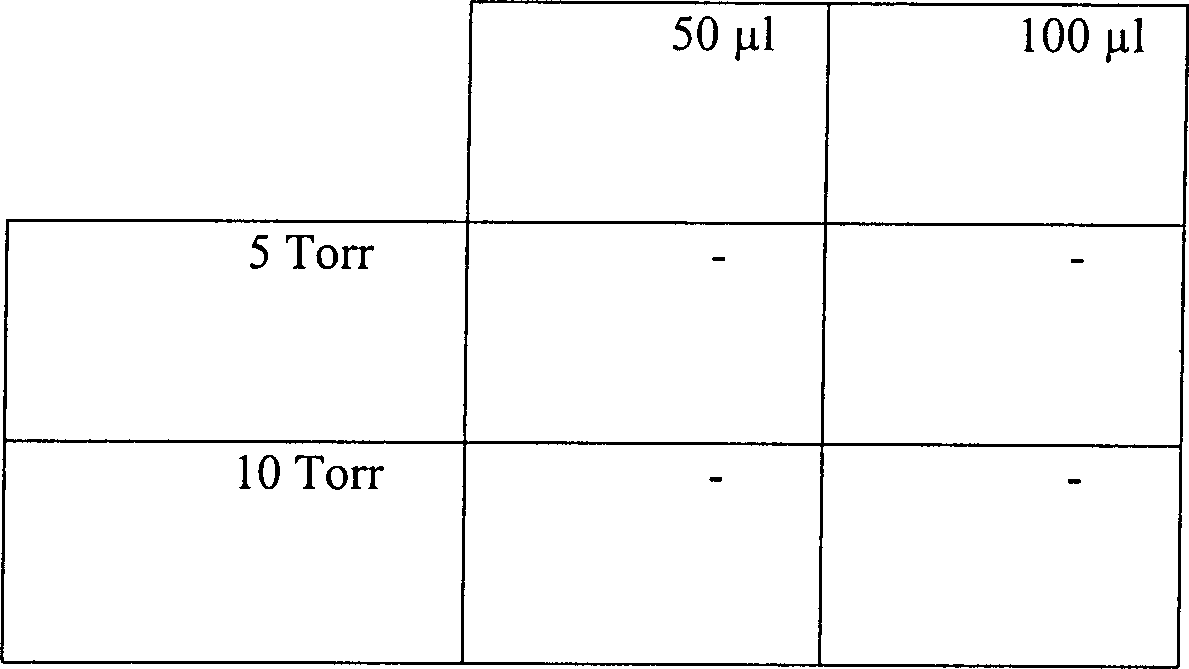
Tabelle 7
-
Wirkung variierender Temperaturen
und Drücke
auf ein diffusionsbeschränktes
Sterilisationssystem
-
Der
Druck nahm von 5 Torr auf 6,15 Torr zu:
-
-
Die
Temperatur des Rohres nahm auf 45°C
zu:
-
-
Diese
Ergebnisse zeigen, dass die Aufrechterhaltung eines konstanten Druckes
oder einer konstanten Temperatur in der diffusionsbeschränkten Umgebung
nicht erforderlich ist, um eine Sterilisation zu bewirken. Unter
den getesteten Bedingungen wird Wasserstoffperoxyd verdampft und
für eine
Zeitdauer in Kontakt mit dem zu sterilisierenden Gerät gehalten,
die ausreicht, eine vollständige
Sterilisation zu bewirken.
-
Das
Verfahren der vorliegenden Erfindung beruht auf der Einbringung
von flüssigem
Wasserstoffperoxyd zu dem zu sterilisierenden Artikel vor der Vakuum-
oder Plasmabehandlung. Der folgende Test wurde durchgeführt, um
den Effekt des Ortes der Einbringung von Wasserstoffperoxyd in der
diffusionsbeschränkten Umgebung
zu bestimmen.
-
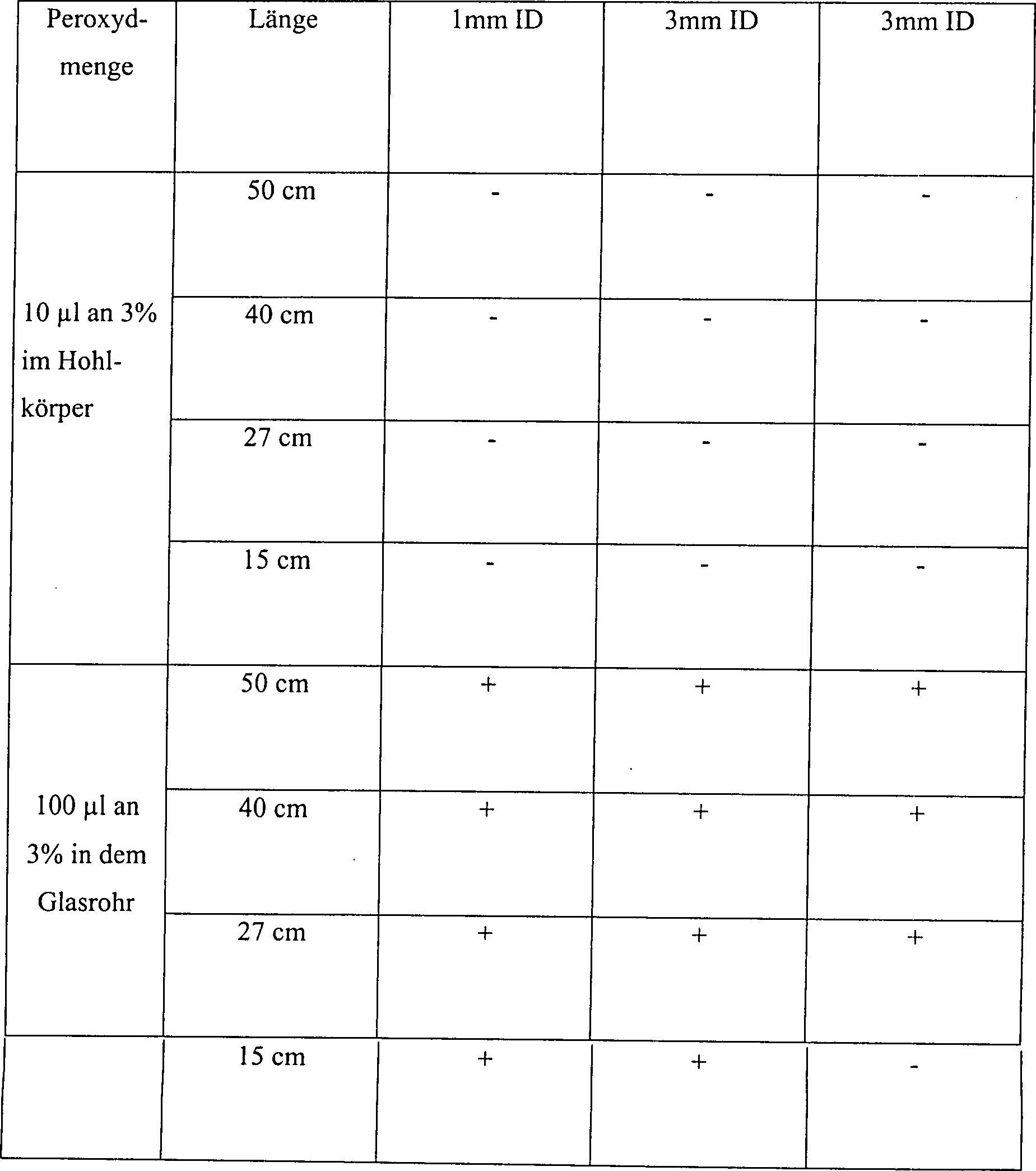
Beispiel 8
-
Eine
Skalpellklinge 5 aus rostfreiem Stahl wurde mit 1,9 × 106 B. stearothermophilus-Sporen angeimpft, und die Klinge 5 wurde
in dem Mittelstück 10 eines
Hohlkörpers 15 platziert,
wie in 1 veranschaulicht.
Die Dimensionen des Mittelstücks 10 betrugen
1,3 cm ID, Länge
5 cm und Volumen 6,6 cc, während
der Hohlkörper
selber in seiner Größe variierte
und über
ein ID von 1, 3 oder 6 mm und eine Länge von 15, 27, 40 oder 50
verfügte.
Der Hohlkörper 15 wurde
in eine 2,2 cm × 60
cm Glasröhre 20 platziert.
Das Rohr 20 wurde verschlossen an einem Ende und das offene
Ende wurde mit einem Gummistopfen 25, enthaltend eine 1
mm × 10
cm Röhre 30 aus
rostfreiem Stahl, die durch den Stopfen 25 platziert ist,
gestöpselt.
Demgemäß konnten die
in das Glasrohr 20 eintretenden oder austretenden Gase
nur durch diese 1 mm × 10
cm große Öffnung passieren.
10 μl einer
3%igen Wasserstoffperoxydlösung
wurden in dem Hohlkörper 15 platziert,
oder 100 μl einer
3%igen Wasserstoffper oxydlösung
wurden in dem Glasrohr 20 platziert, jedoch außerhalb
des Hohlkörpers 15 aus
rostfreiem Stahl. Das Glasrohr 20 wurde anschließend in
einer Vakuumkammer platziert, die verschlossen und für 15 Minuten
auf 1 Torr evakuiert wurde, während
welcher Zeit die Temperatur von etwa 23°C auf etwa 28°C zunahm.
Die Ergebnisse dieses Tests sind wie folgt:
-
Tabelle
8
Effekt einer außerhalb
des Inneren von einem Hohlkörper
platzierten Wasserstoffperoxydlösung
-
Diese
Daten zeigen, dass unten den Testbedingungen gemäß Beispiel 8 die Sterilisation
in dem Inneren des Höhlkörpers nicht
eintrat, wenn Wasserstoffperoxydlösung außerhalb des Hohlkörpers in
einer diffusionsbeschränkten
Umgebung platziert wurde, das jedoch vollständige Sterilisation bewirkt
wurde, wenn die Wasserstoffperoxydlösung in allen Hohlkörpern in
einer diffusionsbeschränkten
Umgebung platziert wurde. Wenn der Wasserstoffperoxyddampf von außen nach
innen diffundieren muss, kann der Sterilisationsmitteldampf nicht
in das Innere des Hohlkörpers
in einer diffusionsbeschränkten
Umgebung eintreten, es sei denn, der Hohlkörper ist hinreichend groß. Wenn
demgemäß die Wasserstoffperoxydlösung außerhalb
des Hohlkörpers
platziert wurde, gestatten nur die kürzesten und breitesten Hohlkörper eine
hinreichende Dampfpenetration, um eine Sterilisation innerhalb des
Hohlkörpers
zu ermöglichen.
Diese Angaben bestätigen,
dass Verfahren nach dem Stand der Technik, welche die Diffusion
von Sterilisationsmitteldampf von außerhalb des Artikels zu dem
Artikelinneren erfordern, unter diesen Bedingungen nicht eine Sterilisation
in diffusionsbeschränkten Umgebungen
erreichen können.
Im Gegensatz hierzu trat unter den gleichen Bedingungen mit viel
geringeren Mengen an Wasserstoffperoxyd eine vollständige Sterilisation
ein, abgesehen davon, dass das Wasserstoffperoxyd innerhalb des
Artikels platziert wurde, wodurch dem Wasserstoffperoxyd gestattet
wurde, von innen nach außen
zu diffundieren.
-
Das
Verfahren der vorliegenden Erfindung ist daher für Umgebungen geeignet, in denen
die Diffusion des Sterilisationsmitteldampfes limitiert ist. Um
den Effekt des Wechsels des Ausmaßes an Diffusionsbeschränkung innerhalb
einer diffusionsbeschränkten
Umgebung zu ermitteln, wurde der folgende Test durchgeführt.
-
Beispiel 9
-
Eine
Skalpellklinge 5 aus rostfreiem Stahl wurde mit 1,9 × 106 B. stearothermophilus-Sporen angeimpft, und in einem 2,2 cm × 60 cm
Glasrohr 20 platziert, wie in 2 veranschaulicht. Das Rohr 20 wurde
an einem Ende verschlossen, und das offene Ende wurde mit einem
Gummistopfen 25 gepfropft. Eine Röhre 30 aus rostfreiem
Stahl mit unterschiedlichen Ausmaßen wurden durch den Stopfen 25 eingeführt. Demgemäß konnten
die in das Glasrohr 20 eintretenden und austretenden Gase
nur durch die Öffnung
in der Röhre 30 passieren,
deren Durchmesser von 1 mm bis 6 mm variierte. Eine 3%ige Wasserstoffperoxydlösung in
Volumina, die von 50 μl
bis 200 μl
reichten, wurde ebenfalls innerhalb des Glasrohres 20 platziert.
Das Glasrohr 20 wurde anschließend in einer Vakuumkammer
platziert, die verschlossen und 15 Minuten bei 5 Torr evakuiert wurde,
während
welcher Zeit die Temperatur von etwa 23°C auf etwa 28°C anstieg.
Zusätzlich
wurden drei Hohlkörper
für 15
Minuten bei 10 Torr mit 3% Wasserstoffperoxyd getestet. Die Ergebnisse
dieses Test sind nachfolgend in der Tabelle 9 aufgelistet.
-
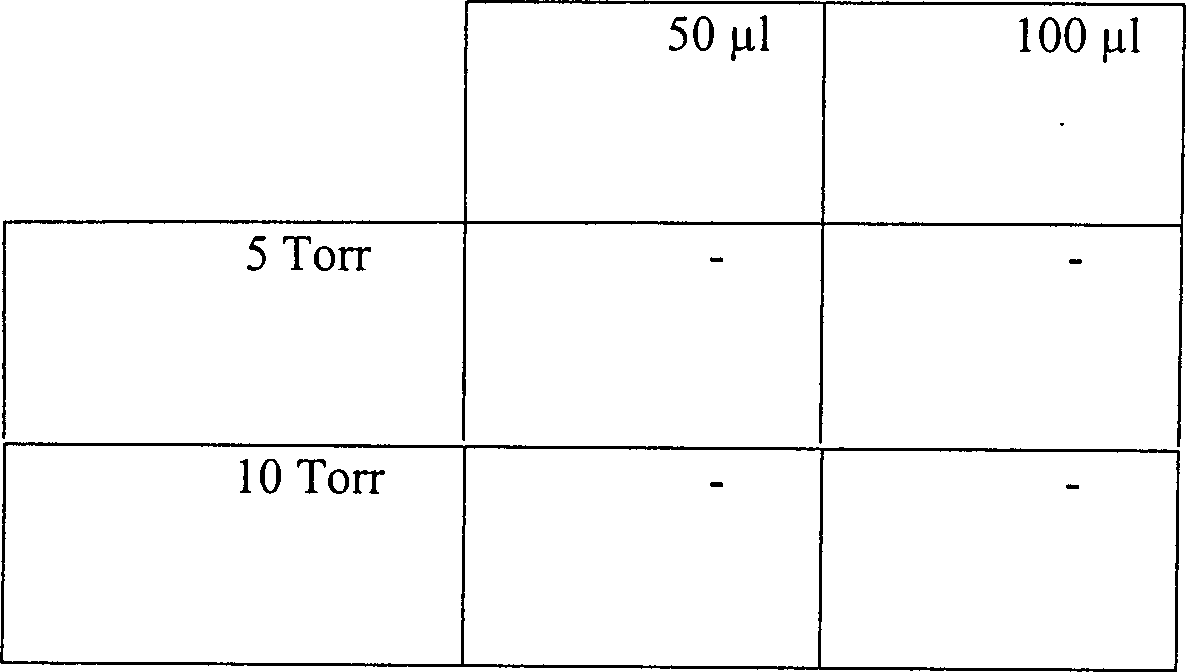
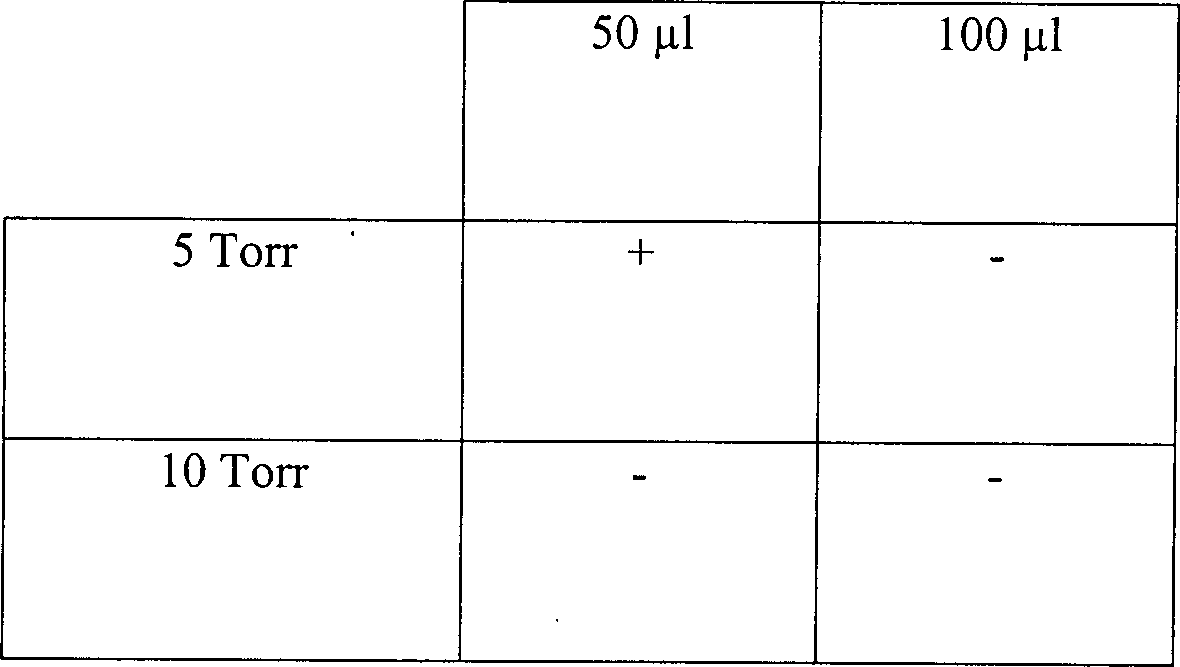
Tabelle
9
Auswirkungen der Röhrenausmaße und des
Vakuumdruckes auf die Sterilisation
15 Vakuum bei 5 Torr bei
3% Wasserstoffperoxyd
-
-
15
Minuten Vakuum bei 10 Torr mit 3% Wasserstoffperoxyd
-
Eine
vollständige
Sterilisation wurde in er Mehrheit der getesteten Umgebungen erreicht.
Die Sterilisation konnte nicht erreicht werden bei Verwendung der
kürzesten
Länge einer
Röhre aus
rostfreiem Stahl bei 5 Torr und mit nur 50 μl Wasserstoffperoxydlösung. Größere Volumen
an Wasserstoffperoxyd müssen
in diesem System eingesetzt werden.
-
Diese
Angaben bestätigen
ebenfalls, dass der Vakuumdruck die Sterilisationswirksamkeit beeinflusst, da
der Behälter
mit dem kürzesten
und breitesten Austrittsrohr Sterilisation bei 10 Torr, nicht jedoch
bei 5 Torr bewerkstelligen konnte. Bei zu niedrigen Drücken (beispielsweise
Drücke
unterhalb von 5 Torr unter den getesteten Bedingungen) erscheint
es jedoch, dass der Wasserstoffperoxyddampf aus dem Inneren des
zu sterilisierenden Artikels zu schnell herausgezogen wird, was
in einer unzureichenden Menge an Wasserstoffperoxyd dampf resultiert,
der es gestattet ist, das Innere des Gerätes zu kontaktieren, um eine
Sterilisation zu bewirken. Es erweckt den Anschein, dass, obwohl
ein Druck von 5 Torr akzeptable Ergebnisse produziert, ein Druck
von etwa 10 Torr unter den getesteten Bedingungen besser ist.
-
Es
ist gezeigt worden, dass das Verfahren der vorliegenden Erfindung
wirksam ist in diffusionsbeschränkten
Umgebungen aus Metall und Glas. Um zu ermitteln, ob das Verfahren
in diffusionsbeschränkten Umgebungen,
die aus anderen Materialien geformt sind, wirksam ist, wurden die
in den Beispielen 10 und 11 beschriebenen Versuche durchgeführt.
-
Beispiel 10
-
Für diesen
Test wurde ein diffusionsbeschränktes
System untersucht. 1,2 × 106 B. stearothermophilus-Sporen wurden auf
Polypropylenvliesstücke
aufgeimpft. Wie in 1 veranschaulicht,
wurden die angeimpften Stücke 5 innerhalb
des Mittelstücks 10 eines
Plastikhohlkörpers 15 platziert,
zusammen mit 10 μl
einer 3%igen Wasserstoffperoxydlösung.
Das Mittelstück 10 war
aus TeflonTM gefertigt und hatte die Ausmaße 1,3 cm × 5 cm.
Der Hohlkörper 15 variierte
von ID 1 mm bis 6 mm und von 15 cm bis 50 cm in der Länge. TeflonTM wurde für den 1 mm Höhlkörper eingesetzt,
Polyethylen wurde für
den 3 mm und den 6 mm Höhlkörper eingesetzt.
Der Höhlkörper 15 wurde
dann in ein 2,2 cm × 60
cm Glasrohr 20 gesetzt. Das Glasrohr 20 wurde
an einem Ende verschlossen, und das offene Ende wurde mit einem
Gummistopfen 25, enthaltend ein 1 mm × 10 cm Stück aus PTFE-Rohr 30 durch
dieses hindurch, abgedichtet. Das Glasrohr 20 wurde in
der Vakuumkammer platziert und für
15 Minuten bei 1 Torr behandelt, während welcher Zeit die Temperatur
von etwa 23°C
auf etwa 28°C
zunahm. Die Ergebnisse dieses Tests sind nachfolgend aufgeführt.
-
Tabelle
10A
Sterilisation in diffusionsbeschränkten Systemen unter Verwendung
von Plastikhohlkörpern
-
Sterilisation
in diffusionsbeschränkten
Umgebungen kann sowohl in kurzen, breiten Hohlkörpern als auch in langen, engen
Hohlkörpern
bewirkt werden, unabhängig
davon, ob Metall oder Plastik eingesetzt wird, um die Hohlkörper zu
bilden. Demgemäß stellt
das Verfahren der vorliegenden Erfindung ein wirksames Sterilisationsverfahren
für diffusionsbeschränkte Artikel
dar und kann für
eine breite Vielfalt an derartigen Artikeln eingesetzt werden, unabhängig von
ihrer Zusammensetzung.
-
Um
dieses weiter zu bestätigen,
wurden 2,1 × 106 B. stearothermophilus-Sporen auf Klingen
aus rostfreiem Stahl aufgeimpft, und 1,2 × 106 B.
stearothermophilus-Sporen wurden auf Polypropylenvliesstücke aufgeimpft.
Wie in 2 gezeigt, wurden
die Klingen 5 oder die Polyproplyenvliesstücke 5 in
einem 2,2 cm × 60 cm
Glasrohr 20 platziert zusammen mit 50 μl an 3%iger Wasserstoffperoxydlösung. Ein
Ende des Rohres wurde verschlossen und das offene Ende wurde mit
einem Gummistopfen 25, enthaltend entweder ein 1 mm × 1 cm Rohr
aus rostfreiem Stahl darin oder ein 1 mm × 10 cm Stück aus einer TeflonTM-Röhre 30 darin,
abgedichtet. Das Glasrohr 20 wurde in einer Vakuumkammer
platziert und für
15 Minuten bei 5 Torr behandelt, während welcher Zeit die Temperatur
von etwa 23°C
auf etwa 28°C
zunahm. Die Ergebnisse sind wie folgt.
-
Tabelle
10B
Wirkung von Metall und Plastik auf die Sterilisation in
einem diffusionsbeschränkten
System
-
Danach
stellen alle vier Kombinationen an Metall und Plastik eine wirksame
Wasserstoffperoxyddampfsterilisation in einer diffusionsbeschränkten Umgebung
zur Verfügung.
Dieser Test bestätigt,
dass das Verfahren der vorliegenden Erfindung ein wirksames Sterilisationsverfahren
für diffusionsbeschränkte Artikel darstellt
und für
eine breite Vielfalt an derartigen Artikeln verwendet werden kann,
unabhängig
von dem eingesetzten Material, aus dem sie geformt sind.
-
Ein
weiterer Test wurde als nächstes
durchgeführt,
um die Wirkung unterschiedlicher Temperaturen und Drücke auf
die Sterilisation von diffusionsbeschränkten Systemen zu ermitteln.
Dieser Test wird nachfolgend beschreiben.
-
Beispiel 11
-
Klingen
aus rostfreiem Stahl wurden mit 2,1 × 106 B.
stearothermophilus-Sporen angeimpft. Die Klingen wurden in einem
2,2 cm × 60
cm Glasrohr 20 platziert, wie in 2 veranschaulicht, zusammen mit verschiedenen
Mengen an 3%iger Wasserstoffperoxydlösung. Das Glasrohr 20 wurde
in einer Vakuumkammer platziert und verschiedenen Drücken und
verschiedenen Temperaturen bei unterschiedlichen Zeitdauern ausgesetzt.
Während
der in Tabelle 11A wiedergegebenen Sterilisationszyklen stieg die
Temperatur von etwa 23°C
auf die angezeigten Temperaturen an. In den in Tabelle 11B wiedergegebenen
Experimenten wurde die Kammer auf etwa 45°C erwärmt. Gemäß einer alternativen Ausführungsform
wurde nicht etwa die Kammer erwärmt,
sondern die Temperatur der Peroxydlösung selber wurde erwärmt. In
den in Tabelle 11C wiedergegebenen Experimenten wurde die Temperatur
von etwa 23°C
auf etwa 28°C
während
der 15minütigen
Einwirkzeit des Vakuums erhöht.
-
Tabelle
11A
Auswirkung der Zeit und des Peroxydvolumens auf die Sterilisation
in einer diffusionsbeschränkten
Umgebung
Bei einem Druck von 5 Torr
-
-
Tabelle
11B
Auswirkung einer erhöhten
Kammertemperatur und eines erhöhten
Peroxydvolumens auf die Sterilisation in einer diffusionsbeschränkten Umgebung
Ca.
45°C Kammertemperatur
-
Tabelle
11C
Auswirkung von Druck und Peroxydvolumen auf die Sterilisation
in einer diffusionsbeschränkten
Umgebung
Mit 15-minütiger
Einwirkzeit
-
Unter
den Testbedingungen gemäß Beispiel
11 waren große
Volumen an Wasserstoffperoxydlösung unwirksam,
um eine Sterilisation zu erreichen, wenn das Vakuum für für kurze
Zeitdauern angewendet wurde. Es wird angenommen, dass dieses wenigstens
teilweise dadurch bedingt ist, dass Wasser schneller verdampft als
Wasserstoffperoxyd. Das in der wässrigen
Lösung
vorliegende Wasser wird daher zuerst verdampfen, und es wird mehr
Zeit benötigt,
um das Wasserstoffperoxyd zu verdampfen. Dieses erklärt ebenfalls,
warum die größeren Volumen
an Wasserstoffperoxydlösung
wirksam waren bei Erreichung einer Sterilisation bei höheren Temperaturen;
die Verdampfung des Wasserstoffperoxyds tritt bei höheren Temperaturen
eher ein. Wenn demgemäß mehr Wasser
in dem System zugegen ist, werden entweder höhere Temperaturen oder mehr
Zeit benötigt,
um eine Sterilisation zu erreichen.
-
Von
diesen Daten ausgehend, erscheint es wiederum so, dass geringfügig höhere Drücke, d.
h. 10 Torr, unter diesen Bedingungen eine Sterilisation wirksamer
bewirken. Es wird angenommen, dass dieses dadurch bedingt ist, das
bei höheren
Drücken
mehr Wasserstoffperoxyddampf in dem System zurückgehalten wird. Bei einem
zu geringen Druck wird Wasserstoffperoxyddampf zu schnell aus dem
System gezogen.
-
Um
eine mutmaßliche
Minimumkonzentration an Peroxyd in dem Flüssig-Vakuum-System in einem diffusionsbeschränkten Behälter zu
bestimmen, wurde Beispiel 12 durchgeführt.
-
Beispiel 12
-
Verschiedene
Konzentrationen an Peroxyd wurden in einem System, im wesentlichen
wie dem in Zusammenhang mit der 2 beschriebenen,
verwendet. In diesem System stellte das Ausgangsrohr 35 ein Rohr
aus rostfreiem Stahl mit einer Länge
von 50 cm und einem Innendurchmesser von 1 mm dar. Eine Klinge aus
rostfreiem Stahl, angeimpft mit 1,9 × 106 B.
stearothermophilus-Sporen wurde in dem Behälter, bei dem es sich um ein
2,2 cm × 60
cm Glasrohr handelte, platziert. Verschiedene Mengen an 3%igem Wasserstoffperoxyd
wurden in den Behälter
eingeführt.
Der Behälter
wurde in einer Vakuumkammer mit einem Volumen von 173 l platziert,
und der Druck wurde für
eine Dauer von 1 Stunde auf 10 Torr verringert, während welcher
Zeit die Temperatur von etwa 23°C
auf etwa 40°C
zunahm. Die sporizide Aktivität
wurde bei jeder Konzentration an Peroxyd ermittelt. Außerdem wurde
in dem Behälter
nach dem Sterilisationsprozess verbleibende Peroxydmenge durch Standardtitrations-techniken
ermittelt, bei denen das Peroxyd mit Kaliumjodid reagierte und mit Natriumthiosulfat
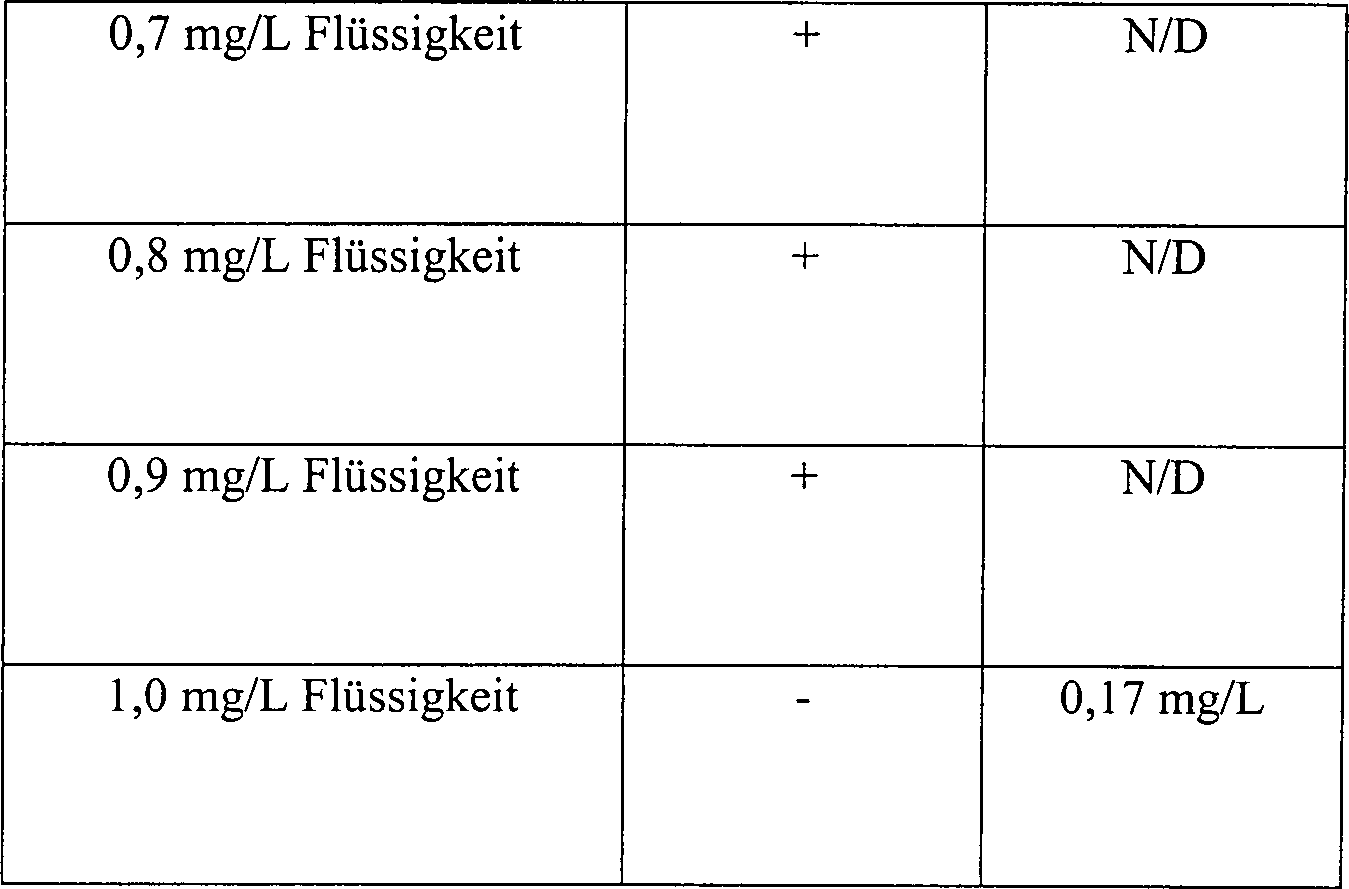
titriert wurde. Die Ergebnisse sind in Tabelle 12 gezeigt, in der "N/D" bedeutet: nicht
ermittelt.
-
-
-
Die
in Tabelle 12 dargestellten Ergebnisse zeigen, dass 1,0 mg/L an
3%igem flüssigen
Peroxyd in dem getesteten System erforderlich waren, um eine Sterilisation
zu bewirken. Ferner war unter den getesteten Bedingungen eine Konzentration
von 0,17 mg/L an in dem System verbleibenden Peroxyd hinreichend,
um eine vollständige
Sterilisation zu bewerkstelligen. Diese Daten zeigen ebenfalls,
dass das in diesen Experimenten eingesetzte Glasrohr ein hinreichendes
Maß an
Diffusionsbeschränkung
zur Verfügung
stellte, um 17% des darin platzierten Wasserstoffperoxyds zurückzuhalten.
-
Wir
untersuchten ferner die Auswirkungen der Länge und des Innendurchmessers
des in dem System eingesetzten Ausgangsrohres ähnlich zu dem gemäß Beispiel
12. Dieser Test wird in Beispiel 13 gezeigt.
-
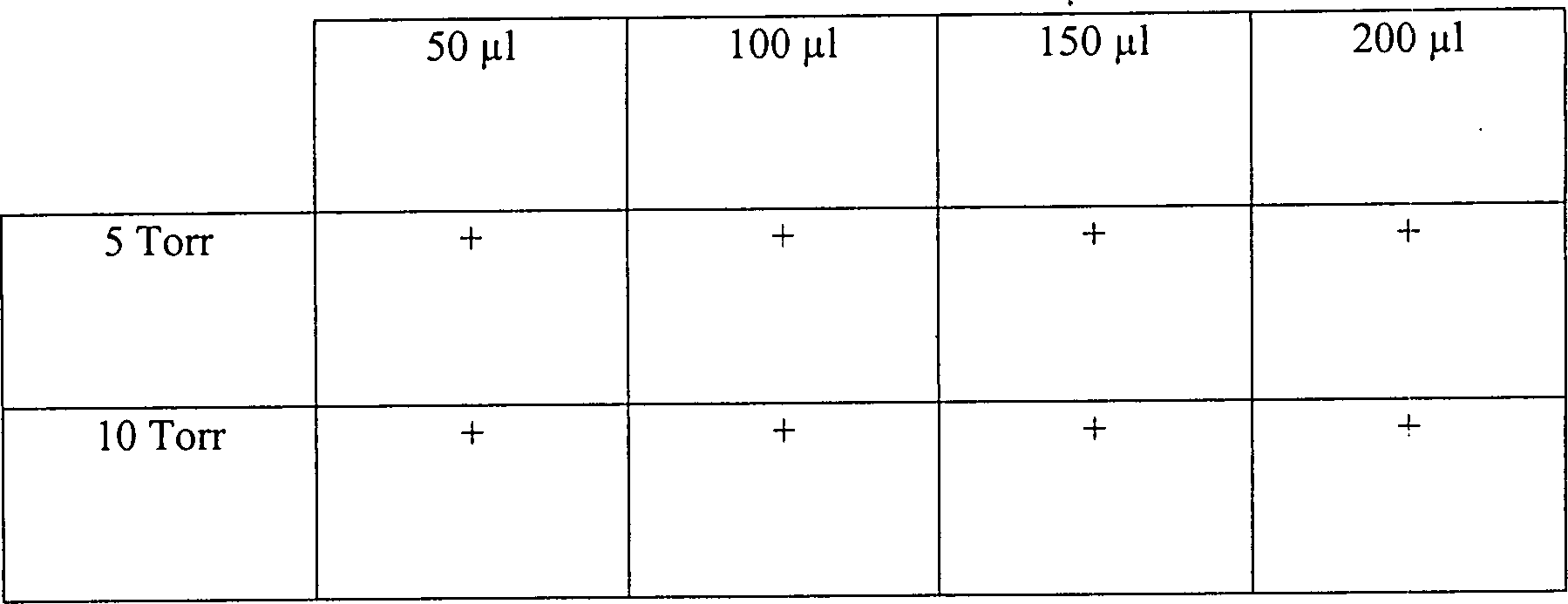
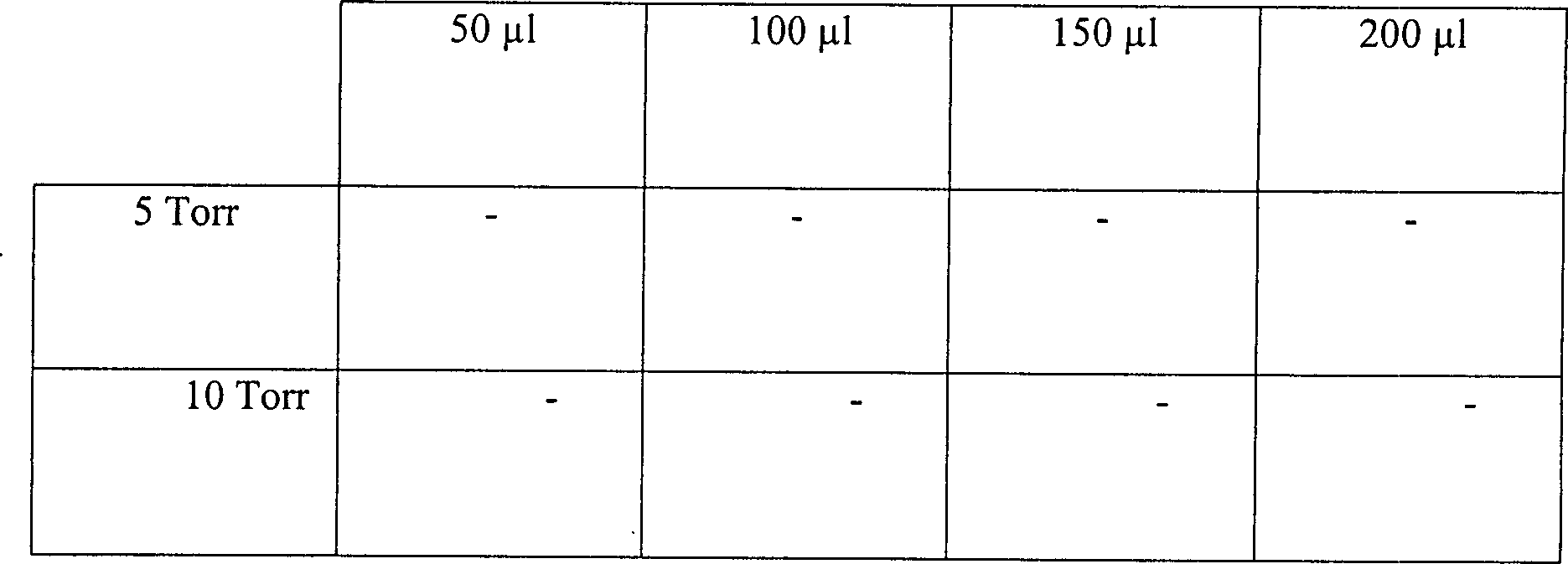
Beispiel 13
-
Es
wurde ein System ähnlich
dem oben im Zusammenhang mit Beispiel 12 beschriebenen eingesetzt, mit
der Ausnahme, dass nicht 1 Stunde sondern 15 Minuten an Vakuum eingesetzt
wurden. Die Temperatur nahm demgemäß nur auf etwa 28°C zu. In
diesem Test wurde die Größe des Ausgangsrohres 35 variiert
wie auch das Volumen an 3%iger Peroxydlösung. Die Ergebnisse sind unten
in Tabelle 13 dargestellt.
-
-
Die
Ergebnisse zeigen, dass, vorrausgesetzt hinreichend Peroxyd ist
zugegen, die durch einen einzigen Eingangs- und Ausgangsanschluss
mit einem Innendurchmesser von 9 mm oder weniger oder einer Länge von
1 cm oder mehr erzeugte Diffusionsbeschränkung ausreichend ist, um eine
Sterilisation zu bewirken.
-
Um
des weiteren die Wirkung der Veränderung
des Ausmaßes
an Dampfdiffusionsbeschränkung
in dem System auf die Sterilisationswirksamkeit zu ermitteln, wurde
der folgende Test durchgeführt.
-
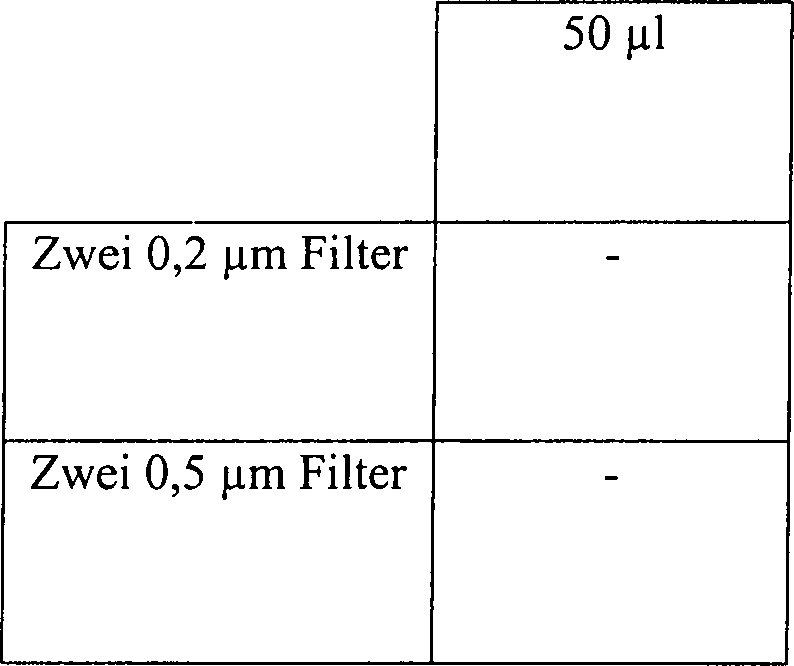
Beispiel 14
-
Eine
Klinge aus rostfreiem Stahl wurde mit 2,1 × 106 B.
stearothermophilus-Sporen angeimpft. Die Klinge 5 wurde
in einem 2,2 cm × 60
cm Glasrohr 20 platziert, wie in 3 gezeigt, zusammen mit unterschiedlichen
Mengen an 3%iger Wasserstoffperoxydlösung. Ein Ende des Rohres wurde
verschlossen, und das offene Ende wurde mit einem Gummistopfen 25,
enthaltend ein darin eingeführtes
Spritzenfilter 35, abgedichtet. Das Glasrohr 20 wurde
in einer Vakuumkammer platziert und für 15 Minuten bei 5 Torr behandelt,
während welcher
Zeit die Temperatur von etwa 23°C
auf etwa 28°C
zunahm. Zur Kontrolle wurden auf identische Weise angeimpfte Klingen
in 2,2 cm × 60
cm Glasrohren platziert. Das offene Ende der Rohre wurde offengelassen, es
wurde kein Stopfen und kein Spritzenfilter eingesetzt. Die Diffusion
des Dampfes aus dem Inneren des Rohres wurde demgemäß nicht
eingeschränkt.
-
Verschiedene
Spritzenfilter mit unterschiedlichen Porengrößen wurden getestet, einschließlich einem MFS
PTFE 25 mm Spritzenfilter mit einem 0,2 μm Membranfilter und einem 0,5 μm Membranfilter;
einem Nalgene PTFE 50 mm Spritzenfilter mit einem 0,2 μm Membranfilter
und einem 0,45 μm
Membranfilter; einem Whatman AnatopTM 101
Plus sterilen Spritzenfilter mit einem 0,02 μm Membranfilter und einem 0,1 μm Membranfilter;
und schließlich
einem Gelman AcrodiscTM CR PTFE Spritzenfilter
mit einer 0,2 μm,
einer 0,45 μm und
einer 1,0 μm
Membran. Die Ergebnisse sind wie folgt.
-
Tabelle
14
Sporizide Aktivität
einer H
2O
2-Lösung mit
Vakuum in einem Behälter,
enthaltend ein Spritzenfilter
15 Minuten Vakuum und 3% Wasserstoffperoxyd
(a)
ohne Spritzenfilter und Stopfen
-
(b)
mit einem MFS
TM PTFE 25 mm Spritzenfilter
(1)
0,2 μm Membranfilter
-
-
(3)
Mit 2 MFS
TM Filtern zusammen mit einem Druck
von 5 Torr
-
(c)
Mit einem Nalgene
TM PTFE 50 mm Spritzenfilter
(1)
0,2 μm Membranfilter
-
(2)
0,45 μm
Membranfilter
-
(d)
Mit einem Whatman Anatop
TM 10 Plus Spritzenfilter
(1)
0,02 μm
Membranfilter
-
-
(e)
Mit einem Gelman Acrodisc
TM CR PTFE Spritzenfilter
(1)
0,2 μm Membranfilter
-
(2)
0,45 μm
Membranfilter
-
-
Aus
diesen Ergebnissen wird offensichtlich, dass bestimmte Filtermarken
nicht eine hinreichende diffusionsbeschränkte Umgebung bei einem Druck
von 5 Torr erzeugen, wenn nur 50 μl
an Wasserstoffperoxydlösung
in dem System platziert sind. Andere Filtermarken stellten hingegen
eine hinreichende Diffusionsbeschränkung zur Verfügung; diese
Filtermarken verfügten
entweder über
längere
Hohlkörper
oder schmalere Filterporengrößen. Die
Verwendung größerer Wasserstoffperoxydvolumen,
eines Drucks von 10 Torr oder von seriellen Filtern verstärkt die
Wirksamkeit des Sterilisationssystems. Dieses ist wichtig, da Filter,
einschließlich solche
aus TyvekTM hergestellte, häufig in
Verpackungen von sterilen Artikeln verwendet werden, um eine Rekontamination
mit Bakterien zu verhindern. Diese Filter haben generell Porengrößen von
1 μm oder
weniger oder, wie im Fall von TyvekTM, erzeugen
einen verzweigten Weg, den Bakterien nicht durchqueren können. Gemäß der vorliegenden
Erfindung können
Filter in Kombination mit anderen Verpackungsmitteln eingesetzt
werden, um eine diffusionsbeschränkte
Umgebung zu erzeugen, um eine Sterilisation zu bewirken, und die
sterilen Artikel können
während
der Lagerung vor dem Einsatz in der Verpackung verbleiben; die Filter
werden eine Rekontamination des sterilen Artikels verhindern.
-
Um
zu testen, ob andere Sterilisationsmittel ebenfalls eingesetzt werden
können,
um eine Sterilisation in diffusionsbeschränkten Umgebungen zu bewirken,
wurde der folgende Test durchgeführt.
-
Beispiel 15
-
Eine
Klinge aus rostfreiem Stahl wurde mit 1,9 × 106 B.
stearothermophilus-Sporen angeimpft. Die Klinge 5 wurde
in einem 2,2 cm × 60
cm Glasrohr 20 platziert, wie in 2 gezeigt, zusammen mit verschiedenen
Mengen an 4,74%iger Peressigsäurelösung (Solvay
Interox Ltd., Warrington, England). Das Glasrohr 20 wurde
in einer Vakuumkammer platziert und für 15 Minuten einem Druck von
5 Torr ausgesetzt, während welcher
Zeit die Temperatur von etwa 23°C
auf etwa 28°C
zunahm. Die Ergebnisse dieses Tests sind unten dargestellt.
-
Tabelle
15
Sterilisation mit Peressigsäure in einem diffusionsbeschränkten System
-
Diese
Resultate zeigen, dass Peressigsäure,
in der Wasserstoffperoxyd co-existent ist, ebenfalls in dem Sterilisationsverfahren
gemäß der vorliegenden
Erfindung eingesetzt werden kann.
-
Es
wurde gefunden, dass durch die Einbringung geringer Mengen an Wasserstoffperoxydlösung zu einem
zu sterilisierenden Artikel vor der Vakuumeinwirkung die Sterilisation
bei tieferen Temperaturen und in kürzeren Zeitdauern bewirkt werden
konnte. Der folgende Test wurde durchgeführt, um verschiedene Methoden
der Einbringung von Wasserstoffperoxydlösung zu einem zu sterilisierenden
Artikel zu untersuchen. Ferner wurde die Wirksam keit von Vakuumbehandlung
und Plasmabehandlung, die der Vorbehandlung mit wässrigem
Wasserstoffperoxyd folgten, getestet. Der Test wird nachfolgend
in Beispiel 16 beschrieben.
-
Beispiel 16
-
In
einer ersten Testserie wurden Klingen aus rostfreiem Stahl mit 2,5 × 106 B. stearothermophilus-Sporen angeimpft.
Die Klingen wurden in einem ausgedehnten Mittelstück eines
3 mm × 50
cm Hohlkörpers
aus rostfreiem Stahl platziert. Der Hohlkörper wurde in einem 1000 ml
Becher, enthaltend 800 ml Wasserstoffperoxydlösung, platziert. Der Hohlkörper wurde
für 5 Minuten
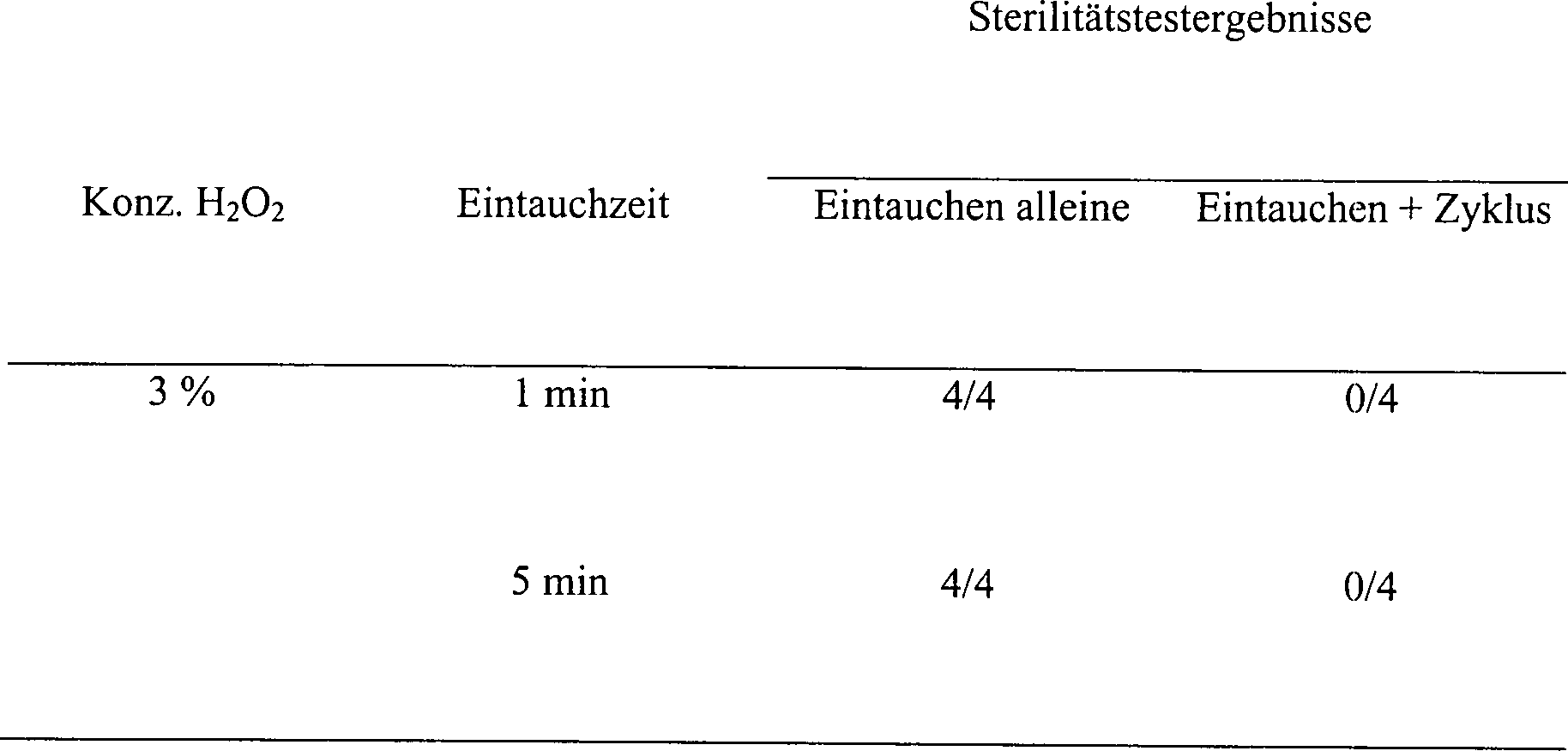
in einer 3%igen Wasserstoffperoxydlösung eingetaucht. Die Anzahl
der überlebenden
Organismen wurde nach diesem anfänglichen
Eintauchen bestimmt. Die Hohlkörper
wurden aus der Wasserstoffperoxydlösung entfernt und die Außenseite
mit Papiertüchern
trocken getupft. Das Innere der Hohlkörper wurde getrocknet mittels
Platzierens von einem Ende des Hohlkörpers in einer Flasche und
Blasens mit einem dreisekündigen
Stoß mit
komprimierter Luft. Die Hohlkörper
wurden geschüttelt,
und das Blasen und Schütteln
wurde wiederholt, bis keine Lösung
mehr herausgeblasen wurde. Nachfolgend wurde der Hohlkörper in
einer Sterilisationskammer platziert und entweder für 15 Minuten
einem Vakuum von 0,5 Torr oder für
15 Minuten einem Plasma bei 0,5 Torr ausgesetzt. Nach 15-minütigem Vakuum nahm
die Temperatur von etwa 23°C
auf etwa 28°C
zu. Die Ergebnisse sind nachfolgend in der Tabelle 16A aufgeführt.
-
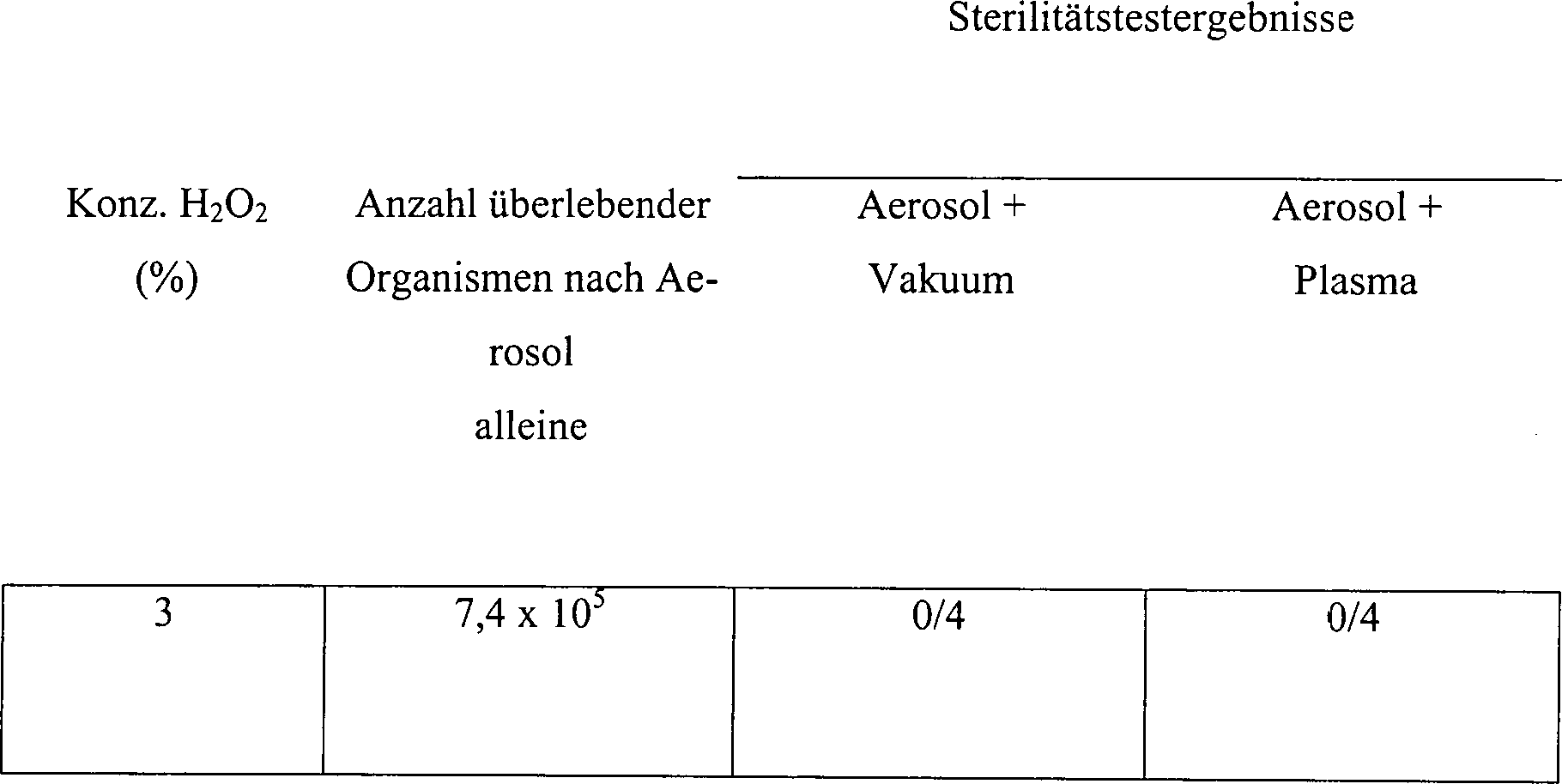
Tabelle
16A
Wirkung eines Bades in H
2O
2 Lösung
auf die sporizide Aktivität
in Hohlkörpern
aus rostfreiem Stahl vor der Behandlung mit entweder einem Plasma
oder einem Vakuum
-
Ein
fünfminütiges Eintauchen
in 3%iger Wasserstoffperoxydlösung
stellte ein wirksames Mittel dar, um Wasserstoffperoxyd vor einer
Vakuum- oder Plasmabehandlung in den Hohlkörper einzubringen. Wie vorangehend
angemerkt, ist die Behandlung mit einer Wasserstoffperoxydlösung alleine
bei Verwendung verdünnter Lösungen und
kurzer Eintauchzeiten unwirksam, um eine Sterilisation zu erreichen.
Der Eintrag einer Wasserstoffperoxydlösung via stationärem Einweichens
stellt einen wenigstens so wirksamen Weg dar, um Wasserstoffperoxyd
einzubringen, wie die Deponierung kleiner Volumen direkt in den
Hohlkörper
der Vorrichtung.
-
Der
Durchflusseintrag von Wasserstoffperoxyd wurde als nächstes getestet.
Klingen aus rostfreiem Stahl wurden hier mit 2,5 × 106 B. stearothermophilus-Sporen angeimpft.
Die Klingen wurden in einem ausgedehnten Mittelstück eines
3 mm × 50
cm Hohlkörpers
aus rostfreiem Stahl platziert. Wasserstoffperoxydlösung mit
einer Konzentration von 3% wurde zu dem Hohlkörper mit einer Fließrate von
0,1 L/min unter Verwendung einer Peristaltikpumpe befördert. Der
Hohlkörper
wurde wie oben beschrieben getrocknet. Der Vorbehandlung mit einer
Wasserstoffperoxydlösung
folgend wurde der Hohlkörper
anschließend
in einer Sterilisationskammer platziert und entweder einem Vakuum
von 0,5 Torr für
15 Minuten oder einem Plasma bei 0,5 Torr für 15 Minuten ausgesetzt. Die
Ergebnisse sind nachfolgend in der Tabelle 16B aufgeführt.
-
Tabelle
16B
Auswirkungen einer Durchflusseinbringung einer H
2O
2 Lösung auf
die sporizide Aktivität
vor der Behandlung von Hohlkörpern
aus rostfreiem Stahl mit entweder einem Vakuum oder einem Plasma
-
Der
Eintrag der Wasserstoffperoxydlösung
via konstantem Durchfluss stellt ebenfalls einen wirksamen Weg dar,
um Wasserstoffperoxyd zu dem System zu befördern.
-
Schließlich wurde
die Wirkung der Einbringung von Wasserstoffperoxyd mittels eines
Aerosolsprays getestet. Klingen aus rostfreiem Stahl wurden mit
2,5 × 106 B. stearothermophilus-Sporen angeimpft.
Die angeimpften Klingen wurden in einem ausgedehnten Mittelstück eines
3 mm × 50
cm Hohlkörpers
aus rostfreiem Stahl platziert. Eine 3%ige Wasserstoffperoxydlösung wurde
zu dem Hohlkörper
via eines dreisekündigen
Aerosolsprayens befördert.
Die Aerosolspraygeschwindigkeit wurde ermittelt mit 0,04 L/min.
Nach fünfminütigem Warten,
das auf die Vorbehandlung mit Wasserstoffperoxyd folgte, wurde der
Hohlkörper
wie oben beschrieben getrocknet, und der Hohlkörper wurde anschließend in
einer Sterilisationskammer platziert und entweder für 15 Minuten
einem Vakuum von 0,5 Torr oder für
15 Minuten bei 0,5 Torr einem Plasma ausgesetzt. Die Ergebnisse
sind nachfolgend in Tabelle 16C aufgeführt.
-
Tabelle
16C
Wirkungen eines Aerosoleintrags einer H
2O
2 Lösung
auf die sporizide Aktivität
vor der Behandlung in Metallhohlkörpern mit entweder einem Vakuum
oder einem Plasma
-
Der
Durchfluss von Wasserstoffperoxyd entweder als flüssige Lösung oder
als Aerosol kann ebenfalls erreicht werden durch Einführen eines
erhöhten
Druckes an dem Eintragende oder eines reduzierten Druckes an dem
Ausgangsende der zu behandelnden Vorrichtung.
-
Es
wird anhand der Daten in den Tabellen 16A bis 16C offensichtlich,
dass alle drei Methoden der Einbringung einer Wasserstoffperoxydlösung in
den zu sterilisierenden Artikel eine wirksame Sterilisation gewährleisten.
Es erscheint demnach so, dass eine Anzahl an unterschiedlichen Einbringungsverfahren
verwendet werden kann, solange die Wasserstoffperoxydlösung in
dem System zugegen ist, bevor das Vakuum oder das Plasma einwirken.
-
Schließlich wurde
die Wirksamkeit der Vorbehandlung mit Wasserstoffperoxyd vor einem
Sterilisationszyklus, der die Einwirkung von Wasserstoffperoxyddampf,
Vakuum und Plasma kombiniert, ermittelt. Der Test war wie folgt.
-
Beispiel 17
-
Klingen
aus rostfreiem Stahl wurden mit 2,5 × 106 B.
stearothermophilus-Sporen angeimpft. Die Klingen wurden in einer
3%igen Wasserstoffperoxydlösung
für entweder
1 oder 5 Minuten eingetaucht. Die Klingen wurden dann in einem ausgedehnten
Mittelstück
eines 3 mm × 50
cm Hohlkörpers
aus rostfreiem Stahl platziert. Der Hohlkörper wurde anschließend in
einer Sterilisationskammer platziert, die auf etwa 0,5 Torr evakuiert
wurde. Der Sterilisationszyklus umfasste eine 15-minütige Wasserstoffperoxyddampfdiffusion
mit einem Minimum von 6 mg/L Wasserstoffperoxyd, gefolgt durch ein
15-minütiges
Plasma von 400 Watt. Im Anschluss an die Plasmabehandlung wurde
die Kammer belüftet
und die Klingen wurden auf Sterilität getestet. Die Ergebnisse
werden nachfolgend gezeigt.
-
Tabelle
17
Wirkung eines H
2O
2 Lösung-Bades
auf die sporizide Aktivität
in Hohlkörpern
aus rostfreiem Stahl vor einem Wasserstoffperoxyddampf- und einem
Plasmazyklus
-
Das
Behandeln der Hohlkörper
alleine in einem Wasserstoffperoxyddampf oder einem Plasmazyklus ließ durchschnittlich
30 überlebende
Organismen pro Klinge zurück.
Die Vorbehandlung der Klingen durch Eintauchen in eine 3%ige Wasserstoffperoxydlösung für 5 Minuten
alleine ließ durchschnittlich
8,2 × 105 überlebend
Organismen pro Klinge zurück.
Unter den Testbedingungen war demnach eine Kombination einer Wasserstoffperoxyddampfeinwirkung
und einer Plasmaeinwirkung, welche sich für viele Artikel als wirksam
erwiesen hat, in einer diffusionsbeschränkten Umgebung unwirksam. Durch
Vorbehandlung der zu sterilisierenden Artikel mit verdünnter Wasserstoffperoxydlösung vor
der Einwirkung von Wasserstoffperoxyddampf und Plasma konnte jedoch
eine vollständige
Sterilisation erreicht werden.
-
Während die
Erfindung beschrieben worden ist im Zusammenhang mit flüssigen Sterilisationsmittellösungen,
enthaltend Wasserstoffperoxyd, wird davon ausgegangen, dass equivalente
Sterilisationsverfahren durch den Fachmann an andere Sterilisationsmittelflüssigkeiten
angepasst werden können.
In einer alternativen Ausführungsform
wird ein Sterilisationsmittel mit einem Dampfdruck, der geringer
ist als der von Wasser oder einem Lösungsmittel, in dem das Sterilisationsmittel
zur Verfügung
gestellt wird, eingesetzt. Für
solche Sterilisationsmittel ist es nur wichtig, dass der Dampfdruck
geringer ist als der des Lösungsmittels
innerhalb des hier betrachteten Temperaturbereichs. Derartige Sterilisationsmittel
können
an die hierin beschriebenen Techniken mit nur geringfügigen Änderungen
angepasst werden, die gemacht werden bedingt durch die Unterschiede
im Dampfdruck zwischen Peroxyd und derartigen anderen Sterilisationsmitteln,
was ohne weiteres durch den Fachmann festgestellt werden kann. Solange
der lokale Dampfdruck an dem Ort der Sterilisationsmittelflüssigkeit
geringer als der Dampfdruck des Sterilisationsmittels ist, kann
die Sterilisation im wesentlichen wie vorangehend beschrieben erreicht
werden.
-
Schlussfolgerung
-
Das
Erreichen einer raschen Sterilisation von Vorrichtungen mit Hohlkörpern bei
tiefen Temperaturen unter Verwendung geringer Konzentration an Sterilisationsmittel
ist bislang eine herausragende Herausforderung gewesen. Ein überlegenes
Sterilisationsverfahren ist gefunden worden, dass den Problemen
bekannter Verfahren abhilft. Durch die Vorbehandlung von zu sterilisierenden
Artikeln mit einer wässrigen
Lösung
an Wasserstoffperoxyd vor der Einwirkung eines Vakuums kann eine
schnelle Sterilisation bei tiefen Temperaturen ohne Beschädigung der
Artikel erreicht werden, ohne dass toxische Rückstände zurückbleiben und ohne die Notwendigkeit,
spezielle Behältnisse
festigen zu müssen.
Das Verfahren der vorliegenden Erfindung ist effizient, ungefährlich und
außerdem
preiswert.