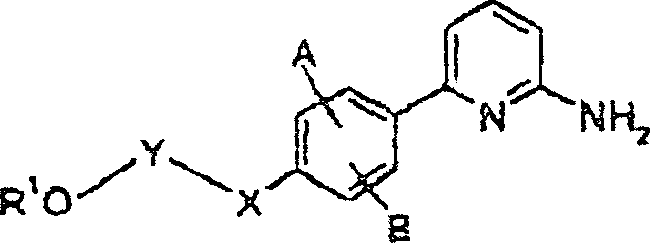
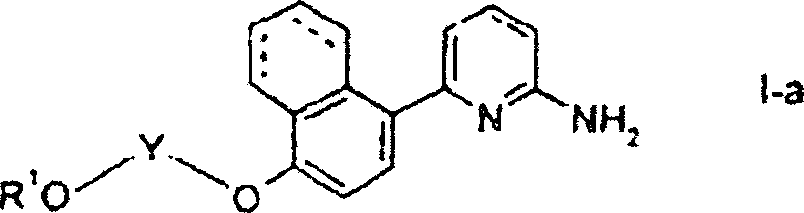
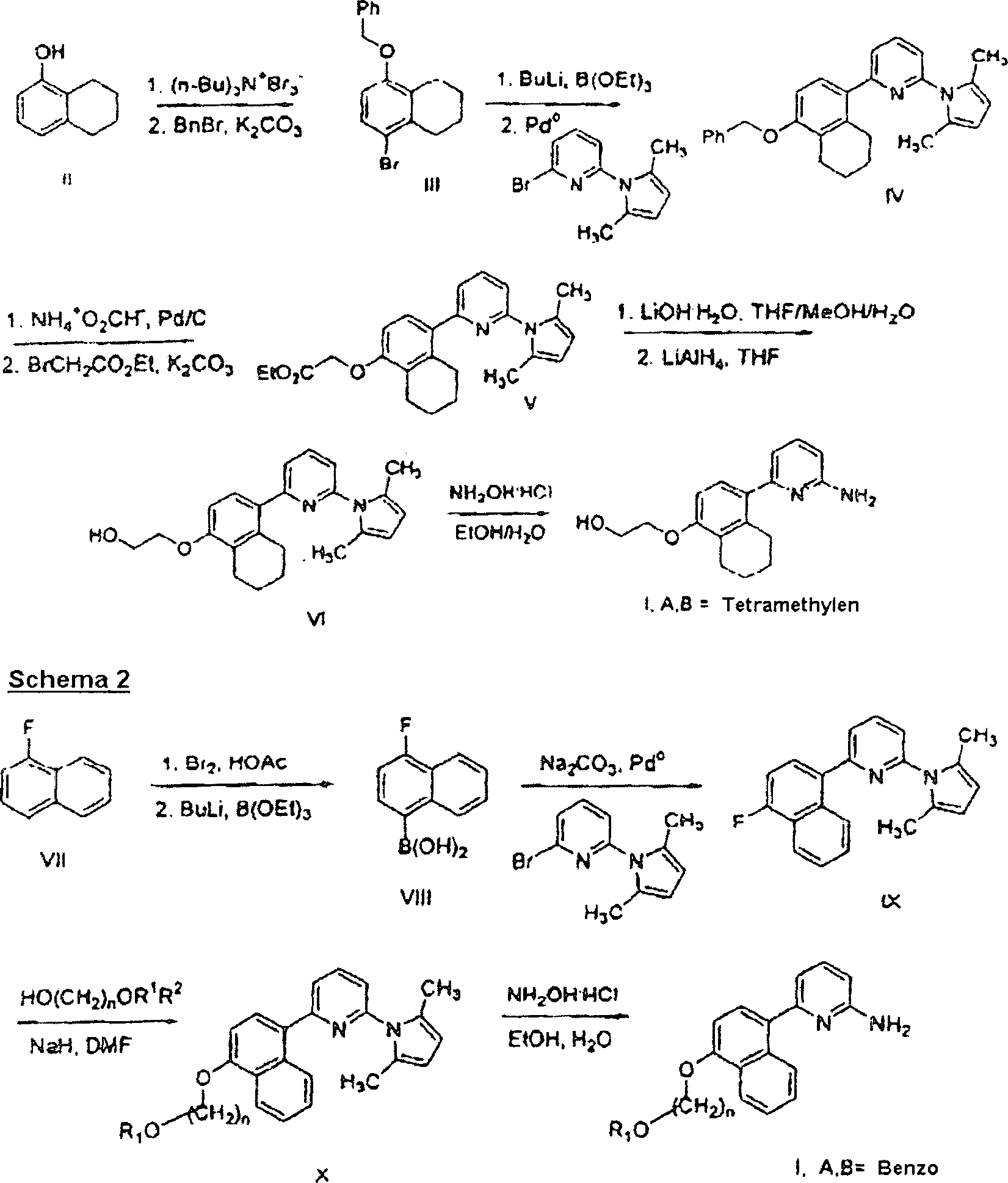
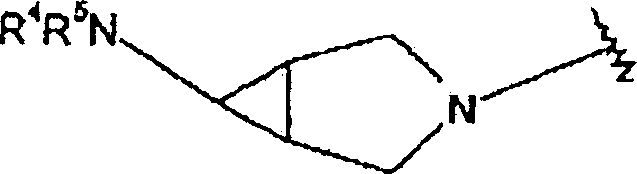
DE60003893T2 - 2-aminopyridine mit kondensierten ringsubstituenten - Google Patents
2-aminopyridine mit kondensierten ringsubstituenten Download PDFInfo
- Publication number
- DE60003893T2 DE60003893T2 DE60003893T DE60003893T DE60003893T2 DE 60003893 T2 DE60003893 T2 DE 60003893T2 DE 60003893 T DE60003893 T DE 60003893T DE 60003893 T DE60003893 T DE 60003893T DE 60003893 T2 DE60003893 T2 DE 60003893T2
- Authority
- DE
- Germany
- Prior art keywords
- group
- disorders
- conditions
- disease
- ring
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 title claims description 6
- 239000000654 additive Substances 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 96
- -1 nitro, cyano, amino Chemical group 0.000 claims description 46
- 208000028017 Psychotic disease Diseases 0.000 claims description 34
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 29
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 28
- 208000019116 sleep disease Diseases 0.000 claims description 25
- 238000000034 method Methods 0.000 claims description 23
- 241000124008 Mammalia Species 0.000 claims description 21
- 201000010099 disease Diseases 0.000 claims description 21
- 208000019901 Anxiety disease Diseases 0.000 claims description 20
- 102000008299 Nitric Oxide Synthase Human genes 0.000 claims description 20
- 108010021487 Nitric Oxide Synthase Proteins 0.000 claims description 20
- 206010012218 Delirium Diseases 0.000 claims description 19
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 claims description 18
- 208000008811 Agoraphobia Diseases 0.000 claims description 15
- 125000003118 aryl group Chemical group 0.000 claims description 15
- 201000009032 substance abuse Diseases 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 15
- 206010012289 Dementia Diseases 0.000 claims description 14
- ZPUCINDJVBIVPJ-LJISPDSOSA-N cocaine Chemical compound O([C@H]1C[C@@H]2CC[C@@H](N2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 ZPUCINDJVBIVPJ-LJISPDSOSA-N 0.000 claims description 14
- 230000000694 effects Effects 0.000 claims description 14
- 150000003839 salts Chemical class 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 13
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 12
- 229910052739 hydrogen Inorganic materials 0.000 claims description 12
- 239000000203 mixture Substances 0.000 claims description 12
- 206010028980 Neoplasm Diseases 0.000 claims description 11
- 230000036506 anxiety Effects 0.000 claims description 11
- 201000011510 cancer Diseases 0.000 claims description 11
- 229910052757 nitrogen Inorganic materials 0.000 claims description 11
- 206010012239 Delusion Diseases 0.000 claims description 10
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 claims description 10
- 230000001154 acute effect Effects 0.000 claims description 10
- 125000000217 alkyl group Chemical group 0.000 claims description 10
- RYYVLZVUVIJVGH-UHFFFAOYSA-N caffeine Chemical compound CN1C(=O)N(C)C(=O)C2=C1N=CN2C RYYVLZVUVIJVGH-UHFFFAOYSA-N 0.000 claims description 10
- 231100000868 delusion Toxicity 0.000 claims description 10
- 208000019906 panic disease Diseases 0.000 claims description 10
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 claims description 9
- 230000002757 inflammatory effect Effects 0.000 claims description 9
- 229910052760 oxygen Inorganic materials 0.000 claims description 9
- 208000031091 Amnestic disease Diseases 0.000 claims description 8
- 206010040070 Septic Shock Diseases 0.000 claims description 8
- 239000003814 drug Substances 0.000 claims description 8
- 239000001257 hydrogen Substances 0.000 claims description 8
- KWTSXDURSIMDCE-QMMMGPOBSA-N (S)-amphetamine Chemical compound C[C@H](N)CC1=CC=CC=C1 KWTSXDURSIMDCE-QMMMGPOBSA-N 0.000 claims description 7
- 241000218236 Cannabis Species 0.000 claims description 7
- 229940025084 amphetamine Drugs 0.000 claims description 7
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 7
- 210000000481 breast Anatomy 0.000 claims description 7
- 229960003920 cocaine Drugs 0.000 claims description 7
- 208000010877 cognitive disease Diseases 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 7
- 125000001624 naphthyl group Chemical group 0.000 claims description 7
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 7
- 239000001301 oxygen Substances 0.000 claims description 7
- 239000008194 pharmaceutical composition Substances 0.000 claims description 7
- JTJMJGYZQZDUJJ-UHFFFAOYSA-N phencyclidine Chemical compound C1CCCCN1C1(C=2C=CC=CC=2)CCCCC1 JTJMJGYZQZDUJJ-UHFFFAOYSA-N 0.000 claims description 7
- 229950010883 phencyclidine Drugs 0.000 claims description 7
- 238000002360 preparation method Methods 0.000 claims description 7
- 229920006395 saturated elastomer Polymers 0.000 claims description 7
- 230000036303 septic shock Effects 0.000 claims description 7
- 208000011117 substance-related disease Diseases 0.000 claims description 7
- 208000024827 Alzheimer disease Diseases 0.000 claims description 6
- 206010019196 Head injury Diseases 0.000 claims description 6
- 208000023105 Huntington disease Diseases 0.000 claims description 6
- 208000008589 Obesity Diseases 0.000 claims description 6
- 208000006011 Stroke Diseases 0.000 claims description 6
- 208000035475 disorder Diseases 0.000 claims description 6
- 125000000623 heterocyclic group Chemical group 0.000 claims description 6
- 230000004968 inflammatory condition Effects 0.000 claims description 6
- 235000020824 obesity Nutrition 0.000 claims description 6
- 230000008569 process Effects 0.000 claims description 6
- 210000003491 skin Anatomy 0.000 claims description 6
- 208000011580 syndromic disease Diseases 0.000 claims description 6
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 claims description 6
- SNICXCGAKADSCV-JTQLQIEISA-N (-)-Nicotine Chemical compound CN1CCC[C@H]1C1=CC=CN=C1 SNICXCGAKADSCV-JTQLQIEISA-N 0.000 claims description 5
- 206010003571 Astrocytoma Diseases 0.000 claims description 5
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 5
- 206010006187 Breast cancer Diseases 0.000 claims description 5
- 208000026310 Breast neoplasm Diseases 0.000 claims description 5
- 201000009030 Carcinoma Diseases 0.000 claims description 5
- 208000031229 Cardiomyopathies Diseases 0.000 claims description 5
- 208000006561 Cluster Headache Diseases 0.000 claims description 5
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 5
- 208000011231 Crohn disease Diseases 0.000 claims description 5
- 208000007342 Diabetic Nephropathies Diseases 0.000 claims description 5
- 208000032131 Diabetic Neuropathies Diseases 0.000 claims description 5
- 206010017943 Gastrointestinal conditions Diseases 0.000 claims description 5
- 208000010412 Glaucoma Diseases 0.000 claims description 5
- 201000005569 Gout Diseases 0.000 claims description 5
- 208000027109 Headache disease Diseases 0.000 claims description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 5
- 206010021138 Hypovolaemic shock Diseases 0.000 claims description 5
- LPHGQDQBBGAPDZ-UHFFFAOYSA-N Isocaffeine Natural products CN1C(=O)N(C)C(=O)C2=C1N(C)C=N2 LPHGQDQBBGAPDZ-UHFFFAOYSA-N 0.000 claims description 5
- 206010025323 Lymphomas Diseases 0.000 claims description 5
- 208000019695 Migraine disease Diseases 0.000 claims description 5
- 208000007920 Neurogenic Inflammation Diseases 0.000 claims description 5
- 208000021384 Obsessive-Compulsive disease Diseases 0.000 claims description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 5
- 206010033664 Panic attack Diseases 0.000 claims description 5
- 208000018737 Parkinson disease Diseases 0.000 claims description 5
- 206010034912 Phobia Diseases 0.000 claims description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 5
- 201000004681 Psoriasis Diseases 0.000 claims description 5
- 206010063837 Reperfusion injury Diseases 0.000 claims description 5
- 206010039491 Sarcoma Diseases 0.000 claims description 5
- 208000019568 Shared Paranoid disease Diseases 0.000 claims description 5
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 5
- 206010041250 Social phobia Diseases 0.000 claims description 5
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 5
- 208000031674 Traumatic Acute Stress disease Diseases 0.000 claims description 5
- 206010044541 Traumatic shock Diseases 0.000 claims description 5
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 5
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 5
- 230000002917 arthritic effect Effects 0.000 claims description 5
- 210000004556 brain Anatomy 0.000 claims description 5
- 229960001948 caffeine Drugs 0.000 claims description 5
- VJEONQKOZGKCAK-UHFFFAOYSA-N caffeine Natural products CN1C(=O)N(C)C(=O)C2=C1C=CN2C VJEONQKOZGKCAK-UHFFFAOYSA-N 0.000 claims description 5
- 208000018912 cluster headache syndrome Diseases 0.000 claims description 5
- 125000004122 cyclic group Chemical group 0.000 claims description 5
- 230000001419 dependent effect Effects 0.000 claims description 5
- 208000033679 diabetic kidney disease Diseases 0.000 claims description 5
- 206010015037 epilepsy Diseases 0.000 claims description 5
- 208000005017 glioblastoma Diseases 0.000 claims description 5
- 229910052736 halogen Inorganic materials 0.000 claims description 5
- 150000002367 halogens Chemical class 0.000 claims description 5
- 230000000147 hypnotic effect Effects 0.000 claims description 5
- 208000014674 injury Diseases 0.000 claims description 5
- 208000002551 irritable bowel syndrome Diseases 0.000 claims description 5
- 230000003902 lesion Effects 0.000 claims description 5
- 210000004185 liver Anatomy 0.000 claims description 5
- 208000014018 liver neoplasm Diseases 0.000 claims description 5
- 210000004072 lung Anatomy 0.000 claims description 5
- 208000020816 lung neoplasm Diseases 0.000 claims description 5
- 208000002780 macular degeneration Diseases 0.000 claims description 5
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 201000001441 melanoma Diseases 0.000 claims description 5
- 206010027599 migraine Diseases 0.000 claims description 5
- 201000006417 multiple sclerosis Diseases 0.000 claims description 5
- 230000004770 neurodegeneration Effects 0.000 claims description 5
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 5
- 229960002715 nicotine Drugs 0.000 claims description 5
- SNICXCGAKADSCV-UHFFFAOYSA-N nicotine Natural products CN1CCCC1C1=CC=CN=C1 SNICXCGAKADSCV-UHFFFAOYSA-N 0.000 claims description 5
- 230000002611 ovarian Effects 0.000 claims description 5
- 230000001575 pathological effect Effects 0.000 claims description 5
- 208000028173 post-traumatic stress disease Diseases 0.000 claims description 5
- 210000002307 prostate Anatomy 0.000 claims description 5
- 201000000980 schizophrenia Diseases 0.000 claims description 5
- 239000000932 sedative agent Substances 0.000 claims description 5
- 201000001716 specific phobia Diseases 0.000 claims description 5
- 208000020431 spinal cord injury Diseases 0.000 claims description 5
- 231100000736 substance abuse Toxicity 0.000 claims description 5
- 230000008733 trauma Effects 0.000 claims description 5
- 230000000472 traumatic effect Effects 0.000 claims description 5
- 230000008673 vomiting Effects 0.000 claims description 5
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 claims description 4
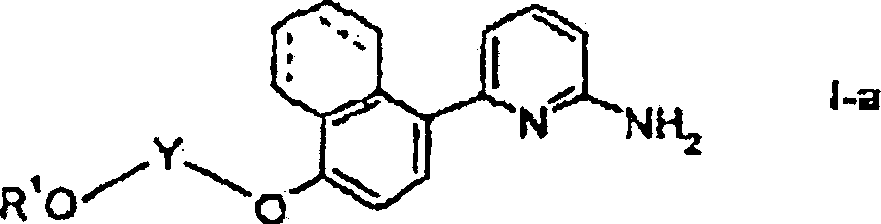
- IPUVRFPZHWJTAO-UHFFFAOYSA-N 2-[[4-(6-aminopyridin-2-yl)-5,6,7,8-tetrahydronaphthalen-1-yl]oxy]ethanol Chemical compound NC1=CC=CC(C=2C=3CCCCC=3C(OCCO)=CC=2)=N1 IPUVRFPZHWJTAO-UHFFFAOYSA-N 0.000 claims description 4
- NNJIGFPJIYAXRU-UHFFFAOYSA-N 6-[4-[2-[2-(dimethylamino)ethoxy]ethoxy]naphthalen-1-yl]pyridin-2-amine Chemical compound C12=CC=CC=C2C(OCCOCCN(C)C)=CC=C1C1=CC=CC(N)=N1 NNJIGFPJIYAXRU-UHFFFAOYSA-N 0.000 claims description 4
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical group C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 claims description 4
- 208000006673 asthma Diseases 0.000 claims description 4
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 claims description 4
- 125000002619 bicyclic group Chemical group 0.000 claims description 4
- 125000004432 carbon atom Chemical group C* 0.000 claims description 4
- 230000003400 hallucinatory effect Effects 0.000 claims description 4
- 125000005842 heteroatom Chemical group 0.000 claims description 4
- 125000006413 ring segment Chemical group 0.000 claims description 4
- 206010040560 shock Diseases 0.000 claims description 4
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 claims description 3
- CECKGACESOTEKY-UHFFFAOYSA-N 1-[[4-(6-aminopyridin-2-yl)naphthalen-1-yl]oxymethyl]cyclohexan-1-ol Chemical compound NC1=CC=CC(C=2C3=CC=CC=C3C(OCC3(O)CCCCC3)=CC=2)=N1 CECKGACESOTEKY-UHFFFAOYSA-N 0.000 claims description 3
- NZTDSIIUEQBCPL-UHFFFAOYSA-N 6-[4-[2-[2-(diethylamino)ethoxy]ethoxy]naphthalen-1-yl]pyridin-2-amine Chemical compound C12=CC=CC=C2C(OCCOCCN(CC)CC)=CC=C1C1=CC=CC(N)=N1 NZTDSIIUEQBCPL-UHFFFAOYSA-N 0.000 claims description 3
- 206010049119 Emotional distress Diseases 0.000 claims description 3
- 208000022559 Inflammatory bowel disease Diseases 0.000 claims description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 3
- 206010033128 Ovarian cancer Diseases 0.000 claims description 3
- 206010060862 Prostate cancer Diseases 0.000 claims description 3
- 208000001407 Vascular Headaches Diseases 0.000 claims description 3
- 206010047700 Vomiting Diseases 0.000 claims description 3
- 208000028505 alcohol-related disease Diseases 0.000 claims description 3
- 210000000038 chest Anatomy 0.000 claims description 3
- 230000001149 cognitive effect Effects 0.000 claims description 3
- 206010017758 gastric cancer Diseases 0.000 claims description 3
- 239000000380 hallucinogen Substances 0.000 claims description 3
- 150000002431 hydrogen Chemical class 0.000 claims description 3
- 201000007270 liver cancer Diseases 0.000 claims description 3
- 201000005202 lung cancer Diseases 0.000 claims description 3
- 230000003340 mental effect Effects 0.000 claims description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 3
- 208000023504 respiratory system disease Diseases 0.000 claims description 3
- 229940125723 sedative agent Drugs 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 201000011549 stomach cancer Diseases 0.000 claims description 3
- 125000006273 (C1-C3) alkyl group Chemical group 0.000 claims description 2
- 125000006274 (C1-C3)alkoxy group Chemical group 0.000 claims description 2
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 claims description 2
- ZYELRISNEGLXPG-UHFFFAOYSA-N 2-[2-[2-[4-(6-aminopyridin-2-yl)naphthalen-1-yl]oxyethoxy]ethyl]-3-azabicyclo[3.1.0]hexan-6-amine Chemical compound C12C(N)C2CNC1CCOCCOC(C1=CC=CC=C11)=CC=C1C1=CC=CC(N)=N1 ZYELRISNEGLXPG-UHFFFAOYSA-N 0.000 claims description 2
- MLQXZNAIYKZANY-UHFFFAOYSA-N 6-[4-[2-(2-piperidin-1-ylethoxy)ethoxy]naphthalen-1-yl]pyridin-2-amine Chemical compound NC1=CC=CC(C=2C3=CC=CC=C3C(OCCOCCN3CCCCC3)=CC=2)=N1 MLQXZNAIYKZANY-UHFFFAOYSA-N 0.000 claims description 2
- OODXSZJAZAINKZ-UHFFFAOYSA-N 6-[4-[2-[2-(4-methylpiperazin-1-yl)ethoxy]ethoxy]naphthalen-1-yl]pyridin-2-amine Chemical compound C1CN(C)CCN1CCOCCOC(C1=CC=CC=C11)=CC=C1C1=CC=CC(N)=N1 OODXSZJAZAINKZ-UHFFFAOYSA-N 0.000 claims description 2
- 206010047112 Vasculitides Diseases 0.000 claims description 2
- 206010047115 Vasculitis Diseases 0.000 claims description 2
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 2
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 2
- 230000002956 necrotizing effect Effects 0.000 claims description 2
- 125000006678 phenoxycarbonyl group Chemical group 0.000 claims description 2
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 2
- 208000005016 Intestinal Neoplasms Diseases 0.000 claims 4
- 230000000968 intestinal effect Effects 0.000 claims 4
- 208000032839 leukemia Diseases 0.000 claims 4
- 206010047124 Vasculitis necrotising Diseases 0.000 claims 3
- 206010019233 Headaches Diseases 0.000 claims 2
- 206010039897 Sedation Diseases 0.000 claims 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims 2
- 231100000869 headache Toxicity 0.000 claims 2
- 239000003326 hypnotic agent Substances 0.000 claims 2
- 201000002313 intestinal cancer Diseases 0.000 claims 2
- 208000028774 intestinal disease Diseases 0.000 claims 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims 2
- 229940005483 opioid analgesics Drugs 0.000 claims 2
- 125000004193 piperazinyl group Chemical group 0.000 claims 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims 2
- 210000002345 respiratory system Anatomy 0.000 claims 2
- 230000036280 sedation Effects 0.000 claims 2
- 230000002792 vascular Effects 0.000 claims 2
- 210000004916 vomit Anatomy 0.000 claims 2
- 125000006569 (C5-C6) heterocyclic group Chemical group 0.000 claims 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims 1
- 229910052717 sulfur Inorganic materials 0.000 claims 1
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 61
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 45
- 238000006243 chemical reaction Methods 0.000 description 28
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 27
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 24
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 22
- 239000000243 solution Substances 0.000 description 21
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 20
- 230000035987 intoxication Effects 0.000 description 19
- 231100000566 intoxication Toxicity 0.000 description 19
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 18
- 238000005160 1H NMR spectroscopy Methods 0.000 description 17
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 16
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 15
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 14
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 14
- 238000010992 reflux Methods 0.000 description 14
- 229910052938 sodium sulfate Inorganic materials 0.000 description 14
- 235000011152 sodium sulphate Nutrition 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 12
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 12
- 239000003921 oil Substances 0.000 description 12
- 235000019198 oils Nutrition 0.000 description 12
- 239000002253 acid Substances 0.000 description 11
- 239000012074 organic phase Substances 0.000 description 10
- 230000002085 persistent effect Effects 0.000 description 10
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 10
- 108010076864 Nitric Oxide Synthase Type II Proteins 0.000 description 9
- 102100029438 Nitric oxide synthase, inducible Human genes 0.000 description 9
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 9
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 8
- 102100022397 Nitric oxide synthase, brain Human genes 0.000 description 8
- 101710111444 Nitric oxide synthase, brain Proteins 0.000 description 8
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 8
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 239000012267 brine Substances 0.000 description 7
- 230000036651 mood Effects 0.000 description 7
- 239000000741 silica gel Substances 0.000 description 7
- 229910002027 silica gel Inorganic materials 0.000 description 7
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- 201000001880 Sexual dysfunction Diseases 0.000 description 6
- 238000001704 evaporation Methods 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 238000002844 melting Methods 0.000 description 6
- 231100000872 sexual dysfunction Toxicity 0.000 description 6
- 239000002585 base Substances 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 230000008018 melting Effects 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 4
- 208000019022 Mood disease Diseases 0.000 description 4
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 4
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- 125000005605 benzo group Chemical group 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 238000001035 drying Methods 0.000 description 4
- 239000003480 eluent Substances 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 229910000029 sodium carbonate Inorganic materials 0.000 description 4
- 239000012312 sodium hydride Substances 0.000 description 4
- 229910000104 sodium hydride Inorganic materials 0.000 description 4
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 3
- KRRMRDUDIDIHRZ-UHFFFAOYSA-N 4-[6-(2,5-dimethyl-1H-pyrrol-3-yl)pyridin-2-yl]-5,6,7,8-tetrahydronaphthalen-1-ol Chemical compound Cc1cc(c(C)[nH]1)-c1cccc(n1)-c1ccc(O)c2CCCCc12 KRRMRDUDIDIHRZ-UHFFFAOYSA-N 0.000 description 3
- JZNNNLBJSWQLSE-UHFFFAOYSA-N 6-[4-[2-[2-(diethylamino)ethoxy]ethoxy]-5,6,7,8-tetrahydronaphthalen-1-yl]pyridin-2-amine Chemical compound C1=2CCCCC=2C(OCCOCCN(CC)CC)=CC=C1C1=CC=CC(N)=N1 JZNNNLBJSWQLSE-UHFFFAOYSA-N 0.000 description 3
- 208000000044 Amnesia Diseases 0.000 description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 3
- 102100028452 Nitric oxide synthase, endothelial Human genes 0.000 description 3
- 101710090055 Nitric oxide synthase, endothelial Proteins 0.000 description 3
- 208000002193 Pain Diseases 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 150000007513 acids Chemical class 0.000 description 3
- 230000001476 alcoholic effect Effects 0.000 description 3
- 230000006986 amnesia Effects 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 239000002674 ointment Substances 0.000 description 3
- 239000000843 powder Substances 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- AJSTXXYNEIHPMD-UHFFFAOYSA-N triethyl borate Chemical compound CCOB(OCC)OCC AJSTXXYNEIHPMD-UHFFFAOYSA-N 0.000 description 3
- IDCGAEJGZLYEAZ-UHFFFAOYSA-N (4-fluoronaphthalen-1-yl)boronic acid Chemical compound C1=CC=C2C(B(O)O)=CC=C(F)C2=C1 IDCGAEJGZLYEAZ-UHFFFAOYSA-N 0.000 description 2
- HTNWPEUXFDDPFM-UHFFFAOYSA-N (4-phenylmethoxynaphthalen-1-yl)boronic acid Chemical compound C12=CC=CC=C2C(B(O)O)=CC=C1OCC1=CC=CC=C1 HTNWPEUXFDDPFM-UHFFFAOYSA-N 0.000 description 2
- VAUJZKBFENPOCH-UHFFFAOYSA-N 1-bromo-4-fluoronaphthalene Chemical compound C1=CC=C2C(F)=CC=C(Br)C2=C1 VAUJZKBFENPOCH-UHFFFAOYSA-N 0.000 description 2
- CWLKTJOTWITYSI-UHFFFAOYSA-N 1-fluoronaphthalene Chemical compound C1=CC=C2C(F)=CC=CC2=C1 CWLKTJOTWITYSI-UHFFFAOYSA-N 0.000 description 2
- PAPNRQCYSFBWDI-UHFFFAOYSA-N 2,5-Dimethyl-1H-pyrrole Chemical compound CC1=CC=C(C)N1 PAPNRQCYSFBWDI-UHFFFAOYSA-N 0.000 description 2
- UQFRAYYPECGRQT-UHFFFAOYSA-N 2-(2,5-dimethyl-1h-pyrrol-3-yl)-6-(4-fluoronaphthalen-1-yl)pyridine Chemical compound N1C(C)=CC(C=2N=C(C=CC=2)C=2C3=CC=CC=C3C(F)=CC=2)=C1C UQFRAYYPECGRQT-UHFFFAOYSA-N 0.000 description 2
- UIBWYKHQMKBAMX-UHFFFAOYSA-N 2-[[4-[6-(2,5-dimethyl-1h-pyrrol-3-yl)pyridin-2-yl]-5,6,7,8-tetrahydronaphthalen-1-yl]oxy]acetic acid Chemical compound N1C(C)=CC(C=2N=C(C=CC=2)C=2C=3CCCCC=3C(OCC(O)=O)=CC=2)=C1C UIBWYKHQMKBAMX-UHFFFAOYSA-N 0.000 description 2
- QKTZDMJWVMETJD-UHFFFAOYSA-N 2-[[4-[6-(2,5-dimethyl-1h-pyrrol-3-yl)pyridin-2-yl]-5,6,7,8-tetrahydronaphthalen-1-yl]oxy]ethanol Chemical compound N1C(C)=CC(C=2N=C(C=CC=2)C=2C=3CCCCC=3C(OCCO)=CC=2)=C1C QKTZDMJWVMETJD-UHFFFAOYSA-N 0.000 description 2
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical group [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 2
- 206010012335 Dependence Diseases 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical group FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 102000000589 Interleukin-1 Human genes 0.000 description 2
- 108010002352 Interleukin-1 Proteins 0.000 description 2
- 102000015696 Interleukins Human genes 0.000 description 2
- 108010063738 Interleukins Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 239000003513 alkali Substances 0.000 description 2
- 150000004703 alkoxides Chemical class 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 2
- VZTDIZULWFCMLS-UHFFFAOYSA-N ammonium formate Chemical compound [NH4+].[O-]C=O VZTDIZULWFCMLS-UHFFFAOYSA-N 0.000 description 2
- 230000003109 amnesic effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 125000005098 aryl alkoxy carbonyl group Chemical group 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000003054 catalyst Substances 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 230000002490 cerebral effect Effects 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Chemical group 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- WQYVRQLZKVEZGA-UHFFFAOYSA-N hypochlorite Chemical compound Cl[O-] WQYVRQLZKVEZGA-UHFFFAOYSA-N 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 235000015110 jellies Nutrition 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N methylene hexane Natural products CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 2
- 229940127240 opiate Drugs 0.000 description 2
- 150000007524 organic acids Chemical group 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000001624 sedative effect Effects 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 238000010254 subcutaneous injection Methods 0.000 description 2
- 239000007929 subcutaneous injection Substances 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 102000003390 tumor necrosis factor Human genes 0.000 description 2
- HDHXRYLXCLLYDC-UHFFFAOYSA-N (4-phenylmethoxy-5,6,7,8-tetrahydronaphthalen-1-yl)boronic acid Chemical compound C1=2CCCCC=2C(B(O)O)=CC=C1OCC1=CC=CC=C1 HDHXRYLXCLLYDC-UHFFFAOYSA-N 0.000 description 1
- BGZGQDDKQNYZID-UHFFFAOYSA-N 1-(hydroxymethyl)cyclohexan-1-ol Chemical compound OCC1(O)CCCCC1 BGZGQDDKQNYZID-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- YFYWODBCYWKFGZ-UHFFFAOYSA-N 2-(2,5-dimethyl-1h-pyrrol-3-yl)-6-(4-phenylmethoxy-5,6,7,8-tetrahydronaphthalen-1-yl)pyridine Chemical compound N1C(C)=CC(C=2N=C(C=CC=2)C=2C=3CCCCC=3C(OCC=3C=CC=CC=3)=CC=2)=C1C YFYWODBCYWKFGZ-UHFFFAOYSA-N 0.000 description 1
- JXZYURNNBYDHOH-UHFFFAOYSA-N 2-(2,5-dimethyl-1h-pyrrol-3-yl)pyridine Chemical compound N1C(C)=CC(C=2N=CC=CC=2)=C1C JXZYURNNBYDHOH-UHFFFAOYSA-N 0.000 description 1
- YIYADLTXOIIHTN-UHFFFAOYSA-N 2-(2-chloroethoxy)-n,n-diethylethanamine Chemical compound CCN(CC)CCOCCCl YIYADLTXOIIHTN-UHFFFAOYSA-N 0.000 description 1
- YSAANLSYLSUVHB-UHFFFAOYSA-N 2-[2-(dimethylamino)ethoxy]ethanol Chemical compound CN(C)CCOCCO YSAANLSYLSUVHB-UHFFFAOYSA-N 0.000 description 1
- 150000003930 2-aminopyridines Chemical class 0.000 description 1
- SQWPRPIVUJCCHY-UHFFFAOYSA-N 2-bromo-6-(2,5-dimethyl-1h-pyrrol-3-yl)pyridine Chemical compound N1C(C)=CC(C=2N=C(Br)C=CC=2)=C1C SQWPRPIVUJCCHY-UHFFFAOYSA-N 0.000 description 1
- RGHQKFQZGLKBCF-UHFFFAOYSA-N 2-bromoethyl acetate Chemical compound CC(=O)OCCBr RGHQKFQZGLKBCF-UHFFFAOYSA-N 0.000 description 1
- 125000000872 2-diethylaminoethoxy group Chemical group [H]C([H])([H])C([H])([H])N(C([H])([H])C([H])([H])[H])C([H])([H])C([H])([H])O* 0.000 description 1
- ALKYHXVLJMQRLQ-UHFFFAOYSA-N 3-Hydroxy-2-naphthoate Chemical compound C1=CC=C2C=C(O)C(C(=O)O)=CC2=C1 ALKYHXVLJMQRLQ-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-M 3-carboxy-2,3-dihydroxypropanoate Chemical compound OC(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-M 0.000 description 1
- 125000002373 5 membered heterocyclic group Chemical group 0.000 description 1
- SCWNNOCLLOHZIG-UHFFFAOYSA-N 5,6,7,8-tetrahydro-1-naphthol Chemical compound C1CCCC2=C1C=CC=C2O SCWNNOCLLOHZIG-UHFFFAOYSA-N 0.000 description 1
- OCKGFTQIICXDQW-ZEQRLZLVSA-N 5-[(1r)-1-hydroxy-2-[4-[(2r)-2-hydroxy-2-(4-methyl-1-oxo-3h-2-benzofuran-5-yl)ethyl]piperazin-1-yl]ethyl]-4-methyl-3h-2-benzofuran-1-one Chemical compound C1=C2C(=O)OCC2=C(C)C([C@@H](O)CN2CCN(CC2)C[C@H](O)C2=CC=C3C(=O)OCC3=C2C)=C1 OCKGFTQIICXDQW-ZEQRLZLVSA-N 0.000 description 1
- BDOZSLZFRCKANW-UHFFFAOYSA-N 5-bromo-8-phenylmethoxy-1,2,3,4-tetrahydronaphthalene Chemical compound C1=2CCCCC=2C(Br)=CC=C1OCC1=CC=CC=C1 BDOZSLZFRCKANW-UHFFFAOYSA-N 0.000 description 1
- 125000004070 6 membered heterocyclic group Chemical group 0.000 description 1
- UKTVQPGOLXAMQI-UHFFFAOYSA-N 6-[4-[2-[2-(dipropylamino)ethoxy]ethoxy]naphthalen-1-yl]pyridin-2-amine Chemical compound C12=CC=CC=C2C(OCCOCCN(CCC)CCC)=CC=C1C1=CC=CC(N)=N1 UKTVQPGOLXAMQI-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 201000006474 Brain Ischemia Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- 206010008120 Cerebral ischaemia Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- DSLZVSRJTYRBFB-LLEIAEIESA-N D-glucaric acid Chemical compound OC(=O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O DSLZVSRJTYRBFB-LLEIAEIESA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 235000019739 Dicalciumphosphate Nutrition 0.000 description 1
- 206010013980 Dyssomnias Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 208000009386 Experimental Arthritis Diseases 0.000 description 1
- 208000033962 Fontaine progeroid syndrome Diseases 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000001828 Gelatine Substances 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010072579 Granulomatosis with polyangiitis Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 208000001953 Hypotension Diseases 0.000 description 1
- 206010061216 Infarction Diseases 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 240000003183 Manihot esculenta Species 0.000 description 1
- 235000016735 Manihot esculenta subsp esculenta Nutrition 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- FIWILGQIZHDAQG-UHFFFAOYSA-N NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F Chemical compound NC1=C(C(=O)NCC2=CC=C(C=C2)OCC(F)(F)F)C=C(C(=N1)N)N1N=C(N=C1)C1(CC1)C(F)(F)F FIWILGQIZHDAQG-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 208000006199 Parasomnias Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 206010036030 Polyarthritis Diseases 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 206010040007 Sense of oppression Diseases 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 206010044248 Toxic shock syndrome Diseases 0.000 description 1
- 231100000650 Toxic shock syndrome Toxicity 0.000 description 1
- 201000004810 Vascular dementia Diseases 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 238000010306 acid treatment Methods 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 208000026345 acute stress disease Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910001854 alkali hydroxide Inorganic materials 0.000 description 1
- 229910001860 alkaline earth metal hydroxide Inorganic materials 0.000 description 1
- 125000004702 alkoxy alkyl carbonyl group Chemical group 0.000 description 1
- 230000029936 alkylation Effects 0.000 description 1
- 238000005804 alkylation reaction Methods 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 230000000949 anxiolytic effect Effects 0.000 description 1
- 239000012736 aqueous medium Substances 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 150000007514 bases Chemical class 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000000051 benzyloxy group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])O* 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- MCQRPQCQMGVWIQ-UHFFFAOYSA-N boron;methylsulfanylmethane Chemical compound [B].CSC MCQRPQCQMGVWIQ-UHFFFAOYSA-N 0.000 description 1
- 150000001642 boronic acid derivatives Chemical class 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 229960003563 calcium carbonate Drugs 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 238000010531 catalytic reduction reaction Methods 0.000 description 1
- 206010007776 catatonia Diseases 0.000 description 1
- 206010008118 cerebral infarction Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 229960002173 citrulline Drugs 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 235000009508 confectionery Nutrition 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- NEFBYIFKOOEVPA-UHFFFAOYSA-K dicalcium phosphate Chemical compound [Ca+2].[Ca+2].[O-]P([O-])([O-])=O NEFBYIFKOOEVPA-UHFFFAOYSA-K 0.000 description 1
- 229940038472 dicalcium phosphate Drugs 0.000 description 1
- 229910000390 dicalcium phosphate Inorganic materials 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 208000001848 dysentery Diseases 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- JPZJHQBJKIIOPP-UHFFFAOYSA-N ethyl 2-[[4-[6-(2,5-dimethyl-1h-pyrrol-3-yl)pyridin-2-yl]-5,6,7,8-tetrahydronaphthalen-1-yl]oxy]acetate Chemical compound C1=2CCCCC=2C(OCC(=O)OCC)=CC=C1C(N=1)=CC=CC=1C=1C=C(C)NC=1C JPZJHQBJKIIOPP-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 238000005469 granulation Methods 0.000 description 1
- 230000003179 granulation Effects 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 210000000548 hind-foot Anatomy 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000007574 infarction Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 230000000302 ischemic effect Effects 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 208000012866 low blood pressure Diseases 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910052987 metal hydride Inorganic materials 0.000 description 1
- 150000004681 metal hydrides Chemical class 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- ZEOQPNRYUCROGZ-UHFFFAOYSA-N n,n-dibutylbutan-1-amine;hydrobromide Chemical compound [Br-].CCCC[NH+](CCCC)CCCC ZEOQPNRYUCROGZ-UHFFFAOYSA-N 0.000 description 1
- 210000002569 neuron Anatomy 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Chemical group 0.000 description 1
- 239000002798 polar solvent Substances 0.000 description 1
- 201000006292 polyarteritis nodosa Diseases 0.000 description 1
- 208000030428 polyarticular arthritis Diseases 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 206010040400 serum sickness Diseases 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000035939 shock Effects 0.000 description 1
- 150000004760 silicates Chemical class 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M sodium chloride Inorganic materials [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 229960001790 sodium citrate Drugs 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 238000000638 solvent extraction Methods 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 201000006152 substance dependence Diseases 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 description 1
- SFLXUZPXEWWQNH-UHFFFAOYSA-K tetrabutylazanium;tribromide Chemical compound [Br-].[Br-].[Br-].CCCC[N+](CCCC)(CCCC)CCCC.CCCC[N+](CCCC)(CCCC)CCCC.CCCC[N+](CCCC)(CCCC)CCCC SFLXUZPXEWWQNH-UHFFFAOYSA-K 0.000 description 1
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 230000002537 thrombolytic effect Effects 0.000 description 1
- 238000003354 tissue distribution assay Methods 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 238000001665 trituration Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/73—Unsubstituted amino or imino radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/06—Antigout agents, e.g. antihyperuricemic or uricosuric agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/06—Antimigraine agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/34—Tobacco-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/04—Inotropic agents, i.e. stimulants of cardiac contraction; Drugs for heart failure
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Psychiatry (AREA)
- Addiction (AREA)
- Pain & Pain Management (AREA)
- Diabetes (AREA)
- Cardiology (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Physical Education & Sports Medicine (AREA)
- Pulmonology (AREA)
- Hospice & Palliative Care (AREA)
- Ophthalmology & Optometry (AREA)
- Heart & Thoracic Surgery (AREA)
- Dermatology (AREA)
- Oncology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Urology & Nephrology (AREA)
- Obesity (AREA)
- Otolaryngology (AREA)
- Communicable Diseases (AREA)
- Psychology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
Description
- Die vorliegende Erfindung betrifft bestimmte 2-Aminopyridine, die kondensierte Ringsubstituenten aufweisen, die eine Aktivität als Stickoxidsynthase-(NOS)-Inhibitoren haben, pharmazeutische Zusammensetzungen, die sie enthalten, und ihre Verwendung zur Behandlung und Verhütung von Leiden des zentralen Nervensystems, entzündlichen Leiden, septischem Schock, Fettsucht und anderen Krankheiten, Leiden und Zuständen.
- Es gibt drei bekannte Isoformen von NOS: Eine induzierbare Form (I-NOS) und zwei konstitutive Formen, die als neuronale NOS (N-NOS) und endotheliale NOS (E-NOS) bezeichnet werden. Jedes dieser Enzyme führt die Umwandlung von Arginin in Citrullin durch, wobei ein Molekül Stickoxid (NO) als Reaktion auf verschiedene Reize erzeugt wird. Es wird angenommen, dass überschüssige Stickoxid-(NO)-Produktion durch NOS eine Rolle bei der Pathologie einer Anzahl von Leiden und Zuständen bei Säugetieren spielt. Es wird z. B. angenommen, dass NO, das durch I-NOS erzeugt wurde, eine Rolle spielt bei Krankheiten, die systemischen niedrigen Blutdruck beinhalten, wie toxischer Schock, und bei Therapien mit bestimmten Cytokinen. Es wurde gezeigt, dass Krebspatienten, die mit Cytokinen, wie Interleukin-1 (IL-1), Interleukin (IL-2) oder Tumornekrosefaktor (TNF) behandelt wurden, unter durch Cytokin induziertem Schock und niedrigem Blutdruck leiden aufgrund von NO, das von Makrophagen erzeugt wurde, d. h. induzierbarem NOS (I-NOS) (siehe Chemical & Engineering News, December 20, Seite 33, (1993)). I-NOS-Inhibitoren können dies umkehren. Es wird auch angenommen, dass I-NOS eine Rolle spielt bei der Pathologie von Krankheiten des zentralen Nervensystems, wie Ischämie. Es wurde z. B. gezeigt, dass die Hemmung von I-NOS cerebrale ischämische Schädigungen bei Ratten verbessert (siehe Am. J. Physiol., 268, Seite R286 (1995)). Die Unterdrückung von durch Adjuvans induzierter Arthritis durch selektive Inhibition von I-NO5 wird berichtet in Eur. J. Pharmacol., 273, Seiten 15–24 (1995).
- Es wird angenommen, dass durch N-NOS produziertes NO eine Rolle spielt bei Krankheiten, wie cerebraler Ischämie, Schmerzen und Opiattoleranz. Die Hemmung von N-NOS vermindert z. B. das Infarktvolumen nach Verschluss der proximalen mittleren cerebralen Arterie bei der Ratte (siehe J. Cerebr. Blood Flow Metab., 14, Seiten 924–929 (1994)). Es wurde gezeigt, dass die N-NOS-Hemmung wirksam ist bei der Schmerzbekämpfung, was gezeigt wird durch Aktivität in der späten Phase bei durch Formalin induziertem Lecken der hinteren Pfote und Tests der durch Essigsäure induzierten abdominalen Verengung (siehe Br. J. Pharmacol., 110, Seiten 219–224 (1993)). Außerdem induziert eine subcutane Injektion von Freund's Adjuvans in die Ratte einen Anstieg von NOS-positiven Neuronen im Rückenmark, was sich manifestiert durch erhöhte Schmerzempfindlichkeit, die mit NOS-Inhibitoren behandelt werden kann (siehe Japanese Journal of Pharmacology, 75, Seiten 327 bis 335 (1997)). Schließlich wurde berichtet, dass Opioidentzug bei Nagetieren durch N-NOS-Hemmung reduziert wurde (siehe Neuropsychopharmacol., 13, Seiten 269–293 (1995).
- Zusammenfassung der Erfindung
- Die Erfindung betrifft Verbindungen der Formel I
oder pharmazeutisch annehmbare Salze davon worin
A und B zusammen einen Ring fusioniert an den Phenylring bilden, wobei der Ring gesättigt oder ungesättigt ist und 5 bis 7 Ringatome enthält, wobei die Ringatome gegebenenfalls 1 bis 2 Heteroatome aufweisen können, die unabhängig ausgewählt sind aus der Gruppe bestehend aus N, O oder s, mit dem Vorbehalt, dass nicht zwei benachbarte Ringglieder Heteroatome sind;
X Sauerstoff oder eine Einfachbindung ist;
Y (C1-C6)-Alkyl ist;
R1 Wasserstoff, eine (C1-C8)-Alkylgruppe oder eine mit -NR2R3 substituierte (C1-C8)-Alkylgruppe ist,
wobei R2 und R3 entweder unabhängig ausgewählt sind aus der Gruppe bestehend aus H, Alkyl, Aryl, Aralkyl oder Tetrahydronaphthalin, wobei die Arylgruppe oder der Arylanteil der Aralkylgruppe Phenyl oder Naphthyl ist, die Alkylgruppe oder der Alkylanteil der Aralkylgruppe 1 bis 6 Kohlenstoffatome enthält und geradkettig oder verzweigt ist und die Arylgruppe, das Tetrahydronaphthalin oder der Arylanteil der Aralkylgruppe gegebenenfalls substituiert ist mit 1 bis 3 Substituenten ausgewählt aus Halogen-, Nitro-, Cyano-, Amino-, (C1-C4)-Alkoxy- und (C1-C4)-Alkylaminoresten oder
R2 und R3 zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen heterocyclischen Ring oder einen cyclischen oder bicyclischen Ring, der gesättigt oder ungesättigt ist, bilden. - Bevorzugt ist der aus R2, R3 und dem Stickstoff, an den diese gebunden sind, gebildete heterocyclische Ring ein Piperidin-, Azetidin-, Piperazin- oder Pyrrolidinring, der gegebenenfalls mit einem oder mehreren Substituenten substituiert ist, die unabhängig ausgewählt sind aus der Gruppe bestehend aus (C1- C6)-Alkyl, Amino, (C1-C6)-Alkylamino, [Di-(C1-C6)-alkyl]amino, phenylsubstituierten 5- und 6-gliedrigen heterocyclischen Ringen, die 1 bis 4 Stickstoffatome enthalten, Benzoyl, Benzoylmethyl, Benzylcarbonyl, Phenylaminocarbonyl, Phenylethyl und Phenoxycarbonyl. Bevorzugt ist der Piperidin-, Azetidin-, Piperazin- oder Pyrrolidinring mit 1 bis 2 Substituenten substituiert. Außerdem ist die Phenyleinheit jedes der vorhergehenden phenylhaltigen Substituenten selbst gegebenenfalls mit einem oder mehreren Substituenten substituiert, die unabhängig ausgewählt sind aus Halogen, (C1-C3)-Alkyl, (C1-C3)- Alkoxy, Nitro, Amino, Cyano, CF3 und OCF3; bevorzugt mit 1 bis 2 Substituenten.
- Bevorzugt ist der cyclische oder bicyclische Ring, der aus R2, R3 und dem Stickstoff, an den sie gebunden sind, gebildet wird, ein 6-Amino-3-azabicyclo[3.1.0]hex-3-ylring mit der Formel
worin R4 und R5 jeweils unabhängig ausgewählt sind aus der Gruppe bestehend aus H, (C1-C6)-Alkyl, Phenyl, Naphthyl, (C1-C6)-Alkyl-C(=O)-, HC(=O)-, (C1-C6)-Alkoxy-(C=O)-, Phenyl-C(=O)-, Naphthyl-C(=O)- und R6R7NC(=O)-, R6 und R7 jeweils unabhängig Wasserstoff oder (C1-C6)-Alkyl sind. - Die vorliegende Erfindung betrifft auch bevorzugte Verbindungen der Formel I-a:
worin die durchbrochene Linie eine fakultative Doppelbindung bedeutet;
Y (C1-C6)-Alkyl ist und
R1 Wasserstoff, (C1-C6) -Alkyl oder eine (C1-C6) -Alkylgruppe ist, die mit -NR2R3 substituiert ist, wobei R2 und R3 wie oben definiert sind. - Einige bevorzugte Verbindungen der Formel I schließen ein:
1-[4-(6-Aminopyridin-2-yl)naphthalin-1-yloxymethyl]cyclohexanol;
6-[4-(2-(2-Dimethylaminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin;
6-[4-(2-Hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin und
6-[4-(2-(2-Diethylaminoethoxy)ethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin. - Zusätzliche Verbindungen der Formel I schließen ein:
6-[4-(2-(2-Diethylaminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin;
6-[4-(2-(2-Dipropylaminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin; 6-[4-(2-(2-(N-Methyl,N-benzyl)aminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin;
6-[4-(2-(2-(1-Piperidinyl)ethoxy)ethoxy)naphthalin-l-yl]pyridin-2-ylamin und
6-[4-(2-(2-(N-Methylpiperazin-4-yl)ethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin;
6-[4-(2-(2-(6-Amino-3-azabicyclo[3.1.0]hex-2-yl)ethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin. - Bereitgestellt wird auch eine pharmazeutische Zusammensetzung, die einen pharmazeutisch annehmbaren Träger und eine Menge einer Verbindung dieser Erfindung enthält, die wirksam ist, um verschiedene Krankheiten, Leiden und Zustände bei Säugetieren, einschließlich Menschen, zu behandeln. Weiterhin wird eine Methode bereitgestellt zur Herstellung eines Arzneimittels, das vorgesehen ist zur Behandlung verschiedener Krankheiten, Leiden und Zustände bei Säugetieren, einschließlich Menschen, wobei diese Methode umfasst, dass den Säugetieren eine Menge einer Verbindung der Erfindung verabreicht wird, die für diese Behandlung wirksam ist.
- Krankheiten, Leiden und Zustände, für die die Zusammensetzungen und Methoden der Erfindung vorgesehen sind, schließen ohne Beschränkung ein: akute Rückenmarksschädigung; Angstleiden ausgewählt aus der Gruppe bestehend aus Panikattacken, Agoraphobie, Panikleiden mit oder ohne Agoraphobie, Agoraphobie ohne eine Historie von Panikleiden, spezifischer Phobie, Sozialphobie, Zwangsstörungen, posttraumatischer Stresserkrankung und akuter Stresserkrankung; Krebs mit oder ohne Metastasenbildung ausgewählt aus der Gruppe bestehend aus Hirn-, Brust-, Darm-, Lungen-, Leber-, Eierstock-, Prostata-, Haut- und Magenkrebs oder Krebs ausgewählt aus der Gruppe bestehend aus Astrocytoma, Karzinoma, Glioblastoma, Leukämien, Lymphoma, Melanoma und Sarkoma; kognitive Störungen ausgewählt aus der Gruppe bestehend aus amnestischen Störungen (z. B. amnestische Leiden aufgrund eines allgemeinen medizinischen Zustands, durch Substanzen induzierte persistierende amnestische Leiden und nicht in anderer Weise spezifizierte amnestische Leiden), Delirien (z. B. Delirien aufgrund eines allgemeinen medizinischen Zustands, durch Substanz induziertes Delirium und nicht in anderer Weise spezifiziertes Delirium), Demenzen (z. B. Demenz vom Typ Alzheimer, vaskuläre Demenz, Demenz aufgrund eines allgemeinen medizinischen Zustands (z. B. durch AIDS, Parkinson, Kopftrauma und Chorea Huntington induzierte Demenzen), durch Substanz induzierte persistierende Demenz, Demenz aufgrund multipler Ethiologien und nicht in anderer Weise spezifizierte Demenzen) und unspezifischen oder nicht anders spezifizierten kognitiven Leiden; Erbrechen, Epilepsie; gastrointestinale Zustände ausgewählt aus der Gruppe bestehend aus Morbus Crohn, Colon irritabile und Colitis ulcerosa; Glaukom; Kopfschmerzleiden ausgewählt aus der Gruppe bestehend aus Migräne, Cluster-Kopfschmerz und vaskulären Kopfschmerzen; Chorea Huntington; entzündliche Leiden, entweder primär entzündliche oder solche, die als eine Komponente eine entzündliche Phase haben, ausgewählt aus der Gruppe bestehend aus akuter undifferenzierter Erkrankung der Atmungsorgane bei Erwachsenen (ARDS), arthritischen Leiden (z. B. Po lyarthritis und Osteoarthritis), Asthma, dermatologischen Läsionen, Gicht, entzündlicher Darmkrankheit, nekrotisierenden Vaskulitiden (z. B. Polyarteriitis nodosa, Serumkrankheit, Wegener's Granulomatose und Kawasaki-Syndrom (Kadison)), neurogener Entzündung, Psoriasis, Reperfusionsschädigung (z. B. nach Myokardinfarkt, Thrombolyse, septischem Schock, Organtransplantation und Diabetes), Schlaganfall und Ganzkörperentzündungssyndrom; Makuladegeneration; Fettsucht; neurodegenerative Krankheiten ausgewählt aus der Gruppe bestehend aus Alzheimer-Krankheit, ALS, multipler Sklerose und Parkinson-Krankheit; pathologische Zustände ausgewählt aus der Gruppe bestehend aus Kardiomyopathie, diabetischer Neuropathie und diabetischer Nephropathie; psychotische Leiden ausgewählt aus der Gruppe bestehend aus Schizophrenie (z. B. paranoide, hebephrene, katatone, undifferenzierte und residuale), schizophreniformen Leiden, schizoaffektiven Leiden, Wahnvorstellungen, kurzen psychotischen Störungen, geteilten psychotischen Störungen bzw. geteiltem Wahn, psychotischen Leiden auf Grund eines allgemeinen medizinischen Zustands und nicht anders spezifizierten psychotischen Leiden; Schlafstörungen ausgewählt aus der Gruppe bestehend aus primären Schlafstörungen (z. B. Parasomnien und Dyssomnien), Schlafstörungen, die mit einem anderen mentalen Leiden in Zusammenhang stehen (einschließlich Gemüts- und Angstleiden, ohne Einschränkung), Schlafstörungen auf Grund eines allgemeinen medizinischen Zustands und nicht in anderer Weise spezifizierten Schlafstörungen; Schlaganfall; Substanzmissbrauchleiden ausgewählt aus der Gruppe bestehend aus mit Alkohol in Beziehung stehenden Leiden, einschließlich Alkoholgebrauch (z. B. Abhängigkeit und Missbrauch) und durch Alkohol induzierte Leiden (z. B. Intoxikation, Entzug, Intoxikationsdelirium, Entzugsdelirium, persistierende Demenz, persistierende Amnesie, Gemütsleiden, Angst, funktionelle Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte Leiden), mit Amphetamin in Beziehung stehenden Leiden, einschließlich Amphetamingebrauch (z. B. Abhängigkeit und Missbrauch) und durch Amphetamin induzierte (z. B. Intoxikation, Entzug, Intoxikationsdelirium, psychotische, Gemüts-, Angstleiden, funktionelle Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte) Leiden, mit Koffein in Beziehung stehende Leiden, wie Intoxikation, durch Angst induzierte Leiden, durch Schlaf induzierte Leiden und nicht in anderer Weise spezifizierte Leiden, mit Cannabis in Beziehung stehende Leiden, einschließlich Cannabisgebrauch (z. B. Missbrauch und Abhängigkeit) und durch Cannabis induzierte (z. B. Intoxikation, Intoxikationsdelirium, psychotische, Angst- und nicht in anderer Weise spezifizierte) Leiden, mit Kokain in Beziehung stehende Leiden, einschließlich Kokaingebrauch (z. B. Abhängigkeit und Missbrauch) und durch Kokain induzierte (z. B. Intoxikation, Entzug, Intoxikationsdelirium, psychotische, Gemüts-, Angstleiden, funktionelle Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte) Leiden, mit Halluzinogenen in Beziehung stehende Leiden, einschließlich Halluzinogengebrauch (z. B. Abhängigkeit und Missbrauch) und durch Halluzinogen induzierte (z. B. Intoxikation, persistierende Wahrnehmung, Intoxikationsdelirium, psychotische, Gemüts-, Angst- und nicht in anderer Weise spezifizierte) Leiden, mit Inhalationsmittel in Beziehung stehende Leiden, einschließlich Inhalationsmittelgebrauch (z. B. Abhängigkeit und Missbrauch) und durch Inhalationsmittel induzierte (z. B. Intoxikation, Intoxikationsdelirium, persistierende Demenz, psychotische, Gemüts-, Angst- und nicht in anderer Weise spezifizierte) Leiden, mit Nikotin in Beziehung stehende Leiden, wie Abhängigkeit, Entzug und nicht in anderer Weise spezifizierte Leiden, mit Opioid in Beziehung stehende Leiden, einschließlich Opioidgebrauch (z. B. Abhängigkeit und Missbrauch) und durch Opioid induzierte (z. B. Intoxikation, Entzug, Intoxikationsdelirium, psychotische, Gemütsleiden, funktionelle Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte) Leiden, mit Phencyclidin in Beziehung stehende Leiden, einschließlich Phencyclidingebrauch (z. B. Abhängigkeit und Missbrauch) und durch Phencyclidin induzierte (z. B. Intoxikation, Intoxikationsdelirium, psychoti sche, Gemüts-, Angst- und nicht in anderer Weise spezifizierte) Leiden, mit Beruhigungsmitteln hypnotischen Mitteln oder angstlösenden Mitteln in Beziehung stehende Leiden, einschließlich Beruhigungsmittelgebrauch (z. B. Abhängigkeit und Missbrauch) und durch Beruhigungsmittel induzierte (z. B. Intoxikation, Entzug, Intoxikationsdelirium, Entzugsdelirium, persistierende Demenz, persistierende Amnesie, psychotische, Gemüts-, Angstleiden, funktionelle Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte) Leiden, mit Polysubstanzen in Beziehung stehende Leiden, andere Substanzabhängigkeits- und Missbrauchsleiden und andere durch Substanzen induzierte Leiden (z. B. Intoxikation, Entzug, Delirium, persistierende Demenz, persistierende Amnesie, psychotische, Gemüts-, Angstleiden, funktioneller Sexualstörung, Schlaf- und nicht in anderer Weise spezifizierte) Leiden, toxämische Zustände ausgewählt aus der Gruppe bestehend aus ARDS, hypovolämischem Schock, Neurontoxizität, septischem Schock und traumatischem Schock, traumatischen Zuständen einschließlich Kopftrauma und Brusttrauma und verschiedenen zusätzlichen Krankheiten, Leiden und Zuständen.
- Außerdem wird hier eine pharmazeutische Zusammensetzung bereitgestellt mit einem pharmazeutisch annehmbaren Träger und einer Menge einer erfindungsgemäßen Verbindung, die wirksam ist, um die Aktivität einer Stickoxidsynthase (NOS) in einem Säugetier, einschließlich einem Menschen, zu hemmen. Weiterhin wird ein Verfahren zur Verfügung gestellt, um die Aktivität von NOS bei einem Säugetier, einschließlich einem Menschen, zu hemmen, das umfasst, dass dem Säugetier eine Menge einer Verbindung der Erfindung verabreicht wird, die wirksam ist, um die Aktivität von NOS zu hemmen.
- Zusätzlich bereitgestellt wird eine pharmazeutische Zusammensetzung zur Behandlung einer Krankheit, eines Leidens oder eines Zustandes, wie oben ausgeführt, bei einem Säugetier, einschließlich einem Menschen; diese Zusammensetzung enthält einen pharmazeutisch annehmbaren Träger und eine Menge einer Verbindung dieser Erfindung, die wirksam ist, um die Aktivität von NOS bei einem Säugetier zu hemmen. Noch zusätzlich wird ein Verfahren bereitgestellt zur Behandlung eines Säugetiers, einschließlich eines Menschen, das von einer Krankheit, einem Leiden oder einem Zustand befallen ist, einschließlich den oben aufgeführten, wobei das Verfahren umfasst, dass dem Säugetier eine Menge einer erfindungsgemäßen Verbindung verabreicht wird, die für diese Behandlung wirksam ist.
- Säuren, die verwendet werden, um pharmazeutisch annehmbare Säureadditionssalze von erfindungsgemäßen Verbindungen aus den entsprechenden Baseverbindungen herzustellen, sind solche Säuren, die nicht toxische Säureadditionssalze bilden (d. h. Salze, die pharmakologisch annehmbare Anionen enthalten, wie Hypochlorid, Hypobromid, Hydroiodid, Nitrat, Sulfat, Bisulfat, Phosphat, saures Phosphat, Acetat, Lactat, Citrat, saures Citrat, Tartrat, Bitartrat, Succinat, Maleat, Fumarat, Gluconat, Saccharat, Benzoat, Methansulfonat, Ethansulfonat, Benzolsulfonat, p-Toluolsulfonat und Pamoat [d. h. 1,1-Methylenbis-(2-hydroxy-3-naphthoat)].
- Verbindungen der Formel I können chirale Zentren enthalten und können daher in verschiedenen enantiomeren und diastereomeren Formen vorliegen; die Erfindung ist auch auf all diese optischen Isomeren und stereoisomeren Verbindungen der Formel I gerichtet ebenso wie auf Mischungen davon und auf alle pharmazeutischen Zusammensetzungen und Methoden zur Behandlung, die diese enthalten oder anwenden.
- Die Erfindung ist auch auf mit Isotopen markierte Verbindungen gerichtet, die identisch mit den für Formel I angegebenen sind, außer der Tatsache, dass ein oder mehrere Atome darin durch ein Atom ersetzt sind mit einer Atommasse oder Massenzahl, die sich von der gewöhnlich in der Natur gefundenen Atommasse oder Massenzahl unterscheidet. Beispiele für Isotopen, die in Verbindungen der Erfindung eingebaut werden können, schließen Isotopen von Wasserstoff, Kohlenstoff, Stickstoff, Sauerstoff, Phosphor, Fluor und Chlor ein, wie 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F bzw. 36Cl.
- Verbindungen der Formel I, Prodrugs davon und pharmazeutisch annehmbare Salze dieser Verbindungen oder dieser Prodrugs, die die vorher erwähnten Isotope und/oder andere Isotope von anderen Atomen enthalten, liegen im Schutzbereich der Erfindung. Bestimmte mit Isotopen markierte Verbindungen der vorliegenden Erfindung, z. B. solche, in die radioaktive Isotope wie 3H und 14C eingebaut wurden, sind z. B. nützlich in Arzneimittel- und/oder Substratgewebeverteilungsassays. Tritiierte, d. h. 3H, und Kohlenstoff-l4-, d. h. 14C, -Isotope sind besonders bevorzugt wegen der Leichtigkeit der Herstellung und der Nachweisbarkeit. Weiterhin kann die Substitution durch schwerere Isotope, wie Deuterium, d. h. 2H, bestimmte therapeutische Vorteile liefern, die durch die größere metabolische Stabilität entstehen, z. B. eine erhöhte in-vivo-Halbwertszeit oder das Erfordernis einer verminderten Dosierung und diese können somit in einigen Fällen bevorzugt sein.
- Mit Isotopen markierte Verbindungen der Formel I der Erfindung und Prodrugs davon können allgemein hergestellt werden, indem die in den Schemata und/oder in den unten angegebenen Beispielen offenbarten Verfahren durchgeführt werden, indem ein leicht erhältliches mit Isotop markiertes Reagenz ein nicht mit Isotop markiertes Reagenz ersetzt.
- Die folgenden Ausdrücke haben die angegebenen Bedeutungen in der gesamten Anmeldung, wenn nicht anders angegeben:
"Alkyl" bezieht sich auf gesättigte einwertige Kohlenwasserstoffreste mit geradkettigen Anteilen, verzweigten Anteilen und dann, wenn die Anzahl der Kohlenstoffatome größer als 3 ist, cyclischen Anteilen und Kombinationen davon;
"ein oder mehrere Substituenten" bezieht sich auf eine Anzahl von Substituenten, die gleich 1 ist bis zur maximalen Anzahl von Substituenten, die möglich sind auf Basis der Anzahl verfügbarer Bindungsstellen;
"Halogen" bezieht sich auf Chlor, Fluor, Brom und Iod;
"Behandeln" bezieht sich auf und schließt ein das Rückgängigmachen, Lindern, Hemmen des Fortschreitens von oder Verhüten einer Krankheit, eines Leidens oder eines Zustandes oder eines oder mehrerer Symptome davon und "Behandlung" bezieht sich auf den Akt der Behandlung, wie vorher definiert. - Detaillierte Beschreibung der Erfindung
- Verbindungen der Formel I können hergestellt werden, wie in den folgenden Reaktionsschemata und der Diskussion beschrieben. Wenn nicht anders angegeben, sind R1, R2, R3, R4, R5, R6 und R7 und die Strukturformel I in den Reaktionsschemata und der Diskussion, die folgt, wie oben definiert.
- Schema I zeigt ein Verfahren zur Herstellung von Verbindungen der Formel I, worin X Sauerstoff ist und A und B einen Tetramethylenring bilden. Schema 2 erläutert ein Verfahren zur Herstellung von Verbindungen der Formel I, worin X Sauerstoff ist und A und B einen Benzoring bilden. Die für die Verfahren. der Schemata 1 und 2 verwendeten Ausgangsmaterialien sind entweder im Handel erhältlich, im Stand der Technik bekannt oder leicht erhältlich aus bekannten Verbindungen mit Methoden, die für den Fachmann auf diesem Gebiet offensichtlich sind.
- Bezug nehmend auf Schema 1 wird die Verbindung der Formel II mit Tetrabutylammoniumtribromid in 1,2-Dichlorethan etwa bei Raumtemperatur umgesetzt. Das Produkt dieser Reaktion wird dann mit Benzylbromid und Kaliumcarbonat in einem Lösungsmittel, wie Acetonitril, etwa bei der Rückflusstemperatur der Reaktionsmischung behandelt, um die Verbindung der Formel III zu bilden.
- Die Verbindung der Formel III wird dann in 1-Benzyloxynaphthalin-4-boronsäure umgewandelt durch das oben beschriebene Verfahren zur Herstellung des Boronsäurederivats der Formel IV in Schema 1. Die Reaktion von 1-Benzyloxynaphthalin-4-boronsäure mit 6-Brom-2-(2,5-dimethylpyrrol)pyridin in einem Ethanollösungsmittel in Gegenwart von Natriumcarbonat und Tetrakistriphenylpalladium etwa bei Rückflusstemperatur der Reaktionsmischung liefert die Verbindung der Formel V, die in die Verbindung der Formel VI umgewandelt werden kann unter Verwendung des folgenden zweistufigen Verfahrens: die Verbindung der Formel V wird mit Ammoniumformiat und 10% Palladium auf Kohlenstoff in einem ethanolischen Lösungsmittel etwa bei Rückflusstemperatur der Reaktionsmischung umgesetzt, was die zu der Verbindung mit der Formel V analoge Verbindung liefert, worin die Benzyloxygruppe der Formel V durch eine Hydroxygruppe ersetzt ist und die Verbindung der Formel VI wird dann gebildet, indem das obige Hydroxyderivat mit 2-Bromethylacetat und Kaliumcarbonat in Acetonitril etwa bei Rückflusstemperatur der Reaktionsmischung umgesetzt wird.
- Die basische Hydrolyse der Verbindung der Formel V gefolgt von der Reduktion mit Lithiumaluminiumhydrid oder Boranmethylsulfid oder anderen geeigneten Metallhydriden in Tetrahydrofuran (THF) oder Ether oder einem geeigneten etherischen Lösungsmittel liefert die gewünschte Verbindung der Formel VI; die basische Hydrolyse wird typischerweise durchgeführt unter Verwendung eines Alkali- oder Erdalkalihydroxids in einer Mischung von THF, Methanol und Wasser etwa bei Raumtemperatur. Die Verbindung der Formel VI kann in die gewünschte Verbindung der Formel I wie folgt umgewandelt werden. Die 2,5-Dimethylpyrrolylschutzgruppe wird durch Reaktion mit Hydroxylaminhydrochlorid entfernt. Diese Reaktion wird allgemein etwa 8 bis etwa 72 Stunden lang in einem alkoholischen oder wässrigen alkoholischen Lösungsmittel durchgeführt bei einer Temperatur etwa von Raumtemperatur bis etwa zur Rückflusstemperatur der Reaktionsmischung, bevorzugt etwa bei Rückflusstemperatur.
- Verbindungen der Formel I, die identisch zu denen der Formel I sind außer der Tatsache, dass der Ring A etwas anderes als ein Benzoring ist, können in analoger Weise hergestellt werden ausgehend von der geeigneten Verbindung, die analog ist der der Formel II, worin der unsubstituierte Benzoring der Formel II durch einen anderen Ring als den Benzoring ersetzt ist, der innerhalb der Definition für Ring A liegt.
- Bezug nehmend auf Schema 2 wird die bekannte 1-Fluornaphthalinverbindung VII mit Brom in Essigsäure bei einer Temperatur von Raumtemperatur bis zur Rückflusstemperatur 1 bis 48 Stunden lang bromiert und das Bromid auf etwa –70°C in trockenem Tetrahydrofuran (THF) gekühlt und dann eine Lösung von n- Butyllithium zugegeben. Die entstehende Lösung wird dann mit Triethylborat versetzt und auf Raumtemperatur erwärmen gelassen, um die Verbindung der Formel VIII zu bilden, die anschließend mit 6-Brom-2-(2,5-dimethylpyrrol)pyridin umgesetzt wird, um die Verbindung der Formel IX zu bilden. Diese Reaktion wird allgemein in einem wässrig-ethanolischen Lösungsmittel durchgeführt in Gegenwart von Natriumcarbonat und Tetrakistriphenylphosphinpalladium etwa bei Rückflusstemperatur.
- Verbindung IX wird dann bei einer Temperatur von Raumtemperatur bis 140°C etwa 1 bis 48 Stunden lang mit einem Alkalialkoxid versetzt, das z. B. aus Natriumhydrid in einem polaren Lösungsmittel, wie Dimethylformamid, hergestellt wurde. Die entstehende Verbindung X wird dann deblockiert, um die 2,5-Dimethylpyrrolylschutzgruppe zu entfernen durch Reaktion mit Hydroxylaminhydrochlorid. Die Reaktion wird allgemein in einem alkoholischen oder wässrig-alkoholischen Lösungsmittel etwa 8 bis etwa 72 Stunden lang bei einer Temperatur von etwa Raumtemperatur bis etwa zur Rückflusstemperatur der Reaktionsmischung, bevorzugt etwa bei der Rückflusstemperatur, durchgeführt.
- Die letzte Stufe in jedem der Schemata I und II zur Herstellung von Verbindungen der Formel I umfasst die Entfernung der Stickstoffschutzgruppe in Form eines 2,5-Dimethylpyrrolylrings. Im Allgemeinen können jedoch Verbindungen der Formel I hergestellt werden durch Entfernung einer Stickstoffschutzgruppe aus einer Verbindung der Formel I'
worin Z1 Wasserstoff ist und Z2 eine Stickstoffschutzgruppe ist oder Z1 und Z2 zusammen eine Stickstoffschutzgruppe bilden. Allgemein verwendete Stickstoffschutzgruppen schließen eine Alkylcarbonylgruppe, wie Formyl, Acetyl, Propionyl etc., eine Alkoxycarbonylgruppe, wie t-Butoxycarbonyl etc., eine Alkoxyalkylcarbonylgruppe, wie Methoxyacetyl, Methoxypropionyl etc., eine substituierte Alkoxycarbonylgruppe, wie Trichlorethoxycarbonyl etc., eine substituierte Alkylcarbonylgruppe, wie Monochlormethylcarbonyl, Monochlorethylcarbonyl, Dichlormethylcarbonyl, Dichlorethylcarbonyl, Trichlormethylcarbonyl, Trichlorethylcarbonyl, Trichlorpropylcarbonyl etc., eine Aralkyloxycarbonylgruppe, wie Benzyloxycarbonyl etc., eine substituierte Aralkyloxycarbonylgruppe, wie p- Nitrobenzyloxycarbonyl etc. ein. Die Entfernung der Stickstoffschutzgruppe kann z. B. durch Säurebehandlung für t-Butoxycarbonyl etc., eine Behandlung mit Zink und einer Säure für Trichlorethoxycarbonyl etc., durch katalytische Reduktion für p-Nitrobenzyloxycarbonyl etc. durchgeführt werden. Die Schutzgruppe kann z. B. in dem Fall, in dem Z1 und Z2 zusammen eine Stickstoffschutzgruppe bilden, eine Ringstruktur aufweisen, wie Pyrrolyl etc., zusätzlich zu anderen dem Fachmann auf diesem Gebiet bekannten. - Die Herstellung anderer Verbindungen der Formel I, die nicht spezifisch in dem vorhergehenden experimentellen Abschnitt beschrieben ist, kann erreicht werden unter Verwendung von Kombinationen der oben beschriebenen Reaktionen, die für den Fachmann auf diesem Gebiet offensichtlich sind. Weiterhin ist bei jeder der oben diskutierten oder erläuterten Reaktionen der Druck nicht kritisch, wenn nicht anders angegeben. Drücke von etwa 0,5 Atmosphären bis etwa 5 Atmosphären sind allgemein annehmbar und Umgebungsdruck, d. h. etwa 1 Atmosphäre, ist der Einfachheit halber bevorzugt.
- Die Verbindungen der Formel I ("die aktiven Verbindungen der Erfindung"), die basisch sind, können eine große Vielzahl verschiedener Salze mit verschiedenen anorganischen und organischen Säuren bilden. Obwohl solche Salze pharmazeutisch annehmbar sein müssen zur Verabreichung an Tiere, ist es in der Praxis oft wünschenswert, anfangs eine Verbindung der Formel I aus der Reaktionsmischung als pharmazeutisch nicht annehmbares Salz zu isolieren, letzteres wieder in die freie basische Verbindung durch Behandlung mit einem alkalischen Reagenz umzuwandeln und anschließend letztere freie Base in ein pharmazeutisch annehmbares Säureadditionssalz umzuwandeln. Die Säureadditionssalze der aktiven Baseverbindungen der Erfindung werden leicht hergestellt, indem die Baseverbindung mit einer im Wesentlichen äquivalenten Menge der ausgewählten Mineralsäure oder organischen Säure in einem wässrigen Lösungsmittelmedium oder in einem geeigneten organischen Lösungsmittel, wie Methanol oder Ethanol, behandelt wird. Bei vorsichtigem Verdampfen des Lösungsmittels wird das gewünschte feste Salz leicht erhalten.
- Die Verbindungen der Erfindung und deren pharmazeutisch annehmbare Salze sind geeignet als NOS-Inhibitoren, d. h. sie besitzen die Fähigkeit, die Aktivität von NOS-Enzymen bei Säugetieren, einschließlich Menschen, zu hemmen und können daher als therapeutische Mittel zur Behandlung verschiedener Krankheiten, Leiden und Zustände bei Säugetieren dienen, die durch überschüssige Pegel von NOS-Aktivität gekennzeichnet sind, einschließlich, ohne Beschränkung, solcher Krankheiten, Leiden und Zustände, die oben aufgeführt sind. Die Fähigkeit der Verbindungen, die NOS-Aktivität zu hemmen, kann bestimmt werden unter Verwendung von Verfahren, die in der Literatur beschrieben werden. Z. B. kann die Fähigkeit von Verbindungen der Formel I, endotheliales NOS zu hemmen, unter Verwendung der von Schmidt et al. in Proc. Natl. Acad. Sci. USA, 88, Seiten 365–369 (1991) und von Pollock et al. in Proc. Natl. Acad. Sci. USA, 88, Seiten 10480–10484 (1991) beschriebenen Verfahren bestimmt werden. Die Fähigkeit von Verbindungen der Formel I, induzierbares NOS zu hemmen, kann unter Verwendung der von Schmidt et al. in Proc. Natl. Acad. Sci. USA, 88, Seiten 365–369 (1991) und von Garvey et al. in J. Biol. Chem., 269, Seiten 26669–26676 (1994) beschriebenen Verfahren bestimmt werden. Die Fähigkeit von Verbindungen der Formel I, neuronales NOS zu hemmen, kann unter Verwendung des von Bredt und Snyder in Proc. Natl. Acad. Sci. USA, 87, 682–685 (1990) beschriebenen Verfahrens bestimmt werden. Der Inhalt dieser Dokumente wird hier durch Bezugnahme miteingeschlossen. Von vier Verbindungen der Formel I, die getestet wurden, wiesen alle eine IC50 < 10 μM für die Hemmung entweder von induzierbarem oder neuronalem NOS auf.
- Die Verbindungen der Erfindung und deren pharmazeutisch annehmbare Salze können über den oralen, parenteralen oder topischen Weg verabreicht werden. Im Allgemeinen werden diese Verbindungen am wünschenswertesten in Dosierungen in einem Bereich von etwa 0, 01 bis etwa 250 mg pro Tag in einer einzelnen oder in verteilten Dosen (d. h. 1 bis 4 Dosen pro Tag) verabreicht, obwohl Variationen notwendigerweise auftreten, abhängig von der Art, dem Gewicht und Zustand des zu behandelnden Patienten und dem jeweilig ausgewählten Verabreichungsweg. Eine Dosierungshöhe, die im Bereich von etwa 0,07 mg bis etwa 21 mg pro kg Körpergewicht pro Tag liegt, wird jedoch am wünschenswertesten angewendet. Variationen können nichtsdestotrotz auftreten, abhängig von dem zu behandelnden Patienten und dessen individuellem Ansprechvermögen auf das Arzneimittel ebenso wie von der Art der ausgewählten pharmazeutischen Formulierung und dem Zeitraum und Intervall, zu dem die Verabreichung durchgeführt wird. In einigen Fällen können Dosierungsbereiche unter der unteren Grenze des oben angeführten Bereichs angemessener sein, während in anderen Fällen noch größere Dosen angewendet werden können, ohne irgendwelche schädlichen Nebenwirkungen zu verursachen, vorausgesetzt, dass solche größeren Dosen zuerst in mehrere kleine Dosen für die Verabreichung über den Tag aufgeteilt werden.
- Die Verbindungen der Erfindung können allein oder in Kombination mit pharmazeutisch annehmbaren Trägern oder Verdünnungsmitteln auf jedem der drei oben angegebenen Wege verabreicht werden und die Verabreichung kann in einer einzelnen Dosis oder in mehrfachen Dosen erfolgen. Genauer können die neuen therapeutischen Mittel der Erfindung in einer großen Vielzahl verschiedener Dosierungsformen verabreicht werden, d. h. sie können mit verschiedenen pharmazeutisch annehmbaren inerten Trägern in Form von Tabletten, Kapseln, Pastillen, Dragees, Pulvern, Sprays, Cremes, Salben, Zäpfchen, Gelees, Gelen, Pasten, Lotionen, Salben, wässrigen Suspensionen, injizierbaren Lösungen, Elixieren, Sirupen und dgl. kombiniert werden.
- Solche Träger schließen feste Verdünnungsmittel oder Füllstoffe, sterile wässrige Medien und verschiedene nicht toxische organische Lösungsmittel etc. ein. Außerdem können orale pharmazeutische Zusammensetzungen geeigneterweise gesüßt und/ oder aromatisiert werden. Im Allgemeinen sind die therapeutisch wirksamen Verbindungen der Erfindung in solchen Dosierungsformen in einem Konzentrationsbereich von etwa 5,0 bis etwa 70 Gew.-% vorhanden.
- Für die orale Verabreichung können Tabletten, die verschiedene Hilfsstoffe, wie mikrokristalline Cellulose, Natriumcitrat, Calciumcarbonat, Dicalciumphosphat und Glycin enthalten, angewendet werden zusammen mit verschiedenen Sprengmitteln, wie Stärke (und bevorzugt Mais-, Kartoffel- oder Tapiokastärke), Alginsäure und bestimmten komplexen Silicaten zusammen mit Granulierungsbindemitteln, wie Polyvinylpyrrolidon, Saccharose, Gelatine und Gummi arabicum. Zusätzlich sind häufig Gleitmittel wie Magnesiumstearat, Natriumlaurylsulfat und Talkum nützlich für Tablettierzwecke. Feste Zusammensetzungen ähnlicher Art können auch angewendet werden als Füllstoffe in Gelatinekapseln; bevorzugte Materialien in diesem Zusammenhang schließen auch Lactose oder Milchzucker ein ebenso wie Polyethylenglycole mit hohem Molekulargewicht. Wenn wässrige Suspensionen und/oder Elixiere für die orale Verabreichung gewünscht sind, kann der aktive Inhaltsstoff mit verschiedenen Süß- oder Aromastoffen, Färbemitteln oder Farbstoffen und, falls erwünscht, Emulsions- und/oder Suspensionsmitteln kombiniert werden ebenso wie mit solchen Verdünnungsmitteln, wie Wasser, Ethanol, Propylenglycol, Glycerin und verschiedenen Kombinationen davon.
- Für die parenterale Verabreichung können Lösungen der aktiven Verbindung der vorliegenden Erfindung entweder in Sesam- oder Erdnussöl oder in wässrigem Propylenglycol angewendet werden. Die wässrigen Lösungen sollten geeigneterweise, falls notwendig, gepuffert (bevorzugt pH-Wert größer als 8) werden und das flüssige Verdünnungsmittel sollte zuerst isotonisch gemacht werden. Diese wässrigen Lösungen sind geeignet für die intravenöse Injektion. Die öligen Lösungen sind geeignet für intraartikuläre, intramuskuläre und subcutane Injektion. Die Herstellung all dieser Lösungen unter sterilen Bedingungen kann leicht erreicht werden mit pharmazeutischen Standardtechniken, die dem Fachmann auf diesem Gebiet wohl bekannt sind.
- Außerdem ist es auch möglich, die aktiven Verbindungen der vorliegenden Erfindung topisch zu verabreichen zur Behandlung von Zuständen der Haut; dies kann erfolgen mit Hilfe von Cremes, Gelees, Gelen, Pasten, Pflastern, Salben und dgl. gemäß pharmazeutischer Standardpraxis.
- Die vorliegende Erfindung wird durch die folgenden Beispiele erläutert. Es versteht sich jedoch, dass die Erfindung nicht auf die spezifischen Details dieser Beispiele beschränkt ist. Schmelzpunkte sind unkorrigiert. Kernmagnetische Protonenresonanzspektren (1H-NMR) und kernmagnetische 13C-Resonanzspektren (13C-NMR) wurden gemessen für Lösungen in Deuterochloroform (CDCl3) oder in CD3OD oder CD3SOCD3 und die Peakpositionen sind ausgedrückt in Teile pro Million (ppm) feldabwärts von Tetramethylsilan (TMS). Die Peakformen sind wie folgt angegeben: s Singulett, d Duplett, t Triplett, q Quartett, m Multiplett, b breit.
- Beispiel 1
- 6-[4-(2-(2-Diethylaminoethoxy)ethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin
- A. 4-Brom-5,6,7,8-tetrahydro-1-benzyloxynaphthalin
- In einen 250-ml-Rundkolben, der mit Zugabetrichter und Stickstoff-(N2)-Einlass versehen war, wurden 2,96 g (20 mmol) 5,6,7,8-Tetrahydronaphthalin-1-ol und 50 ml 1,2-Dichlorethan und unter Rühren eine Lösung von 9,64 g (20 mmol) Tributylammoniumtribromid in 30 ml 1,2-Dichlorethan tropfenweise über 10 Minuten zugegeben. Nach weiterem 10-minütigem Rühren bei Raumtemperatur wurde die Lösung mit Wasser, verdünntem wässrigen Natriumbisulfit und Wasser gewaschen, über Natriumsulfat getrocknet und eingedampft. Die Mischung aus Produkt und Tributylammoniumbromid wurde direkt verwendet.
1H-NMR (δ, CDCl3): 1,70 (m, 4H), 2,56 (t, J = 6, 2H), 2,61 (t, J = 6, 2H), 7,02 (AB, 2H), 8,0 (bs, 1H, OH);
13C-NMR (δ, CDCl3): 22,2, 22,9, 23,8, 30,5, 114,0, 114,7, 126,6, 129,0, 136,7, 154,1. - Das obige Öl wurde in 100 ml Acetonitril gelöst und mit 3,57 ml (30 mmol) Benzylbromid und 5,53 g (40 mmol) Kaliumcarbonat versetzt und dann 14 Stunden lang am Rückfluss erhitzt. Dünnschichtchromatographie (DC) zeigte einen größeren Fleck bei Rf = 0,3 in 10% Methylenchlorid/Hexan (mit Benzylbromid bei Rf = 0,4). Der Ansatz wurde gekühlt, in verdünnte wässrige Salzsäure/Ethylacetat gegossen und die organische Phase abgetrennt, mit Wasser und Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Methylenchlorid/Hexan als Elutionsmittel, was 4,0 g (63%) eines Öls lieferte.
1H-NMR (δ, CDCl3): 1,77 (m, 4H), 2,75 (m, 4H), 5,045 (s, 2H), 6,62 (d, J = 9, 1H), 7,3–7,5 (m, 6H);
13C-NMR (δ, CDCl3): 22,2, 22,9, 24,0, 30,7, 69,9, 109,8, 116,7, 127,1, 127,9, 128,6, 129,1, 129,3, 137,2, 137,5, 155,6. - B. 5,6,7,8-Tetrahydro-1-benzyloxynaphthalin-4-boronsäure
- Es wurde aus Beispiel 1A hergestellt unter Verwendung von Butyllithium in Tetrahydrofuran bei –70°C 1 Stunde lang gefolgt von einer Behandlung mit Triethylborat bei –70°C 1 Stunde lang und bei Raumtemperatur 18 Stunden lang gefolgt von einem Abschrecken mit Salzsäure und Extraktion in Ethylacetat gefolgt von einem Trocknen über Natriumsulfat und Verdampfen, als weißer Feststoff nach Verreiben mit Hexan in 72% Ausbeute.
Schmelzpunkt 199–205°C;
1H-NMR (δ, CDCl3): 1,72 (m, 4H), 2,70 (m, 4H), 5,005 (s, 2H), 6,66 (m, 1H), 7,01 (d, J = 8, 1H), 7,2-7,4 (m, 5H);
13C-NMR (δ, CDCl3): 22,6, 22,9, 23,4, 30,0, 107,8, 125,9, 127,0, 127,6, 128,4, 131,1, 137,5, 140,8, 156,9. - C. 2-(2,5-Dimethylpyrrolyl)-6-[4-benzyloxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- Durch Kuppeln des Produkts von Beispiel 1B mit 6-Brom-(2-(2,5-dimethylpyrrolyl)pyridin in wässrigem Ethanol mit Tetrakistriphenylphosphinpalladium als Katalysator und Natriumcarbonat als Base 18 Stunden lang am Rückfluss gefolgt von einem Kühlen, Auftrennen zwischen Wasser und Ethylacetat, Trocknen der organische Phase über Natriumsulfat und Verdampfen, gefolgt von einer Chromatographie auf Silicagel unter Verwendung von Methanol/Methylenchlorid als Elutionsmittel, wurde es hergestellt in 100 Ausbeute als Öl.
1H-NMR (δ, CDCl3): 1,81 (m, 2H), 1,91 (m, 2H), 2,29 (s, 6H), 2,93 (m, 4H), 5,19 (s, 2H), 6,02 (s, 2H), 6,91 (d, J = 8, 1H), 7,21 (d, J = 8, 1H), 7,32 (d, J = 8, 1H), 7,4–7,6 (m, 6H), 7,89 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 13,5, 22,5, 23,0, 24,0, 28,9, 69,8, 106,8, 108,2, 119,6, 123,1, 126,8, 127,2, 127,8, 12,9, 128,6, 128,7, 132,8, 136,8, 137,6, 138,0, 151,4, 156,8, 160,4;
MS (%): 409 (Stammverbindung + 1, 100). - D. 2-(2,5-Dimethylpyrrolyl)-6-[4-hydroxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- Es wurde aus dem Produkt von Beispiel 1C unter Verwendung von Ammoniumformiat und 10% Palladium auf Kohlenstoff als Katalysator in Ethanol 3 Stunden am Rückfluss gefolgt von Abkühlen, Filtration durch Celite, Verdampfen, Auftrennen zwischen Ethylacetat und wässriger Natriumbicarbonatlösung, Auftrennung, Trocknen über Natriumsulfat und Verdampfen in 100% Ausbeute als niedrigschmelzender Feststoff hergestellt.
1H-NMR (δ, CDCl3): 1,67 (m, 2H), 1,77 (m, 2H), 2,16 (s, 6H), 2, 63 (m, 2H) , 2,73 (m, 2H), 5, 89 (s, 2H), 6,3 (bs, 1H, OH), 6,51 (d, J = 8, 1H), 7,02 (d, J = 8, 1H), 7,13 (d, J = 8, 1H), 7,35 (d, J = 8, 1H), 7,83 (t, J = 8, 1H) ;
13C-NMR (δ, CDCl3): 13,3, 22,3, 22,8, 23,3, 28,6, 106,6, 121,1, 119,7, 123,3, 124,2, 127,8, 128,7, 131,9, 136,6, 138,1, 151,2, 154,4, 160,5;
MS (%): 319 (Stammverbindung + 1, 100). - E. 2-(2,5-Dimethylpyrrolyl)-6-[4-(2-(2-diethylaminoethoxy)- ethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- In einen 125-ml-Dreihalsrundkolben, der mit Stickstoff-(N2)-Einlass und Septum ausgestattet war, wurden 15 ml trockenes Dimethylformamid und 50 mg (1,3 mmol) Natriumhydrid (mit Hexan gewaschen) gegeben. Der Ansatz wurde auf 0°C gekühlt und eine Lösung von 200 mg (0,6 mmol) 2-(2,5-Dimethylpyrrolyl)-6-[4-hydroxy-5,6,7,8-tetrahydronaphthalin-l-yl]pyridin in 5 ml trockenem Dimethylformamid tropfenweise zugegeben. Der Ansatz wurde 30 Minuten bei Raumtemperatur gerührt und dann eine Lösung von 234 mg (1,3 mmol) Diethylaminoethoxyethylchlorid (J. Med. Chem., 34, 3159 (1991)) in 5 ml trockenem Dimethylformamid tropfenweise zugegeben und der Ansatz 20 Stunden lang auf 100°C erhitzt und anschließend mehr Natriumhydrid und Chlorid zugegeben und weitere 24 Stunden lang erhitzt. Der Ansatz wurde gekühlt, in wässrige Natriumhydroxidlösung gegossen und in Ethylacetat extrahiert. Die organische Phase wurde mit Wasser, wässriger Natriumbicarbonatlösung und Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Methanol/Methylenchlorid als Elutionsmittel, was 83 mg (30%) als Öl lieferte.
1H-NMR (δ, CDCl3): 1,03 (t, J = 7, 6H), 1,67 (m, 2H), 1,76 (m, 2H), 2,155 (s, 6H), 2,59 (q, J = 7, 4H), 2,7–2,9 (m, 6H), 3,67 (t, J = 7, 2H), 3,84 (t, J = 6, 2H), 4,14 (t, J = 6, 2H), 5, 87 (s, 2H), 6, 73 (d, J = 8, 1H), 7,11 (d, J = 8, 1H), 7,185 (d, J = 8, 1H), 7,35 (d, J = 8, 1H), 7,82 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 11,68, 13,33, 22,30, 22,87, 23,68, 28,66, 47,61, 52,34, 67,65, 69,67, 70,10, 106,52, 107,80, 119,48, 122,95, 126,59, 127,68, 128,62, 132,55, 136,58, 137,84, 151,21, 156,85, 160,34;
MS (%): 462 (Stammverbindung + 1, 100). - F. 6-[4-(2-(2-Diethylaminoethoxy)ethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin
- In einen 100-ml-Rundkolben, der mit Kühler und Stickstoff(N2)-Einlass ausgestattet war, wurden 83 mg (0,18 mmol) 2-(2,5-Dimethylpyrrol)-6-[4-(2-(2-diethylaminoethoxy)ethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin, 250 mg (3,6 mmol) Hydroxylaminhydrochlorid, 10 ml Ethanol und 1 ml Wasser gegeben. Der Ansatz wurde 40 Stunden lang am Rückfluss erhitzt, gekühlt und in 1 n Salzsäure gegossen. Die wässrige Phase wurde mit Ethylacetat gewaschen und der pH-Wert mit 6 n Natriumhydroxidlösung auf 12 eingestellt, dann mit Methylenchlorid extrahiert. Die organische Phase wurde über Natriumsulfat getrocknet und eingeengt, was 76 mg (100%) eines Öls lieferte, das in das Hydrochloridsalz mit HCl in Ether umgewandelt wurde, was einen amorphen lohfarbenen Feststoff ergab.
1H-NMR (δ, CDCl3): 1,02 (t, J = 7, 6H), 1,64 (m, 2H), 1,73 (m, 2H), 2,59 (q, J = 7, 4H), 2,69 (m, 6H), 3,66 (t, J = 7, 2H), 3,81 (t, J = 5, 2H), 4,10 (t, J = 5, 2H), 4,78 (bs, 2H), 6,37 (d, J = 8, 1H), 6,62 (d, J = 8, 1H), 6,67 (d, J = 8, 1H), 7,08 (d, J = 8, 1H), 7,41 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 11,47, 13,66, 19,90, 22,40, 22,87, 23,68, 25,47, 28,23, 31,67, 32,57, 47,49, 52,18, 67,58, 69,68, 69,87, 106,32, 107,73, 114,33, 126,41, 126,90, 133,44, 136,32, 137,87, 156,26, 156,39, 157,82, 158,61;
MS (%): 384 (Stammverbindung + 1, 100);
HRMS berechnet für C23H34N3O2: 384,2651, gefunden: 384,2655. - Beispiel 2
- 6-[4-(2-Hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin
- A. 2-(2,5-Dimethylpyrrolyl)-6-[4-carboethoxymethoxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- Es wurde aus 2-(2,5-Dimethylpyrrolyl)-6-[4-hydroxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin (von Beispiel 1) durch Alkylierung mit Ethylbromacetat, unter Verwendung von Kaliumcarbonat in Acetonitril hergestellt. Die Mischung wurde 12 Stunden lang am Rückfluss erhitzt, gekühlt, in Wasser gegossen und in Ethylacetat extrahiert. Die organische Phase wurde mit Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Hexan/Ethylacetat. als Elutionsmittel mit einer Ausbeute von 83,5% des Produktes als Öl.
1H-NMR (δ, CDCl3): 1,31 (t, J = 7, 3H), 1,71 (m, 2H), 1,83 (m, 2H), 2,19 (s, 6H) , 4,26 (q, J = 7, 2H), 4,66 (s, 2H), 5,90 (s, 2H), 6,64 (d, J = 8, 1H), 7,12 (d, J = 8, 1H), 7,20 (d, J = 8, 1H), 7,35 (d, J = 8, 1H), 7,82 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 13,4, 14,2, 22,3, 22,9, 23,7, 28,7, 61,2, 65,5, 106,7, 107,8, 119,6, 123,0, 126,9, 127,7, 128,5, 133,4, 137,0, 138,1, 151,3, 156,0, 160,1, 169,0;
MS (%): 405 (Stammverbindung + 1, 100). - B. 2-(2,5-Dimethylpyrrolyl)-6-[4-carboxymethoxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- Es wurde hergestellt aus Beispiel 2A durch 12-stündige Hydrolyse in Tetrahydrofuran, Methanol und Wasser unter Verwendung von Lithiumhydroxid als Base bei Raumtemperatur gefolgt vom Gießen des Ansatzes in verdünnte Salzsäure und Extraktion in Ethylacetat, Trocknen über Natriumsulfat und Verdampfen in 100% Ausbeute als Feststoff.
Schmelzpunkt 199–206°C;
1H-NMR (δ, CDCl3): 1,62 (m, 2H), 1,72 (m, 2H), 2,08 (s, 6H), 2,66 (m, 2H), 2,75 (m, 2H), 4,56 (s, 2H), 5,81 (s, 2H), 6,58 (d, J = 8, 1H), 7,09 (m, 2H), 7,31 (d, J = 8, 1H), 7,80 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 12,95, 22,1, 22,6, 23,4, 28,4, 65,0, 106,5, 107,7, 119,9, 123,3, 126,7, 127,4, 128,5, 132,8, 136,6, 138,3, 151,1, 155,9, 160,1, 171,2;
MS (%): 377 (Stammverbindung + 1, 100). - C. 2-(2,5-Dimethylpyrrolyl)-6-[4-(2-hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin
- In einen 100-ml-Rundkolben, der mit Kühler und Stickstoff(N2)-Einlass ausgestattet war, wurden 100 mg (0,27 mmol) 2-(2,5-Dimethylpyrrolyl)-6-[4-carboxymethoxy-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin (von Beispiel 1), 20 ml trockenes Tetrahydrofuran und 0,6 ml (0,53 mmol) einer 1 M Lösung von Lithiumaluminiumhydrid in Tetrahydrofuran gegeben. Der Ansatz wurde 16 Stunden lang am Rückfluss erhitzt, gekühlt, und mit 1 n Salzsäure abgeschreckt. Der pH-Wert der Mischung wurde mit 1 n wässriger Natriumhydroxidlösung auf 10 eingestellt und mit Ethylacetat extrahiert. Die organische Phase wurde mit Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand von 118 mg (100%) eines Öls wurde direkt in der folgenden Stufe verwendet.
- δ, CDCl3): 1,69 (m, 2H), 1,78 (m, 2H), 2,16 (s, 6H), 2,7–2,9 (m, 4H), 3,95 (m, 2H), 4,08 (m, 2H), 5, 885 (s, 2H), 6,73 (d, J = 8, 1H), 7,13 (d, J = 8, 1H), 7,20 (d, J = 8, 1H), 7,35 (d, J = 8, 1H), 7,83 (t, J = 8, 1H);
MS (%): 363 (Stammverbindung + 1, 100). - D. 6-[4-(2-Hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin-2-ylamin
- In einen 100-ml-Rundkolben, der mit Kühler und Stickstoff(N2)-Einlass ausgestattet war, wurden 118 mg (0,27 mmol) 2-(2,5-Dimethylpyrrolyl)-6-[4-(2-hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]pyridin, 453 mg (6,5 mmol) Hydroxylaminhydrochlorid, 10 ml Ethanol und 1 ml Wasser gegeben. Der Ansatz wurde 40 Stunden lang am Rückfluss erhitzt, gekühlt und in 1 n Salzsäure gegossen. Die wässrige Phase wurde mit Ethylacetat gewaschen und der pH-Wert mit 6 n Natriumhydroxidlösung auf 12 eingestellt und dann mit Methylenchlorid extrahiert. Die organische Phase wurde über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Methanol/Methylenchlorid als Elutionsmittel, was 100 mg (100%) eines Öls lieferte, das in das Hydrochloridsalz umgewandelt wurde mit HCl in Ether, was einen Feststoff ergab.
Schmelzpunkt 170–172°C;
1H-NMR (δ, CDCl3): 1,65 (m, 2H), 1,75 (m, 2H), 2,67 (m, 4H), 3,88 (m, 2H), 3,90 (m, 2H), 6,38 (d, J = 8, 1H), 6, 62 (m, 2H), 7,08 (d, J = 8, 1H), 7,42 (t, J = 8, 1H);
13C-NMR (δ, CDCl3): 22,27, 22,39, 22,74, 23,53, 28,11, 61,15, 68,96, 106,465, 107,655, 114,20, 126,21, 126,845, 133,395, 136,32, 137,98, 156,10, 156,53, 157,745, 158,26;
MS (%): 285 (Stammverbindung + 1, 100);
HRMS berechnet für C17H21N2O2: 285,1603; gefunden 285,1622. - Beispiel 3
- 6-[4-(2-(2-Dimethylaminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin
- A. 4-Brom-1-fluornaphthalin
- In einen 50-ml-Rundkolben, der mit Kühler und N2-Einlass ausgestattet war, wurden 3,75 ml (5,0 g, 34,25 mmol) 1-Fluornaphthalin und 10 ml Tetrachlorkohlenstoff gegeben und anschließend wurden 1,7 ml (5,5 g, 34,375 mmol) Brom 3 Minuten lang tropfenweise zugegeben. Der Ansatz wurde 2 Stunden lang auf 50 bis 60°C erhitzt, wobei sich HBr entwickelte, dann gekühlt und eingeengt. Der Rückstand wurde in Methanol gelöst und über Nacht auf 0°C gehalten. Nach Filtration mit kaltem Methanol war das Produkt mit einem Schmelzpunkt nahe der Raumtemperatur 4,62 g (60%) eines gelben Öls.
1H-NMR (δ, CDCl3): 7,02 (t, J = 8, 1H), 7,6–7,7 (m, 3H), 8,10 (d, J = 8,5, 1H), 8,20 (d, J = 8,5, 1H);
GCMS (%): 224/226 (Stammverbindung, Br79/Br81 100 . - B. 4-Fluornaphthalin-1-boronsäure
- In einen 250-ml-Dreihalsrundkolben, der mit Septum und N2-(Stickstoff)-Einlass ausgestattet war, wurden 4,62 g (20,53 mmol) 4-Brom-l-fluornaphthalin und 100 ml trockenes Tetrahydrofuran gegeben. Die Lösung wurde auf –70°C gekühlt und 15,4 ml (24,64 mmol) einer 1,6 M Lösung von Butyllithium in Hexan wurden tropfenweise 5 Minuten lang zugegeben. Der Ansatz wurde bei –70°C 10 Minuten lang gerührt und dann 4,2 ml (3,59 g, 24,64 mmol) Triethylborat zugegeben und der Ansatz bei –70°C 20 Minuten lang gerührt und auf Raumtemperatur erwärmt. Nach Rühren über Nacht bei Raumtemperatur wurde der Ansatz mit gesättigter wässriger Ammoniumchloridlösung abgeschreckt, mit 1 n Salzsäure angesäuert und in Ethylacetat extrahiert (zweimal). Die vereinigten organischen Phasen wurden mit Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde mit Hexan verrieben, was ein grauweißes Pulver ergab, 1,97 g (51%) als Mischung von Monoaryl- und Diarylboronsäuren.
1H-NMR (δ, CDCl3): 7,2–7,4 (m, 1H), 7,5–7,7 (m, 3H), 8,0–8,5 (m, 1H), 8,5 und 9,2 (m, 1H);
APCl(-)(%): 189 (Stammverbindung – 1, 60). - C. 2-(2,5-Dimethylpyrrolyl)-6-(4-fluornaphth-1-yl)pyridin
- In einen 50-ml-Rundkolben, der mit Kühler und N2-Einlass ausgestattet war, wurden 404 mg (2,13 mmol) 4-Fluornaphthalin-1-boronsäure, 534 mg (2,13 mmol) 2-(2,5-Dimethylpyrrolyl)-6-brompyridin, 902 mg (8,51 mmol) Natriumcarbonat, 150 mg Tetrakistriphenylphosphin, 10 ml Ethanol und 2 ml Wasser gegeben. Der Ansatz wurde über Nacht am Rückfluss erhitzt, gekühlt, in Wasser gegossen und mit Ethylacetat extrahiert. Nach Vereinigen mit einem weiteren Durchlauf in größerem Maßstab wurden die vereinigten organischen Phasen mit Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Hexan/Ethylacetat als Elutionsmittel, was 4,72 g (85%) als Öl lieferte.
1H-NMR (δ, CDCl3): 2,25 (s, 6H), 5,92 (s, 2H), 7,1-7,2 (m, 2H), 7,4-7,6 (m, 4H), 7,95 (t, J = 8, 1H), 8,12 (d, J = 8, 1H), 8,19 (d, J = 8, 1H);
13C-NMR (δ, CDCl3): 13,41, 106,97, 108,82, 109,02, 120,18, 120,78, 120,84, 123,42, 123,81, 123,96, 125,48, 126,20, 127,32, 127,68, 127,76, 128,56, 132,35, 133,90, 138,22, 151,87, 157,82, 158,30, 160,34;
MS (%): 317 (Stammverbindung + 1, 100);
HRMS berechnet für C21H18N2F (Stammverbindung + 1) : 317, 1454; gefunden: 317,1462. - D. 2-(2,5-Dimethylpyrrolyl)-6-(2-(2-dimethylaminoethoxy)ethoxy)naphth-1-yl)pyridin
- In einen 20-ml-Rundkolben, der mit Kühler und Stickstoff(N2)-Einlass ausgestattet war, wurden 126 mg (0, 949 mmol) 2-(2-Dimethylaminoethoxy)ethanol und 2 ml trockenes Dimethylformamid und anschließend 47 mg (1,187 mmol) Natriumhydrid (60% in Öl) gegeben. Der Ansatz wurde auf 70°C erhitzt, um eine vollständige Bildung des Alkoxids sicherzustellen, und dann wurden 150 mg (0,475 mmol) 2-(2,5-Dimethylpyrrolyl)-6-(4-fluornaphth-1-yl)pyridin in 2 ml trockenem Dimethylformamid zugegeben und der Ansatz 30 Minuten lang auf 80°C erhitzt. Der Ansatz wurde gekühlt, in Wasser gegossen und in Ethylacetat extrahiert. Nach Vereinigen mit einem weiteren Durchlauf in größerem Maßstab wurden die vereinigten organischen Phasen mit Kochsalzlösung gewaschen, über Natriumsulfat getrocknet und eingedampft. Der Rückstand wurde auf Silicagel chromatographiert unter Verwendung von Methanol/Methylenchlorid als Elutionsmittel, was 141 mg (69%) als Öl lieferte.
1H-NMR (δ, CDCl3): 2,24 (s, 6H), 2,32 (s, 6H), 2,61 (t, J = 6, 2H), 3,76 (t, J = 6, 2H), 3,98 (t, J = 5, 2H), 4,35 (t, J = 5, 2H) , 5, 90 (s, 2H) , 6, 89 (d, J = 8, 1H) , 7, 21 (d, J = 8, 1H), 7,49 (m, 2H), 7,56 (m, 2H), 7,91 (t, J = 8, 1H), 8,11 (m, 1H), 8,36 (m, 1H);
13C-NMR (δ, CDCl3): 13,45, 45,64, 58,68, 67,87, 69,33, 69,46, 104,34, 106,74, 119,71, 122,40, 123,48, 125,11, 125,20, 125,74, 126,87, 128,22, 128,59, 130,39, 131,88, 138,07, 151,68, 155,12, 159,02;
MS (%): 430 (Stammverbindung + 1, 100);
HRMS berechnet für C27H32N3O2 (Stammverbindung + 1) : 430,2495; gefunden: 430,2498. - E. 6-[4-(2-(2-Dimethylaminoethoxy)ethoxy)naphthalin-1-yl]pyridin-2-ylamin
- Hergestellt wie in Beispiel 1F in 91% Ausbeute, Schmelzpunkt 60–75°C (Zersetzung) als Hydrochloridsalz.
1H-NMR (δ, CDCl3): 2,26 (s, 6H); 2,54 (t, J = 6, 2H), 3,71 (t, J = 6, 2H), 3,95 (t, J = 5, 2H), 4,31 (t, J = 5, 2H), 4,59 (bs, 2H), 6,41 (d, J = 8, 1H), 6,83 (m, 2H), 7,435 (m, 4H), 8,09 (m, 1H), 8,31 (m, 1H);
13C-NMR (δ, CDCl3): 45,88, 58,93, 67,96, 69,56, 69,68, 104,43, 106,54, 115,20, 122,23, 125,06, 125,68, 125,88, 126,64, 127,17, 131,60, 132,17, 137,98, 154,71, 157,77, 158,11;
MS (%): 352 (Stammverbindung + 1, 100);
Analyse berechnet für C21H25N3O2·2HCl·9/4 H2O·1/2 (C4H8O)
C 55,15; H 7,14; N 8,39;
Gefunden: C 55,31; H 7,28; N 8,64. - Beispiel 4
- 1-[4-(6-Aminopyridin-2-yl)naphthalin-1-yloxymethyl]cyclohexanol
- Hergestellt wie in Beispiel 3 unter Verwendung von 1-Hydroxycyclohexanmethanol in 74% Ausbeute als lohfarbenes Pulver als Hydrochloridsalz.
1H-NMR (δ, CDCl3): 0,9–1,9 (m, 10H), 4,02 (s, 2H), 4,89 (bs, 2H), 6,54 (d, J = 8, 1H), 6,87 (m, 2H), 7,5–7,6 (m, 4H), 8,10 (m, 1H), 8,31 (m, 1H);
13C-NMR (δ , CDCl3): 18,98, 21,76, 25,86, 26,34, 29,68, 34,56, 60,40, 71,11, 75,75, 104,52, 107,08, 112,48, 115,21, 121,94, 125,30, 125,61, 125,77, 126,84, 127,48, 130,63, 132,08, 138,55, 154,83, 156,58, 157,79;
MS (%): 349 (Stammverbindung + 1, 100);
HRMS berechnet für C22H23N2O2: 349.1760, gefunden: 349,1786.
Claims (21)
- Verbindung der Formel I oder pharmazeutisch annehmbare Salze davon worin A und B zusammen einen Ring fusioniert an den Phenylring bilden, wobei der Ring gesättigt oder ungesättigt ist und 5 bis 7 Ringatome enthält, wobei die Ringatome gegebenenfalls 1 bis 2 Heteroatome aufweisen können, die unabhängig ausgewählt sind aus der Gruppe bestehend aus N, O oder S, mit dem Vorbehalt, dass nicht zwei benachbarte Ringglieder Heteroatome sind; X Sauerstoff oder eine Einfachbindung ist; Y (C1-C6)-Alkyl ist; R1 Wasserstoff, eine (C1-C8)-Alkylgruppe oder eine mit -NR2R3 substituierte (C1-C8)-Alkylgruppe ist, wobei R2 und R3 entweder unabhängig ausgewählt sind aus der Gruppe bestehend aus H, Alkyl, Aryl, Aralkyl oder Tetrahydronaphthalin, wobei die Arylgruppe oder der Arylanteil der Aralkylgruppe Phenyl oder Naphthyl ist, die Alkylgruppe oder der Alkylanteil der Aralkylgruppe 1 bis 6 Kohlenstoffatome enthält und geradkettig oder verzweigt ist und die Arylgruppe, das Tetrahydronaphthalin oder der Arylanteil der Aralkylgruppe gegebenenfalls substituiert ist mit 1 bis 3 Substitutenten ausgewählt aus Halogen-, Nitro-, Cyano- , Amino-, (C1-C4)-Alkoxy- und (C1-C4)-Alkylaminoresten oder R2 und R3 zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen heterocyclischen Ring oder einen cyclischen oder bicyclischen Ring, der gesättigt oder ungesättigt ist, bilden.
- Verbindung nach Anspruch 1, wobei der aus R2 und R3 gebildete heterocyclische Ring ein Piperizin-, Azetidin- , Piperazin- oder Pyrrolidinring ist, wobei der Piperidin-, Azetidin-, Piperazin- oder Pyrrolidinring gegebenenfalls mit einem oder mehreren Substituenten substituiert ist, die unabhängig ausgewählt sind aus der Gruppe bestehend aus (C1-C6)-Alkyl-, Amino-, (C1-C6)-Alkylamino-, [Di-(C1-C6)-Alkyl]amino-, Phenyl-substituierten 5- bis 6-gliedrigen heterocyclischen Ringen, die 1 bis 4 Ringstickstoffatome enthalten, Benzoyl-, Benzoylmethyl-, Benzylcarbonyl-, Phenylaminocarbonyl-, Phenylethyl- und Phenoxycarbonylgruppen und der Phenylanteil jedes der vorhergehenden Substituenten gegebenenfalls mit einem oder mehreren Substituenten substituiert ist, die jeweils unabhängig ausgewählt sind aus Halogenen, (C1-C3)-Alkyl, (C1-C3)-Alkoxy, Nitro, Amino, Cyano, CF3 oder OCF3.
- Verbindung nach Anspruch 1, wobei R2 und R3 zusammen mit dem Stickstoffatom, an das sie gebunden sind, eine 6-Amino-3-azabicyclo[3.1.0]hex-2-yl-Gruppe der Formel bilden, worin R4 und R5 unabhängig ausgewählt sind aus der Gruppe bestehend aus Wasserstoff, (C1-C6)-Alkyl, Phenyl , Naphthyl , (C1-C6)-Alkyl-C(=O)– , HC(=O)-, (C1-C6)-Alkoxy-(C=O)-, Phenyl-C(=O)-, Naphthyl-C(=O)- und R6R7NC(=O)-, wobei R6 und R7 jeweils unabhängig H oder (C1-C6)-Alkyl sind.
- Verbindung nach Anspruch 4, wobei der kondensierte Ring und der Phenylring eine Naphthalingruppe bilden.
- Verbindung nach Anspruch 1, worin X Sauerstoff ist.
- Verbindung nach Anspruch 1, worin Y -CH2CH2- ist.
- Verbindung nach Anspruch 1, worin R1 eine (C1-C6)-Alkylgruppe ist, die mit -NR2R3 substituiert ist.
- Verbindung nach Anspruch 8, wobei R1 eine 2-substituierte Ethylgruppe ist, die mit -NR2R3 substituiert ist.
- Verbindung nach Anspruch 7, wobei R2 und R3 zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen heterocyclischen Ring bilden ausgewählt aus der Gruppe bestehend aus 3-Azabicyclo(3.1.0]hexyl-, Piperidin- und Piperazinringen.
- Verbindung nach Anspruch 10, wobei der Ring ein 3-Azabicyclo[3.1.0]hexylring ist.
- Verbindung nach Anspruch 7, wobei jeder der Reste R2 und R3 unabhängig Methyl, Ethyl oder Propyl ist.
- Verbindung nach Anspruch 1, wobei A und B zusammen einen Ring bilden, der an den Phenylring kondensiert ist, der kondensierte Ring und der Phenylring zusammen eine Naphthalingruppe bilden, X Sauerstoff ist, Y -CH2CH2ist, R1 eine R2R3NCH2CH2-Gruppe ist und R2 und R3 zusammen einen Ring bilden ausgewählt aus Azabicyclohexan-, Piperidin- und Piperazinringen oder R2 und R3 jeweils unabhängig Methyl, Ethyl oder Propyl sind.
- Verbindung nach Anspruch 1, ausgewählt aus der Gruppe bestehend aus 1-[4-(6-Aminopyridin-2-yl)-naphthalin-1-yloxymethyl]cyclohexanol; 6-[4-(2-(2-Dimethylaminoethoxy)-ethoxy)-naphthalin-1-yl]-pyridin-2-ylamin; 6-[4-(2-Hydroxyethoxy)-5,6,7,8-tetrahydronaphthalin-1-yl]-pyridin-2-ylamin und 6-[4-(2-(2-Diethylaminoethoxy)-ethoxy)-naphthalin-1-yl]pyridin-2-ylamin.
- Verbindung nach Anspruch 1 mit der Formel I-a: worin die durchbrochene Linie eine fakultative Doppelbindung bedeutet; Y (C1-C6)-Alkyl ist und R1 Wasserstoff, (C1-C6)-Alkyl oder eine (C1-C6)-Alkylgruppe ist, die mit -NR2R3 substituiert ist, wobei R2 und R3 jeweils unabhängig ausgewählt sind aus der Gruppe bestehend aus H, Alkyl, Aryl, Aralkyl oder Tetrahydronaphthalin, wobei die Arylgruppe oder der Arylanteil der Aralkylgruppe Phenyl oder Naphthyl ist, die Alkylgruppe oder der Alkylanteil der Aralkylgruppe 1 bis 6 Kohlenstoffatome enthält und geradkettig oder verzweigt ist und die Arylgruppe, das Tetrahydronaphthalin oder der Arylanteil der Aralkylgruppe gegebenenfalls mit 1 bis 3 Substituenten substituiert ist ausgewählt aus Halogen-, Nitro-, Cyano- , Amino-, (C1-C4) -Alkoxy- und (C1-C4) -Alkylaminoresten oder R2 und R3 zusammen mit dem Stickstoffatom, an das sie gebunden sind, einen heterocyclischen Ring oder einen cyclischen oder bicyclischen Ring, der gesättigt oder ungesättigt ist, bilden.
- Verbindung nach Anspruch 1 ausgewählt aus der Gruppe bestehend aus 6-[4-(2-(2-Diethylaminoethoxy)-ethoxy)-naphtalin-1-yl]pyridin-2-ylamin; 6-[4-(2-(2-Dipropylaminoethoxy)-ethoxy)-napttalin-1-yl]pyridin-2-ylamin; 6-[4-(2-(2-(N-Methyl,N-benzyl)aminoethoxy)-ethoxy)-naphthalin-1-yl]-pyridin-2-ylamin; 6-[4-(2-(2-(1-Piperidinyl)ethoxy)-ethoxy)-naphtalin-1-yl]pyridin-2-ylamin; 6-[4-(2-(2-(N-Methylpiperazin-4-yl)ethoxy)-ethoxy)-naphthalin-1-yl]pyridin-2-ylamin und 6-[4-(2-(2-(6-Amino-3-azabicyclo[3.1.0]hex-2-yl)ethoxy)ethoxy)-naphthalin-1-yl]-pyridin-2-ylamin.
- Pharmazeutische Zusammensetzung enthaltend einen pharmazeutisch annehmbaren Träger und eine Menge der Verbindung nach Anspruch 1, die wirksam ist bei einem Säugetier, um folgende Krankheiten, Leiden oder Zustände zu behandeln: eine akute Rückenmarksschädigung; ein Angstleiden ausgewählt aus der Gruppe bestehend aus Panikattacken, Agoraphobie, Panikleiden mit oder ohne Agoraphobie, Agoraphobie ohne eine Historie von Panikleiden, spezifischer Phobie, Sozialphobie, Zwangsstörungen, posttraumatischer Stresserkrankung und akuter Stresserkrankung; Krebs ausgewählt aus der Gruppe bestehend aus Hirn-, Brust-, Darm-, Lungen-, Leber-, Eierstock-, Prostata-, Haut- und Magenkrebs; Krebs ausgewählt aus der Gruppe bestehend aus Astrocytoma, Karzinoma, Glioblastoma, Leukämien, Lymphoma, Melanoma und Sarkoma; kognitive Störungen ausgewählt aus der Gruppe bestehend aus amnestischen Störungen, Delirien, Demenzen und unspezifischen oder nicht anders spezifizierten kognitiven Leiden; Erbrechen, Epilepsie; gastrointestinale Zustände ausgewählt aus der Gruppe bestehend aus Morbus Crohn, Colon irritabile und Colitis ulcerosa; Glaukom; Kopfschmerzleiden ausgewählt aus der Gruppe bestehend aus Migräne, Cluster-Kopfschmerz und vaskulären Kopfschmerzen; Chorea Huntington; entzündliche Leiden ausgewählt aus der Gruppe bestehend aus akuter undifferenzierter Erkrankung der Atmungsorgane bei Erwachsenen (ARDS), arthritischen Leiden, Asthma, dermatologischen Läsionen, Gicht, entzündlicher Darmkrankheit, nekrotisierenden Vaskulitiden, neurogener Entzündung, Psoriasis, Reperfusionsschädigung, Schlaganfall und Ganzkörperentzündungssyndrom; Makuladegeneration; Fettsucht; neurodegenerative Krankheiten ausgewählt aus der Gruppe bestehend aus Alzheimer-Krankheit, ALS, multipler Sklerose und Parkinson-Krankheit; pathologische Zustände ausgewählt aus der Gruppe bestehend aus Kardiomyopathie, diabetischer Neuropathie und diabetischer Nephropathie; psychotische Leiden ausgewählt aus der Gruppe bestehend aus Schizophrenie, schizophreniformen Leiden, schizoaffektiven Leiden, Wahnvorstellungen, kurzen psychotischen Störungen, geteilten psychotischen Störungen bzw. geteiltem Wahn, psychotischen Leiden auf Grund eines allgemeinen medizinischen Zustands und nicht anders spezifizierten psychotischen Leiden; Schlafstörungen ausgewählt aus der Gruppe bestehend aus primären Schlafstörungen, Schlafstörungen, die mit einem anderen mentalen Leiden in Zusammenhang stehen, Schlafstörungen auf Grund eines allgemeinen medizinischen Zustands und nicht in anderer Weise spezifizierten Schlafstörungen; Schlaganfall; Substanzmissbrauchsleiden ausgewählt aus der Gruppe bestehend aus mit Alkohol in Beziehung stehenden Leiden, mit Amphetamin in Beziehung stehenden Leiden, mit Koffein in Beziehung stehenden Leiden, mit Cannabis in Beziehung stehenden Leiden, mit Kokain in Beziehung stehenden Leiden, mit Halluzinogenen in Beziehung stehenden Leiden, mit Inhalationsmitteln in Beziehung stehenden Leiden, mit Nikotin in Beziehung stehenden Leiden, mit Opioiden in Beziehung stehenden Leiden, mit Phencyclidin in Beziehung stehenden Leiden, mit Beruhigungsmitteln in Beziehung stehenden Leiden, mit Hypnotika in Beziehung stehenden Leiden, mit angstlösenden Mitteln in Beziehung stehenden Leiden und Polysubstanz-abhängigen Leiden, einem toxämischen Zustand ausgewählt aus der Gruppe bestehend aus ARDS, hypovolämischem Schock, Neurontoxizität, septischem Schock und traumatischem Schock oder einem traumatischen Zustand ausgewählt aus der Gruppe bestehend aus Brusttrauma und Kopftrauma.
- Verfahren zur Herstellung eines Arzneimittels, das vorgesehen ist zur Behandlung eines Säugetiers, das von folgenden Krankheiten, Leiden oder Zuständen betroffen ist: akute Rückenmarksschädigung; ein Angstleiden ausgewählt aus der Gruppe bestehend aus Panikattacken, Agoraphobie, Panikleiden mit oder ohne Agoraphobie, Agoraphobie ohne eine Historie von Panikleiden, spezifischer Phobie, Sozialphobie, Zwangsstörungen, posttraumatischer Stresserkrankung und akuter Stresserkrankung; Krebs ausgewählt aus der Gruppe bestehend aus Hirn-, Brust-, Darm-, Lungen-, Leber-, Eierstock-, Prostata-, Haut- und Magenkrebs; Krebs ausgewählt aus der Gruppe bestehend aus Astrocytoma, Karzinoma, Glioblastoma, Leukämien, Lymphoma, Melanoma und Sarkoma; kognitive Störungen ausgewählt aus der Gruppe bestehend aus amnestischen Störungen, Delirien, Demenzen und unspezifischen oder nicht anders spezifizierten kognitiven Leiden; Erbrechen, Epilepsie; gastrointestinale Zustände ausgewählt aus der Gruppe bestehend aus Morbus Crohn, Colon irritabile und Colitis ulcerosa; Glaukom; Kopfschmerzleiden ausgewählt aus der Gruppe bestehend aus Migräne, Cluster-Kopfschmerz und vaskulären Kopfschmerzen; Chorea Huntington; entzündliche Leiden ausgewählt aus der Gruppe bestehend aus akuter undifferenzierter Erkrankung der Atmungsorgane bei Erwachsenen (ARDS), arthritischen Leiden, Asthma, dermatologischen Läsionen, Gicht, entzündlicher Darmkrankheit, nekrotisierenden Vaskulitiden, neurogener Entzündung, Psoriasis, Reperfusionsschädigung, Schlaganfall und Ganzkörperentzündungssyndrom; Makuladegeneration; Fettsucht; neurodegenerative Krankheiten ausgewählt aus der Gruppe bestehend aus Alzheimer-Krankheit, ALS, multipler Sklerose und Parkinson-Krankheit; pathologische Zustände ausgewählt aus der Gruppe bestehend aus Kardiomyopathie, diabetischer Neuropathie und diabetischer Nephropathie; psychotische Leiden ausgewählt aus der Gruppe bestehend aus Schizophrenie, schizophreniformen Leiden, schizoaffektiven Leiden, Wahnvorstellungen, kurzen psychotischen Störungen, geteilten psychotischen Störungen bzw. geteiltem Wahn, psychotischen Leiden auf Grund eines allgemeinen medizinischen Zustands und nicht anders spezifizierten psychotischen Leiden; Schlafstörungen ausgewählt aus der Gruppe bestehend aus primären Schlafstörungen, Schlafstörungen, die mit einem anderen mentalen Leiden in Zusammenhang stehen, Schlafstörungen auf Grund eines allgemeinen medizinischen Zustands und nicht in anderer Weise spezifizierten Schlafstörungen; Schlaganfall; Substanzmissbrauchsleiden ausgewählt aus der Gruppe bestehend aus mit Alkohol in Beziehung stehenden Leiden, mit Amphetamin in Beziehung stehenden Leiden, mit Koffein in Beziehung stehenden Leiden, mit Cannabis in Beziehung stehenden Leiden, mit Kokain in Beziehung stehenden Leiden, mit Halluzinogenen in Beziehung stehenden Leiden, mit Inhalationsmitteln in Beziehung stehenden Leiden, mit Nikotin in Beziehung stehenden Leiden, mit Opioiden in Beziehung stehenden Leiden, mit Phencyclidin in Beziehung stehenden Leiden, mit Beruhigungsmitteln in Beziehung stehenden Leiden, mit Hypnotika in Beziehung stehenden Leiden, mit angstlösenden Mitteln in Beziehung stehenden Leiden und Polysubstanz-abhängigen Leiden, einem toxämischen Zustand ausgewählt aus der Gruppe bestehend aus ARDS, hypovolämischem Schock, Neurontoxizität, septischem Schock und traumatischem Schock oder einem traumatischen Zustand ausgewählt aus der Gruppe bestehend aus Brusttrauma und Kopftrauma, wobei das Verfahren dadurch gekennzeichnet ist, dass die Verbindung von Anspruch 1 verwendet wird.
- Pharmazeutische Zusammensetzung enthaltend einen pharmazeutisch annehmbaren Träger und eine Menge der Verbindung nach Anspruch 1, die wirksam ist, um die Aktivität von Stickoxidsynthase (NOS) bei einem Säugetier zu hemmen.
- Verfahren zur Herstellung eines Arzneimittels, das vorgesehen ist zur Hemmung der Aktivität von NOS bei einem Säugetier, dadurch gekennzeichnet, dass die Verbindung von Anspruch 1 verwendet wird.
- Pharmazeutische Zusammensetzung zur Behandlung einer Krankheit, eines Leidens oder eines Zustands bei einem Säugetier, wobei die Zusammensetzung einen pharmazeutisch annehmbaren Träger und eine Menge der Verbindung nach Anspruch 1 enthält, die wirksam ist, um die Aktivität von NOS in dem Säugetier zu hemmen und wobei die Krankheit, das Leiden oder der Zustand ist: eine akute Rückenmarksschädigung; ein Angstleiden ausgewählt aus der Gruppe bestehend aus Panikattacken, Agoraphobie, Panikleiden mit oder ohne Agoraphobie, Agoraphobie ohne eine Historie von Panikleiden, spezifischer Phobie, Sozialphobie, Zwangsstörungen, posttraumatischer Stresserkrankung und akuter Stresserkrankung; Krebs ausgewählt aus der Gruppe bestehend aus Hirn-, Brust-, Darm-, Lungen-, Leber-, Eierstock-, Prostata-, Haut- und Magenkrebs; Krebs ausgewählt aus der Gruppe bestehend aus Astrocytoma, Karzinoma, Glioblastoma, Leukämien, Lymphoma, Melanoma und Sarkoma; kognitive Störungen ausgewählt aus der Gruppe bestehend aus amnestischen Störungen, Delirien, Demenzen und unspezifischen oder nicht anders spezifizierten kognitiven Leiden; Erbrechen, Epilepsie; gastrointestinale Zustände ausgewählt aus der Gruppe bestehend aus Morbus Crohn, Colon irritabile und Colitis ulcerosa; Glaukom; Kopfschmerzleiden ausgewählt aus der Gruppe bestehend aus Migräne, Cluster-Kopfschmerz und vaskulären Kopfschmerzen; Chorea Huntington; entzündliche Leiden ausgewählt aus der Gruppe bestehend aus akuter undifferenzierter Erkrankung der Atmungsorgane bei Erwachsenen (ARDS), arthritischen Leiden, Asthma, dermatologischen Läsionen, Gicht, entzündlicher Darmkrankheit, nekrotisierenden Vaskulitiden, neurogener Entzündung, Psoriasis, Reperfusionsschädigung, Schlaganfall und Ganzkörperentzündungssyndrom; Makuladegeneration; Fettsucht; neurodegenerative Krankheiten ausgewählt aus der Gruppe bestehend aus Alzheimer-Krankheit, ALS, multipler Sklerose und Parkinson-Krankheit; pathologische Zustände ausgewählt aus der Gruppe bestehend aus Kardiomyopathie, diabetischer Neuropathie und diabetischer Nephropathie; psychotische Leiden ausgewählt aus der Gruppe bestehend aus Schizophrenie, schizophreniformen Leiden, schizoaffektiven Leiden, Wahnvorstellungen, kurzen psychotischen Störungen, geteilten psychotischen Störungen bzw. geteiltem Wahn, psychotischen Leiden auf Grund eines allgemeinen medizinischen Zustands und nicht anders spezifizierten psychotischen Leiden; Schlafstörungen ausgewählt aus der Gruppe bestehend aus primären Schlafstörungen, Schlafstörungen, die mit einem anderen mentalen Leiden in Zusammenhang stehen, Schlafstörungen auf Grund eines allgemeinen medizinischen Zustands und nicht in anderer Weise spezifizierten Schlafstörungen; Schlaganfall; Substanzmissbrauchsleiden ausgewählt aus der Gruppe bestehend aus mit Alkohol in Beziehung stehenden Leiden, mit Amphetamin in Beziehung stehenden Leiden, mit Koffein in Beziehung stehenden Leiden, mit Cannabis in Beziehung stehenden Leiden, mit Kokain in Beziehung stehenden Leiden, mit Halluzinogenen in Beziehung stehenden Leiden, mit Inhalationsmitteln in Beziehung stehenden Leiden, mit Nikotin in Beziehung stehenden Leiden, mit Opioiden in Beziehung stehenden Leiden, mit Phencyclidin in Beziehung stehenden Leiden, mit Beruhigungsmitteln in Beziehung stehenden Leiden, mit Hypnotika in Beziehung stehenden Leiden, mit angstlösenden Mitteln in Beziehung stehenden Leiden und Polysubstanz-abhängigen Leiden, einem toxämischen Zustand ausgewählt aus der Gruppe bestehend aus ARDS, hypovolämischem Schock, Neurontoxizität, septischem Schock und traumatischem Schock oder einem traumatischen Zustand ausgewählt aus der Gruppe bestehend aus Brusttrauma und Kopftrauma.
- Verfahren zur Herstellung eines Arzneimittel, das vorgesehen ist zur Behandlung eines Säugetiers, das von einer Krankheit, einem Leiden oder einem Zustand betroffen ist wie folgt: eine akute Rückenmarksschädigung; ein Angstleiden ausgewählt aus der Gruppe bestehend aus Panikattacken, Agoraphobie, Panikleiden mit oder ohne Agoraphobie, Agoraphobie ohne eine Historie von Panikleiden, spezifischer Phobie, Sozialphobie, Zwangsstörungen, posttraumatischer Stresserkrankung und akuter Stresserkrankung; Krebs ausgewählt aus der Gruppe bestehend aus Hirn-, Brust-, Darm-, Lungen-, Leber-, Eierstock-, Prostata-, Haut- und Magenkrebs; Krebs ausgewählt aus der Gruppe bestehend aus Astrocytoma, Karzinoma, Glioblastoma, Leukämien, Lymphoma, Melanoma und Sarkoma; kognitive Störungen ausgewählt aus der Gruppe bestehend aus amnestischen Störungen, Delirien, Demenzen und unspezifischen oder nicht anders spezifizierten kognitiven Leiden; Erbrechen, Epilepsie; gastrointestinale Zustände ausgewählt aus der Gruppe bestehend aus Morbus Crohn, Colon irritabile und Colitis ulcerosa; Glaukom; Kopfschmerzleiden ausgewählt aus der Gruppe bestehend aus Migräne, Cluster-Kopfschmerz und vaskulären Kopfschmerzen; Chorea Huntington; entzündliche Leiden ausgewählt aus der Gruppe bestehend aus akuter undifferenzierter Erkrankung der Atmungsorgane bei Erwachsenen (ARDS), arthritischen Leiden, Asthma, dermatologischen Läsionen, Gicht, entzündlicher Darmkrankheit, nekrotisierenden Vaskulitiden, neurogener Entzündung, Psoriasis, Reperfusionsschädigung, Schlaganfall und Ganzkörperentzündungssyndrom; Makuladegeneration; Fettsucht; neurodegenerative Krankheiten ausgewählt aus der Gruppe bestehend aus Alzheimer-Krankheit, ALS, multipler Sklerose und Parkinson-Krankheit; pathologische Zustände ausgewählt aus der Gruppe bestehend aus Kardiomyopathie, diabetischer Neuropathie und diabetischer Nephropathie; psychotische Leiden ausgewählt aus der Gruppe bestehend aus Schizophrenie, schizophreniformen Leiden, schizoaffektiven Leiden, Wahnvorstellungen, kurzen psychotischen Störungen, geteilten psychotischen Störungen bzw. geteiltem Wahn, psychotischen Leiden auf Grund eines allgemeinen medizinischen Zustands und nicht anders spezifizierten psychotischen Leiden; Schlafstörungen ausgewählt aus der Gruppe bestehend aus primären Schlafstörungen, Schlafstörungen, die mit einem anderen mentalen Leiden in Zusammenhang stehen, Schlafstörungen auf Grund eines allgemeinen medizinischen Zustands und nicht in anderer Weise spezifizierten Schlafstörungen; Schlaganfall; Substanzmissbrauchsleiden ausgewählt aus der Gruppe bestehend aus mit Alkohol in Beziehung stehenden Leiden, mit Amphetamin in Beziehung stehenden Leiden, mit Koffein in Beziehung stehenden Leiden, mit Cannabis in Beziehung stehenden Leiden, mit Kokain in Beziehung stehenden Leiden, mit Halluzinogenen in Beziehung stehenden Leiden, mit Inhalationsmitteln in Beziehung stehenden Leiden, mit Nikotin in Beziehung stehenden Leiden, mit Opioiden in Beziehung stehenden Leiden, mit Phencyclidin in Beziehung stehenden Leiden, mit Beruhigungsmitteln in Beziehung stehenden Leiden, mit Hypnotika in Beziehung stehenden Leiden, mit angstlösenden Mitteln in Beziehung stehenden Leiden und Polysubstanz-abhängigen Leiden, einem toxämischen Zustand ausgewählt aus der Gruppe bestehend aus ARDS, hypovolämischem Schock, Neurontoxizität, septischem Schock und traumatischem Schock oder einem traumatischen Zustand ausgewählt aus der Gruppe bestehend aus Brusttrauma und Kopftrauma, wobei das Verfahren dadurch gekennzeichnet ist, dass die Verbindung von Anspruch 1 verwendet wird, um die Aktivität von NOS bei einem Säugetier zu hemmen.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US12159799P | 1999-02-25 | 1999-02-25 | |
| US121597P | 1999-02-25 | ||
| PCT/IB2000/000109 WO2000050400A1 (en) | 1999-02-25 | 2000-02-02 | 2-aminopyridines containing fused ring substituents |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE60003893D1 DE60003893D1 (de) | 2003-08-21 |
| DE60003893T2 true DE60003893T2 (de) | 2004-02-05 |
Family
ID=22397690
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE60003893T Expired - Fee Related DE60003893T2 (de) | 1999-02-25 | 2000-02-02 | 2-aminopyridine mit kondensierten ringsubstituenten |
Country Status (44)
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20010049379A1 (en) * | 1997-08-27 | 2001-12-06 | Lowe John Adams | 2-aminopyridines containing fused ring substituents |
| IL144308A0 (en) * | 1999-02-25 | 2002-05-23 | Pfizer Prod Inc | 2-aminopyridines containing fused ring substituents |
| BR0109706A (pt) | 2000-03-31 | 2003-02-04 | Euro Celtique Sa | Aminopiridinas e seus usos como anticonvulsivantes e bloqueadores dos canais de sódio |
| US20040092741A1 (en) * | 2002-11-08 | 2004-05-13 | Pfizer Inc | Substituted pyridines via boronic acid coupling |
| US8729107B2 (en) * | 2002-12-06 | 2014-05-20 | Purdue Research Foundation | Pyridines for treating injured mammalian nerve tissue |
| WO2004052291A2 (en) * | 2002-12-06 | 2004-06-24 | Purdue Research Foundation | Pyridines for treating injured mammalian nerve tissue |
| US20050192321A1 (en) * | 2003-09-15 | 2005-09-01 | Meythaler Jay M. | Treatment of neuropathy with rapid release aminopyridine |
| WO2014138460A1 (en) | 2013-03-07 | 2014-09-12 | Northwestern University | 2-aminopyridine-based selective neuronal nitric oxide synthase inhibitors |
| US10759791B2 (en) | 2014-11-04 | 2020-09-01 | Northwestern University | Mammalian and bacterial nitric oxide synthase inhibitors |
| EP3215497A4 (de) | 2014-11-04 | 2018-11-07 | Northwestern University | Säugetier- und bakterielle stickoxid-synthaseinhibitoren |
| US9585867B2 (en) | 2015-08-06 | 2017-03-07 | Charles Everett Ankner | Cannabinod formulation for the sedation of a human or animal |
| US12213973B2 (en) | 2021-10-18 | 2025-02-04 | Northwestern University | Bacterial nitric oxide synthase inhibitors |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU4515696A (en) * | 1994-12-12 | 1996-07-03 | Merck & Co., Inc. | Substituted 2-aminopyridines as inhibitors of nitric oxide synthase |
| JPH101435A (ja) * | 1995-09-14 | 1998-01-06 | Nippon Kayaku Co Ltd | 2−アミノピリジン類を有効成分とする一酸化窒素合成酵素阻害剤 |
| EP0891332B1 (de) * | 1996-03-29 | 2004-03-17 | Pfizer Inc. | 6-phenylpyridinderivate |
| HN1997000027A (es) | 1996-12-06 | 1997-06-05 | Pfizer Prod Inc | Derivados de 6-fenil piridil - 2 amina |
| SK101199A3 (en) * | 1997-02-10 | 2000-10-09 | Pfizer Prod Inc | 2-amino-6-(2-substituted-4-phenoxy)-substituted-pyridines, their use and pharmaceutical compositions based thereupon |
| HN1998000118A (es) * | 1997-08-27 | 1999-02-09 | Pfizer Prod Inc | 2 - aminopiridinas que contienen sustituyentes de anillos condensados. |
| HN1998000125A (es) * | 1997-08-28 | 1999-02-09 | Pfizer Prod Inc | 2-aminopiridinas con sustituyentes alcoxi ramificados |
| EA003991B1 (ru) * | 1998-06-03 | 2003-12-25 | Пфайзер Продактс Инк. | Производные 2-аминопиридинов, способ ингибирования синтазы оксида азота, фармацевтические композиции и способы лечения |
| IL144308A0 (en) * | 1999-02-25 | 2002-05-23 | Pfizer Prod Inc | 2-aminopyridines containing fused ring substituents |
-
2000
- 2000-02-02 IL IL14430800A patent/IL144308A0/xx unknown
- 2000-02-02 CA CA002364719A patent/CA2364719C/en not_active Expired - Fee Related
- 2000-02-02 AU AU21243/00A patent/AU767593B2/en not_active Ceased
- 2000-02-02 NZ NZ512912A patent/NZ512912A/en unknown
- 2000-02-02 WO PCT/IB2000/000109 patent/WO2000050400A1/en not_active Ceased
- 2000-02-02 SK SK1202-2001A patent/SK12022001A3/sk unknown
- 2000-02-02 ES ES00901285T patent/ES2200813T3/es not_active Expired - Lifetime
- 2000-02-02 EA EA200100816A patent/EA003941B1/ru not_active IP Right Cessation
- 2000-02-02 EE EEP200100454A patent/EE200100454A/xx unknown
- 2000-02-02 OA OA1200100224A patent/OA11841A/en unknown
- 2000-02-02 PT PT00901285T patent/PT1155000E/pt unknown
- 2000-02-02 AP APAP/P/2001/002251A patent/AP2001002251A0/en unknown
- 2000-02-02 DE DE60003893T patent/DE60003893T2/de not_active Expired - Fee Related
- 2000-02-02 MX MXPA01008671A patent/MXPA01008671A/es active IP Right Grant
- 2000-02-02 AT AT00901285T patent/ATE245143T1/de not_active IP Right Cessation
- 2000-02-02 EP EP00901285A patent/EP1155000B1/de not_active Expired - Lifetime
- 2000-02-02 HR HR20010597A patent/HRP20010597A2/hr not_active Application Discontinuation
- 2000-02-02 PL PL00350219A patent/PL350219A1/xx not_active Application Discontinuation
- 2000-02-02 JP JP2000600983A patent/JP3825636B2/ja not_active Expired - Fee Related
- 2000-02-02 DK DK00901285T patent/DK1155000T3/da active
- 2000-02-02 BR BR0008569-3A patent/BR0008569A/pt not_active IP Right Cessation
- 2000-02-02 YU YU58301A patent/YU58301A/sh unknown
- 2000-02-02 KR KR1020017010899A patent/KR20010114213A/ko not_active Ceased
- 2000-02-02 TR TR2001/02481T patent/TR200102481T2/xx unknown
- 2000-02-02 HU HU0200163A patent/HUP0200163A3/hu unknown
- 2000-02-02 ID IDW00200101819A patent/ID29892A/id unknown
- 2000-02-02 CZ CZ20013036A patent/CZ20013036A3/cs unknown
- 2000-02-02 CN CN00804126A patent/CN1341099A/zh active Pending
- 2000-02-03 HN HN2000000016A patent/HN2000000016A/es unknown
- 2000-02-15 US US09/504,989 patent/US6211208B1/en not_active Expired - Fee Related
- 2000-02-17 PA PA20008490901A patent/PA8490901A1/es unknown
- 2000-02-23 AR ARP000100767A patent/AR018979A1/es unknown
- 2000-02-23 CO CO00012733A patent/CO5160241A1/es unknown
- 2000-02-23 DZ DZ000036A patent/DZ3017A1/xx active
- 2000-02-23 TN TNTNSN00034A patent/TNSN00034A1/fr unknown
- 2000-02-23 MA MA25912A patent/MA26721A1/fr unknown
- 2000-02-23 PE PE2000000146A patent/PE20001482A1/es not_active Application Discontinuation
- 2000-02-24 SV SV2000000026A patent/SV2002000026A/es not_active Application Discontinuation
- 2000-02-24 GT GT200000021A patent/GT200000021A/es unknown
-
2001
- 2001-02-08 US US09/779,318 patent/US6372768B2/en not_active Expired - Fee Related
- 2001-07-13 IS IS6005A patent/IS6005A/is unknown
- 2001-08-08 CR CR6438A patent/CR6438A/es unknown
- 2001-08-23 NO NO20014095A patent/NO20014095L/no not_active Application Discontinuation
- 2001-08-23 ZA ZA200106974A patent/ZA200106974B/en unknown
- 2001-08-30 BG BG105855A patent/BG105855A/xx unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69725465T2 (de) | 6-phenylpyridyl-2-amin-derivate verwendbar als nos-inhibitoren | |
| DE69817584T2 (de) | 2-aminopyridin enthaltende kondensierte zyklische systeme als nos hemme | |
| DE69109871T2 (de) | Pyridin- und pyridin-n-oxid-derivate von diarylmethyl- piperidinen oder piperazinen, deren zusammensetzungen und anwendung. | |
| EP0270947B1 (de) | Substituierte basische 2-Aminotetraline | |
| DE69329386T2 (de) | Substituierte benzylaminoquinuclidine als substanz p antagonisten | |
| DE69333143T2 (de) | Substituierte chinuclidine als substanz p antagonisten | |
| DE69732966T2 (de) | Substituierte indazolderivate und ihre verwendung als inhibitoren des phosphodiesterase (pde) des typs iv und der produktion des tumor nekrosis faktors (tnf) | |
| DE69523155T2 (de) | Benzimidazolonderivate mit zentraler dopaminerger aktivität | |
| DE69825147T2 (de) | 2-amino-6-(2-substituierte-4-phenoxy)-substituierte-pyridine | |
| DE69804635T2 (de) | Verzweigte alkoxy-substituierte 2-aminopyridine als nos inhibitoren | |
| DE9290063U1 (de) | Chinuclidin-Derivate | |
| DE60003893T2 (de) | 2-aminopyridine mit kondensierten ringsubstituenten | |
| DE69533284T2 (de) | Neue cyclische und acyclische amide zur erhöhung der neurotransmitter ausschüttung | |
| EP0547517B1 (de) | Neue Pyridylderivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zu ihrer Herstellung | |
| DE60203820T2 (de) | Pyridinderivate als nmda-rezeptorliganden | |
| RS58301B1 (sr) | Stabilne formulacije za parenteralnu primenu tapentadola | |
| DE4424714A1 (de) | Neue chemische Verbindung, ihre Herstellung und ihre Verwendung als Arnzneistoff | |
| DE69822300T2 (de) | 3-pyridyl-1-azabicycloalkan-derivate zur behandlung von zns-erkrankungen | |
| DE2257310A1 (de) | 3-substituierte alkenylenamine | |
| DE69923448T2 (de) | 2-aminopyridine mit kondensierten ringsubstituenten als stickstoff-oxid-synthase inhibitoren | |
| DE60215837T2 (de) | 2-amino-6-(2,4,5-substituierte-phenyl)-pyridine zur verwendung als stickoxid-synthase-hemmer | |
| DD228811A1 (de) | Verfahren zur herstellung von neuen triazolopyrimidinen | |
| DE19908539A1 (de) | Polycyclische 2-Amino-Dihydrothiazolsysteme, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel | |
| EP0113911B1 (de) | Pyrido-triazolochinazoline, ihre Herstellung und Verwendung | |
| DE2931010A1 (de) | Neue vinyloge carboxamide, diese enthaltende arzneimittel und verfahren zur herstellung |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |