RU2658919C2 - Замещенные бензольные соединения - Google Patents
Замещенные бензольные соединения Download PDFInfo
- Publication number
- RU2658919C2 RU2658919C2 RU2015118145A RU2015118145A RU2658919C2 RU 2658919 C2 RU2658919 C2 RU 2658919C2 RU 2015118145 A RU2015118145 A RU 2015118145A RU 2015118145 A RU2015118145 A RU 2015118145A RU 2658919 C2 RU2658919 C2 RU 2658919C2
- Authority
- RU
- Russia
- Prior art keywords
- alkyl
- compound
- substituted
- piperidine
- substituent
- Prior art date
Links
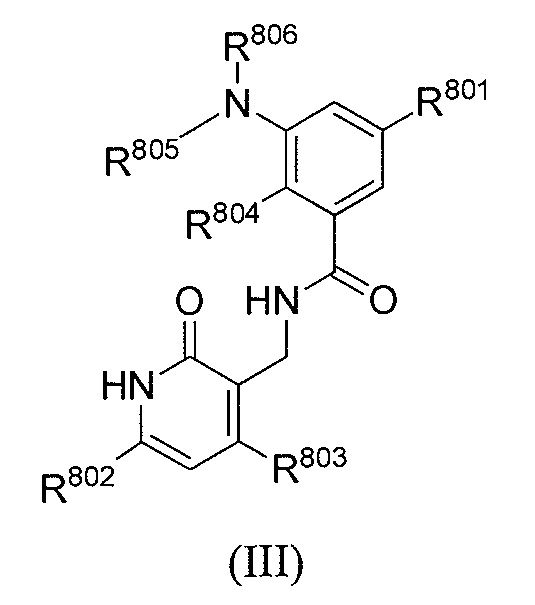
- 125000001997 phenyl group Chemical class [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 title claims abstract description 32
- 150000001875 compounds Chemical class 0.000 claims abstract description 405
- -1 Tx is H Chemical group 0.000 claims abstract description 283
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 237
- 125000001424 substituent group Chemical group 0.000 claims abstract description 161
- 238000000034 method Methods 0.000 claims abstract description 127
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 claims abstract description 117
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 claims abstract description 117
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 104
- 150000002367 halogens Chemical class 0.000 claims abstract description 103
- 102100038970 Histone-lysine N-methyltransferase EZH2 Human genes 0.000 claims abstract description 86
- 101000882127 Homo sapiens Histone-lysine N-methyltransferase EZH2 Proteins 0.000 claims abstract description 86
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims abstract description 79
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 claims abstract description 74
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 claims abstract description 70
- 150000003839 salts Chemical class 0.000 claims abstract description 66
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 62
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims abstract description 59
- 238000011282 treatment Methods 0.000 claims abstract description 59
- 201000011510 cancer Diseases 0.000 claims abstract description 50
- 230000000694 effects Effects 0.000 claims abstract description 41
- 125000003386 piperidinyl group Chemical group 0.000 claims abstract description 41
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims abstract description 40
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 claims abstract description 27
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 26
- DHXVGJBLRPWPCS-UHFFFAOYSA-N Tetrahydropyran Chemical compound C1CCOCC1 DHXVGJBLRPWPCS-UHFFFAOYSA-N 0.000 claims abstract description 25
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims abstract description 22
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 claims abstract description 20
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 20
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims abstract description 19
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims abstract description 17
- 125000005647 linker group Chemical group 0.000 claims abstract description 16
- 125000001412 tetrahydropyranyl group Chemical group 0.000 claims abstract description 13
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 claims abstract description 12
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 claims abstract description 10
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 claims abstract description 10
- MGADZUXDNSDTHW-UHFFFAOYSA-N 2H-pyran Chemical compound C1OC=CC=C1 MGADZUXDNSDTHW-UHFFFAOYSA-N 0.000 claims abstract description 9
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 claims abstract description 8
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims abstract description 8
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims abstract description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims abstract description 5
- 150000003536 tetrazoles Chemical class 0.000 claims abstract description 5
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 claims abstract description 4
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 claims abstract description 4
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 claims abstract description 4
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims abstract description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 claims abstract description 4
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical compound C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 claims abstract description 4
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 claims abstract description 4
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 claims abstract description 4
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims abstract description 4
- 150000003852 triazoles Chemical class 0.000 claims abstract description 4
- 229930192474 thiophene Natural products 0.000 claims abstract description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 103
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims description 101
- 229910052739 hydrogen Inorganic materials 0.000 claims description 61
- 229910052757 nitrogen Inorganic materials 0.000 claims description 61
- 125000002393 azetidinyl group Chemical group 0.000 claims description 47
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 47
- 125000000623 heterocyclic group Chemical group 0.000 claims description 47
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 45
- 125000003545 alkoxy group Chemical group 0.000 claims description 31
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 28
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 28
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 27
- AAOVKJBEBIDNHE-UHFFFAOYSA-N diazepam Chemical compound N=1CC(=O)N(C)C2=CC=C(Cl)C=C2C=1C1=CC=CC=C1 AAOVKJBEBIDNHE-UHFFFAOYSA-N 0.000 claims description 23
- 208000035475 disorder Diseases 0.000 claims description 22
- 229910052731 fluorine Inorganic materials 0.000 claims description 19
- 230000001404 mediated effect Effects 0.000 claims description 19
- 108010036115 Histone Methyltransferases Proteins 0.000 claims description 17
- 102000011787 Histone Methyltransferases Human genes 0.000 claims description 17
- 150000003053 piperidines Chemical group 0.000 claims description 17
- 125000003282 alkyl amino group Chemical group 0.000 claims description 15
- QPMLSUSACCOBDK-UHFFFAOYSA-N diazepane Chemical compound C1CCNNCC1 QPMLSUSACCOBDK-UHFFFAOYSA-N 0.000 claims description 14
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 13
- 208000032839 leukemia Diseases 0.000 claims description 13
- 239000003814 drug Substances 0.000 claims description 12
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 12
- 206010025323 Lymphomas Diseases 0.000 claims description 11
- 239000003937 drug carrier Substances 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 10
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 10
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 8
- 201000003444 follicular lymphoma Diseases 0.000 claims description 8
- 201000003445 large cell neuroendocrine carcinoma Diseases 0.000 claims description 8
- 150000004885 piperazines Chemical group 0.000 claims description 8
- 125000004076 pyridyl group Chemical group 0.000 claims description 8
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 8
- 208000008938 Rhabdoid tumor Diseases 0.000 claims description 7
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 7
- 125000004104 aryloxy group Chemical group 0.000 claims description 6
- 125000002883 imidazolyl group Chemical group 0.000 claims description 6
- GRVDJDISBSALJP-UHFFFAOYSA-N methyloxidanyl Chemical group [O]C GRVDJDISBSALJP-UHFFFAOYSA-N 0.000 claims description 6
- 125000003373 pyrazinyl group Chemical group 0.000 claims description 6
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 5
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 5
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 5
- 201000001441 melanoma Diseases 0.000 claims description 5
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 5
- 101000835860 Homo sapiens SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily B member 1 Proteins 0.000 claims description 4
- 102100025746 SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily B member 1 Human genes 0.000 claims description 4
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 3
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 3
- 230000002950 deficient Effects 0.000 claims description 3
- RABBMOYULJIAFU-UHFFFAOYSA-N 1h-pyrrole;thiophene Chemical compound C=1C=CNC=1.C=1C=CSC=1 RABBMOYULJIAFU-UHFFFAOYSA-N 0.000 claims 1
- 239000002075 main ingredient Substances 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 19
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 abstract 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract 1
- 125000003118 aryl group Chemical group 0.000 description 110
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 81
- 125000006568 (C4-C7) heterocycloalkyl group Chemical group 0.000 description 74
- 239000000203 mixture Substances 0.000 description 68
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 65
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 61
- 125000005842 heteroatom Chemical group 0.000 description 52
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 52
- 230000015572 biosynthetic process Effects 0.000 description 49
- 238000005859 coupling reaction Methods 0.000 description 49
- 125000004093 cyano group Chemical group *C#N 0.000 description 49
- 239000000243 solution Substances 0.000 description 47
- 238000003786 synthesis reaction Methods 0.000 description 46
- 150000001408 amides Chemical class 0.000 description 45
- 239000002253 acid Substances 0.000 description 42
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 description 41
- 229910052799 carbon Inorganic materials 0.000 description 41
- 239000002904 solvent Substances 0.000 description 40
- HEMHJVSKTPXQMS-UHFFFAOYSA-M sodium hydroxide Inorganic materials [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 38
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 37
- 238000006268 reductive amination reaction Methods 0.000 description 37
- 239000002585 base Substances 0.000 description 36
- 230000004048 modification Effects 0.000 description 36
- 238000012986 modification Methods 0.000 description 36
- BAQLUVXNKOTTHU-UHFFFAOYSA-N metofenazate Chemical group COC1=C(OC)C(OC)=CC(C(=O)OCCN2CCN(CCCN3C4=CC(Cl)=CC=C4SC4=CC=CC=C43)CC2)=C1 BAQLUVXNKOTTHU-UHFFFAOYSA-N 0.000 description 35
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 35
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 34
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 34
- 239000012453 solvate Substances 0.000 description 34
- 238000006243 chemical reaction Methods 0.000 description 33
- 229910052760 oxygen Inorganic materials 0.000 description 33
- 125000002757 morpholinyl group Chemical group 0.000 description 32
- 239000002798 polar solvent Substances 0.000 description 32
- 229910052717 sulfur Chemical group 0.000 description 32
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 32
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 32
- 125000000304 alkynyl group Chemical group 0.000 description 29
- 150000002148 esters Chemical class 0.000 description 29
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 28
- 125000003277 amino group Chemical group 0.000 description 28
- 125000004043 oxo group Chemical group O=* 0.000 description 28
- 125000004429 atom Chemical group 0.000 description 27
- 125000004193 piperazinyl group Chemical group 0.000 description 27
- 229920006395 saturated elastomer Polymers 0.000 description 26
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 25
- 239000001257 hydrogen Substances 0.000 description 25
- 239000001301 oxygen Chemical group 0.000 description 25
- 125000003342 alkenyl group Chemical group 0.000 description 24
- 125000004432 carbon atom Chemical group C* 0.000 description 24
- 238000010511 deprotection reaction Methods 0.000 description 24
- 125000002632 imidazolidinyl group Chemical group 0.000 description 24
- 125000000160 oxazolidinyl group Chemical group 0.000 description 24
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 24
- 125000003965 isoxazolidinyl group Chemical group 0.000 description 23
- 150000001412 amines Chemical class 0.000 description 22
- 201000010099 disease Diseases 0.000 description 22
- 239000012634 fragment Substances 0.000 description 22
- 229910052763 palladium Inorganic materials 0.000 description 22
- 239000011541 reaction mixture Substances 0.000 description 22
- 125000005310 triazolidinyl group Chemical group N1(NNCC1)* 0.000 description 22
- 125000000524 functional group Chemical group 0.000 description 21
- 239000000460 chlorine Substances 0.000 description 20
- 238000005932 reductive alkylation reaction Methods 0.000 description 20
- 108010033040 Histones Proteins 0.000 description 19
- 230000011987 methylation Effects 0.000 description 19
- 238000007069 methylation reaction Methods 0.000 description 19
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 18
- 229910052801 chlorine Inorganic materials 0.000 description 18
- 125000003566 oxetanyl group Chemical group 0.000 description 18
- 230000002829 reductive effect Effects 0.000 description 18
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 17
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 17
- 239000003153 chemical reaction reagent Substances 0.000 description 17
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 17
- 125000002053 thietanyl group Chemical group 0.000 description 17
- 210000004027 cell Anatomy 0.000 description 16
- 125000005962 1,4-oxazepanyl group Chemical group 0.000 description 15
- 150000001299 aldehydes Chemical class 0.000 description 15
- 230000003197 catalytic effect Effects 0.000 description 15
- 125000000753 cycloalkyl group Chemical group 0.000 description 15
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 15
- 239000007787 solid Substances 0.000 description 15
- 238000005160 1H NMR spectroscopy Methods 0.000 description 14
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 14
- 238000006069 Suzuki reaction reaction Methods 0.000 description 14
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 14
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 14
- 125000004663 dialkyl amino group Chemical group 0.000 description 14
- 238000012360 testing method Methods 0.000 description 14
- 125000005960 1,4-diazepanyl group Chemical group 0.000 description 13
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 13
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 13
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 13
- 239000003054 catalyst Substances 0.000 description 13
- 238000005984 hydrogenation reaction Methods 0.000 description 13
- 239000011734 sodium Substances 0.000 description 13
- 238000003756 stirring Methods 0.000 description 13
- 238000006467 substitution reaction Methods 0.000 description 13
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 12
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 12
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 12
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 12
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 12
- 239000003638 chemical reducing agent Substances 0.000 description 12
- 150000002431 hydrogen Chemical class 0.000 description 12
- 230000035772 mutation Effects 0.000 description 12
- 239000000758 substrate Substances 0.000 description 12
- 239000011593 sulfur Chemical group 0.000 description 12
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 11
- 125000004448 alkyl carbonyl group Chemical group 0.000 description 11
- 239000012298 atmosphere Substances 0.000 description 11
- 125000000852 azido group Chemical group *N=[N+]=[N-] 0.000 description 11
- 229910052794 bromium Inorganic materials 0.000 description 11
- 238000007385 chemical modification Methods 0.000 description 11
- 230000008878 coupling Effects 0.000 description 11
- 238000010168 coupling process Methods 0.000 description 11
- 150000002576 ketones Chemical class 0.000 description 11
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 11
- 239000012044 organic layer Substances 0.000 description 11
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 description 10
- QHRUXDXIVIYFJJ-UHFFFAOYSA-N 3-(aminomethyl)-1h-pyridin-2-one Chemical class NCC1=CC=CNC1=O QHRUXDXIVIYFJJ-UHFFFAOYSA-N 0.000 description 10
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 10
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 10
- 230000029936 alkylation Effects 0.000 description 10
- 239000000543 intermediate Substances 0.000 description 10
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 10
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 10
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 10
- 239000007858 starting material Substances 0.000 description 10
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 10
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 9
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 9
- 238000005804 alkylation reaction Methods 0.000 description 9
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 9
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 9
- 229910000024 caesium carbonate Inorganic materials 0.000 description 9
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 9
- 239000011737 fluorine Substances 0.000 description 9
- 239000007789 gas Substances 0.000 description 9
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 9
- 239000000463 material Substances 0.000 description 9
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 8
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 8
- 125000004442 acylamino group Chemical group 0.000 description 8
- 125000004947 alkyl aryl amino group Chemical group 0.000 description 8
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 125000001769 aryl amino group Chemical group 0.000 description 8
- 150000007942 carboxylates Chemical class 0.000 description 8
- DGJMPUGMZIKDRO-UHFFFAOYSA-N cyanoacetamide Chemical compound NC(=O)CC#N DGJMPUGMZIKDRO-UHFFFAOYSA-N 0.000 description 8
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 8
- 125000004986 diarylamino group Chemical group 0.000 description 8
- 239000002552 dosage form Substances 0.000 description 8
- 238000004128 high performance liquid chromatography Methods 0.000 description 8
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 8
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 8
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 8
- 125000006239 protecting group Chemical group 0.000 description 8
- 125000004434 sulfur atom Chemical group 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 8
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 7
- 241000282412 Homo Species 0.000 description 7
- 229910019142 PO4 Inorganic materials 0.000 description 7
- 125000005194 alkoxycarbonyloxy group Chemical group 0.000 description 7
- 125000002877 alkyl aryl group Chemical group 0.000 description 7
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 7
- 125000004644 alkyl sulfinyl group Chemical group 0.000 description 7
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 7
- 125000005199 aryl carbonyloxy group Chemical group 0.000 description 7
- 125000005110 aryl thio group Chemical group 0.000 description 7
- 125000005200 aryloxy carbonyloxy group Chemical group 0.000 description 7
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 7
- 230000014509 gene expression Effects 0.000 description 7
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 7
- 229910000041 hydrogen chloride Inorganic materials 0.000 description 7
- 230000007062 hydrolysis Effects 0.000 description 7
- 238000006460 hydrolysis reaction Methods 0.000 description 7
- 230000002401 inhibitory effect Effects 0.000 description 7
- 125000004430 oxygen atom Chemical group O* 0.000 description 7
- 235000021317 phosphate Nutrition 0.000 description 7
- 108090000623 proteins and genes Proteins 0.000 description 7
- 150000003467 sulfuric acid derivatives Chemical group 0.000 description 7
- 238000003419 tautomerization reaction Methods 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 7
- PCJPGNCABBDNJU-UHFFFAOYSA-N 3-(aminomethyl)-4,6-dimethyl-1h-pyridin-2-one Chemical compound CC1=CC(C)=C(CN)C(=O)N1 PCJPGNCABBDNJU-UHFFFAOYSA-N 0.000 description 6
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 6
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 6
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 6
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 6
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 6
- 150000001204 N-oxides Chemical class 0.000 description 6
- 208000006994 Precancerous Conditions Diseases 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 206010039491 Sarcoma Diseases 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 6
- 125000001931 aliphatic group Chemical group 0.000 description 6
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 6
- 235000001014 amino acid Nutrition 0.000 description 6
- 150000001413 amino acids Chemical class 0.000 description 6
- 150000001450 anions Chemical class 0.000 description 6
- 125000005129 aryl carbonyl group Chemical group 0.000 description 6
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 6
- 229910002091 carbon monoxide Inorganic materials 0.000 description 6
- 239000003795 chemical substances by application Substances 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 229910052740 iodine Inorganic materials 0.000 description 6
- 239000011630 iodine Substances 0.000 description 6
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 6
- TWBYWOBDOCUKOW-UHFFFAOYSA-N isonicotinic acid Chemical class OC(=O)C1=CC=NC=C1 TWBYWOBDOCUKOW-UHFFFAOYSA-N 0.000 description 6
- MNXLJDUZJCMJCI-UHFFFAOYSA-N methyl 3-amino-5-bromobenzoate Chemical class COC(=O)C1=CC(N)=CC(Br)=C1 MNXLJDUZJCMJCI-UHFFFAOYSA-N 0.000 description 6
- 238000006396 nitration reaction Methods 0.000 description 6
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 6
- 239000010452 phosphate Substances 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 230000002265 prevention Effects 0.000 description 6
- 230000007017 scission Effects 0.000 description 6
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 6
- 229910000029 sodium carbonate Inorganic materials 0.000 description 6
- 125000005420 sulfonamido group Chemical group S(=O)(=O)(N*)* 0.000 description 6
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 5
- 101150090105 Ezh2 gene Proteins 0.000 description 5
- 101100465401 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) SCL1 gene Proteins 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- 125000002252 acyl group Chemical group 0.000 description 5
- 125000004691 alkyl thio carbonyl group Chemical group 0.000 description 5
- 229910052786 argon Inorganic materials 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 239000004615 ingredient Substances 0.000 description 5
- 150000004702 methyl esters Chemical class 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 238000007254 oxidation reaction Methods 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 238000006722 reduction reaction Methods 0.000 description 5
- 239000000523 sample Substances 0.000 description 5
- 125000001544 thienyl group Chemical group 0.000 description 5
- 150000003568 thioethers Chemical class 0.000 description 5
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- DYUMBFTYRJMAFK-UHFFFAOYSA-N 3-cyano-2-pyridone Chemical compound OC1=NC=CC=C1C#N DYUMBFTYRJMAFK-UHFFFAOYSA-N 0.000 description 4
- 208000036832 Adenocarcinoma of ovary Diseases 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 238000007125 Buchwald synthesis reaction Methods 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 208000000172 Medulloblastoma Diseases 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 4
- 206010061328 Ovarian epithelial cancer Diseases 0.000 description 4
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- 238000000297 Sandmeyer reaction Methods 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- YPWFISCTZQNZAU-UHFFFAOYSA-N Thiane Chemical compound C1CCSCC1 YPWFISCTZQNZAU-UHFFFAOYSA-N 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 description 4
- 125000004414 alkyl thio group Chemical group 0.000 description 4
- 239000002168 alkylating agent Substances 0.000 description 4
- 229940100198 alkylating agent Drugs 0.000 description 4
- 238000005576 amination reaction Methods 0.000 description 4
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 4
- 235000019270 ammonium chloride Nutrition 0.000 description 4
- 238000010171 animal model Methods 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 235000010233 benzoic acid Nutrition 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 150000001768 cations Chemical class 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 238000005660 chlorination reaction Methods 0.000 description 4
- 125000001309 chloro group Chemical group Cl* 0.000 description 4
- 229940125782 compound 2 Drugs 0.000 description 4
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 4
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 4
- 125000005959 diazepanyl group Chemical group 0.000 description 4
- 239000006185 dispersion Substances 0.000 description 4
- 230000032050 esterification Effects 0.000 description 4
- 238000005886 esterification reaction Methods 0.000 description 4
- 235000019439 ethyl acetate Nutrition 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 125000002541 furyl group Chemical group 0.000 description 4
- 150000002430 hydrocarbons Chemical group 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 229910052742 iron Inorganic materials 0.000 description 4
- 125000001786 isothiazolyl group Chemical group 0.000 description 4
- 125000000842 isoxazolyl group Chemical group 0.000 description 4
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 4
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 4
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 4
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- 230000003000 nontoxic effect Effects 0.000 description 4
- 208000013371 ovarian adenocarcinoma Diseases 0.000 description 4
- 201000006588 ovary adenocarcinoma Diseases 0.000 description 4
- 125000002971 oxazolyl group Chemical group 0.000 description 4
- 239000007800 oxidant agent Substances 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 201000002528 pancreatic cancer Diseases 0.000 description 4
- 208000008443 pancreatic carcinoma Diseases 0.000 description 4
- 208000003154 papilloma Diseases 0.000 description 4
- RAIYODFGMLZUDF-UHFFFAOYSA-N piperidin-1-ium;acetate Chemical compound CC([O-])=O.C1CC[NH2+]CC1 RAIYODFGMLZUDF-UHFFFAOYSA-N 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 150000003335 secondary amines Chemical class 0.000 description 4
- 125000003003 spiro group Chemical group 0.000 description 4
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical group [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 4
- 150000003462 sulfoxides Chemical class 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- 125000000335 thiazolyl group Chemical group 0.000 description 4
- 125000002813 thiocarbonyl group Chemical group *C(*)=S 0.000 description 4
- 150000003573 thiols Chemical class 0.000 description 4
- 230000009466 transformation Effects 0.000 description 4
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 3
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 3
- GZNMYDYALSFMOX-UHFFFAOYSA-N 6-methyl-2-oxo-4-propan-2-yl-1h-pyridine-3-carbonitrile Chemical compound CC(C)C=1C=C(C)NC(=O)C=1C#N GZNMYDYALSFMOX-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 201000008271 Atypical teratoid rhabdoid tumor Diseases 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N Benzoic acid Natural products OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- IDBRRKQCWMMDPD-HZCBDIJESA-N C=1C(C=2C=CC(O)=CC=2)=CC(C(=O)OC)=C(C)C=1N(CC)[C@H]1CC[C@H](NC(=O)OC(C)(C)C)CC1 Chemical compound C=1C(C=2C=CC(O)=CC=2)=CC(C(=O)OC)=C(C)C=1N(CC)[C@H]1CC[C@H](NC(=O)OC(C)(C)C)CC1 IDBRRKQCWMMDPD-HZCBDIJESA-N 0.000 description 3
- 208000005243 Chondrosarcoma Diseases 0.000 description 3
- 208000006168 Ewing Sarcoma Diseases 0.000 description 3
- 102100033636 Histone H3.2 Human genes 0.000 description 3
- 239000004472 Lysine Substances 0.000 description 3
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 238000005481 NMR spectroscopy Methods 0.000 description 3
- 201000010133 Oligodendroglioma Diseases 0.000 description 3
- 206010033128 Ovarian cancer Diseases 0.000 description 3
- 206010061535 Ovarian neoplasm Diseases 0.000 description 3
- 208000007541 Preleukemia Diseases 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 3
- 150000001351 alkyl iodides Chemical class 0.000 description 3
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 3
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 125000001246 bromo group Chemical group Br* 0.000 description 3
- 239000002775 capsule Substances 0.000 description 3
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 3
- 150000001735 carboxylic acids Chemical class 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 3
- 125000004473 dialkylaminocarbonyl group Chemical group 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 125000001153 fluoro group Chemical group F* 0.000 description 3
- 238000013537 high throughput screening Methods 0.000 description 3
- 150000004677 hydrates Chemical class 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- ZELBPZUMIQAQKE-UHFFFAOYSA-N methyl 3-[ethyl-[4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]-2-methyl-5-(6-oxo-1H-pyridin-3-yl)benzoate Chemical compound C=1C(C2=CNC(=O)C=C2)=CC(C(=O)OC)=C(C)C=1N(CC)C1CCC(NC(=O)OC(C)(C)C)CC1 ZELBPZUMIQAQKE-UHFFFAOYSA-N 0.000 description 3
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- AHKJGIUKIBGOKH-UHFFFAOYSA-N morpholine;piperidine Chemical compound C1CCNCC1.C1COCCN1 AHKJGIUKIBGOKH-UHFFFAOYSA-N 0.000 description 3
- 230000003287 optical effect Effects 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 3
- ACVYVLVWPXVTIT-UHFFFAOYSA-M phosphinate Chemical compound [O-][PH2]=O ACVYVLVWPXVTIT-UHFFFAOYSA-M 0.000 description 3
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- 150000003141 primary amines Chemical class 0.000 description 3
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 3
- 235000018102 proteins Nutrition 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 125000002098 pyridazinyl group Chemical group 0.000 description 3
- 125000000168 pyrrolyl group Chemical group 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- 150000003457 sulfones Chemical class 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 3
- 125000003831 tetrazolyl group Chemical group 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 238000004809 thin layer chromatography Methods 0.000 description 3
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 description 2
- 125000006656 (C2-C4) alkenyl group Chemical group 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- YZUPZGFPHUVJKC-UHFFFAOYSA-N 1-bromo-2-methoxyethane Chemical compound COCCBr YZUPZGFPHUVJKC-UHFFFAOYSA-N 0.000 description 2
- PAQZWJGSJMLPMG-UHFFFAOYSA-N 2,4,6-tripropyl-1,3,5,2$l^{5},4$l^{5},6$l^{5}-trioxatriphosphinane 2,4,6-trioxide Chemical compound CCCP1(=O)OP(=O)(CCC)OP(=O)(CCC)O1 PAQZWJGSJMLPMG-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- CMBZWMHKHDGBNS-UHFFFAOYSA-N 2-[[1,6-dimethyl-2-oxo-4-(trifluoromethyl)pyridin-3-yl]methyl]isoindole-1,3-dione Chemical compound O=C1N(C)C(C)=CC(C(F)(F)F)=C1CN1C(=O)C2=CC=CC=C2C1=O CMBZWMHKHDGBNS-UHFFFAOYSA-N 0.000 description 2
- YPGVURRZZWLTSN-UHFFFAOYSA-N 2-[[6-methyl-2-oxo-4-(trifluoromethyl)-1h-pyridin-3-yl]methyl]isoindole-1,3-dione Chemical compound O=C1NC(C)=CC(C(F)(F)F)=C1CN1C(=O)C2=CC=CC=C2C1=O YPGVURRZZWLTSN-UHFFFAOYSA-N 0.000 description 2
- JBKINHFZTVLNEM-UHFFFAOYSA-N 2-bromoethoxy-tert-butyl-dimethylsilane Chemical compound CC(C)(C)[Si](C)(C)OCCBr JBKINHFZTVLNEM-UHFFFAOYSA-N 0.000 description 2
- LTAXNWGTCKPZGT-UHFFFAOYSA-N 2-chloro-n-phenylpyridine-4-carboxamide Chemical compound C1=NC(Cl)=CC(C(=O)NC=2C=CC=CC=2)=C1 LTAXNWGTCKPZGT-UHFFFAOYSA-N 0.000 description 2
- OKDGRDCXVWSXDC-UHFFFAOYSA-N 2-chloropyridine Chemical compound ClC1=CC=CC=N1 OKDGRDCXVWSXDC-UHFFFAOYSA-N 0.000 description 2
- CSLOYYSPDKEONH-UHFFFAOYSA-N 3-(aminomethyl)-5-fluoro-6-methyl-4-propan-2-yl-1h-pyridin-2-one Chemical compound CC(C)C=1C(F)=C(C)NC(=O)C=1CN CSLOYYSPDKEONH-UHFFFAOYSA-N 0.000 description 2
- ATIZGVDXSOWZJE-UHFFFAOYSA-N 3-(aminomethyl)-6-methyl-4-(trifluoromethyl)-1h-pyridin-2-one;hydrochloride Chemical compound Cl.CC1=CC(C(F)(F)F)=C(CN)C(=O)N1 ATIZGVDXSOWZJE-UHFFFAOYSA-N 0.000 description 2
- YAYHRYAVXZWUIJ-UHFFFAOYSA-N 3-[[4-(dimethylamino)cyclohexyl]-ethylamino]-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-5-[4-(2-methoxyethoxy)phenyl]-2-methylbenzamide Chemical compound C=1C(C=2C=CC(OCCOC)=CC=2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)C1CCC(N(C)C)CC1 YAYHRYAVXZWUIJ-UHFFFAOYSA-N 0.000 description 2
- XMIIGOLPHOKFCH-UHFFFAOYSA-N 3-phenylpropionic acid Chemical compound OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 2
- OCYMJCILWYHKAU-UHFFFAOYSA-N 4,6-dimethyl-2-oxo-1h-pyridine-3-carbonitrile Chemical compound CC1=CC(C)=C(C#N)C(O)=N1 OCYMJCILWYHKAU-UHFFFAOYSA-N 0.000 description 2
- CSAPESWNZDOAFU-UHFFFAOYSA-N 5-chloro-2-methylbenzoic acid Chemical compound CC1=CC=C(Cl)C=C1C(O)=O CSAPESWNZDOAFU-UHFFFAOYSA-N 0.000 description 2
- 125000006163 5-membered heteroaryl group Chemical group 0.000 description 2
- IMPQPQKUDMOZHV-UHFFFAOYSA-N 6-methyl-2-oxo-4-(trifluoromethyl)-1H-pyridine-3-carbonitrile Chemical compound CC1=CC(C(F)(F)F)=C(C#N)C(=O)N1 IMPQPQKUDMOZHV-UHFFFAOYSA-N 0.000 description 2
- XXEAVIQHEGQVSD-UHFFFAOYSA-N 6-methyl-2-oxo-4-propyl-1h-pyridine-3-carbonitrile Chemical compound CCCC=1C=C(C)NC(=O)C=1C#N XXEAVIQHEGQVSD-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- 206010000830 Acute leukaemia Diseases 0.000 description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 2
- 239000005711 Benzoic acid Substances 0.000 description 2
- 208000003174 Brain Neoplasms Diseases 0.000 description 2
- NMGKGLVYPJMZGR-MCZWQBSQSA-N CC1=C(C(NC(=C1)C)=O)CNC(C1=C(C(=CC(=C1)C=1C=NC(=CC1)OCCO)N(CC)[C@@H]1CC[C@H](CC1)N(C)C)C)=O Chemical compound CC1=C(C(NC(=C1)C)=O)CNC(C1=C(C(=CC(=C1)C=1C=NC(=CC1)OCCO)N(CC)[C@@H]1CC[C@H](CC1)N(C)C)C)=O NMGKGLVYPJMZGR-MCZWQBSQSA-N 0.000 description 2
- GVRHUQPJJZMTGI-QVYRIUEQSA-N CCN([C@H]1CC[C@@H](CC1)N(C)C)c1cc(cc(C(=O)NCc2c(C)cc(C)[nH]c2=O)c1C)-c1ccc(OCCO)cc1 Chemical compound CCN([C@H]1CC[C@@H](CC1)N(C)C)c1cc(cc(C(=O)NCc2c(C)cc(C)[nH]c2=O)c1C)-c1ccc(OCCO)cc1 GVRHUQPJJZMTGI-QVYRIUEQSA-N 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 229910021589 Copper(I) bromide Inorganic materials 0.000 description 2
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 2
- 206010014967 Ependymoma Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 206010018338 Glioma Diseases 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 102000006947 Histones Human genes 0.000 description 2
- 101000615488 Homo sapiens Methyl-CpG-binding domain protein 2 Proteins 0.000 description 2
- 101001071236 Homo sapiens PHD finger protein 19 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- 102100021299 Methyl-CpG-binding domain protein 2 Human genes 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 238000006411 Negishi coupling reaction Methods 0.000 description 2
- 102100036870 PHD finger protein 19 Human genes 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 239000007868 Raney catalyst Substances 0.000 description 2
- 229910000564 Raney nickel Inorganic materials 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical compound [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 2
- 238000010640 amide synthesis reaction Methods 0.000 description 2
- 125000004202 aminomethyl group Chemical group [H]N([H])C([H])([H])* 0.000 description 2
- 229910021529 ammonia Inorganic materials 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 150000003931 anilides Chemical class 0.000 description 2
- 150000001448 anilines Chemical class 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000011260 aqueous acid Substances 0.000 description 2
- 125000003435 aroyl group Chemical group 0.000 description 2
- 125000003710 aryl alkyl group Chemical group 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 210000003719 b-lymphocyte Anatomy 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 2
- 150000001559 benzoic acids Chemical class 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 150000001642 boronic acid derivatives Chemical class 0.000 description 2
- 230000031709 bromination Effects 0.000 description 2
- 238000005893 bromination reaction Methods 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- 229940126214 compound 3 Drugs 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 239000013058 crude material Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 2
- NLUNLVTVUDIHFE-UHFFFAOYSA-N cyclooctylcyclooctane Chemical compound C1CCCCCCC1C1CCCCCCC1 NLUNLVTVUDIHFE-UHFFFAOYSA-N 0.000 description 2
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 2
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 2
- VRLDVERQJMEPIF-UHFFFAOYSA-N dbdmh Chemical compound CC1(C)N(Br)C(=O)N(Br)C1=O VRLDVERQJMEPIF-UHFFFAOYSA-N 0.000 description 2
- 125000005265 dialkylamine group Chemical group 0.000 description 2
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 2
- 125000005594 diketone group Chemical group 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 239000002612 dispersion medium Substances 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 201000011523 endocrine gland cancer Diseases 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 210000001280 germinal center Anatomy 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 2
- 229940093915 gynecological organic acid Drugs 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 208000029824 high grade glioma Diseases 0.000 description 2
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 238000007913 intrathecal administration Methods 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 2
- VFQXVTODMYMSMJ-UHFFFAOYSA-N isonicotinamide Chemical class NC(=O)C1=CC=NC=C1 VFQXVTODMYMSMJ-UHFFFAOYSA-N 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 230000009916 joint effect Effects 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 206010027191 meningioma Diseases 0.000 description 2
- 238000006263 metalation reaction Methods 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- RGXZOGNUNHYYLK-UHFFFAOYSA-N methyl 3-amino-5-chloro-2-methylbenzoate Chemical compound COC(=O)C1=CC(Cl)=CC(N)=C1C RGXZOGNUNHYYLK-UHFFFAOYSA-N 0.000 description 2
- DYJAJULEGGBCRK-UHFFFAOYSA-N methyl 3-bromo-4,6-dichloropyridine-2-carboxylate Chemical compound COC(=O)C1=NC(Cl)=CC(Cl)=C1Br DYJAJULEGGBCRK-UHFFFAOYSA-N 0.000 description 2
- APCPBNNLVCVDPL-UHFFFAOYSA-N methyl 3-bromo-6-chloropyridine-2-carboxylate Chemical compound COC(=O)C1=NC(Cl)=CC=C1Br APCPBNNLVCVDPL-UHFFFAOYSA-N 0.000 description 2
- TVPSJGLMAKTMSV-UHFFFAOYSA-N methyl 5-bromo-3-[ethyl-[4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]-2-methylbenzoate Chemical compound C=1C(Br)=CC(C(=O)OC)=C(C)C=1N(CC)C1CCC(NC(=O)OC(C)(C)C)CC1 TVPSJGLMAKTMSV-UHFFFAOYSA-N 0.000 description 2
- OSWPMRLSEDHDFF-UHFFFAOYSA-N methyl salicylate Chemical compound COC(=O)C1=CC=CC=C1O OSWPMRLSEDHDFF-UHFFFAOYSA-N 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 2
- TXXHDPDFNKHHGW-UHFFFAOYSA-N muconic acid Chemical compound OC(=O)C=CC=CC(O)=O TXXHDPDFNKHHGW-UHFFFAOYSA-N 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- ZXYWTCVDQLRSRJ-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3-[ethyl(oxan-4-yl)amino]-2-methyl-5-[2-(1-methylpiperidin-4-yl)ethynyl]benzamide Chemical compound C=1C(C#CC2CCN(C)CC2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)C1CCOCC1 ZXYWTCVDQLRSRJ-UHFFFAOYSA-N 0.000 description 2
- 239000006199 nebulizer Substances 0.000 description 2
- 150000005338 nitrobenzoic acids Chemical class 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 206010073131 oligoastrocytoma Diseases 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 235000005985 organic acids Nutrition 0.000 description 2
- 208000030806 ovarian endometrioid adenocarcinoma Diseases 0.000 description 2
- 208000012988 ovarian serous adenocarcinoma Diseases 0.000 description 2
- ZEERHWXRRLRIQO-UHFFFAOYSA-N oxan-4-yl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OC1CCOCC1 ZEERHWXRRLRIQO-UHFFFAOYSA-N 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000008177 pharmaceutical agent Substances 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- IBBMAWULFFBRKK-UHFFFAOYSA-N picolinamide Chemical class NC(=O)C1=CC=CC=N1 IBBMAWULFFBRKK-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000012746 preparative thin layer chromatography Methods 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000003380 propellant Substances 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 230000019639 protein methylation Effects 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- UBQKCCHYAOITMY-UHFFFAOYSA-N pyridin-2-ol Chemical class OC1=CC=CC=N1 UBQKCCHYAOITMY-UHFFFAOYSA-N 0.000 description 2
- 125000003410 quininyl group Chemical group 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 238000011808 rodent model Methods 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 238000010898 silica gel chromatography Methods 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- KSAVQLQVUXSOCR-UHFFFAOYSA-M sodium lauroyl sarcosinate Chemical compound [Na+].CCCCCCCCCCCC(=O)N(C)CC([O-])=O KSAVQLQVUXSOCR-UHFFFAOYSA-M 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 239000012321 sodium triacetoxyborohydride Substances 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000005846 sugar alcohols Polymers 0.000 description 2
- 238000004808 supercritical fluid chromatography Methods 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 230000002194 synthesizing effect Effects 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- IOGXOCVLYRDXLW-UHFFFAOYSA-N tert-butyl nitrite Chemical compound CC(C)(C)ON=O IOGXOCVLYRDXLW-UHFFFAOYSA-N 0.000 description 2
- 239000012414 tert-butyl nitrite Substances 0.000 description 2
- VXKWYPOMXBVZSJ-UHFFFAOYSA-N tetramethyltin Chemical compound C[Sn](C)(C)C VXKWYPOMXBVZSJ-UHFFFAOYSA-N 0.000 description 2
- PHCBRBWANGJMHS-UHFFFAOYSA-J tetrasodium;disulfate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O PHCBRBWANGJMHS-UHFFFAOYSA-J 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 125000004001 thioalkyl group Chemical group 0.000 description 2
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 229910052723 transition metal Inorganic materials 0.000 description 2
- 150000003624 transition metals Chemical class 0.000 description 2
- 125000001425 triazolyl group Chemical group 0.000 description 2
- 229910052721 tungsten Inorganic materials 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 2
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- COIQUVGFTILYGA-UHFFFAOYSA-N (4-hydroxyphenyl)boronic acid Chemical compound OB(O)C1=CC=C(O)C=C1 COIQUVGFTILYGA-UHFFFAOYSA-N 0.000 description 1
- YUOLAYZNDYRBEZ-UHFFFAOYSA-N (6-oxo-1h-pyridin-3-yl)boronic acid Chemical compound OB(O)C=1C=CC(=O)NC=1 YUOLAYZNDYRBEZ-UHFFFAOYSA-N 0.000 description 1
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 description 1
- 125000006727 (C1-C6) alkenyl group Chemical group 0.000 description 1
- 125000006728 (C1-C6) alkynyl group Chemical group 0.000 description 1
- IYMKNYVCXUEFJE-SNAWJCMRSA-N (e)-5-methylhex-3-en-2-one Chemical compound CC(C)\C=C\C(C)=O IYMKNYVCXUEFJE-SNAWJCMRSA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- SHXHPUAKLCCLDV-UHFFFAOYSA-N 1,1,1-trifluoropentane-2,4-dione Chemical compound CC(=O)CC(=O)C(F)(F)F SHXHPUAKLCCLDV-UHFFFAOYSA-N 0.000 description 1
- 125000004511 1,2,3-thiadiazolyl group Chemical group 0.000 description 1
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- 125000001376 1,2,4-triazolyl group Chemical group N1N=C(N=C1)* 0.000 description 1
- 125000004517 1,2,5-thiadiazolyl group Chemical group 0.000 description 1
- 125000001781 1,3,4-oxadiazolyl group Chemical group 0.000 description 1
- 125000004520 1,3,4-thiadiazolyl group Chemical group 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- FQUYSHZXSKYCSY-UHFFFAOYSA-N 1,4-diazepane Chemical compound C1CNCCNC1 FQUYSHZXSKYCSY-UHFFFAOYSA-N 0.000 description 1
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 1
- FPIRBHDGWMWJEP-UHFFFAOYSA-N 1-hydroxy-7-azabenzotriazole Chemical compound C1=CN=C2N(O)N=NC2=C1 FPIRBHDGWMWJEP-UHFFFAOYSA-N 0.000 description 1
- DFPYXQYWILNVAU-UHFFFAOYSA-N 1-hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1.C1=CC=C2N(O)N=NC2=C1 DFPYXQYWILNVAU-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- 125000005955 1H-indazolyl group Chemical group 0.000 description 1
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Substances C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 1
- 125000005273 2-acetoxybenzoic acid group Chemical group 0.000 description 1
- HUUYPRUYJXORBI-UHFFFAOYSA-N 2-buta-1,3-dienyl-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound CC1(C)OB(C=CC=C)OC1(C)C HUUYPRUYJXORBI-UHFFFAOYSA-N 0.000 description 1
- 150000005759 2-chloropyridine Chemical class 0.000 description 1
- PCJFEVUKVKQSSL-UHFFFAOYSA-N 2h-1,2,4-oxadiazol-5-one Chemical compound O=C1N=CNO1 PCJFEVUKVKQSSL-UHFFFAOYSA-N 0.000 description 1
- MLMQPDHYNJCQAO-UHFFFAOYSA-N 3,3-dimethylbutyric acid Chemical compound CC(C)(C)CC(O)=O MLMQPDHYNJCQAO-UHFFFAOYSA-N 0.000 description 1
- FZNGSNUBJOVDRX-UHFFFAOYSA-N 3,5-diacetamido-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]benzamide Chemical compound CC(=O)NC1=CC(NC(C)=O)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C1 FZNGSNUBJOVDRX-UHFFFAOYSA-N 0.000 description 1
- JHUUPUMBZGWODW-UHFFFAOYSA-N 3,6-dihydro-1,2-dioxine Chemical compound C1OOCC=C1 JHUUPUMBZGWODW-UHFFFAOYSA-N 0.000 description 1
- XLZYKTYMLBOINK-UHFFFAOYSA-N 3-(4-hydroxybenzoyl)benzoic acid Chemical compound OC(=O)C1=CC=CC(C(=O)C=2C=CC(O)=CC=2)=C1 XLZYKTYMLBOINK-UHFFFAOYSA-N 0.000 description 1
- XATKIQNSVGLPJO-UHFFFAOYSA-N 3-(aminomethyl)-1,4,6-trimethylpyridin-2-one Chemical compound CC=1C=C(C)N(C)C(=O)C=1CN XATKIQNSVGLPJO-UHFFFAOYSA-N 0.000 description 1
- XRHRJYQTXRSSLQ-UHFFFAOYSA-N 3-(aminomethyl)-1,6-dimethyl-4-(trifluoromethyl)pyridin-2-one Chemical compound CC1=CC(C(F)(F)F)=C(CN)C(=O)N1C XRHRJYQTXRSSLQ-UHFFFAOYSA-N 0.000 description 1
- FNUNFHKOYFJBSU-UHFFFAOYSA-N 3-(aminomethyl)-5-fluoro-1,4,6-trimethylpyridin-2-one Chemical compound CC=1C(F)=C(C)N(C)C(=O)C=1CN FNUNFHKOYFJBSU-UHFFFAOYSA-N 0.000 description 1
- JSRPCAOFGDZBRH-UHFFFAOYSA-N 3-(aminomethyl)-6-methyl-4-propan-2-yl-1h-pyridin-2-one Chemical compound CC(C)C=1C=C(C)NC(=O)C=1CN JSRPCAOFGDZBRH-UHFFFAOYSA-N 0.000 description 1
- JBKWKHWTUAUEFI-UHFFFAOYSA-N 3-(aminomethyl)-6-methyl-4-propyl-1h-pyridin-2-one Chemical compound CCCC=1C=C(C)NC(=O)C=1CN JBKWKHWTUAUEFI-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- JHHZQADGLDKIPM-AATRIKPKSA-N 3-Hepten-2-one Chemical compound CCC\C=C\C(C)=O JHHZQADGLDKIPM-AATRIKPKSA-N 0.000 description 1
- CJPMZAQWTRKEEE-UHFFFAOYSA-N 3-bromo-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-5-methoxy-4-propoxybenzamide Chemical compound C1=C(OC)C(OCCC)=C(Br)C=C1C(=O)NCC1=C(C)C=C(C)NC1=O CJPMZAQWTRKEEE-UHFFFAOYSA-N 0.000 description 1
- QOSIYIZOWFDFTH-UHFFFAOYSA-N 3-chloro-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-4-hydroxy-5-methoxybenzamide Chemical compound ClC1=C(O)C(OC)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C1 QOSIYIZOWFDFTH-UHFFFAOYSA-N 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- QMYGFTJCQFEDST-UHFFFAOYSA-N 3-methoxybutyl acetate Chemical group COC(C)CCOC(C)=O QMYGFTJCQFEDST-UHFFFAOYSA-N 0.000 description 1
- PEPBFCOIJRULGJ-UHFFFAOYSA-N 3h-1,2,3-benzodioxazole Chemical compound C1=CC=C2NOOC2=C1 PEPBFCOIJRULGJ-UHFFFAOYSA-N 0.000 description 1
- FWRVYJLUPPGAOX-UHFFFAOYSA-N 4-(2-amino-2-oxoethoxy)-3-chloro-n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-5-methoxybenzamide Chemical compound ClC1=C(OCC(N)=O)C(OC)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C1 FWRVYJLUPPGAOX-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- GAMYYCRTACQSBR-UHFFFAOYSA-N 4-azabenzimidazole Chemical compound C1=CC=C2NC=NC2=N1 GAMYYCRTACQSBR-UHFFFAOYSA-N 0.000 description 1
- RJWBTWIBUIGANW-UHFFFAOYSA-N 4-chlorobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(Cl)C=C1 RJWBTWIBUIGANW-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- 125000005986 4-piperidonyl group Chemical group 0.000 description 1
- OJWUNQFFBITCKA-UHFFFAOYSA-N 5-fluoro-1,4,6-trimethyl-2-oxopyridine-3-carbonitrile Chemical compound CC=1C(F)=C(C)N(C)C(=O)C=1C#N OJWUNQFFBITCKA-UHFFFAOYSA-N 0.000 description 1
- RJIHRJSODASDOX-UHFFFAOYSA-N 5-fluoro-6-methyl-2-oxo-4-propan-2-yl-1h-pyridine-3-carbonitrile Chemical compound CC(C)C=1C(F)=C(C)NC(=O)C=1C#N RJIHRJSODASDOX-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 244000144725 Amygdalus communis Species 0.000 description 1
- 235000011437 Amygdalus communis Nutrition 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- QXLFJZSXNJFUSV-QVYRIUEQSA-N C(C)(C)(C)OC(=O)N[C@@H]1CC[C@H](CC1)N(C=1C(=C(C(=O)OC)C=C(C1)C=1C=NC(=CC1)OCCO[Si](C)(C)C(C)(C)C)C)CC Chemical compound C(C)(C)(C)OC(=O)N[C@@H]1CC[C@H](CC1)N(C=1C(=C(C(=O)OC)C=C(C1)C=1C=NC(=CC1)OCCO[Si](C)(C)C(C)(C)C)C)CC QXLFJZSXNJFUSV-QVYRIUEQSA-N 0.000 description 1
- AWZPOLMHVODZSS-OGESRWMOSA-N C(C)(C)(C)OC(=O)N[C@@H]1CC[C@H](CC1)N(C=1C(=C(C=C(C1)C1=CC=C(C=C1)OCCO[Si](C)(C)C(C)(C)C)C(=O)OC)C)CC Chemical compound C(C)(C)(C)OC(=O)N[C@@H]1CC[C@H](CC1)N(C=1C(=C(C=C(C1)C1=CC=C(C=C1)OCCO[Si](C)(C)C(C)(C)C)C(=O)OC)C)CC AWZPOLMHVODZSS-OGESRWMOSA-N 0.000 description 1
- 125000000041 C6-C10 aryl group Chemical group 0.000 description 1
- YAYHRYAVXZWUIJ-OGESRWMOSA-N C=1C(C=2C=CC(OCCOC)=CC=2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)[C@H]1CC[C@H](N(C)C)CC1 Chemical compound C=1C(C=2C=CC(OCCOC)=CC=2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)[C@H]1CC[C@H](N(C)C)CC1 YAYHRYAVXZWUIJ-OGESRWMOSA-N 0.000 description 1
- QWOJMRHUQHTCJG-UHFFFAOYSA-N CC([CH2-])=O Chemical class CC([CH2-])=O QWOJMRHUQHTCJG-UHFFFAOYSA-N 0.000 description 1
- QKJSLOGPADROHA-QVYRIUEQSA-N CC1=C(C(NC(=C1)C)=O)CNC(C1=C(C(=CC(=C1)C=1C=NC(=CC1)OCCOC)N(CC)[C@@H]1CC[C@H](CC1)N(C)C)C)=O Chemical compound CC1=C(C(NC(=C1)C)=O)CNC(C1=C(C(=CC(=C1)C=1C=NC(=CC1)OCCOC)N(CC)[C@@H]1CC[C@H](CC1)N(C)C)C)=O QKJSLOGPADROHA-QVYRIUEQSA-N 0.000 description 1
- RYOCFGFHMPPUGW-UHFFFAOYSA-N CC=1C2(CCC(C1)CC2)C(=O)O.CC2=CC=C(C=C2)S(=O)(=O)O Chemical compound CC=1C2(CCC(C1)CC2)C(=O)O.CC2=CC=C(C=C2)S(=O)(=O)O RYOCFGFHMPPUGW-UHFFFAOYSA-N 0.000 description 1
- RTXWTSDIZTWXJE-RQNOJGIXSA-N CCN([C@H](CC1)CC[C@@H]1NC(OC(C)(C)C)=O)C1=CC(C(C=C2)=CC=C2OCCOC)=CC(C(O)=O)=C1C Chemical compound CCN([C@H](CC1)CC[C@@H]1NC(OC(C)(C)C)=O)C1=CC(C(C=C2)=CC=C2OCCOC)=CC(C(O)=O)=C1C RTXWTSDIZTWXJE-RQNOJGIXSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-N Caprylic acid Natural products CCCCCCCC(O)=O WWZKQHOCKIZLMA-UHFFFAOYSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 201000000274 Carcinosarcoma Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 201000009047 Chordoma Diseases 0.000 description 1
- 208000004378 Choroid plexus papilloma Diseases 0.000 description 1
- 108010077544 Chromatin Proteins 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 206010073140 Clear cell sarcoma of soft tissue Diseases 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 229920000742 Cotton Chemical class 0.000 description 1
- 102000002004 Cytochrome P-450 Enzyme System Human genes 0.000 description 1
- 108010015742 Cytochrome P-450 Enzyme System Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 206010013710 Drug interaction Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 101710181478 Envelope glycoprotein GP350 Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 229930194542 Keto Natural products 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-L L-tartrate(2-) Chemical compound [O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-L 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 244000062730 Melissa officinalis Species 0.000 description 1
- 235000010654 Melissa officinalis Nutrition 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- TXXHDPDFNKHHGW-CCAGOZQPSA-N Muconic acid Natural products OC(=O)\C=C/C=C\C(O)=O TXXHDPDFNKHHGW-CCAGOZQPSA-N 0.000 description 1
- 101100059320 Mus musculus Ccdc85b gene Proteins 0.000 description 1
- ZKGNPQKYVKXMGJ-UHFFFAOYSA-N N,N-dimethylacetamide Chemical compound CN(C)C(C)=O.CN(C)C(C)=O ZKGNPQKYVKXMGJ-UHFFFAOYSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 108020004711 Nucleic Acid Probes Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000008900 Pancreatic Ductal Carcinoma Diseases 0.000 description 1
- 208000037064 Papilloma of choroid plexus Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- LGRFSURHDFAFJT-UHFFFAOYSA-N Phthalic anhydride Natural products C1=CC=C2C(=O)OC(=O)C2=C1 LGRFSURHDFAFJT-UHFFFAOYSA-N 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 229920001710 Polyorthoester Polymers 0.000 description 1
- 229920002685 Polyoxyl 35CastorOil Polymers 0.000 description 1
- NPYPAHLBTDXSSS-UHFFFAOYSA-N Potassium ion Chemical compound [K+] NPYPAHLBTDXSSS-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 206010070308 Refractory cancer Diseases 0.000 description 1
- 108700028341 SMARCB1 Proteins 0.000 description 1
- 101150008214 SMARCB1 gene Proteins 0.000 description 1
- 241001168730 Simo Species 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- FKNQFGJONOIPTF-UHFFFAOYSA-N Sodium cation Chemical compound [Na+] FKNQFGJONOIPTF-UHFFFAOYSA-N 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102000013127 Vimentin Human genes 0.000 description 1
- 108010065472 Vimentin Proteins 0.000 description 1
- 238000002441 X-ray diffraction Methods 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- BBAWTPDTGRXPDG-UHFFFAOYSA-N [1,3]thiazolo[4,5-b]pyridine Chemical compound C1=CC=C2SC=NC2=N1 BBAWTPDTGRXPDG-UHFFFAOYSA-N 0.000 description 1
- KPCZJLGGXRGYIE-UHFFFAOYSA-N [C]1=CC=CN=C1 Chemical group [C]1=CC=CN=C1 KPCZJLGGXRGYIE-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- WNEFDHCAKLWKAG-UHFFFAOYSA-N acetic acid;2-hydroxybenzoic acid Chemical compound CC(O)=O.OC(=O)C1=CC=CC=C1O WNEFDHCAKLWKAG-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- 150000008043 acidic salts Chemical class 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000010933 acylation Effects 0.000 description 1
- 238000005917 acylation reaction Methods 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910001413 alkali metal ion Inorganic materials 0.000 description 1
- 150000001447 alkali salts Chemical class 0.000 description 1
- 229910001420 alkaline earth metal ion Inorganic materials 0.000 description 1
- 125000005089 alkenylaminocarbonyl group Chemical group 0.000 description 1
- 125000005090 alkenylcarbonyl group Chemical group 0.000 description 1
- 125000000278 alkyl amino alkyl group Chemical group 0.000 description 1
- 125000005422 alkyl sulfonamido group Chemical group 0.000 description 1
- 239000012036 alkyl zinc reagent Substances 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 235000020224 almond Nutrition 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 125000005001 aminoaryl group Chemical group 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 239000000908 ammonium hydroxide Substances 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000005125 aryl alkyl amino carbonyl group Chemical group 0.000 description 1
- 125000005099 aryl alkyl carbonyl group Chemical group 0.000 description 1
- 125000005128 aryl amino alkyl group Chemical group 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 125000004931 azocinyl group Chemical group N1=C(C=CC=CC=C1)* 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- 150000001556 benzimidazoles Chemical class 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004935 benzoxazolinyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- GONOPSZTUGRENK-UHFFFAOYSA-N benzyl(trichloro)silane Chemical compound Cl[Si](Cl)(Cl)CC1=CC=CC=C1 GONOPSZTUGRENK-UHFFFAOYSA-N 0.000 description 1
- 239000003833 bile salt Substances 0.000 description 1
- 229940093761 bile salts Drugs 0.000 description 1
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 210000000133 brain stem Anatomy 0.000 description 1
- 125000005997 bromomethyl group Chemical group 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- JHIWVOJDXOSYLW-UHFFFAOYSA-N butyl 2,2-difluorocyclopropane-1-carboxylate Chemical compound CCCCOC(=O)C1CC1(F)F JHIWVOJDXOSYLW-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000004744 butyloxycarbonyl group Chemical group 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 125000002837 carbocyclic group Chemical group 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 201000007455 central nervous system cancer Diseases 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 238000004296 chiral HPLC Methods 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- FCYRSDMGOLYDHL-UHFFFAOYSA-N chloromethoxyethane Chemical compound CCOCCl FCYRSDMGOLYDHL-UHFFFAOYSA-N 0.000 description 1
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 1
- 210000002987 choroid plexus Anatomy 0.000 description 1
- 208000006571 choroid plexus carcinoma Diseases 0.000 description 1
- 210000003483 chromatin Anatomy 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 201000000292 clear cell sarcoma Diseases 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 125000001047 cyclobutenyl group Chemical group C1(=CCC1)* 0.000 description 1
- 125000002243 cyclohexanonyl group Chemical group *C1(*)C(=O)C(*)(*)C(*)(*)C(*)(*)C1(*)* 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 229940104302 cytosine Drugs 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- DEZRYPDIMOWBDS-UHFFFAOYSA-N dcm dichloromethane Chemical compound ClCCl.ClCCl DEZRYPDIMOWBDS-UHFFFAOYSA-N 0.000 description 1
- 125000004856 decahydroquinolinyl group Chemical group N1(CCCC2CCCCC12)* 0.000 description 1
- 125000003493 decenyl group Chemical group [H]C([*])=C([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000005070 decynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 125000001664 diethylamino group Chemical group [H]C([H])([H])C([H])([H])N(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 1
- HBGGXOJOCNVPFY-UHFFFAOYSA-N diisononyl phthalate Chemical class CC(C)CCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCC(C)C HBGGXOJOCNVPFY-UHFFFAOYSA-N 0.000 description 1
- JMRYOSQOYJBDOI-UHFFFAOYSA-N dilithium;di(propan-2-yl)azanide Chemical compound [Li+].CC(C)[N-]C(C)C.CC(C)N([Li])C(C)C JMRYOSQOYJBDOI-UHFFFAOYSA-N 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- UXGNZZKBCMGWAZ-UHFFFAOYSA-N dimethylformamide dmf Chemical compound CN(C)C=O.CN(C)C=O UXGNZZKBCMGWAZ-UHFFFAOYSA-N 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- MKRTXPORKIRPDG-UHFFFAOYSA-N diphenylphosphoryl azide Chemical compound C=1C=CC=CC=1P(=O)(N=[N+]=[N-])C1=CC=CC=C1 MKRTXPORKIRPDG-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- CETRZFQIITUQQL-UHFFFAOYSA-N dmso dimethylsulfoxide Chemical compound CS(C)=O.CS(C)=O CETRZFQIITUQQL-UHFFFAOYSA-N 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000004945 emulsification Methods 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 230000002327 eosinophilic effect Effects 0.000 description 1
- 230000001973 epigenetic effect Effects 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- OLAMWIPURJGSKE-UHFFFAOYSA-N et2o diethylether Chemical compound CCOCC.CCOCC OLAMWIPURJGSKE-UHFFFAOYSA-N 0.000 description 1
- OCLXJTCGWSSVOE-UHFFFAOYSA-N ethanol etoh Chemical compound CCO.CCO OCLXJTCGWSSVOE-UHFFFAOYSA-N 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 description 1
- DEQYTNZJHKPYEZ-UHFFFAOYSA-N ethyl acetate;heptane Chemical compound CCOC(C)=O.CCCCCCC DEQYTNZJHKPYEZ-UHFFFAOYSA-N 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- OJCSPXHYDFONPU-UHFFFAOYSA-N etoac etoac Chemical compound CCOC(C)=O.CCOC(C)=O OJCSPXHYDFONPU-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000000105 evaporative light scattering detection Methods 0.000 description 1
- 208000020812 extrarenal rhabdoid tumor Diseases 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 238000003818 flash chromatography Methods 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000004785 fluoromethoxy group Chemical group [H]C([H])(F)O* 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical compound [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 125000003838 furazanyl group Chemical group 0.000 description 1
- IECPWNUMDGFDKC-MZJAQBGESA-N fusidic acid Chemical class O[C@@H]([C@@H]12)C[C@H]3\C(=C(/CCC=C(C)C)C(O)=O)[C@@H](OC(C)=O)C[C@]3(C)[C@@]2(C)CC[C@@H]2[C@]1(C)CC[C@@H](O)[C@H]2C IECPWNUMDGFDKC-MZJAQBGESA-N 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229940097042 glucuronate Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- JFCQEDHGNNZCLN-UHFFFAOYSA-N glutaric acid Chemical compound OC(=O)CCCC(O)=O JFCQEDHGNNZCLN-UHFFFAOYSA-N 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- JEGUKCSWCFPDGT-UHFFFAOYSA-N h2o hydrate Chemical compound O.O JEGUKCSWCFPDGT-UHFFFAOYSA-N 0.000 description 1
- 125000004438 haloalkoxy group Chemical group 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 230000003862 health status Effects 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N hydroxymaleic acid group Chemical group O/C(/C(=O)O)=C/C(=O)O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000004926 indolenyl group Chemical group 0.000 description 1
- LPAGFVYQRIESJQ-UHFFFAOYSA-N indoline Chemical compound C1=CC=C2NCCC2=C1 LPAGFVYQRIESJQ-UHFFFAOYSA-N 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 125000002346 iodo group Chemical group I* 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 125000004936 isatinoyl group Chemical group N1(C(=O)C(=O)C2=CC=CC=C12)C(=O)* 0.000 description 1
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000005438 isoindazolyl group Chemical group 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000000865 liniment Substances 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000004777 loss-of-function mutation Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-L malate(2-) Chemical compound [O-]C(=O)C(O)CC([O-])=O BJEPYKJPYRNKOW-UHFFFAOYSA-L 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- BCVXHSPFUWZLGQ-UHFFFAOYSA-N mecn acetonitrile Chemical compound CC#N.CC#N BCVXHSPFUWZLGQ-UHFFFAOYSA-N 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- LULAYUGMBFYYEX-UHFFFAOYSA-N metachloroperbenzoic acid Natural products OC(=O)C1=CC=CC(Cl)=C1 LULAYUGMBFYYEX-UHFFFAOYSA-N 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 125000001160 methoxycarbonyl group Chemical group [H]C([H])([H])OC(*)=O 0.000 description 1
- XSKGHSUHOYEBTK-UHFFFAOYSA-N methyl 2,6-dichloropyridine-4-carboxylate Chemical compound COC(=O)C1=CC(Cl)=NC(Cl)=C1 XSKGHSUHOYEBTK-UHFFFAOYSA-N 0.000 description 1
- YKFPEXSWHBLGDK-UHFFFAOYSA-N methyl 3,4,6-trichloropyridine-2-carboxylate Chemical compound COC(=O)C1=NC(Cl)=CC(Cl)=C1Cl YKFPEXSWHBLGDK-UHFFFAOYSA-N 0.000 description 1
- ACCQXEHKHRDBNW-UHFFFAOYSA-N methyl 3-[ethyl-[4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexyl]amino]-5-[4-(2-methoxyethoxy)phenyl]-2-methylbenzoate Chemical compound C=1C(C=2C=CC(OCCOC)=CC=2)=CC(C(=O)OC)=C(C)C=1N(CC)C1CCC(NC(=O)OC(C)(C)C)CC1 ACCQXEHKHRDBNW-UHFFFAOYSA-N 0.000 description 1
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical class COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 1
- STZCRXQWRGQSJD-GEEYTBSJSA-M methyl orange Chemical compound [Na+].C1=CC(N(C)C)=CC=C1\N=N\C1=CC=C(S([O-])(=O)=O)C=C1 STZCRXQWRGQSJD-GEEYTBSJSA-M 0.000 description 1
- 229940012189 methyl orange Drugs 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- 229960001047 methyl salicylate Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000002808 molecular sieve Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 239000002324 mouth wash Substances 0.000 description 1
- 229940051866 mouthwash Drugs 0.000 description 1
- ZHBSEXHHJLGRKX-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3,4,5-trimethoxybenzamide Chemical compound COC1=C(OC)C(OC)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C1 ZHBSEXHHJLGRKX-UHFFFAOYSA-N 0.000 description 1
- JFEXNEMJRIPESK-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3,5-dimethoxybenzamide Chemical compound COC1=CC(OC)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C1 JFEXNEMJRIPESK-UHFFFAOYSA-N 0.000 description 1
- CJOOKLCQRFMKCZ-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3-(2,2-dimethylpropanoylamino)benzamide Chemical compound O=C1NC(C)=CC(C)=C1CNC(=O)C1=CC=CC(NC(=O)C(C)(C)C)=C1 CJOOKLCQRFMKCZ-UHFFFAOYSA-N 0.000 description 1
- XQFINGFCBFHOPE-UHFFFAOYSA-N n-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methyl]-3-[ethyl-[4-[2-methoxyethyl(methyl)amino]cyclohexyl]amino]-2-methyl-5-(3-morpholin-4-ylprop-1-ynyl)benzamide Chemical compound C=1C(C#CCN2CCOCC2)=CC(C(=O)NCC=2C(NC(C)=CC=2C)=O)=C(C)C=1N(CC)C1CCC(N(C)CCOC)CC1 XQFINGFCBFHOPE-UHFFFAOYSA-N 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- DYBOTOAIZGPJFS-UHFFFAOYSA-N n-[5-[(4,6-dimethyl-2-oxo-1h-pyridin-3-yl)methylcarbamoyl]-2-methylphenyl]furan-2-carboxamide Chemical compound O=C1NC(C)=CC(C)=C1CNC(=O)C1=CC=C(C)C(NC(=O)C=2OC=CC=2)=C1 DYBOTOAIZGPJFS-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N n-hexanoic acid Natural products CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 239000006218 nasal suppository Substances 0.000 description 1
- 210000005170 neoplastic cell Anatomy 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 125000005187 nonenyl group Chemical group C(=CCCCCCCC)* 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 239000002853 nucleic acid probe Substances 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- OIPZNTLJVJGRCI-UHFFFAOYSA-M octadecanoyloxyaluminum;dihydrate Chemical compound O.O.CCCCCCCCCCCCCCCCCC(=O)O[Al] OIPZNTLJVJGRCI-UHFFFAOYSA-M 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000004095 oxindolyl group Chemical group N1(C(CC2=CC=CC=C12)=O)* 0.000 description 1
- QUANRIQJNFHVEU-UHFFFAOYSA-N oxirane;propane-1,2,3-triol Chemical compound C1CO1.OCC(O)CO QUANRIQJNFHVEU-UHFFFAOYSA-N 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- NXJCBFBQEVOTOW-UHFFFAOYSA-L palladium(2+);dihydroxide Chemical compound O[Pd]O NXJCBFBQEVOTOW-UHFFFAOYSA-L 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000001148 pentyloxycarbonyl group Chemical group 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000003285 pharmacodynamic effect Effects 0.000 description 1
- 239000012071 phase Substances 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 125000001484 phenothiazinyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 1
- 125000004932 phenoxathinyl group Chemical group 0.000 description 1
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 125000004928 piperidonyl group Chemical group 0.000 description 1
- 229960005235 piperonyl butoxide Drugs 0.000 description 1
- 125000004591 piperonyl group Chemical group C(C1=CC=2OCOC2C=C1)* 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000008389 polyethoxylated castor oil Substances 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- IUBQJLUDMLPAGT-UHFFFAOYSA-N potassium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([K])[Si](C)(C)C IUBQJLUDMLPAGT-UHFFFAOYSA-N 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 229910001414 potassium ion Inorganic materials 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 238000002953 preparative HPLC Methods 0.000 description 1
- 238000004262 preparative liquid chromatography Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 125000004742 propyloxycarbonyl group Chemical group 0.000 description 1
- NSETWVJZUWGCKE-UHFFFAOYSA-N propylphosphonic acid Chemical compound CCCP(O)(O)=O NSETWVJZUWGCKE-UHFFFAOYSA-N 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 239000012925 reference material Substances 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000006965 reversible inhibition Effects 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- 230000036185 rubor Effects 0.000 description 1
- CVHZOJJKTDOEJC-UHFFFAOYSA-N saccharin Chemical compound C1=CC=C2C(=O)NS(=O)(=O)C2=C1 CVHZOJJKTDOEJC-UHFFFAOYSA-N 0.000 description 1
- 229940081974 saccharin Drugs 0.000 description 1
- 235000019204 saccharin Nutrition 0.000 description 1
- 239000000901 saccharin and its Na,K and Ca salt Substances 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 201000010106 skin squamous cell carcinoma Diseases 0.000 description 1
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 1
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- WGRULTCAYDOGQK-UHFFFAOYSA-M sodium;sodium;hydroxide Chemical compound [OH-].[Na].[Na+] WGRULTCAYDOGQK-UHFFFAOYSA-M 0.000 description 1
- 239000012439 solid excipient Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000005415 substituted alkoxy group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000004426 substituted alkynyl group Chemical group 0.000 description 1
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-M sulfamate Chemical compound NS([O-])(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-M 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- 125000001174 sulfone group Chemical group 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- UXAWXZDXVOYLII-UHFFFAOYSA-N tert-butyl 2,5-diazabicyclo[2.2.1]heptane-2-carboxylate Chemical compound C1C2N(C(=O)OC(C)(C)C)CC1NC2 UXAWXZDXVOYLII-UHFFFAOYSA-N 0.000 description 1
- XPDIKRMPZNLBAC-UHFFFAOYSA-N tert-butyl 3-iodoazetidine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CC(I)C1 XPDIKRMPZNLBAC-UHFFFAOYSA-N 0.000 description 1
- CWXPZXBSDSIRCS-UHFFFAOYSA-N tert-butyl piperazine-1-carboxylate Chemical compound CC(C)(C)OC(=O)N1CCNCC1 CWXPZXBSDSIRCS-UHFFFAOYSA-N 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- WHRNULOCNSKMGB-UHFFFAOYSA-N tetrahydrofuran thf Chemical compound C1CCOC1.C1CCOC1 WHRNULOCNSKMGB-UHFFFAOYSA-N 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- 150000003527 tetrahydropyrans Chemical group 0.000 description 1
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 description 1
- QEMXHQIAXOOASZ-UHFFFAOYSA-N tetramethylammonium Chemical compound C[N+](C)(C)C QEMXHQIAXOOASZ-UHFFFAOYSA-N 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 125000005300 thiocarboxy group Chemical group C(=S)(O)* 0.000 description 1
- 229940113082 thymine Drugs 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 125000003944 tolyl group Chemical group 0.000 description 1
- 125000002088 tosyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1C([H])([H])[H])S(*)(=O)=O 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- JHHZQADGLDKIPM-UHFFFAOYSA-N trans-hept-3-en-2-one Natural products CCCC=CC(C)=O JHHZQADGLDKIPM-UHFFFAOYSA-N 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000002306 tributylsilyl group Chemical group C(CCC)[Si](CCCC)(CCCC)* 0.000 description 1
- 125000004784 trichloromethoxy group Chemical group ClC(O*)(Cl)Cl 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- 238000009777 vacuum freeze-drying Methods 0.000 description 1
- 210000005048 vimentin Anatomy 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 125000001834 xanthenyl group Chemical group C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- GTLDTDOJJJZVBW-UHFFFAOYSA-N zinc cyanide Chemical compound [Zn+2].N#[C-].N#[C-] GTLDTDOJJJZVBW-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4412—Non condensed pyridines; Hydrogenated derivatives thereof having oxo groups directly attached to the heterocyclic ring
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/44—Radicals substituted by doubly-bound oxygen, sulfur, or nitrogen atoms, or by two such atoms singly-bound to the same carbon atom
- C07D213/46—Oxygen atoms
- C07D213/50—Ketonic radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/64—One oxygen atom attached in position 2 or 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Dermatology (AREA)
- Oncology (AREA)
- Diabetes (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Pyridine Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Enzymes And Modification Thereof (AREA)
- Peptides Or Proteins (AREA)
Abstract
Изобретение относится к замещенным бензольным соединениям, представленным формулами I, III, VI, VII.
Соединение формулы III:
или его фармацевтически приемлемые соли, где R801 представляет собой C1-6 алкил, C2-6 алкинил, гетероциклоалкил, выбранный из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, фенил или гетероарил, выбранный из пиррола, фурана, тиофена, тиазола, изотиазола, имидазола, триазола, тетразола, пиразола, оксазола, изоксазола, пиридина, пиразина, пиридазина и пиримидина, каждый из которых содержит в качестве заместителя O-C1-6 алкил-Rx, где Rx представляет собой гидроксил или O-C1-3 алкил и Rx необязательно дополнительно замещен O-C1-3 алкилом; каждый из R802 и R803 независимо представляет собой H, галоген, C1-4 алкил или C1-6 алкоксил; каждый из R804 и R805 независимо представляет собой C1-4 алкил; и
R806 представляет собой –Qx-Tx, где Qx представляет собой связь или C1-4 алкильную связующую группу, Tx представляет собой H, тетрагидропиранил, пиперидинил, замещенный 1, 2 или 3 C1-4 алкильными группами, или циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один или оба C1-4 алкила необязательно содержат в качестве заместителя C1-6 алкокси; обладающие способностью ингибировать активность EZH2, а также к фармацевтическим композициям, содержащим указанные соединения, и способам лечения. 9 н. и 46 з.п. ф-лы., 7 табл., 3 пр.
Description
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет на основании предварительных заявок на патент США №№61/714140, поданной 15 октября 2012 г., 61/714145, поданной 15 октября 2012 г., 61/780703, поданной 13 марта 2013 г., и 61/786277, поданной 14 марта 2013 г. Содержание каждой из указанных предварительных заявок включено в настоящую заявку во всей полноте посредством ссылок.
УРОВЕНЬ ТЕХНИКИ
Существует постоянная потребность в новых агентах, действующих в качестве ингибиторов активности EZH2, которые можно применять для лечения расстройств, опосредованных EZH2 (например, рака).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном из аспектов настоящее изобретение относится к замещенным бензольным соединениям нижепредставленных формул или к их фармацевтически приемлемым солям.
В одном из аспектов настоящее изобретение относится к соединению в соответствии с формулой III:
или к его фармацевтически приемлемой соли или сольвату, где
R801 представляет собой C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, фенил или 5- или 6-членный гетероарил, каждый из которых содержит в качестве заместителя O-C1-6 алкил-Rx или NH-C1-6 алкил-Rx, где Rx представляет собой гидроксил, О-C1-3 алкил или NH-C1-3 алкил, и Rx необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом, кроме случаев, когда Rx представляет собой гидроксил; и R801 необязательно дополнительно замещен;
каждый из R802 и R803 независимо представляет собой Н, галоген, C1-4 алкил, C1-6 алкоксил или C6-C10 арилокси, каждый из которых необязательно замещен одним или более галогенами;
каждый из R804 и R805 независимо представляет собой C1-4 алкил; и
R806 представляет собой -Qx-Tx, где Qx представляет собой связь или C1-4 алкильную связующую группу, Tx представляет собой Н, необязательно замещенный C1-4 алкил, необязательно замещенный С3-С8 циклоалкил или необязательно замещенный 4-14-членный гетероциклоалкил.
Подмножества соединений формулы III включают соединения формулы IVa или IVb и их фармацевтически приемлемые соли или сольваты:
где Z' представляет собой СН или N, и R807 представляет собой C2-3 алкил-Rx.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой I:
или к его фармацевтически приемлемой соли или соль вату, где
R701 представляет собой Н, F, OR707, NHR707, -(С≡С)-(CH2)n7-R708, фенил, 5- или 6-членный гетероарил, C3-8 циклоалкил или 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, где каждый из фенила, 5- или 6-членного гетероарила, C3-8 циклоалкила или 4-7-членного гетероциклоалкила независимо необязательно замещен одной или более группами, выбранными из галогена, C1-3 алкила, ОН, O-C1-6 алкила, NH-C1-6 алкила и C1-3 алкила, замещенного C3-8 циклоалкилом или 4-7-членным гетероциклоалкилом, содержащим 1-3 гетероатома, где каждый из O-C1-6 алкила и NH-C1-6 алкила необязательно замещен гидроксилом, O-C1-3 алкилом или NH-C1-3 алкилом, каждый из O-C1-3 алкила и NH-C1-3 алкила необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом;
каждый из R702 и R703 независимо представляет собой Н, галоген, C1-4 алкил, C1-6 алкоксил или С6-С10 арилокси, каждый из которых необязательно замещен одним или более галогенами;
каждый из R704 и R705 независимо представляет собой C1-4 алкил;
R706 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один или оба C1-4 алкила содержат в качестве заместителя C1-6 алкокси; или R706 представляет собой тетрагидропиранил;
R707 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из гидроксила, C1-4 алкокси, амино, моно- или ди-C1-4 алкиламино, C3-8 циклоалкила и 4-7-членного гетероциклоалкила, содержащего 1-3 гетероатома, где каждый из C3-8 циклоалкила или 4-7-членного гетероциклоалкила независимо необязательно дополнительно замещен C1-3 алкилом;
R708 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из ОН, галогена и C1-4 алкокси, 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, или O-C1-6 алкил, где 4-7-членный гетероциклоалкил необязательно дополнительно содержит в качестве заместителя ОН или C1-6 алкил; и
n7 равняется 0, 1 или 2.
Подмножество соединений формулы I включает соединения формулы II и их фармацевтически приемлемые соли или сольваты:
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой V:
или к его фармацевтически приемлемой соли или сольвату, где
W1 представляет собой N или СН;
W2 представляет собой N или СН;
R401 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил;
R402 представляет собой (а) ОН, (b) (CH2)-О-(C1-C6 алкил),
(с) O(C1-C6 алкил), (d) (CH2)j-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл, (е) (CH2)k-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, (f) О-(CH2)u-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (g) O-(CH2)v-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (b)-(g) необязательно содержат в качестве заместителя R402a,
R402a представляет собой C1-C6 алкил, C1-C6 галогеналкил, ОН или O(C1-C6 алкил);
t равняется 1, 2 или 3;
u равняется 0, 1, 2 или 3;
v равняется 0, 1, 2 или 3;
j равняется 0, 1, 2 или 3; и
k равняется 0, 1, 2 или 3; при условии, что если R402 представляет собой пиперазинил, W1 и W2 представляют собой N.
В некоторых соединениях формулы V W1 представляет собой N, и W2 представляет собой СН.
В некоторых соединениях формулы V R401 представляет собой C1-C6 алкил. Например, R401 представляет собой метил или изопропил. Например, R401 представляет собой метил.
В некоторых соединениях формулы V R402 представляет собой (CH2)k-4-7-членный насыщенный гетероцикл, содержащий один или более атомов азота или кислорода.
В некоторых соединениях формулы V k равняется 0 или 1. Например, k равняется 0. Например, k равняется 1.
В некоторых соединениях формулы V R402 представляет собой азетидинил, пиперазинил или пиперидинил.
В некоторых соединениях R402 представляет собой (CH2)-азетидинил, (CH2)-пирролидинил, (CH2)-пиперидинил, (CH2)-морфолинил или (CH2)-диазепанил.
В некоторых соединениях формулы V t равняется 1.
В некоторых соединениях формулы V R402a представляет собой ОН, метил или метокси.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой VI:
или к его фармацевтически приемлемой соли или сольвату, где
n5 равняется 0, 1 или 2;
R501 представляет собой С(Н) или N;
каждый из R502, R503, R504 и R505 независимо представляет собой C1-4 алкил;
R506 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил) 2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой С(Н), R507 представляет собой морфолин; пиперидин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где гетероцикл представляет собой 4-7-членный гетероцикл, содержащий кислород или азот или и кислород, и азот, и где азот необязательно замещен C1-3 алкилом; где пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН, C1-6 алкил или O-C1-3 алкил;
или, если R501 представляет собой С(Н), R507 может представлять собой пиперазин, необязательно дополнительно замещенный C1-6 алкилом, при условии, что R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой N, R507 представляет собой морфолин, пиперидин, пиперазин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где гетероцикл представляет собой 4-7-членный гетероцикл, содержащий кислород или азот или и кислород, и азот, и где азот необязательно замещен C1-3 алкилом;
где пиперидиновая, пиперазиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН, C1-6 алкил или O-C1-3 алкил.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой VII:
или к его фармацевтически приемлемой соли или сольвату, где
n6 равняется 1 или 2;
каждый из R602, R603, R604 и R605 независимо представляет собой C1-4 алкил;
R606 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил) 2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами; и
R607 представляет собой морфолин, пиперидин, пиперазин, пирролидин, диазепан, азетидин или O-C1-6 алкил, где пиперидиновая, диазепановая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН или C1-6 алкил.
В настоящем изобретении также предложены фармацевтические композиции, содержащие один или более фармацевтически приемлемых носителей и одно или более соединений, выбранных из соединений любой из формул, описанных в настоящей заявке.
Другой аспект настоящего изобретения представляет собой способ лечения или предотвращения расстройства, опосредованного EZH2. Указанный способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества одного или более соединений, выбранных из соединений любой из формул, описанных в настоящей заявке. Указанное расстройство, опосредованное EZH2, представляет собой заболевание, расстройство или состояние, по меньшей мере частично опосредованное активностью EZH2. В одном из вариантов реализации расстройство, опосредованное EZH2, относится к повышенной активности EZH2. В одном из вариантов реализации расстройство, опосредованное EZH2, представляет собой раковое заболевание. Раковое заболевание, опосредованное EZH2, может представлять собой лимфому, лейкоз или меланому, например, диффузную крупноклеточную В-клеточную лимфому (ДККЛ), неходжкинскую лимфому (НХЛ), фолликулярную лимфому, хронический миелогенный лейкоз (ХМЛ), острый миелоидный лейкоз, острый лимфоцитарный лейкоз, лейкоз смешанного происхождения или миелодиспластические синдромы (МДС). В одном из вариантов реализации раковое заболевание, опосредованное EZH2, может представлять собой злокачественную рабдоидную опухоль или INI1-дефицитную опухоль. Гистологический диагноз злокачественной рабдоидной опухоли зависит от идентификации характерных рабдоидных клеток (крупных клеток - с эксцентрически расположенными ядрами и избытком эозинофильной цитоплазмы) и иммуноги с то химии с использованием антител к виментину, кератину и мембранному антигену клеток эпителия. В большинстве злокачественных рабдоидных опухолей ген SMARCB1/INI1, расположенный в сегменте хромосомы 22q11.2, инактивируется путем делеций и/или мутаций. В одном из вариантов реализации злокачественные рабдоидные опухоли могут представлять собой INI1-дефицитную опухоль.
Если не указано иное, любое описание способа лечения включает применение соединений для обеспечения лечения или профилактики, представленной в настоящем описании, а также применение соединений для получения лекарственных средств для лечения или предотвращения указанного состояния. Лечение включает лечение людей или животных, отличных от людей, включая модели грызунов и другие модели заболеваний. Способы, описанные в настоящей заявке, могут быть использованы для выявления кандидатов, подходящих для лечения или предотвращения расстройств, опосредованных EZH2. Например, в настоящем изобретении также предложены способы определения ингибитора EZH2 дикого типа, мутантного EZH2 (например, Y641, А677 и/или А687 мутантного EZH2) или их обоих.
Например, способ включает стадию введения субъекту, имеющему раковое заболевание с аномальным метилированием Н3-K27, эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания. Примеры аномального метилирования Н3-K27 могут включать общее увеличение и/или изменение распределения ди- или триметилирования Н3-K27 в хроматине раковых клеток.
Например, раковое заболевание выбрано из группы, состоящей из раковых заболеваний со сверхэкспрессией EZH2 или других субъединиц PRC2, содержащих мутации с потерей функции в Н3-K27-деметилазах, таких как UTX, или со сверхэкспрессией вспомогательных белков, таких как PHF19/PCL3, способных увеличивать и/или изменять направление действия EZH2 (см. ссылки в Sneeringer et al. Proc Natl Acad. Sci USA 107 (49): 20980-5, 2010).
Например, способ включает стадию введения субъекту, имеющему раковое заболевание со сверхэкспрессией EZH2, терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания.
Например, способ включает стадию введения субъекту, имеющему раковое заболевание с мутацией с потерей функции в Н3-K27-деметилазе UTX, терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания.
Например, способ включает стадию введения субъекту, имеющему раковое заболевание со сверхэкспрессией вспомогательного(ых) компонента(ов) PRC2, такого(их) как PHF19/PCL3, терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания.
В другом аспекте настоящее изобретение относится к способу модулирования активности EZH2 дикого типа, каталитической субъединицы комплекса PRC2, который катализирует моно-, ди- и триметилирование лизина 27 гистона Н3 (Н3-K27). Например, настоящее изобретение относится к способу ингибирования активности EZH2 в клетке. Указанный способ можно осуществлять in vitro или in vivo.
В другом аспекте настоящее изобретение относится к способу ингибирования превращения Н3-K27 в триметилированный Н3-K27 у субъекта. Указанный способ включает введение субъекту терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, для ингибирования гистонметилтрансферазной активности EZH2, что приводит к ингибированию превращения Н3-K27 в триметилированный Н3-K27 у субъекта.
Например, способ включает стадию введения субъекту, имеющему раковое заболевание с экспрессией мутантного EZH2, терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания.
Например, раковое заболевание выбирают из группы, состоящей из фолликулярной лимфомы и диффузной крупноклеточной В-клеточной лимфомы (ДККЛ) В-клеточного подтипа клеток герминативного центра. Например, раковое заболевание представляет собой лимфому, лейкоз или меланому. Предпочтительно, лимфома представляет собой неходжкинскую лимфому (НХЛ), фолликулярную лимфому или диффузную крупноклеточную В-клеточную лимфому. Альтернативно, лейкоз представляет собой хронический миелогенный лейкоз (ХМЛ), острый миелоидный лейкоз, острый лимфоцитарный лейкоз или лейкоз смешанного происхождения.
Например, предраковое состояние представляет собой миелодиспластические синдромы (МДС, ранее известные как предлейкозы).
Например, раковое заболевание представляет собой гематологическое раковое заболевание.
Например, раковое заболевание выбирают из группы, состоящей из рака мозга и центральной нервной системы (ЦНС), рака головы и шеи, рака почек, рака яичников, рака поджелудочной железы, лейкоза, рака легких, лимфомы, миеломы, саркомы, рака молочной железы и рака предстательной железы. Предпочтительно, субъект, нуждающийся в лечении, представляет собой субъекта, у которого ранее был диагностирован, диагностирован или имеется предрасположенность к развитию рака мозга и ЦНС, рака почек, рака яичников, рака поджелудочной железы, лейкоза, лимфомы, миеломы и/или саркомы. Примеры рака мозга и ЦНС включают медуллобластому, олигодендроглиому, атипичную тератоидную/рабдоидную опухоль, карциному хориоидного сплетения, папиллому хориоидного сплетения, эпендимому, глиобластому, менингиому, нейроглиальную опухоль, олигоастроцитому, олигодендроглиому и пинеобластому. Примеры рака яичников включают светлоклеточную аденокарциному яичников, эндометриоидную аденокарциному яичников и серозную аденокарциному яичников. Примеры рака поджелудочной железы включают протоковую аденокарциному поджелудочной железы и эндокринную опухоль поджелудочной железы. Примеры саркомы включают хондросаркому, светлоклеточную саркому мягких тканей, саркому Юинга, желудочно-кишечную стромальную опухоль, остеосаркому, рабдомиосаркому и саркому без дополнительных уточнений (БДУ). Альтернативно, раковые заболевания, подвергающиеся лечению при помощи соединений согласно настоящему изобретению, представляют собой не НХЛ раковые заболевания.
Например, раковое заболевание выбирают из группы, состоящей из медуллобластомы, олигодендроглиомы, светлоклеточной аденокарциномы яичников, эндометриоидной аденокарциномы яичников, серозной аденокарциномы яичников, протоковой аденокарциномы поджелудочной железы, эндокринной опухоли поджелудочной железы, злокачественной рабдоидной опухоли, астроцитомы, атипичной тератоидной/рабдоидной опухоли, карциномы хориоидного сплетения, папилломы хориоидного сплетения, эпендимомы, глиобластомы, менингиомы, нейроглиальной опухоли, олигоастроцитомы, олигодендроглиомы, пинеобластомы, карциносаркомы, хордомы, внегонадной герминогенной опухоли, экстраренальной рабдоидной опухоли, шванномы, плоскоклеточной карциномы кожи, хондросаркомы, светлоклеточной саркомы мягких тканей, саркомы Юинга, желудочно-кишечной стромальной опухоли, остеосаркомы, рабдомиосаркомы и саркомы без дополнительных уточнений (БДУ). Предпочтительно, раковое заболевание представляет собой медуллобластому, светлоклеточную аденокарциному яичников, эндометриоидную аденокарциному яичников, протоковую аденокарциному поджелудочной железы, злокачественную рабдоидную опухоль, атипичную тератоидную/рабдоидную опухоль, карциному хориоидного сплетения, папиллому хориоидного сплетения, глиобластому, менингиому, пинеобластому, карциносаркому, экстраренальную рабдоидную опухоль, шванному, плоскоклеточную карциному кожи, хондросаркому, саркому Юинга, эпителиоидную саркому, ренальную медуллокарциному, диффузную крупноклеточную В-клеточную лимфому, фолликулярную лимфому и/или саркому БДУ. Более предпочтительно, раковое заболевание представляет собой злокачественную рабдоидную опухоль, медуллобластому и/или атипичную тератоидную/рабдоидную опухоль.
Например, способ включает стадию введения субъекту, имеющему раковое заболевание с экспрессией мутантного EZH2, терапевтически эффективного количества одного или более соединений формул, описанных в настоящей заявке, где соединение(я) ингибирует(ют) активность (например, гистонметилтрансферазную активность) мутантного EZH2, EZH2 дикого типа или их обоих, таким образом обеспечивая лечение ракового заболевания.
Например, способ дополнительно включает стадии проведения исследования для детектирования мутантного EZH2 в образце, содержащем раковые клетки, от субъекта, нуждающегося в лечении.
В другом аспекте настоящее изобретение относится к способу выбора терапии для пациента с заболеванием, связанным с метилированием белка, опосредованным EZH2. Способ включает стадии определения наличия мутаций в гене EZH2 субъекта; и выбора терапии для лечения заболевания на основе наличия мутаций в гене EZH2. В одном из вариантов реализации терапия включает введение одного или более соединений согласно настоящему изобретению. В одном из вариантов реализации способ дополнительно включает введение одного или более соединений согласно настоящему изобретению субъекту. В одном из вариантов реализации заболевание представляет собой раковое заболевание, и мутация представляет собой мутацию Y641.
В другом аспекте предложен способ лечения пациента, нуждающегося в лечении, включающий стадии определения наличия мутаций в гене EZH2 и лечения пациента, нуждающегося в лечении, на основе наличия мутаций в гене EZH2, где терапия включает введение соединений согласно настоящему изобретению. В одном из вариантов реализации пациент представляет собой пациента с раковым заболеванием, и мутация представляет собой мутацию Y641.
В другом аспекте настоящее изобретение относится к способу модулирования гистонметилтрансферазной активности EZH2 дикого типа и мутантного EZH2, каталитической субъединицы комплекса PRC2, который катализирует моно-, ди- и триметилирование лизина 27 гистона Н3 (Н3-K27). Например, настоящее изобретение относится к способу ингибирования активности некоторых мутантных форм EZH2 в клетке. Мутантные формы EZH2 включают замещение тирозином 641 (Y641, также Tyr641) остатка другой аминокислоты EZH2 дикого типа. Указанный способ можно проводить in vitro или in vivo.
В другом аспекте настоящее изобретение относится к способу ингибирования превращения Н3-K27 в триметилированный Н3-K27 у субъекта. Способ включает введение субъекту с экспрессией мутантного EZH2 терапевтически эффективного количества одного или более соединений любой из формул, описанных в настоящей заявке, для ингибирования гистонметилтрансферазной активности EZH2, что приводит к ингибированию превращения Н3-K27 в триметилированный Н3-K27 у субъекта. Например, ингибирование гистонметилтрансферазной активности наблюдается в случае EZH2, мутантного по Y641. Например, соединение согласно настоящему изобретению селективно ингибирует гистонметилтрансферазную активность EZH2, мутантного по Y641. Например, EZH2, мутантный по Y641, выбирают из группы, состоящей из Y641C, Y641F, Y641H, Y641N и Y641S.
Способ ингибирования превращения Н3-K27 в триметилированный Н3-K27 у субъекта также может включать проведение исследования для детектирования мутантного EZH2 в образце, полученном от субъекта, перед введением субъекту с экспрессией мутантного EZH2 терапевтически эффективного количества одного или более соединений любой из формул, описанных в настоящей заявке. Например, проведение исследования для детектирования мутантного EZH2 включает повторное секвенирование всего генома или повторное секвенирование целевого участка, позволяющее определить нуклеиновую кислоту, кодирующую мутантный EZH2. Например, проведение исследования для детектирования мутантного EZH2 включает приведение образца в контакт с антителом, которое специфически связывается с полипептидом или его фрагментом, характерным для мутантного EZH2. Например, проведение исследования для детектирования мутантного EZH2 включает приведение образца в очень строгих условиях в контакт с зондом нуклеиновой кислоты, который гибридизуется с образованием нуклеиновой кислоты, кодирующей полипептид или его фрагмент, характерный для мутантного EZH2.
Кроме того, настоящее изобретение также относится к способу определения ингибитора мутантного EZH2, EZH2 дикого типа или их обоих. Способ включает стадии объединения выделенного EZH2 с гистоновым субстратом, донорной метильной группой и исследуемым соединением, где гистоновый субстрат содержит форму Н3-K27, выбранную из группы, состоящей из неметилированного Н3-K27, монометилированного Н3-K27, диметилированного Н3-K27 и любой их комбинации; и проведения исследования для определения метилирования Н3-K27 (например, образование триметилированного Н3-K27) в гистоновом субстрате, что позволяет определить применимость исследуемого соединения в качестве ингибитора EZH2, если метилирование Н3-K27 (например, образование триметилированного Н3-K27) в присутствии исследуемого соединения меньше, чем метилирование Н3-K27 (например, образование триметилированного Н3-K27) при отсутствии исследуемого соединения.
В одном из вариантов реализации проведение исследования для определения метилирования Н3-K27 в гистоновом субстрате включает измерение включения меченых метильных групп.
В одном из вариантов реализации меченые метильные группы представляют собой изотопно меченые метильные группы.
В одном из вариантов реализации проведение исследования для определения метилирования Н3-K27 в гистоновом субстрате включает приведение гистонового субстрата в контакт с антителом, специфически связывающимся с триметилированным Н3-K27.
Также объем настоящего изобретения охватывает способ определения селективного ингибитора мутантного EZH2. Способ включает стадии объединения выделенного мутантного EZH2 с гистоновым субстратом, донорной метильной группой и исследуемым соединением, где гистоновый субстрат содержит форму Н3-K27, выбранную из группы, состоящей из монометилированного Н3-K27, диметилированного Н3-K27 и комбинации монометилированного Н3-K27 и диметилированного Н3-K27, с образованием таким образом исследуемой смеси; объединения выделенного EZH2 дикого типа с гистоновым субстратом, донорной метильной группой и исследуемым соединением, где гистоновый субстрат содержит форму Н3-K27, выбранную из группы, состоящей из монометилированного Н3-K27, диметилированного Н3-K27 и комбинации монометилированного Н3-K27 и диметилированного Н3-K27, с образованием таким образом контрольной смеси; проведения исследования для определения метилирования гистонового субстрата в каждой из исследуемой смеси и контрольной смеси; вычисления отношения (а) триметилирования с мутантным EZH2 и исследуемым соединением (М+) к (b) триметилированию с мутантным EZH2 при отсутствии исследуемого соединения (М-); вычисления отношения (с) триметилирования с EZH2 дикого типа и исследуемым соединением (WT+) к (d) триметилированию с EZH2 дикого типа при отсутствии исследуемого соединения (WT-); сравнения соотношения (а)/(b) и соотношения (c)/(d); и определения применимости исследуемого соединения в качестве ингибитора мутантного EZH2, если соотношение (а)/(b) меньше, чем соотношение (c)/(d).
В настоящем изобретении также предложен способ определения субъекта в качестве кандидата для прохождения лечения с применением одного или более соединений согласно настоящему изобретению. Способ включает стадии проведения исследования для определения мутантного EZH2 в образце, полученном от субъекта; и определения субъекта с экспрессией мутантного EZH2 в качестве кандидата для прохождения лечения с применением одного или более соединений согласно настоящему изобретению, где указанное(ые) соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2.
Другой аспект настоящего изобретения представляет собой способ ингибирования превращения Н3-K27 в триметилированный Н3-K27. Способ включает стадию приведения EZH2 дикого типа, мутантного EZH2 или их обоих в контакт с гистоновым субстратом, содержащим Н3-K27 и эффективное количество соединения согласно настоящему изобретению, где указанное соединение ингибирует гистонметилтрансферазы активность EZH2, что обеспечивает ингибирование превращения Н3-K27 в триметилированный Н3-K27.
Кроме того, соединения или способы, описанные в настоящей заявке, могут быть применены в исследованиях (например, изучение эпигенетических ферментов) и других нетерапевтических целях.
В некоторых вариантах реализации предпочтительные соединения, представленные в настоящей заявке, имеют улучшенные фармакологические и/или фармакокинетические свойства, например, более низкие скорости выведения, сниженный риск проявления нежелательных межлекарственных взаимодействий при комбинированной терапии за счет снижения зависящего от времени обратимого ингибирования ферментов цитохрома Р-450.
Если не указано иное, все технические и научные термины, применяемые в настоящей заявке, имеют то же значение, которое обычно понимает специалист в области техники, к которой относится настоящее изобретение. Если в контексте явно не указано иное, в настоящем описании формы единственного числа также включают формы множественного числа. Несмотря на то, что при реализации на практике или при тестировании настоящего изобретения могут быть использованы способы и материалы, схожие или эквивалентные способам и материалам, описанным в настоящей заявке, подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящей заявке, включены посредством ссылки. Ссылки, приведенные в настоящей заявке, не являются уровнем техники по отношению к заявленному изобретению. В случае противоречий, настоящее описание, включая определения, будет иметь решающее значение. Кроме того, материалы, способы и примеры представлены только в иллюстративных целях и не предназначены для ограничения.
Другие признаки и преимущества настоящего изобретения понятны из нижеприведенного подробного описания и формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены новые замещенные бензольные соединения, способы получения соединений, фармацевтические композиции, содержащие соединения, и различные способы применения соединений.
В одном из аспектов настоящее изобретение относится к соединению в соответствии с формулой I:
или к его фармацевтически приемлемой соли или сольвату, где
R701 представляет собой Н, F, OR707, NHR707, - (С≡С)-(CH2)n7-R708, фенил, 5- или 6-членный гетероарил, C3-8 циклоалкил или 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, где каждый из фенила, 5- или 6-членного гетероарила, C3-8 циклоалкила или 4-7-членного гетероциклоалкила независимо необязательно замещен одной или более группами, выбранными из галогена, C1-3 алкила, ОН, O-C1-6 алкила, NH-C1-6 алкила и C1-3 алкила, замещенного C3-8 циклоалкилом или 4-7-членным гетероциклоалкилом, содержащим 1-3 гетероатома, где каждый из O-C1-6 алкила и NH-C1-6 алкила необязательно замещен гидроксилом, O-C1-3 алкилом или NH-C1-3 алкилом, каждый из O-C1-3 алкила и NH-C1-3 алкила необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом;
каждый из R702 и R703 независимо представляет собой Н, галоген, C1-4 алкил, C1-6 алкоксил или C6-C10 арилокси, каждый из которых необязательно замещен одним или более галогенами;
каждый из R704 и R705 независимо представляет собой C1-4 алкил;
R706 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один или оба C1-4 алкила содержат в качестве заместителя C1-6 алкокси; или R706 представляет собой тетрагидропиранил;
R707 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из гидроксила, C1-4 алкокси, амино, моно- или ди-C1-4 алкиламино, C3-8 циклоалкила и 4-7-членного гетероциклоалкила, содержащего 1-3 гетероатома, где каждый из C3-8 циклоалкила или 4-7-членного гетероциклоалкила независимо необязательно дополнительно замещен C1-3 алкилом;
R708 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из ОН, галогена и C1-4 алкокси, 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, или O-C1-6 алкил, где 4-7-членный гетероциклоалкил необязательно дополнительно содержит в качестве заместителя ОН или C1-6 алкил; и
n7 равняется 0, 1 или 2.
Например, R706 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один из C1-4 алкилов является незамещенным, а другой содержит в качестве заместителя метокси.
Подмножество соединений формулы I включает соединения формулы II и их фармацевтически приемлемые соли:
Соединения формулы I или II могут содержать один или более следующих признаков:
Например, R702 представляет собой метил или изопропил.
Например, R703 представляет собой метил или метоксил.
Например, R704 представляет собой метил.
Например, R701 представляет собой OR707.
Например, R707 представляет собой C1-3 алкил, необязательно содержащий в качестве заместителя ОСН3 или морфолин.
Например, R701 представляет собой Н или F.
Например, R701 представляет собой тетрагидропиранил, необязательно содержащий в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
Например, R701 представляет собой фенил, необязательно содержащий в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
Например, R701 представляет собой 5-членный гетероарил (например, пирролил, фурил, тиофенил, тиазолил, изотиазолил, имидазолил, триазолил, тетразолил, пиразолил, оксазолил или изоксазолил), необязательно содержащий в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
Например, R701 представляет собой 6-членный гетероарил (например, пиридил, пиразинил, пиридазинил или пиримидил), необязательно содержащий в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
Например, R701 представляет собой пиридил, пиримидил, пиразинил, имидазолил или пиразолил, каждый из которых необязательно содержащий в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
Например, R708 представляет собой морфолин, пиперидин, пиперазин, пирролидин, диазепан или азетидин, каждый из которых необязательно содержит в качестве заместителя ОН или C1-6 алкил.
Например, R708 представляет собой морфолин.
Например, R708 представляет собой пиперазин, замещенный C1-6 алкилом.
Например, R708 представляет собой трег-бутил или С(СН3)2ОН.
Например, соединения формулы I или II не включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-((1-метилпиперидин-4-ил)этинил)бензамид (т.е. соединение 105).
Например, соединения формулы I или II не включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамид или N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((1r,4r)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамид (т.е. соединение 2).
Например, соединения формулы I или II включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-((1-метилпиперидин-4-ил)этинил)бензамид (т.е. соединение 105) или N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамид, например, N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((1r,4r)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамид (т.е. соединение 2).
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой III:
или к его фармацевтически приемлемой соли, где
R801 представляет собой C1-6 алкил, C2-6 алкенил, C2-6 алкинил, C3-8 циклоалкил, 4-7-членный гетероциклоалкил, содержащий 1-3 гетероатома, фенил или 5- или 6-членный гетероарил, каждый из которых содержит в качестве заместителя O-C1-6 алкил-Rx или NH-C1-6 алкил-Rx, где Rx представляет собой гидроксил, O-C1-3 алкил или NH-C1-3 алкил, и Rx необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом, кроме случаев, когда Rx представляет собой гидроксил; и R801 необязательно дополнительно замещен;
каждый из R802 и R803 независимо представляет собой Н, галоген, C1-4 алкил, C1-6 алкоксил или С6-С10 арилокси, каждый из которых необязательно замещен одним или более галогенами;
каждый из R804 и R805 независимо представляет собой C1-4 алкил; и
R806 представляет собой -Qx-Tx, где Qx представляет собой связь или C1-4 алкильную связующую группу, Tx представляет собой Н, необязательно замещенный C1-4 алкил, необязательно замещенный С3-С8 циклоалкил или необязательно замещенный 4-14-членный гетероциклоалкил.
Соединения формулы III могут содержать один или более следующих признаков:
Например, Qx представляет собой связь или метильную связующую группу.
Например, Tx представляет собой тетрагидропиранил.
Например, Tx представляет собой пиперидинил, замещенный 1, 2 или 3 C1-4 алкильными группами.
Например, Tx представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)г, где один или оба C1-4 алкила необязательно замещены C1-6 алкокси.
Например, R806 представляет собой циклогексил, содержащий в
Например, R801 представляет собой фенил, содержащий в качестве заместителя O-C1-6 алкил-Rx.
Например, R801 представляет собой 5-членный гетероарил (например, пирролил, фурил, тиофенил, тиазолил, изотиазолил, имидазолил, триазолил, тетразолил, пиразолил, оксазолил, изоксазолил), содержащий в качестве заместителя O-C1-6 алкил-Rx.
Например, R801 представляет собой 6-членный гетероарил (например, пиридил, пиразинил, пиридазинил или пиримидинил), содержащий в качестве заместителя O-C1-6 алкил-Rx.
Например, R801 представляет собой пиридил, пиримидинил, пиразинил, имидазолил или пиразолил, каждый из которых содержит в качестве заместителя O-C1-6 алкил-Rx.
Например, подмножества соединений формулы III включают соединения формулы IVa или IVb и их фармацевтически приемлемые соли:
где Z' представляет собой СН или N, и R807 представляет собой С2-3 алкил-Rx.
Например, R807 представляет собой -CH2CH2OH, -CH2CH2OCH3 или -CH2CH2OCH2CH2OCH3.
Например, R802 представляет собой метил или изопропил.
Например, R803 представляет собой метил или метоксил.
Например, R804 представляет собой метил.
Например, соединения формулы III не включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-((4-(диметиламино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамид или N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((1r,4r)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамид (т.е. соединение 1).
Например, соединения формулы III включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-((4-(диметиламино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамид.
Например, соединения формулы III включают N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((1r,4r)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамид (т.е. соединение 1).
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой IA:
или к его фармацевтически приемлемой соли или сольвату, где
R21 представляет собой водород или C1-C6 алкил,
R22 представляет собой (а) 3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (b) 3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (а)-(b) необязательно замещены одним или более R2a;
каждый из R23 и R24 независимо представляет собой C1-C6 алкил;
R1a представляет собой (а) 3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (b) 3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (а)-(b) необязательно замещены одним или более R3a;
каждый из R2a независимо представляет собой C1-C6 алкил, NH2, NH(C1-C6 алкил) или N(C1-C6 алкил)2;
каждый из R3a независимо представляет собой (а) ОН, (b) C1-C6 алкил или (с) O(C1-C6 алкил), где (b)-(с) необязательно замещены одним или более ОН, и
m равняется 0, 1, 2 или 3;
при условии, что
(i) если R22 представляет собой тетрагидропиранил, R1a не является морфолинилом; или
(ii) если R1a представляет собой пиперазинил или циклопропил, R21 не является метилом, или
(iii) указанное соединение не является N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-(диметиламино)циклогексил)(этил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензамидом или 5-(циклопропилэтинил)-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-(диметиламино)циклогексил)(этил)амино)-2-метилбензамидом.
Например, в некоторых соединениях формулы IA R21 представляет собой C1-C6 алкил. Например, R1 представляет собой метил или изопропил.
Например, в некоторых соединениях формулы IA R22 представляет собой 6-членный насыщенный карбоцикл или 6-членный насыщенный гетероцикл. Например, R22 представляет собой циклогексил или тетрагидропиранил. В некоторых соединениях циклогексил содержит в качестве заместителя N(C1-C6 алкил)2, такой как, например, N(СН3)2.
Например, в некоторых соединениях формулы IA R22 представляет собой тетрагидропиранил.
Например, в некоторых соединениях формулы IA R1a представляет собой 4-7-членный насыщенный гетероцикл. Например, R1a представляет собой азетидинил, пирролидинил, пиперидинил, морфолинил, пиперазинил или диазепанил.
Например, R23 представляет собой этил.
Например, R24 представляет собой метил.
Например, m равняется 0 или 1.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой IIIa:
или к его фармацевтически приемлемой соли или сольвату, где
R101 представляет собой водород, C1-C6 алкил или C1-C6 галогеналкил;
R102 представляет собой водород или галоген;
R103 представляет собой водород или C1-C6 алкил; и
R104 представляет собой водород или C1-C6 алкил; при условии, что если R101 представляет собой метил, и если R102 и R103 представляют собой водород, R104 не является водородом.
Например, в некоторых соединениях формулы IIIa R101 представляет собой C1-C6 алкил. Например, R101 представляет собой метил, н-пропил или изопропил.
Например, в некоторых соединениях формулы IIIa R101 представляет собой C1-C6 галогеналкил. Например, R101 представляет собой CF3, CF2H или CFH2. В некоторых соединениях формулы IIIa R101 представляет собой CF3.
Например, в некоторых соединениях формулы IIIa R102 представляет собой галоген. Например, R102 представляет собой фтор.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой IIIb:
или к его фармацевтически приемлемой соли или сольвату, где
X1 представляет собой N или СН;
R201 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил;
R202 представляет собой водород или C1-C6 алкил;
R203 представляет собой (а) ОН, (b) C1-C6 алкил, (с) O(C1-C6 алкил), (d) (CH2)j-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл, (е) (CH2)k-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, (f) О-(CH2)u-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (g) О-(CH2)v-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (b)-(g) необязательно замещены одним или более R203a;
R203a представляет собой C1-C6 алкил, C1-C6 галогеналкил, ОН или O(C1-C6 алкил);
R204 представляет собой C1-C6 алкил;
t равняется 1, 2 или 3;
u равняется 0, 1, 2 или 3;
v равняется 0, 1, 2 или 3;
z равняется 0, 1, 2 или 3;
j равняется 0, 1, 2 или 3; и
k равняется 0, 1, 2 или 3.
Например, в некоторых соединениях формулы IIIb X1 представляет собой N, и X2 представляет собой СН. Например, в некоторых соединениях формулы III R201 представляет собой C1-C6 алкил. Например, R201 представляет собой метил.
Например, в некоторых соединениях формулы IIIb R202 представляет собой водород. В некоторых других соединениях формулы III R202 представляет собой C1-C6 алкил. Например, R202 представляет собой метил.
Например, в некоторых соединениях формулы IIIb R203 представляет собой (CH2)k-6-членный насыщенный гетероцикл. Например, k равняется 1.
Например, в некоторых других соединениях формулы IIIb R203 представляет собой (CH2)-пиперазинил или (CH2)-морфолинил. Например, t равняется 1.
В некоторых соединениях формулы IIIb R204 представляет собой метил.
В некоторых соединениях формулы IIIb z равняется 2.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой IV:
или к его фармацевтически приемлемой соли или сольвату, где
Y1 представляет собой N или СН;
Y2 представляет собой N или СН;
R301 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил;
R302 представляет собой (a) C1-C6 алкил, (b) C1-C6 галогеналкил, (с) O(C1-C6 алкил), (d) (CH2)j-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл, (е) (CH2)k-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, (f) О-(CH2)u-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (g) О-(CH2)v-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (а)-(g) необязательно замещены одним или более R302a;
R302a представляет собой C1-C6 алкил, C1-C6 галогеналкил, ОН или O(C1-C6 алкил);
t равняется 1, 2 или 3;
u равняется 0, 1, 2 или 3;
v равняется 0, 1, 2 или 3;
j равняется 0, 1, 2 или 3; и
k равняется 0, 1, 2 или 3; при условии, что (i) если R302 представляет собой (CH2)-морфолинил, R301 не является метилом, изопропилом или н-пропилом; или (ii) R302 не является пиперазинилом или (CH2)-пиперазинилом.
Например, в некоторых соединениях формулы IV Y1 представляет собой N, и Y2 представляет собой СН.
Например, в некоторых соединениях формулы IV R301 представляет собой C1-C6 алкил. Например, R301 представляет собой метил или изопропил. В некоторых соединениях R301 представляет собой метил. В других соединениях R301 представляет собой C1-C6 галогеналкил. Например, R301 представляет собой CF3, CF2H или CFH2. В некоторых соединениях R301 представляет собой CF3.
Например, в некоторых соединениях формулы IV R303 представляет собой O(C1-C6 алкил). Например, R302 представляет собой метокси или изопропокси. В некоторых других соединениях R302 представляет собой O-4-6-членный насыщенный гетероцикл. Например, гетероцикл представляет собой азетидинил или пиперидинил. В некоторых соединениях формулы IV R302 представляет собой (CH2)-4-7-членный насыщенный гетероцикл. Например, гетероцикл представляет собой азетидинил, пирролидинил, пиперидинил, морфолинил или диазепанил.
В другом аспекте настоящее изобретение относится к соединению в соответствии с формулой V:
или к его фармацевтически приемлемой соли или сольвату, где
W1 представляет собой N или СН;
W2 представляет собой N или СН;
R401 представляет собой водород, C1-C6 алкил, C1-C6 галогеналкил;
R402 представляет собой (а) ОН, (b) (CH2)-О-(C1-C6 алкил),
(с) O(C1-C6 алкил), (d) (CH2)j-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл, (е) (CH2)k-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, (f) О-(CH2)u-3-8-членный насыщенный, ненасыщенный или ароматический карбоцикл или (g) O-(CH2)v-3-8-членный насыщенный, ненасыщенный или ароматический гетероцикл, содержащий один или более гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы, где (b)-(g) необязательно замещены одним или более R402a;
R402a представляет собой C1-C6 алкил, C1-C6 галогеналкил, ОН или O(C1-C6 алкил);
t равняется 1, 2 или 3;
u равняется 0, 1, 2 или 3;
v равняется 0, 1, 2 или 3;
j равняется 0, 1, 2 или 3; и
k равняется 0, 1, 2 или 3; при условии, что если R402 представляет собой пиперазинил, W1 и W2 представляют собой N.
В некоторых соединениях формулы V W1 представляет собой N, и W2 представляет собой СН.
В некоторых соединениях формулы V R401 представляет собой C1-C6 алкил. Например, R401 представляет собой метил или изопропил. Например, R401 представляет собой метил.
В некоторых соединениях формулы V R402 представляет собой (CH2)k-4-7-членный насыщенный гетероцикл, содержащий один или более атомов азота или кислорода.
В некоторых соединениях формулы V k равняется 0 или 1. Например, k равняется 0. Например, k равняется 1.
В некоторых соединениях формулы V R402 представляет собой азетидинил, пиперазинил или пиперидинил.
В некоторых соединениях R402 представляет собой (CH2)-азетидинил, (CH2)-пирролидинил, (CH2)-пиперидинил, (CH2)-морфолинил или (CH2)-диазепанил.
В некоторых соединениях формулы V t равняется 1.
В некоторых соединениях формулы V R402 представляет собой ОН, метил или метокси.
В другом аспекте настоящее изобретение относится к соединению формулы VI:
или к его фармацевтически приемлемой соли или сольвату, где
n5 равняется 0, 1 или 2;
R501 представляет собой С(Н) или N;
каждый из R502, R503, R504 и R505 независимо представляет собой C1-4 алкил;
R506 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой С(Н), R507 представляет собой морфолин; пиперидин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где гетероцикл представляет собой 4-7-членный гетероцикл, содержащий кислород или азот или и кислород, и азот, и где азот необязательно замещен C1-3 алкилом; где пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН, C1-6 алкил или O-C1-3 алкил;
или если R501 представляет собой С(Н), R507 может представлять собой пиперазин, необязательно дополнительно замещенный C1-6 алкилом, при условии, что R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой N, R507 представляет собой морфолин; пиперидин; пиперазин; диазепан; пирролидин; азетидин; O-C1-6 алкил или O-гетероцикл, где гетероцикл представляет собой 4-7-членный гетероцикл, содержащий кислород или азот или и кислород, и азот, и где азот необязательно замещен C1-3 алкилом; где пиперидиновая, пиперазиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН, C1-6 алкил или O-C1-3 алкил.
В некоторых соединениях формулы VI R501 представляет собой С(Н), и R507 представляет собой пиперидин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где гетероцикл представляет собой 4-7-членный гетероцикл, содержащий кислород или азот или и кислород, и азот, и где азот необязательно замещен C1-3 алкилом; где пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержит в качестве заместителя ОН, C1-6 алкил или O-C1-3 алкил.
В некоторых соединениях формулы VI R501 представляет собой С(Н), и R507 представляет собой пиперидин, диазепан, пирролидин, азетидин или O-C1-6 алкил; где пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержит в качестве заместителя ОН или C1-6 алкил.
В некоторых соединениях формулы VI R501 представляет собой С(Н), и R507 представляет собой пиперазин, необязательно дополнительно замещенный C1-6 алкилом, и R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами.
В некоторых соединениях формулы VI R501 представляет собой N, и R507 представляет собой морфолин, пиперидин, пиперазин, диазепан, пирролидин, азетидин или O-C1-6 алкил; где пиперидиновая, пиперазиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН или C1-6 алкил.
В некоторых соединениях формулы VI R502 представляет собой метил или изопропил, и R503 представляет собой метил.
В некоторых соединениях формулы VI R504 представляет собой метил.
В некоторых соединениях формулы VI R505 представляет собой этил.
В некоторых соединениях формулы VI R506 представляет собой
В некоторых соединениях формулы VI R506 представляет собой
В некоторых соединениях формулы VI, если R501 представляет собой С(Н), R507 представляет собой пиперидин или диазепан, которые содержат в качестве заместителя ОН или C1-6 алкил, или если R501 представляет собой N, R507 представляет собой пиперидин, пиперазин или диазепан, которые необязательно дополнительно содержат в качестве заместителя ОН или C1-6 алкил.
В некоторых соединениях формулы VI, если R501 представляет собой С(Н), R507 представляет собой пиперидин, замещенный C1-6 алкилом, или если R501 представляет собой N, R507 представляет собой пиперидин, содержащий в качестве заместителя ОН, или пиперазин, замещенный C1-6 алкилом.
В некоторых соединениях формулы VI, если R501 представляет собой N, R507 представляет собой незамещенный пиперазин.
В некоторых соединениях формулы VI n5 равняется 0 или 1.
В некоторых соединениях формулы VI, если R501 представляет собой С(Н) или N, R507 представляет собой O-C1-6 алкил или O-гетероцикл, и n5 равняется 1.
В некоторых соединениях формулы VI, если R501 представляет собой С(Н), R507 представляет собой незамещенный пиперазин, и R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами.
В другом аспекте настоящее изобретение относится к соединению формулы VII:
или к его фармацевтически приемлемой соли или сольвату, где
n6 равняется 0, 1 или 2;
каждый из R602, R603, R604 и R605 независимо представляет собой C1-4 алкил; или каждый из R602 и R603 независимо представляет собой C1-4 алкоксил;
R606 представляет собой тетрагидропиран, циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами; и
R607 представляет собой морфолин, пиперидин, пиперазин, пирролидин, диазепан, азетидин или O-C1-6 алкил, где пиперидиновая, диазепановая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя ОН; C1-6 алкил, необязательно замещенный одним или более галогенами; С3-6 циклоалкил; C(O)C1-6 алкил или 4-7-членный гетероциклоалкил, необязательно замещенный C1-4 алкилом;
при условии, что если R606 представляет собой тетрагидропиран, n6 равняется 0 или 2.
В некоторых соединениях формулы VII R602 представляет собой метил или изопропил, и R603 представляет собой метил.
В некоторых соединениях формулы VII R604 представляет собой метил, и R605 представляет собой этил.
В некоторых соединениях формулы VII R606 представляет собой
В некоторых соединениях формулы VII R606 представляет собой
В некоторых соединениях формулы VII R607 представляет собой пиперидин или диазепан, каждый из которых содержит в качестве заместителя ОН или C1-6 алкил.
В некоторых соединениях формулы VII R607 представляет собой пиперидин, содержащий в качестве заместителя ОН.
В некоторых соединениях формулы VII R607 представляет собой пиперидин, замещенный C1-6 алкилом, необязательно замещенным одним или более галогенами; С3-6 циклоалкилом; C(O)C1-6 алкилом или 4-7-членным гетероциклоалкилом.
В некоторых соединениях формулы VII R607 представляет собой пиперидин, замещенный C1-6 алкилом, необязательно замещенным одним или более галогенами; С3-6 циклоалкилом; C(O)C1-6 алкилом или 4-7-членным гетероциклоалкилом; и n6 равняется 0.
В некоторых соединениях формулы VII n6 равняется 2.
В другом аспекте настоящее изобретение относится к соединению формулы VIIa:
или к его фармацевтически приемлемой соли или сольвату, где
RP2 представляет собой СН3 или ОСН3, и
RP7 представляет собой C1-4 алкил; С3-6 циклоалкил или 4-7-членный гетероциклоалкил, необязательно замещенный C1-4 алкилом.
В некоторых соединениях формулы VIIa RP7 представляет собой циклопропил или циклобутил.
В некоторых соединениях формулы VIIa RP7 представляет собой азетидинил или пиперидинил, каждый из которых необязательно содержит в качестве заместителя СН3.
В некоторых соединениях формулы VIIa RP7 представляет собой оксетанил.
В другом аспекте настоящее изобретение относится к соединению формулы VIIb:
или к его фармацевтически приемлемой соли или сольвату, где
RP2 представляет собой СН3 или ОСН3, и
RP7 представляет собой C(O)C1-4 алкил или C1-4 галогеналкил.
В некоторых соединениях формулы VIIb RP7 представляет собой С(O)СН3.
В некоторых соединениях формулы VIIb RP7 представляет собой CH2CF3.
В настоящем изобретении предложены соединения формулы (I'):
или их фармацевтически приемлемые соли.
В указанной формуле
X1 представляет собой N или CR11;
X2 представляет собой N или CR13;
Z представляет собой NR7R8, OR7, S(O)nR7 или CR7R8R14, где n равняется 0, 1 или 2;
каждый из R1, R5, R9 и R10 независимо представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, С(О)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
каждый из R2, R3 и R4 независимо представляет собой -Q1-T1, в котором Q1 представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и T1 представляет собой Н, галоген, гидроксил, СООН, циано или RS1, где RS1 представляет собой C1-С3 алкил, С2-С6 алкенил, С2-С6 алкинил, C1-C6 алкоксил, C(O)O-C1-C6 алкил, С3-С8 циклоалкил, С6-С10 арил, амино, моно-С3-С6 алкиламино, ди-C1-C6 алкиламино, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и RS1 необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, оксо, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
R6 представляет собой С6-С10 арил или 5- или 6-членный гетероарил, каждый из которых необязательно замещен одним или более -Q2-T2, где Q2 представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и T2 представляет собой Н, галоген, циано, -ORa, -NRaRb, - (NRaRbRc) +А-, -С(О)Ra, -C(O)ORa, -C(O)NRaRb, -NRbC(O)Ra, -NRbC(O)ORa, -S(O)2Ra, -S(O)2NRaRb или RS2, где каждый из Ra, Rb и Rc независимо представляет собой Н или RS3, А- представляет собой фармацевтически приемлемый анион, каждый из RS2 и RS3 независимо представляет собой C1-C6 алкил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, или Ra и Rb совместно с атомом N, к которому они прикреплены, образуют 4-12-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, и каждый из RS2, RS3 и 4-12-членного гетероциклоалкильного кольца, образованного Ra и Rb, необязательно замещен одним или более -Q3-Т3, где Q3 представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и Т3 выбран из группы, состоящей из галогена, циано, C1-C6 алкила, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила, 5- или 6-членного гетероарила, ORd, COORd, -S(О)2Rd, -NRdRe и -C(O)NRdRe, каждый из Rd и Re независимо представляет собой Н или C1-C6 алкил, необязательно содержащий в качестве заместителя ОН, O-C1-C6 алкил или NH-C1-C6 алкил, или -Q3-Т3 представляет собой оксо; или любые два соседних -Q2-T2, совместно с атомами, к которым они прикреплены, образуют 5- или 6-членное кольцо, необязательно содержащее 1-4 гетероатома, выбранных из N, О и S, и необязательно замещенное одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арил, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
R7 представляет собой -Q4-T4, в котором Q4 представляет собой связь, C1-C4 алкильную связующую группу или С2-С4 алкенильную связующую группу, каждая из связующих групп необязательно замещена галогеном, циано, гидроксилом или C1-C6 алкокси, и T4 представляет собой Н, галоген, циано, NRfRg, -ORf, -C(O)Rf, -C(O)ORf, -С(О)NRfRg, -C(O)NRfORg, -NRfC(O)Rg, -S(O)2Rf или RS4, где каждый из Rf и Rg независимо представляет собой Н или RS5, каждый из RS4 и RS5 независимо представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и каждый из RS4 и RS5 необязательно замещен одним или более -Q5-Т5, где Q5 представляет собой связь, С(О), C(O)NRk, NRkC(O), NRk, S(O)2, NRkS(O)2 или C1-С3 алкильную связующую группу, Rk представляет собой Н или C1-C6 алкил, и Т5 представляет собой Н, галоген, C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, гидроксил, циано, C1-C6 алкоксил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)qRq, в котором q равняется 0, 1 или 2, и Rq представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и Т5 необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C6 алкила, гидроксила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, кроме случаев, когда Т5 представляет собой Н, галоген, гидроксил или циано; или -Q5-Т5 представляет собой оксо;
каждый из R8, R11, R12 и R13 независимо представляет собой Н, галоген, гидроксил, СООН, циано, RS6, ORS6 или COORS6, где RS6 представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, 4-12-членный гетероциклоалкил, амино, моно-C1-C6 алкиламино или ди-C1-C6 алкиламино, и RS6 необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино и ди-C1-C6 алкиламино; или R7 и R8 совместно с атомом N, к которому они прикреплены, образуют 4-11-членное гетероциклоалкильное кольцо, содержащее 0-2 дополнительных гетероатома, или R7 и R8 совместно с атомом С, к которому они прикреплены, образуют С3-С8 циклоалкил или 4-11-членное гетероциклоалкильное кольцо, содержащее 1-3 гетероатома, и каждое из 4-11-членных гетероциклоалкильных колец или С3-С8 циклоалкилов, образованных R7 и R8, необязательно замещено одним или более -Q6-T6, где Q6 представляет собой связь, С(О), C(O)NRm, NRmC(O), S(O)2 или C1-С3 алкильную связующую группу, Rm представляет собой Н или C1-C6 алкил, и Т6 представляет собой Н, галоген, C1-C6 алкил, гидроксил, циано, C1-C6 алкоксил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)pRp, в котором р равняется 0, 1 или 2, и Rp представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и Т6 необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C6 алкила, гидроксила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, кроме случаев, когда Т6 представляет собой Н, галоген, гидроксил или циано; или -Q6-T6 представляет собой оксо; и
R14 отсутствует или представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила.
Одно из подмножеств соединений формулы (I') включает соединения формулы (Ia):
Другое подмножество соединений формулы (I') включает соединения формулы (Ib), (Ic) или (Id):
Соединения формулы (I'), (Ia), (Ib), (Ic) и (Id) могут содержать один или более следующих признаков, где применимо:
Например, X1 представляет собой CR11, и X2 представляет собой CR13.
Например, X1 представляет собой CR11, и X2 представляет собой N.
Например, X1 представляет собой N, и X2 представляет собой CR13.
Например, X1 представляет собой N, и X2 представляет собой N.
Например, Z представляет собой NR7R8.
Например, Z представляет собой CR7R8R14.
Например, Z представляет собой OR7.
Например, Z представляет собой S(O)nR7, в котором n равняется 0, 1 или 2.
Например, Z представляет собой SR7.
Например, R6 представляет собой незамещенный С6-С10 арил или незамещенный 5- или 6-членный гетероарил.
Например, R6 представляет собой С6-С10 арил, замещенный одним или более -Q2-T2, или 5- или 6-членный гетероарил, замещенный одним или более -Q2-T2.
Например, R6 представляет собой незамещенный фенил.
Например, R6 представляет собой фенил, замещенный одним или более -Q2-T2.
Например, R6 представляет собой 5-6-членный гетероарил, содержащий 1-3 дополнительных гетероатома, выбранных из N, О и S, и необязательно замещенный одним или более -Q2-T2.
Например, R6 представляет собой пиридинил, пиразолил, пиримидинил, хинолинил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, фурил или тиенил, каждый из которых необязательно замещен одним или более -Q2-T2.
Например, Q2 представляет собой связь.
Например, Q2 представляет собой незамещенную C1-С3 алкильную связующую группу.
Например, T2 представляет собой C1-C6 алкил или С6-С10 арил, каждый из которых необязательно замещен одним или более -Q3-Т3.
Например, T2 представляет собой незамещенный или замещенный линейный C1-C6 или разветвленный С3-С6 алкил, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, -н-бутил, втор-бутил, трет-бутил, н-пентил, втор-пентил и н-гексил.
Например, T2 представляет собой фенил.
Например, T2 представляет собой галоген (например, фтор, хлор, бром или йод).
Например, T2 представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиран, морфолинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2.5-диазабицикло[2.2.1]гептанил, 2-окса-6-азаспиро[3.3]гептанил, 2.6-диазаспиро[3.3]гептанил и т.п.), необязательно замещенный одним или более -Q3-Т3.
Например, T2 представляет собой -ORa, -NRaRb, - (NRaRbRc) +A-, -C(O)Ra, -С(О)ORa, -С(О)NRaRb, -NRbC(O)Ra, -NRbC(O)ORa, -S(O)2Ra или -S(O)2NRaRb.
Например, T2 представляет собой -NRaRb или -C(O)NRaRb, где каждый из Ra и Rb независимо представляет собой Н или C1-C6 алкил, или Ra и Rb совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, C1-C6 алкил и 4-7-членное гетероциклоалкильное кольцо, необязательно замещенное одним или более -Q3-Т3.
Например, Q2 представляет собой C1-С3 алкильную связующую группу, необязательно замещенную галогеном или гидроксилом.
Например, Q2 представляет собой связь или метильную связующую группу, и T2 представляет собой Н, галоген, -ORa, -NRaRb, - (NRaRbRc) +A- или -S(O)2NRaRb.
Например, каждый из Ra, Rb и Rc независимо представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более -Q3-Т3.
Например, один из Ra, Rb и Rc представляет собой Н.
Например, Ra и Rb совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом помимо атома N (например, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, морфолинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, 2-окса-6-азаспиро[3.3]гептанил, 2,6-диазаспиро[3.3]гептанил и т.п.), и кольцо необязательно замещено одним или более -Q3-Т3.
Например, -Q3-Т3 представляет собой оксо.
Например, T2 представляет собой 4-7-членный гетероциклоалкил или С3-С8 циклоалкил, и один или более -Q3-Т3 представляют собой оксо.
Например, Q3 представляет собой связь или незамещенную или замещенную C1-С3 алкильную связующую группу.
Например, Т3 представляет собой Н, галоген, 4-7-членный гетероциклоалкил, C1-С3 алкил, ORd, COORd, -S(O)2Rd или -NRdRe.
Например, один из Rd и Re представляет собой Н.
Например, R6 представляет собой фенил или 5- или 6-членный гетероарил, замещенный O-C1-6 алкилом или NH-C1-6 алкилом, каждый из которых необязательно замещен гидроксилом, O-C1-3 алкилом или NH-C1-3 алкилом, каждый из O-C1-3 алкила и NH-C1-3 алкила необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом.
Например, R7 не является Н.
Например, R7 представляет собой -C(O)Rf.
Например, R7 представляет собой -C(O)Rf, в котором Rf представляет собой С3-С8 циклоалкил.
Например, R7 представляет собой C6-C10 арил, замещенный одним или более -Q5-Т5.
Например, R7 представляет собой фенил, необязательно замещенный одним или более -Q5-Т5.
Например, R7 представляет собой C1-C6 алкил, необязательно замещенный одним или более -Q5-Т5.
Например, R7 представляет собой С3-С8 циклоалкил, необязательно замещенный одним или более -Q5-Т5.
Например, R7 представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиран, морфолинил и т.п.), необязательно замещенный одним или более -Q5-Т5.
Например, R7 представляет собой 5-6-членный гетероциклоалкил, необязательно замещенный одним или более -Q5-Т5.
Например, R7 представляет собой изопропил.
Например, R7 представляет собой пирролидинил, пиперидинил, тетрагидропиран, циклопентил, циклогексил или циклогептил, каждый из которых необязательно замещен одним -Q5-Т5.
Например, R7 представляет собой циклопентил или циклогексил, каждый из которых необязательно замещен одним -Q5-Т5.
Например, R7 представляет собой пирролидинил, пиперидинил, тетрагидропиран, тетрагидро-2Н-тиопиранил, циклопентил, циклогексил или циклогептил, каждый из которых необязательно замещен одним или более -Q5-Т5.
Например, R7 представляет собой циклопентил, циклогексил или тетрагидро-2Н-тиопиранил, каждый из которых необязательно замещен одним или более -Q5-Т5.
Например, один или более -Q5-Т5 представляют собой оксо.
Например, R7 представляет собой 1-оксидтетрагидро-2Н-тиопиранил или 1,1-диоксидтетрагидро-2Н-тиопиранил.
Например, Q5 представляет собой связь, и Т5 представляет собой амино, моно-C1-C6 алкиламино или ди-C1-C6 алкиламино.
Например, Q5 представляет собой NHC(О), и Т5 представляет собой C1-C6 алкил или C1-C6 алкокси.
Например, -Q5-Т5 представляет собой оксо.
Например, Т5 представляет собой 4-7-членный гетероциклоалкил или С3-С8 циклоалкил, и один или более -Q5-Т5 представляют собой оксо.
Например, Т5 представляет собой Н, галоген, C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил, С6-С10 арил или 4-7-членный гетероциклоалкил.
Например, Q5 представляет собой связь, и Т5 представляет собой C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Q5 представляет собой СО, S(O)2 или NHC(O); и Т5 представляет собой C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Т5 представляет собой C1-C6 алкил или C1-C6 алкоксил, каждый из которых необязательно замещен галогеном, гидроксилом, циано, C1-C6 алкоксилом, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или С3-С8 циклоалкилом.
Например, Q5 представляет собой C1-С3 алкильную связующую группу, и Т5 представляет собой Н или С6-С10 арил.
Например, Q5 представляет собой C1-С3 алкильную связующую группу, и Т5 представляет собой С3-С8 циклоалкил, 4-7-членный гетероциклоалкил или S(O)qRq.
Например, R11 представляет собой Н.
Например, каждый из R2 и R4 независимо представляет собой Н или C1-C6 алкил, необязательно замещенный амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или C6-С10 арилом.
Например, каждый из R2 и R4 независимо представляет собой C1-С3 алкил, необязательно замещенный C1-C6 алкоксилом.
Например, каждый из R2 и R4 представляет собой метил.
Например, R1 представляет собой Н.
Например, R12 представляет собой Н, метил, этил, этенил или галоген.
Например, R12 представляет собой метил.
Например, R12 представляет собой этил.
Например, R12 представляет собой этенил.
Например, R8 представляет собой Н, метил, этил или этенил.
Например, R8 представляет собой метил.
Например, R8 представляет собой этил.
Например, R8 представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиран, морфолинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, 2-окса-6-азаспиро[3.3]гептанил, 2,6-диазаспиро[3.3]гептанил и т.п.).
Например, R8 представляет собой тетрагидропиран.
Например, R8 представляет собой тетрагидропиран, и R7 представляет собой -Q4-T4, в котором Q4 представляет собой связь или C1-C4 алкильную связующую группу, и T4 представляет собой Н, C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, ни R7, ни R8 не представляют собой тетрагидропиран.
Например, Z представляет собой NR7R8 или CR7R8R14, где R7 и R8 совместно с атомом, к которому они прикреплены, образуют 4-11-членное гетероциклоалкильное кольцо, содержащее 1-3 гетероатома (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиран, морфолинил, 1,4-диокса-8-азаспиро[4.5]деканил и т.п.), или С3-С8 циклоалкил, каждый из которых необязательно замещен одним или более -Q6-T6.
Например, кольцо, образованное R7 и R8, выбрано из группы, состоящей из азетидинила, пирролидинила, пиперидинила, морфолинила, пиперазинила, 1,4-диокса-8-азаспиро[4.5]деканила и циклогексенила, каждый из которых необязательно замещен одним -Q6-Т6.
Например, -Q6-T6 представляет собой оксо.
Например, Т6 представляет собой Н, галоген, C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил, С6-С10 арил или 4-7-членный гетероциклоалкил.
Например, Q6 представляет собой связь, и Т6 представляет собой C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Q6 представляет собой СО, S(O)2 или NHC(O); и Т6 представляет собой C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Т6 представляет собой C1-C6 алкил или C1-C6 алкоксил, каждый из которых необязательно замещен галогеном, гидроксилом, циано, C1-C6 алкоксилом, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или С3-С8 циклоалкилом.
Например, Q6 представляет собой C1-С3 алкильную связующую группу, и Т6 представляет собой Н или С6-С10 арил.
Например, Q6 представляет собой C1-С3 алкильную связующую группу, и Т6 представляет собой С3-С8 циклоалкил, 4-7-членный гетероциклоалкил или S(O)pRp.
Например, каждый из Rp и Rq независимо представляет собой C1-C6 алкил.
Например, R13 представляет собой Н или метил.
Например, R13 представляет собой Н.
Например, R3 представляет собой Н.
Например, А- представляет собой Br- или Cl-.
Например, каждый из R5, R9 и R10 представляет собой Н.
Другое подмножество соединений формулы (I') включает соединения формулы (Ie) или (Ig):
или их фармацевтически приемлемые соли, где Z, X2, R2, R3, R4, R6 и R12 определены в настоящей заявке.
Например, каждый из R2, R4 и R12 независимо представляет собой C1-C6 алкил.
Например, R6 представляет собой С6-С10 арил или 5- или 6-членный гетероарил, каждый из которых независимо необязательно замещен одним или более -Q2-T2, где Q2 представляет собой связь или C1-С3 алкильную связующую группу, и T2 представляет собой Н, галоген, циано, -ORa, -NRaRb, - (NRaRbRc) +A-, -C(O)NRaRb, -NRbC(O)Ra, -S(O)2Ra или RS2, где каждый из Ra и Rb независимо представляет собой Н или RS3, каждый из RS2 и RS3 независимо представляет собой C1-C6 алкил, или Ra и Rb совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, и каждый из RS2, RS3 и 4-7-членного гетероциклоалкильного кольца, образованного Ra и Rb, независимо необязательно замещен одним или более -Q3-Т3, где Q3 представляет собой связь или C1-С3 алкильную связующую группу, и Т3 выбран из группы, состоящей из галогена, C1-C6 алкила, 4-7-членного гетероциклоалкила, ORd, -S(O)Rd и -NRdRe, каждый из Rd и Re независимо представляет собой Н или C1-C6 алкил, или -Q3-Т3 представляет собой оксо; или любые два соседних -Q2-T2, совместно с атомами, к которым они прикреплены, образуют 5- или 6-членное кольцо, необязательно содержащее 1-4 гетероатома, выбранных из N, О и S.
Другое подмножество соединений формулы (I') включает соединения формулы (II'):
или их фармацевтически приемлемые соли,
где
Q2 представляет собой связь или метильную связующую группу;
T2 представляет собой Н, галоген, -ORa, -NRaRb, - (NRaRbRc) +A- или -S(O)2NRaRb;
R7 представляет собой пиперидинил, тетрагидропиран, циклопентил или циклогексил, каждый из которых необязательно замещен одним -Q5-Т5;
R8 представляет собой этил, и
Ra, Rb и Rc определены в настоящей заявке.
Например, Q2 представляет собой связь.
Например, Q2 представляет собой метильную связующую группу.
Например, T2 представляет собой -NRaRb или - (NRaRbRc) +A-.
Другое подмножество соединений формулы (I') включает соединения формулы (IIa):
или их фармацевтически приемлемые соли, где R7, R8, Ra, Rb и Rc определены в настоящей заявке.
Соединения формулы (II') или (IIa) могут содержать один или более следующих признаков, где применимо:
Например, каждый из Ra и Rb независимо представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более -Q3-Т3.
Например, один из Ra и Rb представляет собой Н.
Например, Ra и Rb совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом помимо атома N (например, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, морфолинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил и т.п.), и кольцо необязательно замещено одним или более -Q3-Т3.
Например, Ra и Rb совместно с атомом N, к которому они прикреплены, образуют азетидинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил или морфолинил, и кольцо необязательно замещено одним или более -Q3-Т3.
Например, один или более -Q3-Т3 представляют собой оксо.
Например, Q3 представляет собой связь или незамещенную или замещенную C1-С3 алкильную связующую группу.
Например, Т3 представляет собой Н, галоген, 4-7-членный гетероциклоалкил, C1-С3 алкил, ORd, COORd, -S(O)2Rd или -NRdRe.
Например, один из Rd и Re представляет собой Н.
Например, R7 представляет собой С3-С8 циклоалкил или собой 4-7-членный гетероциклоалкил, каждый из которых необязательно замещен одним или более -Q5-Т5.
Например, R7 представляет собой пиперидинил, тетрагидропиран, тетрагидро-2Н-тиопиранил, циклопентил, циклогексил, пирролидинил или циклогептил, каждый из которых необязательно замещен одним или более -Q5-Т5.
Например, R7 представляет собой циклопентил, циклогексил или тетрагидро-2Н-тиопиранил, каждый из которых необязательно замещен одним или более -Q5-Т5.
Например, Q5 представляет собой NHC(O), и Т5 представляет собой C1-C6 алкил или C1-C6 алкокси.
Например, один или более -Q5-Т5 представляют собой оксо.
Например, R7 представляет собой 1-оксидтетрагидро-2Н-тиопиранил или 1,1-диоксид-тетрагидро-2Н-тиопиранил.
Например, Q5 представляет собой связь, и Т5 представляет собой амино, моно-C1-C6 алкиламино или ди-C1-C6 алкиламино.
Например, Q5 представляет собой СО, S(O)2 или NHC(О); и Т5 представляет собой C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, R8 представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино и ди-C1-C6 алкиламино.
Например, R8 представляет собой Н, метил или этил.
Другое подмножество соединений формулы (I') включает соединения формулы (III'):
или их фармацевтически приемлемые соли,
где
R3 представляет собой водород, C1-С3 алкил или галоген;
R4 представляет собой C1-С3 алкил,
R7 представляет собой C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил, необязательно замещенный одним или более Rs;
R8 представляет собой C1-C6 алкил;
Rh представляет собой -Qh-Th, где Qh представляет собой связь, C1-С3 алкильную связующую группу или N(RN); Th представляет собой ORh1 или -NRh1Rh2, где Rh1 и Rh2 независимо представляют собой водород или C1-C6 алкил, или один из Rh1 и Rh2 представляет собой метил, а другой представляет собой 6-членный N-содержащий гетероциклоалкил, необязательно замещенный одним или двумя метилами, или совместно с атомом N, к которому они прикреплены, Rh1 и Rh2 образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, выбранный из кислорода и азота, где указанное гетероциклоалкильное кольцо необязательно замещено одним или более Ri;
Ri представляет собой C1-С3 алкил, NRN1RN2, С3-С8 циклоалкил или 5- или 6-членный гетероцикл, где каждый из циклоалкилов или гетероциклов необязательно независимо замещен Rj;
RN представляет собой водород, C1-C6 алкил или С3-С8 циклоалкил;
Rj представляет собой C1-С3 алкил, NRN1RN2 или -NC(O)RN;
каждый из RN1 и RN2 независимо представляет собой водород, C1-C6 алкил, С3-С8 циклоалкил, 5- или 6-членный гетероцикл, где каждый из циклоалкилов или гетероциклов необязательно независимо замещен Rj.
Например, R3 представляет собой водород.
Например, R3 представляет собой галоген, такой как, например, фтор или хлор. Например, R3 представляет собой фтор.
Например, R4 представляет собой метил, этил, пропил или изопропил. Например, R4 представляет собой метил. Например, R4 представляет собой изопропил.
Например, R7 представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиран и морфолинил и т.п.).
Например, R7 представляет собой 5- или 6-членный циклоалкил или гетероциклоалкил.
Например, R7 представляет собой 6-членный циклоалкил или гетероциклоалкил.
В некоторых вариантах реализации R7 представляет собой пиперидинил, тетрагидропиранил, циклопентил или циклогексил.
В некоторых вариантах реализации Rj представляет собой метил. В некоторых вариантах реализации Rj представляет собой NH2.
Например, R8 представляет собой C1, С2 или С3 алкил. Например, R8 представляет собой метил. Например, R8 представляет собой этил.
В некоторых вариантах реализации Qh представляет собой связь. В других вариантах реализации Qh представляет собой метилен.
В некоторых вариантах реализации Th представляет собой N(CH3)2.
В некоторых вариантах реализации один из Rh1 и Rh2 представляет собой метил, а другой представляет собой 6-членный N-содержащий гетероциклоалкил, необязательно замещенный одним или двумя метилами. Например, 6-членный N-содержащий гетероциклоалкил не содержит дополнительных гетероатомов в кольце. Например, 6-членный N-содержащий гетероциклоалкил не содержит дополнительных заместителей помимо одной или двух метильных групп.
В некоторых вариантах реализации Rh1 и Rh2 совместно с атомом N, к которому они прикреплены, образуют 6-членное кольцо. Например, Th выбран из пиперидина, морфолина, пиперазина и N-метилпиперазина.
Например, Th представляет собой морфолин.
В некоторых вариантах реализации Ri представляет собой метил или N(CH2)2. В некоторых вариантах реализации Ri представляет собой С3-С8 циклоалкил или 5- или 6-членный гетероцикл. Например, Ri представляет собой 6-членный циклоалкил или гетероцикл, незамещенный Rj или замещенный одним Rj.
В некоторых вариантах реализации RN представляет собой Н или метил.
В некоторых соединениях формулы III' R3 представляет собой водород, R4 представляет собой СН3, и Qh представляет собой метилен.
В некоторых соединениях формулы III' R3 представляет собой фтор, R4 представляет собой пропил, и Qh представляет собой связь.
В некоторых соединениях формулы III' R3 представляет собой водород, R4 представляет собой пропил или изопропил, и Qh представляет собой метилен.
В некоторых соединениях формулы III' R3 представляет собой водород, R4 представляет собой пропил или изопропил, и Qh представляет собой связь.
В некоторых соединениях формулы III' соединения имеют формулу (IIIe),
где
R3 представляет собой Н или F,
R4 представляет собой метил, изопропил или н-пропил,
Rh представляет собой
Соединения согласно настоящему изобретению включают соединения формулы I'' и их фармацевтически приемлемые соли или сольваты:
в указанной формуле
X1' представляет собой N или CR11';
X2' представляет собой N или CR13';
Х3 представляет собой N или С, и если Х3 представляет собой N, R6' отсутствует;
Z2 представляет собой NR7'R8', OR7', S(O)a'R7' или CR7'R8'R14', где а' равняется 0, 1 или 2;
каждый из R1', R5', R9' и R10' независимо представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
каждый из R2', R3' и R4' независимо представляет собой -Q1'-T1', в котором Q1' представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и Т1' представляет собой Н, галоген, гидроксил, СООН, циано, азидо или RS1', где RS1' представляет собой C1-С3 алкил, С2-С6 алкенил, С2-С6 алкинил, C1-C6 алкоксил, C(O)O-C1-C6 алкил, С3-С8 циклоалкил, С6-С10 арил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и RS1' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, оксо, СООН, С(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
R6' представляет собой Н, галоген, циано, азидо, ORa', -NRa'Rb', -C(O)Ra', -C(O)ORa', -C(O)NRa'Rb', -NRb'C(О)Ra', S(O)b'Ra', -S(O)b'NRa'Rb' или RS2', где RS2' представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил или 4-12-членный гетероциклоалкил, b' равняется 0, 1 или 2, каждый из Ra' и Rb' независимо представляет собой Н или RS3', и RS3' представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил; или Ra' и Rb' совместно с атомом N, к которому они прикреплены, образуют 4-12-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом; и каждый из RS2', RS3' и 4-12-членного гетероциклоалкильного кольца, образованного Ra' и Rb', необязательно замещен одним или более -Q2'-T2', где Q2' представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и T2' представляет собой Н, галоген, циано, -ORc', -NRc'Rd', -C(O)Rc', -С(О)ORc', -C(O)NRc'Rd', -NRd'C(O)Rc', -NRd'C(O)ORc', -S(O)2Rc', -S(O)2NRc'Rd' или RS4', где каждый из Rc' и Rd' независимо представляет собой Н или RS5', каждый из RS4' и RS5' независимо представляет собой C1-C6 алкил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, или Rc' и Rd' совместно с атомом N, к которому они прикреплены, образуют 4-12-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом, и каждый из RS4', RS5' и 4-12-членного гетероциклоалкильного кольца, образованного Rc' и Rd', необязательно замещен одним или более -Q3'-Т3', где Q3' представляет собой связь или C1-С3 алкильную связующую группу, необязательно замещенную галогеном, циано, гидроксилом или C1-C6 алкокси, и Т3' выбран из группы, состоящей из галогена, циано, C1-C6 алкила, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила, 5- или 6-членного гетероарила, ORe', COORe', -S(O)2Re', -NRe'Rf' и -С(O)NRe'Rf', каждый из Re' и Rf' независимо представляет собой Н или C1-C6 алкил, или -Q3'-Т3' представляет собой оксо; или -Q2'-T2' представляет собой оксо; при условии, что -Q2'-T2' не является Н;
R7' представляет собой -Q4'-T4', в котором Q4' представляет собой связь, C1-C4 алкильную связующую группу или С2-С4 алкенильную связующую группу, где каждая из связующих групп необязательно замещена галогеном, циано, гидроксилом или C1-C6 алкокси, и T4' представляет собой Н, галоген, циано, NRg'Rh', -ORg', -C(O)Rg', -C(O)ORg', - С(О)NRg'Rh', -C(O)NRg'ORh', -NRg'C(O)Rh', -S(O)2Rg' или RS6', где каждый из Rg' и Rh' независимо представляет собой Н или RS7', каждый из RS6' и RS7' независимо представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и каждый из RS6' и RS7' необязательно замещен одним или более -Q5'-Т5', где Q5' представляет собой связь, С(О), C(O)NRk', NRk'C(O), NRk', S(O)2, NRk'C(O)2 или C1-С3 алкильную связующую группу, Rk' представляет собой Н или C1-C6 алкил, и Т5' представляет собой Н, галоген, C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, гидроксил, циано, C1-C6 алкоксил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)q'Rq', в котором q' равняется 0, 1 или 2, и Rq' представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и Т5' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C6 алкила, гидроксила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, кроме случаев, когда Т5 представляет собой Н, галоген, гидроксил или циано; или -Q5'-Т5' представляет собой оксо; при условии, что R7' не является Н;
каждый из R8', R11', R12' и R13' независимо представляет собой Н, галоген, гидроксил, СООН, циано, RS8', ORS8' или COORS8', где RS8' представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, 4-12-членный гетероциклоалкил, амино, моно-C1-C6 алкиламино или ди-C1-C6 алкиламино, и RS8' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, C(O)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино и ди-C1-C6 алкиламино; или R7' и R8' совместно с атомом N, к которому они прикреплены, образуют 4-12-членное гетероциклоалкильное кольцо, содержащее 0-2 дополнительных гетероатомов, или R7' и R8' совместно с атомом С, к которому они прикреплены, образуют С3-С8 циклоалкил или 4-12-членное гетероциклоалкильное кольцо, содержащее 1-3 гетероатома, и каждый из 4-12-членных гетероциклоалкильных колец или С3-С8 циклоалкила, образованных R7' и R8', необязательно замещен одним или более -Q6' -Т6', где Q6' представляет собой связь, С(О), C(O)NRm', NRm'C(O), S(O)2 или C1-С3 алкильную связующую группу, Rm' представляет собой Н или C1-C6 алкил, и T6' представляет собой Н, галоген, C1-C6 алкил, гидроксил, циано, C1-C6 алкоксил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкил, С6-С10 арила, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил или S(O)p'Rp' в котором р' равняется 0, 1 или 2, и Rp' представляет собой C1-C6 алкил, С2-С6 алкенил, С2-С6 алкинил, С3-С8 циклоалкил, С6-С10 арил, 4-12-членный гетероциклоалкил или 5- или 6-членный гетероарил, и Т6' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, C1-C6 алкила, гидроксила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила, кроме случаев, когда T6' представляет собой Н, галоген, гидроксил или циано; или -Q6'-T6' представляет собой оксо; и
R14' отсутствует или представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, СООН, С(О)O-C1-C6 алкила, циано, C1-C6 алкоксила, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, С3-С8 циклоалкила, С6-С10 арила, 4-12-членного гетероциклоалкила и 5- или 6-членного гетероарила;
при условии, что указанное соединение не является
N-(5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)фуран-2-карбоксамидом,
N,N'-(5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-1,3-фенилен)диацетамидом,
N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-пиваламидобензамидом,
3-(3,4-дигидро-2Н-бензо[b][1,4]диоксепин-7-сульфонамидо)-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)бензамидом,
N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3,5-диметоксибензамидом,
N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3,4,5-триметоксибензамидом,
3-аллил-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-4,5-диметоксибензамидом,
4-(2-амино-2-оксоэтокси)-3-хлор-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-метоксибензамидом,
3-хлор-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-4-гидрокси-5-метоксибензамидом или
3-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-метокси-4-пропоксибензамидом.
Одно из подмножеств соединений формулы (I'') включает соединения формулы (I''a):
Другое подмножество соединений формулы (I'') включает соединения формулы (I''b), (I''с) или (I''d):
Другое подмножество соединений формулы (I'') включает соединения формулы (IIA):
или их фармацевтически приемлемые соли, где n равняется 0, 1 или 2; U представляет собой О, S, N-Q5'-Т5' или CH-Q5'-Т5'; R12' представляет собой Cl, Br или метил; и R6', R8', Q5' и Т5' определены в настоящей заявке.
Другое подмножество соединений формулы (I'') включает соединения формулы (IIB):
или их фармацевтически приемлемые соли, где R7' представляет собой 4- или 6-членный гетероциклоалкил, содержащий один атом азота в кольце и замещенный одной или двумя метильными группами или одной изопропильной группой; R3' представляет собой Н или F; R4' представляет собой метил, этил, н-пропил, изопропил или CF3, и R6' представляет собой CF3, Cl или F, при условии, что если R4' представляет собой метил, (1) R6' представляет собой CF3, или (2) R3' представляет собой F, или (3) R6' представляет собой CF3, и R3' представляет собой F, или (4) R6' представляет собой F или Cl, и R7' представляет собой 6-членный гетероциклоалкил, содержащий только один атом азота и замещенный двумя метильными группами.
Соединения формул (I''), (I''a), (I''b), (I''с), (IIA) и (IIB) могут содержать один или более следующих признаков, где применимо:
Например, X1' представляет собой CR11', и X2' представляет собой CR13'.
Например, X1' представляет собой CR11', и X2' представляет собой N.
Например, X1' представляет собой N, и X2' представляет собой CR13'.
Например, X1' представляет собой N, и X2' представляет собой N.
Например, Х3 представляет собой С.
Например, Х3 представляет собой N, и R6' отсутствует.
Например, Z2 представляет собой NR7'R8'.
Например, Z2 представляет собой CR7'R8'R14'.
Например, Z2 представляет собой OR7'.
Например, Z2 представляет собой S(O)a'R7', в котором а' равняется 0, 1 или 2.
Например, R6' представляет собой Н.
Например, R6' представляет собой галоген (например, фтор, хлор, бром или йод).
Например, R6' не является фтором.
Например, R6' представляет собой C1-С3 алкил, необязательно замещенный одним или более -Q2'-T2'.
Например, R6' представляет собой CF3.
Например, R6' представляет собой С2-С6 алкенил, С2-С6 алкинил или С3-С6 циклоалкил, каждый из которых необязательно замещен одним или более -Q2'-T2'.
Например, R6' представляет собой этенил.
Например, R6' представляет собой этинил.
Например, R6' представляет собой этинил, замещенный одним или более -Q2'-T2', в котором Q2' представляет собой связь или C1-С3 алкильную связующую группу, и T2' представляет собой C1-C6 алкил, С3-С6 циклоалкил или 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q3'-Т3'.
Например, R6' представляет собой циано.
Например, R6' представляет собой азидо.
Например, R6' представляет собой С(O)Н.
Например, R6' представляет собой ORa' или -C(O)Ra'.
Например, R6' представляет собой C1-C6 алкил или 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q2'-T2'.
Например, R6' представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q2'-Т'2'.
Например, R6' представляет собой пиперидинил, 2,2,6,6-тетраметилпиперидинил, 1,2,3,6-тетрагидропиридинил, 2,2,6,6-тетраметил-1,2,3,6-тетрагидропиридинил, пиперазинил, морфолинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил или пирролидинил, каждый из которых необязательно замещен одним или более -Q2'-T2'.
Например, R6' представляет собой 4-7-членный гетероциклоалкил, необязательно замещенный одним или более -Q2'-T2', и -Q2'-T2' представляет собой оксо, или Q2' представляет собой связь, и T2' представляет собой -ORc', -NRc'Rd', -С(О)Rc', -C(O)ORc', -S(O)2Rc', C1-C6 алкил или 4-7-членный гетероциклоалкил, каждый из которых необязательно замещен одним или более -Q3'-Т3', если Rc' или Rd' не является Н.
Например, R6' представляет собой NRa'Rb', -C(O)Ra', -C(O)ORa', -C(O)NRa'Rb', -NRb'C(O)Ra', -SRa', -S(O)2Ra' или -S(O)2NRa'Rb'.
Например, каждый из Ra' и Rb' независимо представляет собой Н, C1-C6 алкил или С3-С8 циклоалкил, необязательно замещенный одним или более -Q2'-T2'.
Например, один из Ra' и Rb' представляет собой Н.
Например, Ra' и Rb' совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом помимо атома N (например, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), и кольцо необязательно замещено одним или более -Q2'-T2'.
Например, -Q2'-T2' представляет собой оксо.
Например, Q2' представляет собой связь.
Например, Q2' представляет собой незамещенную C1-С3 алкильную связующую группу.
Например, T2' представляет собой C1-C6 алкил или С6-С10 арил, каждый из которых необязательно замещен одним или более -Q3'-T3'.
Например, T2' представляет собой незамещенный или замещенный линейный C1-C6 или разветвленный С3-С6 алкил, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, втор-пентил и н-гексил.
Например, T2' представляет собой фенил.
Например, T2' представляет собой галоген (например, фтор, хлор, бром или йод).
Например, T2' представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q3'-Т3'.
Например, T2' представляет собой -ORc', -NRc'Rd', -С(О)Rc', -C(O)ORc' или -S(O)2Rc'.
Например, Rc' представляет собой C1-C6 алкил или 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q3'-Т3'.
Например, каждый из Rc' и Rd' независимо представляет собой Н или C1-C6 алкил, необязательно замещенный одним или более -Q3'-Т3'.
Например, Rc' представляет собой Н.
Например, Rd' представляет собой Н.
Например, Rc' и Rd' совместно с атомом N, к которому они прикреплены, образуют 4-7-членное гетероциклоалкильное кольцо, содержащее 0 или 1 дополнительный гетероатом помимо атома N (например, азетидинил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), и кольцо необязательно замещено одним или более -Q3'-Т3'.
Например, Q2' представляет собой связь, и T2' представляет собой -ORc', -NRc'Rd', -C(O)Rc', -C(O)ORc', -S(O)2Rc', C1-C6 алкил или 4-7-членный гетероциклоалкил, каждый из которых необязательно замещен одним или более -Q3'-Т3', если Rc' или Rd' не является Н.
Например, -Q3'-Т3' представляет собой оксо.
Например, T2' представляет собой 4-7-членный гетероциклоалкил или С3-С8 циклоалкил, и один или более -Q3'-Т3' представляют собой оксо.
Например, Q3' представляет собой связь или незамещенную или замещенную C1-С3 алкильную связующую группу.
Например, Т3' представляет собой Н, галоген, 4-7-членный гетероциклоалкил, C1-С3 алкил, ORe', COORe', -S(О)2Re', -NRe'Rf' или -C(O)NRe'Rf'.
Например, один из Rd' и Re' представляет собой Н.
Например, Q3' представляет собой связь или C1-С3 алкильную связующую группу, и Т3' выбран из группы, состоящей из C1-С3 алкила, галогена, ORe', -S(O)2Re', -NRe'Rf' и -С(О)NRe'Rf'.
Например, Q3' представляет собой связь или C1-С3 алкильную связующую группу, и Т3' выбран из группы, состоящей из C1-С3 алкила, ORe', -S(O)2Re' и -NRe'Rf'.
Например, Re' представляет собой Н.
Например, Rf' представляет собой Н.
Например, R7' представляет собой -С(O)Rg'.
Например, R7' представляет собой -C(O)Rg', в котором Rg' представляет собой С3-С8 циклоалкил, 4-7-членный гетероциклоалкил, С3-С8 циклоалкил.
Например, R7' представляет собой С6-С10 арил, замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой фенил, необязательно замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой C1-C6 алкил, необязательно замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой С3-С8 циклоалкил, необязательно замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазмнил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), необязательно замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой 5-6-членный гетероциклоалкил, необязательно замещенный одним или более -Q5'-Т5'.
Например, R7' представляет собой изопропил.
Например, R7' представляет собой пирролидинил, пиперидинил, тетрагидропиран, циклопентил, циклогексил или циклогептил, каждый из которых необязательно замещен одним -Q5'-Т5'.
Например, R7' представляет собой циклопентил или циклогексил, каждый из которых необязательно замещен одним -Q5'-Т5'.
Например, R7' представляет собой,
Например, Q5,' представляет собой NHC(O), и Т5' представляет собой C1-C6 алкил или C1-C6 алкокси.
Например, -Q5'-Т5' представляет собой оксо.
Например, T4' представляет собой 4-7-членный гетероциклоалкил, С3-С8 циклоалкил или С6-С10 арил, и один или более -Q5,'-Т5' представляют собой оксо.
Например, R7' представляет собой 1-оксидтетрагидро-2Н-тиопиранил или 1,1-диоксидтетрагидро-2Н-тиопиранил.
Например, R7' представляет собой циклогексанонил, например, циклогексанон-4-ил.
Например, Т5' представляет собой Н, галоген, C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил, С6-С10 арил или 4-7-членный гетероциклоалкил.
Например, Q5' представляет собой связь, и Т5' представляет собой C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Q5' представляет собой связь, и Т5' представляет собой 5- или 6-членный гетероарил, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино, Т5' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, C1-C6 алкоксила или С3-С8 циклоалкила.
Например, Q5' представляет собой СО, S(O)2 или NHC(О); и Т5' представляет собой C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Т5' представляет собой C1-C6 алкил или C1-C6 алкоксил, каждый из которых необязательно замещен галогеном, гидроксилом, циано, C1-C6 алкоксилом, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или С3-С8 циклоалкилом.
Например, Q5' представляет собой C1-С3 алкильную связующую группу, и Т5' представляет собой Н или С6-С10 арил.
Например, Q5' представляет собой C1-С3 алкильную связующую группу, и Т5' представляет собой С3-С8 циклоалкил, 4-7-членный гетероциклоалкил или S(O)q'Rq'.
Например, R6' представляет собой галоген (например, фтор, хлор, бром или йод), и Z2 представляет собой S(O)a'R7', в котором а' равняется 0, 1 или 2, и R7' представляет собой C1-C6 алкил (например, метил, этил, н-пропил, изопропил, бутил или трет-бутил), С3-С8 циклоалкил (например, циклопентил, циклогексил или циклогептил) или 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), и R7' необязательно замещен одним или более -Q5'-Т5'.
Например, R6' представляет собой галоген (например, фтор, хлор, бром или йод), и Z2 представляет собой OR7', в котором R7' представляет собой 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), и R7' необязательно замещен одним или более -Q5'-Т5'.
Например, R11' представляет собой Н.
Например, каждый из R2' и R4' независимо представляет собой Н или C1-C6 алкил, необязательно замещенный азидо, галогеном, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или С6-С10 арилом.
Например, каждый из R2' и R4' независимо представляет собой C1-С3 алкил, необязательно замещенный C1-C6 алкоксилом.
Например, каждый из R2' и R4' представляет собой метил.
Например, R1' представляет собой Н.
Например, R1' представляет собой C1-C6 алкил, необязательно замещенный азидо, галогеном, амино, моно-C1-C6 алкиламино, ди-C1-C6 алкиламино или С6-С10 арилом.
Например, R12' представляет собой Н, метил, этил, этенил или галоген.
Например, R12' представляет собой метил.
Например, R12' представляет собой этил.
Например, R12' представляет собой этенил или пропенил.
Например, R12' представляет собой метоксил.
Например, R8' представляет собой Н, метил, этил или этенил.
Например, R8' представляет собой метил.
Например, R8' представляет собой этил.
Например, R8' представляет собой пропил.
Например, R8' представляет собой этенил или пропенил.
Например, R8' представляет собой C1-C6 алкил, замещенный одним или более заместителями, выбранными из группы, состоящей из галогена (например, F, Cl или Br), гидроксила или C1-C6 алкоксила.
Например, R8' представляет собой необязательно замещенный 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.).
Например, R8' представляет собой пиперидинил.
Например, R8' представляет собой необязательно замещенный 4-7-членный гетероциклоалкил, и R7' представляет собой -Q4'-T4', в котором Q4' представляет собой связь или C1-C4 алкильную связующую группу, и T4' представляет собой Н, C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, ни R7', ни R8' не представляют собой тетрагидропиран.
Например, Z2 представляет собой NR7'R8' или CR7'R8'R14', где R7' и R8' совместно с атомом, к которому они прикреплены, образуют 4-11-членное гетероциклоалкильное кольцо, содержащее 1-3 гетероатома (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), или С3-С8 циклоалкил, каждый из которых необязательно замещен одним или более -Q6'-Т6'.
Например, кольцо, образованное R7' и R8', выбрано из группы, состоящей из азетидинила, пирролидинила, пиперидинила, морфолинила, пиперазинила и циклогексенила, каждый из которых необязательно замещен одним -Q6'-Т6'.
Например, -Q6'-Т6' представляет собой оксо.
Например, Т6' представляет собой Н, галоген, C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил, С6-С10 арил или 4-7-членный гетероциклоалкил.
Например, Q6' представляет собой связь, и Т6 представляет собой C1-C6 алкил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Q6' представляет собой СО, S(O)2 или NHC(О); и Т6' представляет собой C1-C6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-7-членный гетероциклоалкил.
Например, Т6' представляет собой C1-C6 алкил или C1-C6 алкоксил, каждый из которых необязательно замещен галогеном, гидроксилом, циано, C1-C6 алкоксилом, амино, моно-C1-C6 алкиламино, ди-С3-С6 алкиламино или С3-С8 циклоалкилом.
Например, Q6' представляет собой C1-С3 алкильную связующую группу, и Т6' представляет собой Н или С6-С10 арил.
Например, Q6' представляет собой C1-С3 алкильную связующую группу, и Т6' представляет собой С3-С8 циклоалкил, 4-7-членный гетероциклоалкил или S(O)p'Rp'.
Например, каждый из Rp' и Rq' независимо представляет собой C1-C6 алкил.
Например, R6' представляет собой -S(O)b'Ra' или азидо, где b' равняется 0, 1 или 2, и Ra' представляет собой C1-C6 алкил или С3-С8 циклоалкил; и Z2 представляет собой NR7'R8', в котором R7' представляет собой С3-С8 циклоалкил (например, циклопентил, циклогексил или циклогептил) или 4-7-членный гетероциклоалкил (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), каждый из которых необязательно замещен одним или более -Q5'-Т5', и R8' представляет собой Н или C1-C6 алкил (например, метил, этил, н-пропил, изопропил, бутил или трет-бутил).
Например, R6' представляет собой галоген (например, фтор, хлор, бром или йод), и Z2 представляет собой NR7'R8' или CR7'R8'R14', где R7' и R8' совместно с атомом, к которому они прикреплены, образуют 4-11-членное гетероциклоалкильное кольцо, содержащее 1-3 гетероатома (например, азетидинил, оксетанил, тиетанил, пирролидинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, пиперидинил, 1,2,3,6-тетрагидропиридинил, пиперазинил, тетрагидро-2Н-пиранил, 3,6-дигидро-2Н-пиранил, тетрагидро-2Н-тиопиранил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, морфолинил и т.п.), или С3-С8 циклоалкил, каждый из которых необязательно замещен одним или более -Q6'-Т6'.
Например, R13' представляет собой Н или метил.
Например, R13' представляет собой Н.
Например, R3' представляет собой Н.
Например, каждый из R5', R9' и R10' представляет собой Н.
В дополнение к вышеописанным признакам соединений согласно настоящему изобретению, где применимо, соединения формулы (IIA') могут содержать один или более следующих признаков:
Например, Q5' представляет собой связь, и Т5' представляет собой Н, C1-С6 алкил, С3-С8 циклоалкил, 4-12-членный гетероциклоалкил, 5- или 6-членный гетероарил, амино, моно-C1-С6 алкиламино или ди-C1-С6 алкиламино, Т5' необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, гидроксила, C1-С6 алкоксила или С3-С8 циклоалкила.
Например, Q5' представляет собой СО, S(O)2 или NHC(О); и Т5' представляет собой C1-С6 алкил, C1-C6 алкоксил, С3-С8 циклоалкил или 4-12-членный гетероциклоалкил.
Например, Q5' представляет собой C1-С3 алкильную связующую группу, и Т5' представляет собой Н или С6-С10 арил.
Например, Q5' представляет собой C1-С3 алкильную связующую группу, и Т5' представляет собой С3-С8 циклоалкил, 4-12-членный гетероциклоалкил или S(O)qRq.
Например, Q5' представляет собой NHC(О), и Т5' представляет собой C1-C6 алкил или C1-C6 алкокси.
Например, один или более -Q5'-Т5' представляют собой оксо.
Например, U представляет собой CH-Q5'-Т5', и n равняется 0.
Например, один или более -Q6'-T6' представляют собой оксо.
Например, Q6' представляет собой связь, и T6' представляет собой C1-С6 алкил или C1-C6 алкокси.
Иллюстративные соединения согласно настоящему изобретению включают соединения, приведенные в таблицах 1А и 1В.
Термины «алкил», «C1, C2, С3, C4, C5 или С6 алкил» или «C1-С6 алкил», применяемые в настоящей заявке, как предполагается, включают C1, C2, С3, C4, C5 или С6 насыщенные алифатические углеводородные группы с прямой цепью (линейные) и С3, C4, C5 или С6 разветвленные насыщенные алифатические углеводородные группы. Например, C1-C6 алкил, как предполагается, включает C1, С2, С3, С4, C5 и С6 алкильные группы. Примеры алкилов включают фрагменты, содержащие от одного до шести атомов углерода, включая, но не ограничиваясь ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, втор-пентил или н-гексил.
В некоторых вариантах реализации линейный или разветвленный алкил содержит шесть или меньше атомов углерода (например, C1-С6 для прямой цепи, С3-С6 для разветвленной цепи), и в другом варианте реализации линейный или разветвленный алкил содержит четыре или меньше атомов углерода.
Термин «циклоалкил», применяемый в настоящей заявке, относится к насыщенной или ненасыщенной неароматической углеводородной моно- или поликольцевой системе (например, конденсированных, мостиковых или спироколец), содержащей от 3 до 30 атомов углерода (например, С3-С10). Примеры циклоалкилов включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопентенил, циклогексенил, циклогептенил и адамантил. Термин, «гетероциклоалкил» относится к насыщенной или ненасыщенной неароматической 3-8-членной моноциклической, 7-12-членной бициклической (конденсированные, мостиковые или спирокольца) или 11-14-членной трициклической (конденсированные, мостиковые или спирокольца) кольцевой системе, содержащей один или более гетероатомов (таких как О, N, S или Se), если не указано иное. Примеры гетероциклоалкильных групп включают, но не ограничиваются ими, пиперидинил, пиперазинил, пирролидинил, диоксанил, тетрагидрофуранил, изоиндолинил, индолинил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, триазолидинил, тетрагидрофуранил, оксиранил, азетидинил, оксетанил, тиетанил, 1,2,3,6-тетрагидропиридинил, тетрагидропиранил, дигидропиранил, пиранил, морфолинил, 1,4-диазепанил, 1,4-оксазепанил, 2-окса-5-азабицикло[2.2.1]гептанил, 2,5-диазабицикло[2.2.1]гептанил, 2-окса-6-азаспиро[3.3]гептанил, 2,6-диазаспиро[3.3]гептанил, 1,4-диокса-8-азаспиро[4.5]деканил и т.п.
Термин «необязательно замещенный алкил» относится к незамещенному алкилу или алкилу, содержащему указанные заместители вместо одного или более атомов водорода при одном или более атомах углерода основной углеводородной цепи. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматические или гетероароматические фрагменты.
«Арилалкильный» или «аралкильный» фрагмент представляет собой алкил, замещенный арилом (например, фенилметил (бензил)). «Алкиларильный» фрагмент представляет собой арил, замещенный алкилом (например, метилфенил).
Термин «алкильная связующая группа», применяемый в настоящей заявке, как предполагается, включает C1, С2, С3, С4, С5 или С6 насыщенные двухвалентные алифатические углеводородные группы с прямой цепью (линейные) и С3, С4, С5 или С6 разветвленные насыщенные алифатические углеводородные группы. Например, C1-С6 алкильная связующая группа, как предполагается, включает C1, C2, С3, С4, С5 и С6 алкильные связующие группы. Примеры алкильных связующих групп включают фрагменты, содержащие от одного до шести атомов углерода, включая, но не ограничиваясь ими, метил (-CH2-), этил (-CH2CH2-), н-пропил (-CH2CH2CH2-), изопропил (-CHCH3CH2-), н-бутил (-CH2CH2CH2CH2-), втор-бутил (-CHCH3CH2CH2-), изобутил (-С(СН3)2CH2-), н-пентил (-CH2CH2CH2CH2CH2-), втор-пентил (-CHCH3CH2CH2CH2-) или н-гексил (-CH2CH2CH2CH2CH2CH2-).
«Алкенил» включает ненасыщенные алифатические группы, по длине и необязательностям замещения аналогичные алкилам, описанным выше, но содержащие по меньшей мере одну двойную связь. Например, термин «алкенил» включает алкенильные группы с прямой цепью (например, этенил, пропенил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил) и разветвленные алкенильные группы. В некоторых вариантах реализации линейная или разветвленная алкенильная группа содержит шесть или меньше атомов углерода в основной цепи (например, С2-С6 для прямой цепи, С3-С6 для разветвленной цепи). Термин «С2-С6» включает алкенильные группы, содержащие от двух до шести атомов углерода. Термин «С3-С6» включает алкенильные группы, содержащие от трех до шести атомов углерода.
Термин «необязательно замещенный алкенил» относится к незамещенному алкенилу или алкенилу, содержащему указанные заместители вместо одного или более атомов водорода при одном или более атомах углерода основной углеводородной цепи. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, гетероциклил, алкиларил или ароматические или гетероароматические фрагменты.
«Алкинил» включает ненасыщенные алифатические группы, по длине и необязательностям замещения аналогичные алкилам, описанным выше, но содержащие по меньшей мере одну тройную связь. Например, «алкинил» включает алкинильные группы с прямой цепью (например, этинил, пропинил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил) и разветвленные алкинильные группы. В некоторых вариантах реализации линейная или разветвленная алкинильная группа содержит шесть или меньше атомов углерода в основной цепи (например, С2-С6 для прямой цепи, С3-С6 для разветвленной цепи). Термин «С2-С6» включает алкинильные группы, содержащие от двух до шести атомов углерода. Термин «С3-С6» включает алкинильные группы, содержащие от трех до шести атомов углерода.
Термин «необязательно замещенный алкинил» относится к незамещенному алкинилу или алкинилу, содержащему указанные заместители вместо одного или более атомов водорода при одном или более атомах углерода основной углеводородной цепи. Такие заместители могут включать, например, алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматические или гетероароматические фрагменты.
Другие необязательно замещенные фрагменты (такие как необязательно замещенный циклоалкил, гетероциклоалкил, арил или гетероарил) включают как незамещенные фрагменты, так и фрагменты, содержащие один или более указанных заместителей. Например, замещенный гетероциклоалкил включает гетероциклоалкилы, замещенные одной или более алкильными группами, такие как 2,2,6,6-тетраметилпиперидинил и 2,2,6,6-тетраметил-1,2,3,6-тетрагидропиридинил.
«Арил» включает группы с ароматичностью, включая «сопряженные» или полициклические системы с по меньшей мере одним ароматическим кольцом, не содержащие гетероатомов в кольцевой структуре. Примеры включают фенил, бензил, 1,2,3,4-тетрагидронафталенил и т.п.
«Гетероарильные» группы представляют собой арильные группы, определенные выше, только содержащие от одного до четырех гетероатомов в кольцевой структуре, и они также могут быть отнесены к «арильным гетероциклам» или «гетероароматическим соединения». Термин «гетероарил», применяемый в настоящей заявке, как предполагается, включает стабильные 5-, 6- или 7-членные моноциклические или 7-, 8-, 9-, 10-, 11- или 12-членные бициклические ароматические гетероциклические кольца, состоящие из атомов углерода и одного или более гетероатомов, например, 1 или 1-2, или 1-3, или 1-4, или 1-5 или 1-6 гетероатомов, или, например, 1, 2, 3, 4, 5 или 6 гетероатомов, независимо выбранных из группы, состоящей из азота, кислорода и серы. Атом азота может быть замещенным или незамещенным (т.е. N или NR, где R представляет собой Н или другие заместители, определенные в настоящей заявке). Гетероатомы азота и серы являются необязательно окисленными (т.е. N→O и S(O)р, где р=1 или 2). Следует отметить, что общее количество атомов S и О в ароматическом гетероцикле не превышает 1.
Примеры гетероарильных групп включают пиррол, фуран, тиофен, тиазол, изотиазол, имидазол, триазол, тетразол, пиразол, оксазол, изоксазол, пиридин, пиразин, пиридазин, пиримидин и т.п.
Кроме того, термины «арил» и «гетероарил» включают полициклические арильные и гетероарильные группы, например, трициклические, бициклические, такие как нафталин, бензоксазол, бензодиоксазол, бензотиазол, бензоимидазол, бензотиофен, метилендиоксифенил, хинолин, изохинолин, нафтридин, индол, бензофуран, пурин, бензофуран, деазапурин, индолизин.
В случае полициклических ароматических колец достаточно, чтобы только одно кольцо было ароматическим (например, 2,3-дигидроиндол), хотя все кольца могут быть ароматическими (например, хинолин). Также второе кольцо может быть конденсированным или иметь внутренний мостик.
Циклоалкильное, гетероциклоалкильное, арильное или гетероарильное кольцо может быть замещено в одном или более положений в кольце (например, по углероду или гетероатому, такому как N, образующим кольцо) заместителями, описанными выше, например, алкилом, алкенилом, алкинилом, галогеном, гидроксилом, алкокси, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилатом, алкилкарбонилом, алкиламинокарбонилом, аралкиламинокарбонилом, алкениламинокарбонилом, алкилкарбонилом, арилкарбонилом, аралкилкарбонилом, алкенилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкилтиокарбонилом, фосфатом, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрилом, алкилтио, арилтио, тиокарбоксилатом, сульфатами, алкилсульфинилом, сульфонато, сульфамоилом, сульфонамидо, нитро, трифторметилом, циано, азидо, гетероциклилом, алкиларилом или ароматическими или гетероароматическими фрагментами. Арильные и гетероарильные группы также могут быть конденсированными или соединены мостиками с алициклическими или гетероциклическими кольцами, не являющимися ароматическими, с образованием таким образом полициклической системы (например, тетралин, метилендиоксифенил).
Термин «карбоцикл» или «карбоциклическое кольцо», применяемый в настоящей заявке, как предполагается, включает любые стабильные моноциклические, бициклические или трициклические кольца, содержащие указанное количество атомов углерода, любое из которых может быть насыщенным, ненасыщенным или ароматическим. Карбоциклы включают циклоалкил и арил. Например, С3-С14 карбоцикл включает моноциклические, бициклические или трициклические кольца, содержащие 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 атомов углерода. Примеры карбоциклов включают, но не ограничиваются ими, циклопропил, циклобутил, циклобутенил, циклопентил, циклопентенил, циклогексил, циклогептенил, циклогептил, циклогептенил, адамантил, циклооктил, циклооктенил, циклооктадиенил, флуоренил, фенил, нафтил, инданил, адамантил и тетрагидронафтил. Кольца с внутренним мостиком также включены в определение карбоцикла, включая, например, [3.3.0]бициклооктан, [4.3.0]бициклононан, [4.4.0]бициклодекан и [2.2.2]бициклооктан. Кольца с внутренним мостиком образуются, когда один или более атомов углерода соединяют два несмежных атома углерода. В одном из вариантов реализации кольца с внутренним мостиком содержат один или два мостиковых атома углерода. Следует отметить, что мостиковая связь всегда приводит к превращению моноциклического кольца в трициклическое кольцо. Если кольцо имеет внутренний мостик, заместители, указанные для кольца, также могут присутствовать в мостиковой связи. Также включены конденсированные (например, нафтил, тетрагидронафтил) и спирокольца.
Термин «гетероцикл» или «гетероциклическая группа», применяемый в настоящей заявке, включает любые кольцевые структуры (насыщенные, ненасыщенные или ароматические), содержащие по меньшей мере один кольцевой гетероатом (например, N, О или S). Гетероцикл включает гетероциклоалкил и гетероарил. Примеры гетероциклов включают, но не ограничиваются ими, морфолин, пирролидин, тетрагидротиофен, пиперидин, пиперазин, оксетан, пиран, тетрагидропиран, азетидин и тетрагидрофуран.
Примеры гетероциклических групп включают, но не ограничиваются ими, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензоксазолинил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолинил, карбозолил, 4aH-карбазолил, карболинил, хроманил, хроменил, циннолинил, декагидрохинолинил, 2H,6H-1,5,2-дитиазинил, дигидрофуро[2,3-b]тетрагидрофуран, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, 1H-индазолил, индоленил, индолинил, индолизинил, индолил, 3Н-индолил, изатиноил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изоксазолил, метилендиоксифенил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,2,4-оксадиазол-5(4Н)-он, оксазолидинил, оксазолил, оксиндолил, пиримидинил, фенантридинил, фенантролинил, феназинил, фенотиазинил, феноксатинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, пиперонил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, 2Н-пирролил, пирролил, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, теразолил, 6H-1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил и ксантенил.
Термин «замещенный», применяемый в настоящей заявке, означает, что любой один или более из атомов водорода при указанном атоме заменен на указанную группу, при условии не превышения нормальной валентности указанного атома и стабильности соединения, образующегося в результате замещения. Если заместитель представляет собой оксо или кето (т.е. =O), тогда заменены два атома водорода при атоме. Кето-заместители не присутствуют в ароматических фрагментах. Термин «двойные кольцевые связи», применяемый в настоящей заявке, относится к двойным связям, которые образуются между двумя смежными кольцевыми атомами (например, С=С, C=N или N=N). «Стабильное соединение» и «стабильная структура» обозначает соединение, достаточно устойчивое для необязательности выделения из реакционной смеси со степенью чистоты, подходящей для применения, и получения на его основе эффективного терапевтического агента.
Если показано, что связь с заместителем пересекает связь между двумя атомами в кольце, тогда такой заместитель может быть связан с любым из атомов в кольце. Если заместитель приведен без указания, по какому атому указанный заместитель связан с остальным фрагментом соединения данной формулы, тогда такой заместитель может быть связан по любому из атомов указанной формулы. Комбинации заместителей и/или переменных допустимы только, если указанные комбинации приводят к образованию стабильных соединений.
Если какая-либо из переменных (например, R1) встречается более одного раза в любом из фрагментов или формуле соединения, ее значение в каждом из случаев не зависит от ее значений для любого из других случаев. Таким образом, например, если группа замещена 0-2 фрагментами R1, тогда группа может быть замещена вплоть до двух фрагментов R1, и значение R1 для каждого из случаев независимо выбирают из определения R1. Кроме того, комбинации заместителей и/или переменных допустимы только, если указанные комбинации приводят к образованию стабильных соединений.
Термин «гидрокси» или «гидроксил» включает группы с -ОН или -О-.
Термин «галоген-» или «галоген», применяемый в настоящей заявке, относится к фтор-, хлор-, бром- и йод-. Термин «пергалогенированный» обычно относится к фрагменту, в котором все атомы водорода заменены атомами галогенов. Термин «галогеналкил» или «галогеналкоксил» относится к алкилу или алкоксилу, замещенному одним или более атомами галогенов.
Термин «карбонил» включает соединения и фрагменты, которые содержат углерод, соединенный двойной связью с атомом кислорода. Примеры фрагментов, содержащих карбонил, включают, но не ограничиваются ими, альдегиды, кетоны, карбоновые кислоты, амиды, сложные эфиры, ангидриды и т.п.
Термин «карбоксил» относится к -СООН или его сложному C1-C6 алкильному эфиру.
«Ацил» включает фрагменты, которые содержат ацильный радикал (R-C(O)-) или карбонильную группу. «Замещенный ацил» включает ацильные группы, в которых один или более атомов водорода заменены, например, алкильными группами, алкинильными группами, галогеном, гидроксилом, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилатом, алкилкарбонилом, арилкарбонилом, алкоксикарбонилом, аминокарбонилом, алкиламинокарбонилом, диалкиламинокарбонилом, алкилтиокарбонилом, алкоксилом, фосфатом, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрилом, алкилтио, арилтио, тиокарбоксилатом, сульфатами, алкилсульфинилом, сульфонато, сульфамоилом, сульфонамидо, нитро, трифторметилом, циано, азидо, гетероциклилом, алкиларилом или ароматическими или гетероароматическими фрагментами.
«Ароил» включает фрагменты с арильным или гетероароматическим фрагментом, связанным с карбонильной группой. Примеры ароильных групп включают фенилкарбокси, нафтилкарбокси и т.п.
«Алкоксиалкил», «алкиламиноалкил» и «тиоалкоксиалкил» включают алкильные группы, описанные выше, в которых атомы кислорода, азота или серы заменяют один или более атомов углерода основной углеводородной цепи.
Термин «алкокси» или «алкоксил» включает замещенные и незамещенные алкильные, алкенильные и алкинильные группы, ковалентно связанные с атомом кислорода. Примеры алкоксильных групп или алкоксильных радикалов включают, но не ограничиваются ими, метоксильную, этоксильную, изопропилоксильную, пропоксильную, бутоксильную и пентоксильную группы. Примеры замещенных алкоксильных групп включают галогенированные алкоксильные группы. Алкоксильные группы могут быть замещены группами, такими как алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, фосфат, фосфонато, фосфинато, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматические или гетероароматические фрагменты. Примеры алкоксильных групп, замещенных галогеном, включают, но не ограничиваются ими, фторметокси, дифторметокси, трифторметокси, хлорметокси, дихлорметокси и трихлорметокси.
Термин «простой эфир» или «алкокси» включает соединения или фрагменты, которые содержат кислород, связанный с двумя атомами углерода или гетероатомами. Например, термин включает «алкоксиалкил», который относится к алкильной, алкенильной или алкинильной группе, ковалентно связанной с атомом кислорода, который ковалентно связан с алкильной группой.
Термин «сложный эфир» относится к соединениям или фрагментам, которые содержат углерод или гетероатом, связанный с атомом кислорода, который связан с углеродом карбонильной группы. Термин «сложный эфир» включает алкоксикарбоксильные группы, такие как метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил, пентоксикарбонил и т.п.
Термин «тиоалкил» включает соединения или фрагменты, которые содержат алкильную группу, соединенную с атомом серы. Тиоалкильные группы могут быть замещены группами, такими как алкил, алкенил, алкинил, галоген, гидроксил, алкилкарбонилокси, арилкарбонилокси, алкоксикарбонилокси, арилоксикарбонилокси, карбоксилат, функциональная группа карбоновой кислоты, алкилкарбонил, арилкарбонил, алкоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил, алкилтиокарбонил, алкоксил, амино (включая алкиламино, диалкиламино, ариламино, диариламино и алкилариламино), ациламино (включая алкилкарбониламино, арилкарбониламино, карбамоил и уреидо), амидино, имино, сульфгидрил, алкилтио, арилтио, тиокарбоксилат, сульфаты, алкилсульфинил, сульфонато, сульфамоил, сульфонамидо, нитро, трифторметил, циано, азидо, гетероциклил, алкиларил или ароматические или гетероароматические фрагменты.
Термин «тиокарбонил» или «тиокарбокси» включает соединения или фрагменты, которые содержат углерод, соединенный двойной связью с атомом серы.
Термин «простой тиоэфир» включает фрагменты, которые содержат атом серы, связанный с двумя атомами углерода или гетероатомами. Примеры простых тиоэфиров включают, но не ограничиваются ими, алктиоалкилы, алктиоалкенилы и алктиоалкинилы. Термин «алктиоалкилы» включает фрагменты с алкильной, алкенильной или алкинильной группой, связанной с атомом серы, который связан с алкильной группой. Аналогично, термин «алктиоалкенилы» относится к фрагментам, в которых алкильная, алкенильная или алкинильная группа связана с атомом серы, который ковалентно связан с алкенильной группой; и «алктиоалкинилы» относится к фрагментам, в которых алкильная, алкенильная или алкинильная группа связана с атомом серы, который ковалентно связан с алкинильной группой.
Термин «амин» или «амино», применяемый в настоящей заявке, относится к незамещенному или замещенному -NH2. «Алкиламино» включает группы соединений, в которых азот в -NH2 связан по меньшей мере с одной алкильной группой. Примеры алкиламиногрупп включают бензиламино, метиламино, этиламино, фенетиламино и т.п. «Диалкиламино» включает группы, в которых азот в -NH2 связан по меньшей мере с двумя алкильными группами. Примеры диалкиламиногрупп включают, но не ограничиваются ими, диметиламино и диэтиламино. «Ариламино» и «диариламино» включают группы, в которых азот связан по меньшей мере с одной или двумя арильными группами, соответственно. «Аминоарил» и «аминоарилокси» относятся к арилу и арилокси, замещенным амино. «Алкилариламино», «алкиламиноарил» или «ариламиноалкил» относятся к аминогруппе, которая связана по меньшей мере с одной алкильной группой и по меньшей мере с одной арильной группой. «Алкаминоалкил» относится к алкильной, алкенильной или алкинильной группе, связанной с атомом азота, который связан с алкильной группой. «Ациламино» включает группы, в которых азот связан с ацильной группой. Примеры ациламино включают, но не ограничиваются ими, алкилкарбониламино-, арилкарбониламино-, карбамоильные и уреидогруппы.
Термин «амид» или «аминокарбокси» включает соединения или фрагменты, которые содержат атом азота, связанный с углеродом карбонильной или тиокарбонильной группы. Термин включает «алкаминокарбоксильные» группы, которые содержат алкильные, алкенильные или алкинильные группы, связанные с аминогруппой, которая связана с углеродом карбонильной или тиокарбонильной группы. Термин также включает «ариламинокарбокси» группы, которые содержат арильные или гетероарильные фрагменты, связанные с аминогруппой, которая связана с углеродом карбонильной или тиокарбонильной группы. Термины «алкиламинокарбокси», «алкениламинокарбокси», «алкиниламинокарбокси» и «ариламинокарбокси» включают фрагменты, в которых алкильные, алкенильные, алкинильные и арильные фрагменты, соответственно, связаны с атомом азота, который, в свою очередь, связан с углеродом карбонильной группы. Амиды могут быть замещены заместителями, такими как алкил с прямой цепью, разветвленный алкил, циклоалкил, арил, гетероарил или гетероцикл. Заместители амидной группы могут быть дополнительно замещены.
Соединения согласно настоящему изобретению, которые содержат атомы азота, могут быть превращены в N-оксиды при помощи обработки окислительным агентом (например, 3-хлорпероксибензойной кислотой (mCPBA) и/или пероксид водорода) с получением других соединений согласно настоящему изобретению. Таким образом, все представленные и заявленные соединения, содержащие азот, если это допускается валентностью и структурой, включают как представленные соединения, так и их N-оксидные производные (которые могут быть обозначены, как N→O или N+-O-). Кроме того, в других случаях, атомы азота в соединениях согласно настоящему изобретению могут быть превращены в N-гидрокси- или N-алкоксисоединения. Например, N-гидроксисоединения могут быть получены путем окисления исходного амина при помощи окислительного агента, такого как m-СРВА. Кроме того, все представленные и заявленные соединения, содержащие азот, если это допускается валентностью и структурой, охватывают как представленные соединения, так и их N-гидрокси- (например, N-OH) и N-алкоксипроизводные (например, N-OR, где R представляет собой замещенный или незамещенный C1-С6 алкил, C1-C6 алкенил, C1-C6 алкинил, 3-14-членный карбоцикл или 3-14-членный гетероцикл).
В настоящем описании структурная формула соединения в некоторых случаях для удобства представляет определенный изомер, но настоящее изобретение может включать все изомеры, такие как геометрические изомеры, оптические изомеры на основе асимметричного углерода, стереоизомеры, таутомеры, энантиомеры, ротамеры, диастереомеры, рацематы и т.п., следует понимать, что не все изомеры могут обладать одинаковой активностью. Кроме того, соединения, представленные формулой, могут обладать кристаллическим полиморфизмом. Следует отметить, что все кристаллические формы, смеси кристаллических форм или их ангидриты или гидраты включены в объем настоящего изобретения.
«Изомерия» означает соединения, которые имеют идентичные молекулярные формулы, но различаются последовательностью связывания атомов или расположением атомов в пространстве. Изомеры, которые отличаются расположением атомов в пространстве, называют «стереоизомерами», и стереоизомеры, которые являются несовместимыми зеркальными отражениями друг друга, называют «энантиомерами» или оптическими изомерами. Смесь, содержащая равные количества отдельных энантиомерных форм с противоположной хиральностью, называют «рацемической смесью».
Атом углерода, связанный с четырьмя различными заместителями, называют «хиральным центром».
«Хиральный изомер» означает соединение с по меньшей мере одним хиральным центром. Соединения, содержащие более одного хирального центра, могут существовать в виде отдельного диастереомера или смеси диастереомеров, называемой «диастереомерной смесью». В случае присутствия одного хирального центра стереоизомер может быть охарактеризован по абсолютной конфигурации (R или S) указанного хирального центра. Абсолютная конфигурация относится к расположению в пространстве заместителей, присоединенных к хиральному центру. Заместители, присоединенные к рассматриваемому хиральному центру, распределяют по старшинству в соответствии с Sequence Rule of Cahn, Ingold and Prelog. (Cahn et al., Angew. Chem. Inter. Edit. 1966, 5, 385; errata 511; Cahn et al., Angew. Chem. 1966, 78, 413; Cahn and Ingold, J. Chem. Soc. 1951 (London), 612; Cahn et al., Experientia 1956, 12, 81; Cahn, J. Chem. Educ. 1964, 41, 116).
«Геометрический изомер» означает диастереомеры, образующиеся из-за затруднений при вращении вокруг двойных связей или циклоалкильной связующей группы (например, 1,3-циклобутил). Указанные конфигурации отличаются по префиксам цис и транс, или Z и Е, в названиях, которые указывают, что группы расположены на одной или противоположных сторонах относительно двойной связи в молекуле в соответствии с правилами Кана-Ингольда-Прелога.
Следует понимать, что соединения согласно настоящему изобретению могут быть изображены в виде различных хиральных изомеров или геометрических изомеров. Также следует понимать, что если соединения имеют хиральные изомерные или геометрические изомерные формы, все изомерные формы включены в объем настоящего изобретения, и указание названия соединения не исключает каких-либо изомерных форм, следует понимать, что не все изомеры могут обладать одинаковой активностью.
Кроме того, структуры и другие соединения, представленные в настоящем изобретении, включают все их атропоизомеры, следует понимать, что не все атропоизомеры могут обладать одинаковой активностью. «Атропоизомеры» представляют собой тип стереоизомеров, в которых атомы двух изомеров по-разному расположены в пространстве. Атропоизомеры образуются из-за ограниченного вращения, вызванного затруднениями при вращении больших групп вокруг центральной связи. Такие атропоизомеры обычно существуют в виде смеси, тем не менее, благодаря последним достижениям в способах хроматографии стало возможным в отдельных случаях разделять смеси двух атропоизомеров.
«Таутомер» представляет собой один из двух или более структурных изомеров, существующих в равновесии и легко переходящих из одной изомерной формы в другую. Указанное превращение приводит к формальному переносу атома водорода и взаимной замене смежных сопряженных двойных связей. Таутомеры существуют в виде смеси таутомеров в растворе. В растворах, в которых возможна таутомеризация, достигается химическое равновесие таутомеров. Точное соотношение таутомеров зависит от нескольких факторов, включая температуру, растворитель и рН. Общее понятие таутомеров, что они являются взаимопревращаемыми путем таутомеризаций, называется таутомерией.
Среди возможных различных типов таутомерии обычно наблюдают два типа. В кето-енольной таутомерии наблюдается одновременное смещение электронов и атома водорода. Кольчато-цепная таутомерия возникает в результате взаимодействия альдегидной группы (-СНО) в молекуле сахара в виде цепи с одной из гидроксильных групп (-ОН) в этой же молекуле с образованием ее циклической (кольцеобразной) формы, наблюдаемой в глюкозе.
Распространенными таутомерными парами являются: кетон-енол, амид-нитрил, лактам-лактим, амид-имидная кислотная таутомерия в гетероциклических кольцах (например, в нуклеиновых основаниях, таких как гуанин, тимин и цитозин), имин-енамин и енамин-енамин. Ниже показан пример кето-енольного равновесия между пиридин-2-(1Н)-онами и соответствующими пиридин-2-олами.
Следует понимать, что соединения согласно настоящему изобретению могут быть изображены в виде различных таутомеров. Также следует понимать, что если соединения имеют различные таутомерные формы, все таутомерные формы включены в объем настоящего изобретения, и указание названия соединения не исключает каких-либо таутомерных форм. Следует понимать, что некоторые таутомеры могут иметь более высокую активность по сравнению с другими таутомерами.
Термин «кристаллические полиморфы», «полиморфы» или «кристаллические формы» обозначает кристаллические структуры, в которых соединение (или его соль или сольват) может кристаллизоваться в виде кристаллических решеток с различной упаковкой, все из которых имеют одинаковый элементный состав. Различные кристаллические формы обычно имеют различные дифракционные рентгенограммы, инфракрасные спектральные характеристики, температуры плавления, плотности, твердости, формы кристаллов, оптические и электрические свойства, стабильности и растворимости. Растворитель для перекристаллизации, скорость кристаллизации, температура хранения и другие факторы могут приводить к преобладанию одной из кристаллических форм. Кристаллические полиморфы соединений могут быть получены путем кристаллизации в различных условиях.
Соединения согласно настоящему изобретению включают соединения по любой из формул, представленных в настоящей заявке. Если это применимо, соединения согласно настоящему изобретению также могут включать их соли и сольваты. Например, соль может быть образована анионом и положительно заряженной группой (например, амино) в замещенном бензольном соединении. Подходящие анионы включают хлорид, бромид, йодид, сульфат, бисульфат, сульфамат, нитрат, фосфат, цитрат, метансульфонат, трифторацетат, глутамат, глюкуронат, глутарат, малат, малеат, сукцинат, фумарат, тартрат, тозилат, салицилат, лактат, нафталинсульфонат и ацетат (например, трифторацетат). Термин «фармацевтически приемлемый анион» относится к аниону, подходящему для образования фармацевтически приемлемой соли. Кроме того, соль может быть образована катионом и отрицательно заряженной группой (например, карбоксилатом) в замещенном бензольном соединении. Подходящие катионы включают ион натрия, ион калия, ион магния, ион кальция и катион аммония, такой как ион тетраметиламмония. Замещенные бензольные соединения также включают соли, содержащие четвертичные атомы азота.
Кроме того, соединения согласно настоящему изобретению, например, соли соединений, могут существовать в гидратированной или негидратированной (безводной) форме или в виде сольватов с молекулами другого растворителя. Неограничивающие примеры гидратов включают моногидраты, дигидраты и т.п. Неограничивающие примеры сольватов включают сольваты с этанолом, сольваты с ацетоном и т.п.
«Сольват» обозначает аддитивную форму с растворителем, которая содержит стехиометрическое или нестехиометрическое количество растворителя. Некоторые соединения имеют тенденцию удерживать фиксированное молярное соотношение молекул растворителя в твердом кристаллическом состоянии, таким образом образуя сольват. Если растворитель представляет собой сольват, образующийся сольват представляет собой гидрат; и если растворитель представляет собой спирт, образующийся сольват представляет собой алкоголят. Гидраты получаются при объединении одной или более молекул воды с одной молекулой вещества, в котором вода сохраняет свое молекулярное состояние, Н2О.
Термин «аналог», применяемый в настоящей заявке, относится к химическому соединению, которое является структурно подобным другому соединению, но немного отличается по составу (например, заменой одного атома на атом другого элемента, присутствием конкретной функциональной группы или заменой одной функциональной группы на другую функциональную группу). Таким образом, аналог представляет собой соединение, аналогичное или сопоставимое с образцовым соединением по функциональности и свойствам, но не по структуре или происхождению.
Термин «производное», определенный в настоящей заявке, относится к соединениям, которые имеют общую структурную основу и замещены различными группами, описанными в настоящей заявке. Например, все соединения, представленные формулой (I'), представляют собой замещенные бензольные соединения и имеют общую основу.
Термин «биоизостер» относится к соединению, полученному в результате замены атома или группы атомов на другой, в целом, сходный, атом или группу атомов. Целью биоизостерного замещения является получение нового соединения с биологическими свойствами, схожими с исходным соединением. Биоизостерное замещение может иметь физико-химическую или топологическую основу. Примеры биоизостеров карбоновых кислот включают, но не ограничиваются ими, ацилсульфонимиды, тетразолы, сульфонаты и фосфонаты. См., например, Patani and LaVoie, Chem. Rev. 96, 3147-3176, 1996.
Настоящее изобретение включает все изотопы атомов, встречающихся в соединениях согласно настоящему изобретению. Изотопы включают атомы, имеющие один и тот же атомный номер, но различные массовые числа. В качестве характерного примера и без ограничений изотопы водорода включают тритий и дейтерий, и изотопы углерода включают С-13 и С-14.
В настоящем изобретении предложены способы синтеза соединений любой из формул, представленных в настоящей заявке. В настоящем изобретении также предложены подробные способы синтеза различных представленных соединений согласно настоящему изобретению в соответствии со следующими схемами, как показано в примерах.
Во всем объеме настоящего описания, если композиции описаны как имеющие, включающие или содержащие специфические компоненты, предполагается, что композиции также состоят по существу из или состоят из указанных компонентов. Аналогично, если способы или процессы описаны как имеющие, включающие или содержащие специфические стадии процесса, процессы также состоят по существу из или состоят из указанных стадий переработки. Кроме того, следует понимать, что порядок стадий или порядок осуществления конкретных действий является несущественным до тех пор, пока изобретение остается осуществимым. Более того, две или более стадий или действий могут проводиться одновременно.
Способы синтеза согласно настоящему изобретению подходят для широкого спектра функциональных групп, следовательно, могут быть использованы различные замещенные исходные материалы. Способы обычно обеспечивают получение целевого конечного соединения, соответствующего окончанию или одной из заключительных стадий всего процесса, хотя в некоторых случаях может быть желательным дальнейшее превращение соединения в его фармацевтически приемлемую соль, сложный эфир или пролекарство.
Соединения согласно настоящему изобретению могут быть получены различным образом с применением коммерчески доступных исходных материалов, соединений, известных из литературы, или из лег ко полу чаемых промежуточных соединений при помощи стандартных способов синтеза и процедур, известных специалистам в данной области техники, или тех, что будут очевидны специалистам в данной области техники после ознакомления с настоящим описанием. Стандартные способы синтеза, процедуры получения органических молекул и способы модификации и управления функциональными группами могут быть получены из соответствующей научной литературы или из обычных учебных пособий по данной области. Не ограничиваясь каким-либо одним или несколькими источниками, классические тексты, такие как, Smith, М.В., March, J., March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition, John Wiley & Sons: New York, 2001; Greene, T.W., Wuts, P.G. М., Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons: New York, 1999; R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); L. Fieser and М. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed.. Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995), включенные в настоящую заявку посредством ссылки, являются полезными и признанными учебными пособиями по органическому синтезу, известными специалистам в данной области техники. Следующие описания способов синтеза приведены для иллюстрации, но не ограничения, общих способов получения соединений согласно настоящему изобретению.
Специалисту в данной области техники понятно, что определенные группы могут требовать защиты от условий реакции путем применения защитных групп. Защитные группы также можно применять для различения подобных функциональных групп в молекулах. Список защитных групп и способы их введения и снятия защиты могут быть найдены в Greene, T.W., Wuts, P.G. M., Protective Groups in Organic Synthesis, 3rd edition, John Wiley & Sons: New York, 1999.
Предпочтительные защитные группы включают, но не ограничиваются ими:
Для гидроксильного фрагмента: ТБС, бензил, ТГП и Ас.
Для карбоновых кислот: сложный бензиловый эфир, сложный метиловый эфир, сложный этиловый эфир, сложный аллиловый эфир.
Для аминов: Cbz, BOC, DMB.
Для двухатомных спиртов: Ас (х2), ТБС (х2) или, если для обеих групп, ацетониды.
Для тиолов: Ас.
Для бензимидазолов: SEM, бензил, РМВ, DMB.
Для альдегидов: диалкилацетали, такие как диметоксиацеталь или диэтилацетил.
В схемах реакций, описанных в настоящей заявке, могут быть получены различные стереоизомеры. Если не указан конкретный стереоизомер, следует понимать, что при проведении реакции могут быть получены все возможные стереоизомеры. Специалисту в данной области техники понятно, что реакции могут быть оптимизированы для преимущественного получения одного из изомеров, или могут быть разработаны новые схемы для получения отдельного изомера. В случае получения смесей для разделения изомеров можно применять техники, такие как препаративная тонкослойная хроматография, препаративная ВЭЖХ, препаративная хиральная ВЭЖХ или препаративная СФХ.
Следующие аббревиатуры используются во всем объеме настоящего описания и определены ниже:
| АА | ацетат аммония |
| АЦН | ацетонитрил |
| Ас | ацетил |
| АсОН | уксусная кислота |
| атм. | атмосфера |
| вод. | водный |
| BID или b.i.d. | два раза в сутки (дважды в день) |
| tBuOK | трет-бутоксид калия |
| Bn | бензил |
| ВОС | трет-бутоксикарбонил |
| (бензотриазол-1- | |
| ВОР | илокси)трис(диметиламино)- |
| фосфонийгексафторфосфат | |
| Cbz | бензилоксикарбонил |
| CDCl3 | дейтерированный хлороформ |
| CH2Cl2 | дихлорметан |
| (1-циано-2-этокси-2- | |
| COMU | оксоэтилиденаминоокси)диметил- |
| аминоморфолинокарбения | |
| гексафторфосфат | |
| д | дни |
| ДБУ | 1,8-диазабицикло[5.4.0]ундец-7-ен |
| ДХЭ | 1,2-дихлорэтан |
| ДХМ | дихлорметан |
| DEAD | диэтилазодикарбоксилат |
| DIAD | диизопропилазодикарбоксилат |
| DiBAL-H | диизобутилалюминийгидрид |
| DIPEA | N,N-диизопропилэтиламин (основание Хунига) |
| ДМА | диметилацетамид |
| ДМАП | N,N-диметил-4-аминопиридин |
| DMB | 2,4-диметоксибензил |
| ДМФА | N,N-диметилформамид |
| ДМСО | диметилсульфоксид |
| DPPA | дифенилфосфорилазид |
| ЭА или EtOAc | этилацетат |
| EDC или EDCI | N-(3-диметиламинопропил)-N'- |
| этилкарбодиимид | |
| Et2O | диэтиловый эфир |
| ELS | испарительное светорассеяние |
| электрораспыление в режиме | |
| ИЭР- | регистрации |
| отрицательных ионов | |
| электрораспыление в режиме | |
| ИЭР+ | регистрации |
| положительных ионов | |
| Et3N или ТЭА | триэтиламин |
| EtOH | этанол |
| FA | муравьиная кислота |
| FC или FCC | флэш-хроматография |
| ч | часы |
| Н2О | вода |
| О-(7-азабензотриазол-1-ил)- | |
| HATU | N,N,N',N'-тетраметилурония |
| гексафторфосфат | |
| НОАТ | 1-гидрокси-7-азабензотриазол |
| HOBt | 1-гидроксибензотриазол |
| HO-Su | N-гидроксисукцинимид |
| HCl | хлорид водорода или соляная кислота |
| ВЭЖХ | высокоэффективная жидкостная |
| хроматография | |
| K2CO3 | карбонат калия |
| KHMDs | гексаметилдисилазид калия |
| ЖХ/МС или ЖХ-МС | жидкостная хроматография с масс- |
| спектрометрией | |
| ЛДА | диизопропиламид лития |
| LiHMDs | гексаметилдисилазид лития |
| УГ | уходящая группа |
| М | молярный |
| m/z | отношение масса/заряд |
| m-СРВА | мета-хлорпербензойная кислота |
| MeCN | ацетонитрил |
| MeOD | метанол-d4 |
| MeI | метилйодид |
| MS3Å | 3Å молекулярные сита |
| MgSO4 | сульфат магния |
| мин | минуты |
| Ms | мезил |
| MsCl | мезилхлорид |
| MsO | мезилат |
| МС | масс-спектр |
| MWI | микроволновое излучение |
| Na2CO3 | карбонат натрия |
| Na2SO4 | сульфат натрия |
| NaHCO3 | бикарбонат натрия |
| NaHMDs | гексаметилдисилазид натрия |
| NaOH | гидроксид натрия |
| NaHCO3 | бикарбонат натрия |
| Na2SO4 | сульфат натрия |
| NIS | N-йодсукцинимид |
| ЯМР | ядерно-магнитный резонанс |
| о/n или O/N | в течение ночи |
| Pd/C | палладий на углероде |
| комплекс [1,1'- | |
| Pd(dppf)Cl2.ДХМ | бис(дифенилфосфино)ферроцен] |
| дихлорпалладия(II) с дихлорметаном | |
| РРАА | циклический ангидрид 1- |
| пропанфосфоновой кислоты | |
| Pd(OH)2 | дигидроксид палладия |
| ПЭ | петролейный эфир |
| ЗГ | защитная группа |
| РМВ | пара-метоксибензил |
| р.о. | через рот (пероральное введение) |
| м.д. | долей на миллион |
| преп. ВЭЖХ | препаративная высокоэффективная |
| жидкостная хроматография | |
| преп. ТСХ | препаративная тонкослойная |
| хроматография | |
| p-TsOH | пара-толуолсульфоновая кислота |
| (бензотриазол-1- | |
| PYBOP | илокси)трипирролидинофосфония |
| гексафторфосфат | |
| QD или q.d. | один раз в сутки (один раз в день) |
| RBF | круглодонная колба |
| ОФ-ВЭЖХ | обращенно-фазовая высокоэффективная |
| жидкостная хроматография | |
| Кт или КТ | комнатная температура |
| SEM | (триметилсилил)этоксиметил |
| SEMCl | (триметилсилил)этоксиметилхлорид |
| СФХ | сверхкритическая флюидная |
| хроматография | |
| SGC | хроматография на силикагеле |
| STAB | триацетоксиборгидрид натрия |
| ТБАФ | фторид тетра-н-бутиламмония |
| ТБМЭ | трет-бутилметиловый эфир |
| ТЭА | триэтиламин |
| ТФУ | трифторуксусная кислота |
| TfO | трифлат |
| ТГФ | тетрагидрофуран |
| ТГП | тетрагидропиран |
| TID или t.i.d | трижды в сутки (три раза в день) |
| ТСХ | тонкослойная хроматография |
| TMSCl | триметилсилилхлорид |
| Ts | тозил |
| TsOH | тозиловая кислота |
| УФ | ультрафиолет |
Соединения согласно настоящему изобретению могут быть легко получены при помощи различных способов, известных специалистам в данной области техники. Соединения согласно настоящему изобретению любой из формул, представленных в настоящей заявке, могут быть получены в соответствии с процедурами, представленными на схемах ниже, из коммерчески доступных исходных материалов или исходных материалов, которые могут быть получены при помощи процедур, описанных в литературе. Если не указано иное, Z и R группы (такие как R, R2, R3, R4, R6, R7, R8 и R12) на схемах являются такими, как определено для переменных в соответствующих положениях в любой из формул, представленных в настоящей заявке.
Специалисту в данной области техники понятно, что в последовательностях реакций и схемах синтеза, описанных в настоящей заявке, может быть изменен порядок некоторых стадий, таких как введение и удаление защитных групп.
На схеме А представлен способ синтеза различных пиридоновых фрагментов:
На схеме В представлен способ синтеза различных промежуточных сложных метиловых эфиров бензойной кислоты:
На схеме С представлен способ синтеза различных тетрагидропирановых фрагментов:
На схеме D представлен способ синтеза различных диметиламиноциклогексиловых аналогов:
На схеме 1 представлен общий синтез модифицированных арильных аналогов с применением общепринятого химического способа.
На схеме 1 представлен общий синтез модифицированных арильных аналогов с применением общепринятого химического способа. Замещенные нитробензойные кислоты, многие из которых являются коммерчески доступными или могут быть получены путем нитрования соответствующих замещенных бензойных кислот или при помощи других химических способов, известных специалисту в данной области техники, могут быть превращены в их сложные метиловые эфиры путем обработки метилйодидом в полярном растворителе, таком как ДМФА, в присутствии соответствующего основания, такого как карбонат натрия, при соответствующей температуре, такой как 60°С (стадия 1). Нитрогруппа может быть восстановлена до амина с применением соответствующего восстанавливающего агента, такого как железо, в присутствии кислоты, такой как хлорид аммония, в полярном растворителе, таком как этанол, при соответствующей температуре, такой как 80°С (стадия 2). Введение R8 может быть осуществлено при помощи восстановительного аминирования с соответствующим кетоном или альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Различные группы R7 могут быть введены при помощи алкилирования с применением R7-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С (стадия 4). Альтернативно, группы R7 могут быть введены при помощи восстановительного аминирования с R7-кетоном или R7-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Сложноэфирный фрагмент может быть превращен в амид с применением обычного двухстадийного способа. Сложный эфир может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол (стадия 5). Затем кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий амин и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида (стадия 6).
В зависимости от природы заместителя R6 можно проводить дополнительные химические модификации для превращения заместителя R6 в альтернативный заместитель R6. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования. Например, как показано на схеме 2, если R6 представляет собой бромид, альтернативные заместители R6 могут быть введены с применением стандартных способов на основе переходных металлов, включающих использование уходящей группы, такой как бромид, в качестве места присоединения. Бромид может быть объединен с соответствующим производным сложного эфира бороновой кислоты в присутствии слабого основания и палладиевого катализатора в полярном растворителе, таком как смесь диоксан/вода, при повышенной температуре с получением нового целевого заместители R6 (т.е. реакция Сузуки). Например, как показано на схеме 3, если реакцию Сузуки проводят с применением производного сложного эфира бороновой кислоты, содержащего формильную группу, для введения аминогрупп может быть проведена дополнительная модификация при помощи реакции восстановительного аминирования с применением первичных и вторичных аминов (например, морфолина, диметиламина).
В зависимости от природы заместителя R7 можно проводить дополнительные химические модификации после стадии 6 схемы 1 для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Вос-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 4 представлен общий синтез 2,6-дизамещенных изоникотинамидных соединений. Для введения арильной группы, которая может быть замещена функциональной группой X, подходящей для дальнейшего превращения, на стадии 1 можно проводить реакцию Сузуки с использованием арильного производного бороновой кислоты и метил-2,6-дихлоризоникотината в качестве исходного материала. Указанные группы Х включают формил или гидроксиметил, которые могут быть легко превращены на стадии 2 в различные группы Y. Такие группы Y включают аминометильные, моноалкиламинометильные и диалкиламинометильные группы. Последние могут быть получены путем восстановительного аминирования в случае, если Х представляет собой формил, или путем превращения Х=гидроксиметил в бромметил с последующим алкилированием с применением амина. Гидролиз сложного эфира на следующей стадии приводит к образованию промежуточной кислоты, которую можно связывать с соответствующими 3-(аминометил)-пиридин-2(1Н)-онами с получением предпоследнего промежуточного соединения, 2-хлор-6-арилизоникотинамида. Затем при помощи реакции Сузуки или реакции аминирования получают соединения, замещенные группой Z в положении 2. В случае реакции аминирования примеры Z могут представлять собой моноалкиламино или диалкиламино. В случае реакции Сузуки Z может представлять собой арил, дигидроарил или тетрагидроарил, такой как циклогексенил.
На схеме 5 представлен общий синтез 6-арил-3-метилпиколинамидов, содержащих моноалкиламино- или диалкиламиногруппы в положении 4. В результате окисления метил-3-бром-6-хлорпиколината до N-оксида с последующим хлорированием с применением оксихлорида фосфора получают метил-3-бром-4,6-дихлорпиколинат. Хлор в положении 4 может быть селективно замещен различными моно- и диал кил аминами, которые также могут содержать функциональные или замещенные функциональные группы, с которых может быть снята защита на одной из следующих стадий. В результате метилирования, катализируемого палладием, с применением тетраметилолова с последующим гидролизом сложного эфира и амидного сочетания с применением соответствующих 3-(аминометил)-пиридин-2(1Н)-онов получают предпоследние промежуточные соединения, 2-хлорпиридины. Реакция сочетания по Сузуки по группе в указанных промежуточных соединениях с применением арильных производных бороновой кислоты приводит к замене 2-хлоргруппы на арильную группу. Таким образом, получают 6-арил-3-метилпиколинамиды, содержащие моноалкиламино- или диалкиламиногруппы в положении 4. Арильная группа может быть замещена функциональной группой X, которая остается в конечном продукте или превращается в другую группу в результате снятия защиты или реакции превращения функциональной группы, например, восстановительного аминирования.
Ниже на схеме 6 представлен общий синтез промежуточных 3-(аминометил)-пиридин-2(1Н)-онов для реакции амидного сочетания из схемы 1. В одном из способов дикетон может быть конденсирован с 2-цианоацетамидом в присутствии соответствующего реагента, такого как ацетат пиперидина, в полярном растворителе, таком как этанол, с получением цианопиридона (стадия 9). В другом способе, если R3 представляет собой Н, соответственно замещенный алкинилкетон может быть конденсирован с 2-цианоацетамидом в присутствии соответствующего реагента, такого как ацетат пиперидина, в полярном растворителе, таком как этанол, с получением цианопиридона (стадия 11). Цианогруппа может быть восстановлена в соответствующих условиях, таких как гидрирование, в присутствии каталитического никеля Ренея в полярном растворителе, таком как раствор аммиака в метаноле, с получением амина (стадия 10).
Кроме того, в зависимости от природы группы R2, R3 или R4 можно проводить дополнительные химические модификации для независимого превращения каждой из них в альтернативный заместитель. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования.
На схеме 4 представлен вариант общего синтеза согласно схеме 1 на основе 2-замещенных (заместитель представляет собой группу R12) метил-3-амино-5-бромбензоатов в качестве исходных материалов. Указанные исходные материалы, в свою очередь, могут быть получены из 2-замещенных 3-нитробензойных кислот, которые являются коммерчески доступными или могут быть получены путем нитрования 2-замещенных бензойных кислот. Таким образом, в результате бромирования 2-замещенных 3-нитробензойных кислот с применением подходящего реагента, такого как 1,3-дибром-5,5-диметил-2,4-имидазолидиндион, получают соответствующие 2-замещенные 3-нитро-5-бромбензойные кислоты. Затем могут быть использованы различные способы этерификации и восстановления нитрогрупп для получения исходных 2-замещенных метил-3-амино-5-бромбензоатов из 2-замещенных 3-нитро-5-бромбензойных кислот.
Как показано на схеме 7, группа R7 может быть введена в 2-замещенные метил-3-амино-5-бромбензоаты на стадии 1 при помощи восстановительного аминирования с соответствующим R7-кетоном или R7-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Аналогично, группы R8 могут быть введены на стадии 2 при помощи восстановительного аминирования с R8-кетоном или R8-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Альтернативно, группы R8 могут быть введены при помощи алкилирования с применением R8-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С. На стадии 3 арильные группы, соответствующие R6, могут быть введены при помощи реакции Сузуки с применением промежуточного бромида и соответствующего арильного производного бороновой кислоты или производного сложного эфира, например, Х-Ar-В(ОН)2, в присутствии слабого основания и палладиевого катализатора в полярном растворителе, таком как смесь диоксан/вода, при повышенной температуре. Группа Х в Х-Ar-В(ОН)2 может представлять собой специально подобранный заместитель в арильном кольце или может представлять собой функциональную группу, которая может быть превращена в другую группу при помощи модификаций функциональных групп. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования. Например, если реакцию Сузуки проводят с применением производного бороновой кислоты, содержащего формильную группу, для введения аминогрупп может быть проведена дополнительная модификация при помощи реакции восстановительного аминирования с применением первичных и вторичных аминов (например, морфолина, диметиламина). На стадии 4 сложноэфирный фрагмент может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол. На стадии 5 кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий амин и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида. В зависимости от природы заместителя R7 можно проводить дополнительные химические модификации после стадии 5 схемы 4 для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Boc-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 8 ниже представлен общий синтез 2-моноалкиламино- и 2-диалкиламино-3-замещенных 6-арилизоникотинамидов, где заместитель в положении 3 соответствует R12, и арильная группа в положении 6 соответствует R6, формулы I'. На стадии 1 заместитель в положении 3 может быть введен при помощи способа, описанного в Epsztain J. et al. Tetrahedron, 1991, v. 47, 1697-16708, при помощи металлирования 2-хлоризоникотинанилида с применением н-бутиллития с последующим захватом алкилйодидом, таким как метилйодид, альдегидом или другой электрофильной группой.
В случае, если реагент захвата приводит к получению заместителя с функциональной группой, указанная группа может быть защищена или превращена в другую функциональную группу, подходящую для проведения последующих химических стадий. На стадии 2 может быть проведен гидролиз анилида в стандартных кислотных условиях с последующим синтезом сложного метилового эфира в стандартных условиях, например, как показано, метилйодид и основание приводят к получению соответствующего метил-2-хлор-3-замещенных изоникотинатов. На стадии 4 может быть введена алкиламиногруппа при помощи реакции сочетания Бухвальда с применением моноалкиламина R7NH2 и метил-2-хлор-3-замещенных изоникотинатов. Указанная реакция широко представлена в химической литературе для различных 2-хлорпиридиновых систем. На необязательной стадии 5 в диалкиламиносоединения могут быть введены группы R8 при помощи восстановительного аминирования с R8-кетоном или R8-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Альтернативно, различные группы R8 могут быть введены при помощи алкилирования с применением R8-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С. На стадии 6 в результате окисления до N-оксида с последующим хлорированием с применением оксихлорида фосфора получают метил-6-хлор-2-моно- или диалкиламино-3-замещенные изоникотинаты. На стадии 7 сложноэфирный фрагмент может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол. На стадии 8 кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий амин или замещенный 3-(аминометил)-пиридин-2(1Н)-он и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида. На стадии 9 арильные группы, соответствующие R6, могут быть введены при помощи реакции Сузуки с применением промежуточного бромида и соответствующего арильного производного бороновой кислоты или производного сложного эфира, например, X-Ar-В(ОН)2, в присутствии слабого основания и палладиевого катализатора в полярном растворителе, таком как смесь диоксан/вода, при повышенной температуре. Группа Х в Х-Ar-В(ОН)2 может представлять собой специально подобранный заместитель в арильном кольце или может представлять собой функциональную группу, которая может быть превращена в другую группу при помощи модификаций функциональных групп. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования. Например, если реакцию Сузуки проводят с применением производного бороновой кислоты, содержащего формильную группу, для введения аминогрупп может быть проведена дополнительная модификация при помощи реакции восстановительного аминирования с применением первичных и вторичных аминов (например, морфолина, диметиламина). В зависимости от природы заместителя R7 можно проводить стадии дополнительных химических модификаций для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Вос-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 9 представлен общий синтез модифицированных арильных аналогов с применением общепринятого химического способа. В результате нитрования замещенной бензойной кислоты, такой как 5-хлор-2-метилбензойная кислота, в стандартных условиях, таких как обработка конц. H2SO4 и конц. HNO3, можно получать нитроаналог. Этерификацию кислоты можно проводить с применением алкилирующего агента, такого как метилйодид, в присутствии основания, такого как карбонат натрия, в полярном растворителе, таком как ДМФА. Нитрогруппа может быть восстановлена с применением условий, таких как использование железа и хлорида аммония в полярном растворителе, таком как этанол, с нагреванием до температуры, такой как 80°С. Полученный анилин может быть превращен в бромид при помощи реакции Зандмейера, такой как обработка с применением CuBr2 и трет-бутилнитрита в растворителе, таком как ацетонитрил. Сочетание, катализируемое палладием, с применением тиола и бромида можно проводить с применением источника палладия, такого как Pd(OAc)2, с лигандом, таким как Xanthphos, в присутствии основания, такого как N,N-диизопропилэтиламин, в растворителе, таком как 1/4-диоксан, необязательно при нагревании до температуры, такой как 100°С. Сложный эфир может быть гидролизован с применением водного раствора основания, такого как NaOH в воде. Полученная кислота может быть соединена с 3-(аминометил)-4,6-диметилпиридин-2(1Н)-оном с применением стандартных условий аминокислотного сочетания, таких как PYBOP в ДМСО. Полученный простой тиоэфир может быть окислен до соответствующего сульфоксида или сульфона с применением соответствующих эквивалентов окислителя, таких как m-СРВА, в растворителе, таком как ДХМ. Арильные заместители могут быть введены при помощи сочетания, катализируемого палладием, такого как реакция Сузуки, описанная выше.
На схеме 10 представлен общий синтез модифицированных арильных аналогов с применением общепринятого химического способа. Замещенный анилин, такой как метил-3-амино-5-хлор-2-метилбензоат, может быть превращен в фенол при помощи реакции Зандмейера, такой как обработка с водным раствором NaNO2 в водном растворе кислоты, таком как 50% раствор H2SO4. Фенол может быть алкилирован с применением алкилирующего агента, такого как тетрагидро-2Н-пиран-4-ил-4-метилбензолсульфонат, в присутствии соответствующего основания, такого как карбонат цезия, в полярном растворителе, таком как ДМФА, необязательно при нагревании до температуры, такой как 80°С. Сложный эфир может быть гидролизован с применением водного раствора основания, такого как NaOH в воде. Полученная кислота может быть соединена с 3-(аминометил)-4,6-диметилпиридин-2(1Н)-оном с применением стандартных условий аминокислотного сочетания, таких как PYBOP в ДМСО. Арильные заместители могут быть введены при помощи сочетания, катализируемого палладием, такого как реакция Сузуки, описанная выше.
На схеме 1' представлен общий синтез бензольных аналогов, в которых Z=-N(R7)(R8), с применением общепринятого химического способа. Замещенные нитробензойные кислоты, многие из которых являются коммерчески доступными или могут быть получены путем нитрования соответствующих замещенных бензойных кислот или при помощи других химических способов, известных специалисту в данной области техники, могут быть превращены в их сложные метиловые эфиры путем обработки метилйодидом в полярном растворителе, таком как ДМФА, в присутствии соответствующего основания, такого как карбонат натрия, при соответствующей температуре, такой как 60°С (стадия 1). Нитрогруппа может быть восстановлена до амина с применением соответствующего восстанавливающего агента, такого как железо, в присутствии кислоты, такой как хлорид аммония, в полярном растворителе, таком как этанол, при соответствующей температуре, такой как 80°С (стадия 2). Введение R7 может быть осуществлено при помощи восстановительного аминирования с соответствующим R7-кетоном или R7-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Различные группы R8 могут быть введены при помощи алкилирования с применением R8-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С (стадия 4). Альтернативно, группы R8 могут быть введены при помощи восстановительного аминирования с R8-кетоном или R8-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Сложноэфирный фрагмент может быть превращен в амид с применением обычного двухстадийного способа. Сложный эфир может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол (стадия 5). Затем кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий амин и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида (стадия 6).
В зависимости от природы заместителя R6 можно проводить дополнительные химические модификации для превращения заместителя R6 в альтернативный заместитель R6. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования. Например, если R6 представляет собой бромид, альтернативные заместители R6 могут быть введены с применением стандартных способов на основе переходных металлов, включающих использование уходящей группы, такой как бромид, в качестве места присоединения.
В одном из указанных способов, представленном на схеме 2', неароматические заместители R6, присоединенные при помощи связи углерод-углерод, могут быть введены при помощи реакции Сузуки с применением соединения, в котором R6=Br, и соответствующего ненасыщенного неароматического производного сложного эфира бороновой кислоты (например, олефинового производного сложного эфира бороновой кислоты, такого как винил-4,4,5,5-тетраметил-2-винил-1,3,2-диоксаборолан) в присутствии слабого основания и палладиевого катализатора в полярном растворителе, таком как смесь диоксан/вода, при повышенной температуре с получением целевого нового заместителя R6. В зависимости от природы заместителя R6 можно проводить дополнительные химические модификации для превращения ненасыщенного заместителя R6 в альтернативный заместитель R6. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования. Например, в случаях введения ненасыщенной неароматической группы R6 в результате дополнительной модификации путем гидрирования получают соответствующую насыщенную группу R6 (например, превращение винильной группы в этильную группу). Если вводимые группы R6 содержат защищенную функциональную аминогруппу, дополнительные модификации включают снятие защиты с получением аминов, которые на следующих стадиях могут быть дополнительно модифицированы, например, при помощи реакций образования амида или восстановительного аминирования.
В другом способе, представленном на схеме 3', неароматические заместители R6, присоединенные при помощи связи углерод-углерод, могут быть введены при помощи реакции Соногаширы с применением соединения, в котором R6=Br, необязательно с последующей дополнительной модификацией введенной алкинильной группы. В реакции Соногаширы соединение, в котором R6=Br, соединяют с терминальным алкиновым производным в присутствии слабого основания, медного катализатора и палладиевого катализатора в органическом растворителе, таком как толуол, при повышенной температуре. В результате реакции происходит замена группы Br на алкинильную группу. Полученное соединение, в котором заместитель R6 представляет собой алкинильную группу, можно подвергать подходящим дополнительным модификациям с получением альтернативного заместителя R6. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций восстановительного аминирования или реакций алкилирования.
В другом способе неароматические заместители R6, присоединенные при помощи связи углерод-углерод, могут быть получены при помощи других реакций замещения атома брома соединений, в которых R6=Br, необязательно с последующей дополнительной модификацией введенной группы R6. Примеры таких реакций замещения включают реакции сочетания с применением реагентов на основе цинка, такие как реакции цианирования и Негиши. В случае реакции цианирования соединения, в которых R6=Br, подвергают взаимодействию с цианидом цинка в стандартных условиях реакции, опосредованной палладиевым катализатором, с получением соединений, в которых R6=CN. Цианогруппу в указанных соединениях можно подвергать дополнительной модификации с получением других групп R6. Такие модификации циано включают i. восстановление до амина, который затем может быть превращен в амид при помощи ацилирования или алкилирования, ii. восстановление до альдегида, который может быть подвергнут реакции восстановительного аминирования с получением соответствующих производных. В реакциях Негиши алкилцинковые реагенты, которые могут быть получены из алкилйодидов (например, N-Boc-3-йодазетидин), соединяют с соединениями, в которых R6=Br, с применением палладиевых или никелевых катализаторов. В полученных продуктах введенная группа R6 может быть превращена в альтернативную группу при помощи дополнительных модификаций с получением альтернативного заместителя R6. Типичные примеры таких модификаций группы R6 на последующих стадиях, таких как снятие защиты, образование амида или алкилирование.
Соединения с заместителями R6, которые представляют собой амины, присоединенные при помощи связи азот-углерод, могут быть введены при помощи реакций сочетания Бухвальда с применением соединений, в которых R6=Br, необязательно с последующей модификацией группы R6, как показано на схеме 4'. В реакции Бухвальда соединения, в которых R6=Br, обрабатывают первичным или вторичным амином (например, трет-бутилпиперазин-1-карбоксилатом) в присутствии палладиевого катализатора (например, Pd(dba)2/BINAP) и основания (например, карбоната цезия) в органическом растворителе (например, толуоле) при повышенной температуре. Продукт реакции сочетания Бухвальда может быть подвергнут последующим подходящим модификациям с получением альтернативного заместителя R6. Такие модификации представляют собой, например, удаление защитной группы, реакции амидного сочетания, реакции восстановительного аминирования или реакции алкилирования.
Соединения с заместителями R6, которые представляют собой алкилтиогруппы, присоединенные при помощи связи сера-углерод, могут быть получены при помощи реакций сочетания с применением соединений, в которых R6=Br, и тиолов в присутствии палладиевого катализатора и слабого основания (например, DIPEA) в органическом растворителе при повышенной температуре. Сульфиды, полученные в результате реакции сочетания, могут быть подвергнуты последующим подходящим модификациям с получением альтернативного заместителя R6. Такие модификации включают реакции окисления серы с получением сульфоксидов и сульфонов, удаление защитной группы, реакции амидного сочетания, реакции восстановительного аминирования или реакции алкилирования.
В модификации общего синтеза на схеме 1' зависимости от природы заместителя R7 можно проводить дополнительные химические модификации после стадии 6 схемы 1' для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Вос-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 5' представлен общий синтез пиколинамидных соединений. В результате окисления метил-3-бром-6-хлорпиколината до N-оксида с последующим хлорированием с применением оксихлорида фосфора получают метил-3-бром-4,6-дихлорпиколинат. Хлор в положении 4 может быть селективно замещен различными моно- и диалкиламинами, которые также могут содержать функциональные или замещенные функциональные группы, с которых может быть снята защита на одной из следующих стадий. Бром в положении 3 может быть сохранен или может быть превращен в альтернативную группу R12 при помощи подходящей реакции замещения и дополнительных модификаций функциональной группы. Такие реакции включают реакции сочетания, опосредованные палладиевыми катализаторами. Например, бром в положении 3 может быть превращен в R12, представляющий собой метильную группу, при помощи реакции Стилле с применением тетраметилолова. В результате гидролиза сложного эфира с последующим амидным сочетанием с применением 3-(аминометил)-пиридин-2-онов получают пиколинамидные соединения, в которых R6 представляет собой хлор. Хлор может быть превращен в альтернативные группы R6 при помощи подходящих реакций замещения на финальной стадии или, альтернативно, перед гидролизом сложного эфира на стадии 6. Примеры таких реакций замещения включают реакции цианирования и аминирования, прямые или опосредованные палладиевыми катализаторами. Аналогичные соединения, в которых R12 представляет собой хлор, могут быть получены аналогичным образом из метил-3,4,6-трихлорпиридин-2-карбоксилата.
На схеме 6' представлен общий синтез промежуточных 3-(аминометил)-пиридин-2(1Н)-онов для реакции амидного сочетания из схемы 1'. В одном из способов дикетон может быть конденсирован с 2-цианоацетамидом в присутствии соответствующего реагента, такого как ацетат пиперидина, в полярном растворителе, таком как этанол, с получением цианопиридона (стадия 9). В другом способе, если R3 представляет собой Н, соответственно замещенный алкинилкетон может быть конденсирован с 2-цианоацетамидом в присутствии соответствующего реагента, такого как ацетат пиперидина, в полярном растворителе, таком как этанол, с получением цианопиридона (стадия 11). Цианогруппа может быть восстановлена в соответствующих условиях, таких как гидрирование, в присутствии каталитического никеля Ренея в полярном растворителе, таком как раствор аммиака в метаноле, с получением амина (стадия 10).
Кроме того, в зависимости от природы группы R2, R3 или R4 можно проводить дополнительные химические модификации для независимого превращения каждой из них в альтернативный заместитель. Типичные примеры таких модификаций включают гидрирование, удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций сочетания, катализируемых палладием, реакций восстановительного аминирования или реакций алкилирования.
На схеме 7' представлен вариант общего синтеза согласно схеме 1' на основе 2-замещенных (заместитель представляет собой группу R12) метил-3-амино-5-бромбензоатов в качестве исходных материалов. Указанные исходные материалы, в свою очередь, могут быть получены из 2-замещенных 3-нитробензойных кислот, которые являются коммерчески доступными или могут быть получены путем нитрования 2-замещенных бензойных кислот. Таким образом, в результате бромирования 2-замещенных 3-нитробензойных кислот с применением подходящего реагента, такого как 1,3-дибром-5,5-диметил-2,4-имидазолидиндион, получают соответствующие 2-замещенные 3-нитро-5-бромбензойные кислоты. Затем могут быть использованы различные способы этерификации и восстановления нитрогрупп для получения исходных 2-замещенных метил-3-амино-5-бромбензоатов из 2-замещенных 3-нитро-5-бромбензойных кислот.
Как показано на схеме 7', группа R7 может быть введена в 2-замещенные метил-3-амино-5-бромбензоаты на стадии 1 при помощи восстановительного аминирования с соответствующим R7-кетоном или R7-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Аналогично, группы R8 могут быть введены на стадии 2 при помощи восстановительного аминирования с R8-кетоном или R8-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Альтернативно, группы R8 могут быть введены при помощи алкилирования с применением R8-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С.На стадии 3 группы R6, отличные от брома, могут быть введены при помощи реакции сочетания, катализируемого палладием. Примеры таких групп R6 и способов описаны выше. Например, аминогруппы могут быть введены при помощи реакций Бухвальда, и ненасыщенные группы могут быть введены при помощи реакций Сузуки или Соногаширы. Заместитель R6 может быть подвергнут последующим подходящим модификациям с получением альтернативного заместителя R6. Типичные примеры таких модификаций включают гидрирование (например, для насыщения ненасыщенных групп), удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций восстановительного аминирования или реакций алкилирования. На стадии 4 сложноэфирный фрагмент может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол. На стадии 5 кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий 3-(аминометил)-пиридин-2-он и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида. В зависимости от природы заместителя R7 можно проводить дополнительные химические модификации после стадии 5 схемы 4' для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Вос-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 8' ниже представлен общий синтез 2-моноалкиламино- и 2-диалкиламино-3,6-дизамещенных изоникотинамидов, где заместитель в положении 3 соответствует R12, и заместитель в положении 6 соответствует R6. На стадии 1 заместитель в положении 3 может быть введен при помощи способа, описанного в Epsztain J. et al. Tetrahedron, 1991, v. 47, 1697-16708, при помощи металлирования 2-хлоризоникотинанилида с применением н-бутиллития с последующим захватом алкилйодидом, таким как метилйодид, альдегидом или другой электрофильной группой.
В случае, если реагент захвата приводит к получению заместителя с функциональной группой, указанная группа может быть защищена или превращена в другую функциональную группу, подходящую для проведения последующих химических стадий. На стадии 2 может быть проведен гидролиз анилида в стандартных кислотных условиях с последующим синтезом сложного метилового эфира в стандартных условиях, например, как показано, метилйодид и основание приводят к получению соответствующего метил-2-хлор-3-замещенных изоникотинатов. На стадии 4 может быть введена алкиламиногруппа при помощи реакции сочетания Бухвальда с применением моноалкиламина R7NH2 и метил-2-хлор-3-замещенных изоникотинатов. Указанная реакция широко представлена в химической литературе для различных 2-хлорпиридиновых систем. На необязательной стадии 5 в диалкиламиносоединения могут быть введены группы R8 при помощи восстановительного аминирования с R8-кетоном или R8-альдегидом в присутствии соответствующего восстанавливающего агента, такого как цианоборгидрид натрия, и каталитической кислоты, такой как уксусная кислота, в соответствующем растворителе, таком как метанол. Альтернативно, различные группы R8 могут быть введены при помощи алкилирования с применением R8-УГ, где УГ представляет собой уходящую группу, такую как йод, в присутствии слабого основания, такого как карбонат цезия, в соответствующем полярном растворителе, таком как ацетонитрил, при соответствующей температуре, такой как 80°С. На стадии 6 в результате окисления до N-оксида с последующим хлорированием с применением оксихлорида фосфора получают метил-6-хлор-2-моно- или диалкиламино-3-замещенные изоникотинаты. На стадии 7 сложноэфирный фрагмент может быть гидролизован до соответствующей кислоты с применением подходящего основания, такого как гидроксид натрия, в полярном растворителе, таком как этанол. На стадии 8 кислота может быть подвергнута стандартной реакции амидного сочетания, при которой добавляют соответствующий замещенный 3-(аминометил)-пиридин-2-он и подходящий реагент амидного сочетания, такой как PYBOP, в подходящем растворителе, таком как ДМСО, с получением целевого амида. На стадии 9 хлор может быть превращен в альтернативные группы R6 при помощи подходящих реакций замещения на финальной стадии или, альтернативно, перед гидролизом сложного эфира на стадии 6. Примеры таких реакций замещения включают реакции цианирования и аминирования, прямые или опосредованные палладиевыми катализаторами. Заместитель R6 может быть подвергнут дополнительным подходящим модификациям для получения альтернативного заместителя R6. Типичные примеры таких модификаций включают гидрирование (например, для насыщения ненасыщенных групп), удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций восстановительного аминирования или реакций алкилирования. В зависимости от природы заместителя R7 можно проводить стадии дополнительных химических модификаций для превращения заместителя R7 в альтернативный заместитель R7. Например, защищенная аминогруппа, содержащаяся в R7, может быть подвергнута реакции снятия защиты (например, расщепления Вос-группы) с получением свободных аминогрупп. Такие свободные аминогруппы могут быть подвергнуты реакциям восстановительного аминирования или реакциям алкилирования с получением замещенных аминов.
На схеме 9' представлен общий синтез бензольных аналогов, в которых Z представляет собой сульфидную, сульфоксидную или сульфоновую группу, с применением общепринятого химического способа. В результате нитрования замещенной бензойной кислоты, такой как 5-хлор-2-метилбензойная кислота, в стандартных условиях, таких как обработка конц. H2SO4 и конц. HNO3, можно получать нитроаналог. Этерификацию кислоты можно проводить с применением алкилирующего агента, такого как метилйодид, в присутствии основания, такого как карбонат натрия, в полярном растворителе, таком как ДМФА. Нитрогруппа может быть восстановлена с применением условий, таких как использование железа и хлорида аммония в полярном растворителе, таком как этанол, с нагреванием до температуры, такой как 80°С. Полученный анилин может быть превращен в бромид при помощи реакции Зандмейера, такой как обработка с применением CuBr2 и трет-бутилнитрита в растворителе, таком как ацетонитрил. Сочетание, катализируемое палладием, с применением тиола и бромида можно проводить с применением источника палладия, такого как Pd(OAc)2, с лигандом, таким как Xanthphos, в присутствии основания, такого как N,N-диизопропилэтиламин, в растворителе, таком как 1,4-диоксан, необязательно при нагревании до температуры, такой как 100°С. Сложный эфир может быть гидролизован с применением водного раствора основания, такого как NaOH в воде. Полученная кислота может быть соединена с соответствующим замещенным 3-(аминометил)-пиридин-2-оном (например, 3-(аминометил)-4,6-диметилпиридин-2(1Н)-оном, представленным на схеме 9') с применением стандартных условий аминокислотного сочетания, таких как PYBOP в ДМСО. Полученный простой тиоэфир может быть окислен до соответствующего сульфоксида или сульфона с применением соответствующих эквивалентов окислителя, таких как m-СРВА, в растворителе, таком как ДХМ. Хлор R6 может быть заменен альтернативной группой R6 на дополнительной стадии 10, после стадии 5 или перед амидным сочетанием. Примеры альтернативных групп R6 включают заместители, которые могут быть введены при помощи сочетания, катализируемого палладием, такого как реакция Бухвальда, с получением аминогрупп (например, морфолино). Заместитель R6 может быть подвергнут дополнительным подходящим модификациям для получения альтернативного заместителя R6. Типичные примеры таких модификаций включают удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций восстановительного аминирования или реакций алкилирования.
На схеме 10' представлен общий синтез модифицированных бензольных аналогов, в которых Z представляет собой простую эфирную группу, с применением общепринятого химического способа. Замещенный анилин, такой как метил-3-амино-5-хлор-2-метилбензоат, может быть превращен в фенол при помощи реакции Зандмейера, такой как обработка с водным раствором NaNO2 в водном растворе кислоты, таком как 50% раствор H2SO4. Фенол может быть алкилирован с применением алкилирующего агента, такого как тетрагидро-2Н-пиран-4-ил-4-метилбензолсульфонат, в присутствии соответствующего основания, такого как карбонат натрия, в полярном растворителе, таком как ДМФА, необязательно при нагревании до температуры, такой как 80°С. Сложный эфир может быть гидролизован с применением водного раствора основания, такого как NaOH в воде. Полученная кислота может быть соединена с соответствующим замещенным 3-(аминометил)-пиридин-2-оном с применением стандартных условий аминокислотного сочетания, таких как PYBOP в ДМСО. Хлор R6 может быть заменен альтернативной группой R6 после дополнительной стадии 5 или перед амидным сочетанием. Примеры альтернативных групп R6 включают заместители, которые могут быть введены при помощи сочетания, катализируемого палладием, такого как реакция Бухвальда, с получением аминогрупп (например, морфолино). Заместитель R6 может быть подвергнут дополнительным подходящим модификациям для получения альтернативного заместителя R6. Типичные примеры таких модификаций включают удаление защитной группы с последующим проведением дополнительных реакций амидного сочетания, реакций восстановительного аминирования или реакций алкилирования.
Соединения согласно настоящему изобретению ингибируют гистонметилтрансферазную активность EZH2 или мутантного EZH2, и, соответственно, в одном из аспектов настоящего изобретения некоторые соединения, описанные в настоящей заявке, представляют собой кандидаты для лечения или предотвращения некоторых состояний и заболеваний. В настоящем изобретении предложены способы лечения состояний и заболеваний, на протекание которых можно воздействовать при помощи модулирования статуса метилирования гистонов или других белков, где указанный статус метилирования по меньшей мере частично опосредован активностью EZH2. Модулирование статуса метилирования гистонов, в свою очередь, может влиять на уровень экспрессии целевых генов, активируемых при помощи метилирования, и/или целевых генов, подавляемых при помощи метилирования. Способ включает введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, полиморфа, сольвата или стереоизомера.
Если не указано иное, любое описание способа лечения включает применение соединений для обеспечения указанного лечения или профилактики, представленной в настоящем описании, а также применение соединений для получения лекарственных средств для лечения или предотвращения указанного состояния. Лечение включает лечение людей или других животных, включая модели грызунов и другие модели заболеваний.
В другом аспекте настоящее изобретение относится к способу модулирования активности EZH2, каталитической субъединицы комплекса PRC2, который катализирует моно-, ди- и триметилирование лизина 27 гистона Н3 (Н3-K27) у субъекта, нуждающегося в лечении. Например, способ включает стадию введения субъекту, имеющему раковое заболевание с экспрессией мутантного EZH2, терапевтически эффективного количества соединения, описанного в настоящей заявке, где указанное соединение(я) ингибирует(ют) гистонметилтрансферазную активность EZH2, таким образом обеспечивая лечение ракового заболевания.
Например, раковое заболевание выбрано из группы, состоящей из фолликулярной лимфомы и диффузной крупноклеточной В-клеточной лимфомы (ДККЛ) В-клеточного подтипа клеток герминативного центра. Например, раковое заболевание представляет собой лимфому, лейкоз или меланому. Предпочтительно, лимфома представляет собой неходжкинскую лимфому (НХЛ), фолликулярную лимфому или диффузную крупноклеточную В-клеточную лимфому. Альтернативно, лейкоз представляет собой хронический миелогенный лейкоз (ХМЛ), острый миелоидный лейкоз, острый лимфоцитарный лейкоз или лейкоз смешанного происхождения.
Например, предраковое состояние представляет собой миелодиспластические синдромы (МДС, ранее известные как предлейкозы).
Например, раковое заболевание представляет собой гематологическое раковое заболевание.
Соединение(я) согласно настоящему изобретению ингибирует(ют) гистонметилтрансферазную активность EZH2 или мутантного EZH2, и, соответственно, в настоящем изобретении также предложены способы лечения состояний и заболеваний, на протекание которых можно воздействовать при помощи модулирования статуса метилирования гистонов или других белков, где указанный статус метилирования по меньшей мере частично опосредован активностью EZH2. В одном из аспектов настоящего изобретения некоторые соединения, описанные в настоящей заявке, представляют собой кандидаты для лечения или предотвращения некоторых состояний и заболеваний. Модулирование статуса метилирования гистонов, в свою очередь, может влиять на уровень экспрессии целевых генов, активируемых при помощи метилирования, и/или целевых генов, подавляемых при помощи метилирования. Способ включает введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения согласно настоящему изобретению.
Термин «субъект», применяемый в настоящей заявке, является взаимозаменяемым с термином «субъект, нуждающийся в этом», и оба указанных термина относятся к субъекту, имеющему расстройство, связанное с метилированием белков, опосредованным EZH2, или к субъекту с повышенным риском развития такого расстройства по сравнению с обычным уровнем для популяции. Термин «субъект» включает млекопитающих. Млекопитающие могут представлять собой, например, человека или соответствующих млекопитающих, отличных от человека, таких как приматы, мыши, крысы, собаки, кошки, коровы, лошади, козы, верблюды, овцы и свиньи. Субъект также может представлять собой птиц или домашних птиц. В одном из вариантов реализации млекопитающее представляет собой человека. Субъект, нуждающийся в лечении, может представлять собой субъекта, у которого ранее было диагностировано или у которого определено раковое заболевание или предраковое состояние. Субъект, нуждающийся в лечении, также может представлять собой субъекта, имеющего (например, страдающего от) раковое заболевание или предраковое состояние. Альтернативно, субъект, нуждающийся в лечении, может представлять собой субъекта с повышенным риском развития такого расстройства по сравнению с обычным уровнем для популяции (т.е. субъект с предрасположенностью к развитию такого расстройства по сравнению с обычным уровнем для популяции). Субъект, нуждающийся в лечении, может иметь предраковое состояние. Субъект, нуждающийся в лечении, может иметь трудноизлечимое или резистентное раковое заболевание (т.е. раковое заболевание, которое не поддается или не поддавалось лечению). Заболевание у субъекта может быть резистентным в начале лечения или может становиться резистентным в процессе лечения. В некоторых вариантах реализации субъект, нуждающийся в лечении, имеет рецидив ракового заболевания после ремиссии в результате недавно проведенной терапии. В некоторых вариантах реализации субъект, нуждающийся в лечении, безрезультатно проходил все известные эффективные способы лечения раковых заболеваний. В некоторых вариантах реализации субъект, нуждающийся в лечении, ранее проходил по меньшей мере одну терапию. В предпочтительном варианте реализации субъект имеет раковое заболевание или раковое состояние. Например, раковое заболевание представляет собой лимфому, лейкоз, меланому или рабдомиосаркому. Предпочтительно, лимфома представляет собой неходжкинскую лимфому, фолликулярную лимфому или диффузную крупно клеточную В-клеточную лимфому. Альтернативно, лейкоз представляет собой хронический миелогенный лейкоз (ХМЛ). Предраковое состояние представляет собой миелодиспластические синдромы (МДС, ранее известные как предлейкозы).
Термин «лечение» или «лечить», применяемый в настоящей заявке, описывает лечение и уход за пациентом с целью борьбы с заболеванием, состоянием или расстройством и включает введение соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, полиморфа или сольвата для облегчения симптомов или осложнений заболевания, состояния или расстройства или для устранения заболевания, состояния или расстройства. Термин «лечить» также может включать обработку клетки in vitro или на животной модели.
Соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, полиморф или сольват также можно использовать для предотвращения соответствующего заболевания, состояния или расстройства или использовать для установления подходящих кандидатов для указанных целей. Термин «предотвращение», «предотвращать» или «защита от», применяемый в настоящей заявке, описывает снижение или устранение проявления симптомов или осложнений указанного заболевания, состояния или расстройства.
Сообщалось, что точечные мутации гена EZH2 по одному аминокислотному остатку (например, Y641, А677 и А687) EZH2 связаны с лимфомой. Другие примеры мутантных EZH2, способов определения мутаций и способов лечения расстройств, связанных с мутациями, описаны, например, в опубликованной заявке на патент США №US 20130040906, содержание которой включено в настоящую заявку во всей полноте посредством ссылки.
Специалист в данной области техники может обратиться к общим справочным материалам за подробным описанием известных способов, представленных в настоящей заявке, или эквивалентных способов. Такие материалы включают Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (2005); Sambrook et al., Molecular Cloning, A Laboratory Manual (3ье издание). Cold Spring Harbor Press, Cold Spring Harbor, New York (2000); Coligan et al., Current Protocols in Immunology, John Wiley & Sons, N.Y.; Enna et al., Current Protocols in Pharmacology, John Wiley & Sons, N.Y.; Fingl et al., The Pharmacological Basis of Therapeutics (1975), Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA, 18ое издание (1990). На указанные материалы также можно ссылаться при реализации или применении аспектов настоящего изобретения.
Термин «комбинированная терапия» или «котерапия», применяемый в настоящей заявке, включает введение соединения согласно настоящему изобретению или его фармацевтически приемлемой соли, полиморфа или сольвата и по меньшей мере второго агента в рамках конкретного режима лечения, предназначенного для обеспечения благотворного эффекта от совместного действия указанных терапевтических агентов. Благотворный эффект комбинирования включает, но не ограничивается ими, фармакокинетическое или фармакодинамическое совместное действие в результате комбинирования терапевтических агентов.
В настоящем изобретении также предложены фармацевтические композиции, содержащие соединение любой из формул, представленных в настоящей заявке, в комбинации с по меньшей мере одним фармацевтически приемлемым вспомогательным веществом или носителем.
«Фармацевтическая композиция» представляет собой состав, содержащий соединения согласно настоящему изобретению в форме, подходящей для введения субъекту. В одном из вариантов реализации фармацевтическая композиция находится в виде объемной массы или в виде стандартной лекарственной формы. Стандартная лекарственная форма представляет собой любую из разнообразных форм, включая, например, капсулу, мешок для внутривенного вливания, таблетку, разовый нагнетатель на аэрозольном ингаляторе или ампулу. Количество активного ингредиента (например, состава на основе представленного соединения или его соли, гидрата, сольвата или изомера) в стандартной дозе композиции является эффективным количеством и варьируется в соответствии с конкретным проводимым лечением. Специалисту в данной области техники понятно, что иногда необходимо вносить обычные изменения в дозировку в зависимости от возраста и состояния пациента. Дозировка также зависит от способа введения. Предполагаются различные способы, включая пероральный, легочный, ректальный, парентеральный, трансдермальный, подкожный, внутривенный, внутримышечный, интраперитонеальный, ингаляционный, трансбуккальный, подъязычный, интраплевральный, интратекальный, интраназальный и т.п. Лекарственные формы для местного или трансдермального введения соединения согласно настоящему изобретению включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и формы для ингаляции. В одном из вариантов реализации активное соединение смешивают в стерильных условиях с фармацевтически приемлемым носителем и с любыми требуемыми консервантами, буферами или пропеллентами.
Выражение «фармацевтически приемлемый», применяемое в настоящей заявке, относится к соединениям, анионам, катионам, материалам, композициям, носителям и/или лекарственным формам, которые, в пределах погрешности медицинской оценки, являются подходящими для применения в контакте с тканями людей и животных без проявления чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соразмерного с приемлемым соотношением польза/риск.
Выражение «фармацевтически приемлемое вспомогательное вещество» обозначает вспомогательное вещество, которое является подходящим для получения фармацевтической композиции, которая является безопасной, нетоксичной и не обладает биологической или какой-либо другой нежелательной активностью, и включает вспомогательное вещество, которое подходит для применения в ветеринарии, а также при лечении человека. Выражение «фармацевтически приемлемое вспомогательное вещество», применяемое в описании и формуле изобретения, включает одно и более одного такого вспомогательного вещества.
Фармацевтическую композицию согласно настоящему изобретению разрабатывают совместимой с предполагаемым способом ее введения. Примеры способов введения включают парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное (например, путем ингаляции), трансдермальное (местное) и трансмукозальное введение. Растворы или суспензии, применяемые для парентерального, интрадермального или подкожного применения, могут содержать следующие компоненты: стерильный разбавитель, такой как вода для инъекций, физраствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные агенты, такие как бензиловый спирт или метилпарабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатирующие агенты, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для регулирования тоничности, такие как хлорид натрия или декстроза. рН можно регулировать при помощи кислот или оснований, таких как соляная кислота или гидроксид натрия. Препарат для парентерального введения может быть заключен в ампулы, одноразовые шприцы или емкости, содержащие несколько доз, произведенные из стекла или пластика.
Соединение или фармацевтическую композицию согласно настоящему изобретению можно вводить субъекту при помощи множества хорошо известных способов, применяемых в настоящее время при химиотерапевтическом лечении. Например, для лечения раковых заболеваний соединение согласно настоящему изобретению можно вводить непосредственно в опухоли, вводить в кровоток или полости тела, применять перорально или наносить на кожу при помощи пластырей. Выбранная доза должна быть достаточной для обеспечения эффективного лечения, но недостаточно высокой для проявления нежелательных побочных эффектов. Предпочтительно тщательно контролировать течение заболевания (например, ракового заболевания, предракового заболевания и т.п.) и состояние здоровья пациента в процессе лечения и в течение разумного срока после лечения.
Термин «терапевтически эффективное количество», применяемый в настоящей заявке, относится к количеству фармацевтического агента, обеспечивающему излечение, облегчение или предотвращение установленного заболевания или состояния или проявление заметного терапевтического или ингибирующего эффекта. Эффект может быть определен при помощи любого способа исследования, известного в данной области техники. Точное эффективное количество для субъекта зависит от массы тела, размера и состояния здоровья субъекта; природы и степени развития состояния; и лекарственного средства или комбинации лекарственных средств, выбранных для введения. Терапевтически эффективное количество для конкретного случая может быть определено при помощи традиционной экспериментальной работы, находящейся в рамках компетенции лечащего врача. В предпочтительном аспекте заболевание или состояние, подвергающееся лечению, представляет собой раковое заболевание. В другом аспекте заболевание или состояние, подвергающееся лечению, представляет собой клеточное пролиферативное расстройство.
Терапевтически эффективное количество для любого соединения может быть сперва оценено при помощи исследований клеточных культур, например, неопластических клеток, или при помощи животных моделей, как правило, крыс, мышей, кроликов, собак или свиней. Животная модель также может быть использована для определения соответствующего диапазона концентраций и способа введения. Затем такая информация может быть использована для определения доз и способов введения, подходящих для применения на людях. Терапевтическая/профилактическая эффективность и токсичность могут быть определены при помощи стандартных фармацевтических процедур с клеточными культурами или подопытными животными, например, ED50 (доза, терапевтически эффективная для 50% популяции) и LD50 (доза, летальная для 50% популяции). Отношение доз, приводящих к токсическому и терапевтическому эффектам, представляет собой терапевтический индекс, и он может быть выражен в виде отношения LD50/ED50. Фармацевтические композиции, обладающие высоким терапевтическим индексом, являются предпочтительными. Дозировку можно варьировать в пределах указанного диапазона в зависимости от применяемой лекарственной формы, чувствительности пациента и способа введения.
Дозировку и способ введения корректируют для обеспечения эффективного(ых) содержания(и) активного(ых) агента(ов) или поддерживания желаемого эффекта. Факторы, которые следует учитывать, включают тяжесть болезненного состояния, общее состояние здоровья субъекта, возраст, вес и пол субъекта, диету, время и частоту введения, комбинацию(и) лекарственных средств, чувствительность и устойчивость/ответ на терапию. Фармацевтические композиции длительного действия можно вводить каждые 3-4 дня, раз в неделю или один раз в две недели в зависимости от периода полувыведения и скорости выведения конкретного состава.
Фармацевтические композиции, содержащие активные соединения согласно настоящему изобретению, можно получать при помощи хорошо известных способов, например, при помощи обычных способов смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсулирования, включения или лиофилизации. Фармацевтические композиции можно получать при помощи обычных способов с применением одного или более фармацевтически приемлемых носителей, содержащих вспомогательные вещества и/или добавки, которые облегчают обработку активных соединений при получении препаратов, которые можно использовать фармацевтически. Конечно, соответствующий состав зависит от выбранного способа введения.
Фармацевтические композиции, подходящие для применения в виде инъекции, включают стерильные водные растворы (если являются водорастворимыми) или дисперсии и стерильные порошки для приготовления стерильных растворов или дисперсий для инъекций. Носители, подходящие для внутривенного введения, включают физраствор, бактериостатическую воду, Cremophor EL™ (BASF, Parsippany, N.J.) или фосфатно-солевой буфер (ФСБ). Во всех случаях композиция должна быть стерильной и текучей в степени, обеспечивающей простоту введения при помощи шприца. Она должна быть стабильной в условиях производства и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или дисперсионную среду, содержащую, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.), и их подходящие смеси. Требуемую текучесть можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддерживания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Предотвращение действия микроорганизмов можно обеспечивать при помощи различных антибактериальных и противогрибковых агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительным является добавление в композицию изотонических агентов, например, сахаров, многоатомных спиртов, таких как маннит и сорбит, и хлорида натрия. Пролонгированное всасывание композиции для инъекции можно обеспечивать путем добавления в композицию агента, который задерживает всасывание, например, моностеарата алюминия и желатина.
Стерильные растворы для инъекций могут быть получены путем добавления требуемого количества активного соединения в соответствующий растворитель в комбинации с одним или более ингредиентами, перечисленными выше, с дальнейшим проведением стерилизации фильтрованием, в случае необходимости. Как правило, дисперсии получают путем добавления активного соединения в стерильное вещество-носитель, которое содержит основную дисперсионную среду и другие требуемые ингредиенты из числа ингредиентов, перечисленных выше. В случае стерильных порошков для получения стерильных растворов для инъекций способы получения представляют собой вакуумную сушку и лиофильную сушку, позволяющие получать порошок активного ингредиента в комбинации с любым дополнительным требуемым ингредиентом из его раствора, предварительно стерилизованного фильтрованием.
Пероральные композиции обычно содержат инертный разбавитель или съедобный фармацевтически приемлемый носитель. Они могут быть заключены в желатиновые капсулы или спрессованы в таблетки. Для перорального терапевтического введения активное соединение может быть смешано с вспомогательными веществами и может применяться в виде таблеток, пастилок или капсул. Пероральные композиции также могут быть получены с применением жидкого носителя для применения в качестве жидкости для полоскания рта, где соединение в жидком носителе применяют перорально и используют для полоскания рта и сплевывают или проглатывают. В качестве части композиции можно применять фармацевтически совместимые связующие агенты и/или адъюванты. Таблетки, пилюли, капсулы, пастилки и т.п. могут содержать любой из следующих ингредиентов или соединений схожей природы: связующее вещество, такое как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; вспомогательное вещество, такое как крахмал или лактоза; разрыхлитель, такой как альгиновая кислота, Primogel или кукурузный крахмал; смазывающее вещество, такое как стеарат магния или Sterotes; скользящее вещество, такое как коллоидный диоксид кремния; подсластитель, такой как сахароза или сахарин; или ароматизатор, такой как перечная мята, метилсалицилат или апельсиновый ароматизатор.
При введении путем ингаляции соединения доставляют в виде аэрозольного спрея из находящегося под давлением контейнера или распылителя, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода, или небулайзера.
Системное введение также можно проводить при помощи трансмукозального или трансдермального способа. При трансмукозальном или трансдермальном введении в составе применяют вещества, способные проникать через соответствующий барьер. Такие проникающие вещества, как правило, известны в данной области техники и включают, например, для трансмукозального введения, детергенты, соли желчных кислот и производные фусидовой кислоты. Трансмукозальное введение можно осуществлять путем применения назальных спреев или суппозиториев. Для трансдермального введения активные соединения получают в виде мазей, бальзамов, гелей или кремов, как правило, известных в данной области техники.
Активные соединения можно получать с применением фармацевтически приемлемых носителей, которые защищают соединение от быстрого выведения из организма, таких как составы с контролируемым высвобождением, включая имплантаты и микроинкапсулированные системы доставки. Можно применять биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, сложные полиортоэфиры и полимолочная кислота. Способы получения таких составов понятны специалистам в данной области техники. Материалы также могут быть получены из коммерческих источников, таких как Alza Corporation и Nova Pharmaceuticals, Inc. В качестве фармацевтически приемлемых носителей также можно применять липосомальные суспензии (включая липосомы, направленные на инфицированные клетки с моноклональными антителами к вирусным антигенам). Они могут быть получены в соответствии со способами, известными специалистам в данной области техники, например, описанными в патенте США №4522811.
Особенно выгодно получать композиции для перорального или парентерального введения в стандартной лекарственной форме, обеспечивающей легкость введения и однородность дозировки. Стандартная лекарственная форма, применяемая в настоящей заявке, относится к физически дискретным формам, подходящим для единичного дозирования субъекту, проходящему лечение; каждая из форм содержит заранее определенное количество активного соединения, рассчитанное для обеспечения целевого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Спецификация стандартных лекарственных форм согласно настоящему изобретению обусловлена и непосредственно зависит от уникальных характеристик активного соединения и конкретного достигаемого терапевтического эффекта.
При терапевтическом применении дозировки фармацевтических композиций, применяемые в соответствии с настоящим изобретением, варьируются в зависимости от агента, возраста, массы тела и клинического состояния пациента, проходящего лечение, опыта и заключения лечащего врача или практикующего врача, проводящего терапию, и других факторов, влияющих на выбранную дозировку. Как правило, доза должна быть достаточной для обеспечения замедления и предпочтительно регрессии роста опухолей, а также предпочтительно обеспечения полной регрессии ракового заболевания. Дозировки могут варьироваться от примерно 0,01 мг/кг в сутки до примерно 5000 мг/кг в сутки. В предпочтительных аспектах дозировки могут варьироваться от примерно 1 мг/кг в сутки до примерно 1000 мг/кг в сутки. В одном из аспектов доза находится в диапазоне от примерно 0,1 мг/сутки до примерно 50 г/сутки; от примерно 0,1 мг/сутки до примерно 25 г/сутки; от примерно 0,1 мг/сутки до примерно 10 г/сутки; от примерно 0,1 мг до примерно 3 г/сутки; или от примерно 0,1 мг до примерно 1 г/сутки, в виде единичной дозы, раздельных доз или непрерывной дозы (которую можно регулировать в зависимости от массы тела в кг, площади поверхности тела в м2 и возраста пациента в годах). Эффективное количество фармацевтического агента представляет собой количество, которое обеспечивает объективно определяемое улучшение, отмечаемое лечащим врачом или другим квалифицированным наблюдателем. Например, регрессия опухоли у пациента может быть измерена на основе диаметра опухоли. Уменьшение диаметра опухоли указывает на регрессию. Регрессия также указывает на повторное образование опухолей после прекращения лечения. Термин «эффективная дозировка», применяемый в настоящей заявке, относится к количеству активного соединения, обеспечивающему целевой биологический эффект у субъекта или в клетке.
Фармацевтические композиции могут быть внесены в контейнер, упаковку или дозатор вместе с инструкциями по введению.
Соединения согласно настоящему изобретению способны дополнительно образовывать соли. Все из указанных форм также включены в объем заявленного изобретения.
Термин «фармацевтически приемлемые соли», применяемый в настоящей заявке, относится к производным соединений согласно настоящему изобретению, в которых исходное соединение модифицируют с получением кислых или основных солей. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, минеральные или органические кислые соли основных остатков, таких как амины, щелочные или органические соли кислотных остатков, таких как карбоновые кислоты, и т.п. Фармацевтически приемлемые соли включают обычные нетоксичные соли или четвертичные аммонийные соли исходного соединения, полученные, например, из нетоксичных неорганических или органических кислот. Например, такие обычные нетоксичные соли включают, но не ограничиваются ими, соли, полученные из неорганических или органических кислот, выбранных из 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, диугольной, угольной, лимонной, эдетовой, этандисульфоновой, 1,2-этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой, гликолевой, гликолиларсаниловой, гексилрезорциновой, гидрабаминовой, бромистоводородной, соляной, йодистоводородной, гидроксималеиновой, гидроксинафтойной, изетионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой, азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, подуксусной (subacetic), янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной, толуолсульфоновой и широко распространенных аминокислот, например, глицина, аланина, фенилаланина, аргинина и т.п.
Другие примеры фармацевтически приемлемых солей включают гексановую кислоту, циклопентанпропионовую кислоту, пировиноградную кислоту, малоновую кислоту, 3-(4-гидроксибензоил)бензойную кислоту, коричную кислоту, 4-хлорбензолсульфоновую кислоту, 2-нафталинсульфоновую кислоту, 4-толуолсульфоновую кислоту, камфорсульфоновую кислоту, 4-метилбицикло-[2.2.2]-окт-2-ен-1-карбоновую кислоту, 3-фенилпропионовую кислоту, триметилуксусную кислоту, трет-бутилуксусную кислоту, муконовую кислоту и т.п. Настоящее изобретение также охватывает соли, полученные в случае замены кислотного протона в исходном соединении на ион металла, например, ион щелочного металла, ион щелочноземельного металла или ион аллюминия; или его координирования с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Следует понимать, что отношение соединения в виде соли к катиону или аниону соли может составлять 1:1 или любое отношение, отличное от 1:1, например, 3:1, 2:1, 1:2 или 1:3.
Следует понимать, что все ссылки на фармацевтически приемлемые соли включают аддитивные формы с растворителем (сольваты) и кристаллические формы (полиморфы) указанной соли, определенные в настоящей заявке.
Соединения согласно настоящему изобретению также могут быть получены в виде сложных эфиров, например, фармацевтически приемлемых сложных эфиров. Например, функциональная карбоксильная группа в соединении может быть превращена в соответствующий сложный эфир, например, сложный метиловый, этиловый или другой эфир. Кроме того, гидроксильная группа в соединении может быть превращена в соответствующий сложный эфир, например, ацетат, пропионат или другой сложный эфир.
Соединения или их фармацевтически приемлемые соли вводят перорально, назально, трансдермально, легочно, ингаляционно, трансбуккально, сублингвально, интраперитонеально, подкожно, внутримышечно, внутривенно, ректально, внутриплеврально, интратекально и парентерально. В одном из вариантов реализации соединение вводят перорально. Специалисту в данной области понятны преимущества конкретных способов введения.
Режим дозирования применяемых соединений выбирают в соответствии с различными факторами, включающими тип, вид, возраст, массу тела, пол и медицинское состояние пациента; тяжесть состояния, подвергающегося лечению; способ введения/функцию почек и печени пациента; и конкретное применяемое соединение или его соль. Квалифицированный врач или ветеринар может легко определить и прописать эффективное количество лекарственного средства, требуемого для предотвращения, противодействия или прекращения прогрессирования состояния.
Способы получения и введения представленных соединений согласно настоящему изобретению можно найти в Remington: the Science and Practice of Pharmacy, 19th edition. Mack Publishing Co., Easton, PA (1995). В одном из вариантов реализации соединения, описанные в настоящей заявке, и их фармацевтически приемлемые соли применяют в фармацевтических препаратах в комбинации с фармацевтически приемлемым носителем или разбавителем. Подходящие фармацевтически приемлемые носители включают инертные твердые наполнители или разбавители и стерильные водные или органические растворы. Соединения могут содержаться в указанных фармацевтических композициях в количествах, достаточных для обеспечения целевой дозировки, находящейся в диапазоне, описанном в настоящей заявке.
Если не указано иное, все процентные значения и отношения, применяемые в настоящей заявке, являются массовыми. Другие признаки и преимущества настоящего изобретения понятны из различных примеров. В приведенных примерах представлены различные компоненты и методики, подходящие для применения при практической реализации настоящего изобретения. Примеры не ограничивают заявленное изобретение. На основе настоящего описания специалист в данной области техники может определять и применять другие компоненты и методики, подходящие для применения при практической реализации настоящего изобретения.
Для простоты в схемах синтеза, описанных в настоящей заявке, соединения могут быть представлены в виде одной конкретной конфигурации. Такие конкретные конфигурации не следует истолковывать как ограничивающие изобретение каким-либо изомером, таутомером, региоизомером или стереоизомером, а также не исключают смеси изомеров, таутомеров, региоизомеров или стереоизомеров; тем не менее, следует понимать, что указанный изомер, таутомер, региоизомер или стереоизомер может иметь более высокую активность чем другой изомер, таутомер, региоизомер или стереоизомер.
После получения соединения, разработанные, выбранные и/или оптимизированные при помощи вышеописанных способов, могут быть охарактеризованы с применением различных исследований, известных специалистам в данной области техники, для определения наличия у соединений биологической активности. Например, молекулы могут быть охарактеризованы при помощи обычных способов, включая, но не ограничиваясь ими, способы, описанные ниже, для определения наличия у них предполагаемой активности, активности связывания и/или специфичности связывания.
Кроме того, для ускорения анализа с применением указанных исследований можно применять высокопроизводительный скрининг. В результате становится возможным быстрый скрининг молекул, описанных в настоящей заявке, для определения их активности с применением способов, известных в данной области техники. Общие методики проведения высокопроизводительного скрининга описаны, например, в Devlin (1998) High Throughput Screening, Marcel Dekker; и патенте США №5763263. В высокопроизводительных исследованиях можно применять один или более различных способов исследования, включая, но не ограничиваясь ими, способы, описанные ниже.
Все публикации и патентные документы, приведенные в настоящей заявке, включены в настоящую заявку посредством ссылки, как если бы каждая указанная публикация или документ была специально и индивидуально включена в настоящую заявку посредством ссылки. Предполагается, что цитирование публикаций и патентных документов не следует рассматривать как допущение о том, что какая-либо из указанных публикаций или документов представляет собой предшествующий уровень техники, это же нельзя допускать и в отношении содержания и даты подачи указанных публикаций и документов. Настоящее изобретение описано при помощи напечатанного описания, специалистам в данной области техники понятно, что настоящее изобретение может быть реализовано в различных вариантах реализации, и что вышеприведенное описание и нижеприведенные примеры представлены в качестве иллюстрации и не ограничивают нижеприведенную формулу изобретения.
Примеры
Пример 1. Синтез соединений согласно настоящему изобретению
Общие экспериментальные определения
ЯМР
Если не указано иное, спектры 1H-ЯМР получали с применением CDCl3 и записывали при 400 или 500 МГц с применением магнитного (500 МГц) прибора Varian или Oxford Instruments. Мультиплетность обозначали следующим образом: s = синглет, d = дублет, t = триплет, q = квартет, quint = квинтет, sxt = секстет, m = мультиплет, dd = дублет дублетов, dt=дублет триплетов; ушир. обозначает уширенный сигнал.
ЖХМС и ВЭЖХ
Масс-спектрометрия: система Waters Acquity для сверхвысокоэффективной ЖХ. ВЭЖХ: продукты анализировали при помощи Shimadzu SPD-20A с колонкой 150×4,5 мм YMC ODS-M80 или колонкой 150×4,6 мм YMC-Pack Pro C18 при 1,0 мл/мин. Подвижная фаза представляла собой MeCN:H2O=3:2 (с содержанием 0,3% SDS и 0,05% H3PO4). Продукты очищали при помощи ВЭЖХ/МС (МеОН-H2O с содержанием 0,1% гидроксида аммония) с применением системы Waters AutoPurification System с масс-спектрометрическим детектором 3100.
HCl соль 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она
К раствору 2-цианоацетамида (8,40 г, 100 ммоль) и ацетилацетона (10,0 г, 100 ммоль) в H2O (200 мл) добавляли K2CO3 (4,00 г, 28,9 ммоль). Смесь перемешивали при КТ в течение 22 часов. Затем осажденное твердое вещество фильтровали с применением воронки Бюхнера, промывали ледяной H2O и сушили под вакуумом с получением 4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила (13,5 г, выход 91%).
К раствору 4,6-диметил-2-оксо-1,2-дигидропиридин-3-карбонитрила (10,0 г, 67,5 ммоль) в МеОН (1,50 л) и конц. HCl (30 мл) добавляли 10% Pd(OH)2 (19 г) в атмосфере N2. Газ N2 заменяли на газ H2 и смесь перемешивали в течение 26 часов при КТ в атмосфере водорода. Газ H2 заменяли на газ N2. Смесь фильтровали через целит, промывали МеОН и концентрировали. Остаток растирали с EtOH, собирали с применением воронки Бюхнера и сушили под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (11,5 г, 90%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 11,86 (ушир, 1Н), 5,98 (s, 1H), 3,78 (m, 2H), 2,20 (s, 3Н), 2,16 (s, 3Н).
HCl соль 3-(аминометил)-6-метил-4-пропил-1,2-дигидропиридин-2-она
К раствору t-BuOK (20,0 г, 179 ммоль) и цианоацетамида (16,5 г, 196 ммоль) в ДМСО (300 мл) при перемешивании добавляли (3Е)-3-гептен-2-он (20,0 г, 178 ммоль). Реакционную смесь перемешивали при 23°С в течение 30 минут, а затем к реакционной смеси добавляли еще t-BuOK (60,0 г, 712 ммоль). Реакционную смесь помешали в атмосферу кислорода и перемешивали в течение 16 ч. Затем реакционную смесь продували аргоном и охлаждали до 0°С. Смесь разбавляли вод. раствором HCl и полученный осадок собирали. Твердое вещество промывали водой и сушили с получением 6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-карбонитрила (15,0 г, 47%).
К раствору 6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-карбонитрила (15,0 г, 85,1 ммоль) в метаноле (600 мл) и концентрированной HCl (15 мл) при перемешивании добавляли Pd(OH)2 (15,0 г). Смесь перемешивали в течение 48 часов в атмосфере H2. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме. К остатку добавляли этанол, полученный осадок собирали и сушили с получением указанного в заголовке соединения в виде белого твердого вещества (13,0 г, 60%). 1H-ЯМР (400 МГц, CDCl3) δ м.д.; 11,86 (ушир с., 1H), 6,00 (s, 1H), 3,78 (q, J=5,5 Гц, 2H), 3,61 (ушир, s, 2H), 2,46 (m, 2H), 2,17 (s, 3Н), 1,50 (sxt, J=7,4 Гц, 2Н), 0,91 (t, J=7,4 Гц, 3Н).
6-Метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-карбонитрил
К раствору 2-цианоацетамида (35,1 г, 417 ммоль) и t-BuOK (42,5 г, 379 ммоль) в ДМСО (631 мл) добавляли 5-метил-3-гексен-2-он (50,0 мл, 379 ммоль) в атмосфере N2. Смесь перемешивали при 23°С в течение 30 мин, а затем добавляли еще t-BuOK (127 г, 1137 ммоль). Газ N2 заменяли на газ О2 и смесь перемешивали в течение 45 ч при 23°С в атмосфере кислорода. Смесь охлаждали до 0°С, разбавляли H2O (200 мл) и 5 н. раствором HCl (227 мл, медленно добавляли). Смесь перемешивали в течение 15 мин при 0°С и твердое вещество собирали с применением воронки Бюхнера. Твердое вещество промывали H2O (1500 мл) и сушили горячим воздухом (55°С, 16 ч) с получением 6-метил-2-оксо-4-(пропан-2-ил)-1,2-дигидропиридин-3-карбонитрила в виде белого твердого вещества (26,6 г, 40%). 1H-ЯМР (400 МГц, CDCl3) δ м.д.; 6,14 (s, 1Н), 3,25-3,29 (m, 1H), 2,45 (s, 3Н), 1,26 (d, J=6,8 Гц, 6Н); ЖХ-МС: m/z 177,1 [M+H]+, 198,9 [M+Na]+.
HCl соль 3-(аминометил)-6-метил-4-(2-пропил)-1,2-дигидропиридин-2-она
К раствору 6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-карбонитрила (5,00 г, 28,4 ммоль) в МеОН (400 мл) и конц. HCl (8,8 мл) добавляли 10% Pd(OH)2 (5,17 г, 3,68 ммоль) в атмосфере N2. Газ N2 заменяли на газ H2 и смесь перемешивали в течение 24 ч при 23°С в атмосфере водорода. Газ H2 заменяли на газ N2 и смесь фильтровали через целит, промывали МеОН и фильтрат концентрировали. Остаток растирали с EtOH-ТБМЭ, твердое вещество собирали с применением воронки Бюхнера и сушили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (6,15 г, 100%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 11,9 (ушир-s, 1Н), 8,03 (ушир-s, 2Н), 6,12 (s, 1H), 3,82-3,84 (m, 2Н), 3,08-3,12 (m, 1H), 2,19 (s, 3H), 1,12 (d, J=6,8 Гц, 6Н).
6-Метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-карбонитрил
К раствору 2-цианоацетамида (14,0 г, 166 ммоль) и трифторацетилацетона (20,0 мл, 166 ммоль) в H2O (332 мл) добавляли K2CO3 (6,60 г, 47,9 ммоль). Смесь перемешивали при 23°С в течение 15 ч. Осажденное твердое вещество собирали с применением воронки Бюхнера, промывали ледяной H2O и сушили горячим воздухом (60°С, 16 ч) с получением указанного в заголовке соединения в виде белого твердого вещества (17,6 г, 52%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 2,38 (s, 3H), 6,66 (s, 1H).
Соль HCl: гидрохлорид 3-(аминометил)-6-метил-4-(трифторметил)-1,2-дигидропиридин-2-она
К раствору 6-метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-карбонитрила (400 мг, 1,98 ммоль) в МеОН (19,8 мл) и конц. НС1 (436 мкл) добавляли 10% Pd(OH)2 (361 мг, 0,257 ммоль) в атмосфере N2. Газ N2 заменяли на газ H2 и смесь перемешивали в течение 18 ч при 23°С в атмосфере водорода. Газ H2 заменяли на газ N2. Смесь фильтровали через целит, промывали МеОН и фильтрат концентрировали. Остаток растирали с MeOH-Et2O, собирали с применением воронки Бюхнера и сушили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (433 мг, 100%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 2,31 (s, 3H), 3,88 (s, 2Н), 6,43 (s, 1H).
5-Фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-карбонитрил
Указанное в заголовке соединение получали (0,430 г, 38%) при помощи способа, аналогичного способу получения 5-фтор-4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила, и очищали при помощи хроматографии на силикагеле (50%-100% смесями EtOAc-гептан). 1H-ЯМР (400 МГц): δ м.д. 3,56 (s, 3Н), 2,43 (d, J=2,1 Гц, 3Н), 2,41 (d, J=8,4 Гц, 3Н); MC (ИЭР) [М+Н]+ 181,1.
3-(Аминометил)-5-фтор-1,4,6-триметилпиридин-2(1Н)-он
Указанное в заголовке соединение получали (0,440 г, выход 100%) при помощи способа, аналогичного способу получения 3-(аминометил)-5-фтор-4-изопропил-6-метилпиридин-2(1Н)-она. 1H-ЯМР (400 МГц, CD3OD): δ м.д. 3,75 (s, 2H), 3,52 (s, 3Н), 2,36 (d, J=3,2 Гц, 3Н), 2,23 (d, J=2,1 Гц, 3Н); MC (ИЭР) [M+H]+ 185,1.
3-(Аминометил)-1,4,6-триметилпиридин-2(1Н)-он
Указанное в заголовке соединение получали (200 мг, выход 100%) при помощи способа, аналогичного способу получения 3-(аминометил)-5-фтор-4-изопропил-6-метилпиридин-2(1Н)-она. 1H-ЯМР (400 МГц): δ м.д. 5,90 (s, 1Н), 3,75 (s, 2H), 3,51 (s, 3Н), 2,30 (s, 3Н), 2,19 (s, 3Н); MC (ИЭР) [M+H]+ 167,1.
2-((6-Метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил)метил)изоиндолин-1,3-дион
Раствор фталевого ангидрида (0,140 г, 0,948 ммоль), триэтиламина (0,264 мл, 1,90 ммоль) и гидрохлорида 3-(аминометил)-6-метил-4-(трифторметил)пиридин-2(1Н)-она (0,230 г, 0,948 ммоль) в уксусной кислоте (2,71 мл, 47,4 моль) грели при помощи микроволнового излучения при 100°С в течение 1 ч. Данные ЖХ-МС показали единичный пик, соответствующий целевому продукту. Реакционную смесь погружали в воду, и осажденное твердое вещество собирали при помощи фильтрования, промывали водой и сушили с получением указанного в заголовке соединения (265 мг, выход 83%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 7.83 (s, 4H), 6,29 (s, 1Н), 4,74 (s, 2H), 2,24 (s, 3Н); MC (ИЭР) [М+Н]+ 337,2.
2-((1,6-Диметил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил)метил)изоиндолин-1,3-дион
Карбонат цезия (257 мг, 0,788 ммоль) добавляли к суспензии 2-((6-метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил)метил)изоиндолин-1,3-диона (265 мг, 0,788 ммоль) в ДМСО (2,34 мл) при 23°С. Реакционная смесь сразу окрашивалась в желтый цвет. После перемешивания в течение 16 ч при 23°С добавляли метилйодид (49,3 мкл, 0,788 ммоль), и желтый цвет переходил в светло-желтый. После перемешивания в течение 1 ч ЖХ-данные MC свидетельствовали о завершении реакции. Реакционную смесь погружали в ледяную воду и фильтровали, промывали эфиром и сушили с получением указанного в заголовке соединения (250 мг, выход 91%). 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,79 (m, 4H), 6,51 (s, 1Н), 4,88 (s, 2H), 3,51 (s, 3Н), 2,48 (s, 3Н); MC (ИЭР) [М+Н]+ 351,2.
3-(Аминометил)-1,6-диметил-4-(трифторметил)пиридин-2(1Н)-он
Гидрат гидразина (106 мкл, 2,14 ммоль) добавляли к суспензии 2-((1,6-диметил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил)метил)изоиндолин-1,3-диона (250 мг, 0,714 ммоль) в этаноле (4,2 мл) и реакционную смесь грели при 80°С в течение 2 ч. ЖХ-Данные МС свидетельствовали о завершении реакции, смесь охлаждали до температуры окружающей среды, фильтровали для удаления осажденного твердого вещества. Затем фильтрат концентрировали и перегоняли в виде азеотропа с ДМФА с получением неочищенного указанного в заголовке соединения (178 мг, 113%). Неочищенное соединение применяли непосредственно на следующей стадии без дополнительной очистки. МС (ИЭР) [М+Н]+ 221,1.
Стадия 1: синтез метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-гидрокси-4-метил-[1,1'-бифенил]-3-карбоксилата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метилбензоата (10 г, 21,3 ммоль, см., например, WO 2012142504 (Attorney Docket No. 41478-507001WO)) и (4-гидроксифенил)бороновой кислоты (3,5 г, 25,3 ммоль) в смеси диоксана (225 мл) и воды (75 мл) при перемешивании добавляли Na2CO3 (8,01 г, 75,5 ммоль), и раствор продували аргоном в течение 30 мин. Затем добавляли Pd(PPh3)4 (2,4 г, 2,07 ммоль) и аргон снова продували в течение дополнительных 15 мин. Реакционную массу грели при 100°С в течение 4 ч. Затем реакционную смесь разбавляли водой, и смесь экстрагировали этилацетатом. Объединенный органический слой сушили над сульфатом натрия. В результате удаления растворителя при пониженном давлении с последующей очисткой при помощи колоночной хроматографии получали указанное в заголовке соединение (8,9 г, выход 87%).
Стадия 2: синтез метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксилата
К раствору метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-гидрокси-4-метил-[1,1'-бифенил]-3-карбоксилата (0,6 г, 1,24 ммоль) и 1-бром-2-метоксиэтана (0,519 г, 3,73 ммоль) в ацетонитриле (6 мл) при перемешивании добавляли Cs2CO3 (0,485 г, 1,49 ммоль) и реакционную смесь перемешивали при 80°С в течение 12 ч. Затем к реакционной смеси добавляли воду и экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,6 г, выход 76,5%).
Стадия 3: синтез трет-бутил-((транс)-4-((5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-ил(этил)амино)циклогексил)карбамата
Водный раствор NaOH (0,066 г, 1,66 ммоль в 5 мл H2O) добавляли к раствору 5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксилата (0,6 г, 1,11 ммоль) в EtOH (10 мл) и перемешивали при 60°С в течение 1 ч. После завершения реакции этанол удаляли при пониженном давлении и остаток подкисляли с применением лимонной кислоты для регулирования значения рН до 4. Экстрагирование проводили с применением 10% смеси метанола в ДХМ. Объединенные органические слои сушили и концентрировали с получением соответствующей кислоты (0,5 г, выход 85,6%).
Затем вышеописанную кислоту (0,5 г, 0,95 ммоль) расстворяли в ДМСО (5 мл) и к реакционной смеси добавляли 3-(аминометил)-4,6-диметилпиридин-2(1Н)-он (0,288 г, 1,90 ммоль) и триэтиламин (0,096 г, 0,950 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин перед добавлением РуВор (0,741 г, 1,42 ммоль) и перемешивание продолжали в течение ночи при комнатной температуре. После завершения реакции реакционную массу опускали в лед и проводили экстрагирование с применением 10% раствором МеОН/ДХМ. Объединенные органические слои сушили над сульфатом натрия и концентрировали при пониженном давлении с получением неочищенного материала, который затем очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,45 г, выход 71,8%).
Стадия 4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((транс)-4-(диметиламино)-циклогексил)-(этил)-амино)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
К раствору трет-бутил-((транс)-4-((5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-ил)(этил)амино)циклогексил)карбамата (0,45 г, 0,681 ммоль) в ДХМ (5 мл) при 0°С при перемешивании добавляли ТФУ (1 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали досуха. Затем остаток подщелачивали Na2CO3 (вод.) до рН 8, и водный слой экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении с получением соединения со снятой Boc-защитой (0,3 г, выход 78,7%).
К раствору соединения со снятой Вос-защитой (0,3 г, 0,535 ммоль) в дихлорметане (3 мл) при 0°С при перемешивании добавляли раствор формальдегида (35-41% вод.) (0,056 г, 1,87 ммоль) и смесь перемешивали в течение 20 мин. Затем добавляли NaBH(OAc)3 (0,28 г, 1,33 ммоль) и смесь перемешивали в течение 2 ч при 0°С. После завершения реакции добавляли воду, и смесь экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении. Неочищенное соединение очищали при помощи преп. ВЭЖХ с получением указанного в заголовке соединения (0,1 г, выход 31,7%).
ЖХМС: 589,75 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,47 (ушир, 1Н), 9,48 (ушир, 1Н), 8,21 (ушир, 1Н), 7,57 (d, 2H, J=8,0 Гц), 7,40 (s, 1Н), 7,23 (s, 1Н), 7,03 (d, 2H, J=8,8 Гц), 5,87 (s, 1Н), 4,29 (d, 2H, J=4,4 Гц), 4,14-4,12 (m, 2H), 3,69-3,66 (m, 2H), 3,32 (s, 3H), 3,13 (m, 4H), 2,69-2,68 (m, 6H), 2,24 (s, 3H), 2,21 (s, 3H), 2,11 (s, 3H), 1,96 (m, 4H), 1,44 (m, 4H), 0,85 (t, 3H, J=6,8 Гц).
Соединение 3:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-гидроксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
Стадия 1: синтез метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метил-[1,1'-бифенил]-3-карбоксилата
К раствору метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-гидрокси-4-метил-[1,1'-бифенил]-3-карбоксилата (0,8 г, 1,65 ммоль) и (2-бромэтокси)(трет-бутил)диметилсилана (1,97 г, 8,29 ммоль) в ацетонитриле (10 мл) при перемешивании добавляли Cs2CO3 (1,61 г, 4,97 ммоль) и реакционную смесь перемешивали при 80°С в течение 12 ч. Затем реакционную массу разбавляли водой и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,7 г, выход 70%).
Стадия 2: синтез трет-бутил-((транс)-4-((5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-гидроксиэтокси)-4-метил-[1,1'-бифенил]-3-ил)(этил)амино)циклогексил)карбамата
Согласно протоколу, описанному для стадии 3 способа получения соединения 2, с применением метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-(2-((трет-бутилдиметилсилил)окси)этокси)-4-метил-[1,1'-бифенил]-3-карбоксилата (0,7 г, 1,09 ммоль) и 3-(аминометил)-4,6-диметилпиридин-2(1Н)-она (0,291 г, 1,91 ммоль) получали указанное в заголовке соединение (0,45 г, выход 61,8%).
Стадия 3: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-гидроксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
К раствору трет-бутил-((транс)-4-((5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-гидроксиэтокси)-4-метил-[1,1'-бифенил]-3-ил)(этил)амино)циклогексил)карбамата (0,45 г, 0,59 ммоль) в ДХМ (5 мл) при 0°С при перемешивании добавляли ТФУ (1 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали досуха. Затем остаток подщелачивали Na2CO3 (вод.) до рН 8, и водный слой экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении с получением соединения со снятой Вос-защитой (0,3 г, выход 76,9%).
К раствору соединения со снятой Вос-защитой (0,3 г, 0,45 ммоль) в дихлорметане (3 мл) при 0°С при перемешивании добавляли раствор формальдегида (35-41% вод.) (0,05 г, 1,59 ммоль) и смесь перемешивали в течение 20 мин. Затем добавляли NaBH(OAc)3 (0,24 г, 1,13 ммоль) и полученную смесь перемешивали в течение 2 ч при 0°С. После завершения реакции добавляли воду, и смесь экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении. Неочищенное соединение очищали при помощи преп. ВЭЖХ с получением указанного в заголовке соединения (0,1 г, выход 32,1%).
ЖХМС: 575,55 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,50 (ушир, 1Н), 9,52 (ушир, 1Н), 8,23 (ушир, 1Н), 7,58 (d, 2H, J=8,4 Гц), 7,45 (s, 1Н), 7,26 (s, 1Н), 7,02 (d, 2H, J=8,4 Гц), 5,87 (s, 1Н), 4,30-4,29 (m, 2H), 4,03-4,00 (m, 2H), 3,75-3,72 (m, 2H), 3,22-3,12 (m, 3H), 2,93 (m, 1Н), 2,69 (m, 6H), 2,25 (s, 3H), 2,21 (s, 3H), 2,11 (s, 3H), 1,97 (m, 4H), 1,45 (m, 4H), 0,85 (t, 3H, J=6,8 Гц).
Соединение 4
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-5-(6-(2-гидроксиэтокси)пиридин-3-ил)-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-гидроксипиридин-3-ил)-2-метилбензоата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метилбензоата (2 г, 4,27 ммоль) и (6-гидроксипиридин-3-ил)бороновой кислоты (1,06 г, 7,69 ммоль) в смеси диоксан/вода (16:4 мл) при перемешивании добавляли Na2CO3 (1,63 г, 15,38 ммоль) и раствор продували аргоном в течение 15 мин. Затем добавляли Pd(PPh3)4 (0,25 г, 0,21 ммоль) и аргон продували снова в течение 10 мин. Реакционную массу грели при 100°С в течение 3 ч. Затем реакционную смесь разбавляли водой, и смесь экстрагировали 10% раствором МеОН/ДХМ. Объединенные органические слои сушили над Na2SO4, растворитель удаляли при пониженном давлении, и полученный неочищенный материал очищали при помощи колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (0,9 г, выход 43,6%).
Стадия 2: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-3-ил)-2-метилбензоата
К раствору метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-гидроксипиридин-3-ил)-2-метилбензоата (0,9 г, 1,86 ммоль) и (2-бромэтокси)(трет-бутил)диметилсилана (1,33 г, 5,59 ммоль) в ДМФА (10 мл) при перемешивании добавляли трет-бутоксид калия (0,25 г, 2,23 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Затем добавляли воду и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,7 г, выход 63,6%).
Стадия 3: синтез трет-бутил-((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-(2-гидроксиэтокси)пиридин-3-ил)-2-метилфенил)(этил)амино)циклогексил)карбамата
Согласно протоколу, описанному для стадии 3 способа получения соединения 2, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-(2-((трет-бутилдиметилсилил)окси)этокси)пиридин-3-ил)-2-метилбензоата (0,7 г, 1,09 ммоль) и 3-(амино метил)-4,6-диметилпиридин-2(1Н)-она (0,24 г, 1,59 ммоль) получали указанное в заголовке соединение (0,4 г, выход 56,2%).
Стадия 4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(((транс)-4-(диметиламино)циклогексил) (этил)амино)-5-(6-(2-гидроксиэтокси)пиридин-3-ил)-2-метилбензамида
Согласно протоколу, описанному для стадии 3 способа получения соединения 3, с применением трет-бутил-((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-(2-гидроксиэтокси)пиридин-3-ил)-2-метилфенил)(этил)амино)циклогексил)карбамата (0,4 г, 0,62 ммоль) получали указанное в заголовке соединение (0,11 г, выход 42,0%).
ЖХМС: 576,60 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,46 (ушир, 1Н), 9,51 (ушир, 1Н), 8,16 (s, 1H), 7,97 (s, 1H), 7,80 (d, 1H, J=8,8 Гц), 7,32 (s, 1H), 7,16 (s, 1H), 6,48 (d, 1H, J=9,6 Гц), 5,87 (s, 1H), 4,28 (d, 2H, J=5,2 Гц), 4,05-4,02 (m, 2H), 3,67-3,64 (m, 2H), 3,12 (m, 3Н), 2,75 (m, 1H), 2,69-2,68 (m, 6H), 2,21 (s, 3H+3H), 2,11 (s, 3Н), 1,96-1,91 (m, 4H), 1,43 (m, 4H), 0,83 (t, 3Н, J=6,8 Гц).
Соединение 5:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилбензоата
К раствору метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-гидроксипиридин-3-ил)-2-метилбензоата (0,3 г, 0,62 ммоль) и 1-бром-2-метоксиэтана (0,259 г, 1,86 ммоль) в ДМФА (3 мл) при перемешивании добавляли KOtBu (0,083 г, 0,75 ммоль) и полученную реакционную смесь перемешивали при 22°С в течение 2 ч. Затем добавляли воду и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над безводным Na2SO4 и концентрировали в вакууме. Неочищенное соединение очищали при помощи колоночной хроматографии с применением щелочного оксида алюминия с получением указанного в заголовке соединения (0,3 г, выход 89,3%).
Стадия 2: синтез трет-бутил-((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилфенил)(этил)амино)циклогексил)карбамата
Согласно протоколу, описанному для стадии 3 способа получения соединения 2, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилбензоата (0,3 г, 0,55 ммоль) и 3-(аминометил)-4,6-диметилпиридин-2(1Н)-она (0,14 г, 0,95 ммоль) получали указанное в заголовке соединение (0,2 г, выход 54,7%).
Стадия 3: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилбензамида
Согласно протоколу, описанному для стадии 3 способа получения соединения 3, с применением трет-бутил-((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-(2-метоксиэтокси)пиридин-3-ил)-2-метилфенил)(этил)амино)циклогексил)карбамата получали указанное в заголовке соединение (0,1 г, выход 59,9%).
ЖХМС: 590,65 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,48 (ушир, 1Н), 9,56 (ушир, 1Н), 8,17 (m, 1H), 7,99 (s, 1H), 7,80 (d, 1H, J=9,6 Гц), 7,34 (m, 1H), 7,18 (m, 1H), 6,48 (d, 1H, J=9,6 Гц), 5,87 (s, 1H), 4,28 (d, 2H, J=4,8 Гц), 4,16-4,14 (m, 2H), 3,62-3,60 (m, 2H), 3,24 (s, 3H), 3,13 (m, 4H), 2,69-2,68 (m, 6H), 2,21 (s, 6H+3H), 2,05-1,92 (m, 4H), 1,44 (m, 4H), 0,83 (t, 3H, J=6,8 Гц).
Соединение 6;
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-(2-метоксиэтокси)этокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
Стадия 1-3: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-4'-(2-(2-метоксиэтокси)этокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
Согласно протоколу, описанному для стадий 2-4 способа получения соединения 2, с применением метил-5-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-4'-гидрокси-4-метил-[1,1'-бифенил]-3-карбоксилата и 1-бром-2-(2-метоксиэтокси)этана.
ЖХМС: 633,65 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,46 (ушир, 1Н), 8,17 (ушир, 1Н), 7,53 (d, 2H, J=8,0 Гц), 7,31 (s, 1Н), 7,14 (s, 1Н), 7,01 (d, 2H, J=8,0 Гц), 5,86 (s, 1Н), 4,28 (d, 2H, J=3,6 Гц), 4,12 (s, 2H), 3,75 (s, 2H), 3,59 (d, 2H, J=4,8 Гц), 3,46 (t, 2H, J=4,0 Гц), 3,25 (s, 3Н), 3,16-2,98 (m, 2H), 2,72-2,60 (m, 2H), 2,20 (s, 3Н), 2,15-2,01 (ушир, 12Н), 1,89-1,68 (m, 5H), 1,48-1,26 (m, 2H), 1,26-1,04 (m, 2H), 0,82 (t, 3Н, J=6,0 Гц).
Соединение 6b
Синтез 5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-N-((4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
Стадия 1: синтез 2-амино-6-метил-4-оксо-4Н-пиран-3-карбонитрила
К раствору NaH (60% 19,03 г, 476 ммоль) в ТГФ (400 мл) при перемешивании при -10°С по каплям добавляли малононитрил (31,4 г, 476 ммоль) и смесь перемешивали при той же температуре в течение 20 мин. Затем при -10°С в течение 15 мин добавляли 4-метиленоксетан-2-он (40 г, 476 ммоль) и реакционную смесь перемешивали при той же температуре в течение 1 ч. Затем реакционную смесь нейтрализовывали разбавленным раствором HCl (вод.) и концентрировали досуха с получением указанного в заголовке соединения (50 г, выход 70%).
Стадия 2: синтез 4-гидрокси-6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила
Суспензию 2-амино-6-метил-4-оксо-4Н-пиран-3-карбонитрила (50 г, 333 ммоль) в 10% растворе HCl (600 мл) грели при температуре обратной конденсации в течение 4 ч. Осадок собирали при помощи фильтрования и промывали водой, а затем перекристаллизовывали из МеОН с получением указанного в заголовке соединения (45 г, выход 90%).
Стадия 3: синтез 4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила
К раствору 4-гидрокси-6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила (2 г, 13,24 ммоль) в ДМФА (10 мл) при 0°С при перемешивании добавляли KOtBu (1,48 г, 13,2 ммоль) и метилйодид (1,88 г, 13,2 ммоль). Полученную реакционную массу перемешивали при комнатной температуре в течение 12 ч. Затем реакционную смесь концентрировали досуха. Остаток разбавляли 20% раствором МеОН/ДХМ и фильтровали, фильтрат тщательно промывали 20% раствором МеОН/ДХМ. Фильтрат концентрировали при пониженном давлении с получением неочищенного материала, который очищали при помощи колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (1 г, выход 46,1%).
Стадия 4: синтез 3-(аминометил)-4-метокси-6-метилпиридин-2(1Н)-она
К раствору 4-гидрокси-6-метил-2-оксо-1,2-дигидропиридин-3-карбонитрила (0,3 г, 1,82 ммоль) в метаноле (5 мл) добавляли каталитическое количество никеля Ренея и раствор аммиака (1 мл). Реакционную массу перемешивали при комнатной температуре при повышенном давлении водорода (баллон) в течение 3 ч. После завершения реакции реакционную массу фильтровали через целит и промывали метанолом, фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,3 г, 97,7%).
Стадия 5: синтез трет-бутил-((транс)-4-(этил(5-(((4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-ил)амино)циклогексил)карбамата
Согласно протоколу, описанному для части 2 стадии 3 способа получения соединения 2, с применением 3-(аминометил)-4-метокси-6-метилпиридин-2(1Н)-она (0,3 г, 0,88 ммоль) и 3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)амино)-5-(2-метоксиэтокси)-2-метилбензойной кислоты (0,3 г, 1,77 ммоль) получали указанное в заголовке соединение (0,07 г, выход 16,1%).
Стадия 6: синтез 5-(((транс)-4-(диметиламино)циклогексил)(этил)амино)-N-((4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-карбоксамида
Согласно протоколу, описанному для стадии 4 способа получения соединения 2, с применением трет-бутил-((транс)-4-(этил(5-(((4-метокси-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4'-(2-метоксиэтокси)-4-метил-[1,1'-бифенил]-3-ил)амино)циклогексил)карбамата (0,07 г, 0,14 ммоль) получали указанное в заголовке соединение (0,02 г, выход 24%).
ЖХМС: 605,5 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,43 (ушир, 1Н), 8,22 (s, 2H), 7,97 (t, 1Н, J=2,0 Гц), 7,53 (d, 2H, J=8 Гц), 7,30 (s, 1Н), 7,13 (s, 1Н), 7,00 (d, 2H, J=8,0 Гц), 6,09 (s, 1Н), 4,23 (d, 2H, J=4,0 Гц), 4,12 (t, 2H, 4,0 Гц), 3,80 (s, 3H), 3,67 (t, 2H, J=4,0 Гц), 3,32 (s, 3H), 3,09 (q, 2H, J=6,8 Гц), 2,19 (t, 12H, J=8,0 Гц), 1,81 (t, 4H, J=12,8 Гц), 1,38 (q, 2H, J=12,0 Гц), 1,17 (q, 2H, J=12,0 Гц), 0,83 (t, 3H, J=6,8 Гц). Сигналы 1Н совпадали с пиком растворителя.
Стадия 1: синтез метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)-(метил)амино)циклогексил)(этил)амино)-2-метилбензоата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метилбензоата (3 г, 6,41 ммоль, см., например, WO 2012142504) в ТГФ (30 мл) при перемешивании при 0°С добавляли NaH (0,184 г, 7,69 ммоль) и смесь перемешивали при той же температуре в течение 20 мин. Затем при 0°С добавляли метилйодид (9,10 г, 64,10 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Затем реакцию гасили ледяной водой, и смесь экстрагировали дихлорметаном. Объединенные органические слои промывали водой, сушили, концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии с получением неочищенного указанного в заголовке соединения, которое применяли без дополнительной очистки (3 г, выход 97,4%).
Стадия 2: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-(3-гидроксипроп-1-ин-1-ил)-2-метилбензоата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата (2 г, 4,14 ммоль) в сухом толуоле при перемешивании добавляли CuI (0,015 г, 0,079 ммоль), PPh3 (0,043 г, 0,165 ммоль), PdCl2(PPh3)2 (0,058 г, 0,082 ммоль) и N,N-диизопропиламин (1,08 г, 10,78 ммоль) и реакционную смесь продували аргоном в течение 15 мин. К реакционной смеси добавляли проп-2-ин-1-ол (0,46 г, 8,29 ммоль), и реакционную смесь грели при 80°С в герметичном состоянии в течение 5 ч. Затем реакцию гасили водой, и смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4. Неочищенное соединение очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (1,2 г, выход 63,2%).
Стадия 3: синтез метил-5-(3-бромпроп-1-ин-1-ил)-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата
К раствору метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-(3-гидроксипроп-1-ин-1-ил)-2-метилбензоата (1,2 г, 2,62 ммоль) в ДХМ (15 мл) при перемешивании при 0°С добавляли PPh3 (1,37 г, 5,22 ммоль) и CBr4 (1,7 г, 5,10 ммоль) и реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Затем реакцию гасили ледяной водой, и смесь экстрагировали дихлорметаном. Объединенные органические слои промывали водой, сушили и концентрировали при пониженном давлении. Неочищенный материал очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,5 г, выход 38,5%).
Стадия 4: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензоата
К раствору метил-5-(3-бромпроп-1-ин-1-ил)-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата (1 экв.) в ДМФА при перемешивании добавляли морфолин (5 экв.) и реакционную смесь перемешивали в течение 12 ч при комнатной температуре. Затем реакцию гасили ледяной водой, и смесь экстрагировали дихлорметаном. Объединенные органические слои промывали водой, сушили и концентрировали при пониженном давлении с получением целевого неочищенного указанного в заголовке соединения, которое применяли на следующей стадии без дополнительной очистки (выход 98,7%).
Стадия 5: синтез трет-бутил-((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)фенил)(этил)амино)циклогексил)(метил)карбамата
NaOH (1,5 экв.) добавляли к раствору метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензоата (1 экв.) в EtOH:H2O (9:1) и смесь перемешивали при 60°С в течение 1 ч. После завершения реакции этанол удаляли при пониженном давлении, и смесь подкисляли разбавленным раствором HCl до рН 6, и рН доводили до 4 с применением лимонной кислоты. Экстрагирование проводили с применением 10% смеси метанола в ДХМ. Объединенные органические слои концентрировали досуха с получением соответствующей кислоты.
Затем вышеописанную кислоту (1 экв.) расстворяли в ДМСО и к реакционной смеси добавляли 3-(аминометил)-4,6-диметилпиридин-2(1Н)-он (2 экв.) и триэтиламин (1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин перед добавлением к реакционной смеси PyBop (1,5 экв.) и перемешивание продолжали в течение ночи при комнатной температуре. После завершения реакции реакционную массу опускали в лед и проводили экстрагирование с применением 10% раствора МеОН/ДХМ. Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении с получением неочищенного материала, который затем очищали при помощи промывки водой, а затем ацетонитрилом с получением целевого указанного в заголовке соединения (выход 69,4%).
Стадия 6: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамида
К раствору трет-бутил((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)фенил)(этил)амино)циклогексил)(метил)карбамата (1 экв.) в ДХМ при 0°С при перемешивании добавляли ТФУ (3 экв.) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали досуха. Затем остаток подщелачивали Na2CO3 (вод.) до рН 8, и водный слой экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения (выход 99%), которое применяли на следующей стадии реакции без дополнительной очистки.
Стадия 7: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамида
К раствору N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамида (1 экв.) в дихлорэтане при 0°С при перемешивании добавляли 2-метоксиацетальдегид (10 экв.) и уксусную кислоту (6 экв.) и смесь перемешивали в течение 20 мин. Затем добавляли NaBH(OAc)3 (3 экв.) и смесь перемешивали в течение 2 ч при 0°С. После завершения реакции добавляли воду, и смесь экстрагировали 20% раствором метанола в ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении. Неочищенное соединение очищали при помощи преп. ВЭЖХ с получением целевой молекулы (0,1 г, выход 33,6%).
ЖХМС: 606,65 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,50 (ушир, 1Н), 9,22 (ушир, 1Н), 8,18 (t, 1H), 7,24 (s, 1H), 7,09 (s, 1H), 5,86 (s, 1H), 4,26-4,25 (m, 4H), 3,66-3,59 (m, 4H), 3,48-3,36 (m, 3H), 3,29-3,17 (m, 7H), 3,04-3,01 (m, 3H), 2,69-2,68 (m, 4H), 2,20 (s, 3H), 2,19 (s, 3H), 2,11 (s, 3H), 2,00-1,92 (m, 2H), 1,82-1,73 (m, 3H), 1,46 (m, 4H), 0,78 (t, 3H, J=6,4 Гц).
Альтернативная схема синтеза соединения 2:
Стадия А: синтез 4-(проп-2-ин-1-ил)морфолина
К раствору пропаргилбромида (50 г, 420 ммоль) в ацетоне (300 мл) при 0°С при перемешивании добавляли Cs2CO3 (136,5 г, 420 ммоль). Затем по каплям добавляли морфолин (36,60 г, 420 ммоль) в ацетоне (200 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную массу фильтровали, и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (50 г, неочищенного). Выделенное соединение применяли непосредственно на последующей стадии сочетания без дополнительной очистки.
Стадия 1: синтез метил-5-бром-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метилбензоата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата (30 г, 62,24 ммоль) в метаноле (100 мл) при 0°С при перемешивании добавляли метанольный раствор HCl (500 мл) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Затем реакционную смесь концентрировали досуха. Остаток подщелачивали Na2CO3 (вод.) до рН 8, и водный слой экстрагировали 10% раствором метанола в ДХМ (200 мл × 3). Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (25 г, неочищенной). Выделенное соединение применяли на следующей стадии без дополнительной очистки.
Стадия 2: синтез метил-5-бром-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензоата
К раствору неочищенного метил-5-бром-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метилбензоата (25 г, 65,44 ммоль) при перемешивании добавляли 1-бром-2-метоксиэтан (18,19 г, 130,8 ммоль) в ацетонитриле (250 мл), K2CO3 (18,06 г, 130,8 ммоль) и KI (6,51 г, 39,21 ммоль). Полученную реакционную массу перемешивали при 65°С в течение 16 ч. Затем реакционную смесь разбавляли водой (300 мл) и экстрагировали ДХМ (500 мл × 3). Объединенные органические слои промывали водой, сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (20 г, выход 69,3%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ 7,55 (s, 1H), 7,45 (s, 1H), 3,82 (s, 3Н), 3,32 (m, 4H), 3,20 (s, 3H), 3,05 (q, 2H), 2,61 (m, 1H), 2,32 (s, 3Н), 2,30 (m, 1H), 2,15 (s, 3H), 1,77-1,67 (m, 4H), 1,37-1,31(m, 2H), 1,24-1,18 (m, 2H), 0,78 (t, 3Н, J=6,8 Гц).
Стадия 3: синтез метил-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензоата
Раствор метил-5-бром-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензоата (30 г, 68,02 ммоль), 4-(проп-2-ин-1-ил)морфолина (25,51 г, 204 ммоль) и триэтиламина (20,61 г, 204 ммоль) в ДМФА (300 мл) продували аргоном в течение 20 мин. Затем добавляли CuI (3,87 г, 20,36 ммоль) и Pd (PPh3)4 (7,85 г, 6,79 ммоль), и аргон продували в течение дополнительных 20 мин. Реакционную смесь грели при 105°С в течение 4 ч, а затем охлаждали до комнатной температуры. Реакцию гасили водой (100 мл), и водную фазу экстрагировали 10% раствором МеОН/ДХМ (400 мл × 3). Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле с получением указанного в заголовке соединения (21 г, выход 63,7%).
1H-ЯМР (ДМСО-d6, 400 МГц) δ 7,46 (s, 1Н), 7,32 (s, 1H), 3,82 (s, 3H), 3,62-3,57 (m, 6H), 3,50 (s, 2H), 3,35-3,32 (m, 2H), 3,21 (s, 3H), 3,17 (m, 1H), 3,05 (q, 2H), 2,61-2,58 (m, 2H), 2,38 (s, 3H), 2,33 (m, 1H), 2,18 (m, 2H), 1,77-1,70 (m, 4H), 1,36-1,20 (m, 4H), 0,77 (t, 3H, J=6,8 Гц), сигналы 3H совпадали с пиком растворителя.
Стадия 4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензамида
Водный раствор NaOH (2,59 г, 64,91 ммоль в 10 мл H2O) добавляли к раствору метил-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопроп-1-ин-1-ил)бензоата (21 г, 43,29 ммоль) в EtOH (100 мл) и смесь перемешивали при 60°С в течение 1 ч. После завершения реакции этанол удаляли при пониженном давлении, и остаток подкисляли с применением разбавленного раствора HCl, и значение рН доводили до 4 с применением лимонной кислоты. Проводили экстрагирование с применением 10% раствора МеОН/ДХМ (200 мл × 3). Объединенные органические слои концентрировали досуха с получением соответствующей кислоты (15,5 г, выход 76%).
К раствору вышеописанной кислоты (15,5 г, 32,90 ммоль) в ДМСО (50 мл) добавляли 3-(аминометил)-4,6-диметилпиридин-2(1H)-он (10 г, 65,80 ммоль) и триэтиламин (23 мл, 164,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 мин перед добавлением к реакционной смеси PyBop (25,66 г, 49,34 ммоль) при 0°С и перемешивание продолжали в течение ночи при комнатной температуре. Затем реакционную массу погружали в ледяную воду (100 мл) и проводили экстрагирование с применением 10% раствора МеОН/ДХМ (200 мл × 3). Объединенные органические слои сушили над Na2SO4 и концентрировали при пониженном давлении. Неочищенное соединение очищали при помощи колоночной хроматографии с применением щелочного оксида алюминия с элюированием раствором МеОН:ДХМ с получением указанного в заголовке соединения (11 г, выход 55,3%).
ЖХМС: 606,50 (М+1)+; 1H-ЯМР (MeOD, 400 МГц) δ 7,23 (s, 1H), 7,09 (s, 1H), 6,11 (s, 1H), 4,46 (s, 2H), 3,74-3,72 (m, 4H), 3,51 (s, 2H), 3,47 (t, 2H, J=5,6 Гц,), 3,32 (s, 3Н), 3,07 (q, 2H, J=7,2 Гц), 2,64-2,63 (m, 7H), 2,38 (m, 1H), 2,37 (s, 3Н), 2,27 (s, 3Н), 2,26 (s, 3Н), 2,25 (s, 3Н), 1,89-1,86 (m, 4H), 1,50-1,30 (m, 4H), 0,83 (t, 3Н, J=7,2 Гц).
Соединение 7
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензоата
Согласно протоколу, описанному для стадии 4 способа получения соединения 8, с применением метил-5-(3-бромпроп-1-ин-1-ил)-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата и N-метилпиперидина (5 экв.) получали указанное в заголовке соединение (выход 99%).
Стадия 2: синтез трет-бутил((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)фенил)(этил)амино)циклогексил)(метил)карбамата
Согласно протоколу, описанному для стадии 5 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензоата и 3-(аминометил)-4,6-диметилпиридин-2(1Н)-она (2 экв.) получали указанное в заголовке соединение (выход 73,4%).
Стадия 3: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензамида
Согласно протоколу, описанному для стадии 6 способа получения соединения 8, с применением трет-бутил((транс)-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)фенил)(этил)амино)циклогексил)(метил)карбамата получали указанное в заголовке соединение (выход 89,7%).
Стадия 4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензамида
Согласно протоколу, описанному для стадии 7 способа получения соединения 8, с применением N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метил-5-(3-(4-метилпиперазин-1-ил)проп-1-ин-1-ил)бензамида получали указанное в заголовке соединение (0,07 г, выход 18,1%).
ЖХМС: 619,65 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,50 (ушир, 1Н), 9,28 (ушир, 1Н), 8,17 (t, 1H), 7,17 (s, 1H), 7,01 (s, 1H), 5,87 (s, 1H), 4,25 (d, 2H, J=4,8 Гц), 3,66 (m, 2H), 3,62 (m, 2H), 3,44-3,36 (m, 3Н), 3,31 (s, 3H), 3,17-3,02 (m, 8H), 2,79 (s, 3H), 2,69-2,68 (m, 4H), 2,61 (m, 2H), 2,19 (s, 6H), 2,11 (s, 3H), 1,96-1,92 (m, 2H), 1,83 (m, 2H), 1,46 (m, 4H), 0,78 (t, 3H, J=6,4 Гц).
Соединение 8
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-(3-гидрокси-3-метилбут-1-ин-1-ил)-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-(3-гидрокси-3-метилбут-1-ин-1-ил)-2-метилбензоата
К раствору метил-5-бром-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата (1 г, 2,07 ммоль) в ДМФА (10 мл) при перемешивании добавляли CuI (0,118 г, 0,62 ммоль), Ра(PPh3)4 (0,239 г, 0,21 ммоль), триэтиламин (0,84 мл, 6,2 ммоль) и реакционную смесь продували аргоном в течение 15 мин. Добавляли 2-метилбут-3-ин-2-ол (0,523 г, 6,22 ммоль) и реакционную смесь грели при 100°С в герметичной пробирке в течение 6 ч. Затем реакцию гасили водой, и смесь экстрагировали этилацетатом. Объединенные органические слои сушили над Na2SO4. Неочищенное соединение очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (0,8 г, выход 80%).
Стадии 2-4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-(3-гидрокси-3-метилбут-1-ин-1-ил)-2-метилбензамида
Согласно протоколу, описанному для стадий 5-7 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-(3-гидрокси-3-метилбут-1-ин-1-ил)-2-метилбензоата (0,8 г, 1,64 ммоль) получали указанное в заголовке соединение (0,11 г, выход 17,5%).
ЖХМС: 565,90 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,45 (ушир, 1Н), 9,14 (ушир, 1Н), 8,17 (t, 1H, J=4,4 Гц), 7,11 (s, 1Н), 6,94 (s, 1Н), 5,86 (s, 1Н), 5,08-5,05 (m, 1Н), 4,96-4,93 (m, 1Н), 4,25 (d, 2H, J=5,2 Гц), 3,81-3,77 (m, 3Н), 3,45-3,22 (m, 6H), 3,03-3,01 (m, 3Н), 2,68-2,67 (m, 4H), 2,19 (s, 3Н+3Н), 2,11 (s, 3Н), 2,02-1,91 (m, 2H), 1,84 (m, 2H), 1,44 (s, 6H), 0,77 (t, 3Н, J=6,8 Гц). Сигналы 1Н совпадали с пиком растворителя.
Соединение 9
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-фтор-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-фтор-2-метилбензоата
Согласно протоколу, описанному для стадии 1 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-фтор-2-метилбензоата (1 г, 2,45 ммоль, см., например, предварительную совместную заявку на патент США №61/714145, поданную 15 октября 2012 (Attorney Docket No. 41478-514P02US)) в ДМФА в качестве растворителя (10 мл) получали указанное в заголовке соединение (0,95 г, выход 95%).
Стадии 2-4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-фтор-2-метилбензамида
Согласно протоколам, описанным для стадий 5-7 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-фтор-2-метилбензоата (0,95 г, 2,25 ммоль) получали указанное в заголовке соединение (0,05 г, выход 4,6%).
ЖХМС: 501,40 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,47 (ушир, 1Н), 9,25 (s, 1Н), 8,17 (t, 1H), 7,02 (d, 1H, J=10,8 Гц), 6,76 (d, 1H, J=6,8 Гц), 5,86 (s, 1H), 4,25 (d, 2H, J=5,2 Гц), 3,62 (m, 2H), 3,37 (s, 3H), 3,29-3,25 (m, 3H), 3,03-3,01 (m, 2H), 2,69-2,68 (m, 4H), 2,19 (s, 3H), 2,14 (s, 3H), 2,11 (s, 3H), 1,97-1,92 (m, 2H), 1,83 (m, 2H), 1,49-1,44 (m, 4H), 0,79 (t, 3H, J=6,8 Гц).
Соединение 10:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)амино)-2-метилбензоата
К раствору метил-3-амино-2-метилбензоата (4,1 г, 24,82 ммоль) и трет-бутил-(4-оксоциклогексил)карбамата (6,35 г, 29,80 ммоль) в дихлорэтане (40 мл) при перемешивании добавляли уксусную кислоту (8,94 г, 149 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 минут. Затем при 0°С добавляли триацетоксиборгидрид натрия (15,8 г, 74,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакцию гасили Na2CO3 (вод.), органическую фазу отделяли, и водную фазу экстрагировали ДХМ. Объединенные органические слои промывали водой, сушили и концентрировали при пониженном давлении. Полученный неочищенный материал очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (3,1 г, выход 34,8%).
Стадия 2: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-2-метилбензоата
К раствору метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)амино)-2-метилбензоата (2,9 г, 8,01 ммоль) и ацетальдегида (0,53 г, 12,01 ммоль) в дихлорэтане (30 мл) при перемешивании добавляли уксусную кислоту (2,88 г, 48,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 20 мин. Затем при 0°С добавляли триацетоксиборгидрид натрия (5,1 г, 24,05 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакцию гасили Na2CO3 (вод.), органическую фазу отделяли, и водную фазу экстрагировали ДХМ. Объединенные органические слои промывали водой, сушили и концентрировали при пониженном давлении и неочищенный материал очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (2,8 г, выход 61%).
Стадии 3-6: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензамида
Согласно протоколу, описанному для стадий 1-4 способа получения соединения 11, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метилбензоата (1,2 г, 3,08 ммоль) получали указанное в заголовке соединение (0,1 г, выход 4,3%).
ЖХМС: 483,40 (M+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,45 (ушир, 1Н), 9,30 (ушир, 1Н), 8,04 (s, 1H), 7,18 (m, 2H), 6,98 (m, 1Н), 5,86 (s, 1Н), 4,27 (m, 2H), 3,62 (m, 2H), 3,46-3,30 (m, 6H), 3,17-3,09 (m, 2H), 2,69 (m, 4H), 2,21 (s, 3Н), 2,20 (s, 3Н), 2,11 (s, 3Н), 1,98-1,87 (m, 4H), 1,45 (m, 4H), 0,79 (t, 3Н).
Соединение 11:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-метокси-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-метокси-2-метилбензоата
Согласно протоколу, описанному для стадии 1 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-метокси-2-метилбензоата (см., например, WO 2012/142513 (Attorney Docket No. 41478-508001WO)).
Стадии 2-4: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-метокси-2-метилбензамида
Согласно протоколу, описанному для стадий 5-7 способа получения соединения 8, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)(метил)амино)циклогексил)(этил)амино)-5-метокси-2-метилбензоата.
ЖХМС: 513,55 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,49 (ушир, 1Н), 9,27 (s, 1Н), 8,07 (s, 1H), 6,74 (ушир, 1Н), 6,58 (s, 1Н), 5,87 (s, 1Н), 4,26 (d, 2H, J=4,0 Гц), 3,72 (s, 3Н), 3,62 (ушир, 2H), 3,50-2,90 (m, 9H), 2,68 (d, 3H, J=3,6 Гц), 2,20 (s, 3Н), 2,11 (s, 6H), 2,04-1,87 (m, 4H), 1,56-1,38 (m, 4H), 0,80 (ушир t, 3Н, J=6,4 Гц).
Соединение 12:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-(2-метоксиэтокси)-2-метилбензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(2-метоксиэтокси)-2-метилбензоата
Согласно протоколу, описанному для стадий 1-2 способа получения соединения 10, с применением метил-3-амино-5-(2-метоксиэтокси)-2-метилбензоата.
Стадии 2-5: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-5-(2-метоксиэтокси)-2-метилбензамида
Согласно протоколу, описанному для стадий 1-4 способа получения соединения 11, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-5-(2-метоксиэтокси)-2-метилбензоата.
ЖХМС: 557,60 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,47 (ушир, 1Н), 9,19 (s, 1Н), 8,05 (s, 1H), 6,73 (s, 1H), 6,56 (s, 1H), 5,86 (s, 1H), 4,25 (d, 2H, J=3,6 Гц), 4,05 (ушир, 2Н), 3,63 (ушир, 4Н), 3,30 (d, 3Н, J=6,4 Гц), 3,25-2,93 (m, 3H), 2,68 (d, 4Н, J=3,6 Гц), 2,19 (s, 3Н), 2,11 (s, 6H), 2,03-1,69 (m, 4Н), 1,53-1,38 (m, 4Н), 0,80 (ушир t, 3Н, J=6,4 Гц). Сигналы 3Н совпадали с пиком растворителя.
Соединение 13:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(2-морфолиноэтокси)бензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метил-5-(2-морфолиноэтокси)бензоата
Согласно протоколу, описанному для стадий 1-2 способа получения соединения 10, с применением метил-3-амино-2-метил-5-(2-морфолиноэтокси)бензоата.
Стадии 2-5: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(2-морфолиноэтокси)бензамида
Согласно протоколу, описанному для стадий 1-4 способа получения соединения 11, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метил-5-(2-морфолиноэтокси)бензоата.
ЖХМС: 612,55 (M+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,45 (ушир, 1Н), 9,09 (s, 1H), 8,48 (s, 1H), 8,01 (s, 1H), 6,77 (s, 1H), 6,67 (s, 1H), 5,87 (s, 1H), 4,44 (ушир, 2Н), 4,27 (d, 2Н, J=3,2 Гц), 4,00-3,89 (m, 6H), 3,64-3,47 (m, 6H), 3,38 (q, 2Н, J=6,4 Гц), 3,42-3,23 (m, 6H), 3,14-3,00 (m, 4H), 2,98-2,79 (m, 2Н), 2,21 (s, 3H), 2,11 (s, 3H), 1,99 (ушир, 1H), 1,90-1,78 (m, 2Н), 1,70-1,59 (m, 2Н), 1,53-1,37 (m, 3H), 0,81 (ушир t, 3H, J=6,4 Гц).
Соединение 14:
Синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопропокси)бензамида
Стадия 1: синтез метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метил-5-(3-морфолинопропокси)бензоата
Согласно протоколу, описанному для стадий 1-2 способа получения соединения 10, с применением метил-3-амино-2-метил-5-(3-морфолинопропокси)бензоата.
Стадии 2-5: синтез N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метил-5-(3-морфолинопропокси)бензамида
Согласно протоколу, описанному для стадий 1-4 способа получения соединения 11, с применением метил-3-(((транс)-4-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метил-5-(3-морфолинопропокси)бензоата.
ЖХМС: 626,75 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,45 (ушир, 1Н), 8,48 (s, 2H), 8,03 (s, 1H), 6,72 (s, 1H), 6,59 (s, 1H), 5,87 (s, 1H), 4,26 (d, 2H, J=3,2 Гц), 4,03 (m, 2H), 3,93 (m, 5H), 3,65-3,57 (m, 2H), 3,55 (t, 2H, J=4,4 Гц), 3,46 (m, 4H), 3,17 (s, 3Н), 3,13-3,05 (m, 3H), 3,05-2,91 (m, 3H), 2,67-2,54 (m, 1H), 2,19 (s, 3H), 2,18-2,09 (m, 3H), 2,11 (s, 3Н), 2,09-1,98 (m, 4H), 1,88-1,76 (m, 2H), 1,41 (q, 2H, J=11,2 Гц), 1,35-1,20 (m, 2H), 0,79 (t, 3H, J=6,4 Гц).
Соединения 15-26:
Соединения 15-26 синтезировали из обычного промежуточного 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензамида в соответствии со стандартным вышеописанным протоколом сочетания Сузуки.
Стадия 1: синтез 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензамида
В соответствии с оригинальным протоколом стадии 7 способа получения соединения 157 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-(метиламино)циклогексил)амино)-2-метилбензамид (2,5 г, 4,98 ммоль) превращали в целевое соединение (1,6 г, выход 57,8%).
Стадия 2: общие условия сочетания Сузуки
К раствору 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил((транс)-4-((2-метоксиэтил)(метил)амино)циклогексил)амино)-2-метилбензамида (1 экв.) и бороновой кислоты/сложного эфира (1,2 экв.) в смеси диоксан/вода при перемешивании добавляли Na2CO3 (3,6 экв.), и раствор продували аргоном в течение 15 мин. Затем добавляли Pd(PPh3)4 (0,1 экв.) и аргон продували снова в течение 10 мин. Объединенную реакционную смесь грели при 100°С в течение 2 ч. Затем реакционную смесь разбавляли водой, и смесь экстрагировали 10% раствором МеОН/ДХМ. Объединенные органические слои сушили над Na2SO4, и растворитель удаляли при пониженном давлении с получением неочищенного материала, который очищали при помощи колоночной хроматографии/преп. ВЭЖХ с получением целевых соединений. Аналитические данные для соединений 15-26 представлены в таблице ниже.
Метил 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензоат
Указанное в заголовке соединение получали (0,940 г, выход 100%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензамида. 1H-ЯМР (400 МГц): δ м.д. 7,27 (dt, J=8,6, 2,6 Гц, 1Н), 6,98 (dt, J=9,7, 1,9 Гц, 1Н), 3,90 (d, J=2,2 Гц, 3Н), 3,54 (m, 1Н), 3,05 (q, J=7,0 Гц, 2Н), 3,06 (m, 1Н), 2,96 (m, 1Н), 2,42 (s, 3Н), 1,85 (td, J=12,7, 4,6 Гц, 1Н), 1,76 (d, J=1,8 Гц, 1Н), 1,68 (m, 1Н), 1,23 (q, J=12,2 Гц, 1Н), 1,20 (dd, J=6,8, 1,6 Гц, 3Н), 1,12 (dd, J=6,0, 1,8 Гц, 3Н), 0,86 (td, J=7,0, 1,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 323,3.
Трет-бутил-4-(этил(5-фтор-3-(метоксикарбонил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Метил-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензоат (0,938 г, 2,91 ммоль), Boc2O (1,69 мл, 7,27 ммоль) и ТЭА (2,43 мл, 17,46 ммоль) при КТ растворяли в ДХМ (18,7 мл, 291 ммоль) и реакционную смесь перемешивали в течение ночи. Данные МС свидетельствовали о завершении реакции. Реакционную смесь разбавляли этилацетатом и водой. Отделенный водный слой еще раз экстрагировали этилацетатом. Объединенную органическую фазу сушили над сульфатом магния, фильтровали и выпаривали. Остаток очищали при помощи хроматографии на силикагеле (1%-20% смесями EtOAc/гептан) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (1,17 г, выход 95%). 1H-ЯМР (400 МГц, CDCl3): δ м.д. 7,31 (dd, J=8,9, 2,7 Гц, 1Н), 6,99 (dd, J=10,0, 2,7 Гц, 1Н), 4,27 (m, 1H), 3,90 (s, 3Н), 3,65 (m, 1Н), 3,34 (m, 1Н), 3,00 (m, 2H), 2,45 (s, 3Н), 1,86 (m, 2H), 1,78 (m, 1Н), 1,48 (q, J=6,6 Гц, 1Н), 1,45 (s, 9H), 1,34 (d, J=6,7 Гц, 3Н), 1,18 (d, J=6,8, 3Н), 0,84 (t, J=7,0, 3Н); МС (ИЭР) [M+H]+ 424,4.
3-((1-(Трет-бутоксикарбонил)-2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензойная кислота
Указанное в заголовке соединение получали (1,18 г, выход 96%) при помощи способа, аналогичного способу получения 3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензойной кислоты. 1H-ЯМР (400 МГц): δ м.д. 7,48 (dd, J=8,9, 2,8 Гц, 1Н), 7,05 (dd, J=9,8, 2,6 Гц, 1Н), 4,28 (m, 1Н), 3,67 (m, 1Н), 3,36 (m, 1Н), 3,02 (m, 2H), 2,53 (s, 3Н), 1,89 (m, 2H), 1,80 (m, 1Н), 1,50 (q, J=6,9 Гц, 1Н), 1,47 (s, 9H), 1,36 (d, J=6,8 Гц, 3Н), 1,20 (d, J=6,8 Гц, 3Н), 0,84 (t, J=7,0, 3Н); МС (ИЭР) [М+Н]+ 410,4.
Трет-бутил-4-(этил(5-фтор-3-(((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (76,0 мг, выход 62%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (400 МГц): δ м.д. 7,06 (ушир t, J=6,0 Гц, 1Н), 6,84 (dd, J=10,5, 2,0 Гц, 1Н), 6,80 (d, J=7,2 Гц, 1Н), 4,55 (d, J=5,4 Гц, 2H), 4,29 (m, 1Н), 3,63 (q, J=6,4 Гц, 1Н), 3,54 (s, 3Н), 3,36 (m, 1Н), 3,00 (m, 2H), 2,43 (d, J=5,5 Гц, 3Н), 2,36 (d, J=3,2 Гц, 3Н), 2,25 (s, 3Н), 1,87 (m, 2H), 1,78 (m, 1Н), 1,49 (m, 1Н), 1,46 (s, 9H), 1,35 (d, J=2,8 Гц, 3Н), 1,19 (d, J=6,8 Гц, 3Н), 0,85 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 575,5.
Трет-бутил-4-(этил(5-фтор-2-метил-3-(((1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)фенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (56,0 мг, выход 47%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1Н-ЯМР (400 МГц): δ м.д. 7,12 (s, 1H), 6,85 (d, J=9,0, 2H), 6,00 (s, 1H), 4,54 (d, J=5,3 Гц, 2H), 4,31 (m, 1H), 3,63 (q, J=5,7 Гц, 1H), 3,54 (s, 3H), 3,42 (m, 1H), 3,07 (m, 2H), 2,39 (s, 3H), 2,35 (s, 3H), 2,30 (ушир, 3H), 1,87 (m, 2H), 1,81 (m, 1H), 1,49 (m, 1H), 1,46 (s, 9H), 1,36 (d, J=6,3 Гц, 3H), 1,20 (d, J=6,7 Гц, 3H), 0,89 (ушир, 3H); МС (ИЭР) [М+Н]+ 557,5.
Трет-бутил-4-((3-(((1,6-диметил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-фтор-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (150 мг, выход 95%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,01 (dd, J=10,6, 2,5 Гц, 1H), 6,82 (dd, J=8,3, 2,8 Гц, 1H), 6,50 (s, 1H), 4,56 (s, 2H), 4,20 (m, 1H), 3,70 (q, J=4,6 Гц, 1H), 3,61 (s, 3H), 3,48 (m, 1H), 3,04 (m, 2H), 2,50 (s, 3H), 2,25 (s, 3H), 1,89 (m, 3H), 1,52 (m, 1H), 1,44 (s, 9H), 1,33 (d, J=6,6 Гц, 3H), 1,20 (d, J=7,0 Гц, 3H), 1,17 (d, J=7,0 Гц, 3H), 0,84 (t, J=7,0 Гц, 3H); МС (ИЭР) [М+Н]+ 612,8.
Трет-бутил-4-(этил(5-фтор-3-(((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (50,0 мг, выход 41%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (400 МГц) δ м.д. 7,10 (t, J=6,0 Гц, 1Н), 6,82 (m, 2H), 6,08 (s, 1Н), 4,59 (m, 2H), 4,28 (m, 1Н), 3,63 (m, 1Н), 3,52 (m, 2H), 3,35 (m, 1Н), 2,99 (m, 2H), 2,29 (s, 3Н), 2,24 (s, 3Н), 1,85 (m, 2H), 1,74 (m, 1H), 1,48 (m, 1Н), 1,46 (s, 9H), 1,34 (d, J=6,71 Гц, 3Н), 1,22 (dd, J=6,83, 0,08 Гц, 6H), 1,18 (d, J=6,87 Гц, 3Н), 0,83 (t, J=7,00 Гц, 3Н); МС (ИЭР) [М+Н]+ 571,5.
Трет-бутил-4-(этил(5-фтор-2-метил-3-(((6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил)карбамоил)фенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (64,0 мг, выход 53%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (400 МГц) δ м.д. 7,19 (t, J=6,0 Гц 1Н) 6,81 (m, 2H) 5,97 (s, 1Н) 4,55 (m, 2H) 4,28 (m, 1H) 3,64 (m, 1H) 3,50 (m, 1H) 3,35 (m, 1H) 2,98 (m, 2H) 2,69 (m, 2H) 2,25 (s, 6H) 1,84 (m, 1H), 1,76 (m, 1H), 1,64 (m, 3H) 1,46 (m, 10H) 1,34 (d, J=6,68 Гц, 3Н) 1,18 (d, J=6,87 Гц, 3Н) 1,02 (t, J=7,34 Гц, 3Н) 0,84 (t, J=7,1 Гц 3Н); МС (ИЭР) [М+Н]+ 571,5.
Гидрохлорид 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида
Трет-бутил-4-(этил(5-фтор-3-(((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат (75,0 мг, 0,131 ммоль) растворяли в дихлорметане (1 мл), и при КТ добавляли 4 н. раствор HCl в 1,4-диоксане (1,63 мл, 6,53 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч. Затем реакционную смесь концентрировали и несколько раз перегоняли в виде азеотропа с МеОН с получением указанного в заголовке соединения в виде твердого вещества (67,0 мг, выход 100%). 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,80 (ушир, 1H), 8,27 (t, J=4,9 Гц, 1H), 7,10 (d, J=9,3 Гц, 1H), 6,80 (d, J=9,3 Гц, 1H), 4,33 (t, J=3,9 Гц, 2H), 3,72 (m, 2H), 3,43 (s, 3Н), 3,34 (m, 1H), 2,99 (m, 2H), 2,32 (d, J=3,5 Гц, 3Н), 2,24 (d, J=2,2 Гц, 3Н), 2,12 (s, 3Н), 1,83 (m, 2H), 1,70 (m, 1H), 1,45 (m, 1H), 1,27 (d, J=7,2 Гц, 3Н), 1,21 (d, J=6,2 Гц, 3Н), 0,79 (t, J=6,7 Гц, 3Н); МС (ИЭР) [М+Н]+ 475,3.
Дигидрохлорид 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метил-N-((1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)бензамида
Указанное в заголовке соединение получали (52,0 мг, выход 100%) при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. 1H-ЯМР (400 МГц, ДМСО-d6): δ м.д. 8,85 (ушир, 2Н), 8,16 (s, 1Н), 7,10 (d, J=11,1 Гц, 1Н), 6,79 (d, J=7,4 Гц, 1Н), 6,04 (s, 1Н), 4,30 (t, J=4,6 Гц, 2Н), 3,71 (m, 2Н), 3,41 (s, 3Н), 3,33 (m, 1Н), 2,99 (m, 2Н), 2,30 (s, 3H), 2,20 (s, 3H), 2,13 (s, 3H), 1,83 (m, 2Н), 1,70 (m, 1Н), 1,48 (m, 1Н), 1,27 (d, J=6,7 Гц, 3Н), 1,21 (d, J=6,1 Гц, 3Н), 0,79 (t, J=6,7 Гц, 3Н); МС (ИЭР) [М+Н]+ 457,4.
Дигидрохлорид 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида
Указанное в заголовке соединение получали (40,0 мг, выход 97%) при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,78 (ушир m, 2Н), 8,14 (m, 1Н), 7,05 (d, J=10,6 Гц, 1Н), 6,72 (d, J=9,6 Гц, 1Н), 5,97 (s, 1Н), 4,26 (m, 2Н), 3,65 (ушир m, 2Н), 3,27 (ушир m, 1H), 3,15 (ушир m, 2H), 2,95 (ушир m, 2H), 2,09 (s, 6H), 1,80 (m, 2H), 1,65 (m, 1H), 1,41 (m, 1H), 1,22 (d, J=7,0 Гц, 3Н), 1,17 (d, J=6,6 Гц, 3Н), 1,07 (d, J=6,8 Гц, 6H), 0,74 (t, J=6,67 Гц, 3Н); MC (ИЭР) [М+Н]+ 471,4.
3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метил-N-((6-метил-2-оксо-4-пропил-1,2-дигидропиридин-3-ил)метил)бензамид
Указанное в заголовке соединение получали (60,0 мг, выход 76%) при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида и очистки при помощи обращенно-фазовой ВЭЖХ. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 6,96 (dd, J=10,3, 2,3 Гц, 1H), 6,76 (dd, J=8,0, 1,6 Гц, 1H), 6,10 (s, 1H), 4,43 (s, 2H), 3,48 (m, 1H), 3,16 (m, 1H), 3,04 (m, 3Н), 2,64 (m, 2H), 2,22 (s, 3Н), 2,19 (s, 3Н), 1,81 (m, 1H), 1,73 (m, 2H), 1,61 (m, 2H), 1,24 (m, 1H), 1,19 (d, J=7,14 Гц, 3Н), 1,09 (d, J=6,1 Гц, 3Н), 0,99 (t, J=7,4 Гц, 3Н), 0,83 (t, J=7,00 Гц, 3Н); MC (ИЭР) [М+Н]+ 471,4.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-фтор-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (526 мг, выход 74%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида и очистки при помощи обращенно-фазовой ВЭЖХ. 1H-ЯМР (400 МГц): δ м.д. 7,12 (t, J=4,7 Гц, 1Н), 6,83 (dd, J=4,7, 2,4 Гц, 2Н), 5,98 (s, 1Н), 4,53 (d, J=5,9 Гц, 2Н), 4,28 (m, 1Н), 3,62 (m, 1Н), 3,37 (m, 1Н), 3,00 (m, 2Н), 2,41 (s, 3Н), 2,27 (s, 3Н), 2,25 (s, 3Н), 1,87 (m, 2Н), 1,78 (m, 1Н), 1,49 (q, J=6,7 Гц, 1Н), 1,46 (s, 9H), 1,34 (d, J=6,7 Гц, 3Н), 1,18 (d, J=7,2 Гц, 3Н), 0,84 (t, J=7,2, 3Н); MC (ИЭР) [М+Н]+ 543,5.
Дигидрохлорид N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензамида
Указанное в заголовке соединение получали (500 мг, выход 100%) при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Это дигидрохлоридная форма соединения, полученного ранее, см. N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-((2,6-транс-диметилпиперидин-4-ил](этил)амино)-5-фтор-2-метилбензамид.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-метил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамид
Указанное в заголовке соединение получали (83,0 мг, выход 87%) при помощи способа, аналогичного способу получения метил-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензоата. 1H-ЯМР (400 МГц): δ м.д. 7,13 (t, J=6,1 Гц, 1Н), 6,83 (dd, J=10,4, 2,8 Гц, 1Н), 6,77 (dd, J=8,0, 2,4 Гц, 1H), 5,95 (s, 1Н), 4,53 (d, J=6,2 Гц, 2Н), 3,50 (s, 1Н), 3,27 (ушир, 1Н), 3,08 (ушир, 1Н), 3,03 (q, J=6,8 Гц, 2Н), 2,40 (s, 3Н), 2,33 (ушир, 3Н), 2,24 (s, 3H), 2,23 (s, 3H), 1,72-1,62 (m, 3Н), 1,09 (ушир, 3Н), 1,00 (ушир, 3Н), 0,85 (t, J=7,2, 3H); MC (ИЭР) [М+Н]+ 457,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-этил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамид
К раствору дигидрохлорида N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-2-метилбензамида (150 мг, 0,291 ммоль) в МеОН (2 мл, 49,4 ммоль) и уксусной кислоте (0,017 мл, 0,291 ммоль) при 0°С при перемешивании добавляли ацетальдегид (0,164 мл, 2,91 ммоль) и триацетоксиборгидрид натрия (185 мг, 0,873 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Данные MC свидетельствовали о завершении реакции. Реакцию гасили насыщенным вод. раствором NaHCO3 до рН 8-9. Отделенную вод. фазу экстрагировали ДХМ. Объединенную орг. фазу концентрировали с получением 120 мг неочищенного материала. В результате очистки при помощи обращенно-фазовой ВЭЖХ/МС получали указанное в заголовке соединение (103 мг, выход 75%). 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,01 (dd, J=9,7, 2,9 Гц, 1Н), 6,81 (dd, J=8,5, 2,9 Гц, 1Н), 6,11 (s, 1Н), 4,46 (s, 2H), 3,53 (ушир, 2Н), 3,21 (m, 1Н), 3,07 (q, J=6,5, 2H), 2,37 (s, 3H), 2,24 (s, 3Н), 2,22 (s, 3Н), 1,86-1,77 (m, 4H), 1,45 (d, J=12,3 Гц, 2H), 1,14 (ушир, 6Н), 1,09 (ушир, 3Н), 0,86 (t, J=7,1, 3Н); MC (ИЭР) [М+Н]+ 471,4.
5-Бром-2-метил-3-нитробензойная кислота
К раствору 2-метил-3-нитробензойной кислоты (5,00 г, 27,6 ммоль) в H2SO4 (20 мл) при 0°С при перемешивании добавляли 1,3-дибром-5,5-диметилгидантоин (4,34 г, 15,20 ммоль). Реакционную смесь перемешивали при 0°С в течение 5 часов. Реакционную смесь погружали в ледяную воду, полученное осажденное твердое вещество собирали, промывали водой и сушили в вакууме с получением указанного в заголовке соединения в виде белого твердого вещества (7,28 г, количественный выход). 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д.; 8,31 (s, 1Н), 8,17 (s, 1Н), 2,43 (s, 3Н).
Метил-5-бром-2-метил-3-нитробензоат
К раствору 5-бром-2-метил-3-нитробензойной кислоты (7,28 г, 28,0 ммоль) в ДМФА (100 мл) при перемешивании добавляли карбонат натрия (11,9 г, 112 ммоль) и метилйодид (15,9 г, 112 ммоль). Реакционную смесь перемешивали при 60°С в течение 8 часов. После завершения реакции реакционную смесь фильтровали и промывали этилацетатом. Объединенный фильтрат промывали водой, и водную фазу повторно экстрагировали этилацетатом. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества (7,74 г, количественный выход). 1H-ЯМР (400 МГц, CDCl3) δ (м.д.) 8,17 (s, 1Н), 7,91 (s, 1H), 3,96 (s, 3Н), 2,59 (s, 3H).
Метил-3-амино-5-бром-2-метилбензоат
К раствору метил-5-бром-2-метил-3-нитробензоата (7,60 г, 27,7 ммоль) в вод. растворе EtOH (100 мл EtOH и 20 мл H2O) при перемешивании добавляли хлорид аммония (4,45 г, 83,1 ммоль) и железо (4,64 г, 83,1 ммоль). Реакционную смесь перемешивали при 80°С в течение 5 часов. Затем смесь фильтровали через целит, и слой целита промывали этилацетатом. Объединенный фильтрат концентрировали в вакууме. Полученный остаток растворяли в этилацетате и воде. Водный слой экстрагировали этилацетатом (два раза). Объединенный органический слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде коричневой маслянистой жидкости (6,67 г, 99%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,37 (s, 1H), 6,92 (s, 1H), 3,94 (s, 3H), 3,80 (ушир, 2Н), 2,31 (s, 3Н).
Метил-5-бром-2-метил-3-[(оксан-4-ил)амино]бензоат
К раствору метил-3-амино-5-бром-2-метилбензоата (40,2 г, 165 ммоль) в CH2Cl2 (500 мл) и АсОН (60 мл) при перемешивании добавляли дигидро-2Н-пиран-4-он (17,3 г, 173 ммоль) и триацетоксиборгидрид натрия (73,6 г, 330 ммоль). Реакционную смесь перемешивали при КТ в течение 20 часов. Затем добавляли насыщенный вод. раствор NaHCO3 и смесь разделяли. Водный слой экстрагировали CH2Cl2, и объединенный органический слой концентрировали в вакууме. Остаток растирали с этиловым эфиром, и полученный осадок собирали с получением указанного в заголовке соединения в виде белого твердого вещества (39,1 г, 72%). 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,01 (s, 1H), 6,98 (s, 1H), 5,00 (d, J=7,6 Гц, 1H), 3,84-3,87 (m, 2H), 3,79 (s, 3H), 3,54-3,56 (m, 1H), 3,43 (m, 2H), 2,14 (s, 3H), 1,81-1,84 (m, 2H), 1,47-1,55 (m, 2H).
Метил-5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензоат
К раствору метил-5-бром-2-метил-3-[(оксан-4-ил)амино]бензоата (39,1 г, 119 ммоль) в CH2Cl2 (400 мл) и АсОН (40 мл) при перемешивании добавляли ацетальдегид (24,7 г, 476 ммоль) и триацетоксиборгидрид натрия (79,6 г, 357 ммоль). Реакционную смесь перемешивали при КТ в течение 24 часов. Затем добавляли насыщенный вод. раствор NaHCO3 и смесь разделяли. Водный слой экстрагировали CH2Cl2, и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (SiO2; смесью гептан/EtOAc=3/1) с получением указанного в заголовке соединения в виде вязкой маслянистой жидкости (44,1 г, количественный выход). 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,62 (s, 1H), 7,52 (s, 1H), 3,80 (m, 5H), 3,31 (m, 2H), 2,97-3,05 (m, 2H), 2,87-2,96 (m, 1H), 2,38 (s, 3H), 1,52-1,61 (m, 2H), 1,37-1,50 (m, 2H), 0,87 (t, J=6,8 Гц, 3H).
Метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоат
К раствору метил-5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензоата (2,93 г, 8,23 ммоль) и бис(пинаколато)диборона (2,72 г, 10,7 ммоль) в ДМСО (40 мл) при перемешивании добавляли ацетат калия (3,07 г, 31,3 ммоль) и Pd(dppf)Cl2 (672 мг, 0,823 ммоль). Реакционную смесь перемешивали при 80°С в течение 2,5 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (SiO2; смесями гептан/этилацетат = 5/1-2/1) с получением указанного в заголовке соединения в виде желтой маслянистой жидкости (2,92 г, выход 88%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,99 (s, 1H), 7,66 (s, 1H), 3,90-3,98 (m, 2H), 3,89 (s, 3H), 3,25-3,37 (m, 2H), 3,09 (q, J=7,1 Гц, 2H), 2,92-3,02 (m, 1H), 2,54 (s, 3H), 1,57-1,76 (m, 4H), 1,35 м.д. (s, 12H), 0,85 (t, J=7,1 Гц, 3Н).
Метил-5-бром-3-{[транс-4-(диметиламино)циклогексил]амино}-2-метилбензоат
К раствору метил-3-амино-5-бром-2-метилбензоата (5,00 г, 20,5 ммоль) в CH2Cl2 (100 мл) и АсОН (5 мл) при перемешивании добавляли 4-(диметиламино)циклогексан-1-он (3,76 г, 26,6 ммоль) и триацетоксиборгидрид натрия (13,0 г, 61,5 ммоль). Реакционную смесь перемешивали при КТ в течение 4 часов. Затем добавляли насыщенный вод. раствор NaHCO3 и смесь разделяли. Водный слой экстрагировали CH2Cl2 (2×50 мл) и объединенные органические слои концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью гептан/EtOAc=1/1) с получением указанного в заголовке соединения в виде коричневой маслянистой жидкости (2,10 г, 28%). 1H-ЯМР (500 МГц, CDCl3) δ м.д. 7,20 (d, J=1,9 Гц, 1Н), 6,81 (d, J=1,9 Гц, 1Н), 3,87 (s, 3H), 3,58 (d, J=7,3 Гц, 1Н), 3,20 (m, 1Н), 2,30 (s, 6H), 2,20 (s, 3H), 2,16-2,26 (m, 3H), 1,97 (m, 2H), 1,34-1,46 (m, 2H), 1,14-1,25 (m, 2H); MC (ИЭР) [M+H]+ 369,2, 371,2.
Метил-5-бром-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метилбензоат
К раствору метил-5-бром-3-{[транс-4-(диметиламино)циклогексил]амино}-2-метилбензоата (2,10 г, 5,69 ммоль) в CH2Cl2 (40 мл) и AcOH (2 мл) при перемешивании добавляли ацетальдегид (626 мг, 14,2 ммоль) и триацетоксиборгидрид натрия (3,62 г, 17,1 ммоль). Реакционную смесь перемешивали при КТ в течение 3 часов, а затем добавляли насыщенный вод. раствор NaHCO3 и смесь разделяли. Водный слой экстрагировали CH2Cl2, и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью гептан/этилацетат=3/2) с получением указанного в заголовке соединения в виде желтой маслянистой жидкости (824 мг, 36%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,67 (d, J=2,0 Гц, 1Н), 7,33 (d, J=2,0 Гц, 1Н), 3,89 (s, 3H), 3,03 (q, J=7,0 Гц, 2H), 2,57-2,69 (m, 1Н), 2,42 (s, 3H), 2,24 (s, 6H), 2,07-2,18 (m, 1Н), 1,88 (m, 4H), 1,09-1,44 (m, 4H), 0,85 (t, J=7,0 Гц, 3H); MC (ИЭР) [М+Н]+ 397,3, 399,3.
Метил-3-((транс-4-аминоциклогексил)(этил)амино)-5-бром-2-метилбензоат
Метил-5-бром-3-((4-транс-((трет-бутоксикарбонил)амино)циклогексил)(этил)амино)-2-метилбензоат (1,00 г, 2,13 ммоль) растворяли в ДХМ (1 мл) при КТ. Затем при КТ по каплям в течение 10 мин добавляли 4 М раствор HCl в 1,4-диоксане (8 мл, 32,0 ммоль). После перемешивания в течение дополнительных 10 мин данные ТСХ (20% Е/Н) свидетельствовали о завершении реакции, пятно исходного вещества при Rf=0,55 отсутствовало, и наблюдали только базовую линию. Затем смесь концентрировали, повторно растворяли в 10 мл ДХМ и при перемешивании обрабатывали бикарбонатом натрия (0,447 г, 5,33 ммоль) в течение 15 мин (наблюдали образование пузырьков газа). Затем смесь фильтровали через целит с применением ДХМ, фильтрат концентрировали с получением указанного в заголовке соединения (0,780 г, выход 100%). 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,62 (d, J=2,1 Гц, 1Н), 7,44 (d, J=2,1 Гц, 1Н), 3,85 (s, 3Н), 3,07 (q, J=7,0 Гц, 2H), 3,00 (m, 1Н), 2,72 (m, 1Н), 2,38 (s, 3Н), 1,95 (m, 4H), 1,49 (m, 2H), 1,33 (m, 2H), 0,83 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 369,2, 371,2.
Метил-5-бром-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензоат
К раствору метил-3-((транс-4-аминоциклогексил)(этил)амино)-5-бром-2-метилбензоата (0,787 г, 2,13 ммоль) в метаноле (3 мл) и ДХМ (5 мл) при 0°С добавляли формальдегид (37% раствор в воде, 0,793 мл, 10,7 ммоль) и смесь перемешивали в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия (1,81 г, 8,52 ммоль) и смесь перемешивали в течение 30 мин при 0°С, а затем при КТ в течение 30 мин. Данные МС свидетельствовали о завершении реакции. Реакцию гасили нас. раствором NaHCO3, смесь экстрагировали 8×DCM до отсутствия продукта при Rf=0,35, определяемого при помощи ТСХ (10% 7 н. раствор NH3 в МеОН/ДХМ). Объединенную орг. фазу сушили (Na2SO4), фильтровали, концентрировали и очищали при помощи хроматографии (25,0 г колонка, 5% раствор МеОН/ДХМ, а затем 10% 7 н. раствор NH3 в МеОН/ДХМ в изократическом режиме) с получением указанного в заголовке соединения (850 мг, выход 100%). 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,60 (d, J=2,1 Гц, 1Н), 7,42 (d, J=2,1 Гц, 1Н), 3,84 (s, 3H), 3,06 (q, J=7,0 Гц, 2Н), 2,67 (m, 1H), 2,37 (s, 3Н), 2,35 (m, 1H), 2,31 (s, 6H), 1,91 (m, 4H), 1,40 (m, 2H), 1,24 (m, 2H), 0,82 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 397,3, 399,3.
5-Бром-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензойная кислота
Указанное в заголовке соединение получали (820 мг, выход 100%) при помощи способа, аналогичного способу получения 3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил) бензойной кислоты. МС (ИЭР) [М+Н]+ 383,3, 385,3. Неочищенное соединение применяли без дополнительной очистки на следующей реакционной стадии.
5-Бром-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
Указанное в заголовке соединение получали (110 мг, выход 86%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил (1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,31 (d, J=2, 0 Гц, 1Н), 7,16 (d, J=2,0 Гц, 1Н), 6,24 (s, 1Н), 4,51 (s, 2H), 3,47-3,41 (m, 1Н), 3,08 (q, J=7,0 Гц, 2H), 2,75-2,67 (m, 1Н), 2,32 (s, 6H), 2,28 (s, 3Н), 2,34-2,26 (m, 1Н), 2,22 (s, 3Н), 1,98-1,88 (m, 4H), 1,49-1,39 (m, 2H), 1,30-1,24 (m, 2H), 1,23 (d, J=7,0 Гц, 6H), 0,85 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 545,4, 547,4.
5-Бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамид
К раствору метил-5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензоата (31,0 г, 87,0 ммоль) в этаноле (100 мл) при перемешивании добавляли вод. раствор NaOH (2 н., 100 мл). Реакционную смесь перемешивали при 60°С в течение 3 часов. После охлаждения до КТ реакционную смесь концентрировали в вакууме, и полученный остаток растворяли в этилацетате и воде. Водный слой подкисляли вод. раствором KHSO4, экстрагировали этилацетатом (300 мл, два раза) и концентрировали в вакууме с получением 5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензойной кислоты в виде неочищенного продукта (28,0 г, 97%).
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензойной кислоты (5,00 г, 14,6 ммоль) и HCl соли 3-(аминометил)-4,б-диметил-1,2-дигидропиридин-2-она (3,31 г, 17,5 ммоль) в ДМСО (50 мл) при перемешивании добавляли PYBOP (11,4 г, 21,9 ммоль) и основание Хунига (7,63 мл, 43,8 ммоль). Реакционную смесь перемешивали при КТ в течение 4 часов. Реакцию гасили водой, полученный осадок собирали и промывали водой (2×100 мл) и этиловым эфиром (20 мл). Собранное твердое вещество сушили под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (5,70 г, 82%). 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 11,47 (s, 1H), 8,23 (ушир, 1Н), 7,30 (s, 1H), 7,08 (s, 1H), 5,85 (s, 1H), 4,23 (d, J=4, 4 Гц, 2Н), 3,81 (d, J=10,4 Гц, 2Н), 3,20-3,26 (m, 2Н), 3,00-3,07 (m, 1H), 2,91-2,96 (m, 2Н), 2,18 (s, 3Н), 2,14 (s, 3H), 2,10 (s, 3H), 1,58-1,60 (m, 2Н), 1,45-1,50 (m, 2Н), 0,78 (t, J=6, 8 Гц, 3Н); МС (ИЭР) [М+Н]+ 476,3, 478,3.
5-Бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил)бензамид
К раствору метил-5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензоата (31,0 г, 87,0 ммоль) в этаноле (100 мл) при перемешивании добавляли вод. раствор NaOH (2 н., 100 мл). Реакционную смесь перемешивали при 60°С в течение 3 часов. После охлаждения до КТ реакционную смесь концентрировали в вакууме, и полученный остаток растворяли в этилацетате и воде. Водный слой подкисляли вод. раствором KHSO4, экстрагировали этилацетатом (300 мл, два раза) и концентрировали в вакууме с получением 5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензойной кислоты в виде неочищенного продукта (28,0 г, 97%).
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензойной кислоты (3,00 г, 8,77 ммоль) и HCl соли 3-(аминометил)-6-метил-4-(пропан-2-ил)-1,2-дигидропиридин-2-она (2,47 мг, 11,4 ммоль) в ДМСО (40 мл) при перемешивании добавляли PYBOP (6,84 мг, 13,1 ммоль) и основание Хунига (7,63 мл, 43,8 ммоль). Реакционную смесь перемешивали при КТ в течение 17 часов. Реакцию гасили водой, и водный слой экстрагировали этилацетатом. Органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (SiO2; смесью этилацетат/МеОН=6/1). Фракции, содержащие целевой материал, собирали и концентрировали в вакууме. Остаток повторно очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями от гептан/этилацетат=1/1 до этилацетат/метанол=10/1) с получением указанного в заголовке соединения в виде белого аморфного твердого вещества (5,45 г, количественный выход). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 10,54 (ушир, 1Н), 7,21 (d, J=2,2 Гц, 1Н), 7,17 (d, J=2,2 Гц, 1Н), 7,04-7,10 (m, 1Н), 6,05 (s, 1Н), 4,57 (d, J=6,2 Гц, 2H), 3,91-3,99 (m, 2H), 3,47-3,56 (m, 1Н), 3,27-3,36 (m, 2H), 3,02 (q, J=7,2 Гц, 2H), 2,87-2,98 (m, 1Н), 2,27 (s, 3Н), 2,24 (s, 3Н), 1,61-1,70 (m, 4H), 1,21 (d, J=7,0 Гц, 6H), 0,85 (t, J=7,2 Гц, 3Н).
5-Бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метилбензойной кислоты (500 мг, 1,46 ммоль) и гидрохлорида 3-(аминометил)-6-метил-4-(трифторметил)-1,2-дигидропиридин-2-она (461 мг, 1,90 ммоль) в ДМСО (11 мл) при перемешивании добавляли PYBOP (1,14 г, 2,19 ммоль) и основание Хунига (0,763 мл, 4,38 ммоль). Реакционную смесь перемешивали при КТ в течение 15 часов. Реакцию гасили водой, смесь разбавляли EtOAc и разделяли. Органический слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2, от смеси EtOAc/гептан=1/1 до EtOAc) с получением указанного в заголовке соединения (563 мг, ~89% чистота, 65%). 1H-ЯМР (400 МГц, ДМСО-d6) 5 м.д. 7,23 (d, J=2,0 Гц, 1Н), 7,19 (d, J=2,0 Гц, 1Н), 6,82 (t, J=6,4 Гц, 1Н), 6,35 (s, 1Н), 4,71 (d, J=6,4 Гц, 2Н), 3,92-3,97 (m, 2Н), 3,27-3,34 (m, 2Н), 3,03 (q, J=7, 2 Гц, 2Н), 2,89-2,95 (m, 1Н), 2,39 (s, 3Н), 2,27 (s, 3Н), 1,62-1,68 (m, 4H), 0,86 (t, J=7,2 Гц, 3Н).
5-Бром-2-(метоксиметил)пиридин
К раствору (5-бром-2-пиридил)метанола (1,50 г, 7,98 ммоль) и MeI (600 мкл, 9,58 ммоль) в ДМФА (10 мл) при 0°С при перемешивании добавляли NaH (60% в масле, 400 мг, 9,98 ммоль). Реакционную смесь перемешивали при КТ в течение 3,5 часов. Реакцию гасили водой, смесь разбавляли EtOAc и разделяли. Органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/гептан=1/8) с получением указанного в заголовке соединения в виде белого твердого вещества (1,52 г, 94%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,62 (d, J=2,4 Гц, 1Н), 7,82 (dd, J=2,4, 8,4 Гц, 1Н), 7,34 (d, J=8,4 Гц, 1Н), 4,54 (s, 2Н), 3,48 (s, 3Н).
2-(Метоксиметил)-5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин
К раствору 5-бром-2-(метоксиметил)пиридина (700 мг, 3,46 ммоль) и бис(пинаколато)диборона (968 мг, 3,81 ммоль) в 1,2-диметоксиэтане (10 мл) при перемешивании добавляли ацетат калия (1,02 г, 10,4 ммоль) и комплекс Pd(dppf)Cl2⋅CH2Cl2 (595 мг, 0,692 ммоль). Реакционную смесь перемешивали при 80°С в течение 3 часов. Смесь охлаждали до кт, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза), сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде неочищенного продукта (1,6 г, ~50% чистота (количественный выход)). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,88 (s, 1H), 8,07 (d, J=8,0 Гц, 1Н), 7,42 (d, J=8,0 Гц, 1Н), 4,61 (s, 2H), 3,48 (s, 3H), 1,25 (s, 12H).
3-[Этил(оксан-4-ил)амино]-5-[6-(метоксиметил)пиридин-3-ил]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(пропан-2-ил)-1,2-дигидропиридин-3-ил]метил}бензамида (125 мг, 0,198 ммоль) и неочищенного 2-(метоксиметил)-5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (160 мг, ~50% чистота, 0,317 ммоль) в 1,4-диоксане (2 мл) и H2O (0,4 мл) при перемешивании добавляли Pd(PPh3)4 (23,0 мг, 0,02 ммоль) и карбонат натрия (76,0 мг, 0,713 ммоль). Реакционную смесь перемешивали при 100°С в течение 3 часов. Смесь охлаждали до кт, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/2 до EtOAc) и (SiO2; от EtOAc до смеси EtOAc/MeOH=5/1+5% ТЭА) и при помощи преп. ТСХ (SiO2; EtOAc, 6 проявлений). Смесь растирали со смесью EtOAc-гексан с получением указанного в заголовке соединения в виде белого твердого вещества (33,4 мг, 31%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 9,88-9,90 (m, 1H), 8,69 (d, J=2,4 Гц, 1Н), 7,81 (dd, J=2,4, 8,0 Гц, 1Н), 7,44 (d, J=8,0 Гц, 1Н), 7,28-7,29 (m, 1Н), 7,24-7,25 (m, 1Н), 7,09-7,12 (m, 1Н), 6,03 (s, 1Н), 4,61 (s, 2H), 4,60-4,61 (m, 2H), 3,94-3,97 (m, 2H), 3,50-3,58 (m, 1Н), 3,50 (s, 3Н), 3,29-3,36 (m, 2H), 3,10 (q, J=6,8 Гц, 2H), 2,99-3,03 (m, 1Н), 2,34 (s, 3Н), 2,23 (s, 3Н) 1,66-1,73 (m, 4H), 1,22 (d, J=6, 8 Гц, 6Н), 0,90 (t, J=6,8 Гц, 3Н); MC (ИЭР) [М+Н]+ 547,4; ВЭЖХ 98,0% чистота.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-(6-метоксипиридин-3-ил)-2-метилбензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (100 мг, 0,210 ммоль) и 2-метокси-5-пиридинбороновой кислоты (51 мг, 0,336 ммоль) в 1,4-диоксане (2 мл) и H2O (0,4 мл) при перемешивании добавляли Pd(PPh3)4 (25 мг, 0,0216 ммоль) и карбонат натрия (80 мг, 0,756 ммоль). Реакционную смесь перемешивали при 100°С в течение 4 часов. Смесь охлаждали до кт, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями от гептан/этилацетат=1/1 ~ EtOAc до EtOAc/MeOH=10/1). Смесь растирали со смесью EtOAc-гексан с получением указанного в заголовке соединения в виде белого твердого вещества (66,7 мг, 63%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 10,7-10,8 (m, 1H), 8,29 (d, J=2,8 Гц, 1H), 7,70 (dd, J=2,8, 8,8 Гц, 1H), 7,25 (d, J=1,6 Гц, 1H), 7,20 (d, J=1,6 Гц, 1H), 7,13 (t, J=6,0 Гц, 1H), 6,77 (d, J=8,8 Гц, 1H), 5,91 (s, 1H), 4,55 (d, J=6,0 Гц, 2Н), 3,95 (s, 3Н), 3,93-3,96 (m, 2Н), 3,28-3,36 (m, 2Н), 3,10 (q, J=7,2 Гц, 2Н), 2,96-3,03 (m, 1H), 2,41 (s, 3Н), 2,34 (s, 3Н), 2,17 (s, 3Н) 1,68-1,72 (m, 4H), 0,89 (t, J=7, 2 Гц, 3Н); МС (ИЭР) [М+Н]+ 505,5; ВЭЖХ 99,3% чистота.
4-{[5-(Тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метил}морфолин
К раствору 4-[(5-бромпиридин-2-ил)метил]морфолин (500 мг, 1,94 ммоль) и бис(пинаколато)диборона (542 мг, 2,13 ммоль) в 1,2-диметоксиэтане (5 мл) при перемешивании добавляли ацетат калия (571 мг, 5,82 ммоль) и Pd(dppf)Cl2 (400 мг, 0,235 ммоль). Реакционную смесь перемешивали при 80°С в течение 1,5 часов. Смесь охлаждали до кт, выпаривали, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде неочищенного продукта (934 мг, ~60% чистота (количественный выход)). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,63 (d, J=2,4 Гц, 1H), 7,79 (dd, J=2,4, 8,4 Гц, 1H), 7,34 (d, J=8,4 Гц, 1H), 3,71-3,78 (m, 4H), 3,61 (s, 2Н), 2,45-2,58 (m, 4H), 1,26 (s, 12H).
3-[Этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил]метил}-5-[6-(морфолин-4-илметил)пиридин-3-ил]бензамид
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(трифторметил)-1,2-дигидропиридин-3-ил]метил}бензамида (274 мг, ~89% чистота, 0,46 ммоль) и неочищенного 4-{[5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метил}морфолина (470 мг, ~60% чистота, 0,927 ммоль) в 1,4-диоксане (4,6 мл) и H2O (0,92 мл) при перемешивании добавляли Pd(PPh3)4 (53,0 мг, 0,0459 ммоль) и карбонат натрия (176 мг, 1,66 ммоль). Реакционную смесь перемешивали при 100°С в течение 3 часов. Смесь охлаждали до кт, выпаривали, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смеси EtOAc/MeOH=5/1) и (SiO2; от EtOAc до смеси EtOAc/MeOH=5/1+5% ТЭА). Смесь растирали со смесью Et2O-гексан с получением указанного в заголовке соединения в виде белого твердого вещества (28,0 мг, 9,7%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,41 (d, J=2,4 Гц, 1Н), 7,64 (dd, J=2,4, 8,0 Гц, 1Н), 7,30-7,40 (m, 2H), 7,22 (s, 1Н), 7,18 (s, 1Н), 6,26 (s, 1Н), 4,77 (d, J=6,4 Гц, 2H), 3,94-3,97 (m, 2H), 3,66-3,77 (m, 4H), 3,49 (s, 2H), 3,26-3,38 (m, 2H), 3,10 (q, J=6,8 Гц, 2H), 2,94-3,05 (m, 1H), 2,42-2,49 (m, 4H), 2,39 (s, 3H), 2,31 (s, 3H) 1,66-1,73 (m, 4H), 0,90 (t, J=6,8 Гц, 3H); МС (ИЭР) [М+Н]+ 628,6; ВЭЖХ 95,4% чистота.
1-[(4-Бром-2-фторфенил)метил]азетидин-3-ол
К раствору 4-бром-2-фторбензилового спирта (818 мг, 3,99 ммоль) и триэтиламина (0,666 мл, 4,79 ммоль) в CH2Cl2 (6,8 мл) при 0°С при перемешивании по каплям добавляли MsCl (0,340 мл, 4,39 ммоль). Реакционную смесь перемешивали при 0°С в течение 3 часов. Реакцию гасили водой, смесь разбавляли EtOAc и разделяли. Органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали.
К раствору неочищенного мезилата и триэтиламина (2,22 мл, 16,0 ммоль) в ДМФА (6,8 мл) при перемешивании добавляли гидрохлорид 3-гидроксиазетидина (655 мг, 5,99 ммоль).
Реакционную смесь перемешивали при 23°С в течение 14 часов. Реакцию гасили водой, смесь разбавляли этилацетатом и разделяли. Органический слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями этилацетат/гептан=1/1-2/1) с получением указанного в заголовке соединения (698 мг, выход 67%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,17-7,27 (m, 3Н), 4,42-4,47 (m, 1Н), 3,61-3,67 (m, 4H), 2,95-2,99 (m, 2H), 1,90-2,05 (m, 1H).
1-{[2-Фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил}азетидин-3-ол
К раствору 1-[(4-бром-2-фторфенил)метил]азетидин-3-ола (348 мг, 1,34 ммоль) и бис(пинаколато)диборона (374 мг, 1,47 ммоль) в 1,2-диметоксиэтане (3 мл) при перемешивании добавляли ацетат калия (394 мг, 4,02 ммоль) и Pd(dppf)Cl2 (273 мг, 0,335 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Смесь охлаждали до кт, выпаривали, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения в виде неочищенного продукта (650 мг, ~63% чистота (количественный выход)).
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-{3-фтор-4-[(3-гидроксиазетидин-1-ил)метил]фенил}-2-метилбензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (203 мг, 0,426 ммоль) и неочищенного 1-{[2-фтор-4-(тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил}азетидин-3-ола (350 мг, ~63% чистота, 0,67 ммоль) в 1,4-диоксане (4 мл) и Н2О (0,8 мл) при перемешивании добавляли Ра(PPh3)4 (48 мг, 0,0415 ммоль) и карбонат натрия (160 мг, 1,51 ммоль). Реакционную смесь перемешивали при 100°С в течение 3 часов. Смесь охлаждали до кт, выпаривали, разбавляли EtOAc и фильтровали через слой целита. Фильтрат промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смеси EtOAc/MeOH=5/l), (SiO2; от EtOAc до смеси EtOAc/MeOH=5/1+5% ТЭА) и при помощи преп. ТСХ (SiO2; смесью EtOAc/MeOH=20/1,6 проявлений). Смесь растирали со смесью EtOAc-гексан с получением указанного в заголовке соединения в виде белого твердого вещества (74,1 мг, 31%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,33 (t, J=6,0 Гц, 1H), 7,13-7,30 (m, 5H), 5,91 (s, 1H), 4,56 (d, J=6,0 Гц, 2H), 4,34-4,38 (m, 1H), 3,94-3,98 (m, 2H), 3,56-3,60 (m, 2H), 3,56 (s, 2H), 3,29-3,36 (m, 2H), 3,09 (q, J=7,2 Гц, 2H), 3,01-3,03 (m, 1H), 2,91-2,94 (m, 2H), 2,43 (s, 3Н), 2,38 (s, 3Н), 2,13 (s, 3Н), 1,68-1,74 (m, 4H), 0,90 (t, J=7,2 Гц, 3Н); MC (ИЭР) [М+Н]+ 577,6; ВЭЖХ 95,0% чистота.
N-(2-Гидроксиэтил)-4-(тетраметил-1,3,2-диоксаборолан-2-ил)бензамид
К раствору 4-бромбензойной кислоты (2,00 г, 9,95 ммоль) и 2-аминоэтан-1-ола (912 мг, 14,9 ммоль) в ТГФ (200 мл) при перемешивании добавляли HATU (6,81 г, 17,9 ммоль) и основание Хунига (5,20 мл, 29,9 ммоль). Реакционную смесь перемешивали при КТ в течение 2 часов. Затем реакцию гасили водой. Смесь концентрировали в вакууме, и полученный остаток растворяли в этилацетате и воде. Водный слой экстрагировали этилацетатом (два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (SiO2; смесью гептан/этилацетат=1/1) с получением N-(2-гидроксиэтил)бензамида в виде белого твердого вещества (1,70 г, 70%).
К раствору N-(2-гидроксиэтил)бензамида (1,70 г, 6,96 ммоль) и бис(пинаколато)диборона (2,12 г, 8,36 ммоль) в 1,2-диметоксиэтане (40 мл) при перемешивании добавляли ацетат калия (2,05 г, 20,9 ммоль) и Pd(dppf)Cl2 (255 мг, 0,348 ммоль). Реакционную смесь перемешивали при 80°С в течение 4 часов. После охлаждения до КТ смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (SiO2; смесью гептан/этилацетат=1/1) с получением указанного в заголовке соединения в виде коричневого твердого вещества (1,20 г, 59%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,87 (d, J=8, 2 Гц, 2Н), 7,76 (d, J=8,2 Гц, 2Н), 6,71 (ушир, 1Н), 3,80-3,88 (m, 2Н), 3,60-3,69 (m, 2Н), 1,35 (s, 12H); МС (ИЭР) [М+Н]+ 292,2.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-{4-[(2-гидроксиэтил)карбамоил]фенил}-2-метилбензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (200 мг, 0,419 ммоль) и N-(2-гидроксиэтил)-4-(тетраметил-1,3,2-диоксаборолан-2-ил)бензамида (196 мг, 0,673 ммоль) в 1,4-диоксане (4,2 мл) и H2O (0,8 мл) при перемешивании добавляли Pd(PPh3)4 (49 мг, 0,0424 ммоль) и карбонат натрия (160 мг, 1,51 ммоль). Реакционную смесь перемешивали при 100°С в течение 2 часов. Смесь охлаждали до кт, выпаривали и разбавляли EtOAc. Смесь промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смесей EtOAc/MeOH=10/1-5/1), (SiO2; от EtOAc до смесей EtOAc/MeOH=10/1-5/1). Смесь растирали со смесью CH2Cl2-Et2O-гексан с получением указанного в заголовке соединения (122,2 мг, 52%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,75-7,79 (m, 1H), 7,70 (ушир s, 1H), 7,60 (d, J=8,4 Гц, 2H), 7,30-7,33 (m, 4H), 5,63 (s, 1H), 4,52 (d, J=6,4 Гц, 2H), 4,12-4,18 (m, 1H), 3,92-3,98 (m, 4H), 3,72-3,75 (m, 2H), 3,29 (m, 2H), 3,11 (q, J=7,2 Гц, 2H), 2,98-3,03 (m, 1H), 2,41 (s, 3H), 2,37 (s, 3H), 1,90 (s, 3Н), 1,66-1,73 (m, 4H), 0,90 (t, J=7,2 Гц, 3H); MC (ИЭР) [М+Н]+ 561,5; ВЭЖХ 95,8% чистота.
3-[Этил(оксан-4-ил)амино]-5-{4-[(2-гидроксиэтил)карбамоил]фенил}-2-метил-N-{[6-метил-2-оксо-4-(пропан-2-ил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(пропан-2-ил)-1,2-дигидропиридин-3-ил]метил}бензамида (250 мг, ~80% чистота, 0,396 ммоль) и N-(2-гидроксиэтил)-4-(тетраметил-1,3,2-диоксаборолан-2-ил)бензамида (184 мг, 0,634 ммоль) в 1,4-диоксане (4 мл) и H2O (0,8 мл) при перемешивании добавляли Pd(PPh3)4 (40 мг, 0,0346 ммоль) и карбонат натрия (151 мг, 1,43 ммоль). Реакционную смесь перемешивали при 100°С в течение 2 часов. Смесь охлаждали до кт, выпаривали и разбавляли EtOAc. Смесь промывали водой (два раза) и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смесей EtOAc/MeOH=10/1-5/1). Смесь растирали со смесью CH2Cl2-EtOAc-гексан с получением указанного в заголовке соединения в виде белого твердого вещества (176 мг, выход 75%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,85 (t, J=6,4 Гц, 1Н), 7,67 (t, J=5,2 Гц, 1Н), 7,52 (d, J=8,4 Гц, 2Н), 7,26-7,30 (m, 4H), 5,89 (s, 1Н), 4,61 (d, J=6,4 Гц, 2Н), 3,91-4,02 (m, 3Н), 3,84-3,89 (m, 2Н), 3,64-3,68 (m, 2Н), 3,51-3,56 (m, 1Н), 3,29-3,36 (m, 2H), 3,09 (q, J=6,8 Гц, 2Н), 2,97-3,03 (m, 1Н), 2,40 (s, 3Н), 2,02 (s, 3Н), 1,64-1,68 (m, 4H), 1,18 (d, J=6,8 Гц, 6Н), 0,88 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 589,5; ВЭЖХ 96,7% чистота.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(4-метил-1,4-диазепан-1-ил)метил]пиридин-3-ил}бензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (2,00 г, 4,20 ммоль) и [5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метанола (1,18 г, 5,04 ммоль) в 1,4-диоксане (40 мл) и H2O (4 мл) при перемешивании добавляли Pd(PPh3)4 (485 мг, 0,420 ммоль) и карбонат натрия (1,34 г, 12,6 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Затем реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/5 до этилацетата) с получением N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида в виде белого твердого вещества (800 мг, выход 37%).
К раствору N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида (200 мг, 0,396 ммоль) в CH2Cl2 (4 мл) при перемешивании добавляли метансульфонилхлорид (54,4 мг, 0,475 ммоль) и основание Хунига (206 мкл, 1,19 ммоль). Реакционную смесь перемешивали при КТ в течение 30 минут. Затем к реакционной смеси добавляли 1-метилгомопиперазин (226 мг, 1,98 ммоль), и полученную смесь перемешивали при КТ в течение 1 часа. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=20/1) с получением указанного в заголовке соединения в виде белого твердого вещества (25,1 мг). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,63 (dd, J=2,3, 0,8 Гц, 1Н), 7,75 (dd, J=8,2, 2,3 Гц, 1Н), 7,48 (d, J=8,2 Гц, 1Н), 7,29 (d, J=2,0 Гц, 1Н), 7,25 (d, J=2,0 Гц, 1Н), 7,20 (t, J=5,9 Гц, 1Н), 5,91 (s, 1Н), 4,56 (d, J=5,9 Гц, 2H), 3,96 (m, 2H), 3,80 (s, 2H), 3,26-3,36 (m, 2H), 3,09 (q, J=7,0 Гц, 2H), 2,95-3,05 (m, 1Н), 2,75-2,82 (m, 4H), 2,60-2,71 (m, 4H), 2,39 (s, 3H), 2,36 (s, 3Н), 2,34 (s, 3H), 2,14 (s, 3H), 1,79-1,89 (m, 4H), 1,64-1,74 (m, 2H), 0,89 (t, J=7,0 Гц, 3Н); MC (ИЭР) [M+R]+ 601,6; ВЭЖХ 93,4% чистота.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(пирролидин-1-илметил)пиридин-3-ил]бензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (2,00 г, 4,20 ммоль) и [5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метанола (1,18 г, 5,04 ммоль) в 1,4-диоксане (40 мл) и H2O (4 мл) при перемешивании добавляли Pd(PPh3)4 (485 мг, 0,420 ммоль) и карбонат натрия (1,34 г, 12,6 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Затем реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/5 до этилацетата) с получением N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида в виде белого твердого вещества (800 мг, 37%).
К раствору N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида (200 мг, 0,396 ммоль) в CH2Cl2 (4 мл) при перемешивании добавляли метансульфонилхлорид (68,1 мг, 0,595 ммоль) и основание Хунига (206 мкл, 1,19 ммоль). Реакционную смесь перемешивали при КТ в течение 30 минут. Затем к реакционной смеси добавляли пирролидин (141 мг, 1,98 ммоль), и полученную смесь перемешивали при КТ в течение 4 дней. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/5 до этилацетата) с получением указанного в заголовке соединения в виде белого твердого вещества (21,0 мг, выход 9,5%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,67 (d, J=2,0 Гц, 1Н), 7,75 (dd, J=8,2, 2,0 Гц, 1Н), 7,45 (d, J=8,2 Гц, 1Н), 7,30 (d, J=2,0 Гц, 1Н), 7,25 (d, J=2,0 Гц, 1Н), 7,15 (t, J=5,7 Гц, 1Н), 5,92 (s, 1Н), 4,56 (d, J=5,7 Гц, 2Н), 3,96 (m, 2Н), 3,64 (s, 2Н), 3,28-3,39 (m, 2Н), 3,10 (q, J=7,0 Гц, 2Н), 3,02 (m, 1Н), 2,46 (m, 4H), 2,41 (s, 3H), 2,35 (s, 3H), 2,19 (s, 3H), 1,68-1,75 (m, 4H), 1,61 (m, 2Н), 1,46 (m, 2Н), 0,90 (t, J=7,0 Гц, 3H); MC (ИЭР) [М+Н]+ 558,6; ВЭЖХ 96,3% чистота.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(пиперидин-1-илметил)пиридин-3-ил]бензамид
К раствору 5-бром-N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метилбензамида (2,00 г, 4,20 ммоль) и [5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метанола (1,18 г, 5,04 ммоль) в 1,4-диоксане (40 мл) и H2O (4 мл) при перемешивании добавляли Pd(PPh3)4 (485 мг, 0,420 ммоль) и карбонат натрия (1,34 г, 12,6 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Затем реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/5 до этилацетата) с получением N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида в виде белого твердого вещества (800 мг, 37%).
К раствору N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метилбензамида (200 мг, 0,396 ммоль) в CH2Cl2 (4 мл) при перемешивании добавляли метансульфонилхлорид (54,4 мг, 0,475 ммоль) и основание Хунига (206 мкл, 1,19 ммоль). Реакционную смесь перемешивали при КТ в течение 30 минут. Затем к реакционной смеси добавляли пиперидин (169 мг, 1,98 ммоль), и полученную смесь перемешивали при КТ в течение 1 часа. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смеси гептан/этилацетат=1/5 до этилацетат/МеОН=20/1) с получением указанного в заголовке соединения в виде белого твердого вещества (81,2 мг, выход 35,9%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,64 (d, J=2,0 Гц, 1Н), 7,73 (dd, J=8,2, 2,0 Гц, 1Н), 7,42 (d, J=8,2 Гц, 1Н), 7,28 (d, J=2,0 Гц, 1Н), 7,24 (d, J=2,0 Гц, 1Н), 7,17-7,22 (m, 1Н), 5,90 (s, 1Н), 4,56 (d, J=8,0 Гц, 1Н), 4,54 (d, J=8,0 Гц, 1Н), 3,94 (m, 2H), 3,61 (s, 2H), 3,27-3,36 (m, 2H), 3,09 (q, J=7,0 Гц, 2H), 2,96-3,04 (m, 1Н), 2,40 (m, 4H), 2,39 (s, 3Н), 2,34 (s, 3H), 2,14 (s, 3H), 1,70 (m, 2H), 1,50-1,63 (m, 6H), 1,38-1,49 (m, 2H), 0,89 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 572,5; ВЭЖХ 97,6% чистота.
3-[Этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 5-бром-3-[этил(оксан-4-ил)амино]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамида (1,50 г, 2,97 ммоль) и [5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метанола (1,89 г, 8,03 ммоль) в 1,4-диоксане (20 мл) и воде (5 мл) при перемешивании добавляли Pd(PPh3)4 (515 мг, 0,446 ммоль) и карбонат натрия (1,14 г, 10,7 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Затем добавляли [5-(тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил]метанол (800 мг, 3,40 ммоль), Pd(PPh3)4 (200 мг, 0,173 ммоль) и карбонат натрия (630 мг, 5,94 ммоль) и смесь перемешивали при 80°С в течение 14 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (1; NH-SiO2; смесями этилацетат/МеОН=50/1-6/1, 2; SiO2; смесями этилацетат/МеОН=8/1-5/1) с получением указанного в заголовке соединения в виде белого твердого вещества (457 мг, 29%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 10,51 (ушир s, 1H), 8,60 (s, 1H), 7,64-7,73 (m, 1H), 7,24-7,27(m, 1H), 7,17-7,24 (m, 1H), 7,11-7,17 (m, 2H), 6,07 (s, 1H), 4,69 (ушир s, 2Н), 4,61 (d, J=6,2 Гц, 2Н), 3,84-4,02 (m, 3H), 3,53-3,65 (m, 1H), 3,28-3,40 (m, 2Н), 3,10 (q, J=7,0 Гц, 2Н), 2,96-3,06 (m, 1H), 2,36 (s, 3H), 2,27(s, 3H), 1,65-1,76 (m, 4H), 1,24 (d, J=7,0 Гц, 6Н), 0,90 (t, J=7,0 Гц, 3H).
3-[Этил(оксан-4-ил)амино]-2-метил-5-{6-[(4-метил-1,4-диазепан-1-ил)метил]пиридин-3-ил}-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамида (200 мг, 0,375 ммоль) в CH2Cl2 (4 мл) при перемешивании добавляли метансульфонилхлорид (51,6 мг, 0,451 ммоль) и основание Хунига (195 мкл, 1,13 ммоль). Реакционную смесь перемешивали при КТ в течение 1 часа. Затем к реакционной смеси добавляли 1-метилгомопиперазин (129 мг, 1,13 ммоль), и полученную смесь перемешивали при КТ в течение 1 часа. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от этилацетата до смеси этилацетат/МеОН=15/1) с получением указанного в заголовке соединения в виде белого твердого вещества (81,3 мг, выход 34,5%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,65 (d, J=2,3 Гц, 1H), 7,76 (dd, J=8,2, 2,3 Гц, 1H), 7,50 (d, J=8,2 Гц, 1H), 7,29 (d, J=2,0 Гц, 1H), 7,23 (d, J=2,0 Гц, 1H), 7,12 (t, J=5,9 Гц, 1Н), 6,03 (s, 1H), 4,61 (d, J=5,9 Гц, 2H), 3,95 (m, 2H), 3,81 (s, 2H), 3,54 (m, 1H), 3,27-3,37 (m, 2H), 3,10 (q, J=6,8 Гц, 2H), 3,01 (m, 1H), 2,76-2,84 (m, 4H), 2,60-2,71 (m, 4H), 2,37 (s, 3Н), 2,33 (s, 3H), 2,22 (s, 3H), 1,84 (m, 2H), 1,67-1,74 (m, 4H), 1,21 (d, J=7,0 Гц, 6H), 0,85-0,90 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 629,6; ВЭЖХ 91,7% чистота.
3-[Этил(оксан-4-ил)амино]-5-(6-{[(3S)-3-гидроксипиперидин-1-ил]метил}пиридин-3-ил)-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору 3-[этил(оксан-4-ил)амино]-5-[6-(гидроксиметил)пиридин-3-ил]-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамида (200 мг, 0,375 ммоль) в CH2Cl2 (4 мл) при перемешивании добавляли метансульфонилхлорид (51,6 мг, 0,451 ммоль) и основание Хунига (195 мкл, 1,13 ммоль). Реакционную смесь перемешивали при КТ в течение 1 часа. Затем к реакционной смеси добавляли HCl соль (S)-3-гидроксипиперидина (258 мг, 1,88 ммоль), и полученную смесь перемешивали при КТ в течение 1 часа. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=20/1) с получением указанного в заголовке соединения в виде белого твердого вещества (39,9 мг, выход 17,3%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,63-8,66 (m, 1H), 7,74 (dd, J=8,2, 2,3 Гц, 1H), 7,40 (d, J=8,2 Гц, 1H), 7,28 (d, J=2,0 Гц, 1H), 7,22 (d, J=2,0 Гц, 1H), 7,17 (t, J=5, 9 Гц, 1H), 6,02 (d, J=0,8 Гц, 1H), 4,61 (d, J=5,9 Гц, 2H), 3,91-3,98 (m, 2H), 3,82 (ушир, 1H), 3,66 (s, 1H), 3,65 (s, 1H), 3,52 (m, 1H), 3,26-3,36 (m, 2H), 3,09 (q, J=7,0 Гц, 2H), 2,95-3,05 (m, 1H), 2,52 (m, 3H), 2,35-2,41 (m, 1H), 2,34 (s, 3H), 2,19 (s, 3H), 1,74-1,88 (m, 4H), 1,67-1,73 (m, 2H), 1,56 (m, 2H), 1,20 (d, J=7,0 Гц, 6Н), 0,89 (t, J=7,0 Гц, 3H); MC (ИЭР) [М+Н]+ 616,6; ВЭЖХ 97,4% чистота.
5-Бром-2-[(1-метилпиперидин-4-ил)окси]пиридин
К раствору 4-гидрокси-1-метилпиперидина (175 мг, 1,52 ммоль) в ТГФ (8,0 мл) при перемешивании добавляли NaH (60%, 60,8 мг, 1,52 ммоль). Реакционную смесь перемешивали в течение 10 мин. При 0°С добавляли 2,5-дибромпиридин (300 мг, 1,27 ммоль) и перемешивали при температуре обратной конденсации в течение 9,5 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Органический слой промывали водой и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями гептан/этилацетат=5/1-1/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (309 мг, 90%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,15 (d, J=2,6 Гц, 1Н), 7,62 (dd, J=8,8, 2,6 Гц, 1Н), 6,63 (d, J=8,8 Гц, 1Н), 4,95-5,04 (m, 1Н), 2,63-2,76 (m, 2H), 2,23-2,36 (m, 2H), 2,30 (s, 3H), 1,98-2,08 (m, 2H), 1,75-1,87 (m, 2H).
Метил-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилпиперидин-4-ил)окси]пиридин-3-ил}бензоат
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (110 мг, 0,273 ммоль) и 5-бром-2-[(1-метилпиперидин-4-ил)окси]пиридина (96,1 мг, 0,355 ммоль) в 1,4-диоксане (2,5 мл) и воде (0,5 мл) при перемешивании добавляли Pd(PPh3)4 (47,3 мг, 0,0410 ммоль) и карбонат натрия (104 мг, 0,982 ммоль). Реакционную смесь перемешивали при 80°С в течение 4 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Смесь фильтровали и разделяли. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями гептан/этилацетат=3/1-1/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (70,1 мг, 55%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,33 (d, J=2,6 Гц, 1Н), 7,77 (dd, J=8,6, 2,6 Гц, 1Н), 7,73 (d, J=1,8 Гц, 1Н), 7,41 (d, J=1,8 Гц, 1Н), 6,79 (d, J=8,6 Гц, 1Н), 5,05-5,15 (m, 1Н), 3,92-4,02 (m, 2H), 3,92 (s, 3Н), 3,29-3,38 (m, 2H), 3,11 (q, J=7,0 Гц, 2Н), 2,97-3,06 (m, 1Н), 2,69-2,79 (m, 2H), 2,53 (s, 3Н), 2,32(s, 3Н), 2,24-2,37 (m, 2H), 2,03-2,14 (m, 2H), 1,80-1,93 (m, 2H), 1,63-1,77 (m, 4H), 0,90 (t, J=7,0 Гц, 3Н).
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилпиперидин-4-ил)окси]пиридин-3-ил}бензамид
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилпиперидин-4-ил)окси]пиридин-3-ил}бензоата (70,1 мг, 0,150 ммоль) в этаноле (2 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 150 мкл). Реакционную смесь перемешивали при 90°С в течение 1 часа. После охлаждения до 0°С реакционную смесь нейтрализовывали 5 н. раствором HCl. Смесь концентрировали в вакууме и сушили под вакуумом с получением неочищенной 3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилпиперидин-4-ил)окси]пиридин-3-ил}бензойной кислоты.
К раствору неочищенной карбоновой кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (42,4 мг, 0,225 ммоль) в ДМСО (2 мл) при перемешивании добавляли PYBOP (117 мг, 0,225 ммоль) и основание Хунига (131 мкл, 0,750 ммоль). Реакционную смесь перемешивали при КТ в течение 17 часов. Реакцию гасили водой. Смесь экстрагировали этилацетатом (10 мл, два раза), и объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями этилацетат/МеОН=50/1-10/1) с получением неочищенного соединения. Неочищенное соединение суспендировали с этилацетатом и гептаном. Полученное осажденное твердое вещество собирали при помощи фильтрования. Твердое вещество сушили под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (56,7 мг, 64%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 10,23 (ушир s, 1Н), 8,27 (d, J=2,6 Гц, 1Н), 7,70 (dd, J=8,4, 2,6 Гц, 1Н), 7,25 (d, J=1,8 Гц, 1Н), 7,20 (d, J=1,8 Гц, 1Н), 7,10 (t, J=5,9 Гц, 1Н), 6,75 (d, J=8,4 Гц, 1Н), 5,91 (s, 1Н), 5,03-5,12 (m, 1Н), 4,55 (d, J=5,9 Гц, 2Н), 3,92-3,99 (m, 2H), 3,27-3,37 (m, 2H), 3,09 (q, J=7,0 Гц, 2H), 2,95-3,05 (m, 1Н), 2,68-2,79 (m, 2H), 2,41 (s, 3H), 2,33 (s, 3H), 2,32 (s, 3H), 2,26-2,36 (m, 2H), 2,19 (s, 3H), 2,03-2,12 (m, 2H), 1,80-1,91 (m, 2H), 1,62-1,76 (m, 4H), 0,89 (t, J=7,0 Гц, 3H); MC (ИЭР) [M+H]+ 588,7; ВЭЖХ 97,0% чистота.
1-Метилазетидин-3-ол
К раствору бензил-3-гидроксиазетидин-1-карбоксилата (134 мг, 0,646 ммоль) в ТГФ (5,0 мл) при 0°С при перемешивании добавляли алюмогидрид лития (75,0 мг, 0,968 ммоль) и смесь перемешивали при температуре обратной конденсации в течение 2 часов. После охлаждения до 0°С к смеси добавляли воду (75 мкл), 5 н. вод. раствор NaOH (75 мкл) и воду (225 мкл) и смесь перемешивали при кт в течение 30 мин. Осажденное твердое вещество удаляли при помощи фильтрования. Фильтрат концентрировали в вакууме. Остаток применяли на следующей стадии без дополнительной очистки (бесцветная маслянистая жидкость, 107 мг, количественный выход). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 4,35-4,43 (m, 1Н), 3,63-3,68 (m, 2H), 2,88-2,96 (m, 2H), 2,35 (s, 3Н).
5-Бром-2-[(1-метилазетидин-3-ил)окси]пиридин
К раствору неочищенного 1-метилазетидин-3-ола (107 мг, 1,23 ммоль) в ТГФ (5,0 мл) при перемешивании добавляли NaH (60%, 64,1 мг, 1,60 ммоль). Реакционную смесь перемешивали в течение 15 мин. При 0°С добавляли 2,5-дибромпиридин (292 мг, 1,23 ммоль) и смесь перемешивали при температуре обратной конденсации в течение 17 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Органический слой промывали водой и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями гептан/этилацетат=6/1-2/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (38,8 мг, выход 25%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,14 (d, J=2,6 Гц, 1Н), 7,64 (dd, J=8,8, 2,6 Гц, 1Н), 6,66 (d, J=8,8 Гц, 1Н), 5,12-5,20 (m, 1Н), 3,71-3,87 (m, 2H), 3,02-3,17 (m, 2H), 2,40 (s, 3Н).
Метил-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилазетидин-3-ил)окси]пиридин-3-ил}бензоат
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (77,2 мг, 0,192 ммоль) и 5-бром-2-[(1-метилазетидин-3-ил)окси]пиридина (38,8 мг, 0,160 ммоль) в 1,4-диоксане (2,0 мл) и воде (0,5 мл) при перемешивании добавляли Pd(PPh3)4 (27,7 мг, 0,0240 ммоль) и карбонат натрия (60,9 мг, 0,575 ммоль). Реакционную смесь перемешивали при 80°С в течение 1,5 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Смесь фильтровали и разделяли. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесями гептан/этилацетат=3/1-1/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (33,1 мг, 47%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,31 (dd, J=2,6, 0,7 Гц, 1Н), 7,78 (dd, J=8,8, 2,6 Гц, 1Н), 7,72 (d, J=2,2 Гц, 1Н), 7,40 (d, J=1,8 Гц, 1Н), 6,79-6,85 (m, 1Н), 5,22-5,30 (m, 1Н), 3,93-4,00 (m, 2H), 3,92 (s, 3H), 3,83-3,89 (m, 2H), 3,28-3,38 (m, 2H), 3,06-3,21 (m, 4H), 2,95-3,06 (m, 1Н), 2,53 (s, 3H), 2,43 (s, 3H), 1,63-1,78 (m, 4H), 0,90 (t, J=7,1 Гц, 3H).
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилазетидин-3-ил)окси]пиридин-3-ил}бензамид
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилазетидин-3-ил)окси]пиридин-3-ил}бензоата (33,1 мг, 0,0753 ммоль) в метаноле (600 мкл) при перемешивании добавляли вод. раствор NaOH (5 н., 150 мкл). Реакционную смесь перемешивали при 60°С в течение 1 часа. После охлаждения до КТ реакционную смесь концентрировали в вакууме и сушили под вакуумом с получением неочищенной натриевой соли 3-[этил(оксан-4-ил)амино]-2-метил-5-{6-[(1-метилазетидин-3-ил)окси]пиридин-3-ил}бензойной кислоты.
К раствору неочищенной натриевой соли карбоновой кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (21,3 мг, 0,113 ммоль) в ДМСО (300 мкл) при перемешивании добавляли PYBOP (98,0 мг, 0,188 ммоль) и основание Хунига (39,4 мкл, 0,226 ммоль). Реакционную смесь перемешивали при КТ в течение 21 часа. Реакцию гасили водой. Смесь экстрагировали этилацетатом (1 мл, два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=10/1) с получением указанного в заголовке соединения в виде белого твердого вещества (11,6 мг, 28%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,25 (d, J=2,0 Гц, 1Н), 7,71 (dd, J=8,8, 2,0 Гц, 1Н), 7,25 (d, J=1,6 Гц, 1Н), 7,20 (d, J=1,6 Гц, 1Н), 7,18 (t, J=5,9 Гц, 1Н), 6,76 (d, J=8,8 Гц, 1Н), 5,93 (s, 1Н), 5,17-5,28 (m, 1Н), 4,56 (d, J=5,9 Гц, 2Н), 3,95 (m, 2H), 3,79-3,87 (m, 2H), 3,27-3,37 (m, 2H), 3,05-3,18 (m, 4H), 2,94-3,04 (m, 1Н), 2,39-2,44 (s×2, 6H), 2,34 (s, 3Н), 2,19 (s, 3Н), 1,62-1,72 (m, 4H), 0,88 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 560,6; ВЭЖХ 71,0% чистота.
1-(5-Йодпиридин-2-ил)-4-метил-1,4-диазепан
К раствору 2-бром-5-йодпиридина (200 мг, 0,704 ммоль) и 1-метилгомопиперазина (121 мг, 1,06 ммоль) в НМП (3 мл) при перемешивании добавляли карбонат калия (146 мг, 1,06 ммоль). Реакционную смесь подвергали воздействию микроволнового излучения при 150°С в течение 2 часов. После завершения реакции к смеси добавляли этилацетат и воду. Водный слой экстрагировали этилацетатом, и объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью гептан/этилацетат=6/1-2/1) с получением указанного в заголовке соединения в виде белого твердого вещества (187 мг, 83%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,23-8,28 (m, 1H), 7,60 (dd, J=9,0, 2,4 Гц, 1H), 6,33 (d, J=9,0 Гц, 1H), 3,74-3,81 (m, 2H), 3,55-3,63 (m, 2H), 2,63-2,70 (m, 2H), 2,51-2,59 (m, 2H), 2,37 (s, 3H), 1,96-2,04 (m, 2H).
Метил-3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(4-метил-1,4-диазепан-1-ил)пиридин-3-ил]бензоат
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (180 мг, 0,446 ммоль) и 1-(5-йодпиридин-2-ил)-4-метил-!,4-диазепана (184 мг, 0,580 ммоль) в 1,4-диоксане (4 мл) и воде (1 мл) при перемешивании добавляли Pd(PPh3)4 (77,4 мг, 0,067 ммоль) и карбонат натрия (170 мг, 1,61 ммоль). Реакционную смесь перемешивали при 80°С в течение 14,5 часов. После охлаждения до КТ к смеси добавляли этилацетат и воду. Водный слой экстрагировали этилацетатом. Объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (1; SiO2; смесью гептан/этилацетат=3/1-1/1, 2; SiO2; смесями от гептан/этилацетат=1/1 до этилацетат/МеОН=8/1, затем CHCl3/МеОН=5/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (25,5 мг, выход 12%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,38 (d, J=2,4 Гц, 1H), 7,72 (d, J=1,8 Гц, 1H), 7,68 (dd, J=8,8, 2,4 Гц, 1H), 7,41 (d, J=1,8 Гц, 1H), 6,56 (d, J=8,8 Гц, 1H), 3,86-4,01 (m, 4H), 3,92(s, 3H), 3,64-3,68 (m, 2H), 3,29-3,38 (m, 2H), 3,10 (q, J=7, 0 Гц, 2H), 2,96-3,06 (m, 1H), 2,75-2,84 (m, 2H), 2,60-2,70 (m, 2H), 2,51 (s, 3H), 2,43 (s, 3H), 2,05-2,17 (m, 2H), 1,61-1,80 (m, 4H), 0,90 м.д. (t, J=7,0 Гц, 3H).
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(4-метил-1,4-диазепан-1-ил)пиридин-3-ил]бензамид
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(4-метил-1,4-диазепан-1-ил)пиридин-3-ил]бензоата (25,5 мг, 0,055 ммоль) в этаноле (2 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 44 мкл). Реакционную смесь перемешивали при 90°С в течение 1,5 часов. После охлаждения до 0°С и нейтрализации 5 н. вод. раствором HCl реакционную смесь концентрировали в вакууме и сушили под вакуумом с получением неочищенной натриевой соли 3-[этил(оксан-4-ил)амино]-2-метил-5-[6-(4-метил-1,4-диазепан-1-ил)пиридин-3-ил]бензойной кислоты.
К раствору неочищенной натриевой соли карбоновой кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (13,4 мг, 0,071 ммоль) в ДМСО (2 мл) при перемешивании добавляли PYBOP (42,7 мг, 0,082 ммоль) и основание Хунига (47,6 мкл, 0,273 ммоль). Реакционную смесь перемешивали при КТ в течение 15 часов. Реакцию гасили водой. Смесь экстрагировали этилацетатом (10 мл, два раза), и объединенный органический слой промывали водой (два раза) и солевым раствором. Органический слой сушили над MgSO4 и фильтровали. Фильтрат концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=50/1-10/1) с получением неочищенного соединения. Неочищенное соединение суспендировали с этилацетатом и гептаном. Полученное осажденное твердое вещество собирали при помощи фильтрования. Твердое вещество сушили под вакуумом с получением указанного в заголовке соединения в виде белого твердого вещества (9,20 мг, 28%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 9,74 (ушир s, 1H), 8,32 (d, J=2,6 Гц, 1H), 7,61 (dd, J=8,8, 2,6 Гц, 1H), 7,26 (ушир s, 1H), 7,19 (d, J=1,8 Гц, 1H), 7,04-7,09 (m, 1H), 6,51 (d, J=8,8 Гц, 1Н), 5,91 (s, 1H), 4,54 (d, J=5,9 Гц, 2H), 3,92-3,99 (m, 2H), 3,82-3,89 (m, 2H), 3,63-3,69 (m, 2H), 3,27-3,38 (m, 2H), 2,95-3,13 (m, 3H), 2,68-2,76 (m, 2H), 2,55-2,62 (m, 2H), 2,41 (s, 3H), 2,39 (s, 3H), 2,32 (s, 3H), 2,20 (s, 3H), 1,99-2,09 (m, 2H), 1,62-1,77 (m, 4H), 0,88 (t, J=7,0 Гц, 3H); MC (ИЭР) [М+Н]+ 587,7; ВЭЖХ 95,0% чистота.
1-[(5-Бромпиридин-2-ил)метил]пиперидин-4-ол
К раствору (4-бромфенил)метанола (2,00 г, 10,6 ммоль) в CH2Cl2 (40 мл) при перемешивании добавляли метансульфонилхлорид (1,46 г, 12,8 ммоль) и основание Хунига (5,54 мл, 31,8 ммоль). Реакционную смесь перемешивали при КТ в течение 1 часа. Затем к реакционной смеси добавляли пиперидин-4-ол (5,36 г, 53,0 ммоль), и полученную смесь перемешивали при КТ в течение 16 часов. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток растворяли в этилацетате и воде. Водный слой экстрагировали этилацетатом (100 мл, два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью гептан/этилацетат=1/3) с получением указанного в заголовке соединения в виде коричневой маслянистой жидкости (1,97 г, выход 69%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,61 (d, J=2,3 Гц, 1H), 7,78 (dd, J=8,2, 2,3 Гц, 1H), 7,34 (d, J=8,2 Гц, 1H), 3,73 (m, 1H), 3,60 (s, 2H), 2,72-2,82 (m, 2H), 2,19-2,29 (m, 2H), 1,90 (m, 2H), 1,55-1,68 (m, 2H); MC (ИЭР) [М+Н]+ 271,1, 273,1.
Метил-3-[этил(оксан-4-ил)амино]-5-{6-[(4-гидроксипиперидин-1-ил)метил]пиридин-3-ил}-2-метилбензоат
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (480 мг, 1,19 ммоль) и 1-[(5-бромпиридин-2-ил)метил]пиперидин-4-ола (484 мг, 1,79 ммоль) в 1,4-диоксане (10 мл) и H2O (2,5 мл) при перемешивании добавляли Pd(PPh3)4 (138 мг, 0,119 ммоль) и карбонат натрия (378 мг, 3,57 ммоль). Реакционную смесь перемешивали при 80°С в течение 4 часов. Затем реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; этилацетатом) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (520 мг, 93%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,76 (d, J=2,3 Гц, 1H), 7,84 (dd, J=8,4, 2,3 Гц, 1H), 7,69 (d, J=8,4 Гц, 1H), 7,49 (ушир, 1H), 7,47 (ушир, 1H), 3,98 (m, 2H), 3,94 (s, 3Н), 3,74 (m, 1H), 3,72 (s, 2H), 3,36 (m, 2H), 3,14 (q, J=6,8 Гц, 2H), 2,99-3,09 (m, 1H), 2,73-2,87 (m, 2H), 2,56 (s, 3Н), 2,20-2,34 (m, 2H), 1,94 (m, 2H), 1,64-1,80 (m, 6H), 0,93 (t, J=6,8 Гц, 3Н); MC (ИЭР) [М+Н]+ 468,4.
3-[Этил(оксан-4-ил)амино]-5-{6-[(4-гидроксипиперидин-1-ил)метил]пиридин-3-ил}-2-метил-N-{[6-метил-2-оксо-4-(2-пропил)-1,2-дигидропиридин-3-ил]метил}бензамид
К раствору метил-3-[этил(оксан-4-ил)амино]-5-{6-[(4-гидроксипиперидин-1-ил)метил]пиридин-3-ил}-2-метилбензоата (520 мг, 1,11 ммоль) в метаноле (10 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 1 мл). Реакционную смесь перемешивали при 60°С в течение 1 часа. После охлаждения до КТ реакционную смесь концентрировали в вакууме и сушили под вакуумом с получением неочищенной натриевой соли 3-[этил(оксан-4-ил)амино]-5-{6-[(4-гидроксипиперидин-1-ил)метил]пиридин-3-ил}-2-метилбензойной кислоты.
К раствору неочищенной натриевой соли карбоновой кислоты и HCl соли 3-(аминометил)-6-метил-4-(2-пропил)-1,2-дигидропиридин-2-она (361 мг, 1.67 ммоль) в ДМСО (5 мл) при перемешивании добавляли PYBOP (145 мг, 2,78 ммоль) и основание Хунига (580 мкл, 3,33 ммоль). Реакционную смесь перемешивали при КТ в течение 20 часов. Реакцию гасили водой. Смесь экстрагировали этилацетатом (10 мл, два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=10/1) с получением указанного в заголовке соединения в виде белого твердого вещества (250 мг, 37%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 8,68 (d, J=2,0 Гц, 1Н), 7,77 (dd, J=7,8, 2,0 Гц, 1Н), 7,44 (d, J=7,8 Гц, 1Н), 7,29 (d, J=2,0 Гц, 1Н), 7,23 (d, J=2,0 Гц, 1Н), 7,13 (t, J=5,9 Гц, 1Н), 6,04 (s, 1Н), 4,62 (d, J=5,9 Гц, 2H), 3,96 (m, 2H), 3,73 (m, 1Н), 3,68 (s, 2H), 3,55 (m, 1Н), 3,27-3,43 (m, 2H), 3,11 (q, J=7,0 Гц, 2H), 2,97-3,06 (m, 1Н), 2,77-2,87 (m, 2H), 2,35 (s, 3Н), 2,24 (s, 3Н), 2,21-2,31 (m, 2H), 1,85-1,99 (m, 2H), 1,64-1,75 (m, 6H), 1,23 (s, 3Н), 1,22 (s, 3Н), 0,90 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 616,7; ВЭЖХ 97,4% чистота.
1-[(4-Бром-2-фторфенил)метил]пиперидин-4-ол
К раствору (4-бром-2-фторфенил)метанола (2,00 г, 9,76 ммоль) в CH2Cl2 (40 мл) при перемешивании добавляли метансульфонилхлорид (1,34 г, 11,7 ммоль) и основание Хунига (5,09 мл, 29,3 ммоль). Реакционную смесь перемешивали при КТ в течение 3 часов. Затем к реакционной смеси добавляли пиперидин-4-ол (4,94 г, 48,8 ммоль), и полученную смесь перемешивали при КТ в течение 16 часов. Реакцию гасили водой, и смесь концентрировали в вакууме. Остаток растворяли в этилацетате и воде. Водный слой экстрагировали этилацетатом (100 мл, два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью гептан/этилацетат=1/2) с получением указанного в заголовке соединения в виде светло-желтого твердого вещества (1,97 г, 70%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,24-7,31 (m, 2Н), 7,19-7,23 (m, 1Н), 3,70 (m, 1H), 3,53 (m, 2H), 2,70-2,79 (m, 2H), 2,15-2,25 (m, 2H), 1,89 (m, 2H), 1,52-1,64 (m, 2H); MC (ИЭР) [М+Н]+ 288,1, 290,0.
Метил-3-[этил(оксан-4-ил)амино]-5-{3-фтор-4-[(4-гидроксипиперидин-1-ил)метил]фенил}-2-метилбензоат
К раствору метил-3-[этил(оксан-4-ил)амино]-2-метил-5-(тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (430 мг, 1,07 ммоль) и 1-[(4-бром-2-фторфенил)метил]пиперидин-4-ола (461 мг, 1,60 ммоль) в 1,4-диоксане (8 мл) и H2O (2 мл) при перемешивании добавляли Pd(PPh3)4 (124 мг, 0,107 ммоль) и карбонат натрия (340 мг, 3,21 ммоль). Реакционную смесь перемешивали при 80°С в течение 6 часов. Затем реакционную смесь фильтровали через слой целита. Фильтрат концентрировали в вакууме, полученный остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; этилацетатом) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (461 мг, 89%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,42-7,48 (m, 2H), 7,28-7,37 (m, 2H), 7,19-7,24 (m, 1H), 3,98 (m, 2H), 3,93 (s, 3Н), 3,71 (m, 1H), 3,63 (s, 2H), 3,29-3,40 (m, 2H), 3,13 (q, J=7,0 Гц, 2H), 2,97-3,07 (m, 1H), 2,71-2,86 (m, 2H), 2,55 (s, 3Н), 2,15-2,29 (m, 2H), 1,92 (m, 4H), 1,65-1,80 (m, 4Н), 0,92 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 485,4.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(оксан-4-ил)амино]-5-{3-фтор-4-[(4-гидроксипиперидин-1-ил)метил]фенил}-2-метилбензамид
К раствору метил-3-[этил(оксан-4-ил)амино]-5-{3-фтор-4-[(4-гидроксипиперидин-1-ил)метил]фенил}-2-метилбензоата (461 мг, 1,11 ммоль) в метаноле (10 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 1 мл). Реакционную смесь перемешивали при 60°С в течение 1 часа. После охлаждения до КТ реакционную смесь концентрировали в вакууме и сушили под вакуумом с получением неочищенной натриевой соли 3-[этил(оксан-4-ил)амино]-5-{3-фтор-4-[(4-гидроксипиперидин-1-ил)метил]фенил}-2-метилбензойной кислоты.
К раствору неочищенной натриевой соли карбоновой кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (269 мг, 1,43 ммоль) в ДМСО (4 мл) при перемешивании добавляли PYBOP (1,24 мг, 2,38 ммоль) и основание Хунига (497 мкл, 2,85 ммоль). Реакционную смесь перемешивали при КТ в течение 20 часов. Реакцию гасили водой. Смесь экстрагировали этилацетатом (10 мл, два раза), и объединенный органический слой концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; смесью этилацетат/МеОН=20/1) с получением указанного в заголовке соединения в виде белого твердого вещества (208 мг, 36%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,32-7,37 (m, 1H), 7,19-7,31 (m, 4H), 7,14 (dd, J=11,1, 1,8 Гц, 1H), 5,90 (s, 1H), 4,55 (d, J=5,9 Гц, 2H), 3,94 (m, 2H), 3,60-3,69 (m, 1H), 3,55 (s, 2H), 3,31 (m, 2H), 3,09 (q, J=7,0 Гц, 2H), 2,95-3,04 (m, 1H), 2,71-2,81 (m, 2H), 2,39 (s, 3H), 2,34 (s, 3H), 2,14-2,23 (m, 2H), 2,12 (s, 3Н), 1,83 (m, 2H), 1,66-1,72 (m, 4H), 1,50-1,62 (m, 2H), 1,25 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 605,6; ВЭЖХ 99,7% чистота.
Азетидин-3-ол 2,2,2-трифторацетат
К раствору трет-бутил-3-гидроксиазетидин-1-карбоксилата (3,44 г, 19,9 ммоль) в ДХМ (10 мл) при КТ при перемешивании осторожно добавляли ТФУ (10 мл, 130 ммоль). После протекания реакции в течение 1,5 ч растворители удаляли в вакууме с получением неочищенного указанного в заголовке соединения (6,65 г, 35,5 ммоль, выход 179%, с остаточным количеством ТФУ) в виде светло-желтой маслянистой жидкости. Продукт применяли на следующей стадии без дополнительной очистки. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 8,6 (ушир, 2Н), 4,52 (m, 1H), 4,06 (m, 2H), 3,73 (m, 2H).
1-(5-Бромпиридин-2-ил)азетидин-3-ол
К неочищенному азетидин-3-ол-2,2,2-трифторацетату (6,65 г, 19,9 ммоль, содержащему предположительно 2,93 г остаточного ТФУ) при перемешивании при помощи магнитной мешалки порциями в течение 5 мин (осторожно, экзотермическая реакция) добавляли триэтиламин (6,77 мл, 48,5 ммоль) с получением двухфазной смеси. Добавляли ацетонитрил (5 мл) (образование одного слоя), а затем 2,5-дибромпиридин (500 мг, 2,11 ммоль). Реакционную смесь грели при 80°С в течение 16 ч. После охлаждения до комнатной температуры реакционную смесь разбавляли водой (30 мл) и экстрагировали смесью EtOAc-гептан (1:1, 5×30 мл). Объединенные экстракты промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. В результате очистки при помощи колоночной хроматографии на силикагеле (30%-100% смесями EtOAc-гептан) получали указанное в заголовке соединение (108 мг, выход 22%) в виде бесцветной стеклообразной пленки. 1H-ЯМР (400 МГц, C6D6) δ м.д. 8,25 (dd, J=2, 4, 0,6 Гц, 1Н), 7,12 (dd, J=8,8, 2,3 Гц, 1H), 5,54 (dd, J=8,8, 0,6 Гц, 1H), 4,06 (m, 1H), 3,77 (m, 2H), 3,43-3,67 (m, 2H); MC (ИЭР) [М+Н]+ 229,0.
2-Бром-5-((1-метилпиперидин-4-ил)окси)пиразин
К раствору гидрохлоридной соли 1-метилазетидин-3-ола (442 мг, 3,57 ммоль) в ДМФА (10 мл) при 0°С добавляли NaH в минеральном масле (60%, 286 мг, 7,15 ммоль) и полученную смесь перемешивали в течение 0,5 ч. Затем порциями добавляли дибромпиразин (1,0 г, 4,20 ммоль). Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 14 ч. Реакцию гасили добавлением насыщенного водного раствора NH4Cl и смесь экстрагировали EtOAc (3×40 мл). Объединенную орг.фазу промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали под вакуумом. Неочищенную смесь очищали при помощи флэш-хроматографии (SiO2, 30%-100% смесями EtOAc : гептан) с получением указанного в заголовке соединения (230 мг, 26%). 1H-ЯМР (400 МГц): δ м.д. 8,15 (d, J=1,2 Гц, 1Н), 8,03 (d, J=1,2 Гц, 1H), 5,17 (add, J=11,2, 5,6, 5,6 Гц, 1Н), 3,82-3,79 (m, 2H), 3,16-3,12 (m, 2H), 2,42 (s, 3H).
2-Бром-5-((1-метилпиперидин-4-ил)окси)пиразин
Указанное в заголовке соединение получали (450 мг, выход 27%) при помощи способа, описанного для 2-бром-5-((1-метилпиперидин-4-ил)окси)пиразина. 1H-ЯМР (400 МГц): δ м.д. 8,15 (d, J=1,2 Гц, 1Н), 7,99 (d, J=1,6 Гц, 1Н), 5,00 (dddd, J=8,0, 8,0, 4,0, 4,0, 1Н), 2,79-2,66 (m, 2H), 2,35-2,26 (m, 2H), 2,32 (s, 3H), 2,08-2,02 (m, 2H), 1,90-1,81 (m, 2H).
5-Бром-2-(метоксиметил)пиридин
К раствору (5-бромпиридин-2-ил)метанола (0,474 г, 2,52 ммоль) в ТГФ (30 мл, 366 ммоль) и ДМФА (10 мл, 129 ммоль) при 0°С добавляли гидрид натрия (60% в минеральном масле, 0,202 г, 5,04 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После охлаждения реакционной смеси до 0°С добавляли метилйодид (0,158 мл, 2,52 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, и данные ЖХМС свидетельствовали об отсутствии исходного материала. Реакционную смесь охлаждали до 0°С, реакцию гасили МеОН, и смесь концентрировали. Неочищенный продукт очищали при помощи хроматографии на силикагеле смесью этилацетатом/гептан с получением указанного в заголовке соединения (35,0 мг, выход 6,87%). 1H-ЯМР (400 МГц): δ м.д. 8,59 (d, J=2,4 Гц, 1Н), 7,79 (dd, J=8,1, 2,4 Гц, 1Н), 7,30 (d, J=7,9 Гц, 1Н), 4,50 (s, 2H), 3,44 (s, 3Н); MC (ИЭР) [М+Н]+ 202,0.
1-Метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазин
В герметичную пробирку добавляли 1-((5-бромпиридин-2-ил)метил)-4-метилпиперазин (500 мг, 1,85 ммоль), бис(пинаколато)диборон (564 мг, 2,22 ммоль), ацетат калия (272 мг, 2,78 ммоль) и 1,4-диксан (8 мл, 93,5 ммоль). Смесь дегазировали путем продувания N2 в течение 15 мин. Затем добавляли трициклогексилфосфин (67,5 мг, 0,241 ммоль) и трис(дибензилиденацетон)дипалладий(0) (85,0 мг, 0,093 ммоль) и дополнительно дегазировали в течение 15 мин. Затем темную смесь герметизировали в атмосфере N2 и грели в течение 8 ч при 80°С. Данные MC (требуется применение проточно-инжекционного способа) свидетельствовали о получении целевой массы 318 (М+Н) и отсутствии пика исходного вещества при 270/272. Реакционную смесь фильтровали через целит и промывали диксаном (10 мл), а затем EtOAc (10 мл). Объединенный зеленоватый темно-желтый фильтрат концентрировали и сушили под вакуумом в течение ночи с получением продукта в виде неочищенной вязкой желтой маслянистой жидкости (1,33 г, выход 227%). 1H-ЯМР соответствовал неочищенному продукту. Неочищенный материал применяли непосредственно без дополнительной очистки. 1H-ЯМР (400 МГц) δ м.д. 8,91 (s, 1H), 8,04 (d, J=7,6 Гц, 1H), 7,40 (d, J=7,6 Гц, 1H), 3,71 (s, 2H), 2,61 (ушир, 8Н), 2,36 (s, 3H), 1,36 (s, 12H); МС (ИЭР) [М+Н]+ 318,3.
2-(Метоксиметил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин
Указанное в заголовке соединение получали (90,0 мг, выход 209%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде светло-желтой маслянистой жидкости. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 250,3.
1-(5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)азетидин-3-ол
Указанное в заголовке соединение получали (270 мг, выход 213%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде светло-желтого полукристаллического твердого вещества. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 277,3.
Трет-бутил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазин-1-карбоксилат
Указанное в заголовке соединение получали (1,18 мг, выход 232%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде неочищенной маслянистой жидкости. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 404,4.
1-(5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)пиперидин-4-ол
Указанное в заголовке соединение получали (320 мг, выход 180%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде желто-оранжевого полукристаллического твердого вещества. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 304,2.
2-(4-Метилпиперазин-1-ил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразин
Указанное в заголовке соединение получали (420 мг, выход 237%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде красной маслянистой жидкости. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 305,3.
2-((1-Метилазетидин-3-ил)окси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразин
Указанное в заголовке соединение получали (360 мг, выход 216%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде светло-желтого полукристаллического твердого вещества. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 292,2.
2-((1-Метилпиперидин-4-ил)окси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразин
Указанное в заголовке соединение получали (260 мг, выход 128%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде светло-желтого полукристаллического твердого вещества. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 320,2.
2-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-5-(трифторметил)пиразин
Указанное в заголовке соединение получали (77,0 мг, выход 40%) при помощи способа, описанного для 1-метил-4-((5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-ил)метил)пиперазина, в виде темноватой маслянистой жидкости. Неочищенный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 275,1.
2,6-Транс-диметилпиперидин-4-он
К раствору 1-бензил-2,6-транс-диметилпиперидин-4-она (4,80 г, 22,1 ммоль) в МеОН (100 мл) добавляли влажный 10% Pd/C (1,0 г) в атмосфере N2. Газ N2 заменяли на газ H2, и смесь перемешивали в течение 18 ч при КТ в атмосфере водорода. Газ H2 заменяли на газ N2. Смесь фильтровали через целит, промывали МеОН и концентрировали в вакууме. Неочищенный материал применяли непосредственно без дополнительной очистки.
Трет-бутил-2,6-транс-диметил-4-оксопиперидин-1-карбоксилат
К раствору 2,6-транс-диметилпиперидин-4-она (1,20 г, неочищенного) и ди-трет-бутил-дикарбоната (10,3 г, 47,2 ммоль) в ДХМ (15 мл) при перемешивании добавляли триэтиламин (15,0 мл, 108 ммоль). Реакционную смесь перемешивали при КТ в течение 20 часов. Реакционную смесь концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесью гептан/EtOAc=3/1) с получением указанного в заголовке соединения в виде белого твердого вещества (1,40 г, выход 65%). 1H-ЯМР (400 МГц) δ м.д. 4,40 (m, 2H), 2,86 (dd, J=6,8, 18,0 Гц, 2Н), 2,39 (dd, J=1,6, 17,6 Гц, 2H), 1,51 (s, 9H), 1,27 (d, J=6,4 Гц, 6Н).
Трет-бутил-4-((5-бром-3-(метоксикарбонил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
К раствору метил-3-амино-5-бром-2-метилбензоата (3,65 г, 15,0 ммоль) и трет-бутил-2,6-транс-диметил-4-оксопиперидин-3-карбоксилата (3,00 г, 13,2 ммоль) в 1,2-дихлорэтане (18 мл, 228 ммоль) при КТ добавляли уксусную кислоту (6 мл, 105 ммоль) и смесь перемешивали в течение 15 мин. Затем добавляли триацетоксиборгидрид натрия (8,39 г, 40,0 ммоль) и смесь перемешивали в течение ночи (17 ч). Данные ТСХ (20% Е/Н) продемонстрировали Rf=0,35 для анилина, Rf=0,25 для кетона и Rf=0,45 для нового пятна. Исходный кетон (ограничивающее исходное вещество) отсутствовал. Реакцию гасили медленным добавлением нас. раствора NaHCO3 до получения рН смеси примерно 8. Отделенную вод. фазу экстрагировали 3×EtOAc. Объединенную орг. фазу сушили (Na2SO4), фильтровали и концентрировали с получением светло-желтой маслянистой жидкости. Маслянистую жидкость очищали при помощи колоночной флэш-хроматографии (SiO2, 15% смесью EtOAc : гептан) с получением указанного в заголовке соединения в виде получистого белого твердого вещества (2,65 г, выход 41%). Неочищенный материал применяли непосредственно без дополнительной очистки. Данный материал применяли непосредственно без дополнительной очистки. МС (ИЭР) [М+Н]+ 455,3, 457,3.
Трет-бутил-4-((5-бром-3-(метоксикарбонил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
К раствору трет-бутил-4-((5-бром-3-(метоксикарбонил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата (2,65 г, 5,81 ммоль) и ацетальдегида (0,657 мл, 11,6 ммоль) в 1,2-дихлорэтане (15 мл, 190 ммоль) при комнатной температуре добавляли уксусную кислоту (1,99 мл, 34,9 ммоль) и полученную смесь перемешивали в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия (3,70 г, 17,4 ммоль) и смесь перемешивали при комнатной температуре в течение 3 ч. Реакцию гасили медленным добавлением насыщенного водного раствора NaHCO3 до получения рН смеси 8. Водную фазу экстрагировали EtOAc. Объединенные органические фазы сушили с Na2SO4, фильтровали и концентрировали в вакууме с получением светло-желтой маслянистой жидкости. Маслянистую жидкость очищали при помощи колоночной флэш-хроматографии (SiO2, 10% смесью EtOAc : гептан) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (1,81 г, выход 64%). 1H-ЯМР (400 МГц) δ м.д. 7,73 (d, J=2,1 Гц, 1Н), 7,35 (d, J=2,1 Гц, 1H), 4,27 (m, 1H), 3,90 (s, 3H), 3,66 (m, 1H), 3,35 (m, 1H), 2,92-3,10 (m, 2H), 2,45 (s, 3H), 1,75-1,95 (m, 3H), 1,48 (m, 1H), 1,46 (s, 9H), 1,35 (d, J=6,7 Гц, 3H), 1,20 (d, J=6,7 Гц, 3H), 0,85 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 483,3, 485,4.
5-Бром-3-((1-(трет-бутоксикарбонил)-2,6-транс-диметилпиперидин-4-ил)(этил)амино)-2-метилбензойная кислота
Указанное в заголовке соединение получали (1,75 г, выход 100%) при помощи способа, аналогичного способу получения 3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензойной кислоты. 1H-ЯМР (400 МГц) δ м.д. 7,87 (d, J=2,1 Гц, 1H), 7,37 (d, J=2,1 Гц, 1H), 4,25 (m, 1H), 3,64 (m, 1H), 3,33 (m, 1H), 2,90-3,10 (m, 2H), 2,49 (s, 3H), 1,71-1,92 (m, 3H), 1,47 (m, 1H), 1,44 (s, 9H), 1,33 (d, J=6,7 Гц, 3Н), 1,17 (d, J=6,7 Гц, 3Н), 0,84 (t, J=7,0 Гц, 3Н); MC (ИЭР) [M+H]+469,3, 471,3.
Трет-бутил-4-((5-бром-3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (2,10 г, выход 93%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (400 МГц) δ м.д. 7,18 (s, 2H), 5,95 (s, 1H), 4,50 (d, J=5,9 Гц, 2H), 4,25 (m, 1H), 3,60 (m, 1H), 3,31 (m, 1H), 2,98 (m, 2H), 2,37 (s, 3Н), 2,23 (s, 6H), 1,82 (m, 2H), 1,74 (m, 1H), 1,44 (m, 1H), 1,43 (s, 9H), 1,31 (d, J=6,7 Гц, 3Н), 1,15 (d, J=6,7 Гц, 3Н), 0,81 (t, J=6,7 Гц, 3Н); МС (ИЭР) [М+Н]+ 603,5, 605,5.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Раствор трет-бутил-4-((5-бром-3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата (100 мг, 0,166 ммоль), 2-метокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (58,4 мг, 0,249 ммоль) и карбоната натрия (61,5 мг, 0,58 ммоль) в 1,4-диоксане (1 мл, 11,7 ммоль) и воде (0,2 мл, 11,1 ммоль) дегазировали путем продувания N2 в течение 15 мин. Затем добавляли Pd(Ph3P)4 (19,1 мг, 0,017 ммоль) и дополнительно дегазировали в течение 10 мин. Затем смесь герметизировали и грели при 100°С в течение 4,5 ч. Данные МС свидетельствовали о завершении реакции. Смесь разбавляли 5 мл воды, экстрагировали 3×EtOAc, сушили (Na2SO4), фильтровали и концентрировали. Маслянистую жидкость очищали при помощи колоночной флэш-хроматографии (SiO2, 10%-100% смесями EtOAc : гептан) с получением указанного в заголовке соединения (88 мг, выход 84%). 1H-ЯМР (400 МГц) δ м.д. 8,31 (d, J=2,4 Гц, 1Н), 7,72 (dd, J=2,4, 8,5 Гц, 1Н), 7,27 (s, 1Н), 7,24 (ушир, 1Н), 6,80 (d, J=8,5 Гц, 1Н), 5,94 (s, 1Н), 4,56 (d, J=5,8 Гц, 2H), 4,29 (ушир, 1Н), 3,98 (s, 3H), 3,65 (m, 1Н), 3,44 (m, 1Н), 3,07 (m, 2H), 2,43 (s, 3H), 2,36 (s, 3H), 2,21 (s, 3H), 1,75-1,98 (m, 3H), 1,55 (m, 1Н), 1,46 (s, 9H), 1,35 (d, J=6,4 Гц, 3H), 1,20 (d, J=6,7 Гц, 3H), 0,89 (ушир, 3H); МС (ИЭР) [М+Н]+ 632,5.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(6-(морфолинометил)пиридин-3-ил)фенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (116 мг, выход 100%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,71 (d, J=2,0 Гц, 1Н), 8,04 (dd, J=2,0, 8,3 Гц, 1Н), 7,61 (d, J=7,8 Гц, 1Н), 7,49 (d, J=1,5 Гц, 1Н), 7,37 (d, J=2,0 Гц, 1Н), 4,50 (s, 2H), 4,21 (m, 1Н), 3,71 (m, 6H), 3,59 (m, 1Н), 3,13 (m, 2H), 2,53 (m, 2H), 2,40 (s, 3H), 2,35 (s, 3H), 2,25 (s, 3H), 1,89 (m, 2H), 1,58 (m, 1Н), 1,45 (s, 9H), 1,35 (d, J=6,9 Гц, 3H), 1,25 (d, J=7,2 Гц, 3H), 0,89 (t, d, J=6,9 Гц, 3H); МС (ИЭР) [М+Н]+ 701,6.
Трет-бутил-4-((5-(3-((1-(трет-бутоксикарбонил)-2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4-метилфенил)пиридин-2-ил)метил)пиперазин-1-карбоксилат
Указанное в заголовке соединение получали (133 мг, выход 100%) в виде получистого соединения при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. МС (ИЭР) [М+Н]+ 800,8. Продукт применяли на следующей стадии без дополнительной очистки.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(6-((4-метилпиперазин-1-ил)метил)пиридин-3-ил)фенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (68,0 мг, выход 58%) в виде получистого соединение при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. МС (ИЭР) [М+Н]+ 714,7. Продукт применяли на следующей стадии без дополнительной очистки.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метил-5-(6-(4-метилпиперазин-1-ил)пиридин-3-ил)фенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилат
Указанное в заголовке соединение получали (100 мг, выход 87%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. 1H-ЯМР (500 МГц) δ м.д. 12,20 (ушир s, 1H), 8,35 (d, J=2,4 Гц, 1H), 7,62 (dd, J=2,4, 8,8 Гц, 1H), 7,23 (d, J=2,0 Гц, 1H), 7,21 (d, J=1,5 Гц, 1H), 7,17 (t, J=5,9 Гц, 1H), 6,85 (d, J=8,8 Гц, 1H), 5,92 (s, 1H), 4,56 (d, J=5,9 Гц, 2Н), 4,26 (m, 1H), 3,64 (m, 1H), 3,58 (t, J=4,9 Гц, 4Н), 3,43 (m, 1H), 2,97-3,11 (m, 2Н), 2,54 (t, J=4,9 Гц, 4Н), 2,40 (s, 3H), 2,16 (s, 3H), 2,13 (s, 3H), 2,14 (s, 3H), 1,75-1,93 (m, 3H), 1,50 (m, 1H), 1,45 (s, 9H), 1,33 (d, J=6,8 Гц, 3H), 1,18 (d, J=6,8 Гц, 3H), 0,85 (t, J=7,3 Гц, 3H); MC (ИЭР) [М+Н]+ 700,7.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(6-метоксипиридин-3-ил)-2-метилбензамид
4 M раствор HCl (3 мл, 12,0 ммоль) в диоксане при КТ добавляли к раствору трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата (88,0 мг, 0,139 ммоль) в ДХМ (2 мл) и сразу наблюдали выпадение белого осадка. Через 1 ч данные МС свидетельствовали о завершении реакции. Данные ТСХ (50% Е/Н) свидетельствовали об отсутствии пятна исходного вещества при Rf=0,3, наблюдали только базовую линию. Смесь концентрировали и очищали при помощи обращенно-фазовой ВЭЖХ с получением указанного в заголовке соединения (39,6 мг, выход 54%). 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,30 (d, J=2,6 Гц, 1Н), 7,88 (dd, J=2,3, 8,8 Гц, 1Н), 7,39 (s, 1Н), 7,26 (d, J=1,5 Гц, 1Н), 6,84 (d, J=8,8 Гц, 1Н), 6,08 (s, 1Н), 4,45 (s, 2H), 3,90 (s, 3Н), 3,55 (m, 1Н), 3,26 (m, 1Н), 3,17 (m, 3Н), 2,36 (s, 3Н), 2,28 (s, 3Н), 2,21 (s, 3Н), 1,93 (ушир d, J=12,3 Гц, 1Н), 1,80 (m, 2H), 1,25 (m, 1Н), 1,24 (d, J=7,0 Гц, 3Н), 1,13 (d, J=6,1 Гц, 3Н), 0,87 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 532,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-2-метил-5-(6-(морфолинометил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (30,0 мг, выход 30%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(6-метоксипиридин-3-ил)-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,67 (d, J=2,4 Гц, 1Н), 8,01 (dd, J=2,4, 8,0 Гц, 1Н), 7,57 (d, J=8,2 Гц, 1Н), 7,46 (s, 1Н), 7,33 (s, 1Н), 6,08 (s, 1Н), 4,46 (s, 2H), 3,67 (m, 6H), 3,55 (m, 1Н), 3,31 (m, 1Н), 3,14 (m, 3Н), 2,49 (m, 4H), 2,36 (s, 3Н), 2,30 (s, 3Н), 2,21 (s, 3Н), 1,90 (m Гц, 1Н), 1,78 (m, 2H), 1,25 (m, 1Н), 1,24 (d, J=7,0 Гц, 3Н), 1,13 (d, J=6,1 Гц, 3Н), 0,87 (t, J=7,0 Гц, 3Н); МС (ИЭР) [M+H]+ 601,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-2-метил-5-(6-(пиперазин-1-илметил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (27,0 мг, выход 27%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(6-метоксипиридин-3-ил)-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,67 (d, J=2,3 Гц, 1Н), 8,01 (dd, J=2,3, 8,2 Гц, 1Н), 7,58 (d, J=8,2 Гц, 1Н), 7,45 (d, J=1,8 Гц, 1Н), 7,32 (d, J=1,8 Гц, 1Н), 6,08 (s, 1Н), 4,46 (s, 2H), 3,66 (s, 2H), 3,47 (m, 1Н), 3,25 (m, 2Н), 3,13 (m, 2Н), 3,05 (m, 1Н), 2,84 (m, 4Н), 2,49 (m, 4Н), 2,36 (s, 3H), 2,30 (s, 3Н), 2,21 (s, 3H), 1,95 (m Гц, 1Н), 1,75 (m, 2H), 1,25 (m, 1Н), 1,20 (d, J=7,0 Гц, 3Н), 1,09 (d, J=6,1 Гц, 3Н), 0,87 (t, J=6,7 Гц, 3Н); МС (ИЭР) [М+Н]+ 600,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-2-метил-5-(6-((4-метилпиперазин-1-ил)метил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (35,0 мг, выход 59%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(6-метоксипиридин-3-ил)-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,66 (d, J=1,5 Гц, 1Н), 8,00 (dd, J=2,1, 8,2 Гц, 1Н), 7,55 (d, J=8,2 Гц, 1Н), 7,44 (ушир, 1Н), 7,31 (ушир, 1Н), 6,08 (s, 1H), 4,46 (s, 2H), 3,68 (s, 2H), 3,45 (m, 1Н), 3,30 (m, 2H), 3,14 (m, 2H), 2,98 (m, 1Н), 2,50 (m, 7H), 2,36 (s, 3H), 2,29 (s, 3Н), 2,25 (s, 3H), 2,21 (s, 3Н), 1,85 (m, 1Н), 1,75 (m, 2H), 1,25 (m, 1Н), 1,19 (d, J=7,0 Гц, 3Н), 1,05 (d, J=6,1 Гц, 3Н), 0,86 (t, J=6,7 Гц, 3Н); МС (ИЭР) [M+H]+ 614,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-2-метил-5-(6-(4-метилпиперазин-1-ил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (106 мг, выход 54%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-(6-метоксипиридин-3-ил)-2-метилбензамида. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 8,34 (d, J=2,5 Гц, 1Н), 7,81 (J=2,5, 9,3 Гц, 1Н), 7,40 (d, J=1,5 Гц, 1Н), 7,26 (d, J=1,5 Гц, 1Н), 6,90 (d, J=9,3 Гц, 1Н), 6,12 (s, 1Н), 4,50 (s, 2H), 3,60 (m, 4H), 3,49 (m, 1Н), 3,26 (m, 1Н), 3,15 (m, 2H), 3,06 (m, 1Н), 2,57 (m, 4H), 2,40 (s, 3Н), 2,36 (s, 3H), 2,31 (s, 3Н), 2,24 (s, 3Н), 1,90 (m, 1Н), 1,78 (m, 2H), 1,28 (m, 1Н), 1,23 (d, J=6,9 Гц, 3Н), 1,12 (d, J=6,4 Гц, 3Н), 0,90 (t, J=6,9 Гц, 3Н); МС (ИЭР) [M+H]+ 600,5.
3-((4-Транс-аминоциклогексил)(этил)амино)-5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
Указанное в заголовке соединение получали при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида, с последующей очисткой при помощи хроматографии на силикагеле (10% 7 н. NH3/MeOH в ДХМ) (440 мг, 100%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,30 (d, J=2,0 Гц, 1H), 7,17 (d, J=2,0 Гц, 1H), 6,10 (s, 1H), 4,46 (s, 2H), 3,07 (q, J=7,0 Гц, 2Н), 2,75-2,68 (m, 1H), 2,60-2,53 (m, 1H), 2,37 (s, 3Н), 2,25 (s, 3Н), 2,22 (s, 3Н), 1,90-1,84 (m, 2H), 1,84-1,78 (m, 2H), 1,50-1,41 (m, 2H), 1,14-1,05 (m, 2H), 0,85 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 489,3.
5-Бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензамид
Указанное в заголовке соединение получали при помощи способа, аналогичного способу получения метил-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензоата, с последующей очисткой при помощи хроматографии на силикагеле (10% 7 н. NH3/МеОН в ДХМ) (335 мг, 72%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,31 (d, J=2,0 Гц, 1H), 7,17 (d, J=2,0 Гц, 1H), 6,11 (s, 1H), 4,46 (s, 2H), 3,08 (q, J=7,0 Гц, 2H), 2,75-2,67 (m, 1H), 2,38 (s, 3Н), 2,28 (s, 6H), 2,25 (s, 3Н), 2,29-2,23 (m, 1H), 2,21 (s, 3Н), 1,98-1,85 (m, 4H), 1,49-1,39 (m, 2H), 1,28-1,19 (m, 2H), 0,86 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 519,4.
5-Бром-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
Указанное в заголовке соединение получали (361 мг, выход 31%) при помощи способа, аналогичного способу получения 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метилбензамида. 1H-ЯМР (400 МГц) δ м.д. 13,8 (ушир, s, 1H), 7,20 (s, 1H), 7,08 (t, J=5,4 Гц, 1H), 5,09 (s, 1H), 4,60 (d, J=5, 9 Гц, 2Н), 3,96 (ушир, d, J=11,2 Гц, 2Н), 3,52 (m, 1H), 3,32 (m, 2Н), 3,06 (m, 2Н), 2,96 (m, 1H), 2,30 (s, 3Н), 2,27 (s, 3H), 1,64-1,72 (m, 4H), 1,22 (d, J=6,4 Гц, 6H), 0,88 (t, J=7,3 Гц, 3Н)); MC (ИЭР) [М+Н]+ 504,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метил-5-(6-(морфолинометил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (64,0 мг, выход 67%) в виде светло-желтого твердого вещества при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 8,68 (d, J=2,0 Гц, 1H), 8,03 (dd, J=8,0 Гц, J=2,0 Гц, 1H), 7,60 (d, J=8,0 Гц, 1H), 7,46 (d, J=2,0 Гц, 1H), 7,34 (d, J=2,0 Гц, 1H), 6,10 (s, 1H), 4,50 (s, 2Н), 3,71 (m, 4H), 3,68 (s, 2Н), 3,17 (q, J=7,0 Гц, 2Н), 2,82-2,75 (m, 1H), 2,54-2,50 (m, 4H), 2,39 (s, 3H), 2,34 (s, 3H), 2,24 (s, 9H), 2,23-2,16 (m, 1H), 1,98-1,90 (m, 4H), 1,51-1,41 (m, 2H), 1,27-1,17 (m, 2H), 0,90 (t, J=7,0 Гц, 3H); MC (ИЭР) [M+H]+ 615,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(метоксиметил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (64,0 мг, выход 67%) в виде светло-желтого твердого вещества при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 8,66 (d, J=2,2 Гц, 1H), 8,03 (dd, J=2,2 и 8,0 Гц, 1H), 7,54 (d, J=8,0 Гц, 1H), 7,43 (d, J=2,0 Гц, 1H), 7,30 (d, J=2,0 Гц, 1H), 6,08 (s, 1H), 4,55 (s, 2H), 4,45 (s, 2H), 3,44 (s, 3H), 3,14 (q, J=7,0 Гц, 2H), 2,75 (m, 1H), 2,36 (s, 3H), 2,29 (s, 9H), 2,21 (s, 3H), 2,19-2,25 (m, 1H), 1,93 (m, 4H), 1,45 (m, 2H), 1,23 (m, 2H), 0,86 (t, J=7,0 Гц, 3H); MC (ИЭР) [М+Н]+ 560,5.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(3-гидроксиазетидин-1-ил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (31,0 мг, выход 27%) в виде светло-желтого твердого вещества при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,20 (d, J=2,4 Гц, 1Н), 7,77 (dd, J=8,5, 2,4 Гц, 1Н), 7,33 (d, J=1,8 Гц, 1Н), 7,20 (d, J=1,8 Гц, 1Н), 6,48 (d, J=8,5 Гц, 1Н), 6,10 (s, 1Н), 4,70 (m, 1Н), 4,48 (s, 2H), 4,28 (dd, J=9,4, 6,4 Гц, 2H), 3,82 (dd, J=9,4, 4,5 Гц, 2H), 3,14 (q, J=7,0 Гц, 2H), 2,75 (m, 1Н), 2,38 (s, 3Н), 2,29 (s, 3H), 2,24 (s, 6H), 2,23 (s, 3Н), 2,17-2,26 (m, 1Н), 1,93 (m, 4H), 1,44 (m, 2H), 1,21 (m, 2H), 0,88 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 587,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(4-гидроксипиперидин-1-ил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (51,0 мг, выход 54%) в виде белого твердого вещества при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,28 (d, J=2,6 Гц, 1Н), 7,75 (dd, J=9,0, 2,6 Гц, 1Н), 7,34 (d, J=1,8 Гц, 1Н), 7,22 (d, J=1,8 Гц, 1Н), 6,87 (d, J=8,8 Гц, 1Н), 6,08 (s, 1Н), 4,47 (s, 2H), 4,07 (dt, J=13,5, 4,1 Гц, 2H), 3,82 (m, 1Н), 3,13 (m, 4H), 2,75 (m, 1Н), 2,38 (s, 3Н), 2,29 (s, 3Н), 2,23 (s, 9H), 2,16-2,25 (m, 1Н), 1,91 (m, 6H), 1,39-1,56 (m, 4Н), 1,21 (m, 2H), 0,88 (t, J=6, 9 Гц, 3Н); МС (ИЭР) [М+Н]+ 615,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метил-5-(5-(4-метилпиперазин-1-ил)пиразин-2-ил)бензамид
Указанное в заголовке соединение получали (18,0 мг, выход 19%) в виде светло-желтой стеклообразной пленки при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,54 (s, 1Н), 8,24 (s, 1H), 7,77 (d, J=1,5 Гц 1Н), 7,56 (d, J=1,2 Гц, 1Н), 6,11 (s, 1Н), 4,49 (s, 2H), 3,68 (m, 4Н), 3,15 (q, J=6,9 Гц, 2H), 2,75 (m, 1Н), 2,57 (m, 4Н), 2,39 (s, 3Н), 2,35 (s, 3Н), 2,31 (s, 3Н), 2,25 (s, 6H), 2,24 (s, 3Н), 2,19-2,25 (m, 1Н), 1,94 (m, 4Н), 1,45 (m, 2H), 1,22 (m, 2H), 0,88 (t, J=6,9 Гц, 3Н); МС (ИЭР) [М+Н]+ 615,7.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-формилпиридин-3-ил)-2-метилбензамид
В пробирку для микроволнового нагревателя вносили 5-бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензамид (286 мг, 0,553 ммоль), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиколинальдегид (193 мг, 0,829 ммоль), карбонат натрия (205 мг, 1,934 ммоль), 1,4-диоксан (3340 мкл, 39,0 ммоль) и воду (667 мкл, 37,0 ммоль). Суспензию продували N2 в течение 5 мин и добавляли Pd(Ph3P)4 (63,9 мг, 0,055 ммоль). Реакционную смесь продували N2 в течение дополнительных 5 минут, герметизировали и нагревали до 100°С в течение 45 мин при помощи микроволнового излучения. После охлаждения до комнатной температуры смесь разбавляли водой (15 мл) и экстрагировали 10% раствором МеОН/ДХМ (3×50 мл). Объединенные органические слои сушили (Na2SO4) и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (12 г колонка, 7 н. раствор NH3 в МеОН/ДХМ=5-20%) с получением указанного в заголовке соединения в виде получистого желтого твердого вещества (260 мг, выход 87%). МС (ИЭР) [М+Н]+ 544,4. Указанный получистый продукт применяли на следующей стадии без дополнительной очистки.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метил-5-(6-((4-метил-1,4-диазепан-1-ил)метил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (19,0 мг, выход 32%) при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-этил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,64 (dd, J=2,42, 0,86 Гц, 1Н), 8,00 (dd, J=8,14, 2,35 Гц, 1Н), 7,60 (d, J=8,1 Гц, 1Н), 7,42 (d, J=2,02 Гц, 1Н), 7,29 (d, J=1,8 Гц, 1H), 6,08 (s, 1H), 4,46 (s, 2H), 3,80 (s, 2H), 3,14 (m, 2H), 2,78 (m, 7H), 2,72 (m, 2H), 2,38 (s, 3H), 2,36 (s, 3H), 2,36-2,29 (m, 2H), 2,29 (s, 9H), 2,21 (s, 3H), 1,93 (m, 4H), 1,86 (m, 2H), 1,45 (m, 1H), 1,22 (m, 2Н), 0,86 (t, J=7,7 Гц, 3Н); MC (ИЭР) [М+Н]+ 642,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(((S)-3-гидроксипиперидин-1-ил)метил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (10,0 мг, выход 20%) в виде белого твердого вещества при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-этил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,65 (d, J=2,2 Гц, 1Н), 8,00 (dd, J=1,3 Гц, 2,4 Гц, 1Н), 7,56 (d, J=8,1 Гц, 1Н), 7,42 (d, J=1,66 Гц, 1Н), 7,30 (d, J=1,65 Гц, 1Н), 6,08 (s, 1Н), 4,46 (s, 2Н), 3,67 (m, 3Н), 3,14 (m, 2Н), 2,78 (m, 2Н), 2,36 (s, 3Н), 2,32 (s, 6H), 2,29 (s, 3Н), 2,25-2,40 (m, 1Н), 2,21 (s, 3Н), 2,14 (m, 1Н), 1,93 (d, J=9,8 Гц, 4H), 1,75 (m, 1Н), 1,44 (m, 4H), 1,21 (m, 5H), 0,86 (t, J=7,7 Гц, 3Н); MC (ИЭР) [М+Н]+ 629,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(((S)-3-гидроксипирролидин-1-ил)метил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (7,00 мг, выход 15%) в виде белого твердого вещества при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-этил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,65 (d, J=2,4 Гц, 1Н), 8,00 (dd, J=1,4, 2,4 Гц, 1Н), 7,56 (d, J=7,5 Гц, 1Н), 7,42 (d, J=1,9 Гц, 1Н), 7,29 (d, J=1,8 Гц, 1Н), 6,08 (s, 1Н), 4,45 (s, 2H), 4,32 (m, 1Н), 3,78 (q, J=13,9, 8,25 Гц, 2H), 3,14 (q, J=7,0 Гц, 2H), 2,80 (m, 3Н), 2,54 (m, 2H), 2,36 (s, 3Н), 2,29 (s, 3H), 2,22 (s, 6H), 2,21 (s, 3Н), 2,14 (m, 1Н), 1,91 (m, 4H), 1,76 (m, 1Н), 1,44 (m, 2H), 1,21 (m, 4H), 0,86 (t, J=7,1 Гц, 3Н); MC (ИЭР) [М+Н]+ 615,6.
N-((4-Изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-(((S)-3-гидроксипирролидин-1-ил)метил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали при помощи способа, аналогичного вышеописанному способу получения соединения 148.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(6-((3-гидроксиазетидин-1-ил)метил)пиридин-3-ил)-2-метилбензамид
Указанное в заголовке соединение получали (7,00 мг, выход 12%) в виде белого твердого вещества при помощи способа, аналогичного способу получения N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-этил-2,6-транс-диметилпиперидин-4-ил)амино)-5-фтор-2-метилбензамида. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,66 (d, J=2 Гц, 1Н) 7,99 (dd, J=2,6, 2,4 Гц, 1H), 7,44 (d, J=7,9 Гц, 1Н), 7,42 (d, J=1,8 Гц, 1Н), 7,29 (d, J=1,8 Гц, 1 H), 6,08 (s, 1Н), 4,46 (s, 2H), 4,35 (m, 1Н), 3,79 (ушир, 2H), 3,67 (m, 2H), 3,14 (m, 2H), 3,05 (m, 2H), 2,75 (m, 1Н), 2,36 (s, 3Н), 2,29 (s, 3Н), 2,27 (s, 6H), 2,21 (s, 3H), 1,92 (m, 4H), 1,44 (m, 2H), 1,23 (m, 3Н), 0,86 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 601,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(5-метоксипиразин-2-ил)-2-метилбензамид
Указанное в заголовке соединение получали (11,2 мг, выход 21%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил) метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 8,57 (J=1,2 Гц, 1Н), 8,21 (J=1,2 Гц, 1Н), 7,83 (d, J=1,8 Гц 1Н), 7,61 (d, J=1,8 Гц, 1Н), 6,21 (J=0,9 Гц, 1Н), 4,52 (s, 2H), 3,97 (s, 3Н), 3,88 (ушир d, J=11,6 Гц, 2H), 3,44 (m, 1Н), 3,32 (m, 2H), 3,13 (q, J=7,0 Гц, 2H), 3,07 (m, 1Н), 2,31 (s, 3Н), 2,24 (s, 3Н), 1,72 (m, 2H), 1,62 (m, 2H), 1,21 (d, J=6,7 Гц, 6H), 0,86 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 534,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил) метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(5-(трифторметил)пиразин-2-ил)бензамид
Указанное в заголовке соединение получали (5,10 мг, выход 8,1%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц): δ м.д. 10,30 (ушир, 1Н), 9,05 (d, J=1,2 Гц, 1Н), 8,92 (d, J=0,8 Гц, 1Н), 7,90 (d, J=2,0 Гц, 1Н), 7,74 (d, J=1,6 Гц, 1Н), 7,24 (t, J=6,0 Гц 1Н), 5,95 (s, 1Н), 4,57 (d, J=6,0 Гц, 2Н), 3,97 (ушир d, J=7, 9 Гц, 2Н), 3,37-3,31 (m, 2Н), 3,15 (q, J=7, 0 Гц 2Н), 3,06 (dddd, J=7,4, 7,4, 7,4, 7,4 Гц, 1Н), 2,43 (s, 3H), 2,40 (s, 3H), 2,22 (s, 3H), 1,74-1,66 (m, 4H), 0,91 (t, J=1, 0 Гц 3H); МС (ИЭР) [М+Н]+ 544,5.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(5-((1-метилпиперидин-4-ил)окси)пиразин-2-ил)бензамид
Указанное в заголовке соединение получали (28,0 мг, выход 22%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц): δ м.д. 8,39 (d, J=1,2 Гц, 1Н), 8,17 (d, J=1,2 Гц, 1Н), 7,68 (d, J=1,2 Гц, 1Н), 7,58 (d, J=1, 6 Гц, 1Н), 7,20 (t, J=5,6 Гц, 1Н), 5,91 (s, 1Н), 5,07-5,03 (m, 1Н), 4,56 (d, J=5,8 Гц, 2H), 3,94 (ушир d, J=11,3 Гц, 2Н), 3,32 (ddd, J=11,1, 11,1, 2,8 Гц, 2H), 3,11 (q, J=7,0 Гц, 2H), 3,04 (dddd, J=9,4, 9,4, 4,9, 4,9 Гц, 1Н), 2,76-2,69 (m, 2H), 2,40 (s, 3H), 2,36 (s, 3H), 3,33-3,28 (m, 2H), 2,32 (s, 3H), 2,15 (s, 3H), 2,09-2,05 (m, 4H), 1,86 (dddd, J=12,5, 12,5, 3,7, 3,7 Гц, 2H), 1,74-1,64 (m, 2H), 0,88 (t, J=7, 0 Гц, 3H); МС (ИЭР) [М+Н]+ 589,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(5-((1-метилазетидин-3-ил)окси)пиразин-2-ил)бензамид
Указанное в заголовке соединение получали (21,0 мг, выход 18%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц): δ м.д. 8,39 (d, J=1,2 Гц, 1Н), 8,21 (d, J=1,6 Гц, 1Н), 7,69 (d, J=2,0 Гц, 1Н), 7,59 (d, J=1,6 Гц, 1Н), 7,22 (t, J=6,0 Гц, 1Н), 5,91 (s, 1Н), 5,21 (dddd, J=5,9, 5,9, 5,9, 5,9 Гц, 1Н), 4,56 (d, J=5,8 Гц, 2H), 3,94 (ушир d, J=11,3 Гц, 2H), 3,83-3,80 (m, 2H), 3,32 (ddd, J=11,1, 11,1, 3,2 Гц, 2H), 3,17-3,09 (m, 4H), 3,06 (dddd, J=10,1, 10,1, 5,0, 5,0 Гц, 1Н), 2,41 (s, 3H), 2,40 (s, 3H), 2,36 (s, 3H), 2,15 (s, 3H), 1,74-1,64 (m, 4H), 0,88 (t, J=7, 0 Гц, 3H); МС (ИЭР) [М+Н]+ 561,5.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(5-изопропоксипиразин-2-ил)-2-метилбензамид
Указанное в заголовке соединение получали (23,0 мг, выход 34%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата, с последующей очисткой при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц): δ м.д. 8,40 (d, J=1,2 Гц, 1Н), 8,12 (d, J=1,2 Гц, 1Н), 7,69 (d, J=2,0 Гц, 1Н), 7,59 (d, J=2,0 Гц, 1Н), 7,24 (t, J=6,0 Гц 1Н), 5,91 (s, 1Н), 5,27 (septet, J=6,4 Гц, 1Н), 4,56 (d, J=5,6 Гц, 2Н), 3,94 (ушир d, J=11,2 Гц, 2H), 3,32 (ddd, J=11,2, 11,2, 2,8 Гц, 2Н), 3,12 (q, J=7,2 Гц, 2Н), 3,32 (dddd, J=9, 9, 9,9, 4,8, 4,8 Гц, 1Н), 2,40 (s, 3H), 2,36 (s, 3H), 2,14 (s, 3H), 1,73-1,66 (m, 4H), 1,38 (s, 3H), 1,37 (s, 3H), 0,89 (t, J=7,0 Гц, 3H); МС (ИЭР) [М+Н]+ 534,5.
Метил-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(морфолин-4-ил)-1-пропин-1-ил]бензоат
К раствору метил-5-бром-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метилбензоата (80 мг, 0,201 ммоль) и 4-(1-пропин-3-ил)морфолина (0,051 мл, 0,4 ммоль) в ДМФА (4 мл) при перемешивании добавляли Pd(PPh3)4 (23,0 мг, 0,0199 ммоль), CuI (7,60 мг, 0,0399 ммоль) и триэтиламин (0,056 мл, 0,399 ммоль). Реакционную смесь перемешивали при 80°С в течение 1,5 часов. Смесь охлаждали до кт, разбавляли EtOAc и водой и фильтровали через слой целита. Фильтрат разделяли. Органический слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смесей EtOAc/гептан=1/3-1/1 до EtOAc) с получением указанного в заголовке соединения в виде неочищенного продукта (73,2 мг, ~76% чистота, 64%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,68 (ушир s, 1H), 7,29 (ушир s, 1H), 3,89 (s, 3Н), 3,77-3,80 (m, 4H), 3,50 (s, 2H), 3,03 (q, J=6,8 Гц, 2H), 2,60-2,67 (m, 5H), 2,47 (s, 3Н), 2,26 (s, 6H), 2,13-2,20 (m, 1H), 1,85-1,91 (m, 4H), 1,17-1,36 (m, 4H), 0,84 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 442,4.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(морфолин-4-ил)проп-1-ин-1-ил]бензамид
К раствору метил-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(морфолин-4-ил)-1-пропин-1-ил]бензоата (56,2 мг, 0,127 ммоль) в этаноле (1,5 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 0,051 мл). Реакционную смесь перемешивали при 70°С в течение 1,5 часов. После охлаждения до КТ реакционную смесь концентрировали в вакууме, перегоняли в виде азеотропа с толуолом (два раза) и сушили в вакууме.
К раствору неочищенной 3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(морфолин-4-ил)-1-пропин-1-ил]бензойной кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (31,1 мг, 0,165 ммоль) в ДМСО (2 мл) при перемешивании добавляли PYBOP (100 мг, 0,191 ммоль) и основание Хунига (0,066 мл, 0,381 ммоль). Реакционную смесь перемешивали при КТ в течение 14 ч. Реакцию гасили водой, смесь разбавляли CHCl3 и разделяли. Органический слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смесей EtOAc/MeOH=10/1-5/1). Смесь растирали со смесью EtOAc-гексан с получением указанного в заголовке соединения (34,7 мг, 49%). Соединение дополнительно очищали при помощи преп.ТСХ (NH-SiO2; смесью EtOAc/МеОН=10/1; 4 проявления) и растирали со смесью EtOAc-гексан с получением соединения с высокой степенью чистоты в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,15 (s, 1Н), 7,13 (s, 1Н), 7,03 (t, J=6, 4 Гц, 1Н), 5,92 (s, 1H), 4,51 (d, J=6,4 Гц, 2H), 3,73-3,86 (m, 4H), 3,48 (s, 2H), 3,01 (q, J=7,2 Гц, 2H), 2,62-2,66 (m, 5H), 2,40 (s, 3H), 2,29 (s, 3H), 2,25 (s, 6H), 2,23 (s, 3H), 2,11-2,19 (m, 1Н), 1,82-1,87 (m, 4H), 1,12-1,42 (m, 4H), 0,83 (t, J=7,2 Гц, 3H); МС (ИЭР) [М+Н]+ 562,6; ВЭЖХ 95,4% чистота.
1-Метил-4-(1-пропин-3-ил)-1,4-диазепан
К раствору 3-бром-1-пропина (прибл. 9,2 M, 865 мкл, 7,96 ммоль) в ацетоне (8 мл) при перемешивании добавляли карбонат цезия (2,85 г, 8,76 ммоль) и 1-метилгомопиперазин (1,00 г, 8,76 ммоль). Реакционную смесь перемешивали при КТ в течение 18 часов. Затем реакционную смесь фильтровали, и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения в виде коричневой маслянистой жидкости (887 мг, 61%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 3,38 (s, 1Н), 3,37 (s, 1Н), 2,76-2,84 (m, 4H), 2,63-2,70 (m, 4H), 2,37 (s, 3H), 1,85 (s, 1H), 1,79-1,89 (m, 2H).
Метил-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(4-метил-1,4-диазепан-1-ил)-1-пропин-1-ил]бензоат
К раствору метил-5-бром-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метилбензоата (295 мг, 0,742 ммоль) и 1-метил-4-(1-пропин-4-ил)-1,4-диазепана (338 мг, 2,23 ммоль) в ДМФА (7,4 мл) при перемешивании добавляли Рd(РРh3)4 (171 мг, 0,148 ммоль), CuI (28 мг, 0,148 ммоль) и триэтиламин (0,31 мл, 2,23 ммоль). Реакционную смесь перемешивали при 80°С в течение 2 часов. Смесь охлаждали до кт, разбавляли EtOAc и водой и фильтровали через слой целита. Фильтрат разделяли. Органический слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от смесей EtOAc/гептан=1/2-1/1 до EtOAc) с получением указанного в заголовке соединения в виде неочищенного продукта (120 мг, 72% чистота, 35%). 1H-ЯМР (400 МГц, CDCl3) δ м.д. 7,29-7,33 (m, 2H), 3,89 (s, 3Н), 3,58 (s, 2H), 3,03 (q, J=7,2 Гц, 2H), 2,85-2,90 (m, 4H), 2,62-2,71 (m, 5H), 2,47 (s, 3Н), 2,38 (s, 3Н), 2,25 (s, 6H), 2,13-2,20 (m, 1H), 1,84-1,90 (m, 6H), 1,13-1,40 (m, 4H), 0,84 (t, J=7,2 Гц, 3Н); MC (ИЭР) [M+H]+ 469,5.
N-[(4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(4-метил-1,4-диазепан-1-ил)-1-пропин-1-ил]бензамид
К раствору метил-3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(4-метил-1,4-диазепан-1-ил)-1-пропин-1-ил]бензоата (120 мг, 0,256 ммоль) в этаноле (4 мл) при перемешивании добавляли вод. раствор NaOH (5 н., 0,150 мл). Реакционную смесь перемешивали при 70°С в течение 2 часов. После охлаждения до КТ реакционную смесь нейтрализовывали 2 н. раствором HCl (0,25 мл), концентрировали в вакууме, перегоняли в виде азеотропа с толуолом (два раза) и сушили в вакууме.
К раствору неочищенной 3-{[транс-4-(диметиламино)циклогексил](этил)амино}-2-метил-5-[3-(4-метил-1,4-диазепан-1-ил)-1-пропин-1-ил]бензойной кислоты и HCl соли 3-(аминометил)-4,6-диметил-1,2-дигидропиридин-2-она (63,0 мг, 0,333 ммоль) в ДМФА (4 мл) при перемешивании добавляли PYBOP (200 мг, 0,384 ммоль) и основание Хунига (0,179 мл, 1,02 ммоль). Реакционную смесь перемешивали при КТ в течение 14 ч. Смесь выпаривали. Остаток очищали при помощи колоночной хроматографии на силикагеле (NH-SiO2; от EtOAc до смесей EtOAc/MeOH=10/1-5/1) с получением указанного в заголовке соединения (101 мг, 67%). Соединение дополнительно очищали при помощи преп. ТСХ (NH-SiO2; смесью EtOAc/MeOH=10/1; 4 проявления) и растирали со смесью ТБМЭ-гексан с получением соединения с высокой степенью чистоты в виде белого твердого вещества. 1H-ЯМР (400 МГц, ДМСО-d6) δ м.д. 7,13-7,16 (m, 1Н), 7,13 (s, 1H), 7,12 (s, 1H), 5,92 (s, 1H), 4,50 (d, J=6,0 Гц, 2H), 3,55 (s, 2H), 3,01 (q, J=7,2 Гц, 2Н), 2,84-2,90 (m, 4H), 2,69-2,73 (m, 4H), 2,59-2,65 (m, 1H), 2,39 (s, 3Н), 2,37 (s, 3Н), 2,30 (s, 3Н), 2,24 (s, 6H), 2,22 (s, 3H), 2,12-2,17 (m, 1H), 1,84-1,89 (m, 6H), 1,13-1,40 (m, 4H), 0,83 (t, J=7,2 Гц, 3Н); MC (ИЭР) [М+Н]+ 589,6; ВЭЖХ 93,5% чистота.
3-((трет-бутилдифенилсилил)окси)-1-(проп-2-ин-1-ил)азетидин
К раствору 3-((трет-бутилдифенилсилил)окси)азетидина (935 мг, 3,00 ммоль) и основания Хунига (786 мл, 4,50 ммоль) в ДХМ (10 мл) при -78°С при перемешивании медленно добавляли пропаргилбромид (267 мл, 3,00 ммоль). Через 5 мин реакционную смесь медленно нагревали до 23°С и перемешивали в течение 1 ч. Реакцию гасили нас. вод. раствором NaHCO3 и водой, вод. фазу экстрагировали ДХМ, объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали при помощи колоночной хроматографии на силикагеле (смесью гептан/EtOAc=3/1) с получением указанного в заголовке соединения в виде бесцветной маслянистой жидкости (588 мг, выход 49%). 1H-ЯМР (400 МГц) δ м.д. 7,63 (m, 4H), 7,40 (m, 6H), 4,42 (dddd, J=5,6 Гц, 1Н), 3,45 (ddd, J=2,4, 6,0, 6,0 Гц, 2Н), 3,28 (d, J=2,4 Гц, 2Н), 3,19 (ddd, J=2,0, 6,0, 6,0 Гц, 2Н), 2,27 (t, J=2,4 Гц, 1Н), 1,06 (s, 9H).
Метил-5-(3-(3-((трет-бутилдифенилсилил)окси)азетидин-1-ил)проп-1-ин-1-ил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензоат
Раствор 3-((трет-бутилдифенилсилил)окси)-1-(проп-2-ин-1-ил)азетидина (584 мг, 1,67 ммоль), метил-5-бром-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензоата (604 мг, 1,52 ммоль) и триэтиламина (2,10 мл, 15,2 ммоль) в ДМФА (15 мл) продували N2 в течение 10 мин. Затем добавляли CuI (28,9 мг, 152 ммоль) и Pd(PPh3)4 (88,0 мг, 0,076 ммоль) и продували N2 в течение дополнительных 10 мин. Реакционную смесь грели при 100°С в течение 6 ч, а затем охлаждали до кт. Реакцию гасили нас. вод. раствором NaHCO3 и водой, и отделенную вод. фазу экстрагировали ТБМЭ. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи колоночной хроматографии на силикагеле (10% 7 н. NH3 в МеОН/ДХМ) с получением указанного в заголовке соединения в виде светло-коричневой пены (709 мг, выход 70%). 1H-ЯМР (400 МГц) δ м.д. 7,58 (m, 5H), 7,39 (m, 7H), 4,40 (dddd, J=6, 0 Гц, 1Н), 3,83 (s, 3Н), 3,49 (s, 2H), 3,42 (m, 2H), 3,36 (m, 2H), 3,05 (ddd, J=6,8 Гц, 2H), 2,65 (m, 1H), 2,44 (s, 3Н), 2,25 (s, 6H), 2,23 (m, 1H), 1,89 (ушир d, J=9,6 Гц, 4Н), 1,37 (m, 2H), 1,19 (m, 2H), 0,99 (s, 9H), 0,82 (t, J=6,8 Гц, 3Н); MC (ИЭР) [М+Н]+ 666,6.
3-((4-Транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-2-метилбензойная кислота
К раствору метил-5-(3-(3-((трет-бутилдифенилсилил)окси)азетидин-1-ил)проп-1-ин-1-ил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-2-метилбензоата (696 мг, 1,05 ммоль) в EtOH (10 мл) добавляли 1,0 н. вод. раствор NaOH (3,2 мл, 3,20 ммоль). Реакционную смесь грели при 60°С в течение 6 ч. После охлаждения до 23°С добавляли 1,0 н. вод. раствор HCl (3,3 мл, 3,30 ммоль). Смесь концентрировали в вакууме с получением указанного в заголовке соединения в виде неочищенных продуктов. MC (ИЭР) [М+Н]+ 414,4.
3-((4-Транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
К раствору 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-2-метилбензойной кислоты (неочищенной, 432 мг, 1,05 ммоль) и 3-(аминометил)-4-изопропил-6-метилпиридин-2(1Н)-она (162 мг, 0,90 ммоль) в ДМСО (5 мл) при перемешивании добавляли EDC (258 мг, 1,45 ммоль) и НОВТ (206 мг, 1,35 ммоль). Реакционную смесь перемешивали при 23°С в течение 20 ч. Фракцию смеси очищали при помощи ВЭЖХ с получением указанного в заголовке соединения в виде белого твердого вещества (16,7 мг). 1H-ЯМР (400 МГц) δ м.д. 7,25 (d, J=1,6 Гц, 1Н), 7,10 (d, J=1,2 Гц, 1Н), 6,24 (s, 1Н), 4,51 (s, 2H), 4,36 (dddd, J=6,4 Гц, 1Н), 3,64 (dd, J=2,0, 6,4 Гц, 2H), 3,52 (s, 2H), 3,44 (m, 1Н), 3,17 (dd, J=2,0, 6,4 Гц, 2H), 3,08 (ddd, J=6, 8 Гц, 2H), 2,69 (m, 1Н), 2,28 (s, 6H), 2,26 (s, 6H), 2,23 (m, 1Н), 1,92 (m, 4H), 1,43 (m, 2H), 1,23 (d, J=6,8 Гц, 6H), 1,24 (m, 2H), 0,84 (t, J=6,8 Гц, 3Н). 13С-ЯМР (400 МГц) δ м.д. 172,26, 166,06, 163,28, 151,26, 145,72, 140,51, 135,90, 129,27, 126,36, 121,68, 121,28, 105,95, 85,86, 84,79, 64,88, 63,19, 63,00, 62,30, 47,16, 42,07, 41,74, 35,86, 31,08, 29,63, 28,45, 23,03, 19,01, 15,55, 13,78; МС (ИЭР) [М+Н]+ 576,6.
1-(Проп-2-ин-1-ил)пиперидин
К раствору пиперидина (388 мг, 4,56 ммоль) в ацетоне (10 мл) при перемешивании добавляли Cs2CO3 (1490 мг, 4,56 ммоль), а затем по каплям добавляли 3-бромпроп-1-ин (542 мг, 4,56 ммоль). После перемешивания в течение выходных при кт реакционную смесь фильтровали, и фильтрат выпаривали досуха. Остаток распределяли между этиловым эфиром и водным раствором NaHCO3. Отделенный органический слой сушили и выпаривали с получением указанного в заголовке соединения (389 мг, выход 69%) в виде оранжево-коричневой маслянистой жидкости. 1H-ЯМР (400 МГц) δ м.д. 3,27 (d, J=2,5 Гц, 2H), 2,45-2,53 (m, 4H), 2,22 (t, J=2,6 Гц, 1Н), 1,58-1,64 (m, 4H), 1,39-1,45 (m, 2H).
1-(Проп-2-ин-1-ил)пирролидин
Указанное в заголовке соединение получали (423 мг, 61%) при помощи способа, аналогичного способу получения 1-(проп-2-ин-1-ил) пиперидина. 1H-ЯМР (400 МГц) δ м.д. 3,39 (d, J=2,6 Гц, 2Н), 2,58-2,62 (m, 4Н), 2,19 (t, J=4,1 Гц, 1H), 1,77-1,80 (m, 4H).
(S)-1-(Проп-2-ин-1-ил)пиперидин-3-ол
Указанное в заголовке соединение получали (138 мг, 46%) при помощи способа, аналогичного способу получения 1-(Проп-2-ин-1-ил)пиперидина. 1H-ЯМР (400 МГц) δ м.д. 3,78-3,83 (m, 1H), 3,28 (t, J=2,6 Гц, 2Н), 2,68 (ушир d, J=10 Гц, 1H), 2,38-2,49 (m, 3Н), 2,24 (t, J=2,5 Гц, 1H), 1,42-1,83 (m, 4H).
3,5-Цис-диметил-1-(проп-2-ин-1-ил)пиперазин
Раствор 2,6-цис-диметилпиперазина (1920 мг, 16,8 ммоль) в ДХМ (10 мл) при -78°С добавляли к раствору 3-бромпроп-1-ина (500 мг, 4,20 ммоль) в ДХМ (10 мл) и смесь перемешивали в течение 30 мин, а затем нагревали до кт. Данные МС указывали на начилие сильного пика целевого соединения при 153 (М+Н) и пика избытка исходного вещества при 115 (М+Н), что свидетельствовало о завершении реакции. Данные ТСХ (10% 7 н. NH3 в МеОН/ДХМ) продемонстрировали Rf=0,6 для нового пятна и Rf=0,4 для исходного амина. В результате концентрирования смеси и очистки при помощи хроматографии (50 г колонка, 10% раствор МеОН/ДХМ, а затем 5% 7 н. NH3 в МеОН/ДХМ) получали указанное в заголовке соединение (0,550 г, выход 86%). 1H-ЯМР (400 МГц) δ м.д. 4,84 (ушир, 1H), 3,31 (d, J=2,4 Гц, 2Н), 2,98 (m, 2Н), 2,79 (ddd, J=2,1, 11,3 Гц, 2Н), 2,26 (t, J=2,4 Гц, 1H), 1,89 (dd, J=10,4, 10,7 Гц 2Н), 1,10 (d, J=6,4 Гц, 6Н); МС (ИЭР) [М+Н]+ 153,1.
1-(Трет-бутилдифенилсилил)-2,6-цис-диметил-4-(проп-2-ин-1-ил)пиперазин
Указанное в заголовке соединение получали (138 мг, 46%) при помощи способа, аналогичного способу получения трет-бутил-4-(этил(5-фтор-3-(метоксикарбонил)-2-метилфенил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. 1H-ЯМР (400 МГц): δ м.д. 4,16 (ушир, 2Н), 3,33 (m, 2H), 2,62 (m, 2H), 2,43 (m, 2H), 2,25 (ушир, 1Н), 1,52 (s, 9H), 1,37 (s, J=6,7 Гц, 3Н); МС (ИЭР) [М+Н]+ 253,2.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-((5)-3-гидроксипиперидин-1-ил)проп-1-ин-1-ил)-2-метилбензамид
Указанное в заголовке соединение получали (27,0 мг, выход 43%) при помощи трехстадийного способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Указанное в заголовке соединение очищали при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 7,19 (d, J=1,2 Гц, 1Н), 7,05 (d, J=1,6 Гц, 1Н), 6,07 (s, 1Н), 4,42 (s, 2H), 3,63-3,70 (m, 1Н), 3,48 (d, J=1,8 Гц, 2H), 3,04 (q, J=7,0 Гц, 2H), 2,96-3,01 (m, 1Н), 2,75-2,78 (m, 1Н), 2,62-2,68 (m, 1Н), 2,34 (s, 3Н), 2,22 (s, 3Н), 2,22 (s, 6H), 2,21 (s, 3Н), 2,08-2,22 (m, 3Н), 1,72-1,90 (m, 6H), 1,13-1,59 (m, 6H), 0,80 (t, J=7,1 Гц, 3Н). МС (ИЭР) [М+Н]+ 576,8.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-2-метилбензамид
Указанное в заголовке соединение получали (64,0 мг, выход 41%) при помощи трехстадийного способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Указанное в заголовке соединение очищали при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD) δ м.д. 7,22 (d, J=1,3 Гц, 1H), 7,08 (d, J=1,6 Гц, 1H), 6,07 (s, 1H), 4,42 (s, 2H), 4,32 (m, 1H), 3,58-3,62 (m, 2H), 3,48 (s, 2H), 3,12-3,16 (m, 2H), 3,04 (q, J=7,0 Гц, 2H), 2,60-2,69 (m, 1H), 2,34 (s, 3H), 2,23 (s, 3H), 2,22 (s, 6H), 2,21 (s, 3H), 2,13-2,20 (m, 1H), 1,84-1,90 (m, 4H), 1,34-1,44 (m, 2H), 1,10-1,22 (m, 2H), 0,80 (t, J=6,8 Гц, 3H). MC (ИЭР) [M+H]+ 548,7.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(3-(пиперидин-1-ил)проп-1-ин-1-ил)бензамид
Указанное в заголовке соединение получали (33,0 мг, выход 50%) при помощи трехстадийного способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Указанное в заголовке соединение очищали при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,26 (d, J=1,6 Гц, 1H), 7,10 (d, J=1,6 Гц, 1H), 6,10 (s, 1H), 4,45 (s, 2H), 3,90 (m, 2H), 3,46 (s, 2H), 3,35 (m, 2H), 3,10-2,98 (m, 3H), 2,60 (ушир, 4Н), 2,37 (s, 3H), 2,27 (s, 3H), 2,24 (s, 3H), 1,65 (m, 8H), 1,48 (ушир, 2Н), 0,84 (t, J=7,0 Гц, 3H); МС (ИЭР) [М+Н]+ 519,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(3-(пирролидин-1-ил)проп-1-ин-1-ил)бензамид
Указанное в заголовке соединение получали (30,0 мг, выход 23%) при помощи трехстадийного способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Указанное в заголовке соединение очищали при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,25 (d, J=1,5 Гц, 1Н), 7,10 (d, J=1,6 Гц, 1H), 6,10 (s, 1H), 4,44 (s, 2Н), 3,90 (m, 2Н), 3,60 (s, 2Н), 3,34 (m, 2Н), 3,10-2,98 (m, 3H), 2,71 (ушир, 4Н), 2,36 (s, 3H), 2,27 (s, 3H), 2,23 (s, 3H), 1,85 (m, 4Н), 1,70-1,55 (m, 4Н), 0,83 (t, J=6, 8 Гц, 3H); МС (ИЭР) [М+Н]+ 505,5.
5-(3-(4-(Трет-бутилдифенилсилил)-3,5-цис-диметилпиперазин-1-ил)проп-1-ин-1-ил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
Указанное в заголовке соединение получали (40,0 мг, выход 15%) при помощи трехстадийного способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. Указанное в заголовке соединение очищали при помощи обращенно-фазовой ВЭЖХ/МС. 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,25 (d, J=1,7 Гц, 1Н), 7,09 (d, J=1,4 Гц, 1H), 6,23 (d, J=0,9 Гц, 1Н), 4,50 (s, 2H), 4,09 (m 2H), 3,90 (m, 2H), 3,53 (s, 2H), 3,43 (m, 1Н), 3,36 (m, 2H), 3,08 (t, J=6,9 Гц, 2H), 3,01 (m, 1Н), 2,74 (m, 2H), 2,38 (dd, J=11,5, 4,1 Гц, 2H), 2,28 (s, 3Н), 2,27 (s, 3H), 1,7-1,58 (m, 4H), 1,47 (s, 9H), 1,31 (d, J=6,7 Гц, 6Н), 1,23 (d, J=6,9 Гц, 6Н), 0,84 (t, J=6,9 Гц, 3Н); МС (ИЭР) [М+Н]+ 676,7.
5-(3-(Цис-3,5-диметилпиперазин-1-ил)проп-1-ин-1-ил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
К раствору 5-(3-(4-(трет-бутилдифенилсилил)-3,5-цис-диметилпиперазин-1-ил)проп-1-ин-1-ил)-3-(этил(тетрагидро-2Н-пиран-4-ил) амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида (40 мг, 0,059 ммоль) в ДХМ (381 мкл, 5,918 ммоль) при КТ добавляли 4 М раствор HCl в 1,4-диоксане (1480 мкл, 5,918 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Затем реакционную смесь концентрировали, и остаток очищали при помощи обращенно-фазовой ВЭЖХ/МС с получением указанного в заголовке соединения (33 мг, выход 97%). 1H-ЯМР (400 МГц, CD3OD): δ м.д. 7,27 (d, J=1,5 Гц, 1Н), 7,11 (d, J=1,6 Гц, 1Н), 6,23 (d, J=0,6 Гц, 1Н), 4,50 (s, 2H), 3,91 (m, 2H), 3,52 (s, 2H), 3,44 (q, J=7,0 Гц, 1Н), 3,34 (m, 2H), 3,07 (q, J=6, 9 Гц, 2H), 3,01 (m, 1Н), 2,98 (m, 2H), 2,86 (m, 2H), 2,28 (s, 3Н), 2,27 (s, 3Н), 1,95 (t, J=10,8 Гц, 2H), 1,70 (m, 2H), 1,60 (qd, J=12,7, 4,2 Гц, 2H), 1,23 (d, J=6,6 Гц, 6Н), 1,09 (d, J=6,4 Гц, 6Н), 0,84 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 576,5.
Трет-бутил-4-((3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(метоксикарбонил)-4-метилфенил)этинил)пиперидин-1-карбоксилат
К раствору метил-5-бром-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метилбензоата (1,80 г, 5,05 ммоль) и трет-бутил-4-этинилпиперидин-1-карбоксилата (1,80 г, 8,59 ммоль) в ДМФА (40 мл) добавляли триэтиламин (2,82 мл, 20,2 ммоль) и йодид меди(I) (0,096 г, 0,505 ммоль). Реакционную смесь дегазировали путем продувания азота в течение 15 мин. Затем добавляли тетракис(трифенилфосфин)палладий(0) (0,292 г, 0,253 ммоль) и смесь дегазировали в течение дополнительных 10 мин путем продувания азота. Реакционную смесь грели при 80°С в течение 6 ч. Реакцию гасили нас. раствором NaHCO3, экстрагировали ТБМЭ (3×40 мл), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи хроматографии (0%-40% смесями AcOEt/гептан) с получением указанного в заголовке соединения (2,40 г, выход 98%). 1H-ЯМР (500 МГц) δ м.д. 7,65 (s, 1H), 7,28 (s, 1H), 3,97 (ушир d, J=11,3 Гц, 2H), 3,90 (s, 3Н), 3,76 (m, 2H), 3,34 (dt, J=2,0, 11,7 Гц, 2H), 3,24 (add, J=3,4, 8,8, 12,2 Гц, 2H), 3,08 (ушир, 2H), 2,98 (ушир, 1H), 2,80 (dddd, J=3,9, 3,9, 3,9, 3,9 Гц, 1H), 2,52 (s, 3Н), 1,87 (m, 2H), 1,60-1,74 (m, 6H), 1,48 (s, 9Н), 0,89 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 485,4.
5-((1-(Трет-бутоксикарбонил)пиперидин-4-ил)этинил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метилбензойная кислота
К раствору трет-бутил-4-((3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(метоксикарбонил)-4-метилфенил)этинил)пиперидин-1-карбоксилата (2,4 г, 4,95 ммоль) в этаноле (20,0 мл) при КТ добавляли раствор гидроксида натрия (0,565 г, 14,1 ммоль) в воде (3,0 мл). Реакционную смесь грели при 60°С в течение 6 ч. Реакцию гасили 1 М раствором HCl (5 мл), а затем добавляли избыток раствора лимонной кислоты для получения рН 5. Смесь концентрировали для удаления EtOH и полученную водную фазу экстрагировали AcOEt (2×40 мл). Органические слои объединяли, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали при помощи хроматографии (10%-100% смесями AcOEt/гептан) с получением указанного в заголовке соединения (2,30 г, выход 99%). 1H-ЯМР (500 МГц) δ м.д. 7,82 (s, 1H), 7,35 (s, 1H), 3,98 (ушир d, J=11,3 Гц, 2Н), 3,77 (m, 2H), 3,35 (dt, J=1,5, 11,3 Гц, 2Н), 3,25 (ddd, J=3,4, 8,3, 12,2 Гц, 2H), 3,11 (ушир, 2H), 3,00 (ушир, 1H), 2,81 (dddd, J=3,9, 3,9, 3,9, 3,9 Гц, 1H), 2,60 (s, 3Н), 1,88 (m, 2H), 1,60-1,78 (m, 6H), 1,48 (s, 9H), 0,90 (t, J=6,8 Гц, 3Н); МС (ИЭР) [М+Н]+ 471,4.
Трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(этил(тетрагидро-2Н-пиран-4-ил)амино)-4-метилфенил)этинил)пиперидин-1-карбоксилат
К раствору 5-((1-(трет-бутоксикарбонил)пиперидин-4-ил)этинил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метилбензойной кислоты (1,06 г, 2,25 ммоль) в ДМСО (5,8 мл) при КТ добавляли триэтиламин (0,90 мл, 6,44 ммоль) и хлорид (4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метанаминия (0,405 г, 2,15 ммоль). Прозрачный раствор становился гетерогенным. Затем добавляли НОВТ (0,493 г, 3,22 ммоль) и EDC (0,617 г, 3,22 ммоль) и полученную реакционную смесь перемешивали при КТ в течение ночи. Реакцию гасили водой (80 мл), и суспензию перемешивали в течение 1 ч при КТ. Суспензию фильтровали, и слой фильтрата промывали водой (2×20 мл). Собранное твердое вещество сушили под вакуумом с получением указанного в заголовке соединения (1,27 г, выход 98%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,22 (s, 1H), 7,08 (d, J=1,0 Гц 1H), 6,11 (s, 1H), 4,45 (s, 2H), 3,92 (ушир d, J=10,8 Гц, 2H), 3,78 (dd, J=4,4, 5,4 Гц, 1H), 3,75 (dd, J=4,4, 5,4 Гц, 1H), 3,36 (t, J=11,7 Гц, 2H), 3,21 (ушир t, J=8,3 Гц, 2H), 3,07 (q, J=7,3 Гц, 2H), 3,01 (dddd, J=3, 9, 3,9, 11,3, 11,3 Гц, 1H), 2,84 (dddd, J=3,4, 3,4, 3,9, 3,9 Гц, 1H), 2,38 (s, 3H), 2,28 (s, 3H), 2,25 (s, 3H), 1,88 (m, 2H), 1,70 (ушир d, J=12,2 Гц, 2H), 1,60 (m, 4H), 1,47 (s, 9H), 0,87 (t, J=1, 3 Гц, 3H); МС (ИЭР) [М+Н]+ 605,6.
Трет-бутил-4-((3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4-метилфенил)этинил)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали (491 мг, выход 34%) при помощи способа, аналогичного способу получения 3-((4-транс-(диметиламино)циклогексил)(этил)амино)-5-(3-(3-гидроксиазетидин-1-ил)проп-1-ин-1-ил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 8,22 (t, J=4,9 Гц 1H), 7,22 (s, 1H), 7,06 (d, J=1,0 Гц 1H), 6,24 (s, 1H), 4,52 (d, J=4, 4 Гц, 2H), 3,92 (ушир d, J=10,8 Гц, 2H), 3,75 (m, 2H), 3,45 (m, 1H), 3,34 (t, J=11,7 Гц, 2H), 3,20 (ушир d, J=10,3 Гц, 2H), 3,07 (q, J=7,3 Гц, 2H), 3,01 (m, 1H), 2,83 (m, 1H), 2,28 (s, 6H), 1,87 (m, 2H), 1,70 (ушир d, J=11,3 Гц, 2H), 1,60 (m, 4H), 1,47 (s, 9H), 1,24 (d, J=6,9 Гц, 6H), 0,85 (t, J=6,9 Гц, 3H); МС (ИЭР) [М+Н]+ 633,7.
3-(Этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метил-5-(пиперидин-4-илэтинил)бензамид
К раствору трет-бутил-4-((3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-(((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-4-метилфенил)этинил)пиперидин-1-карбоксилата (212 мг, 0,335 ммоль) в ДХМ (2 мл) при КТ добавляли 4 М раствор HCl в 1,4-диоксане (3 мл, 12,0 ммоль) и реакционная смесь становилась мутной. После перемешивания в течение 30 мин данные ТСХ (10% раствор МеОН/ДХМ) свидетельствовали о завершении реакции, Rf=0,5 для исходного вещества и Rf=0,3 для нового пятна. Смесь концентрировали, повторно растворяли в ДХМ и промывали нас. раствором Na2SO4. Вод. фазу экстрагировали 4×ДХМ до прекращения обнаружения продукта при помощи ТСХ. Объединенную орг. фазу сушили (Na2SO4), фильтровали и концентрировали с получением указанного в заголовке соединения в виде коричневатого твердого вещества (257 мг, выход 144%). Предполагали выход 100%, равный 178 мг, и следующую реакционную стадию проводили без дополнительной очистки продукта. Данные Н-ЯМР и МС свидетельствовали о получении целевого продукта с небольшим количеством примесей. 1H-ЯМР (400 МГц, CD3OD) δ м.д.; 7,18 (d, J=1,5 Гц 1H), 7,03 (d, J=1,5 Гц, 1H), 6,20 (s, 1H), 4,47 (s, 2H), 3,88 (m, 2H), 3,45 (m, 1H), 3,31 (m, 2H), 2,93-3,15 (m, 5H), 2,79 (m, 3H), 2,24 (s, 6H), 1,98 (m, 3H), 1,40-1,75 (m, 6H), 1,19 (d, J=6,7 Гц, 6H), 0,81 (t, J=7,0 Гц, 3H); МС (ИЭР) [М+Н]+ 533,5.
(S)-3-(Этил(тетрагидро-2Н-пиран-4-ил)амино)-5-((1-(2-гидроксипропил)пиперидин-4-ил)этинил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
К 3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метил-5-(пиперидин-4-илэтинил)бензамиду (80 мг) в метаноле (4,1 мл) в герметичной пробирке добавляли (S)-2-метилоксиран (24 мкл). Реакционную смесь грели при 65°С в течение 3 ч. Реакционную смесь концентрировали в вакууме, и остаток очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (33,0 мг, выход 50%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,21 (s, 1Н), 7,06 (d, J=1,0 Гц, 1Н), 6,24 (s, 1Н), 4,50 (s, 2H), 3,94 (m, 1Н), 3,92 (ушир d, J=10,8 Гц, 2H), 3,46 (m, 1Н), 3,35 (t, J=11,7 Гц, 2H), 3,07 (q, J=6,8 Гц, 2H), 3,01 (m, 1Н), 2,90 (m, 1Н), 2,84 (m, 1Н), 2,64 (m, 1Н), 2,3-2,42 (m, 3H), 2,28 (s, 6H), 1,94 (m, 2H), 1,67-1,80 (m, 4H), 1,60 (dq, J=4, 4, 11,7 Гц, 2H), 1,24 (d, J=6,3 Гц, 6H), 1,15 (d, J=6,4 Гц, 3Н), 0,85 (t, J=7,3 Гц, 3Н); MC (ИЭР) [М+Н]+ 591,5.
(R)-3-(Этил(тетрагидро-2Н-пиран-4-ил)амино)-5-((1-(2-гидроксипропил)пиперидин-4-ил)этинил)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамид
К 3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-N-((4-изопропил-6-метил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метил-5-(пиперидин-4-илэтинил)бензамиду (80,0 мг) в метаноле (4,1 мл) в герметичной пробирке добавляли (R)-2-метилоксиран (24 мкл). Реакционную смесь грели при 65°С в течение 3 ч. Реакционную смесь концентрировали в вакууме, и остаток очищали при помощи ВЭЖХ с получением указанного в заголовке соединения (33,0 мг, выход 50%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,21 (d, J=1,0 Гц, 1Н), 7,06 (d, J=1,0 Гц, 1Н), 6,24 (s, 1Н), 4,50 (s, 2H), 3,94 (m, 1Н), 3,92 (ушир d, J=10,8 Гц, 2H), 3,46 (m, 1Н), 3,35 (t, J=11,7 Гц, 2H), 3,07 (q, J=6,8 Гц, 2H), 3,01 (m, 1Н), 2,88 (m, 1Н), 2,82 (m, 1Н), 2,62 (m, 1Н), 2,3-2,42 (m, 3Н), 2,28 (s, 6H), 1,94 (m, 2H), 1,67-1,80 (m, 4H), 1,60 (dq, J=4,4, 11,7 Гц, 2H), 1,24 (d, J=6,9 Гц, 6H), 1,14 (d, J=5,9 Гц, 3Н), 0,85 (t, J=6,9 Гц, 3Н); МС (ИЭР) [М+Н]+ 591,6.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(пиперидин-4-илэтинил)бензамид
К раствору трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(этил(тетрагидро-2Н-пиран-4-ил)амино)-4-метилфенил)этинил)пиперидин-1-карбоксилата (250 мг, 0,413 ммоль) в ДХМ (3 мл) при 20°С добавляли 4 М раствор HCl в 1,4-диоксане (3 мл, 12,0 ммоль). Смесь перемешивали при 20°С в течение 1 ч. Данные ЖХМС свидетельствовали о завершении реакции. Реакционную смесь концентрировали, и остаток растворяли в ДХМ, а затем нейтрализовывали нас. раствором NaHCO3/солевым раствором. Органический слой сушили (Na2SO4) и фильтровали. Фильтрат концентрировали. Остаток применяли на стадии алкилирования без дополнительной очистки (209 мг, 100%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,21 (ушир, 1Н), 7,07 (ушир, 1Н), 6,11 (s, 1Н), 4,46 (s, 2H), 3,95-3,89 (m, 2H), 3,39-3,34 (m, 2H), 3,08 (q, J=7,0 Гц, 2H), 3,06-2,98 (m, 3Н), 2,79-2,72 (m, 1Н), 2,72-2,65 (m, 2H), 2,38 (s, 3Н), 2,28 (s, 3Н), 2,25 (s, 3Н), 1,94-1,88 (m, 2H), 1,73-1,68 (m, 2H), 1,68-1,56 (m, 4H), 0,85 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 505,5.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-((1-метилпиперидин-4-ил)этинил)бензамид
К раствору N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(пиперидин-4-илэтинил)бензамида (100 мг, 0,198 ммоль) в метаноле (5 мл) при 0°С добавляли 35% раствор формальдегида в H2O (0,155 мл, 1,98 ммоль). После перемешивания при 0°С в течение 10 мин добавляли цианоборгидрид натрия (24,9 мг, 0,396 ммоль). Полученную смесь перемешивали при 0°С в течение 1 ч. Данные ЖХМС свидетельствовали о завершении реакции. Реакцию гасили нас. раствором NaHCO3/солевым раствором и смесь экстрагировали смесью EtAOc/гептан. Органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали при помощи хроматографии (10 г колонка, смесью МеОН/ДХМ=1:9, а затем смесью МеОН/7 М раствор NH3 в МеОН/ДХМ=1:1:8) с получением указанного в заголовке соединения (96,0 мг, 93%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,22 (ушир, 1Н), 7,08 (ушир, 1Н), 6,10 (s, 1Н), 4,46 (s, 2H), 3,94-3,87 (m, 2H), 3,35-3,30 (m, 2H), 3,07 (q, J=7,0 Гц, 2H), 3,04-2,97 (m, 1Н), 2,79-2,71 (m, 2H), 2,67-2,58 (m, 1Н), 2,38 (s, 3Н), 2,28 (s, 3Н), 2,28 (s, 3Н), 2,25 (s, 3Н), 2,28-2,21 (m, 2H), 1,97-1,91 (m, 2H), 1,78-1,67 (m, 4H), 1,64-1,54 (m, 2H), 0,85 (t, J=7,0 Гц, 3Н); MC (ИЭР) [М+Н]+ 519,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-5-((1-этилпиперидин-4-ил)этинил)-2-метилбензамид
В грушевидную колбу с N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(тетрагидро-2Н-пиран-4-ил)амино)-2-метил-5-(пиперидин-4-илэтинил)бензамидом (100 мг, 0,198 ммоль) в метаноле (5 мл, 124 ммоль) при 0°С добавляли ацетальдегид (0,112 мл, 1,98 ммоль). После перемешивания при 0°С в течение 10 мин добавляли цианоборгидрид натрия (24,9 мг, 0,396 ммоль). Смесь перемешивали при 0°С в течение 1 ч. Данные МС свидетельствовали о завершении реакции. Реакцию гасили нас.раствором NaHCO3/солевым раствором, и смесь экстрагировали смесью EtAOc/гептан. Органический слой сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали при помощи хроматографии (10,0 г колонка, смесью МеОН/ДХМ=1:9, затем смесью МеОН/7 М раствор NH3 в МеОН/ДХМ=1:1:8) с получением указанного в заголовке соединения (90,0 мг, 85%). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,21 (s, 1H), 7,07 (s, 1H), 6,11 (s, 1H), 4,46 (s, 2H), 3,95-3,88 (m, 2H), 3,37-3,33 (m, 2H), 3,07 (q, J=7,0 Гц, 2H), 3,05-2,98 (m, 1H), 2,87-2,78 (m, 2H), 2,69-2,61 (m, 1H), 2,45 (q, J=7,0 Гц, 2Н), 2,38 (s, 3H), 2,28 (s, 3H), 2,25 (s, 3H), 2,28-2,20 (m, 2H), 1,99-1,93 (m, 2H), 1,79-1,67 (m, 4H), 1,64-1,55 (m, 2H), 1,11 (t, J=7,0 Гц, 3H), 0,85 (t, J=7,0 Гц, 3H); МС (ИЭР) [М+Н]+ 533,5.
Трет-бутил-4-((5-бром-3-(метоксикарбонил)-2-метилфенил)амино)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали (1,75, выход 68%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(метоксикарбонил)-2-метил-5-(трифторметил)фенил)амино)пиперидин-1-карбоксилата. 1H-ЯМР (500 МГц) δ м.д. 7,25 (s, 1Н), 6,85 (s, 1Н), 4,05 (ушир, 2Н), 3,88 (s, 3Н), 3,49-3,41 (m, 1Н), 2,98 (t, J=10 Гц, 2Н), 2,23 (s, 3H), 2,09-2,02 (m, 2Н), 1,48 (s, 9H), 1,44-1,34 (m, 2Н); МС (ИЭР) [М+Н]+ 427,2, 429,2.
Трет-бутил-4-((5-бром-3-(метоксикарбонил)-2-метилфенил)(этил)амино)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали (1,28 г, выход 87%) при помощи способа, аналогичного способу получения трет-бутил-4-(этил(3-(метоксикарбонил)-2-метил-5-(трифторметил)фенил)амино)пиперидин-1-карбоксилата. 1H-ЯМР (500 МГц) δ м.д. 7,71 (d, J=2,0 Гц, 1Н), 7,36 (d, J=2,0 Гц, 1Н), 4,05 (ушир, 2Н), 3,90 (s, 3Н), 3,04 (q, J=6,5 Гц, 2Н), 2,90-2,84 (m, 1Н), 2,70 (t, J=12,5 Гц, 2Н), 2,45 (s, 3Н), 1,78-1,70 (m, 2Н), 1,55-1,47 (m, 2Н), 1,46 (s, 9H), 0,89 (t, J=6,5 Гц, 3Н); МС (ИЭР) [М+Н]+ 455,3, 457,3.
5-Бром-3-((1-(трет-бутоксикарбонил)пиперидин-4-ил)(этил)амино)-2-метилбензойная кислота
Указанное в заголовке соединение получали (1,07 г, выход 100%) при помощи способа, аналогичного способу получения 3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензойной кислоты. 1H-ЯМР (500 МГц) δ м.д. 7,81 (d, J=2,0 Гц, 1Н), 7,36 (d, J=2,0 Гц, 1H), 4,03 (m, 2H), 3,02 (q, J=7,0 Гц, 2H), 2,89-2,83 (m, 1H), 2,73-2,66 (m, 2H), 2,47 (s, 3Н), 1,77-1,70 (m, 2H), 1,53-1,45 (m, 2H), 1,43 (s, 9H), 0,85 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 441,3, 443,3.
Трет-бутил-4-((5-бром-3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-2-метилфенил)(этил)амино)пиперидин-1-карбоксилат
Указанное в заголовке соединение получали (1,10 г, выход 77%) при помощи способа, аналогичного способу получения N-[(4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил]-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил)бензамида. 1H-ЯМР (500 МГц) δ м.д. 7,36 (d, J=2,0 Гц, 1H), 7,21 (d, J=2,0 Гц, 1H), 6,11 (s, 1H), 4,46 (s, 2H), 4,04-3,98 (m, 2H), 3,07 (q, J=7,0 Гц, 2H), 3,01-2,94 (m, 1H), 2,80-2,70 (m, 2H), 2,38 (s, 3Н), 2,25 (s, 3Н), 2,23 (s, 3Н), 1,78-1,72 (m, 2H), 1,52-1,46 (m, 2H), 1,45 (s, 9H), 0,86 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 575,4, 7,4.
5-Бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(пиперидин-4-ил)амино)-2-метилбензамид
Указанное в заголовке соединение получали (413 мг, выход 100%) при помощи способа, аналогичного способу получения гидрохлорида 3-((2,6-транс-диметилпиперидин-4-ил)(этил)амино)-5-фтор-N-((5-фтор-1,4,6-триметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-2-метилбензамида, с последующей очисткой при помощи хроматографии на силикагеле (10% 7 н. раствор NH3 в МеОН/ДХМ). 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,33 (d, J=2,0 Гц, 1Н), 7,19 (d, J=2,0 Гц, 1Н), 6,10 (s, 1Н), 4,45 (s, 2H), 3,09 (q, J=7,5 Гц, 2H), 3,05-2,99 (m, 2H), 2,90-2,83 (m, 1Н), 2,52-2,45 (m, 2H), 2,37 (s, 3Н), 2,25 (s, 3H), 2,24 (s, 3H), 1,78-1,72 (m, 2H), 1,58-1,49 (m, 2H), 0,86 (t, J=7, 5 Гц, 3Н); МС (ИЭР) [М+Н]+ 475,3, 477,4.
5-Бром-N-((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-метилпиперидин-4-ил)амино)-2-метилбензамид
Указанное в заголовке соединение получали (400 мг, выход 84%) при помощи способа, аналогичного способу получения метил-3-[этил(1-метилпиперидин-4-ил)амино]-2-метил-5-(трифторметил) бензоата. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 7,35 (d, J=2,0 Гц, 1Н), 7,20 (d, J=2,0 Гц, 1Н), 6,12 (s, 1Н), 4,46 (s, 2H), 3,08 (q, J=7,0 Гц, 2H), 2,90-2,84 (m, 2H), 2,85-2,79 (m, 1Н), 2,37 (s, 3Н), 2,26 (s, 3H), 2,25 (s, 3H), 2,23 (s, 3H), 2,08-2,01 (m, 2H), 1,80-1,74 (m, 2H), 1,71-1,62 (m, 2H), 0,86 (t, J=7,0 Гц, 3Н); МС (ИЭР) [М+Н]+ 489,3, 491,4.
N-((4,6-Диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)-3-(этил(1-метилпиперидин-4-ил)амино)-2-метил-5-(6-(4-метилпиперазин-1-ил)пиридин-3-ил)бензамид
Указанное в заголовке соединение получали (34,0 мг, выход 28%) при помощи способа, аналогичного способу получения трет-бутил-4-((3-(((4,6-диметил-2-оксо-1,2-дигидропиридин-3-ил)метил)карбамоил)-5-(6-метоксипиридин-3-ил)-2-метилфенил)(этил)амино)-2,6-транс-диметилпиперидин-1-карбоксилата. 1H-ЯМР (500 МГц, CD3OD) δ м.д. 8,33 (d, J=2,5 Гц, 1H), 7,81 (dd, J=8,8, 2,5 Гц, 1H), 7,40 (d, J=2,0 Гц, 1Н), 7,26 (d, J=2,0 Гц, 1H), 6,90 (d, J=8,8 Гц, 1H), 6,12 (s, 1H), 4,50 (s, 2H), 3,62-3,57 (m, 4H), 3,15 (q, J=7,0 Гц, 2Н), 2,94-2,89 (m, 1H), 2,89-2,84 (m, 2H), 2,60-2,56 (m, 4H), 2,40 (s, 3H), 2,36 (s, 3H), 2,31 (s, 3H), 2,26 (s, 3H), 2,25 (s, 3H), 2,10-2,03 (m, 2H), 1,86-1,80 (m, 2H), 1,75-1,66 (m, 2H), 0,90 (t, J=7,0 Гц, 3H); МС (ИЭР) [M+H]+ 586,6.
Соединения 157-163 синтезировали при помощи способов, аналогичных вышеописанным способам получения. Аналитические данные для соединений 157-163 представлены ниже.
Соединение 157: ЖХМС: 545,5 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,48 (ушир, 1H), 8,96 (ушир, 1H), 8,17 (s, 1H), 7,38-7,08 (m, 1H), 6,96 (s, 1H), 5,87 (s, 2H), 4,35 (s, 2H), 3,82 (d, 2H, J=10,4 Гц), 3,51 (t, 2H, J=10,4 Гц), 3,41-3,29 (m, 1H), 3,27-3,06 (m, 4H), 3,05-2,89 (m, 3H), 2,88-2,76 (m, 1H), 2,19 (s, 6H), 2,11 (s, 3H), 1,96 (m, 2H), 1,72 (q, 1H, J=12 Гц), 1,65-1,41 (m, 4H), 0,93 (ушир, 2H), 0,85-0,73 (m, 5H).
Соединение 158: ЖХМС: 559,6 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,47 (ушир, 1H), 9,36 (m, 1H), 8,17 (ушир, 1H), 7,23-7,07 (m, 1H), 6,97 (s, 1H), 5,87 (s, 1H), 4,24 (m, 2H), 3,84 (d, 2H, J=12,0 Гц), 3,61 (q, 1H, J=8,0 Гц), 3,40-3,18 (m, 4H), 3,10-2,88 (m, 3H), 2,87-2,21 (m, 2H), 2,25-2,09 (m, 14H), 1,93 (m, 2H), 1,79-1,49 (m, 7H), 0,78 (t, 3H, J=6,8 Гц).
Соединение 159: ЖХМС: 561,5 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,48 (ушир, 1H), 10,41 (ушир, 1Н), 8,17 (s, 1H), 7,25-7,05 (m, 2H), 6,97 (s, 1H), 5,87 (s, 1H), 4,73 (d, 4H, J=6,4 Гц), 4,35 (s, 1H), 4,25 (d, 2H, J=5,2 Гц), 3,82 (d, 2H, J=10,4 Гц), 3,47-3,30 (m, 2H), 3,20 (t, 2H, J=10,4 Гц), 3,13-2,78 (m, 6H), 2,19 (s, 6H), 2,11 (s, 3H), 2,03 (m, 2H), 1,78 (q, 1H, J=12 Гц), 1,68-1,40 (m, 4H), 0,78 (t, 3H, J=6,8 Гц).
Соединение 160: ЖХМС: 588,7 (М+1)+; 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,45 (ушир, 1H), 8,15 (m, 1H), 7,09 (s, 1H), 6,92 (s, 1H), 5,85 (s, 1H), 4,24 (d, 2H, J=4,8 Гц), 3,92-3,83 (m, 1H), 3,70-3,62 (m, 1H), 3,38 (q, 1H, J=7,2 Гц), 3,35-3,20 (m, 1H), 3,17-30,6 (m, 1H), 3,00 (q, 2H, J=7,2), 2,93-2,84 (m, 1H), 2,18 (d, 2H, J=6,8 Гц), 2,22-207 (m, 15H), 1,99 (s, 3H), 1,90-1,70 (m, 6H), 1,64-1,42 (m, 2H), 1,34 (q, 2H, J=12,0 Гц), 1,17-1,05 (m, 2H), 0,76 (t, 3H, J=6,8 Гц).
Соединение 161: ЖХМС: 628,6 (M+1)+; 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,46 (ушир, 1H), 8,16 (t, 1H, 4,8 Гц), 7,08 (s, 1H), 6,9 (s, 1H), 5,85 (s, 1H), 4,24 (d, 2H, J=4,8 Гц), 3,16 (q, 2H, J=10,4 Гц), 2,99 (q, 2H, 6,8 Гц), 2,89-2,70 (m, 2H), 2,68-2,53 (m, 4H), 2,48-2,45 (m, 1H), 2,20-2,03 (m, 15H), 1,89-1,70 (m, 6H), 1,65-1,54 (m, 2H), 1,40-1,36 (m, 2H), 1,11 (q, 2H, J=11,2 Гц), 0,76 (t, 3H, J=6,8 Гц).
Соединение 162: ЖХМС: 574,5 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 11,48 (ушир, 1H), 10,4-9,90 (m, 1H), 8,16 (s, 1H), 7,16 (s, 1H), 7,01 (s, 1H), 5,87 (s, 2H), 4,43 (ушир, 2H), 4,25 (d, 2H, J=4,4 Гц), 4,25-3,97 (m, 4H), 3,82 (d, 2H, J=8,0 Гц), 3,23 (t, 2H, J=11,2 Гц), 3,20-2,95 (m, 4H), (2,95-2,73 (m, 4H), 2,19 (s, 6H), 2,11-1,99 (m, 5H), 1,80 (ушир, 2H), 1,65-1,40 (m, 4H), 0,78 (t, 3H, J=6,8 Гц).
Соединение 163: ЖХМС: 535,5 (М+1)+; соль ТФУ: 1H-ЯМР (ДМСО-d6, 400 МГц) δ 8,32 (s, 2H), 7,95 (t, 1H, J=4,4 Гц), 7,11 (s, 1H), 6,93 (s, 1H), 6,09 (s, 1H), 4,19 (d, 2H, J=4,4 Гц), 3,83 (ушир, 2H), 3,80 (s, 3H), 3,23 (t, 2H, J=10,8 Гц), 2,99 (q, 2H, J=7,2 Гц), 2,97-2,89 (m, 1H), 2,68-2,52 (m, 2H), 2,22-2,15 (m, 9H), 2,13-2,03 (m, 2H), 1,88-1,68 (m, 2H), 1,65-1,54 (m, 4H), 1,53-1,42 (m, 2H), 0,77 (t, 3H, J=6,8 Гц).
Пример 2: Протокол биологического исследования и общие способы
Протокол исследований фермента PRC2 дикого дипа и его мутантных форм
Общие материалы. S-аденозилметионин (SAM), S-аденозилгомоцитеин (SAH), бицин, KCl, Tween 20, диметилсульфоксид (ДМСО) и желатин из бычьей кожи (BSG) приобретали в Sigma-Aldrich с наиболее высокой необязательной степенью чистоты. Дитиотреитол (DTT) приобретали в EMD. 3H-SAM приобретали в American Radiolabeled Chemicals с удельной активностью 80 Ки/ммоль. 384-луночные планшеты со стрептавидином Flashplates приобретали в PerkinElmer.
Субстраты. Пептиды, соответствующие остаткам 21-44 гистона Н3 человека, содержащие немодифицированный лизин 27 (H3K27me0) или диметилиро ванный лизин 27 (H3K27me2), синтезировали с использованием мотива с С-терминальной меткой, аффинной к линкеру G(K-биотин), и С-терминальной амидной концевой группой, в 21st Century Biochemicals. Пептиды очищали путем высокоэффективной жидкостной хроматографии (ВЭЖХ) для достижения чистоты более 95%, которую подтверждали путем жидкостной хроматографии-масс-спектрометрии (ЖХ-МС). Последовательности приведены ниже.
Олигонуклеосомы эритроцитов цыпленка выделяли из крови цыпленка согласно известным способам.
Рекомбинантные комплексы PRC2. Комплексы PRC2 человека очищали в виде 4-компонентных комплексов ферментов, совместно экспрессируемых клетками Spodoptera frugiperda (sf9), с использованием системы экспрессии бакуловирусов. Экспрессируемые субъединицы представляли собой EZH2 дикого типа (NM_004456) или мутанты Y641F, N, H, S или С EZH2, полученные из конструкта EZH2 дикого типа, EED (NM_003797), Suz12 (NM_015355) и RbAp48 (NM_005610). Субъединица EED содержала N-терминальную метку FLAG, которую использовали для очищения 4-компонентного комплекса в целом от клеточных лизатов sf9. Чистота комплексов составляла 95% или более, что определяли путем ДСН-ПААГ и при помощи анализа на Agilent Bioanalyzer. Концентрации ферментов в маточных растворах (как правило, 0,3-1,0 мг/мл) определяли в исследовании Bradford в отношении альбумина бычьей сыворотки (БСА), который использовали в качестве стандарта.
Общий способ исследования ферментов PRC2 с использованием пептидных субстратов. Все исследования проводили в буфере, состоящем из 20 мМ бицина (рН=7,6), 0,5 мМ DTT, 0,005% BSG и 0,002% Tween 20, полученном в день использования. Соединения в 100% ДМСО (1 мкл) помещали в полипропиленовые 384-луночные планшеты с V-образным дном (Greiner) с использованием Platemate 2×3, оборудованного пипеткой с 384-канальной головкой (Thermo). В колонки 11, 12, 23, 24 рядов А-Н для получения максимального контрольного сигнала добавляли ДМСО (1 мкл), а в колонки 11, 12, 23, 24 рядов I-Р для получения минимального контрольного сигнала добавляли SAH, известный продукт и ингибитор PRC2 (1 мкл). При помощи Multidrop Combi (Thermo) добавляли коктейль (40 мкл), содержащий фермент PRC2 дикого типа и пептид H3K27me0 или любой из мутантных ферментов Y641 и пептид H3K27me2. Соединения инкубировали с PRC2 в течение 30 минут при 25°С, затем для запуска реакции добавляли коктейль (10 мкл), содержащий смесь нерадиоактивного и 3H-SAM (конечный объем = 51 мкл). Во всех случаях получали следующие конечные концентрации: 4 нМ фермент PRC2 дикого типа или мутант, 1 мМ SAH в лунках с минимальным контрольным сигналом, концентрация ДМСО составляла 1%. Конечные концентрации остальных компонентов указаны ниже в таблице 2. Исследования прекращали путем добавления нерадиоактивного SAM (10 мкл) до достижения конечной концентрации 600 мкМ, в результате чего происходило разбавление 3H-SAM до уровня, при котором его включение в пептидный субстрат больше не поддавалось обнаружению. Затем 50 мкл реакционной смеси из 384-луночного полипропиленового планшета переносили в 384-луночный планшет Flashplate, и оставляли биотинилированные пептиды связываться с покрытием стрептавидина по меньшей мере на 1 час, после чего трижды промывали 0,1% Tween 20 в устройстве промывки планшетов Biotek ELx405. Затем планшеты исследовали на анализаторе планшетов PerkinElmer TopCount для измерения количества 3H-меченного пептида, связанного с покрытием Flashplate, которое определяли как количество распадов в минуту (dpm) или, в качестве альтернативы, как число импульсов в минуту (cpm).
Общий способ исследования фермента PRC2 дикого типа с использованием олигонуклеосомного субстрата. Исследования проводили в буфере, состоящем из 20 мМ бицина (рН=7,6), 0,5 мМ DTT, 0,005% BSG, 100 мМ KCl и 0,002% Tween 20, полученном в день использования. Соединения в 100% ДМСО (1 мкл) помещали в полипропиленовые 384-луночные планшеты с V-образным дном (Greiner) с использованием Platemate 2×3, оборудованного пипеткой с 384-канальной головкой (Thermo). В колонки 11, 12, 23, 24 рядов А-Н для получения максимального контрольного сигнала добавляли ДМСО (1 мкл), а в колонки 11, 12, 23, 24 рядов I-Р для получения минимального контрольного сигнала добавляли SAH, известный продукт и ингибитор PRC2 (1 мкл). При помощи Multidrop Combi (Thermo) добавляли коктейль (40 мкл), содержащий фермент PRC2 дикого типа и олигонуклеосомы эритроцитов цыпленка. Соединения инкубировали с PRC2 в течение 30 минут при 25°С, затеы для запуска реакции добавляли коктейль (10 мкл), содержащий смесь нерадиоактивного и 3H-SAM (конечный объем = 51 мкл). Получали следующие конечные концентрации: 4 нМ фермент PRC2 дикого типа, 430 нМ нерадиоактивный SAM, 120 нМ 3H-SAM, 120 нМ олигонуклеосомы эритроцитов цыпленка, 1 мМ SAH в лунках с минимальным контрольным сигналом, концентрация ДМСО составляла 1%. Исследование прекращали путем добавления нерадиоактивного SAM (10 мкл) до достижения конечной концентрации 600 мкМ, в результате чего происходило разбавление 3H-SAM до уровня, при котором его включение в субстрат, представлявший собой олигонуклеосомы эритроцитов цыпленка, больше не поддавалось обнаружению. Затем 50 мкл реакционной смеси из 384-луночного полипропиленового планшета переносили в 384-луночный планшет Flashplate, нуклеосомы эритроцитов цыпленка иммобилизовали на поверхности планшета, затем трижды промывали 0,1% Tween 20 в устройстве промывки планшетов Biotek ELx405. Затем планшеты исследовали на анализаторе планшетов PerkinElmer TopCount для измерения количества 3H-меченных олигонуклеосом эритроцитов цыпленка, связанных с покрытием Flashplate, которое определяли как количество распадов в минуту (dpm) или, в качестве альтернативы, как число импульсов в минуту (cpm). Вычисление значения ингибирования в %:
где dpm = число распадов в минуту, cmpd = сигнал в исследуемой лунке, a min и max соответствуют минимальному и максимальному контрольному сигналу.
Четырехпараметровая подстановка для определения IC50:
где верхнее и нижнее значения, как правило, являются плавающими, но также могут быть приняты за 100 или 0, соответственно, в случае 3-параметровой подстановки. Коэффициент Хилла, как правило, является плавающим, но может быть принят за 1 в случае 3-параметровой подстановки. Y представляет собой ингибирование в %, а Х представляет собой концентрацию соединения.
Значения IC50 в исследованиях фермента PRC2 с использованием пептидных субстратов (например, EZH2 дикого типа и Y641F) приведены ниже в таблицах 3А и 3В.
Исследование метилирования WSU-DLCL2
Суспензионные клетки WSU-DLCL2 приобретали в DSMZ (немецкая коллекция микроорганизмов и клеточных культур, Braunschweig, Germany). Среду RPMI/Glutamax, пенициллин-стрептомицин, эмбриональную бычью сыворотку, инактивированную нагреванием, и D-PBS приобретали в Life Technologies, Grand Island, NY, США. Буферы для экстракции и нейтрализации (5Х) приобретали в Active Motif, Carlsbad, СА, США. Кроличье антитело к гистону Н3 приобретали в Abcam, Cambridge, MA, США. Кроличье антитело к H3K27me3 и антикроличий IgG, конъюгированный с HRP, приобретали в Cell Signaling Technology, Danvers, MA, США. ТМВ "суперчувствительный" субстрат получали в BioFX Laboratories, Owings Mills, MD, США. Альбумин бычьей сыворотки, не содержащий IgG, приобретали в Jackson ImmunoResearch, West Grove, PA, США. PBS, содержащий Tween (10X PBST), приобретали в KPL, Gaithersburg, MD, США. Серную кислоту приобретали в Ricca Chemical, Arlington, TX, США. Планшеты для иммуноферментного анализа (ELISA) Immulon приобретали в Thermo, Rochester, NY, США. Планшеты для клеточных культур с V-образным дном приобретали в Corning Inc., Corning, NY, США. Полипропиленовые планшеты с V-образным дном приобретали в Greiner Bio-One, Monroe, NC, США.
Суспензионные клетки WSU-DLCL2 выдерживали в питательной среде (RPMI 1640, дополненной 10% (об./об.) эмбриональной бычьей сывороткой, инактивированной нагреванием, и 100 единиц/мл пенициллина-стрептомицина) и выращивали при 37°С и 5% CO2. В условиях исследования клетки инкубировали в среде для исследования (RPMI 1640, дополненной 20% (об./об.) эмбриональной бычьей сывороткой, инактивированной нагреванием, и 100 единиц/мл пенициллина-стрептомицина) при 37°С и 5% CO2 на встряхивателе для планшетов.
Клетки WSU-DLCL2 высевали в среду для исследования в концентрации 50000 клеток на мл в 96-луночный планшет для клеточных культур с V-образным дном, объем составлял 200 мкл на лунку. Соединение (1 мкл) добавляли непосредственно из 96-луночного исходного планшета в планшет с V-образным дном, содержащий клетки. Планшеты инкубировали на встряхивателе для титровальных планшетов при 37°С, 5% CO2 в течение 96 часов. После четырехдневной инкубации планшеты центрифугировали при 241×g в течение пяти минут, из каждой лунки планшета с клетками осторожно аспирировали среду, не воздействуя на сгусток клеток. Этот сгусток повторно суспендировали в 200 мкл DPBS, и планшеты снова центрифугировали при 241×g в течение пяти минут. Аспирировали надосадочную жидкость и в лунки добавляли охлажденный (4°С) буфер для экстракции (100 мкл). Планшеты инкубировали при 4°С на орбитальном встряхивателе в течение двух часов. Планшеты центрифугировали при 3427×g в течение 10 минут. Надосадочную жидкость (по 80 мкл из лунки) переносили в соответствующую лунку 96-луночного полипропиленового планшета с V-образным дном. В полипропиленовый планшет с V-образным дном, содержащий надосадочную жидкость, добавляли буфер для нейтрализации 5Х (20 мкл на лунку). Полипропиленовые планшеты, содержащие неочищенный препарат гистонов (СНР), инкубировали на орбитальном встряхивателе в течение пяти минут. Неочищенные препараты гистонов добавляли (2 мкл на лунку) в двух повторностях в каждую соответствующую лунку 96-луночных планшетов ELISA, содержащую 100 мкл буфера для нанесения оболочки (1X PBS+БСА 0,05% (масс./об.)). Закрывали планшеты и инкубировали в течение ночи при 4°С. На следующий день планшеты трижды промывали 300 мкл на лунку 1X PBST. Содержимое лунок фиксировали в течение двух часов с использованием 300 мкл на лунку разбавителя ELISA ((PBS (1X) БСА (2% (масс./об.)) и Tween 20 (0,05% (об./об.))). Планшеты трижды промывали 1X PBST. Для детектирования гистона Н3 в лунки добавляли по 100 мкл антитела к гистону Н3 (Abcam, ab1791), разбавленного 1:10000 в разбавителе ELISA. Для детектирования триметилирования H3K27 в лунки добавляли по 100 мкл антитела к H3K27me3, разбавленного 1:2000 в разбавителе ELISA. Планшеты инкубировали в течение 90 минут при комнатной температуре. Планшеты трижды промывали 300 мкл на лунку 1X PBST. Для детектирования гистона Н3 в лунки добавляли по 100 мкл антикроличьего IgG антитела, конъюгированного с HRP, разбавленного 1:6000 в разбавителе ELISA. Для детектирования H3K27me3 в лунки добавляли по 100 мкл антикроличьего IgG антитела, конъюгированного с HRP, разбавленного 1:4000 в разбавителе ELISA. Планшеты инкубировали при комнатной температуре в течение 90 минут. Планшеты четыре раза промывали 300 мкл на лунку 1X PBST 300. В лунки добавляли по 100 мкл субстрата ТМВ. Планшеты с гистоном Н3 инкубировали в течение пяти минут при комнатной температуре. Планшеты с H3K27me3 инкубировали в течение 10 минут при комнатной температуре. Реакцию останавливали с использованием 1н. серной кислоты (100 мкл на лунку). Определяли поглощение при 450 нм в каждом планшете.
В каждом планшете использовали восемь контрольных лунок, в которые добавляли только ДМСО (минимальное ингибирование), а также восемь контрольных лунок для определения максимального ингибирования (фоновые лунки).
Для определения ингибирования в процентах в каждой из исследуемых лунок планшета рассчитывали средние значения отношений для каждого типа контроля. Проводили последовательные трехкратные разбавления исследуемого соединения в ДМСО для получения десяти исследуемых концентраций, начиная с 25 мкМ. Определяли значение ингибирования в процентах, получали кривые IC50 с использованием двух лунок для каждой концентрации соединения. Значения IC50, полученные в этом исследовании, приведены ниже в таблицах 3А и 3В.
Анализ пролиферации клеток
Суспензионные клетки WSU-DLCL2 приобретали в DSMZ (немецкая коллекция микроорганизмов и клеточных культур, Braunschweig, Germany). Среду RPMI/Glutamax, пенициллин/стрептомицин, эмбриональную бычью сыворотку, инактивированную нагреванием, приобретали в Life Technologies, Grand Island, NY, США. Полипропиленовые 384-луночные планшеты с V-образным дном приобретали в Greiner Bio-One, Monroe, NC, США. Белые матовые 384-луночные планшеты для клеточных культур приобретали в Perkin Elmer, Waltham, МА, США. Cell-Titer Glo® приобретали в Promega Corporation, Madison, WI, США. Планшетный анализатор SpectraMax М5 приобретали в Molecular Devices LLC, Sunnyvale, CA, США.
Суспензионные клетки WSU-DLCL2 выдерживали в питательной среде (RPMI 1640, дополненная 10% (об./об.) эмбриональной бычьей сывороткой, инактивированной нагреванием) и выращивали при 37°С и 5% CO2. В условиях исследования клетки инкубировали в среде для исследования (RPMI 1640, дополненная 20% (об./об.) эмбриональной бычьей сывороткой, инактивированной нагреванием, и 100 единиц/мл пенициллина-стрептомицина) при 37°С и 5% СО2.
Для определения действия соединений в отношении пролиферации клеточной линии WSU-DLCL2 клетки в экспоненциальной фазе роста размещали в белые матовые 384-луночные планшеты с плотностью 1250 клеток/мл до достижения конечного объема среды для исследования, составляющего 50 мкл. Планшет с маточным раствором соединения готовили путем последовательного 3-кратного разбавления в ДМСО в трех повторностях для получения девяти точек, начиная с 10 мМ (максимальная конечная концентрация соединения в исследовании составляла 20 мкМ, а концентрация ДМСО составляла 0,2%). В соответствующие лунки планшета с клетками добавляли 100 нл аликвоту из планшета с маточным раствором соединения. В качестве контроля со 100% ингибированием клетки обрабатывали стауроспорином в конечной концентрации 200 нМ, а в качестве контроля с 0% ингибированием клетки обрабатывали ДМСО. После добавления соединений планшеты для исследования инкубировали в течение 6 дней при 37°С, 5% CO2, относительной влажности >90%. Жизнеспособность клеток измеряли путем количественной оценки АТФ, присутствующего в клеточных культурах, добавляли 35 мкл реагента Cell Titer Glo® в планшеты для клеток. Анализировали люминесценцию на SpectraMax M5. Концентрацию, подавляющую жизнеспосбоность клеток на 50%, определяли с использованием 4-параметровой подстановки в нормированные кривые зависимости доза-ответ. Значения IC50, полученные в этом исследовании, также приведены ниже в таблицах 3А и 3В. Данные масс-спектрометрии указанных соединений также приведены ниже в таблицах 3А и 3В.
Пример 3: Определение минимальной цитотоксической концентрации (LCC)
Хорошо известно, что пролиферация клеток происходит посредством деления клеток, в результате чего количество клеток после деления в два раза превосходит количество клеток до деления. При заданных окружающих условиях (например, рН, ионная сила, температура, плотность клеток, содержание белков и факторов роста в среде и т.д.) пролиферация клеток происходит путем последовательного удвоения (т.е. деления) согласно следующему уравнению, при условии, что доступны подходящие питательные вещества и прочие необходимые факторы.
где Nt представляет собой количество клеток в момент времени (t) после начала наблюдения. N0 представляет собой количество клеток в момент начала наблюдения, t представляет собой время после начала периода наблюдения, a tD представляет собой период времени, требуемый для удвоения количества клеток, также называемый временем удвоения. Уравнение A.1 можно превращать в более удобную форму показательного уравнения с основанием е, используя уравнение 0,693=ln(2).
Константа скорости пролиферации клеток (kp) обратно пропорциональна времени удвоения, зависимость выражена следующим уравнением.
Объединяя уравнения А.2 и А.3, получаем
Таким образом, согласно уравнению А.4 можно ожидать, что количество клеток экспоненциально возрастает со временем во время ранней стадии роста клеток, называемой логарифмической фазой роста. Показательные уравнения наподобие уравнения А.4 можно переводить в линейную форму путем логарифмирования каждой из частей уравнения.
Таким образом, можно ожидать, что график зависимости ln(Nt) от времени будет представлять собой нисходящую прямую линию, где коэффициент наклона соответствует kp, а отрезок, отсекаемый по оси y, соответствует ln(N0).
Изменения окружающих условий могут приводить к изменению скорости пролиферации клеток, которое можно количественно оценивать как изменение константы скорости пролиферации kp. Одним из условий, которое может вызывать изменение скорости пролиферации, является введение в систему антипролиферативного соединения в начале периода наблюдения (т.е. в момент времени t=0). Если антипролиферативное соединение оказывает немедленное воздействие на пролиферацию клеток, можно ожидать, что график зависимости ln(Nt) от времени будет линейным для всех концентраций соединения, и увеличение концентрации соединения будет приводить к уменьшению значения kp.
В зависимости от механизма антипролиферативного действия некоторые соединения могут и не оказывать немедленное воздействие на скорость пролиферации. Напротив, проявление воздействия соединения может происходить по прошествии латентного периода. В указанных случаях график зависимости ln(Nt) от времени становится двухфазным, а момент времени, в который начинает действовать соединение, можно определять по разрыву между фазами. Константа скорости пролиферации для каждой концентрации соединения определяется коэффициентом наклона кривой зависимости ln(Nt) от времени от момента времени, когда соединение начинает действовать, до конца периода наблюдения и не зависит от того, начинает ли соединение действовать на пролиферацию немедленно или по прошествии латентного периода.
Обработка растущих клеток соединением может влиять на наблюдаемую пролиферацию одним из двух общих способов: путем подавления дополнительного деления клеток (цитостаз) или путем уничтожения клеток (цитотоксичность). Если соединение является цитостатическим, то увеличение концентрации соединения приводит к уменьшению значения kp до прекращения деления клеток. В этот момент скорость роста клеток, а следовательно и значение kp становятся равным нулю. С другой стороны, если соединение является цитотоксическим, то значение kp определяется двумя константами скоростей: константой скорости продолжающегося роста клеток в присутствии соединения (kg) и константной скорости уничтожения клеток под действием соединения (kd). Общая константа скорости пролиферации при данной концентрации соединения, таким образом, соответствует разнице абсолютных значений указанных противоположных по знаку констант скорости.
При концентрациях соединения, при которых скорость роста клеток превосходит скорость уничтожения клеток, значение kp будет положительным (т.е., kp>0). При концентрациях соединения, при которых скорость роста клеток ниже скорости уничтожения клеток, значение kp будет отрицательным (т.е., kp<0), и со временем количество клеток будет уменьшаться, что указывает на устойчивую цитотоксичность. Если значение kg точно соответствует kd, то общая константа скорости пролиферации, kp, будет равна нулю. Таким образом, можно определить минимальную цитотоксическую концентрацию (LCC) как концентрацию соединения, при которой значение kp равно нулю, так как при любой концентрации выше указанной наблюдают явную цитотоксичность. Примечание: при концентрациях ниже LCC уничтожение клеток также необязательно происходит, но его скорость ниже скорости остаточной пролиферации. Предполагается, что описанное лечение не определяет биологические детали, относящиеся к действию соединения. Напротив, задачей настоящего описания является исключительно определение практического параметра, при помощи которого можно проводить объективную количественную оценку концентрации соединения, при которой скорость уничтожения клеток превосходит скорость роста новых клеток. Фактически, LCC соответствует предельной или критической концентрации, выше которой наблюдают явную цитотоксичность, но не цитотоксической концентрации, как таковой. С этой точки зрения LCC можно рассматривать в схожем ключе с другими предельными физическими показателями, такими как критическая концентрация мицеллообразования (ККМ), которую используют для определения концентрации липида, моющего вещества или других поверхностно-активных частиц, выше которой все молекулы включаются в мицеллярные структуры.
Традиционно воздействие антипролиферативных соединений на рост клеток количественно оценивают по значению IC50, которое определяют как концентрацию соединения, которая приводит к снижению скорости пролиферации клеток в два раза по сравнению со значением, наблюдаемым в отсутствие соединения (т.е. в контрольном образце, в котором используют носитель или растворитель). Тем не менее, ТС50 не позволяет проводить различия между цитостатическими и цитотоксическими соединениями. В противоположность этому, LCC позволяет легко проводить различия между указанными видами соединений, а кроме того проводить количественную оценку концентрации, при которой проявляется явное цитотоксическое действие.
Если интервал наблюдения ограничен началом воздействия и завершением эксперимента, то данные, как правило, хорошо ложатся на прямую линию графика зависимости ln(Nt) от времени (см. выше). При помощи указанных подстановок можно легко определять значение kp для каждой концентрации исследуемого соединения. В свою очередь, график зависимости значения kp от концентрации соединения ([I]) имеет форму нисходящей изотермы, имеющей максимальное значение kmax (определенное в контрольном образце, в котором используют носитель или растворитель) при [I]=0 и минимальное значение при kmin при определенной концентрации соединения.
где Imid представляет собой концентрацию соединения, при которой значение kp находится посередине между значениями kmax и kmin (следует отметить, что значение Imid не совпадает с IC50 за исключением случая чистого полностью цитостатического соединения). Таким образом, подстановка данных из второго графика в уравнение А.7 обеспечивает оценочные значения kmax, kmin и Imid. Если соединение является цитостатическим (согласно приведенному в настоящем описании определению), то значение kmin не может быть меньше нуля. В случае цитотоксических соединений kmin составляет менее нуля, а абсолютное значение kmin напрямую связано с эффективностью уничтожения клеток под действием соединения.
Значения, полученные в результате подстановки в уравнение А.7, также можно использовать для определения значения LCC. По определению, если [I]=LCC, то kp=0. При таких условиях уравнение А.7 принимает вид
В результате алгебраического преобразования уравнения А.8 получают уравнение для LCC.
Указанный анализ легко проводить с использованием программного обеспечения, выполняющего подстановку в нелинейные кривые, и его можно применять для клеточных исследований активности соединения при изыскании и разработке лекарственных средств. Таким образом, значение LCC может обеспечивать поддающийся анализу критерий определения SAR (соотношения структура-активность) соединения.
Пример 4: Исследования in vivo
Мыши
Самки мышей Fox Chase SCID® (CB17/Icr-Prkdcscid/IcrIcoCrl, Charles River Laboratories) или бестимусных мышей (Crl:NU(Ncr)-Foxn1nu, Charles River Laboratories) имели возраст 8 недель и диапазон массы тела (BW) 16,0-21,1 г в 1 день исследования. Животным предоставляли доступ к воде ad libitum (обратный осмос 1 м.д. Cl) и NIH 31 Modified and Irradiated Lab Diet®, состоящей из 18,0% неочищенного белка, 5,0% неочищенного жира и 5,0% неочищенных волокон. Мышей размещали на облученные подстилки Enrich-o'cobs™ в стационарных микроизоляторах с 12-часовым циклом смены дня и ночи при 20-22°С (68-72°F) и влажности 40-60%. Все процедуры удовлетворяли рекомендациям Guide for Care and Use of Laboratory Animals, касающимся ограничения подвижности, содержания, хирургических процедур, регулирования приема пищи и жидкостей и ветеринарного ухода.
Опухолевая клеточная культура
Клеточные линии лимфомы человека получали из различных источников (АТСС, DSMZ), например, WSU-DLCL2 получали в DSMZ. Клеточные линии выдерживали в Пьемонте в виде суспензионных культур в среде RPMI-1640, содержащей 100 единиц/мл натриевой соли пенициллина G, 100 г/мл стрептомицина и 25 г/мл гентамицина. Среду дополняли 10% эмбриональной бычьей сывороткой и 2 мМ глутамином. Клетки выращивали в колбах для тканевых культур в инкубаторе с влажной камерой при 37°С в атмосфере 5% CO2 и 95% воздуха.
Имплантация опухоли in vivo
Клеточные линии лимфомы человека, например, клетки WSU-DLCL2, выращивали до достижения середины логарифмической фазы роста и повторно суспендировали в PBS, содержащем 50% Matrigel™ (BD Biosciences). В правый бок каждой мыши подкожно вводили 1×107 клеток (0,2 мл клеточной суспензии). При помощи штангенциркуля измеряли размер опухоли в двух изменениях для отслеживания ее роста до тех пор, пока средний объем не достигал желаемого диапазона 80-120 мм3. Размер опухоли, в мм3, рассчитывали по формуле:
где w = ширина, а l = длина опухоли, в мм. Массу опухоли можно оценивать с учетом предположения, что масса 1 мг эквивалентна объему опухоли 1 мм3. Через 10-30 дней мышей с объемом опухоли 108-126 мм3 распределяли по группам лечения со средним объемом опухоли 117-119 мм3.
Исследуемые образцы
Исследуемые соединения хранили при комнатной температуре без доступа света. В каждый день введения готовили свежие составы соединения путем суспендирования порошков в 0,5% карбоксиметилцеллюлозе натрия (NaCMC) и 0,1% Tween® 80 в деионизированной воде. Соединение 141 (свободное основание) растворяли в стерильном солевом растворе, рН доводили до 4,5 при помощи свежей HCl каждый день. Для лечения контрольных групп использовали носители, 0,5% NaCMC и 0,1% Tween® 80 в деионизированной воде или стерильный солевой раствор с рН 4,5, согласно указанной схеме введения. Перед введением составы хранили без доступа света при 4°С. Если не указано иное, соединения, указанные и исследуемые в данном эксперименте, имели форму конкретной соли, указанную в настоящем параграфе.
Схема лечения
Мышам при помощи перорального зонда или путем интраперитонеальной инъекции вводили дозу соединения в диапазоне 12,5-600 мг/кг согласно схеме TID (три раза в день каждые 8 часов), BID (2 раза в день каждые 12 часов) или QD (один раз в день), продолжительность введения была различной. Объем каждой доставляемой дозы составлял 0,2 мл/20 г массы тела мыши (10 мл/кг), его регулировали по последнему измеренному значению массы тела каждого отдельного животного. Максимальная продолжительность лечения составляла 28 дней.
Анализ медианного объема опухоли (MTV) и подавления роста опухоли (TGI)
Эффективность лечения определяли в последний день введения. В каждой группе определяли MTV(n), медианный объем опухоли для количества животных, n, которых можно было исследовать в последний день. Подавление роста опухоли в процентах можно определять несколькими способами. Во-первых, разницу MTV(n) в соответствующей контрольной группе и MTV(n) в группе, которой вводили лекарственное средство, выражали как отношение в процентах по сравнению со значением MTV(n) в контрольной группе:
Другим способом вычисления %TGI является определение изменения размера опухоли от 1 дня до дня n, где n соответствует последнему дню введения.
Токсичность
Массу животных определяли ежедневно в период с 1 по 5 день, а затем два раза в неделю до завершения исследования. Проводили регулярное исследование животных для выявления и регистрации явных признаков нежелательных побочных эффектов, связанных с лечением. Токсичность максимальной переносимой дозы (MTD) определяют как приемлемую, если среднее снижение BW в группе составляет менее 20% во время исследования, а смертность по причинам, связанным с лечением (TR), составляет не более 10%. Смерть классифицируют как связанную с лечением (TR), если ее можно связать с побочными эффектами лечения на основании клинических признаков и/или вскрытия, или если она вызвана неизвестными причинами, выявленными в период лечения. Смерть классифицируют как не связанную с лечением (NTR), если существуют доказательства того, что смерть не связана с побочными эффектами лечения. Смерти NTR, происходящие в период дозирования, как правило, разделяют на NTRa (вследствие несчастного случая или человеческой ошибки) или NTRm (вследствие подтвержденного по результатам вскрытия распространения опухоли, вызванного инвазией и/или метастазами). Животных, которые после перорального введения умирали по неизвестным причинам в период дозирования, можно отнести к группе NTRu, если показатели по группе в целом не подтверждают классификацию TR и результаты вскрытия, исключение ошибки дозирования не представляется возможным.
Отбор проб
На 7 или 28 день исследования проводили отбор проб у мышей при помощи заранее определенного способа определения целевого подавления опухолей. У указанных мышей собирали образцы опухолей без использования РНКазы и разделяли образцы на две равные части. Замороженные образцы опухолевой ткани каждого животного мгновенно замораживали в жидком N2 и растирали с использованием пестика и ступки.
Статистический и графический анализ
Все статистические и графические анализы проводили на Prism 3.03 (GraphPad) для ОС Windows. Для исследования статистической значимости результатов в контрольных группах и группах, которым проводили лечение, на протяжении всего курса лечения использовали анализ повторных измерений ANOVA, затем апостериорный тест множественного сравнения по методу Даннета или 2-факторный ANOVA. Результаты Prism представлены как незначительные (ns), если Р>0,05, значимые (обозначены "*"), если 0,01<Р<0,05, высоко значимые ("**"), если 0,001<Р<0,01, и исключительно значимые ("***"), если Р<0,001.
Экстракция гистонов
Для выделения гистонов гомогенизировали 60-90 мг опухолевой ткани в 1,5 мл буфера для экстракции ядер (10 мМ Tris-HCl, 10 мМ MgCl2, 25 мМ KCl, 1% Triton X-100, 8,6% сахарозы и таблетка с ингибитором протеазы Roche 1836145) и инкубировали во льду в течение 5 минут. Ядра собирали путем центрифугирования при 600 g в течение 5 минут при 4°С и один раз промывали PBS. Удаляли надосадочную жидкость и экстрагировали гистоны в течение одного часа с использованием 0,4 н. охлажденной серной кислоты, встряхивая на вортексе каждые 15 минут. Экстракты осветляли путем центрифугирования при 10000 g в течение 10 минут при 4°С и переносили в свежие пробирки для микроцентрифуги, содержащие 10х объем ледяного ацетона. Гистоны осаждали при -20°С в течение 2 часов или оставляли на ночь, гранулировали путем центрифугирования при 10000 g в течение 10 минут и повторно суспендировали в воде.
ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (ELISA)
Получали гистоны в эквивалентых концентрациях в буфере для нанесения покрытия (PBS+0,05%БСА), что приводило к получению 0,5 нг/мкл образца, и 100 мкл образца или стандарта добавляли в двух повторностях в 2 96-луночных планшета для ELISA (Thermo Labsystems, Immulon 4HBX #3885). Планшеты закрывали и инкубировали в течение ночи при 4°С. На следующий день планшеты промывали 3х с использованием 300 мкл/лунка PBST (PBS+0,05% Tween 20; 10Х PBST, KPL #51-14-02) на устройстве для промывки планшетов Bio Tek. Планшеты блокировали 300 мкл/лунка разбавителя (PBS+2% БСА+0,05% Tween 20), инкубировали при КТ в течение 2 часов и промывали 3х PBST. Все антитела разбавляли в разбавителе. В каждый планшет добавляли 100 мкл/лунка анти-H3K27me3 (CST #9733, 50% маточный раствор в глицерине, 1:1000) или антитела к общим Н3 (Abcam ab1791, 50% в глицерине, 1:10000). Планшеты инкубировали в течение 90 минут при КТ и промывали 3х PBST. В планшет с H3K27Me3 добавляли 100 мкл/лунка антитела к Rb-IgG-HRP (Cell Signaling Technology, 7074), разбавленного 1:2000, в планшете с Н3 указанное антитело разбавляли 1:6000 и инкубировали в течение 90 минут при КТ. Планшеты промывали 4Х PBST. Для детектирования добавляли 100 мкл/лунка субстрата ТМВ (BioFx Laboratories, #TMBS), и планшеты инкубировали без доступа света при КТ в течение 5 минут. Реакцию останавливали с использованием 100 мкл/лунка 1н. H2SO4. Анализировали поглощение при 450 нм на анализаторе микропланшетов SpectaMax M5.
7-дневное исследование PD
Для исследования способности соединения модулировать метку гистона H3K27me3 в опухолях in vivo мышам с ксенотрансплантом опухоли WSU-DLCL2 вводили 200 мг/кг BID или 400 мг/кг QD дозу соединения или носитель (схема BID) в течение 7 дней. В группы включали по 4 животных. Животных умерщвляли через 3 часа после введения последней дозы и опухоли сохраняли в замороженном состоянии согласно приведенному выше описанию. После экстракции гистонов образцы анализировали в исследовании ELISA с использованием антител, направленных на триметилированное состояние гистона H3K27 (H3K27me3) или общий гистон Н3. На основании полученных данных вычисляли отношение глобально-метилированного и общего H3K27. Среднее отношение глобального метилирования для всех групп, измеренное при помощи ELISA, указывает на целевой диапазон ингибирования по сравнению с носителем.
28-дневное исследование эффективности на модели ксенотрансплантата WSU-DLCL2
Для исследования способности соединения инициировать подавление роста опухоли in vivo мышам с ксенотрансплантатом опухоли WSU-DLCL2 вводили 12,5, 25 или 50 мг/кг QD дозу соединения в течение 28 дней путем интраперитонеальной инъекции. Объем опухоли и массу тела определяли два раза в неделю. Одновременно отдельной когорте мышей (n=4 в группе) вводили такие же дозы, но в течение 7 дней, мышей умерщвляли на 7 день через 3 часа после введения последней дозы для отбора пробы опухоли и определения целевого ингибирования. Глобальное метилирование H3K27me3, нормированное по общему Н3, измеряли путем ELISA и представляли в качестве конечного результата.
Исследование эффективности с повышающимися дозами на модели ксенотрансплантата WSU-DLCL2
Для исследования способности соединения проявлять противоопухолевое действие in vivo мышам с ксенотранспланатом опухоли WSU-DLCL2 вводили, например, 37,5, 75 или 150 мг/кг TID дозу соединения в течение 28 дней. В эксперименте по определению эффективности использовали по 12 мышей на группу. Одновременно отдельной когорте вводили такие же дозы согласно указанной схеме, но в течение 7 дней, для определения целевого ингибирования в течение 7 дней (n=6 на группу). Измеряли рост опухоли по истечении 28-дневного курса лечения в группах, в которых вводили носитель и соединение.
Экстрагировали гистоны из опухолей, собранных после 7-дневного дозирования (параллельная когорта PD) и по завершении исследования на 28 день в когорте определения эффективности (через 3 часа после введения последней дозы для обеих когорт). Было определено, что лечение приводило к модуляции метильной метки H3K27me3 зависящим от дозы образом.
Исследование эффективности различных схем дозирования
Для определения способности соединений подавлять рост опухоли при других схемах дозирования, отличных от TID, проводили исследование эффективности с использованием ксенотрансплантата WSU-DLCL2, где проводили непосредственное сравнение схем TID, BID и QD. Каждая группа содержала по 12 животных, лечение мышей проводили в течение 28 дней. Измеряли рост опухоли на протяжении 28-дневного курса лечения в группах, которым вводили носитель и соединение.
На 28 день мышей умерщвляли и собирали образцы опухолей через 3 часа после введения последней дозы для определения целевого ингибирования.
Пример 5: Противораковое действие на модели ксенотрансплантата диффузной крупноклеточной В-клеточной лимфомы человека KARPAS-422 у мышей
Анализировали противораковую активность исследуемого соединения на модели ксенотрансплантата KARPAS-422 у мышей, то есть на модели ксенотрансплантата диффузной крупноклеточной В-клеточной лимфомы человека. 45 самок мышей CAnN.Cg-Foxn1nu/CrlCrlj (Charles River Laboratories Japan) со средним размером опухоли (TV) KARPAS-422, достигавшим примерно 150 мм3, отбирали на основании значений TV и случайным образом распределяли по пяти группам. На 1 день начинали перорально вводить соединение (например, 80,5, 161, 322 и 644 мг/кг) или носитель. Соединение вводили один раз в день на 1 и 29 день и два раза в день каждый день в период со 2 по 28 день. Вводимый объем (0,1 мл/10 г массы тела) рассчитывали по данным массы тела перед введением. Значения TV и массы тела измеряли два раза в неделю. Схема указанного эксперимента приведена в таблице 4.
Значение TV рассчитывали по данным, измеренным при помощи штангенциркуля, с использованием формулы объема продолговатого эллипсоида (L×W2)/2, где L и W представляют собой соответствующие значения длины и ширины, измеренные во взаимно-перпендикулярных направлениях (мм).
Данные выражены в виде среднее ± среднеквадратическое отклонение (СКО). Различия TV в группах, в которых вводили носитель, и группах, в которых вводили соединение, исследовали при помощи дисперсионного анализа повторных измерений (ANOVA), затем при помощи теста множественного сравнения по методу Даннета. Значение Р<0,05 (двусторонний) считали статистически значимым. Статистический анализ проводили с использованием пакета программного обеспечения Prism 5, версия 5.04 (GraphPad Software, Inc., CA, США).
Описание каждого из патентных документов и научных статей, указанных в настоящей заявке, включено в настоящую заявку во всей полноте посредством ссылки для всех целей.
Настоящее изобретение может быть реализовано в других конкретных формах, не выходящих за рамки сущности или существенных характеристик настоящего изобретения. Вышеуказанные варианты реализации, таким образом, следует рассматривать во всех отношениях как иллюстративные, но не ограничивающие изобретение, описанное в настоящей заявке. Объем изобретения, таким образом, определяется прилагаемой формулой изобретения, а не приведенным выше описанием, и предполагается, что все изменения, не выходящие за рамки значения и диапазона эквивалентности формулы изобретения, включены в указанный объем.
Claims (98)
1. Соединение формулы III:
или его фармацевтически приемлемая соль, где
R801 представляет собой C1-6 алкил, C2-6 алкинил, гетероциклоалкил, выбранный из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, фенил или гетероарил, выбранный из пиррола, фурана, тиофена, тиазола, изотиазола, имидазола, триазола, тетразола, пиразола, оксазола, изоксазола, пиридина, пиразина, пиридазина и пиримидина, каждый из которых содержит в качестве заместителя O-C1-6 алкил-Rx, где Rx представляет собой гидроксил или O-C1-3 алкил и Rx необязательно дополнительно замещен O-C1-3 алкилом;
каждый из R802 и R803 независимо представляет собой H, галоген, C1-4 алкил или C1-6 алкоксил;
каждый из R804 и R805 независимо представляет собой C1-4 алкил; и
R806 представляет собой -Qx-Tx, где Qx представляет собой связь или C1-4 алкильную связующую группу, Tx представляет собой H, тетрагидропиранил, пиперидинил, замещенный 1, 2 или 3 C1-4 алкильными группами, или циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один или оба C1-4 алкила необязательно содержат в качестве заместителя C1-6 алкокси;
при условии, что указанное соединение не является
2. Соединение по п. 1, отличающееся тем, что R806 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2.
4. Соединение по п. 1, отличающееся тем, что R801 представляет собой фенил или гетероарил, содержащий в качестве заместителя O-C1-6 алкил-Rx.
5. Соединение по п. 1, отличающееся тем, что указанное соединение представлено формулой IVa или IVb:
где Z’ представляет собой CH или N и R807 представляет собой C2-3 алкил-Rx.
6. Соединение по п. 5, отличающееся тем, что R807 представляет собой -CH2CH2OH, -CH2CH2OCH3 или -CH2CH2OCH2CH2OCH3.
7. Соединение по п. 1, отличающееся тем, что R802 представляет собой метил или изопропил и R803 представляет собой метил или метоксил.
8. Соединение по п. 1, отличающееся тем, что R804 представляет собой метил.
9. Соединение формулы I:
или его фармацевтически приемлемая соль, где
R701 представляет собой H, F, OR707, -(C≡C)-(CH2)n7-R708, фенил, гетероарил, выбранный из пиррола, фурана, тиофена, тиазола, изотиазола, имидазола, триазола, тетразола, пиразола, оксазола, изоксазола, пиридина, пиразина, пиридазина и пиримидина, C3-8 циклоалкил или гетероциклоалкил, выбранный из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, где фенил, гетероарил, C3-8 циклоалкил или гетероциклоалкил, каждый независимо, необязательно замещен одной или более группами, выбранными из галогена, C1-3 алкила, OH, O-C1-6 алкила, NH-C1-6 алкила и C1-3 алкила, замещенного C3-8 циклоалкилом или гетероциклоалкилом, выбранным из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, где каждый из O-C1-6 алкила и NH-C1-6 алкила необязательно замещен гидроксилом, O-C1-3 алкилом или NH-C1-3 алкилом, и каждый из O-C1-3 алкила и NH-C1-3 алкила необязательно дополнительно замещен O-C1-3 алкилом или NH-C1-3 алкилом;
каждый из R702 и R703 независимо представляет собой H, галоген, C1-4 алкил, C1-6 алкоксил или C6-C10 арилокси, каждый из которых необязательно замещен одним или более галогенами;
каждый из R704 и R705 независимо представляет собой C1-4 алкил;
R706 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один или оба C1-4 алкила содержат в качестве заместителя C1-6 алкокси; или R706 представляет собой тетрагидропиранил;
R707 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из гидроксила, C1-4 алкокси, амино, моно- или ди-C1-4 алкиламино, C3-8 циклоалкила и гетероциклоалкила, выбранного из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, где C3-8 циклоалкил или гетероциклоалкил, каждый независимо, необязательно дополнительно замещен C1-3 алкилом;
R708 представляет собой C1-4 алкил, необязательно замещенный одной или более группами, выбранными из OH, галогена и C1-4 алкокси, гетероциклоалкил, выбранный из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана, или O-C1-6 алкил, где гетероциклоалкил необязательно дополнительно содержит в качестве заместителя OH или C1-6 алкил; и
10. Соединение по п. 9, отличающееся тем, что R706 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, где один из C1-4 алкилов является незамещенным, а другой замещен метокси.
12. Соединение по п. 9, отличающееся тем, что указанное соединение представлено формулой II:
13. Соединение по п. 9, отличающееся тем, что R702 представляет собой метил или изопропил и R703 представляет собой метил или метоксил.
14. Соединение по п. 9, отличающееся тем, что R704 представляет собой метил.
15. Соединение по п. 9, отличающееся тем, что R701 представляет собой OR707 и R707 представляет собой C1-3 алкил, необязательно содержащий в качестве заместителя OCH3 или морфолин.
16. Соединение по п. 9, отличающееся тем, что R701 представляет собой H или F.
17. Соединение по п. 9, отличающееся тем, что R701 представляет собой тетрагидропиранил, фенил, пиридил, пиримидил, пиразинил, имидазолил или пиразолил, каждый из которых необязательно содержит в качестве заместителя метил, метокси, этил, замещенный морфолином, или -OCH2CH2OCH3.
18. Соединение по п. 9, отличающееся тем, что R708 представляет собой морфолин, пиперидин, пиперазин, пирролидин, диазепан или азетидин, каждый из которых необязательно содержит в качестве заместителя OH или C1-6 алкил.
19. Соединение по п. 9, отличающееся тем, что R708 представляет собой морфолин.
20. Соединение по п. 9, отличающееся тем, что R708 представляет собой пиперазин, замещенный C1-6 алкилом.
21. Соединение по п. 9, отличающееся тем, что R708 представляет собой метил, трет-бутил или C(CH3)2OH.
22. Соединение формулы VI:
или его фармацевтически приемлемая соль;
где
n5 равняется 0, 1 или 2;
R501 представляет собой C(H) или N;
каждый из R502, R503, R504 и R505 независимо в каждом случае представляет собой C1-4 алкил;
R506 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой C(H), R507 представляет собой морфолин, пиперидин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где указанный гетероцикл выбран из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана и где указанный гетероцикл необязательно замещен по атому азота C1-3 алкилом; где указанные пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно замещены OH, C1-6 алкилом или O-C1-3 алкилом;
или если R501 представляет собой C(H), R507 может представлять собой пиперазин, необязательно дополнительно замещенный C1-6 алкилом, при условии, что R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами;
если R501 представляет собой N, R507 представляет собой морфолин, пиперидин, пиперазин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где указанный гетероцикл выбран из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана и где указанный гетероцикл необязательно замещен по атому азота C1-3 алкилом; где указанные пиперидиновая, пиперазиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя OH, C1-6 алкил или O-C1-3 алкил.
23. Соединение по п. 22, отличающееся тем, что R501 представляет собой C(H) и R507 представляет собой пиперидин, диазепан, пирролидин, азетидин, O-C1-6 алкил или O-гетероцикл, где указанный гетероцикл выбран из морфолина, пирролидина, тетрагидротиофена, пиперидина, пиперазина, оксетана, пирана, тетрагидропирана, азетидина и тетрагидрофурана и где указанный гетероцикл необязательно замещен по атому азота C1-3 алкилом; где указанные пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя OH, C1-6 алкил или O-C1-3 алкил.
24. Соединение по п. 22, отличающееся тем, что R501 представляет собой C(H) и R507 представляет собой пиперидин, диазепан, пирролидин, азетидин или O-C1-6 алкил, где указанные пиперидиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя OH или C1-6 алкил.
25. Соединение по п. 22, отличающееся тем, что R501 представляет собой C(H), R507 представляет собой пиперазин, необязательно дополнительно замещенный C1-6 алкилом, и R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами.
26. Соединение по п. 22, отличающееся тем, что R501 представляет собой N и R507 представляет собой морфолин, пиперидин, пиперазин, диазепан, пирролидин, азетидин или O-C1-6 алкил, где указанные пиперидиновая, пиперазиновая, диазепановая, пирролидиновая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя OH или C1-6 алкил.
27. Соединение по п. 22, отличающееся тем, что R502 представляет собой метил или изопропил и R503 представляет собой метил.
28. Соединение по п. 22, отличающееся тем, что R504 представляет собой метил.
29. Соединение по п. 22, отличающееся тем, что R505 представляет собой этил.
30. Соединение по п. 22, отличающееся тем, что R506 представляет собой
31. Соединение по п. 22, отличающееся тем, что R506 представляет собой
32. Соединение по п. 22, отличающееся тем, что, если R501 представляет собой C(H), R507 представляет собой пиперидин или диазепан, которые содержат в качестве заместителя OH или C1-6 алкил, или если R501 представляет собой N, R507 представляет собой пиперидин, пиперазин или диазепан, которые необязательно дополнительно содержат в качестве заместителя OH или C1-6 алкил.
33. Соединение по п. 22, отличающееся тем, что, если R501 представляет собой C(H), R507 представляет собой пиперидин, замещенный C1-6 алкилом, или если R501 представляет собой N, R507 представляет собой пиперидин, содержащий в качестве заместителя OH, или пиперазин, замещенный C1-6 алкилом.
34. Соединение по п. 22, отличающееся тем, что, если R501 представляет собой N, R507 представляет собой незамещенный пиперазин.
35. Соединение по п. 22, отличающееся тем, что n5 равняется 0 или 1.
36. Соединение по п. 22, отличающееся тем, что, если R501 представляет собой C(H) или N, R507 представляет собой O-C1-6 алкил или O-гетероцикл и n5 равно 1.
37. Соединение по п. 22, отличающееся тем, что, если R501 представляет собой C(H), R507 представляет собой незамещенный пиперазин и R506 представляет собой пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами.
38. Соединение формулы VII:
или его фармацевтически приемлемая соль;
где
n6 равняется 1 или 2;
каждый из R602, R603, R604 и R605 независимо представляет собой C1-4 алкил;
R606 представляет собой циклогексил, содержащий в качестве заместителя N(C1-4 алкил)2, или пиперидин, замещенный 1, 2 или 3 C1-4 алкильными группами; и
R607 представляет собой морфолин, пиперидин, пиперазин, пирролидин, диазепан, азетидин или O-C1-6 алкил, где пиперидиновая, диазепановая или азетидиновая группы необязательно дополнительно содержат в качестве заместителя OH или C1-6 алкил.
39. Соединение по п. 38, отличающееся тем, что R602 представляет собой метил или изопропил и R603 представляет собой метил.
40. Соединение по п. 38, отличающееся тем, что R604 представляет собой метил и R605 представляет собой этил.
41. Соединение по п. 38, отличающееся тем, что R606 представляет собой
42. Соединение по п. 38, отличающееся тем, что R606 представляет собой
43. Соединение по п. 38, отличающееся тем, что R607 представляет собой пиперидин или диазепан, каждый из которых содержит в качестве заместителя OH или C1-6 алкил.
44. Соединение по п. 38, отличающееся тем, что R607 представляет собой пиперидин, содержащий в качестве заместителя OH.
45. Соединение по п. 38, отличающееся тем, что n6 равняется 2.
46. Соединение, выбранное из:
и их фармацевтически приемлемых солей.
47. Фармацевтическая композиция, обладающая способностью ингибировать активность EZH2, содержащая терапевтически эффективное количество соединения по любому из пп. 1-46 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель.
48. Способ лечения расстройства, опосредованного EZH2, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп. 1-46 или его фармацевтически приемлемой соли.
49. Способ по п. 48, отличающийся тем, что указанное расстройство, опосредованное EZH2, представляет собой рак.
50. Способ по п. 49, отличающийся тем, что указанный рак представляет собой лимфому, лейкоз или меланому.
51. Способ по п. 49, отличающийся тем, что указанный рак представляет собой диффузную крупноклеточную B-клеточную лимфому (ДККЛ), неходжкинскую лимфому (НХЛ), фолликулярную лимфому, хронический миелогенный лейкоз (ХМЛ), острый миелоидный лейкоз, острый лимфоцитарный лейкоз, лейкоз смешанного происхождения или миелодиспластические синдромы (МДС).
52. Способ по п. 49, отличающийся тем, что указанный рак представляет собой злокачественную рабдоидную опухоль или INI1-дефицитную опухоль.
53. Соединение по любому из пп. 1-46 для применения в способе лечения расстройства, опосредованного EZH2.
54. Применение соединения по любому из пп. 1-46 для получения лекарственного средства для лечения расстройства, опосредованного EZH2.
55. Фармацевтическая композиция, обладающая способностью ингибировать гистонметилтрансферазную активность EZH2 или его мутанта, содержащая терапевтически эффективное количество соединения по любому из пп. 1-46 в качестве основного ингредиента и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201261714145P | 2012-10-15 | 2012-10-15 | |
| US201261714140P | 2012-10-15 | 2012-10-15 | |
| US61/714,145 | 2012-10-15 | ||
| US61/714,140 | 2012-10-15 | ||
| US201361780703P | 2013-03-13 | 2013-03-13 | |
| US61/780,703 | 2013-03-13 | ||
| US201361786277P | 2013-03-14 | 2013-03-14 | |
| US61/786,277 | 2013-03-14 | ||
| PCT/US2013/065127 WO2014062733A2 (en) | 2012-10-15 | 2013-10-15 | Substituted benzene compounds |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2015118145A RU2015118145A (ru) | 2016-12-10 |
| RU2658919C2 true RU2658919C2 (ru) | 2018-06-26 |
Family
ID=50475881
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015118135A RU2662436C2 (ru) | 2012-10-15 | 2013-10-15 | Содержащие заместители бензольные соединения |
| RU2015118145A RU2658919C2 (ru) | 2012-10-15 | 2013-10-15 | Замещенные бензольные соединения |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015118135A RU2662436C2 (ru) | 2012-10-15 | 2013-10-15 | Содержащие заместители бензольные соединения |
Country Status (23)
| Country | Link |
|---|---|
| US (8) | US9006242B2 (ru) |
| EP (4) | EP3628662A1 (ru) |
| JP (4) | JP6461802B2 (ru) |
| KR (2) | KR102057365B1 (ru) |
| CN (3) | CN105102431B (ru) |
| AR (1) | AR093244A1 (ru) |
| AU (2) | AU2013331380B2 (ru) |
| BR (2) | BR112015008487B1 (ru) |
| CA (2) | CA2888021A1 (ru) |
| CL (2) | CL2015000944A1 (ru) |
| HK (2) | HK1213264A1 (ru) |
| IL (4) | IL238135B (ru) |
| MX (2) | MX353929B (ru) |
| MY (1) | MY180311A (ru) |
| NZ (2) | NZ706738A (ru) |
| PE (2) | PE20150887A1 (ru) |
| PH (2) | PH12015500800A1 (ru) |
| RU (2) | RU2662436C2 (ru) |
| SG (3) | SG11201502820YA (ru) |
| TW (2) | TWI588131B (ru) |
| UA (2) | UA115074C2 (ru) |
| WO (2) | WO2014062733A2 (ru) |
| ZA (2) | ZA201502526B (ru) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20130102477A1 (en) | 2010-06-23 | 2013-04-25 | Ryan D. Morin | Biomarkers for non-hodgkin lymphomas and uses thereof |
| US9175331B2 (en) * | 2010-09-10 | 2015-11-03 | Epizyme, Inc. | Inhibitors of human EZH2, and methods of use thereof |
| TW201733984A (zh) | 2011-04-13 | 2017-10-01 | 雅酶股份有限公司 | 經取代之苯化合物 |
| JO3438B1 (ar) | 2011-04-13 | 2019-10-20 | Epizyme Inc | مركبات بنزين مستبدلة بأريل أو أريل غير متجانس |
| EP2780013A4 (en) | 2011-11-18 | 2015-07-01 | Constellation Pharmaceuticals Inc | MODULATORS OF METHYL MODIFYING ENZYMES, COMPOSITIONS AND USES THEREOF |
| US9085583B2 (en) | 2012-02-10 | 2015-07-21 | Constellation—Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| BR112015008487B1 (pt) * | 2012-10-15 | 2022-05-31 | Epizyme, Inc | Compostos de benzeno substituído, composição farmacêutica compreendendo os ditos compostos e uso terapêutico dos mesmos para tratar um distúrbio mediado por ezh2 |
| CA2894657A1 (en) | 2012-12-13 | 2014-07-10 | Glaxosmithkline Llc | Enhancer of zeste homolog 2 inhibitors |
| WO2014100665A1 (en) | 2012-12-21 | 2014-06-26 | Epizyme, Inc. | 1,4-pyridone bicyclic heteroaryl compounds |
| EP2935214B1 (en) * | 2012-12-21 | 2019-02-20 | Epizyme, Inc. | 1,4-pyridone compounds |
| AP2015008601A0 (en) | 2013-03-14 | 2015-07-31 | Boehringer Ingelheim Int | Substituted 2-aza-bicyclo[2.2.1] heptane-3-carboxylic acid (benzyl-cyano-methyl)-amides inhibitors of cathepsin C |
| JP6294953B2 (ja) | 2013-03-14 | 2018-03-14 | ヤンセン ファーマシューティカ エヌ.ベー. | P2x7調節物質 |
| TWI599567B (zh) | 2013-03-14 | 2017-09-21 | 健生藥品公司 | P2x7調節劑 |
| JO3509B1 (ar) | 2013-03-14 | 2020-07-05 | Janssen Pharmaceutica Nv | معدلات p2x7 |
| US10053463B2 (en) | 2013-03-14 | 2018-08-21 | Janssen Pharmaceutica Nv | Substituted [1,2,4]triazolo[4,3-a]pyrazines as P2X7 modulators |
| WO2014151142A1 (en) | 2013-03-15 | 2014-09-25 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| WO2015004618A1 (en) | 2013-07-10 | 2015-01-15 | Glaxosmithkline Intellectual Property (No.2) Limited | Enhancer of zeste homolog 2 inhibitors |
| EP3022184B1 (en) | 2013-07-19 | 2017-09-27 | Epizyme, Inc. | Substituted benzene compounds |
| US9624205B2 (en) | 2013-07-19 | 2017-04-18 | Epizyme, Inc. | Substituted 6,5-fused bicyclic heteroaryl compounds |
| US9969716B2 (en) | 2013-08-15 | 2018-05-15 | Constellation Pharmaceuticals, Inc. | Indole derivatives as modulators of methyl modifying enzymes, compositions and uses thereof |
| HUE063984T2 (hu) | 2013-10-16 | 2024-02-28 | Epizyme Inc | Hidroklorid só forma az EZH2 gátlásához |
| BR112016012713A2 (pt) | 2013-12-06 | 2017-08-08 | Epizyme Inc | Método para tratamento de câncer em um paciente necessitado, e, método de selecionar um paciente para um método de tratamento |
| SG10201811128RA (en) | 2014-06-17 | 2019-01-30 | Epizyme Inc | Ezh2 inhibitors for treating lymphoma |
| UA118610C2 (uk) | 2014-09-12 | 2019-02-11 | Бьорінгер Інгельхайм Інтернаціональ Гмбх | Спіроциклічні інгібітори катепсину c |
| JP6592510B2 (ja) | 2014-09-12 | 2019-10-16 | ヤンセン ファーマシューティカ エヌ.ベー. | P2x7調節因子 |
| IL289947B2 (en) * | 2014-10-16 | 2024-06-01 | Epizyme Inc | A method for treating cancer |
| PL3220916T3 (pl) | 2014-11-17 | 2023-08-14 | Epizyme, Inc. | Sposób leczenia raka n-((4,6-dimetylo-2-okso-1,2-dihydropirydyn-3-ylo)metylo)-5-(etylo(tetrahydro-2h-piran-4-ylo)amino)-4-metylo-4'-(morfolinometylo)-[1,1'-bifenylo]-3-karboksyamidem |
| WO2016101956A2 (en) | 2014-12-23 | 2016-06-30 | University Of Copenhagen | Treatment of cancer by inhibiting ezh2 activity |
| SG11201708286PA (en) | 2015-04-20 | 2017-11-29 | Epizyme Inc | Combination therapy for treating cancer |
| WO2016201328A1 (en) * | 2015-06-10 | 2016-12-15 | Epizyme, Inc. | Ezh2 inhibitors for treating lymphoma |
| WO2017035234A1 (en) | 2015-08-24 | 2017-03-02 | Epizyme, Inc. | Method for treating cancer |
| TW201718598A (zh) | 2015-08-27 | 2017-06-01 | 美國禮來大藥廠 | Ezh2抑制劑 |
| WO2017040190A1 (en) | 2015-08-28 | 2017-03-09 | Constellation Pharmaceuticals, Inc. | Crystalline forms of (r)-n-((4-methoxy-6-methyl-2-oxo-1,2-dihydropyridin-3-yl)methyl)-2-methyl-1-(1-(1-(2,2,2-trifluoroethyl)piperidin-4-yl)ethyl)-1h-indole-3-carboxamide |
| AU2017211331A1 (en) | 2016-01-29 | 2018-06-07 | Epizyme, Inc. | Combination therapy for treating cancer |
| EP3445365A4 (en) * | 2016-04-22 | 2019-10-16 | Dana-Farber Cancer Institute, Inc. | EZH2 INHIBITORS AND USES THEREOF |
| CA3025933A1 (en) | 2016-06-01 | 2017-12-07 | Epizyme, Inc. | Use of ezh2 inhibitors for treating cancer |
| EP3471830A4 (en) | 2016-06-17 | 2020-02-26 | Epizyme Inc | EZH2 INHIBITORS TO TREAT CANCER |
| WO2018075598A1 (en) | 2016-10-19 | 2018-04-26 | Constellation Pharmaceuticals, Inc. | Synthesis of inhibitors of ezh2 |
| US20200262813A1 (en) * | 2016-11-11 | 2020-08-20 | Shanghai Haiyan Pharmaceutical Technology Co., Ltd. | 1,5,7-trisubstituted isoquinoline derivatives, preparation thereof, and use thereof in medicines |
| US10266542B2 (en) | 2017-03-15 | 2019-04-23 | Mirati Therapeutics, Inc. | EZH2 inhibitors |
| WO2018183885A1 (en) | 2017-03-31 | 2018-10-04 | Epizyme, Inc. | Combination therapy for treating cancer |
| JP2020522687A (ja) | 2017-06-02 | 2020-07-30 | エピザイム,インコーポレイティド | 癌を処置するためのezh2阻害剤の使用 |
| CA3074720A1 (en) | 2017-09-05 | 2019-03-14 | Epizyme, Inc. | Combination therapy for treating cancer |
| DK4043466T3 (da) | 2018-01-31 | 2024-09-30 | Mirati Therapeutics Inc | PRC2-inhibitorer |
| WO2020011607A1 (en) | 2018-07-09 | 2020-01-16 | Fondation Asile Des Aveugles | Inhibition of prc2 subunits to treat eye disorders |
| MA53721A (fr) | 2018-09-28 | 2021-09-15 | Janssen Pharmaceutica Nv | Modulateurs de la monoacylglycérol lipase |
| TW202035409A (zh) | 2018-09-28 | 2020-10-01 | 比利時商健生藥品公司 | 單醯基甘油脂肪酶調節劑 |
| JP2022545467A (ja) | 2019-08-22 | 2022-10-27 | ジュノー セラピューティクス インコーポレイテッド | T細胞療法とzesteホモログ2エンハンサー(EZH2)阻害剤との併用療法および関連方法 |
| CN114555596A (zh) | 2019-09-30 | 2022-05-27 | 詹森药业有限公司 | 放射性标记的mgl pet配体 |
| CN111303133A (zh) * | 2020-03-25 | 2020-06-19 | 清华大学 | 降解ezh2蛋白的小分子化合物 |
| BR112022019077A2 (pt) | 2020-03-26 | 2022-12-27 | Janssen Pharmaceutica Nv | Moduladores da monoacilglicerol lipase |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20090012031A1 (en) * | 2007-07-03 | 2009-01-08 | The Regents Of The University Of Michigan | EZH2 Cancer Markers |
| RU2376286C2 (ru) * | 2004-03-11 | 2009-12-20 | Актелион Фармасьютиклз Лтд | Производные индол-1-илуксусной кислоты |
| WO2011140324A1 (en) * | 2010-05-07 | 2011-11-10 | Glaxosmithkline Llc | Indoles |
Family Cites Families (75)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4522811A (en) | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| JPH0733729A (ja) | 1993-07-26 | 1995-02-03 | Kirin Brewery Co Ltd | N−シアノ−n′−置換−アリールカルボキシイミダミド化合物の製造法 |
| HUT74450A (en) | 1993-12-27 | 1996-12-30 | Eisai Co Ltd | Anthranilic acid derivative and pharmaceutical compns. contg. such compds. |
| DE19516776A1 (de) | 1995-05-10 | 1996-11-14 | Boehringer Ingelheim Int | Chromatin-Regulatorgene |
| US5741819A (en) | 1995-06-07 | 1998-04-21 | 3-Dimensional Pharmaceuticals, Inc. | Arylsulfonylaminobenzene derivatives and the use thereof as factor Xa inhibitors |
| US5763263A (en) | 1995-11-27 | 1998-06-09 | Dehlinger; Peter J. | Method and apparatus for producing position addressable combinatorial libraries |
| JP3906935B2 (ja) | 1995-12-18 | 2007-04-18 | 杏林製薬株式会社 | N−置換ジオキソチアゾリジルベンズアミド誘導体及びその製造法 |
| AU6060099A (en) | 1998-09-30 | 2000-04-17 | Procter & Gamble Company, The | 2-substituted ketoamides |
| UA71587C2 (ru) | 1998-11-10 | 2004-12-15 | Шерінг Акцієнгезелльшафт | Translated By PlajАМИДЫ АНТРАНИЛОВОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕЧЕБНЫХ СРЕДСТВ |
| US6710058B2 (en) | 2000-11-06 | 2004-03-23 | Bristol-Myers Squibb Pharma Company | Monocyclic or bicyclic carbocycles and heterocycles as factor Xa inhibitors |
| ATE438624T1 (de) | 2000-12-28 | 2009-08-15 | Shionogi & Co | 2-pyridonderivate mit affinität für den cannabinoid-typ-2-rezeptor |
| JP2004528295A (ja) | 2001-01-30 | 2004-09-16 | サイトピア ピーティワイ リミテッド | キナーゼ阻害方法 |
| US7700293B2 (en) | 2001-08-02 | 2010-04-20 | The Regents Of The University Of Michigan | Expression profile of prostate cancer |
| ES2421511T3 (es) | 2001-12-21 | 2013-09-03 | X Ceptor Therapeutics Inc | Moduladores de LXR |
| EP2130820A1 (en) | 2002-02-19 | 2009-12-09 | Shionogi & Co., Ltd. | Antipruritics |
| TW200306155A (en) | 2002-03-19 | 2003-11-16 | Du Pont | Benzamides and advantageous compositions thereof for use as fungicides |
| CN1753680B (zh) | 2002-12-27 | 2010-12-08 | 苏坎波公司 | 用于治疗腹部不适的前列腺素衍生物 |
| US7405295B2 (en) | 2003-06-04 | 2008-07-29 | Cgi Pharmaceuticals, Inc. | Certain imidazo[1,2-a]pyrazin-8-ylamines and method of inhibition of Bruton's tyrosine kinase by such compounds |
| US7442685B2 (en) | 2003-06-13 | 2008-10-28 | The University Of North Carolina At Chapel Hill | DOT1 histone methyltransferases as a target for identifying therapeutic agents for leukemia |
| JP4869068B2 (ja) | 2003-06-19 | 2012-02-01 | スミスクライン ビーチャム コーポレーション | 化合物 |
| ES2297490T3 (es) | 2003-07-23 | 2008-05-01 | Bayer Pharmaceuticals Corporation | Omega-carboxiarildifenilurea fluoro sustituida para el tratamiento y prevencion de enfermadades y afecciones. |
| DE602004026321D1 (de) | 2003-08-26 | 2010-05-12 | Merck Hdac Res Llc | Verwendung von SAHA zur Behandlung von Mesotheliom |
| US20050059682A1 (en) | 2003-09-12 | 2005-03-17 | Supergen, Inc., A Delaware Corporation | Compositions and methods for treatment of cancer |
| CN1286973C (zh) | 2004-04-12 | 2006-11-29 | 上海第二医科大学附属瑞金医院 | 一种组蛋白甲基转移酶及其制备方法 |
| EP1765994B1 (en) | 2004-06-01 | 2009-11-18 | The University of North Carolina at Chapel Hill | Reconstituted histone methyltransferase complex and methods of identifying modulators thereof |
| JO2787B1 (en) | 2005-04-27 | 2014-03-15 | امجين إنك, | Alternative amide derivatives and methods of use |
| DE602006019423D1 (de) | 2005-06-02 | 2011-02-17 | Univ North Carolina | Reinigung, charakterisierung und wiederherstellung einer ubiquitin-e3-ligase |
| FR2889526B1 (fr) | 2005-08-04 | 2012-02-17 | Aventis Pharma Sa | 7-aza-indazoles substitues, compositions les contenant, procede de fabrication et utilisation |
| KR101347102B1 (ko) | 2005-10-19 | 2014-01-03 | 그뤼넨탈 게엠베하 | 신규한 바닐로이드 수용체 리간드 및 약제를 제조하기 위한이의 용도 |
| AU2006306541B2 (en) | 2005-10-21 | 2011-07-14 | Merck Sharp & Dohme Corp. | Potassium channel inhibitors |
| ATE547514T1 (de) | 2005-10-28 | 2012-03-15 | Univ North Carolina | Protein-demethylasen mit einer jmjc-domäne |
| EP1960551A2 (en) | 2005-12-01 | 2008-08-27 | Medical Prognosis Institute | Methods and devices for identifying biomarkers of treatment response and use thereof to predict treatment efficacy |
| WO2007070818A1 (en) | 2005-12-14 | 2007-06-21 | Bristol-Myers Squibb Company | Six-membered heterocycles useful as serine protease inhibitors |
| EP1974055A4 (en) | 2006-01-20 | 2010-01-27 | Univ North Carolina | DIAGNOSTIC AND THERAPEUTIC OBJECTIVES AGAINST LEUKEMIA |
| UA93548C2 (ru) * | 2006-05-05 | 2011-02-25 | Айерем Елелсі | Соединения и композиции kak модуляторы хеджхоговского сигнального пути |
| AU2007333021A1 (en) | 2006-05-15 | 2008-06-19 | Irm Llc | Terephthalamate compounds and compositions, and their use as HIV integrase inhibitors |
| WO2007136592A2 (en) | 2006-05-18 | 2007-11-29 | Amphora Discovery Corporation | 2-0x0-l,2-dihydr0quin0line derivatives, compositions, and uses thereof as antiproliferative agents |
| EP2086318A4 (en) | 2006-10-10 | 2009-12-23 | Burnham Inst Medical Research | NEUROPROTEKTIVE COMPOSITIONS AND METHOD |
| US8314087B2 (en) | 2007-02-16 | 2012-11-20 | Amgen Inc. | Nitrogen-containing heterocyclyl ketones and methods of use |
| US8338437B2 (en) | 2007-02-28 | 2012-12-25 | Methylgene Inc. | Amines as small molecule inhibitors |
| WO2008109534A1 (en) | 2007-03-02 | 2008-09-12 | Mdrna, Inc. | Nucleic acid compounds for inhibiting ezh2 gene expression and uses thereof |
| WO2008113006A1 (en) | 2007-03-14 | 2008-09-18 | Xenon Pharmaceuticals Inc. | Methods of using quinolinone compounds in treating sodium channel-mediated diseases or conditions |
| DE102007017884A1 (de) | 2007-04-13 | 2008-10-16 | Grünethal GmbH | Neue Vanilloid-Rezeptor Liganden und ihre Verwendung zur Herstellung von Arzneimitteln |
| CN101754955A (zh) | 2007-07-16 | 2010-06-23 | 雅培制药有限公司 | 作为蛋白激酶抑制剂的吲唑、苯并异*唑和苯并异噻唑化合物 |
| JP2011502148A (ja) | 2007-10-31 | 2011-01-20 | メルク・シャープ・エンド・ドーム・コーポレイション | 疼痛の治療用としてのp2x3受容体アンタゴニスト |
| AU2008337286B2 (en) | 2007-12-19 | 2014-08-07 | Cancer Research Technology Limited | Pyrido[2,3-b]pyrazine-8-substituted compounds and their use |
| WO2009094427A1 (en) | 2008-01-23 | 2009-07-30 | Bristol-Myers Squibb Company | 4-pyridinone compounds and their use for cancer |
| WO2009124137A2 (en) | 2008-04-01 | 2009-10-08 | Mount Sinai School Of Medicine Of New York University | Method of suppressing gene transcription through histone lysine methylation |
| US20100113415A1 (en) | 2008-05-29 | 2010-05-06 | Rajapakse Hemaka A | Epha4 rtk inhibitors for treatment of neurological and neurodegenerative disorders and cancer |
| UY31982A (es) | 2008-07-16 | 2010-02-26 | Boehringer Ingelheim Int | Derivados de 1,2-dihidropiridin-3-carboxamidas n-sustituidas |
| CA2730064A1 (en) | 2008-08-08 | 2010-02-11 | Asim Kumar Debnath | Small molecule inhibitors of retroviral assembly and maturation |
| FR2934995B1 (fr) | 2008-08-14 | 2010-08-27 | Sanofi Aventis | Composes d'azetidines polysubstitues, leur preparation et leur application en therapeutique |
| AU2009342734A1 (en) | 2009-03-24 | 2011-10-13 | Sanofi | 9H-pyrrolo[2,3-b: 5,4-c'] dipyridine azacarboline derivatives, preparation thereof, and therapeutic use thereof |
| WO2010111653A2 (en) | 2009-03-27 | 2010-09-30 | The Uab Research Foundation | Modulating ires-mediated translation |
| WO2011011366A2 (en) | 2009-07-20 | 2011-01-27 | Constellation Pharmaceuticals | Agents for stimulating activity of methyl modifying enzymes and methods of use thereof |
| US8329149B2 (en) | 2009-12-30 | 2012-12-11 | Avon Products, Inc. | Topical lightening composition and uses thereof |
| ES2534804T3 (es) | 2010-05-07 | 2015-04-28 | Glaxosmithkline Llc | Indazoles |
| WO2012005805A1 (en) | 2010-05-07 | 2012-01-12 | Glaxosmithkline Llc | Azaindazoles |
| US20130102477A1 (en) | 2010-06-23 | 2013-04-25 | Ryan D. Morin | Biomarkers for non-hodgkin lymphomas and uses thereof |
| US9175331B2 (en) | 2010-09-10 | 2015-11-03 | Epizyme, Inc. | Inhibitors of human EZH2, and methods of use thereof |
| RU2765155C2 (ru) | 2010-09-10 | 2022-01-26 | Эпизайм, Инк. | Ингибиторы ezh2 человека и способы их применения |
| WO2012068589A2 (en) | 2010-11-19 | 2012-05-24 | Constellation Pharmaceuticals | Modulators of methyl modifying enzymes, compositions and uses thereof |
| JP5908493B2 (ja) | 2010-12-01 | 2016-04-26 | グラクソスミスクライン・リミテッド・ライアビリティ・カンパニーGlaxoSmithKline LLC | インドール |
| AU2011336272A1 (en) | 2010-12-03 | 2013-06-20 | Epizyme, Inc. | 7-deazapurine modulators of histone methyltransferase, and methods of use thereof |
| US8791782B2 (en) * | 2011-01-28 | 2014-07-29 | Uses, Inc. | AC power conditioning circuit |
| WO2012118812A2 (en) | 2011-02-28 | 2012-09-07 | Epizyme, Inc. | Substituted 6,5-fused bicyclic heteroaryl compounds |
| JO3438B1 (ar) * | 2011-04-13 | 2019-10-20 | Epizyme Inc | مركبات بنزين مستبدلة بأريل أو أريل غير متجانس |
| TW201733984A (zh) | 2011-04-13 | 2017-10-01 | 雅酶股份有限公司 | 經取代之苯化合物 |
| KR20140082742A (ko) | 2011-09-30 | 2014-07-02 | 글락소스미스클라인 엘엘씨 | 암을 치료하는 방법 |
| ES2718900T3 (es) | 2012-03-12 | 2019-07-05 | Epizyme Inc | Inhibidores de EZH2 humana y métodos de uso de los mismos |
| ES2745016T3 (es) | 2012-04-13 | 2020-02-27 | Epizyme Inc | Bromhidrato de N-((4,6-dimetil-2-oxo-L,2-dihidropiridin-3-il)metil)-5-(etil(tetrahidro-2H-piran-4-il)amino)-4-metil-4'-(morfolinometil)-[L,1'-bifenil]-3-carboxamida para su uso en el tratamiento de un trastorno proliferativo celular del sistema hematológico |
| JP6340361B2 (ja) * | 2012-04-13 | 2018-06-06 | エピザイム,インコーポレイティド | がんを処置するための組合せ治療 |
| WO2013173441A2 (en) | 2012-05-16 | 2013-11-21 | Glaxosmithkline Llc | Enhancer of zeste homolog 2 inhibitors |
| PT2908823T (pt) * | 2012-10-15 | 2019-11-04 | Epizyme Inc | Métodos para tratamento do cancro |
| BR112015008487B1 (pt) | 2012-10-15 | 2022-05-31 | Epizyme, Inc | Compostos de benzeno substituído, composição farmacêutica compreendendo os ditos compostos e uso terapêutico dos mesmos para tratar um distúrbio mediado por ezh2 |
-
2013
- 2013-10-15 BR BR112015008487-7A patent/BR112015008487B1/pt active IP Right Grant
- 2013-10-15 MX MX2015004722A patent/MX353929B/es active IP Right Grant
- 2013-10-15 EP EP19188699.3A patent/EP3628662A1/en active Pending
- 2013-10-15 MX MX2015004721A patent/MX2015004721A/es active IP Right Grant
- 2013-10-15 CA CA2888021A patent/CA2888021A1/en not_active Abandoned
- 2013-10-15 SG SG11201502820YA patent/SG11201502820YA/en unknown
- 2013-10-15 SG SG11201502803VA patent/SG11201502803VA/en unknown
- 2013-10-15 KR KR1020157012670A patent/KR102057365B1/ko active IP Right Grant
- 2013-10-15 CA CA2887562A patent/CA2887562C/en active Active
- 2013-10-15 NZ NZ706738A patent/NZ706738A/en unknown
- 2013-10-15 TW TW102137117A patent/TWI588131B/zh active
- 2013-10-15 BR BR112015008480A patent/BR112015008480A2/pt not_active Application Discontinuation
- 2013-10-15 RU RU2015118135A patent/RU2662436C2/ru active
- 2013-10-15 EP EP20161557.2A patent/EP3725314A1/en not_active Withdrawn
- 2013-10-15 WO PCT/US2013/065127 patent/WO2014062733A2/en active Application Filing
- 2013-10-15 US US14/054,695 patent/US9006242B2/en active Active
- 2013-10-15 RU RU2015118145A patent/RU2658919C2/ru active
- 2013-10-15 PE PE2015000489A patent/PE20150887A1/es active IP Right Grant
- 2013-10-15 AR ARP130103745A patent/AR093244A1/es active IP Right Grant
- 2013-10-15 TW TW106111749A patent/TWI651303B/zh active
- 2013-10-15 AU AU2013331380A patent/AU2013331380B2/en active Active
- 2013-10-15 NZ NZ706739A patent/NZ706739A/en unknown
- 2013-10-15 CN CN201380065677.7A patent/CN105102431B/zh active Active
- 2013-10-15 UA UAA201504700A patent/UA115074C2/uk unknown
- 2013-10-15 EP EP13846696.6A patent/EP2906537B1/en active Active
- 2013-10-15 PE PE2015000488A patent/PE20150886A1/es active IP Right Grant
- 2013-10-15 WO PCT/US2013/065126 patent/WO2014062732A1/en active Application Filing
- 2013-10-15 CN CN201380065683.2A patent/CN105102432B/zh active Active
- 2013-10-15 SG SG10201705989YA patent/SG10201705989YA/en unknown
- 2013-10-15 UA UAA201504699A patent/UA119136C2/uk unknown
- 2013-10-15 EP EP13847763.3A patent/EP2906538A4/en not_active Withdrawn
- 2013-10-15 JP JP2015537018A patent/JP6461802B2/ja active Active
- 2013-10-15 AU AU2013331381A patent/AU2013331381B2/en active Active
- 2013-10-15 KR KR1020157012673A patent/KR102057366B1/ko active IP Right Grant
- 2013-10-15 JP JP2015537019A patent/JP6461803B2/ja active Active
- 2013-10-15 CN CN201811510752.7A patent/CN110041250A/zh active Pending
- 2013-10-15 MY MYPI2015000966A patent/MY180311A/en unknown
- 2013-10-15 US US14/435,704 patent/US10092572B2/en active Active
-
2015
- 2015-03-05 US US14/639,878 patent/US9089575B2/en active Active
- 2015-04-02 IL IL238135A patent/IL238135B/en active IP Right Grant
- 2015-04-10 PH PH12015500800A patent/PH12015500800A1/en unknown
- 2015-04-12 IL IL238197A patent/IL238197A0/en active IP Right Grant
- 2015-04-15 CL CL2015000944A patent/CL2015000944A1/es unknown
- 2015-04-15 PH PH12015500825A patent/PH12015500825B1/en unknown
- 2015-04-15 ZA ZA2015/02526A patent/ZA201502526B/en unknown
- 2015-04-15 CL CL2015000942A patent/CL2015000942A1/es unknown
- 2015-04-16 ZA ZA2015/02560A patent/ZA201502560B/en unknown
- 2015-06-17 US US14/742,466 patent/US9532992B2/en active Active
-
2016
- 2016-02-04 HK HK16101355.9A patent/HK1213264A1/zh unknown
- 2016-02-05 HK HK16101447.9A patent/HK1213552A1/zh unknown
- 2016-11-22 US US15/359,538 patent/US10098888B2/en active Active
-
2018
- 2018-02-21 JP JP2018028907A patent/JP6559275B2/ja active Active
- 2018-02-21 JP JP2018028891A patent/JP2018087238A/ja not_active Withdrawn
- 2018-09-04 US US16/120,702 patent/US20190060322A1/en not_active Abandoned
- 2018-09-26 IL IL261964A patent/IL261964B/en active IP Right Grant
-
2019
- 2019-03-18 IL IL265437A patent/IL265437A/en unknown
-
2020
- 2020-07-09 US US16/924,962 patent/US11642348B2/en active Active
-
2023
- 2023-03-23 US US18/188,700 patent/US20240165121A1/en active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2376286C2 (ru) * | 2004-03-11 | 2009-12-20 | Актелион Фармасьютиклз Лтд | Производные индол-1-илуксусной кислоты |
| US20090012031A1 (en) * | 2007-07-03 | 2009-01-08 | The Regents Of The University Of Michigan | EZH2 Cancer Markers |
| WO2011140324A1 (en) * | 2010-05-07 | 2011-11-10 | Glaxosmithkline Llc | Indoles |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11642348B2 (en) | Substituted benzene compounds | |
| JP6778226B2 (ja) | アリール置換またはヘテロアリール置換ベンゼン化合物 | |
| US10150759B2 (en) | 1,4-pyridone bicycic heteroaryl compounds | |
| EP2935214B1 (en) | 1,4-pyridone compounds | |
| US20200361914A1 (en) | Substituted benzene and 6,5-fused bicyclic heteroaryl compounds | |
| US10150764B2 (en) | Substituted benzene compounds | |
| AU2013361060A1 (en) | 1,4-pyridone compounds | |
| RU2785567C2 (ru) | Арил- или гетероарилзамещенные бензольные соединения |