RU2611202C2 - Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования - Google Patents
Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования Download PDFInfo
- Publication number
- RU2611202C2 RU2611202C2 RU2013151885A RU2013151885A RU2611202C2 RU 2611202 C2 RU2611202 C2 RU 2611202C2 RU 2013151885 A RU2013151885 A RU 2013151885A RU 2013151885 A RU2013151885 A RU 2013151885A RU 2611202 C2 RU2611202 C2 RU 2611202C2
- Authority
- RU
- Russia
- Prior art keywords
- seq
- aav
- amino acids
- cell
- capsid protein
- Prior art date
Links
- 210000002845 virion Anatomy 0.000 title claims abstract description 109
- 238000000034 method Methods 0.000 title claims abstract description 49
- 241000702421 Dependoparvovirus Species 0.000 title claims abstract description 28
- 210000000234 capsid Anatomy 0.000 title abstract description 39
- 108090000565 Capsid Proteins Proteins 0.000 claims abstract description 107
- 102100023321 Ceruloplasmin Human genes 0.000 claims abstract description 107
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 90
- 230000002207 retinal effect Effects 0.000 claims abstract description 73
- 238000002347 injection Methods 0.000 claims abstract description 41
- 239000007924 injection Substances 0.000 claims abstract description 41
- 208000030533 eye disease Diseases 0.000 claims abstract description 7
- 150000001413 amino acids Chemical group 0.000 claims description 349
- 210000004027 cell Anatomy 0.000 claims description 147
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 147
- 238000003780 insertion Methods 0.000 claims description 94
- 230000037431 insertion Effects 0.000 claims description 94
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 58
- 229920001184 polypeptide Polymers 0.000 claims description 55
- 125000003729 nucleotide group Chemical group 0.000 claims description 39
- 241000702423 Adeno-associated virus - 2 Species 0.000 claims description 38
- 239000002773 nucleotide Substances 0.000 claims description 36
- 241000700605 Viruses Species 0.000 claims description 32
- 102000039446 nucleic acids Human genes 0.000 claims description 26
- 108020004707 nucleic acids Proteins 0.000 claims description 26
- 150000007523 nucleic acids Chemical class 0.000 claims description 26
- 210000000327 mueller cell Anatomy 0.000 claims description 15
- 210000003583 retinal pigment epithelium Anatomy 0.000 claims description 14
- 210000000411 amacrine cell Anatomy 0.000 claims description 13
- 108010025020 Nerve Growth Factor Proteins 0.000 claims description 12
- 108020004459 Small interfering RNA Proteins 0.000 claims description 12
- 108091023037 Aptamer Proteins 0.000 claims description 11
- 102000004330 Rhodopsin Human genes 0.000 claims description 11
- 108090000820 Rhodopsin Proteins 0.000 claims description 11
- 210000002287 horizontal cell Anatomy 0.000 claims description 11
- 230000001965 increasing effect Effects 0.000 claims description 11
- NCYCYZXNIZJOKI-IOUUIBBYSA-N 11-cis-retinal Chemical compound O=C/C=C(\C)/C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-IOUUIBBYSA-N 0.000 claims description 10
- -1 neuroturin Proteins 0.000 claims description 10
- 241001164825 Adeno-associated virus - 8 Species 0.000 claims description 9
- 230000002452 interceptive effect Effects 0.000 claims description 9
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 9
- 101710111169 Retinoschisin Proteins 0.000 claims description 8
- 102100039507 Retinoschisin Human genes 0.000 claims description 8
- 241001655883 Adeno-associated virus - 1 Species 0.000 claims description 7
- 241000972680 Adeno-associated virus - 6 Species 0.000 claims description 7
- 241001164823 Adeno-associated virus - 7 Species 0.000 claims description 7
- 102000007072 Nerve Growth Factors Human genes 0.000 claims description 7
- 208000017442 Retinal disease Diseases 0.000 claims description 7
- 239000003900 neurotrophic factor Substances 0.000 claims description 7
- 241001634120 Adeno-associated virus - 5 Species 0.000 claims description 6
- 241000649045 Adeno-associated virus 10 Species 0.000 claims description 6
- 201000007254 color blindness Diseases 0.000 claims description 6
- 208000002780 macular degeneration Diseases 0.000 claims description 6
- 108010005939 Ciliary Neurotrophic Factor Proteins 0.000 claims description 5
- 102100031614 Ciliary neurotrophic factor Human genes 0.000 claims description 5
- 208000006992 Color Vision Defects Diseases 0.000 claims description 5
- 108091006109 GTPases Proteins 0.000 claims description 5
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 claims description 5
- 102000015336 Nerve Growth Factor Human genes 0.000 claims description 5
- 230000001772 anti-angiogenic effect Effects 0.000 claims description 5
- 230000000324 neuroprotective effect Effects 0.000 claims description 5
- 230000002093 peripheral effect Effects 0.000 claims description 5
- 239000000790 retinal pigment Substances 0.000 claims description 5
- 210000003986 cell retinal photoreceptor Anatomy 0.000 claims description 4
- 201000007714 retinoschisis Diseases 0.000 claims description 4
- 206010012689 Diabetic retinopathy Diseases 0.000 claims description 3
- 102400001368 Epidermal growth factor Human genes 0.000 claims description 3
- 101800003838 Epidermal growth factor Proteins 0.000 claims description 3
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 claims description 3
- 102000003693 Hedgehog Proteins Human genes 0.000 claims description 3
- 108090000031 Hedgehog Proteins Proteins 0.000 claims description 3
- 201000003533 Leber congenital amaurosis Diseases 0.000 claims description 3
- 201000000761 achromatopsia Diseases 0.000 claims description 3
- 210000005013 brain tissue Anatomy 0.000 claims description 3
- 229940116977 epidermal growth factor Drugs 0.000 claims description 3
- 230000002518 glial effect Effects 0.000 claims description 3
- 229940053128 nerve growth factor Drugs 0.000 claims description 3
- 239000008194 pharmaceutical composition Substances 0.000 claims description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 claims description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 claims description 2
- 229940088872 Apoptosis inhibitor Drugs 0.000 claims description 2
- 208000003098 Ganglion Cysts Diseases 0.000 claims description 2
- 208000010412 Glaucoma Diseases 0.000 claims description 2
- 208000005400 Synovial Cyst Diseases 0.000 claims description 2
- 239000000158 apoptosis inhibitor Substances 0.000 claims description 2
- 239000004055 small Interfering RNA Substances 0.000 claims description 2
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 claims 2
- 102000013446 GTP Phosphohydrolases Human genes 0.000 claims 2
- 101000729271 Homo sapiens Retinoid isomerohydrolase Proteins 0.000 claims 2
- 102100031176 Retinoid isomerohydrolase Human genes 0.000 claims 2
- 101100264173 Homo sapiens XIAP gene Proteins 0.000 claims 1
- 108700031544 X-Linked Inhibitor of Apoptosis Proteins 0.000 claims 1
- 102000050257 X-Linked Inhibitor of Apoptosis Human genes 0.000 claims 1
- 230000002424 anti-apoptotic effect Effects 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 9
- 208000015181 infectious disease Diseases 0.000 abstract description 8
- 230000000694 effects Effects 0.000 abstract description 4
- 239000003814 drug Substances 0.000 abstract 2
- 235000001014 amino acid Nutrition 0.000 description 282
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 62
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 45
- 108091033319 polynucleotide Proteins 0.000 description 30
- 102000040430 polynucleotide Human genes 0.000 description 30
- 239000002157 polynucleotide Substances 0.000 description 30
- 108091008695 photoreceptors Proteins 0.000 description 28
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 27
- 210000001525 retina Anatomy 0.000 description 25
- 239000005090 green fluorescent protein Substances 0.000 description 22
- 230000002950 deficient Effects 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 20
- 239000002245 particle Substances 0.000 description 19
- 210000000608 photoreceptor cell Anatomy 0.000 description 19
- 230000003612 virological effect Effects 0.000 description 19
- 102000004169 proteins and genes Human genes 0.000 description 17
- 235000018102 proteins Nutrition 0.000 description 16
- 239000013608 rAAV vector Substances 0.000 description 16
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 15
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 15
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 15
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 15
- 108091030071 RNAI Proteins 0.000 description 15
- 230000006870 function Effects 0.000 description 15
- 230000009368 gene silencing by RNA Effects 0.000 description 15
- 238000010361 transduction Methods 0.000 description 13
- 230000026683 transduction Effects 0.000 description 13
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 12
- 230000010076 replication Effects 0.000 description 12
- 210000003994 retinal ganglion cell Anatomy 0.000 description 12
- 108010042407 Endonucleases Proteins 0.000 description 11
- 201000010099 disease Diseases 0.000 description 11
- 230000001105 regulatory effect Effects 0.000 description 11
- 238000006467 substitution reaction Methods 0.000 description 11
- 108700028369 Alleles Proteins 0.000 description 10
- 241000699670 Mus sp. Species 0.000 description 10
- 238000002571 electroretinography Methods 0.000 description 10
- 238000009396 hybridization Methods 0.000 description 10
- 239000000243 solution Substances 0.000 description 10
- 241000024188 Andala Species 0.000 description 9
- 101100429084 Mus musculus Rs1 gene Proteins 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- 239000013607 AAV vector Substances 0.000 description 8
- 101710197658 Capsid protein VP1 Proteins 0.000 description 8
- 238000004806 packaging method and process Methods 0.000 description 8
- 239000013598 vector Substances 0.000 description 8
- 108020004414 DNA Proteins 0.000 description 7
- 102100031780 Endonuclease Human genes 0.000 description 7
- 108091008605 VEGF receptors Proteins 0.000 description 7
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 7
- 230000002068 genetic effect Effects 0.000 description 7
- 230000035772 mutation Effects 0.000 description 7
- 229940124676 vascular endothelial growth factor receptor Drugs 0.000 description 7
- 101710132601 Capsid protein Proteins 0.000 description 6
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 6
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 6
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 6
- 241000288906 Primates Species 0.000 description 6
- 101710118046 RNA-directed RNA polymerase Proteins 0.000 description 6
- 101710108545 Viral protein 1 Proteins 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 230000002458 infectious effect Effects 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 108091026890 Coding region Proteins 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 239000000872 buffer Substances 0.000 description 5
- 230000008859 change Effects 0.000 description 5
- 238000011161 development Methods 0.000 description 5
- 210000004962 mammalian cell Anatomy 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 238000013518 transcription Methods 0.000 description 5
- 230000035897 transcription Effects 0.000 description 5
- 241000701161 unidentified adenovirus Species 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 102000004533 Endonucleases Human genes 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- 108700026244 Open Reading Frames Proteins 0.000 description 4
- 108700019146 Transgenes Proteins 0.000 description 4
- 230000027455 binding Effects 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 238000002073 fluorescence micrograph Methods 0.000 description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 4
- 230000006872 improvement Effects 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 238000003752 polymerase chain reaction Methods 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- 102000034348 GTPases Human genes 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 108090000099 Neurotrophin-4 Proteins 0.000 description 3
- 102000003683 Neurotrophin-4 Human genes 0.000 description 3
- 101710163270 Nuclease Proteins 0.000 description 3
- 102000010175 Opsin Human genes 0.000 description 3
- 108050001704 Opsin Proteins 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 238000010353 genetic engineering Methods 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000000670 limiting effect Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 229940097998 neurotrophin 4 Drugs 0.000 description 3
- 210000002445 nipple Anatomy 0.000 description 3
- 210000004940 nucleus Anatomy 0.000 description 3
- 210000001328 optic nerve Anatomy 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 230000000861 pro-apoptotic effect Effects 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 239000001488 sodium phosphate Substances 0.000 description 3
- 229910000162 sodium phosphate Inorganic materials 0.000 description 3
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 3
- ZOOGRGPOEVQQDX-UUOKFMHZSA-N 3',5'-cyclic GMP Chemical compound C([C@H]1O2)OP(O)(=O)O[C@H]1[C@@H](O)[C@@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-UUOKFMHZSA-N 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 102000000844 Cell Surface Receptors Human genes 0.000 description 2
- 108010001857 Cell Surface Receptors Proteins 0.000 description 2
- 102000010970 Connexin Human genes 0.000 description 2
- 108050001175 Connexin Proteins 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 101150066002 GFP gene Proteins 0.000 description 2
- 102100025623 Gap junction delta-2 protein Human genes 0.000 description 2
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 description 2
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101000654452 Homo sapiens Protein transport protein Sec16B Proteins 0.000 description 2
- 101000814438 Homo sapiens Retinoschisin Proteins 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 241000282553 Macaca Species 0.000 description 2
- 208000001344 Macular Edema Diseases 0.000 description 2
- 206010025415 Macular oedema Diseases 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 108091028043 Nucleic acid sequence Proteins 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 208000002158 Proliferative Vitreoretinopathy Diseases 0.000 description 2
- 102100031481 Protein transport protein Sec16B Human genes 0.000 description 2
- 101150084777 RS1 gene Proteins 0.000 description 2
- 102100022881 Rab proteins geranylgeranyltransferase component A 1 Human genes 0.000 description 2
- 208000007014 Retinitis pigmentosa Diseases 0.000 description 2
- 206010038934 Retinopathy proliferative Diseases 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 101710172711 Structural protein Proteins 0.000 description 2
- 241000701093 Suid alphaherpesvirus 1 Species 0.000 description 2
- 102000005406 Tissue Inhibitor of Metalloproteinase-3 Human genes 0.000 description 2
- 108010031429 Tissue Inhibitor of Metalloproteinase-3 Proteins 0.000 description 2
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 206010064930 age-related macular degeneration Diseases 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000001506 calcium phosphate Substances 0.000 description 2
- 229910000389 calcium phosphate Inorganic materials 0.000 description 2
- 235000011010 calcium phosphates Nutrition 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 108010015417 connexin 36 Proteins 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 239000003937 drug carrier Substances 0.000 description 2
- 238000004520 electroporation Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 102000055658 human RS1 Human genes 0.000 description 2
- 210000005260 human cell Anatomy 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 108010048996 interstitial retinol-binding protein Proteins 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- 230000007774 longterm Effects 0.000 description 2
- 201000010230 macular retinal edema Diseases 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 208000021971 neovascular inflammatory vitreoretinopathy Diseases 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- 238000002428 photodynamic therapy Methods 0.000 description 2
- 239000000049 pigment Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 238000011112 process operation Methods 0.000 description 2
- 230000006785 proliferative vitreoretinopathy Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 2
- 210000000964 retinal cone photoreceptor cell Anatomy 0.000 description 2
- 210000000844 retinal pigment epithelial cell Anatomy 0.000 description 2
- 208000004644 retinal vein occlusion Diseases 0.000 description 2
- 238000012163 sequencing technique Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000001509 sodium citrate Substances 0.000 description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 2
- 235000002374 tyrosine Nutrition 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 210000003501 vero cell Anatomy 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 1
- 101100490659 Arabidopsis thaliana AGP17 gene Proteins 0.000 description 1
- 208000031104 Arterial Occlusive disease Diseases 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 101150079123 Bad gene Proteins 0.000 description 1
- 208000009137 Behcet syndrome Diseases 0.000 description 1
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 description 1
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 108091006146 Channels Proteins 0.000 description 1
- 208000005590 Choroidal Neovascularization Diseases 0.000 description 1
- 206010060823 Choroidal neovascularisation Diseases 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 208000003322 Coinfection Diseases 0.000 description 1
- 208000036693 Color-vision disease Diseases 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 102100029142 Cyclic nucleotide-gated cation channel alpha-3 Human genes 0.000 description 1
- 102100029140 Cyclic nucleotide-gated cation channel beta-3 Human genes 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 206010012688 Diabetic retinal oedema Diseases 0.000 description 1
- 206010012692 Diabetic uveitis Diseases 0.000 description 1
- 102400001047 Endostatin Human genes 0.000 description 1
- 108010079505 Endostatins Proteins 0.000 description 1
- 108010041308 Endothelial Growth Factors Proteins 0.000 description 1
- 208000001351 Epiretinal Membrane Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 208000020564 Eye injury Diseases 0.000 description 1
- 108091006020 Fc-tagged proteins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- 102000034286 G proteins Human genes 0.000 description 1
- 108091006027 G proteins Proteins 0.000 description 1
- 108091004242 G-Protein-Coupled Receptor Kinase 1 Proteins 0.000 description 1
- 102000004437 G-Protein-Coupled Receptor Kinase 1 Human genes 0.000 description 1
- 102100039214 Guanine nucleotide-binding protein G(t) subunit alpha-2 Human genes 0.000 description 1
- 208000032087 Hereditary Leber Optic Atrophy Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 201000002563 Histoplasmosis Diseases 0.000 description 1
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 1
- 101000771071 Homo sapiens Cyclic nucleotide-gated cation channel alpha-3 Proteins 0.000 description 1
- 101000771083 Homo sapiens Cyclic nucleotide-gated cation channel beta-3 Proteins 0.000 description 1
- 101000888142 Homo sapiens Guanine nucleotide-binding protein G(t) subunit alpha-2 Proteins 0.000 description 1
- 101000726148 Homo sapiens Protein crumbs homolog 1 Proteins 0.000 description 1
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- 101100273566 Humulus lupulus CCL10 gene Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 208000032578 Inherited retinal disease Diseases 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 102000004310 Ion Channels Human genes 0.000 description 1
- 108090000862 Ion Channels Proteins 0.000 description 1
- 101150105817 Irbp gene Proteins 0.000 description 1
- 208000010038 Ischemic Optic Neuropathy Diseases 0.000 description 1
- 208000032420 Latent Infection Diseases 0.000 description 1
- 201000000639 Leber hereditary optic neuropathy Diseases 0.000 description 1
- 208000031471 Macular fibrosis Diseases 0.000 description 1
- 208000010164 Multifocal Choroiditis Diseases 0.000 description 1
- 101000598988 Mus musculus Medium-wave-sensitive opsin 1 Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 101100049938 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) exr-1 gene Proteins 0.000 description 1
- 208000001140 Night Blindness Diseases 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 206010030924 Optic ischaemic neuropathy Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 101150046816 PRPH2 gene Proteins 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 241000701945 Parvoviridae Species 0.000 description 1
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 1
- 102100035846 Pigment epithelium-derived factor Human genes 0.000 description 1
- 208000034461 Progressive cone dystrophy Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical class CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 102100027331 Protein crumbs homolog 1 Human genes 0.000 description 1
- 230000004570 RNA-binding Effects 0.000 description 1
- 101710088575 Rab escort protein 1 Proteins 0.000 description 1
- 101710108890 Rab proteins geranylgeranyltransferase component A 1 Proteins 0.000 description 1
- 206010064714 Radiation retinopathy Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108091081062 Repeated sequence (DNA) Proteins 0.000 description 1
- 206010038848 Retinal detachment Diseases 0.000 description 1
- 206010038910 Retinitis Diseases 0.000 description 1
- 206010038933 Retinopathy of prematurity Diseases 0.000 description 1
- 108090000799 Rhodopsin kinases Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 241000282849 Ruminantia Species 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 101710106192 Short-wave-sensitive opsin 1 Proteins 0.000 description 1
- 108091027967 Small hairpin RNA Proteins 0.000 description 1
- 208000027073 Stargardt disease Diseases 0.000 description 1
- 206010042742 Sympathetic ophthalmia Diseases 0.000 description 1
- 108010006830 TIE receptors Proteins 0.000 description 1
- 102000005450 TIE receptors Human genes 0.000 description 1
- 206010043189 Telangiectasia Diseases 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 208000031861 Tritanopia Diseases 0.000 description 1
- 102400000731 Tumstatin Human genes 0.000 description 1
- 208000014769 Usher Syndromes Diseases 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 208000029977 White Dot Syndromes Diseases 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- 201000002553 achromatopsia 4 Diseases 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000023564 acute macular neuroretinopathy Diseases 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 239000002870 angiogenesis inducing agent Substances 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 201000007058 anterior ischemic optic neuropathy Diseases 0.000 description 1
- 230000006909 anti-apoptosis Effects 0.000 description 1
- 230000002137 anti-vascular effect Effects 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 208000021328 arterial occlusion Diseases 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- 241000701792 avian adenovirus Species 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- 201000010018 blue color blindness Diseases 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 201000005667 central retinal vein occlusion Diseases 0.000 description 1
- 210000000349 chromosome Anatomy 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000010367 cloning Methods 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 201000008615 cone dystrophy Diseases 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 210000004087 cornea Anatomy 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- 206010012601 diabetes mellitus Diseases 0.000 description 1
- 201000011190 diabetic macular edema Diseases 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 208000037771 disease arising from reactivation of latent virus Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 210000002308 embryonic cell Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 238000005538 encapsulation Methods 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 230000004438 eyesight Effects 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 102000034356 gene-regulatory proteins Human genes 0.000 description 1
- 108091006104 gene-regulatory proteins Proteins 0.000 description 1
- 230000004077 genetic alteration Effects 0.000 description 1
- 231100000118 genetic alteration Toxicity 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 229940094991 herring sperm dna Drugs 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000012606 in vitro cell culture Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- NBQNWMBBSKPBAY-UHFFFAOYSA-N iodixanol Chemical compound IC=1C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C(I)C=1N(C(=O)C)CC(O)CN(C(C)=O)C1=C(I)C(C(=O)NCC(O)CO)=C(I)C(C(=O)NCC(O)CO)=C1I NBQNWMBBSKPBAY-UHFFFAOYSA-N 0.000 description 1
- 229960004359 iodixanol Drugs 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 150000002690 malonic acid derivatives Chemical class 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 230000021121 meiosis Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 230000011278 mitosis Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 238000007899 nucleic acid hybridization Methods 0.000 description 1
- 238000012014 optical coherence tomography Methods 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 239000006179 pH buffering agent Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 235000008729 phenylalanine Nutrition 0.000 description 1
- 150000002994 phenylalanines Chemical class 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000000649 photocoagulation Effects 0.000 description 1
- 230000016732 phototransduction Effects 0.000 description 1
- 230000001766 physiological effect Effects 0.000 description 1
- 108090000102 pigment epithelium-derived factor Proteins 0.000 description 1
- 210000001127 pigmented epithelial cell Anatomy 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 201000007914 proliferative diabetic retinopathy Diseases 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000013646 rAAV2 vector Substances 0.000 description 1
- 101150101384 rat1 gene Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 201000000763 red color blindness Diseases 0.000 description 1
- 201000000757 red-green color blindness Diseases 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000004264 retinal detachment Effects 0.000 description 1
- 230000004283 retinal dysfunction Effects 0.000 description 1
- 230000004243 retinal function Effects 0.000 description 1
- 230000004281 retinal morphology Effects 0.000 description 1
- 230000003085 retinopathic effect Effects 0.000 description 1
- YXAZULPIBAGTKR-UHFFFAOYSA-N rev antisense Chemical compound O=C1NC(=O)C(C)=CN1C1OC(COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(S)(=O)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)OC2C(OC(C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)OC2C(OC(C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)OC2C(OC(C2)N2C(N=C(N)C=C2)=O)CO)C(O)C1 YXAZULPIBAGTKR-UHFFFAOYSA-N 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 238000009666 routine test Methods 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 210000003786 sclera Anatomy 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 208000022417 sinus histiocytosis with massive lymphadenopathy Diseases 0.000 description 1
- 229910001415 sodium ion Inorganic materials 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 238000003153 stable transfection Methods 0.000 description 1
- 238000013517 stratification Methods 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 208000009056 telangiectasis Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 108010012374 type IV collagen alpha3 chain Proteins 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 230000029812 viral genome replication Effects 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
- C12Q1/701—Specific hybridization probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
- C12N15/861—Adenoviral vectors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/1703—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- A61K38/1709—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0075—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the delivery route, e.g. oral, subcutaneous
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/06—Antiglaucoma agents or miotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/005—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from viruses
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/115—Aptamers, i.e. nucleic acids binding a target molecule specifically and with high affinity without hybridising therewith ; Nucleic acids binding to non-nucleic acids, e.g. aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
- C12N15/864—Parvoviral vectors, e.g. parvovirus, densovirus
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/70—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving virus or bacteriophage
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5058—Neurological cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/33—Fusion polypeptide fusions for targeting to specific cell types, e.g. tissue specific targeting, targeting of a bacterial subspecies
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/16—Aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/32—Special delivery means, e.g. tissue-specific
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14021—Viruses as such, e.g. new isolates, mutants or their genomic sequences
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14121—Viruses as such, e.g. new isolates, mutants or their genomic sequences
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14122—New viral proteins or individual genes, new structural or functional aspects of known viral proteins or genes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14142—Use of virus, viral particle or viral elements as a vector virus or viral particle as vehicle, e.g. encapsulating small organic molecule
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14143—Use of virus, viral particle or viral elements as a vector viral genome or elements thereof as genetic vector
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14141—Use of virus, viral particle or viral elements as a vector
- C12N2750/14145—Special targeting system for viral vectors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2750/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssDNA viruses
- C12N2750/00011—Details
- C12N2750/14011—Parvoviridae
- C12N2750/14111—Dependovirus, e.g. adenoassociated viruses
- C12N2750/14151—Methods of production or purification of viral material
- C12N2750/14152—Methods of production or purification of viral material relating to complementing cells and packaging systems for producing virus or viral particles
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2810/00—Vectors comprising a targeting moiety
- C12N2810/40—Vectors comprising a peptide as targeting moiety, e.g. a synthetic peptide, from undefined source
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/16—Primer sets for multiplex assays
Abstract
Изобретение относится к области биотехнологии, вирусологии и медицины. Предложены вирионы аденоассоциированного вируса (AAV) с вариантным капсидным белком, где вирионы AAV демонстрируют большую инфекционность ретинальной клетки, когда вводятся интравитреальной инъекцией, по сравнению с AAV дикого типа. Также описаны способы доставки генного продукта в ретинальную клетку индивидуума и способы лечения глазных болезней. 6 н. и 18 з.п. ф-лы, 25 ил., 2 табл., 3 пр.
Description
Перекрестная ссылка на родственные заявки
[0001] Эта заявка испрашивает приоритет предварительной заявки на патент США №61/478,355, поданной апреля 22, 2011, описание которой во всей полноте включено в настоящую заявку путем ссылки.
Заявление относительно федерально спонсируемого исследования
[0002] Это изобретение было сделано при государственной поддержке под Грантом № EY016994-02 и EY1018241, предоставленным Национальным офтальмологическим институтом Национального института здравоохранения. Государство обладает определенными правами на изобретение.
Уровень техники
[0003] Фоторецепторы являются первыми нейронами в сетчатке, которые получают и обрабатывают визуальную информацию, преобразовывая видимую электромагнитную радиацию в гиперполяризованные ответы через фототрансдукцию. Подавляющее большинство унаследованных ретинальных болезней приводит к потере этих клеток или непосредственно, например, в доминантных мутациях, которые влияют на укладку белка родопсина, или косвенно, например, в рецессивных мутациях, влияющих на ретинальные метаболические циклы в пигментном эпителии сетчатки (RPE).
[0004] AAV принадлежит семейству Parvoviridae и роду Dependovirus, представители которого требуют совместного инфицирования с вирусом-помощником, таким как аденовирус, для активирования репликации, AAV порождает латентную инфекцию в отсутствие помощника. Вирионы состоят из 25 нм икосаэдрического капсида, охватывающего одноцепочечную геномную ДНК, состоящую из 4,9 тысяч нуклеотидов, с двумя открытыми рамками считывания: rep и cap. Неструктурный ген rep кодирует четыре регуляторных белка, важных для вирусной репликации, тогда как cap кодирует три структурных белка (VP1-3), которые собираются в 60-мерную капсидную оболочку. Этот вирусный капсид содействует способности векторов AAV преодолевать многие биологические барьеры вирусной трансдукции, включая связывание рецепторов клеточной поверхности, эндоцитоз, внутриклеточную миграцию и распаковывание в ядре.
Литература
[0005] Патентная публикация США №2005/0053922; патентная публикация США №2009/0202490; Allocca et al. (2007) J. Virol. 81:11372; Boucas et al. (2009) J. Gene Med. 11:1103.
Сущность изобретения
[0006] Настоящее раскрытие обеспечивает вирионы аденоассоциированного вируса (AAV) с измененным капсидным белком, отличающийся тем, что вирионы AAV демонстрируют большую инфекционность клетки сетчатки, когда вводятся путем интравитреальной инъекции, по сравнению с AAV дикого типа. Настоящее раскрытие также обеспечивает способы доставки генного продукта в клетку сетчатки индивидуума и способы лечения глазных болезней.
Краткое описание чертежей
[0007] На фигуре 1 представлена репрезентативная трехмерная модель AAV2, содержащего случайный гептамер после аминокислоты 587.
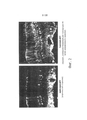
[0008] На фигуре 2 изображены более значительные уровни интравитреальной трансдукции вариантом 7М8 AAV2 (справа) относительно AAV2 (слева).
[0009] На фигуре 3 представлены репрезентативные флюоресцентные изображения криосрезов сетчатки, показывающие экспрессию зеленого флуоресцентного белка (GFP), возникающую вследствие 7М8 переноса гена GFP под контролем убиквитарного промотора CAG (слева) или фоторецептор специфического промотора Rho (справа).
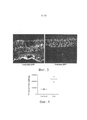
[0010] На фигуре 4 изображены фоторецепторные клетки GFP+ на миллион клеток сетчатки, как подсчитано поточной цитометрией, после трансдукции 7М8 или 7М8, несущих 4 тирозиновые мутации (7m8.4YF).
[0011] На фигуре 5 представлена аминокислотная последовательность VP1 AAV2 (SEQ ID №1).
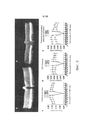
[0012] На фигуре 6 представлены аминокислотные последовательности, соответствующие аминокислотам 570-610 AAV2 (фигура 5) капсидного белка VP1 AAV различных серотипов AAV.
[0013] На фигурах 7A-I изображены структурные улучшения в мышиной сетчатке Rs1h-/- после переноса гена.
[0014] На фигурах 8A-D изображено функциональное спасение волн А и В электроретинограммы после доставки гена RS1.
[0015] На фигурах 9А-Е изображены устойчивые улучшения толщины сетчатки, измеренной спустя 10 месяцев после лечения 7m8-rho-RS1.
[0016] На фигуре 10 представлена аминокислотная последовательность ретиношизина.
[0017] На фигуре 11 представлена аминокислотная последовательность нейротрофического фактора головного мозга.
[0018] На фигуре 12 представлена аминокислотная последовательность RPE65.
[0019] На фигурах 13А-С представлена нуклеотидная последовательность конструкта 7m8-rho-RS1.
[0020] На фигуре 14 представлена аминокислотная последовательность периферина-2.
[0021] На фигуре 15 представлена аминокислотная последовательность периферина.
[0022] На фигуре 16 представлена аминокислотная последовательность регуляторного взаимодействующего белка-1 ГТФазы пигментной дистрофии сетчатки.
[0023] На фигурах 17А-С представлено выравнивание аминокислотных последовательностей участков петли IV капсидного белка AAV (петля GH). Сайты встраивания показаны жирным шрифтом и подчеркиванием.
[0024] На фигурах 18А-С представлено выравнивание аминокислотных последовательностей участков петли капсидного белка GH AAV с гетерологичными пептидными встраиваниями.
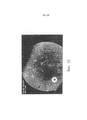
[0025] На фигуре 19 представлено флуоресцентное изображение дна, показывающее экспрессию GFP в центре сетчатки примата спустя 9 недель после введения 7m8, несущего GFP под управлением промотора коннексина-36.
Определения
[0026] Термин "ретинальная клетка" может относиться в настоящем документе к любому из клеточных типов, которые содержит сетчатка, такому как ретинальные клетки ганглия, амакринные клетки, горизонтальные клетки, биполярные клетки и клетки фоторецептора, включая палочки и колбочки, глиальные клетки Мюллера, клетки пигментного эпителия сетчатки.
[0027] "AAV" является аббревиатурой для аденоассоциированного вируса и может быть использована для обозначения самого вируса или его производных. Термин охватывает все подтипы и природного происхождения, и рекомбинантные формы, за исключением случаев, когда требуется иное. Аббревиатура "rAAV" относится к рекомбинантному аденоассоциированному вирусу, также именуемого рекомбинантным вектором AAV (или "вектор rAAV"). Термин "AAV" включает AAV тип 1 (AAV-1), AAV тип 2 (AAV-2), AAV тип 3 (AAV-3), AAV тип 4 (AAV-4), AAV тип 5 (AAV-5), AAV тип 6 (AAV-6), AAV тип 7 (AAV-7), AAV тип 8 (AAV-8), птичий AAV, бычий AAV, псовый AAV, конский AAV, приматный AAV, неприматный AAV и овечий AAV. "Приматный AAV" относится к AAV, который инфицирует приматов, "неприматный AAV" относится к AAV, который инфицирует неприматных млекопитающих, "бычий AAV" относится к AAV, который инфицирует жвачных млекопитающих и пр.
[0028] Геномные последовательности различных серотипов AAV, также как и последовательности природных концевых повторов (TR), белков Rep и капсидных субъединиц известны из уровня техники. Такие последовательности могут быть найдены в литературе или общедоступных базах данных, таких как GenBank. Смотри, например, номера доступов GenBank NC_002077 (AAV-1), AF063497 (AAV-1), NC_001401 (AAV-2), AF043303 (AAV-2), NC_001729 (AAV-3). NC_001829 (AAV-4), U89790 (AAV-4), NC_006152 (AAV-5), AF513851 (AAV-7), AF513852 (AAV-8) и NC_006261 (AAV-8); сведения которых включены в настоящий документ путем ссылки касательно последовательностей нуклеиновых кислот и аминокислот AAV. Смотри также, например, Srivistava et al. (1983) J. Virology 45:555; Chiorini et al. (1998) J. Virology 71:6823; Chiorini et al. (1999) J. Virology 73:1309; Bantel-Schaal et al. (1999) J. Virology 73:939; Xiao et al. (1999) J. Virology 73:3994; Muramatsu et al. (1996) Virology 221:208; Shade et al., (1986) J. Virol. 58:921; Gao et al. (2002) Proc. Nat. Acad. Sci. USA 99:11854; Moris et al. (2004) Virology 33:375-383; международные патентные публикации WO 00/28061, WO 99/61601, WO 98/11244; и патент США №6156303.
[0029] "Вектор rAAV", как использовано в настоящем документе, относится к вектору AAV, содержащему полинуклеотидную последовательность, которая происходит не от AAV (т.е., полинуклеотид, ксеногенный к AAV), обычно последовательность, представляющую интерес для генетической трансформации клетки. В основном, гетерологичный полинуклеотид является фланкированным, по меньшей мере, одной или обычно двумя последовательностями инвертированных концевых повторов AAV (ITR). Термин вектор rAAV охватывает как части вектора rAAV, так и векторные плазмиды rAAV. Вектор rAAV может быть либо одноцепочечным (ssAAV), либо самокомплементарным (scAAV).
[0030] "Вирус AAV" или "частица вируса AAV", или "частица вектора rAAV" относится к частице вируса, состоящей из, по меньшей мере, одного капсидного белка AAV (обычно всех капсидных белков AAV дикого типа) и инкапсулированного полинуклеотида вектора rAAV. Если частица содержит гетерологичный полинуклеотид (т.е. полинуклеотид, не являющийся геномом AAV дикого типа, такой как трансген, который будет доставлен в клетку млекопитающего), обычно упоминается как "частица вектора rAAV" или просто "вектор rAAV". Таким образом, получение частицы rAAV обязательно включает получение вектора rAAV как такового, и вектор содержится в пределах частицы rAAV.
[0031] "Упаковывание" относится к серии внутриклеточных событий, которые приводят к сборке и инкапсулированию частицы AAV.
[0032] Гены "rep" и "cap" AAV относятся к полинуклеотидным последовательностям, кодирующим репликацию и капсидирующие белки аденоассоциированного вируса. "Rep" и "cap" AAV именуются в настоящем документе как "упаковочные гены" AAV.
[0033] "Вирус-помощник" для AAV относится к вирусу, который позволяет AAV (например, AAV дикого типа) реплицироваться и упаковываться с помощью клетки млекопитающего. Ряд таких вирусов-помощников для AAV известны из уровня техники, включая аденовирусы, герпевирусы и проксивирусы, такие как вирус коровьей оспы. Аденовирусы охватывают много различных подгрупп, хотя обычно используется аденовирус 5 типа, подгруппы С. Известны многочисленные аденовирусы человека, нечеловеческих млекопитающих и птичьего происхождения и доступные из депозитариев, таких как АТСС. Вирусы семейства герпеса включают, например, вирусы герпеса простого (HSV) и вирусы Эпштейн-Барра (EBV), а также вирусы цитомегалии (CMV) и вирусы псевдобешенства (PRV); которые также доступны из депозитария АТСС.
[0034] "Хелперная вирусная функция(и) относится к функции(ям), закодированной в геноме вируса-помощника, который позволяет AAV реплицироваться и упаковываться (в сочетании с другими необходимыми условиями для репликации и упаковывания, описанными в настоящем документе). Как описано в настоящем документе, "хелперная вирусная функция" может обеспечивать ряд путей, включая обеспеченные вирусами-помощниками или обеспеченные, например, полинуклеотидными последовательностями, кодирующими необходимую функцию(и) в клетке-продуценте в пути. Например, плазмиду или другой вектор экспрессии, содержащий нуклеотидные последовательности, кодирующие один или более аденовирусных белков, трансфектируют в клетку-продуцент вместе с вектором rAAV.
[0035] "Инфекционный" вирус или вирусная частица является вирусом, который содержит компетентно собранный вирусный капсид и способен доставить полинуклеотидный компонент в клетку, для которой вирусный вид является тропическим. Термин не обязательно подразумевает любую репликационную способность вируса. Методы подсчета инфекционных вирусных частиц описаны в другом разделе в этом описании и в уровне техники. Вирусная инфекционность может быть выражена как отношение инфекционных вирусных частиц ко всем вирусным частицам. Способы определения отношения инфекционных вирусных частиц ко всем вирусным частицам известны из уровня техники. Смотри, например, Grainger et al. (2005) Mol. Ther. 11:S337 (описывающий анализ инфекционного титра TCID50); и Zolotukhin et al. (1999) Gene Ther. 6:973. Смотри также Примеры.
[0036] "Репликационно компетентный" вирус (например, репликационно компетентный AAV) относится к фенотипичному вирусу дикого типа, который является инфекционным, а также способен реплицироваться в инфицированной клетке (то есть, в присутствии вируса-помощника или хелперных вирусных функций). В случае AAV, репликационная компетенция обычно требует присутствия функциональных упаковочных генов AAV. В целом, векторы rAAV, как описано в настоящем документе, являются репликационно некомпетентными в клетках млекопитающих (особенно в клетках человека) из-за отсутствия одного или более упаковочных генов AAV. Обычно, такие векторы rAAV испытывают недостаток в любых последовательностях упаковочных генов AAV, чтобы минимизировать возможность того, что репликационная компетенция AAV генерируется рекомбинацией между упаковочными генами AAV и поступающим вектором rAAV. Во многих вариантах осуществления изобретения препараты вектора rAAV, как описано в данном документе, являются такими, что почти не содержат репликационно компетентного AAV (rcAAV, также именуемый как RCA) (например, меньше, чем приблизительно 1 rcAAV на 102 частиц rAAV, меньше, чем приблизительно 1 rcAAV на 104 частиц rAAV, меньше, чем приблизительно 1 rcAAV на 108 частиц rAAV, меньше, чем приблизительно 1 rcAAV на 1012 частиц rAAV или rcAAV отсутствует).
[0037] Термин "полинуклеотид" относится к полимерной форме нуклеотидов любой длины, включая дезоксирибонуклеотиды или рибонуклеотиды или их аналоги. Полинуклеотиды могут содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги, и могут быть прерванными ненуклеотидными компонентами. Если имеются, то модификации нуклеотидной структуре могут придаваться до или после сборки полимера. Термин полинуклеотид, как использовано в настоящем документе, относится взаимозаменяемо к дву- и одноцепочечным молекулам. Если не определено и не требуется иное, то любой вариант осуществления изобретения, описанного в настоящем документе, которое является полинуклеотидом, охватывает как двуцепочечную форму, так и каждую из двух комплементарных одноцепочечных форм, известных или предсказанных для составления двуцепочечной формы.
[0038] Реакции гибридизации нуклеиновых кислот могут проводиться в условиях разной "жесткости". Условия, повышающие жесткость реакции гибридизации широко известны и опубликованы в уровне техники. Смотри, например, Sambrook et al. Molecular Cloning, A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1989, включенный в настоящий документ путем ссылки. Например, смотри страницу 7.52 в Sambrook et al. Примеры соответствующих условий включают (в порядке повышающейся жесткости): температуры инкубации 25°С, 37°С, 50°С и 68°С; буферные концентрации 10 × SSC, 6 × SSC, 1 × SSC, 0,1 × SSC (где 1 × SSC является 0,15 М NaCl и 15 мМ цитратным буфером) и их эквиваленты с использованием других буферных систем; концентрации формамида 0%, 25%, 50% и 75%; время инкубирования от 5 минут до 24 часов; 1, 2 или более стадий отмывания; инкубационное время отмывки 1, 2 или 15 минут; и отмывочные растворы 6 × SSC, 1 × SSC, 0.1 × SSC или деионизированная вода. Примером жестких условий гибридизации является гибридизация при 50°С или выше и 0,1 × SSC (15 мМ хлорида натрия/1,5 мМ цитрата натрия). Другим примером жестких условий гибридизации является инкубирование в течение ночи при 42°С в растворе: 50% формамида, 1 × SSC (150 мМ NaCl, 15 мМ цитрата натрия), 50 мМ фосфата натрия (рН 7,6), 5 × раствора Денхардта, 10% сульфата декстрана и 20 мкг/мл денатурированной, расщепленной ДНК из молок лососевых, с последующим отмыванием фильтров в 0,1 × SSC при приблизительно 65°C. Как другой пример, жесткие условия гибридизации включают: предварительную гибридизацию в течение от 8 часов до ночи при 65°С в растворе, содержащем 6Х SSC (1X SSC является 0,15 М NaCl, 0,015 М цитрата Na; рН 7,0), 5Х раствора Денхардта, 0,05% фосфата натрия и 100 мкг/мл ДНК спермы сельди; гибридизация в течение 18-20 часов при 65°С в растворе, содержащем 6Х SSC, 1X раствора Денхардта, 100 мкг/мл тРНК дрожжей и 0,05% фосфата натрия; отмывание фильтров при 65°С в течение одного часа в растворе, содержащем 0,2Х SSC и 0,1% SDS (додецилсульфата натрия).
[0039] Жесткие условия гибридизации являются условиями гибридизации, которые, по меньшей мере, столь же жесткие как представленные выше условия. Другие жесткие условия гибридизации известны из уровня техники и также могут быть применены для идентификации нуклеиновых кислот этого определенного варианта осуществления изобретения.
[0040] "Tm" является температурой в градусах Цельсия, при которой 50% полинуклеотидного дуплекса, образованного комплементарными нитями, соединенными водородными связями в антипараллельном направлении спариванием оснований Уотсона-Крика, диссоциирует в одиночную нить в условиях эксперимента. Tm может быть предсказана согласно стандартной формуле, такой как:
[0041] Tm=81,5+16,6 log[X+]+0,41 (% G/C)-0,61 (% F)-600/L
[0042] где [Х+] является концентрацией катионов (особенно ионов натрия, Na+ в моль/л; (% G/C) является количеством остатков G и С как процент всех остатков в дуплексе;
(% F) является процентным содержанием формамида в растворе (вес/об); и
L является количеством нуклеотидов в каждой нити дуплекса.
[0043] Полинуклеотид или полипептид имеют определенную процентную "идентичность последовательности" с другим полинуклеотидом или полипептидом, обозначающую что, при выравнивании этот процент оснований или аминокислот является таким же при сравнении этих двух последовательностей. Подобие последовательностей может быть определено многими различными способами. Для определения идентичности последовательностей последовательности могут выравниваться с использованием методов и компьютерных программ, включая BLAST, доступный из всемирной компьютерной сети с ncbi.nlm.nih.gov/BLAST/. Другим алгоритмом выравнивания является FASTA, доступный из пакета Genetics Computing Group (GCG) из Madison, Wisconsin, USA, находящегося в полной собственности филиала Oxford Molecular Group, Inc. Другие методы выравнивания описаны в Methods in Enzymology, vol. 266: Computer Methods for Macromolecular Sequence Analysis (1996), ed. Doolittle, Academic Press, Inc., a division of Harcourt Brace & Co., San Diego, California, USA. Особенно интересными являются программы выравнивания, которые разрешают пропуски в последовательности. Алгоритм Смита-Уотермана является одним из типов алгоритма, который разрешает пропуски при выравнивании последовательностей. Смотри Meth. Mol. Biol. 70:173-187 (1997). Также, программа GAP, использующая метод выравнивания Нидлмана-Вунша, может быть применена для выравнивания последовательностей. См. J. Mol. Biol. 48:443-453 (1970)
[0044] Представляющей интерес является программа BestFit, использующая алгоритм локальной гомологии Смита и Уотермана (Advances in Applied Mathematics 2:482-489 (1981), для определения идентичности последовательностей. Штраф за образование пропусков будет обычно заключаться в пределах от 1 до 5, обычно от 2 до 4 и во многих вариантах осуществления изобретения будет составлять 3. Штраф за продолжения пропуска будет обычно заключаться в пределах от приблизительно 0,01, до 0,20, и во многих случаях будет составлять 0,10. Программа содержит параметры, используемые по умолчанию, определенные с помощью последовательностей, введенных для сравнения. Предпочтительно, идентичность последовательностей определяется с помощью параметров по умолчанию, определенных программой. Эта программа доступна также из пакета Genetics Computing Group (GCG) из Madison, Wisconsin, USA.
[0045] Другой представляющей интерес программой является алгоритм FastDB. FastDB описан в Current Methods в Sequence Comparison и Analysis, Macromolecule Sequencing и Synthesis, Selected Methods и Applications, pp.127-149, 1988, Alan R. Liss, Inc. Процент идентичности последовательностей рассчитывают с помощью FastDB, исходя из следующих параметров:
[0046] штраф за нарушение комплементарности: 1.00;
[0047] штраф за пропуск в последовательности: 1.00;
[0048] штраф за размер пропуска: 0.33; и
[0049] штраф за стыки: 30.0.
[0050] "Ген" относится к полинуклеотиду, содержащему, по меньшей мере, одну открытую рамку считывания, которая способна кодировать определенный белок после транскрипции и трансляции.
[0051] "Генный продукт" является молекулой, полученной в результате экспрессии определенного гена. Генные продукты включают, например, полипептид, аптамер, интерферирующую РНК, мРНК и т.п.
[0052] "Малые интерферирующие РНК" или "короткие интерферирующие РНК " или миРНК являются РНК-дуплексами нуклеотидов, которые ориентированы на представляющий интерес ген ("ген-мишень"). "РНК-дуплекс" относится к структуре, образованной комплементарным спариванием между двумя участками молекулы РНК. миРНК является "нацеленной" на ген, в котором нуклеотидная последовательность части дуплекса миРНК комплементарна нуклеотидной последовательности нацеленного гена. В некоторых вариантах осуществления изобретения длина дуплекса миРНК составляет меньше чем 30 нуклеотидов. В некоторых вариантах осуществления изобретения дуплекс может составлять 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11 или 10 нуклеотидов в длину. В некоторых вариантах осуществления изобретения длина дуплекса составляет 19-25 нуклеотидов в длину. РНК-дуплексная часть миРНК может быть частью шпилькообразной структуры. В дополнение к дуплексной части шпилькообразная структура может содержать петлевую часть, находящуюся между двумя последовательностями, образующими дуплекс.Длина петли может меняться. В некоторых вариантах осуществления изобретения петля является в 5, 6, 7, 8, 9, 10, 11, 12 и 13 нуклеотидов в длину. Шпилькообразная структура может также содержать 3' или 5' "липкие" части. В некоторых вариантах осуществления изобретения "липкий" конец является 3' или 5' концом 0, 1, 2, 3, 4 или 5 нуклеотидов в длину.
[0053] "Короткая шпилечная РНК" или кшРНК является полинуклеотидным конструктом, который может быть получен для экспрессии интерферирующих РНК, таких как миРНК.
[0054] "Рекомбинант" в применении к полинуклеотиду означает, что полинуклеотид является продуктом различных комбинаций клонирования, этапов рестрикции или лигирования и других процедур, которые приводят к конструкту, который отличается от найденного в природе полинуклеотида. Рекомбинантный вирус является вирусной частицей, содержащей рекомбинантный полинуклеотид. Термины соответственно включают репликации оригинального полинуклеотидного конструкта и потомство оригинального вирусного конструкта.
[0055] "Регуляторный элемент" или "регуляторная последовательность" является нуклеотидной последовательностью, вовлеченной во взаимодействие молекул, которая способствует функциональному регулированию полинуклеотида, включая репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию или деградацию полинуклеотида. Регулирование может влиять на частоту, скорость или специфику процесса и может быть улучшающим или ингибирующим по природе. Известные из уровня техники элементы включают, например, регулирующие транскрипцию последовательности, такие как промоторы и энхансеры. Промотор является участком ДНК, способным в определенных условиях к связыванию РНК-полимеразы и инициированию транскрипции кодирующей области, обычно располагаемой по ходу транскрипции (в направлении 3') от промотора.
[0056] "Функционально связанный" относится к непосредственному соседству генетических элементов, причем элементы находятся в контакте, позволяющем им работать ожидаемым способом. Например, промотор функционально связан с кодирующей областью, если промотор помогает инициировать транскрипцию кодирующей последовательности. Между промотором и кодирующей областью, до тех пор, пока поддерживается эта функциональная связь, могут находиться интроны.
[0057] "Экспрессионный вектор" является вектором, содержащем область, которая кодирует целевой пептид и используется для осуществления экспрессии белка в намеченной клетке-мишени. Экспрессионный вектор также содержит регуляторные элементы, функционально связанные с кодирующей областью для облегчения экспрессии белка в клетке-мишени. Комбинацию регуляторных элементов и гена или генов, с которыми они функционально связаны для экспрессии, иногда называют "кассетой экспрессии", большое количество которых известно и доступно из уровня техники или может быть легко создано из компонентов, доступных из уровня техники.
[0058] "Гетерологичный" означает полученный из генотипно отличной единицы от той остальной единицы, с которой он сравнивается. Например, полинуклеотид, введенный генно-инженерным способом в плазмиду или вектор, полученный из разных видов, является гетерологичным полинуклеотидом. Промотор, удаленный из его природной кодирующей последовательности и функционально связанный с кодирующей последовательностью, с которой он в природе не связан, является гетерологичным промотором. Так, например, rAAV, который включает гетерологичную нуклеиновую кислоту, кодирующую гетерологичный генный продукт, является rAAV, включающим нуклеиновую кислоту, обычно не содержащуюся во встречающемся в природе вирусе, AAV дикого типа, и кодируемый гетерологичный генный продукт является генным продуктом, обычно некодируемым встречающимся в природе вирусом, AAV дикого типа.
[0059] Термины "генетическое изменение" и "генетическая модификация" (и их грамматические варианты) используются взаимозаменяемо в данном документе для обозначения процесса, при котором генетический элемент (например, полинуклеотид) вводят в клетку отличным от митоза или мейоза способом. Элемент может быть гетерологичным к клетке или может быть дополнительной копией или усовершенствованной версией элемента, уже существующего в клетке. Генетическое изменение может быть осуществлено, например, путем трасфектирования клетки рекомбинантной плазмидой или другим полинуклеотидом с помощью любого процесса, известного из уровня техники, такого как электропорация, кальций-фосфатная преципитация или контактирование с полинуклеотид-липосомным комплексом. Генетическое изменение также может быть осуществлено, например, путем трансдукции или инфекции вируса ДНК или РНК или вирусного вектора. Обычно генетический элемент вводится в хромосому или минихромосому в клетке; но любое изменение, изменяющее фенотип и/или генотип клетки и ее потомства, включено в этот термин.
[0060] Клетка является так называемой "стабильно" измененной, трансфектированной, генетически модифицированной или трансформированной генетической последовательностью, если последовательность доступна для выполнения ее функции во время продленной культуры клеток in vitro. Обычно такая клетка является «наследственно» измененной (генетически модифицированной) в том отношении, что вводится генетическое изменение, которое также наследуется потомством измененной клетки.
[0061] Термины "полипептид", "пептид" и "белок" используются в настоящем документе взаимозаменяемо для обозначения полимеров аминокислот любой длины. Термины также охватывают модифицированный аминокислотный полимер, например, образованием дисульфидных связей, гликолизацией, липидизацией, фосфорилированием или конъюгацией с маркирующим компонентом. Полипептиды, такие как анти-ангиогенные полипептиды, нейропротекторные полипептиды и подобное, когда обсуждаются в контексте доставки генного продукта субъекту-млекопитающему, и их композиции, относятся, соответственно, к интактному полипептиду или любому его фрагменту или генно-инженерному производному, сохраняющему желаемую биохимическую функцию интактного белка. Подобным образом, указания на нуклеиновые кислоты, кодирующие анти-ангиогенные полипептиды, нуклеиновые кислоты, кодирующие нейропротекторные полипептиды, и другие такие нуклеиновые кислоты для использования в доставке генного продукта субъекту-млекопитающему (которые могут называться "трансгенами" и будут доставлены в клетку-реципиент), включают полинуклеотиды, кодирующие интактный полипептид или любой фрагмент или генно-инженерное производное, обладающие желаемой биохимической функцией.
[0062] "Выделенная" плазмида, нуклеиновая кислота, вектор, вирус, вирион, клетка-хозяин или другое вещество относится к получению вещества, лишенного, по меньшей мере, некоторых других компонентов, которые могут также присутствовать, откуда вещество или подобное вещество происходит или изначально получено. Так, например, выделенное вещество может быть получено с использованием методов очистки для его обогащения из исходной смеси. Обогащение может быть измерено на абсолютном базисе, таком как вес на объем раствора, или оно может быть измерено относительно второго, потенциально интерферирующего вещества, присутствующего в исходной смеси. Увеличивающиеся обогащения вариантов осуществления этого описания являются в возрастающей степени более выделенными. Выделенная плазмида, нуклеиновая кислота, вектор, вирус, клетка-хозяин или другое вещество являются в некоторых вариантах осуществления изобретения очищенными, например, от приблизительно 80% до приблизительно 90% чистоты, по меньшей мере, приблизительно 90% чистоты, по меньшей мере, приблизительно 95% чистоты, по меньшей мере, приблизительно 98% чистоты или, по меньшей мере, приблизительно 99%, или более чистоты.
[0063] Как использовано в настоящем документе, термины "терапия", "лечение" или подобные относятся к получению желательного фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения болезни или ее симптомов и/или может быть терапевтическим с точки зрения частичного или полного излечивания от болезни и/или неблагоприятного воздействия, относящегося к болезни. "Лечение", как использовано в настоящем документе, охватывает любое лечение болезни у млекопитающего, особенно у человека, и включает: (а) препятствование возникновению болезни у субъекта, предрасположенного к заболеванию или с повышенным риском приобретения заболевания, но у которого болезнь еще не диагностирована; (b) ингибирование болезни, то есть, остановку ее развития; и (с) облегчение болезни, то есть, вызов регресса болезни.
[0064] Термины "индивидуум", "хозяин", "субъект" и "пациент" в настоящем документе используются взаимозаменяемо, относятся к млекопитающим, включая, человеческие и нечеловеческие приматы, включая человекообразных обезьян и людей; млекопитающих спортивных животных (например, лошади); млекопитающих сельскохозяйственных животных (например, овцы, козы и т.д.); млекопитающих домашних животных (собаки, кошки и т.д.); и грызуны (например, мыши, крысы, и т.д.), но не ограничиваются перечисленными.
[0065] Прежде чем дальше описывать настоящее изобретение следует понимать, что это изобретение не ограничивается описанными конкретными вариантами осуществления, и как таковые, они могут, конечно, изменяться. Также следует понимать, что терминология, используемая в настоящем документе, предназначена исключительно для описания конкретных вариантов осуществления изобретения, а не для его ограничения, поскольку объем настоящего изобретения будет ограничиваться только приложенной формулой.
[0066] В случаях, когда предусмотрен диапазон значений, следует понимать, что каждое промежуточное значение, с точностью до десятой единицы нижнего предела, между верхним и нижним пределом такого диапазона или любое другое указанное или промежуточное значение в этом установленном диапазоне, охвачено изобретением, если контекст ясно не указывает иное. Верхние и нижние пределы этих меньших диапазонов могут независимо включаться в меньшие диапазоны и также охватываться изобретением с учетом любого специально исключенного предела в установленном диапазоне. Когда установленный диапазон включает один или оба предела, то диапазоны, исключающие один из двух или оба эти указанные пределы, также включены в изобретение.
[0067] Если не указано иное, то все технические и научные термины, использованные в настоящем документе, имеют те же значения, как и обычно понятные для специалиста в области техники, к которой относится изобретение. Хотя любые методы и материалы, подобные или эквивалентные тем, что описаны в настоящем документе, могут также использоваться в практике или тестировании настоящего изобретения, теперь описаны предпочтительные методы и материалы. Все публикации, указанные в настоящем документе, включены в данную заявку путем ссылки для раскрытия и описания методов и/или материалов, в связи с которыми цитируются публикации
[0068] Нужно отметить, что, как использовано в настоящем документе и в приложенной формуле, формы единственного числа включают формы множественного числа, если контекст ясно не указывает на иное. Так, например, ссылка на "вирион рекомбинантного AAV" включает ряд таких вирионов, а ссылка на "фоторецепторную клетку" включает ссылку на одну или более фоторецепторных клеток и их эквиваленты, известные специалисту в данной области техники, и т.д. Нужно дополнительно отметить, что формула может быть составлена так, чтобы исключить любой необязательный элемент. В таковом качестве это высказывание призвано служить ранее упомянутой основой для использования такой исключительной терминологии как "исключительно", "только" и т.п. в связи с перечислением элементов формулы изобретения или использованием негативных признаков.
[0069] Следует принимать во внимание, что некоторые особенности изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, могут также предусматриваться в комбинации в единственном варианте осуществления. И наоборот, различные особенности изобретения, которые для краткости описаны в контексте единственного варианта осуществления, могут также предусматриваться отдельно или в любой пригодной субкомбинации. Все комбинации вариантов осуществления, относящиеся к изобретению, определенно охвачены данным изобретением и раскрыты в настоящем документе так же, как если бы каждая комбинация была в нем индивидуально и явно раскрыта. Кроме того, все субкомбинации различных вариантов осуществления изобретения и их элементов также определенно охвачены данным изобретением и раскрыты в настоящем документе так же, как если бы каждая такая подкомбинация была в нем индивидуально и явно раскрыта.
[0070] Публикации, рассмотренные в данном документе, предоставлены исключительно на момент их раскрытия до даты подачи настоящей заявки. Ничто в данном документе не должно истолковываться как допуск, что данное изобретение не наделено правом предшествовать такой публикации по причине более раннего изобретения. Также даты предоставленных публикаций могут отличаться от фактических годов издания, которые, возможно, нуждаются в независимом подтверждении.
Подробное описание
[0071] В настоящем описании предложены вирионы аденоассоциированного вируса (AAV) с измененным (вариантным) капсидным белком, причем вирионы AAV демонстрируют большую инфекционность ретинальной клетки, когда вводятся интравитреальной инъекцией, по сравнению с AAV дикого типа, когда вводятся интравитреальной инъекцией. В настоящем описании дополнительно предложены способы доставки генного продукта в ретинальную клетку у индивидуума и способы лечения болезни глаз.
[0072] Ретинальна клетка может быть фоторецептором (например, палочки; колбочки), ганглиозной клеткой сетчатки (RGC), клеткой Мюллера (глиальная клетка Мюллера), биполярной клеткой, амакринной клеткой, горизонтальной клеткой или клеткой пигментного эпителия сетчатки (RPE).
ВАРИАНТНЫЕ КАПСИДНЫХ БЕЛКИ AAV
[0073] В настоящем описании предложены вариантные капсидные белки AAV, отличающийся тем, что вариантный капсидный белок AAV содержит вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в сайте встраивания в петле GH капсидного белка или петле IV, по сравнению с соответствующим капсидным белком родительского AAV, и где вариантный капсидный белок, когда присутствует в вирионе AAV, предоставляет повышенную инфекционность ретинальной клетки по сравнению с инфекционностью ретинальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV. В некоторых случаях ретинальная клетка является фоторецепторной клеткой (например, палочки; колбочки). В других случаях ретинальная клетка является RGC. В других случаях ретинальная клетка является клеткой RPE. В других случаях ретинальная клетка является клеткой Мюллера. Другие ретинальные клетки включают амакринные клетки, биполярные клетки и горизонтальные клетки. "Вставка из приблизительно 5 аминокислот до приблизительно 11 аминокислот" также именуемая в настоящем документе как "пептидная вставка" (например, вставка гетерологичного пептида). "Соответствующий родительский капсидный белок AAV" относится к капсидному белку AAV того же серотипа AAV без пептидной вставки.
[0074] Сайт встраивания находится в петле GH или петле IV капсидного белка AAV, например, в доступной для растворителя части петли GH или петли IV капсидного белка AAV. Для петли GH/ петли IV капсида AAV, смотри, например, van Vliet et al. (2006) Mol. Ther. 14:809; Padron et al. (2005) J. Virol. 79:5047; и Shen et al. (2007) Mol. Ther. 15:1955. Например, сайт встраивания может находиться в пределах аминокислот 411-650 капсидного белка AAV, как указано на фигурах 17А и 17B. Например, сайт встраивания может находиться в пределах аминокислот 570-611 из AAV2, в пределах аминокислот 571-612 из AAV1, в пределах аминокислот 560-601 из AAV5, в пределах аминокислот с 571 по 612 из AAV6, в пределах аминокислот с 572 по 613 из AAV7, в пределах аминокислот с 573 по 614 из AAV8, в пределах аминокислот с 571 по 612 из AAV9 или в пределах аминокислот с 573 по 614 из AAV 10, как указано на фигуре 6.
[0075] В некоторых случаях от приблизительно 5 аминокислот до приблизительно 11 аминокислот вставляется в сайт встраивания в петле GH или петле IV капсидного белка относительно соответствующего родительского капсидного белка AAV. Например, сайт встраивания может находиться между аминокислотами 587 и 588 AAV2 или соответствующими положениями капсидной субъединицы другого серотипа AAV. Следует заметить, что сайт встраивания 587/588 базируется на капсидном белке AAV2. От приблизительно 5 аминокислот до приблизительно 11 аминокислот может быть вставлено в соответствующий сайт другого серотипа AAV, отличного от AAV2 (например, AAV8, AAV9 и т.д.). Специалист в данной области техники знал бы, исходя из сравнения аминокислотных последовательностей капсидных белков различных серотипов AAV, где сайт встраивания "соответствующий аминокислотам 587-588 из AAV2" будет находиться в капсидном белке любого данного серотипа AAV. Последовательности, соответствующие аминокислотам 570-611 капсидного белка VP1 из AAV2 (смотри фигуру 5) в различных серотипах показаны на фигуре 6. Смотри, например, GenBank Accession No. NP_049542 для AAV1; GenBank Accession No. AAD13756 для AAV5; GenBank Accession No. AAB95459 для AAV6; GenBank Accession No. YP_077178 для AAV7; GenBank Accession No. YP_077180 для AAV8; GenBank Accession No. AAS99264 для AAV9 и GenBank Accession No. AAT46337 для AAV10.
[0076] В некоторых вариантах осуществления изобретения сайт встраивания является единственным местом вставки между двумя смежными аминокислотами, расположенными между аминокислотами 570-614 из VP1 любого серотипа AAV, например, место вставки между двумя смежными аминокислотами, расположенными в аминокислотах 570-610, аминокислотах 580-600, аминокислотах 570-575, аминокислотах 575-580, аминокислотах 580-585, аминокислотах 585-590, аминокислотах 590-600 или аминокислотах 600-614 VP1 любого серотипа AAV или варианта. Например, сайт встраивания может находиться между аминокислотами 580 и 581, аминокислотами 581 и 582, аминокислотами 583 и 584, аминокислотами 584 и 585, аминокислотами 585 и 586, аминокислотами 586 и 587, аминокислотами 587 и 588, аминокислотами 588 и 589, или аминокислотами 589 и 590. Сайт встраивания может находиться между аминокислотами 575 и 576, аминокислотами 576 и 577, аминокислотами 577 и 578, аминокислотами 578 и 579 или аминокислотами 579 и 580. Сайт встраивания может находиться между аминокислотами 590 и 591, аминокислотами 591 и 592, аминокислотами 592 и 593, аминокислотами 593 и 594, аминокислотами 594 и 595, аминокислотами 595 и 596, аминокислотами 596 и 597, аминокислотами 597 и 598, аминокислотами 598 и 599 или аминокислотами 599 и 600.
[0077] Например, сайт встраивания может находиться между аминокислотами 587 и 588 из AAV2, между аминокислотами 590 и 591 из AAV1, между аминокислотами 575 и 576 из AAV5, между аминокислотами 590 и 591 из AAV6, между аминокислотами 589 и 590 из AAV7, между аминокислотами 590 и 591 из AAV8, между аминокислотами 588 и 589 из AAV9 или между аминокислотами 588 и 589 из AAV10.
[0078] Как другой пример, сайт встраивания может находиться между аминокислотами 450 и 460 капсидного белка AAV, как показано на фигуре 17А. Например, сайт встраивания может находиться у (например, непосредственно у N-конца) аминокислоты 453 из AAV2, у аминокислоты 454 из AAV1, у аминокислоты 454 из AAV6, у аминокислоты 456 из AAV7, у аминокислоты 456 из AAV8, у аминокислоты 454 из AAV9 или у аминокислоты 456 из AAV10, как показано на фигуре 17А.
[0079] В некоторых вариантах осуществления изобретения заявленный капсидный белок включает петлю GH, содержащую аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% аминокислотную идентичность с аминокислотной последовательностью, указанной на фигуре 18А-С.
Инсерционные пептиды
[0080] Как указано выше, пептид из приблизительно 5 аминокислот до приблизительно 11 аминокислот в длину вставляют в петлю GH капсида AAV. Инсерционный пептид имеет длину в 5 аминокислот, 6 аминокислот, 7 аминокислот, 8 аминокислот, 9 аминокислот, 10 аминокислот или 11 аминокислот.
[0081] Инсерционный пептид может содержать аминокислотную последовательность любой из указанных ниже формул.
[0082] Например, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу I:
[0083] Y1Y2X1X2X3X4X5X6X7Y3Y4
[0084] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu, Asn и Lys;
Х2 выбран из Gly, Glu, Ala и Asp;
Х3 выбран из Glu, Thr, Gly и Pro;
Х4 выбран из Thr, Ile, Gln и Lys;
Х5 выбран из Thr и Ala;
Х6 выбран из Arg, Asn и Thr;
Х7, если присутствует, выбран из Pro и Asn.
[0085] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIa:
[0086] Y1Y2X1X2X3X4X5X6X7Y3Y4
[0087] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
каждый X1-Х4 является любой аминокислотой;
X5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[0088] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIb:
[0089] Y1Y2X1X2X3X4X5X6X7Y3Y4
[0090] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu и Asn;
Х2, если присутствует, выбран из Gly и Glu;
Х3 выбран из Glu и Thr;
Х4 выбран из Thr и Ile;
Х5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[0091] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу III:
[0092] Y1Y2X1X2X3X4X5X6X7Y3Y4
[0093] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является Lys;
Х2 выбран из Ala и Asp;
Х3 выбран из Gly и Pro;
Х4 выбран из Gln и Lys;
Х5 выбран из Thr и Ala;
Х6 выбран из Asn и Thr;
Х7, если присутствует, является Asn.
[0094] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IV:
[0095] Y1Y2X1X2X3X4X5X6X7Y3Y4
[0096] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Leu, Asn, Arg, Ala, Ser и Lys;
Х2 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Gly, Glu, Ala, Val, Thr и Asp;
Х3 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Glu, Thr, Gly, Asp или Pro;
Х4 выбран из Thr, Ile, Gly, Lys, Asp и Gln;
Х5 является полярной аминокислотой, спиртом (аминокислота, имеющая свободные гидроксильные группы), или гидрофобной аминокислотой; или выбран из Thr, Ser, Val и Ala;
Х6 является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Arg, Val, Lys, Pro, Thr и Asn; и
Х7, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Pro, Gly, Phe, Asn и Arg.
[0097] В качестве неограничивающих примеров, инсерционный пептид может содержать аминокислотную последовательность, выбранную из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60).
[0098] В некоторых случаях инсерционный пептид имеет от 1 до 4 спейсерных аминокислот (Y1-Y4) у аминоконца и/или у карбоксильного конца любой из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59), и STGKVPN (SEQ ID №60). Пригодная спейсерная аминокислота включает лейцин, аланин, глицин и серии, но не ограничивается ими.
[0099] Например, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: LALGETTRPA (SEQ ID №45); LANETITRPA (SEQ ID №46), LAKAGQANNA (SEQ ID №47), LAKDPKTTNA (SEQ ID №48), LAKDTDTTRA (SEQ ID №61), LARAGGSVGA (SEQ ID №62), LAAVDTTKFA (SEQ ID №63) и LASTGKVPNA (SEQ ID №64). Как другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: AALGETTRPA (SEQ ID №49); AANETITRPA (SEQ ID №50), AAKAGQANNA (SEQ ID №51) и AAKDPKTTNA (SEQ ID №52). Как еще другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: GLGETTRPA (SEQ ID №53); GNETITRPA (SEQ ID №54), GKAGQANNA (SEQ ID №55) и GKDPKTTNA (SEQ ID №56). Как другой пример, в некоторых случаях инсерционный пептид содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60), фланкированную на С-конце с помощью АА и на N-конце с помощью А; или содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60) фланкированную на С-конце с помощью G и на N-конце с помощью А.
[00100] В некоторых вариантах осуществления изобретения, заявленный вариантный капсид AAV не включает никаких других аминокислотных замещений, вставок или делеций, кроме как вставки из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV. В других вариантах осуществления изобретения, заявленный вариантный капсид AAV включает от 1 до приблизительно 25 аминокислотных вставок, делеций или замещений по сравнению с родительским капсидным белком AAV, дополнительно к вставке из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с родительским капсидным белком AAV. Например, в некоторых вариантах осуществления изобретения, заявленный вариантный капсид AAV включает от 1 до приблизительно 5, от приблизительно 5 до приблизительно 10, от приблизительно 10 до приблизительно 15, от приблизительно 15 до приблизительно 20 или от приблизительно 20 до приблизительно 25 аминокислотных вставок, делеций или замещений по сравнению с родительским капсидным белком AAV, дополнительно к вставке из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с родительским капсидным белком AAV.
[00101] В некоторых вариантах осуществления изобретения, заявленный вариантный капсидный полипептид не включает одно, два, три или четыре из следующих аминокислотных замещений: Y273F, Y444F, Y500F и Y730F.
[00102] В некоторых вариантах осуществления изобретения, заявленный вариантный капсидный полипептид содержит, дополнительно к инсерционному пептиду как описано выше, одно, два, три или четыре из следующих аминокислотных замещений: Y273F, Y444F, Y500F и Y730F.
[00103] В некоторых вариантах осуществления изобретения, вариантный капсидный полипептид AAV является химерным капсидом, например, капсид содержит часть капсида AAV первого серотипа AAV и часть капсида AAV второго серотипа; и содержит вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV.
[00104] В некоторых вариантах осуществления изобретения, заявленный вариантный капсидный белок содержит аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98% или, по меньшей мере, приблизительно 99% аминокислотную идентичность с аминокислотной последовательность, представленной на фигуре 5; и вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV.
[00105] В некоторых вариантах осуществления изобретения, заявленный вариантный капсидный белок является выделенным, например, очищенным. В некоторых случаях заявленный вариантный капсидный белок включен в вектор AAV, который тоже предусмотрен. Как подробно описано ниже, заявленный вариантный капсидный белок может быть включенным в рекомбинантный вирион AAV.
ВИРИОН РЕКОМБИНАНТНОГО AAV
[00106] В настоящем описании предложен вирион рекомбинантного аденоассоциированного вируса (rAAV), содержащий: а) вариантный капсидный белок AAV, причем вариантный капсидный белок AAV содержит вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в сайте встраивания в петле GH или петле IV капсидного белка по сравнению с соответствующим родительским капсидным белком AAV, и где вариантный капсидный белок демонстрирует большую инфекционность ретинальной клетки по сравнению с инфекционностью ретинальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV; и b) гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую генный продукт. В некоторых случаях ретинальная клетка является фоторецепторной клеткой (например, палочками и/или колбочками). В других случаях ретинальная клетка является клеткой RGC. В других случаях ретинальная клетка является клеткой RPE. В других случаях ретинальная клетка является клеткой Мюллера. В других случаях ретинальная клетка может включать амакринные клетки, биполярные клетки и горизонтальные клетки. "Вставка из приблизительно 5 аминокислот до приблизительно 11 аминокислот" также именуется в настоящем документе как "пептидная вставка" (например, вставка гетерологичного пептида). "Соответствующий родительский капсидный белок AAV" относится к капсидному белку AAV того же серотипа AAV без пептидной вставки.
[00107] Сайт встраивания находится в петле GH или петле IV капсидного белка AAV, например, в доступной для растворителя части петли GH или петли IV капсидного белка AAV. Для петли GH, смотри, например, van Vliet et al. (2006) Mol. Ther. 14:809; Padron et al. (2005) J. Virol. 79:5047; и Shen et al. (2007) Mol. Ther. 15:1955. Например, сайт встраивания находится в пределах аминокислот 570-611 из AAV2, в пределах аминокислот 571-612 из AAV1, в пределах аминокислот 560-601 из AAV5, в пределах аминокислот от 571 до 612 из AAV6, в пределах аминокислот от 572 до 613 из AAV7, в пределах аминокислот от 573 до 614 из AAV8, в пределах аминокислот от 571 до 612 из AAV9 или в пределах аминокислот от 573 до 614 из AAV10.
[00108] От приблизительно 5 аминокислот до приблизительно 11 аминокислот вставляется в сайт встраивания в петле GH или петле IV капсидного протеина по сравнению с соответствующим родительским капсидным белком AAV. Например, сайт встраивания может находиться между аминокислотами 587 и 588 из AAV2, или в соответствующих положениях капсидной субъединицы другого серотипа AAV. Следует заметить, что сайт встраивания 587/588 базируется на капсидном белке AAV2. От приблизительно 5 аминокислот до приблизительно 11 аминокислот может вставляться ответствующий сайт в другом серотипе AAV, отличном от AAV2 (например, AAV8, AAV9 и т.д.). Специалист в данной области техники знал бы, исходя из сравнения аминокислотных последовательностей капсидных белков различных серотипов AAV, где сайт встраивания, "соответствующий аминокислотам 587-588 из AAV2", будет находиться в капсидном белке любого данного серотипа AAV. Последовательности, соответствующие аминокислотам 570-611 капсидного белка VP1 из AAV2 (см. фигуру 5) в различных серотипах AAV, показаны на фигуре 6.
[00109] В некоторых вариантах осуществления изобретения, сайт встраивания является единственным местом вставки между двумя смежными аминокислотами, расположенными между аминокислотами 570-614 из VP1 любого серотипа AAV, например, сайт встраивания находится между двумя смежными аминокислотами, расположенными в аминокислотах 570-614, в аминокислотах 580-600, в аминокислотах 570-575, в аминокислотах 575-580, в аминокислотах 580-585, в аминокислотах 585-590, в аминокислотах 590-600 или в аминокислотах 600-610 из VP1 любого серотипа или варианта AAV. Например, сайт встраивания может находиться между аминокислотами 580 и 581, аминокислотами 581 и 582, аминокислотами 583 и 584, аминокислотами 584 и 585, аминокислотами 585 и 586, аминокислотами 586 и 587, аминокислотами 587 и 588, аминокислотами 588 и 589 или аминокислотами 589 и 590. Сайт встраивания может находиться между аминокислотами 575 и 576, аминокислотами 576 и 577, аминокислотами 577 и 578, аминокислотами 578 и 579 или аминокислотами 579 и 580. Сайт встраивания может находиться между аминокислотами 590 и 591, аминокислотами 591 и 592, аминокислотами 592 и 593, аминокислотами 593 и 594, аминокислотами 594 и 595, аминокислотами 595 и 596, аминокислотами 596 и 597, аминокислотами 597 и 598, аминокислотами 598 и 599 или аминокислотами 599 и 600.
[00110] Например, сайт встраивания может находиться между аминокислотами 587 и 588 из AAV2, между аминокислотами 590 и 591 из AAV1, между аминокислотами 575 и 576 из AAV5, между аминокислотами 590 и 591 из AAV6, между аминокислотами 589 и 590 из AAV7, между аминокислотами 590 и 591 из AAV8, между аминокислотами 588 и 589 из AAV9 или между аминокислотами 589 и 590 из AAV10.
Инсерционные пептиды
[00111] Как отмечалось выше, заявленный вирион rAAV содержит пептид из приблизительно 5 аминокислот до приблизительно 11 аминокислот в длину, вставленный в петлю GH капсида AAV. Инсерционный пептид имеет длину в 5 аминокислот, 6 аминокислот, 7 аминокислот, 8 аминокислот, 9 аминокислот, 10 аминокислот или 11 аминокислот.
[00112] Инсерционный пептид может содержать аминокислотную последовательность любой формулы, указанной ниже.
[00113] Например, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу I:
[00114] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00115] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu, Asn и Lys;
Х2 выбран из Gly, Glu, Ala и Asp;
Х3 выбран из Glu, Thr, Gly и Pro;
Х4 выбран из Thr, Ile, Gln и Lys;
Х5 выбран из Thr и Ala;
Х6 выбран из Arg, Asn и Thr;
Х7, если присутствует, выбран из Pro и Asn.
[00116] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIa:
[00117] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00118] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
каждый X1-Х4 является любой аминокислотой;
Х5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[00119] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIb:
[00120] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00121] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu и Asn;
Х2, если присутствует, выбран из Gly и Glu;
Х3 выбран из Glu и Thr;
Х4 выбран из Thr и Ile;
Х5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[00122] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу III:
[00123] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00124] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является Lys;
Х2 выбран из Ala и Asp;
Х3 выбран из Gly и Pro;
Х4 выбран из Gln и Lys;
X5 выбран из Thr и Ala;
Х6 выбран из Asn и Thr;
Х7, если присутствует, является Asn.
[00125] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IV:
[00126] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00127] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Leu, Asn, Arg, Ala, Ser и Lys;
Х2 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Gly, Glu, Ala, Val, Thr и Asp;
Х3 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Glu, Thr, Gly, Asp или Pro;
Х4 выбран из Thr, Ile, Gly, Lys, Asp и Gln;
Х5 является полярной аминокислотой, спиртом (аминокислотой, имеющей свободные гидроксильные группы), или гидрофобной аминокислотой; или выбран из Thr, Ser, Val и Ala;
Х6 является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Arg, Val, Lys, Pro, Thr и Asn; и
Х7, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Pro, Gly, Phe, Asn и Arg.
[00128] В качестве неограничивающих примеров, инсерционный пептид может содержать аминокислотную последовательность, выбранную из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60).
[00129] В некоторых случаях инсерционный пептид имеет от 1 до 4 спейсерных аминокислот (Y1-Y4) у аминоконца и/или у карбоксильного конца любой из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60). Пригодная спейсерная аминокислота включает лейцин, аланин, глицин и серии, но не ограничивается ими.
[00130] Например, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: LALGETTRPA (SEQ ID №45); LANETITRPA (SEQ ID №46), LAKAGQANNA (SEQ ID №47), LAKDPKTTNA (SEQ ID №48), LAKDTDTTRA (SEQ ID №61), LARAGGSVGA (SEQ ID №62), LAAVDTTKFA (SEQ ID №63) и LASTGKVPNA (SEQ ID №64). Как другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: AALGETTRPA (SEQ ID №49); AANETITRPA (SEQ ID №50), AAKAGQANNA (SEQ ID №51) и AAKDPKTTNA (SEQ ID №52). Как еще другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: GLGETTRPA (SEQ ID №53); GNETITRPA (SEQ ID №54), GKAGQANNA (SEQ ID №55) и GKDPKTTNA (SEQ ID №56). Как другой пример, в некоторых случаях инсерционный пептид содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60), фланкированную на С-конце с помощью АА и на N-конце с помощью А; или содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60) фланкированную на С-конце с помощью G и на N-конце с помощью А.
[00131] В некоторых вариантах осуществления изобретения, заявленный капсид вириона rAAV не включает никаких других аминокислотных замещений, вставок или делеций, кроме как вставки из приблизительно 7 аминокислот до приблизительно 10 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV. В других вариантах осуществления изобретения, заявленный капсид вириона rAAV включает от 1 до приблизительно 25 аминокислотных вставок, делеций или замещений по сравнению с соответствующим родительским капсидным белком AAV дополнительно к вставке из приблизительно 7 аминокислот до приблизительно 10 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV. Например, в некоторых вариантах осуществления изобретения, заявленный капсид вириона rAAV включает от 1 до приблизительно 5, от приблизительно 5 до приблизительно 10, от приблизительно 10 до приблизительно 15, от приблизительно 15 до приблизительно 20 или от приблизительно 20 до приблизительно 25 аминокислотных вставок, делеций или замещений по сравнению с соответствующим родительским капсидным белком AAV дополнительно к вставке из приблизительно 7 аминокислот до приблизительно 10 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV.
[00132] В некоторых вариантах осуществления изобретения заявленный капсид вириона rAAV не включает одно, два, три или четыре следующих аминокислотных замещения: Y273F, Y444F, Y500F и Y730F.
[00133] В некоторых вариантах осуществления изобретения заявленный вариантный капсидный полипептид содержит дополнительно к инсерционному пептиду, как описано выше, одно, два, три или четыре следующих аминокислотных замещения: Y273F, Y444F, Y500F и Y730F.
[00134] В некоторых вариантах осуществления изобретения, заявленный капсид вириона rAAV является химерным капсидом, например, капсид содержит часть капсида AAV первого серотипа AAV часть капсида AAV второго серотипа; и содержит вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV.
[00135] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV содержит капсидный белок, содержащий аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98% или, по меньшей мере, приблизительно 99% идентичность аминокислотной последовательности с аминокислотной последовательностью, представленной на фигуре 5; и вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV.
[00136] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV содержит капсидный белок, который включает петлю GH, содержащую аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 85%, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% идентичность аминокислотной последовательности с аминокислотной последовательностью, указанной на фигуре 18А-С.
[00137] Заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или белее чем 50-кратное повышение инфекционности ретинальной клетки по сравнению с ифекционностью ретинальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00138] В некоторых случаях заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное, повышение инфекционности ретинальной клетки, когда вводиться интравитреальной инъекцией по сравнению с инфекционностью ретинальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00139] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки фоторецептора (палочка или колбочка) по сравнению с инфекционностью фоторецепторной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00140] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки фоторецептора (палочка или колбочка), когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью фоторецепторной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00141] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности RGC по сравнению с инфекционностью RGC вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00142] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное, повышение инфекционности RGC, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью RGC вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00143] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки RPE по сравнению с инфекционностью клетки RPE вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00144] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки RPE, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью клетки RPE вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00145] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки Мюллера по сравнению с инфекционностью клетки Мюллера вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00146] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности клетки Мюллера, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью клетки Мюллера вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00147] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности биполярной клетки по сравнению с инфекционностью биполярной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00148] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности биполярной клетки, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью биполярной клетки вирионом AAV содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00149] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности амакринной клетки по сравнению с инфекционностью амакринной клетки вирионом AAV содержащим соответствующий родительский капсидный белок AAV.
[00150] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности амакринной клетки, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью амакринной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00151] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности горизонтальной клетки по сравнению с инфекционностью горизонтальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV.
[00152] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности горизонтальной клетки, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью горизонтальной клетки вирионом AAV содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
[00153] В некоторых случаях заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение способности пересекать внутреннюю пограничную мембрану (ILM) по сравнению со способностью вириона AAV, содержащего соответствующий родительский капсидный белок AAV, to cross the ILM.
[00154] В некоторых случаях заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение способности, когда вводиться интравитреальной инъекцией, пересекать внутреннюю пограничную мембрану (ILM), по сравнению со способностью вириона AAV, содержащего соответствующий родительский капсидный белок AAV, пересекать ILM, когда вводиться интравитреальной инъекцией.
[00155] Заявленный вирион rAAV может пересекать ILM, а также может пересекать слои клеток, включая клетки Мюллера, амакринные клетки и т.д., для достижения клеток фоторецептора и или клеток RPE. Например, заявленный вирион rAAV, когда вводиться интравитреальной инъекцией, может пересекать ILM, а также может пересекать слои клеток, включая клетки Мюллера, амакринные клетки и т.д., для достижения фоторецепторных клеток или клеток RPE.
[00156] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV селективно инфицирует ретинальную клетку, например, заявленный вирион rAAV инфицирует ретинальную клетку с 10-кратной, 15-кратной, 20-кратной, 25-кратной, 50-кратной или более чем 50-кратной специфичностью, чем неретинальную клетку, например, клетку вне глаза. Например, в некоторых вариантах осуществления изобретения, заявленный вирион rAAV селективно инфицирует ретинальную клетку, например, заявленный вирион rAAV инфицирует фоторецепторную клетку с 10-кратной, 15-кратной, 20-кратной, 25-кратной, 50-кратной или более чем 50-кратной специфичностью, чем неретинальную клетку, например, клетку вне глаза.
[00157] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV селективно инфицирует фоторецепторную клетку, например, заявленный вирион rAAV инфицирует ретинальную клетку с 10-кратной, 15-кратной, 20-кратной, 25-кратной, 50-кратной или более чем 50-кратной специфичностью, чем неретинальную фоторецепторную клетку, присутствующую в глазе, например, ганглиозную клетку сетчатки, клетку Мюллера и т.д.
[00158] В некоторых вариантах осуществления изобретения, заявленный вирион rAAV демонстрирует, по меньшей мере, 10-кратное, по меньшей мере, 15-кратное, по меньшей мере, 20-кратное, по меньшей мере, 25-кратное, по меньшей мере, 50-кратное или более чем 50-кратное повышение инфекционности фоторецепторной клетки, когда вводиться интравитреальной инъекцией, по сравнению с инфекционностью фоторецепторной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV, когда вводиться интравитреальной инъекцией.
Генные продукты
[00159] Заявленный вирион rAAV содержит гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую генный продукт. В некоторых вариантах осуществления изобретения, генный продукт является интерферирующей РНК. В некоторых вариантах осуществления изобретения генный продукт является аптамером. В некоторых вариантах осуществления изобретения генный продукт является полипептидом. В некоторых вариантах осуществления изобретения генный продукт является сайт-специфичной нуклеазой, которая обеспечивает сайт-специфический «нокдаун»
Интерферирующая РНК
[00160] Когда генным продуктом является интерферирующая РНК (РНКи), пригодные РНКи включают РНКи, которые уменьшают уровень апоптотического или ангиогенного фактора в клетке. Например, РНКи может быть миРНК или миРНК, которая снижает уровень генного продукта, который вызывает или способствует апоптозу в клетке. Гены, генные продукты которых вызывают или способствуют апоптозу, упомянуты в данном документе как "проапоптотические гены", а продукты таких генов (мРНК; белок) упомянуты как "проапоптотические генные продукты". Проапоптотические генные продукты включают, например, генные продукты Вах, Bid, Bak и Bad. Смотри, например, патент США №7846730.
[00161] Интерферирующие РНК также могут быть против ангиогенного продукта, например VEGF (например, Cand5; смотри, например, патентную публикацию США №2011/0143400; патентную публикацию США №2008/0188437; и Reich et al. (2003) Mol. Vis. 9:210), VEGFR1 (например, миРНК-027; смотри, например, Kaiser et al. (2010) Am. J. Ophthalmol. 150:33; и Shen et al. (2006) Gene Ther. 13:225), или VEGFR2 (Kou et al. (2005) Biochem. 44:15064). Смотри также, патенты США №6649596, 6399586, 5661135, 5639872 и 5639736; и патенты США №7947659 и 7919473.
Аптамеры
[00162] Когда генным продуктом является аптамер, представляющие интерес примерные аптамеры включают аптамер против сосудистого фактора эндотелиального роста (VEGF). Смотри, например, Ng et al. (2006) Nat. Rev. Drug Discovery 5:123; и Lee et al. (2005) Proc. Natl. Acad. Sci. USA 102:18902. Например, аптамер VEGF может содержать нуклеотидную последовательность 5'-cgcaaucagugaaugcuuauacauccg-3' (SEQ ID №17). Также пригодным для использования является PDGF-специфический аптамер, например, Е10030; смотри, например, Ni и Hui (2009) Ophthalmologica 223:401; и Akiyama et al. (2006) J. Cell Physiol. 207:407).
Полипептиды
[00163] Когда генным продуктом является полипептид, полипептид является обычно полипептидом, улучшающим функцию ретинальной клетки, например, функцию палочковидной или колбочковидной фоторецепторной клетки, ретинальной клетки нервного узла, клетки Мюллера, биполярной клетки, амакринной клетки, горизонтальной клетки или ретинального пигментированного эпителиоцита. Примерные полипептиды включают нейропротекторные полипептиды (например, GDNF, CNTF, NT4, NGF и NTN); антиангиогенные полипептиды (например, растворимый рецептор фактора роста эндотелия сосудов (VEGF); VEGF-связывающее антитело; фрагмент VEGF-связывающего антитела (например, одноцепочечное анти-VEGF антитело); эндостатин; тумстатин; ангиостатин; растворимый полипептид Fit (Lai et al. (2005) Mol. Ther. 12:659); слитый белок Fc, содержащий растворимы полипептид Flt (смотри, например, Pechan et al. (2009) Gene Ther. 16:10); фактор пигментного эпителия (PEDF); растворимый рецептор Tie-2; и т.д.; тканевый ингибитор металлопротеиназы-3 (TIMP-3); свето-реактивный опсин, например, родопсин; антиапоптозные полипептиды (например, Bcl-2, Bcl-Xl); и т.п. Пригодные полипептиды включают глиальный нейротрофический фактор (GDNF); фактор роста фибробластов 2; нейротурин (NTN); цилиарный нейротрофический фактор (CNTF); фактор роста нервов (NGF); нейротрофин -4 (NT4); нейротрофический фактор из тканей мозга (BDNF; например, полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% идентичность последовательности аминокислот со смежным удлинением от приблизительно 200 аминокислот до 247 аминокислот аминокислотной последовательности, представленной на фигуре 11 (SEQ ID №11)); эпидермальный фактор роста; родопсин; Х-сцепленный ингибитор апоптоза; и хеджехог-белок, но не ограничиваются ими.
[00164] Пригодные свето-реактивные опсины включают, например, свето-реактивный опсин, как описано в патентной публикации США №2007/0261127 (например, ChR2; Chop2); патентной публикации США №2001/0086421; патентной публикации США №2010/0015095; и Diester et al. (2011) Nat. Neurosci. 14:387.
[00165] Пригодные полипептиды также включают ретиношизин (например, полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100%, идентичность последовательности аминокислот со смежным удлинением от приблизительно 200 аминокислот до 224 аминокислот аминокислотной последовательности, представленной на фигуре 10 (SEQ ID №10). Пригодные полипептиды включают, например, (RGPR)-взаимодействующий белок-1 регулятора ГТФазы пигментной дистрофии сетчатки (смотри, например, GenBank Accession № Q96KN7, Q9EPQ2, и Q9GLM3) (например, полипептид, содержащий аминокислотную последовательность, имеющую, по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100%, идентичность последовательности аминокислот со смежным удлинением от приблизительно 1150 аминокислот до приблизительно 1200 аминокислот или от приблизительно 1200 аминокислот до 1286 аминокислот аминокислотной последовательности, представленной на фигуре 16 (SEQ ID №21); периферин-2 (Prph2) (смотри, например, GenBank Accession No. NP_000313 (например, полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% идентичность последовательности аминокислот со смежным удлинением от приблизительно 300 аминокислот до 346 аминокислот аминокислотной последовательности, представленной на фигуре 14 (SEQ ID №19); и Travis et al. (1991) Genomics 10:733); периферии (например, полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% идентичность последовательности аминокислот со смежным удлинением от приблизительно 400 аминокислот до приблизительно 470 аминокислот аминокислотной последовательности, представленной на фигуре 15 (SEQ ID №20); специфический к пигментному эпителию сетчатки протеин (RPE65), (например, полипептид, содержащий аминокислотную последовательность, имеющую по меньшей мере, приблизительно 90%, по меньшей мере, приблизительно 95%, по меньшей мере, приблизительно 98%, по меньшей мере, приблизительно 99% или 100% идентичность последовательности аминокислот со смежным удлинением от приблизительно 200 аминокислот до 247 аминокислот аминокислотной последовательности, представленной на фигуре 12 (SEQ ID №12)) (смотри, например, GenBank AAC39660; и Morimura et al. (1998) Proc. Natl. Acad. Sci. USA 95:3088); и т.п.
[00166] Пригодные полипептиды также включают: СНМ (хороидермия (Rab эскортный протеин 1)), полипептид, который, когда дефектный или дефицитный, вызывает хороидермию (смотри, например, Donnelly et al. (1994) Hum. Mol. Genet. 3:1017; и van Bokhoven et al. (1994) Hum. Mol. Genet. 3:1041); и гомолог Крамба 1 (CRB1), олигопептид, который, когда дефектный или дефицитный, вызывает амавроз Лебера и пигментный ретинит (смотри, например, den Hollander et al. (1999) Nat. Genet. 23:217; и GenBank Accession No. CAM23328).
[00167] Пригодные полипептиды также включают полипептиды, которые, когда дефектны или дефицитны, приводят к ахроматопсии, тогда такие полипептиды включают, например, субъединицу альфа ЦГМФ-зависимого канала колбочкового фоторецептора (CNGA3) смотри, например, GenBank Accession No. NP_001289; и Booij et al. (2011) Ophthalmology 118:160-167); бета-субъединицу ЦГМФ-зависимого ионного канала колбочкового фоторецептора (CNGB3) (смотри, например, Kohl et al. (2005) Eur J Hum Genet. 13(3):302); гуаниновонуклеотидный связывающий белок (белок G), полипептид 2 альфа трансдуцирующей активности (GNAT2) (АСНМ4); и АСНМ5; и полипептиды, которые, когда дефектны или дефицитны, приводят к различным формам дальтонизма (например, L-опсин, М-опсин, и S-опсин). См. Mancuso et al. (2009) Nature 461(7265):784-787.
Сайт-специфичные эндонуклеазы
[00168] В некоторых случаях целевой генный продукт является сайт-специфичной эндонуклеазой, которая обеспечивает сайт-специфичный «нокдаун» генной функции, например, когда эндонуклеаза «нокаутирует» аллель, связанную с ретинальной болезнью. Например, в случаях, когда доминантная аллель кодирует дефектную копию гена, который, когда дикого типа, является ретинальным структурным белком и/или предусматривает нормальную ретинальную функцию, то сайт-специфичная эндонуклеаза может быть нацеленной на дефектную аллель и «нокаутирует» дефектную аллель.
[00169] В дополнение к «нокаутированию» дефектной аллели сайт-специфичная нуклеаза может также использоваться для стимулирования гомологичной рекомбинации с донором ДНК, который кодирует функциональную копию протеина, закодированного дефектной аллелью. Таким образом, например, заявленный вирион rAAV может использоваться для доставки сайт-специфичной эндонуклеазы, которая «нокаутирует» дефектную аллель, и может использоваться для доставки функциональной копии дефектной аллели, приводящей к восстановлению дефектной аллели, тем самым, обеспечивая продуцирование функционального ретинального протеина (например, функционального ретиношизина, функционального RPE65, функционального периферина и т.д.). Смотри, например, Li et al. (2011) Nature 475:217. В некоторых вариантах осуществления изобретения, заявленный вирион rAAV содержит гетерологичную нуклеотидную последовательность, которая кодирует сайт-специфичную эндонуклеазу; и гетерологичную нуклеотидную последовательность, которая кодирует функциональную копию дефектной аллели, где функциональная копия кодирует функциональный ретинальный протеин. Функциональные ретинальные протеины включают, например, ретиношизин, RPE65, (RGPR)-взаимодействующий белок-1 регулятора ГТФазы пигментной дистрофии сетчатки, периферии, периферин -2 и т.п.
[00170] Сайт-специфичные эндонуклеазы, пригодные для использования, включают, например, нуклеазы "цинковые пальцы" (ZFN); и подобные активатору транскрипции эффекторные нуклеазы (TALEN), когда такие сайт-специфичные эндонуклеазы не природного происхождения и модифицированы для нацеливания на специфичный ген. Такие сайт-специфичные эндонуклеазы могут быть сконструированы для сокращения определенных местоположений в геноме, а негомологичное соединение концов может затем восстановить разрыв при вставке или удалении нескольких нуклеотидов. Такие сайт-специфичные эндонуклеазы (также именуемый как "INDEL") затем выбрасывают белок из рамки и эффективно «нокаутируют» ген. Смотри, например, патентную публикацию США №2011/0301073.
Регуляторные последовательности
[00171] В некоторых вариантах осуществления изобретения нуклеотидная последовательность, кодирующая целевой генный продукт, функционально связана с конститутивным промотором. В других вариантах осуществления изобретения, нуклеотидная последовательность, кодирующая целевой генный продукт, функционально связана с индуцибельным промотором. В некоторых случаях, нуклеотидная последовательность, кодирующая целевой генный продукт, функционально связана с тканеспецифичным или клеточноспецифичным регуляторным элементом. Например, в некоторых случаях, нуклеотидная последовательность, кодирующая целевой генный продукт, функционально связана с фоторецепторспецифичным регуляторным элементом (например, фоторецепторспецифичным промотором), например, регуляторным элементом, который обеспечивает селективную экспрессию функционально связанного гена в фоторецепторной клетке. Пригодные фоторецепторспецифичные регуляторные элементы включают, например, родопсиновый промотор; родопсинокиназный промотор (Young et al. (2003) Ophthalmol. Vis. Sci. 44:4076); промотор гена бета-фосфодиэстеразы (Nicoud et al. (2007) J. Gene Meet. 9:1015); промотор гена пигментного ретинита (Nicoud et al. (2007) выше); энхансер гена межфоторецепторного ретинол-связывающего белка (IRBP) (Nicoud et al. (2007) выше); промотор гена IRBP (Yokoyama et al. (1992) Exp Eye Res. 55:225).
ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ
[00172] В настоящем описании предложена фармацевтическая композиция, содержащая: а) заявленный вирион rAAV, как описано выше; и b) фармацевтически приемлемый носитель, разбавитель, эксципиент или буфер. В некоторых вариантах осуществления изобретения, фармацевтически приемлемый носитель, разбавитель, эксципиент или буфер является пригодным для использования у человека.
[00173] Такие эксципиенты, носители, разбавители и буферы включают любой фармацевтический агент, который может вводиться без неспецифичной токсичности. Фармацевтически приемлемые эксципиенты включают жидкости, такие как вода, солевой раствор, глицерин и этонол, но не ограничиваются ими. Фармацевтически приемлемые соли, включенные в настоящий документ, могут быть, например, солями минеральных кислот, такими как гидрохлориды, гидробромиды, фосфаты, сульфаты и т.п.; солями органических кислот, такими как ацетаты, пропионаты, малонаты, бензоаты и т.п. Кроме того, вспомогательные материалы, такие как смачивающие или эмульгирующие агенты, рН буферные вещества и т.п., могут присутствовать в таких наполнителях. Широкий спектр фармацевтически приемлемых эксципиентов известен из уровня техники и не требует детального обсуждения в настоящем документе. Фармацевтически приемлемые эксципиенты вполне достаточно описаны в различных публикациях, включая, например, A. Gennaro (2000) "Remington: The Science и Practice of Pharmacy," 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms и Drug Delivery Systems (1999) H.C. Ansel et al., eds., 7th ed., Lippincott, Williams, & Wilkins; и Handbook of Pharmaceutical Эксципиент S (2000) A.H. Kibbe et al., eds., 3rd ed. Amer. Pharmaceutical Assoc.
СПОСОБЫ ДОСТАВКИ ГЕННОГО ПРОДУКТА В РЕТИНАЛЬНУЮ КЛЕТКУ И СПОСОБЫ ЛЕЧЕНИЯ
[00174] В настоящем описании предложен способ доставки генного продукта в ретинальную клетку индивидуума, способ, включающий введение индивидууму заявленного вириона rAAV, как описано выше. Генный продукт может быть полипептидом или интерферирующей РНК (например, кшРНК, миРНК и т.п.), аптамером или сайт-специфичной эндонуклеазой, как описано выше. Доставка генного продукта в ретинальную клетку может предусматриваться для лечения заболевания сетчатки. Ретинальная клетка может быть фоторецептором, ганглиозной клеткой сетчатки, клеткой Мюллера, биполярной клеткой, амакринной клеткой, горизонтальной клеткой или клеткой пигментного эпителия сетчатки. В некоторых случаях ретинальная клетка является фоторецепторной клеткой, например, палочковидной или колбочковидной клеткой.
[00175] В настоящем описании предложен способ лечения заболевания сетчатки, способ, включающий введение индивидууму, нуждающемуся в этом, эффективного количества заявленного вириона rAAV, как описано выше. Заявленный вирион rAAV может вводиться внутриглазной инъекцией, интравитреальной инъекцией, или любым другим удобным способом или путем введения. Другие удобные способы и пути введения включают, например, внутривенный, внутриназальный и так далее.
[00176] "Терапевтически эффективное количество" попадает в относительно широкий диапазон, который может быть определен посредством экспериментирования и/или клинических испытаний. Например, для in vivo инъекций, то есть, инъекций непосредственно в глаз, терапевтически эффективная доза будет порядка от приблизительно 106 до приблизительно 1015 вирионов rAAV, например, от приблизительно 108 до 1012 вирионов rAAV. Для in vitro трансдукции, эффективное количество вирионов rAAV, которые будут доставлены в лотки, будет порядка от приблизительно 108 до приблизительно 1013 вирионов rAAV. Другие эффективные дозировки могут быть легко определены специалистом в данной области техники путем обычных испытаний, определяющих кривую зависимости "доза-эффект".
[00177] В некоторых вариантах осуществления изобретения более чем одно введение (например, два, три, четыре или более введений) может использоваться для достижения желаемого уровня экспрессии гена в течение различных интервалов, например, ежедневно, еженедельно, ежемесячно, ежегодно, и т.д.
[00178] Глазные заболевания, которые могут лечиться с помощью заявленного способа, включают острую макулярную нейроретинопатию; болезнь Бехсета; хориоидальную неоваскуляризацию; диабетический увеит; гистоплазмоз; дегенерацию желтого пятна, такую как острая дегенерация желтого пятна, неэксудативну возрастную макулярную дистрофию и эксудативну возрастную макулярную дистрофию; эдему, такую как макулярная эдема, кистозный макулярный отек и диабетический отек желтого пятна; многофокальный хориоидит; глазную травму, влияющую на заднее глазное место или местоположение; глазные опухоли; заболевания сетчатки, такие как окклюзия центральных вен сетчатки, диабетическая ретинопатия (включая пролиферативную диабетическую ретинопатию), пролиферативную витреоретинопатию (PVR), окклюзионное поражение артерий сетчатки, отслоение сетчатки, увеальную болезнь сетчатки; симпатическую офтальмию; синдром Фогта-Коянаги-Харада (VKH); увеальную диффузию; следующее глазное заболевание, вызванное лазерной терапией глаз или под влиянием лазерной терапии глаз; следующие глазные заболевания, вызванные фотодинамической терапией или под влиянием фотодинамической терапии; фото коагуляцию, радиационную ретинопатию; расстройства эпиретинальной мембраны; окклюзию ветки вены сетчатки; переднюю ишемическую оптическую нейропатию; неретинопатическую диабетическую дисфункцию сетчатки; ретиношизис, пигментный ретинит; глаукому; синдром Ушера, палочко-колбочковую дистрофию; болезнь Штаргардта (желтопятнистая абиотрофия сетчатки); унаследованную дегенерацию желтого пятна; хориоретинальную дегенерацию; амавроз Лебера; врожденную стационарную ночную слепоту; хороидеремию; синдром Барде-Бидля; макулярную телеангиэктазию; атрофию зрительного нерва Лебера; ретролентальную фиброплазияю и расстройства цветного зрения, включая ахроматопсию, протанопию, дейтеранопию и тританопию, но не ограничиваются перечисленными.
НУКЛЕИНОВЫЕ КИСЛОТЫ И КЛЕТКИ-ХОЗЯЕВА
[00179] В настоящем описании предложена выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность, которая кодирует заявленный вариантный капсидный белок аденоассоциированного вируса (AAV), как описано выше, где вариантный капсидный белок AAV содержит вставку из приблизительно 5 аминокислот до приблизительно 11 аминокислот в петле GH или петле IV по сравнению с соответствующим родительским капсидным белком AAV, и где вариантный капсидный белок, когда присутствует в вирионе AAV, обеспечивает повышенную инфекционность ретинальной клетки по сравнению с инфекционностью ретинальной клетки вирионом AAV, содержащим соответствующий родительский капсидный белок AAV. Заявленная выделенная нуклеиновая кислота может быть вектором AAV, например, рекомбинантным вектором AAV.
Инсерционные пептиды
[00180] Вариантный капсидный белок AAV, кодируемый заявленной нуклеиновой кислотой, имеет инсерционный пептид из приблизительно 5 аминокислот до приблизительно 11 аминокислот в длину, вставленный в петлю GH капсида AAV. Инсерционный пептид имеет длину 5 аминокислот, 6 аминокислот, 7 аминокислот, 8 аминокислот, 9 аминокислот, 10 аминокислот или 11 аминокислот.
[00181] Инсерционный пептид может содержать аминокислотную последовательность любой формулы, указанной ниже.
[00182] Например, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу I:
[00183] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00184] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu, Asn и Lys;
Х2 выбран из Gly, Glu, Ala и Asp;
Х3 выбран из Glu, Thr, Gly и Pro;
Х4 выбран из Thr, Ile, Gln и Lys;
Х5 выбран из Thr и Ala;
Х6 выбран из Arg, Asn и Thr;
Х7, если присутствует, выбран из Pro и Asn.
[00185] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIa:
[00186] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00187] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
каждый X1-Х4 является любой аминокислотой;
Х5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[00188] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IIb:
[00189] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00190] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, выбран из Leu и Asn;
Х2, если присутствует, выбран из Gly и Glu;
Х3 выбран из Glu и Thr;
Х4 выбран из Thr и Ile;
Х5 является Thr;
Х6 является Arg; и
Х7 является Pro.
[00191] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу III:
[00192] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00193] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является Lys;
Х2 выбран из Ala и Asp;
Х3 выбран из Gly и Pro;
Х4 выбран из Gln и Lys;
Х5 выбран из Thr и Ala;
Х6 выбран из Asn и Thr;
Х7, если присутствует, является Asn.
[00194] Как другой пример, инсерционный пептид может быть пептидом из 5 до 11 аминокислот в длину, где инсерционный пептид имеет Формулу IV:
[00195] Y1Y2X1X2X3X4X5X6X7Y3Y4
[00196] где:
каждый Y1-Y4, если присутствует, независимо выбран из Ala, Leu, Gly, Ser и Thr;
X1, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Leu, Asn, Arg, Ala, Ser и Lys;
Х2 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Gly, Glu, Ala, Val, Thr и Asp;
Х3 является заряженной аминокислотой или незаряженной аминокислотой; или выбран из Glu, Thr, Gly, Asp или Pro;
X4 выбран из Thr, Ile, Gly, Lys, Asp и Gln;
X5 является полярной аминокислотой, спиртом (аминокислота, имеющая свободные гидроксильные группы), или гидрофобной аминокислотой; или выбран из Thr, Ser, Val и Ala;
Х6 является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Arg, Val, Lys, Pro, Thr и Asn; и
Х7, если присутствует, является положительно заряженной аминокислотой или незаряженной аминокислотой; или выбран из Pro, Gly, Phe, Asn и Arg.
[00197] В качестве неограничивающих примеров, инсерционный пептид может содержать аминокислотную последовательность, выбранную из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60).
[00198] В некоторых случаях инсерционный пептид имеет от 1 до 4 спейсерных аминокислот (Y1-Y4) у аминоконца и/или у карбоксильного конца любой из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59), и STGKVPN (SEQ ID №60). Пригодные спейсерные аминокислоты включают лейцин, аланин, глицин и серии, но не ограничиваются ими.
[00199] Например, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: LALGETTRPA (SEQ ID №45); LANETITRPA (SEQ ID №46), LAKAGQANNA (SEQ ID №47), LAKDPKTTNA (SEQ ID №48), LAKDTDTTRA (SEQ ID №61), LARAGGSVGA (SEQ ID №62), LAAVDTTKFA (SEQ ID №63) и LASTGKVPNA (SEQ ID №64). Как другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: AALGETTRPA (SEQ ID №49); AANETITRPA (SEQ ID №50), AAKAGQANNA (SEQ ID №51) и AAKDPKTTNA (SEQ ID №52). Как еще другой пример, в некоторых случаях инсерционный пептид имеет одну из следующих аминокислотных последовательностей: GLGETTRPA (SEQ ID №53); GNETITRPA (SEQ ID №54), GKAGQANNA (SEQ ID №55) и GKDPKTTNA (SEQ ID №56). Как другой пример, в некоторых случаях инсерционный пептид содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60), фланкированную на С-конце с помощью АА и на N-конце с помощью А; или содержит одну из KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60) фланкированную на С-конце с помощью G и на N-конце с помощью А.
[00200] Заявленный рекомбинантный вектор AAV может использоваться для получения заявленного рекомбинантного вириона AAV, как описано выше. Таким образом, в настоящем описании предложен рекомбинантный вектор AAV, который, когда введен в пригодную клетку, может обеспечивать продуцирование заявленного рекомбинантного вириона AAV.
[00201] Данное изобретение дополнительно предусматривает клетки-хозяева, например, выделенные (генетически модифицированные) клетки-хозяева, содержащие заявленную нуклеиновую кислоту. Заявленная клетка-хозяин может быть выделенной клеткой, например, клеткой в in vitro культуре. Заявленная клетка-хозяин пригодна для продуцирования заявленного вириона rAAV, как описано ниже. Когда заявленная клетка-хозяин используется для продуцирования заявленного вириона rAAV, ее называют "пакующей клеткой". В некоторых вариантах осуществления изобретения, заявленная клетка-хозяин является стабильно генетически модифицированной заявленной нуклеиновой кислотой. В других вариантах осуществления изобретения, заявленная клетка-хозяин является временно генетически модифицированной заявленной нуклеиновой кислотой.
[00202] Заявленная нуклеиновая кислота является стабильно или временно введенной в клетку-хозяин с использованием отработанных технологий, включая электропорацию, кальций-фосфатную преципитацию, опосредованную липосомами трансфекцию и т.п., но не ограничивается указанными. Для стабильной трансфекции заявленная нуклеиновая кислота будет, как правило, дополнительно включать селектируемый маркер, например, любой из нескольких известных селектируемых маркеров, таких как резистентность к неомицину и т.п.
[00203] Заявленную клетку-хозяин получают путем введения заявленной нуклеиновой кислоты в любую из многочисленных клеток, например клеток млекопитающих, включая, например, мышиные клетки и клетки приматов (например, клетки человека). Пригодные клетки млекопитающих включают эмбриональные клетки и клеточные линии, где пригодные клеточные линии включают клетки 293, клетки COS, клетки HeLa, клетки Веро, 3Т3 мышиные фибробласты, фибробласты С3Н10Т1/2, клетки ЯКХ и т.п., но не ограничиваются указанными. Неограничивающие примеры пригодных клеток-хозяев включают, клетки HeLa (например, CCL-2 - номер Американская коллекция типовых культур (АТСС)), клетки ЯКХ (например, АТСС № CRL9618, CCL61, CRL9096), клетки 293 (например, АТСС № CRL-1573), клетки Веро, клетки NIH 3Т3 (например, АТСС № CRL-1658), клетки Huh-7, клетки BHK (например, АТСС № CCL10), клетки РС12 (АТСС № CRL1721), клетки COS, клетки COS-7 (ATCC № CRL1651), клетки RAT1, мышиные L клетки (АТСС № CCLI.3), человеческие эмбриональные клетки почек (HEK) (АТСС № CRL1573), клетки HLHepG2 и т.п. заявленная клетка-хозяин может также быть получена с использованием бакуловируса для инфицирования клеток насекомых, таких как клетки Sf9, которые продуцируют AAV (смотри, например, патент США №7271002; патентную публикацию США №12/297,958)
[00204] В некоторых вариантах осуществления изобретения, заявленная генетически-модифицированная клетка-хозяин включает кроме нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую вариантный капсидный белок AAV, как описано выше, нуклеиновую кислоту, которая содержит нуклеотидную последовательность, кодирующую один или более «рэп»-белков AAV. В других вариантах осуществления изобретения заявленная клетка-хозяин дополнительно содержит вектор rAAV. Вирион rAAV может быть получен с использованием заявленной клетки-хозяина. Способы получения вириона rAAV описаны, например, в патентной публикации США №2005/0053922 и патентной публикации США №2009/0202490.
Примеры
[00205] Следующие примеры использованы для того, чтобы обеспечить специалиста в данной области техники полным раскрытием и описанием того, как получить и использовать настоящее изобретение, и не предназначаются для ограничения объема того, что изобретатели расценивают как их изобретение, и при этом они не означают, что приведенные ниже эксперименты представляют собой все или единственные выполняемые эксперименты. Были приняты меры для того, чтобы сохранить точность относительно используемых чисел (например, количеств, температуры и т.д.), но некоторые экспериментальные ошибки и допущения должны быть учтены. Если не указано иное, то части являются частями по весу, молекулярный вес является средневесовым молекулярным весом, температура является градусами Цельсия, а давление является атмосферным или почти атмосферным. Могут использоваться стандартные аббревиатуры, например, п.о., пара оснований; т.п.н., тысяча пар оснований; пл, пиколитр(ы); с., секунда(ы); мин, минута(ы); ч., час(ы); ак, аминокислота(ы); нт, нуклеотид(ы); в/м, внутримышечно; в/б, внутрибрюшинно; п/к, подкожно и т.п.
Пример 1. Вариант AAV с повышенной трансдукцией ретинальных клеток
[00206] Используемый подход должен был создать библиотеку пептидного дисплея путем введения уникального сайта AvrII в геном AAV2 дикого типа между аминокислотой 587 и 588 с помощью мутагенеза полимеразной цепной реакции (ПЦР). Случайную нуклеотидную вставку 21, 7mer For, использовали для синтеза вставок дцДНК вместе с антисмысловым праймером 7mer Rev. Полученные вставки дцДНК клонировали в сайт AvrII генома после расщепления с NheI, продуцируя многообразную 7mer библиотеку, которую затем упаковали (Perabo et al., 2003; Muller et al., 2003). Вирус получали таким образом, что каждый вирусный геном упаковывался или инкапсулировался в тот вариант капсидного белка, который закодирован геномом. В связи с этим функциональные усовершенствования, идентифицированные посредством селекции, могут быть связаны с последовательностью генома, кодирующего эту усовершенствованную функцию, содержащуюся в вирусном капсиде
[00207] Эту библиотеку подвергли положительному отбору на мышах rho-GFP (Wensel et al. (2005) Vision Res. 45:3445). Кратко, в одном этапе отбора взрослых мышей rho-GFP интравитреально инъецировали 2 мкл диализированного забуференного фосфатом физиологического раствора, очищенной йодиксанолом библиотекой с геномным титром приблизительно 1×1012 вирусных геномов (вг)/мл. Сверхтонкую 30 1/2-калиберную одноразовую иглу вводили через склеру глаза животного возле экватора рядом с роговицей в стекловидную полость. Инъекцию 2 мкл вируса проводили с непосредственным наблюдением иглы в центре стекловидной полости. Спустя неделю после инъекции глаза энуклеировали, а сетчатку разделяли с использованием света, обработкой папаинпротеазой, после чего выделяли фоторецепторные популяции клеточным сортером с активацией (FACS). Эффективные вирионы затем амплифицировали с помощью ПЦР из последующих геномных экстракций и дополнительно клонировали и перепаковывали для инъекции.
[00208] Дальнейшие повторы этого отбора выполнялись, сужая пул вариантов до субпопуляции с более пермиссивными мутациями. После трех повторов, проводили этап ПЦР с внесением ошибок для создания дополнительного поколения вариантов для отбора. В целом, этот процесс повторяли для двух поколений. В результате этот процесс направленного развития создал фоторецептор-пермиссивные варианты AAV при применении положительного отбора и вызванного мутагенеза, подобно процессу природного развития.
[00209] Затем кэп-гены пятидесяти вариантов секвенировали для определения самых значительных и успешных вариантов для обладания премассивными мутациями для интравитреальной трансдукции фоторецепторов. Из 50 клонов 46 дали удобочитаемые последовательности вставки 7mer. Существенно, почти две трети клонов содержали тот же отличительный мотив 7mer (~588LGETTRP~; SEQ ID №13). Что интересно, следующий самый значительный вариант (~588NETITRP~; SEQ ID №14) также содержал похожий фланкирующий мотив, состоящий из положительно заряженного остатка аргинина между остатками полярного треонина и неполярного пролина (TRP).
[00210] Таблица 1. Секвенирование выделенных вариантов из направленного развития показывает высокую степень сходимости в вирусных библиотеках. Все варианты получены из 7mer библиотеки AAV2 с приблизительно 64% вариантов, содержащих тот же мотив 7mer (~588LGETTRP- (SEQ ID №13)).
[00211] Среди 7mer-вставок последовательностей были умеренные предпочтения в определенных положениях, например, положительно заряженная аминокислота в положении 1; отрицательно заряженная аминокислота в положении 2; спирт (например, аминокислота, имеющая спиртовую группу (свободную гидроксильную группу), такую как Thr или Ser) в положении 5.
[00212] 7mer-вставки были фланкированы спейсерами, как показано в таблице 2:
[00213] Фигура 1. Представлена трехмерная модель капсида вируса AAV2, содержащего случайный гептамер (показанный оранжевым) после аминокислоты 587. Эта область капсида вируса AAV2, вероятно, участвует в связывании рецептора клеточной поверхности.
[00214] В свете высокой степени сходимости библиотеки из вышеописанного отбора, рекомбинантную форму AAV2 ~588LGETTRP~ (SEQ ID №13; названную 7М8) клонировали и упаковывали вектор с трансгеном scCAG-GFP для визуализации его профиля трансдукции. Спустя три недели после интравитреальной инъекции у взрослых мышей наблюдалась сильная экспрессия многочисленных клеточных типов, включая ганглиозные клетки сетчатки (RGC) и клетки Мюллера. Важно, наблюдалась трансдукция фоторецепторов в сетчатках, инъецированных 7М8, после проверки экспрессии GFP в ядрах внешнего ядерного слоя (ONL) (красные стрелки) и во внешних сегментах (фигура 2, голубая стрелка), тогда как AAV2 не показал видимой экспрессии фоторецепторов.
[00215] Фигура 2 7М8-вариант AAV2 (справа) демонстрирует большие уровни интравитреальной трансдукции фоторецептора относительно AAV2 (слева). Конфокальная микроскопия поперечных срезов сетчатки спустя три недели после интравитреальной инъекции 2 мкл 1×1012 вг/мл AAV2 7М8 и AAV2 scCAG GFP у взрослых мышей. Красные стрелки (верх) указывают на ядра фоторецепторов, а голубая стрелка (верх) указывает на внешние сегменты фоторецептора.
[00216] Учитывая усиление трансдукции клеток сетчатки, была предпринята попытка для повышения специфичности экспрессии с помощью трансгена ssRho-eGFP, содержащего фоторецептор-специфичный родопсиновый промотор для повышения разрешения эффективности трансдукции конкретно в фоторецепторах (фигура 3). Действительно, использование фоторецептор-специфичного промотора Rho ограничило экспрессию фоторецепторами GFP. Была предпринята попытка для улучшения эффективности трансдукции 7М8 путем комбинирования рационального конструктивного подхода с предыдущим подходом направленного развития. Для этого четыре поверхностно экспонированные остатки тирозина были мутагенизированы до фенилаланинов на капсиде 7М8 (Y273F, Y444F, Y500F и Y730F), который прежде был показан для повышения фоторецепторной инфекционности фоторецепторов (Petrs-Silva et al., 2009). Интересно, добавление мутаций сократило количество трансдуцированных фоторецепторов по сравнению с оригинальным вирусом, как показано FAC-сортингом фоторецепторов GFP(+) из инфицированных 7m8 или 7m8-4YF сетчаток (фигура 4).
[00217] Фигура 3. Представлены флуоресцентные изображения криосрезов сетчатки, показывающие экспрессию GFP, обусловленную 7m8, несущим ген GFP под контролем универсального промотора CAG (слева) или фоторецептор-специфичного промотора Rho (справа).
[00218] Фигура 4. Фоторецепторные клетки GFP(+) на миллион клеток сетчатки, как посчитано с помощью проточной цитометрии. 7m8 преобразовывает больше чем 2х количество фоторецепторов по сравнению с 7m8, несущим 4 тирозиновые мутации (верх).
Пример 2 Лечение ретиношизиса
[00219] Используя экспрессирующий конструкт 7m8-rho-RS1, функциональный белок ретиношизина (RS1) был доставлен ретиношизин-дефицитным мышам (Rs1h-дефицитные мыши; Rs1h является мышиным гомологом человеческого RS1). Вектор содержит нуклеотидную последовательность, кодирующую функциональный белок ретиношизина под транскрипционным контролем родопсинового промотора. Смотри фигуры 13А-С, где выделенная жирным шрифтом и подчеркиванием нуклеотидная последовательность (нуклеотиды 4013-4851) является родопсиновым промотором; а нуклеотиды 4866-5540 (со стартовой atg и стоп tga последовательностями, показано жирным шрифтом) кодируют протеин RS1 человека.
[00220] Конструкт 7m8-rho-RS1 вводили интравитреально мышам Rs1h-/- при Р15. Мыши Rs1h-/- были получены направленным разрушением экзона 3 гена Rs1h, как описано (Weber et al. (2002) Proc. Natl. Acad. Sci. USA 99:6222). Мыши Rs1h-/- являются дефицитными по белковому продукту Rs1h, имеют электроотрицательный ERG (например, сниженная b-волна с относительным сохранением a-волны) и расслоение слоев сетчатки, подобно тому, что наблюдается у пациентов-людей с ретиношизисом. Инъекция вектора 7m8-rho-RS1 в Rs1h-/- ведет к высоким уровням экспрессии панретинального RS1 из фоторецепторов в сетчатке. Экспрессия RS1 ведет к усовершенствованной морфологии сетчатки с уменьшением в количестве и размере полостей в сетчатке, как показано на изображении, созданном оптической когерентной томографией в спектральной области (SD-OCT) (фигуры 7A-I), спасению b-волны ERG (фигуры 8A-D) и длительному структурному сохранению сетчатки (фигуры 9А-Е).
[00221] Фигуры 7A-I. Представляют SD-OCT-изображения сетчаток с высокой разрешающей способностью, инъецированных 7m8-rho-GFP (левая колонка), 7m8-rho-RS1 (средняя колонка или) или неинъецированных животных WT (правая колонка). Изображения дна были взяты через внутренний ядерный слой верхней сетчатки и исключают другие слои (а-с). Поперечные изображения верхней (d-f) и нижней (g-i) сетчатки были взяты с использованием соска зрительного нерва в качестве ориентира.
[00222] Необработанная сетчатка RS1 увеличивается по всей толщине, если мерить от внутренней пограничной мембраны (ILM) до фоторецепторов, в силу того, что патология прогрессирует из-за шизисного расслаивания внутренней сетчатки. Этот процесс отличается от наблюдаемого при большинстве ретинальных дегенеративных заболеваний (RDD), которые не образуют шизис, но демонстрируют прогрессирующую гибель фоторецепторных клеток в INL и сопутствующее истончение сетчатки и потерю амплитуды ERG. В RS1 утончаются ONL, поскольку из-за болезни гибнут рецепторы, но это отличается от полного изменения толщины сетчатки. Обычно считается, что успешная терапия для RS1 возвратила бы полную толщину сетчатки к дикому типу и снизила интенсивность потери фоторецепторов в ONL. В большинстве RDD, отличных от Rs1, потеря фоторецепторов, отмеченных утончением ONL, равняется снижению физиологической мощности сетчатки, как измерено с помощью амплитуды ERG. RS1 является одним из очень немногих примеров заболеваний сетчатки, при котором патология увеличивает толщину сетчатки с сопутствующей потерей амплитуды электроретинографии. Таким образом, восстановление генного продукта RS1, внеклеточного ретинального клея, утончает сетчатку назад к толщине дикого типа и возвращает амплитуду электроретинографии к почти нормальным уровням, поскольку рассасывается шизис.
[00223] Фигура 8а демонстрирует сравнение функционального восстановления необработанных Rs1-/- глаз с глазами, инъецированными AAV2-rho-RS1, 7m8-rho-GFP и 7m8-rho-RS1, спустя один месяц (слева) и 4 месяца (справа) после инъекции. Спустя один месяц после инъекции 7m8-rho-RS1 приводил к значительному спасению амплитуды b-волны ERG, тогда как AAV2-rho.RS1 был статистически неотличим от необработанных глаз.
[00224] Спустя 4 месяца, 7m8-rho-RS1 амплитуда далее увеличивалась к амплитуде дикого типа (справа). Фигура 8b показывает репрезентативные следы ERG от 7m8-rho-RS1-инъецированных глаз, демонстрирующие улучшенную амплитуду a-волны и b-волны и форму волны, близкую к глазам дикого типа, по сравнению с 7m8-rho-GFP-инъецированными глазами. Фигура 8с показывает амплитуду полной области скотопической b-волны, возникающей вследствие высокой интенсивности (1 log cd × с/м2), стимул регистрировали ежемесячно, начиная с одного месяца после инъекции в Р15 для каждого состояния. Были зарегистрированы три ответа и усреднены для каждого глаза в каждый момент времени.
[00225] Средние амплитуды b-волны ERG были нанесены на график как функция постинъеционного времени. n=7 использовали для обоих условиях. Фигура 8d показывает анализ ответов ERG, скотопические (верхние следы, диапазон от -3 до 1 log cd × с/м2) и фотопические (нижние следы, диапазон от -0,9 до 1,4 log cd × с/м2) условия указывают улучшенную функцию палочек и колбочек в диапазоне интенсивности стимулов.
[00226] Фигуры 9А-Е. Длительные улучшения толщины сетчатки, измеренные спустя 10 месяцев после лечения 7m8-rho-RS1. Репрезентативные поперечные изображения SD-OCT обработанных а) 7m8-rho-RS1 или b) 7m8-rho-GFP сетчаток спустя 10 месяцев после инъекций сосредоточены на соске зрительного нерва. Измерения с) толщины сетчатки, d) толщины ONL и е) и толщины внутреннего и внешнего сегментов показаны на графике как функция расстояния от соска зрительного нерва.
Пример 3. Вариант AAV, использованный для доставки белка в клетки сетчатки макаки
[0001] Был получен вирион рекомбинантного AAV2 (7m8, несущий GFP под управлением промотора коннексина36). Вирион рекомбинантного AAV2 включал капсидный вариант AAV2 с вставкой пептида LALGETTRPA между аминокислотами 587 и 588 капсида AAV2 и GFP под транскрипционным контролем промотора коннексина36, который экспрессируется в промежуточных нейронах. Вирион rAAV2 инъецировали интравитреально в глаз макаки. Данные показаны на фигуре 18.
[0002] Фигура 18 обеспечивает флуоресцентное изображение дна, демонстрирующее экспрессию GFP позади сетчатки спустя 9 недель после введения 7m8, несущего GFP под управлением промотора коннексина36. По сравнению с родительским серотипом AAV2 (Yin et al, IOVS 52(5); 2775), повышенный уровень экспрессии был замечен в фовеальном кольце, а видимая флуоресценция была замечена в центральной сетчатке вне фовеа.
REFERENCES
[0003] Daiger SP, Bowne SJ, Sullivan LS (2007) Perspective on genes и mutations causing retinitis pigmentosa. Arch Ophthalmol 125:151-158.
[0004] Dalkara D, Kolstad KD, Caporale N, Visel M, Klimczak RR, et al. (2009) Inner Limiting Membrane Barriers to AAV Mediated Retinal Transduction from the Vitreous. Mol Ther.
[0005] den Hollander Al, Roepman R, Koenekoop RK, Cremers FP (2008) Leber congenital amaurosis: genes, proteins и disease mechanisms. Prog Retin Eye Res 27:391-419.
[0006] Gruter O, Kostic С, Crippa SV, Perez MT, Zografos L, et al. (2005) Lentiviral vector-mediated gene transfer in adult mouse photoreceptors is impaired by the presence of a physical barrier. Gene Ther 12:942-947.
[0007] Maguire AM, Simonelli F, Pierce EA, Pugh EN, Jr., Mingozzi F, et al. (2008) Safety и efficacy of gene transfer for Leber's congenital amaurosis. N Engl J Med 358:2240-2248.
[0008] Mancuso K, Hauswirth WW, Li Q, Connor ТВ, Kuchenbecker JA, et al. (2009) Gene therapy for red-green colour blindness in adult primates. Nature 461:784-787.
[0009] McGee Sanftner LH, Abel H, Hauswirth WW, Flannery JG (2001) Glial cell line derived neurotrophic factor delays photoreceptor degeneration in a transgenic rat model of retinitis pigmentosa. Mol Ther 4:622-629.
[0010] Muller OJ, Kaul F, Weitzman MD, Pasqualini R, Arap W, et al. (2003) Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors. Nat Biotechnol 21:1040-1046.
[0011] Nakazawa Т. et al. (2007) Attenuated glial reactions и photoreceptor degeneration after retinal detachment in mice deficient in glial fibrillary acidic protein и vimentin. Invest Ophthamol Vis Sci 48:2760-8.
[0012] Nakazawa Т. et al. (2006) Characterization of cytokine responses to retinal detachment in rats. Mol Vis 12:867-78.
[0013] Perabo L, Buning H, Kofler DM, Ried MU, Girod A, et al. (2003) In vitro selection of viral vectors with modified tropism: the adeno-associated virus display. Mol Ther 8:151-157.
[0014] Petrs-Silva H, Dinculescu A, Li Q, Min SH, Chiodo V, et al. (2009) High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors. Mol Ther 17:463-471.
[0015] Reme СЕ, Grimm С, Hafezi F, Wenzel A, Williams TP (2000) Apoptosis in the Retina: The Silent Death of Vision. News Physiol Sci 15:120-124.
[0016] Rolling F (2004) Recombinant AAV-mediated gene transfer to the retina: gene therapy perspectives. Gene Ther 11 Suppl 1:S26-32.
[0017] Wensel TG, Gross AK, Chan F, Sykoudis K, Wilson JH (2005) Rhodopsin-EGFP knock-ins for imaging quantal gene alterations. Vision Res 45:3445-3453.
[0018] Zhong L, Li B, Mah CS, Govindasamy L, Agbandje-McKenna M, et al. (2008) Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci USA 105:7827-7832.
[0019] Несмотря на то, что настоящее изобретение описано со ссылкой на конкретные варианты его осуществления, специалисту в данной области техники должно быть понятно, что могут осуществляться разные изменения и эквивалентные замещения без отклонения от истинной сущности и объема изобретения. Кроме того, могут быть осуществлены многие модификации для того, чтобы приспособить конкретную ситуацию, материал, композицию вещества, процесса, технологической операции или операций к цели, сущности и объему настоящего изобретения. Все такие модификации предназначены быть охваченными объемом прилагаемой формулы изобретения.
Claims (28)
1. Вирион рекомбинантного аденоассоциированного вируса rAAV для доставки генного продукта в ретинальную клетку, содержащий:
a) вариантный капсидный белок аденоассоциированного вируса AAV, который содержит вставку пептида в петле GH капсидного белка по сравнению с соответствующим родительским капсидным белком аденоассоциированного вируса AAV, где пептид включает аминокислотную последовательность, выбранную из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60), где участок вставки находится в пределах аминокислот 570-611 капсидного белка AAV2, изложенного в SEQ ID №1, или соответствующем положении в капсидном белке другого серотипа AAV, и где вариантный капсидный белок обеспечивает повышенную инфекционность вириона rAAV в ретинальной клетке по сравнению с инфекционностью вириона AAV, содержащего соответствующий родительский капсидный белок AAV; и
b) гетерологичную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую генный продукт.
2. Вирион rAAV по п. 1, отличающийся тем, что вставка включает аминокислотную последовательность LGETTRP (SEQ ID №13).
3. Вирион rAAV по п. 1, отличающийся тем, что ретинальная клетка является фоторецептором, ганглиозной клеткой сетчатки, клеткой Мюллера, биполярной клеткой, амакринной клеткой, горизонтальной клеткой или клеткой пигментного эпителия сетчатки.
4. Вирион rAAV по п. 1, отличающийся тем, что сайт встраивания находится между аминокислотами 587 и 588 из AAV2, между аминокислотами 590 и 591 из AAV1, между аминокислотами 575 и 576 из AAV5, между аминокислотами 590 и 591 из AAV6, между аминокислотами 589 и 590 из AAV7, между аминокислотами 590 и 591 из AAV8, между аминокислотами 588 и 589 из AAV9 или между аминокислотами 588 и 589 из AAV10.
5. Вирион rAAV по п. 1, отличающийся тем, что он демонстрирует, по меньшей мере, 10-кратное повышение инфекционности в ретинальной клетке по сравнению с инфекционностью вириона AAV, содержащего соответствующий родительский капсидный белок AAV.
6. Вирион rAAV по п. 1, отличающийся тем, что он демонстрирует, по меньшей мере, 50-кратное повышение инфекционности в ретинальной клетке по сравнению с инфекционностью вириона AAV, содержащего соответствующий родительский капсидный белок AAV.
7. Вирион rAAV по п. 1, отличающийся тем, что генный продукт является интерферирующей РНК или аптамером.
8. Вирион rAAV по п. 1, отличающийся тем, что генный продукт является полипептидом.
9. Вирион rAAV по п. 8, отличающийся тем, что полипептид является нейропротекторным полипептидом, анти-ангиогенным полипептидом или полипептидом, который повышает функцию ретинальной клетки.
10. Вирион rAAV по п. 8, отличающийся тем, что полипептид выбирают из группы, состоящей из глиального нейротрофического фактора, фактора роста фибробластов 2, нейротурина, цилиарного нейротрофического фактора, фактора роста нервов, нейротрофического фактора из тканей мозга, эпидермального фактора роста, родопсина, Х-сцепленного ингибитора апоптоза, ретиношизина, RPE65, взаимодействующего белка-1 регулятора ГТФазы пигментной дистрофии сетчатки, периферина, периферина-2, родопсина или хеджехог-белка.
11. Фармацевтическая композиция для доставки генного продукта в ретинальную клетку, содержащая:
a) вирион рекомбинантного аденоассоциированного вируса rAAV по п. 1; и
b) фармацевтически приемлемый эксципиент.
12. Способ доставки генного продукта в ретинальную клетку индивидуума, который включает введение индивидууму вириона рекомбинантного аденоассоциированного вируса rAAV по п. 1.
13. Способ по п. 12, отличающийся тем, что генный продукт является короткой интерферирующей РНК или аптамером.
14. Способ по п. 12, отличающийся тем, что генный продукт является полипептидом.
15. Способ по п. 14, отличающийся тем, что полипептид является нейропротекторным полипептидом, анти-ангиогенным полипептидом, анти-апоптическим фактором или полипептидом, который повышает функцию ретинальной клетки.
16. Способ по п. 14, отличающийся тем, что полипептид является глиальным нейротрофическим фактором, фактором роста фибробластов 2, нейротурином, цилиарным нейротрофическим фактором, фактор роста нервов, нейротрофическим фактором из тканей мозга, эпидермальным фактором роста, родопсином, Х-сцепленным ингибитором апоптоза, ретиношизином, RPE65, взаимодействующим белком-1 регулятора ГТФазы пигментной дистрофии сетчатки, периферином, периферином-2, родопсином или хеджехог-белком.
17. Способ лечения заболевания сетчатки, который включает введение индивидууму, нуждающемуся в этом, эффективного количества вириона рекомбинантного аденоассоциированного вируса rAAV по п. 1.
18. Способ по п. 17, отличающийся тем, что указанное введение является внутриглазной инъекцией.
19. Способ по п. 17, отличающийся тем, что указанное введение является интравитреальной инъекцией.
20. Способ по п. 17, отличающийся тем, что глазная болезнь является глаукомой, пигментной дистрофией сетчатки, макулярной дегенерацией, ретиношизисом, врожденным амаврозом Лебера, диабетической ретинопатией, ахроматопсией или дальтонизмом.
21. Вариантный капсидный белок аденоассоциированного вируса AAV для доставки генного продукта в ретинальную клетку, который содержит вставку пептида в петле GH капсидного белка по сравнению с соответствующим родительским капсидным белком AAV, где пептид включает аминокислотную последовательность, выбранную из числа LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60), где участок вставки находится в пределах аминокислот 570-611 капсидного белка AAV2 изложенного в SEQ ID №1, или соответствующем положении в капсидном белке другого серотипа AAV, и где вариантный капсидный белок, когда присутствует в вирионе AAV, обеспечивает повышенную инфекционность вириона AAV в ретинальной клетке.
22. Вариантный капсидный белок AAV по п. 21, отличающийся тем, что вставка содержит аминокислотную последовательность, выбранную из LGETTRP (SEQ ID №13), NETITRP (SEQ ID №14), KAGQANN (SEQ ID №15), KDPKTTN (SEQ ID №16), KDTDTTR (SEQ ID №57), RAGGSVG (SEQ ID №58), AVDTTKF (SEQ ID №59) и STGKVPN (SEQ ID №60).
23. Выделенная нуклеиновая кислота, содержащая нуклеотидную последовательность, которая кодирует вариантный капсидный белок аденоассоциированного вируса AAV по п. 21 или 22.
24. Выделенная генетически модифицированная клетка-хозяин, экспрессирующая капсидный белок аденоассоциированного вируса AAV по п. 21 или 22, содержащая нуклеиновую кислоту по п. 23.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161478355P | 2011-04-22 | 2011-04-22 | |
| US61/478,355 | 2011-04-22 | ||
| PCT/US2012/034413 WO2012145601A2 (en) | 2011-04-22 | 2012-04-20 | Adeno-associated virus virions with variant capsid and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017104094A Division RU2742724C9 (ru) | 2011-04-22 | 2017-02-08 | Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2013151885A RU2013151885A (ru) | 2015-05-27 |
| RU2611202C2 true RU2611202C2 (ru) | 2017-02-21 |
Family
ID=47042176
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2013151885A RU2611202C2 (ru) | 2011-04-22 | 2012-04-20 | Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования |
| RU2017104094A RU2742724C9 (ru) | 2011-04-22 | 2017-02-08 | Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017104094A RU2742724C9 (ru) | 2011-04-22 | 2017-02-08 | Вирионы аденоассоциированного вируса с вариантным капсидом и способы их использования |
Country Status (25)
| Country | Link |
|---|---|
| US (9) | US9193956B2 (ru) |
| EP (4) | EP2699270B1 (ru) |
| JP (5) | JP6072772B2 (ru) |
| KR (4) | KR102202908B1 (ru) |
| CN (3) | CN103561774B (ru) |
| AU (4) | AU2012245328B2 (ru) |
| BR (1) | BR112013027120B1 (ru) |
| CA (2) | CA3069946C (ru) |
| CY (3) | CY1119765T1 (ru) |
| DK (3) | DK2699270T3 (ru) |
| ES (3) | ES2791499T3 (ru) |
| HK (1) | HK1247855A1 (ru) |
| HR (3) | HRP20220036T1 (ru) |
| HU (3) | HUE049629T2 (ru) |
| IL (2) | IL280819B1 (ru) |
| LT (3) | LT2699270T (ru) |
| MX (1) | MX349138B (ru) |
| PL (3) | PL3693025T3 (ru) |
| PT (3) | PT3693025T (ru) |
| RS (3) | RS62795B1 (ru) |
| RU (2) | RU2611202C2 (ru) |
| SG (3) | SG194583A1 (ru) |
| SI (3) | SI3693025T1 (ru) |
| WO (1) | WO2012145601A2 (ru) |
| ZA (2) | ZA201307968B (ru) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2020123868A1 (en) * | 2018-12-12 | 2020-06-18 | Tesseract Health, Inc. | Biometric identification and health status determination |
| RU2770922C2 (ru) * | 2017-09-20 | 2022-04-25 | 4Д Молекьюлар Терапьютикс Инк. | Капсиды вариантов аденоассоциированных вирусов и методы их применения |
| US11737665B2 (en) | 2019-06-21 | 2023-08-29 | Tesseract Health, Inc. | Multi-modal eye imaging with shared optical path |
| RU2809389C2 (ru) * | 2019-04-24 | 2023-12-11 | Такара Байо Инк. | Мутант aav, обладающий способностью нацеливаться на головной мозг |
Families Citing this family (226)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9233131B2 (en) | 2003-06-30 | 2016-01-12 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| US9441244B2 (en) | 2003-06-30 | 2016-09-13 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| US8663624B2 (en) | 2010-10-06 | 2014-03-04 | The Regents Of The University Of California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| SG194583A1 (en) * | 2011-04-22 | 2013-12-30 | Univ California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| TWI702955B (zh) | 2012-05-15 | 2020-09-01 | 澳大利亞商艾佛蘭屈澳洲私營有限公司 | 使用腺相關病毒(aav)sflt-1治療老年性黃斑部退化(amd) |
| WO2014093709A1 (en) | 2012-12-12 | 2014-06-19 | The Broad Institute, Inc. | Methods, models, systems, and apparatus for identifying target sequences for cas enzymes or crispr-cas systems for target sequences and conveying results thereof |
| IL239317B (en) | 2012-12-12 | 2022-07-01 | Broad Inst Inc | Providing, engineering and optimizing systems, methods and compositions for sequence manipulation and therapeutic applications |
| ES2741502T3 (es) | 2013-02-08 | 2020-02-11 | Univ Pennsylvania | Cápside de AAV8 modificada para la transferencia génica para terapias de retina |
| US10266845B2 (en) | 2013-02-08 | 2019-04-23 | The Trustees Of The University Of Pennsylvania | Enhanced AAV-mediated gene transfer for retinal therapies |
| ES2805355T3 (es) | 2013-03-15 | 2021-02-11 | Univ Pennsylvania | Composiciones para tratar MPSI |
| EP3517135A1 (en) * | 2013-05-16 | 2019-07-31 | Applied Genetic Technologies Corporation | Promoters, expression cassettes, vectors, kits, and methods for the treatment of achromatopsia and other diseases |
| JP6600624B2 (ja) | 2013-05-31 | 2019-10-30 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | アデノ随伴ウイルス変異体及びその使用方法 |
| KR20160044457A (ko) | 2013-06-17 | 2016-04-25 | 더 브로드 인스티튜트, 인코퍼레이티드 | 서열 조작을 위한 탠덤 안내 시스템, 방법 및 조성물의 전달, 조작 및 최적화 |
| CN105492611A (zh) | 2013-06-17 | 2016-04-13 | 布罗德研究所有限公司 | 用于序列操纵的优化的crispr-cas双切口酶系统、方法以及组合物 |
| EP3597755A1 (en) | 2013-06-17 | 2020-01-22 | The Broad Institute, Inc. | Delivery, use and therapeutic applications of the crispr-cas systems and compositions for targeting disorders and diseases using viral components |
| WO2014204727A1 (en) | 2013-06-17 | 2014-12-24 | The Broad Institute Inc. | Functional genomics using crispr-cas systems, compositions methods, screens and applications thereof |
| CN113425857A (zh) | 2013-06-17 | 2021-09-24 | 布罗德研究所有限公司 | 用于肝靶向和治疗的crispr-cas系统、载体和组合物的递送与用途 |
| ES2716615T3 (es) * | 2013-06-28 | 2019-06-13 | Inst Nat Sante Rech Med | Métodos para expresar un polinucleótido de interés en la retina de un sujeto |
| ES2794499T3 (es) | 2013-07-08 | 2020-11-18 | Inst Nat Sante Rech Med | Procedimientos de realización de la omisión de exón mediada por oligonucleótidos antisentido en la retina de un sujeto que lo necesita |
| EP3564379A1 (en) | 2013-09-13 | 2019-11-06 | California Institute of Technology | Selective recovery |
| WO2015089486A2 (en) | 2013-12-12 | 2015-06-18 | The Broad Institute Inc. | Systems, methods and compositions for sequence manipulation with optimized functional crispr-cas systems |
| CA2932478A1 (en) * | 2013-12-12 | 2015-06-18 | Massachusetts Institute Of Technology | Delivery, use and therapeutic applications of the crispr-cas systems and compositions for genome editing |
| BR112016013547A2 (pt) | 2013-12-12 | 2017-10-03 | Broad Inst Inc | Composições e métodos de uso de sistemas crispr-cas em distúrbios de repetições de nucleotídeos |
| WO2015089364A1 (en) | 2013-12-12 | 2015-06-18 | The Broad Institute Inc. | Crystal structure of a crispr-cas system, and uses thereof |
| GB201403684D0 (en) | 2014-03-03 | 2014-04-16 | King S College London | Vector |
| WO2015126972A1 (en) * | 2014-02-21 | 2015-08-27 | University Of Florida Research Foundation, Inc. | Methods and compositions for gene delivery to on bipolar cells |
| CA2941640A1 (en) * | 2014-03-04 | 2015-09-11 | University Of Florida Research Foundation, Inc. | Improved raav vectors and methods for transduction of photoreceptors and rpe cells |
| EP3114227B1 (en) | 2014-03-05 | 2021-07-21 | Editas Medicine, Inc. | Crispr/cas-related methods and compositions for treating usher syndrome and retinitis pigmentosa |
| DK3116997T3 (da) | 2014-03-10 | 2019-08-19 | Editas Medicine Inc | Crispr/cas-relaterede fremgangsmåder og sammensætninger til behandling af lebers kongenitale amaurose 10 (lca10) |
| US11339437B2 (en) | 2014-03-10 | 2022-05-24 | Editas Medicine, Inc. | Compositions and methods for treating CEP290-associated disease |
| US11141493B2 (en) | 2014-03-10 | 2021-10-12 | Editas Medicine, Inc. | Compositions and methods for treating CEP290-associated disease |
| CN106414474B (zh) | 2014-03-17 | 2021-01-15 | 阿德夫拉姆生物技术股份有限公司 | 用于视锥细胞中增强的基因表达的组合物和方法 |
| WO2015148863A2 (en) | 2014-03-26 | 2015-10-01 | Editas Medicine, Inc. | Crispr/cas-related methods and compositions for treating sickle cell disease |
| WO2015168666A2 (en) * | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
| US10577627B2 (en) | 2014-06-09 | 2020-03-03 | Voyager Therapeutics, Inc. | Chimeric capsids |
| WO2016018816A1 (en) * | 2014-07-31 | 2016-02-04 | The Board Of Regents Of The University Of Oklahoma | High isomerohydrolase activity mutants of mammalian rpe65 |
| US10821193B2 (en) * | 2014-09-16 | 2020-11-03 | Genzyme Corporation | Adeno-associated viral vectors for treating myocilin (MYOC) glaucoma |
| CN112553229A (zh) | 2014-11-05 | 2021-03-26 | 沃雅戈治疗公司 | 用于治疗帕金森病的aadc多核苷酸 |
| DK3218386T3 (da) | 2014-11-14 | 2021-06-07 | Voyager Therapeutics Inc | Modulatorisk polynukleotid |
| KR102599909B1 (ko) | 2014-11-14 | 2023-11-09 | 보이저 테라퓨틱스, 인크. | 근위축성 측삭 경화증(als)을 치료하는 조성물 및 방법 |
| US11697825B2 (en) | 2014-12-12 | 2023-07-11 | Voyager Therapeutics, Inc. | Compositions and methods for the production of scAAV |
| EP3230451B1 (en) | 2014-12-12 | 2021-04-07 | The Broad Institute, Inc. | Protected guide rnas (pgrnas) |
| US10584321B2 (en) * | 2015-02-13 | 2020-03-10 | University Of Massachusetts | Compositions and methods for transient delivery of nucleases |
| US10648000B2 (en) | 2015-02-16 | 2020-05-12 | University Of Florida Research Foundation, Incorporated | rAAV vector compositions, methods for targeting vascular endothelial cells and use in treatment of type I diabetes |
| US10472650B2 (en) * | 2015-02-20 | 2019-11-12 | University Of Iowa Research Foundation | Methods and compositions for treating genetic eye diseases |
| WO2016141078A1 (en) | 2015-03-02 | 2016-09-09 | Avalanche Biotechnologies, Inc. | Compositions and methods for intravitreal delivery of polynucleotides to retinal cones |
| JP6836999B2 (ja) * | 2015-03-24 | 2021-03-03 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニアThe Regents Of The University Of California | アデノ随伴ウイルス変異体及びその使用方法 |
| US10081659B2 (en) | 2015-04-06 | 2018-09-25 | The United States Of America, As Represented By The Secretary, Dept. Of Health And Human Services | Adeno-associated vectors for enhanced transduction and reduced immunogenicity |
| US11180793B2 (en) | 2015-04-24 | 2021-11-23 | Editas Medicine, Inc. | Evaluation of Cas9 molecule/guide RNA molecule complexes |
| EP3294332A4 (en) * | 2015-05-14 | 2018-12-26 | Joslin Diabetes Center, Inc. | Retinol-binding protein 3 (rbp3) as a protective factor in non-diabetic retinal degeneration |
| EP3929287A3 (en) | 2015-06-18 | 2022-04-13 | The Broad Institute, Inc. | Crispr enzyme mutations reducing off-target effects |
| WO2016205759A1 (en) | 2015-06-18 | 2016-12-22 | The Broad Institute Inc. | Engineering and optimization of systems, methods, enzymes and guide scaffolds of cas9 orthologs and variants for sequence manipulation |
| WO2017093566A1 (en) * | 2015-12-04 | 2017-06-08 | Universite Pierre Et Marie Curie (Paris 6) | Promoters and uses thereof |
| AU2016366549B2 (en) | 2015-12-11 | 2022-11-10 | California Institute Of Technology | Targeting peptides for directing adeno-associated viruses (AAVs) |
| US11510998B2 (en) | 2015-12-11 | 2022-11-29 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Gene therapy for combined methylmalonic acidemia/aciduria and hyperhomocysteinemia/homocystinuria, cobalamin C type, and deficiency of MMACHC |
| GB2545763A (en) | 2015-12-23 | 2017-06-28 | Adverum Biotechnologies Inc | Mutant viral capsid libraries and related systems and methods |
| US10973929B2 (en) | 2016-02-03 | 2021-04-13 | The Trustees Of The University Of Pennsylvania | Gene therapy for treating mucopolysaccharidosis type I |
| EP3433364A1 (en) | 2016-03-25 | 2019-01-30 | Editas Medicine, Inc. | Systems and methods for treating alpha 1-antitrypsin (a1at) deficiency |
| AU2017248731A1 (en) | 2016-04-15 | 2018-10-18 | The Trustees Of The University Of Pennsylvania | Compositions for treatment of wet age-related macular degeneration |
| WO2017189959A1 (en) | 2016-04-29 | 2017-11-02 | Voyager Therapeutics, Inc. | Compositions for the treatment of disease |
| EP4049683A1 (en) | 2016-04-29 | 2022-08-31 | Adverum Biotechnologies, Inc. | Evasion of neutralizing antibodies by a recombinant adeno-associated virus |
| US11299751B2 (en) | 2016-04-29 | 2022-04-12 | Voyager Therapeutics, Inc. | Compositions for the treatment of disease |
| KR102466887B1 (ko) | 2016-04-29 | 2022-11-11 | 젠사이트 바이올로직스 | Chrimson을 사용한 광유전학적 시력 회복 |
| WO2017192750A1 (en) * | 2016-05-04 | 2017-11-09 | Oregon Health & Science University | Recombinant adeno-associated viral vectors |
| ES2941502T3 (es) | 2016-05-13 | 2023-05-23 | 4D Molecular Therapeutics Inc | Variantes de cápsides de virus adenoasociado y procedimientos de utilización de las mismas |
| AU2017267665C1 (en) | 2016-05-18 | 2023-10-05 | Voyager Therapeutics, Inc. | Modulatory polynucleotides |
| CA3024449A1 (en) | 2016-05-18 | 2017-11-23 | Voyager Therapeutics, Inc. | Compositions and methods of treating huntington's disease |
| MA44546B1 (fr) * | 2016-06-15 | 2021-03-31 | Univ California | Virus adéno-associés variants et procédés d'utilisation |
| KR20190038536A (ko) * | 2016-06-16 | 2019-04-08 | 애드베룸 바이오테크놀로지스, 인코포레이티드 | 안구 혈관신생을 저하시키기 위한 조성물 및 방법 |
| KR20210021113A (ko) * | 2016-06-16 | 2021-02-24 | 애드베룸 바이오테크놀로지스, 인코포레이티드 | Aav2 변이체를 아플리베르셉트와 함께 사용하는 amd의 치료 |
| JP7071332B2 (ja) * | 2016-07-29 | 2022-05-18 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 変異カプシドを有するアデノ随伴ウイルスビリオン及びその使用方法 |
| US11566263B2 (en) | 2016-08-02 | 2023-01-31 | Editas Medicine, Inc. | Compositions and methods for treating CEP290 associated disease |
| AU2017321488B2 (en) | 2016-08-30 | 2022-10-20 | The Regents Of The University Of California | Methods for biomedical targeting and delivery and devices and systems for practicing the same |
| US11192925B2 (en) | 2016-10-19 | 2021-12-07 | Adverum Biotechnologies, Inc. | Modified AAV capsids and uses thereof |
| EP3535282A4 (en) * | 2016-11-06 | 2020-04-08 | Nanoscope Technologies LLC | OPTOGENETIC MODULATION BY OPSINE WITH SEVERAL PROPERTIES FOR THE RESTORATION OF SIGHT AND OTHER APPLICATIONS THEREOF |
| US11236360B2 (en) | 2016-12-09 | 2022-02-01 | Regents Of The University Of Minnesota | Adeno-associated viruses engineered for selectable tropism |
| WO2018160686A1 (en) * | 2017-02-28 | 2018-09-07 | Adverum Biotechnologies, Inc. | Modified aav capsids and uses thereof |
| WO2018170184A1 (en) | 2017-03-14 | 2018-09-20 | Editas Medicine, Inc. | Systems and methods for the treatment of hemoglobinopathies |
| SG11201907653QA (en) | 2017-03-17 | 2019-09-27 | Adverum Biotechnologies Inc | Compositions and methods for enhanced gene expression |
| WO2018189244A1 (en) * | 2017-04-11 | 2018-10-18 | Ruprecht-Karls-Universität Heidelberg | Adeno-associated virus library |
| KR20190139951A (ko) | 2017-04-14 | 2019-12-18 | 리젠엑스바이오 인크. | 인간 뉴런 또는 신경교 세포에 의해 생성된 재조합 인간 이두로네이트-2 설파타제(ids)를 이용한 뮤코다당증 ii형의 치료 |
| AU2018261003A1 (en) | 2017-05-05 | 2019-11-14 | Voyager Therapeutics, Inc. | Compositions and methods of treating Huntington's Disease |
| US11603542B2 (en) | 2017-05-05 | 2023-03-14 | Voyager Therapeutics, Inc. | Compositions and methods of treating amyotrophic lateral sclerosis (ALS) |
| WO2018209158A2 (en) | 2017-05-10 | 2018-11-15 | Editas Medicine, Inc. | Crispr/rna-guided nuclease systems and methods |
| JOP20190269A1 (ar) | 2017-06-15 | 2019-11-20 | Voyager Therapeutics Inc | بولي نوكليوتيدات aadc لعلاج مرض باركنسون |
| CN110461368A (zh) * | 2017-06-30 | 2019-11-15 | 加利福尼亚大学董事会 | 具有变异衣壳的腺相关病毒病毒体及其使用方法 |
| US11890329B2 (en) | 2017-07-06 | 2024-02-06 | The Trustees Of The University Of Pennsylvania | AAV9-mediated gene therapy for treating mucopolysaccharidosis type I |
| AU2018302016A1 (en) | 2017-07-17 | 2020-02-06 | The Regents Of The University Of California | Trajectory array guide system |
| CN110709511A (zh) | 2017-08-28 | 2020-01-17 | 加利福尼亚大学董事会 | 腺相关病毒衣壳变体及其使用方法 |
| WO2019079242A1 (en) | 2017-10-16 | 2019-04-25 | Voyager Therapeutics, Inc. | TREATMENT OF AMYOTROPHIC LATERAL SCLEROSIS (ALS) |
| JP7303816B2 (ja) * | 2017-10-16 | 2023-07-05 | ビゲネロン ゲゼルシャフト ミット ベシュレンクテル ハフツング | Aavベクター |
| TWI804518B (zh) | 2017-10-16 | 2023-06-11 | 美商航海家醫療公司 | 肌萎縮性脊髓側索硬化症(als)之治療 |
| CA3079565A1 (en) | 2017-10-18 | 2019-04-25 | Regenxbio Inc. | Treatment of ocular diseases and metastatic colon cancer with human post-translationally modified vegf-trap |
| BR112020007405A2 (pt) | 2017-10-18 | 2020-12-08 | Regenxbio Inc. | Produtos terapêuticos de anticorpo pós-translacionalmente modificados totalmente humanos |
| US11723988B2 (en) | 2017-10-20 | 2023-08-15 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Methods of expressing a polynucleotide of interest in the cone photoreceptors of a subject comprising the subretinal delivery of a therapeutically effective amount of a recombinant AAV9-derived vector |
| WO2019084015A1 (en) * | 2017-10-23 | 2019-05-02 | Daniel Schmidt | PROGRAMMABLE SET OF VIRUS COMPOSITES FOR ADMINISTRATION OF GENES TARGETING A RECEPTOR |
| EP4272728A2 (en) | 2017-11-27 | 2023-11-08 | 4D Molecular Therapeutics Inc. | Adeno-associated virus variant capsids and use for inhibiting angiogenesis |
| US10610606B2 (en) | 2018-02-01 | 2020-04-07 | Homology Medicines, Inc. | Adeno-associated virus compositions for PAH gene transfer and methods of use thereof |
| WO2019157395A1 (en) * | 2018-02-08 | 2019-08-15 | Applied Stemcells, Inc | Methods for screening variant of target gene |
| JP7244547B2 (ja) | 2018-02-19 | 2023-03-22 | ホモロジー・メディシンズ・インコーポレイテッド | F8遺伝子機能を回復させるためのアデノ随伴ウイルス組成物及びその使用の方法 |
| AU2019247191A1 (en) * | 2018-04-03 | 2020-10-15 | Ginkgo Bioworks, Inc. | Virus vectors for targeting ophthalmic tissues |
| EP3788165A1 (en) | 2018-04-29 | 2021-03-10 | REGENXBIO Inc. | Systems and methods of spectrophotometry for the determination of genome content, capsid content and full/empty ratios of adeno-associated virus particles |
| WO2019212921A1 (en) | 2018-04-29 | 2019-11-07 | Regenxbio Inc. | Scalable clarification process for recombinant aav production |
| JP7438981B2 (ja) * | 2018-05-11 | 2024-02-27 | マサチューセッツ アイ アンド イヤー インファーマリー | アデノ随伴ウイルスの肝臓特異的向性 |
| US11821009B2 (en) | 2018-05-15 | 2023-11-21 | Cornell University | Genetic modification of the AAV capsid resulting in altered tropism and enhanced vector delivery |
| EP3808840A4 (en) * | 2018-06-14 | 2022-03-23 | Avixgen Inc. | PHARMACEUTICAL COMPOSITION COMPRISING A CELL-PENETRATING PEPTIDE FUSION PROTEIN AND RPE65 FOR THE TREATMENT OF LEBER'S CONGENITAL AMAUROSIS |
| JP7385603B2 (ja) | 2018-06-14 | 2023-11-22 | リジェネクスバイオ インコーポレイテッド | 組換えaav生成のためのアニオン交換クロマトグラフィー |
| CA3105381A1 (en) | 2018-07-11 | 2020-01-16 | The Brigham And Women's Hospital, Inc. | Methods and compositions for delivery of agents across the blood-brain barrier |
| KR20210043580A (ko) | 2018-08-10 | 2021-04-21 | 리젠엑스바이오 인크. | 재조합 aav 생산을 위한 규모 조정 가능한 방법 |
| WO2020068990A1 (en) | 2018-09-26 | 2020-04-02 | California Institute Of Technology | Adeno-associated virus compositions for targeted gene therapy |
| KR20210075994A (ko) | 2018-10-15 | 2021-06-23 | 리젠엑스바이오 인크. | 복제 결함 바이러스 벡터 및 바이러스의 감염성을 측정하는 방법 |
| US20220090129A1 (en) * | 2018-12-05 | 2022-03-24 | Abeona Therapeutics Inc. | Recombinant adeno-associated viral vector for gene delivery |
| US20220096658A1 (en) * | 2018-12-21 | 2022-03-31 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Svcs. | Adeno-associated viruses and their uses for inner ear therapy |
| CN110437317B (zh) * | 2019-01-30 | 2023-05-02 | 上海科技大学 | 具有变异衣壳蛋白的腺相关病毒及其用途 |
| US11718834B2 (en) | 2019-02-15 | 2023-08-08 | Sangamo Therapeutics, Inc. | Compositions and methods for producing recombinant AAV |
| EP3931335A2 (en) | 2019-02-25 | 2022-01-05 | Novartis AG | Compositions and methods to treat bietti crystalline dystrophy |
| BR112021016501A2 (pt) | 2019-02-25 | 2021-10-26 | Novartis Ag | Composições e métodos para tratar distrofia cristalina de bietti |
| CA3131919A1 (en) | 2019-02-28 | 2020-09-03 | Regeneron Pharmaceuticals, Inc. | Adeno-associated virus vectors for the delivery of therapeutics |
| CN111621502B (zh) * | 2019-02-28 | 2023-05-02 | 武汉纽福斯生物科技有限公司 | 视网膜劈裂蛋白的编码序列、其表达载体构建及其应用 |
| AU2020231505A1 (en) | 2019-03-04 | 2021-08-19 | Adverum Biotechnologies, Inc. | Sequential intravitreal administration of AAV gene therapy to contralateral eyes |
| KR20220004987A (ko) | 2019-04-03 | 2022-01-12 | 리젠엑스바이오 인크. | 눈 병리에 대한 유전자 요법 |
| TW202102526A (zh) * | 2019-04-04 | 2021-01-16 | 美商銳進科斯生物股份有限公司 | 重組腺相關病毒及其用途 |
| PL3953483T3 (pl) | 2019-04-11 | 2024-04-22 | Regenxbio Inc. | Sposoby chromatografii wykluczania do charakteryzowania kompozycji rekombinowanych wirusów towarzyszących adenowirusom |
| WO2020214929A1 (en) | 2019-04-19 | 2020-10-22 | Regenxbio Inc. | Adeno-associated virus vector formulations and methods |
| AU2020262416A1 (en) | 2019-04-24 | 2021-12-16 | Regenxbio Inc. | Fully-human post-translationally modified antibody therapeutics |
| EP3752524A4 (en) * | 2019-04-27 | 2021-11-24 | Ocugen, Inc. | GENE THERAPY MEDIATED BY AN ADENO-ASSOCIATED VIRUS VECTOR FOR OPHTHALMIC DISEASES |
| WO2020264438A2 (en) | 2019-06-27 | 2020-12-30 | University Of Florida Research Foundation, Incorporated | Enhancing aav-mediated transduction of ocular tissues with hyaluronic acid |
| US20220251567A1 (en) | 2019-07-10 | 2022-08-11 | Inserm (Institut National De La Santè Et De La Recherche Médicale) | Methods for the treatment of epilepsy |
| CN114729331A (zh) * | 2019-07-11 | 2022-07-08 | 法国国家科学研究中心 | 化学修饰的腺相关病毒 |
| US10801042B1 (en) | 2019-07-15 | 2020-10-13 | Vigene Biosciences, Inc. | Use of ion concentrations to increase the packaging efficiency of recombinant adeno-associated virus |
| US10557149B1 (en) | 2019-07-15 | 2020-02-11 | Vigene Biosciences, Inc. | Recombinantly-modified adeno-associated virus helper vectors and their use to improve the packaging efficiency of recombinantly-modified adeno-associated virus |
| US10653731B1 (en) | 2019-07-15 | 2020-05-19 | Vigene Biosciences Inc. | Recombinantly-modified adeno-associated virus (rAAV) having improved packaging efficiency |
| JP2022544004A (ja) | 2019-07-26 | 2022-10-17 | リジェネックスバイオ インコーポレイテッド | 操作された核酸調節エレメントならびにその使用方法 |
| RU2751592C2 (ru) | 2019-08-22 | 2021-07-15 | Общество С Ограниченной Ответственностью "Анабион" | Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе |
| BR112022003811A2 (pt) | 2019-08-26 | 2022-11-16 | Regenxbio Inc | Tratamento de retinopatia diabética com fab anti vegf totalmente humano modificado pós tradução |
| AU2020345915A1 (en) | 2019-09-11 | 2022-03-24 | Adverum Biotechnologies, Inc. | Methods of treating ocular neovascular diseases using AAV2 variants encoding aflibercept |
| WO2021050974A1 (en) * | 2019-09-12 | 2021-03-18 | The Broad Institute, Inc. | Engineered adeno-associated virus capsids |
| GB201913974D0 (en) | 2019-09-27 | 2019-11-13 | King S College London | Vector |
| US20220347298A1 (en) | 2019-10-04 | 2022-11-03 | Ultragenyx Pharmaceutical Inc. | Methods for improved therapeutic use of recombinant aav |
| CA3156984A1 (en) | 2019-10-07 | 2021-04-15 | Regenxbio Inc. | Adeno-associated virus vector pharmaceutical composition and methods |
| EP4045664A1 (en) * | 2019-10-16 | 2022-08-24 | Wuxi Apptec (Shanghai) Co., Ltd. | A novel aav variant |
| CN114746125A (zh) * | 2019-11-08 | 2022-07-12 | 瑞泽恩制药公司 | 用于x连锁青少年型视网膜劈裂症疗法的crispr和aav策略 |
| EP4061943A1 (en) | 2019-11-19 | 2022-09-28 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Antisense oligonucleotides and their use for the treatment of cancer |
| US20230057380A1 (en) * | 2019-11-26 | 2023-02-23 | University Of Massachusetts | Recombinant adeno-associated virus for delivery of kh902 (conbercept) and uses thereof |
| US20230270886A1 (en) | 2019-11-28 | 2023-08-31 | Regenxbio Inc. | Microdystrophin gene therapy constructs and uses thereof |
| WO2021142300A2 (en) * | 2020-01-10 | 2021-07-15 | The Brigham And Women's Hospital, Inc. | Methods and compositions for delivery of immunotherapy agents across the blood-brain barrier to treat brain cancer |
| TW202140791A (zh) | 2020-01-13 | 2021-11-01 | 美商霍蒙拉奇醫藥公司 | 治療苯酮尿症之方法 |
| AU2021211416A1 (en) | 2020-01-22 | 2022-08-11 | Regenxbio Inc. | Treatment of mucopolysaccharidosis I with fully-human glycosylated human alpha-L-iduronidase (IDUA) |
| TW202136516A (zh) | 2020-01-29 | 2021-10-01 | 美商銳進科斯生物股份有限公司 | Iva型黏多醣病之治療 |
| JP2023512242A (ja) | 2020-01-29 | 2023-03-24 | レジェンクスバイオ インコーポレーテッド | ヒト神経細胞またはヒトグリア細胞が産生した組換えヒトイズロン酸-2-スルファターゼ(ids)によるムコ多糖症iiの治療 |
| AU2021218703A1 (en) | 2020-02-14 | 2022-07-28 | Ultragenyx Pharmaceutical Inc. | Gene therapy for treating CDKL5 deficiency disorder |
| WO2021188892A1 (en) | 2020-03-19 | 2021-09-23 | Ultragenyx Pharmaceutical Inc. | Compositions and methods for reducing reverse packaging of cap and rep sequences in recombinant aav |
| EP4127189A1 (en) | 2020-03-31 | 2023-02-08 | Ultragenyx Pharmaceutical Inc. | Gene therapy for treating propionic acidemia |
| EP4132961A1 (en) | 2020-04-10 | 2023-02-15 | Sorbonne Université | G-protein-gated-k+ channel-mediated enhancements in light sensitivity in rod-cone dystrophy (rcd) |
| CA3179895A1 (en) | 2020-04-24 | 2021-10-28 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Methods for preventing induction of immune responses to the transduced cells expressing a transgene product after ocular gene therapy |
| WO2021222094A1 (en) | 2020-04-27 | 2021-11-04 | 4D Molecular Therapeutics Inc. | Codon optimized gla genes and uses thereof |
| TW202208397A (zh) | 2020-05-13 | 2022-03-01 | 美商航海家醫療公司 | Aav蛋白殼之趨性重定向 |
| JP2023540429A (ja) | 2020-07-10 | 2023-09-25 | アンセルム(アンスティチュート・ナシオナル・ドゥ・ラ・サンテ・エ・ドゥ・ラ・ルシェルシュ・メディカル) | てんかんを治療するための方法及び組成物 |
| CN112226461B (zh) * | 2020-08-21 | 2022-04-22 | 华侨大学 | Cd4阳性细胞特异性基因传递载体及其应用 |
| US20230303630A1 (en) * | 2020-08-21 | 2023-09-28 | Capsida, Inc. | Adeno-associated virus compositions having preferred expression levels |
| WO2022060916A1 (en) | 2020-09-15 | 2022-03-24 | Regenxbio Inc. | Vectorized antibodies for anti-viral therapy |
| EP4213890A1 (en) | 2020-09-15 | 2023-07-26 | RegenxBio Inc. | Vectorized lanadelumab and administration thereof |
| CN113754727B (zh) * | 2020-09-30 | 2022-07-12 | 广州派真生物技术有限公司 | 腺相关病毒突变体及其应用 |
| US20240024508A1 (en) | 2020-10-07 | 2024-01-25 | Regenxbio Inc. | Formulations for suprachoroidal administration such as high viscosity formulations |
| CA3193697A1 (en) | 2020-10-07 | 2022-04-14 | Joseph Bruder | Adeno-associated viruses for ocular delivery of gene therapy |
| KR20230106598A (ko) | 2020-10-07 | 2023-07-13 | 리젠엑스바이오 인크. | 겔 제형과 같은 맥락막위 투여용 제형 |
| WO2022076750A2 (en) | 2020-10-07 | 2022-04-14 | Regenxbio Inc. | Recombinant adeno-associated viruses for cns or muscle delivery |
| WO2022076591A1 (en) | 2020-10-07 | 2022-04-14 | Regenxbio Inc. | Formulations for suprachoroidal administration such as formulations with aggregate formation |
| US20230391864A1 (en) | 2020-10-28 | 2023-12-07 | Regenxbio, Inc. | Vectorized anti-tnf-alpha antibodies for ocular indications |
| WO2022094157A1 (en) | 2020-10-28 | 2022-05-05 | Regenxbio Inc. | Vectorized anti-cgrp and anti-cgrpr antibodies and administration thereof |
| CA3196964A1 (en) | 2020-10-29 | 2022-05-05 | Xu Wang | Vectorized tnf-alpha antagonists for ocular indications |
| WO2022094255A2 (en) | 2020-10-29 | 2022-05-05 | Regenxbio Inc. | Vectorized factor xii antibodies and administration thereof |
| US20240002839A1 (en) | 2020-12-02 | 2024-01-04 | Decibel Therapeutics, Inc. | Crispr sam biosensor cell lines and methods of use thereof |
| IL303614A (en) | 2020-12-16 | 2023-08-01 | Regenxbio Inc | A method for producing an ADNO-linked recombinant virus particle |
| WO2022126189A1 (en) * | 2020-12-16 | 2022-06-23 | Children's Medical Research Institute | Adeno-associated virus capsids and vectors |
| WO2022147087A1 (en) | 2020-12-29 | 2022-07-07 | Regenxbio Inc. | Tau-specific antibody gene therapy compositions, methods and uses thereof |
| US20240084329A1 (en) | 2021-01-21 | 2024-03-14 | Regenxbio Inc. | Improved production of recombinant polypeptides and viruses |
| KR20230145386A (ko) | 2021-02-10 | 2023-10-17 | 리젠엑스바이오 인크. | 재조합 인간 이두로네이트-2-설파타아제(ids)를 사용한 점액다당류증 ii의 치료 |
| CN113121651B (zh) * | 2021-04-19 | 2023-11-17 | 信念医药科技(上海)有限公司 | 低中和抗体腺相关病毒衣壳蛋白 |
| CN113121652B (zh) * | 2021-04-19 | 2022-10-11 | 上海信致医药科技有限公司 | 视网膜和肌肉高亲和性腺相关病毒衣壳蛋白及相关应用 |
| EP4326339A2 (en) | 2021-04-20 | 2024-02-28 | Institut National de la Santé et de la Recherche Médicale (INSERM) | Compositions and methods for treating retinal degenerative disorders |
| BR112023021999A2 (pt) | 2021-04-26 | 2023-12-26 | Regenxbio Inc | Administração de terapia gênica de microdistrofina para tratamento de distrofinopatias |
| WO2022232790A1 (en) | 2021-04-27 | 2022-11-03 | Adverum Biotechnologies, Inc. | Methods of treating ocular diseases using aav2 variants encoding aflibercept |
| EP4334454A2 (en) | 2021-05-04 | 2024-03-13 | RegenxBio Inc. | Novel aav vectors and methods and uses thereof |
| EP4337267A1 (en) | 2021-05-11 | 2024-03-20 | RegenxBio Inc. | Treatment of duchenne muscular dystrophy and combinations thereof |
| BR112023024705A2 (pt) | 2021-05-26 | 2024-02-15 | Centre Nat Rech Scient | Aprimoramento mediado por canal de k+ com portão para proteína g em sensibilidade à luz na distrofia de cones e bastonetes (rcd) |
| WO2022247917A1 (zh) | 2021-05-28 | 2022-12-01 | 上海瑞宏迪医药有限公司 | 衣壳变异的重组腺相关病毒及其应用 |
| AU2022283898A1 (en) * | 2021-06-03 | 2024-01-04 | Dyno Therapeutics, Inc. | Capsid variants and methods of using the same |
| WO2023280926A1 (en) | 2021-07-07 | 2023-01-12 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Synergistic combination of rdcfv2 and rdcvf2l for the treatment of tauopathies |
| AR126407A1 (es) | 2021-07-08 | 2023-10-11 | Tenaya Therapeutics Inc | Casetes de expresión optimizada para genoterapia |
| WO2023004331A1 (en) | 2021-07-19 | 2023-01-26 | New York University | Auf1 combination therapies for treatment of muscle degenerative disease |
| WO2023019168A1 (en) | 2021-08-11 | 2023-02-16 | Ultragenyx Pharmaceutical Inc. | Compositions and methods for treating a muscular dystrophy |
| WO2023022631A1 (ru) | 2021-08-20 | 2023-02-23 | Акционерное общество "БИОКАД" | Способ получения модифицированного капсида аденоассоциированного вируса |
| AR126840A1 (es) | 2021-08-20 | 2023-11-22 | Llc «Anabion» | Proteína de la cápside vp1 modificada aislada del virus adeno-asociado de serotipo 5 (aav5), cápside y vector basado en esta |
| AR126839A1 (es) | 2021-08-20 | 2023-11-22 | Llc «Anabion» | Proteína de la cápside vp1 modificada aislada del virus adeno-asociado de serotipo 9 (aav9), cápside y vector basado en esta |
| WO2023060113A1 (en) | 2021-10-05 | 2023-04-13 | Regenxbio Inc. | Compositions and methods for recombinant aav production |
| WO2023060269A1 (en) | 2021-10-07 | 2023-04-13 | Regenxbio Inc. | Recombinant adeno-associated viruses for targeted delivery |
| WO2023060272A2 (en) | 2021-10-07 | 2023-04-13 | Regenxbio Inc. | Recombinant adeno-associated viruses for cns tropic delivery |
| EP4163296A1 (en) | 2021-10-11 | 2023-04-12 | Sparingvision | G-protein-gated-k+ channel-mediated enhancements in light sensitivity in patients with rod-cone dystrophy (rcd) |
| WO2023077092A1 (en) | 2021-10-28 | 2023-05-04 | Regenxbio Inc. | Engineered nucleic acid regulatory elements and methods and uses thereof |
| WO2023108507A1 (en) * | 2021-12-15 | 2023-06-22 | National Institute Of Biological Sciences, Beijing | Recombinant aav vectors and use thereof |
| WO2023150566A1 (en) | 2022-02-02 | 2023-08-10 | Adverum Biotechnologies, Inc. | Methods of treating ocular neovascular diseases using aav2 variants encoding aflibercept |
| WO2023158990A1 (en) | 2022-02-16 | 2023-08-24 | Adverum Biotechnologies, Inc. | Method of reducing cst fluctuation in neovascular amd by a recombinant adeno-associated virus |
| WO2023155828A1 (en) | 2022-02-17 | 2023-08-24 | Skyline Therapeutics (Shanghai) Co., Ltd. | Recombinant adeno-associated virus with modified aav capsid polypeptides |
| WO2023172491A1 (en) | 2022-03-07 | 2023-09-14 | Ultragenyx Pharmaceutical Inc. | Modified batch aav production systems and methods |
| TW202346590A (zh) | 2022-03-13 | 2023-12-01 | 美商銳進科斯生物股份有限公司 | 經修飾之肌肉特異性啟動子 |
| WO2023178220A1 (en) | 2022-03-16 | 2023-09-21 | Regenxbio Inc. | Compositions and methods for recombinant aav production |
| WO2023183623A1 (en) | 2022-03-25 | 2023-09-28 | Regenxbio Inc. | Dominant-negative tumor necrosis factor alpha adeno-associated virus gene therapy |
| WO2023196873A1 (en) | 2022-04-06 | 2023-10-12 | Regenxbio Inc. | Pharmaceutical composition comprising a recombinant adeno-associated virus vector with an expression cassette encoding a transgene forsuprachoidal administration |
| TW202345913A (zh) | 2022-04-06 | 2023-12-01 | 美商銳進科斯生物股份有限公司 | 用於脈絡膜上投與之調配物諸如凝膠調配物 |
| TW202404651A (zh) | 2022-04-06 | 2024-02-01 | 美商銳進科斯生物股份有限公司 | 用於脈絡膜上投與之調配物諸如形成聚集體之調配物 |
| WO2023201207A1 (en) | 2022-04-11 | 2023-10-19 | Tenaya Therapeutics, Inc. | Adeno-associated virus with engineered capsid |
| WO2023201308A1 (en) | 2022-04-14 | 2023-10-19 | Regenxbio Inc. | Gene therapy for treating an ocular disease |
| WO2023201277A1 (en) | 2022-04-14 | 2023-10-19 | Regenxbio Inc. | Recombinant adeno-associated viruses for cns tropic delivery |
| CN116970648A (zh) * | 2022-04-24 | 2023-10-31 | 上海朗昇生物科技有限公司 | 新型aav衣壳改造株及其用途 |
| TW202400803A (zh) | 2022-05-03 | 2024-01-01 | 美商銳進科斯生物股份有限公司 | 載體化抗補體抗體與補體劑及其投與 |
| WO2023215807A1 (en) | 2022-05-03 | 2023-11-09 | Regenxbio Inc. | VECTORIZED ANTI-TNF-α INHIBITORS FOR OCULAR INDICATIONS |
| WO2023240062A1 (en) | 2022-06-07 | 2023-12-14 | Adverum Biotechnologies, Inc. | Melanopsin variants for vision restoration |
| WO2023239627A2 (en) | 2022-06-08 | 2023-12-14 | Regenxbio Inc. | Methods for recombinant aav production |
| WO2024017990A1 (en) | 2022-07-21 | 2024-01-25 | Institut National de la Santé et de la Recherche Médicale | Methods and compositions for treating chronic pain disorders |
| WO2024033837A1 (en) | 2022-08-11 | 2024-02-15 | Institute Of Molecular And Clinical Ophthalmology Basel (Iob) | Human cone photoreceptor optogenetic constructs |
| WO2024044725A2 (en) | 2022-08-24 | 2024-02-29 | Regenxbio Inc. | Recombinant adeno-associated viruses and uses thereof |
| WO2024073669A1 (en) | 2022-09-30 | 2024-04-04 | Regenxbio Inc. | Treatment of ocular diseases with recombinant viral vectors encoding anti-vegf fab |
| WO2024081746A2 (en) | 2022-10-11 | 2024-04-18 | Regenxbio Inc. | Engineered nucleic acid regulatory elements and methods and uses thereof |
| WO2024084075A1 (en) | 2022-10-20 | 2024-04-25 | Sparingvision | Compositions and methods for treating retinal degenerative disorders |
| EP4357359A1 (en) | 2022-10-20 | 2024-04-24 | Sparingvision | G-protein-gated-k+ channel-mediated enhancements in light sensitivity in rod-cone dystrophy (rcd) |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2301260C2 (ru) * | 2000-09-22 | 2007-06-20 | Вирэкссис Корпорейшн | Вирусные векторы с зависимой от условий репликацией и их применение |
| WO2010093784A2 (en) * | 2009-02-11 | 2010-08-19 | The University Of North Carolina At Chapel Hill | Modified virus vectors and methods of making and using the same |
Family Cites Families (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB9206016D0 (en) | 1992-03-19 | 1992-04-29 | Sandoz Ltd | Improvements in or relating to organic compounds |
| US5639872A (en) | 1993-07-27 | 1997-06-17 | Hybridon, Inc. | Human VEGF-specific oligonucleotides |
| US6440425B1 (en) | 1995-05-01 | 2002-08-27 | Aventis Pasteur Limited | High molecular weight major outer membrane protein of moraxella |
| US6001650A (en) * | 1995-08-03 | 1999-12-14 | Avigen, Inc. | High-efficiency wild-type-free AAV helper functions |
| WO1997020925A1 (en) | 1995-12-08 | 1997-06-12 | Hybridon, Inc. | Modified vegf antisense oligonucleotides for treatment of skin disorders |
| US6096548A (en) | 1996-03-25 | 2000-08-01 | Maxygen, Inc. | Method for directing evolution of a virus |
| EP0927044A4 (en) | 1996-04-16 | 1999-09-08 | Immusol Inc | DEFINED TARGET VIRAL VECTORS |
| US20030215422A1 (en) | 1996-09-11 | 2003-11-20 | John A. Chiorini | Aav4 vector and uses thereof |
| US6156303A (en) | 1997-06-11 | 2000-12-05 | University Of Washington | Adeno-associated virus (AAV) isolates and AAV vectors derived therefrom |
| US6710036B2 (en) | 1997-07-25 | 2004-03-23 | Avigen, Inc. | Induction of immune response to antigens expressed by recombinant adeno-associated virus |
| WO1999014354A1 (en) | 1997-09-19 | 1999-03-25 | The Trustees Of The University Of The Pennsylvania | Methods and vector constructs useful for production of recombinant aav |
| EP1690868A1 (en) | 1997-10-31 | 2006-08-16 | Maxygen, Inc. | Modification of virus tropism and host range by viral genome shuffling |
| US6410300B1 (en) | 1998-01-12 | 2002-06-25 | The University Of North Carolina At Chapel Hill | Methods and formulations for mediating adeno-associated virus (AAV) attachment and infection and methods for purifying AAV |
| US6551795B1 (en) * | 1998-02-18 | 2003-04-22 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to pseudomonas aeruginosa for diagnostics and therapeutics |
| AU762220B2 (en) | 1998-05-28 | 2003-06-19 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | AAV5 vector and uses thereof |
| DE19827457C1 (de) | 1998-06-19 | 2000-03-02 | Medigene Ag | Strukturprotein von AAV, seine Herstellung und Verwendung |
| ATE294874T1 (de) * | 1998-09-11 | 2005-05-15 | Univ California | Rekombinante adenovirus für gewebespezifische genexpression ins herz |
| EP1127150B1 (en) | 1998-11-05 | 2007-05-16 | The Trustees Of The University Of Pennsylvania | Adeno-associated virus serotype 1 nucleic acid sequences, vectors and host cells containing same |
| DE69941905D1 (de) | 1998-11-10 | 2010-02-25 | Univ North Carolina | Virusvektoren und verfahren für ihre herstellung und verabreichung. |
| US6943153B1 (en) | 1999-03-15 | 2005-09-13 | The Regents Of The University Of California | Use of recombinant gene delivery vectors for treating or preventing diseases of the eye |
| US6498244B1 (en) | 1999-05-28 | 2002-12-24 | Cell Genesys, Inc. | Adeno-associated virus capsid immunologic determinants |
| US7314912B1 (en) | 1999-06-21 | 2008-01-01 | Medigene Aktiengesellschaft | AAv scleroprotein, production and use thereof |
| DE19933288A1 (de) | 1999-07-15 | 2001-01-18 | Medigene Ag | Strukturprotein von Adeno-assoziiertem Virus mit veränderter Antigenität, seine Herstellung und Verwendung |
| DE19933719A1 (de) | 1999-07-19 | 2001-01-25 | Medigene Ag | Strukturprotein in Adeno-assoziiertem Virus mit veränderten chromatographischen Eigenschaften, seine Herstellung und Verwendung |
| US8232081B2 (en) | 1999-09-21 | 2012-07-31 | Basf Se | Methods and microorganisms for production of panto-compounds |
| DE10001363A1 (de) | 2000-01-14 | 2001-07-26 | Windmoeller & Hoelscher | Extruderdüsenkopf |
| US20070026394A1 (en) | 2000-02-11 | 2007-02-01 | Lawrence Blatt | Modulation of gene expression associated with inflammation proliferation and neurite outgrowth using nucleic acid based technologies |
| US6855314B1 (en) | 2000-03-22 | 2005-02-15 | The United States Of America As Represented By The Department Of Health And Human Services | AAV5 vector for transducing brain cells and lung cells |
| WO2002053703A2 (en) * | 2001-01-05 | 2002-07-11 | Children's Hospital, Inc. | Aav2 vectors and methods |
| US7749492B2 (en) * | 2001-01-05 | 2010-07-06 | Nationwide Children's Hospital, Inc. | AAV vectors and methods |
| US20030144221A1 (en) | 2001-07-17 | 2003-07-31 | Isis Pharmaceuticals Inc. | Antisense modulation of BCL2-associated X protein expression |
| US20030129203A1 (en) * | 2001-08-27 | 2003-07-10 | Nautilus Biotech S.A. | Mutant recombinant adeno-associated viruses |
| US7647184B2 (en) | 2001-08-27 | 2010-01-12 | Hanall Pharmaceuticals, Co. Ltd | High throughput directed evolution by rational mutagenesis |
| CA2467959C (en) | 2001-11-09 | 2009-03-10 | Robert M. Kotin | Production of adeno-associated virus in insect cells |
| BRPI0214119B8 (pt) | 2001-11-13 | 2021-05-25 | Univ Pennsylvania | vírus adenoassociado recombinante, método de geração do referido vírus e composição compreendendo o referido vírus |
| AU2002352261B2 (en) | 2001-12-21 | 2008-02-07 | Medigene Ag | A library of modified structural genes or capsid modified particles useful for the identification of viral clones with desired cell tropism |
| DE10216005A1 (de) | 2002-04-11 | 2003-10-30 | Max Planck Gesellschaft | Verwendung von biologischen Photorezeptoren als direkt lichtgesteuerte Ionenkanäle |
| WO2003089612A2 (en) | 2002-04-17 | 2003-10-30 | University Of Florida Research Foundation, Inc. | IMPROVED rAAV VECTORS |
| US20040142416A1 (en) | 2002-04-30 | 2004-07-22 | Laipis Philip J. | Treatment for phenylketonuria |
| AU2003223775A1 (en) | 2002-04-30 | 2003-11-17 | Duke University | Adeno-associated viral vectors and methods for their production from hybrid adenovirus and for their use |
| US7254489B2 (en) | 2002-05-31 | 2007-08-07 | Microsoft Corporation | Systems, methods and apparatus for reconstructing phylogentic trees |
| US7148342B2 (en) | 2002-07-24 | 2006-12-12 | The Trustees Of The University Of Pennyslvania | Compositions and methods for sirna inhibition of angiogenesis |
| AU2003265855A1 (en) | 2002-08-28 | 2004-03-19 | University Of Florida | Modified aav |
| JP2006510360A (ja) * | 2002-12-18 | 2006-03-30 | ノバルティス アクチエンゲゼルシャフト | 内皮細胞特異的結合ペプチド |
| US20070172460A1 (en) | 2003-03-19 | 2007-07-26 | Jurgen Kleinschmidt | Random peptide library displayed on aav vectors |
| WO2004108922A2 (en) | 2003-04-25 | 2004-12-16 | The Trustees Of The University Of Pennsylvania | Use of aav comprising a capsid protein from aav7 or aav8 for the delivery of genes encoding apoprotein a or e genes to the liver |
| WO2004101799A2 (en) * | 2003-05-14 | 2004-11-25 | Istituto Di Ricerche Di Biologia Molecolare P Angeletti Spa | Broadening adenovirus tropism |
| EP1486567A1 (en) | 2003-06-11 | 2004-12-15 | Deutsches Krebsforschungszentrum Stiftung des öffentlichen Rechts | Improved adeno-associated virus (AAV) vector for gene therapy |
| DK2657248T3 (en) | 2003-06-19 | 2017-06-26 | Genzyme Corp | AAV virions with reduced immunoreactivity and applications thereof |
| WO2005000240A2 (en) | 2003-06-23 | 2005-01-06 | A & G Pharmaceutical, Inc. | Compositions and methods for restoring sensitivity of tumor cells to antitumor therapy and inducing apoptosis |
| US9441244B2 (en) | 2003-06-30 | 2016-09-13 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| US9233131B2 (en) | 2003-06-30 | 2016-01-12 | The Regents Of The University Of California | Mutant adeno-associated virus virions and methods of use thereof |
| US20050148069A1 (en) | 2003-09-24 | 2005-07-07 | Gage Fred H. | IGF-1 instructs multipotent adult CNS neural stem cells to an oligodendroglial lineage |
| PT3211085T (pt) | 2003-09-30 | 2021-06-17 | Univ Pennsylvania | Clados de vírus adeno-associados (aav), sequências, vetores que as contêm, e suas utilizações |
| KR100550967B1 (ko) | 2003-12-03 | 2006-02-13 | 주식회사 엘지생활건강 | 유중수형 화장료 조성물 |
| US7947659B2 (en) | 2004-03-12 | 2011-05-24 | Alnylam Pharmaceuticals, Inc. | iRNA agents targeting VEGF |
| US7427396B2 (en) | 2004-06-03 | 2008-09-23 | Genzyme Corporation | AAV vectors for gene delivery to the lung |
| EP1828390B1 (en) | 2004-12-15 | 2012-06-13 | The University Of North Carolina At Chapel Hill | Chimeric vectors |
| US20060211650A1 (en) | 2004-12-16 | 2006-09-21 | Forest Laboratories, Inc. | Reducing carbohydrate derivatives of adamantane amines, and synthesis and methods of use thereof |
| WO2006101634A1 (en) | 2005-02-17 | 2006-09-28 | The Regents Of The University Of California | Müller cell specific gene therapy |
| CN101203613B (zh) | 2005-04-07 | 2012-12-12 | 宾夕法尼亚大学托管会 | 增强腺相关病毒载体功能的方法 |
| US20070053996A1 (en) | 2005-07-22 | 2007-03-08 | Boyden Edward S | Light-activated cation channel and uses thereof |
| CN1834255A (zh) * | 2005-12-23 | 2006-09-20 | 上海交通大学附属第一人民医院 | 加快并提高腺相关病毒介导的基因在视网膜细胞内表达的方法 |
| WO2007089632A2 (en) | 2006-01-27 | 2007-08-09 | The University Of North Carolina At Chapel Hill | Heparin and heparan sulfate binding chimeric vectors |
| EP2007795B1 (en) | 2006-03-30 | 2016-11-16 | The Board Of Trustees Of The Leland Stanford Junior University | Aav capsid proteins |
| AU2007247929A1 (en) | 2006-05-04 | 2007-11-15 | Pennsylvania College Of Optometry | Restoration of visual responses by In Vivo delivery of rhodopsin nucleic acids |
| DK3023500T3 (da) * | 2006-06-21 | 2020-04-20 | Uniqure Ip Bv | Insektceller til fremstilling af AAV-vektorer |
| US7872118B2 (en) | 2006-09-08 | 2011-01-18 | Opko Ophthalmics, Llc | siRNA and methods of manufacture |
| CN1966082B (zh) * | 2006-11-03 | 2010-06-30 | 许瑞安 | 一种防治结直肠癌的基因药物及其制备方法和用途 |
| US9725485B2 (en) | 2012-05-15 | 2017-08-08 | University Of Florida Research Foundation, Inc. | AAV vectors with high transduction efficiency and uses thereof for gene therapy |
| SI2147096T1 (sl) | 2007-04-13 | 2015-07-31 | Catalyst Biosciences, Inc., | Modificirani polipeptidi faktorja VII in njihove uporabe |
| EP1985708B1 (en) * | 2007-04-27 | 2015-04-15 | Universität Rostock | Selective targeting of viruses to neural precursor cells |
| US8632764B2 (en) * | 2008-04-30 | 2014-01-21 | University Of North Carolina At Chapel Hill | Directed evolution and in vivo panning of virus vectors |
| ES2538468T3 (es) | 2008-05-20 | 2015-06-22 | Eos Neuroscience, Inc. | Vectores para la administración de proteínas sensibles a la luz y métodos para su utilización |
| WO2009154452A1 (en) | 2008-06-17 | 2009-12-23 | Amsterdam Molecular Therapeutics B.V. | Parvoviral capsid with incorporated Gly-Ala repeat region |
| CN101532024A (zh) * | 2009-04-30 | 2009-09-16 | 许瑞安 | 一种用于基因治疗的新型细胞特异性内含microRNA结合序列的基因HAAVmir |
| US8734809B2 (en) | 2009-05-28 | 2014-05-27 | University Of Massachusetts | AAV's and uses thereof |
| EP2550021A2 (en) | 2010-03-22 | 2013-01-30 | Association Institut de Myologie | Methods of increasing efficiency of vector penetration of target tissue |
| AU2011256838B2 (en) | 2010-05-17 | 2014-10-09 | Sangamo Therapeutics, Inc. | Novel DNA-binding proteins and uses thereof |
| US8663624B2 (en) * | 2010-10-06 | 2014-03-04 | The Regents Of The University Of California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| WO2012109570A1 (en) * | 2011-02-10 | 2012-08-16 | The University Of North Carolina At Chapel Hill | Viral vectors with modified transduction profiles and methods of making and using the same |
| SG194583A1 (en) | 2011-04-22 | 2013-12-30 | Univ California | Adeno-associated virus virions with variant capsid and methods of use thereof |
| US9169299B2 (en) | 2011-08-24 | 2015-10-27 | The Board Of Trustees Of The Leleand Stanford Junior University | AAV capsid proteins for nucleic acid transfer |
| EP3470523A1 (en) | 2012-05-09 | 2019-04-17 | Oregon Health & Science University | Adeno associated virus plasmids and vectors |
| TWI702955B (zh) | 2012-05-15 | 2020-09-01 | 澳大利亞商艾佛蘭屈澳洲私營有限公司 | 使用腺相關病毒(aav)sflt-1治療老年性黃斑部退化(amd) |
| EP2940131B1 (en) | 2012-12-25 | 2019-02-20 | Takara Bio Inc. | Aav variant |
| ES2741502T3 (es) | 2013-02-08 | 2020-02-11 | Univ Pennsylvania | Cápside de AAV8 modificada para la transferencia génica para terapias de retina |
| AU2014273085B2 (en) | 2013-05-29 | 2020-10-22 | Cellectis | New compact scaffold of Cas9 in the type II CRISPR system |
| JP6600624B2 (ja) | 2013-05-31 | 2019-10-30 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | アデノ随伴ウイルス変異体及びその使用方法 |
| WO2015048534A1 (en) | 2013-09-26 | 2015-04-02 | University Of Florida Research Foundation, Inc. | Synthetic combinatorial aav capsid library for targeted gene therapy |
| JP6552511B2 (ja) | 2013-10-11 | 2019-07-31 | マサチューセッツ アイ アンド イヤー インファーマリー | 祖先ウイルス配列を予測する方法およびその使用 |
| CN106414474B (zh) | 2014-03-17 | 2021-01-15 | 阿德夫拉姆生物技术股份有限公司 | 用于视锥细胞中增强的基因表达的组合物和方法 |
| WO2015168666A2 (en) | 2014-05-02 | 2015-11-05 | Genzyme Corporation | Aav vectors for retinal and cns gene therapy |
| WO2015191693A2 (en) | 2014-06-10 | 2015-12-17 | Massachusetts Institute Of Technology | Method for gene editing |
| WO2016141078A1 (en) | 2015-03-02 | 2016-09-09 | Avalanche Biotechnologies, Inc. | Compositions and methods for intravitreal delivery of polynucleotides to retinal cones |
| ES2806054T3 (es) | 2015-03-06 | 2021-02-16 | Massachusetts Eye & Ear Infirmary | Terapias de aumento génico de la degeneración retiniana causada por mutaciones en el gen PRPF31 |
| US20190000940A1 (en) | 2015-07-31 | 2019-01-03 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of aadc deficiency |
| ES2941502T3 (es) | 2016-05-13 | 2023-05-23 | 4D Molecular Therapeutics Inc | Variantes de cápsides de virus adenoasociado y procedimientos de utilización de las mismas |
| CN110709511A (zh) | 2017-08-28 | 2020-01-17 | 加利福尼亚大学董事会 | 腺相关病毒衣壳变体及其使用方法 |
-
2012
- 2012-04-20 SG SG2013078597A patent/SG194583A1/en unknown
- 2012-04-20 ES ES17168534T patent/ES2791499T3/es active Active
- 2012-04-20 HU HUE17168534A patent/HUE049629T2/hu unknown
- 2012-04-20 LT LTEP12774323.5T patent/LT2699270T/lt unknown
- 2012-04-20 IL IL280819A patent/IL280819B1/en unknown
- 2012-04-20 AU AU2012245328A patent/AU2012245328B2/en active Active
- 2012-04-20 ES ES12774323.5T patent/ES2638342T3/es active Active
- 2012-04-20 KR KR1020207002952A patent/KR102202908B1/ko active IP Right Grant
- 2012-04-20 ES ES20151479T patent/ES2904638T3/es active Active
- 2012-04-20 LT LTEP20151479.1T patent/LT3693025T/lt unknown
- 2012-04-20 RS RS20220014A patent/RS62795B1/sr unknown
- 2012-04-20 SG SG10201800873WA patent/SG10201800873WA/en unknown
- 2012-04-20 PT PT201514791T patent/PT3693025T/pt unknown
- 2012-04-20 RU RU2013151885A patent/RU2611202C2/ru active
- 2012-04-20 CN CN201280024852.3A patent/CN103561774B/zh active Active
- 2012-04-20 KR KR1020217000600A patent/KR102391725B1/ko active IP Right Grant
- 2012-04-20 WO PCT/US2012/034413 patent/WO2012145601A2/en active Application Filing
- 2012-04-20 PL PL20151479T patent/PL3693025T3/pl unknown
- 2012-04-20 PT PT127743235T patent/PT2699270T/pt unknown
- 2012-04-20 DK DK12774323.5T patent/DK2699270T3/en active
- 2012-04-20 RS RS20200498A patent/RS60207B1/sr unknown
- 2012-04-20 EP EP12774323.5A patent/EP2699270B1/en active Active
- 2012-04-20 CN CN201611072467.2A patent/CN107012171B/zh active Active
- 2012-04-20 MX MX2013012384A patent/MX349138B/es active IP Right Grant
- 2012-04-20 PL PL17168534T patent/PL3254703T3/pl unknown
- 2012-04-20 SG SG10202110919YA patent/SG10202110919YA/en unknown
- 2012-04-20 JP JP2014506568A patent/JP6072772B2/ja active Active
- 2012-04-20 BR BR112013027120-5A patent/BR112013027120B1/pt active IP Right Grant
- 2012-04-20 SI SI201231974T patent/SI3693025T1/sl unknown
- 2012-04-20 SI SI201231053T patent/SI2699270T1/sl unknown
- 2012-04-20 PL PL12774323T patent/PL2699270T3/pl unknown
- 2012-04-20 EP EP20151479.1A patent/EP3693025B1/en active Active
- 2012-04-20 EP EP17168534.0A patent/EP3254703B1/en active Active
- 2012-04-20 HU HUE20151479A patent/HUE057102T2/hu unknown
- 2012-04-20 CN CN201610137255.1A patent/CN105755044A/zh active Pending
- 2012-04-20 RS RS20170855A patent/RS56246B1/sr unknown
- 2012-04-20 CA CA3069946A patent/CA3069946C/en active Active
- 2012-04-20 EP EP21201945.9A patent/EP4005603A1/en active Pending
- 2012-04-20 SI SI201231780T patent/SI3254703T1/sl unknown
- 2012-04-20 LT LTEP17168534.0T patent/LT3254703T/lt unknown
- 2012-04-20 HU HUE12774323A patent/HUE034510T2/en unknown
- 2012-04-20 DK DK17168534.0T patent/DK3254703T3/da active
- 2012-04-20 CA CA2833870A patent/CA2833870C/en active Active
- 2012-04-20 PT PT171685340T patent/PT3254703T/pt unknown
- 2012-04-20 DK DK20151479.1T patent/DK3693025T3/da active
- 2012-04-20 HR HRP20220036TT patent/HRP20220036T1/hr unknown
- 2012-04-20 KR KR1020227013781A patent/KR20220056884A/ko not_active Application Discontinuation
- 2012-04-20 KR KR1020137030816A patent/KR102121355B1/ko active IP Right Grant
- 2012-04-20 US US14/113,205 patent/US9193956B2/en active Active
-
2013
- 2013-10-20 IL IL228976A patent/IL228976B/en active IP Right Grant
- 2013-10-24 ZA ZA2013/07968A patent/ZA201307968B/en unknown
-
2014
- 2014-07-28 US US14/444,375 patent/US20140364338A1/en not_active Abandoned
- 2014-12-11 ZA ZA2014/09129A patent/ZA201409129B/en unknown
-
2015
- 2015-01-27 US US14/606,543 patent/US9856539B2/en active Active
- 2015-04-30 US US14/701,063 patent/US9458517B2/en active Active
- 2015-11-11 US US14/938,154 patent/US9587282B2/en active Active
-
2016
- 2016-08-23 US US15/244,892 patent/US10214785B2/en active Active
- 2016-08-23 US US15/244,884 patent/US10202657B2/en active Active
- 2016-12-13 AU AU2016273850A patent/AU2016273850B2/en active Active
- 2016-12-28 JP JP2016254766A patent/JP2017113002A/ja active Pending
-
2017
- 2017-02-08 RU RU2017104094A patent/RU2742724C9/ru active
- 2017-09-05 HR HRP20171334TT patent/HRP20171334T1/hr unknown
- 2017-09-20 CY CY20171100993T patent/CY1119765T1/el unknown
-
2018
- 2018-06-11 HK HK18107536.6A patent/HK1247855A1/zh unknown
- 2018-09-25 AU AU2018236725A patent/AU2018236725B2/en active Active
- 2018-12-21 US US16/230,080 patent/US11236402B2/en active Active
-
2019
- 2019-12-02 JP JP2019217747A patent/JP2020028308A/ja not_active Withdrawn
-
2020
- 2020-05-11 HR HRP20200762TT patent/HRP20200762T1/hr unknown
- 2020-05-12 CY CY20201100437T patent/CY1122902T1/el unknown
- 2020-09-28 AU AU2020244399A patent/AU2020244399B2/en active Active
-
2021
- 2021-05-28 JP JP2021090666A patent/JP2021121638A/ja active Pending
- 2021-12-14 US US17/551,030 patent/US20220243291A1/en active Pending
-
2022
- 2022-01-12 CY CY20221100029T patent/CY1124905T1/el unknown
- 2022-07-05 JP JP2022108206A patent/JP2022125201A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2301260C2 (ru) * | 2000-09-22 | 2007-06-20 | Вирэкссис Корпорейшн | Вирусные векторы с зависимой от условий репликацией и их применение |
| WO2010093784A2 (en) * | 2009-02-11 | 2010-08-19 | The University Of North Carolina At Chapel Hill | Modified virus vectors and methods of making and using the same |
Non-Patent Citations (2)
| Title |
|---|
| PETRS-SILVA H. et al., "High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors", Mol Ther. 2009 Mar;17(3):463-71. PARK T.K. et al., "Intravitreal delivery of AAV8 retinoschisin results in cell type-specific gene expression and retinal rescue in the Rs1-KO mouse", Gene Ther. 2009 Jul;16(7):916-26. * |
| PETRS-SILVA H. et al., "High-efficiency transduction of the mouse retina by tyrosine-mutant AAV serotype vectors", Mol Ther. 2009 Mar;17(3):463-71. PARK T.K. et al., "Intravitreal delivery of AAV8 retinoschisin results in cell type-specific gene expression and retinal rescue in the Rs1-KO mouse", Gene Ther. 2009 Jul;16(7):916-26.RU 2301260 C2, 20.06.2007. * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2770922C2 (ru) * | 2017-09-20 | 2022-04-25 | 4Д Молекьюлар Терапьютикс Инк. | Капсиды вариантов аденоассоциированных вирусов и методы их применения |
| WO2020123868A1 (en) * | 2018-12-12 | 2020-06-18 | Tesseract Health, Inc. | Biometric identification and health status determination |
| RU2809389C2 (ru) * | 2019-04-24 | 2023-12-11 | Такара Байо Инк. | Мутант aav, обладающий способностью нацеливаться на головной мозг |
| US11737665B2 (en) | 2019-06-21 | 2023-08-29 | Tesseract Health, Inc. | Multi-modal eye imaging with shared optical path |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220243291A1 (en) | Adeno-Associated Virus Virions with Variant Capsid and Methods of Use Thereof | |
| AU2018290954B2 (en) | Adeno-associated virus virions with variant capsids and methods of use thereof | |
| KR20230043794A (ko) | 변이체 캡시드를 갖는 아데노-연관 바이러스 비리온 및 이의 사용 방법 |