JP5713402B2 - ポリアリーレンスルフィド及びその製造方法 - Google Patents
ポリアリーレンスルフィド及びその製造方法 Download PDFInfo
- Publication number
- JP5713402B2 JP5713402B2 JP2011514384A JP2011514384A JP5713402B2 JP 5713402 B2 JP5713402 B2 JP 5713402B2 JP 2011514384 A JP2011514384 A JP 2011514384A JP 2011514384 A JP2011514384 A JP 2011514384A JP 5713402 B2 JP5713402 B2 JP 5713402B2
- Authority
- JP
- Japan
- Prior art keywords
- polymerization
- alkali metal
- hydroxyl group
- polymer
- sulfur source
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/0209—Polyarylenethioethers derived from monomers containing one aromatic ring
- C08G75/0213—Polyarylenethioethers derived from monomers containing one aromatic ring containing elements other than carbon, hydrogen or sulfur
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/025—Preparatory processes
- C08G75/0254—Preparatory processes using metal sulfides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/025—Preparatory processes
- C08G75/0259—Preparatory processes metal hydrogensulfides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/025—Preparatory processes
- C08G75/0268—Preparatory processes using disulfides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/025—Preparatory processes
- C08G75/0272—Preparatory processes using other sulfur sources
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/02—Polythioethers
- C08G75/0204—Polyarylenethioethers
- C08G75/0286—Chemical after-treatment
- C08G75/029—Modification with organic compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G75/00—Macromolecular compounds obtained by reactions forming a linkage containing sulfur with or without nitrogen, oxygen, or carbon in the main chain of the macromolecule
- C08G75/14—Polysulfides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L81/00—Compositions of macromolecular compounds obtained by reactions forming in the main chain of the macromolecule a linkage containing sulfur with or without nitrogen, oxygen or carbon only; Compositions of polysulfones; Compositions of derivatives of such polymers
- C08L81/02—Polythioethers; Polythioether-ethers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L81/00—Compositions of macromolecular compounds obtained by reactions forming in the main chain of the macromolecule a linkage containing sulfur with or without nitrogen, oxygen or carbon only; Compositions of polysulfones; Compositions of derivatives of such polymers
- C08L81/04—Polysulfides
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Polymers With Sulfur, Phosphorus Or Metals In The Main Chain (AREA)
Description
(1)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させる重合工程;
(2)該重合工程後、該有機アミド溶媒及び該重合工程で生成したポリマーを含有する重合反応系内に、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物を、仕込み硫黄源100モルに対して、0.001〜20モルの割合で加えて、該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる反応工程;並びに、
(3)該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程;
を含むポリアリーレンスルフィドの製造方法が提供される。
また、本発明によれば、下記の工程:
(1)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させる重合工程;
(2)該重合工程後、該有機アミド溶媒及び該重合工程で生成したポリマーを含有する重合反応系内に、1個のヒドロキシル基を含有し、かつ、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物を、仕込み硫黄源100モルに対して、0.001〜20モルの割合で加えて、該生成ポリマーと該ヒドロキシル基含有有機化合物とを、170〜290℃の範囲内の温度で、かつ、5分間から3時間の範囲内の反応時間で反応させる反応工程;並びに、
(3)該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程;
を含むポリアリーレンスルフィドの製造方法であって、
該ヒドロキシル基含有有機化合物が、脂肪族アルコール、脂環式アルコール、及び芳香族アルコールからなる群より選ばれる少なくとも一種のヒドロキシル基含有有機化合物である製造方法が提供される。
(a)該ポリアリーレンスルフィドが、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物との反応生成物であって、その結合ハロゲン原子の少なくとも一部が該ヒドロキシル基含有有機化合物との反応により除去されたものであり、
(b)温度310℃及び剪断速度1,216sec−1で測定した溶融粘度が1〜100Pa・s、
(c)ゲルパーミエーションクロマトグラフィにより測定した重量平均分子量が10,000〜60,000、
(d)篩分法により測定した平均粒径が100〜1,000μm、並びに
(e)燃焼フラスコ法により測定した結合ハロゲン原子の含有量が4,000ppm未満
であるポリアリーレンスルフィドが提供される。
また、本発明によれば、有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させて得られたポリアリーレンスルフィドであって、
(a)該ポリアリーレンスルフィドが、重合反応後、1個のヒドロキシル基を含有し、かつ、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物との、170〜290℃の範囲内の温度、かつ、5分間から3時間の範囲内の反応時間の反応で得られた反応生成物であって、その結合ハロゲン原子の少なくとも一部が該ヒドロキシル基含有有機化合物との反応により除去されたものであり、その際、該ヒドロキシル基含有有機化合物が、脂肪族アルコール、脂環式アルコール、及び芳香族アルコールからなる群より選ばれる少なくとも一種のヒドロキシル基含有有機化合物であり、
(b)温度310℃及び剪断速度1,216sec −1 で測定した溶融粘度が1〜100Pa・s、
(c)ゲルパーミエーションクロマトグラフィにより測定した重量平均分子量が10,000〜60,000、
(d)篩分法により測定した平均粒径が100〜1,000μm、並びに
(e)燃焼フラスコ法により測定した結合ハロゲン原子の含有量が4,000ppm未満
であるポリアリーレンスルフィドが提供される。
本発明では、硫黄源としてアルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源を使用する。アルカリ金属硫化物としては、硫化リチウム、硫化ナトリウム、硫化カリウム、硫化ルビジウム、硫化セシウム、及びこれらの2種以上の混合物などを挙げることができる。アルカリ金属水硫化物としては、水硫化リチウム、水硫化ナトリウム、水硫化カリウム、水硫化ルビジウム、水硫化セシウム、及びこれらの2種以上の混合物などを挙げることができる。
本発明で使用するジハロ芳香族化合物は、芳香環に直接結合した2個のハロゲン原子を有するジハロゲン化芳香族化合物である。ジハロ芳香族化合物の具体例としては、例えば、o−ジハロベンゼン、m−ジハロベンゼン、p−ジハロベンゼン、ジハロトルエン、ジハロナフタレン、メトキシ−ジハロベンゼン、ジハロビフェニル、ジハロ安息香酸、ジハロジフェニルエーテル、ジハロジフェニルスルホン、ジハロジフェニルスルホキシド、ジハロジフェニルケトン等が挙げられる。これらの中でも、p−ジハロベンゼン、m−ジハロベンゼン、及びこれら両者の混合物が好ましく、p−ジハロベンゼンがより好ましい。
生成PASに分岐または架橋構造を導入するために、3個以上のハロゲン原子が結合したポリハロ化合物(必ずしも芳香族化合物でなくてもよい)、活性水素含有ハロゲン化芳香族化合物、ハロゲン化芳香族ニトロ化合物等を併用することができる。分岐・架橋剤としてのポリハロ化合物として、好ましくはトリハロベンゼンが挙げられる。
本発明では、脱水反応及び重合反応の溶媒として、非プロトン性極性有機溶媒である有機アミド溶媒を用いる。有機アミド溶媒は、高温でアルカリに対して安定なものが好ましい。有機アミド溶媒の具体例としては、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド等のアミド化合物;N−メチル−ε−カプロラクタム等のN−アルキルカプロラクタム化合物;N−メチル−2−ピロリドン、N−シクロヘキシル−2−ピロリドン等のN−アルキルピロリドン化合物またはN−シクロアルキルピロリドン化合物;1,3−ジアルキル−2−イミダゾリジノン等のN,N−ジアルキルイミダゾリジノン化合物;テトラメチル尿素等のテトラアルキル尿素化合物;ヘキサメチルリン酸トリアミド等のヘキサアルキルリン酸トリアミド化合物等が挙げられる。これらの有機アミド溶媒は、それぞれ単独で用いてもよいし、2種類以上を組み合わせて用いてもよい。
本発明では、重合反応を促進させるために、必要に応じて、各種重合助剤を用いることができる。重合助剤の具体例としては、一般にPASの重合助剤として公知の水、有機カルボン酸金属塩、有機スルホン酸金属塩、ハロゲン化リチウムなどのアルカリ金属ハライド、アルカリ土類金属ハライド、芳香族カルボン酸のアルカリ土類金属塩、リン酸アルカリ金属塩、アルコール類、パラフィン系炭化水素類、及びこれらの2種以上の混合物などが挙げられる。有機カルボン酸金属塩としては、アルカリ金属カルボン酸塩が好ましい。アルカリ金属カルボン酸塩としては、例えば、酢酸リチウム、酢酸ナトリウム、酢酸カリウム、プロピオン酸ナトリウム、吉草酸リチウム、安息香酸リチウム、安息香酸ナトリウム、フェニル酢酸ナトリウム、p−トルイル酸カリウム、及びこれらの2種以上の混合物を挙げることができる。アルカリ金属カルボン酸塩としては、安価で入手しやすいことから、酢酸ナトリウムが特に好ましい。重合助剤の使用量は、化合物の種類により異なるが、仕込み硫黄源1モルに対し、通常0.01〜10モル、好ましくは0.1〜2モル、より好ましくは0.2〜1.8モル、特に好ましくは0.3〜1.7モルの範囲内である。重合助剤が、有機カルボン酸金属塩、有機スルホン酸塩、及びアルカリ金属ハライドである場合には、その使用量の上限は、仕込み硫黄源1モルに対し、好ましくは1モル以下、より好ましくは0.8モル以下であることが望ましい。
本発明では、重合反応を促進させ、高重合度のPASを短時間で得るために、各種相分離剤を用いることが好ましい。相分離剤とは、それ自身でまたは少量の水の共存下に、有機アミド溶媒に溶解し、PASの有機アミド溶媒に対する溶解性を低下させる作用を有する化合物である。相分離剤自体は、PASの溶媒ではない化合物である。
重合工程の前工程として、脱水工程を配置して反応系内の水分量を調節することが好ましい。脱水工程は、望ましくは不活性ガス雰囲気下、有機アミド溶媒とアルカリ金属硫化物とを含む混合物を加熱して反応させ、蒸留により水を系外へ排出する方法により実施する。硫黄源としてアルカリ金属水硫化物を用いる場合には、アルカリ金属水硫化物とアルカリ金属水酸化物とを含む混合物を加熱して反応させ、蒸留により水を系外へ排出する方法により実施する。
本発明では、脱水工程後、系内に残存する混合物に、必要に応じてアルカリ金属水酸化物及び水を添加することができる。特に、硫黄源としてアルカリ金属水硫化物を用いる場合には、脱水時に生成した硫化水素に伴い生成するアルカリ金属水酸化物のモル数と脱水前に添加したアルカリ金属水酸化物のモル数と脱水後に添加するアルカリ金属水酸化物のモル数の総モル数が、硫黄源として脱水後に系内に存在するアルカリ金属水硫化物を含む仕込み硫黄源1モル当たり好ましくは1.00〜1.09モル、より好ましくは1.00超過1.09モル以下となり、かつ、水のモル数が仕込み硫黄源1モル当たり通常0.02〜2.0モル、好ましくは0.05〜2.0モル、より好ましくは0.5〜2.0モルとなるように調整することが望ましい。仕込み硫黄源の量は、[仕込み硫黄源]=[総仕込み硫黄モル]−[脱水後の揮散硫黄モル]の式により算出される。
重合工程は、脱水工程終了後の混合物にジハロ芳香族化合物を仕込み、有機アミド溶媒中で硫黄源とジハロ芳香族化合物を加熱することにより行われる。脱水工程で用いた反応槽とは異なる重合槽を使用する場合には、重合槽に脱水工程後の混合物とジハロ芳香族化合物を投入する。脱水工程後、重合工程前には、必要に応じて、有機アミド溶媒量や共存水分量などの調整を行ってもよい。また、重合工程前または重合工程中に、重合助剤その他の添加物を混合してもよい。
i)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
ii)相分離剤の存在下、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含む少なくとも2段階の重合工程により重合反応を行うことが好ましい。
I)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを、仕込み硫黄源1モル当たり0.02〜2.0モルの水が存在する状態で、170〜270℃の温度で重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
II)仕込み硫黄源1モル当たり2.0モル超過10モル以下の水が存在する状態となるように重合反応系内の水分量を調整するとともに、245〜290℃の温度に加熱することにより、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含む少なくとも2段階の重合工程により重合反応を行うことがより好ましい。
(1)有機アミド溶媒と硫黄源とジハロ芳香族化合物と所定モル比のアルカリ金属水酸化物とを含有する反応混合物を、仕込み硫黄源1モルに対して、通常0.02〜2.0モル、好ましくは0.05〜2.0モル、より好ましくは0.5〜2.0モルの水の存在下に、170〜270℃に加熱して重合反応を行い、ジハロ芳香族化合物の転化率80〜99%でポリマーを生成させる前段重合工程;及び
(2)仕込み硫黄源1モル当たり2.0モルを超え、10モル以下の水が存在する状態となるように反応系内の水量を調整するとともに、245〜290℃に加熱して、重合反応を継続する後段重合工程;
を含む少なくとも2段階の重合工程により重合反応を行うことが好ましい。後段重合工程では、相分離剤として水を使用することが好ましいが、水に代えて、あるいは水と共に他の相分離剤(重合助剤;例えば、有機カルボン酸金属塩)を、仕込み硫黄源1モル当り、好ましくは0.01〜3モルの範囲内で用いることができる。
転化率=[〔DHA仕込み量(モル)−DHA残存量(モル)〕/〔DHA仕込み量(モル)−DHA過剰量(モル)〕]×100
によって転化率を算出する。それ以外の場合には、下記式
転化率=[〔DHA仕込み量(モル)−DHA残存量(モル)〕/〔DHA仕込み量(モル)〕]×100
によって転化率を算出する。
本発明では、前記の如き重合工程の後、有機アミド溶媒及び生成ポリマーを含有する重合反応系内に、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物を、仕込み硫黄源100モルに対して、0.01〜20モルの割合で加えて、該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる反応工程を配置する。この反応工程後に、重合反応系内からポリマーを取得する回収工程を配置する。
i)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
ii)相分離剤の存在下、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含み、
該反応工程が、該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程であり、かつ、
該回収工程が、該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程である製造方法を挙げることができる。
I)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを、仕込み硫黄源1モル当たり、通常0.02〜2.0モル、好ましくは0.05〜2.0モル、より好ましくは0.5〜2.0モルの水が存在する状態で、170〜270℃の温度で重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
II)仕込み硫黄源1モル当たり2.0モル超過10モル以下の水が存在する状態となるように重合反応系内の水分量を調整するとともに、245〜290℃の温度に加熱することにより、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含み、
該反応工程が、該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程であり、かつ、
該回収工程が、該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程である製造方法を挙げることができる。後段重合工程では、相分離剤として水を使用することが好ましいが、水に代えて、あるいは水と共に他の相分離剤(重合助剤;例えば、有機カルボン酸金属塩)を、仕込み硫黄源1モル当り、好ましくは0.01〜3モルの範囲内で用いることができる。
1)有機アミド溶媒、アルカリ金属水硫化物を含有する硫黄源、及び該アルカリ金属水硫化物1モル当たり0.95〜1.05モルのアルカリ金属水酸化物を含有する混合物を加熱して、該混合物を含有する系内から水を含む留出物の少なくとも一部を系外に排出する脱水工程;
2)脱水工程の後、系内に残存する混合物に、必要に応じてアルカリ金属水酸化物及び水を添加して、脱水時に生成した硫化水素に伴い生成するアルカリ金属水酸化物のモル数と脱水前に添加したアルカリ金属水酸化物のモル数と脱水後に添加するアルカリ金属水酸化物のモル数の総モル数が、脱水工程後に系内に存在する仕込み硫黄源1モル当たり1.00〜1.09モル、好ましくは1.00モル超過1.09モル以下となり、かつ、水のモル数が該仕込み硫黄源1モル当たり、通常0.02〜2.0モル、好ましくは0.05〜2.0モル、より好ましくは0.5〜2.0モルとなるように調整する仕込み工程;
3)該混合物にジハロ芳香族化合物を添加し、有機アミド溶媒中で硫黄源とジハロ芳香族化合物とを170〜270℃の温度で重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;
4)仕込み硫黄源1モル当たり2.0モル超過10モル以下の水が存在する状態となるように重合反応系内の水量を調整するとともに、245〜290℃の温度に加熱することにより、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
5)該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程;並びに、
6)該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程;
を含む製造方法を挙げることができる。後段重合工程では、相分離剤として水を使用することが好ましいが、水に代えて、あるいは水と共に他の相分離剤(重合助剤;例えば、有機カルボン酸金属塩)を、仕込み硫黄源1モル当り、好ましくは0.01〜3モルの範囲内で用いることができる。
本発明の製造方法において、反応後の後処理は、通常の重合反応後の後処理工程と同様の方法により行うことができる。例えば、反応終了後、冷却した生成物スラリーをそのまま、あるいは水などで希釈してから、濾別し、次いで、洗浄と濾過を繰り返してから、乾燥することにより、PASを回収することができる。洗浄は、水洗、有機溶媒洗浄、酸洗浄などを適宜組み合わせて、副生アルカリ金属塩やオリゴマーが残存しなくなるまで行うことが好ましい。
本発明の製造方法によれば、主として末端ハロゲン基からなる結合ハロゲン原子の含有量(単に「ハロゲン含有量」ともいう)が低減したPASを製造することができる。結合ハロゲン原子の含有量は、通常4,000ppm未満、好ましくは3,900ppm以下、より好ましくは3,800ppm以下である。多くの場合、結合ハロゲン原子の含有量を2,000ppm以下、さらには1,500ppm以下にまで低減させることができる。結合ハロゲン原子の含有量の下限値は、通常50ppm、多くの場合100ppmまたは200ppmである。
(a)ポリマー鎖末端のハロゲン原子の少なくとも一部がヒドロキシル基含有有機化合物との反応により除去されており、
(b)温度310℃及び剪断速度1,216sec−1で測定した溶融粘度が1〜100Pa・s、
(c)ゲルパーミエーションクロマトグラフィにより測定した重量平均分子量が10,000〜60,000、
(d)篩分法により測定した平均粒径が100〜1,000μm、並びに
(e)燃焼フラスコ法により測定した結合ハロゲン原子の含有量が4,000ppm未満
であるポリアリーレンスルフィドを得ることができる。
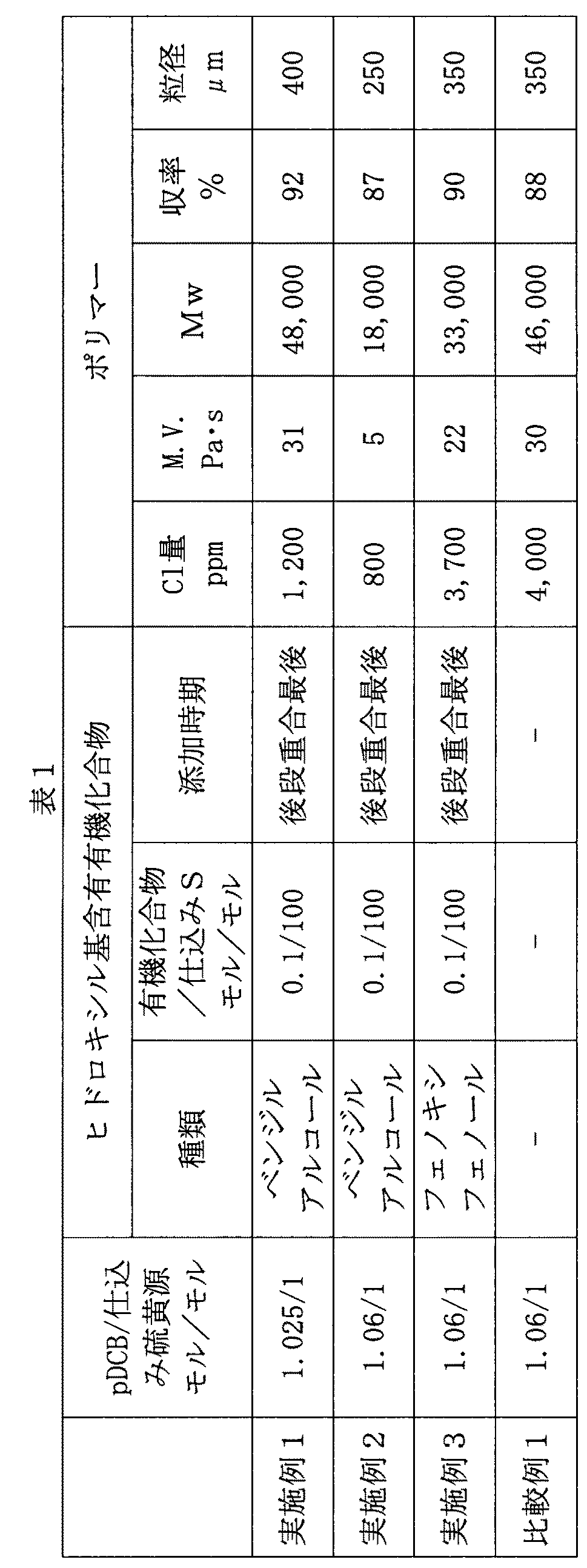
反応後、反応混合物を目開き径の異なる複数のスクリーンで篩別して分別し、洗浄した。目開き径150μm(100メッシュ)のスクリーンで捕集したものを「粒状ポリマー」とした。粒状ポリマーの収率は、脱水工程後の反応缶中に存在する仕込み硫黄源中の有効硫黄成分の全てがポリマーに転換したと仮定したときのポリマー質量(理論量)を基準とした。仕込み硫黄源がジハロ芳香族化合物よりも過剰のモル比で仕込まれた場合は、仕込み硫黄源の全てがポリマーに転換することはあり得ない場合もあるが、その場合でも、一応仕込み硫黄源の量を基準として収率を算出することとする。
回収したポリマーの平均粒径は、使用篩として、メッシュ#7(目開き径2,800μm)、#12(目開き径1,410μm)、#16(目開き径1,000μm)、#24(目開き径710μm)、#32(目開き径500μm)、#60(目開き径250μm)、#100(目開き径150μm)、#145(目開き径105μm)、#200(目開き径75μm)を用いた篩分法により測定した。
洗浄により副生アルカリ金属塩の全てを実質的に除去したポリマー試料を用いて、燃焼フラスコ法によりハロゲン(塩素)原子の含有量の測定を行った。
ポリマーの重量平均分子量(Mw)は、株式会社センシュー科学製の高温ゲルパーミエーションクロマトグラフ(GPC)SSC−7000を用いて、以下の条件で測定した。重量平均分子量は、ポリスチレン換算値として算出した。
温度: 210℃、
検出器: UV検出器(360nm)、
サンプル注入量: 200μl(濃度:0.05質量%)、
流速: 0.7ml/分、
標準ポリスチレン: 616,000、113,000、26,000、8,200、及び600の5種類の標準ポリスチレン。
乾燥した粒状ポリマー約20gを用いて、東洋精機製キャピログラフ1−C(登録商標)により溶融粘度を測定した。キャピラリーとして1mmφ×10mmLのフラットダイを使用し、設定温度を310℃とした。ポリマー試料を装置内に導入し、5分間保持した後、剪断速度1,216sec−1で溶融粘度を測定した。
20リットルのオートクレーブに、N−メチル−2−ピロリドン(以下、「NMP」と略記)5,999g、水硫化ナトリウム(NaSH;純度62質量%、Na2Sを15g含む)2,000g、水酸化ナトリウム(NaOH;純度73.5質量%)1,192gを仕込んだ。水酸化ナトリウム/硫黄源(NaOH/S)のモル比は、0.978であり、NaOH/NaSHのモル比は、0.990であった。これら各純度の水硫化ナトリウム及び水酸化ナトリウムは、残りの成分として、水和水などの水分を含有するものである。
20リットルのオートクレーブに、N−メチル−2−ピロリドン(NMP)6,002g、水硫化ナトリウム(NaSH;純度62質量%、Na2Sを25g含む)2,000g、水酸化ナトリウム(NaOH;純度73.5質量%)1,188gを仕込んだ。水酸化ナトリウム/硫黄源(NaOH/S)のモル比は、0.967であり、NaOH/NaSHのモル比は、0.987であった。
比較例1と同じ条件で、前段重合及び後段重合を行った。後段重合終了後、反応系内に、仕込み硫黄源100モルに対して0.1モルのベンジルアルコールをポンプで圧入し、さらに1時間反応させた。反応系を室温付近まで冷却してから、内容物を比較例1と同様の条件で処理した。このようにして得られた粒状ポリマーは、その収率が87%、平均粒子径が250μm、溶融粘度が5Pa・s、重量平均分子量Mwが18,000であり、塩素含有量が800ppmであった。結果を表1に示す。
比較例1と同じ条件で、前段重合及び後段重合を行った。後段重合終了後、反応系内に、仕込み硫黄源100モルに対して0.1モルのフェノキシフェノールをポンプで圧入し、さらに1時間反応させた。反応系を室温付近まで冷却してから、内容物を比較例1と同様の条件で処理した。このようにして得られた粒状ポリマーは、その収率が90%、平均粒子径が350μm、溶融粘度が22Pa・s、重量平均分子量Mwが33,000であり、塩素含有量が3,700ppmであった。結果を表1に示す。
Claims (13)
- 下記の工程:
(1)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させる重合工程;
(2)該重合工程後、該有機アミド溶媒及び該重合工程で生成したポリマーを含有する重合反応系内に、1個のヒドロキシル基を含有し、かつ、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物を、仕込み硫黄源100モルに対して、0.001〜20モルの割合で加えて、該生成ポリマーと該ヒドロキシル基含有有機化合物とを、170〜290℃の範囲内の温度で、かつ、5分間から3時間の範囲内の反応時間で反応させる反応工程;並びに、
(3)該反応工程後、該反応工程で生成したポリマーを含有する重合反応系内から該ポリマーを回収する回収工程;
を含むポリアリーレンスルフィドの製造方法であって、
該ヒドロキシル基含有有機化合物が、脂肪族アルコール、脂環式アルコール、及び芳香族アルコールからなる群より選ばれる少なくとも一種のヒドロキシル基含有有機化合物である製造方法。 - 該重合工程が、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物との重合反応開始後、相分離剤の存在下、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる相分離重合工程を含み、かつ、
該反応工程が、該相分離重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程である
請求項1記載の製造方法。 - 該重合工程が、
i)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
ii)相分離剤の存在下、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含み、かつ、
該反応工程が、該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程である
請求項1記載の製造方法。 - 該重合工程が、
I)有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを、仕込み硫黄源1モル当たり0.02〜2.0モルの水が存在する状態で、170〜270℃の温度で重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
II)仕込み硫黄源1モル当たり2.0モル超過10モル以下の水が存在する状態となるように重合反応系内の水分量を調整するとともに、245〜290℃の温度に加熱することにより、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含み、かつ、
該反応工程が、該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程である
請求項1記載の製造方法。 - 該重合工程に先立って、
1)有機アミド溶媒、アルカリ金属水硫化物を含有する硫黄源、及び該アルカリ金属水硫化物1モル当たり0.95〜1.05モルのアルカリ金属水酸化物を含有する混合物を加熱して、該混合物を含有する系内から水を含む留出物の少なくとも一部を系外に排出する脱水工程;並びに、
2)脱水工程の後、系内に残存する混合物に、必要に応じてアルカリ金属水酸化物及び水を添加して、脱水時に生成した硫化水素に伴い生成するアルカリ金属水酸化物のモル数と脱水前に添加したアルカリ金属水酸化物のモル数と脱水後に添加するアルカリ金属水酸化物のモル数の総モル数が、脱水工程後に系内に存在する仕込み硫黄源1モル当たり1.00〜1.09モルとなり、かつ、水のモル数が該仕込み硫黄源1モル当たり0.02〜2.0モルとなるように調整する仕込み工程;
を配置し、
該重合工程が、
3)該混合物にジハロ芳香族化合物を添加し、有機アミド溶媒中で硫黄源とジハロ芳香族化合物とを170〜270℃の温度で重合反応させて、該ジハロ芳香族化合物の転化率が80〜99%のポリマーを生成させる前段重合工程;並びに、
4)仕込み硫黄源1モル当たり2.0モル超過10モル以下の水が存在する状態となるように重合反応系内の水量を調整するとともに、245〜290℃の温度に加熱することにより、重合反応系内に生成ポリマー濃厚相と生成ポリマー希薄相とが混在する相分離状態で重合反応を継続させる後段重合工程;
を含み、かつ、
該反応工程が、該後段重合工程後、相分離状態にある重合反応系内に、該ヒドロキシル基含有有機化合物を加えて、相分離状態を維持させながら該生成ポリマーと該ヒドロキシル基含有有機化合物とを反応させる工程である
請求項1記載の製造方法。 - 該重合工程において、仕込み硫黄源1モルに対して、1.00モル超過1.09モル以下のジハロ芳香族化合物を反応させる請求項1記載の製造方法。
- 該反応工程において、該重合工程後、有機アミド溶媒及び該重合工程で生成したポリマーを含有する重合反応系内に該ヒドロキシル基含有有機化合物を添加した後、170〜290℃の範囲内の温度で、5分間から3時間の範囲内の反応時間で、該生成ポリマーと該ヒドロキシル基含有有機化合物との反応を行う請求項1記載の製造方法。
- 該回収工程において、温度310℃及び剪断速度1,216sec−1で測定した溶融粘度が1〜100Pa・s、ゲルパーミエーションクロマトグラフィにより測定した重量平均分子量が10,000〜60,000、篩分法により測定した平均粒径が100〜1,000μm、並びに燃焼フラスコ法により測定した結合ハロゲン原子の含有量が4,000ppm未満のポリアリーレンスルフィドを回収する請求項1記載の製造方法。
- 該ヒドロキシル基含有有機化合物が、沸点が100℃以上のヒドロキシル基含有有機化合物である請求項1記載の製造方法。
- 該ヒドロキシル基含有有機化合物が、ベンジルアルコール、o−トリルメタノール、m−トリルメタノール、p−トリルメタノール、p−イソプロピルベンジルアルコール、1−フェニルエタノール、2−フェニルエタノール、1−フェニル−1−プロパノール、1−フェニル−2−プロパノール、及び3−フェニル−1−プロパノールからなる群より選ばれる少なくとも一種の芳香族アルコールである請求項1記載の製造方法。
- 有機アミド溶媒中で、アルカリ金属硫化物及びアルカリ金属水硫化物からなる群より選ばれる少なくとも一種の硫黄源とジハロ芳香族化合物とを重合反応させて得られたポリアリーレンスルフィドであって、
(a)該ポリアリーレンスルフィドが、重合反応後、1個のヒドロキシル基を含有し、かつ、結合ハロゲン原子を含有しないヒドロキシル基含有有機化合物との、170〜290℃の範囲内の温度、かつ、5分間から3時間の範囲内の反応時間の反応で得られた反応生成物であって、その結合ハロゲン原子の少なくとも一部が該ヒドロキシル基含有有機化合物との反応により除去されたものであり、その際、該ヒドロキシル基含有有機化合物が、脂肪族アルコール、脂環式アルコール、及び芳香族アルコールからなる群より選ばれる少なくとも一種のヒドロキシル基含有有機化合物であり、
(b)温度310℃及び剪断速度1,216sec−1で測定した溶融粘度が1〜100Pa・s、
(c)ゲルパーミエーションクロマトグラフィにより測定した重量平均分子量が10,000〜60,000、
(d)篩分法により測定した平均粒径が100〜1,000μm、並びに
(e)燃焼フラスコ法により測定した結合ハロゲン原子の含有量が4,000ppm未満
であるポリアリーレンスルフィド。 - 結合ハロゲン原子の含有量が、3,900ppm以下である請求項11記載のポリアリーレンスルフィド。
- 結合ハロゲン原子の含有量が、2,000ppm以下である請求項11記載のポリアリーレンスルフィド。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2011514384A JP5713402B2 (ja) | 2009-05-18 | 2010-05-11 | ポリアリーレンスルフィド及びその製造方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009119841 | 2009-05-18 | ||
| JP2009119841 | 2009-05-18 | ||
| PCT/JP2010/057931 WO2010134445A1 (ja) | 2009-05-18 | 2010-05-11 | ポリアリーレンスルフィド及びその製造方法 |
| JP2011514384A JP5713402B2 (ja) | 2009-05-18 | 2010-05-11 | ポリアリーレンスルフィド及びその製造方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2010134445A1 JPWO2010134445A1 (ja) | 2012-11-08 |
| JP5713402B2 true JP5713402B2 (ja) | 2015-05-07 |
Family
ID=43126126
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011514384A Expired - Fee Related JP5713402B2 (ja) | 2009-05-18 | 2010-05-11 | ポリアリーレンスルフィド及びその製造方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US8530605B2 (ja) |
| EP (1) | EP2433977A4 (ja) |
| JP (1) | JP5713402B2 (ja) |
| KR (1) | KR101287729B1 (ja) |
| CN (1) | CN102428122B (ja) |
| WO (1) | WO2010134445A1 (ja) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5781086B2 (ja) * | 2010-11-26 | 2015-09-16 | 株式会社クレハ | ポリアリーレンスルフィドの製造方法、及びポリアリーレンスルフィド |
| KR101934139B1 (ko) | 2011-09-20 | 2018-12-31 | 티코나 엘엘씨 | 폴리아릴렌 설파이드/액정 중합체 얼로이 및 이를 포함하는 조성물 |
| CN103987758B (zh) | 2011-09-20 | 2016-06-08 | 提克纳有限责任公司 | 便携式电子设备的壳体 |
| EP2758463A2 (en) | 2011-09-20 | 2014-07-30 | Ticona LLC | Low chlorine filled melt processed polyarylene sulfide composition |
| WO2013043566A2 (en) | 2011-09-20 | 2013-03-28 | Ticona Llc | Overmolded composite structure for an electronic device |
| US8921513B2 (en) | 2011-09-20 | 2014-12-30 | Ticona Llc | Low halogen content disulfide washed polyarylene sulfide |
| JP6207809B2 (ja) * | 2012-02-29 | 2017-10-04 | Dic株式会社 | ポリアリーレンサルファイド樹脂組成物およびその成形体 |
| US9394430B2 (en) | 2012-04-13 | 2016-07-19 | Ticona Llc | Continuous fiber reinforced polyarylene sulfide |
| KR101598792B1 (ko) * | 2013-03-25 | 2016-03-02 | 디아이씨 가부시끼가이샤 | 폴리아릴렌설피드 수지의 제조 방법 및 폴리아릴렌설피드 수지 조성물 |
| JP6684206B2 (ja) | 2013-09-25 | 2020-04-22 | ティコナ・エルエルシー | ポリアリーレンスルフィドの形成中における塩副生成物の分離 |
| WO2015047719A1 (en) | 2013-09-25 | 2015-04-02 | Ticona Llc | Method of polyarylene sulfide crystallization |
| US9562139B2 (en) | 2013-09-25 | 2017-02-07 | Ticona Llc | Process for forming low halogen content polyarylene sulfides |
| WO2015047718A1 (en) | 2013-09-25 | 2015-04-02 | Ticona Llc | Multi-stage process for forming polyarylene sulfides |
| WO2015047717A1 (en) | 2013-09-25 | 2015-04-02 | Ticona Llc | Method and system for separation of a polymer from multiple compounds |
| JP2016536377A (ja) | 2013-09-25 | 2016-11-24 | ティコナ・エルエルシー | ポリアリーレンスルフィドを形成するためのスクラビングプロセス |
| JP6374030B2 (ja) * | 2014-12-29 | 2018-08-15 | 株式会社クレハ | ポリアリーレンスルフィドの製造方法、及びポリアリーレンスルフィド |
| JP6803844B2 (ja) | 2015-02-19 | 2020-12-23 | ティコナ・エルエルシー | 低粘度のポリアリーレンスルフィドを形成する方法 |
| WO2016133740A1 (en) | 2015-02-19 | 2016-08-25 | Ticona Llc | Method of polyarylene sulfide precipitation |
| WO2016133739A1 (en) | 2015-02-19 | 2016-08-25 | Ticona Llc | Method for forming a high molecular weight polyarylene sulfide |
| JP6783242B2 (ja) | 2015-03-25 | 2020-11-11 | ティコナ・エルエルシー | 高溶融粘度のポリアリーレンスルフィドを形成する方法 |
| CN107636045B (zh) * | 2015-06-12 | 2020-02-18 | 株式会社吴羽 | 制造粒状聚亚芳基硫醚的方法、以及粒状聚亚芳基硫醚 |
| JP6751580B2 (ja) * | 2016-03-31 | 2020-09-09 | 株式会社クレハ | 粒状ポリアリーレンスルフィドの製造方法、粒状ポリアリーレンスルフィドの平均粒子径増大方法、粒状ポリアリーレンスルフィドの粒子強度向上方法、及び粒状ポリアリーレンスルフィド |
| JP6668506B2 (ja) * | 2017-10-12 | 2020-03-18 | 株式会社クレハ | 重合体の連続製造装置および連続製造方法 |
| US11407861B2 (en) | 2019-06-28 | 2022-08-09 | Ticona Llc | Method for forming a polyarylene sulfide |
| KR102709321B1 (ko) * | 2019-12-11 | 2024-09-24 | 디아이씨 가부시끼가이샤 | 폴리아릴렌설파이드, 그 정제 방법 및 제조 방법 |
| US11319441B2 (en) | 2019-12-20 | 2022-05-03 | Ticona Llc | Method for forming a polyarylene sulfide |
| US20230192958A1 (en) * | 2020-05-22 | 2023-06-22 | Kureha Corporation | Polyarylene sulfide production method |
| CN111690137A (zh) * | 2020-06-19 | 2020-09-22 | 四川中科兴业高新材料有限公司 | 一种特种可消毒重复使用熔喷布材料及其制备方法 |
| EP4206259A4 (en) * | 2020-08-27 | 2024-10-23 | Toray Industries, Inc. | PROCESS FOR PRODUCING POLY(ARYLENE SULFIDE), PROCESS FOR PRODUCING COPOLYMER OF POLY(ARYLENE SULFIDE) AND POLY(ARYLENE SULFIDE) |
| WO2023038889A1 (en) | 2021-09-08 | 2023-03-16 | Ticona Llc | Extraction technique for recovering an organic solvent from a polyarylene sulfide waste sludge |
| WO2023038887A1 (en) | 2021-09-08 | 2023-03-16 | Ticona Llc | Anti-solvent technique for recovering an organic solvent from a polyarylene sulfide waste sludge |
| CN118510875A (zh) | 2022-02-04 | 2024-08-16 | 西姆莱斯股份公司 | 一种香料混合物 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS617332A (ja) | 1984-06-20 | 1986-01-14 | Kureha Chem Ind Co Ltd | 高分子量ポリアリ−レンスルフイドの製造法 |
| US4645826A (en) | 1984-06-20 | 1987-02-24 | Kureha Kagaku Kogyo Kabushiki Kaisha | Process for production of high to ultra-high molecular weight linear polyarylenesulfides |
| US4820801A (en) | 1985-11-02 | 1989-04-11 | Tosoh Corp. | Polyphenylene sulfide containing covalently bonded chlorine in a reduced amount |
| JPH0629320B2 (ja) | 1985-11-02 | 1994-04-20 | 東ソー株式会社 | ポリフエニレンスルフイドおよびその製造方法 |
| DE3601215A1 (de) | 1986-01-17 | 1987-07-23 | Bayer Ag | Polyarylensulfide mit definiert einstellbaren schmelzviskositaeten |
| JPS6333775A (ja) | 1986-07-28 | 1988-02-13 | シャープ株式会社 | ライトボックス |
| JPH02209925A (ja) * | 1989-02-10 | 1990-08-21 | Tonen Corp | ポリアリーレンサルフアイドの鎖延長方法 |
| DE69222997T2 (de) | 1991-08-06 | 1998-04-30 | Tosoh Corp | Verfahren zur Herstellung von Polyarylensulfid |
| JP3216228B2 (ja) | 1991-08-06 | 2001-10-09 | 東ソー株式会社 | ポリアリーレンスルフィドの製造方法 |
| JPH069780A (ja) * | 1992-03-27 | 1994-01-18 | Kureha Chem Ind Co Ltd | 無水フタル酸基含有ポリアリーレンチオエーテルの製造方法 |
| JP4256506B2 (ja) * | 1998-12-24 | 2009-04-22 | 株式会社クレハ | ポリアリーレンスルフィドの製造方法 |
| JP2004123958A (ja) * | 2002-10-04 | 2004-04-22 | Idemitsu Petrochem Co Ltd | ポリアリーレンスルフィドの製造方法 |
| ATE407166T1 (de) * | 2002-12-27 | 2008-09-15 | Kureha Corp | Polyarylensulfid und dessen herstellungsverfahren |
| CN102105512B (zh) | 2008-07-22 | 2013-01-23 | 株式会社吴羽 | 末端卤基含量降低了的聚芳撑硫醚的制造方法 |
-
2010
- 2010-05-11 KR KR1020117027472A patent/KR101287729B1/ko not_active Expired - Fee Related
- 2010-05-11 CN CN2010800217526A patent/CN102428122B/zh not_active Expired - Fee Related
- 2010-05-11 US US13/320,484 patent/US8530605B2/en active Active
- 2010-05-11 WO PCT/JP2010/057931 patent/WO2010134445A1/ja not_active Ceased
- 2010-05-11 JP JP2011514384A patent/JP5713402B2/ja not_active Expired - Fee Related
- 2010-05-11 EP EP10777678.3A patent/EP2433977A4/en not_active Withdrawn
Also Published As
| Publication number | Publication date |
|---|---|
| KR101287729B1 (ko) | 2013-07-19 |
| EP2433977A4 (en) | 2015-08-12 |
| EP2433977A1 (en) | 2012-03-28 |
| US8530605B2 (en) | 2013-09-10 |
| JPWO2010134445A1 (ja) | 2012-11-08 |
| KR20120009498A (ko) | 2012-01-31 |
| CN102428122A (zh) | 2012-04-25 |
| CN102428122B (zh) | 2013-08-21 |
| US20120065361A1 (en) | 2012-03-15 |
| WO2010134445A1 (ja) | 2010-11-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5713402B2 (ja) | ポリアリーレンスルフィド及びその製造方法 | |
| JP5731196B2 (ja) | 末端ハロゲン基含量が低減されたポリアリーレンスルフィドの製造方法 | |
| JP5623277B2 (ja) | 粒状ポリアリーレンスルフィドの製造方法 | |
| JP4777610B2 (ja) | ポリアリーレンスルフィド及びその製造方法 | |
| JP6517337B2 (ja) | 粒状ポリアリーレンスルフィドを製造する方法、及び粒状ポリアリーレンスルフィド | |
| JP4310279B2 (ja) | ポリアリーレンスルフィドの製造方法及び洗浄方法、並びに洗浄に使用した有機溶媒の精製方法 | |
| CN101048443B (zh) | 聚芳撑硫醚的制造方法 | |
| JP6419311B2 (ja) | 微粉ポリアリーレンスルフィドを製造する方法及び微粉ポリアリーレンスルフィド | |
| JP2007314803A (ja) | ポリアリーレンスルフィドの製造方法 | |
| US11661482B2 (en) | Separation and purification method of polyarylene sulfide | |
| JP6456742B2 (ja) | 微粉ポリアリーレンスルフィドを製造する製造方法及び微粉ポリアリーレンスルフィド | |
| JP6366683B2 (ja) | 熱処理微粉ポリアリーレンスルフィド、及び該熱処理微粉ポリアリーレンスルフィドを製造する製造方法 | |
| US11597800B2 (en) | Separation and recovery method of polyarlene sulfide | |
| WO2020121785A1 (ja) | ポリアリーレンスルフィドの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130228 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140603 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140728 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150203 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20150220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20150223 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150223 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150305 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5713402 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |