JP5426552B2 - Gsk−3阻害剤としてのシアノアミノキノロン及びテトラゾロアミノキノロン - Google Patents
Gsk−3阻害剤としてのシアノアミノキノロン及びテトラゾロアミノキノロン Download PDFInfo
- Publication number
- JP5426552B2 JP5426552B2 JP2010524862A JP2010524862A JP5426552B2 JP 5426552 B2 JP5426552 B2 JP 5426552B2 JP 2010524862 A JP2010524862 A JP 2010524862A JP 2010524862 A JP2010524862 A JP 2010524862A JP 5426552 B2 JP5426552 B2 JP 5426552B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- alkyl
- aryl
- pharmaceutically acceptable
- heteroaryl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 0 *C1(*)N(C=C(C(c2c(c(F)c3NCCCc4ncccc4)N)=O)C#N)c2c3OC1 Chemical compound *C1(*)N(C=C(C(c2c(c(F)c3NCCCc4ncccc4)N)=O)C#N)c2c3OC1 0.000 description 7
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/06—Peri-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/02—Muscle relaxants, e.g. for tetanus or cramps
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Diabetes (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Psychiatry (AREA)
- Oncology (AREA)
- Virology (AREA)
- Psychology (AREA)
- Hematology (AREA)
- Communicable Diseases (AREA)
- Tropical Medicine & Parasitology (AREA)
- Endocrinology (AREA)
- Obesity (AREA)
- Vascular Medicine (AREA)
- Cardiology (AREA)
- AIDS & HIV (AREA)
- Urology & Nephrology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hospice & Palliative Care (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
Description
本出願は、2007年9月11日に出願のLiらの米国仮出願第60/993,346号の優先権を主張する。上述した出願の開示内容は、全体として本願明細書に含まれるものとする。
分野
GSK-3仲介疾患を治療するための化合物、組成物及び方法が提供される。一実施態様において、本明細書において提供される化合物は、GSK-3阻害剤であるシアノアミノキノロンである。一実施態様において、本明細書において提供される化合物は、GSK-3阻害剤であるテトラゾロアミノキノロンである。
GSK-3は、多くの調節タンパク質の活性をリン酸化し調整することがわかった。これには、グリコーゲン合成に必要とされる律速酵素であるグリコーゲン合成酵素、微小管関連タンパク質タウ、遺伝子転写因子β-カテニン、翻訳開始因子e1F-2Bだけでなく、ATPクエン酸リアーゼ、アキシン、熱ショック因子-1、c-Jun、c-myc、c-myb、CREB、CEPBαが含まれる。これらの多様な標的は、細胞代謝、増殖、分化及び発生の多くの局面においてGSK-3を関係させている。
ある実施態様において、本明細書において提供される組成物及び方法に用いられる化合物は、式IIのテトラゾロアミノキノロン又はその医薬的に許容され得る誘導体である:
式I又はIIの化合物及び医薬的に許容され得る担体を含有する医薬組成物が本明細書において提供される。また、本明細書において提供される化合物及び組成物を投与することによってGSK-3仲介疾患の一つ以上の症状を治療するか、予防するか、又は改善させるための方法が提供される。
ある実施態様において、本明細書において提供される化合物及び組成物を投与することによってGSK-3の作用を阻止するための方法が本明細書において提供される。他の実施態様において、一つ以上のGSK-3仲介疾患を治療するか、予防するか、又は改善させるための方法が本明細書において提供される。他の実施態様において、本明細書において提供される化合物及び組成物を投与することによって糖尿病、アルツハイマー病のような痴呆を含む慢性神経変性疾患、パーキンソン病、進行性核上性麻痺、亜急性硬化性全脳炎パーキンソン症候群、脳炎後パーキンソン症候群、拳闘家脳症、ガムパーキンソン痴呆症候群、ピック病、大脳皮質基底核変性症、前頭側頭骨痴呆、ハンチントン病、AIDS関連痴呆、筋萎縮性側索硬化症、多発性硬化症、神経外傷性疾患、例えば、急性脳卒中、てんかん、気分障害、例えば、うつ病、統合失調症又は双極性障害、関節リウマチ、炎症性腸疾患、潰瘍性大腸炎、クローン病、敗血症、膵臓癌、卵巣癌、骨粗鬆症と関連がある病態が挙げられるがこれらに限定されない疾患或いは病態の一つ以上の症状を治療するか、予防するか、又は改善させるための方法が本明細書において提供される。
特に定義されない限り、本明細書に用いられるすべての技術的及び科学的用語は当業者によって一般に理解されるのと同じ意味を有する。すべての特許、出願、公開された出願及び他の公報は、全体として本願明細書に含まれるものとする。本明細書において用語に対する定義が複数ある場合には、特にことわらない限り、この項のものが優先する。
本明細書に用いられる“被検者”は、動物、典型的には、ヒト、例えば、患者を含む哺乳動物である。
本明細書に用いられる用語“GSK-3仲介疾患、或いは“GSK-3仲介病態”は、GSK-3が役割を果たすことが知られるいかなる疾患も他の有害な病態或いは状態も意味する。このような疾患或いは病態としては、糖尿病、糖尿病と関連がある病態、アルツハイマー病のような痴呆を含む慢性神経変性疾患、パーキンソン病、進行性核上性麻痺、亜急性硬化性全脳炎パーキンソン症候群、脳炎後パーキンソン症候群、拳闘家脳症、ガムパーキンソン痴呆症候群、ピック病、大脳皮質基底核変性症、前頭側頭骨痴呆、ハンチントン病、AIDS関連痴呆、筋萎縮性側索硬化症、多発性硬化症、神経外傷性疾患、例えば、急性脳卒中、てんかん、気分障害、例えば、うつ病、統合失調症又は双極性障害、関節リウマチ、炎症性腸疾患、潰瘍性大腸炎、クローン病、敗血症、膵臓癌、卵巣癌、骨粗鬆症が挙げられるがこれらに限定されない。
本明細書に用いられる生物活性は、化合物の生体内活性又は化合物、組成物又は他の混合物の生体内投与時に生じる生理的応答を意味する。従って、生物活性は、このような化合物、組成物及び混合物の治療効果及び薬物動態挙動を包含する。生物活性は、このような活性を試験するように設計された試験管内システムにおいて認めることができる。
本明細書に用いられる具体的な化合物又は医薬組成物の投与による具体的な疾患の症状の改善は、永続的にしても一時的にしても、持続的しても一過性にしても、組成物の投与に起因し得る或いは関連し得るいかなる改善をも意味する。
本明細書に用いられ、特にことわらない限り、用語“管理する(manage)”、“管理すること(managing)”及び“管理(management)”は、指定された疾患又は障害の再発を疾患又は障害にすでに罹っている患者において防止すること、及び/又は疾患又は障害に罹っている患者が寛解期のままである時間を長くすることを包含する。これらの用語は、疾患又は障害の許容限界、発症及び/又は持続期間を調整すること、又は患者が疾患又は障害に応答する方法を変えることを包含する。
本明細書に用いられるIC50は、このような応答を測定する分析において最大応答の50%阻止を達成する具体的な試験化合物の量、濃度又は用量を意味する。
本明細書に用いられるEC50は、具体的な試験化合物によって誘導され、誘発され又は増強される具体的な応答の最大発現の50%で用量依存的応答を引き出す具体的な試験化合物の用量、濃度又は総量を意味する。
本明細書に用いられる用語GSK3阻害剤は、以下に一般的に記載されるGSK3阻害活性に対する無細胞分析において測定されるように、GSK3に関するIC50が約100μMを超えない、一実施態様においては、約50μMを超えない化合物を意味する。ある実施態様において、本明細書において提供される化合物は、無細胞GSK3キナーゼ分析において測定されるように、GSK3に関するIC50が約10μMを超えない、一実施態様においては、約5μMを超えない、又は1μMを超えない。
本明細書に用いられる抗菌活性が実質的にないか或いは抗菌活性が非常に低いは、最小阻止濃度(MIC)として、試験化合物を測定した抗菌活性が、約0.5μM、1μM、5μM、10μM、50μM、75μM、100μM、150μM、200μM又は250μMを超えることを意味する。一部の実施態様において、MICは、E.コリ(E. Coli)及び/又はS.アウレウス(S. aureus)の増殖阻止に関する。
本明細書に用いられる細菌増殖分析の最小阻止濃度(MIC)は、培養液において細菌増殖に対して阻止を引き起こすのに必要とされる化合物の最低レベルである。ある実施態様において、本明細書における化合物の抗菌活性は、MICとして測定した。
本明細書に用いられるバイオアべイラビリティは、試験化合物の吸収の速度と程度を意味する。バイオアべイラビリティを決定する方法は、当業者に周知である。例えば、本明細書に記載される化合物のいずれかのバイオアべイラビリティは、動物に化合物を投与し、続いて経時血液試料を採取するとともに化合物の血中濃度を測定することによって経験的に決定され得る。生体内半減期(t1/2)は、血中化合物の濃度が1/2だけ低下するのにかかる時間として定義される。静脈内投与に対する曲線下面積の推定を用いて、経口投与に対する曲線下面積を推定し、バイオアべイラビリティデータを得ることができる。例えば、Milo Gibal (1991) Biopharmaceutics and Pharmacology, 4th edition (Lea and Sediger)を参照のこと。
本明細書に用いられる実質的に純粋なは、このような純度を評価するために当業者によって用いられる分析標準法、例えば、薄層クロマトグラフィー(TLC)、ゲル電気泳動、高性能液体クロマトグラフィー(HPLC)、核磁気共鳴(NMR)、質量分析(MS)によって決定される容易に検出可能な不純物を含まないと思われる充分に均一な、或いは更に精製によって物質の酵素活性や生物活性のような物理的性質と化学的性質が検出可能に変わらないような充分に純粋なを意味する。実質的に化学的に純粋な化合物を得る化合物の精製方法は、当業者に既知である。しかしながら、実質的に化学的に純粋な化合物は、立体異性体混合物であってもよい。このような場合には、更に精製によって化合物の比活性が増加することがあり得る。本開示内容は、すべてのこのような可能な異性体だけでなく、これらのラセミ体及び光学的に純粋な形を含むことを意味する。光学活性(+)及び(-)、(R)-及び(S)-、又は(D)-及び(L)-異性体は、キラルシントン又はキラル試薬を用いて調製されてもよく、又は従来の技術、例えば、逆相HPLCを用いて分割されてもよい。本明細書に記載される化合物がオレフィン二重結合又は他の幾何学的不斉中心を含有する場合、特にことわらない限り、化合物がE幾何異性体もZ幾何異性体も共に含むことが意図されている。同様に、すべての互変異性体も含まれることが意図されている。
本明細書に用いられる命名法アルキル、アルコキシ、カルボニル等は、当業者によって通常理解されているように用いられる。
本明細書に用いられる“シクロアルキル”は、ある実施態様において、炭素原子3〜10個、他の実施態様において、炭素原子3〜6個の飽和単環式又は多環式環系を意味し; シクロアルケニル及びシクロアルキニルは、それぞれ少なくとも1つの二重結合及び少なくとも1つの三重結合を含む単環式又は多環式環系を意味する。シクロアルケニル基及びシクロアルキニル基は、ある実施態様において、炭素原子3〜10個を含有してもよく、シクロアルケニル基は、更に実施態様において、炭素原子4〜7個を含有してもよく、シクロアルキニル基は、更に実施態様において、炭素原子8〜10個を含有してもよい。シクロアルキル基、シクロアルケニル基及びシクロアルキニル基の環系は、縮合、架橋又はスピロ結合方法で一緒に結合することができる1つの環又は2つ以上の環から構成されていてもよい。
本明細書に用いられる“アリール”は、炭素原子6〜19個を含有する芳香族の単環基又は多環基を意味する。アリール基としては、フルオレニル、置換フルオレニル、フェニル、置換フェニル、ナフチル、置換ナフチルのような基が挙げられるが、これらに限定されない。
本明細書に用いられる“ヘテロアリール”は、ある実施態様において、環系における原子の1つ以上、一実施態様において、1〜3つがヘテロ原子、即ち、窒素、酸素又はイオウが挙げられるがこれらに限定されない炭素以外の元素である約5〜約15員の単環式又は多環式芳香環系を意味する。ヘテロアリール基は、場合によりベンゼン環に縮合されていてもよい。ヘテロアリール基としては、フリル、イミダゾリル、ピロリジニル、ピリミジニル、テトラゾリル、チエニル、ピリジル、ピロリル、N-メチルピロリル、キノリニル及びイソキノリニルが挙げられるが、これらに限定されない。
本明細書に用いられる“ヘテロシクリル”は、環系における原子の1つ以上、一実施態様において、1〜3つがヘテロ原子、即ち、窒素、酸素又はイオウが挙げられるがこれらに限定されない炭素以外の元素である、一実施態様において、3〜10員、他の実施態様において、4〜7員、更に実施態様において、5〜6員の単環式又は多環式非芳香環系を意味する。1つ又は複数のヘテロ原子が窒素である実施態様において、窒素は、場合により、アルキル、アルケニル、アルキニル、アリール、ヘテロアリール、アラルキル、ヘテロアラルキル、シクロアルキル、ヘテロシクリル、シクロアルキルアルキル、ヘテロシクリルアルキル、アシル、アミノカルボニル、アルコキシカルボニル、グアニジノで置換されてもよく、或いは窒素が四基化されて、置換基が上記ように選ばれるアンモニウム基を形成してもよい。
本明細書に用いられる“アラルキル”は、アルキルの水素原子の1つがアリールによって置き換えられているアルキル基を意味する。
本明細書に用いられる“ヘテロアラルキル”は、アルキルの水素原子の1つがヘテロアリール基によって置き換えられているアルキル基を意味する。
本明細書に用いられる“ハロ”、“ハロゲン”又は“ハライド”はF、Cl、Br又はIを意味する。
本明細書に用いられる擬ハライド又は擬ハロ基は、ハライドと実質的に同様に振る舞う基である。このような化合物は、ハライドと同様にして使用することができ、また、同様にして処理することができる。擬ハライドとしては、シアノ、チオシアネート、セレノシアネート、トリフルオロメトキシ、及びアジドが挙げられるが、これらに限定されない。
本明細書に用いられる“ハロアルキル”は、水素原子の1つ以上がハロゲンによって置き換えられているアルキル基を意味する。“低級ハロアルキル”は、水素原子の1つ以上がハロゲンによって置き換えられている低級アルキル基を意味する。このような基としては、クロロメチル、トリフルオロメチル及び1-クロロ-2-フルオロエチルが挙げられるが、これらに限定されない。
本明細書に用いられる“縮合ヘテロシクリルアリール”は、縮合されたヘテロシクリルとアリールを意味する。一実施態様において、縮合ヘテロシクリルアリールは、ヘテロシクリルが約5〜約6つの環原子を含有し、そのアリールがフェニルであるものである。縮合ヘテロシクリルアリールは、環系のいかなる原子によって結合されていてもよい。代表的な縮合ヘテロシクリルアリール基は、1,3-ベンゾジオキソラン-4-イル、1,3-ベンゾジオキソラン-5-イル、1,3-ベンゾジオキソラン-6-イル、1,3-ベンゾジオキソラン-7-イル、4-インドリニル、5-インドリニル、6-インドリニル及び7-インドリニルが挙げられる。
本明細書に用いられる“縮合アリールヘテロシクリル”は、縮合されたアリールとヘテロシクリルを意味する。一実施態様において、縮合アリールヘテロシクリルは、そのアリールがフェニルであり、ヘテロシクリルが環原子約5〜約6個を含有するものである。縮合アリールヘテロシクリルは、環系のいかなる原子によって結合されてもよい。代表的な縮合アリールヘテロシクリル基としては、1-インドリニル、2-インドリニル、3-インドリニル、1,2,3,4-テトラヒドロキノリン-1-イル、1,2,3,4-テトラヒドロキノリン-2-イル、1,2,3,4-テトラヒドロキノリン-3-イル及び1,2,3,4-テトラヒドロキノリン-4-イルが挙げられる。
本明細書に用いられる“カルボキシ”は、二価基、-C(O)O-を意味する。
本明細書に用いられる“アミノカルボニル”は、-C(O)NH2を意味する。
本明細書に用いられる“アルキルアミノカルボニル”は、-C(O)NHR(ここで、Rは、低級アルキルを含むアルキルである)を意味する。本明細書に用いられる“ジアルキルアミノカルボニル”は、-C(O)NR'R(ここで、R'及びRは、独立して、低級アルキルを含むアルキルである)を意味し;“カルボキシアミド”は、式-NR'COR(ここで、R'及びRは、独立して、低級アルキルを含むアルキルである)の基を意味する。
本明細書に用いられる“アリールアルキルアミノカルボニル”は、-C(O)NRR'(ここで、R及びR'の一方は、フェニルのようなアリールであり、R及びR'のもう一方は、低級アルキルを含むアルキルである)を意味する。
本明細書に用いられる“アリールアミノカルボニル”は、-C(O)NHR(ここで、Rは、フェニルのようなアリールである)を意味する。
本明細書に用いられる“ヒドロキシカルボニル”は、-COOHを意味する。
本明細書に用いられる“アルコキシカルボニル”は、-C(O)OR(ここで、Rは、低級アルキルを含むアルキルである)を意味する。
本明細書に用いられる“アリールオキシカルボニル”は、-C(O)OR(ここで、Rは、フェニルのようなアリールである)を意味する。
本明細書に用いられる“アルコキシ”及び“アルキルチオ”は、RO-及びRS-(ここで、Rは、低級アルキルを含むアルキルである)を意味する。
本明細書に用いられる“アリールオキシ”及び“アリールチオ”は、RO-及びRS-(ここで、Rは、フェニルのようなアリールである)を意味する。
所定の置換基の数が指定されていない(例えば、“ハロアルキル”)の場合、1つ以上の置換基が存在してもよい。例えば、“ハロアルキル”は、同じか又は異なるハロゲンの1つ以上を含むことができる。“C1-3アルコキシフェニル”は、1つ、2つ又は3つの炭素を含有する同じか又は異なるアルコキシ基の1つ以上を含むことになる。
本明細書に用いられる保護基、アミノ酸及び他の化合物の略号は、特にことわらない限り、これらの一般の使用、認識された略号、又は生化学命名法に関するIUPAC-IUB規約に従うものである((1972) Biochem. 11:942-944を参照のこと)。
GSK3阻害剤化合物、その化合物を含有する組成物及びその使用方法が、本明細書において提供される。ある実施態様において、本明細書において提供される化合物のGSK3に関するIC50は、無細胞GSK3キナーゼ分析において測定されるように、約1μMを超えないか又は約0.5μMを超えない。ある実施態様において、本明細書において提供される化合物の阻害活性は、キナーゼの少なくとも一つの他のタイプと比較して、GSK3に関して選択的である。ある実施態様において、本明細書において提供されるGSK3阻害剤のGSK3に対する選択性は、少なくとも一つの他のキナーゼと比較して、少なくとも約1倍、2倍、5倍、10倍、又は少なくとも約100倍、又は少なくとも約1000倍である。
ある実施態様において、本明細書において提供されるGSK3阻害剤は、実質的に抗菌活性がないか或いは抗菌活性が非常に低い。抗菌活性は、試験化合物に対する最小阻止濃度(MIC)を推定することによって当該技術において既知の方法によって測定し得る。MICは、培養液における細菌増殖に対して阻止を引き起こすのに必要とされる化合物で最低レベルである。ある実施態様において、E.コリ及び/又はS.アウレウスの増殖阻止に関する最小阻止濃度として測定される本明細書における化合物の抗菌活性は、約10μM、50μM、75μM、100μM、150μM、200μM又は250μMより大きい。(臨床検査標準協会. 好気的に増殖する細菌のための希釈抗菌薬感受性試験方法; 承認規格-第7版: CLSI文書 M7-A4. CLSI, Wayne, PA.(2003))
ある実施態様において、本明細書において提供される化合物は、当該技術において既知の同様の化合物と比較して耐性を増強した。このような許容性の増強は、化合物の薬物動態プロファイルの変化によって現れる。薬物動態プロファイルは、バイオアべイラビリティ、生体内半減期及び生体内効力が挙げられるが、これらに限定されない多くの因子に基づくものである。ある実施態様において、本明細書において提供される化合物は、当該技術において既知の同様の化合物と比較して効力、安定性及び受容体-選択性が挙げられるがこれらに限定されない改善された性質を有する。
ある実施態様において、本明細書において提供される組成物及び方法に用いられる化合物は、下記式Iの化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、本明細書において提供される組成物及び方法に用いられる化合物は、式I(式中、R1a及びR1bは、各々低級アルキルである)を有する。ある実施態様において、R1a及びR1bは、各々メチルである。ある実施態様において、R1a及びR1bは、各々水素である。
ある実施態様において、R1aは、水素であり、R1bは、低級アルキルである。ある実施形態において、R1aは、水素であり、R1bは、メチルである。
ある実施形態において、R1cは、1つ以上の低級アルキル基で置換されている。ある実施態様において、R1cは、1つ以上のメチル基で置換されている。
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物又はその医薬的に許容され得る誘導体又は塩は、下記より選ばれる
ある実施態様において、本明細書において提供される組成物及び方法に用いられる化合物は、式IIのテトラゾロキノロン又はその医薬的に許容され得る誘導体である:
i) R1は、水素、低級アルキル、シクロアルキル、ヘテロシクリル、アリール、アラルキル、ヘテロシクロアルキル又はヘテロアラルキルであり; R8は、水素、ハロ又はアルコキシであるか; 又は
ii) R1とR8は、これらが置換されている原子と一緒になってヘテロ原子1-4個を含有する5-8員置換又は無置換複素環又はヘテロアリール環を形成し; ここで、存在する場合の置換基は、1つ以上のQ0より選ばれ;
Q0は、ハロ、ヒドロキシル、アルコキシ、シクロアルキル、アリール、ヘテロアリール、アラルキル、擬ハロ、アミノ、ニトロ、アルキル、ハロアルキル、アルケニル又はアルキニルであり;
R2は、水素、低級アルキル、COOR2a又は場合により置換されていてもよいアリールであり、ここで、存在する場合の置換基は、1〜4つのQ1基より選ばれる;
R2aは、水素、又は低級アルキルであり;
R3は、H又は低級アルキルであり;
R5は、NR5aR5b又はSR5aであり;
R5a及びR5bは、各々独立して、水素、低級アルキル又はCOR5Cであり;
R5Cは、低級アルキル又は低級ハロアルキルであり;
R6は、ハロであり;
Ra及びRbは、以下の通り選ばれる:
i) Raは、水素又は低級アルキルであり、Rbは以下の基である
-(CH2)n(NRc)mR、
-(CH2)nORd、
-(CH2)nS(O)lRd、
-CH(Rj)(CH2)n(NRc)mR、
-CH(Rj)(CH2)nORd、又は
-CH(Rj)(CH2)nS(O)lRd
ii) Ra及びRbは、これらが置換されている窒素原子と一緒になってヘテロ原子1-4個を含有する5-7員置換又は無置換複素環又はヘテロアリール環を形成し; ここで、存在する場合の置換基は、1〜4つのQ1基より選ばれ;
Rcは、水素又は低級アルキルであり;
Rは、アルキル、アリール、ヘテロアリール、シクロアルキル、ヘテロシクリル、縮合アリールヘテロシクリル、縮合アリールヘテロシクリル、-C(O)ORd、-C(O)Rd、-C(O)NReRe又は-CHRdRdであり;
各々のRdは、アルキル、アリール、ヘテロシクリル、ヘテロアリール、シクロアルキル、縮合ヘテロシクリルアリール又は縮合アリールヘテロシクリルであり;
各々Reは、水素、アルキル、アリール、ヘテロシクリル、ヘテロアリール、シクロアルキル、縮合ヘテロシクリルアリール又は縮合アリールヘテロシクリルであり;
Rjは、低級アルキル又は低級ハロアルキルであり;
nは、0〜6であり;
mは、0又は1であり;
lは、0〜2であり、ここで、R及びRdは、場合により、1〜4つの置換基で置換されていてもよく、各々独立して、Q1より選ばれ、ここで、Q1は、本明細書に定義した通りである)。
R50は、ヒドロキシ、アルコキシル、アラルコキシ、アルキル、ヘテロアリール、ヘテロシクリル、アリール又は-NR70R71であり、ここで、R70及びR71は、各々独立して、水素、アルキル、アラルキル、アリール、ヘテロアリール、ヘテロアラルキル又はヘテロシクリルであるか、又はR70とR71が一緒になってアルキレン、アザアルキレン、オキサアルキレン又はチアアルキレンを形成し;
R51、R52及びR53は、各々独立して、水素、アルキル、アリール、アラルキル、ヘテロアリール、ヘテロアラルキル、ヘテロシクリル又はヘテロシクリルアルキルであり;
R60は、水素、アルキル、アリール、アラルキル、ヘテロアリール、ヘテロアラルキル、ヘテロシクリル又はヘテロシクリルアルキルであり;
R63は、アルコキシ、アラルコキシ、アルキル、ヘテロアリール、ヘテロシクリル、アリール又は-NR70R71である。
ある実施態様において、R及びRdは、場合により、1、2、3又は4つのQ1置換基で置換されていてもよい。
ある実施態様において、nは、1-6である。
ある実施態様において、化合物は、下記式IIAの化合物又はその医薬的に許容され得る誘導体である:
一実施態様において、化合物は、式IIA (式中、
Rx及びRyは、各々独立して、水素又は低級アルキルであり;
Raは、水素又は低級アルキルであり;
Rbは、(CH2)n(NRc)mRであり;
Rcは、水素又は低級アルキルであり;
Rは、アリール、ヘテロアリール又はヘテロシクリルであり;
nは、1-3であり;
mは、0又は1である)
を有する。
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
一実施態様において、Rcは、低級アルキルである。一実施態様において、Rcは、メチル又はエチルである。一実施態様において、Rは、フェニルである。
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体である:
一実施態様において、Rは、5又は6員ヘテロアリールである。一実施態様において、Rは、ピリジル又はイミダゾリルである。
ある実施態様において、化合物は、下記式の化合物又はその医薬的に許容され得る誘導体又は塩より選ばれる:
例示的化合物の無細胞分析におけるGSK3酵素に対するIC50(μM)は、以下の通り表1において示されている: A < 0.01μM及びB= 0.01-0.1μM。
E.コリ、ATCC8739及びS.アウレウススミスに対する抗菌活性は、MIC(μM)として表される。
本明細書において提供される化合物は、適切な容易に利用可能な試薬を置き換えることによる当該技術において既知の一つ以上の方法の通常の変更による当業者に既知の方法によって(例えば、国際特許出願第PCT/US07/06480号を参照のこと)、また、本明細書の実施例において例示されるように調製することができる。その塩、酸及び他の誘導体は、当業者に既知の方法によって合成することができる。
キラル化合物のR-異性体とS-異性体は、当業者に既知のいかなる技術によっても調製することができる。例えば、これらは、適切な光学的に純粋な前駆物質からキラル合成或いは不斉合成によって調製することができ又はラセミ混合物から任意の慣用の技術によって、例えば、‘キラル’カラム、TLCを用いるクロマトグラフィーによる分割又はジアステレオ異性体の調製、その分離及び望ましい異性体の再生によっても得ることができる。例えば、“化合物、ラセミ体及び分割”, J. Jacques, A. Collet, & S.H. Wilen, (Wiley-Interscience, New York, 1981); 有機化合物の立体化学, Ernest L. Eliel, Samuel H. Wilen & Lewis N. Manda (1994 John Wiley & Sons, Inc.), 立体選択的合成 実際的なアプローチ, Mihaly Nogradi (1995 VCH Publishers, Inc., NY, NY)を参照のこと。
本明細書において提供される医薬組成物は、GSK-3仲介疾患の症状の一つ以上の予防、治療、又は改善に用いられる治療的に有効な量の本明細書において提供される化合物の一つ以上を含有する。
組成物は、本明細書において提供される一つ以上の化合物を含有する。化合物は、経口投与に適切な医薬製剤、例えば、液剤、懸濁剤、錠剤、分散性錠剤、丸剤、カプセル剤、散剤、徐放性製剤又はエリキシル剤に又は非経口投与に対して滅菌液剤又は滅菌懸濁剤にだけでなく、経皮貼付製剤及び乾燥粉末吸入器に処方することができる。典型的には、上記化合物は、当該技術において周知の技術及び手順を用いて医薬組成物に処方される(例えば、Ansel 医薬品剤形概論, Seventh Edition 1999を参照のこと)。
組成物において、有効な濃度の一つ以上の化合物又は医薬的に許容され得る誘導体は、適切な医薬担体又は賦形剤と混合される。化合物は、上記のように、対応する塩、エステル、エノールエーテル又はエステル、酸、塩基、溶媒和物、水和物又は製剤以前のプロドラッグとして誘導体化されてもよい。組成物における化合物の濃度は、GSK-3仲介疾患の症状の一つ以上を治療するか、予防するか又は改善させる投与時の量の送達に有効な濃度である。
典型的には、組成物は、単一用量投与に処方される。組成物を処方するために、化合物の質量分率は、治療された病態が緩和或いは改善されるような有効濃度で、選ばれた賦形剤に溶解、懸濁、分散或いは混合される。本明細書において提供される化合物の投与に適切な医薬担体又は賦形剤には、具体的な投与方法に適切である当業者に既知の任意の担体が含まれる。
更に、化合物は、組成物における唯一の医薬的に活性成分として処方されてもよく或いは他の有効成分と合わせてもよい。腫瘍標的リポソームのような組織標的リポソームを含むリポソーム懸濁液も、医薬的に許容され得る担体として適切であり得る。これらは、当業者に既知の方法に従って調製することができる。例えば、リポソーム製剤は、当該技術において既知であるように調製することができる。概要としては、多重膜小胞(MLV)のようなリポソームは、フラスコの内部で卵ホスファチジルコリンと脳ホスファチジルセリン(7:3のモル分率)を乾燥することによって形成されてもよい。二価のカチオン(PBS)を欠いているリン酸緩衝食塩水中の本明細書において提供される化合物の溶液が添加され、脂質膜が分散されるまでフラスコが振盪される。得られた小胞を洗浄して、封入されていない化合物を除去し、遠心分離によって沈降させ、次にPBSに再懸濁させる。
医薬組成物における活性化合物の濃度は、活性化合物の吸収、不活性化及び排出速度、化合物の物理化学的特性、投薬計画、及び投与される量だけでなく、当業者に既知の他の因子に左右される。例えば、送達される量は、GSK-3仲介疾患の症状の一つ以上を改善させるのに充分な量である。
典型的には、治療的に有効な用量は、約0.1ng/ml〜約50-100μg/mlの有効成分の血清濃度を生じなければならない。医薬組成物は、典型的には、1日体重1kg当り約0.001mg〜約2000mgの化合物の用量を与えなければならない。医薬単位剤形は、単位剤形につき約1mg〜約1000mg、ある実施態様において、約10mg〜約500mgの不可欠な有効成分或いは不可欠な成分の組み合わせを与えるように調製される。
有効成分は、一度に投与されてもよく、又は多くのより少量に分けられて時間間隔で投与されてもよい。正確な用量と治療期間は、治療されている疾患の関数であり、既知の実験プロトコールを用いて経験的に又は生体内又は試験管内試験データから外挿することによって決定されてもよいことが理解される。濃度及び用量の値が緩和すべき病態の重症度によって異なってもよいことは留意すべきことである。いかなる具体的な被検者に対しても、特定の用法・用量が個々の要求及び組成物の投与を行うか或いは指図する人の専門の判断に従って経時調整されなければならず、また、本明細書に示される濃度範囲が単に例示にすぎず、特許請求された組成物の範囲又は実施を制限することを意図していないことが更によく理解されるべきである。
医薬的に許容され得る誘導体には、酸、塩基、エノールエーテル又はエステル、塩、エステル、水和物、溶媒和物又はプロドラッグの形態が含まれる。薬物速度論的特性が対応する中性化合物より優れているように誘導体が選ばれる。
組成物は、経口的に、非経口的に、直腸に、局所的に及び局部的にが挙げられるが、これらに限定されない適切な経路によって投与されることが意図される。経口投与用のカプセル剤及び錠剤が処方され得る。組成物は、液体、半流動体又は固体の状態であり、各々の投与経路に適切な方法で処方される。
非経口的、皮内、皮下、又は局所適用に用いられる液剤又は懸濁剤には、以下の成分: 滅菌希釈剤、例えば、注射用蒸留水、食塩水、固定油、ポリエチレングリコール、グリセリン、プロピレングリコール、ジメチルアセトアミド又は他の合成溶媒; 抗菌剤、例えば、ベンジルアルコール、メチルパラベン; 抗酸化剤、例えば、アスコルビン酸、重亜硫酸ナトリウム; キレート化剤、例えば、エチレンジアミン四酢酸(EDTA); 緩衝液、例えば、酢酸塩、クエン酸塩、リン酸塩; 及び張性調整のための物質、例えば、塩化ナトリウム又はデキストロースのいずれかが含まれ得る。非経口製剤は、ガラス、プラスチック又は他の適切な材料からできているアンプル、使い捨て注射器又は単回又は複数回投与バイアルに封入され得る。
化合物が不充分な溶解性を示す場合、化合物を可溶化する方法が用いられてもよい。このような方法は、当業者に既知であり、ジメチルスルホキシド(DMSO)のような共溶媒を用いること、TWEEN(登録商標)のような界面活性剤を用いること、又は水性重炭酸ナトリウムに溶解することが挙げられるが、これらに限定されない。
一つ又は複数の化合物の混合又は添加の際に得られた混合物は、溶液、懸濁液、エマルジョン等であってもよい。得られた混合物の形は、意図された投与方法や選ばれた担体又は賦形剤における化合物の溶解性が含まれる多くの因子に左右される。一実施態様において、有効な濃度は、治療される疾患、障害又は病態の症状を改善させるのに充分な量であり、経験的に決定されてもよい。
徐放性製剤もまた、調製することができる。徐放性性製剤の適切な例としては、本明細書において提供される化合物を含有する固体疎水性ポリマーの半透性マトリックスが挙げられ、マトリックスは、成形された製品、例えば、膜、又はマイクロカプセルの形である。徐放性マトリックスの例としては、ポリエステル、ヒドロゲル(例えば、ポリ(2-ヒドロキシエチルメタクリレート)、又はポリ(ビニルアルコール))、ポリ乳酸、L-グルタミン酸とエチル-L-グルタミン酸塩のコポリマー、非分解性エチレン-酢酸ビニル、分解性乳酸-グリコール酸コポリマー、例えば、LUPRON DEPOTM (乳酸-グリコール酸コポリマーと酢酸ロイプロリドから構成される注射用マイクロスフェア)、及びポリ-D-(-)-3-ヒドロキシ酪酸が挙げられる。エチレン-酢酸ビニルや乳酸-グリコール酸のようなポリマーは、100日以上にわたって分子の放出を可能にするが、あるヒドロゲルはより短い間にタンパク質を放出する。封入された化合物が長期間体内に残存する場合、37oCの水分にさらされる結果として変性又は凝集することになり、生物活性の低下と構造の可能な変化が生じる。関係する作用機序に依っては安定化のために合理的な方策が講じられ得る。例えば、凝集機序がチオ-ジスルフィド交換による分子間S--S結合形成であることが見出される場合には、安定化は、スルフヒドリル残基を変性し、酸性溶液から凍結乾燥させ、水分を制御し、適切な添加剤を用い、且つ個々のポリマーマトリックス組成物を開発することによって達成させることができる。
活性化合物又は医薬的に許容され得る誘導体は、体からの急速な排除に対して化合物を保護する担体、例えば、持続放出製剤又はコーティングによって調製されてもよい。
組成物は、性質の望ましい組み合わせを得るように他の活性化合物を含むことができる。本明細書に記載されるように、本明細書において提供される化合物又はその医薬的に許容され得る誘導体は、また、有利には、治療又は予防のためにGSK-3仲介疾患のような上文に示される疾患又は病状の一つ以上を治療するのに有益である一般技術において既知の他の薬理作用のある物質と共に投与されてもよい。このような併用療法が本明細書において提供される組成物及び治療方法の態様を更に構成することは理解されるべきである。
経口医薬剤形は、固体か、ゲルか又は液体である。固体剤形は、錠剤、カプセル剤、顆粒剤、原末である。経口錠剤の種類には、腸溶コーティングされ、糖衣がかけられ又はフィルムコートされていてもよい圧縮チュアブルロゼンジや圧縮チュアブル錠が含まれる。カプセル剤は、硬ゼラチンカプセル又は軟ゼラチンカプセルであってもよく、顆粒剤及び散剤は、当業者に既知の他の成分の組み合わせによって非発泡性又は発泡性の形で与えられてもよい。
ある実施態様において、製剤は、固体剤形、例えば、カプセル剤又は錠剤である。錠剤、丸剤、カプセル剤、トローチ剤等は、以下の成分のいずれか、又は似通った性質の化合物を含有し得る: 結合剤; 希釈剤; 崩壊剤; 滑沢剤; 流動促進剤; 甘味剤; 及び香味剤。
結合剤の例としては、ミクロクリスタリンセルロース、トラガカントゴム、ブドウ糖液、アラビアゴム粘液、ゼラチン液、スクロース及びデンプン糊が挙げられる。潤滑剤としては、タルク、デンプン、ステアリン酸マグネシウム、ステアリン酸カルシウム、石松子及びステアリン酸が挙げられる。希釈剤としては、例えば、ラクトース、スクロース、デンプン、カオリン、塩、マンニトール及びリン酸二ナトリウム塩が挙げられる。流動促進剤としては、コロイド状二酸化ケイ素が挙げられるが、これに限定されない。崩壊剤としては、クロスカルメロースナトリウム、デンプングリコール酸ナトリウム、アルギン酸、コーンスターチ、ポテトデンプン、ベントナイト、メチルセルロース、寒天及びカルボキシメチルセルロースが挙げられる。着色剤としては、例えば、許可され認定されたFD & C水溶性色素、その混合物; 及びアルミナ水和物に懸濁した水不溶性FD & C色素のいずれかが挙げられる。甘味剤としては、スクロース、ラクトース、マンニトール及び人工甘味剤、例えば、サッカリン、及び多くの噴霧乾燥香味が挙げられる。香味剤としては、果実のような植物から抽出される天然香味及び感じのよい感覚を生じる化合物の合成ブレンド、例えば、ペパーミントやサリチル酸メチルが挙げられるが、これらに限定されない。湿潤剤は、プロピレングリコールモノステアレート、ソルビタンモノオレエート、ジエチレングリコールモノラウレート及びポリオキシエチレンラウラルエーテルが挙げられる。催吐コーティングとしては、脂肪酸、脂肪、ワックス、シェラック、アンモニア処理したシェラック及び酢酸フタル酸セルロースが挙げられる。膜コーティングとしては、ヒドロキシエチルセルロース、カルボキシメチルセルロースナトリウム、ポリエチレングリコール4000及び酢酸フタル酸セルロースが挙げられる。
経口投与が望まれる場合には、胃の酸性環境から保護する組成物において化合物を与えることができる。例えば、組成物は、胃において完全な状態を維持するとともに腸において活性化合物を放出する腸溶コーティングで処方され得る。組成物は、また、制酸剤又は他のこのような成分と組み合わせて処方されてもよい。
活性材料は、また、望ましい作用を損なわない他の活性材料と、又は望ましい作用、例えば、制酸剤、H2遮断薬、利尿剤を補足する材料と混合され得る。有効成分は、本明細書に記載される化合物又はその医薬的に許容され得る誘導体である。より高い濃度、約98質量%までの有効成分が含まれてもよい。
錠剤に含まれる医薬的に許容され得る担体は、結合剤、滑沢剤、希釈剤、崩壊剤、着色物質、香味剤、及び湿潤剤である。腸溶錠は、腸溶コーティングがあることから、胃酸の作用に抵抗するとともに中性或いはアルカリの腸において溶解するか又は崩壊する。糖衣錠は、医薬的に許容され得る物質の異なる層が適用される圧縮錠剤である。膜コーティング錠は、ポリマー又は他の適切なコーティングで被覆された圧縮錠剤である。多重圧縮錠剤は、前述の医薬的に許容される物質を用いて複数回の圧縮サイクルによって製造された圧縮錠剤である。着色剤が上記剤形に用いられてもよい。香味剤及び甘味剤は、圧縮錠剤、糖衣錠、多重圧縮錠剤及び咀嚼錠に用いられる。香味剤及び甘味剤は、咀嚼錠及びロゼンジ剤の形成に特に有用である。
液体経口剤形には、水性液剤、乳剤、懸濁剤、非発泡顆粒から再構成される溶液及び/又は懸濁液及び発泡顆粒から再構成される発泡製剤が含まれる。水性液剤としては、例えば、エリキシル剤及びシロップ剤が挙げられる。乳剤は、水中油型又は油中水型である。
溶媒には、グリセリン、ソルビトール、アルコール及びシロップが含まれる。防腐剤の例としては、グリセリン、メチルパラベン、プロピルパラベン、安息香酸、安息香酸ナトリウム及びアルコールが挙げられる。乳剤に用いられる非水性液体の例としては、鉱油及び綿実油が挙げられる。乳化剤の例としては、ゼラチン、アラビアゴム、トラガカントゴム、ベントナイト、及び界面活性剤、例えば、ポリオキシエチレンソルビタンモノオレエートが挙げられる。懸濁化剤には、カルボキシメチルセルロースナトリウム、ペクチン、トラガカントゴム、ヴィーガム及びアラビアゴムが含まれる。希釈剤には、ラクトース及びスクロースが含まれる。甘味剤には、スクロース、シロップ、グリセリン及び人工甘味剤、例えば、サッカリンが含まれる。湿潤剤には、プロピレングリコールモノステアレート、ソルビタンモノオレエート、ジエチレングリコールモノラウレート及びポリオキシエチレンラウリルエーテルが含まれる。有機酸には、クエン酸及び酒石酸酸が含まれる。二酸化炭素源には、重炭酸ナトリウム及び炭酸ナトリウムが含まれる。着色剤には、許可され認定されたFD & C水溶性色素のいずれか、及びその混合物が含まれる。香味剤には、果実のような植物から抽出される天然香味、及び感じのよい味覚を生じる化合物の合成ブレンドが含まれる。
固体剤形のための、例えば、プロピレンカーボネート、植物油又はトリグリセリド中の、溶液又は懸濁液は、ゼラチンカプセルに封入される。このような溶液、及びその調製及び封入は、米国特許第4,328,245号; 同第4,409,239号; 及び同4,410,545号に開示されている。液体剤形のための、例えば、ポリエチレングリコール中の溶液は、投与のために容易に測定されるように充分な量の医薬的に許容され得る液体担体、例えば、水で希釈されていてもよい。
他の製剤としては、医薬的に許容され得るアセタールを含むアルコール水溶液が挙げられるが、これに限定されない。これらの製剤に用いられるアルコールは、プロピレングリコール及びエタノールが挙げられるがこれらに限定されない、1つ以上のヒドロキシル基を有する任意の医薬的に許容され得る水混和性溶媒である。アセタールとしては、低級アルキルアルデヒドのジ(低級アルキル)アセタール、例えば、アセトアルデヒドジエチルアセタールが挙げられるが、これらに限定されない。
すべての実施態様において、錠剤及びカプセル剤の製剤は、有効成分の溶解を改善させるか又は持続させるために当業者が既知のように被覆されていてもよい。従って、例えば、これらは、慣用の経腸的に消化可能なコーティング、例えば、サリチル酸フェニル、ワックス、酢酸フタル酸セルロースで被覆されていてもよい。
一般的には、皮下、筋肉内又は静脈内の注射を特徴とする非経口投与もまた、本明細書に企図される。注射剤は、慣用の形で、液体の溶液又は懸濁液、注射前に溶解又は懸濁するのに適した固体の形として、又はエマルジョンとして調製され得る。適切な賦形剤は、例えば、水、食塩水、デキストロース、グリセロール又はエタノールである。更に、所望により、投与される医薬組成物は、また、少量の非毒性補助物質、例えば、湿潤剤又は乳化剤、pH緩衝剤、安定剤、溶解度向上剤、及び他のこのような物質、例えば、酢酸ナトリウム、ソルビタンモノラウレート、トリエタノールアミンオレエート、シクロデキストリンを含有してもよい。一定レベルの用量が維持されるような緩慢な放出又は徐放性系の植込みもまた、本明細書に企図される。概要としては、本明細書において提供される化合物は、体液に不溶である外側のポリマー膜、例えば、ポリエチレン、ポリプロピレン、エチレン/プロピレンコポリマー、エチレン/アクリル酸エチルコポリマー、エチレン/酢酸ビニルコポリマー、シリコーンゴム、ポリジメチルシロキサン、ネオプレンゴム、塩素化ポリエチレン、ポリ塩化ビニル、酢酸ビニル、塩化ビニリデン、エチレン又はプロピレンとの塩化ビニルコポリマー、イオノマーポリエチレンテレフタレート、ブチルゴムエピクロロヒドリンゴム、エチレン/ビニルアルコールコポリマー、エチレン/酢酸ビニル/ビニルアルコールターポリマー、エチレン/ビニルオキシエタノールコポリマーによって取り囲まれている、固体の内部マトリックス、例えば、ポリメチルメタクリレート、ポリブチルメタクリレート、可塑化された又は可塑化されていないポリ塩化ビニル、可塑化ナイロン、可塑化ポリエチレンテレフタレート、天然ゴム、ポリイソプレン、ポリイソブチレン、ポリブタジエン、ポリエチレン、エチレン-酢酸ビニルコポリマー、シリコーンゴム、ポリジメチルシロキサン、シリコーンカーボネートコポリマー、親水性ポリマー、例えば、アクリル酸やメタクリル酸のエステルのヒドロゲル、コラーゲン、架橋ポリビニルアルコール、部分的に加水分解された架橋ポリ酢酸ビニルに分散される。化合物は、放出速度制御段階で外側のポリマー膜を通って拡散する。このような非経口組成物に含有される活性化合物のパーセントは、その個々の種類だけでなく、化合物の活性及び被検者の要求に非常に左右される。
静脈内に投与される場合には、適切な担体には、生理食塩水又はリン酸緩衝食塩水(PBS)、及び増粘剤や可溶化剤、例えば、グルコース、ポリエチレングリコール、ポリプロピレングリコールを含有する溶液、その混合物が含まれる。
非経口製剤に用いられる医薬的に許容され得る担体には、水性賦形剤、非水性賦形剤、抗菌剤、等張剤、緩衝剤、抗酸化剤、局所麻酔剤、懸濁剤、分散剤、乳化剤、金属イオン封鎖剤、キレート化剤及び他の医薬的に許容され得る物質が含まれる。
水性賦形剤の例としては、塩化ナトリウム注射液、リンゲル注射液、等張デキストロース注射液、滅菌蒸留水注射液、デキストロース及びラクトリンゲル注射液が挙げられる。非水性非経口賦形剤には、植物由来の固定油、綿実油、コーン油、ゴマ油及びピーナッツ油が含まれる。フェノール又はクレゾール、水銀剤、ベンジルアルコール、クロロブタノール、メチルp-ヒドロキシ安息香酸エステル、プロピルp-ヒドロキシ安息香酸エステル、チメロサール、塩化ベンザルコニウム及び塩化ベンゼトニウムが含まれる、静菌濃度又は静真菌濃度での抗菌剤は、複数回投与容器に包装される非経口製剤に添加されなければならない。等張剤には、塩化ナトリウム及びデキストロースが含まれる。緩衝剤には、リン酸塩及びクエン酸塩が含まれる。抗酸化剤には、重硫酸ナトリウムが含まれる。局所麻酔剤には、プロカイン塩酸塩が含まれる。懸濁化剤及び分散剤には、カルボキシメチルセルロースナトリウム、ヒドロキシプロピルメチルセルロース及びポリビニルピロリドンが含まれる。乳化剤には、ポリソルベート80(TWEEN(登録商標)80)が含まれる。金属イオンの封鎖剤又はキレート化剤には、EDTAが含まれる。医薬担体には、水混和性賦形剤のためのエチルアルコール、ポリエチレングリコール及びプロピレングリコール及びpH調整のための水酸化ナトリウム、塩酸、クエン酸又は乳酸が含まれる。
単位用量非経口製剤は、アンプル、バイアル又は針の付いた注射器に包装される。非経口投与用のすべての製剤は、当該技術において既知で実施されるように無菌でなければならない。
説明的には、活性化合物を含有する滅菌水溶液の静脈内又は動脈内注入は、有効な投与方式である。望ましい薬理作用を生じるのに必要であるように、他の実施態様は、注入される活性材料を含有する水性又は油性の滅菌溶液又は懸濁液である。
注射用剤は、局所及び全身投与のために設計される。典型的には、治療的に有効な用量は、一つ又は複数の治療された組織に対して少なくとも約0.1% w/wから約90% w/w以上まで、例えば、1% w/wを超える活性化合物の濃度を含有するように処方される。有効成分は、一度に投与されてもよく、又は時間の間隔で投与される多くのより少量に分けられてもよい。治療の正確な用量及び持続期間は、治療されている組織の関数であり、既知の実験プロトコールを用いて経験的に又は生体内又は試験管内の試験データから外挿して決定されてもよいことが理解される。濃度及び用量値が治療される個人の年齢によって異なってもよいことは留意すべきである。具体的な被検者に対する個々の用法・用量は、個々の要求及び製剤の投与を管理しているか又は指図している人の専門の判断に従って経時調整されなければならず、且つ本明細書に示される濃度範囲が単に例示にすぎず、特許請求された製剤の範囲又は実施を制限することを意図しないことは、更に理解されるべきである。
化合物は、微粉化又は他の適切な形に懸濁されてもよく又はより可溶性の活性製品を生じるか又はプロドラッグを生じるように誘導体化されてもよい。得られた混合物の形は、意図された投与方式及び選ばれた担体又は賦形剤における化合物の溶解性を含む多くの要因に左右される。有効濃度は、病態の症状を改善させるのに充分な濃度であり、経験的に決定することができる。
溶液、エマルジョン及び他の混合物として投与のために再構成され得る凍結乾燥粉末もまた、本明細書において興味深い。これらは、固形物又はゲルとして再構成され、処方されてもよい。
滅菌凍結乾燥粉末は、本明細書において提供される化合物、又はその医薬的に許容され得る誘導体を適切な溶媒に溶解することによって調製される。溶媒は、粉末又は粉末から調製される再構成した溶液の安定性又は他の薬理学的成分を改善する賦形剤を含有してもよい。用いることができる賦形剤には、デキストロース、ソルビトール、フルクトース、コーンシロップ、キシリトール、グリセリン、グルコース、スクロース又は他の適切な物質が含まれてもよいが、これらに限定されない。溶媒は、また、典型的には、ほぼ中性pHで、当業者に既知の緩衝剤、例えば、クエン酸塩、リン酸ナトリウム、リン酸カリウム又は他のこのような緩衝剤を含有してもよい。次の溶液の滅菌ろ過に続いて当業者に既知の標準条件下で凍結乾燥して、望ましい製剤を与える。一般に、得られた溶液は、凍結乾燥のためにバイアルに分配される。各バイアルは、化合物の単回用量(10-1000mg又は100-500mg)又は複数回用量を含有する。凍結乾燥粉末は、適切な条件下で、例えば、約4℃〜室温で保存され得る。
注射用蒸留水によるこの凍結乾燥粉末の再構成は、非経口投与に用いられる製剤を与える。再構成に対して、約1-50mg、約5-35mg、又は約9-30mgの凍結乾燥粉末は、1mLの滅菌水又は他の適切な担体に対して添加される。正確な量は、選ばれた化合物に左右される。このような量は、経験的に決定され得る。
局所投与や全身投与に記載されるように局所混合物が調製される。得られた混合物は、溶液、懸濁液、エマルジョン等であってもよく、クリーム剤、ゲル剤、軟膏剤、乳剤、液剤、エリキシル剤、ローション剤、懸濁剤、チンキ剤、パスタ剤、発泡剤、エアゾール剤、洗浄剤、噴霧剤、坐剤、絆創膏、経皮貼付剤又は局所投与に適切な他の製剤として処方される。
化合物又はその医薬的に許容され得る誘導体は、局所適用のための、例えば、吸入によるエアゾール剤として処方されてもよい(例えば、炎症性疾患、特に喘息の治療に有効なステロイドの送達用のエアゾール剤が記載されている、米国特許第4,044,126号、同第4,414,209号及び同第4,364,923号を参照のこと)。呼吸器に投与するためのこれらの製剤は、単独で又はラクトースのような不活性の担体と組み合わせて、噴霧器のためのエアゾール又は溶液の形で、又は吸入のための超微粒粉末としてあり得る。このような場合、製剤の粒子の直径は、典型的には、50ミクロン未満又は10ミクロン未満である。
化合物は、局部又は局所適用のために、例えば、ゲル剤、クリーム剤及びローション剤の形で、例えば、眼における、皮膚や粘膜への局所適用のために、眼への適用のために又は嚢内又は脊椎内適用のために処方されてもよい。局所投与は、経皮送達のために、また、眼又は粘膜への投与のために、又は吸入療法のために企図される。経鼻溶液は、また、活性化合物単独で又は他の医薬的に許容され得る賦形剤と組み合わせて投与され得る。
これらの溶液、特に眼科使用のために意図されたものは、適切な塩と0.01% - 10%等張液、pH約5-7として処方することができる。
局所適用、経皮貼付剤、直腸投与のような他の投与経路もまた本明細書において企図される。
例えば、直腸投与用の医薬剤形は、全身作用のための直腸坐剤、カプセル剤及び錠剤である。本明細書に用いられる直腸坐剤は、一つ以上の薬理的に又は治療的に活性な成分を放出する体温で融解するか又は軟化する直腸へ挿入するための固体本体を意味する。直腸坐剤に用いられる医薬的に許容され得る物質は、基剤又は賦形剤及び融点を上げる物質である。基剤の例としては、カカオバター(カカオ脂)、グリセリンゼラチン、カーボワックス(ポリオキシエチレングリコール)及び脂肪酸のモノ、ジ及びトリグリセリドの適切な混合物が挙げられる。種々の基剤の組み合わせが用いられてもよい。坐剤の融点を上げる物質には、鯨蝋及びワックスが含まれる。直腸坐剤は、圧縮法によって又は成形によって調製することができる。直腸坐剤の典型的な質量は、約2〜3gmである。
直腸投与のための錠剤及びカプセルは、同じ医薬的に許容され得る物質を用いて経口投与のための製剤と同じ方法によって製造される。
本明細書において提供される有効成分は、当業者に周知である放出制御手段によって又は送達デバイスによって投与され得る。例としては、米国特許第3,845,770号; 同第3,916,899号; 同第3,536,809号; 同第3,598,123号; 同第4,008,719号、同第5,674,533号、同第5,059,595号、同第5,591,767号、同第5,120,548号、同第5,073,543号、同第5,639,476号、同第5,354,556号、同第5,639,480号、同第5,733,566号、同第5,739,108号、同第5,891,474号、同第5,922,356号、同第5,972,891号、同第5,980,945号、同第5,993,855号、同第6,045,830号、同第6,087,324号、同第6,113,943号、同第6,197,350号、同第6,248,363号、同第6,264,970号、同第6,267,981号、同第6,376,461号、同第6,419,961号、同第6,589,548号、同第6,613,358号、同第6,699,500号、同第6,740,634号に記載されるものが挙げられるが、これらに限定されず、これらの明細書の各々の記載は、本願明細書に含まれるものとする。このような剤形は、望ましい放出プロファイルを種々の割合で与える、例えば、ヒドロプロピルメチルセルロース、他のポリマーマトリックス、ゲル、透過性膜、浸透系、多層コーティング、微小粒子、リポソーム、マイクロスフェア、又はこれらの組み合わせを用いて一つ以上の有効成分の持続放出又は徐放性を与えるように使用し得る。本明細書に記載されるものを含む当業者に既知の適切な徐放性製剤は、本明細書において提供される有効成分と用いるのに容易に選ばれ得る。
すべての徐放性医薬品は、これらの制御されていない対応物によって達成されるより薬物療法を改善するという一般の目標を有する。理想的には、医療に最適に設計された徐放性製剤の使用は、最低限の時間で病態を治癒させるか又は制御するために使われている最少限の薬剤物質を特徴とする。徐放性製剤の利点には、薬剤の長時間の活性、投薬頻度の減少、及び患者の服薬遵守を増加が含まれる。更に、徐放性製剤は、作用の開始時間又は他の特性、例えば、薬剤の血中濃度に影響するように使用し得るので、副作用(例えば、悪影響)の発生に影響し得る。
ある実施態様において、静注、植込み可能な浸透圧ポンプ、経皮貼付剤、リポソーム、又は他の投与方式を用いて物質が投与されてもよい。一実施態様において、ポンプが用いられてもよい(Sefton, CRC Crit. Ref. Biomed. Eng. 14:201 (1987); Buchwald et al., Surgery 88:507 (1980); Saudek et al., N. Engl. J. Med. 321:574 (1989)を参照のこと)。他の実施態様においては、高分子材料が使用し得る。更に他の実施態様において、治療目標の近くに、即ち、このように全身投与量の一部分だけを必要とする放出制御系が配置され得る(例えば、Goodson, Medical Applications of Controlled Release, vol. 2, pp. 115-138 (1984)を参照のこと)。一部の実施態様において、放出制御デバイスが被検者に不適切な免疫活性化又は腫瘍の部位の付近に導入される。他の放出制御系は、Langer (Science 249:1527-1533 (1990)によって総説で述べられている。有効成分は、体液に不溶である外側のポリマー膜、例えば、ポリエチレン、ポリプロピレン、エチレン/プロピレンコポリマー、エチレン/アクリル酸エチルコポリマー、エチレン/酢酸ビニルコポリマー、シリコーンゴム、ポリジメチルシロキサン、ネオプレンゴム、塩素化ポリエチレン、ポリ塩化ビニル、酢酸ビニル、塩化ビニリデン、エチレン又はプロピレンとの塩化ビニルコポリマー、アイオノマーポリエチレンテレフタレート、ブチルゴムエピクロロヒドリンゴム、エチレン/ビニルアルコールコポリマー、エチレン/酢酸ビニル/ビニルアルコールターポリマー、又はエチレン/ビニルオキシエタノールコポリマーによって取り囲まれている、固体内部マトリックス、例えば、ポリメチルメタクリレート、ポリブチルメタクリレート、可塑化された又は可塑化されていないポリ塩化ビニル、可塑化ナイロン、可塑化ポリエチレンテレフタレート、天然ゴム、ポリイソプレン、ポリイソブチレン、ポリブタジエン、ポリエチレン、エチレン-酢酸ビニルコポリマー、シリコーンゴム、ポリジメチルシロキサン、シリコーンカーボネートコポリマー、親水性ポリマー、例えば、アクリル酸エステルやメタクリル酸エステルのヒドロゲル、コラーゲン、架橋ポリビニルアルコール、部分的に加水分解された架橋ポリ酢酸ビニルに分散され得る。その後、放出速度制御段階で有効成分が外側のポリマー膜を通って拡散する。このような非経口組成物に含有される有効成分のパーセントは、その個々の性質だけでなく、被検者の要求に非常に左右される。
本明細書において提供される化合物、又はその医薬的に許容され得る誘導体は、治療される被検者の体の具体的な組織、受容体、又は他の領域に標的にされるように処方されてもよい。このような多くのターゲッティング法が当業者に周知である。本組成物に用いられるこのようなすべてのターゲッティング法は、本明細書において企図される。ターゲッティング法の限定されない例としては、例えば、米国特許第6,316,652号、同第6,274,552号、同第6,271,359号、同第6,253,872号、同第6,139,865号、同第6,131,570号、同第6,120,751号、同第6,071,495号、同第6,060,082号、同第6,048,736号、同第6,039,975号、同第6,004,534号、同第5,985,307号、同第5,972,366号、同第5,900,252号、同第5,840,674号、同第5,759,542号、同第5,709,874号を参照のこと。
一実施態様において、組織標的化リポソーム、例えば、腫瘍標的化リポソームを含むリポソーム懸濁液もまた、医薬的に許容され得る担体として適切であり得る。これらは、当業者に周知の方法に従って調製することができる。例えば、米国特許第4,522,811号に記載されるようにリポソーム製剤を調製することができる。概要としては、卵ホスファチジルコリンと脳ホスファチジルセリン(7:3のモル比率)をフラスコの内側で乾燥することによって多重膜小胞(MLV)のようなリポソームを形成することができる。二価のカチオン(PBS)を欠いているリン酸緩衝食塩水中の本明細書において提供される化合物の溶液が添加され、脂質膜が分散されるまでフラスコが振盪される。得られた小胞を洗浄して、封入されていない化合物を除去し、遠心分離によって沈降させ、次にPBSに再懸濁させる。
化合物又は医薬的に許容され得る誘導体は、包装材料、GSK-3活性と関連している一つ以上の症状の治療、予防又は改善に用いられる、本明細書において提供される化合物又はその医薬的に許容され得る誘導体、及び化合物又はその医薬的に許容され得る誘導体がGSK-3仲介疾患の一つ以上の症状の治療、予防又は改善に用いられることを示すラベルを含有する製品として包装され得る。
本明細書において提供される製品は、包装材料を含有する。医薬品を包装するのに用いられる包装材料は、当業者に周知である。例えば、米国特許第5,323,907号、同第5,052,558号、同第5,033,252号を参照のこと。医薬包装材料の例としては、ブリスターパック、びん、チューブ、吸入器、ポンプ、バッグ、バイアル、容器、注射器、びん、及び選ばれた製剤及び意図された投与及び治療方式に適切な任意の包装材料が挙げられるが、これらに限定されない。本明細書において提供される化合物及び組成物の幅広い製剤が企図される。
望ましい生物活性を有するものを確認するために化合物を試験するのに生理的、薬理的及び生物化学的な標準手順が利用可能である。本明細書において提供される化合物のGSK3阻害活性は、本明細書に記載される分析だけでなく、当業者に一般に既知の分析を用いて容易に検出され得る。
GSK3の個々の阻害剤を確認するのに例示的な方法には、無細胞と細胞ベース双方のGSK3キナーゼ分析が含まれる。無細胞GSK3キナーゼ分析は、ポリペプチドGSK3との直接相互作用によって作用する阻害剤を検出し、細胞ベースGSK3キナーゼ分析は、GSK3自体との直接相互作用によって、又はGSK3発現と又は成熟した活性GSK3を生じるのに必要とされる翻訳後処理との干渉によって機能する阻害剤を確認することができる。米国出願第20050054663号には、例示的な無細胞と細胞ベースのGSK3キナーゼ分析が記載されている。本明細書に用いられる例示的な分析を概要として以下に述べる:
ルシフェラーゼ結合タンパク質キナーゼ分析
すべての結合ルシフェラーゼ分析は、キナーゼ分析の完了後にホタルルシフェラーゼ(Promega)との簡単なインキュベーションを用いることにより行われる。KinaseGlo Plusは、ATP>10μMとのキナーゼ反応を読み取るために、KinaseGloはATP<10μMに用いられる。キナーゼ反応のための384-ウエルプレートにおける分析容積は、30マイクロリットルである。
10-25ngの組換え全長ヒトGSK3β(Upstate)を、20mM MOPS、pH 7.0、10mM酢酸マグネシウム、0.2mM EDTA、2mM EGTA、30mM塩化マグネシウム、62.5μMホスホグリコーゲンシンターゼペプチド-2、5μM ATP、10mMβ-グリセロールホスフェート、1mMオルトバナジン酸ナトリウム及び1mMジチオトレイトール中30℃で1時間種々の濃度の化合物の有無においてインキューベートする。KinaseGloルシフェラーゼ反応まで進行させる(以下参照のこと)。
CDK2
組換えヒト全長Cyclin A(Upstate)と錯体を形成した20-50ngの組換え全長ヒトCDK2(Upstate)を、20mM MOPS、pH 7.0、0.2mM EDTA、2mM EGTA、30mM塩化マグネシウム、1mg/mL Histone HI(Roche)、10μM ATP、10mMβ-グリセロールホスフェート、1mMオルトバナジン酸ナトリウム及び1mMジチオトレイトール中30℃で1時間種々の濃度の化合物の有無においてインキューベートする。KinaseGlo Plusルシフェラーゼ反応まで進行させる(以下参照のこと)。
CDK5
組換えヒト全長p35(Upstate)と錯体を形成した10-25ngの組換え全長ヒトCDK5を、20mM MOPS、pH 7.0、0.2mM EDTA、2mM EGTA、30mM塩化マグネシウム、1mg/mL Histone HI(Roche)、10μM ATP、10mMβ-グリセロールホスフェート、1mMオルトバナジン酸ナトリウム及び1mMジチオトレイトール中30℃で1時間種々の濃度の化合物の有無においてインキューベートする。KinaseGlo Plusルシフェラーゼ反応まで進行させる(以下参照のこと)。
ルシフェラーゼ反応:
キナーゼ反応の完了後、同量のKinaseGlo又はKinaseGlo Plusルシフェラーゼ試薬(Promega)を添加し、ルミネッセンスプレートリーダーを用いて5-10分以内にルミネッセンスを読み出した。化合物活性は、最大量で見られる最大阻止に相対する阻止%として表され、次に、曲線適合ソフトウェア(GraphPad Prizm)を用いてIC50値を算出した。
化合物及び組成物の使用方法もまた提供される。方法は、化合物及び組成物の試験管内及び生体内使用の双方に関係している。
ある実施態様において、本明細書において提供される化合物又はその医薬的に許容され得る誘導体を投与することによってGSK-3の作用を阻止する方法が本明細書において提供される。ある実施態様において、糖尿病、糖尿病と関連する病態、アルツハイマー病、パーキンソン病、進行性核上性麻痺、亜急性硬化性全脳炎パーキンソン症候群、脳炎後パーキンソン症候群、拳闘家脳症、ガムパーキンソン痴呆症候群、ピック病、大脳皮質基底核変性症、前頭側頭骨痴呆、ハンチントン病、AIDS関連痴呆、筋萎縮性側索硬化症、多発性硬化症、神経外傷性疾患、うつ病、双極性気分障害、関節リウマチ、炎症性腸疾患、潰瘍性大腸炎、クローン病、敗血症、膵臓癌、卵巣癌及び骨粗鬆症が挙げられるがこれらに限定されないGSK-3仲介疾患の治療、予防又は改善のための方法が本明細書において提供される。一実施態様において、GSK-3仲介疾患は糖尿病である。
本明細書において提供される化合物は、唯一の有効成分として又は他の有効成分と組み合わせて投与することができる。本明細書において提供される化合物と組み合わせて用いることができる他の有効成分には、GSK-3仲介疾患、例えば、糖尿病と関連がある病態、アルツハイマー病のような痴呆を含む慢性神経変性疾患、パーキンソン病、進行性核上性麻痺、亜急性硬化性全脳炎パーキンソン症候群、脳炎後パーキンソン症候群、拳闘家脳症、ガムパーキンソン痴呆症候群、ピック病、大脳皮質基底核変性症、前頭側頭骨痴呆、ハンチントン病、AIDS関連痴呆、筋萎縮性側索硬化症、多発性硬化症、神経外傷性疾患、例えば、急性脳卒中、てんかん、気分障害、例えば、うつ病、統合失調症又は双極性障害を治療する既知の化合物が含まれるがこれらに限定されない。有効成分の組み合わせの投与は、有効成分の患者への個別投与によるか又は複数の有効成分が一つの医薬製剤中に存在する併用製品の形で行うことができる。
ある実施態様において、本明細書において提供される化合物は、当該技術において既知の一つ以上のGSK-3阻害剤化合物と組み合わせて投与され得る。このような化合物は、例えば、国際出願第PCT/US07/06480号、国際公開第WO 99/65897号、同第WO 00/38675号に記載されている。
ある実施態様において、本明細書において提供される化合物は、当該技術において既知の一つ以上の抗糖尿病薬と組み合わせて投与され得る。抗糖尿病薬には、インスリン及びインスリン誘導体、例えば、Lantus(登録商標)(www.lantus.comを参照のこと)又はHMR 1964、速効性インスリン(米国特許第6,221,633号を参照のこと)、GLP-1誘導体、例えば、WO 98/08871に開示されるもの及び経口的に有効な低血糖有効成分が含まれる。
経口的に有効な低血糖有効成分には、スルホニル尿素(例えば、トルブタミド、グリベンクラミド、グリピジド又はグリメピリド)、ビグアニジン(例えば、メトホルミン)、メグリチニド(例えば、レパグリニド)、オキサジアゾリジンジオン、チアゾリジンジオン(例えば、トログリタゾン、シグリタゾン、ピオグリタゾン、ロシグリタゾン又はWO 97/41097に開示されている化合物)、グルコシダーゼ阻害剤(例えば、ミグリトール又はアカルボース)、グルカゴン拮抗薬、GLP-1作動薬、カリウムチャネルオープナ、例えば、WO 97/26265、WO 99/03861に開示されるもの、インスリン感作物質、グルコース新生及び/又はグリコーゲン分解の刺激に関与する肝酵素阻害剤、グルコース取り込みのモジュレータ、脂質代謝を変える化合物、例えば、抗高脂血症有効成分や抗脂血症有効成分、食物摂取、PPAR及びPXRの作動薬を低下させる化合物及びベータ細胞のATP感受性カリウムチャネルに作用する有効成分が含まれるがこれらに限定されない。
本明細書において提供される化合物と上述の化合物の一つ以上及び場合により更に一つ以上の薬理的に活性な物質とのあらゆる適切な組み合わせが本明細書に企図されることは理解される。
上記の詳細な説明及び次の実施例が単に説明にすぎず、内容の範囲に対する制限とするべきでないことは理解される。開示された実施態様に対する種々の変更と修正は、当業者に明らかである。本明細書において提供される化学構造、置換基、誘導体、中間体、合成、製剤及び/又は使用方法に関するものを含むが限定されないこのような変更と修正は、本発明の真意及び範囲を逸脱せずに行われてもよい。本明細書に述べられる米国特許及び公開の明細書の記載は、本願明細書に含まれるものとする。
濃H2SO4(25ml)中の市販の1(5g、17.8ミリモル)の溶液を固体KNO3(3.7g、35.6ミリモル)で0℃において少しずつ処理した。次に、この混合物を室温に温めておいた。1時間撹拌した後、この反応混合物を100mLの氷水に注ぎ入れ、得られた沈殿物をろ過によって除去し、氷水で洗浄した。得られた固形物を乾燥して、2を淡黄色の固形物として得た(4g、72%)。この化合物を精製せずに次の工程に用いた。
(S)-9,10-ジフルオロ-3-メチル-8-ニトロ-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボキサミド(3)
化合物2(4g、12.2ミリモル)をSOCl2(25mL)に懸濁し、透明な溶液が得られるまで2-3時間還流した。反応の完了時に、SOCl2を減圧下で除去した。残りの固形物をジオキサンで希釈し、氷浴中で冷却した。濃NH4OHの溶液を、激しく撹拌しながら注意深く添加した。生じた沈殿をろ過によって集め、水洗した。固形物を減圧下で乾燥して、アミド3を得た(3.3g、収率81%)。この化合物を精製せずに次の工程に用いた。
(S)-8-アミノ-9,10-ジフルオロ-3-メチル-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボキサミド(4)
水/メタノール(1:1v/v、30mL)の混合物中の3(1g、3.07ミリモル)の懸濁液にヒドロ亜硫酸ナトリウム(Na2S2O4、4.3g、24.6ミリモル)を添加した。この懸濁液をすべての出発物質が消失するまで5時間還流した。完了時に、この反応混合物を室温に冷却し、50mLの水を添加した。20分後、淡黄色の固形物をろ過によって集め、水洗した。固形物を減圧下で乾燥して、4を得(725mg、収率74%)、これを精製せずに次の工程に用いた。
(S)-8-アミノ-9,10-ジフルオロ-3-メチル-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリル(5)
DCM(20mL)中の4(500mg、1.69ミリモル)とトリエチルアミン(1.2mL、8.5ミリモル)の溶液にPOCl3(431μL、3.2ミリモル)を0℃でAr(又はN2)下に滴下した。撹拌を更に5時間続けた。色の暗い混合物が生じた。反応の完了時に、DCMを減圧下で除去し、残留物を数回水洗した。固形物を減圧下で乾燥して、5(385mg、収率82%)を得た。この生成物は、DMF又はDMSOを除いてほとんど可溶性でなく、精製せずに次の工程に用いた。
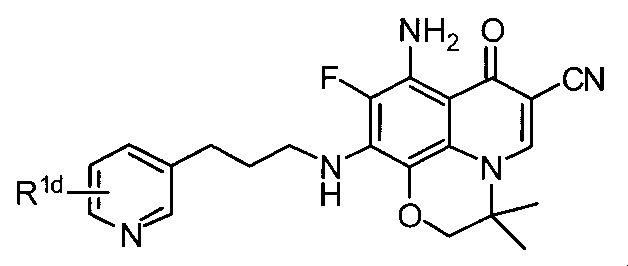
(S)-8-アミノ-9-フルオロ-3-メチル-7-オキソ-10-(3-(ピリジン-3-イル)プロピルアミノ)-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリルの調製
MS (EP) m/z: 394.1 (M+1). (C21H20FN5O2の計算値、393.16)
(S)-8-アミノ-9-フルオロ-3-メチル-10-(3-(3-メチルピリジン-2-イル)プロピルアミノ)-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリルの調製
(収率39%) MS (EP) m/z: 408.1 (M+1). (C22H22FN5O2の計算値 407.18)
8-アミノ-9-フルオロ-3,3-ジメチル-7-オキソ-10-(3-(ピリジン-2-イル)プロピルアミノ)-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリルの調製
市販のエチル3-オキソ-3-(2,3,4,5-テトラフルオロフェニル)プロパノエート(6)(15g、56.8ミリモル)、酢酸無水物(13.4mL、142ミリモル)及びトリエチルオルトホーメート(14.1mL、18ミリモル)の撹拌溶液を、120℃で1.5時間加熱した。この混合物を、減圧下で濃縮し、高真空中で5時間乾燥した。10.1g(31.5ミリモル)の粗生成物を、EtOH/DCM(30mL)に溶解し、0℃まで冷却した。この溶液に2-アミノ-2-メチルプロパン-1-オール(3.36mL、34.7ミリモル)を非常にゆっくりと添加した。30分後、溶媒を蒸発によって除去し、生成物を凍結乾燥して、7を黄色の固形物として得(粗生成物11.9g)、これを精製せずに次の工程に用いた。
9,10-ジフルオロ-3,3-ジメチル-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボン酸(8)
THF(45mL)中の7(11.2g、30.8ミリモル)の溶液に、KOH(4.32g、77ミリモル)の粉砕ペレットを氷冷却しながら添加した。1.5時間後、50mLの10%水性KOHを添加し、反応混合物を85oCまでゆっくりと加熱し、もう2時間撹拌した。この反応混合物を、pH 4まで1N HClで酸性にした。白色沈殿をろ過によって集めて、8を得、これを精製せずに次の工程に用いた(7.5g、収率83%)。
9,10-ジヒドロ-3,3-ジメチル-8-ニトロ-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボン酸(9)
濃H2SO4(30mL)中の8(7.5g、25.4ミリモル)の溶液を、固体のKNO3(3.9g、38.6ミリモル)で0℃において少しずつ処理した。0℃で2時間撹拌した後、この反応混合物を500mLの氷水に注ぎ入れ、得られた沈殿をろ過によって除去し、氷冷水で洗浄した。得られた固形物を乾燥して、9を黄色の固形物(7.6g、87%収率)として得た。
9(7.62g、22.4ミリモル)とSOCl2(80ml)の混合物を、透明な溶液が得られるまで3時間還流した。完了時に、SOCl2を減圧下で除去した。残りの固形物を1,4-ジオキサンに溶解し、この混合物を0oCまで冷却した。濃NH4OH溶液(150mL)をこの混合物に激しく撹拌しながらゆっくりと添加し、温度を0oCに維持した。生じた沈殿をろ過によって集め、氷冷水で洗浄した。固形物を乾燥して、化合物10(6.85g、90%収率)を得た。この化合物を精製せずに次の工程に用いた。
8-アミノ-9,10-ジフルオロ-3,3-ジメチル-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボキサミド(11)
水/メタノール1/1v/v(160mL)の混合物中の10(6.3g、18.6ミリモル)の懸濁液にヒドロ亜硫酸ナトリウム(19.4g、116ミリモル)を添加し、この懸濁液を、すべての出発物質が使用されるまで5時間還流した。この混合物がまだ熱い間に生成物をろ過によって集め、温水で洗浄した。固形物を減圧下で乾燥して、11を得た(2.92g、収率51%)。
8-アミノ-9,10-ジフルオロ-3,3-ジメチル-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリル(12)
CH2Cl2(20ml)中の11(2.92g、9.44ミリモル)とトリエチルアミン(6.6mL、47ミリモル)の混合物を0oCまで冷却し、POCl3(4.35g、28ミリモル)を撹拌しながら滴下した。この混合物を0oCで更に5時間撹拌した。この時間の間に、反応混合物が暗褐色になった。反応の完了後、溶媒を蒸発によって除去した。70mLの水を添加し、この混合物を室温で1時間撹拌した。生じた沈殿をろ過によって集め、水洗した。固形物を減圧下で乾燥して、12を褐色の固形物として得た(2.6g、94%)。この化合物を精製せずに次の工程に用いた。
8-アミノ-9-フルオロ-3,3-ジメチル-7-オキソ-10-(3-(ピリジン-2-イル)プロピルアミノ)-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリル
MS (EP) m/z: 408.1 (M+1). (C22H22FN5O2の計算値、407.18)
8-アミノ-9-フルオロ-3,3-ジメチル-10-(3-(3-メチルピリジン-2-イル)プロピルアミノ)-7-オキソ-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリルの調製
(収率23%) MS (EP) m/z: 422.1 (M+1). (C23H24FN5O2の計算値、421.19)
8-アミノ-9-フルオロ-3,3-ジメチル-7-オキソ-10-(3-(ピリジン-3-イル)プロピルアミノ)-3,7-ジヒドロ-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-6-カルボニトリルの調製
(収率27%) MS (EP) m/z: 408.1 (M+1). (C22H22FN5O2の計算値、407.18)
(S)-10-(3-(1H-イミダゾール-1-イル)プロピルアミノ)-8-アミノ-9-フルオロ-3-メチル-6-(1H-テトラゾール-5-イル)-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-7(3H)-1の調製
イソプロパノールと水(1:1 v/v、15ml)中のニトリル5(40mg、0.14ミリモル)の混合物に20mgのアジ化ナトリウム(0.29ミリモル)と22mgの塩化亜鉛(0.29ミリモル)を添加した。この混合物を110℃で18時間加熱した。沈殿をろ過によって集め、水洗した。この固形物を減圧下で乾燥して、27mgの13(収率60%)を得た。この標記化合物を精製せずに次の工程に用いた。
(S)-10-(3-(1H-イミダゾール-1-イル)プロピルアミノ)-8-アミノ-9-フルオロ-3-メチル-6-(1H-テトラゾール-5-イル)-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-7(3H)-オンの調製
5mlのDMSO中の13(250mg、0.78ミリモル)の溶液に、132μl(1.17ミリモル)の3-(1H-イミダゾール-1-イル)プロパン-1-アミンを添加した。この反応混合物を120℃まで1時間加熱した。反応の完了時に、DMSOを除去し、残りの固形物を分取用HPLCによって精製した。生成物を含有する合わせたHPLC画分に数滴の1N HClを添加した後に、乾燥して、化合物のHCl塩を生成した。標記化合物を、黄色の固形物として得た(118mg、収率37%)。
MS (EP) m/z: 426.4 (M+1). (C19H20FN9O2の計算値、425.42)
上記と同様の合成手順又はその通常の変更を用いて以下の化合物を調製した。
(S)-8-アミノ-10-(3-(エチル(フェニル)アミノ)プロピルアミノ)-9-フルオロ-3-メチル-6-(1H-テトラゾール-5-イル)-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-7(3H)-オンの調製
(S)-8-アミノ-9-フルオロ-3-メチル-10-(3-(ピリジン-2-イル)プロピルアミノ)-6-(1H-テトラゾール-5-イル)-2H-(1,4)オキサジノ(2,3,4-ij)キノリン-7(3H)-オンの調製
m, 1H), 6.96-6.94 (m, 2H), 6.46 (bs, 2H), 6.10 (s, 1H), 4.01 (s, 2H), 1.56 (s, 6H)
Hep G2細胞を、ジャパニーズコレクションオブリサーチバイオリソーシズから入手し、37°Cに保持した5%CO2加湿雰囲気中、標準培養液、100U/mLペニシリンと100g/mLストレプトマイシンで補足された10%ウシ胎児血清を含有する低糖ダルベッコ変法イーグル培地(DMEM)において増殖させた。Hep G2細胞を、1mM EDTAを含有する0.25%トリプシン溶液と収集し、12ウェルプレートに1ウェル当たり1×105細胞で植菌した。3日間培養した後、細胞をリン酸緩衝食塩水(PBS)で一回洗浄し、100のU/mLペニシリンと100g/mLストレプトマイシンで補足した無血清低糖DMEMとインキューベートした。3時間培養した後、この無血清低糖DMEMに種々の濃度の本明細書において提供される化合物と2.5Ci/mL D-(2-3H)グルコース(PerkinElmer、ボストン、マサチューセッツ州、USA)を添加した。DMSO(0.3%、最終濃度)の賦形剤対照も用いた。反応培養液の合計容積/ウェルは、1.0mLの無血清低糖DMEMであった。37°Cで3時間インキュベートした後、培養液を吸引し、細胞をPBSで二回洗浄し、0.4mg/mL担体グリコーゲンを含有する0.25mLの1N KOHを添加した。37°Cで30分間インキュベートした後、0.25mLの48.8%(w/v) KOHを細胞溶解のための各ウェルに添加した。95°Cで30分間インキュベートした後、1.5mLの95%(v/v)エタノールを細胞溶解物に添加した。全グリコーゲンを、-20°Cで一晩沈降させた。グリコーゲン沈澱を、4°Cで30分間19,000×gで遠心分離によって回収した。沈澱を、1mLの70%(v/v)エタノールで一回洗浄し、0.5mLの水に再懸濁した。グリコーゲンへの(3H)グルコースの取込みを、液体シンチレーションカウンタ(Packard Instrument Co.、Meriden、コネティカット州、USA)を用いて評価した。
雄Crlj:CD1(ICR)マウスを日本チャールズリバーラボラトリーズ(横浜、日本)から入手した。すべてのマウスに、標準食餌(日本クレア、東京、日本)と随意に水道水を与えた。動物の世話と使用のための施設のガイドラインすべてをこの実験に適用した。試験化合物を0.3%カルボキシメチルセルロースナトリウム塩(CMC-Na; Sigma、セントルイス、ミズーリ州)に懸濁した。15-17時間絶食させた後、7週齢のICRマウスに試験化合物(30mg/kg)又は賦形剤(0.3% CMC-Na)を経口投与した。試験化合物治療の30分後にブドウ糖液(5g/kg)を経口投与した。試験化合物治療の前と、グルコース負荷の0、0.5、1及び2時間後にEDTA・2Kを含有する毛細管を用いて尾静脈から血液試料を集めた。血液試料を2,500×gで5分間遠心分離し、分離された血漿を氷上に保持し、同じ日に分析した。グルコースC II-試験(和光純薬工業、大阪、日本)を用いて血漿血糖値を求めた。
反復投与実験
雄ob/ob又はC57BL/6Jマウスを日本チャールズリバーラボラトリーズ(横浜、日本)から入手した。すべてのマウスに、OA-2食餌(日本クレア、東京、日本)と随意に水道水を与えた。動物世話と使用のための施設のガイドラインすべてをこの実験に適用した。各試験化合物を0.3%カルボキシメチルセルロースナトリウム塩(CMC-Na; Sigma、セントルイス、ミズーリ州)に懸濁した。10mg/kgの試験化合物を、6週齢のob/ob又はC57BL/6Jマウスに14日間一日一回経口投与した。7日目と14日目の投与の12時間後にEDTA2Kを含有する毛細管を用いて尾静脈から血液試料を集めた。血液試料は2,500×gで5分間遠心分離し、分離された血漿を氷上に保持し、同じ日に分析した。血漿血糖値をグルコースC II-試験(和光純薬工業、大阪、日本)を用いて求めた。
以下の化合物をこの分析において試験した:
イヌ嘔吐実験
株式会社日本医科学動物資材研究所(東京、日本)から雄ビーグル犬を入手した。犬に標準食餌(オリエンタル酵母工業、東京、日本)を与えた。水は、随意に利用できた。試験化合物をジメチルスルホキシド(100mg/mL)に溶解し、続いて50%ポリエチレングリコール400で希釈して、1、3及び10mg/mLの濃度を得た。犬に化合物(0.1、0.3及び1mg/kg、0.1mL/kg)を橈側皮静脈を経て静脈内に投薬した。投薬0.17、0.5、1、2及び4時間後にEDTA-2K(VENOJECT II、テルモ、東京、日本)を含有する真空管に対向する橈側皮静脈から血液試料を集め、氷上に保持した。血漿試料を、遠心分離(2200g、10分、4°C)によって分離し、-20°Cで保存した。血漿試料を、内部標準を含有するメタノールとアセトニトリル(1:1、v/v)の2容積の混合物と混合し、13400gで3分間遠心分離した。上清を15%アセトニトリルで20倍に希釈し、10μLアリコートをLC/MS/MSシステムに供した。HPLCによる分離をWaters Alliance 2795 Separations Module(Waters Corp.、マサチューセッツ州)で行った。正イオン対を用いたMRM方式においてエレクトロスプレーイオン化インターフェイスを備えたMicromass Quattro Ultima Pt(Waters Corp.)を用いて質量スペクトルを求めた。
この実験において以下の化合物を試験した:
上記実施態様は、単に例示にすぎないものであり、当業者は、通常と同じ程度の実験、個々の化合物の多くの等価物、材料及び手順を用いて認識するか、又は確認することができる。このような等価物すべてが、特許請求された内容の範囲内であるとみなされ、添付の特許請求の範囲によって包含される。
Claims (18)
- 次式IIの化合物又はその医薬的に許容され得る塩、溶媒和物又は水和物:
(式中、R1及びR8は、以下の通りである:
i) R1は、水素、低級アルキル、シクロアルキル、ヘテロシクリル、アリール、アラルキル、ヘテロシクロアルキル又はヘテロアラルキルであり; R8は、水素、ハロ又はアルコキシであるか; 又は
ii) R1とR8は、これらが置換されている原子と一緒になってヘテロ原子1-4個を含有する5-8員置換又は無置換複素環又はヘテロアリール環を形成し; ここで、存在する場合の置換基は、1つ以上のQ0より選ばれ;
Q0は、ハロ、ヒドロキシル、アルコキシ、シクロアルキル、アリール、ヘテロアリール、アラルキル、擬ハロ、アミノ、ニトロ、アルキル、ハロアルキル、アルケニル又はアルキニルであり;
R2は、水素、低級アルキル、COOR2a又は場合により置換されていてもよいアリールであり、ここで、存在する場合の置換基は、1〜4つのQ1基より選ばれる;
R2aは、水素、又は低級アルキルであり;
R3は、水素又は低級アルキルであり;
R5は、NR5aR5b又はSR5aであり;
R5a及びR5bは、各々独立して、水素、低級アルキル又はCOR5Cであり;
R5Cは、低級アルキル又は低級ハロアルキルであり;
R6は、ハロであり;
Ra及びRbは、以下の通り選ばれる:
i) Raは、水素又は低級アルキルであり、Rbは以下の基である
-(CH2)n(NRc)mR、
-(CH2)nORd、
-(CH2)nS(O)lRd、
-CH(Rj)(CH2)n(NRc)mR、
-CH(Rj)(CH2)nORd、又は
-CH(Rj)(CH2)nS(O)lRd
ii) Ra及びRbは、これらが置換されている窒素原子と一緒になってヘテロ原子1-4個を含有する5-7員置換又は無置換複素環又はヘテロアリール環を形成し; ここで、存在する場合の置換基は、1〜4つのQ1基より選ばれ;
Rcは、水素又は低級アルキルであり;
Rは、アルキル、アリール、ヘテロアリール、シクロアルキル、ヘテロシクリル、縮合ヘテロシクリルアリール、縮合アリールヘテロシクリル、-C(O)ORd、-C(O)Rd、-C(O)NReRe又は-CHRdRdであり;
各々のRdは、アルキル、アリール、ヘテロシクリル、ヘテロアリール、シクロアルキル、縮合ヘテロシクリルアリール又は縮合アリールヘテロシクリルであり;
各々Reは、水素、アルキル、アリール、ヘテロシクリル、ヘテロアリール、シクロアルキル、縮合ヘテロシクリルアリール又は縮合アリールヘテロシクリルであり;
Rjは、低級アルキル又は低級ハロアルキルであり;
nは、0〜6であり;
mは、0又は1であり;
lは、0〜2であり、ここで、R及びRdは、場合により、1〜4つの置換基で置換されていてもよく、各々独立して、Q1より選ばれ、
ここで、Q1は、ハロ、擬ハロ、ヒドロキシ、オキソ、チア、ニトリル、ニトロ、ホルミル、メルカプト、ヒドロキシカルボニル、ヒドロキシカルボニルアルキル、アルキル、ハロアルキル、ポリハロアルキル、アミノアルキル、ジアミノアルキル、二重結合1〜2個を含有するアルケニル、三重結合1〜2個を含有するアルキニル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、アリール、ヘテロアリール、アラルキル、アラルケニル、アラルキニル、ヘテロアリールアルキル、トリアルキルシリル、ジアルキルアリールシリル、アルキルジアリールシリル、トリアリールシリル、アルキリデン、アリールアルキリデン、アルキルカルボニル、アリールカルボニル、ヘテロアリールカルボニル、アルコキシカルボニル、アルコキシカルボニルアルキル、アリールオキシカルボニル、アリールオキシカルボニルアルキル、アラルコキシカルボニル、アラルコキシカルボニルアルキル、アリールカルボニルアルキル、アミノカルボニル、アルキルアミノカルボニル、ジアルキルアミノカルボニル、アリールアミノカルボニル、ジアリールアミノカルボニル、アリールアルキルアミノカルボニル、アルコキシ、アリールオキシ、ヘテロアリールオキシ、ヘテロアラルコキシ、ヘテロシクリルオキシ、シクロアルコキシ、ペルフルオロアルコキシ、アルケニルオキシ、アルキニルオキシ、アラルコキシ、アルキルカルボニルオキシ、アリールカルボニルオキシ、アラルキルカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、アラルコキシカルボニルオキシ、アミノカルボニルオキシ、アルキルアミノカルボニルオキシ、ジアルキルアミノカルボニルオキシ、アルキルアリールアミノカルボニルオキシ、ジアリールアミノカルボニルオキシ、グアニジノ、イソチオウレイド、ウレイド、N-アルキルウレイド、N-アリールウレイド、N'-アルキルウレイド、N',N'-ジアルキルウレイド、N'-アルキル-N'-アリールウレイド、N',N'-ジアリールウレイド、N'-アリールウレイド、N,N'-ジアルキルウレイド、N-アルキル-N'-アリールウレイド、N-アリール-N'-アルキルウレイド、N,N'-ジアリールウレイド、N,N',N'-トリアルキルウレイド、N,N'-ジアルキル-N'-アリールウレイド、N-アルキル-N',N'-ジアリールウレイド、N-アリール-N',N'-ジアルキルウレイド、N,N'-ジアリール-N'-アルキルウレイド、N,N',N'-トリアリールウレイド、アミジノ、アルキルアミジノ、アリールアミジノ、アミノチオカルボニル、アルキルアミノチオカルボニル、アリールアミノチオカルボニル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、アリールアミノアルキル、ジアリールアミノアルキル、アルキルアリールアミノアルキル、アルキルアミノ、ジアルキルアミノ、ハロアルキルアミノ、アリールアミノ、ジアリールアミノ、アルキルアリールアミノ、アルキルカルボニルアミノ、アルコキシカルボニルアミノ、アラルコキシカルボニルアミノ、アリールカルボニルアミノ、アリールカルボニルアミノアルキル、アリールオキシカルボニルアミノアルキル、アリールオキシアリールカルボニルアミノ、アリールオキシカルボニルアミノ、アルキルスルホニルアミノ、アリールスルホニルアミノ、ヘテロアリールスルホニルアミノ、ヘテロシクリルスルホニルアミノ、ヘテロアリールチオ、アジド、-N+R51R52R53、P(R50)2、P(=O)(R50)2、OP(=O)(R50)2、-NR60C(=O)R63、ジアルキルホスホニル、アルキルアリールホスホニル、ジアリールホスホニル、ヒドロキシホスホニル、アルキルチオ、アリールチオ、ペルフルオロアルキルチオ、ヒドロキシカルボニルアルキルチオ、チオシアノ、イソチオシアノ、アルキルスルフィニルオキシ、アルキルスルホニルオキシ、アリールスルフィニルオキシ、アリールスルホニルオキシ、ヒドロキシスルホニルオキシ、アルコキシスルホニルオキシ、アミノスルホニルオキシ、アルキルアミノスルホニルオキシ、ジアルキルアミノスルホニルオキシ、アリールアミノスルホニルオキシ、ジアリールアミノスルホニルオキシ、アルキルアリールアミノスルホニルオキシ、アルキルスルフィニル、アルキルスルホニル、アリールスルフィニル、アリールスルホニル、ヒドロキシスルホニル、アルコキシスルホニル、アミノスルホニル、アルキルアミノスルホニル、ジアルキルアミノスルホニル、アリールアミノスルホニル、ジアリールアミノスルホニル又はアルキルアリールアミノスルホニルであるか; 又は1,2又は1,3配置で原子を置換している2つのQ1基が一緒になってアルキレンジオキシ(即ち、-O-(CH2)y-O-)、チオアルキレンオキシ(即ち、-S-(CH2)y-O-)又はアルキレンジチオキシ(即ち、-S-(CH2)y-S-)(ここで、yは、1又は2である)を形成するか; 又は同じ原子を置換している2つのQ1基が一緒になってアルキレンを形成し;
Q1は、各々独立して、無置換か又は1、2又は3つの置換基で置換され、置換基は、各々独立してQ2より選ばれており;
Q2は、各々独立して、ハロ、擬ハロ、ヒドロキシ、オキソ、チア、ニトリル、ニトロ、ホルミル、メルカプト、ヒドキシロカルボニル、ヒドロキシカルボニルアルキル、アルキル、ハロアルキル、ポリハロアルキル、アミノアルキル、ジアミノアルキル、二重結合1〜2個を含有するアルケニル、三重結合1〜2個を含有するアルキニル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、アリール、ヘテロアリール、アラルキル、アラルケニル、アラルキニル、ヘテロアリールアルキル、トリアルキルシリル、ジアルキルアリールシリル、アルキルジアリールシリル、トリアリールシリル、アルキリデン、アリールアルキリデン、アルキルカルボニル、アリールカルボニル、ヘテロアリールカルボニル、アルコキシカルボニル、アルコキシカルボニルアルキル、アリールオキシカルボニル、アリールオキシカルボニルアルキル、アラルコキシカルボニル、アラルコキシカルボニルアルキル、アリールカルボニルアルキル、アミノカルボニル、アルキルアミノカルボニル、ジアルキルアミノカルボニル、アリールアミノカルボニル、ジアリールアミノカルボニル、アリールアルキルアミノカルボニル、アルコキシ、アリールオキシ、ヘテロアリールオキシ、ヘテロアラルコキシ、ヘテロシクリルオキシ、シクロアルコキシ、ペルフルオロアルコキシ、アルケニルオキシ、アルキニルオキシ、アラルコキシ、アルキルカルボニルオキシ、アリールカルボニルオキシ、アラルキルカルボニルオキシ、アルコキシカルボニルオキシ、アリールオキシカルボニルオキシ、アラルコキシカルボニルオキシ、アミノカルボニルオキシ、アルキルアミノカルボニルオキシ、ジアルキルアミノカルボニルオキシ、アルキルアリールアミノカルボニルオキシ、ジアリールアミノカルボニルオキシ、グアニジノ、イソチオウレイド、ウレイド、N-アルキルウレイド、N-アリールウレイド、N'-アルキルウレイド、N',N'-ジアルキルウレイド、N'-アルキル-N'-アリールウレイド、N',N'-ジアリールウレイド、N'-アリールウレイド、N,N'-ジアルキルウレイド、N-アルキル-N'-アリールウレイド、N-アリール-N'-アルキルウレイド、N,N'-ジアリールウレイド、N,N',N'-トリアルキルウレイド、N,N'-ジアルキル-N'-アリールウレイド、N-アルキル-N',N'-ジアリールウレイド、N-アリール-N',N'-ジアルキルウレイド、N,N'-ジアリール-N'-アルキルウレイド、N,N',N'-トリアリールウレイド、アミジノ、アルキルアミジノ、アリールアミジノ、アミノチオカルボニル、アルキルアミノチオカルボニル、アリールアミノチオカルボニル、アミノ、アミノアルキル、アルキルアミノアルキル、ジアルキルアミノアルキル、アリールアミノアルキル、ジアリールアミノアルキル、アルキルアリールアミノアルキル、アルキルアミノ、ジアルキルアミノ、ハロアルキルアミノ、アリールアミノ、ジアリールアミノ、アルキルアリールアミノ、アルキルカルボニルアミノ、アルコキシカルボニルアミノ、アラルコキシカルボニルアミノ、アリールカルボニルアミノ、アリールカルボニルアミノアルキル、アリールオキシカルボニルアミノアルキル、アリールオキシアリールカルボニルアミノ、アリールオキシカルボニルアミノ、アルキルスルホニルアミノ、アリールスルホニルアミノ、ヘテロアリールスルホニルアミノ、ヘテロシクリルスルホニルアミノ、ヘテロアリールチオ、アジド、-N+R51R52R53、P(R50)2、P(=O)(R50)2、OP(=O)(R50)2、-NR60C(=O)R63、ジアルキルホスホニル、アルキルアリールホスホニル、ジアリールホスホニル、ヒドロキシホスホニル、アルキルチオ、アリールチオ、ペルフルオロアルキルチオ、ヒドロキシカルボニルアルキルチオ、チオシアノ、イソチオシアノ、アルキルスルフィニルオキシ、アルキルスルホニルオキシ、アリールスルフィニルオキシ、アリールスルホニルオキシ、ヒドロキシスルホニルオキシ、アルコキシスルホニルオキシ、アミノスルホニルオキシ、アルキルアミノスルホニルオキシ、ジアルキルアミノスルホニルオキシ、アリールアミノスルホニルオキシ、ジアリールアミノスルホニルオキシ、アルキルアリールアミノスルホニルオキシ、アルキルスルフィニル、アルキルスルホニル、アリールスルフィニル、アリールスルホニル、ヒドロキシスルホニル、アルコキシスルホニル、アミノスルホニル、アルキルアミノスルホニル、ジアルキルアミノスルホニル、アリールアミノスルホニル、ジアリールアミノスルホニル又はアルキルアリールアミノスルホニルであるか; 又は1,2又は1,3配置で原子を置換している2つのQ2基が一緒になってアルキレンジオキシ(即ち、-O-(CH2)y-O-)、チオアルキレンオキシ(即ち、-S-(CH2)y-O-)又はアルキレンジチオキシ(即ち、-S-(CH2)y-S-)(ここで、yは、1又は2である)を形成するか; 又は同じ原子を置換している2つのQ2基が一緒になってアルキレンを形成し;
R50は、ヒドロキシ、アルコキシル、アラルコキシ、アルキル、ヘテロアリール、ヘテロシクリル、アリール又は-NR70R71であり、ここで、R70及びR71は、各々独立して、水素、アルキル、アラルキル、アリール、ヘテロアリール、ヘテロアラルキル又はヘテロシクリルであるか、又はR70とR71が一緒になってアルキレン、アザアルキレン、オキサアルキレン又はチアアルキレンを形成し;
R51、R52及びR53は、各々独立して、水素、アルキル、アリール、アラルキル、ヘテロアリール、ヘテロアラルキル、ヘテロシクリル又はヘテロシクリルアルキルであり;
R60は、水素、アルキル、アリール、アラルキル、ヘテロアリール、ヘテロアラルキル、ヘテロシクリル又はヘテロシクリルアルキルであり;
R63は、アルコキシ、アラルコキシ、アルキル、ヘテロアリール、ヘテロシクリル、アリール又は-NR70R71であるが、m=1である場合には、Rはアルキル又はシクロアルキルではない)。 - 請求項1〜12のいずれか1項に記載の化合物及び医薬的に許容され得る担体を含む医薬組成物。
- GSK-3の作用を阻害するための請求項13に記載の医薬組成物。
- GSK-3仲介疾患を治療するか、予防するか又は改善させるための、請求項13に記載の医薬組成物。
- GSK-3仲介疾患が、糖尿病、糖尿病と関連がある病態、アルツハイマー病、パーキンソン病、進行性核上性麻痺、亜急性硬化性全脳炎パーキンソン症候群、脳炎後パーキンソン症候群、拳闘家脳症、ガムパーキンソン痴呆症候群、ピック病、大脳皮質基底核変性症、前頭側頭骨痴呆、ハンチントン病、AIDS関連痴呆、筋萎縮性側索硬化症、多発性硬化症、神経外傷性疾患、うつ病、双極性気分障害、関節リウマチ、炎症性腸疾患、潰瘍性大腸炎、クローン病、敗血症、膵臓癌、卵巣癌又は骨粗鬆症である、請求項15に記載の医薬組成物。
- GSK-3仲介疾患が、糖尿病である、請求項15又は16に記載の医薬組成物。
- GSK-3仲介疾患を治療するか、予防するか又は改善させるのに用いられる薬剤を製造するための請求項1〜12のいずれか1項に記載の化合物の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US99334607P | 2007-09-11 | 2007-09-11 | |
| US60/993,346 | 2007-09-11 | ||
| PCT/US2008/010615 WO2009035634A2 (en) | 2007-09-11 | 2008-09-11 | Cyanoaminoquinolones and tetrazoloaminoquinolones as gsk-3 inhibitors |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2010539164A JP2010539164A (ja) | 2010-12-16 |
| JP2010539164A5 JP2010539164A5 (ja) | 2013-12-05 |
| JP5426552B2 true JP5426552B2 (ja) | 2014-02-26 |
Family
ID=40090032
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010524862A Expired - Fee Related JP5426552B2 (ja) | 2007-09-11 | 2008-09-11 | Gsk−3阻害剤としてのシアノアミノキノロン及びテトラゾロアミノキノロン |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US8389514B2 (ja) |
| EP (1) | EP2203458B1 (ja) |
| JP (1) | JP5426552B2 (ja) |
| KR (1) | KR101563018B1 (ja) |
| CN (2) | CN101855228B (ja) |
| AT (1) | ATE531721T1 (ja) |
| AU (1) | AU2008299903B2 (ja) |
| BR (1) | BRPI0816798A2 (ja) |
| CA (1) | CA2699151A1 (ja) |
| ES (1) | ES2371800T3 (ja) |
| MX (1) | MX2010002667A (ja) |
| WO (1) | WO2009035634A2 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2010088924A1 (en) | 2009-02-06 | 2010-08-12 | Telormedix Sa | Pharmaceutical compositions comprising imidazoquinolin(amines) and derivatives thereof suitable for local administration |
| CN102421784B (zh) * | 2009-03-11 | 2015-09-30 | 杏林制药株式会社 | 作为gsk-3抑制剂的7-环烷基氨基喹诺酮 |
| WO2011107494A1 (de) | 2010-03-03 | 2011-09-09 | Sanofi | Neue aromatische glykosidderivate, diese verbindungen enthaltende arzneimittel und deren verwendung |
| US8530413B2 (en) | 2010-06-21 | 2013-09-10 | Sanofi | Heterocyclically substituted methoxyphenyl derivatives with an oxo group, processes for preparation thereof and use thereof as medicaments |
| TW201215388A (en) | 2010-07-05 | 2012-04-16 | Sanofi Sa | (2-aryloxyacetylamino)phenylpropionic acid derivatives, processes for preparation thereof and use thereof as medicaments |
| TW201215387A (en) | 2010-07-05 | 2012-04-16 | Sanofi Aventis | Spirocyclically substituted 1,3-propane dioxide derivatives, processes for preparation thereof and use thereof as a medicament |
| TW201221505A (en) | 2010-07-05 | 2012-06-01 | Sanofi Sa | Aryloxyalkylene-substituted hydroxyphenylhexynoic acids, process for preparation thereof and use thereof as a medicament |
| WO2013037390A1 (en) | 2011-09-12 | 2013-03-21 | Sanofi | 6-(4-hydroxy-phenyl)-3-styryl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| WO2013045413A1 (en) | 2011-09-27 | 2013-04-04 | Sanofi | 6-(4-hydroxy-phenyl)-3-alkyl-1h-pyrazolo[3,4-b]pyridine-4-carboxylic acid amide derivatives as kinase inhibitors |
| WO2015155738A2 (en) | 2014-04-09 | 2015-10-15 | Christopher Rudd | Use of gsk-3 inhibitors or activators which modulate pd-1 or t-bet expression to modulate t cell immunity |
| EP3920885A1 (en) | 2019-02-08 | 2021-12-15 | Frequency Therapeutics, Inc. | Valproic acid compounds and wnt agonists for treating ear disorders |
Family Cites Families (119)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES206819A1 (es) | 1952-12-17 | 1953-06-01 | Moreno Rodriguez Juan | Maquina punzadora perfeccionada de taladro multiple |
| US3536809A (en) * | 1969-02-17 | 1970-10-27 | Alza Corp | Medication method |
| US3598123A (en) * | 1969-04-01 | 1971-08-10 | Alza Corp | Bandage for administering drugs |
| US4044126A (en) * | 1972-04-20 | 1977-08-23 | Allen & Hanburys Limited | Steroidal aerosol compositions and process for the preparation thereof |
| GB1429184A (en) * | 1972-04-20 | 1976-03-24 | Allen & Hanburys Ltd | Physically anti-inflammatory steroids for use in aerosols |
| US3845770A (en) * | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US3916899A (en) * | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US4008719A (en) * | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| US4410545A (en) * | 1981-02-13 | 1983-10-18 | Syntex (U.S.A.) Inc. | Carbonate diester solutions of PGE-type compounds |
| US4328245A (en) * | 1981-02-13 | 1982-05-04 | Syntex (U.S.A.) Inc. | Carbonate diester solutions of PGE-type compounds |
| US4409239A (en) * | 1982-01-21 | 1983-10-11 | Syntex (U.S.A.) Inc. | Propylene glycol diester solutions of PGE-type compounds |
| JPS591489A (ja) | 1982-06-29 | 1984-01-06 | Dai Ichi Seiyaku Co Ltd | ピリドベンゾオキサジン誘導体 |
| DE3420193A1 (de) * | 1984-05-30 | 1985-12-05 | Boehringer Ingelheim KG, 6507 Ingelheim | Neue substituierte pyrrolidinone, verfahren zu ihrer herstellung und arzneimittel |
| US4822801A (en) | 1984-07-20 | 1989-04-18 | Warner-Lambert Company | 4-oxo-1,4-dihydroquinoline-3-carboxylic acid derivative as antibacterial agents |
| KR890002631B1 (ko) * | 1984-10-04 | 1989-07-21 | 몬산토 캄파니 | 생물학적으로 활성인 소마토트로핀을 지속적으로 유리하는 조성물 |
| IE58110B1 (en) * | 1984-10-30 | 1993-07-14 | Elan Corp Plc | Controlled release powder and process for its preparation |
| JPS6253987A (ja) | 1985-05-24 | 1987-03-09 | Tokyo Tanabe Co Ltd | ベンゾ〔ij〕キノリジン−2−カルボン酸化合物、その製造法及びそれを有効成分とする抗菌剤 |
| DE3522405A1 (de) * | 1985-06-22 | 1987-01-02 | Bayer Ag | 1,8-verbrueckte 4-chinolon-3-carbonsaeuren, verfahren zu ihrer herstellung sowie diese enthaltende arzneimittel und ihre verwendung zur herstellung von arzneimitteln |
| US4772706A (en) | 1986-01-13 | 1988-09-20 | Warner-Lambert Company | Process for quinoline-3-carboxylic acid antibacterial agents |
| JPH089597B2 (ja) | 1986-01-21 | 1996-01-31 | 杏林製薬株式会社 | 選択毒性に優れた8‐アルコキシキノロンカルボン酸およびその塩並びにその製造方法 |
| JPS62198685A (ja) | 1986-02-26 | 1987-09-02 | Kyorin Pharmaceut Co Ltd | キノロンカルボン酸誘導体及びその製造方法 |
| ZW16387A1 (en) | 1986-09-12 | 1988-05-25 | Hoffmann La Roche | Tricyclic compounds |
| JPH0696545B2 (ja) | 1986-12-08 | 1994-11-30 | 宇部興産株式会社 | 3,5,6−トリフルオロ−4−ヒドロキシフタル酸の製造法 |
| US5033252A (en) * | 1987-12-23 | 1991-07-23 | Entravision, Inc. | Method of packaging and sterilizing a pharmaceutical product |
| US5052558A (en) * | 1987-12-23 | 1991-10-01 | Entravision, Inc. | Packaged pharmaceutical product |
| JPH0228178A (ja) * | 1988-04-23 | 1990-01-30 | Toyama Chem Co Ltd | 新規なピリドンカルボン酸誘導体およびその塩並びにそれらの製造法 |
| US5073543A (en) * | 1988-07-21 | 1991-12-17 | G. D. Searle & Co. | Controlled release formulations of trophic factors in ganglioside-lipsome vehicle |
| US5612059A (en) * | 1988-08-30 | 1997-03-18 | Pfizer Inc. | Use of asymmetric membranes in delivery devices |
| CA2001203C (en) * | 1988-10-24 | 2001-02-13 | Thomas P. Demuth, Jr. | Novel antimicrobial dithiocarbamoyl quinolones |
| IT1229203B (it) * | 1989-03-22 | 1991-07-25 | Bioresearch Spa | Impiego di acido 5 metiltetraidrofolico, di acido 5 formiltetraidrofolico e dei loro sali farmaceuticamente accettabili per la preparazione di composizioni farmaceutiche in forma a rilascio controllato attive nella terapia dei disturbi mentali organici e composizioni farmaceutiche relative. |
| US5153203A (en) * | 1989-03-30 | 1992-10-06 | Wakunaga Seiyaku Kabushiki Kaisha | Quinolone derivatives and salts thereof, preparation processes thereof, and antibacterial agents containing the same |
| US5120548A (en) * | 1989-11-07 | 1992-06-09 | Merck & Co., Inc. | Swelling modulated polymeric drug delivery device |
| US5585112A (en) * | 1989-12-22 | 1996-12-17 | Imarx Pharmaceutical Corp. | Method of preparing gas and gaseous precursor-filled microspheres |
| IT1246382B (it) * | 1990-04-17 | 1994-11-18 | Eurand Int | Metodo per la cessione mirata e controllata di farmaci nell'intestino e particolarmente nel colon |
| US5733566A (en) * | 1990-05-15 | 1998-03-31 | Alkermes Controlled Therapeutics Inc. Ii | Controlled release of antiparasitic agents in animals |
| FR2663336B1 (fr) * | 1990-06-18 | 1992-09-04 | Adir | Nouveaux derives peptidiques, leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| US5543390A (en) * | 1990-11-01 | 1996-08-06 | State Of Oregon, Acting By And Through The Oregon State Board Of Higher Education, Acting For And On Behalf Of The Oregon Health Sciences University | Covalent microparticle-drug conjugates for biological targeting |
| US5580578A (en) * | 1992-01-27 | 1996-12-03 | Euro-Celtique, S.A. | Controlled release formulations coated with aqueous dispersions of acrylic polymers |
| NO304832B1 (no) * | 1992-05-27 | 1999-02-22 | Ube Industries | Aminokinolonderivater samt middel mot HIV |
| US5323907A (en) * | 1992-06-23 | 1994-06-28 | Multi-Comp, Inc. | Child resistant package assembly for dispensing pharmaceutical medications |
| TW333456B (en) * | 1992-12-07 | 1998-06-11 | Takeda Pharm Ind Co Ltd | A pharmaceutical composition of sustained-release preparation the invention relates to a pharmaceutical composition of sustained-release preparation which comprises a physiologically active peptide. |
| US5591767A (en) * | 1993-01-25 | 1997-01-07 | Pharmetrix Corporation | Liquid reservoir transdermal patch for the administration of ketorolac |
| US5430152A (en) * | 1993-02-16 | 1995-07-04 | Hoechst Celanese Corporation | Method for preparing quinoline carboxylic acids and derivatives thereof |
| JP2862747B2 (ja) | 1993-03-03 | 1999-03-03 | 株式会社品川工業所 | 連続式玉子焼装置及び玉子焼皿 |
| US6274552B1 (en) * | 1993-03-18 | 2001-08-14 | Cytimmune Sciences, Inc. | Composition and method for delivery of biologically-active factors |
| US5638480A (en) * | 1993-04-01 | 1997-06-10 | Bridgestone Corporation | Optical waveguide hose |
| US5985307A (en) * | 1993-04-14 | 1999-11-16 | Emory University | Device and method for non-occlusive localized drug delivery |
| US5523092A (en) * | 1993-04-14 | 1996-06-04 | Emory University | Device for local drug delivery and methods for using the same |
| US6087324A (en) * | 1993-06-24 | 2000-07-11 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| US6004534A (en) * | 1993-07-23 | 1999-12-21 | Massachusetts Institute Of Technology | Targeted polymerized liposomes for improved drug delivery |
| IT1270594B (it) * | 1994-07-07 | 1997-05-07 | Recordati Chem Pharm | Composizione farmaceutica a rilascio controllato di moguisteina in sospensione liquida |
| US5759542A (en) * | 1994-08-05 | 1998-06-02 | New England Deaconess Hospital Corporation | Compositions and methods for the delivery of drugs by platelets for the treatment of cardiovascular and other diseases |
| US5660854A (en) * | 1994-11-28 | 1997-08-26 | Haynes; Duncan H | Drug releasing surgical implant or dressing material |
| US6316652B1 (en) * | 1995-06-06 | 2001-11-13 | Kosta Steliou | Drug mitochondrial targeting agents |
| US5798119A (en) * | 1995-06-13 | 1998-08-25 | S. C. Johnson & Son, Inc. | Osmotic-delivery devices having vapor-permeable coatings |
| WO1997001331A2 (en) * | 1995-06-27 | 1997-01-16 | Takeda Chemical Industries, Ltd. | Method of producing sustained-release preparation |
| TW448055B (en) * | 1995-09-04 | 2001-08-01 | Takeda Chemical Industries Ltd | Method of production of sustained-release preparation |
| JP2909418B2 (ja) * | 1995-09-18 | 1999-06-23 | 株式会社資生堂 | 薬物の遅延放出型マイクロスフイア |
| US6039975A (en) * | 1995-10-17 | 2000-03-21 | Hoffman-La Roche Inc. | Colon targeted delivery system |
| US5980945A (en) * | 1996-01-16 | 1999-11-09 | Societe De Conseils De Recherches Et D'applications Scientifique S.A. | Sustained release drug formulations |
| WO1997026265A1 (en) | 1996-01-17 | 1997-07-24 | Novo Nordisk A/S | Fused 1,2,4-thiadiazine and fused 1,4-thiazine derivatives, their preparation and use |
| TW345603B (en) * | 1996-05-29 | 1998-11-21 | Gmundner Fertigteile Gmbh | A noise control device for tracks |
| US6264970B1 (en) * | 1996-06-26 | 2001-07-24 | Takeda Chemical Industries, Ltd. | Sustained-release preparation |
| US6419961B1 (en) * | 1996-08-29 | 2002-07-16 | Takeda Chemical Industries, Ltd. | Sustained release microcapsules of a bioactive substance and a biodegradable polymer |
| JP3149958B2 (ja) | 1996-08-30 | 2001-03-26 | ノボ ノルディスク アクティーゼルスカブ | Glp―1誘導体 |
| EP1007012A4 (en) * | 1996-10-01 | 2006-01-18 | Cima Labs Inc | TASTE-MASKED MICRO-CAPSULE COMPOSITION AND MANUFACTURING PROCESS |
| CA2217134A1 (en) * | 1996-10-09 | 1998-04-09 | Sumitomo Pharmaceuticals Co., Ltd. | Sustained release formulation |
| ES2221019T3 (es) * | 1996-10-31 | 2004-12-16 | Takeda Chemical Industries, Ltd. | Preparacion de liberacion mantenida. |
| US6131570A (en) * | 1998-06-30 | 2000-10-17 | Aradigm Corporation | Temperature controlling device for aerosol drug delivery |
| DE69724140T2 (de) | 1996-11-28 | 2004-06-03 | Wakunaga Pharmaceutical Co., Ltd. | Pyridoncarbonsäurederivate oder ihre salze und diese als aktive bestandteile enthaltende medikamente |
| DE69719367T2 (de) * | 1996-12-20 | 2003-10-16 | Takeda Chemical Industries, Ltd. | Verfahren zur herstellung einer zusammensetzung mit verzoegerter abgabe |
| ATE246190T1 (de) | 1996-12-31 | 2003-08-15 | Reddys Lab Ltd Dr | Heterozyklische verbindungen, verfahren zu ihrer herstellung, pharmazeutische zusammensetzungen die diese enthalten und ihre anwendung in der behandlung von diabetis und verwandten krankheiten |
| US5891474A (en) * | 1997-01-29 | 1999-04-06 | Poli Industria Chimica, S.P.A. | Time-specific controlled release dosage formulations and method of preparing same |
| US6120751A (en) * | 1997-03-21 | 2000-09-19 | Imarx Pharmaceutical Corp. | Charged lipids and uses for the same |
| US6060082A (en) * | 1997-04-18 | 2000-05-09 | Massachusetts Institute Of Technology | Polymerized liposomes targeted to M cells and useful for oral or mucosal drug delivery |
| DE19726167B4 (de) * | 1997-06-20 | 2008-01-24 | Sanofi-Aventis Deutschland Gmbh | Insulin, Verfahren zu seiner Herstellung und es enthaltende pharmazeutische Zubereitung |
| RU2215004C2 (ru) | 1997-07-16 | 2003-10-27 | Ново Нордиск А/С | Конденсированное производное 1,2,4-тиадиазина, фармацевтическая композиция и способ получения лекарственного препарата |
| CO4970713A1 (es) | 1997-09-19 | 2000-11-07 | Sanofi Synthelabo | Derivados de carboxamidotiazoles, su preparacion, composiciones farmaceuticas que los contienen |
| CN1055927C (zh) | 1997-11-18 | 2000-08-30 | 中国科学院上海药物研究所 | 左旋氧氟沙星类似物的合成及其用途 |
| WO1999036099A1 (fr) * | 1998-01-16 | 1999-07-22 | Takeda Chemical Industries, Ltd. | Compositions a liberation controlee, leur procede de fabrication et leur utilisation |
| US6350458B1 (en) * | 1998-02-10 | 2002-02-26 | Generex Pharmaceuticals Incorporated | Mixed micellar drug deliver system and method of preparation |
| US6613358B2 (en) * | 1998-03-18 | 2003-09-02 | Theodore W. Randolph | Sustained-release composition including amorphous polymer |
| US6048736A (en) * | 1998-04-29 | 2000-04-11 | Kosak; Kenneth M. | Cyclodextrin polymers for carrying and releasing drugs |
| KR19990085365A (ko) * | 1998-05-16 | 1999-12-06 | 허영섭 | 지속적으로 약물 조절방출이 가능한 생분해성 고분자 미립구 및그 제조방법 |
| US6221897B1 (en) * | 1998-06-10 | 2001-04-24 | Aventis Pharma Deutschland Gmbh | Benzothiepine 1,1-dioxide derivatives, a process for their preparation, pharmaceuticals comprising these compounds, and their use |
| KR100581199B1 (ko) | 1998-06-19 | 2006-05-17 | 카이론 코포레이션 | 글리코겐 신타제 키나제 3의 억제제 |
| DE19845405C2 (de) * | 1998-10-02 | 2000-07-13 | Aventis Pharma Gmbh | Arylsubstituierte Propanolaminderivate und deren Verwendung |
| GB9828640D0 (en) | 1998-12-23 | 1999-02-17 | Smithkline Beecham Plc | Novel method and compounds |
| GB9900416D0 (en) | 1999-01-08 | 1999-02-24 | Alizyme Therapeutics Ltd | Inhibitors |
| US6248363B1 (en) * | 1999-11-23 | 2001-06-19 | Lipocine, Inc. | Solid carriers for improved delivery of active ingredients in pharmaceutical compositions |
| US6271359B1 (en) * | 1999-04-14 | 2001-08-07 | Musc Foundation For Research Development | Tissue-specific and pathogen-specific toxic agents and ribozymes |
| AU3956900A (en) | 1999-04-16 | 2000-11-02 | Boehringer Ingelheim International Gmbh | Substituted imidazoles, their preparation and use |
| JP2002543200A (ja) | 1999-04-30 | 2002-12-17 | ニューロゲン コーポレイション | 9H−ピリミド[4、5−b]インドール誘導体:CRF1特異性リガンド |
| GB9911863D0 (en) | 1999-05-21 | 1999-07-21 | Knoll Ag | Therapeutic agents |
| US6399640B1 (en) | 1999-06-18 | 2002-06-04 | Merck & Co., Inc. | Arylthiazolidinedione and aryloxazolidinedione derivatives |
| WO2001009111A1 (en) | 1999-07-29 | 2001-02-08 | Eli Lilly And Company | Benzofurylpiperazines and benzofurylhomopiperazines: serotonin agonists |
| ATE302754T1 (de) * | 1999-09-01 | 2005-09-15 | Aventis Pharma Gmbh | Sulfonylcarboxamidderivate, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| SE9904108D0 (sv) * | 1999-11-15 | 1999-11-15 | New Pharma Research Ab | Nya föreningar |
| US6825353B2 (en) * | 2000-02-25 | 2004-11-30 | Daiichi Pharmaceutical Co., Ltd. | Process for producing quinolonecarboxylic acids and intermediates thereof |
| KR100502876B1 (ko) | 2000-04-28 | 2005-07-21 | 아사히 가세이 파마 가부시키가이샤 | 신규 이환성 화합물 |
| ATE310728T1 (de) | 2000-05-11 | 2005-12-15 | Bristol Myers Squibb Co | Tetrahydroisochinolin-analoga als wachstumshormon-sekretagoga |
| JP2003534377A (ja) | 2000-05-30 | 2003-11-18 | メルク エンド カムパニー インコーポレーテッド | メラノコルチン受容体作働薬 |
| JP2004502777A (ja) | 2000-07-12 | 2004-01-29 | ファルマシア・アンド・アップジョン・カンパニー | ウイルス感染の治療に有用なオキサジノキノロン |
| WO2002009758A2 (en) | 2000-08-01 | 2002-02-07 | Wockhardt Limited | Inhibitors of cellular efflux pumps of microbes |
| AP2001002264A0 (en) | 2000-08-30 | 2001-09-30 | Pfizer Prod Inc | Sustained release formulations for growth hormone secretagogues. |
| SE0101675D0 (sv) * | 2001-05-11 | 2001-05-11 | Astrazeneca Ab | Novel composition |
| WO2004019932A1 (en) | 2002-08-30 | 2004-03-11 | Pharmacia & Upjohn Company | Method of preventing or treating atherosclerosis or restenosis |
| US20040132764A1 (en) * | 2002-10-23 | 2004-07-08 | Morphochem Aktiengesellschaft Fuer Kombinatorische Chemie | Antibiotics for the treatment of infections in acidic environments |
| WO2004089930A1 (en) | 2003-04-02 | 2004-10-21 | Imclone Systems Incorporated | 4-fluoroquinolone derivatives and their use as kinase inhibitors |
| RU2351335C2 (ru) | 2003-04-30 | 2009-04-10 | Морфохем Акциенгезельшафт Фюр Комбинаторише Хеми | Применение оксазолидинон-хинолиновых гибридных антибиотиков для лечения сибирской язвы и других инфекций |
| DE60329831D1 (de) | 2003-06-10 | 2009-12-10 | Biondi Ricardo Miguel | Verwendung einer Verbingung gemäss Formel I zur Herstellung einer pharmazeutischen Zubereitung |
| US7276608B2 (en) | 2003-07-11 | 2007-10-02 | Bristol-Myers Squibb Company | Tetrahydroquinoline derivatives as cannabinoid receptor modulators |
| KR20060041254A (ko) | 2003-07-24 | 2006-05-11 | 아스텔라스세이야쿠 가부시키가이샤 | 퀴놀론 유도체 또는 그의 염 |
| US20050054663A1 (en) * | 2003-08-13 | 2005-03-10 | Bennett Christina N. | GSK-3 inhibitors |
| DE102004004973A1 (de) * | 2004-01-31 | 2005-09-01 | Aventis Pharma Deutschland Gmbh | 7-Phenylamino-4-chinolon-3-carbonsäure-Derivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| US7402674B2 (en) * | 2004-01-31 | 2008-07-22 | Sanofi-Aventis Deutschland Gmbh, | 7-Phenylamino-4-quinolone-3-carboxylic acid derivatives, process for their preparation and their use as medicaments |
| JP5424480B2 (ja) * | 2006-03-13 | 2014-02-26 | 杏林製薬株式会社 | Gsk−3インヒビターとしてのアミノキノロン |
| CA2699152C (en) * | 2007-09-12 | 2015-11-24 | Activx Biosciences, Inc. | Spirocyclic aminoquinolones as gsk-3 inhibitors |
| CN102421784B (zh) * | 2009-03-11 | 2015-09-30 | 杏林制药株式会社 | 作为gsk-3抑制剂的7-环烷基氨基喹诺酮 |
-
2008
- 2008-09-11 EP EP08830095A patent/EP2203458B1/en active Active
- 2008-09-11 MX MX2010002667A patent/MX2010002667A/es active IP Right Grant
- 2008-09-11 CN CN2008801155430A patent/CN101855228B/zh not_active Expired - Fee Related
- 2008-09-11 KR KR1020107007735A patent/KR101563018B1/ko not_active Expired - Fee Related
- 2008-09-11 AU AU2008299903A patent/AU2008299903B2/en not_active Ceased
- 2008-09-11 US US12/677,789 patent/US8389514B2/en not_active Expired - Fee Related
- 2008-09-11 AT AT08830095T patent/ATE531721T1/de active
- 2008-09-11 JP JP2010524862A patent/JP5426552B2/ja not_active Expired - Fee Related
- 2008-09-11 WO PCT/US2008/010615 patent/WO2009035634A2/en not_active Ceased
- 2008-09-11 BR BRPI0816798A patent/BRPI0816798A2/pt not_active Application Discontinuation
- 2008-09-11 ES ES08830095T patent/ES2371800T3/es active Active
- 2008-09-11 CN CN201110205276.XA patent/CN102351880B/zh not_active Expired - Fee Related
- 2008-09-11 CA CA2699151A patent/CA2699151A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| CN102351880A (zh) | 2012-02-15 |
| ES2371800T3 (es) | 2012-01-10 |
| CN101855228A (zh) | 2010-10-06 |
| MX2010002667A (es) | 2010-04-01 |
| WO2009035634A3 (en) | 2009-06-04 |
| US8389514B2 (en) | 2013-03-05 |
| HK1162502A1 (en) | 2012-08-31 |
| CN102351880B (zh) | 2014-11-12 |
| AU2008299903B2 (en) | 2013-08-29 |
| JP2010539164A (ja) | 2010-12-16 |
| EP2203458B1 (en) | 2011-11-02 |
| AU2008299903A1 (en) | 2009-03-19 |
| US20110172219A1 (en) | 2011-07-14 |
| BRPI0816798A2 (pt) | 2016-10-11 |
| CN101855228B (zh) | 2012-10-24 |
| KR20100063114A (ko) | 2010-06-10 |
| WO2009035634A2 (en) | 2009-03-19 |
| EP2203458A2 (en) | 2010-07-07 |
| CA2699151A1 (en) | 2009-03-19 |
| KR101563018B1 (ko) | 2015-10-23 |
| ATE531721T1 (de) | 2011-11-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5426552B2 (ja) | Gsk−3阻害剤としてのシアノアミノキノロン及びテトラゾロアミノキノロン | |
| JP5424480B2 (ja) | Gsk−3インヒビターとしてのアミノキノロン | |
| US10556908B2 (en) | Substituted imidazo[1,2-a]pyrazines as LSD1 inhibitors | |
| US10851115B2 (en) | Heterocyclic compounds as RSV inhibitors | |
| US11459330B2 (en) | Substituted bicyclic heterocyclic compounds as PRMT5 inhibitors | |
| KR101597841B1 (ko) | Gsk-3 억제제로서의 스피로시클릭 아미노퀴놀론 | |
| US20190152968A1 (en) | Azepin-2-one derivatives as rsv inhibitors | |
| KR20110136836A (ko) | Gsk-3 억제제로서의 7-시클로알킬아미노퀴놀론 | |
| KR20250174699A (ko) | Cdk9 활성을 조절하기 위한 화합물, 조성물 및 방법 | |
| DE102006014685A1 (de) | Imidazo-pyridin-2-on-derivate als Inhibitoren von Lipasen und Phospholiphasen | |
| US20230312601A1 (en) | Thiazolo[5,4-b]pyridine malt-1 inhibitors | |
| US20150175649A1 (en) | SYNTHETIC pGpG ANALOGS, METHODS OF PREPARATION AND METHODS OF USE | |
| HK1162502B (en) | Cyanoaminoquinolones and tetrazoloaminoquinolones as gsk-3 inhibitors | |
| HK1130495A (en) | Aminoquinolones as gsk-3 inhibitors |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20100924 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100924 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110527 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110527 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A132 Effective date: 20130417 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130617 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130826 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20131009 |
|
| A524 | Written submission of copy of amendment under article 19 pct |
Free format text: JAPANESE INTERMEDIATE CODE: A524 Effective date: 20131009 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20131030 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20131128 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 Ref document number: 5426552 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |