JP2007511205A - 気体透過性物質を利用する細胞を培養する方法及び装置 - Google Patents
気体透過性物質を利用する細胞を培養する方法及び装置 Download PDFInfo
- Publication number
- JP2007511205A JP2007511205A JP2006534398A JP2006534398A JP2007511205A JP 2007511205 A JP2007511205 A JP 2007511205A JP 2006534398 A JP2006534398 A JP 2006534398A JP 2006534398 A JP2006534398 A JP 2006534398A JP 2007511205 A JP2007511205 A JP 2007511205A
- Authority
- JP
- Japan
- Prior art keywords
- gas permeable
- medium
- gas
- cell culture
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/02—Form or structure of the vessel
- C12M23/08—Flask, bottle or test tube
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M23/00—Constructional details, e.g. recesses, hinges
- C12M23/24—Gas permeable parts
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/06—Plates; Walls; Drawers; Multilayer plates
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12M—APPARATUS FOR ENZYMOLOGY OR MICROBIOLOGY; APPARATUS FOR CULTURING MICROORGANISMS FOR PRODUCING BIOMASS, FOR GROWING CELLS OR FOR OBTAINING FERMENTATION OR METABOLIC PRODUCTS, i.e. BIOREACTORS OR FERMENTERS
- C12M25/00—Means for supporting, enclosing or fixing the microorganisms, e.g. immunocoatings
- C12M25/14—Scaffolds; Matrices
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2500/00—Specific components of cell culture medium
- C12N2500/02—Atmosphere, e.g. low oxygen conditions
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Sustainable Development (AREA)
- Clinical Laboratory Science (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
Description
本出願は、2003年10月8日付けで出願された米国仮出願第60/509,651号(その全体が参照により本明細書中に援用される)の優先権を主張するものである。
細胞の培養は、バイオテクノロジーの重要な要素である。細胞は、研究段階の間は少量で培養され、そして、通常、培養の規模は、研究がその目的であるヒト及び動物の保健医療に利益を与えることに移行するにしたがって増大する。この規模の増大は、しばしば、スケールアップと称される。或る装置及び方法は、広範な細胞型を培養することを可能にするとして、研究段階の細胞培養に関して十分に確立されており、したがって、最も幅広い対象に対して有用である。これらの装置は、マルチウェル組織培養プレート、組織培養フラスコ、ローラボトル及び細胞培養用バッグを含む。残念ながら、これらの装置は非効率的であり、これらはスケールアップ時の労力、混入の危険性及び費用の観点で、より非効率的にさえなる。研究及びスケールアップ効率を改善する、スケールアップを研究し且つ維持する、代替的な装置及び方法を作製することが必要とされている。本考察は、従来技術における制限の多くを特定し、以下により詳細に記載される解決策を示す。
この装置の設置面積を大きくすることで、より多くの培地を存在させることができるというものである。大きい設置面積を有する装置の作製は製造の見地から困難であり、典型的なインキュベータ及びフローフードにおいて利用可能な制限された空間量を直ちに大きくし、装置の取り扱いをより難しくする。したがって、市販の細胞培養装置は小さい。このように、培養のスケールアップは、複数の装置を使用すること、又はより精巧な、複雑な、且つ費用のかかる代替品を用いることが必要である。
る。仕様書、操作指示書及び/又は特許は、各製品に対する培地の高さ及び培地容積に対する気体透過性表面積の割合を決定する。
Inc. )に譲渡された特許文献2及び特許文献3)は、典型的なバッグは、「全容積の約1/4〜1/2を満たされて、培地及び細胞の容積の比較的高い内表面積比を提供し、それにより十分な酸素がバッグ内で拡散し、且つ二酸化炭素がバッグの外に拡散することで細胞の代謝及び増殖を容易にすることができる」と記述している。パティリョ他の観点から、バクスターインターナショナル社製のLifecell(登録商標)X−Fold(商標)バッグに関して実現される最適な培地高は、その600cm2バッグに対するものであって、1.0cm〜2.0cmの培地の高さ、及び、2.0cm2/ml〜1.0cm2/mlの、培地容積に対する気体透過性表面積の割合を与える。
ているため、バッグ内で使用される気体移動面積は必要以上に大きくなる。
Barbera-Guillem )は、「マイクロタイタープレートの設置面積の場合、膜面積は最大化され、容積は最小化され、最大の気体相互交換を有する巨大な増殖面を提供する空間をもたらす」と記述している。この製品をいかにして使用するかを規定する操作プロトコルは、わずか10mlの培地の導入を明記しており、それにより培地が存在することができる高さを0.2cmに制限している。この装置と関連する特許文献9(2002年6月25日付けで出願)は、最大1.27cm(0.5インチ)までの高さが可能であるが、0.18cm〜約0.2cm(約0.07〜約0.08インチ)の高さがより好ましいであろうと記述している。同様に、この装置と関連する特許文献10は、最大20mmまでの高さが可能であるが、4mmの高さがより好ましいであろうと記述している。この特許において記載される1.27cmというより高い高さが市販の装置に組み込まれたとしても、この培地の高さはバッグで可能な高さを超えることはない。さらに、このことは、培地容積に対する気体透過性表面積の割合を1.00cm2/ml(バッグと同様)にしか減少させないであろう。特許文献9は、装置の1つの側面のみが気体透過性である構成を示す。この構成(商品化されていない)において、1.27cm(0.5インチ)の培地の高さでは、0.79cm2/mlの、培地容積に対する気体透過性表面積の割合が得られ、この割合は、細胞培養用バッグのものよりも若干低いであろう。したがって、側壁があるにもかかわらず、形状が最大の培地高を可能にしたとしても、バッグと比較して、スケールアップ効率は改善されていない。
養カセットは最大160mlまでの培養容積を提供し、Petaka(商標)は最大25mlまでの培養容積を提供する。したがって、ちょうど1,000mlの培養を実施するためには、100個のOpticell(登録商標)カートリッジ、7個のCLINIcell(登録商標)培養カセット、又は40個のPetaka(商標)カートリッジが必要となるであろう。
うに、適切な機能には、気体透過性物質の厚さが約0.013cm(約0.005インチ)未満又はそれ以下である必要があることを指示している。Si−Culture(商標)バッグは、ジメチルシリコーンから構成され、約0.011cm(約0.0045インチ)の厚みを有する。バーバラ・ギレム他(特許文献9)及びバーバラ・ギレム(特許文献10)は、気体透過性膜の厚みは、膜が適したポリマー類(ポリスチレン、ポリエチレン、ポリカーボネート、ポリオレフィン、エチレン酢酸ビニル、ポリプロピレン、ポリスルフォン、ポリテトラフルオロエチレン又はシリコーン共重合体を含む)から成る場合、約0.003cm(約0.00125インチ)未満〜約0.013cm(約0.005インチ)の範囲であり得ることを記述している。フィルムをこの薄さに維持することは、フィルムが破裂しやすく、製造中に容易に針穴が開きやすく、且つシートプロファイル以外のプロファイルを許容しない、カレンダ加工(calendaring )以外の任意の方法により作製することが困難であるため、不都合である。本明細書中において、従来の見識を超える増加した厚みのシリコーンがいかにして細胞培養を妨げないかが示されるであろう。
培地の割合が、適切な細胞サポートとして記載されている(特許文献14及び特許文献15)。細胞培養面積に対して培地容積を増大することは供給の頻度を最小化する観点において有利であるものの、実際には、気体透過性表面積の各cmより高い培地高は制限されている。これらの特許に含まれる装置の市販設計は、他の気体透過性装置のように、これらは細胞上に存在することができる培地の量を制限することを示す。培地容積の半分より多くが、半透過性膜のすぐ上の領域には存在せず、細胞のすぐ上に存在している培地の高さを減少させる。装置の非気体透過性側壁は、使用に関する指示に従って操作されるとき、CELLine(商標)製品における半透過性膜上に培地が存在する場所の高さが、CL1000ウェルにおいてはおよそ3.8cm、CL350ウェルにおいては2.6cm、CL6ウェルにおいては1.9cmであるように設計されている。使用に関する指示に従って操作されるとき、細胞培養区画内に存在している培地の高さは、CL1000ウェルに関しては15mm、CL350ウェルに関しては14mm、CL6ウェルに関しては26mmである。この特許は、装置は培地の上方面で気体/液体界面を一体化すると記載する。したがって、気体移動が装置の底部を介して且つ培地の頂部で起こるため、培地容積に対する気体移動表面積の割合もまた制限される。各装置に関する培地容積に対する気体移動表面積の割合は、CL1000ウェルに関してはおよそ0.31cm2/ml、CL350ウェルに関しては0.32cm2/ml、CL6ウェルに関しては1.20cm2/mlである。
培地容積に対する気体透過性表面積の割合をもたらす。さらに、中空の気体透過性コアを有する必要性は、空間を無駄にする。この装置は、5cmの長さ当たり100mlの培地の内部容積しか有さず、等しい長さの従来のボトルの500mlと対照的である。培地容積の制限は、この装置を、従来のローラボトルよりもスケールアップ効率が低いものとしているが、これは、より多くのボトルが等量の培養に必要であるからである。この装置に伴なう別の問題は、エッチングされた孔(直径90μm(ミクロン))を気体移動のために使用することである。これらの孔は、気体の進入を可能にするのに十分大きいが、液体が細胞区画から出ることを防ぐのに十分小さい。しかし、ほとんどの滅菌フィルターは0.45μm(ミクロン)、より一般的には0.2μm(ミクロン)の粒子が通過することを妨害するため、これらの孔は細胞区画の細菌侵入を許してしまうであろう。
不十分である。静止気体透過性装置は、装置の底部及び頂部を介する気体移動のみを可能にする。したがって、従来のスカフォールド(マルチシェルフ組織培養フラスコ内に備えられたスチレンシェルフ等)を含む場合、これらは細胞がある位置での気体交換を阻害する効果を有するであろう。気体透過性物質は、付着スカフォールドが十分な気体移動を妨げない様式で位置決めするべきである。これがいかに有益になるかは、本明細書中の発明の詳細な説明においてさらに説明されるであろう。
らない過剰容積の気体)に取り組んでいない。
下方気体透過性物質から成る気体透過性装置に関して、培地の高さを、従来の見識により決定される、又は市販されている装置において利用可能な高さよりも増大させることは有益であり得ることが発見された。本発明の発明者等によって、細胞培養培地内の基質の対流は、従来認識されているよりも重要な役割を果たすと予想される。物質移動のための拡散への歴史的な依存は、対流が与える寄与を過小評価しているように見受けられる。このことは、細胞培養培地中のグルコース及び乳酸塩等の基質の移動速度を過小評価することにつながり、従来許容されていたよりも細胞から遠くに存在する培地が細胞に対して有用であり得ることを認識することができないであろう。培地中の基質の移動速度が過小評価されると、細胞から遠すぎると思われている領域内に存在する培地は、無駄であると間違って見なされるであろう。論理的な結論として、装置によって占められる空間を減少させ、より経済的に滅菌、出荷、保管及び廃棄されるようにするために、気体透過性装置が細胞に対して有用であり得るよりも少ない培地を保持するように不必要に構成されることになる。
交換に必要ないことを示す。このことは、従来装置における気体の存在に起因する過剰な装置サイズに対する必要性を排除し、且つ気体透過性装置が従来のスカフォールドを一体化することを可能にする。これは、従来装置よりも小さな空間を占めるさまざまな細胞培養装置構成を可能にし、且つこれらの装置をスケールアップに関してより効率的にする。やはり、本発明者等により、対流の役割は寄与因子であり得ることが予期される。
これらの発見は、細胞を培養する新たな装置及び方法を作り出すことを可能にし、これらは、現在の装置(ペトリ皿、マルチウェル組織培養プレート、組織培養フラスコ、マルチシェルフ組織培養フラスコ、ローラボトル、気体透過性ペトリ皿、気体透過性マルチウェルプレート、気体透過性細胞培養用バッグ、区画化気体透過性装置及び気体透過性回転装置等)を上回る劇的な効率及びスケールアップの改善を提供することができる。
本明細書中に開示される或る実施の形態は、気体透過性物質から少なくとも部分的に成る側壁を介して気体交換を可能にすることにより、気体透過性装置を使用する優れた細胞培養法を提供する。
体透過性表面積の割合の低減を可能にするために壁高を増大することにより、気体透過性カートリッジに対する優れた代替物を提供する。
本明細書中に開示される或る実施の形態は、培地の高さの増大及び培地容積に対する気体透過性表面積の割合の低減を可能にするために壁高を増大することにより、区画化気体透過性装置に対する優れた代替物を提供する。
従来の細胞培養装置又は方法では考えられていない高さに培地を保持することができる気体透過性装置を構成することにより、取り扱い頻度、労力、滅菌費用、出荷費用、保管費用、インキュベータ用空間の使用、廃棄費用、及び混入の危険性を減らすことを含む利点を生じることができる。また、培地容積に対する気体透過性表面積の割合を、従来の細胞培養装置又は方法では考えられていない割合まで減少させることも、培養効率を増大させ得る。これにより、装置の長さ又は幅を対応して増大させることなく、培地の高さを増大させることが可能となる。好ましい実施形態では、培地の高さを増大させるか、又は培地容積に対する気体透過性表面積の割合を減らすかのいずれかを可能とする措置がとられる。培地の高さを増大させ、且つ培地容積に対する気体透過性表面積の割合を減らすことの両方を可能とする措置がとられる。
1.27cmを超えるべきである。細胞培養用バッグの形態では、培地の高さは最高点で2.0cm高を超えていることが好ましい。形態が区画化された装置であり、その装置内の培地全てが半透過性膜の上全体に存在する場合、栄養区画の培地の高さは、好ましくは半透過性膜の上の1.0cm高であるべきである。形態が区画化された気体透過性装置である場合、栄養区画の培地の高さは、好ましくは半透過性膜の上の3.8cm高を超えるべきである。
。
場合、大部分の壁と気体の接触が阻止されないようにすることが好ましい。
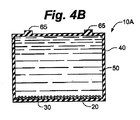
ずに下方気体透過性物質サポート80が下方気体透過性物質30と部分的に接触することができるようにすることで、気体区画90が維持される。周囲気体にさらすことに加えて、下方気体透過性物質サポート80は、細胞20がどんなに低い位置でも積み重ならないように実質的に水平な状態で下方気体透過性物質30を維持する。これは、細胞20が下方気体透過性物質30の全体にわたって均等に分布し得る状態に対して、拡散勾配を生じ、且つ細胞増殖を制限するであろう。したがって、下方気体透過性物質サポート80の設計目的は、物質が実質的に水平に保たれることを必要とする多くの場所で、下方気体透過性物質30の下面と十分な気体を接触させたまま、下方気体透過性物質30と接触させることであり得る。当業者は、この目的を達成する多くの方法があることを認識しているであろう。図5に示されるように、突出部110がこの目的を達成する。
下げることができる、気体透過性細胞培養装置に関する好ましい実施形態の断面図を示す。図7Aでは、培地50を気体透過性細胞培養装置10Dに加え、浮き胴(buoyant shoulder)25と接触させる。図7Bでは、培地50は浮き胴25に上方の力を及ぼし、その結果、培地50の容積が増大するに応じて気体透過性細胞培養装置10Dの高さが上がる。示された構成では、壁40Dは気体透過性細胞培養装置10Dの高さを伸縮させるように形作られたベローである。浮き胴25は、培地50よりも密度が小さい任意の生体適合性材料であり得る。また、浮き胴は壁40の一体部分であり得る。気体透過性細胞培養装置10Dを上方に伸長するのに十分な力を発揮するには、培地50の適切な容積を移動させる大きさに作るべきである。この構成では、気体透過性細胞培養装置10Dは、培養を行うのに必要な分だけの空間だけを占め、1つの製品で様々な用途に最適な大きさとなり得る。例えば、ハイブリドーマを培養することに適した培地の容積は、膵島を維持することに適した培地の量とは異なる場合がある。そのような場合、気体透過性細胞培養装置10Dは、各用途に必要な分だけの空間を占めるだけでよい。また、最小容積の状態で、滅菌、出荷、保管、インキュベーション及び廃棄することが可能であり、それにより培養プロセスの費用を削減できる。当業者は、例えば、同時係属中の米国特許出願第10/460,850号で記載されるような多種多様な機械的メカニズム等、浮力以外の装置の形状(プロファイル)を変更する多くの他の方法があることを認識するであろう。
せ、スカフォールド120の露出面に付着させる。
れ、図12DはB−Bでの断面図を示す。速い速度の気体移動が非常に活発な細胞をサポートするために必要であるいくつかの用途では、図12Aの構成が優れ得る。なぜなら、図12Cの構成の場合のように、気体移動用のチャネルがスカフォールドの端によって閉塞されない(unobstructred )ためである。気体透過性細胞培養装置が回転される他の用途では、図12Cの構成が優れ得る。なぜなら、その形状が、細胞のせん断を引き起こし得る渦巻きを最小限にし得るからである。
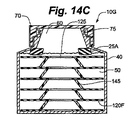
る。圧縮されたスプリングアーム145は拡張しようとするが、気体透過性細胞培養装置10Gの上方部分の重さがスプリング力を上回るため、拡張することができない。図14Bでは、種菌130Aを加えることにより浮き胴25Aに対して働いた力を受けて、気体透過性細胞培養装置10Gの高さが上がっている。浮き胴25Aによる種菌130Aの転移により働く上方への力は、スプリングアーム145Kのスプリング力と組み合わされた場合、気体透過性細胞培養装置10Gの上方部分の重さを上回る。スプリングアーム145がその下方の隣接したスカフォールド120Fに対して及ぼす力のため、スカフォールド120Fが離れて互いに等間隔で保持される。各スカフォールド120F上に直接存在する種菌130Aの体積が、各スカフォールド120F上に堆積され得る細胞の量を表す場合、互いに等間隔を保持することは、播種の際に特に有益である。スカフォールド120Fのそれぞれの上に存在する種菌130Aを等しい体積にすることにより、等しい数の細胞が各スカフォールド120F上に存在することができる。図14Cでは、細胞集団の拡大と栄養要求量の増大に伴う培地50の追加に応じて、図14Bに比べ、気体透過性細胞培養装置10Gの高さを再度上げている。スカフォールド120Fは、スプリ
ングアーム145がその下方の隣接したスカフォールド120Fに対して及ぼす力のため、さらに離れて互いに等間隔で保持される。各スカフォールド120Fの間の一定した距離は、細胞の位置する場所全てにおいて表面積に対する培地50の容積の一定の割合を保障し、勾配形成の可能性を減らす。図14Dにおいて、培地50の除去及び浮き胴25Aの上方への力の喪失により、気体透過性細胞培養装置10Gは崩壊している。気体透過性細胞培養装置は、今は廃棄用に効率的な大きさとなっている。接着細胞の回復が必要な場合では、気体透過性細胞培養装置10Gを崩壊させることは、培地50を除去するとともにトリプシンを加える場合、有益である。この様式では、細胞を回復させるのにわずか少量のトリプシンしか必要とされない。当業者は、気体透過性細胞培養装置10Gの高さを変更する多くの他の方法が適用され得ることを認識するであろう。
ンプ150の上方への移動を始めていない。スカフォールド間の最小距離は、ランプ150上に存在するスカフォールド120Gの下方面と接触するランプ150の高さによって決まることが分かる。図15Cを参照すると、スカフォールド120Gはそれらの間の距離が最大となる位置にある。スカフォールドロケータスクリュー170が回転矢印180の方向に回転することで、持ち上げポスト160がランプ150を上り、その上に存在するスカフォールド120Gを上昇させる。持ち上げポスト160がランプ150Lの最も高い点に存在する場合、ランプ150の高さと持ち上げポスト160の高さを足したものに等しいスカフォールド120L間の最大距離が達成される。スカフォールドロケータスクリュー170が回転する際、スカフォールド120Gが回転するのを防止することにより、持ち上げポスト160がランプ150を上昇移動する間に、ランプ150を固定位置に留まらせる。これは、さねはぎ配置で気体透過性細胞培養装置壁の内部にスカフォールド120Gを噛み合わせることにより達成することができる。図15Aのスカフォールドの上面図で最もよく示されるように、つまみ212は気体透過性壁40Hから延び、各スカフォールド120Gの溝215と噛み合う。これは、ロケータスクリュー170の回転中にスカフォールド120Gの回転を防止するだけではなく、スカフォールド120Gから気体透過性壁40Hが引き離されるのも阻止する。こうして、気体透過性細胞培養装置の形状が保持される。ロケータスクリュー170は、滅菌ピペットチップにより回転されるように構成され、それにより装置の混入を防ぎ、標準的な実験器具の使用によりスカフォールド間の距離を再配置することを可能にし得る。
実施例
下方気体透過性物質から成る装置により、培地の高さを変更することが細胞増殖及び抗体産生に及ぼす影響を査定するため、評価を行った。培地容積に対する気体透過性物質表面積の割合を変更することの効果もまた査定された。下方気体透過性物質及び従来の見識を超えた高さで培地を保持する能力を備えて構成された単区画の試験装置を、従来の見識の範囲内の高さで培地を保持した単区画の対照試験装置と比較した。Si−Cultureバッグ(米国特許第5,686,304号)に定められた1.6cmという培地の高さの限定に対して比較を行った。対照試験装置は、高さ1.6cmで培地を収容するように構成し、試験装置全てに使用された気体透過性物質は、実際のSi−Culture(商標)バッグから得られた気体透過性物質から成っていた。
20.4cmの高さに存在した場合の結果を比較した。培地50Aは、10%のHycloneFBSが添加されたHycloneHyQSFM4MAb−Utilityで構成された。細胞20BはIgGを分泌するマウスハイブリドーマ細胞であり、下方気体透過性物質30A 1cm2当たり0.76×106個の播種密度で播種した。周囲条件を5%CO2、95%R.H.、及び37Cとした。周期的に細胞の計数とモノクローナル抗体産生の測定値をELISAにより取った。表1はその結果を示す。
米国特許第5,686,304号及び米国特許出願第10/183132号によって記載されたような従来の見識、及びシリコーンを使用する市販の気体透過性製品のデザインは、約0.013cm(0.005インチ)を超える厚さのシリコーンが使用されるべきではないことを指示している。しかし、厚さを増大することは製造面及び製品の信頼性の点で利点がある。したがって、下方シリコーン気体透過性物質の厚さが細胞増殖に及ぼす影響を査定するために評価を行った。従来の見識の物質の厚さを、厚さを増大させた同一の材料と比較した。
従来の見識とは異なる様式で気体透過性細胞培養装置を構成することにより得られる利点を査定するために評価を行った。2つの一般的なフォーマット、すなわち、1)非回転型気体透過性装置、及び2)回転型気体透過性装置を評価した。非回転型気体透過性装置の構成では、培地の高さは、従来の見識によって課された制限をかなり超えていた。培地容積に対する気体透過性表面積の割合は従来の見識のものよりもかなり低く減少した。回転型気体透過性装置の構成では、最新型の気体透過性回転型ボトルのものよりも、培地を気体透過性壁からさらに離れて存在させ、より多くの培地を1つの装置当たりに存在させた。
は気体透過性ではなかった。培地は、2.5%のHycloneFBSを添加したHycloneSFM4MAbで構成された。各試験装置に、使用される培地1ml当たり細胞密度0.04×106個のマウスハイブリドーマ細胞を播種した。試験装置それぞれに2,050mlの培地を入れた。周囲条件を5%CO2、95%R.H.、及び37Cとした。
stem(商標)、及びザルトリウスグループのビバサイエンス社からのminiPERM(商標)とは異なり、回転型試験装置は標準的なローララック上で機能することができた。そのため、回転型気体透過性装置のスケールアップ効率は他の装置及び手法よりもはるかに優れる。
気体透過性壁を介して生じる気体交換を可能とすることにより、気体/液体界面が存在しない場合の接着細胞の培養能を査定するために評価を行った。試験装置を図17に示されるような様式で構成した。この装置は気体/液体界面により気体が移動する可能性を排除した。気体透過性壁試験装置12は、長方形の液体密封外枠241から成り、1つの気体透過性壁200A及び5つの非気体透過性壁210で構成された。気体透過性壁200Aはシリコーン膜から成り、およそ0.0045の厚さであり、メドトロニック社(ミネアポリス)から購入した。この膜はメドトロニック社で、Si−Culture(商標)バッグを製造するために使用される。液体搬入口220及び液体除去口230は、播種及び栄養供給を可能とする。対照Falcon(商標)T−175組織培養フラスコに相当する接着面を設けるために、底部接着スカフォールド240は、Falcon組織培養フラスコから除去されたプラスチックの断片で構成された。外枠241の内寸法は深さ6cm、幅10cm、及び高さ0.635cmであった。そのため、気体透過性壁200Aは幅10cm及び高さ0.635cmであり、6.35cm2の表面積を生じた。底部接着スカフォールド240は幅10cm及び深さ6cmであり、60cm2の接着面を可能とした。気体透過性壁試験装置12を、播種中、培地で全体的に満たし、それにより全ての気体/液体界面が排除された。そのため、気体交換は気体透過性壁200Aに対しての垂直方向への拡散によって生じるだけとなり得る。60,000個のBHK生細胞(98%の生存度)から成る種物を、10%のHycloneFBS及び1%のL−グルタミンを添加した38.1mlのEMEM培地に懸濁させた。そのため、播種密度は、利用可能な接着スカフォールド240領域1cm2当たり生細胞10,000個であった。培地の容積に対する気体透過性膜の表面積は0.167cm2/mlであった。接着スカフォールドの表面積に対する気体透過性膜の表面積は0.106cm2/cm2であった。対照T−175組織培養フラスコに同じ播種密度及び生存度で同一の細胞を播種した。気体透過性壁試験装置12及びT−175対照を5%CO2、95%R.H.、及び37℃の標準的な細胞培養用インキュベータに配置した。
択肢が見えてくる。例えば、気体透過性装置は、1つの側壁を気体透過性にすることにより従来のT−フラスコフォーマットに構築されてもよい。この様式では、気体/液体界面が必要とされないので、より多くの培地が培養に利用され得るか又は装置のプロファイルが低減され得る。
気体/液体界面が存在することなく複数のスカフォールド上に接着細胞を培養する能力を査定するために、評価を行った。気体交換は気体透過性装置の壁を介して行われた。気体透過性試験装置は、気体/液体界面による気体移動の可能性を排除した図18に示したような様式で構成された。マルチスカフォールド試験装置14は、1つの気体透過性壁200B及び5つの非気体透過性壁210Aで構成された長方形の液体密封外枠で構成された。気体透過性壁200Bは、0.015厚の成形シリコーン物質で構成された。液体搬入口220A及び液体除去口230Aは播種及び栄養供給を可能とする。接着スカフォールド240Aは、NUNC(商標)CellFactory細胞培養装置から除去されたプラスチックで構成された。マルチスカフォールド試験装置14の内寸法は長さ15.24cm、幅7.62cm、及び高さ2.54cmであった。そのため、気体透過性壁200Bは幅7.62cm、及び高さ2.54cmであり、19.35cm2の気体透過性物質表面積を生じた。各接着スカフォールド240Aは幅6.6cm、及び長さ15.03cmであり、1つの接着スカフォールド240A当たり99cm2の接着表面積を生じた。
覚的な顕微比較により、マルチスカフォールド気体透過性試験装置14及びT−175対照フラスコの両方の試験群の細胞密度がほぼ一致して現れ、およそ95%の集密性であった。
従来のフラスコに比べ、細胞を培養するために1つを超えるスカフォールドを備えて構成された非回転型気体透過性細胞培養装置の性能を評価するために試験装置を構成した。図19Aは、気体透過性試験装置260の断面図を示す。スカフォールド120Hを垂直に配置し、一貫した間隙をスペーサ135Bにより各スカフォールド120H間で維持した。壁40Jは気体透過性であり、メドトロニック社(ミネアポリス)から購入したシリコーンから成り、およそ0.0045の厚さであった。縫合部(suture)270は気体透過性壁40に力を加え、バルクヘッドガスケット280に気体透過性壁40を押し付け、気体透過性壁40と、上方のバルクヘッド290及び下方のバルクヘッド300との間に液体密封シールを作製した。培地出入口60Bは、気体透過性試験装置260に対する液体の搬入及び除去を可能にした。蓋70Cは混入を防ぎ、操作中は密栓されていた。図19Bはスカフォールド120Hの斜視図を示す。このスカフォールドは組織培養処理されたポリスチレンから作られ、約0.102cm(0.040インチ)の厚さであった。直径約1.905cm(0.75インチ)のピペット出入開口部125Aはピペットの出入を可能とし、スカフォールド120H間で気体がトラップされるのを防いだ。4つのベントスロット190は、トラップされた気体が出るためのさらなる領域を可能とし、気体/液体界面がすべて除去されるのを確実にした。各スカフォールド120Hの片面当たりの表面積は約86cm2であった。気体透過性試験装置260の内径は約11.176cm(4.4インチ)であり、下方バルクヘッド300の内側面から上方(上部)バルクヘッド290の内側面へ測定した場合の内高は約5.715cm(2.25インチ)であった。そのため、気体透過性物質の表面積は561cm2であった。8つのスカフォールド120Hは、スペーサ135Bを用いて垂直に積層され、スカフォールドそれぞれの間の間隙を約0.635cm(0.25インチ)に維持した。8つのスカフォールド120Hの上面の表面積を合わせると、695cm2であった。気体透過性試験装置260の内容積はおよそ500mlであった。したがって、培地容積に対する気体透過性物質の割合は561cm2/500ml、すなわち1.12cm2/mlであった。
スコ及び気体透過性試験装置260をトリプシン処理し、標準的な細胞計数技法を用いて、存在する細胞数を測定した。表6はその結果を要約する。
各装置によって占められる空間の容積は注目に値する。気体透過性試験装置260の設置面積は100cm2であり、ネックを含めた高さは7.6cmであった。そのため、占められた空間は約760cm3であった。ネックを含めたT−175フラスコの設置面積はおよそ長さ23cm×幅11cmであり、本体は高さ約3.7cmであった。そのため、占められた空間は約936cm3であった。気体透過性試験装置260はT−175フラスコよりも約8.4倍多い細胞を培養したので、同一の時間で同じ量の細胞を得るには8.4個のT−175フラスコを用いることになるであろう。表7は、表6の実験結果に基づいて、気体透過性試験装置260により培養された同数の細胞をT−175フラスコを用いて生成した場合、占められたであろう空間の差異を示す。
図19Aに示される試験装置を用いて、実施例6で前に規定されたように、細胞がスカフォールドの上面及び底面の両方に接着するかどうかを確かめるために実験を行った。このことは、2段階の播種により完遂し得る。段階1では、垂直位置に配向させたまま、第
1の種菌を気体透過性試験装置に配置した。細胞を24時間かけて、スカフォールド上に重力で沈降させ、且つスカフォールドの上面に接着させた。段階2では、第2の種菌を気体透過性試験装置に配置した。気体透過性試験装置を反転させ、第2の種菌の細胞を、スカフォールド上に重力で沈降させ、且つスカフォールドの底面に接着させた。
装置内により大きなスカフォールド領域を挿入することにより、装置の大きさをさらに低減することができるかを確かめるために試験を行った。空間さらに節減するために、各スカフォールドの上方及び下方の面を用いて細胞を培養した。実施例7の気体透過性試験をさらなるスカフォールドを用いて製造した。表面積に対する容積の割合が従来の組織培養フラスコとほぼ同じとなるようにスカフォールドの数及びスカフォールド間の距離を選択した。従来のT−175フラスコに推奨される培地容積は、約16〜32mlと異なる(インビトロジェンライフテクノロジー(Invitrogen Life Technologies))。このことは、接着表面から約0.09〜0.18cmのところに培地が存在することを要求する。この実施例の試験装置は2段階で播種され、細胞を各スカフォールドの上面及び下面上に存在させるようにした。したがって、空間及び労力節約の点で気体透過性細胞培養装置がもたらすことのできる価値の控えめな評価を得るために、各スカフォールド間に0.34cmの培地の高さが存在することを可能にした。この様式では、表面積に対する培地の割合は、T−175フラスコに対して一定に保たれた。事実上、各スカフォールド面はスカフォールド間の培地の半分を利用できた。また、そのスカフォールドに隣接したスカフォールドは、もう半分の培地を利用できた。そのため、スカフォールドの各面に利用可能な培地は、増殖表面1cm2当たり0.17cm高さの従来の組織培養フラスコと一致した。
m2当たり1.7mmの培地が利用可能であるように意図される場合、新規気体透過生細胞培養装置により占められる空間の容積が決定され得る。表8は、この場合の、各タイプの装置により占められる空間の容積の劇的な差異を示す。
図19Aの断面図で示されたように、且つ実施例5でさらに規定されたように、気体透過性試験装置260を構成し、1つを超えるスカフォールドを備えて構成される気体透過性細胞培養装置を回転させる性能を評価した。
のプロトコル開発により多くの選択肢を可能とする。
Claims (1)
- 複数の側面によって接合された頂部及び底部を備える気体透過性細胞培養装置であって、前記底部は気体透過性物質から成り、1つの側面の少なくとも一部は気体透過性物質から成り、それにより、該装置(the apparatus )が少なくとも2つの位置、すなわち垂直及び水平に配向される場合に細胞を培養することが可能な、気体透過性細胞培養装置。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US50965103P | 2003-10-08 | 2003-10-08 | |
| PCT/US2004/033297 WO2005035728A2 (en) | 2003-10-08 | 2004-10-08 | Cell culture methods and devices utilizing gas permeable materials |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011104616A Division JP2011147460A (ja) | 2003-10-08 | 2011-05-09 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2011265191A Division JP2012040033A (ja) | 2003-10-08 | 2011-12-02 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2007511205A true JP2007511205A (ja) | 2007-05-10 |
Family
ID=34435003
Family Applications (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006534398A Pending JP2007511205A (ja) | 2003-10-08 | 2004-10-08 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2011104616A Pending JP2011147460A (ja) | 2003-10-08 | 2011-05-09 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2011265191A Pending JP2012040033A (ja) | 2003-10-08 | 2011-12-02 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2014192922A Pending JP2014236753A (ja) | 2003-10-08 | 2014-09-22 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2016099018A Pending JP2016174614A (ja) | 2003-10-08 | 2016-05-17 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
Family Applications After (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011104616A Pending JP2011147460A (ja) | 2003-10-08 | 2011-05-09 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2011265191A Pending JP2012040033A (ja) | 2003-10-08 | 2011-12-02 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2014192922A Pending JP2014236753A (ja) | 2003-10-08 | 2014-09-22 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2016099018A Pending JP2016174614A (ja) | 2003-10-08 | 2016-05-17 | 気体透過性物質を利用する細胞を培養する方法及び装置 |
Country Status (7)
| Country | Link |
|---|---|
| US (9) | US9255243B2 (ja) |
| EP (4) | EP3943591A1 (ja) |
| JP (5) | JP2007511205A (ja) |
| CN (2) | CN103173354B (ja) |
| AU (4) | AU2004280623B2 (ja) |
| CA (1) | CA2542116C (ja) |
| WO (1) | WO2005035728A2 (ja) |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011519557A (ja) * | 2008-05-05 | 2011-07-14 | ウィルソン ウォルフ マニュファクチャリング コーポレイション | 細胞容器 |
| JP2011521642A (ja) * | 2008-05-30 | 2011-07-28 | コーニング インコーポレイテッド | 細胞培養容器の組立体 |
| JP2011147460A (ja) * | 2003-10-08 | 2011-08-04 | Wilson Wolf Manufacturing Corp | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2014530618A (ja) * | 2011-10-21 | 2014-11-20 | セル・メディカ・リミテッド | 細胞の無菌増殖のための装置 |
| JP2015501653A (ja) * | 2011-12-12 | 2015-01-19 | セル・メディカ・リミテッド | T細胞増殖のためのプロセス |
| US8999703B2 (en) | 2008-05-05 | 2015-04-07 | Daniel P. Welch | Cell container |
| JP2016077164A (ja) * | 2014-10-10 | 2016-05-16 | 大日本印刷株式会社 | 細胞培養容器 |
| WO2016152697A1 (ja) * | 2015-03-20 | 2016-09-29 | 積水化学工業株式会社 | 微生物の培養方法及び培養装置 |
| JP2016530895A (ja) * | 2013-09-23 | 2016-10-06 | ウィルソン ウォルフ マニュファクチャリング コーポレイションWilson Wolf Manufacturing Corporation | 動物細胞を遺伝子改変する改良された方法 |
| JP2016178946A (ja) * | 2010-10-12 | 2016-10-13 | ナルジェ・エヌユーエヌシー・インターナショナル・コーポレーション | 細胞培養デバイス |
| JP2018033387A (ja) * | 2016-08-31 | 2018-03-08 | 株式会社アステック | 細胞培養容器 |
| JP2018515144A (ja) * | 2015-05-21 | 2018-06-14 | オリビオテック リミティド | 細胞培養装置、システム及びその使用方法 |
| JP2018518987A (ja) * | 2015-05-08 | 2018-07-19 | ウィルソン ウォルフ マニュファクチャリングWilson Wolf Manufacturing | 試験のための改良された培養方法と装置 |
| WO2018164232A1 (ja) * | 2017-03-08 | 2018-09-13 | 株式会社アステック | 細胞培養容器 |
| JP2022506841A (ja) * | 2018-11-08 | 2022-01-17 | ガンマデルタ セラピューティクス リミティッド | 細胞を単離及び拡大する方法 |
| JP2022506836A (ja) * | 2018-11-08 | 2022-01-17 | ガンマデルタ セラピューティクス リミティッド | 細胞を単離及び拡大する方法 |
| JP7371012B2 (ja) | 2018-05-15 | 2023-10-30 | ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル | インビトロ細胞培養の為の自己持続型の低酸素状態並びにガス勾配及び非ガス化学勾配を生成するデバイス、システム、及び装置 |
| US11981923B2 (en) | 2012-02-09 | 2024-05-14 | Baylor College Of Medicine | Pepmixes to generate multiviral CTLS with broad specificity |
Families Citing this family (148)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7323024B2 (en) * | 2003-12-10 | 2008-01-29 | Babcock & Wilcox Technical Services Y-12, Llc | Vessel with filter and method of use |
| US8257964B2 (en) | 2006-01-04 | 2012-09-04 | Cell ASIC | Microwell cell-culture device and fabrication method |
| US9637715B2 (en) | 2005-07-07 | 2017-05-02 | Emd Millipore Corporation | Cell culture and invasion assay method and system |
| US9354156B2 (en) | 2007-02-08 | 2016-05-31 | Emd Millipore Corporation | Microfluidic particle analysis method, device and system |
| EP3029135B1 (en) | 2005-07-07 | 2021-03-17 | The Regents of the University of California | Apparatus for cell culture array |
| US9388374B2 (en) | 2005-07-07 | 2016-07-12 | Emd Millipore Corporation | Microfluidic cell culture systems |
| US7745209B2 (en) * | 2005-07-26 | 2010-06-29 | Corning Incorporated | Multilayered cell culture apparatus |
| JP2007097407A (ja) * | 2005-09-30 | 2007-04-19 | Espec Corp | 細胞製造方法及び細胞培養装置 |
| DE102006004157A1 (de) * | 2006-01-30 | 2007-08-02 | Eppendorf Ag | Vorrichtung und Verfahren zum Inkubieren von Zellen |
| US7745210B2 (en) * | 2006-06-30 | 2010-06-29 | Corning Incorporated | Fluid flow diverter for cell culture vessel |
| US9175254B2 (en) * | 2006-07-07 | 2015-11-03 | University Of Miami | Enhanced oxygen cell culture platforms |
| JP2009542230A (ja) * | 2006-07-07 | 2009-12-03 | ユニバーシティ オブ マイアミ | 酸素増強細胞培養基盤 |
| EP2126037A1 (en) * | 2006-11-14 | 2009-12-02 | Acme Biosystems, LLC | Cell culture apparatus and associated methods |
| US20080131959A1 (en) * | 2006-11-15 | 2008-06-05 | Millipore Corporation | Bioreactor construction |
| US20080176318A1 (en) | 2006-12-07 | 2008-07-24 | Wilson John R | Highly efficient devices and methods for culturing cells |
| US7897379B2 (en) * | 2007-02-26 | 2011-03-01 | Corning Incorporated | Device and method for reducing bubble formation in cell culture |
| US9309491B2 (en) | 2007-05-29 | 2016-04-12 | Corning Incorporated | Cell culture apparatus for co-culture of cells |
| EP3173787B1 (en) | 2008-01-03 | 2021-06-02 | EMD Millipore Corporation | Cell culture array system for automated assays and methods of operation and manufacture thereof |
| AU2009268666B2 (en) * | 2008-07-08 | 2014-11-13 | Wilson Wolf Manufacturing, LLC | Improved gas permeable cell culture device and method of use |
| US9783769B2 (en) * | 2008-07-16 | 2017-10-10 | Emd Millipore Corporation | Layered flask cell culture system |
| WO2010042072A1 (en) * | 2008-10-08 | 2010-04-15 | Agency For Science, Technology And Research | Apparatus for culturing anchorage dependent cells |
| CA2741481A1 (en) * | 2008-10-22 | 2010-04-29 | Biovest International, Inc. | Perfusion bioreactors, cell culture systems, and methods for production of cells and cell-derived products |
| US9125397B2 (en) * | 2009-04-29 | 2015-09-08 | Biolife Solutions, Inc. | Apparatuses and compositions for cryopreservation of cellular monolayers |
| JP5257960B2 (ja) | 2009-06-09 | 2013-08-07 | 株式会社ジェイテック | 回転培養ベッセル及びそれを用いた自動細胞培養装置 |
| US8778669B2 (en) * | 2009-07-22 | 2014-07-15 | Corning Incorporated | Multilayer tissue culture vessel |
| RU2012111349A (ru) | 2009-08-24 | 2013-10-27 | Байлор Колледж Оф Медсин | Генерация линий ctl со специфичностью против множества опухолевых антигенов или множества вирусов |
| SG181559A1 (en) * | 2009-12-08 | 2012-07-30 | Wolf Wilson Mfg Corp | Improved methods of cell culture for adoptive cell therapy |
| US8956860B2 (en) | 2009-12-08 | 2015-02-17 | Juan F. Vera | Methods of cell culture for adoptive cell therapy |
| US9353342B2 (en) | 2010-01-21 | 2016-05-31 | Emd Millipore Corporation | Cell culture and gradient migration assay methods and devices |
| WO2011133183A1 (en) * | 2010-04-20 | 2011-10-27 | University Of Utah Research Foundation | Phase separation sprayed scaffold |
| KR20130109000A (ko) | 2010-05-11 | 2013-10-07 | 아르텔리스 에스에이 | 세포 배양 장치 및 방법 |
| WO2012129201A1 (en) | 2011-03-22 | 2012-09-27 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Methods of growing tumor infiltrating lymphocytes in gas-permeable containers |
| US10526572B2 (en) | 2011-04-01 | 2020-01-07 | EMD Millipore Corporaticn | Cell culture and invasion assay method and system |
| EP2700707B1 (en) * | 2011-04-21 | 2018-06-06 | Nipro Corporation | Cell culture method and cell culture kit |
| CN104245917B (zh) | 2011-12-03 | 2017-07-21 | Emd密理博公司 | 用于微流体细胞培养的微型培育系统和方法 |
| AU2012351347B2 (en) | 2011-12-12 | 2016-05-19 | Baylor College Of Medicine | Process of expanding T cells |
| JP5662927B2 (ja) * | 2011-12-22 | 2015-02-04 | 株式会社日立製作所 | 包装容器 |
| CN102643744A (zh) * | 2012-04-18 | 2012-08-22 | 广州洁特生物过滤制品有限公司 | 一种高通量细胞培养器及其制造方法 |
| JP6386447B2 (ja) * | 2012-05-18 | 2018-09-05 | ウィルソン ウォルフ マニュファクチャリング コーポレイションWilson Wolf Manufacturing Corporation | 養子細胞療法のための改良された細胞培養法 |
| US9872448B2 (en) * | 2012-08-06 | 2018-01-23 | Council Of Scientific & Industrial Research | Bioreactor vessel for large scale growing of plants under aseptic condition |
| US9005550B2 (en) | 2012-10-29 | 2015-04-14 | Corning Incorporated | Multi-layered cell culture vessel with manifold grips |
| US9790465B2 (en) * | 2013-04-30 | 2017-10-17 | Corning Incorporated | Spheroid cell culture well article and methods thereof |
| SG11201510526VA (en) | 2013-06-24 | 2016-01-28 | Wolf Wilson Mfg Corp | Closed system device and methods for gas permeable cell culture process |
| US20170044496A1 (en) | 2014-04-10 | 2017-02-16 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Enhanced Expansion of Tumor-Infiltrating Lymphocytes for Adoptive Cell Therapy |
| US11078455B2 (en) * | 2014-06-09 | 2021-08-03 | Seiichi YOKOO | Closed culture vessel for adherent cells |
| JP6930914B2 (ja) | 2014-10-29 | 2021-09-01 | コーニング インコーポレイテッド | 灌流バイオリアクタ・プラットフォーム |
| SG11201703493SA (en) | 2014-10-29 | 2017-05-30 | Corning Inc | Cell culture insert |
| EP3223874B1 (en) * | 2014-11-24 | 2019-09-25 | Biotronik AG | Method for producing a storable molded body made of bacterial cellulose and a molded body produced according to the method |
| CA3009153A1 (en) | 2015-01-30 | 2016-08-04 | The University Of North Carolina At Chapel Hill | Methods to generate gastrointestinal epithelial tissue constructs |
| CN108138098B (zh) * | 2015-06-25 | 2023-04-18 | 奥克兰服务有限公司 | 组织培养设备和方法 |
| KR101714010B1 (ko) * | 2015-07-13 | 2017-03-08 | 재단법인 아산사회복지재단 | 3차원 조직 재생을 위한 적층 가능한 세포배양용장치 및 이를 이용한 배양방법 |
| US9683208B2 (en) * | 2015-07-31 | 2017-06-20 | Ernest Louis Stadler | Horizontal single use pressurizable modular multi-agitator microbial fermentator |
| JP6999941B2 (ja) | 2015-09-18 | 2022-02-10 | ベイラー カレッジ オブ メディスン | 病原体からの免疫原性抗原同定および臨床的有効性との相関 |
| WO2017100771A1 (en) * | 2015-12-11 | 2017-06-15 | The University Of Iowa Research Foundation | Methods of producing biosynthetic bacterial cellulose membranes |
| WO2017169259A1 (ja) * | 2016-03-28 | 2017-10-05 | ソニー株式会社 | 細胞培養容器、細胞培養システム、細胞培養キット及び細胞培養方法 |
| SG11201809805WA (en) | 2016-05-05 | 2018-12-28 | Southwest Res Inst | Three-dimensional bioreactor for cell expansion and related applications |
| US10813342B2 (en) | 2016-05-10 | 2020-10-27 | Excet Incorporated | Methods of using training aid delivery devices (TADD) |
| WO2018009894A1 (en) | 2016-07-07 | 2018-01-11 | Iovance Biotherapeutics, Inc. | Programmed death 1 ligand 1 (pd-l1) binding proteins and methods of use thereof |
| US10053660B2 (en) * | 2016-07-12 | 2018-08-21 | California Institute Of Technology | Substrates for high-density cell growth and metabolite exchange |
| IL266209B1 (en) | 2016-10-26 | 2024-10-01 | Iovance Biotherapeutics Inc | Restimulation of cryopreserved sputum infiltrates lymphocytes |
| TWI788307B (zh) | 2016-10-31 | 2023-01-01 | 美商艾歐凡斯生物治療公司 | 用於擴增腫瘤浸潤性淋巴細胞之工程化人造抗原呈現細胞 |
| AU2017357650B2 (en) | 2016-11-11 | 2023-07-13 | Oribiotech Ltd | Cell culture device system and methods of use thereof |
| WO2018094167A1 (en) | 2016-11-17 | 2018-05-24 | Iovance Biotherapeutics, Inc. | Remnant tumor infiltrating lymphocytes and methods of preparing and using the same |
| WO2018129336A1 (en) | 2017-01-06 | 2018-07-12 | Iovance Biotherapeutics, Inc. | Expansion of tumor infiltrating lymphocytes with potassium channel agonists and therapeutic uses thereof |
| JP2020514289A (ja) | 2017-01-06 | 2020-05-21 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 腫瘍壊死因子受容体スーパーファミリー(tnfrsf)アゴニストによる腫瘍浸潤リンパ球(til)の拡大培養及びtilとtnfrsfアゴニストとの治療的併用 |
| US11254913B1 (en) | 2017-03-29 | 2022-02-22 | Iovance Biotherapeutics, Inc. | Processes for production of tumor infiltrating lymphocytes and uses of same in immunotherapy |
| JOP20190224A1 (ar) | 2017-03-29 | 2019-09-26 | Iovance Biotherapeutics Inc | عمليات من أجل إنتاج الخلايا اللمفاوية المرتشحة للأورام واستخداماتها في العلاج المناعي |
| WO2018195014A1 (en) | 2017-04-19 | 2018-10-25 | Neubiser Richard | Bioreactor for biological material |
| TW202409272A (zh) | 2017-05-10 | 2024-03-01 | 美商艾歐凡斯生物治療公司 | 源自液體腫瘤之腫瘤浸潤性淋巴細胞的擴增和該經擴增腫瘤浸潤性淋巴細胞之治療用途 |
| US10821134B2 (en) | 2017-05-17 | 2020-11-03 | Board Of Regents, The University Of Texas System | BK virus specific T cells |
| WO2018215936A1 (en) | 2017-05-24 | 2018-11-29 | Novartis Ag | Antibody-cytokine engrafted proteins and methods of use in the treatment of cancer |
| JP2020522516A (ja) | 2017-06-05 | 2020-07-30 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 二重抵抗性黒色腫において腫瘍浸潤リンパ球を使用する方法 |
| US11857970B2 (en) | 2017-07-14 | 2024-01-02 | Corning Incorporated | Cell culture vessel |
| EP3652290B1 (en) | 2017-07-14 | 2022-05-04 | Corning Incorporated | 3d cell culture vessels for manual or automatic media exchange |
| JP7195302B2 (ja) | 2017-07-14 | 2022-12-23 | コーニング インコーポレイテッド | 3d培養のための細胞培養容器及び3d細胞の培養方法 |
| WO2019014636A1 (en) | 2017-07-14 | 2019-01-17 | Corning Incorporated | CONTAINER FOR CELL CULTURE |
| US20200277573A1 (en) | 2017-11-17 | 2020-09-03 | Iovance Biotherapeutics, Inc. | Til expansion from fine needle aspirates and small biopsies |
| JP2021503885A (ja) | 2017-11-22 | 2021-02-15 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 末梢血からの末梢血リンパ球(pbl)の拡大培養 |
| JP7565795B2 (ja) | 2017-12-15 | 2024-10-11 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 腫瘍浸潤リンパ球の有益な投与を決定するシステム及び方法並びにその使用方法、並びに腫瘍浸潤リンパ球の有益な投与及びその使用方法 |
| WO2019136459A1 (en) | 2018-01-08 | 2019-07-11 | Iovance Biotherapeutics, Inc. | Processes for generating til products enriched for tumor antigen-specific t-cells |
| CN111836887A (zh) | 2018-01-08 | 2020-10-27 | 艾欧凡斯生物治疗公司 | 产生富含肿瘤抗原特异性t细胞的til产品的方法 |
| US11713446B2 (en) | 2018-01-08 | 2023-08-01 | Iovance Biotherapeutics, Inc. | Processes for generating TIL products enriched for tumor antigen-specific T-cells |
| US10889792B2 (en) * | 2018-02-09 | 2021-01-12 | Global Life Sciences Solutions Usa Llc | Cell expansion vessel systems and methods |
| US12077743B2 (en) | 2018-02-09 | 2024-09-03 | Global Life Sciences Solutions Usa Llc | Apparatus for fluid line management in a bioprocessing system |
| US20210087511A1 (en) * | 2018-02-09 | 2021-03-25 | Global Life Sciences Solutions Usa Llc | Bioprocessing methods for cell therapy |
| US11932842B2 (en) | 2018-02-09 | 2024-03-19 | Global Life Sciences Solutions Usa Llc | Bioprocessing apparatus |
| US11920119B2 (en) | 2018-02-09 | 2024-03-05 | Global Life Sciences Solutions Usa Llc | Systems and methods for bioprocessing |
| DK3775165T3 (da) | 2018-03-29 | 2024-07-08 | Iovance Biotherapeutics Inc | Fremgangsmåder til frembringelse af tumorinfiltrerende lymfocytter og anvendelser heraf i immunterapi |
| US11149244B2 (en) | 2018-04-04 | 2021-10-19 | Southwest Research Institute | Three-dimensional bioreactor for T-cell activation and expansion for immunotherapy |
| WO2019210131A1 (en) | 2018-04-27 | 2019-10-31 | Iovance Biotherapeutics, Inc. | Closed process for expansion and gene editing of tumor infiltrating lymphocytes and uses of same in immunotherapy |
| WO2019217753A1 (en) | 2018-05-10 | 2019-11-14 | Iovance Biotherapeutics, Inc. | Processes for production of tumor infiltrating lymphocytes and uses of same in immunotherapy |
| EP3649229B1 (en) | 2018-07-13 | 2021-08-25 | Corning Incorporated | Cell culture vessels with stabilizer devices |
| JP7171696B2 (ja) | 2018-07-13 | 2022-11-15 | コーニング インコーポレイテッド | 相互接続されたウェルを有するマイクロプレートを備えた流体デバイス |
| CN111032851B (zh) | 2018-07-13 | 2024-03-29 | 康宁股份有限公司 | 具有包含液体介质传递表面的侧壁的微腔皿 |
| TW202031273A (zh) | 2018-08-31 | 2020-09-01 | 美商艾歐凡斯生物治療公司 | 抗pd-1抗體難治療性之非小細胞肺癌(nsclc)病患的治療 |
| US20220322655A1 (en) | 2018-09-20 | 2022-10-13 | Iovance Biotherapeutics, Inc. | Expansion of TILs from Cryopreserved Tumor Samples |
| US11447731B2 (en) | 2018-09-24 | 2022-09-20 | Southwest Research Institute | Three-dimensional bioreactors |
| WO2020071438A1 (ja) * | 2018-10-02 | 2020-04-09 | 学校法人同志社 | 角膜内皮細胞を保存するための方法および容器 |
| WO2020096927A1 (en) | 2018-11-05 | 2020-05-14 | Iovance Biotherapeutics, Inc. | Expansion of tils utilizing akt pathway inhibitors |
| US20220090018A1 (en) | 2018-11-05 | 2022-03-24 | Iovance Biotherapeutics, Inc. | Processes for production of tumor infiltrating lymphocytes and used of the same in immunotherapy |
| AU2019377422A1 (en) | 2018-11-05 | 2021-05-27 | Iovance Biotherapeutics, Inc. | Treatment of NSCLC patients refractory for anti-PD-1 antibody |
| EP3877512A2 (en) | 2018-11-05 | 2021-09-15 | Iovance Biotherapeutics, Inc. | Selection of improved tumor reactive t-cells |
| JP2022514023A (ja) | 2018-12-19 | 2022-02-09 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 操作されたサイトカイン受容体対を使用して腫瘍浸潤リンパ球を拡大培養する方法及びその使用 |
| US11447729B2 (en) | 2018-12-21 | 2022-09-20 | Global Life Sciences Solutions Usa Llc | Apparatus and method for bioprocessing |
| EP3906295A1 (en) | 2019-01-04 | 2021-11-10 | Oribiotech Ltd | Cell processing unit, cell processing system and methods of use thereof |
| US12024699B2 (en) | 2019-01-04 | 2024-07-02 | Oribiotech Ltd. | Systems, devices, and methods for cell processing |
| US20200308532A1 (en) | 2019-03-29 | 2020-10-01 | Fenwal, Inc. | Automated Systems and Methods for Cell Culturing |
| KR20210146895A (ko) * | 2019-03-29 | 2021-12-06 | 고리츠다이가쿠호진 요코하마시리츠다이가쿠 | 매트릭스 조성물 |
| US10772914B1 (en) | 2019-04-18 | 2020-09-15 | Baylor College Of Medicine | EBV-specific immune cells |
| WO2020232029A1 (en) | 2019-05-13 | 2020-11-19 | Iovance Biotherapeutics, Inc. | Methods and compositions for selecting tumor infiltrating lymphocytes and uses of the same in immunotherapy |
| CN110283725A (zh) * | 2019-07-02 | 2019-09-27 | 英诺维尔智能科技(苏州)有限公司 | 一种新型多层贴壁细胞培养容器结构 |
| CN110218649A (zh) * | 2019-07-02 | 2019-09-10 | 英诺维尔智能科技(苏州)有限公司 | 一种新型两侧透气多层贴壁细胞培养容器结构 |
| EP4048773A4 (en) * | 2019-10-24 | 2024-01-03 | Octane Biotech Inc. | CELL CULTURE CHAMBER WITH IMPROVED CELL CONTACT SURFACES |
| CA3155727A1 (en) | 2019-10-25 | 2021-04-29 | Cecile Chartier-Courtaud | Gene editing of tumor infiltrating lymphocytes and uses of same in immunotherapy |
| US11981885B2 (en) | 2019-11-15 | 2024-05-14 | City Of Hope | System, device and method for production of bioproduct including high density cell respirator (HDCR) for intensified production of adeno-associated viruses (AAV) and cell-based production |
| KR102417445B1 (ko) * | 2019-11-29 | 2022-07-06 | 주식회사 아모그린텍 | 세포배양장치 |
| CA3161104A1 (en) | 2019-12-11 | 2021-06-17 | Cecile Chartier-Courtaud | Processes for the production of tumor infiltrating lymphocytes (tils) and methods of using the same |
| FR3104611B1 (fr) * | 2019-12-11 | 2022-10-07 | Air Liquide | Digesteur comprenant une paroi interne présentant des expansions et/ou des creux |
| WO2021163501A1 (en) * | 2020-02-14 | 2021-08-19 | Xcell Biosciences, Inc. | Gas and liquid flow regulation system for cell culture |
| GB202003406D0 (en) | 2020-03-09 | 2020-04-22 | Oribiotech Ltd | A bioreactor having sensors therin |
| EP4118179A1 (en) * | 2020-03-09 | 2023-01-18 | Oribiotech Ltd | Cell culture container |
| EP4107247A2 (en) | 2020-03-10 | 2022-12-28 | Cellares Corporation | Systems, devices, and methods for cell processing |
| MX2022011646A (es) | 2020-03-20 | 2022-10-13 | Gammadelta Therapeutics Ltd | Celulas t v delta1+ para el tratamiento de neoplasias mieloides. |
| US20210290674A1 (en) * | 2020-03-20 | 2021-09-23 | GammaDelta Therapeutics Ltd. | Methods for treating myeloid malignancies |
| CN115997008A (zh) | 2020-04-22 | 2023-04-21 | 艾欧凡斯生物治疗公司 | 协调用于患者特异性免疫疗法的细胞的制造的系统和方法 |
| CA3177413A1 (en) | 2020-05-04 | 2021-11-11 | Michelle SIMPSON-ABELSON | Selection of improved tumor reactive t-cells |
| EP4146794A1 (en) | 2020-05-04 | 2023-03-15 | Iovance Biotherapeutics, Inc. | Processes for production of tumor infiltrating lymphocytes and uses of the same in immunotherapy |
| GB202006989D0 (en) | 2020-05-12 | 2020-06-24 | Gammadelta Therapeutics Ltd | Methods for isolating gamma delta t cells |
| WO2022076606A1 (en) | 2020-10-06 | 2022-04-14 | Iovance Biotherapeutics, Inc. | Treatment of nsclc patients with tumor infiltrating lymphocyte therapies |
| EP4225330A1 (en) | 2020-10-06 | 2023-08-16 | Iovance Biotherapeutics, Inc. | Treatment of nsclc patients with tumor infiltrating lymphocyte therapies |
| CA3201818A1 (en) | 2020-12-11 | 2022-06-16 | Maria Fardis | Treatment of cancer patients with tumor infiltrating lymphocyte therapies in combination with braf inhibitors and/or mek inhibitors |
| EP4262811A1 (en) | 2020-12-17 | 2023-10-25 | Iovance Biotherapeutics, Inc. | Treatment with tumor infiltrating lymphocyte therapies in combination with ctla-4 and pd-1 inhibitors |
| JP2024500403A (ja) | 2020-12-17 | 2024-01-09 | アイオバンス バイオセラピューティクス,インコーポレイテッド | 腫瘍浸潤リンパ球によるがんの治療 |
| CN112682606B (zh) * | 2021-01-21 | 2022-01-07 | 江苏丰禾机械制造股份有限公司 | 内置弹性连接结构的波纹管补偿器 |
| TW202308669A (zh) | 2021-04-19 | 2023-03-01 | 美商艾歐凡斯生物治療公司 | 嵌合共刺激性受體、趨化激素受體及彼等於細胞免疫治療之用途 |
| EP4377446A1 (en) | 2021-07-28 | 2024-06-05 | Iovance Biotherapeutics, Inc. | Treatment of cancer patients with tumor infiltrating lymphocyte therapies in combination with kras inhibitors |
| GB2609490A (en) | 2021-08-05 | 2023-02-08 | Oribiotech Ltd | Outlet valve for a container |
| US20240344007A1 (en) * | 2021-08-06 | 2024-10-17 | The Regents Of The University Of California | Devices for growing cultures of microorganisms |
| EP4423755A2 (en) | 2021-10-27 | 2024-09-04 | Iovance Biotherapeutics, Inc. | Systems and methods for coordinating manufacturing of cells for patient-specific immunotherapy |
| EP4430167A1 (en) | 2021-11-10 | 2024-09-18 | Iovance Biotherapeutics, Inc. | Methods of expansion treatment utilizing cd8 tumor infiltrating lymphocytes |
| WO2023147486A1 (en) | 2022-01-28 | 2023-08-03 | Iovance Biotherapeutics, Inc. | Tumor infiltrating lymphocytes engineered to express payloads |
| AU2023226294A1 (en) * | 2022-02-25 | 2024-09-05 | Duogenic StemCells Corporation | Cell proliferation apparatuses and uses thereof |
| GB202204926D0 (en) | 2022-04-04 | 2022-05-18 | Gammadelta Therapeutics Ltd | Method for expanding gammadelta T cells |
| WO2023201369A1 (en) | 2022-04-15 | 2023-10-19 | Iovance Biotherapeutics, Inc. | Til expansion processes using specific cytokine combinations and/or akti treatment |
| WO2024030758A1 (en) | 2022-08-01 | 2024-02-08 | Iovance Biotherapeutics, Inc. | Chimeric costimulatory receptors, chemokine receptors, and the use of same in cellular immunotherapies |
| WO2024118836A1 (en) | 2022-11-30 | 2024-06-06 | Iovance Biotherapeutics, Inc. | Processes for production of tumor infiltrating lymphocytes with shortened rep step |
| WO2024151885A1 (en) | 2023-01-13 | 2024-07-18 | Iovance Biotherapeutics, Inc. | Use of til as maintenance therapy for nsclc patients who achieved pr/cr after prior therapy |
| WO2024209429A1 (en) | 2023-04-07 | 2024-10-10 | Takeda Pharmaceutical Company Limited | T cells for use in treating relapsed or refractory acute myeloid leukemia |
Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6434283A (en) * | 1987-07-29 | 1989-02-03 | Mitsui Petrochemical Ind | Method for cultivation and apparatus therefor |
| JPH05123182A (ja) * | 1991-10-30 | 1993-05-21 | Nakano Vinegar Co Ltd | 静置培養による微生物セルロースの製造法及びその装置 |
| JPH078267A (ja) * | 1993-06-25 | 1995-01-13 | Kajima Corp | 付着微細藻類の培養方法 |
| JPH1128083A (ja) * | 1997-07-11 | 1999-02-02 | Menicon Co Ltd | 細胞培養用容器 |
| WO2001092462A1 (en) * | 1999-05-28 | 2001-12-06 | Ashby Scientific Ltd. | Culture chamber |
| JP2002528567A (ja) * | 1998-10-28 | 2002-09-03 | アシュビー・サイエンティフィック・リミテッド | 織り込まれた多孔性シリコーンラバー |
| JP2002335946A (ja) * | 2001-05-21 | 2002-11-26 | Core Biotech Co Ltd | 細胞培養管及びこれを用いた大量細胞培養器 |
Family Cites Families (151)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3459176A (en) | 1966-06-24 | 1969-08-05 | Beckman Instruments Inc | Apparatus and method of sampling a dialyzable component of blood |
| GB1376131A (en) | 1971-02-09 | 1974-12-04 | Nat Res Dev | Improvements in and relating to cell culture systems |
| DE2128744C3 (de) | 1971-06-09 | 1979-03-29 | Max-Planck-Gesellschaft Zur Foerderung Der Wissenschaften E.V., 3400 Goettingen | Verfahren zur Massenkultivation von Zellen und Geweben |
| US3839155A (en) | 1972-07-27 | 1974-10-01 | Merck & Co Inc | Cell and vaccine production |
| US3870602A (en) * | 1973-04-30 | 1975-03-11 | California Lab Ind Inc | Gas permeable sterile culture bottle |
| US3948732A (en) | 1973-05-31 | 1976-04-06 | Instrumentation Laboratory, Inc. | Cell culture assembly |
| US3941661A (en) | 1974-01-16 | 1976-03-02 | The Curators Of The University Of Missouri | Roller culture bottle insert |
| US4096577A (en) * | 1975-03-03 | 1978-06-20 | Ferber Leon A | Thin flexible electronic calculator |
| JPS5238082A (en) | 1975-09-13 | 1977-03-24 | Heraeus Gmbh W C | Cultivating container for microorganism * bacterium and tissue |
| US4228243A (en) | 1978-07-13 | 1980-10-14 | Toray Industries, Inc. | Cell culture propagation apparatus |
| JPS564989A (en) | 1979-06-27 | 1981-01-19 | Sony Corp | Writing method for horizontal linearity corrected signal in horizontal llnearity correcting memory of beam index type color television receiver |
| US4296205A (en) | 1980-02-22 | 1981-10-20 | Verma Dharmvir S | Cell culture and continuous dialysis flask and method |
| US4321330A (en) | 1980-04-04 | 1982-03-23 | Baker Fraser L | Tissue culture device |
| US4317886A (en) | 1980-08-11 | 1982-03-02 | Becton, Dickinson And Company | Multiple interior surface roller bottle |
| JPS5876792U (ja) | 1981-11-18 | 1983-05-24 | 東洋リノリユ−ム株式会社 | デスクトツプ |
| US4435508A (en) | 1981-11-20 | 1984-03-06 | Gabridge Michael G | Tissue culture vessel |
| JPS59220182A (ja) * | 1983-05-27 | 1984-12-11 | Ishikawa Seisakusho:Kk | 培養槽 |
| DE3322004A1 (de) | 1983-06-18 | 1984-12-20 | Robert Bosch Gmbh, 7000 Stuttgart | Induktives element, insbesondere uebertrager |
| US4578588A (en) | 1983-08-12 | 1986-03-25 | Galkin Benjamin M | Volume reduction in liquid scintillation counting |
| DE3409501A1 (de) | 1984-03-15 | 1985-10-24 | Sandoz-Patent-GmbH, 7850 Lörrach | Verfahren zur kultivierung von zellen |
| US4748124A (en) | 1984-10-30 | 1988-05-31 | E. I. Du Pont De Nemours And Company | Compartmentalized cell-culture device and method |
| NZ214417A (en) * | 1984-12-21 | 1988-06-30 | Univ Texas | Microbially produced cellulose |
| US4668632A (en) | 1985-02-06 | 1987-05-26 | Vxr, Inc. | Sparger and apparatus for and method of growing cells |
| JPH053724Y2 (ja) | 1985-04-15 | 1993-01-28 | ||
| US4654308A (en) | 1985-06-19 | 1987-03-31 | La Corporation De L'ecole Polytechnique | Bioreactor |
| JPS6232875A (ja) * | 1985-08-06 | 1987-02-12 | Toyo Eng Corp | 槽 |
| EP0264464B1 (en) * | 1985-10-19 | 1992-05-13 | Daikin Industries, Limited | Culture vessel |
| US4661455A (en) | 1986-01-16 | 1987-04-28 | Dorr-Oliver Incorporated | Membrane cell culturing device |
| US4829002A (en) | 1986-05-12 | 1989-05-09 | Baxter International Inc. | System for metering nutrient media to cell culture containers and method |
| US4937194A (en) | 1986-05-12 | 1990-06-26 | Baxter International Inc. | Method for metering nutrient media to cell culture containers |
| US4734373A (en) | 1986-06-24 | 1988-03-29 | Bartal Arie H | Apparatus for enhancing cell growth, preservation and transport |
| US4945203A (en) | 1986-11-06 | 1990-07-31 | American Fluoroseal Corporation | Method and apparatus for making fluorocarbon film plastic bags using a laser |
| US4847462A (en) | 1986-11-06 | 1989-07-11 | American Fluoroseal Corporation | Method and apparatus for making fluorocarbon film plastic bags using a laser |
| US4717668A (en) * | 1986-12-12 | 1988-01-05 | Baxter Travenol Laboratories, Inc. | Plastic roller bottle for suspension cultures |
| US5786215A (en) | 1987-05-20 | 1998-07-28 | Baxter International Inc. | Method for culturing animal cells |
| US5047347A (en) | 1987-08-17 | 1991-09-10 | Cline Martin J | Gas permeable culture flask and method for culturing mammalian cells |
| US4839292B1 (en) | 1987-09-11 | 1994-09-13 | Joseph G Cremonese | Cell culture flask utilizing membrane barrier |
| US4829004A (en) | 1987-11-24 | 1989-05-09 | The University Of Michigan | Roller bottle system |
| US4824787A (en) | 1987-12-09 | 1989-04-25 | In Vitro Scientific Products, Inc. | Roller bottle for tissue culture growth |
| US5026650A (en) | 1988-06-30 | 1991-06-25 | The United States Of Amercia As Represented By The Administrator Of The National Aeronautics And Space Administration | Horizontally rotated cell culture system with a coaxial tubular oxygenator |
| US5153131A (en) | 1990-12-11 | 1992-10-06 | The United States Of America As Represented By The Administrator Of The National Aeronautics And Space Administration | High aspect reactor vessel and method of use |
| CA1307225C (en) | 1988-07-19 | 1992-09-08 | David W. Armstrong | Cell culture bioreactor |
| DE68926421T2 (de) | 1988-08-20 | 1996-09-12 | Nitto Denko Corp | Verfahren zur Entfernung von gelösten Gasen aus einer Flüssigkeit |
| US4939151A (en) | 1988-10-31 | 1990-07-03 | Baxter International Inc. | Adherent cell culture flask |
| US5068195A (en) | 1988-11-02 | 1991-11-26 | Du Pont Merck Pharmaceutical Company | Dot matrix membrane cell expansion and maintenance vessel |
| US4960706A (en) | 1989-03-27 | 1990-10-02 | Baxter International, Inc. | Static oxygenator for suspension culture of animal cells |
| US4912058A (en) | 1989-04-27 | 1990-03-27 | Becton, Dickinson And Company | Roller bottle |
| CA2015294A1 (en) | 1989-04-28 | 1990-10-28 | John J. Rinehart | Generation and expansion of lak cells |
| US5240854A (en) | 1989-06-05 | 1993-08-31 | Berry Eric S | Continuous high-density cell culture system |
| US4937196A (en) | 1989-08-18 | 1990-06-26 | Brunswick Corporation | Membrane bioreactor system |
| JPH0734699Y2 (ja) | 1990-01-22 | 1995-08-09 | 東洋ガラス株式会社 | カレンダー |
| US5173225A (en) | 1990-05-07 | 1992-12-22 | Bowolfe, Inc. | Method for making ultra-thin dense skin membrane |
| EP0471947A1 (en) | 1990-06-29 | 1992-02-26 | Sekisui Chemical Co., Ltd. | Culture bag |
| FR2666094A1 (fr) | 1990-08-22 | 1992-02-28 | Cyclopore Sa | Bouteille de culture en masse de cellules et procede pour son assemblage. |
| US5139951A (en) | 1990-10-10 | 1992-08-18 | Costar Corporation | Culture device having a detachable cell or tissue growth surface |
| US5650325A (en) | 1990-11-29 | 1997-07-22 | Spielmann; Richard | Apparatus having a rotatable stack of parallel trays with culturing surfaces on opposite sides for liquid/gas exchange |
| CA2055966C (en) | 1990-12-19 | 1995-08-01 | Oresta Natalia Fedun | Cell culture insert |
| CA2062100C (en) | 1991-03-05 | 2000-10-31 | Hirotoshi Fujisawa | Disc cartridge |
| JPH0734699B2 (ja) | 1991-03-14 | 1995-04-19 | アース製薬株式会社 | 屋内ダニ防除用エアゾール剤およびそれを用いた屋内ダニ防除方法 |
| GB9112836D0 (en) | 1991-06-14 | 1991-07-31 | Medical Res Council | Production of monoclonal antibodies |
| JPH053724A (ja) * | 1991-06-27 | 1993-01-14 | Kiriyuu Kogyo Kk | きのこ栽培容器 |
| US5310676A (en) | 1991-11-15 | 1994-05-10 | A/S Nunc | Cell cultivating device |
| DE4206585C2 (de) | 1992-03-03 | 1994-11-24 | Augustinus Dr Med Bader | Vorrichtung zur Massenkultur von Zellen |
| DE4214157C1 (ja) * | 1992-04-29 | 1993-08-05 | Degussa Ag, 6000 Frankfurt, De | |
| GB2268187A (en) | 1992-07-01 | 1994-01-05 | Univ Hull | Cell culture vessels |
| DE4229325C2 (de) | 1992-09-02 | 1995-12-21 | Heraeus Instr Gmbh | Kulturgefäß für Zellkulturen |
| DE4229334C2 (de) | 1992-09-02 | 1995-12-21 | Heraeus Instr Gmbh | Rollflaschenähnliches Kulturgefäß für Zellkulturen |
| US5330908A (en) | 1992-12-23 | 1994-07-19 | The United States Of America As Represented By The Administrator, National Aeronautics And Space Administration | High density cell culture system |
| US5324428A (en) | 1993-07-19 | 1994-06-28 | Spectrum Medical Industries, Inc. | Disposable dialysis apparatus |
| JPH0734699A (ja) | 1993-07-21 | 1995-02-03 | Ishikawajima Harima Heavy Ind Co Ltd | エレベータ式駐車装置 |
| AT401476B (de) * | 1993-08-20 | 1996-09-25 | Sy Lab Vertriebsges M B H | Thermokammer |
| US5686301A (en) | 1993-09-02 | 1997-11-11 | Heraeus Instruments Gmbh | Culture vessel for cell cultures |
| US5437998A (en) * | 1993-09-09 | 1995-08-01 | Synthecon, Inc. | Gas permeable bioreactor and method of use |
| US5702941A (en) | 1993-09-09 | 1997-12-30 | Synthecon, Inc. | Gas permeable bioreactor and method of use |
| PT720508E (pt) | 1993-09-22 | 2000-09-29 | Pierce Chemical Co | Dispositivo para dialisar amostras |
| FR2710492B1 (fr) * | 1993-09-29 | 1997-08-01 | Compac Int Inc | Sac pour la culture de blanc de champignon. |
| US5534423A (en) | 1993-10-08 | 1996-07-09 | Regents Of The University Of Michigan | Methods of increasing rates of infection by directing motion of vectors |
| JPH0734699U (ja) * | 1993-12-07 | 1995-06-27 | 信越ポリマー株式会社 | 好気培養容器 |
| KR0184295B1 (ko) | 1994-02-10 | 1999-05-15 | 도키와 후미가츠 | 아실옥시벤젠술폰산 또는 그 염의 제조법 |
| JP2766182B2 (ja) * | 1994-04-14 | 1998-06-18 | 株式会社バイオポリマー・リサーチ | バクテリアセルロースの製造方法 |
| EP0760008A1 (en) * | 1994-05-19 | 1997-03-05 | Dako A/S | Pna probes for detection of neisseria gonorrhoeae and chlamydia trachomatis |
| US5565353A (en) | 1994-06-22 | 1996-10-15 | Board Of Regents, The University Of Texas System | Perfusable culture device |
| US5714384A (en) * | 1994-06-28 | 1998-02-03 | Wilson; John R. | Compartmentalized tissue culture bag |
| US5693537A (en) | 1994-06-28 | 1997-12-02 | Wilson; John R. | Compartmentalized tissue culture flask |
| US5707869A (en) | 1994-06-28 | 1998-01-13 | Wolf; Martin L. | Compartmentalized multiple well tissue culture plate |
| ATE292673T1 (de) | 1994-06-28 | 2005-04-15 | Wilson Wolf Corp | Zellkulturflasche mit mehreren kammern |
| JPH0834802A (ja) * | 1994-07-21 | 1996-02-06 | Gun Ei Chem Ind Co Ltd | バクテリアセルロース、その製造方法及び該バクテリアセルロースを用いた加工物 |
| US5527705A (en) | 1994-09-12 | 1996-06-18 | Becton, Dickinson And Company | Roller bottle for trans-membrane co-culture of cells and method for its use |
| US6297046B1 (en) | 1994-10-28 | 2001-10-02 | Baxter International Inc. | Multilayer gas-permeable container for the culture of adherent and non-adherent cells |
| US5935847A (en) | 1994-10-28 | 1999-08-10 | Baxter International Inc. | Multilayer gas-permeable container for the culture of adherent and non-adherent cells |
| DE19504958C1 (de) | 1995-02-15 | 1995-11-02 | Heraeus Instr Gmbh | Verfahren für die Kultivierung von Zellen auf einem Träger, Vorrichtung zur Durchführung des Verfahrens und Verwendung der Vorrichtung |
| BE1009306A5 (fr) | 1995-04-28 | 1997-02-04 | Baxter Int | Bioreacteur. |
| CA2175626C (en) | 1995-05-18 | 1999-08-03 | Timothy A. Stevens | Tissue culture flask |
| US5985653A (en) | 1995-06-07 | 1999-11-16 | Aastrom Biosciences, Inc. | Incubator apparatus for use in a system for maintaining and growing biological cells |
| DE19529099C2 (de) | 1995-08-08 | 1997-12-04 | Forschungszentrum Juelich Gmbh | Vorrichtung zur Serien-Kultivierung von Mikroorganismen bzw. Zellen in begasten Flüssigkeitssäulen |
| DE69612861T2 (de) | 1995-08-31 | 2001-08-30 | Ashby Scientific Ltd., Coalville | Verfahren und vorrichtung zur kultivierung von biologischem material |
| US5614412A (en) | 1995-09-08 | 1997-03-25 | Smith; Stephen L. | Apparatus for carrying flexible containers and method of transferring fluids to containers |
| US5686304A (en) | 1995-12-15 | 1997-11-11 | Avecor Cardiovascular, Inc. | Cell culture apparatus and method |
| US6145688A (en) | 1996-07-17 | 2000-11-14 | Smith; James C. | Closure device for containers |
| US5866419A (en) | 1996-09-16 | 1999-02-02 | Meder; Martin G. | Roller bottle |
| US5876604A (en) | 1996-10-24 | 1999-03-02 | Compact Membrane Systems, Inc | Method of gasifying or degasifying a liquid |
| US6306491B1 (en) | 1996-12-20 | 2001-10-23 | Gore Enterprise Holdings, Inc. | Respiratory aids |
| US5736398A (en) * | 1997-01-16 | 1998-04-07 | Board Of Regents, The University Of Texas System | Gas permeable pouches for growing cultures |
| US5817509A (en) | 1997-03-19 | 1998-10-06 | Becton Dickinson And Company | Culture vessel assembly |
| US5928936A (en) | 1997-04-09 | 1999-07-27 | Huntington Medical Research Institutes | Cell culture container that self-seals after cannula penetration made of porous sheets |
| DE19719751A1 (de) | 1997-05-10 | 1998-11-12 | Augustinus Dr Med Bader | Vorrichtung zum Züchten und/oder Behandeln von Zellen |
| US5914154A (en) | 1997-05-30 | 1999-06-22 | Compact Membrane Systems, Inc. | Non-porous gas permeable membrane |
| US5783075A (en) | 1997-06-23 | 1998-07-21 | Spectrum Medical Laboratories, Inc. | Disposable dialyzer apparatus |
| US6190913B1 (en) | 1997-08-12 | 2001-02-20 | Vijay Singh | Method for culturing cells using wave-induced agitation |
| US6596532B1 (en) | 1997-12-12 | 2003-07-22 | BIOMéRIEUX, INC. | Device for isolation and surface culture of microorganisms from bulk fluids |
| GB9803362D0 (en) | 1998-02-17 | 1998-04-15 | Cellon Sa | A cell culture vessel |
| US5989913A (en) * | 1998-07-02 | 1999-11-23 | Charles Daniel Anderson | Culture vessel for growing or culturing cells, cellular aggregates, tissues and organoids and methods for using the same |
| DE29817223U1 (de) * | 1998-09-24 | 1998-11-19 | Marotzki, Stefan, Dr., 25436 Tornesch | Vorrichtung zur Aufnahme einer Zellkultur |
| EP1183187A4 (en) * | 1998-10-21 | 2004-03-17 | Wei K Hsu | STERILIZED CULTURE SYSTEM WITH MICROFILTRATION MEMBRANE CAPABLE OF FIXABLE RELEASE |
| US6410309B1 (en) | 1999-03-23 | 2002-06-25 | Biocrystal Ltd | Cell culture apparatus and methods of use |
| US6455310B1 (en) | 1999-03-23 | 2002-09-24 | Biocrystal Ltd. | Cell culture apparatus and method for culturing cells |
| DE19915611A1 (de) | 1999-04-07 | 2000-11-16 | Augustinus Bader | Rollhalterung |
| US7560274B1 (en) | 1999-05-28 | 2009-07-14 | Cellon S.A. | Culture chamber |
| ATE373079T1 (de) | 1999-06-21 | 2007-09-15 | Gen Hospital Corp | Zellkultursysteme und verfahren für einrichtungen zur organunterstützung |
| US6562616B1 (en) | 1999-06-21 | 2003-05-13 | The General Hospital Corporation | Methods and devices for cell culturing and organ assist systems |
| US6569675B2 (en) | 2000-06-16 | 2003-05-27 | Corning Incorporated | Cell cultivating flask and method for using the cell cultivating flask |
| US20030077816A1 (en) | 2000-12-27 | 2003-04-24 | Richard Kronenthal | Bioreactor and method for using |
| DE10109706B4 (de) | 2001-02-11 | 2006-03-09 | In Vitro Systems & Services Gmbh | Verfahren zur Herstellung von Kulturgefäßen |
| EP1245670A3 (en) | 2001-03-27 | 2004-01-28 | Becton, Dickson and Company | Method and apparatus for culturing cells |
| JP2003018365A (ja) * | 2001-07-05 | 2003-01-17 | Nisca Corp | 画像読取装置及び画像読取方法 |
| US20040072347A1 (en) | 2001-07-27 | 2004-04-15 | Gerold Schuler | Generation of fully mature and stable dendritic cells from leukaphereses products for clinical applications |
| WO2003060061A1 (en) | 2001-12-21 | 2003-07-24 | Organogenesis Inc. | Chamber with adjustable volume for cell culture and organ assist |
| TW547111U (en) | 2002-01-10 | 2003-08-11 | Dcd Inc | Exercise apparatus |
| US7033823B2 (en) | 2002-01-31 | 2006-04-25 | Cesco Bioengineering, Inc. | Cell-cultivating device |
| DE10204531A1 (de) | 2002-02-01 | 2003-08-21 | Inst Chemo Biosensorik | Deckelelement |
| US7507579B2 (en) | 2002-05-01 | 2009-03-24 | Massachusetts Institute Of Technology | Apparatus and methods for simultaneous operation of miniaturized reactors |
| US7229820B2 (en) * | 2002-06-13 | 2007-06-12 | Wilson Wolf Manufacturing Corporation | Apparatus and method for culturing and preserving tissue constructs |
| US20040029266A1 (en) | 2002-08-09 | 2004-02-12 | Emilio Barbera-Guillem | Cell and tissue culture device |
| US20040110199A1 (en) | 2002-08-28 | 2004-06-10 | Montemagno Carlo D. | Microfluidic affinity system using polydimethylsiloxane and a surface modification process |
| US20040067585A1 (en) | 2002-10-07 | 2004-04-08 | Yu-Chi Wang | Cell cultivation surface and method of making the same |
| US20050032205A1 (en) * | 2003-08-05 | 2005-02-10 | Smith Sidney T. | In vitro cell culture employing a fibrin network in a flexible gas permeable container |
| CN103173354B (zh) | 2003-10-08 | 2017-07-14 | 威尔森沃尔夫制造公司 | 利用透气性材料进行细胞培养的方法及装置 |
| US7078228B2 (en) | 2003-12-31 | 2006-07-18 | Corning Incorporated | Cell cultivating flask |
| BRPI0405989A (pt) | 2004-12-22 | 2006-09-05 | Unilever Nv | artigo plastificado para tratamento da pele |
| JP4649224B2 (ja) | 2005-02-09 | 2011-03-09 | 株式会社カネカ | 付着性細胞の培養方法および培養装置 |
| US7745209B2 (en) | 2005-07-26 | 2010-06-29 | Corning Incorporated | Multilayered cell culture apparatus |
| WO2007020598A2 (en) | 2005-08-17 | 2007-02-22 | Koninklijke Philips Electronics N.V. | Method and apparatus featuring simple click style interactions according to a clinical task workflow |
| JP4878195B2 (ja) | 2006-03-30 | 2012-02-15 | 株式会社 ジャパン・ティッシュ・エンジニアリング | 培養組織の包装容器 |
| JP5659448B2 (ja) | 2006-08-23 | 2015-01-28 | 株式会社フコク | 培養容器及び同容器を用いた細胞培養方法 |
| US20080176318A1 (en) | 2006-12-07 | 2008-07-24 | Wilson John R | Highly efficient devices and methods for culturing cells |
| US7897379B2 (en) | 2007-02-26 | 2011-03-01 | Corning Incorporated | Device and method for reducing bubble formation in cell culture |
| US20090160975A1 (en) | 2007-12-19 | 2009-06-25 | Ncr Corporation | Methods and Apparatus for Improved Image Processing to Provide Retroactive Image Focusing and Improved Depth of Field in Retail Imaging Systems |
| AU2009268666B2 (en) | 2008-07-08 | 2014-11-13 | Wilson Wolf Manufacturing, LLC | Improved gas permeable cell culture device and method of use |
| JP6232875B2 (ja) | 2013-09-19 | 2017-11-22 | コベルコ建機株式会社 | ハイブリッド建設機械の動力制御装置 |
| US10183132B2 (en) | 2014-09-11 | 2019-01-22 | Ethicon Llc | Methods and devices for co-delivery of liquid and powdered hemostats and sealants |
| JP6434283B2 (ja) | 2014-11-18 | 2018-12-05 | 株式会社栗本鐵工所 | ラジオコントロール用送信機 |
-
2004
- 2004-10-08 CN CN201310052707.2A patent/CN103173354B/zh not_active Expired - Lifetime
- 2004-10-08 EP EP21192856.9A patent/EP3943591A1/en active Pending
- 2004-10-08 EP EP18197251.4A patent/EP3450538B1/en not_active Expired - Lifetime
- 2004-10-08 CN CN2004800326848A patent/CN101120083B/zh not_active Ceased
- 2004-10-08 EP EP04794599A patent/EP1687400A4/en not_active Withdrawn
- 2004-10-08 EP EP11158157.5A patent/EP2336293B1/en not_active Revoked
- 2004-10-08 CA CA2542116A patent/CA2542116C/en not_active Expired - Lifetime
- 2004-10-08 US US10/961,814 patent/US9255243B2/en not_active Expired - Lifetime
- 2004-10-08 WO PCT/US2004/033297 patent/WO2005035728A2/en active Application Filing
- 2004-10-08 JP JP2006534398A patent/JP2007511205A/ja active Pending
- 2004-10-08 AU AU2004280623A patent/AU2004280623B2/en not_active Expired
-
2006
- 2006-08-16 US US11/505,122 patent/US8415144B2/en active Active
-
2010
- 2010-04-02 US US12/753,573 patent/US8697443B2/en active Active
-
2011
- 2011-02-01 AU AU2011200410A patent/AU2011200410B2/en not_active Expired
- 2011-02-17 US US13/029,762 patent/US8168432B2/en not_active Expired - Lifetime
- 2011-05-09 JP JP2011104616A patent/JP2011147460A/ja active Pending
- 2011-07-29 US US13/194,363 patent/US8158427B2/en not_active Expired - Lifetime
- 2011-07-29 US US13/194,298 patent/US8158426B2/en not_active Expired - Lifetime
- 2011-12-02 JP JP2011265191A patent/JP2012040033A/ja active Pending
-
2014
- 2014-09-22 JP JP2014192922A patent/JP2014236753A/ja active Pending
-
2015
- 2015-07-27 US US14/810,071 patent/US9441192B2/en not_active Expired - Lifetime
- 2015-07-27 US US14/809,484 patent/US9410114B2/en not_active Ceased
-
2016
- 2016-05-17 JP JP2016099018A patent/JP2016174614A/ja active Pending
-
2018
- 2018-06-12 US US16/006,318 patent/USRE49293E1/en not_active Expired - Lifetime
-
2019
- 2019-10-07 AU AU2019240734A patent/AU2019240734B2/en not_active Expired
-
2022
- 2022-07-26 AU AU2022209247A patent/AU2022209247A1/en active Pending
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6434283A (en) * | 1987-07-29 | 1989-02-03 | Mitsui Petrochemical Ind | Method for cultivation and apparatus therefor |
| JPH05123182A (ja) * | 1991-10-30 | 1993-05-21 | Nakano Vinegar Co Ltd | 静置培養による微生物セルロースの製造法及びその装置 |
| JPH078267A (ja) * | 1993-06-25 | 1995-01-13 | Kajima Corp | 付着微細藻類の培養方法 |
| JPH1128083A (ja) * | 1997-07-11 | 1999-02-02 | Menicon Co Ltd | 細胞培養用容器 |
| JP2002528567A (ja) * | 1998-10-28 | 2002-09-03 | アシュビー・サイエンティフィック・リミテッド | 織り込まれた多孔性シリコーンラバー |
| WO2001092462A1 (en) * | 1999-05-28 | 2001-12-06 | Ashby Scientific Ltd. | Culture chamber |
| JP2002335946A (ja) * | 2001-05-21 | 2002-11-26 | Core Biotech Co Ltd | 細胞培養管及びこれを用いた大量細胞培養器 |
Cited By (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE49293E1 (en) | 2003-10-08 | 2022-11-15 | Wilson Wolf Manufacturing | Cell culture methods and devices utilizing gas permeable materials |
| JP2011147460A (ja) * | 2003-10-08 | 2011-08-04 | Wilson Wolf Manufacturing Corp | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2012040033A (ja) * | 2003-10-08 | 2012-03-01 | Wilson Wolf Manufacturing Corp | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2014236753A (ja) * | 2003-10-08 | 2014-12-18 | ウィルソン ウォルフ マニュファクチャリング コーポレイションWilson Wolf Manufacturing Corporation | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| JP2016174614A (ja) * | 2003-10-08 | 2016-10-06 | ウィルソン ウォルフ マニュファクチャリング コーポレイションWilson Wolf Manufacturing Corporation | 気体透過性物質を利用する細胞を培養する方法及び装置 |
| US9255243B2 (en) | 2003-10-08 | 2016-02-09 | Wilson Wolf Manufacturing Corporation | Cell culture methods and devices utilizing gas permeable materials |
| US9410114B2 (en) | 2003-10-08 | 2016-08-09 | Wilson Wolf Manufacturing | Cell culture methods and devices utilizing gas permeable materials |
| US9441192B2 (en) | 2003-10-08 | 2016-09-13 | Wilson Wolf Manufacturing | Cell culture methods and devices utilizing gas permeable materials |
| US8999703B2 (en) | 2008-05-05 | 2015-04-07 | Daniel P. Welch | Cell container |
| JP2011519557A (ja) * | 2008-05-05 | 2011-07-14 | ウィルソン ウォルフ マニュファクチャリング コーポレイション | 細胞容器 |
| JP2011521642A (ja) * | 2008-05-30 | 2011-07-28 | コーニング インコーポレイテッド | 細胞培養容器の組立体 |
| JP2016178946A (ja) * | 2010-10-12 | 2016-10-13 | ナルジェ・エヌユーエヌシー・インターナショナル・コーポレーション | 細胞培養デバイス |
| JP2014530618A (ja) * | 2011-10-21 | 2014-11-20 | セル・メディカ・リミテッド | 細胞の無菌増殖のための装置 |
| JP2017169594A (ja) * | 2011-12-12 | 2017-09-28 | セル・メディカ・リミテッド | T細胞増殖のためのプロセス |
| JP2020022505A (ja) * | 2011-12-12 | 2020-02-13 | セル・メディカ・リミテッド | T細胞増殖のためのプロセス |
| JP2015501653A (ja) * | 2011-12-12 | 2015-01-19 | セル・メディカ・リミテッド | T細胞増殖のためのプロセス |
| US11981923B2 (en) | 2012-02-09 | 2024-05-14 | Baylor College Of Medicine | Pepmixes to generate multiviral CTLS with broad specificity |
| JP2016530895A (ja) * | 2013-09-23 | 2016-10-06 | ウィルソン ウォルフ マニュファクチャリング コーポレイションWilson Wolf Manufacturing Corporation | 動物細胞を遺伝子改変する改良された方法 |
| JP2016077164A (ja) * | 2014-10-10 | 2016-05-16 | 大日本印刷株式会社 | 細胞培養容器 |
| WO2016152697A1 (ja) * | 2015-03-20 | 2016-09-29 | 積水化学工業株式会社 | 微生物の培養方法及び培養装置 |
| JPWO2016152697A1 (ja) * | 2015-03-20 | 2018-01-18 | 積水化学工業株式会社 | 微生物の培養方法及び培養装置 |
| JP7271175B2 (ja) | 2015-05-08 | 2023-05-11 | ウィルソン ウォルフ マニュファクチャリング | 試験のための改良された培養方法と装置 |
| JP2018518987A (ja) * | 2015-05-08 | 2018-07-19 | ウィルソン ウォルフ マニュファクチャリングWilson Wolf Manufacturing | 試験のための改良された培養方法と装置 |
| JP7175761B2 (ja) | 2015-05-21 | 2022-11-21 | オリビオテック リミティド | 細胞培養装置、システム及びその使用方法 |
| JP2021106591A (ja) * | 2015-05-21 | 2021-07-29 | オリビオテック リミティド | 細胞培養装置、システム及びその使用方法 |
| JP2018515144A (ja) * | 2015-05-21 | 2018-06-14 | オリビオテック リミティド | 細胞培養装置、システム及びその使用方法 |
| JP7280907B2 (ja) | 2015-05-21 | 2023-05-24 | オリビオテック リミティド | 細胞培養装置、システム及びその使用方法 |
| WO2018043576A1 (ja) * | 2016-08-31 | 2018-03-08 | 株式会社アステック | 細胞培養容器 |
| JP2018033387A (ja) * | 2016-08-31 | 2018-03-08 | 株式会社アステック | 細胞培養容器 |
| JP2018143210A (ja) * | 2017-03-08 | 2018-09-20 | 株式会社アステック | 細胞培養容器 |
| WO2018164232A1 (ja) * | 2017-03-08 | 2018-09-13 | 株式会社アステック | 細胞培養容器 |
| JP7371012B2 (ja) | 2018-05-15 | 2023-10-30 | ザ ユニバーシティ オブ ノース カロライナ アット チャペル ヒル | インビトロ細胞培養の為の自己持続型の低酸素状態並びにガス勾配及び非ガス化学勾配を生成するデバイス、システム、及び装置 |
| JP2022506841A (ja) * | 2018-11-08 | 2022-01-17 | ガンマデルタ セラピューティクス リミティッド | 細胞を単離及び拡大する方法 |
| JP2022506836A (ja) * | 2018-11-08 | 2022-01-17 | ガンマデルタ セラピューティクス リミティッド | 細胞を単離及び拡大する方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| AU2019240734B2 (en) | Cell culture methods and devices utilizing gas permeable materials | |
| US11377635B2 (en) | Highly efficient gas permeable devices and methods for culturing cells | |
| AU2012254908B2 (en) | Cell culture methods and devices utilizing gas permeable materials | |
| AU2017203120B2 (en) | Cell culture methods and devices utilizing gas permeable materials | |
| AU2013200127A2 (en) | Highly efficient gas permeable devices and methods for culturing cells |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070820 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20100520 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100525 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100825 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101109 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110208 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110216 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110309 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110316 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110509 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111227 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20120209 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20120323 |