JP2004511430A - 二重特異性免疫グロブリン様抗原結合蛋白および製造方法 - Google Patents
二重特異性免疫グロブリン様抗原結合蛋白および製造方法 Download PDFInfo
- Publication number
- JP2004511430A JP2004511430A JP2001587003A JP2001587003A JP2004511430A JP 2004511430 A JP2004511430 A JP 2004511430A JP 2001587003 A JP2001587003 A JP 2001587003A JP 2001587003 A JP2001587003 A JP 2001587003A JP 2004511430 A JP2004511430 A JP 2004511430A
- Authority
- JP
- Japan
- Prior art keywords
- antigen
- binding protein
- antigen binding
- protein according
- seq
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 102000025171 antigen binding proteins Human genes 0.000 title claims abstract description 159
- 108091000831 antigen binding proteins Proteins 0.000 title claims abstract description 159
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 17
- 230000027455 binding Effects 0.000 claims abstract description 210
- 239000000427 antigen Substances 0.000 claims abstract description 119
- 108091007433 antigens Proteins 0.000 claims abstract description 118
- 102000036639 antigens Human genes 0.000 claims abstract description 118
- 108060003951 Immunoglobulin Proteins 0.000 claims abstract description 14
- 102000018358 immunoglobulin Human genes 0.000 claims abstract description 14
- 230000000295 complement effect Effects 0.000 claims abstract description 11
- 230000003013 cytotoxicity Effects 0.000 claims abstract description 9
- 231100000135 cytotoxicity Toxicity 0.000 claims abstract description 9
- 230000001404 mediated effect Effects 0.000 claims abstract description 8
- 210000004027 cell Anatomy 0.000 claims description 83
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 50
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 43
- 238000000034 method Methods 0.000 claims description 42
- 229920001184 polypeptide Polymers 0.000 claims description 42
- 102000005962 receptors Human genes 0.000 claims description 35
- 108020003175 receptors Proteins 0.000 claims description 35
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 claims description 32
- 101100372762 Rattus norvegicus Flt1 gene Proteins 0.000 claims description 22
- 101100381481 Caenorhabditis elegans baz-2 gene Proteins 0.000 claims description 21
- 230000014509 gene expression Effects 0.000 claims description 16
- 239000013604 expression vector Substances 0.000 claims description 15
- 230000004913 activation Effects 0.000 claims description 14
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 14
- 108020004414 DNA Proteins 0.000 claims description 13
- 239000000126 substance Substances 0.000 claims description 12
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 11
- 102000004127 Cytokines Human genes 0.000 claims description 11
- 108090000695 Cytokines Proteins 0.000 claims description 11
- 108091008605 VEGF receptors Proteins 0.000 claims description 11
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 claims description 11
- 230000033115 angiogenesis Effects 0.000 claims description 11
- 230000001580 bacterial effect Effects 0.000 claims description 11
- 108010087819 Fc receptors Proteins 0.000 claims description 9
- 102000009109 Fc receptors Human genes 0.000 claims description 9
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 claims description 9
- 210000004962 mammalian cell Anatomy 0.000 claims description 9
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 8
- 210000000987 immune system Anatomy 0.000 claims description 8
- 101710160107 Outer membrane protein A Proteins 0.000 claims description 7
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 claims description 7
- 230000015572 biosynthetic process Effects 0.000 claims description 7
- 239000012636 effector Substances 0.000 claims description 7
- 239000002773 nucleotide Substances 0.000 claims description 7
- 125000003729 nucleotide group Chemical group 0.000 claims description 7
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 5
- 102000004388 Interleukin-4 Human genes 0.000 claims description 5
- 108090000978 Interleukin-4 Proteins 0.000 claims description 5
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 5
- 230000004614 tumor growth Effects 0.000 claims description 5
- -1 EGF-R Proteins 0.000 claims description 4
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 claims description 4
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 claims description 4
- 102000000588 Interleukin-2 Human genes 0.000 claims description 4
- 108010002350 Interleukin-2 Proteins 0.000 claims description 4
- 108091008606 PDGF receptors Proteins 0.000 claims description 4
- 108020004511 Recombinant DNA Proteins 0.000 claims description 4
- 210000002540 macrophage Anatomy 0.000 claims description 4
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 claims description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 claims description 3
- 101100481408 Danio rerio tie2 gene Proteins 0.000 claims description 3
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 claims description 3
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 claims description 3
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 claims description 3
- 101000917824 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-b Proteins 0.000 claims description 3
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 claims description 3
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 claims description 3
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 3
- 108010002616 Interleukin-5 Proteins 0.000 claims description 3
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 claims description 3
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 claims description 3
- 101100481410 Mus musculus Tek gene Proteins 0.000 claims description 3
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 3
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 3
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 claims description 3
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 claims description 3
- 230000000259 anti-tumor effect Effects 0.000 claims description 3
- 230000003472 neutralizing effect Effects 0.000 claims description 3
- 210000000440 neutrophil Anatomy 0.000 claims description 3
- 108091008598 receptor tyrosine kinases Proteins 0.000 claims description 3
- 102000027426 receptor tyrosine kinases Human genes 0.000 claims description 3
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 claims 6
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 claims 3
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 claims 3
- 102000003675 cytokine receptors Human genes 0.000 claims 2
- 108010057085 cytokine receptors Proteins 0.000 claims 2
- 210000000822 natural killer cell Anatomy 0.000 claims 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 claims 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 claims 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 claims 1
- 102100039897 Interleukin-5 Human genes 0.000 claims 1
- 210000005253 yeast cell Anatomy 0.000 claims 1
- 229940072221 immunoglobulins Drugs 0.000 abstract description 5
- 238000013461 design Methods 0.000 abstract description 4
- 230000001419 dependent effect Effects 0.000 abstract description 3
- 108090000623 proteins and genes Proteins 0.000 description 67
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 60
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 60
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 60
- 102000004169 proteins and genes Human genes 0.000 description 31
- 239000013598 vector Substances 0.000 description 29
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 23
- 241000699666 Mus <mouse, genus> Species 0.000 description 20
- 230000006870 function Effects 0.000 description 18
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 15
- 102100035194 Placenta growth factor Human genes 0.000 description 15
- 238000003752 polymerase chain reaction Methods 0.000 description 14
- 101001001487 Homo sapiens Phosphatidylinositol-glycan biosynthesis class F protein Proteins 0.000 description 12
- 206010028980 Neoplasm Diseases 0.000 description 12
- 150000001413 amino acids Chemical class 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 11
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 11
- 230000026731 phosphorylation Effects 0.000 description 11
- 238000006366 phosphorylation reaction Methods 0.000 description 11
- 239000002246 antineoplastic agent Substances 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 210000002889 endothelial cell Anatomy 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 241000699670 Mus sp. Species 0.000 description 8
- 108010076504 Protein Sorting Signals Proteins 0.000 description 8
- 125000000539 amino acid group Chemical group 0.000 description 8
- 238000003556 assay Methods 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 230000004927 fusion Effects 0.000 description 8
- 239000002609 medium Substances 0.000 description 8
- 239000002953 phosphate buffered saline Substances 0.000 description 8
- 241000588724 Escherichia coli Species 0.000 description 7
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 description 7
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 7
- 102000058223 human VEGFA Human genes 0.000 description 7
- 239000003446 ligand Substances 0.000 description 7
- 239000000203 mixture Substances 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 230000028327 secretion Effects 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 101710117290 Aldo-keto reductase family 1 member C4 Proteins 0.000 description 6
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 6
- 241000724791 Filamentous phage Species 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 6
- 201000011510 cancer Diseases 0.000 description 6
- 238000004132 cross linking Methods 0.000 description 6
- 108020001507 fusion proteins Proteins 0.000 description 6
- 102000037865 fusion proteins Human genes 0.000 description 6
- 210000004408 hybridoma Anatomy 0.000 description 6
- 229960000485 methotrexate Drugs 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 238000002823 phage display Methods 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 230000003389 potentiating effect Effects 0.000 description 6
- 238000012216 screening Methods 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- 238000006467 substitution reaction Methods 0.000 description 6
- 241000283973 Oryctolagus cuniculus Species 0.000 description 5
- 230000000903 blocking effect Effects 0.000 description 5
- 230000004186 co-expression Effects 0.000 description 5
- 238000012217 deletion Methods 0.000 description 5
- 230000037430 deletion Effects 0.000 description 5
- 231100000673 dose–response relationship Toxicity 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 238000003780 insertion Methods 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 230000005012 migration Effects 0.000 description 5
- 238000013508 migration Methods 0.000 description 5
- 238000004091 panning Methods 0.000 description 5
- 238000002360 preparation method Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- 108020004705 Codon Proteins 0.000 description 4
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 4
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 4
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 4
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 229940127089 cytotoxic agent Drugs 0.000 description 4
- 108020001096 dihydrofolate reductase Proteins 0.000 description 4
- 229940126864 fibroblast growth factor Drugs 0.000 description 4
- 239000000833 heterodimer Substances 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 229940028885 interleukin-4 Drugs 0.000 description 4
- 239000000651 prodrug Substances 0.000 description 4
- 229940002612 prodrug Drugs 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 102100034278 Annexin A6 Human genes 0.000 description 3
- 108090001008 Avidin Proteins 0.000 description 3
- 101710132601 Capsid protein Proteins 0.000 description 3
- 101710094648 Coat protein Proteins 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 102000001301 EGF receptor Human genes 0.000 description 3
- 108060006698 EGF receptor Proteins 0.000 description 3
- 238000002965 ELISA Methods 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 3
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 102100021181 Golgi phosphoprotein 3 Human genes 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 3
- 101710125418 Major capsid protein Proteins 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 101710141454 Nucleoprotein Proteins 0.000 description 3
- 108091000080 Phosphotransferase Proteins 0.000 description 3
- 101710083689 Probable capsid protein Proteins 0.000 description 3
- 108010090804 Streptavidin Proteins 0.000 description 3
- 101150006914 TRP1 gene Proteins 0.000 description 3
- 101710120037 Toxin CcdB Proteins 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 238000001042 affinity chromatography Methods 0.000 description 3
- 229960000723 ampicillin Drugs 0.000 description 3
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 230000013020 embryo development Effects 0.000 description 3
- 230000003053 immunization Effects 0.000 description 3
- 238000002649 immunization Methods 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 230000002401 inhibitory effect Effects 0.000 description 3
- 208000032839 leukemia Diseases 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- 102000020233 phosphotransferase Human genes 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 230000001225 therapeutic effect Effects 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 230000009261 transgenic effect Effects 0.000 description 3
- 230000014616 translation Effects 0.000 description 3
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 3
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 108090000656 Annexin A6 Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 208000005623 Carcinogenesis Diseases 0.000 description 2
- 101150074155 DHFR gene Proteins 0.000 description 2
- 238000001712 DNA sequencing Methods 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 238000012286 ELISA Assay Methods 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 102000000743 Interleukin-5 Human genes 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 241000609499 Palicourea Species 0.000 description 2
- 102000003992 Peroxidases Human genes 0.000 description 2
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 2
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 2
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 108010073443 Ribi adjuvant Proteins 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- 108020005038 Terminator Codon Proteins 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 101150117115 V gene Proteins 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 230000036952 cancer formation Effects 0.000 description 2
- 229940041514 candida albicans extract Drugs 0.000 description 2
- 231100000504 carcinogenesis Toxicity 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- 238000010382 chemical cross-linking Methods 0.000 description 2
- 239000013599 cloning vector Substances 0.000 description 2
- 230000009918 complex formation Effects 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 239000003978 infusion fluid Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 229940100602 interleukin-5 Drugs 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 210000001161 mammalian embryo Anatomy 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 235000013336 milk Nutrition 0.000 description 2
- 239000008267 milk Substances 0.000 description 2
- 210000004080 milk Anatomy 0.000 description 2
- 230000037230 mobility Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 108040007629 peroxidase activity proteins Proteins 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 238000003566 phosphorylation assay Methods 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000012743 protein tagging Effects 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 239000012137 tryptone Substances 0.000 description 2
- 230000008728 vascular permeability Effects 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 239000012138 yeast extract Substances 0.000 description 2
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- KLDBMPMWBVTYGW-AIDJSRAFSA-N 2-aminoacetic acid (2S)-2-amino-3-hydroxypropanoic acid Chemical compound NCC(O)=O.NCC(O)=O.NCC(O)=O.NCC(O)=O.OC[C@H](N)C(O)=O KLDBMPMWBVTYGW-AIDJSRAFSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 1
- FHIDNBAQOFJWCA-UAKXSSHOSA-N 5-fluorouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 FHIDNBAQOFJWCA-UAKXSSHOSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 108010032595 Antibody Binding Sites Proteins 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000304886 Bacilli Species 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108020004635 Complementary DNA Proteins 0.000 description 1
- 102100031673 Corneodesmosin Human genes 0.000 description 1
- 101710139375 Corneodesmosin Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241000699802 Cricetulus griseus Species 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UWTATZPHSA-N D-alanine Chemical compound C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 102400001368 Epidermal growth factor Human genes 0.000 description 1
- 241001524679 Escherichia virus M13 Species 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 101000690301 Homo sapiens Aldo-keto reductase family 1 member C4 Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101000840258 Homo sapiens Immunoglobulin J chain Proteins 0.000 description 1
- 101001116548 Homo sapiens Protein CBFA2T1 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 102100029571 Immunoglobulin J chain Human genes 0.000 description 1
- 102000010789 Interleukin-2 Receptors Human genes 0.000 description 1
- 108010038453 Interleukin-2 Receptors Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 101710204212 Neocarzinostatin Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 102000016979 Other receptors Human genes 0.000 description 1
- 238000012408 PCR amplification Methods 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 206010057249 Phagocytosis Diseases 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 102000004879 Racemases and epimerases Human genes 0.000 description 1
- 108090001066 Racemases and epimerases Proteins 0.000 description 1
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 1
- 108010039491 Ricin Proteins 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 102000002262 Thromboplastin Human genes 0.000 description 1
- 108010000499 Thromboplastin Proteins 0.000 description 1
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- OSGAYBCDTDRGGQ-UHFFFAOYSA-L calcium sulfate Chemical class [Ca+2].[O-]S([O-])(=O)=O OSGAYBCDTDRGGQ-UHFFFAOYSA-L 0.000 description 1
- 235000011132 calcium sulphate Nutrition 0.000 description 1
- 229930195731 calicheamicin Natural products 0.000 description 1
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 238000001378 electrochemiluminescence detection Methods 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000010595 endothelial cell migration Effects 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 102000045108 human EGFR Human genes 0.000 description 1
- 102000055590 human KDR Human genes 0.000 description 1
- 102000054751 human RUNX1T1 Human genes 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 229960000318 kanamycin Drugs 0.000 description 1
- 229930027917 kanamycin Natural products 0.000 description 1
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 1
- 229930182823 kanamycin A Natural products 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 239000008204 material by function Substances 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- 230000008172 membrane trafficking Effects 0.000 description 1
- 238000010232 migration assay Methods 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 108091005573 modified proteins Proteins 0.000 description 1
- 102000035118 modified proteins Human genes 0.000 description 1
- 230000009149 molecular binding Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 229960000210 nalidixic acid Drugs 0.000 description 1
- MHWLWQUZZRMNGJ-UHFFFAOYSA-N nalidixic acid Chemical compound C1=C(C)N=C2N(CC)C=C(C(O)=O)C(=O)C2=C1 MHWLWQUZZRMNGJ-UHFFFAOYSA-N 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000014207 opsonization Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 108700010839 phage proteins Proteins 0.000 description 1
- 230000008782 phagocytosis Effects 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 235000011151 potassium sulphates Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 239000008299 semisolid dosage form Substances 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 235000020183 skimmed milk Nutrition 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000010474 transient expression Effects 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 108010002164 tyrosine receptor Proteins 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 230000006459 vascular development Effects 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 230000032665 vasculature development Effects 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Description
発明の分野
本発明は免疫グロブリン(Ig)型抗原結合蛋白の製造を目的とするものである。より詳細には、本発明は、天然免疫グロブリンの特性を示すことのできる二重特異性抗原結合蛋白を提供する。天然IgG免疫グロブリンは単一特異性且つ二価であり、同じ抗原エピトープに特異的な2個の結合ドメインを持っている。これとは対照的に、本発明に係るIgG型抗原結合蛋白は二重特異性且つ二価である。本発明に係る蛋白は、2つの軽鎖の各々と2つの重鎖の各々に、4個の抗原結合部位を持つ。軽鎖上にある抗原結合部位が重鎖上にある抗原結合部位と異なっている時、この蛋白は二重特異性且つ二価である。この抗原結合部位が同じである時、このIgG型蛋白は単一特異性且つ四価である。本発明に係る抗原結合蛋白の設計は、望ましくない可変ドメインの対合を回避するやり方で、係る分子の効率的な製造を提供する。
【0002】
発明の背景
抗体の特異性とは、抗原の特定のエピトープに対する抗体の選択的認識を意味する。例えば天然抗体は単一特異性である。二重特異性抗体(BsAb)とは、2個の異なる抗原結合特異性または部位を持つ抗体である。抗原結合蛋白が1以上の特異性を持つ場合、認識されるエピトープは、単一の抗原と、または1以上の抗原と結合できる。
【0003】
抗体価とは、抗原結合蛋白が特定のエピトープに対して持つ結合部位の数を意味する。例えば、天然IgG抗体は単一特異性且つ二価である。抗原結合蛋白が1以上のエピトープに対して特異性を持つ場合、抗体価は各々のエピトープについて算出する。例えば、4個の結合部位を持ち単一のエピトープを認識する抗原結合蛋白は四価である。4個の結合部位と2個の異なるエピトープに対する特異性を持つ抗原結合蛋白は、二価であると考えられる。
【0004】
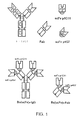
天然の抗体分子は、2つの同一の重鎖と二つの同一の軽鎖で構成されている。各々の軽鎖は鎖間ジスルフィド結合によって重鎖と共有結合している。2つの重鎖はさらに複数のジスルフィド結合によって相互に連結している。図1は、典型的なIgG抗体の構造を示している。個々の鎖は折り畳まれて、類似の大きさ(110−125アミノ酸)および構造を持ち異なる機能を有するドメインとなっている。軽鎖は1つの可変ドメイン(VL)と1つの定常ドメイン(CL)を含んでいる。重鎖は1つの可変ドメイン(VH)と、抗体のクラスまたはイソタイプに応じて3または4個の定常ドメイン(CH1、CH2、CH3およびCH4)を含んでいる。マウスおよびヒトでは、イソタイプはIgA、IgD、IgE、IgGおよびIgMであり、IgAとIgGはさらにサブクラスまたはサブタイプに細分される。VLおよびVHドメインから成る抗体部分は「Fv」と呼ばれ、抗原結合部位を構成する。一本鎖Fv(scFv)は、1個のポリペプチド鎖上にVLドメインとVHドメインを含む改変された蛋白であり、ここで、一方のドメインのN末端と他方のドメインのC末端は可撓性のリンカーによって結合している。「Fab」とは、VL、VH、CLおよびCH1ドメインで構成される抗体の部分を指す。
【0005】
可変ドメインは、抗体間で、特に抗原結合部位の位置でかなりのアミノ酸配列変化性を示す。各々のVLおよびVHには、「超可変」または「相補性決定領域」(CDR)と呼ばれる3個の領域が見出される。
【0006】
「Fc」は、対合した重鎖定常ドメインを含む抗体部分の呼称である。例えばIgG抗体では、FcはCH2およびCH3ドメインを含む。IgAまたはIgM抗体のFcはさらにCH4ドメインを含む。Fcは、Fcレセプター結合、補体仲介細胞傷害の活性化、および抗体依存性細胞性細胞傷害に関係している。複数のIgG様蛋白の複合体であるIgAおよびIgMのような天然抗体については、複合体の形成はFc定常ドメインを必要とする。
【0007】
最後に、「ヒンジ」領域が、2個の重鎖の共有結合のための抗体のFabおよびFc部分を分離し複数のジスルフィド結合を含むと共に、Fab相互の、そしてFcに対するFabの可動性を与えている。
【0008】
多特異性抗原結合蛋白は、癌の画像化および治療薬といった幾つかの小規模臨床試験に使用されてきたが、広範な臨床評価は、効率的な製造法の欠如によって阻まれている。これまでこのような蛋白の設計は、主として多特異性を提供することに関心が持たれていた。天然抗体分子の持つその他の有用な機能を与えることに注意が払われた例は殆ど無かった。
【0009】
近年、二重特異性および/または多価抗体フラグメントの製造のために、多岐にわたる化学的および組換え方法が開発されている。総説としては、Holliger,P. and Winter,G., Curr.Opin.Biotechnol. 4, 446−449(1993);Carter,P. et al., J.Hematotherapy 4, 463−470(1995);Pluckthun,A. and Pack,P., Immunotechnology 3, 83−105(1997)を参照されたい。二重特異性および/または二価性は、可撓性リンカー、ロイシンジッパーモチーフ、CHCL−ヘテロ二量体化による2個のscFv分子の融合、ならびに二価単一特異性diabodyおよび関連構造を形成するためのscFv分子の結合によって達成されてきた。多価性は、例えばp53、ストレプトアビジン、およびヘリックス・ターン・ヘリックスモチーフを使用することにより、scFvまたはFabフラグメントのカルボキシまたはアミノ末端に多量体化配列を付加することによって達成されてきた。例えば、(scFv1)−ヒンジ−ヘリックス−ターン−ヘリックス−(scFv2)という形のscFv融合蛋白のヘリックス・ターン・ヘリックスモチーフを介する二量体化により、2個の標的抗原の各々に対して2個のscFv結合部位を有する四価二重特異性ミニ抗体が生成する。
【0010】
多少なりとも完全なIgG定常ドメイン構造を持つという点でIgG抗体に似ている、IgG型二重特異性抗体の製造は、2個の異なるIgG分子の化学的架橋、または同じ細胞からの二種類の抗体の同時発現によって達成された。化学的架橋は効率が悪く、抗体活性の損失を招き得る。構成成分である重鎖および軽鎖の誤対合のため、いずれの方法も、かなりの量の望ましくない且つ非機能的な物質の生成を招く。誤対合を減少または排除するために用いる方法は、別の望ましくない効果を有する。
【0011】
望ましくない異種生成物の産生は、これまで用いられてきた方法の多くにとって著明な欠点となっている。例えば、二重特異性抗体(BsAb)の製造の際、様々なドメインの適切な結合を保証する方法が無いと、実際にはその生成物の一部だけが二重特異性であるに過ぎない。トランスフェクトされた細胞で同時発現されるIgG重鎖および軽鎖の、異なる二つの組の間に不要な対合が起こることを克服するために開発された1つの戦略は、同じ抗体重鎖間のホモ二量体化を減らすための、2個の重鎖のCH3ドメインの修飾である。Merchant,A.M., et al., (1998) Nat.Biotechnology 16, 677−681。その方法では、二重特異性抗体の各結合部位に同一の軽鎖の使用を要求することにより、軽鎖の誤対合が排除された。
【0012】
二重特異性分子の取得を目的とした殆どの仕事において、抗原特異性以外の機能的または構造的側面の維持には殆ど注意が払われてこなかった。例えば、Fc領域重鎖定常ドメインの存在および機能を必要とする、補体仲介細胞傷害(CMC)および抗体依存性細胞仲介細胞傷害(ADCC)は、殆どの二重特異性抗体において、いずれも失われている。ColomaおよびMorrisonは、scFvを完全な重鎖のC末端に融合させることにより、Fcドメインを有する二価BsAb分子の均質集団を作製した。この融合物と抗体軽鎖の同時発現は、一端で第一の抗原と、そして他端で第二の抗原と結合する、二価二重特異性分子の均質集団の生成を導いた(Coloma,M.J. and Morrison,S.L.(1997) Nat.Biotechnology 15, 159−163)。しかしながらこの分子は補体を活性化する能力が低下しており、CMCを奏効させることができなかった。さらに、このCH3ドメインは低い親和性で高親和性Fcレセプター(FcγR1)に結合した。
【0013】
本発明は、(1) 二重特異性且つ二価であり得、(2) 抗原結合部位の選択に関する束縛が排除されており、(3) Fc定常ドメインおよびこれに付随する機能を有し、(4) 実質上均質であり、そして(5) さらなる加工を行わずに哺乳動物またはその他の細胞で製造できる、抗原結合蛋白を提供することにより、これらの不都合を克服する。
【0014】
発明の要約
本発明は、免疫グロブリン様複合体中で安定に結合している2個の第一ポリペプチドと2個の第二ポリペプチドの複合体を含む、抗原結合蛋白を目的とするものである。第一ポリペプチドは、免疫グロブリン重鎖第一定常ドメイン(CH1ドメイン)と安定に結合できる、免疫グロブリン軽鎖定常ドメイン(CLドメイン)のN末端に位置する抗原結合部位を含む。第二ポリペプチドは、CH1ドメインのN末端に位置する抗原結合部位とこれに続く1またはそれ以上の重鎖Fc領域定常ドメイン(CHドメイン)を含む。このFc CHドメインは安定な自己結合ができ、即ち、各CHドメインは自己の別のコピーと対合または結合することができる。したがって、本発明に係る抗原結合蛋白は一般に4個のポリペプチドおよび4個の抗原結合部位で構成される。抗原結合部位は抗原に結合できる任意のアミノ酸配列によっても提供され得るが、好ましい態様では、抗原結合部位は一本鎖Fvにより提供される。第一および第二ポリペプチドの結合部位が異なっている場合、この抗原結合蛋白は二重特異性である。それらが同じである場合、この抗原結合蛋白は単一特異性である。必ずという訳ではないが通常、これらのポリペプチドはジスルフィド橋によって共有結合している。好ましい態様では、本発明に係る抗原結合蛋白は二重特異性且つ二価である。即ち、これらは同じ抗原または異なる抗原上にあってよい二つの異なるエピトープに結合する。
【0015】
ポリペプチド鎖の結合に備えることに加え、Fc定常ドメインは他の免疫グロブリン機能にも貢献する。その機能には、補体仲介細胞傷害の活性化、抗体依存性細胞仲介細胞傷害の活性化、およびFcレセプター結合が包含される。本発明に係る抗原結合蛋白を治療または診断目的で投与する場合、Fc定常ドメインはまた血清半減期にも寄与する。Fc定常ドメインはいかなる哺乳動物または鳥類の種に由来するものであってもよい。本発明に係る抗原結合蛋白を人間の治療に使用する場合、ヒト起源の定常ドメインが好ましいが、可変ドメインはヒト以外の起源であってもよい。ヒト可変ドメインが好ましい場合、キメラscFvを使用できる。
【0016】
抗原結合部位はいかなる抗原に特異的なものであってもよく、任意の手段で取得できる。例えば、scFvはモノクローナル抗体から、または、VLおよびVHドメインの無作為組み合わせライブラリーから取得できる。
【0017】
好ましい態様では、scFvはヒトキナーゼ挿入ドメイン含有レセプター(KDR)に特異的に結合する。特に好ましいのは、KDRの細胞外ドメインに結合し、そのリガンドである血管内皮増殖因子(VEGF)による結合を遮断し、そして/またはVEGFが誘発するKDRの活性化を中和する、抗原結合蛋白である。別の好ましい態様では、scFvはFlt−1に特異的に結合する。Flt−1の細胞外ドメインに結合し、そのリガンドVEGFおよび胎盤成長因子(PIGF)の一方または両方による結合を遮断し、そして/またはVEGFが誘発するまたはPIGFが誘発するFlt−1の活性化を中和する、抗原結合蛋白もまた特に好ましい。
【0018】
二官能性抗原結合蛋白による二元的レセプター遮断は、VEGFにより刺激される血管新生の阻害において、より有効となり得る。好ましい態様では、組換え二重特異性二価抗原結合蛋白は、Flt−1およびKDRの両者を、VEGFおよび胎盤成長因子(PIGF)を包含するそれらのリガンドとの結合から遮断することができる。したがって、好ましい二重特異性二価抗原結合蛋白は、KDR/VEGF、Flt−1/VEGFおよび/またはFlt−1/PIGF相互作用を妨害する。このような抗原結合蛋白は、VEGFにより刺激されるヒト内皮細胞の分裂誘発の、そしてVEGFおよびPIGFにより誘発されるヒト白血病細胞の遊走の、親抗体よりも強力なインヒビターとなり得る。
【0019】
KDRおよび/またはFlt−1のリガンド結合を遮断し、またはその活性化を中和する本発明に係る抗原結合蛋白は、内皮細胞増殖、血管新生および腫瘍成長を低下させ、そしてVEGFおよびPIGFにより誘発されるヒト白血病細胞の遊走を阻害するのに有用である。
【0020】
本発明はさらに、本発明に係る第一および第二ポリペプチドをコードしている1またはそれ以上の組換えDNA組み立て物を、発現と複合体形成をさせるに充分な時間と方法で、哺乳動物細胞中で同時発現させ、その抗原結合蛋白を回収する、抗原結合蛋白を製造する方法を包含する。
【0021】
本発明の或る態様では、scFvドメイン(VLおよびVH)をコードしている遺伝子を、scFv発現およびスクリーニングを提供する細菌ベクター中でクローニングし組み立てる。所望のscFvをコードしているヌクレオチド配列を、哺乳動物細胞中で有効な発現を提供するよう設計したクローニングベクターの所望の重鎖または軽鎖定常ドメインをコードしている配列に、フレーム内で連結する。即ち、scFvと軽鎖定常ドメインをコードしている第一組み立て物と、scFvと重鎖定常ドメインをコードしている第二組み立て物とが同じまたは別個の発現ベクターにある、二つの組み立て物を、宿主細胞中にトランスフェクトし、同時発現させる。
【0022】
二価且つ二重特異性である本発明に係る抗原結合蛋白は、望ましい特徴の組み合わせを持っている。第一に、これらは均質である。設計により、抗体重鎖および軽鎖の誤対合は大幅に減少または排除される。例えば、典型的な二重特異性抗体は、二つの特異性を提供するために2個の異なる重鎖の使用を必要とする。重鎖がIgG型分子に配置される場合は4個の組み合わせが可能である。これらのうち2個は誤対合した重鎖で構成され、その結果この生成物は単一特異性である。逆に本発明に係る蛋白では、全ての重鎖が等価であり、誤対合は起こらない。各々の重鎖が第一の完全な結合部位を含み、各々の軽鎖が第二の異なる結合部位を含むため、二重特異性を提供するためにはただ一つの型の重鎖とただ一つの型の軽鎖を必要とするに過ぎない。
【0023】
本発明に係る二重特異性蛋白の第二の利点は、四量体型においてこれらが各結合特異性に関して二価であるという事である。二量体のBsAbを欠く天然抗体の特徴は、この天然抗体が、それが有する抗体結合部位に関して二価であるという事である。二量体のBsAbは、それが有する2個の結合部位のそれぞれに関して一価である。二価性は、結合の協同性と、1個の抗原結合部位を含む分子をはるかに凌駕するアビディティの増大を実現するため、この事は抗体機能にとって重要である。
【0024】
本発明に係る蛋白の第三の利点は、天然抗体のFc領域を構成し(例えば、IgG分子についてはCH2およびCH3)他の抗体機能を提供する重鎖定常ドメインが存在し得る事である。さらに、CLおよびCH1ドメインと共に複数の結合ドメインがFc領域と隔たっており、その結果、Fc領域により提供される機能が損なわれない。保持される機能はFcが或る種の補助分子に結合する能力に関連し(例えば、細胞表面および可溶性Fcレセプターへの結合、IgAおよびIgMについてはJ鎖の結合、IgAについてはS蛋白)、そして、補体経路の活性化(補体仲介細胞傷害、CMC)、幾つかの異なる白血球集団により標的細胞に結合した抗体の認識(抗体依存性細胞仲介細胞傷害、ADCC)およびオプソニン化(貪食作用の増強)を包含する。加えて、重鎖のカルボキシ末端への大ドメインの付加を回避することにより、立体障害が回避される。これは、上述の機能の多くにとって重要であり、より高次構造の抗体分子の組み立てにとっても重要である(例えば、IgAは2個のFcを介して結合した4個の重鎖で構成され;IgMは5個のFcにより結合した10個の重鎖で構成されている)。最後に、Fc重鎖定常ドメインは血清半減期の増大を付与する。
【0025】
本発明に係る蛋白の第四の利点は、完全な生成物の取得にインビトロでの加工を必要としないことである。人工的な方法で再編成されてはいるものの、各々のドメインは生態系での発現を可能にする本来の性質を持っている。
【0026】
本発明はまた、単一特異性四価抗原結合蛋白の産生にも適用できる。このような蛋白では、4個の結合部位は全て同じ特異性を持っている。さらに、本発明は一価二重特異性抗原結合蛋白および二価単一特異性抗原結合蛋白の製造方法を提供する。例えば、Fab型蛋白を製造できるが、これは、2個の異なる結合部位または2個の等価な結合部位を含み、第一結合部位はCLドメインに連結し、第二結合部位はCH1ドメインに連結している。
【0027】
好ましい態様では、第一および第二結合部位はそれぞれ一本鎖Fv(scFv)によって与えられる。第一の結合特異性を持つscFvはCLドメインと融合してscFv−CLポリペプチドを形成し、第二の結合特異性を持つscFvはCHと融合してscFv−CHポリペプチドを形成する。本明細書で言及するように、2またはそれ以上のCHドメインがあり、そのドメインのうち1個がCH1である限り、scFv−CHポリペプチドは、抗体重鎖の任意の部分と融合したscFvとして定義される。scFv−CL−scFv−CHヘテロ二量体はCLおよびCH1定常ドメインの天然の結合により形成される。少なくとも1個のCH2、CH3、またはCH4定常ドメインの存在は、一方のポリペプチド上のCH2、CH3、またはCH4ドメインと、別のポリペプチド上にあるそれ自身のコピーとの天然の結合によって、4個の結合部位を持つ抗原結合蛋白に2個のscFv−CL−scFv−CHヘテロ二量体を対合させる事を可能にする。
【0028】
正確な重鎖定常ドメイン構造は所望の機能的特性によって決定する。抗原結合蛋白が特定のイソタイプを持つことを望むのであれば、そのイソタイプの免疫グロブリン由来のCHドメインが選択されるであろう。例えば、所望のイソタイプがIgG1である場合、そのドメイン構造は(scFv)2−CH1−CH2−CH3であり、定常ドメインはIgG1抗体由来のものである。
【0029】
このアプローチを使用して、4個の抗原結合部位を持つIgG様抗原結合蛋白の均質集団を得る。各々のヘテロ二量体が2個の異なる結合部位を含む場合、そのようにして形成される抗原結合蛋白は二重特異性且つ二価である。ヘテロ二量体が2個の等価な結合部位を含む場合、形成される抗原結合蛋白は単一特異性且つ四価である。ここに詳細を述べる態様では、抗原結合部位は抗体可変ドメインに含まれている。しかしながら、本発明はさらに、1またはそれ以上の結合機能が、目的とする特定の蛋白または抗原との既知の結合相互作用に基づいて選ばれた構造によって与えられる、二重特異性分子をも意図している。例えば、HIV−1のgp120の一部を、CD4に結合する能力に基づいて選択することができる。これに代わり、或る結合部位は、同種のレセプター蛋白に結合する能力に基づき選択したホルモンまたはサイトカインに対応するアミノ酸配列を含むかも知れない。
【0030】
本発明に係る或る抗原結合蛋白は、抗原に結合させるため、または蛋白とそのリガンドの相互作用を遮断するために使用する。本発明に係る別の抗原結合蛋白は、免疫細胞と標的細胞の間の相互作用を促進するために使用する。最後に、本発明に係る抗原結合蛋白は、抗腫瘍物質、標的部分、リポーター分子、または目的抗原に対する検出可能シグナル産生物質を局在化させるために使用する。
【0031】
本発明はさらに、KDRおよびその類似体に結合する、または血管新生もしくは腫瘍形成に関与するその他のレセプター分子に結合する抗原結合蛋白を提供する。
【0032】
発明の詳細な説明
本発明は、均質であり、そして、結合の協同性(アビディティ)といった天然抗体の機能的特性、ならびに補体仲介細胞傷害および抗体依存性細胞毒性を活性化する能力を保持できる、抗原結合蛋白を提供するものである。一般に、本発明に係る抗原結合蛋白は、各々の抗体可変ドメインの代わりに完全な抗原結合部位を有する、天然に存在する抗体の定常ドメイン構造を持つ。即ち、天然に存在する抗体においては、軽鎖可変ドメイン(VL)と重鎖可変ドメイン(VH)の組み合わせにより単一の結合部位が提供され、その結果、例えばIgG型抗体の4個の可変ドメインは2個の完全な結合部位を提供する。対照的に、本発明に係るIgG型抗原結合蛋白は4個の完全な結合部位を持つが、それは、完全な抗原結合部位を含む構造が天然に存在する抗体の各々のVLおよびVH可変ドメインに取って代わるためである。
【0033】
別途記載の無い限り、または文脈から明白でない限り、本明細書中使用する抗体ドメイン、領域およびフラグメントは、当分野で周知の容認された標準的定義である。例えば、Abbas,A.K., et al.,(1991) Cellular and Molecular Immunology, W.B.Saunders Company, Philadelphia, PAを参照されたい。
【0034】
典型的なFvの抗原結合部位は、抗原に対する結合部位の親和性に様々な度合いで寄与する6個の相補性決定領域(CDR)を含んでいる。より少ないCDR(例えば3、4または5個)を含む抗原結合部位もまた機能的であり、本発明の範囲内に包含される。CDRおよびフレームワーク領域(FR)の範囲は、集められたアミノ酸配列のデータベースとの比較によって決定し、ここではそれらの領域が配列間の変異性に従って定義されている。3個の重鎖可変ドメインCDR(CDRH1、CDRH2およびCDRH3)および3個の軽鎖可変ドメインCDR(CDRL1、CDRL2およびCDRL3)がある。
【0035】
アビディティは免疫グロブリンとその抗原の間の結合の強さの尺度である。各結合部位における結合の強さを評価する親和性とは異なり、アビディティは免疫グロブリン分子の親和性と価数の両者に関係する。
【0036】
本発明に係る蛋白は、1またはそれ以上の免疫グロブリンクラスの抗体の一部から誘導され、またはそれを取り込んでいる。免疫グロブリンのクラスはIgG、IgM、IgA、IgDおよびIgEイソタイプを包含し、IgGおよびIgAの場合それらのサブタイプを包含する。
【0037】
本発明に係る抗原結合蛋白は、2個の軽鎖と2個の重鎖を含むヘテロ四量体であるという点でIgGタイプの抗体に似ている。しかしながらIgGタイプの抗体とは異なり、これらは4個の抗原結合部位を持ち、少なくともCH1およびもう1個別のCHドメインが存在する場合には、より少ない定常ドメインを持っているかも知れない。4個の抗原結合部位はそれぞれ2個の結合特異性のための2個の結合部位、または1個の結合特異性のための4個の結合部位を含み得る。
【0038】
好ましい態様では、この形を持つ二重特異性蛋白は、天然に存在するIgG型抗体のようなアビディティ特性を示すことができる。天然に存在するIgG分子の場合そうであるように、各々の結合特異性について、2個の等価な抗原結合部位の存在が抗原との結合の協同性を実現する。当業者にとっては周知であるが、重鎖定常領域の適切な選択によって、他のクラスの抗体、例えばIgA、IgM、およびその他の型の抗体に似た二重特異性抗体を作製できる事は明白である。
【0039】
本発明は、重鎖が軽鎖と対合する時に1個のヘテロ二量体分子内で異なる結合特異性が結び付けられるよう、異なる特異性の結合ドメインを重鎖および軽鎖定常ドメインと連結することを意図している。このような分子の集団は、実際において全二量体が第一の特異性を持つ1個の結合ドメインと、第二の特異性を持つ1個の結合ドメインを含むという点で、実質上均質である。CLおよびCH1ドメインの結合を介する重鎖と軽鎖の優先的な自然の対合に依存することにより、同じ特異性を持つ2個の結合ドメインを含む二量体の形成が低下しまたは排除される。同様に、重鎖の優先的結合がFc領域を介して起こり、本発明に係る抗原結合蛋白を形成する。
【0040】
一般に、本発明に係る抗原結合蛋白は完全なCLおよびCH1ドメインを含んでおり、これらは鎖間ジスルフィド結合により共有結合している。しかしながら本発明はまた、アミノ酸が除去または挿入されており、そして該ドメインが安定な複合体として結合できる限り、共に鎖間ジスルフィド結合を持っているかも知れないし持っていないかも知れない修飾CLおよびCH1ドメインの使用をも意図している。
【0041】
安定な結合、または複合体とは、生理的条件下で抗原結合蛋白のポリペプチドが複合体として存在することを意味する。例えば、非還元条件下の天然ゲル上で、該ポリペプチドは複合体として移動する。全ての抗体軽鎖が与えられた任意の重鎖と有効に結合する訳ではなく、逆もまた同様であるという事が理解できるであろう。しかしながら、有効に対合するCLおよびCH1定常ドメインの組み合わせは当分野で周知であり、それが好ましい。
【0042】
天然抗体がそうであるように、重鎖−軽鎖ヘテロ二量体は特定の重鎖定常ドメインの結合を介して結合し、より高次の構造を形成する。例えば、IgG型抗体は、四量体構造において、共有結合により結びついた2個の重鎖−軽鎖ヘテロ二量体を含んでいる。別の或る抗体型は類似の四量体構造を含んでいるが、この四量体構造は例えば2個の四量体(IgA)または10個の四量体(IgM)を含む、より高次の構造に組み込まれる。
【0043】
天然抗体と同様に、本発明に係る二価二重特異性抗原結合蛋白は、重鎖の適切な結合をFc定常ドメインとヒンジ領域に頼っている。一般に本発明に係る抗原結合蛋白は、ヒンジ領域と1またはそれ以上のFc定常ドメインまたはその一部を含んでいる。付随する全ての機能を保持するためには、通常、全てのFc定常ドメインを取り込んでいるのが望ましい。しかし、本発明はさらに、少なくともそのような1個のドメインが存在するならば、或る定常ドメインのみを含んでいることをも意図している。様々なFc機能がFcの異なる部分に依存しているので、全ての機能を所望する訳でないのならば、より少ないCHドメインを重鎖に取り込むだけでよい。例えば、補体の著しい活性化はIgGのCH2またはIgMのCH3を必要とする。本発明はさらに、重鎖が安定な複合体として結びつくことができる限り、アミノ酸が置換、除去、挿入または修飾された、修飾ヒンジおよびFc重鎖ドメインの使用をも意図している。
【0044】
好ましい抗原結合蛋白の抗原結合部位は、任意の所望特異性を持つFv領域で構成される。このFvは一本鎖Fv(scFv)であり、ドメインを結合させて機能的抗原結合部位を形成させるペプチドリンカーによって連結したVHドメインとVLドメイン(いずれの順序でもよい)で構成されている(例えば、米国特許第4946778号、Ladner et al.,(Genex);WO88/09344, Creative Biomolecules,Inc., Uhston et al.を参照されたい)。WO92/01047, Cambridge Antibody Technology/McCafferty et al.,は、可溶性組換え遺伝子ディスプレーパッケージの表面のscFvフラグメントのディスプレーを記載している。
【0045】
scFvの製造に用いるペプチドリンカーは、VLおよびVHドメインの適切な三次元折り畳みと結合、ならびに標的分子結合特異性の維持を保証するよう選択された可撓性ペプチドである。一般に、VLまたはVH配列のカルボキシ末端は、このようなペプチドリンカーによって、相補的VHまたはVL配列のアミノ末端に共有結合する。リンカーは一般に10ないし50アミノ酸残基であるが、抗原結合部位を形成させるに充分な可撓性を持つ任意の長さが考えられる。好ましくはリンカーは10ないし30アミノ酸残基である。より好ましくはリンカーは12ないし30アミノ酸残基である。最も好ましくはリンカーは15ないし25アミノ酸残基である。このようなリンカーペプチドの例は(Gly−Gly−Gly−Gly−Ser)3を包含する。
【0046】
本発明における使用のため、任意の起源のVLおよびVHドメインをscFv中に取り込むことができる。例えば、VLおよびVHドメインは所望の結合特性を持つモノクローナル抗体から直接取得できる。別法として、VLおよびVHドメインは、選択した哺乳動物由来のV遺伝子配列のライブラリーからのものであってもよい。このようなライブラリーの要素はVLおよびVHドメインの無作為の組み合わせを発現し、所望の結合特性を持つ要素を同定するため、任意の所望抗原を用いてスクリーニングする。特に好ましいのはヒトV遺伝子ライブラリーである。このようなスクリーニングのための方法は当分野で既知である。選択した非ヒト起源のVLおよびVHドメインは、例えばCDRループをヒトVLおよびVHドメインに置換することにより「ヒト化」し、または、当分野で既知のその他の手段によって修飾して、人間に投与した時の免疫原性を低下させることができる。
【0047】
生理的免疫反応において、発現される抗体遺伝子の突然変異および選択は、標的抗原について高い親和性を有する抗体の産生につながる。scFvで発現されるVLおよびVHドメインを同様にインビトロ突然変異およびスクリーニング法に付して、高親和性変異体を取得することができる。
【0048】
細菌分泌シグナル配列および簡便な制限クローニング部位を含む、scFvの組み立てと発現のためのベクターが入手できる。特定の抗原に特異的な結合部位をコードしているVLおよびVH遺伝子の組み合わせをB細胞ハイブリドーマのcDNAから単離する。別法として、VLおよびVH遺伝子の無作為組み合わせをゲノムDNAから取得し、次いでその生成物を目的抗原との結合についてスクリーニングする。典型的には、クローニングのために、クローニングベクター中の制限部位と両立し得るプライマーを用いて、ポリメラーゼ連鎖反応(PCR)を使用する。例えば、Dreher,M.L. et al.(1991) J.Immunol.Methods 139:197−205;Ward,E.S.(1993) Adv.Pharmacol. 24:1−20;Chowdhury,P.S. and Pastan,I.(1999) Nat.Biotechnol. 17:568−572を参照されたい。
【0049】
VLおよびVHドメインの、選択したまたは無作為の組み合わせを持つscFvを発現させるために、これらのドメインをコードしているV遺伝子を細菌の発現ベクター中に組み込む。例えば、細菌分泌シグナル配列およびペプチドリンカーをコードしている配列を持ち、そしてVLおよびVH遺伝子の挿入のために都合のよい制限部位を有するベクターを使用することができる。別法として、最初に、例えば部分重複プライマーを用いるPCR増幅により、必要な全コード化配列(例えば、分泌シグナル、VL、VHおよびリンカーペプチド)を単一の配列中に組み込み、その後プラスミドまたはその他のベクター中にライゲーションすることが望ましいかも知れない。VLおよびVHドメインの特別な組み合わせの取得を望む場合には、それらのドメインをコードしている配列に特異的なPCRプライマーを使用する。多数のVLおよびVHドメインの多様な組み合わせの作製を望む場合には、複数の配列を増幅するプライマーの混合物を使用する。
【0050】
好ましい細菌ベクターは線維状ファージのコート蛋白に結合するscFvの発現をさせることができる。最も普通に用いられるファージのコート蛋白はファージM13の遺伝子III蛋白である。線維状ファージ上のscFvのディスプレーは、scFvの大集団を所望の結合特性についてスクリーニングすることを望む場合には特に有用である。scFv−gIII蛋白融合物を発現する細菌細胞をM13変異体に感染させるが、この変異体は、scFv−gIII融合物遺伝子を持つベクターDNAをファージ粒子の中に優先的にパッケージングさせることができ、その中にscFv−gIIIコート蛋白融合物が組み込まれる。得られるファージ粒子の各々は特定のscFvをディスプレーし、scFvをコードしているベクターを含んでいる。次いでscFvの多様な集まりをディスプレーしているこのようなファージ粒子の集団を、パンニング法により所望の結合特性について濃縮する。典型的には、所望の粒子を、所望のファージ粒子が結合することのできる抗原で被覆した固体表面に固定化する。結合した粒子を集め、細菌細胞を感染させるためにさらに使用する。パンニング法を反復して所望の結合特性をさらに濃縮する。
【0051】
scFv−gIII融合物をコードしているベクターはscFvおよびgIIIコード化領域の結合点に翻訳停止コドンを含むことができる。対応する翻訳停止サプレッサーを持つ細菌細胞中で発現される時、この融合蛋白が産生される。対応するサプレッサーを持たない細菌細胞で発現される場合には、遊離のscFvが産生する。
【0052】
血管内皮増殖因子(VEGF)は、胚の発生中の血管形成、および成人の血管新生プロセス、例えば創傷治癒、糖尿病性網膜症、慢性関節リウマチ、乾癬、炎症性疾患、腫瘍の増殖および転移の、重要な調節物質である。VEGFは、血管透過性の強力な誘導物質であり、内皮細胞の遊走および増殖の刺激物質であり、そしてその活性を主として2種類のチロシンキナーゼレセプター、VEGFレセプター1(VEGFR−1)、またはfms様チロシンレセプター1(Flt−1)、およびVEGFレセプター2(VEGFR−2)、またはキナーゼ挿入ドメイン含有レセプター(KDR、およびマウスのFlk−1)によって仲介する。Ferrara,N., Curr.Top.Microbiol.Immunol., 237, 1−30(1999);Klagsbrum,M., et al., Cytokine Growth Factor Rev. 7, 259−270(1996);Neufeld,G., et al. FASEB J. 13, 9−22(1999)。多くの研究が、VEGFとそのレセプターの過剰発現は腫瘍に関連する血管新生において、そしてそれ故腫瘍の増殖および転移において重要な役割を果たしていることを示している。
【0053】
Flt−1およびKDRは胚の血管の発生において別個の機能を持っている。マウスにおいていずれかのレセプターをコードしている遺伝子の選択的除去は胚にとって致死的であり、胚の発生におけるVEGF経路の生理的重要性を立証している。KDR欠損マウスは血島形成が損なわれ且つ成熟した内皮細胞を欠失しており、一方無Flt−1胚は内皮細胞が潤沢であるにもかかわらず、不完全な血管形成のため、正常な血管系を発達させることができない。Shalaby,F., et al., Nature 376, 62−66(1995);Fong,G.H., et al., Nature 376, 66−70(1995)。これに対し、チロシンキナーゼドメインの末端切除によるFlt−1シグナル伝達の不活性化はマウス胚の血管新生および胚の発生を損なうことがなく、Flt−1レセプターによるシグナル伝達が胚の血管系の発生にとって必須でないことを示唆している。Hiratsuka,S., et al., Proc.Natl.Acad.Sci.USA, 95, 9349−9354(1998)。成人におけるVEGFに対するFlt−1およびKDRの生物学的応答もまた異なっているように見受けられる。一般的にKDRは、内皮細胞増殖、遊走、分化、管形成、血管透過性増大、および血管の完全性の維持をもたらす主たるVEGFシグナルトランスデューサーであると考えられている。Flt−1ははるかに弱いキナーゼ活性を持ち、VEGFにより刺激された場合に分裂応答を誘発できない(これはKDRのおよそ10倍の親和性でVEGFに結合するのであるが)。Flt−1はさらに、VEGFおよび胎盤増殖因子(PIGF)により誘発される単球/マクロファージの遊走と組織因子の産生にも関連している。Barleon,B., et al., Blood 87, 3336−3343(1996);Clauss,M., et al., J.Biol.Chem. 271, 17629−17634(1996)。
【0054】
好ましい態様では、本発明に係る抗原結合蛋白は、KDRに結合しKDRへのVEGFの結合を遮断するscFvを含んでいる。scFv p1C11(配列番号27、28)はマウスscFvファージディスプレーライブラリーから製造する(Zhu et al., 1998)。p1C11はVEGF−KDR相互作用を遮断し、VEGFにより刺激されるレセプター燐酸化とヒト血管内皮細胞(HUVEC)の分裂誘発を阻害する。このscFvは、例えばHUVEC上の可溶性KDRおよび細胞表面発現されるKDRの両者と、高い親和性(Kd=2.1nM)で結合する。
【0055】
第二の好ましい態様では、本発明に係る抗原結合蛋白は、Flt−1に結合しそしてFlt−1へのVEGFの結合および/またはPIGFの結合を遮断する、scFvを含んでいる。Mab 6.12は可溶性および細胞表面発現されるFlt−1に結合する。scFv 6.12はマウスモノクローナル抗体Mab 6.12のVLおよびVHドメインを含んでいる。Mab 6.12を産生するハイブリドーマセルラインはATCC番号PTA−3344として寄託されている。この寄託は、特許手続上の微生物の寄託の国際承認に関するブダペスト条約およびその規則(ブダペスト条約)の規定の下になされた。これは、生きている培養を寄託日から30年間維持することを保証するものである。この微生物はブダペスト条約の条件の下でATCCによって入手可能とされ、関連する米国特許の登録時に無制限の入手可能性を保証する、出願者とATCCとの合意の下にある。寄託された菌株の入手可能性は、任意の政府当局の下でその特許法に従って付与された権利に違反してその発明を実施する許可と解釈してはならない。
【0056】
本発明に係る抗原結合蛋白は任意のエピトープ、抗原部位または蛋白に対する結合部位を持ち得る。好ましい抗原結合蛋白はレセプター蛋白の活性化を中和する。VEGFレセプターおよび血管新生に関与するその他のレセプターが特に興味深い。VEGFレセプターはKDR、Flk−1、Flt−1を包含する。インビボ血管新生の可能性ある調節物質として関与しているその他の因子は、線維芽細胞増殖因子(FGF)、血小板由来増殖因子(PDGF)、上皮増殖因子(EGF)を包含する。対応するレセプターは、線維芽細胞増殖因子(FGF−R)、血小板由来増殖因子レセプター(PDGF−R)、上皮増殖因子レセプター(EGF−R)である。血管新生および/または腫瘍形成に関与するレセプターチロシンキナーゼもまた興味深い。このようなレセプターチロシンキナーゼは、FLT4、HER2/neu、TekおよびTie2を包含する。興味深いレセプターは、ヒト蛋白およびその他の哺乳動物由来の類似体を包含する。上に列挙したレセプターとして抗体が知られており、それらは本発明に係る抗原結合蛋白に使用するためのscFv VLおよびVHドメインの供給源である。列挙したレセプターのいずれかに特異的な本発明に係る抗原結合蛋白は単一特異性または二重特異性であってよい。本発明に係る或る二重特異性抗原結合蛋白は、上記レセプターのうち2種類に結合する。一つの好ましい態様では、係る二重特異性抗原結合蛋白はHER2およびEGF−Rに結合する。第二の好ましい態様では、本発明に係る抗原結合蛋白はKDRおよびFLT−1に結合する。
【0057】
本発明に係る二重特異性抗原結合蛋白は、標的細胞上の抗原と免疫系エフェクター細胞上の抗原を架橋させることができる。これは、例えば細胞表面に目的とする特定の抗原を持つ細胞に対する免疫反応を促進させるために有用となり得る。本発明によれば、免疫系エフェクター細胞は、抗原特異的細胞、例えば細胞性免疫反応を活性化するT細胞、ならびに非特異的細胞、例えば細胞性免疫反応を仲介するマクロファージ、好中球およびナチュラルキラー(NK)細胞を包含する。
【0058】
本発明に係る抗原結合蛋白は、免疫系エフェクター細胞の任意の細胞表面抗原のための結合部位を持ち得る。このような細胞表面抗原は、例えばサイトカインおよびリンホカインレセプター、Fcレセプター、CD3、CD16、CD28、CD32およびCD64を包含する。一般に、抗原結合部位はscFvによって提供され、これは前記の抗原に対する抗体から誘導され、当分野で周知である。サイトカインおよびリンホカインレセプターに特異的な本発明に係る抗原結合部位はまた、該レセプターのための天然リガンドの全体または一部に対応するアミノ酸配列であってもよい。例えば、細胞表面抗原がIL−2レセプターである時、本発明に係る抗原結合蛋白は、対応するアミノ酸またはIL−2の配列を含む抗原結合部位を持ち得る。その他のサイトカインおよびリンホカインは、例えばインターロイキン−4(IL−4)およびインターロイキン−5(IL−5)のようなインターロイキン、ならびに顆粒球−マクロファージCSF(GM−CSF)、および顆粒球CSF(G−CSF)のようなコロニー刺激因子(CSF)を包含する。
【0059】
本発明に係る好ましい抗原結合蛋白は、CL軽鎖定常ドメインに連結したscFvを有する第一ポリペプチド、ならびにCH1、CH2およびCH3重鎖定常ドメインに連結したscFvを有する第二ポリペプチドを発現させることによって作製する。scFvをコードしているDNAフラグメントは、例えば、哺乳動物細胞中でヒト重鎖のいずれかのヒト軽鎖を発現するよう設計したHCMVベクター中にクローニングできる(例えば、Bendig, et al.,米国特許5840299;Maeda, et al.(1991) Hum.Antibod.Hybridomas 2, 124−134を参照されたい)。このようなベクターは、軽鎖および重鎖組み立て物の高レベル転写のためのヒトサイトメガロウイルス(HCMV)プロモーターおよびエンハンサーを含んでいる。好ましい態様では、軽鎖発現ベクターは、ヒトκ軽鎖をコードしているpKN100(Dr.S.Tannan Jones, MRC Collaborative Center, London, Englandより寄贈)であり、重鎖発現ベクターは、ヒトγ−1重鎖をコードしているpG1D105(Dr.S.Tannan Jonesより寄贈)である。いずれのベクターも、哺乳動物細胞およびE.coli中で機能するHCMVプロモーターおよびエンハンサー、複製起点ならびに選択マーカーを含んでいる。
【0060】
選択マーカーは、形質転換された宿主細胞が選択培養基中で生存または増殖するのに必要な蛋白をコードしている遺伝子である。典型的な選択マーカーは、(a) 抗生物質またはその他の毒素、例えばアンピシリン、ネオマイシン、メソトレキサート、またはテトラサイクリンに対する耐性を付与する、(b) 栄養要求性欠陥を補完する、または(c) 複合培地から得られない重要な栄養素、例えばBacilliのためのD−アラニンラセマーゼをコードしている遺伝子、を供給する、蛋白をコードしている。特に有用な選択マーカーはメソトレキサートに対する耐性を付与する。例えば、DHFRの競合的アンタゴニストであるメソトレキサート(Mtx)を含有する培養基で全形質転換体を培養することにより、DHFR選択遺伝子で形質転換した細胞をまず同定する。野生型DHFRを使用する場合の適当な宿主細胞は、UrlaubおよびChasin(1980) Proc.Natl.Acad.Sci.USA 77, 4216の記載のように調製し増殖させた、DHFR活性を欠失するチャイニーズハムスター卵巣(CHO)セルラインである。次に、形質転換した細胞を増加レベルのメソトレキサートに暴露する。このことにより多コピーのDHFR遺伝子の合成が導かれ、同時にこの発現ベクターを含む多コピーの他のDNA、例えば抗体または抗体フラグメントをコードしているDNAの合成が導かれる。
【0061】
酵母中で遺伝子組み立て物を発現させることが望ましい場合、酵母での使用に好適な選択遺伝子は、酵母プラスミドYRp7に存在するtrp1遺伝子である。Stinchcomb et al.(1979) Nature, 282, 39;Kingsman et al.(1979) Gene 7, 141。このtrp1遺伝子は、トリプトファン中で増殖する能力を欠く酵母の突然変異株、例えばATCC No.44076またはPEP4−1のための選択マーカーを提供する。Jones(1977) Genetics 85, 12。次いでこの酵母宿主細胞ゲノム中のtrp1損傷の存在が、トリプトファン不在下での増殖により形質転換を検出するための有効な環境を提供する。同様に、Leu2欠失酵母菌株(ATCC20622または38626)は、Leu2遺伝子を持つ既知のプラスミドによって補完される。
【0062】
ベクターの形質転換および本発明に係る抗原結合蛋白の発現のために好ましい宿主細胞は、哺乳動物細胞、例えばCOS−7細胞、チャイニーズハムスター卵巣(CHO)細胞、およびリンパ球起源のセルライン、例えばリンパ腫、骨髄腫、またはハイブリドーマ細胞である。その他の真核生物宿主、例えば酵母がこれらに代わって使用できる。形質転換した宿主細胞は、当分野で既知の方法により、同化可能な炭素源、例えばグルコースまたは乳糖のような炭水化物、窒素、例えばアミノ酸、ペプチド、蛋白またはそれらの分解産物、例えばペプトン、アンモニウム塩など、および無機塩類、例えばナトリウム、カリウム、マグネシウムおよびカルシウムの硫酸塩、燐酸塩および/または炭酸塩を含有する液体培地で培養する。培地はさらに、例えば微量元素、例えば鉄、亜鉛、マンガンなどの増殖促進物質を含有する。
【0063】
本発明に係る抗原結合蛋白の各可変ドメインは完全な免疫グロブリン重鎖もしくは軽鎖可変ドメインであるか、または天然に存在するドメインの機能的等価物もしくは突然変異体もしくは誘導体であるか、または例えばWO93/11236(Medical Research Comncil et al./Griffiths et al.)に記載のような技術を用いてインビトロで組み立てられた合成ドメインとすることができる。例えば、少なくとも1個のアミノ酸を欠失する抗体可変ドメインに対応するドメインを結合させることが可能である。重要な特徴的性質は、相補的可変ドメインと結合して抗原結合部位を形成する、各可変ドメインの能力である。
【0064】
同様に、定常ドメインの重要な特徴は、安定な複合体を形成する能力である。本発明に係る抗原結合蛋白は完全なCLおよびCH1ドメインを含むが、本発明は、該ドメインが安定な複合体として結合できる限り、アミノ酸が除去または挿入されているかも知れない、そして鎖間ジスルフィド結合を持っているかも知れないし持っていないかも知れない、修飾されたCLおよびCH1ドメインの使用をも意図している。
【0065】
Fc定常ドメインの重要な特徴的性質は、自己結合し、Fcレセプターに結合し、CMCを開始させ、そしてADCCを開始させる自己結合の能力を包含する。先に述べたように、本発明に係る抗原結合蛋白は、あらゆる定常ドメイン構造または機能が存在している必要はない。したがって、重鎖可変ドメイン、軽鎖可変ドメイン、定常ドメイン、scFvおよびFcという語は、機能的に等価である全ての変異体を包含すると解するべきである。
【0066】
本発明の好ましい態様では、二重特異性抗体の抗原結合部位は2種類の異なる結合特異性を持つscFvドメインを含む。例えば、IgG分子のVLおよびVHドメインを異なる特異性を持つscFvドメインに置換し、その結果、本明細書中でBs(scFv)4−IgGと称する得られた分子はその標的抗原の各々について二価となる。Bs(scFv)4−IgGは、様々な発現系、とりわけ哺乳動物細胞中で機能的に発現され且つ組み立てられ、2個の異なるエピトープに同時に結合できる。
【0067】
本明細書で先に記したように、scFvは軽鎖および重鎖定常ドメインとの結合にとって好ましい。しかしながら、それが望ましいまたは都合のよい場合は、本発明に係る二重特異性抗原結合蛋白の抗原結合部位を含む構造は、Fv以上または以下を包含する。例えば、これはさらに定常領域部分(例えば、軽鎖または重鎖ドメインへのFabの連結)またはFvの一部のみ(例えば、抗原結合が1個の可変ドメインにより前もって決定されており、第二の可変ドメインが親和性または特異性に殆ど寄与しない場合)を包含する。したがって、抗原結合部位は、さらに軽鎖または重鎖定常領域に連結した単一のポリペプチド鎖を含み、それが、該抗原結合蛋白中のドメインの配置を前もって明確に決定し、少なくとも2個の定常ドメインを有するIg型構造全体を形成することを可能にする。
【0068】
所望の結合特性を持つ抗原結合蛋白に包含させるための抗原結合部位は様々な方法で取得できる。選ばれた結合ドメインのVLおよびVH部分のアミノ酸配列は、天然に存在する抗体に対応しているか、または所望の免疫原性もしくは結合特性を得られるよう選択または修飾する。例えば、非ヒト供給源から誘導した抗原結合部位をヒト可変ドメインに置換した、キメラ可変ドメインが組み立てられる。キメラ組み立て物は、例えば非ヒト起源の抗原結合ドメインを人間の治療に使用することを望む場合、有害な免疫原性性質の排除にとって特に貴重である。好ましいキメラドメインは、ヒトフレームワーク領域(FR)に導入した1またはそれ以上の非ヒト起源相補性決定領域(CDR)を含むアミノ酸配列を有するドメインである。係るキメラの例については、Jones,P.T. et al.,(1996) Nature 321, 522−525;Riechman,L. et al.,(1988) Nature 332, 323−327;米国特許第5530101号(Queen et al.)を参照されたい。可変ドメインは高度の構造的相同性を持っており、CDRおよびFRに対応する可変ドメイン内のアミノ酸残基が容易に同定できる。例えば、Kabat,E.A., et al.(1991) Sequences of Proteins of Immunological Interest. 5th ed. National Center for Biotechnology Information, 米国国立衛生研究所、Bethesda, MDを参照されたい。したがって、抗原結合に参加するアミノ酸は容易に同定できる。加えて、導入されたCDRを含むキメラ結合ドメインの、抗原に対する親和性を保持または増強する方法が開発された。1つの方法は、CDR領域のコンホメーションに影響を及ぼす外来フレームワーク残基をこのキメラドメインに包含させることである。第二の方法は、この外来可変領域に最も近い相同性を持つヒト可変ドメイン上に、外来CDRを導入することである。Queen,C. et al.,(1989) Proc.Natl.Acad.Sci.USA 86, 10029−10033。まず、所望のCDR配列を含む部分重複プライマーを用いて個々のFR配列を増幅し、得られた遺伝子セグメントを次の増幅反応に加えることにより、CDRを最も容易に異なるFR上に導入できる。異なる可変ドメイン上へのCDRの導入は、このアミノ酸配列のCDRに隣接し、またはCDRのコンホメーションに影響を及ぼす折り畳まれた可変ドメイン構造中のCDRにパッキングされた、アミノ酸残基の置換を含むことができる。故に、本発明に係るヒト化ドメインは、1またはそれ以上の非ヒトCDRと共に、結合特性を保持または増強するためにさらなる置換または置き換えを施した係るドメインを含むヒト抗体を包含する。
【0069】
本発明に係るキメラ結合ドメインはさらに、scFvを免疫系に対して自己として出現させるため表面露出残基を置き換えることによってヒト化させた抗体をも包含する(Padlan,E.A.(1991) Mol.Immunol. 28, 489−498)。抗体はこの方法によって親和性を失うことなくヒト化する(Roguska et al.(1994) Proc.Natl.Acad.Sci.USA 91, 969−973)。抗原結合部位近傍におけるアミノ酸残基のパッキングが不変であるため、親和性は保持される。ヒト化目的のための本発明に係るscFvの表面露出残基の置換は、結合特性に影響するCDR残基または隣接残基の置換を意味しない。
【0070】
本発明は、本質的に人間のものである結合ドメインを意図するものである。ヒト結合ドメインは、ヒト重鎖および軽鎖可変ドメインの組み合わせが線維状ファージの表面にディスプレーされているファージディスプレーライブラリーから取得する(例えば、McCafferty et al.(1990) Nature 348, 552−554;Aujame et al.(1997) Human Antibodies 8, 155−168)。可変ドメインの組み合わせは典型的にはFabまたはscFvの形で線維状ファージ上にディスプレーされる。このライブラリーを、所望の抗原結合特性を持つ可変ドメインの組み合わせを有するファージについてスクリーニングする。好ましい可変ドメインの組み合わせは、選ばれた抗原に対して高い親和性を示し、他の関連抗原に対する交差反応性を殆ど示さない。極めて大レパートリーの抗体フラグメントをスクリーニングすることにより(例えば、Griffiths et al.(1994) EMBO J. 13, 3245−3260)、充分な多様性を持つ高親和性Mabが単離でき、多くは所望抗原についてナノモル以下の親和性を有すると予想される。
【0071】
別法として、ヒト結合ドメインは、再編成されていないヒトIg遺伝子セグメントをその中に導入し、そして内因性マウスIg遺伝子を失活させたトランスジェニック動物から取得することができる(Bruggemann and Taussig(1997) Curr.Opin.Biotechnol. 8, 455−458)。好ましいトランスジェニック動物は、1Mbを超えるサイズの極めて大きな隣接Ig遺伝子フラグメントを含んでいる(Mendez et al.(1997) Nature Genet. 15, 146−156)が、中等度の親和性のヒトMabは、より小さな遺伝子座を含むトランスジェニック動物から生成することができる(例えば、Wagner et al.(1994) Eur.J.Immunol. 42, 2672−2681;Green et al.(1994) Nature Genet. 7, 13−21)。
【0072】
本発明に係る結合ドメインは結合特性を直接突然変異または親和性成熟の方法によって改善させたものを包含する。親和性と特異性は、CDRを突然変異させ、所望の特性を有する抗原結合部位についてスクリーニングすることによって修飾または改善できる(例えば、Yang et al.(1995) J.Mol.Bio. 254, 392−403)。CDRは様々な方法で突然変異させる。1つの方法は、個々の残基または残基の組み合わせを無作為化する事であり、その結果、他の点では同一の抗原結合部位の集団において、20の全アミノ酸が特定の位置に見出される。別法として、誤りがちなPCR法により、CDR残基の範囲に突然変異を誘発する(例えば、Hawkins et al.(1992) J.Mol.Bio. 226, 889−896を参照されたい)。重鎖および軽鎖可変領域遺伝子を含むファージディスプレーベクターをE.coliの突然変異菌株で増殖させる(例えば、Low et al.(1996) J.Mol.Bio. 250, 359−368を参照されたい)。これらの突然変異誘発方法は当業者の知悉する多くの方法の実例である。
【0073】
本発明の別の態様では、抗原結合蛋白を抗腫瘍物質または検出可能シグナル生成物質に、化学的または生合成的に連結させることができる。抗体に連結させる抗腫瘍物質は、該抗体が結合した腫瘍を、または該抗体が結合した細胞の環境において腫瘍を破壊または損傷する任意の物質を包含する。例えば、抗腫瘍物質は化学療法剤またはラジオアイソトープのような毒性物質である。好適な化学療法剤は当業者に知られており、アントラサイクリン類(例えばダウノマイシンおよびドキソルビシン)、メソトレキサート、ビンデシン、ネオカルジノスタチン、シスプラチン、クロラムブシル、シトシンアラビノシド、5−フルオロウリジン、メルファラン、リシンおよびカリケアミシンを包含する。化学療法剤は常法を用いて抗体とコンジュゲートさせる(例えば、Hermentin and Seiler(1988) Behring Inst. Mitt. 82, 197−215を参照されたい)。
【0074】
検出可能シグナル生成物質は、診断目的のためにインビボおよびインビトロで有用である。シグナル生成物質は、外的手段、通常電磁気放射の測定により検出し得る測定可能なシグナルを生成する。大抵は、シグナル生成物質は酵素または発色団であるか、または蛍光、燐光または化学ルミネセンスにより光を発する。発色団は、紫外または可視領域で光を吸収する色素を包含し、酵素触媒反応の基質または分解産物であってよい。
【0075】
本発明はさらに、標的またはリポーター部分が連結した本発明に係る抗原結合蛋白を意図している。標的部分が結合対の第一の成員である。抗腫瘍物質は、例えば係る対の第二の成員とコンジュゲートさせ、それにより抗原結合蛋白が結合する部位へと導かれる。このような結合対の一般的な例はアビジンとビオチンである。好ましい態様では、ビオチンを本発明に係る抗原結合蛋白にコンジュゲートさせ、それによりアビジンまたはストレプトアビジンにコンジュゲートした抗腫瘍物質またはその他の部分のための標的を提供する。別法として、ビオチンまたはもう一つのこのような部分を本発明に係る抗原結合蛋白に連結させ、例えば検出可能なシグナル生成物質がアビジンまたはストレプトアビジンにコンジュゲートしている診断系において、リポーターとして使用する。
【0076】
抗腫瘍物質として使用するための好適なラジオアイソトープもまた当業者に知られている。例えば、131Iまたは211Atを使用する。これらのアイソトープを常套技術を用いて抗体に結合させる(例えば、Pedley et al.(1993) Br.J.Cancer 68, 69−73を参照されたい)。別法として、抗体に結合させる抗腫瘍物質は、プロドラッグを活性化する酵素である。このようにして、腫瘍部位に到達するまでは不活性型のままでいるプロドラッグを投与するが、いったん抗体複合体が投与されたならば、その腫瘍部位においてプロドラッグは細胞毒型に変換される。実際には、抗体−酵素コンジュゲートを患者に投与し、治療されるべき組織の領域に局在化させる。次いでプロドラッグをこの患者に投与し、その結果細胞毒性薬物への変換が、治療すべき組織の領域で起こる。別法として、抗体にコンジュゲートさせる抗腫瘍物質はサイトカイン、例えばインターロイキン−2(IL−2)、インターロイキン−4(IL−4)または腫瘍壊死因子α(TNF−α)である。抗体が腫瘍をサイトカインの標的とさせ、その結果、サイトカインは他の組織に影響を及ぼすことなく腫瘍の損傷または破壊を仲介する。サイトカインは常套的組換えDNA技術を用いてDNAレベルで抗体と融合させる。
【0077】
本発明に係る蛋白は、さらなるアミノ酸残基、例えば、単離または精製を容易にするためのペプチドタグ、または該蛋白が発現される任意の特定宿主における分泌または膜輸送を促進するためのシグナル配列、と融合させることができる。
【0078】
KDRの2個の異なるエピトープに特異的な結合ドメインを持つ二重特異性蛋白に関連し、そして本発明に係る抗原結合蛋白の有利な機能的側面を立証する、本発明の具体例をここに提供する。使用する結合ドメインは、KDRで免疫したマウスから組み立てたファージディスプレーライブラリーから単離するscFv p1C11およびscFv p4G7から誘導する(Zhu et al., 1998;Lu et al., 1999)。
【0079】
scFv p4G7は、KDRおよびマウス相同体Flk−1の両者に共通するエピトープに結合し、いずれのレセプターに対するVEGFの結合も妨害しない。scFv p1C11はKDRの異なるエピトープに結合し、VEGFの結合を遮断できるが、Flk−1には結合しない。したがって、各結合ドメインのうち2つをディスプレーする二重特異性二価免疫グロブリン様分子はKDRへの結合について四価であり、Flk−1への結合については二価である。
【0080】
Flk−1に対して二価であるBs(scFv)4−IgGは、Flk−1に対する二価diabodyであるDAB p4G7と類似のアビディティを持っている。Bs(scFv)4−IgGおよびDAB p4G7のアビディティはそれら各々の一価対応物であるBs(scFv)2−FabおよびscFv p4Gのおよそ10ないし23倍高く、この事は、二価性に起因する増強された結合を立証している。Bs(scFv)4−IgGはその構成成分の結合部位の両方の生物学的機能を保持しており、KDRおよびFlk−1の両者に対し、親抗体と同じ位有効に結合する(図4)。Bs(scFv)4−IgGは、ヒト内皮細胞上の表面発現KDRに結合し、KDR/VEGF相互作用を遮断し、そしてVEGFにより誘発されるKDRレセプター燐酸化を用量依存的に中和する(図5および6)。とりわけBS(scFv)4−IgGは、c−p1C11よりも低い親和性でKDRに結合し、そしてKDR/VEGF相互作用の遮断においてELISA検定で4倍有効性が低いという事実にも拘わらず、VEGFにより誘発されるレセプター燐酸化の中和においてc−p1C11と同じ位強力である。Bs(scFv)4−IgGの生物活性の増強は、KDRに関して四価であることに由来する増強した結合に帰することができる。Bs(scFv)4−IgGは、分子内架橋(即ち、同じKDR分子内部で2個のエピトープを架橋する)および/または細胞表面で多分子複合体を形成するための分子間架橋の能力を持っている。
【0081】
本発明に係る抗原結合蛋白は人間およびその他の哺乳動物の疾病の治療に有用である。この抗原結合蛋白は、天然および改変抗体についてこれまで知られているのと同じ目的および同じ方法で使用する。したがってこの抗原結合蛋白は、当分野で周知の研究、診断または治療方法のためにインビボおよびインビトロで使用できる。
【0082】
診断または治療目的で人間の身体に使用する場合、本発明に係る抗原結合蛋白は、薬学上許容し得る担体をさらに含む組成物の形で投与するという事が理解できる。好適な薬学上許容し得る担体は、例えば水、食塩水、燐酸緩衝化食塩水、デキストロース、グリセロール、エタノールなどのうち1またはそれ以上、ならびにこれらの組み合わせを包含する。薬学上許容し得る担体はさらに、湿潤もしくは乳化剤、保存料または緩衝剤といった補助物質を少量含み、これらは該結合蛋白の貯蔵期間または有効性を増大させる。本発明に係る組成物は様々な形態であってよい。これらは、例えば固体、半固体および液体投与型、例えば錠剤、丸剤、散剤、液体、分散剤または懸濁剤、リポソーム、坐剤、注射溶液および注入溶液を包含する。好ましい形態は意図する投与方式および治療適応に依存する。好ましい組成物は注射溶液または注入溶液の形態である。
【0083】
本発明に係る好ましい薬用組成物は、他の抗体による人間の受動免疫に用いられるものに類似している。好ましい投与方式は非経口的である。
【0084】
本明細書に開示する本発明の原則に当業者が変化を施すことができるという事が理解および予想でき、また、係る修飾は本発明の範囲内に包含される事を意図している。
【0085】
以下の実施例は本発明をさらに例示するものであるが、いかなる方法によっても本発明の範囲を限定するものと解してはならない。例えばベクターおよびプラスミドの組み立て、係るベクターおよびプラスミドへのポリペプチドをコードしている遺伝子の挿入、宿主細胞へのプラスミドの導入、ならびに遺伝子および遺伝子産物の発現およびその測定といった常法の詳細な説明は、Sambrook,J. et al.,(1989) Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory Pressを包含する多数の刊行物から得ることができる。本明細書に記載する全ての参考文献は引用によりその全体を本明細書の一部とする。
【0086】
実施例1:材料および方法
蛋白および抗体
完全なKDRコード化配列血管内皮増殖因子(VEGF)、キナーゼ挿入ドメイン含有レセプター−アルカリホスファターゼ融合蛋白(KDR−AP)およびそのマウス相同体、胎児肝キナーゼ1(Flk−1)−APをそれぞれバキュロウイルスおよびNIH3T3細胞で発現させ、記載の方法に従い精製する(Zhu et al., 1998)。
【0087】
ヒトKDRコード化配列は公表されている(GenBank Accession No.AF035121)。KDR細胞外ドメイン(ECD)免疫グロブリン(Ig)ドメイン除去突然変異体をPCRクローニングにより組み立て、NIH 3T3細胞で発現させ、記載のように精製する(Lu et al.,(2000) J.Biol.Chem. 275, 14321−14330)。このKDR ECD Igドメイン除去突然変異体は以下の構造を有する:
KDR(Ig1−7):レセプターの7個のIgドメイン全てを含む完全長KDR ECD(アミノ酸Met1からVal742まで);
KDR(Ig1−3):3個のN末端ECD Igドメインを含む突然変異体(アミノ酸Met1からLys327まで);および、
KDR(Ig3−7):KDR ECD Igドメイン3ないし7を含む突然変異体(アミノ酸Asp225からVal742まで)。
【0088】
抗KDR一本鎖Fv(scFv)p1C11およびscFv p4G7を、Zhu et al.(1998) Cancer Res., 58, 3209−3214およびLu et al.(1999) J.Immunol.Methods, 230, 159−171に報告されたように、KDRで免疫したマウスから組み立てたファージディスプレーライブラリーから単離する。
【0089】
二価scFvフラグメントの形態であるdiabody DAB p4G7(Holliger et al.(1993) Proc.Natl.Acad.Sci.USA 90, 6444−6448;Zhu et al.(1996) Bio/Technology, 14, 192−196)を、前にZhu et al.(1996)およびLu et al.(1999)に記載されたようにscFv p4G7から組み立てる。scFv p1C11から組み立てたマウス/ヒトキメラIgG1抗体であるc−p1C11、および表皮増殖因子(EGF)レセプターに対するキメラIgG1抗体であるC225は、いずれもImClone Systems Incorporated(New York, NY)で製造されている。Zhu, et al.(1999)。
【0090】
抗Flt−1抗体Mab6.12(IgG1, κ)を産生するハイブリドーマセルライン(ATCC No.PTA−334)は、ImClone Systems Incorporated (New York, NY)において該レセプターの組換え型で免疫したマウスから確立した。
【0091】
マウスの免疫および一本鎖抗体ファージディスプレーライブラリーの組み立て 雌性BALB/Cマウスに、Ribi Adjuvant System 200μl中のKDR−AP 10μgを2回腹腔内(i.p.)注射し、続いて2ヶ月の間にRIBIアジュバント無しで1回i.p.注射する。このマウスはまた、最初の免疫の時点で、RIBI 200μlに入れたKDR−AP 10μgの皮下(s.c.)注射を受ける。このマウスは安楽死の3日前にKDR−AP 20μgでi.p.ブースティングする。ドナーマウスの脾臓を摘出し、細胞を単離する。RNAを抽出し、mRNAを脾臓細胞の全RNAから精製する。逆転写の後、発現されたVLおよびVH遺伝子に対応するcDNAを個別に増幅する。増幅した生成物を、各遺伝子を受容するよう設計したベクター中に別々に挿入するか、または、分泌シグナル配列およびポリペプチドリンカーをコードしているヌクレオチドに連結し(例えばPCR増幅により)、融合した生成物を所望ベクター中に挿入することができる。例えば、Zhu et al., 1998を参照されたい。
【0092】
マウスscFvを線維状ファージ上にディスプレーするための材料と方法は市販品が入手できる(Recombinant Phage Antibody System, Amersham Pharmacia Biotech)。簡潔に述べると、scFvを線維状ファージ表面にディスプレーするには、抗体VHおよびVLドメインを15アミノ酸リンカー(GGGGS)3によって結合させる。この組み立て物のC末端を、15アミノ酸Eタグを持ちアンバーコドン(TAG)で終わっているファージ蛋白IIIのN末端に連結する。Eタグと蛋白IIIの間に位置するアンバーコドンは、非サプレッサー宿主(例えばHB2151細胞)中に導入された場合はscFvを可溶性型で産生させ、サプレッサー宿主(例えばTG1細胞)中に導入された場合は蛋白IIIを介してファージをディスプレーさせる。
【0093】
このscFv−遺伝子III組み立て物をpCANTAB 5Eベクターにライゲーションする。形質転換したTG1細胞を2YTAGプレート(17g/lトリプトン、10g/l酵母抽出物、5g/l NaCl、20g/lグルコース、100μg/mlアンピシリン、15g/l Bacto−agar)に蒔き、インキュベートする。コロニーを削り取って2YT培地(17g/lトリプトン、10g/l酵母抽出物、5g/l NaCl )10mlに入れ、50%グリセロール5mlと混合し、ライブラリーストックとして−70℃で保存する。
【0094】
生物学的パンニング
ライブラリーストックを対数期まで増殖させ、M13K07ヘルパーファージで救済し、2YTAK培地(アンピシリン100μg/mlおよびカナマイシン50μg/mlを含有する2YT)で一夜30℃で増幅する。このファージ調製物を4% PEG/0.5M NaClで沈殿させ、アルカリホスファターゼ(AP)500μg/mlを含有する3%脱脂乳/PBSに再懸濁し、37℃で1時間インキュベートして、AP scFvに対する特異性を持つファージ−scFvを遮断し且つ他の非特異結合を遮断する。
【0095】
KDR−AP(10μg/ml)被覆Maxisorp Star管(Nunc, Denmark)を、まず3%牛乳/PBSを用いて37℃で1時間遮断し、次にファージ調製物と共に室温で1時間インキュベートする。この管をPBST(0.1%Tween20を含有するPBS)で10回洗浄し、その後PBSで10回洗浄する。結合したファージを、新たに調製した100mMトリエチルアミン溶液1mlで10分間室温で溶離する。溶出したファージを対数期なか頃のTG1細胞10mlと共に37℃で静止させて30分間、振盪しつつ30分間インキュベートする。次いで、感染したTG1細胞を2YTAGプレートに蒔き、ファージストックの作製で上に示したように一夜30℃でインキュベートする。
【0096】
スクリーニング操作(パンニング)を連続回実施して、所望の結合特異性を持つディスプレーされたscFvをさらに濃縮する。2または3回パンニングを実施した後、個々の細菌コロニーを別々にスクリーニングして所望のKDR結合特性を持つクローンを同定する。同定したクローンはVEGF結合の遮断についてさらに試験することができる。クローンのDNAフィンガープリンティングを用いてユニークなクローンを識別する。各消化パターンの代表的クローンを選び、DNA配列決定に付す。
【0097】
ファージELISA
個々のTG1クローンを96ウェルプレートで37℃で増殖させ、上記のようにM13K07ヘルパーファージで救済する。増幅したファージ調製物を1/6容量の18%牛乳/PBSの添加によりRTで1時間遮断し、KDR−APまたはAPで被覆したMaxi−sorp 96ウェル微量定量プレート(Nunc)に加える。室温で1時間のインキュベートの後、プレートをPBSTで3回洗浄し、ウサギ抗M13ファージAb−HRPコンジュゲートと共にインキュベートする。プレートを5回洗浄し、TMBペルオキシダーゼ基質を加え、450nmのODをマイクロプレート読み取り機を用いて読み取る。
【0098】
可溶性scFvの調製
個々のクローンのファージを用いて非サプレッサーE.coli宿主HB2151を感染させ、感染させたものを2YTAG−N(2YTAG;100μg/mlナリジキシン酸)プレート上で選択する。この細胞を1mMイソプロピル−1−チオ−B−D−ガラクトピラノシドを含有する2YTA培地で30℃で培養することにより、HB2151におけるscFvの発現を誘導する。20%(w/v)蔗糖、200mM NaCl、1mM EDTAおよび0.1mM PMSFを含有する25mM Tris(pH7.5)に細胞ペレットを再懸濁し、続いて穏やかに振盪しながら4℃で1時間インキュベートすることにより、この細胞のペリプラズム抽出物を調製する。15000rpmで15分間遠心分離した後、RPAS精製モジュール(Pharmacia Biotech)を用いる親和クロマトグラフィーによって可溶性scFvを上清から精製する。
【0099】
Mab6.12からのscFvの調製
Mab6.12のVHおよびVL遺伝子を、Bendig et al.(1996) Antibody Engineering: A Practical Approach, McCafferty,J., Hoogenboom,H.R., Chiswell,D.J., eds., Oxford University Press, Incorporated; p147−168の方法に従い、ハイブリドーマ細胞から単離したmRNAからRT−PCRによってクローニングする。マウス抗体軽鎖リーダー配列の5’末端とハイブリダイズするよう特異的に設計した11個の5’プライマー、および、マウスκ軽鎖定常領域の5’末端とハイブリダイズする1個の3’プライマーを使用して、VL遺伝子をクローニングする。マウス抗体重鎖リーダー配列の5’末端とハイブリダイズするよう特異的に設計した12個の5’プライマー、および、マウスIgG1重鎖定常領域の5’末端とハイブリダイズする1個の3’プライマーを使用して、VH遺伝子をクローニングする。抗体の各々について合計23のPCR反応(VL遺伝子について11およびVH遺伝子について12)を実施する。PCRにより生成した400ないし500塩基対の間のサイズの全フラグメントを製造者の説明書に記載のようにしてpCR(登録商標)2.1ベクター中にクローニングし(TA Cloning(登録商標)キット、Invitrogen, Carlsbad, CA)、その後E.coli菌株XL−1の形質転換を行う。
【0100】
部分重複PCRを用いてscFv6.12を組み立てるため、MAB6.12のVLおよびVH遺伝子をコードしているPCRフラグメントを使用する。このscFvでは、15アミノ酸リンカー(グリシン−グリシン−グリシン−グリシン−セリン)3、または(GGGGS)3を介してMab6.12 VHのC末端をMab6.12 VLのN末端に連結する(図1A)。次いでscFv6.12コード化遺伝子を、可溶性scFv蛋白の発現のため、ベクターpCANTAB 5E(Amersham Pharmacia Biotech, Piscataway, NJ)中にクローニングする。
【0101】
BsAb−IgG[Bs(scFv)4−IgG]およびBsAb−Fab[Bs(svFv)2−Fab]のための発現ベクターの組み立て
プライマーJZZ−2(配列番号29)およびJZZ−3(配列番号30)を用いるPCRによって、scFv p4G7をコードしている遺伝子をscFv発現ベクターから増幅する。次に、プライマーJZZ−12(配列番号31)およびJZZ−3(配列番号30)を用いるPCRによって、哺乳動物細胞における蛋白分泌のためのリーダーペプチド配列をscFvコード化配列の5’末端に加える。
【0102】
同様に、プライマーJZZ−2(配列番号29)およびp1C11VL3−2(配列番号32)を用いるPCRによって、scFv p1C11をコードしている遺伝子をscFv発現ベクターから増幅し、続いて、プライマーJZZ−12(配列番号31)およびp1C11VL3−2(配列番号32)を用いるPCRによってリーダーペプチド配列を加える。
【0103】
軽鎖および重鎖両方の分泌のため、19アミノ酸より成る同じリーダーペプチドMGWSCIILFLVATATGVHS(配列番号33)を使用する。
【0104】
Bs(scFv)4−IgGの軽鎖および重鎖のため、別々の発現ベクターを組み立てる。クローニングしたscFv p4G7遺伝子をHindIIIおよびBamHIで消化し、ヒトκ軽鎖定常領域(CL)を含むベクターpKN100(Dr.S.T.Jones, MRC Collaboraive Center, London, England、より寄贈)中にライゲーションしてBsAb−IgG軽鎖BsIgG−Lのための発現ベクターを作り出す。クローニングしたscFv p1C11遺伝子をHindIIIおよびBamHIで消化し、ヒトIgG1重鎖定常領域(CH)を含むベクターpG1D105(Dr.S.T.Jonesより寄贈)中にライゲーションしてBsAb−IgG重鎖BsIgG−Hのための発現ベクターを作り出す。これらのベクターは、メソトレキサートに対する耐性を付与しベクター配列の増幅を提供するDHFR遺伝子の存在を除いて米国特許5840299に記載の軽鎖(HCMV−VL−HCK)および重鎖(HCMV−VH−HCγ 1)ベクターに類似している。
【0105】
Bs(scFv)2−Fabのための発現ベクターを製造するため、プライマーJZZ−12(配列番号31)およびJZZ−18(配列番号34)を用いるPCRによって、蛋白翻訳を停止するための停止コドンを、ベクターBsIgG−Hの第一定常ドメイン(CH1)の直後に導入する。この遺伝子フラグメントをHindIIIおよびNaeIで消化し、ベクターpG1D105に挿入してベクターBsFab−Hを作り出す。全ての組み立て物を制限酵素消化により調査し、DNA配列決定により確認する。
【0106】
この実施例で使用したプライマー配列を下記および配列表に記す。
【0107】
JZZ−2配列(配列番号29):
5’−CTAGTAGCAACTGCCACCGGCGTACATTCACAGGTCAAGCTGC−3’
JZZ−3配列(配列番号30):
5’−TCGAAGGATCACTCACCTTTTATTTCCAGC−3’
JZZ−12配列(配列番号31):
5’−GGTCAAAAGCTTATGGGATGGTCATGTATCATCCTTTTTCTAGTAGCAACT−3’
p1C11VL3−2配列(配列番号32):
5’−TCGATCTAGAAGGATCCACTCACGTTTTATTTCCAG−3’
リーダーペプチド(配列番号33):
MGWSCIILFLVATATGVHS
JZZ−18(配列番号34):
5’−TCTCGGCCGGCTTAAGCTGCGCATGTGTGAGT−3’
抗体の発現および精製
Zhu et al.(1999) Cancer Lett. 136, 203−213に記載の方法に従い、Bs(scFv)4−IgGおよびBs(scFv)2−Fabそれぞれの一過性発現のため、ベクターBsIgG−LおよびBsIgG−H、またはBsIgG−LおよびBsFab−H由来の同量のDNAを用いてCOS細胞を同時トランスフェクトする。トランスフェクションの24時間後、この細胞を無血清培地に交換する。条件付けた上清をトランスフェクションの48時間および120時間後に集める。製造者(Pharmacia Biotech, Piscataway, NJ)の記載したプロトコルに従い、Bs(scFv)4−IgGおよびBs(scFv)2−Fabを、プールした上清から、プロテインGカラムを用いる親和クロマトグラフィーによって精製する。抗体を含有する画分をプールし、緩衝液をPBSに交換し、Centricon 10濃縮機(Amicon Corp., Beverly, MA)を用いて濃縮する。抗体の純度をSDS−PAGEにより分析する。精製した抗体の濃度を、捕捉剤として山羊抗ヒトIgG Fc特異抗体を、そして検出剤としてHRP−コンジュゲートした山羊抗ヒトκ鎖抗体を使用して、ELISAにより測定する。標準曲線を臨床等級の抗体C225またはc−p1C11を用いて検定する。
【0108】
KDRに対する二重特異性抗体の結合検定
上に記載のBsAbの二重特異性を立証するため2種類の異なる検定を実施する。
【0109】
直接結合検定では、まず、96ウェルプレート(Nunc, Roskilde, Denmark)を、捕捉剤としてウサギ抗AP抗体(DAKO−Immunogloblins A/S, Denmark)を使用して、KDR(Ig1−7)−AP、KDR(Ig1−3)−APまたはKDR(Ig3−7)−AP融合蛋白(ウェルあたり1.0μg/ml x 100μl)で被覆する。次いでこのプレートをBsAb、c−p1C11またはDAB p4G7と共に室温で1時間インキュベートし、その後BsAbおよびc−p1C11のためにはウサギ抗ヒトIgG Fc特異抗体−HRPコンジュゲート(Cappel, Organon Teknika Corp. West Chester, PA)と共に、またはDAB p4G7のためにはマウス抗Eタグ抗体−HRPコンジュゲート(Pharmacia Biotech)と共にインキュベートする。このプレートを5回洗浄し、TMBペルオキシダーゼ基質(KPL, Gaithersburg, MD)を加え、450nmのODをマイクロプレート読み取り機(Molecular Device, Sunnyvale, CA)を用いて読み取る(Zhu et al., 1998)。
【0110】
架橋検定では、最初にこの抗体をKDR(Ig1−7)−AP、KDR(Ig1−3)−APまたはKDR(Ig3−7)−APと共に溶液中でインキュベートする。混合物をKDR(Ig1−3)(タグ無し)で被覆した96ウェルプレートに移し、室温で2時間インキュベートする。プレートを洗浄し、KDR(Ig1−3)(タグ無し)に結合したAP活性をAP基質p−ニトロフェノールホスファート(Sigma)の添加によって測定し、405nmのODを読み取る(Zhu et al., 1998)。
【0111】
KDRおよびFlk−1に対するBs(scFv)4−IgGおよびBs(scFv)2−Fabの定量的結合検定 KDR−APまたはFlk−1−AP(100ng蛋白/ウェル)のいずれかで被覆した96ウェルMaxi−sorp微量定量プレート(Nunc)に、種々の量のBs(scFv)4−IgG、Bs(scFv)2−Fab、c−p1C11またはscFv p4G7を加え、室温で1時間インキュベートし、その後、二重特異性抗体およびc−p1C11のためにはウサギ抗ヒトIgG Fc特異抗体−HRPコンジュゲートと共に、またはscFv p4G7のためにはマウス抗Eタグ抗体−HRPコンジュゲートと共に、室温で1時間インキュベートする。プレートを洗浄し上記のように発色させる。
【0112】
フローサイトメトリー(FACS)分析
初期継代HUVEC細胞を増殖因子枯渇EBM−2培地で一夜増殖させてKDRレセプターの発現を誘導する。細胞を収穫し、PBSで3回洗浄し、5μg/mlのBs(scFv)4−IgGまたはc−p1C11と共に4℃で1時間インキュベートし、続いてFITC標識したウサギ抗ヒトFc抗体(Cappel, Organon Teknika Corp.)と共にさらに1時間インキュベートする。細胞を洗浄し、フローサイトメトリーにより分析する(Zhu et al., 1999)。
【0113】
結合速度の分析
BsAbおよび親scFvの結合速度を、BIAcoreバイオセンサー(Pharmacia Biosensor)を使用し表面プラスモン共鳴により測定する。KDR−AP、Flk−1−AP、またはFlt−1−Fc融合蛋白をセンサーチップ上に固定化し、様々な抗体を1.5nMないし200nMの範囲の濃度で注入する。各濃度におけるセンサーグラムを得、速度定数konおよびkoffを決定するため、プログラムBIA Evaluation2.0を用いて評価する。速度定数の比koff/konとしてKdを算出する。
【0114】
VEGF/KDR、VEGF/Flt−1、およびPIGF/Flt−1リガンド遮断検定
遮断検定では、種々の量のBsAb、scFvまたはc−p1C11を、固定量のKDR−AP、Flk−1−APまたはFlt−1−Fc(R&D Systems, Minneapolis, MN)と混合し、室温で1時間インキュベートする。次いでこの混合物をVEGF165またはPIGFで被覆した96ウェルプレートに移し、RTでさらに2時間インキュベートし、その後このプレートを5回洗浄する。VEGF165およびPIGFは典型的には200ng/ウェルで被覆する。VEGF165はVEGFの165アミノ酸型である。KDR−APまたはFlk−1−APについてはVEGFに結合したAP活性を記載のように定量する(Zhu, et al., 1998;1999)。VEGFまたはPIGFに結合したFlt−1−Fcを測定するため、プレートをマウス抗ヒトFc−HRPコンジュゲートと共にインキュベートする。
【0115】
燐酸化阻害検定
完全長KDR(ImClone Systems)でトランスフェクトした安定な293セルラインを使用し、かつて記載された方法(Zhu et al., 1998;1999)に従い、KDR燐酸化検定を実施する。簡潔に述べると、トランスフェクトした293細胞(プレートあたり〜3x106細胞)を抗体の存在下または不在下で15分間インキュベートし、その後20ng/mlのVEGF 165により室温でさらに15分間刺激する。次いでこの細胞を溶解し、細胞溶解液をKDR燐酸化検定に使用する。KDRレセプターを、抗KDR抗体Mab4.13(ImClone Systems)に結合させたプロテインAセファロースビーズ(Santa Cruz Biotechnology,Inc., CA)を用いて細胞溶解液から免疫沈降させる。蛋白をSDS−PAGEで分離しウェスタンブロット分析に付す。KDR燐酸化を検出するため、ブロットを抗ホスホチロシンMab、PY20(ICN Biomedicals,Inc. Aurora, OH)でプロービングする。このシグナルを、増強した化学ルミネセンスを用いて検出する(Amersham, Arlington Heights, IL)。このブロットをポリクローナル抗KDR抗体(ImClone Systems)で再プロービングして、SDS−ポリアクリルアミドゲルの各列に同量の蛋白がロードされていることを確実とする。
【0116】
抗マイトジェン検定
HUVEC(5x103細胞/ウェル)を、VEGF、塩基性線維芽細胞増殖因子(bFGF)、または上皮細胞増殖因子(EGF)を除いたEBM−2培地(Clonetics, Walkersville, MD)200ulを入れた96ウェル組織培養プレート(Wallach,Inc., Gaithersburg, MD)に蒔き、37℃で72時間インキュベートする。様々な量の抗体を2個ずつのウェルに加え、37℃で1時間プレインキュベートし、その後VEGF165を最終濃度16ng/mlとなるように加える。18時間のインキュベーションの後、[3H]−チミジン([3H]−TdR)(Amersham)0.25uCiを各ウェルに加え、さらに4時間インキュベートする。細胞を氷上に置き、血清含有培地で2回洗浄し、引き続き10% TCAと共に4℃で10分間インキュベートする。次にこの細胞を水で1回洗浄し、2% SDS 25μlに可溶化する。シンチレーション液(150μl/ウェル)を加え、DNAの取り込んだ放射性をシンチレーションカウンター(Wallach, Model 1450 Microbeta Scintillation Counter)で測定する。
【0117】
白血病遊走検定
HL60およびHEL細胞を無血清単純RPMI 1640培地で3回洗浄し、この培地に1x106/mlで懸濁する。細胞懸濁液のアリコート100μlを3μm孔transwell insert(HL60細胞用)または8μm孔transwell insert(HEL細胞用)(Costar(登録商標), Corning Incorporated, Corning, NY)のいずれかに加え、抗原結合蛋白と共に37℃で30分間インキュベートする。次にこのinsertを、VEGF165を加えたまたは加えていない無血清RPMI 1640 0.5mlを入れた24ウェルプレートのウェルに入れる。37℃、5%CO2でHL60細胞については16−18時間、HEL細胞については4時間遊走を実施する。遊走した細胞を下室から集め、コールターカウンター(Model Z1, Coulter Electronics Ltd., Luton, England)で計数する。
【0118】
実施例2:二重特異性抗体の製造
Bs(scFv)4−IgGおよびBs(scFv)2−Fabの組み立て
2種類の抗KDR scFv抗体、scFv p1C11およびp4G7を、Bs(scFv)4−IgGおよびBs(scFv)2−Fabの組み立てに使用する(図2A)。scFv p1C11はKDRに特異的に結合しKDR/VEGF相互作用を遮断し、一方scFv p4G7はKDRとそのマウス同族体Flk−1の両者に結合するがKDR/VEGFまたはFlk−1/VEGF相互作用のいずれをも遮断しない(Zhu et al., 1998, Lu et al., 1999)。p1C11はKDR ECD Igドメイン1ないし3内部に位置するエピトープに結合し、一方p4G7のためのエピトープはIgドメイン6および7内部に位置するということが、エピトープマッピング研究で明らかとなっている(Lu et al., 2000)。scFv p1C11およびp4G7をコードしている遺伝子セグメントを、ヒトIgG1分子のCHおよびCLをコードしている遺伝子セグメントにそれぞれ結合させ、その結果scFv配列はそれぞれCH1およびCLのN末端に融合して、発現ベクターBsIgG−HおよびBsIgG−Lが作られる(図2A)。この配置はIgGの元のVHおよびVLドメインを、各々独立した抗原結合ユニットを構成する2個のscFv分子に置換する(図1)。BsIgG−HおよびBsIgG−Lの同時発現は、IgG様二価二重特異性分子Bs(scFv)4−IgGを生成する(図1)。一価二重特異性Fab様分子(図1)、Bs(scFv)2−Fabもまた、BsIgG−LおよびBsFab−Hの同時発現によって生成する。停止コドンをCH1ドメインの末端に導入することにより、BsIgG−HからベクターBsFab−Hを組み立てる(図2A)。
【0119】
Bs(scFv)4−IgGおよびBs(scFv)2−Fabの発現と精製
Bs(scFv)4−IgGとBs(scFv)2−FabをCOS細胞で一過性発現させ、プロテインGカラムを用いる親和クロマトグラフィーにより細胞培養上清から精製する。精製したBsAbをSDS−PAGEにより分析する(図2B)。非還元条件下で、Bs(scFv)4−IgGは分子量およそ200kDaの単一のバンドを生じ、一方Bs(scFv)2−Fabは〜75kDaの主たるバンドを生ずる(図2B、2および3列)。還元条件下では、Bs(scFv)4−IgGは、それぞれscFv−CH1−CH2−CH3融合物(〜63kDa)およびscFv−CL融合物(〜37kDa)に対する予想移動度を持つ2個の主たるバンドを生成する(図2B、5列)。これに対し、Bs(scFv)2−Fabは、scFv−CH1およびscFv−CL融合物をそれぞれ示す、〜38kDaおよび37kDaの分子量を持つ2個の主たるバンドを生ずる(図2B、6列)。対照として、c−p1C11、キメラIgG1抗体は、非還元条件下で〜150kDaの1個のバンドを(図2B、1列)、そして還元条件下で〜50kDa(重鎖、VH−CH1−CH2−CH3融合物)および〜25kDa(軽鎖、VL−CL融合物)という2個のバンドを生ずる(図2B、5列)。
【0120】
実施例3:BsAbは同時に2個のエピトープに結合する
BsAbの二重特異性
BsAbの二重の特異性を、完全長KDR ECDおよびそのIgドメイン除去突然変異体のうちの2個を用いて検定する(図3A)。かつて観察されたようにp1C11はIgドメイン1ないし3を含むKDR突然変異体とのみ結合し(Zhu et al., 1999)、一方p4G7はIgドメイン6および7を含む突然変異体とのみ結合する(Lu et al., 1999)。対照的に、Bs(scFv)4−IgGおよびBs(scFv)2−Fabはいずれも3種類のKDR変異体の全てに結合し、この事は、BsAbは、一方はIgドメイン1ないし3上のエピトープに、そして他方はIgドメイン6および7上のエピトープに結合する2個の結合部位を有することを示すものである。
【0121】
BsAbが両方のエピトープに同時に結合できるか否かを調べるため、APで標識したまたはしていない幾つかのKDR ECD Igドメイン除去突然変異体を使用して架橋検定を実施する。この検定では、BsAbをまずKDR(Ig1−7)−AP、KDR(Ig1−3)−APまたはKDR(Ig3−7)−APとインキュベートする。混合物をKDR(Ig1−3)(タグ無し)で被覆した微量定量プレートに移し、その後KDR(Ig1−3)(タグ無し)に結合したAP活性を測定する(図3B)。プレートに結合したAP活性により立証されるように、Bs(scFv)4−IgGおよびBs(scFv)2−Fabはいずれも3種類全てのKDR−AP変異体と溶液中で有効に結合し、固定化KDR(Ig1−3)(タグ無し)と架橋複合体を形成する(図3B)。対照的に、c−p1C11は、KDR(Ig1−3)(タグ無し)を、Igドメイン1−3を含むKDR変異体、即ちKDR(Ig1−7)−APおよびKDR(Ig1−3)−APとのみ架橋させ、KDR(Ig3−7)−APとは架橋させない。予想されたように、p4G7は、いずれのKDR変異体をも固定化KDR(Ig1−3)(タグ無し)と架橋させることができないが、これはp4G7がKDR(Ig1−3)突然変異体と結合しないためである。
【0122】
BsAbによる抗原結合
BsAbの抗原結合効率を固定化KDR(図4A)およびFlk−1(図4B)に関して測定する。図4Aは、KDRに対するBs(scFv)4−IgGおよびBs(scFv)2−Fabの用量依存的結合を示している。Bs(scFv)4−IgGとBs(scFv)2−Fabの両者は、それが誘導されたp1C11の8ないし10倍の親和性を持つキメラ抗KDR抗体であるc−p1C11と同じ位有効にKDRに結合する。Bs(scFv)4−IgGおよびBs(scFv)2−FabもまたscFv p4G7と同様、用量依存的にFlk−1に結合するが、c−p1C11は結合しない。予想されたように、ヒトEGFRに対するキメラ抗体C225はいずれの抗原とも結合しない。
【0123】
細胞表面発現レセプターに対するBsAbの結合をFACS分析によって検定する。かつてc−p1C11で観察されたように(Zhu et al., 1999)、Bs(scFv)4−IgGは初期継代HUVEC上で発現されたKDRに有効に結合する。
【0124】
KDRおよびFlk−1に対するBsAbの結合速度をBIAcore装置を用いる表面プラスモン共鳴によって測定する(第1表)。KDRに対するBs(scFv)4−IgGおよびBs(scFv)2−Fabの全体的親和性(Kd)またはアビディティはそれぞれ1.4nMおよび1.1nMであり、これは一価scFv p1C11およびp4G7のそれと似通っているが、二価c−p1C11またはDAB p4G7のそれの4ないし10倍弱い。これに対して、Flk−1に対して二価であるBs(scFv)4−IgGは、二価DAB p4G7(Kd、 0.18nM)と類似のアビディティ(Kd、0.33nM)を示す。Flk−1に対していずれも一価であるBs(scFv)2−FabおよびscFv p4G7は類似の親和性(Kd、それぞれ1.7nMおよび4.2nM)でFlk−1に結合し、この親和性はそれらの二価対応物より5ないし20倍弱い。
【0125】
Bs(scFv)4−IgGによるVEGF遮断
図5は、Bs(scFv)4−IgGが、KDR−APが固定化VEGFに結合するのを有効に遮断することを示している。KDR結合を50%遮断するのに要する抗体濃度である、Bs(scFv)4−IgGおよびc−p1C11のIC50は、それぞれ4nMおよび1nMである。scFv p4G7で観察されるように、Bs(scFv)4−IgGは、VEGFに対するKDRマウス同族体Flk−1の結合を遮断しない(示していない)。Bs(scFv)4−IgGは、VEGF/Flk−1結合に影響を及ぼさないscFv p4G7に対応するFlk−1エピトープに結合する。scFv p1c11が特異的であるKDRエピトープはFlk−1には無い。したがってFlk−1に対するVEGF結合は遮断されない。抗EGFR抗体C225は、VEGFに対するKDRの結合に効果を示さない。
【0126】
BsAbによるKDR燐酸化阻害
VEGFにより誘導されるレセプター燐酸化に及ぼすBs(scFv)4−IgGの生物学的効果を、KDRトランスフェクト293細胞を用いて測定する。図6に示すように、VEGF処理はKDRレセプターの強力な燐酸化を誘導する。Bs(scFv)4−IgGによる前処理はVEGFで誘導されるレセプター燐酸化を用量依存的に阻害する(図6)。さらに、Bs(scFv)4−IgGは、検定した各々の抗体濃度においてc−p1C11と等しく強力である。
【0127】
分裂誘発の阻害
VEGFにより刺激されるヒト内皮細胞の分裂誘発に及ぼす抗KDR抗体の効果を、HUVECを用いる[3H]−TdR DNA取り込み検定によって測定する。VEGF、bFGFまたはEGFを含まないEBM−2培地200μlを入れた96ウェル組織培養プレートにHUVEC(5x103細胞/ウェル)を蒔き、37℃で72時間インキュベートする。様々な量の抗体を2個ずつのウェルに加え、37℃で1時間プレインキュベートし、その後最終濃度16ng/mlとなるようにVEGF165を加える。18時間インキュベーションした後、0.25μCiの[3H]−TdRを各ウェルに加え、さらに4時間インキュベートする。DNAの取り込んだ放射性をシンチレーションカウンターで測定する。
【0128】
scFv p1C11およびBs(scFv)4−IgGの両者はVEGFで刺激されたHUVECの分裂誘発を有効に阻害する。Bs(scFv)4−IgGは、親scFvよりも強力な、HUVECのVEGF誘導性分裂誘発のインヒビターである。予想されたように、KDRと結合しないscFv p2A6、およびKDR/VEGF結合を遮断しないscFv p4G7は、VEGF刺激性内皮細胞増殖に何ら阻害効果を示さない。
【図面の簡単な説明】
【図1】
Bs(scFv)4−IgGおよびBs(scFv)2−Fab分子の模式図である。Bs(scFv)4−IgGでは、ヒトIgG1分子のVHおよびVLドメインが2個の異なる特異性のscFv抗体に置換されている。哺乳動物細胞におけるscFv−軽鎖およびscFv−重鎖融合ポリペプチドの同時発現は、二価のIgG様二重特異性分子の形成をもたらす。Bs(scFv)2−Fabにおいて、重鎖CH1ドメインのC末端に停止コドンが導入されており、これが二価のFab様二重特異性分子の発現をもたらす(図2Aをも参照されたい)。
【図2】
発現組み立て物と、精製したBs(scFv)4−IgGおよびBs(scFv)2−Fab抗体の例を示す(ドメインは一定の拡大率ではない)。図A:個々のscFv組み立て物を、5’末端で哺乳動物細胞での分泌のためのリーダー配列に、そして3’末端でヒトIgG分子のCLまたはCH1ドメインに融合させる。図B:プロテインG精製したBs(scFv)4−IgGおよびBs(scFv)2−Fab抗体のSDS−PAGE分析。1−3列は非還元条件でのランである。1列、c−p1C11、キメラIgG1;2列、Bs(scFv)4−IgG;3列、Bs(scFv)2−Fab。4−6列は還元条件でのランである。4列、c−p1C11;5列、Bs(scFv)4−IgG;6列、Bs(scFv)2−Fab。分子量標準の位置もまた示す。
【図3】
Bs(scFv)4−IgGおよびBs(scFv)2Fab抗体の二重特異性についてのELISA検定の結果を示す。図Aは、KDR ECD Igドメイン除去突然変異体−AP融合蛋白への、Bs(scFv)4−IgG、Bs(scFv)2−Fabおよびその親抗体の結合を示す。図Bは、異なるKDR ECD Igドメイン除去突然変異体KDR(Ig1−3)およびKDR(Ig3−7)−AP上に位置する二つの異なるエピトープへの、Bs(scFv)4−IgGおよびBs(scFv)2−Fabによる同時結合の検出のための、架橋ELISAを示す。BsAbを、KDR(Ig1−7)−AP、KDR(Ig1−3)−APまたはKDR(Ig3−7)−APと共に溶液中でインキュベートし、タグ無しのKDR(Ig1−3)で被覆したプレートに移す。可溶相抗体/KDR変異体−AP複合体と固定化KDR(Ig1−3)との間で形成した架橋複合体を、プレートに結合したAP活性を測定することにより検出する。示したデータは三重の測定値の平均値±SDである。
【図4】
固定化した完全長KDR−AP(図A)およびFlk−1−AP(図B)への、Bs(scFv)4−IgG、Bs(scFv)2−Fabおよびその親抗体の用量依存的結合を示す。示したデータは三重の測定値の平均値±SDである。
【図5】
Bs(scFv)4−IgGおよびc−p1C11による、固定化VEGFへのKDRの結合の阻害を証明している。示したデータは三重の測定値の平均値±SDである。
【図6】
Bs(scFv)4−IgGおよびc−p1C11による、KDRレセプターの、VEGFにより刺激された燐酸化の用量依存的阻害を証明している。KDRによりトランスフェクトさせた293細胞を種々の量の抗体によりRTで15分間処理し、その後VEGF 20ng/mlと共に(対照群を除く)RTでさらに15分間インキュベートした。KDRの燐酸化をかつて記載されたプロトコルに従い分析する(Zhu et al.(1998) Cancer Res. 58, 3209−3214;Zhu et al(1999) Cancer Lett. 136, 203−213)。
Claims (77)
- 2個の第一ポリペプチドと2個の第二ポリペプチドの複合体を含む抗原結合蛋白であって、
第一ポリペプチドが免疫グロブリン軽鎖定常ドメイン(CLドメイン)のN末端に位置する抗原結合部位を有し、ここでこのCLドメインは免疫グロブリン重鎖第一定常ドメイン(CH1ドメイン)と安定に結合でき、そして
第二ポリペプチドが該CH1ドメインのN末端に位置する抗原結合部位を有し、このCH1ドメインの後には、安定な自己結合ができる1またはそれ以上の重鎖定常ドメインがある、
抗原結合蛋白。 - 1またはそれ以上の前記抗原結合部位が一本鎖Fvにより提供される、請求項1に記載の抗原結合蛋白。
- 前記第一および第二ポリペプチドの前記抗原結合部位が異なる特異性を有する、請求項1に記載の抗原結合蛋白。
- 前記第一および第二ポリペプチドの前記抗原結合部位が同じ特異性を有する、請求項1に記載の抗原結合蛋白。
- 前記特異性が異なる抗原上に存在するエピトープに対するものである、請求項3に記載の抗原結合蛋白。
- 前記特異性が同じ抗原上に存在するエピトープに対するものである、請求項3に記載の抗原結合蛋白。
- 前記第一ポリペプチドと第二ポリペプチドが共有結合している、請求項1に記載の抗原結合蛋白。
- 前記2個の第二ポリペプチドが共有結合している、請求項1に記載の抗原結合蛋白。
- 前記第二ポリペプチドがイソタイプIgA、IgDまたはIgGの抗体のCH1、CH2およびCH3ドメインを有する、請求項1に記載の抗原結合蛋白。
- 前記第二ポリペプチドがイソタイプIgEまたはIgMの抗体のCH1、CH2、CH3およびCH4ドメインを有する、請求項1に記載の抗原結合蛋白。
- 前記定常ドメインが哺乳動物の定常ドメインである、請求項1に記載の抗原結合蛋白。
- 前記定常ドメインがヒト定常ドメインである、請求項1に記載の抗原結合蛋白。
- 1またはそれ以上の前記一本鎖Fvがマウス一本鎖Fvである、請求項1に記載の抗原結合蛋白。
- 1またはそれ以上の前記一本鎖Fvが、ヒトフレームワーク領域を持つキメラ一本鎖Fvである、請求項1に記載の抗原結合蛋白。
- 前記一本鎖FvがヒトVLおよびVHドメインである、請求項1に記載の抗原結合蛋白。
- 安定な自己結合ができる前記重鎖定常ドメインが、任意の免疫グロブリンイソタイプまたはサブタイプ由来のCH2、CH3、およびCH4ドメインから成る群から選ばれる、請求項1に記載の抗原結合蛋白。
- Fcレセプターと結合できる、請求項1に記載の抗原結合蛋白。
- 補体仲介細胞傷害(CMC)を奏効することのできる、請求項1に記載の抗原結合蛋白。
- 抗体依存性細胞仲介細胞傷害(ADCC)を奏効することのできる、請求項1に記載の抗原結合蛋白。
- 抗腫瘍物質に連結している、請求項1に記載の抗原結合蛋白。
- 検出可能シグナル生成物質に連結している、請求項1に記載の抗原結合蛋白。
- VEGFレセプターの活性化を中和する、請求項1に記載の抗原結合蛋白。
- VEGFレセプターが哺乳動物のものである、請求項22に記載の抗原結合蛋白。
- VEGFレセプターが人間のものである、請求項22に記載の抗原結合蛋白。
- VEGFレセプターがflt−1またはflk−1遺伝子によりコードされている、請求項24に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がKDRに特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がFLT1に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がFLT4に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がEGF−Rに特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がHER2に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がFGF−Rに特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がPDGF−Rに特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がレセプターチロシンキナーゼに特異的である、請求項1に記載の抗原結合蛋白。
- 抗原結合部位のうち少なくとも1個がTekに特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個がTie−2に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち一方がKDRに特異的であり、他方の前記結合部位がFLT1に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち一方がKDRに特異的であり、他方の抗原結合部位がFLT4、EGF−R、HER2、FGF−R、PDGF−R、TekおよびTie2から成る群から選ばれる抗原に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち一方がEGF−Rに特異的であり、他方の抗原結合部位がHER2に特異的である、請求項1に記載の抗原結合蛋白。
- 前記抗原結合部位のうち少なくとも1個が免疫系エフェクター細胞の細胞表面抗原に特異的である、請求項1に記載の抗原結合蛋白。
- 免疫系エフェクター細胞がT細胞、マクロファージ、好中球、またはNK細胞である、請求項39に記載の抗原結合蛋白。
- 前記細胞表面抗原がCD3、CD16、CD28、CD32、CD64、Fcレセプター、サイトカインレセプターまたはリンホカインレセプターである、請求項39に記載の抗原結合蛋白。
- 前記細胞表面抗原がサイトカインまたはリンホカインのレセプターであり、そして抗原結合部位がサイトカインもしくはリンホカインまたはそれらの一部のアミノ酸配列を含む、請求項39に記載の抗原結合蛋白。
- レセプターがIL−2、IL−4、IL−5、GM−CSFまたはG−CSFのレセプターである、請求項42に記載の抗原結合蛋白。
- 前記抗原結合部位のうち1個が免疫系エフェクター細胞の細胞表面抗原に特異的である、請求項26、27、28、29、30、31、32、33、34および35のいずれか1項に記載の抗原結合蛋白。
- 前記免疫系エフェクター細胞がT細胞、マクロファージ、好中球、またはNK細胞である、請求項44に記載の抗原結合蛋白。
- 前記細胞表面抗原がCD3、CD16、CD28、CD32、CD64、Fcレセプター、サイトカインレセプターまたはリンホカインレセプターである、請求項44に記載の抗原結合蛋白。
- 2個の第一ポリペプチドと2個の第二ポリペプチドの複合体を含む抗原結合蛋白であって、
第一ポリペプチドが免疫グロブリン軽鎖定常ドメイン(CLドメイン)のN末端に位置する一本鎖Fvを有し、ここでこのCLドメインは免疫グロブリン重鎖第一定常ドメイン(CH1ドメイン)と安定に結合でき、そして
第二ポリペプチドが該CH1ドメインのN末端に位置する一本鎖Fvを有し、ここでこのCH1ドメインの後には、安定な自己結合ができる1またはそれ以上の重鎖定常ドメインがある、
抗原結合蛋白。 - 前記第一および第二ポリペプチドの抗原結合部位が異なる特異性を有する、請求項47に記載の抗原結合蛋白。
- 前記第一および第二ポリペプチドの抗原結合部位が同じ特異性を有する、請求項47に記載の抗原結合蛋白。
- KDRの活性化を中和する、請求項47に記載の抗原結合蛋白。
- 前記一本鎖Fvの一方または両方が一本鎖Fv p1c11である、請求項50に記載の抗原結合蛋白。
- 前記一本鎖Fvの一方または両方が一本鎖Fv p4G7である、請求項50に記載の抗原結合蛋白。
- FLT1の活性化を中和する、請求項47に記載の抗原結合蛋白。
- 前記一本鎖Fvの一方または両方が一本鎖Fv 6.12である、請求項53に記載の抗原結合蛋白。
- 前記一本鎖Fvの一方または両方の相補性決定領域(CDR)のアミノ酸配列が、
CDRH1では配列番号1;
CDRH2では配列番号2;
CDRH3では配列番号3;
CDRL1では配列番号4;
CDRL2では配列番号5;そして、
CDRL3では配列番号6、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の相補性決定領域(CDR)をコードしているヌクレオチド配列が、
CDRH1については配列番号9;
CDRH2については配列番号10;
CDRH3については配列番号11;
CDRL1については配列番号12;
CDRL2については配列番号13;そして、
CDRL3については配列番号14、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の可変ドメインのアミノ酸配列が、
重鎖可変ドメイン(VH)については配列番号7;そして、
軽鎖可変ドメイン(VL)については配列番号8、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の可変ドメインをコードしているヌクレオチド配列が、
重鎖可変ドメイン(VH)については配列番号15;そして、
軽鎖可変ドメイン(VL)については配列番号16、
で示される、請求項50に記載の抗原結合蛋白。 - 一本鎖Fvの一方または両方の相補性決定領域(CDR)のアミノ酸配列が、
CDRH1では配列番号1;
CDRH2では配列番号21;
CDRH3では配列番号3;
CDRL1では配列番号4;
CDRL2では配列番号5;そして、
CDRL3では配列番号6、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の相補性決定領域(CDR)をコードしているヌクレオチド配列が、
CDRH1については配列番号9;
CDRH2については配列番号24;
CDRH3については配列番号11;
CDRL1については配列番号12;
CDRL2については配列番号13;そして、
CDRL3については配列番号14、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の可変ドメインのアミノ酸配列が、
重鎖可変ドメイン(VH)については配列番号22;そして、
軽鎖可変ドメイン(VL)については配列番号23、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方の可変ドメインをコードしているヌクレオチド配列が、
重鎖可変ドメイン(VH)については配列番号25;そして、
軽鎖可変ドメイン(VL)については配列番号26、
で示される、請求項50に記載の抗原結合蛋白。 - 前記一本鎖Fvの一方または両方が配列番号27または配列番号28で示されるヌクレオチド配列を有する、請求項50に記載の抗原結合蛋白。
- (a) 宿主細胞において、
免疫グロブリン軽鎖定常ドメイン(CLドメイン)のN末端に位置する抗原結合部位を有する第一ポリペプチドをコードしている組換えDNA組み立て物、ここでこのCLドメインは免疫グロブリン重鎖第一定常ドメイン(CH1ドメイン)と安定に結合できる、および
該CH1ドメインのN末端に位置する抗原結合部位を有する第二ポリペプチドをコードしている組換えDNA組み立て物、ここでこのCH1ドメインの後には、安定な自己結合ができる1またはそれ以上の重鎖定常ドメインがある、
を、該ポリペプチドの発現および該抗原結合蛋白の形成をさせるに充分な時間および方法で同時発現させ;そして、
(b) 該抗原結合蛋白を回収する、
ことを含む、抗原結合蛋白を製造する方法。 - 前記組み立て物が同じDNA発現ベクター上にある、請求項64に記載の方法。
- 前記組み立て物が異なるDNA発現ベクター上にある、請求項64に記載の方法。
- 前記宿主細胞が細菌細胞、酵母細胞または哺乳動物細胞である、請求項64に記載の方法。
- 前記抗原結合蛋白が宿主細胞から分泌される、請求項64に記載の方法。
- 細胞を、前記該レセプターの活性化を中和するに充分な量の請求項1に記載の抗原結合蛋白で処理することを含む、VEGFレセプターの活性化を中和する方法。
- 前記抗原結合部位のうち少なくとも1個がKDRに特異的である、請求項69に記載の方法。
- 前記抗原結合部位のうち少なくとも1個がFLT1に特異的である、請求項69に記載の方法。
- 細胞を、腫瘍の増殖を低下させるに充分な量の請求項1に記載の抗原結合蛋白で処理することを含み、ここで前記抗原結合部位のうち少なくとも1個はVEGFレセプターに特異的である、腫瘍の増殖を低下させる方法。
- 前記抗原結合部位のうち少なくとも1個がKDRに特異的である、請求項72に記載の方法。
- 前記抗原結合部位のうち少なくとも1個がFLT1に特異的である、請求項72に記載の方法。
- 細胞を、血管新生を阻害するに充分な量の請求項1に記載の抗原結合蛋白で処理することを含み、ここで抗原結合部位のうち少なくとも1個はVEGFレセプターに特異的である、血管新生を阻害する方法。
- 前記抗原結合部位のうち少なくとも1個がKDRに特異的である、請求項75に記載の方法。
- 前記抗原結合部位のうち少なくとも1個がFLT1に特異的である、請求項75に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US20674900P | 2000-05-24 | 2000-05-24 | |
| PCT/US2001/016924 WO2001090192A2 (en) | 2000-05-24 | 2001-05-24 | Bispecific immunoglobulin-like antigen binding proteins and method of production |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004511430A true JP2004511430A (ja) | 2004-04-15 |
| JP2004511430A5 JP2004511430A5 (ja) | 2008-07-17 |
Family
ID=22767777
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001587003A Pending JP2004511430A (ja) | 2000-05-24 | 2001-05-24 | 二重特異性免疫グロブリン様抗原結合蛋白および製造方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US20020103345A1 (ja) |
| EP (1) | EP1299419A2 (ja) |
| JP (1) | JP2004511430A (ja) |
| AU (1) | AU2001264946A1 (ja) |
| CA (1) | CA2409991A1 (ja) |
| WO (1) | WO2001090192A2 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005518336A (ja) * | 2001-06-26 | 2005-06-23 | イムクローン システムズ インコーポレイティド | Vegf受容体に結合する二重特異性抗体 |
| JP2005526482A (ja) * | 2001-08-10 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Vegfr−1を発現する幹細胞の単離および動員 |
| JP2009504191A (ja) * | 2005-08-19 | 2009-02-05 | アボット・ラボラトリーズ | 二重可変ドメイン免疫グロブリン及びその使用 |
| JP2010535032A (ja) * | 2007-07-31 | 2010-11-18 | メディミューン,エルエルシー | 多重特異性エピトープ結合性タンパク質およびその用途 |
| JP2012228248A (ja) * | 2005-08-19 | 2012-11-22 | Abbott Lab | 二重可変ドメイン免疫グロブリン及びその使用 |
Families Citing this family (250)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6448077B1 (en) * | 1994-02-10 | 2002-09-10 | Imclone Systems, Inc. | Chimeric and humanized monoclonal antibodies specific to VEGF receptors |
| US20030108545A1 (en) * | 1994-02-10 | 2003-06-12 | Patricia Rockwell | Combination methods of inhibiting tumor growth with a vascular endothelial growth factor receptor antagonist |
| CA2311729A1 (en) * | 1998-01-23 | 1999-07-29 | Imclone Systems Incorporated | Purified populations of stem cells |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| JP2005508298A (ja) * | 2001-06-20 | 2005-03-31 | イムクローン システムズ インコーポレイティド | アテローム性動脈硬化症及び他の炎症性疾患を処置する方法 |
| US20060073141A1 (en) * | 2001-06-28 | 2006-04-06 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| US20050271663A1 (en) * | 2001-06-28 | 2005-12-08 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| DK1399484T3 (da) * | 2001-06-28 | 2010-11-08 | Domantis Ltd | Dobbelt-specifik ligand og anvendelse af denne |
| US8298769B2 (en) | 2001-08-23 | 2012-10-30 | Rsr Limited | Epitope regions of a thyrotrophin (TSH) receptor, uses thereof and antibodies thereto |
| EP2075256A2 (en) | 2002-01-14 | 2009-07-01 | William Herman | Multispecific binding molecules |
| CA2478169C (en) | 2002-03-04 | 2013-04-16 | Imclone Systems Incorporated | Human antibodies specific to kdr and uses thereof |
| US7696320B2 (en) | 2004-08-24 | 2010-04-13 | Domantis Limited | Ligands that have binding specificity for VEGF and/or EGFR and methods of use therefor |
| CN1678634A (zh) * | 2002-06-28 | 2005-10-05 | 多曼蒂斯有限公司 | 免疫球蛋白单个变体抗原结合区及其特异性构建体 |
| US9321832B2 (en) * | 2002-06-28 | 2016-04-26 | Domantis Limited | Ligand |
| HUE025086T2 (en) * | 2002-10-10 | 2016-02-29 | Merck Patent Gmbh | Pharmaceutical preparations for ERB-B1 receptor |
| JP2006523090A (ja) * | 2002-12-27 | 2006-10-12 | ドマンティス リミテッド | リガンドに、そしてリガンド受容体に特異的な二重特異性単一ドメイン抗体 |
| CA2528961A1 (en) | 2003-06-09 | 2005-01-06 | Samuel Waksal | Methods of inhibiting receptor tyrosine kinases with an extracellular antagonist and an intracellular antagonist |
| EP2311945A1 (en) | 2003-10-14 | 2011-04-20 | Chugai Seiyaku Kabushiki Kaisha | Bispecific antibodies substituting for functional proteins |
| AU2005206536B2 (en) * | 2004-01-16 | 2010-09-02 | Regeneron Pharmaceuticals, Inc. | Fusion polypeptides capable of activating receptors |
| US8298532B2 (en) | 2004-01-16 | 2012-10-30 | Regeneron Pharmaceuticals, Inc. | Fusion polypeptides capable of activating receptors |
| US20050282233A1 (en) * | 2004-03-05 | 2005-12-22 | Ludwig Institute For Cancer Research | Multivalent antibody materials and methods for VEGF/PDGF family of growth factors |
| ATE507240T1 (de) * | 2004-03-05 | 2011-05-15 | Vegenics Pty Ltd | Materialien und verfahren für wachstumsfaktorbindende konstrukte |
| EP1732946B1 (en) * | 2004-03-08 | 2011-07-27 | ZymoGenetics, Inc. | Dimeric fusion proteins and materials and methods for producing them |
| CN1997382A (zh) * | 2004-05-05 | 2007-07-11 | 梅里麦克制药股份有限公司 | 调节生物活性的双特异性结合剂 |
| EP1773881A4 (en) * | 2004-05-13 | 2008-08-06 | Imclone Systems Inc | Inhibition of macrophage-stimulating protein receptor (RON) |
| MXPA06014031A (es) | 2004-06-01 | 2007-10-08 | Domantis Ltd | Anticuerpos de fusion biespecificos con vida media de serica mejorada. |
| KR101699142B1 (ko) * | 2004-06-18 | 2017-01-23 | 암브룩스, 인코포레이티드 | 신규 항원-결합 폴리펩티드 및 이의 용도 |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| ES2523457T3 (es) * | 2004-11-18 | 2014-11-26 | Imclone Llc | Anticuerpos contra el receptor 1 del factor de crecimiento endotelial vascular |
| ES2323651T3 (es) * | 2005-01-05 | 2009-07-22 | F-Star Biotechnologische Forschungs- Und Entwicklungsges.M.B.H. | Dominios sinteticos de inmunoglobulina con propiedades de union elaborados por ingenieria en regiones de la molecula diferentes de las regiones que determinan la complementariedad. |
| WO2006105021A2 (en) | 2005-03-25 | 2006-10-05 | Tolerrx, Inc. | Gitr binding molecules and uses therefor |
| WO2006106905A1 (ja) | 2005-03-31 | 2006-10-12 | Chugai Seiyaku Kabushiki Kaisha | 会合制御によるポリペプチド製造方法 |
| US20120237442A1 (en) * | 2005-04-06 | 2012-09-20 | Ibc Pharmaceuticals, Inc. | Design and Construction of Novel Multivalent Antibodies |
| ES2452115T3 (es) | 2005-06-17 | 2014-03-31 | Imclone Llc | Un anticuerpo anti-PDGFRalfa para su uso en el tratamiento de cáncer de huesos metastásico |
| JP5372500B2 (ja) * | 2005-06-17 | 2013-12-18 | トレラクス リクイデーティング トラスト | Ilt3結合分子およびその使用 |
| US10307481B2 (en) | 2005-07-25 | 2019-06-04 | Aptevo Research And Development Llc | CD37 immunotherapeutics and uses thereof |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| WO2007063308A2 (en) * | 2005-12-01 | 2007-06-07 | Domantis Limited | Noncompetitive domain antibody formats that bind interleukin 1 receptor type 1 |
| AP2008004569A0 (en) | 2006-02-03 | 2008-08-31 | Imclone Systems Inc | IGR-IR antagonists as adjuvants for treatment of prostrate cancer |
| AU2007245164A1 (en) | 2006-03-28 | 2007-11-08 | Biogen Idec Ma Inc. | Anti-IGF-IR antibodies and uses thereof |
| CN105177091A (zh) | 2006-03-31 | 2015-12-23 | 中外制药株式会社 | 用于纯化双特异性抗体的抗体修饰方法 |
| EP2006381B1 (en) | 2006-03-31 | 2016-02-03 | Chugai Seiyaku Kabushiki Kaisha | Method for controlling blood pharmacokinetics of antibodies |
| NZ573646A (en) | 2006-06-12 | 2012-04-27 | Wyeth Llc | Single-chain multivalent binding proteins with effector function |
| EP2041180B8 (en) * | 2006-06-19 | 2014-03-05 | Liquidating Trust | Ilt3 binding molecules and uses therefor |
| AT503889B1 (de) | 2006-07-05 | 2011-12-15 | Star Biotechnologische Forschungs Und Entwicklungsges M B H F | Multivalente immunglobuline |
| EA019595B1 (ru) | 2007-04-17 | 2014-04-30 | Имклоун Элэлси | СПЕЦИФИЧНЫЕ ИНГИБИТОРЫ PDGFRβ |
| KR20100040840A (ko) * | 2007-06-06 | 2010-04-21 | 도만티스 리미티드 | 폴리펩티드,항체 가변 도메인 및 길항제 |
| KR100883430B1 (ko) * | 2007-06-13 | 2009-02-12 | 한국생명공학연구원 | 혈관내피성장인자 수용체를 중화하는 인간 단클론항체 및그 용도 |
| ES2627223T3 (es) | 2007-06-26 | 2017-07-27 | F-Star Biotechnologische Forschungs- Und Entwicklungsges.M.B.H | Presentación de agentes de unión |
| ES2591281T3 (es) | 2007-07-12 | 2016-11-25 | Gitr, Inc. | Terapias de combinación que emplean moléculas de enlazamiento a GITR |
| EP2197490A2 (en) * | 2007-08-28 | 2010-06-23 | Biogen Idec MA, Inc. | Compositions that bind multiple epitopes of igf-1r |
| EP4368721A2 (en) | 2007-09-26 | 2024-05-15 | Chugai Seiyaku Kabushiki Kaisha | Method of modifying isoelectric point of antibody via amino acid substitution in cdr |
| CN104004088B (zh) | 2007-09-26 | 2017-11-07 | Ucb医药有限公司 | 双特异性抗体融合物 |
| EP2050764A1 (en) * | 2007-10-15 | 2009-04-22 | sanofi-aventis | Novel polyvalent bispecific antibody format and uses thereof |
| UY31478A1 (es) * | 2007-11-21 | 2009-07-17 | Inhibicion del receptor para la proteina estimulante del macrofago (ron) y métodos para el tratamiento de lo mismo | |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| WO2009120922A2 (en) | 2008-03-27 | 2009-10-01 | Zymogenetics, Inc. | Compositions and methods for inhibiting pdgfrbeta and vegf-a |
| WO2009126944A1 (en) | 2008-04-11 | 2009-10-15 | Trubion Pharmaceuticals, Inc. | Cd37 immunotherapeutic and combination with bifunctional chemotherapeutic thereof |
| EP2113255A1 (en) | 2008-05-02 | 2009-11-04 | f-star Biotechnologische Forschungs- und Entwicklungsges.m.b.H. | Cytotoxic immunoglobulin |
| EP2346526A2 (en) | 2008-09-22 | 2011-07-27 | Massachusetts Institute of Technology | Compositions of and methods of using ligand dimers |
| PL2334705T3 (pl) * | 2008-09-26 | 2017-06-30 | Ucb Biopharma Sprl | Produkty biologiczne |
| JP2012507299A (ja) * | 2008-10-31 | 2012-03-29 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | Light標的分子およびその使用 |
| WO2010096394A2 (en) | 2009-02-17 | 2010-08-26 | Redwood Biosciences, Inc. | Aldehyde-tagged protein-based drug carriers and methods of use |
| KR101431318B1 (ko) | 2009-04-02 | 2014-08-20 | 로슈 글리카트 아게 | 전장 항체 및 단일쇄 fab 단편을 포함하는 다중특이성 항체 |
| PL2417156T3 (pl) | 2009-04-07 | 2015-07-31 | Roche Glycart Ag | Trójwartościowe, bispecyficzne przeciwciała |
| US9676845B2 (en) | 2009-06-16 | 2017-06-13 | Hoffmann-La Roche, Inc. | Bispecific antigen binding proteins |
| WO2011028952A1 (en) * | 2009-09-02 | 2011-03-10 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| ES2788869T3 (es) * | 2009-09-03 | 2020-10-23 | Merck Sharp & Dohme | Anticuerpos anti-GITR |
| SG10201408401RA (en) | 2009-09-16 | 2015-01-29 | Genentech Inc | Coiled coil and/or tether containing protein complexes and uses thereof |
| ES2581571T3 (es) | 2009-11-17 | 2016-09-06 | Janssen Biotech, Inc. | Presentación de proteínas diméricas de disulfuro vinculado en fagos filamentosos |
| US8450086B2 (en) | 2009-11-17 | 2013-05-28 | Centocor Ortho Biotech Inc. | Bacterial membrane protein secretion |
| EP2555788B1 (en) | 2010-03-24 | 2017-10-11 | Massachusetts Institute of Technology | NEUREGULIN DIMER FOR AN ErbB/HER RECEPTOR FOR USE IN REDUCING CARDIOTOXICITY. |
| AR080793A1 (es) | 2010-03-26 | 2012-05-09 | Roche Glycart Ag | Anticuerpos biespecificos |
| EP2598530A2 (en) | 2010-07-29 | 2013-06-05 | Xencor, Inc. | Antibodies with modified isoelectric points |
| JP5758004B2 (ja) | 2010-08-24 | 2015-08-05 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | ジスルフィドによって安定化されたFv断片を含む二重特異性抗体 |
| CA2807269A1 (en) | 2010-08-24 | 2012-03-01 | Roche Glycart Ag | Activatable bispecific antibodies |
| BR112013012213A2 (pt) | 2010-11-17 | 2020-09-01 | Chugai Seiyaku Kabushiki Kaisha | moléculas de ligação a antígeno mul tlespecíficas tendo função alternativa à função dos fatores viii, ix e x de coagulação sanguínea, e anticorpo bies- 5 pecífico, seus usos na prevenção ou tratamento de hemorragia, ácido nucleico, vetor, célula, método para produzir as referidas moléculas de ligação, composição farmacêutica e kit |
| BR112013013003A2 (pt) | 2010-11-24 | 2016-08-09 | Glaxo Group Ltd | proteína de ligação de antígeno, e, composição farmacêutica |
| BR112013013311A2 (pt) | 2010-11-30 | 2017-09-19 | Chugai Pharmaceutical Co Ltd | agente terapêutico de indução de citotoxicidade |
| JP5766296B2 (ja) | 2010-12-23 | 2015-08-19 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | ポリペプチド−ポリヌクレオチド複合体、およびエフェクター成分の標的化された送達におけるその使用 |
| WO2012097333A2 (en) | 2011-01-14 | 2012-07-19 | Redwood Bioscience, Inc. | Aldehyde-tagged immunoglobulin polypeptides and method of use thereof |
| CN103502271B (zh) | 2011-02-28 | 2016-10-26 | 霍夫曼-拉罗奇有限公司 | 抗原结合蛋白 |
| RU2013141078A (ru) | 2011-02-28 | 2015-04-10 | Ф. Хоффманн-Ля Рош Аг | Одновалентные антигенсвязывающие белки |
| EP2686014A1 (en) | 2011-03-16 | 2014-01-22 | Sanofi | Uses of a dual v region antibody-like protein |
| IL273982B2 (en) | 2011-08-05 | 2023-03-01 | Regeneron Pharma | Humanized mice possess a universal light chain |
| US10851178B2 (en) | 2011-10-10 | 2020-12-01 | Xencor, Inc. | Heterodimeric human IgG1 polypeptides with isoelectric point modifications |
| CN109134658B (zh) | 2011-10-31 | 2022-10-14 | 中外制药株式会社 | 控制了重链与轻链的缔合的抗原结合分子 |
| CA2854806A1 (en) | 2011-11-07 | 2013-05-16 | Medimmune, Llc | Multispecific and multivalent binding proteins and uses thereof |
| EP2812357B1 (en) | 2012-02-10 | 2020-11-04 | F.Hoffmann-La Roche Ag | Single-chain antibodies and other heteromultimers |
| CA2871882A1 (en) | 2012-06-27 | 2014-01-03 | F. Hoffmann-La Roche Ag | Method for making antibody fc-region conjugates comprising at least one binding entity that specifically binds to a target and uses thereof |
| MX354862B (es) | 2012-06-27 | 2018-03-23 | Hoffmann La Roche | Método para la producción de entidades dirigidas altamente selectivas hechas a la medida y biespecíficas que contienen dos entidades de unión diferentes. |
| US20150231241A1 (en) | 2012-08-14 | 2015-08-20 | Ibc Pharmaceuticals, Inc. | Combination therapy for inducing immune response to disease |
| US9682143B2 (en) | 2012-08-14 | 2017-06-20 | Ibc Pharmaceuticals, Inc. | Combination therapy for inducing immune response to disease |
| US10131710B2 (en) | 2013-01-14 | 2018-11-20 | Xencor, Inc. | Optimized antibody variable regions |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| KR102211837B1 (ko) | 2013-01-14 | 2021-02-03 | 젠코어 인코포레이티드 | 신규한 이형이량체 단백질 |
| US9701759B2 (en) | 2013-01-14 | 2017-07-11 | Xencor, Inc. | Heterodimeric proteins |
| US10487155B2 (en) | 2013-01-14 | 2019-11-26 | Xencor, Inc. | Heterodimeric proteins |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| EP2945969A1 (en) | 2013-01-15 | 2015-11-25 | Xencor, Inc. | Rapid clearance of antigen complexes using novel antibodies |
| CA3093606A1 (en) | 2013-03-15 | 2014-09-18 | Xencor, Inc. | Heterodimeric proteins for induction of t cells |
| US10106624B2 (en) | 2013-03-15 | 2018-10-23 | Xencor, Inc. | Heterodimeric proteins |
| US10519242B2 (en) | 2013-03-15 | 2019-12-31 | Xencor, Inc. | Targeting regulatory T cells with heterodimeric proteins |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| RU2730594C2 (ru) | 2013-09-27 | 2020-08-24 | Чугаи Сейяку Кабусики Кайся | Способ получения полипептидного гетеромультимера |
| JP6422956B2 (ja) | 2013-10-11 | 2018-11-14 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性ドメイン交換共通可変軽鎖抗体 |
| MY178233A (en) | 2013-12-20 | 2020-10-07 | Hutchinson Fred Cancer Res | Tagged chimeric effector molecules and receptors thereof |
| JOP20200094A1 (ar) | 2014-01-24 | 2017-06-16 | Dana Farber Cancer Inst Inc | جزيئات جسم مضاد لـ pd-1 واستخداماتها |
| JOP20200096A1 (ar) | 2014-01-31 | 2017-06-16 | Children’S Medical Center Corp | جزيئات جسم مضاد لـ tim-3 واستخداماتها |
| BR122024001145A2 (pt) | 2014-03-14 | 2024-02-27 | Novartis Ag | Molécula de anticorpo isolada capaz de se ligar a lag-3, seu método de produção, composição farmacêutica, ácidos nucleicos, vetor de expressão, método para detecção de lag-3 em uma amostra biológica, e uso das referidas molécula de anticorpo e composição |
| US20170335281A1 (en) | 2014-03-15 | 2017-11-23 | Novartis Ag | Treatment of cancer using chimeric antigen receptor |
| WO2015149077A1 (en) | 2014-03-28 | 2015-10-01 | Xencor, Inc. | Bispecific antibodies that bind to cd38 and cd3 |
| SG11201607434WA (en) | 2014-04-07 | 2016-10-28 | Chugai Pharmaceutical Co Ltd | Immunoactivating antigen-binding molecule |
| WO2015174439A1 (ja) | 2014-05-13 | 2015-11-19 | 中外製薬株式会社 | 免疫抑制機能を有する細胞に対するt細胞リダイレクト抗原結合分子 |
| GB201411320D0 (en) | 2014-06-25 | 2014-08-06 | Ucb Biopharma Sprl | Antibody construct |
| AU2015282627B2 (en) | 2014-06-30 | 2020-04-02 | Glykos Finland Oy | Saccharide derivative of a toxic payload and antibody conjugates thereof |
| US11542488B2 (en) | 2014-07-21 | 2023-01-03 | Novartis Ag | Sortase synthesized chimeric antigen receptors |
| EP3722316A1 (en) | 2014-07-21 | 2020-10-14 | Novartis AG | Treatment of cancer using a cd33 chimeric antigen receptor |
| WO2016014565A2 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Treatment of cancer using humanized anti-bcma chimeric antigen receptor |
| WO2016014530A1 (en) | 2014-07-21 | 2016-01-28 | Novartis Ag | Combinations of low, immune enhancing. doses of mtor inhibitors and cars |
| EP4205749A1 (en) | 2014-07-31 | 2023-07-05 | Novartis AG | Subset-optimized chimeric antigen receptor-containing cells |
| WO2016025880A1 (en) | 2014-08-14 | 2016-02-18 | Novartis Ag | Treatment of cancer using gfr alpha-4 chimeric antigen receptor |
| CN112410363A (zh) | 2014-08-19 | 2021-02-26 | 诺华股份有限公司 | 抗cd123嵌合抗原受体(car)用于癌症治疗 |
| US10577417B2 (en) | 2014-09-17 | 2020-03-03 | Novartis Ag | Targeting cytotoxic cells with chimeric receptors for adoptive immunotherapy |
| TWI700300B (zh) | 2014-09-26 | 2020-08-01 | 日商中外製藥股份有限公司 | 中和具有第viii凝血因子(fviii)機能替代活性的物質之抗體 |
| TWI701435B (zh) | 2014-09-26 | 2020-08-11 | 日商中外製藥股份有限公司 | 測定fviii的反應性之方法 |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| ES2952717T3 (es) | 2014-10-14 | 2023-11-03 | Novartis Ag | Moléculas de anticuerpos contra PD-L1 y usos de las mismas |
| AU2015353416C1 (en) | 2014-11-26 | 2022-01-27 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and CD38 |
| PE20171324A1 (es) | 2014-11-26 | 2017-09-11 | Xencor Inc | Anticuerpos heterodimericos que se unen a cd3 y a antigenos tumorales |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| US20180334490A1 (en) | 2014-12-03 | 2018-11-22 | Qilong H. Wu | Methods for b cell preconditioning in car therapy |
| CN107001482B (zh) | 2014-12-03 | 2021-06-15 | 豪夫迈·罗氏有限公司 | 多特异性抗体 |
| WO2016105450A2 (en) | 2014-12-22 | 2016-06-30 | Xencor, Inc. | Trispecific antibodies |
| WO2016141387A1 (en) | 2015-03-05 | 2016-09-09 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| EP3279216A4 (en) | 2015-04-01 | 2019-06-19 | Chugai Seiyaku Kabushiki Kaisha | PROCESS FOR PREPARING POLYPEPTIDE HETERO OLIGOMER |
| SG11201708191XA (en) | 2015-04-08 | 2017-11-29 | Novartis Ag | Cd20 therapies, cd22 therapies, and combination therapies with a cd19 chimeric antigen receptor (car) - expressing cell |
| WO2016172583A1 (en) | 2015-04-23 | 2016-10-27 | Novartis Ag | Treatment of cancer using chimeric antigen receptor and protein kinase a blocker |
| EP3288570A4 (en) * | 2015-04-29 | 2018-11-21 | Fred Hutchinson Cancer Research Center | Modified stem cells and uses thereof |
| EP3316902A1 (en) | 2015-07-29 | 2018-05-09 | Novartis AG | Combination therapies comprising antibody molecules to tim-3 |
| WO2017019896A1 (en) | 2015-07-29 | 2017-02-02 | Novartis Ag | Combination therapies comprising antibody molecules to pd-1 |
| EP3317301B1 (en) | 2015-07-29 | 2021-04-07 | Novartis AG | Combination therapies comprising antibody molecules to lag-3 |
| AU2016326449B2 (en) | 2015-09-21 | 2024-10-31 | Aptevo Research And Development Llc | CD3 binding polypeptides |
| CN108602884B (zh) * | 2015-11-08 | 2024-06-25 | 豪夫迈·罗氏有限公司 | 筛选多特异性抗体的方法 |
| EP3378487B1 (en) | 2015-11-18 | 2022-03-16 | Chugai Seiyaku Kabushiki Kaisha | Combination therapy using t cell redirection antigen binding molecule against cell having immunosuppressing function |
| JP6925278B2 (ja) | 2015-11-18 | 2021-08-25 | 中外製薬株式会社 | 液性免疫応答の増強方法 |
| AU2016365742A1 (en) | 2015-12-07 | 2018-06-21 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and PSMA |
| US20200261573A1 (en) | 2015-12-17 | 2020-08-20 | Novartis Ag | Combination of c-met inhibitor with antibody molecule to pd-1 and uses thereof |
| US20180371093A1 (en) | 2015-12-17 | 2018-12-27 | Novartis Ag | Antibody molecules to pd-1 and uses thereof |
| EP3398965A4 (en) | 2015-12-28 | 2019-09-18 | Chugai Seiyaku Kabushiki Kaisha | METHOD FOR PROMOTING THE EFFICACY OF PURIFYING A POLYPEPTIDE CONTAINING AN FC REGION |
| WO2017125897A1 (en) | 2016-01-21 | 2017-07-27 | Novartis Ag | Multispecific molecules targeting cll-1 |
| CN105481981B (zh) * | 2016-01-27 | 2019-03-19 | 中国人民解放军第二军医大学 | 靶向vegf双特异性抗体及其用途 |
| WO2017149515A1 (en) | 2016-03-04 | 2017-09-08 | Novartis Ag | Cells expressing multiple chimeric antigen receptor (car) molecules and uses therefore |
| SG11201807936VA (en) | 2016-03-14 | 2018-10-30 | Chugai Pharmaceutical Co Ltd | Cell injury inducing therapeutic drug for use in cancer therapy |
| EP3432924A1 (en) | 2016-03-23 | 2019-01-30 | Novartis AG | Cell secreted minibodies and uses thereof |
| SI3443096T1 (sl) | 2016-04-15 | 2023-07-31 | Novartis Ag | Sestavki in postopki za selektivno izražanje himerni antigenskih receptorjev |
| AU2017257504A1 (en) | 2016-04-26 | 2018-10-25 | R.P. Scherer Technologies, Llc | Antibody conjugates and methods of making and using the same |
| EP3464375A2 (en) | 2016-06-02 | 2019-04-10 | Novartis AG | Therapeutic regimens for chimeric antigen receptor (car)- expressing cells |
| IL263542B2 (en) | 2016-06-14 | 2024-10-01 | Xencor Inc | Bispecific antibodies inhibit immunological checkpoint |
| EP4050032A1 (en) | 2016-06-28 | 2022-08-31 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| US20190336504A1 (en) | 2016-07-15 | 2019-11-07 | Novartis Ag | Treatment and prevention of cytokine release syndrome using a chimeric antigen receptor in combination with a kinase inhibitor |
| BR112019001570A2 (pt) | 2016-07-28 | 2019-07-09 | Novartis Ag | terapias de combinação de receptores de antígeno quiméricos e inibidores de pd-1 |
| EP3490590A2 (en) | 2016-08-01 | 2019-06-05 | Novartis AG | Treatment of cancer using a chimeric antigen receptor in combination with an inhibitor of a pro-m2 macrophage molecule |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| CA3035327A1 (en) | 2016-09-06 | 2018-03-15 | Chugai Seiyaku Kabushiki Kaisha | Methods of using a bispecific antibody that recognizes coagulation factor ix and/or activated coagulation factor ix and coagulation factor x and/or activated coagulation factor x |
| CN117866991A (zh) | 2016-10-07 | 2024-04-12 | 诺华股份有限公司 | 用于治疗癌症的嵌合抗原受体 |
| MX2019004327A (es) | 2016-10-14 | 2019-10-14 | Xencor Inc | Proteinas de fusion heterodimericas biespecificas que contienen proteinas de fusion fc il-15/il-15ra y fragmentos de anticuerpo pd-1. |
| EP3574005B1 (en) | 2017-01-26 | 2021-12-15 | Novartis AG | Cd28 compositions and methods for chimeric antigen receptor therapy |
| JOP20190189A1 (ar) | 2017-02-02 | 2019-08-01 | Amgen Res Munich Gmbh | تركيبة صيدلانية ذات درجة حموضة منخفضة تتضمن بنيات جسم مضاد يستهدف الخلية t |
| CA3221995C (en) | 2017-02-08 | 2024-05-28 | Dragonfly Therapeutics, Inc. | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer |
| KR20240060739A (ko) | 2017-02-20 | 2024-05-08 | 드래곤플라이 쎄라퓨틱스, 인크. | Her2, nkg2d 및 cd16에 결합하는 단백질 |
| US20200048359A1 (en) | 2017-02-28 | 2020-02-13 | Novartis Ag | Shp inhibitor compositions and uses for chimeric antigen receptor therapy |
| US20200055948A1 (en) | 2017-04-28 | 2020-02-20 | Novartis Ag | Cells expressing a bcma-targeting chimeric antigen receptor, and combination therapy with a gamma secretase inhibitor |
| US20200179511A1 (en) | 2017-04-28 | 2020-06-11 | Novartis Ag | Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor |
| CN111448323B (zh) * | 2017-06-07 | 2023-12-01 | 长源赋能(上海)生命科技有限公司 | 精确制导的多功能治疗抗体 |
| US11312783B2 (en) | 2017-06-22 | 2022-04-26 | Novartis Ag | Antibody molecules to CD73 and uses thereof |
| WO2019006007A1 (en) | 2017-06-27 | 2019-01-03 | Novartis Ag | POSOLOGICAL REGIMES FOR ANTI-TIM3 ANTIBODIES AND USES THEREOF |
| WO2019006472A1 (en) | 2017-06-30 | 2019-01-03 | Xencor, Inc. | TARGETED HETETRODIMERIC FUSION PROTEINS CONTAINING IL-15 / IL-15RA AND ANTIGEN-BINDING DOMAINS |
| MA49565A (fr) | 2017-07-11 | 2020-05-20 | Compass Therapeutics Llc | Anticorps agonistes qui lient cd137 humain et leurs utilisations |
| EP3655023A1 (en) | 2017-07-20 | 2020-05-27 | Novartis AG | Dosage regimens of anti-lag-3 antibodies and uses thereof |
| SG11201810270SA (en) | 2017-09-29 | 2019-04-29 | Chugai Pharmaceutical Co Ltd | Multispecific antigen-binding molecules having blood coagulation factor viii (fviii) cofactor function-substituting activity and pharmaceutical formulations containing such a molecule as an active ing |
| US11718679B2 (en) | 2017-10-31 | 2023-08-08 | Compass Therapeutics Llc | CD137 antibodies and PD-1 antagonists and uses thereof |
| AU2018366199A1 (en) | 2017-11-08 | 2020-05-28 | Xencor, Inc. | Bispecific and monospecific antibodies using novel anti-PD-1 sequences |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| WO2019099838A1 (en) | 2017-11-16 | 2019-05-23 | Novartis Ag | Combination therapies |
| EP3713961A2 (en) | 2017-11-20 | 2020-09-30 | Compass Therapeutics LLC | Cd137 antibodies and tumor antigen-targeting antibodies and uses thereof |
| MA51291A (fr) | 2017-12-19 | 2020-10-28 | Xencor Inc | Protéines de fusion il-2 fc modifiées |
| CA3090249A1 (en) | 2018-01-31 | 2019-08-08 | Novartis Ag | Combination therapy using a chimeric antigen receptor |
| MX2020008336A (es) | 2018-02-08 | 2020-09-21 | Dragonfly Therapeutics Inc | Dominios variables de anticuerpos que se dirigen al receptor nkg2d. |
| AU2019247415A1 (en) | 2018-04-04 | 2020-10-22 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| US20210147547A1 (en) | 2018-04-13 | 2021-05-20 | Novartis Ag | Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof |
| CN112437777A (zh) | 2018-04-18 | 2021-03-02 | Xencor股份有限公司 | 包含IL-15/IL-15RA Fc融合蛋白和TIM-3抗原结合结构域的靶向TIM-3的异源二聚体融合蛋白 |
| SG11202010163QA (en) | 2018-04-18 | 2020-11-27 | Xencor Inc | Pd-1 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and pd-1 antigen binding domains and uses thereof |
| WO2019210153A1 (en) | 2018-04-27 | 2019-10-31 | Novartis Ag | Car t cell therapies with enhanced efficacy |
| WO2019226658A1 (en) | 2018-05-21 | 2019-11-28 | Compass Therapeutics Llc | Multispecific antigen-binding compositions and methods of use |
| EP3797120A1 (en) | 2018-05-21 | 2021-03-31 | Compass Therapeutics LLC | Compositions and methods for enhancing the killing of target cells by nk cells |
| WO2019227003A1 (en) | 2018-05-25 | 2019-11-28 | Novartis Ag | Combination therapy with chimeric antigen receptor (car) therapies |
| US20210214459A1 (en) | 2018-05-31 | 2021-07-15 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| JP7438988B2 (ja) | 2018-06-13 | 2024-02-27 | ノバルティス アーゲー | Bcmaキメラ抗原受容体及びその使用 |
| SG11202012712YA (en) | 2018-06-19 | 2021-01-28 | Atarga Llc | Antibody molecules to complement component 5 and uses thereof |
| MA53094A (fr) | 2018-07-02 | 2021-05-12 | Amgen Inc | Protéine de liaison à l'antigène anti-steap1 |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| WO2020021465A1 (en) | 2018-07-25 | 2020-01-30 | Advanced Accelerator Applications (Italy) S.R.L. | Method of treatment of neuroendocrine tumors |
| KR20210069641A (ko) | 2018-10-03 | 2021-06-11 | 젠코어 인코포레이티드 | IL-12 이종이량체 Fc-융합 단백질 |
| MX2021005594A (es) | 2018-11-13 | 2021-10-22 | Compass Therapeutics Llc | Constructos multiespecificos de union contra moleculas de puntos de control y usos de los mismos. |
| CA3122727A1 (en) | 2018-12-20 | 2020-06-25 | Novartis Ag | Pharmaceutical combinations |
| CN113271945A (zh) | 2018-12-20 | 2021-08-17 | 诺华股份有限公司 | 包含3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物的给药方案和药物组合 |
| US20220144798A1 (en) | 2019-02-15 | 2022-05-12 | Novartis Ag | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| US10871640B2 (en) | 2019-02-15 | 2020-12-22 | Perkinelmer Cellular Technologies Germany Gmbh | Methods and systems for automated imaging of three-dimensional objects |
| EP3924054A1 (en) | 2019-02-15 | 2021-12-22 | Novartis AG | 3-(1-oxo-5-(piperidin-4-yl)isoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| US20220088075A1 (en) | 2019-02-22 | 2022-03-24 | The Trustees Of The University Of Pennsylvania | Combination therapies of egfrviii chimeric antigen receptors and pd-1 inhibitors |
| WO2020180726A1 (en) | 2019-03-01 | 2020-09-10 | Xencor, Inc. | Heterodimeric antibodies that bind enpp3 and cd3 |
| BR112021019337A2 (pt) | 2019-03-29 | 2021-12-07 | Atarga Llc | Anticorpo anti-fgf23 |
| BR112022007179A2 (pt) | 2019-10-21 | 2022-08-23 | Novartis Ag | Inibidores de tim-3 e usos dos mesmos |
| JP2022553293A (ja) | 2019-10-21 | 2022-12-22 | ノバルティス アーゲー | ベネトクラックスおよびtim-3阻害剤を用いた併用療法 |
| AR120566A1 (es) | 2019-11-26 | 2022-02-23 | Novartis Ag | Receptores de antígeno quiméricos y sus usos |
| IL293834A (en) | 2019-12-20 | 2022-08-01 | Novartis Ag | A combination of anti-tim-3 antibody mbg453 and anti, nis793 tgf-beta antibody with or without decitabine or anti-pd-1 antibody spratlizumab, for the treatment of myelofibrosis and myelodysplastic syndrome |
| EP4090762A1 (en) | 2020-01-17 | 2022-11-23 | Becton, Dickinson and Company | Methods and compositions for single cell secretomics |
| BR112022012310A2 (pt) | 2020-01-17 | 2022-09-06 | Novartis Ag | Combinação compreendendo um inibidor de tim-3 e um agente hipometilante para uso no tratamento de síndrome mielodisplásica ou leucemia mielomonocítica crônica |
| MX2022010685A (es) | 2020-02-27 | 2022-09-23 | Novartis Ag | Metodos de produccion de celulas que expresan receptores de antigeno quimericos. |
| EP4142789A1 (en) | 2020-04-29 | 2023-03-08 | Amgen Inc. | Pharmaceutical formulation |
| CA3173706A1 (en) | 2020-04-29 | 2021-11-04 | Twinkle R. Christian | Pharmaceutical formulation |
| WO2021231976A1 (en) | 2020-05-14 | 2021-11-18 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (psma) and cd3 |
| US20230321067A1 (en) | 2020-06-23 | 2023-10-12 | Novartis Ag | Dosing regimen comprising 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives |
| BR112023000482A2 (pt) | 2020-07-16 | 2023-01-31 | Novartis Ag | Anticorpos antibetacelulina, fragmentos dos mesmos e moléculas de ligação multiespecíficas |
| WO2022026592A2 (en) | 2020-07-28 | 2022-02-03 | Celltas Bio, Inc. | Antibody molecules to coronavirus and uses thereof |
| US20230271940A1 (en) | 2020-08-03 | 2023-08-31 | Novartis Ag | Heteroaryl substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| EP4200332A1 (en) | 2020-08-19 | 2023-06-28 | Xencor, Inc. | Anti-cd28 and/or anti-b7h3 compositions |
| MX2023002280A (es) | 2020-08-24 | 2023-05-23 | Amgen Inc | Formulacion farmaceutica que comprende un bite, anticuerpo biespecifico y metionina. |
| US20230338587A1 (en) | 2020-08-31 | 2023-10-26 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| WO2022043557A1 (en) | 2020-08-31 | 2022-03-03 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| JP2023547499A (ja) | 2020-11-06 | 2023-11-10 | ノバルティス アーゲー | 抗体Fc変異体 |
| US20240033358A1 (en) | 2020-11-13 | 2024-02-01 | Novartis Ag | Combination therapies with chimeric antigen receptor (car)-expressing cells |
| JP2024505049A (ja) | 2021-01-29 | 2024-02-02 | ノバルティス アーゲー | 抗cd73及び抗entpd2抗体のための投与方式並びにその使用 |
| EP4305067A1 (en) | 2021-03-09 | 2024-01-17 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cldn6 |
| JP2024509274A (ja) | 2021-03-10 | 2024-02-29 | ゼンコア インコーポレイテッド | Cd3及びgpc3に結合するヘテロ二量体抗体 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| AR125874A1 (es) | 2021-05-18 | 2023-08-23 | Novartis Ag | Terapias de combinación |
| TW202313108A (zh) | 2021-06-01 | 2023-04-01 | 美商安進公司 | 製備凍乾蛋白配製物之加速方法 |
| IL308847A (en) | 2021-06-30 | 2024-01-01 | Amgen Inc | The method of recovering a freeze-dried formulation |
| EP4405396A2 (en) | 2021-09-20 | 2024-07-31 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of her2 positive cancer |
| WO2023092004A1 (en) | 2021-11-17 | 2023-05-25 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of tau-related disorders |
| CN118647633A (zh) | 2022-02-07 | 2024-09-13 | 威斯特拉公司 | 抗独特型抗体分子及其用途 |
| AU2023259350A1 (en) | 2022-04-26 | 2024-10-17 | Amgen Inc. | Lyophilization method |
| WO2023220695A2 (en) | 2022-05-13 | 2023-11-16 | Voyager Therapeutics, Inc. | Compositions and methods for the treatment of her2 positive cancer |
| WO2024030976A2 (en) | 2022-08-03 | 2024-02-08 | Voyager Therapeutics, Inc. | Compositions and methods for crossing the blood brain barrier |
| WO2024040020A1 (en) | 2022-08-15 | 2024-02-22 | Absci Corporation | Quantitative affinity activity specific cell enrichment |
| WO2024168061A2 (en) | 2023-02-07 | 2024-08-15 | Ayan Therapeutics Inc. | Antibody molecules binding to sars-cov-2 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10179151A (ja) * | 1996-09-03 | 1998-07-07 | Gsf Forschungszentrum Fuer Umwelt & Gesundheit Gmbh | 二特異的抗体を用いた幹細胞移植における汚染腫瘍細胞の除去 |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5869620A (en) * | 1986-09-02 | 1999-02-09 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US6121424A (en) * | 1991-11-25 | 2000-09-19 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US4946778A (en) * | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5202238A (en) * | 1987-10-27 | 1993-04-13 | Oncogen | Production of chimeric antibodies by homologous recombination |
| AU4128089A (en) * | 1988-09-15 | 1990-03-22 | Rorer International (Overseas) Inc. | Monoclonal antibodies specific to human epidermal growth factor receptor and therapeutic methods employing same |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US20010021382A1 (en) * | 1991-03-29 | 2001-09-13 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| US5367057A (en) * | 1991-04-02 | 1994-11-22 | The Trustees Of Princeton University | Tyrosine kinase receptor flk-2 and fragments thereof |
| US5861301A (en) * | 1992-02-20 | 1999-01-19 | American Cayanamid Company | Recombinant kinase insert domain containing receptor and gene encoding same |
| US5965132A (en) * | 1992-03-05 | 1999-10-12 | Board Of Regents, The University Of Texas System | Methods and compositions for targeting the vasculature of solid tumors |
| US6036955A (en) * | 1992-03-05 | 2000-03-14 | The Scripps Research Institute | Kits and methods for the specific coagulation of vasculature |
| US6177401B1 (en) * | 1992-11-13 | 2001-01-23 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften | Use of organic compounds for the inhibition of Flk-1 mediated vasculogenesis and angiogenesis |
| US5840299A (en) * | 1994-01-25 | 1998-11-24 | Athena Neurosciences, Inc. | Humanized antibodies against leukocyte adhesion molecule VLA-4 |
| US6448077B1 (en) * | 1994-02-10 | 2002-09-10 | Imclone Systems, Inc. | Chimeric and humanized monoclonal antibodies specific to VEGF receptors |
| US5840301A (en) * | 1994-02-10 | 1998-11-24 | Imclone Systems Incorporated | Methods of use of chimerized, humanized, and single chain antibodies specific to VEGF receptors |
| US5861499A (en) * | 1994-02-10 | 1999-01-19 | Imclone Systems Incorporated | Nucleic acid molecules encoding the variable or hypervariable region of a monoclonal antibody that binds to an extracellular domain |
| ES2259247T3 (es) * | 1998-12-21 | 2006-09-16 | Ludwig Institute For Cancer Research | Anticuerpos frente a vegf-d truncado y sus usos. |
| IL144578A0 (en) * | 1999-01-29 | 2002-05-23 | Imclone Systems Inc | Antibodies specific to kdr and uses thereof |
| US7740841B1 (en) * | 2000-01-28 | 2010-06-22 | Sunnybrook Health Science Center | Therapeutic method for reducing angiogenesis |
| CN1461344A (zh) * | 2000-07-25 | 2003-12-10 | 免疫医疗公司 | 多价靶结合蛋白 |
-
2001
- 2001-05-24 AU AU2001264946A patent/AU2001264946A1/en not_active Abandoned
- 2001-05-24 CA CA002409991A patent/CA2409991A1/en not_active Abandoned
- 2001-05-24 JP JP2001587003A patent/JP2004511430A/ja active Pending
- 2001-05-24 EP EP01939426A patent/EP1299419A2/en not_active Withdrawn
- 2001-05-24 WO PCT/US2001/016924 patent/WO2001090192A2/en active Application Filing
- 2001-05-24 US US09/865,198 patent/US20020103345A1/en not_active Abandoned
-
2004
- 2004-02-13 US US10/778,910 patent/US20040259156A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH10179151A (ja) * | 1996-09-03 | 1998-07-07 | Gsf Forschungszentrum Fuer Umwelt & Gesundheit Gmbh | 二特異的抗体を用いた幹細胞移植における汚染腫瘍細胞の除去 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005518336A (ja) * | 2001-06-26 | 2005-06-23 | イムクローン システムズ インコーポレイティド | Vegf受容体に結合する二重特異性抗体 |
| JP2005526482A (ja) * | 2001-08-10 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Vegfr−1を発現する幹細胞の単離および動員 |
| JP2009504191A (ja) * | 2005-08-19 | 2009-02-05 | アボット・ラボラトリーズ | 二重可変ドメイン免疫グロブリン及びその使用 |
| JP2012228248A (ja) * | 2005-08-19 | 2012-11-22 | Abbott Lab | 二重可変ドメイン免疫グロブリン及びその使用 |
| JP2010535032A (ja) * | 2007-07-31 | 2010-11-18 | メディミューン,エルエルシー | 多重特異性エピトープ結合性タンパク質およびその用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2001090192A2 (en) | 2001-11-29 |
| US20020103345A1 (en) | 2002-08-01 |
| WO2001090192A3 (en) | 2003-01-16 |
| CA2409991A1 (en) | 2001-11-29 |
| AU2001264946A1 (en) | 2001-12-03 |
| US20040259156A1 (en) | 2004-12-23 |
| EP1299419A2 (en) | 2003-04-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2004511430A (ja) | 二重特異性免疫グロブリン様抗原結合蛋白および製造方法 | |
| US20240076370A1 (en) | Antibodies targeting g-protein coupled receptor and methods of use | |
| CN109071654B (zh) | 靶向Fc受体样5的抗体及使用方法 | |
| US20040242851A1 (en) | Bispecific antibodies that bind to vegf receptors | |
| CN113603783B (zh) | 蛋白酶可切割的双特异性抗体及其用途 | |
| JP2009526857A (ja) | 機能性抗体 | |
| TWI381848B (zh) | 抗纖維母細胞生長因子受體-3 (fgfr-3) 抗體及包含其之醫藥組合物 | |
| JP2008512352A (ja) | 新規な四価の二重特異性抗体 | |
| US20020064528A1 (en) | Antibodies specific to KDR and uses thereof | |
| JP2018500014A (ja) | B細胞成熟化抗原を標的化する抗体および使用の方法 | |
| CA2361553A1 (en) | Antibodies specific to kdr and uses thereof | |
| JP2012105667A (ja) | Kdrに特異的なヒト抗体及びその利用 | |
| WO1995025167A1 (en) | Anti-egfr single-chain fvs and anti-egfr antibodies | |
| KR102691493B1 (ko) | α-SYN/IGF1R에 대한 이중 특이 항체 및 그 용도 | |
| CN113135995B (zh) | 抗her3单克隆抗体及其应用 | |
| WO2004003211A1 (en) | Bispecific antibodies that bind to vegf receptors | |
| CA3230246A1 (en) | Bispecific antibody and use thereof | |
| US11891446B2 (en) | Highly potent antibodies binding to death receptor 5 | |
| NZ732567B2 (en) | Antibodies targeting g-protein coupled receptor and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080523 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080523 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20090812 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090812 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20110920 |