JP2005518336A - Vegf受容体に結合する二重特異性抗体 - Google Patents
Vegf受容体に結合する二重特異性抗体 Download PDFInfo
- Publication number
- JP2005518336A JP2005518336A JP2003508383A JP2003508383A JP2005518336A JP 2005518336 A JP2005518336 A JP 2005518336A JP 2003508383 A JP2003508383 A JP 2003508383A JP 2003508383 A JP2003508383 A JP 2003508383A JP 2005518336 A JP2005518336 A JP 2005518336A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- antibody
- vegf receptor
- kdr
- vegf
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 230000027455 binding Effects 0.000 title claims abstract description 129
- 108091008605 VEGF receptors Proteins 0.000 title claims abstract description 88
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 title claims abstract description 86
- 239000000427 antigen Substances 0.000 claims abstract description 84
- 108091007433 antigens Proteins 0.000 claims abstract description 84
- 102000036639 antigens Human genes 0.000 claims abstract description 84
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims abstract description 59
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims abstract description 59
- 230000004913 activation Effects 0.000 claims abstract description 8
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 claims abstract description 6
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 claims abstract description 6
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 claims abstract description 6
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 claims abstract description 6
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 claims description 78
- 101100372762 Rattus norvegicus Flt1 gene Proteins 0.000 claims description 63
- 101100381481 Caenorhabditis elegans baz-2 gene Proteins 0.000 claims description 62
- 210000004027 cell Anatomy 0.000 claims description 61
- 238000000034 method Methods 0.000 claims description 44
- 102000005962 receptors Human genes 0.000 claims description 41
- 108020003175 receptors Proteins 0.000 claims description 41
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 40
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 32
- 239000002773 nucleotide Substances 0.000 claims description 29
- 125000003729 nucleotide group Chemical group 0.000 claims description 29
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 17
- 108020004414 DNA Proteins 0.000 claims description 16
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 14
- 230000033115 angiogenesis Effects 0.000 claims description 12
- 229920001184 polypeptide Polymers 0.000 claims description 12
- 230000004614 tumor growth Effects 0.000 claims description 12
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 claims description 10
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 claims description 10
- 230000014509 gene expression Effects 0.000 claims description 9
- 230000002401 inhibitory effect Effects 0.000 claims description 7
- 230000001580 bacterial effect Effects 0.000 claims description 6
- 239000013604 expression vector Substances 0.000 claims description 6
- 241000124008 Mammalia Species 0.000 claims description 5
- 210000004962 mammalian cell Anatomy 0.000 claims description 5
- 230000003472 neutralizing effect Effects 0.000 claims description 5
- 230000015572 biosynthetic process Effects 0.000 claims description 4
- 108020004511 Recombinant DNA Proteins 0.000 claims description 3
- 238000005734 heterodimerization reaction Methods 0.000 claims description 2
- 210000005253 yeast cell Anatomy 0.000 claims description 2
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims 1
- 230000003834 intracellular effect Effects 0.000 claims 1
- 230000012292 cell migration Effects 0.000 abstract description 15
- 102000025171 antigen binding proteins Human genes 0.000 abstract description 11
- 108091000831 antigen binding proteins Proteins 0.000 abstract description 11
- 208000032839 leukemia Diseases 0.000 abstract description 10
- 230000003915 cell function Effects 0.000 abstract description 5
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 abstract description 4
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 abstract description 4
- 210000003556 vascular endothelial cell Anatomy 0.000 abstract description 4
- 108090000623 proteins and genes Proteins 0.000 description 58
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 57
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 57
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 description 28
- 102100035194 Placenta growth factor Human genes 0.000 description 28
- 102000004169 proteins and genes Human genes 0.000 description 22
- 239000013598 vector Substances 0.000 description 18
- 206010028980 Neoplasm Diseases 0.000 description 17
- 239000002246 antineoplastic agent Substances 0.000 description 17
- 238000003556 assay Methods 0.000 description 14
- 239000002953 phosphate buffered saline Substances 0.000 description 13
- 241000699666 Mus <mouse, genus> Species 0.000 description 12
- 239000002609 medium Substances 0.000 description 12
- 230000000694 effects Effects 0.000 description 11
- 230000006870 function Effects 0.000 description 11
- 238000003752 polymerase chain reaction Methods 0.000 description 11
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 239000000203 mixture Substances 0.000 description 10
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 9
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 9
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 9
- 230000001588 bifunctional effect Effects 0.000 description 9
- 210000002889 endothelial cell Anatomy 0.000 description 9
- 230000005012 migration Effects 0.000 description 9
- 238000013508 migration Methods 0.000 description 9
- 238000002823 phage display Methods 0.000 description 9
- 241000588724 Escherichia coli Species 0.000 description 8
- 108060003951 Immunoglobulin Proteins 0.000 description 8
- 241000699670 Mus sp. Species 0.000 description 8
- 108010076504 Protein Sorting Signals Proteins 0.000 description 8
- 230000000903 blocking effect Effects 0.000 description 8
- 239000012634 fragment Substances 0.000 description 8
- 108020001507 fusion proteins Proteins 0.000 description 8
- 102000037865 fusion proteins Human genes 0.000 description 8
- 102000018358 immunoglobulin Human genes 0.000 description 8
- 239000003446 ligand Substances 0.000 description 8
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 7
- 125000000539 amino acid group Chemical group 0.000 description 7
- 150000001413 amino acids Chemical class 0.000 description 7
- 201000011510 cancer Diseases 0.000 description 7
- 230000012010 growth Effects 0.000 description 7
- 238000002360 preparation method Methods 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- 102000014914 Carrier Proteins Human genes 0.000 description 6
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 230000002491 angiogenic effect Effects 0.000 description 6
- 108091008324 binding proteins Proteins 0.000 description 6
- 238000006471 dimerization reaction Methods 0.000 description 6
- 210000004408 hybridoma Anatomy 0.000 description 6
- 229960000485 methotrexate Drugs 0.000 description 6
- 239000013612 plasmid Substances 0.000 description 6
- 230000003389 potentiating effect Effects 0.000 description 6
- 241000282412 Homo Species 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 238000010367 cloning Methods 0.000 description 5
- 230000000295 complement effect Effects 0.000 description 5
- 229940127089 cytotoxic agent Drugs 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 210000001161 mammalian embryo Anatomy 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 238000012216 screening Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 230000009261 transgenic effect Effects 0.000 description 5
- 102000004127 Cytokines Human genes 0.000 description 4
- 108090000695 Cytokines Proteins 0.000 description 4
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 description 4
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 4
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 4
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 4
- 108020005038 Terminator Codon Proteins 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 229960000723 ampicillin Drugs 0.000 description 4
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 238000004132 cross linking Methods 0.000 description 4
- 108020001096 dihydrofolate reductase Proteins 0.000 description 4
- 102000058223 human VEGFA Human genes 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 235000013336 milk Nutrition 0.000 description 4
- 239000008267 milk Substances 0.000 description 4
- 210000004080 milk Anatomy 0.000 description 4
- 230000035772 mutation Effects 0.000 description 4
- 229940002612 prodrug Drugs 0.000 description 4
- 239000000651 prodrug Substances 0.000 description 4
- 230000028327 secretion Effects 0.000 description 4
- 239000000243 solution Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- 238000011282 treatment Methods 0.000 description 4
- 229910052720 vanadium Inorganic materials 0.000 description 4
- 102100034278 Annexin A6 Human genes 0.000 description 3
- 108090001008 Avidin Proteins 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 241000724791 Filamentous phage Species 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 238000012408 PCR amplification Methods 0.000 description 3
- 102100040681 Platelet-derived growth factor C Human genes 0.000 description 3
- 108010090804 Streptavidin Proteins 0.000 description 3
- 101150006914 TRP1 gene Proteins 0.000 description 3
- 108010073925 Vascular Endothelial Growth Factor B Proteins 0.000 description 3
- 108010073923 Vascular Endothelial Growth Factor C Proteins 0.000 description 3
- 108010073919 Vascular Endothelial Growth Factor D Proteins 0.000 description 3
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 3
- 102100038217 Vascular endothelial growth factor B Human genes 0.000 description 3
- 102100038232 Vascular endothelial growth factor C Human genes 0.000 description 3
- 102100038234 Vascular endothelial growth factor D Human genes 0.000 description 3
- 238000001042 affinity chromatography Methods 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 229910002091 carbon monoxide Inorganic materials 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 231100000599 cytotoxic agent Toxicity 0.000 description 3
- 239000002619 cytotoxin Substances 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 230000002163 immunogen Effects 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 230000005764 inhibitory process Effects 0.000 description 3
- 238000003780 insertion Methods 0.000 description 3
- 230000037431 insertion Effects 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 230000009401 metastasis Effects 0.000 description 3
- 230000009871 nonspecific binding Effects 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 230000026731 phosphorylation Effects 0.000 description 3
- 238000006366 phosphorylation reaction Methods 0.000 description 3
- 108010017992 platelet-derived growth factor C Proteins 0.000 description 3
- 230000003248 secreting effect Effects 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 230000009466 transformation Effects 0.000 description 3
- HKZAAJSTFUZYTO-LURJTMIESA-N (2s)-2-[[2-[[2-[[2-[(2-aminoacetyl)amino]acetyl]amino]acetyl]amino]acetyl]amino]-3-hydroxypropanoic acid Chemical compound NCC(=O)NCC(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O HKZAAJSTFUZYTO-LURJTMIESA-N 0.000 description 2
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 2
- FHIDNBAQOFJWCA-UAKXSSHOSA-N 5-fluorouridine Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 FHIDNBAQOFJWCA-UAKXSSHOSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- 108090000656 Annexin A6 Proteins 0.000 description 2
- 108010032595 Antibody Binding Sites Proteins 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 241000894006 Bacteria Species 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 241000699802 Cricetulus griseus Species 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 101710112752 Cytotoxin Proteins 0.000 description 2
- WEAHRLBPCANXCN-UHFFFAOYSA-N Daunomycin Natural products CCC1(O)CC(OC2CC(N)C(O)C(C)O2)c3cc4C(=O)c5c(OC)cccc5C(=O)c4c(O)c3C1 WEAHRLBPCANXCN-UHFFFAOYSA-N 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- 102000009109 Fc receptors Human genes 0.000 description 2
- 108010087819 Fc receptors Proteins 0.000 description 2
- 108010093488 His-His-His-His-His-His Proteins 0.000 description 2
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 2
- 102100020873 Interleukin-2 Human genes 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 2
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 2
- 108091000080 Phosphotransferase Proteins 0.000 description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 108010073443 Ribi adjuvant Proteins 0.000 description 2
- 102000006601 Thymidine Kinase Human genes 0.000 description 2
- 108020004440 Thymidine kinase Proteins 0.000 description 2
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- 101150117115 V gene Proteins 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 230000003321 amplification Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000005557 antagonist Substances 0.000 description 2
- 229940045799 anthracyclines and related substance Drugs 0.000 description 2
- 230000001621 anti-mitogenic effect Effects 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004556 brain Anatomy 0.000 description 2
- 229930195731 calicheamicin Natural products 0.000 description 2
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 description 2
- 229940041514 candida albicans extract Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 230000002860 competitive effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 230000009260 cross reactivity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 210000002257 embryonic structure Anatomy 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000013613 expression plasmid Substances 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 235000013861 fat-free Nutrition 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 208000005017 glioblastoma Diseases 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 102000055590 human KDR Human genes 0.000 description 2
- 210000000987 immune system Anatomy 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 229940028885 interleukin-4 Drugs 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 229960000318 kanamycin Drugs 0.000 description 2
- 229930027917 kanamycin Natural products 0.000 description 2
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 2
- 229930182823 kanamycin A Natural products 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 229960001924 melphalan Drugs 0.000 description 2
- 108020004999 messenger RNA Proteins 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 201000000050 myeloid neoplasm Diseases 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 238000003199 nucleic acid amplification method Methods 0.000 description 2
- 238000004091 panning Methods 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 2
- 102000020233 phosphotransferase Human genes 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- -1 sodium Chemical class 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 239000012137 tryptone Substances 0.000 description 2
- 230000008728 vascular permeability Effects 0.000 description 2
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 2
- 229960004355 vindesine Drugs 0.000 description 2
- 239000012138 yeast extract Substances 0.000 description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 1
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 1
- NHBKXEKEPDILRR-UHFFFAOYSA-N 2,3-bis(butanoylsulfanyl)propyl butanoate Chemical compound CCCC(=O)OCC(SC(=O)CCC)CSC(=O)CCC NHBKXEKEPDILRR-UHFFFAOYSA-N 0.000 description 1
- KLDBMPMWBVTYGW-AIDJSRAFSA-N 2-aminoacetic acid (2S)-2-amino-3-hydroxypropanoic acid Chemical compound NCC(O)=O.NCC(O)=O.NCC(O)=O.NCC(O)=O.OC[C@H](N)C(O)=O KLDBMPMWBVTYGW-AIDJSRAFSA-N 0.000 description 1
- XZKIHKMTEMTJQX-UHFFFAOYSA-N 4-Nitrophenyl Phosphate Chemical compound OP(O)(=O)OC1=CC=C([N+]([O-])=O)C=C1 XZKIHKMTEMTJQX-UHFFFAOYSA-N 0.000 description 1
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 101100136076 Aspergillus oryzae (strain ATCC 42149 / RIB 40) pel1 gene Proteins 0.000 description 1
- 241000304886 Bacilli Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- QNAYBMKLOCPYGJ-UWTATZPHSA-N D-alanine Chemical compound C[C@@H](N)C(O)=O QNAYBMKLOCPYGJ-UWTATZPHSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- 101150074155 DHFR gene Proteins 0.000 description 1
- 238000001712 DNA sequencing Methods 0.000 description 1
- 230000006820 DNA synthesis Effects 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 101710146739 Enterotoxin Proteins 0.000 description 1
- 206010015548 Euthanasia Diseases 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 206010019695 Hepatic neoplasm Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000690301 Homo sapiens Aldo-keto reductase family 1 member C4 Proteins 0.000 description 1
- 101001116548 Homo sapiens Protein CBFA2T1 Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 239000001888 Peptone Substances 0.000 description 1
- 108010080698 Peptones Proteins 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 201000004681 Psoriasis Diseases 0.000 description 1
- 102000004879 Racemases and epimerases Human genes 0.000 description 1
- 108090001066 Racemases and epimerases Proteins 0.000 description 1
- 102000004278 Receptor Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000873 Receptor Protein-Tyrosine Kinases Proteins 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 101150003725 TK gene Proteins 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- 102000002262 Thromboplastin Human genes 0.000 description 1
- 108010000499 Thromboplastin Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- LVTKHGUGBGNBPL-UHFFFAOYSA-N Trp-P-1 Chemical compound N1C2=CC=CC=C2C2=C1C(C)=C(N)N=C2C LVTKHGUGBGNBPL-UHFFFAOYSA-N 0.000 description 1
- 238000011167 VEGF-binding assay Methods 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 229960003896 aminopterin Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000003466 anti-cipated effect Effects 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 238000002725 brachytherapy Methods 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000012830 cancer therapeutic Substances 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 238000006555 catalytic reaction Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 238000004040 coloring Methods 0.000 description 1
- 230000009918 complex formation Effects 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 235000013681 dietary sucrose Nutrition 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 230000005670 electromagnetic radiation Effects 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000010595 endothelial cell migration Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000000147 enterotoxin Substances 0.000 description 1
- 231100000655 enterotoxin Toxicity 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 210000002216 heart Anatomy 0.000 description 1
- 102000054751 human RUNX1T1 Human genes 0.000 description 1
- 239000012216 imaging agent Substances 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 230000006831 intrinsic signaling Effects 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 210000002429 large intestine Anatomy 0.000 description 1
- 108020001756 ligand binding domains Proteins 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011572 manganese Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 238000010232 migration assay Methods 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 230000008747 mitogenic response Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 230000000869 mutational effect Effects 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 230000013152 negative regulation of cell migration Effects 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 238000012856 packing Methods 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 210000000496 pancreas Anatomy 0.000 description 1
- 101150040383 pel2 gene Proteins 0.000 description 1
- 101150050446 pelB gene Proteins 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 235000019319 peptone Nutrition 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- 108700010839 phage proteins Proteins 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- DCWXELXMIBXGTH-UHFFFAOYSA-N phosphotyrosine Chemical compound OC(=O)C(N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-UHFFFAOYSA-N 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 1
- 229920002401 polyacrylamide Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000644 propagated effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000010839 reverse transcription Methods 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 230000005070 ripening Effects 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 239000006152 selective media Substances 0.000 description 1
- 239000008299 semisolid dosage form Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 210000003491 skin Anatomy 0.000 description 1
- 210000000813 small intestine Anatomy 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 210000004989 spleen cell Anatomy 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 229960004793 sucrose Drugs 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 230000002381 testicular Effects 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 239000003053 toxin Substances 0.000 description 1
- 231100000765 toxin Toxicity 0.000 description 1
- 108700012359 toxins Proteins 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 230000004565 tumor cell growth Effects 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 108010002164 tyrosine receptor Proteins 0.000 description 1
- 210000003606 umbilical vein Anatomy 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 210000003932 urinary bladder Anatomy 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 208000024719 uterine cervix neoplasm Diseases 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 230000029663 wound healing Effects 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/626—Diabody or triabody
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biochemistry (AREA)
- Dermatology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Rheumatology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Physical Education & Sports Medicine (AREA)
- Urology & Nephrology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Vascular Medicine (AREA)
- Pain & Pain Management (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Description
本発明は、2つの異なるVEGF受容体の細胞外ドメインに特異的に結合する二重特異性抗原結合蛋白質の生成に関する。二重特異性抗原結合蛋白質は、VEGF受容体の活性化をブロックし、VEGFにより誘発される細胞機能、例えば血管内皮細胞の有糸分裂生起及び白血病細胞の移動を抑制又は阻害するのに使用される。本発明の抗原結合蛋白質は、免疫グロブリン重鎖可変ドメイン及び免疫グロブリン軽鎖可変ドメインから成る抗原結合部位を有し、一価又は二価であってよい。抗原結合蛋白質はさらに、免疫グロブリン定常領域を含むことができる。
血管内皮成長因子(VEGF)、胎盤成長因子(PlGF)及びこれらの受容体VEGFR-1/Flt-1、VEGFR-2/KDR及びVEGFR-2/KDR及びVEGFR-3/Flt-4は、脈管形成、血管形成及び腫瘍細胞の成長に重要な役割を有する。
本発明は、第1VEGF受容体に対して特異的な抗原結合部位と、第2VEGF受容体に対して特異的な抗原結合部位とを有する抗体を提供する。これらの抗体は二価以上であり、三価、四価又は多価であってよい。
本発明は、第1VEGF受容体と第2VEGF受容体とに特異的に結合することができる二重特異性抗体を提供する。特に重要なのは、このような受容体の細胞外ドメインに結合する抗体である。本明細書中に定義されるVEGF受容体の細胞外ドメインは、受容体の細胞外部分のリガンド結合ドメイン、並びに、二量化及びオーバラップ・エピトープに関与する細胞外部分を含む。VEGF受容体の細胞外ドメインに結合されると、抗体は効果的にリガンド結合をブロックし、且つ/又は受容体二量化を妨害する。このような結合の結果として、抗体はVEGF受容体の活性化を中和する。受容体の中和とは、受容体の内在的な信号伝達能力を減少及び/又は不活性化することを意味する。VEGF受容体の中和に関して信頼性の高いアッセイは、受容体リン酸化反応の阻害である。受容体リン酸化反応の測定法は当業者に良く知られており、例えばモノクローナル抗体又は放射性標識によるホスホチロシンの測定を含む。
細胞株
受容体の組換え形で免疫化されたマウスから、抗Flt-1抗体Mab6.12(IgG1, κ)をImClone Systems Incorporated (New York, NY)で確立した。Cornell Medical Center, New YorkのDr. S. Rafiiから、一次培養されたヒト臍静脈内皮細胞(HUVEC)を得、そしてEBM-2培地(Clonetics, Walkersvill, MD)内で37℃、5%CO2で維持した。白血病細胞株HL60及びHELを10%ウシ胎仔血清を含有するRPMI中で維持し、5%CO2で37℃において成長させた。
安定的にトランスフェクトされたNIH 3T3中で、可溶性融合蛋白質KDR-アルカリ・ホスファターゼ(AP)を発現させ、Lu, D.他、2000, J.Biol.Chem.,275:14321-14330によって記載されているように、APに対する固定化モノクローナル抗体を使用して、アフィニティ・クロマトグラフィによって細胞培養上澄みから精製した。VEGF 165蛋白質をバキュロウィルス中に発現させ、上述の手順に従って精製した。Id. PlGF及びFlt-1-Fc融合蛋白質をR&Dシステム(Minneapolis, MN)から購入した。
「Antibody Engineering: A Practical Approach」(McCafferty, J., Hoogenboom, H.R., Chiswell, D.J.編、Oxford University Press, Incorporated; p147-168)におけるBendig他(1996)の手順に従って、ハイブリドーマ細胞から分離されたmRNAから、Mab 6.12のVH遺伝子及びVL遺伝子をRT-PCRによってクローニングした。マウス抗体軽鎖リーダー配列の5'末端とハイブリダイズするように特異的に構成された11個の5'プライマーと、マウスκ軽鎖定常領域の5'末端とハイブリダイズする1つの3'プライマーとを使用して、VL遺伝子をクローニングした。マウス抗体重鎖リーダー配列の5'末端とハイブリダイズするように特異的に構成された12個の5'プライマーと、マウスIgG1重鎖定常領域の5'末端とハイブリダイズする1つの3'プライマーとを使用して、VH遺伝子をクローニングした。合計で23回、すなわちVL遺伝子に関しては11回、VH遺伝子に関しては12回にわたって、PCR反応を実施した。製造業者の指示書(TA Cloning(登録商標)Kit, Invitrogen, Carlsbad, CA)に記載されている通りに、サイズ400〜500塩基対の全てのPCR生成フラグメントをpCR(登録商標)2.1ベクター中にクローニングし、続いてE.coli菌株XL-1を形質転換した。
KDRで免疫化されたマウスの脾細胞から構成されたファージ表示ライブラリから、KDRに対する一本鎖抗体scFv plC11を分離した(Zhu, Z.他、1998, Cancer Res. 58:3209-3214)。雌BALB/Cマウスに、200μlのRIBIアジュバント・システム中の10μg KDR-APを2回腹腔内(i.p.)注射し、続いて、2か月間にわたってRIBIアジュバントなしのi.p.注射を1回施した。これらのマウスにはまた、初回免疫化時に、200μlのRIBI中の10μg KDR-APを皮下(s.c.)注射した。マウスには、安楽死3日前に20μgのKDR-APをi.p.でブーストした。脾臓細胞から抽出された総RNAから、mRNAを精製した。逆転写後、発現させられたVH遺伝子及びVL遺伝子に対応するcDNAを別個に増幅した。それぞれの遺伝子を別個に受容するように構成されるか、又は、(例えばPCR増幅によって)分泌信号配列をコードするヌクレオチド及びポリペプチド・リンカーにリンクされたベクター内に、増幅生成物を挿入し、融合生成物を所望のベクター内に挿入した。例えばZhu他、1998を参照されたい。
3.7 x 1010個のクローンを含有する大型ヒトFabファージ表示ライブラリ(DeHaard他、J.Biol.Chem. 274:18218-30(1999))を選択のために使用した。このライブラリは、ヒト定常鎖遺伝子(κ及びλ)に融合されたPCR増幅抗体可変軽鎖遺伝子と、ヒトIgG1重鎖CH1ドメインをコードするDNAに融合された可変重鎖遺伝子との組み合わせから成っている。重鎖構造及び軽鎖構造の双方には、信号配列、すなわち軽鎖の場合にはpelBが、また重鎖の場合には遺伝子III信号配列が先行する。重鎖構造はさらに、ファージ表示に対応する遺伝子III蛋白質部分、ヘキサヒスチジン・タグ、及び11アミノ酸長c-mycタグをコードし、この重鎖構造にはアンバー・コドン(TAG)が続く。ヘキサヒスチジン及びc-mycタグは、精製又は検出のために使用することができる。アンバー・コドンは、サプレッサー宿主(例えばTG1細胞)を使用してファージ表示を可能にするか、又は、非サプレッサー宿主(例えばHB2151細胞)内に形質転換されると可溶形のFabフラグメントの生成を可能にする。
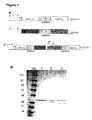
ダイアボディを構成するために、plC11及びscFv6.12の可変ドメインをPCR特異的集成のために使用して、発現プラスミドpDAB-KF1(図1A)を形成した。先ず、plC11及びMab 6.12のVHドメイン及びVLドメインから、下記遺伝子フラグメントをPCRによって生成した;plC11のVLドメインには、5アミノ酸リンカーGGGGSコードセグメントが続き、Mab 6.12のVHドメインには、E.coli熱安定性エンテロトキシンII(stII)信号配列コードセグメントが先行し(Picken, R.N.他、1983、Infect. Immun. 42:269-275)、且つ、GGGGSリンカーコードセグメントが続き;そしてplC11のVMドメインには、GGGGSリンカーコードセグメントが先行する。それぞれPCRフラグメントplC11 VL、Mab 6.12 VH、及びMab 6.12 VL及びplC11 VHをアニールすることにより、クロスオーバーscFv、PLH-1C11-6.12及びpLH-6.12-1C11を構成し、続いてPCR増幅することにより、続くクローニングのために適切な制限部位を導入した。それぞれpLH-1C11-6.12及びpLH-6.12-lC11に由来するSfiI/NheI及びNheI/NotIフラグメントを、ベクターpCANTAB 5E中に連結することにより、2つのクロスオーバーscFvの同時分泌のための発現プラスミドpDAB-KF1を構成した。クロスオーバーscFvフラグメントをコードする全ての配列をDNA配列決定することにより評価した。
前記手順(Lu, D他、1999, J.Immunol Methods 230:159-171)に従って、シェーカーフラスコ内で30℃で成長させられた発現プラスミドを含有するE.coli菌株HB2151から、ダイアボディを調製した。20%(w/v)サッカロースを含有する25mM Tris(pH7.5)、200mM NaCl、1mM EDTA及び0.1mM PMSF中で細胞ぺレットを最懸濁することにより、細胞のペリプラスム抽出物を調製し、続いて、静かに震盪させながら4℃で1時間にわたってインキュベートした。15,000rpmで15分間にわたって遠心分離したあと、RPAS精製モジュール(Amersham Pharmacia Biotech)を使用した抗Eタグ・アフィニティ・クロマトグラフィによって、上澄みから可溶性ダイアボディを精製した。ダイアボディ調製純度を試験するために、E.coliペリプラスム抽出物及び精製されたダイアボディの両方を18%ポリアクリルアミド・ゲル(Novex, San Diego, CA)中で電気泳動させ、Colloidal Blue Stain キット(Novex)で着色することにより視覚化した。
ダイアボディの二重抗原結合キャパシティを見極めるために、2つのアッセイを実施した。第1に、架橋アッセイを用いることにより、ダイアボディがその標的抗原の両方に同時に結合することができるか否かを調査した。簡潔に云えば、Flt-1-Fc融合蛋白質(一晩で4℃で1ウェル当たり1μl/ml x 100ml)を予塗被された96ウェルMaxi-sorpマイクロタイター・プレート(Nunc, Roskilde, Denmark)内でダイアボディ又はその親scFvを室温(RT)で1時間にわたって先ずインキュベートした。プレートを、0.1%Tween(PBST)を含有するPBSで3回洗浄し、続いて、RTでさらに1時間にわたってKDR-AP融合蛋白質と一緒にインキュベートした。次いで、AP基質、リン酸p-ニトロフェニル(Sigma, St. Louis, MO)を添加することにより、プレートに結合されたKDR-APを定量し、続いて、405nm(Lu, D.他、1999)における吸光度を読み取った。第2に、直接結合アッセイにおいて、KDR又はFlt-1を塗被された96ウェル・プレートに、種々の量のダイアボディ又はscFvを添加し、RTで1時間にわたってインキュベートし、その後プレートをPBSTで3回洗浄した。次いで、100μlの抗Eタグ抗体-HRP複合体(Amersham Pharmacia Biotech)と一緒に、プレートをRTで1時間にわたってインキュベートした。プレートを洗浄し、ペルオキシダーゼ基質を添加し、前記手順(Lu, D.他、1999)に従って450nmにおける吸光度を読み取った。
前記プロトコル(Zhu,Z.他、1998;Lu, D.他,1999)に従って、アッセイを行った。簡潔に云えば、種々の量のダイアボディ又はscFvを固定量のKDR-AP(100ng)又はFlt-1-Fc融合蛋白質(50ng)と混合し、RTで1時間にわたってインキュベートした。次いで混合物を、VEGF165(200ng/ウェル)又はPlGF(200ng/ウェル)を予塗被した96ウェル・マイクロタイターに移し、RTでさらに2時間にわたってインキュベートし、その後プレートをPBSで5回洗浄した。KDR-APアッセイに際しては、APに対応する基質を添加し、続いて405nmにおける吸光度を読み取ることにより、プレートに結合されたKDR-APを定量した。Flt-1-Fcアッセイに際しては、プレートをマウス抗ヒトFc-HRP複合体と一緒にインキュベートし、これにより、プレートに結合されたFlt-1-Fcを定量した。次いで、IC50、すなわち、VEGF又はPlGFにKDR又はFlt-1が結合するのを50%阻害するのに必要となる抗体濃度を計算した。
KDR及びFlt-1に対するダイアボディ及びその親scFvの結合動力学特性を、BIAコア・バイオセンサー(Pharmacia Biosensor)を使用して測定した。KDR-AP又はFlt-1-Fc融合蛋白質をセンサーチップ上に固定化し、可溶性抗体を1.5nM〜100nMの範囲の濃度で注入した。それぞれの濃度でセンサーグラムを得、BIA Evaluation 2.0プログラムで分析し、これにより速度定数kon及びkoffを測定した。親和定数Kdを速度定数koff/konの比から計算した。
VEGF、塩基性線維芽細胞増殖因子又は上皮成長因子(EGF)を含有しないEBM-2培地200μl中で、96ウェル組織培養プレート上でHUVEC(5 x 103細胞/ウェル)を平板培養し、37℃で72時間にわたってインキュベートした。種々の量の抗体を二重ウェルに添加し、37℃で1時間にわたって予めインキュベートした。その後VEGF165を最終濃度16ng/mlまで添加した。18時間のインキュベーション後、0.25μCiの[3H]-TdR(Amersham)を各ウェルに添加し、さらに4時間にわたってインキュベートした。細胞をPBSで1回洗浄し、トリプシン処理し、ガラス繊維フィルター(Printed Filtermat A, Wallach)上に細胞収集器(Harvester 96, MACH III M, TOMTEC, Orange, CT)で収集した。膜をH2Oで3回洗浄し、そして空気乾燥した。シンチレーション流体を添加し、DNA内蔵放射能をシンチレーション・カウンター(Wallach, Model 1450 Microbeta Liquid Scintillation Counter)で測定した。
無血清プレーンRPMI1640培地で3回、HL60及びHEL細胞を洗浄し、1 x 106/mlで培地内に懸濁した。100μl細胞懸濁液のアリコートを3μmポア・トランスウェル・インサート(HL60細胞の場合)、又は8μmポア・トランスウェル・インサート(HL細胞の場合)(Costar(登録商標)、Corning Incorporated, Corning, NY)に添加し、30分間37℃で抗体と一緒にインキュベートした。次いで、VEGF165を有する又は有さない0.5mlの無血清RPMI 1640を含有する24ウェル・プレートのウェル内に、インサートを挿入した。HL60細胞の場合には16〜18時間にわたって、又はHL細胞の場合には4時間にわたって、37℃で5%CO2で移動を行った。低い方の区画から移動細胞を捕集し、Coulterカウンター(Model Z1, Coulter Electronics Ltd., Luton, England)でカウントした。
ダイアボディ構造
実施例1に従って形成された抗KDR x 抗Flt-1ダイアボディを精製し、SDS-PAGEによって分析した。2成分ポリペプチドを電気泳動条件下で解明し、予期されるものに近い移動度を有する2つの主要なバンドを生じさせた(図1B);低い方のバンドは第1ポリペプチド(m.w.,25179.6ダルトン)を表し、高い方のバンドはE-タグを有する第2ポリペプチド(m.w.,26693.8ダルトン)と相関する(図1A)。
抗KDR x 抗Flt-1ダイアボディがその標的抗原の両方に同時に結合できるか否かを調査するための架橋アッセイ。Flt-1に結合されたダイアボディが可溶性KDRを捕捉する能力を試験するために、ダイアボディを先ず固定化Flt-1に結合させておき、続いてKDR-APと一緒にインキュベートした。図2Aに示すように、プレート結合AP活性によって実証される通り、ダイアボディは可溶性KDRを固定化Flt-1に効率的に架橋させたが、しかし親単一特異性scFvはこのような架橋をもたらさなかった。
VEGF誘発型白血病細胞移動及びHUVEC有糸分裂生起の阻害
ダイアボディを先ず、VEGF及びPlGFによって誘発される細胞移動の阻害活性におけるその活性に関して試験した。VEGF及びPlGFの両方は、用量に応じてヒト白血病細胞HL60及びHELの移動を誘発した(図4A及び4D)。scFv plC11及びscFv6.12はVEGF誘発型及びPlGF誘発型の細胞移動を阻害した(図4B,4C,4E及び4F)。示したデータは3回以上の別個の試験の代表であり、3部から成る試料の平均±SDを表す。2つのscFvは異なる有効性パターンを示した:scFv plC11はVEGF誘発型細胞移動のより強力な阻害因子であるのに対して、scFv6.12は、PlGF誘発型細胞移動の阻害において僅かにより大きな効力を有する。対照的に、ダイアボディはVEGF及びPlGFの両方によって誘発された細胞移動をブロックする上で等しい効果を有する。単純な混合物として、又はダイアボディ形式で形成されたscFv plC11及びscFv6.12双方の組み合わせは、scFv単独の場合よりも、より強力な阻害効果を有することを実証した。注目すべきなのは、scFv plC11もscFv6.12も、最高抗体濃度(すなわち200nM)で試験しても、単独ではVEGF又はPlGF誘発型細胞移動を完全には阻害することはできなかったことである。対照的に、混合物又はダイアボディとして形成されたscFv plC11及びscFv6.12の組み合わせは、抗体濃度200 nMで細胞移動を完全になくした。表皮成長因子受容体に対する抗体である、C225のFabフラグメントは、このアッセイでは細胞移動の有意な阻害を示さなかった。
Claims (42)
- 抗体であって、第1VEGF受容体に対して特異的な第1抗原結合部位と、第2VEGF受容体に対して特異的な第2抗原結合部位とを有することを特徴とする、抗体。
- 該第1及び第2のVEGF受容体が哺乳動物受容体である、請求項1に記載の抗体。
- 該第1及び第2のVEGF受容体がヒト受容体である、請求項1に記載の抗体。
- 該第1及び第2のVEGF受容体が、KDR、Flt-1及びFlt-4から成る群から選択される、請求項3に記載の抗体。
- 該第1VEGF受容体がKDRであり、該第2VEGF受容体がFlt-1である、請求項3に記載の抗体。
- 該第1VEGF受容体がKDRであり、該第1抗原結合部位の相補性決定領域(CRD)のアミノ酸配列が:
CDRH1におけるSEQ ID NO:1;
CDRH2におけるSEQ ID NO:2;
CDRH3におけるSEQ ID NO:3;
CDRL1におけるSEQ ID NO:4;
CDRL2におけるSEQ ID NO:5;及び
CDRL3におけるSEQ ID NO:6
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の可変ドメインのアミノ酸配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:7;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:8
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の相補性決定領域(CRD)のヌクレオチド配列が:
CDRH1に対応するSEQ ID NO:9;
CDRH2に対応するSEQ ID NO:10;
CDRH3に対応するSEQ ID NO:11;
CDRL1に対応するSEQ ID NO:12;
CDRL2に対応するSEQ ID NO:13;及び
CDRL3に対応するSEQ ID NO:14
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の可変ドメインのヌクレオチド配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:15;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:16
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の相補性決定領域(CRD)のアミノ酸配列が:
CDRH1に対応するSEQ ID NO:1;
CDRH2に対応するSEQ ID NO:21;
CDRH3に対応するSEQ ID NO:3;
CDRL1に対応するSEQ ID NO:4;
CDRL2に対応するSEQ ID NO:5;及び
CDRL3に対応するSEQ ID NO:6
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の可変ドメインのアミノ酸配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:22;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:23
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の相補性決定領域(CRD)のヌクレオチド配列が:
CDRH1に対応するSEQ ID NO:9;
CDRH2に対応するSEQ ID NO:24;
CDRH3に対応するSEQ ID NO:11;
CDRL1に対応するSEQ ID NO:12;
CDRL2に対応するSEQ ID NO:13;及び
CDRL3に対応するSEQ ID NO:14
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位の可変ドメインのヌクレオチド配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:25;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:26
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がKDRであり、該第1抗原結合部位がCDRL1、CDRL2、CDRL3、CDRH1、CDRH2及びCDRH3におけるアミノ酸配列セットを含み、該セットが、SEQ ID NO:53,54,55,65,66及び67のセット、SEQ ID NO:56,57,58,65,66及び67のセット、SEQ ID NO:59,60,61,65,66及び67のセット、並びにSEQ ID NO:62,63,64,68,69及び70のセットから成る群から選択される、請求項3に記載の抗体。
- 該第1VEGF受容体がKDRであり、該第1結合部位が、VHドメインとVLドメインとの対を含み、該ドメイン対が、SEQ ID NO:72及び74、SEQ ID NO:76及び78、SEQ ID NO:76及び81、並びにSEQ ID NO:83及び85から成る群から選択される、請求項3に記載の抗体。
- 該第1VEGF受容体がKDRであり、該第1抗原結合部位が、それぞれSEQ ID NO:65,66,及び67によって与えられたアミノ酸配列CDRH1、CDRH2及びCDRH3のセット、並びに、SEQ ID NO:106,107及び108のセットと、SEQ ID NO:109,110及び111のセットと、SEQ ID NO:112,113及び114のセットと、SEQ ID NO:115,116及び117のセットと、SEQ ID NO:118,119及び120のセットと、SEQ ID NO:121,122及び123のセットと、SEQ ID NO:124,125及び126のセットと、SEQ ID NO:127,128及び129のセットと、SEQ ID NO:130,131及び132のセットと、SEQ ID NO:133,134及び135のセットとから成る群から選択されたCDRL1、CDRL2、CDRL3におけるアミノ酸配列セットを含む、請求項3に記載の抗体。
- 該第1VEGF受容体がKDRであり、該第1結合ドメインのVHドメインがSEQ ID NO:76を含み、該第1結合ドメインのVLドメインが、SEQ ID NO:87、SEQ ID NO:89、SEQ ID NO:91、SEQ ID NO:93、SEQ ID NO:95、SEQ ID NO:97、SEQ ID NO:99、SEQ ID NO:101、SEQ ID NO:103及びSEQ ID NO:105から成る群から選択された配列を含む、請求項3に記載の抗体。
- 該第2VEGF受容体がFlt-1であり、該第2抗原結合部位がMab 6.12(ATCC No. PTA-3344)の重鎖及び軽鎖可変ドメインを含む、請求項6から17までのいずれか1項に記載の抗体。
- 該第1VEGF受容体がFlt-1であり、該第1抗原結合部位の相補性決定領域(CDR)のアミノ酸配列が:
CDRH1におけるSEQ ID NO:35;
CDRH2におけるSEQ ID NO:36;
CDRH3におけるSEQ ID NO:37;
CDRL1におけるSEQ ID NO:38;
CDRL2におけるSEQ ID NO:39;及び
CDRL3におけるSEQ ID NO:40
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がFlt-1であり、該第1抗原結合部位の可変ドメインのアミノ酸配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:41;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:42
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がFlt-1であり、該第1抗原結合部位の相補性決定領域(CRD)のヌクレオチド配列が:
CDRH1に対応するSEQ ID NO:43;
CDRH2に対応するSEQ ID NO:44;
CDRH3に対応するSEQ ID NO:45;
CDRL1に対応するSEQ ID NO:46;
CDRL2に対応するSEQ ID NO:47;及び
CDRL3に対応するSEQ ID NO:48
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がFlt-1であり、該第1抗原結合部位の可変領域のヌクレオチド配列が:
重鎖可変ドメイン(VH)に対応するSEQ ID NO:49;及び
軽鎖可変ドメイン(VL)に対応するSEQ ID NO:50
を含む、請求項3に記載の抗体。 - 該第1VEGF受容体がFlt-1であり、該第1抗原結合部位がMab 6.12(ATCC No. PTA-3344)の重鎖及び軽鎖可変ドメインを含む、請求項3に記載の抗体。
- 第1VEGF受容体の細胞外ドメイン及び第2VEGF受容体の細胞外ドメインに特異的に結合する抗体であって、該第1又は第2VEGF受容体に対する抗体の結合が、前記VEGF受容体の活性化を中和することを特徴とする、抗体。
- VEGFの結合をブロックする、請求項24に記載の抗体。
- 受容体ホモ二量化をブロックする、請求項24に記載の抗体。
- 受容体ヘテロ二量化をブロックする、請求項24に記載の抗体。
- 該第1及び第2VEGF受容体が、KDR、Flt-1及びFlt-4から成る群から選択される、請求項24に記載の抗体。
- 該第1VEGR受容体がKDRであり、該第2VEGR受容体がFlt-1である、請求項24に記載の抗体。
- 抗体であって、第1VEGF受容体の細胞外ドメイン及び第2VEGF受容体の細胞外ドメインに特異的に結合し、腫瘍成長を抑制することを特徴とする、抗体。
- 該第1及び第2VEGF受容体が、KDR、Flt-1及びFlt-4から成る群から選択される、請求項29に記載の抗体。
- 該第1VEGR受容体がKDRであり、該第2VEGR受容体がFlt-1である、請求項29に記載の抗体。
- 抗体であって、第1VEGF受容体の細胞外ドメイン及び第2VEGF受容体の細胞外ドメインに特異的に結合し、血管形成を阻害することを特徴とする抗体。
- 該第1及び第2VEGF受容体が、KDR、Flt-1及びFlt-4から成る群から選択される、請求項32に記載の抗体。
- 該第1VEGR受容体がKDRであり、該第2VEGR受容体がFlt-1である、請求項32に記載の抗体。
- 第1VEGF受容体の細胞外ドメインに特異的に結合する、第1免疫グロブリン重鎖可変ドメインと第1免疫グロブリン軽鎖可変ドメインとを含む第1抗原結合部位、並びに、第2VEGF受容体の細胞外ドメインに特異的に結合する、第2免疫グロブリン重鎖可変ドメインと第2免疫グロブリン軽鎖可変ドメインとを含む第2抗原結合部位を有する抗体の形成方法であって、
a) 宿主細胞中に
該第2免疫グロブリン軽鎖可変ドメインのN末端に該第1免疫グロブリン重鎖可変ドメインが配置された第1ポリペプチドをコードする組換えDNA構築体と、
該第1免疫グロブリン軽鎖可変ドメインのN末端に該第2免疫グロブリン重鎖可変ドメインが配置された第2ポリペプチドをコードする組換えDNA構築体とを、
該ポリペプチドの発現と該抗体の形成とを可能にするのに十分な時間及び方法で、
同時発現させ;そして
b) 該抗体を回収する
ことを特徴とする、抗体の形成方法。 - 該構築体が同一DNA発現ベクター上にある、請求項35に記載の方法。
- 該構築体が異なるDNA発現ベクター上にある、請求項35に記載の方法。
- 該宿主細胞が細菌細胞、酵母細胞又は哺乳動物細胞である、請求項35に記載の方法。
- 該抗体が該宿主細胞から分泌される、請求項35に記載の方法。
- 細胞内の第1VEGF受容体及び第2VEGF受容体の活性化を中和する方法であって、該受容体の活性化を中和するのに十分な量の、該第1VEGF受容体に対して特異的な第1抗原結合部位と、該第2VEGF受容体に対して特異的な第2抗原結合部位とを有する抗体で、細胞を処理することを含む、細胞内の第1VEGF受容体及び第2VEGF受容体の活性化を中和する方法。
- 腫瘍成長を抑制する必要のある哺乳動物における腫瘍成長の抑制方法であって、腫瘍成長を抑制するのに有効な量の、第1VEGF受容体に対して特異的な第1抗原結合部位と、第2VEGF受容体に対して特異的な第2抗原結合部位とを有する抗体で、該哺乳動物を治療することを特徴とする、腫瘍成長の低減方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US30129901P | 2001-06-26 | 2001-06-26 | |
| PCT/US2002/020332 WO2003002144A1 (en) | 2001-06-26 | 2002-06-26 | Bispecific antibodies that bind to vegf receptors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005518336A true JP2005518336A (ja) | 2005-06-23 |
| JP2005518336A5 JP2005518336A5 (ja) | 2006-01-05 |
Family
ID=23162781
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003508383A Pending JP2005518336A (ja) | 2001-06-26 | 2002-06-26 | Vegf受容体に結合する二重特異性抗体 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US20040242851A1 (ja) |
| EP (1) | EP1411983A4 (ja) |
| JP (1) | JP2005518336A (ja) |
| CA (1) | CA2452058A1 (ja) |
| WO (1) | WO2003002144A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005526482A (ja) * | 2001-08-10 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Vegfr−1を発現する幹細胞の単離および動員 |
| JP2013506419A (ja) * | 2009-10-01 | 2013-02-28 | アメリカ合衆国 | 抗血管内皮増殖因子受容体−2キメラ抗原受容体及び癌の治療のためのその使用 |
Families Citing this family (63)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005526506A (ja) | 2002-03-04 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Kdrに特異的なヒト抗体及びその利用 |
| GB0305702D0 (en) * | 2003-03-12 | 2003-04-16 | Univ Birmingham | Bispecific antibodies |
| WO2005047334A1 (en) * | 2003-11-13 | 2005-05-26 | Hanmi Pharmaceutical. Co., Ltd. | Igg fc fragment for a drug carrier and method for the preparation thereof |
| WO2005077065A2 (en) * | 2004-02-09 | 2005-08-25 | The Regents Of The University Of California | Selective high-affinity polydentate ligands and methods of making such |
| US20050282233A1 (en) * | 2004-03-05 | 2005-12-22 | Ludwig Institute For Cancer Research | Multivalent antibody materials and methods for VEGF/PDGF family of growth factors |
| CA2587143C (en) * | 2004-12-08 | 2017-12-05 | Immunomedics, Inc. | Methods and compositions for immunotherapy and detection of inflammatory and immune-dysregulatory disease, infectious disease, pathologic angiogenesis and cancer |
| EP1726650A1 (en) * | 2005-05-27 | 2006-11-29 | Universitätsklinikum Freiburg | Monoclonal antibodies and single chain antibody fragments against cell-surface prostate specific membrane antigen |
| GB0512225D0 (en) * | 2005-06-16 | 2005-07-27 | Univ Sheffield | Immunoglobulin molecules |
| US20090297530A1 (en) | 2006-05-22 | 2009-12-03 | Feng Wang-Johanning | Herv-k antigens, antibodies, and methods |
| WO2007137279A2 (en) * | 2006-05-22 | 2007-11-29 | Board Of Regents, The University Of Texas System | Herv-k antigens, antibodies, and methods |
| WO2009013543A2 (en) * | 2007-07-25 | 2009-01-29 | Astrazeneca Ab | Targeted binging agents directed to kdr and uses thereof - 035 |
| AU2009239491B2 (en) | 2008-04-21 | 2014-07-17 | Lawrence Livermore National Security, Llc | Selective high-affinity polydentate ligands and methods of making such |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| US20120282274A1 (en) * | 2009-11-20 | 2012-11-08 | Northshore University Health System Research Institute | Targeting of the c-terminal segment of c.difficile toxin b for improved clinical diagnosis, prevention, and treatment |
| EP2596026B1 (en) | 2010-07-23 | 2020-04-08 | Trustees of Boston University | Anti-despr inhibitors as therapeutics for inhibition of pathological angiogenesis and tumor cell invasiveness and for molecular imaging and targeted delivery |
| AU2011283694B2 (en) | 2010-07-29 | 2017-04-13 | Xencor, Inc. | Antibodies with modified isoelectric points |
| US10851178B2 (en) | 2011-10-10 | 2020-12-01 | Xencor, Inc. | Heterodimeric human IgG1 polypeptides with isoelectric point modifications |
| US9701759B2 (en) | 2013-01-14 | 2017-07-11 | Xencor, Inc. | Heterodimeric proteins |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| US10738132B2 (en) | 2013-01-14 | 2020-08-11 | Xencor, Inc. | Heterodimeric proteins |
| US10487155B2 (en) | 2013-01-14 | 2019-11-26 | Xencor, Inc. | Heterodimeric proteins |
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| US10131710B2 (en) | 2013-01-14 | 2018-11-20 | Xencor, Inc. | Optimized antibody variable regions |
| WO2014113510A1 (en) | 2013-01-15 | 2014-07-24 | Xencor, Inc. | Rapid clearance of antigen complexes using novel antibodies |
| US10106624B2 (en) | 2013-03-15 | 2018-10-23 | Xencor, Inc. | Heterodimeric proteins |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| EP3421495A3 (en) | 2013-03-15 | 2019-05-15 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| US10519242B2 (en) | 2013-03-15 | 2019-12-31 | Xencor, Inc. | Targeting regulatory T cells with heterodimeric proteins |
| KR102049990B1 (ko) | 2013-03-28 | 2019-12-03 | 삼성전자주식회사 | c-Met 항체 및 VEGF 결합 단편이 연결된 융합 단백질 |
| ES2915378T3 (es) | 2013-09-13 | 2022-06-22 | Hoffmann La Roche | Procedimientos para detectar y cuantificar una proteína de célula huésped en líneas celulares |
| NZ756750A (en) | 2013-09-13 | 2022-05-27 | Genentech Inc | Methods and compositions comprising purified recombinant polypeptides |
| BR112016022385A2 (pt) | 2014-03-28 | 2018-06-19 | Xencor, Inc | anticorpos específicos que se ligam a cd38 e cd3 |
| WO2015197598A2 (en) * | 2014-06-27 | 2015-12-30 | Innate Pharma | Multispecific antigen binding proteins |
| AU2015279316B2 (en) | 2014-06-27 | 2021-03-04 | Innate Pharma | Multispecific NKp46 binding proteins |
| AU2015353416C1 (en) | 2014-11-26 | 2022-01-27 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and CD38 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| CN110894240B (zh) | 2014-11-26 | 2022-04-15 | 森科股份有限公司 | 结合cd3和肿瘤抗原的异二聚体抗体 |
| WO2016105450A2 (en) | 2014-12-22 | 2016-06-30 | Xencor, Inc. | Trispecific antibodies |
| WO2016141387A1 (en) | 2015-03-05 | 2016-09-09 | Xencor, Inc. | Modulation of t cells with bispecific antibodies and fc fusions |
| JP6971153B2 (ja) | 2015-06-23 | 2021-11-24 | イナート・ファルマ・ソシエテ・アノニムInnate Pharma Pharma S.A. | 多重特異的nkエンゲイジャータンパク質 |
| CA2995716A1 (en) | 2015-08-24 | 2017-03-02 | Trustees Of Boston University | Anti-despr monoclonal antibody targeted therapy and imaging for cancer and stroke |
| JP7058219B2 (ja) | 2015-12-07 | 2022-04-21 | ゼンコア インコーポレイテッド | Cd3及びpsmaに結合するヘテロ二量体抗体 |
| CA3026151A1 (en) | 2016-06-14 | 2017-12-21 | Xencor, Inc. | Bispecific checkpoint inhibitor antibodies |
| EP3475304B1 (en) | 2016-06-28 | 2022-03-23 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| US20200017588A1 (en) * | 2016-10-14 | 2020-01-16 | Dana-Farber Cancer Institute, Inc. | Modular tetravalent bispecific antibody platform |
| PE20191034A1 (es) | 2016-10-14 | 2019-08-05 | Xencor Inc | Proteinas de fusion heterodimericas biespecificas que contienen proteinas de fusion fc il-15/il-15r y fragmentos de anticuerpo pd-1 |
| AU2018291497A1 (en) | 2017-06-30 | 2020-01-16 | Xencor, Inc. | Targeted heterodimeric Fc fusion proteins containing IL-15/IL-15Ra and antigen binding domains |
| CN111356475A (zh) | 2017-09-18 | 2020-06-30 | 波士顿大学董事会 | 用于治疗NETosis和中性粒细胞激活的方法 |
| EP3706793A1 (en) | 2017-11-08 | 2020-09-16 | Xencor, Inc. | Bispecific and monospecific antibodies using novel anti-pd-1 sequences |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| JP2021506291A (ja) | 2017-12-19 | 2021-02-22 | ゼンコア インコーポレイテッド | 改変されたil−2 fc融合タンパク質 |
| CA3096052A1 (en) | 2018-04-04 | 2019-10-10 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| CA3097741A1 (en) | 2018-04-18 | 2019-10-24 | Xencor, Inc. | Tim-3 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and tim-3 antigen binding domains |
| US11524991B2 (en) | 2018-04-18 | 2022-12-13 | Xencor, Inc. | PD-1 targeted heterodimeric fusion proteins containing IL-15/IL-15Ra Fc-fusion proteins and PD-1 antigen binding domains and uses thereof |
| WO2019241609A1 (en) | 2018-06-15 | 2019-12-19 | Trustees Of Boston University | Polypeptide compositions and methods for site-specific targeting of therapeutic agents |
| SG11202103192RA (en) | 2018-10-03 | 2021-04-29 | Xencor Inc | Il-12 heterodimeric fc-fusion proteins |
| JP2022523946A (ja) | 2019-03-01 | 2022-04-27 | ゼンコア インコーポレイテッド | Enpp3およびcd3に結合するヘテロ二量体抗体 |
| WO2021231976A1 (en) | 2020-05-14 | 2021-11-18 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (psma) and cd3 |
| US11584792B2 (en) | 2020-10-15 | 2023-02-21 | Trustees Of Boston University | Antibody therapies and methods for treating coronavirus infection |
| AU2022232375A1 (en) | 2021-03-09 | 2023-09-21 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cldn6 |
| KR20230154311A (ko) | 2021-03-10 | 2023-11-07 | 젠코어 인코포레이티드 | Cd3 및 gpc3에 결합하는 이종이량체 항체 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000021560A1 (en) * | 1998-10-09 | 2000-04-20 | Ludwig Institute For Cancer Research | Flt4 (VEGFR-3) AS A TARGET FOR TUMOR IMAGING AND ANTI-TUMOR THERAPY |
| WO2000044777A1 (en) * | 1999-01-29 | 2000-08-03 | Imclone Systems Incorporated | Antibodies specific to kdr and uses thereof |
| JP2004511430A (ja) * | 2000-05-24 | 2004-04-15 | イムクローン システムズ インコーポレイティド | 二重特異性免疫グロブリン様抗原結合蛋白および製造方法 |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5869620A (en) * | 1986-09-02 | 1999-02-09 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US6121424A (en) * | 1991-11-25 | 2000-09-19 | Enzon, Inc. | Multivalent antigen-binding proteins |
| US4946778A (en) * | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5202238A (en) * | 1987-10-27 | 1993-04-13 | Oncogen | Production of chimeric antibodies by homologous recombination |
| AU4128089A (en) * | 1988-09-15 | 1990-03-22 | Rorer International (Overseas) Inc. | Monoclonal antibodies specific to human epidermal growth factor receptor and therapeutic methods employing same |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US20010021382A1 (en) * | 1991-03-29 | 2001-09-13 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| US5367057A (en) * | 1991-04-02 | 1994-11-22 | The Trustees Of Princeton University | Tyrosine kinase receptor flk-2 and fragments thereof |
| US5861301A (en) * | 1992-02-20 | 1999-01-19 | American Cayanamid Company | Recombinant kinase insert domain containing receptor and gene encoding same |
| US5965132A (en) * | 1992-03-05 | 1999-10-12 | Board Of Regents, The University Of Texas System | Methods and compositions for targeting the vasculature of solid tumors |
| US6036955A (en) * | 1992-03-05 | 2000-03-14 | The Scripps Research Institute | Kits and methods for the specific coagulation of vasculature |
| US6824777B1 (en) * | 1992-10-09 | 2004-11-30 | Licentia Ltd. | Flt4 (VEGFR-3) as a target for tumor imaging and anti-tumor therapy |
| US6177401B1 (en) * | 1992-11-13 | 2001-01-23 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften | Use of organic compounds for the inhibition of Flk-1 mediated vasculogenesis and angiogenesis |
| WO1995009917A1 (en) * | 1993-10-07 | 1995-04-13 | The Regents Of The University Of California | Genetically engineered bispecific tetravalent antibodies |
| US5840299A (en) * | 1994-01-25 | 1998-11-24 | Athena Neurosciences, Inc. | Humanized antibodies against leukocyte adhesion molecule VLA-4 |
| US5840301A (en) * | 1994-02-10 | 1998-11-24 | Imclone Systems Incorporated | Methods of use of chimerized, humanized, and single chain antibodies specific to VEGF receptors |
| US6448077B1 (en) * | 1994-02-10 | 2002-09-10 | Imclone Systems, Inc. | Chimeric and humanized monoclonal antibodies specific to VEGF receptors |
| US5861499A (en) * | 1994-02-10 | 1999-01-19 | Imclone Systems Incorporated | Nucleic acid molecules encoding the variable or hypervariable region of a monoclonal antibody that binds to an extracellular domain |
| PT1140175E (pt) * | 1998-12-21 | 2006-06-30 | Ludwig Inst Cancer Res | Anticorpos para o vegf-d truncado e suas utilizacoes |
-
2002
- 2002-06-26 WO PCT/US2002/020332 patent/WO2003002144A1/en active Application Filing
- 2002-06-26 US US10/482,630 patent/US20040242851A1/en not_active Abandoned
- 2002-06-26 CA CA002452058A patent/CA2452058A1/en not_active Abandoned
- 2002-06-26 JP JP2003508383A patent/JP2005518336A/ja active Pending
- 2002-06-26 EP EP02744670A patent/EP1411983A4/en not_active Withdrawn
- 2002-12-24 US US10/520,026 patent/US20090028859A1/en not_active Abandoned
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000021560A1 (en) * | 1998-10-09 | 2000-04-20 | Ludwig Institute For Cancer Research | Flt4 (VEGFR-3) AS A TARGET FOR TUMOR IMAGING AND ANTI-TUMOR THERAPY |
| WO2000044777A1 (en) * | 1999-01-29 | 2000-08-03 | Imclone Systems Incorporated | Antibodies specific to kdr and uses thereof |
| JP2004511430A (ja) * | 2000-05-24 | 2004-04-15 | イムクローン システムズ インコーポレイティド | 二重特異性免疫グロブリン様抗原結合蛋白および製造方法 |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005526482A (ja) * | 2001-08-10 | 2005-09-08 | イムクローン システムズ インコーポレイティド | Vegfr−1を発現する幹細胞の単離および動員 |
| JP2013506419A (ja) * | 2009-10-01 | 2013-02-28 | アメリカ合衆国 | 抗血管内皮増殖因子受容体−2キメラ抗原受容体及び癌の治療のためのその使用 |
| US9522955B2 (en) | 2009-10-01 | 2016-12-20 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Anti-vascular endothelial growth factor receptor-2 chimeric antigen receptors and use of same for the treatment of cancer |
Also Published As
| Publication number | Publication date |
|---|---|
| US20090028859A1 (en) | 2009-01-29 |
| CA2452058A1 (en) | 2003-01-09 |
| EP1411983A4 (en) | 2006-06-21 |
| US20040242851A1 (en) | 2004-12-02 |
| EP1411983A1 (en) | 2004-04-28 |
| WO2003002144A1 (en) | 2003-01-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2005518336A (ja) | Vegf受容体に結合する二重特異性抗体 | |
| US7498414B2 (en) | Human antibodies specific to KDR and uses thereof | |
| US20040259156A1 (en) | Bispecific immunoglobulin-like antigen binding proteins and method of production | |
| JP6895890B2 (ja) | ヒト化抗muc1* 抗体 | |
| JP2009526857A (ja) | 機能性抗体 | |
| JP2008512352A (ja) | 新規な四価の二重特異性抗体 | |
| JP2016116522A (ja) | ヘテロ多量体分子を作製するための方法 | |
| AU2071695A (en) | Anti-EGFR single-chain FVS and anti-EGFR antibodies | |
| CA2738782A1 (en) | Anti cxcr4 antibodies and their use for the treatment of cancer | |
| CZ20032586A3 (cs) | Kombinované metody inhibice nádorového růstu s antagonistou receptoru vaskulárního endotelového růstového faktoru | |
| KR20230028708A (ko) | 항-b7-h4/항-4-1bb 이중특이적 항체 및 이의 용도 | |
| WO2004003211A1 (en) | Bispecific antibodies that bind to vegf receptors | |
| US20240141061A1 (en) | Novel antibody against cd55 and use thereof | |
| CN118791607A (zh) | 双特异性抗体及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050524 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050601 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080108 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20080404 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20080411 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080708 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20090812 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20090812 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091027 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100323 |