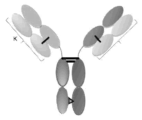
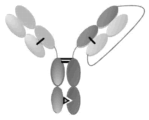
KR20240060739A - Her2, nkg2d 및 cd16에 결합하는 단백질 - Google Patents
Her2, nkg2d 및 cd16에 결합하는 단백질 Download PDFInfo
- Publication number
- KR20240060739A KR20240060739A KR1020247014453A KR20247014453A KR20240060739A KR 20240060739 A KR20240060739 A KR 20240060739A KR 1020247014453 A KR1020247014453 A KR 1020247014453A KR 20247014453 A KR20247014453 A KR 20247014453A KR 20240060739 A KR20240060739 A KR 20240060739A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- gly
- thr
- leu
- gln
- Prior art date
Links
- 230000027455 binding Effects 0.000 title claims description 226
- 108090000623 proteins and genes Proteins 0.000 title description 59
- 102000004169 proteins and genes Human genes 0.000 title description 58
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 title 1
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 181
- 230000009870 specific binding Effects 0.000 claims abstract description 140
- 108091008324 binding proteins Proteins 0.000 claims abstract description 139
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims abstract description 130
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims abstract description 120
- 201000011510 cancer Diseases 0.000 claims abstract description 94
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 claims abstract description 42
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 claims abstract description 42
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 claims abstract description 38
- 238000000034 method Methods 0.000 claims abstract description 37
- 102000023732 binding proteins Human genes 0.000 claims abstract 26
- 210000004027 cell Anatomy 0.000 claims description 270
- 210000000822 natural killer cell Anatomy 0.000 claims description 225
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 claims description 146
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 claims description 134
- 241000282414 Homo sapiens Species 0.000 claims description 133
- 239000000427 antigen Substances 0.000 claims description 94
- 108091007433 antigens Proteins 0.000 claims description 94
- 102000036639 antigens Human genes 0.000 claims description 94
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 84
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 73
- 229920001184 polypeptide Polymers 0.000 claims description 69
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 62
- 239000000203 mixture Substances 0.000 claims description 56
- 238000009472 formulation Methods 0.000 claims description 43
- 230000003213 activating effect Effects 0.000 claims description 27
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 claims description 15
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 claims description 15
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 claims description 13
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 claims description 13
- 206010006187 Breast cancer Diseases 0.000 claims description 12
- 208000026310 Breast neoplasm Diseases 0.000 claims description 12
- 150000001413 amino acids Chemical class 0.000 claims description 12
- 239000003446 ligand Substances 0.000 claims description 11
- 150000007523 nucleic acids Chemical class 0.000 claims description 9
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 7
- 239000010445 mica Substances 0.000 claims description 7
- 229910052618 mica group Inorganic materials 0.000 claims description 7
- 206010046766 uterine cancer Diseases 0.000 claims description 7
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 6
- 241000282412 Homo Species 0.000 claims description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 6
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 6
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 6
- 208000020989 salivary duct carcinoma Diseases 0.000 claims description 6
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 201000004101 esophageal cancer Diseases 0.000 claims description 5
- 206010017758 gastric cancer Diseases 0.000 claims description 5
- 201000011549 stomach cancer Diseases 0.000 claims description 5
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 5
- 206010005003 Bladder cancer Diseases 0.000 claims description 4
- 239000012634 fragment Substances 0.000 claims description 4
- 201000005249 lung adenocarcinoma Diseases 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 3
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 2
- 101100101727 Homo sapiens RAET1L gene Proteins 0.000 claims description 2
- 102100040013 UL16-binding protein 6 Human genes 0.000 claims description 2
- 108020004707 nucleic acids Proteins 0.000 claims description 2
- 102000039446 nucleic acids Human genes 0.000 claims description 2
- 239000001608 potassium adipate Substances 0.000 claims description 2
- 239000001601 sodium adipate Substances 0.000 claims description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims 1
- 239000000539 dimer Substances 0.000 claims 1
- 229910052698 phosphorus Inorganic materials 0.000 claims 1
- 239000011574 phosphorus Substances 0.000 claims 1
- 239000008194 pharmaceutical composition Substances 0.000 abstract description 12
- 108010001657 NK Cell Lectin-Like Receptor Subfamily K Proteins 0.000 abstract description 8
- 102000000812 NK Cell Lectin-Like Receptor Subfamily K Human genes 0.000 abstract description 8
- 102000014914 Carrier Proteins Human genes 0.000 description 113
- 235000018102 proteins Nutrition 0.000 description 57
- 230000037396 body weight Effects 0.000 description 47
- YOOAQCZYZHGUAZ-KATARQTJSA-N Thr-Leu-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YOOAQCZYZHGUAZ-KATARQTJSA-N 0.000 description 46
- FQPDRTDDEZXCEC-SVSWQMSJSA-N Thr-Ile-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O FQPDRTDDEZXCEC-SVSWQMSJSA-N 0.000 description 44
- 230000009089 cytolysis Effects 0.000 description 42
- 210000004881 tumor cell Anatomy 0.000 description 42
- 229960000575 trastuzumab Drugs 0.000 description 41
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 38
- 230000004913 activation Effects 0.000 description 36
- 102000000588 Interleukin-2 Human genes 0.000 description 31
- 108010002350 Interleukin-2 Proteins 0.000 description 31
- 230000008685 targeting Effects 0.000 description 31
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 description 30
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 description 30
- 241000880493 Leptailurus serval Species 0.000 description 29
- 239000001963 growth medium Substances 0.000 description 29
- ZDILXFDENZVOTL-BPNCWPANSA-N Ala-Val-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZDILXFDENZVOTL-BPNCWPANSA-N 0.000 description 27
- PDIDTSZKKFEDMB-UWVGGRQHSA-N Lys-Pro-Gly Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O PDIDTSZKKFEDMB-UWVGGRQHSA-N 0.000 description 27
- 230000000284 resting effect Effects 0.000 description 27
- JXFLPKSDLDEOQK-JHEQGTHGSA-N Gln-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCC(N)=O JXFLPKSDLDEOQK-JHEQGTHGSA-N 0.000 description 26
- 108010074328 Interferon-gamma Proteins 0.000 description 26
- PMGDADKJMCOXHX-UHFFFAOYSA-N L-Arginyl-L-glutamin-acetat Natural products NC(=N)NCCCC(N)C(=O)NC(CCC(N)=O)C(O)=O PMGDADKJMCOXHX-UHFFFAOYSA-N 0.000 description 26
- FEHQLKKBVJHSEC-SZMVWBNQSA-N Leu-Glu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 FEHQLKKBVJHSEC-SZMVWBNQSA-N 0.000 description 26
- 241000699666 Mus <mouse, genus> Species 0.000 description 26
- 108010008355 arginyl-glutamine Proteins 0.000 description 26
- 230000000694 effects Effects 0.000 description 26
- XKUKSGPZAADMRA-UHFFFAOYSA-N glycyl-glycyl-glycine Natural products NCC(=O)NCC(=O)NCC(O)=O XKUKSGPZAADMRA-UHFFFAOYSA-N 0.000 description 26
- 101100505161 Caenorhabditis elegans mel-32 gene Proteins 0.000 description 25
- 102100037850 Interferon gamma Human genes 0.000 description 25
- QOIKZODVIPOPDD-AVGNSLFASA-N Tyr-Cys-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(O)=O QOIKZODVIPOPDD-AVGNSLFASA-N 0.000 description 25
- 102000005962 receptors Human genes 0.000 description 25
- 108020003175 receptors Proteins 0.000 description 25
- PDUHNKAFQXQNLH-ZETCQYMHSA-N Gly-Lys-Gly Chemical compound NCCCC[C@H](NC(=O)CN)C(=O)NCC(O)=O PDUHNKAFQXQNLH-ZETCQYMHSA-N 0.000 description 24
- KLYYKKGCPOGDPE-OEAJRASXSA-N Phe-Thr-Leu Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O KLYYKKGCPOGDPE-OEAJRASXSA-N 0.000 description 24
- UIGMAMGZOJVTDN-WHFBIAKZSA-N Ser-Gly-Ser Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O UIGMAMGZOJVTDN-WHFBIAKZSA-N 0.000 description 24
- QUILOGWWLXMSAT-IHRRRGAJSA-N Tyr-Gln-Gln Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O QUILOGWWLXMSAT-IHRRRGAJSA-N 0.000 description 24
- 235000001014 amino acid Nutrition 0.000 description 24
- 108010044292 tryptophyltyrosine Proteins 0.000 description 24
- ZFBBMCKQSNJZSN-AUTRQRHGSA-N Gln-Val-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O ZFBBMCKQSNJZSN-AUTRQRHGSA-N 0.000 description 23
- SPSSJSICDYYTQN-HJGDQZAQSA-N Met-Thr-Gln Chemical compound CSCC[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O SPSSJSICDYYTQN-HJGDQZAQSA-N 0.000 description 23
- FMDHKPRACUXATF-ACZMJKKPSA-N Ser-Gln-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(O)=O FMDHKPRACUXATF-ACZMJKKPSA-N 0.000 description 23
- 230000035772 mutation Effects 0.000 description 23
- 108010051242 phenylalanylserine Proteins 0.000 description 23
- 108010087846 prolyl-prolyl-glycine Proteins 0.000 description 23
- 108010072986 threonyl-seryl-lysine Proteins 0.000 description 23
- BTYTYHBSJKQBQA-GCJQMDKQSA-N Ala-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C)N)O BTYTYHBSJKQBQA-GCJQMDKQSA-N 0.000 description 22
- ARHJJAAWNWOACN-FXQIFTODSA-N Ala-Ser-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O ARHJJAAWNWOACN-FXQIFTODSA-N 0.000 description 22
- AOHKLEBWKMKITA-IHRRRGAJSA-N Arg-Phe-Ser Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N AOHKLEBWKMKITA-IHRRRGAJSA-N 0.000 description 22
- XYBJLTKSGFBLCS-QXEWZRGKSA-N Asp-Arg-Val Chemical compound NC(N)=NCCC[C@@H](C(=O)N[C@@H](C(C)C)C(O)=O)NC(=O)[C@@H](N)CC(O)=O XYBJLTKSGFBLCS-QXEWZRGKSA-N 0.000 description 22
- SZQCDCKIGWQAQN-FXQIFTODSA-N Cys-Arg-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O SZQCDCKIGWQAQN-FXQIFTODSA-N 0.000 description 22
- WLRYGVYQFXRJDA-DCAQKATOSA-N Gln-Pro-Pro Chemical compound NC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N1[C@H](C(O)=O)CCC1 WLRYGVYQFXRJDA-DCAQKATOSA-N 0.000 description 22
- CQGSYZCULZMEDE-UHFFFAOYSA-N Leu-Gln-Pro Natural products CC(C)CC(N)C(=O)NC(CCC(N)=O)C(=O)N1CCCC1C(O)=O CQGSYZCULZMEDE-UHFFFAOYSA-N 0.000 description 22
- LINKCQUOMUDLKN-KATARQTJSA-N Leu-Thr-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(C)C)N)O LINKCQUOMUDLKN-KATARQTJSA-N 0.000 description 22
- AIRZWUMAHCDDHR-KKUMJFAQSA-N Lys-Leu-Leu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O AIRZWUMAHCDDHR-KKUMJFAQSA-N 0.000 description 22
- YTJFXEDRUOQGSP-DCAQKATOSA-N Lys-Pro-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O YTJFXEDRUOQGSP-DCAQKATOSA-N 0.000 description 22
- HTONZBWRYUKUKC-RCWTZXSCSA-N Val-Thr-Val Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(O)=O HTONZBWRYUKUKC-RCWTZXSCSA-N 0.000 description 22
- 108010077245 asparaginyl-proline Proteins 0.000 description 22
- 108010070409 phenylalanyl-glycyl-glycine Proteins 0.000 description 22
- 238000006467 substitution reaction Methods 0.000 description 22
- CREYEAPXISDKSB-FQPOAREZSA-N Ala-Thr-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O CREYEAPXISDKSB-FQPOAREZSA-N 0.000 description 21
- RTFXPCYMDYBZNQ-SRVKXCTJSA-N Asn-Tyr-Asn Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O RTFXPCYMDYBZNQ-SRVKXCTJSA-N 0.000 description 21
- UESYBOXFJWJVSB-AVGNSLFASA-N Gln-Phe-Ser Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O UESYBOXFJWJVSB-AVGNSLFASA-N 0.000 description 21
- KAFOIVJDVSZUMD-DCAQKATOSA-N Leu-Gln-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O KAFOIVJDVSZUMD-DCAQKATOSA-N 0.000 description 21
- KAFOIVJDVSZUMD-UHFFFAOYSA-N Leu-Gln-Gln Natural products CC(C)CC(N)C(=O)NC(CCC(N)=O)C(=O)NC(CCC(N)=O)C(O)=O KAFOIVJDVSZUMD-UHFFFAOYSA-N 0.000 description 21
- WRODMZBHNNPRLN-SRVKXCTJSA-N Lys-Leu-Ser Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O WRODMZBHNNPRLN-SRVKXCTJSA-N 0.000 description 21
- -1 NCR Proteins 0.000 description 21
- LNICFEXCAHIJOR-DCAQKATOSA-N Pro-Ser-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O LNICFEXCAHIJOR-DCAQKATOSA-N 0.000 description 21
- HBOABDXGTMMDSE-GUBZILKMSA-N Ser-Arg-Val Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(O)=O HBOABDXGTMMDSE-GUBZILKMSA-N 0.000 description 21
- GJFYFGOEWLDQGW-GUBZILKMSA-N Ser-Leu-Gln Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CO)N GJFYFGOEWLDQGW-GUBZILKMSA-N 0.000 description 21
- HDBOEVPDIDDEPC-CIUDSAMLSA-N Ser-Lys-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(O)=O HDBOEVPDIDDEPC-CIUDSAMLSA-N 0.000 description 21
- AZWNCEBQZXELEZ-FXQIFTODSA-N Ser-Pro-Ser Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O AZWNCEBQZXELEZ-FXQIFTODSA-N 0.000 description 21
- SIEBDTCABMZCLF-XGEHTFHBSA-N Ser-Val-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O SIEBDTCABMZCLF-XGEHTFHBSA-N 0.000 description 21
- GXUWHVZYDAHFSV-FLBSBUHZSA-N Thr-Ile-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(O)=O GXUWHVZYDAHFSV-FLBSBUHZSA-N 0.000 description 21
- GQHAIUPYZPTADF-FDARSICLSA-N Trp-Ile-Arg Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 GQHAIUPYZPTADF-FDARSICLSA-N 0.000 description 21
- SMLCYZYQFRTLCO-UWJYBYFXSA-N Tyr-Cys-Ala Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CS)C(=O)N[C@@H](C)C(O)=O SMLCYZYQFRTLCO-UWJYBYFXSA-N 0.000 description 21
- QRCBQDPRKMYTMB-IHPCNDPISA-N Tyr-Trp-Ser Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N QRCBQDPRKMYTMB-IHPCNDPISA-N 0.000 description 21
- OVLIFGQSBSNGHY-KKHAAJSZSA-N Val-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](C(C)C)N)O OVLIFGQSBSNGHY-KKHAAJSZSA-N 0.000 description 21
- 108010037850 glycylvaline Proteins 0.000 description 21
- 108010034529 leucyl-lysine Proteins 0.000 description 21
- 108010003137 tyrosyltyrosine Proteins 0.000 description 21
- SGYSTDWPNPKJPP-GUBZILKMSA-N Arg-Ala-Arg Chemical compound NC(=N)NCCC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SGYSTDWPNPKJPP-GUBZILKMSA-N 0.000 description 20
- ICZWAZVKLACMKR-CIUDSAMLSA-N Asp-His-Ser Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CN=CN1 ICZWAZVKLACMKR-CIUDSAMLSA-N 0.000 description 20
- QNFRBNZGVVKBNJ-PEFMBERDSA-N Asp-Ile-Gln Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CC(=O)O)N QNFRBNZGVVKBNJ-PEFMBERDSA-N 0.000 description 20
- RFTVTKBHDXCEEX-WDSKDSINSA-N Glu-Ser-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)NCC(O)=O RFTVTKBHDXCEEX-WDSKDSINSA-N 0.000 description 20
- STVHDEHTKFXBJQ-LAEOZQHASA-N Gly-Glu-Ile Chemical compound [H]NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O STVHDEHTKFXBJQ-LAEOZQHASA-N 0.000 description 20
- UHPAZODVFFYEEL-QWRGUYRKSA-N Gly-Leu-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)CN UHPAZODVFFYEEL-QWRGUYRKSA-N 0.000 description 20
- ISSDODCYBOWWIP-GJZGRUSLSA-N Gly-Pro-Trp Chemical compound [H]NCC(=O)N1CCC[C@H]1C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O ISSDODCYBOWWIP-GJZGRUSLSA-N 0.000 description 20
- JSLVAHYTAJJEQH-QWRGUYRKSA-N Gly-Ser-Phe Chemical compound NCC(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 JSLVAHYTAJJEQH-QWRGUYRKSA-N 0.000 description 20
- LCRDMSSAKLTKBU-ZDLURKLDSA-N Gly-Ser-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)CN LCRDMSSAKLTKBU-ZDLURKLDSA-N 0.000 description 20
- HXWALXSAVBLTPK-NUTKFTJISA-N Leu-Ala-Trp Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(C)C)N HXWALXSAVBLTPK-NUTKFTJISA-N 0.000 description 20
- IXHKPDJKKCUKHS-GARJFASQSA-N Lys-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCCN)N IXHKPDJKKCUKHS-GARJFASQSA-N 0.000 description 20
- DMNANGOFEUVBRV-GJZGRUSLSA-N Pro-Trp-Gly Chemical compound N([C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)NCC(=O)O)C(=O)[C@@H]1CCCN1 DMNANGOFEUVBRV-GJZGRUSLSA-N 0.000 description 20
- OQPNSDWGAMFJNU-QWRGUYRKSA-N Ser-Gly-Tyr Chemical compound OC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CC1=CC=C(O)C=C1 OQPNSDWGAMFJNU-QWRGUYRKSA-N 0.000 description 20
- FEZASNVQLJQBHW-CABZTGNLSA-N Trp-Gly-Ala Chemical compound C1=CC=C2C(C[C@H](N)C(=O)NCC(=O)N[C@@H](C)C(O)=O)=CNC2=C1 FEZASNVQLJQBHW-CABZTGNLSA-N 0.000 description 20
- SSYBNWFXCFNRFN-GUBZILKMSA-N Val-Pro-Ser Chemical compound CC(C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CO)C(O)=O SSYBNWFXCFNRFN-GUBZILKMSA-N 0.000 description 20
- GUIYPEKUEMQBIK-JSGCOSHPSA-N Val-Tyr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](Cc1ccc(O)cc1)C(=O)NCC(O)=O GUIYPEKUEMQBIK-JSGCOSHPSA-N 0.000 description 20
- 108010047495 alanylglycine Proteins 0.000 description 20
- 108010091092 arginyl-glycyl-proline Proteins 0.000 description 20
- 108010093581 aspartyl-proline Proteins 0.000 description 20
- 230000014509 gene expression Effects 0.000 description 20
- 108010015792 glycyllysine Proteins 0.000 description 20
- 108010090333 leucyl-lysyl-proline Proteins 0.000 description 20
- 239000002609 medium Substances 0.000 description 20
- 108010017949 tyrosyl-glycyl-glycine Proteins 0.000 description 20
- UGTZYIPOBYXWRW-SRVKXCTJSA-N Ser-Phe-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O UGTZYIPOBYXWRW-SRVKXCTJSA-N 0.000 description 19
- BMKNXTJLHFIAAH-CIUDSAMLSA-N Ser-Ser-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O BMKNXTJLHFIAAH-CIUDSAMLSA-N 0.000 description 19
- 238000005734 heterodimerization reaction Methods 0.000 description 19
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 19
- SVFOIXMRMLROHO-SRVKXCTJSA-N Asp-Asp-Phe Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 SVFOIXMRMLROHO-SRVKXCTJSA-N 0.000 description 18
- XMBSYZWANAQXEV-UHFFFAOYSA-N N-alpha-L-glutamyl-L-phenylalanine Natural products OC(=O)CCC(N)C(=O)NC(C(O)=O)CC1=CC=CC=C1 XMBSYZWANAQXEV-UHFFFAOYSA-N 0.000 description 18
- JAGGEZACYAAMIL-CQDKDKBSSA-N Tyr-Lys-Ala Chemical compound C[C@@H](C(=O)O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC1=CC=C(C=C1)O)N JAGGEZACYAAMIL-CQDKDKBSSA-N 0.000 description 18
- 238000000684 flow cytometry Methods 0.000 description 18
- 239000003112 inhibitor Substances 0.000 description 18
- DBUNZBWUWCIELX-JHEQGTHGSA-N Gly-Thr-Glu Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(O)=O DBUNZBWUWCIELX-JHEQGTHGSA-N 0.000 description 17
- 101000581981 Homo sapiens Neural cell adhesion molecule 1 Proteins 0.000 description 17
- PXKACEXYLPBMAD-JBDRJPRFSA-N Ile-Ser-Ser Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PXKACEXYLPBMAD-JBDRJPRFSA-N 0.000 description 17
- 102100027347 Neural cell adhesion molecule 1 Human genes 0.000 description 17
- 230000006051 NK cell activation Effects 0.000 description 16
- 210000001744 T-lymphocyte Anatomy 0.000 description 16
- 238000002784 cytotoxicity assay Methods 0.000 description 16
- 231100000263 cytotoxicity test Toxicity 0.000 description 16
- 239000012669 liquid formulation Substances 0.000 description 16
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 15
- 230000003013 cytotoxicity Effects 0.000 description 15
- 231100000135 cytotoxicity Toxicity 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- XHVONGZZVUUORG-WEDXCCLWSA-N Gly-Thr-Lys Chemical compound NCC(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCCN XHVONGZZVUUORG-WEDXCCLWSA-N 0.000 description 14
- NAXPHWZXEXNDIW-JTQLQIEISA-N Phe-Gly-Gly Chemical compound OC(=O)CNC(=O)CNC(=O)[C@@H](N)CC1=CC=CC=C1 NAXPHWZXEXNDIW-JTQLQIEISA-N 0.000 description 14
- VCAWFLIWYNMHQP-UKJIMTQDSA-N Val-Glu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](C(C)C)N VCAWFLIWYNMHQP-UKJIMTQDSA-N 0.000 description 14
- 239000011324 bead Substances 0.000 description 14
- 238000010586 diagram Methods 0.000 description 14
- 238000011534 incubation Methods 0.000 description 14
- 108010017391 lysylvaline Proteins 0.000 description 14
- 150000003839 salts Chemical class 0.000 description 13
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 239000002253 acid Substances 0.000 description 12
- 238000004519 manufacturing process Methods 0.000 description 12
- 229940024606 amino acid Drugs 0.000 description 11
- 239000002585 base Substances 0.000 description 11
- 230000001404 mediated effect Effects 0.000 description 11
- 239000013641 positive control Substances 0.000 description 11
- 230000002269 spontaneous effect Effects 0.000 description 11
- BIBYEFRASCNLAA-CDMKHQONSA-N Thr-Phe-Gly Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@H](C(=O)NCC(O)=O)CC1=CC=CC=C1 BIBYEFRASCNLAA-CDMKHQONSA-N 0.000 description 10
- 239000003795 chemical substances by application Substances 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 10
- 230000001472 cytotoxic effect Effects 0.000 description 10
- 238000000432 density-gradient centrifugation Methods 0.000 description 10
- 102000051957 human ERBB2 Human genes 0.000 description 10
- 239000000543 intermediate Substances 0.000 description 10
- 102000004127 Cytokines Human genes 0.000 description 9
- 108090000695 Cytokines Proteins 0.000 description 9
- UGCIQUYEJIEHKX-GVXVVHGQSA-N Lys-Val-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O UGCIQUYEJIEHKX-GVXVVHGQSA-N 0.000 description 9
- 108010069205 aspartyl-phenylalanine Proteins 0.000 description 9
- 238000003556 assay Methods 0.000 description 9
- 229960002685 biotin Drugs 0.000 description 9
- 239000011616 biotin Substances 0.000 description 9
- 239000006172 buffering agent Substances 0.000 description 9
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 9
- 102000044042 human KLRK1 Human genes 0.000 description 9
- 238000001990 intravenous administration Methods 0.000 description 9
- 239000002953 phosphate buffered saline Substances 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 239000003755 preservative agent Substances 0.000 description 9
- 201000009030 Carcinoma Diseases 0.000 description 8
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 8
- UQJNXZSSGQIPIQ-FBCQKBJTSA-N Gly-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)CN UQJNXZSSGQIPIQ-FBCQKBJTSA-N 0.000 description 8
- 229930195725 Mannitol Natural products 0.000 description 8
- 229930191564 Monensin Natural products 0.000 description 8
- GAOZTHIDHYLHMS-UHFFFAOYSA-N Monensin A Natural products O1C(CC)(C2C(CC(O2)C2C(CC(C)C(O)(CO)O2)C)C)CCC1C(O1)(C)CCC21CC(O)C(C)C(C(C)C(OC)C(C)C(O)=O)O2 GAOZTHIDHYLHMS-UHFFFAOYSA-N 0.000 description 8
- KQNZDYYTLMIZCT-KQPMLPITSA-N brefeldin A Chemical compound O[C@@H]1\C=C\C(=O)O[C@@H](C)CCC\C=C\[C@@H]2C[C@H](O)C[C@H]21 KQNZDYYTLMIZCT-KQPMLPITSA-N 0.000 description 8
- 239000003814 drug Substances 0.000 description 8
- 239000000594 mannitol Substances 0.000 description 8
- 235000010355 mannitol Nutrition 0.000 description 8
- 230000007246 mechanism Effects 0.000 description 8
- 229960005358 monensin Drugs 0.000 description 8
- GAOZTHIDHYLHMS-KEOBGNEYSA-N monensin A Chemical compound C([C@@](O1)(C)[C@H]2CC[C@@](O2)(CC)[C@H]2[C@H](C[C@@H](O2)[C@@H]2[C@H](C[C@@H](C)[C@](O)(CO)O2)C)C)C[C@@]21C[C@H](O)[C@@H](C)[C@@H]([C@@H](C)[C@@H](OC)[C@H](C)C(O)=O)O2 GAOZTHIDHYLHMS-KEOBGNEYSA-N 0.000 description 8
- 210000005259 peripheral blood Anatomy 0.000 description 8
- 239000011886 peripheral blood Substances 0.000 description 8
- 230000011664 signaling Effects 0.000 description 8
- 238000010186 staining Methods 0.000 description 8
- 239000008227 sterile water for injection Substances 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- 230000004614 tumor growth Effects 0.000 description 8
- NVTPVQLIZCOJFK-FOHZUACHSA-N Gly-Thr-Asp Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(O)=O NVTPVQLIZCOJFK-FOHZUACHSA-N 0.000 description 7
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 7
- 101100404853 Mus musculus Klrk1 gene Proteins 0.000 description 7
- 241000699670 Mus sp. Species 0.000 description 7
- 150000007513 acids Chemical class 0.000 description 7
- 230000006240 deamidation Effects 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 108010010147 glycylglutamine Proteins 0.000 description 7
- 230000002147 killing effect Effects 0.000 description 7
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 7
- 229920000053 polysorbate 80 Polymers 0.000 description 7
- 238000007920 subcutaneous administration Methods 0.000 description 7
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 6
- 108060003951 Immunoglobulin Proteins 0.000 description 6
- 108020003285 Isocitrate lyase Proteins 0.000 description 6
- 102100030301 MHC class I polypeptide-related sequence A Human genes 0.000 description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 description 6
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 6
- 238000002835 absorbance Methods 0.000 description 6
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 6
- 239000008365 aqueous carrier Substances 0.000 description 6
- 239000008228 bacteriostatic water for injection Substances 0.000 description 6
- 230000008901 benefit Effects 0.000 description 6
- JUMGSHROWPPKFX-UHFFFAOYSA-N brefeldin-A Natural products CC1CCCC=CC2(C)CC(O)CC2(C)C(O)C=CC(=O)O1 JUMGSHROWPPKFX-UHFFFAOYSA-N 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 230000022534 cell killing Effects 0.000 description 6
- 230000036755 cellular response Effects 0.000 description 6
- 239000003153 chemical reaction reagent Substances 0.000 description 6
- 238000002648 combination therapy Methods 0.000 description 6
- 238000004132 cross linking Methods 0.000 description 6
- 239000012228 culture supernatant Substances 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 229940126534 drug product Drugs 0.000 description 6
- 239000012636 effector Substances 0.000 description 6
- 238000004108 freeze drying Methods 0.000 description 6
- 102000018358 immunoglobulin Human genes 0.000 description 6
- 238000001727 in vivo Methods 0.000 description 6
- 230000003993 interaction Effects 0.000 description 6
- 238000002955 isolation Methods 0.000 description 6
- 238000002372 labelling Methods 0.000 description 6
- 201000001441 melanoma Diseases 0.000 description 6
- 238000002625 monoclonal antibody therapy Methods 0.000 description 6
- 239000000825 pharmaceutical preparation Substances 0.000 description 6
- 229920005862 polyol Polymers 0.000 description 6
- 150000003077 polyols Chemical class 0.000 description 6
- 230000000638 stimulation Effects 0.000 description 6
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical compound O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 6
- 108090000672 Annexin A5 Proteins 0.000 description 5
- 102000004121 Annexin A5 Human genes 0.000 description 5
- 101710145634 Antigen 1 Proteins 0.000 description 5
- MNQMTYSEKZHIDF-GCJQMDKQSA-N Asp-Thr-Ala Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O MNQMTYSEKZHIDF-GCJQMDKQSA-N 0.000 description 5
- OYTPNWYZORARHL-XHNCKOQMSA-N Gln-Ala-Pro Chemical compound C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N OYTPNWYZORARHL-XHNCKOQMSA-N 0.000 description 5
- MIIVFRCYJABHTQ-ONGXEEELSA-N Gly-Leu-Val Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O MIIVFRCYJABHTQ-ONGXEEELSA-N 0.000 description 5
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 5
- LBRCLQMZAHRTLV-ZKWXMUAHSA-N Ile-Gly-Ser Chemical compound CC[C@H](C)[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O LBRCLQMZAHRTLV-ZKWXMUAHSA-N 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 5
- RWDVVSKYZBNDCO-MELADBBJSA-N Ser-Phe-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=CC=C2)NC(=O)[C@H](CO)N)C(=O)O RWDVVSKYZBNDCO-MELADBBJSA-N 0.000 description 5
- 229930006000 Sucrose Natural products 0.000 description 5
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 5
- PZTZYZUTCPZWJH-FXQIFTODSA-N Val-Ser-Ser Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)O)N PZTZYZUTCPZWJH-FXQIFTODSA-N 0.000 description 5
- OWFGFHQMSBTKLX-UFYCRDLUSA-N Val-Tyr-Tyr Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N OWFGFHQMSBTKLX-UFYCRDLUSA-N 0.000 description 5
- 108010086434 alanyl-seryl-glycine Proteins 0.000 description 5
- 210000003719 b-lymphocyte Anatomy 0.000 description 5
- 239000008366 buffered solution Substances 0.000 description 5
- 239000004067 bulking agent Substances 0.000 description 5
- 239000006285 cell suspension Substances 0.000 description 5
- 239000003599 detergent Substances 0.000 description 5
- 238000010790 dilution Methods 0.000 description 5
- 239000012895 dilution Substances 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 102000037865 fusion proteins Human genes 0.000 description 5
- 108020001507 fusion proteins Proteins 0.000 description 5
- VPZXBVLAVMBEQI-UHFFFAOYSA-N glycyl-DL-alpha-alanine Natural products OC(=O)C(C)NC(=O)CN VPZXBVLAVMBEQI-UHFFFAOYSA-N 0.000 description 5
- 108010089804 glycyl-threonine Proteins 0.000 description 5
- 239000000710 homodimer Substances 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 230000003834 intracellular effect Effects 0.000 description 5
- 239000012139 lysis buffer Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 230000001603 reducing effect Effects 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- 229940124597 therapeutic agent Drugs 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 4
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 4
- YYSWCHMLFJLLBJ-ZLUOBGJFSA-N Ala-Ala-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YYSWCHMLFJLLBJ-ZLUOBGJFSA-N 0.000 description 4
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 4
- WLVLIYYBPPONRJ-GCJQMDKQSA-N Asn-Thr-Ala Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O WLVLIYYBPPONRJ-GCJQMDKQSA-N 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 101100506090 Caenorhabditis elegans hil-2 gene Proteins 0.000 description 4
- 206010014733 Endometrial cancer Diseases 0.000 description 4
- 206010014759 Endometrial neoplasm Diseases 0.000 description 4
- 229910052693 Europium Inorganic materials 0.000 description 4
- OACQOWPRWGNKTP-AVGNSLFASA-N Gln-Tyr-Asp Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(O)=O)C(O)=O OACQOWPRWGNKTP-AVGNSLFASA-N 0.000 description 4
- SGVGIVDZLSHSEN-RYUDHWBXSA-N Gln-Tyr-Gly Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(O)=O SGVGIVDZLSHSEN-RYUDHWBXSA-N 0.000 description 4
- AVZHGSCDKIQZPQ-CIUDSAMLSA-N Glu-Arg-Ala Chemical compound C[C@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](N)CCC(O)=O)C(O)=O AVZHGSCDKIQZPQ-CIUDSAMLSA-N 0.000 description 4
- BYYNJRSNDARRBX-YFKPBYRVSA-N Gly-Gln-Gly Chemical compound NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O BYYNJRSNDARRBX-YFKPBYRVSA-N 0.000 description 4
- 229940076838 Immune checkpoint inhibitor Drugs 0.000 description 4
- 102000002698 KIR Receptors Human genes 0.000 description 4
- 108010043610 KIR Receptors Proteins 0.000 description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 4
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 4
- KIZIOFNVSOSKJI-CIUDSAMLSA-N Leu-Ser-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N KIZIOFNVSOSKJI-CIUDSAMLSA-N 0.000 description 4
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 4
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 4
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 208000006265 Renal cell carcinoma Diseases 0.000 description 4
- YMTLKLXDFCSCNX-BYPYZUCNSA-N Ser-Gly-Gly Chemical compound OC[C@H](N)C(=O)NCC(=O)NCC(O)=O YMTLKLXDFCSCNX-BYPYZUCNSA-N 0.000 description 4
- KIEIJCFVGZCUAS-MELADBBJSA-N Ser-Tyr-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC2=CC=C(C=C2)O)NC(=O)[C@H](CO)N)C(=O)O KIEIJCFVGZCUAS-MELADBBJSA-N 0.000 description 4
- MNYNCKZAEIAONY-XGEHTFHBSA-N Thr-Val-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CO)C(O)=O MNYNCKZAEIAONY-XGEHTFHBSA-N 0.000 description 4
- MBLJBGZWLHTJBH-SZMVWBNQSA-N Trp-Val-Arg Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O)=CNC2=C1 MBLJBGZWLHTJBH-SZMVWBNQSA-N 0.000 description 4
- 108010008685 alanyl-glutamyl-aspartic acid Proteins 0.000 description 4
- 108010069020 alanyl-prolyl-glycine Proteins 0.000 description 4
- 108010087924 alanylproline Proteins 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 4
- 229940098773 bovine serum albumin Drugs 0.000 description 4
- 239000000969 carrier Substances 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 238000003501 co-culture Methods 0.000 description 4
- 206010052015 cytokine release syndrome Diseases 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 4
- KDQPSPMLNJTZAL-UHFFFAOYSA-L disodium hydrogenphosphate dihydrate Chemical compound O.O.[Na+].[Na+].OP([O-])([O-])=O KDQPSPMLNJTZAL-UHFFFAOYSA-L 0.000 description 4
- 230000009977 dual effect Effects 0.000 description 4
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 239000000833 heterodimer Substances 0.000 description 4
- 239000012274 immune-checkpoint protein inhibitor Substances 0.000 description 4
- 201000005202 lung cancer Diseases 0.000 description 4
- 208000020816 lung neoplasm Diseases 0.000 description 4
- 238000010172 mouse model Methods 0.000 description 4
- 230000009871 nonspecific binding Effects 0.000 description 4
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 4
- 229940068968 polysorbate 80 Drugs 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 239000011734 sodium Substances 0.000 description 4
- 239000001509 sodium citrate Substances 0.000 description 4
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 108010073969 valyllysine Proteins 0.000 description 4
- OOSZCNKVJAVHJI-UHFFFAOYSA-N 1-[(4-fluorophenyl)methyl]piperazine Chemical compound C1=CC(F)=CC=C1CN1CCNCC1 OOSZCNKVJAVHJI-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- VKKYFICVTYKFIO-CIUDSAMLSA-N Arg-Ala-Glu Chemical compound OC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N VKKYFICVTYKFIO-CIUDSAMLSA-N 0.000 description 3
- UDSVWSUXKYXSTR-QWRGUYRKSA-N Asn-Gly-Tyr Chemical compound [H]N[C@@H](CC(N)=O)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O UDSVWSUXKYXSTR-QWRGUYRKSA-N 0.000 description 3
- MKJBPDLENBUHQU-CIUDSAMLSA-N Asn-Ser-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O MKJBPDLENBUHQU-CIUDSAMLSA-N 0.000 description 3
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 3
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 3
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 3
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 3
- 102000008203 CTLA-4 Antigen Human genes 0.000 description 3
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 3
- 206010008342 Cervix carcinoma Diseases 0.000 description 3
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 206010009944 Colon cancer Diseases 0.000 description 3
- 238000012286 ELISA Assay Methods 0.000 description 3
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- WPJDPEOQUIXXOY-AVGNSLFASA-N Gln-Tyr-Asn Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O WPJDPEOQUIXXOY-AVGNSLFASA-N 0.000 description 3
- PAQUJCSYVIBPLC-AVGNSLFASA-N Glu-Asp-Phe Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 PAQUJCSYVIBPLC-AVGNSLFASA-N 0.000 description 3
- INGJLBQKTRJLFO-UKJIMTQDSA-N Glu-Ile-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H](N)CCC(O)=O INGJLBQKTRJLFO-UKJIMTQDSA-N 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- MTBIKIMYHUWBRX-QWRGUYRKSA-N Gly-Phe-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)CN MTBIKIMYHUWBRX-QWRGUYRKSA-N 0.000 description 3
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 3
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 3
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 3
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 description 3
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 3
- RMNMUUCYTMLWNA-ZPFDUUQYSA-N Ile-Lys-Asp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(=O)O)C(=O)O)N RMNMUUCYTMLWNA-ZPFDUUQYSA-N 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- 102100022338 Integrin alpha-M Human genes 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- AXZGZMGRBDQTEY-SRVKXCTJSA-N Leu-Gln-Met Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCSC)C(O)=O AXZGZMGRBDQTEY-SRVKXCTJSA-N 0.000 description 3
- SBANPBVRHYIMRR-GARJFASQSA-N Leu-Ser-Pro Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N SBANPBVRHYIMRR-GARJFASQSA-N 0.000 description 3
- SBANPBVRHYIMRR-UHFFFAOYSA-N Leu-Ser-Pro Natural products CC(C)CC(N)C(=O)NC(CO)C(=O)N1CCCC1C(O)=O SBANPBVRHYIMRR-UHFFFAOYSA-N 0.000 description 3
- LCNASHSOFMRYFO-WDCWCFNPSA-N Leu-Thr-Gln Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(N)=O LCNASHSOFMRYFO-WDCWCFNPSA-N 0.000 description 3
- AIMGJYMCTAABEN-GVXVVHGQSA-N Leu-Val-Glu Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O AIMGJYMCTAABEN-GVXVVHGQSA-N 0.000 description 3
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 3
- GQZMPWBZQALKJO-UWVGGRQHSA-N Lys-Gly-Arg Chemical compound [H]N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(O)=O GQZMPWBZQALKJO-UWVGGRQHSA-N 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- YBAFDPFAUTYYRW-UHFFFAOYSA-N N-L-alpha-glutamyl-L-leucine Natural products CC(C)CC(C(O)=O)NC(=O)C(N)CCC(O)=O YBAFDPFAUTYYRW-UHFFFAOYSA-N 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 102100040678 Programmed cell death protein 1 Human genes 0.000 description 3
- 101710089372 Programmed cell death protein 1 Proteins 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- WDXYVIIVDIDOSX-DCAQKATOSA-N Ser-Arg-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CCCN=C(N)N WDXYVIIVDIDOSX-DCAQKATOSA-N 0.000 description 3
- ULVMNZOKDBHKKI-ACZMJKKPSA-N Ser-Gln-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O ULVMNZOKDBHKKI-ACZMJKKPSA-N 0.000 description 3
- KDGARKCAKHBEDB-NKWVEPMBSA-N Ser-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CO)N)C(=O)O KDGARKCAKHBEDB-NKWVEPMBSA-N 0.000 description 3
- SFTZWNJFZYOLBD-ZDLURKLDSA-N Ser-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CO SFTZWNJFZYOLBD-ZDLURKLDSA-N 0.000 description 3
- QYSFWUIXDFJUDW-DCAQKATOSA-N Ser-Leu-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QYSFWUIXDFJUDW-DCAQKATOSA-N 0.000 description 3
- YUJLIIRMIAGMCQ-CIUDSAMLSA-N Ser-Leu-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CO)C(O)=O YUJLIIRMIAGMCQ-CIUDSAMLSA-N 0.000 description 3
- 206010042971 T-cell lymphoma Diseases 0.000 description 3
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 description 3
- ZESGVALRVJIVLZ-VFCFLDTKSA-N Thr-Thr-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@@H]1C(=O)O)N)O ZESGVALRVJIVLZ-VFCFLDTKSA-N 0.000 description 3
- SVGAWGVHFIYAEE-JSGCOSHPSA-N Trp-Gly-Gln Chemical compound C1=CC=C2C(C[C@H](N)C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(O)=O)=CNC2=C1 SVGAWGVHFIYAEE-JSGCOSHPSA-N 0.000 description 3
- PKZIWSHDJYIPRH-JBACZVJFSA-N Trp-Tyr-Gln Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O PKZIWSHDJYIPRH-JBACZVJFSA-N 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- XGZBEGGGAUQBMB-KJEVXHAQSA-N Tyr-Pro-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CC2=CC=C(C=C2)O)N)O XGZBEGGGAUQBMB-KJEVXHAQSA-N 0.000 description 3
- VYQQQIRHIFALGE-UWJYBYFXSA-N Tyr-Ser-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 VYQQQIRHIFALGE-UWJYBYFXSA-N 0.000 description 3
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 3
- VJOWWOGRNXRQMF-UVBJJODRSA-N Val-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](C)NC(=O)[C@@H](N)C(C)C)C(O)=O)=CNC2=C1 VJOWWOGRNXRQMF-UVBJJODRSA-N 0.000 description 3
- 208000009956 adenocarcinoma Diseases 0.000 description 3
- 125000000539 amino acid group Chemical group 0.000 description 3
- 108010013835 arginine glutamate Proteins 0.000 description 3
- 108010068265 aspartyltyrosine Proteins 0.000 description 3
- 230000001580 bacterial effect Effects 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 230000000903 blocking effect Effects 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 210000002798 bone marrow cell Anatomy 0.000 description 3
- 210000000481 breast Anatomy 0.000 description 3
- 239000007853 buffer solution Substances 0.000 description 3
- 230000006037 cell lysis Effects 0.000 description 3
- 201000010881 cervical cancer Diseases 0.000 description 3
- 208000006990 cholangiocarcinoma Diseases 0.000 description 3
- 229960004106 citric acid Drugs 0.000 description 3
- 230000000295 complement effect Effects 0.000 description 3
- 230000016396 cytokine production Effects 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 230000001627 detrimental effect Effects 0.000 description 3
- 150000002016 disaccharides Chemical class 0.000 description 3
- 231100000673 dose–response relationship Toxicity 0.000 description 3
- 238000012377 drug delivery Methods 0.000 description 3
- 201000003914 endometrial carcinoma Diseases 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 210000003743 erythrocyte Anatomy 0.000 description 3
- 238000011156 evaluation Methods 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 108010078144 glutaminyl-glycine Proteins 0.000 description 3
- 108010067216 glycyl-glycyl-glycine Proteins 0.000 description 3
- 238000003306 harvesting Methods 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 238000000338 in vitro Methods 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 108010038320 lysylphenylalanine Proteins 0.000 description 3
- 238000002844 melting Methods 0.000 description 3
- 230000008018 melting Effects 0.000 description 3
- 231100000252 nontoxic Toxicity 0.000 description 3
- 230000003000 nontoxic effect Effects 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 108010020755 prolyl-glycyl-glycine Proteins 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000009738 saturating Methods 0.000 description 3
- 208000000649 small cell carcinoma Diseases 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 229940074545 sodium dihydrogen phosphate dihydrate Drugs 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 206010041823 squamous cell carcinoma Diseases 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 229960002317 succinimide Drugs 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 108010061238 threonyl-glycine Proteins 0.000 description 3
- 230000032258 transport Effects 0.000 description 3
- 108010058119 tryptophyl-glycyl-glycine Proteins 0.000 description 3
- 108010038745 tryptophylglycine Proteins 0.000 description 3
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 3
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 3
- 108010035534 tyrosyl-leucyl-alanine Proteins 0.000 description 3
- 210000003932 urinary bladder Anatomy 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- UAIUNKRWKOVEES-UHFFFAOYSA-N 3,3',5,5'-tetramethylbenzidine Chemical compound CC1=C(N)C(C)=CC(C=2C=C(C)C(N)=C(C)C=2)=C1 UAIUNKRWKOVEES-UHFFFAOYSA-N 0.000 description 2
- 241000251468 Actinopterygii Species 0.000 description 2
- BUDNAJYVCUHLSV-ZLUOBGJFSA-N Ala-Asp-Ser Chemical compound C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O BUDNAJYVCUHLSV-ZLUOBGJFSA-N 0.000 description 2
- VNYMOTCMNHJGTG-JBDRJPRFSA-N Ala-Ile-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O VNYMOTCMNHJGTG-JBDRJPRFSA-N 0.000 description 2
- REAQAWSENITKJL-DDWPSWQVSA-N Ala-Met-Asp-Tyr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O REAQAWSENITKJL-DDWPSWQVSA-N 0.000 description 2
- NZGRHTKZFSVPAN-BIIVOSGPSA-N Ala-Ser-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CO)C(=O)N1CCC[C@@H]1C(=O)O)N NZGRHTKZFSVPAN-BIIVOSGPSA-N 0.000 description 2
- NCQMBSJGJMYKCK-ZLUOBGJFSA-N Ala-Ser-Ser Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O NCQMBSJGJMYKCK-ZLUOBGJFSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-M Aminoacetate Chemical compound NCC([O-])=O DHMQDGOQFOQNFH-UHFFFAOYSA-M 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 206010061424 Anal cancer Diseases 0.000 description 2
- OTOXOKCIIQLMFH-KZVJFYERSA-N Arg-Ala-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCN=C(N)N OTOXOKCIIQLMFH-KZVJFYERSA-N 0.000 description 2
- JBDLMLZNDRLDIX-HJGDQZAQSA-N Asn-Thr-Leu Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O JBDLMLZNDRLDIX-HJGDQZAQSA-N 0.000 description 2
- MRQQMVZUHXUPEV-IHRRRGAJSA-N Asp-Arg-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O MRQQMVZUHXUPEV-IHRRRGAJSA-N 0.000 description 2
- QXHVOUSPVAWEMX-ZLUOBGJFSA-N Asp-Asp-Ser Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O QXHVOUSPVAWEMX-ZLUOBGJFSA-N 0.000 description 2
- KYQNAIMCTRZLNP-QSFUFRPTSA-N Asp-Ile-Val Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(O)=O KYQNAIMCTRZLNP-QSFUFRPTSA-N 0.000 description 2
- USNJAPJZSGTTPX-XVSYOHENSA-N Asp-Phe-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O USNJAPJZSGTTPX-XVSYOHENSA-N 0.000 description 2
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 description 2
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 2
- 208000003950 B-cell lymphoma Diseases 0.000 description 2
- 101150013553 CD40 gene Proteins 0.000 description 2
- 101100355609 Caenorhabditis elegans rae-1 gene Proteins 0.000 description 2
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 2
- 208000005243 Chondrosarcoma Diseases 0.000 description 2
- YASYEJJMZJALEJ-UHFFFAOYSA-N Citric acid monohydrate Chemical compound O.OC(=O)CC(O)(C(O)=O)CC(O)=O YASYEJJMZJALEJ-UHFFFAOYSA-N 0.000 description 2
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 2
- OZHXXYOHPLLLMI-CIUDSAMLSA-N Cys-Lys-Ala Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O OZHXXYOHPLLLMI-CIUDSAMLSA-N 0.000 description 2
- ALNKNYKSZPSLBD-ZDLURKLDSA-N Cys-Thr-Gly Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O ALNKNYKSZPSLBD-ZDLURKLDSA-N 0.000 description 2
- 101710112752 Cytotoxin Proteins 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- 108010009540 DNA (Cytosine-5-)-Methyltransferase 1 Proteins 0.000 description 2
- 102100036279 DNA (cytosine-5)-methyltransferase 1 Human genes 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 241000283073 Equus caballus Species 0.000 description 2
- 108010087819 Fc receptors Proteins 0.000 description 2
- 102000009109 Fc receptors Human genes 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- OOLCSQQPSLIETN-JYJNAYRXSA-N Gln-His-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)[C@H](CC2=CN=CN2)NC(=O)[C@H](CCC(=O)N)N)O OOLCSQQPSLIETN-JYJNAYRXSA-N 0.000 description 2
- XZLLTYBONVKGLO-SDDRHHMPSA-N Gln-Lys-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(=O)N)N)C(=O)O XZLLTYBONVKGLO-SDDRHHMPSA-N 0.000 description 2
- FQCILXROGNOZON-YUMQZZPRSA-N Gln-Pro-Gly Chemical compound NC(=O)CC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O FQCILXROGNOZON-YUMQZZPRSA-N 0.000 description 2
- CMBXOSFZCFGDLE-IHRRRGAJSA-N Gln-Tyr-Gln Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O CMBXOSFZCFGDLE-IHRRRGAJSA-N 0.000 description 2
- WIMVKDYAKRAUCG-IHRRRGAJSA-N Gln-Tyr-Glu Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O WIMVKDYAKRAUCG-IHRRRGAJSA-N 0.000 description 2
- XTZDZAXYPDISRR-MNXVOIDGSA-N Glu-Ile-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N XTZDZAXYPDISRR-MNXVOIDGSA-N 0.000 description 2
- YQPFCZVKMUVZIN-AUTRQRHGSA-N Glu-Val-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O YQPFCZVKMUVZIN-AUTRQRHGSA-N 0.000 description 2
- LJPIRKICOISLKN-WHFBIAKZSA-N Gly-Ala-Ser Chemical compound NCC(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O LJPIRKICOISLKN-WHFBIAKZSA-N 0.000 description 2
- OCQUNKSFDYDXBG-QXEWZRGKSA-N Gly-Arg-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CCCN=C(N)N OCQUNKSFDYDXBG-QXEWZRGKSA-N 0.000 description 2
- CQZDZKRHFWJXDF-WDSKDSINSA-N Gly-Gln-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CN CQZDZKRHFWJXDF-WDSKDSINSA-N 0.000 description 2
- UFPXDFOYHVEIPI-BYPYZUCNSA-N Gly-Gly-Asp Chemical compound NCC(=O)NCC(=O)N[C@H](C(O)=O)CC(O)=O UFPXDFOYHVEIPI-BYPYZUCNSA-N 0.000 description 2
- BHPQOIPBLYJNAW-NGZCFLSTSA-N Gly-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)CN BHPQOIPBLYJNAW-NGZCFLSTSA-N 0.000 description 2
- WNZOCXUOGVYYBJ-CDMKHQONSA-N Gly-Phe-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)NC(=O)CN)O WNZOCXUOGVYYBJ-CDMKHQONSA-N 0.000 description 2
- QAMMIGULQSIRCD-IRXDYDNUSA-N Gly-Phe-Tyr Chemical compound C([C@H](NC(=O)C[NH3+])C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C([O-])=O)C1=CC=CC=C1 QAMMIGULQSIRCD-IRXDYDNUSA-N 0.000 description 2
- SOEGEPHNZOISMT-BYPYZUCNSA-N Gly-Ser-Gly Chemical compound NCC(=O)N[C@@H](CO)C(=O)NCC(O)=O SOEGEPHNZOISMT-BYPYZUCNSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 102000004457 Granulocyte-Macrophage Colony-Stimulating Factor Human genes 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- HOLOYAZCIHDQNS-YVNDNENWSA-N Ile-Gln-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N HOLOYAZCIHDQNS-YVNDNENWSA-N 0.000 description 2
- NZGTYCMLUGYMCV-XUXIUFHCSA-N Ile-Lys-Arg Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N NZGTYCMLUGYMCV-XUXIUFHCSA-N 0.000 description 2
- PRTZQMBYUZFSFA-XEGUGMAKSA-N Ile-Tyr-Gly Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)NCC(=O)O)N PRTZQMBYUZFSFA-XEGUGMAKSA-N 0.000 description 2
- NSPNUMNLZNOPAQ-SJWGOKEGSA-N Ile-Tyr-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N2CCC[C@@H]2C(=O)O)N NSPNUMNLZNOPAQ-SJWGOKEGSA-N 0.000 description 2
- 102000037984 Inhibitory immune checkpoint proteins Human genes 0.000 description 2
- 108091008026 Inhibitory immune checkpoint proteins Proteins 0.000 description 2
- 101150069255 KLRC1 gene Proteins 0.000 description 2
- ZTLGVASZOIKNIX-DCAQKATOSA-N Leu-Gln-Glu Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N ZTLGVASZOIKNIX-DCAQKATOSA-N 0.000 description 2
- QDSKNVXKLPQNOJ-GVXVVHGQSA-N Leu-Gln-Val Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C(C)C)C(O)=O QDSKNVXKLPQNOJ-GVXVVHGQSA-N 0.000 description 2
- BTNXKBVLWJBTNR-SRVKXCTJSA-N Leu-His-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(N)=O)C(O)=O BTNXKBVLWJBTNR-SRVKXCTJSA-N 0.000 description 2
- PWPBLZXWFXJFHE-RHYQMDGZSA-N Leu-Pro-Thr Chemical compound CC(C)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O PWPBLZXWFXJFHE-RHYQMDGZSA-N 0.000 description 2
- LJBVRCDPWOJOEK-PPCPHDFISA-N Leu-Thr-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O LJBVRCDPWOJOEK-PPCPHDFISA-N 0.000 description 2
- VUBIPAHVHMZHCM-KKUMJFAQSA-N Leu-Tyr-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CO)C(O)=O)CC1=CC=C(O)C=C1 VUBIPAHVHMZHCM-KKUMJFAQSA-N 0.000 description 2
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 2
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- SJDQOYTYNGZZJX-SRVKXCTJSA-N Met-Glu-Leu Chemical compound CSCC[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O SJDQOYTYNGZZJX-SRVKXCTJSA-N 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 208000003445 Mouth Neoplasms Diseases 0.000 description 2
- 101100174574 Mus musculus Pikfyve gene Proteins 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- WUGMRIBZSVSJNP-UHFFFAOYSA-N N-L-alanyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)C)C(O)=O)=CNC2=C1 WUGMRIBZSVSJNP-UHFFFAOYSA-N 0.000 description 2
- 108010079364 N-glycylalanine Proteins 0.000 description 2
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 description 2
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 description 2
- 241000009328 Perro Species 0.000 description 2
- 206010057249 Phagocytosis Diseases 0.000 description 2
- MCIXMYKSPQUMJG-SRVKXCTJSA-N Phe-Ser-Ser Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MCIXMYKSPQUMJG-SRVKXCTJSA-N 0.000 description 2
- FGWUALWGCZJQDJ-URLPEUOOSA-N Phe-Thr-Ile Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O FGWUALWGCZJQDJ-URLPEUOOSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- VCYJKOLZYPYGJV-AVGNSLFASA-N Pro-Arg-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O VCYJKOLZYPYGJV-AVGNSLFASA-N 0.000 description 2
- MGDFPGCFVJFITQ-CIUDSAMLSA-N Pro-Glu-Asp Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O MGDFPGCFVJFITQ-CIUDSAMLSA-N 0.000 description 2
- LEIKGVHQTKHOLM-IUCAKERBSA-N Pro-Pro-Gly Chemical compound OC(=O)CNC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 LEIKGVHQTKHOLM-IUCAKERBSA-N 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 2
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 2
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 2
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- QVOGDCQNGLBNCR-FXQIFTODSA-N Ser-Arg-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O QVOGDCQNGLBNCR-FXQIFTODSA-N 0.000 description 2
- HZWAHWQZPSXNCB-BPUTZDHNSA-N Ser-Arg-Trp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O HZWAHWQZPSXNCB-BPUTZDHNSA-N 0.000 description 2
- HJEBZBMOTCQYDN-ACZMJKKPSA-N Ser-Glu-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O HJEBZBMOTCQYDN-ACZMJKKPSA-N 0.000 description 2
- ZOPISOXXPQNOCO-SVSWQMSJSA-N Ser-Ile-Thr Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)O)NC(=O)[C@H](CO)N ZOPISOXXPQNOCO-SVSWQMSJSA-N 0.000 description 2
- MQQBBLVOUUJKLH-HJPIBITLSA-N Ser-Ile-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O MQQBBLVOUUJKLH-HJPIBITLSA-N 0.000 description 2
- UBRMZSHOOIVJPW-SRVKXCTJSA-N Ser-Leu-Lys Chemical compound OC[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(O)=O UBRMZSHOOIVJPW-SRVKXCTJSA-N 0.000 description 2
- RHAPJNVNWDBFQI-BQBZGAKWSA-N Ser-Pro-Gly Chemical compound OC[C@H](N)C(=O)N1CCC[C@H]1C(=O)NCC(O)=O RHAPJNVNWDBFQI-BQBZGAKWSA-N 0.000 description 2
- CUXJENOFJXOSOZ-BIIVOSGPSA-N Ser-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CO)N)C(=O)O CUXJENOFJXOSOZ-BIIVOSGPSA-N 0.000 description 2
- RXUOAOOZIWABBW-XGEHTFHBSA-N Ser-Thr-Arg Chemical compound OC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@H](C(O)=O)CCCN=C(N)N RXUOAOOZIWABBW-XGEHTFHBSA-N 0.000 description 2
- VVKVHAOOUGNDPJ-SRVKXCTJSA-N Ser-Tyr-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(O)=O VVKVHAOOUGNDPJ-SRVKXCTJSA-N 0.000 description 2
- OSFZCEQJLWCIBG-BZSNNMDCSA-N Ser-Tyr-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O OSFZCEQJLWCIBG-BZSNNMDCSA-N 0.000 description 2
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- 206010054184 Small intestine carcinoma Diseases 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 230000005867 T cell response Effects 0.000 description 2
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- NJEMRSFGDNECGF-GCJQMDKQSA-N Thr-Ala-Asp Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC(O)=O NJEMRSFGDNECGF-GCJQMDKQSA-N 0.000 description 2
- UNURFMVMXLENAZ-KJEVXHAQSA-N Thr-Arg-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O UNURFMVMXLENAZ-KJEVXHAQSA-N 0.000 description 2
- DXPURPNJDFCKKO-RHYQMDGZSA-N Thr-Lys-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCCCN)NC(=O)[C@@H](N)[C@@H](C)O)C(O)=O DXPURPNJDFCKKO-RHYQMDGZSA-N 0.000 description 2
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 2
- DZKFGCNKEVMXFA-JUKXBJQTSA-N Tyr-Ile-His Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](N)Cc1ccc(O)cc1)C(=O)N[C@@H](Cc1cnc[nH]1)C(O)=O DZKFGCNKEVMXFA-JUKXBJQTSA-N 0.000 description 2
- GULIUBBXCYPDJU-CQDKDKBSSA-N Tyr-Leu-Ala Chemical compound [O-]C(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H]([NH3+])CC1=CC=C(O)C=C1 GULIUBBXCYPDJU-CQDKDKBSSA-N 0.000 description 2
- ZPFLBLFITJCBTP-QWRGUYRKSA-N Tyr-Ser-Gly Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(=O)NCC(O)=O ZPFLBLFITJCBTP-QWRGUYRKSA-N 0.000 description 2
- ZZDYJFVIKVSUFA-WLTAIBSBSA-N Tyr-Thr-Gly Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O ZZDYJFVIKVSUFA-WLTAIBSBSA-N 0.000 description 2
- ZYVAAYAOTVJBSS-GMVOTWDCSA-N Tyr-Trp-Ala Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](C)C(O)=O ZYVAAYAOTVJBSS-GMVOTWDCSA-N 0.000 description 2
- PVPAOIGJYHVWBT-KKHAAJSZSA-N Val-Asn-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](C(C)C)N)O PVPAOIGJYHVWBT-KKHAAJSZSA-N 0.000 description 2
- ZXYPHBKIZLAQTL-QXEWZRGKSA-N Val-Pro-Asp Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(=O)O)C(=O)O)N ZXYPHBKIZLAQTL-QXEWZRGKSA-N 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 230000005975 antitumor immune response Effects 0.000 description 2
- 239000013011 aqueous formulation Substances 0.000 description 2
- 108010038850 arginyl-isoleucyl-tyrosine Proteins 0.000 description 2
- 108010084758 arginyl-tyrosyl-aspartic acid Proteins 0.000 description 2
- 108010047857 aspartylglycine Proteins 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 238000002619 cancer immunotherapy Methods 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 210000003169 central nervous system Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 229960002303 citric acid monohydrate Drugs 0.000 description 2
- 231100000599 cytotoxic agent Toxicity 0.000 description 2
- 239000002619 cytotoxin Substances 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 229920001971 elastomer Polymers 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000005558 fluorometry Methods 0.000 description 2
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 2
- 108010063718 gamma-glutamylaspartic acid Proteins 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 108010074027 glycyl-seryl-phenylalanine Proteins 0.000 description 2
- 108010050848 glycylleucine Proteins 0.000 description 2
- 230000003394 haemopoietic effect Effects 0.000 description 2
- 108010025306 histidylleucine Proteins 0.000 description 2
- 108010018006 histidylserine Proteins 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 150000004679 hydroxides Chemical class 0.000 description 2
- 238000009169 immunotherapy Methods 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 238000011081 inoculation Methods 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 108010057821 leucylproline Proteins 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 2
- 239000012931 lyophilized formulation Substances 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 201000007924 marginal zone B-cell lymphoma Diseases 0.000 description 2
- 208000021937 marginal zone lymphoma Diseases 0.000 description 2
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 238000001565 modulated differential scanning calorimetry Methods 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 210000000066 myeloid cell Anatomy 0.000 description 2
- 210000004985 myeloid-derived suppressor cell Anatomy 0.000 description 2
- 229920002113 octoxynol Polymers 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- 230000008782 phagocytosis Effects 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 235000015497 potassium bicarbonate Nutrition 0.000 description 2
- 229910000028 potassium bicarbonate Inorganic materials 0.000 description 2
- 239000011736 potassium bicarbonate Substances 0.000 description 2
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 108010077112 prolyl-proline Proteins 0.000 description 2
- 108010079317 prolyl-tyrosine Proteins 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 206010038038 rectal cancer Diseases 0.000 description 2
- 201000001275 rectum cancer Diseases 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 230000002195 synergetic effect Effects 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 238000001890 transfection Methods 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- JNTMAZFVYNDPLB-PEDHHIEDSA-N (2S,3S)-2-[[[(2S)-1-[(2S,3S)-2-amino-3-methyl-1-oxopentyl]-2-pyrrolidinyl]-oxomethyl]amino]-3-methylpentanoic acid Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)CC)C(O)=O JNTMAZFVYNDPLB-PEDHHIEDSA-N 0.000 description 1
- XVZCXCTYGHPNEM-IHRRRGAJSA-N (2s)-1-[(2s)-2-[[(2s)-2-amino-4-methylpentanoyl]amino]-4-methylpentanoyl]pyrrolidine-2-carboxylic acid Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(O)=O XVZCXCTYGHPNEM-IHRRRGAJSA-N 0.000 description 1
- SSOORFWOBGFTHL-OTEJMHTDSA-N (4S)-5-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[2-[(2S)-2-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S,3S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-6-amino-1-[[(2S)-6-amino-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-5-carbamimidamido-1-[[(2S)-5-carbamimidamido-1-[[(1S)-4-carbamimidamido-1-carboxybutyl]amino]-1-oxopentan-2-yl]amino]-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-1-oxohexan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]carbamoyl]pyrrolidin-1-yl]-2-oxoethyl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-1-oxohexan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-5-carbamimidamido-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-[[(2S)-2-[[(2S)-2-[[(2S)-2,6-diaminohexanoyl]amino]-3-methylbutanoyl]amino]propanoyl]amino]-5-oxopentanoic acid Chemical compound CC[C@H](C)[C@H](NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H]1CCCN1C(=O)CNC(=O)[C@H](Cc1c[nH]c2ccccc12)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](Cc1ccccc1)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@@H](N)CCCCN)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(C)C)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SSOORFWOBGFTHL-OTEJMHTDSA-N 0.000 description 1
- HGHOBRRUMWJWCU-FXQIFTODSA-N (4s)-4-[[(2s)-2-aminopropanoyl]amino]-5-[[(2s)-3-carboxy-1-(carboxymethylamino)-1-oxopropan-2-yl]amino]-5-oxopentanoic acid Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O HGHOBRRUMWJWCU-FXQIFTODSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- 125000004178 (C1-C4) alkyl group Chemical group 0.000 description 1
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 1
- ZUQUTHURQVDNKF-KEWYIRBNSA-N 1-[(3R,4R,5S,6R)-3-amino-2,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]ethanone Chemical compound CC(=O)C1(O)O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1N ZUQUTHURQVDNKF-KEWYIRBNSA-N 0.000 description 1
- BGFTWECWAICPDG-UHFFFAOYSA-N 2-[bis(4-chlorophenyl)methyl]-4-n-[3-[bis(4-chlorophenyl)methyl]-4-(dimethylamino)phenyl]-1-n,1-n-dimethylbenzene-1,4-diamine Chemical compound C1=C(C(C=2C=CC(Cl)=CC=2)C=2C=CC(Cl)=CC=2)C(N(C)C)=CC=C1NC(C=1)=CC=C(N(C)C)C=1C(C=1C=CC(Cl)=CC=1)C1=CC=C(Cl)C=C1 BGFTWECWAICPDG-UHFFFAOYSA-N 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- ZRPLANDPDWYOMZ-UHFFFAOYSA-N 3-cyclopentylpropionic acid Chemical compound OC(=O)CCC1CCCC1 ZRPLANDPDWYOMZ-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- ZHSKUOZOLHMKEA-UHFFFAOYSA-N 4-[5-[bis(2-chloroethyl)amino]-1-methylbenzimidazol-2-yl]butanoic acid;hydron;chloride Chemical compound Cl.ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 ZHSKUOZOLHMKEA-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 description 1
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 1
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 1
- 208000003200 Adenoma Diseases 0.000 description 1
- 206010001233 Adenoma benign Diseases 0.000 description 1
- 108010029445 Agammaglobulinaemia Tyrosine Kinase Proteins 0.000 description 1
- RLMISHABBKUNFO-WHFBIAKZSA-N Ala-Ala-Gly Chemical compound C[C@H](N)C(=O)N[C@@H](C)C(=O)NCC(O)=O RLMISHABBKUNFO-WHFBIAKZSA-N 0.000 description 1
- KQFRUSHJPKXBMB-BHDSKKPTSA-N Ala-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](C)NC(=O)[C@@H](N)C)C(O)=O)=CNC2=C1 KQFRUSHJPKXBMB-BHDSKKPTSA-N 0.000 description 1
- DVWVZSJAYIJZFI-FXQIFTODSA-N Ala-Arg-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(O)=O DVWVZSJAYIJZFI-FXQIFTODSA-N 0.000 description 1
- WRDANSJTFOHBPI-FXQIFTODSA-N Ala-Arg-Cys Chemical compound C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CS)C(=O)O)N WRDANSJTFOHBPI-FXQIFTODSA-N 0.000 description 1
- JBGSZRYCXBPWGX-BQBZGAKWSA-N Ala-Arg-Gly Chemical compound OC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](N)C)CCCN=C(N)N JBGSZRYCXBPWGX-BQBZGAKWSA-N 0.000 description 1
- SKHCUBQVZJHOFM-NAKRPEOUSA-N Ala-Arg-Ile Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O SKHCUBQVZJHOFM-NAKRPEOUSA-N 0.000 description 1
- XQJAFSDFQZPYCU-UWJYBYFXSA-N Ala-Asn-Tyr Chemical compound C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N XQJAFSDFQZPYCU-UWJYBYFXSA-N 0.000 description 1
- IKKVASZHTMKJIR-ZKWXMUAHSA-N Ala-Asp-Val Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O IKKVASZHTMKJIR-ZKWXMUAHSA-N 0.000 description 1
- VIGKUFXFTPWYER-BIIVOSGPSA-N Ala-Cys-Pro Chemical compound C[C@@H](C(=O)N[C@@H](CS)C(=O)N1CCC[C@@H]1C(=O)O)N VIGKUFXFTPWYER-BIIVOSGPSA-N 0.000 description 1
- AWAXZRDKUHOPBO-GUBZILKMSA-N Ala-Gln-Lys Chemical compound C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(O)=O AWAXZRDKUHOPBO-GUBZILKMSA-N 0.000 description 1
- VGPWRRFOPXVGOH-BYPYZUCNSA-N Ala-Gly-Gly Chemical compound C[C@H](N)C(=O)NCC(=O)NCC(O)=O VGPWRRFOPXVGOH-BYPYZUCNSA-N 0.000 description 1
- IVKWMMGFLAMMKJ-XVYDVKMFSA-N Ala-His-Asn Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CC(=O)N)C(=O)O)N IVKWMMGFLAMMKJ-XVYDVKMFSA-N 0.000 description 1
- NOGFDULFCFXBHB-CIUDSAMLSA-N Ala-Leu-Cys Chemical compound C[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(=O)O)N NOGFDULFCFXBHB-CIUDSAMLSA-N 0.000 description 1
- MEFILNJXAVSUTO-JXUBOQSCSA-N Ala-Leu-Thr Chemical compound C[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MEFILNJXAVSUTO-JXUBOQSCSA-N 0.000 description 1
- SDZRIBWEVVRDQI-CIUDSAMLSA-N Ala-Lys-Asp Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(O)=O SDZRIBWEVVRDQI-CIUDSAMLSA-N 0.000 description 1
- RUXQNKVQSKOOBS-JURCDPSOSA-N Ala-Phe-Ile Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O RUXQNKVQSKOOBS-JURCDPSOSA-N 0.000 description 1
- ZBLQIYPCUWZSRZ-QEJZJMRPSA-N Ala-Phe-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](C)N)CC1=CC=CC=C1 ZBLQIYPCUWZSRZ-QEJZJMRPSA-N 0.000 description 1
- WNHNMKOFKCHKKD-BFHQHQDPSA-N Ala-Thr-Gly Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O WNHNMKOFKCHKKD-BFHQHQDPSA-N 0.000 description 1
- VNFSAYFQLXPHPY-CIQUZCHMSA-N Ala-Thr-Ile Chemical compound [H]N[C@@H](C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O VNFSAYFQLXPHPY-CIQUZCHMSA-N 0.000 description 1
- MUGAESARFRGOTQ-IGNZVWTISA-N Ala-Tyr-Tyr Chemical compound C[C@@H](C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)N MUGAESARFRGOTQ-IGNZVWTISA-N 0.000 description 1
- XSLGWYYNOSUMRM-ZKWXMUAHSA-N Ala-Val-Asn Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(N)=O)C(O)=O XSLGWYYNOSUMRM-ZKWXMUAHSA-N 0.000 description 1
- OMSKGWFGWCQFBD-KZVJFYERSA-N Ala-Val-Thr Chemical compound [H]N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OMSKGWFGWCQFBD-KZVJFYERSA-N 0.000 description 1
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 1
- 201000003076 Angiosarcoma Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- GHNDBBVSWOWYII-LPEHRKFASA-N Arg-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCCN=C(N)N)N)C(=O)O GHNDBBVSWOWYII-LPEHRKFASA-N 0.000 description 1
- NKBQZKVMKJJDLX-SRVKXCTJSA-N Arg-Glu-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(O)=O NKBQZKVMKJJDLX-SRVKXCTJSA-N 0.000 description 1
- OQCWXQJLCDPRHV-UWVGGRQHSA-N Arg-Gly-Leu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O OQCWXQJLCDPRHV-UWVGGRQHSA-N 0.000 description 1
- KRQSPVKUISQQFS-FJXKBIBVSA-N Arg-Gly-Thr Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCN=C(N)N KRQSPVKUISQQFS-FJXKBIBVSA-N 0.000 description 1
- LLUGJARLJCGLAR-CYDGBPFRSA-N Arg-Ile-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](C(C)C)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N LLUGJARLJCGLAR-CYDGBPFRSA-N 0.000 description 1
- NMRHDSAOIURTNT-RWMBFGLXSA-N Arg-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N NMRHDSAOIURTNT-RWMBFGLXSA-N 0.000 description 1
- FIQKRDXFTANIEJ-ULQDDVLXSA-N Arg-Phe-His Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC2=CN=CN2)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N FIQKRDXFTANIEJ-ULQDDVLXSA-N 0.000 description 1
- IGFJVXOATGZTHD-UHFFFAOYSA-N Arg-Phe-His Natural products NC(CCNC(=N)N)C(=O)NC(Cc1ccccc1)C(=O)NC(Cc2c[nH]cn2)C(=O)O IGFJVXOATGZTHD-UHFFFAOYSA-N 0.000 description 1
- PRLPSDIHSRITSF-UNQGMJICSA-N Arg-Phe-Thr Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)O)C(O)=O PRLPSDIHSRITSF-UNQGMJICSA-N 0.000 description 1
- ISJWBVIYRBAXEB-CIUDSAMLSA-N Arg-Ser-Glu Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(O)=O)C(O)=O ISJWBVIYRBAXEB-CIUDSAMLSA-N 0.000 description 1
- JOTRDIXZHNQYGP-DCAQKATOSA-N Arg-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCCN=C(N)N)N JOTRDIXZHNQYGP-DCAQKATOSA-N 0.000 description 1
- UGJLILSJKSBVIR-ZFWWWQNUSA-N Arg-Trp-Gly Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@H](CCCN=C(N)N)N)C(=O)NCC(O)=O)=CNC2=C1 UGJLILSJKSBVIR-ZFWWWQNUSA-N 0.000 description 1
- AOJYORNRFWWEIV-IHRRRGAJSA-N Arg-Tyr-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)N[C@H](C(=O)N[C@@H](CC(O)=O)C(O)=O)CC1=CC=C(O)C=C1 AOJYORNRFWWEIV-IHRRRGAJSA-N 0.000 description 1
- FTMRPIVPSDVGCC-GUBZILKMSA-N Arg-Val-Cys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CCCN=C(N)N)N FTMRPIVPSDVGCC-GUBZILKMSA-N 0.000 description 1
- QLSRIZIDQXDQHK-RCWTZXSCSA-N Arg-Val-Thr Chemical compound [H]N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QLSRIZIDQXDQHK-RCWTZXSCSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- XWGJDUSDTRPQRK-ZLUOBGJFSA-N Asn-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC(N)=O XWGJDUSDTRPQRK-ZLUOBGJFSA-N 0.000 description 1
- XWFPGQVLOVGSLU-CIUDSAMLSA-N Asn-Gln-Arg Chemical compound NC(=O)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N XWFPGQVLOVGSLU-CIUDSAMLSA-N 0.000 description 1
- WPOLSNAQGVHROR-GUBZILKMSA-N Asn-Gln-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CC(=O)N)N WPOLSNAQGVHROR-GUBZILKMSA-N 0.000 description 1
- GJFYPBDMUGGLFR-NKWVEPMBSA-N Asn-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CC(=O)N)N)C(=O)O GJFYPBDMUGGLFR-NKWVEPMBSA-N 0.000 description 1
- GOKCTAJWRPSCHP-VHWLVUOQSA-N Asn-Ile-Trp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(=O)N)N GOKCTAJWRPSCHP-VHWLVUOQSA-N 0.000 description 1
- JTXVXGXTRXMOFJ-FXQIFTODSA-N Asn-Pro-Asn Chemical compound NC(=O)C[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O JTXVXGXTRXMOFJ-FXQIFTODSA-N 0.000 description 1
- UGXYFDQFLVCDFC-CIUDSAMLSA-N Asn-Ser-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O UGXYFDQFLVCDFC-CIUDSAMLSA-N 0.000 description 1
- BIGRHVNFFJTHEB-UBHSHLNASA-N Asn-Trp-Asp Chemical compound [H]N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)N[C@@H](CC(O)=O)C(O)=O BIGRHVNFFJTHEB-UBHSHLNASA-N 0.000 description 1
- NECWUSYTYSIFNC-DLOVCJGASA-N Asp-Ala-Phe Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 NECWUSYTYSIFNC-DLOVCJGASA-N 0.000 description 1
- AAIUGNSRQDGCDC-ZLUOBGJFSA-N Asp-Cys-Cys Chemical compound C([C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CS)C(=O)O)N)C(=O)O AAIUGNSRQDGCDC-ZLUOBGJFSA-N 0.000 description 1
- KHGPWGKPYHPOIK-QWRGUYRKSA-N Asp-Gly-Phe Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O KHGPWGKPYHPOIK-QWRGUYRKSA-N 0.000 description 1
- SVABRQFIHCSNCI-FOHZUACHSA-N Asp-Gly-Thr Chemical compound [H]N[C@@H](CC(O)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O SVABRQFIHCSNCI-FOHZUACHSA-N 0.000 description 1
- SPKCGKRUYKMDHP-GUDRVLHUSA-N Asp-Ile-Pro Chemical compound CC[C@H](C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CC(=O)O)N SPKCGKRUYKMDHP-GUDRVLHUSA-N 0.000 description 1
- UAXIKORUDGGIGA-DCAQKATOSA-N Asp-Pro-Lys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CC(=O)O)N)C(=O)N[C@@H](CCCCN)C(=O)O UAXIKORUDGGIGA-DCAQKATOSA-N 0.000 description 1
- QSFHZPQUAAQHAQ-CIUDSAMLSA-N Asp-Ser-Leu Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(O)=O QSFHZPQUAAQHAQ-CIUDSAMLSA-N 0.000 description 1
- MGSVBZIBCCKGCY-ZLUOBGJFSA-N Asp-Ser-Ser Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O MGSVBZIBCCKGCY-ZLUOBGJFSA-N 0.000 description 1
- GCACQYDBDHRVGE-LKXGYXEUSA-N Asp-Thr-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H]([C@H](O)C)NC(=O)[C@@H](N)CC(O)=O GCACQYDBDHRVGE-LKXGYXEUSA-N 0.000 description 1
- HTSSXFASOUSJQG-IHPCNDPISA-N Asp-Tyr-Trp Chemical compound [H]N[C@@H](CC(O)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC2=C1C=CC=C2)C(O)=O HTSSXFASOUSJQG-IHPCNDPISA-N 0.000 description 1
- GYNUXDMCDILYIQ-QRTARXTBSA-N Asp-Val-Trp Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)NC(=O)[C@H](CC(=O)O)N GYNUXDMCDILYIQ-QRTARXTBSA-N 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 108010008014 B-Cell Maturation Antigen Proteins 0.000 description 1
- 102000006942 B-Cell Maturation Antigen Human genes 0.000 description 1
- 229940124290 BCR-ABL tyrosine kinase inhibitor Drugs 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006417 Bronchial carcinoma Diseases 0.000 description 1
- 208000011691 Burkitt lymphomas Diseases 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- 102100024217 CAMPATH-1 antigen Human genes 0.000 description 1
- 102100038077 CD226 antigen Human genes 0.000 description 1
- 102100027207 CD27 antigen Human genes 0.000 description 1
- 108010065524 CD52 Antigen Proteins 0.000 description 1
- 102100025221 CD70 antigen Human genes 0.000 description 1
- 108091007914 CDKs Proteins 0.000 description 1
- 239000012275 CTLA-4 inhibitor Substances 0.000 description 1
- 229940045513 CTLA4 antagonist Drugs 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- SHHKQEUPHAENFK-UHFFFAOYSA-N Carboquone Chemical compound O=C1C(C)=C(N2CC2)C(=O)C(C(COC(N)=O)OC)=C1N1CC1 SHHKQEUPHAENFK-UHFFFAOYSA-N 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- 102100034744 Cell division cycle 7-related protein kinase Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 208000004378 Choroid plexus papilloma Diseases 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 108090000266 Cyclin-dependent kinases Proteins 0.000 description 1
- 102000003903 Cyclin-dependent kinases Human genes 0.000 description 1
- AMRLSQGGERHDHJ-FXQIFTODSA-N Cys-Ala-Arg Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O AMRLSQGGERHDHJ-FXQIFTODSA-N 0.000 description 1
- BYALSSDCQYHKMY-XGEHTFHBSA-N Cys-Arg-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CS)N)O BYALSSDCQYHKMY-XGEHTFHBSA-N 0.000 description 1
- BPHKULHWEIUDOB-FXQIFTODSA-N Cys-Gln-Gln Chemical compound SC[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O BPHKULHWEIUDOB-FXQIFTODSA-N 0.000 description 1
- HHABWQIFXZPZCK-ACZMJKKPSA-N Cys-Gln-Ser Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CS)N HHABWQIFXZPZCK-ACZMJKKPSA-N 0.000 description 1
- MUZAUPFGPMMZSS-GUBZILKMSA-N Cys-Glu-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)O)NC(=O)[C@H](CS)N MUZAUPFGPMMZSS-GUBZILKMSA-N 0.000 description 1
- CIVXDCMSSFGWAL-YUMQZZPRSA-N Cys-Lys-Gly Chemical compound C(CCN)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CS)N CIVXDCMSSFGWAL-YUMQZZPRSA-N 0.000 description 1
- NIXHTNJAGGFBAW-CIUDSAMLSA-N Cys-Lys-Ser Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CS)N NIXHTNJAGGFBAW-CIUDSAMLSA-N 0.000 description 1
- WZJLBUPPZRZNTO-CIUDSAMLSA-N Cys-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CS)N WZJLBUPPZRZNTO-CIUDSAMLSA-N 0.000 description 1
- SAEVTQWAYDPXMU-KATARQTJSA-N Cys-Thr-Leu Chemical compound [H]N[C@@H](CS)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O SAEVTQWAYDPXMU-KATARQTJSA-N 0.000 description 1
- FNXOZWPPOJRBRE-XGEHTFHBSA-N Cys-Val-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CS)N)O FNXOZWPPOJRBRE-XGEHTFHBSA-N 0.000 description 1
- 201000005171 Cystadenoma Diseases 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 1
- 108010049207 Death Domain Receptors Proteins 0.000 description 1
- 102000009058 Death Domain Receptors Human genes 0.000 description 1
- 208000002699 Digestive System Neoplasms Diseases 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108010052167 Dihydroorotate Dehydrogenase Proteins 0.000 description 1
- 102100032823 Dihydroorotate dehydrogenase (quinone), mitochondrial Human genes 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010061825 Duodenal neoplasm Diseases 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 208000005431 Endometrioid Carcinoma Diseases 0.000 description 1
- SAMRUMKYXPVKPA-VFKOLLTISA-N Enocitabine Chemical compound O=C1N=C(NC(=O)CCCCCCCCCCCCCCCCCCCCC)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 SAMRUMKYXPVKPA-VFKOLLTISA-N 0.000 description 1
- 208000002460 Enteropathy-Associated T-Cell Lymphoma Diseases 0.000 description 1
- OBMLHUPNRURLOK-XGRAFVIBSA-N Epitiostanol Chemical compound C1[C@@H]2S[C@@H]2C[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 OBMLHUPNRURLOK-XGRAFVIBSA-N 0.000 description 1
- CTKXFMQHOOWWEB-UHFFFAOYSA-N Ethylene oxide/propylene oxide copolymer Chemical compound CCCOC(C)COCCO CTKXFMQHOOWWEB-UHFFFAOYSA-N 0.000 description 1
- 208000006168 Ewing Sarcoma Diseases 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 208000004057 Focal Nodular Hyperplasia Diseases 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 208000008999 Giant Cell Carcinoma Diseases 0.000 description 1
- PRBLYKYHAJEABA-SRVKXCTJSA-N Gln-Arg-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(O)=O PRBLYKYHAJEABA-SRVKXCTJSA-N 0.000 description 1
- XOKGKOQWADCLFQ-GARJFASQSA-N Gln-Arg-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CCC(=O)N)N)C(=O)O XOKGKOQWADCLFQ-GARJFASQSA-N 0.000 description 1
- AAOBFSKXAVIORT-GUBZILKMSA-N Gln-Asn-Leu Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O AAOBFSKXAVIORT-GUBZILKMSA-N 0.000 description 1
- KZEUVLLVULIPNX-GUBZILKMSA-N Gln-Asp-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N KZEUVLLVULIPNX-GUBZILKMSA-N 0.000 description 1
- UICOTGULOUGGLC-NUMRIWBASA-N Gln-Asp-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@H](CCC(=O)N)N)O UICOTGULOUGGLC-NUMRIWBASA-N 0.000 description 1
- IXFVOPOHSRKJNG-LAEOZQHASA-N Gln-Asp-Val Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O IXFVOPOHSRKJNG-LAEOZQHASA-N 0.000 description 1
- GPISLLFQNHELLK-DCAQKATOSA-N Gln-Gln-His Chemical compound C1=C(NC=N1)C[C@@H](C(=O)O)NC(=O)[C@H](CCC(=O)N)NC(=O)[C@H](CCC(=O)N)N GPISLLFQNHELLK-DCAQKATOSA-N 0.000 description 1
- IKFZXRLDMYWNBU-YUMQZZPRSA-N Gln-Gly-Arg Chemical compound NC(=O)CC[C@H](N)C(=O)NCC(=O)N[C@H](C(O)=O)CCCN=C(N)N IKFZXRLDMYWNBU-YUMQZZPRSA-N 0.000 description 1
- YXQCLIVLWCKCRS-RYUDHWBXSA-N Gln-Gly-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)CNC(=O)[C@H](CCC(=O)N)N)O YXQCLIVLWCKCRS-RYUDHWBXSA-N 0.000 description 1
- HWEINOMSWQSJDC-SRVKXCTJSA-N Gln-Leu-Arg Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O HWEINOMSWQSJDC-SRVKXCTJSA-N 0.000 description 1
- LGIKBBLQVSWUGK-DCAQKATOSA-N Gln-Leu-Gln Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O LGIKBBLQVSWUGK-DCAQKATOSA-N 0.000 description 1
- SHAUZYVSXAMYAZ-JYJNAYRXSA-N Gln-Leu-Phe Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)NC(=O)[C@H](CCC(=O)N)N SHAUZYVSXAMYAZ-JYJNAYRXSA-N 0.000 description 1
- ZBKUIQNCRIYVGH-SDDRHHMPSA-N Gln-Leu-Pro Chemical compound CC(C)C[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N ZBKUIQNCRIYVGH-SDDRHHMPSA-N 0.000 description 1
- SWDSRANUCKNBLA-AVGNSLFASA-N Gln-Phe-Asp Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N SWDSRANUCKNBLA-AVGNSLFASA-N 0.000 description 1
- KUBFPYIMAGXGBT-ACZMJKKPSA-N Gln-Ser-Ala Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O KUBFPYIMAGXGBT-ACZMJKKPSA-N 0.000 description 1
- OKARHJKJTKFQBM-ACZMJKKPSA-N Gln-Ser-Asn Chemical compound C(CC(=O)N)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(=O)N)C(=O)O)N OKARHJKJTKFQBM-ACZMJKKPSA-N 0.000 description 1
- KPNWAJMEMRCLAL-GUBZILKMSA-N Gln-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(=O)N)N KPNWAJMEMRCLAL-GUBZILKMSA-N 0.000 description 1
- GHAXJVNBAKGWEJ-AVGNSLFASA-N Gln-Ser-Tyr Chemical compound [H]N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O GHAXJVNBAKGWEJ-AVGNSLFASA-N 0.000 description 1
- BJVBMSTUUWGZKX-JYJNAYRXSA-N Gln-Tyr-His Chemical compound N[C@@H](CCC(N)=O)C(=O)N[C@@H](Cc1ccc(O)cc1)C(=O)N[C@@H](Cc1cnc[nH]1)C(O)=O BJVBMSTUUWGZKX-JYJNAYRXSA-N 0.000 description 1
- UBRQJXFDVZNYJP-AVGNSLFASA-N Gln-Tyr-Ser Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O UBRQJXFDVZNYJP-AVGNSLFASA-N 0.000 description 1
- HPBKQFJXDUVNQV-FHWLQOOXSA-N Gln-Tyr-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)NC(=O)[C@H](CCC(=O)N)N)O HPBKQFJXDUVNQV-FHWLQOOXSA-N 0.000 description 1
- OACPJRQRAHMQEQ-NHCYSSNCSA-N Gln-Val-Arg Chemical compound NC(=O)CC[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(O)=O OACPJRQRAHMQEQ-NHCYSSNCSA-N 0.000 description 1
- QZQYITIKPAUDGN-GVXVVHGQSA-N Gln-Val-His Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCC(=O)N)N QZQYITIKPAUDGN-GVXVVHGQSA-N 0.000 description 1
- SDSMVVSHLAAOJL-UKJIMTQDSA-N Gln-Val-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CCC(=O)N)N SDSMVVSHLAAOJL-UKJIMTQDSA-N 0.000 description 1
- VYOILACOFPPNQH-UMNHJUIQSA-N Gln-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)N)N VYOILACOFPPNQH-UMNHJUIQSA-N 0.000 description 1
- WZZSKAJIHTUUSG-ACZMJKKPSA-N Glu-Ala-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(O)=O WZZSKAJIHTUUSG-ACZMJKKPSA-N 0.000 description 1
- NTBDVNJIWCKURJ-ACZMJKKPSA-N Glu-Asp-Asn Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O NTBDVNJIWCKURJ-ACZMJKKPSA-N 0.000 description 1
- JVSBYEDSSRZQGV-GUBZILKMSA-N Glu-Asp-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCC(O)=O JVSBYEDSSRZQGV-GUBZILKMSA-N 0.000 description 1
- JRCUFCXYZLPSDZ-ACZMJKKPSA-N Glu-Asp-Ser Chemical compound OC(=O)CC[C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(O)=O JRCUFCXYZLPSDZ-ACZMJKKPSA-N 0.000 description 1
- WATXSTJXNBOHKD-LAEOZQHASA-N Glu-Asp-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](C(C)C)C(O)=O WATXSTJXNBOHKD-LAEOZQHASA-N 0.000 description 1
- PXHABOCPJVTGEK-BQBZGAKWSA-N Glu-Gln-Gly Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O PXHABOCPJVTGEK-BQBZGAKWSA-N 0.000 description 1
- AUTNXSQEVVHSJK-YVNDNENWSA-N Glu-Glu-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CCC(O)=O AUTNXSQEVVHSJK-YVNDNENWSA-N 0.000 description 1
- DNPCBMNFQVTHMA-DCAQKATOSA-N Glu-Leu-Gln Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O DNPCBMNFQVTHMA-DCAQKATOSA-N 0.000 description 1
- NJCALAAIGREHDR-WDCWCFNPSA-N Glu-Leu-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O NJCALAAIGREHDR-WDCWCFNPSA-N 0.000 description 1
- GJBUAAAIZSRCDC-GVXVVHGQSA-N Glu-Leu-Val Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O GJBUAAAIZSRCDC-GVXVVHGQSA-N 0.000 description 1
- JWNZHMSRZXXGTM-XKBZYTNZSA-N Glu-Ser-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(O)=O JWNZHMSRZXXGTM-XKBZYTNZSA-N 0.000 description 1
- DDXZHOHEABQXSE-NKIYYHGXSA-N Glu-Thr-His Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)[C@H](CCC(=O)O)N)O DDXZHOHEABQXSE-NKIYYHGXSA-N 0.000 description 1
- YQAQQKPWFOBSMU-WDCWCFNPSA-N Glu-Thr-Leu Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O YQAQQKPWFOBSMU-WDCWCFNPSA-N 0.000 description 1
- ZYRXTRTUCAVNBQ-GVXVVHGQSA-N Glu-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CCC(=O)O)N ZYRXTRTUCAVNBQ-GVXVVHGQSA-N 0.000 description 1
- RMWAOBGCZZSJHE-UMNHJUIQSA-N Glu-Val-Pro Chemical compound CC(C)[C@@H](C(=O)N1CCC[C@@H]1C(=O)O)NC(=O)[C@H](CCC(=O)O)N RMWAOBGCZZSJHE-UMNHJUIQSA-N 0.000 description 1
- WGYHAAXZWPEBDQ-IFFSRLJSSA-N Glu-Val-Thr Chemical compound [H]N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O WGYHAAXZWPEBDQ-IFFSRLJSSA-N 0.000 description 1
- 206010018404 Glucagonoma Diseases 0.000 description 1
- QIZJOTQTCAGKPU-KWQFWETISA-N Gly-Ala-Tyr Chemical compound [NH3+]CC(=O)N[C@@H](C)C(=O)N[C@H](C([O-])=O)CC1=CC=C(O)C=C1 QIZJOTQTCAGKPU-KWQFWETISA-N 0.000 description 1
- JVWPPCWUDRJGAE-YUMQZZPRSA-N Gly-Asn-Leu Chemical compound [H]NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(O)=O JVWPPCWUDRJGAE-YUMQZZPRSA-N 0.000 description 1
- LXXLEUBUOMCAMR-NKWVEPMBSA-N Gly-Asp-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)O)NC(=O)CN)C(=O)O LXXLEUBUOMCAMR-NKWVEPMBSA-N 0.000 description 1
- MQVNVZUEPUIAFA-WDSKDSINSA-N Gly-Cys-Gln Chemical compound C(CC(=O)N)[C@@H](C(=O)O)NC(=O)[C@H](CS)NC(=O)CN MQVNVZUEPUIAFA-WDSKDSINSA-N 0.000 description 1
- XMPXVJIDADUOQB-RCOVLWMOSA-N Gly-Gly-Ile Chemical compound CC[C@H](C)[C@@H](C([O-])=O)NC(=O)CNC(=O)C[NH3+] XMPXVJIDADUOQB-RCOVLWMOSA-N 0.000 description 1
- XPJBQTCXPJNIFE-ZETCQYMHSA-N Gly-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)CN XPJBQTCXPJNIFE-ZETCQYMHSA-N 0.000 description 1
- YWAQATDNEKZFFK-BYPYZUCNSA-N Gly-Gly-Ser Chemical compound NCC(=O)NCC(=O)N[C@@H](CO)C(O)=O YWAQATDNEKZFFK-BYPYZUCNSA-N 0.000 description 1
- OLPPXYMMIARYAL-QMMMGPOBSA-N Gly-Gly-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)CNC(=O)CN OLPPXYMMIARYAL-QMMMGPOBSA-N 0.000 description 1
- HHSOPSCKAZKQHQ-PEXQALLHSA-N Gly-His-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)NC(=O)CN HHSOPSCKAZKQHQ-PEXQALLHSA-N 0.000 description 1
- HAXARWKYFIIHKD-ZKWXMUAHSA-N Gly-Ile-Ser Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(O)=O HAXARWKYFIIHKD-ZKWXMUAHSA-N 0.000 description 1
- TWTPDFFBLQEBOE-IUCAKERBSA-N Gly-Leu-Gln Chemical compound [H]NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O TWTPDFFBLQEBOE-IUCAKERBSA-N 0.000 description 1
- VBOBNHSVQKKTOT-YUMQZZPRSA-N Gly-Lys-Ala Chemical compound [H]NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O VBOBNHSVQKKTOT-YUMQZZPRSA-N 0.000 description 1
- SJLKKOZFHSJJAW-YUMQZZPRSA-N Gly-Met-Glu Chemical compound CSCC[C@@H](C(=O)N[C@@H](CCC(=O)O)C(=O)O)NC(=O)CN SJLKKOZFHSJJAW-YUMQZZPRSA-N 0.000 description 1
- RVGMVLVBDRQVKB-UWVGGRQHSA-N Gly-Met-His Chemical compound CSCC[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)NC(=O)CN RVGMVLVBDRQVKB-UWVGGRQHSA-N 0.000 description 1
- GAFKBWKVXNERFA-QWRGUYRKSA-N Gly-Phe-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)CN)CC1=CC=CC=C1 GAFKBWKVXNERFA-QWRGUYRKSA-N 0.000 description 1
- IRJWAYCXIYUHQE-WHFBIAKZSA-N Gly-Ser-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)CN IRJWAYCXIYUHQE-WHFBIAKZSA-N 0.000 description 1
- IALQAMYQJBZNSK-WHFBIAKZSA-N Gly-Ser-Asn Chemical compound [H]NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O IALQAMYQJBZNSK-WHFBIAKZSA-N 0.000 description 1
- OHUKZZYSJBKFRR-WHFBIAKZSA-N Gly-Ser-Asp Chemical compound [H]NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(O)=O OHUKZZYSJBKFRR-WHFBIAKZSA-N 0.000 description 1
- WNGHUXFWEWTKAO-YUMQZZPRSA-N Gly-Ser-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)[C@H](CO)NC(=O)CN WNGHUXFWEWTKAO-YUMQZZPRSA-N 0.000 description 1
- POJJAZJHBGXEGM-YUMQZZPRSA-N Gly-Ser-Lys Chemical compound C(CCN)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)CN POJJAZJHBGXEGM-YUMQZZPRSA-N 0.000 description 1
- ZZWUYQXMIFTIIY-WEDXCCLWSA-N Gly-Thr-Leu Chemical compound [H]NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(O)=O ZZWUYQXMIFTIIY-WEDXCCLWSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 108010017080 Granulocyte Colony-Stimulating Factor Proteins 0.000 description 1
- 102000004269 Granulocyte Colony-Stimulating Factor Human genes 0.000 description 1
- 102000001398 Granzyme Human genes 0.000 description 1
- 108060005986 Granzyme Proteins 0.000 description 1
- 208000002125 Hemangioendothelioma Diseases 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- 206010019629 Hepatic adenoma Diseases 0.000 description 1
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 1
- 206010073073 Hepatobiliary cancer Diseases 0.000 description 1
- 229920000209 Hexadimethrine bromide Polymers 0.000 description 1
- BQFGKVYHKCNEMF-DCAQKATOSA-N His-Glu-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC1=CN=CN1 BQFGKVYHKCNEMF-DCAQKATOSA-N 0.000 description 1
- SKYULSWNBYAQMG-IHRRRGAJSA-N His-Leu-Arg Chemical compound [H]N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O SKYULSWNBYAQMG-IHRRRGAJSA-N 0.000 description 1
- KYFGGRHWLFZXPU-KKUMJFAQSA-N His-Phe-Asn Chemical compound C1=CC=C(C=C1)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H](CC2=CN=CN2)N KYFGGRHWLFZXPU-KKUMJFAQSA-N 0.000 description 1
- HBGKOLSGLYMWSW-DCAQKATOSA-N His-Pro-Cys Chemical compound C1C[C@H](N(C1)C(=O)[C@H](CC2=CN=CN2)N)C(=O)N[C@@H](CS)C(=O)O HBGKOLSGLYMWSW-DCAQKATOSA-N 0.000 description 1
- ZHHLTWUOWXHVQJ-YUMQZZPRSA-N His-Ser-Gly Chemical compound C1=C(NC=N1)C[C@@H](C(=O)N[C@@H](CO)C(=O)NCC(=O)O)N ZHHLTWUOWXHVQJ-YUMQZZPRSA-N 0.000 description 1
- GIRSNERMXCMDBO-GARJFASQSA-N His-Ser-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CO)NC(=O)[C@H](CC2=CN=CN2)N)C(=O)O GIRSNERMXCMDBO-GARJFASQSA-N 0.000 description 1
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 description 1
- 101000884298 Homo sapiens CD226 antigen Proteins 0.000 description 1
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 description 1
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 description 1
- 101000945740 Homo sapiens Cell division cycle 7-related protein kinase Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 1
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 1
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 1
- 101000991061 Homo sapiens MHC class I polypeptide-related sequence B Proteins 0.000 description 1
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 1
- 101000744394 Homo sapiens Oxidized purine nucleoside triphosphate hydrolase Proteins 0.000 description 1
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 description 1
- 101001136592 Homo sapiens Prostate stem cell antigen Proteins 0.000 description 1
- 101000633784 Homo sapiens SLAM family member 7 Proteins 0.000 description 1
- 101000777293 Homo sapiens Serine/threonine-protein kinase Chk1 Proteins 0.000 description 1
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 description 1
- 101000610605 Homo sapiens Tumor necrosis factor receptor superfamily member 10A Proteins 0.000 description 1
- 101000610604 Homo sapiens Tumor necrosis factor receptor superfamily member 10B Proteins 0.000 description 1
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 1
- 101000679903 Homo sapiens Tumor necrosis factor receptor superfamily member 25 Proteins 0.000 description 1
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 description 1
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 description 1
- 101000621390 Homo sapiens Wee1-like protein kinase Proteins 0.000 description 1
- 206010062767 Hypophysitis Diseases 0.000 description 1
- 108010073807 IgG Receptors Proteins 0.000 description 1
- ASCFJMSGKUIRDU-ZPFDUUQYSA-N Ile-Arg-Gln Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(O)=O ASCFJMSGKUIRDU-ZPFDUUQYSA-N 0.000 description 1
- LVQDUPQUJZWKSU-PYJNHQTQSA-N Ile-Arg-His Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N LVQDUPQUJZWKSU-PYJNHQTQSA-N 0.000 description 1
- LDRALPZEVHVXEK-KBIXCLLPSA-N Ile-Cys-Glu Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N LDRALPZEVHVXEK-KBIXCLLPSA-N 0.000 description 1
- SLQVFYWBGNNOTK-BYULHYEWSA-N Ile-Gly-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)NCC(=O)N[C@@H](CC(=O)N)C(=O)O)N SLQVFYWBGNNOTK-BYULHYEWSA-N 0.000 description 1
- TVYWVSJGSHQWMT-AJNGGQMLSA-N Ile-Leu-Lys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)O)N TVYWVSJGSHQWMT-AJNGGQMLSA-N 0.000 description 1
- RQQCJTLBSJMVCR-DSYPUSFNSA-N Ile-Leu-Trp Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)N RQQCJTLBSJMVCR-DSYPUSFNSA-N 0.000 description 1
- IITVUURPOYGCTD-NAKRPEOUSA-N Ile-Pro-Ala Chemical compound CC[C@H](C)[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(O)=O IITVUURPOYGCTD-NAKRPEOUSA-N 0.000 description 1
- FBGXMKUWQFPHFB-JBDRJPRFSA-N Ile-Ser-Cys Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N FBGXMKUWQFPHFB-JBDRJPRFSA-N 0.000 description 1
- HXIDVIFHRYRXLZ-NAKRPEOUSA-N Ile-Ser-Val Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)O)N HXIDVIFHRYRXLZ-NAKRPEOUSA-N 0.000 description 1
- WXLYNEHOGRYNFU-URLPEUOOSA-N Ile-Thr-Phe Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)O)N WXLYNEHOGRYNFU-URLPEUOOSA-N 0.000 description 1
- MUFXDFWAJSPHIQ-XDTLVQLUSA-N Ile-Tyr Chemical compound CC[C@H](C)[C@H]([NH3+])C(=O)N[C@H](C([O-])=O)CC1=CC=C(O)C=C1 MUFXDFWAJSPHIQ-XDTLVQLUSA-N 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 102000013462 Interleukin-12 Human genes 0.000 description 1
- 108010065805 Interleukin-12 Proteins 0.000 description 1
- 102000003812 Interleukin-15 Human genes 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- SHGAZHPCJJPHSC-NUEINMDLSA-N Isotretinoin Chemical compound OC(=O)C=C(C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-NUEINMDLSA-N 0.000 description 1
- 229940122245 Janus kinase inhibitor Drugs 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- SENJXOPIZNYLHU-UHFFFAOYSA-N L-leucyl-L-arginine Natural products CC(C)CC(N)C(=O)NC(C(O)=O)CCCN=C(N)N SENJXOPIZNYLHU-UHFFFAOYSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- TYYLDKGBCJGJGW-UHFFFAOYSA-N L-tryptophan-L-tyrosine Natural products C=1NC2=CC=CC=C2C=1CC(N)C(=O)NC(C(O)=O)CC1=CC=C(O)C=C1 TYYLDKGBCJGJGW-UHFFFAOYSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 102000017578 LAG3 Human genes 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 1
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 1
- 206010023825 Laryngeal cancer Diseases 0.000 description 1
- 208000018142 Leiomyosarcoma Diseases 0.000 description 1
- KVRKAGGMEWNURO-CIUDSAMLSA-N Leu-Ala-Cys Chemical compound C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CC(C)C)N KVRKAGGMEWNURO-CIUDSAMLSA-N 0.000 description 1
- HASRFYOMVPJRPU-SRVKXCTJSA-N Leu-Arg-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CCC(O)=O)C(O)=O HASRFYOMVPJRPU-SRVKXCTJSA-N 0.000 description 1
- FJUKMPUELVROGK-IHRRRGAJSA-N Leu-Arg-His Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CCCN=C(N)N)C(=O)N[C@@H](CC1=CN=CN1)C(=O)O)N FJUKMPUELVROGK-IHRRRGAJSA-N 0.000 description 1
- UCOCBWDBHCUPQP-DCAQKATOSA-N Leu-Arg-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(O)=O UCOCBWDBHCUPQP-DCAQKATOSA-N 0.000 description 1
- DBVWMYGBVFCRBE-CIUDSAMLSA-N Leu-Asn-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O DBVWMYGBVFCRBE-CIUDSAMLSA-N 0.000 description 1
- USTCFDAQCLDPBD-XIRDDKMYSA-N Leu-Asn-Trp Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)O)N USTCFDAQCLDPBD-XIRDDKMYSA-N 0.000 description 1
- ZURHXHNAEJJRNU-CIUDSAMLSA-N Leu-Asp-Asn Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O ZURHXHNAEJJRNU-CIUDSAMLSA-N 0.000 description 1
- XVSJMWYYLHPDKY-DCAQKATOSA-N Leu-Asp-Met Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCSC)C(O)=O XVSJMWYYLHPDKY-DCAQKATOSA-N 0.000 description 1
- PIHFVNPEAHFNLN-KKUMJFAQSA-N Leu-Cys-Tyr Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC1=CC=C(C=C1)O)C(=O)O)N PIHFVNPEAHFNLN-KKUMJFAQSA-N 0.000 description 1
- VQPPIMUZCZCOIL-GUBZILKMSA-N Leu-Gln-Ala Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](C)C(O)=O VQPPIMUZCZCOIL-GUBZILKMSA-N 0.000 description 1
- ZYLJULGXQDNXDK-GUBZILKMSA-N Leu-Gln-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(O)=O ZYLJULGXQDNXDK-GUBZILKMSA-N 0.000 description 1
- DPWGZWUMUUJQDT-IUCAKERBSA-N Leu-Gln-Gly Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(O)=O DPWGZWUMUUJQDT-IUCAKERBSA-N 0.000 description 1
- YFBBUHJJUXXZOF-UWVGGRQHSA-N Leu-Gly-Pro Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N1CCC[C@H]1C(O)=O YFBBUHJJUXXZOF-UWVGGRQHSA-N 0.000 description 1
- VGPCJSXPPOQPBK-YUMQZZPRSA-N Leu-Gly-Ser Chemical compound CC(C)C[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O VGPCJSXPPOQPBK-YUMQZZPRSA-N 0.000 description 1
- DDEMUMVXNFPDKC-SRVKXCTJSA-N Leu-His-Cys Chemical compound CC(C)C[C@@H](C(=O)N[C@@H](CC1=CN=CN1)C(=O)N[C@@H](CS)C(=O)O)N DDEMUMVXNFPDKC-SRVKXCTJSA-N 0.000 description 1
- KOSWSHVQIVTVQF-ZPFDUUQYSA-N Leu-Ile-Asp Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(O)=O)C(O)=O KOSWSHVQIVTVQF-ZPFDUUQYSA-N 0.000 description 1
- AUBMZAMQCOYSIC-MNXVOIDGSA-N Leu-Ile-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(N)=O)C(O)=O AUBMZAMQCOYSIC-MNXVOIDGSA-N 0.000 description 1
- FAELBUXXFQLUAX-AJNGGQMLSA-N Leu-Leu-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(C)C FAELBUXXFQLUAX-AJNGGQMLSA-N 0.000 description 1
- XVZCXCTYGHPNEM-UHFFFAOYSA-N Leu-Leu-Pro Natural products CC(C)CC(N)C(=O)NC(CC(C)C)C(=O)N1CCCC1C(O)=O XVZCXCTYGHPNEM-UHFFFAOYSA-N 0.000 description 1
- VCHVSKNMTXWIIP-SRVKXCTJSA-N Leu-Lys-Ser Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(O)=O VCHVSKNMTXWIIP-SRVKXCTJSA-N 0.000 description 1
- IWMJFLJQHIDZQW-KKUMJFAQSA-N Leu-Ser-Phe Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 IWMJFLJQHIDZQW-KKUMJFAQSA-N 0.000 description 1
- BRTVHXHCUSXYRI-CIUDSAMLSA-N Leu-Ser-Ser Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O BRTVHXHCUSXYRI-CIUDSAMLSA-N 0.000 description 1
- ZDJQVSIPFLMNOX-RHYQMDGZSA-N Leu-Thr-Arg Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCCN=C(N)N ZDJQVSIPFLMNOX-RHYQMDGZSA-N 0.000 description 1
- LFSQWRSVPNKJGP-WDCWCFNPSA-N Leu-Thr-Glu Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@H](C(O)=O)CCC(O)=O LFSQWRSVPNKJGP-WDCWCFNPSA-N 0.000 description 1
- VHTIZYYHIUHMCA-JYJNAYRXSA-N Leu-Tyr-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCC(N)=O)C(O)=O VHTIZYYHIUHMCA-JYJNAYRXSA-N 0.000 description 1
- ARNIBBOXIAWUOP-MGHWNKPDSA-N Leu-Tyr-Ile Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O ARNIBBOXIAWUOP-MGHWNKPDSA-N 0.000 description 1
- MVJRBCJCRYGCKV-GVXVVHGQSA-N Leu-Val-Gln Chemical compound [H]N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O MVJRBCJCRYGCKV-GVXVVHGQSA-N 0.000 description 1
- QESXLSQLQHHTIX-RHYQMDGZSA-N Leu-Val-Thr Chemical compound CC(C)C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O QESXLSQLQHHTIX-RHYQMDGZSA-N 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- 208000036241 Liver adenomatosis Diseases 0.000 description 1
- UWKNTTJNVSYXPC-CIUDSAMLSA-N Lys-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCCCN UWKNTTJNVSYXPC-CIUDSAMLSA-N 0.000 description 1
- YKIRNDPUWONXQN-GUBZILKMSA-N Lys-Asn-Gln Chemical compound C(CCN)C[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)N[C@@H](CCC(=O)N)C(=O)O)N YKIRNDPUWONXQN-GUBZILKMSA-N 0.000 description 1
- PXHCFKXNSBJSTQ-KKUMJFAQSA-N Lys-Asn-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CCCCN)N)O PXHCFKXNSBJSTQ-KKUMJFAQSA-N 0.000 description 1
- WGCKDDHUFPQSMZ-ZPFDUUQYSA-N Lys-Asp-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CCCCN WGCKDDHUFPQSMZ-ZPFDUUQYSA-N 0.000 description 1
- GQFDWEDHOQRNLC-QWRGUYRKSA-N Lys-Gly-Leu Chemical compound CC(C)C[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN GQFDWEDHOQRNLC-QWRGUYRKSA-N 0.000 description 1
- RFQATBGBLDAKGI-VHSXEESVSA-N Lys-Gly-Pro Chemical compound C1C[C@@H](N(C1)C(=O)CNC(=O)[C@H](CCCCN)N)C(=O)O RFQATBGBLDAKGI-VHSXEESVSA-N 0.000 description 1
- KEPWSUPUFAPBRF-DKIMLUQUSA-N Lys-Ile-Phe Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O KEPWSUPUFAPBRF-DKIMLUQUSA-N 0.000 description 1
- SKRGVGLIRUGANF-AVGNSLFASA-N Lys-Leu-Glu Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O SKRGVGLIRUGANF-AVGNSLFASA-N 0.000 description 1
- OIQSIMFSVLLWBX-VOAKCMCISA-N Lys-Leu-Thr Chemical compound [H]N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O OIQSIMFSVLLWBX-VOAKCMCISA-N 0.000 description 1
- FPQMQEOVSKMVMA-ACRUOGEOSA-N Lys-Tyr-Tyr Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)O)NC(=O)[C@H](CCCCN)N)O FPQMQEOVSKMVMA-ACRUOGEOSA-N 0.000 description 1
- 201000003791 MALT lymphoma Diseases 0.000 description 1
- 229940124787 MELK inhibitor Drugs 0.000 description 1
- 102100030300 MHC class I polypeptide-related sequence B Human genes 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 108010046938 Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 206010025537 Malignant anorectal neoplasms Diseases 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 1
- 208000015021 Meningeal Neoplasms Diseases 0.000 description 1
- MPCKIRSXNKACRF-GUBZILKMSA-N Met-Pro-Asn Chemical compound CSCC[C@H](N)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(N)=O)C(O)=O MPCKIRSXNKACRF-GUBZILKMSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 102100034256 Mucin-1 Human genes 0.000 description 1
- 206010057269 Mucoepidermoid carcinoma Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 208000002231 Muscle Neoplasms Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- SITLTJHOQZFJGG-UHFFFAOYSA-N N-L-alpha-glutamyl-L-valine Natural products CC(C)C(C(O)=O)NC(=O)C(N)CCC(O)=O SITLTJHOQZFJGG-UHFFFAOYSA-N 0.000 description 1
- KZNQNBZMBZJQJO-UHFFFAOYSA-N N-glycyl-L-proline Natural products NCC(=O)N1CCCC1C(O)=O KZNQNBZMBZJQJO-UHFFFAOYSA-N 0.000 description 1
- 206010028767 Nasal sinus cancer Diseases 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- 101100342977 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) leu-1 gene Proteins 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 206010029488 Nodular melanoma Diseases 0.000 description 1
- 208000010505 Nose Neoplasms Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 102100039792 Oxidized purine nucleoside triphosphate hydrolase Human genes 0.000 description 1
- 239000012661 PARP inhibitor Substances 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 208000037064 Papilloma of choroid plexus Diseases 0.000 description 1
- 208000003937 Paranasal Sinus Neoplasms Diseases 0.000 description 1
- 208000004091 Parotid Neoplasms Diseases 0.000 description 1
- 206010061336 Pelvic neoplasm Diseases 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 1
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 description 1
- 206010034811 Pharyngeal cancer Diseases 0.000 description 1
- FPTXMUIBLMGTQH-ONGXEEELSA-N Phe-Ala-Gly Chemical compound OC(=O)CNC(=O)[C@H](C)NC(=O)[C@@H](N)CC1=CC=CC=C1 FPTXMUIBLMGTQH-ONGXEEELSA-N 0.000 description 1
- CSYVXYQDIVCQNU-QWRGUYRKSA-N Phe-Asp-Gly Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(O)=O)C(=O)NCC(O)=O CSYVXYQDIVCQNU-QWRGUYRKSA-N 0.000 description 1
- CUMXHKAOHNWRFQ-BZSNNMDCSA-N Phe-Asp-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 CUMXHKAOHNWRFQ-BZSNNMDCSA-N 0.000 description 1
- JWQWPTLEOFNCGX-AVGNSLFASA-N Phe-Glu-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC1=CC=CC=C1 JWQWPTLEOFNCGX-AVGNSLFASA-N 0.000 description 1
- QPVFUAUFEBPIPT-CDMKHQONSA-N Phe-Gly-Thr Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(O)=O QPVFUAUFEBPIPT-CDMKHQONSA-N 0.000 description 1
- YZJKNDCEPDDIDA-BZSNNMDCSA-N Phe-His-Lys Chemical compound C([C@@H](C(=O)N[C@@H](CCCCN)C(O)=O)NC(=O)[C@@H](N)CC=1C=CC=CC=1)C1=CN=CN1 YZJKNDCEPDDIDA-BZSNNMDCSA-N 0.000 description 1
- KNYPNEYICHHLQL-ACRUOGEOSA-N Phe-Leu-Tyr Chemical compound C([C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C1=CC=CC=C1 KNYPNEYICHHLQL-ACRUOGEOSA-N 0.000 description 1
- FQUUYTNBMIBOHS-IHRRRGAJSA-N Phe-Met-Ser Chemical compound CSCC[C@@H](C(=O)N[C@@H](CO)C(=O)O)NC(=O)[C@H](CC1=CC=CC=C1)N FQUUYTNBMIBOHS-IHRRRGAJSA-N 0.000 description 1
- BPCLGWHVPVTTFM-QWRGUYRKSA-N Phe-Ser-Gly Chemical compound [H]N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(=O)NCC(O)=O BPCLGWHVPVTTFM-QWRGUYRKSA-N 0.000 description 1
- RAGOJJCBGXARPO-XVSYOHENSA-N Phe-Thr-Asp Chemical compound OC(=O)C[C@@H](C(O)=O)NC(=O)[C@H]([C@H](O)C)NC(=O)[C@@H](N)CC1=CC=CC=C1 RAGOJJCBGXARPO-XVSYOHENSA-N 0.000 description 1
- BPIMVBKDLSBKIJ-FCLVOEFKSA-N Phe-Thr-Phe Chemical compound C([C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(O)=O)C1=CC=CC=C1 BPIMVBKDLSBKIJ-FCLVOEFKSA-N 0.000 description 1
- MHNBYYFXWDUGBW-RPTUDFQQSA-N Phe-Tyr-Thr Chemical compound C[C@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)NC(=O)[C@H](CC2=CC=CC=C2)N)O MHNBYYFXWDUGBW-RPTUDFQQSA-N 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000007452 Plasmacytoma Diseases 0.000 description 1
- 108010064218 Poly (ADP-Ribose) Polymerase-1 Proteins 0.000 description 1
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 description 1
- 102100023712 Poly [ADP-ribose] polymerase 1 Human genes 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- HFVNWDWLWUCIHC-GUPDPFMOSA-N Prednimustine Chemical compound O=C([C@@]1(O)CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)[C@@H](O)C[C@@]21C)COC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 HFVNWDWLWUCIHC-GUPDPFMOSA-N 0.000 description 1
- IFMDQWDAJUMMJC-DCAQKATOSA-N Pro-Ala-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(O)=O IFMDQWDAJUMMJC-DCAQKATOSA-N 0.000 description 1
- XQLBWXHVZVBNJM-FXQIFTODSA-N Pro-Ala-Ser Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1 XQLBWXHVZVBNJM-FXQIFTODSA-N 0.000 description 1
- JARJPEMLQAWNBR-GUBZILKMSA-N Pro-Asp-Arg Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O JARJPEMLQAWNBR-GUBZILKMSA-N 0.000 description 1
- KPDRZQUWJKTMBP-DCAQKATOSA-N Pro-Asp-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)O)NC(=O)[C@@H]1CCCN1 KPDRZQUWJKTMBP-DCAQKATOSA-N 0.000 description 1
- FKKHDBFNOLCYQM-FXQIFTODSA-N Pro-Cys-Ala Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CS)C(=O)N[C@@H](C)C(O)=O FKKHDBFNOLCYQM-FXQIFTODSA-N 0.000 description 1
- VDGTVWFMRXVQCT-GUBZILKMSA-N Pro-Glu-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CCCN1 VDGTVWFMRXVQCT-GUBZILKMSA-N 0.000 description 1
- NMELOOXSGDRBRU-YUMQZZPRSA-N Pro-Glu-Gly Chemical compound OC(=O)CNC(=O)[C@H](CCC(=O)O)NC(=O)[C@@H]1CCCN1 NMELOOXSGDRBRU-YUMQZZPRSA-N 0.000 description 1
- LXVLKXPFIDDHJG-CIUDSAMLSA-N Pro-Glu-Ser Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O LXVLKXPFIDDHJG-CIUDSAMLSA-N 0.000 description 1
- JMVQDLDPDBXAAX-YUMQZZPRSA-N Pro-Gly-Gln Chemical compound NC(=O)CC[C@@H](C(O)=O)NC(=O)CNC(=O)[C@@H]1CCCN1 JMVQDLDPDBXAAX-YUMQZZPRSA-N 0.000 description 1
- GURGCNUWVSDYTP-SRVKXCTJSA-N Pro-Leu-Gln Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O GURGCNUWVSDYTP-SRVKXCTJSA-N 0.000 description 1
- CDGABSWLRMECHC-IHRRRGAJSA-N Pro-Lys-His Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC2=CN=CN2)C(=O)O CDGABSWLRMECHC-IHRRRGAJSA-N 0.000 description 1
- RMODQFBNDDENCP-IHRRRGAJSA-N Pro-Lys-Leu Chemical compound [H]N1CCC[C@H]1C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(O)=O RMODQFBNDDENCP-IHRRRGAJSA-N 0.000 description 1
- PCWLNNZTBJTZRN-AVGNSLFASA-N Pro-Pro-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@H]1NCCC1 PCWLNNZTBJTZRN-AVGNSLFASA-N 0.000 description 1
- RCYUBVHMVUHEBM-RCWTZXSCSA-N Pro-Pro-Thr Chemical compound [H]N1CCC[C@H]1C(=O)N1CCC[C@H]1C(=O)N[C@@H]([C@@H](C)O)C(O)=O RCYUBVHMVUHEBM-RCWTZXSCSA-N 0.000 description 1
- DYJTXTCEXMCPBF-UFYCRDLUSA-N Pro-Tyr-Phe Chemical compound C1C[C@H](NC1)C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N[C@@H](CC3=CC=CC=C3)C(=O)O DYJTXTCEXMCPBF-UFYCRDLUSA-N 0.000 description 1
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102100036735 Prostate stem cell antigen Human genes 0.000 description 1
- 229940079156 Proteasome inhibitor Drugs 0.000 description 1
- 206010051807 Pseudosarcoma Diseases 0.000 description 1
- 201000008183 Pulmonary blastoma Diseases 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- BKRGVLQUQGGVSM-KBXCAEBGSA-N Revanil Chemical compound C1=CC(C=2[C@H](N(C)C[C@H](C=2)NC(=O)N(CC)CC)C2)=C3C2=CNC3=C1 BKRGVLQUQGGVSM-KBXCAEBGSA-N 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 102100029198 SLAM family member 7 Human genes 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010070834 Sensitisation Diseases 0.000 description 1
- MWMKFWJYRRGXOR-ZLUOBGJFSA-N Ser-Ala-Asn Chemical compound N[C@H](C(=O)N[C@H](C(=O)N[C@H](C(=O)O)CC(N)=O)C)CO MWMKFWJYRRGXOR-ZLUOBGJFSA-N 0.000 description 1
- LVVBAKCGXXUHFO-ZLUOBGJFSA-N Ser-Ala-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(O)=O LVVBAKCGXXUHFO-ZLUOBGJFSA-N 0.000 description 1
- IDQFQFVEWMWRQQ-DLOVCJGASA-N Ser-Ala-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O IDQFQFVEWMWRQQ-DLOVCJGASA-N 0.000 description 1
- YQHZVYJAGWMHES-ZLUOBGJFSA-N Ser-Ala-Ser Chemical compound OC[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O YQHZVYJAGWMHES-ZLUOBGJFSA-N 0.000 description 1
- IDCKUIWEIZYVSO-WFBYXXMGSA-N Ser-Ala-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CO)C)C(O)=O)=CNC2=C1 IDCKUIWEIZYVSO-WFBYXXMGSA-N 0.000 description 1
- GXXTUIUYTWGPMV-FXQIFTODSA-N Ser-Arg-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(O)=O GXXTUIUYTWGPMV-FXQIFTODSA-N 0.000 description 1
- QEDMOZUJTGEIBF-FXQIFTODSA-N Ser-Arg-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(O)=O QEDMOZUJTGEIBF-FXQIFTODSA-N 0.000 description 1
- JJKSSJVYOVRJMZ-FXQIFTODSA-N Ser-Arg-Cys Chemical compound C(C[C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CO)N)CN=C(N)N JJKSSJVYOVRJMZ-FXQIFTODSA-N 0.000 description 1
- OBXVZEAMXFSGPU-FXQIFTODSA-N Ser-Asn-Arg Chemical compound C(C[C@@H](C(=O)O)NC(=O)[C@H](CC(=O)N)NC(=O)[C@H](CO)N)CN=C(N)N OBXVZEAMXFSGPU-FXQIFTODSA-N 0.000 description 1
- OOKCGAYXSNJBGQ-ZLUOBGJFSA-N Ser-Asn-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O OOKCGAYXSNJBGQ-ZLUOBGJFSA-N 0.000 description 1
- CNIIKZQXBBQHCX-FXQIFTODSA-N Ser-Asp-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O CNIIKZQXBBQHCX-FXQIFTODSA-N 0.000 description 1
- CTRHXXXHUJTTRZ-ZLUOBGJFSA-N Ser-Asp-Cys Chemical compound C([C@@H](C(=O)N[C@@H](CS)C(=O)O)NC(=O)[C@H](CO)N)C(=O)O CTRHXXXHUJTTRZ-ZLUOBGJFSA-N 0.000 description 1
- UQFYNFTYDHUIMI-WHFBIAKZSA-N Ser-Gly-Ala Chemical compound OC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](N)CO UQFYNFTYDHUIMI-WHFBIAKZSA-N 0.000 description 1
- XXXAXOWMBOKTRN-XPUUQOCRSA-N Ser-Gly-Val Chemical compound [H]N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C(C)C)C(O)=O XXXAXOWMBOKTRN-XPUUQOCRSA-N 0.000 description 1
- CLKKNZQUQMZDGD-SRVKXCTJSA-N Ser-His-Lys Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CO)CC1=CN=CN1 CLKKNZQUQMZDGD-SRVKXCTJSA-N 0.000 description 1
- FUMGHWDRRFCKEP-CIUDSAMLSA-N Ser-Leu-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(O)=O FUMGHWDRRFCKEP-CIUDSAMLSA-N 0.000 description 1
- ZIFYDQAFEMIZII-GUBZILKMSA-N Ser-Leu-Glu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(O)=O ZIFYDQAFEMIZII-GUBZILKMSA-N 0.000 description 1
- MUJQWSAWLLRJCE-KATARQTJSA-N Ser-Leu-Thr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O MUJQWSAWLLRJCE-KATARQTJSA-N 0.000 description 1
- JAWGSPUJAXYXJA-IHRRRGAJSA-N Ser-Phe-Arg Chemical compound NC(N)=NCCC[C@@H](C(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CO)N)CC1=CC=CC=C1 JAWGSPUJAXYXJA-IHRRRGAJSA-N 0.000 description 1
- KZPRPBLHYMZIMH-MXAVVETBSA-N Ser-Phe-Ile Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O KZPRPBLHYMZIMH-MXAVVETBSA-N 0.000 description 1
- UPLYXVPQLJVWMM-KKUMJFAQSA-N Ser-Phe-Leu Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC(C)C)C(O)=O UPLYXVPQLJVWMM-KKUMJFAQSA-N 0.000 description 1
- MQUZANJDFOQOBX-SRVKXCTJSA-N Ser-Phe-Ser Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CO)C(O)=O MQUZANJDFOQOBX-SRVKXCTJSA-N 0.000 description 1
- ZKBKUWQVDWWSRI-BZSNNMDCSA-N Ser-Phe-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZKBKUWQVDWWSRI-BZSNNMDCSA-N 0.000 description 1
- ADJDNJCSPNFFPI-FXQIFTODSA-N Ser-Pro-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)CO ADJDNJCSPNFFPI-FXQIFTODSA-N 0.000 description 1
- PJIQEIFXZPCWOJ-FXQIFTODSA-N Ser-Pro-Asp Chemical compound [H]N[C@@H](CO)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CC(O)=O)C(O)=O PJIQEIFXZPCWOJ-FXQIFTODSA-N 0.000 description 1
- OVQZAFXWIWNYKA-GUBZILKMSA-N Ser-Pro-Met Chemical compound CSCC[C@@H](C(=O)O)NC(=O)[C@@H]1CCCN1C(=O)[C@H](CO)N OVQZAFXWIWNYKA-GUBZILKMSA-N 0.000 description 1
- HHJFMHQYEAAOBM-ZLUOBGJFSA-N Ser-Ser-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(O)=O HHJFMHQYEAAOBM-ZLUOBGJFSA-N 0.000 description 1
- WLJPJRGQRNCIQS-ZLUOBGJFSA-N Ser-Ser-Asn Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(O)=O WLJPJRGQRNCIQS-ZLUOBGJFSA-N 0.000 description 1
- XJDMUQCLVSCRSJ-VZFHVOOUSA-N Ser-Thr-Ala Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C)C(O)=O XJDMUQCLVSCRSJ-VZFHVOOUSA-N 0.000 description 1
- WUXCHQZLUHBSDJ-LKXGYXEUSA-N Ser-Thr-Asp Chemical compound OC[C@H](N)C(=O)N[C@@H]([C@H](O)C)C(=O)N[C@@H](CC(O)=O)C(O)=O WUXCHQZLUHBSDJ-LKXGYXEUSA-N 0.000 description 1
- ZKOKTQPHFMRSJP-YJRXYDGGSA-N Ser-Thr-Tyr Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O ZKOKTQPHFMRSJP-YJRXYDGGSA-N 0.000 description 1
- FGBLCMLXHRPVOF-IHRRRGAJSA-N Ser-Tyr-Arg Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O FGBLCMLXHRPVOF-IHRRRGAJSA-N 0.000 description 1
- UKKROEYWYIHWBD-ZKWXMUAHSA-N Ser-Val-Asp Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(O)=O)C(O)=O UKKROEYWYIHWBD-ZKWXMUAHSA-N 0.000 description 1
- LLSLRQOEAFCZLW-NRPADANISA-N Ser-Val-Gln Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O LLSLRQOEAFCZLW-NRPADANISA-N 0.000 description 1
- LGIMRDKGABDMBN-DCAQKATOSA-N Ser-Val-Lys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CCCCN)C(=O)O)NC(=O)[C@H](CO)N LGIMRDKGABDMBN-DCAQKATOSA-N 0.000 description 1
- HNDMFDBQXYZSRM-IHRRRGAJSA-N Ser-Val-Phe Chemical compound [H]N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O HNDMFDBQXYZSRM-IHRRRGAJSA-N 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 102100031081 Serine/threonine-protein kinase Chk1 Human genes 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 208000032383 Soft tissue cancer Diseases 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 208000010502 Subcutaneous panniculitis-like T-cell lymphoma Diseases 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 206010042553 Superficial spreading melanoma stage unspecified Diseases 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 208000000389 T-cell leukemia Diseases 0.000 description 1
- 208000028530 T-cell lymphoblastic leukemia/lymphoma Diseases 0.000 description 1
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 description 1
- 208000020982 T-lymphoblastic lymphoma Diseases 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- DWYAUVCQDTZIJI-VZFHVOOUSA-N Thr-Ala-Ser Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(O)=O DWYAUVCQDTZIJI-VZFHVOOUSA-N 0.000 description 1
- IRKWVRSEQFTGGV-VEVYYDQMSA-N Thr-Asn-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O IRKWVRSEQFTGGV-VEVYYDQMSA-N 0.000 description 1
- APIQKJYZDWVOCE-VEVYYDQMSA-N Thr-Asp-Met Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCSC)C(O)=O APIQKJYZDWVOCE-VEVYYDQMSA-N 0.000 description 1
- XDARBNMYXKUFOJ-GSSVUCPTSA-N Thr-Asp-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)O)C(O)=O XDARBNMYXKUFOJ-GSSVUCPTSA-N 0.000 description 1
- QILPDQCTQZDHFM-HJGDQZAQSA-N Thr-Gln-Arg Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O QILPDQCTQZDHFM-HJGDQZAQSA-N 0.000 description 1
- DIPIPFHFLPTCLK-LOKLDPHHSA-N Thr-Gln-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCC(=O)N)C(=O)N1CCC[C@@H]1C(=O)O)N)O DIPIPFHFLPTCLK-LOKLDPHHSA-N 0.000 description 1
- DKDHTRVDOUZZTP-IFFSRLJSSA-N Thr-Gln-Val Chemical compound CC(C)[C@H](NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)[C@@H](C)O)C(O)=O DKDHTRVDOUZZTP-IFFSRLJSSA-N 0.000 description 1
- JQAWYCUUFIMTHE-WLTAIBSBSA-N Thr-Gly-Tyr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O JQAWYCUUFIMTHE-WLTAIBSBSA-N 0.000 description 1
- PAXANSWUSVPFNK-IUKAMOBKSA-N Thr-Ile-Asn Chemical compound CC[C@H](C)[C@@H](C(=O)N[C@@H](CC(=O)N)C(=O)O)NC(=O)[C@H]([C@@H](C)O)N PAXANSWUSVPFNK-IUKAMOBKSA-N 0.000 description 1
- KZSYAEWQMJEGRZ-RHYQMDGZSA-N Thr-Leu-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(O)=O KZSYAEWQMJEGRZ-RHYQMDGZSA-N 0.000 description 1
- YJVJPJPHHFOVMG-VEVYYDQMSA-N Thr-Met-Asp Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(=O)O)C(=O)O)N)O YJVJPJPHHFOVMG-VEVYYDQMSA-N 0.000 description 1
- GUHLYMZJVXUIPO-RCWTZXSCSA-N Thr-Met-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](C(C)C)C(O)=O GUHLYMZJVXUIPO-RCWTZXSCSA-N 0.000 description 1
- HSQXHRIRJSFDOH-URLPEUOOSA-N Thr-Phe-Ile Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)N[C@@H]([C@@H](C)CC)C(O)=O HSQXHRIRJSFDOH-URLPEUOOSA-N 0.000 description 1
- VTMGKRABARCZAX-OSUNSFLBSA-N Thr-Pro-Ile Chemical compound CC[C@H](C)[C@@H](C(O)=O)NC(=O)[C@@H]1CCCN1C(=O)[C@@H](N)[C@@H](C)O VTMGKRABARCZAX-OSUNSFLBSA-N 0.000 description 1
- XHWCDRUPDNSDAZ-XKBZYTNZSA-N Thr-Ser-Glu Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(=O)O)C(=O)O)N)O XHWCDRUPDNSDAZ-XKBZYTNZSA-N 0.000 description 1
- IQPWNQRRAJHOKV-KATARQTJSA-N Thr-Ser-Lys Chemical compound C[C@@H](O)[C@H](N)C(=O)N[C@@H](CO)C(=O)N[C@H](C(O)=O)CCCCN IQPWNQRRAJHOKV-KATARQTJSA-N 0.000 description 1
- WPSKTVVMQCXPRO-BWBBJGPYSA-N Thr-Ser-Ser Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(O)=O WPSKTVVMQCXPRO-BWBBJGPYSA-N 0.000 description 1
- IEZVHOULSUULHD-XGEHTFHBSA-N Thr-Ser-Val Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](C(C)C)C(O)=O IEZVHOULSUULHD-XGEHTFHBSA-N 0.000 description 1
- LECUEEHKUFYOOV-ZJDVBMNYSA-N Thr-Thr-Val Chemical compound CC(C)[C@@H](C(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](N)[C@@H](C)O LECUEEHKUFYOOV-ZJDVBMNYSA-N 0.000 description 1
- VGNKUXWYFFDWDH-BEMMVCDISA-N Thr-Trp-Pro Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](CC1=CNC2=CC=CC=C21)C(=O)N3CCC[C@@H]3C(=O)O)N)O VGNKUXWYFFDWDH-BEMMVCDISA-N 0.000 description 1
- NJGMALCNYAMYCB-JRQIVUDYSA-N Thr-Tyr-Asn Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(O)=O NJGMALCNYAMYCB-JRQIVUDYSA-N 0.000 description 1
- AXEJRUGTOJPZKG-XGEHTFHBSA-N Thr-Val-Cys Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CS)C(=O)O)N)O AXEJRUGTOJPZKG-XGEHTFHBSA-N 0.000 description 1
- KZTLZZQTJMCGIP-ZJDVBMNYSA-N Thr-Val-Thr Chemical compound [H]N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H]([C@@H](C)O)C(O)=O KZTLZZQTJMCGIP-ZJDVBMNYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- 206010062129 Tongue neoplasm Diseases 0.000 description 1
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- DZIKVMCFXIIETR-JSGCOSHPSA-N Trp-Gly-Glu Chemical compound [H]N[C@@H](CC1=CNC2=C1C=CC=C2)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(O)=O DZIKVMCFXIIETR-JSGCOSHPSA-N 0.000 description 1
- JVTHMUDOKPQBOT-NSHDSACASA-N Trp-Gly-Gly Chemical compound C1=CC=C2C(C[C@H]([NH3+])C(=O)NCC(=O)NCC([O-])=O)=CNC2=C1 JVTHMUDOKPQBOT-NSHDSACASA-N 0.000 description 1
- YRXXUYPYPHRJPB-RXVVDRJESA-N Trp-Gly-Trp Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)NCC(=O)N[C@@H](CC3=CNC4=CC=CC=C43)C(=O)O)N YRXXUYPYPHRJPB-RXVVDRJESA-N 0.000 description 1
- KIMOCKLJBXHFIN-YLVFBTJISA-N Trp-Ile-Gly Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(O)=O)=CNC2=C1 KIMOCKLJBXHFIN-YLVFBTJISA-N 0.000 description 1
- UJRIVCPPPMYCNA-HOCLYGCPSA-N Trp-Leu-Gly Chemical compound CC(C)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CC1=CNC2=CC=CC=C21)N UJRIVCPPPMYCNA-HOCLYGCPSA-N 0.000 description 1
- YXSSXUIBUJGHJY-SFJXLCSZSA-N Trp-Thr-Phe Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)[C@H](O)C)C(O)=O)C1=CC=CC=C1 YXSSXUIBUJGHJY-SFJXLCSZSA-N 0.000 description 1
- UOXPLPBMEPLZBW-WDSOQIARSA-N Trp-Val-Lys Chemical compound C1=CC=C2C(C[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(O)=O)=CNC2=C1 UOXPLPBMEPLZBW-WDSOQIARSA-N 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 102100040113 Tumor necrosis factor receptor superfamily member 10A Human genes 0.000 description 1
- 102100040112 Tumor necrosis factor receptor superfamily member 10B Human genes 0.000 description 1
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 1
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 1
- 102100022203 Tumor necrosis factor receptor superfamily member 25 Human genes 0.000 description 1
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 1
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 description 1
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 description 1
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 description 1
- CDRYEAWHKJSGAF-BPNCWPANSA-N Tyr-Ala-Met Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](C)C(=O)N[C@@H](CCSC)C(O)=O CDRYEAWHKJSGAF-BPNCWPANSA-N 0.000 description 1
- VTFWAGGJDRSQFG-MELADBBJSA-N Tyr-Asn-Pro Chemical compound C1C[C@@H](N(C1)C(=O)[C@H](CC(=O)N)NC(=O)[C@H](CC2=CC=C(C=C2)O)N)C(=O)O VTFWAGGJDRSQFG-MELADBBJSA-N 0.000 description 1
- NSTPFWRAIDTNGH-BZSNNMDCSA-N Tyr-Asn-Tyr Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(O)=O NSTPFWRAIDTNGH-BZSNNMDCSA-N 0.000 description 1
- GAYLGYUVTDMLKC-UWJYBYFXSA-N Tyr-Asp-Ala Chemical compound OC(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](N)CC1=CC=C(O)C=C1 GAYLGYUVTDMLKC-UWJYBYFXSA-N 0.000 description 1
- BEIGSKUPTIFYRZ-SRVKXCTJSA-N Tyr-Asp-Asp Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC(=O)O)C(=O)N[C@@H](CC(=O)O)C(=O)O)N)O BEIGSKUPTIFYRZ-SRVKXCTJSA-N 0.000 description 1
- KCPFDGNYAMKZQP-KBPBESRZSA-N Tyr-Gly-Leu Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)NCC(=O)N[C@@H](CC(C)C)C(O)=O KCPFDGNYAMKZQP-KBPBESRZSA-N 0.000 description 1
- JHORGUYURUBVOM-KKUMJFAQSA-N Tyr-His-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CNC=N1)C(=O)N[C@@H](CO)C(O)=O JHORGUYURUBVOM-KKUMJFAQSA-N 0.000 description 1
- LMKKMCGTDANZTR-BZSNNMDCSA-N Tyr-Phe-Asp Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(O)=O)C(O)=O)C1=CC=C(O)C=C1 LMKKMCGTDANZTR-BZSNNMDCSA-N 0.000 description 1
- LDKDSFQSEUOCOO-RPTUDFQQSA-N Tyr-Thr-Phe Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC1=CC=CC=C1)C(O)=O LDKDSFQSEUOCOO-RPTUDFQQSA-N 0.000 description 1
- KLQPIEVIKOQRAW-IZPVPAKOSA-N Tyr-Thr-Thr Chemical compound C[C@H]([C@@H](C(=O)N[C@@H]([C@@H](C)O)C(=O)O)NC(=O)[C@H](CC1=CC=C(C=C1)O)N)O KLQPIEVIKOQRAW-IZPVPAKOSA-N 0.000 description 1
- NUQZCPSZHGIYTA-HKUYNNGSSA-N Tyr-Trp-Gly Chemical compound C1=CC=C2C(=C1)C(=CN2)C[C@@H](C(=O)NCC(=O)O)NC(=O)[C@H](CC3=CC=C(C=C3)O)N NUQZCPSZHGIYTA-HKUYNNGSSA-N 0.000 description 1
- ANHVRCNNGJMJNG-BZSNNMDCSA-N Tyr-Tyr-Cys Chemical compound C1=CC(=CC=C1C[C@@H](C(=O)N[C@@H](CC2=CC=C(C=C2)O)C(=O)N[C@@H](CS)C(=O)O)N)O ANHVRCNNGJMJNG-BZSNNMDCSA-N 0.000 description 1
- WYOBRXPIZVKNMF-IRXDYDNUSA-N Tyr-Tyr-Gly Chemical compound C([C@H](N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(O)=O)C1=CC=C(O)C=C1 WYOBRXPIZVKNMF-IRXDYDNUSA-N 0.000 description 1
- AGDDLOQMXUQPDY-BZSNNMDCSA-N Tyr-Tyr-Ser Chemical compound [H]N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CC1=CC=C(O)C=C1)C(=O)N[C@@H](CO)C(O)=O AGDDLOQMXUQPDY-BZSNNMDCSA-N 0.000 description 1
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 description 1
- 101150013568 US16 gene Proteins 0.000 description 1
- 208000023915 Ureteral Neoplasms Diseases 0.000 description 1
- 206010046392 Ureteric cancer Diseases 0.000 description 1
- 206010046431 Urethral cancer Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- COYSIHFOCOMGCF-UHFFFAOYSA-N Val-Arg-Gly Natural products CC(C)C(N)C(=O)NC(C(=O)NCC(O)=O)CCCN=C(N)N COYSIHFOCOMGCF-UHFFFAOYSA-N 0.000 description 1
- DLYOEFGPYTZVSP-AEJSXWLSSA-N Val-Cys-Pro Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CS)C(=O)N1CCC[C@@H]1C(=O)O)N DLYOEFGPYTZVSP-AEJSXWLSSA-N 0.000 description 1
- LAYSXAOGWHKNED-XPUUQOCRSA-N Val-Gly-Ser Chemical compound CC(C)[C@H](N)C(=O)NCC(=O)N[C@@H](CO)C(O)=O LAYSXAOGWHKNED-XPUUQOCRSA-N 0.000 description 1
- DAVNYIUELQBTAP-XUXIUFHCSA-N Val-Leu-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C(C)C)N DAVNYIUELQBTAP-XUXIUFHCSA-N 0.000 description 1
- CKTMJBPRVQWPHU-JSGCOSHPSA-N Val-Phe-Gly Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CC1=CC=CC=C1)C(=O)NCC(=O)O)N CKTMJBPRVQWPHU-JSGCOSHPSA-N 0.000 description 1
- AJNUKMZFHXUBMK-GUBZILKMSA-N Val-Ser-Arg Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCN=C(N)N)C(=O)O)N AJNUKMZFHXUBMK-GUBZILKMSA-N 0.000 description 1
- JQTYTBPCSOAZHI-FXQIFTODSA-N Val-Ser-Cys Chemical compound CC(C)[C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CS)C(=O)O)N JQTYTBPCSOAZHI-FXQIFTODSA-N 0.000 description 1
- PGQUDQYHWICSAB-NAKRPEOUSA-N Val-Ser-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)N PGQUDQYHWICSAB-NAKRPEOUSA-N 0.000 description 1
- VHIZXDZMTDVFGX-DCAQKATOSA-N Val-Ser-Leu Chemical compound CC(C)C[C@@H](C(=O)O)NC(=O)[C@H](CO)NC(=O)[C@H](C(C)C)N VHIZXDZMTDVFGX-DCAQKATOSA-N 0.000 description 1
- CEKSLIVSNNGOKH-KZVJFYERSA-N Val-Thr-Ala Chemical compound C[C@H]([C@@H](C(=O)N[C@@H](C)C(=O)O)NC(=O)[C@H](C(C)C)N)O CEKSLIVSNNGOKH-KZVJFYERSA-N 0.000 description 1
- YQYFYUSYEDNLSD-YEPSODPASA-N Val-Thr-Gly Chemical compound CC(C)[C@H](N)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(O)=O YQYFYUSYEDNLSD-YEPSODPASA-N 0.000 description 1
- WUFHZIRMAZZWRS-OSUNSFLBSA-N Val-Thr-Ile Chemical compound CC[C@H](C)[C@@H](C(=O)O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](C(C)C)N WUFHZIRMAZZWRS-OSUNSFLBSA-N 0.000 description 1
- VVIZITNVZUAEMI-DLOVCJGASA-N Val-Val-Gln Chemical compound CC(C)[C@H](N)C(=O)N[C@@H](C(C)C)C(=O)N[C@H](C(O)=O)CCC(N)=O VVIZITNVZUAEMI-DLOVCJGASA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- ZVNYJIZDIRKMBF-UHFFFAOYSA-N Vesnarinone Chemical compound C1=C(OC)C(OC)=CC=C1C(=O)N1CCN(C=2C=C3CCC(=O)NC3=CC=2)CC1 ZVNYJIZDIRKMBF-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- 208000000260 Warts Diseases 0.000 description 1
- 102100023037 Wee1-like protein kinase Human genes 0.000 description 1
- 208000008383 Wilms tumor Diseases 0.000 description 1
- 208000012018 Yolk sac tumor Diseases 0.000 description 1
- 108010081404 acein-2 Proteins 0.000 description 1
- 229960000583 acetic acid Drugs 0.000 description 1
- 208000009621 actinic keratosis Diseases 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- 208000002517 adenoid cystic carcinoma Diseases 0.000 description 1
- 201000001256 adenosarcoma Diseases 0.000 description 1
- 201000008395 adenosquamous carcinoma Diseases 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 238000001261 affinity purification Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- 108010084217 alanyl-glutamyl-aspartyl-glycine Proteins 0.000 description 1
- 108010076324 alanyl-glycyl-glycine Proteins 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000004178 amaranth Substances 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- 201000007696 anal canal cancer Diseases 0.000 description 1
- 206010002449 angioimmunoblastic T-cell lymphoma Diseases 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 108010089975 arginyl-glycyl-aspartyl-serine Proteins 0.000 description 1
- 108010069926 arginyl-glycyl-serine Proteins 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 108010040443 aspartyl-aspartic acid Proteins 0.000 description 1
- 108010038633 aspartylglutamate Proteins 0.000 description 1
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 208000029336 bartholin gland carcinoma Diseases 0.000 description 1
- 230000033590 base-excision repair Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 229940092714 benzenesulfonic acid Drugs 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000997 bicalutamide Drugs 0.000 description 1
- 201000009036 biliary tract cancer Diseases 0.000 description 1
- 208000020790 biliary tract neoplasm Diseases 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 210000001754 blood buffy coat Anatomy 0.000 description 1
- 230000036765 blood level Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 201000006491 bone marrow cancer Diseases 0.000 description 1
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 229960002115 carboquone Drugs 0.000 description 1
- 208000002458 carcinoid tumor Diseases 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 238000000423 cell based assay Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- SBNPWPIBESPSIF-MHWMIDJBSA-N cetrorelix Chemical compound C([C@@H](C(=O)N[C@H](CCCNC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 SBNPWPIBESPSIF-MHWMIDJBSA-N 0.000 description 1
- 229960003230 cetrorelix Drugs 0.000 description 1
- 108700008462 cetrorelix Proteins 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 208000006571 choroid plexus carcinoma Diseases 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 208000009060 clear cell adenocarcinoma Diseases 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 201000010918 connective tissue cancer Diseases 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- 108010060199 cysteinylproline Proteins 0.000 description 1
- 108010069495 cysteinyltyrosine Proteins 0.000 description 1
- 230000001461 cytolytic effect Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000009615 deamination Effects 0.000 description 1
- 238000006481 deamination reaction Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 238000011118 depth filtration Methods 0.000 description 1
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 1
- 208000024558 digestive system cancer Diseases 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 230000003467 diminishing effect Effects 0.000 description 1
- 108010054812 diprotin A Proteins 0.000 description 1
- 108010054813 diprotin B Proteins 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000013583 drug formulation Substances 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 201000000312 duodenum cancer Diseases 0.000 description 1
- 239000000806 elastomer Substances 0.000 description 1
- 210000000750 endocrine system Anatomy 0.000 description 1
- 208000001991 endodermal sinus tumor Diseases 0.000 description 1
- 201000003908 endometrial adenocarcinoma Diseases 0.000 description 1
- 210000005168 endometrial cell Anatomy 0.000 description 1
- 201000006828 endometrial hyperplasia Diseases 0.000 description 1
- 201000000330 endometrial stromal sarcoma Diseases 0.000 description 1
- 208000028730 endometrioid adenocarcinoma Diseases 0.000 description 1
- 208000029179 endometrioid stromal sarcoma Diseases 0.000 description 1
- 229950011487 enocitabine Drugs 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 229950002973 epitiostanol Drugs 0.000 description 1
- GOZRRIWDZQPGMN-UHFFFAOYSA-N ethyl 2-[5-(7h-purin-6-ylsulfanyl)pentanoylamino]acetate Chemical compound CCOC(=O)CNC(=O)CCCCSC1=NC=NC2=C1NC=N2 GOZRRIWDZQPGMN-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 229960002199 etretinate Drugs 0.000 description 1
- HQMNCQVAMBCHCO-DJRRULDNSA-N etretinate Chemical compound CCOC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)C=C(OC)C(C)=C1C HQMNCQVAMBCHCO-DJRRULDNSA-N 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 238000013213 extrapolation Methods 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 210000000285 follicular dendritic cell Anatomy 0.000 description 1
- 201000003444 follicular lymphoma Diseases 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 229960004783 fotemustine Drugs 0.000 description 1
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 201000011555 gastric fundus cancer Diseases 0.000 description 1
- 208000015419 gastrin-producing neuroendocrine tumor Diseases 0.000 description 1
- 201000000052 gastrinoma Diseases 0.000 description 1
- 201000010231 gastrointestinal system cancer Diseases 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 108010057083 glutamyl-aspartyl-leucine Proteins 0.000 description 1
- 108010072405 glycyl-aspartyl-glycine Proteins 0.000 description 1
- 108010026364 glycyl-glycyl-leucine Proteins 0.000 description 1
- 108010078326 glycyl-glycyl-valine Proteins 0.000 description 1
- 108010028188 glycyl-histidyl-serine Proteins 0.000 description 1
- 108010079413 glycyl-prolyl-glutamic acid Proteins 0.000 description 1
- 108010082286 glycyl-seryl-alanine Proteins 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 201000009277 hairy cell leukemia Diseases 0.000 description 1
- 230000005802 health problem Effects 0.000 description 1
- 201000010235 heart cancer Diseases 0.000 description 1
- 208000024348 heart neoplasm Diseases 0.000 description 1
- 201000002222 hemangioblastoma Diseases 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 201000005787 hematologic cancer Diseases 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 108010040030 histidinoalanine Proteins 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 238000000265 homogenisation Methods 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 1
- 229960001101 ifosfamide Drugs 0.000 description 1
- 201000002312 ileal neoplasm Diseases 0.000 description 1
- 238000010191 image analysis Methods 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- DBIGHPPNXATHOF-UHFFFAOYSA-N improsulfan Chemical compound CS(=O)(=O)OCCCNCCCOS(C)(=O)=O DBIGHPPNXATHOF-UHFFFAOYSA-N 0.000 description 1
- 229950008097 improsulfan Drugs 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000003331 infrared imaging Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 206010022498 insulinoma Diseases 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000010212 intracellular staining Methods 0.000 description 1
- 208000020082 intraepithelial neoplasia Diseases 0.000 description 1
- 201000007450 intrahepatic cholangiocarcinoma Diseases 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 230000002262 irrigation Effects 0.000 description 1
- 238000003973 irrigation Methods 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 108010044374 isoleucyl-tyrosine Proteins 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 229960005280 isotretinoin Drugs 0.000 description 1
- 201000003856 jejunal cancer Diseases 0.000 description 1
- 201000009592 jejunal neoplasm Diseases 0.000 description 1
- FPCCSQOGAWCVBH-UHFFFAOYSA-N ketanserin Chemical compound C1=CC(F)=CC=C1C(=O)C1CCN(CCN2C(C3=CC=CC=C3NC2=O)=O)CC1 FPCCSQOGAWCVBH-UHFFFAOYSA-N 0.000 description 1
- 229960005417 ketanserin Drugs 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 201000011061 large intestine cancer Diseases 0.000 description 1
- 206010023841 laryngeal neoplasm Diseases 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- 108010076756 leucyl-alanyl-phenylalanine Proteins 0.000 description 1
- 108010000761 leucylarginine Proteins 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229960003587 lisuride Drugs 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000000014 lung giant cell carcinoma Diseases 0.000 description 1
- 201000000966 lung oat cell carcinoma Diseases 0.000 description 1
- 201000007919 lymphoplasmacytic lymphoma Diseases 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 108010009298 lysylglutamic acid Proteins 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 201000005831 male reproductive organ cancer Diseases 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 208000030883 malignant astrocytoma Diseases 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000006178 malignant mesothelioma Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 208000022006 malignant tumor of meninges Diseases 0.000 description 1
- 208000016847 malignant urinary system neoplasm Diseases 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 201000008203 medulloepithelioma Diseases 0.000 description 1
- 208000011645 metastatic carcinoma Diseases 0.000 description 1
- 206010061289 metastatic neoplasm Diseases 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- VFKZTMPDYBFSTM-GUCUJZIJSA-N mitolactol Chemical compound BrC[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-GUCUJZIJSA-N 0.000 description 1
- 229950010913 mitolactol Drugs 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000012434 mixed-mode chromatography Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 201000002077 muscle cancer Diseases 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 208000037830 nasal cancer Diseases 0.000 description 1
- 229950007221 nedaplatin Drugs 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 201000008026 nephroblastoma Diseases 0.000 description 1
- 201000011682 nervous system cancer Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- 229950008607 nitracrine Drugs 0.000 description 1
- YMVWGSQGCWCDGW-UHFFFAOYSA-N nitracrine Chemical compound C1=CC([N+]([O-])=O)=C2C(NCCCN(C)C)=C(C=CC=C3)C3=NC2=C1 YMVWGSQGCWCDGW-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 201000000032 nodular malignant melanoma Diseases 0.000 description 1
- 231100000065 noncytotoxic Toxicity 0.000 description 1
- 230000002020 noncytotoxic effect Effects 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 210000004248 oligodendroglia Anatomy 0.000 description 1
- 201000000890 orbital cancer Diseases 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- ICMWWNHDUZJFDW-UHFFFAOYSA-N oxymetholone Natural products C1CC2CC(=O)C(=CO)CC2(C)C2C1C1CCC(C)(O)C1(C)CC2 ICMWWNHDUZJFDW-UHFFFAOYSA-N 0.000 description 1
- ICMWWNHDUZJFDW-DHODBPELSA-N oxymetholone Chemical compound C([C@@H]1CC2)C(=O)\C(=C/O)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@](C)(O)[C@@]2(C)CC1 ICMWWNHDUZJFDW-DHODBPELSA-N 0.000 description 1
- 229960005244 oxymetholone Drugs 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 208000021255 pancreatic insulinoma Diseases 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 201000005163 papillary serous adenocarcinoma Diseases 0.000 description 1
- 208000024641 papillary serous cystadenocarcinoma Diseases 0.000 description 1
- 201000007052 paranasal sinus cancer Diseases 0.000 description 1
- 201000001219 parotid gland cancer Diseases 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229960002340 pentostatin Drugs 0.000 description 1
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 1
- 229930192851 perforin Natural products 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 230000002974 pharmacogenomic effect Effects 0.000 description 1
- DYUMLJSJISTVPV-UHFFFAOYSA-N phenyl propanoate Chemical compound CCC(=O)OC1=CC=CC=C1 DYUMLJSJISTVPV-UHFFFAOYSA-N 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 108010012581 phenylalanylglutamate Proteins 0.000 description 1
- 239000002935 phosphatidylinositol 3 kinase inhibitor Substances 0.000 description 1
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 210000003635 pituitary gland Anatomy 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001993 poloxamer 188 Polymers 0.000 description 1
- 229940044519 poloxamer 188 Drugs 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 229940068977 polysorbate 20 Drugs 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 229960004694 prednimustine Drugs 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 201000006037 primary mediastinal B-cell lymphoma Diseases 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 229960003857 proglumide Drugs 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108010031719 prolyl-serine Proteins 0.000 description 1
- 108010015796 prolylisoleucine Proteins 0.000 description 1
- 108010090894 prolylleucine Proteins 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 239000003207 proteasome inhibitor Substances 0.000 description 1
- 210000004203 pyloric antrum Anatomy 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 1
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 201000007416 salivary gland adenoid cystic carcinoma Diseases 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 230000008313 sensitization Effects 0.000 description 1
- 208000004548 serous cystadenocarcinoma Diseases 0.000 description 1
- 108010026333 seryl-proline Proteins 0.000 description 1
- 108010071207 serylmethionine Proteins 0.000 description 1
- 201000010153 skin papilloma Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 201000000267 smooth muscle cancer Diseases 0.000 description 1
- 230000008410 smoothened signaling pathway Effects 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 229960002668 sodium chloride Drugs 0.000 description 1
- 239000008354 sodium chloride injection Substances 0.000 description 1
- 229940074404 sodium succinate Drugs 0.000 description 1
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 1
- WZWGGYFEOBVNLA-UHFFFAOYSA-N sodium;dihydrate Chemical compound O.O.[Na] WZWGGYFEOBVNLA-UHFFFAOYSA-N 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 201000011096 spinal cancer Diseases 0.000 description 1
- 208000014618 spinal cord cancer Diseases 0.000 description 1
- 206010062113 splenic marginal zone lymphoma Diseases 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 208000030457 superficial spreading melanoma Diseases 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229960001367 tartaric acid Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 230000004797 therapeutic response Effects 0.000 description 1
- 108010033670 threonyl-aspartyl-tyrosine Proteins 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 201000006134 tongue cancer Diseases 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 108010084932 tryptophyl-proline Proteins 0.000 description 1
- 230000005909 tumor killing Effects 0.000 description 1
- 230000006433 tumor necrosis factor production Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- 208000010576 undifferentiated carcinoma Diseases 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 201000004435 urinary system cancer Diseases 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 208000008662 verrucous carcinoma Diseases 0.000 description 1
- 229950005577 vesnarinone Drugs 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2851—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the lectin superfamily, e.g. CD23, CD72
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/283—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against Fc-receptors, e.g. CD16, CD32, CD64
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/80—Vaccine for a specifically defined cancer
- A61K2039/804—Blood cells [leukemia, lymphoma]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/524—CH2 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/53—Hinge
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/71—Decreased effector function due to an Fc-modification
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/30—Non-immunoglobulin-derived peptide or protein having an immunoglobulin constant or Fc region, or a fragment thereof, attached thereto
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Epidemiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Prostheses (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
HER2, NKG2D 수용체, 및 CD16에 결합하는 다중-특이적 결합 단백질, 뿐만 아니라 암의 치료에 유용한 제약 조성물 및 치료 방법이 기재된다.
Description
관련 출원의 상호 참고
본 출원은 2017년 2월 20일에 출원한 미국 가특허 출원 번호 62/461,146을 우선권으로 주장하며, 그의 전체 내용은 모든 목적을 위해 본원에 참고로 포함된다.
서열 목록
본 출원은 ASCII 포맷으로 전자적으로 제출된 서열 목록을 포함하며, 이는 그의 전문이 본원에 참고로 포함된다. 2018년 2월 16일에 생성된 상기 ASCII 사본은 DFY-008PC_SL.txt로 명명되고, 92,807 바이트의 크기를 갖는다.
본 발명의 분야
본 발명은 인간 표피 성장 인자 수용체 2 (HER2 또는 ErbB2), NKG2D 수용체, 및 CD16에 결합하는 다중-특이적 결합 단백질에 관한 것이다.
암의 치료를 위해 문헌에서 보고된 실질적인 연구 노력 및 과학적 진보에도 불구하고 상기 질환은 계속해서 상당한 건강 문제이다. 가장 흔히 진단되는 일부 암에는 전립선암, 유방암 및 폐암이 포함된다. 전립선암은 남성에서 가장 흔한 형태의 암이다. 유방암은 여성에서 주된 사망 원인이다. 이들 암에 대한 현재의 치료 옵션은 모든 환자에 대해 효과적이지 않고/거나 실질적인 부작용을 가질 수 있다. 다른 유형의 암 또한 기존 치료 옵션을 이용하여 치료하기가 여전히 힘들다.
암 면역요법은 고도로 특이적이고 환자 자신의 면역계를 이용하여 암 세포의 파괴를 용이하게 할 수 있기 때문에 바람직하다. 융합 단백질, 예컨대 이중-특이적 T-세포 결속체는 종양 세포 및 T-세포에 결합하여 종양 세포의 파괴를 용이하게 하는, 문헌에 기재된 암 면역요법이다. 특정 종양-연관 항원 및 특정 면역 세포에 결합하는 항체는 문헌에 기재되어 있다. 예를 들어, WO 2016/134371 및 WO 2015/095412를 참고한다.
천연 킬러 (NK) 세포는 선천성 면역계의 성분이고, 순환 림프구의 대략 15%를 구성한다. NK 세포는 사실상 모든 조직에 침투하며, 원래 사전 민감화에 대한 필요없이 효과적으로 종양 세포를 사멸시키는 능력을 특징으로 하였다. 활성화된 NK 세포는 세포독성 T 세포와 유사한 수단에 의해 - 즉, 퍼포린 및 그랜자임을 함유하는 세포용해성 과립을 통해서, 뿐만 아니라 사멸 수용체 경로를 통해서 표적 세포를 사멸시킨다. 활성화된 NK 세포는 또한 표적 조직으로 다른 백혈구의 동원을 촉진시키는 염증성 시토카인, 예컨대 IFN-γ 및 케모카인을 분비한다.
NK 세포는 그들의 표면 상의 다양한 활성화 및 억제 수용체를 통해 신호에 반응한다. 예를 들어, NK 세포가 건강한 자가-세포와 직면할 때, 그들의 활성은 킬러-세포 이뮤노글로불린-유사 수용체 (KIR)의 활성화를 통해 억제된다. 대안적으로, NK 세포가 외래 세포 또는 암 세포와 직면할 때, 이들은 그들의 활성화 수용체 (예를 들어, NKG2D, NCR, DNAM1)를 통해 활성화된다. NK 세포는 또한 그들의 표면 상의 CD16 수용체를 통해 일부 이뮤노글로불린의 불변 영역에 의해 활성화된다. 활성화에 대한 NK 세포의 전반적인 민감도는 자극 및 억제 신호의 합에 따라 좌우된다.
HER2 (ErbB2)는 표피 성장 인자 수용체 패밀리에 속하는 막경유 당단백질이다. 이는 수용체 티로신 키나제이며, 세포 생존, 증식 및 성장을 조절한다. HER2는 인간 악성 종양에서 중요한 역할을 한다. erbB2 유전자는 인간 유방암에서 대략 30%로 증폭되거나 과발현된다. HER2-과발현 유방암을 가진 환자는 암이 HER2를 과발현하지 않는 환자에 비해 실질적으로 보다 낮은 전체 생존율 및 보다 짧은 무병 기간을 갖는다. 더욱이, HER2의 과발현은 증가된 유방암 전이를 유도한다. HER2의 과발현은 또한 여러 다른 암 유형, 예컨대 유방암, 난소암, 식도암, 방광암 및 위암, 타액관 암종, 폐의 선암종 및 공격적인 형태의 자궁암, 예컨대 자궁 장액성 자궁내막 암종에서 발생하는 것으로 공지되어 있다.
본 발명은 암 세포 상의 HER2 및 천연 킬러 세포 상의 NKG2D 수용체 및 CD16 수용체에 결합하는 다중-특이적 결합 단백질을 제공한다. 이러한 단백질은 1종 초과의 NK 활성화 수용체에 결속할 수 있고, NKG2D에 대한 천연 리간드의 결합을 차단할 수 있다. 특정 실시양태에서, 상기 단백질은 인간에서, 및 다른 종, 예컨대 설치류 및 시노몰구스 원숭이에서 NK 세포를 효능화시킬 수 있다. 본 발명의 다양한 측면 및 실시양태는 하기에 더욱 상세하게 기재된다.
따라서, 본 발명의 한 측면은 NKG2D에 결합하는 제1 항원-결합 부위; HER2에 결합하는 제2 항원-결합 부위; 및 CD16에 결합하기에 충분한 항체 Fc 도메인, 그의 부분, 또는 CD16에 결합하는 제3 항원-결합 부위를 포함하는 단백질을 제공한다. 항원-결합 부위는 각각 항체 중쇄 가변 도메인 및 항체 경쇄 가변 도메인 (예를 들어, 항체에서와 같이 배열되거나, 또는 함께 융합되어 scFv를 형성함)을 포함할 수 있거나, 또는 항원-결합 부위 중 하나 이상은 단일 도메인 항체, 예컨대 VHH 항체, 예컨대 낙타과 항체 또는 VNAR 항체, 예컨대 연골 어류에서 발견되는 것들일 수 있다.
한 실시양태에서, NKG2D에 결합하는 제1 항원-결합 부위는, 예컨대 SEQ ID NO:1과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일한 아미노산 서열을 갖고/거나 SEQ ID NO:1의 CDR1 (SEQ ID NO:62), CDR2 (SEQ ID NO:63) 및 CDR3 (SEQ ID NO:64) 서열과 동일한 아미노산 서열을 포함함으로써, SEQ ID NO:1과 관련된 중쇄 가변 도메인을 포함할 수 있다. 대안적으로, 제1 항원-결합 부위는 SEQ ID NO:41과 관련된 중쇄 가변 도메인 및 SEQ ID NO:42와 관련된 경쇄 가변 도메인을 포함할 수 있다. 예를 들어, 제1 항원 결합 부위의 중쇄 가변 도메인은 SEQ ID NO:41과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:41의 CDR1 (SEQ ID NO:65), CDR2 (SEQ ID NO:66) 및 CDR3 (SEQ ID NO:67) 서열과 동일한 아미노산 서열을 포함할 수 있다. 유사하게, 제2 항원-결합 부위의 경쇄 가변 도메인은 SEQ ID NO:42와 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:42의 CDR1 (SEQ ID NO:68), CDR2 (SEQ ID NO:69) 및 CDR3 (SEQ ID NO:70) 서열과 동일한 아미노산 서열을 포함할 수 있다. 다른 실시양태에서, 제1 항원-결합 부위는 SEQ ID NO:43과 관련된 중쇄 가변 도메인 및 SEQ ID NO:44와 관련된 경쇄 가변 도메인을 포함할 수 있다. 예를 들어, 제1 항원-결합 부위의 중쇄 가변 도메인은 SEQ ID NO:43과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:43의 CDR1 (SEQ ID NO:71), CDR2 (SEQ ID NO:72) 및 CDR3 (SEQ ID NO:73) 서열과 동일한 아미노산 서열을 포함할 수 있다. 유사하게, 제2 항원-결합 부위의 경쇄 가변 도메인은 SEQ ID NO:44와 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:44의 CDR1 (SEQ ID NO:74), CDR2 (SEQ ID NO:75) 및 CDR3 (SEQ ID NO:76) 서열과 동일한 아미노산 서열을 포함할 수 있다.
대안적으로, 제1 항원-결합 부위는, 예컨대 SEQ ID NO:45와 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일한 및 SEQ ID NO:46과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일한 아미노산 서열을 각각 가짐으로써, SEQ ID NO:45와 관련된 중쇄 가변 도메인 및 SEQ ID NO:46과 관련된 경쇄 가변 도메인을 포함할 수 있다. 또 다른 실시양태에서, 제1 항원-결합 부위는, 예컨대 SEQ ID NO:47과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일한 및 SEQ ID NO:48과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일한 아미노산 서열을 각각 가짐으로써, SEQ ID NO:47과 관련된 중쇄 가변 도메인 및 SEQ ID NO:48과 관련된 경쇄 가변 도메인을 포함할 수 있다.
제2 항원-결합 부위는 임의적으로 SEQ ID NO:49와 관련된 중쇄 가변 도메인 및 SEQ ID NO:53과 관련된 경쇄 가변 도메인을 포함할 수 있다. 예를 들어, 제2 항원-결합 부위의 중쇄 가변 도메인은 SEQ ID NO:49와 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:49의 CDR1 (SEQ ID NO:50), CDR2 (SEQ ID NO:51) 및 CDR3 (SEQ ID NO:52) 서열과 동일한 아미노산 서열을 포함할 수 있다. 유사하게, 제2 항원-결합 부위의 경쇄 가변 도메인은 SEQ ID NO:53과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:53의 CDR1 (SEQ ID NO:54), CDR2 (SEQ ID NO:55) 및 CDR3 (SEQ ID NO:56) 서열과 동일한 아미노산 서열을 포함할 수 있다.
대안적으로, 제2 항원-결합 부위는 SEQ ID NO:57과 관련된 중쇄 가변 도메인 및 SEQ ID NO:58과 관련된 경쇄 가변 도메인을 포함할 수 있다. 예를 들어, 제2 항원-결합 부위의 중쇄 가변 도메인은 SEQ ID NO:57과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:57의 CDR1 (SEQ ID NO:77), CDR2 (SEQ ID NO:78) 및 CDR3 (SEQ ID NO:79) 서열과 동일한 아미노산 서열을 포함할 수 있다. 유사하게, 제2 항원-결합 부위의 경쇄 가변 도메인은 SEQ ID NO:58과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:58의 CDR1 (SEQ ID NO:80), CDR2 (SEQ ID NO:81) 및 CDR3 (SEQ ID NO:82) 서열과 동일한 아미노산 서열을 포함할 수 있다.
또 다른 실시양태에서, 제2 항원-결합 부위는 SEQ ID NO:59와 관련된 중쇄 가변 도메인 및 SEQ ID NO:60과 관련된 경쇄 가변 도메인을 포함할 수 있다. 예를 들어, 제2 항원-결합 부위의 중쇄 가변 도메인은 SEQ ID NO:59와 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:59의 CDR1 (SEQ ID NO:83), CDR2 (SEQ ID NO:84) 및 CDR3 (SEQ ID NO:85) 서열과 동일한 아미노산 서열을 포함할 수 있다. 유사하게, 제2 항원-결합 부위의 경쇄 가변 도메인은 SEQ ID NO:60과 적어도 90% (예를 들어, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% 또는 100%) 동일할 수 있고/거나, SEQ ID NO:60의 CDR1 (SEQ ID NO:86), CDR2 (SEQ ID NO:87) 및 CDR3 (SEQ ID NO:88) 서열과 동일한 아미노산 서열을 포함할 수 있다.
일부 실시양태에서, 제2 항원-결합 부위는 제1 항원-결합 부위에 존재하는 경쇄 가변 도메인의 아미노산 서열과 동일한 아미노산 서열을 갖는 경쇄 가변 도메인을 포함한다.
일부 실시양태에서, 상기 단백질은 CD16에 결합하기에 충분한 항체 Fc 도메인의 부분을 포함하며, 상기 항체 Fc 도메인은 힌지 및 CH2 도메인, 및/또는 인간 IgG 항체의 아미노산 서열 234-332와 적어도 90% 동일한 아미노산 서열을 포함한다.
이들 단백질 중 하나를 함유하는 제형; 이들 단백질을 발현하는 하나 이상의 핵산을 함유하는 세포, 및 이들 단백질을 사용하여 종양 세포 사멸을 증진시키는 방법이 제공된다.
본 발명의 또 다른 측면은 환자에서 암을 치료하는 방법에 관한 것이다. 상기 방법은 암의 치료를 필요로 하는 환자에게 본원에 기재된 다중-특이적 결합 단백질의 치료 유효량을 투여하는 것을 포함한다. 다중-특이적 결합 단백질을 이용하여 치료하기 위한 예시적인 암에는 예를 들어 유방암, 난소암, 식도암, 방광암 및 위암, 타액관 암종, 폐의 선암종 및 공격적인 형태의 자궁암, 예컨대 자궁 장액성 자궁내막 암종이 포함된다.
도 1은 NKG2D-결합 도메인 (우측 아암), 종양 연관 항원-결합 도메인 (좌측 아암), 및 CD16에 결합하는 Fc 도메인 또는 그의 부분을 함유하는 다중-특이적 결합 단백질의 대표도이다.
도 2는 scFv 포맷의 NKG2D-결합 도메인 (우측 아암), 종양 연관 항원-결합 도메인 (좌측 아암), 및 CD16에 결합하는 Fc 도메인 또는 그의 부분을 함유하는 다중-특이적 결합 단백질의 대표도이다.
도 3은 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 인간 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 4는 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 시노몰구스 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 5는 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 마우스 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 6은 유동 세포분석법에 의해 NKG2D-결합 도메인 (클론으로 열거됨)과 인간 NKG2D를 발현하는 EL4 세포의 결합을 입증하는 막대 그래프이며, 백그라운드 대비 평균 형광 강도 (MFI) 배수를 제시한다.
도 7은 유동 세포분석법에 의해 NKG2D-결합 도메인 (클론으로 열거됨)과 마우스 NKG2D를 발현하는 EL4 세포의 결합을 입증하는 막대 그래프이며, 백그라운드 대비 평균 형광 강도 (MFI) 배수를 제시한다.
도 8은 천연 리간드 ULBP-6과 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 인간 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 9는 천연 리간드 MICA와 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 인간 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 10은 천연 리간드 Rae-1 델타와 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 마우스 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 11은 인간 NKG2D-CD3 제타 융합 단백질을 발현하는 TNFα-양성 세포의 백분율을 정량화함으로써 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NKG2D의 활성화를 제시하는 막대 그래프이다.
도 12는 마우스 NKG2D-CD3 제타 융합 단백질을 발현하는 TNFα-양성 세포의 백분율을 정량화함으로써 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NKG2D의 활성화를 제시하는 막대 그래프이다.
도 13은 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 14는 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 15는 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 16은 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 17은 종양 세포에 대한 NKG2D-결합 도메인 (클론으로 열거됨)의 세포독성 효과를 제시하는 막대 그래프이다.
도 18은 시차 주사 형광측정법에 의해 측정되는 NKG2D-결합 도메인 (클론으로 열거됨)의 융점을 제시하는 막대 그래프이다.
도 19는 다중-특이적 결합 단백질에 의한 인간 NK 세포의 증진된 활성화를 제시하는 그래프이다.
도 20은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 21은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 22는 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 23은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 24는 다중-특이적 결합 단백질이 마우스 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 25는 다중-특이적 결합 단백질이 마우스 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 26은 EL4 세포 상에서 발현된 NKG2D에 대한 HER2-표적화 TriNKET의 결합 프로파일이다. 도 26은 이제 HER2 제2 표적화 아암과 쌍을 형성한 동일한 2개의 NKG2D-결합 도메인을 나타낸다.
도 27a는 인간 786-O 신세포 암종 세포 상에서 발현된 HER2에 대한 HER2-표적화 TriNKET의 결합 프로파일이고; 도 27b는 TriNKET를 함유하는 NKG2D 결합 클론 C26이 인간 HER2에 의해 형질도입된 RMA 세포에 결합함을 제시하고; 도 27c는 TriNKET를 함유하는 NKG2D 결합 클론 F04가 인간 HER2에 의해 형질도입된 RMA 세포에 결합함을 제시한다.
도 28a - 28c는 CD107a 탈과립화 및 IFNγ 시토카인 생산에서의 증가에 의해 나타나는 바와 같이 TriNKET 및 트라스투주맙이 HER2-양성 인간 종양 세포와의 공동-배양에서 일차 인간 NK 세포를 활성화시킬 수 있음을 입증하는 막대 그래프이다. 모노클로날 항체 트라스투주맙과 비교하면, 두 TriNKET 모두 다양한 인간 HER2 암 세포에 의해 인간 NK 세포의 우수한 활성화를 나타내었다. 도 28a는 인간 NK 세포가 SkBr-3 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28b는 인간 NK 세포가 Colo201 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28c는 인간 NK 세포가 HCC1954 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다.
도 29a-29b는 TriNKET가 트라스투주맙에 비해 HER2 중간 및 낮은 암에 대해 보다 양호한 이점을 제공한다는 것을 입증하는 그래프이다. 도 29a는 HER2 높은-SkBr-3 종양 세포의 활성화된 인간 NK 세포 사멸을 제시한다. 도 29b는 HER2 낮은-786-O 종양 세포의 인간 NK 세포 사멸을 제시한다. TriNKET는 낮은 HER2 발현을 갖는 암 세포에 대해 트라스투주맙에 비해 더 큰 이점을 제공한다.
도 30a-30c는 CD16 및 NKG2D를 사용하는 NK 세포의 상승작용적 활성화의 막대 그래프이다. 도 30a는 CD107a의 수준을 입증하고; 도 30b는 IFNγ의 수준을 입증하고; 도 30c는 CD107a 및 IFNγ의 수준을 입증한다. 그래프는 평균 (n = 2) ±SD를 나타낸다. 데이터는 5명의 상이한 건강한 공여자를 이용하는 5회의 독립적인 실험을 대표한다.
도 31은 NKG2D 및 CD16을 표적으로 하는 TriNKET를 사용하여 NK 세포의 활성화의 막대 그래프이다. 시험한 항체는 인간 IgG1 이소타입이었다. 그래프는 평균 (n = 2) ± SD를 나타낸다.
도 32a - 32c는 IL-2-활성화된 및 휴지된 인간 NK 세포를 사용하여 세포독성 활성의 TriNKET 증진을 입증하는 그래프이다. 도 32a는 휴지된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. 도 32b는 IL-2-활성화된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. 도 32c는 IL-2-활성화된 인간 NK 세포에 의한 NCI-H661 폐암 세포의 특이적 용해 백분율을 제시한다.
도 33a & 33b는 건강한 공여자로부터의 B 세포가 TriNKET-매개된 용해에 민감성임을 제시하는 막대 그래프이다. 도 33c & 33d는 골수 세포가 TriNKET-매개된 용해에 저항성임을 제시하는 막대 그래프이다.
도 34는 장기간 공동-배양에서 SkBr-3 종양 세포의 TriNKET-매개된 hPBMC 사멸의 선 그래프이다.
도 35는 하나의 분자에서 삼중-특이적 결합이 최대 NK 세포 활성을 위해 중요함을 제시하는 선 그래프이다.
도 36은 RMA/S-HER2 피하 SC2.2 효능의 연구 설계의 흐름도이다.
도 37은 SC2.2가 피하 RMA/S-HER2 종양 성장에 대해 효과가 없음을 제시하는 선 그래프이다.
도 38a는 HER2-TriNKET-C26이 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시한다. 도 38b는 HER2-TriNKET-F04가 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시한다. 점선은 이소타입 대조군을 나타낸다. 채워지지 않은 실선은 비염색 대조군을 나타낸다. 채워진 실선은 TriNKET를 나타낸다.
도 39는 트리오맙 형태의 TriNKET의 대표도이며, 이는 IgG-유사 형태를 유지하는 삼관능성의 이중특이적 항체이다. 이 키메라는 2가지 모 항체로부터 유래된 2개의 절반 항체로 이루어지고, 이들 각각은 1개의 경쇄 및 1개의 중쇄를 갖는다. 트리오맙 형태는 ½의 래트 항체 및 ½의 마우스 항체를 함유하는 이종이량체성 구축물일 수 있다.
도 40은 KiH 공통 경쇄 (LC) 형태의 TriNKET의 대표도이며, 이는 놉-인투-홀 (knobs-into-holes, KIH) 기술과 관련이 있다. KiH는 표적 1 및 2에 결합하는 2개의 Fab 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다. KiH 포맷의 TriNKET는 2개의 상이한 중쇄, 및 두 중쇄 모두와 쌍을 형성한 공통 경쇄를 함유하는, 표적 1 및 표적 2에 결합하는 2개의 fab를 갖는 이종이량체성 구축물일 수 있다.
도 41은 이중-가변 도메인 이뮤노글로불린 (DVD-Ig™) 형태의 TriNKET의 대표도이며, 이는 가요성 천연 발생 링커를 통해 2개의 모노클로날 항체의 표적 결합 도메인을 조합하고, 4가 IgG-유사 분자를 생성한다. DVD-Ig™는 항원 2를 표적으로 하는 가변 도메인이 항원 1을 표적으로 하는 Fab의 가변 도메인의 N 말단에 융합된 동종이량체성 구축물이고, 상기 구축물은 정상 Fc를 함유한다.
도 42는 직교(Orthogonal) Fab 계면 (Ortho-Fab) 형태의 TriNKET의 대표도이며, 이는 Fc에 융합된, 표적 1 및 표적 2에 결합하는 2개의 Fab를 함유하는 이종이량체성 구축물이다. LC-HC 쌍 형성은 직교 계면에 의해 보장된다. 이종이량체화는 Fc에서의 돌연변이에 의해 보장된다.
도 43은 2-in-1 Ig 포맷의 TriNKET의 대표도이다.
도 44는 ES 형태의 TriNKET의 대표도이며, 이는 Fc에 융합된, 표적 1 및 표적 2에 결합하는 2개의 상이한 Fab를 함유하는 이종이량체성 구축물이다. 이종이량체화는 Fc에서 정전기적 조정 돌연변이에 의해 보장된다.
도 45는 Fab 아암 교환 형태의 TriNKET의 대표도이다: 중쇄 및 부착된 경쇄 (절반-분자)를 또 다른 분자로부터의 중쇄-경쇄 쌍과 교체함으로써 Fab 아암을 교환하여 이중특이적 항체를 생성하는 항체. Fab 아암 교환 형태 (cFae)는 표적 1 및 2에 결합하는 2개의 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다.
도 46은 SEED 바디 형태의 TriNKET의 대표도이며, 이는 표적 1 및 2에 결합하는 2개의 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다.
도 47은 LuZ-Y 형태의 TriNKET의 대표도이며, 여기서 류신 지퍼를 사용하여 2개의 상이한 HC의 이종이량체화를 유도한다. LuZ-Y 형태는 Fc에 융합된, 표적 1 및 2에 결합하는 2개의 상이한 scFab를 함유하는 이종이량체이다. 이종이량체화는 Fc의 C-말단에 융합된 류신 지퍼 모티프에 의해 보장된다.
도 48은 Cov-X-바디 형태의 TriNKET의 대표도이다.
도 49a-49b는 ĸλ-바디 형태의 TriNKET의 대표도이며, 이는 이종이량체화 돌연변이에 의해 안정화된 Fc에 융합된 2개의 상이한 Fab를 갖는 이종이량체성 구축물이며: 항원 1을 표적으로 하는 Fab1은 카파 LC를 함유하는 반면에, 항원 2를 표적으로 하는 제2 Fab는 람다 LC를 함유한다. 도 49a는 ĸλ-바디의 한 형태의 예시적인 대표도이며; 도 49b는 또 다른 ĸλ-바디의 예시적인 대표도이다.
도 50은 Fc에 융합된, 표적 1에 결합하는 Fab 및 표적 2에 결합하는 scFab를 포함하는 Oasc-Fab 이종이량체성 구축물이다. 이종이량체화는 Fc에서의 돌연변이에 의해 보장된다.
도 51는 항원 1 및 2에 결합하는 2개의 상이한 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체성 구축물인 DuetMab이다. Fab 1 및 2는 정확한 경쇄 (LC) 및 중쇄 (HC) 쌍 형성을 보장하는 차별적인 S-S 브릿지를 함유한다.
도 52는 이종이량체화에 의해 안정화된 Fc에 융합된, 표적 1 및 2에 결합하는 2개의 상이한 Fab를 갖는 이종이량체성 구축물인 CrossmAb이다. CL 및 CH1 도메인 및 VH 및 VL 도메인이 전환되고, 예를 들어 CH1은 VL과 일렬로 융합된 반면에, CL은 VH와 일렬로 융합된다.
도 53은 항원 2에 결합하는 Fab가 항원 1에 결합하는 Fab의 HC의 N 말단에 융합된 동종이량체성 구축물인 Fit-Ig이다. 상기 구축물은 야생형 Fc를 함유한다.
도 2는 scFv 포맷의 NKG2D-결합 도메인 (우측 아암), 종양 연관 항원-결합 도메인 (좌측 아암), 및 CD16에 결합하는 Fc 도메인 또는 그의 부분을 함유하는 다중-특이적 결합 단백질의 대표도이다.
도 3은 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 인간 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 4는 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 시노몰구스 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 5는 ELISA 검정에서 NKG2D-결합 도메인 (클론으로 열거됨)과 마우스 재조합 NKG2D의 결합 친화도를 입증하는 선 그래프이다.
도 6은 유동 세포분석법에 의해 NKG2D-결합 도메인 (클론으로 열거됨)과 인간 NKG2D를 발현하는 EL4 세포의 결합을 입증하는 막대 그래프이며, 백그라운드 대비 평균 형광 강도 (MFI) 배수를 제시한다.
도 7은 유동 세포분석법에 의해 NKG2D-결합 도메인 (클론으로 열거됨)과 마우스 NKG2D를 발현하는 EL4 세포의 결합을 입증하는 막대 그래프이며, 백그라운드 대비 평균 형광 강도 (MFI) 배수를 제시한다.
도 8은 천연 리간드 ULBP-6과 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 인간 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 9는 천연 리간드 MICA와 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 인간 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 10은 천연 리간드 Rae-1 델타와 경쟁함으로써 NKG2D-결합 도메인 (클론으로 열거됨)과 재조합 마우스 NKG2D-Fc의 특이적 결합 친화도를 입증하는 선 그래프이다.
도 11은 인간 NKG2D-CD3 제타 융합 단백질을 발현하는 TNFα-양성 세포의 백분율을 정량화함으로써 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NKG2D의 활성화를 제시하는 막대 그래프이다.
도 12는 마우스 NKG2D-CD3 제타 융합 단백질을 발현하는 TNFα-양성 세포의 백분율을 정량화함으로써 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NKG2D의 활성화를 제시하는 막대 그래프이다.
도 13은 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 14는 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 인간 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 15는 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 16은 NKG2D-결합 도메인 (클론으로 열거됨)에 의한 마우스 NK 세포의 활성화를 제시하는 막대 그래프이다.
도 17은 종양 세포에 대한 NKG2D-결합 도메인 (클론으로 열거됨)의 세포독성 효과를 제시하는 막대 그래프이다.
도 18은 시차 주사 형광측정법에 의해 측정되는 NKG2D-결합 도메인 (클론으로 열거됨)의 융점을 제시하는 막대 그래프이다.
도 19는 다중-특이적 결합 단백질에 의한 인간 NK 세포의 증진된 활성화를 제시하는 그래프이다.
도 20은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 21은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 22는 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 23은 다중-특이적 결합 단백질이 인간 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 24는 다중-특이적 결합 단백질이 마우스 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 25는 다중-특이적 결합 단백질이 마우스 NK 세포에 의해 종양 표적 세포에 대해 높은 수준의 세포독성을 유도하였음을 제시하는 그래프이다.
도 26은 EL4 세포 상에서 발현된 NKG2D에 대한 HER2-표적화 TriNKET의 결합 프로파일이다. 도 26은 이제 HER2 제2 표적화 아암과 쌍을 형성한 동일한 2개의 NKG2D-결합 도메인을 나타낸다.
도 27a는 인간 786-O 신세포 암종 세포 상에서 발현된 HER2에 대한 HER2-표적화 TriNKET의 결합 프로파일이고; 도 27b는 TriNKET를 함유하는 NKG2D 결합 클론 C26이 인간 HER2에 의해 형질도입된 RMA 세포에 결합함을 제시하고; 도 27c는 TriNKET를 함유하는 NKG2D 결합 클론 F04가 인간 HER2에 의해 형질도입된 RMA 세포에 결합함을 제시한다.
도 28a - 28c는 CD107a 탈과립화 및 IFNγ 시토카인 생산에서의 증가에 의해 나타나는 바와 같이 TriNKET 및 트라스투주맙이 HER2-양성 인간 종양 세포와의 공동-배양에서 일차 인간 NK 세포를 활성화시킬 수 있음을 입증하는 막대 그래프이다. 모노클로날 항체 트라스투주맙과 비교하면, 두 TriNKET 모두 다양한 인간 HER2 암 세포에 의해 인간 NK 세포의 우수한 활성화를 나타내었다. 도 28a는 인간 NK 세포가 SkBr-3 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28b는 인간 NK 세포가 Colo201 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28c는 인간 NK 세포가 HCC1954 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다.
도 29a-29b는 TriNKET가 트라스투주맙에 비해 HER2 중간 및 낮은 암에 대해 보다 양호한 이점을 제공한다는 것을 입증하는 그래프이다. 도 29a는 HER2 높은-SkBr-3 종양 세포의 활성화된 인간 NK 세포 사멸을 제시한다. 도 29b는 HER2 낮은-786-O 종양 세포의 인간 NK 세포 사멸을 제시한다. TriNKET는 낮은 HER2 발현을 갖는 암 세포에 대해 트라스투주맙에 비해 더 큰 이점을 제공한다.
도 30a-30c는 CD16 및 NKG2D를 사용하는 NK 세포의 상승작용적 활성화의 막대 그래프이다. 도 30a는 CD107a의 수준을 입증하고; 도 30b는 IFNγ의 수준을 입증하고; 도 30c는 CD107a 및 IFNγ의 수준을 입증한다. 그래프는 평균 (n = 2) ±SD를 나타낸다. 데이터는 5명의 상이한 건강한 공여자를 이용하는 5회의 독립적인 실험을 대표한다.
도 31은 NKG2D 및 CD16을 표적으로 하는 TriNKET를 사용하여 NK 세포의 활성화의 막대 그래프이다. 시험한 항체는 인간 IgG1 이소타입이었다. 그래프는 평균 (n = 2) ± SD를 나타낸다.
도 32a - 32c는 IL-2-활성화된 및 휴지된 인간 NK 세포를 사용하여 세포독성 활성의 TriNKET 증진을 입증하는 그래프이다. 도 32a는 휴지된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. 도 32b는 IL-2-활성화된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. 도 32c는 IL-2-활성화된 인간 NK 세포에 의한 NCI-H661 폐암 세포의 특이적 용해 백분율을 제시한다.
도 33a & 33b는 건강한 공여자로부터의 B 세포가 TriNKET-매개된 용해에 민감성임을 제시하는 막대 그래프이다. 도 33c & 33d는 골수 세포가 TriNKET-매개된 용해에 저항성임을 제시하는 막대 그래프이다.
도 34는 장기간 공동-배양에서 SkBr-3 종양 세포의 TriNKET-매개된 hPBMC 사멸의 선 그래프이다.
도 35는 하나의 분자에서 삼중-특이적 결합이 최대 NK 세포 활성을 위해 중요함을 제시하는 선 그래프이다.
도 36은 RMA/S-HER2 피하 SC2.2 효능의 연구 설계의 흐름도이다.
도 37은 SC2.2가 피하 RMA/S-HER2 종양 성장에 대해 효과가 없음을 제시하는 선 그래프이다.
도 38a는 HER2-TriNKET-C26이 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시한다. 도 38b는 HER2-TriNKET-F04가 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시한다. 점선은 이소타입 대조군을 나타낸다. 채워지지 않은 실선은 비염색 대조군을 나타낸다. 채워진 실선은 TriNKET를 나타낸다.
도 39는 트리오맙 형태의 TriNKET의 대표도이며, 이는 IgG-유사 형태를 유지하는 삼관능성의 이중특이적 항체이다. 이 키메라는 2가지 모 항체로부터 유래된 2개의 절반 항체로 이루어지고, 이들 각각은 1개의 경쇄 및 1개의 중쇄를 갖는다. 트리오맙 형태는 ½의 래트 항체 및 ½의 마우스 항체를 함유하는 이종이량체성 구축물일 수 있다.
도 40은 KiH 공통 경쇄 (LC) 형태의 TriNKET의 대표도이며, 이는 놉-인투-홀 (knobs-into-holes, KIH) 기술과 관련이 있다. KiH는 표적 1 및 2에 결합하는 2개의 Fab 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다. KiH 포맷의 TriNKET는 2개의 상이한 중쇄, 및 두 중쇄 모두와 쌍을 형성한 공통 경쇄를 함유하는, 표적 1 및 표적 2에 결합하는 2개의 fab를 갖는 이종이량체성 구축물일 수 있다.
도 41은 이중-가변 도메인 이뮤노글로불린 (DVD-Ig™) 형태의 TriNKET의 대표도이며, 이는 가요성 천연 발생 링커를 통해 2개의 모노클로날 항체의 표적 결합 도메인을 조합하고, 4가 IgG-유사 분자를 생성한다. DVD-Ig™는 항원 2를 표적으로 하는 가변 도메인이 항원 1을 표적으로 하는 Fab의 가변 도메인의 N 말단에 융합된 동종이량체성 구축물이고, 상기 구축물은 정상 Fc를 함유한다.
도 42는 직교(Orthogonal) Fab 계면 (Ortho-Fab) 형태의 TriNKET의 대표도이며, 이는 Fc에 융합된, 표적 1 및 표적 2에 결합하는 2개의 Fab를 함유하는 이종이량체성 구축물이다. LC-HC 쌍 형성은 직교 계면에 의해 보장된다. 이종이량체화는 Fc에서의 돌연변이에 의해 보장된다.
도 43은 2-in-1 Ig 포맷의 TriNKET의 대표도이다.
도 44는 ES 형태의 TriNKET의 대표도이며, 이는 Fc에 융합된, 표적 1 및 표적 2에 결합하는 2개의 상이한 Fab를 함유하는 이종이량체성 구축물이다. 이종이량체화는 Fc에서 정전기적 조정 돌연변이에 의해 보장된다.
도 45는 Fab 아암 교환 형태의 TriNKET의 대표도이다: 중쇄 및 부착된 경쇄 (절반-분자)를 또 다른 분자로부터의 중쇄-경쇄 쌍과 교체함으로써 Fab 아암을 교환하여 이중특이적 항체를 생성하는 항체. Fab 아암 교환 형태 (cFae)는 표적 1 및 2에 결합하는 2개의 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다.
도 46은 SEED 바디 형태의 TriNKET의 대표도이며, 이는 표적 1 및 2에 결합하는 2개의 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체이다.
도 47은 LuZ-Y 형태의 TriNKET의 대표도이며, 여기서 류신 지퍼를 사용하여 2개의 상이한 HC의 이종이량체화를 유도한다. LuZ-Y 형태는 Fc에 융합된, 표적 1 및 2에 결합하는 2개의 상이한 scFab를 함유하는 이종이량체이다. 이종이량체화는 Fc의 C-말단에 융합된 류신 지퍼 모티프에 의해 보장된다.
도 48은 Cov-X-바디 형태의 TriNKET의 대표도이다.
도 49a-49b는 ĸλ-바디 형태의 TriNKET의 대표도이며, 이는 이종이량체화 돌연변이에 의해 안정화된 Fc에 융합된 2개의 상이한 Fab를 갖는 이종이량체성 구축물이며: 항원 1을 표적으로 하는 Fab1은 카파 LC를 함유하는 반면에, 항원 2를 표적으로 하는 제2 Fab는 람다 LC를 함유한다. 도 49a는 ĸλ-바디의 한 형태의 예시적인 대표도이며; 도 49b는 또 다른 ĸλ-바디의 예시적인 대표도이다.
도 50은 Fc에 융합된, 표적 1에 결합하는 Fab 및 표적 2에 결합하는 scFab를 포함하는 Oasc-Fab 이종이량체성 구축물이다. 이종이량체화는 Fc에서의 돌연변이에 의해 보장된다.
도 51는 항원 1 및 2에 결합하는 2개의 상이한 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 함유하는 이종이량체성 구축물인 DuetMab이다. Fab 1 및 2는 정확한 경쇄 (LC) 및 중쇄 (HC) 쌍 형성을 보장하는 차별적인 S-S 브릿지를 함유한다.
도 52는 이종이량체화에 의해 안정화된 Fc에 융합된, 표적 1 및 2에 결합하는 2개의 상이한 Fab를 갖는 이종이량체성 구축물인 CrossmAb이다. CL 및 CH1 도메인 및 VH 및 VL 도메인이 전환되고, 예를 들어 CH1은 VL과 일렬로 융합된 반면에, CL은 VH와 일렬로 융합된다.
도 53은 항원 2에 결합하는 Fab가 항원 1에 결합하는 Fab의 HC의 N 말단에 융합된 동종이량체성 구축물인 Fit-Ig이다. 상기 구축물은 야생형 Fc를 함유한다.
본 발명은 암 세포 상의 HER2에 결합하고, 천연 킬러 세포 상의 NKG2D 수용체 및 CD16 수용체에 결합하여 천연 킬러 세포를 활성화시키는 다중-특이적 결합 단백질, 이러한 다중-특이적 결합 단백질을 포함하는 제약 조성물, 및 이러한 다중-특이적 단백질 및 제약 조성물을 이용하는 치료 방법, 예컨대 암의 치료 방법을 제공한다. 본 발명의 다양한 측면은 섹션별로 하기에 설명되지만, 하나의 특별한 섹션에 기재된 본 발명의 측면이 임의의 다른 섹션으로 제한되지 않는다.
본 발명의 이해를 용이하게 하기 위해, 수많은 용어 및 문구가 하기에 정의된다.
본원에서 사용된 바와 같이, 단수형 용어는 "하나 이상"을 의미하고, 문맥상 부적절하지 않다면 복수형을 포함한다. 본원에서 사용된 바와 같이, 용어 "항원-결합 부위"는 항원 결합에 참여하는 이뮤노글로불린 분자의 부분을 지칭한다. 인간 항체에서, 항원-결합 부위는 중쇄 ("H") 및 경쇄 ("L")의 N-말단 가변 ("V") 영역의 아미노산 잔기에 의해 형성된다. 중쇄 및 경쇄의 V 영역 내에 있는 3개의 고도로 분기한 스트레치는 "초가변 영역"으로 지칭되며, 이는 "프레임워크 영역" 또는 "FR"로 공지된 더욱 보존된 플랭킹 스트레치들 사이에 삽입되어 있다. 따라서, 용어 "FR"은 이뮤노글로불린에서 초가변 영역들 사이에서 그에 인접하여 천연적으로 발견되는 아미노산 서열을 지칭한다. 인간 항체 분자에서, 경쇄의 3개의 초가변 영역 및 중쇄의 3개의 초가변 영역은 서로에 대해 삼차원 공간으로 배치되어 항원-결합 표면을 형성한다. 항원-결합 표면은 결합된 항원의 삼차원 표면에 대해 상보성이고, 각각의 중쇄 및 경쇄의 3개의 초가변 영역은 "상보성-결정 영역" 또는 "CDR"로 지칭된다. 특정 동물, 예컨대 낙타 및 연골 어류에서는, 항원-결합 부위가 단일 항체 쇄에 의해 형성되어, "단일 도메인 항체"를 제공한다. 항원-결합 부위는 무손상 항체로서, 항원-결합 표면을 보유하는 항체의 항원-결합 단편으로, 또는 단일 폴리펩티드에서 중쇄 가변 도메인을 경쇄 가변 도메인에 연결하기 위해 펩티드 링커를 사용하는 재조합 폴리펩티드, 예컨대 scFv로 존재할 수 있다.
본원에서 사용된 바와 같이, 용어 "종양 연관 항원"은 암과 연관된 단백질, 당단백질, 강글리오시드, 탄수화물, 지질을 비롯하여 이로 제한되지 않는 임의의 항원을 의미한다. 이러한 항원은 악성 세포 상에서 또는 종양 미세환경에서, 예컨대 종양-연관 혈관, 세포외 매트릭스, 간엽성 간질, 또는 면역 침윤물 상에서 발현될 수 있다.
본원에서 사용된 바와 같이, 용어 "대상체" 및 "환자"는 본원에 기재된 방법 및 조성물에 의해 치료되는 유기체를 지칭한다. 이러한 유기체에는 바람직하게는 포유류 (예를 들어, 뮤린, 원숭이, 말, 소, 돼지, 개, 고양이 등)이 포함되고, 더욱 바람직하게는 인간이 포함된다.
본원에서 사용된 바와 같이, 용어 "유효량"은 유익한 또는 원하는 결과를 달성하는데 충분한 화합물 (예를 들어, 본 발명의 화합물)의 양을 지칭한다. 유효량은 하나 이상의 투여, 적용 또는 용량으로 투여될 수 있고, 특정한 제형 또는 투여 경로로 제한되는 것으로 의도되지 않는다. 본원에서 사용된 바와 같이, 용어 "치료하는"은 상태, 질환, 장애 등을 개선시키는 임의의 효과, 예를 들어 줄이거나, 감소시키거나, 조절하거나, 완화시키거나 또는 제거하거나, 또는 이들의 증상을 완화시키는 것을 포함한다.
본원에서 사용된 바와 같이, 용어 "제약 조성물"은 조성물이 생체내 또는 생체외에서 진단적 또는 치료적으로 사용하기에 특히 적합하게 만드는 불활성 또는 활성의 담체와 활성 작용제의 조합물을 지칭한다.
본원에서 사용된 바와 같이, 용어 "제약상 허용가능한 담체"는 임의의 표준 제약 담체, 예컨대 인산염 완충된 식염수 용액, 물, 에멀젼 (예를 들어, 오일/물 또는 물/오일 에멀젼), 및 다양한 유형의 습윤제를 지칭한다. 조성물은 또한 안정화제 및 보존제를 포함할 수 있다. 담체, 안정화제 및 아주반트의 예에 대해서는, 예를 들어 문헌 [Martin, Remington's Pharmaceutical Sciences, 15th Ed., Mack Publ. Co., Easton, PA [1975]]을 참고한다.
본원에서 사용된 바와 같이, 용어 "제약상 허용가능한 염"은 대상체에게 투여시 본 발명의 화합물 또는 그의 활성 대사물 또는 잔기를 제공할 수 있는, 본 발명의 화합물의 임의의 제약상 허용가능한 염 (예를 들어, 산 또는 염기)을 지칭한다. 관련 기술분야의 기술자에게 공지된 바와 같이, 본 발명의 화합물의 "염"은 무기 또는 유기 산 및 염기로부터 유래될 수 있다. 예시적인 산에는 염산, 브로민화수소산, 황산, 질산, 과염소산, 푸마르산, 말레산, 인산, 글리콜산, 락트산, 살리실산, 숙신산, 톨루엔-p-술폰산, 타르타르산, 아세트산, 시트르산, 메탄술폰산, 에탄술폰산, 포름산, 벤조산, 말론산, 나프탈렌-2-술폰산, 벤젠술폰산 등이 포함되나 이로 제한되지 않는다. 다른 산, 예컨대 옥살산은 그 자체로는 제약상 허용가능하지 않지만, 본 발명의 화합물 및 그들의 제약상 허용가능한 산 부가 염을 수득하는데 있어서 중간체로서 유용한 염의 제조에서 사용될 수 있다.
예시적인 염기에는 알칼리 금속 (예를 들어, 나트륨) 수산화물, 알칼리토 금속 (예를 들어, 마그네슘) 수산화물, 암모니아, 및 화학식 NW4 +의 화합물 (여기서, W는 C1-4 알킬임) 등이 포함되나 이로 제한되지 않는다.
예시적인 염에는 아세테이트, 아디페이트, 알기네이트, 아스파르테이트, 벤조에이트, 벤젠술포네이트, 비술페이트, 부티레이트, 시트레이트, 캄포레이트, 캄포르술포네이트, 시클로펜탄프로피오네이트, 디글루코네이트, 도데실술페이트, 에탄술포네이트, 푸마레이트, 플루코헵타노에이트, 글리세로포스페이트, 헤미술페이트, 헵타노에이트, 헥사노에이트, 히드로클로라이드, 히드로브로마이드, 히드로아이오다이드, 2-히드록시에탄술포네이트, 락테이트, 말레에이트, 메탄술포네이트, 2-나프탈렌술포네이트, 니코티네이트, 옥살레이트, 팔모에이트, 펙티네이트, 퍼술페이트, 페닐프로피오네이트, 피크레이트, 피발레이트, 프로피오네이트, 숙시네이트, 타르트레이트, 티오시아네이트, 토실레이트, 운데카노에이트 등이 포함되나 이로 제한되지 않는다. 염의 다른 예에는 적합한 양이온, 예컨대 Na+, NH4 + 및 NW4 + (여기서, W는 C1-4 알킬 기임) 등과 배합된 본 발명의 화합물의 음이온이 포함된다.
치료적 용도의 경우, 본 발명의 화합물의 염은 제약상 허용가능한 것으로 고려된다. 그러나, 제약상 허용가능하지 않은 산 및 염기의 염 또한 예를 들어 제약상 허용가능한 화합물의 제조 또는 정제에 사용될 수 있다.
명세서에 걸쳐, 조성물이 특정한 성분을 갖거나, 수반하거나 또는 포함하는 것으로 기재되거나, 또는 공정 및 방법이 특정한 단계를 갖거나, 수반하거나 또는 포함하는 것으로 기재된 경우에는, 인용된 성분들로 본질적으로 이루어지거나 또는 그들로 이루어진 본 발명의 조성물이 있고, 인용된 가공 단계들로 본질적으로 이루어지거나 또는 그들로 이루어진 본 발명에 따른 공정 및 방법이 있는 것으로 추가로 고려된다.
일반적으로, 백분율을 특정하는 조성은 달리 명시하지 않는다면 중량을 기준으로 한다. 추가로, 변수에 대한 정의가 수반되지 않는다면, 상기 변수의 이전의 정의가 적용된다.
I. 단백질
본 발명은 암 세포 상의 HER2에 결합하고, 천연 킬러 세포 상의 NKG2D 수용체 및 CD16 수용체에 결합하여 천연 킬러 세포를 활성화시키는 다중-특이적 결합 단백질을 제공한다. 다중-특이적 결합 단백질은 본원에 기재된 제약 조성물 및 치료 방법에서 유용하다. 다중-특이적 결합 단백질과 천연 킬러 세포 상의 NKG2D 수용체 및 CD16 수용체의 결합은 암 세포의 파괴에 대한 천연 킬러 세포의 활성을 증진시킨다. 다중-특이적 결합 단백질과 암 세포 상의 HER2의 결합은 암 세포가 천연 킬러 세포에 근접하게 만들고, 이는 천연 킬러 세포에 의한 암 세포의 직접적인 및 간접적인 파괴를 용이하게 한다. 예시적인 다중-특이적 결합 단백질에 대한 추가의 기재가 하기에 제공된다.
다중-특이적 결합 단백질의 제1 성분은 NKG2D 수용체-발현 세포에 결합하며, 상기 세포에는 NK 세포, γδ T 세포 및 CD8+ αβ T 세포가 포함될 수 있으나 이로 제한되지 않는다. NKG2D 결합시, 다중-특이적 결합 단백질은 천연 리간드, 예컨대 ULBP6 및 MICA가 NKG2D에 결합하고 NKG2D 수용체를 활성화시키는 것을 차단할 수 있다.
다중-특이적 결합 단백질의 제2 성분은 HER2-발현 세포에 결합하며, 이에는 유방암, 난소암, 식도암, 방광암 및 위암, 타액관 암종, 폐의 선암종 및 공격적인 형태의 자궁암, 예컨대 자궁 장액성 자궁내막 암종이 포함될 수 있으나 이로 제한되지 않는다.
다중-특이적 결합 단백질의 제3 성분은 백혈구의 표면 상의 Fc 수용체인 CD16을 발현하는 세포, 예컨대 천연 킬러 세포, 대식세포, 호중구, 호산구, 거대 세포, 및 여포성 수지상 세포에 결합한다.
본원에 기재된 다중-특이적 결합 단백질은 다양한 포맷을 가질 수 있다. 예를 들어, 한 포맷은 제1 이뮤노글로불린 중쇄, 제1 이뮤노글로불린 경쇄, 제2 이뮤노글로불린 중쇄 및 제2 이뮤노글로불린 경쇄를 포함하는 이종이량체성 다중-특이적 항체이다 (도 1). 제1 이뮤노글로불린 중쇄는 제1 Fc (힌지-CH2-CH3) 도메인, 제1 중쇄 가변 도메인 및 임의적으로 제1 CH1 중쇄 도메인을 포함한다. 제1 이뮤노글로불린 경쇄는 제1 경쇄 가변 도메인 및 제1 경쇄 불변 도메인을 포함한다. 제1 이뮤노글로불린 경쇄는 제1 이뮤노글로불린 중쇄와 함께 NKG2D에 결합하는 항원-결합 부위를 형성한다. 제2 이뮤노글로불린 중쇄는 제2 Fc (힌지-CH2-CH3) 도메인, 제2 중쇄 가변 도메인 및 임의적으로 제2 CH1 중쇄 도메인을 포함한다. 제2 이뮤노글로불린 경쇄는 제2 경쇄 가변 도메인 및 제2 경쇄 불변 도메인을 포함한다. 제2 이뮤노글로불린 경쇄는 제2 이뮤노글로불린 중쇄와 함께 HER2에 결합하는 항원-결합 부위를 형성한다. 제1 Fc 도메인 및 제2 Fc 도메인은 함께 CD16에 결합할 수 있다 (도 1). 일부 실시양태에서, 제1 이뮤노글로불린 경쇄는 제2 이뮤노글로불린 경쇄와 동일할 수 있다.
또 다른 예시적인 포맷은 제1 이뮤노글로불린 중쇄, 제2 이뮤노글로불린 중쇄 및 이뮤노글로불린 경쇄를 포함하는 이종이량체성 다중-특이적 항체와 관련이 있다 (도 2). 제1 이뮤노글로불린 중쇄는 NKG2D 또는 HER2와 쌍을 형성하여 그와 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인으로 구성된 단일-쇄 가변 단편 (scFv)에 링커 또는 항체 힌지를 통해 융합된 제1 Fc (힌지-CH2-CH3) 도메인을 포함한다. 제2 이뮤노글로불린 중쇄는 제2 Fc (힌지-CH2-CH3) 도메인, 제2 중쇄 가변 도메인 및 임의적으로 CH1 중쇄 도메인을 포함한다. 이뮤노글로불린 경쇄는 경쇄 가변 도메인 및 불변 경쇄 도메인을 포함한다. 제2 이뮤노글로불린 중쇄는 이뮤노글로불린 경쇄와 쌍을 형성하고, NKG2D 또는 HER2에 결합한다. 제1 Fc 도메인 및 제2 Fc 도메인은 함께 CD16에 결합할 수 있다 (도 2).
하나 이상의 추가의 결합 모티프가 임의적으로 링커 서열을 통해 불변 영역 CH3 도메인의 C-말단에 융합될 수 있다. 특정 실시양태에서, 항원-결합 부위는 단일-쇄 또는 디술피드-안정화된 가변 영역 (scFv)일 수 있거나, 또는 4가 또는 3가 분자를 형성할 수 있다.
일부 실시양태에서, 다중-특이적 결합 단백질은 트리오맙 형태를 갖고, 이는 IgG-유사 형태를 유지하는 삼관능성의 이중특이적 항체이다. 이 키메라는 2가지 모 항체로부터 유래된 2개의 절반 항체로 이루어지며, 이들 각각은 1개의 경쇄 및 1개의 중쇄를 갖는다.
일부 실시양태에서, 다중-특이적 결합 단백질은 놉-인투-홀 (KIH) 기술과 관련이 있는 KiH 공통 경쇄 (LC) 형태를 갖는다. KIH는 CH3 도메인이 각각의 중쇄에서 "놉" 또는 "홀"을 생성하도록 조작하여 이종이량체화를 촉진하는 것과 관련이 있다. "놉-인투-홀 (KiH)" Fc 기술에 대한 개념은, 소형 잔기를 벌크 잔기로 치환시킴으로써 (예를 들어, EU 넘버링에서 T366WCH3A) 1개의 CH3 도메인 (CH3A)에 "놉"을 도입시키는 것이었다. "놉"을 수용하기 위해, 놉에 가장 가까운 이웃 잔기를 더 작은 잔기로 교체함으로써 (예를 들어, T366S/L368A/Y407VCH3B) 다른 CH3 도메인 (CH3B) 상에 상보적인 "홀" 표면이 생성되었다. "홀" 돌연변이는 구조화된-가이드된 파지 라이브러리 스크리닝에 의해 최적화되었다 (Atwell S, Ridgway JB, Wells JA, Carter P., Stable heterodimers from remodeling the domain interface of a homodimer using a phage display library, J. Mol. Biol. (1997) 270(1):26-35). KiH Fc 변이체의 X-선 결정 구조 (Elliott JM, Ultsch M, Lee J, Tong R, Takeda K, Spiess C, et al., Antiparallel conformation of knob and hole aglycosylated half-antibody homodimers is mediated by a CH2-CH3 hydrophobic interaction. J. Mol. Biol. (2014) 426(9):1947-57; Mimoto F, Kadono S, Katada H, Igawa T, Kamikawa T, Hattori K. Crystal structure of a novel asymmetrically engineered Fc variant with improved affinity for FcgammaRs. Mol. Immunol. (2014) 58(1):132-8)는, CH3 도메인 코어 계면 사이에서 입체적 상보성에 의해 유도된 소수성 상호작용에 의해 이종이량체화가 열역학적으로 선호되는 반면에, 놉-놉 및 홀-홀 계면은 각각 입체 장애 및 유리한 상호작용 방해로 인해 동종이량체를 선호하지 않는다.
일부 실시양태에서, 다중-특이적 결합 단백질은 이중-가변 도메인 이뮤노글로불린 (DVD-Ig™) 형태를 가지며, 이는 2개의 모노클로날 항체의 표적 결합 도메인을 가요성 천연 발생 링커를 통해 조합하고, 4가 IgG-유사 분자를 생성한다.
일부 실시양태에서, 다중-특이적 결합 단백질은 직교 Fab 계면 (Ortho-Fab) 형태를 갖는다. ortho-Fab IgG 접근법에서 (Lewis SM, Wu X, Pustilnik A, Sereno A, Huang F, Rick HL, et al., Generation of bispecific IgG antibodies by structure-based design of an orthogonal Fab interface. Nat. Biotechnol. (2014) 32(2):191-8), 구조-기반 영역별 설계는 1개의 Fab에서만 LC 및 HCVH-CH1 계면에서 상보성 돌연변이를 도입하고, 다른 Fab에서는 어떠한 변화도 주지 않는다.
일부 실시양태에서, 다중-특이적 결합 단백질은 2-in-1 Ig 포맷을 갖는다. 일부 실시양태에서, 다중-특이적 결합 단백질은 ES 형태를 가지며, 이는 Fc에 융합된, 표적 1 및 표적 2에 결합하는 2개의 상이한 Fab를 함유하는 이종이량체성 구축물이다. 이종이량체화는 Fc에서 정전기적 조정 돌연변이에 의해 보장된다. 일부 실시양태에서, 다중-특이적 결합 단백질은 ĸλ-바디 형태를 가지며, 이는 이종이량체화 돌연변이에 의해 안정화된 Fc에 융합된 2개의 상이한 Fab를 갖는 이종이량체성 구축물이고: 항원 1을 표적으로 하는 Fab1은 카파 LC를 함유하는 반면에, 항원 2를 표적으로 하는 제2 Fab는 람다 LC를 함유한다. 도 49a는 ĸλ-바디의 한 형태의 예시적인 대표도이며; 도 49b는 또 다른 ĸλ-바디의 예시적인 대표도이다.
일부 실시양태에서, 다중-특이적 결합 단백질은 Fab 아암 교환 형태 (중쇄 및 부착된 경쇄 (절반-분자)를 또 다른 분자로부터의 중쇄-경쇄 쌍과 교체함으로써 Fab 아암을 교환하여 이중특이적 항체를 생성하는 항체)를 갖는다. 일부 실시양태에서, 다중-특이적 결합 단백질은 SEED 바디 형태를 갖는다. 가닥-교환 조작된 도메인 (SEED) 플랫폼은 비대칭의 이중특이적 항체-유사 분자를 생성하도록 설계되었고, 이는 천연 항체의 치료적 적용을 확장시키는 능력을 갖는다. 이 단백질 조작된 플랫폼은 보존된 CH3 도메인 내의 이뮤노글로불린의 구조적으로 관련된 서열의 교환을 기반으로 한다. SEED 설계는 AG/GA 이종이량체의 효율적인 생성을 가능하게 하는 반면에, AG 및 GA SEED CH3 도메인의 동종이량체는 선호하지 않는다. (Muda M. et al., Protein Eng. Des. Sel. (2011, 24(5):447-54)). 일부 실시양태에서, 다중-특이적 결합 단백질은 LuZ-Y 형태를 가지며, 여기서 류신 지퍼를 사용하여 2개의 상이한 HC의 이종이량체화를 유도한다. (Wranik, BJ. et al., J. Biol. Chem. (2012), 287:43331-9).
일부 실시양태에서, 다중-특이적 결합 단백질은 Cov-X-바디 형태를 갖는다. 이중특이적 CovX-바디에서, 2개의 상이한 펩티드가 분지형 아제티디논 링커를 이용하여 함께 결합하고, 부위-특이적인 방식으로 온화한 조건하에 스캐폴드 항체에 융합된다. 약물작용발생단은 기능적 활성을 담당하는 반면에, 항체 스캐폴드는 긴 반감기 및 Ig-유사 분포를 부여한다. 약물작용발생단은 화학적으로 최적화될 수 있거나 또는 다른 약물작용발생단과 교체되어, 최적화되거나 또는 독특한 이중특이적 항체를 생성할 수 있다. (Doppalapudi VR et al., PNAS (2010), 107(52);22611-22616).
일부 실시양태에서, 다중-특이적 결합 단백질은 Fc에 융합된, 표적 1에 결합하는 Fab 및 표적 2에 결합하는 scFab를 포함하는 Oasc-Fab 이종이량체성 형태를 갖는다. 이종이량체화는 Fc에서의 돌연변이에 의해 보장된다.
일부 실시양태에서, 다중-특이적 결합 단백질은 DuetMab 형태를 가지며, 이는 항원 1 및 2에 결합하는 2개의 상이한 Fab, 및 이종이량체화 돌연변이에 의해 안정화된 Fc를 포함하는 이종이량체성 구축물이다. Fab 1 및 2는 정확한 LC 및 HC 쌍 형성을 보장하는 차별적인 S-S 브릿지를 함유한다.
일부 실시양태에서, 다중-특이적 결합 단백질은 CrossmAb 형태를 가지며, 이는 이종이량체화에 의해 안정화된 Fc에 융합된, 표적 1 및 2에 결합하는 2개의 상이한 Fab를 갖는 이종이량체성 구축물이다. CL 및 CH1 도메인 및 VH 및 VL 도메인이 전환되고, 예를 들어 CH1은 VL과 일렬로 융합된 반면에, CL은 VH와 일렬로 융합된다.
일부 실시양태에서, 다중-특이적 결합 단백질은 Fit-Ig 형태를 가지며, 이는 항원 2에 결합하는 Fab가 항원 1에 결합하는 Fab의 HC의 N 말단에 융합된 동종이량체성 구축물이다. 상기 구축물은 야생형 Fc를 함유한다.
다중-특이적 결합 단백질의 추가의 포맷은 본원에 기재된 NKG2D- 및 HER2-결합 단편의 다양한 포맷을 조합함으로써 고안될 수 있다.
표 1은 조합되어 NKG2D에 결합할 수 있는 중쇄 가변 도메인 및 경쇄 가변 도메인의 펩티드 서열을 열거한다.
대안적으로, US 9,273,136에 기재된 바와 같이, SEQ ID NO:45로 정의되는 중쇄 가변 도메인은 SEQ ID NO:46으로 정의되는 경쇄 가변 도메인과 쌍을 형성하여, NKG2D에 결합할 수 있는 항원-결합 부위를 형성할 수 있다.
대안적으로, US 7,879,985에 기재된 바와 같이, SEQ ID NO:47로 정의되는 중쇄 가변 도메인은 SEQ ID NO:48로 정의된 경쇄 가변 도메인과 쌍을 형성하여, NKG2D에 결합할 수 있는 항원-결합 부위를 형성할 수 있다.
표 2는 조합되어 HER2에 결합할 수 있는 중쇄 가변 도메인 및 경쇄 가변 도메인의 펩티드 서열을 열거한다.
대안적으로, HER2에 결합할 수 있는 신규한 항원-결합 부위는 SEQ ID NO:61에 의해 정의된 아미노산 서열에 대한 결합에 대해 스크리닝함으로써 확인될 수 있다.
Fc 도메인 내에서, CD16 결합은 힌지 영역 및 CH2 도메인에 의해 매개된다. 예를 들어, 인간 IgG1 내에서, CD16과의 상호작용은 주로 CH2 도메인에 있는 아미노산 잔기 Asp 265 - Glu 269, Asn 297 - Thr 299, Ala 327 - Ile 332, Leu 234 - Ser 239, 및 탄수화물 잔기 N-아세틸-D-글루코사민에 집중된다 (Sondermann et al., Nature, 406(6793):267-273 참고). 공지된 도메인을 기준으로 하여, 돌연변이는 예컨대 파지-디스플레이된 라이브러리 또는 효모 표면-디스플레이된 cDNA 라이브러리를 이용함으로써 CD16에 대한 결합 친화도를 증진시키거나 감소시키기 위해 선택될 수 있거나, 또는 상호작용의 공지된 삼차원 구조를 기준으로 하여 고안될 수 있다.
이종이량체성 항체 중쇄의 조립체는 동일한 세포에서 2개의 상이한 항체 중쇄 서열을 발현시킴으로써 달성될 수 있고, 이는 각각의 항체 중쇄의 동종이량체의 조립체, 뿐만 아니라 이종이량체의 조립체를 유도할 수 있다. 이종이량체의 바람직한 조립체의 촉진은 US13/494870, US16/028850, US11/533709, US12/875015, US13/289934, US14/773418, US12/811207, US13/866756, US14/647480, 및 US14/830336에서 제시된 바와 같이 각각의 항체 중쇄 불변 영역의 CH3 도메인에서 상이한 돌연변이를 도입시킴으로써 달성될 수 있다. 예를 들어, 돌연변이는 인간 IgG1을 기준으로 CH3 도메인에서 이루어질 수 있고, 제1 폴리펩티드 및 제2 폴리펩티드 내에서 아미노산 치환의 구별되는 쌍의 도입은 이들 2개의 쇄가 서로 선택적으로 이종이량체화하는 것을 가능하게 한다. 하기 기재된 아미노산 치환의 위치는 모두 카바트(Kabat)에서와 같이 EU 인덱스에 따라 넘버링된다.
한 시나리오에서, 제1 폴리펩티드에서의 아미노산 치환은 원래의 아미노산을 아르기닌 (R), 페닐알라닌 (F), 티로신 (Y) 또는 트립토판 (W)으로부터 선택된 더 큰 아미노산으로 교체하고, 제2 폴리펩티드에서의 적어도 1개의 아미노산 치환은 원래의 아미노산(들)을 알라닌 (A), 세린 (S), 트레오닌 (T) 또는 발린 (V)으로부터 선택된 더 작은 아미노산(들)로 교체하고, 이로써 더 큰 아미노산 치환 (융기부)이 더 작은 아미노산 치환 (공동)의 표면에 들어 맞는다. 예를 들어, 한 폴리펩티드는 T366W 치환을 도입할 수 있고, 다른 것은 T366S, L368A 및 Y407V를 비롯한 3개의 치환을 도입할 수 있다.
본 발명의 항체 중쇄 가변 도메인은 임의적으로 항체 불변 영역, 예컨대 CH1 도메인이 있거나 없이 힌지, CH2 및 CH3 도메인을 포함하는 IgG 불변 영역과 적어도 90% 동일한 아미노산 서열에 커플링될 수 있다. 일부 실시양태에서, 상기 불변 영역의 아미노산 서열은 인간 항체 불변 영역, 예컨대 인간 IgG1 불변 영역, IgG2 불변 영역, IgG3 불변 영역, 또는 IgG4 불변 영역과 적어도 90% 동일하다. 일부 다른 실시양태에서, 상기 불변 영역의 아미노산 서열은 또 다른 포유류, 예컨대 토끼, 개, 고양이, 마우스 또는 말로부터의 항체 불변 영역과 적어도 90% 동일하다. 인간 IgG1 불변 영역에 비해 하나 이상의 돌연변이를 불변 영역에, 예를 들어 Q347, Y349, L351, S354, E356, E357, K360, Q362, S364, T366, L368, K370, N390, K392, T394, D399, S400, D401, F405, Y407, K409, T411 및/또는 K439에서 도입할 수 있다. 예시적인 치환에는 예를 들어 Q347E, Q347R, Y349S, Y349K, Y349T, Y349D, Y349E, Y349C, T350V, L351K, L351D, L351Y, S354C, E356K, E357Q, E357L, E357W, K360E, K360W, Q362E, S364K, S364E, S364H, S364D, T366V, T366I, T366L, T366M, T366K, T366W, T366S, L368E, L368A, L368D, K370S, N390D, N390E, K392L, K392M, K392V, K392F, K392D, K392E, T394F, T394W, D399R, D399K, D399V, S400K, S400R, D401K, F405A, F405T, Y407A, Y407I , Y407V, K409F, K409W, K409D, T411D, T411E, K439D, 및 K439E가 포함된다.
특정 실시양태에서, 인간 IgG1 불변 영역의 CH1에 도입될 수 있는 돌연변이는 아미노산 V125, F126, P127, T135, T139, A140, F170, P171 및/또는 V173에 있을 수 있다. 특정 실시양태에서, 인간 IgG1 불변 영역의 Cκ에 도입될 수 있는 돌연변이는 아미노산 E123, F116, S176, V163, S174 및/또는 T164에 있을 수 있다.
아미노산 치환은 표 3에 제시된 하기 치환 세트로부터 선택될 수 있다.
대안적으로, 아미노산 치환은 표 4에 제시된 하기 치환 세트로부터 선택될 수 있다.
대안적으로, 아미노산 치환은 표 5에 제시된 하기 치환 세트로부터 선택될 수 있다.
대안적으로, 각각의 폴리펩티드 쇄에서 적어도 1개의 아미노산 치환은 표 6으로부터 선택될 수 있다.
대안적으로, 적어도 1개의 아미노산 치환은 표 7에 나타낸 하기 치환 세트로부터 선택될 수 있으며, 제1 폴리펩티드 컬럼에서 나타낸 위치(들)은 임의의 공지된 음으로 하전된 아미노산으로 교체되고, 제2 폴리펩티드 컬럼에서 나타낸 위치(들)은 임의의 공지된 양으로 하전된 아미노산으로 교체된다.
대안적으로, 적어도 1개의 아미노산 치환은 표 8에 나타낸 하기 치환 세트로부터 선택될 수 있으며, 제1 폴리펩티드 컬럼에서 나타낸 위치(들)은 임의의 공지된 양으로 하전된 아미노산으로 교체되고, 제2 폴리펩티드 컬럼에서 나타낸 위치(들)은 임의의 공지된 음으로 하전된 아미노산으로 교체된다.
대안적으로, 아미노산 치환은 표 9에 나타낸 하기 치환 세트로부터 선택될 수 있다.
대안적으로 또는 추가로, 이종다합체 단백질의 구조적 안정성은 제1 또는 제2 폴리펩티드 쇄에 S354C 및 반대쪽 폴리펩티드 쇄에 Y349C를 도입함으로써 증가될 수 있고, 이는 2개의 폴리펩티드의 계면 내에서 인공적인 디술피드 브릿지를 형성한다.
상기 기재된 다중-특이적 단백질은 관련 기술분야의 기술자에게 널리 공지된 재조합 DNA 기술을 이용하여 제조될 수 있다. 예를 들어, 제1 이뮤노글로불린 중쇄를 코딩하는 제1 핵산 서열을 제1 발현 벡터에 클로닝할 수 있고; 제2 이뮤노글로불린 중쇄를 코딩하는 제2 핵산 서열을 제2 발현 벡터에 클로닝할 수 있고; 이뮤노글로불린 경쇄를 코딩하는 제3 핵산 서열을 제3 발현 벡터에 클로닝할 수 있고; 제1, 제2 및 제3 발현 벡터를 함께 숙주 세포에 안정하게 형질감염시켜, 다합체 단백질을 생성할 수 있다.
다중-특이적 단백질의 최고 수율을 달성하기 위해, 제1, 제2 및 제3 발현 벡터의 상이한 비를 연구하여 숙주 세포로의 형질감염을 위해 최적의 비를 결정할 수 있다. 형질감염 이후, 세포 은행을 생성하기 위해 관련 기술분야에 공지된 방법, 예컨대 제한된 희석, ELISA, FACS, 현미경 검사 또는 클론픽스(Clonepix)를 이용하여 단일 클론을 단리할 수 있다.
클론을 생물 반응기 규모 증가에 적합한 조건하에 배양하고, 다중-특이적 단백질의 발현을 유지할 수 있다. 다중-특이적 단백질을 관련 기술분야에 공지된 방법, 예컨대 원심분리, 심층 여과, 세포 용해, 균질화, 냉동-해동, 친화도 정제, 겔 여과, 이온 교환 크로마토그래피, 소수성 상호작용 교환 크로마토그래피, 및 혼합-방식 크로마토그래피를 이용하여 단리하고 정제할 수 있다.
II. 다중-특이적 단백질의 특징
특정 실시양태에서, NKG2D-결합 도메인 및 HER2-결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질은 인간 NKG2D를 발현하는 세포에 결합한다. 특정 실시양태에서, NKG2D-결합 도메인 및 HER2-결합 도메인을 포함하는 다중-특이적 결합 단백질은 동일한 HER2-결합 도메인을 갖는 모노클로날 항체에 필적하는 수준으로 HER2에 결합한다. 예를 들어, NKG2D-결합 도메인 및 트라스투주맙으로부터의 HER2-결합 도메인을 포함하는 다중-특이적 결합 단백질은 트라스투주맙에 필적하는 수준으로 세포 상에서 발현된 HER2에 결합할 수 있다.
그러나, 본원에 기재된 다중-특이적 결합 단백질은 종양 성장을 감소시키고 암 세포를 사멸시키는데 더욱 효과적이다. 예를 들어, HER2 발현 종양/암 세포를 표적으로 하는 본 개시내용의 다중-특이적 결합 단백질은 SC2.2 (NKG2D에 대한 리간드인 ULBP-6에 연결된 트라스투주맙으로부터 유래된 scFv로부터 형성된 단일 쇄 이중특이적 분자)에 비해 더욱 효과적이다. SC2.2는 HER2+ 암 세포 및 NKG2D+ NK 세포와 동시에 결합한다. 따라서, HER2+ 암 세포 개수를 감소시키는데 있어서 SC2.2의 효과를 시험하였다. 시험관내 활성화 및 세포독성 검정은, SC2.2가 NK 세포의 활성화 및 사멸에 효과적이었음을 입증하였다. 그러나, SC2.2는 RMA/S-HER2 피하 종양 모델에서 효능을 입증하는데 실패하였다. SC2.2의 효능을 또한 생체 내에서 RMA/S-HER2 과발현 공통 유전자 마우스 모델에서 시험하였다 (도 36). 이 마우스 모델에서, SC2.2는 비히클 대조군에 비해 종양 성장의 조절을 입증하는데 실패하였다 (도 37). 따라서, SC2.2가 NK 세포를 활성화 및 사멸시킬 수 있고, HER2+ 암 세포에 결합할 수 있지만, 이들 성질은 HER2+ 종양 성장을 효과적으로 조절하는데 불충분하였다.
특정 실시양태에서, NKG2D-결합 도메인 및 종양 연관 항원에 대한 결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질은 항원을 발현하는 종양 세포와 함께 배양될 때 일차 인간 NK 세포를 활성화시킨다. NK 세포 활성화는 CD107a 탈과립화 및 IFNγ 시토카인 생산에서의 증가에 의해 나타난다. 추가로, 종양 연관 항원-결합 도메인을 포함하는 모노클로날 항체와 비교할 때, 다중-특이적 결합 단백질은 항원을 발현하는 종양 세포의 존재하에 인간 NK 세포의 우수한 활성화를 나타낸다. 예를 들어, 모노클로날 항체 트라스투주맙과 비교할 때, HER2-결합 도메인을 갖는 본 개시내용의 다중-특이적 결합 단백질은 HER2-발현 암 세포의 존재하에 인간 NK 세포의 우수한 활성화를 나타낸다.
특정 실시양태에서, NKG2D-결합 도메인 및 종양 연관 항원에 대한 결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질은 항원을 발현하는 종양 세포의 존재하에 휴지된 및 IL-2-활성화된 인간 NK 세포의 활성을 증진시킨다. 휴지된 NK 세포는 IL-2-활성화된 NK 세포에 비해 적은 백그라운드 IFNγ 생산 및 CD107a 탈과립화를 나타내었다. 특정 실시양태에서, 휴지된 NK 세포는 IL-2-활성화된 NK 세포에 비해 IFNγ 생산 및 CD107a 탈과립화에서 더 큰 변화를 나타낸다. 특정 실시양태에서, IL-2-활성화된 NK 세포는 TriNKET로의 자극 이후에 IFNγ+; CD107a+가 되는 세포의 더 큰 백분율을 나타내었다.
특정 실시양태에서, NKG2D-결합 도메인 및 종양 연관 항원에 대한 결합 도메인 (종양 연관 항원의 비제한적인 예에는 CD20, BCMA 및 HER2가 포함됨)을 포함하는 본원에 기재된 다중-특이적 결합 단백질은 항원을 발현하는 종양 세포의 존재하에 휴지된 및 IL-2-활성화된 인간 NK 세포의 세포독성 활성을 증진시킨다. 추가로, HER2에 대한 결합 도메인을 포함하는 다중-특이적 결합 단백질 (예를 들어, A40-다중-특이적 결합 단백질, A49-다중-특이적 결합 단백질, C26-다중-특이적 결합 단백질, F04-다중-특이적 결합 단백질, F43-다중-특이적 결합 단백질, F47-다중-특이적 결합 단백질, 및 E79-다중-특이적 결합 단백질)은 HER2-결합 부위를 포함하는 모노클로날 항체에 비해 종양 세포에 대해 활성화된 및 휴지된 NK 세포 반응을 더욱 강력하게 지시한다. 특정 실시양태에서, 다중-특이적 결합 단백질은 HER2-결합 부위를 포함하는 모노클로날 항체에 비해 중간 및 낮은 HER2를 발현하는 종양 세포에 대한 이점을 제공한다. 따라서, 다중-특이적 결합 단백질을 포함하는 요법은 모노클로날 항체 요법에 비해 우수할 수 있다.
특정 실시양태에서, 모노클로날 항체에 비해, HER2에 대한 결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질 (예를 들어, A40-다중-특이적 결합 단백질, A49-다중-특이적 결합 단백질, C26-다중-특이적 결합 단백질, F04-다중-특이적 결합 단백질, F43-다중-특이적 결합 단백질, F47-다중-특이적 결합 단백질, 및 E79-다중-특이적 결합 단백질)은 Fc 수용체 (FcR)의 높은 발현을 갖는 암, 또는 높은 수준의 FcR을 갖는 종양 미세환경에 있는 암의 치료에 유리하다. 모노클로날 항체는 무엇보다도 ADCC, CDC, 식균작용 및 신호 차단을 비롯한 다중 메카니즘을 통해 종양 성장에 대한 그들의 효과를 발휘한다. FcγR 중에서, CD16은 IgG Fc에 대해 가장 낮은 친화도를 갖고; FcγRI (CD64)는 높은-친화도 FcR이며, CD16에 비해 약 1000배 더 강력하게 IgG Fc에 결합한다. CD64는 여러 조혈 계통, 예컨대 골수 계통에서 정상적으로 발현되고, 이들 세포 유형으로부터 유래된 종양, 예컨대 급성 골수성 백혈병 (AML)에서 발현될 수 있다. 종양으로 침윤하는 면역 세포, 예컨대 MDSC 및 단핵구는 또한 CD64를 발현하고, 종양 미세환경에 침윤하는 것으로 공지되어 있다. 종양에 의한 또는 종양 미세환경에서 CD64의 발현은 모노클로날 항체 요법에 대해 해로운 효과를 가질 수 있다. 항체가 높은-친화도 수용체에 결합하는 것을 선호하기 때문에, 종양 미세환경에서 CD64의 발현은 이들 항체가 NK 세포의 표면 상의 CD16에 결속하는 것을 어렵게 만든다. 다중-특이적 결합 단백질은 NK 세포 표면 상의 2개의 활성화 수용체를 표적화함으로써 모노클로날 항체 요법에 대한 (종양 또는 종양 미세환경에서) CD64 발현의 해로운 효과를 극복할 수 있다. NK 세포 상의 2개의 활성화 수용체의 이중 표적화가 NK 세포와의 더욱 강력한 특이적 결합을 제공하기 때문에, 종양 세포에서 CD64 발현과 무관하게, 다중-특이적 결합 단백질은 모든 종양 세포에 대한 인간 NK 세포 반응을 매개할 수 있다.
일부 실시양태에서, HER2에 대한 결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질 (예를 들어, A40-다중-특이적 결합 단백질, A49-다중-특이적 결합 단백질, C26-다중-특이적 결합 단백질, F04-다중-특이적 결합 단백질, F43-다중-특이적 결합 단백질, F47-다중-특이적 결합 단백질, 및 E79-다중-특이적 결합 단백질)은 감소된 온-표적 오프-종양 부작용을 통해 더욱 양호한 안전성 프로파일을 제공한다. 천연 킬러 세포 및 CD8 T 세포 둘 다 종양 세포를 직접적으로 용해시킬 수 있지만, NK 세포 및 CD8 T 세포가 종양 세포로부터 자가의 정상 세포를 인식하는 메카니즘은 상이하다. NK 세포의 활성은 활성화 (NCR, NKG2D, CD16 등) 및 억제 (KIR, NKG2A 등) 수용체로부터 신호의 균형에 의해 조절된다. 이들 활성화 및 억제 신호의 균형은 NK 세포가 스트레스 받았거나, 바이러스에 감염되었거나 또는 형질전환된 자가-세포로부터 건강한 자가-세포를 결정하는 것을 가능하게 한다. 자가-관용의 '빌트-인' 메카니즘은 정상의 건강한 조직을 NK 세포 반응으로부터 보호하는데 도움이 될 것이다. 이 원리를 확장시키기 위해, NK 세포의 자가-관용은 오프-종양 부작용 없이 또는 증가된 치료 범위에서 다중-특이적 결합 단백질이 자가 및 종양 둘 다에서 발현되는 항원을 표적으로 하는 것을 가능하게 할 것이다. 천연 킬러 세포와 달리, T 세포는 활성화 및 이펙터 기능을 위해 MHC 분자에 의해 제시되는 특정한 펩티드의 인식을 필요로 한다. T 세포는 면역요법의 주요 표적이었고, 여러 전략은 종양에 대한 T 세포 반응을 재지시하는 것으로 개발되었다. T 세포 이중특이적, 체크포인트 억제제, 및 CAR-T 세포는 모두 FDA에 의해 승인되었지만, 종종 용량-제한 독성으로 어려움이 있다. T 세포 이중특이적 및 CAR-T 세포는 종양 세포의 표면 상의 항원을 표적으로 하는 결합 도메인을 이용하고, 이펙터 세포에 활성화 신호를 전도하는 조작된 신호전달 도메인을 이용함으로써 TCR-MHC 인식 시스템에 대해 작용한다. 항-종양 면역 반응을 유도하는데 효과적임에도 불구하고, 이들 요법은 종종 시토카인 방출 증후군 (CRS), 및 온-표적 오프-종양 부작용과 연관된다. 다중-특이적 결합 단백질은 NK 세포 활성화 및 억제의 천연 시스템을 '무효화'하지 않을 것이기 때문에 이러한 맥락에서 독특하다. 대신에, 다중-특이적 결합 단백질은 상기 균형을 흔들도록 고안되고, 건강한 자가 세포에 대한 NK 관용은 유지하면서 NK 세포에 추가의 활성화 신호를 제공한다.
일부 실시양태에서, HER2에 대한 결합 도메인을 포함하는, NKG2D-결합 도메인을 포함하는 본원에 기재된 다중-특이적 결합 단백질 (예를 들어, A40-다중-특이적 결합 단백질, A49-다중-특이적 결합 단백질, C26-다중-특이적 결합 단백질, F04-다중-특이적 결합 단백질, F43-다중-특이적 결합 단백질, F47-다중-특이적 결합 단백질, 및 E79-다중-특이적 결합 단백질)은 동일한 종양 항원-결합 도메인을 포함하는 모노클로날 항체에 비해 종양의 진행을 더욱 효과적으로 지연시킨다. 일부 실시양태에서, NKG2D-결합 도메인 및 종양 항원-결합 도메인을 포함하는 다중-특이적 결합 단백질은 동일한 종양 항원-결합 도메인을 포함하는 모노클로날 항체에 비해 암 전이에 대해 더욱 효과적이다.
III. 치료적 적용
본 발명은 본원에 기재된 다중-특이적 결합 단백질 및/또는 본원에 기재된 제약 조성물을 이용하여 암을 치료하는 방법을 제공한다. 상기 방법을 이용하여, 암의 치료를 필요로 하는 환자에게 본원에 기재된 다중-특이적 결합 단백질의 치료 유효량을 투여함으로써, HER2를 발현하는 다양한 암을 치료할 수 있다.
치료 방법은 치료할 암에 따라 특징화될 수 있다. 예를 들어, 특정 실시양태에서, 암은 유방암, 난소암, 식도암, 방광암 또는 위암, 타액관 암종, 타액관 암종들, 폐의 선암종 또는 공격적인 형태의 자궁암, 예컨대 자궁 장액성 자궁내막 암종이다.
특정의 다른 실시양태에서, 암은 뇌암, 유방암, 자궁경부암, 결장암, 결장직장암, 자궁내막암, 식도암, 백혈병, 폐암, 간암, 흑색종, 난소암, 췌장암, 직장암, 신암, 위암, 고환암, 또는 자궁암이다. 여전히 다른 실시양태에서, 암은 편평 상피 암종, 선암종, 소세포 암종, 흑색종, 신경모세포종, 육종 (예를 들어, 혈관육종 또는 연골육종), 후두암, 이하선암, 담도암, 갑상선암, 말단 흑자 흑색종, 광선 각화증, 급성 림프구성 백혈병, 급성 골수성 백혈병, 아데노이드 낭성 암종, 선종, 선육종, 선편평상피 암종, 항문관암, 항문암, 항문직장암, 성상세포 종양, 바르톨린샘 암종, 기저 세포 암종, 담관암, 골암, 골수암, 기관지암, 기관지샘 암종, 유암종, 담관 암종, 연골육종, 맥락막총 유두종/암종, 만성 림프구성 백혈병, 만성 골수성 백혈병, 투명 세포 암종, 결합 조직암, 낭선종, 소화계암, 십이지장암, 내분비계암, 내배엽동 종양, 자궁내막 과다형성, 자궁내막 간질성 육종, 자궁내막모양 선암종, 자궁내막 세포 암, 상의세포 암, 상피 세포 암, 유잉 육종, 안구 및 안와 암, 여성 색식기암, 국소 결절성 과다형성, 담낭암, 위 전정부 암, 위 기저부 암, 가스트린종, 교모세포종, 글루카곤종, 심장암, 혈관모세포종, 혈관내피종, 혈관종, 간선종, 간선종증, 간담관암, 간세포 암종, 호지킨병, 회장암, 인슐린종, 상피내 신형성, 상피내 편평 상피 신형성, 간내 담관암, 침윤성 편평 상피 암종, 공장암, 관절암, 카포시 육종, 골반암, 거대 세포 암종, 큰창자암, 평활근육종, 악성 검정사마귀 흑색종, 림프종, 남성 생식기 암, 악성 흑색종, 악성 중피 종양, 수모세포종, 수질상피종, 뇌막암, 중피암, 전이성 암종, 구강암, 점막표피양 암종, 다발성 골수종, 근육암, 비강암, 신경계암, 신경상피 선암종 결절성 흑색종, 비-상피성 피부암, 비-호지킨 림프종, 귀리 세포 암종, 희소돌기아교세포암, 구강암, 골육종, 유두상 장액성 선암종, 음경암, 인두암, 뇌하수체 종양, 형질세포종, 가육종, 폐 모세포종, 직장암, 신세포 암종, 호흡계암, 망막모세포종, 횡문근육종, 육종, 장액성 암종, 부비동암, 피부암, 소세포 암종, 소장암, 평활근육암, 연조직암, 소마토스타틴-분비 종양, 척추암, 편평 상피 암종, 횡문근육암, 중피세포하 암, 표재 확산 흑색종, T 세포 백혈병, 설암, 미분화 암종, 수뇨관암, 요도암, 비뇨기 방광암, 비뇨계암, 자궁경부암, 자궁체부암, 포도막 흑색종, 질암, 사마귀모양 암종, VIP종, 외음암, 잘 분화된 암종, 또는 빌름스 종양이다.
특정의 다른 실시양태에서, 암은 비-호지킨 림프종, 예컨대 B-세포 림프종 또는 T-세포 림프종이다. 특정 실시양태에서, 비-호지킨 림프종은 B-세포 림프종, 예컨대 미만성 거대 B-세포 림프종, 원발성 종격동 B-세포 림프종, 여포성 림프종, 소형 림프구성 림프종, 맨틀 세포 림프종, 변연부 B-세포 림프종, 림프절외 변연부 B-세포 림프종, 결절성 변연부 B-세포 림프종, 비장 변연부 B-세포 림프종, 버킷 림프종, 림프구형질세포성 림프종, 모발상 세포 백혈병, 또는 원발성 중추신경계 (CNS) 림프종이다. 특정의 다른 실시양태에서, 비-호지킨 림프종은 T-세포 림프종, 예컨대 전구체 T-림프모구성 림프종, 말초 T-세포 림프종, 피부 T-세포 림프종, 혈관면역모구성 T-세포 림프종, 림프절외 천연 킬러/T-세포 림프종, 장질환 유형 T-세포 림프종, 피하 지방층염-유사 T-세포 림프종, 역형성 거대 세포 림프종, 또는 말초 T-세포 림프종이다.
치료할 암은 암 세포의 표면 상에서 발현되는 특정한 항원의 존재에 따라 특징화될 수 있다. 특정 실시양태에서, 암 세포는 HER2 외에도 다음 중 하나 이상을 발현할 수 있다: CD2, CD19, CD20, CD30, CD38, CD40, CD52, CD70, EGFR/ERBB1, IGF1R, HER3/ERBB3, HER4/ERBB4, MUC1, cMET, SLAMF7, PSCA, MICA, MICB, TRAILR1, TRAILR2, MAGE-A3, B7.1, B7.2, CTLA4, 및 PD1.
IV. 조합 요법
본 발명의 또 다른 측면은 조합 요법을 제공한다. 본원에 기재된 다중-특이적 결합 단백질을 암을 치료하기 위해 추가의 치료제와 조합하여 사용한다.
암 치료에서 조합 요법의 일부로서 사용될 수 있는 예시적인 치료제에는 예를 들어 방사선, 미토마이신, 트레티노인, 리보무스틴, 겜시타빈, 빈크리스틴, 에토포시드, 클라드리빈, 미토브로니톨, 메토트렉세이트, 독소루비신, 카르보쿠온, 펜토스타틴, 니트라크린, 지노스타틴, 세트로렉릭스, 레트로졸, 랄티트렉세드, 다우노루비신, 파드로졸, 포테무스틴, 티말파신, 소부족산, 네다플라틴, 시타라빈, 비칼루타미드, 비노렐빈, 베스나리논, 아미노글루테티미드, 암사크린, 프로글루미드, 엘리프티늄 아세테이트, 케탄세린, 독시플루리딘, 에트레티네이트, 이소트레티노인, 스트렙토조신, 니무스틴, 빈데신, 플루타미드, 드로게닐, 부토신, 카르모푸르, 라족산, 시조필란, 카르보플라틴, 미토락톨, 테가푸르, 이포스파미드, 프레드니무스틴, 피시바닐, 레바미솔, 테니포시드, 임프로술판, 에노시타빈, 리수리드, 옥시메톨론, 타목시펜, 프로게스테론, 메피티오스탄, 에피티오스타놀, 포르메스탄, 인터페론-알파, 인터페론-2 알파, 인터페론-베타, 인터페론-감마, 콜로니 자극 인자-1, 콜로니 자극 인자-2, 데니류킨 디프티톡스, 인터류킨-2, 루테인화 호르몬 방출 인자, 및 그의 동족 수용체에 대한 차별적인 결합, 및 증가된 또는 감소된 혈청 반감기를 나타낼 수 있는 상기 언급된 작용제의 변형체가 포함된다.
암 치료에서 조합 요법의 일부로서 사용될 수 있는 추가의 작용제 부류는 면역 체크포인트 억제제이다. 예시적인 면역 체크포인트 억제제에는 (i) 세포독성 T-림프구-연관 항원 4 (CTLA4), (ii) 프로그래밍된 세포 사멸 단백질 1 (PD1), (iii) PDL1, (iv) LAG3, (v) B7-H3, (vi) B7-H4, 및 (vii) TIM3 중 하나 이상을 억제하는 작용제가 포함된다. CTLA4 억제제 이필리무맙은 흑색종의 치료를 위해 미국 식품의약국에 의해 승인되었다.
암 치료에서 조합 요법의 일부로서 사용될 수 있는 여전히 다른 작용제는 비-체크포인트 표적 (예를 들어, 헤르셉틴) 및 비-세포독성제 (예를 들어, 티로신-키나제 억제제)를 표적으로 하는 모노클로날 항체 작용제이다.
항암제의 여전히 다른 카테고리에는 예를 들어 (i) ALK 억제제, ATR 억제제, A2A 길항제, 염기 절단 복구 억제제, Bcr-Abl 티로신 키나제 억제제, 브루톤 티로신 키나제 억제제, CDC7 억제제, CHK1 억제제, 시클린-의존성 키나제 억제제, DNA-PK 억제제, DNA-PK 및 mTOR 둘 다의 억제제, DNMT1 억제제, DNMT1 억제제 + 2-클로로-데옥시아데노신, HDAC 억제제, 헷지호그 신호전달 경로 억제제, IDO 억제제, JAK 억제제, mTOR 억제제, MEK 억제제, MELK 억제제, MTH1 억제제, PARP 억제제, 포스포이노시티드 3-키나제 억제제, PARP1 및 DHODH 둘 다의 억제제, 프로테아좀 억제제, 토포이소머라제-II 억제제, 티로신 키나제 억제제, VEGFR 억제제, 및 WEE1 억제제로부터 선택된 억제제; (ii) OX40, CD137, CD40, GITR, CD27, HVEM, TNFRSF25 또는 ICOS의 효능제; 및 (iii) IL-12, IL-15, GM-CSF 및 G-CSF로부터 선택된 시토카인이 포함된다.
본 발명의 단백질은 또한 원발성 병변의 수술적 제거에 대해 부가적으로 사용될 수 있다.
다중-특이적 결합 단백질 및 추가의 치료제의 양 및 상대적인 투여 시기는 원하는 조합된 치료 효과를 달성하기 위해 선택될 수 있다. 예를 들어, 이러한 투여가 필요한 환자에게 조합 요법을 투여할 때, 조합물 중의 치료제, 또는 치료제를 포함하는 제약 조성물 또는 조성물들은 임의의 순서로, 예를 들어 순차적으로, 공동으로, 함께, 동시에 등으로 투여될 수 있다. 추가로, 예를 들어, 추가의 치료제(들)이 그의 예방적 또는 치료적 효과를 발휘하는 동안에 다중-특이적 결합 단백질을 투여할 수 있거나, 또는 그 반대로 할 수 있다.
V. 제약 조성물
본 개시내용은 또한 본원에 기재된 단백질의 치료 유효량을 함유하는 제약 조성물을 특징으로 한다. 상기 조성물은 다양한 약물 전달 시스템에서 사용하기 위해 제형화될 수 있다. 1종 이상의 생리학적으로 허용가능한 부형제 또는 담체 또한 적절한 제형을 위해 조성물에 포함될 수 있다. 본 개시내용에서 사용하기에 적합한 제형은 문헌 [Remington's Pharmaceutical Sciences, Mack Publishing Company, Philadelphia, Pa., 17th ed., 1985]에서 확인한다. 약물 전달을 위한 방법의 간단한 검토를 위해서는, 예를 들어 문헌 [Langer (Science 249:1527-1533, 1990)]를 참고한다.
본 개시내용의 정맥내 약물 전달 제형은 백, 펜 또는 시린지에 함유될 수 있다. 특정 실시양태에서, 백은 튜브 및/또는 니들을 포함하는 채널에 연결될 수 있다. 특정 실시양태에서, 제형은 동결건조된 제형 또는 액체 제형일 수 있다. 특정 실시양태에서, 제형은 냉동-건조되고 (동결건조되고), 약 12-60개 바이알에 함유될 수 있다. 특정 실시양태에서, 제형은 냉동-건조될 수 있고, 45 mg의 냉동-건조된 제형이 하나의 바이알에 함유될 수 있다. 특정 실시양태에서, 약 40 mg - 약 100 mg의 냉동-건조된 제형이 하나의 바이알에 함유될 수 있다. 특정 실시양태에서, 12, 27 또는 45개 바이알로부터의 냉동 건조된 제형을 조합하여 정맥내 약물 제형에서 단백질의 치료적 용량을 수득한다. 특정 실시양태에서, 제형은 액체 제형일 수 있고, 약 250 mg/바이알 내지 약 1000 mg/바이알로 보관될 수 있다. 특정 실시양태에서, 제형은 액체 제형일 수 있고, 약 600 mg/바이알로 보관될 수 있다. 특정 실시양태에서, 제형은 액체 제형일 수 있고, 약 250 mg/바이알로 보관될 수 있다.
본 개시내용은 제형을 형성하는 완충된 용액 중에 단백질의 치료 유효량을 포함하는 액체 수성 제약 제형으로 존재할 수 있다.
이들 조성물은 통상적인 멸균화 기술에 의해 멸균될 수 있거나, 또는 멸균 여과될 수 있다. 생성된 수성 용액을 그대로 사용하기 위해 포장하거나 또는 동결건조시킬 수 있고, 동결건조된 제제는 투여하기 전에 멸균 수성 담체와 조합된다. 제제의 pH는 전형적으로 3 내지 11, 더욱 바람직하게는 5 내지 9 또는 6 내지 8, 및 가장 바람직하게는 7 내지 8, 예컨대 7 내지 7.5일 것이다. 고체 형태로 생성된 조성물은 다중 단일 용량 단위로 포장될 수 있고, 이들 각각은 상기 언급된 작용제 또는 작용제들을 고정된 양으로 함유한다. 고체 형태의 조성물은 또한 융통성 있는 양을 위해 컨테이너에 포장될 수 있다.
특정 실시양태에서, 본 개시내용은 본 개시내용의 단백질을 만니톨, 시트르산 일수화물, 시트르산나트륨, 인산이나트륨 이수화물, 인산이수소나트륨 이수화물, 염화나트륨, 폴리소르베이트 80, 물, 및 수산화나트륨과 조합하여 포함하는, 연장된 반감기를 갖는 제형을 제공한다.
특정 실시양태에서, pH-완충된 용액 중에 본 개시내용의 단백질을 포함하는 수성 제형이 제조된다. 본 발명의 완충제는 약 4 내지 약 8, 예를 들어 약 4.5 내지 약 6.0, 또는 약 4.8 내지 약 5.5 범위의 pH를 가질 수 있거나, 또는 약 5.0 내지 약 5.2의 pH를 가질 수 있다. 상기 인용된 pH에 대해 중간 범위 또한 본 개시내용의 일부로서 의도된다. 예를 들어, 상한 및/또는 하한으로서 상기 인용된 임의의 값의 조합을 이용하는 값의 범위가 포함되는 것으로 의도된다. 이 범위 내에서 pH를 조절하는 완충제의 예에는 아세테이트 (예를 들어, 아세트산나트륨), 숙시네이트 (예컨대, 숙신산나트륨), 글루코네이트, 히스티딘, 시트레이트 및 다른 유기 산 완충제가 포함된다.
특정 실시양태에서, 제형은 약 4 내지 약 8 범위의 pH를 유지하기 위해 시트레이트 및 포스페이트를 함유하는 완충제 시스템을 포함한다. 특정 실시양태에서, pH 범위는 약 4.5 내지 약 6.0, 또는 약 pH 4.8 내지 약 5.5, 또는 약 5.0 내지 약 5.2의 pH 범위일 수 있다. 특정 실시양태에서, 완충제 시스템은 시트르산 일수화물, 시트르산나트륨, 인산이나트륨 이수화물, 및/또는 인산이수소나트륨 이수화물을 포함한다. 특정 실시양태에서, 완충제 시스템은 약 1.3 mg/ml의 시트르산 (예를 들어, 1.305 mg/ml), 약 0.3 mg/ml의 시트르산나트륨 (예를 들어, 0.305 mg/ml), 약 1.5 mg/ml의 인산이나트륨 이수화물 (예를 들어 1.53 mg/ml), 약 0.9 mg/ml의 인산이수소나트륨 이수화물 (예를 들어, 0.86), 및 약 6.2 mg/ml의 염화나트륨 (예를 들어, 6.165 mg/ml)을 포함한다. 특정 실시양태에서, 완충제 시스템은 1-1.5 mg/ml의 시트르산, 0.25 내지 0.5 mg/ml의 시트르산나트륨, 1.25 내지 1.75 mg/ml의 인산이나트륨 이수화물, 0.7 내지 1.1 mg/ml의 인산이수소나트륨 이수화물, 및 6.0 내지 6.4 mg/ml의 염화나트륨을 포함한다. 특정 실시양태에서, 제형의 pH를 수산화나트륨으로 조정한다.
등장화제로서 작용하고, 항체를 안정화시킬 수 있는 폴리올 또한 제형에 포함될 수 있다. 폴리올은 제형의 원하는 등장성과 관련하여 변할 수 있는 양으로 제형에 첨가된다. 특정 실시양태에서, 수성 제형은 등장성일 수 있다. 첨가되는 폴리올의 양 또한 폴리올의 분자량과 관련하여 변경될 수 있다. 예를 들어, 이당류 (예컨대, 트레할로스)에 비해 보다 적은 양의 단당류 (예를 들어, 만니톨)를 첨가할 수 있다. 특정 실시양태에서, 등장화제로서 제형에서 사용될 수 있는 폴리올은 만니톨이다. 특정 실시양태에서, 만니톨 농도는 약 5 내지 약 20 mg/ml일 수 있다. 특정 실시양태에서, 만니톨의 농도는 약 7.5 내지 15 mg/ml일 수 있다. 특정 실시양태에서, 만니톨의 농도는 약 10-14 mg/ml일 수 있다. 특정 실시양태에서, 만니톨의 농도는 약 12 mg/ml일 수 있다. 특정 실시양태에서, 폴리올 소르비톨이 제형에 포함될 수 있다.
세제 또는 계면활성제 또한 제형에 포함될 수 있다. 예시적인 세제에는 비이온성 세제, 예컨대 폴리소르베이트 (예를 들어, 폴리소르베이트 20, 80 등) 또는 폴록사머 (예를 들어, 폴록사머 188)가 포함된다. 첨가되는 세제의 양은 제형화된 항체의 응집을 감소시키고/거나 제형에서 입자의 형성을 최소화시키고/거나 흡착을 감소시키도록 하는 양이다. 특정 실시양태에서, 제형은 폴리소르베이트인 계면활성제를 포함할 수 있다. 특정 실시양태에서, 제형은 세제 폴리소르베이트 80 또는 트윈 80을 함유할 수 있다. 트윈 80은 폴리옥시에틸렌 (20) 소르비탄모노올레에이트를 기재하기 위해 사용되는 용어이다 (Fiedler, Lexikon der Hifsstoffe, Editio Cantor Verlag Aulendorf, 4th edi., 1996 참고). 특정 실시양태에서, 제형은 약 0.1 mg/mL 내지 약 10 mg/mL의 폴리소르베이트 80, 또는 약 0.5 mg/mL 내지 약 5 mg/mL를 함유할 수 있다. 특정 실시양태에서, 약 0.1% 폴리소르베이트 80이 제형에 첨가될 수 있다.
실시양태에서, 본 개시내용의 단백질 생성물은 액체 제형으로 제형화된다. 액체 제형은 고무 스토퍼로 밀폐되고 알루미늄 크림프 밀봉 마개로 밀봉된 USP / Ph Eur 유형 I 50R 바이알에서 10 mg/mL 농도로 제공될 수 있다. 스토퍼는 USP 및 Ph Eur에 따라 엘라스토머로 제조될 수 있다. 특정 실시양태에서, 바이알은 60 mL의 추출가능한 부피가 가능하도록 61.2 mL의 단백질 생성물 용액으로 충전될 수 있다. 특정 실시양태에서, 액체 제형은 0.9% 식염수 용액으로 희석될 수 있다.
특정 실시양태에서, 본 개시내용의 액체 제형은 안정화 수준에서 당과 조합된 10 mg/mL 농도의 용액으로서 제조될 수 있다. 특정 실시양태에서, 액체 제형은 수성 담체 중에서 제조될 수 있다. 특정 실시양태에서, 안정화제는 정맥내 투여에 바람직하지 않거나 적합하지 않은 점도를 생성할 수 있는 것보다는 적은 양으로 첨가될 수 있다. 특정 실시양태에서, 당은 이당류, 예를 들어 수크로스일 수 있다. 특정 실시양태에서, 액체 제형은 또한 완충화제, 계면활성제 및 보존제 중 하나 이상을 포함할 수 있다.
특정 실시양태에서, 액체 제형의 pH는 제약상 허용가능한 산 및/또는 염기의 첨가에 의해 설정될 수 있다. 특정 실시양태에서, 제약상 허용가능한 산은 염산일 수 있다. 특정 실시양태에서, 염기는 수산화나트륨일 수 있다.
응집 외에도, 탈아미드화는 발효, 수확/세포 정화, 정제, 약물 물질/약물 생성물 보관 및 샘플 분석 동안에 일어날 수 있는 펩티드 및 단백질의 흔한 생성물 변형이다. 탈아미드화는 단백질로부터 NH3의 소실에 의해 가수분해가 일어날 수 있는 숙신이미드 중간체를 형성하는 것이다. 숙신이미드 중간체는 모 펩티드의 17 달톤 질량 감소를 일으킨다. 후속적인 가수분해는 18 달톤 질량 증가를 일으킨다. 숙신이미드 중간체의 단리는 수성 조건하에서의 불안정성으로 인해 어렵다. 따라서, 탈아미드화는 전형적으로 1 달톤 질량 증가로서 검출가능하다. 아스파라긴의 탈아미드화는 아스파르트산 또는 이소아스파르트산을 생성한다. 탈아미드화 속도에 영향을 미치는 파라미터에는 pH, 온도, 용매 유전 상수, 이온 강도, 일차 서열, 국지적 폴리펩티드 형태 및 삼차 구조가 포함된다. 펩티드 쇄에서 Asn에 인접한 아미노산 잔기는 탈아미드화 속도에 영향을 미친다. 단백질 서열에서 Asn 이후의 Gly 및 Ser은 탈아미드화에 대한 더욱 높은 민감성을 일으킨다.
특정 실시양태에서, 본 개시내용의 액체 제형은 단백질 생성물의 탈아미노화를 방지하기 위한 pH 및 습도의 조건하에 보존될 수 있다.
본원에서 관심 수성 담체는 제약상 허용가능하고 (인간에게 투여하기에 안전하고 무독성임) 액체 제형의 제조에 유용한 것이다. 예시적인 담체에는 주사용 멸균수 (SWFI), 주사용 정균수 (BWFI), pH 완충된 용액 (예를 들어, 포스페이트-완충된 식염수), 멸균 식염수 용액, 링거 용액 또는 덱스트로스 용액이 포함된다.
보존제는 박테리아 작용을 감소시키기 위해 본원의 제형에 임의적으로 첨가될 수 있다. 보존제의 첨가는 예를 들어 다중-사용 (다중-용량) 제형의 생산을 용이하게 할 수 있다.
정맥내 (IV) 제형은 특정한 예에서, 예컨대 환자가 이식 후에 IV 경로를 통해 모든 약물을 제공받으면서 입원해 있을 때 바람직한 투여 경로일 수 있다. 특정 실시양태에서, 액체 제형을 투여하기 전에 0.9% 염화나트륨 용액으로 희석한다. 특정 실시양태에서, 주사를 위해 희석된 약물 생성물은 등장성이고, 정맥내 주입에 의한 투여에 적합하다.
특정 실시양태에서, 염 또는 완충제 성분은 10 mM - 200 mM의 양으로 첨가될 수 있다. 염 및/또는 완충제는 제약상 허용가능하고, "염기 형성" 금속 또는 아민과 함께 다양한 공지된 산 (무기 및 유기)으로부터 유래된다. 특정 실시양태에서, 완충제는 포스페이트 완충제일 수 있다. 특정 실시양태에서, 완충제는 글리시네이트, 카르보네이트, 시트레이트 완충제일 수 있으며, 이러한 경우에, 나트륨, 칼륨 또는 암모늄 이온이 반대이온으로 작용할 수 있다.
보존제는 박테리아 작용을 감소시키기 위해 본원의 제형에 임의적으로 첨가될 수 있다. 보존제의 첨가는 예를 들어 다중-사용 (다중-용량) 제형의 생산을 용이하게 할 수 있다.
본원에서 관심 수성 담체는 제약상 허용가능하고 (인간에게 투여하기에 안전하고 무독성임) 액체 제형의 제조에 유용한 것이다. 예시적인 담체에는 주사용 멸균수 (SWFI), 주사용 정균수 (BWFI), pH 완충된 용액 (예를 들어, 포스페이트-완충된 식염수), 멸균 식염수 용액, 링거 용액 또는 덱스트로스 용액이 포함된다.
본 개시내용은 단백질 및 동결건조 보호제를 포함하는 동결건조된 제형으로 존재할 수 있다. 동결건조 보호제는 당, 예를 들어 이당류일 수 있다. 특정 실시양태에서, 동결건조 보호제는 수크로스 또는 말토스일 수 있다. 동결건조된 제형은 또한 완충화제, 계면활성제, 벌크화제 및/또는 보존제 중 하나 이상을 포함할 수 있다.
동결건조된 약물 생성물의 안정화에 유용한 수크로스 또는 말토스의 양은 적어도 1:2의 단백질 대 수크로스 또는 말토스의 중량 비일 수 있다. 특정 실시양태에서, 단백질 대 수크로스 또는 말토스의 중량 비는 1:2 내지 1:5일 수 있다.
특정 실시양태에서, 동결건조 이전에 제형의 pH는 제약상 허용가능한 산 및/또는 염기의 첨가에 의해 설정될 수 있다. 특정 실시양태에서, 제약상 허용가능한 산은 염산일 수 있다. 특정 실시양태에서, 제약상 허용가능한 염기는 수산화나트륨일 수 있다.
동결건조 이전에, 본 개시내용의 단백질을 함유하는 용액의 pH는 6 내지 8로 조정될 수 있다. 특정 실시양태에서, 동결건조된 약물 생성물을 위한 pH 범위는 7 내지 8일 수 있다.
특정 실시양태에서, 염 또는 완충제 성분은 10 mM - 200 mM의 양으로 첨가될 수 있다. 염 및/또는 완충제는 제약상 허용가능하고, "염기 형성" 금속 또는 아민과 함께 다양한 공지된 산 (무기 및 유기)으로부터 유래된다. 특정 실시양태에서, 완충제는 포스페이트 완충제일 수 있다. 특정 실시양태에서, 완충제는 글리시네이트, 카르보네이트, 시트레이트 완충제일 수 있고, 이러한 경우에, 나트륨, 칼륨 또는 암모늄 이온이 반대이온으로 작용할 수 있다.
특정 실시양태에서, "벌크화제"가 첨가될 수 있다. "벌크화제"는 동결건조된 혼합물에 질량을 추가하고, 동결건조된 케이크의 물리적 구조에 기여하는 (예를 들어, 개방 공극 구조체를 유지하는 본질적으로 균일한 동결건조된 케이크의 생산을 용이하게 함) 화합물이다. 예시적인 벌크화제에는 만니톨, 글리신, 폴리에틸렌 글리콜 및 소르비톨이 포함된다. 본 발명의 동결건조된 제형은 이러한 벌크화제를 함유할 수 있다.
보존제는 박테리아 작용을 감소시키기 위해 본원의 제형에 임의적으로 첨가될 수 있다. 보존제의 첨가는 예를 들어 다중-사용 (다중-용량) 제형의 생산을 용이하게 할 수 있다.
특정 실시양태에서, 동결건조된 약물 생성물은 수성 담체에 의해 구성될 수 있다. 본원에서 관심 수성 담체는 제약상 허용가능하고 (예를 들어, 인간에게 투여하기에 안전하고 무독성임) 동결건조 이후에 액체 제형의 제조에 유용한 것이다. 예시적인 희석제에는 주사용 멸균수 (SWFI), 주사용 정균수 (BWFI), pH 완충된 용액 (예를 들어, 포스페이트-완충된 식염수), 멸균 식염수 용액, 링거 용액 또는 덱스트로스 용액이 포함된다.
특정 실시양태에서, 본 개시내용의 동결건조된 약물 생성물은 주사용 멸균수, USP (SWFI) 또는 0.9% 염화나트륨 주사, USP에 의해 재구성된다. 재구성하는 동안에, 동결건조된 분말은 용액으로 해리된다.
특정 실시양태에서, 본 개시내용의 동결건조된 단백질 생성물은 약 4.5 mL 주사용수로 재구성되고 0.9% 식염수 용액 (염화나트륨 용액)에 의해 희석된다.
본 발명의 제약 조성물에서 활성 성분의 실제 투여 수준은 환자에게 독성이 없이 특정한 환자, 조성 및 투여 방식에 대해 원하는 치료 반응을 달성하는데 효과적인 활성 성분의 양을 수득하도록 달라질 수 있다.
특정한 용량은 각각의 환자에 대해 균일한 용량, 예를 들어 50-5000 mg의 단백질일 수 있다. 대안적으로, 환자의 용량은 대략적인 환자의 체중 또는 표면적에 맞추어질 수 있다. 적절한 용량을 결정하기 위한 다른 인자에는 치료하거나 예방할 질환 또는 상태, 질환의 중증도, 투여 경로, 환자의 연령, 성별 및 의학적 상태가 포함될 수 있다. 치료를 위한 적절한 용량을 결정하기 위해 필요한 계산의 추가의 개량은 특히 본원에 개시된 용량 정보 및 검정에 비추어 관련 기술분야의 기술자에 의해 일상적으로 이루어진다. 용량은 적절한 용량-반응 데이터와 함께 사용되는 용량을 결정하기 위해 공지된 검정을 이용하여 결정될 수 있다. 개별 환자의 용량은 질환의 진행을 모니터링하면서 조정될 수 있다. 용량이 효과적인 농도에 도달하거나 그를 유지하기 위해 조정될 필요가 있는지를 보기 위해 환자에서 표적화가능한 구축물 또는 복합체의 혈액 수준을 측정할 수 있다. 약물유전체학을 이용하여 표적화가능한 구축물 및/또는 복합체, 및 그의 용량이 주어진 개체에 대해 가장 효과적일 가능성이 있는지를 결정할 수 있다 (Schmitz et al., Clinica Chimica Acta 308: 43-53, 2001; Steimer et al., Clinica Chimica Acta 308: 33-41, 2001).
일반적으로, 체중을 기준으로 하는 용량은 약 0.01 μg 내지 약 100 mg/kg 체중, 예컨대 약 0.01 μg 내지 약 100 mg/kg 체중, 약 0.01 μg 내지 약 50 mg/kg 체중, 약 0.01 μg 내지 약 10 mg/kg 체중, 약 0.01 μg 내지 약 1 mg/kg 체중, 약 0.01 μg 내지 약 100 μg/kg 체중, 약 0.01 μg 내지 약 50 μg/kg 체중, 약 0.01 μg 내지 약 10 μg/kg 체중, 약 0.01 μg 내지 약 1 μg/kg 체중, 약 0.01 μg 내지 약 0.1 μg/kg 체중, 약 0.1 μg 내지 약 100 mg/kg 체중, 약 0.1 μg 내지 약 50 mg/kg 체중, 약 0.1 μg 내지 약 10 mg/kg 체중, 약 0.1 μg 내지 약 1 mg/kg 체중, 약 0.1 μg 내지 약 100 μg/kg 체중, 약 0.1 μg 내지 약 10 μg/kg 체중, 약 0.1 μg 내지 약 1 μg/kg 체중, 약 1 μg 내지 약 100 mg/kg 체중, 약 1 μg 내지 약 50 mg/kg 체중, 약 1 μg 내지 약 10 mg/kg 체중, 약 1 μg 내지 약 1 mg/kg 체중, 약 1 μg 내지 약 100 μg/kg 체중, 약 1 μg 내지 약 50 μg/kg 체중, 약 1 μg 내지 약 10 μg/kg 체중, 약 10 μg 내지 약 100 mg/kg 체중, 약 10 μg 내지 약 50 mg/kg 체중, 약 10 μg 내지 약 10 mg/kg 체중, 약 10 μg 내지 약 1 mg/kg 체중, 약 10 μg 내지 약 100 μg/kg 체중, 약 10 μg 내지 약 50 μg/kg 체중, 약 50 μg 내지 약 100 mg/kg 체중, 약 50 μg 내지 약 50 mg/kg 체중, 약 50 μg 내지 약 10 mg/kg 체중, 약 50 μg 내지 약 1 mg/kg 체중, 약 50 μg 내지 약 100 μg/kg 체중, 약 100 μg 내지 약 100 mg/kg 체중, 약 100 μg 내지 약 50 mg/kg 체중, 약 100 μg 내지 약 10 mg/kg 체중, 약 100 μg 내지 약 1 mg/kg 체중, 약 1 mg 내지 약 100 mg/kg 체중, 약 1 mg 내지 약 50 mg/kg 체중, 약 1 mg 내지 약 10 mg/kg 체중, 약 10 mg 내지 약 100 mg/kg 체중, 약 10 mg 내지 약 50 mg/kg 체중, 약 50 mg 내지 약 100 mg/kg 체중이다.
용량은 매일, 매주, 매월 또는 매년마다 1회 이상, 또는 심지어 2 내지 20 년마다 1회로 제공될 수 있다. 관련 기술분야의 통상의 기술자는 체액 또는 조직에서 표적화가능한 구축물 또는 복합체의 측정된 체류 시간 및 농도를 기준으로 하여 투여를 위한 반복 속도를 용이하게 추정할 수 있다. 본 발명의 투여는 정맥내, 동맥내, 복강내, 근육내, 피하, 흉막내, 척추강내, 강내로, 카테터를 통한 관주에 의해, 또는 직접적인 병변내 주사에 의한 것일 수 있다. 이는 매일 1회 이상, 매주 1회 이상, 매월 1회 이상, 및 매년 1회 이상 투여될 수 있다.
상기 기재는 본 발명의 여러 측면 및 실시양태를 기재한다. 본 특허 출원은 상기 측면 및 실시양태의 모든 조합 및 치환을 고려한다.
실시예
본 발명은 이제 일반적으로 기재되고, 하기 실시예를 참고하여 더욱 용이하게 이해될 것이며, 하기 실시예는 본 발명의 특정 측면 및 실시양태를 기재하기 위한 목적으로만 포함되며, 본 발명을 제한하는 것으로 의도되지 않는다.
실시예 1 - NKG2D-결합 도메인은 NKG2D에 결합한다
NKG2D-결합 도메인은 정제된 재조합 NKG2D에 결합한다
인간, 마우스 또는 시노몰구스 NKG2D 엑토도메인의 핵산 서열을 인간 IgG1 Fc 도메인을 코딩하는 핵산 서열과 융합하고, 발현시키고자 하는 포유류 세포에 도입하였다. 정제 후에, NKG2D-Fc 융합 단백질을 마이크로플레이트의 웰에 흡착시켰다. 웰을 소 혈청 알부민으로 차단하여 비-특이적 결합을 방지한 후에, NKG2D-결합 도메인을 적정하고, NKG2D-Fc 융합 단백질로 미리 흡착된 웰에 첨가하였다. 서양고추냉이 퍼옥시다제에 접합되어 있고, Fc 교차-반응성을 피하기 위해 인간 카파 경쇄를 특이적으로 인식하는 이차 항체를 이용하여 일차 항체 결합을 검출하였다. 서양고추냉이 퍼옥시다제에 대한 기질인 3,3',5,5'-테트라메틸벤지딘 (TMB)을 결합 신호를 가시화하기 위해 웰에 첨가하였고, 흡광도를 450 nM에서 측정하고, 540 nM에서 보정하였다. NKG2D-결합 도메인 클론, 이소타입 대조군 또는 양성 대조군 (SEQ ID NO: 45-48, 또는 이바이오사이언스(eBioscience)에서 입수가능한 항-마우스 NKG2D 클론 MI-6 및 CX-5로부터 선택됨)을 각각의 웰에 첨가하였다.
이소타입 대조군은 재조합 NKG2D-Fc 단백질에 대해 최소의 결합을 나타낸 반면에, 양성 대조군은 재조합 항원에 가장 강력하게 결합하였다. 모든 클론에 의해 생산된 NKG2D-결합 도메인은 인간, 마우스 및 시노몰구스 재조합 NKG2D-Fc 단백질에 걸쳐 결합을 입증하였지만, 클론마다 친화도가 달랐다. 일반적으로, 각각의 항-NKG2D 클론은 유사한 친화도로 인간 (도 3) 및 시노몰구스 (도 4) 재조합 NKG2D-Fc에 결합하였지만, 마우스 (도 5) 재조합 NKG2D-Fc에 대해서는 더 낮은 친화도를 가졌다.
NKG2D-결합 도메인은 NKG2D를 발현하는 세포에 결합한다
EL4 마우스 림프종 세포주는 인간 또는 마우스 NKG2D - CD3 제타 신호전달 도메인 키메라 항원 수용체를 발현하도록 조작되었다. NKG2D-결합 클론, 이소타입 대조군 또는 양성 대조군을 100 nM 농도로 사용하여, EL4 세포 상에서 발현된 세포외 NKG2D를 염색하였다. 항체 결합을 형광단-접합된 항-인간 IgG 이차 항체를 이용하여 검출하였다. 세포를 유동 세포분석법에 의해 분석하였고, 백그라운드 대비 배수 (FOB)를 모 EL4 세포와 비교하여 NKG2D-발현 세포의 평균 형광 강도 (MFI)를 이용하여 계산하였다.
모든 클론에 의해 생산된 NKG2D-결합 도메인은 인간 및 마우스 NKG2D를 발현하는 EL4 세포에 결합하였다. 양성 대조군 항체 (SEQ ID NO:45-48, 또는 이바이오사이언스에서 입수가능한 항-마우스 NKG2D 클론 MI-6 및 CX-5로부터 선택됨)는 최상의 FOB 결합 신호를 제공하였다. 각각의 클론에 대한 NKG2D-결합 친화도는 인간 NKG2D (도 6) 및 마우스 (도 7) NKG2D를 발현하는 세포에서 유사하였다.
실시예 2 - NKG2D-결합 도메인은 천연 리간드가 NKG2D에 결합하는 것을 차단한다
ULBP-6과의 경쟁
재조합 인간 NKG2D-Fc 단백질을 마이크로플레이트의 웰에 흡착시켰고, 비-특이적 결합을 감소시키기 위해 상기 웰을 소 혈청 알부민으로 차단하였다. 포화 농도의 ULBP-6-His-비오틴을 웰에 첨가한 다음, NKG2D-결합 도메인 클론을 첨가하였다. 2-시간 인큐베이션 이후, 웰을 세척하고, NKG2D-Fc 코팅된 웰에 결합된 채로 남아있는 ULBP-6-His-비오틴을 서양고추냉이 퍼옥시다제 및 TMB 기질에 접합된 스트렙타비딘에 의해 검출하였다. 흡광도를 450 nM에서 측정하고, 540 nM에서 보정하였다. 백그라운드를 차감한 후에, NKG2D-결합 도메인과 NKG2D-Fc 단백질의 특이적 결합을 웰에서 NKG2D-Fc 단백질에 대한 결합이 차단된 ULBP-6-His-비오틴의 백분율로부터 계산하였다. 양성 대조군 항체 (SEQ ID NO:45-48로부터 선택됨) 및 다양한 NKG2D-결합 도메인은 ULBP-6이 NKG2D에 결합하는 것을 차단한 반면에, 이소타입 대조군은 ULBP-6과 거의 경쟁하지 않는 것으로 보였다 (도 8).
MICA와의 경쟁
재조합 인간 MICA-Fc 단백질을 마이크로플레이트의 웰에 흡착시켰고, 비-특이적 결합을 감소시키기 위해 웰을 소 혈청 알부민으로 차단하였다. NKG2D-Fc-비오틴을 웰에 첨가한 다음, NKG2D-결합 도메인을 첨가하였다. 인큐베이션 및 세척 이후, MICA-Fc 코팅된 웰에 결합된 채로 남아있는 NKG2D-Fc-비오틴을 스트렙타비딘-HRP 및 TMB 기질을 이용하여 검출하였다. 흡광도를 450 nM에서 측정하고, 540 nM에서 보정하였다. 백그라운드를 차감한 후에, NKG2D-결합 도메인과 NKG2D-Fc 단백질의 특이적 결합을 MICA-Fc 코팅된 웰에 대한 결합이 차단된 NKG2D-Fc-비오틴의 백분율로부터 계산하였다. 양성 대조군 항체 (SEQ ID NO: 45-48로부터 선택됨) 및 다양한 NKG2D-결합 도메인은 MICA가 NKG2D에 결합하는 것을 차단한 반면에, 이소타입 대조군은 MICA와 거의 경쟁하지 않는 것으로 보였다 (도 9).
Rae-1 델타와의 경쟁
재조합 마우스 Rae-1델타-Fc (알앤디 시스템즈(R&D Systems)로부터 구입함)를 마이크로플레이트의 웰에 흡착시켰고, 비-특이적 결합을 감소시키기 위해 웰을 소 혈청 알부민으로 차단하였다. 마우스 NKG2D-Fc-비오틴을 웰에 첨가한 다음, NKG2D-결합 도메인을 첨가하였다. 인큐베이션 및 세척 후에, Rae-1델타-Fc 코팅된 웰에 결합된 채로 남아있는 NKG2D-Fc-비오틴을 스트렙타비딘-HRP 및 TMB 기질을 이용하여 검출하였다. 흡광도를 450 nM에서 측정하고, 540 nM에서 보정하였다. 백그라운드를 차감한 후에, NKG2D-결합 도메인과 NKG2D-Fc 단백질의 특이적 결합을 Rae-1델타-Fc 코팅된 웰에 대한 결합이 차단된 NKG2D-Fc-비오틴의 백분율로부터 계산하였다. 양성 대조군 (SEQ ID NO:45-48, 또는 이바이오사이언스에서 입수가능한 항-마우스 NKG2D 클론 MI-6 및 CX-5로부터 선택됨) 및 다양한 NKG2D-결합 도메인 클론은 Rae-1델타가 마우스 NKG2D에 결합하는 것을 차단한 반면에, 이소타입 대조군 항체는 Rae-1델타와 거의 경쟁하지 않는 것으로 보였다 (도 10).
실시예 3 - NKG2D-결합 도메인 클론은 NKG2D를 활성화시킨다
인간 및 마우스 NKG2D의 핵산 서열을 CD3 제타 신호전달 도메인을 코딩하는 핵산 서열에 융합시켜 키메라 항원 수용체 (CAR) 구축물을 수득하였다. 이어서, NKG2D-CAR 구축물을 깁슨(Gibson) 조립체를 이용하여 레트로바이러스 벡터에 클로닝시키고, 레트로바이러스 생산을 위해 expi293 세포에 형질감염시켰다. EL4 세포를 8 μg/mL 폴리브렌과 함께 NKG2D-CAR을 함유하는 바이러스로 감염시켰다. 감염 24 시간 후에, EL4 세포에서 NKG2D-CAR의 발현 수준을 유동 세포분석법에 의해 분석하고, 세포 표면 상에서 높은 수준의 NKG2D-CAR을 발현하는 클론을 선택하였다.
NKG2D-결합 도메인이 NKG2D를 활성화시키는지 여부를 결정하기 위해, 이들을 마이크로플레이트의 웰에 흡착시켰고, NKG2D-CAR EL4 세포를 항체 단편-코팅된 웰 상에서 4 시간 동안 브레펠딘-A 및 모넨신의 존재하에 배양하였다. NKG2D 활성화에 대한 지표인 세포내 TNFα 생산을 유동 세포분석법에 의해 검정하였다. TNFα-양성 세포의 백분율을 양성 대조군으로 처리된 세포에 대해 정규화하였다. 모든 NKG2D-결합 도메인은 인간 NKG2D (도 11) 및 마우스 NKG2D (도 12) 둘 다를 활성화시켰다.
실시예 4 - NKG2D-결합 도메인은 NK 세포를 활성화시킨다
일차 인간 NK 세포
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. NK 세포 (CD3- CD56+)를 자성 비드에 의한 음성 선택을 이용하여 PBMC로부터 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >95%이었다. 이어서, 단리된 NK 세포를 NKG2D-결합 도메인이 흡착되어 있는 마이크로플레이트의 웰로 옮기기 전에, 이들을 100 ng/mL IL-2를 함유하는 배지에서 24-48 시간 동안 배양하였고, 형광단-접합된 항-CD107a 항체, 브레펠딘-A, 및 모넨신을 함유하는 배지에서 배양하였다. 배양 후에, NK 세포를 CD3, CD56 및 IFN-γ에 대한 형광단-접합된 항체를 사용하여 유동 세포분석법에 의해 검정하였다. CD107a 및 IFN-γ 염색을 CD3- CD56+ 세포에서 분석하여, NK 세포 활성화를 평가하였다. CD107a/IFN-γ 이중-양성 세포에서의 증가는 1개의 수용체보다는 2개의 활성화 수용체의 결속을 통한 보다 양호한 NK 세포 활성화를 나타낸다. NKG2D-결합 도메인 및 양성 대조군 (SEQ ID NO:45-48로부터 선택됨)은 이소타입 대조군에 비해 CD107a+ 및 IFN-γ+가 되는 NK 세포의 높은 백분율을 나타내었다 (도 13 & 도 14는 NK 세포 준비를 위해 상이한 공여자의 PBMC를 각각 사용하는 2회의 독립적인 실험으로부터의 데이터를 나타냄).
일차 마우스 NK 세포
비장을 C57Bl/6 마우스로부터 입수하였고, 70 μm 세포 스트레이너를 통해 분쇄하여, 단일 세포 현탁액을 수득하였다. 세포를 펠렛화하고, ACK 용해 완충제 (써모 피셔 사이언티픽(Thermo Fisher Scientific)으로부터 구입함, #A1049201; 155mM 염화암모늄, 10mM 중탄산칼륨, 0.01mM EDTA) 중에 재현탁시켜, 적혈구를 제거하였다. NK 세포 단리를 위해 수확하고 준비하기 전에 남아있는 세포를 100 ng/mL hIL-2와 함께 72 시간 동안 배양하였다. 이어서, 자성 비드를 사용하는 음성 고갈 기술을 이용하여 비장 세포로부터 NK 세포 (CD3-NK1.1+)를 전형적으로 >90% 순도로 단리하였다. 정제된 NK 세포를 NKG2D-결합 도메인이 흡착되어 있는 마이크로플레이트의 웰로 옮기기 전에, 이들을 100 ng/mL mIL-15를 함유하는 배지에서 48 시간 동안 배양하고, 형광단-접합된 항-CD107a 항체, 브레펠딘-A, 및 모넨신을 함유하는 배지에서 배양하였다. NKG2D-결합 도메인-코팅된 웰에서 배양한 후에, NK 세포를 CD3, NK1.1 및 IFN-γ에 대한 형광단-접합된 항체를 사용하여 유동 세포분석법에 의해 검정하였다. CD107a 및 IFN-γ 염색을 CD3- NK1.1+ 세포에서 분석하여 NK 세포 활성화를 평가하였다. CD107a/IFN-γ 이중-양성 세포에서의 증가는 1개의 수용체보다는 2개의 활성화 수용체의 결속을 통한 보다 양호한 NK 세포 활성화를 나타낸다. NKG2D-결합 도메인 및 양성 대조군 (이바이오사이언스에서 입수가능한 항-마우스 NKG2D 클론 MI-6 및 CX-5로부터 선택됨)은 이소타입 대조군에 비해 CD107a+ 및 IFN-γ+가 되는 NK 세포의 높은 백분율을 나타내었다 (도 15 & 도 16은 NK 세포 준비를 위해 상이한 마우스를 각각 사용하는 2회의 독립적인 실험으로부터의 데이터를 나타냄).
실시예 5 - NKG2D-결합 도메인은 표적 종양 세포의 세포독성을 가능하게 한다
인간 및 마우스 일차 NK 세포 활성화 검정은 NKG2D-결합 도메인과 함께 인큐베이션한 후에 NK 세포 상의 증가된 세포독성 마커를 입증한다. 이것이 증가된 종양 세포 용해로 해석되는지 여부를 다루기 위해, 각각의 NKG2D-결합 도메인을 단일특이적 항체로 발달시키는 세포-기반 검정을 이용하였다. Fc 영역은 1개의 표적화 아암으로서 사용된 반면에, Fab 영역 (NKG2D-결합 도메인)은 또 다른 표적화 아암으로서 작용하여, NK 세포를 활성화시켰다. 인간 기원이며 높은 수준의 Fc 수용체를 발현하는 THP-1 세포를 종양 표적으로서 사용하였고, 퍼킨 엘머(Perkin Elmer) DELFIA 세포독성 키트를 사용하였다. THP-1 세포를 BATDA 시약으로 표지화하고, 배양 배지에서 105/mL로 재현탁시켰다. 이어서, 표지화된 THP-1 세포를 마이크로타이터 플레이트의 웰에서 37℃에서 3 시간 동안 NKG2D 항체 및 단리된 마우스 NK 세포와 조합하였다. 인큐베이션 후에, 20 μl의 배양물 상청액을 제거하고, 200 μl의 유로퓸 용액과 혼합하고, 어두운 곳에서 진탕하면서 15 분 동안 인큐베이션하였다. 시간-분해 형광 모듈을 구비한 페라스타(PheraStar) 플레이트 판독기에 의해 시간에 걸쳐 형광을 측정하였고 (여기 337nm, 방출 620nm), 특이적 용해를 키트 지침에 따라 계산하였다.
양성 대조군, ULBP-6 (NKG2D에 대한 천연 리간드)은 마우스 NK 세포에 의한 THP-1 표적 세포의 증가된 특이적 용해를 나타내었다. NKG2D 항체 또한 THP-1 표적 세포의 증가된 특이적 용해를 나타낸 반면에, 이소타입 대조군 항체는 감소된 특이적 용해를 나타내었다. 점선은 항체를 첨가하지 않고 마우스 NK 세포에 의한 THP-1 세포의 특이적 용해를 나타낸다 (도 17).
실시예 6 - NKG2D 항체는 높은 열안정성을 나타낸다
NKG2D-결합 도메인의 융점을 시차 주사 형광측정법을 이용하여 검정하였다. 외삽된 겉보기 융점은 전형적인 IgG1 항체에 비해 높았다 (도 18).
실시예 7 - 다중-특이적 결합 단백질은 NK 세포를 활성화시키는 증진된 능력을 제시한다
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. NK 세포 (CD3- CD56+)를 자성 비드에 의한 음성 선택을 이용하여 PBMC로부터 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >95%이었다. 이어서 단리된 NK 세포를 다중-특이적 및 이중특이적 결합 단백질이 각각 흡착되어 있는 마이크로플레이트의 웰로 옮기기 전에, 이들을 100 ng/mL IL-2를 함유하는 배지에서 24-48 시간 동안 배양하고, 형광단-접합된 항-CD107a 항체, 브레펠딘-A, 및 모넨신을 함유하는 배지에서 배양하였다. 배양 이후, NK 세포를 CD3, CD56 및 IFN-γ에 대한 형광단-접합된 항체를 이용하여 유동 세포분석법에 의해 검정하였다. CD107a 및 IFN-γ 염색을 CD3- CD56+ 세포에서 분석하여 NK 세포 활성화를 평가하였다. CD107a/IFN-γ 이중-양성 세포에서의 증가는 보다 양호한 NK 세포 활성화를 나타낸다. AL2.2는 HER2-결합 도메인 (트라스투주맙), NKG2D-결합 도메인 (ULBP-6) 및 인간 IgG1 Fc 도메인을 함유하는 다중-특이적 결합 단백질이다. 이는 트라스투주맙 동종이량체 및 ULBP-6-Fc 동종이량체로부터 출발하여 조절된 Fab-아암 교환 반응 (cFAE)을 통해 제조되었다 (Labrijn et al. Nature Protocols 9, 2450-2463 참고). SC2.2는 트라스투주맙으로부터 유래된 scFv, 및 ULBP-6를 포함하는 단일 쇄 단백질 (SEQ ID NO:93)이다.
CD107a 및 IFN-γ 염색의 분석은, 이소타입 대조군 IgG는 NK 세포의 활성화를 나타내지 않는 반면에, 이중특이적 단백질에 비해 다중-특이적 결합 단백질로 자극된 후에 CD107a+ 및 IFN-γ+가 되는 NK 세포의 보다 높은 백분율을 나타내며, 이는 단지 1개 (NKG2D)에 비해 2개의 활성화 수용체 (NKG2D 및 CD16)의 결속을 통한 더욱 강력한 NK 세포 활성화를 입증한다 (도 19). NK 세포 활성화에서 이러한 증가는 더욱 강력한 종양 세포 사멸로 해석되는 것으로 예상된다.
실시예 8 - 다중-특이적 결합 단백질은 표적 종양 세포에 대해 증진된 세포독성을 제시한다
일차 인간 NK 세포 세포독성 검정
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. NK 세포 (CD3- CD56+)를 자성 비드에 의한 음석 선택을 이용하여 PBMC로부터 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >95%이었다. 이어서, NK 세포를 세포독성 검정에서 사용하기 전에 100ng/mL IL-2를 함유하는 배지에서 밤새 배양하였다. 다음 날, NK 세포를 신선한 배양 배지 중에서 5x105/mL로 재현탁시켰다. 인간 유방암 세포 SkBr-3 세포를 퍼킨 엘머 DELFIA 세포독성 키트에 따라 BATDA 시약으로 표지화하고, 배양 배지 중에서 5x104/mL로 재현탁시켰다. 다중-특이적 결합 단백질의 다양한 희석액을 배양 배지로 만들었다. 이어서, NK 세포, 표지화된 SkBr-3 세포 및 다중-특이적 결합 단백질을 마이크로타이터 플레이트의 웰에서 조합하고, 37℃에서 3 시간 동안 인큐베이션하였다. 인큐베이션 후에, 20 μl의 배양물 상청액을 제거하고, 200 μl의 유로퓸 용액과 혼합하고, 어두운 곳에서 진탕하면서 15 분 동안 인큐베이션하였다. 시간-분해 형광 모듈을 구비한 페라스타 플레이트 판독기에 의해 시간에 걸쳐 형광을 측정하였고 (여기 337nm, 방출 620nm), 특이적 용해를 키트 지침에 따라 계산하였다. AL0.2는 HER2-결합 도메인 (트라스투주맙), NKG2D-결합 도메인 (SEQ ID NO: 1-44로부터 선택됨) 및 인간 IgG1 Fc 도메인을 함유하는 다중-특이적 결합 단백질이다. 이는 트라스투주맙 동종이량체 및 항-NKG2D 동종이량체로부터 출발하여 조절된 Fab-아암 교환 반응 (cFAE)을 통해 제조되었다. AL0.2si는 AL0.2를 기반으로 하고, CD16 결합을 제거하는 Fc 도메인에서의 추가의 D265A 돌연변이를 함유한다. 트라스투주맙-si는 트라스투주맙을 기반으로 하고, CD16 결합을 제거하는 Fc 도메인에서의 추가의 D265A 돌연변이를 함유한다. AL2.2는 HER2-결합 도메인 (트라스투주맙), NKG2D-결합 도메인 (ULBP-6) 및 인간 IgG1 Fc 도메인을 함유하는 다중-특이적 결합 단백질이다. SC2.2는 트라스투주맙으로부터 유래된 scFv, 및 ULBP-6을 포함하는 단일 쇄 단백질이다.
AL0.2는 용량 의존성 방식으로 트라스투주맙에 비해 인간 NK 세포에 의한 SkBr-3 표적 세포의 증진된 용해를 나타내었고, EC50에서 0.0311의 p 값을 가졌다 (도 20). AL0.2si (도 21) 및 트라스투주맙-si (도 22)는 AL0.2에 비해 SkBr-3 세포의 효능 및 최대 특이적 용해 둘 다에서의 감소를 나타내었고, EC50에서 각각 0.0002 및 0.0001의 p-값을 가졌다 (도 21-22). 또한, AL0.2는 용량 의존성 방식으로 AL2.2에 비해 SkBr-3 세포의 증진된 용해를 나타내었다 (도 23). 이소타입 대조군 IgG는 시험한 임의의 농도에서 특이적 용해의 증가를 나타내지 않았다. 이와 함께, 데이터는 NK 세포 상의 2개의 활성화 수용체 및 1개의 종양 항원에 결속하는 다중-특이적 결합 단백질이 NK 세포 상의 1개의 활성화 수용체 및 1개의 종양 항원에 결속하는 이중특이적 단백질에 비해 인간 NK 세포에 의한 종양 세포의 더욱 강력한 사멸을 유도함을 입증하였다.
일차 마우스 NK 세포 세포독성 검정
비장을 C57Bl/6 마우스로부터 입수하였고, 70 μm 세포 스트레이너를 통해 분쇄하여, 단일 세포 현탁액을 수득하였다. 세포를 펠렛화하고, ACK 용해 완충제 (써모 피셔 사이언티픽으로부터 구입함, #A1049201; 155mM 염화암모늄, 10mM 중탄산칼륨, 0.01mM EDTA) 중에 재현탁시켜, 적혈구를 제거하였다. NK 세포 단리를 위해 수확하고 준비하기 전에 남아있는 세포를 100 ng/mL hIL-2와 함께 72 시간 동안 배양하였다. 이어서, 자성 비드에 의한 음성 고갈 기술을 이용하여 비장 세포로부터 NK 세포 (CD3-NK1.1+)를 전형적으로 >90% 순도로 단리하였다. 정제된 NK 세포를 세포독성 검정을 위해 106/mL에서 배양 배지에 재현탁시키기 전에 100 ng/mL mIL-15를 함유하는 배지에서 48 시간 동안 배양하였다. RMA-HER2-dTomato, HER2 및 dTomato를 발현하도록 조작된 마우스 종양 세포주, 및 그의 대조군 대응물, zsGreen을 발현하는 RMA 세포를 표적으로서 사용하였다. 이들을 배양 배지 중에서 2x105/mL로 재현탁시키고, 마이크로플레이트의 웰에 1:1 비로 시딩하였다. 다중-특이적 단백질의 희석액을 배양 배지로 만들고, NK 세포와 함께 RMA 세포에 첨가하였다. 밤새 37℃에서 5% CO2하에 인큐베이션한 후에, RMA-HER2-dTomato 및 RMA-zsGreen 세포의 백분율을 형광 리포터를 이용하여 유동 세포분석법에 의해 결정하여, 2가지 세포 유형을 확인하였다. 특이적 표적 세포 사멸 = (1- ((처리 그룹에서 % RMA-Ca2T-dTomato 세포 * 대조군 그룹에서 % RMA-zsGreen 세포)/(대조군 그룹에서 % RMA-Ca2T-dTomato 세포 * 처리 그룹에서 % RMA-zsGreen 세포))) * 100%.
AL2.2는 SC2.2 (도 25) 및 트라스투주맙 (도 24)에 비해 종양 표적에 대한 NK 세포 반응을 재지정하는데 더욱 강력하다. 대조군 단백질은 특이적 표적 사멸에 대해 거의 효과를 나타내지 않았다. 이들 데이터는, NK 세포 상의 2개의 활성화 수용체 및 1개의 종양 항원에 결속하는 다중-특이적 결합 단백질이 NK 세포 상의 1개의 활성화 수용체 및 1개의 종양 항원에 결속하는 이중특이적 단백질에 비해 마우스 NK 세포에 의한 종양 세포의 더욱 강력한 사멸을 유도함을 입증한다.
실시예 9 - 다중-특이적 결합 단백질은 NKG2D에 결합한다
EL4 마우스 림프종 세포주를 도 1에 제시된 바와 같이 각각 NKG2D-결합 도메인, HER2-결합 도메인 및 CD16에 결합하는 Fc 도메인을 함유하는 인간 NKG2D 삼중특이적 결합 단백질 (TriNKET)을 발현하도록 조작하였고, EL4 세포 상에서 발현된 세포외 NKG2D에 대한 그들의 친화도에 대해 시험하였다. 다중-특이적 결합 단백질과 NKG2D의 결합을 형광단-접합된 항-인간 IgG 이차 항체를 이용하여 검출하였다. 세포를 유동 세포분석법에 의해 분석하였고, 백그라운드 대비 배수 (FOB)를 모 EL4 세포와 비교하여 NKG2D-발현 세포의 평균 형광 강도 (MFI)를 이용하여 계산하였다.
시험한 TriNKET에는 HER2-TriNKET-C26 (ADI-28226 및 HER2-결합 도메인) 및 HER2-TriNKET-F04 (ADI-29404 및 HER2-결합 도메인)이 포함된다. 시험한 분자에서 사용된 HER2-결합 도메인은 트라스투주맙의 중쇄 가변 도메인 및 경쇄 가변 도메인으로 구성되었다.
데이터는 본 개시내용의 HER2 표적화 TriNKET가 NKG2D에 결합함을 제시한다 (도 26).
실시예 10 - 다중-특이적 결합 단백질은 인간 종양 항원에 결합한다
삼중특이적-결합 단백질은 HER2에 결합한다
HER2를 발현하는 인간 암 세포주를 이용하여 HER2 표적화 TriNKET와 종양 연관 항원의 결합을 검정하였다. 신세포 암종 세포주 786-O는 낮은 수준의 HER2를 발현한다. TriNKET 및 임의적으로 모 항-HER2 모노클로날 항체 (트라스투주맙)를 상기 세포와 함께 인큐베이션하였고, 형광단-접합된 항-인간 IgG 이차 항체를 이용하여 결합을 검출하였다. 세포를 유동 세포분석법에 의해 분석하였고, 백그라운드 대비 배수 (FOB)를 이차 항체 대조군에 대해 정규화된 TriNKET 및 트라스투주맙으로부터의 평균 형광 강도 (MFI)를 이용하여 계산하였다. HER2-TriNKET-C26 및 HER2-TriNKET-F04는 트라스투주맙과 비교할 때 786-O 세포 상에서 발현된 HER2에 대해 유사한 수준의 결합을 나타낸다 (도 27a).
인간 HER2에 의해 형질도입된 RMA 세포를 사용하여 HER2 표적화 TriNKET에 의한 세포 발현된 인간 HER2에 대한 결합을 시험하였다. TriNKET를 20 μg/mL로 희석하였고, 형광단 접합된 항-인간 IgG 이차 항체를 이용하여 결합을 검출하였다. 세포를 유동 세포분석법에 의해 분석하였고, 세포 발현된 HER2에 대한 결합을 이소타입 염색된 및 비염색된 세포 집단과 비교하였다. 도 27b 및 도 27c는 2가지 구별되는 NKG2D 결합 도메인을 함유하지만 동일한 HER-결합 도메인을 갖는 TriNKET의 프로파일 (도 27b에 제시된 C26.2 TriNKET와 HER2-결합 부위의 결합 프로파일; 도 27c에 제시된 F04.2 TriNKET와 HER2-결합 부위의 결합 프로파일)을 제시한다. 두 TriNKET 모두 RMA 세포 상의 세포 표면 HER2에 대해 유사한 수준의 결합을 나타낸다.
실시예 11 - 다중-특이적 결합 단백질은 NK 세포를 활성화시킨다
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. NK 세포 (CD3- CD56+)를 자성 비드에 의한 음석 선택을 이용하여 PBMC로부터 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >90%이었다. 단리된 NK 세포를 활성화를 위해 100ng/mL IL-2를 함유하는 배지에서 배양하거나 또는 시토카인 없이 밤새 휴지시켰다. IL-2-활성화된 NK 세포를 활성화 이후 24-48 시간 내에 사용하였다.
종양 항원을 발현하는 인간 암 세포를 수확하고, 배양 배지 중에서 2x106/mL로 재현탁시켰다. 종양 항원을 표적으로 하는 모노클로날 항체 또는 TriNKET를 배양 배지에서 희석하였다. 활성화된 NK 세포를 수확하고, 세척하고, 배양 배지 중에서 2x106/mL로 재현탁시켰다. 이어서, 암 세포를 IL-2의 존재하에 모노클로날 항체/TriNKET 및 활성화된 NK 세포와 혼합하였다. 브레펠딘-A 및 모넨신 또한 혼합된 배양물에 첨가하여, 세포내 시토카인 염색을 위해 세포로부터 단백질 수송을 차단하였다. 형광단-접합된 항-CD107a를 혼합된 배양물에 첨가하고, CD3, CD56 및 IFN-γ에 대한 형광단-접합된 항체를 이용하여 FACS 분석을 위한 샘플을 준비하기 전에, 배양물을 4 시간 동안 인큐베이션하였다. CD107a 및 IFN-γ 염색을 CD3- CD56+ 세포에서 분석하여 NK 세포 활성화를 평가하였다. CD107a/IFN-γ 이중-양성 세포에서의 증가는 1개의 수용체보다는 2개의 활성화 수용체의 결속을 통한 보다 양호한 NK 세포 활성화를 나타낸다.
TriNKET는 각각 HER2-발현 SkBr-3 세포 (도 28a), Colo201 세포 (도 28b) 및 HCC1954 세포 (도 28c)와 공동-배양된 인간 NK 세포의 활성화를 매개하고, 이는 CD107a 탈과립화 및 IFN-γ 생산의 증가에 의해 나타난다. SkBr-3 세포 및 HCC1954 세포는 높은 수준의 표면 HER2 발현을 갖고, Colo201은 중간 HER2 발현을 갖는다. 모노클로날 항체 트라스투주맙과 비교하여, TriNKET는 인간 암 세포의 존재하에 인간 NK 세포의 우수한 활성화를 나타낸다. NK 세포 단독, NK 세포 + SkBr-3 세포는 음성 대조군으로서 사용된다.
TriNKET (C26-TriNKET-HER2 및 F04-TriNKET-HER2)는 CD33-발현 인간 AML Mv4-11 세포와 공동-배양된 인간 NK 세포의 활성화를 매개하고, 이는 CD107a 탈과립화 및 IFN-γ 생산의 증가를 나타내었다. 모노클로날 항-CD33 항체에 비해, TriNKET (C26-TriNKET-HER2 및 F04-TriNKET-HER2)는 HER2를 발현하는 인간 암 세포의 존재하에 인간 NK 세포의 우수한 활성화를 나타내었다 (도 28a-28c).
실시예 12 - 삼중특이적-결합 단백질은 표적 암 세포의 세포독성을 가능하게 한다
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. NK 세포 (CD3- CD56+)를 자성 비드에 의한 음석 선택을 이용하여 PBMC로부터 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >90%이었다. 단리된 NK 세포를 활성화를 위해 100ng/mL IL-2를 함유하는 배지에서 배양하거나 또는 시토카인 없이 밤새 휴지시켰다. IL-2-활성화된 또는 휴지된 NK 세포를 다음 날 세포독성 검정에서 사용하였다.
인간 NK 세포가 TriNKET의 존재하에 암 세포를 용해시키는 능력을 시험하기 위해, 프로메가(Promega)로부터의 시토 톡스(cyto Tox) 96 비-방사선 활성 세포독성 검정 (G1780)을 제조자의 지침에 따라 이용하였다. 간략히, 종양 항원을 발현하는 인간 암 세포를 수확하고, 세척하고, 배양 배지 중에서 1-2x105/mL로 재현탁시켰다. 휴지된 및/또는 활성화된 NK 세포를 수확하고, 세척하고, 암 세포에서와 동일한 배양 배지 중에서 105-2.0x106/mL로 재현탁시켰다. 96 웰 플레이트의 각각의 웰에서, 암 세포 상에서 발현된 종양 항원을 표적으로 하는 TriNKET이 있거나 없이 50 μl의 암 세포 현탁액을 50 μl의 NK 세포 현탁액과 혼합하였다. 37℃에서 5% CO2하에 3 시간 15 분 동안 인큐베이션한 후에, 10x 용해 완충제를 각각 최대 용해 및 음성 시약 대조군으로서 암 세포만을 함유하는 웰에 및 배지만을 함유하는 웰에 첨가하였다. 이어서, 플레이트를 추가 45 분 동안 다시 인큐베이터에 두어서, 총 4 시간의 인큐베이션에 도달하였다. 이어서, 세포를 펠렛화하고, 배양물 상청액을 새로운 96 웰 플레이트로 옮기고, 발달을 위해 기질과 혼합하였다. 새로운 플레이트를 실온에서 30 분 동안 인큐베이션하고, 흡광도를 스펙트라맥스(SpectraMax) i3x 상에서 492 nm에서 판독하였다. 암 세포의 특이적 용해의 백분율을 다음과 같이 계산하였다: % 특이적 용해 = ((실험적 용해 - NK 세포 단독으로부터 자발적 용해 - 암 세포 단독으로부터 자발적 용해) / (최대 용해 - 음성 시약 대조군)) x 100%.
TriNKET는 트라스투주맙, 항-HER2 모노클로날 항체의 세포독성 활성에 비해 낮은 표면 발현을 갖는 표적에 대한 NK 세포 세포독성을 증진시킨다. 휴지된 인간 NK 세포를 높은 HER2-발현 SkBr 종양 세포 및 낮은 HER2-발현 786-O 암 세포와 혼합하였고, 높은 및 낮은 HER2-발현 암 세포에 대한 휴지된 인간 NK 세포의 세포독성 활성을 용량-반응성 방식으로 증진시키는 TriNKET의 능력을 검정하였다. 도 29a 및 도 29b에서 점선은 TriNKET의 부재하에 암 세포에 대한 휴지된 NK 세포의 세포독성 활성을 나타낸다. 도 29b에 제시된 바와 같이, 활성화된 인간 NK 세포를 낮은 HER2-발현 786-O 세포 및 TriNKET (예를 들어, HER2에 대한 결합 도메인을 포함하는 CD26-TriNKET 및 F04-TriNKET)와 혼합할 때, 암 세포에 대한 활성화된 인간 NK 세포의 용량-반응성 세포독성 활성이 관찰되었다.
실시예 13 - NKG2D와 CD16을 가교시킴으로써 인간 NK 세포의 상승작용적 활성화
일차 인간 NK 세포 활성화 검정
말초 혈액 단핵 세포 (PBMC)를 밀도 구배 원심분리를 이용하여 말초 인간 혈액 연막으로부터 단리하였다. 음성 자성 비드 (스템셀(StemCell) # 17955)를 사용하여 NK 세포를 PBMC로부터 정제하였다. NK 세포는 유동 세포분석법에 의해 결정된 바와 같이 >90% CD3-CD56+이었다. 이어서, 세포를 활성화 검정에서 사용하기 전에 100 ng/mL hIL-2 (페프로테크(Peprotech) #200-02)를 함유하는 배지에서 48 시간 동안 확장시켰다. 항체를 96-웰 편평 바닥 플레이트 상에 100 μl 멸균 PBS 중 2 μg/ml (항-CD16, 바이오레전드(Biolegend) # 302013) 및 5 μg/mL (항-NKG2D, 알앤디 #MAB139)의 농도로 밤새 4℃에서 코팅한 후, 웰을 철저히 세척하여 과잉의 항체를 제거하였다. 탈과립화를 평가하기 위해, IL-2-활성화된 NK 세포를 100 ng/mL hIL2 및 1 μg/mL APC-접합된 항-CD107a mAb (바이오레전드 # 328619)로 보충된 배양 배지 중에서 5x105 세포/ml로 재현탁시켰다. 이어서, 1x105 세포/웰을 항체 코팅된 플레이트 상에 첨가하였다. 단백질 수송 억제제 브레펠딘 A (BFA, 바이오레전드 # 420601) 및 모넨신 (바이오레전드 # 420701)을 각각 1:1000 및 1:270의 최종 희석으로 첨가하였다. 플레이팅된 세포를 37℃에서 5% CO2하에 4 시간 동안 인큐베이션하였다. IFN-γ의 세포내 염색을 위해, NK 세포를 항-CD3 (바이오레전드 #300452) 및 항-CD56 mAb (바이오레전드 # 318328)로 표지화하고, 후속적으로 고정하고, 투과화시키고, 항-IFN-γ mAb (바이오레전드 # 506507)로 표지화하였다. NK 세포를 살아있는 CD56+CD3- 세포 상에 게이팅한 후에 유동 세포분석법에 의해 CD107a 및 IFN-γ의 발현에 대해 분석하였다.
수용체 조합물의 상대적인 효능을 연구하기 위해, 플레이트-결합된 자극에 의한 NKG2D 또는 CD16의 가교 및 두 수용체의 공동 가교를 수행하였다. 도 30 (도 30a-30c)에 제시된 바와 같이, CD16 및 NKG2D의 조합된 자극은 매우 상승된 수준의 CD107a (탈과립화) (도 30a) 및/또는 IFN-γ 생산 (도 30b)을 나타내었다. 점선은 각각의 수용체의 개별 자극의 상가적 효과를 나타낸다.
항-CD16, 항-NKG2D, 또는 두 모노클로날 항체의 조합물에 의한 플레이트-결합된 자극 4 시간 후에 IL-2-활성화된 NK 세포의 CD107a 수준 및 세포내 IFN-γ 생산을 분석하였다. 그래프는 평균 (n = 2) ± SD를 나타낸다. 도 19a는 CD107a의 수준을 입증하고; 도 30b는 IFNγ의 수준을 입증하고; 도 30c는 CD107a 및 IFN-γ의 수준을 입증한다. 도 30a-30c에 제시된 데이터는 5명의 상이한 건강한 공여자를 이용한 5회의 독립적인 실험을 대표한다.
IL-2-활성화된 NK 세포의 CD107a 탈과립화 및 세포내 IFN-γ 생산을 트라스투주맙, 항-NKG2D, 또는 트라스투주맙 및 항-NKG2D 항체의 결합 도메인으로부터 유래된 TriNKET에 의한 플레이트-결합된 자극 4 시간 후에 분석하였다 (도 31). 모든 경우에, 시험한 항체는 인간 IgG1 이소타입이었다. 그래프는 평균 (n = 2) ± SD를 나타낸다.
실시예 14 - TriNKET의 성질
세포-발현된 인간 NKG2D에 결합하는 TriNKET의 평가
인간 NKG2D에 의해 형질도입된 EL4 세포를 사용하여 세포-발현된 인간 NKG2D에 대한 결합을 시험하였다. TriNKET를 20μg/mL로 희석한 다음, 계열 희석하였다. mAb 또는 TriNKET 희석액을 이용하여 세포를 염색하고, TriNKET 또는 mAb의 결합을 형광단-접합된 항-인간 IgG 이차 항체를 이용하여 검출하였다. 세포를 유동 세포분석법에 의해 분석하고, 결합 MFI를 이차 항체 대조군에 대해 정규화하여, 백그라운드 값에 비한 배수를 수득하였다.
세포-발현된 인간 암 항원에 결합하는 TriNKET의 평가
HER2를 발현하는 인간 암 세포주를 사용하여, 상이한 NKG2D 표적화 클론으로부터 유래된 TriNKET의 종양 항원 결합을 평가하였다. 인간 신세포 암종 세포주 786-O는 낮은 수준의 HER2를 발현하고, 이를 이용하여 세포-발현된 HER2에 결합하는 TriNKET를 평가하였다. TriNKET를 20 μg/mL로 희석하였고, 각각의 세포와 함께 인큐베이션하였다. TriNKET의 결합을 형광단-접합된 항-인간 IgG 이차 항체를 이용하여 검출하였다. 세포를 유동 세포분석법에 의해 분석하였고, HER2를 발현하는 세포에 대한 결합 MFI를 이차 항체 대조군에 대해 정규화하여, 백그라운드 값에 비한 배수를 수득하였다.
인간 HER2-양성 암 세포주의 항체 결합 능력의 결정
HER2-양성 인간 암 세포주의 항체 결합 능력 (ABC)을 측정하였다. 방스 랩(Bangs Lab)으로부터의 콴텀 심플리 셀룰러 키트(Quantum Simply Cellular kit)를 사용하였고 (#815), 항체 표지화된 비드의 제조를 위해 제조자의 지침을 따랐다. 간략히, 4개의 비드 집단 각각을 포화량의 항-HER2 항체로 염색하고, 세포 집단 또한 포화량의 동일한 항체로 염색하였다. 샘플 데이터를 각각의 비드 집단, 뿐만 아니라 세포 집단에 대해 획득하였다. 상기 키트에 제공된 퀵칼(QuickCal) 워크시트를 각각의 세포주에 대해 표준 곡선의 생성 및 ABC 값의 외삽을 위해 사용하였다.
TriNKET에 의한 일차 NK 세포의 활성화
PBMC를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. 단리된 PBMC를 세척하고, NK 세포 단리를 위해 준비하였다. NK 세포를 자성 비드에 의한 음성 선택 기술을 이용하여 단리하였고; 단리된 NK 세포의 순도는 전형적으로 >90% CD3-CD56+이었다. 단리된 NK 세포를 활성화를 위해 100ng/mL IL-2를 함유하는 배지에서 배양하거나 또는 시토카인 없이 밤새 휴지시켰다. IL-2-활성화된 NK 세포를 24-48 시간 이후 사용하였고; 휴지된 NK 세포는 항상 정제 다음 날에 사용하였다.
관심 암 표적을 발현하는 인간 암 세포주를 배양물로부터 수확하였고, 세포를 2x106/mL로 조정하였다. 관심 암 표적을 표적으로 하는 모노클로날 항체 또는 TriNKET를 배양 배지에서 희석하였다. 휴지된 및/또는 활성화된 NK 세포를 배양물로부터 수확하였고, 세포를 세척하고, 배양 배지 중에서 2x106/mL로 재현탁시켰다. IL-2, 및 형광단-접합된 항-CD107a를 배양 활성화를 위해 NK 세포에 첨가하였다. 브레펠딘-A 및 모넨신을 배양 배지에 희석하여, 세포내 시토카인 염색을 위해 세포로부터 단백질 수송을 차단하였다. 96-웰 플레이트에 50 μl의 종양 표적, mAb/TriNKET, BFA/모넨신, 및 NK 세포를 200 μl의 총 배양물 부피를 위해 첨가하였다. 샘플을 FACS 분석을 위해 준비하기 전에, 플레이트를 4 시간 동안 배양하였다.
배양 활성화 4 시간 후에, CD3, CD56 및 IFNγ에 대한 형광단-접합된 항체를 사용하여 유동 세포분석법에 의한 분석을 위해 세포를 준비하였다. CD107a 및 IFNγ 염색을 CD3-CD56+ 집단에서 분석하여 NK 세포 활성화를 평가하였다.
일차 인간 NK 세포 세포독성 검정
PBMC를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. 단리된 PBMC를 세척하고, NK 세포 단리를 위해 준비하였다. NK 세포를 자성 비드에 의한 음성 선택 기술을 이용하여 단리하였고, 단리된 NK 세포의 순도는 전형적으로 >90% CD3-CD56+이었다. 단리된 NK 세포를 100ng/mL IL-2를 함유하는 배지에서 배양하거나 또는 시토카인 없이 밤새 휴지시켰다. 다음 날, IL-2-활성화된 또는 휴지된 NK 세포를 세포독성 검정에서 사용하였다.
시토 톡스 96 LHD 방출 검정:
인간 NK 세포가 종양 세포를 용해시키는 능력을 프로메가로부터의 시토 톡스 96 비-방사선 활성 세포독성 검정 (G1780)을 이용하여 TriNKET을 첨가하거나 첨가하지 않고 측정하였다. 관심 암 표적을 발현하는 인간 암 세포주를 배양물로부터 수확하였고, 세포를 PBS로 세척하고, 표적 세포로서 사용하기 위해 성장 배지 중에서 1-2x105/mL로 재현탁시켰다. 50 μl의 표적 세포 현탁액을 각각의 웰에 첨가하였다. 관심 암 항원을 표적으로 하는 모노클로날 항체 또는 TriNKET를 배양 배지에서 희석하고, 50 μl의 희석된 mAb 또는 TriNKET를 각각의 웰에 첨가하였다. 휴지된 및/또는 활성화된 NK 세포를 배양물로부터 수확하였고, 세포를 세척하고, 배양 배지 중에서 원하는 E:T 비에 따라 105-2.0x106/mL로 재현탁시켰다. 50 μl의 NK 세포를 플레이트의 각각의 웰에 첨가하여, 총 150 μl의 배양물 부피를 만들었다. 플레이트를 37℃에서 5% CO2하에 3 시간 15 분 동안 인큐베이션하였다. 인큐베이션 후에, 10x 용해 완충제를 최대 용해 및 부피 대조군으로서 표적 세포 단독의 웰에 및 배지 단독을 함유하는 웰에 첨가하였다. 이어서, 플레이트를 추가 45 분 동안 인큐베이터에 다시 두어서, 발달시키기 전에 총 4 시간의 인큐베이션을 달성하였다.
인큐베이션 후에, 플레이트를 인큐베이터로부터 제거하고, 세포를 200g에서 5 분 동안 원심분리에 의해 펠렛화하였다. 50 μl의 배양물 상청액을 깨끗한 마이크로플레이트로 옮기고, 50 μl의 기질 용액을 각각의 웰에 첨가하였다. 플레이트를 빛으로부터 보호하고, 실온에서 30 분 동안 인큐베이션하였다. 50 μl의 중단 용액을 각각의 웰에 첨가하고, 흡광도를 스펙트라맥스 i3x 상에서 492nm에서 판독하였다. % 특이적 용해를 다음과 같이 계산하였다: % 특이적 용해 = ((실험적 방출 - 이펙터로부터 자발적 방출 - 표적으로부터 자발적 방출) / (최대 방출 - 자발적 방출)) * 100%.
DELFIA 세포독성 검정:
관심 표적을 발현하는 인간 암 세포주를 배양물로부터 수확하였고, 세포를 PBS로 세척하고, BATDA 시약 (퍼킨 엘머 AD0116)에 의해 표지화를 위해 성장 배지 중에서 106/mL로 재현탁시켰다. 표적 세포의 표지화를 위해 제조자의 지침을 따랐다. 표지화 후에, 세포를 PBS로 3회 세척하고, 배양 배지 중에서 0.5-1.0x105/mL로 재현탁시켰다. 백그라운드 웰을 제조하기 위해, 분취량의 표지화된 세포를 따로 두고, 세포를 배지로부터 회전시켰다. 100 μl의 배지를 주의해서 웰에 삼중으로 첨가하여, 펠렛화된 세포의 교란을 피하였다. 100 μl의 BATDA 표지화된 세포를 96-웰 플레이트의 각각의 웰에 첨가하였다. 표적 세포로부터 자발적 방출을 위해 웰을 저장하고, 1% 트리톤-X를 첨가함으로써 표적 세포의 최대 용해를 위해 웰을 준비하였다. 관심 종양 표적에 대한 모노클로날 항체 또는 TriNKET를 배양 배지에서 희석하고, 50 μl의 희석된 mAb 또는 TriNKET를 각각의 웰에 첨가하였다. 휴지된 및/또는 활성화된 NK 세포를 배양물로부터 수확하였고, 세포를 세척하고, 배양 배지 중에서 원하는 E:T 비에 따라 105-2.0x106/mL로 재현탁시켰다. 50 μl의 NK 세포를 플레이트의 각각의 웰에 첨가하여, 총 200 μl 배양물 부피를 제조하였다. 검정을 진행하기 전에, 플레이트를 37℃에서 5% CO2하에 2-3 시간 동안 인큐베이션하였다.
2-3 시간 동안 배양한 후에, 플레이트를 인큐베이터로부터 제거하고, 세포를 200g에서 5 분 동안 원심분리에 의해 펠렛화하였다. 20 μl의 배양물 상청액을 제조자로부터 공급된 깨끗한 마이크로플레이트로 옮기고, 200 μl의 실온 유로퓸 용액을 각각의 웰에 첨가하였다. 플레이트를 빛으로부터 보호하고, 플레이트 진탕기 상에서 250rpm에서 15 분 동안 인큐베이션하였다. 플레이트를 빅터(Victor) 3 또는 스펙트라맥스 i3X 장비를 이용하여 판독하였다. % 특이적 용해를 다음과 같이 계산하였다: % 특이적 용해 = ((실험적 방출 - 자발적 방출) / (최대 방출 - 자발적 방출)) * 100%.
장기간 인간 PBMC 세포독성 검정:
SkBr-3 표적 세포를 백맘 3.0 누크라이트 그린(BacMam 3.0 NucLight Green) (#4622)으로 표지화하여, 표적 세포의 추적을 가능하게 하였다. 제조자의 프로토콜에 따라 SkBr-3 표적 세포를 표지화하였다. 아넥신 V 레드(Annexin V Red) (에센 바이오사이언스(Essen Bioscience) #4641)를 희석하고, 제조자의 지침에 따라 준비하였다. 모노클로날 항체 또는 TriNKET를 배양 배지로 희석하였다. 50 μl의 mAb 또는 TriNKET, 아넥신 V, 및 휴지된 NK 세포를 표지화된 SkBr-3 세포를 이미 함유하는 96 웰 플레이트의 웰에 첨가하고; 50ul의 완전 배양 배지를 총 200 μl 배양물 부피를 위해 첨가하였다.
영상 수집을 인큐사이트(IncuCyte) S3 상에서 설정하였다. 상, 그린 및 레드 채널에 대한 영상을 웰당 2개의 영상으로 매시간 마다 수집하였다. 영상 분석을 인큐사이트 S3 소프트웨어를 이용하여 수행하였다. 그린 및 레드 채널에 대한 마스크를 생성하여, 각각 종양 세포 및 아넥신 V 양성 세포의 개수를 카운트하였다. % 아넥신 V 양성 Mv4-11 표적 세포를 계산하기 위해, 하기 식을 이용하였다. % 아넥신 V 양성 SkBr-3 세포 = ((중첩 물체 카운트) / (그린 물체 카운트)) * 100%.
HER+ 암 세포를 표적으로 하는 TriNKET와 SC2.2의 비교
HER2를 표적으로 하는 TriNKET는 SkBr-3 세포 개수를 감소시키는데 있어서 트라스투주맙에 비해 더욱 효과적이었고, 시간 0으로부터의 세포의 60%만이 60 시간 후에 남아 있었다. 종양/암 세포를 발현하는 HER2를 표적으로 하는 본 개시내용의 TriNKET는 SC2.2 (NKG2D에 대한 리간드인 ULBP-6에 연결된 트라스투주맙으로부터 유래된 scFv로부터 형성된 단일 쇄 이중특이적 분자)에 비해 더욱 효과적이었다. SC2.2는 HER2+ 암 세포 및 NKG2D+ NK 세포에 동시에 결합한다. 따라서, HER2+ 암 세포 개수를 감소시키는데 있어서 SC2.2의 효과를 연구하였다. 시험관내 활성화 및 세포독성 검정은, SC2.2가 NK 세포를 활성화 및 사멸시키는데 효과적이었음을 입증하였다. 그러나, SC2.2는 RMA/S-HER2 피하 종양 모델에서의 효능을 입증하는데 실패하였다. SC2.2의 효능을 또한 RMA/S-HER2 과발현 공통 유전자 마우스 모델을 이용하여 생체 내에서 시험하였다. 이 마우스 모델에서, SC2.2는 비히클 대조군에 비해 종양 성장의 조절을 입증하는데 실패하였다. 따라서, SC2.2가 비록 NK 세포를 활성화시키고 사멸시킬 수 있으며, HER2+ 암 세포에 결합하지만, 이들 성질은 HER2+ 종양 성장을 효과적으로 조절하는데 불충분하였다.
C57Bl/6 마우스에서 SC2.2 혈청 반감기의 평가
C57Bl/6 마우스에서 SC2.2의 혈청 반감기를 결정하기 위해, SC2.2를 형광 태그로 표지화하여 생체 내에서 그의 농도를 추적하였다. SC2.2를 IRDye 800CW (리코르(Licor) #929-70020)로 표지화하였다. 표지화된 단백질을 3마리의 C57Bl/6 마우스에게 정맥내로 주사하였고, 지정된 시점에서 각각의 마우스로부터 혈액을 수집하였다. 수집한 후에, 혈액을 1000g에서 15 분 동안 원심분리하고, 각각의 샘플로부터 혈청을 수집하고, 모든 시점에서 수집할 때까지 4C에서 보관하였다.
오디세이(Odyssey) CLx 적외선 영상화 시스템을 이용하여 혈청을 영상화하고, 이미지(Image) J 소프트웨어를 이용하여 800 채널로부터의 형광 신호를 정량화하였다. 영상 강도를 첫번째 시점에 대해 정규화하였고, 데이터를 이상성 붕괴 방정식(biphasic decay equation)에 대입하였다. 이 실험 시스템에서, SC2.2의 베타 반감기는 대략 7 시간으로 계산되었다.
RMA/S-HER2 피하 종양에 대한 SC2.2의 생체내 시험
생체내 연구를 도 37에 따라 고안하여, 피하 RMA/S-HER2 종양에 대한 SC2.2의 효능을 시험하였다. 인간 HER2로 형질도입된 106 RMA/S 세포를 20마리의 C57Bl/6 마우스의 옆구리에 피하 주사하였다. 종양 접종 이후 2 일째에 시작하여, SC2.2를 IP 주사를 통해 매일 주입하였다. SC2.2를 비히클 대조군과 함께 높은 및 낮은 농도로 투여하였다. 종양 접종 이후 4 일째에 시작하여, 연구 기간 동안에 월요일, 수요일 및 금요일에 종양을 측정하였다. 종양 부피를 하기 식을 이용하여 계산하였다: 종양 부피 = 길이 x 너비 x 높이
인간 HER2-양성 암 세포주의 항체 결합 능력
표 10은 HER2 표면 정량화의 결과를 제시한다. SkBr-3 및 HCC1954 세포는 높은 (+++) 수준의 표면 HER2를 갖는 것으로 확인되었다. ZR-75-1 및 Colo201은 중간 수준 (++)의 표면 HER2를 나타내었고, 786-O는 낮은 수준의 HER2 (+)를 나타내었다.
표 10: HER2-양성 암 세포주의 ABC
일차 인간 NK 세포는 다양한 수준의 HER2를 발현하는 인간 암 세포주와 공동-배양된 TriNKET에 의해 활성화된다
도 28a - 28c는 TriNKET 및 트라스투주맙이 HER2-양성 인간 종양 세포와의 공동-배양에서 일차 인간 NK 세포를 활성화시킬 수 있음을 제시하며, 이는 CD107a 탈과립화 및 IFNγ 시토카인 생산에서의 증가에 의해 나타난다. 모노클로날 항체 트라스투주맙과 비교하여, TriNKET (HER2-TriNKET-C26 및 HER2-TriNKET-F04) 둘 다 다양한 인간 HER2 암 세포에 의한 인간 NK 세포의 우수한 활성화를 나타내었다.
도 28a는 인간 NK 세포가 SkBr-3 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28b는 인간 NK 세포가 Colo201 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다. 도 28c는 인간 NK 세포가 HCC1954 세포와 함께 배양될 때 TriNKET에 의해 활성화됨을 제시한다.
TriNKET는 휴지된 및 IL-2-활성화된 인간 NK 세포의 세포독성을 증진시킨다
도 32a - 32c는 IL-2-활성화된 및 휴지된 인간 NK 세포를 이용하는 세포독성 활성의 TriNKET 증진을 제시한다. 도 32a는 휴지된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. 도 32b는 IL-2-활성화된 인간 NK 세포에 의한 SkBr-3 종양 세포의 특이적 용해 백분율을 제시한다. IL-2-활성화된 및 휴지된 NK 세포 집단은 동일한 공여자로부터의 것이었다. 트라스투주맙과 비교시, TriNKET는 활성화된 또는 휴지된 NK 세포 집단에 의해 SkBr-3 세포에 대한 반응을 더욱 강력하게 지시하였다. 도 32c는 휴지된 인간 NK 세포에 의한 HER2-발현 NCI-H661 폐암 세포의 특이적 용해 백분율을 제시한다. 상이한 NKG2D-결합 도메인을 갖는 2가지 TriNKET는 모노클로날 항체 트라스투주맙에 비해 NCI-H661 HER2+ 암 세포의 보다 높은 최대 용해를 유도할 수 있다.
TriNKET는 낮은 표면 발현을 갖는 표적에 대한 NK 세포 세포독성을 증진시킨다
낮은 HER2 표면 발현을 갖는 표적 세포에 대한 TriNKET의 효과를 연구하였다. 도 29a-29b는 TriNKET가 HER2-중간 및 낮은 암에 대해 트라스투주맙에 비해 더 큰 이점을 제공한다는 것을 제시한다. 도 29a는 HER2-높은 SkBr-3 종양 세포의 활성화된 인간 NK 세포 사멸을 제시한다. 도 29b는 HER2-낮은 786-O 종양 세포의 인간 NK 세포 사멸을 제시한다. TriNKET는 낮은 HER2 발현을 갖는 암 세포에 대해 트라스투주맙에 비해 더 큰 이점을 제공한다.
높은 FcR 발현을 갖는 암의 치료에서 또는 높은 FcR 수준을 갖는 종양 미세환경에서 TriNKET의 이점
모노클로날 항체 요법이 여러 암 유형, 예컨대 혈액학적 및 고형 종양의 치료를 위해 승인되었다. 암 치료에서 모노클로날 항체의 사용이 개선된 환자 결과를 갖지만, 여전히 제약이 있다. 메카니즘 연구는 모노클로날 항체가 무엇보다도 ADCC, CDC 식균작용, 및 신호 차단을 비롯한 다중 메카니즘을 통해 종양 성장에 대한 그들의 효과를 발휘한다는 것을 입증하였다.
가장 주목할만하게는, ADCC는 모노클로날 항체가 그들의 효과를 발휘하는 주요 메카니즘인 것으로 생각된다. ADCC는 천연 킬러 세포의 표면 상에서 낮은-친화도 FcγRIII (CD16)의 항체 Fc 결속에 의존하고, 이는 종양 세포의 직접적인 용해를 매개한다. FcγR 중에서, CD16은 IgG Fc에 대해 가장 낮은 친화도를 갖고, FcγRI (CD64)는 높은-친화도 FcR이고, CD16에 비해 약 1000배 더 강력하게 IgG Fc에 결합한다.
CD64는 여러 조혈 계통, 예컨대 골수 계통에서 정상적으로 발현되고, 이들 세포 유형으로부터 유래된 종양, 예컨대 급성 골수성 백혈병 (AML)에서 발현될 수 있다. 종양으로 침윤하는 면역 세포, 예컨대 MDSC 및 단핵구는 또한 CD64를 발현하고, 종양 미세환경에 침윤하는 것으로 공지되어 있다. 종양에 의한 또는 종양 미세환경에서의 CD64 발현은 모노클로날 항체 요법에 대해 해로운 효과를 가질 수 있다. 항체가 높은-친화도 수용체와 결합하는 것을 선호하기 때문에, 종양 미세환경에서의 CD64 발현은 이들 항체가 NK 세포의 표면 상의 CD16에 결속하는 것을 어렵게 만든다. TriNKET는 NK 세포 표면 상의 2개의 활성화 수용체를 표적화함으로써 모노클로날 항체 요법에 대한 CD64 발현의 해로운 효과를 극복할 수 있다.
PBMC 배양물에서 정상 골수 및 정상 B 세포의 사멸: TriNKET는 더 적은 온-표적 오프-종양 부작용을 통해 보다 양호한 안전성 프로파일을 제공한다
천연 킬러 세포 및 CD8 T 세포 둘 다 종양 세포를 직접적으로 용해시킬 수 있지만, NK 세포 및 CD8 T 세포가 종양 세포로부터 자가의 정상 세포를 인식하는 메카니즘은 상이하다. NK 세포의 활성은 활성화 (NCRs, NKG2D, CD16 등) 및 억제 (KIRs, NKG2A 등) 수용체로부터 신호의 균형에 의해 조절된다. 이들 활성화 및 억제 신호의 균형은 NK 세포가 스트레스 받았거나, 바이러스에 감염되었거나 또는 형질전환된 자가-세포로부터 건강한 자가-세포를 결정하는 것을 가능하게 한다. 자가-관용의 '빌트-인' 메카니즘은 정상의 건강한 조직을 NK 세포 반응으로부터 보호하는데 도움이 될 것이다. 이 원리를 확장시키기 위해, NK 세포의 자가-관용은 오프-종양 부작용 없이 또는 증가된 치료 범위에서 TriNKET가 자가 및 종양 둘 다에서 발현되는 항원을 표적으로 하는 것을 가능하게 할 것이다.
천연 킬러 세포와 달리, T 세포는 활성화 및 이펙터 기능을 위해 MHC 분자에 의해 제시되는 특정한 펩티드의 인식을 필요로 한다. T 세포는 면역요법의 주요 표적이었고, 여러 전략은 종양에 대한 T 세포 반응을 재지시하는 것으로 개발되었다. T 세포 이중특이적, 체크포인트 억제제, 및 CAR-T 세포는 모두 FDA에 의해 승인되었지만, 종종 용량-제한 독성으로 어려움이 있다. T 세포 이중특이적 및 CAR-T 세포는 종양 세포의 표면 상의 항원을 표적으로 하는 결합 도메인을 이용하고, 이펙터 세포에 활성화 신호를 전도하는 조작된 신호전달 도메인을 이용함으로써 TCR-MHC 인식 시스템에 대해 작용한다. 항-종양 면역 반응을 유도하는데 효과적임에도 불구하고, 이들 요법은 종종 시토카인 방출 증후군 (CRS), 및 온-표적 오프-종양 부작용과 연관된다. TriNKET는 NK 세포 활성화 및 억제의 천연 시스템을 '무효화'하지 않을 것이기 때문에 이러한 맥락에서 독특하다. 대신에, TriNKET는 상기 균형을 흔들도록 고안되고, 건강한 자가 세포에 대한 NK 관용은 유지하면서 NK 세포에 추가의 활성화 신호를 제공한다.
PBMC를 밀도 구배 원심분리에 의해 전혈로부터 단리하였다. 임의의 오염 적혈구를 ACK 용해 완충제에서 인큐베이션에 의해 용해시켰다. PBMC를 PBS로 3회 세척하고, 총 PBMC를 카운트하였다. PBMC를 일차 세포 배양 배지에서 106/mL로 조정하였다. 1mL의 PBMC를 24 웰 플레이트의 웰에 시딩하였고, 지정된 TriNKET 또는 mAb를 PBMC 배양물에 10μg/mL로 첨가하였다. 세포를 37℃에서 5% CO2하에 밤새 배양하였다. 다음 날 (24 시간 후), PBMC를 배양물로부터 수확하였고, FACS 분석을 위해 준비하였다. CD45+; CD19+ B 세포 및 CD45+; CD33+; CD11b+ 골수 세포의 백분율을 상이한 처리 그룹에 걸쳐 분석하였다.
도 33a & 33b는 건강한 공여자로부터의 B 세포가 TriNKET 매개된 용해에 대해 민감성임을 제시하고, 도 33c & 33d는 자가 골수 세포가 TriNKET 매개된 NK 세포 반응으로부터 보호되고, 따라서 TriNKET 용해에 대해 저항성임을 제시한다. CD20을 표적으로 하는 TriNKET로 처리된 PBMC는 CD45+ 림프구 집단을 갖는 CD19+ B 세포의 감소된 빈도를 나타내었지만 (도 33a), CD45+, CD3-, CD56- 림프구 집단에서는 효과가 없었다 (도 33b). 이들 배양물에서, CD45+, CD33+, CD11b+ 골수 세포의 빈도 (도 33c), 또는 CD45+, CD33+, CD11b+ 골수 세포의 빈도 (도 33d)는 변하지 않았다.
TriNKET는 장기간 공동-배양시에 SkBr-3 종양 세포의 hPBMC 사멸을 매개한다
일차 인간 PBMC 세포독성 검정
도 34는 인간 PBMC와 함께 배양시에 SkBr-3 세포의 장기간 사멸을 제시한다. 단독 배양시에 SkBr-3 세포는 증식하고, 60 시간 내에 거의 두배가 된다. 인간 PBMC를 배양물 중의 SkBr-3 세포에 첨가하였을 때 증식 속도가 느려졌고, CD33을 표적으로 하는 이소타입 대조군 TriNKET를 첨가하였을 때 증식이 또한 느려졌지만, 더 적은 정도로 느려졌다. 배양물을 트라스투주맙 SkBr-3으로 처리하였을 때 더 이상 증식하지 않았고, 시간 0으로부터 60 시간 후에 세포의 80%만이 남아 있었다. SkBr-3 세포가 HER2 신호 차단에 대해 민감하기 때문에, SkBr-3 세포 성장에 대한 효과는 HER2 신호 차단에 의해 또는 Fc 이펙터 기능, 예컨대 ADCC를 통해 매개될 수 있다.
실시예 15 - HER2-양성 세포에 대해 TriNKET, 모노클로날 항체, 또는 이중특이적 항체에 의해 매개된 휴지된 인간 NK 세포의 세포독성 활성
PBMC를 밀도 구배 원심분리를 이용하여 인간 말초 혈액 연막으로부터 단리하였다. 단리된 PBMC를 세척하고, NK 세포 단리를 위해 준비하였다. NK 세포를 자성 비드에 의한 음성 선택 기술을 이용하여 단리하였고; 단리된 NK 세포의 순도는 전형적으로 >90% CD3-CD56+이었다. 단리된 NK 세포를 100 ng/mL IL-2를 함유하는 배지에서 배양하거나 또는 시토카인 없이 밤새 휴지시켰다. 다음 날, IL-2-활성화된 또는 휴지된 NK 세포를 세포독성 검정에서 사용하였다.
DELFIA 세포독성 검정:
관심 표적을 발현하는 인간 암 세포주를 배양물로부터 수확하였고, 세포를 HBS로 세척하고, BATDA 시약 (퍼킨 엘머 AD0116)에 의해 표지화를 위해 성장 배지 중에서 106/mL로 재현탁시켰다. 표적 세포의 표지화를 위해 제조자의 지침을 따랐다. 표지화 후에, 세포를 HBS로 3회 세척하고, 배양 배지 중에서 0.5-1.0x105/mL로 재현탁시켰다. 백그라운드 웰을 제조하기 위해, 분취량의 표지화된 세포를 따로 두고, 세포를 배지로부터 회전시켰다. 100 μl의 배지를 주의해서 웰에 삼중으로 첨가하여, 펠렛화된 세포의 교란을 피하였다. 100 μl의 BATDA 표지화된 세포를 96-웰 플레이트의 각각의 웰에 첨가하였다. 표적 세포로부터 자발적 방출을 위해 웰을 저장하고, 1% 트리톤-X를 첨가함으로써 표적 세포의 최대 용해를 위해 웰을 준비하였다. 관심 종양 표적에 대한 모노클로날 항체 또는 TriNKET를 배양 배지에서 희석하고, 50 μl의 희석된 mAb 또는 TriNKET를 각각의 웰에 첨가하였다. 휴지된 및/또는 활성화된 NK 세포를 배양물로부터 수확하였고, 세포를 세척하고, 배양 배지 중에서 원하는 E:T 비에 따라 105-2.0x106/mL로 재현탁시켰다. 50 μl의 NK 세포를 플레이트의 각각의 웰에 첨가하여, 총 200 μl 배양물 부피를 제조하였다. 검정을 진행하기 전에, 플레이트를 37℃에서 5% CO2하에 2-3 시간 동안 인큐베이션하였다.
2-3 시간 동안 배양한 후에, 플레이트를 인큐베이터로부터 제거하고, 세포를 200g에서 5 분 동안 원심분리에 의해 펠렛화하였다. 20 μl의 배양물 상청액을 제조자로부터 공급된 깨끗한 마이크로플레이트로 옮기고, 200 μl의 실온 유로퓸 용액을 각각의 웰에 첨가하였다. 플레이트를 빛으로부터 보호하고, 플레이트 진탕기 상에서 250rpm에서 15 분 동안 인큐베이션하였다. 플레이트를 빅터 3 또는 스펙트라맥스 i3X 장비를 이용하여 판독하였다. % 특이적 용해를 다음과 같이 계산하였다: % 특이적 용해 = ((실험적 방출 - 자발적 방출) / (최대 방출 - 자발적 방출)) * 100%.
모노클로날 항체 및 이중특이적 NK 세포 결속체의 조합물은 TriNKET 활성을 재현하지 않는다:
도 35는 HER2-양성 Colo-201 세포주에 대해 TriNKET, 모노클로날 항체, 또는 이중특이적 항체에 의해 매개된 휴지된 인간 NK 세포의 세포독성 활성을 제시한다. HER2를 표적으로 하는 TriNKET (ADI-29404 (F04))는 휴지된 인간 NK 세포에 의한 Colo-201 세포의 최대 용해를 유도하였다. D265A 돌연변이를 TriNKET의 CH2 도메인에 도입하여 FcR 결합을 제거하였다. HER2-TriNKET (ADI-29404 (F04))-D265A는 Colo-201 세포의 용해를 매개하는데 실패하였고, 이는 NK 세포 상의 CD16 및 NKG2D의 이중 표적화의 중요성을 입증하였다. NK 세포에 대한 이중 표적화의 중요성을 추가로 입증하기 위해, 모노클로날 항체 트라스투주맙을 사용하여 HER2를 표적화하고, NK 세포에 의해 ADCC를 매개하였고, 트라스투주맙 단독은 Colo-201 세포의 NK 세포 용해를 증가시킬 수 있지만, 트라스투주맙 단독에 의해 달성된 최대 용해는 TriNKET에 비해 약 4배 더 낮았다. 동일한 분자 상에서 CD16 및 NKG2D를 표적화하는 것의 중요성을 이해하기 위해, TriNKET (ADI-29404 (F04)) 활성을 트라스투주맙과 조합하여 HER2 및 NKG2D를 표적화하는 이중특이적 항체의 활성과 비교하였다. 등몰 농도로 사용하였을 때, 이중특이적 및 트라스투주맙의 조합물은 휴지된 인간 NK 세포에 의해 Colo-201 세포의 최대 용해를 매개할 수 없었다. 트라스투주맙 + 이중특이적 조합물의 실패는 한 분자에 TriNKET의 삼중특이적-결합을 함유하는 것의 중요성을 입증한다.
실시예 16 - 가교 검정
인간 HER2에 의해 형질도입된 RMA 세포를 사용하여 HER2 표적화 TriNKET에 의한 HER2 및 NKG2D와의 동시 결합을 시험하였다. TriNKET를 이용하여 표면 HER2를 20 μg/mL로 염색하였다. 이어서, TriNKET의 결합을 비오틴화 재조합 인간 NKG2D-Fc를 이용하여 검출하였다. 이어서, 결합된 NKG2D-Fc를 스트렙타비딘-APC를 이용하여 검출하였다. 세포를 유동 세포분석법에 의해 분석하고, TriNKET-가교를 이소타입 염색된 및 비염색된 세포 집단과 비교하였다. 도 38a는 HER2에 대한 결합 도메인을 포함하는 TriNKET-C26이 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시하고, 도 38b는 HER2에 대한 결합 도메인을 포함하는 TriNKET-F04가 hNKG2D-Fc를 RMA-HER2 세포에 가교시킴을 제시한다.
참고문헌의 도입
본원에 인용된 각각의 특허 문헌 및 과학 논문의 전체 개시내용은 모든 목적을 위해 참고로 포함된다.
등가물
본 발명은 그의 개념 또는 필수 특징을 벗어나지 않고 다른 특정한 형태로 실시될 수 있다. 따라서, 상기 실시양태는 본원에 기재된 본 발명을 제한하기 보다는 모든 측면에서 설명하는 것으로 고려된다. 따라서, 본 발명의 범주는 상기 기재에 의해서가 아니라 첨부된 청구항에 의해 지정되고, 청구항의 등가물의 의미 및 범위 내에 있는 모든 변화는 본원에 포함되는 것으로 의도된다.
SEQUENCE LISTING
<110> ADIMAB, LLC.
<120> PROTEINS BINDING HER2, NKG2D AND CD16
<130> DFY-008PC
<140>
<141>
<150> 62/461,146
<151> 2017-02-20
<160> 109
<170> PatentIn version 3.5
<210> 1
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 1
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 2
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 3
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 3
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 4
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 4
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 5
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 6
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 7
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 8
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asn Ser Tyr Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 9
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 9
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 10
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 10
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 11
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 11
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Gly Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 12
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 12
Glu Leu Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ser Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asp Ile Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 13
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 13
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 14
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 14
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 15
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 15
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 16
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Lys Glu Val Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 17
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 17
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 18
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 19
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 20
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ile Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 21
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 22
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 23
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 23
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 24
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 24
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 25
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 25
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 26
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 26
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 27
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 27
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 28
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 28
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ser Ser Phe Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 29
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 30
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Ser Tyr Ser Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 31
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 31
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 32
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Ser Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 33
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 33
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 34
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 34
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gln Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 35
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 35
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 36
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 37
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 37
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 38
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 38
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Glu Leu Tyr Ser Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 39
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 39
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 40
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asp Thr Phe Ile Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 41
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asp Ser Ser Ile Arg His Ala Tyr Tyr Tyr Tyr Gly Met
100 105 110
Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 42
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 42
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Ser Thr Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 43
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 43
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Ser Asp Arg Phe His Pro Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 44
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 44
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Asp Thr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 121
<212> PRT
<213> Homo sapiens
<400> 45
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Phe Ile Arg Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Gly Leu Gly Asp Gly Thr Tyr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 46
<211> 110
<212> PRT
<213> Homo sapiens
<400> 46
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Asn Asn
20 25 30
Ala Val Asn Trp Tyr Gln Gln Leu Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Tyr Asp Asp Leu Leu Pro Ser Gly Val Ser Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Phe Leu Ala Ile Ser Gly Leu Gln
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser Leu
85 90 95
Asn Gly Pro Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
<210> 47
<211> 115
<212> PRT
<213> Homo sapiens
<400> 47
Gln Val His Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Asp Asp Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly His Ile Ser Tyr Ser Gly Ser Ala Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Asn Trp Asp Asp Ala Phe Asn Ile Trp Gly Gln Gly Thr Met Val Thr
100 105 110
Val Ser Ser
115
<210> 48
<211> 108
<212> PRT
<213> Homo sapiens
<400> 48
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 49
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 50
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 50
Gly Phe Asn Ile Lys Asp Thr
1 5
<210> 51
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 51
Tyr Pro Thr Asn Gly Tyr
1 5
<210> 52
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 52
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 53
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 53
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 54
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 54
Gln Asp Val Asn Thr Ala Val Ala
1 5
<210> 55
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 55
Ser Ala Ser Phe Leu Tyr Ser
1 5
<210> 56
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 56
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 57
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 57
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Thr Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asp Val Asn Pro Asn Ser Gly Gly Ser Ile Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Phe Thr Leu Ser Val Asp Arg Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 58
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 58
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Ile Gly
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Arg Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 59
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 59
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Leu Lys Leu Ser Cys Thr Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Lys Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Asp Pro Lys Phe
50 55 60
Gln Asp Lys Ala Thr Ile Thr Ala Asp Thr Ser Ser Asn Thr Ala Tyr
65 70 75 80
Leu Gln Val Ser Arg Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Ala Ser Val Thr Val Ser Ser Ala
115 120
<210> 60
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 60
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Val Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly His Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Arg Tyr Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Val Gln Ala
65 70 75 80
Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 61
<211> 1255
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 61
Met Glu Leu Ala Ala Leu Cys Arg Trp Gly Leu Leu Leu Ala Leu Leu
1 5 10 15
Pro Pro Gly Ala Ala Ser Thr Gln Val Cys Thr Gly Thr Asp Met Lys
20 25 30
Leu Arg Leu Pro Ala Ser Pro Glu Thr His Leu Asp Met Leu Arg His
35 40 45
Leu Tyr Gln Gly Cys Gln Val Val Gln Gly Asn Leu Glu Leu Thr Tyr
50 55 60
Leu Pro Thr Asn Ala Ser Leu Ser Phe Leu Gln Asp Ile Gln Glu Val
65 70 75 80
Gln Gly Tyr Val Leu Ile Ala His Asn Gln Val Arg Gln Val Pro Leu
85 90 95
Gln Arg Leu Arg Ile Val Arg Gly Thr Gln Leu Phe Glu Asp Asn Tyr
100 105 110
Ala Leu Ala Val Leu Asp Asn Gly Asp Pro Leu Asn Asn Thr Thr Pro
115 120 125
Val Thr Gly Ala Ser Pro Gly Gly Leu Arg Glu Leu Gln Leu Arg Ser
130 135 140
Leu Thr Glu Ile Leu Lys Gly Gly Val Leu Ile Gln Arg Asn Pro Gln
145 150 155 160
Leu Cys Tyr Gln Asp Thr Ile Leu Trp Lys Asp Ile Phe His Lys Asn
165 170 175
Asn Gln Leu Ala Leu Thr Leu Ile Asp Thr Asn Arg Ser Arg Ala Cys
180 185 190
His Pro Cys Ser Pro Met Cys Lys Gly Ser Arg Cys Trp Gly Glu Ser
195 200 205
Ser Glu Asp Cys Gln Ser Leu Thr Arg Thr Val Cys Ala Gly Gly Cys
210 215 220
Ala Arg Cys Lys Gly Pro Leu Pro Thr Asp Cys Cys His Glu Gln Cys
225 230 235 240
Ala Ala Gly Cys Thr Gly Pro Lys His Ser Asp Cys Leu Ala Cys Leu
245 250 255
His Phe Asn His Ser Gly Ile Cys Glu Leu His Cys Pro Ala Leu Val
260 265 270
Thr Tyr Asn Thr Asp Thr Phe Glu Ser Met Pro Asn Pro Glu Gly Arg
275 280 285
Tyr Thr Phe Gly Ala Ser Cys Val Thr Ala Cys Pro Tyr Asn Tyr Leu
290 295 300
Ser Thr Asp Val Gly Ser Cys Thr Leu Val Cys Pro Leu His Asn Gln
305 310 315 320
Glu Val Thr Ala Glu Asp Gly Thr Gln Arg Cys Glu Lys Cys Ser Lys
325 330 335
Pro Cys Ala Arg Val Cys Tyr Gly Leu Gly Met Glu His Leu Arg Glu
340 345 350
Val Arg Ala Val Thr Ser Ala Asn Ile Gln Glu Phe Ala Gly Cys Lys
355 360 365
Lys Ile Phe Gly Ser Leu Ala Phe Leu Pro Glu Ser Phe Asp Gly Asp
370 375 380
Pro Ala Ser Asn Thr Ala Pro Leu Gln Pro Glu Gln Leu Gln Val Phe
385 390 395 400
Glu Thr Leu Glu Glu Ile Thr Gly Tyr Leu Tyr Ile Ser Ala Trp Pro
405 410 415
Asp Ser Leu Pro Asp Leu Ser Val Phe Gln Asn Leu Gln Val Ile Arg
420 425 430
Gly Arg Ile Leu His Asn Gly Ala Tyr Ser Leu Thr Leu Gln Gly Leu
435 440 445
Gly Ile Ser Trp Leu Gly Leu Arg Ser Leu Arg Glu Leu Gly Ser Gly
450 455 460
Leu Ala Leu Ile His His Asn Thr His Leu Cys Phe Val His Thr Val
465 470 475 480
Pro Trp Asp Gln Leu Phe Arg Asn Pro His Gln Ala Leu Leu His Thr
485 490 495
Ala Asn Arg Pro Glu Asp Glu Cys Val Gly Glu Gly Leu Ala Cys His
500 505 510
Gln Leu Cys Ala Arg Gly His Cys Trp Gly Pro Gly Pro Thr Gln Cys
515 520 525
Val Asn Cys Ser Gln Phe Leu Arg Gly Gln Glu Cys Val Glu Glu Cys
530 535 540
Arg Val Leu Gln Gly Leu Pro Arg Glu Tyr Val Asn Ala Arg His Cys
545 550 555 560
Leu Pro Cys His Pro Glu Cys Gln Pro Gln Asn Gly Ser Val Thr Cys
565 570 575
Phe Gly Pro Glu Ala Asp Gln Cys Val Ala Cys Ala His Tyr Lys Asp
580 585 590
Pro Pro Phe Cys Val Ala Arg Cys Pro Ser Gly Val Lys Pro Asp Leu
595 600 605
Ser Tyr Met Pro Ile Trp Lys Phe Pro Asp Glu Glu Gly Ala Cys Gln
610 615 620
Pro Cys Pro Ile Asn Cys Thr His Ser Cys Val Asp Leu Asp Asp Lys
625 630 635 640
Gly Cys Pro Ala Glu Gln Arg Ala Ser Pro Leu Thr Ser Ile Ile Ser
645 650 655
Ala Val Val Gly Ile Leu Leu Val Val Val Leu Gly Val Val Phe Gly
660 665 670
Ile Leu Ile Lys Arg Arg Gln Gln Lys Ile Arg Lys Tyr Thr Met Arg
675 680 685
Arg Leu Leu Gln Glu Thr Glu Leu Val Glu Pro Leu Thr Pro Ser Gly
690 695 700
Ala Met Pro Asn Gln Ala Gln Met Arg Ile Leu Lys Glu Thr Glu Leu
705 710 715 720
Arg Lys Val Lys Val Leu Gly Ser Gly Ala Phe Gly Thr Val Tyr Lys
725 730 735
Gly Ile Trp Ile Pro Asp Gly Glu Asn Val Lys Ile Pro Val Ala Ile
740 745 750
Lys Val Leu Arg Glu Asn Thr Ser Pro Lys Ala Asn Lys Glu Ile Leu
755 760 765
Asp Glu Ala Tyr Val Met Ala Gly Val Gly Ser Pro Tyr Val Ser Arg
770 775 780
Leu Leu Gly Ile Cys Leu Thr Ser Thr Val Gln Leu Val Thr Gln Leu
785 790 795 800
Met Pro Tyr Gly Cys Leu Leu Asp His Val Arg Glu Asn Arg Gly Arg
805 810 815
Leu Gly Ser Gln Asp Leu Leu Asn Trp Cys Met Gln Ile Ala Lys Gly
820 825 830
Met Ser Tyr Leu Glu Asp Val Arg Leu Val His Arg Asp Leu Ala Ala
835 840 845
Arg Asn Val Leu Val Lys Ser Pro Asn His Val Lys Ile Thr Asp Phe
850 855 860
Gly Leu Ala Arg Leu Leu Asp Ile Asp Glu Thr Glu Tyr His Ala Asp
865 870 875 880
Gly Gly Lys Val Pro Ile Lys Trp Met Ala Leu Glu Ser Ile Leu Arg
885 890 895
Arg Arg Phe Thr His Gln Ser Asp Val Trp Ser Tyr Gly Val Thr Val
900 905 910
Trp Glu Leu Met Thr Phe Gly Ala Lys Pro Tyr Asp Gly Ile Pro Ala
915 920 925
Arg Glu Ile Pro Asp Leu Leu Glu Lys Gly Glu Arg Leu Pro Gln Pro
930 935 940
Pro Ile Cys Thr Ile Asp Val Tyr Met Ile Met Val Lys Cys Trp Met
945 950 955 960
Ile Asp Ser Glu Cys Arg Pro Arg Phe Arg Glu Leu Val Ser Glu Phe
965 970 975
Ser Arg Met Ala Arg Asp Pro Gln Arg Phe Val Val Ile Gln Asn Glu
980 985 990
Asp Leu Gly Pro Ala Ser Pro Leu Asp Ser Thr Phe Tyr Arg Ser Leu
995 1000 1005
Leu Glu Asp Asp Asp Met Gly Asp Leu Val Asp Ala Glu Glu Tyr
1010 1015 1020
Leu Val Pro Gln Gln Gly Phe Phe Cys Pro Asp Pro Ala Pro Gly
1025 1030 1035
Ala Gly Gly Met Val His His Arg His Arg Ser Ser Ser Thr Arg
1040 1045 1050
Ser Gly Gly Gly Asp Leu Thr Leu Gly Leu Glu Pro Ser Glu Glu
1055 1060 1065
Glu Ala Pro Arg Ser Pro Leu Ala Pro Ser Glu Gly Ala Gly Ser
1070 1075 1080
Asp Val Phe Asp Gly Asp Leu Gly Met Gly Ala Ala Lys Gly Leu
1085 1090 1095
Gln Ser Leu Pro Thr His Asp Pro Ser Pro Leu Gln Arg Tyr Ser
1100 1105 1110
Glu Asp Pro Thr Val Pro Leu Pro Ser Glu Thr Asp Gly Tyr Val
1115 1120 1125
Ala Pro Leu Thr Cys Ser Pro Gln Pro Glu Tyr Val Asn Gln Pro
1130 1135 1140
Asp Val Arg Pro Gln Pro Pro Ser Pro Arg Glu Gly Pro Leu Pro
1145 1150 1155
Ala Ala Arg Pro Ala Gly Ala Thr Leu Glu Arg Pro Lys Thr Leu
1160 1165 1170
Ser Pro Gly Lys Asn Gly Val Val Lys Asp Val Phe Ala Phe Gly
1175 1180 1185
Gly Ala Val Glu Asn Pro Glu Tyr Leu Thr Pro Gln Gly Gly Ala
1190 1195 1200
Ala Pro Gln Pro His Pro Pro Pro Ala Phe Ser Pro Ala Phe Asp
1205 1210 1215
Asn Leu Tyr Tyr Trp Asp Gln Asp Pro Pro Glu Arg Gly Ala Pro
1220 1225 1230
Pro Ser Thr Phe Lys Gly Thr Pro Thr Ala Glu Asn Pro Glu Tyr
1235 1240 1245
Leu Gly Leu Asp Val Pro Val
1250 1255
<210> 62
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 62
Gly Ser Phe Ser Gly Tyr Tyr Trp Ser
1 5
<210> 63
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 63
Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 64
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 64
Ala Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro
1 5 10
<210> 65
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 65
Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5
<210> 66
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 66
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 67
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 67
Ala Arg Gly Asp Ser Ser Ile Arg His Ala Tyr Tyr Tyr Tyr Gly Met
1 5 10 15
Asp Val
<210> 68
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 68
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 69
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 69
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 70
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 70
Gln Gln Tyr Tyr Ser Thr Pro Ile Thr
1 5
<210> 71
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 71
Gly Ser Ile Ser Ser Ser Ser Tyr Tyr Trp Gly
1 5 10
<210> 72
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 72
Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 73
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 73
Ala Arg Gly Ser Asp Arg Phe His Pro Tyr Phe Asp Tyr
1 5 10
<210> 74
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 74
Arg Ala Ser Gln Ser Val Ser Arg Tyr Leu Ala
1 5 10
<210> 75
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 75
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 76
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 76
Gln Gln Phe Asp Thr Trp Pro Pro Thr
1 5
<210> 77
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 77
Gly Phe Thr Phe Thr Asp Tyr
1 5
<210> 78
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 78
Asn Pro Asn Ser Gly Gly
1 5
<210> 79
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 79
Asn Leu Gly Pro Ser Phe Tyr Phe Asp Tyr
1 5 10
<210> 80
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 80
Gln Asp Val Ser Ile Gly Val Ala
1 5
<210> 81
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 81
Ser Ala Ser Tyr Arg Tyr Thr
1 5
<210> 82
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 82
Gln Gln Tyr Tyr Ile Tyr Pro Tyr Thr
1 5
<210> 83
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 83
Gly Phe Asn Ile Lys Asp Thr
1 5
<210> 84
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 84
Tyr Pro Thr Asn Gly Tyr
1 5
<210> 85
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 85
Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
1 5 10
<210> 86
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 86
Gln Asp Val Asn Thr Ala Val Ala
1 5
<210> 87
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 87
Ser Ala Ser Phe Arg Tyr Thr
1 5
<210> 88
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 88
Gln Gln His Tyr Thr Thr Pro Pro Thr
1 5
<210> 89
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 89
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ala Arg Gly Pro Trp Ser Phe Asp Pro Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 90
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 90
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Glu Gln Tyr Asp Ser Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 91
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 91
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Arg Lys Ala Ser Gly Ser Phe Tyr Tyr Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 92
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 92
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Glu Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Pro Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 93
<211> 246
<212> PRT
<213> Homo sapiens
<400> 93
Met Ala Ala Ala Ala Ile Pro Ala Leu Leu Leu Cys Leu Pro Leu Leu
1 5 10 15
Phe Leu Leu Phe Gly Trp Ser Arg Ala Arg Arg Asp Asp Pro His Ser
20 25 30
Leu Cys Tyr Asp Ile Thr Val Ile Pro Lys Phe Arg Pro Gly Pro Arg
35 40 45
Trp Cys Ala Val Gln Gly Gln Val Asp Glu Lys Thr Phe Leu His Tyr
50 55 60
Asp Cys Gly Asn Lys Thr Val Thr Pro Val Ser Pro Leu Gly Lys Lys
65 70 75 80
Leu Asn Val Thr Met Ala Trp Lys Ala Gln Asn Pro Val Leu Arg Glu
85 90 95
Val Val Asp Ile Leu Thr Glu Gln Leu Leu Asp Ile Gln Leu Glu Asn
100 105 110
Tyr Thr Pro Lys Glu Pro Leu Thr Leu Gln Ala Arg Met Ser Cys Glu
115 120 125
Gln Lys Ala Glu Gly His Ser Ser Gly Ser Trp Gln Phe Ser Ile Asp
130 135 140
Gly Gln Thr Phe Leu Leu Phe Asp Ser Glu Lys Arg Met Trp Thr Thr
145 150 155 160
Val His Pro Gly Ala Arg Lys Met Lys Glu Lys Trp Glu Asn Asp Lys
165 170 175
Asp Val Ala Met Ser Phe His Tyr Ile Ser Met Gly Asp Cys Ile Gly
180 185 190
Trp Leu Glu Asp Phe Leu Met Gly Met Asp Ser Thr Leu Glu Pro Ser
195 200 205
Ala Gly Ala Pro Leu Ala Met Ser Ser Gly Thr Thr Gln Leu Arg Ala
210 215 220
Thr Ala Thr Thr Leu Ile Leu Cys Cys Leu Leu Ile Ile Leu Pro Cys
225 230 235 240
Phe Ile Leu Pro Gly Ile
245
<210> 94
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 94
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Asn Tyr Gly Asp Thr Thr His Asp Tyr Tyr Tyr
100 105 110
Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 95
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 95
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Asp Trp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 96
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 96
Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5
<210> 97
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 97
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 98
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 98
Ala Arg Gly Ala Pro Asn Tyr Gly Asp Thr Thr His Asp Tyr Tyr Tyr
1 5 10 15
Met Asp Val
<210> 99
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 99
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 100
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 100
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 101
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 101
Gln Gln Tyr Asp Asp Trp Pro Phe Thr
1 5
<210> 102
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 102
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 103
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 103
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Val Ser Phe Pro Arg
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 104
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 104
Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5
<210> 105
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 105
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 106
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 106
Ala Arg Gly Ala Pro Met Gly Ala Ala Ala Gly Trp Phe Asp Pro
1 5 10 15
<210> 107
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 107
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 108
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 108
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 109
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 109
Gln Gln Gly Val Ser Phe Pro Arg Thr
1 5
Claims (23)
- (a) NKG2D에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하는, 제1 항원-결합 부위;
(b) HER2에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하는, 제2 항원-결합 부위; 및
(c) CD16에 결합하는 항체 Fc 도메인 또는 그의 부분
을 포함하는 다중-특이적 결합 단백질이며, 여기서
제1 항원-결합 부위, 제2 항원-결합 부위, 또는 제1 및 제2 항원-결합 부위 각각이 동일한 폴리펩티드 상에 존재하는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하고,
다중-특이적 결합 단백질이 암 세포 상의 HER2에 결합하고 천연 킬러 (NK) 세포 상의 NKG2D에 결합하여 NK 세포를 활성화시키도록 및 NK 세포 상의 CD16에 결합하여 NK 세포를 활성화시키도록 구성된 것인,
다중-특이적 결합 단백질. - 제1항에 있어서, 제1 항원-결합 부위가 인간 및 비-인간 영장류에서 NKG2D에 결합하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 제1 항원-결합 부위의 중쇄 가변 도메인 및 경쇄 가변 도메인이 동일한 폴리펩티드 상에 존재하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 제2 항원-결합 부위의 중쇄 가변 도메인 및 경쇄 가변 도메인이 동일한 폴리펩티드 상에 존재하는 것인 다중-특이적 결합 단백질.
- 제4항에 있어서,
(i) 링커 또는 항체 힌지를 통해 제1 Fc 도메인의 N-말단에 융합된 단일-쇄 가변 단편 (scFv)으로 본질적으로 이루어진 제1 이뮤노글로불린 중쇄;
(ii) 제2 Fc 도메인의 N-말단에 연결된, 중쇄 가변 도메인 및 CH1 중쇄 도메인으로 본질적으로 이루어진 제2 이뮤노글로불린 중쇄; 및
(iii) 경쇄 가변 도메인 및 불변 경쇄 도메인으로 본질적으로 이루어진 이뮤노글로불린 경쇄
로 본질적으로 이루어진 다중-특이적 결합 단백질이며, 여기서
(a) scFv가 쌍을 형성하여 NKG2D에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하고, (ii)의 중쇄 가변 도메인 및 (iii)의 경쇄 가변 도메인이 쌍을 형성하여 HER2에 결합하거나;
(b) scFv가 쌍을 형성하여 HER2에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하고, (ii)의 중쇄 가변 도메인 및 (iii)의 경쇄 가변 도메인이 쌍을 형성하여 NKG2D에 결합하고,
제1 및 제2 Fc 도메인이 CD16에 결합하는 이량체를 형성하는 것인, 다중-특이적 결합 단백질. - 제5항에 있어서, scFv의 중쇄 가변 도메인 및 경쇄 가변 도메인이 쌍을 형성하여 NKG2D에 결합하고, (ii)의 중쇄 가변 도메인 및 (iii)의 경쇄 가변 도메인이 쌍을 형성하여 HER2에 결합하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 쌍을 형성하여 NKG2D에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인이 천연 리간드가 NKG2D에 결합하여 그를 활성화시키는 것을 차단하는 것인 다중-특이적 결합 단백질.
- 제7항에 있어서, 천연 리간드가 ULBP6 또는 MICA인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 쌍을 형성하여 NKG2D에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인이
(a) SEQ ID NO:1과 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열;
(b) SEQ ID NO:41과 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:42와 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열;
(c) SEQ ID NO:43과 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:44와 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열;
(d) SEQ ID NO:45와 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:46과 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열;
(e) SEQ ID NO:47과 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:48과 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열;
(f) SEQ ID NO:94와 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:95와 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열; 또는
(g) SEQ ID NO:102와 적어도 90% 동일한 중쇄 가변 도메인 아미노산 서열 및 SEQ ID NO:103과 적어도 90% 동일한 경쇄 가변 도메인 아미노산 서열
을 포함하는 것인 다중-특이적 결합 단백질. - 제1항 또는 제2항 있어서, 쌍을 형성하여 HER2에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인이 각각 SEQ ID NO: 50, 51, 및 52의 중쇄 CDR1, CDR2, 및 CDR3 아미노산 서열, 및 각각 SEQ ID NO: 54, 55, 및 56의 경쇄 CDR1, CDR2, 및 CDR3 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제10항에 있어서, 중쇄 가변 도메인이 SEQ ID NO:49와 적어도 90% 동일한 아미노산 서열을 포함하고, 경쇄 가변 도메인이 SEQ ID NO:53과 적어도 90% 동일한 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 쌍을 형성하여 HER2에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인이 각각 SEQ ID NO: 77, 78, 및 79의 중쇄 CDR1, CDR2, 및 CDR3 아미노산 서열, 및 각각 SEQ ID NO: 80, 81, 및 82의 경쇄 CDR1, CDR2, 및 CDR3 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제12항에 있어서, 중쇄 가변 도메인이 SEQ ID NO:57과 적어도 90% 동일한 아미노산 서열을 포함하고, 경쇄 가변 도메인이 SEQ ID NO:58과 적어도 90% 동일한 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 쌍을 형성하여 HER2에 결합하는 중쇄 가변 도메인 및 경쇄 가변 도메인이 각각 SEQ ID NO: 83, 84, 및 85의 중쇄 CDR1, CDR2, 및 CDR3 아미노산 서열, 및 각각 SEQ ID NO: 86, 87, 및 88의 경쇄 CDR1, CDR2, 및 CDR3 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제14항에 있어서, 중쇄 가변 도메인이 SEQ ID NO:59와 적어도 90% 동일한 아미노산 서열을 포함하고, 경쇄 가변 도메인이 SEQ ID NO:60과 적어도 90% 동일한 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 있어서, 항체 Fc 도메인의 힌지 및 CH2 도메인을 포함하는 것인 다중-특이적 결합 단백질.
- 제16항에 있어서, 힌지 및 CH2 도메인이 인간 IgG1 항체의 힌지 및 CH2 도메인인 것인 다중-특이적 결합 단백질.
- 제16항에 있어서, Fc 도메인이 인간 IgG1 항체의 아미노산 234-332와 적어도 90% 동일한 아미노산 서열을 포함하는 것인 다중-특이적 결합 단백질.
- 제18항에 있어서, Fc 도메인이 인간 IgG1의 Fc 도메인과 적어도 90% 동일한 아미노산 서열을 포함하고, 카바트(Kabat)에서와 같이 EU 인덱스에 따라 넘버링된 Q347, Y349, T350, L351, S354, E356, E357, K360, Q362, S364, T366, L368, K370, N390, K392, T394, D399, S400, D401, F405, Y407, K409, T411, 및 K439로 이루어진 군으로부터 선택되는 하나 이상의 위치에서 상이한 것인 다중-특이적 결합 단백질.
- 제1항 또는 제2항에 따른 다중-특이적 결합 단백질 및 제약상 허용가능한 담체를 포함하는 제형.
- 제1항 또는 제2항에 따른 다중-특이적 결합 단백질을 코딩하는 하나 이상의 핵산을 포함하는 세포.
- 제20항에 있어서, 암을 치료하는 방법에 사용하기 위한 제형이며, 여기서 상기 방법이 다중-특이적 결합 단백질 또는 제형을 환자에게 투여하는 것을 포함하는 것인 제형.
- 제22항에 있어서, 상기 암이 유방암, 난소암, 식도암, 방광암, 위암, 타액관 암종, 폐의 선암종, 및 공격적인 형태의 자궁암으로 이루어진 군으로부터 선택되는 것인 제형.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762461146P | 2017-02-20 | 2017-02-20 | |
| US62/461,146 | 2017-02-20 | ||
| KR1020197027269A KR20190120782A (ko) | 2017-02-20 | 2018-02-20 | Her2, nkg2d 및 cd16에 결합하는 단백질 |
| PCT/US2018/018771 WO2018152518A1 (en) | 2017-02-20 | 2018-02-20 | Proteins binding her2, nkg2d and cd16 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197027269A Division KR20190120782A (ko) | 2017-02-20 | 2018-02-20 | Her2, nkg2d 및 cd16에 결합하는 단백질 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20240060739A true KR20240060739A (ko) | 2024-05-08 |
Family
ID=63170743
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197027269A KR20190120782A (ko) | 2017-02-20 | 2018-02-20 | Her2, nkg2d 및 cd16에 결합하는 단백질 |
| KR1020247014453A KR20240060739A (ko) | 2017-02-20 | 2018-02-20 | Her2, nkg2d 및 cd16에 결합하는 단백질 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197027269A KR20190120782A (ko) | 2017-02-20 | 2018-02-20 | Her2, nkg2d 및 cd16에 결합하는 단백질 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US11884732B2 (ko) |
| EP (2) | EP4273258A3 (ko) |
| JP (3) | JP2020508997A (ko) |
| KR (2) | KR20190120782A (ko) |
| CN (1) | CN110944661A (ko) |
| AU (1) | AU2018220736A1 (ko) |
| BR (1) | BR112019017197A2 (ko) |
| CA (2) | CA3054079A1 (ko) |
| DK (1) | DK3582806T3 (ko) |
| ES (1) | ES2955074T3 (ko) |
| FI (1) | FI3582806T3 (ko) |
| IL (1) | IL268755A (ko) |
| MX (1) | MX2019009848A (ko) |
| SG (1) | SG11201907646YA (ko) |
| WO (1) | WO2018152518A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SG11201907299XA (en) | 2017-02-08 | 2019-09-27 | Dragonfly Therapeutics Inc | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer |
| DK3582806T3 (da) | 2017-02-20 | 2023-09-11 | Dragonfly Therapeutics Inc | Proteiner, der binder her2, nkg2d og cd16 |
| MX2020008336A (es) | 2018-02-08 | 2020-09-21 | Dragonfly Therapeutics Inc | Dominios variables de anticuerpos que se dirigen al receptor nkg2d. |
| AU2019225741A1 (en) * | 2018-02-20 | 2020-09-17 | Dragonfly Therapeutics, Inc. | Multi-specific binding proteins that bind cd33, nkg2d, and cd16, and methods of use |
| EA202091977A1 (ru) * | 2018-05-28 | 2021-02-09 | Драгонфлай Терапьютикс, Инк. | Мультиспецифические связывающие белки, которые связывают cd33, nkg2d и cd16, и способы применения |
| EA202091888A1 (ru) * | 2018-08-08 | 2020-10-23 | Драгонфлай Терапьютикс, Инк. | Вариабельные домены антител, нацеленные на рецептор nkg2d |
| PE20211279A1 (es) | 2018-10-23 | 2021-07-19 | Dragonfly Therapeutics Inc | Proteinas heterodimericas fusionadas con fc |
| EP4021943A4 (en) * | 2019-08-30 | 2023-09-13 | Dragonfly Therapeutics, Inc. | PHARMACEUTICAL FORMULATIONS AND DOSAGE SCHEDULES FOR MULTI-SPECIFIC BINDING PROTEINS THAT BIND HER2, NKG2D AND CD16 FOR CANCER TREATMENT |
| CN116063550A (zh) * | 2020-09-02 | 2023-05-05 | 南京北恒生物科技有限公司 | 靶向nk激活性受体的嵌合抗原受体 |
| WO2022258691A1 (en) * | 2021-06-09 | 2022-12-15 | Innate Pharma | Multispecific proteins binding to nkg2d, a cytokine receptor, a tumour antigen and cd16a |
| WO2024056861A1 (en) | 2022-09-15 | 2024-03-21 | Avidicure Ip B.V. | Multispecific antigen binding proteins for stimulating nk cells and use thereof |
Family Cites Families (274)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1988008854A1 (en) | 1987-05-06 | 1988-11-17 | Egbert Oosterwijk | Monoclonal antibodies to renal cell carcinoma |
| WO1989006692A1 (en) | 1988-01-12 | 1989-07-27 | Genentech, Inc. | Method of treating tumor cells by inhibiting growth factor receptor function |
| EP0415929A1 (en) | 1988-01-15 | 1991-03-13 | Centocor, Inc. | Heteroligating antibodies and therapeutic uses thereof |
| EP0557300B1 (en) | 1990-10-29 | 1997-11-19 | Chiron Corporation | Bispecific antibodies, method of production, and uses thereof |
| EP1400536A1 (en) | 1991-06-14 | 2004-03-24 | Genentech Inc. | Method for making humanized antibodies |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| DK0627940T3 (da) | 1992-03-05 | 2003-09-01 | Univ Texas | Anvendelse af immunokonjugater til diagnose og/eller terapi af vaskulariserede tumorer |
| US5965132A (en) | 1992-03-05 | 1999-10-12 | Board Of Regents, The University Of Texas System | Methods and compositions for targeting the vasculature of solid tumors |
| US5776427A (en) | 1992-03-05 | 1998-07-07 | Board Of Regents, The University Of Texas System | Methods for targeting the vasculature of solid tumors |
| US6036955A (en) | 1992-03-05 | 2000-03-14 | The Scripps Research Institute | Kits and methods for the specific coagulation of vasculature |
| US7381803B1 (en) | 1992-03-27 | 2008-06-03 | Pdl Biopharma, Inc. | Humanized antibodies against CD3 |
| US6129914A (en) | 1992-03-27 | 2000-10-10 | Protein Design Labs, Inc. | Bispecific antibody effective to treat B-cell lymphoma and cell line |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| EP0871673B1 (en) | 1995-05-03 | 2006-04-05 | Bioenhancementsments Ltd. | Bispecific antibodies in which the binding capability is reversibly inhibited by a photocleavable moiety |
| DE19531346A1 (de) | 1995-08-25 | 1997-02-27 | Gsf Forschungszentrum Umwelt | Arzneimittel zur Immuntherapie, enthaltend Antikörper, die spezifisch das MHCII-Antigen eines zu behandelnden Patienten erkennen |
| US7951917B1 (en) | 1997-05-02 | 2011-05-31 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| PT1071752E (pt) | 1998-04-21 | 2003-11-28 | Micromet Ag | Polipeptidos especificos para cd19xcd3 e suas utilizacoes |
| US6572856B1 (en) | 1998-09-10 | 2003-06-03 | The University Of Virginia Patent Foundation | Methods for the prevention and treatment of cancer using anti-C3b(i) antibodies |
| AU1218000A (en) | 1998-10-21 | 2000-05-08 | Sunol Molecular Corporation | Polyspecific binding molecules and uses thereof |
| CN1423700A (zh) | 2000-03-24 | 2003-06-11 | 麦克美特股份公司 | 含有针对nkg2d受体复合物的表位的结合位点的多功能多肽 |
| WO2001090192A2 (en) | 2000-05-24 | 2001-11-29 | Imclone Systems Incorporated | Bispecific immunoglobulin-like antigen binding proteins and method of production |
| US20040115198A1 (en) | 2001-02-28 | 2004-06-17 | Fred Hutchinson Cancer Research Center | Activation of lymphocyte populations expressing NKG2D using anti-NKG2D antibodies and ligand derivatives |
| US20020193569A1 (en) | 2001-06-04 | 2002-12-19 | Idec Pharmaceuticals Corporation | Bispecific fusion protein and method of use for enhancing effector cell killing of target cells |
| DE10156482A1 (de) | 2001-11-12 | 2003-05-28 | Gundram Jung | Bispezifisches Antikörper-Molekül |
| US7202343B2 (en) | 2002-08-19 | 2007-04-10 | Abgenix, Inc. | Antibodies directed to monocyte chemo-attractant protein-1 (MCP-1) and uses thereof |
| US7820166B2 (en) | 2002-10-11 | 2010-10-26 | Micromet Ag | Potent T cell modulating molecules |
| DE10261223A1 (de) | 2002-12-20 | 2004-07-08 | MedInnova Gesellschaft für medizinische Innovationen aus akademischer Forschung mbH | Steigerung der Immunantwort durch Substanzen, welche die Funktion von Natürlichen Killerzellen beeinflussen |
| KR20050108349A (ko) | 2003-02-06 | 2005-11-16 | 마이크로메트 에이지 | 영속적인 티 세포 반응을 유도하는 삼량체 폴리펩티드 구조물 |
| US7666417B2 (en) | 2003-04-22 | 2010-02-23 | Fred Hutchinson Cancer Research Center | Methods and compositions for treating autoimmune diseases or conditions |
| WO2004106380A2 (en) | 2003-05-31 | 2004-12-09 | Micromet Ag | Human-anti-human cd3 binding molecules |
| US7635472B2 (en) | 2003-05-31 | 2009-12-22 | Micromet Ag | Pharmaceutical compositions comprising bispecific anti-cd3, anti-cd19 antibody constructs for the treatment of b-cell related disorders |
| KR101299599B1 (ko) | 2003-07-24 | 2013-08-23 | 위니베르시따 데글리 스뚜디 디 뻬루지아 | Nk 세포 강화 화합물을 사용하여 치료용 항체의 효율을 높이는 방법 및 조성물 |
| HN2004000285A (es) | 2003-08-04 | 2006-04-27 | Pfizer Prod Inc | ANTICUERPOS DIRIGIDOS A c-MET |
| NZ546173A (en) | 2003-10-16 | 2009-04-30 | Micromet Ag | Multispecific deimmunized CD3-binders |
| US7235641B2 (en) | 2003-12-22 | 2007-06-26 | Micromet Ag | Bispecific antibodies |
| US20110020273A1 (en) | 2005-04-06 | 2011-01-27 | Ibc Pharmaceuticals, Inc. | Bispecific Immunocytokine Dock-and-Lock (DNL) Complexes and Therapeutic Use Thereof |
| SI1716178T1 (sl) | 2004-02-16 | 2010-11-30 | Micromet Ag | Manj imunogene vezne molekule |
| WO2006008096A1 (en) | 2004-07-16 | 2006-01-26 | Micromet Ag | Expression-enhanced polypeptides |
| UA90480C2 (uk) * | 2004-07-22 | 2010-05-11 | Джэнэнтэк, Инк. | Фармацевтична композиція, що має протипухлинну активність, яка включає антитіло до her2 |
| WO2006037960A2 (en) | 2004-10-01 | 2006-04-13 | Avidex Ltd. | T-cell receptors containing a non-native disulfide interchain bond linked to therapeutic agents |
| DOP2006000029A (es) | 2005-02-07 | 2006-08-15 | Genentech Inc | Antibody variants and uses thereof. (variantes de un anticuerpo y usos de las mismas) |
| US9284375B2 (en) | 2005-04-15 | 2016-03-15 | Macrogenics, Inc. | Covalent diabodies and uses thereof |
| US9296816B2 (en) | 2005-04-15 | 2016-03-29 | Macrogenics, Inc. | Covalent diabodies and uses thereof |
| JP2006316040A (ja) | 2005-05-13 | 2006-11-24 | Genentech Inc | Herceptin(登録商標)補助療法 |
| WO2007002905A1 (en) | 2005-06-29 | 2007-01-04 | University Of Miami | Antibody-immune cell ligand fusion protein for cancer therapy |
| JP2009504787A (ja) | 2005-08-19 | 2009-02-05 | シーラス コーポレイション | 抗体によって媒介される免疫応答の増強 |
| PE20071101A1 (es) | 2005-08-31 | 2007-12-21 | Amgen Inc | Polipeptidos y anticuerpos |
| EP1940881B1 (en) | 2005-10-11 | 2016-11-30 | Amgen Research (Munich) GmbH | Compositions comprising cross-species-specific antibodies and uses thereof |
| CN101300272B (zh) | 2005-10-14 | 2013-09-18 | 依奈特制药公司 | 用于治疗增生性病症的组合物和方法 |
| US20080299137A1 (en) | 2005-10-28 | 2008-12-04 | Novo Nordisk A/S | Fusion Proteins That Bind Effector Lymphocytes And Target Cells |
| JP2009514537A (ja) | 2005-11-03 | 2009-04-09 | ジェネンテック・インコーポレーテッド | 治療的抗her2抗体融合ポリペプチド |
| EP1949107A1 (en) | 2005-11-03 | 2008-07-30 | Fred Hutchinson Cancer Research Center | Negative immunomodulation of immune responses by nkg2d-positive cd4-positive cells |
| RU2008129080A (ru) | 2005-12-16 | 2010-01-27 | Микромет Аг (De) | Средства и способы лечения опухолевых заболеваний |
| EP1820513A1 (en) | 2006-02-15 | 2007-08-22 | Trion Pharma Gmbh | Destruction of tumor cells expressing low to medium levels of tumor associated target antigens by trifunctional bispecific antibodies |
| CA2654317A1 (en) | 2006-06-12 | 2007-12-21 | Trubion Pharmaceuticals, Inc. | Single-chain multivalent binding proteins with effector function |
| GB0614780D0 (en) | 2006-07-25 | 2006-09-06 | Ucb Sa | Biological products |
| US8192927B2 (en) | 2006-09-07 | 2012-06-05 | Crucell Holland B.V. | Human bind molecules capable of neutralizing influenza virus h5n1 and uses thereof |
| EP1900752A1 (en) | 2006-09-15 | 2008-03-19 | DOMPE' pha.r.ma s.p.a. | Human anti-folate receptor alpha antibodies and antibody fragments for the radioimmunotherapy of ovarian carcinoma |
| NZ581395A (en) | 2007-05-14 | 2012-08-31 | Biogen Idec Inc | Single-chain fc (scfc) regions, binding polypeptides comprising same, and methods related thereto |
| EP2014680A1 (en) | 2007-07-10 | 2009-01-14 | Friedrich-Alexander-Universität Erlangen-Nürnberg | Recombinant, single-chain, trivalent tri-specific or bi-specific antibody derivatives |
| CA2694396A1 (en) | 2007-07-25 | 2009-01-29 | Astrazeneca Ab | Targeted binding agents directed to kdr and uses thereof - 035 |
| MX2010001684A (es) | 2007-08-15 | 2010-04-21 | Amunix Inc | Composiciones y metodos para modificar propiedades de polipeptidos biologicamente activos. |
| JOP20080381B1 (ar) | 2007-08-23 | 2023-03-28 | Amgen Inc | بروتينات مرتبطة بمولدات مضادات تتفاعل مع بروبروتين كونفيرتاز سيتيليزين ككسين من النوع 9 (pcsk9) |
| JP5933894B2 (ja) | 2007-09-14 | 2016-06-15 | アディマブ, エルエルシー | 合理的に設計された、合成抗体ライブラリおよびその使用 |
| JP5591712B2 (ja) | 2007-12-14 | 2014-09-17 | ノボ・ノルデイスク・エー/エス | ヒトnkg2dに対する抗体とその使用 |
| PT2235064E (pt) | 2008-01-07 | 2016-03-01 | Amgen Inc | Método de preparação de moléculas heterodiméricas de fc de anticorpos utilizando efeitos de indução eletrostática |
| US20090226442A1 (en) | 2008-01-22 | 2009-09-10 | Biogen Idec Ma Inc. | RON antibodies and uses thereof |
| BRPI0913366A8 (pt) * | 2008-06-03 | 2017-07-11 | Abbott Lab | Imunoglobulinas de domínio variável duplo e seus usos |
| US8067339B2 (en) | 2008-07-09 | 2011-11-29 | Merck Sharp & Dohme Corp. | Surface display of whole antibodies in eukaryotes |
| US9273136B2 (en) * | 2008-08-04 | 2016-03-01 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Fully human anti-human NKG2D monoclonal antibodies |
| CA2737351A1 (en) | 2008-09-26 | 2010-04-01 | Wyeth Llc | Single chain antibody library design |
| WO2010054007A1 (en) | 2008-11-07 | 2010-05-14 | Fabrus Llc | Combinatorial antibody libraries and uses thereof |
| WO2010080124A2 (en) | 2008-12-18 | 2010-07-15 | Dana-Farber Cancer Institute, Inc. | Nkg2d-fc for immunotherapy |
| SG10201407908VA (en) | 2008-12-19 | 2015-01-29 | Macrogenics Inc | Covalent diabodies and uses thereof |
| CA2757531A1 (en) | 2009-04-07 | 2010-10-14 | Roche Glycart Ag | Bispecific anti-erbb-3/anti-c-met antibodies |
| EP2429584A4 (en) | 2009-05-13 | 2013-02-20 | Genzyme Corp | TREATMENT PROCEDURE AND COMPOSITIONS |
| US20130209514A1 (en) | 2009-06-09 | 2013-08-15 | Eli Gilboa | Aptamer-targeted costimulatory ligand aptamer |
| SG177560A1 (en) | 2009-07-06 | 2012-03-29 | Hoffmann La Roche | Bi-specific digoxigenin binding antibodies |
| UY32808A (es) | 2009-07-29 | 2011-02-28 | Abbott Lab | Inmunoglobulinas como dominio variable dual y usos de las mismas |
| US9493578B2 (en) | 2009-09-02 | 2016-11-15 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| US9062287B2 (en) * | 2009-09-11 | 2015-06-23 | Takara Bio Inc. | Process for production of natural killer cells |
| PL2493503T5 (pl) | 2009-10-27 | 2021-05-31 | Amgen Research (Munich) Gmbh | Schemat dawkowania do podawania dwuswoistego przeciwciała CD19xCD3 |
| WO2011057124A1 (en) | 2009-11-06 | 2011-05-12 | Transtarget, Inc. | Polyclonal bispecific antibody compositions and method of use |
| EP2332994A1 (en) | 2009-12-09 | 2011-06-15 | Friedrich-Alexander-Universität Erlangen-Nürnberg | Trispecific therapeutics against acute myeloid leukaemia |
| WO2011075636A2 (en) | 2009-12-18 | 2011-06-23 | Amgen Inc. | Wise binding agents and epitopes |
| US8658765B2 (en) | 2009-12-31 | 2014-02-25 | Avidbiotics Corp. | Non-natural MIC proteins |
| US8796420B2 (en) | 2009-12-31 | 2014-08-05 | Avidbiotics Corp. | Non-natural MIC proteins |
| US20120294857A1 (en) | 2010-01-11 | 2012-11-22 | Trustees Of Dartmouth College | Monomeric Bi-Specific Fusion Protein |
| US8802091B2 (en) | 2010-03-04 | 2014-08-12 | Macrogenics, Inc. | Antibodies reactive with B7-H3 and uses thereof |
| PH12018501083A1 (en) | 2010-03-04 | 2019-02-18 | Macrogenics Inc | Antibodies reactive with b7-h3, immunologically active fragments thereof and uses thereof |
| TWI653333B (zh) | 2010-04-01 | 2019-03-11 | 安進研究(慕尼黑)有限責任公司 | 跨物種專一性之PSMAxCD3雙專一性單鏈抗體 |
| EA201201435A1 (ru) | 2010-04-20 | 2013-04-30 | Генмаб А/С | ГЕТЕРОДИМЕРНЫЕ АНТИТЕЛО-Fc-СОДЕРЖАЩИЕ БЕЛКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ |
| EP2569337A1 (en) | 2010-05-14 | 2013-03-20 | Rinat Neuroscience Corp. | Heterodimeric proteins and methods for producing and purifying them |
| NZ702680A (en) | 2010-06-19 | 2016-07-29 | Sloan Kettering Inst Cancer | Anti-gd2 antibodies |
| UY33492A (es) | 2010-07-09 | 2012-01-31 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| DE102010039018B4 (de) | 2010-08-06 | 2013-02-28 | Technische Universität Dresden | Anti-La Antikörper und ihre Anwendung zum Immunotargeting |
| CA2808154A1 (en) | 2010-08-13 | 2012-02-16 | Medimmmune Limited | Monomeric polypeptides comprising variant fc regions and methods of use |
| BR112013001847A2 (pt) | 2010-08-24 | 2016-05-31 | Hoffmann La Roche | anticorpo biespecífico, método de preparação do anticorpo biespecífico, do anticorpo biespecífico trivalente, métodos e composição farmacêutica |
| TWI560199B (en) | 2010-08-31 | 2016-12-01 | Sanofi Sa | Peptide or peptide complex binding to α2 integrin and methods and uses involving the same |
| WO2012032080A1 (en) | 2010-09-07 | 2012-03-15 | F-Star Biotechnologische Forschungs- Und Entwicklungsges.M.B.H | Stabilised human fc |
| AU2011299066A1 (en) | 2010-09-10 | 2013-03-21 | Apexigen, Inc. | Anti-IL-1 beta antibodies and methods of use |
| UY33707A (es) | 2010-11-04 | 2012-05-31 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| MX352929B (es) | 2010-11-05 | 2017-12-13 | Zymeworks Inc | DISEÑO DE ANTICUERPOS HETERODIMÉRICOS ESTABLES CON MUTACIONES EN EL DOMINIO Fc. |
| CA2817015A1 (en) | 2010-11-09 | 2012-05-18 | Altimab Therapeutics, Inc. | Protein complexes for antigen binding and methods of use |
| US20120195900A1 (en) | 2010-12-22 | 2012-08-02 | Abbott Laboratories | Tri-variable domain binding proteins and uses thereof |
| CA2827923C (en) | 2011-02-25 | 2021-11-23 | Chugai Seiyaku Kabushiki Kaisha | Fc.gamma.riib-specific fc antibody |
| EP2686345B1 (en) | 2011-03-16 | 2018-04-25 | Amgen Inc. | Fc variants |
| SG10201602371VA (en) | 2011-03-25 | 2016-04-28 | Glenmark Pharmaceuticals Sa | Hetero-dimeric immunoglobulins |
| JP6400470B2 (ja) | 2011-05-16 | 2018-10-03 | ジェネロン(シャンハイ)コーポレイション リミテッド | 多重特異性Fab融合タンパク質および使用法 |
| CA2836873C (en) | 2011-05-21 | 2019-10-22 | Macrogenics, Inc. | Deimmunized serum-binding domains and their use for extending serum half-life |
| AU2012258637B2 (en) * | 2011-05-24 | 2017-07-20 | Zyngenia, Inc. | Multivalent and monovalent multispecific complexes and their uses |
| US8852599B2 (en) | 2011-05-26 | 2014-10-07 | Bristol-Myers Squibb Company | Immunoconjugates, compositions for making them, and methods of making and use |
| WO2012175613A1 (en) | 2011-06-21 | 2012-12-27 | Innate Pharma | NKp46-MEDIATED NK CELL TUNING |
| DE102011118022B4 (de) | 2011-06-30 | 2018-01-18 | Gemoab Monoclonals Gmbh | Antikörper gegen das Prostata-spezifische Stammzellenantigen und dessen Verwendung |
| CN109517059B (zh) | 2011-06-30 | 2023-03-28 | 中外制药株式会社 | 异源二聚化多肽 |
| RU2613368C2 (ru) | 2011-07-22 | 2017-03-16 | Аффимед Гмбх | Поливалентная антиген-связывающая fv-молекула |
| WO2013036799A2 (en) | 2011-09-09 | 2013-03-14 | Fred Hutchinson Cancer Research Center | Methods and compositions involving nkg2d inhibitors and cancer |
| WO2013047748A1 (ja) | 2011-09-30 | 2013-04-04 | 中外製薬株式会社 | 複数の生理活性を有する抗原の消失を促進する抗原結合分子 |
| CN107287660A (zh) | 2011-09-30 | 2017-10-24 | 中外制药株式会社 | 离子浓度依赖性结合分子文库 |
| BR112014015018A2 (pt) | 2011-12-19 | 2020-10-27 | Synimmune Gmbh | moléculas de anticorpo biespecífico e seu método de produção, bem como composição farmacêutica e molécula de ácido nucleico |
| JP6335796B2 (ja) | 2012-02-08 | 2018-06-06 | アイジーエム バイオサイエンシズ インク.Igm Biosciences Inc. | Cdim結合タンパク質及びその使用 |
| GB201203442D0 (en) | 2012-02-28 | 2012-04-11 | Univ Birmingham | Immunotherapeutic molecules and uses |
| US9029510B2 (en) | 2012-03-30 | 2015-05-12 | Sorrento Therapeutics, Inc. | Fully human antibodies that bind to VEGFR2 and methods of use thereof |
| KR102171431B1 (ko) | 2012-04-20 | 2020-10-30 | 메뤼스 엔.페. | Ig-유사 분자의 제조방법 및 제조수단 |
| US9163090B2 (en) | 2012-05-07 | 2015-10-20 | Cellerant Therapeutics, Inc. | Antibodies specific for CLL-1 |
| TWI766939B (zh) | 2012-05-30 | 2022-06-11 | 日商中外製藥股份有限公司 | 標的組織專一的抗原結合分子 |
| WO2013187495A1 (ja) | 2012-06-14 | 2013-12-19 | 中外製薬株式会社 | 改変されたFc領域を含む抗原結合分子 |
| EP2863946A4 (en) | 2012-06-21 | 2016-04-13 | Sorrento Therapeutics Inc | ANTIGEN-BINDING PROTEINS THAT BIND TO C-MET |
| EP2867253B1 (en) | 2012-06-27 | 2016-09-14 | F. Hoffmann-La Roche AG | Method for selection and production of tailor-made highly selective and multi-specific targeting entities containing at least two different binding entities and uses thereof |
| EP2872170A4 (en) | 2012-07-13 | 2016-06-22 | Zymeworks Inc | BISPECIFIC ASYMMETRIC HETÉRODIMÈRES COMPRISING ANTI-CD3 RECOMBINANT PRODUCTS |
| AU2013293092A1 (en) | 2012-07-23 | 2015-02-26 | Zymeworks Inc. | Immunoglobulin constructs comprising selective pairing of the light and heavy chains |
| WO2014022540A1 (en) | 2012-08-02 | 2014-02-06 | Regeneron Pharmaceuticals, Inc. | Multivalent antigen-binding proteins |
| CN109513003A (zh) | 2012-08-14 | 2019-03-26 | Ibc药品公司 | 用于治疗疾病的t-细胞重定向双特异性抗体 |
| CA2889681C (en) | 2012-09-27 | 2023-04-11 | Merus B.V. | Bispecific igg antibodies as t cell engagers |
| JP6571527B2 (ja) | 2012-11-21 | 2019-09-04 | ウーハン ワイゼットワイ バイオファルマ カンパニー リミテッドWuhan Yzy Biopharma Co., Ltd. | 二重特異性抗体 |
| ES2861446T3 (es) | 2012-11-27 | 2021-10-06 | Univ Ajou Ind Academic Coop Found | Par de variantes del dominio CH3 que induce la formación de heterodímero de la región constante de la cadena pesada del anticuerpo con alta eficiencia, método para prepararlo y uso del mismo |
| EA201500741A1 (ru) * | 2013-01-10 | 2016-01-29 | Генмаб Б.В. | ВАРИАНТЫ Fc-ОБЛАСТИ IGG1 ЧЕЛОВЕКА И ИХ ПРИМЕНЕНИЕ |
| DK2943511T3 (da) | 2013-01-14 | 2019-10-21 | Xencor Inc | Nye heterodimeriske proteiner |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| EP2948475A2 (en) | 2013-01-23 | 2015-12-02 | AbbVie Inc. | Methods and compositions for modulating an immune response |
| US10077315B2 (en) | 2013-02-05 | 2018-09-18 | Engmab Sàrl | Bispecific antibodies against CD3 and BCMA |
| EA201891502A1 (ru) | 2013-02-26 | 2018-12-28 | Роше Гликарт Аг | Биспецифические антигенсвязывающие молекулы, активирующие т-клетки |
| BR112015022790A8 (pt) | 2013-03-14 | 2020-01-21 | Univ Duke | molécula biespecífica, composição farmacêutica, método de tratamento de uma infecção por vírus latente em um indivíduo em necessidade de tal tratamento, método de tratamento de uma infecção por vírus persistente em um indivíduo em necessidade de tal tratamento, método de tratamento de uma infecção por vírus inativo em um indivíduo em necessidade de tal tratamento, método para exterminar uma célula que contém um genoma viral, e, método para exterminar uma célula que expressa uma proteína viral |
| AU2014232501C1 (en) | 2013-03-15 | 2021-04-22 | Xencor, Inc. | Heterodimeric proteins |
| US10858417B2 (en) * | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| CA2903576C (en) | 2013-03-15 | 2021-06-08 | Nai-Kong V. Cheung | High affinity anti-gd2 antibodies |
| WO2014165818A2 (en) | 2013-04-05 | 2014-10-09 | T Cell Therapeutics, Inc. | Compositions and methods for preventing and treating prostate cancer |
| US10156574B2 (en) | 2013-04-29 | 2018-12-18 | Adimab, Llc | Polyspecificity reagents, methods for their preparation and use |
| WO2014180577A1 (en) | 2013-05-10 | 2014-11-13 | Numab Ag | Bispecific constructs and their use in the treatment of various diseases |
| US10174117B2 (en) * | 2013-06-11 | 2019-01-08 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Anti-HER2 single domain antibodies, polypeptides comprising thereof and their use for treating cancer |
| WO2015007727A1 (en) | 2013-07-15 | 2015-01-22 | Novo Nordisk A/S | Antibodies that bind urokinase plasminogen activator |
| KR20220042248A (ko) | 2013-07-16 | 2022-04-04 | 제넨테크, 인크. | Pd-1 축 결합 길항제 및 tigit 억제제를 사용한 암을 치료하는 방법 |
| ES2683268T3 (es) | 2013-07-25 | 2018-09-25 | Cytomx Therapeutics, Inc. | Anticuerpos multiespecíficos, anticuerpos activables multiespecíficos y métodos para usar los mismos |
| JP6599338B2 (ja) | 2013-09-16 | 2019-10-30 | ヘルムホルツ・ツェントルム・ミュンヒェン・ドイチェス・フォルシュンクスツェントルム・フューア・ゲズントハイト・ウント・ウムベルト(ゲーエムベーハー) | Hbv感染および関連症状の治療のための免疫エフェクター細胞表面抗原およびhbv抗原結合性の二重特異性または多重特異性ポリペプチド |
| GB2518221A (en) | 2013-09-16 | 2015-03-18 | Sergej Michailovic Kiprijanov | Tetravalent antigen-binding protein molecule |
| GB2519786A (en) | 2013-10-30 | 2015-05-06 | Sergej Michailovic Kiprijanov | Multivalent antigen-binding protein molecules |
| JP6553069B2 (ja) | 2013-11-07 | 2019-07-31 | メモリアル スローン ケタリング キャンサー センター | 抗wt1/hla二重特異性抗体 |
| DE102013019352A1 (de) | 2013-11-13 | 2015-09-17 | Elke Pogge Von Strandmann | Tri-spezifische rekombinante Antikörperderivate zur Behandlung von malignen Erkrankungen durch Aktivierung einer NK-Zell-basierten Immunantwort |
| RU2737882C2 (ru) | 2013-11-27 | 2020-12-04 | Займворкс Инк. | Биспецифические антигенсвязывающие конструкции против her2 |
| EP3461845B1 (en) | 2013-12-13 | 2020-09-16 | Genentech, Inc. | Anti-cd33 antibodies and immunoconjugates |
| WO2015095412A1 (en) | 2013-12-19 | 2015-06-25 | Zhong Wang | Bispecific antibody with two single-domain antigen-binding fragments |
| RU2732032C2 (ru) | 2013-12-20 | 2020-09-10 | Дженентек, Инк. | Антитела с двойной специфичностью |
| RU2016129517A (ru) | 2013-12-20 | 2018-01-25 | Ф. Хоффманн-Ля Рош Аг | Биспецифические антитела к her2 и способы применения |
| JP6585600B2 (ja) | 2013-12-23 | 2019-10-02 | ザイムワークス インコーポレイティド | C末端軽鎖ポリペプチド伸長を含有する抗体、ならびにその複合体及びその使用方法 |
| CN106459182B (zh) | 2013-12-30 | 2021-09-03 | 岸迈生物科技有限公司 | 串联fab免疫球蛋白及其用途 |
| MX2016009050A (es) | 2014-01-15 | 2016-12-09 | Zymeworks Inc | Construcciones biespecificas de union a los antigenos cd3 y cd19. |
| EP3241561A1 (en) | 2014-03-05 | 2017-11-08 | Ucl Business Plc | Chimeric antigen receptor (car) with antigen binding domains to the t cell receptor beta constant region |
| RU2016142476A (ru) | 2014-03-31 | 2018-05-07 | Дженентек, Инк. | Комбинированная терапия, включающая антиангиогенезные агенты и агонисты, связывающие ох40 |
| US20170022291A1 (en) | 2014-04-01 | 2017-01-26 | Adimab, Llc | Multispecific antibody analogs comprising a common light chain, and methods of their preparation and use |
| UA117289C2 (uk) | 2014-04-02 | 2018-07-10 | Ф. Хоффманн-Ля Рош Аг | Мультиспецифічне антитіло |
| SI3126383T1 (sl) | 2014-04-03 | 2019-05-31 | Igm Biosciences, Inc. | Modificirana veriga J |
| WO2015157592A1 (en) | 2014-04-11 | 2015-10-15 | Medimmune, Llc | Bispecific her2 antibodies |
| EP2930188A1 (en) | 2014-04-13 | 2015-10-14 | Affimed Therapeutics AG | Trifunctional antigen-binding molecule |
| EP2942629A1 (en) | 2014-05-08 | 2015-11-11 | Universität Würzburg | Predictive markers for successful cancer immunotherapy |
| TWI707872B (zh) | 2014-05-29 | 2020-10-21 | 美商宏觀基因股份有限公司 | 特異性結合多種癌症抗原的三特異性結合分子和其使用方法 |
| GB201409558D0 (en) | 2014-05-29 | 2014-07-16 | Ucb Biopharma Sprl | Method |
| WO2015197593A1 (en) | 2014-06-27 | 2015-12-30 | Innate Pharma | MULTISPECIFIC NKp46 BINDING PROTEINS |
| JP6702893B2 (ja) | 2014-06-27 | 2020-06-03 | イナート・ファルマ・ソシエテ・アノニムInnate Pharma Pharma S.A. | 多重特異的抗原結合タンパク質 |
| WO2015197582A1 (en) | 2014-06-27 | 2015-12-30 | Innate Pharma | Monomeric multispecific antigen binding proteins |
| CN106999556B (zh) | 2014-07-21 | 2021-07-30 | 武汉友芝友生物制药有限公司 | 细胞因子诱导的杀伤细胞的双特异性抗体介导的癌症治疗 |
| BR112017001242A2 (pt) | 2014-07-21 | 2017-12-05 | Novartis Ag | tratamento de câncer usando um receptor antigênico quimérico a cd33 |
| US9777073B2 (en) | 2014-07-21 | 2017-10-03 | Wuhan Yzy Biopharma Co., Ltd. | Construction and application of bispecific antibody EpCAM×CD3 |
| EP2985294A1 (en) | 2014-08-14 | 2016-02-17 | Deutsches Krebsforschungszentrum | Recombinant antibody molecule and its use for target cell restricted T cell activation |
| CA2958200A1 (en) | 2014-08-14 | 2016-02-18 | Novartis Ag | Treatment of cancer using a gfr alpha-4 chimeric antigen receptor |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| JP2017533255A (ja) | 2014-08-28 | 2017-11-09 | アカデミス・ジーケンハイス・ライデン・ハー・オー・デー・エヌ・エルユーエムセーAcademisch Ziekenhuis Leiden H.O.D.N. Lumc | Cd94/nkg2aおよび/またはcd94/nkg2b抗体、ワクチンの組み合わせ |
| ES2688035T3 (es) | 2014-08-29 | 2018-10-30 | Gemoab Monoclonals Gmbh | Receptor de antígeno universal que expresa células inmunes para direccionamiento de antígenos múltiples diversos, procedimiento para fabricación del mismo y utilización del mismo para tratamiento de cáncer, infecciones y enfermedades autoinmunes |
| WO2016070959A1 (en) | 2014-11-03 | 2016-05-12 | Merck Patent Gmbh | Methods for generating bispecific shark variable antibody domains and use thereof |
| JP6721590B2 (ja) | 2014-12-03 | 2020-07-15 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | 多重特異性抗体 |
| RS63149B1 (sr) | 2014-12-05 | 2022-05-31 | Xyphos Biosciences Inc | Insertabilni varijabilni fragmenti antitela i modifikovani a1-a2 domeni nkg2d liganada |
| CA2970255A1 (en) | 2014-12-17 | 2016-06-23 | Intrexon Corporation | Intercalated single-chain variable fragments |
| EP3233917B1 (en) | 2014-12-19 | 2024-04-17 | Chiome Bioscience, Inc | Fusion protein comprising three binding domains to 5t4 and cd3 |
| EA201791527A1 (ru) | 2015-01-02 | 2017-12-29 | Дайэкс Корп. | Биспецифические антитела против плазменного калликреина и фактора xii |
| JP2018503399A (ja) | 2015-01-14 | 2018-02-08 | コンパス セラピューティクス リミテッド ライアビリティ カンパニー | 多特異性免疫調節抗原結合構築物 |
| WO2016122701A1 (en) * | 2015-01-26 | 2016-08-04 | Macrogenics, Inc. | Anti-dr5 antibodies and molecules comprising dr5-binding domains thereof |
| AU2016219785B2 (en) | 2015-02-20 | 2021-10-28 | Ohio State Innovation Foundation | Bivalent antibody directed against NKG2D and tumor associated antigens |
| MA41613A (fr) | 2015-02-23 | 2018-01-02 | Abbvie Stemcentrx Llc | Récepteurs antigéniques chimériques anti-dll3 et procédés d'utilisation desdits récepteurs |
| WO2016135041A1 (en) | 2015-02-26 | 2016-09-01 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Fusion proteins and antibodies comprising thereof for promoting apoptosis |
| US11673957B2 (en) | 2015-03-10 | 2023-06-13 | Eureka Therapeutics, Inc. | Anti-ROR2 antibodies |
| CN107223135B (zh) | 2015-03-16 | 2021-11-02 | 亥姆霍兹慕尼黑中心-德国环境健康研究中心(Gmbh) | 用于治疗hbv感染和相关病症的三特异性结合分子 |
| RU2021124437A (ru) | 2015-04-03 | 2021-09-29 | Еурека Терапьютикс, Инк. | Конструкции, направленные на комплексы пептида afp/mhc, и виды их использования |
| ES2901273T3 (es) | 2015-04-06 | 2022-03-21 | Subdomain Llc | Polipéptidos que contienen dominios de unión de novo y usos de los mismos |
| JP6999421B2 (ja) | 2015-04-07 | 2022-02-04 | アレクトル エルエルシー | 抗ソルチリン抗体及びその使用方法 |
| WO2016166139A1 (en) | 2015-04-14 | 2016-10-20 | Eberhard Karls Universität Tübingen | Bispecific fusion proteins for enhancing immune responses of lymphocytes against tumor cells |
| JP2018524284A (ja) | 2015-05-18 | 2018-08-30 | ユーリカ セラピューティックス, インコーポレイテッド | 抗ror1抗体 |
| EP3095792A1 (en) | 2015-05-19 | 2016-11-23 | Klinikum rechts der Isar der Technischen Universität München | T cell receptor with specificity for myeloperoxidase peptide and uses thereof |
| WO2016191305A1 (en) | 2015-05-22 | 2016-12-01 | The Board Of Trustees Of The Leland Stanford Junior University | Btn3a ectodomain proteins and methods of use |
| KR102492532B1 (ko) | 2015-05-29 | 2023-01-30 | 아게누스 인코포레이티드 | 항-ctla-4 항체 및 이의 사용 방법 |
| ES2936317T3 (es) | 2015-05-29 | 2023-03-16 | Bristol Myers Squibb Co | Anticuerpos contra OX40 y usos de los mismos |
| US20160361360A1 (en) | 2015-06-12 | 2016-12-15 | Immunomedics, Inc. | Disease therapy with chimeric antigen receptor (car) constructs and t cells (car-t) or nk cells (car-nk) expressing car constructs |
| JP2018518491A (ja) | 2015-06-12 | 2018-07-12 | アレクトル エルエルシー | 抗cd33抗体及びその使用方法 |
| WO2016207273A2 (en) * | 2015-06-23 | 2016-12-29 | Innate Pharma | Multispecific antigen binding proteins |
| JP6971153B2 (ja) | 2015-06-23 | 2021-11-24 | イナート・ファルマ・ソシエテ・アノニムInnate Pharma Pharma S.A. | 多重特異的nkエンゲイジャータンパク質 |
| PE20180499A1 (es) | 2015-07-06 | 2018-03-09 | Ucb Biopharma Sprl | Anticuerpos de union a tau |
| WO2017011342A1 (en) | 2015-07-10 | 2017-01-19 | Abbvie Inc. | Igm-or-ige-modified binding proteins and uses thereof |
| CA2991799A1 (en) | 2015-07-15 | 2017-01-19 | Zymeworks Inc. | Drug-conjugated bi-specific antigen-binding constructs |
| US20180312592A1 (en) | 2015-07-16 | 2018-11-01 | Cellerant Therapeutics, Inc. | Cysteine-substituted immunoglobulins |
| TWI793062B (zh) | 2015-07-31 | 2023-02-21 | 德商安美基研究(慕尼黑)公司 | Dll3及cd3抗體構築體 |
| AU2016322934A1 (en) | 2015-09-14 | 2018-04-12 | Compass Therapeutics Llc | Compositions and methods for treating cancer via antagonism of the CD155/TIGIT pathway and TGF-beta |
| CR20180163A (es) | 2015-10-02 | 2018-05-25 | Hoffmann La Roche | Anticuerpos biespecíficos específicos para un receptor de tnf coestimulador |
| AU2016343987B2 (en) | 2015-10-29 | 2023-11-23 | Alector Llc | Anti-Siglec-9 antibodies and methods of use thereof |
| ES2909973T3 (es) | 2015-11-04 | 2022-05-10 | Hope City | Receptores quiméricos para el antígeno que se dirigen a HER2 |
| EP3373952A4 (en) | 2015-11-10 | 2019-05-22 | Fred Hutchinson Cancer Research Center | NKG2D decoys |
| US20180327499A1 (en) | 2015-11-13 | 2018-11-15 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Anti- nkg2d single domain antibodies and uses thereof |
| AU2016383475B2 (en) | 2015-12-28 | 2024-02-22 | Innate Pharma | Variable regions for NKp46 binding proteins |
| JP2019509055A (ja) | 2016-01-13 | 2019-04-04 | コンパス セラピューティクス リミテッド ライアビリティ カンパニー | 多特異性免疫調節抗原結合構築物 |
| ES2847155T3 (es) | 2016-01-21 | 2021-08-02 | Novartis Ag | Moléculas multiespecíficas que fijan como objetivo CLL-1 |
| US20170233472A1 (en) | 2016-02-17 | 2017-08-17 | Macrogenics, Inc. | ROR1-Binding Molecules, and Methods of Use Thereof |
| WO2017143406A1 (en) | 2016-02-26 | 2017-08-31 | Imunexus Pty Ltd | Multi-specific molecules |
| CA3016563A1 (en) | 2016-03-21 | 2017-09-28 | Elstar Therapeutics, Inc. | Multispecific and multifunctional molecules and uses thereof |
| EP3432924A1 (en) | 2016-03-23 | 2019-01-30 | Novartis AG | Cell secreted minibodies and uses thereof |
| US10961311B2 (en) | 2016-04-15 | 2021-03-30 | Macrogenics, Inc. | B7-H3 binding molecules, antibody drug conjugates thereof and methods of use thereof |
| WO2017177337A1 (en) | 2016-04-15 | 2017-10-19 | Zymeworks Inc. | Multi-specific antigen-binding constructs targeting immunotherapeutics |
| GB201610044D0 (en) | 2016-06-08 | 2016-07-20 | Ucb Biopharma Sprl | Antibodies |
| RU2022104399A (ru) | 2016-06-14 | 2022-05-05 | Ксенкор, Инк. | Биспецифические антитела-ингибиторы контрольных точек |
| US9567399B1 (en) | 2016-06-20 | 2017-02-14 | Kymab Limited | Antibodies and immunocytokines |
| CN105906722B (zh) | 2016-06-24 | 2020-02-07 | 安徽未名细胞治疗有限公司 | 一种Her2特异性嵌合抗原受体及其应用 |
| US20200048347A1 (en) | 2016-09-01 | 2020-02-13 | Immunomab, Inc. | Bispecific antibodies |
| WO2018071777A1 (en) | 2016-10-14 | 2018-04-19 | Harpoon Therapeutics, Inc. | Innate immune cell trispecific binding proteins and methods of use |
| CN110267678A (zh) | 2016-10-29 | 2019-09-20 | 霍夫曼-拉罗奇有限公司 | 抗mic抗体和使用方法 |
| CA3044593A1 (en) | 2016-11-22 | 2018-05-31 | TCR2 Therapeutics Inc. | Compositions and methods for tcr reprogramming using fusion proteins |
| JOP20190134A1 (ar) | 2016-12-23 | 2019-06-02 | Potenza Therapeutics Inc | بروتينات رابطة لمولد ضد مضادة لنيوروبيلين وطرق استخدامها |
| EP3579866A4 (en) | 2017-02-08 | 2020-12-09 | Dragonfly Therapeutics, Inc. | HEAVY CHAIN VARIABLE ANTIBODY DOMAINS WITH NKG2D RECEPTOR AIMING |
| SG11201907299XA (en) * | 2017-02-08 | 2019-09-27 | Dragonfly Therapeutics Inc | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer |
| BR112019016424A2 (pt) | 2017-02-10 | 2020-04-07 | Dragonfly Therapeutics Inc | proteínas de ligação a bcma, nkg2d e cd16 |
| CN110913902A (zh) | 2017-02-10 | 2020-03-24 | 蜻蜓疗法股份有限公司 | 结合psma、nkg2d和cd16的蛋白质 |
| AU2018220734A1 (en) | 2017-02-20 | 2019-09-12 | Dragonfly Therapeutics, Inc. | Proteins binding CD33, NKG2D and CD16 |
| SG11201907645PA (en) | 2017-02-20 | 2019-09-27 | Dragonfly Therapeutics Inc | Proteins binding cd123, nkg2d and cd16 |
| DK3582806T3 (da) | 2017-02-20 | 2023-09-11 | Dragonfly Therapeutics Inc | Proteiner, der binder her2, nkg2d og cd16 |
| US20200231700A1 (en) | 2017-02-20 | 2020-07-23 | Dragonfly Therapeutics, Inc. | Proteins binding gd2, nkg2d and cd16 |
| AU2018224319B2 (en) | 2017-02-27 | 2024-04-04 | Dragonfly Therapeutics, Inc. | Multispecific binding proteins targeting CEA |
| WO2018201051A1 (en) | 2017-04-28 | 2018-11-01 | Novartis Ag | Bcma-targeting agent, and combination therapy with a gamma secretase inhibitor |
| WO2018217947A1 (en) | 2017-05-23 | 2018-11-29 | Dragonfly Therapeutics, Inc. | A protein binding nkg2d, cd16 and a tumor-associated antigen |
| JP2020522474A (ja) | 2017-05-23 | 2020-07-30 | ドラゴンフライ セラピューティクス, インコーポレイテッド | Nkg2d、cd16、および腫瘍関連抗原に結合するタンパク質 |
| US20200157174A1 (en) | 2017-05-23 | 2020-05-21 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16 and ror1 or ror2 |
| CA3070986A1 (en) | 2017-07-31 | 2019-02-07 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16 and flt3 |
| CA3073117A1 (en) | 2017-08-16 | 2019-02-21 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16, and hla-e |
| JP2020531525A (ja) | 2017-08-23 | 2020-11-05 | ドラゴンフライ セラピューティクス, インコーポレイテッド | Nkg2d、cd16、および腫瘍−関連抗原に結合するタンパク質 |
| KR20200044957A (ko) | 2017-09-07 | 2020-04-29 | 드래곤플라이 쎄라퓨틱스, 인크. | Nkg2d, cd16 및 종양-연관 항원에 결합하는 단백질 |
| SG11202002298PA (en) | 2017-09-14 | 2020-04-29 | Dragonfly Therapeutics Inc | Proteins binding nkg2d, cd16, and c-type lectin-like molecule-1 (cll-1) |
| MX2020008336A (es) | 2018-02-08 | 2020-09-21 | Dragonfly Therapeutics Inc | Dominios variables de anticuerpos que se dirigen al receptor nkg2d. |
| EP3749347A4 (en) | 2018-02-08 | 2021-11-03 | Dragonfly Therapeutics, Inc. | CANCER POLYTHERAPY INVOLVING MULTI-SPECIFIC BINDING PROTEINS THAT ACTIVATE NATURAL KILLER CELLS |
| AU2019225741A1 (en) | 2018-02-20 | 2020-09-17 | Dragonfly Therapeutics, Inc. | Multi-specific binding proteins that bind cd33, nkg2d, and cd16, and methods of use |
| SG11202007943RA (en) | 2018-02-20 | 2020-09-29 | Dragonfly Therapeutics Inc | Antibody variable domains targeting cd33, and use thereof |
| US20210221894A1 (en) | 2018-04-03 | 2021-07-22 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16 and an antigen associated with tumors, mdscs and/or tams |
| US20210238290A1 (en) | 2018-05-07 | 2021-08-05 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16 and p-cadherin |
| MX2020012273A (es) | 2018-05-16 | 2021-04-28 | Dragonfly Therapeutics Inc | Proteína de union a nkg2d, cd16 y proteína de activación de fibroblastos. |
| EA202091977A1 (ru) | 2018-05-28 | 2021-02-09 | Драгонфлай Терапьютикс, Инк. | Мультиспецифические связывающие белки, которые связывают cd33, nkg2d и cd16, и способы применения |
| EA202091888A1 (ru) | 2018-08-08 | 2020-10-23 | Драгонфлай Терапьютикс, Инк. | Вариабельные домены антител, нацеленные на рецептор nkg2d |
| MX2021001510A (es) | 2018-08-08 | 2021-07-02 | Dragonfly Therapeutics Inc | Proteínas de union a nkg2d, cd16, y un antígeno asociado a tumores. |
| CR20210687A (es) | 2019-06-25 | 2022-03-03 | Gilead Sciences Inc | PROTEÍNAS DE FUSIÓN FLT3L-Fc Y MÉTODOS DE USO |
| AR119393A1 (es) | 2019-07-15 | 2021-12-15 | Hoffmann La Roche | Anticuerpos que se unen a nkg2d |
| EP4021943A4 (en) | 2019-08-30 | 2023-09-13 | Dragonfly Therapeutics, Inc. | PHARMACEUTICAL FORMULATIONS AND DOSAGE SCHEDULES FOR MULTI-SPECIFIC BINDING PROTEINS THAT BIND HER2, NKG2D AND CD16 FOR CANCER TREATMENT |
| KR20230008181A (ko) | 2020-05-06 | 2023-01-13 | 드래곤플라이 쎄라퓨틱스, 인크. | Nkg2d, cd16 및 clec12a에 결합하는 단백질 |
-
2018
- 2018-02-20 DK DK18754782.3T patent/DK3582806T3/da active
- 2018-02-20 EP EP23179516.2A patent/EP4273258A3/en active Pending
- 2018-02-20 FI FIEP18754782.3T patent/FI3582806T3/fi active
- 2018-02-20 SG SG11201907646YA patent/SG11201907646YA/en unknown
- 2018-02-20 CA CA3054079A patent/CA3054079A1/en active Pending
- 2018-02-20 US US16/486,569 patent/US11884732B2/en active Active
- 2018-02-20 KR KR1020197027269A patent/KR20190120782A/ko active Application Filing
- 2018-02-20 JP JP2019544919A patent/JP2020508997A/ja active Pending
- 2018-02-20 ES ES18754782T patent/ES2955074T3/es active Active
- 2018-02-20 KR KR1020247014453A patent/KR20240060739A/ko not_active Application Discontinuation
- 2018-02-20 CN CN201880026497.0A patent/CN110944661A/zh active Pending
- 2018-02-20 MX MX2019009848A patent/MX2019009848A/es unknown
- 2018-02-20 EP EP18754782.3A patent/EP3582806B1/en active Active
- 2018-02-20 AU AU2018220736A patent/AU2018220736A1/en active Pending
- 2018-02-20 BR BR112019017197A patent/BR112019017197A2/pt unknown
- 2018-02-20 CA CA3235295A patent/CA3235295A1/en active Pending
- 2018-02-20 WO PCT/US2018/018771 patent/WO2018152518A1/en active Application Filing
-
2019
- 2019-08-18 IL IL26875519A patent/IL268755A/en unknown
-
2022
- 2022-04-28 JP JP2022074381A patent/JP2022101687A/ja not_active Withdrawn
-
2024
- 2024-01-04 JP JP2024000143A patent/JP2024024048A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA3235295A1 (en) | 2018-08-23 |
| CA3054079A1 (en) | 2018-08-23 |
| EP3582806B1 (en) | 2023-07-26 |
| EP3582806A1 (en) | 2019-12-25 |
| CN110944661A (zh) | 2020-03-31 |
| EP3582806A4 (en) | 2020-12-16 |
| JP2024024048A (ja) | 2024-02-21 |
| US11884732B2 (en) | 2024-01-30 |
| EP4273258A3 (en) | 2024-01-17 |
| AU2018220736A1 (en) | 2019-09-05 |
| MX2019009848A (es) | 2019-12-19 |
| US20200231678A1 (en) | 2020-07-23 |
| ES2955074T3 (es) | 2023-11-28 |
| BR112019017197A2 (pt) | 2020-04-14 |
| WO2018152518A1 (en) | 2018-08-23 |
| EP4273258A2 (en) | 2023-11-08 |
| IL268755A (en) | 2019-10-31 |
| DK3582806T3 (da) | 2023-09-11 |
| JP2020508997A (ja) | 2020-03-26 |
| SG11201907646YA (en) | 2019-09-27 |
| KR20190120782A (ko) | 2019-10-24 |
| JP2022101687A (ja) | 2022-07-06 |
| FI3582806T3 (fi) | 2023-09-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20240166753A1 (en) | Multi-specific binding proteins that bind nkg2d, cd16, and a tumor-associated antigen for activation of natural killer cells and therapeutic uses thereof to treat cancer | |
| JP7431392B2 (ja) | NKG2D、CD16およびNectin4に結合するタンパク質 | |
| US11884732B2 (en) | Proteins binding HER2, NKG2D and CD16 | |
| KR20190123299A (ko) | Caix, ano1, 메소텔린, trop2, cea, 또는 클라우딘-18.2를 표적화하는 다중특이적 결합 단백질 | |
| KR20200010428A (ko) | Nkg2d, cd16, 및 ror1 또는 ror2에 결합하는 단백질 | |
| KR102645411B1 (ko) | Her2, nkg2d 및 cd16에 결합하는 다중-특이적 결합 단백질 및 사용 방법 | |
| KR20190115469A (ko) | Bcma, nkg2d 및 cd16에 결합하는 단백질 | |
| KR20200051789A (ko) | Nkg2d, cd16, 및 c-유형 렉틴-유사 분자-1 (cll-1)에 결합하는 단백질 | |
| KR20190120775A (ko) | Cd33, nkg2d 및 cd16에 결합하는 단백질 | |
| US20240018266A1 (en) | Proteins binding cd123, nkg2d and cd16 | |
| KR20200010430A (ko) | Nkg2d, cd16 및 종양-연관 항원에 결합하는 단백질 | |
| KR20200038530A (ko) | Nkg2d, cd16 및 종양-연관 항원에 결합하는 단백질 | |
| KR20200010429A (ko) | Nkg2d, cd16 및 종양-연관 항원에 결합하는 단백질 | |
| KR20190120770A (ko) | Psma, nkg2d 및 cd16에 결합하는 단백질 | |
| KR20190120783A (ko) | Gd2, nkg2d 및 cd16에 결합하는 단백질 | |
| CA3221995C (en) | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer | |
| RU2792671C2 (ru) | Полиспецифические связывающие белки, нацеленные на caix, ano1, мезотелин, trop2, сea или клаудин-18.2 | |
| RU2809125C2 (ru) | Полиспецифические связывающие белки для активации клеток-натуральных киллеров и их терапевтическое применение для лечения злокачественного новообразования | |
| KR20240078657A (ko) | Bcma, nkg2d 및 cd16에 결합하는 단백질 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal |