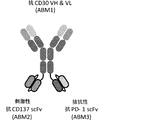
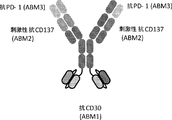
JP2018503399A - 多特異性免疫調節抗原結合構築物 - Google Patents
多特異性免疫調節抗原結合構築物 Download PDFInfo
- Publication number
- JP2018503399A JP2018503399A JP2017556515A JP2017556515A JP2018503399A JP 2018503399 A JP2018503399 A JP 2018503399A JP 2017556515 A JP2017556515 A JP 2017556515A JP 2017556515 A JP2017556515 A JP 2017556515A JP 2018503399 A JP2018503399 A JP 2018503399A
- Authority
- JP
- Japan
- Prior art keywords
- miac
- cancer
- cell
- abm2
- abm3
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 230000027455 binding Effects 0.000 title claims abstract description 351
- 239000000427 antigen Substances 0.000 title claims abstract description 295
- 108091007433 antigens Proteins 0.000 title claims abstract description 291
- 102000036639 antigens Human genes 0.000 title claims abstract description 291
- 230000002519 immonomodulatory effect Effects 0.000 title claims abstract description 19
- 210000004027 cell Anatomy 0.000 claims abstract description 358
- 239000012636 effector Substances 0.000 claims abstract description 212
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 152
- 201000011510 cancer Diseases 0.000 claims abstract description 130
- 102000005962 receptors Human genes 0.000 claims abstract description 116
- 108020003175 receptors Proteins 0.000 claims abstract description 116
- 238000000034 method Methods 0.000 claims abstract description 110
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 84
- 108091008042 inhibitory receptors Proteins 0.000 claims abstract description 83
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 83
- 229920001184 polypeptide Polymers 0.000 claims abstract description 80
- 210000002865 immune cell Anatomy 0.000 claims abstract description 55
- 239000000203 mixture Substances 0.000 claims abstract description 23
- 239000012634 fragment Substances 0.000 claims description 72
- 108060003951 Immunoglobulin Proteins 0.000 claims description 69
- 102000018358 immunoglobulin Human genes 0.000 claims description 69
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 44
- 230000002401 inhibitory effect Effects 0.000 claims description 43
- -1 CC123 Proteins 0.000 claims description 37
- 108010043610 KIR Receptors Proteins 0.000 claims description 34
- 108020001507 fusion proteins Proteins 0.000 claims description 34
- 102000037865 fusion proteins Human genes 0.000 claims description 34
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 claims description 33
- 230000003213 activating effect Effects 0.000 claims description 33
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 claims description 32
- 102100033627 Killer cell immunoglobulin-like receptor 3DL1 Human genes 0.000 claims description 32
- 230000035755 proliferation Effects 0.000 claims description 32
- 230000004913 activation Effects 0.000 claims description 30
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 claims description 29
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 claims description 29
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 claims description 29
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 claims description 29
- 102100026878 Interleukin-2 receptor subunit alpha Human genes 0.000 claims description 29
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 claims description 28
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 claims description 28
- 239000008194 pharmaceutical composition Substances 0.000 claims description 28
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 claims description 27
- 108010074328 Interferon-gamma Proteins 0.000 claims description 27
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 claims description 27
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 27
- 101000633786 Homo sapiens SLAM family member 6 Proteins 0.000 claims description 26
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 26
- 102100029197 SLAM family member 6 Human genes 0.000 claims description 26
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 26
- 239000003795 chemical substances by application Substances 0.000 claims description 24
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 claims description 23
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 claims description 23
- 108091033319 polynucleotide Proteins 0.000 claims description 21
- 239000002157 polynucleotide Substances 0.000 claims description 21
- 102000040430 polynucleotide Human genes 0.000 claims description 21
- 102100037850 Interferon gamma Human genes 0.000 claims description 20
- 230000003827 upregulation Effects 0.000 claims description 19
- 102000001398 Granzyme Human genes 0.000 claims description 18
- 108060005986 Granzyme Proteins 0.000 claims description 18
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims description 18
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims description 17
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 claims description 17
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 claims description 17
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 claims description 17
- 230000028327 secretion Effects 0.000 claims description 17
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 claims description 16
- 108010002350 Interleukin-2 Proteins 0.000 claims description 15
- 230000001472 cytotoxic effect Effects 0.000 claims description 15
- 238000004519 manufacturing process Methods 0.000 claims description 15
- 201000005962 mycosis fungoides Diseases 0.000 claims description 15
- 239000000539 dimer Substances 0.000 claims description 14
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 13
- 108010003723 Single-Domain Antibodies Proteins 0.000 claims description 13
- 102100027207 CD27 antigen Human genes 0.000 claims description 12
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 12
- 230000004048 modification Effects 0.000 claims description 12
- 238000012986 modification Methods 0.000 claims description 12
- 239000013598 vector Substances 0.000 claims description 12
- 102100024263 CD160 antigen Human genes 0.000 claims description 11
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 claims description 11
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 claims description 11
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 11
- 206010009944 Colon cancer Diseases 0.000 claims description 10
- 208000003445 Mouth Neoplasms Diseases 0.000 claims description 10
- 206010029260 Neuroblastoma Diseases 0.000 claims description 10
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 10
- 230000020411 cell activation Effects 0.000 claims description 10
- 230000004663 cell proliferation Effects 0.000 claims description 10
- 206010017758 gastric cancer Diseases 0.000 claims description 10
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 claims description 10
- 201000011549 stomach cancer Diseases 0.000 claims description 10
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 9
- 108010074708 B7-H1 Antigen Proteins 0.000 claims description 9
- 206010006187 Breast cancer Diseases 0.000 claims description 9
- 208000026310 Breast neoplasm Diseases 0.000 claims description 9
- 102100035133 Lysosome-associated membrane glycoprotein 1 Human genes 0.000 claims description 9
- 102100038082 Natural killer cell receptor 2B4 Human genes 0.000 claims description 9
- 102100029215 Signaling lymphocytic activation molecule Human genes 0.000 claims description 9
- 239000003814 drug Substances 0.000 claims description 9
- 239000003550 marker Substances 0.000 claims description 9
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 8
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 claims description 8
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 claims description 8
- 101001068136 Homo sapiens Hepatitis A virus cellular receptor 1 Proteins 0.000 claims description 8
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 claims description 8
- 101000971533 Homo sapiens Killer cell lectin-like receptor subfamily G member 1 Proteins 0.000 claims description 8
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 claims description 8
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 claims description 8
- 102100021457 Killer cell lectin-like receptor subfamily G member 1 Human genes 0.000 claims description 8
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 8
- 229940124597 therapeutic agent Drugs 0.000 claims description 8
- 102100025137 Early activation antigen CD69 Human genes 0.000 claims description 7
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 claims description 7
- 101001117317 Homo sapiens Programmed cell death 1 ligand 1 Proteins 0.000 claims description 7
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 7
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims description 7
- 102000008070 Interferon-gamma Human genes 0.000 claims description 7
- 206010025323 Lymphomas Diseases 0.000 claims description 7
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 7
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 claims description 7
- 230000003828 downregulation Effects 0.000 claims description 7
- 229960003130 interferon gamma Drugs 0.000 claims description 7
- 201000001441 melanoma Diseases 0.000 claims description 7
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 claims description 6
- 102100025475 Carcinoembryonic antigen-related cell adhesion molecule 5 Human genes 0.000 claims description 6
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 claims description 6
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 claims description 6
- 101000633778 Homo sapiens SLAM family member 5 Proteins 0.000 claims description 6
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 claims description 6
- 101000679903 Homo sapiens Tumor necrosis factor receptor superfamily member 25 Proteins 0.000 claims description 6
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 claims description 6
- 102100025584 Leukocyte immunoglobulin-like receptor subfamily B member 1 Human genes 0.000 claims description 6
- 101710116782 Lysosome-associated membrane glycoprotein 1 Proteins 0.000 claims description 6
- 101710141230 Natural killer cell receptor 2B4 Proteins 0.000 claims description 6
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 6
- 208000015634 Rectal Neoplasms Diseases 0.000 claims description 6
- 102100029216 SLAM family member 5 Human genes 0.000 claims description 6
- 108010074687 Signaling Lymphocytic Activation Molecule Family Member 1 Proteins 0.000 claims description 6
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 claims description 6
- 102100033447 T-lymphocyte surface antigen Ly-9 Human genes 0.000 claims description 6
- 101150074789 Timd2 gene Proteins 0.000 claims description 6
- 102100022203 Tumor necrosis factor receptor superfamily member 25 Human genes 0.000 claims description 6
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 6
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 claims description 6
- 208000029742 colonic neoplasm Diseases 0.000 claims description 6
- 239000000710 homodimer Substances 0.000 claims description 6
- 208000032839 leukemia Diseases 0.000 claims description 6
- 230000000873 masking effect Effects 0.000 claims description 6
- 208000003154 papilloma Diseases 0.000 claims description 6
- 206010038038 rectal cancer Diseases 0.000 claims description 6
- 201000001275 rectum cancer Diseases 0.000 claims description 6
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 5
- 208000006468 Adrenal Cortex Neoplasms Diseases 0.000 claims description 5
- 206010061424 Anal cancer Diseases 0.000 claims description 5
- 208000007860 Anus Neoplasms Diseases 0.000 claims description 5
- 206010073360 Appendix cancer Diseases 0.000 claims description 5
- 206010003571 Astrocytoma Diseases 0.000 claims description 5
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 claims description 5
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 5
- 208000005440 Basal Cell Neoplasms Diseases 0.000 claims description 5
- 206010004146 Basal cell carcinoma Diseases 0.000 claims description 5
- 206010004593 Bile duct cancer Diseases 0.000 claims description 5
- 206010005003 Bladder cancer Diseases 0.000 claims description 5
- 206010005949 Bone cancer Diseases 0.000 claims description 5
- 208000018084 Bone neoplasm Diseases 0.000 claims description 5
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 5
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 5
- 206010007279 Carcinoid tumour of the gastrointestinal tract Diseases 0.000 claims description 5
- 201000009030 Carcinoma Diseases 0.000 claims description 5
- 206010007953 Central nervous system lymphoma Diseases 0.000 claims description 5
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 5
- 201000009047 Chordoma Diseases 0.000 claims description 5
- 208000009798 Craniopharyngioma Diseases 0.000 claims description 5
- 102100027816 Cytotoxic and regulatory T-cell molecule Human genes 0.000 claims description 5
- 208000006402 Ductal Carcinoma Diseases 0.000 claims description 5
- 206010014733 Endometrial cancer Diseases 0.000 claims description 5
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 5
- 206010014967 Ependymoma Diseases 0.000 claims description 5
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 5
- 208000006168 Ewing Sarcoma Diseases 0.000 claims description 5
- 206010053717 Fibrous histiocytoma Diseases 0.000 claims description 5
- 208000022072 Gallbladder Neoplasms Diseases 0.000 claims description 5
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 claims description 5
- 208000032612 Glial tumor Diseases 0.000 claims description 5
- 206010018338 Glioma Diseases 0.000 claims description 5
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 claims description 5
- 101000633784 Homo sapiens SLAM family member 7 Proteins 0.000 claims description 5
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 claims description 5
- 206010061252 Intraocular melanoma Diseases 0.000 claims description 5
- 208000009164 Islet Cell Adenoma Diseases 0.000 claims description 5
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 5
- 208000008839 Kidney Neoplasms Diseases 0.000 claims description 5
- 201000005099 Langerhans cell histiocytosis Diseases 0.000 claims description 5
- 206010023825 Laryngeal cancer Diseases 0.000 claims description 5
- 206010062038 Lip neoplasm Diseases 0.000 claims description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 5
- 208000006644 Malignant Fibrous Histiocytoma Diseases 0.000 claims description 5
- 208000032271 Malignant tumor of penis Diseases 0.000 claims description 5
- 208000002030 Merkel cell carcinoma Diseases 0.000 claims description 5
- 206010027406 Mesothelioma Diseases 0.000 claims description 5
- 102100023123 Mucin-16 Human genes 0.000 claims description 5
- 208000034578 Multiple myelomas Diseases 0.000 claims description 5
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 5
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 claims description 5
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 claims description 5
- 208000001894 Nasopharyngeal Neoplasms Diseases 0.000 claims description 5
- 206010061306 Nasopharyngeal cancer Diseases 0.000 claims description 5
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 claims description 5
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 5
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 5
- 206010031096 Oropharyngeal cancer Diseases 0.000 claims description 5
- 206010057444 Oropharyngeal neoplasm Diseases 0.000 claims description 5
- 206010033128 Ovarian cancer Diseases 0.000 claims description 5
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 5
- 206010061332 Paraganglion neoplasm Diseases 0.000 claims description 5
- 208000000821 Parathyroid Neoplasms Diseases 0.000 claims description 5
- 208000002471 Penile Neoplasms Diseases 0.000 claims description 5
- 206010034299 Penile cancer Diseases 0.000 claims description 5
- 208000009565 Pharyngeal Neoplasms Diseases 0.000 claims description 5
- 206010034811 Pharyngeal cancer Diseases 0.000 claims description 5
- 206010060862 Prostate cancer Diseases 0.000 claims description 5
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 5
- 206010038389 Renal cancer Diseases 0.000 claims description 5
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 5
- 201000000582 Retinoblastoma Diseases 0.000 claims description 5
- 208000008938 Rhabdoid tumor Diseases 0.000 claims description 5
- 206010073334 Rhabdoid tumour Diseases 0.000 claims description 5
- 102100029198 SLAM family member 7 Human genes 0.000 claims description 5
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 claims description 5
- 206010061934 Salivary gland cancer Diseases 0.000 claims description 5
- 206010039491 Sarcoma Diseases 0.000 claims description 5
- 208000009359 Sezary Syndrome Diseases 0.000 claims description 5
- 208000021388 Sezary disease Diseases 0.000 claims description 5
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 5
- 206010041067 Small cell lung cancer Diseases 0.000 claims description 5
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 claims description 5
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 5
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 5
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 claims description 5
- 206010043276 Teratoma Diseases 0.000 claims description 5
- 208000024313 Testicular Neoplasms Diseases 0.000 claims description 5
- 206010057644 Testis cancer Diseases 0.000 claims description 5
- 206010043515 Throat cancer Diseases 0.000 claims description 5
- 208000000728 Thymus Neoplasms Diseases 0.000 claims description 5
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 5
- 208000015778 Undifferentiated pleomorphic sarcoma Diseases 0.000 claims description 5
- 208000023915 Ureteral Neoplasms Diseases 0.000 claims description 5
- 206010046392 Ureteric cancer Diseases 0.000 claims description 5
- 206010046431 Urethral cancer Diseases 0.000 claims description 5
- 206010046458 Urethral neoplasms Diseases 0.000 claims description 5
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 5
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 5
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 5
- 201000005969 Uveal melanoma Diseases 0.000 claims description 5
- 208000033559 Waldenström macroglobulinemia Diseases 0.000 claims description 5
- 208000008383 Wilms tumor Diseases 0.000 claims description 5
- 201000011165 anus cancer Diseases 0.000 claims description 5
- 208000021780 appendiceal neoplasm Diseases 0.000 claims description 5
- 208000001119 benign fibrous histiocytoma Diseases 0.000 claims description 5
- 208000026900 bile duct neoplasm Diseases 0.000 claims description 5
- 201000010881 cervical cancer Diseases 0.000 claims description 5
- 208000006990 cholangiocarcinoma Diseases 0.000 claims description 5
- 108010072917 class-I restricted T cell-associated molecule Proteins 0.000 claims description 5
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 claims description 5
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 claims description 5
- 231100000433 cytotoxic Toxicity 0.000 claims description 5
- 201000004101 esophageal cancer Diseases 0.000 claims description 5
- 208000024519 eye neoplasm Diseases 0.000 claims description 5
- 201000010175 gallbladder cancer Diseases 0.000 claims description 5
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 claims description 5
- 201000009277 hairy cell leukemia Diseases 0.000 claims description 5
- 201000010536 head and neck cancer Diseases 0.000 claims description 5
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 5
- 208000024348 heart neoplasm Diseases 0.000 claims description 5
- 206010073071 hepatocellular carcinoma Diseases 0.000 claims description 5
- 231100000844 hepatocellular carcinoma Toxicity 0.000 claims description 5
- 201000006866 hypopharynx cancer Diseases 0.000 claims description 5
- 102000006495 integrins Human genes 0.000 claims description 5
- 108010044426 integrins Proteins 0.000 claims description 5
- 201000010982 kidney cancer Diseases 0.000 claims description 5
- 210000000244 kidney pelvis Anatomy 0.000 claims description 5
- 206010023841 laryngeal neoplasm Diseases 0.000 claims description 5
- 201000006721 lip cancer Diseases 0.000 claims description 5
- 201000007270 liver cancer Diseases 0.000 claims description 5
- 208000014018 liver neoplasm Diseases 0.000 claims description 5
- 201000005202 lung cancer Diseases 0.000 claims description 5
- 208000020816 lung neoplasm Diseases 0.000 claims description 5
- 201000000564 macroglobulinemia Diseases 0.000 claims description 5
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 5
- 208000020984 malignant renal pelvis neoplasm Diseases 0.000 claims description 5
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 claims description 5
- 201000006462 myelodysplastic/myeloproliferative neoplasm Diseases 0.000 claims description 5
- 201000008026 nephroblastoma Diseases 0.000 claims description 5
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 5
- 201000008106 ocular cancer Diseases 0.000 claims description 5
- 201000002575 ocular melanoma Diseases 0.000 claims description 5
- 201000006958 oropharynx cancer Diseases 0.000 claims description 5
- 201000008968 osteosarcoma Diseases 0.000 claims description 5
- 201000002528 pancreatic cancer Diseases 0.000 claims description 5
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 5
- 208000029211 papillomatosis Diseases 0.000 claims description 5
- 208000007312 paraganglioma Diseases 0.000 claims description 5
- 208000028591 pheochromocytoma Diseases 0.000 claims description 5
- 208000016800 primary central nervous system lymphoma Diseases 0.000 claims description 5
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 5
- 201000007444 renal pelvis carcinoma Diseases 0.000 claims description 5
- 208000037968 sinus cancer Diseases 0.000 claims description 5
- 201000000849 skin cancer Diseases 0.000 claims description 5
- 208000000587 small cell lung carcinoma Diseases 0.000 claims description 5
- 201000002314 small intestine cancer Diseases 0.000 claims description 5
- 206010062261 spinal cord neoplasm Diseases 0.000 claims description 5
- 208000011580 syndromic disease Diseases 0.000 claims description 5
- 201000003120 testicular cancer Diseases 0.000 claims description 5
- 208000008732 thymoma Diseases 0.000 claims description 5
- 201000002510 thyroid cancer Diseases 0.000 claims description 5
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 5
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 5
- 206010046766 uterine cancer Diseases 0.000 claims description 5
- 206010046885 vaginal cancer Diseases 0.000 claims description 5
- 208000013139 vaginal neoplasm Diseases 0.000 claims description 5
- 102100031585 ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Human genes 0.000 claims description 4
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 4
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 4
- 102000001301 EGF receptor Human genes 0.000 claims description 4
- 108060006698 EGF receptor Proteins 0.000 claims description 4
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 claims description 4
- 102100033919 Ephrin-A2 Human genes 0.000 claims description 4
- 108010043942 Ephrin-A2 Proteins 0.000 claims description 4
- 108010066687 Epithelial Cell Adhesion Molecule Proteins 0.000 claims description 4
- 102000018651 Epithelial Cell Adhesion Molecule Human genes 0.000 claims description 4
- 208000021309 Germ cell tumor Diseases 0.000 claims description 4
- 102000003693 Hedgehog Proteins Human genes 0.000 claims description 4
- 108090000031 Hedgehog Proteins Proteins 0.000 claims description 4
- 101000777636 Homo sapiens ADP-ribosyl cyclase/cyclic ADP-ribose hydrolase 1 Proteins 0.000 claims description 4
- 101000972282 Homo sapiens Mucin-5AC Proteins 0.000 claims description 4
- 101000972276 Homo sapiens Mucin-5B Proteins 0.000 claims description 4
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 4
- 206010021042 Hypopharyngeal cancer Diseases 0.000 claims description 4
- 206010056305 Hypopharyngeal neoplasm Diseases 0.000 claims description 4
- 101150069255 KLRC1 gene Proteins 0.000 claims description 4
- 108010017736 Leukocyte Immunoglobulin-like Receptor B1 Proteins 0.000 claims description 4
- 102100020943 Leukocyte-associated immunoglobulin-like receptor 1 Human genes 0.000 claims description 4
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 claims description 4
- 102100022494 Mucin-5B Human genes 0.000 claims description 4
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 claims description 4
- 208000034176 Neoplasms, Germ Cell and Embryonal Diseases 0.000 claims description 4
- 208000010505 Nose Neoplasms Diseases 0.000 claims description 4
- 208000007913 Pituitary Neoplasms Diseases 0.000 claims description 4
- 201000008199 Pleuropulmonary blastoma Diseases 0.000 claims description 4
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 4
- 206010047741 Vulval cancer Diseases 0.000 claims description 4
- 208000004354 Vulvar Neoplasms Diseases 0.000 claims description 4
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 claims description 4
- 208000014616 embryonal neoplasm Diseases 0.000 claims description 4
- 201000011523 endocrine gland cancer Diseases 0.000 claims description 4
- 201000008298 histiocytosis Diseases 0.000 claims description 4
- 208000037830 nasal cancer Diseases 0.000 claims description 4
- 208000010916 pituitary tumor Diseases 0.000 claims description 4
- 210000001519 tissue Anatomy 0.000 claims description 4
- 201000005102 vulva cancer Diseases 0.000 claims description 4
- 102100038080 B-cell receptor CD22 Human genes 0.000 claims description 3
- 108010029697 CD40 Ligand Proteins 0.000 claims description 3
- 102100032937 CD40 ligand Human genes 0.000 claims description 3
- 102100025222 CD63 antigen Human genes 0.000 claims description 3
- 108010021064 CTLA-4 Antigen Proteins 0.000 claims description 3
- 102100029968 Calreticulin Human genes 0.000 claims description 3
- 108090000549 Calreticulin Proteins 0.000 claims description 3
- 108010022366 Carcinoembryonic Antigen Proteins 0.000 claims description 3
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 claims description 3
- 102100038083 Endosialin Human genes 0.000 claims description 3
- 108010007707 Hepatitis A Virus Cellular Receptor 2 Proteins 0.000 claims description 3
- 101000914324 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 5 Proteins 0.000 claims description 3
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 claims description 3
- 101000878602 Homo sapiens Immunoglobulin alpha Fc receptor Proteins 0.000 claims description 3
- 101001027081 Homo sapiens Killer cell immunoglobulin-like receptor 2DL1 Proteins 0.000 claims description 3
- 101001138062 Homo sapiens Leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 claims description 3
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 claims description 3
- 101000831286 Homo sapiens Protein timeless homolog Proteins 0.000 claims description 3
- 101000752245 Homo sapiens Rho guanine nucleotide exchange factor 5 Proteins 0.000 claims description 3
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 claims description 3
- 101000679857 Homo sapiens Tumor necrosis factor receptor superfamily member 3 Proteins 0.000 claims description 3
- 102100038005 Immunoglobulin alpha Fc receptor Human genes 0.000 claims description 3
- 102100037363 Killer cell immunoglobulin-like receptor 2DL1 Human genes 0.000 claims description 3
- 102000017578 LAG3 Human genes 0.000 claims description 3
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 claims description 3
- 206010073059 Malignant neoplasm of unknown primary site Diseases 0.000 claims description 3
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 claims description 3
- 101100291452 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) MMS1 gene Proteins 0.000 claims description 3
- 108010029180 Sialic Acid Binding Ig-like Lectin 3 Proteins 0.000 claims description 3
- 101800001271 Surface protein Proteins 0.000 claims description 3
- 102100035721 Syndecan-1 Human genes 0.000 claims description 3
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 claims description 3
- 101710114141 T-lymphocyte surface antigen Ly-9 Proteins 0.000 claims description 3
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 claims description 3
- 102100022156 Tumor necrosis factor receptor superfamily member 3 Human genes 0.000 claims description 3
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 3
- 201000006612 cervical squamous cell carcinoma Diseases 0.000 claims description 3
- 239000000032 diagnostic agent Substances 0.000 claims description 3
- 229940039227 diagnostic agent Drugs 0.000 claims description 3
- 230000001605 fetal effect Effects 0.000 claims description 3
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 claims description 3
- 239000003112 inhibitor Substances 0.000 claims description 3
- 230000001394 metastastic effect Effects 0.000 claims description 3
- 206010061289 metastatic neoplasm Diseases 0.000 claims description 3
- 101001005269 Arabidopsis thaliana Ceramide synthase 1 LOH3 Proteins 0.000 claims description 2
- 101001005312 Arabidopsis thaliana Ceramide synthase LOH1 Proteins 0.000 claims description 2
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 claims description 2
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 claims description 2
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 claims description 2
- 102100036305 C-C chemokine receptor type 8 Human genes 0.000 claims description 2
- 108700012439 CA9 Proteins 0.000 claims description 2
- 102100038077 CD226 antigen Human genes 0.000 claims description 2
- 108010058905 CD44v6 antigen Proteins 0.000 claims description 2
- 108010062802 CD66 antigens Proteins 0.000 claims description 2
- 102100025221 CD70 antigen Human genes 0.000 claims description 2
- 102000000905 Cadherin Human genes 0.000 claims description 2
- 108050007957 Cadherin Proteins 0.000 claims description 2
- 102100024423 Carbonic anhydrase 9 Human genes 0.000 claims description 2
- 102100024533 Carcinoembryonic antigen-related cell adhesion molecule 1 Human genes 0.000 claims description 2
- 108010009685 Cholinergic Receptors Proteins 0.000 claims description 2
- 108010059480 Chondroitin Sulfate Proteoglycans Proteins 0.000 claims description 2
- 102000005598 Chondroitin Sulfate Proteoglycans Human genes 0.000 claims description 2
- 102100034573 Desmoglein-4 Human genes 0.000 claims description 2
- 101710183213 Desmoglein-4 Proteins 0.000 claims description 2
- 101710144543 Endosialin Proteins 0.000 claims description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 claims description 2
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 claims description 2
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 claims description 2
- 101000716063 Homo sapiens C-C chemokine receptor type 8 Proteins 0.000 claims description 2
- 101000884298 Homo sapiens CD226 antigen Proteins 0.000 claims description 2
- 101000934368 Homo sapiens CD63 antigen Proteins 0.000 claims description 2
- 101000934356 Homo sapiens CD70 antigen Proteins 0.000 claims description 2
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 claims description 2
- 101000945371 Homo sapiens Killer cell immunoglobulin-like receptor 2DL2 Proteins 0.000 claims description 2
- 101000945333 Homo sapiens Killer cell immunoglobulin-like receptor 2DL3 Proteins 0.000 claims description 2
- 101000945340 Homo sapiens Killer cell immunoglobulin-like receptor 2DS1 Proteins 0.000 claims description 2
- 101000945342 Homo sapiens Killer cell immunoglobulin-like receptor 2DS4 Proteins 0.000 claims description 2
- 101000945351 Homo sapiens Killer cell immunoglobulin-like receptor 3DL1 Proteins 0.000 claims description 2
- 101000945490 Homo sapiens Killer cell immunoglobulin-like receptor 3DL2 Proteins 0.000 claims description 2
- 101000971538 Homo sapiens Killer cell lectin-like receptor subfamily F member 1 Proteins 0.000 claims description 2
- 101000984190 Homo sapiens Leukocyte immunoglobulin-like receptor subfamily B member 1 Proteins 0.000 claims description 2
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 claims description 2
- 101001133081 Homo sapiens Mucin-2 Proteins 0.000 claims description 2
- 101000972284 Homo sapiens Mucin-3A Proteins 0.000 claims description 2
- 101000972286 Homo sapiens Mucin-4 Proteins 0.000 claims description 2
- 101000972273 Homo sapiens Mucin-7 Proteins 0.000 claims description 2
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 claims description 2
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 claims description 2
- 101000589305 Homo sapiens Natural cytotoxicity triggering receptor 2 Proteins 0.000 claims description 2
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 claims description 2
- 101001136592 Homo sapiens Prostate stem cell antigen Proteins 0.000 claims description 2
- 101000650817 Homo sapiens Semaphorin-4D Proteins 0.000 claims description 2
- 101000863882 Homo sapiens Sialic acid-binding Ig-like lectin 7 Proteins 0.000 claims description 2
- 101000863883 Homo sapiens Sialic acid-binding Ig-like lectin 9 Proteins 0.000 claims description 2
- 101000596234 Homo sapiens T-cell surface protein tactile Proteins 0.000 claims description 2
- 101150074862 KLRC3 gene Proteins 0.000 claims description 2
- 102100033599 Killer cell immunoglobulin-like receptor 2DL2 Human genes 0.000 claims description 2
- 102100033634 Killer cell immunoglobulin-like receptor 2DL3 Human genes 0.000 claims description 2
- 102100033631 Killer cell immunoglobulin-like receptor 2DS1 Human genes 0.000 claims description 2
- 102100033624 Killer cell immunoglobulin-like receptor 2DS4 Human genes 0.000 claims description 2
- 102100034840 Killer cell immunoglobulin-like receptor 3DL2 Human genes 0.000 claims description 2
- 102100023678 Killer cell lectin-like receptor subfamily B member 1 Human genes 0.000 claims description 2
- 101710131918 Killer cell lectin-like receptor subfamily B member 1A Proteins 0.000 claims description 2
- 102100021458 Killer cell lectin-like receptor subfamily F member 1 Human genes 0.000 claims description 2
- 108090000015 Mesothelin Proteins 0.000 claims description 2
- 102000003735 Mesothelin Human genes 0.000 claims description 2
- 102100034256 Mucin-1 Human genes 0.000 claims description 2
- 102100034263 Mucin-2 Human genes 0.000 claims description 2
- 102100022497 Mucin-3A Human genes 0.000 claims description 2
- 102100022693 Mucin-4 Human genes 0.000 claims description 2
- 102100022492 Mucin-7 Human genes 0.000 claims description 2
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 claims description 2
- 102100022701 NKG2-E type II integral membrane protein Human genes 0.000 claims description 2
- 108010004217 Natural Cytotoxicity Triggering Receptor 1 Proteins 0.000 claims description 2
- 102100032870 Natural cytotoxicity triggering receptor 1 Human genes 0.000 claims description 2
- 102100032851 Natural cytotoxicity triggering receptor 2 Human genes 0.000 claims description 2
- 102100036735 Prostate stem cell antigen Human genes 0.000 claims description 2
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 claims description 2
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 claims description 2
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 claims description 2
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 claims description 2
- 102100027744 Semaphorin-4D Human genes 0.000 claims description 2
- 102100029946 Sialic acid-binding Ig-like lectin 7 Human genes 0.000 claims description 2
- 102100029965 Sialic acid-binding Ig-like lectin 9 Human genes 0.000 claims description 2
- 102000004584 Somatomedin Receptors Human genes 0.000 claims description 2
- 108010017622 Somatomedin Receptors Proteins 0.000 claims description 2
- 101000668858 Spinacia oleracea 30S ribosomal protein S1, chloroplastic Proteins 0.000 claims description 2
- 101000898746 Streptomyces clavuligerus Clavaminate synthase 1 Proteins 0.000 claims description 2
- 102100035268 T-cell surface protein tactile Human genes 0.000 claims description 2
- 102000034337 acetylcholine receptors Human genes 0.000 claims description 2
- SRHNADOZAAWYLV-XLMUYGLTSA-N alpha-L-Fucp-(1->2)-beta-D-Galp-(1->4)-[alpha-L-Fucp-(1->3)]-beta-D-GlcpNAc Chemical compound O[C@H]1[C@H](O)[C@H](O)[C@H](C)O[C@H]1O[C@H]1[C@H](O[C@H]2[C@@H]([C@@H](NC(C)=O)[C@H](O)O[C@@H]2CO)O[C@H]2[C@H]([C@H](O)[C@H](O)[C@H](C)O2)O)O[C@H](CO)[C@H](O)[C@@H]1O SRHNADOZAAWYLV-XLMUYGLTSA-N 0.000 claims description 2
- 230000004611 cancer cell death Effects 0.000 claims description 2
- 230000005907 cancer growth Effects 0.000 claims description 2
- 210000001072 colon Anatomy 0.000 claims description 2
- 210000002950 fibroblast Anatomy 0.000 claims description 2
- 125000002446 fucosyl group Chemical group C1([C@@H](O)[C@H](O)[C@H](O)[C@@H](O1)C)* 0.000 claims description 2
- 210000002443 helper t lymphocyte Anatomy 0.000 claims description 2
- 210000004180 plasmocyte Anatomy 0.000 claims description 2
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 claims description 2
- 239000002243 precursor Substances 0.000 claims description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 claims 5
- 102100020873 Interleukin-2 Human genes 0.000 claims 4
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 claims 3
- 102100025390 Integrin beta-2 Human genes 0.000 claims 3
- 208000017604 Hodgkin disease Diseases 0.000 claims 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims 2
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims 2
- 201000008822 gestational choriocarcinoma Diseases 0.000 claims 2
- 101001046686 Homo sapiens Integrin alpha-M Proteins 0.000 claims 1
- 101000628547 Homo sapiens Metalloreductase STEAP1 Proteins 0.000 claims 1
- 102100022338 Integrin alpha-M Human genes 0.000 claims 1
- 102100022297 Integrin alpha-X Human genes 0.000 claims 1
- 102100026712 Metalloreductase STEAP1 Human genes 0.000 claims 1
- 206010028729 Nasal cavity cancer Diseases 0.000 claims 1
- 230000002124 endocrine Effects 0.000 claims 1
- 230000013595 glycosylation Effects 0.000 claims 1
- 238000006206 glycosylation reaction Methods 0.000 claims 1
- 108010025001 leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 claims 1
- 210000001161 mammalian embryo Anatomy 0.000 claims 1
- 210000003928 nasal cavity Anatomy 0.000 claims 1
- 230000009826 neoplastic cell growth Effects 0.000 claims 1
- 210000004872 soft tissue Anatomy 0.000 claims 1
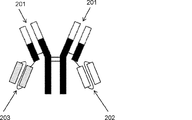
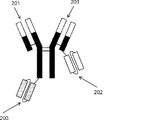
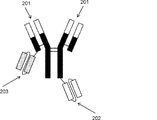
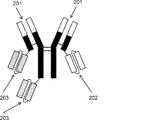
- 230000004957 immunoregulator effect Effects 0.000 abstract description 11
- 125000005647 linker group Chemical group 0.000 description 89
- 108090000623 proteins and genes Proteins 0.000 description 59
- 102000004169 proteins and genes Human genes 0.000 description 54
- 235000018102 proteins Nutrition 0.000 description 52
- 230000000694 effects Effects 0.000 description 46
- 150000007523 nucleic acids Chemical class 0.000 description 45
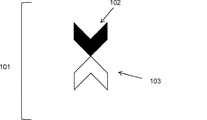
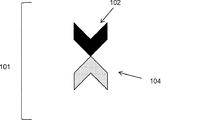
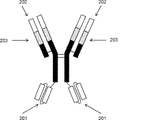
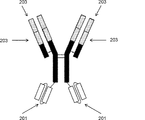
- 238000010586 diagram Methods 0.000 description 39
- 101150029707 ERBB2 gene Proteins 0.000 description 34
- 238000003556 assay Methods 0.000 description 31
- 210000004881 tumor cell Anatomy 0.000 description 26
- 150000001413 amino acids Chemical group 0.000 description 25
- 230000008685 targeting Effects 0.000 description 25
- 235000001014 amino acid Nutrition 0.000 description 21
- 229940024606 amino acid Drugs 0.000 description 20
- 239000003153 chemical reaction reagent Substances 0.000 description 20
- 230000001965 increasing effect Effects 0.000 description 20
- 238000011282 treatment Methods 0.000 description 19
- 108010087819 Fc receptors Proteins 0.000 description 17
- 102000009109 Fc receptors Human genes 0.000 description 17
- 238000003501 co-culture Methods 0.000 description 16
- 102100040247 Tumor necrosis factor Human genes 0.000 description 15
- 201000010099 disease Diseases 0.000 description 15
- 238000012412 chemical coupling Methods 0.000 description 14
- 102000004127 Cytokines Human genes 0.000 description 13
- 108090000695 Cytokines Proteins 0.000 description 13
- 239000003446 ligand Substances 0.000 description 13
- 210000004986 primary T-cell Anatomy 0.000 description 13
- 108020004414 DNA Proteins 0.000 description 12
- 210000003719 b-lymphocyte Anatomy 0.000 description 12
- 230000016396 cytokine production Effects 0.000 description 12
- 238000000684 flow cytometry Methods 0.000 description 12
- 230000006870 function Effects 0.000 description 12
- 230000003993 interaction Effects 0.000 description 12
- 238000006467 substitution reaction Methods 0.000 description 12
- 208000004736 B-Cell Leukemia Diseases 0.000 description 11
- 208000003950 B-cell lymphoma Diseases 0.000 description 11
- 241000588724 Escherichia coli Species 0.000 description 11
- 102000000588 Interleukin-2 Human genes 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- 230000004071 biological effect Effects 0.000 description 10
- 238000002474 experimental method Methods 0.000 description 10
- 102000039446 nucleic acids Human genes 0.000 description 10
- 108020004707 nucleic acids Proteins 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 9
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 9
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 9
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 9
- 230000005540 biological transmission Effects 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 230000006698 induction Effects 0.000 description 9
- 230000001225 therapeutic effect Effects 0.000 description 9
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 8
- 230000001419 dependent effect Effects 0.000 description 8
- 238000005516 engineering process Methods 0.000 description 8
- 210000004408 hybridoma Anatomy 0.000 description 8
- 229940072221 immunoglobulins Drugs 0.000 description 8
- 238000011534 incubation Methods 0.000 description 8
- 201000000050 myeloid neoplasm Diseases 0.000 description 8
- 210000004897 n-terminal region Anatomy 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 241000894007 species Species 0.000 description 8
- 230000004936 stimulating effect Effects 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 125000000539 amino acid group Chemical group 0.000 description 7
- 239000005557 antagonist Substances 0.000 description 7
- 210000004899 c-terminal region Anatomy 0.000 description 7
- 239000002552 dosage form Substances 0.000 description 7
- 239000006201 parenteral dosage form Substances 0.000 description 7
- 229940124531 pharmaceutical excipient Drugs 0.000 description 7
- 230000000638 stimulation Effects 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- VDABVNMGKGUPEY-UHFFFAOYSA-N 6-carboxyfluorescein succinimidyl ester Chemical compound C=1C(O)=CC=C2C=1OC1=CC(O)=CC=C1C2(C1=C2)OC(=O)C1=CC=C2C(=O)ON1C(=O)CCC1=O VDABVNMGKGUPEY-UHFFFAOYSA-N 0.000 description 6
- 108700022150 Designed Ankyrin Repeat Proteins Proteins 0.000 description 6
- 241000699666 Mus <mouse, genus> Species 0.000 description 6
- 108010079855 Peptide Aptamers Proteins 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 102100024554 Tetranectin Human genes 0.000 description 6
- 102000002933 Thioredoxin Human genes 0.000 description 6
- 239000000556 agonist Substances 0.000 description 6
- 238000013459 approach Methods 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 230000000903 blocking effect Effects 0.000 description 6
- 239000000872 buffer Substances 0.000 description 6
- 238000002523 gelfiltration Methods 0.000 description 6
- 230000036541 health Effects 0.000 description 6
- 210000000581 natural killer T-cell Anatomy 0.000 description 6
- YBYRMVIVWMBXKQ-UHFFFAOYSA-N phenylmethanesulfonyl fluoride Chemical compound FS(=O)(=O)CC1=CC=CC=C1 YBYRMVIVWMBXKQ-UHFFFAOYSA-N 0.000 description 6
- 230000011664 signaling Effects 0.000 description 6
- 230000009870 specific binding Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 108010013645 tetranectin Proteins 0.000 description 6
- 108060008226 thioredoxin Proteins 0.000 description 6
- 229940094937 thioredoxin Drugs 0.000 description 6
- 102000054930 Agouti-Related Human genes 0.000 description 5
- 241000894006 Bacteria Species 0.000 description 5
- 101000609473 Ecballium elaterium Trypsin inhibitor 2 Proteins 0.000 description 5
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 5
- 101000680845 Luffa aegyptiaca Ribosome-inactivating protein luffin P1 Proteins 0.000 description 5
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 5
- 230000008485 antagonism Effects 0.000 description 5
- 238000009175 antibody therapy Methods 0.000 description 5
- 239000011324 bead Substances 0.000 description 5
- 238000005119 centrifugation Methods 0.000 description 5
- 239000001963 growth medium Substances 0.000 description 5
- 238000000099 in vitro assay Methods 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 230000000670 limiting effect Effects 0.000 description 5
- 230000035772 mutation Effects 0.000 description 5
- 210000000822 natural killer cell Anatomy 0.000 description 5
- 230000000069 prophylactic effect Effects 0.000 description 5
- 238000000746 purification Methods 0.000 description 5
- 108090001008 Avidin Proteins 0.000 description 4
- 239000004971 Cross linker Substances 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 108010091358 Hypoxanthine Phosphoribosyltransferase Proteins 0.000 description 4
- 102000002698 KIR Receptors Human genes 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 108091008877 NK cell receptors Proteins 0.000 description 4
- 102000010648 Natural Killer Cell Receptors Human genes 0.000 description 4
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 230000003042 antagnostic effect Effects 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 239000002518 antifoaming agent Substances 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 238000010494 dissociation reaction Methods 0.000 description 4
- 230000005593 dissociations Effects 0.000 description 4
- 235000019441 ethanol Nutrition 0.000 description 4
- 238000010195 expression analysis Methods 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- TWXDDNPPQUTEOV-FVGYRXGTSA-N methamphetamine hydrochloride Chemical compound Cl.CN[C@@H](C)CC1=CC=CC=C1 TWXDDNPPQUTEOV-FVGYRXGTSA-N 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 238000012552 review Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 239000006228 supernatant Substances 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 238000001890 transfection Methods 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical group O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- KBPLFHHGFOOTCA-UHFFFAOYSA-N 1-Octanol Chemical compound CCCCCCCCO KBPLFHHGFOOTCA-UHFFFAOYSA-N 0.000 description 3
- 229920000936 Agarose Polymers 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 108010012236 Chemokines Proteins 0.000 description 3
- 102000019034 Chemokines Human genes 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 229920001917 Ficoll Polymers 0.000 description 3
- 241000233866 Fungi Species 0.000 description 3
- 102100029098 Hypoxanthine-guanine phosphoribosyltransferase Human genes 0.000 description 3
- 208000032004 Large-Cell Anaplastic Lymphoma Diseases 0.000 description 3
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 3
- 230000004988 N-glycosylation Effects 0.000 description 3
- 241000235648 Pichia Species 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 3
- 230000009824 affinity maturation Effects 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 229960000455 brentuximab vedotin Drugs 0.000 description 3
- 210000004671 cell-free system Anatomy 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 208000013056 classic Hodgkin lymphoma Diseases 0.000 description 3
- 239000000356 contaminant Substances 0.000 description 3
- 239000012228 culture supernatant Substances 0.000 description 3
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 3
- 235000014113 dietary fatty acids Nutrition 0.000 description 3
- 229960003668 docetaxel Drugs 0.000 description 3
- 239000000194 fatty acid Substances 0.000 description 3
- 229930195729 fatty acid Natural products 0.000 description 3
- 208000003884 gestational trophoblastic disease Diseases 0.000 description 3
- 230000001976 improved effect Effects 0.000 description 3
- 238000005462 in vivo assay Methods 0.000 description 3
- 229960005386 ipilimumab Drugs 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 210000004698 lymphocyte Anatomy 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 239000011859 microparticle Substances 0.000 description 3
- 239000002105 nanoparticle Substances 0.000 description 3
- 239000013612 plasmid Substances 0.000 description 3
- 239000013641 positive control Substances 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 229960004641 rituximab Drugs 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical class C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 238000010186 staining Methods 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 239000001993 wax Substances 0.000 description 3
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 2
- HNXQXTQTPAJEJL-UHFFFAOYSA-N 2-aminopteridin-4-ol Chemical compound C1=CN=C2NC(N)=NC(=O)C2=N1 HNXQXTQTPAJEJL-UHFFFAOYSA-N 0.000 description 2
- YIWUKEYIRIRTPP-UHFFFAOYSA-N 2-ethylhexan-1-ol Chemical compound CCCCC(CC)CO YIWUKEYIRIRTPP-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 2
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 2
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- 101100190466 Caenorhabditis elegans pid-3 gene Proteins 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 2
- 102000003952 Caspase 3 Human genes 0.000 description 2
- 108090000397 Caspase 3 Proteins 0.000 description 2
- 244000062995 Cassia occidentalis Species 0.000 description 2
- 102000001327 Chemokine CCL5 Human genes 0.000 description 2
- 108010055166 Chemokine CCL5 Proteins 0.000 description 2
- VYZAMTAEIAYCRO-BJUDXGSMSA-N Chromium-51 Chemical compound [51Cr] VYZAMTAEIAYCRO-BJUDXGSMSA-N 0.000 description 2
- 241000699802 Cricetulus griseus Species 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 2
- 238000011510 Elispot assay Methods 0.000 description 2
- 241000588921 Enterobacteriaceae Species 0.000 description 2
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 2
- 108010040476 FITC-annexin A5 Proteins 0.000 description 2
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 2
- 108010069236 Goserelin Proteins 0.000 description 2
- 229920002907 Guar gum Polymers 0.000 description 2
- 101000998120 Homo sapiens Interleukin-3 receptor subunit alpha Proteins 0.000 description 2
- 101001023379 Homo sapiens Lysosome-associated membrane glycoprotein 1 Proteins 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 2
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102100033493 Interleukin-3 receptor subunit alpha Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 108090001007 Interleukin-8 Proteins 0.000 description 2
- 244000285963 Kluyveromyces fragilis Species 0.000 description 2
- 241001138401 Kluyveromyces lactis Species 0.000 description 2
- 241001099157 Komagataella Species 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 230000006051 NK cell activation Effects 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 239000012980 RPMI-1640 medium Substances 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 108020004511 Recombinant DNA Proteins 0.000 description 2
- 241000235070 Saccharomyces Species 0.000 description 2
- 241000187747 Streptomyces Species 0.000 description 2
- 230000006052 T cell proliferation Effects 0.000 description 2
- 108091008874 T cell receptors Proteins 0.000 description 2
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 2
- QHNORJFCVHUPNH-UHFFFAOYSA-L To-Pro-3 Chemical compound [I-].[I-].S1C2=CC=CC=C2[N+](C)=C1C=CC=C1C2=CC=CC=C2N(CCC[N+](C)(C)C)C=C1 QHNORJFCVHUPNH-UHFFFAOYSA-L 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- 229960000853 abiraterone Drugs 0.000 description 2
- GZOSMCIZMLWJML-VJLLXTKPSA-N abiraterone Chemical compound C([C@H]1[C@H]2[C@@H]([C@]3(CC[C@H](O)CC3=CC2)C)CC[C@@]11C)C=C1C1=CC=CN=C1 GZOSMCIZMLWJML-VJLLXTKPSA-N 0.000 description 2
- 108010052004 acetyl-2-naphthylalanyl-3-chlorophenylalanyl-1-oxohexadecyl-seryl-4-aminophenylalanyl(hydroorotyl)-4-aminophenylalanyl(carbamoyl)-leucyl-ILys-prolyl-alaninamide Proteins 0.000 description 2
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 201000002454 adrenal cortex cancer Diseases 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 229960002932 anastrozole Drugs 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 229960002707 bendamustine Drugs 0.000 description 2
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 229960002938 bexarotene Drugs 0.000 description 2
- 229960000997 bicalutamide Drugs 0.000 description 2
- 230000008512 biological response Effects 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 229960004117 capecitabine Drugs 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 230000022534 cell killing Effects 0.000 description 2
- 230000014564 chemokine production Effects 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 2
- 239000006184 cosolvent Substances 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 229960002465 dabrafenib Drugs 0.000 description 2
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 2
- 229960003901 dacarbazine Drugs 0.000 description 2
- 229960000640 dactinomycin Drugs 0.000 description 2
- 229960002272 degarelix Drugs 0.000 description 2
- MEUCPCLKGZSHTA-XYAYPHGZSA-N degarelix Chemical compound C([C@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)NC(=O)[C@H](CC=1C=CC(NC(=O)[C@H]2NC(=O)NC(=O)C2)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(NC(N)=O)C=C1 MEUCPCLKGZSHTA-XYAYPHGZSA-N 0.000 description 2
- 239000000412 dendrimer Substances 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 230000029087 digestion Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000003113 dilution method Methods 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 230000009977 dual effect Effects 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 229960001904 epirubicin Drugs 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 229960001433 erlotinib Drugs 0.000 description 2
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 2
- 229960000255 exemestane Drugs 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 150000002191 fatty alcohols Chemical class 0.000 description 2
- 239000000945 filler Substances 0.000 description 2
- 229960000390 fludarabine Drugs 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 2
- 235000008191 folinic acid Nutrition 0.000 description 2
- 239000011672 folinic acid Substances 0.000 description 2
- 229960002258 fulvestrant Drugs 0.000 description 2
- 238000001502 gel electrophoresis Methods 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 229960002913 goserelin Drugs 0.000 description 2
- 230000006867 granzyme B production Effects 0.000 description 2
- 239000000665 guar gum Substances 0.000 description 2
- 235000010417 guar gum Nutrition 0.000 description 2
- 229960002154 guar gum Drugs 0.000 description 2
- 239000000833 heterodimer Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000010354 integration Effects 0.000 description 2
- 238000001361 intraarterial administration Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 229960004768 irinotecan Drugs 0.000 description 2
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 2
- 201000002529 islet cell tumor Diseases 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 229960004942 lenalidomide Drugs 0.000 description 2
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 2
- 229960003881 letrozole Drugs 0.000 description 2
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 2
- 229960001691 leucovorin Drugs 0.000 description 2
- GFIJNRVAKGFPGQ-LIJARHBVSA-N leuprolide Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 GFIJNRVAKGFPGQ-LIJARHBVSA-N 0.000 description 2
- 229960004338 leuprorelin Drugs 0.000 description 2
- 208000025854 malignant tumor of adrenal cortex Diseases 0.000 description 2
- 229960001786 megestrol Drugs 0.000 description 2
- JBVNBBXAMBZTMQ-CEGNMAFCSA-N megestrol Chemical compound C1=CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 JBVNBBXAMBZTMQ-CEGNMAFCSA-N 0.000 description 2
- 208000037970 metastatic squamous neck cancer Diseases 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 239000007758 minimum essential medium Substances 0.000 description 2
- 238000010369 molecular cloning Methods 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 229960001756 oxaliplatin Drugs 0.000 description 2
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 2
- 238000004806 packaging method and process Methods 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- WRUUGTRCQOWXEG-UHFFFAOYSA-N pamidronate Chemical compound NCCC(O)(P(O)(O)=O)P(O)(O)=O WRUUGTRCQOWXEG-UHFFFAOYSA-N 0.000 description 2
- 229940046231 pamidronate Drugs 0.000 description 2
- 208000022102 pancreatic neuroendocrine neoplasm Diseases 0.000 description 2
- 229960005079 pemetrexed Drugs 0.000 description 2
- QOFFJEBXNKRSPX-ZDUSSCGKSA-N pemetrexed Chemical compound C1=N[C]2NC(N)=NC(=O)C2=C1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 QOFFJEBXNKRSPX-ZDUSSCGKSA-N 0.000 description 2
- 210000001322 periplasm Anatomy 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 229920001451 polypropylene glycol Polymers 0.000 description 2
- 229920001296 polysiloxane Polymers 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 210000001236 prokaryotic cell Anatomy 0.000 description 2
- 230000001737 promoting effect Effects 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 2
- 239000000523 sample Substances 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 229960002930 sirolimus Drugs 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- HLZKNKRTKFSKGZ-UHFFFAOYSA-N tetradecan-1-ol Chemical compound CCCCCCCCCCCCCCO HLZKNKRTKFSKGZ-UHFFFAOYSA-N 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 229960000575 trastuzumab Drugs 0.000 description 2
- 238000000108 ultra-filtration Methods 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 2
- 229960004276 zoledronic acid Drugs 0.000 description 2
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 1
- DEQANNDTNATYII-OULOTJBUSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-19-[[(2r)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-n-[(2r,3r)-1,3-dihydroxybutan-2-yl]-7-[(1r)-1-hydroxyethyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxa Chemical compound C([C@@H](N)C(=O)N[C@H]1CSSC[C@H](NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](CC=2C3=CC=CC=C3NC=2)NC(=O)[C@H](CC=2C=CC=CC=2)NC1=O)C(=O)N[C@H](CO)[C@H](O)C)C1=CC=CC=C1 DEQANNDTNATYII-OULOTJBUSA-N 0.000 description 1
- PUDHBTGHUJUUFI-SCTWWAJVSA-N (4r,7s,10s,13r,16s,19r)-10-(4-aminobutyl)-n-[(2s,3r)-1-amino-3-hydroxy-1-oxobutan-2-yl]-19-[[(2r)-2-amino-3-naphthalen-2-ylpropanoyl]amino]-16-[(4-hydroxyphenyl)methyl]-13-(1h-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-7-propan-2-yl-1,2-dithia-5,8,11,14,17-p Chemical compound C([C@H]1C(=O)N[C@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(N[C@@H](CSSC[C@@H](C(=O)N1)NC(=O)[C@H](N)CC=1C=C2C=CC=CC2=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(N)=O)=O)C(C)C)C1=CC=C(O)C=C1 PUDHBTGHUJUUFI-SCTWWAJVSA-N 0.000 description 1
- ALSTYHKOOCGGFT-KTKRTIGZSA-N (9Z)-octadecen-1-ol Chemical compound CCCCCCCC\C=C/CCCCCCCCO ALSTYHKOOCGGFT-KTKRTIGZSA-N 0.000 description 1
- OKMWKBLSFKFYGZ-UHFFFAOYSA-N 1-behenoylglycerol Chemical compound CCCCCCCCCCCCCCCCCCCCCC(=O)OCC(O)CO OKMWKBLSFKFYGZ-UHFFFAOYSA-N 0.000 description 1
- 239000000263 2,3-dihydroxypropyl (Z)-octadec-9-enoate Substances 0.000 description 1
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 1
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- FESDHLLVLYZNFY-UHFFFAOYSA-N 2-benzylbenzoic acid Chemical compound OC(=O)C1=CC=CC=C1CC1=CC=CC=C1 FESDHLLVLYZNFY-UHFFFAOYSA-N 0.000 description 1
- ZJGBFJBMTKEFNQ-UHFFFAOYSA-N 3-(2,5-dioxopyrrol-1-yl)benzoic acid Chemical compound OC(=O)C1=CC=CC(N2C(C=CC2=O)=O)=C1 ZJGBFJBMTKEFNQ-UHFFFAOYSA-N 0.000 description 1
- RZRNAYUHWVFMIP-GDCKJWNLSA-N 3-oleoyl-sn-glycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-GDCKJWNLSA-N 0.000 description 1
- 238000010600 3H thymidine incorporation assay Methods 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 1
- GOZMBJCYMQQACI-UHFFFAOYSA-N 6,7-dimethyl-3-[[methyl-[2-[methyl-[[1-[3-(trifluoromethyl)phenyl]indol-3-yl]methyl]amino]ethyl]amino]methyl]chromen-4-one;dihydrochloride Chemical compound Cl.Cl.C=1OC2=CC(C)=C(C)C=C2C(=O)C=1CN(C)CCN(C)CC(C1=CC=CC=C11)=CN1C1=CC=CC(C(F)(F)F)=C1 GOZMBJCYMQQACI-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- YXHLJMWYDTXDHS-IRFLANFNSA-N 7-aminoactinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=C(N)C=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 YXHLJMWYDTXDHS-IRFLANFNSA-N 0.000 description 1
- 108700012813 7-aminoactinomycin D Proteins 0.000 description 1
- ZGXJTSGNIOSYLO-UHFFFAOYSA-N 88755TAZ87 Chemical compound NCC(=O)CCC(O)=O ZGXJTSGNIOSYLO-UHFFFAOYSA-N 0.000 description 1
- 102000000074 ADP-ribosyl Cyclase Human genes 0.000 description 1
- 108010080394 ADP-ribosyl Cyclase Proteins 0.000 description 1
- BUROJSBIWGDYCN-GAUTUEMISA-N AP 23573 Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-GAUTUEMISA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108700028369 Alleles Proteins 0.000 description 1
- 108010049777 Ankyrins Proteins 0.000 description 1
- 102000008102 Ankyrins Human genes 0.000 description 1
- 108090000672 Annexin A5 Proteins 0.000 description 1
- 102000004121 Annexin A5 Human genes 0.000 description 1
- 108091023037 Aptamer Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 208000002109 Argyria Diseases 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000228212 Aspergillus Species 0.000 description 1
- 241000351920 Aspergillus nidulans Species 0.000 description 1
- 241000228245 Aspergillus niger Species 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 241000194108 Bacillus licheniformis Species 0.000 description 1
- 235000014469 Bacillus subtilis Nutrition 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 101000984722 Bos taurus Pancreatic trypsin inhibitor Proteins 0.000 description 1
- 108010037003 Buserelin Proteins 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000222120 Candida <Saccharomycetales> Species 0.000 description 1
- 241000222122 Candida albicans Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- 229920001661 Chitosan Polymers 0.000 description 1
- 241000282552 Chlorocebus aethiops Species 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 239000001692 EU approved anti-caking agent Substances 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000588914 Enterobacter Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 101800003838 Epidermal growth factor Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588698 Erwinia Species 0.000 description 1
- 241000588722 Escherichia Species 0.000 description 1
- 241001302584 Escherichia coli str. K-12 substr. W3110 Species 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 206010015995 Eyelid ptosis Diseases 0.000 description 1
- 108091006020 Fc-tagged proteins Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010067306 Fibronectins Proteins 0.000 description 1
- 102000016359 Fibronectins Human genes 0.000 description 1
- 108010029961 Filgrastim Proteins 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- MPJKWIXIYCLVCU-UHFFFAOYSA-N Folinic acid Natural products NC1=NC2=C(N(C=O)C(CNc3ccc(cc3)C(=O)NC(CCC(=O)O)CC(=O)O)CN2)C(=O)N1 MPJKWIXIYCLVCU-UHFFFAOYSA-N 0.000 description 1
- 102000000802 Galectin 3 Human genes 0.000 description 1
- 108010001517 Galectin 3 Proteins 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 102100032518 Gamma-crystallin B Human genes 0.000 description 1
- 101710092798 Gamma-crystallin B Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000991061 Homo sapiens MHC class I polypeptide-related sequence B Proteins 0.000 description 1
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- SHBUUTHKGIVMJT-UHFFFAOYSA-N Hydroxystearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OO SHBUUTHKGIVMJT-UHFFFAOYSA-N 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 102000037978 Immune checkpoint receptors Human genes 0.000 description 1
- 108091008028 Immune checkpoint receptors Proteins 0.000 description 1
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 1
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108010078049 Interferon alpha-2 Proteins 0.000 description 1
- 108010050904 Interferons Proteins 0.000 description 1
- 102000014150 Interferons Human genes 0.000 description 1
- 102000009875 Ki-67 Antigen Human genes 0.000 description 1
- 108010020437 Ki-67 Antigen Proteins 0.000 description 1
- 241000588748 Klebsiella Species 0.000 description 1
- 241000235649 Kluyveromyces Species 0.000 description 1
- 102000003855 L-lactate dehydrogenase Human genes 0.000 description 1
- 108700023483 L-lactate dehydrogenases Proteins 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 239000002118 L01XE12 - Vandetanib Substances 0.000 description 1
- 239000002145 L01XE14 - Bosutinib Substances 0.000 description 1
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 1
- 239000002137 L01XE24 - Ponatinib Substances 0.000 description 1
- 241000481961 Lachancea thermotolerans Species 0.000 description 1
- 241000235651 Lachancea waltii Species 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 239000005639 Lauric acid Substances 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 102000019298 Lipocalin Human genes 0.000 description 1
- 108050006654 Lipocalin Proteins 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 108010009254 Lysosomal-Associated Membrane Protein 1 Proteins 0.000 description 1
- 108010009489 Lysosomal-Associated Membrane Protein 3 Proteins 0.000 description 1
- 102100030300 MHC class I polypeptide-related sequence B Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 239000005913 Maltodextrin Substances 0.000 description 1
- 229920002774 Maltodextrin Polymers 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- XOGTZOOQQBDUSI-UHFFFAOYSA-M Mesna Chemical compound [Na+].[O-]S(=O)(=O)CCS XOGTZOOQQBDUSI-UHFFFAOYSA-M 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 108010001657 NK Cell Lectin-Like Receptor Subfamily K Proteins 0.000 description 1
- 108010004222 Natural Cytotoxicity Triggering Receptor 3 Proteins 0.000 description 1
- 102100032852 Natural cytotoxicity triggering receptor 3 Human genes 0.000 description 1
- 241000221961 Neurospora crassa Species 0.000 description 1
- 108010016076 Octreotide Proteins 0.000 description 1
- 108091034117 Oligonucleotide Proteins 0.000 description 1
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 241000228143 Penicillium Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229920002675 Polyoxyl Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 102100033237 Pro-epidermal growth factor Human genes 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 241000588769 Proteus <enterobacteria> Species 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108020005091 Replication Origin Proteins 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- 241000607142 Salmonella Species 0.000 description 1
- 241000293869 Salmonella enterica subsp. enterica serovar Typhimurium Species 0.000 description 1
- 241000235347 Schizosaccharomyces pombe Species 0.000 description 1
- 241000311088 Schwanniomyces Species 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 241000607720 Serratia Species 0.000 description 1
- 241000607768 Shigella Species 0.000 description 1
- 108010029157 Sialic Acid Binding Ig-like Lectin 2 Proteins 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 239000004147 Sorbitan trioleate Substances 0.000 description 1
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 108090000058 Syndecan-1 Proteins 0.000 description 1
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 241001149964 Tolypocladium Species 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 241000223259 Trichoderma Species 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 241000235013 Yarrowia Species 0.000 description 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 150000001298 alcohols Chemical group 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 229940100198 alkylating agent Drugs 0.000 description 1
- 239000002168 alkylating agent Substances 0.000 description 1
- 229960001097 amifostine Drugs 0.000 description 1
- JKOQGQFVAUAYPM-UHFFFAOYSA-N amifostine Chemical compound NCCCNCCSP(O)(O)=O JKOQGQFVAUAYPM-UHFFFAOYSA-N 0.000 description 1
- 229960002749 aminolevulinic acid Drugs 0.000 description 1
- 238000012870 ammonium sulfate precipitation Methods 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 238000011230 antibody-based therapy Methods 0.000 description 1
- 210000000628 antibody-producing cell Anatomy 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- ATALOFNDEOCMKK-OITMNORJSA-N aprepitant Chemical compound O([C@@H]([C@@H]1C=2C=CC(F)=CC=2)O[C@H](C)C=2C=C(C=C(C=2)C(F)(F)F)C(F)(F)F)CCN1CC1=NNC(=O)N1 ATALOFNDEOCMKK-OITMNORJSA-N 0.000 description 1
- 229960001372 aprepitant Drugs 0.000 description 1
- 239000008135 aqueous vehicle Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000005812 autoimmune toxicity Effects 0.000 description 1
- 231100001152 autoimmune toxicity Toxicity 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical compound CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 238000011021 bench scale process Methods 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000012575 bio-layer interferometry Methods 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 1
- 229960003736 bosutinib Drugs 0.000 description 1
- UBPYILGKFZZVDX-UHFFFAOYSA-N bosutinib Chemical compound C1=C(Cl)C(OC)=CC(NC=2C3=CC(OC)=C(OCCCN4CCN(C)CC4)C=C3N=CC=2C#N)=C1Cl UBPYILGKFZZVDX-UHFFFAOYSA-N 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 244000309464 bull Species 0.000 description 1
- 229960002719 buserelin Drugs 0.000 description 1
- CUWODFFVMXJOKD-UVLQAERKSA-N buserelin Chemical compound CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](COC(C)(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 CUWODFFVMXJOKD-UVLQAERKSA-N 0.000 description 1
- BMQGVNUXMIRLCK-OAGWZNDDSA-N cabazitaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC)C(=O)C1=CC=CC=C1 BMQGVNUXMIRLCK-OAGWZNDDSA-N 0.000 description 1
- 229960001573 cabazitaxel Drugs 0.000 description 1
- HFCFMRYTXDINDK-WNQIDUERSA-N cabozantinib malate Chemical compound OC(=O)[C@@H](O)CC(O)=O.C=12C=C(OC)C(OC)=CC2=NC=CC=1OC(C=C1)=CC=C1NC(=O)C1(C(=O)NC=2C=CC(F)=CC=2)CC1 HFCFMRYTXDINDK-WNQIDUERSA-N 0.000 description 1
- 229960002865 cabozantinib s-malate Drugs 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 229960002438 carfilzomib Drugs 0.000 description 1
- BLMPQMFVWMYDKT-NZTKNTHTSA-N carfilzomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)[C@]1(C)OC1)NC(=O)CN1CCOCC1)CC1=CC=CC=C1 BLMPQMFVWMYDKT-NZTKNTHTSA-N 0.000 description 1
- 108010021331 carfilzomib Proteins 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 229960002798 cetrimide Drugs 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 229960001927 cetylpyridinium chloride Drugs 0.000 description 1
- YMKDRGPMQRFJGP-UHFFFAOYSA-M cetylpyridinium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCC[N+]1=CC=CC=C1 YMKDRGPMQRFJGP-UHFFFAOYSA-M 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 1
- 238000011098 chromatofocusing Methods 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- ACSIXWWBWUQEHA-UHFFFAOYSA-N clodronic acid Chemical compound OP(O)(=O)C(Cl)(Cl)P(O)(O)=O ACSIXWWBWUQEHA-UHFFFAOYSA-N 0.000 description 1
- 229960002286 clodronic acid Drugs 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 230000002301 combined effect Effects 0.000 description 1
- 244000221110 common millet Species 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000005289 controlled pore glass Substances 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 1
- 229960005061 crizotinib Drugs 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 238000009109 curative therapy Methods 0.000 description 1
- 238000011461 current therapy Methods 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 229960003843 cyproterone Drugs 0.000 description 1
- DUSHUSLJJMDGTE-ZJPMUUANSA-N cyproterone Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DUSHUSLJJMDGTE-ZJPMUUANSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 238000007822 cytometric assay Methods 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 238000002784 cytotoxicity assay Methods 0.000 description 1
- 231100000263 cytotoxicity test Toxicity 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 229960003603 decitabine Drugs 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 229960001251 denosumab Drugs 0.000 description 1
- 239000008356 dextrose and sodium chloride injection Substances 0.000 description 1
- 239000008355 dextrose injection Substances 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 229940008099 dimethicone Drugs 0.000 description 1
- 239000004205 dimethyl polysiloxane Substances 0.000 description 1
- 235000013870 dimethyl polysiloxane Nutrition 0.000 description 1
- AMTWCFIAVKBGOD-UHFFFAOYSA-N dioxosilane;methoxy-dimethyl-trimethylsilyloxysilane Chemical compound O=[Si]=O.CO[Si](C)(C)O[Si](C)(C)C AMTWCFIAVKBGOD-UHFFFAOYSA-N 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 208000030172 endocrine system disease Diseases 0.000 description 1
- 239000006274 endogenous ligand Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 1
- 229940116977 epidermal growth factor Drugs 0.000 description 1
- UFNVPOGXISZXJD-XJPMSQCNSA-N eribulin Chemical compound C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 UFNVPOGXISZXJD-XJPMSQCNSA-N 0.000 description 1
- 229960003649 eribulin Drugs 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 229960004177 filgrastim Drugs 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 150000002270 gangliosides Chemical class 0.000 description 1
- 239000003349 gelling agent Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229960004859 glucarpidase Drugs 0.000 description 1
- 108010049491 glucarpidase Proteins 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229940049654 glyceryl behenate Drugs 0.000 description 1
- 125000003712 glycosamine group Chemical group 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 102000048362 human PDCD1 Human genes 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000011577 humanized mouse model Methods 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 238000012872 hydroxylapatite chromatography Methods 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 229940072106 hydroxystearate Drugs 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960002411 imatinib Drugs 0.000 description 1
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 238000007654 immersion Methods 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000003053 immunization Effects 0.000 description 1
- 238000002649 immunization Methods 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000003259 immunoinhibitory effect Effects 0.000 description 1
- 230000001506 immunosuppresive effect Effects 0.000 description 1
- 238000009169 immunotherapy Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 150000002484 inorganic compounds Chemical class 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 229940079322 interferon Drugs 0.000 description 1
- 229960003507 interferon alfa-2b Drugs 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 229960002014 ixabepilone Drugs 0.000 description 1
- FABUFPQFXZVHFB-CFWQTKTJSA-N ixabepilone Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@H](C)C(=O)C(C)(C)[C@H](O)CC(=O)N1)O)C)=C\C1=CSC(C)=N1 FABUFPQFXZVHFB-CFWQTKTJSA-N 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 229960002437 lanreotide Drugs 0.000 description 1
- 108010021336 lanreotide Proteins 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 229940035034 maltodextrin Drugs 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229960004616 medroxyprogesterone Drugs 0.000 description 1
- FRQMUZJSZHZSGN-HBNHAYAOSA-N medroxyprogesterone Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 FRQMUZJSZHZSGN-HBNHAYAOSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960004635 mesna Drugs 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 239000010445 mica Substances 0.000 description 1
- 229910052618 mica group Inorganic materials 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000001823 molecular biology technique Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 238000002625 monoclonal antibody therapy Methods 0.000 description 1
- RZRNAYUHWVFMIP-UHFFFAOYSA-N monoelaidin Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-UHFFFAOYSA-N 0.000 description 1
- 229940043348 myristyl alcohol Drugs 0.000 description 1
- RKISUIUJZGSLEV-UHFFFAOYSA-N n-[2-(octadecanoylamino)ethyl]octadecanamide Chemical compound CCCCCCCCCCCCCCCCCC(=O)NCCNC(=O)CCCCCCCCCCCCCCCCC RKISUIUJZGSLEV-UHFFFAOYSA-N 0.000 description 1
- 230000037125 natural defense Effects 0.000 description 1
- 229940086322 navelbine Drugs 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- 108010087904 neutravidin Proteins 0.000 description 1
- 230000009835 non selective interaction Effects 0.000 description 1
- 239000002687 nonaqueous vehicle Substances 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 229960002700 octreotide Drugs 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000003883 ointment base Substances 0.000 description 1
- 229940055577 oleyl alcohol Drugs 0.000 description 1
- XMLQWXUVTXCDDL-UHFFFAOYSA-N oleyl alcohol Natural products CCCCCCC=CCCCCCCCCCCO XMLQWXUVTXCDDL-UHFFFAOYSA-N 0.000 description 1
- 239000002751 oligonucleotide probe Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- CPZBLNMUGSZIPR-NVXWUHKLSA-N palonosetron Chemical compound C1N(CC2)CCC2[C@@H]1N1C(=O)C(C=CC=C2CCC3)=C2[C@H]3C1 CPZBLNMUGSZIPR-NVXWUHKLSA-N 0.000 description 1
- 229960002131 palonosetron Drugs 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- NMHMNPHRMNGLLB-UHFFFAOYSA-N phloretic acid Chemical compound OC(=O)CCC1=CC=C(O)C=C1 NMHMNPHRMNGLLB-UHFFFAOYSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920000575 polymersome Polymers 0.000 description 1
- 229960000688 pomalidomide Drugs 0.000 description 1
- UVSMNLNDYGZFPF-UHFFFAOYSA-N pomalidomide Chemical compound O=C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O UVSMNLNDYGZFPF-UHFFFAOYSA-N 0.000 description 1
- 229960001131 ponatinib Drugs 0.000 description 1
- PHXJVRSECIGDHY-UHFFFAOYSA-N ponatinib Chemical compound C1CN(C)CCN1CC(C(=C1)C(F)(F)F)=CC=C1NC(=O)C1=CC=C(C)C(C#CC=2N3N=CC=CC3=NC=2)=C1 PHXJVRSECIGDHY-UHFFFAOYSA-N 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 229960000214 pralatrexate Drugs 0.000 description 1
- OGSBUKJUDHAQEA-WMCAAGNKSA-N pralatrexate Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CC(CC#C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OGSBUKJUDHAQEA-WMCAAGNKSA-N 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 201000003004 ptosis Diseases 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 229960000424 rasburicase Drugs 0.000 description 1
- 108010084837 rasburicase Proteins 0.000 description 1
- 238000001525 receptor binding assay Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960001302 ridaforolimus Drugs 0.000 description 1
- 229960003452 romidepsin Drugs 0.000 description 1
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 1
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 1
- 108010091666 romidepsin Proteins 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 238000010187 selection method Methods 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000007727 signaling mechanism Effects 0.000 description 1
- 229940083037 simethicone Drugs 0.000 description 1
- 239000000344 soap Substances 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000008354 sodium chloride injection Substances 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 229910000162 sodium phosphate Inorganic materials 0.000 description 1
- MIXCUJKCXRNYFM-UHFFFAOYSA-M sodium;diiodomethanesulfonate;n-propyl-n-[2-(2,4,6-trichlorophenoxy)ethyl]imidazole-1-carboxamide Chemical compound [Na+].[O-]S(=O)(=O)C(I)I.C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl MIXCUJKCXRNYFM-UHFFFAOYSA-M 0.000 description 1
- 235000019337 sorbitan trioleate Nutrition 0.000 description 1
- 229960000391 sorbitan trioleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000009987 spinning Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000001502 supplementing effect Effects 0.000 description 1
- 210000000225 synapse Anatomy 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 238000002626 targeted therapy Methods 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- 229960003433 thalidomide Drugs 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- AOBORMOPSGHCAX-DGHZZKTQSA-N tocofersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-DGHZZKTQSA-N 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 230000005030 transcription termination Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000003146 transient transfection Methods 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- GBABOYUKABKIAF-IELIFDKJSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IELIFDKJSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 1
- 229960004449 vismodegib Drugs 0.000 description 1
- BPQMGSKTAYIVFO-UHFFFAOYSA-N vismodegib Chemical compound ClC1=CC(S(=O)(=O)C)=CC=C1C(=O)NC1=CC=C(Cl)C(C=2N=CC=CC=2)=C1 BPQMGSKTAYIVFO-UHFFFAOYSA-N 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- 210000003905 vulva Anatomy 0.000 description 1
- 239000008136 water-miscible vehicle Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39558—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against tumor tissues, cells, antigens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
- A61K39/001116—Receptors for cytokines
- A61K39/001117—Receptors for tumor necrosis factors [TNF], e.g. lymphotoxin receptor [LTR] or CD30
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2851—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the lectin superfamily, e.g. CD23, CD72
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/64—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising a combination of variable region and constant region components
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
Abstract
Description
本出願は、2015年1月14日に出願された米国特許仮出願第62/103,402号の利益を主張し、当該仮出願は、すべての目的のために、参照によりその全体が本明細書に組み込まれる。
本出願は、ASCIIフォーマットで電子的に提出され、その全体が参照により本明細書に組み込まれる、配列表を含む。XYZで作製された前記ASCIIのコピーは、XYZPCT_CRF_sequencelisting.txtと名づけられ、XYZバイトのサイズである。
多特異性免疫調節抗原結合構築物(MIAC)及びMIACを含む組成物が本明細書で提供される。該構築物を使用する方法及び該構築物を作製する方法も提供される。
エフェクター細胞ベースの免疫調節抗体療法は抗体を利用して、T細胞及びナチュラルキラー(NK)細胞などのエフェクター細胞を腫瘍などの所望の作用部位に動員する。
ある種の癌細胞は、(i)エフェクター細胞によって発現される活性化受容体に対するリガンドを発現することができない;または(ii)エフェクター細胞によって発現される阻害性受容体に対するリガンドを発現する。結果として生じる、癌細胞がエフェクター細胞において活性化シグナルを刺激することができないこと、または癌細胞がエフェクター細胞において阻害性シグナルを刺激することに成功することは、それぞれ、癌の進行を促進することもできる。
エフェクター免疫細胞によって発現される活性化受容体に特異的に結合する抗原結合モジュール2(ABM2)であって、活性化受容体へのABM2の結合が活性化受容体を刺激するABM2;及び
エフェクター免疫細胞によって発現される阻害性受容体に特異的に結合する抗原結合モジュール3(ABM3)であって、阻害性受容体へのABM3の結合が阻害性受容体に拮抗するABM3
を含む多特異性免疫調節抗原結合構築物(MIAC)のポリペプチドが本明細書に記載され、ここで、ABM1、ABM2及びABM3は互いに作動可能に連結され、随意に、各抗原結合モジュールは、他の抗原結合モジュールのそれぞれが、そのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と、結合することができる。
エフェクター免疫細胞によって発現される活性化受容体に特異的に結合する抗原結合モジュール2(ABM2)であって、活性化受容体へのABM2の結合が活性化受容体を刺激するABM2
を含む多特異性免疫調節抗原結合構築物(MIAC)も本明細書に記載され、ここで、ABM1及びABM2は互いに作動可能に連結され、随意に、各抗原結合モジュールは、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合することができる。いくつかの態様では、MIACはさらにFcを含み、随意に、ABM2はFabフラグメントであり、ABM1はscFvフラグメントであり、随意に、ABM2の重鎖のC末端はFcのN末端に連結しており、ABM1はFcのC末端に連結しており、随意に、MIACは二量体であり、随意に、二量体はホモ二量体である。
エフェクター免疫細胞によって発現される阻害性受容体に特異的に結合する抗原結合モジュール3(ABM3)であって、阻害性受容体へのABM3の結合が阻害性受容体に拮抗するABM3
を含む多特異性免疫調節抗原結合構築物(MIAC)も本明細書に記載され、ここで、ABM1及びABM3は互いに作動可能に連結され、随意に、各抗原結合モジュールは、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合することができる。いくつかの態様では、MIACはさらにFcを含み、随意に、ABM3はFabフラグメントであり、ABM1はscFvフラグメントであり、随意に、ABM3の重鎖のC末端はFcのN末端に連結しており、ABM1はFcのC末端に連結しており、随意に、MIACは二量体であり、随意に、二量体はホモ二量体である。
別段定義しない限り、本明細書で使用されるすべての技術用語、表記及び他の科学専門用語は、本発明が属する分野の当業者によって通常理解される意味を有することが意図される。ある場合には、通常理解される意味を有する用語は、明確にするために及び/または容易に参照するために本明細書で定義され、本明細書におけるそのような定義の包含は、必ずしも当技術分野で一般に理解されるものと比較して相違を表すと解釈されるべきでない。本明細書で記載されるまたは言及される技法及び手順は、一般に十分理解されており、従来の方法論、例えば、Sambrook et al.,Molecular Cloning:A Laboratory Manual 2nd ed.(1989)Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NYに記載されている、広範に利用されている分子クローニングの方法論などを使用して、当業者によって通常用いられる。必要に応じて、市販のキット及び試薬の使用を含む手順は、特記しない限り、一般に、製造者が規定したプロトコール及び/またはパラメーターに従って行われる。
2.1.癌細胞を標的にし、同時に同じエフェクター細胞の活性化受容体及び阻害性受容体を調節する、多特異性免疫調節抗原結合構築物(MIAC)
MIACのコンセプトの一態様を図1に図示する。これは、3つのABMを含む、3つのABMから本質的に成る、または3つのABMから成るMIACを示す。ABM1は癌細胞特異的抗原結合部位を含む。ABM2はエフェクター細胞によって発現される活性化受容体に対してアゴニスト活性を有する結合部位を含む。ABM3はエフェクター細胞によって発現される阻害性受容体に対してアンタゴニスト活性を有する結合部位を含む。
MIACのコンセプトの別の態様を図9に図示する。これは、2つのABMを含む、2つのABMから本質的に成る、または2つのABMから成るMIACを示す。ABM1は癌細胞特異的抗原結合部位を含む。ABM2はエフェクター細胞によって発現される活性化受容体に対してアゴニスト活性を有する結合部位を含む。
MIACのコンセプトの別の態様を図10に図示する。これは、2つのABMを含む、2つのABMから本質的に成る、または2つのABMから成るMIACを示す。ABM1は癌細胞特異的抗原結合部位を含む。ABM3はエフェクター細胞によって発現される阻害性受容体に対してアンタゴニスト活性を有する結合部位を含む。
MIACは、Fcなどの足場を含むことができる。そのような足場は、各ABMを互いに作動可能に連結するのに使用することができる。ある種の態様では、1つまたは複数のABMが、Fcなどの足場を含むことができる。
MIACのABMは、任意の適切な抗原結合分子を含むことができる。いくつかの実施形態では、ABMは、免疫グロブリン、抗体、抗体フラグメント及び/または代替足場から選択される分子を含む。
本明細書で提供されるABMを、抗原に対するその結合価の点から特徴づけることができる。ABMは任意の適切な結合価を有し得る。いくつかの実施形態では、ABMは、一価でも、二価でも、三価でも、四価でも、四価を超えてもよい。ABMを形成する分子の選択を介して結合価を制御することができることを当業者は認識するであろう。例えば、scFv ABMは一般に一価であるであろうし、IgG ABMは一般に二価であるであろう。
本明細書で提供されるMIACでは、ABM1は癌細胞によって発現される抗原(「癌細胞抗原」)に特異的に結合する。ABM1が結合する好ましい抗原としては、癌細胞によって発現されるが正常細胞によって発現されないもの、または正常細胞と比べると癌細胞でアップレギュレートされるものが挙げられる。抗原が細胞の表面で発現され、ここで抗原がABM1に接触可能であることが好ましい。任意の適切な癌細胞抗原がABM1によって標的にされ得、当業者は、ABM1による結合に適切な抗原を選択することができるであろう。
本明細書で提供されるMIACでは、ABM2はエフェクター細胞によって発現される活性化受容体に特異的に結合する。活性化受容体へのABM2の結合が活性化受容体を刺激し、エフェクター細胞への活性化シグナルの伝達をもたらす。例えば、活性化受容体に対するABM2の親和性、ABM2の結合価またはABM2の数を変え、それによって、活性化シグナルの強度を変えることによって、エフェクター細胞の活性を調整することができる。
本明細書で提供されるMIACでは、ABM3は、エフェクター細胞によって発現される阻害性受容体に特異的に結合する。阻害性受容体へのABM3の結合が阻害性受容体に拮抗し、エフェクター細胞に伝達される阻害性シグナルの遮断をもたらす。例えば、阻害性受容体に対するABM3の親和性、ABM3の結合価またはABM3の数を変えて、それによって、阻害性シグナルの拮抗の程度を変えることによって、エフェクター細胞の活性をさらに調整することができる。
任意の適切なABM1、ABM2及び/またはABM3を組み合わせて、本明細書のMIACを作製することができる。以下の組み合わせは、単に例示目的で提供され、ABM1、ABM2及びABM3のいかなる特定の組み合わせにも本発明を限定することを意図するものではない。
いくつかの実施形態では、本明細書で提供されるMIACは、エフェクター細胞のFc受容体に結合する結合モジュールを含む。Fc受容体としては、例えば、CD16(CD16a、CD16b)、CD32a、CD64及びCD89が挙げられる。
本明細書で提供されるMIACは、MIACを含むABMが、MIACを形成するために、共有結合的にまたは非共有結合的に互いに会合(または「結合」)することを特徴とする。当業者は、ABMの性質及び用途に基づいて、会合の種類を選択することができる。
いくつかの実施形態では、ABMは、互いに共有結合的に会合している。共有結合的会合は、任意の適切な共有結合的連結でもよい。
いくつかの実施形態では、ABMは互いに非共有結合的に会合している。非共有会合的会合は、任意の適切な共有結合的連結でもよい。
図2A〜6及び11A〜18Bは、本明細書で提供されるMIACの例示的非限定例を提供する。
MIACは、当技術分野で既知であり且つ以下により詳細に記載されている、核酸クローニング、タンパク質発現及びタンパク質アセンブリの技法を使用して調製することができる。本開示の他の個所で記載するように、MIACを形成するABMは、複数のサブユニットを有するタンパク質(及び融合タンパク質)からアセンブルすることができる。MIACが複数のサブユニットから形成される場合は、MIACの最終的なアセンブリは、組換え細胞の内部で行ってもよいし、組換え細胞の外部で行ってもよい。
ABMの生成に使用される抗原は、細胞によって発現されるインタクトな分子(例えば、癌細胞特異的抗原、活性化受容体及び/もしくは阻害性受容体)またはこれらの分子のフラグメントでもよい。抗原は、単離タンパク質の形態でもよし、当該タンパク質を発現する細胞の形態でもよい。ABMを生成するのに有用な抗原の他の形態は当業者に明らかである。
抗体は、例えば、全体が参照により組み込まれる、Kohler et al.,Nature,1975,256:495−497によって最初に記載されたハイブリドーマ法を使用して、及び/または組換えDNA法(例えば、全体が参照により組み込まれる、米国特許第4,816,567を参照されたい)によって、得ることができる。例えば、ファージまたは酵母ベースのライブラリーを使用して、モノクローナル抗体を得ることもできる。例えば、米国特許第8,258,082号及び第8,691,730号(これらのそれぞれは、その全体が参照により組み込まれる)を参照されたい。
ヒト化抗体は、モノクローナル抗体の構造部分の大部分またはすべてを対応するヒト抗体配列と置き換えることによって生成することができる。したがって、抗原特異的な可変領域またはCDRのみが非ヒト配列から構成されるハイブリッド分子が生成される。ヒト化抗体を得るための方法としては、例えば、Winter and Milstein,Nature,1991,349:293−299;Rader et al.,Proc.Nat.Acad.Sci.U.S.A.,1998,95:8910−8915;Steinberger et al.,J.Biol.Chem.,2000,275:36073−36078;Queen et al.,Proc.Natl.Acad.Sci.U.S.A.,1989,86:10029−10033;ならびに米国特許第5,585,089号;第5,693,761号;第5,693,762号;及び第6,180,370号(これらのそれぞれは、その全体が参照により組み込まれる)に記載されているものが挙げられる。
ヒト抗体は、当技術分野で既知の様々な技法によって、例えば、トランスジェニック動物(例えば、ヒト化マウス)を使用することによって、生成することができる。例えば、Jakobovits et al.,Proc.Natl.Acad.Sci.U.S.A.,1993,90:2551;Jakobovits et al.,Nature,1993,362:255−258;Bruggermann et al.,Year in Immuno.,1993,7:33;ならびに米国特許第5,591,669号、第5,589,369号及び第5,545,807号(これらのそれぞれは、その全体が参照により組み込まれる)を参照されたい。ヒト抗体はまた、ファージディスプレイライブラリーに由来してもよい(例えば、Hoogenboom et al.,J.Mol.Biol.,1991,227:381−388;Marks et al.,J.Mol.Biol.,1991,222:581−597;ならびに米国特許第5,565,332号及び第5,573,905号)(これらのそれぞれは、その全体が参照により組み込まれる)を参照されたい)。ヒト抗体は、インビトロ活性化B細胞によっても生成することができる(例えば、米国特許第5,567,610号及び第5,229,275号(これらのそれぞれは、その全体が参照により組み込まれる)を参照されたい)。ヒト抗体はまた、酵母ベースのライブラリーに由来してもよい(例えば、全体が参照により組み込まれる、米国特許第8,691,730号を参照されたい)。
代替足場は、当技術分野で既知の任意の方法によって調製することができる。
融合タンパク質は、当技術分野で既知の標準的な分子生物学的方法を使用して生成することができる。一般に、融合される2種以上のタンパク質、例えば2種以上のABMをコードするポリヌクレオチド配列を合成する。ポリヌクレオチド配列は、ポリヌクレオチド配列の転写及び翻訳が2種以上のタンパク質(例えば、ABM)を含むポリペプチド鎖の発現をもたらすように設計する。このポリペプチド鎖は「融合タンパク質」といわれる。融合タンパク質の1つの実例はscFvに融合したIgG重鎖である。
任意の適切なポリペプチドリンカーを使用して、MIACのABMを互いに結合させることができ、当業者は、ABMの性質及びMIACの用途に基づいて、適切なポリペプチドリンカーを選択することができる。適切なリンカー組成物は当技術分野で既知であり、本開示の他の個所で記載される。ABMの親和性及びMIACの生物活性に対する様々なリンカー長の効果を評価することによって、適切なリンカー長を選択することができる。適切なリンカー長の決定は、十分、当業者の能力内である。
いくつかの実施形態では、ABMを別々に発現させ、ポリペプチドリンカー以外の化学的カップリング試薬を使用して、発現後に、2つ以上のABMを互いに結合させる。そのような実施形態では、第1のABMと第1の化学的カップリング試薬の間の化学結合の形成に適した条件下で、第1のABMが第1の化学的カップリング試薬と接触する。次いで、第1の化学的カップリング試薬と第2のABMの間の化学結合の形成に適した条件下で、第2のABMが第1のABM及び第1の化学的カップリング試薬によって形成されるコンジュゲートと接触する。同様の技法を利用することによって、さらなるABMを第1及び/もしくは第2のABMに、または第1の化学的カップリング試薬にコンジュゲートすることができる。化学的カップリング試薬とABMの間の化学結合の形成に適した条件は、例えば、全体が参照により組み込まれる、Hermanson,Bioconjugate Techniques,2013,3d ed.,Academic Press,London,UK,Waltham MA,and San Diego,CAに提供される。
5.1ベクター
本発明は、MIACをコードする単離核酸、その核酸を含むベクター及び宿主細胞ならびにMIACを生成するための組換え技法も提供する。
任意の適切な宿主細胞を使用して、本明細書で提供されるMIACを生成することができる。適切な宿主細胞の実例を以下に提供する。これらの宿主細胞は、限定することを意図するものではない。
組換えタンパク質生成の一般的な方法、特に、抗体の生成方法を、本明細書で提供されるMIACの生成に適用することができる。抗体の生成方法のさらなる詳細は、Al−Rubeai,ed.,Antibody Expression and Production,2011,Springer,Heidelberg,London,New Yorkに提供される。
いくつかの実施形態では、MIACを剤にコンジュゲートすることができる。有用な剤としては、例えば、治療剤及び診断剤が挙げられる。いくつかの実施形態では、剤は、リンカーを用いてMIACにコンジュゲートされる。いくつかの態様では、リンカーは生分解性リンカーである。
本明細書で提供されるMIACは、任意の適切な医薬組成物中に提供することができ、任意の適切な投与経路で投与することができる。適切な投与経路としては、限定されないが非経口、吸入、動脈内、皮内、筋肉内、腹腔内、静脈内、経鼻、肺及び皮下経路が挙げられる。
ある種の実施形態では、MIACを含む非経口剤形が提供される。非経口剤形は、限定されないが、皮下、静脈内(ボーラス注射を含める)、筋肉内及び動脈内を含めた、様々な経路で対象に投与することができる。それらの投与は、典型的には汚染物に対する対象の自然防御を迂回するので、非経口剤形は、典型的には、無菌であるか、対象への投与に先立って無菌化することができる。非経口剤形の例としては、限定されないが、注射用液剤、注射用の医薬的に許容可能なビヒクルに容易に溶解または懸濁される乾燥製品、注射用懸濁剤及び乳剤が挙げられる。
活性用の任意の適切なインビトロまたはインビボアッセイを使用して、本明細書で提供されるMIACの活性を評価することができる。いくつかの実施形態では、多数のMIAC構築物を効率的に調べることを可能にするために、これらのアッセイをハイスループットアプローチに適合させることができる。
ヒトの治療法では、医師は、予防的または治癒的治療に従って、ならびに年齢、体重、状態及び治療される対象に特異的な他の要因に従って、最も適切だと考える薬量を決定する。
治療適用については、本発明のMIACは、当技術分野で既知のもの及び上述のものなどの医薬的に許容可能な剤形で、哺乳動物、一般にヒトに投与される。例えば、本発明のMIACは、ヒトに対して、ボーラスとしてまたはある期間にわたる持続注入によって静脈内に、筋肉内、腹腔内、脳脊髄内、皮下、関節内、滑液包内、髄腔内または腫瘍内の経路によって、投与することができる。MIACはまた、局部的及び全身的な治療効果を発揮するために、腫瘍周囲、病巣内または病変周囲経路によって適切に投与される。腹腔内経路は、例えば卵巣腫瘍の治療において、特に有用であり得る。
いくつかの実施形態では、本明細書で提供されるMIACは診断適用で使用される。例えば、検出可能な部分でMIACを標識することができる。適切な検出可能な部分としては、限定されないが、放射性同位体、蛍光標識及び酵素−基盤標識が挙げられる。
いくつかの実施形態では、本明細書で提供されるMIACは、キットの形態で提供される。いくつかの実施形態では、キットは、手順を実施ための説明書とともに、所定量の試薬のパッケージ化された組み合わせを含む。いくつかの実施形態では、手順は治療手順である。他の実施形態では、手順は診断アッセイである。さらに他の実施形態では、手順は研究アッセイである。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は古典的ホジキンリンパ腫及び全身性未分化大細胞型リンパ腫で発現されるタンパク質であるCD30と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるCD137と結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性KIR受容体と結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。CD20に対するABMの例はリツキシマブである。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性KIR受容体と結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性KIR受容体と結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性KIR受容体と結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRと結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRと結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRと結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRと結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、B細胞の表面で発現され、B細胞リンパ腫及び白血病の治療に関連するタンパク質である、CD20と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるNKG2Dと結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRと結合し、これに拮抗する。このMIACは、ABM2またはABM3のいずれかを含むが、両方は含まない。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は、古典的ホジキンリンパ腫及び全身性未分化大細胞型リンパ腫で発現されるタンパク質である、CD30と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるCD137と結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRであるPD−1と結合し、これに拮抗する。
本明細書に記載のMIACを以下の抗原結合モジュールで作製する。ABM1は古典的ホジキンリンパ腫及び全身性未分化大細胞型リンパ腫で発現されるタンパク質である、CD30と結合する。ABM2は、エフェクター細胞によって発現される活性化受容体であるCD137と結合し、これを刺激する。ABM3は、エフェクター細胞によって発現される阻害性受容体である阻害性KIRであるPD−1と結合し、これに拮抗する。
以下に記載のように、個別の腫瘍関連抗原、チェックポイント受容体及び活性化受容体、またはこれらの組み合わせを標的とするいくつかの例示的な単一特異性、二重特異性及び三重特異性MIAC構築物を調製した。例示的抗体型式の代表を図21に示す。二重特異性構築物については、標的1に対するscFvを、標的2に対する全長IgG1抗体の重鎖のC末端に(G4S)3リンカーを介して遺伝学的に融合した。三重特異性構築物については、標的1及び2に対するscFvを、それぞれ、標的3に対する全長IgG1抗体の重鎖及び軽鎖のC末端に(G4S)3リンカーを介して遺伝学的に融合した。抗CD3結合ドメインを含む構築物については、N結合型グリコシル化を防止する及びADCCを低減するために、Fcドメインのアミノ酸N297をアラニンに変異させた。
表A〜Cに示すように、例示的な単一特異性、二重特異性及び三重特異性抗体構築物を調製した。
DNA2.0(Menlo Park、CA)によって、最終的な遺伝子産物を市販の哺乳類発現ベクターpD2610−v1またはpD2610−v10(DNA2.0、Menlo Park、CA)のいずれかにサブクローニングし、ヒト胎児由来腎臓293(HEK−293)細胞株において、一過的トランスフェクションによって発現させた。
個々の抗原結合
ForteBio Octetを使用してMIAC構築物の抗原結合を解析した。組換えのヒトPD−1 Fc、Her2 Fc、CD137 Fc融合タンパク質をSino Biologicalから購入し、組換えのHisタグ付きヒトCD3イプシロンをAcroBiosystemsから購入した。すべての抗原を0.25ug/ulの終濃度でPBS中に再構成した。PD−1、Her2及びCD137結合の解析については、抗原(Fortebioキネティクス緩衝液中に100nM)をプロテインAセンサーに3分間固定化し、続いて、センサーを300nMリツキシマブに10分間浸漬することによって、センサーの電位フリー結合部位を遮断した。100nM MIAC構築物に5分間センサーを浸漬することによって会合が進み、ブランクのキネティクス緩衝液中に5分間で解離が生じた。CD3イプシロン結合については、抗原をNi−NTAセンサーに固定化し、50nM MIAC構築物中で会合を行った。ForteBioデータ解析9.0ソフトウェアを使用して、結合データを解析した。代表的な結合センソグラム(sensograms)を図23に示す。測定した親和性を表Eにまとめる。このデータは、1つより多い標的に結合する試験した4つのMIACのそれぞれが、各標的に同時に結合することができることを示す。このデータは、MIACの結合親和性が同時結合条件下で0.12〜1.66nMの範囲にわたることも示す。
例示的なHer2標的化MIACの生物活性を評価するための適切な細胞株を同定するために、Her2及びPD−L1(プログラム死リガンド−1)の表面発現についてフローサイトメトリーによって癌細胞株パネルをスクリーニングした。図24の結果は、JIMT1細胞株が高いHer2発現を有し、免疫阻害分子、すなわちプログラム死リガンド−1(PD−L1;CD274)をその表面で発現したことを示す。これらの発見に基づいて、例示的なHer2標的化MIACのインビトロでの機能性評価のために、JIMT1細胞を選択した。
Her2+JIMT1細胞の表面への例示的MIAC構築物の結合をフローサイトメトリーによって解析した。以下のように実験を行った。
本実験を、Her2及びCD137を標的とする例示的な二重特異性MIAC1の、JIMT1腫瘍細胞と共培養されるヒト一次T細胞の増殖及び活性化を増強する能力を判定するために行った。α−Her2/α−CD137MIAC(PID92)の応答を、等モル濃度の、MIACと同一のFab配列を有する混合した単一特異性α−Her2抗体及びα−CD137抗体と比較した。以下のように実験を行った。
本実験を、Her2及びCD137を標的とする例示的な二重特異性MIACの、JIMT1腫瘍細胞と共培養されるヒト一次T細胞からのサイトカイン産生を増強する能力を判定するために行った。対照として、α−Her2/α−CD137MIAC(PID92)MIACの効果を、等モル濃度の、MIACと同じFab配列を有する混合した単一特異性α−Her2及びα−CD137抗体と比較した。
本実験を、Her2及びCD3を標的とする例示的な二重特異性MIACの、JIMT1腫瘍細胞と共培養されるヒト一次T細胞の増殖及び活性化を増強する能力を判定するために行った。対照として、α−Her2/α−CD3 MIAC(PID128)MIACの効果を、等モル濃度の、MIAC中に含まれる同じFab配列を有するCD3標的抗体と比較した。以下のように実験を行った。
本実験を、Her2及びCD3を標的とする例示的な二重特異性MIACの、JIMT1腫瘍細胞と共培養されるヒト一次T細胞からのサイトカイン産生を増強する能力を判定するために行った。対照として、α−Her2/α−CD3MIAC(PID128)MIACを等モル濃度の、MIACと同じFab配列を有する単一特異性抗CD3抗体と比較した。
本実験を、Her2、CD3及びPD−1(プログラム死受容体−1)を標的とする例示的な三重特異性MIACの、JIMT1腫瘍細胞と共培養されるヒト一次T細胞の増殖及び活性化を増強する能力を判定するために行った。対照として、MIACの効果を、等モル濃度の、三重特異性α−Her2/α−CD3/α−PD−1 MIAC(PID130)と同一のFab配列を有する混合した単一特異性抗Her2、抗CD3及び抗PD−1抗体と比較した。以下のように実験を行った。
本実験を、Her2、CD3及びPD−1を標的とする例示的な三重特異性MIACの、JIMT1腫瘍細胞と共培養されるヒト一次T細胞からのサイトカイン産生を増強する能力を判定するために行った。対照として、α−Her2/α−CD3/α−PD−1 MIAC(PID130)を、等モル濃度の、MIACと同一のFab配列を有するHer2、CD3及びPD−1に対する混合した単一特異性抗体と比較した。
本実験を、Her2及びCD3を標的化する例示的な二重特異性MIACの、ガンマインターフェロンの産生を増強し、ヒトBT474乳房細胞株の死滅を促進する能力を判定するために行った。α−Her2/α−CD3MIAC(PID128)の応答を、等モル濃度の、MIACと同一のFab配列を有する混合した単一特異性α−Her2及びα−CD3抗体と比較した。以下のように実験を行った。
本明細書に記載される開示は、独立した有用性を有する複数の別個の発明を包含することができる。これらの発明のそれぞれをその好ましい形態(複数可)で開示してきたが、本明細書で開示及び例示するそれらの特定の実施形態は、多数の変形形態が可能であるので、限定的な意味で考えられるべきでない。本発明の主題は、本明細書に開示される様々な要素、特色、機能及び/または特性の新規且つ自明でない組み合わせ及び部分組み合わせを含む。以下の特許請求の範囲は、新規且つ自明でないと見なされるある特定の組み合わせ及び部分組み合わせを特に示す。特長、機能、要素及び/または特性の他の組み合わせ及び部分組み合わせにおいて具体化される発明を、本出願、本出願から優先権を主張する出願または関連出願において請求することができる。そのような特許請求の範囲も、異なる発明に向けられてものであろうと、同じ発明に向けられたものであろうと、及び元の特許請求の範囲と比べて範囲が広い、狭い、等しいまたは異なるものであろうとなかろうと、本開示の本発明の主題内に含まれる。
配列番号1−実施例13由来の重鎖#1
ブレンツキシマブVH_ヒトIgG1 HC定常_(GGGGS)3_ウレルマブVH_(GGGGS)7_ウレルマブ_VK
配列番号2−実施例13由来の重鎖#2
ブレンツキシマブVH_ヒトIgG1定常_(GGGGS)3_ペンブロリズマブVH_(GGGGS)7_ペンブロリズマブ_VK
配列番号3−実施例13由来の軽鎖
ブレンツキシマブVL_ヒトIgG1 LC定常
配列番号5−実施例14由来の重鎖
ペンブロリズマブVH_(GGGGS)2_ウレルマブVH_ヒトIgG1 HC定常_(GGGGS)3_ブレンツキシマブVH_(GGGGS)7_ブレンツキシマブ_VK
配列番号6−実施例14由来の軽鎖
ペンブロリズマブVL_(GGGGS)2_ウレルマブVL_ヒトIgG1 LC定常
配列番号7−重鎖(DID−1)
トラスツズマブVH_ヒトIgG1 HC定常
配列番号8−軽鎖(DID−2)
トラスツズマブVL_ヒトカッパLC定常
トラスツズマブ重鎖CDR
CDR−H1:GFNIKDT(配列番号28)
CDR−H2:YPTNGY(配列番号29)
CDR−H3:WGGDGFYAMDY(配列番号30)
トラスツズマブ軽鎖CDR
CDR−L1:RASQDVNTAVA(配列番号31)
CDR−L2:SASFLYS(配列番号32)
CDR−L3:QQHYTTPPT(配列番号33)
配列番号9−重鎖(DID−365)
ブリナツモマブ_CD3 VH_ヒト非グリコシル化IgG1定常
配列番号10−軽鎖(DID−8)
ブリナツモマブ_CD3VL_ヒトカッパLC定常
ブリナツモマブ重鎖CDR
CDR−H1:GYTFTRYTMH(配列番号34)
CDR−H2:YINPSRGYT(配列番号35)
CDR−H3:YYDDHYCLDY(配列番号36)
ブリナツモマブ軽鎖CDR
CDR−L1:RASSSVSYMN(配列番号37)
CDR−L2:DTSKVAS(配列番号38)
CDR−L3:QQWSSNPLT(配列番号39)
配列番号11−重鎖(DID−9)
ウレルマブVH_ヒトIgG1定常
配列番号12−軽鎖(DID−309)
ウレルマブVL_ヒトカッパLC定常
ウレルマブ重鎖CDR
CDR−H1:GGSFSGYY(配列番号40)
CDR−H2:NHGGY(配列番号41)
CDR−H3:DYGPGNYDWYFDL(配列番号42)
ウレルマブ軽鎖CDR
CDR−L1:RASQSVSSYLA(配列番号43)
CDR−L2:DASNRAT(配列番号44)
CDR−L3:QQRSNWPPALT(配列番号45)
配列番号13−重鎖(DID−15)
ペンブロリズマブVH_ヒトIgG1定常
配列番号14−軽鎖(DID−16)
ペンブロリズマブVL_ヒトカッパLC定常
ペンブロリズマブ重鎖CDR
CDR−H1:GYTFTNYYMY(配列番号46)
CDR−H2:NPSNGG(配列番号47)
CDR−H3:RDYRFDMGFDY(配列番号48)
ペンブロリズマブ軽鎖CDR
CDR−L1:RASKGVSTSGYSYLH(配列番号49)
CDR−L2:LASYLES(配列番号50)
CDR−L3:QHSRDLPLT(配列番号51)
配列番号15−重鎖(DID−366)
ブリナツモマブ_CD3 VH_ヒト非グリコシル化IgG1 HC定常_(GGGGS)3_トラスツズマブVH_(GGGGS)4_トラスツズマブVL
ブリナツモマブ重鎖CDR
CDR−H1:GYTFTRYTMH(配列番号52)
CDR−H2:YINPSRGYT(配列番号53)
CDR−H3:YYDDHYCLDY(配列番号54)
トラスツズマブ重鎖CDR
CDR−H1:GFNIKDT(配列番号55)
CDR−H2:YPTNGY(配列番号56)
CDR−H3:WGGDGFYAMDY(配列番号57)
トラスツズマブ軽鎖CDR
CDR−L1:RASQDVNTAVA(配列番号58)
CDR−L2:SASFLYS(配列番号59)
CDR−L3:QQHYTTPPT(配列番号60)
配列番号16−重鎖(DID−26)
ウレルマブVH_ヒトIgG1 HC定常_(GGGGS)3_トラスツズマブVH_(GGGGS)4_トラスツズマブVL
ウレルマブ重鎖CDR
CDR−H1:GGSFSGYY(配列番号61)
CDR−H2:NHGGY(配列番号62)
CDR−H3:DYGPGNYDWYFDL(配列番号63)
トラスツズマブ重鎖CDR
CDR−H1:GFNIKDT(配列番号64)
CDR−H2:YPTNGY(配列番号65)
CDR−H3:WGGDGFYAMDY(配列番号66)
トラスツズマブ軽鎖CDR
CDR−L1:RASQDVNTAVA(配列番号67)
CDR−L2:SASFLYS(配列番号68)
CDR−L3:QQHYTTPPT(配列番号69)
配列番号17−重鎖(DID−27)
ペンブロリズマブVH_ヒトIgG1 HC定常_(GGGGS)3_トラスツズマブVH_(GGGGS)4_トラスツズマブVL
ペンブロリズマブ重鎖CDR
CDR−H1:GYTFTNYYMY(配列番号70)
CDR−H2:NPSNGG(配列番号71)
CDR−H3:RDYRFDMGFDY(配列番号72)
トラスツズマブ重鎖CDR
CDR−H1:GFNIKDT(配列番号73)
CDR−H2:YPTNGY(配列番号74)
CDR−H3:WGGDGFYAMDY(配列番号75)
トラスツズマブ軽鎖CDR
CDR−L1:RASQDVNTAVA(配列番号76)
CDR−L2:SASFLYS(配列番号77)
CDR−L3:QQHYTTPPT(配列番号78)
配列番号18−軽鎖(DID−50)
ブリナツモマブ_CD3 VL_ヒトカッパLC定常_(GGGGS)3_ペンブロリズマブVH_(GGGGS)4_ペンブロリズマブVL
ブリナツモマブ軽鎖CDR
CDR−L1:RASSSVSYMN(配列番号79)
CDR−L2:DTSKVAS(配列番号80)
CDR−L3:QQWSSNPLT(配列番号81)
ペンブロリズマブ重鎖CDR
CDR−H1:GYTFTNYYMY(配列番号82)
CDR−H2:NPSNGG(配列番号83)
CDR−H3:RDYRFDMGFDY(配列番号84)
ペンブロリズマブ軽鎖CDR
CDR−L1:RASKGVSTSGYSYLH(配列番号85)
CDR−L2:LASYLES(配列番号86)
CDR−L3:QHSRDLPLT(配列番号87)
配列番号19−軽鎖(DID−310)
ウレルマブVL_ヒトカッパLC定常_(GGGGS)3_ペンブロリズマブVH_(GGGGS)4_ペンブロリズマブVL
ウレルマブ軽鎖CDR
CDR−L1:RASQSVSSYLA(配列番号88)
CDR−L2:DASNRAT(配列番号89)
CDR−L3:QQRSNWPPALT(配列番号90)
ペンブロリズマブ重鎖CDR
CDR−H1:GYTFTNYYMY(配列番号91)
CDR−H2:NPSNGG(配列番号92)
CDR−H3:RDYRFDMGFDY(配列番号93)
ペンブロリズマブ軽鎖CDR
CDR−L1:RASKGVSTSGYSYLH(配列番号94)
CDR−L2:LASYLES(配列番号95)
CDR−L3:QHSRDLPLT(配列番号96)
Claims (68)
- a.癌細胞によって発現される抗原に特異的に結合する抗原結合モジュール1(ABM1);
b.エフェクター免疫細胞によって発現される活性化受容体に特異的に結合する抗原結合モジュール2(ABM2)であって、前記活性化受容体へのABM2の結合が前記活性化受容体を刺激する、ABM2;及び
c.前記エフェクター免疫細胞によって発現される阻害性受容体に特異的に結合する抗原結合モジュール3(ABM3)であって、前記阻害性受容体へのABM3の前記結合が前記阻害性受容体に拮抗する、ABM3
を含み、
ABM1、ABM2及びABM3が互いに作動可能に連結され、
各抗原結合モジュールが、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合することができる、多特異性免疫調節抗原結合構築物(MIAC)のポリペプチド。 - 前記MIACがFcをさらに含み、ここで、ABM1がscFvフラグメントであり、ABM2がFabフラグメントであり、ABM3がscFvフラグメントであり、ABM2がFcに連結しており、ABM3がABM2に連結しており、ABM1がFcに連結しており、ここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より多くの量の、エフェクター免疫細胞によるIFN−γ、TNF−α、IL−2及びグランザイムBの分泌のうちの少なくとも1つを誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成り、ここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の前記対照セットと比較して、より高いレベルのエフェクター免疫細胞増殖を誘導し、かつここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の前記対照セットと比較して、より高いレベルの、エフェクター免疫細胞のCD25細胞表面発現を誘導する、請求項1に記載のMIAC。
- 前記MIACが、一緒に連結しているABM1、ABM2、ABM3及びFcから成り、ここで、ABM1がscFvフラグメントであり、ABM2がFabフラグメントであり、ABM3がscFvフラグメントであり、ABM2の重鎖のC末端がFcのN末端に連結しており、ABM1がFcのC末端に連結しており、ABM3がABM2の軽鎖のC末端に連結しており、ここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より多くの量の、エフェクター免疫細胞によるIFN−γ、TNF−α、IL−2及びグランザイムBの分泌のうちの少なくとも1つを誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成り、ここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の前記対照セットと比較して、より高いレベルのエフェクター免疫細胞増殖を誘導し、かつここで、前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の前記対照セットと比較して、より高いレベルの、エフェクター免疫細胞のCD25細胞表面発現を誘導する、請求項1に記載のMIAC。
- 前記MIACが、一緒に連結しているABM1、ABM2、ABM3及びFcから成り、ここで、ABM1がscFvフラグメントであり、ABM2がFabフラグメントであり、ABM3がscFvフラグメントであり、ABM2の重鎖のC末端がFcのN末端に連結しており、ABM1がFcのC末端に連結しており、ABM3がABM2の軽鎖のC末端に連結している、請求項1に記載のMIAC。
- 前記MIACが足場をさらに含み、ここで、随意に、前記足場がFcであり、随意に、前記FcがヒトFcであり、随意に、前記FcがヒトIgGのFcであり、随意に、ABM1、ABM2及びABM3のそれぞれが、リンカーを伴ってまたは伴わずに、直接的または間接的に前記足場に連結しており、随意に、前記リンカーがポリペプチドリンカーである、請求項1に記載のMIAC。
- FcがIgG(IgG1、IgG2、IgG3、IgG4)、IgA(IgA1、IgA2)、IgD、IgEまたはIgMであり、随意に、Fcが改変され、随意に、前記改変がグリコシル化を低減し、随意に、前記改変がADCCを低減する、請求項5に記載のMIAC。
- ABM1、ABM2及びABM3のそれぞれが抗体またはその抗原結合性フラグメントである、上記請求項のいずれか1項に記載のMIAC。
- 前記抗体またはその抗原結合性フラグメントがIgG(IgG1、IgG2、IgG3、IgG4)、IgA(IgA1、IgA2)、IgD、IgE、IgM、DVD−Ig及び/または重鎖抗体である、請求項7に記載のMIAC。
- 前記抗体またはその抗原結合性フラグメントがFvフラグメント、Fabフラグメント、F(ab’)2フラグメント、Fab’フラグメント、scFvフラグメント、scFv−Fcフラグメント及び/または単一ドメイン抗体もしくはその抗原結合性フラグメントである、請求項7に記載のMIAC。
- 前記抗体またはその抗原結合性フラグメントがモノクローナル、ヒト、ヒト化及び/またはキメラである、請求項7に記載のMIAC。
- ABM1、ABM2及びABM3の少なくとも1つが代替足場をさらに含むか、または前記MIACが代替足場をさらに含む、先行請求項のいずれか1項に記載のMIAC。
- 前記癌細胞によって発現される前記抗原が腫瘍関連抗原または腫瘍特異的抗原である、先行請求項のいずれか1項に記載のMIAC。
- 前記癌細胞によって発現される前記抗原が、HER2、CD20、9−O−アセチル−GD3、βhCG、A33抗原、CA19−9マーカー、CA−125マーカー、カルレティキュリン、カルボアンヒドラーゼIX(MN/CA IX)、CCR5、CCR8、CD19、CD22、CD25、CD27、CD30、CD33、CD38、CD44v6、CD63、CD70、CC123、CD138、癌胎児性抗原(CEA;CD66e)、デスモグレイン4、E−カドヘリンネオエピトープ、エンドシアリン、エフリンA2(EphA2)、上皮増殖因子受容体(EGFR)、上皮細胞接着分子(EpCAM)、ErbB2、胎児アセチルコリン受容体、線維芽細胞活性化抗原(FAP)、フコシルGM1、GD2、GD3、GM2、ガングリオシドGD3、グロボH、糖タンパク質100、HER2/neu、HER3、HER4、インスリン様増殖因子受容体1、ルイス−Y、LG、Ly−6、黒色腫特異的コンドロイチン硫酸プロテオグリカン(MCSCP)、メソテリン、MUC1、MUC2、MUC3、MUC4、MUC5AC、MUC5B、MUC7、MUC16、ミューラー管抑制物質(MIS)II型受容体、形質細胞抗原、ポリSA、PSCA、PSMA、ソニックヘッジホッグ(SHH)、SAS、STEAP、sTn抗原、TNF−アルファ前駆体及びこれらの組み合わせから選択される、先行請求項のいずれか1項に記載のMIAC。
- 前記活性化受容体が、2B4(CD244)、α4β1インテグリン、β2インテグリン、CD2、CD16、CD27、CD38、CD96、CD100、CD160、CD137、CEACAM1(CD66)、CRTAM、CS1(CD319)、DNAM−1(CD226)、GITR(TNFRSF18)、活性化型のKIR、NKG2C、NKG2D、NKG2E、1種または複数種の天然の細胞傷害受容体、NTB−A、PEN−5及びこれらの組み合わせから選択され、随意に、前記β2インテグリンが、CD11a〜CD18、CD11b〜CD18またはCD11c〜CD18を含み、随意に、前記活性化型のKIRがKIR2DS1、KIR2DS4またはKIR−Sを含み、随意に、前記天然の細胞傷害受容体がNKp30、NKp44、NKp46またはNKp80を含む、先行請求項のいずれか1項に記載のMIAC。
- 前記阻害性受容体が、KIR、ILT2/LIR−1/CD85j、阻害型のKIR、KLRG1、LAIR−1、NKG2A、NKR−P1A、Siglec−3、Siglec−7、Siglec−9及びこれらの組み合わせから選択され、随意に、前記阻害型のKIRがKIR2DL1、KIR2DL2、KIR2DL3、KIR3DL1、KIR3DL2またはKIR−Lを含む、先行請求項のいずれか1項に記載のMIAC。
- 前記活性化受容体が、CD3、CD2(LFA2、OX34)、CD5、CD27(TNFRSF7)、CD28、CD30(TNFRSF8)、CD40L、CD84(SLAMF5)、CD137(4−1BB)、CD226、CD229(Ly9、SLAMF3)、CD244(2B4、SLAMF4)、CD319(CRACC、BLAME)、CD352(Ly108、NTBA、SLAMF6)、CRTAM(CD355)、DR3(TNFRSF25)、GITR(CD357)、HVEM(CD270)、ICOS、LIGHT、LTβR(TNFRSF3)、OX40(CD134)、NKG2D、SLAM(CD150、SLAMF1)、TCRα、TCRβ、TCRδγ、TIM1(HAVCR、KIM1)及びこれらの組み合わせから選択される、請求項1〜13のいずれか1項に記載のMIAC。
- 前記阻害性受容体が、PD−1(CD279)、2B4(CD244、SLAMF4)、B71(CD80)、B7H1(CD274、PD−L1)、BTLA(CD272)、CD160(BY55、NK28)、CD352(Ly108、NTBA、SLAMF6)、CD358(DR6)、CTLA−4(CD152)、LAG3、LAIR1、PD−1H(VISTA)、TIGIT(VSIG9、VSTM3)、TIM2(TIMD2)、TIM3(HAVCR2、KIM3)及びこれらの組み合わせから選択される、請求項1〜13のいずれか1項に記載のMIAC。
- 前記エフェクター免疫細胞がT細胞またはナチュラルキラー(NK)細胞であり、随意に、前記T細胞がCD4+ヘルパーT細胞またはCD8+細胞傷害性T細胞である、先行請求項のいずれか1項に記載のMIAC。
- 前記癌細胞が、急性リンパ性白血病(ALL)、急性骨髄性白血病(AML)、副腎皮質癌、肛門癌、虫垂癌、星状細胞腫、基底細胞癌、脳腫瘍、胆管癌、膀胱癌、骨癌、乳癌、気管支腫瘍、バーキットリンパ腫、原発不明癌、心臓腫瘍、子宮頸癌、脊索腫、慢性リンパ性白血病(CLL)、慢性骨髄性白血病(CML)、慢性骨髄増殖性新生物、結腸癌、結腸直腸癌、頭蓋咽頭腫、皮膚T細胞リンパ腫、腺管癌、胚芽腫、子宮内膜癌、上衣腫、食道癌、鼻腔神経芽細胞腫、線維性組織球腫、ユーイング肉腫、眼癌、胚細胞腫瘍、胆嚢癌、胃癌(gastric cancer)、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、神経膠腫、頭頸部癌、ヘアリーセル白血病、肝細胞癌、組織球増殖症、ホジキンリンパ腫、下咽頭癌、眼内黒色腫、膵島細胞腫瘍、カポジ肉腫、腎臓癌、ランゲルハンス細胞組織球症、喉頭癌、白血病、唇及び口腔の癌、肝臓癌、非浸潤性小葉癌、肺癌、リンパ腫、マクログロブリン血症、悪性線維性組織球腫、黒色腫、メルケル細胞癌、中皮腫、原発不明の転移性扁平上皮頸部癌、NUT遺伝子関与正中管癌腫(midline tract carcinoma involving NUT gene)、口腔癌、多発性内分泌腫瘍症候群、多発性骨髄腫、菌状息肉症、骨髄異形成症候群、骨髄異形成/骨髄増殖性新生物、鼻腔及び副鼻腔の癌、鼻咽頭癌、神経芽腫、非ホジキンリンパ腫、非小細胞肺癌、中咽頭癌、骨肉腫、卵巣癌、膵臓癌、乳頭腫症、傍神経節腫、副甲状腺癌、陰茎癌、咽頭癌、褐色細胞腫、下垂体腫瘍、胸膜肺芽腫、原発性中枢神経系リンパ腫、前立腺癌、直腸癌、腎細胞癌、腎盂及び尿管の癌、網膜芽細胞腫、ラブドイド腫瘍、唾液腺癌、セザリー症候群、皮膚癌、小細胞肺癌、小腸癌、軟部組織肉腫、脊髄腫瘍、胃癌(stomach cancer)、T細胞リンパ腫、奇形腫、精巣癌、咽喉癌、胸腺腫及び胸腺癌、甲状腺癌、尿道癌、子宮癌、腟癌、外陰癌ならびにウィルムス腫瘍に由来する細胞である、先行請求項のいずれか1項に記載のMIAC。
- ABM2が4つの免疫グロブリン可変ドメインを含む、先行請求項のいずれか1項に記載のMIAC。
- ABM1が2つの免疫グロブリン可変ドメインを含む、請求項20に記載のMIAC。
- ABM3が2つの免疫グロブリン可変ドメインを含む、請求項21に記載のMIAC。
- ABM2がFabフラグメントであり、ABM1がscFvフラグメントであり、ABM3がscFvフラグメントである、請求項22に記載のMIAC。
- 前記MIACがFcをさらに含み、ABM2がFcに連結しており、ABM3がABM2に連結しており、ABM1がFcに連結している、上記請求項のいずれか1項に記載のMIAC。
- ABM2の重鎖のC末端がFcのN末端に連結しており、ABM1がFcのC末端に連結しており、ABM3がABM2の軽鎖のC末端に連結している、請求項24に記載のMIAC。
- 各連結が直接的であるかまたはリンカーを介しており、随意に、前記リンカーがポリペプチドリンカーであり、随意に、前記ポリペプチドリンカーがgly−serリンカーまたは免疫グロブリンヒンジ領域もしくはその一部である、上記請求項のいずれか1項に記載のMIAC。
- 前記MIACが二量体であり、随意に、前記二量体がホモ二量体である、上記請求項のいずれか1項に記載のMIAC。
- 前記エフェクター免疫細胞によって発現されるさらなる分子と特異的に結合する抗原結合モジュール4(ABM4)をさらに含む、先行請求項のいずれか1項に記載のMIAC。
- 前記エフェクター免疫細胞によって発現される前記さらなる分子が、CD16(CD16a、CD16b)、CD32a、CD64及びCD89から選択される、請求項28に記載のMIAC。
- ABM4がFcである、請求項28に記載のMIAC。
- ABM1が抗HER2であり、ABM2が抗CD3であり、ABM3が抗PD−1である、請求項1〜30のいずれか1項に記載のMIAC。
- ABM1、ABM2及びABM3のうちの少なくとも2つが互いに共有結合的に会合している、先行請求項のいずれか1項に記載のMIAC。
- 前記共有結合的会合が融合タンパク質の形態である、請求項32に記載のMIAC。
- ABM1、ABM2及びABM3のうちの少なくとも2つが互いに非共有結合的に会合している、先行請求項のいずれか1項に記載のMIAC。
- a.癌細胞によって発現される抗原に特異的に結合する抗原結合モジュール1(ABM1);及び
b.エフェクター免疫細胞によって発現される活性化受容体に特異的に結合する抗原結合モジュール2(ABM2)であって、前記活性化受容体へのABM2の結合が前記活性化受容体を刺激するABM2
を含み、
ABM1及びABM2が互いに作動可能に連結され、
各抗原結合モジュールが、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合することができる、多特異性免疫調節抗原結合構築物(MIAC)。 - ABM1が抗CD30であり、ABM2が抗CD137である、請求項35に記載のMIAC。
- 前記MIACがFcをさらに含み、随意に、ABM2がFabフラグメントであり、ABM1がscFvフラグメントであり、随意に、ABM2の重鎖のC末端がFcのN末端に連結しており、ABM1がFcのC末端に連結しており、随意に、前記MIACが二量体であり、随意に、前記二量体がホモ二量体である、請求項35に記載のMIAC。
- a.癌細胞によって発現される抗原に特異的に結合する抗原結合モジュール1(ABM1);及び
b.エフェクター免疫細胞によって発現される阻害性受容体に特異的に結合する抗原結合モジュール3(ABM3)であって、前記阻害性受容体へのABM3の前記結合が前記阻害性受容体に拮抗する、ABM3
を含み、
ABM1及びABM3が互いに作動可能に連結され、
各抗原結合モジュールが、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合することができる、多特異性免疫調節抗原結合構築物(MIAC)。 - ABM1が抗CD30であり、ABM2が抗PD−1である、請求項38に記載のMIAC。
- 前記MIACがFcをさらに含み、随意に、ABM3がFabフラグメントであり、ABM1がscFvフラグメントであり、随意に、ABM3の重鎖のC末端がFcのN末端に連結しており、ABM1がFcのC末端に連結しており、随意に、前記MIACが二量体であり、随意に、前記二量体がホモ二量体である、請求項38に記載のMIAC。
- 前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より多くの量の、エフェクター免疫細胞によるIFN−γ、TNF−α、IL−2及びグランザイムBの分泌のうちの少なくとも1つを誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成る、先行請求項のいずれか1項に記載のMIAC。
- 前記MIACによって誘導されるIFN−γ、TNF−α、IL−2及び/またはグランザイムBの分泌の量が、抗体の前記対照セットによって誘導されるものより約2、3、4、5、6、7または8倍多い、請求項41に記載のMIAC。
- 前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より高いレベルのエフェクター免疫細胞増殖を誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成る、先行請求項のいずれか1項に記載のMIAC。
- 前記MIACによって誘導される増殖のレベルが、抗体の前記対照セットによって誘導されるものより約2、3、4、5、6、7または8倍高い、請求項43に記載のMIAC。
- 前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より高いレベルの、エフェクター免疫細胞のCD25細胞表面発現を誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成る、先行請求項のいずれか1項に記載のMIAC。
- 前記MIACによって誘導される前記CD25の発現が、抗体の前記対照セットによって誘導されるものより約2、3、4、5、6、7または8倍多い、請求項45に記載のMIAC。
- 前記MIACが、少なくとも1つのエフェクター免疫細胞及び少なくとも1つの癌細胞に結合する際に、抗体の対照セットと比較して、より高いレベルの癌細胞死を誘導し、ここで、抗体の前記対照セットが、全体としては前記MIACと同じ標的に特異的に結合する、等モル濃度で存在する別々の単一特異性抗体から成る、先行請求項のいずれか1項に記載のMIAC。
- 各ABMが、他の抗原結合モジュールのそれぞれがそのそれぞれの抗原または受容体に結合するのと同時に、そのそれぞれの抗原または受容体と結合し、随意に、そのそれぞれの抗原または受容体に対する各結合モジュールの親和性が、各ABMがそのそれぞれの抗原または受容体に同時に結合する場合、約0.3nM〜約1.7nM、0.37〜1.66nM、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3.1.4、1.5、1.6または1.7nMである、先行請求項のいずれか1項に記載のMIAC。
- 先行請求項のいずれか1項に記載のMIAC及び剤を含む、コンジュゲート。
- 前記剤が、治療剤、診断剤、マスキング部分、切断可能部分及びこれらの組み合わせから選択される、請求項49に記載のコンジュゲート。
- 前記剤がリンカーによってMIACに結合している、請求項49または請求項50に記載のコンジュゲート。
- 先行請求項のいずれか1項に記載のMIACまたはコンジュゲート及び賦形剤を含む、医薬組成物。
- 癌を有する対象を治療する方法であって、有効量の、先行請求項のいずれか1項に記載のMIACもしくはコンジュゲートまたは請求項52に記載の医薬組成物を前記対象に投与することを含む、前記方法。
- 癌の成長を阻害するかまたは低減させる方法であって、前記癌を、有効量の前記対象に対する先行請求項のいずれか1項に記載のMIACもしくはコンジュゲートまたは請求項52に記載の医薬組成物に接触させることを含む、前記方法。
- 前記MIACが癌細胞及びエフェクター細胞と結合する、請求項53または請求項54に記載の方法。
- 前記MIACが2つ以上のエフェクター細胞と結合する、請求項55に記載の方法。
- 前記MIACが前記エフェクター細胞の活性化受容体を刺激し、前記エフェクター細胞の阻害性受容体に拮抗する、請求項53〜56のいずれか1項に記載の方法。
- 前記MIACが前記エフェクター細胞を活性化する、請求項53〜57のいずれか1項に記載の方法。
- 前記活性化されたエフェクター細胞が、癌細胞に対する細胞傷害性、増殖、IL−2の分泌、インターフェロンガンマの分泌、LAMP−1のアップレギュレーション、CD16のダウンレギュレーション、CD69のアップレギュレーション及びKLRG1のアップレギュレーションから選択される表現型を示す、請求項53〜58のいずれか1項に記載の方法。
- 前記MIACによって誘導される前記増殖が、ABM3を含まないMIACによって誘導される増殖を上回る、請求項59に記載の方法。
- 前記癌が、急性リンパ性白血病(ALL)、急性骨髄性白血病(AML)、副腎皮質癌、肛門癌、虫垂癌、星状細胞腫、基底細胞癌、脳腫瘍、胆管癌、膀胱癌、骨癌、乳癌、気管支腫瘍、バーキットリンパ腫、原発不明癌、心臓腫瘍、子宮頸癌、脊索腫、慢性リンパ性白血病(CLL)、慢性骨髄性白血病(CML)、慢性骨髄増殖性新生物、結腸癌、結腸直腸癌、頭蓋咽頭腫、皮膚T細胞リンパ腫、腺管癌、胚芽腫、子宮内膜癌、上衣腫、食道癌、鼻腔神経芽細胞腫、線維性組織球腫、ユーイング肉腫、眼癌、胚細胞腫瘍、胆嚢癌、胃癌(gastric cancer)、消化管カルチノイド腫瘍、消化管間質腫瘍、妊娠性絨毛性疾患、神経膠腫、頭頸部癌、ヘアリーセル白血病、肝細胞癌、組織球増殖症、ホジキンリンパ腫、下咽頭癌、眼内黒色腫、膵島細胞腫瘍、カポジ肉腫、腎臓癌、ランゲルハンス細胞組織球症、喉頭癌、白血病、唇及び口腔の癌、肝臓癌、非浸潤性小葉癌、肺癌、リンパ腫、マクログロブリン血症、悪性線維性組織球腫、黒色腫、メルケル細胞癌、中皮腫、原発不明の転移性扁平上皮頸部癌、NUT遺伝子関与正中管癌腫(midline tract carcinoma involving NUT gene)、口腔癌、多発性内分泌腫瘍症候群、多発性骨髄腫、菌状息肉症、骨髄異形成症候群、骨髄異形成/骨髄増殖性新生物、鼻腔及び副鼻腔の癌、鼻咽頭癌、神経芽腫、非ホジキンリンパ腫、非小細胞肺癌、中咽頭癌、骨肉腫、卵巣癌、膵臓癌、乳頭腫症、傍神経節腫、副甲状腺癌、陰茎癌、咽頭癌、褐色細胞腫、下垂体腫瘍、胸膜肺芽腫、原発性中枢神経系リンパ腫、前立腺癌、直腸癌、腎細胞癌、腎盂及び尿管の癌、網膜芽細胞腫、ラブドイド腫瘍、唾液腺癌、セザリー症候群、皮膚癌、小細胞肺癌、小腸癌、軟部組織肉腫、脊髄腫瘍、胃癌(stomach cancer)、T細胞リンパ腫、奇形腫、精巣癌、咽喉癌、胸腺腫及び胸腺癌、甲状腺癌、尿道癌、子宮癌、腟癌、外陰癌ならびにウィルムス腫瘍から選択される、請求項53〜60のいずれか1項に記載の方法。
- 少なくとも1つのさらなる剤を前記対象に投与することをさらに含む、請求項53〜61のいずれか1項に記載の方法。
- 請求項1〜48のいずれか1項に記載のMIACをコードする少なくとも1つのポリヌクレオチドまたは一連のポリヌクレオチドを含む、組成物。
- 請求項63に記載の組成物を含む細胞。
- 請求項64に記載の細胞で前記MIACを発現させることを含む、MIACを作製する方法。
- 請求項1〜48のいずれか1項に記載のMIACの前記ABMを発現させること、および、MIACを形成するために前記ABMをアセンブルすることを含む、MIACを作製する方法。
- 請求項1〜48のいずれか1項に記載のMIACをコードする少なくとも1つのポリヌクレオチドまたは一連のポリヌクレオチドを含む、ベクターまたは一連のベクター。
- 請求項1〜48のいずれか1項に記載のMIAC及び使用のための説明書を含むキット。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562103402P | 2015-01-14 | 2015-01-14 | |
| US62/103,402 | 2015-01-14 | ||
| PCT/US2016/013291 WO2016115274A1 (en) | 2015-01-14 | 2016-01-13 | Multispecific immunomodulatory antigen-binding constructs |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2018503399A true JP2018503399A (ja) | 2018-02-08 |
| JP2018503399A5 JP2018503399A5 (ja) | 2019-02-28 |
Family
ID=56406350
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017556515A Withdrawn JP2018503399A (ja) | 2015-01-14 | 2016-01-13 | 多特異性免疫調節抗原結合構築物 |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20180318417A1 (ja) |
| EP (1) | EP3245227A4 (ja) |
| JP (1) | JP2018503399A (ja) |
| CN (1) | CN107614522A (ja) |
| AU (1) | AU2016206707A1 (ja) |
| BR (1) | BR112017015136A2 (ja) |
| CA (1) | CA2973720A1 (ja) |
| WO (1) | WO2016115274A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021519072A (ja) * | 2018-03-27 | 2021-08-10 | システィミューン, インク.Systimmune, Inc. | ガイダンス及びナビゲーションコントロール蛋白質並びにその生産及び使用方法 |
| JP2021521275A (ja) * | 2018-04-13 | 2021-08-26 | アフィメド ゲーエムベーハー | Nk細胞結合抗体融合構築物 |
| JP2021533161A (ja) * | 2018-08-08 | 2021-12-02 | ドラゴンフライ セラピューティクス, インコーポレイテッド | Her2、nkg2dおよびcd16に結合する多重特異性結合タンパク質ならびに使用方法 |
Families Citing this family (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11053316B2 (en) | 2013-01-14 | 2021-07-06 | Xencor, Inc. | Optimized antibody variable regions |
| US10968276B2 (en) | 2013-03-12 | 2021-04-06 | Xencor, Inc. | Optimized anti-CD3 variable regions |
| US9605084B2 (en) | 2013-03-15 | 2017-03-28 | Xencor, Inc. | Heterodimeric proteins |
| KR102211837B1 (ko) | 2013-01-14 | 2021-02-03 | 젠코어 인코포레이티드 | 신규한 이형이량체 단백질 |
| US10858417B2 (en) | 2013-03-15 | 2020-12-08 | Xencor, Inc. | Heterodimeric proteins |
| KR20230022270A (ko) | 2014-03-28 | 2023-02-14 | 젠코어 인코포레이티드 | Cd38 및 cd3에 결합하는 이중특이적 항체 |
| US10259887B2 (en) | 2014-11-26 | 2019-04-16 | Xencor, Inc. | Heterodimeric antibodies that bind CD3 and tumor antigens |
| EP3223845B1 (en) | 2014-11-26 | 2021-05-19 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cd20 |
| JP2017536830A (ja) | 2014-11-26 | 2017-12-14 | ゼンコー・インコーポレイテッドXencor、 Inc. | Cd3及びcd38に結合するヘテロ二量体抗体 |
| IL292449B2 (en) | 2015-03-13 | 2024-02-01 | Cytomx Therapeutics Inc | Nucleic acids encoding antibodies against PDL1 and methods for their preparation |
| EP3466967A1 (en) | 2015-05-18 | 2019-04-10 | TCR2 Therapeutics Inc. | Compositions and methods for tcr reprogramming using fusion proteins |
| CN114591433A (zh) | 2015-07-13 | 2022-06-07 | 西托姆克斯治疗公司 | 抗pd-1抗体、可活化抗pd-1抗体及其使用方法 |
| CN108699136B (zh) | 2015-12-07 | 2022-03-18 | Xencor股份有限公司 | 结合cd3和psma的异二聚抗体 |
| WO2017106061A1 (en) | 2015-12-14 | 2017-06-22 | Macrogenics, Inc. | Bispecific molecules having immunoreactivity with pd-1 and ctla-4, and methods of use thereof |
| MA43874A (fr) * | 2016-01-13 | 2018-11-21 | Compass Therapeutics Llc | Constructions de liaison à l'antigène immunomodulateur multispécifique |
| WO2017165464A1 (en) | 2016-03-21 | 2017-09-28 | Elstar Therapeutics, Inc. | Multispecific and multifunctional molecules and uses thereof |
| BR112018071612A2 (pt) * | 2016-04-22 | 2019-02-19 | Alligator Bioscience Ab | polipeptídeos biespecíficos inovadores contra cd137 |
| MX2018014950A (es) * | 2016-06-07 | 2019-04-25 | Macrogenics Inc | Terapia de combinacion. |
| WO2017218707A2 (en) | 2016-06-14 | 2017-12-21 | Xencor, Inc. | Bispecific checkpoint inhibitor antibodies |
| WO2018005706A1 (en) | 2016-06-28 | 2018-01-04 | Xencor, Inc. | Heterodimeric antibodies that bind somatostatin receptor 2 |
| EP3478321A4 (en) | 2016-06-30 | 2020-04-22 | Oncorus, Inc. | PSEUDOTYPIZED ONCOLYTIC VIRAL ADMINISTRATION OF THERAPEUTIC POLYPEPTIDES |
| US11242376B2 (en) | 2016-08-02 | 2022-02-08 | TCR2 Therapeutics Inc. | Compositions and methods for TCR reprogramming using fusion proteins |
| KR20230130174A (ko) * | 2016-08-30 | 2023-09-11 | 젠코어 인코포레이티드 | 공자극 및 체크포인트 수용체에 결합하는 이중특이적 면역조절 항체 |
| US10793632B2 (en) | 2016-08-30 | 2020-10-06 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| WO2018045110A1 (en) * | 2016-08-30 | 2018-03-08 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| AU2017332452B2 (en) | 2016-09-23 | 2021-01-07 | Merus N.V. | Binding molecules that modulate a biological activity expressed by a cell |
| WO2018058111A1 (en) * | 2016-09-26 | 2018-03-29 | The Brigham And Women's Hospital, Inc. | Regulators of b cell-mediated immunosuppression |
| EP3504234A4 (en) | 2016-09-29 | 2020-12-02 | Beijing Hanmi Pharmaceutical Co., Ltd. | HETERODIMER IMMUNOGLOBULIN CONSTRUCTS AND MANUFACTURING PROCESSES |
| ES2875959T3 (es) | 2016-10-07 | 2021-11-11 | Tcr2 Therapeutics Inc | Composiciones y métodos para reprogramación de receptores de linfocitos T mediante el uso de proteínas de fusión |
| CN106632681B (zh) | 2016-10-11 | 2017-11-14 | 北京东方百泰生物科技有限公司 | 抗egfr和抗cd3双特异抗体及其应用 |
| MX2019005858A (es) * | 2016-11-18 | 2019-08-12 | Beijing Hanmi Pharmaceutical Co Ltd | Anticuerpo biespecifico heterodimerico estructural de anticuerpo natural anti-pd-1/anti-her2 y metodo para preparar el mismo. |
| CA3044593A1 (en) | 2016-11-22 | 2018-05-31 | TCR2 Therapeutics Inc. | Compositions and methods for tcr reprogramming using fusion proteins |
| EP3564265A4 (en) * | 2016-12-30 | 2021-02-17 | Cytocares (Shanghai) Inc. | TRIFUNCTIONAL MOLECULE AND ITS APPLICATION |
| MA47200A (fr) * | 2017-01-03 | 2019-11-13 | Hoffmann La Roche | Molécules bispécifiques de liaison à l'antigène comprenant un clone 20h4.9 anti-4-1bb |
| AU2018219887A1 (en) | 2017-02-08 | 2019-08-22 | Dragonfly Therapeutics, Inc. | Multi-specific binding proteins for activation of natural killer cells and therapeutic uses thereof to treat cancer |
| MX2019009541A (es) * | 2017-02-10 | 2019-12-16 | Dragonfly Therapeutics Inc | Proteinas que se unen a psma, nkg2d y cd16. |
| US20200291089A1 (en) | 2017-02-16 | 2020-09-17 | Elstar Therapeutics, Inc. | Multifunctional molecules comprising a trimeric ligand and uses thereof |
| CA3235295A1 (en) | 2017-02-20 | 2018-08-23 | Dragonfly Therapeutics, Inc. | Proteins binding her2, nkg2d and cd16 |
| SG11201907753TA (en) | 2017-02-24 | 2019-09-27 | Macrogenics Inc | Bispecific binding molecules that are capable of binding cd137 and tumor antigens, and uses thereof |
| KR20200130514A (ko) * | 2017-02-27 | 2020-11-18 | 드래곤플라이 쎄라퓨틱스, 인크. | Caix, ano1, 메소텔린, trop2, cea, 또는 클라우딘-18.2를 표적화하는 다중특이적 결합 단백질 |
| CN106939050B (zh) * | 2017-03-27 | 2019-05-10 | 顺昊细胞生物技术(天津)股份有限公司 | 抗pd1和cd19双特异性抗体及其应用 |
| CN107043425B (zh) * | 2017-03-27 | 2019-05-10 | 顺昊细胞生物技术(天津)股份有限公司 | 抗pd1和cd20双特异性抗体及其应用 |
| CN106986939B (zh) * | 2017-03-27 | 2019-06-07 | 顺昊细胞生物技术(天津)股份有限公司 | 抗pd-1和tem-8双特异性抗体及其应用 |
| US20200385472A1 (en) * | 2017-04-28 | 2020-12-10 | Elstar Therapeutics, Inc. | Multispecific molecules comprising a non-immunoglobulin heterodimerization domain and uses thereof |
| CA3064743A1 (en) * | 2017-05-23 | 2018-11-29 | Dragonfly Therapeutics, Inc. | A protein binding nkg2d, cd16 and ror1 or ror2 |
| WO2018222901A1 (en) | 2017-05-31 | 2018-12-06 | Elstar Therapeutics, Inc. | Multispecific molecules that bind to myeloproliferative leukemia (mpl) protein and uses thereof |
| BR112019025188A2 (pt) | 2017-06-01 | 2020-06-23 | Cytomx Therapeutics, Inc. | Anticorpos anti-pdl1 ativáveis e métodos de uso dos mesmos |
| CN110891650A (zh) * | 2017-06-25 | 2020-03-17 | 西雅图免疫公司 | 制导和导航控制蛋白及其制造和使用方法 |
| JP7402521B2 (ja) | 2017-07-11 | 2023-12-21 | コンパス セラピューティクス リミテッド ライアビリティ カンパニー | ヒトcd137に結合するアゴニスト性抗体およびその使用 |
| AU2018304585B2 (en) | 2017-07-20 | 2023-07-06 | Alligator Bioscience Ab | Antigen binding proteins binding to 5T4 and 4-1BB and related compositions and methods |
| WO2019035938A1 (en) | 2017-08-16 | 2019-02-21 | Elstar Therapeutics, Inc. | MULTISPECIFIC MOLECULES BINDING TO BCMA AND USES THEREOF |
| US20200231679A1 (en) * | 2017-08-23 | 2020-07-23 | Dragonfly Therapeutics, Inc. | Proteins binding nkg2d, cd16 and a tumor-associated antigen |
| WO2019051308A1 (en) | 2017-09-07 | 2019-03-14 | Dragonfly Therapeutics, Inc. | NKG2D, CD16 BINDING PROTEINS AND ANTIGEN ASSOCIATED WITH A TUMOR |
| WO2019089753A2 (en) | 2017-10-31 | 2019-05-09 | Compass Therapeutics Llc | Cd137 antibodies and pd-1 antagonists and uses thereof |
| US11312770B2 (en) | 2017-11-08 | 2022-04-26 | Xencor, Inc. | Bispecific and monospecific antibodies using novel anti-PD-1 sequences |
| US10981992B2 (en) | 2017-11-08 | 2021-04-20 | Xencor, Inc. | Bispecific immunomodulatory antibodies that bind costimulatory and checkpoint receptors |
| EP3713961A2 (en) | 2017-11-20 | 2020-09-30 | Compass Therapeutics LLC | Cd137 antibodies and tumor antigen-targeting antibodies and uses thereof |
| KR20200100098A (ko) | 2017-12-19 | 2020-08-25 | 젠코어 인코포레이티드 | 조작된 il-2 fc 융합 단백질 |
| EP3502140A1 (en) * | 2017-12-21 | 2019-06-26 | F. Hoffmann-La Roche AG | Combination therapy of tumor targeted icos agonists with t-cell bispecific molecules |
| EP3732202A4 (en) * | 2017-12-28 | 2022-06-15 | Nanjing Legend Biotech Co., Ltd. | SINGLE DOMAIN ANTIBODIES AND VARIANTS THEREOF AGAINST TIGIT |
| EP3731850A4 (en) | 2017-12-29 | 2021-12-01 | Oncorus, Inc. | ONCOLYTIC VIRUS DELIVERY OF THERAPEUTIC POLYPEPTIDES |
| PE20220278A1 (es) | 2018-02-08 | 2022-02-25 | Dragonfly Therapeutics Inc | Dominios variables de anticuerpos que se dirigen al receptor nkg2d |
| WO2019153200A1 (zh) * | 2018-02-08 | 2019-08-15 | 北京韩美药品有限公司 | 抗pd-1/抗her2天然抗体结构样异源二聚体形式双特异抗体及其制备 |
| CA3090236A1 (en) * | 2018-02-08 | 2019-08-15 | Dragonfly Therapeutics, Inc. | Combination therapy of cancer involving multi-specific binding proteins that activate natural killer cells |
| SG11202007572VA (en) | 2018-02-15 | 2020-09-29 | Macrogenics Inc | Variant cd3-binding domains and their use in combination therapies for the treatment of disease |
| CN112119099A (zh) * | 2018-03-02 | 2020-12-22 | Cdr-生物科技股份有限公司 | 三特异性抗原结合蛋白 |
| WO2019178362A1 (en) | 2018-03-14 | 2019-09-19 | Elstar Therapeutics, Inc. | Multifunctional molecules that bind to calreticulin and uses thereof |
| US20210009711A1 (en) | 2018-03-14 | 2021-01-14 | Elstar Therapeutics, Inc. | Multifunctional molecules and uses thereof |
| US10982006B2 (en) | 2018-04-04 | 2021-04-20 | Xencor, Inc. | Heterodimeric antibodies that bind fibroblast activation protein |
| EP3781598A1 (en) | 2018-04-18 | 2021-02-24 | Xencor, Inc. | Tim-3 targeted heterodimeric fusion proteins containing il-15/il-15ra fc-fusion proteins and tim-3 antigen binding domains |
| AU2019256539A1 (en) | 2018-04-18 | 2020-11-26 | Xencor, Inc. | PD-1 targeted heterodimeric fusion proteins containing IL-15/IL-15Ra Fc-fusion proteins and PD-1 antigen binding domains and uses thereof |
| JP2021523913A (ja) * | 2018-05-16 | 2021-09-09 | ドラゴンフライ セラピューティクス, インコーポレイテッド | Nkg2d、cd16、及び線維芽細胞活性化タンパク質と結合するタンパク質 |
| WO2019226658A1 (en) * | 2018-05-21 | 2019-11-28 | Compass Therapeutics Llc | Multispecific antigen-binding compositions and methods of use |
| CN112384534A (zh) * | 2018-05-21 | 2021-02-19 | 指南针制药有限责任公司 | 用于增强nk细胞对靶细胞的杀死的组合物和方法 |
| WO2019224385A2 (en) * | 2018-05-24 | 2019-11-28 | Glenmark Pharmaceuticals S.A. | Combined bispecific antibody and immuno-oncology therapies |
| AU2019297451A1 (en) | 2018-07-03 | 2021-01-28 | Marengo Therapeutics, Inc. | Anti-TCR antibody molecules and uses thereof |
| EP3876986A4 (en) * | 2018-09-18 | 2022-06-01 | Pandion Operations, Inc. | TARGETED IMMUNOTLERANCE |
| EP3861016A2 (en) | 2018-10-03 | 2021-08-11 | Xencor, Inc. | Il-12 heterodimeric fc-fusion proteins |
| US11046769B2 (en) | 2018-11-13 | 2021-06-29 | Compass Therapeutics Llc | Multispecific binding constructs against checkpoint molecules and uses thereof |
| CN111196856A (zh) * | 2018-11-19 | 2020-05-26 | 三生国健药业(上海)股份有限公司 | 抗her2/pd1双特异性抗体 |
| WO2020172601A1 (en) | 2019-02-21 | 2020-08-27 | Elstar Therapeutics, Inc. | Multifunctional molecules that bind to calreticulin and uses thereof |
| SG11202109033XA (en) | 2019-02-21 | 2021-09-29 | Marengo Therapeutics Inc | Multifunctional molecules that bind to t cells and uses thereof to treat autoimmune disorders |
| SG11202109122SA (en) | 2019-02-21 | 2021-09-29 | Marengo Therapeutics Inc | Anti-tcr antibody molecules and uses thereof |
| AU2020226893A1 (en) | 2019-02-21 | 2021-09-23 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to T cell related cancer cells and uses thereof |
| CN114127111A (zh) | 2019-02-21 | 2022-03-01 | 马伦戈治疗公司 | 与nkp30结合的抗体分子及其用途 |
| CA3132185A1 (en) | 2019-03-01 | 2020-09-10 | Xencor, Inc. | Heterodimeric antibodies that bind enpp3 and cd3 |
| WO2020205504A1 (en) * | 2019-03-29 | 2020-10-08 | Compass Therapeutics Llc | Common light chains and methods of use |
| WO2020214957A1 (en) * | 2019-04-19 | 2020-10-22 | Tcrcure Biopharma Corp. | Anti-pd-1 antibodies and uses thereof |
| KR20220008866A (ko) * | 2019-05-14 | 2022-01-21 | 하푼 테라퓨틱스, 인크. | EpCAM 결합 단백질 및 사용 방법 |
| AU2020332310A1 (en) * | 2019-08-16 | 2022-03-10 | The Regents Of The University Of California | Combined cancer therapy involving chemical activation of integrins and targeted cell immunotherapy |
| JP2023501379A (ja) * | 2019-11-06 | 2023-01-18 | システィミューン, インク. | ガイダンス及びナビゲーションコントロールタンパク質、その製造方法及び使用方法 |
| WO2021138407A2 (en) | 2020-01-03 | 2021-07-08 | Marengo Therapeutics, Inc. | Multifunctional molecules that bind to cd33 and uses thereof |
| BR112022013403A2 (pt) * | 2020-01-10 | 2022-10-11 | Shanghai Henlius Biotech Inc | Anticorpos anti-tigit, anticorpos multiespecíficos que compreendem os mesmos e métodos de uso dos mesmos |
| KR102559355B1 (ko) * | 2020-01-31 | 2023-07-25 | 주식회사 제넥신 | 항-taa 항체, 항-pd-l1 항체 및 il-2를 포함하는 융합단백질 및 이의 용도 |
| KR20230028242A (ko) | 2020-04-24 | 2023-02-28 | 마렝고 테라퓨틱스, 인크. | T 세포 관련 암 세포에 결합하는 다중기능성 분자 및 그것의 용도 |
| WO2021222595A2 (en) * | 2020-04-30 | 2021-11-04 | Virtuoso Binco, Inc. | Multispecific antibodies targeting cd38 and epcam and uses thereof |
| US11919956B2 (en) | 2020-05-14 | 2024-03-05 | Xencor, Inc. | Heterodimeric antibodies that bind prostate specific membrane antigen (PSMA) and CD3 |
| CN114057882B (zh) * | 2020-07-31 | 2023-01-06 | 山东博安生物技术股份有限公司 | 多价多特异性抗体 |
| KR102607909B1 (ko) | 2020-08-19 | 2023-12-01 | 젠코어 인코포레이티드 | 항-cd28 조성물 |
| CA3190755A1 (en) | 2020-08-26 | 2022-03-03 | Andreas Loew | Multifunctional molecules that bind to calreticulin and uses thereof |
| EP4204096A2 (en) | 2020-08-26 | 2023-07-05 | Marengo Therapeutics, Inc. | Antibody molecules that bind to nkp30 and uses thereof |
| CN116761818A (zh) | 2020-08-26 | 2023-09-15 | 马伦戈治疗公司 | 检测trbc1或trbc2的方法 |
| WO2022170619A1 (en) * | 2021-02-11 | 2022-08-18 | Adagene Pte. Ltd. | Anti-cd3 antibodies and methods of use thereof |
| WO2022192403A1 (en) | 2021-03-09 | 2022-09-15 | Xencor, Inc. | Heterodimeric antibodies that bind cd3 and cldn6 |
| JP2024509274A (ja) | 2021-03-10 | 2024-02-29 | ゼンコア インコーポレイテッド | Cd3及びgpc3に結合するヘテロ二量体抗体 |
| AU2022255506A1 (en) | 2021-04-08 | 2023-11-09 | Marengo Therapeutics, Inc. | Multifunctional molecules binding to tcr and uses thereof |
| WO2022262678A1 (zh) * | 2021-06-15 | 2022-12-22 | 盛禾(中国)生物制药有限公司 | 一种多特异性抗原结合蛋白及其应用 |
| WO2023011273A1 (zh) * | 2021-08-02 | 2023-02-09 | 盛禾(中国)生物制药有限公司 | 一种多特异性抗原结合蛋白及其应用 |
| CN117999290A (zh) * | 2021-08-02 | 2024-05-07 | 盛禾(中国)生物制药有限公司 | 一种多特异性抗原结合蛋白及其应用 |
| WO2024008039A1 (zh) * | 2022-07-08 | 2024-01-11 | 盛禾(中国)生物制药有限公司 | 一种异源二聚体融合蛋白及其应用 |
| WO2024028386A1 (en) * | 2022-08-02 | 2024-02-08 | Ose Immunotherapeutics | Multifunctional molecule directed against cd28 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| HUP0300369A2 (hu) * | 2000-04-11 | 2003-06-28 | Genentech, Inc. | Többértékű antitestek és alkalmazásuk |
| WO2008027236A2 (en) * | 2006-08-30 | 2008-03-06 | Genentech, Inc. | Multispecific antibodies |
| JP2010535032A (ja) * | 2007-07-31 | 2010-11-18 | メディミューン,エルエルシー | 多重特異性エピトープ結合性タンパク質およびその用途 |
| KR101958753B1 (ko) * | 2010-04-13 | 2019-03-15 | 셀덱스 쎄라퓨틱스, 인크. | 인간 cd27에 결합하는 항체 및 이의 용도 |
| UY33492A (es) * | 2010-07-09 | 2012-01-31 | Abbott Lab | Inmunoglobulinas con dominio variable dual y usos de las mismas |
| CA2814780C (en) * | 2010-09-22 | 2017-05-16 | Amgen Inc. | Carrier immunoglobulins and uses thereof |
| WO2014100490A1 (en) * | 2012-12-19 | 2014-06-26 | Adimab, Llc | Multivalent antibody analogs, and methods of their preparation and use |
| MA43874A (fr) * | 2016-01-13 | 2018-11-21 | Compass Therapeutics Llc | Constructions de liaison à l'antigène immunomodulateur multispécifique |
-
2016
- 2016-01-13 JP JP2017556515A patent/JP2018503399A/ja not_active Withdrawn
- 2016-01-13 EP EP16737835.5A patent/EP3245227A4/en not_active Withdrawn
- 2016-01-13 AU AU2016206707A patent/AU2016206707A1/en not_active Abandoned
- 2016-01-13 WO PCT/US2016/013291 patent/WO2016115274A1/en active Application Filing
- 2016-01-13 CN CN201680012450.XA patent/CN107614522A/zh active Pending
- 2016-01-13 BR BR112017015136A patent/BR112017015136A2/pt not_active Application Discontinuation
- 2016-01-13 US US15/543,542 patent/US20180318417A1/en not_active Abandoned
- 2016-01-13 CA CA2973720A patent/CA2973720A1/en not_active Abandoned
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021519072A (ja) * | 2018-03-27 | 2021-08-10 | システィミューン, インク.Systimmune, Inc. | ガイダンス及びナビゲーションコントロール蛋白質並びにその生産及び使用方法 |
| JP2021521275A (ja) * | 2018-04-13 | 2021-08-26 | アフィメド ゲーエムベーハー | Nk細胞結合抗体融合構築物 |
| CN113880952A (zh) * | 2018-04-13 | 2022-01-04 | 艾菲默德有限责任公司 | 自然杀伤细胞接合抗体融合构建体 |
| JP2021533161A (ja) * | 2018-08-08 | 2021-12-02 | ドラゴンフライ セラピューティクス, インコーポレイテッド | Her2、nkg2dおよびcd16に結合する多重特異性結合タンパク質ならびに使用方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20180318417A1 (en) | 2018-11-08 |
| BR112017015136A2 (pt) | 2018-01-30 |
| CN107614522A (zh) | 2018-01-19 |
| EP3245227A4 (en) | 2018-07-25 |
| AU2016206707A1 (en) | 2017-08-10 |
| WO2016115274A8 (en) | 2017-08-17 |
| EP3245227A1 (en) | 2017-11-22 |
| CA2973720A1 (en) | 2016-07-21 |
| WO2016115274A1 (en) | 2016-07-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20190031785A1 (en) | Multispecific immunomodulatory antigen-binding constructs | |
| US20180318417A1 (en) | Multispecific immunomodulatory antigen-binding constructs | |
| US11208487B2 (en) | Anti-HLA-G antibodies, compositions comprising anti-HLA-G antibodies and methods of using anti-HLA-G antibodies | |
| JP2019033743A (ja) | インターロイキン−21ムテイン及び治療方法 | |
| JP2020504171A (ja) | 抗PD−1抗体との組み合わせのための抗Tim−3抗体 | |
| TWI797100B (zh) | 抗-神經纖毛蛋白質(neuropilin)抗原-結合蛋白及其使用方法 | |
| TW201920277A (zh) | 抗cd39抗體、包含抗cd39抗體之組成物及使用抗cd39抗體之方法 | |
| JP7360440B2 (ja) | Pd-l1及びcd137に結合する抗体分子 | |
| KR102574071B1 (ko) | 항-gitr 항원-결합 단백질 및 그의 사용 방법 | |
| US10683358B2 (en) | Human TNFRSF25 antibody | |
| WO2020011976A1 (en) | Mesothelin and cd137 binding molecules | |
| KR20210124959A (ko) | 항체 제제 | |
| CN112566937A (zh) | 对cd3特异性的抗体及其用途 | |
| WO2020165374A1 (en) | Bifunctional molecule comprising il-15ra | |
| CA3026652A1 (en) | Anti-tnfrsf25 antibodies | |
| JP2021105053A (ja) | Pd−1/cd3二重特異性タンパク質による血液がん治療 | |
| CN114008077A (zh) | 抗体和使用方法 | |
| RU2795625C2 (ru) | Антигенсвязывающие белки против gitr и способы их применения | |
| RU2776714C2 (ru) | Антигенсвязывающие белки против tigit и способы их применения | |
| CN117957253A (zh) | 癌症的组合治疗中针对cd40和cd137的多特异性结合剂 | |
| CN116981694A (zh) | 抗pd-1多肽及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170915 Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20190111 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20190111 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20200213 |