ES2791485T3 - Método y material para complejación en el sitio activo de moléculas biológicas - Google Patents
Método y material para complejación en el sitio activo de moléculas biológicas Download PDFInfo
- Publication number
- ES2791485T3 ES2791485T3 ES10749160T ES10749160T ES2791485T3 ES 2791485 T3 ES2791485 T3 ES 2791485T3 ES 10749160 T ES10749160 T ES 10749160T ES 10749160 T ES10749160 T ES 10749160T ES 2791485 T3 ES2791485 T3 ES 2791485T3
- Authority
- ES
- Spain
- Prior art keywords
- composition
- plant
- hydrogen peroxide
- polyphenol
- plant tissue
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/82—Theaceae (Tea family), e.g. camellia
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N59/00—Biocides, pest repellants or attractants, or plant growth regulators containing elements or inorganic compounds
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N65/00—Biocides, pest repellants or attractants, or plant growth regulators containing material from algae, lichens, bryophyta, multi-cellular fungi or plants, or extracts thereof
- A01N65/08—Magnoliopsida [dicotyledons]
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23K—FODDER
- A23K20/00—Accessory food factors for animal feeding-stuffs
- A23K20/10—Organic substances
- A23K20/111—Aromatic compounds
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS, OR NON-ALCOHOLIC BEVERAGES, NOT COVERED BY SUBCLASSES A21D OR A23B-A23J; THEIR PREPARATION OR TREATMENT, e.g. COOKING, MODIFICATION OF NUTRITIVE QUALITIES, PHYSICAL TREATMENT; PRESERVATION OF FOODS OR FOODSTUFFS, IN GENERAL
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
- A23L33/10—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof using additives
- A23L33/105—Plant extracts, their artificial duplicates or their derivatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/045—Hydroxy compounds, e.g. alcohols; Salts thereof, e.g. alcoholates
- A61K31/05—Phenols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/12—Ketones
- A61K31/122—Ketones having the oxygen directly attached to a ring, e.g. quinones, vitamin K1, anthralin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/40—Peroxides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K36/00—Medicinal preparations of undetermined constitution containing material from algae, lichens, fungi or plants, or derivatives thereof, e.g. traditional herbal medicines
- A61K36/18—Magnoliophyta (angiosperms)
- A61K36/185—Magnoliopsida (dicotyledons)
- A61K36/22—Anacardiaceae (Sumac family), e.g. smoketree, sumac or poison oak
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/44—Oxidoreductases (1)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07G—COMPOUNDS OF UNKNOWN CONSTITUTION
- C07G1/00—Lignin; Lignin derivatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/107—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length by chemical modification of precursor peptides
- C07K1/1072—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length by chemical modification of precursor peptides by covalent attachment of residues or functional groups
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Natural Medicines & Medicinal Plants (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Mycology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Botany (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Polymers & Plastics (AREA)
- Alternative & Traditional Medicine (AREA)
- Medical Informatics (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Food Science & Technology (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Inorganic Chemistry (AREA)
- Environmental Sciences (AREA)
- Wood Science & Technology (AREA)
- Dentistry (AREA)
- Plant Pathology (AREA)
- Agronomy & Crop Science (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Nutrition Science (AREA)
Abstract
Una composicion oxidante de polifenol para uso en terapia antimicrobiana, comprendiendo la composicion: a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y b. una especie reactiva de oxigeno exogeno que incluye peroxido de hidrogeno; y en la que la composicion esta sustancialmente libre de agentes reductores activos y enzimas.
Description
DESCRIPCIÓN
Método y material para complejación en el sitio activo de moléculas biológicas
Campo técnico
La presente invención generalmente se refiere a composiciones oxidantes de polifenoles para causar oxidación localmente mejorada y/o entrecruzamiento de proteínas, microorganismos y tejidos biológicos.
Antecedentes de la invención
A pesar de cientos de millones de años de evolución divergente, casi todas las plantas, animales y patógenos comparten algunos fundamentos bioquímicos y estrategias comunes para la defensa del medio ambiente. Esto hace que la botánica sea una rica fuente de compuestos útiles y compatibles para el control de patógenos en animales. El uso de la bioquímica funcional de las plantas ha sido durante mucho tiempo la base de las medicinas tradicionales y herbales y, a menudo, se considera que es menos probable que desencadene respuestas inmunológicas no deseadas entre especies genéticamente menos distantes dentro de los mismos filos que las proteínas o polímeros muy complicados altamente purificados.
Los sistemas inmunes de la mayoría de los organismos superiores protegen de la infección con defensas de especificidad creciente. La más simple es una barrera física que evita que los patógenos, tales como bacterias y virus, ingresen al organismo. Las plantas y los animales también tienen sistemas inmunes innatos que son respuestas genéticamente codificadas a patógenos específicos, o varias respuestas no específicas a los compuestos químicos patógenos.
Las plantas tienen típicamente un sistema inmune de dos ramificaciones. El primero reconoce y responde a las moléculas comunes a muchas clases de microbios, incluidos los no patógenos, mediante el aumento de la expresión de las enzimas generadoras de ROS (especies reactivas de oxígeno) capaces de iniciar explosiones oxidativas, pero dicha respuesta oxidativa directa consume mucha energía y debe regularse estrictamente para prevenir la autotoxicidad. Muchos microorganismos patógenos (bacterias, hongos, protozoos) están equipados con peroxidasas o catalasas como contramedidas contra tales explosiones de ROS. La segunda rama del sistema inmune innato es la respuesta de la lesión a múltiples componentes como se describió anteriormente, iniciada por la reacción entre compuestos quinónicos y aminoácidos cuando las células están dañadas. Estos compuestos generalmente están separados por compartimientos y no cooperan en los sistemas vivos. En las plantas, la disrupción celular hace que varios compuestos de fenol y especies reactivas de oxígeno entren en contacto con las polifenol oxidasas (PPO), oxidando los compuestos de fenol para formar compuestos quinónicos que se asocian agresivamente entre sí y con los aminoácidos de las células o cualquier microorganismo presente. Esto afecta muchos fenómenos fisiológicos, como el pardeamiento o la decoloración de los alimentos, la precipitación de proteínas, la actividad germicida, la astringencia, los cambios en la digestibilidad de los alimentos y más.
La oxidación de polifenoles en sistemas de plantas genera polifenoles oxidados (también denominados o-polifenoles, biopolímeros oxidados, poliquinonas y compuestos quinónicos) con una multiplicidad de grupos quinónicos que son capaces de unirse covalentemente. Una vez formados, los o-polifenoles de alta afinidad forman espontáneamente enlaces cruzados intra e intercadena covalentes que condensan proteínas de forma mucho más agresiva que los enlaces de hidrógeno característicos de los polifenoles no oxidados. En los sistemas vegetales, los o-polifenoles entrecruzan las proteínas de las células dañadas para formar un escudo refractario entre los tejidos sanos y un ataque adicional. También evitan la propagación de patógenos al unirse agresivamente a sus vías metabólicas, deshabilitando las enzimas de virulencia y deteniendo la motilidad del patógeno.
Los vertebrados superiores poseen una capa adicional de protección, el sistema inmune adaptativo, que permite una respuesta inmune inmediata más fuerte a los patógenos encontrados previamente. La agregación de moléculas más pequeñas en el patógeno crea complejos grandes con una mayor antigenicidad del patógeno para el sistema inmunitario del huésped. Cada patógeno es "recordado" por un antígeno característico. Si un patógeno infecta el cuerpo más de una vez, estas células de memoria específicas se utilizan para eliminarlo de manera rápida y eficiente; sin embargo, estas respuestas personalizadas pueden tardar muchos días en desarrollarse. Mientras tanto, la defensa primaria contra los patógenos recientemente encontrados, especialmente en la infección de animales inmunológicamente deficientes o inmaduros, se basa únicamente en el sistema inmune innato y, a menudo, se asocia con respuestas fisiológicas negativas tales como diarrea, vómito, fiebre, inflamación, etc.. Dichas respuestas sistémicas a la infección son la expresión de un gran número de efectores inmunes que pueden ser metabólicamente extremadamente costosos, incluso fatales para el huésped.
Uno de los peligros más comunes asociados con una respuesta sistémica no controlada por el sistema inmune innato es la deshidratación diarreica provocada por enfermedades infecciosas o parásitos. La deshidratación diarreica afecta a más de 2 mil millones de personas cada año y es la causa más común de muerte para los bebés del tercer mundo, responsable de más de 1,5 millones de muertes por año. Además de la rehidratación, la mayoría de los esfuerzos para tratar la diarrea se han centrado en aumentar la inmunidad de la mucosa humana mediante la modulación de las respuestas inmunes sistémicas, tal como el uso de fármacos reductores de la motilidad intestinal, modificadores de la permeabilidad mucosa o terapias con antibióticos. Estos enfoques tienen un éxito limitado pero introducen riesgos no
deseados de efectos secundarios, resistencia a los patógenos o senescencia fisiológica.
Existe una demanda comercial constante de alternativas botánicas a los antibióticos y desinfectantes químicos sintéticos para el control de enfermedades asociadas con el agua, la superficie y los patógenos transmitidos por los alimentos. El aumento explosivo de las enfermedades resistentes a los antibióticos se ha asociado con el uso excesivo de antibióticos tanto en humanos como en ganado. Muchos gobiernos regionales y organizaciones internacionales de salud han pedido la eliminación gradual del uso innecesario de antibióticos, especialmente en alimentos para ganado donde se usan subterapéuticamente para mejorar el crecimiento. Hasta la fecha, se reconoce ampliamente que existen pocas alternativas rentables y ambientalmente racionales para el control seguro de los patógenos. Décadas de investigación sobre plantas como fuentes de nuevos antimicrobianos se han centrado principalmente en la extracción mecánica o por solventes de compuestos vegetales específicos y no han tenido éxito en generar composiciones con potencia, seguridad, preferencia del usuario y perfil ambiental necesarios para igualar el rendimiento de los antibióticos y germicidas actuales.
Resumen
La presente invención se define en y por medio de las reivindicaciones adjuntas.
La presente divulgación proporciona una composición bioquímica que comprende un fluido procesado que contiene una molécula que tiene un grupo hidroxilo que se combina con un mecanismo de activación para activar la molécula oxidando el grupo hidroxilo con un agente oxidante y un catalizador. La activación de la molécula aumenta la afinidad de unión de la molécula.
En una realización, la molécula comprende un polifenol. En una realización alternativa, la molécula comprende una molécula de carbohidrato polimérico o derivados de polisacárido. En otra realización, el polifenol se deriva de una planta. En una realización, la planta comprende Camellia sinensis, o Púnica granatum u otras plantas portadoras de polifenoles. En otra realización, el polifenol se deriva de la raíz, hojas, tallos, corteza, fruta u otros tejidos de plantas que contienen polifenoles.
En una realización alternativa, la molécula comprende taninos, lignina, flavonoides, hidroxicumarina o alcaloides. En otra realización, la molécula comprende al menos una sección sintética artificial. En una realización, el catalizador comprende una catalasa, una peroxidasa, una fenoloxidasa, una tirosinasa o un catalizador metálico. En una realización alternativa, el catalizador está ubicado en una célula animal. En otra realización, el catalizador es generado por un patógeno. En una realización, el patógeno comprende virus, bacterias, hongos, un organismo eucariota o priónico. En una realización alternativa, el agente oxidante comprende especies reactivas de oxígeno (ROS).
En otra realización, la especie reactiva de oxígeno comprende peróxido de hidrógeno. En otra realización, la especie reactiva de oxígeno comprende peróxidos inorgánicos u orgánicos. En una realización, la especie reactiva de oxígeno comprende un producto de reducción de ozono por superóxido dismutasa, glucosa oxidasa, hidratación de un percarbonato o hidratación de peróxido de carbamida (peróxido de urea) u otro método indirecto para generar especies estables reactivas de oxígeno. En una realización alternativa, el fluido procesado se prepara a partir de una mezcla seca que contiene un polifenol o un derivado de polisacárido. En otra realización, el fluido procesado se prepara a partir de material vegetal intacto que contiene un polifenol. En otra realización, el mecanismo de activación se inicia cuando el polifenol o el derivado de polisacárido está en contacto con la enzima y el agente oxidante en una solución. En una realización, el grupo hidroxilo se convierte en un grupo carbonilo después de la activación del grupo hidroxilo. En una realización alternativa, la molécula comprende un grupo quinónico después de la activación del grupo hidroxilo. En otra realización, la molécula tiene un efecto en la inactivación de un patógeno después de la activación del grupo hidroxilo. En una realización, el agente oxidante proporciona radicales libres. En realizaciones alternativas, la molécula activada proporciona radicales libres.
La presente divulgación también proporciona un método para preparar una composición que comprende obtener un biopolímero de una planta y activar un grupo hidroxilo en el biopolímero, de modo que se aumenta la afinidad de unión molecular del biopolímero.
En una realización, el biopolímero comprende un polifenol, un derivado de polisacárido o una molécula polimérica. En realizaciones alternativas, la activación se realiza colocando el biopolímero en contacto con una enzima o un agente oxidante. En otra realización, el método comprende además entrecruzar el biopolímero activado con una proteína de un animal. En una realización, el método comprende además una pluralidad de biopolímeros que forman estructuras de entrecruzamiento entre sí. En una realización alternativa, el método comprende además unir el biopolímero con un patógeno. En una realización alternativa, el método comprende unir el biopolímero con una célula. En otra realización, el método comprende unir el biopolímero con un virus. En una realización adicional, la unión del polímero a múltiples patógenos provoca la aglomeración o eliminación de microorganismos, proteínas o estructuras proteicas de la solución. En otra realización, la unión cesa la propagación del patógeno. En algunas realizaciones, el biopolímero activado es capaz de bloquear una ruta metabólica de un patógeno. En una realización alternativa, el método comprende además tratar un síntoma diarreico de un animal usando el biopolímero activado. En una realización adicional, el método comprende tratar cualquier tejido dañado de un animal usando el biopolímero activado. En otra realización, la activación del grupo hidroxilo se desencadena por medio de una enzima en un sitio de un animal. En
una realización, la activación del grupo hidroxilo se logra mediante la adición exógena de una enzima. En una realización alternativa, el método comprende además eliminar o inactivar una oxidorreductasa o un compuesto reductor que reacciona con un oxidante. En otra realización, el método comprende además formar una barrera mediante el entrecruzamiento del biopolímero con una proteína de un animal, por lo que se evita la invasión de un patógeno. En una realización adicional, el método comprende entrecruzar el biopolímero con una proteína de un animal, para promover la curación acelerada de lesiones.
La presente divulgación también proporciona un método para facilitar una reacción localizada que comprende localizar una especie añadida reactiva de oxígeno en una proximidad reactiva de un grupo hidroxilo en un biopolímero, activando el grupo hidroxilo del biopolímero y aplicando el biopolímero a un sitio objetivo.
En una realización, el biopolímero comprende un polifenol o un derivado de polisacárido. En una realización alternativa, la activación se logra provocando el encuentro con una enzima. En otra realización, la especie reactiva de oxígeno comprende peróxido de hidrógeno. En una realización, el método comprende además aumentar la densidad del peróxido de hidrógeno en la proximidad reactiva de un grupo hidroxilo mediante la adición de peróxido de hidrógeno a una solución que contiene el biopolímero. En una realización alternativa, el biopolímero comprende múltiples grupos hidroxilo.
La presente divulgación proporciona un método de suministro químico controlado que comprende preparar una biomolécula que contiene una sustancia química preseleccionada y seleccionar un tamaño, un peso o una combinación de los mismos para controlar una velocidad de penetración de la bio-molécula a través de un tejido animal.
En una realización, la sustancia química comprende un compuesto fenólico. En una realización alternativa, la sustancia química comprende compuesto quinónico. En otra realización, la biomolécula comprende alguna cantidad de un extracto de una planta. En una realización, la preparación de la molécula comprende aislar la molécula. En una realización alternativa, la selección comprende extracción. En otra realización, la velocidad de penetración es moderada, de modo que la aplicación de la biomolécula a un animal no causa una respuesta tóxica del tejido del animal. En una realización adicional, la aplicación de la biomolécula a un animal reduce la estimulación externa de la respuesta inmune del sistema animal. En una realización, la ingestión de la biomolécula mejora la utilización de la nutrición para el crecimiento en sistemas animales.
Breve descripción de los dibujos
La Figura 1 ilustra varias rutas de reacción para la conversión de unidades de fenol en quinonas de acuerdo con una realización de la presente divulgación.
La Figura 2 ilustra una composición preparada de acuerdo con una realización de la presente divulgación.
La Figura 3 ilustra un diagrama de flujo de un método para preparar una composición de origen vegetal de acuerdo con una realización de la presente divulgación.
La Figura 4 ilustra un diagrama de flujo de un método para inactivar agentes reductores/enzimas usando un disolvente de acuerdo con una realización de la presente divulgación.
La Figura 5 ilustra un diagrama de flujo de un método de inactivación por calor de agentes reductores/enzimas de acuerdo con una realización de la presente divulgación.
La Figura 6 ilustra aplicaciones de la composición de origen vegetal de acuerdo con algunas realizaciones de la presente divulgación.
Descripción detallada de la invención
La presente divulgación proporciona nuevas composiciones bioactivas. En un aspecto de la divulgación, un sistema bioquímico comprende un biopolímero o el equivalente sintético combinado con una fuente estable de especies reactivas de oxígeno (ROS) y una fuente separada de una enzima o catalizador reductor de oxido. Las combinaciones de las sustancias pueden provocar la formación de un biopolímero oxidado con una mayor afinidad de unión a proteínas y actividad de control microbiano.
Algunas realizaciones contienen una mezcla de material de origen vegetal con propiedades astringentes y/o germicidas y un precursor de activación en solución estable. La solución está sustancialmente libre de enzimas y sustancias catalíticas que pueden causar que los otros componentes reaccionen de una manera que causa degradación. La mezcla de este material germicida de origen vegetal y el precursor de activación es catalizada por varias enzimas de células animales, vegetales o microbianas para liberar radicales oxidativos y formar un material vegetal activado con propiedades astringentes y germicidas significativamente mejoradas. La liberación de radicales oxidativos y la formación de material vegetal activado generalmente se localizan en la fuente de la enzima biológica catalizadora, concentrando así dicha actividad en la proximidad de la entidad o material biológico desencadenante para obtener el máximo efecto. El catalizador desencadenante también puede ser de origen no biológico, tal como un metal que provoca la reducción del precursor de activación para provocar la autooxidación del material de origen vegetal en su forma activada.
En realizaciones alternativas, el sistema bioactivo y germicida contiene una mezcla de un material de origen vegetal, tal como polifenoles. Un experto en la materia apreciaría que cualquier macromolécula, polímero, agregado de moléculas pequeñas, fragmentos de membrana celular, compuestos reticulados que contengan una multiplicidad de unidades fenólicas expuestas y un precursor de activación (por ejemplo, un oxidante, como el peróxido de hidrógeno), o combinaciones de los mismos son aplicables.
En otras realizaciones, los materiales activadores contienen ozono o peroxona. En algunas realizaciones, el material vegetal puede ser una fuente de peróxido de hidrógeno natural. Sin embargo, una concentración endógena de H2O2 es muy variable y generalmente se puede perder en el procesamiento del material vegetal. Uno de los aspectos ventajosos de algunas realizaciones es que la fuente del agente oxidante puede provenir de peróxido de hidrógeno, ozono, peroxona u otro oxidante comercial añadido de manera exógena como precursor de activación.
En algunas realizaciones, una unidad de fenol puede transportar de 1 a 3 grupos hidroxilo (OH) que pueden reaccionar con el oxidante. Por lo tanto, una macromolécula que contenía grupos fenólicos esta compuesta sustancialmente de cientos a miles o más grupos hidroxi que puede transportar. Este grupo molecular de alta densidad de grupos hidroxi proporciona otras oportunidades de enlace no covalente, atracción de carga y secuestro físico para las moléculas de peróxido de hidrógeno dentro de una proximidad cercana y reactiva a las unidades fenólicas. El secuestro de acuerdo con las realizaciones proporciona un método novedoso para mantener la estabilidad y la saturación mejorada de peróxido de hidrógeno dentro de la proximidad reactiva del sustrato polifenólico en soluciones de concentración más bajas que los componentes equivalentes no secuestrados. El secuestro puede ser el resultado de combinar una concentración suficientemente alta de peróxido de hidrógeno en agua para establecer fuerzas de atracción intermoleculares entre una porción sustancial de los grupos funcionales hidroxilo del polifenol y las moléculas de peróxido de hidrógeno. El aumento del secuestro puede reducir significativamente la pérdida de oxidante por el calentamiento, la exposición a los rayos ultravioleta, la reducción de contaminantes y la degradación espontánea al tiempo que aumenta el número potencial de sitios de unión de alta afinidad en el polímero al encontrar las enzimas apropiadas.
En algunas realizaciones, cierta cantidad de extractos crudos de material vegetal, incluidos los fragmentos de células vegetales pobladas con enzimas procesadoras de especies reactivas de oxígeno (ROS) parcialmente desnaturalizadas tal como catalasa, peroxidasa, dismutasa, glucosa oxidasa, o una combinación de las mismas, puede funcionar como una estructura de secuestro de peróxido de hidrógeno. Estas ROS incluyen peróxido de hidrógeno (H2O2), superóxido (O2-), oxígeno singlete (1O2*) y radical hidroxilo (•OH). En realizaciones alternativas, el precursor de activación puede generarse por la degradación del ozono disuelto (O3) o por su conversión por dismutasas activas en H2O2. En otras realizaciones, el precursor de activación también puede generarse mediante la conversión enzimática de cualquier superóxido, tal como un peróxido de ácido graso.
El componente de la composición que aporta las unidades de fenol puede contener un polifenol y/o cualquier macromolécula heterogénea u homogénea que sea sintética, de origen vegetal o animal. En algunas realizaciones, el polifenol contiene más de dos grupos fenol. En realizaciones alternativas, el polifenol contiene más de 30 grupos fenol. En otras realizaciones, el polifenol contiene de 100 a 10.000 grupos fenol. Una persona experta en la técnica apreciaría que cualquier número de grupos fenol puede estar contenido en la composición mientras que las composiciones contengan las características deseadas descritas en el presente documento, tales como la velocidad de absorción, sea moderada.
Los materiales basados en plantas descritos en el presente documento incluyen, pero no se limitan a, polifenoles, ligninas, polisacáridos y otros materiales o estructuras de moléculas grandes que están terminados predominantemente por grupos carbonilo que están disponibles para la transformación en quinona. Las soluciones efectivas pueden procesarse a partir de una gran variedad de tejidos vegetales diferentes de diferentes especies debido a la naturaleza ubicua de los materiales apropiados.
La técnica típica para obtener compuestos antimicrobianos de fuentes botánicas se basa en la extracción mecánica o solvente de moléculas orgánicas de manera que no proporcionen medios prácticos para aprovechar la respuesta química de la lesión de tejidos vegetales vivos para aplicación comercial, especialmente en animales u otros sistemas vegetales. La disrupción celular, ya sea por procesamiento comercial, ataque de patógenos, herbívoros, daño ambiental o descomposición natural, desencadena las reacciones y hace que los compuestos antimicrobianos sean inútiles en un período de tiempo muy corto.
Los polifenoles constituyen una amplia gama de polímeros orgánicos producidos por plantas y son sustratos importantes en la respuesta de las plantas a la lesión. Estos polímeros pueden experimentar cierta conversión oxidativa para formar compuestos antimicrobianos, pero pueden producir comportamientos ligeramente diferentes. Los polisacáridos también pueden sufrir alguna transformación oxidativa, formando bioadhesivos con potencial antimicrobiano y de sellado de lesiones y pueden ser análogos eficaces de quinona.
Los procesos subyacentes están enraizados en una serie compleja de reacciones químicas que pueden involucrar múltiples formaciones enzimáticas directas e indirectas de compuestos intermedios altamente reactivos. las oxidorreductasas pueden mediar esta cascada química, típicamente en presencia de una fuente de especies reactivas de oxígeno, con varias modalidades posibles que convierten grupos funcionales hidroxilo (OH) de polímeros
aromáticos en grupos carbonilo (=O) que forman enlaces covalentes responsables de estructuras biológicas de alta resistencia y defensas antimicrobianas. Los grupos carbonilo son grupos funcionales que contienen un átomo de carbono doblemente unido a un átomo de oxígeno: C=O. Los grupos cetona contienen grupos carbonilo (C-C(=O)-C) en los que cada uno de los grupos carbonilo se une a otros dos átomos de carbono con el átomo de carbono del carbonilo. Algunos de los sustratos interesados particulares incluyen compuestos con múltiples subunidades aromáticas que forman moléculas orgánicas con estructuras de diona cíclica totalmente conjugadas con grupos >C(= O) en cualquier disposición de enlaces dobles, incluidos análogos policíclicos y heterocíclicos, que forman enlaces covalentes con aminoácidos nucleofílicos y proteínas. El término "quinónico" utilizado en este documento incluye cualquier compuesto que contenga subunidades con cualquier número de grupos carbonilo.
Las subunidades de hidroxilo convertidas u oxidadas exhiben una afinidad de unión aumentada característica de múltiples quinonas y semiquinonas en una configuración de heteropolímero u homopolímero. La oxidación solo puede tener lugar en una parte de los grupos funcionales de un polifenol. El carácter heterogéneo típico de estos polifenoles oxidados es capaz de presentar actividad quinónica mientras conserva un comportamiento básico de polifenoles. Las diferencias en la estructura macroscópica, la forma terciaria y el peso molecular causarán diferentes afinidades por diferentes proteínas con una mayor mezcla macroscópica o heterogeneidad intramolecular que proporciona un espectro potencialmente más amplio.
Además de haber sido identificado como un cofactor transitorio en una serie de actividades de entrecruzamiento biológica, los monómeros de quinona se conocen desde hace mucho tiempo por su potente efecto germicida. Además de proporcionar una fuente de radicales libres estables, las quinonas pueden formar complejos irreversibles con aminoácidos nucleofílicos en las proteínas, lo que a menudo conduce a la inactivación de la proteína y la pérdida de la función biológica asociada. Por esa razón, el potencial efecto antimicrobiano de los compuestos quinónicos es excelente. Los objetivos probables en la célula microbiana son las adhesiones expuestas en la superficie, los polipéptidos de la pared celular, los efectores de la motilidad y las enzimas unidas a la membrana. Las quinonas también pueden hacer que los sustratos no estén disponibles para el microorganismo.
Como con todos los antimicrobianos derivados de plantas, los posibles efectos tóxicos de las quinonas deben examinarse a fondo. Algunas quinonas han demostrado efectividad antimicrobiana con diluciones logarítmica de 5 a 6 unidades. Los monómeros de quinona son moléculas pequeñas que penetran fácilmente en los tejidos y presentan una toxicidad que puede limitar su uso medicinal, mientras que los compuestos poliquinónicos contienen una multitud de segmentos quinónicos en un biopolímero, molécula compuesta o análogo sintético. Los compuestos poliquinónicos de suficiente peso molecular y tamaño pueden tener una absorción sistémica reducida, lo que corresponde a un potencial de toxicidad reducido para organismos superiores.
El estudio de la actividad germicida de los compuestos de quinona comenzó a principios de 1900 pero no se entendió bien hasta la década de 1940. La inhibición de la formalina de la reacción de color entre la quinona y muchas proteínas diferentes, tales como la albúmina de huevo, la caseína, el suero de caballo y la peptona, indica que la reacción es principalmente entre las quinonas y el grupo amino de las proteínas. El mecanismo germicida de una poliquinona sola puede tomar tres formas principales: la reacción de unión covalente con proteínas bacterianas, el entrecruzamiento de las citoproteínas de células rotas para formar de manera astringente una barrera refractaria a los patógenos, y un modo de ciclo REDOX que genera peróxidos y radicales libres que causan daño oxidativo a la envoltura del patógeno.
El producto principal de la oxidación de fenol fue identificado por Pryor en 1940 como o-difenoles. Esta producción puede resultar de la autooxidación en presencia de radicales de oxígeno o de la conversión enzimática por fenoloxidasas. Las fenoloxidasas (por ejemplo, L-dopa: oxígeno oxidorreductasa; EC 1.14.18.1), también conocidas como polifenol oxidasas y tirosinasas (por ejemplo, Lisil oxidasa; EC 1.4.3.13), son proteínas que contienen cobre que catalizan la oxidación de los monofenoles en o-difenoles y la posterior oxidación de o-difenoles a las correspondientes o-quinonas. Las fenoloxidasas están muy extendidas en el reino animal, así como en plantas, hongos y procariotas. Los insectos también los usan en la esclerotización en la formación rápida de cascarones de huevo de alta resistencia, capullos y estructuras de seda.
Aunque son el resultado de cientos de millones de años de evolución divergente, la similitud estructural muy cercana de las enzimas oxidativas que incluyen peroxidasa, polifenol oxidasa, lacasa, etc., encontradas en plantas, hongos, bacterias y peroxidasas como la mieloperoxidasa, la lactoperoxidasa y todas las peroxidasas de diferentes tejidos animales, indica la necesidad de alcanzar los mismos fines biológicos básicos. Esta similitud funcional se puede utilizar como un método novedoso para desencadenar la oxidación controlada de polifenoles a través de reinos biológicos o filos.
Por ejemplo, la tirosinasa es la enzima central de la familia de fenoloxidasa junto con varias otras oxidorreductasas que catalizan una etapa en la formación de pigmentos de melanina. La tirosinasa en mamíferos es funcionalmente similar a la fenoloxidasa en la cascada química que causa esclerotización, melanización y producción de péptidos antimicrobianos en insectos.
El peróxido de hidrógeno es una de las fuentes biológicas más comunes de especies reactivas de oxígeno involucradas en la creación enzimática de poliquinonas. Se expresa en cantidad sustancial en tejidos vivos de muchas plantas. Es un producto metabólico ubicuo y un iniciador clave que se consume en el proceso de oxidación de
polifenoles que ocurre en los tejidos dañados. Tanto el oxidante mismo (H2O2) como su producto de reacción mediado por enzimas, las poliquinonas, son antimicrobianos y este último también tiene fuertes propiedades astringentes. Estos son los compuestos principales que permiten el uso medicinal tradicional de muchos materiales vegetales frescos como vendajes para lesiones. Sin embargo, el potencial antimicrobiano en las proximidades de un tejido vegetal recién cortado se degrada en gran medida en cuestión de minutos debido a la naturaleza transitoria de estos compuestos en el tejido vegetal lesionado.
La mezcla de materiales vegetales, oxidantes y enzimas se ha utilizado para generar polifenoles y carbohidratos oxidados para una variedad de usos industriales y comerciales, pero la composición del material vegetal con enzimas desnaturalizadas o eliminadas para permitir una combinación estable con oxidante con el propósito de aplicar a un objetivo que proporciona una fuente separada de catalizador o enzima para afectar los sistemas biológicos, es novedosa.
Las referencias que describen composiciones de materiales vegetales y oxidantes para su uso en sistemas biológicos son limitadas. El documento US 2002/0034553 describe un gel de aloe vera y musgo irlandés como un vehículo pasivo engrosado para suministrar hidrógeno o peróxido de zinc como fuente de oxigenación para crear condiciones desfavorables para las bacterias anaerobias en las lesiones dérmicas. La patente de Estados Unidos No. 5.260.021 divulga un ungüento de gel que contiene peróxido de hidrógeno como vehículo para transportar oxígeno para usar solo como desinfectante para lentes de contacto o similares. La patente de Estados Unidos No. 4.696.757 describe un gel que contiene peróxido de hidrógeno para tratar cortes superficiales y para decolorar el cabello. Ninguna de estas patentes hace referencia a la combinación de un oxidante, como el peróxido de hidrógeno, y un componente de polifenol con la intención de causar o permitir una reacción entre los dos.
En la fisiología de plantas superiores, el peróxido de hidrógeno, los polifenoles, las proteínas y las oxidorreductasas se segregan en el citoplasma estructurado, los orgánulos y las estructuras de membrana de la célula viva. La ruptura de la célula por infección, lesión, aplastamiento, pulverización, desecación, ensilaje u otros procesos físicamente perjudiciales dan como resultado la mezcla y el agotamiento del potencial reactivo útil de estos componentes. El arte actual de la extracción botánica no ofrece medios obvios para capturar una combinación estable de estos componentes. Por lo tanto, no es sorprendente que, a pesar de más de 50 años desde el descubrimiento y la documentación de la función de los sistemas de polifenoles oxidados dentro de las plantas, las industrias de la salud y la agricultura botánica no hayan comercializado con éxito esta química multimolecular, sino que se hayan centrado en la captura de moléculas nutricional y farmacológicamente inherentemente estables que pueden ser simplemente empaquetadas o extraídas.
Existe una comprensión significativa de los polifenoles oxidados enzimáticamente dentro de las ciencias botánicas, pero no existe una referencia conocida para un método y composición ex-vivo estable para restaurar, duplicar o mejorar la capacidad de este sistema de oxidación de polifenoles para uso con fisiología animal u otras aplicaciones biológicas fuera del contexto de la bioquímica de plantas in vivo.
Las interfaces ambientales y las necesidades inmunológicas del reino vegetal son en muchos aspectos similares a las de los animales. Los tejidos externos de las plantas, tales como las cutículas de las hojas, las cáscaras de las frutas y las cáscaras de las semillas, son tejidos vivos adaptados para defenderse contra patógenos similares y estreses físicos como la dermis y la mucosa humana. Los animales y las plantas también tienen algunos mecanismos análogos para hacer frente a las lesiones. Como tal, los mecanismos bioquímicos utilizados en las plantas pueden aplicarse a los animales.
En otro aspecto, un método para producir sistemas bioquímicos estables comprende extraer un sustrato de polifenol estable en una composición libre de agentes reductores activos, enzimas o catalizadores y combinar el sustrato de polifenol con una fuente concentrada de especies reactivas de oxígeno que promueven el inicio y la propagación de reacciones de oxidación cuando se aplica o combina con una fuente separada de oxidorreductasas o catalizadores apropiados.
Las composiciones de acuerdo con algunas realizaciones de la divulgación introducen peróxido de hidrógeno en concentraciones suficientemente altas en una solución acuosa de biopolímero vegetal para establecer el secuestro o estabilización de oxidantes concentrados dentro de la proximidad reactiva íntima de los grupos funcionales hidroxilo de los polifenoles. El oxidante secuestrado resiste la difusión lejos del biopolímero cuando se somete a dilución. Los agentes reductores se eliminan o desnaturalizan en formulaciones que contienen la combinación oxidante-polifenol para hacer que la combinación oxidante-polifenol sea sustancialmente no reactiva a las proteínas hasta que se pone en contacto con una superficie, tejido, organismo, recubrimiento o solución que proporciona una fuente de enzimas oxidorreductasas u otros agentes catalíticos que median directa o indirectamente la conversión del biopolímero en una forma activada.
En otro aspecto de la divulgación, las composiciones contienen una formulación eficiente específica del objetivo de biopolímeros oxidados mediada por enzimas de origen animal. Este mecanismo permite el suministro de efectos útiles desde el punto de vista médico y comercial a los tractos o tejidos del cuerpo animal. Estos efectos son análogos a las respuestas básicas de la lesión de la planta. Muchas de las reacciones bioquímicas involucradas están bien estudiadas pero aún no se comprenden completamente. No obstante, no existe una técnica en el estado del arte para estabilizar y aplicar la combinación estabilizada de oxidantes y polifenoles a la fisiología animal o patógenos como fuente de
activación enzimática. Las enzimas comunes que actúan como complejantes de fenol en muchas plantas, bacterias y hongos, tales como lacasas u fenol oxidasas, son funcionalmente similares a las enzimas animales comunes, tales como catalasas, peroxidasas, que también pueden causar la formación de grupos quinónicos con una afinidad mejorada por los aminoácidos de las proteínas.
En algunas realizaciones, la solución líquida preparada tiene muchas ventajas prácticas significativas sobre los extractos botánicos antimicrobianos típicos convencionales. Estos incluyen mayor solubilidad en agua y capacidad de suministro, mayor estabilidad del pH, mayor estabilidad a la temperatura, potencia predecible, baja toxicidad en animales, bajas concentraciones inhibitorias mínimas en un amplio espectro de bacterias gram negativas y gram positivas, bajo olor y sabor, eficiencia en el uso de materias primas , y carencia de productos de degradación ambiental nocivos.
Algunas realizaciones de la presente divulgación imitan mecanismos de defensa de las plantas que han evolucionado conjuntamente con patógenos ambientales durante muchos millones de años. La acción de unión a proteínas no específica de los biopolímeros activados contiene múltiples actividades que pueden causar la inactivación microbiana. Todos son radicalmente diferentes a las acciones germicidas o antibióticas convencionales y es mucho menos probable que promuevan la resistencia de una manera que se ha asociado con el uso subterapéutico y la contaminación ambiental con antibióticos.
Los polifenoles oxidados pueden tener varios mecanismos biológicos de acción. Una sola molécula poliquinónica de este tipo puede contener de varios a miles de sitios de unión en una población densa y no diluyente, de modo que el compuesto puede entrecruzar y condensar aminoácidos y proteínas de organismos dañados para formar una barrera refractaria contra patógenos e irritantes. El compuesto puede unirse y causar una distorsión e inactivación significativas de las vías metabólicas y los efectos de virulencia de los patógenos. Son capaces de aglomerar físicamente, arrastrar o inmovilizar patógenos para evitar que los patógenos se propaguen. Las formas quinónicas o fenólicas también pueden causar la liberación de radicales oxidativos para causar daño a la membrana del patógeno y lisis. También pueden bloquear los receptores responsables del dolor y las respuestas inflamatorias.
Los polifenoles generados de acuerdo con las realizaciones de la divulgación pueden ser polímeros solubles individuales, moléculas compuestas, conglomerados macromoleculares o agregados con proteínas o fragmentos celulares. El secuestro estabilizador de los oxidantes puede ser el resultado de afinidades de hidrógeno, intercambio de electrones o de efectos capilares a mayor escala.
En muchas situaciones, puede ser beneficioso promover mezclas heterogéneas de biopolímeros activados para maximizar la bioactividad/biodisponibilidad frente a una gama más amplia de patógenos. La combinación de polifenoles extraídos de múltiples materiales vegetales puede servir para ampliar aún más el espectro de unión. En algunos casos, no todas las subunidades de fenol experimentan conversión de quinona y el sustrato puede retener características y comportamientos de los compuestos no oxidados además del comportamiento quinónico.
Los expertos en la materia entenderán que muchos otros polímeros orgánicos naturales o sintetizados también pueden oxidarse para formar una multiplicidad de grupos funcionales carbonilo o quinónicos que pueden usarse en lugar de o combinados con polifenoles.
En algunos aspectos de la divulgación, se usan enzimas no botánicas para desencadenar la oxidación de polifenoles. Esto permite la introducción de una solución estable de oxidante de polifenol para atravesar pasivamente los tractos del cuerpo animal para suministrar materiales no reaccionados a tejidos comprometidos a los que no se puede acceder prácticamente por otros medios, aumentando así la biodisponibilidad efectiva de la composición útil. La formación de quinona catalizada por objetivo restringe las reacciones bioquímicas no específicas a la proximidad inmediata del tejido comprometido, reduciendo así el riesgo de efectos indeseables de tejido macroscópico o interacción sistémica.
La existencia de enzimas funcionalmente idénticas en los reinos animal y vegetal permite la transferencia novedosa de las reacciones de polifenoles mediadas por enzimas a aplicaciones no botánicas. Por ejemplo, el tracto gastrointestinal de los vertebrados superiores tiene 2 tipos diferentes de peroxidasas. El primer tipo comprende una peroxidasa soluble que se encuentra en la mucosidad digestiva de ratas y cerdos que es secretada por el sistema inmune eosinófilo. El segundo tipo comprende una peroxidasa insoluble encontrada en las células de la mucosa gastrointestinal que se liberan únicamente en las lesiones. El segundo tipo de peroxidasa es básicamente el equivalente funcional a las peroxidasas involucradas en la formación de poliquinonas de la respuesta a la lesión de la planta y puede desencadenar actividad quinónica específicamente en el sitio en la proximidad directa de las células dañadas, vulnerables o infectadas mientras permanece pasivo al tejido sano.
Dicha composición estable de oxidante de polifenol de este tipo tiene efectos bioquímicos particularmente útiles sobre una lesión tisular o una membrana mucosa irritada del tracto digestivo, tracto respiratorio, tracto urinario, tracto reproductivo u otras interfaces mucosas dentro de animales superiores. La ingestión de la composición en solución líquida la suministrará pasivamente al sitio de las células dañadas y la infección en el que las enzimas oxidorreductasas catalizarán la actividad poliquinónica. Las poliquinonas entrecruzarán y condensarán proteínas celulares de células huésped dañadas en una barrera protectora. La unión no específica de alta afinidad a proteínas de superficie, enzimas, receptores y estructuras críticas para el metabolismo, la virulencia y la motilidad inmovilizan e inactivan un espectro muy amplio de patógenos. La aglomeración de patógenos también puede aumentar la antigenicidad potencial para
evocar respuestas inmunes del huésped.
En un aspecto de la presente divulgación, el efecto astringente fuerte pero localizado sobre el tejido afectado también puede reducir los exudados fluidos. Se sabe que la astringencia macroscópica no localizada de altas concentraciones de taninos y otros polifenoles en el sistema digestivo interfiere con las absorciones nutricionales y puede causar daños a la mucosa; mientras que la activación localizada en el objetivo de comportamiento quinónica minimiza estas preocupaciones.
En algunos aspectos de la divulgación, las composiciones comprenden un nuevo control microbiano bioactivo y sistemas protectores de tejidos. La mezcla del material bioactivo y los precursores de activación son catalizados por varias enzimas de células animales, vegetales o microbianas. Si la enzima activadora está asociada con el tejido de interés, tal como el tejido lesionado o infectado, la ingestión o aplicación de la composición no activada permitirá la etapa al tejido comprometido, incluso en las profundidades de un tracto corporal. La liberación de radicales oxidativos y la formación de material vegetal activado específicamente en el sitio en el tejido objetivo aumenta significativamente la biodisponibilidad y restringe la actividad mejorada a la proximidad inmediata de la fuente de la enzima para una interacción colateral reducida con otros tejidos.
En algunas de las realizaciones, el material bioactivo de origen vegetal puede ser polifenoles o cualquier biomolécula, polímeros sintéticos, agregados de moléculas pequeñas, fragmentos celulares o grupos de compuestos entrecruzados que comprenden una multiplicidad hasta decenas de miles de sitios de reacción expuestos.
Se pueden usar muchas plantas como una fuente económica de polifenoles apropiados. La hoja de Camellia sinensis es un ejemplo que puede ser una buena fuente de materia prima botánica debido a la disponibilidad común de fuentes cultivadas, la baja toxicidad natural documentada y el alto contenido de polifenoles solubles en agua. El grupo de polifenoles del flavonol (catequinas no oxidadas) constituye hasta el 30% del peso de la hoja seca de Camellia sinensis, lo que la convierte en una fuente económica. También se han producido composiciones astringentes antimicrobianas efectivas a partir de muchas especies y estructuras de plantas diferentes, incluyendo semillas de centeno, frijol mungo, piel de Daikon, cáscara de granada, gayuba, piel de aloe vera, cactus tubos de órgano, agallas de china, hojas de orégano, fruta de caqui, germen de trigo, semillas de cebada y granos de café, lo que demuestra la naturaleza ubicua de este mecanismo de defensa de las plantas en el reino vegetal.
En algunos aspectos, los métodos para extraer un sustrato de polifenol de materiales vegetales permiten una formulación, almacenamiento y suministro estables al tener extractos que contienen oxidorreductasas activas u otros agentes reductores sustancialmente libres. Algunos aspectos de la divulgación implican la desnaturalización térmica o por disolvente de las materias primas vegetales para obtener el componente biopolímero de la planta libre de enzimas activas oxidantes de polifenoles. La disponibilidad de suministro de materia prima y los diferentes tipos de tejidos vegetales pueden dictar posiblemente diferentes procesamientos. Por ejemplo, los materiales vegetales desecados o secos ya carecen de peróxido de hidrógeno y, por lo tanto, pueden sufrir procesos de desnaturalización enzimática después de la extracción de polifenoles.
Un ejemplo de un proceso eficiente para producir una fuente económica de materia prima de polifenoles libre de enzimas degradantes comprende desecar rápidamente hojas enteras de Camellia sinensis recién cosechadas en aire a alta temperatura para desnaturalizar las polifenol oxidasas que pueden causar la oxidación de los polifenoles de hojas verdes. Este proceso mantiene una composición muy cercana a las hojas de té vivas con la excepción de la pérdida de peróxido de hidrógeno, agua y algunos cambios enzimáticos que generalmente ocurren extremadamente rápido después de la cosecha. Las hojas se pulverizan para facilitar la manipulación y la eficiencia de extracción.
Por el contrario, el té negro se somete a un ejemplo de un proceso de fabricación alternativo. En el proceso de fabricación, las hojas de Camellia sinensis se trituran y sus estructuras celulares se rompen mientras aún contienen polifenol oxidasa activa. Esto inicia la oxidación aeróbica enzimática de las catequinas en quinonas que se condensan espontáneamente para formar compuestos volátiles. El material vegetal así procesado aún puede ser una fuente útil de polifenoles, pero el material vegetal tendrá un menor contenido de polifenoles y requerirá desnaturalización enzimática adicional al calentar el material vegetal o su extracto a una temperatura suficiente (preferiblemente 80 °C a 110 °C) para blanquear o desnaturalizar las enzimas. Un disolvente desnaturalizante de proteínas, como el etanol, puede usarse alternativamente en el proceso de extracción de material vegetal para destruir o eliminar enzimas celulares.
La mayoría de las plantas producen peróxido de hidrógeno como parte de las actividades biológicas de rutina, así como en respuesta al estrés. La concentración de H2O2 en el tejido vegetal varía enormemente según la especie, el tipo de tejido, el estrés ambiental y las estaciones. Se pierde o se consume en el procesamiento típico posterior a la cosecha y generalmente no es práctico capturarlo de fuentes naturales, especialmente dado el bajo costo de los oxidantes sintéticos equivalentes.
En algunas realizaciones, los métodos y composiciones de acuerdo con algunas realizaciones de la presente divulgación comprenden la adición exógena de peróxido de hidrógeno, que puede ser una fuente comercialmente práctica y estable de especies reactivas de oxígeno para la generación mejorada de subunidades quinónicas dentro de los polifenoles. Un experto en la materia también comprenderá que se pueden usar otras fuentes directas de especies reactivas de oxígeno para diversas aplicaciones, tales como ozono, peróxido de zinc, peroxidasas, peróxido
de carbamida, percarbonato de sodio, peróxido de calcio, peróxido de magnesio, perborato de sodio monohidratado, ozonida (O3-), superóxido (O2-), óxido (O2-), dioxigenilo (O2+) o una fuente o fuentes indirectas de especies reactivas de oxígeno, tales como oxígeno gaseoso, agua disociada, también se pueden utilizar ácidos grasos catalíticos descompuestos, glucosa y polifenoles.
En algunos aspectos, las realizaciones de la presente divulgación incluyen combinaciones de especies de oxígeno reactivo de alta concentración, tales como peróxido de hidrógeno, con un sustrato de polifenol para proporcionar un ambiente estabilizador que resista la difusión de moléculas de peróxido de hidrógeno lejos de la proximidad reactiva íntima a las subunidades de fenol. Las estructuras de polifenoles proporcionan muchas oportunidades de enlace no covalente y atraen carga a las moléculas de peróxido de hidrógeno. El peróxido de hidrógeno también es un producto de la autooxidación de polifenoles, ayudando a mantener el equilibrio macroscópico en solución. Los secuestros estables pueden proteger el peróxido de hidrógeno del calor, la exposición a los rayos ultravioleta, la reducción de contaminantes y la degradación espontánea.
La Figura 1 ilustra varias rutas de reacción para la conversión de la unidad de fenol 102 en quinonas 104 o semiquinonas 106 de acuerdo con una realización de la divulgación. Como se usa en el presente documento, "quinona" se refiere a todos los compuestos quinónicos, tales como quinonas y semiquinonas. El peróxido de hidrógeno 108 puede ser una fuente de especies reactivas de oxígeno para iniciar la oxidación, y también puede ser un producto de la oxidación de polifenoles. Por lo tanto, se puede establecer un equilibrio estable en una solución con polifenoles. Una vez iniciada, la fuente de especies reactivas de oxígeno (ROS) facilita la propagación eficiente de la generación de quinonas a través de sustratos de polifenol, incluso sin mediación enzimática directa. E1H2O2 concentrado en agua es, por lo tanto, un buen componente oxidante. Sin embargo, el peróxido de hidrógeno se puede lograr indirectamente a través de otras reacciones, tales como la descomposición de ozono, ácidos grasos o percarbonatos, por nombrar solo algunas de esas reacciones. Las oxidorreductasas celulares también pueden estar involucradas en la generación indirecta de las especies de oxígeno involucradas en el inicio o propagación de la cascada de reacción de oxidación. Por ejemplo, la catalasa que defiende las células animales y muchos patógenos del daño por ROS disociará e1H2O2 en agua y especies reactivas de oxígeno.
El peróxido de hidrógeno se produce naturalmente en las células vegetales y animales, pero su concentración puede variar enormemente dependiendo de la especie, la estación, el estrés y el tipo de tejido. Aunque ciertos tipos de plantas, como las suculentas, pueden almacenar cantidades significativas de peróxido de hidrógeno en sus tejidos, generalmente no es práctico extraerlo de fuentes vegetales debido a la presencia de enzimas reductoras segregadas del peróxido de hidrógeno y/o polifenoles solo por delicadas divisiones subcelulares que son inevitablemente violadas por procesos de extracción comerciales típicos. La mezcla desencadena la respuesta oxidativa de la lesión y consume rápidamente el peróxido de hidrógeno, dejando un exceso de polifenoles, enzimas y otros compuestos botánicos no involucrados.
Algunos aspectos de la presente divulgación incluyen el uso de una fuente de especies reactivas de oxígeno fabricadas o generadas por separado en combinación con el sustrato de polifenol sustancialmente libre de agentes reductores activos o enzimas.
En algunas realizaciones, las composiciones oxidantes de biopolímeros son soluciones acuosas. En realizaciones alternativas, fibras, hidrogeles, medios microporosos, micelas, emulsiones y otras estructuras encapsulan físicamente la composición oxidante de biopolímeros. En otras realizaciones más, las mezclas de polvos secos, gránulos u otros materiales que contienen polifenoles no líquidos combinados con un oxidante seco, tales como el percarbonato de potasio, se usan como un kit para hidratarse para producir una solución útil oxidante de polifenoles.
En algunas realizaciones, el catalizador se administra al sitio objetivo por separado como un líquido, aerosol o como un recubrimiento superficial en un aplicador, apósito o utensilio de limpieza. Un ejemplo de esto es una esponja absorbente infundida con un agente reductor, tal como la catalasa o el cobre, que causará la liberación rápida de radicales de oxígeno y la formación de quinonas cuando se pone en contacto con una composición oxidante de polifenoles. Esto puede usarse para generar una fuerte acción germicida, particularmente para destruir virus en superficies no biológicas o para desinfectar tejidos sanos en ausencia de enzimas catalizadoras expuestas. Por ejemplo, las envolturas virales generalmente no tienen enzimas, sino que están formadas por proteínas que pueden unirse mediante poliquinonas. Por lo tanto, se puede usar un catalizador o enzima administrado por separado para iniciar las reacciones virales/germicidas. En algunos aspectos de la divulgación, los compuestos poliquinónicos de acuerdo con las realizaciones comprenden utilidades tales como un floculante microbiano. Agregar estos compuestos poliquinónicos a una fuente de agua contaminada puede causar la agregación de los microorganismos en masas que precipitan o pueden filtrarse más fácilmente por medios mecánicos. La deposición de compuestos poliquinónicos en medios filtrantes mecánicos puede atrapar proteínas y microorganismos mientras imparte características germicidas. Esto se puede lograr aplicando una poliquinona activada a un medio filtrante o circulación de composiciones formadoras de poliquinona a través de un medio filtrante que tiene un aspecto catalítico en su superficie, tal como una biopelícula bacteriana. Esto puede encontrar aplicación en muchas aplicaciones de recirculación y filtración de una solo pasada.
La Figura 2 ilustra una composición 200 preparada de acuerdo con algunas realizaciones de la presente divulgación. La composición 200 contiene biopolímeros 202 que contienen moléculas 204 que contienen grupos hidroxilo. Las
moléculas 204 que contienen grupos hidroxilo se ilustran como polifenoles, pero pueden ser fenoles, polifenoles, polisacáridos o combinaciones de los mismos. En realizaciones alternativas, las moléculas 204 que contienen grupos hidroxilo son taninos, ligninas y flavonoides. Un experto en la materia apreciaría que los biopolímeros 202 pueden ser cualquier molécula de enlace corto (tales como 2 a 100 unidades repetitivas o 100 a 1000 unidades repetitivas), macromoléculas, moléculas de cadena larga, moléculas estructuradas en anillo, moléculas de apilamiento de electrones n y/o de apilamiento estructural. Además, los biopolímeros 202 también pueden ser cualquier sustancia que se pueda derivar u obtener de plantas o moléculas sintéticas artificiales. Además, los biopolímeros 202 pueden obtenerse a partir de combinaciones de plantas. Por ejemplo, el extracto de la planta A contiene una alta proporción de polifenoles y el extracto de la planta B contiene una alta proporción de polisacáridos. El biopolímero 202 puede obtenerse a partir de una mezcla de los extractos de la planta A y la planta B. En tal caso, el 70% del biopolímero 202 puede provenir de la planta A y el 30% del biopolímero 202 puede provenir de la planta B, por lo que la composición 200 puede tener propiedades químicas más cercanas al polifenol que a las propiedades químicas de los polisacáridos. Por lo tanto, las propiedades reactivas deseadas de la composición 200, tales como una reactividad y velocidad de reacción deseadas, pueden diseñarse usando diferentes combinaciones de las plantas A y B.
La composición 200 también puede contener un reactivo oxidante 206 y/o una enzima 208. En algunas realizaciones, el agente oxidante 206 comprende especies reactivas de oxígeno. En algunas realizaciones, el agente oxidante 206 proviene del peróxido de hidrógeno 210 disponible comercialmente, tal como > 60%, 20% - 60%, 35% y 8% - 20% de H2O2 en agua. En realizaciones alternativas, el agente oxidante 206 comprende 1-2% o menos del 10% de H2O2 en agua. En algunas realizaciones, el agente oxidante 206 proviene de una reacción de ozono 212, ácido graso 214 o percarbonato 216. En algunas realizaciones, el agente oxidante 206, tal como el peróxido de hidrógeno, es producido endógenamente por el biopolímero o las plantas. En realizaciones alternativas, el agente oxidante 206 se agrega exógenamente al sistema, tal como mediante la adición de peróxido de hidrógeno disponible comercialmente a una solución del biopolímero 202 y la enzima 208.
En algunas realizaciones, la enzima 208 se genera endógenamente o se agrega exógenamente. Por ejemplo, la enzima 208 utilizada para activar o facilitar la reacción es generada por los patógenos 230 en el tejido de un animal 218. Alternativamente, la enzima 218 se genera en las células/tejidos de los animales 218 y/o plantas 232. Además, la enzima se puede añadir a una solución que contiene el biopolímero 202 y el agente oxidante 206 antes de aplicar la composición 200 a un animal o una planta.
En algunas realizaciones, la molécula 204 que contiene el grupo hidroxilo forma compuestos quinónicos 234 y/o 246. El compuesto quinónico 234, 242, 244, 246, el grupo hidroxilo 236, 238, 240 y la molécula 204 que contiene el grupo hidroxilo pueden proporcionar interacciones, tales como fuerzas de enlace covalente, interacciones de enlace de hidrógeno o interacciones de apilamiento de electrones, para mantener las especies reactivas de oxígeno (ROS) localizadas en la proximidad del reactivo. Las especies reactivas de oxígeno pueden ser reactivos oxidantes.
La Figura 3 muestra la etapa 300 de un proceso para preparar una composición de origen vegetal de acuerdo con una realización de la presente divulgación. En la etapa 302, los agentes reductores activos o catalizadores se inactivan o eliminan. En la etapa 304, se extraen sustratos de polifenoles sustancialmente libres de agentes reductores activos o catalizadores. En la etapa 306, los sustratos de polifenol se mezclan con una fuente de especies reactivas de oxígeno y/o catalizadores para iniciar y propagar las reacciones de oxidación. Como se describió anteriormente, la fuente de especies reactivas de oxígeno, tales como el peróxido de hidrógeno, puede agregarse de manera exógena o generarse endógenamente mediante un extracto vegetal. De manera similar, los catalizadores para iniciar las reacciones de oxidación pueden agregarse de manera exógena o generarse endógenamente en un sitio aplicado, tal como un sitio infectado con patógeno o un área de tejido dañado. En la etapa 308, la mezcla se aplica a un sitio objetivo, tal como un área lesionada de un animal. El método 300 descrito anteriormente es una realización. Todos las etapas son opcionales y se pueden agregar etapas adicionales. La secuencia de las etapas puede ser en cualquier orden. Otras variaciones son aplicables. Por ejemplo, una solución, sustancialmente libre de catalizadores reductores y que contiene polifenoles extraídos de una planta, se mezcla con peróxido de hidrógeno. La solución se puede almacenar en un contenedor para un proceso de activación posterior. La solución se activa a través de un mecanismo de activación después de ser suministrada a un sitio de un animal infectado con un patógeno, que genera catalizadores para activar las reacciones. En otros ejemplos, una solución que contiene polifenol y peróxido de hidrógeno se activa mediante la adición exógena de catalizadores antes de la aplicación a un objetivo, tal como un sitio de un animal o una planta.
La Figura 4 muestra la etapa 400 de un proceso para inactivar agentes reductores/enzimas por disolvente de acuerdo con una realización de la divulgación. En la etapa 402, se eligen las plantas que se usan para elaborar la composición de origen vegetal. En la etapa 404, las composiciones de polifenoles se extraen de la planta usando una solución. En la etapa 406, la solución se calienta entre 80 °C y 110 °C para blanquear y desnaturalizar las enzimas. En la etapa 408, se usa un disolvente desnaturalizante de proteínas, tal como el etanol, para destruir o eliminar las enzimas celulares contenidas en la planta.
La Figura 5 muestra la etapa 500 de un proceso para inactivar agentes reductores/enzimas por calor de acuerdo con una realización de la divulgación. En la etapa 502, se elige la planta utilizada para elaborar la composición de origen vegetal. En la etapa 504, la polifenol oxidasa de la planta se desnaturaliza desecando rápidamente hojas enteras de Camellia sinensis en aire a alta temperatura. En la etapa 506, la enzima celular en agua se elimina y/o inactiva. En la
etapa 508, las hojas se pulverizan. En la etapa 510, se agrega solvente para extraer los polifenoles.
La Figura 6 ilustra algunas aplicaciones de la composición de origen vegetal de acuerdo con algunas realizaciones. Las aplicaciones incluyen suplementos nutricionales para animales, coagulación de tejidos animales, formación de barrera contra patógenos, reacciones desencadenantes de objetivos, adición exógena de enzima oxidativa para aplicaciones biocidas, secuestro de peróxido de hidrógeno, suministro temporizado, detención metabólica de patógenos, bebidas medicinales, antagonistas de los receptores, floculantes microbianos, conservación de sustancias biológicas, lavado antimicrobiano, aplicaciones agrícolas, saneamiento de agua de estanques, tratamientos de superficie de dispositivos médicos y vehículos de suministro de medicamentos, por nombrar solo algunas de esas aplicaciones.
Algunos modos de acción de acuerdo con las realizaciones incluyen la función de activación objetivo de una población densa de sitios de unión de alta afinidad y baja especificidad en un sustrato de biomolécula relativamente grande. En algunas realizaciones, se usa un extracto de planta completo. En algunas realizaciones, una mezcla de plantas se mezcla con diferentes especies fenólicas dominantes y pesos moleculares con afinidades de proteínas ligeramente diferentes, por lo que se puede facilitar el intervalo de actividad más amplio posible.
Normalmente, el concepto de diseño de fármacos de fármacos convencionales se ha centrado en interacciones moleculares altamente específicas. En comparación, algunas realizaciones de la divulgación usan actividad no selectiva que se hace altamente efectiva y segura mediante la activación específica del sitio. En algunas realizaciones de la presente divulgación, los complejos moleculares atraviesan el sistema digestivo en una solución de moléculas en base acuosa que mantienen los componentes reactivos múltiples necesarios secuestrados en proximidad reactiva directa entre sí a pesar de los gradientes de difusión en altos niveles de dilución. Esto mantiene una biodisponibilidad completa hasta que encuentra tejidos mucosos dañados o patógenos que presentan enzimas apropiadas para activar el complejo. La activación en el sitio cataliza una transformación altamente localizada del complejo molecular pasivo en un aglutinante de proteínas agresivo con cientos o miles de sitios activos potenciales, que son mucho más agresivos que los dos sitios de unión encontrados en los anticuerpos. Esta activación altamente específica del sitio y la naturaleza no absorbida del gran polímero "pegajoso" crea una acción potente y precisa que presenta un potencial sistémico adverso mínimo. Una acumulación de estos biopolímeros de plantas "pegajosos" se ancla firmemente al sitio objetivo y comienza a imitar la reacción inmune mecánica altamente eficiente que normalmente ocurriría en el sitio de una lesión de la planta.
En algunas realizaciones, los mecanismos en inmunología vegetal descritos anteriormente se aplican a animales. Los mecanismos incluyen (1) unión no específica a vías funcionales de infección de bacterias o levaduras, que pueden matar a las bacterias o levaduras al afectar su metabolismo y reproducción, (2) unión a toxinas (generalmente proteicas) presentes en el sitio y/o bloquea los patógenos de la expresión de más factores de virulencia enzimática, (3) inmoviliza y/o deteriora su motilidad o causa aglomeración que impide la propagación y desprendimiento, (4) efectos de entrecruzamiento de proteínas de células dañadas en una barrera física que reduce la exposición a más infección o irritación, (5) unión a receptores de señales inflamatorias que funcionan como antagonistas para una variedad de respuestas fisiológicas, (6) deshabilitar el mecanismo de penetración celular o atrapar virus y/o prevenir la propagación y la eliminación, y (7) efecto astringente y de barrera localizados para reducir la pérdida de líquido intersticial de los tejidos dañados.
En algunas realizaciones, las dosis efectivas son extremadamente pequeñas en comparación con los astringentes físicos utilizados en el método tradicional para detener la diarrea y se cree que son insuficientes para crear un efecto astringente físico que se haya asociado con daño intestinal o deterioro de la absorción nutricional asociado con el uso de taninos.
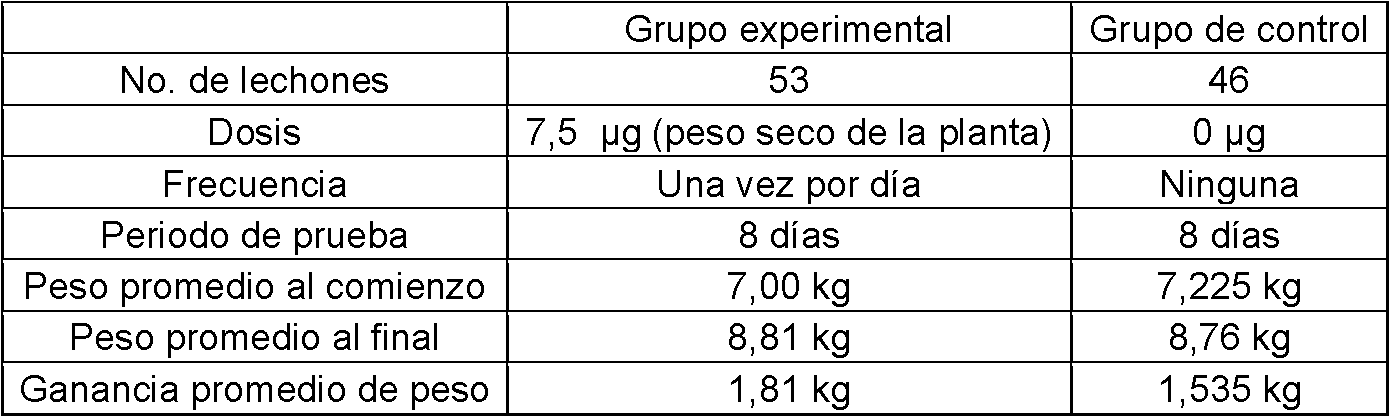
Se realizan algunos experimentos usando el complejo preparado de acuerdo con las realizaciones de la presente divulgación. La efectividad de los complejos está respaldada por la observación constante del crecimiento mejorado en cerdos tratados con los complejos elaborados de acuerdo con algunas de las realizaciones. La insensibilidad de los complejos a la dilución, la naturaleza pasiva en la mucosa sana y la actividad mínima en las bacterias no patógenas son algunos de los factores que permiten y hacen que el suministro acuoso a baja concentración sea preferible y más efectivo.
La mezcla preparada de acuerdo con algunas realizaciones de la presente divulgación puede ser útil en una lesión de tejido o una membrana mucosa irritada del tracto digestivo, tracto respiratorio, tracto urinario, tracto reproductivo u otra interfaz mucosa dentro de animales superiores. Estos tejidos y bacterias infecciosas pueden ser una fuente de enzimas oxidativas que catalizan la conversión del sustrato de polifenoles en su forma oxidada. En algunas realizaciones, la ingestión de la composición fenólica/oxidante descrita anteriormente puede dirigir y/o indirectamente convertir los polifenoles en un compuesto poliquinónico (u o-polifenol) a través de la conversión enzimática directa o la autooxidación de unidades hidroxilo con una enzima descompuesta con peróxido de hidrógeno. La molécula poliquinónica puede unirse covalentemente a las proteínas de las células de los tejidos dañados o a las proteínas de la superficie de los patógenos para inmovilizarlas, inactivarlas y/o condensarlas. Las proteínas unidas pueden formar una matriz protectora, que reduce la capacidad de colonización de los patógenos, proporciona un fuerte efecto astringente que contrae la lesión y reduce el exudado de líquidos. Las reacciones subyacentes pueden tomar diferentes vías, dependiendo de las enzimas específicas, la estructura y el tipo de la molécula de polifenol, la
concentración relativa del oxidante, el ambiente de dilución, etc. Un oxidante que no está directamente involucrado en la formación enzimática de unidades quinónicas puede liberar radicales oxidativos que dañan directamente las estructuras celulares de los patógenos. La explosión localizada de tales radicales cerca de los patógenos inmovilizados crea una acción germicida focalizada que es mucho más eficiente que la acción difusa de los germicidas en solución libre. El uso de más de un material vegetal como sustratos o combinaciones con plantas con actividad germicida conocida sin oxidación como constituyentes adicionales puede ser deseable para aumentar el espectro o la potencia de la actividad antimicrobiana.
En otras realizaciones, las enzimas oxidativas pueden administrarse al sitio de reacción por separado. Como ejemplo, una de las realizaciones contiene virus de lucha en ausencia de tejido infectado o bacterias al proporcionar una fuente de enzimas catalizadoras. Las envolturas virales generalmente no tienen las enzimas, pero están formadas por proteínas que pueden unirse a la macromolécula una vez convertidas en una poliquinona. El uso de tal poliquinona convertida previamente es aplicable en algunas realizaciones.
Algunas realizaciones de la presente divulgación pueden usarse en solución como un aditivo germicida. Puede ser desencadenada por las enzimas de microorganismos, tales como bacterias y hongos, en ausencia de otros tejidos vegetales o animales. La eficacia germicida en superficies o en solución puede mejorarse aún más mediante la adición de una enzima u otro catalizador a la superficie o solución a tratar o mediante la aplicación de las composiciones a una superficie, implemento o recipiente que se trata con una enzima o catalizador de activación.
Algunas realizaciones de la presente divulgación pueden usarse como un floculante microbiano, agregando los microorganismos en masas que precipitan o pueden filtrarse por medios mecánicos. La agregación de gérmenes y sus productos también puede aumentar la antigenicidad potencial para provocar respuestas inmunes. La actividad astringente puede ser citotóxica para los gérmenes como resultado de (1) entrecruzamiento que desactiva las proteínas y enzimas o receptores de la superficie de las células germinales, componentes de transducción de señales, funciones de absorción y transferencia nutricional y (2) reduce o deteriora la movilidad de los gérmenes y virus. Ambos tipos de acciones pueden deshabilitar la infectividad de los virus.
La prueba bactericida demostró que una cantidad de peróxido de hidrógeno que las bacterias pueden agotar en 16 horas puede usarse para matar completamente a todas las bacterias, sin ser consumido, cuando se usa una composición elaborada de acuerdo con las realizaciones de la presente divulgación. El material de origen vegetal que no experimentó reacciones de oxidación no mostró ningún efecto bactericida. Esto indicó que al menos parte del compuesto polifenólico soluble se convirtió en poliquinona. En un entorno in vivo, este efecto germicida de origen vegetal aumentará aún más si la cantidad de catalasa o peroxidasa no es tan limitada. Una planta de tabaco transformada con una peroxidasa aniónica de tabaco quimérico es capaz de producir una peroxidasa de alto nivel, que demostró que ser 7 veces más rápida en la cicatrización de lesiones que una planta de tabaco no transferida. La mayor eficiencia de la conversión de polifenol a quinona es más probable debido a la cantidad significativa de enzimas que a la cantidad de sustrato.
Algunos aspectos de la presente divulgación incluyen la capacidad de entrecruzamiento de proteínas. El tanino tiene una capacidad conocida de unión a proteínas. Sin embargo, la unión de la proteína de tanino se basa en enlaces de hidrógeno y la proteína de unión preferida es la proteína rica en prolina, generalmente en la saliva y el líquido mucoso del sistema digestivo. La prueba de entrecruzamiento y precipitación de proteínas demuestra que la albúmina de huevo formó una precipitación densa y completa en 10 minutos. La precipitación con plantas solo toma 3 días para recibir resultados similares. La muestra con solo el agente oxidante no tuvo ningún efecto de precipitación. Esto indica que las realizaciones de la presente divulgación tienen una capacidad y eficiencia de entrecruzamiento de proteínas mucho mayor.
Algunas de las realizaciones incluyen una mezcla de un germicida de origen vegetal y una composición y oxidante de entrecruzamiento de proteínas. La composición de entrecruzamiento de proteína y germicida de origen vegetal puede contener una planta que tiene compuestos fenólicos altos. El oxidante puede ser peróxido de hidrógeno. Algunos de los métodos que pueden usarse para fabricar tales composiciones se describen en la solicitud de patente de los Estados Unidos No. 12/317.638, presentada el 23 de diciembre de 2008 y titulada "MATERIALES Y SISTEMAS BIOCIDAS DE ORIGEN VEGETAL".
Algunas realizaciones de la presente divulgación se pueden aplicar a reacciones de oxidación-reducción y/o radicales de los compuestos fenólicos de plantas. Los compuestos fenólicos de la planta pueden incluir fenoles, polifenoles, hidroxicumarinas, flavonoides, alcaloides y cualquier otro componente con subunidades químicas similares a los monofenoles o difenoles para oxidar, reducir o entrecruzar otras moléculas en o sobre microorganismos, plantas y animales, generando así efectos antimicrobianos, efectos antivirales, efectos astringentes y efectos de curación de lesiones en diferentes organismos o tejidos objetivo. Los términos "quinona" y "poliquinona" usados en la presente divulgación incluyen cualquier monómero o polímero orgánico de configuraciones de anillo aromático con uno o más oxígenos de doble enlace.
Las composiciones y los métodos pueden utilizarse para facilitar la curación de la lesión en la piel o aplicarse al sistema digestivo para la curación de cualquier infección del sistema digestivo. Las composiciones y los métodos también se pueden utilizar en diversas aplicaciones ambientales específicas, tal como los usos in vitro e in vivo.
En algunas realizaciones, las aplicaciones de la presente divulgación incluyen antimicrobianos, antihelmínticos, antilaxantes/antidiarreicos, analgésicos, antiinflamatorios, ingredientes cosméticos, queratolíticos, oxidantes para procesos industriales, agentes quelantes de metales y adhesivos orgánicos. En realizaciones alternativas, los usos fisiológicos incluyen antisépticos, desinfectantes, virucidas, fungicidas, astringentes, adhesivos de tejidos, protectores de lesiones, prevención de biopelículas, antiinflamatorios, analgésicos, hemostasia, conservantes de productos, coagulantes, floculantes, enjuagues bucales, irrigantes, agentes desbridantes, tónicos gástricos, antidiarreicos, tratamientos para úlceras, agentes esclerotizantes, desinfectantes de agua, conservantes de agua, limpiadores oxidantes y desodorantes. En realizaciones alternativas, las aplicaciones incluyen hacer que los humanos o animales ingieran las composiciones para tratar o prevenir que los patógenos o moléculas patógenas infecten, dañen o sean absorbidos por los tejidos de sus sistemas digestivos. En otras realizaciones, las aplicaciones incluyen la prevención o el tratamiento de la diarrea animal a través de la reducción de las secreciones de fluidos por acción astringente, antiinflamatoria o antimicrobiana. En algunas realizaciones, las aplicaciones incluyen los tratamientos de erosiones por reflujo gástrico, úlceras pépticas u otras lesiones del sistema digestivo. En realizaciones alternativas, las aplicaciones incluyen los tratamientos de irritaciones o infecciones de la cavidad nasal o auditiva. En otras realizaciones, las aplicaciones incluyen aerosoles antimicrobianos en el tracto respiratorio para reducir los patógenos y también para proteger el revestimiento del tracto respiratorio de la invasión de los patógenos, tales como bacterias, virus y hongos. En algunas realizaciones, las aplicaciones incluyen aerosoles del tracto respiratorio y enjuagues sinusales para eliminar los alérgenos de contacto. En realizaciones alternativas, las aplicaciones incluyen enjuagues del tracto urinario para tratamientos antiinfecciosos o antiinflamatorios o enjuagues antisépticos de rutina para implantes del tracto urinario y pacientes de diálisis renal. En otras realizaciones, las aplicaciones incluyen preservación de órganos antisépticos para trasplante de órganos.
En algunas realizaciones, las aplicaciones incluyen un lavado antimicrobiano para infecciones por bacterias, virus y levaduras en piel normal o dañada, lesiones superficiales o en cualquier cavidad de la mucosa. En realizaciones alternativas, las aplicaciones incluyen adhesivos tisulares para la curación acelerada, el cierre o la hemostasia de incisiones o lesiones quirúrgicas. En otras realizaciones, las aplicaciones incluyen tratamientos de incisiones quirúrgicas o lesiones tópicas para la reducción de cicatrices. En algunas realizaciones, las aplicaciones incluyen tratamiento de primeros auxilios para cortes tópicos, quemaduras o abrasiones. En realizaciones alternativas, las aplicaciones incluyen ungüentos antisépticos, enjuagues de ungüentos o irrigantes para el tratamiento de la úlcera de la mucosa oral y procedimientos dentales. En otras realizaciones, las aplicaciones incluyen tratamientos de periodontitis y tratamientos de dientes sensibles, tales como sellado de microgrietas de dientes. En algunas realizaciones, las aplicaciones incluyen enjuagues orales para halitosis. En realizaciones alternativas, las aplicaciones incluyen inmersiones para dermatitis, tiña inguinal, infecciones vaginales y pie de atleta. En otras realizaciones, las aplicaciones incluyen, tratamientos antimicrobianos y curativos de quemaduras, lesiones crónicas y úlceras. En algunas realizaciones, las aplicaciones incluyen la prevención o reducción de la formación de biopelículas en tejidos o superficies.
En realizaciones alternativas, las aplicaciones incluyen aplicaciones agrícolas. Por ejemplo, el patógeno superficial puede reducirse y las micro lesiones pueden sellarse rociando o remojando la planta con la composición oxidante de polifenol. Además, la salud general de las plantas se puede mejorar fortaleciendo la estructura de la superficie o estimulando un mayor crecimiento o desarrollo mediante las reacciones de entrecruzamiento.
En otras realizaciones, las aplicaciones incluyen aerosoles o atomizadores líquidos de la composición como desinfectante de bioseguridad para instalaciones de granja de animales. En algunas realizaciones, las aplicaciones incluyen esterilización de alimentos para animales. En realizaciones alternativas, las aplicaciones incluyen aditivos para alimentos o agua para la conservación y prevención de la transmisión de enfermedades. En otras realizaciones, las aplicaciones incluyen lavados de plantas, frutas frescas y vegetales. El rociado o enjuague de una solución que contiene la composición descrita en el presente documento puede matar o suprimir las bacterias de la superficie, extender la vida útil y proteger la superficie o parar la invasión de plagas en cultivos vivos o productos agrícolas. En algunas realizaciones, las aplicaciones incluyen desinfección de semillas de plantas para almacenamiento y saneamiento antes de la germinación. En realizaciones alternativas, las aplicaciones incluyen atomización de conservación o tratamiento de agua para flores recién cortadas. En otras realizaciones, las aplicaciones incluyen adhesivo tisular para injerto de plantas y remediación de aguas subterráneas.
En algunas realizaciones, las aplicaciones incluyen atomización de conservación de carne y mariscos para reducir las bacterias y formar finas capas antidigestivas para evitar una invasión microbiana. Las realizaciones alternativas incluyen desinfectantes de procesamiento de carne para la prevención de la contaminación microbiana. En realizaciones alternativas, las aplicaciones incluyen saneamiento de agua de estanques para pesquerías, tales como peces, camarones, ostras, abulón y mejillones. En otras realizaciones, las aplicaciones incluyen el tratamiento de enfermedades para plantas y animales acuáticos. En algunas realizaciones, las aplicaciones incluyen desinfectantes para acuarios, aditivos conservantes para productos que contienen líquidos, ingredientes desinfectantes para limpiadores de superficies, recubrimientos cíclicos REDOX de quinona para dispositivos médicos, vestimenta y equipos de preparación de alimentos, desinfección de instrumentos y entornos hospitalarios, soluciones de hidratación antimicrobiana para dispositivos médicos con recubrimiento hidrofílico y tratamientos orgánicos anticorrosivos para metales.
En realizaciones alternativas, las aplicaciones incluyen choque industrial de agua, conservantes o desincrustantes. En
otras realizaciones, las aplicaciones incluyen saneamiento de agua de piscinas y bañeras de hidromasaje. En algunas realizaciones, las aplicaciones incluyen vehículos para compuestos terapéuticos de molécula pequeña. En realizaciones alternativas, las aplicaciones incluyen estabilizadores para oxidantes, modificación de sabores de alimentos e inyección en tumores y quistes.
En algunas realizaciones, las composiciones pueden estar en forma de polvo seco. La composición se puede alimentar a un animal en forma de polvo seco o en combinación con al menos un fluido. Las composiciones en forma seca pueden contener polifenoles o moléculas poliméricas, especies reactivas de oxígeno, catalizadores o una combinación de los mismos. Las especies reactivas de oxígeno pueden contener percarbonato de sodio, percarbonato de potasio y/o cualquier otra sustancia que sea capaz de activar el polifenol y/o las moléculas poliméricas. Las especies reactivas de oxígeno, el material que contiene polifenol o moléculas poliméricas, un catalizador o una combinación de los mismos pueden alimentarse a los animales al mismo tiempo o por separado.
En algunas realizaciones, el término "polifenoles" usado en el presente documento contiene más de una unidad de fenol o bloque de construcción por molécula. En realizaciones alternativas, el término "polifenoles" contiene una unidad de fenol por molécula. En otras realizaciones, el término "polifenoles" incluye taninos hidrolizables (ésteres de ácido gálico de glucosa y otros azúcares) y fenilpropanoides, tales como ligninas, flavonoides y taninos condensados.
En algunas realizaciones, el peróxido de hidrógeno añadido a una solución que contiene polifenol es del 1% al 2%. En realizaciones alternativas, el peróxido de hidrógeno añadido a una solución que contiene polifenol es inferior al 10%. Una persona experta en la materia apreciaría que puede aplicarse cualquier concentración de peróxido de hidrógeno siempre que la concentración de peróxido de hidrógeno no sea demasiado alta para reaccionar de forma exagerada con los polifenoles en la solución. Las reacciones de reacción exagerada incluyen proporcionar una concentración de peróxido de hidrógeno, lo que hace que los polifenoles activados no puedan realizar las funciones descritas en la presente divulgación.
En algunas realizaciones, el término "fluido" usado en el presente documento incluye líquido, gas, fluido supercrítico, una forma de sustancia sólida móvil, o una combinación de los mismos. En algunas realizaciones, el término "patógeno" incluye cualquier agente infeccioso, gérmenes, bacterias, virus o una combinación de los mismos. En algunas realizaciones, el término "patógeno" incluye cualquier sustancia biológica que potencialmente pueda causar enfermedad, dolencia, daño, perjuicio o impacto negativo a un huésped, tal como un animal u otra sustancia biológica. En algunas realizaciones, el término "biopolímero" incluye cualquier sustancia que pueda derivarse u obtenerse de una planta, un animal o sustancias biológicas. En realizaciones alternativas, el término "biopolímero" incluye cualquier molécula polimérica producida por un organismo biológico, tal como una planta viva. Además, el término "biopolímero" puede incluir celulosa y almidón, proteínas y péptidos, y ADN y ARN. En algunas realizaciones, el término "biopolímero" incluye unidades plurales de azúcares, aminoácidos y nucleótidos. En algunas realizaciones, el término "afinidad de unión" incluye cualquier interacción y/o unión intermolecular o intramolecular. Por ejemplo, enlaces covalentes, enlaces iónicos, enlaces de hidrógeno, momentos dipolares, momentos dipolares inducidos y fuerzas electrostáticas. En algunas realizaciones, el término "proximidad reactiva" se refiere a cualquier interacción que existe entre dos o más moléculas/átomos, de modo que las dos o más moléculas no se mueven libremente al azar en una solución.
En algunas realizaciones, el término "efecto en la inactivación de un patógeno" descrito en este documento incluye bloquear el acceso de los patógenos a tejidos animales/vegetales, sofocar las rutas metabólicas de los patógenos, unir factores virales, inmovilizar/agregar los patógenos y/o realizar daños oxidativos a los patógenos. En algunas realizaciones, las fuentes de especies reactivas de oxígeno y/o peróxido de hidrógeno pueden obtenerse de fuentes naturales y artificiales, tales como aloe fresco y/o cilantro. En algunas realizaciones, el polifenol activado incluye opolifenol, polifenol oxidado, polifenona y poliquinona.
El término "fluido de proceso" puede incluir un fluido que se procesa artificialmente y/o biológicamente. El término "procesado biológicamente" puede referirse a que una composición añadida es procesada por una sustancia biológica, tal como un animal. El término "procesado artificialmente" puede incluir filtración, desecación, aislamiento, extracción o cualquier otro proceso de fabricación o laboratorio químico/biológico. Por ejemplo, el término "fluido de proceso" puede incluir la situación de que una forma de sustancias en polvo seco se alimenta a animales y que tiene un fluido de los animales o fluido agregado para disolver o dispersar el polvo seco, formando así un fluido procesado. El polvo seco puede contener polifenoles y especies reactivas de oxígeno, tales como el percarbonato de sodio y el percarbonato de potasio, para alimentar a los animales. Alternativamente, el polvo seco puede contener principalmente polifenoles. La especie reactiva de oxígeno puede alimentarse al animal en forma líquida junto o por separado con el polvo seco. En otra realización alternativa, la forma de polvo seco puede contener principalmente especies reactivas de oxígeno. Los polifenoles o grupos hidroxilo que contienen moléculas pueden ser alimentados a los animales en forma líquida juntos o por separado con el polvo seco.
Los siguientes experimentos muestran la efectividad de las composiciones preparadas de acuerdo con algunas de las realizaciones de la presente divulgación.
Experimento 1
Se prepararon tres muestras de albúmina de suero bovino (BSA) en polvo purificado en solución acuosa. La muestra # 1 contenía BSA únicamente. La muestra # 2 contenía BSA y polifenol oxidasa. La muestra # 3 contenía BSA, polifenol oxidasa y peróxido de hidrógeno. Cada muestra mostró turbidez similar en estado estacionario después de 30 minutos, medida por un espectrofotómetro. Se añadió una solución acuosa de polifenoles (tanino) de agallas de china a cada una de las muestras. Después de una hora, la muestra # 1 mostró pocos cambios visibles. La muestra # 2 exhibió un aumento en la turbidez debido al aumento del tamaño de partícula, lo que indica una coagulación de proteína menor. La muestra # 3 exhibió un fuerte precipitado en el fondo del tubo de ensayo y una falta de turbidez, lo que demuestra que se puede lograr un aumento sustancial en la coagulación de proteínas mediante la reacción enzimática de los polifenoles con una fuente de especies reactivas de oxígeno.
Experimento 2
Se añadió una solución de agallas de china y peróxido de hidrógeno a (1) un tubo que contenía clara de huevo de gallina en polvo (los procesos de desecación utilizados en la fabricación de enzimas desnaturalizantes de clara de huevo en polvo) reconstituido en agua y (2) un tubo que contenía albúmina de huevo de gallina fresco en agua. Se observó una precipitación mucho mayor en la muestra de albúmina de huevo de gallina fresco, lo que demuestra que los polifenoles de las plantas pueden ser catalizados por enzimas de origen animal para aumentar la unión a las proteínas de manera consistente con la formación de quinona exhibida en las lesiones de las plantas.
Experimento 3
La formulación A se preparó usando el método descrito a continuación. Se preparó un gramo de polvo de té verde comercial en 1 litro de agua desionizada en un vaso de precipitados Pyrex de 1 litro y se dejó extraer a temperatura ambiente durante 6 horas. Se añadió peróxido de hidrógeno al 35% de calidad alimentaria a la solución y se dejó reposar durante 4 horas, luego se filtró a través de un medio o filtro de malla de 2 micras. La solución madre resultante se diluyó 1000:1, 200:1 y 100:1 con agua de Mohm. Se añadieron 15 mL de soluciones diluidas a soluciones de cultivo en partes iguales que contenían 107 cultivos de E. coli de cepa silvestre (controles de agua) y se dejaron incubar a 37 °C. A las 2 h, 4 h, 6 h y 8 h, se inundó una muestra de cada serie de pruebas en placas de agar y se incubó, y se realizaron recuentos manuales de colonias. La muestra 100:1 alcanzó el 100% de muerte a las 4 h, la 200:1 logró el 100% de muerte a las 6 h, y la 1000:1 fue solo bacteriostática. Esto demuestra la viabilidad de fabricar una composición de origen botánico con altas capacidades germicidas con una materia prima y un aporte de energía excepcionalmente bajos.
Experimento 4
Se añadió un cultivo de cepa silvestre de E-coli a tres muestras. La muestra A contenía 25 ppm de peróxido de hidrógeno en agua. La muestra B contenía una solución de Formulación A diluida a una fracción equivalente de 25 ppm de peróxido de hidrógeno. La muestra C contenía una solución que tenía un extracto de té verde de la misma concentración de Formulación A pero sin peróxido de hidrógeno. La población de bacterias en el peróxido de hidrógeno (la muestra A) se redujo inicialmente, pero comenzó a exhibir una mayor turbidez visual después de 16 horas, lo que indica el agotamiento de la capacidad antimicrobiana. El extracto de té verde solo (la muestra C) exhibió poca actividad antimicrobiana notable. La formulación A (la muestra B) continuó matando las bacterias y no mostró rebote después de 3 días, lo que indica un 100% de muerte y/o una mayor eficacia antimicrobiana, lo que demuestra un rendimiento germicida significativamente mejorado como resultado de la combinación de extracto de té verde y peróxido de hidrógeno.
Experimento 5
La muestra # 2 era una solución preparada previamente usando la formulación A anterior, que se diluyó para duplicar la misma concentración de polifenoles que la muestra # 1 preparada previamente. En la muestra # 3, se combinaron polifenol y peróxido de hidrógeno diluido para lograr la misma relación de polifenol a peróxido de hidrógeno que en la muestra # 2. Se prepararon diluciones en serie de cada muestra y se dejaron reposar durante 24 horas. Se añadió a cada muestra una solución que contenía 105/mL de cepa silvestre de E coli, que luego se incubó y se sembró en placas de agar para el conteo visual de colonias. Las soluciones de oxidante de polifenoles previamente preparadas de la muestra # 2 continuaron matando bacterias de manera efectiva a concentraciones significativamente más bajas que en las diluciones de la muestra # 3, lo que demuestra el rendimiento mejorado a bajas concentraciones cuando se produce una composición oxidante de sustrato de polifenol a una concentración alta (en ausencia de oxidorreductasas activas u otros agentes reductores) antes de la dilución, apoyando el concepto de secuestro de fuerza intermolecular para mejorar la estabilidad.
Experimento 6
El siguiente es un método para preparar la formulación B y una demostración de un proceso de extracción de sustrato de polifenol. Se usan 30 gramos de corteza de granada seca, que se secó a 150 °C durante 1 hora, se molió hasta polvo fino y se combinó con 10 litros de agua desionizada calentada a 80 °C durante 20 minutos, luego se enfrió a temperatura ambiente durante 2 horas. Se añadió peróxido de hidrógeno al 35% de calidad alimentaria y se dejó reposar durante 6 horas, y luego se filtró a través de un medio de 5 micras. La solución de peróxido de hidrógeno agregada tenía menos del 10% en solución después de agregarla en la solución para evitar una reacción exagerada
con los polifenoles. Se añadieron diluciones en agua en serie de la solución resultante a 107-108 cultivos de bacterias en medio líquido. La solución resultante se incubó durante 24 horas y se observó visualmente la turbidez. Como se muestra en la Tabla 1, la turbidez (+ turbia, - no turbia) indica bacterias viables.
Tabla 1
Experimento 7
La aplicación de una dilución 200:1 de la formulación A a heridas de lanceta simétricas bilaterales en ratones de laboratorio demostró el cierre de las heridas en aproximadamente un tercio de las heridas tratadas con un control de solución salina o ungüento antibiótico.
Experimento 8
Se aplicó una almohadilla de algodón empapada en una dilución 200:1 de la formulación A a la mucosa oral inflamada durante 10 minutos. De tres voluntarios, todos experimentaron una reducción significativa en el dolor y la hinchazón en una hora. La infección se resolvió por completo en dos, demostrando potencial antiinflamatorio y antiinfeccioso en el tejido mucoso.
Experimento 9
Diez voluntarios humanos con síntomas actuales y anteriores de diarrea frecuente o crónica recibieron 5 mL de dilución 40:1 de la Formulación B en 250 mL de agua durante 5 días. Nueve expresaron una reducción significativa en el malestar y los síntomas durante 1 semana o más.
Experimento 10
Se introdujeron 0,5 mL de dilución 100:1 de la Formulación A y la Formulación B en un pozo perforado en una placa de agar con infusión de sangre de oveja que se inoculó en la superficie con E. coli. El perímetro del pozo formó rápidamente un área opaca de proteínas sanguíneas entrecruzadas que eran refractarias a la penetración del complejo p P-O y no mostraban zona de supresión bacteriana alrededor del pozo. En comparación, el agar con nutrientes mínimos sin proteínas sanguíneas mostró una zona de supresión significativa indicativa de difusión de PP-O a través del medio, lo que demuestra la baja penetración en el tejido de las composiciones que soportan un potencial de toxicidad reducido.
Ejemplo 11
Los cerdos híbridos Landrace asiáticos de raza pura de 5 días de edad en una granja comercial se dividieron en 13 sujetos de prueba y 3 sujetos de control, todos alimentados con cantidades y tipos idénticos de alimento desde el nacimiento hasta los 3 meses. Los sujetos de prueba recibieron 5 microgramos (equivalente de peso seco de la planta) de Formulación A cada tercer día en agua de alimentación y la misma dosis diariamente si se observaba diarrea. Los controles recibieron inyecciones de antibióticos para tratar la diarrea. A los 21 días, el grupo de prueba encontró menos diarrea y en promedio fueron 1,0 kg más pesados que los controles. A los 3 meses, el peso promedio de los sujetos de prueba fue entre un 25 y un 30% mayor que el de los controles con base en la medida de la circunferencia, lo que demuestra la viabilidad de la Formulación A como alternativa a los antibióticos tal como un profiláctico y promotor del crecimiento.
Experimento 12
Se rastreó y evaluó el crecimiento de 99 lechones Landrace de pura raza. Los lechones se alimentaron con una composición oxidante de polifenol de la Formulación B en un sustituto de leche porcina. Los lechones de 21 días tienden a estar estresados por la transición ambiental y tienen una mayor incidencia de diarrea durante aproximadamente una semana. El grupo experimental mostró un aumento de peso promedio 18% mayor durante este período que el grupo de control, lo que demuestra el valor comercial en la optimización del crecimiento y la
compatibilidad con el sustituto de leche.
Tabla 2
Experimento 13
La seguridad toxicológica se probó usando 10 cerdos Landrace de pura raza libre de patógenos específicos, de 23 días de edad. A los cerdos se les administró una dosis diaria de 250 |jg o una dosis de 2500 |jg durante 45 días. Se monitorearon la hematología y el crecimiento y se realizó la histología, que no mostró ningún efecto negativo sobre los tejidos u órganos.
Experimento 14
Se dividieron 50 lechones de partida destetados en 5 grupos y cada uno recibió una dosis de 12 jg una vez cada tercer día durante 5 semanas. El análisis estadístico muestra un aumento de peso superior en los grupos experimentales. Los experimentos anteriores son evidencia de los usos efectivos de las composiciones oxidantes de polifenol en el control de patógenos y muestran un valor medible en numerosas aplicaciones comerciales y médicamente útiles. Aunque los experimentos demuestran beneficios directos de promoción del crecimiento en la producción animal agrícola, se sabe que el uso de cerdos tiene similitudes fisiológicas e inmunológicas cercanas con los humanos y se usan comúnmente como predictores de rendimiento y seguridad en humanos. Por lo tanto, los efectos potenciales pueden ser proyectados y reivindicados para los humanos. Esto se ve respaldado por la experiencia directa en la eliminación rápida de molestias digestivas ocasionales y diarrea de causas no específicas. Se ha observado que dosis únicas que varían de 20 jg a 250 jg (peso seco equivalente) son efectivas para resolver la diarrea en humanos, con alivio sintomático típicamente notado dentro de una hora.
Producción
Algunas de las realizaciones se han producido de acuerdo con los métodos descritos en este documento. El proceso de fabricación puede utilizar materiales y procedimientos de producción orgánica utilizando materiales grado alimenticio aprobados por el Programa Nacional Orgánico (NOP) y generalmente reconocidos como seguros (GRAS). El proceso de fabricación se puede llevar a cabo en un laboratorio de sala limpia según las Buenas Prácticas de Fabricación (GMP).
Algunos métodos de producción incluyen proceso previo botánico, desnaturalización y extracción de proteínas, secuestro intramolecular de reactivos en complejo fenólico metaestable, procesamiento posterior y dilución y formulación con ingredientes adicionales.
El proceso divulgado en este documento es aplicable a una amplia gama de especies de plantas y tipos de tejidos debido a la naturaleza ubicua de la química de interés. Las fuentes de planta se pueden elegir en función de la disponibilidad de fuentes de cultivo, contenido de fracción clave y componentes secundarios que pueden potencialmente impartir efectos característicos deseables o indeseables, tales como toxicidad y autodegradación.
La fabricación de la composición divulgada en el presente documento puede incorporar varios métodos de control de calidad estandarizados que miden directamente el contenido del sustrato, la potencia del iniciador, el rendimiento microbiológico y la capacidad de unión molecular. La fabricación de la composición se había probado a temperatura ambiente durante más de un año. El resultado muestra pruebas de estabilidad aceleradas con muestras retenidas. Se ha determinado que el umbral de dilución de estabilidad microbiológica del compuesto es superior al que hace que sea autoconservante.
Algunas de las realizaciones se han producido con éxito a partir de una variedad de diferentes bases vegetales. Se obtienen resultados preferidos cuando se usan plantas alimenticias no controvertidas y bien caracterizadas con una larga historia de uso en medicinas complementarias y alternativas. Un experto en la materia apreciaría que muchas plantas, tejidos vegetales o combinaciones se pueden utilizar para hacer diferentes formulaciones para diferentes mercados, siempre y cuando el mecanismo de trabajo sea funcional, estructural, química, biológica o físicamente equivalente a las realizaciones descritas en el presente documento.
La presente divulgación se ha descrito en términos de realizaciones específicas que incorporan detalles para facilitar la comprensión de los principios de construcción y operación de la divulgación.
Claims (18)
1. Una composición oxidante de polifenol para uso en terapia antimicrobiana, comprendiendo la composición: a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y
b. una especie reactiva de oxígeno exógeno que incluye peróxido de hidrógeno; y
en la que la composición está sustancialmente libre de agentes reductores activos y enzimas.
2. La composición para uso de la reivindicación 1, en la que el peróxido de hidrógeno es secuestrado por el extracto para estabilizar y concentrar especies reactivas de oxígeno cerca de unidades fenólicas en la composición.
3. La composición para uso de la reivindicación 1 o la reivindicación 2, en la que el tejido vegetal comprende un componente seleccionado del grupo que consiste en semillas de centeno, frijol mungo, piel de Daikon, granada, gayuba, piel de aloe vera, cactus tubos de órgano, agallas de china, orégano, fruta de caqui, germen de trigo, semillas de cebada, granos de café, té verde, té negro, granada, tabaco, una planta suculenta y tejidos vegetales externos, raíces, hojas, cutículas de hojas, cortezas, frutas, piel y cáscaras de los mismos.
4. La composición para uso de la reivindicación 1, en la que la planta comprende Camellia sinensis, granada, o una combinación de las mismas.
5. La composición para uso de la reivindicación 1, en la que el extracto comprende un polifenol seleccionado del grupo que consiste en lignina, flavonoide, hidroxicumarina y alcaloides.
6. La composición para el uso de cualquiera de las reivindicaciones 1 a 5 en el tratamiento de una infección o daño al sistema digestivo; tratar, prevenir o mejorar los síntomas de la diarrea; tratar o prevenir enfermedades asociadas con agentes patógenos transmitidos por el agua; tratar un tejido infectado; o tratar un tejido herido.
7. Uso de una composición oxidante de polifenol que comprende:
a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y
b. un peróxido de hidrógeno exógeno; y
en la que la composición está sustancialmente libre de agentes reductores activos y enzimas, en la fabricación de un medicamento para tratar una infección microbiana.
8. La composición para el uso de cualquiera de las reivindicaciones 1 a 6 o el uso de la reivindicación 7, en la que la composición está en forma de polvo seco.
9. Un kit que comprende una forma seca de la composición para el uso de cualquiera de las reivindicaciones 1 a 6.
10. El kit de la reivindicación 9, en el que la forma seca del material generador de peróxido de hidrógeno comprende un componente seleccionado del grupo que consiste en percarbonato de sodio, percarbonato de potasio, un peróxido de carbamida y peróxido de urea.
11. Un método para producir la composición oxidante de polifenol para el uso de cualquiera de las reivindicaciones 1 a 6, en el que el método comprende:
obtener un tejido vegetal;
inactivar o eliminar agentes reductores activos y catalizadores del tejido vegetal;
extraer sustratos de polifenol del tejido vegetal que están sustancialmente libres de agentes reductores activos y catalizadores; y
mezclar los sustratos de polifenol con peróxido de hidrógeno exógeno.
12. El método de la reivindicación 11, en el que los polifenoles se extraen del tejido vegetal usando una solución.
13. El método de la reivindicación 11 o la reivindicación 12, en el que la inactivación o eliminación de agentes reductores activos o catalizadores del tejido vegetal comprende:
desecar el tejido vegetal en aire a alta temperatura;
calentar la solución de polifenoles extraídos del tejido vegetal para desnaturalizar las enzimas; y/o
utilizar una solución desnaturalizante de proteínas para destruir o eliminar las enzimas celulares contenidas en el tejido vegetal.
14. El método de la reivindicación 13, en el que se pulveriza tejido vegetal desecado.
15. Un uso no terapéutico de una composición como antimicrobiano, en el que la composición comprende:
a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y b. una especie reactiva de oxígeno exógeno que incluye peróxido de hidrógeno; y
en la que la composición está sustancialmente libre de agentes reductores activos y enzimas.
16. El uso no terapéutico de la reivindicación 15, en el que la composición se usa como o para un ingrediente cosmético; un desinfectante; un conservante de biopelícula; un conservante de producto; un limpiador oxidante; un desodorante; un enjuague bucal para halitosis; una aplicación agrícola tal como la reducción de patógenos superficiales o el sellado de micro lesiones al rociar o remojar la planta con la composición, fortalecer la estructura de la superficie y estimular un mayor crecimiento o desarrollo; un desinfectante de bioseguridad para instalaciones de granjas de animales; esterilización de alimentos para animales; lavado de plantas, frutas y verduras frescas; extender la vida útil; proteger la superficie o evitar la invasión de plagas en cultivos vivos o productos agrícolas; desinfección de semillas de plantas para almacenamiento y saneamiento antes de la germinación; atomizador de preservación o tratamiento de agua para flores recién cortadas; remediación de aguas subterráneas; atomizador de preservación de carnes y mariscos para reducir las bacterias y formar finas capas antidigestivas para evitar una invasión microbiana; desinfectantes para procesamiento de carne para la prevención de la contaminación microbiana; desinfección del agua de estanques para la pesca; tratamiento de enfermedades para plantas acuáticas; desinfectantes para acuarios; aditivos conservantes para productos que contienen líquidos; ingredientes desinfectantes para limpiadores de superficies; revestimientos cíclicos redox de quinona para dispositivos médicos, ropa y equipos de preparación de alimentos, equipos hospitalarios y desinfección de instrumentos; soluciones hidratantes antimicrobianas para dispositivos médicos con recubrimiento hidrofílico; conservantes o antiincrustantes industriales de choque de agua; o bañera de hidromasaje y saneamiento de agua de piscina.
17. Uso de una composición para estimular el crecimiento en animales, en la que la composición comprende:
a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y b. una especie reactiva de oxígeno exógeno que incluye peróxido de hidrógeno; y
en la que la composición está sustancialmente libre de agentes reductores activos y enzimas.
18. Un método para estimular el crecimiento en animales, comprendiendo el método administrar una composición al animal, en el que la composición comprende:
a. un extracto soluble en agua de un tejido vegetal que contiene polifenoles que incluye un tanino; y
b. una especie reactiva de oxígeno exógeno que incluye peróxido de hidrógeno; y
en el que la composición está sustancialmente libre de agentes reductores activos y enzimas.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US20926009P | 2009-03-04 | 2009-03-04 | |
| PCT/US2010/025805 WO2010101844A1 (en) | 2009-03-04 | 2010-03-01 | Method and material for site activated complexing of biologic molecules |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2791485T3 true ES2791485T3 (es) | 2020-11-04 |
Family
ID=42709967
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES10749160T Active ES2791485T3 (es) | 2009-03-04 | 2010-03-01 | Método y material para complejación en el sitio activo de moléculas biológicas |
Country Status (23)
| Country | Link |
|---|---|
| US (7) | US8343552B2 (es) |
| EP (1) | EP2403938B1 (es) |
| JP (3) | JP2012519690A (es) |
| KR (1) | KR101790352B1 (es) |
| CN (1) | CN102421891B (es) |
| AU (1) | AU2010221579B2 (es) |
| BR (1) | BRPI1006287A2 (es) |
| CA (1) | CA2754226C (es) |
| DK (1) | DK2403938T3 (es) |
| ES (1) | ES2791485T3 (es) |
| HK (1) | HK1164916A1 (es) |
| HR (1) | HRP20200392T1 (es) |
| HU (1) | HUE049150T2 (es) |
| IL (2) | IL214951A (es) |
| MX (1) | MX344857B (es) |
| MY (1) | MY172676A (es) |
| PH (2) | PH12015502712B1 (es) |
| PL (1) | PL2403938T3 (es) |
| RU (1) | RU2571924C2 (es) |
| SG (3) | SG10201502453SA (es) |
| TW (2) | TW201634053A (es) |
| WO (1) | WO2010101844A1 (es) |
| ZA (1) | ZA201106974B (es) |
Families Citing this family (28)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8734867B2 (en) * | 2007-12-28 | 2014-05-27 | Liveleaf, Inc. | Antibacterial having an extract of pomegranate combined with hydrogen peroxide |
| SG10201502453SA (en) | 2009-03-04 | 2015-05-28 | Liveleaf Inc | Method and material for site activated complexing of biologic molecules |
| US9192635B2 (en) | 2011-06-24 | 2015-11-24 | Liveleaf, Inc. | Method of treating damaged mucosal or gastrointestinal tissue by administering a composition comprising a mixture of pomegranate and green tea extracts and releasably bound hydrogen peroxide |
| US8722040B2 (en) * | 2011-06-24 | 2014-05-13 | Liveleaf, Inc. | Site-activated binding systems that selectively increase the bioactivity of phenolic compounds at target sites |
| CN103155953A (zh) * | 2011-12-19 | 2013-06-19 | 陕西恒田化工有限公司 | 一种石榴皮多酚植物杀菌剂、用途以及制备方法 |
| US20150328258A1 (en) * | 2012-05-30 | 2015-11-19 | Ibh Ventures, Llc | Polyphenol-reactive oxygen species compositions and methods |
| US9526754B1 (en) * | 2012-11-26 | 2016-12-27 | Manuel Serrano | Plant polyphenols extraction and activation thereof |
| US8716351B1 (en) | 2012-12-23 | 2014-05-06 | Liveleaf, Inc. | Methods of treating gastrointestinal spasms |
| CN104936587A (zh) * | 2012-12-26 | 2015-09-23 | 株式会社Az | 创伤愈合促进剂 |
| GB2535666B (en) | 2014-04-30 | 2017-03-29 | Matoke Holdings Ltd | Antimicrobial compositions |
| US20170112877A1 (en) * | 2014-06-13 | 2017-04-27 | Alexander L. Huang | Non-toxic agent for a broad-spectrum, bactericidal or bacteriostatic treatment of antibiotic-resistant bacteria in animals |
| US10945974B2 (en) | 2015-06-01 | 2021-03-16 | Xeno Biosciences Inc. | Methods and compositions to modulate the gut microbiota and to manage weight |
| US11311573B2 (en) | 2016-11-30 | 2022-04-26 | Xeno Biosciences Inc. | Pharmaceutical preparations and methods to manage weight and to modulate the gut microbiota |
| CN107094996B (zh) * | 2017-04-24 | 2020-07-24 | 浙江省农业科学院 | 一种含石榴皮复合植物提取物及其制备方法和应用 |
| CN107114562B (zh) * | 2017-04-24 | 2020-08-14 | 浙江省农业科学院 | 一种抗炎兼具抑菌和抗氧化功能的复合型植物水提物及其制备方法和应用 |
| US20200352184A1 (en) * | 2017-08-17 | 2020-11-12 | Apeel Technology, Inc. | Prevention of Postharvest Physiological Deterioration using Sulfur-Donating Compounds |
| GB201716986D0 (en) | 2017-10-16 | 2017-11-29 | Matoke Holdings Ltd | Antimicrobial compositions |
| IT201800004842A1 (it) * | 2018-04-24 | 2019-10-24 | Sistema di cottura | |
| CN108822184A (zh) * | 2018-04-25 | 2018-11-16 | 浙江工业大学 | 一种蛋白功能改性的方法 |
| CN109251865B (zh) * | 2018-09-30 | 2021-06-15 | 哈尔滨工业大学 | 一种小球藻细胞表面耗氧保护层的制备方法 |
| CN109297916B (zh) * | 2018-11-20 | 2021-03-30 | 中国农业科学院农产品加工研究所 | 分析多酚化合物氧化产物的人工神经网络及预测方法 |
| CN109699954A (zh) * | 2019-03-08 | 2019-05-03 | 合浦果香园食品有限公司 | 一种制备海参水果馅料的方法 |
| JP7381251B2 (ja) | 2019-08-23 | 2023-11-15 | セッツ株式会社 | 抗ノロウイルス剤、消毒剤及び洗浄剤 |
| CN111713510B (zh) * | 2020-06-08 | 2021-11-23 | 西北农林科技大学 | 五倍子提取物用于制备植物源诱抗剂的应用及诱抗剂 |
| CN111777979A (zh) * | 2020-07-16 | 2020-10-16 | 江苏明天胶业有限公司 | 一种高强度耐候型改性硅烷密封胶及其制备工艺 |
| WO2022016131A1 (en) * | 2020-07-17 | 2022-01-20 | Scientlce, Llc | Anti-fouling and foul-releasing compositions and methods of making and using same |
| WO2022223736A1 (en) | 2021-04-23 | 2022-10-27 | Aurena Laboratories Holding Ab | Transition metal oxide adducts for regulated generation of reactive oxygen species |
| NL2029251B1 (nl) | 2021-09-24 | 2023-03-31 | Cindro Holding B V | Gestabiliseerd waterstofperoxide |
Family Cites Families (114)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB191400001A (en) * | 1913-01-10 | 1915-05-20 | Loche & Cie Soc | Improvements in or relating to Brooms or the like. |
| US1844018A (en) | 1929-04-18 | 1932-02-09 | Mead Res Engineering Company | Method of preparing tanning substances |
| DE530650C (de) | 1930-12-09 | 1931-07-31 | Hoffmann La Roche & Co Akt Ges | Verfahren zur Herstellung von Protocatechualdehyd und seinen Substitutionsprodukten |
| US1965458A (en) | 1932-05-18 | 1934-07-03 | Hoffmann La Roche | Process for the manufacture of aromatic hydroxy aldehydes |
| US3484248A (en) * | 1967-07-03 | 1969-12-16 | Lipton Inc Thomas J | Alkaline conversion of green tea using hydrogen peroxide |
| GB1204585A (en) * | 1968-01-23 | 1970-09-09 | Tenco Brooke Bond Ltd | Improvements in or relating to the fermentation of tea |
| US3817835A (en) | 1969-03-26 | 1974-06-18 | Squibb & Sons Inc | Process for the production of antimicrobial agents |
| US3692904A (en) | 1970-05-25 | 1972-09-19 | Daiichi Seiyaku Co | Method for treating scours in domestic livestock |
| US3824184A (en) | 1970-09-04 | 1974-07-16 | Economics Lab | Slime control in industrial waters |
| GB1377396A (en) * | 1971-04-26 | 1974-12-18 | Unilever Ltd | Instant tea powder |
| IT986371B (it) | 1972-06-02 | 1975-01-30 | Degussa | Procedimento per la produzione di percarbonato alcalino |
| US3860694A (en) | 1972-08-31 | 1975-01-14 | Du Pont | Process for the preparation of perhydrates |
| JPS5429599B2 (es) | 1974-12-28 | 1979-09-25 | ||
| SE7601543L (sv) | 1975-02-21 | 1976-08-23 | Snam Progetti | Forfarande for extrahering av fenoler och oligosackarider ur vegetabiliskt material |
| US4171280A (en) | 1977-11-03 | 1979-10-16 | The Clorox Company | Powder percarbonate bleach and formation thereof |
| US4171281A (en) * | 1978-02-03 | 1979-10-16 | Bystrenin Mikhail N | Graphitization and reducing charge |
| US4514334A (en) | 1979-05-31 | 1985-04-30 | General Electric Company | Polyphenolic compounds |
| FR2486523A1 (fr) | 1980-07-11 | 1982-01-15 | Rhone Poulenc Ind | Procede de preparation de polyphenols comportant eventuellement un groupement aldehyde |
| US4623465A (en) | 1981-04-20 | 1986-11-18 | Massachusetts Institute Of Technology | Removal of combined organic substances from aqueous solutions |
| US4472302A (en) | 1983-03-09 | 1984-09-18 | Merck & Co., Inc. | Heat shock process for the isolation of bacterial protein |
| US4472602A (en) | 1983-08-11 | 1984-09-18 | At&T Technologies, Inc. | Telephone set with transducer/ringer |
| US5141611A (en) | 1985-05-16 | 1992-08-25 | Memtec Limited | Removing and recovering plant polyphenols |
| US4829001A (en) | 1985-11-08 | 1989-05-09 | Minnesota Mining And Manufacturing Company | Enzymatic neutralization of hydrogen peroxide |
| US4647952A (en) | 1985-11-13 | 1987-03-03 | The Mead Corporation | Phenolic developer resins |
| GB8528307D0 (en) * | 1985-11-18 | 1985-12-24 | Beecham Group Plc | Veterinary compositions |
| US4696757A (en) | 1986-06-16 | 1987-09-29 | American Home Products Corporation | Stable hydrogen peroxide gels |
| US5296376A (en) | 1986-11-04 | 1994-03-22 | Imperial Chemical Industries Plc | DNA, constructs, cells and plants derived therefrom |
| US4966762A (en) | 1988-10-06 | 1990-10-30 | Fmc Corporation | Process for manufacturing a soda ash peroxygen carrier |
| US5231193A (en) | 1989-03-29 | 1993-07-27 | Kikkoman Corporation | Process for producing ellagic acid |
| JPH0791302B2 (ja) | 1989-03-29 | 1995-10-04 | キッコーマン株式会社 | エラグ酸の製造法 |
| US5389369A (en) | 1991-02-21 | 1995-02-14 | Exoxemis, Inc. | Halo peroxidase containing compositions for killing yeast and sporular microorganisms |
| US5756090A (en) | 1991-02-21 | 1998-05-26 | Eoe, Inc. | Oxygen activatable formulations for disinfection or sterilization |
| US5208010A (en) | 1991-06-17 | 1993-05-04 | Dental Concepts Inc. | Tooth whitening dentifrice |
| CN1079393A (zh) * | 1992-06-05 | 1993-12-15 | 郭干举 | 治疗慢性胃炎复方五倍子成药方法 |
| US5260021A (en) * | 1992-06-29 | 1993-11-09 | Allergan, Inc. | Hydrogen peroxide-containing gels and contact lens disinfecting using same |
| WO1994003607A1 (en) | 1992-07-30 | 1994-02-17 | Keygene N.V. | Dna constructs, cells and plants derived therefrom |
| DK144392D0 (da) | 1992-12-01 | 1992-12-01 | Novo Nordisk As | Aktivering af enzymer |
| US5328706A (en) | 1993-04-29 | 1994-07-12 | Endico Felix W | Food manufacturing process utilizing hydrogen peroxide for microbial control |
| US6068862A (en) | 1993-06-30 | 2000-05-30 | Taiyo Kagaku Co., Ltd. | Tea-derived feed additive and animal feed containing the same |
| US5653746A (en) | 1994-03-08 | 1997-08-05 | Meadox Medicals, Inc. | Radially expandable tubular prosthesis |
| US5661170A (en) | 1994-03-21 | 1997-08-26 | Woodward Laboratories, Inc. | Antimicrobial compositions and methods for using the same |
| US5614501A (en) | 1994-07-21 | 1997-03-25 | The University Of Montana | Compositions and methods for animal husbandry and for treating gastrointestinal disorders |
| TW449485B (en) | 1995-03-31 | 2001-08-11 | Colgate Palmolive Co | Skin care products containing anti itching/anti irritant agents |
| US5824414A (en) | 1995-04-28 | 1998-10-20 | Mitsui Chemicals, Inc. | Preparation of spherical polyphenol particles |
| US7048906B2 (en) * | 1995-05-17 | 2006-05-23 | Cedars-Sinai Medical Center | Methods of diagnosing and treating small intestinal bacterial overgrowth (SIBO) and SIBO-related conditions |
| US5839369A (en) | 1995-10-20 | 1998-11-24 | Eastman Kodak Company | Method of controlled laser imaging of zirconia alloy ceramic lithographic member to provide localized melting in exposed areas |
| US6063428A (en) | 1996-02-26 | 2000-05-16 | The Procter & Gamble Company | Green tea extract subjected to cation exchange treatment and nanofiltration to improve clarity and color |
| JP3320307B2 (ja) | 1996-06-06 | 2002-09-03 | 株式会社エス・ディー・エス バイオテック | フェノール性化合物等の高分子化方法及びその利用 |
| US6642277B1 (en) | 1996-09-20 | 2003-11-04 | The Howard Foundation | Food supplements containing polyphenols |
| KR100467532B1 (ko) | 1996-10-16 | 2005-01-24 | 피에스 팔마큐티칼스 인코퍼레이션 | 프로안토시아니딘 중합체로 된 항-설사 장용피 조제물 |
| US6436342B1 (en) | 1996-11-13 | 2002-08-20 | The Procter & Gamble Company | Sprayable disinfecting compositions and processes for disinfecting surfaces therewith |
| CA2270339A1 (en) | 1996-11-25 | 1998-06-04 | Unilever Plc | Enzymatic oxidation process |
| US5891440A (en) | 1996-12-31 | 1999-04-06 | Lansky; Ephraim Philip | Phytoestrogen supplement prepared from pomegranate seeds and a herbal mixture or coconut milk |
| JPH1143696A (ja) * | 1997-07-29 | 1999-02-16 | Saito Shigeru | 緑茶入り洗浄料 |
| GB9721139D0 (en) | 1997-10-07 | 1997-12-03 | Glaxo Group Ltd | Medicaments |
| JP4137224B2 (ja) | 1998-03-31 | 2008-08-20 | 天野エンザイム株式会社 | 酵素による蛋白質の架橋法 |
| JP4357624B2 (ja) * | 1998-04-01 | 2009-11-04 | 大正製薬株式会社 | 殺菌剤および消化酵素を配合した組成物 |
| US6071541A (en) * | 1998-07-31 | 2000-06-06 | Murad; Howard | Pharmaceutical compositions and methods for managing skin conditions |
| WO2000020406A1 (en) | 1998-10-06 | 2000-04-13 | Research Development Foundation | ANTIBACTERIAL AND ANTIFUNGAL FLAVANONES FROM $i(EYSENHARDTIA TEXANA) |
| US20030078212A1 (en) | 1998-10-30 | 2003-04-24 | Jia-He Li | Pharmaceutical compositions containing poly(adp-ribose) glycohydrolase inhibitors and methods of using the same |
| US6630163B1 (en) | 1999-04-22 | 2003-10-07 | Howard Murad | Method of treating dermatological disorders with fruit extracts |
| US7297344B1 (en) | 1999-05-27 | 2007-11-20 | Euro-Celtique, S.A. | Preparations for the promotion of wound healing in the upper respiratory tract and/or ear |
| US7504251B2 (en) | 1999-06-03 | 2009-03-17 | Biobalance Llc | Bacterial strain, processed plant extracts, compositions containing same, processes for their preparation and their therapeutic and industrial applications |
| GB9918028D0 (en) | 1999-07-30 | 1999-09-29 | Unilever Plc | Skin care composition |
| US6716805B1 (en) * | 1999-09-27 | 2004-04-06 | The Procter & Gamble Company | Hard surface cleaning compositions, premoistened wipes, methods of use, and articles comprising said compositions or wipes and instructions for use resulting in easier cleaning and maintenance, improved surface appearance and/or hygiene under stress conditions such as no-rinse |
| KR100366608B1 (ko) | 2000-02-15 | 2003-01-09 | 마스터진(주) | 형질전환 식물체로부터 생산된 재조합 인간 파필로마바이러스 백신 |
| US20020034553A1 (en) * | 2000-09-19 | 2002-03-21 | Janice Zayas | Skin healing, conditioning and enhancing lotion |
| EP1322167B1 (en) * | 2000-09-29 | 2006-11-02 | The Procter & Gamble Company | Allergen neutralization compositions |
| PL203187B1 (pl) * | 2001-01-16 | 2009-09-30 | Unilever Nv | Doustna kompozycja zawierajaca kwas pikolinowy i cząstki nadtlenkowe oraz jej zastosowanie |
| US7381427B2 (en) | 2001-02-09 | 2008-06-03 | Mickey Miller | Seborrheic keratosis treatment |
| JP4382295B2 (ja) * | 2001-02-15 | 2009-12-09 | 森永乳業株式会社 | ウレアーゼ不活性化組成物及び飲食品 |
| US20030044474A1 (en) | 2001-08-03 | 2003-03-06 | Shaklee Corporation | High molecular weight, lipophilic, orally ingestible bioactive agents in formulations having improved bioavailability |
| EP1312412B1 (en) * | 2001-11-20 | 2013-03-13 | Mitsubishi Gas Chemical Company, Inc. | Process for producing hydrogen-containing gas |
| ATE327310T1 (de) * | 2002-02-28 | 2006-06-15 | Unilever Nv | Flüssige reinigungsmittel |
| US20030228379A1 (en) * | 2002-05-28 | 2003-12-11 | Wenyuan Shi | Herbs and herbal combinations useful for the treatment of microbial infections |
| US20040001665A1 (en) | 2002-07-01 | 2004-01-01 | Majd Zoorob | Optical device |
| US6911196B2 (en) * | 2002-07-31 | 2005-06-28 | Samir I. Hamtini | Topical medicament for treating nappy rash |
| AU2003293082A1 (en) * | 2002-11-27 | 2004-06-23 | Tufts University | Antioxidant-functionalized polymers |
| KR100505819B1 (ko) * | 2002-12-23 | 2005-08-03 | (주)오비티 | 식물의 흰가루병 방제제 |
| US20040228831A1 (en) | 2003-05-15 | 2004-11-18 | Belinka Benjamin A. | Polymeric conjugates for tissue activated drug delivery |
| KR20050028755A (ko) * | 2003-09-19 | 2005-03-23 | 한국염색기술연구소 | 오배자로부터 천연항균제를 추출하는 방법 |
| EP1703800B1 (en) * | 2004-01-16 | 2008-02-20 | Unilever Plc | Process for the manufacture of a tea product and products obtained thereby |
| ZA200605708B (en) * | 2004-01-16 | 2008-01-30 | Unilever Plc | Process for the manufacture of a tea product and products obtained thereby |
| US7744555B2 (en) * | 2004-02-06 | 2010-06-29 | Depuy Spine, Inc. | Implant having a photocatalytic unit |
| JP5411405B2 (ja) | 2004-03-16 | 2014-02-12 | コンビ株式会社 | 家畜・家禽用下痢抑制剤 |
| EP1740196B1 (en) | 2004-03-23 | 2015-08-26 | Lifeline Nutraceuticals Corporation | Compositions and method for alleviating inflammation and oxidative stress in a mammal |
| US20070178055A1 (en) * | 2004-04-01 | 2007-08-02 | Buch Robert M | Dissolvable tooth whitening strip |
| US20060024385A1 (en) | 2004-07-27 | 2006-02-02 | Pedersen Mark A | Metabolic capacity enhancing compositions and methods for use in a mammal |
| US20060024339A1 (en) * | 2004-07-29 | 2006-02-02 | Howard Murad | Methods of managing the redness associated with a dermatological condition |
| JP4798973B2 (ja) * | 2004-08-04 | 2011-10-19 | 丸善製薬株式会社 | 抗菌用組成物 |
| WO2006038893A1 (en) | 2004-10-06 | 2006-04-13 | Agency For Science, Technology And Research | Oxidation of phenolic compound with hydrogen peroxide generated in the presence of the phenolic compound |
| JP2006182727A (ja) * | 2004-12-28 | 2006-07-13 | Kao Corp | 酸化染毛剤 |
| US20060165812A1 (en) * | 2005-01-21 | 2006-07-27 | Amershire Investment Corporation | Method and topical formulation for treating headaches |
| AR057325A1 (es) * | 2005-05-25 | 2007-11-28 | Progenics Pharm Inc | Sintesis de (s)-n-metilnaltrexona, composiciones farmaceuticas y usos |
| BRPI0610243A2 (pt) | 2005-05-27 | 2010-06-08 | Univ Central Florida Res Found | vacina produzida de planta contra amebìase |
| WO2007003068A1 (fr) | 2005-06-30 | 2007-01-11 | Hangzhou Lixin Biotechnology Co. Ltd. | Additif pour nourriture, procédé de préparation de celui-ci et application de celui-ci |
| RU2319494C2 (ru) * | 2005-11-11 | 2008-03-20 | РАНХЕЛЬ Хосе Анхель ОЛАЛДЕ | Синергетическая композиция растительного происхождения (варианты), способ лечения заболеваний с ее использованием |
| WO2007058935A2 (en) | 2005-11-14 | 2007-05-24 | Bausch & Lomb Incorporated | Ophthalmic composition for dry eye therapy |
| WO2007079331A2 (en) | 2005-12-13 | 2007-07-12 | Richard Paul Bonfiglio | Antibacterial oral rinse formulation for preventing coronary artery disease |
| US20090093440A1 (en) * | 2005-12-20 | 2009-04-09 | Howard Murad | Fragranced Therapeutic Delivery System |
| WO2007090096A2 (en) * | 2006-01-27 | 2007-08-09 | Rdx Technologies, Inc. | Electrochemical methods for redox control to preserve, stabilize and activate compounds |
| WO2007117352A2 (en) * | 2006-02-08 | 2007-10-18 | Howard Murad | Topical therapeutic delivery system |
| CA2650022C (en) | 2006-05-01 | 2017-05-16 | Barry Quart | Method for treatment of constipation-predominant irritable bowel syndrome |
| JP4892727B2 (ja) * | 2006-09-21 | 2012-03-07 | 国立大学法人 鹿児島大学 | 高分子タンニンの酵素的架橋反応 |
| CN1939468B (zh) * | 2006-09-27 | 2010-04-14 | 西南大学 | 复方五倍子渔用抗菌剂配方 |
| JP2008143808A (ja) * | 2006-12-07 | 2008-06-26 | Airomin Seiyaku Kk | 高濃度のコロイド状の有機ヨウ素を含有する液体製剤及びその製造方法 |
| WO2008079898A1 (en) * | 2006-12-20 | 2008-07-03 | Pharmwest, Inc. | Methods and topical formulations comprising colloidal metal for treating or preventing skin conditions |
| KR100870138B1 (ko) * | 2007-05-15 | 2008-11-24 | 한국식품연구원 | 삶은 나물의 신선도 유지를 위한 천연항균제 및 동천연항균제를 포함하는 삶은 나물 용기 |
| ES2550481T3 (es) | 2007-08-16 | 2015-11-10 | The University Of Chicago | Resistencia a patógenos de plantas |
| CN101260129A (zh) * | 2008-04-12 | 2008-09-10 | 竹山县天新医药化工有限责任公司 | 一种单宁酸的提纯方法 |
| WO2010018418A1 (en) | 2008-08-12 | 2010-02-18 | Novatech D.O.O. | Formulation based on micronized clinoptilolite as therapeutic agent providing highly bioavailable silicon |
| SG10201502453SA (en) | 2009-03-04 | 2015-05-28 | Liveleaf Inc | Method and material for site activated complexing of biologic molecules |
| US8722040B2 (en) * | 2011-06-24 | 2014-05-13 | Liveleaf, Inc. | Site-activated binding systems that selectively increase the bioactivity of phenolic compounds at target sites |
| US8716351B1 (en) * | 2012-12-23 | 2014-05-06 | Liveleaf, Inc. | Methods of treating gastrointestinal spasms |
-
2010
- 2010-03-01 SG SG10201502453SA patent/SG10201502453SA/en unknown
- 2010-03-01 HU HUE10749160A patent/HUE049150T2/hu unknown
- 2010-03-01 MY MYPI2011004116A patent/MY172676A/en unknown
- 2010-03-01 US US12/715,270 patent/US8343552B2/en active Active
- 2010-03-01 AU AU2010221579A patent/AU2010221579B2/en active Active
- 2010-03-01 WO PCT/US2010/025805 patent/WO2010101844A1/en active Application Filing
- 2010-03-01 DK DK10749160.7T patent/DK2403938T3/da active
- 2010-03-01 EP EP10749160.7A patent/EP2403938B1/en active Active
- 2010-03-01 MX MX2011009242A patent/MX344857B/es active IP Right Grant
- 2010-03-01 SG SG2011062767A patent/SG173905A1/en unknown
- 2010-03-01 SG SG10201503255SA patent/SG10201503255SA/en unknown
- 2010-03-01 ES ES10749160T patent/ES2791485T3/es active Active
- 2010-03-01 CA CA2754226A patent/CA2754226C/en active Active
- 2010-03-01 PL PL10749160T patent/PL2403938T3/pl unknown
- 2010-03-01 JP JP2011553012A patent/JP2012519690A/ja active Pending
- 2010-03-01 KR KR1020117023149A patent/KR101790352B1/ko active IP Right Grant
- 2010-03-01 CN CN201080019845.5A patent/CN102421891B/zh active Active
- 2010-03-01 BR BRPI1006287-4A patent/BRPI1006287A2/pt not_active Application Discontinuation
- 2010-03-01 RU RU2011138328/10A patent/RU2571924C2/ru active
- 2010-03-03 TW TW105118724A patent/TW201634053A/zh unknown
- 2010-03-03 TW TW099106177A patent/TWI632856B/zh active
-
2011
- 2011-09-04 IL IL214951A patent/IL214951A/en active IP Right Grant
- 2011-09-23 ZA ZA2011/06974A patent/ZA201106974B/en unknown
-
2012
- 2012-05-03 HK HK12104309.4A patent/HK1164916A1/xx unknown
- 2012-11-16 US US13/680,007 patent/US8586110B2/en active Active
-
2013
- 2013-09-15 US US14/027,228 patent/US20140072660A1/en not_active Abandoned
- 2013-09-15 US US14/027,235 patent/US20140072655A1/en not_active Abandoned
-
2014
- 2014-02-12 US US14/178,459 patent/US20140161902A1/en not_active Abandoned
-
2015
- 2015-07-24 JP JP2015146637A patent/JP6047207B2/ja active Active
- 2015-12-04 PH PH12015502712A patent/PH12015502712B1/en unknown
-
2016
- 2016-05-22 IL IL245765A patent/IL245765A0/en unknown
- 2016-11-18 JP JP2016225240A patent/JP2017061529A/ja active Pending
-
2017
- 2017-10-27 PH PH12017501978A patent/PH12017501978A1/en unknown
-
2018
- 2018-01-23 US US15/878,239 patent/US20190000909A1/en not_active Abandoned
-
2020
- 2020-03-04 US US16/809,076 patent/US20210038674A1/en not_active Abandoned
- 2020-03-10 HR HRP20200392TT patent/HRP20200392T1/hr unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2791485T3 (es) | Método y material para complejación en el sitio activo de moléculas biológicas | |
| US20230321142A1 (en) | Methods of treating gastric infections, gastroenteritis, and wounds | |
| JP7462868B2 (ja) | 乳酸菌生産物質含有組成物、エクオール生成方法および乳酸菌生産物質含有組成物の製造方法 | |
| Wieczynska et al. | Antimicrobial activity, cytotoxicity and total phenolic content of different extracts of propolis from the west Pomeranian region in Poland | |
| KR20190042151A (ko) | 천연물 항진균 식품조성물 | |
| CN114028546A (zh) | 复合多肽杀菌制剂及其制备方法和用途 | |
| US20230149496A1 (en) | Blocking a pathogen from expressing a virulence factor | |
| CN113015432B (zh) | 包含硫酸化半乳糖的组合物及其实施方式 | |
| CN104430617A (zh) | 中药消毒剂 | |
| RU2285434C2 (ru) | Способ получения биологически активного препарата для животных на основе каллизии душистой | |
| CN111803418A (zh) | 一种抗病毒组合物及其在儿童日用品中的应用 | |
| Taraszkiewicz et al. | Inno� ati� e� trategies to�� ercome� io� lm� esistance | |
| KR20190046438A (ko) | 만성 치주질환 개선 식품조성물 |