DE69828330T2 - Aktiviertes Protein C Formulierungen - Google Patents
Aktiviertes Protein C Formulierungen Download PDFInfo
- Publication number
- DE69828330T2 DE69828330T2 DE69828330T DE69828330T DE69828330T2 DE 69828330 T2 DE69828330 T2 DE 69828330T2 DE 69828330 T DE69828330 T DE 69828330T DE 69828330 T DE69828330 T DE 69828330T DE 69828330 T2 DE69828330 T2 DE 69828330T2
- Authority
- DE
- Germany
- Prior art keywords
- formulation according
- formulation
- activated protein
- apc
- sucrose
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000000203 mixture Substances 0.000 title claims description 77
- 238000009472 formulation Methods 0.000 title claims description 70
- 101800004937 Protein C Proteins 0.000 title claims description 52
- 101800001700 Saposin-D Proteins 0.000 title claims description 50
- 229960000856 protein c Drugs 0.000 title claims description 50
- 102100036546 Salivary acidic proline-rich phosphoprotein 1/2 Human genes 0.000 title claims 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 83
- 239000011780 sodium chloride Substances 0.000 claims description 42
- 239000000945 filler Substances 0.000 claims description 39
- 229930006000 Sucrose Natural products 0.000 claims description 31
- 239000005720 sucrose Substances 0.000 claims description 31
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims description 30
- 150000003839 salts Chemical class 0.000 claims description 23
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 claims description 13
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 claims description 13
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 claims description 13
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 claims description 12
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 claims description 12
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 claims description 12
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims description 11
- 229930195725 Mannitol Natural products 0.000 claims description 11
- 239000012931 lyophilized formulation Substances 0.000 claims description 11
- 239000000594 mannitol Substances 0.000 claims description 11
- 235000010355 mannitol Nutrition 0.000 claims description 11
- 230000015271 coagulation Effects 0.000 claims description 7
- 238000005345 coagulation Methods 0.000 claims description 7
- 239000001509 sodium citrate Substances 0.000 claims description 7
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 claims description 7
- PIEPQKCYPFFYMG-UHFFFAOYSA-N tris acetate Chemical compound CC(O)=O.OCC(N)(CO)CO PIEPQKCYPFFYMG-UHFFFAOYSA-N 0.000 claims description 7
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 claims description 5
- 239000007853 buffer solution Substances 0.000 claims description 5
- 201000010099 disease Diseases 0.000 claims description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 4
- 230000002093 peripheral effect Effects 0.000 claims description 4
- 239000001488 sodium phosphate Substances 0.000 claims description 4
- 229910000162 sodium phosphate Inorganic materials 0.000 claims description 4
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims description 4
- 239000002552 dosage form Substances 0.000 claims description 3
- 206010003178 Arterial thrombosis Diseases 0.000 claims description 2
- 206010051055 Deep vein thrombosis Diseases 0.000 claims description 2
- 208000010378 Pulmonary Embolism Diseases 0.000 claims description 2
- 206010047249 Venous thrombosis Diseases 0.000 claims description 2
- 230000001154 acute effect Effects 0.000 claims description 2
- 206010000891 acute myocardial infarction Diseases 0.000 claims description 2
- 210000001367 artery Anatomy 0.000 claims description 2
- 239000001103 potassium chloride Substances 0.000 claims description 2
- 235000011164 potassium chloride Nutrition 0.000 claims description 2
- 206010043647 Thrombotic Stroke Diseases 0.000 claims 2
- 208000009190 disseminated intravascular coagulation Diseases 0.000 claims 1
- 102000017975 Protein C Human genes 0.000 description 45
- 239000000243 solution Substances 0.000 description 32
- 238000000034 method Methods 0.000 description 18
- 238000004108 freeze drying Methods 0.000 description 17
- 239000000872 buffer Substances 0.000 description 14
- 238000007710 freezing Methods 0.000 description 14
- 230000008014 freezing Effects 0.000 description 14
- 101500025568 Homo sapiens Saposin-D Proteins 0.000 description 13
- 239000007983 Tris buffer Substances 0.000 description 13
- 229940100689 human protein c Drugs 0.000 description 13
- 108090000623 proteins and genes Proteins 0.000 description 13
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 13
- VEVRNHHLCPGNDU-MUGJNUQGSA-O desmosine Chemical compound OC(=O)[C@@H](N)CCCC[N+]1=CC(CC[C@H](N)C(O)=O)=C(CCC[C@H](N)C(O)=O)C(CC[C@H](N)C(O)=O)=C1 VEVRNHHLCPGNDU-MUGJNUQGSA-O 0.000 description 12
- 235000018102 proteins Nutrition 0.000 description 12
- 102000004169 proteins and genes Human genes 0.000 description 12
- 108090000190 Thrombin Proteins 0.000 description 10
- 229960004072 thrombin Drugs 0.000 description 10
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- 230000004913 activation Effects 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 102000010911 Enzyme Precursors Human genes 0.000 description 7
- 108010062466 Enzyme Precursors Proteins 0.000 description 7
- 239000003146 anticoagulant agent Substances 0.000 description 7
- 238000006731 degradation reaction Methods 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 239000011347 resin Substances 0.000 description 6
- 229920005989 resin Polymers 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 229920001612 Hydroxyethyl starch Polymers 0.000 description 5
- 230000015556 catabolic process Effects 0.000 description 5
- 229940050526 hydroxyethylstarch Drugs 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 230000008569 process Effects 0.000 description 5
- 239000004471 Glycine Substances 0.000 description 4
- 229940127219 anticoagulant drug Drugs 0.000 description 4
- 239000007857 degradation product Substances 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 230000009477 glass transition Effects 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- PGOHTUIFYSHAQG-LJSDBVFPSA-N (2S)-6-amino-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-5-amino-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-5-amino-2-[[(2S)-1-[(2S,3R)-2-[[(2S)-2-[[(2S)-2-[[(2R)-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-1-[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-4-methylsulfanylbutanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-5-carbamimidamidopentanoyl]amino]propanoyl]pyrrolidine-2-carbonyl]amino]-3-methylbutanoyl]amino]-4-methylpentanoyl]amino]-4-methylpentanoyl]amino]acetyl]amino]-3-hydroxypropanoyl]amino]-4-methylpentanoyl]amino]-3-sulfanylpropanoyl]amino]-4-methylsulfanylbutanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-hydroxybutanoyl]pyrrolidine-2-carbonyl]amino]-5-oxopentanoyl]amino]-3-hydroxypropanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-imidazol-5-yl)propanoyl]amino]-4-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-5-carbamimidamidopentanoyl]amino]-5-oxopentanoyl]amino]-3-hydroxybutanoyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-oxopentanoyl]amino]-3-phenylpropanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-methylbutanoyl]amino]-4-methylpentanoyl]amino]-4-oxobutanoyl]amino]-5-carbamimidamidopentanoyl]amino]-3-(1H-indol-3-yl)propanoyl]amino]-4-carboxybutanoyl]amino]-5-oxopentanoyl]amino]hexanoic acid Chemical compound CSCC[C@H](N)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@@H](Cc1cnc[nH]1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](Cc1ccccc1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](Cc1c[nH]c2ccccc12)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCCN)C(O)=O PGOHTUIFYSHAQG-LJSDBVFPSA-N 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 3
- 206010053567 Coagulopathies Diseases 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 108010022999 Serine Proteases Proteins 0.000 description 3
- 102000012479 Serine Proteases Human genes 0.000 description 3
- 108010000499 Thromboplastin Proteins 0.000 description 3
- 102000002262 Thromboplastin Human genes 0.000 description 3
- 230000003024 amidolytic effect Effects 0.000 description 3
- 235000001014 amino acid Nutrition 0.000 description 3
- 150000001413 amino acids Chemical class 0.000 description 3
- 239000003957 anion exchange resin Substances 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 230000035602 clotting Effects 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 239000006167 equilibration buffer Substances 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- 238000000386 microscopy Methods 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 3
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 3
- 239000008223 sterile water Substances 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 125000000539 amino acid group Chemical group 0.000 description 2
- 229960004676 antithrombotic agent Drugs 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 239000013024 dilution buffer Substances 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 210000003292 kidney cell Anatomy 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 230000014508 negative regulation of coagulation Effects 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000028327 secretion Effects 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 101710173438 Late L2 mu core protein Proteins 0.000 description 1
- 125000000729 N-terminal amino-acid group Chemical group 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 101710188315 Protein X Proteins 0.000 description 1
- 208000017442 Retinal disease Diseases 0.000 description 1
- 206010038923 Retinopathy Diseases 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 208000037919 acquired disease Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 150000001450 anions Chemical group 0.000 description 1
- 125000000637 arginyl group Chemical group N[C@@H](CCCNC(N)=N)C(=O)* 0.000 description 1
- 230000023555 blood coagulation Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 230000003139 buffering effect Effects 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 150000001720 carbohydrates Chemical class 0.000 description 1
- 235000014633 carbohydrates Nutrition 0.000 description 1
- 230000021523 carboxylation Effects 0.000 description 1
- 238000006473 carboxylation reaction Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000012531 culture fluid Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- MCWXGJITAZMZEV-UHFFFAOYSA-N dimethoate Chemical compound CNC(=O)CSP(=S)(OC)OC MCWXGJITAZMZEV-UHFFFAOYSA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 230000000058 esterolytic effect Effects 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- UHBYWPGGCSDKFX-VKHMYHEASA-N gamma-carboxy-L-glutamic acid Chemical group OC(=O)[C@@H](N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-VKHMYHEASA-N 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 125000000291 glutamic acid group Chemical group N[C@@H](CCC(O)=O)C(=O)* 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000004189 ion pair high performance liquid chromatography Methods 0.000 description 1
- 238000012417 linear regression Methods 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 238000012792 lyophilization process Methods 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 238000001471 micro-filtration Methods 0.000 description 1
- 238000005065 mining Methods 0.000 description 1
- 230000004001 molecular interaction Effects 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 230000000474 nursing effect Effects 0.000 description 1
- 229940127216 oral anticoagulant drug Drugs 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000000019 pro-fibrinolytic effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 230000009076 regulation of hemostasis Effects 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 125000000185 sucrose group Chemical group 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 231100001274 therapeutic index Toxicity 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 208000019553 vascular disease Diseases 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/715—Polysaccharides, i.e. having more than five saccharide radicals attached to each other by glycosidic linkages; Derivatives thereof, e.g. ethers, esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/482—Serine endopeptidases (3.4.21)
- A61K38/4866—Protein C (3.4.21.69)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/14—Vasoprotectives; Antihaemorrhoidals; Drugs for varicose therapy; Capillary stabilisers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6464—Protein C (3.4.21.69)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21069—Protein C activated (3.4.21.69)
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Wood Science & Technology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Vascular Medicine (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Gastroenterology & Hepatology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
- Die Erfindung liegt im Gebiet der Humanmedizin, insbesondere der Behandlung von vaskulären Störungen mit aktiviertem Protein C. Genauer gesagt betrifft die vorliegende Erfindung Formulierungen von aktiviertem, humanem Protein C.
- Protein C ist eine Serinprotease und ein natürlich vorkommendes Antikoagulans, das eine Rolle bei der Regulation der Hämostase durch die Inaktivierung der Faktoren Va und VIIIa in der Gerinnungskaskade spielt. Humanes Protein C wird in vivo primär in der Leber als einzelnes Polypeptid mit 461 Aminosäuren gebildet. Dieses Vorläufermolekül durchläuft mehrfach posttranslationale Modifikationen einschließlich 1) Abspaltung einer 42 Aminosäure langen Signalsequenz, 2) proteolytische Spaltung des einkettigen Zymogens zwischen dem Lysinrest an der Position 156 und dem Argininrest an der Position 157 unter Bildung einer zweikettigen Zymogenform des Moleküls (das heißt eine leichte Kette mit 155 Aminosäureresten ist über eine Disulfidbrücke an die die Serinprotease enthaltende schwere Kette mit 262 Aminosäureresten gebunden), 3) Vitamin-K abhängige Carboxylierung von neun Glutaminsäureresten die in den ersten 42 Aminosäuren der leichten Kette vorkommen, was zu 9 γ-Carboxyglutaminsäureresten führt und 4) Kohlenhydratanfügung an vier Stellen (eine in der leichten Kette und drei in der schweren Kette). Die schwere Kette enthält die gut etablierte Serinproteasentriade aus Asp 257, His 211 und Ser 360. Schließlich wird das zirkulierende zweikettige Zymogen in vivo durch Thrombin an einer Phospholipidoberfläche in Gegenwart von Calciumionen aktiviert. Die Aktivierung kommt durch die Entfernung eines Dodecapeptids am N-Terminus der schweren Kette unter Bildung des aktivierten Protein C (aPC) zustande, das eine enzymatische Aktivität besitzt.
- Zusätzlich zu den enzymatischen Aktivitäten von aPC innerhalb der Blutgerinnungskaskade kann aPC auch eine Autodegradierung durchmachen, was zu einer verringerten Funktionalität als Antikoagulans führt. Es wurde ein wichtiger Abbauweg aufgefunden. Die Autodegradierung des N-Terminus der leichten Kette kann zu einer Spaltung auf jeder Seite des Histidinrests an Position 10 führen. Daher führt dieser Abbauweg zu zwei inaktiven Produkten: 1) Des(1-9)-aktiviertes Protein C, worin die ersten 9 N-terminalen Reste der leichten Kette entfernt wurden und 2) Des(1-10)-aktiviertes Protein C, worin die ersten 10 N-terminalen Reste der leichten Kette entfernt wurden. Dieser Abbauweg, der vorher nicht berichtet wurde, führt zu einem Verlust der Antikoagulansaktivität aufgrund der Entfernung der entscheidenden GLA Reste an den Positionen 6 und 7. Daher ist die Minimierung des Ausmaßes an Des(1-9)- und Des(1-10)-aktivierten Protein C Autodegradierungsprodukten wichtig bei der Erzielung einer starken, hochreinen pharmazeutischen Formulierung von aktiviertem Protein C. Diese Varianten waren bisher unbekannte Abbauprodukte und sind zunehmend schwer, falls überhaupt durch herkömmliche Reinigungstechniken zu entfernen. Es wurde ferner festgestellt, dass die Löslichkeit aus dem festen Zustand in Gegenwart einer ausgewählten Gruppe an Füllstoffen signifikant verbessert ist.
- Es ist auf jeden Fall erwünscht, einen solchen Abbau von aktiviertem Protein C sowohl in den Lösungs- als auch festen Lyophilisierungszuständen zu minimieren. Demnach erlauben diese Erkenntnisse die Herstellung von potenten, hochreinen, Formulierungen von aktiviertem Protein C, die pharmazeutisch elegant sind, für das Pflegepersonal.
- Die vorliegende Erfindung liefert verbesserte Formulierungen von aktiviertem Protein C, die im wesentlichen frei von Autodegradierungsprodukten, insbesondere Des(1-9)- und Des(1-10)-Formen der leichten Kette des aktivierten Protein C, sind. Daher sind diese Formulierungen zur Verabreichung an einen Patienten geeignet, der dessen bedarf.
- Die vorliegende Erfindung liefert eine stabile lyophilisierte Formulierung, die aktiviertes Protein C und einen Füllstoff umfasst, der ausgewählt ist aus der Gruppe, welche besteht aus Mannit, Trehalose, Raffinose, Saccharose und Gemischen hievon.
- Die vorliegende Erfindung liefert auch eine stabile, lyophilisierte Formulierung, die etwa 2,5 mg/ml aktiviertes Protein C, etwa 15 mg/ml Saccharose und etwa 20 mg/ml NaCl enthält. Darüberhinaus liefert die vorliegende Erfindung eine stabile, lyophilisierte Formulierung, die etwa 5 mg/ml aktiviertes Protein C, etwa 30 mg/ml Saccharose und etwa 38 mg/ml NaCl enthält.
- Die vorliegende Erfindung liefert auch ein Verfahren zur Herstellung einer Formulierung, die aktiviertes Protein C und einen Füllstoff umfasst, der aus der Gruppe ausgewählt wird, die besteht aus Mannit, Trehalose, Raffinose und Saccharose und Gemischen hiervon.
- Die Erfindung liefert auch eine Einheitsdosierungsform, die ein Einheitsdosierungsbehältnis umfasst, das die Formulierung enthält, worin das Gewicht-zu-Gewichtverhältnis etwa 1 Teil aktiviertes Protein C, etwa 7,6 Teile Salz und etwa 6 Teile Füllstoff enthält.
- Die Erfindung liefert ferner ein Verfahren zur Behandlung von Krankheitszuständen, die eine intravaskuläre Koagulation umfassen, welches die Verabreichung einer hierin beschriebenen Formulierung von aktiviertem Protein C umfasst.
- Für die Zwecke der vorliegenden Erfindung, wie sie hierin beschrieben und beansprucht wird, werden die folgenden Ausdrücke wie folgt definiert.
- aPC oder aktiviertes Protein C bezieht sich auf aktiviertes Protein C, das rekombinant ist oder aus dem Plasma stammt. aPC umfasst und ist vorzugsweise humanes aktiviertes Protein C, obwohl aPC auch andere Spezies oder Derivate mit den proteolytischen, amidolytischen, esterolytischen und biologischen (gerinnungshemmenden oder profibrinolytischen) Eigenschaften von Protein C umfassen kann. Beispiele für Protein C Derivate sind von Gerlitz et al.,
US 5 453 373 A und Foster et al.,US 5 516 650 A beschrieben.
APTT – aktivierte, partielle Thromboplastinzeit
r-hPC – rekombinantes humanes Protein C Zymogen
r-aPC – rekombinantes aktiviertes Protein C, das durch die Aktivierung des Protein C Zymogens in vitro oder in vivo oder durch die direkte Sekretion der aktivierten Form von Protein C aus prokaryontischen Zellen, eukaryontischen Zellen oder transgenen Tierzellen hergestellt wird, einschließlich beispielsweise der Sekretion aus humanen Nierenzellen 293 als Zymogen und die anschließende Reinigung und Aktivierung durch Techniken, die dem Fachmann gut bekannt sind und in Yan,US 4 981 952 A und Cottingham, WO 97/20043 A gezeigt sind.
Kontinuierliche Infusion – die im wesentlichen ununterbrochene Fortsetzung der Einführung einer Lösung in ein Blutgefäß für einen bestimmten Zeitraum.
Bolusinjektion – die Injektion eines Arzneimittels in einer definierten Menge (Bolus genannt) auf einmal.
Zur Verabreichung geeignet – eine lyophilisierte Formulierung oder Lösung, die zur Verabreichung als therapeutisches Mittel geeignet ist.
Zymogen – Protein C Zymogen bezieht sich, wie hierin verwendet, auf sekretierte, inaktive Formen von Protein C, die einkettig oder zweikettig sein können,
Pharmazeutisch annehmbarer Puffer – ein pharmazeutisch annehmbarer Puffer ist der Technik bekannt. Pharmazeutisch annehmbare Puffer umfassen Natriumphosphat, Natriumcitrat, Natriumacetat oder Tris. - Aktiviertes Protein X ist ein antithrombotisches Mittel mit einem breiteren therapeutischen Index als verfügbare Antikoagulantien, wie Heparin und die oralen Antikoagulantien vom Hydroxykumarintyp. Als antithrombotisches Mittel weist aPC einen deutlichen Effekt auf die Behandlung einer großen Vielzahl an erworbenen Krankheitszuständen auf, die eine intravaskuläre Koagulation umfassen, einschließlich Schlaganfall, tiefe Venenthrombose, Lungenembolie, periphere, arterielle Thrombose, Embolien, die vom Herzen oder peripheren Arterien stammen, akuter Myokardinfarkt, disseminierte, intravaskuläre Koagulation und akute Prä- oder Postkapillarverschlüsse, einschließlich Transplantationen oder Retinathrombose.
- Die vorliegende Erfindung betrifft Formulierungen von aktiviertem Protein C. Die gewünschte Formulierung wäre eine, die ein stabiles, lyophilisiertes Produkt mit hoher Reinheit ist, das aus aktiviertem Protein C und einem Füllstoff besteht, der aus der Gruppe ausgewählt ist, welche besteht aus Mannit, Trehalose, Raffinose und Saccharose. Das lyophilisierte Produkt wird mit dem geeigneten Verdünnungsmittel rekonstituiert, wie sterilem Wasser oder steriler Kochsalzlösung. Vorzugsweise hat die entstehende Lösung einen pH von etwa 5,5 bis etwa 6,5.
- Die molekularen Wechselwirkungen in einer Formulierung zwischen aktiviertem Protein C, Puffer, Salzkonzentration, pH, Temperatur und Füllstoffen sind komplex und die Rolle, die jeder Faktor zur Stabilität der Formulierung beiträgt, ist nicht vorhersehbar. Die lyophilisierten Formulierungen der vorliegenden Erfindung liefern stabiles, enzymatisch aktives aktiviertes Protein C nach einer Resuspendierung aufgrund einer verringerten Autodegradierung. Die vorliegende Erfindung weist insbesondere verringerte Mengen des Des(1-9)-aPC und des Des(1-10)-aPC auf. Im allgemeinen betragen die Mengen des Des(1-9)- und des Des(1-10)-aPC weniger als 10 % des Autodegradierungsprodukts. Vorzugsweise betragen die Mengen des Des(1-9)- und des Des(1-10)-aPC weniger als 8 % des Autodegradierungsprodukts. Noch bevorzugter betragen die Mengen des Des(1-9)- und des Des(1-10)-aPC weniger als 5 % und vor allem weniger als 3 % des Autodegradierungsprodukts. Diese Stabilität wird durch eine sorgfältige Kontrolle der Prozessierungsbedingungen und durch die Zugabe von Saccharose, Trehalose, Raffinose oder Mannit erhalten. Interessanterweise liefern andere Füllstoffe, wie Hydroxyethylstärke und Glycin nicht die notwendige Stabilität oder pharmazeutische Eleganz.
- Die Füllstoffe der vorliegenden Erfindung liefern eine pharmazeutisch elegante Formulierung, die eine gleichförmige Erscheinung aufweist und leicht solubilisiert werden kann, wenn sie mit einem geeigneten Solut resuspendiert wird. Nach einer Rekonstitution ist die Formulierung für bis zu 24 Stunden bis 48 Stunden bei Raumtemperatur stabil. Dies führt zu einer Stabilität, die vorher nicht erreicht werden konnte.
- Bevorzugte Füllstoffe in der Formulierung von aktiviertem Protein C sind Saccharose, Trehalose und Raffinose. Noch bevorzugtere Füllstoffe sind Saccharose und Raffinose und der am meisten bevorzugte Füllstoff ist Saccharose. Die Menge an Füllstoff beträgt in der Formulierung 1 Teil aPC auf 1 bis 10 Teile Füllstoff auf einer Gewicht-zu-Gewicht Basis. Darüber hinaus ist die Füllstoffkonzentration der Formulierung eine wichtige Formulierungsvariable des Gefriertrocknungsprozesses. Die optimale Konzentration an Füllstoff hängt von der Menge an aPC und der Art des ausgewählten Füllstoffs ab. Die bevorzugte Konzentration an Saccharose in der Gefrierlösung beträgt 10 bis 40 mg/ml. Eine bevorzugtere Konzentra tion an Saccharose beträgt 15 bis 30 mg/ml. Die am meisten bevorzugte Konzentration an Saccharose in der Gefrierlösung beträgt 15 mg/ml in einer Formulierung von aPC bei 2,5 mg/ml. Die am meisten bevorzugte Konzentration an Saccharose in der Gefrierlösung beträgt 30 mg/ml in einer Formulierung von aPC bei 5,0 mg/ml. Das Vorkommen des beanspruchten Füllstoffs in der Formulierung an aktiviertem Protein C bietet eine erhöhte chemische und physikalische Stabilität.
- Vor dem Gefriertrocknen und bei der Rekonstitution ist es bevorzugt, den pH im Bereich von 5,5 bis 6,5 zu halten, um die Autodegradierung im gelösten Zustand zu minimieren. Der bevorzugte pH der Formulierung ist ein pH zwischen etwa pH 5,6 und etwa pH 6,4. Bevorzugter ist ein pH zwischen etwa 5,7 und etwa 6,3. Noch bevorzugter ist ein pH zwischen etwa 5,8 und etwa 6,2. Noch bevorzugter ist ein pH zwischen etwa 5,9 und etwa 6,1. Der am meisten bevorzugte pH beträgt etwa pH 6,0.
- Um eine wirksame pH Kontrolle aufrechtzuerhalten sollte die aPC Lösung einen pharmazeutisch annehmbaren Puffer aufweisen. Demnach enthält die Formulierung bei der Gefriertrocknung wahlweise und vorzugsweise einen pharmazeutisch annehmbaren Puffer. Repräsentative Puffersysteme umfassen Tris-Acetat, Natriumcitrat und Natriumphosphat. Bevorzugtere Puffersysteme umfassen Natriumcitrat und Natriumphosphat. Der am meisten bevorzugte Puffer ist Natriumcitrat. Die bevorzugte Molarität des Puffersystems beträgt 10 mM bis 50 mM. Eine bevorzugtere Molarität des Puffersystems beträgt 10 mM bis 20 mM. Die am meisten bevorzugte Molarität beträgt 40 mM. Der Fachmann erkennt, dass viele andere Puffersysteme verfügbar sind, die ebenfalls in den Formulierungen der vorliegenden Erfindung verwendet werden können.
- Ähnlich ist während dem Gefriertrocknen und bei der Rekonstitution die Ionenstärke eine kritische Variable, um die Stabilität im Lösungszustand sicherzustellen. Die Ionenstärke wird im allgemeinen durch die Salzkonzentration der Lösung bestimmt. Pharmazeutisch annehmbare Salze, die typischerweise verwendet werden, um die Ionenstärke zu bilden, umfassen unter anderem Kaliumchlorid (KCl) und Natriumchlorid (NaCl). Das bevorzugte Salz in der vorliegenden Erfindung ist Natriumchlorid. Während der Gefriertrocknung muss die Salzkonzentration hoch genug sein, um das Salz während dem Gefrierschritt des Gefriertrocknungszyklus ausfallen zu lassen. Vorzugsweise beträgt die Natriumchloridkonzentration mehr als 150 mM. Bevorzugter liegt die Natriumchloridkonzentration in der Gefrierlösung zwischen 150 mM bis 1000 mM. Für eine Formulierung, die 2,5 mg/ml aPC enthält, liegt eine bevorzugtere Natriumchloridkonzentration in der Gefrierlösung zwischen 150 mM und 650 mM. Noch bevorzugter liegt die Natriumchloridkonzentration in der Gefrierlösung zwischen 250 mM und 450 mM. Noch bevorzugter liegt die Natriumchloridkonzentation in der Gefrierlösung zwischen 300 mM und 400 mM. Die am meisten bevorzugte Natriumchloridkonzentration in der Gefrierlösung beträgt 325 mM für eine Formulierung, die 2,5 mg/ml aPC enthält.
- Ähnlich liegt für eine Formulierung, die 5,0 mg/ml aPC enthält, die bevorzugtere Natriumchloridkonzentration in der Gefrierlösung zwischen 150 mM und 1000 mM. Noch bevorzugter liegt die Natriumchloridkonzentration in der Gefrierlösung zwischen 250 mM und 750 mM. Noch bevorzugter liegt die Natriumchloridkonzentration in der Gefrierlösung zwischen 400 mM und 700 mM. Die am meisten bevorzugte Natriumchloridkonzentration in der Gefrierlösung beträgt 650 mM für eine Formulierung, die 5,0 mg/ml aPC enthält.
- Das Verhältnis von aPC : Salz : Füllstoff (G:G:G) ist ein wichtiger Faktor bei einer Formulierung, die für den Gefriertrocknungsprozess geeignet ist. Das Verhältnis variiert in Abhängigkeit von der Konzentration an aPC, der Salzauswahl und der Konzentration und Füllstoffauswahl und der Konzentration. Der Fachmann kann leicht das bevorzugte Verhältnis von aPC : Salz : Füllstoff durch Techniken ermitteln, die in der Technik bekannt und beschrieben sind, wie in Beispiel 1. Insbesondere ist ein Gewichtsverhältnis von einem Teil aktiviertem Protein C zu etwa 7 bis 8 Teilen Salz zu etwa 5 bis 7 Teilen Füllstoff bevorzugt. Bevorzugter ist ein Gewichtsverhältnis von einem Teil aktiviertem Protein C zu etwa 7,5 bis etwa 8 Teilen Salz zu etwa 5,5 bis etwa 6,5 Teilen Füllstoff. Am bevorzugtesten ist ein Verhältnis von etwa 1 Teil aktiviertem Protein C zu etwa 7,6 Teilen Salz zu etwa 6 Teilen Füllstoff.
- Das bevorzugte Salz ist Natriumchlorid mit einer Konzentration von 325 mM (für eine Formulierung, die 2,5 mg/ml aPC enthält) und 650 mM (für eine Formulierung, die 5,0 mg/ml aPC enthält) und ein Verhältnis von etwa 1,3:1 mit Saccharose (G:G) bevorzugt. Diese Konzentration ist hoch genug, um das Salz während des Einfrierprozesses ausfallen zu lassen, was höchstwahrscheinlich zu einem amorphen Gemisch aus aPC, Saccharose und Citrat führt, das lyophilisiert werden kann. So verleiht die Ionenstärke von NaCl in den bevorzugten Konzentrationen von 325 mM und 650 mM der Formulierung während dem Gefriertrocknungsprozess eine Stabilität.
- Die vorliegende Erfindung liefert ferner ein Verfahren zur Herstellung einer stabilen, lyophilisierten Formulierung, das die Lyophilisierung einer Lösung umfasst, die aktiviertes Protein C und einen Füllstoff aus der Gruppe enthält die aus Mannit, Trehalose, Raffinose, Saccharose und Gemischen hiervon besteht. Die Erfindung liefert auch ein Verfahren zur Herstellung einer stabilen, lyophilisierten Formulierung, das die Lyophilisierung einer Lösung umfasst, die etwa 2,5 mg/ml aktiviertes Protein C, etwa 15 mg/ml Saccharose, etwa 19 mg/ml NaCl und einen Natriumcitratpuffer mit einem pH von mehr als 5,5 aber weniger als 6,5 enthält. Darüberhinaus liefert die vorliegende Erfindung ein Verfahren zur Herstellung einer stabilen, lyophilisierten Formulierung, das die Lyophilisierung einer Lösung umfasst, die etwa 5 mg/ml aktiviertes Protein C, etwa 30 mg/ml Saccharose, etwa 38 mg/ml NaCl und einen Citratpuffer mit einem pH von mehr als 5,5 aber weniger als 6,5 enthält.
- Die vorliegende Erfindung liefert eine Einheitsdosierungsform, die einen Einheitsdosierungsbehälter umfasst, der eine stabile lyophilisierte Formulierung enthält, die aktiviertes Protein C und einen Füllstoff enthält, der aus der Gruppe ausgewählt ist, welche besteht aus Mannit, Trehalose, Raffinose, Saccharose und Gemischen hiervon. Darüberhinaus liefert die vorliegende Erfindung ein Verfahren zur Behandlung von Krankheitszuständen, die die intravaskuläre Koagulation betreffen, das die Verabreichung dieser Formulierung umfasst.
- Das aPC wird vorzugsweise parenteral verabreicht, um dessen Abgabe in den Blutstrom in einer wirksamen Form sicherzustellen, wobei die geeignete Dosis als kontinuierliche Infusion für etwa 1 bis etwa 48 Stunden verabreicht wird. Die Menge an verabreichtem aPC reicht von etwa 0,01 mg/kg/h bis etwa 0,05 mg/kg/h. Alternativ dazu wird das aPC durch die Injektion eines Teils der geeigneten Dosis pro Stunde als Bolusinjektion über einen Zeitraum von etwa 5 Minuten bis etwa 30 Minuten verabreicht, wonach eine kontinuierliche Infusion der geeigneten Dosis für etwa 23 Stunden bis etwa 47 Stunden erfolgt, die zur geeigneten Dosis führt, welche über 24 Stunden bis 48 Stunden verabreicht wird.
- Die folgenden Beispiele helfen bei der Beschreibung, wie die Erfindung durchgeführt wird und erläutern die Erfindung. Der Umfang der vorliegenden Erfindung soll nicht nur aus den folgenden Beispielen bestehen.
- Präparation 1
- Herstellung von humanem Protein C
- Rekombinantes humanes Protein C (rHPC) wird in humanen 293 Nierenzellen durch Techniken hergestellt, die dem Fachmann gut bekannt sind, wie die, die in Yan,
US 4 981 952 A beschrieben sind, wobei die gesamte Beschreibung hiervon hiermit eingeführt ist. Das für humanes Protein C kodierende Gen ist in Bang et al,US 4 775 624 A beschrieben und beansprucht. Das zur Expression von humanem Protein C in 293-Zellen verwendete Plasmid ist das Plasmid pLPC, das in Bang et al,US 4 992 373 A beschrieben ist. Die Konstruktion von Plasmid pLPC ist auch in derEP 0 445 939 A und Grinnell et al., 1987, Bio/Technology 5: 1189-1192 beschrieben. Kurz gesagt wird das Plasmid in 293 Zellen transfiziert, dann werden stabile Transformanden identifiziert, subkultiviert und in serumfreiem Medium angezogen. Nach der Fermentation erhält man ein zellfreies Medium durch Mikrofiltration. - Das humane Protein C wird aus der Kulturtlüssigkeit durch eine Anpassung an die Techniken von Yan
US 4 981 952 A abgetrennt. Das geklärte Medium wird auf 4 mM EDTA gebracht, bevor es an eine Anionenaustauscherharzsäule adsorbiert wird (Fast-Flow Q, Pharmacia). Nach dem Waschen mit 4 Säulenvolumina 20 mM Tris, 200 mM NaCl, pH 7,4 und 2 Säulenvolumina 20 mM Tris, 150 mM NaCl, pH 7,4 wird das gebundene rekombinante humane Protein C Zymogen mit 20 mM Tris, 150 mM NaCl, 10 mM CaCl2 pH 7,4 eluiert. Das eluierte Protein ist zu mehr als 95 % rein nach der Elution, wie dies durch SDS-Polyacrylamidgelelektrophorese beurteilt wird. - Eine weitere Reinigung des Proteins wird durch Aufstocken des Proteins auf 3 M bezüglich NaCl gefolgt von einer Adsorption an ein hydrophobes Wechselwirkungsharz (Toyopearl Phenyl 650M, Toso Haas) erreicht, das mit 20 mM Tris, 3 M NaCl, 10 mM CaCl2 pH 7,4 äquilibriert ist. Nach dem Waschen mit 2 Säulenvolumina des Äquilibrierungspuffers ohne CaCl2 wird das rekombinante humane Protein C mit 20 mM Tris pH 7,4 eluiert.
- Das eluierte Protein wird durch die Entfernung des restlichen Calciums auf die Aktivierung vorbereitet. Das rekombinante humane Protein C passiert eine Metallaffinitätssäule (Chelex-100, Bio-Rad), um Calcium zu entfernen und wird erneut an einen Anionenaustauscher gebunden (Fast Flow Q, Pharmacia). Diese beiden Säulen werden in Reihe angeordnet und mit 20 mM Tris, 150 mM NaCl, 5 mM EDTA pH 7,4 äquilibriert. Nach der Beladung mit Protein wird die Chelex-100 Säule mit einem Säulenvolumen desselben Puffers gewaschen, bevor sie aus der Reihe genommen wird. Die Anionenaustauschersäule wird mit 3 Säulenvolumina Äquilibrierungspuffer gewaschen, bevor das Protein mit 0,4 M NaCl, 20 mM Tris-Acetat pH 6,5 eluiert wird. Die Proteinkonzentrationen der Lösungen an rekombinantem humanem Protein C und rekombinantem aktiviertem Protein C werden jeweils durch Extinktion bei UV von 280 nm und mit E0,1% = 1,81 oder 1,85 gemessen.
- Präparation 2
- Aktivierung von rekombinantem humanem Protein C
- Rinderthrombin wird an aktivierte CH-Sepharose 4B (Pharmacia) in Gegenwart von 50 mM HE-PES pH 7,5 bei 4°C gekuppelt. Die Kupplungsreaktion wird mittels etwa 5000 Einheiten Thrombin/ml Harz auf Harz ausgeführt, das bereits in eine Säule gepackt ist. Die Thrombinlösung zirkuliert für etwa 3 Stunden durch die Säule, bevor 2-Aminoethanol (MEA) in einer Konzentration von 0,6 ml/l der zirkulierenden Lösung zugegeben wird. Die MEA enthaltende Lösung wird für weitere 10-12 Stunden zirkuliert, um die vollständige Blockierung der nicht-abreagierten Amine auf dem Harz sicherzustellen. Nach der Blockierung wird das mit Thromin-gekuppelte Harz mit 10 Säulenvolumina an 1 M NaCl, 20 mM Tris pH 6,5 gewaschen, um das gesamte nicht-spezifisch gebundene Protein zu entfernen und wird in Aktivierungsreaktionen nach der Äquilibrierung in Aktivierungspuffer verwendet.
- Gereinigtes r-hPC wird auf 5 mM EDTA gebracht (um restliches Calcium zu binden) und mit 20 mM Tris, pH 7,4 oder 20 mM Tris-Acetat pH 6,5 auf eine Konzentration von 2 mg/ml verdünnt. Dieses Material passiert eine Thrombinsäule, die bei 37°C mit 50 mM NaCl und entweder 20 mM Tris pH 7,4 oder 20 mM Tris-Acetat pH 6,5 äquilibriert ist. Die Flußrate wird so eingestellt, dass eine Kontaktzeit von etwa 20 Minuten zwischen dem r-hPC und dem Thrombinharz ermöglicht wird. Der Effluent wird gesammelt und sofort auf amidolytische Aktivität getestet. Falls das Material keine spezifische Aktivität (amidolytisch) im Vergleich zu einem etablierten aPC Standard aufweist, wird es über die Thrombinsäule zurückgeführt, um das r-hPC vollständig zu aktivieren. Danach erfolgt eine 1:1 Verdünnung des Materials mit 20 mM Puffer wie oben mit einem pH von entweder 7,4 oder 6,5, um das aPC bei geringeren Konzentrationen zu halten, während es auf den nächsten Aufarbeitungsschritt wartet.
- Die Entfernung des ausgelaugten Thrombins vom aPC Material wird durch Bindung des aPC an ein Anionenaustauscherharz erreicht (Fast Flow Q, Pharmacia), das in einem Aktivierungspuffer mit 150 mM NaCl äquilibriert ist (entweder 20 mM Tris pH 7,4 oder 20 mM Tris-Acetat pH 6,5). Thrombin interagiert unter diesen Bedingungen nicht mit dem Anionenaustauscherharz, sondern läuft durch die Säule in den Probenauftragseffluent. Wenn das aPC auf die Säule aufgetragen ist, wird ein Waschschritt mit 2-6 Säulenvolumina mit einem 20 mM Äquilibrierungspuffer ausgeführt, bevor das gebundene aPC mit einer Stufenelution mittels 0,4 M NaCl entweder in 5 mM Tris-Acetat pH 6,5 oder 20 mM Tris pH 7,4 eluiert wird. Größervolumige Waschschritte der Säule erleichtern die vollständige Entfernung des Dodecapeptids. Das Material, das aus dieser Säule eluiert, wird entweder in einer gefrorenen Lösung (-20°C) oder als lyophilisiertes Pulver gelagert.
- Die Antikoagulansaktivität des aktivierten Protein C wird durch Messen der Verlängerung der Gerinnungszeit im aktivierten partiellen Thromboplastinzeittest (APTT) bestimmt. Es wird eine Standardkurve in Verdünnungspuffer (1 mg/ml Radioimmuntest-reines Rinderserumalbumin [BSA], 20 mM Tris, pH 7,4, 150 mM NaCl, 0,02 % NaN3) hergestellt, die von 125-1000 ng/ml reicht, wobei die Proben in mehreren Verdünnungen in diesem Konzentrationsbereich hergestellt werden. Zu jeder Probenküvette werden 50 μl kaltes Pferdeplasma und 50 μl des rekonstituierten Reagenzes für die aktivierte partielle Thromboplastinzeit (APTT Reagenz, Sigma) gegeben und bei 37°C für 5 Minuten inkubiert. Nach der Inkubation werden 50 μl der geeigneten Proben oder Standards zu jeder Küvette gegeben. Verdünnungspuffer wird anstelle der Probe oder des Standards verwendet, um die basale Gerinnungszeit zu bestimmen. Der Timer des Fibrometers (CoA Screener Hemostasis Analyser, American Labor) wird unmittelbar nach der Zugabe von 50 μl 30 mM CaCl2 mit 37°C zu jeder Probe oder zu jedem Standard gestartet. Die Konzentration des aktivierten Protein C in den Proben wird aus der linearen Regressionsgleichung der Standardkurve berechnet. Die hierin angegebenen Gerinnungszeiten sind das Mittel von minimal drei Parallelansätzen, einschließlich der Proben für die Standardkurve.
- Beispiel 1
- Formulierung von aktiviertem Protein C
- Das humane aktivierte Protein C wird wie in den Präparationen 1 und 2 beschrieben hergestellt. Die Formulierungen des aktivierten Protein C werden auf die Verarbeitung in einem herkömmlichen Gefriertrockner analysiert. Gefriertrocknungsmikroskopie und Differentialscanningkalorimetrie (DSC) werden zum Messen der zwei Parameter verwendet, die bestimmen, ob eine Formulierung in einem herkömmlichen Gefriertrockner verarbeitet werden kann. Die Gefriertrocknungsmikroskopie ist eine brauchbare Technik bei der Bestimmung der Kolabierungstemperaturen der gefrorenen Lösungen, die lyophilisiert werden sollen. Die DSC ist eine brauchbare Technik bei der Bestimmung der Glasübergangstemperatur (Tg') der gefrorenen Lösung. Die Kolabierungs- und Glasübergangstemperaturen sind speziell bei der Vorhersage der oberen Temperaturgrenzen brauchbar, die sicher während des Gefriertrocknungsprozesses verwendet werden können. Die Ergebnisse der Gefriertrocknungsmikroskopie sind zur Glasübergangstemperatur des Tg' komplementär, wobei die Werte durch DSC erhalten werden. Eine Kolabierungstemperatur über -40°C ist für die Probe optimal, die in einem herkömmlichen Gefriertrockner verarbeitet werden soll.
- Das Verhältnis von aPC zu Saccharose zu Natriumchlorid (in 10 oder 20 mM Citratpuffer) ist eine wichtige Formulierungsvariable, die die Kolabierungs- und Glasübergangstemperaturen beeinflusst. Um in einem herkömmlichen Gefriertrockner verarbeitet zu werden, muss die Natriumchloridkonzentration hoch genug sein (vorzugsweise 325 mM für 2,5 mg/ml aPC und 650 mM für 5 mg/ml aPC Formulierungen), um das Auskristallisieren des Natriumchlorids während dem Gefrierabschnitt des Gefriertrocknungsprozesses zu verursachen. Die aPC Formulierungen können in einem herkömmlichen Gefriertrockner unter Bildung der lyophilisierten Produkte verarbeitet werden, die aus 1 Teil aPC, 6 Teilen Saccharose und 7,6 Teilen Natriumchlorid bezogen auf das Gewicht bestehen.
- Beispiel 2
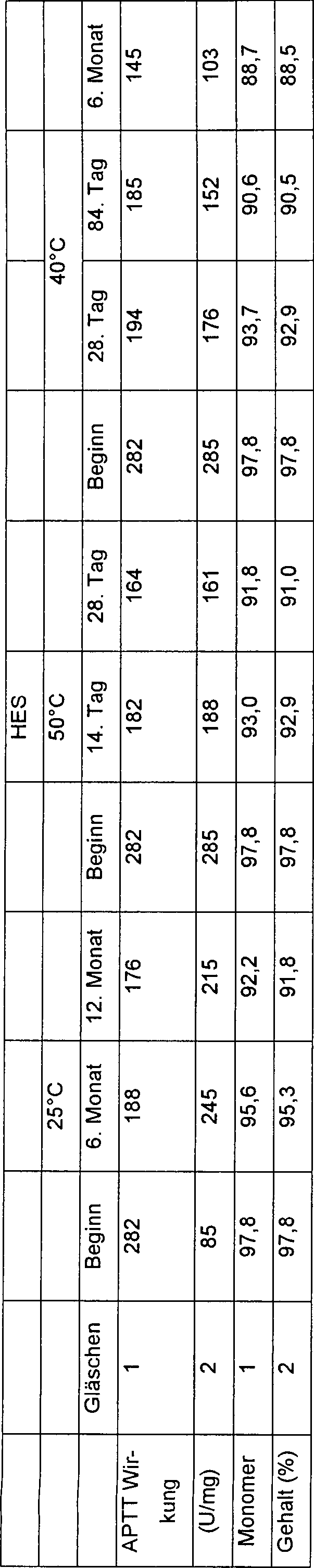
- Stabilität von aPC in Produktformulierungen, die unterschiedliche Füllstoffe enthalten
- Es werden Fomulierungen von aPC hergestellt, um die Wirkung von verschiedenen Füllstoffen auf die Stabilität des Moleküls zu untersuchen. Es werden insgesamt 6 Hilfsstoffe zu aPC in Phosphatpuffer gegeben, der kein Salz enthält. Diese Füllstoffe sind Glycin, Mannit, Saccharose, Trehalose, Raffinose und Hydroxyethylstärke (HES). Die Stabilität von aPC im Phosphat ohne Salz und ohne Füllstoffformulierung ("Kontrolle") wird mit der in den Füllstoffformulierungen verglichen. Es werden Proben bei 50°C, 40°C und 25°C für verschiedene Zeitspannen gelagert. Die Daten aus der Analyse dieser Proben werden mit den anfänglichen Werten (Zeitpunkt = 0) verglichen. Die APTT Wirksamkeit, Größenausschlusshochleistungsflüssigchromatographie (SE-HPLC), SDS-PAGE und Proteingehaltstests werden verwendet, um die physikalische und chemische Stabilität der Formulierungen zu evaluieren.
- Die aPC Formulierungen werden durch Lösen von aPC in Phosphatpuffer mit 5 mg/ml aPC hergestellt. Die Füllstoffe werden zu Teilen der aPC Lösung in einem Verhältnis von 6:1 (Füllstoff zu aPC) oder 30 mg/ml gegeben. Die Proben werden mit 5 mg aPC/Gläschen lyophilisiert.
- Die Formulierungen werden bei 50°C für 14 und 28 Tage, bei 40°C für 28 Tage, 48 Tage und 6 Monate und bei 25°C für 6 und 12 Monate auf Stabilität gelegt. Für jeden Zeitpunkt werden 2 Gläschen jeder Formulierung unabhängig als getrennte Proben analysiert und die Daten aus diesen Proben werden mit denen der anfänglichen Werte (Zeitpunkt = 0) verglichen. Die Analysen umfassen aPC Wirksamkeit (APTT), SDS-PAGE, Prozent an aPC Monomer und Proteingehalt.
- Es gibt keine signifikanten Veränderungen im pH, der Farbe, der Verpackungscharakteristiken und des physikalischen Erscheinungsbildes bei allen Proben über die Stabilitätsperiode von 1 Jahr. Bei einer Analyse durch die APTT und SE-HPLC Verfahren weisen die HES und Glycin-Formulierungen eine geringere physikalische Stabilität (durch Aggregation) und eine chemische Stabilität (Wirksamkeit) auf, wenn sie mit der Kontrolle verglichen werden. Die Mannitformulierung bietet eine leicht bessere physikalische und chemische Stabilität als die Kontrolle und die verbleibenden Formulierungen mit Saccharose, Trehalose und Raffinose zeigen alle eine sogar verbesserte physikalische und chemische Stabilität im Vergleich zur Kontrolle. Daher bieten Mannit, Saccharose, Trehalose und Raffinose als Füllstoffe in aPC Formulierungen eine erhöhte chemische und physikalische Stabilität im Vergleich mit einer aPC Formulierung ohne Füllstoff oder mit denen, die Glycin oder HES enthalten.
- Beispiel 3
- Stabilität von rekombinantem, humanem, aktiviertem Protein C
- Zwei Lots einer lyophilisierten Formulierung von rekombinantem, humanem, aktiviertem Protein C (aPC) werden für 1 Monat bei 40°C/75 % relativer Luftfeuchtigkeit gelagert und dann auf einen möglichen Abbau analysiert. Die Stabilität von aPC wird auch nach einer Rekonstitution mit sterilem Wasser und einer Lagerung für bis zu 72 Stunden bei Umgebungstemperatur getestet. Das lyophilisierte aPC Produkt besteht aus 10 mg aPC, 60 mg Saccharose, 76 mg Natriumchlorid und 15,1 mg Citrat pro Gläschen. Das aPC ist in dieser Formulierung im trockenen Zustand für mindestens 1 Monat stabil, wenn es bei 40°C/75 % relativer Luftfeuchtigkeit gelagert wird und in Lösung für 24 Stunden, wenn es bei Umgebungstemperatur gelagert wird.
- Beide Lots werden mit derselben Einheitsformel aus 10 mg aPC, 60 mg Saccharose, 76 mg Natriumchlorid und 15,1 mg Citrat pro Gläschen hergestellt. Beide lyophilisierten Lots an aPC werden für 1 Monat bei 40°C/75 % relativer Luftfeuchtigkeit gelagert und die Stabilität von aPC wird mittels des APTT Wirksamkeitstests, Ionenpaar-HPLC zur Quantifizierung der aPC Peptide und Massenspektroskopie zur Quantifizierung der Proteinvarianten verfolgt. Ein Lot wird auch mit sterilem Wasser auf 1 mg/ml aPC rekonstituiert und bei Umgebungstemperatur gehalten. Die Stabilität von aPC in Lösung wird zu den Zeitpunkten 0, 1, 4, 8, 24, 48 und 72 Stunden mittels APTT und Massenspektrometriemethoden verfolgt.
- Es findet kein Verlust der aPC Aktivität und eine nicht signifikante Menge an strukturellem Abbau des Moleküls nach einer Lagerung im trockenen Zustand für 1 Monat bei 40°C/75 % relativer Luftfeuchtigkeit statt. Das aPC ist in dieser Formulierung für bis zu 24 Stunden bei 1 mg/ml nach der Rekonstitution stabil.
Claims (16)
- Lyophilisierte Formulierung, die ein rekombinantes, humanes, aktiviertes Protein C, einen Füllstoff, der ausgewählt ist aus der Gruppe, die besteht aus Mannit, Trehalose, Raffinose und Saccharose und Gemischen hiervon und ein Puffersystem umfasst, so dass bei der Rekonstitution die entstehende Formulierung einen pH zwischen etwa 5,5 und 6,5 aufweist.
- Formulierung nach Anspruch 1, worin der pH zwischen etwa 5,9 und 6,1 liegt.
- Formulierung nach Anspruch 1 oder Anspruch 2, worin das Puffersystem ausgewählt ist aus Trisacetat, Natriumcitrat und Natriumphosphat oder Gemischen hiervon.
- Formulierung nach Anspruch 3, worin das Puffersystem Natriumcitrat ist.
- Formulierung nach einem der Ansprüche 1 bis 4, die ferner ein pharmazeutisch annehmbares Salz umfasst.
- Lyophilisierte Formulierung, die ein rekombinantes, humanes, aktiviertes Protein C, ein Salz und einen Füllstoff umfasst, der aus der Gruppe ausgewählt ist, die besteht aus Mannit, Trehalose, Raffinose und Saccharose, worin das Gewichtsverhältnis ein Teil rekombinantes, humanes, aktiviertes Protein C zu etwa 7 bis 8 Teile Salz zu etwa 5 bis 7 Teile Füllstoff beträgt.
- Formulierung nach Anspruch 6, worin das Gewichtsverhältnis ein Teil rekombinantes, humanes, aktiviertes Protein C zu 7,6 Teile Salz zu 6 Teile Füllstoff beträgt.
- Formulierung nach einem der Ansprüche 5 bis 7, worin das Salz ausgewählt ist aus Kaliumchlorid und Natriumchlorid.
- Formulierung nach Anspruch 8, worin das Salz Natriumchlorid ist.
- Formulierung nach einem der Ansprüche 1 bis 9, worin der Füllstoff Saccharose ist.
- Formulierung nach einem der Ansprüche 5 bis 10, so dass bei der Rekonstitution die entstehende Formulierung 5 mg/ml rekombinantes, humanes, aktiviertes Protein C, 30 mg/ml Saccharose und 38 mg/ml Natriumchlorid enthält.
- Lyophilisierte Formulierung, die 5 mg rekombinantes, humanes, aktiviertes Protein C, 30 mg Saccharose und 38 mg Natriumchlorid umfasst.
- Formulierung nach einem der Ansprüche 1 bis 12 zur Verwendung bei der Behandlung der Krankheitszustände, die die intravaskuläre Koagulation betreffen.
- Formulierung nach Anspruch 13, worin der Krankheitszustand, der eine intravaskuläre Koagulation umfasst, aus der Gruppe ausgewählt ist, die besteht aus thrombotischem Schlaganfall, tiefer Venenthrombose, Lungenembolie, peripherer arterieller Thrombose, Embolien, die aus dem Herzen oder den peripheren Arterien kommen, akutem Myokardinfarkt, disseminierter intravaskulärer Koagulation und akuter Prä- oder Postkapillarverschlüsse.
- Formulierung nach Anspruch 14 zur Verwendung bei der Behandlung des thrombotischen Schlaganfalls.
- Einheitsdosierungsform, die eine Formulierung nach einem der Ansprüche 1 bis 12 in einem Einheitsdosierungsbehältnis umfasst.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4525597P | 1997-04-28 | 1997-04-28 | |
| US45255P | 1997-04-28 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69828330D1 DE69828330D1 (de) | 2005-02-03 |
| DE69828330T2 true DE69828330T2 (de) | 2005-10-13 |
Family
ID=21936854
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69828330T Expired - Lifetime DE69828330T2 (de) | 1997-04-28 | 1998-04-28 | Aktiviertes Protein C Formulierungen |
Country Status (34)
| Country | Link |
|---|---|
| US (4) | US6159468A (de) |
| EP (2) | EP0875252B1 (de) |
| JP (2) | JP4383546B2 (de) |
| KR (2) | KR100450856B1 (de) |
| CN (2) | CN1227025C (de) |
| AR (2) | AR015598A1 (de) |
| AT (1) | ATE285788T1 (de) |
| AU (2) | AU740753C (de) |
| BR (2) | BR9809292A (de) |
| CA (2) | CA2288143C (de) |
| CO (2) | CO4940438A1 (de) |
| CZ (1) | CZ298429B6 (de) |
| DE (1) | DE69828330T2 (de) |
| DK (1) | DK0875252T3 (de) |
| EA (2) | EA002149B1 (de) |
| EG (1) | EG23685A (de) |
| ES (1) | ES2234072T3 (de) |
| HU (2) | HU224826B1 (de) |
| ID (2) | ID23172A (de) |
| IL (2) | IL132502A0 (de) |
| IN (2) | IN183798B (de) |
| MY (2) | MY120984A (de) |
| NO (2) | NO995134L (de) |
| NZ (2) | NZ337828A (de) |
| PE (2) | PE84799A1 (de) |
| PL (2) | PL195090B1 (de) |
| PT (1) | PT875252E (de) |
| SI (1) | SI0875252T1 (de) |
| SV (2) | SV1998000050A (de) |
| TR (2) | TR199902631T2 (de) |
| TW (2) | TWI242443B (de) |
| UA (2) | UA55448C2 (de) |
| WO (2) | WO1998048822A1 (de) |
| ZA (2) | ZA983496B (de) |
Families Citing this family (61)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ID23172A (id) | 1997-04-28 | 2000-03-23 | Lilly Co Eli | Metode yang diperbaiki untuk pengolahan protein c teraktivasi |
| US6630137B1 (en) * | 1997-04-28 | 2003-10-07 | Eli Lilly And Company | Activated protein C formulations |
| HUP0001237A3 (en) * | 1997-10-20 | 2002-01-28 | Lilly Co Eli | Methods for treating vascular disorders |
| US6815533B1 (en) | 1998-07-31 | 2004-11-09 | Eli Lilly And Company | Cryogranulation of activated protein C |
| BR9915317A (pt) * | 1998-11-13 | 2001-08-07 | Lilly Co Eli | Método de tratar trombocitopenia induzida por heparina |
| JP2002530353A (ja) * | 1998-11-20 | 2002-09-17 | イーライ・リリー・アンド・カンパニー | ウイルス性出血熱の処置法 |
| DE69905489T2 (de) * | 1998-11-23 | 2003-09-11 | Eli Lilly And Co., Indianapolis | Protein c zur behandlung von sichelzellanämie und thalassämie |
| CN1329503A (zh) * | 1998-12-10 | 2002-01-02 | 伊莱利利公司 | 治疗血小板减少性紫癜和溶血性尿毒综合征的方法 |
| US6758938B1 (en) * | 1999-08-31 | 2004-07-06 | Micron Technology, Inc. | Delivery of dissolved ozone |
| US7204981B2 (en) * | 2000-03-28 | 2007-04-17 | Eli Lilly And Company | Methods of treating diseases with activated protein C |
| WO2001089558A2 (en) * | 2000-05-24 | 2001-11-29 | Eli Lilly And Company | Formulations and use of activated protein c and protein c zymogen for treating hypercoagulable states |
| ATE400030T1 (de) | 2001-02-19 | 2008-07-15 | Merck Patent Gmbh | Methode zur identifizierung von t-zellepitopen und deren anwendung zur herstellung von molekülen mit reduzierter immunogenität |
| US7101982B2 (en) * | 2001-03-30 | 2006-09-05 | Immunex Corporation | Control of ph transitions during chromatography |
| US20030055003A1 (en) * | 2001-07-19 | 2003-03-20 | David Bar-Or | Use of copper chelators to inhibit the inactivation of protein C |
| US20030073636A1 (en) * | 2001-09-19 | 2003-04-17 | Oklahoma Medical Research Foundation | Method of treating diabetes |
| WO2003024398A2 (en) | 2001-09-19 | 2003-03-27 | Oklahoma Medical Research Foundation | Treatment of sepsis with tafi |
| DE10149030A1 (de) * | 2001-10-05 | 2003-04-10 | Viscum Ag | Stabile galenische gefriergetrocknete Arzneimittelzubereitung von rViscumin |
| BR0213292A (pt) | 2001-10-15 | 2006-05-23 | Chiron Corp | tratamento de pneumonia severa por administração de inibidor da via de fator tecidual (tfpi) |
| ES2325653T3 (es) | 2001-12-21 | 2009-09-11 | Novo Nordisk Health Care Ag | Composicion liquida de polipeptidos del factor vii. |
| EP1485121A4 (de) * | 2002-03-08 | 2007-11-07 | Lilly Co Eli | Aktivierte protein-c-formulierungen |
| BRPI0311959B8 (pt) | 2002-06-21 | 2021-05-25 | Novo Nordisk Healthcare Ag | composição, métodos para preparar um polipeptídeo estável do fator vii, e para tratar uma síndrome responsiva do fator vii, e, uso do polipeptídeo do fator vii |
| NZ562480A (en) * | 2002-10-29 | 2009-08-28 | Alza Corp | Stabilized, solid-state polypeptide particles |
| US20070142272A1 (en) * | 2003-01-24 | 2007-06-21 | Zlokovic Berislav V | Neuroprotective activity of activated protein c independent of its anticoagulant activity |
| US7897734B2 (en) | 2003-03-26 | 2011-03-01 | Novo Nordisk Healthcare Ag | Method for the production of proteins |
| ES2382157T3 (es) * | 2003-06-25 | 2012-06-05 | Novo Nordisk Health Care Ag | Composición líquida de polipépttidos del factor VII |
| BRPI0508992A (pt) * | 2004-03-17 | 2007-09-04 | Chiron Corp | tratamento de pneumonia severa pela administração de tfpi |
| EP1773371A4 (de) * | 2004-07-23 | 2009-12-30 | Univ Rochester | Aktiviertes protein c hemmt unerwünschte effekte von plasminogenaktivator im gehirn |
| US20090148458A1 (en) * | 2005-06-23 | 2009-06-11 | The University Of British Columbia | Coagulation factor iii polymorphisms associated with prediction of subject outcome and response to therapy |
| US9175283B2 (en) * | 2006-05-31 | 2015-11-03 | Genzyme Corporation | Use polysaccharides for promotion of enzymatic activity |
| US20100041600A1 (en) * | 2006-06-09 | 2010-02-18 | Russel James A | Interferon gamma polymorphisms as indicators of subject outcome in critically ill subjects |
| EA019345B1 (ru) * | 2007-03-05 | 2014-03-31 | Кадила Хелзкэр Лимитед | Композиции, содержащие конъюгаты пэг-интерферон-альфа и рафинозу в качестве криопротектора |
| MX2009010361A (es) | 2007-03-29 | 2009-10-16 | Abbott Lab | Anticuerpos il-12 anti-humanos cristalinos. |
| SG186607A1 (en) * | 2007-11-30 | 2013-01-30 | Abbott Lab | Protein formulations and methods of making same |
| US8883146B2 (en) | 2007-11-30 | 2014-11-11 | Abbvie Inc. | Protein formulations and methods of making same |
| US20110171200A1 (en) * | 2008-01-15 | 2011-07-14 | Walley Keith R | Protein c rs2069915 as a response predictor to survival and administration of activated protein c or protein c-like compound |
| WO2010062896A1 (en) * | 2008-11-28 | 2010-06-03 | Abbott Laboratories | Stable antibody compositions and methods for stabilizing same |
| WO2012068519A2 (en) | 2010-11-19 | 2012-05-24 | Sirius Genomics Inc. | Markers associated with response to activated protein c administration, and uses thereof |
| US9062106B2 (en) | 2011-04-27 | 2015-06-23 | Abbvie Inc. | Methods for controlling the galactosylation profile of recombinantly-expressed proteins |
| WO2013151727A1 (en) | 2012-04-03 | 2013-10-10 | Smith Medical Asd, Inc. | Heparin-bulking agent compositions and methods thereof |
| US9067990B2 (en) | 2013-03-14 | 2015-06-30 | Abbvie, Inc. | Protein purification using displacement chromatography |
| WO2013158273A1 (en) | 2012-04-20 | 2013-10-24 | Abbvie Inc. | Methods to modulate c-terminal lysine variant distribution |
| US9334319B2 (en) | 2012-04-20 | 2016-05-10 | Abbvie Inc. | Low acidic species compositions |
| US9249182B2 (en) | 2012-05-24 | 2016-02-02 | Abbvie, Inc. | Purification of antibodies using hydrophobic interaction chromatography |
| WO2014005183A1 (en) | 2012-07-04 | 2014-01-09 | The University Of Sydney | Treatment of inflammatory skin disorders |
| US9512214B2 (en) | 2012-09-02 | 2016-12-06 | Abbvie, Inc. | Methods to control protein heterogeneity |
| BR112015004467A2 (pt) | 2012-09-02 | 2017-03-21 | Abbvie Inc | método para controlar a heterogeneidade de proteínas |
| AU2013381687A1 (en) | 2013-03-12 | 2015-09-24 | Abbvie Inc. | Human antibodies that bind human TNF-alpha and methods of preparing the same |
| US9017687B1 (en) | 2013-10-18 | 2015-04-28 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same using displacement chromatography |
| US9499614B2 (en) | 2013-03-14 | 2016-11-22 | Abbvie Inc. | Methods for modulating protein glycosylation profiles of recombinant protein therapeutics using monosaccharides and oligosaccharides |
| WO2014159579A1 (en) | 2013-03-14 | 2014-10-02 | Abbvie Inc. | MUTATED ANTI-TNFα ANTIBODIES AND METHODS OF THEIR USE |
| US9598667B2 (en) | 2013-10-04 | 2017-03-21 | Abbvie Inc. | Use of metal ions for modulation of protein glycosylation profiles of recombinant proteins |
| US9085618B2 (en) | 2013-10-18 | 2015-07-21 | Abbvie, Inc. | Low acidic species compositions and methods for producing and using the same |
| US8946395B1 (en) | 2013-10-18 | 2015-02-03 | Abbvie Inc. | Purification of proteins using hydrophobic interaction chromatography |
| US9181337B2 (en) | 2013-10-18 | 2015-11-10 | Abbvie, Inc. | Modulated lysine variant species compositions and methods for producing and using the same |
| US20150139988A1 (en) | 2013-11-15 | 2015-05-21 | Abbvie, Inc. | Glycoengineered binding protein compositions |
| DK3137102T3 (da) | 2014-04-16 | 2021-10-11 | Zz Biotech Llc | Apc til anvendelse til behandling af unormal kutan ardannelse |
| CN106488773B (zh) | 2014-04-16 | 2020-02-11 | Zz生物技术有限责任公司 | Apc类似物用于创伤愈合的用途 |
| US11058750B2 (en) | 2015-12-03 | 2021-07-13 | Mor Research Applications Ltd. | Compositions and methods for treatment of ocular diseases |
| HRP20212027T1 (hr) | 2016-06-01 | 2022-04-01 | Servier IP UK Limited | Formulacije polialkilen oksidne asparaginaze i postupci njihove priprave i uporabe |
| CN108159399B (zh) * | 2017-12-29 | 2020-07-24 | 华中科技大学同济医学院附属同济医院 | 一种凝血蛋白酶aPC在防治糖尿病心肌病药物中的应用 |
| WO2023119230A1 (en) | 2021-12-22 | 2023-06-29 | L'oreal | Coagulation pathway and nicotinamide-adenine dinucleotide pathway modulating compositions and methods of their use |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4775624A (en) * | 1985-02-08 | 1988-10-04 | Eli Lilly And Company | Vectors and compounds for expression of human protein C |
| US4849403A (en) * | 1985-05-29 | 1989-07-18 | Pentapharm Ag | Protein C activator, methods of preparation and use thereof |
| US5516650A (en) | 1985-06-27 | 1996-05-14 | Zymogenetics, Inc. | Production of activated protein C |
| AT399095B (de) * | 1986-03-27 | 1995-03-27 | Vukovich Thomas Dr | Verfahren zur auftrennung von proteinen mittels gradientenelution und vorrichtung zur durchführung des verfahrens |
| US5175087A (en) * | 1987-07-06 | 1992-12-29 | Biopool International, Inc. | Method of performing tissue plasminogen activator assay |
| CA1329760C (en) * | 1987-10-29 | 1994-05-24 | Ted C. K. Lee | Plasma and recombinant protein formulations in high ionic strength media |
| US4877608A (en) * | 1987-11-09 | 1989-10-31 | Rorer Pharmaceutical Corporation | Pharmaceutical plasma protein formulations in low ionic strength media |
| US4992373A (en) * | 1987-12-04 | 1991-02-12 | Eli Lilly And Company | Vectors and compounds for direct expression of activated human protein C |
| JP2739050B2 (ja) * | 1988-01-28 | 1998-04-08 | ヘキスト薬品工業株式会社 | 抗血液凝固剤 |
| JPH01226900A (ja) * | 1988-03-08 | 1989-09-11 | Green Cross Corp:The | プロテインcの精製方法 |
| DE3823519A1 (de) * | 1988-07-12 | 1990-01-18 | Basf Ag | Verfahren zur reinigung von aktiviertem protein c |
| US4981952A (en) * | 1988-10-04 | 1991-01-01 | Eli Lilly And Company | Method for the purification of vitamin K-dependent proteins |
| US5093117A (en) * | 1989-01-24 | 1992-03-03 | Baxter International Inc. | Compositions and method for the treatment or prophylaxis of sepsis or septic shock |
| JPH05506354A (ja) * | 1990-02-09 | 1993-09-22 | ザイモジェネティクス,インコーポレイティド | 端が切り取られた軽鎖を有する活性プロテインc |
| IL97312A (en) * | 1990-02-23 | 1999-01-26 | Lilly Co Eli | A method of generating a polypeptide in an eukaryotic vector AND recombinant surrogate cell containing an enhanced transcriptional control unit based on the primary late adenovirus coefficient |
| US5040862A (en) | 1990-05-07 | 1991-08-20 | Corning Incorporated | Method of trimming optical power |
| AT402262B (de) * | 1991-06-20 | 1997-03-25 | Immuno Ag | Arzneimittel enthaltend aktiviertes protein c |
| US5413732A (en) * | 1991-08-19 | 1995-05-09 | Abaxis, Inc. | Reagent compositions for analytical testing |
| MY110664A (en) | 1992-05-21 | 1999-01-30 | Lilly Co Eli | Protein c derivatives |
| DE4234295A1 (de) * | 1992-10-12 | 1994-04-14 | Thomae Gmbh Dr K | Carbonsäurederivate, diese Verbindungen enthaltende Arzneimittel und Verfahren zu ihrer Herstellung |
| US5395923A (en) * | 1993-02-23 | 1995-03-07 | Haemacure-Biotech, Inc. | Process for the obtention of a biological adhesive made of concentrated coagulation factors by "salting-out" |
| JP2886061B2 (ja) * | 1993-10-29 | 1999-04-26 | 財団法人化学及血清療法研究所 | プロテインcもしくは活性化プロテインcの安定化方法及び安定化組成物 |
| JP3043558B2 (ja) * | 1993-10-29 | 2000-05-22 | 財団法人化学及血清療法研究所 | ヒト活性化プロテインc調製物及びその製法 |
| JPH07165605A (ja) * | 1993-12-16 | 1995-06-27 | Teijin Ltd | 活性化プロテインcバイアル |
| NZ270271A (en) * | 1994-01-05 | 1996-07-26 | Lilly Co Eli | Minimizing protein c degradation |
| JPH08301786A (ja) * | 1995-05-11 | 1996-11-19 | Mochida Pharmaceut Co Ltd | 吸収性骨疾患予防・治療剤 |
| WO1997020043A1 (en) | 1995-11-30 | 1997-06-05 | Zymogenetics, Inc. | Protein c production in transgenic animals |
| ID23172A (id) * | 1997-04-28 | 2000-03-23 | Lilly Co Eli | Metode yang diperbaiki untuk pengolahan protein c teraktivasi |
| HUP0001237A3 (en) | 1997-10-20 | 2002-01-28 | Lilly Co Eli | Methods for treating vascular disorders |
-
1998
- 1998-04-24 ID IDW991254A patent/ID23172A/id unknown
- 1998-04-24 WO PCT/US1998/008384 patent/WO1998048822A1/en not_active Ceased
- 1998-04-24 CZ CZ0381099A patent/CZ298429B6/cs not_active IP Right Cessation
- 1998-04-24 CN CNB988063824A patent/CN1227025C/zh not_active Expired - Fee Related
- 1998-04-24 CO CO98022605A patent/CO4940438A1/es unknown
- 1998-04-24 TR TR1999/02631T patent/TR199902631T2/xx unknown
- 1998-04-24 HU HU0100284A patent/HU224826B1/hu not_active IP Right Cessation
- 1998-04-24 AR ARP980101909A patent/AR015598A1/es active IP Right Grant
- 1998-04-24 JP JP54721998A patent/JP4383546B2/ja not_active Expired - Fee Related
- 1998-04-24 PL PL98336889A patent/PL195090B1/pl not_active IP Right Cessation
- 1998-04-24 ZA ZA9803496A patent/ZA983496B/xx unknown
- 1998-04-24 AU AU71618/98A patent/AU740753C/en not_active Ceased
- 1998-04-24 ZA ZA9803497A patent/ZA983497B/xx unknown
- 1998-04-24 HU HU0003401A patent/HUP0003401A3/hu unknown
- 1998-04-24 KR KR10-1999-7009933A patent/KR100450856B1/ko not_active Expired - Fee Related
- 1998-04-24 IL IL13250298A patent/IL132502A0/xx unknown
- 1998-04-24 UA UA99105884A patent/UA55448C2/uk unknown
- 1998-04-24 PE PE1998000311A patent/PE84799A1/es not_active Application Discontinuation
- 1998-04-24 CA CA2288143A patent/CA2288143C/en not_active Expired - Fee Related
- 1998-04-24 NZ NZ337828A patent/NZ337828A/en unknown
- 1998-04-24 AR ARP980101908A patent/AR012010A1/es active IP Right Grant
- 1998-04-24 KR KR1019997009835A patent/KR100564189B1/ko not_active Expired - Fee Related
- 1998-04-24 IL IL13232598A patent/IL132325A/xx not_active IP Right Cessation
- 1998-04-24 US US09/065,975 patent/US6159468A/en not_active Expired - Lifetime
- 1998-04-24 BR BR9809292-8A patent/BR9809292A/pt not_active Application Discontinuation
- 1998-04-24 EA EA199900980A patent/EA002149B1/ru not_active IP Right Cessation
- 1998-04-24 ID IDW991133A patent/ID22933A/id unknown
- 1998-04-24 WO PCT/US1998/008386 patent/WO1998048818A1/en not_active Ceased
- 1998-04-24 AU AU72589/98A patent/AU743531B2/en not_active Ceased
- 1998-04-24 PL PL98336420A patent/PL195642B1/pl unknown
- 1998-04-24 EA EA199900979A patent/EA004881B1/ru not_active IP Right Cessation
- 1998-04-24 TR TR1999/02529T patent/TR199902529T2/xx unknown
- 1998-04-24 BR BRPI9809304-5A patent/BR9809304B1/pt not_active IP Right Cessation
- 1998-04-24 CA CA002287267A patent/CA2287267C/en not_active Expired - Fee Related
- 1998-04-24 UA UA99105788A patent/UA73071C2/uk unknown
- 1998-04-24 NZ NZ500346A patent/NZ500346A/en unknown
- 1998-04-24 CO CO98022609A patent/CO4950523A1/es unknown
- 1998-04-24 CN CNB988045672A patent/CN1235638C/zh not_active Expired - Fee Related
- 1998-04-24 JP JP54722198A patent/JP4383547B2/ja not_active Expired - Lifetime
- 1998-04-24 US US09/065,872 patent/US6162629A/en not_active Expired - Lifetime
- 1998-04-24 PE PE1998000309A patent/PE86299A1/es not_active Application Discontinuation
- 1998-04-26 EG EG45198A patent/EG23685A/xx active
- 1998-04-27 MY MYPI98001899A patent/MY120984A/en unknown
- 1998-04-27 IN IN751CA1998 patent/IN183798B/en unknown
- 1998-04-27 IN IN752CA1998 patent/IN187157B/en unknown
- 1998-04-27 SV SV1998000050A patent/SV1998000050A/es not_active Application Discontinuation
- 1998-04-27 MY MYPI98001900A patent/MY118591A/en unknown
- 1998-04-27 SV SV1998000051A patent/SV1998000051A/es not_active Application Discontinuation
- 1998-04-28 TW TW087106558A patent/TWI242443B/zh not_active IP Right Cessation
- 1998-04-28 AT AT98303311T patent/ATE285788T1/de not_active IP Right Cessation
- 1998-04-28 DE DE69828330T patent/DE69828330T2/de not_active Expired - Lifetime
- 1998-04-28 ES ES98303311T patent/ES2234072T3/es not_active Expired - Lifetime
- 1998-04-28 EP EP98303311A patent/EP0875252B1/de not_active Expired - Lifetime
- 1998-04-28 TW TW087106549A patent/TW585871B/zh not_active IP Right Cessation
- 1998-04-28 SI SI9830752T patent/SI0875252T1/xx unknown
- 1998-04-28 DK DK98303311T patent/DK0875252T3/da active
- 1998-04-28 PT PT98303311T patent/PT875252E/pt unknown
- 1998-04-28 EP EP98303312A patent/EP0875563A3/de not_active Withdrawn
-
1999
- 1999-10-21 NO NO995134A patent/NO995134L/no not_active Application Discontinuation
- 1999-10-25 NO NO995198A patent/NO995198L/no not_active Application Discontinuation
-
2000
- 2000-09-14 US US09/662,232 patent/US6395270B1/en not_active Expired - Lifetime
- 2000-09-21 US US09/667,570 patent/US6436397B1/en not_active Expired - Lifetime
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69828330T2 (de) | Aktiviertes Protein C Formulierungen | |
| DE69729786T2 (de) | Hochkonzentrierte, lyophilisierte und flüssige faktor-ix formulierungen | |
| US6630137B1 (en) | Activated protein C formulations | |
| DE69829721T2 (de) | Verwendung von aktiviertem Protein-C zur Behandlung überschiessender Blutgerinnung bei Sepsis | |
| DE69333724T2 (de) | Hybrider menschlich-schweinlicher faktor viii | |
| DE3520228C2 (de) | Wasserlösliche bioaktive Trockenfeststoffzusammensetzung, Verfahren zu ihrer Herstellung und sie enthaltende pharmazeutische Präparate | |
| DE60024268T2 (de) | Zusammensetzungen mit stabilem faktor viii | |
| DE69828462T2 (de) | Verwendung von APC, in Kombination mit Blutplättchenaggregationshemmer, zur Behandlung thrombothischer Störungen | |
| EP0796623A2 (de) | Pharmazeutisches Präparat zur Behandlung von Blutgerinnungs-störungen | |
| EP0382174A1 (de) | Gewebs-Plasminogenaktivator-Derivat | |
| DE68929388T2 (de) | Aus Harn isolierte antikoagulierende Verbindung | |
| DE102006008613A1 (de) | Stabilisierte Zubereitungen von Serin-Endopeptidasen, deren Herstellung und Verwendung | |
| DE2734427C3 (de) | Verfahren zur Gewinnung von thrombinartigen Enzymen aus Schlangengiften | |
| DE69906568T2 (de) | Behandlung von hämorrhagischem virusfieber mit protein c | |
| AT409334B (de) | Pharmazeutisches präparat enthaltend vitamin k-abhängige einzelfaktoren | |
| DE69425581T2 (de) | Methode zur stabilisierung von protein c oder aktiviertem protein c und stabilisierte verbindungen | |
| DE69833727T2 (de) | Verfahren zur Behandlung der Gefässerkrankungen mit aktiviertem Protein C | |
| DE69905489T2 (de) | Protein c zur behandlung von sichelzellanämie und thalassämie | |
| DE69930419T2 (de) | Verwendung von menschliche protein c zur herstellung eines arzneimittels zur behandlung von heparininduzierter thrombozytopenie | |
| DE69127757T2 (de) | Thrombolytisches peptid, seine produktion und thrombolisches agens | |
| AT405740B (de) | Von willebrand-faktor-derivat sowie ein verfahren zur isolierung von proteinen | |
| US20050143283A1 (en) | Activated protein c formulations | |
| DE69916493T2 (de) | Verwendung von protein c zur behandlung von thrombozytopenischer purpura und hämolytisches urämisches syndrom | |
| JP7237085B2 (ja) | 凝固異常を伴う敗血症の治療及び/又は改善のための医薬 | |
| AT408612B (de) | Verwendung von mindestens 2 gerinnungsfaktoren zur herstellung eines pharmazeutischen präparats |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8328 | Change in the person/name/address of the agent |
Representative=s name: KROHER, STROBEL RECHTS- UND PATENTANWAELTE, 80336 |
|
| 8328 | Change in the person/name/address of the agent |
Representative=s name: DR. SCHOEN & PARTNER, 80336 MUENCHEN |