-
Die
vorliegende Erfindung bezieht sich auf die Verwendung von Trioxepanverbindungen
oder substituierten 1,2,4-Trioxacycloheptanen in einem Verfahren
zur Herstellung von Acryl(co)polymeren, vorzugsweise Acrylharzen
mit hohem Feststoffgehalt, styrolischen (Co)polymeren und/oder ethylenischen
(Co)polymeren, vorzugsweise Polyethylen geringer Dichte (LDPE).
-
Acrylharze
mit hohem Feststoffgehalt sind Harze, die typischerweise in Beschichtungszusammensetzungen
verwendet werden. Aus Umweltschutzgründen setzen solche Beschichtungszusammensetzungen vorzugsweise
so wenig wie möglich
flüchtige
Stoffe frei, wenn sie verwendet werden. Um dies zu erreichen, werden
Harze benötigt,
die so wenig wie möglich
von einem oder mehreren Lösungsmitteln
enthalten. Um die Beschichtungszusammensetzungen handhaben zu können, insbesondere
wenn sie gesprüht
werden sollen, müssen
typischerweise acrylische Harzzusammensetzungen mit einem geringen
Molekulargewicht verwendet werden, so dass eine geringe Lösungsviskosität erhalten
wird. In der Praxis bedeutet dies, dass in diesen Beschichtungszusammensetzungen
häufig
Acrylharze mit einem niedrigen Molekulargewicht und einer engen Molekulargewichtsverteilung
verwendet werden. Ein Beispiel für
Verfahren, bei denen solche speziellen Beschichtungsharze mit hohem
Feststoffgehalt hergestellt werden, findet man in WO 96/27620. In
dieser Patentanmeldung wird die Verwendung spezieller cyclischer
Ketonperoxide offenbart. Ähnlich
offenbart WO 00/08072 die Verwendung von speziellen Dialkylverbindungen,
um die Acrylharze mit hohem Feststoffgehalt zu erhalten. Es besteht
jedoch ein Bedürfnis
nach weiteren alternativen Verfahren. In diesen alternativen Verfahren
wird vorzugsweise ein Peroxid verwendet, das nicht phlegmatisiert
zu werden braucht, so dass die hohe Menge an Peroxid, die verwendet
wird, kein unerwünschtes
Lösungsmittel einführt, wie
Lösungsmittel,
die den Siedepunkt des Polymerisationsmediums verändern.
-
US 3,517,032 offenbart die
Synthese von organischen Trioxiden, d. h. Verbindungen der Art R-O-O-O-R,
und die Verwendung dieser speziellen Trioxyverbindungen als Katalysatoren
für die
Polymerisation von ungesättigten
Monomeren, wie Vinylestern und Halogeniden.
-
Für die Herstellung
von styrolischen Harzen wird typischerweise Styrol mit Hilfe eines
radikalisch induzierten Verfahrens (co)polymerisiert. Die Radikale
können
mittels eines thermischen Verfahrens gebildet werden, wobei vermutet
wird, dass Styrol zuerst dimerisiert und anschließend mit
einem dritten Monomermolekül
Radikale bildet. Um den Reaktorausstoß zu erhöhen und eine bessere Kontrolle über das
Molekulargewicht des Polymers zu gewinnen, werden jedoch häufig ein
oder mehrere Peroxide als Quelle für Radikale verwendet. Typischerweise
wird ein Peroxid gesucht, dass ein Polymer mit einem hohen Molekulargewicht
erzeugt, im Vergleich zu Polymeren, die mit anderen Peroxiden unter ähnlichen
Bedingungen erzeugt werden. Solche Peroxide können in größeren Mengen verwendet werden,
was die Polymerisationsgeschwindigkeit erhöht, womit eine Reduktion des
Molekulargewichts des Harzes einhergeht. Daher kann dasselbe Polymer
wie vorher mit einer erhöhten
Polymerisationsgeschwindigkeit hergestellt werden, was zu einer
erhöhten
Reaktor-Raum-Zeit-Ausbeute führt.
Aus diesem Grund werden difunktionelle Peroxide, Peroxide mit zwei
Persauerstoffbindungen in einem Molekül, oder Peroxide, die eine
kontrollierte Vernetzung bewirken, für die Verwendung in Betracht
gezogen oder werden in herkömmlichen
Styrolpolymerisationsverfahren verwendet. Es werden jedoch noch
alternative Polymerisationssysteme gewünscht, vorzugsweise solche,
die eine weitere Erhöhung
der Reaktor-Raum-Zeit-Ausbeute ermöglichen. Um eine unerwünschte Kontaminierung
des endgültigen Harzes
zu vermeiden, enthalten die alternativen Peroxide vorzugsweise weniger
als 25 Gew.-%, besonders bevorzugt weniger als 20 Gew.-%, ganz besonders
bevorzugt weniger als 10 Gew.-%, eines Phlegmatisators, bezogen
auf das Gewicht der endgültigen Zubereitung.
Je nach der Situation kann es am meisten bevorzugt sein, eine Peroxid-Zubereitung
zu haben, die im Wesentlichen frei von Phlegmatisator ist.
-
Ähnlich besteht
auch ein Bedürfnis
nach einem Peroxid-initiierten Verfahren, bei dem Ethylen-(Co)polymere
hergestellt werden, die einen reduzierten Gehalt an Phlegmatisator
aufweisen und/oder die hocheffiziente Peroxide verwenden.
-
Die
vorliegende Erfindung bezieht sich auf alternative Verfahren, bei
denen ein spezieller Typ von Peroxid verwendet wird. Es zeigte sich,
dass bei diesen Verfahren das Molekulargewicht des resultierenden
Harzes genau gesteuert werden konnte, dass die Polymerausbeute sehr
hoch war und dass einige Verfahren zu einem farblosen Produkt führten. Insbesondere
bezieht sich die vorliegende Erfindung auf ein Verfahren, bei dem
ein oder mehrere Monomere polymerisiert werden, wobei man wenigstens
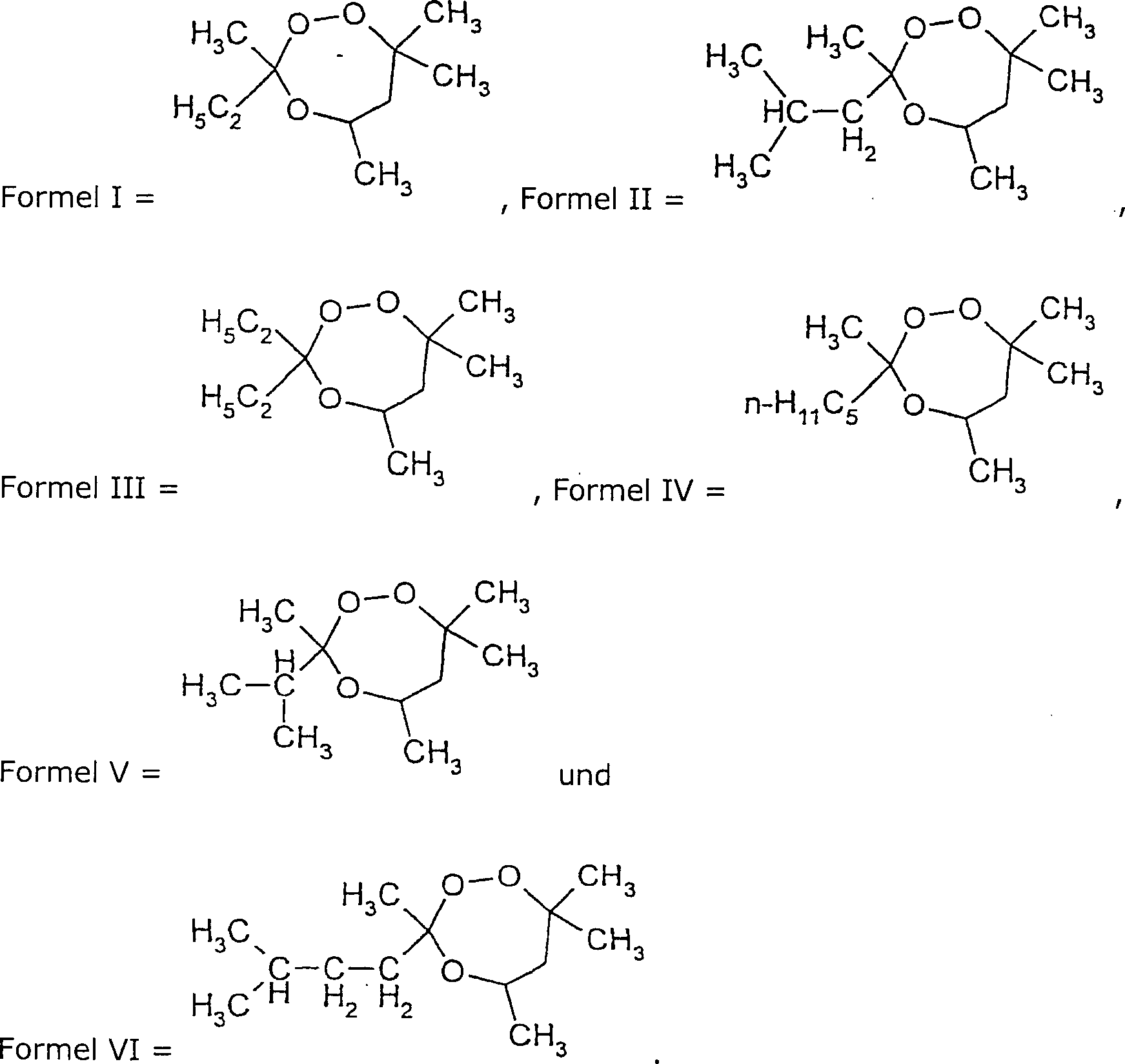
einen Initiator verwendet, der aus Trioxepanverbindungen der Formel
I
ausgewählt sind, wobei R
1–3 unabhängig aus
Wasserstoff und substituierten oder unsubstituierten Kohlenwasserstoffgruppen
ausgewählt
sind, wobei zwei der Gruppen R
1–3 unter
Bildung einer Ringstruktur miteinander verknüpft sein können. Vorzugsweise sind R
1–3 unabhängig aus
der Gruppe ausgewählt,
die aus Wasserstoff und substituiertem oder unsubstituiertem C
1-C
20-Alkyl, C
3-C
20-Cycloalkyl, C
6-C
20-Aryl, C
7-C
20-Aralkyl und C
7-C
20-Alkaryl besteht,
wobei diese Gruppen lineare oder verzweigte Alkyleinheiten enthalten
können,
wobei zwei der Gruppen R
1–3 unter Bildung eines
(substituierten) Cycloalkylrings miteinander verknüpft sein
können, wobei
die wahlfreien ein oder mehreren Substituenten an R
1 bis
R
3 jeweils aus der Gruppe ausgewählt sind, die
aus Hydroxy, Alkoxy, linearem oder verzweigtem Alk(en)yl, Aryloxy,
Halogen, Carbonsäure,
Ester, Carboxy, Nitril und Amido besteht. Vorzugsweise sind R
1 und R
3 aus Niederal kylgruppen,
wie Methyl, Ethyl und Isopropyl, ausgewählt, wobei Methyl und Ethyl
am meisten bevorzugt sind. R
2 ist vorzugsweise
aus Wasserstoff, Methyl, Ethyl, Isopropyl, Isobutyl, tert-Butyl,
Amyl, Isoamyl, Cyclohexyl, Phenyl, CH
3C(O)CH
2-, C
2H
5OC(O)CH
2-, HOC(CH
3)
2CH
2- und
ausgewählt, wobei R
4 unabhängig aus
der Gruppe von Verbindungen ausgewählt ist, die für R
1–3 angegeben sind,
oder R
1 und R
2 unter
Bildung eines substituierten oder unsubstituierten Cycloalkylrings
miteinander verknüpft
sind. Ein weiteres bevorzugtes Produkt ist
-
-
Eine
erste Gruppe von bevorzugten Verfahren gemäß der Erfindung sind die Polymerisationsverfahren zur
Herstellung von Acrylatharzen mit hohem Feststoffgehalt. Diese Verfahren
sind vom herkömmlichen
Typ, zum Beispiel in Masse, Suspension, Emulsion oder Lösung, außer dass
wenigstens ein Peroxid, wie es oben beschrieben ist, verwendet wird.
Vorzugsweise wird eine Lösungspolymerisation
verwendet.
-
Eine
zweite Gruppe von bevorzugten Polymerisationsverfahren gemäß der Erfindung
sind die Styrol-Polymerisationsverfahren, bei denen es sich bei
wenigstens 40 Gew.-% des Monomers um Styrol handelt. Das Verfahren
ist in Anspruch 5 definiert. Zu diesen Verfahren gehören die
Herstellung von Copolymeren, wie Poly(styrol-acrylnitril) (SAN),
und kautschukmodifizierte Polymere, wie Methacrylat-Butadien-Styrol
(MBS) und stoßfeste
Polystyrolharze (HIPS), wie in der Technik bekannt ist. Die Verfahren
können
durch Massen-, Suspensions-, Emulsions- oder Lösungspolymerisationsverfahren
durchgeführt
werden, wie in der Technik bekannt ist. Am meisten bevorzugt innerhalb
dieser zweiten Gruppe von Verfahren sind Massenpolymerisationsverfahren
und/oder Suspensions/Massen-Verfahren, bei denen zuerst ein Teil
der Polymerisation in Suspension durchgeführt wird, woraufhin das Reaktionsgemisch
einem Massenverfahren zugeführt
wird. In diesen am meisten bevorzugten Verfahren wird typischerweise
Standard-Polystyrol (GPPS) und/oder HIPS erzeugt.
-
Eine
dritte Gruppe von bevorzugten Polymerisationsverfahren sind die
Hochdruck-Polymerisationsverfahren, bei denen Ethylen bei Drücken im
Bereich von 500 bis 4000 bar radikalisch (co)polymerisiert wird. Bei
diesen Verfahren wird erwartet, dass die einzigartigen Eigenschaften
der Peroxide gemäß der Erfindung sehr
effiziente Polymerisationsreaktionen mit einer verbesserten Steuerung
des Molekulargewichts des resultierenden Polyethylen- oder Ethylen-Copolymers
ermöglichen.
-
Typischerweise
liegt die Polymerisationstemperatur für alle diese Verfahren im Bereich
von Umgebungstemperatur bis 400°C,
vorzugsweise 40 bis 350°C.
Es ist auch möglich,
die Polymerisation unter Verwendung eines Temperaturprofils durchzuführen, z.
B. die Anfangspolymerisation unterhalb von 100°C durchzuführen und dann die Temperatur über 100°C anzuheben,
um die Polymerisation zu beenden. Bei Lösungspolymerisationsverfahren
wird die Polymerisation häufig
bei der Rückflusstemperatur
des Lösungsmittels
oder Lösungsmittelgemischs
durchgeführt.
Diese Variationen sind dem Fachmann alle bekannt, der keine Schwierigkeit
haben wird, die Reaktionsbedingungen je nach dem besonderen Polymerisationsverfahren
und dem speziellen verwendeten Radikalpolymerisationsstarter entsprechend
auszuwählen.
Die Trioxepane sind jedoch zur Verwendung bei Hochtemperatur-Polymerisationsverfahren
hervorragend geeignet, insbesondere solche, bei denen die Temperatur
höher als
140°C, besonders
bevorzugt höher
als 165°C,
ist, wo herkömmliche
Peroxide zu reaktiv sind, was zu schlechten Ausbeuten führt.
-
Geeignete
(Co)monomere zur Herstellung von Beschichtungsharzen auf Lösungsmittelbasis
mit hohem Feststoffgehalt sind olefinische oder ethylenisch ungesättigte Monomere,
zum Beispiel substituierte oder unsubstituierte vinylaromatische
Monomere, einschließlich
Styrol, α-Methylstyrol,
p-Methylstyrol und halogenierten Styrolen, Divinylbenzol, Ethylen,
ethylenisch ungesättigte
Carbonsäuren
und Derivate davon, wie (Meth)acrylsäuren, (Meth)acrylsäureester,
(Meth)acrylsäure,
Methoxyethylacrylat, Dimethylamino(meth)acrylat, Isobutylmethacrylat,
Laurylmethacrylat, Stearylmethacrylat, Allylmethacrylat, 2-Hydroxypropyl(meth)acrylat,
Methacrylamid, z. B. Butyl(meth)acrylat, 2-Ethylhexyl(meth)acrylat,
2-Ethylhexyl(meth)acrylat, 2-Hydroxyethyl(meth)acrylat und Glycidyl(meth)acrylat,
Methyl(meth)acrylat und Ethyl(meth)acrylat, ethylenisch ungesättigte Nitrile
und Amide, wie Acrylnitril, Methacrylnitril und Acrylamid, substituierte
oder unsubstituierte ethylenisch ungesättigte Monomere, wie Butadien,
Isopren und Chloropren, Vinylester, wie Vinylacetat und Vinylpropionat
und Vinylester von Versatic Acid, ethylenisch ungesättigte Dicarbonsäuren und
ihre Derivate einschließlich
Mono- und Diestern, Anhydriden und Imiden, wie Maleinsäureanhydrid,
Citraconsäureanhydrid,
Citraconsäure,
Itaconsäure,
5-Norbornen-2,3-dicarbonsäureanhydrid,
Maleinsäure,
Fumarsäure,
Aryl-, Alkyl- und
Aralkylcitraconimide und -maleimide, Vinylhalogenide, wie Vinylchlorid und
Vinylidenchlorid, Vinylether, wie Methylvinylether und n-Butylvinylether,
Olefine, wie Ethylen, Isobuten und 4-Methylpenten, Allylverbindungen,
wie (Di)allylester, zum Beispiel Diallylphthalate, (Di)allylcarbonate
und Triallyl(iso)cyanurat. Monomere wie Methacrylsäure, Diethylaminoethylmethacrylat,
Dimethylaminoethylmethacrylat, tertiär-Butylaminoethylmethacrylat
und 3-(2-Methacryloxyethyl)-2,2-spirocylohexyloxazoliden können verwendet
werden, um die Haftungseigenschaften der endgültigen Beschichtungszusammensetzungen zu
modifizieren.
-
Im
Allgemeinen müssen
die Acrylharze mit dem hohen Feststoffgehalt chemisch aktive Gruppen
(üblicherweise
Hydroxy- oder Carboxyfunktionen) enthalten, um einen Molekulargewichtszuwachs
und Netzwerkbildung während
der endgültigen
Vernetzungsreaktion (Härtungsreaktion)
zu erfahren, wenn die Beschichtungszusammensetzung auf die zu beschichtende
Oberfläche
aufgetragen wird. Da Melamin oder Isocyanate häufig als Härtungsmittel verwendet werden,
ist es typischerweise wünschenswert,
dass das Acrylharz mit dem hohen Feststoffgehalt einen Hydroxygehalt
von 2 bis 7 Gew.-% hat. Um ein Polymer herzustellen, das einen Hydroxygehalt
von 2–7
Gew.-% hat, wird eine ausreichende Menge Hydroxyalkylacrylat oder
-methacrylat verwendet (normalerweise 20–40 Gew.-% der Monomerzusammensetzung),
und/oder ein Initiator, der solche funktionellen Gruppen in das
Harz einführt,
wird verwendet. Aus diesem Grund kann die Verwendung von Trioxepanverbindungen
mit Hydroxygruppen bevorzugt sein. Es können jedoch auch andere funktionelle
Gruppen, wie Carbonsäuregruppen,
verwendet werden.
-
Beispiele
für Hydroxyalkylacrylate
und -methacrylate, die verwendet werden können, um solche funktionellen
Polymere herzustellen, sind: 2-Hydroxyethyl(meth)acrylat, 2-Hydroxypropyl(meth)acrylat,
2-Hydroxybutyl(meth)acrylat, 3-Hydroxypropyl(meth)acrylat
und 4-Hydroxybutyl(meth)acrylat. Die zu verwendende Menge dieser
funktionellen (Co)monomere hängt
vom gewünschten
Hydroxywert des endgültigen
Harzes und von der Art des verwendeten Initiators ab, worüber sich
der Fachmann im Klaren sein wird.
-
Zu
den bevorzugten Comonomeren, die zur Herstellung der Acrylharze
mit hohem Feststoffgehalt verwendet werden können, gehören: Methyl(meth)acrylat, Ethyl(meth)acrylat,
Butyl(meth)acrylat, Isobutyl(meth)acrylat, Hexyl(meth)acrylat, 2-Ethylhexyl(meth)acrylat,
Lauryl(meth)acrylat, Propyl(meth)acrylat, Isopropyl(meth)acrylat,
Styrol, para-Methylstyrol, (Meth)acrylsäure und Vinylacetat.
-
Die
Comonomere, die im herkömmlichen
Styrol-Polymerisationsverfahren der zweiten bevorzugten Gruppe von
Polymerisationen verwendet werden können, sind vom herkömmlichen
Typ; dazu gehören
Monomere wie (M)ethyl(meth)acrylat, Acrylnitril, Vinylpyridin und
vernetzende Comonomere, wie Divinylbenzol und Triallylisocyanurat.
Wie oben erwähnt,
können
während
des Polymerisationsvorgangs auch Kautschuke vorhanden sein, wobei
Styrol auf diesen Kau tschuk gepfropft wird, wie bei Verfahren zur
Herstellung von HIPS, MBS und Acrylnitril-Styrol-Butadien-Kautschuk-(ABS)-Harzen.
-
Die
Comonomere, die in der dritten bevorzugten Gruppe von Polymerisationsverfahren
verwendet werden können,
sind vom herkömmlichen
Typ; dazu gehören
Alkene, wie Hexen und Octen, Vinylacetat und Acrylsäure.
-
Die
Menge des Initiators, die bei einem dieser Verfahren verwendet wird,
variiert in Abhängigkeit
von der Polymerisationstemperatur, der Fähigkeit der Ableitung der Polymerisationswärme, den
Arten der verwendeten Monomere und gegebenenfalls dem ausgeübten Druck.
Gewöhnlich
werden 0,001–25
Gew.-% Initiator eingesetzt, bezogen auf das Gesamtgewicht der Monomere.
Vorzugsweise werden 0,001–15
Gew.-% Initiator eingesetzt.
-
Geeignete
Lösungsmittel
zur Verwendung in einem Lösungsmittelpolymerisationsverfahren
sind zum Beispiel Toluol, Xylol, Tetrahydronaphthalin, Ethylacetat,
Methoxypropylacetat, n-Butylacetat, Oxohexylacetat, Oxoheptylacetat,
Propylenglycolmethyletheracetat, Butylglycolacetat, Ethylethoxypropionat,
Aceton, Acetylaceton, Methylethylketon, Methylisobutylketon, Methyl-n-amylketon,
Methylisoamylketon, Ethylalkohol, Isopropanol, Butanol, Benzylalkohol,
Diacetonalkohol, Methoxypropanal, Lösungsbenzin, andere aliphatische,
cycloaliphatische und/oder aromatische Kohlenwasserstoffe, z. B.
Solvesso 100®,
Ester, wie Exxate 700®, Ether, Ketone, Alkohole
und Gemische davon, die herkömmlicherweise
verwendet werden. Es sei angemerkt, dass bei Massen-GPPS- und HIPS-Verfahren
typischerweise Ethylbenzol als Lösungsmittel
verwendet wird. Herkömmlicherweise
sind die primären
Faktoren bei der Auswahl eines geeigneten Lösungsmittels die Kosten, Toxizität, Entzündbarkeit,
Flüchtigkeit
und Kettenübertragungswirkung.
-
Es
sei angemerkt, dass bestimmte Trioxepane bekannt sind. Siehe zum
Beispiel Kirk & Othmer,
Encyclopedia of Chem. Tech., 3. Aufl., Vol. 17, Seite 57, das ein
1,2,4-Trioxacycloheptan der Formel
offenbart.
-
WO
98/50354 offenbart vier verwandte Trioxepanverbindungen einschließlich des
Produkts der Formel
und lehrt die Verwendung
dieser Verbindungen zusammen mit einem Coagens in Vernetzungsverfahren.
Das vorliegend beanspruchte Verfahren erstreckt sich nicht auf Verfahren,
bei denen Duromere oder nichtthermoplastische Elastomere gebildet
werden. Die Ausdrücke
werden in ihrer herkömmlichen
Bedeutung verwendet, wie es zum Beispiel in Kapitel 1.3 von W. Hofmann,
Rubber Technology Handbook (Carl Hanser Verlag, 1989), offenbart
ist.
-
US 3,517,032 offenbart,
dass
in einem Verfahren zur Herstellung
eines cyclischen Trioxids der Formel 4,4,7,7-Tetramethyl-1,2,3-trioxyacycloheptan
gebildet werden kann. Es heißt,
das cyclische Trioxid sei als Polymerisationskatalysator geeignet.
Es gibt keine Offenbarung, dass das kontaminierende Trioxepan zu
diesem Zweck verwendet werden kann.
-
Die
Trioxepane zur Verwendung gemäß der vorliegenden
Erfindung können
zum Beispiel in herkömmlicher
Weise synthetisiert werden, indem man HOC(CH3)HCH2C(CH3)2OOH
mit einem Keton umsetzt, typischerweise in Gegenwart eines Katalysators
und mit anschließenden
Reinigungsschritten. Ein solches Verfahren ist zum Beispiel in WO
98/50354 offenbart (siehe Beispiel 1).
-
Zu
den geeigneten Ketonen zur Verwendung bei der Synthese der vorliegenden
Peroxide gehören zum
Beispiel Aceton, Acetophenon, Methyl-n-amylketon, Ethylbutylketon,
Ethylpropylketon, Methylisoamylketon, Methylheptylketon, Methylhexylketon,
Ethylamylketon, Dimethylketon, Diethylketon, Dipropylketon, Methylethylketon,
Methylisobutylketon, Methylisopropylketon, Methylpropylketon, Methyl-t-butylketon,
Isobutylheptylketon, Diisobutylketon, 2,4-Pentandion, 2,4-Hexandion,
2,4-Heptandion, 3,5-Heptandion, 3,5-Octandion, 5-Methyl-2,4-hexandion, 2,6-Dimethyl-3,5-heptandion,
2,4-Octandion, 5,5-Dimethyl-2,4-hexandion,
6-Methyl-2,4-heptandion, 1-Phenyl-1,3-butandion, 1-Phenyl-1,3-pentandion, 1,3-Diphenyl-1,3-propandion,
1-Phenyl-2,4-pentandion, Methylbenzylketon, Phenylmethylketon, Phenylethylketon,
Methylchlormethylketon, Methylbrommethylketon und Kopplungsprodukte
davon. Selbstverständlich
können
auch andere Ketone mit den geeigneten R-Gruppen, die den Peroxiden
der Formel I entsprechen, wie Verbindungen der Formel HORC(O)ROH,
sowie Gemische von zwei oder mehr verschiedenen Ketonen eingesetzt
werden.
-
Beispiele
für bevorzugte
Ketone sind Aceton, Methylethylketon (jedes Isomer), Diethylketon
(jedes Isomer), Methylpropylketon (jedes Isomer), Methylbutylketon
(jedes Isomer), Methylamylketon (jedes Isomer), Methylhexylketon
(jedes Isomer), Methylheptylketon (jedes Isomer), Ethylpropylketon
(jedes Isomer), Ethylbutylketon (jedes Isomer), Ethylamylketon (jedes
Isomer), Ethylhexylketon (jedes Isomer), Cyclohexanon, Acetylaceton,
Ethylacetoacetat, Diacetonalkohol und Gemische davon.
-
Die
Peroxide können
als solche oder in Form von Pulvern, Granulaten, Pellets, Pastillen,
Flocken, Blöcken,
Pasten und Lösungen
hergestellt, transportiert, gelagert und angewendet werden. Falls
notwendig, können
diese Zubereitungen je nach dem besonderen Peroxid und seiner Konzentration
in der Zubereitung gegebenenfalls phlegmatisiert werden. Vorzugsweise
werden die Peroxide in einer solchen Form verwendet, dass es sich
bei wenigstens 50 Gew.-%, besonders bevorzugt wenigstens 75 Gew.-%,
ganz besonders bevorzugt mehr als 85 Gew.-%, der Peroxidzubereitung
um eines oder mehrere der Trioxepane gemäß der Erfindung handelt. Am
meisten bevorzugt wird das Peroxid in seiner technisch reinen Form
verwendet.
-
Der
Ausdruck "hoher
Feststoffgehalt" wird
verwendet, um Harzzusammensetzungen zu bezeichnen, die wenigstens
50 Gew.-% Feststoffe (nichtflüchtige
Substanz) enthalten, bezogen auf das Gesamtgewicht der Harzzusammensetzung.
Besonders bevorzugt enthalten sie mehr als 60 Gew.-%, am meisten
bevorzugt mehr als 70 Gew.-%, Feststoffe.
-
Der
Ausdruck "niedriges
Molekulargewicht" wird
verwendet, um (Co)polymere mit einem Molekulargewicht von unter
50000, vorzugsweise unter 25000, besonders bevorzugt unter 15000
Dalton, zu bezeichnen.
-
Während der
Polymerisationsverfahren der vorliegenden Erfindung können die üblichen
Additive in herkömmlichen
Mengen eingesetzt werden. Beispiele für solche Additive sind Kettenübertragungsmittel,
wie Thiole, Disulfide und/oder CCl4.
-
Beschichtungszusammensetzungen
auf der Basis der Acrylharze mit dem hohen Feststoffgehalt, wie sie
gemäß der Erfindung
hergestellt werden, umfassen die herkömmlichen Härtungsmittel und können herkömmliche
Additive, wie Stabilisatoren, Tenside, UV-Absorber, Katalysatorenblocker,
Antioxidantien, Pigmentdispergiermittel, Fließverbesserer, Viskositätsmodifikatoren,
Verlaufmittel und Lösungsmittel
umfassen. Solche Additive für
die Beschichtungszusammenset zungen können in dem Verfahren gemäß der Erfindung
vorhanden sein, wenn sie den Polymerisationsvorgang nicht beeinträchtigen.
-
Experimentelles
-
Verwendete Chemikalien
-
- Styrol von Merck (vor der Verwendung destilliert)
- Dichlormethan von Baker
- Solvesso® 100
und Exxate® 700
von ExxonMobil
- Trigonox® 301
von Akzo Nobel (cyclisches Methylethylketonperoxid 41% in Phlegmatisator)
- Trigonox® 22
von Akzo Nobel (1,1-di(tert-butylperoxy)cyclohexan in Phlegmatisator)
- Trigonox® B
von Akzo Nobel (Di-tert-butylperoxid)
-
Alle
anderen verwendeten Chemikalien wurden von Acros Chemicals, p. a.,
geliefert und ohne weitere Reinigung verwendet.
-
Das
Molekulargewicht (die Molekulargewichtsverteilung) von Polymeren
wurde in herkömmlicher
Weise bestimmt, wobei man eine Waters-510-HPLC-Pumpe, die üblichen
Säulen
und Nachweisgeräte
sowie Polystyrolstandards verwendete.
-
Der
Polymerisationsgrad wurde bestimmt, indem man die Menge des nicht
umgesetzten Monomers in herkömmlicher
Weise durch Gaschromatographie bestimmte.
-
Beispiele 1 bis 10 und
Vergleichsbeispiele A bis D
-
In
diesen Beispielen werden Acrylate in einem Lösungsmittel polymerisiert,
wobei man einen ummantelten Glasreaktor mit einem Durchmesser von
60 mm und einer Höhe
von 80 mm verwendete, der mit einem Turborührer, einem Rückflusskühler und
einem Injektionsanschluss ausgestattet war.
-
Lösungsmittel
(40 g) wurde zu dem Reaktor gegeben. Die Temperatur wurde so eingestellt,
dass das in dem Experiment verwendete Peroxid eine Halbwertszeit
von 15 Minuten bei dieser Temperatur hat. Für Polymerisationstemperaturen
von bis zu einschließlich
126°C wurde
Butylacetat als Lösungsmittel
verwendet. Für
Polymerisationen von 126 bis einschließlich 165°C wurde Solvesso® 100
verwendet, Exxate® 700 wurde für Polymerisationen
bei einer Temperatur von 165–200°C verwendet,
und Ethylnonanoat wurde für
Polymerisationen bei 220°C
verwendet.
-
Stickstoff
wurde verwendet, um sauerstofffreie Polymerisationsbedingungen zu
erhalten.
-
Monomere
(40 g Butylacrylat, 28 g Hydroxyethylmethacrylat, 20 g Styrol, 10
g Methylmethacrylat und 2 g Methacrylsäure) und 30 mÄq. (30 mmol
für eine
Verbindung mit einer O-O-Bindung pro Molekül, 15 mmol für eine Verbindung
mit zwei O-O-Bindungen pro Molekül
usw.) Initiator wurden über
einen Zeitraum von vier Stunden unter Verwendung einer Watson-Marlow-Pumpe
in den Reaktor eindosiert. Danach wurde die Polymerisation eine
weitere Stunde bei derselben Temperatur fortgesetzt.
-
Das
resultierende Polymer wurde in herkömmlicher Weise analysiert.
Die Molekulargewichte wurden durch HP-SEC bestimmt, wobei Polystyrolstandards
verwendet wurden. Der Feststoffgehalt des entstandenen Harzes wurde
durch gravimetrische Analyse bestimmt, indem man etwa 1 g Harz genau
abwog, diese Probe in etwa 10 g Toluol auflöste und anschließend 4 Stunden
lang bei 125°C
in einem Ofen mit Luftumwälzung trocknete.
Nach dem Abkühlen
der Probe ist das Gewicht des restlichen Materials dividiert durch
das Gewicht der ursprünglichen
Probe der Feststoffgehalt. Die Viskosität wurde unter Verwendung eines
Brookfield-Viscometers
bei 25°C
gemessen.
-
Das
Referenzprodukt "cyclisches
MIAKP" wurde an
Ort und Stelle unter Verwendung des für die Zusammensetzung V in
WO 96/03397 angegebenen Verfahrens hergestellt, aber unter Verwendung
von Isoamylketon anstelle von Isobutylketon. Diese Verbindung sowie
das kommerzielle Produkt Trigonox® 301
werden als repräsentativ
für moderne
Polymerisationsinitiatoren für
Acrylat mit hohem Feststoffgehalt angesehen. Das cyclische MIAKP
war phlegmatisiert und enthielt 67,3 Gew.-% Peroxid. Die Trioxepane
gemäß der Erfindung waren
in technisch reiner Form und enthielten mehr als 95 Gew.-% Peroxid.
Die folgenden Produkte wurden verwendet:
-
-
Die
Ergebnisse werden im Folgenden vorgestellt:
-
-
Diese
Ergebnisse zeigen, dass die Trioxepane gemäß der Erfindung sehr effiziente
Initiatoren zur Herstellung von Acrylatharzen mit niedrigem Molekulargewicht
und hohem Feststoffgehalt, die eine enge Molekulargewichtsverteilung
haben, in hoher Ausbeute sind. Weiterhin könnten diese Produkte verwendet
werden, ohne dass Phlegmatisatoren notwendig sind. Aus unbekannten
Gründen
ergaben die Produkte der Beispiele 7 und 8 ein farbloses Harz, während die
Farbe der anderen Harze von einem leichten bis zu einem deutlicheren Gelb
variierte.
-
Beispiel 11 und Vergleichsbeispiel
E
-
Glasampullen
(2,5 ml) wurden mit etwa 1,3 g des Initiator/Styrol-Gemischs (0,75
Milliäquivalente
Initiator, das sind 0,75 mmol in Beispiel 7 und 0,375 mmol in Beispiel
C, pro 100 g Styrol) gefüllt
und in Trockeneis gelegt, so dass das Gemisch auf etwa –70°C gekühlt wurde.
Die Luft oberhalb des gefrorenen Gemischs wurde mit Stickstoff ausgespült, und
die Ampullen wurden zugeschmolzen. Die Ampullen wurden in ein Ölbad mit
einer Temperatur von 120°C
gegeben, damit der Inhalt polymerisieren konnte. Die Ampullen wurden
nach 2, 4, 6 und 8 Stunden aus dem Bad genommen. Nach der Entnahme
aus dem Bad wurden sie gereinigt, aufgebrochen, in einen 100-ml-Spitzkolben übergeführt, und
der Inhalt wurde während
wenigstens 48 Stunden in 20 ml Dichlormethan sich auflösen gelassen.
Das Dichlormethan enthielt 25 g n-Butylbenzol und 6,25 g butyliertes Hydroxytoluol
pro 2500 ml Dichlormethan als internen Standard für die anschließende GC-Analyse bzw. Antioxidans.
Nach dem Auflösen
wurden die Umsetzung von Styrol zu Polystyrol und das Molekulargewicht
des Polystyrols in herkömmlicher
Weise unter Verwendung von GC- bzw. GPC-Technik bestimmt.
-
Die
folgende Tabelle zeigt die Umsetzung von Styrol und das Gewichtsmittel
des Molekulargewichts (Mw) des Harzes, wie sie nach 2, 4, 6 und
8 Stunden Polymerisationszeit beobachtet wurden.
-
-
Beispiel 12 und Vergleichsbeispiel
F
-
In
den Beispielen 12 und F wurden die Experimente der Beispiele 11
und E wiederholt, aber die Polymerisation wurde bei 140°C ausgeführt.
-
-
Aus
den Beispielen 11, 12, E und F folgt, dass das Produkt gemäß der Erfindung
im Vergleich zu einem herkömmlichen
Peroxid, wie Trigonox® 22, bei gleicher Umsetzung
sehr hohe Ausbeuten an Polystyrol und ein wünschenswertes höheres Molekulargewicht
ergibt.