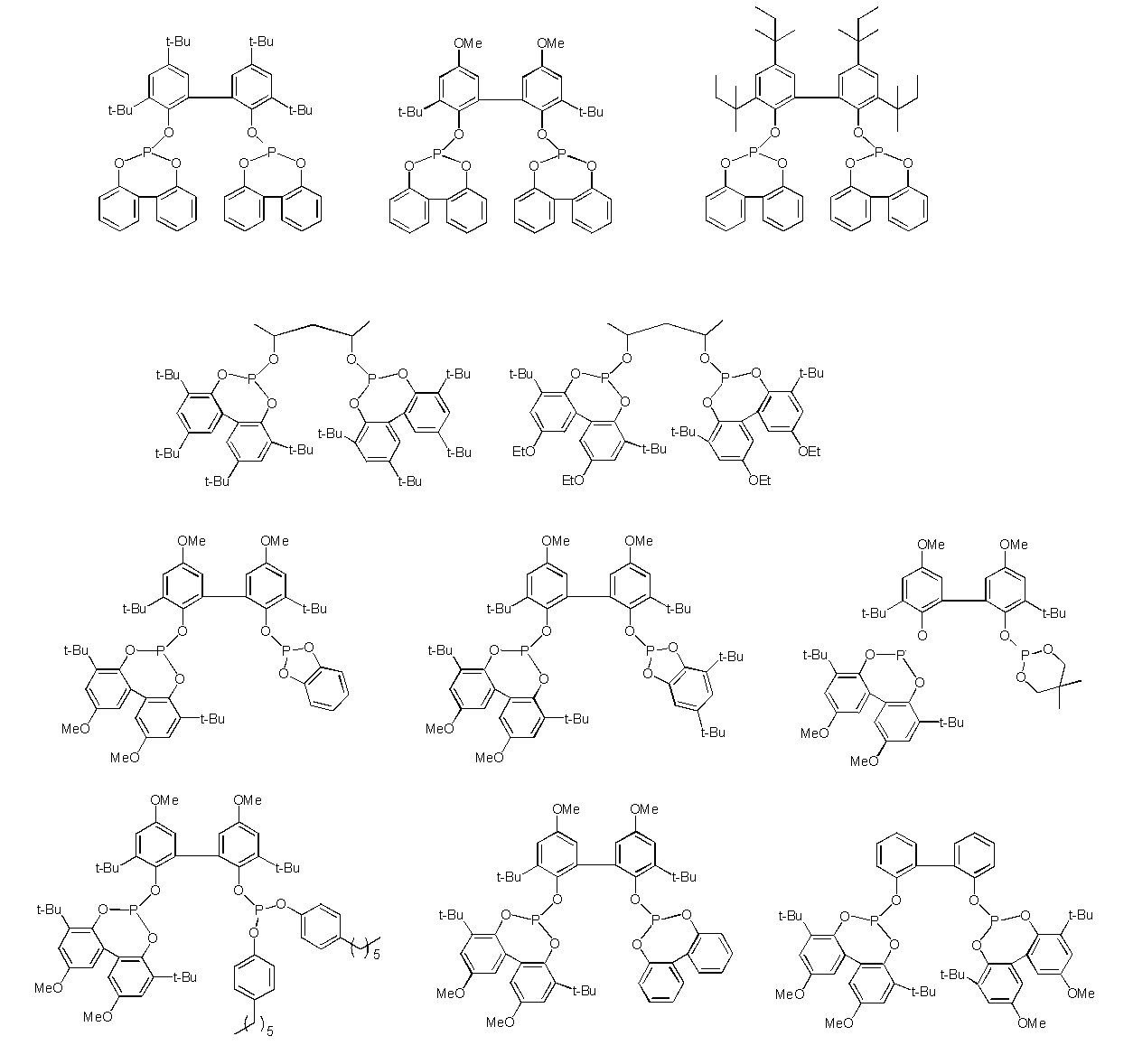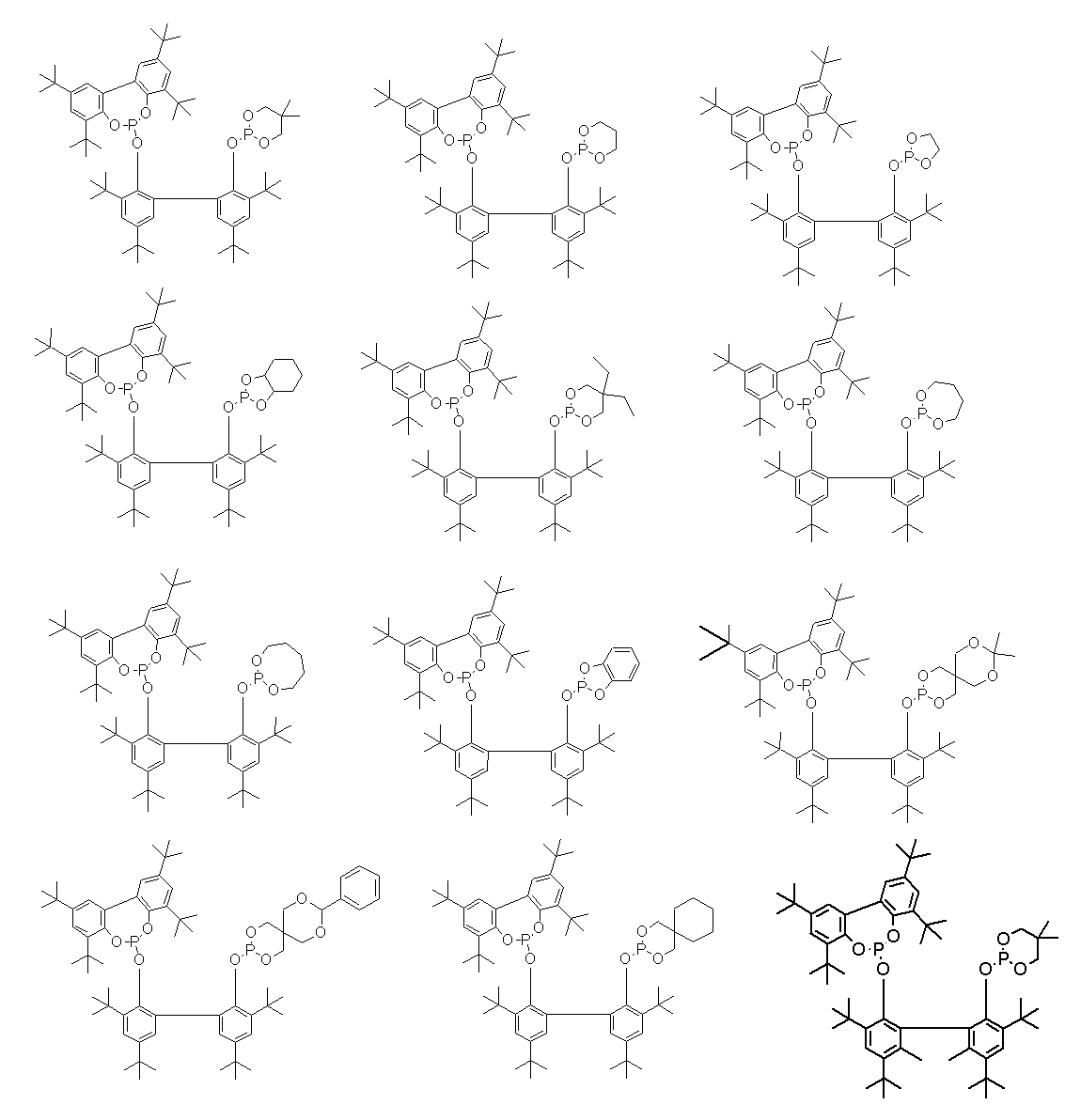WO2017150337A1 - ジアルデヒド化合物の製造方法 - Google Patents
ジアルデヒド化合物の製造方法 Download PDFInfo
- Publication number
- WO2017150337A1 WO2017150337A1 PCT/JP2017/006866 JP2017006866W WO2017150337A1 WO 2017150337 A1 WO2017150337 A1 WO 2017150337A1 JP 2017006866 W JP2017006866 W JP 2017006866W WO 2017150337 A1 WO2017150337 A1 WO 2017150337A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- group
- compound
- reaction
- substituent
- carbon atoms
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C45/00—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds
- C07C45/49—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide
- C07C45/50—Preparation of compounds having >C = O groups bound only to carbon or hydrogen atoms; Preparation of chelates of such compounds by reaction with carbon monoxide by oxo-reactions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2204—Organic complexes the ligands containing oxygen or sulfur as complexing atoms
- B01J31/2208—Oxygen, e.g. acetylacetonates
- B01J31/2221—At least one oxygen and one phosphorous atom present as complexing atoms in an at least bidentate or bridging ligand
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C47/00—Compounds having —CHO groups
- C07C47/02—Saturated compounds having —CHO groups bound to acyclic carbon atoms or to hydrogen
- C07C47/12—Saturated compounds having —CHO groups bound to acyclic carbon atoms or to hydrogen containing more than one —CHO group
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/30—Addition reactions at carbon centres, i.e. to either C-C or C-X multiple bonds
- B01J2231/32—Addition reactions to C=C or C-C triple bonds
- B01J2231/321—Hydroformylation, metalformylation, carbonylation or hydroaminomethylation
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/80—Complexes comprising metals of Group VIII as the central metal
- B01J2531/82—Metals of the platinum group
- B01J2531/822—Rhodium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2540/00—Compositional aspects of coordination complexes or ligands in catalyst systems
- B01J2540/50—Non-coordinating groups comprising phosphorus
- B01J2540/52—Phosphorus acid or phosphorus acid ester groups
- B01J2540/525—Phosphorus acid or phosphorus acid ester groups being phosphorous acid (-ester) groups ((RO)P(OR')2) or the isomeric phosphonic acid (-ester) groups (R(R'O)2P=O), i.e. R= C, R'= C, H
Definitions
- the present invention relates to a method for producing a dialdehyde compound. Specifically, it relates to a method for producing 1,5-pentane dial having an alkyl group at the 3-position.
- 3-methylglutaraldehyde (3-methyl-1,5-pentane dial, hereinafter abbreviated as MGL) is a useful compound as a curing agent for light-sensitive materials, a tanning agent for leather, and a synthetic intermediate (for example, see Patent Documents 1 to 3).
- MGL 3-methylglutaraldehyde
- a method for producing MGL a method of hydrolyzing pyranyl ether obtained by Diels-Alder reaction of crotonaldehyde and methyl vinyl ether is known (see Non-Patent Documents 1 and 2).
- an object of the present invention is to provide a method for producing 1,5-pentane dial having an alkyl group at the 3-position such as MGL in a high yield under mild conditions.
- the present invention relates to the following [1] to [4]. [1] The following general formula (1)
- R 1 represents an alkyl group having 1 to 6 carbon atoms.
- the following general formula (2) includes a step of hydroformylating an aldehyde compound represented by the formula (hereinafter referred to as aldehyde compound (1)).
- R 9 , R 10 , R 12 and R 13 each independently represent a hydrocarbon group having 1 to 40 carbon atoms which may have a substituent, and R 9 and R 10 , R 12 and R 13 are R 11 represents a hydrocarbon bridging group optionally having a substituent having 1 to 40 carbon atoms.
- 1,5-pentane dial having an alkyl group at the 3-position can be produced in a high yield under mild conditions.
- the dialdehyde compound (2) is produced by a hydroformylation reaction of the aldehyde compound (1). Since the aldehyde compound (1) has a double bond at the terminal, a part of the aldehyde compound (1) may isomerize to the internal olefin (1) ′ in the presence of the metal compound.
- the olefin isomerization reaction is generally a reversible reaction, in the case of the aldehyde compound (1) isomerization reaction, the generated internal olefin (1) ′ is a trisubstituted olefin and an ⁇ , ⁇ -unsaturated carbonyl compound. Therefore, it is expected that the reaction is relatively stable and the reverse reaction hardly occurs.
- the alkyl group having 1 to 6 carbon atoms represented by R 1 may be linear, branched or cyclic, such as a methyl group, an ethyl group, an n-propyl group, Examples include isopropyl group, n-butyl group, isobutyl group, t-butyl group, n-pentyl group, n-hexyl group, cyclopropyl group, cyclobutyl group, cyclopentyl group, methylcyclopentyl group, cyclohexyl group and the like.
- a methyl group, an ethyl group, and an n-propyl group are preferable, a methyl group and an ethyl group are more preferable, and a methyl group is particularly preferable because the production of the aldehyde compound (1) is easy.
- 3-methyl-3-buten-1-al can be synthesized from isoprenol according to the methods described in JP-T-2007-525522 and International Publication No. 2008/037693.
- the dialdehyde compound (2) is obtained by a hydroformylation reaction of the aldehyde compound (1).
- the hydroformylation reaction can be carried out by reacting the aldehyde compound (1) with carbon monoxide and hydrogen in the presence of a Group 8-10 metal compound and optionally a ligand.
- Examples of the Group 8 to 10 metal compounds include rhodium compounds, cobalt compounds, ruthenium compounds, and iron compounds.
- rhodium compounds include Rh (acac) (CO) 2 , Rh (acac) 3 , RhCl (CO) (PPh 3 ) 2 , RhCl (PPh 3 ) 3 , RhBr (CO) (PPh 3 ) 2 , Rh 4. (CO) 12 , Rh 6 (CO) 16 and the like.
- Examples of the cobalt compound include HCo (CO) 3 , HCo (CO) 4 , Co 2 (CO) 8 , HCo 3 (CO) 9, and the like.
- the ruthenium compound examples include Ru (CO) 3 (PPh 3 ) 2 , RuCl 2 (PPh 3 ) 3 , RuCl 3 (PPh 3 ) 3 , Ru 3 (CO) 12 and the like.
- the iron compounds for example, Fe (CO) 5, Fe ( CO) 4 PPh 3, Fe (CO) 4 (PPh 3) 2 and the like.
- Rh (acac) (CO) 2 and Rh (acac) 3 are preferably used from the viewpoint of availability. Particularly preferred.
- the amount of the Group 8-10 metal compound used is preferably in the range of 0.0001 to 100 mmol, more preferably in the range of 0.005 to 10 mmol in terms of metal atoms per liter of the reaction mixture. .
- the amount of the Group 8-10 metal compound used is less than 0.0001 mmol in terms of metal atoms per liter of the reaction mixture, the reaction rate tends to be extremely slow, and even if it exceeds 100 mmol, it is commensurate with it. The effect is not obtained, and the catalyst cost only increases.
- the ligand to be used is not particularly limited, and conventionally known ligands can be used.
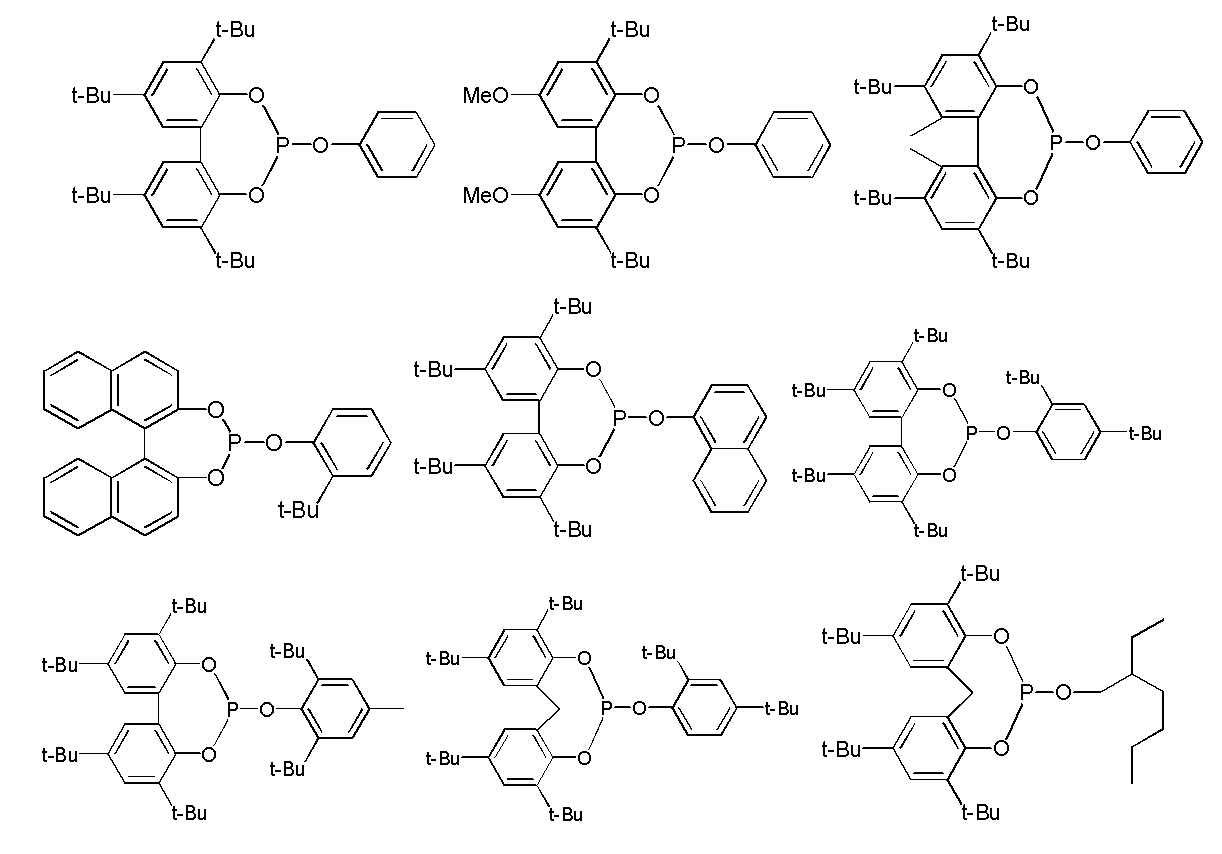
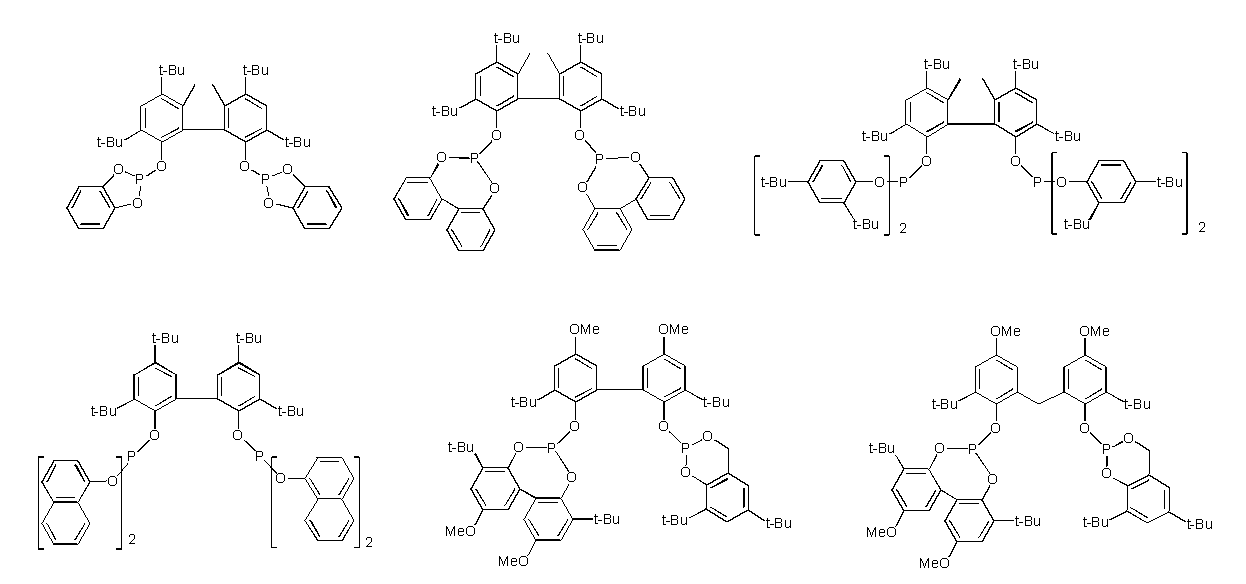
- Examples of such ligands include, for example, compounds represented by the following general formulas (3) to (5), phosphoramidites (International Publication No. 2003/018192, International Publication No. 2002/083695, (International Publication No. 2004/026803, International Publication No. 2006/045557, International Publication No. 2003/066642, International Publication No. 2000/005641, International Publication No. 1999/065656, International Publication No.
- R 3 to R 5 each independently represents a hydrocarbon group having 1 to 24 carbon atoms which may have a substituent, and may be linked to each other.
- R 6 to R 8 each independently represents a hydrocarbon group having 1 to 24 carbon atoms which may have a substituent, and may be linked to each other.
- R 9 , R 10 , R 12 and R 13 each independently represent a hydrocarbon group having 1 to 40 carbon atoms which may have a substituent, and R 9 and R 10 , R 12 and R 13 are R 11 represents a hydrocarbon bridging group optionally having a substituent having 1 to 40 carbon atoms.
- the hydrocarbon group having 1 to 24 carbon atoms which may have a substituent which R 3 to R 8 each independently represents is linear or branched. Or may be cyclic, for example, an alkyl group such as a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, a t-butyl group, an n-pentyl group, a cyclohexyl group; a phenyl group, a naphthyl group And aryl groups such as anthracenyl group. Of these, a phenyl group and a naphthyl group are preferable.
- the hydrocarbon group may have a substituent as long as it does not inhibit the hydroformylation reaction.
- substituents include an alkyl group, an aryl group, an alkoxy group, a silyl group, an amino group, an acyl group, and a carboxy group. , Acyloxy groups, amide groups, ionic groups such as —SO 3 M (wherein M represents an inorganic or organic cation), sulfonyl groups, halogens, nitro groups, cyano groups, fluoroalkyl groups, hydroxy groups, etc. .
- Examples of the compound represented by the general formula (3) used as a ligand in the present invention include tris (2-methylphenyl) phosphite, tris (2,6-dimethylphenyl) phosphite, tris (2 -Isopropylphenyl) phosphite, tris (2-phenylphenyl) phosphite, tris (2-tert-butylphenyl) phosphite, tris (2-tert-butyl-5-methylphenyl) phosphite, tris (2,4 -Di-t-butylphenyl) phosphite, (2-t-butylphenyl) bis (2-methylphenyl) phosphite, bis (2-t-butylphenyl) (2-methylphenyl) phosphite, etc.
- tris (2-t-butylphenyl) phosphite tris (2-t-butyl-5-methylphenyl) phosphite, and tris (2,4-di-t-butylphenyl) phosphite Is preferable.
- Examples of the compound represented by the general formula (4) used as a ligand in the present invention include triphenylphosphine, tris (4-methylphenyl) phosphine, tris (4-methoxyphenyl) phosphine, tris (4- Fluorophenyl) phosphine, tris (4-chlorophenyl) phosphine, tris (dimethylaminophenyl) phosphine, diphenylpropylphosphine, t-butyldiphenylphosphine, n-butyldiphenylphosphine, n-hexyldiphenylphosphine, cyclohexyldiphenylphosphine, dicyclohexylphenylphosphine , Tricyclohexylphosphine, tribenzylphosphine, sulfonated triphenylphosphine, tris (3-sulfophenyl
- the electronic parameter (Electronic Parameter: ⁇ -Values) is 2065 to 2090 cm ⁇ 1 and the steric parameter (Steric Parameter: ⁇ -Values) is 135 to 190 °. Those included in the range are preferable.
- the above two parameters are described in the literature [C. A. Tolman, Chem. Rev. , 177, 313 (1977)], and the electronic parameter is the A1 infrared absorption spectrum of CO of Ni (CO) 3 L (L is a phosphorus ligand) measured in dichloromethane.
- the steric parameter is defined so as to surround the van der Waals radius of the outermost atom of the group bonded to phosphorus at a position 2.28 angstroms from the center of the phosphorus atom. It is defined by the apex angle of the drawn cone.
- the hydrocarbon group having 1 to 40 carbon atoms which may have a substituent represented by R 9 , R 10 , R 12 or R 13 is linear or branched. Or may be cyclic, for example, an alkyl group such as a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, a t-butyl group, an n-pentyl group, a cyclohexyl group; a phenyl group, a naphthyl group And aryl groups such as anthracenyl group. Of these, a phenyl group and a naphthyl group are preferable.
- the hydrocarbon group may have a substituent as long as it does not inhibit the hydroformylation reaction.
- substituents include an alkyl group, an aryl group, an alkoxy group, a silyl group, an amino group, an acyl group, and a carboxy group. , Acyloxy groups, amide groups, ionic groups such as —SO 3 M (wherein M represents an inorganic or organic cation), sulfonyl groups, halogens, nitro groups, cyano groups, fluoroalkyl groups, hydroxy groups, etc. .
- R 9 and R 10 , R 12 and R 13 , and R 11 linked to each other include an alkylene group, a cycloalkylene group, a phenylene group, a naphthylene group, and a divalent crosslinking group represented by the following general formula (6) Etc.
- R 14 and R 15 each independently represents an alkylene group having 1 to 6 carbon atoms which may have a substituent
- Ar 1 and Ar 2 each independently represent an arylene group which may have a substituent
- M, n, p, x, y each independently represents 0 or 1
- Q represents —CR 16 R 17 —, —O—, —S—, —NR 18 —, —SiR 19 R 20
- alkylene group examples include an ethylene group, a trimethylene group, a tetramethylene group, a pentamethylene group, and a group represented by the following formula.
- Examples of the cycloalkylene group include a cyclopropylene group, 1,2-cyclopentylene group, 1,3-cyclopentylene group, 1,2-cyclohexylene group, 1,3-cyclohexylene group, 1,4 -Cyclohexylene group and the like.
- Examples of the phenylene group include a 1,2-phenylene group, a 1,3-phenylene group, and a 1,4-phenylene group.
- Examples of the naphthylene group include 1,2-naphthylene group and 1,8-naphthylene group.
- R 9 and R 10 , R 12 and R 13 , and R 11 linked to each other may have a substituent, and examples of the substituent include a methyl group, an ethyl group, a propyl group, a butyl group, Preferably an alkyl group having 1 to 5 carbon atoms such as a pentyl group; preferably an alkoxyl group having 1 to 4 carbon atoms such as a methoxy group, an ethoxy group, a propoxy group and a butoxy group; an aryl group such as a phenyl group and a naphthyl group Can be mentioned.
- examples of the alkylene group having 1 to 6 carbon atoms which may have a substituent represented by R 14 and R 15 include an ethylene group, an n-propylene group, an n-butylene group, an n- Pentylene group, n-hexylene group, 2-methyl-ethylene group, 1,2-dimethylethylene group, 2-methyl-n-propylene group, 2,2-dimethyl-n-propylene group, 3-methyl-n- A pentylene group is exemplified.
- Examples of the arylene group represented by Ar 1 and Ar 2 include a phenylene group, a naphthylene group, and an anthracenylene group.
- Examples of the alkyl group which may have a substituent having 1 to 12 carbon atoms represented by R 16 to R 20 include a methyl group, an ethyl group, an n-propyl group, an isopropyl group, an n-butyl group, an isobutyl group, Examples thereof include a t-butyl group, an n-pentyl group, and a cyclohexyl group.
- R 14 to R 20 and Ar 1 and Ar 2 may have a substituent as long as they do not inhibit the hydroformylation reaction.
- substituents include an alkyl group, an aryl group, an alkoxy group, and a silyl group.
- M represents an inorganic or organic cation
- sulfonyl groups halogens
- nitro groups nitro groups
- cyano groups fluoro
- fluoro examples thereof include an alkyl group and a hydroxy group.
- Examples of the compound represented by the general formula (5) include, but are not limited to, the following compounds.
- compounds represented by the formula (3) and the formula (5) are preferable from the viewpoint of increasing the yield of the dialdehyde compound (2). Furthermore, the compound represented by Formula (3) is more preferable from the viewpoint of reaction rate, and the compound represented by Formula (5) is more preferable from the viewpoint of suppressing by-products.
- the amount of the ligand used is not particularly limited, but it is in the range of 1 to 1000 mol in terms of the coordinating atom in the ligand with respect to 1 mol of the metal in the group 8-10 metal compound. It is preferably in the range of 2 to 500 moles, more preferably in the range of 3 to 200 moles from the viewpoint of reaction rate.
- the amount of the ligand used is less than 1 mol in terms of a coordinating atom in the ligand with respect to 1 mol of the metal in the group 8-10 metal compound, the stability of the catalyst is impaired, and 1000 mol When the ratio exceeds 1, the reaction rate tends to decrease.
- the hydroformylation reaction can be performed in the presence or absence of a solvent.
- solvents include saturated aliphatic hydrocarbons such as pentane, hexane, heptane, octane, nonane, decane, and cyclohexane; aromatic hydrocarbons such as benzene, toluene, ethylbenzene, propylbenzene, xylene, and ethyltoluene; isopropyl alcohol, Alcohols such as isobutyl alcohol, isopentyl alcohol, neopentyl alcohol, ethylene glycol, 1,2-propanediol, 1,3-propanediol, 1,2-butanediol, 1,4-butanediol, diethylene glycol, triethylene glycol Dimethyl ether, ethyl methyl ether, diethyl ether, dipropyl ether, butyl methyl ether, t
- One of these solvents may be used alone, or two or more thereof may be used in combination.
- aromatic hydrocarbons are preferable from the viewpoint of catalyst solubility and stability under reaction conditions, and toluene, ethylbenzene, and xylene are more preferable.
- the amount of the solvent used is not particularly limited, but it is usually preferably in the range of 1 to 90% by mass with respect to the entire reaction mixture.
- the reaction temperature in the hydroformylation reaction is preferably in the range of 40 to 170 ° C., and more preferably in the range of 50 to 150 ° C. from the viewpoint of suppressing catalyst deactivation.
- the reaction pressure is preferably in the range of 0.01 to 15 MPa (gauge pressure), more preferably in the range of 0.5 to 10 MPa (gauge pressure), from the viewpoints of reactivity and catalyst stability.
- the reaction time is usually in the range of 0.5 to 20 hours, and preferably in the range of 0.5 to 10 hours.
- the method for carrying out the hydroformylation reaction is not particularly limited.
- Carbon monoxide: hydrogen (molar ratio) is preferably in the range of 0.01 to 50, and more preferably 0.1 to 10 from the viewpoint of reactivity and reaction selectivity.
- the reaction can be carried out batchwise or continuously using a stirring reaction tank, a circulation reaction tank, a bubble column reaction tank, or the like. If necessary, the unreacted aldehyde compound (1) may be recovered from the reaction solution after the reaction and recycled to the reactor.
- the continuous mode can be carried out in a single reactor or multiple reactors in series or parallel.
- the method for separating and purifying the dialdehyde compound (2) from the reaction mixture obtained by the above method is not particularly limited, and a method used for the separation and purification of ordinary organic compounds can be applied.
- a high purity dialdehyde compound (2) can be obtained by distilling off the solvent or basic substance from the reaction mixture under reduced pressure and then distilling the residue under reduced pressure.
- the ligand and the Group 8-10 metal compound may be separated by subjecting to methods such as evaporation, extraction, and adsorption.
- the separated ligand and the Group 8-10 metal compound can be used again for the hydroformylation reaction.
- the obtained dialdehyde compound (2) can be diluted with a solvent such as water and stored as necessary in order to avoid multimerization.
- triphenylphosphine electroactive parameter 2069.1 cm ⁇ 1 , steric parameter 145 °
- 1,5-pentane dial having an alkyl group at the 3-position which is useful as a curing agent for light-sensitive materials, a tanning agent for leather, and a synthetic intermediate, can be produced in a high yield under mild conditions.
Abstract
Description
[1]下記一般式(1)
で表されるアルデヒド化合物(以下、アルデヒド化合物(1)と称する)をヒドロホルミル化する工程を含む、下記一般式(2)
で表されるジアルデヒド化合物(以下、ジアルデヒド化合物(2)と称する)の製造方法。
[2]前記ヒドロホルミル化を、第8~10族金属化合物および配位子の存在下に行う、[1]の製造方法。
[3]前記第8~10族金属化合物がロジウム化合物である、[2]の製造方法。
[4]前記配位子が下記一般式(5)で表される化合物である、[2]または[3]の製造方法。
アルデヒド化合物(1)は末端に二重結合を有するため、金属化合物存在下においてその一部が内部オレフィン(1)’へと異性化する可能性がある。オレフィンの異性化反応は一般的に可逆反応であるものの、アルデヒド化合物(1)の異性化反応の場合、生成する内部オレフィン(1)’は三置換オレフィンでありかつα,β-不飽和カルボニル化合物であるため比較的安定で、逆反応が起こりにくいことが予想される。アルデヒド化合物(1)のヒドロホルミル化反応においては上記異性化反応によるジアルデヒド化合物(2)の収率低下が懸念されるため、この反応を用いる方法をジアルデヒド化合物(2)の製造方法として敢えて検討することは通常考えられない。しかしながら本発明者らの検討により、当該反応を採用することで、驚くべきことにジアルデヒド化合物(2)を従来法よりも温和な条件で収率良く製造できることが判明した。
ヒドロホルミル化反応は、第8~10族金属化合物および必要に応じて配位子の存在下に、アルデヒド化合物(1)を一酸化炭素および水素と反応させることによって行うことができる。
第8~10族金属化合物の使用量は、反応混合液1リットルあたり金属原子換算で0.0001~100ミリモルの範囲であるのが好ましく、0.005~10ミリモルの範囲であるのがより好ましい。第8~10族金属化合物の使用量が、反応混合液1リットルあたり金属原子換算で0.0001ミリモル未満であると、反応速度が極めて遅くなる傾向にあり、また100ミリモルを超えてもそれに見合う効果が得られず、触媒コストが増大するのみである。
具体的には、例えば特表2007-506691号公報の9~40頁に記載の化合物を用いることができる。
配位子はそれぞれ単独で用いてもよく、2種以上を併用してもよい。
上記フェニレン基としては、例えば1,2-フェニレン基、1,3-フェニレン基、1,4-フェニレン基などが挙げられる。
上記ナフチレン基としては、例えば1,2-ナフチレン基、1,8-ナフチレン基などが挙げられる。
一酸化炭素:水素(モル比)は、0.01~50の範囲であることが好ましく、反応性、反応選択率の観点からは0.1~10であることがより好ましい。
反応は、攪拌型反応槽、循環型反応槽、気泡塔型反応槽などを用いて、バッチ方式または連続方式で行うことができる。必要ならば、未反応のアルデヒド化合物(1)を反応後の反応液から回収し、反応器へ再循環しながら実施してもよい。連続方式は、単一反応器または直列もしくは並列の複数の反応器で実施することができる。
ビスホスファイトA0.98gおよびRh(acac)(CO)2 13.2mgをトルエン50mlに溶解させた溶液を調製した[ロジウム原子:リン原子=1:20(モル比)]。ガス導入口およびサンプリング口を備えた電磁攪拌式オートクレーブに、窒素雰囲気下、トルエン28ml、3-メチル-3-ブテン-1-アール8mlおよび上記調製した触媒液4ml(反応系内のロジウム化合物濃度;0.1mmol/L)を加え、オートクレーブ内を一酸化炭素:水素=1:1(モル比)の混合ガスで8MPa(ゲージ圧)とした後、攪拌しながらオートクレーブ内の温度を130℃に昇温し、6時間反応させた。なお、反応中は、一酸化炭素:水素=1:1(モル比)の混合ガスを常時供給し、反応系内の圧力を一定に保った。得られた反応液をガスクロマトグラフィーで分析したところ、3-メチル-3-ブテン-1-アールの転化率は75.9%、MGLの選択率は66.1%であった。
ビスホスファイトAに代えてトリス(2,4-ジ-t-ブチルフェニル)ホスファイト(エレクトロニックパラメーター2085.1cm-1、ステリックパラメーター175°)3.23gを用いたこと[ロジウム原子:リン原子=1:100(モル比)]および反応時間を3時間としたこと以外は、実施例1と同様に反応を実施した。3-メチル-3-ブテン-1-アールの転化率は79.2%、MGLの選択率は41.0%であった。
ビスホスファイトAに代えてトリフェニルホスフィン(エレクトロニックパラメーター2069.1cm-1、ステリックパラメーター145°)1.31gを用いたこと[ロジウム原子:リン原子=1:100(モル比)]および反応時間を4.5時間としたこと以外は、実施例1と同様に反応を実施した。3-メチル-3-ブテン-1-アールの転化率は93.6%、MGLの選択率は34.1%であった。
Claims (4)
- 前記ヒドロホルミル化を、第8~10族金属化合物および配位子の存在下に行う、請求項1に記載の製造方法。
- 前記第8~10族金属化合物がロジウム化合物である、請求項2に記載の製造方法。
Priority Applications (8)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| SG11201807445TA SG11201807445TA (en) | 2016-03-01 | 2017-02-23 | Method of producing dialdehyde compound |
| CA3015873A CA3015873A1 (en) | 2016-03-01 | 2017-02-23 | Method of producing dialdehyde compound |
| RU2018131105A RU2018131105A (ru) | 2016-03-01 | 2017-02-23 | Способ получения диальдегидного соединения |
| CN201780013929.XA CN108698969A (zh) | 2016-03-01 | 2017-02-23 | 二醛化合物的制造方法 |
| JP2018503088A JP6835403B2 (ja) | 2016-03-01 | 2017-02-23 | ジアルデヒド化合物の製造方法 |
| EP17759803.4A EP3424897A4 (en) | 2016-03-01 | 2017-02-23 | PROCESS FOR PRODUCING DIALDEHYDE COMPOUND |
| US16/081,283 US10479750B2 (en) | 2016-03-01 | 2017-02-23 | Method of producing dialdehyde compound |
| HK18116757.9A HK1257629A1 (zh) | 2016-03-01 | 2018-12-31 | 二醛化合物的製造方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016038623 | 2016-03-01 | ||
| JP2016-038623 | 2016-03-01 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2017150337A1 true WO2017150337A1 (ja) | 2017-09-08 |
Family
ID=59742883
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2017/006866 WO2017150337A1 (ja) | 2016-03-01 | 2017-02-23 | ジアルデヒド化合物の製造方法 |
Country Status (10)
| Country | Link |
|---|---|
| US (1) | US10479750B2 (ja) |
| EP (1) | EP3424897A4 (ja) |
| JP (1) | JP6835403B2 (ja) |
| CN (1) | CN108698969A (ja) |
| CA (1) | CA3015873A1 (ja) |
| HK (1) | HK1257629A1 (ja) |
| RU (1) | RU2018131105A (ja) |
| SG (1) | SG11201807445TA (ja) |
| TW (1) | TW201736331A (ja) |
| WO (1) | WO2017150337A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113480415A (zh) * | 2021-06-30 | 2021-10-08 | 中国成达工程有限公司 | 一种丙烯醛氢甲酰化合成丁二醛工艺 |
Citations (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2137603A1 (de) | 1971-07-27 | 1973-02-08 | Diamalt Ag | Mittel zum gerben von haeuten und fellen |
| JPH05178779A (ja) * | 1991-06-11 | 1993-07-20 | Mitsubishi Kasei Corp | ヒドロホルミル化法およびビスホスファイト化合物 |
| WO1995000525A1 (de) | 1993-06-25 | 1995-01-05 | Basf Aktiengesellschaft | Phosphorhaltige calixarene |
| JPH07281342A (ja) | 1994-04-13 | 1995-10-27 | Konica Corp | ハロゲン化銀写真感光材料及びその現像処理方法 |
| WO1997046507A1 (de) | 1996-05-31 | 1997-12-11 | Basf Aktiengesellschaft | Verfahren zur hydroformylierung und dafür geeignete katalysatoren, die phosphorverbindungen als liganden enthalten |
| JPH1171318A (ja) * | 1997-08-28 | 1999-03-16 | Kuraray Co Ltd | ジアルデヒドの製造方法 |
| WO1999046044A1 (de) | 1998-03-12 | 1999-09-16 | Basf Aktiengesellschaft | Katalysator, umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines phosphonitliganden und verfahren zur hydroformylierung |
| WO1999065606A1 (de) | 1998-06-18 | 1999-12-23 | Basf Aktiengesellschaft | Katalysator, umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines phosphinitliganden, verfahren zur hydroformylierung |
| WO2000005641A1 (en) | 1998-07-24 | 2000-02-03 | Lear Automotive Dearborn, Inc. | Integrated palmtop computer with cellular telephone |
| WO2000055164A1 (de) | 1999-03-17 | 2000-09-21 | Basf Aktiengesellschaft | Phosphabenzolverbindungen und ihre verwendung als liganden für hydroformylierungskatalysatoren |
| WO2000069801A1 (de) | 1999-05-12 | 2000-11-23 | Basf Aktiengesellschaft | Eta 5-phospholyl- und eta 5-polyphospholylkomplexe und ihre verwendung in der hydroformylierung |
| WO2001058589A1 (de) | 2000-02-10 | 2001-08-16 | Basf Aktiengesellschaft | VERBINDUNGEN DES PHOSPHORS, ARSENS UND DES ANTIMONS BASIEREND AUF DIARYLANELLIERTEN BICYCLO`2.2.N!-GRUNDKÖRPERN UND DIESE ENTHALTENDE KATAKYSATOREN |
| WO2001085661A1 (de) | 2000-05-12 | 2001-11-15 | Basf Aktiengesellschaft | Metall-komplex, der einen 2-phospha-tricyclo[{3.3.1.1 (3,7)}]decylrest als liganden trägt in der hydroformylierung |
| WO2002083695A1 (de) | 2001-03-29 | 2002-10-24 | Basf Aktiengesellschaft | Liganden für pnicogenchelatkomplexe mit einem metall der viii. nebengruppe und verwendung der komplexe als katalysatoren für hydroformylierung, carbnonylierung, hydrocyanierung oder hydrierung |
| WO2003018192A2 (de) | 2001-08-24 | 2003-03-06 | Basf Aktiengesellschaft | Verfahren zur herstellung von 2-propylheptanol sowie dafür geeignete hydroformylierungskatalysatoren und deren weitere verwendung zur carbonylierung, hydrocyanierung und hydrierung |
| WO2003053571A2 (de) | 2001-12-21 | 2003-07-03 | Basf Aktiengesellschaft | Katalysator umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines liganden mit einem unverbrückten heterophosphacyclohexan-strukturelement |
| WO2003053572A1 (de) | 2001-12-21 | 2003-07-03 | Basf Aktiengesellschaft | Verfahren zur hydroformylierung in gegenwart eines polymeren liganden mit phosphacyclohexan-strukturlementen |
| WO2003066642A1 (de) | 2002-02-08 | 2003-08-14 | Basf Aktiengesellschaft | Phosphorchelatverbindungen |
| WO2004026803A1 (de) | 2002-09-13 | 2004-04-01 | Basf Aktiengesellschaft | Verfahren zur herstellung von dialdehyden und/oder ethylenisch ungesättigten monoaldehyden durch hydroformylierung ethylenisch ungesättigter verbindungen |
| WO2006045597A1 (de) | 2004-10-26 | 2006-05-04 | Basf Aktiengesellschaft | Liganden zur asymmetrischen hydroformylierung |
| JP2007506691A (ja) | 2003-09-25 | 2007-03-22 | ビーエーエスエフ アクチェンゲゼルシャフト | 1,7−オクタジエンの製造方法及びその使用 |
| JP2007525522A (ja) | 2004-02-26 | 2007-09-06 | ザ ヌトラスウィート カンパニー | 第一アルコール及び第二アルコールの好気的酸化のための触媒系 |
| WO2008037693A1 (de) | 2006-09-26 | 2008-04-03 | Basf Se | Kontinuierliches verfahren zur herstellung von citral |
| JP2009102244A (ja) | 2007-10-22 | 2009-05-14 | Toyotama Koryo Kk | 3−メチルシクロペンタデカン類の製造方法、および3−メチルシクロペンタデカン類製造中間体 |
| WO2009059963A1 (de) | 2007-11-05 | 2009-05-14 | Basf Se | Verfahren zur hydroformylierung |
| JP2011521990A (ja) * | 2008-06-03 | 2011-07-28 | エボニック オクセノ ゲゼルシャフト ミット ベシュレンクテル ハフツング | ヒドロホルミル化によりc4−含有炭化水素流から1−ブテンを分離する方法 |
| JP2015509491A (ja) * | 2012-02-23 | 2015-03-30 | エボニック デグサ ゲーエムベーハーEvonik Degussa GmbH | イソブテンのヒドロホルミル化のための、及び、生成物混合物の分離のための、方法及び装置 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2314694C2 (de) * | 1973-03-24 | 1975-02-20 | Basf Ag, 6700 Ludwigshafen | Verfahren zur Herstellung von alpha, omega-Dialdehyden |
| JPS58157739A (ja) * | 1982-03-12 | 1983-09-19 | Kuraray Co Ltd | 1,9−ノナンジア−ルの製造方法 |
| US4808756A (en) | 1986-04-07 | 1989-02-28 | Kuraray Co., Ltd. | Method for production of α,ω-dialdehydes |
| TW213465B (ja) | 1991-06-11 | 1993-09-21 | Mitsubishi Chemicals Co Ltd | |
| US5312996A (en) * | 1992-06-29 | 1994-05-17 | Union Carbide Chemicals & Plastics Technology Corporation | Hydroformylation process for producing 1,6-hexanedials |
| JP2008031125A (ja) * | 2006-07-31 | 2008-02-14 | Kuraray Co Ltd | アルデヒドの製造方法 |
| DE102012208530A1 (de) * | 2012-05-22 | 2013-11-28 | Bayer Pharma AG | Substituierte Piperidinoacetamide und ihre Verwendung |
| CN105050996B (zh) * | 2013-03-27 | 2018-05-29 | 株式会社可乐丽 | 二醛的制造方法 |
-
2017
- 2017-02-23 US US16/081,283 patent/US10479750B2/en not_active Expired - Fee Related
- 2017-02-23 SG SG11201807445TA patent/SG11201807445TA/en unknown
- 2017-02-23 EP EP17759803.4A patent/EP3424897A4/en not_active Withdrawn
- 2017-02-23 WO PCT/JP2017/006866 patent/WO2017150337A1/ja active Application Filing
- 2017-02-23 JP JP2018503088A patent/JP6835403B2/ja active Active
- 2017-02-23 CA CA3015873A patent/CA3015873A1/en not_active Abandoned
- 2017-02-23 CN CN201780013929.XA patent/CN108698969A/zh active Pending
- 2017-02-23 RU RU2018131105A patent/RU2018131105A/ru not_active Application Discontinuation
- 2017-03-01 TW TW106106594A patent/TW201736331A/zh unknown
-
2018
- 2018-12-31 HK HK18116757.9A patent/HK1257629A1/zh unknown
Patent Citations (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2137603A1 (de) | 1971-07-27 | 1973-02-08 | Diamalt Ag | Mittel zum gerben von haeuten und fellen |
| JPH05178779A (ja) * | 1991-06-11 | 1993-07-20 | Mitsubishi Kasei Corp | ヒドロホルミル化法およびビスホスファイト化合物 |
| WO1995000525A1 (de) | 1993-06-25 | 1995-01-05 | Basf Aktiengesellschaft | Phosphorhaltige calixarene |
| JPH07281342A (ja) | 1994-04-13 | 1995-10-27 | Konica Corp | ハロゲン化銀写真感光材料及びその現像処理方法 |
| WO1997046507A1 (de) | 1996-05-31 | 1997-12-11 | Basf Aktiengesellschaft | Verfahren zur hydroformylierung und dafür geeignete katalysatoren, die phosphorverbindungen als liganden enthalten |
| JPH1171318A (ja) * | 1997-08-28 | 1999-03-16 | Kuraray Co Ltd | ジアルデヒドの製造方法 |
| WO1999046044A1 (de) | 1998-03-12 | 1999-09-16 | Basf Aktiengesellschaft | Katalysator, umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines phosphonitliganden und verfahren zur hydroformylierung |
| WO1999065606A1 (de) | 1998-06-18 | 1999-12-23 | Basf Aktiengesellschaft | Katalysator, umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines phosphinitliganden, verfahren zur hydroformylierung |
| WO2000005641A1 (en) | 1998-07-24 | 2000-02-03 | Lear Automotive Dearborn, Inc. | Integrated palmtop computer with cellular telephone |
| WO2000055164A1 (de) | 1999-03-17 | 2000-09-21 | Basf Aktiengesellschaft | Phosphabenzolverbindungen und ihre verwendung als liganden für hydroformylierungskatalysatoren |
| WO2000069801A1 (de) | 1999-05-12 | 2000-11-23 | Basf Aktiengesellschaft | Eta 5-phospholyl- und eta 5-polyphospholylkomplexe und ihre verwendung in der hydroformylierung |
| WO2001058589A1 (de) | 2000-02-10 | 2001-08-16 | Basf Aktiengesellschaft | VERBINDUNGEN DES PHOSPHORS, ARSENS UND DES ANTIMONS BASIEREND AUF DIARYLANELLIERTEN BICYCLO`2.2.N!-GRUNDKÖRPERN UND DIESE ENTHALTENDE KATAKYSATOREN |
| WO2001085661A1 (de) | 2000-05-12 | 2001-11-15 | Basf Aktiengesellschaft | Metall-komplex, der einen 2-phospha-tricyclo[{3.3.1.1 (3,7)}]decylrest als liganden trägt in der hydroformylierung |
| WO2002083695A1 (de) | 2001-03-29 | 2002-10-24 | Basf Aktiengesellschaft | Liganden für pnicogenchelatkomplexe mit einem metall der viii. nebengruppe und verwendung der komplexe als katalysatoren für hydroformylierung, carbnonylierung, hydrocyanierung oder hydrierung |
| WO2003018192A2 (de) | 2001-08-24 | 2003-03-06 | Basf Aktiengesellschaft | Verfahren zur herstellung von 2-propylheptanol sowie dafür geeignete hydroformylierungskatalysatoren und deren weitere verwendung zur carbonylierung, hydrocyanierung und hydrierung |
| WO2003053571A2 (de) | 2001-12-21 | 2003-07-03 | Basf Aktiengesellschaft | Katalysator umfassend einen komplex eines metalls der viii. nebengruppe auf basis eines liganden mit einem unverbrückten heterophosphacyclohexan-strukturelement |
| WO2003053572A1 (de) | 2001-12-21 | 2003-07-03 | Basf Aktiengesellschaft | Verfahren zur hydroformylierung in gegenwart eines polymeren liganden mit phosphacyclohexan-strukturlementen |
| WO2003066642A1 (de) | 2002-02-08 | 2003-08-14 | Basf Aktiengesellschaft | Phosphorchelatverbindungen |
| WO2004026803A1 (de) | 2002-09-13 | 2004-04-01 | Basf Aktiengesellschaft | Verfahren zur herstellung von dialdehyden und/oder ethylenisch ungesättigten monoaldehyden durch hydroformylierung ethylenisch ungesättigter verbindungen |
| JP2007506691A (ja) | 2003-09-25 | 2007-03-22 | ビーエーエスエフ アクチェンゲゼルシャフト | 1,7−オクタジエンの製造方法及びその使用 |
| JP2007525522A (ja) | 2004-02-26 | 2007-09-06 | ザ ヌトラスウィート カンパニー | 第一アルコール及び第二アルコールの好気的酸化のための触媒系 |
| WO2006045597A1 (de) | 2004-10-26 | 2006-05-04 | Basf Aktiengesellschaft | Liganden zur asymmetrischen hydroformylierung |
| WO2008037693A1 (de) | 2006-09-26 | 2008-04-03 | Basf Se | Kontinuierliches verfahren zur herstellung von citral |
| JP2009102244A (ja) | 2007-10-22 | 2009-05-14 | Toyotama Koryo Kk | 3−メチルシクロペンタデカン類の製造方法、および3−メチルシクロペンタデカン類製造中間体 |
| WO2009059963A1 (de) | 2007-11-05 | 2009-05-14 | Basf Se | Verfahren zur hydroformylierung |
| JP2011521990A (ja) * | 2008-06-03 | 2011-07-28 | エボニック オクセノ ゲゼルシャフト ミット ベシュレンクテル ハフツング | ヒドロホルミル化によりc4−含有炭化水素流から1−ブテンを分離する方法 |
| JP2015509491A (ja) * | 2012-02-23 | 2015-03-30 | エボニック デグサ ゲーエムベーハーEvonik Degussa GmbH | イソブテンのヒドロホルミル化のための、及び、生成物混合物の分離のための、方法及び装置 |
Non-Patent Citations (5)
| Title |
|---|
| C.A. TOLMAN, CHEM. REV., vol. 177, 1977, pages 313 |
| ORGANIC SYNTHESES, vol. 34, 1954, pages 29 |
| ORGANIC SYNTHESES, vol. 34, 1954, pages 71 |
| RAYMOND I. LONGLEY, JR. ET AL.: "3-METHYL-1,5- PENTANEDIOL", ORGANIC SYNTHESES, vol. 34, 1954, pages 71 - 73, XP055403451 * |
| See also references of EP3424897A4 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN113480415A (zh) * | 2021-06-30 | 2021-10-08 | 中国成达工程有限公司 | 一种丙烯醛氢甲酰化合成丁二醛工艺 |
| CN113480415B (zh) * | 2021-06-30 | 2023-10-24 | 中国成达工程有限公司 | 一种丙烯醛氢甲酰化合成丁二醛工艺 |
Also Published As
| Publication number | Publication date |
|---|---|
| SG11201807445TA (en) | 2018-09-27 |
| CA3015873A1 (en) | 2017-09-08 |
| CN108698969A (zh) | 2018-10-23 |
| RU2018131105A3 (ja) | 2020-04-01 |
| TW201736331A (zh) | 2017-10-16 |
| US10479750B2 (en) | 2019-11-19 |
| RU2018131105A (ru) | 2020-04-01 |
| HK1257629A1 (zh) | 2019-10-25 |
| JPWO2017150337A1 (ja) | 2018-12-27 |
| JP6835403B2 (ja) | 2021-02-24 |
| US20190023636A1 (en) | 2019-01-24 |
| EP3424897A4 (en) | 2019-10-09 |
| EP3424897A1 (en) | 2019-01-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CA2649019C (en) | Method for producing aldehyde using bisphosphite and group 8-10 metal compound, and such bisphosphite | |
| JP6558742B2 (ja) | アルデヒド化合物の製造方法およびアセタール化合物 | |
| JP6835403B2 (ja) | ジアルデヒド化合物の製造方法 | |
| JP6255007B2 (ja) | ジアルデヒドの製造方法 | |
| US20150329452A1 (en) | Method for producing optically active isopulegol and optically active menthol | |
| JP4964760B2 (ja) | ビスホスファイト、並びに該ビスホスファイトおよび第8〜10族金属化合物を用いたアルデヒド化合物の製造方法 | |
| US7160835B2 (en) | Bisphosphine process for producing the same and use thereof | |
| JP2014189525A (ja) | 直鎖状ジアルデヒドの製造方法 | |
| JP4994836B2 (ja) | ビスホスファイトおよび該ビスホスファイトを用いたアルデヒド化合物の製造方法 | |
| WO2017175582A1 (ja) | ビスホスファイトおよびそれを用いた1,9-ノナンジアールの製造方法 | |
| Ozolin et al. | Asymmetric hydrogenation of diethyl 1-phenylvinylphosphonate by metal complexes in CH 2 Cl 2 and in supercritical carbon dioxide using phosphite-type ligands | |
| JP4176459B2 (ja) | ビスホスフィン、その製造方法およびその用途 | |
| Mokheseng | Rhoduim phosphine catalysed hydroformylation | |
| JP2013213022A (ja) | 末端アルコールの製造方法 | |
| JP2012201624A (ja) | 4−アミノブチルアルデヒドアセタールの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 2018503088 Country of ref document: JP |
|
| ENP | Entry into the national phase |
Ref document number: 3015873 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 11201807445T Country of ref document: SG |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2017759803 Country of ref document: EP |
|
| ENP | Entry into the national phase |
Ref document number: 2017759803 Country of ref document: EP Effective date: 20181001 |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 17759803 Country of ref document: EP Kind code of ref document: A1 |