WO2013128755A1 - 吸収性物品 - Google Patents
吸収性物品 Download PDFInfo
- Publication number
- WO2013128755A1 WO2013128755A1 PCT/JP2012/082087 JP2012082087W WO2013128755A1 WO 2013128755 A1 WO2013128755 A1 WO 2013128755A1 JP 2012082087 W JP2012082087 W JP 2012082087W WO 2013128755 A1 WO2013128755 A1 WO 2013128755A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- acid
- chain hydrocarbon
- absorbent article
- absorber
- top sheet
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/51104—Topsheet, i.e. the permeable cover or layer facing the skin the top sheet having a three-dimensional cross-section, e.g. corrugations, embossments, recesses or projections
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/45—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the shape
- A61F13/47—Sanitary towels, incontinence pads or napkins
- A61F13/475—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means
- A61F13/4751—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means the means preventing fluid flow in a transversal direction
- A61F13/4756—Sanitary towels, incontinence pads or napkins characterised by edge leakage prevention means the means preventing fluid flow in a transversal direction the means consisting of grooves, e.g. channels, depressions or embossments, resulting in a heterogeneous surface level
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/513—Topsheet, i.e. the permeable cover or layer facing the skin characterised by its function or properties, e.g. stretchability, breathability, rewet, visual effect; having areas of different permeability
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/20—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing organic materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/22—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons containing macromolecular materials
- A61L15/26—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L15/00—Chemical aspects of, or use of materials for, bandages, dressings or absorbent pads
- A61L15/16—Bandages, dressings or absorbent pads for physiological fluids such as urine or blood, e.g. sanitary towels, tampons
- A61L15/42—Use of materials characterised by their function or physical properties
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F2013/51186—Topsheet, i.e. the permeable cover or layer facing the skin specially shaped topsheets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/15—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators
- A61F13/51—Absorbent pads, e.g. sanitary towels, swabs or tampons for external or internal application to the body; Supporting or fastening means therefor; Tampon applicators characterised by the outer layers
- A61F13/511—Topsheet, i.e. the permeable cover or layer facing the skin
- A61F13/513—Topsheet, i.e. the permeable cover or layer facing the skin characterised by its function or properties, e.g. stretchability, breathability, rewet, visual effect; having areas of different permeability
- A61F2013/51355—Topsheet, i.e. the permeable cover or layer facing the skin characterised by its function or properties, e.g. stretchability, breathability, rewet, visual effect; having areas of different permeability for improving fluid flow
Definitions
- the present invention relates to absorbent articles such as sanitary napkins, panty liners, incontinence pads, incontinence liners and the like.
- a sanitary napkin in which the side panel is composed of a liquid-permeable perforated polymer film and a backing sheet is known in the prior art (for example, Patent Document 1). Further, the central absorbent body is provided with a central absorbent body comprising a top sheet, a back sheet and an absorbent body, and a pair of flaps comprising a top sheet and a back sheet extending outward from the center of both sides of the central absorbent body.
- a sanitary napkin in which the topsheet is in contact with the backsheet at the boundary between the and the flap is known in the prior art (e.g., U.S. Pat. No. 5,958,015).
- the body fluid absorbed by the absorbent body may temporarily exude from the widthwise edge of the absorbent body.
- the body fluid exuded from the absorbent penetrates between the liquid-permeable perforated polymer film and the backing sheet in the side panel. And may leak from the width direction of the absorbent article.
- the conventional absorbent article as described in Patent Document 2 since the top sheet is joined to the back sheet at the boundary between the central absorbent body and the flap, the body fluid exuded from the absorbent body However, there is no penetration between the topsheet and the backsheet at the flaps. However, the body fluid exuding from the absorbent at the widthwise edge of the absorber temporarily loses place between the top sheet and the backsheet, so the topsheet at the widthwise edge of the absorber May leak out from the width direction of the absorbent article.
- An object of this invention is to provide the absorbent article which can suppress that the bodily fluid which exudeed from the absorber by pressure being applied to an absorbent article may leak from the width direction of an absorbent article.
- the present invention adopts the following configuration in order to solve the above-mentioned problems. That is, according to the present invention, the liquid-permeable top sheet provided on the skin side having the longitudinal direction and the width direction, the liquid-impermeable back sheet provided on the clothing side, and the longitudinal direction in the width direction An absorbent article comprising an extending edge and a liquid-retaining absorber provided between a top sheet and a back sheet, wherein the absorbent article exudes from the absorber at least outside of both widthwise edges of the absorber. And a plurality of second flow paths, and the plurality of first flow paths extend in the longitudinal direction and are arranged in the width direction, and the plurality of second flow paths are provided. The flow paths connect adjacent first flow paths.
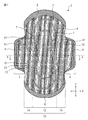
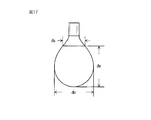
- FIG. 1 is a plan view of an embodiment of the absorbent article of the present invention.
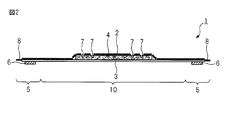
- FIG. 2 is a schematic cross-sectional view showing a cross section taken along line AA of FIG.
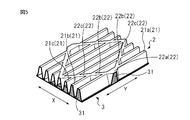
- FIG. 3 is a first ridge formed on the top sheet of the wing part and the region outside the widthwise edges of the absorbent body of the main body part in the top sheet of the absorbent article according to an embodiment of the present invention, It is a figure for demonstrating a 2nd protrusion and a bottom part.
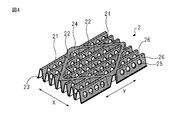
- Drawing 4 is a figure for explaining the 1st projected rim, the 2nd projected rim, and the bottom formed in the field provided with the absorber in the top sheet of the absorptive article of one embodiment of the present invention. It is.
- FIG. 1 is a plan view of an embodiment of the absorbent article of the present invention.
- FIG. 2 is a schematic cross-sectional view showing a cross section taken along line AA of FIG.
- FIG. 3 is a first ridge formed on the top sheet of the
- FIG. 5 is a figure for demonstrating the flow path comprised from the projection part of a top sheet, and a back sheet.
- FIG. 6 is a figure for demonstrating the bodily fluid of the wearer who leaked out from the absorber and flowed into the flow path.
- FIG. 7 is a figure for demonstrating the manufacturing method of the absorbent article of one Embodiment of this invention.
- FIG. 8 is a view for explaining a recess-forming roll used for producing the absorbent article of one embodiment of the present invention.
- FIG. 9 is a view for explaining a region where a recess is formed by the recess forming roll in the top sheet.
- FIG. 10 is a view for explaining an upper stage roll of a drawing gear roll used for manufacturing an absorbent article according to an embodiment of the present invention.
- FIG. 11 is a view for explaining a lower roll of a drawing gear roll used for manufacturing an absorbent article according to an embodiment of the present invention.
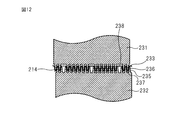
- FIG. 12 is a view for explaining a top sheet sheet stretched by a stretching gear roll.
- FIG. 13 is a plan view of a modified example of one embodiment of the absorbent article of the present invention.
- FIG. 14 is a plan view showing the area outside the widthwise edge of the absorbent body in a modification of the embodiment of the absorbent article of the present invention.
- FIG. 15 is an electron micrograph of the skin contact surface of the top sheet in the sanitary napkin in which the top sheet contains avian C2L oil fatty acid glyceride.
- FIG. 16 is a photomicrograph of menstrual blood with or without a blood modifying agent.
- FIG. 17 is a diagram for explaining a method of measuring surface tension.
- FIG. 1 is a plan view of an absorbent article according to an embodiment of the present invention
- FIG. 2 is a schematic cross-sectional view taken along the line AA of FIG.
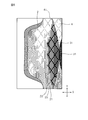
- the absorbent article 1 has a liquid-permeable top sheet 2 provided on the skin side (skin contact side), a liquid-impermeable back sheet 3 provided on the clothing side (non-skin contact side), and a top sheet 2 and a back sheet 3, provided on both sides of the main body 10 so as to extend in the width direction from both side edges of the main body 10 including the liquid-retaining absorber 4 provided between the back sheet 3 and And a pair of wing portions 5 provided with the top sheet 2 and the back sheet 3.
- Reference numeral 51 is a root of the wing 5 (a boundary between the main body 10 and the wing 5).
- the surface on the opposite side of the surface on the clothing side of the wing portion 5 is constituted by the top sheet 2.
- An adhesive portion 6 is provided on the surface of the wing portion 5 on the clothes side.
- the width direction of the absorbent article 1 is the X direction
- the longitudinal direction is the Y direction
- the plane direction of the absorbent article 1 is the XY direction.
- the shape of the main body portion 10 is not particularly limited as long as it is a shape that conforms to the shape of a female body and an underwear, such as a rectangular shape, an oval shape, and an hourglass shape.
- the longitudinal dimension in the outer shape of the main body 10 is preferably 100 to 500 mm, more preferably 150 to 350 mm. Further, the dimension in the width direction of the outer shape of the main body 10 is preferably 30 to 200 mm, more preferably 40 to 180 mm.
- the top sheet 2 transfers body fluid such as urine and menstrual blood discharged from the wearer to the absorber 4. At least a portion of the top sheet 2 is liquid permeable and has a number of openings for the passage of body fluids.
- the top sheet 2 is made of a resin film.
- the resin film used as the top sheet 2 is made of a copolymer of an olefin and an acrylic ester, another monomer such as vinyl acetate, polyolefin, polyester, polypropylene, polyethylene, polyethylene terephthalate, polyamide, cellulose acetate or the like.
- the resin film used as the top sheet 2 is particularly preferably a copolymer of an olefin and another monomer, or a polyolefin, from the viewpoint of high flexibility and low irritation to the skin.
- the basis weight of the top sheet 2 is preferably 1 g / m 2 or more and 40 g / m 2 or less, more preferably 10 g / m 2 or more and 35 g / m 2 or less.
- the thickness of the resin film which comprises the top sheet 2 becomes like this. Preferably it is 0.01 mm or more and 0.4 mm or less, More preferably, it is 0.1 mm or more and 0.35 mm or less.
- the thickness of the resin film constituting the top sheet 2 is less than 0.01 mm, the hiding property of the top sheet 2 described below may be too small, and the thickness of the resin film constituting the top sheet 2 is If it exceeds 0.4 mm, the rigidity of the top sheet 2 may be high, and the stimulation of the top sheet 2 given to the wearer's skin may be too strong. Since the top sheet 2 has a ridge portion described later, the apparent thickness of the top sheet 2 is larger than the thickness of the resin film constituting the top sheet 2.
- the apparent thickness of the top sheet 2 is preferably 0.01 mm or more and 1 mm or less, more preferably 0.1 mm or more and 0.5 mm or less.
- the top sheet 2 has concealability in order to prevent the body fluid absorbed by the absorber 4 from being seen from the outside.
- the hiding property of the top sheet 2 is produced by mixing a filler such as titanium oxide into the resin.
- the filler is titanium oxide
- the content of titanium oxide is preferably 1% to 50%, more preferably 3% to 15%, based on the weight of the resin film.
- the content of the titanium oxide is less than 1% with respect to the weight of the resin film, the effect of hiding the body fluid absorbed by the absorber 4 in the top sheet 2 may be too small.
- sheet forming of the resin containing titanium oxide may be difficult.
- the top sheet 2 extends in the longitudinal direction, and includes a plurality of first protrusions 21 aligned in the width direction, and a plurality of second protrusions 22 connecting the adjacent first protrusions 21; It has a first projection 21 and a bottom 23 of the base of the second projection 22.
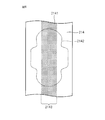
- FIG. 3 shows the first ridges formed on the region 14 outside the both edges 41 of the absorbent body 4 in the width direction of the top sheet 2 of the main body 10 and the top sheet 2 of the wing 5 (see FIG. 1) It is a figure for demonstrating a 2nd protrusion part and a bottom part.
- FIG. 4 is for demonstrating the 1st protrusion, the 2nd protrusion, and the bottom part which were formed in the area
- region 12 in which the absorber 4 in the top sheet 2 of the main-body part 10 is provided (refer FIG. 1).
- the first ridge, the second ridge, and the bottom formed in the region 12 in the top sheet 2 of the main body 10 in which the absorber 4 is provided are slightly different as described later.
- the top sheet 2 extends in the longitudinal direction (Y direction) in the regions 14 and the wings 5 outside the both edges 41 in the width direction of the absorber 4, and the width direction (X direction) And a plurality of first protrusions 21 aligned with each other.
- the shape of the cross section of the first protrusion 21 is, for example, a shape in which a substantially U-shape is turned upside down (hereinafter, referred to as a substantially reverse U-shape).
- the U-shape can be inverted upside-down when it is deformed, such as rounding corners or changing a straight line into a curve, in the substantially inverted U-shape. included.
- the substantially inverted U-shape also includes an inverted V-shape, an M-shape, and a trapezoid.
- the adjacent first protrusions 21 are connected via the plurality of second protrusions 22. It is preferable that the second ridges 22 extend in a direction oblique to the first ridges 21 extending in the longitudinal direction (Y direction). For example, it is preferable that an angle between the first protrusion 21 and the second protrusion 22 be 10 degrees or more and 170 degrees or less.
- the shape of the cross section of the second protrusion 22 when the second protrusion 22 is cut in a direction orthogonal to the direction in which the second protrusion 22 extends is, for example, a substantially reverse V-shape. .
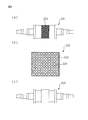
- FIG. 5 is a view for explaining a flow path formed of the ridges 21 and 22 of the top sheet 2 and the back sheet 3.
- a hollow structure is formed.
- the body fluid 31 that has leaked from the absorber 4 flows into the hollow structure. That is, the first protrusion 21 and the second protrusion 22 together with the back sheet 3 described later form a flow path for pouring the body fluid 31 into.
- the body fluid 31 which has flowed into the flow path constituted by the second ridge 22a and the back sheet 3 is constituted by the first ridge 21a and the back sheet 3.
- the body fluid that has flowed into the flow path formed of the first ridge 21 a and the back sheet 3 is longitudinally (in the Y direction) in the flow path formed of the first ridge 21 a and the back sheet 3 Flows to After flowing in the longitudinal direction (Y direction), the body fluid 31 passes through the flow path formed of the second ridge 22 b and the back sheet 3 to form the adjacent first ridge 21 b and the back sheet 3.
- the body fluid that has flowed into the flow path formed of the first ridge 21 b and the back sheet 3 is longitudinally (in the Y direction) in the flow path formed of the first ridge 21 b and the back sheet 3 Flows to After flowing in the longitudinal direction (Y direction), the body fluid 31 is separated from the first ridge 21 c and the back sheet 3 adjacent to each other through the flow path formed of the second ridge 22 c and the back sheet 3. Flow into the flow path composed of In this manner, the body fluid 31 flows in the longitudinal direction (Y direction) in the flow path formed of the first ridge 21 and the back sheet 3, and thereafter, the body fluid 31 forms the second ridge.
- the emitted body fluid spreads in the width direction (X direction) between the top sheet 2 and the back sheet 3.
- the bodily fluid 31 which exudes from the absorber 4 spreads in the width direction (X direction), and when the pressure is applied to the absorbent article 1, the bodily fluid 31 which exudes from the absorber 4 is absorbed. Leakage from the width direction of the sex article 1 can be suppressed.
- the number of first protrusions 21 per cm in the width direction is preferably 3 or more, more preferably 5 or more. If the number of first protrusions 21 per cm in the width direction is 2 or less, the amount of body fluid that can be accumulated in the first protrusions 21 decreases, and the body fluid exuded from the absorber is absorbed It may leak from the width direction of the sex goods.
- the length in the longitudinal direction (Y direction) of the second ridge portion 22 is preferably 0.3 mm or more and 5 mm or less, and more preferably 0.5 mm or more and 3 mm or less.
- the length in the longitudinal direction (Y direction) of the second ridge 22 is smaller than 0.3 mm, the body fluid flowing into the first ridge 21 passes through the second ridge 22. It may be difficult to flow into the adjacent first protrusion 21, and there may be a case where the body fluid which has lost its place of spot exudes out of the top sheet 2.
- the length in the longitudinal direction (Y direction) of the second protrusion 22 is greater than 5 mm, the body fluid flowing into the first protrusion 21 elongates in the first protrusion 21. Before flowing in the direction (Y direction), it may flow into the adjacent first ridge 21 via the second ridge 22 and the body fluid exuded from the absorber is from the width direction of the absorbent article May leak.
- the first protrusion 21 and the second protrusion 22 will be present.
- the first protrusion 21 and the second protrusion 22 impart a soft touch to the surface of the absorbent article 1. Therefore, this makes the skin contact of the undergarment of the undergarment when wearing the undergarment with the absorbent article 1 better.
- the top sheet 2 of the region 12 of the main body 10 in which the absorber 4 is provided is the region 14 and the wing 5 outside the both edges 41 of the main body 10 in the width direction of the absorber 4.
- the first protrusion 21, the second protrusion 22 and the bottom 23 are included.
- the first ridge 21, the second ridge 22 and the bottom 23 of the top sheet 2 in the region 12 of the main body 10 in which the absorbent body 4 is provided have a blood-modified surface described later on the skin side surface.
- the agent layer 24 is further included.
- the first ridge 21 of the top sheet 2 in the area 12 where the absorber 4 is provided further includes an opening 25 described later.
- the first protrusion 21 of the top sheet 2 of the region 12 of the main body 10 in which the absorber 4 is provided has a plurality of openings 25 aligned in the longitudinal direction (Y direction) on both side surfaces 26 thereof.
- the body fluid of the wearer discharged to the top sheet 2 of the area 12 where the absorber 4 of the main body 10 is provided passes through the opening 25 and moves to the absorber 4.
- the body fluid of the wearer discharged to the top sheet 2 by the substantially U shape in the width direction (X direction) formed by the two adjacent first ridges 21 and the bottom 23 is the bottom 23 Gather quickly towards you.
- the body fluid flowing toward the bottom 23 passes through the opening 25 provided on the side surface 26 of the first protrusion 21 and reaches the absorber 4 before reaching the bottom 23.
- the body fluid accumulated in the bottom portion 23 also passes through the opening 25 provided in the side surface 26 of the first protrusion 21 and flows to the absorber 4. Therefore, the body fluid of the wearer is quickly absorbed by the absorbent body 4 by the opening 25 provided on the side surface 26 of the first protrusion 21. In addition, the amount of body fluid remaining in the top sheet 2 can be reduced by the openings 25 provided on the side surface 26 of the first protrusion 21.
- a blood modifying agent is applied to the skin side surface of the top sheet 2 of the region 12 where the absorber 4 of the main body portion 10 is provided, and a blood modifying layer 24 is formed on the skin contacting side surface of the top sheet 2 May be formed.
- the blood modifier layer 24 can prevent the body fluid of the wearer, in particular, the highly viscous menstrual blood from remaining on the surface of the top sheet 2.
- the blood modifying agent layer 24 will be described in detail later.
- the top The feel of the sheet 2 becomes good.
- the first ridge portion is less likely to be crushed, so the first ridge is formed on the top sheet 2 of the region 12 of the main body portion 10 where the absorber 4 is provided. It is preferable to provide both the part and the second protrusion.
- the back sheet 3 shown in FIGS. 1 and 2 prevents the body fluid absorbed by the absorber 4 from leaking out.
- the back sheet 3 is made of a material that is impermeable to body fluid.
- a hydrophobic non-woven fabric an impermeable plastic film such as polyethylene and polypropylene or a laminate sheet of non-woven fabric and an impermeable plastic film, or the like is used.
- an SMS non-woven fabric in which a highly water-resistant melt-blown non-woven fabric is sandwiched by strong spunbond non-woven fabrics may be used as the back sheet 3.
- the back sheet 3 overlaps with the top sheet 2
- the back sheet 3 is a body fluid 31 together with the first ridge 21 and the second ridge 22 formed on the top sheet 2 described above.
- Form a flow path for pouring The back sheet 3 is joined to the bottom 23 of the top sheet 2 using an adhesive such as a hot melt adhesive.
- the absorber 4 absorbs and holds the body fluid. It is preferable that the absorber 4 is bulky, hard to lose its shape, and less in chemical stimulation.
- a composite absorbent made of fluff pulp or air-laid non-woven fabric and super absorbent polymer (SAP) is used as the absorbent 4.
- SAP super absorbent polymer
- the composite absorber may be covered with a liquid permeable material such as a tissue.
- artificial cellulose fibers such as chemical pulp, cellulose fibers, rayon and acetate may be used.
- the basis weight of the absorbent fiber such as pulp in the composite absorbent is preferably 100 g / m 2 or more and 800 g / m 2 or less, and the mass ratio of the superabsorbent polymer in the composite absorbent is the absorbency
- the fiber content is preferably 100% to 10% to 65%.
- the basis weight of a liquid-permeable material such as a tissue covering the composite mixture is preferably 12 g / m 2 or more and 30 g / m 2 or less.
- the air-laid non-woven fabric of the composite mixture for example, a non-woven fabric in which pulp and synthetic fibers are heat-sealed or a non-woven fabric in which pulp and synthetic fibers are fixed with a binder can be used.
- the superabsorbent polymer of the composite absorbent has a three-dimensional network structure in which a water-soluble polymer is appropriately crosslinked.
- the absorbent polymer absorbs 30 to 60 times as much water as the volume of absorbent polymer before absorbing water.
- this absorbable polymer is essentially water insoluble.
- the absorbent polymer does not release the water once absorbed, even if some pressure is applied.
- this absorbent polymer for example, starch-based, acrylic acid-based or amino acid-based particulate or fibrous polymers are used.
- the shape and structure of the absorber 4 can be changed as needed, but the total amount of absorption of the absorber 4 needs to correspond to the designed insertion amount as the absorbent article 1 and the desired application.
- the size, absorption capacity and the like of the absorber 4 change depending on the application.
- the edge 41 in the width direction of the absorber 4 is curved so as to protrude in the width direction (X direction).
- the first protrusion 21 provided on the top sheet 2 in the area 14 outside the both edges 41 in the width direction of the absorber 4 proceeds in the longitudinal direction (Y direction) And the widthwise edge 41 of the absorber 4. Therefore, the body fluid 31 which has flowed in the longitudinal direction (Y direction) in the flow path constituted by the first ridge 21 and the back sheet, and which is exuded from the absorber 4 is absorbed by the absorber 4 again. .
- Absorber 4 is bonded to back sheet 3 using a hot melt adhesive. Thereby, peeling of the absorber 4 from the back sheet 3 can be suppressed.
- the wing portion 5 is provided on the absorbent article 1 in order to stably fix the absorbent article 1 to the undergarment.
- the absorbent article 1 can be stably fixed to the undergarment by bending the wing portion 5 to the outer surface side of the undergarment and then sticking it to the crotch portion of the undergarment through the adhesive portion 6.
- the adhesive portion 6 fixes the absorbent article 1 to the crotch portion of the undergarment.
- an adhesive which forms the adhesion part 6 what is a styrene-type polymer, a tackifier, and a plasticizer as a main component, for example is used suitably.
- the styrene-based polymer include styrene-ethylene-butylene-styrene block copolymer, styrene-butylene polymer, styrene-butylene-styrene block copolymer, and styrene-isobutylene-styrene copolymer. Or a blend of two or more polymers.
- styrene-ethylene-butylene-styrene block copolymer is preferable in that the thermal stability is good.
- tackifier and the plasticizer those which are solid at normal temperature can be preferably used, and as the tackifier, for example, C5 petroleum resin, C9 petroleum resin, dicyclopentadiene petroleum resin, rosin petroleum resin And polyterpene resins, terpene phenol resins, etc.
- the plasticizer include, in addition to monomer plasticizers such as triflecil phosphate, dibutyl phthalate and dioctyl phthalate, polymer plasticizers such as vinyl polymers and polyesters.
- the top sheet 2 and the absorbent body 4 have compressed grooves 7 extending from the top sheet 2 to the inside of the absorbent body 4 which are compressed in the thickness direction by embossing.
- the squeeze groove 7 suppresses the diffusion of the body fluid discharged to the central portion of the absorbent article 1 (the portion facing the outlet of the body fluid of the wearer) in the width direction (X direction). Moreover, it can suppress that the top sheet 2 peels from the absorber 4 by this.
- the pressing groove 7 surrounds the central portion of the absorbent article 1 and has a continuous and substantially annular shape.
- the pressing groove 7 surrounding the center part of the absorbent article 1 may be partially interrupted. That is, the pressing groove 7 may have a discontinuous and substantially annular shape.
- the compression bonding of the top sheet 2 to the back sheet 3 by heat embossing forms the seal portions 8 on both sides in the longitudinal direction and both sides in the width direction of the absorbent article 1.
- the top sheet 2 can be prevented from peeling off from the back sheet 3.
- both ends of the flow path constituted by the first ridge 21 and the back sheet 3 are compressed and sealed by the sealing portions 8 on both sides in the longitudinal direction.
- both ends of the flow path formed of the first ridge 21 and the back sheet 3 are closed, the first ridge 21 and the back sheet 3 are formed.
- the body fluid of the wearer that has flowed in a large amount through the flow path can be prevented from leaking from both ends in the longitudinal direction of the absorbent article 1.
- the blood modifying agent of the blood modifying agent layer 24 is a blood modifying agent having an IOB of about 0.00 to about 0.60, a melting point of about 45.degree. C. or less, 100 g of water at 25.degree. It has a water solubility of 00 to about 0.00 to about 0.05 g.
- IOB Inorganic Organic Balance
- IOB value calculated by inorganic value / organic value.
- the IOB is about 0.00 to about 0.60, preferably about 0.00 to about 0.50, and about 0.00 to about 0.40. More preferred is about 0 to about 0.30. This is because the lower the IOB, the higher the organicity and the higher the affinity to blood cells.
- the "melting point” means the peak top temperature of an endothermic peak when changing from solid state to liquid state when measured at a temperature rising rate of 10 ° C./min in a differential scanning calorimeter.
- the melting point can be measured, for example, using a DSC-60 type DSC measurement apparatus manufactured by Shimadzu Corporation.
- the blood modifying agent may be liquid or solid at room temperature as long as it has a melting point of about 45 ° C. or less, ie, even if the melting point is about 25 ° C. or more, or less than about 25 ° C. It may well have a melting point such as, for example, about -5.degree. C., about -20.degree. The reason why the melting point of the blood modifying agent is about 45 ° C. or less will be described later.
- the vapor pressure of the blood modifying agent is preferably about 0 to about 200 Pa at 25 ° C. (1 atm), more preferably about 0 to about 100 Pa, and further preferably about 0 to about 10 Pa. Preferably, about 0 to about 1 Pa is even more preferred, and about 0.0 to about 0.1 Pa is even more preferred.
- the vapor pressure is preferably about 0 to about 700 Pa and about 0 to about 100 Pa at 40 ° C. (1 atm).
- the melting point of the blood modifying agent can be properly used depending on the weather, the length of wearing time, and the like. For example, in areas where the average temperature is less than about 10 ° C, menstrual blood may be excreted and then cooled by the ambient temperature by employing a blood modifying agent having a melting point of less than about 10 ° C. It is believed that blood modifying agents can stably modify blood.
- the melting point of the blood modifying agent is preferably higher in the range of 45 ° C. or less. It is because it is hard to be affected by sweat, friction at the time of wearing, etc., and it is difficult for the blood modifying agent to move even when worn for a long time.
- a water solubility of 0.00 to 0.05 g For a water solubility of 0.00 to 0.05 g, add a 0.05 g sample to 100 g deionized water at 25 ° C., allow to stand for 24 hours, and after 24 hours, lightly stir as needed, Then, it can be measured by visually evaluating whether the sample has dissolved.
- dissolving includes cases where the sample is completely dissolved in deionized water to form a homogeneous mixture and cases where the sample is completely emulsified. "Complete” means that there is no clump of sample in deionized water.
- the surface of the top sheet is coated with a surfactant for the purpose of changing blood surface tension and the like to rapidly absorb the blood.
- the surfactant generally has high water solubility
- the surfactant-coated top sheet is compatible with hydrophilic components (such as plasma) in the blood, rather the blood remains on the top sheet.
- hydrophilic components such as plasma
- solubility in 100 g of water at 25 ° C. may be simply referred to as “water solubility”.
- the weight average molecular weight means a value in terms of polystyrene, which is determined by gel permeation chromatography (GPC).
- GPC measurement conditions include the following. Model: High-performance liquid chromatogram Lachrom Elite manufactured by Hitachi High-Technologies Corporation Column: Showa Denko KK SHODEX KF-801, KF-803 and KF-804 Eluent: THF Flow rate: 1.0 mL / min Implanted volume: 100 ⁇ L Detection: RI (differential refractometer)
- the weight average molecular weight described in the Example of this specification is measured based on the said conditions.
- the above blood modifying agent is preferably selected from the following (i) to (iii), (I) Hydrocarbons, (Ii) from a carbonyl group (-CO-) and an oxy group (-O-) inserted between (ii-1) a hydrocarbon moiety and (ii-2) a C-C single bond of the above-mentioned hydrocarbon moiety
- hydrocarbon means a compound consisting of carbon and hydrogen, and is a chain hydrocarbon, for example, paraffinic hydrocarbon (also referred to as alkane not containing double bond and triple bond) Olefinic hydrocarbons (containing one double bond, also called alkenes), acetylenic hydrocarbons (containing one triple bond, also called alkynes), and a group consisting of double bonds and triple bonds And hydrocarbons containing two or more bonds selected from, as well as cyclic hydrocarbons such as aromatic hydrocarbons and alicyclic hydrocarbons.
- paraffinic hydrocarbon also referred to as alkane not containing double bond and triple bond
- Olefinic hydrocarbons containing one double bond, also called alkenes
- acetylenic hydrocarbons containing one triple bond, also called alkynes
- hydrocarbons containing two or more bonds selected from, as well as cyclic hydrocarbons such as aromatic hydrocarbons and alicyclic hydrocarbons.
- the hydrocarbon is preferably a chain hydrocarbon and an alicyclic hydrocarbon, more preferably a chain hydrocarbon, a paraffin hydrocarbon, an olefin hydrocarbon and two double bonds. It is more preferable that it is the hydrocarbon (it does not contain a triple bond) which contains above, and it is still more preferable that it is a paraffinic hydrocarbon.
- the chained hydrocarbons include straight chained hydrocarbons and branched chained hydrocarbons.
- each oxy group (—O—) is not adjacent. Accordingly, the compounds (ii) and (iii) do not include compounds in which the oxy group is continuous (so-called peroxides).
- At least one hydrogen atom of the hydrocarbon moiety is a hydroxyl group (-) rather than a compound in which at least one hydrogen atom of the hydrocarbon moiety is substituted with a carboxyl group (-COOH).
- Compounds substituted with OH) are preferred.
- Table 1 since the carboxyl group binds to metals and the like in blood, and the inorganic value greatly increases from 150 to 400 or more, the blood modifying agent having a carboxyl group is used at the time of use This is because the IOB value may exceed about 0.60 and the affinity to blood cells may be reduced.
- the above blood modifying agent comprises the following (i ') to (iii'), (I ') hydrocarbons, (Ii ') (ii'-1) a hydrocarbon moiety, and (ii'-2) a carbonyl bond (-CO-), an ester bond (-COO) inserted between a C-C single bond of the above-mentioned hydrocarbon moiety -), A compound having one or more same or different bonds selected from the group consisting of carbonate bond (-OCOO-), and ether bond (-O-), and (iii ') (iii'-) 1) Carbonyl bond (-CO-), ester bond (-COO-), carbonate bond (-OCOO) inserted between the hydrocarbon moiety and the C-C single bond of the above-mentioned hydrocarbon moiety (iii'-2) A carboxyl group (-), and one or more, same or different bond selected from the group consisting of an ether bond (-O-) and (iii'
- the blood modifying agent has about 1.8 or less carbonyl bonds (-CO-) and 2 or less ester bonds (-COO-) per 10 carbon atoms in the hydrocarbon moiety. About 1.5 or less carbonate bond (-OCOO-), about 6 or less ether bond (-O-), about 0.8 or less carboxyl group (-COOH), and / or hydroxyl group (-OH) Or a compound having about 1.2 or less).
- the above blood modifying agent is any of the following (A) to (F), (A) A compound having (A1) a chain hydrocarbon moiety and 2 to 4 hydroxyl groups replacing the hydrogen atom of the chain hydrocarbon moiety, (A2) a chain hydrocarbon moiety, and the above chain Ester with a compound having one carboxyl group replacing the hydrogen atom of the cyclic hydrocarbon moiety, (B) A compound having (B1) a chain hydrocarbon moiety and 2 to 4 hydroxyl groups replacing the hydrogen atom of the chain hydrocarbon moiety, (B2) a chain hydrocarbon moiety, and the above chain Ether with a compound having one hydroxyl group replacing the hydrogen atom of the cyclic hydrocarbon moiety, (C) a carboxylic acid, a hydroxy acid, an alkoxy acid or an oxo acid containing a (C1) linear hydrocarbon moiety and 2 to 4 carboxyl groups replacing the hydrogen atom of the linear hydrocarbon moiety; C2) an ester of a compound having a chain hydrocarbon moiety
- a compound having (A1) a chain hydrocarbon moiety and 2 to 4 hydroxyl groups replacing the hydrogen atom of the chain hydrocarbon moiety, (A2) a chain hydrocarbon moiety, and the above chain Ester with a compound having one carboxyl group replacing hydrogen atoms in the cyclic hydrocarbon moiety (hereinafter sometimes referred to as “compound (A)”) has the above-mentioned IOB, melting point and water solubility And all hydroxyl groups may not be esterified.
- (A1) a compound having a chain hydrocarbon portion and 2 to 4 hydroxyl groups replacing the hydrogen atom of the above chain hydrocarbon portion (hereinafter sometimes referred to as “compound (A1)”)
- chain hydrocarbon tetraols such as alkanetetraols such as pentaerythritol
- chain hydrocarbon triols such as alkanetriols such as glycerin
- chain hydrocarbon diols such as alkane diols such as Glycol is mentioned.
- Examples of (A2) a compound having a chain hydrocarbon portion and one carboxyl group replacing the hydrogen atom of the chain hydrocarbon portion include, for example, And compounds in which one hydrogen atom on a hydrocarbon is substituted with one carboxyl group (—COOH), such as fatty acid.
- Examples of the compound (A) include an ester of (a 1 ) chain hydrocarbon tetraol and at least one fatty acid, an ester of (a 2 ) chain hydrocarbon triol and at least one fatty acid, and (a 3 And esters of linear hydrocarbon diols and at least one fatty acid.
- the ester of the above linear hydrocarbon tetraol and at least one fatty acid may be, for example, the following formula (1): Tetraester of pentaerythritol with fatty acid, the following formula (2): Triester of pentaerythritol with fatty acid, the following formula (3): A diester of pentaerythritol with fatty acid, the following formula (4): And monoesters of fatty acid with pentaerythritol. (Wherein, R 1 to R 4 are each a chain hydrocarbon)
- esters of pentaerythritol and fatty acids have the above IOB, melting point and water solubility
- saturated fatty acids such as C 2 to C 30 saturated fatty acids, for example, acetic acid (C 2 ) (C 2 represents a carbon number, R 1 C, R 2 C, R 3 C or R 4 C, which corresponds to the carbon number of R 2 C, hereinafter the same), propanoic acid (C 3 ), butanoic acid (C 4 ) and isomers thereof, for example, 2-methylpropanoic acid (C 4) ), pentanoic acid (C 5) and isomers thereof such as 2-methylbutanoic acid (C 5), 2,2-dimethyl propanoic acid (C 5), hexanoic acid (C 6), heptanoic acid (C 7) Oct
- the fatty acids can also be unsaturated fatty acids.
- unsaturated fatty acids include C 3 -C 20 unsaturated fatty acids such as monounsaturated fatty acids such as crotonic acid (C 4 ), myristoleic acid (C 14 ), palmitoleic acid (C 16 ), Oleic acid (C 18 ), elaidic acid (C 18 ), vacenic acid (C 18 ), gadeuric acid (C 20 ), eicosenic acid (C 20 ), etc., diunsaturated fatty acids such as linoleic acid (C 18 ), Eicosadienoic acid (C 20 ) and the like, triunsaturated fatty acids such as linolenic acid, for example ⁇ -linolenic acid (C 18 ) and ⁇ -linolenic acid (C 18 ), pinolenic acid (C 18 ), eleostearic acid, For example, ⁇ -eleostearic acid (C 18
- the ester of pentaerythritol and fatty acid is an ester of pentaerythritol and fatty acid derived from saturated fatty acid, that is, an ester of pentaerythritol and saturated fatty acid, in consideration of the possibility of modification by oxidation etc. preferable.
- the ester of pentaerythritol and a fatty acid in order to make IOB small and make it more hydrophobic, it is preferable to be a diester, a triester or a tetraester, and a triester or a tetraester is more preferable. And tetra-esters are more preferred.
- the total carbon number of fatty acids constituting the tetraester of pentaerythritol and fatty acid that is, in the above formula (1), R 1 C, R 2 C, R 3 C and When the total number of carbons in the R 4 C portion is 15, the IOB is 0.60. Therefore, in the case of tetraester of pentaerythritol and fatty acid, IOB satisfies the requirement of about 0.00 to about 0.60 when the total number of carbons is about 15 or more.
- Examples of the tetraester of pentaerythritol and fatty acid include pentaerythritol, hexanoic acid (C 6 ), heptanoic acid (C 7 ), octanoic acid (C 8 ), for example, 2-ethylhexanoic acid (C 8 ), These include tetraesters with nonanoic acid (C 9 ), decanoic acid (C 10 ) and / or dodecanoic acid (C 12 ).
- the total carbon number of the fatty acid constituting the triester of pentaerythritol and fatty acid that is, the R 1 C, R 2 C and R 3 C moieties in the above formula (2)
- the IOB is 0.58 when the sum of the carbon numbers of these is 19. Therefore, in the case of the triester of pentaerythritol and fatty acid, IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of fatty acid is about 19 or more.
- the total carbon number of fatty acids constituting the diester of pentaerythritol and fatty acid that is, the total carbon number of R 1 C and R 2 C in the above formula (3) is In the case of 22, the IOB is 0.59. Accordingly, in the diester of pentaerythritol and fatty acid, IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of fatty acid is about 22 or more.
- esters of pentaerythritol and fatty acid examples include Unistar H-408 BRS, H-2408 BRS-22 (mixed product), etc. (all manufactured by NOF Corporation).
- the ester of the above linear hydrocarbon triol and at least one fatty acid may be, for example, the following formula (5): Triester of glycerin and fatty acid, the following formula (6): A diester of glycerin and a fatty acid, and the following formula (7): (Wherein, each of R 5 to R 7 is a chain hydrocarbon) And monoesters of glycerin and fatty acids.
- fatty acids (R 5 COOH, R 6 COOH and R 7 COOH) constituting the ester of glycerin and fatty acid if the ester of glycerin and fatty acid satisfies the requirements of the above IOB, melting point and water solubility
- the fatty acids listed in the “ester of (a 1 ) chain hydrocarbon tetraol and at least one fatty acid” are not particularly limited, and examples thereof include saturated fatty acids and unsaturated fatty acids, which are modified by oxidation etc. In consideration of the possibility of doing so, an ester of glycerin and a fatty acid derived from a saturated fatty acid, that is, an ester of glycerin and a saturated fatty acid is preferable.
- ester of glycerol and a fatty acid in order to make IOB small and to make it more hydrophobic, it is preferable that it is diester or triester, and it is more preferable that it is triester.
- triester of glycerin and fatty acid is also referred to as triglyceride, for example, triester of glycerin and octanoic acid (C 8 ), triester of glycerin and decanoic acid (C 10 ), glycerin and dodecanoic acid (C 12 And triesters of glycerin with two or three fatty acids, and mixtures thereof.
- Examples of the triester of the above glycerin and two or more fatty acids include triester of glycerin and octanoic acid (C 8 ) and decanoic acid (C 10 ), glycerin, octanoic acid (C 8 ), decane Acid (C 10 ) and triester with dodecanoic acid (C 12 ), glycerin and octanoic acid (C 8 ), decanoic acid (C 10 ), dodecanoic acid (C 12 ), tetradecanoic acid (C 14 ), hexadecanoic acid Examples thereof include triesters with (C 16 ) and octadecanoic acid (C 18 ).
- the total carbon number of fatty acids constituting the triester of glycerin and fatty acid ie, R 5 C in the formula (5)
- the sum of the carbon numbers of the R 6 C and R 7 C moieties is about 40 or less.
- the total carbon number of fatty acids constituting the triester of glycerin and fatty acid that is, in the formula (5), the R 5 C, R 6 C and R 7 C moieties
- the IOB is 0.60. Therefore, in the above-mentioned triesters of glycerin and fatty acid, the IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of fatty acid is about 12 or more.
- the above-mentioned triester of glycerin and a fatty acid is a so-called fat and is a component that can constitute the human body, and thus is preferable from the viewpoint of safety.
- tricotic oil fatty acid glyceride NA36
- PANACET 800 PANACET 800B
- PANACET 810S avian C2L oil fatty acid glyceride and triCL oil fatty acid glyceride (manufactured by NOF CORPORATION) Etc.).
- the above-mentioned diester of glycerin and fatty acid is also referred to as diglyceride, for example, a diester of glycerin and decanoic acid (C 10 ), a diester of glycerin and dodecanoic acid (C 12 ), and glycerin and hexadecanoic acid (C 16 ) Included are diesters and diesters of glycerin with two fatty acids, and mixtures thereof.
- the total carbon number of fatty acids constituting the diester of glycerin and fatty acid ie, the case where the total carbon number of R 5 C and R 6 C moieties in the formula (6) is 16
- the IOB is 0.58. Therefore, in the case of the diester of glycerin and fatty acid, the IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of fatty acid is about 16 or more.
- the monoester of glycerin and fatty acid is also referred to as monoglyceride, and examples thereof include icosanoic acid (C 20 ) monoester of glycerin, docosanoic acid (C 22 ) monoester of glycerin and the like.
- the carbon number of fatty acid constituting the monoester of glycerin and fatty acid that is, in the formula (7), the IOB is 0.59 when the carbon number of the R 5 C portion is 19 It becomes. Therefore, in the monoester of glycerin and fatty acid, the IOB satisfies the requirement of about 0.00 to about 0.60 when the carbon number of the fatty acid is about 19 or more.
- esters of the above linear hydrocarbon diol and at least one fatty acid include C 2 to C 6 linear hydrocarbon diols, such as C 2 to C 6 glycols, such as ethylene glycol, propylene glycol, butylene And mono- or diesters of glycol, pentylene glycol or hexylene glycol with fatty acids.
- ester of the above linear hydrocarbon diol and at least one fatty acid for example, the following formula (8): R 8 COOC k H 2k OCOR 9 (8) (Wherein k is an integer of 2 to 6 and R 8 and R 9 are each a chain hydrocarbon) A diester of a C 2 -C 6 glycol with a fatty acid, and the following formula (9): R 8 COOC k H 2k OH (9) (Wherein k is an integer of 2 to 6 and R 8 is a chain hydrocarbon) And monoesters of fatty acid with C 2 -C 6 glycol.
- ester of C 2 to C 6 glycol and fatty acid as the fatty acid to be esterified (corresponding to R 8 COOH and R 9 COOH in the formula (8) and the formula (9)), C 2 to C 6 glycol
- ester of fatty acid with the fatty acid provided that it satisfies the requirements of the above IOB, melting point and water solubility, for example, "ester of (a 1 ) chain hydrocarbon tetraol with at least one fatty acid"
- the ester of a C 2 ⁇ C 6 glycols and fatty acid in view of the potential for degradation by oxidation and the like, derived from saturated fatty acids, esters of C 2 ⁇ C 6 glycols and fatty acid, Nachi Suwa, C 2 It is preferably an ester of a -C 6 glycol and a saturated fatty acid.
- ester of C 2 -C 6 glycol and fatty acid an ester of glycol and fatty acid derived from glycol having a large number of carbon atoms, for example, butylene glycol, in order to make IOB small and make it more hydrophobic. It is preferable that it is an ester of a glycol derived from pentylene glycol or hexylene glycol and a fatty acid.
- ester of C 2 -C 6 glycol and fatty acid a diester is preferable in order to make IOB small and to make it more hydrophobic.
- examples of commercial products of the ester of C 2 -C 6 glycol and fatty acid include Commol BL, Commol BS (manufactured by NOF Corporation) and the like.
- (B) a compound having a chain hydrocarbon moiety and 2 to 4 hydroxyl groups replacing the hydrogen atom of the chain hydrocarbon moiety, (B2) a chain hydrocarbon moiety, and Ether with compound having one hydroxyl group replacing hydrogen atom of linear hydrocarbon moiety
- (B) A compound having (B1) a chain hydrocarbon moiety and 2 to 4 hydroxyl groups replacing the hydrogen atom of the chain hydrocarbon moiety, (B2) a chain hydrocarbon moiety, and the above chain Ether with a compound having one hydroxyl group replacing hydrogen atoms in the cyclic hydrocarbon moiety (hereinafter sometimes referred to as “compound (B)”) has the above-mentioned IOB, melting point and water solubility And all hydroxyl groups may not be etherified.
- Examples of the compound having (B1) a chain hydrocarbon portion and 2 to 4 hydroxyl groups replacing the hydrogen atoms of the above chain hydrocarbon portion are listed as the compound (A1) in the “compound (A)”.
- Examples of (B2) a compound having a linear hydrocarbon moiety and one hydroxyl group replacing the hydrogen atom of the linear hydrocarbon moiety include, for example, A compound in which one hydrogen atom of hydrocarbon is substituted with one hydroxyl group (—OH), for example, aliphatic monohydric alcohol such as saturated aliphatic monohydric alcohol and unsaturated aliphatic monohydric alcohol Can be mentioned.
- saturated aliphatic monohydric alcohol for example, a C 1 to C 20 saturated aliphatic monohydric alcohol, for example, methyl alcohol (C 1 ) (C 1 represents a carbon number, the same applies hereinafter), ethyl alcohol C 2 ), propyl alcohol (C 3 ) and its isomers, such as isopropyl alcohol (C 3 ), butyl alcohol (C 4 ) and its isomers, such as sec-butyl alcohol (C 4 ) and tert-butyl alcohol (C 4 ), pentyl alcohol (C 5 ), hexyl alcohol (C 6 ), heptyl alcohol (C 7 ), octyl alcohol (C 8 ) and isomers thereof, such as 2-ethylhexyl alcohol (C 8 ), nonyl alcohol (C 9 ), decyl alcohol (C 10 ), dodecyl alcohol (C 12 ), tetradecyl al Call (C 14), hexadect
- an ether of (b 1 ) chain hydrocarbon tetraol and at least one aliphatic monohydric alcohol for example, monoether, diether, triether and tetraether, preferably diether, triether Ethers and tetraethers, more preferably triethers and tetraethers, and even more preferably tetraethers, ethers of (b 2 ) chain hydrocarbon triols and at least one aliphatic monohydric alcohol, such as monoethers, diethers and the like triether, preferably diethers and triethers and more preferably tri-ether, and (b 3) a chain hydrocarbon diol and at least one aliphatic monohydric ether alcohols, for example, mono- and diethers and, Mashiku diethers.
- Examples of the ether of the above linear hydrocarbon tetraol and at least one aliphatic monohydric alcohol include the following formulas (10) to (13): (Wherein, each of R 10 to R 13 is a chain hydrocarbon). And tetraethers of pentaerythritol and aliphatic monohydric alcohols, triethers, diethers and monoethers.
- Examples of the ether of the above linear hydrocarbon triol and at least one aliphatic monohydric alcohol include the following formulas (14) to (16): (Wherein, R 14 to R 16 are each a chain hydrocarbon). And triethers of glycerol and aliphatic monohydric alcohols, diethers and monoethers.
- R 17 OC n H 2n OR 18 (Wherein n is an integer of 2 to 6 and R 17 and R 18 are each a chain hydrocarbon) Diethers of C 2 -C 6 glycols and aliphatic monohydric alcohols, and the following formula (18): R 17 OC n H 2n OH (18) (Wherein n is an integer of 2 to 6 and R 17 is a chain hydrocarbon) And monoethers of C 2 -C 6 glycols and aliphatic monohydric alcohols.
- the total carbon number of aliphatic monohydric alcohol constituting the tetraether of pentaerythritol and aliphatic monohydric alcohol that is, in the above formula (10)
- the IOB is 0.44. Therefore, in the above tetraether of pentaerythritol and aliphatic monohydric alcohol, IOB is required to be about 0.00 to about 0.60 when the total carbon number of aliphatic monohydric alcohol is about 4 or more. Fulfill.
- the total carbon number of aliphatic monohydric alcohol constituting triether of pentaerythritol and aliphatic monohydric alcohol ie, in the above formula (11)
- the IOB is 0.57. Therefore, in the above triether of pentaerythritol and aliphatic monohydric alcohol, IOB is required to be about 0.00 to about 0.60 when the total carbon number of aliphatic monohydric alcohol is about 9 or more. Fulfill.
- the total carbon number of aliphatic monohydric alcohols constituting the diether of pentaerythritol and aliphatic monohydric alcohol that is, R 10 in the above formula (12)
- the IOB is 0.60 when the sum of the carbon numbers of the and R 11 moieties is 15. Therefore, in the diether of pentaerythritol and aliphatic monohydric alcohol, IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of aliphatic monohydric alcohol is about 15 or more. .
- the carbon number of the aliphatic monohydric alcohol constituting the monoether of pentaerythritol and aliphatic monohydric alcohol that is, R 10 in the above formula (13)
- the IOB is 0.59. Therefore, in the monoether of pentaerythritol and aliphatic monohydric alcohol, the IOB satisfies the requirement of about 0.00 to about 0.60 when the carbon number of the aliphatic monohydric alcohol is about 22 or more.
- the total carbon number of aliphatic monohydric alcohol constituting triether of glycerin and aliphatic monohydric alcohol that is, R in the formula (14)
- the IOB is 0.50. Therefore, in the above triether of glycerin and aliphatic monohydric alcohol, IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of aliphatic monohydric alcohol is about 3 or more. .
- the total carbon number of aliphatic monohydric alcohols constituting the diether of glycerin and an aliphatic monohydric alcohol that is, in the formula (15), R 14 and R 15
- the IOB is 0.58. Therefore, in the diether of glycerin and an aliphatic monohydric alcohol, the IOB satisfies the requirement of about 0.00 to about 0.60 when the total carbon number of the aliphatic monohydric alcohol is about 9 or more.
- the carbon number of the aliphatic monohydric alcohol constituting the monoether of glycerin and aliphatic monohydric alcohol that is, the carbon of R 14 in the formula (16)
- the IOB is 0.58. Therefore, in the monoether of glycerin and aliphatic monohydric alcohol, the IOB satisfies the requirement of about 0.00 to about 0.60 when the carbon number of the aliphatic monohydric alcohol is about 16 or more.
- the compound (B) can be produced by dehydration condensation of the compound (B1) and the compound (B2) in the presence of an acid catalyst.
- compound C1 a linear hydrocarbon moiety and a carboxylic acid, a hydroxy acid, an alkoxy acid or an oxo acid containing 2 to 4 carboxyl groups replacing the hydrogen atom of the linear hydrocarbon moiety
- compound C1 may be, for example, a linear hydrocarbon carboxylic acid having 2 to 4 carboxyl groups, such as a linear hydrocarbon dicarboxylic acid, such as an alkane dicarboxylic acid, such as ethanedioic acid.
- a linear hydrocarbon hydroxy acid having 2 to 4 carboxyl groups for example, a linear chain having 2 to 4 carboxyl groups, such as malic acid, tartaric acid, citric acid, isocitric acid, etc.
- Hydrocarbon alkoxy acids such as O-acetyl citric acid, and linear hydrocarbon oxo acids having 2 to 4 carboxyl groups are included.
- Examples of the compound having a (C2) linear hydrocarbon moiety and one hydroxyl group replacing the hydrogen atom of the linear hydrocarbon moiety include those listed in the “compound (B)”, for example, Aliphatic monohydric alcohols are mentioned.
- an ester of a linear hydrocarbon tetracarboxylic acid having 4 carboxyl groups (c 1 ), a hydroxy acid, an alkoxy acid or an oxo acid, and at least one aliphatic monohydric alcohol for example, Mono-, di-, tri- and tetra-esters, preferably diesters, tri- and tetra-esters, more preferably tri- and tetra-esters, and still more preferably tetra-esters, chained with 3 (c 2 ) carboxyl groups
- Esters of hydrocarbon tricarboxylic acids, hydroxy acids, alkoxy acids or oxo acids with at least one aliphatic monohydric alcohol such as monoesters, diesters and triesters, preferably diesters and triesters, and more preferably triesters Ester
- aliphatic monohydric alcohol constituting the above ether corresponding to R 19 OH and R 20 OH in the formula (19)
- the above ether satisfies the requirements of the above IOB, melting point and water solubility It is not particularly limited, and examples thereof include aliphatic monohydric alcohols listed in the “compound (B)” section.
- the total carbon number of the aliphatic monohydric alcohol constituting the ether that is, the carbon number of the R 19 and R 20 moieties in the above formula (19) Since the IOB is 0.50 when the sum of the two is 2, the requirement of the above IOB is satisfied if the total carbon number is about 2 or more. However, when the total carbon number is about 6, the water solubility is as high as about 2 g, and there is also a problem from the viewpoint of the vapor pressure. In order to satisfy the requirement of water solubility of about 0.00 to about 0.05 g, the total carbon number is preferably about 8 or more.
- dialkyl ketone [(D 2 ) dialkyl ketone]
- dialkyl ketone following Formula (20): R 21 COR 22 (20) (Wherein, each of R 21 and R 22 is an alkyl group) And compounds having the formula:
- the total carbon number is preferably about 8 or more. Also, in consideration of the vapor pressure, the carbon number is preferably about 10 or more, and preferably about 12 or more.
- the melting point is about ⁇ 50 ° C.
- the vapor pressure is about 230 Pa at 20 ° C.
- the above-mentioned dialkyl ketone is commercially available and can be obtained by a known method, for example, oxidation of a secondary alcohol with chromic acid or the like.
- Examples of the fatty acid (corresponding to R 23 COOH in the formula (21)) constituting the above-mentioned ester are listed, for example, in “ester of (a 1 ) chain hydrocarbon tetraol with at least one fatty acid”.
- a fatty acid that is, a saturated fatty acid or an unsaturated fatty acid is mentioned, and considering the possibility of modification by oxidation etc., a saturated fatty acid is preferred.
- the aliphatic monohydric alcohol (corresponding to R 24 OH in the formula (21)) constituting the above-mentioned ester include, for example, aliphatic monohydric alcohols listed in the “compound (B)” section.
- the sum of carbon number of fatty acid and aliphatic monohydric alcohol that is, the sum of carbon number of R 23 C and R 24 in the formula (21) is 5
- the IOB is 0.60
- the requirements of the above IOB are satisfied when the total carbon number of the R 23 C and R 24 moieties is about 5 or more.
- the vapor pressure is as high as 2,000 Pa or more. Therefore, in consideration of the vapor pressure, the total carbon number is preferably about 12 or more. If the total carbon number is about 11 or more, the water solubility can satisfy the requirement of about 0.00 to about 0.05 g.
- esters of the above fatty acids with aliphatic monohydric alcohols include, for example, esters of dodecanoic acid (C 12 ), dodecyl alcohol (C 12 ), tetradecanoic acid (C 14 ), and dodecyl alcohol (C 12 )
- esters of fatty acids and aliphatic monohydric alcohols include Electol WE 20 and Electol WE 40 (all manufactured by NOF Corporation).
- the total carbon number of R 25 and R 26 is preferably about 7 or more, and more preferably about 9 or more.
- the above dialkyl carbonate is commercially available, and can be synthesized by the reaction of phosgene with alcohol, the reaction of formic acid chloride ester with alcohol or alcoholate, and the reaction of silver carbonate with alkyl iodide.
- Examples of the above-mentioned polyoxy C 2 -C 6 alkylene glycol or ester or ether thereof include (e 1 ) polyoxy C 2 -C 6 alkylene glycol, (e 2 ) polyoxy C An ester of a 2 to C 6 alkylene glycol with at least one fatty acid, an ether of (e 3 ) polyoxy C 2 to C 6 alkylene glycol and at least one aliphatic monohydric alcohol, (e 4 ) polyoxy C 2 to C 6 An ester of an alkylene glycol with a linear hydrocarbon tetracarboxylic acid, a linear hydrocarbon tricarboxylic acid, or a linear hydrocarbon dicarboxylic acid, and (e 5 ) polyoxy C 2 -C 6 alkylene glycol, with a linear hydrocarbon tetra And ethers with linear hydro
- oxy C 2 ⁇ C 6 alkylene backbone from the viewpoint of lowering the polyoxy C 2 ⁇ C 6 IOB of alkylene glycols, polyoxypropylene skeleton, oxybutylene skeleton, it is oxypentylene skeleton, or an oxy hexylene skeleton preferably More preferably, they are an oxybutylene skeleton, an oxypentylene skeleton, or an oxyhexylene skeleton.
- the above polyoxy C 2 -C 6 alkylene glycol has the following formula (23): HO- (C m H 2m O) n -H (23) (In the formula, m is an integer of 2 to 6) Can be represented by
- homopolymers of formula (23) may include homopolymers of propylene glycol, butylene glycol, pentylene glycol or hexylene glycol. From the above, in the formula (23), m is about 3 to about 6, and more preferably about 4 to about 6, and n is 2 or more.
- n the poly C 2 -C 6 alkylene glycol has an IOB of about 0.00 to about 0.60, a melting point of about 45 ° C. or less, and 100 g of water at 25 ° C. It is a value that has a water solubility of about 0.00 to about 0.05 g.
- the weight average molecular weight of the polyoxy C 2 -C 6 alkylene glycol is preferably about 200 to about 10,000, more preferably about 250 to about 8,000, and more preferably It is in the range of about 250 to about 5,000.
- the weight average molecular weight of the poly C 3 alkylene glycol, ie, polypropylene glycol is preferably about 1,000 to about 10,000, more preferably about 3,000 to about 8 And more preferably in the range of about 4,000 to about 5,000.
- the weight average molecular weight is less than about 1,000, the water solubility does not satisfy the requirements, and the larger the weight average molecular weight, the more the absorber transfer rate and the top sheet whiteness tend to be improved.
- Examples of commercial products of polyoxy C 2 ⁇ C 6 alkylene glycol e.g., UNIOL (TM) D-1000, D-1200 , D-2000, D-3000, D-4000, PB-500, PB-700, PB -1000 and PB-2000 (manufactured by NOF Corporation).
- UNIOL TM
- D-1000, D-1200 , D-2000, D-3000, D-4000, PB-500, PB-700, PB -1000 and PB-2000 manufactured by NOF Corporation.
- ester of (e 2 ) polyoxy C 2 -C 6 alkylene glycol with at least one fatty acid is the OH terminal of the polyoxy C 2 to C 6 alkylene glycol described in the section “(e 1 ) polyoxy C 2 to C 6 alkylene glycol”.
- fatty acids ie, monoesters and diesters.
- the fatty acid to be esterified is, for example, listed in “ester of (a 1 ) chain hydrocarbon tetraol and at least one fatty acid”.
- Fatty acids that is, saturated fatty acids or unsaturated fatty acids, and in view of the possibility of modification by oxidation etc., saturated fatty acids are preferred.
- Examples of commercially available esters of the polyoxy C 2 -C 6 alkylene glycol and fatty acid include Wilbright cp 9 (manufactured by NOF Corporation).
- aliphatic monohydric alcohols to be etherified in the ether of polyoxy C 2 -C 6 alkylene glycol and at least one aliphatic monohydric alcohol include, for example, aliphatics listed in the “compound (B)” section. Monohydric alcohol is mentioned.
- esters of the above polyoxy C 2 -C 6 alkylene glycol with chain hydrocarbon tetracarboxylic acid, chain hydrocarbon tricarboxylic acid, or chain hydrocarbon dicarboxylic acid are commercially available, and chain hydrocarbon tetracarbons are also commercially available. It can be produced by polycondensation of C 2 -C 6 alkylene glycol with an acid, linear hydrocarbon tricarboxylic acid or linear hydrocarbon dicarboxylic acid under known conditions.
- chain hydrocarbon tetraol to be etherified the chain hydrocarbon triol, and the chain hydrocarbon diol, those described in the “compound (A)” section, for example, pentaerythritol, glycerin and glycol Can be mentioned.
- ethers of the above polyoxy C 2 -C 6 alkylene glycol and chain hydrocarbon tetraol, chain hydrocarbon triol, or chain hydrocarbon diol are, for example, UnilobeTM 5TP-300 KB, and Uniol (trademark) TG-3000 and TG-4000 (made by NOF Corporation) can be mentioned.
- Unilube (TM) 5TP-300KB is a compound obtained by polycondensation of 65 moles of propylene glycol and 5 moles of ethylene glycol with 1 mole of pentaerythritol, and its IOB is 0.39, and the melting point is less than 45 ° C. And the water solubility was less than 0.05 g.
- Uniol (TM) TG-3000 is a compound obtained by polycondensing 50 moles of propylene glycol with 1 mole of glycerin, its IOB is 0.42, its melting point is less than 45 ° C, and its water solubility is 0.05 g And the weight average molecular weight was about 3,000.
- Uniol (TM) TG-4000 is a compound obtained by polycondensing 70 moles of propylene glycol with 1 mole of glycerin, its IOB is 0.40, melting point is less than 45 ° C., and water solubility is 0.05 g And the weight average molecular weight was about 4,000.
- the ether of the polyoxy C 2 -C 6 alkylene glycol and the chain hydrocarbon tetraol, chain hydrocarbon triol or chain hydrocarbon diol is also a chain hydrocarbon tetraol, chain hydrocarbon triol or It can be produced by adding a C 2 -C 6 alkylene oxide to a linear hydrocarbon diol under known conditions.
- the chain hydrocarbon has an IOB of 0.00 and an aqueous solubility of almost 0 g because the inorganic value is 0, and the blood has a melting point of about 45 ° C. or less. It may be included in the modifier.
- Examples of the chain hydrocarbon include (f 1 ) chain alkanes such as straight chain alkanes and branched chain alkanes, and in the case of straight chain alkanes, for example, the melting point is about 45 ° C. or less In general, those containing 22 or less carbon atoms are included. Also, in consideration of the vapor pressure, those having 13 or more carbon atoms are generally included.
- the blood modifying agent has been found to at least have the effect of reducing blood viscosity and surface tension. Since the menstrual blood to be absorbed by the absorbent article contains proteins such as the endometrial wall as compared with normal blood, they act to connect the blood cells to each other, and the blood cells are in a continuous state. Cheap. Therefore, the menstrual blood to be absorbed by the absorbent article tends to have a high viscosity, and when the top sheet is a non-woven fabric or a woven fabric, menstrual blood tends to be clogged between fibers, and the wearer feels sticky. And it spreads and leaks on the surface of the top sheet.
- a blood modifying agent having an IOB of about 0.00 to about 0.60 is highly organic and easily enters between blood cells, thereby stabilizing the blood cells and making it difficult for the blood cells to form a continuous structure. It is thought that can be done. It is considered that the absorber makes it easy to absorb menstrual blood by stabilizing the blood cells and making the blood cells less likely to form a continuous structure.
- the so-called SAP when menstrual blood is absorbed, blood cells that have undergone continuous change cover the SAP surface, making it difficult for the SAP to exhibit its absorption performance.
- SAP By stabilizing blood cells, it is considered that SAP can more easily exhibit absorption performance.
- the blood modifying agent having high affinity for red blood cells protects the red blood cell membrane, so that the red blood cells are less likely to be destroyed.
- FIG. 7 is a figure for demonstrating the absorbent article manufacturing apparatus 100 used for the manufacturing method of the absorbent article 1 in one Embodiment of this invention.
- a process of forming an absorbent a process of preparing a sheet for top sheet, a process of forming compressed grooves in a laminate, a process of preparing a sheet for back sheet, a continuum of absorbent articles Cutting and applying a blood modifying agent to the absorbent article.
- the top sheet sheet used in the step of preparing the top sheet sheet includes a process of preparing the resin film sheet, a process of forming the recess in the resin film sheet, and a process of gear stretching the resin film sheet. It is manufactured by the manufacturing method of the seat for sheets.
- the absorber 128 is formed on the belt 110.
- Pulverized pulp 122 is supplied to the pattern drum 120 from a pulverized pulp supply device (not shown).
- a recess 124 is formed on the outer peripheral portion of the pattern drum 120 as a mold for packing crushed pulp.
- the inside of the pattern drum 120 is suctioned 126, and the crushed pulp 122 supplied to the pattern drum 120 is sucked into the recess 124 and compressed. Then, the pulp 122 compressed in the recess 124 is formed into the absorber 128.
- the absorber 128 is placed on the belt.
- the top sheet 216 produced by the method for producing a top sheet described later is disposed on the absorber 128 and the top sheet 216 is adhered to the absorber 128. .
- the emboss device 130 is used to form the squeezed grooves in the laminate 262 of the top sheet 216 and the absorber 128.
- the laminate 262 passes between the upper roll 131 and the lower roll 132 of the embossing device 130.
- On the surface of the outer periphery of the upper roll 131 a convex portion (not shown) having a shape corresponding to the pressing groove 7 of the absorbent article 1 shown in FIG. 1 is provided.
- the lower roll 132 is a plain roll whose outer peripheral surface is smooth.
- the portion of the laminate 262 corresponding to the compressed grooves 7 of the absorbent article 1 shown in FIG. 1 is in the thickness direction And compressed grooves are formed in the laminate 262.
- an adhesive is applied to the sheet 142 for back sheet supplied from the sheet roll 140 for back sheet using an application device (not shown), and then lamination is performed in which compressed grooves are formed. It adheres to the surface on the opposite side to the sheet
- the cutter 150 is used to cut the continuum 144 of the absorbent article into the shape of the absorbent article to produce the absorbent article.
- the above-described blood modifying agent 161 is applied to the central region of the absorbent article using a modifier applying spray 160 to apply blood to the surface of the top sheet. Form a modifier layer.
- the blood modifying agent 161 applied to the central region of the absorbent article may be applied to at least a portion facing the outlet of the wearer's body fluid.
- the length in the lengthwise direction is preferably 50 mm or more, more preferably 10 mm or more
- the length in the width direction is preferably 10 mm or more, more preferably 30 mm or more, centering on the center of the absorbent article.
- a blood modifying agent may be applied to an area.
- the blood modifying agent was applied after the step of cutting the continuum of the absorbent article, the blood modifying agent may be applied in the step of producing the top sheet described later.
- the downstream stage of the manufacturing process of the absorbent article for example, the blood just before packaging the absorbent article It is preferred to apply the modifier to the absorbent article.
- the method of manufacturing the absorbent article 1 includes a step of forming an adhesive portion on the continuous body 144 of the absorbent article, a step of forming a seal portion on the continuous body 144 of the absorbent article, and the like.
- the resin film sheet 212 supplied from the roll 210 of the resin film sheet is supplied to the recess forming roll 220.
- the resin film sheet 212 is made to pass the recessed part formation roll 220, and the resin film sheet 214 (refer FIG. 9) in which the recessed part 2141 was formed is produced.
- the recess forming roll 220 comprises a knurling roll 221 and a preheating roll 222 having a smooth surface.
- FIGS. 8A and 8B show an example of the knurled roll 221.
- FIG. FIG. 8A is a view showing the entire knurled roll 221
- FIG. 8B is an enlarged view of a portion 223 having unevenness on the outer peripheral surface of the knurled roll 221.
- FIG. 8C shows an example of the preheating roll 222 having a smooth surface.
- a grid-like convex portion 224 is provided on the surface 223 of the knurled roll 221.
- a rhombus recess 225 is formed on the surface of the knurled roll 221.
- the shape of the recessed part 225 of the knurl roll 221 is not limited to a rhombus, You may be shapes, such as a square, a rectangle, a parallelogram, a trapezoid, a triangle, and a hexagon.
- the center line spacing of the convex parts 224 arranged in parallel in the lattice-like convex parts 224 is preferably 0.2 mm or more and 10 mm or less, more preferably 0.4 mm or more and 2 mm It is below.
- the pitch of the grid-like convex portions 224 is less than 0.2 mm or greater than 10 mm, the concave portion may not be formed in the resin film.
- the width of the grid-like convex portion 224 is preferably 0.01 mm or more and 1 mm or less, and more preferably 0.03 mm or more and 0.1 or less.
- the length of one side of the rhombic recess 225 is preferably 0.1 mm or more and 5 mm or less, and more preferably 0.2 mm or more and 1 mm or less.
- the width of the grid-like convex part 224 is less than 0.01 mm or more than 1 mm, or when the length of one side of the rhombus concave part 225 is less than 0.1 mm or more than 5 mm, the concave part may not be formed in the resin film. .
- the preheated roll 222 having a smooth surface is maintained at a temperature of 70 ° C. or more and 100 ° C. or less, and heats the supplied resin film sheet 212. Thereby, the resin film sheet 212 becomes soft and easy to form.
- the resin film sheet 212 passes between the knurled roll 221 and the roll 222 having a smooth surface, the resin film sheet 212 receives a strong pressure in the thickness direction in a portion in contact with the grid-like convex portion 224. Thereby, as shown in FIG. 9, the fine recessed part 2141 is formed in the resin film sheet 214. As shown in FIG. In fact, the number of recesses 2141 formed in the resin film sheet 212 is smaller than that shown in FIG. 9, and the number of recesses 2141 per unit area is also much larger than that shown in FIG.
- the concave portion 2141 is formed only in the range 2143 corresponding to the area 12 (see FIG. 1) in the resin film sheet 214 where the absorber 4 of the absorbent article 1 is provided. Here, the range corresponding to the absorbent article 1 in the resin film sheet 214 is the range indicated by the dotted line 2142.
- the first ridge portion, the second ridge portion, and the second ridge portion of the top sheet 2 are caused to pass through the resin film sheet 214 having the recess formed in the stretching gear roll 230 shown in FIG.
- the bottom is formed in a resin film sheet 214.
- symbol 216 is a resin film sheet which formed the 1st protrusion part, the 2nd protrusion part, and the bottom part.
- the drawing gear roll 230 includes an upper roll 231 and a lower roll 232.
- 10 (a) is a view for explaining the upper roll 231 of the drawing gear roll 230
- FIG. 10 (b) is a view for explaining the gear teeth 233 arranged on the outer peripheral surface of the upper roll 231.
- 10 (c) is a cross-sectional view taken along the line BB in FIG. 10 (b).
- the gear teeth 233 extend discontinuously in the circumferential direction of the upper roll 231. That is, the gear teeth 233 extending in the circumferential direction of the upper roll 231 are interrupted at multiple points along the way.
- a second protrusion portion is formed on the resin film sheet 214 by the portion 234 where the gear teeth 233 are disconnected.
- the width of gear teeth 233 is, for example, 0.3 mm or more and 0.5 mm or less, and the distance between the centers of adjacent gear teeth 233 is, for example, 1.0 mm or more and 1.2 mm or less.
- FIG. 11 (a) is a view for explaining the lower roll 232 of the drawing gear roll 230
- FIG. 11 (b) is a view for explaining the gear teeth 235 disposed on the outer peripheral surface of the lower roll 232
- FIG. 11C is a cross-sectional view taken along the line CC of FIG.
- the gear teeth 235 extend in the circumferential direction of the lower roll 232.
- the lower roll 232 is not interrupted at multiple points along the way.
- the width of the gear teeth 235 is, for example, equal to the width of the gear teeth 233 of the upper roll 231, and the distance between the centers of adjacent gear teeth 235 is, for example, equal to the distance between the centers of the gear teeth 233 of the upper roll 231.
- the radial length of the upper roll 231 at the portion where the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 are engaged, that is, the biting depth is, for example, 1.25 mm.
- the gap between the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 when the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 are engaged is, for example, 0.25 mm or more , 0.45 mm or less.
- the resin film sheet 214 passes through the drawing gear roll 230, the resin film 214 is bent in a substantially wave shape, and the resin film 214 forms the first ridge 21 and the second ridge of the top sheet 2.
- the portion 22 is formed.
- an opening 25 (see FIG. 4) of the top sheet 2 is further formed in the region 2143 (see FIG. 9) in which the recess 2141 of the resin film sheet 214 is formed.
- the resin film sheet 214 is largely drawn at a portion 236 where the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 are engaged.
- the resin film sheet 214 is thin at the part where the concave part 2141 (see FIG. 9) is formed in the above-mentioned concave part forming step, and the part where the scratch is given by the grid-like convex part 224 of the knurling roll 221 As it is present, the strength is weak, and the recess 2141 of the resin film sheet 214 breaks when it is stretched.
- the concave portion 2141 of the resin film sheet 214 is torn, the torn portion of the resin film sheet 214 is spread, and the opening portion is to the torn portion of the resin film sheet 214. It is formed.
- the resin film sheet 214 is not stretched much at the portions 237 and 238 where the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 are not engaged. For this reason, in the portions 237 and 238 in which the gear teeth 233 of the upper roll 231 and the gear teeth 235 of the lower roll 232 in the resin film sheet 241 are not engaged, the resin film sheet 214 described above The recess 2141 formed in the recess forming step is not broken and does not become an opening.
- the absorbent article 1 according to the embodiment of the present invention described above can be modified as follows.
- the absorbent article may not have a wing. That is, the absorbent article may be only the main body.
- an adhesive part is provided on the clothes-side surface of the main body part so that the absorbent article can be fixed to the underwear even without the wing part.
- the first channel and the second channel can be formed by the first ridge of the top sheet and the back It is not limited to the flow path constituted of the sheet and the flow path constituted of the second ridge portion of the top sheet and the back sheet.
- a resin layer is formed in a region between the top sheet and the back sheet outside the widthwise edges of the absorber in the main body, except for the portion corresponding to the flow path, by a method such as printing. It is also good.
- the portion where the resin layer is not formed is hollow between the top sheet and the back sheet, so that portion can be used as a flow path for pouring in the body fluid that has leaked from the absorber.
- the first channel 21 and the second channel 22 may be formed in the top sheet 2, and the first sheet and the second channel may not be formed in the top sheet 2 of the wing portion 5. Also in this case, when pressure is applied to the absorbent article 1, it is possible to suppress leakage of the body fluid exuded from the absorbent body 4 from the width direction of the absorbent article 1.
- the first protrusion is formed at least outside the both edges in the width direction of the absorber.
- the strip 21, the second protrusion 22 and the bottom 23 may be formed on the side sheet 18A, and the bottom 23 of the side sheet 18A may be joined to the back sheet.
- the top sheet 2A may be a non-woven fabric. Even when the top sheet 2A is a non-woven fabric, it is possible to easily fold the wing portion of the absorbent article in accordance with the shape of the edge of the leg opening of the undergarment.
- the non-woven fabric used for the top sheet 2A may be natural fibers or chemical fibers. Natural fibers used for the top sheet 2A include cellulose such as crushed pulp and cotton. Chemical fibers used for the top sheet 2A include regenerated cellulose such as rayon and fibril rayon, semi-synthetic cellulose such as acetate and triacetate, thermoplastic hydrophobic chemical fiber, and thermoplastic hydrophobic chemical fiber subjected to hydrophilization treatment, etc. It can be mentioned.
- thermoplastic hydrophobic chemical fibers used for the top sheet 2A include single fibers such as polyethylene (PE), polypropylene (PP) and polyethylene terephthalate (PET), fibers obtained by graft polymerization of polyethylene and polypropylene, and core-sheath structures, etc. Composite fibers are mentioned.
- the top sheet 2A may be provided with the first protrusion, the second protrusion, and the bottom.
- first ridge, the second ridge, and the bottom can be formed on the top sheet or the side sheet at least on the outer sides of both edges in the width direction of the absorber, an absorber on the top sheet is provided.
- the first protrusion, the second protrusion, and the bottom may or may not be formed in the area being covered.
- the first ridge 21B of the top sheet 2B is curved so as to protrude outward in the width direction at least outside the both edges 41B in the width direction of the absorber 4B. It is also good.
- the body fluid 31B which has flowed in the longitudinal direction (Y direction) in the flow path constituted by the first ridge 21B and the back sheet, and which is exuded from the absorber 4B is absorbed again by the absorber 4B. . And it can further suppress that the bodily fluid 31B which exudes from the absorber 4B by applying pressure to an absorbent article leaks from the width direction of an absorbent article.
- the edge 41B in the width direction of the absorber 4B is not curved so as to protrude inward in the width direction (X direction)
- the flow path formed of the first protrusion 21B and the back sheet The body fluid 31B that flows from the absorber 4B and flows in the longitudinal direction (Y direction) is absorbed by the absorber 4B again.
- the blood modifying agent since the blood modifying agent has a mechanism to lower the viscosity and surface tension of the blood, the body fluid is transferred to the absorber 4 without remaining on the top sheet 2 by the blood modifying layer 24 and absorbed. 4 can be absorbed.
- the following examples confirmed that the blood modifying agent has a mechanism to lower the viscosity and surface tension of blood. This check was performed using a non-woven fabric in which the body fluid tends to remain as compared to the resin film.
- the sanitary napkin comprises a top sheet formed of an air through non-woven fabric (composite fiber of polyester and polyethylene terephthalate, basis weight: 35 g / m 2 ) treated with a hydrophilic agent, and a composite of air through non-woven fabric (polyester and polyethylene terephthalate) Fiber, second sheet formed of basis weight: 30 g / m 2 ), pulp (basis weight: 150 to 450 g / m 2 , more in the central part), acrylic high absorption polymer (basis weight: 15 g / m 2 ) And, it was formed from an absorbent including a tissue as a core wrap, a water repellent treated side sheet, and a back sheet made of polyethylene film.
- an absorbent including a tissue as a core wrap, a water repellent treated side sheet, and a back sheet made of polyethylene film.
- Triethylene CL oil fatty acid glycerides, manufactured by NOF Corporation C 8 fatty acid: fatty acid of C 12 is approximately included in a weight ratio of 44:56, triesters of glycerin and fatty acid, the weight average molecular weight: about 570
- -Panaceto 800 B manufactured by NOF Corporation Triester of glycerin and fatty acid in which all fatty acids are 2-ethylhexanoic acid (C 8 ), weight average molecular weight: about 470 NA36, manufactured by NOF Corporation C 16 fatty acids: C 18 fatty acids: C 20 fatty acids (including both saturated fatty acids and unsaturated fatty acids) in a weight ratio of approximately 5: 92: 3, Triester of glycerin and fatty acid, weight average molecular weight: about 880
- Tricot oil fatty acid glyceride manufactured by NOF Corporation C 8 fatty acid: C 10 fatty acid: C 12 fatty acid: C 14 fatty acid: C 16 fatty acid (including both saturated fatty acid and unsaturated fatty acid) is approximately 4 Triester of glycerin and fatty acid, contained in a weight ratio of 8: 60: 25: 3, weight average molecular weight: 670 ⁇ Caprylic diglyceride, manufactured by NOF Corporation Diester of glycerin and fatty acid wherein fatty acid is octanoic acid, weight average molecular weight: 340
- Uniol D-4000 polypropylene glycol manufactured by NOF Corporation, weight average molecular weight: about 4,000 Uniol PB500, polybutylene glycol manufactured by NOF Corporation, weight average molecular weight: about 500 Uniol PB700, manufactured by NOF Corporation, polyoxybutylene polyoxypropylene glycol, weight average molecular weight: about 700
- Uniol PB 1000 R polybutylene glycol manufactured by NOF Corporation, weight average molecular weight: about 1000 [Ester of (e 2 ) polyoxy C 2 -C 6 alkylene glycol with at least one fatty acid] ⁇ Wilbright cp 9, a compound in which OH groups at both ends of polybutylene glycol manufactured by NOF Corporation were esterified with hexadecanoic acid (C 16 ), weight average molecular weight: about 1,150
- UNIOL TG-3000 glyceryl ether of polypropylene glycol manufactured by NOF Corporation, about 16 repeating units, weight average molecular weight: about 3,000 ⁇ UNIOL TG-4000, glyceryl ether of polypropylene glycol manufactured by NOF Corporation, about 16 repeating units, weight average molecular weight: about 4,000
- -PEG 1500 polyethylene glycol manufactured by NOF Corporation, weight average molecular weight: about 1,500 to about 1,600 Nonion S-6, manufactured by NOF Corporation, polyoxyethylene monostearate, repeating unit of about 7 weight average molecular weight: about 880 Will Bright s 753, manufactured by NOF Corporation polyoxyethylene polyoxypropylene polyoxybutylene glycerin, weight average molecular weight: about 960
- TG-330 a glyceryl ether of polypropylene glycol manufactured by NOF Corporation, about 6 repeating units, weight average molecular weight: about 330 ⁇ UNIOL TG-1000, glyceryl ether of polypropylene glycol manufactured by NOF Corporation, about 16 repeating units, weight average molecular weight: about 1,000
- Unirube DGP-700 a diglyceryl ether of polypropylene glycol manufactured by NOF Corporation, about 9 repeating units, weight average molecular weight: about 700 -Uniox HC60, manufactured by NOF Co., Ltd. polyoxyethylene hydrogenated castor oil, weight average molecular weight: about 3,570 ⁇ Vaseline, Cognis Japan Ltd. Petroleum derived hydrocarbon, semi-solid
- the IOB, melting point and water solubility of the above sample are shown in Table 2 below.
- the water solubility was measured according to the above-mentioned method, but 20.0 g was added to 100 g of demineralized water, and a sample dissolved after 24 hours was evaluated as "20 g ⁇ ", and 100 g of demineralized water was used. A sample in which 0.05 g was dissolved but not 1.00 g was evaluated as 0.05 to 1.00 g.
- fusing point " ⁇ 45" means that melting
- the skin contact surface of the top sheet of the above-mentioned sanitary napkin was coated with the above-mentioned blood modifier. Heat each blood modifier to its melting point + 20 ° C if the blood modifier is liquid at room temperature, and if the blood modifier is solid at room temperature, then control seam HMA gun Each blood modifying agent was atomized and applied to the entire skin contact surface of the top sheet so that the basis weight was approximately 5 g / m 2 .
- FIG. 15 is an electron micrograph of the skin contact surface of the top sheet in the sanitary napkin (No. 2-5) in which the top sheet contains avian C2L oil fatty acid glyceride. As is apparent from FIG. 15, the tri-C2L oil fatty acid glyceride is in the form of fine particles and adheres to the surface of the fiber. The rewet rate and the absorber transfer rate were measured according to the following procedure.
- Rewet rate (%) 100 ⁇ (weight of filter paper after test ⁇ weight of original filter paper) / 6
- absorber transfer speed which is the time for blood to transfer from the top sheet to the absorber after the second drop of blood.
- absorber transfer rate means the time from when blood is introduced into the top sheet to when the red color of blood is not seen on the surface and inside of the top sheet.
- the rewet rate was 22.7% and the absorber transfer rate was over 60 seconds, but both the glycerin and fatty acid triesters had rewet rates From the fact that it is 7.0% or less and the absorber transfer rate is 8 seconds or less, it can be seen that the absorption performance is greatly improved. However, among triesters of glycerin and fatty acid, NA50 of which the melting point exceeds 45 ° C. shows no significant improvement in the absorption performance.
- a blood modifying agent having an IOB of about 0.00 to about 0.60, a melting point of about 45 ° C. or less, and an aqueous solubility of about 0.00 to about 0.05 g per 100 g of water at 25 ° C. It was found that the absorption performance was greatly improved.
- sanitary napkins were worn by a plurality of volunteer subjects.
- sanitary napkins containing blood modifiers 2-1 to 2-3 there was no tackiness on the top sheet even after menstrual blood absorption, and it was answered that the top sheet was smooth. .
- Defibrillation blood after blood collection, stirred for about 5 minutes in an Erlenmeyer flask together with glass beads
- EDTA blood Addition of 0.5 mL of 12% EDTA ⁇ 2K saline to 65 mL of venous blood
- Serum or plasma Supernatant after centrifuging defibrillated blood or EDTA blood, respectively, at about 1900 G at room temperature for 10 minutes
- Blood cells Remove the serum from the blood and remove the residual phosphate buffered saline (PBS) ) Washed twice and then added with phosphate buffered saline for the removed serum
- An absorbent article was produced in the same manner as in Example 2 except that avian C2L oil fatty acid glyceride was applied so as to give a basis weight of approximately 5 g / m 2, and the rewet rate was evaluated for the above various blood. . Three measurements were taken for each blood and the mean value was taken. The results are shown in Table 3 below.
- Example 2 The same tendency as equine EDTA blood obtained in Example 2 was also obtained in human and sheep blood. The same tendency was also observed in defibrinated blood and EDTA blood.
- the top sheet containing the blood modifying agent has low blood retention and can be rapidly transferred to the absorber after absorbing blood.
- Example 4 [Viscosity of blood containing blood modifying agent] The viscosity of the blood containing the blood modifying agent was measured using Rheometric Expansion System ARES (Rheometric Scientific, Inc). 2% by weight of Panaceto 810s was added to equine defibrinated blood, the mixture was lightly stirred to form a sample, the sample was loaded on a parallel plate of 50 mm in diameter, the gap was made 100 ⁇ m, and the viscosity was measured at 37 ⁇ 0.5 ° C. . Because of the parallel plate, the sample was not subjected to a uniform shear rate, but the average shear rate displayed on the instrument was 10 s ⁇ 1 .
- the viscosity of horse-defibrillated blood containing 2% by mass of Panaceto 810s was 5.9 mPa ⁇ s, while the viscosity of horse-defibrillated blood containing no blood modifying agent was 50.4 mPa ⁇ s.
- equine defibrinated blood containing 2% by weight of Panaceto 810s reduces the viscosity by about 90% as compared to the case without blood modifying agent.
- blood contains components such as blood cells and is known to have thixotropy properties, it is considered that the blood modifying agent of the present disclosure can lower the viscosity of blood in a low viscosity region. By reducing the viscosity of blood, it is thought that absorbed menstrual blood can be rapidly transferred from the top sheet to the absorber.
- Example 5 [Micrograph of blood containing blood modifier] A healthy volunteer's menstrual blood is collected on a food protection wrap film, and in part, Panaceto 810s dispersed in 10 times mass phosphate buffered saline, the concentration of Panaceto 810s is 1% by mass As it was added. The menstrual blood was applied to a slide glass, covered with a cover glass, and the condition of red blood cells was observed with a light microscope. A photomicrograph of menstrual blood containing no blood modifying agent is shown in FIG. 16 (a), and a photomicrograph of menstrual blood containing PANACET 810s is shown in FIG. 16 (b).
- red blood cells form a lump of rhomsen, etc., but in menstrual blood containing PANACET 810s, the red blood cells are dispersed stably. I understand. Therefore, it is suggested that the blood modifying agent works to stabilize red blood cells in the blood.
- Example 6 [Surface tension of blood containing blood modifier] The surface tension of blood containing a blood modifying agent was measured by a pendant drop method using a contact angle meter Drop Master 500 manufactured by Kyowa Interface Science Co., Ltd. The surface tension was measured after adding a predetermined amount of blood modifying agent to sheep defibrinated blood and shaking sufficiently. The measurement is automatically performed by the device, but the surface tension ⁇ is obtained by the following equation (see FIG. 17).
- the density ⁇ is the density test method and density / mass / volume conversion table in JIS K 2249-1995, 5. It was measured at the temperature shown in Table 5 below according to the vibrational density test method. For measurement, DA-505 of Kyoto Electronics Industries Ltd. was used. The results are shown in Table 5.
- the blood modifying agent has a water solubility of about 0.00 to about 0.05 g per 100 g of water at 25 ° C., but its solubility in water is very low. It can be seen that the surface tension of the blood can be reduced. By lowering the surface tension of the blood, it is considered that the absorbed blood can be rapidly transferred to the absorber without being held between the fibers of the top sheet.
Landscapes
- Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Hematology (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Fluid Mechanics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Absorbent Articles And Supports Therefor (AREA)
Abstract
吸収性物品(1)に圧力がかかることにより吸収体(4)からしみ出た体液(31)が吸収性物品(1)の幅方向から漏れることを抑制できる吸収性物品を提供する。本発明は、長手方向(Y方向)および幅方向(X方向)を有し、肌側に設けられた液透過性のトップシート(2)と着衣側に設けられた液不透過性のバックシート(3)と幅方向の両側に長手方向に延びる縁を含みトップシート(2)およびバックシート(3)の間に設けられた液保持性の吸収体(4)とを備えた吸収性物品(1)であって、少なくとも吸収体(4)の幅方向の両縁の外側において、吸収体(4)からしみ出た体液(31)を流し込むための複数の第1の流路(21)および複数の第2の流路(22)を含み、複数の第1の流路(21)は、長手方向に延在し、幅方向に並び、複数の第2の流路(22)は隣接する第1の流路(21)を連結する。
Description
本発明は、生理用ナプキン、パンティライナ、失禁パッド、失禁ライナなどの吸収性物品に関する。
サイドパネルが、液体透過性の孔あき高分子フィルムおよび裏打ちシートから構成される生理用ナプキンが従来技術として知られている(たとえば、特許文献1)。また、トップシート、バックシートおよび吸収体からなる中央吸収体部と、中央吸収体部の両側部中央から外方に延出し、トップシートおよびバックシートからなる一対のフラップとを備え、中央吸収体とフラップとの間の境界では、トップシートはバックシートと接合している生理用ナプキンが従来技術として知られている(たとえば、特許文献2)。
吸収性物品の吸収体に圧力がかかったとき、吸収体に吸収されていた体液が、吸収体の幅方向の縁から一時的にしみ出る場合がある。この場合、特許文献1に記載されているような従来の吸収性物品では、吸収体からしみ出た体液が、サイドパネルで液体透過性の孔あき高分子フィルムと裏打ちシートとの間に浸透し、吸収性物品の幅方向から漏れる場合がある。一方、特許文献2に記載されているような従来の吸収性物品では、トップシートは、中央吸収体とフラップとの間の境界でバックシートと接合しているので、吸収体からしみ出た体液が、フラップの部分でトップシートとバックシートとの間に浸透することはない。しかし、吸収体の幅方向の縁の部分で吸収体からしみ出た体液は、トップシートとバックシートとの間において一時的に行き場を失うので、吸収体の幅方向の縁の部分でトップシートの外へしみ出てしまい、吸収性物品の幅方向から漏れる場合がある。
本発明は、吸収性物品に圧力がかかることにより吸収体からしみ出た体液が吸収性物品の幅方向から漏れることを抑制できる吸収性物品を提供することを目的とする。
本発明は、上記課題を解決するため、以下の構成を採用した。
すなわち、本発明は、長手方向および幅方向を有し、肌側に設けられた液透過性のトップシートと着衣側に設けられた液不透過性のバックシートと幅方向の両側に長手方向に延びる縁を含みトップシートおよびバックシートの間に設けられた液保持性の吸収体とを備えた吸収性物品であって、少なくとも吸収体の幅方向の両縁の外側において、吸収体からしみ出た体液を流し込むための複数の第1の流路および複数の第2の流路を含み、複数の第1の流路は、長手方向に延在し、幅方向に並び、複数の第2の流路は、隣接する第1の流路を連結する。
すなわち、本発明は、長手方向および幅方向を有し、肌側に設けられた液透過性のトップシートと着衣側に設けられた液不透過性のバックシートと幅方向の両側に長手方向に延びる縁を含みトップシートおよびバックシートの間に設けられた液保持性の吸収体とを備えた吸収性物品であって、少なくとも吸収体の幅方向の両縁の外側において、吸収体からしみ出た体液を流し込むための複数の第1の流路および複数の第2の流路を含み、複数の第1の流路は、長手方向に延在し、幅方向に並び、複数の第2の流路は、隣接する第1の流路を連結する。
本発明によれば、吸収性物品に圧力がかかることにより吸収体からしみ出た体液が吸収性物品の幅方向から漏れることを抑制できる。
以下、図面を参照して、本発明を説明するが、本発明は図面に記載されたものに限定されるものではない。
図1は本発明の一実施形態の吸収性物品の平面図であり、図2は図1のA-A線断面を示す概略断面図である。吸収性物品1は、肌側(肌当接側)に設けられた液透過性のトップシート2、着衣側(非肌当接側)に設けられた液不透過性のバックシート3およびトップシート2とバックシート3との間に設けられた液保持性の吸収体4を備える本体部10と、本体部10の両側縁から幅方向に延出するように本体部10の両側に設けられ、トップシート2およびバックシート3を備えた一対のウイング部5とを含む。符号51がウイング部5の付け根(本体部10とウイング部5との間の境界)となる。ウイング部5における着衣側の面の反対側の面は、トップシート2で構成されている。ウイング部5の着衣側の面に、粘着部6が設けられている。なお、図1において、吸収性物品1の幅方向はX方向であり、長手方向はY方向である。また、吸収性物品1の平面方向は、XY方向である。
本体部10の形状は、長方形、楕円型、砂時計型など、女性の身体および下着の形状に適合する形状であればとくに限定されない。本体部10の外形における長手方向の延べ寸法は、好ましくは100~500mmであり、より好ましくは150~350mmである。また、本体部10の外形における幅方向の延べ寸法は、好ましくは30~200mmであり、より好ましくは40~180mmである。
トップシート2は、着用者から排出された尿、経血などの体液を、吸収体4へ移動させる。トップシート2の少なくとも一部は液透過性を有し、体液を透過するための多数の開口部を有する。
トップシート2は樹脂フィルムから作製される。トップシート2として使用される樹脂フィルムは、オレフィンとアクリル酸エステル、酢酸ビニルなどの他モノマーとの共重合体、ポリオレフィン、ポリエステル、ポリプロピレン、ポリエチレン、ポリエチレンテレフタレート、ポリアミド、酢酸セルロースなどから作製される。柔軟性が高く肌に対する刺激が少ない点から、トップシート2として使用される樹脂フィルムは、オレフィンと他モノマーとの共重合体、またはポリオレフィンがとくに好ましい。
トップシート2の坪量は、好ましくは1g/m2以上、40g/m2以下であり、より好ましくは10g/m2以上、35g/m2以下である。また、トップシート2を構成する樹脂フィルムの厚さは、好ましくは0.01mm以上、0.4mm以下であり、より好ましくは0.1mm以上、0.35mm以下である。トップシート2を構成する樹脂フィルムの厚さが0.01mm未満の場合には、トップシート2の後述の隠ぺい性が小さすぎてしまう場合があり、トップシート2を構成する樹脂フィルムの厚さが0.4mmを超える場合には、トップシート2の剛性が高くなり、着用者の肌に与えるトップシート2の刺激が強くなりすぎる場合がある。トップシート2は後述する突条部を有するので、トップシート2の見かけ上の厚さは、トップシート2を構成する樹脂フィルムの厚さよりも大きい。トップシート2の見かけ上の厚さは、好ましくは0.01mm以上、1mm以下であり、より好ましくは0.1mm以上、0.5mm以下である。
トップシート2は、吸収体4に吸収された体液が外部から見えないようにするため、隠ぺい性を有する。トップシート2の隠ぺい性は、酸化チタンなどのフィラーを樹脂に混ぜることによって生ずる。フィラーが酸化チタンの場合、酸化チタンの含有量は、樹脂フィルムの重量に対して、好ましくは1%以上、50%以下であり、より好ましくは3%以上、15%以下である。酸化チタンの含有量が樹脂フィルムの重量に対して1%未満であると、トップシート2における吸収体4に吸収された体液を隠ぺいする効果が小さすぎる場合がある。酸化チタンの含有量が樹脂フィルムの重量に対して50%を超えると、酸化チタンを含有した樹脂のシート成形が困難になる場合がある。
トップシート2は、長手方向に延在し、幅方向に並ぶ複数の第1の突条部21と、隣接する第1の突条部21を連結する複数の第2の突条部22と、第1の突条部21および該第2の突条部22の基礎となる部分の底部23とを有する。
図3および図4を参照して、トップシート2に設けられた第1の突条部21、第2の突条部22および底部23を詳細に説明する。図3は、本体部10のトップシート2における吸収体4の幅方向の両縁41の外側の領域14およびウイング部5のトップシート2に形成した(図1参照)第1の突条部、第2の突条部および底部を説明するための図である。図4は、本体部10のトップシート2における吸収体4が設けられている領域12に形成した(図1参照)第1の突条部、第2の突条部および底部を説明するための図である。本体部10のトップシート2における吸収体4の幅方向の両縁41の外側の領域14およびウイング部5のトップシート2に形成した第1の突条部、第2の突条部および底部と、本体部10のトップシート2における吸収体4が設けられている領域12に形成した第1の突条部、第2の突条部および底部とは、後述するように少し異なる。
図3に示すように、吸収体4の幅方向の両縁41の外側の領域14およびウイング部5において、トップシート2は、長手方向(Y方向)に延びており、幅方向(X方向)に並ぶ複数の第1の突条部21を含む。第1の突条部21の断面の形状は、たとえば、略U字形状を上下逆さまにした形状(以下、略逆U字形状と呼ぶ)である。略逆U字形状には、U字形状を逆さまにした形状の他に、角を丸めたり、直線を曲線に変えたりするなどの変形を加えるとU字形状を逆さまにした形状になる形状も含まれる。たとえば、略逆U字形状には、V字形状を逆さまにした形状、M字形状および台形も含まれる。
隣接する第1の突条部21は、複数の第2の突条部22を介して連結する。第2の突条部22は、長手方向(Y方向)に延びる第1の突条部21に対して斜めの方向に延びていることが好ましい。たとえば、第1の突条部21と第2の突条部22との間のなす角度は、10°以上、170°以下であることが好ましい。第2の突条部22が延びる方向に対して直交する方向で第2の突条部22を切断したときの第2の突条部22の断面の形状は、たとえば略逆V字形状である。
図5は、トップシート2の突条部21,22とバックシート3とから構成された流路を説明するための図である。図5に示すように、第1の突条部21および第2の突条部22と後述のバックシート3とが組み合わさると、中空構造が形成される。そして、吸収体4からしみ出た体液31が、その中空構造の中に流れ込む。すなわち、第1の突条部21および第2の突条部22は、後述のバックシート3と一緒になって体液31を流し込むため流路を形成する。
たとえば、吸収体4からしみ出した後、第2の突条部22aとバックシート3とから構成される流路に流れ込んだ体液31は、第1の突条部21aとバックシート3とから構成される流路に流れ込む。第1の突条部21aとバックシート3とから構成される流路に流れ込んだ体液は、第1の突条部21aとバックシート3とから構成される流路の中を長手方向(Y方向)に流れる。長手方向(Y方向)に流れた後、体液31は、第2の突条部22bとバックシート3とから構成される流路を介して、隣接する第1の突条部21bとバックシート3とから構成される流路に流れ込む。第1の突条部21bとバックシート3とから構成される流路に流れ込んだ体液は、第1の突条部21bとバックシート3とから構成される流路の中を長手方向(Y方向)に流れる。長手方向(Y方向)に流れた後、体液31は、第2の突条部22cとバックシート3とから構成される流路を介して隣接する第1の突条部21cとバックシート3とから構成される流路に流れ込む。このように、体液31が第1の突条部21とバックシート3とから構成される流路の中を長手方向(Y方向)に流れることと、その後、体液31が、第2の突条部22とバックシート3とから構成される流路を介して、隣接する第1の突条部21とバックシート3とから構成される流路に流れ込むこととを繰り返しながら、吸収体4からしみ出た体液は、トップシート2とバックシート3との間を幅方向(X方向)に広がっていく。
図6に示すように、吸収体4からしみ出た体液31は、トップシート2の第1の突条部21とバックシートとから構成される流路により長手方向(Y方向)に広がった後に、トップシート2の第2の突条部22とバックシートとから構成される流路により幅方向(X方向)に広がる。これにより、吸収体4からしみ出た体液31が、幅方向(X方向)に広がるためには、多量の体液が吸収体4からしみ出すことが必要になる。したがって、これにより、吸収体4からしみ出た体液31が、幅方向(X方向)に広がることが抑制され、吸収性物品1に圧力がかかることにより吸収体4からしみ出た体液31が吸収性物品1の幅方向から漏れることを抑制できる。
幅方向における1cm当たりの第1の突条部21の数は、好ましくは3以上であり、より好ましくは、5以上である。幅方向における1cm当たりの第1の突条部21の数が2以下であると、第1の突条部21の中に蓄積できる体液の量が少なくなり、吸収体からしみ出た体液が吸収性物品の幅方向から漏れる場合がある。
第2の突条部22の長手方向(Y方向)の長さは、好ましくは0.3mm以上、5mm以下であり、より好ましくは0.5mm以上、3mm以下である。第2の突条部22の長手方向(Y方向)の長さが0.3mmよりも小さい場合、第1の突条部21に流れ込んだ体液が、第2の突条部22を介して、隣接する第1の突条部21に流れ込むことが難しくなり、行き場を失った体液が、トップシート2の外へしみ出す場合がある。また、第2の突条部22の長手方向(Y方向)の長さが5mmよりも大きい場合、第1の突条部21に流れ込んだ体液が、第1の突条部21の中を長手方向(Y方向)に流れる前に第2の突条部22を介して、隣接する第1の突条部21に流れ込む場合があり、吸収体からしみ出た体液が吸収性物品の幅方向から漏れる場合がある。
ウイング部5のトップシート2に第1の突条部21および第2の突条部22を設けることによって、吸収性物品1を下着に固定するためにウイング部5を折り曲げたときの折り曲げた部分に第1の突条部21および第2の突条部22が存在することになる。第1の突条部21および第2の突条部22は、軟らかい肌触りを吸収性物品1の表面に付与する。したがって、これにより、吸収性物品1を装着した下着を履いたときの下着の足ぐりの肌当たりが良好になる。
図4に示すように、本体部10の吸収体4が設けられている領域12のトップシート2は、本体部10の吸収体4の幅方向の両縁41の外側の領域14およびウイング部5におけるトップシート2と同様に、第1の突条部21、第2の突条部22および底部23を含む。しかし、本体部10の吸収体4が設けられている領域12のトップシート2の第1の突条部21、第2の突条部22および底部23は、肌側の表面に後述の血液改質剤層24をさらに含む。また、吸収体4が設けられている領域12のトップシート2の第1の突条部21は、後述の開口部25をさらに含む。
本体部10の吸収体4が設けられている領域12のトップシート2の第1の突条部21は、その両側面26に、長手方向(Y方向)に並ぶ複数の開口部25を有する。本体部10の吸収体4が設けられている領域12のトップシート2に排出された着用者の体液は、開口部25を通過して吸収体4へ移動する。また、隣接する2つの第1の突条部21と底部23とによって形成される幅方向(X方向)の略U字形状によって、トップシート2に排出された着用者の体液は、底部23の方に向かって素早く集まる。底部23の方に向かって流れる体液は、底部23に到達する前に、第1の突条部21の側面26に設けられた開口部25を通過し、吸収体4に流れる。また、底部23に溜まった体液も第1の突条部21の側面26に設けられた開口部25を通過し、吸収体4に流れる。したがって、第1の突条部21の側面26に設けられた開口部25によって、着用者の体液は、吸収体4に素早く吸収される。また、第1の突条部21の側面26に設けられた開口部25によって、トップシート2に残留する体液の量を減少させることができる。
本体部10の吸収体4が設けられている領域12のトップシート2の肌側の表面に血液改質剤を塗布して、トップシート2の肌当接側の表面に血液改質剤層24を形成してもよい。この血液改質剤層24によって、トップシート2の表面に、着用者の体液、とくに粘度の高い経血が残るのを抑制することができる。この血液改質剤層24は、後で詳細に説明する。
本体部10の吸収体4が設けられている領域12のトップシート2に設けられた第1の突条部21によって着用者の肌とトップシート2との間の接触面積が小さくなるので、トップシート2の肌触りが良好になる。なお、本体部10の吸収体4が設けられている領域12のトップシート2に第1の突条部のみを形成し、第2の突条部を形成しなくてもよい。この場合も着用者の肌とトップシート2との間の接触面積が小さくなるので、トップシート2の肌触りが良好になる。しかし、第2の突条部を設けることによって、第1の突条部はつぶれにくくなるので、本体部10の吸収体4が設けられている領域12のトップシート2に、第1の突条部と第2の突条部との両方を設けることが好ましい。
図1および図2に示すバックシート3は、吸収体4に吸収された体液が外へ漏れ出すのを防止する。バックシート3には、体液を透過しない材料が使用される。たとえば、バックシート3として、疎水性の不織布、ポリエチレンおよびポリプロピレンなどの不透水性のプラスチックフィルムまたは不織布と不透水性プラスチックフィルムとのラミネートシートなどが使用される。また、耐水性の高いメルトブローン不織布を強度の強いスパンボンド不織布で挟んだSMS不織布をバックシート3として使用してもよい。体液は通さない通気性を有する材料をバックシート3として使用することにより、着用時のムレを低減させることができる。
バックシート3がトップシート2と重なっている部分では、バックシート3は、上述のトップシート2に形成された第1の突条部21および第2の突条部22と一緒になって体液31を流し込むため流路を形成する。また、バックシート3はホットメルト接着剤などの接着剤を使用してトップシート2の底部23と接合している。
吸収体4は体液を吸収して保持する。吸収体4は、嵩高であり、型崩れし難く、化学的刺激が少ないものであることが好ましい。たとえば、吸収体4として、フラッフ状パルプもしくはエアレイド不織布と高吸収性ポリマー(SAP)とからなる複合吸収体が使用される。この複合吸収体は、ティッシュなどの液透過性の材料で覆われていてもよい。
また、上記複合吸収体のフラッフ状パルプの代わりに、たとえば、化学パルプ、セルロース繊維、レーヨンおよびアセテートなどの人工セルロース繊維を使用してもよい。上記複合吸収体中のパルプなどの吸収性繊維の坪量は、好ましくは100g/m2以上、800g/m2以下であり、上記複合吸収体中の高吸収性ポリマーの質量比は、吸収性繊維を100%として好ましくは10%以上、65%以下である。上記複合混合体を覆うティッシュなど液透過性の材料の坪量は、好ましくは12g/m2以上、30g/m2以下である。
上記複合混合体のエアレイド不織布として、たとえば、パルプと合成繊維とを熱融着させた不織布またはパルプと合成繊維とをバインダーで固着させた不織布を使用することができる。
上記複合吸収体の高吸収性ポリマーは、水溶性高分子が適度に架橋した三次元網目構造を有する。この吸収性ポリマーは、水を吸収する前の吸収性ポリマーの体積に対して30~60倍の水を吸収する。しかし、この吸収性ポリマーは本質的に水不溶性である。また、この吸収性ポリマーは、多少の圧力を加えられても、一旦吸収された水を離水しない。この吸収性ポリマーとして、たとえば、デンプン系、アクリル酸系またはアミノ酸系の粒子状または繊維状のポリマーが使用される。
吸収体4の形状および構造は必要に応じて変えることができるが、吸収体4の全吸収量は、吸収性物品1としての設計挿入量および所望の用途に対応させる必要がある。また、吸収体4のサイズや吸収能力などは用途に応じて変わる。
図1に示すように、吸収体4の幅方向の縁41は、幅方向(X方向)内側へ突出するように湾曲している。これにより、図6に示すように、吸収体4の幅方向の両縁41の外側の領域14のトップシート2に設けられた第1の突条部21は、長手方向(Y方向)に進むと吸収体4の幅方向の縁41に到達することになる。したがって、第1の突条部21とバックシートとから構成される流路の中を長手方向(Y方向)に流れる、吸収体4からしみ出た体液31は、再び吸収体4に吸収される。これにより、第2の突条部22とバックシート3とから構成される流路を介して、隣接する第1の突条部21とバックシート3とから構成される流路に流れ込む体液の量が減少し、吸収性物品1に圧力がかかることにより吸収体4からしみ出た体液31が吸収性物品1の幅方向から漏れることを、さらに抑制できる。
ホットメルト接着剤を使用して吸収体4はバックシート3と接着している。これによりバックシート3から吸収体4が剥がれることを抑制できる。
ウイング部5は、吸収性物品1を下着に安定して固定するために吸収性物品1に設けられている。ウイング部5を下着の外面側に折り曲げた後、粘着部6を介して下着のクロッチ部に張り付けることによって、吸収性物品1を下着に安定して固定することができる。
粘着部6は、吸収性物品1を下着のクロッチ部に固定する。粘着部6を形成する粘着剤としては、たとえばスチレン系ポリマー、粘着付与剤、可塑剤のいずれかが主成分であるものが好適に使用される。前記スチレン系ポリマーとしては、スチレン-エチレン-ブチレン-スチレンブロック共重合体、スチレン-ブチレン重合体、スチレン-ブチレン-スチレンブロック共重合体、スチレン-イソブチレン-スチレン共重合体などが挙げられるが、これらのうち1種のみを使用しても、二種以上のポリマーブレンドであってもよい。この中でも熱安定性が良好であるという点で、スチレン-エチレン-ブチレン-スチレンブロック共重合体が好ましい。
また、前記粘着付与剤および可塑剤としては、常温で固体のものを好ましく用いることができ、粘着付与剤ではたとえばC5系石油樹脂、C9系石油樹脂、ジシクロペンタジエン系石油樹脂、ロジン系石油樹脂、ポリテルペン樹脂、テルペンフェノール樹脂などが挙げられ、前記可塑剤ではたとえば、リン酸トリフレシル、フタル酸ジブチル、フタル酸ジオクチルなどのモノマー可塑剤の他、ビニル重合体やポリエステルのようなポリマー可塑剤が挙げられる。
図1および図2に示すように、トップシート2および吸収体4は、エンボス加工により厚み方向に圧縮して形成された、トップシート2から吸収体4の内部に至る圧搾溝7を有する。圧搾溝7は、吸収性物品1の中心部分(着用者の体液の排出口に対向する部分)に排出された体液が幅方向(X方向)に拡散するのを抑制する。また、これにより吸収体4からトップシート2が剥がれることを抑制できる。圧搾溝7は、吸収性物品1の中心部分を囲み、連続的な略環状の形状を有する。なお、吸収性物品1の中央部を囲む圧搾溝7は、部分的に途切れていてもよい。すなわち、圧搾溝7は、非連続的な略環状の形状を有していてもよい。
また、ヒートエンボス加工によりトップシート2をバックシート3に圧縮接合させることによって、吸収性物品1の長手方向両側および幅方向両側にシール部8が形成される。これにより、トップシート2がバックシート3から剥がれないようにできる。また、長手方向両側のシール部8によって、第1の突条部21とバックシート3とから構成される流路の両端部は、圧縮して密閉される。これにより、第1の突条部21とバックシート3とから構成される流路の両端部は塞がれていることになるので、第1の突条部21とバックシート3とから構成される流路の中を大量に流れた着用者の体液が、吸収性物品1の長手方向の両端から漏れることを防止できる。
次に、上述の血液改質剤層24を詳細に説明する。血液改質剤層24の血液改質剤は、血液改質剤は、約0.00~約0.60のIOBと、約45℃以下の融点と、25℃の水100gに対する、約0.00~約0.00~約0.05gの水溶解度とを有する。
IOB(Inorganic Organic Balance)は、親水性および親油性のバランスを示す指標であり、本明細書では、小田らによる次式:
IOB=無機性値/有機性値
により算出される値を意味する。
IOB=無機性値/有機性値
により算出される値を意味する。
上記無機性値と、有機性値とは、藤田穆「有機化合物の予測と有機概念図」化学の領域Vol.11,No.10(1957)p.719-725)に記載される有機概念図に基づく。藤田氏による、主要な基の有機性値および無機性値を、下記表1にまとめる。
たとえば、炭素数14のテトラデカン酸と、炭素数12のドデシルアルコールとのエステルの場合には、有機性値が520(CH2,20×26個)、無機性値が60(-COOR,60×1個)となるため、IOB=0.12となる。
上記血液改質剤において、IOBは、約0.00~約0.60であり、約0.00~約0.50であることが好ましく、約0.00~約0.40であることがより好ましく、そして約0~約0.30であることがさらに好ましい。IOBが低いほど、有機性が高く、血球との親和性が高くなると考えられるからである。
本明細書において、「融点」は、示差走査熱量分析計において、昇温速度10℃/分で測定した場合の、固形状から液状に変化する際の吸熱ピークのピークトップ温度を意味する。上記融点は、たとえば、島津製作所社製のDSC-60型DSC測定装置を用いて測定することができる。
上記血液改質剤は、約45℃以下の融点を有すれば、室温で液体であっても、または固体であってもよい、すなわち、融点が約25℃以上でも、または約25℃未満でもよく、そしてたとえば、約-5℃、約-20℃等の融点を有することができる。上記血液改質剤の融点が約45℃以下である根拠は、後述する。
上記血液改質剤は、その融点に下限は存在しないが、その蒸気圧が低いことが好ましい。上記血液改質剤の蒸気圧は、25℃(1気圧)で約0~約200Paであることが好ましく、約0~約100Paであることがより好ましく、約0~約10Paであることがさらに好ましく、約0~約1Paであることがさらにいっそう好ましく、そして約0.0~約0.1Paであることがさらにいっそう好ましい。本開示の吸収性物品が、人体に接して用いられることを考慮すると、上記蒸気圧は、40℃(1気圧)で約0~約700Paであることが好ましく、約0~約100Paであることがより好ましく、約0~約10Paであることがさらに好ましく、約0~約1Paであることがさらにいっそう好ましく、そして約0.0~約0.1Paであることがさらにいっそう好ましい。上記血液改質剤の蒸気圧が高いと、保存中に気化し、その量の減少、着用時の臭気等の問題が発生する場合があるからである。
また、血液改質剤の融点を、気候、着用時間の長さ等に応じて、使い分けることができる。たとえば、平均気温が約10℃以下の地域では、約10℃以下の融点を有する血液改質剤を採用することにより、経血が排泄された後、周囲温度によって冷却された場合であっても、血液改質剤が、安定して血液を改質することができると考えられる。また、吸収性物品が長時間にわたって使用される場合には、血液改質剤の融点は、45℃以下の範囲で高い方が好ましい。汗、着用時の摩擦等の影響を受けにくく、長時間着用した場合であっても、血液改質剤が移動しにくいからである。
0.00~0.05gの水溶解度は、25℃において、100gの脱イオン水に、0.05gの試料を添加し、24時間静置し、24時間後に、必要に応じて軽く攪拌し、次いで、試料が溶解したか否か目視で評価することにより測定することができる。なお、本明細書では、水溶解度に関して、「溶解」には、試料が脱イオン水に完全に溶解し、均一混合物を形成した場合と、試料が完全にエマルション化した場合とが含まれる。なお、「完全」とは、脱イオン水に、試料の塊が存在しないことを意味する。
当技術分野では、血液の表面張力等を変化させ、血液を迅速に吸収することを目的として、トップシートの表面を、界面活性剤でコーティングすることが行われている。しかし、界面活性剤は、一般に水溶解度が高いため、界面活性剤がコーティングされたトップシートは、血液中の親水性成分(血漿等)となじみがよく、むしろ血液をトップシートに残存させるようにはたらく傾向がある。上記血液改質剤は、水溶解度が低いため、従来公知の界面活性剤と異なり、血液をトップシートに残存させず、迅速に吸収体に移行させることができると考えられる。
本明細書において、25℃における、100gの水に対する溶解度を、単に、「水溶解度」と称する場合がある。
本明細書において、「重量平均分子量」は、多分散系の化合物(たとえば、逐次重合により製造された化合物、複数の脂肪酸と、複数の脂肪族1価アルコールとから生成されたエステル)と、単一化合物(たとえば、1種の脂肪酸と、1種の脂肪族1価アルコールから生成されたエステル)とを含む概念であり、Ni個の分子量Miの分子(i=1、またはi=1,2・・・)からなる系において、次の式:
Mw=ΣNiMi 2/ΣNiMi
により求められるMwを意味する。
Mw=ΣNiMi 2/ΣNiMi
により求められるMwを意味する。
本明細書において、重量平均分子量は、ゲルパーミエーションクロマトグラフィー(GPC)により求められる、ポリスチレン換算の値を意味する。GPCの測定条件としては、たとえば、以下が挙げられる。
機種:(株)日立ハイテクノロジーズ製 高速液体クロマトグラム Lachrom Elite
カラム:昭和電工(株)製 SHODEX KF-801、KF-803およびKF-804
溶離液:THF
流量 :1.0mL/分
打込み量:100μL
検出:RI(示差屈折計)
なお、本明細書の実施例に記載される重量平均分子量は、上記条件により測定したものである。
機種:(株)日立ハイテクノロジーズ製 高速液体クロマトグラム Lachrom Elite
カラム:昭和電工(株)製 SHODEX KF-801、KF-803およびKF-804
溶離液:THF
流量 :1.0mL/分
打込み量:100μL
検出:RI(示差屈折計)
なお、本明細書の実施例に記載される重量平均分子量は、上記条件により測定したものである。
上記血液改質剤は、好ましくは、次の(i)~(iii)、
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、および
(iii) (iii-1)炭化水素部分と、(iii-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基と、(iii-3)上記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択される。
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、および
(iii) (iii-1)炭化水素部分と、(iii-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基と、(iii-3)上記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択される。
本明細書において、「炭化水素」は、炭素と水素とから成る化合物を意味し、鎖状炭化水素、たとえば、パラフィン系炭化水素(二重結合および三重結合を含まない、アルカンとも称される)、オレフィン系炭化水素(二重結合を1つ含む、アルケンとも称される)、アセチレン系炭化水素(三重結合を1つ含む、アルキンとも称される)、および二重結合および三重結合から成る群から選択される結合を2つ以上含む炭化水素、ならびに環状炭化水素、たとえば、芳香族炭化水素、脂環式炭化水素が挙げられる。
上記炭化水素としては、鎖状炭化水素および脂環式炭化水素であることが好ましく、鎖状炭化水素であることがより好ましく、パラフィン系炭化水素、オレフィン系炭化水素、および二重結合を2つ以上含む炭化水素(三重結合を含まない)であることがさらに好ましく、そしてパラフィン系炭化水素であることがさらに好ましい。上記鎖状炭化水素には、直鎖状炭化水素および分岐鎖状炭化水素が含まれる。
上記(ii)および(iii)の化合物において、オキシ基(-O-)が2つ以上挿入されている場合には、各オキシ基(-O-)は隣接していない。したがって、上記(ii)および(iii)の化合物には、オキシ基が連続する化合物(いわゆる、過酸化物)は含まれない。
また、上記(iii)の化合物では、炭化水素部分の少なくとも1つの水素原子が、カルボキシル基(-COOH)で置換された化合物よりも、炭化水素部分の少なくとも1つの水素原子が、ヒドロキシル基(-OH)で置換された化合物の方が好ましい。表1に示すように、カルボキシル基は、経血中の金属等と結合し、無機性値が150から、400以上へと大幅に上昇するため、カルボキシル基を有する血液改質剤は、使用時にIOBの値が約0.60を上回り、血球との親和性が低下する可能性があるからである。
上記血液改質剤は、より好ましくは、次の(i’)~(iii’)、
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合とを有する化合物、および
(iii’) (iii’-1)炭化水素部分と、(iii’-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合と、(iii’-3)上記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択される。
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合とを有する化合物、および
(iii’) (iii’-1)炭化水素部分と、(iii’-2)上記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合と、(iii’-3)上記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択される。
上記(ii’)および(iii’)の化合物において、2以上の同一または異なる結合が挿入されている場合、すなわち、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)およびエーテル結合(-O-)から選択される2以上の同一または異なる結合が挿入されている場合には、各結合は隣接しておらず、各結合の間には、少なくとも、炭素原子が1つ介在する。
上記血液改質剤は、さらに好ましくは、炭化水素部分中に、炭素原子10個当たり、カルボニル結合(-CO-)を約1.8個以下、エステル結合(-COO-)を2個以下、カーボネート結合(-OCOO-)を約1.5個以下、エーテル結合(-O-)を約6個以下、カルボキシル基(-COOH)を約0.8個以下、そして/またはヒドロキシル基(-OH)を約1.2個以下有する化合物であることができる。
上記血液改質剤は、さらに好ましくは、次の(A)~(F)、
(A) (A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、上記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC2~C6アルキレングリコール、またはそのアルキルエステルもしくはアルキルエーテル、および
(F)鎖状炭化水素、
ならびにそれらの任意の組み合わせから成る群から選択される。以下、(A)~(F)に従う血液改質剤について詳細に説明する。
(A) (A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、上記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC2~C6アルキレングリコール、またはそのアルキルエステルもしくはアルキルエーテル、および
(F)鎖状炭化水素、
ならびにそれらの任意の組み合わせから成る群から選択される。以下、(A)~(F)に従う血液改質剤について詳細に説明する。
[(A) (A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル]
(A) (A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル(以下、「化合物(A)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのヒドロキシル基がエステル化されていなくともよい。
(A) (A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル(以下、「化合物(A)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのヒドロキシル基がエステル化されていなくともよい。
(A1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物(以下、「化合物(A1)」と称する場合がある)としては、たとえば、鎖状炭化水素テトラオール、たとえば、アルカンテトラオール、たとえば、ペンタエリトリトール、鎖状炭化水素トリオール、たとえば、アルカントリオール、たとえば、グリセリン、および鎖状炭化水素ジオール、たとえば、アルカンジオール、たとえば、グリコールが挙げられる。
(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物(以下、「化合物(A2)」と称する場合がある)としては、たとえば、炭化水素上の1つの水素原子が、1つのカルボキシル基(-COOH)で置換された化合物、たとえば、脂肪酸が挙げられる。
化合物(A)としては、たとえば、(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル、(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル、および(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルが挙げられる。
(A2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物(以下、「化合物(A2)」と称する場合がある)としては、たとえば、炭化水素上の1つの水素原子が、1つのカルボキシル基(-COOH)で置換された化合物、たとえば、脂肪酸が挙げられる。
化合物(A)としては、たとえば、(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル、(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル、および(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルが挙げられる。
[(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル]
上記鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、次の式(1):
のペンタエリトリトールと脂肪酸とのテトラエステル、次の式(2):
のペンタエリトリトールと脂肪酸とのトリエステル、次の式(3):
のペンタエリトリトールと脂肪酸とのジエステル、次の式(4):
のペンタエリトリトールと脂肪酸とのモノエステルが挙げられる。
(式中、R1~R4は、それぞれ、鎖状炭化水素である)
上記鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、次の式(1):
(式中、R1~R4は、それぞれ、鎖状炭化水素である)
上記ペンタエリトリトールと脂肪酸とのエステルを構成する脂肪酸(R1COOH、R2COOH,R3COOH,およびR4COOH)としては、ペンタエリトリトールと脂肪酸とのエステルが、上記IOB、融点および水溶解度の要件を満たすものであれば、特に制限されないが、たとえば、飽和脂肪酸、たとえば、C2~C30の飽和脂肪酸、たとえば、酢酸(C2)(C2は、炭素数を示し、R1C、R2C,R3CまたはR4Cの炭素数に相当する、以下同じ)、プロパン酸(C3)、ブタン酸(C4)およびその異性体、たとえば、2-メチルプロパン酸(C4)、ペンタン酸(C5)およびその異性体、たとえば、2-メチルブタン酸(C5)、2,2-ジメチルプロパン酸(C5)、ヘキサン酸(C6)、ヘプタン酸(C7)、オクタン酸(C8)およびその異性体、たとえば、2-エチルヘキサン酸(C8)、ノナン酸(C9)、デカン酸(C10)、ドデカン酸(C12)、テトラデカン酸(C14)、ヘキサデカン酸(C16)、ヘプタデカン酸(C17)、オクタデカン酸(C18)、エイコサン酸(C20)、ドコサン酸(C22)、テトラコサン酸(C24)、ヘキサコサン酸(C26)、オクタコサン酸(C28)、トリアコンタン酸(C30)等、ならびにこれらの異性体(上述のものを除く)が挙げられる。
上記脂肪酸はまた、不飽和脂肪酸であることができる。上記不飽和脂肪酸としては、たとえば、C3~C20の不飽和脂肪酸、たとえば、モノ不飽和脂肪酸、たとえば、クロトン酸(C4)、ミリストレイン酸(C14)、パルミトレイン酸(C16)、オレイン酸(C18)、エライジン酸(C18)、バクセン酸(C18)、ガドレイン酸(C20)、エイコセン酸(C20)等、ジ不飽和脂肪酸、たとえば、リノール酸(C18)、エイコサジエン酸(C20)等、トリ不飽和脂肪酸、たとえば、リノレン酸、たとえば、α-リノレン酸(C18)およびγ-リノレン酸(C18)、ピノレン酸(C18)、エレオステアリン酸、たとえば、α-エレオステアリン酸(C18)およびβ-エレオステアリン酸(C18)、ミード酸(C20)、ジホモ-γ-リノレン酸(C20)、エイコサトリエン酸(C20)等、テトラ不飽和脂肪酸、たとえば、ステアリドン酸(C20)、アラキドン酸(C20)、エイコサテトラエン酸(C20)等、ペンタ不飽和脂肪酸、たとえば、ボセオペンタエン酸(C18)、エイコサペンタエン酸(C20)等、ならびにこれらの部分水素付加物が挙げられる。
上記ペンタエリトリトールと脂肪酸とのエステルとしては、酸化等により変性する可能性を考慮すると、飽和脂肪酸に由来する、ペンタエリトリトールと脂肪酸とのエステル、すなわち、ペンタエリトリトールと飽和脂肪酸とのエステルであることが好ましい。また、上記ペンタエリトリトールと脂肪酸とのエステルとしては、IOBを小さくし、より疎水性とするために、ジエステル、トリエステルまたはテトラエステルであることが好ましく、トリエステルまたはテトラエステルであることがより好ましく、そしてテトラエステルであることがさらに好ましい。
上記ペンタエリトリトールと脂肪酸とのテトラエステルでは、ペンタエリトリトールと脂肪酸とのテトラエステルを構成する脂肪酸の炭素数の合計、すなわち、上記式(1)において、R1C、R2C、R3CおよびR4C部分の炭素数の合計が15の場合にIOBが0.60となる。したがって、上記ペンタエリトリトールと脂肪酸とのテトラエステルでは、上記炭素数の合計が約15以上である場合に、IOBが約0.00~約0.60の要件を満たす。上記ペンタエリトリトールと脂肪酸とのテトラエステルでは、たとえば、ペンタエリトリトールと、ヘキサン酸(C6)、ヘプタン酸(C7)、オクタン酸(C8)、たとえば、2-エチルヘキサン酸(C8)、ノナン酸(C9)、デカン酸(C10)および/またはドデカン酸(C12)とのテトラエステルが挙げられる。
上記ペンタエリトリトールと脂肪酸とのトリエステルでは、ペンタエリトリトールと脂肪酸とのトリエステルを構成する脂肪酸の炭素数の合計、すなわち、上記式(2)において、R1C、R2CおよびR3C部分の炭素数の合計が19の場合にIOBが0.58となる。したがって、上記ペンタエリトリトールと脂肪酸とのトリエステルでは、脂肪酸の炭素数の合計が約19以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記ペンタエリトリトールと脂肪酸とのジエステルでは、ペンタエリトリトールと脂肪酸とのジエステルを構成する脂肪酸の炭素数の合計、すなわち、上記式(3)において、R1CおよびR2C部分の炭素数の合計が22の場合にIOBが0.59となる。したがって、上記ペンタエリトリトールと脂肪酸とのジエステルでは、脂肪酸の炭素数の合計が約22以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記ペンタエリトリトールと脂肪酸とのモノエステルでは、ペンタエリトリトールと脂肪酸とのモノエステルを構成する脂肪酸の炭素数、すなわち、上記式(4)において、R1C部分の炭素数が25の場合にIOBが0.60となる。したがって、上記ペンタエリトリトールと脂肪酸とのモノエステルでは、脂肪酸の炭素数が約25以上である場合に、IOBが約0.00~約0.60の要件を満たす。なお、上記計算に当たっては、二重結合、三重結合、iso分岐、およびtert分岐の影響は、考慮していない。
上記ペンタエリトリトールと脂肪酸とのエステルの市販品としては、ユニスター H-408BRS、H-2408BRS-22(混合品)等(以上、日油株式会社製)が挙げられる。
[(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル]
上記鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、次の式(5):
のグリセリンと脂肪酸とのトリエステル、次の式(6):
のグリセリンと脂肪酸とのジエステル、および次の式(7):
(式中、R5~R7は、それぞれ、鎖状炭化水素である)
のグリセリンと脂肪酸とのモノエステルが挙げられる。
上記鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、次の式(5):
のグリセリンと脂肪酸とのモノエステルが挙げられる。
上記グリセリンと脂肪酸とのエステルを構成する脂肪酸(R5COOH、R6COOHおよびR7COOH)としては、グリセリンと脂肪酸とのエステルが、上記IOB、融点および水溶解度の要件を満たすものであれば、特に制限されず、たとえば、「(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル」において列挙される脂肪酸、すなわち、飽和脂肪酸および不飽和脂肪酸が挙げられ、酸化等により変性する可能性を考慮すると、飽和脂肪酸に由来する、グリセリンと脂肪酸とのエステル、すなわち、グリセリンと飽和脂肪酸とのエステルであることが好ましい。
また、上記グリセリンと脂肪酸とのエステルとしては、IOBを小さくし、より疎水性とするために、ジエステルまたはトリエステルであることが好ましく、そしてトリエステルであることがより好ましい。
上記グリセリンと脂肪酸とのトリエステルは、トリグリセリドとも称され、たとえば、グリセリンとオクタン酸(C8)とのトリエステル、グリセリンとデカン酸(C10)とのトリエステル、グリセリンとドデカン酸(C12)とのトリエステル、およびグリセリンと、2種または3種の脂肪酸とのトリエステル、ならびにこれらの混合物が挙げられる。
上記グリセリンと、2種以上の脂肪酸とのトリエステルとしては、たとえば、グリセリンと、オクタン酸(C8)およびデカン酸(C10)とのトリエステル、グリセリンと、オクタン酸(C8)、デカン酸(C10)およびドデカン酸(C12)とのトリエステル、グリセリンと、オクタン酸(C8)、デカン酸(C10)、ドデカン酸(C12)、テトラデカン酸(C14)、ヘキサデカン酸(C16)およびオクタデカン酸(C18)とのトリエステル等が挙げられる。
上記グリセリンと脂肪酸とのトリエステルとしては、融点を約45℃以下とするために、グリセリンと脂肪酸とのトリエステルを構成する脂肪酸の炭素数の合計、すなわち、式(5)において、R5C、R6CおよびR7C部分の炭素数の合計が、約40以下であることが好ましい。
また、上記グリセリンと脂肪酸とのトリエステルでは、グリセリンと脂肪酸とのトリエステルを構成する脂肪酸の炭素数の合計、すなわち、式(5)において、R5C、R6CおよびR7C部分の炭素数の合計が12の場合にIOBが0.60となる。したがって、上記グリセリンと脂肪酸とのトリエステルでは、脂肪酸の炭素数の合計が約12以上である場合に、IOBが約0.00~約0.60の要件を満たす。上記グリセリンと脂肪酸とのトリエステルは、いわゆる、脂肪であり、人体を構成しうる成分であるため、安全性の観点から好ましい。
上記グリセリンと脂肪酸とのトリエステルの市販品としては、トリヤシ油脂肪酸グリセリド、NA36、パナセート800、パナセート800Bおよびパナセート810S、ならびにトリC2L油脂肪酸グリセリドおよびトリCL油脂肪酸グリセリド(以上、日油株式会社製)等が挙げられる。
上記グリセリンと脂肪酸とのジエステルは、ジグリセリドとも称され、たとえば、グリセリンとデカン酸(C10)とのジエステル、グリセリンとドデカン酸(C12)とのジエステル、グリセリンとヘキサデカン酸(C16)とのジエステル、およびグリセリンと、2種の脂肪酸とのジエステル、ならびにこれらの混合物が挙げられる。
上記グリセリンと脂肪酸とのジエステルでは、グリセリンと脂肪酸とのジエステルを構成する脂肪酸の炭素数の合計、すなわち、式(6)において、R5CおよびR6C部分の炭素数の合計が16の場合にIOBが0.58となる。したがって、上記グリセリンと脂肪酸とのジエステルでは、脂肪酸の炭素数の合計が約16以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記グリセリンと脂肪酸とのモノエステルは、モノグリセリドとも称され、たとえば、グリセリンのイコサン酸(C20)モノエステル、グリセリンのドコサン酸(C22)モノエステル等が挙げられる。上記グリセリンと脂肪酸とのモノエステルでは、グリセリンと脂肪酸とのモノエステルを構成する脂肪酸の炭素数、すなわち、式(7)において、R5C部分の炭素数が19の場合にIOBが0.59となる。したがって、上記グリセリンと脂肪酸とのモノエステルでは、脂肪酸の炭素数が約19以上である場合に、IOBが約0.00~約0.60の要件を満たす。
[(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステル]
上記鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、C2~C6の鎖状炭化水素ジオール、たとえば、C2~C6のグリコール、たとえば、エチレングリコール、プロピレングリコール、ブチレングリコール、ペンチレングリコールまたはヘキシレングリコールと、脂肪酸とのモノエステルまたはジエステルが挙げられる。
上記鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、C2~C6の鎖状炭化水素ジオール、たとえば、C2~C6のグリコール、たとえば、エチレングリコール、プロピレングリコール、ブチレングリコール、ペンチレングリコールまたはヘキシレングリコールと、脂肪酸とのモノエステルまたはジエステルが挙げられる。
具体的には、上記鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステルとしては、たとえば、次の式(8):
R8COOCkH2kOCOR9 (8)
(式中、kは、2~6の整数であり、そしてR8およびR9は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのジエステル、および次の式(9):
R8COOCkH2kOH (9)
(式中、kは、2~6の整数であり、そしてR8は、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのモノエステルが挙げられる。
R8COOCkH2kOCOR9 (8)
(式中、kは、2~6の整数であり、そしてR8およびR9は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのジエステル、および次の式(9):
R8COOCkH2kOH (9)
(式中、kは、2~6の整数であり、そしてR8は、鎖状炭化水素である)
のC2~C6グリコールと脂肪酸とのモノエステルが挙げられる。
上記C2~C6グリコールと脂肪酸とのエステルにおいて、エステル化すべき脂肪酸(式(8)および式(9)において、R8COOHおよびR9COOHに相当する)としては、C2~C6グリコールと脂肪酸とのエステルが、上記IOB、融点および水溶解度の要件を満たすものであれば、特に制限されず、たとえば、「(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル」において列挙されている脂肪酸、すなわち、飽和脂肪酸および不飽和脂肪酸が挙げられ、酸化等により変性する可能性を考慮すると、飽和脂肪酸が好ましい。
式(8)に示されるブチレングリコール(k=4)と脂肪酸とのジエステルでは、R8CおよびR9C部分の炭素数の合計が6の場合に、IOBが、0.60となる。したがって、式(8)に示されるブチレングリコール(k=4)と脂肪酸とのジエステルでは、上記炭素数の合計が約6以上の場合に、IOBが約0.00~約0.60の要件を満たす。また、式(9)に示されるエチレングリコール(k=2)と脂肪酸とのモノエステルでは、R8C部分の炭素数が12の場合に、IOBが0.57となる。したがって、式(9)に示されるエチレングリコール(k=2)と脂肪酸とのモノエステルでは、脂肪酸の炭素数が約12以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記C2~C6グリコールと脂肪酸とのエステルとしては、酸化等により変性する可能性を考慮すると、飽和脂肪酸に由来する、C2~C6グリコールと脂肪酸とのエステル、すわなち、C2~C6グリコールと飽和脂肪酸とのエステルであることが好ましい。
また、上記C2~C6グリコールと脂肪酸とのエステルとしては、IOBを小さくし、より疎水性とするために、炭素数の大きいグリコールに由来する、グリコールと脂肪酸とのエステル、たとえば、ブチレングリコール、ペンチレングリコールまたはヘキシレングリコールに由来するグリコールと脂肪酸とのエステルであることが好ましい。
さらに、上記C2~C6グリコールと脂肪酸とのエステルとしては、IOBを小さくし、より疎水性とするために、ジエステルであることが好ましい。上記C2~C6グリコールと脂肪酸とのエステルの市販品としては、たとえば、コムポールBL、コムポールBS(以上、日油株式会社製)等が挙げられる。
[(B) (B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル]
(B) (B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル(以下、「化合物(B)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのヒドロキシル基がエーテル化されていなくともよい。
(B) (B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル(以下、「化合物(B)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのヒドロキシル基がエーテル化されていなくともよい。
(B1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物としては、「化合物(A)」において化合物(A1)として列挙されるもの、たとえば、ペンタエリトリトール、グリセリン、およびグリコールが挙げられる。
(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物(以下、「化合物(B2)」と称する場合がある)としては、たとえば、炭化水素の1個の水素原子が、1個のヒドロキシル基(-OH)で置換された化合物、たとえば、脂肪族1価アルコール、たとえば、飽和脂肪族1価アルコールおよび不飽和脂肪族1価アルコールが挙げられる。
(B2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物(以下、「化合物(B2)」と称する場合がある)としては、たとえば、炭化水素の1個の水素原子が、1個のヒドロキシル基(-OH)で置換された化合物、たとえば、脂肪族1価アルコール、たとえば、飽和脂肪族1価アルコールおよび不飽和脂肪族1価アルコールが挙げられる。
上記飽和脂肪族1価アルコールとしては、たとえば、C1~C20の飽和脂肪族1価アルコール、たとえば、メチルアルコール(C1)(C1は、炭素数を示す、以下同じ)、エチルアルコール(C2)、プロピルアルコール(C3)およびその異性体、たとえば、イソプロピルアルコール(C3)、ブチルアルコール(C4)およびその異性体、たとえば、sec-ブチルアルコール(C4)およびtert-ブチルアルコール(C4)、ペンチルアルコール(C5)、ヘキシルアルコール(C6)、ヘプチルアルコール(C7)、オクチルアルコール(C8)およびその異性体、たとえば、2-エチルヘキシルアルコール(C8)、ノニルアルコール(C9)、デシルアルコール(C10)、ドデシルアルコール(C12)、テトラデシルアルコール(C14)、ヘキサデシルアルコール(C16)、へプラデシルアルコール(C17)、オクタデシルアルコール(C18)、およびエイコシルアルコール(C20)、ならびにこれらの列挙されていない異性体が挙げられる。
上記不飽和脂肪族1価アルコールとしては、上記飽和脂肪族1価アルコールのC-C単結合の1つを、C=C二重結合で置換したもの、たとえば、オレイルアルコールが挙げられ、たとえば、新日本理化株式会社から、リカコールシリーズおよびアンジェコオールシリーズの名称で市販されている。
化合物(B)としては、たとえば、(b1)鎖状炭化水素テトラオールと少なくとも1の脂肪族1価アルコールとのエーテル、たとえば、モノエーテル、ジエーテル、トリエーテルおよびテトラエーテル、好ましくはジエーテル、トリエーテルおよびテトラエーテル、より好ましくはトリエーテルおよびテトラエーテル、そしてさらに好ましくはテトラエーテル、(b2)鎖状炭化水素トリオールと少なくとも1の脂肪族1価アルコールとのエーテル、たとえば、モノエーテル、ジエーテルおよびトリエーテル、好ましくはジエーテルおよびトリエーテル、そしてより好ましくはトリエーテル、ならびに(b3)鎖状炭化水素ジオールと少なくとも1の脂肪族1価アルコールとのエーテル、たとえば、モノエーテルおよびジエーテル、そして好ましくはジエーテルが挙げられる。
上記鎖状炭化水素テトラオールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、たとえば、次の式(10)~(13):
(式中、R10~R13は、それぞれ、鎖状炭化水素である。)
の、ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテル、トリエーテル、ジエーテルおよびモノエーテルが挙げられる。
の、ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテル、トリエーテル、ジエーテルおよびモノエーテルが挙げられる。
上記鎖状炭化水素トリオールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、たとえば、次の式(14)~(16):
(式中、R14~R16は、それぞれ、鎖状炭化水素である。)
の、グリセリンと脂肪族1価アルコールとのトリエーテル、ジエーテルおよびモノエーテルが挙げられる。
の、グリセリンと脂肪族1価アルコールとのトリエーテル、ジエーテルおよびモノエーテルが挙げられる。
上記鎖状炭化水素ジオールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、次の式(17):
R17OCnH2nOR18 (17)
(式中、nは、2~6の整数であり、そしてR17およびR18は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのジエーテル、および次の式(18):
R17OCnH2nOH (18)
(式中、nは、2~6の整数であり、そしてR17は、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのモノエーテルが挙げられる。
R17OCnH2nOR18 (17)
(式中、nは、2~6の整数であり、そしてR17およびR18は、それぞれ、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのジエーテル、および次の式(18):
R17OCnH2nOH (18)
(式中、nは、2~6の整数であり、そしてR17は、鎖状炭化水素である)
のC2~C6グリコールと脂肪族1価アルコールとのモノエーテルが挙げられる。
上記ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテルでは、ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、上記式(10)において、R10、R11、R12およびR13部分の炭素数の合計が4の場合にIOBが0.44となる。したがって、上記ペンタエリトリトールと脂肪族1価アルコールとのテトラエーテルでは、脂肪族1価アルコールの炭素数の合計が約4以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記ペンタエリトリトールと脂肪族1価アルコールとのトリエーテルでは、ペンタエリトリトールと脂肪族1価アルコールとのトリエーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、上記式(11)において、R10、R11およびR12部分の炭素数の合計が9の場合にIOBが0.57となる。したがって、上記ペンタエリトリトールと脂肪族1価アルコールとのトリエーテルでは、脂肪族1価アルコールの炭素数の合計が約9以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記ペンタエリトリトールと脂肪族1価アルコールとのジエーテルでは、ペンタエリトリトールと脂肪族1価アルコールとのジエーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、上記式(12)において、R10およびR11部分の炭素数の合計が15の場合にIOBが0.60となる。したがって、上記ペンタエリトリトールと脂肪族1価アルコールとのジエーテルでは、脂肪族1価アルコールの炭素数の合計が約15以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記ペンタエリトリトールと脂肪族1価アルコールとのモノエーテルでは、ペンタエリトリトールと脂肪族1価アルコールとのモノエーテルを構成する脂肪族1価アルコールの炭素数、すなわち、上記式(13)において、R10部分の炭素数が22の場合にIOBが0.59となる。したがって、上記ペンタエリトリトールと脂肪族1価アルコールとのモノエーテルでは、脂肪族1価アルコールの炭素数が約22以上である場合に、IOBが約0.00~約0.60の要件を満たす。
また、上記グリセリンと脂肪族1価アルコールとのトリエーテルでは、グリセリンと脂肪族1価アルコールとのトリエーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、式(14)において、R14、R15およびR16部分の炭素数の合計が3の場合にIOBが0.50となる。したがって、上記グリセリンと脂肪族1価アルコールとのトリエーテルでは、脂肪族1価アルコールの炭素数の合計が約3以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記グリセリンと脂肪族1価アルコールとのジエーテルでは、グリセリンと脂肪族1価アルコールとのジエーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、式(15)において、R14およびR15部分の炭素数の合計が9の場合にIOBが0.58となる。したがって、上記グリセリンと脂肪族1価アルコールとのジエーテルでは、脂肪族1価アルコールの炭素数の合計が約9以上である場合に、IOBが約0.00~約0.60の要件を満たす。
上記グリセリンと脂肪族1価アルコールとのモノエーテルでは、グリセリンと脂肪族1価アルコールとのモノエーテルを構成する脂肪族1価アルコールの炭素数、すなわち、式(16)において、R14部分の炭素数が16の場合にIOBが0.58となる。したがって、上記グリセリンと脂肪族1価アルコールとのモノエーテルでは、脂肪族1価アルコールの炭素数が約16以上である場合に、IOBが約0.00~約0.60の要件を満たす。
式(17)に示されるブチレングリコール(n=4)と脂肪族1価アルコールとのジエーテルでは、R17およびR18部分の炭素数の合計が2の場合に、IOBが、0.33となる。したがって、式(17)に示されるブチレングリコール(n=4)と脂肪族1価アルコールとのジエーテルでは、脂肪族1価アルコールの炭素数の合計が2以上の場合に、IOBが約0.00~約0.60の要件を満たす。また、式(18)に示されるエチレングリコール(n=2)と脂肪族1価アルコールとのモノエーテルでは、R17部分の炭素数が8の場合に、IOBが0.60となる。したがって、式(18)に示されるエチレングリコール(n=2)と脂肪族1価アルコールとのモノエーテルでは、脂肪族1価アルコールの炭素数が約8以上である場合に、IOBが約0.00~約0.60の要件を満たす。
化合物(B)としては、化合物(B1)と、化合物(B2)とを、酸触媒の存在下で、脱水縮合することにより生成することができる。
[(C) (C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル]
(C) (C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル(以下、「化合物(C)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのカルボキシル基がエステル化されていなくともよい。
(C) (C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル(以下、「化合物(C)」と称する場合がある)は、上述のIOB、融点および水溶解度を有する限り、全てのカルボキシル基がエステル化されていなくともよい。
(C1)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸(以下、「化合物(C1)」と称する場合がある)としては、たとえば、2~4個のカルボキシル基を有する鎖状炭化水素カルボン酸、たとえば、鎖状炭化水素ジカルボン酸、たとえば、アルカンジカルボン酸、たとえば、エタン二酸、プロパン二酸、ブタン二酸、ペンタン二酸、ヘキサン二酸、ヘプタン二酸、オクタン二酸、ノナン二酸およびデカン二酸、鎖状炭化水素トリカルボン酸、たとえば、アルカントリカルボン酸、たとえば、プロパン三酸、ブタン三酸、ペンタン三酸、ヘキサン三酸、ヘプタン三酸、オクタン三酸、ノナン三酸およびデカン三酸、ならびに鎖状炭化水素テトラカルボン酸、たとえば、アルカンテトラカルボン酸、たとえば、ブタン四酸、ペンタン四酸、ヘキサン四酸、ヘプタン四酸、オクタン四酸、ノナン四酸およびデカン四酸が挙げられる。
また、化合物(C1)には、2~4個のカルボキシル基を有する鎖状炭化水素ヒドロキシ酸、たとえば、リンゴ酸、酒石酸、クエン酸、イソクエン酸等、2~4個のカルボキシル基を有する鎖状炭化水素アルコキシ酸、たとえば、O-アセチルクエン酸、および2~4個のカルボキシル基を有する鎖状炭化水素オキソ酸が含まれる。(C2)鎖状炭化水素部分と、上記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物としては、「化合物(B)」の項で列挙されるもの、たとえば、脂肪族1価アルコールが挙げられる。
化合物(C)としては、(c1)4個のカルボキシル基を有する鎖状炭化水素テトラカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、たとえば、モノエステル、ジエステル、トリエステルおよびテトラエステル、好ましくはジエステル、トリエステルおよびテトラエステル、より好ましくはトリエステルおよびテトラエステル、そしてさらに好ましくはテトラエステル、(c2)3個のカルボキシル基を有する鎖状炭化水素トリカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、たとえば、モノエステル、ジエステルおよびトリエステル、好ましくはジエステルおよびトリエステル、そしてより好ましくはトリエステル、ならびに(c3)2個のカルボキシル基を有する鎖状炭化水素ジカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、たとえば、モノエステルおよびジエステル、好ましくはジエステルが挙げられる。化合物(C)の例としては、アジピン酸ジオクチル、O-アセチルクエン酸トリブチル等が挙げられ、そして市販されている。
[(D)鎖状炭化水素部分と、上記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物]
(D)鎖状炭化水素部分と、上記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物(以下、「化合物(D)」と称する場合がある)としては、(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル、(d2)ジアルキルケトン、(d3)脂肪酸と脂肪族1価アルコールとのエステル、および(d4)ジアルキルカーボネートが挙げられる。
(D)鎖状炭化水素部分と、上記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物(以下、「化合物(D)」と称する場合がある)としては、(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル、(d2)ジアルキルケトン、(d3)脂肪酸と脂肪族1価アルコールとのエステル、および(d4)ジアルキルカーボネートが挙げられる。
[(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル]
上記脂肪族1価アルコールと脂肪族1価アルコールとのエーテルとしては、次の式(19):
R19OR20 (19)
(式中、R19およびR20は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
上記脂肪族1価アルコールと脂肪族1価アルコールとのエーテルとしては、次の式(19):
R19OR20 (19)
(式中、R19およびR20は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
上記エーテルを構成する脂肪族1価アルコール(式(19)において、R19OHおよびR20OHに相当する)としては、上記エーテルが、上記IOB、融点および水溶解度の要件を満たすものであれば、特に制限されず、たとえば、「化合物(B)」の項で列挙される脂肪族1価アルコールが挙げられる。
脂肪族1価アルコールと脂肪族1価アルコールとのエーテルでは、当該エーテルを構成する脂肪族1価アルコールの炭素数の合計、すなわち、上記式(19)において、R19およびR20部分の炭素数の合計が2の場合にIOBが0.50となるため、当該炭素数の合計が約2以上であれば、上記IOBの要件を満たす。しかし、上記炭素数の合計が6程度では、水溶解度が約2gと高く、蒸気圧の観点からも問題がある。水溶解度が約0.00~約0.05gの要件を満たすためには、上記炭素数の合計が約8以上であることが好ましい。
[(d2)ジアルキルケトン]
上記ジアルキルケトンとしては、次の式(20):
R21COR22 (20)
(式中、R21およびR22は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
上記ジアルキルケトンとしては、次の式(20):
R21COR22 (20)
(式中、R21およびR22は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
上記ジアルキルケトンでは、R21およびR22の炭素数の合計が5の場合にIOBが0.54となるため、当該炭素数の合計が約5以上であれば、上記IOBの要件を満たす。しかし、上記炭素数の合計が5程度では、水溶解度が約2gと高い。したがって、水溶解度が約0.00~約0.05gの要件を満たすためには、上記炭素数の合計が約8以上であることが好ましい。また、蒸気圧を考慮すると、上記炭素数は、約10以上であることが好ましく、そして約12以上であることが好ましい。なお、上記炭素数の合計が約8の場合、たとえば、5-ノナノンでは、融点は約-50℃であり、蒸気圧は20℃で約230Paである。上記ジアルキルケトンは、市販されている他、公知の方法、たとえば、第二級アルコールを、クロム酸等で酸化することにより得ることができる。
[(d3)脂肪酸と脂肪族1価アルコールとのエステル]
上記脂肪酸と脂肪族1価アルコールとのエステルとしては、たとえば、次の式(21):
R23COOR24 (21)
(式中、R23およびR24は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
上記脂肪酸と脂肪族1価アルコールとのエステルとしては、たとえば、次の式(21):
R23COOR24 (21)
(式中、R23およびR24は、それぞれ、鎖状炭化水素である)
を有する化合物が挙げられる。
上記エステルを構成する脂肪酸(式(21)において、R23COOHに相当する)としては、たとえば、「(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル」において列挙されている脂肪酸、すなわち、飽和脂肪酸または不飽和脂肪酸が挙げられ、酸化等により変性する可能性を考慮すると、飽和脂肪酸が好ましい。上記エステルを構成する脂肪族1価アルコール(式(21)において、R24OHに相当する)としては、たとえば、「化合物(B)」の項で列挙される脂肪族1価アルコールが挙げられる。
なお、上記脂肪酸と脂肪族1価アルコールとのエステルでは、脂肪酸および脂肪族1価アルコールの炭素数の合計、すなわち、式(21)において、R23CおよびR24部分の炭素数の合計が5の場合にIOBが0.60となるため、R23CおよびR24部分の炭素数の合計が約5以上である場合に、上記IOBの要件を満たす。しかし、たとえば、上記炭素数の合計が6の酢酸ブチルでは、蒸気圧が2,000Pa超と高い。したがって、蒸気圧を考慮すると、上記炭素数の合計が約12以上であることが好ましい。なお、上記炭素数の合計が約11以上であれば、水溶解度が約0.00~約0.05gの要件を満たすことができる。
上記脂肪酸と脂肪族1価アルコールとのエステルの例としては、たとえば、ドデカン酸(C12)と、ドデシルアルコール(C12)とのエステル、テトラデカン酸(C14)と、ドデシルアルコール(C12)とのエステル等が挙げられ、上記脂肪酸と脂肪族1価アルコールとのエステルの市販品としては、たとえば、エレクトールWE20、およびエレクトールWE40(以上、日油株式会社製)が挙げられる。
[(d4)ジアルキルカーボネート]
上記ジアルキルカーボネートとしては、次の式(22):
R25OC(=O)OR26 (22)
(式中、R25およびR26は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
上記ジアルキルカーボネートとしては、次の式(22):
R25OC(=O)OR26 (22)
(式中、R25およびR26は、それぞれ、アルキル基である)
を有する化合物が挙げられる。
上記ジアルキルカーボネートでは、R25およびR26の炭素数の合計が6の場合にIOBが0.57となるため、R25およびR26の炭素数の合計が、約6以上であれば、IOBの要件を満たす。水溶解度を考慮すると、R25およびR26の炭素数の合計が約7以上であることが好ましく、そして約9以上であることがより好ましい。上記ジアルキルカーボネートは、市販されている他、ホスゲンとアルコールとの反応、塩化ギ酸エステルとアルコールまたはアルコラートとの反応、および炭酸銀とヨウ化アルキルとの反応により合成することができる。
[(E)ポリオキシC2~C6アルキレングリコール、またはそのエステルもしくはエーテル]
上記ポリオキシC2~C6アルキレングリコール、またはそのエステルもしくはエーテル(以下、化合物(E)と称する場合がある)としては、(e1)ポリオキシC2~C6アルキレングリコール、(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル、(e3)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテル、(e4)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステル、および(e5)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルが挙げられる。以下、説明する。
上記ポリオキシC2~C6アルキレングリコール、またはそのエステルもしくはエーテル(以下、化合物(E)と称する場合がある)としては、(e1)ポリオキシC2~C6アルキレングリコール、(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル、(e3)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテル、(e4)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステル、および(e5)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルが挙げられる。以下、説明する。
[(e1)ポリオキシC2~C6アルキレングリコール]
上記ポリオキシC2~C6アルキレングリコールは、i)オキシC2~C6アルキレン骨格、すなわち、オキシエチレン骨格、オキシプロピレン骨格、オキシブチレン骨格、オキシペンチレン骨格、およびオキシヘキシレン骨格からなる群から選択されるいずれか1種の骨格を有しかつ両末端にヒドロキシ基を有するホモポリマー、ii)上記群から選択される2種以上の骨格を有しかつ両末端にヒドロキシ基を有するブロックコポリマー、またはiii)上記群から選択される2種以上の骨格を有しかつ両末端にヒドロキシ基を有するランダムコポリマーを意味する。
上記ポリオキシC2~C6アルキレングリコールは、i)オキシC2~C6アルキレン骨格、すなわち、オキシエチレン骨格、オキシプロピレン骨格、オキシブチレン骨格、オキシペンチレン骨格、およびオキシヘキシレン骨格からなる群から選択されるいずれか1種の骨格を有しかつ両末端にヒドロキシ基を有するホモポリマー、ii)上記群から選択される2種以上の骨格を有しかつ両末端にヒドロキシ基を有するブロックコポリマー、またはiii)上記群から選択される2種以上の骨格を有しかつ両末端にヒドロキシ基を有するランダムコポリマーを意味する。
上記オキシC2~C6アルキレン骨格は、ポリオキシC2~C6アルキレングリコールのIOBを低くする観点から、オキシプロピレン骨格、オキシブチレン骨格、オキシペンチレン骨格、又はオキシヘキシレン骨格であることが好ましく、オキシブチレン骨格、オキシペンチレン骨格、又はオキシヘキシレン骨格であることがより好ましい。
上記ポリオキシC2~C6アルキレングリコールは、次の式(23):
HO-(CmH2mO)n-H (23)
(式中、mは2~6の整数である)
により表わされうる。
HO-(CmH2mO)n-H (23)
(式中、mは2~6の整数である)
により表わされうる。
なお、本発明者が確認したところ、ポリエチレングリコール(式(23)において、m=2のホモポリマーに相当する)は、n≧45(重量平均分子量約2,000超)の場合に、約0.00~約0.60のIOBの要件を満たすものの、重量平均分子量が約4,000を超えた場合であっても、水溶解度の要件を満たさなかった。したがって、(e1)ポリオキシC2~C6アルキレングリコールには、エチレングリコールのホモポリマーは含まれないと考えられ、エチレングリコールは、他のグリコールとのブロックコポリマー又はランダムコポリマーとして、(e1)ポリオキシC2~C6アルキレングリコールに含まれるべきである。
したがって、式(23)のホモポリマーには、プロピレングリコール、ブチレングリコール、ペンチレングリコール又はヘキシレングリコールのホモポリマーが含まれうる。以上より、式(23)において、mは、約3~約6であり、そして約4~約6であることがより好ましく、そしてnは2以上である。
上記式(23)において、nの値は、ポリC2~C6アルキレングリコールが、約0.00~約0.60のIOBと、約45℃以下の融点と、25℃の水100gに対する、約0.00~約0.05gの水溶解度とを有するような値である。たとえば、式(23)がポリプロピレングリコール(m=3のホモポリマー)である場合には、n=12の場合に、IOBが0.58となる。したがって、式(23)がポリプロピレングリコール(m=3のホモポリマー)である場合には、m≧約12の場合に、上記IOBの要件を満たす。また、式(21)がポリブチレングリコール(m=4のホモポリマー)である場合には、n=7の場合に、IOBが0.57となる。したがって、式(23)がポリブチレングリコール(m=4のホモポリマー)である場合には、n≧約7の場合に、上記IOBの要件を満たす。
IOB、融点および水溶解度の観点から、ポリオキシC2~C6アルキレングリコールの重量平均分子量は、好ましくは約200~約10,000、より好ましくは約250~約8,000、そしてさらに好ましくは、約250~約5,000の範囲にある。また、IOB、融点および水溶解度の観点から、ポリC3アルキレングリコール、すなわち、ポリプロピレングリコールの重量平均分子量は、好ましくは約1,000~約10,000、より好ましくは約3,000~約8,000、そしてさらに好ましくは、約4,000~約5,000の範囲にある。上記重量平均分子量が約1,000未満では、水溶解度が要件を満たさず、そして重量平均分子量が大きいほど、特に、吸収体移行速度およびトップシートの白さが向上する傾向があるからである。
上記ポリオキシC2~C6アルキレングリコールの市販品としては、たとえば、ユニオール(商標)D-1000,D-1200,D-2000,D-3000,D-4000,PB-500,PB-700,PB-1000およびPB-2000(以上、日油株式会社製)が挙げられる。
[(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル]
上記ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステルとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールのOH末端の一方または両方が、脂肪酸によりエステル化されているもの、すなわち、モノエステルおよびジエステルが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステルとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールのOH末端の一方または両方が、脂肪酸によりエステル化されているもの、すなわち、モノエステルおよびジエステルが挙げられる。
ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステルにおいて、エステル化すべき脂肪酸としては、たとえば、「(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル」において列挙されている脂肪酸、すなわち、飽和脂肪酸または不飽和脂肪酸が挙げられ、酸化等により変性する可能性を考慮すると、飽和脂肪酸が好ましい。上記ポリオキシC2~C6アルキレングリコールと脂肪酸とのエステルの市販品としては、たとえば、ウィルブライトcp9(日油株式会社製)が挙げられる。
[(e3)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテル]
上記ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールのOH末端の一方または両方が、脂肪族1価アルコールによりエーテル化されているもの、すなわち、モノエーテルおよびジエーテルが挙げられる。ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルにおいて、エーテル化すべき脂肪族1価アルコールとしては、たとえば、「化合物(B)」の項で列挙されている脂肪族1価アルコールが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールのOH末端の一方または両方が、脂肪族1価アルコールによりエーテル化されているもの、すなわち、モノエーテルおよびジエーテルが挙げられる。ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテルにおいて、エーテル化すべき脂肪族1価アルコールとしては、たとえば、「化合物(B)」の項で列挙されている脂肪族1価アルコールが挙げられる。
[(e4)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステル]
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステルにおいて、エステル化すべきポリオキシC2~C6アルキレングリコールとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールが挙げられる。また、エステル化すべき鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、および鎖状炭化水素ジカルボン酸としては、「化合物(C)」の項で説明されるものが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステルにおいて、エステル化すべきポリオキシC2~C6アルキレングリコールとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールが挙げられる。また、エステル化すべき鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、および鎖状炭化水素ジカルボン酸としては、「化合物(C)」の項で説明されるものが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステルは、市販されているほか、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸に、C2~C6アルキレングリコールを、公知の条件で重縮合させることにより製造することができる。
[(e5)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテル]
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルにおいて、エーテル化すべきポリオキシC2~C6アルキレングリコールとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールが挙げられる。また、エーテル化すべき鎖状炭化水素テトラオール、鎖状炭化水素トリオール、および鎖状炭化水素ジオールとしては、「化合物(A)」の項で説明されるもの、たとえば、ペンタエリトリトール、グリセリン、およびグリコールが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルにおいて、エーテル化すべきポリオキシC2~C6アルキレングリコールとしては、「(e1)ポリオキシC2~C6アルキレングリコール」の項で説明したポリオキシC2~C6アルキレングリコールが挙げられる。また、エーテル化すべき鎖状炭化水素テトラオール、鎖状炭化水素トリオール、および鎖状炭化水素ジオールとしては、「化合物(A)」の項で説明されるもの、たとえば、ペンタエリトリトール、グリセリン、およびグリコールが挙げられる。
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルの市販品としては、たとえば、ユニルーブ(商標)5TP-300KB,ならびにユニオール(商標)TG-3000およびTG-4000(日油株式会社製)が挙げられる。ユニルーブ(商標)5TP-300KBは、ペンタエリトリトール1モルに、プロピレングリコール65モルと、エチレングリコール5モルとを重縮合させた化合物であり、そのIOBは0.39であり、融点は45℃未満であり、そして水溶解度は0.05g未満であった。
ユニオール(商標)TG-3000は、グリセリン1モルに、プロピレングリコール50モルを重縮合させた化合物であり、そのIOBは0.42であり、融点は45℃未満であり、水溶解度は0.05g未満であり、そして重量平均分子量は約3,000であった。ユニオール(商標)TG-4000は、グリセリン1モルに、プロピレングリコール70モルを重縮合させた化合物であり、そのIOBは0.40であり、融点は45℃未満であり、水溶解度は0.05g未満であり、そして重量平均分子量は約4,000であった。
上記ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテルはまた、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールに、C2~C6アルキレンオキシドを、公知の条件で付加させることにより製造することができる。
[(F)鎖状炭化水素]
上記鎖状炭化水素は、上記無機性値が0であることから、IOBが0.00であり、そして水溶解度がほぼ0gであるので、融点が約45℃以下のものであれば、上記血液改質剤に含まれうる。上記鎖状炭化水素としては、たとえば、(f1)鎖状アルカン、たとえば、直鎖アルカンおよび分岐鎖アルカンが挙げられ、たとえば、直鎖アルカンの場合には、融点が約45℃以下であることを考慮すると、おおむね、炭素数が22以下のものが含まれる。また、蒸気圧を考慮すると、おおむね、炭素数が13以上のものが含まれる。分岐鎖アルカンの場合には、直鎖アルカンよりも、同一炭素数において、融点が低くなる場合があるため、炭素数が22以上のものも含まれうる。上記炭化水素の市販品としては、たとえば、パールリーム6(日油株式会社)が挙げられる。
上記鎖状炭化水素は、上記無機性値が0であることから、IOBが0.00であり、そして水溶解度がほぼ0gであるので、融点が約45℃以下のものであれば、上記血液改質剤に含まれうる。上記鎖状炭化水素としては、たとえば、(f1)鎖状アルカン、たとえば、直鎖アルカンおよび分岐鎖アルカンが挙げられ、たとえば、直鎖アルカンの場合には、融点が約45℃以下であることを考慮すると、おおむね、炭素数が22以下のものが含まれる。また、蒸気圧を考慮すると、おおむね、炭素数が13以上のものが含まれる。分岐鎖アルカンの場合には、直鎖アルカンよりも、同一炭素数において、融点が低くなる場合があるため、炭素数が22以上のものも含まれうる。上記炭化水素の市販品としては、たとえば、パールリーム6(日油株式会社)が挙げられる。
上記血液改質剤は、実施例と共に詳細に考察するが、血液の粘度および表面張力を下げる作用を少なくとも有することが見いだされた。吸収性物品が吸収すべき経血は、通常の血液と比較して、子宮内膜壁等のタンパク質を含むため、それらが血球同士を繋ぐように作用して、血球が連銭した状態をとりやすい。そのため、吸収性物品が吸収すべき経血は、高粘度となりやすく、トップシートが不織布または織布である場合には、経血が繊維の間に目詰まりしやすく、着用者はベタつき感を覚えやすく、そしてトップシートの表面で経血が拡散し、漏れやすくなる。
また、IOBが約0.00~約0.60である血液改質剤は、有機性が高く、血球の間に入り込みやすいので、血球を安定化させ、血球に連銭構造を形成しにくくすることができると考えられる。上記改質剤が、血球を安定化させ、血球に連銭構造を形成しにくくすることにより、吸収体が経血を吸収しやすくなると考えられる。たとえば、アクリル系高吸収ポリマー、いわゆる、SAPを含む吸収性物品では、経血を吸収すると、連銭した血球がSAP表面を覆い、SAPが吸収性能を発揮しにくくなることが知られているが、血球を安定化することにより、SAPが吸収性能を発揮しやすくなると考えられる。また、赤血球と親和性の高い血液改質剤が、赤血球膜を保護するため、赤血球が破壊されにくくなると考えられる。
次に、図7を参照して、本発明の一実施形態における吸収性物品1の製造方法を説明する。図7は、本発明の一実施形態における吸収性物品1の製造方法に使用する吸収性物品製造装置100を説明するための図である。吸収性物品1の製造方法は、吸収体を形成する工程、トップシート用シートを用意する工程、積層体に圧搾溝を形成する工程、バックシート用シートを用意する工程、吸収性物品の連続体を切断する工程および吸収性物品に血液改質剤を塗布する工程を含む。また、トップシート用シートを用意する工程で使用されるトップシート用シートは、樹脂フィルムシートを用意する工程、樹脂フィルムシートに凹部を形成する工程および樹脂フィルムシートにギア延伸する工程を含むトップシート用シートの製造方法によって製造される。
吸収体を形成する工程では、吸収体128をベルト110上に形成する。不図示の粉砕パルプ供給装置から粉砕パルプ122をパターンドラム120に供給する。パターンドラム120の外周部には粉砕パルプを詰める型として凹部124が形成されている。パターンドラム120の内部は吸引126されており、パターンドラム120に供給された粉砕パルプ122は、凹部124の中に吸い込まれ、圧縮される。そして、凹部124の中で圧縮されたパルプ122は吸収体128に成形される。吸収体128はベルト上に載置される。
トップシート用シートを用意する工程では、後述するトップシート用シートの製造方法によって製造したトップシート用シート216を吸収体128の上に配置して、トップシート用シート216を吸収体128に接着する。
積層体に圧搾溝を形成する工程では、エンボス加工装置130を使用して、トップシート用シート216および吸収体128の積層体262に圧搾溝を形成する。積層体262は、エンボス加工装置130の上段ロール131と下段ロール132との間を通過する。上段ロール131の外周の表面には、図1に示す吸収性物品1の圧搾溝7に対応する形状の凸部(不図示)が設けられている。下段ロール132は、外周の表面が平滑であるプレーンロールである。エンボス加工装置130の上段ロール131と下段ロール132との間に積層体262を通過させることによって、積層体262における、図1に示す吸収性物品1の圧搾溝7に対応する部分が厚さ方向に圧縮され、圧搾溝が積層体262に形成される。
バックシート用シートを用意する工程では、バックシート用シートロール140から供給されたバックシート用シート142を、不図示の塗布装置を使用して接着剤を塗布した後、圧搾溝が形成された積層体134のトップシート用シート側とは反対側の面に重ねて接着し、吸収性物品の連続体144を形成する。
吸収性物品の連続体を切断する工程では、カッタ150を使用して吸収性物品の連続体144を吸収性物品の形状となるように切断して吸収性物品を作製する。
吸収性物品に血液改質剤を塗布する工程では、改質剤塗布スプレー160を使用して吸収性物品の中央の領域に上述の血液改質剤161を塗布して、トップシートの表面に血液改質剤層を形成する。
吸収性物品の中央の領域に塗布される血液改質剤161は、少なくとも着用者の体液の排出口に対向する部分に塗布されていればよい。たとえば、吸収性物品の中心を中心として、長さ方向の長さが、好ましくは50mm以上、より好ましくは10mm以上であり、幅方向の長さが、好ましくは10mm以上、より好ましくは30mm以上である領域に血液改質剤が塗布されてもよい。
吸収性物品の連続体を切断する工程の後で、血液改質剤を塗布したが、後述のトップシート用シートの製造工程で血液改質剤を塗布してもよい。吸収性物品を製造する途中に、塗布した血液改質剤が吸収性物品から落ちることを抑制するために、吸収性物品の製造工程の川下の段階、たとえば、吸収性物品を包装する直前に血液改質剤を吸収性物品に塗布することが好ましい。
吸収性物品1の製造方法には、他に、吸収性物品の連続体144に粘着部を形成する工程および吸収性物品の連続体144にシール部を形成する工程などを含む。
次に、トップシート用シートの製造方法を説明する。
樹脂フィルムシートを用意する工程では、図7に示すように、樹脂フィルムシートのロール210から供給された樹脂フィルムシート212を凹部形成ロール220に供給する。
樹脂フィルムシートに凹部を形成する工程では、樹脂フィルムシート212を凹部形成ロール220に通過させて、凹部2141が形成された樹脂フィルムシート214(図9参照)を作製する。凹部形成ロール220は、ローレットロール221と平滑な表面を有する予熱ロール222とからなる。
図8(a)および(b)は、ローレットロール221の一例を示す図である。図8(a)は、ローレットロール221の全体を示す図であり、図8(b)は、ローレットロール221の外周表面の凹凸を有する部分223を拡大した図である。図8(c)は、平滑な表面を有する予熱ロール222の一例を示す図である。ローレットロール221の表面223には、格子状の凸部224が設けられている。これにより、ローレットロール221の表面に菱形の凹部225が形成される。なお、ローレットロール221の凹部225の形状は菱形に限定されず、正方形、長方形、平行四辺形、台形、三角形、六角形などの形状であってもよい。
格子状の凸部224において平行に並ぶ凸部224の中心線間隔、すなわち格子状の凸部224のピッチは、好ましくは0.2mm以上、10mm以下であり、より好ましくは0.4mm以上、2mm以下である。格子状の凸部224のピッチが0.2mm未満、または10mmより大きい場合、樹脂フィルムに凹部が形成されない場合がある。また、格子状の凸部224の幅は、好ましくは0.01mm以上、1mm以下であり、より好ましくは0.03mm以上、0.1以下である。また、菱形の凹部225の一辺の長さは、好ましくは0.1mm以上、5mm以下であり、より好ましくは0.2mm以上、1mm以下である。格子状の凸部224の幅が0.01mm未満もしくは1mmより大きい場合、または菱形の凹部225の一辺の長さが0.1mm未満もしくは5mmより大きい場合、樹脂フィルムに凹部が形成されない場合がある。
平滑な表面を有する予熱ロール222は、70℃以上、100℃以下の温度に保持されており、供給された樹脂フィルムシート212を加熱する。これにより、樹脂フィルムシート212は柔らかくなり、成形しやすくなる。
樹脂フィルムシート212が、ローレットロール221と平滑な表面を有するロール222との間を通過するとき、格子状の凸部224と接する部分では、樹脂フィルムシート212は厚さ方向に強い圧力を受ける。これにより、図9に示すように、樹脂フィルムシート214に細かい凹部2141が形成される。なお、実際に、樹脂フィルムシート212に形成される凹部2141は、図9に示されているよりも小さく、単位面積当たりの凹部2141の数も図9に示されているよりもずっと多い。凹部2141は、樹脂フィルムシート214における、吸収性物品1の吸収体4が設けられている領域12(図1参照)に対応する範囲2143のみに形成される。ここで、樹脂フィルムシート214における、吸収性物品1に対応する範囲は、符号2142の点線で示される範囲である。
樹脂フィルムシートにギア延伸する工程では、図7に示す延伸ギアロール230に凹部を形成した樹脂フィルムシート214を通過させることによって、トップシート2の第1の突条部、第2の突条部および底部を樹脂フィルムシート214に形成する。符号216は、第1の突条部、第2の突条部および底部を形成した樹脂フィルムシートである。
延伸ギアロール230は、上段ロール231と下段ロール232とを含む。図10(a)は、延伸ギアロール230の上段ロール231を説明するための図であり、図10(b)は、上段ロール231の外周面上に配置されたギア歯233を説明するための図であり、図10(c)は、図10(b)のB-B線断面図である。ギア歯233は、上段ロール231の円周方向に非連続的に延びている。すなわち、上段ロール231の円周方向に延びているギア歯233は、途中で複数箇所途切れている。このギア歯233が途切れている箇所234により、樹脂フィルムシート214に第2の突条部が形成される。
ギア歯233の幅は、たとえば0.3mm以上、0.5mm以下であり、隣接するギア歯233の中心間の距離は、たとえば1.0mm以上、1.2mm以下である。
図11(a)は、延伸ギアロール230の下段ロール232を説明するための図であり、図11(b)は、下段ロール232の外周面上に配置されたギア歯235を説明するための図であり、図11(c)は、図11(b)のC-C線断面図である。ギア歯235は、下段ロール232の円周方向に延びている。下段ロール232は、上段ロール231のように途中で複数箇所途切れていない。ギア歯235の幅は、たとえば上段ロール231のギア歯233の幅と等しく、隣接するギア歯235の中心間の距離は、たとえば上段ロール231のギア歯233の中心間の距離と等しい。
上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っている部分における上段ロール231の径方向の長さ、すなわち噛み込み深さは、たとえば1.25mmである。上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っているときの上段ロール231のギア歯233と下段ロール232のギア歯235との間の隙間は、たとえば、0.25mm以上、0.45mm以下である。
図7に示すように樹脂フィルムシート214が延伸ギアロール230を通過するとき、樹脂フィルム214は略波状に折り曲げられ、樹脂フィルム214にトップシート2の第1の突条部21および第2の突条部22が形成される。また、樹脂フィルムシート214の凹部2141が形成された領域2143(図9参照)には、トップシート2の開口部25(図4参照)がさらに形成される。
次に、図12を参照して、延伸ギアロール230に樹脂フィルムシート214を通過させたとき、樹脂フィルムシート214に開口部が形成される原理を説明する。なお、この原理は、本発明を限定するものではない。
樹脂フィルムシート214は、上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っている部分236で大きく延伸される。上述の凹部形成工程で凹部2141(図9参照)が形成された部分は、樹脂フィルムシート214が薄くなっており、さらにローレットロール221の格子状の凸部224により傷が付与されている部分であるので、強度が弱く、樹脂フィルムシート214の凹部2141は、延伸を受けると破れる。このため、樹脂フィルムシート214の延伸を受けた部分236では、樹脂フィルムシート214の凹部2141が破れて、樹脂フィルムシート214の破れた部分が広がり、樹脂フィルムシート214の破れた部分に開口部が形成される。
樹脂フィルムシート214は、上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っていない部分237,238ではあまり延伸されない。このため、樹脂フィルムシート241における上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っていない部分237,238では、樹脂フィルムシート214が延伸ギアロール230を通過しても、上述の凹部形成工程で形成された凹部2141は、破れず開口部にならない。
樹脂フィルムシート214の凹部2141が形成されていない領域では、上段ロール231のギア歯233と下段ロール232のギア歯235とが噛み合っている部分236で樹脂フィルムシート214が大きく延伸されても樹脂フィルムシート214は破れない。このため、樹脂フィルムシート214における、本体部10の吸収体4の幅方向の両縁41の外側の領域14およびウイング部5にそれぞれ対応する領域には開口部は形成されない。
以上の本発明の一実施形態の吸収性物品1を次のように変形することができる。
(1)吸収性物品は、ウイング部を有さなくてもよい。すなわち、吸収性物品は、本体部のみであってもよい。この場合、本体部の着衣側の面に粘着部を設け、ウイング部がなくても吸収性物品を下着に固定できるようにする。
(1)吸収性物品は、ウイング部を有さなくてもよい。すなわち、吸収性物品は、本体部のみであってもよい。この場合、本体部の着衣側の面に粘着部を設け、ウイング部がなくても吸収性物品を下着に固定できるようにする。
(2)少なくとも吸収体の幅方向の両縁の外側において、吸収体からしみ出た体液を流し込むための、長手方向に延在し、幅方向に並ぶ複数の第1の流路、および隣接する第1の流路を連結する複数の第2の流路を吸収性物品に形成することができれば、第1の流路および第2の流路は、トップシートの第1の突条部とバックシートとから構成される流路およびトップシートの第2の突条部とバックシートとから構成される流路に限定されない。たとえば、トップシートとバックシートとの間における本体部の吸収体の幅方向の両縁の外側の領域に、印刷法などの方法によって、流路に対応する部分を除いた樹脂層を形成してもよい。この場合、トップシートとバックシートとの間で樹脂層が形成されていない部分は中空になるので、吸収体からしみ出た体液を流し込むための流路としてその部分を用いることができる。
(3)吸収体4の幅方向の縁41の外側にあり、本体部10およびウイング部5の境界であるウイング部の付け根51と、吸収体4の幅方向の両縁41との間に、第1の流路21および第2の流路22をトップシート2に形成し、ウイング部5のトップシート2には第1の流路および第2の流路を形成しないようにしてもよい。この場合も、吸収性物品1に圧力がかかることにより吸収体4からしみ出た体液が吸収性物品1の幅方向から漏れることを抑制できる。
(4)図13に示す吸収性物品1Aのように、トップシート2の幅方向両側にサイドシート18Aが設けられている場合、少なくとも吸収体の幅方向の両縁の外側において、第1の突条部21、第2の突条部22および底部23をサイドシート18Aに形成し、サイドシート18Aの底部23をバックシートと接合してもよい。この場合、吸収体4Aからしみ出た体液を流し込むための、長手方向に延在し、幅方向に並ぶ複数の第1の流路を、サイドシート18Aの第1の突条部21とバックシートとで構成し、隣接する第1の流路を連結する複数の第2の流路をサイドシート18Aの第2の突条部22とバックシートとで構成することになる。この場合も、吸収性物品1に圧力がかかることにより吸収体4からしみ出た体液が吸収性物品1の幅方向から漏れることを抑制できる。
また、この場合、トップシート2Aは不織布であってもよい。トップシート2Aが不織布である場合も、下着の脚開口部の縁の形状に合わせて吸収性物品のウイング部を折り畳むことが容易にできる。
トップシート2Aに用いる不織布は、天然繊維でも化学繊維でもよい。トップシート2Aに用いる天然繊維には、粉砕パルプ、コットンなどのセルロースが挙げられる。トップシート2Aに用いる化学繊維には、レーヨン、フィブリルレーヨンなどの再生セルロース、アセテート、トリアセテートなどの半合成セルロース、熱可塑性疎水性化学繊維、および親水化処理を施した熱可塑性疎水性化学繊維などが挙げられる。トップシート2Aに用いる熱可塑性疎水性化学繊維には、ポリエチレン(PE)、ポリプロピレン(PP)、ポリエチレンテレフタレート(PET)などの単繊維、ポリエチレンとポリプロピレンをグラフト重合してなる繊維および芯鞘構造などの複合繊維が挙げられる。
なお、トップシート2の幅方向両側にサイドシート18Aが設けられている場合も、トップシート2Aに第1の突条部、第2の突条部および底部を設けてもよい。
すなわち、少なくとも吸収体の幅方向の両縁の外側において、第1の突条部、第2の突条部および底部をトップシートまたはサイドシートに形成することができれば、トップシートにおける吸収体が設けられている領域に、第1の突条部、第2の突条部および底部を形成してもよいし、形成しなくてもよい。
(5)図14に示すように、少なくとも吸収体4Bの幅方向の両縁41Bの外側において、トップシート2Bの第1の突条部21Bが、幅方向外側へ突出するように湾曲していてもよい。これにより第1の突条部21Bとバックシートとから構成される流路の中を長手方向(Y方向)に流れる、吸収体4Bからしみ出た体液31Bは、再び吸収体4Bに吸収される。そして、吸収性物品に圧力がかかることにより吸収体4Bからしみ出た体液31Bが吸収性物品の幅方向から漏れることを、さらに抑制できる。また、吸収体4Bの幅方向の縁41Bが、幅方向(X方向)内側へ突出するように湾曲していなくても、第1の突条部21Bとバックシートとから構成される流路の中を長手方向(Y方向)に流れる、吸収体4Bからしみ出た体液31Bは、再び吸収体4Bに吸収される。
本発明では、血液改質剤が、血液の粘度および表面張力を下げるメカニズムを有するために、体液が、血液改質剤層24によってトップシート2に残存せずに吸収体4へ移動し吸収体4に吸収されることができる。以下の実施例によって、血液改質剤が、血液の粘度および表面張力を下げるメカニズムを有することを確認した。この確認は、樹脂フィルムに比べて体液が残存しやすい不織布を用いて行った。
[例1]
[リウェット率および吸収体移行速度の評価]
[血液改質剤のデータ]
市販の生理用ナプキンを準備した。当該生理用ナプキンは、親水剤で処理されたエアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシートと、エアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:30g/m2)から形成されたセカンドシートと、パルプ(坪量:150~450g/m2、中央部ほど多い)、アクリル系高吸収ポリマー(坪量:15g/m2)およびコアラップとしてのティッシュを含む吸収体と、撥水剤処理されたサイドシートと、ポリエチレンフィルムから成るバックシートとから形成されていた。
[リウェット率および吸収体移行速度の評価]
[血液改質剤のデータ]
市販の生理用ナプキンを準備した。当該生理用ナプキンは、親水剤で処理されたエアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシートと、エアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:30g/m2)から形成されたセカンドシートと、パルプ(坪量:150~450g/m2、中央部ほど多い)、アクリル系高吸収ポリマー(坪量:15g/m2)およびコアラップとしてのティッシュを含む吸収体と、撥水剤処理されたサイドシートと、ポリエチレンフィルムから成るバックシートとから形成されていた。
以下に、実験に用いられた血液改質剤を列挙する。
[(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル]
・ユニスター H-408BRS,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトール,重量平均分子量:約640
・ユニスター H-2408BRS-22,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトールと、ジ2-エチルヘキサン酸ネオペンチルグリコールとの混合物(58:42,重量比),重量平均分子量:約520
[(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル]
・ユニスター H-408BRS,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトール,重量平均分子量:約640
・ユニスター H-2408BRS-22,日油株式会社製
テトラ2-エチルヘキサン酸ペンタエリトリトールと、ジ2-エチルヘキサン酸ネオペンチルグリコールとの混合物(58:42,重量比),重量平均分子量:約520
[(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル]
・Cetiol SB45DEO,コグニスジャパン株式会社製
脂肪酸が、オレイン酸またはステアリル酸である、グリセリンと脂肪酸とのトリエステル
・SOY42,日油株式会社製
C14の脂肪酸:C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ0.2:11:88:0.8の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:880
・Cetiol SB45DEO,コグニスジャパン株式会社製
脂肪酸が、オレイン酸またはステアリル酸である、グリセリンと脂肪酸とのトリエステル
・SOY42,日油株式会社製
C14の脂肪酸:C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ0.2:11:88:0.8の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:880
・トリC2L油脂肪酸グリセリド,日油株式会社製
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸がおおよそ37:7:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
・トリCL油脂肪酸グリセリド,日油株式会社製
C8の脂肪酸:C12の脂肪酸がおおよそ44:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸がおおよそ37:7:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
・トリCL油脂肪酸グリセリド,日油株式会社製
C8の脂肪酸:C12の脂肪酸がおおよそ44:56の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約570
・パナセート810s,日油株式会社製
C8の脂肪酸:C10の脂肪酸がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約480
・パナセート800,日油株式会社製
脂肪酸が全てオクタン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
C8の脂肪酸:C10の脂肪酸がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約480
・パナセート800,日油株式会社製
脂肪酸が全てオクタン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
・パナセート800B,日油株式会社製
脂肪酸が全て2-エチルヘキサン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
・NA36,日油株式会社製
C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ5:92:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
脂肪酸が全て2-エチルヘキサン酸(C8)である、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約470
・NA36,日油株式会社製
C16の脂肪酸:C18の脂肪酸:C20の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ5:92:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
・トリヤシ油脂肪酸グリセリド,日油株式会社製
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸:C14の脂肪酸:C16の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ4:8:60:25:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:670
・カプリル酸ジグリセリド,日油株式会社製
脂肪酸がオクタン酸である、グリセリンと脂肪酸とのジエステル,重量平均分子量:340
C8の脂肪酸:C10の脂肪酸:C12の脂肪酸:C14の脂肪酸:C16の脂肪酸(飽和脂肪酸および不飽和脂肪酸の両方を含む)がおおよそ4:8:60:25:3の重量比で含まれている、グリセリンと脂肪酸とのトリエステル,重量平均分子量:670
・カプリル酸ジグリセリド,日油株式会社製
脂肪酸がオクタン酸である、グリセリンと脂肪酸とのジエステル,重量平均分子量:340
[(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステル]
・コムポールBL,日油株式会社製
ブチレングリコールのドデカン酸(C12)モノエステル,重量平均分子量:約270
・コムポールBS,日油株式会社製
ブチレングリコールのオクタデカン酸(C18)モノエステル,重量平均分子量:約350
・ユニスター H-208BRS,日油株式会社製
ジ2-エチルヘキサン酸ネオペンチルグリコール,重量平均分子量:約360
・コムポールBL,日油株式会社製
ブチレングリコールのドデカン酸(C12)モノエステル,重量平均分子量:約270
・コムポールBS,日油株式会社製
ブチレングリコールのオクタデカン酸(C18)モノエステル,重量平均分子量:約350
・ユニスター H-208BRS,日油株式会社製
ジ2-エチルヘキサン酸ネオペンチルグリコール,重量平均分子量:約360
[(c2)3個のカルボキシル基を有する鎖状炭化水素トリカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル]
・O-アセチルクエン酸トリブチル,東京化成工業株式会社製
重量平均分子量:約400
・O-アセチルクエン酸トリブチル,東京化成工業株式会社製
重量平均分子量:約400
[(c3)2個のカルボキシル基を有する鎖状炭化水素ジカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル]
・アジピン酸ジオクチル,和光純薬工業製
重量平均分子量:約380
・アジピン酸ジオクチル,和光純薬工業製
重量平均分子量:約380
[(d3)脂肪酸と脂肪族1価アルコールとのエステル]
・エレクトールWE20,日油株式会社製
ドデカン酸(C12)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約360
・エレクトールWE40,日油株式会社製
テトラデカン酸(C14)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約390
・エレクトールWE20,日油株式会社製
ドデカン酸(C12)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約360
・エレクトールWE40,日油株式会社製
テトラデカン酸(C14)と、ドデシルアルコール(C12)とのエステル,重量平均分子量:約390
[(e1)ポリオキシC2~C6アルキレングリコール]
・ユニオールD-1000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,000
・ユニオールD-1200,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,200
・ユニオールD-3000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約3,000
・ユニオールD-1000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,000
・ユニオールD-1200,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約1,200
・ユニオールD-3000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約3,000
・ユニオールD-4000,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約4,000
・ユニオールPB500,日油株式会社製
ポリブチレングリコール,重量平均分子量:約500
・ユニオールPB700,日油株式会社製
ポリオキシブチレンポリオキシプロピレングリコール,重量平均分子量:約700
ポリプロピレングリコール,重量平均分子量:約4,000
・ユニオールPB500,日油株式会社製
ポリブチレングリコール,重量平均分子量:約500
・ユニオールPB700,日油株式会社製
ポリオキシブチレンポリオキシプロピレングリコール,重量平均分子量:約700
・ユニオールPB1000R,日油株式会社製
ポリブチレングリコール,重量平均分子量:約1000
[(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル]
・ウィルブライトcp9,日油株式会社製
ポリブチレングリコールの両末端のOH基が、ヘキサデカン酸(C16)によりエステル化された化合物,重量平均分子量:約1,150
ポリブチレングリコール,重量平均分子量:約1000
[(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル]
・ウィルブライトcp9,日油株式会社製
ポリブチレングリコールの両末端のOH基が、ヘキサデカン酸(C16)によりエステル化された化合物,重量平均分子量:約1,150
[(e3)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエーテル]
・ユニルーブMS-70K,日油株式会社製
ポリプロピレングリコールのステアリルエーテル,約15の繰返し単位,重量平均分子量:約1,140
・ユニルーブMS-70K,日油株式会社製
ポリプロピレングリコールのステアリルエーテル,約15の繰返し単位,重量平均分子量:約1,140
[(e5)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテル]
・ユニルーブ5TP-300KB
ペンタエリトリトール1モルに、エチレンオキシド5モルと、プロピレンオキシド65モルとを付加させることにより生成した、ポリオキシエチレンポリオキシプロピレンペンタエリスリトールエーテル,重量平均分子量:4,130
・ユニルーブ5TP-300KB
ペンタエリトリトール1モルに、エチレンオキシド5モルと、プロピレンオキシド65モルとを付加させることにより生成した、ポリオキシエチレンポリオキシプロピレンペンタエリスリトールエーテル,重量平均分子量:4,130
・ユニオール TG-3000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約3,000
・ユニオール TG-4000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約4,000
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約3,000
・ユニオール TG-4000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約4,000
[(f1)鎖状アルカン]
・パールリーム6,日油株式会社製
流動イソパラフィン、イソブテンおよびn-ブテンを共重合し、次いで水素を付加することにより生成された分岐鎖炭化水素、重合度:約5~約10,重量平均分子量:約330
・パールリーム6,日油株式会社製
流動イソパラフィン、イソブテンおよびn-ブテンを共重合し、次いで水素を付加することにより生成された分岐鎖炭化水素、重合度:約5~約10,重量平均分子量:約330
[その他の材料]
・NA50,日油株式会社製
NA36に水素を付加し、原料である不飽和脂肪酸に由来する二重結合の比率を下げたグリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
・(カプリル酸/カプリン酸)モノグリセリド,日油株式会社製
オクタン酸(C8)およびデカン酸(C10)がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのモノエステル,重量平均分子量:約220
・Monomuls 90-L2ラウリン酸モノグリセリド,コグニスジャパン株式会社製
・NA50,日油株式会社製
NA36に水素を付加し、原料である不飽和脂肪酸に由来する二重結合の比率を下げたグリセリンと脂肪酸とのトリエステル,重量平均分子量:約880
・(カプリル酸/カプリン酸)モノグリセリド,日油株式会社製
オクタン酸(C8)およびデカン酸(C10)がおおよそ85:15の重量比で含まれている、グリセリンと脂肪酸とのモノエステル,重量平均分子量:約220
・Monomuls 90-L2ラウリン酸モノグリセリド,コグニスジャパン株式会社製
・クエン酸イソプロピル,東京化成工業株式会社製
重量平均分子量:約230
・リンゴ酸ジイソステアリル
重量平均分子量:約640
・ユニオールD-400,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約400
重量平均分子量:約230
・リンゴ酸ジイソステアリル
重量平均分子量:約640
・ユニオールD-400,日油株式会社製
ポリプロピレングリコール,重量平均分子量:約400
・PEG1500,日油株式会社製
ポリエチレングリコール,重量平均分子量:約1,500~約1,600
・ノニオンS-6,日油株式会社製
ポリオキシエチレンモノステアレート、約7の繰返し単位、重量平均分子量:約880
・ウィルブライトs753,日油株式会社製
ポリオキシエチレンポリオキシプロピレンポリオキシブチレングリセリン,重量平均分子量:約960
ポリエチレングリコール,重量平均分子量:約1,500~約1,600
・ノニオンS-6,日油株式会社製
ポリオキシエチレンモノステアレート、約7の繰返し単位、重量平均分子量:約880
・ウィルブライトs753,日油株式会社製
ポリオキシエチレンポリオキシプロピレンポリオキシブチレングリセリン,重量平均分子量:約960
・ユニオール TG-330,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約6の繰返し単位,重量平均分子量:約330
・ユニオール TG-1000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約1,000
ポリプロピレングリコールのグリセリルエーテル,約6の繰返し単位,重量平均分子量:約330
・ユニオール TG-1000,日油株式会社製
ポリプロピレングリコールのグリセリルエーテル,約16の繰返し単位,重量平均分子量:約1,000
・ユニルーブ DGP-700,日油株式会社製
ポリプロピレングリコールのジグリセリルエーテル,約9の繰返し単位,重量平均分子量:約700
・ユニオックスHC60,日油株式会社製
ポリオキシエチレン硬化ヒマシ油,重量平均分子量:約3,570
・ワセリン,コグニスジャパン株式会社製
石油に由来する炭化水素、半固形
ポリプロピレングリコールのジグリセリルエーテル,約9の繰返し単位,重量平均分子量:約700
・ユニオックスHC60,日油株式会社製
ポリオキシエチレン硬化ヒマシ油,重量平均分子量:約3,570
・ワセリン,コグニスジャパン株式会社製
石油に由来する炭化水素、半固形
上記試料の、IOB,融点および水溶解度を、下記表2に示す。なお、水溶解度は、上述の方法にしたがって測定したが、100gの脱塩水に、20.0gを添加し、24時間後に溶解した試料は、「20g<」と評価し、そして100gの脱塩水に、0.05gは溶解したが、1.00gは溶解しなかった試料は、0.05~1.00gと評価した。また、融点に関し、「<45」は、融点が45℃未満であることを意味する。
上記生理用ナプキンのトップシートの肌当接面を、上述の血液改質剤で塗工した。各血液改質剤を、血液改質剤が室温で液体である場合にはそのまま、そして血液改質剤が室温で固体である場合には、融点+20℃まで加熱し、次いで、コントロールシームHMAガンを用いて、各血液改質剤を微粒化し、トップシートの肌当接面の全体に、坪量がおおよそ5g/m2となるように塗布した。
図15は、トップシートがトリC2L油脂肪酸グリセリドを含む生理用ナプキン(No.2-5)における、トップシートの肌当接面の電子顕微鏡写真である。図15から明らかなように、トリC2L油脂肪酸グリセリドは、微粒子状で、繊維の表面に付着している。
以下の手順にしたがって、リウェット率と、吸収体移行速度とを測定した。
以下の手順にしたがって、リウェット率と、吸収体移行速度とを測定した。
[試験方法]
各血液改質剤を含むトップシートの上に、穴の開いたアクリル板(200mm×100mm,125g,中央に、40mm×10mmの穴が開いている)を置き、上記穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(以下、「EDTA」と称する)が添加されたもの)3gを、ピペットを用いて滴下(1回目)し、1分後、37±1℃のウマEDTA血3gを、アクリル板の穴から、ピペットで再度滴下した(2回目)。
各血液改質剤を含むトップシートの上に、穴の開いたアクリル板(200mm×100mm,125g,中央に、40mm×10mmの穴が開いている)を置き、上記穴から、37±1℃のウマEDTA血(ウマの血液に、凝結防止のため、エチレンジアミン四酢酸(以下、「EDTA」と称する)が添加されたもの)3gを、ピペットを用いて滴下(1回目)し、1分後、37±1℃のウマEDTA血3gを、アクリル板の穴から、ピペットで再度滴下した(2回目)。
2回目の血液の滴下後、直ちに上記アクリル板を外し、血液を滴下した場所に、ろ紙(アドバンテック東洋株式会社 定性濾紙 No.2,50mm×35mm)10枚を置き、その上から、圧力が30g/cm2となるようにおもりを置いた。1分後、上記ろ紙を取出し、以下の式に従って、「リウェット率」を算出した。
リウェット率(%)=100×(試験後のろ紙質量-当初のろ紙質量)/6
リウェット率(%)=100×(試験後のろ紙質量-当初のろ紙質量)/6
また、リウェット率の評価とは別に、2回目の血液の滴下後、血液がトップシートから吸収体に移行する時間である「吸収体移行速度」を測定した。上記吸収体移行速度は、トップシートに血液を投入してから、トップシートの表面及び内部に、血液の赤さが見られなくなるまでの時間を意味する。
リウェット率と、吸収体移行速度の結果を、以下の表2に示す。
リウェット率と、吸収体移行速度の結果を、以下の表2に示す。
次いで、吸収体移行速度の試験後のトップシートの肌当接面の白さを、以下の基準にしたがって、目視で評価した。
◎:血液の赤さがほとんど残っておらず、血液が存在した場所と、存在していない場所の区別がつかない
○:血液の赤さが若干残っているが、血液の存在した場所と、存在していない場所の区別がつきいにくい
△:血液の赤さが若干残っており、血液が存在した場所が分かる
×:血液の赤さがそのまま残っている
結果を、併せて下記表2に示す。
◎:血液の赤さがほとんど残っておらず、血液が存在した場所と、存在していない場所の区別がつかない
○:血液の赤さが若干残っているが、血液の存在した場所と、存在していない場所の区別がつきいにくい
△:血液の赤さが若干残っており、血液が存在した場所が分かる
×:血液の赤さがそのまま残っている
結果を、併せて下記表2に示す。
血液改質剤を有しない場合には、リウェット率は22.7%であり、そして吸収体移行速度は60秒超であったが、グリセリンと脂肪酸とのトリエステルは、いずれも、リウェット率が7.0%以下であり、そして吸収体移行速度が8秒以下であることから、吸収性能が大幅に改善されていることが分かる。しかし、グリセリンと脂肪酸とのトリエステルのうち、融点が45℃を超えるNA50では、吸収性能に大きな改善はみられなかった。
同様に、約0.00~約0.60のIOBと、約45℃以下の融点と、25℃の水100gに対する、約0.00~約0.05gの水溶解度を有する血液改質剤では、吸収性能が大きく改善されることが分かった。
次に、No.2-1~2-47の生理用ナプキンを、複数のボランティアの被験者に着用してもらったところ、No.2-1~2-32の血液改質剤を含む生理用ナプキンでは、経血を吸収した後であってもトップシートにべたつき感がなく、トップシートがサラサラしているとの回答を得た。
また、No.2-1~No.2-32の生理用ナプキンでは、そして特に、No.2-1~11,15~19および32の血液改質剤を含む生理用ナプキンでは、経血を吸収後のトップシートの肌当接面が、血液で赤く染まっておらず、不快感が少ないとの回答を得た。
[例2]
動物の各種血液に関して、上述の手順にしたがって、リウェット率を評価した。実験に用いられた血液は、以下の通りである。
[動物種]
(1)ヒト
(2)ウマ
(3)ヒツジ
動物の各種血液に関して、上述の手順にしたがって、リウェット率を評価した。実験に用いられた血液は、以下の通りである。
[動物種]
(1)ヒト
(2)ウマ
(3)ヒツジ
[血液種]
・脱繊維血:血液を採取後、ガラスビーズと共に、三角フラスコ内で約5分間撹拌したもの
・EDTA血:静脈血65mLに、12%EDTA・2K生理食塩液0.5mLを添加したもの
・脱繊維血:血液を採取後、ガラスビーズと共に、三角フラスコ内で約5分間撹拌したもの
・EDTA血:静脈血65mLに、12%EDTA・2K生理食塩液0.5mLを添加したもの
[分画]
血清または血漿:それぞれ、脱繊維血またはEDTA血を、室温下で、約1900Gで10分間遠心分離した後の上清
血球:血液から血清を除去し、残差をリン酸緩衝生理食塩液(PBS)で2回洗浄し、次いで除去した血清分のリン酸緩衝生理食塩液を加えたもの
血清または血漿:それぞれ、脱繊維血またはEDTA血を、室温下で、約1900Gで10分間遠心分離した後の上清
血球:血液から血清を除去し、残差をリン酸緩衝生理食塩液(PBS)で2回洗浄し、次いで除去した血清分のリン酸緩衝生理食塩液を加えたもの
トリC2L油脂肪酸グリセリドが、坪量がおおよそ5g/m2となるように塗布されている以外は、例2と同様にして吸収性物品を製造し、上述の各種血液に関して、リウェット率を評価した。各血液に関して測定を3回行い、その平均値を採用した。
結果を、下記表3に示す。
結果を、下記表3に示す。
例2で得られた、ウマEDTA血と同様の傾向が、ヒトおよびヒツジの血液でも得られた。また、脱繊維血およびEDTA血においても、同様の傾向が観察された。
[例3]
[血液保持性の評価]
血液改質剤を含むトップシートと、血液改質剤を含まないトップシートとにおける血液保持性を評価した。
[血液保持性の評価]
血液改質剤を含むトップシートと、血液改質剤を含まないトップシートとにおける血液保持性を評価した。
[試験方法]
(1)エアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシートの肌当接面に、トリC2L油脂肪酸グリセリドを、コントロールシームHMAガンを用いて微粒化し、坪量がおおよそ5g/m2となるように塗布する。また、比較のため、トリC2L油脂肪酸グリセリドを塗布していないものも準備する。次いで、トリC2L油脂肪酸グリセリドが塗布されているトップシートと、塗布されていないトップシートとの両方を、0.2gの大きさにカットし、セルストレイナー+トップシートの質量(a)を正確に測定する。
(1)エアスルー不織布(ポリエステルおよびポリエチレンテレフタレートから成る複合繊維、坪量:35g/m2)から形成されたトップシートの肌当接面に、トリC2L油脂肪酸グリセリドを、コントロールシームHMAガンを用いて微粒化し、坪量がおおよそ5g/m2となるように塗布する。また、比較のため、トリC2L油脂肪酸グリセリドを塗布していないものも準備する。次いで、トリC2L油脂肪酸グリセリドが塗布されているトップシートと、塗布されていないトップシートとの両方を、0.2gの大きさにカットし、セルストレイナー+トップシートの質量(a)を正確に測定する。
(2)ウマEDTA血約2mLを、肌当接面側から添加し、1分間静置する。
(3)セルストレイナーを、遠心管にセットし、スピンダウンして、余剰のウマEDTA血を取り除く。
(4)セルストレイナー+ウマEDTA血を含むトップシートの重量(b)を測定する。
(5)下式にしたがって、トップシート1g当たりの当初吸収量(g)を算出する。
当初吸収量=[重量(b)-重量(a)]/0.2
(6)セルストレイナーを、遠心管に再セットし、室温下、約1200Gで1分間遠心分離する。
(3)セルストレイナーを、遠心管にセットし、スピンダウンして、余剰のウマEDTA血を取り除く。
(4)セルストレイナー+ウマEDTA血を含むトップシートの重量(b)を測定する。
(5)下式にしたがって、トップシート1g当たりの当初吸収量(g)を算出する。
当初吸収量=[重量(b)-重量(a)]/0.2
(6)セルストレイナーを、遠心管に再セットし、室温下、約1200Gで1分間遠心分離する。
(7)セルストレイナー+ウマEDTA血を含むトップシートの重量(c)を測定する。
(8)下式にしたがって、トップシート1g当たりの試験後吸収量(g)を算出する。
試験後吸収量=[重量(c)-重量(a)]/0.2
(9)下式にしたがって血液保持率(%)を算出した。
血液保持率(%)=100×試験後吸収量/当初吸収量
なお、測定は3回行い、その平均値を採用した。結果を、下記表4に示す。
(8)下式にしたがって、トップシート1g当たりの試験後吸収量(g)を算出する。
試験後吸収量=[重量(c)-重量(a)]/0.2
(9)下式にしたがって血液保持率(%)を算出した。
血液保持率(%)=100×試験後吸収量/当初吸収量
なお、測定は3回行い、その平均値を採用した。結果を、下記表4に示す。
血液改質剤を含むトップシートは、血液保持性が低く、血液を吸収後、迅速に吸収体に移行させることができることが示唆される。
[例4]
[血液改質剤を含む血液の粘性]
血液改質剤を含む血液の粘性を、Rheometric Expansion System ARES(Rheometric Scientific,Inc)を用いて測定した。ウマ脱繊維血に、パナセート810sを2質量%添加し、軽く撹拌して試料を形成し、直径50mmのパラレルプレートに試料を載せ、ギャップを100μmとし、37±0.5℃で粘度を測定した。パラレルプレートゆえ、試料に均一なせん断速度はかかっていないが、機器に表示された平均せん断速度は、10s-1であった。
[血液改質剤を含む血液の粘性]
血液改質剤を含む血液の粘性を、Rheometric Expansion System ARES(Rheometric Scientific,Inc)を用いて測定した。ウマ脱繊維血に、パナセート810sを2質量%添加し、軽く撹拌して試料を形成し、直径50mmのパラレルプレートに試料を載せ、ギャップを100μmとし、37±0.5℃で粘度を測定した。パラレルプレートゆえ、試料に均一なせん断速度はかかっていないが、機器に表示された平均せん断速度は、10s-1であった。
パナセート810sを2質量%含むウマ脱繊維血の粘度は、5.9mPa・sであり、一方、血液改質剤を含まないウマ脱繊維血の粘度は、50.4mPa・sであった。したがって、パナセート810sを2質量%含むウマ脱繊維血は、血液改質剤を含まない場合と比較して、約90%粘度を下げることが分かる。血液は、血球等の成分を含み、チキソトロピーの性質を有することが知られているが、本開示の血液改質剤は、低粘度域で、血液の粘度を下げることができると考えられる。血液の粘度を下げることにより、吸収した経血を、トップシートから吸収体に速やかに移行させることができると考えられる。
[例5]
[血液改質剤を含む血液の顕微鏡写真]
健常ボランティアの経血を食品保護用ラップフィルム上に採取し、その一部に、10倍の質量のリン酸緩衝生理食塩水中に分散されたパナセート810sを、パナセート810sの濃度が1質量%となるように添加した。経血を、スライドグラスに適下し、カバーグラスをかけ、光学顕微鏡にて、赤血球の状態を観察した。血液改質剤を含まない経血の顕微鏡写真を図16(a)に、そしてパナセート810sを含む経血の顕微鏡写真を図16(b)に示す。
[血液改質剤を含む血液の顕微鏡写真]
健常ボランティアの経血を食品保護用ラップフィルム上に採取し、その一部に、10倍の質量のリン酸緩衝生理食塩水中に分散されたパナセート810sを、パナセート810sの濃度が1質量%となるように添加した。経血を、スライドグラスに適下し、カバーグラスをかけ、光学顕微鏡にて、赤血球の状態を観察した。血液改質剤を含まない経血の顕微鏡写真を図16(a)に、そしてパナセート810sを含む経血の顕微鏡写真を図16(b)に示す。
図16から、血液改質剤を含まない経血では、赤血球が連銭等の集合塊を形成しているが、パナセート810sを含む経血では、赤血球が、それぞれ、安定に分散していることが分かる。したがって、血液改質剤は、血液の中で、赤血球を安定化させる働きをしていることが示唆される。
[例6]
[血液改質剤を含む血液の表面張力]
血液改質剤を含む血液の表面張力を、協和界面科学社製接触角計 Drop Master500を用い、ペンダントドロップ法にて測定した。表面張力は、ヒツジ脱繊維血に、所定の量の血液改質剤を添加し、十分振とうした後に測定した。測定は、機器が自動で行うが、表面張力γは、以下の式により求められる(図17を参照)。
[血液改質剤を含む血液の表面張力]
血液改質剤を含む血液の表面張力を、協和界面科学社製接触角計 Drop Master500を用い、ペンダントドロップ法にて測定した。表面張力は、ヒツジ脱繊維血に、所定の量の血液改質剤を添加し、十分振とうした後に測定した。測定は、機器が自動で行うが、表面張力γは、以下の式により求められる(図17を参照)。
γ=g×ρ×(de)2×1/H
g:重力定数
1/H:ds/deから求められる補正項
ρ:密度
de:最大直径
ds:滴下端よりdeだけ上がった位置での径
g:重力定数
1/H:ds/deから求められる補正項
ρ:密度
de:最大直径
ds:滴下端よりdeだけ上がった位置での径
密度ρは、JIS K 2249-1995の「密度試験方法および密度・質量・容量換算表」の5.振動式密度試験方法に準拠し、下記表5に示される温度で測定した。測定には、京都電子工業株式会社のDA-505を用いた。結果を、表5に示す。
表5から、血液改質剤は、25℃の水100gに対する、約0.00~約0.05gの水溶解度を有することからも明らかなように、水への溶解性が非常に低いが、血液の表面張力を下げることができることが分かる。血液の表面張力を下げることにより、吸収した血液をトップシートの繊維間に保持せず、速やかに吸収体に移行させることができると考えられる。
実施形態と変形例の一つ、もしくは複数を組み合わせることは可能である。変形例同士を組み合わせることも可能である。
以上の説明はあくまで一例であり、発明は、上記の実施形態に何ら限定されるものではない。
1,1A 吸収性物品
2,2A,2B トップシート
3 バックシート
4,4A,4B 吸収体
5 ウイング部
6 粘着部
7 圧搾溝
8 シール部
10 本体部
18A サイドシート
21,21B 第1の突条部
22,22B 第2の突条部
23,23B 底部
24 血液改質剤層
25 開口部
26 第1の突条部の側面
31 吸収体からしみ出た体液
100 トップシート製造装置
120 パターンドラム
130 エンボス加工装置
140 バックシート用ロール
150 カッタ
160 改質剤塗布スプレー
210 樹脂フィルムシートのロール
212,214,216 樹脂フィルムシート
220 凹部形成ロール
230 延伸ギアロール
231 上段ロール
232 下段ロール
233,235 ギア歯
234 ギア歯が途切れている箇所
2,2A,2B トップシート
3 バックシート
4,4A,4B 吸収体
5 ウイング部
6 粘着部
7 圧搾溝
8 シール部
10 本体部
18A サイドシート
21,21B 第1の突条部
22,22B 第2の突条部
23,23B 底部
24 血液改質剤層
25 開口部
26 第1の突条部の側面
31 吸収体からしみ出た体液
100 トップシート製造装置
120 パターンドラム
130 エンボス加工装置
140 バックシート用ロール
150 カッタ
160 改質剤塗布スプレー
210 樹脂フィルムシートのロール
212,214,216 樹脂フィルムシート
220 凹部形成ロール
230 延伸ギアロール
231 上段ロール
232 下段ロール
233,235 ギア歯
234 ギア歯が途切れている箇所
Claims (13)
- 長手方向および幅方向を有し、肌側に設けられた液透過性のトップシートと着衣側に設けられた液不透過性のバックシートと幅方向の両側に長手方向に延びる縁を含み該トップシートおよび該バックシートの間に設けられた液保持性の吸収体とを備えた吸収性物品であって、
少なくとも前記吸収体の幅方向の両縁の外側において、前記吸収体からしみ出た体液を流し込むための複数の第1の流路および複数の第2の流路を含み、
前記複数の第1の流路は、長手方向に延在し、幅方向に並び、
前記複数の第2の流路は、隣接する前記第1の流路を連結する、吸収性物品。 - 少なくとも前記吸収体の幅方向の両縁の外側において、前記トップシートは、長手方向に延在し、幅方向に並ぶ複数の第1の突条部と、隣接する該第1の突条部を連結する複数の第2の突条部と、該第1の突条部および該第2の突条部の基礎となる部分の底部とを含み、
前記トップシートの底部は、前記バックシートと接合し、
前記第1の流路は、前記トップシートの前記第1の突条部および前記バックシートから構成され、
前記第2の流路は、前記トップシートの第2の突条部および前記バックシートから構成される、請求項1に記載の吸収性物品。 - 前記トップシートの幅方向両側に一対のサイドシートをさらに備え、
前記サイドシートは、少なくとも前記吸収体の幅方向の両縁の外側に設けられ、
少なくとも前記吸収体の幅方向の両縁の外側において、前記サイドシートは、長手方向に延在し、幅方向に並ぶ複数の第1の突条部と、隣接する該第1の突条部を連結する複数の第2の突条部と、該第1の突条部および該第2の突条部の基礎となる部分の底部とを含み、
前記サイドシートの底部は、前記バックシートと接合し、
前記第1の流路は、前記サイドシートの前記第1の突条部および前記バックシートから構成され、
前記第2の流路は、前記サイドシートの第2の突条部および前記バックシートから構成される、請求項1に記載の吸収性物品。 - 前記吸収体の幅方向の縁が、幅方向内側へ突出するように湾曲している、請求項1~3のいずれか1項に記載の吸収性物品。
- 少なくとも前記吸収体の幅方向の両縁の外側において、前記第1の流路が、幅方向外側へ突出するように湾曲している、請求項1~4のいずれか1項に記載の吸収性物品。
- 前記トップシート、前記バックシートおよび前記吸収体を備えた本体部と、該本体部の両側縁から幅方向に延出するように該本体部の両側に設けられた一対のウイング部とを含み、
前記吸収体の幅方向の両縁と、前記吸収体の幅方向の縁の外側にあり、前記本体部および前記ウイング部の境界であるウイング部の付け根との間に、前記第1の流路および前記第2の流路を少なくとも含む、請求項1~5のいずれか1項に記載の吸収性物品。 - 前記第1の流路の長手方向の両端部を圧縮して密閉するシール部を長手方向両側に含む請求項1~6のいずれか1項に記載の吸収性物品。
- 前記吸収体が設けられている領域の少なくとも一部の領域において、前記トップシートは、前記複数の第1の突条部と肌側の表面に設けられた血液改質剤層とを含み、
前記吸収体が設けられている領域の少なくとも一部の前記領域では、前記第1の突条部は、長手方向に並ぶ複数の開口部を両側面に有する、請求項1~7のいずれか1項に記載の吸収性物品。 - 前記血液改質剤層の血液改質剤が、0.00~0.60のIOBと、45℃以下の融点と、25℃の水100gに対する、0.00~0.05gの水溶解度とを有する、請求項8に記載の吸収性物品。
- 前記血液改質剤が、次の(i)~(iii)、
(i)炭化水素、
(ii) (ii-1)炭化水素部分と、(ii-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、および
(iii) (iii-1)炭化水素部分と、(iii-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル基(-CO-)およびオキシ基(-O-)から成る群から選択される、一または複数の、同一または異なる基と、(iii-3)前記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択され、
ここで、(ii)または(iii)の化合物において、オキシ基が2つ以上挿入されている場合には、各オキシ基は隣接していない、請求項9に記載の吸収性物品。 - 前記血液改質剤が、次の(i’)~(iii’)、
(i’)炭化水素、
(ii’) (ii’-1)炭化水素部分と、(ii’-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合とを有する化合物、および
(iii’) (iii’-1)炭化水素部分と、(iii’-2)前記炭化水素部分のC-C単結合間に挿入された、カルボニル結合(-CO-)、エステル結合(-COO-)、カーボネート結合(-OCOO-)、およびエーテル結合(-O-)から成る群から選択される、一または複数の、同一または異なる結合と、(iii’-3)前記炭化水素部分の水素原子を置換する、カルボキシル基(-COOH)およびヒドロキシル基(-OH)から成る群から選択される、一または複数の、同一または異なる基とを有する化合物、
ならびにそれらの任意の組み合わせから成る群から選択され、
ここで、(ii’)または(iii’)の化合物において、2以上の同一または異なる結合が挿入されている場合には、各結合は隣接していない、請求項9または10に記載の吸収性物品。 - 前記血液改質剤が、次の(A)~(F)、
(A) (A1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(A2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のカルボキシル基とを有する化合物とのエステル、
(B) (B1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する2~4個のヒドロキシル基とを有する化合物と、(B2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエーテル、
(C) (C1)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する、2~4個のカルボキシル基とを含むカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、(C2)鎖状炭化水素部分と、前記鎖状炭化水素部分の水素原子を置換する1個のヒドロキシル基とを有する化合物とのエステル、
(D)鎖状炭化水素部分と、前記鎖状炭化水素部分のC-C単結合間に挿入された、エーテル結合(-O-)、カルボニル結合(-CO-)、エステル結合(-COO-)、およびカーボネート結合(-OCOO-)から成る群から選択されるいずれか1つの結合とを有する化合物、
(E)ポリオキシC2~C6アルキレングリコール、またはそのアルキルエステルもしくはアルキルエーテル、および
(F)鎖状炭化水素、
ならびにそれらの任意の組み合わせから成る群から選択される、請求項9~11のいずれか1項に記載の吸収性物品。 - 前記血液改質剤が、(a1)鎖状炭化水素テトラオールと少なくとも1の脂肪酸とのエステル、(a2)鎖状炭化水素トリオールと少なくとも1の脂肪酸とのエステル、(a3)鎖状炭化水素ジオールと少なくとも1の脂肪酸とのエステル、(b1)鎖状炭化水素テトラオールと少なくとも1の脂肪族1価アルコールとのエーテル、(b2)鎖状炭化水素トリオールと少なくとも1の脂肪族1価アルコールとのエーテル、(b3)鎖状炭化水素ジオールと少なくとも1の脂肪族1価アルコールとのエーテル、(c1)4個のカルボキシル基を有する鎖状炭化水素テトラカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(c2)3個のカルボキシル基を有する鎖状炭化水素トリカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(c3)2個のカルボキシル基を有する鎖状炭化水素ジカルボン酸、ヒドロキシ酸、アルコキシ酸またはオキソ酸と、少なくとも1の脂肪族1価アルコールとのエステル、(d1)脂肪族1価アルコールと脂肪族1価アルコールとのエーテル、(d2)ジアルキルケトン、(d3)脂肪酸と脂肪族1価アルコールとのエステル、(d4)ジアルキルカーボネート、(e1)ポリオキシC2~C6アルキレングリコール、(e2)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪酸とのエステル、(e3)ポリオキシC2~C6アルキレングリコールと少なくとも1の脂肪族1価アルコールとのエーテル、(e4)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラカルボン酸、鎖状炭化水素トリカルボン酸、または鎖状炭化水素ジカルボン酸とのエステル、(e5)ポリオキシC2~C6アルキレングリコールと、鎖状炭化水素テトラオール、鎖状炭化水素トリオール、または鎖状炭化水素ジオールとのエーテル、および(f1)鎖状アルカン、ならびにそれらの任意の組み合わせから成る群から選択される、請求項9~12のいずれか1項に記載の吸収性物品。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US14/381,928 US9375365B2 (en) | 2012-02-29 | 2012-12-11 | Absorbent article |
| EP12869942.8A EP2821038A4 (en) | 2012-02-29 | 2012-12-11 | ABSORBENT ARTICLE |
| CN201280072752.8A CN104271090B (zh) | 2012-02-29 | 2012-12-11 | 吸收性物品 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012044439 | 2012-02-29 | ||
| JP2012-044439 | 2012-02-29 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2013128755A1 true WO2013128755A1 (ja) | 2013-09-06 |
Family
ID=49081974
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2012/082087 WO2013128755A1 (ja) | 2012-02-29 | 2012-12-11 | 吸収性物品 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US9375365B2 (ja) |
| EP (1) | EP2821038A4 (ja) |
| JP (1) | JP5843740B2 (ja) |
| CN (1) | CN104271090B (ja) |
| AR (1) | AR090176A1 (ja) |
| TW (1) | TWI572343B (ja) |
| WO (1) | WO2013128755A1 (ja) |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10206826B2 (en) | 2014-03-06 | 2019-02-19 | The Procter & Gamble Company | Three-dimensional substrates |
| JP6395474B2 (ja) * | 2014-06-30 | 2018-09-26 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP6418818B2 (ja) * | 2014-06-30 | 2018-11-07 | ユニ・チャーム株式会社 | 吸収性物品用の表面シート |
| EP3340954B1 (en) | 2015-08-26 | 2020-03-25 | The Procter and Gamble Company | Absorbent articles having three-dimensional substrates and indicia |
| CN109310532A (zh) | 2016-07-01 | 2019-02-05 | 宝洁公司 | 具有改善的顶片干燥度的吸收制品 |
| EP3509553B1 (en) * | 2016-09-09 | 2023-06-14 | The Procter & Gamble Company | Three-dimensional apertured substrates |
| RU2669092C1 (ru) * | 2016-12-30 | 2018-10-08 | Ханчжоу Юньонг Санитари Продактс Ко., Лтд. | Ультратонкий супервпитывающий детский подгузник |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6456051A (en) | 1987-08-26 | 1989-03-02 | Personal Products Co | Sanitary napkin |
| JPH08510665A (ja) * | 1993-05-21 | 1996-11-12 | ザ、プロクター、エンド、ギャンブル、カンパニー | 染み透り阻止用圧着接合部を有する吸収物品 |
| JPH08322879A (ja) * | 1995-06-02 | 1996-12-10 | Procter & Gamble Co:The | 生理用ナプキン |
| JP3091283B2 (ja) | 1991-12-09 | 2000-09-25 | 花王株式会社 | 生理用ナプキン |
| JP2001129019A (ja) * | 1999-11-02 | 2001-05-15 | Kao Corp | 吸収性物品 |
| JP2006510456A (ja) * | 2002-12-18 | 2006-03-30 | ザ プロクター アンド ギャンブル カンパニー | 身体清潔効果のための生理用ナプキン |
| WO2008149771A1 (ja) * | 2007-05-30 | 2008-12-11 | Uni-Charm Corporation | 吸収性物品 |
| JP5122007B1 (ja) * | 2011-03-31 | 2013-01-16 | ユニ・チャーム株式会社 | 吸収性物品 |
Family Cites Families (109)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3929135A (en) | 1974-12-20 | 1975-12-30 | Procter & Gamble | Absorptive structure having tapered capillaries |
| JPS5717081A (en) | 1981-05-25 | 1982-01-28 | Noriko Ikegami | Electronic interpreter |
| US4588630A (en) | 1984-06-13 | 1986-05-13 | Chicopee | Apertured fusible fabrics |
| US5181563A (en) * | 1987-03-16 | 1993-01-26 | Mcneil-Ppc, Inc. | Anatomically shaped absorbent pad |
| DE3852732T2 (de) | 1987-07-30 | 1995-05-24 | Kao Corp | Sanitärartikel. |
| JPH0775616B2 (ja) | 1987-07-30 | 1995-08-16 | 花王株式会社 | 衛生用品の表面材 |
| JPH082364B2 (ja) | 1987-12-16 | 1996-01-17 | 花王株式会社 | 衛生用品の表面材 |
| JPH0720856B2 (ja) | 1988-12-01 | 1995-03-08 | 株式会社大塚製薬工場 | 皮膚の殺菌・清拭用組成物 |
| JP2728921B2 (ja) | 1989-03-01 | 1998-03-18 | 花王株式会社 | 凹凸を有する不織布の製造方法 |
| US5334176A (en) | 1991-07-23 | 1994-08-02 | The Procter & Gamble Company | Absorbent core for use in catamenial products |
| CA2243108A1 (en) | 1991-07-23 | 1993-01-24 | Katherine Louise Mayer | Stretchable absorbent articles |
| MA22660A1 (fr) | 1991-10-01 | 1993-04-01 | Procter & Gamble | Article absorbant comportant des rabats et des zones d'extensibilite differentielle . |
| JPH065614A (ja) | 1992-06-17 | 1994-01-14 | Murata Mfg Co Ltd | 熱処理装置 |
| JPH0784697A (ja) | 1993-09-10 | 1995-03-31 | Canon Inc | 情報処理装置 |
| US5614283A (en) | 1994-12-22 | 1997-03-25 | Tredegar Industries | Absorbent composite with three-dimensional film surface for use in absorbent disposable products |
| US5650214A (en) | 1996-05-31 | 1997-07-22 | The Procter & Gamble Company | Web materials exhibiting elastic-like behavior and soft, cloth-like texture |
| US5891126A (en) | 1996-08-30 | 1999-04-06 | The Procter & Gamble Company | Absorbent interlabial device treated with a polysiloxane emollient |
| JPH1095810A (ja) | 1996-09-24 | 1998-04-14 | Oji Paper Co Ltd | 高吸水性樹脂及びその製造方法 |
| ZA985679B (en) | 1997-06-30 | 1999-01-26 | Procter & Gamble | Absorbent article with multi-layered extensible wings |
| US6277104B1 (en) * | 1997-08-25 | 2001-08-21 | Mcneil-Ppc, Inc. | Air permeable, liquid impermeable barrier structures and products made therefrom |
| EP1035814B1 (en) | 1997-12-05 | 2003-09-03 | The Procter & Gamble Company | Compound sanitary napkin having flaps and zone of extensibility |
| US6262331B1 (en) | 1998-06-05 | 2001-07-17 | The Procter & Gamble Company | Absorbent article having a topsheet that includes selectively openable and closable openings |
| EP1034804A1 (en) | 1999-03-05 | 2000-09-13 | The Procter & Gamble Company | Articles comprising an oxidising agent and a hemolytic agent |
| US6730819B1 (en) | 1999-03-05 | 2004-05-04 | The Procter & Gamble Company | Articles comprising oxidizing and hemolytic agents |
| US6153209A (en) | 1999-09-28 | 2000-11-28 | The Procter & Gamble Company | Article having a transferable breathable skin care composition thereon |
| JP3748743B2 (ja) | 1999-10-04 | 2006-02-22 | ユニ・チャーム株式会社 | 吸収性物品およびその製造方法 |
| JP3576052B2 (ja) * | 1999-10-29 | 2004-10-13 | ユニ・チャーム株式会社 | 使い捨て着用物品に使用する可撓性複合シート |
| US20010044614A1 (en) | 1999-12-23 | 2001-11-22 | Damay Emmanuelle Cecile | Reducing agents for feminine care products |
| JP3701208B2 (ja) | 2000-03-13 | 2005-09-28 | ユニ・チャーム株式会社 | 開孔シートとこの開孔シートを使用した吸収性物品および前記開孔シートの製造方法。 |
| EP1250940B1 (en) | 2001-04-17 | 2010-01-06 | The Procter & Gamble Company | An absorbent article comprising an agent able to convey a perception to the wearer |
| JP3926587B2 (ja) | 2001-07-12 | 2007-06-06 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP4855606B2 (ja) | 2001-08-10 | 2012-01-18 | ユニ・チャーム株式会社 | 吸収性物品 |
| SE519783C2 (sv) | 2001-08-31 | 2003-04-08 | Sca Hygiene Prod Ab | Absorberande alster innefattande öppningar i absorptionskroppen |
| US20030082219A1 (en) | 2001-10-01 | 2003-05-01 | The Procter & Gamble Company | Skin care compositions comprising low concentrations of skin treatment agents |
| SG103382A1 (en) | 2002-01-11 | 2004-04-29 | Uni Charm Corp | Colored absorbent article |
| JP4693847B2 (ja) | 2002-03-26 | 2011-06-01 | ユニ・チャーム株式会社 | 吸収性物品およびその製造方法 |
| JP4278963B2 (ja) | 2002-03-26 | 2009-06-17 | ユニ・チャーム株式会社 | 吸収性物品 |
| EP1371379B2 (en) | 2002-06-12 | 2012-06-20 | SCA Hygiene Products AB | Absorbent article containing a skincare composition |
| JP3949020B2 (ja) | 2002-07-19 | 2007-07-25 | 花王株式会社 | 吸収性物品 |
| US9035123B2 (en) | 2002-10-01 | 2015-05-19 | The Procter & Gamble Company | Absorbent article having a lotioned topsheet |
| JP2005095759A (ja) | 2003-09-24 | 2005-04-14 | San-Dia Polymer Ltd | 吸収剤とこれを用いてなる吸収性物品 |
| US20050096614A1 (en) | 2003-10-29 | 2005-05-05 | Perez Roberto C. | Cover layer for an absorbent article |
| JP4476102B2 (ja) | 2003-12-11 | 2010-06-09 | 花王株式会社 | 吸収性物品の表面シート |
| ES2617855T3 (es) | 2004-06-21 | 2017-06-20 | The Procter & Gamble Company | Articulo absorbente con lámina superior que contiene loción |
| JP4459013B2 (ja) | 2004-10-20 | 2010-04-28 | 花王株式会社 | 吸収性物品 |
| US8211078B2 (en) | 2005-02-17 | 2012-07-03 | The Procter And Gamble Company | Sanitary napkins capable of taking complex three-dimensional shape in use |
| JP4514630B2 (ja) | 2005-03-16 | 2010-07-28 | 花王株式会社 | 吸収性物品の表面シート |
| JP4523866B2 (ja) | 2005-03-31 | 2010-08-11 | ユニ・チャーム株式会社 | 吸収性物品 |
| MX2007014914A (es) | 2005-06-02 | 2008-02-14 | Procter & Gamble | Articulo absorbente con elemento reforzador cruzado. |
| JP4792249B2 (ja) | 2005-07-11 | 2011-10-12 | ユニ・チャーム株式会社 | 体液吸収性物品 |
| WO2007105147A1 (en) | 2006-03-14 | 2007-09-20 | The Procter & Gamble Company | Absorbent articles with lotions |
| JP5123497B2 (ja) | 2006-06-23 | 2013-01-23 | ユニ・チャーム株式会社 | 不織布、不織布製造方法及び不織布製造装置 |
| JP5123511B2 (ja) | 2006-06-23 | 2013-01-23 | ユニ・チャーム株式会社 | 不織布 |
| JP5154048B2 (ja) | 2006-06-23 | 2013-02-27 | ユニ・チャーム株式会社 | 不織布 |
| JP5123505B2 (ja) | 2006-06-23 | 2013-01-23 | ユニ・チャーム株式会社 | 不織布 |
| JP5328089B2 (ja) | 2006-06-23 | 2013-10-30 | ユニ・チャーム株式会社 | 多層不織布及び多層不織布の製造方法 |
| JP5123512B2 (ja) | 2006-06-23 | 2013-01-23 | ユニ・チャーム株式会社 | 不織布 |
| JP5069891B2 (ja) | 2006-06-23 | 2012-11-07 | ユニ・チャーム株式会社 | 不織布 |
| JP5069890B2 (ja) | 2006-06-23 | 2012-11-07 | ユニ・チャーム株式会社 | 不織布 |
| KR101395379B1 (ko) | 2006-06-23 | 2014-05-14 | 유니챰 가부시키가이샤 | 흡수성 물품 |
| JP5123513B2 (ja) | 2006-06-23 | 2013-01-23 | ユニ・チャーム株式会社 | 吸収体 |
| JP5328088B2 (ja) | 2006-06-23 | 2013-10-30 | ユニ・チャーム株式会社 | 不織布 |
| JP4986673B2 (ja) | 2007-03-27 | 2012-07-25 | 花王株式会社 | 吸収性物品 |
| CN101484111B (zh) | 2006-07-05 | 2013-05-22 | 花王株式会社 | 吸收性物品 |
| JP5021380B2 (ja) | 2006-07-05 | 2012-09-05 | 花王株式会社 | 吸収性物品 |
| JP4939192B2 (ja) | 2006-12-05 | 2012-05-23 | ユニ・チャーム株式会社 | 不織布、不織布の製造方法及び吸収性物品 |
| JP4939196B2 (ja) | 2006-12-12 | 2012-05-23 | ユニ・チャーム株式会社 | 不織布、不織布の製造方法及び吸収性物品 |
| ATE528425T1 (de) | 2006-12-05 | 2011-10-15 | Uni Charm Corp | Vliesstoff, verfahren zur herstellung von vliesstoff sowie saugkörper |
| JP5171643B2 (ja) | 2006-12-13 | 2013-03-27 | ユニ・チャーム株式会社 | 吸収性物品 |
| AR065378A1 (es) | 2007-02-16 | 2009-06-03 | Procter & Gamble | Articulo absorbente con locion que comprende un material de polipropilenglicol |
| JP4979424B2 (ja) | 2007-03-20 | 2012-07-18 | 花王株式会社 | 吸収性物品 |
| JP4979423B2 (ja) | 2007-03-20 | 2012-07-18 | 花王株式会社 | 吸収性物品 |
| JP5114087B2 (ja) | 2007-04-17 | 2013-01-09 | ユニ・チャーム株式会社 | 不織布、及び、吸収性物品 |
| JP4879074B2 (ja) | 2007-04-17 | 2012-02-15 | ユニ・チャーム株式会社 | 不織布製造方法 |
| WO2008133067A1 (ja) | 2007-04-17 | 2008-11-06 | Uni-Charm Corporation | 不織布、不織布製造方法、及び、吸収性物品 |
| US20080281287A1 (en) | 2007-05-08 | 2008-11-13 | Marcelo Ana Maria Elena R | Sanitary napkin including body-facing protrusions for preventing side leakage and obliquely arranged embossed channels |
| EP1992366B1 (en) | 2007-05-15 | 2011-07-06 | The Procter & Gamble Company | Use of a lotion composition on an absorbent article for reducing adherence of feces or menses to the skin |
| JP5568210B2 (ja) | 2007-06-13 | 2014-08-06 | ユニ・チャーム株式会社 | 不織布シートの製造方法 |
| JP5497987B2 (ja) | 2007-06-22 | 2014-05-21 | ユニ・チャーム株式会社 | 不織布およびその製造方法 |
| JP2009005767A (ja) | 2007-06-26 | 2009-01-15 | Kao Corp | 吸収性物品 |
| US7942858B2 (en) | 2007-07-03 | 2011-05-17 | Mcneil-Ppc, Inc. | Sanitary napkin including body-facing protrusions and arcuately arranged embossed channels |
| JP4652387B2 (ja) | 2007-10-03 | 2011-03-16 | 王子製紙株式会社 | 折り返し部を有する吸収体製品 |
| EP2242519A2 (en) | 2008-02-15 | 2010-10-27 | The Procter & Gamble Company | Absorbent article with lotion comprising a polypropylene glycol material |
| JP2009201878A (ja) | 2008-02-29 | 2009-09-10 | Uni Charm Corp | 吸収性物品 |
| JP5173616B2 (ja) | 2008-06-10 | 2013-04-03 | 花王株式会社 | 吸収性物品 |
| JP5371361B2 (ja) | 2008-10-10 | 2013-12-18 | ユニ・チャーム株式会社 | 吸収性物品及び吸収性物品の製造方法 |
| JP5455363B2 (ja) | 2008-12-25 | 2014-03-26 | ユニ・チャーム株式会社 | 薄型吸収性物品 |
| JP5520124B2 (ja) | 2009-05-14 | 2014-06-11 | ユニ・チャーム株式会社 | 透液性繊維不織布 |
| JP5401177B2 (ja) | 2009-06-04 | 2014-01-29 | 花王株式会社 | 吸収性物品 |
| WO2010134456A1 (ja) | 2009-05-20 | 2010-11-25 | 花王株式会社 | 吸収体および吸収性物品 |
| JP5590834B2 (ja) | 2009-08-11 | 2014-09-17 | ユニ・チャーム株式会社 | 不織布およびその製造方法 |
| JP2011067484A (ja) | 2009-09-28 | 2011-04-07 | Kao Corp | 吸収性物品 |
| JP5623052B2 (ja) | 2009-09-29 | 2014-11-12 | ユニ・チャーム株式会社 | 不織布の製造方法 |
| JP5530693B2 (ja) | 2009-09-30 | 2014-06-25 | 大王製紙株式会社 | 吸収性物品 |
| JP5421720B2 (ja) | 2009-10-09 | 2014-02-19 | ユニ・チャーム株式会社 | 不織布 |
| JP5395630B2 (ja) | 2009-11-13 | 2014-01-22 | 花王株式会社 | 吸収性物品 |
| JP5466489B2 (ja) | 2009-11-16 | 2014-04-09 | 花王株式会社 | 吸収性物品 |
| JP5551926B2 (ja) | 2009-12-09 | 2014-07-16 | 花王株式会社 | 吸収性物品 |
| JP5506520B2 (ja) | 2010-04-16 | 2014-05-28 | ユニ・チャーム株式会社 | 伸長性繊維と伸縮性繊維とを含む、凹凸を有する不織布、及び当該不織布を製造する方法 |
| JP5506519B2 (ja) | 2010-04-16 | 2014-05-28 | ユニ・チャーム株式会社 | 凹凸を有する不織布を簡易に製造する方法、及び不織布を簡易に加工する方法 |
| JP5749907B2 (ja) | 2010-08-31 | 2015-07-15 | ユニ・チャーム株式会社 | 吸収性物品及び生理用ナプキン |
| US8921640B2 (en) * | 2010-10-08 | 2014-12-30 | The Procter & Gamble Company | Absorbent article with philic anhydrous lotion |
| JP5916327B2 (ja) * | 2011-09-30 | 2016-05-11 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5745377B2 (ja) * | 2011-09-30 | 2015-07-08 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5713950B2 (ja) * | 2012-03-30 | 2015-05-07 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5709789B2 (ja) * | 2012-03-30 | 2015-04-30 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5762345B2 (ja) * | 2012-03-30 | 2015-08-12 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5726123B2 (ja) * | 2012-03-30 | 2015-05-27 | ユニ・チャーム株式会社 | 吸収性物品 |
| JP5847055B2 (ja) * | 2012-02-29 | 2016-01-20 | ユニ・チャーム株式会社 | 吸収性物品 |
-
2012
- 2012-10-24 JP JP2012235041A patent/JP5843740B2/ja not_active Expired - Fee Related
- 2012-12-11 CN CN201280072752.8A patent/CN104271090B/zh not_active Expired - Fee Related
- 2012-12-11 WO PCT/JP2012/082087 patent/WO2013128755A1/ja active Application Filing
- 2012-12-11 EP EP12869942.8A patent/EP2821038A4/en not_active Withdrawn
- 2012-12-11 US US14/381,928 patent/US9375365B2/en not_active Expired - Fee Related
-
2013
- 2013-02-26 TW TW102106718A patent/TWI572343B/zh not_active IP Right Cessation
- 2013-02-27 AR ARP130100608 patent/AR090176A1/es active IP Right Grant
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6456051A (en) | 1987-08-26 | 1989-03-02 | Personal Products Co | Sanitary napkin |
| JP3091283B2 (ja) | 1991-12-09 | 2000-09-25 | 花王株式会社 | 生理用ナプキン |
| JPH08510665A (ja) * | 1993-05-21 | 1996-11-12 | ザ、プロクター、エンド、ギャンブル、カンパニー | 染み透り阻止用圧着接合部を有する吸収物品 |
| JPH08322879A (ja) * | 1995-06-02 | 1996-12-10 | Procter & Gamble Co:The | 生理用ナプキン |
| JP2001129019A (ja) * | 1999-11-02 | 2001-05-15 | Kao Corp | 吸収性物品 |
| JP2006510456A (ja) * | 2002-12-18 | 2006-03-30 | ザ プロクター アンド ギャンブル カンパニー | 身体清潔効果のための生理用ナプキン |
| WO2008149771A1 (ja) * | 2007-05-30 | 2008-12-11 | Uni-Charm Corporation | 吸収性物品 |
| JP5122007B1 (ja) * | 2011-03-31 | 2013-01-16 | ユニ・チャーム株式会社 | 吸収性物品 |
Non-Patent Citations (2)
| Title |
|---|
| FUJITA A.: "Organic compound predictions and organic paradigms", KAGAKU NO RYOIKI, vol. 11, no. 10, 1957, pages 719 - 725 |
| See also references of EP2821038A4 * |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150065984A1 (en) | 2015-03-05 |
| JP2013208419A (ja) | 2013-10-10 |
| TWI572343B (zh) | 2017-03-01 |
| TW201406359A (zh) | 2014-02-16 |
| CN104271090A (zh) | 2015-01-07 |
| CN104271090B (zh) | 2016-03-02 |
| EP2821038A1 (en) | 2015-01-07 |
| JP5843740B2 (ja) | 2016-01-13 |
| EP2821038A4 (en) | 2015-09-30 |
| US9375365B2 (en) | 2016-06-28 |
| AR090176A1 (es) | 2014-10-22 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5713951B2 (ja) | 吸収性物品 | |
| JP5925015B2 (ja) | 吸収性物品 | |
| JP5847055B2 (ja) | 吸収性物品 | |
| WO2013128755A1 (ja) | 吸収性物品 | |
| WO2013129327A1 (ja) | 吸収性物品 | |
| JP5963639B2 (ja) | 吸収性物品 | |
| JP6037606B2 (ja) | 吸収性物品、吸収性物品のトップシートおよびそのトップシートの製造方法 | |
| JP5709788B2 (ja) | 吸収性物品 | |
| JP5916327B2 (ja) | 吸収性物品 | |
| JP5745377B2 (ja) | 吸収性物品 | |
| JP6041473B2 (ja) | 吸収性物品 | |
| JP5769655B2 (ja) | 吸収性物品 | |
| JP6041472B2 (ja) | 吸収性物品、吸収性物品のトップシートおよびそのトップシートの製造方法 | |
| JP5762346B2 (ja) | 吸収性物品 | |
| WO2013129332A1 (ja) | 吸収性物品 | |
| JP2013208410A (ja) | 吸収性物品 | |
| JP2013212153A (ja) | 吸収性物品 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 12869942 Country of ref document: EP Kind code of ref document: A1 |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2012869942 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 14381928 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |