WO2005104264A1 - Elektrolumineszierende polymere und deren verwendung - Google Patents
Elektrolumineszierende polymere und deren verwendung Download PDFInfo
- Publication number
- WO2005104264A1 WO2005104264A1 PCT/EP2005/004448 EP2005004448W WO2005104264A1 WO 2005104264 A1 WO2005104264 A1 WO 2005104264A1 EP 2005004448 W EP2005004448 W EP 2005004448W WO 2005104264 A1 WO2005104264 A1 WO 2005104264A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- polymers
- units
- occurrence
- different
- atoms
- Prior art date
Links
- 229920000642 polymer Polymers 0.000 title claims abstract description 136
- 125000004432 carbon atom Chemical group C* 0.000 claims description 43
- 125000003118 aryl group Chemical group 0.000 claims description 33
- 229910052757 nitrogen Inorganic materials 0.000 claims description 32
- 239000000203 mixture Substances 0.000 claims description 24
- 150000003254 radicals Chemical class 0.000 claims description 23
- -1 aromatic radicals Chemical class 0.000 claims description 18
- 229910052760 oxygen Inorganic materials 0.000 claims description 17
- 239000000243 solution Substances 0.000 claims description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 12
- 125000001072 heteroaryl group Chemical group 0.000 claims description 11
- 238000002347 injection Methods 0.000 claims description 11
- 239000007924 injection Substances 0.000 claims description 11
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 claims description 11
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 claims description 10
- 229910052740 iodine Inorganic materials 0.000 claims description 10
- 238000006116 polymerization reaction Methods 0.000 claims description 10
- 239000002904 solvent Substances 0.000 claims description 10
- 150000001875 compounds Chemical class 0.000 claims description 9
- 229920000547 conjugated polymer Polymers 0.000 claims description 8
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 8
- 229910052717 sulfur Inorganic materials 0.000 claims description 8
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 7
- 125000005842 heteroatom Chemical group 0.000 claims description 7
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 claims description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 6
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 claims description 6
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims description 6
- 125000000623 heterocyclic group Chemical group 0.000 claims description 6
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 claims description 6
- 125000004429 atom Chemical group 0.000 claims description 5
- 230000001588 bifunctional effect Effects 0.000 claims description 5
- 125000006165 cyclic alkyl group Chemical group 0.000 claims description 5
- 238000004770 highest occupied molecular orbital Methods 0.000 claims description 5
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 claims description 5
- 125000002950 monocyclic group Chemical group 0.000 claims description 5
- 125000005259 triarylamine group Chemical group 0.000 claims description 5
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 claims description 4
- 125000003545 alkoxy group Chemical group 0.000 claims description 4
- CUFNKYGDVFVPHO-UHFFFAOYSA-N azulene Chemical compound C1=CC=CC2=CC=CC2=C1 CUFNKYGDVFVPHO-UHFFFAOYSA-N 0.000 claims description 4
- 125000004122 cyclic group Chemical group 0.000 claims description 4
- 125000003367 polycyclic group Chemical group 0.000 claims description 4
- 239000000126 substance Substances 0.000 claims description 4
- 230000007704 transition Effects 0.000 claims description 4
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical compound C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 claims description 3
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 claims description 3
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 claims description 3
- XXPBFNVKTVJZKF-UHFFFAOYSA-N 9,10-dihydrophenanthrene Chemical class C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 claims description 3
- SNFCXVRWFNAHQX-UHFFFAOYSA-N 9,9'-spirobi[fluorene] Chemical class C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=CC=C21 SNFCXVRWFNAHQX-UHFFFAOYSA-N 0.000 claims description 3
- 239000005964 Acibenzolar-S-methyl Substances 0.000 claims description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 230000008878 coupling Effects 0.000 claims description 3
- 238000010168 coupling process Methods 0.000 claims description 3
- 238000005859 coupling reaction Methods 0.000 claims description 3
- 125000003983 fluorenyl group Chemical class C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims description 3
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical compound C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 claims description 3
- 229950000688 phenothiazine Drugs 0.000 claims description 3
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical compound C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 claims description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 3
- 229930192474 thiophene Natural products 0.000 claims description 3
- ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 1,2-dihydrophenazine Chemical compound C1=CC=C2N=C(C=CCC3)C3=NC2=C1 ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 0.000 claims description 2
- 125000004958 1,4-naphthylene group Chemical group 0.000 claims description 2
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 claims description 2
- XDFUNRTWHPWCKO-UHFFFAOYSA-N 4,5,9,10-tetrahydropyrene Chemical class C1CC2=CC=CC3=C2C2=C1C=CC=C2CC3 XDFUNRTWHPWCKO-UHFFFAOYSA-N 0.000 claims description 2
- WPCIUCNVWJNRCD-UHFFFAOYSA-N 4,5-dihydropyrene Chemical class C1=CC=C2CCC3=CC=CC4=CC=C1C2=C34 WPCIUCNVWJNRCD-UHFFFAOYSA-N 0.000 claims description 2
- MZCJSUCRGWIKHH-UHFFFAOYSA-N 6,7-dihydrobenzo[d][1]benzoxepine Chemical class O1CCC2=CC=CC=C2C2=CC=CC=C21 MZCJSUCRGWIKHH-UHFFFAOYSA-N 0.000 claims description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 2
- 125000004104 aryloxy group Chemical group 0.000 claims description 2
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical compound C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 claims description 2
- 230000008859 change Effects 0.000 claims description 2
- 230000005669 field effect Effects 0.000 claims description 2
- 238000009472 formulation Methods 0.000 claims description 2
- 125000000524 functional group Chemical group 0.000 claims description 2
- 150000002240 furans Chemical class 0.000 claims description 2
- 125000005553 heteroaryloxy group Chemical group 0.000 claims description 2
- 150000002576 ketones Chemical class 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- NFBOHOGPQUYFRF-UHFFFAOYSA-N oxanthrene Chemical compound C1=CC=C2OC3=CC=CC=C3OC2=C1 NFBOHOGPQUYFRF-UHFFFAOYSA-N 0.000 claims description 2
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 claims description 2
- GJSGGHOYGKMUPT-UHFFFAOYSA-N phenoxathiine Chemical compound C1=CC=C2OC3=CC=CC=C3SC2=C1 GJSGGHOYGKMUPT-UHFFFAOYSA-N 0.000 claims description 2
- 238000010791 quenching Methods 0.000 claims description 2
- 150000003462 sulfoxides Chemical class 0.000 claims description 2
- GVIJJXMXTUZIOD-UHFFFAOYSA-N thianthrene Chemical compound C1=CC=C2SC3=CC=CC=C3SC2=C1 GVIJJXMXTUZIOD-UHFFFAOYSA-N 0.000 claims description 2
- 239000010409 thin film Substances 0.000 claims description 2
- 238000006619 Stille reaction Methods 0.000 claims 1
- 238000006069 Suzuki reaction reaction Methods 0.000 claims 1
- 150000001716 carbazoles Chemical class 0.000 claims 1
- 125000001791 phenazinyl group Chemical class C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 claims 1
- 150000004756 silanes Chemical class 0.000 claims 1
- 150000003457 sulfones Chemical class 0.000 claims 1
- 239000000463 material Substances 0.000 abstract description 7
- 229920000620 organic polymer Polymers 0.000 abstract 1
- 239000000178 monomer Substances 0.000 description 19
- 230000015572 biosynthetic process Effects 0.000 description 17
- 238000003786 synthesis reaction Methods 0.000 description 17
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 238000005160 1H NMR spectroscopy Methods 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 13
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 125000001424 substituent group Chemical group 0.000 description 12
- 230000000052 comparative effect Effects 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 229920001577 copolymer Polymers 0.000 description 7
- 239000004020 conductor Substances 0.000 description 6
- 229960000583 acetic acid Drugs 0.000 description 5
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- ZSWYHFIMWNQODH-UHFFFAOYSA-N 2,7-dibromo-9,10-dimethylphenanthrene Chemical compound C1=C(Br)C=C2C(C)=C(C)C3=CC(Br)=CC=C3C2=C1 ZSWYHFIMWNQODH-UHFFFAOYSA-N 0.000 description 4
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 239000003086 colorant Substances 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- CCERQOYLJJULMD-UHFFFAOYSA-M magnesium;carbanide;chloride Chemical compound [CH3-].[Mg+2].[Cl-] CCERQOYLJJULMD-UHFFFAOYSA-M 0.000 description 4
- 150000002987 phenanthrenes Chemical class 0.000 description 4
- 238000000746 purification Methods 0.000 description 4
- 238000001953 recrystallisation Methods 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 238000003756 stirring Methods 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- ICPSWZFVWAPUKF-UHFFFAOYSA-N 1,1'-spirobi[fluorene] Chemical compound C1=CC=C2C=C3C4(C=5C(C6=CC=CC=C6C=5)=CC=C4)C=CC=C3C2=C1 ICPSWZFVWAPUKF-UHFFFAOYSA-N 0.000 description 3
- RICKKZXCGCSLIU-UHFFFAOYSA-N 2-[2-[carboxymethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]ethyl-[[3-hydroxy-5-(hydroxymethyl)-2-methylpyridin-4-yl]methyl]amino]acetic acid Chemical compound CC1=NC=C(CO)C(CN(CCN(CC(O)=O)CC=2C(=C(C)N=CC=2CO)O)CC(O)=O)=C1O RICKKZXCGCSLIU-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 239000007818 Grignard reagent Substances 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000021615 conjugation Effects 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 3
- 150000004795 grignard reagents Chemical class 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- MKDOFUXBAMDLQH-UHFFFAOYSA-N 1-octylphenanthrene-2,7-diamine Chemical compound C(CCCCCCC)C1=C(C=CC=2C3=CC=C(C=C3C=CC1=2)N)N MKDOFUXBAMDLQH-UHFFFAOYSA-N 0.000 description 2
- CBUAMAYUPKHYEM-UHFFFAOYSA-N 2,7-dibromo-10,10-dimethyl-9h-phenanthren-9-ol Chemical compound C1=C(Br)C=C2C(C)(C)C(O)C3=CC(Br)=CC=C3C2=C1 CBUAMAYUPKHYEM-UHFFFAOYSA-N 0.000 description 2
- GEABGQLNFJOXIZ-UHFFFAOYSA-N 2,7-dibromo-10,10-dimethylphenanthren-9-one Chemical compound C1=C(Br)C=C2C(C)(C)C(=O)C3=CC(Br)=CC=C3C2=C1 GEABGQLNFJOXIZ-UHFFFAOYSA-N 0.000 description 2
- DODCSEOANUKRNO-UHFFFAOYSA-N 2,7-dibromo-9,10-dimethylphenanthrene-9,10-diol Chemical compound C1=C(Br)C=C2C(O)(C)C(C)(O)C3=CC(Br)=CC=C3C2=C1 DODCSEOANUKRNO-UHFFFAOYSA-N 0.000 description 2
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 229910052786 argon Inorganic materials 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 238000011097 chromatography purification Methods 0.000 description 2
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical compound C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- 238000005265 energy consumption Methods 0.000 description 2
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- PJULCNAVAGQLAT-UHFFFAOYSA-N indeno[2,1-a]fluorene Chemical compound C1=CC=C2C=C3C4=CC5=CC=CC=C5C4=CC=C3C2=C1 PJULCNAVAGQLAT-UHFFFAOYSA-N 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 238000004020 luminiscence type Methods 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 238000000034 method Methods 0.000 description 2
- 125000002524 organometallic group Chemical group 0.000 description 2
- QJZDTUSIYGXUJR-UHFFFAOYSA-N phenanthrene-2,7-diamine Chemical compound NC1=CC=C2C3=CC=C(N)C=C3C=CC2=C1 QJZDTUSIYGXUJR-UHFFFAOYSA-N 0.000 description 2
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 2
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 description 2
- 235000011152 sodium sulphate Nutrition 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- HQDYNFWTFJFEPR-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene Chemical compound C1=C2CCCC(C=C3)C2=C2C3=CC=CC2=C1 HQDYNFWTFJFEPR-UHFFFAOYSA-N 0.000 description 1
- ZFXBERJDEUDDMX-UHFFFAOYSA-N 1,2,3,5-tetrazine Chemical compound C1=NC=NN=N1 ZFXBERJDEUDDMX-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- HTJMXYRLEDBSLT-UHFFFAOYSA-N 1,2,4,5-tetrazine Chemical compound C1=NN=CN=N1 HTJMXYRLEDBSLT-UHFFFAOYSA-N 0.000 description 1
- BBVIDBNAYOIXOE-UHFFFAOYSA-N 1,2,4-oxadiazole Chemical compound C=1N=CON=1 BBVIDBNAYOIXOE-UHFFFAOYSA-N 0.000 description 1
- YGTAZGSLCXNBQL-UHFFFAOYSA-N 1,2,4-thiadiazole Chemical compound C=1N=CSN=1 YGTAZGSLCXNBQL-UHFFFAOYSA-N 0.000 description 1
- FYADHXFMURLYQI-UHFFFAOYSA-N 1,2,4-triazine Chemical compound C1=CN=NC=N1 FYADHXFMURLYQI-UHFFFAOYSA-N 0.000 description 1
- UDGKZGLPXCRRAM-UHFFFAOYSA-N 1,2,5-thiadiazole Chemical compound C=1C=NSN=1 UDGKZGLPXCRRAM-UHFFFAOYSA-N 0.000 description 1
- UUSUFQUCLACDTA-UHFFFAOYSA-N 1,2-dihydropyrene Chemical compound C1=CC=C2C=CC3=CCCC4=CC=C1C2=C43 UUSUFQUCLACDTA-UHFFFAOYSA-N 0.000 description 1
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical compound C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 1
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical compound C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 1
- JIHQDMXYYFUGFV-UHFFFAOYSA-N 1,3,5-triazine Chemical compound C1=NC=NC=N1 JIHQDMXYYFUGFV-UHFFFAOYSA-N 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical compound N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 1
- IPTXXSZUISGKCJ-UHFFFAOYSA-N 1-bromo-4-(diethoxyphosphorylmethyl)benzene Chemical compound CCOP(=O)(OCC)CC1=CC=C(Br)C=C1 IPTXXSZUISGKCJ-UHFFFAOYSA-N 0.000 description 1
- VMKOFRJSULQZRM-UHFFFAOYSA-N 1-bromooctane Chemical compound CCCCCCCCBr VMKOFRJSULQZRM-UHFFFAOYSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- USYCQABRSUEURP-UHFFFAOYSA-N 1h-benzo[f]benzimidazole Chemical compound C1=CC=C2C=C(NC=N3)C3=CC2=C1 USYCQABRSUEURP-UHFFFAOYSA-N 0.000 description 1
- IGHOZKDBCCFNNC-UHFFFAOYSA-N 1h-imidazole;quinoxaline Chemical compound C1=CNC=N1.N1=CC=NC2=CC=CC=C21 IGHOZKDBCCFNNC-UHFFFAOYSA-N 0.000 description 1
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- NXDKKTGZVKPJSF-UHFFFAOYSA-N 2,7-bis[2-(4-bromophenyl)ethenyl]-9,10-dioctylphenanthrene Chemical compound C=1C=C2C3=CC=C(C=CC=4C=CC(Br)=CC=4)C=C3C(CCCCCCCC)=C(CCCCCCCC)C2=CC=1C=CC1=CC=C(Br)C=C1 NXDKKTGZVKPJSF-UHFFFAOYSA-N 0.000 description 1
- CXDKJFQAVVHKLA-UHFFFAOYSA-N 2,7-dibromo-9,10-bis(2-ethylhexyl)phenanthrene Chemical compound C1=C(Br)C=C2C(CC(CC)CCCC)=C(CC(CC)CCCC)C3=CC(Br)=CC=C3C2=C1 CXDKJFQAVVHKLA-UHFFFAOYSA-N 0.000 description 1
- YJHLURHBFXSBFM-UHFFFAOYSA-N 2,7-dibromo-9,10-bis(4-tert-butylphenyl)phenanthrene Chemical compound C1=CC(C(C)(C)C)=CC=C1C(C1=CC(Br)=CC=C1C1=CC=C(Br)C=C11)=C1C1=CC=C(C(C)(C)C)C=C1 YJHLURHBFXSBFM-UHFFFAOYSA-N 0.000 description 1
- HYZBQSUTBGLTJZ-UHFFFAOYSA-N 2,7-dibromo-9,10-dioctylphenanthrene Chemical compound C1=C(Br)C=C2C(CCCCCCCC)=C(CCCCCCCC)C3=CC(Br)=CC=C3C2=C1 HYZBQSUTBGLTJZ-UHFFFAOYSA-N 0.000 description 1
- LTZIIBSPYWTOQV-UHFFFAOYSA-N 2,7-dibromophenanthrene-9,10-dione Chemical compound BrC1=CC=C2C3=CC=C(Br)C=C3C(=O)C(=O)C2=C1 LTZIIBSPYWTOQV-UHFFFAOYSA-N 0.000 description 1
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical compound C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 1
- LYTMVABTDYMBQK-UHFFFAOYSA-N 2-benzothiophene Chemical compound C1=CC=CC2=CSC=C21 LYTMVABTDYMBQK-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- HYHWOVJTIDJGDJ-UHFFFAOYSA-N 2-n,7-n-bis(4-bromophenyl)-2-n,7-n-bis(4-tert-butylphenyl)-9,10-dimethylphenanthrene-2,7-diamine Chemical compound C1=C2C(C)=C(C)C3=CC(N(C=4C=CC(Br)=CC=4)C=4C=CC(=CC=4)C(C)(C)C)=CC=C3C2=CC=C1N(C=1C=CC(=CC=1)C(C)(C)C)C1=CC=C(Br)C=C1 HYHWOVJTIDJGDJ-UHFFFAOYSA-N 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- UOMXLEWVJZEVGP-UHFFFAOYSA-N 4-tert-butyl-n-phenylaniline Chemical compound C1=CC(C(C)(C)C)=CC=C1NC1=CC=CC=C1 UOMXLEWVJZEVGP-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- BPMFPOGUJAAYHL-UHFFFAOYSA-N 9H-Pyrido[2,3-b]indole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=N1 BPMFPOGUJAAYHL-UHFFFAOYSA-N 0.000 description 1
- FMMWHPNWAFZXNH-UHFFFAOYSA-N Benz[a]pyrene Chemical compound C1=C2C3=CC=CC=C3C=C(C=C3)C2=C2C3=CC=CC2=C1 FMMWHPNWAFZXNH-UHFFFAOYSA-N 0.000 description 1
- JJTVXBDQQXJRTO-UHFFFAOYSA-N CCCC[Mg]C1=CC=CC=C1 Chemical compound CCCC[Mg]C1=CC=CC=C1 JJTVXBDQQXJRTO-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical class [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 description 1
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 1
- OJUNDVWJGXVXGJ-UHFFFAOYSA-M [Cl-].CCCCC(CC)C[Mg+] Chemical compound [Cl-].CCCCC(CC)C[Mg+] OJUNDVWJGXVXGJ-UHFFFAOYSA-M 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 125000005264 aryl amine group Chemical group 0.000 description 1
- 229920005601 base polymer Polymers 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- WMUIZUWOEIQJEH-UHFFFAOYSA-N benzo[e][1,3]benzoxazole Chemical compound C1=CC=C2C(N=CO3)=C3C=CC2=C1 WMUIZUWOEIQJEH-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical compound C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 1
- 239000012964 benzotriazole Substances 0.000 description 1
- JRXXLCKWQFKACW-UHFFFAOYSA-N biphenylacetylene Chemical compound C1=CC=CC=C1C#CC1=CC=CC=C1 JRXXLCKWQFKACW-UHFFFAOYSA-N 0.000 description 1
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000000480 butynyl group Chemical group [*]C#CC([H])([H])C([H])([H])[H] 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000002800 charge carrier Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 125000001162 cycloheptenyl group Chemical group C1(=CCCCCC1)* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000522 cyclooctenyl group Chemical group C1(=CCCCCCC1)* 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 125000005266 diarylamine group Chemical group 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 229960000452 diethylstilbestrol Drugs 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- JKFAIQOWCVVSKC-UHFFFAOYSA-N furazan Chemical compound C=1C=NON=1 JKFAIQOWCVVSKC-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 125000006038 hexenyl group Chemical group 0.000 description 1
- 125000005980 hexynyl group Chemical group 0.000 description 1
- 230000005525 hole transport Effects 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 150000003949 imides Chemical class 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- HOBCFUWDNJPFHB-UHFFFAOYSA-N indolizine Chemical compound C1=CC=CN2C=CC=C21 HOBCFUWDNJPFHB-UHFFFAOYSA-N 0.000 description 1
- 238000007641 inkjet printing Methods 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000004365 octenyl group Chemical group C(=CCCCCCC)* 0.000 description 1
- 125000005069 octynyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C#C* 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 229910052762 osmium Inorganic materials 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000005981 pentynyl group Chemical group 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- RKPUJZVCCNLCAG-UHFFFAOYSA-N phenanthrene-1,2-dicarbaldehyde Chemical compound C1=CC=C2C3=CC=C(C=O)C(C=O)=C3C=CC2=C1 RKPUJZVCCNLCAG-UHFFFAOYSA-N 0.000 description 1
- 150000002988 phenazines Chemical class 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229920001690 polydopamine Polymers 0.000 description 1
- 229920002098 polyfluorene Polymers 0.000 description 1
- 229920006254 polymer film Polymers 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002568 propynyl group Chemical group [*]C#CC([H])([H])[H] 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical compound N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 1
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 229910052707 ruthenium Inorganic materials 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- MNWBNISUBARLIT-UHFFFAOYSA-N sodium cyanide Chemical compound [Na+].N#[C-] MNWBNISUBARLIT-UHFFFAOYSA-N 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- XTQHKBHJIVJGKJ-UHFFFAOYSA-N sulfur monoxide Chemical compound S=O XTQHKBHJIVJGKJ-UHFFFAOYSA-N 0.000 description 1
- 125000006836 terphenylene group Chemical group 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 229910052723 transition metal Inorganic materials 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- WRECIMRULFAWHA-UHFFFAOYSA-N trimethyl borate Chemical compound COB(OC)OC WRECIMRULFAWHA-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000010626 work up procedure Methods 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/02—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/57—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton
- C07C211/61—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton with at least one of the condensed ring systems formed by three or more rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C25/00—Compounds containing at least one halogen atom bound to a six-membered aromatic ring
- C07C25/18—Polycyclic aromatic halogenated hydrocarbons
- C07C25/22—Polycyclic aromatic halogenated hydrocarbons with condensed rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C25/00—Compounds containing at least one halogen atom bound to a six-membered aromatic ring
- C07C25/24—Halogenated aromatic hydrocarbons with unsaturated side chains
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/12—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule
- C08G61/121—Macromolecular compounds containing atoms other than carbon in the main chain of the macromolecule derived from organic halides
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G73/00—Macromolecular compounds obtained by reactions forming a linkage containing nitrogen with or without oxygen or carbon in the main chain of the macromolecule, not provided for in groups C08G12/00 - C08G71/00
- C08G73/02—Polyamines
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/101—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing an anthracene dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/105—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing a methine or polymethine dye
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B69/00—Dyes not provided for by a single group of this subclass
- C09B69/10—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds
- C09B69/109—Polymeric dyes; Reaction products of dyes with monomers or with macromolecular compounds containing other specific dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K10/00—Organic devices specially adapted for rectifying, amplifying, oscillating or switching; Organic capacitors or resistors having a potential-jump barrier or a surface barrier
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/151—Copolymers
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/02—Ortho- or ortho- and peri-condensed systems
- C07C2603/04—Ortho- or ortho- and peri-condensed systems containing three rings
- C07C2603/22—Ortho- or ortho- and peri-condensed systems containing three rings containing only six-membered rings
- C07C2603/26—Phenanthrenes; Hydrogenated phenanthrenes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/14—Macromolecular compounds
- C09K2211/1408—Carbocyclic compounds
- C09K2211/1416—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/14—Macromolecular compounds
- C09K2211/1441—Heterocyclic
- C09K2211/1458—Heterocyclic containing sulfur as the only heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/14—Macromolecular compounds
- C09K2211/1441—Heterocyclic
- C09K2211/1466—Heterocyclic containing nitrogen as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/10—Organic polymers or oligomers
- H10K85/111—Organic polymers or oligomers comprising aromatic, heteroaromatic, or aryl chains, e.g. polyaniline, polyphenylene or polyphenylene vinylene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/12—All metal or with adjacent metals
- Y10T428/12493—Composite; i.e., plural, adjacent, spatially distinct metal components [e.g., layers, joint, etc.]
- Y10T428/12535—Composite; i.e., plural, adjacent, spatially distinct metal components [e.g., layers, joint, etc.] with additional, spatially distinct nonmetal component
- Y10T428/12556—Organic component
Definitions
- Preferred polymers according to the invention are those in which at least one structural element has charge transport properties, ie. H. contain the units from groups 1 and / or 2.
- the preferred proportion can be different again, for example up to 100 mol%, if the units are hole-conducting or electron-conducting.
- polymers according to the invention in which the index m, the same or different with each occurrence, is 0 or 1.
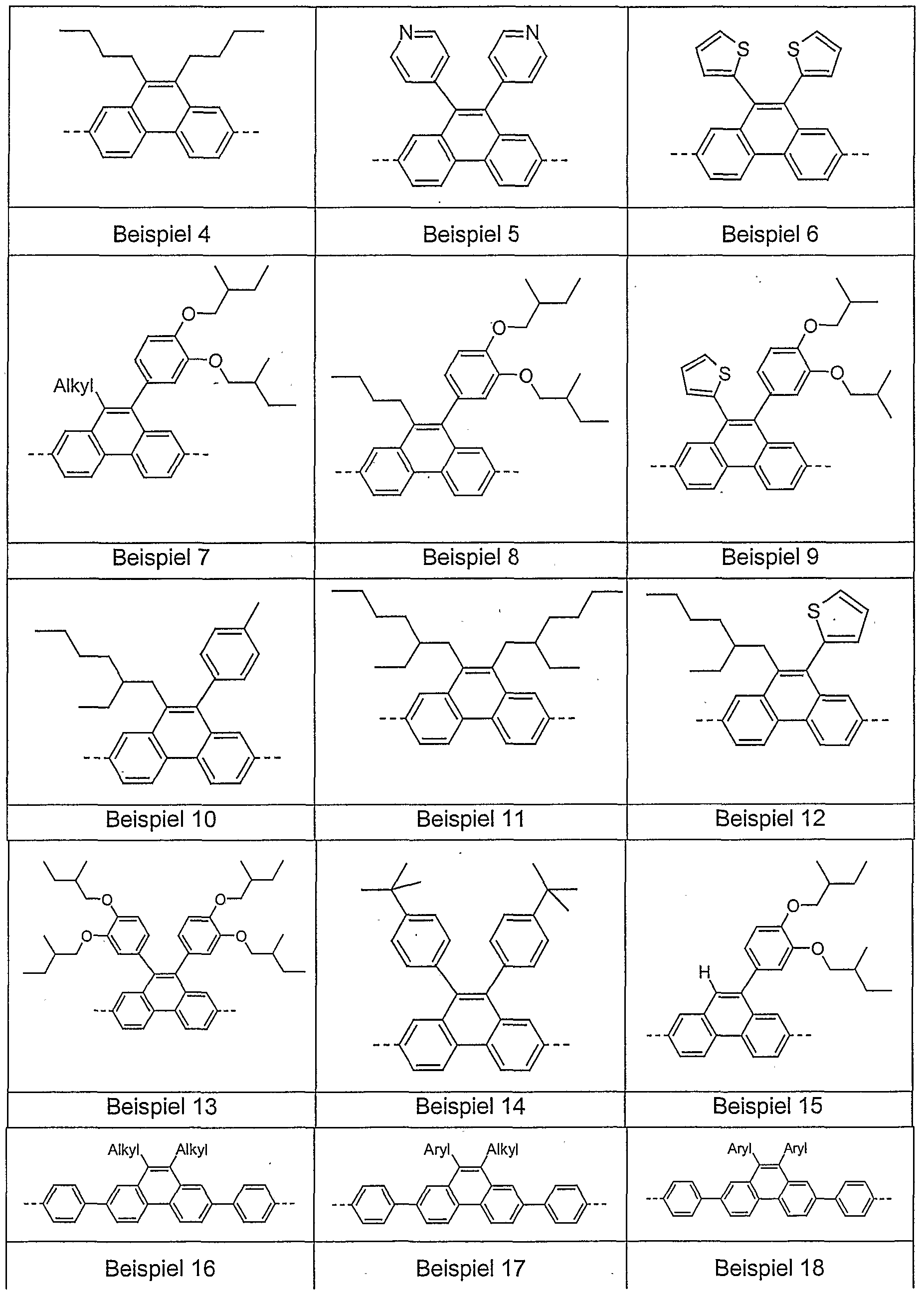
- Examples of preferred units according to formula (1) are structures according to the examples 1 to 36 shown, the linkage in the polymer taking place in each case through the 2,7 positions of the phenanthrene units, as indicated by the dashed bonds. Possible substituents on the R groups are generally not listed for better clarity.
- Alkyl here generally stands for an aliphatic alkyl group, aryl for an aromatic or heteroaromatic system, as described for R.
- Examples 1 to 21 are examples of backbone units, examples 22 to 33 examples of emitting units and examples 34 to 36 examples of hole-conducting units.
- the polymers according to the invention can be used in PLEDs. These contain
- PLEDs can be produced is described in detail as a general method in WO 04/037887, which must be adapted accordingly for the individual case.
- the invention thus also relates to a PLED with one or more active layers, at least one of these active layers containing one or more polymers according to the invention.
- the active layer can be, for example, a light-emitting layer and / or a transport layer and / or a charge injection layer and / or an intermediate layer.
- Table 1 EL data of some polymers according to the invention and a comparison polymer (the efficiency stands for the maximum efficiency, the voltage is the voltage for a brightness of 100 cd / m 2 is required and the color is specified in CIE x / y coordinates).
Abstract
Description
Claims
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/578,540 US7947382B2 (en) | 2004-04-26 | 2005-04-26 | Electroluminescent polymers and the use thereof |
| DE502005006329T DE502005006329D1 (de) | 2004-04-26 | 2005-04-26 | Elektrolumineszierende polymere und deren verwendung |
| EP05744529A EP1741149B1 (de) | 2004-04-26 | 2005-04-26 | Elektrolumineszierende polymere und deren verwendung |
| KR1020067022228A KR101188157B1 (ko) | 2004-04-26 | 2005-04-26 | 전자발광 중합체 및 그의 용도 |
| JP2007509955A JP5500565B2 (ja) | 2004-04-26 | 2005-04-26 | エレクトロルミネセンスポリマーおよびその使用 |
| CN2005800132067A CN1947275B (zh) | 2004-04-26 | 2005-04-26 | 电致发光聚合物和其用途 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE102004020298A DE102004020298A1 (de) | 2004-04-26 | 2004-04-26 | Elektrolumineszierende Polymere und deren Verwendung |
| DE102004020298.2 | 2004-04-26 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2005104264A1 true WO2005104264A1 (de) | 2005-11-03 |
Family
ID=34968099
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/EP2005/004448 WO2005104264A1 (de) | 2004-04-26 | 2005-04-26 | Elektrolumineszierende polymere und deren verwendung |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US7947382B2 (de) |
| EP (1) | EP1741149B1 (de) |
| JP (1) | JP5500565B2 (de) |
| KR (1) | KR101188157B1 (de) |
| CN (1) | CN1947275B (de) |
| AT (1) | ATE418798T1 (de) |
| DE (2) | DE102004020298A1 (de) |
| WO (1) | WO2005104264A1 (de) |
Cited By (238)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007022845A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2007090773A1 (en) * | 2006-02-10 | 2007-08-16 | Ciba Holding Inc. | Novel polymers |
| WO2008006743A1 (en) * | 2006-07-14 | 2008-01-17 | Ciba Holding Inc | Novel electroluminescent polymers for electronic applications |
| WO2008019744A1 (de) * | 2006-08-17 | 2008-02-21 | Merck Patent Gmbh | Konjugierte polymere, verfahren zu deren herstellung sowie deren verwendung |
| WO2008143272A1 (ja) * | 2007-05-17 | 2008-11-27 | Sumitomo Chemical Company, Limited | アントラセン系高分子化合物及びそれを用いてなる発光素子 |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008015526A1 (de) | 2008-03-25 | 2009-10-01 | Merck Patent Gmbh | Metallkomplexe |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| JP2009536981A (ja) * | 2006-05-12 | 2009-10-22 | メルク パテント ゲーエムベーハー | インデノフルオレンポリマー系有機半導体材料 |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008044868A1 (de) * | 2008-08-29 | 2010-03-04 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057050A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057051A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| DE102009010714A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung |
| WO2010099852A1 (de) | 2009-03-02 | 2010-09-10 | Merck Patent Gmbh | Metallkomplexe mit azaborol-liganden und elektronische vorrichtung damit |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2248869A2 (de) | 2005-09-12 | 2010-11-10 | Merck Patent GmbH | Verbindungen für organische elektronische Vorrichtungen |
| US20100288974A1 (en) * | 2005-08-10 | 2010-11-18 | Merck Patent Gmbh | Electroluminescent polymers and use thereof |
| WO2010136112A1 (en) * | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Conjugated polymers and their use as organic semiconductors |
| WO2010145726A1 (en) * | 2009-06-15 | 2010-12-23 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Pyrene-based polymers for organic light emitting diodes (oleds ) |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011012212A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011060867A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Stickstoffhaltige kondensierte heterozyklen für oleds |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011088877A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| WO2011116865A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2011116857A1 (en) | 2010-03-23 | 2011-09-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2011128017A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Überbrückte triarylamine und -phosphine als materialien für elektronische vorrichtungen |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| WO2012110182A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP2514736A1 (de) | 2006-07-28 | 2012-10-24 | Basf Se | Zwischenprodukte für Polymere |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012163464A1 (en) | 2011-06-01 | 2012-12-06 | Merck Patent Gmbh | Hybrid ambipolar tfts |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013013753A2 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Polymers and oligomers with functionalized side groups |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| US8445630B2 (en) | 2005-03-14 | 2013-05-21 | Basf Se | Polymers |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| WO2013182263A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Phenanthrenverbindungen für organische elektronische vorrichtungen |
| WO2013190705A1 (en) | 2012-06-21 | 2013-12-27 | L'oreal | Cosmetic composition comprising a supramolecular polymer, a non volatile silicone oil and a non volatile hydrocarbonated oil |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014102543A2 (en) * | 2012-12-24 | 2014-07-03 | Cambridge Display Technology Limited | Polymer and device |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US8865321B2 (en) | 2008-11-11 | 2014-10-21 | Merck Patent Gmbh | Organic electroluminescent devices |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| WO2015015183A1 (en) * | 2013-07-31 | 2015-02-05 | Cambridge Display Technology Limited | Polymer and organic electronic device |
| WO2015082879A1 (en) * | 2013-12-03 | 2015-06-11 | Cambridge Display Technology Limited | 4,7-phenanthroline containing polymer and organic electronic device |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| WO2015131976A1 (de) * | 2014-03-07 | 2015-09-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018095381A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 印刷油墨组合物及其制备方法和用途 |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US10323180B2 (en) | 2014-12-04 | 2019-06-18 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Deuterated organic compound, mixture and composition containing said compound, and organic electronic device |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| US10364316B2 (en) | 2015-01-13 | 2019-07-30 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Conjugated polymer containing ethynyl crosslinking group, mixture, formulation, organic electronic device containing the same and application therof |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019168366A1 (ko) | 2018-02-28 | 2019-09-06 | 주식회사 엘지화학 | 중합체, 이를 포함하는 코팅 조성물 및 이를 이용한 유기 발광 소자 |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019212183A1 (ko) * | 2018-05-03 | 2019-11-07 | 주식회사 엘지화학 | 중합성 액정 화합물, 광학 소자용 액정 조성물, 중합체, 광학 이방체 및 디스플레이 장치용 광학 소자 |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| US10573827B2 (en) | 2014-12-11 | 2020-02-25 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Organic metal complex, and polymer, mixture, composition and organic electronic device containing same and use thereof |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| US11555128B2 (en) | 2015-11-12 | 2023-01-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing composition, electronic device comprising same and preparation method for functional material thin film |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
Families Citing this family (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2325226A1 (de) * | 2002-10-30 | 2011-05-25 | Sumitomo Chemical Company, Limited | Aryl-Copolymerverbindungen und damit hergestellte lichtemittierende Vorrichtungen aus Polymer |
| DE502005009868D1 (de) | 2004-05-19 | 2010-08-19 | Merck Patent Gmbh | Metallkomplexe |
| EP1645610A1 (de) | 2004-10-11 | 2006-04-12 | Covion Organic Semiconductors GmbH | Phenanthren-Derivate |
| US20070191583A1 (en) * | 2005-12-19 | 2007-08-16 | Josemon Jacob | Polymers based on 3,6-and 2,7-conjugated poly(phenanthrene) and pled devices |
| US20070152209A1 (en) * | 2005-12-19 | 2007-07-05 | Uckert Frank P | Devices using polymers based on 3,6- and 2,7-conjugated poly(phenanthrene) |
| DE102006006412A1 (de) * | 2006-02-13 | 2007-08-16 | Merck Patent Gmbh | Elektronisches Bauteil, Verfahren zu dessen Herstellung und dessen Verwendung |
| CN101553940B (zh) * | 2006-11-14 | 2010-10-13 | 出光兴产株式会社 | 有机薄膜晶体管和有机薄膜发光晶体管 |
| US20110173758A1 (en) * | 2008-06-20 | 2011-07-21 | Ricky Jay Fontaine | Inflatable mattress and method of operating same |
| JP5691177B2 (ja) * | 2009-01-29 | 2015-04-01 | 住友化学株式会社 | 高分子化合物及びそれを用いる発光素子 |
| CN102421858A (zh) | 2009-06-22 | 2012-04-18 | 默克专利有限公司 | 导电制剂 |
| JP5840621B2 (ja) | 2009-12-23 | 2016-01-06 | メルク パテント ゲーエムベーハー | 有機半導体化合物を含む組成物 |
| EP2559079B1 (de) | 2010-04-12 | 2020-04-01 | Merck Patent GmbH | Zusammensetzung und verfahren zur herstellung organischer elektronischer vorrichtungen |
| EP2576724B1 (de) | 2010-05-27 | 2019-04-24 | Merck Patent GmbH | Verfahren zur herstellung organischer elektronischer vorrichtungen |
| CN102391479B (zh) * | 2011-09-19 | 2013-05-22 | 南昌大学 | 功能基封端的基于n-取代咔唑和氟代苯并噻二唑共轭聚合物及制备和应用 |
| CN104093689A (zh) | 2012-01-31 | 2014-10-08 | 剑桥显示技术有限公司 | 聚合物 |
| WO2013191086A1 (ja) * | 2012-06-19 | 2013-12-27 | 住友化学株式会社 | 高分子化合物およびそれを用いた発光素子 |
| WO2014008971A1 (en) * | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Organic electronic device comprising an organic semiconductor formulation |
| JP6545619B2 (ja) * | 2012-09-27 | 2019-07-17 | メルク パテント ゲーエムベーハー | 有機エレクトロルミッセンス素子のための材料 |
| KR20210056453A (ko) * | 2012-11-23 | 2021-05-18 | 메르크 파텐트 게엠베하 | 전자 소자용 재료 |
| EP2985802B1 (de) * | 2013-04-11 | 2017-08-30 | Nippon Steel & Sumikin Chemical Co., Ltd. | Adamantanverbindung für organische elektrolumineszenzelemente und organisches elektrolumineszenzelement |
| CN103254044B (zh) * | 2013-05-22 | 2015-08-26 | 河南省科学院化学研究所有限公司 | 2,7-二溴-9,10取代-菲衍生物 |
| KR102105891B1 (ko) * | 2013-07-09 | 2020-05-04 | 에스케이이노베이션 주식회사 | 신규 착화합물 및 이를 이용한 폴리(알킬렌 카보네이트)의 제조방법 |
| WO2016065136A1 (en) * | 2014-10-22 | 2016-04-28 | He Yan | Conjugated polymers based on terthiophene and their applications |
| KR102561772B1 (ko) * | 2018-09-11 | 2023-07-28 | 주식회사 엘지화학 | 신규한 고분자 및 이를 이용한 유기 발광 소자 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1329474A1 (de) * | 2002-01-11 | 2003-07-23 | Xerox Corporation | Polythiophene und damit hergestellte Vorrichtungen |
| WO2004037887A2 (de) * | 2002-10-25 | 2004-05-06 | Covion Organic Semiconductors Gmbh | Arylamin-einheiten enthaltende konjugierte polymere, deren darstellung und verwendung |
Family Cites Families (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2597977B1 (fr) | 1986-04-24 | 1990-09-21 | Commissariat Energie Atomique | Systeme de bobines pour la production de gradients de champs magnetiques de polarisation tres uniformes dans une installation d'imagerie ou de spectroscopie par rmn |
| JP2526585B2 (ja) * | 1986-07-29 | 1996-08-21 | 三菱瓦斯化学株式会社 | 炭素材料用原料ピッチの製造法 |
| GB8909011D0 (en) | 1989-04-20 | 1989-06-07 | Friend Richard H | Electroluminescent devices |
| US5609970A (en) * | 1995-01-12 | 1997-03-11 | Polaroid Corporation | Electroluminescent device with polymeric charge injection layer |
| US5792568A (en) * | 1995-04-25 | 1998-08-11 | Sharp Kabushiki Kaisha | Organic electroluminescent element |
| JP3697347B2 (ja) | 1998-02-25 | 2005-09-21 | 株式会社東芝 | シールド形コイルユニットおよびmri用能動遮蔽形傾斜磁場コイルユニット |
| KR100280707B1 (ko) * | 1998-11-12 | 2001-02-01 | 김순택 | 발광 화합물 및 이를 발색재료로서 채용하고있는 표시소자 |
| KR100280709B1 (ko) * | 1998-11-12 | 2001-02-01 | 김순택 | 발광 화합물 및 이를 발색재료로서 채용하고있는 표시소자 |
| CA2360644A1 (en) | 1999-02-04 | 2000-08-10 | The Dow Chemical Company | Fluorene copolymers and devices made therefrom |
| US6493572B1 (en) | 1999-09-30 | 2002-12-10 | Toshiba America Mri, Inc. | Inherently de-coupled sandwiched solenoidal array coil |
| JP4421079B2 (ja) | 2000-05-23 | 2010-02-24 | 株式会社東芝 | Mri用傾斜磁場コイル |
| DE10109027A1 (de) | 2001-02-24 | 2002-09-05 | Covion Organic Semiconductors | Rhodium- und Iridium-Komplexe |
| JP4438042B2 (ja) | 2001-03-08 | 2010-03-24 | キヤノン株式会社 | 金属配位化合物、電界発光素子及び表示装置 |
| CN100357370C (zh) | 2001-03-10 | 2007-12-26 | 默克专利有限公司 | 有机半导体的溶液与分散液 |
| WO2002077060A1 (de) | 2001-03-24 | 2002-10-03 | Covion Organic Semiconductors Gmbh | Konjugierte polymere enthaltend spirobifluoren-einheiten und fluoren-einheiten und deren verwendung |
| DE10116962A1 (de) | 2001-04-05 | 2002-10-10 | Covion Organic Semiconductors | Rhodium- und Iridium-Komplexe |
| JP2003055276A (ja) * | 2001-08-10 | 2003-02-26 | Sony Corp | フェナントレン誘導体及びその製造方法、並びにその合成中間体及びその製造方法、及びそのフェナントレン誘導体を用いた有機電界発光素子 |
| DE10141624A1 (de) | 2001-08-24 | 2003-03-06 | Covion Organic Semiconductors | Lösungen polymerer Halbleiter |
| DE10143353A1 (de) | 2001-09-04 | 2003-03-20 | Covion Organic Semiconductors | Konjugierte Polymere enthaltend Spirobifluoren-Einheiten und deren Verwendung |
| CN1139617C (zh) * | 2001-11-30 | 2004-02-25 | 中国科学院化学研究所 | 含喹喔啉的共轭高聚物及其应用 |
| DE10159946A1 (de) | 2001-12-06 | 2003-06-18 | Covion Organic Semiconductors | Prozess zur Herstellung von Aryl-Aryl gekoppelten Verbindungen |
| DE10238903A1 (de) | 2002-08-24 | 2004-03-04 | Covion Organic Semiconductors Gmbh | Rhodium- und Iridium-Komplexe |
| DE10304819A1 (de) | 2003-02-06 | 2004-08-19 | Covion Organic Semiconductors Gmbh | Carbazol-enthaltende konjugierte Polymere und Blends, deren Darstellung und Verwendung |
| JP4090389B2 (ja) | 2003-06-10 | 2008-05-28 | 株式会社日立製作所 | 核磁気共鳴装置 |
| DE10328627A1 (de) | 2003-06-26 | 2005-02-17 | Covion Organic Semiconductors Gmbh | Neue Materialien für die Elektrolumineszenz |
| DE10337077A1 (de) | 2003-08-12 | 2005-03-10 | Covion Organic Semiconductors | Konjugierte Copolymere, deren Darstellung und Verwendung |
| DE10337346A1 (de) | 2003-08-12 | 2005-03-31 | Covion Organic Semiconductors Gmbh | Konjugierte Polymere enthaltend Dihydrophenanthren-Einheiten und deren Verwendung |
| DE10343606A1 (de) * | 2003-09-20 | 2005-04-14 | Covion Organic Semiconductors Gmbh | Weiß emittierende Copolymere, deren Darstellung und Verwendung |
| DE10349033A1 (de) | 2003-10-22 | 2005-05-25 | Covion Organic Semiconductors Gmbh | Neue Materialien für die Elektrolumineszenz und deren Verwendung |
| DE10350606A1 (de) | 2003-10-30 | 2005-06-09 | Covion Organic Semiconductors Gmbh | Verfahren zur Herstellung heteroleptischer, ortho-metallierter Organometall-Verbindungen |
-
2004
- 2004-04-26 DE DE102004020298A patent/DE102004020298A1/de not_active Withdrawn
-
2005
- 2005-04-26 CN CN2005800132067A patent/CN1947275B/zh active Active
- 2005-04-26 JP JP2007509955A patent/JP5500565B2/ja active Active
- 2005-04-26 EP EP05744529A patent/EP1741149B1/de active Active
- 2005-04-26 DE DE502005006329T patent/DE502005006329D1/de active Active
- 2005-04-26 AT AT05744529T patent/ATE418798T1/de not_active IP Right Cessation
- 2005-04-26 US US11/578,540 patent/US7947382B2/en active Active
- 2005-04-26 KR KR1020067022228A patent/KR101188157B1/ko active IP Right Grant
- 2005-04-26 WO PCT/EP2005/004448 patent/WO2005104264A1/de not_active Application Discontinuation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1329474A1 (de) * | 2002-01-11 | 2003-07-23 | Xerox Corporation | Polythiophene und damit hergestellte Vorrichtungen |
| WO2004037887A2 (de) * | 2002-10-25 | 2004-05-06 | Covion Organic Semiconductors Gmbh | Arylamin-einheiten enthaltende konjugierte polymere, deren darstellung und verwendung |
Non-Patent Citations (4)
| Title |
|---|
| CHARLES K. BRADSHER, LEO E. BEAVERS, N. TOKURA: "Aromatic Cyclodehydration. XXXIII. 2,7-Disubstituted Phenanthrenes", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 78, 1956, pages 3196 - 3198, XP002339238 * |
| LEE C. WASHBURN, D.E. PEARSON: "Potential Antimalarials. 8. Some 10-Substituted 9-Phenanthrenemethanols", JOURNAL OF MEDICINAL CHEMISTRY, vol. 17, no. 7, 1974, pages 676 - 682, XP002339239 * |
| V. N. BOCHENKOV: "Synthesis of some 2,7- and 2,5-Disubstituted Phenanthrenes", JOURNAL OF ORGANIC CHEMISTRY OF THE USSR, vol. 12, 1976, pages 2355 - 2357, XP009051835 * |
| WELDON G. BROWN, BEN A. BLUESTEIN: "Conversion of 2,7-Dibromofluorene to 2,7-Dibromophenanthrene", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 65, 1943, pages 1235 - 1236, XP002339237 * |
Cited By (330)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8445630B2 (en) | 2005-03-14 | 2013-05-21 | Basf Se | Polymers |
| US20100288974A1 (en) * | 2005-08-10 | 2010-11-18 | Merck Patent Gmbh | Electroluminescent polymers and use thereof |
| WO2007022845A1 (de) | 2005-08-26 | 2007-03-01 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| EP3211058A1 (de) | 2005-08-26 | 2017-08-30 | Merck Patent GmbH | Neue materialien für organische elektrolumineszenzvorrichtungen |
| EP2248869A2 (de) | 2005-09-12 | 2010-11-10 | Merck Patent GmbH | Verbindungen für organische elektronische Vorrichtungen |
| WO2007090773A1 (en) * | 2006-02-10 | 2007-08-16 | Ciba Holding Inc. | Novel polymers |
| KR101368183B1 (ko) | 2006-02-10 | 2014-02-27 | 시바 홀딩 인크 | 신규 중합체 |
| US8138303B2 (en) | 2006-02-10 | 2012-03-20 | Basf Se | Polymers |
| JP2009526111A (ja) * | 2006-02-10 | 2009-07-16 | チバ ホールディング インコーポレーテッド | 新規ポリマー |
| JP2009536981A (ja) * | 2006-05-12 | 2009-10-22 | メルク パテント ゲーエムベーハー | インデノフルオレンポリマー系有機半導体材料 |
| US8221906B2 (en) | 2006-07-14 | 2012-07-17 | Basf Se | Electroluminescent polymers for electronic applications |
| WO2008006743A1 (en) * | 2006-07-14 | 2008-01-17 | Ciba Holding Inc | Novel electroluminescent polymers for electronic applications |
| CN101490125B (zh) * | 2006-07-14 | 2012-11-14 | 西巴控股有限公司 | 用于电子应用的新型电致发光聚合物 |
| EP2514736A1 (de) | 2006-07-28 | 2012-10-24 | Basf Se | Zwischenprodukte für Polymere |
| WO2008019744A1 (de) * | 2006-08-17 | 2008-02-21 | Merck Patent Gmbh | Konjugierte polymere, verfahren zu deren herstellung sowie deren verwendung |
| US8513877B2 (en) | 2007-05-17 | 2013-08-20 | Sumitomo Chemical Company, Limited | Anthracene polymer compound and light emitting device using the same |
| WO2008143272A1 (ja) * | 2007-05-17 | 2008-11-27 | Sumitomo Chemical Company, Limited | アントラセン系高分子化合物及びそれを用いてなる発光素子 |
| DE102007024850A1 (de) | 2007-05-29 | 2008-12-04 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008015526A1 (de) | 2008-03-25 | 2009-10-01 | Merck Patent Gmbh | Metallkomplexe |
| DE102008017591A1 (de) | 2008-04-07 | 2009-10-08 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008018670A1 (de) | 2008-04-14 | 2009-10-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US9481826B2 (en) | 2008-06-05 | 2016-11-01 | Merck Patent Gmbh | Electronic device comprising metal complexes |
| DE102008027005A1 (de) | 2008-06-05 | 2009-12-10 | Merck Patent Gmbh | Organische elektronische Vorrichtung enthaltend Metallkomplexe |
| US10538698B2 (en) | 2008-06-05 | 2020-01-21 | Merck Patent Gmbh | Electronic device comprising metal complexes |
| DE102008033943A1 (de) | 2008-07-18 | 2010-01-21 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8580395B2 (en) | 2008-08-29 | 2013-11-12 | Merck Patent Gmbh | Electroluminescent polymers, method for the production thereof, and use thereof |
| DE102008044868A1 (de) * | 2008-08-29 | 2010-03-04 | Merck Patent Gmbh | Elektrolumineszierende Polymere, Verfahren zu ihrer Herstellung sowie ihre Verwendung |
| US8637168B2 (en) | 2008-10-08 | 2014-01-28 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102008050841B4 (de) | 2008-10-08 | 2019-08-01 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008050841A1 (de) | 2008-10-08 | 2010-04-15 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008054141A1 (de) | 2008-10-31 | 2010-05-06 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8865321B2 (en) | 2008-11-11 | 2014-10-21 | Merck Patent Gmbh | Organic electroluminescent devices |
| DE102008056688A1 (de) | 2008-11-11 | 2010-05-12 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057051A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102008057050A1 (de) | 2008-11-13 | 2010-05-20 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| US8597798B2 (en) | 2008-11-13 | 2013-12-03 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| US9475792B2 (en) | 2009-01-20 | 2016-10-25 | Merck Patent Gmbh | Materials for organic electroluminescence devices |
| DE102009005288A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009005289A1 (de) | 2009-01-20 | 2010-07-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010083873A1 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2010083872A2 (de) | 2009-01-20 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009005289B4 (de) | 2009-01-20 | 2023-06-22 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen, Verfahren zu deren Herstellung und elektronische Vorrichtungen, enthaltend diese |
| DE102009005746A1 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010083869A2 (de) | 2009-01-23 | 2010-07-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US8710284B2 (en) | 2009-01-23 | 2014-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices containing substituted 10-benzo[c]phenanthrenes |
| US9006503B2 (en) | 2009-01-23 | 2015-04-14 | Merck Patent Gmbh | Organic electroluminescence devices containing substituted benzo[C]phenanthrenes |
| DE102009007038A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| US9169282B2 (en) | 2009-02-02 | 2015-10-27 | Merck Patent Gmbh | Metal complexes |
| WO2010086089A1 (de) | 2009-02-02 | 2010-08-05 | Merck Patent Gmbh | Metallkomplexe |
| DE102009009277B4 (de) | 2009-02-17 | 2023-12-07 | Merck Patent Gmbh | Organische elektronische Vorrichtung, Verfahren zu deren Herstellung und Verwendung von Verbindungen |
| WO2010094378A1 (de) | 2009-02-17 | 2010-08-26 | Merck Patent Gmbh | Organische elektronische vorrichtung |
| DE102009009277A1 (de) | 2009-02-17 | 2010-08-19 | Merck Patent Gmbh | Organische elektronische Vorrichtung |
| US9066410B2 (en) | 2009-02-17 | 2015-06-23 | Merck Patent Gmbh | Organic electronic device |
| US9315617B2 (en) | 2009-02-27 | 2016-04-19 | Merck Patent Gmbh | Crosslinkable and crosslinked polymers, method for the production thereof, and use thereof |
| DE102009010714A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte Polymere, Verfahren zu deren Herstellung sowie deren Verwendung |
| WO2010097156A1 (de) | 2009-02-27 | 2010-09-02 | Merck Patent Gmbh | Vernetzbare und vernetzte polymere, verfahren zu deren herstellung sowie deren verwendung |
| US9074128B2 (en) | 2009-03-02 | 2015-07-07 | Merck Patent Gmbh | Metal complexes having azaborol ligands and electronic device having the same |
| WO2010099852A1 (de) | 2009-03-02 | 2010-09-10 | Merck Patent Gmbh | Metallkomplexe mit azaborol-liganden und elektronische vorrichtung damit |
| DE102009011223A1 (de) | 2009-03-02 | 2010-09-23 | Merck Patent Gmbh | Metallkomplexe |
| DE102009013041A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2010102709A1 (de) | 2009-03-13 | 2010-09-16 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US9085579B2 (en) | 2009-03-13 | 2015-07-21 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| DE102009022858A1 (de) | 2009-05-27 | 2011-12-15 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| KR101854920B1 (ko) | 2009-05-29 | 2018-05-04 | 메르크 파텐트 게엠베하 | 공액 중합체 및 유기 반도체로서의 그 사용 |
| US8398895B2 (en) | 2009-05-29 | 2013-03-19 | Merck Patent Gesellschaft Mit Beschrankter Haftung | Conjugated polymers and their use as organic semiconductors |
| WO2010136112A1 (en) * | 2009-05-29 | 2010-12-02 | Merck Patent Gmbh | Conjugated polymers and their use as organic semiconductors |
| WO2010145726A1 (en) * | 2009-06-15 | 2010-12-23 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Pyrene-based polymers for organic light emitting diodes (oleds ) |
| WO2011000455A1 (de) | 2009-06-30 | 2011-01-06 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009031021A1 (de) | 2009-06-30 | 2011-01-05 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009033371A1 (de) | 2009-07-16 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009034625A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011012212A1 (de) | 2009-07-27 | 2011-02-03 | Merck Patent Gmbh | Neue materialien für organische elektrolumineszenzvorrichtungen |
| WO2011015265A2 (en) | 2009-08-04 | 2011-02-10 | Merck Patent Gmbh | Electronic devices comprising multi cyclic hydrocarbons |
| WO2011035836A1 (de) | 2009-09-23 | 2011-03-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009042693A1 (de) | 2009-09-23 | 2011-03-24 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011042107A2 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009048791A1 (de) | 2009-10-08 | 2011-04-14 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009049587A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| WO2011044988A1 (de) | 2009-10-16 | 2011-04-21 | Merck Patent Gmbh | Metallkomplexe |
| DE102009053191A1 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011054442A2 (de) | 2009-11-06 | 2011-05-12 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009052428A1 (de) | 2009-11-10 | 2011-05-12 | Merck Patent Gmbh | Verbindung für elektronische Vorrichtungen |
| WO2011057701A1 (de) | 2009-11-10 | 2011-05-19 | Merck Patent Gmbh | Organische verbindungen für elektroluminiszenz vorrichtungen |
| WO2011057706A2 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102009053382A1 (de) | 2009-11-14 | 2011-05-19 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102009053644A1 (de) | 2009-11-17 | 2011-05-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102009053644B4 (de) | 2009-11-17 | 2019-07-04 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011060859A1 (de) | 2009-11-17 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102009053836A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011060867A1 (de) | 2009-11-18 | 2011-05-26 | Merck Patent Gmbh | Stickstoffhaltige kondensierte heterozyklen für oleds |
| WO2011076314A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent formulations |
| WO2011076326A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Electroluminescent functional surfactants |
| WO2011076323A1 (en) | 2009-12-22 | 2011-06-30 | Merck Patent Gmbh | Formulations comprising phase-separated functional materials |
| WO2011085781A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010004803A1 (de) | 2010-01-16 | 2011-07-21 | Merck Patent GmbH, 64293 | Materialien für organische Elektrolumineszenzvorrichtungen |
| DE102010005697A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent GmbH, 64293 | Verbindungen für elektronische Vorrichtungen |
| WO2011088877A1 (de) | 2010-01-25 | 2011-07-28 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102010009193A1 (de) | 2010-02-24 | 2011-08-25 | Merck Patent GmbH, 64293 | Fluor-Fluor Assoziate |
| WO2011103953A1 (de) | 2010-02-24 | 2011-09-01 | Merck Patent Gmbh | Fluor-fluor assoziate |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011107186A2 (de) | 2010-03-02 | 2011-09-09 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011110275A2 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Radiative fibers |
| WO2011110277A1 (en) | 2010-03-11 | 2011-09-15 | Merck Patent Gmbh | Fibers in therapy and cosmetics |
| WO2011116857A1 (en) | 2010-03-23 | 2011-09-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2011116865A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010012738A1 (de) | 2010-03-25 | 2011-09-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2011128017A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Überbrückte triarylamine und -phosphine als materialien für elektronische vorrichtungen |
| DE102010014933A1 (de) | 2010-04-14 | 2011-10-20 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011137951A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische elektrolumineszenzvorrichtungen |
| DE102010019306A1 (de) | 2010-05-04 | 2011-11-10 | Merck Patent Gmbh | Organische Elektrolumineszenzvorrichtungen |
| WO2011147521A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Down conversion |
| WO2011147522A1 (en) | 2010-05-27 | 2011-12-01 | Merck Patent Gmbh | Compositions comprising quantum dots |
| EP3309236A1 (de) | 2010-05-27 | 2018-04-18 | Merck Patent GmbH | Zusammensetzungen mit quantenpunkten |
| DE102010024335A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2011157346A1 (de) | 2010-06-18 | 2011-12-22 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2011160757A1 (de) | 2010-06-22 | 2011-12-29 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010024542A1 (de) | 2010-06-22 | 2011-12-22 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| WO2011160758A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| DE102010024897A1 (de) | 2010-06-24 | 2011-12-29 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012016630A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| DE102010033548A1 (de) | 2010-08-05 | 2012-02-09 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| DE102010048607A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| DE102010048608A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| WO2012048781A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Materialien auf basis von triphenylen für organische elektrolumineszenzvorrichtungen |
| WO2012048780A1 (de) | 2010-10-15 | 2012-04-19 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012095143A1 (de) | 2011-01-13 | 2012-07-19 | Merck Patent Gmbh | Verbindungen für organische elektrolumineszenzvorrichtungen |
| DE102012000064A1 (de) | 2011-01-21 | 2012-07-26 | Merck Patent Gmbh | Materialien für organische Elektrolumineszenzvorrichtungen |
| EP2482159A2 (de) | 2011-01-28 | 2012-08-01 | Honeywell International, Inc. | Verfahren und umkonfigurierbare System zur Optimierung der Leistung eines zustandsabhängigen Wartungssystems |
| WO2012107158A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | 1,3 - dioxan-5-on-verbindungen |
| DE102011010841A1 (de) | 2011-02-10 | 2012-08-16 | Merck Patent Gmbh | (1,3)-Dioxan-5-on-Verbindungen |
| WO2012110182A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102011011539A1 (de) | 2011-02-17 | 2012-08-23 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| WO2012139693A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012139692A1 (de) | 2011-04-13 | 2012-10-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2012143079A1 (de) | 2011-04-18 | 2012-10-26 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012150001A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012149999A1 (de) | 2011-05-05 | 2012-11-08 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2012163464A1 (en) | 2011-06-01 | 2012-12-06 | Merck Patent Gmbh | Hybrid ambipolar tfts |
| WO2013013753A2 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Polymers and oligomers with functionalized side groups |
| WO2013013754A1 (en) | 2011-07-25 | 2013-01-31 | Merck Patent Gmbh | Copolymers with functionalized side chains |
| WO2013017189A1 (de) | 2011-07-29 | 2013-02-07 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2013017192A1 (de) | 2011-08-03 | 2013-02-07 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP3439065A1 (de) | 2011-08-03 | 2019-02-06 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| DE102011116165A1 (de) | 2011-10-14 | 2013-04-18 | Merck Patent Gmbh | Benzodioxepin-3-on-Verbindungen |
| WO2013060418A1 (en) | 2011-10-27 | 2013-05-02 | Merck Patent Gmbh | Materials for electronic devices |
| WO2013083216A1 (de) | 2011-11-17 | 2013-06-13 | Merck Patent Gmbh | Spiro -dihydroacridinderivate und ihre verwendung als materialien für organische elektrolumineszenzvorrichtungen |
| WO2013087142A1 (de) | 2011-12-12 | 2013-06-20 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| DE102011121022A1 (de) | 2011-12-13 | 2013-06-13 | Merck Patent Gmbh | Organische Sensibilisatoren für Up- Conversion |
| WO2013087162A1 (de) | 2011-12-13 | 2013-06-20 | Merck Patent Gmbh | Organische sensibilisatoren für die aufwärtskonvers ion (up-conversion) |
| DE102012022880A1 (de) | 2011-12-22 | 2013-06-27 | Merck Patent Gmbh | Elektronische Vorrichtungen enthaltend organische Schichten |
| EP3101088A1 (de) | 2012-02-14 | 2016-12-07 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP3235892A1 (de) | 2012-02-14 | 2017-10-25 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2013120577A1 (en) | 2012-02-14 | 2013-08-22 | Merck Patent Gmbh | Spirobifluorene compounds for organic electroluminescent devices |
| WO2013139431A1 (de) | 2012-03-23 | 2013-09-26 | Merck Patent Gmbh | 9,9'-spirobixanthenderivate für elektrolumineszenzvorrichtungen |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| US11424411B2 (en) | 2012-06-06 | 2022-08-23 | Merck Patent Gmbh | Phenanthrene compounds for organic electronic devices |
| WO2013182263A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Phenanthrenverbindungen für organische elektronische vorrichtungen |
| US9799833B2 (en) | 2012-06-06 | 2017-10-24 | Merck Patent Gmbh | Phenanthrene compounds for organic electronic devices |
| US10446759B2 (en) | 2012-06-06 | 2019-10-15 | Merck Patent Gmbh | Phenanthrene compounds for organic electronic devices |
| WO2013190705A1 (en) | 2012-06-21 | 2013-12-27 | L'oreal | Cosmetic composition comprising a supramolecular polymer, a non volatile silicone oil and a non volatile hydrocarbonated oil |
| WO2014008982A1 (de) | 2012-07-13 | 2014-01-16 | Merck Patent Gmbh | Metallkomplexe |
| WO2014015937A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektrolumineszierende vorrichtungen |
| WO2014015935A2 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Verbindungen und organische elektronische vorrichtungen |
| WO2014015938A1 (de) | 2012-07-23 | 2014-01-30 | Merck Patent Gmbh | Derivate von 2-diarylaminofluoren und diese enthaltnde organische elektronische verbindungen |
| EP3424907A2 (de) | 2012-07-23 | 2019-01-09 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| DE202013012401U1 (de) | 2012-07-23 | 2016-10-12 | Merck Patent Gmbh | Verbindungen und Organische Elektronische Vorrichtungen |
| EP3424936A1 (de) | 2012-08-07 | 2019-01-09 | Merck Patent GmbH | Metallkomplexe |
| WO2014023377A2 (de) | 2012-08-07 | 2014-02-13 | Merck Patent Gmbh | Metallkomplexe |
| WO2014044347A1 (de) | 2012-09-20 | 2014-03-27 | Merck Patent Gmbh | Metallkomplexe |
| EP3378857A1 (de) | 2012-11-12 | 2018-09-26 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2014082705A1 (de) | 2012-11-30 | 2014-06-05 | Merck Patent Gmbh | Elektronische vorrichtung |
| WO2014102543A3 (en) * | 2012-12-24 | 2014-10-02 | Cambridge Display Technology Limited | Polymer and device |
| US9966534B2 (en) | 2012-12-24 | 2018-05-08 | Cambridge Display Technology Limited | Polymer and device |
| WO2014102543A2 (en) * | 2012-12-24 | 2014-07-03 | Cambridge Display Technology Limited | Polymer and device |
| WO2014106522A1 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2014106524A2 (de) | 2013-01-03 | 2014-07-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015014429A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elekrolumineszenzvorrichtung |
| WO2015014427A1 (de) | 2013-07-29 | 2015-02-05 | Merck Patent Gmbh | Elektrooptische vorrichtung und deren verwendung |
| US10290810B2 (en) | 2013-07-31 | 2019-05-14 | Cambridge Display Technology Limited | Polymer and organic electronic device |
| WO2015015183A1 (en) * | 2013-07-31 | 2015-02-05 | Cambridge Display Technology Limited | Polymer and organic electronic device |
| EP3904361A2 (de) | 2013-10-02 | 2021-11-03 | Merck Patent GmbH | Borenthaltende verbindungen |
| WO2015082879A1 (en) * | 2013-12-03 | 2015-06-11 | Cambridge Display Technology Limited | 4,7-phenanthroline containing polymer and organic electronic device |
| EP3693437A1 (de) | 2013-12-06 | 2020-08-12 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| EP3345984A1 (de) | 2013-12-06 | 2018-07-11 | Merck Patent GmbH | Verbindungen und organische elektronische vorrichtungen |
| WO2015086108A1 (de) | 2013-12-12 | 2015-06-18 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2015090504A2 (de) | 2013-12-19 | 2015-06-25 | Merck Patent Gmbh | Heterocyclische spiroverbindungen |
| EP3708634A1 (de) | 2013-12-19 | 2020-09-16 | Merck Patent GmbH | Heterocyclische spiroverbindungen |
| WO2015131976A1 (de) * | 2014-03-07 | 2015-09-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| US10727413B2 (en) | 2014-03-07 | 2020-07-28 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016034262A1 (de) | 2014-09-05 | 2016-03-10 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| WO2016074755A1 (de) | 2014-11-11 | 2016-05-19 | Merck Patent Gmbh | Materialien für organische elektrolumineszenzvorrichtungen |
| US10323180B2 (en) | 2014-12-04 | 2019-06-18 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Deuterated organic compound, mixture and composition containing said compound, and organic electronic device |
| US10573827B2 (en) | 2014-12-11 | 2020-02-25 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Organic metal complex, and polymer, mixture, composition and organic electronic device containing same and use thereof |
| WO2016107663A1 (de) | 2014-12-30 | 2016-07-07 | Merck Patent Gmbh | Formulierungen und elektronische vorrichtungen |
| US10364316B2 (en) | 2015-01-13 | 2019-07-30 | Guangzhou Chinaray Optoelectronics Materials Ltd. | Conjugated polymer containing ethynyl crosslinking group, mixture, formulation, organic electronic device containing the same and application therof |
| WO2016119992A1 (en) | 2015-01-30 | 2016-08-04 | Merck Patent Gmbh | Materials for electronic devices |
| WO2016124304A1 (de) | 2015-02-03 | 2016-08-11 | Merck Patent Gmbh | Metallkomplexe |
| WO2016155866A1 (en) | 2015-03-30 | 2016-10-06 | Merck Patent Gmbh | Formulation of an organic functional material comprising a siloxane solvent |
| WO2016198144A1 (en) | 2015-06-10 | 2016-12-15 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2016198141A1 (en) | 2015-06-12 | 2016-12-15 | Merck Patent Gmbh | Esters containing non-aromatic cycles as solvents for oled formulations |
| EP3581633A1 (de) | 2015-06-12 | 2019-12-18 | Merck Patent GmbH | Ester mit nichtaromatischen zyklen als lösungsmittel für oled-formulierungen |
| WO2017012687A1 (en) | 2015-07-22 | 2017-01-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017012694A1 (en) | 2015-07-23 | 2017-01-26 | Merck Patent Gmbh | Phenyl derivatives substituted with at least two electron acceptors and at least two electron donors for use in organic electronic devices |
| EP4236652A2 (de) | 2015-07-29 | 2023-08-30 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| EP4301110A2 (de) | 2015-07-30 | 2024-01-03 | Merck Patent GmbH | Materialien für organische elektrolumineszenzvorrichtungen |
| WO2017016630A1 (en) | 2015-07-30 | 2017-02-02 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017028940A1 (en) | 2015-08-14 | 2017-02-23 | Merck Patent Gmbh | Phenoxazine derivatives for organic electroluminescent devices |
| WO2017036572A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Formulation of an organic functional material comprising an epoxy group containing solvent |
| WO2017036573A1 (en) | 2015-08-28 | 2017-03-09 | Merck Patent Gmbh | Compounds for electronic devices |
| US11555128B2 (en) | 2015-11-12 | 2023-01-17 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing composition, electronic device comprising same and preparation method for functional material thin film |
| WO2017097391A1 (en) | 2015-12-10 | 2017-06-15 | Merck Patent Gmbh | Formulations containing ketones comprising non-aromatic cycles |
| EP4084109A1 (de) | 2015-12-15 | 2022-11-02 | Merck Patent GmbH | Ester mit aromatischen gruppen als lösungsmittel für organische elektronische formulierungen |
| WO2017102048A1 (en) | 2015-12-15 | 2017-06-22 | Merck Patent Gmbh | Esters containing aromatic groups as solvents for organic electronic formulations |
| WO2017102052A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a solid solvent |
| WO2017102049A1 (en) | 2015-12-16 | 2017-06-22 | Merck Patent Gmbh | Formulations containing a mixture of at least two different solvents |
| WO2017133829A1 (de) | 2016-02-05 | 2017-08-10 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2017140404A1 (en) | 2016-02-17 | 2017-08-24 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017157783A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine formulierung enthaltend mindestens einen organischen halbleiter |
| DE102016003104A1 (de) | 2016-03-15 | 2017-09-21 | Merck Patent Gmbh | Behälter umfassend eine Formulierung enthaltend mindestens einen organischen Halbleiter |
| WO2017157983A1 (de) | 2016-03-17 | 2017-09-21 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2017178311A1 (de) | 2016-04-11 | 2017-10-19 | Merck Patent Gmbh | Heterocyclische verbindungen mit dibenzofuran- und/oder dibenzothiophen-strukturen |
| EP3978477A2 (de) | 2016-06-03 | 2022-04-06 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2017207596A1 (en) | 2016-06-03 | 2017-12-07 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2017216129A1 (en) | 2016-06-16 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2017216128A1 (en) | 2016-06-17 | 2017-12-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001928A1 (en) | 2016-06-28 | 2018-01-04 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018001990A1 (de) | 2016-06-30 | 2018-01-04 | Merck Patent Gmbh | Verfahren zur auftrennung von enantiomerenmischungen von metallkomplexen |
| EP3792235A1 (de) | 2016-07-08 | 2021-03-17 | Merck Patent GmbH | Materialien für organische elektrolumineszente vorrichtungen |
| WO2018007421A1 (en) | 2016-07-08 | 2018-01-11 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018011186A1 (de) | 2016-07-14 | 2018-01-18 | Merck Patent Gmbh | Metallkomplexe |
| WO2018024719A1 (en) | 2016-08-04 | 2018-02-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018050584A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit spirobifluoren-strukturen |
| WO2018050583A1 (de) | 2016-09-14 | 2018-03-22 | Merck Patent Gmbh | Verbindungen mit carbazol-strukturen |
| WO2018060218A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Carbazole mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| WO2018060307A1 (de) | 2016-09-30 | 2018-04-05 | Merck Patent Gmbh | Verbindungen mit diazadibenzofuran- oder diazadibenzothiophen-strukturen |
| EP4255151A2 (de) | 2016-10-10 | 2023-10-04 | Merck Patent GmbH | Spiro[fluoren-9,9'-(thio)xanthen] verbindungen |
| WO2018069167A1 (de) | 2016-10-10 | 2018-04-19 | Merck Patent Gmbh | Elektronische vorrichtung |
| EP4113643A1 (de) | 2016-10-10 | 2023-01-04 | Merck Patent GmbH | Elektronische vorrichtung |
| WO2018077660A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018077662A1 (en) | 2016-10-31 | 2018-05-03 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018083053A1 (de) | 2016-11-02 | 2018-05-11 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018087020A1 (en) | 2016-11-08 | 2018-05-17 | Merck Patent Gmbh | Compounds for electronic devices |
| EP4271163A2 (de) | 2016-11-14 | 2023-11-01 | Merck Patent GmbH | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018087346A1 (de) | 2016-11-14 | 2018-05-17 | Merck Patent Gmbh | Verbindungen mit einer akzeptor- und einer donorgruppe |
| WO2018095839A1 (de) | 2016-11-22 | 2018-05-31 | Merck Patent Gmbh | Verbrückte triarylamine für elektronische vorrichtungen |
| US11248138B2 (en) | 2016-11-23 | 2022-02-15 | Guangzhou Chinaray Optoelectronic Materials Ltd. | Printing ink formulations, preparation methods and uses thereof |
| WO2018095381A1 (zh) | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 印刷油墨组合物及其制备方法和用途 |
| WO2018095940A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused indeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018095888A1 (en) | 2016-11-25 | 2018-05-31 | Merck Patent Gmbh | Bisbenzofuran-fused 2,8-diaminoindeno[1,2-b]fluorene derivatives and related compounds as materials for organic electroluminescent devices (oled) |
| WO2018099846A1 (de) | 2016-11-30 | 2018-06-07 | Merck Patent Gmbh | Verbindungen mit valerolaktam-strukturen |
| WO2018104195A1 (de) | 2016-12-05 | 2018-06-14 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| EP3978491A1 (de) | 2016-12-05 | 2022-04-06 | Merck Patent GmbH | Stickstoffhaltige heterocyclen zur verwendung in oleds |
| WO2018104202A1 (en) | 2016-12-06 | 2018-06-14 | Merck Patent Gmbh | Preparation process for an electronic device |
| WO2018108760A1 (en) | 2016-12-13 | 2018-06-21 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018114883A1 (de) | 2016-12-22 | 2018-06-28 | Merck Patent Gmbh | Mischungen umfassend mindestens zwei organisch funktionelle verbindungen |
| WO2018134392A1 (en) | 2017-01-23 | 2018-07-26 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2018138039A1 (de) | 2017-01-25 | 2018-08-02 | Merck Patent Gmbh | Carbazolderivate |
| WO2018138318A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2018138319A1 (en) | 2017-01-30 | 2018-08-02 | Merck Patent Gmbh | Method for forming an organic electroluminescence (el) element |
| WO2018141706A1 (de) | 2017-02-02 | 2018-08-09 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2018157981A1 (de) | 2017-03-02 | 2018-09-07 | Merck Patent Gmbh | Materialien für organische elektronische vorrichtungen |
| WO2018166932A1 (de) | 2017-03-13 | 2018-09-20 | Merck Patent Gmbh | Verbindungen mit arylamin-strukturen |
| WO2018178136A1 (en) | 2017-03-31 | 2018-10-04 | Merck Patent Gmbh | Printing method for an organic light emitting diode (oled) |
| WO2018189050A1 (en) | 2017-04-10 | 2018-10-18 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018197447A1 (de) | 2017-04-25 | 2018-11-01 | Merck Patent Gmbh | Verbindungen für elektronische vorrichtungen |
| WO2018202603A1 (en) | 2017-05-03 | 2018-11-08 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2018215318A1 (de) | 2017-05-22 | 2018-11-29 | Merck Patent Gmbh | Hexazyklische heteroaromatische verbindungen für elektronische vorrichtungen |
| WO2018234346A1 (en) | 2017-06-23 | 2018-12-27 | Merck Patent Gmbh | MATERIALS FOR ORGANIC ELECTROLUMINESCENT DEVICES |
| WO2019002190A1 (en) | 2017-06-28 | 2019-01-03 | Merck Patent Gmbh | MATERIALS FOR ELECTRONIC DEVICES |
| WO2019016184A1 (en) | 2017-07-18 | 2019-01-24 | Merck Patent Gmbh | FORMULATION OF AN ORGANIC FUNCTIONAL MATERIAL |
| WO2019020654A1 (en) | 2017-07-28 | 2019-01-31 | Merck Patent Gmbh | SPIROBIFLUORENE DERIVATIVES FOR USE IN ELECTRONIC DEVICES |
| WO2019048443A1 (de) | 2017-09-08 | 2019-03-14 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| EP4242286A2 (de) | 2017-11-23 | 2023-09-13 | Merck Patent GmbH | Materialien für elektronische vorrichtungen |
| WO2019101719A1 (de) | 2017-11-23 | 2019-05-31 | Merck Patent Gmbh | Materialien für elektronische vorrichtungen |
| WO2019115577A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Substituted aromatic amines for use in organic electroluminescent devices |
| WO2019115573A1 (en) | 2017-12-15 | 2019-06-20 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019121458A1 (de) | 2017-12-19 | 2019-06-27 | Merck Patent Gmbh | Heterocyclische verbindung zur verwendung in electronischen vorrichtungen |
| WO2019121483A1 (en) | 2017-12-20 | 2019-06-27 | Merck Patent Gmbh | Heteroaromatic compounds |
| WO2019162483A1 (en) | 2018-02-26 | 2019-08-29 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2019168366A1 (ko) | 2018-02-28 | 2019-09-06 | 주식회사 엘지화학 | 중합체, 이를 포함하는 코팅 조성물 및 이를 이용한 유기 발광 소자 |
| WO2019175149A1 (en) | 2018-03-16 | 2019-09-19 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2019212183A1 (ko) * | 2018-05-03 | 2019-11-07 | 주식회사 엘지화학 | 중합성 액정 화합물, 광학 소자용 액정 조성물, 중합체, 광학 이방체 및 디스플레이 장치용 광학 소자 |
| US11674082B2 (en) | 2018-05-03 | 2023-06-13 | Lg Chem, Ltd. | Polymerizable liquid crystal compound, liquid crystal composition for optical element, polymer, optically anisotropic body, and optical element for display device |
| TWI715021B (zh) * | 2018-05-03 | 2021-01-01 | 南韓商Lg化學股份有限公司 | 可聚合液晶化合物、用於光學部件之液晶組成物、聚合物、光學各向異性體以及用於顯示裝置的光學部件 |
| WO2019238782A1 (en) | 2018-06-15 | 2019-12-19 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2020064662A2 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verfahren zur herstellung von sterisch gehinderten stickstoffhaltigen heteroaromatischen verbindungen |
| EP4190880A1 (de) | 2018-09-27 | 2023-06-07 | Merck Patent GmbH | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020064666A1 (de) | 2018-09-27 | 2020-04-02 | Merck Patent Gmbh | Verbindungen, die in einer organischen elektronischen vorrichtung als aktive verbindungen einsetzbar sind |
| WO2020094539A1 (de) | 2018-11-05 | 2020-05-14 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2020094538A1 (en) | 2018-11-06 | 2020-05-14 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2020099349A1 (de) | 2018-11-14 | 2020-05-22 | Merck Patent Gmbh | Zur herstellung einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021078710A1 (en) | 2019-10-22 | 2021-04-29 | Merck Patent Gmbh | Materials for organic electroluminescent devices |
| WO2021078831A1 (de) | 2019-10-25 | 2021-04-29 | Merck Patent Gmbh | In einer organischen elektronischen vorrichtung einsetzbare verbindungen |
| WO2021122538A1 (de) | 2019-12-18 | 2021-06-24 | Merck Patent Gmbh | Aromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021122740A1 (de) | 2019-12-19 | 2021-06-24 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021151922A1 (de) | 2020-01-29 | 2021-08-05 | Merck Patent Gmbh | Benzimidazol-derivate |
| WO2021170522A1 (de) | 2020-02-25 | 2021-09-02 | Merck Patent Gmbh | Verwendung von heterocyclischen verbindungen in einer organischen elektronischen vorrichtung |
| WO2021175706A1 (de) | 2020-03-02 | 2021-09-10 | Merck Patent Gmbh | Verwendung von sulfonverbindungen in einer organischen elektronischen vorrichtung |
| WO2021185829A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021185712A1 (de) | 2020-03-17 | 2021-09-23 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021191183A1 (de) | 2020-03-26 | 2021-09-30 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021204646A1 (de) | 2020-04-06 | 2021-10-14 | Merck Patent Gmbh | Polycyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2021213917A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Emulsions comprising organic functional materials |
| WO2021213918A1 (en) | 2020-04-21 | 2021-10-28 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2021254984A1 (de) | 2020-06-18 | 2021-12-23 | Merck Patent Gmbh | Indenoazanaphthaline |
| WO2022002772A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heteroaromatische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022002771A1 (de) | 2020-06-29 | 2022-01-06 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022069421A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen einsetzbare verbindungen |
| WO2022069422A1 (de) | 2020-09-30 | 2022-04-07 | Merck Patent Gmbh | Verbindungen zur strukturierung von funktionalen schichten organischer elektrolumineszenzvorrichtungen |
| WO2022079068A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022079067A1 (de) | 2020-10-16 | 2022-04-21 | Merck Patent Gmbh | Verbindungen mit heteroatomen für organische elektrolumineszenzvorrichtungen |
| WO2022122607A1 (en) | 2020-12-08 | 2022-06-16 | Merck Patent Gmbh | An ink system and a method for inkjet printing |
| WO2022129114A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2022129113A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Stickstoffhaltige heteroaromaten für organische elektrolumineszenzvorrichtungen |
| WO2022129116A1 (de) | 2020-12-18 | 2022-06-23 | Merck Patent Gmbh | Indolo[3.2.1-jk]carbazole-6-carbonitril-derivate als blau fluoreszierende emitter zur verwendung in oleds |
| WO2022223675A1 (en) | 2021-04-23 | 2022-10-27 | Merck Patent Gmbh | Formulation of an organic functional material |
| WO2022229234A1 (de) | 2021-04-30 | 2022-11-03 | Merck Patent Gmbh | Stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023012084A1 (en) | 2021-08-02 | 2023-02-09 | Merck Patent Gmbh | A printing method by combining inks |
| WO2023041454A1 (de) | 2021-09-14 | 2023-03-23 | Merck Patent Gmbh | Borhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023057327A1 (en) | 2021-10-05 | 2023-04-13 | Merck Patent Gmbh | Method for forming an organic element of an electronic device |
| WO2023072799A1 (de) | 2021-10-27 | 2023-05-04 | Merck Patent Gmbh | Bor- und stickstoffhaltige, heterocyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023099543A1 (en) | 2021-11-30 | 2023-06-08 | Merck Patent Gmbh | Compounds having fluorene structures |
| WO2023161167A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Stickstoffhaltige heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023161168A1 (de) | 2022-02-23 | 2023-08-31 | Merck Patent Gmbh | Aromatische heterocyclen für organische elektrolumineszenzvorrichtungen |
| WO2023213837A1 (de) | 2022-05-06 | 2023-11-09 | Merck Patent Gmbh | Cyclische verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2023237458A1 (en) | 2022-06-07 | 2023-12-14 | Merck Patent Gmbh | Method of printing a functional layer of an electronic device by combining inks |
| WO2023247345A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Heterocyclen für photoelektrische vorrichtungen |
| WO2023247338A1 (de) | 2022-06-20 | 2023-12-28 | Merck Patent Gmbh | Organische heterocyclen für photoelektrische vorrichtungen |
| WO2024061942A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende verbindungen für organische elektrolumineszenzvorrichtungen |
| WO2024061948A1 (de) | 2022-09-22 | 2024-03-28 | Merck Patent Gmbh | Stickstoffenthaltende heterocyclen für organische elektrolumineszenzvorrichtungen |
Also Published As
| Publication number | Publication date |
|---|---|
| CN1947275B (zh) | 2011-08-03 |
| CN1947275A (zh) | 2007-04-11 |
| JP2007534815A (ja) | 2007-11-29 |
| ATE418798T1 (de) | 2009-01-15 |
| KR20070012430A (ko) | 2007-01-25 |
| EP1741149A1 (de) | 2007-01-10 |
| JP5500565B2 (ja) | 2014-05-21 |
| DE102004020298A1 (de) | 2005-11-10 |
| DE502005006329D1 (de) | 2009-02-05 |
| US20070205714A1 (en) | 2007-09-06 |
| US7947382B2 (en) | 2011-05-24 |
| EP1741149B1 (de) | 2008-12-24 |
| KR101188157B1 (ko) | 2012-10-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1741149B1 (de) | Elektrolumineszierende polymere und deren verwendung | |
| EP1741148B1 (de) | Elektrolumineszierende polymere enthaltend planare arylamin-einheiten, deren darstellung und verwendung | |
| DE102005037734B4 (de) | Elektrolumineszierende Polymere, ihre Verwendung und bifunktionelle monomere Verbindungen | |
| EP1819749B1 (de) | Teilkonjugierte polymere, deren darstellung und verwendung | |
| EP1656408B1 (de) | Konjugierte polymere enthaltend dihydrophenanthren-einheiten und deren verwendung | |
| EP1831326B1 (de) | Elektrolumineszierende polymere und deren verwendung | |
| EP2273512B1 (de) | Konjugierte Polymere enthaltend Triarylamin-arylvinylen-einheiten, deren Darstellung und Verwendung | |
| EP1745113B1 (de) | Neue materialmischungen für die elektrolumineszenz | |
| EP2038241B1 (de) | Elektrolumineszierende polymere und ihre verwendung | |
| DE102010048498A1 (de) | Materialien für organische Elektrolumineszenzvorrichtungen | |
| WO2007085377A2 (de) | Elektrolumineszierende materialien und deren verwendung | |
| WO2010136111A1 (de) | Zusammensetzung, enthaltend mindestens eine emitterverbindung und mindestens ein polymer mit konjugationsunterbrechenden einheiten | |
| DE102006038683A1 (de) | Konjugierte Polymere, deren Darstellung und Verwendung | |
| WO2011098205A1 (de) | Elektrolumineszierende polymere, verfahren zu ihrer herstellung sowie ihre verwendung | |
| WO2005111113A1 (de) | Elektrolumineszierende polymere | |
| EP2867329A1 (de) | Polymere enthaltend 2,7-pyren-struktureinheiten |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| AK | Designated states |
Kind code of ref document: A1 Designated state(s): AE AG AL AM AT AU AZ BA BB BG BR BW BY BZ CA CH CN CO CR CU CZ DE DK DM DZ EC EE EG ES FI GB GD GE GH GM HR HU ID IL IN IS JP KE KG KM KP KR KZ LC LK LR LS LT LU LV MA MD MG MK MN MW MX MZ NA NI NO NZ OM PG PH PL PT RO RU SC SD SE SG SK SL SM SY TJ TM TN TR TT TZ UA UG US UZ VC VN YU ZA ZM ZW |
|
| AL | Designated countries for regional patents |
Kind code of ref document: A1 Designated state(s): GM KE LS MW MZ NA SD SL SZ TZ UG ZM ZW AM AZ BY KG KZ MD RU TJ TM AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HU IE IS IT LT LU MC NL PL PT RO SE SI SK TR BF BJ CF CG CI CM GA GN GQ GW ML MR NE SN TD TG |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application | ||
| WWE | Wipo information: entry into national phase |
Ref document number: 2005744529 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 11578540 Country of ref document: US Ref document number: 2007205714 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 1020067022228 Country of ref document: KR |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 200580013206.7 Country of ref document: CN Ref document number: 2007509955 Country of ref document: JP |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWW | Wipo information: withdrawn in national office |
Ref document number: DE |
|
| WWP | Wipo information: published in national office |
Ref document number: 2005744529 Country of ref document: EP |
|
| WWP | Wipo information: published in national office |
Ref document number: 1020067022228 Country of ref document: KR |
|
| WWP | Wipo information: published in national office |
Ref document number: 11578540 Country of ref document: US |