RU2505609C2 - Композиции и способы гибридизации - Google Patents
Композиции и способы гибридизации Download PDFInfo
- Publication number
- RU2505609C2 RU2505609C2 RU2010151493/10A RU2010151493A RU2505609C2 RU 2505609 C2 RU2505609 C2 RU 2505609C2 RU 2010151493/10 A RU2010151493/10 A RU 2010151493/10A RU 2010151493 A RU2010151493 A RU 2010151493A RU 2505609 C2 RU2505609 C2 RU 2505609C2
- Authority
- RU
- Russia
- Prior art keywords
- hybridization
- composition
- polar aprotic
- aprotic solvent
- probe
- Prior art date
Links
- YEJRWHAVMIAJKC-UHFFFAOYSA-N O=C1OCCC1 Chemical compound O=C1OCCC1 YEJRWHAVMIAJKC-UHFFFAOYSA-N 0.000 description 1
- XCWPBWWTGHQKDR-UHFFFAOYSA-N S=C1SCCS1 Chemical compound S=C1SCCS1 XCWPBWWTGHQKDR-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6832—Enhancement of hybridisation reaction
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6813—Hybridisation assays
- C12Q1/6841—In situ hybridisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2527/00—Reactions demanding special reaction conditions
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/14—Heterocyclic carbon compound [i.e., O, S, N, Se, Te, as only ring hetero atom]
- Y10T436/142222—Hetero-O [e.g., ascorbic acid, etc.]
- Y10T436/143333—Saccharide [e.g., DNA, etc.]
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Analytical Chemistry (AREA)
- Immunology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Изобретение относится к области молекулярной биологии. Предложены способ, композиция и применение полярного апротонного растворителя с циклической основной структурой для гибридизации последовательностей нуклеиновых кислот. Изобретение может быть использовано в гибридизационных анализах. 3 н. и 16 з.п. ф-лы, 25 табл., 2 ил., 22 пр.
Description
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к водным композициям для применения при гибридизации, например, для применения при гибридизации in situ (ISH).
В одной форме осуществления настоящее изобретение относится к области молекулярного исследования ДНК и РНК. В частности, изобретение относится к областям цитологии, гистологии и молекулярной биологии. В одном аспекте настоящее изобретение относится к энергии (например, времени инкубации и нагреванию), необходимой во время гибридизации между нуклеиновыми кислотами, например, при гибридизации in situ, направленной на ДНК и РНК.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Структура двойной спирали ДНК стабилизирована образованием водородных связей между основаниями на противоположных нитях, когда основания спарены единственным конкретным путем (А+Т или G+C). Это спаривание комплементарных оснований (гибридизация) является центральным для всех процессов, в которые вовлечены нуклеиновые кислоты.
В основном примере гибридизации фрагменты или последовательности нуклеиновой кислоты связываются с комплементарным фрагментом или последовательностью нуклеиновой кислоты. Например, при гибридизации можно использовать нуклеиново-кислотные зонды, предназначенные для связывания или "гибридизации" с мишенью, например, ДНК или РНК. Один из типов гибридизации, гибридизация in situ (ISH), включает гибридизацию с мишенью в образце, где образец может находиться in vivo или, например, быть зафиксированным или прикрепленным на предметном стекле. Зонды могут быть мечеными, чтобы дать возможность идентификации гибрида зонд-мишень путем использования флуоресцентного микроскопа или микроскопа со светлым полем/сканера. Фрагмент или последовательность типично представляет собой двунитевую или однонитевую нуклеиновую кислоту, такую как ДНК, РНК или аналоги. В некоторых формах осуществления фрагмент или последовательность может представлять собой зонд, который может быть меченым с использованием радиоактивных меток, таких как 31P,33P или 32S, не радиоактивных меток, таких как дигоксигенин и биотин, или флуоресцентных меток. Такие меченые зонды можно использовать для определения генетических аномалий в последовательности-мишени, обеспечивая ценную информацию, например, о пренатальных расстройствах, раке и других генетических или инфекционных заболеваниях.
Эффективность и точность гибридизационных анализов нуклеиновых кислот, в основном, зависит по меньшей мере от одного из трех факторов: а) условий денатурации (то есть разделения, например, двух нитей нуклеиновой кислоты), б) условий ренатурации (то есть повторного отжига, например, двух нитей нуклеиновой кислоты) и в) условий отмывки после гибридизации.
В традиционных экспериментах по гибридизации, таких как анализы ISH, используют формамид-содержащий раствор для денатурации двунитевой нуклеиновой кислоты. Формамид является растворителем, который обладает дестабилизирующим эффектом на состояние спирали, например, ДНК, РНК и их аналогов, за счет вытеснения слабо и однородно связанных молекул гидратов. Кроме того, формамид стабилизирует спиральное состояние ДНК, РНК и их аналогов за счет 'формамидирования' связующих сайтов оснований Уотсона-Крика. Однако формамид является токсичным, опасным веществом, подлежащим строгим регламентациям применения и утилизации.
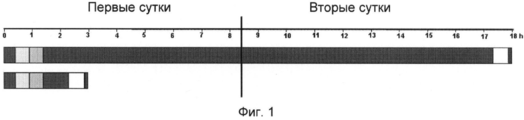
Кроме того, использование формамида, хотя оно принято в качестве стандартной методики гибридизации, затруднено длительным временем, требующимся для завершения гибридизации, в зависимости от используемых условий и нуклеиново-кислотных фрагментов или последовательностей. Например, за стадией денатурации следует длительная, требующая много времени стадия гибридизации, которая, например, в традиционном протоколе флуоресцентной гибридизации in situ (FISH) занимает 14-24 часов и может занимать даже вплоть до 72 часов. Примеры времени традиционной гибридизации показаны на фиг.1 и 2.
Стадия ренатурации (то есть гибридизации) двух комплементарных нитей цепей нуклеиновой кислоты является, несомненно, наиболее длительным по времени аспектом анализа с использованием гибридизации. До сих пор считали, что использование хаотропных агентов, таких как формамид, гуанидиний водород и мочевина, которые взаимодействуют со связующими сайтами оснований нуклеиновой кислоты Уотсона-Крика и посредством этого разрушают водородные связи между комплементарными основаниями нуклеиновых кислот, является единственным путем снижения температуры плавления (Тm) комплементарных цепей. Однако, хотя использование хаотропных агентов снижает Тm, эти агенты, оказывается, значительно продлевают время гибридизации по сравнению с гибридизацией в водном растворе без хаотропного агента. Кроме того, помимо недостатка, связанного с длительным временем обработки, использование высокой концентрации формамида, оказывается, влечет за собой морфологическую деструкцию клеточной, ядерной и/или хромосомной структуры. Наконец, формамид считают токсичным и опасным химическим веществом для людей.
В настоящем изобретении предложены некоторые потенциальные преимущества по сравнению с предшествующим уровнем техники, такие как более быстрое время гибридизации, более низкие температуры гибридизации и менее токсичные растворители для гибридизации.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является разработка композиций, результатом которой является по меньшей мере одно из следующих преимуществ: высоко чувствительные, технически простые, гибкие, надежные методики гибридизации и быстрые анализы. В некоторых формах осуществления, например, одним из преимуществ может быть способность к регулированию времени гибридизации путем варьирования температуры реакции гибридизации в значительно большей степени, чем доступно с использованием способов предшествующего уровня техники. Например, гибридизация может быть возможной при комнатной температуре.
В одной форме осуществления композиции и способы по изобретению снижают энергию, необходимую для гибридизации. Композиции и способы по изобретению применимы к любой методике гибридизации. Композиции и способы по изобретению также применимы к любой молекулярной системе, которая гибридизуется или связывается, используя спаривание оснований, такой как, например, ДНК, РНК, ПНК (пептидилнуклеиновая кислота), ЗНК (замкнутая нуклеиновая кислота) и их синтетические и природные аналоги.
Следующей целью изобретения является разработка способов и композиций для гибридизации, которые сохраняют морфологию биологического образца. Другой целью изобретения является разработка нетоксичной композиции и методики гибридизации. Еще одной другой целью изобретения является разработка методики гибридизации с низким испарением. Следующей целью изобретения является разработка методики гибридизации, обнаружимой 20x объективом. Еще одной другой целью изобретения является разработка композиции с низкой концентрацией зонда. Другой целью изобретения является уменьшение и/или устранение необходимости в блокировании неспецифического связывания. Композиции и способы по изобретению могут также дать возможность использовать гетерогенные зонды без необходимости блокирования, удаления или иного повреждения связывания, например, повторяющихся последовательностей в биологическом образце.
В одной форме осуществления способ и композиции для гибридизации нуклеиновых кислот по настоящему изобретению полезны для анализа in vivo или in vitro геномной ДНК, хромосом, хромосомных фрагментов, генов и хромосомных аберраций, таких как транслокации, делеции, амплификации, инсерции, мутации или инверсии, связанных с нормальным состоянием или с заболеванием. Кроме того, эти способы и композиции полезны для обнаружения инфекционных агентов, а также изменений в уровнях экспрессии РНК, например, мРНК, и ее комплементарной ДНК (кДНК).
Другие применения включают анализ in vivo или in vitro мессенджер-РНК (мРНК), вирусной РНК, вирусной ДНК, малой интерферирующей РНК (siPHK), малой ядерной РНК (snPHK), некодирующей РНК (ncРНК, например, тРНК и рРНК), транспортной мессенджер-РНК (tmPHK), микроРНК (miPHK), piwi-взаимодействующей РНК (piRNA), длинной некодирующей РНК, малой ядрышковой РНК (snoPHK), антисмысловой РНК, двунитевой РНК (dsPHK), метилирований и других модификаций оснований, однонуклеотидных полиморфизмов (SNP), вариаций числа копий (CNV) и нуклеиновых кислот, меченых, например, радиоактивными изотопами, флуоресцентными молекулами, биотином, дигоксигенином (DIG) или антигенами, одних или в комбинации с немечеными нуклеиновыми кислотами.
Способ и композиции для гибридизации нуклеиновых кислот по настоящему изобретению полезны для анализа in vivo или in vitro нуклеиновых кислот, используя методики, такие как ПЦР, ПЦР in situ, Норзерн-блоттинг, Саузерн-блоттинг, проточная цитометрия, авторадиография, флуоресцентная микроскопия, хемилюминесценция, иммуногистохимия, виртуальный кариотип, анализ гена, ДНК-микрочипы (например, сравнительная геномная гибридизация на микрочипах (CGH на микрочипах)), профилирование генной экспрессии, Gene ID, анализ мозаичных микромассивов, гель-электрофорез, капиллярный электрофорез и гибридизации in situ, такие как FISH, SISH, CISH. Способы и композиции по изобретению можно применять на образцах in vitro и in vivo, таких как таких как мазки костного мозга, мазки крови, заключенные в парафин препараты тканей, ферментативно диссоциированные образцы тканей, костный мозг, амниоциты, цитоспиновые препараты, импринты и т.д.
В одной форме осуществления в изобретении предложены способы и композиции для гибридизации по меньшей мере одной молекулы с мишенью. Изобретение может, например, исключить использование формамида или снизить зависимость от него. Например, способы и композиции по изобретению могут снизить энергетический барьер для гибридизации без использования формамида. Более низкий энергетический барьер может уменьшить время и/или температуру, необходимые для гибридизации. Например, изобретение может дать возможность гибридизации при более низких температурах или может дать возможность быстрой гибридизации при более высоких температурах. Таким образом, в некоторых аспектах настоящее изобретение дает возможность преодолеть основную длительную стадию в гибридизационных анализах.
Один аспект изобретения составляет композиция или раствор для применения при гибридизации. Композиции для применения в изобретении включают водную композицию, содержащую по меньшей мере одну нуклеиново-кислотную последовательность и по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей. Количеством, эффективным для денатурации двунитевых нуклеотидных последовательностей, является количество, которое обеспечивает гибридизацию. Например, одним из путей тестирования, является ли количество полярного апротонного растворителя эффективным для обеспечения гибридизации, является определение того, дает ли полярный апротонный растворитель при его использовании в способах и композициях для гибридизации, описанных в данной заявке, таких как пример 1, обнаружимый сигнал и/или амплифицированный продукт нуклеиновой кислоты.
Не ограничивающие примеры эффективных количеств полярных апротонных растворителей включают, например, от примерно 1% до примерно 95% (об/об). В некоторых формах осуществления концентрация полярного апротонного растворителя составляет от 5% до 60% (об/об). В других формах осуществления концентрация полярного апротонного растворителя составляет от 10% до 60% (об/об). В других формах осуществления концентрация полярного апротонного растворителя составляет от 30% до 50% (об/об). Концентрации от 1% до 5%, от 5% до 10%, 10%, от 10% до 20%, от 20% до 30%, от 30% до 40%, от 40% до 50% или от 50% до 60% (об/об) также пригодны. В некоторых формах осуществления полярный апротонный растворитель будет присутствовать в концентрации 0,1%, 0,25%, 0,5%, 1%, 2%, 3%, 4% или 5% (об/об). В других формах осуществления полярный апротонный растворитель будет присутствовать в концентрации 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 10,5%, 11%, 11,5%, 12%, 12,5%, 13%, 13,5%, 14%, 14,5%, 15%, 15,5%, 16%, 16,5%, 17%, 17,5%, 18%, 18,5%, 19%, 19,5% или 20% (об/об).
В соответствии с другим аспектом настоящего изобретения водная композиция, содержащая полярный апротонный растворитель, обладает сниженной токсичностью. Например, композиция, менее токсичная, чем традиционные растворы для гибридизации, может включать композицию при условии, что эта композиция не содержит формамид, или при условии, что эта композиция содержит менее чем 10%, или менее чем 5%, или менее чем 2%, или менее чем 1%, или менее чем 0,5%, или менее чем 0,1%, или менее чем 0,05%, или менее чем 0,01% формамида. Менее токсичная композиция может также включать композицию при условии, что эта композиция не содержит диметилсульфоксид (ДМСО), или при условии, что эта композиция содержит менее чем 10%, 5%, 2% или менее чем 1%, или менее чем 0,5%, или менее чем 0,1%, или менее чем 0,05%, или менее чем 0,01% ДМСО.
В одном аспекте изобретения подходящие полярные апротонные растворители для применения в изобретении могут быть выбраны на основании их параметров растворимости Хансена. Например, подходящие полярные апротонные растворители могут иметь дисперсионный параметр растворимости от 17,7 до 22,0 МПа1/2, полярный параметр растворимости от 13 до 23 МПа1/2 и параметр растворимости за счет водородных связей от 3 до 13 МПа1/2.
В соответствии с одним аспектом настоящего изобретения подходящие полярные апротонные растворители для применения в изобретении являются циклическими соединениями. Циклическое соединение имеет циклическую основную структуру. Примеры включают циклические соединения, раскрытые в данной заявке. В других формах осуществления полярный апротонный растворитель может быть выбран из приведенных ниже формул 1-4:
где X представляет собой О и R1 представляет собой алкилдиил.
В соответствии с другим аспектом изобретения подходящие полярные апротонные растворители для применения в изобретении могут быть выбраны из приведенной ниже формулы 5:
где Х является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О или N или S или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и
где Y представляет собой О или S или С.
Примеры подходящих апротонных растворителей в соответствии с формулой 5 приведены ниже в формулах 6-9:
| где: | где: | где: | где: |
| Х не существует; | Z и Х представляют собой O; | Х не существует; | Х не существует; |
| A, B и Z представляют собой O; | А и В составляют часть алкилдиила; | А составляет часть алкилдиила; | А составляет часть алкилдиила; |
| Y представляет собой С; и R представляет собой этан-1,2-диил; | Y представляет собой S; и R представляет собой бутан-1,4-диил; | Y представляет собой С; | Y представляет собой С; |
| В и Z представляют собой O; и R представляет собой пропан-1,3-диил; | В представляет собой метиламин; | ||
| Z представляет собой O; и | |||
| R представляет собой пропан-1,3-диил; |
В соответствии с еще одним другим аспектом изобретения полярный апротонный растворитель имеет лактоновую, сульфоновую, нитрильную, сульфитную или карбонатную функциональную группу. Такие соединения отличаются их относительно высокими диэлектрическими постоянными, высокими дипольными моментами и растворимостью в воде.
В соответствии с другим аспектом изобретения полярный апротонный растворитель, имеющий лактоновую функциональную группу, представляет собой γ-бутиролактон (GBL), полярный апротонный растворитель, имеющий сульфоновую функциональную группу, представляет собой сульфолан (SL), полярный апротонный растворитель, имеющий нитрильную функциональную группу, представляет собой ацетонитрил (AN), полярный апротонный растворитель, имеющий сульфитную функциональную группу, представляет собой гликольсульфит/этиленсульфит (GS), и полярный апротонный растворитель, имеющий карбонатную функциональную группу, представляет собой этиленкарбонат (ЕС), пропиленкарбонат (PC) или этилентиокарбонат (ETC).
В соответствии еще с одним другим аспектом в изобретении раскрыт способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности,
- получение второй нуклеиново-кислотной последовательности,
- получение водной композиции, содержащей по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и
- объединение первой и второй нуклеиново-кислотной последовательности и водной композиции в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотной последовательности.
В одной форме осуществления обеспечивают достаточное количество энергии для гибридизации первой и второй нуклеиновых кислот.
В одной форме осуществления гибридизация первой нуклеиново-кислотной последовательности со второй нуклеиново-кислотной последовательностью происходит в течение менее чем 8 часов, как, например, менее чем 6 часов, менее чем 5 часов, менее чем 4 часов, менее чем 3 часов, менее чем 2 часов или менее чем 1 часа.
Способ может, например, включать:
- получение первой нуклеиново-кислотной последовательности, и
- нанесение водной композиции, содержащей вторую нуклеиново-кислотную последовательность и по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, на первую нуклеиново-кислотную последовательность в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотной последовательности.
В одной форме осуществления обеспечивают достаточное количество энергии для гибридизации первой и второй нуклеиновых кислот.
В одной форме осуществления гибридизация первой нуклеиново-кислотной последовательности со второй нуклеиново-кислотной последовательностью происходит в течение менее чем 8 часов, как, например, менее чем 6 часов, менее чем 5 часов, менее чем 4 часов, менее чем 3 часов, менее чем 2 часов или менее чем 1 часа.
В соответствии еще с одним другим аспектом настоящего изобретения энергию гибридизации обеспечивают путем нагревания водной композиции и нуклеиново-кислотной последовательности. Таким образом, стадия гибридизации может включать стадии нагревания и охлаждения водной композиции и нуклеиново-кислотных последовательностей.
В соответствии с другим аспектом изобретения стадии денатурации и гибридизации могут происходить по отдельности. Например, образец можно денатурировать раствором без зонда, а затем гибридизовать с зондом.
Следующий аспект изобретения включает способ, где в стадию обеспечения достаточного количества энергии для гибридизации нуклеиновых кислот вовлечена стадия нагревания, проводимая путем использования микроволн, горячих бань, горячих пластин, нагревательной спирали, элемента Пельтье, индукционного нагревания или нагревательных ламп.
В соответствии с другим аспектом настоящее изобретение относится к способу, где гибридизация занимает менее чем 1 час. В других формах осуществления гибридизация занимает менее чем 30 минут. В других формах осуществления гибридизация занимает менее чем 15 минут. В других формах осуществления гибридизация занимает менее чем 5 минут.
В соответствии со следующим аспектом изобретение относится к применению композиции, содержащей от 1 до 95% (об/об) по меньшей мере одного полярного апротонного растворителя в гибридизационных анализах.
В соответствии с еще одним другим аспектом изобретение относится к применению композиции, содержащей водную композицию, как описано в данном изобретении, для применения в гибридизационных анализах.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг.1 изображена типичная периодизация определения одного локуса первично мечеными FISH зондами на фиксированных формальдегидом заключенных в парафин тканевых срезах (гистологических образцах). Полосы представляют собой гибридизацию, проведенную с использованием традиционного раствора (верх), и типичную периодизацию для гибридизации, проведенной с использованием композиции по изобретению (низ). Первая полоса слева в каждой периодизации представляет собой стадию депарафинизации; вторая полоса представляет собой стадию предварительной термической обработки; третья полоса представляет собой стадию расщепления; четвертая полоса представляет собой стадию денатурации и гибридизации; пятая полоса представляет собой стадию жесткой отмывки; и шестая полоса представляет собой стадию заливки в среду.
На фиг.2 изображена типичная периодизация определения одного локуса первично мечеными FISH зондами на цитологических образцах. Полосы представляют собой гибридизацию, проведенную с использованием традиционного раствора (верх), и типичную периодизацию гибридизации, проведенной с использованием композиции по изобретению (низ). Первая полоса слева в каждой периодизации представляет собой стадию фиксации; вторая полоса представляет собой стадию денатурации и гибридизации; третья полоса представляет собой стадию жесткой отмывки; и четвертая полоса представляет собой стадию заливки в среду.
ПОДРОБНОЕ ОПИСАНИЕ
А. Определения
В контексте настоящего изобретения приведенные ниже термины следует понимать, как описано ниже.
"Биологический образец" следует понимать как любой образец in vivo, in vitro или in situ одной или более чем одной клетки или клеточного фрагмента. Он может, например, представлять собой одноклеточный или многоклеточный организм, тканевой срез, цитологический образец, хромосомный препарат, очищенные нуклеиново-кислотные последовательности, искусственно полученные нуклеиново-кислотные последовательности, полученные, например, посредством системы на биологической основе или путем химического синтеза, микрочип или другую форму нуклеиново-кислотного чипа. В одной форме осуществления образец представляет собой образец от млекопитающего, такой как, например, образец от человека, мыши, крысы, кошки или лошади.
"Нуклеиновая кислота", "нуклеиново-кислотная цепь" и "нуклеиново-кислотная последовательность" означает все, что связывается или гибридизуется, используя спаривание оснований, включая олигомеры или полимеры, имеющие каркас, образованный из природных нуклеотидов, и/или нуклеиново-кислотные аналоги, содержащие нестандартные нуклеиновые основания и/или нестандартные каркасы (например, пептидную нуклеиновую кислоту (ПНК) или замкнутую нуклеиновую кислоту (ЗНК)) или любую форму производного нуклеиновой кислоты.
Как используют в данной заявке, термин "пептидная нуклеиновая кислота" или "ПНК" означает синтетический полимер, имеющий полиамидный каркас с боковыми нуклеиновыми основаниями (природными или модифицированными), включающий, но не ограниченный ими, любой из олигомерных или полимерных сегментов, называемый или заявленный как пептидные нуклеиновые кислоты, например, в патентах США №№5539082, 5527675, 5623049, 5714331, 5718262, 5736336, 5773571, 5766855, 5786461, 5837459, 5891625, 5972610, 5986053, 6107470, 6201103, 6228982 и 6357163, WO 96/04000, где все эти документы включены в данную заявку посредством ссылки, или в любой из ссылок, цитируемых в них. Боковое нуклеотидное основание, такое как, например, пуриновое или пиримидиновое основание, на ПНК может быть соединено с каркасом посредством линкера, такого как, например, один из линкеров, заявленных в PCT/US02/30573 или в любой из ссылок, цитируемых там. В одной форме осуществления ПНК имеет каркас N-(2-аминоэтил)-глицин). ПНК могут быть синтезированы (и необязательно мечены), как заявлено в PCT/US02/30573 или в любой из ссылок, цитируемых там. ПНК гибридизуются прочно и с высокой специфичностью последовательности с ДНК и РНК, поскольку каркас ПНК является незаряженным. Следовательно, короткие ПНК зонды могут проявлять сравнимую специфичность с более длинными ДНК или РНК зондами. ПНК зонды могут также проявлять более высокую специфичность при связывании с комплементарной ДНК или РНК.
Как используют в данной заявке, термин "замкнутая нуклеиновая кислота" или "ЗНК" означает олигомер или полимер, содержащий по меньшей мере одну или более чем одну субъединицу ЗНК. Как используют в данной заявке, термин "субъединица ЗНК" означает рибонуклеотид, содержащий метиленовый мостик, который соединяет 2'-кислород рибозы с 4'-углеродом. См. общее описание в Kurreck, Eur. J. Biochem, 270:1628-44(2003).
Примеры нуклеиновых кислот и нуклеиново-кислотных аналогов также включают полимеры нуклеотидных мономеров, включающих дву- и однонитевые дезоксирибонуклеотиды (ДНК), рибонуклеотиды (РНК), их α-аномерные формы, их синтетические и природные аналоги и тому подобное. Нуклеиново-кислотная цепь может состоять полностью из дезоксирибонуклеотидов, рибонуклеотидов, пептидных нуклеиновых кислот (ПНК), замкнутых нуклеиновых кислот (ЗНК), их синтетических или природных аналогов или их смесей. ДНК, РНК или другие нуклеиновые кислоты, как определено в данной заявке, можно использовать в способе и композициях по изобретению.
"Полярный апротонный растворитель" относится к органическому растворителю, имеющему дипольный момент примерно 2 единицы дебай или более, растворимость в воде по меньшей мере примерно 5% (объем) при температуре окружающей среды или близкой к ней, то есть примерно 20°С, и который не претерпевает значительный водородный обмен при примерно нейтральном рН, то есть в диапазоне от 5 до 9 или в диапазоне от 6 до 8. Полярные апротонные растворители включают растворители, определенные в соответствии с параметрами растворимости Хансена, обсужденными ниже.
"Алкилдиил" относится к насыщенному или ненасыщенному, разветвленному, прямоцепочечному или циклическому углеводородному радикалу, имеющему два одновалентных радикальных центра, образованных путем удаления одного атома водорода из каждого из двух различных атомов углерода исходного алкана, алкена или алкина.
"Водный раствор" следует понимать как раствор, содержащий воду, даже небольшие количества воды. Например, раствор, содержащий 1% воды, следует понимать как водный раствор.
"Гибридизацию" следует понимать как включающую стадии как денатурации, так и ренатурации методики гибридизации, если не указано иное.
"Композиция для гибридизации" относится к водному раствору по изобретению для осуществления методики гибридизации, например, для связывания зонда с нуклеиново-кислотной последовательностью. Композиции для гибридизации могут содержать, например, по меньшей мере один полярный апротонный растворитель, по меньшей мере одну нуклеиново-кислотную последовательность и раствор для гибридизации. Композиции для гибридизации не содержат ферментов или других компонентов, таких как дезоксинуклеозидтрифосфаты (dNTP), для амплификации нуклеиновых кислот в биологическом образце.
"Раствор для гибридизации" относится к водному раствору для применения в композиции для гибридизации по изобретению. Растворы для гибридизации подробно обсуждены ниже и могут содержать, например, буферные агенты, катализаторы, хелатирующие агенты, соли, детергенты и блокирующие агенты.
"Композиция ПЦР" относится к водному раствору по изобретению для осуществления методики гибридизации, чтобы амплифицировать нуклеиново-кислотную последовательность. Композиции ПЦР могут содержать, например, по меньшей мере один полярный апротонный растворитель, по меньшей мере один фермент для амплификации нуклеиновых кислот, набор нуклеиново-кислотных олигонуклеотидных праймеров, смесь dNTP и раствор ПЦР.
"Раствор ПЦР" относится к водному раствору для применения в композиции ПЦР по изобретению. Растворы ПЦР могут содержать, например, буферные агенты, катализаторы, хелатирующие агенты, соли и детергенты.
"Параметры растворимости Хансена" и "HSP" относятся к приведенным ниже параметрам энергии когезии (растворимости): (1) дисперсионному параметру растворимости (δD, "параметр D"), который измеряет неполярные взаимодействия, образующиеся в результате атомных сил; (2) полярному параметру растворимости (δP, "параметр Р"), который измеряет взаимодействия постоянных диполей с постоянными диполями; и (3) параметру растворимости за счет водородных связей (δH, "параметр Н"), который измеряет обмен электронами. Параметры растворимости Хансена дополнительно определены ниже.
"Повторяющиеся последовательности" следует понимать как относящиеся к компонентам геномов млекопитающих, претерпевающих быструю ренатурацию (примерно 25%) и/или среднюю ренатурацию (примерно 30%). Быстро ренатурирующие компоненты содержат малые (длиной в несколько нуклеотидов) высоко повторяющиеся последовательности, обычно находящиеся в тандеме (например, сателлитную ДНК), тогда как средне ренатурирующие компоненты содержат рассеянные повторяющиеся ДНК. Рассеянные повторяющиеся последовательности классифицируют либо как SINE (короткие рассеянные повторяющиеся последовательности), либо как LINE (длинные рассеянные повторяющиеся последовательности), где и те, и другие классифицируют как ретротранспозоны у приматов. SINE и LINE элементы включают, но не ограничены ими, Alu-повторы, Kpn-повторы, динуклеотидные повторы, тринуклеотидные повторы, тетрануклеотидные повторы, пентануклеотидные повторы и гексануклеотидные повторы. Alu повторы составляют большинство SINE элементов человека и характеризуются консенсус-последовательностью примерно от 280 до 300 п.о., которая состоит из двух подобных последовательностей, организованных в виде димера голова-хвост. В дополнение к SINE и LINE элементам повторяющиеся последовательности также существуют в теломерах хромосом на концах хромосом и в центромерах хромосом, которые содержат отличающиеся повторяющиеся последовательности, которые существуют только в центральном участке хромосомы. Однако, в отличие от SINE и LINE, которые случайно распределены по всему геному, повторяющиеся последовательности теломеров и центромеров локализованы в центральном участке хромосомы.
"Нетоксичный" и "сниженная токсичность" определяют в отношении маркировки токсичности формамида в соответствии с "Директивой 1999/45/ЕС Европейского Парламента и Совета от 3.1 мая 1999, вносящей изменения в законы, регламенты и административные акты государств-членов, связанные с классификацией, упаковкой и маркировкой опасных веществ, с целью приведения их в соответствие с Регламентом" (ecb.jrc.it/legislation/1999L0045EC.pdf) ("Директива"). В соответствии с Директивой токсичность определяют, используя приведенный ниже порядок классификации: Т+"очень токсичный"; Т "токсичный", С "коррозионный", Хn "вредный", Xi "раздражающий". Фразы риска ("R-фразы") описывают риски классифицированной токсичности. Формамид описан как Т (токсичный) и R61 (может причинить вред новорожденному ребенку). Все из приведенных ниже химических веществ классифицированы как менее токсичные, чем формамид: ацетонитрил (Xn, R11, R20, R21, R22, R36); сульфолан (Хn, R22); γ-бутиролактон (Хn, R22, R32) и этиленкарбонат (Xi, R36, R37, R38). В момент подачи данной заявки этилентритиокарбонат и гликольсульфит в настоящее время не маркированы.
Б. Выбор растворителя
Подходящие полярные апротонные растворители для применения в изобретении могут быть выбраны на основании их параметров растворимости Хансена. Способы экспериментального определения и/или вычисления HSP для растворителя известны в данной области техники, и HSP сообщены более чем для 1200 химических веществ.
Например, параметр D можно вычислить с разумной точностью на основании показателя преломления или его можно вывести из таблиц путем сравнения с известными растворителями подобного размера, формы и композиции после установления критической температуры и молярного объема. Параметр Р можно оценить на основании известных дипольных моментов (см., например, McClellan A.L., Tables of Experimental Dipole Moments (W.H. Freeman 1963)), используя уравнение 1:
Уравнение 1:δP=37,4(дипольный момент)/V1/2,
где V представляет собой молярный объем. Не существует уравнений для вычисления параметра Н. Вместо этого параметр Н обычно определяют на основании групповых вкладов.
Характеристики HSP удобно визуализировать, используя круговое изображение, где HSP экспериментально определенного, подходящего референсного растворителя находится в центре круга. Радиус круга (R) показывает максимально допустимое отклонение от HSP референсного растворителя, которое все еще дает возможность, чтобы осуществлялось "хорошее" взаимодействие. Хорошие растворители находятся внутри круга, а плохие находятся вне круга. Расстояние, Ra, между двумя растворителями на основании их соответствующих значений HSP можно определить, используя уравнение 2:
Уравнение 2:(Ra)2=4(δD1-δD2)2+(δP1-δP2)2 (δH1-δH2)2,
где подстрочным индексом 1 показан референсный образец, подстрочным индексом 2 показано тестируемое химическое вещество, и все значения выражены в МПа1/2. Для хорошей растворимости требуется, чтобы Ra составлял менее чем экспериментально определенный радиус круга растворимости Ro. Относительную разность энергии между двумя растворителями, то есть число RED, можно вычислить путем взятия отношения Ra к Ro, как показано в уравнении 3.
Уравнение 3: RED=Ra/Ro.
Числа RED менее чем 1,0 показывают высокое сродство; числа RED, равные или близкие к 1,0, показывают пограничные состояния; и прогрессивно возрастающие числа RED показывают прогрессивно снижающееся сродство.
В некоторых формах осуществления параметры D полярных апротонных растворителей по изобретению составляют от 17,7 до 22,0 МПа1/2. Такие относительно высокие параметры D обычно связаны с растворителями, имеющими циклические структуры и/или структуры с атомами серы или галогенов. Линейные соединения, вероятно, не находятся среди наиболее подходящих полярных апротонных растворителей для применения в изобретении, но могут быть рассмотрены, если их параметры Р и Н находятся в пределах интервалов, обсуждаемых ниже. Поскольку параметр D умножают на 4 в уравнении 2, пределы составляют половину от Ro. Кроме того, следует отметить, что значения D около 21 или выше часто характерны для твердого вещества.
В некоторых формах осуществления параметры Р полярных апротонных растворителей по изобретению составляют от 13 до 23 МПа1/2. Такие исключительно высокие параметры Р обычно связаны с растворителями, имеющими высокий дипольный момент, и преимущественно также относительно низкий молекулярный объем. Например, для V около 60 см3/моль дипольный момент должен составлять от 4,5 до 3,1. Для V около 90 см3/моль дипольный момент должен составлять от 5,6 до 3,9.
В некоторых формах осуществления параметры Н полярных апротонных растворителей по изобретению составляют от 3 до 13 МПа1/2. Как правило, полярные апротонные растворители, имеющие спиртовую группу, неприменимы в композициях и способах по изобретению, поскольку параметры Н таких растворителей были бы слишком высокими.
Молярный объем полярного апротонного растворителя может также быть релевантным, поскольку он входит в оценку всех трех параметров растворимости Хансена. По мере того как молярный объем становится меньше, жидкости склонны к быстрому выпариванию. По мере того как молярный объем становится больше, жидкости склонны к вступлению в твердую область в диапазоне параметров D и Р, приведенном выше. Таким образом, полярные апротонные растворители по изобретению, вероятнее, близки к границе жидкость/твердое вещество в диапазоне HSP.
В некоторых формах осуществления полярные апротонные растворители по изобретению имеют лактоновую, сульфоновую, нитрильную, сульфитную и/или карбонатную функциональную группу. Такие соединения отличаются своими относительно высокими диэлектрическими постоянными, высокими дипольными моментами и растворимостью в воде. Примерным полярным апротонным растворителем с лактоновой функциональной группой является γ-бутиролактон (GBL), примерным полярным апротонным растворителем с сульфоновой функциональной группой является сульфолан (SL; тетраметиленсульфид-диоксид), примерным полярным апротонным растворителем с нитрильной функциональной группой является ацетонитрил (AN), примерным полярным апротонным растворителем с сульфитной функциональной группой является гликольсульфит/этиленсульфит (GS), и примерными полярными апротонными растворителями с карбонатной функциональной группой являются этиленкарбонат (ЕС), пропиленкарбонат (PC) или этилентритиокарбонат (ETC). Структуры этих примерных растворителей представлены ниже, и их параметры растворимости Хансена, числа RED и молярные объемы приведены в таблице 1.
| Таблица 1 | |||||
| D | Р | Н | RED | Молярный объем (см3/моль) | |
| Корреляция(Ro=3,9) | 19,57 | 19,11 | 7,71 | - | - |
| GBL | 19,0 | 16,6 | 7,4 | 0,712 | 76,5 |
| PC | 20,0 | 18,0 | 4,1 | 0,993 | 85,2 |
| SL | 20,3 | 18,2 | 10,9 | 0,929 | 95,7 |
| EC | 19,4 | 21,7 | 5,1 | 0,946 | 66,0 |
| ETC | n/a | n/a | n/a | n/a | n/a |
| GS | 20,0 | 15,9 | 5,1 | n/a | 75,1 |
| n/a=недоступен | |||||
Другими подходящими полярными апротонными растворителями, которые можно использовать в изобретении, являются циклические соединения, такие как, например, ε-капролактон. Кроме того, замещенные пирролидиноны и родственные структуры с атомом азота в 5- или 6-членном кольце и циклические структуры с двумя нитрильными группами или одним атомом брома и одной нитрильной группой могут быть также пригодны для использования в изобретении. Например, N-метилпирролидинон (показан ниже) может быть подходящим полярным апротонным растворителем для применения в способах и композициях по изобретению.
Другие подходящие полярные апротонные растворители могут содержать кольцевую уретановую группу (NHCOO-). Однако не все такие соединения пригодны, поскольку 1,3-диметил-2-имидазолидинон не производит сигналов при использовании в композициях для гибридизации по изобретению. Специалист в данной области техники может провести скрининг на соединения, полезные в композициях и способах по изобретению, как описано в данной заявке. Примерные химические вещества, которые могут быть пригодными для использования в изобретении, представлены ниже в таблицах 2 и 3.
| Таблица 2 | |||
| Растворитель | D | Р | Н |
| Ацетанилид | 20,6 | 13,3 | 12,4 |
| N-Ацетилпирролидон | 17,8 | 13,1 | 8,3 |
| 4-Аминопиридин | 20,4 | 16,1 | 12,9 |
| Бензамид | 21,2 | 14,7 | 11,2 |
| Бензимидазол | 20,6 | 14,9 | 11,0 |
| 1,2,3-Бензотриазол | 18,7 | 15,6 | 12,4 |
| Бутадиендиоксид | 18,3 | 14,4 | 6,2 |
| 2,3-Бутиленкарбонат | 18,0 | 16,8 | 3,1 |
| Капролактон(эпсилон) | 19,7 | 15,0 | 7,4 |
| Малеиновый хлорангидрид | 20,4 | 17,3 | 11,5 |
| 2-Хлорциклогексанон | 18,5 | 13,0 | 5,1 |
| Хлорнитрометан | 17,4 | 13,5 | 5,5 |
| Цитраконовый ангидрид | 19,2 | 17,0 | 11,2 |
| Кротонлактон | 19,0 | 19,8 | 9,6 |
| Циклопропилнитрил | 18,6 | 16,2 | 5,7 |
| Диметилсульфат | 17,7 | 17,0 | 9,7 |
| Диметилсульфон | 19,0 | 19,4 | 12,3 |
| Диметилсульфоксид | 18,4 | 16,4 | 10,2 |
| 1,2-Динитробензол | 20,6 | 22,7 | 5,4 |
| 2,4-Динитротолуол | 20,0 | 13,1 | 4,9 |
| Дифенилсульфон | 21,1 | 14,4 | 3,4 |
| 1,2-Динитробензол | 20,6 | 22,7 | 5,4 |
| 2,4-Динитротолуол | 20,0 | 13,1 | 4,9 |
| Дифенилсульфон | 21,1 | 14,4 | 3,4 |
| 1,2-Динитробензол | 20,6 | 22,7 | 5,4 |
| 2,4-Динитротолуол | 20,0 | 13,1 | 4,9 |
| Эпсилон-капролактам | 19,4 | 13,8 | 3,9 |
| Этансульфонилхлорид | 17,7 | 14,9 | 6,8 |
| Фурфураль | 18,6 | 14,9 | 5,1 |
| 2-Фуронитрил | 18,4 | 15,0 | 8,2 |
| Изоксазол | 18,8 | 13,4 | 11,2 |
| Малеиновый ангидрид | 20,2 | 18,1 | 12,6 |
| Малононитрил | 17,7 | 18,4 | 6,7 |
| 4-Метоксибензонитрил | 19,4 | 16,7 | 5,4 |
| 1-Метокси-2-нитробензол | 19,6 | 16,3 | 5,5 |
| 1-Метилимидазол | 19,7 | 15,6 | 11,2 |
| 3-Метилизоксазол | 19,4 | 14,8 | 11,8 |
| N-Метилморфолин-N-оксид | 19,0 | 16,1 | 10,2 |
| Метилфенилсульфон | 20,0 | 16,9 | 7,8 |
| Метилсульфолан | 19,4 | 17,4 | 5,3 |
| Метил-4-толуолсульфонат | 19,6 | 15,3 | 3,8 |
| 3-Нитроанилин | 21,2 | 18,7 | 10,3 |
| 2-Нитротиофен | 19,7 | 16,2 | 8,2 |
| 9,10-Фенантренхинон | 20,3 | 17,1 | 4,8 |
| Фталевый ангидрид | 20,6 | 20,1 | 10,1 |
| 1,3-Пропансультон | 18,4 | 16,0 | 9,0 |
| бета-Пропиолактон | 19,7 | 18,2 | 10,3 |
| 2-Пирролидон | 19,4 | 17,4 | 11,3 |
| Сахарин | 21,0 | 13,9 | 8,8 |
| Сукцинонитрил | 17,9 | 16,2 | 7,9 |
| Сульфаниламид | 20,0 | 19,5 | 10,7 |
| Сульфолан | 20,3 | 18,2 | 10,9 |
| 2,2,6,6-Тетрахлорциклогексанон | 19,5 | 14,0 | 6,3 |
| Тиазол | 20,5 | 18,8 | 10,8 |
| 3,3,3-Трихлорпропен | 17,7 | 15,5 | 3,4 |
| 1,1,2-Трихлорпропен | 17,7 | 15,7 | 3,4 |
| 1,2,3-Трихлорпропен | 17,8 | 15,7 | 3,4 |
В таблице 2 приведен примерный перечень потенциальных химических веществ для использования в композициях и способах по изобретению на основании их параметров растворимости Хансена. Другие соединения могут, конечно, также соответствовать этим требованиям. Некоторые из этих химических веществ использованы в растворах для гибридизации и/или ПЦР на предшествующем уровне техники (например, диметилсульфоксид (ДМСО) использован в растворах для гибридизации и/или ПЦР, и сульфолан (SL) использован в растворах ПЦР), но большинство не было использовано. Однако на уровне техники не было признано, что эти соединения можно выгодно использовать для снижения времени и/или температур гибридизации, как раскрыто в данной заявке.
| Таблица 3 | ||
| Химическое вещество (дипольный момент) | RED | Точка плавления °С |
| Хлорэтиленкарбонат (4,02) | 0,92 | - |
| 2-Оксазолидинон (5,07) | 0,48 | 86-89 |
| 2-Имидазол | 1,49 | 90-91 |
| 1,5-Диметилтетразол (5,3) | ~1,5 | 70-72 |
| М-Этилтетразол (5,46) | ~1,5 | |
| Триметиленсульфид-диоксид (4,49) | ~ | - |
| Триметиленсульфит (3,63) | - | - |
| 1,3-Диметил-5-тетразол (4,02) | ~ | ~ |
| Пиридазин (3,97) | 1,16 | -8 |
| 2-Тиоурацил (4,21) | - | - |
| N-Метилимидазол (6,2) | 1,28 | - |
| 1-Нитрозо-2-пирролидинон | ~1,37 | - |
| Этилэтилфосфинат (3,51) | - | - |
| 5-Циано-2-тиоурацил (5,19) | - | - |
| 4Н-Пиран-4-тион (4,08) | 1,35 | 32-34 |
| 4Н-Пиран-4-он=гамма-пирон (4,08) | 1,49 | Boiling Point (BP) 80 |
| 2-Нитрофуран (4,41) | 1,14 | 29 |
| Метил-альфа-бромтетронат (6,24) | - | - |
| Тетрагидротиапиран оксид (4,19) | 1,75 | 60-64 |
| Пиколинонитрил (2-цианопиридин) (5,23) | 0,40 | 26-28 (BP 212-215) |
| Нитробензимидазол (6,0) | 0,52 | 207-209 |
| Изатин (5,76) | - | 193-195 |
| N-Фенилсиднон (6,55) | - | - |
| Гликольсульфат (Этилен гликоль) Примечание: нерастворим при 40% |
99°С | |
Не все из химических веществ, перечисленных в таблицах 2 и 3, пригодны для использования в композициях и способах по изобретению. Например, хотя ДМСО перечислен в таблице 2 в связи с тем, что его параметры растворимости Хансена (HSP) попадают в пределы вышеописанных интервалов, ДМСО не функционирует как снижающий время и/или температуры гибридизации в композициях и способах по изобретению. Таким образом, в некоторых формах осуществления водная композиция не содержит ДМСО в качестве полярного апротонного растворителя. Однако в пределах компетенции обычного специалиста в данной области техники находится скрининг на пригодные соединения с использованием представленного в данной заявке руководства, включая тестирование соединения в одном из приведенных примеров. Например, в некоторых формах осуществления подходящие полярные апротонные растворители будут иметь HSP в пределах вышеописанных интервалов и структуру, показанную выше в формулах 1-9.
В. Композиции, буферы и растворы
(1) Растворы для гибридизации
Традиционные растворы для гибридизации известны в данной области техники. Такие растворы могут содержать, например, буферные агенты, катализаторы, хелатирующие агенты, соли, детергенты и блокирующие агенты.
Например, буферные агенты могут включать SSC, HEPES, SSPE, PIPES, ТМАС, TRIS, SET, лимонную кислоту, фосфатный буфер, такой как, например, фосфат калия или пирофосфат натрия, и т.д. Буферные агенты могут присутствовать в концентрациях от 0,5x до 50x. Типично буферные агенты присутствуют в концентрациях от 2x до 10x.
Катализаторы могут включать полимеры, такие как фиколл, ПВП, гепарин, декстрансульфат, белки, такие как БСА, гликоли, такие как этиленгликоль, глицерин, 1,3-пропандиол, пропиленгликоль или диэтиленгликоль, их комбинации, такие как раствор Денхардта и BLOTTO, и органические растворители, такие как формамид, диметилформамид, ДМСО и т.д. Катализатор может присутствовать в концентрациях от 1% до 80% или от 0,1x до 10x. Типично формамид присутствует в концентрациях от 25% до 75%, тогда как ДМСО, декстрансульфат и гликоль присутствуют в концентрациях от 5% до 10%.
Хелатирующие агенты могут включать ЭДТА, ЭГТА и т.д. Хелатирующие агенты могут присутствовать в концентрациях от 0,1 мМ до 10 мМ. Типично хелатирующие агенты присутствуют в концентрациях от 0,5 мМ до 5 мМ.
Соли могут включать хлорид натрия, фосфат натрия, фосфат магния и т.д. Соли могут присутствовать в концентрациях от 1 мМ до 750 мМ. Типично соли присутствуют в концентрациях от 10 мМ до 500 мМ.
Детергенты могут включать Твин, ДСН, тритон, CHAPS, деоксихолевую кислоту и т.д. Детергент может присутствовать в концентрациях от 0,01% до 10%. Типично детергенты присутствуют в концентрациях от 0,1% до 1%.
Нуклеиново-кислотные блокирующие агенты могут включать дрожжевую тРНК, гомополимерную ДНК, денатурированную ДНК спермы лосося, ДНК спермы сельди, суммарную ДНК человека, ДНК СОТ1 и т.д. Блокирующие нуклеиновые кислоты могут присутствовать в концентрациях от 0,05 мг/мл до 100 мг/мл.
В литературе существуют большие различия в отношении традиционных растворов для гибридизации. Например, традиционный раствор для гибридизации может содержать 5x или 6x SSC, 0,01 М EDTA, 5х раствор Денхардта, 0,5% ДСН и 100 мг/мл деградированной в результате гидродинамического сдвига, денатурированной ДНК спермы лосося. Другой традиционный раствор для гибридизации может содержать 50 мМ HEPES, 0,5 М NaCl и 0,2 мМ ЭДТА. Типичный раствор для гибридизации для FISH на биологических образцах для определения РНК может содержать, например, 2x SSC, 10% декстрансульфат, 2 мМ комплекс ванадил-рибонуклеозид, 50% формамид, 0,02% БСА, свободной от РНКазы, и 1 мг/мл тРНК E. соli. Типичный раствор для гибридизации для FISH на биологических образцах для определения ДНК может содержать, например, 2х SSC, 10% декстрансульфат, 50% формамид и, например, 0,3 мг/мл ДНК спермы лосося или 0,1 мг/мл ДНК СОТ1. Другие типичные растворы для гибридизации могут содержать 40% формамид, 10% декстрансульфат, 30 мМ NaCl, 5 мМ фосфатный буфер, Alu-ПНК (блокирующую ПНК) или ДНК СОТ-1 и в некоторых случаях 0,1 мкг/мкл суммарной ДНК человека (THD).
Композиции по изобретению могут включать раствор для гибридизации, содержащий любой из компонентов традиционных растворов для гибридизации, приведенных выше, в комбинации по меньшей мере с одним полярным апротонным растворителем. Традиционные компоненты могут присутствовать в таких же концентрациях, как используют в традиционных растворах для гибридизации, либо могут присутствовать в более высоких или более низких концентрациях, либо могут быть полностью исключены.
Например, если композиции по изобретению содержат соли, такие как NaCl, и/или фосфатный буфер, соли могут присутствовать в концентрациях 0-1200 мМ NaCl и/или 0-200 мМ фосфатный буфер. В некоторых формах осуществления концентрации солей могут составлять, например, 300 мМ NaCl и 5 мМ фосфатный буфер или 600 мМ NaCl и 10 мМ фосфатный буфер.
Если композиции по изобретению содержат катализаторы, такие как декстрансульфат, гликоль или ДМСО, декстрансульфат может присутствовать в концентрациях от 5% до 40%, гликоль может присутствовать в концентрациях от 0,1% до 10%, и ДМСО может составлять от 0,1% до 10%. В некоторых формах осуществления концентрация декстрансульфата может составлять 10% или 20% и концентрация этиленгликоля, 1,3-пропанлиола или глицерина может составлять от 1% до 10%. В некоторых формах осуществления концентрация ДМСО может составлять 1%. В некоторых формах осуществления водная композиция не содержит ДМСО в качестве катализатора. В некоторых формах осуществления водная композиция не содержит формамид в качестве катализатора или содержит формамид при условии, что композиция содержит менее чем 10%, или менее чем 5%, или менее чем 2%, или менее чем 1%, или менее чем 0,5%, или менее чем 0,1%, или менее чем 0,05%, или менее чем 0,01%.
Если композиции по изобретению содержат лимонную кислоту, концентрации могут находиться в интервале от 1 мМ до 50 мМ, и рН может находиться в интервале от 5,0 до 8,0. В некоторых формах осуществления концентрация лимонной кислоты может составлять 10 мМ, и рН может составлять 6,2.
Композиции по изобретению могут содержать агенты, которые уменьшают неспецифическое связывание, например, с клеточной мембраной, такие как ДНК спермы лосося или небольшие количества суммарной ДНК человека, или, например, они могут содержать блокирующие агенты для блокирования связывания, например, повторяющихся последовательностей с мишенью, такие как большие количества суммарной ДНК человека или ДНК, обогащенная повторами, или специфические блокирующие агенты, такие как фрагменты и последовательности ПНК или ЗНК. Эти агенты могут присутствовать в концентрациях от 0,01-100 мкг/мкл или 0,01-100 мкМ. Например, в некоторых формах осуществления эти агенты будут составлять 0,1 мкг/мкл суммарной ДНК человека или 0,1 мкг/мкл не человеческой ДНК, такой как ДНК спермы сельди, спермы лосося или тимуса теленка, или 5 мкМ блокирующей ПНК.
Один аспект изобретения составляет композиция или раствор для применения при гибридизации. Композиции для применения в изобретении включают водную композицию, содержащую нуклеиново-кислотную последовательность и по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей. Количество, эффективное для денатурации двунитевых нуклеотидных последовательностей, представляет собой количество, которое обеспечивает гибридизацию. Например, одним из путей тестирования, эффективно ли количество полярного апротонного растворителя для обеспечения гибридизации, является определение того, дает ли полярный апротонный растворитель при использовании в способах и композициях для гибридизации, описанных в данной заявке, таких как пример 1, обнаружимый сигнал и/или амплифицированный продукт нуклеиновой кислоты.
Не ограничивающие примеры эффективных количеств полярных апротонных растворителей включают, например, от примерно 1% до примерно 95% (об/об). В некоторых формах осуществления концентрация полярного апротонного растворителя составляет от 5% до 60% (об/об). В других формах осуществления концентрация полярного апротонного растворителя составляет от 10% до 60% (об/об). В других формах осуществления концентрация полярного апротонного растворителя составляет от 30% до 50% (об/об). Концентрации от 1% до 5%, от 5% до 10%, 10%, от 10% до 20%, от 20% до 30%, от 30% до 40%, от 40% до 50% или от 50% до 60% (об/об) также пригодны. В некоторых формах осуществления полярный апротонный растворитель будет присутствовать в концентрации 0,1%, 0,25%, 0,5%, 1%, 2%, 3%, 4% или 5% (об/об). В других формах осуществления полярный апротонный растворитель будет присутствовать в концентрации 7%, 7,5%, 8%, 8,5%, 9%, 9,5%, 10%, 10,5%, 11%, 11,5%, 12%, 12,5%, 13%, 13,5%, 14%, 14,5%, 15%, 15,5%, 16%, 16,5%, 17%, 17,5%, 18%, 18,5%, 19%, 19,5% или 20% (об/об).
Если композиции по изобретению используют в гибридизационном анализе, они могут дополнительно содержать один или более чем один нуклеиново-кислотный зонд. Эти зонды могут быть непосредственно или опосредованно мечеными обнаружимыми соединениями, такими как ферменты, хромофоры, флуорохромы и гаптены. ДНК зонды могут присутствовать в концентрациях от 0,1 до 100 нг/мкл. Например, в некоторых формах осуществления зонды могут присутствовать в концентрациях от 1 до 10 нг/мкл. ПНК зонды могут присутствовать в концентрациях от 0,5 до 5000 нМ. Например, в некоторых формах осуществления зонды могут присутствовать в концентрациях от 5 до 1000 нМ.
В одной форме осуществления композиция по изобретению содержит смесь 40% полярного апротонного растворителя (об/об) (например, этиленкарбоната, "ЕС"), 10% декстрансульфата, 300 мМ NaCl, 5 мМ фосфатного буфера и 1-10 нг/мкл зонда. Другая примерная композиция по настоящему изобретению содержит смесь 15% ЕС, 20% декстрансульфата, 600 мМ NaCl, 10 мМ фосфатного буфера и 0,1 мкг/мкл суммарной ДНК человека. Еще одна другая примерная композиция содержит 15% ЕС, 20% декстрансульфат, 600 мМ NaCl, 10 мМ лимонную кислоту рН 6,2 и 0,1 мкг/мкл не человеческой ДНК (например, спермы сельди, спермы лосося или тимуса теленка) или 0,5% формамид или 1% гликоль (например, этиленгликоль, 1,3-пропандиол или глицерин).
(2) Полярный апротонный растворитель(и)
Различные полярные апротонные растворители могут придавать различные свойства композициям по изобретению. Например, выбор полярного апротонного растворителя может вносить вклад в стабильность композиции, поскольку некоторые полярные апротонные растворители могут разлагаться со временем. Например, полярный апротонный растворитель этиленкарбонат распадается до этиленгликоля, который является относительно стабильной молекулой, и диоксида углерода, который может взаимодействовать с водой с образованием угольной кислоты, изменяя кислотность композиций по изобретению. Не связываясь теорией, считают, что изменение рН при распаде этиленкарбоната делает композиции по изобретению менее эффективными для гибридизации. Однако стабильность может быть улучшена путем снижения рН композиции, путем добавления лимонной кислоты в качестве буфера при рН 6,2 вместо традиционного фосфатного буфера, который типично используют примерно при рН 7,4, и/или путем добавления этиленгликоля в концентрациях, например, от 0,1% до 10% или от 0,5% до 5%, как, например, 1%, 2%, 3% и т.д. Например, с 10 мМ цитратным буфером композиции по изобретению стабильны при 2-8°С в течение примерно 8 месяцев. Стабильность можно также улучшить, если хранить композиции при низких температурах (например, -20°С).
Кроме того, некоторые полярные апротонные растворители могут вызывать разделение композиций по изобретению на многофазные системы в определенных условиях. Условия, при которых получают многофазные системы, могут быть различными для различных полярных апротонных растворителей. Как правило, однако, как только концентрация полярного апротонного растворителя увеличивается, увеличивается число фаз. Например, композиции, содержащие низкие концентрации этиленкарбоната (то есть менее 20%), могут существовать в виде одной фазы, тогда как композиции, содержащие более высокие концентрации этиленкарбоната, могут разделяться на две или даже на три фазы. Например, композиции, содержащие 15% этиленкарбоната, существуют в виде единой фазы при комнатной температуре, тогда как композиции, содержащие 40% этиленкарбоната, состоят из вязкой нижней фазы (примерно 25% суммарного объема) и менее вязкой верхней фазы (примерно 75% суммарного объема) при комнатной температуре.
С другой стороны, некоторые полярные апротонные растворители могут существовать в двух фазах при комнатной температуре даже при низких концентрациях. Например, сульфолан, убутиролактон, этилентритиокарбонат, гликольсульфит и пропиленкарбонат существуют в виде двух фаз при концентрациях 10, 15, 20 или 25% (20% декстран сульфат, 600 мМ NaCl, 10 мМ цитратный буфер) при комнатной температуре.
Может быть также возможным изменить число фаз путем регулирования температуры композиций по изобретению. Как правило, как только температура повышается, число фаз уменьшается. Например, при 2-8°С композиции, содержащие 40% этиленкарбонат, могут разделиться на трехфазную систему.
Может быть также возможным изменить число фаз путем регулирования концентрации декстрансульфата и/или соли в композиции. Вообще говоря, снижение концентрации декстрансульфата (традиционная концентрация составляет 10%) и/или концентрации соли может уменьшить число фаз. Однако в зависимости от конкретного полярного апротонного растворителя и его концентрации в композиции единые фазы могут быть получены даже при более высоких концентрациях соли и декстрансульфата. Например, композиция, содержащая низкие количества ЕС (например, 15%, 10% или 5%), может хорошо работать за счет увеличения концентраций декстрансульфата и соли, все же удерживаясь в однофазной системе. В конкретной форме осуществления композиции, содержащие ДНК зонд гена HER2, ПНК зонд CENY, 15% ЕС, 20% декстрансульфат, 600 мМ NaCl и 10 мМ фосфатный буфер, замерзают при -20°С. В других формах осуществления композиции являются жидкими при -20°С.
Некоторые полярные апротонные растворители могут давать более сильные сигналы в одной фазе или в другой. Например, 40% гликольсульфит дает сильные сигналы в нижней фазе и не дает сигналов в верхней фазе. Подобным образом, некоторые типы зондов могут давать более сильные сигналы в одной фазе или в другой. Например, ПНК зонды склонны показывать более сильные сигналы в нижней фазе, чем в верхней фазе.
Соответственно, многофазные системы по изобретению можно использовать, чтобы удобно исследовать различные аспекты образца. Например, двухфазную систему можно использовать для отделения образцов, меченых ПНК зондами, от образцов, меченых ДНК зондами. Другие применения включают выделение специфичной фазы, проявляющей, например, определенные преимущества гибридизации, так что изолированную фазу можно использовать в качестве однофазной системы. Зонд и/или образец можно добавлять до или после выделение конкретной фазы.
Гибридизации можно проводить с однофазной композицией по изобретению, с индивидуальными фазами многофазных композиций по изобретению или со смесями любой одной или более чем одной из фаз в многофазной композиции по изобретению. Например, в однофазной системе объем образца можно экстрагировать для использования при гибридизации. В многофазной системе можно экстрагировать объем образца из интересующей фазы (например, верхней, нижней или средней фазы) для использования при гибридизации. Альтернативно фазы в многофазной системе можно смешивать перед экстракцией объема смешанного образца для использования при гибридизации. Однако многофазная система может дать сильный и неравномерный локальный фон окрашивания в зависимости от композиции. Хотя добавление низких количеств формамида уменьшит фон в однофазной системе, оно обладает малым эффектом в многофазной системе при высоких концентрациях (например, 40%) полярного апротонного растворителя. Кроме того, как только концентрация формамида увеличивается, более высокие концентрации зонда и/или более длительные периоды гибридизации необходимы для поддержания сильной интенсивности сигнала.
(3) Оптимизация для конкретных применений
Композиции по изобретению можно варьировать с целью оптимизации результатов для конкретного применения. Например, концентрацию полярного апротонного растворителя, соли, катализатора, блокирующего агента и/или ионов водорода (то есть рН) можно варьировать, чтобы улучшить результаты для конкретного применения.
Например, концентрацию полярного апротонного растворителя можно варьировать, чтобы улучшить интенсивность сигнала и фоновое окрашивание. Как правило, как только концентрация полярного апротонного растворителя увеличивается, интенсивность сигнала увеличивается, а фоновое окрашивание уменьшается. Например, композиции, содержащие 15% ЕС, склонны показывать более сильные сигналы и меньше фона, чем композиции, содержащие 5% ЕС. Однако интенсивность сигнала можно улучшить для композиций, имеющих низкие концентрации полярного апротонного растворителя (например, от 0% до 20%), если увеличить концентрации соли и/или декстрансульфата. Например, сильные сигналы можно наблюдать при 5%-10% ЕС, когда концентрация соли поднимается примерно в 8-16 раз от традиционных концентраций соли (то есть примерно 1200 мМ NaCl, 20 мМ фосфатный буфер). Подобным образом, когда используют более низкие концентрации полярного апротонного растворителя, более высокие концентрации декстрансульфата обычно требуются для поддержания хорошей интенсивности сигнала и фона.
Соответственно, концентрации соли и декстрансульфата можно также варьировать, чтобы улучшить интенсивность сигнала и фоновое окрашивание. Как правило, как только концентрации соли и декстрансульфата увеличиваются, увеличивается интенсивность сигнала и уменьшается фон. Например, концентрации соли, которые примерно в два-четыре раза выше традиционных концентраций (то есть 300 мМ NaCl, 5 мМ фосфатный буфер), дают сильные сигналы и низкий фон. Неожиданно, однако, гибридизация происходит при использовании композиций по изобретению даже при полном отсутствии соли. Интенсивности сигнала могут быть улучшены в бессолевых условиях за счет увеличения концентраций катализатора и/или полярного апротонного растворителя.
Подобным образом, интенсивность сигнала увеличивается, когда концентрация декстрансульфата увеличивается от 0% до 20%. Однако хорошие сигналы можно наблюдать даже при концентрациях декстрансульфата 0%. Интенсивность сигнала можно улучшить в условиях низкого декстрансульфата за счет увеличения концентраций полярного апротонного растворителя и/или соли.
Кроме того, типы зондов, используемых в композициях по изобретению, можно варьировать для улучшения результатов. Например, в некоторых аспектах изобретения комбинации ДНК/ДНК зондов могут показать меньше фона, чем комбинации ДНК/ПНК зондов в композициях по изобретению или наоборот. С другой стороны, ПНК зонды склонны показывать более сильные сигналы, чем ДНК зонды, в условиях низкой соли и/или низких концентраций полярного апротонного растворителя. Действительно, ПНК зонды также показывают сигналы, когда полярный апротонный растворитель отсутствует, тогда как ДНК зонды показывают слабые или не показывают никаких сигналов без полярного апротонного растворителя.
Г. Области применения, способы и применение
(1) Аналитические образцы
Способы и композиции по изобретению можно применять полностью или частично во всех типах областей применения гибридизации в области цитологии, гистологии или молекулярной биологии. В соответствии с одной формой осуществления первая или вторая нуклеиново-кислотная последовательность в способах по изобретению присутствует в биологическом образце. Примеры таких образцов включают, например, образцы ткани, клеточные препараты, препараты клеточных фрагментов и изолированные или обогащенные препараты клеточных компонентов. Образец может иметь происхождение из различных тканей, таких как, например, молочная железа, легкое, прямая и ободочная кишка, простата, голова и шея, желудок, поджелудочная железа, пищевод, печень и мочевой пузырь, или других релевантных тканей и их новообразований, из любой клеточной суспензии, образца крови, аспирационной диагностической пункции, асцитной жидкости, мокроты, промывания брюшной полости, промывания легкого, мочи, фекалий, соскоба клеток, мазка клеток, клеток, полученных с помощью цитоцентрифуги, или цитологических препаратов.
Образец может быть выделен и обработан, используя стандартные протоколы. Препараты клеточных фрагментов могут быть, например, получены путем гомогенизации клеток, обработки замораживанием-оттаиванием или клеточного лизиса. Изолированный образец можно обработать множеством различных путей в зависимости от цели получения образца и в зависимости от обычных методов, принятых в данном месте. Часто образец обрабатывают различными реагентами, чтобы сохранить ткань для последующего анализа образца, альтернативно образец можно анализировать непосредственно. Примерами широко используемых способов сохранения образцов является фиксация формалином с последующим заключением в парафин и криоконсервация.
Для метафазных препаратов клеточные культуры обычно обрабатывают колцемидом или другим подходящим агентом, прерывающим полюс веретена деления, чтобы остановить клеточный цикл в метафазе. Затем клетки фиксируют и капают на предметные стекла, обрабатывают формальдегидом, промывают и обезвоживают в этаноле. Затем добавляют зонды, и образцы анализируют с помощью любой из методик, обсужденных ниже.
Цитология включает исследование индивидуальных клеток и/или хромосомных препаратов из биологического образца. Цитологическое исследование образца начинается с получения образца клеток, которое типично можно осуществлять путем соскоба, мазка или щеточной биопсии области, как в случае образцов шейки матки, или путем сбора жидкостей организма, таких как полученные из грудной полости, мочевого пузыря или позвоночного столба, либо путем аспирационной диагностической пункции или тонкоигольной пункционной биопсии, как в случае внутренних опухолей. При общепринятом получении цитологического препарата вручную образец переносят в жидкий суспендирующий материал, а затем клетки в жидкости переносят непосредственно или посредством стадий обработки центрифугированием на предметное стекло микроскопа для визуализации. При типичном автоматизированном получении цитологических препаратов фильтрующее устройство помещают в жидкую суспензию, и это фильтрующее устройство и распределяет клетки, и улавливает клетки на фильтре. Затем фильтр извлекают и помещают в контакте с предметным стеклом. Затем клетки фиксируют на предметном стекле, после чего анализируют с помощью любой из методик, обсужденных ниже.
В традиционном эксперименте по гибридизации с использованием цитологического образца стекла, содержащие образец, погружают в формальдегидный буфер, отмывают, а затем обезвоживают в этаноле. Затем добавляют зонды, и образец покрывают покровным стеклом. Стекло инкубируют при температуре, достаточной для денатурации любой нуклеиновой кислоты в образце (например, 5 минут при 82°С), а затем инкубируют при температуре, достаточной, чтобы дать возможность гибридизации (например, в течение ночи при 45°С). После гибридизации покровные стекла удаляют, и образцы подвергают отмывке высокой жесткости (например, 10 минут при 65°С) с последующей серией отмывок низкой жесткости (например, 2×3 минуты при комнатной температуре). Затем образцы обезвоживают и заливают в среду для анализа.
Гистология включает исследование клеток в тонких срезах ткани. Для приготовления образца ткани для гистологического исследования кусочки ткани фиксируют в подходящем фиксаторе, типично в альдегиде, таком как формальдегид или глутаральдегид, а затем заключают в расплавленный парафиновый воск. Затем восковой блок, содержащий образец ткани, режут на микротоме для получения тонких срезов парафина, содержащих ткань, типично от 2 до 10 микрон толщины. Затем срез образца наносят на предметное стекло, высушивают на воздухе и нагревают, чтобы вызвать приклеивание образца к предметному стеклу. Затем остаточный парафин растворяют подходящим растворителем, типично ксилолом, толуолом или другими. Затем так называемые депарафинизирующие растворители удаляют реагентом промывающего - обезвоживающего типа, после чего анализируют с помощью любой из методик, обсужденных ниже. Альтернативно срезы можно приготовить из замороженных образцов, кратковременно зафиксировать в 10% формалине или других подходящих фиксаторах, а затем инфузировать обезвоживающим реагентом перед анализом образца.
В традиционном эксперименте по гибридизации с использованием гистологического образца фиксированные формалином, заключенные в парафин образцы ткани режут на срезы 2-6 мкм и собирают на стеклах. Парафин плавят (например, 30-60 минут при 60°С), а затем удаляют (депарафинизируют) путем промывания ксилолом (или заменителем ксилола), например, 2×5 минут. Образцы регидратируют, промывают, а затем предварительно обрабатывают (например, 10 минут при 95-100°С). Стекла промывают, а затем обрабатывают пепсином или другим подходящим усилителем проницаемости, например, 3-15 минут при 37°С. Стекла промывают (например, 2×3 минуты), обезвоживают и наносят зонд. Образцы покрывают покровным стеклом, и стекло инкубируют при температуре, достаточной для денатурации любой нуклеиновой кислоты в образце (например, 5 минут при 82°С), с последующей инкубацией при температуре, достаточной, чтобы дать возможность гибридизации (например, в течение ночи при 45°С). После гибридизации покровные стекла удаляют, и образцы подвергают отмывке высокой жесткости (например, 10 минут при 65°С) с последующей серией отмывок низкой жесткости (например, 2×3 минуты при комнатной температуре). Затем образцы обезвоживают и заливают в среду для анализа.
(2) Методики гибридизации
Композиции и способы по настоящему изобретению можно применять полностью или частично во всех типах методик гибридизации нуклеиновых кислот, известных в данной области техники для цитологических и гистологических образцов. Такие методики включают, например, гибридизацию in situ (ISH), флуоресцентную гибридизацию in situ (FISH; включая многоцветную FISH, Fiber-FISH и т.д.), хромогенную гибридизацию in situ (CISH), гибридизацию in situ с окрашиванием серебром (SISH), сравнительную геномную гибридизацию (CGH), хромосомные отпечатки и микрочипы in situ.
Молекулярные зонды, которые пригодны для использования в изобретении, описаны, например, в публикации патента США №2005/0266459, которая включена в данную заявку посредством ссылки. Как правило, зонды могут быть получены путем химического синтеза или путем амплификации специфичной последовательности ДНК с помощью клонирования, встраивания ДНК в вектор и амплификации вектора со вставкой в соответствующих клетках-хозяевах. Обычно используемые векторы включают бактериальные плазмиды, космиды, бактериальные искусственные хромосомы (ВАС), искусственные хромосомы фага Р1 (РАС) или дрожжевые искусственные хромосомы (YAC). Затем амплифицированную ДНК экстрагируют и очищают для использования в качестве зонда. Способы получения и/или синтеза зондов известны в данной области техники, например, как раскрыто в PCT/US02/30573.
Как правило, тип зонда определяет тип признака, который можно определить в гибридизационном анализе. Например, зонды на основе суммарной ядерной или геномной ДНК можно использовать в качестве видоспецифического зонда. Хромосомные отпечатки представляют собой коллекции последовательностей ДНК, имеющих происхождение от одного типа хромосом, и могут позволить идентифицировать этот специфичный тип хромосом в метафазных и интерфазных ядрах, подсчитать число определенной хромосомы, показать транслокации или идентифицировать экстрахромосомные фрагменты хроматина. Различные хромосомные типы также имеют уникальные повторяющиеся последовательности, которые могут быть мишенью для гибридизации с зондом, чтобы определить и подсчитать специфичные хромосомы. Зонды, которые представляют собой вставки большого размера, можно использовать для направления на уникальные однокопийные последовательности. При этих зондах большого размера эффективность гибридизации обратно пропорциональна размеру зонда. Зонды меньшего размера можно также использовать для определения аберраций, таких как делеции, амплификации, инверсии, дупликации и анеуплоидия. Например, различно окрашенные локус-специфичные зонды можно использовать для определения транслокаций посредством гибридизации in situ с раздельным сигналом.
Как правило, способность к различению между близкородственными последовательностями обратно пропорциональна длине зонда для гибридизации, поскольку различие в термической стабильности уменьшается между комплексами дикого типа и мутантными комплексами по мере увеличения длины зонда. Зонды более чем 10 п.о. в длину обычно требуются для получения различия последовательности, необходимого, чтобы правильно идентифицировать уникальный организм или интересующее клиническое состояние. С другой стороны, столь малые различия последовательности, как одна пара оснований (точечная мутация), в очень коротких олигомерах (<10 пар оснований) могут быть достаточны, чтобы обеспечить различение гибридизации с комплементарными нуклеиново-кислотными последовательностями-мишенями по сравнению с последовательностями, не являющимися мишенями.
В одной форме осуществления по меньшей мере одна серия зондов для гибридизации in situ может включать один или более чем один ПНК зонд, как определено выше и как описано в патенте США №7105294, который включен в данную заявку посредством ссылки. Способы синтеза ПНК зондов описаны в PCT/US02/30573. Альтернативно или дополнительно по меньшей мере одна серия зондов для гибридизации в любой из методик, обсужденных выше, может содержать один или более чем один зонд, представляющий собой замкнутую нуклеиновую кислоту (ЗНК), как описано в WO 99/14226, которая включена в данную заявку посредством ссылки. За счет дополнительной мостиковой связи между 2' и 4' атомами углерода каркас ЗНК предварительно организован для гибридизации. Взаимодействия ЗНК/ДНК и ЗНК/РНК более сильны, чем соответствующие взаимодействия ДНК/ДНК или ДНК/РНК, на что указывает более высокая температура плавления. Таким образом, композиции и способы по изобретению, которые снижают энергию, требующуюся для гибридизации, особенно полезны для гибридизаций с ЗНК зондами.
В одной форме осуществления зонды могут содержать обнаружимую метку (молекулу, которая обеспечивает аналитически идентифицируемый сигнал, который дает возможность обнаружения гибрида зонд-мишень), как раскрыто в публикации патента США №2005/0266459, которая включена в данную заявку посредством ссылки. Обнаружимая метка может быть непосредственно присоединена к зонду или присоединена к зонду опосредованно, например, путем использования линкера. Любой способ мечения, известный специалистам в данной области техники, включая ферментативный и химический способы, можно использовать для мечения зондов, используемых в способах и композициях по изобретению. В других формах осуществления зонды являются немечеными.
Как правило, в методиках гибридизации, таких как CGH, FISH, CISH и SISH, используют большие, в основном, неспецифичные, нуклеиново-кислотные зонды, которые гибридизуются с варьирующей жесткостью с генами или фрагментами генов в хромосомах клеток. Использование больших зондов делает методику гибридизации in situ очень чувствительной. Однако успешное использование больших геномных зондов в традиционных гибридизационных анализах зависит от блокирования нежелательного фонового окрашивания, являющегося результатом, например, повторяющихся последовательностей, которые присутствуют на протяжении всего генома. Такие стадии блокирования требуют много времени и являются дорогостоящими. Как обсуждено ниже, способы и композиции по изобретению выгодно уменьшают и/или устраняют необходимость в таких стадиях блокирования. Однако в одной форме осуществления повторяющиеся последовательности могут быть супрессированы в соответствии со способами, известными в данной области техники, например, как раскрыто в PCT/US02/30573.
Связанные зонды можно обнаружить в цитологических и гистологических образцах либо непосредственно, либо опосредованно с флуорохромами (например, FISH), органическими хромогенами (например, CISH), частицами серебра (например, SISH) или другими частицами металла (например, флуоресцентная гибридизация in situ, усиленная золотом, GOLDFISH). Таким образом, в зависимости от способа обнаружения, популяции клеток, полученные из образца, подлежащего тестированию, можно визуализировать посредством флуоресцентной микроскопии или общепринятой световой микроскопии со светлым полем.
Гибридизационные анализы на цитологических и гистологических образцах являются важными инструментами для определения числа, размера и/или локализации специфичных последовательностей ДНК. Например, при CGH целые геномы окрашивают и сравнивают с нормальными референсными геномами для определения областей с аберрантным числом копий. Типично ДНК из ткани субъекта и из нормальной контрольной ткани метят зондами различного цвета. Пулы ДНК смешивают и добавляют к метафазному препарату нормальных хромосом (или к микрочипам для CGH на микрочипах или на матрице). Затем соотношения цветов сравнивают для идентификации областей с аберрантным числом копий.
FISH типично используют, когда требуется множественная цветовая визуализация и/или когда протокол требует количественного определения сигналов. Эта методика, как правило, включает приготовление цитологического образца, мечение зондов, денатурацию хромосом-мишеней и зонда, гибридизацию зонда с последовательностью-мишенью и обнаружение сигнала. Типично реакция гибридизации флуоресцентно окрашивает последовательности-мишени таким образом, что их локализацию, размер или число можно определить, используя флуоресцентную микроскопию, проточную цитометрию или другие подходящие приборы. Последовательности ДНК в диапазоне от целых геномов до нескольких килобаз можно исследовать, используя FISH. FISH можно также использовать на метафазных препаратах и интерфазных ядрах.
FISH успешно использована для картирования повторяющихся и однокопийных последовательностей ДНК на метафазных хромосомах, интерфазных ядрах, хроматиновых нитях и открытых молекулах ДНК, а также для идентификации хромосом и анализа кариотипа посредством локализации больших повторяющихся семейств, типично рибосомных ДНК, и основных семейств тандемных повторов. Одно из наиболее важных применений для FISH состояло в определении однокопийных последовательностей ДНК, в частности, генов, связанных с заболеваниями у людей и других эукариотических модельных видов, и в определении инфекционных агентов. FISH можно использовать для определения, например, хромосомной анеуплоидии при пренатальных диагнозах, гематологических раках и солидных опухолях; генных аномалий, таких как амплификации онкогенов, делеции генов или слияния генов; хромосомных структурных аномалий, таких как транслокации, дупликации, инсерции или инверсии; синдромов генных последовательностей, таких как синдром микроделеций; генетических эффектов различных терапий; вирусных нуклеиновых кислот в соматических клетках и сайтов интеграции вирусов в хромосомах и т.д. При многоцветной FISH каждую хромосому окрашивают отдельным цветом, что обеспечивает определение нормальных хромосом, от которых имеют происхождение аномальные хромосомы. Такие методики включают мультиплексную FISH (m-FISH), спектральное кариотипирование (SKY), комбинированное бинарное мечение (COBRA), кариотипирование с изменением цвета, межвидовое дифференциальное окрашивание, многоцветное дифференциальное окрашивание высокого разрешения, теломерную мультиплексную FISH (TM-FISH), FISH с раздельными сигналами (ssFISH) и FISH со слитыми сигналами. CISH и SISH можно применять во многих областях применения, тех же, что и FISH, и эти методики обладают дополнительным преимуществом, давая возможность анализа морфологии лежащей в основе ткани, например, в гистопатологических областях применения. Если проводят FISH, гибридизационная смесь может содержать серии различных и сбалансированных пар зондов, как описано в патенте США №6730474, который включен в данную заявку посредством ссылки. Для CISH гибридизационная смесь может содержать по меньшей мере одну серию зондов, сконструированных для обнаружения одним или более чем одним общепринятым органическим хромогеном, и для SISH гибридизационная смесь может содержать по меньшей мере одну серию зондов, сконструированных для обнаружения частицами серебра, как раскрыто в Powell RD et al., "Metallographic in situ hybridization", Hum. Pathol., 38: 1145-59.
Композиции по изобретению можно также применять полностью или частично во всех типах молекулярно-биологических методик, в которые вовлечена гибридизация, включая блоттинг и гибридизацию с зондом (например, Саузерн, Норзерн и т.д.), в микрочипах и в методиках амплификации, включающих традиционную ПЦР, ОТ-ПЦР, мутационную ПЦР, асимметрическую ПЦР, ПЦР с горячим запуском, обратную ПЦР, мультиплексную ПЦР, гнездовую ПЦР, количественную ПЦР и ПЦР in situ. ПЦР in situ представляет собой полимеразную цепную реакцию, которая идет внутри клетки или на стекле, например, на вышеописанных цитологических и гистологических образцах. Типично после приклеивания образца к предметному стеклу клетки регидратируют и пермеабилизуют, а затем объединяют с соответствующей смесью реагентов ПЦР, включающей полимеразу, dNTP и праймеры. ПЦР можно проводить в специально предназначенном аппарате, таком как GeneAmp In situ PCR System 1000 (Perkin Elmer Biosystems, Foster City, CA), и амплифицированный продукт можно определять, используя меченые зонды, или путем включения меченых dNTP во время амплификации. Композиции по изобретению улучшат эффективность традиционного и in situ ПЦР анализа, например, за счет снижения температур денатурации и гибридизации и/или времени, требующегося для проведения циклов амплификации.
(3) Условия гибридизации
Способ по настоящему изобретению включает применение полярных апротонных растворителей при гибридизации цепей нуклеиновых кислот. Композиции по настоящему изобретению особенно полезны при этом способе.
Способы гибридизации, использующие композиции по изобретению, могут включать нанесение композиций на образец, содержащий нуклеиново-кислотную последовательность-мишень, наиболее вероятно в двунитевой форме. Обычно, чтобы обеспечить доступ зонда для гибридизации с последовательностью-мишенью, образец и композицию нагревают для денатурации нуклеиновых кислот-мишеней. Во время денатурации полярный апротонный растворитель взаимодействует с последовательностью и способствует денатурации мишени и ренатурации зонда с мишенью. Полярные апротонные растворители, описанные в настоящем изобретении, значительно ускоряют этот процесс и уменьшают жесткость и токсичность условий гибридизации по сравнению с формамидом.
Гибридизации с использованием композиций по изобретению можно проводить, используя такую же методологию анализа, как для гибридизаций, проводимых с традиционными композициями. Однако композиции по изобретению дают возможность более коротких периодов гибридизации. Например, в стадиях предварительной обработки нагреванием, расщепления, денатурации, гибридизации, отмывки и заливки в среду можно использовать такие же условия в отношении объемов, температур, реагентов и периодов инкубации, как для традиционных композиций. В традиционных протоколах гибридизации, известных в данной области техники, существуют значительные вариации. Например, в некоторых протоколах указана отдельная стадия денатурации потенциальных двунитевых нуклеотидов в отсутствие зонда, перед последующей стадией гибридизации. Композиции по изобретению можно использовать в любом из традиционных протоколов гибридизации, известных в данной области техники.
Альтернативно анализы с использованием композиций по изобретению можно изменить и оптимизировать по сравнению с традиционными методологиями, например, за счет уменьшения времени гибридизации, повышения или снижения температур денатурации и/или гибридизации и/или увеличения или уменьшения объемов гибридизации.
Например, в некоторых формах осуществления композиции по изобретению будут давать сильные сигналы, когда температура денатурации составляет от 60 до 100°С, а температура гибридизации составляет от 20 до 60°С. В других формах осуществления композиции по изобретению будут давать сильные сигналы, когда температура денатурации составляет от 60 до 70°С, от 70 до 80°С, от 80 до 90°С или от 90 до 100°С, а температура гибридизации составляет от 20 до 30°С, от 30 до 40°С, от 40 до 50°С или от 50 до 60°С. В других формах осуществления композиции по изобретению будут давать сильные сигналы, когда температура денатурации составляет 72, 82 или 92°С, а температура гибридизации составляет 40, 45 или 50°С.
В других формах осуществления композиции по изобретению будут давать сильные сигналы, когда время денатурации составляет от 0 до 10 минут, а время гибридизации составляет от 0 минут до 24 часов. В других формах осуществления композиции по изобретению будут давать сильные сигналы, когда время денатурации составляет от 0 до 5 минут, а время гибридизации составляет от 0 минут до 8 часов. В других формах осуществления композиции по изобретению будут давать сильные сигналы, когда время денатурации составляет 0, 1, 2, 3, 4 или 5 минут, а время гибридизации составляет 0 минут, 5 минут, 15 минут, 30 минут, 60 минут, 180 минут или 240 минут. Специалистам в данной области техники понятно, что в некоторых случаях, например, определения РНК, стадия денатурации не требуется.
Соответственно, гибридизации с использованием композиций по изобретению можно проводить менее чем за 8 часов. В других формах осуществления гибридизацию проводят менее чем за 6 часов. Еще в других формах осуществления гибридизацию проводят менее чем за 4 часа. В других формах осуществления гибридизацию проводят в пределах 3 часов. Еще в других формах осуществления гибридизацию проводят в пределах 2 часов. В других формах осуществления гибридизацию проводят в пределах 1 часа. Еще в других формах осуществления гибридизацию проводят в пределах 30 минут. В других формах осуществления гибридизация может проходить в пределах 15 минут. Гибридизация может даже проходить в пределах 10 минут или менее чем за 5 минут. На фиг.1 и 2 проиллюстрирована типичная периодизация для гибридизаций, проводимых на цитологических и гистологических образцах, соответственно, с использованием композиций по изобретению по сравнению с гибридизациями с использованием традиционных композиций.
Когда изменяется время гибридизации, концентрацию зонда можно также варьировать с целью получения сильных сигналов и/или снижения фона. Например, когда время гибридизации уменьшается, количество зонда можно увеличить, чтобы улучшить интенсивность сигнала. С другой стороны, когда время гибридизации уменьшается, количество зонда можно уменьшить, чтобы улучшить фоновое окрашивание.
Композиции по изобретению неожиданно устраняют необходимость в стадии блокирования во время гибридизации за счет улучшения интенсивности сигнала и фона путем блокирования связывания, например, повторяющихся последовательностей с ДНК-мишенью. Таким образом, нет необходимости в использовании суммарной ДНК человека, блокирующей ПНК, СОТ-1 ДНК или ДНК из любого другого источника в качестве блокирующего агента. Однако уровни фона можно дополнительно снизить путем добавления агентов, которые уменьшают неспецифическое связывание, например, с клеточной мембраной, таких как небольшие количества суммарной ДНК человека или ДНК не человеческого происхождения (например, ДНК спермы лосося), в реакцию гибридизации с использованием композиций по изобретению.
Водные композиции по изобретению, кроме того, обеспечивают возможность значительно уменьшить концентрацию нуклеиново-кислотных последовательностей, включенных в композицию. Как правило, концентрацию зондов можно уменьшить в 2-8 раз по сравнению с традиционными концентрациями. Например, если зонды HER2 ДНК и зонды CEN17 ПНК используют в композициях по изобретению, их концентрацию можно уменьшить на ¼ и ½, соответственно, по сравнению с их концентрациями в традиционных композициях для гибридизации. Этот признак, параллельно с отсутствием какой-либо потребности в блокирующей ДНК, такой как блокирующая ПНК или СОТ1, дает возможность увеличить объем зонда в автоматизированных системах приборов по сравнению с традиционным объемом 10 мкл, используемым в традиционных системах композиций, что снижает потерю за счет испарения, как более подробно обсуждено ниже.
Уменьшение концентрации зонда также позволяет снизить фон. Однако уменьшение концентрации зонда обратно связано со временем гибридизации, то есть, чем ниже концентрация, тем большее время гибридизации требуется. Тем не менее, даже когда используют крайне низкие концентрации зонда с водными композициями по изобретению, время гибридизации все же короче, чем с традиционными композициями.
Композиции по изобретению часто дают возможность лучших соотношений сигнала и фона, чем традиционные композиции для гибридизации. Например, с некоторыми зондами одночасовая гибридизация с композициями по изобретению даст подобный фон и более сильные сигналы, чем гибридизация в течение ночи в традиционных композициях. Фон не виден, когда зонд не добавляют.
Традиционные способы анализа можно также изменить и оптимизировать при использовании композиций по изобретению в зависимости от того, является ли система ручной, полуавтоматической или автоматической. Например, для полуавтоматической или автоматической системы будут полезны короткие периоды гибридизации, полученные с композициями по изобретению. Короткое время гибридизации может уменьшить трудности, которые встречаются при использовании в таких системах традиционных композиций. Например, одна из проблем при полуавтоматических или автоматических системах состоит в том, что во время гибридизации может происходить значительное испарение образца, поскольку такие системы требуют малых объемов образца (например, 10-150 мкл), повышенных температур и протяженных периодов гибридизации (например, 14 часов). Таким образом, доли компонентов в традиционных композициях для гибридизации фактически неизменны. Однако, поскольку композиции по изобретению дают возможность более быстрых гибридизаций, испарение уменьшается, что дает возможность повышенной гибкости в долях компонентов в композициях для гибридизации, используемых в полуавтоматических и автоматических системах.
Например, два автоматических аппарата использованы для проведения гибридизаций с использованием композиций по изобретению. Композиции, содержащие 40% этиленкарбонат (об/об), использованы в аппарате, раскрытом в заявке РСТ DK 2008/000430, и композиции, содержащие 15% этиленкарбонат (об/об), использованы в аппарате HYBRIMASTER HS-300 (Aloka CO. LTD, Japan). Когда композиции по изобретению используют в HYBRIMASTER HS-300, этот аппарат может осуществлять быструю FISH гибридизацию с водой вместо традиционной токсичной смеси с формамидом, улучшая, таким образом, безопасность и уменьшая испарение. Если полосы, смоченные водой, прикрепляют к крышке внутренней части реакционной единицы аппарата Aloka (гибридизационной камеры), как описано в публикации заявки на патент США №2005/0281711, которая включена в данную заявку посредством ссылки, испарение даже дополнительно снижено.
Другая проблема при автоматизированном анализе визуализации состоит в необходимом числе изображений, огромном количестве требующегося места для хранения и времени, необходимом для снятия изображений. Композиции по изобретению позволяют решить эту проблему за счет получения очень сильных сигналов по сравнению с традиционными композициями. В связи с очень сильными сигналами, которые дают композиции по изобретению, визуализацию можно проводить при меньшем увеличении, чем требуется для традиционных композиций, и их можно все же обнаруживать и анализировать, например, с помощью алгоритмов. Поскольку фокальная плоскость становится шире при меньшем увеличении, композиции по изобретению уменьшают или устраняют потребность в снятии серийных срезов образца. В результате общая визуализация является значительно более быстрой, поскольку композиции по изобретению требуют меньше или не требуют серийных срезов, и каждое изображение покрывает значительно большую площадь. Кроме того, общее время анализа является более быстрым, поскольку общие файлы изображений значительно меньше.
Таким образом, композиции и способы по изобретению позволяют решить многие из проблем, связанных с традиционными композициями и способами гибридизации.
Описание может быть более четко понято с помощью нижеследующих не ограничивающих примеров, которые составляют предпочтительные формы осуществления композиций в соответствии с описанием. Кроме примеров, или, где не указано иное, все числа, выражающие количества ингредиентов, условия реакции и т.д., используемые в описании и формуле изобретения, следует понимать как модифицируемые во всех случаях термином "примерно". Соответственно, если не указано противоположное, числовые параметры, приведенные в последующем описании и прилагаемой формуле изобретения, являются приближенными, которые могут варьировать в зависимости от желаемых свойств, которые хотели бы получить в этой связи. По крайней мере, и не в качестве попытки ограничить применение доктрины эквивалентов к объему формулы изобретения, каждый числовой параметр следует истолковывать в свете числа значимых цифр и обычных методов округления.
Несмотря на то что числовые интервалы и параметры, изложенные в широком объеме, являются приблизительными, числовые значения, изложенные в конкретном примере, указанны по возможности точно. Любое числовое значение, однако, само по себе содержит некоторые ошибки, являющиеся неизбежным результатом стандартного отклонения, обнаруживаемого в соответствующих контрольных измерениях. Последующие примеры иллюстрируют настоящее изобретение, и их никоим образом не следует рассматривать как ограничивающие изобретение.
ПРИМЕРЫ
Теперь будет сделана подробная ссылка на конкретные формы осуществления изобретения. Хотя изобретение описано в связи с этими формами осуществления, должно быть понятно, что они не предназначены для ограничения изобретения этими формами осуществления. Напротив, подразумевают, что изобретение охватывает альтернативы, модификации и эквиваленты, которые могут быть включены в изобретение, как определено прилагаемой формулой изобретения.
Реагенты, используемые в приведенных ниже примерах, представляют собой реагенты из набора Dako's Histology FISH Accessory Kit (K5599) и Cytology FISH Accessory Kit (K5499) (Dako Denmark A/S, Glostrup Denmark). Эти наборы содержат все ключевые реагенты за исключением зонда, необходимые для выполнения методики FISH для фиксированных формалином, заключенных в парафин тканевых срезов образцов. Все образцы готовили в соответствии с описанием изготовителя. Прибор Dako Hybridizer (S2450, Dako) использовали для стадий расщепления, денатурации и гибридизации.
Оценку FISH препаратов проводили в течение недели после гибридизации, используя флуоресцентный микроскоп Leica DM6000B, оборудованный отдельными фильтрами для ДАПИ, ФИТЦ, Texas Red и двойным фильтром ФИТЦ/Texas Red, под 10x, 20x, 40x и 100x иммерсионным объективом.
Оценку CISH препаратов проводили, используя световой микроскоп Olympus BX51, под 4x, 10x, 20x, 40x и 60x объективом.
В последующих Примерах "декстрансульфат" относится к натриевой соли декстрансульфата (D8906, Sigma), имеющего молекулярную массу Мw более 500000. Все концентрации полярных апротонных растворителей приведены в процентах об/об. Фосфатный буфер относится к фосфатному буферному раствору, содержащему NaH2PO4×2H2O (двухосновный фосфат натрия дигидрат) и Na2HPO4×H2O (одноосновный фосфат натрия моногидрат). Цитратный буфер относится к цитратному буферному раствору, содержащему цитрат натрия (Nа3С6Н5О7×2Н2О; 1.06448, Merck) и лимонной кислоты моногидрат (С6Н8О7×Н2O; 1.00244, Merck).
Общая гистологическая методика FISH/CISH (Примеры 1-20)
Препараты со срезами фиксированных формалином, заключенных в парафин (FFPE) множественных тканевых упорядоченных срезов от людей (миндалины, карцинома молочной железы, почки и ободочная кишка) запекали при 60°С в течение 30-60 мин, депарафинизировали в ванночках с ксилолом, регидратировали в ванночках с этанолом, затем переносили в отмывочный буфер. Затем образцы предварительно обрабатывали в растворе предварительной обработки минимум при 95°С в течение 10 мин и отмывали 2×3 мин. Затем образцы расщепляли пепсином RTU при 37°С в течение 3 мин, отмывали 2×3 мин, обезвоживали в серии выпариваний этанолом и высушивали на воздухе. Затем образцы инкубировали с 10 мкл FISH зонда, как описано для индивидуальных экспериментов. Затем образцы отмывали жесткой отмывкой при 65°С 10 мин, затем отмывали 2×3 мин, затем обезвоживали в серии выпариваний этанолом и высушивали на воздухе. Наконец, препараты заливали 15 мкл заливочной среды Antifade. Когда окрашивание было завершено, наблюдатели, обученные оценке интенсивности сигнала, морфологии и фона окрашенных препаратов, осуществляли оценку.
Общая цитологическая методика FISH (Примеры 21-22)
Стекла с препаратами метафаз фиксировали 3,7% формальдегидом в течение 2 мин, отмывали 2×5 мин, обезвоживали в серии выпариваний этанолом и высушивали на воздухе. Затем образцы инкубировали с 10 мкл FISH зонда, как описано для индивидуальных экспериментов. Затем образцы отмывали жесткой отмывкой при 65°С 10 мин, затем отмывали 2×3 мин, затем обезвоживали обезвоживали в серии выпариваний этанолом и высушивали на воздухе. Наконец, препараты заливали 15 мкл заливочной среды Antifade. Когда окрашивание было завершено, наблюдатели, обученные оценке интенсивности сигнала, морфологии и фона окрашенных препаратов, осуществляли оценку, как описано в руководстве по оценке гистологических срезов.
Руководство по оценке тканевых срезов
Интенсивности сигнала оценивали по шкале 0-3, где 0 означает отсутствие сигнала, а 3 соответствует сильному сигналу. Клеточные/тканевые структуры оценивают по шкале 0-3, где 0 означает отсутствие структуры и отсутствие границ ядер, и 3 соответствует интактной структуре и четким границам ядер. Между 0 и 3 существуют дополнительные градации 0,5, вне которых наблюдатель может оценивать интенсивность сигнала, тканевую структуру и фон.
Интенсивность сигнала оценивают по градуированной системе на шкале 0-3.
0 Сигнал не виден.
1 Интенсивность сигнала слабая.
2 Интенсивность сигнала умеренная.
3 Интенсивность сигнала сильная. Эта система оценки позволяет использовать градации ½.
Тканевую и ядерную структуру оценивают по градуированной системе на шкале 0-3.
0 Тканевые структуры и границы ядер полностью разрушены.
1 Тканевые структуры и/или границы ядер слабые. Эта градация включает ситуации, где некоторые зоны имеют пустые ядра.
2 Тканевые структуры и/или границы ядер видны, но границы ядер нечеткие. Эта градация включает ситуации, где несколько ядер являются пустыми.
3 Тканевые структуры и границы ядер интактные и четкие.
Эта система оценки позволяет использовать градации ½.
Фон оценивают по градуированной системе на шкале 0-3.
0 Фон небольшой или не виден.
1 Некоторый фон.
2 Умеренный фон.
3 Высокий фон.
Эта система оценки позволяет использовать градации ½.
Пример 1
В данном примере сравнивают интенсивность сигнала и клеточную морфологию от образцов, обработанных композициями по изобретению или традиционными растворами для гибридизации, в зависимости от температуры денатурации.
FISH Композиция зонда I: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% формамид (15515-026, Invitrogen), 5 мкМ блокирующие ПНК (см. Kirsten Vang Nielsen et al., PNA Suppression Method Combined with Fluorescence In Situ Hybridisation (FISH) Technique inPRINS and PNA Technologies in Chromosomal Investigation, Chapter 10 (Franck Pellestor ed.) (Nova Science Publishers, Inc. 2006)), 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1 (RP11-1143Е20, размер 192 кб).
FISH Композиция зонда II: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат (03519, Fluka), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1 (RP11-1143E20, размер 192 кб).
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды денатурировали, как указано, в течение 5 мин и гибридизовали при 45°С в течение 60 минут.
Результаты:
| Температура денатурации | Сигнал | Клеточная морфология | ||
| (I) Формамид | (II) ЕС | Формамид | ЕС | |
| 72°С | 0 | 2 | Хорошая | Хорошая |
| 82°С | ½ | 3 | Хорошая | Хорошая |
| 92°С | ½ | 3 | Плохая | Плохая |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | ||||
Пример 2
В данном примере сравнивают интенсивность сигнала и фоновое окрашивание от образцов, обработанных композициями по изобретению или традиционными растворами для гибридизации, в зависимости от температуры денатурации.
FISH Композиция зонда I: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% формамид, 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда II: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат, 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 14 часов, 4 часов, 2 часов, 60 минут, 30 минут, 15 минут, 0 минут.
Результаты:
| Время гибридизации | Сигнал | Фоновое окрашивание | ||
| (I) Формамид | (II)ЕС | Формамид | ЕС | |
| 14 часов | 3 | 3 | +½ | +2 |
| 4 часов | 1 | 3 | +½ | +1 |
| 2 часов | ½ | 3 | +0 | +1 |
| 60 мин. | ½ | 3 | +0 | +1 |
| 30 мин. | 0 | 2½ | +0 | +1 |
| 15 мин. | 0 | 2 | +0 | +1 |
| 0 мин. | 0 | 1 | +0 | +½ |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | ||||
Пример 3
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, имеющими различные полярные апротонные растворители, или традиционными растворами для гибридизации.
FISH Композиция зонда I: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% формамид, 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда II: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат (ЕС), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда III: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% пропиленкарбонат (PC) (540013, Aldrich), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда IV: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% сульфолан (SL) (T22209, Aldrich), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда V: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% ацетонитрил (AN) (C02CIIX, Lab-Scan), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда VI: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% γ-бутиролактон (GBL) (B103608, Aldrich), 5 мкМ блокирующие ПНК, 7,5 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| Сигнал | |||||
| (1) Формамид | (II)ЕС | (III)PC | (IV)SL | (V)AN | (VI)GBL |
| ½ | 3 | 3 | 3 | 2 | 3 |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | |||||
Пример 4
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, имеющих различные концентрации полярного апротонного растворителя.
FISH Композиции зонда: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 10-60% этиленкарбонат (как указано), 5 мкМ блокирующие ПНК, 7,5 нг/мкл меченого Texas Red ДНК зонда гена /GK-константной области (CTD-3050E15, RP11-1083E8; размер 227 кб) и 7,5 нг/мкл меченого ФИТЦ ДНК зонда гена /GK-вариабельной области (CTD-2575M21, RP11-122B6, RP11-316G9; размер 350 и 429 кб).
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| Этиленкарбонат(ЕС) | ||||||
| 10% | 20% | 30% | 40% | 60% | ||
| Интенсивность сигнала | Texas Red | 1½ | 2 | 3 | 3 | 2 |
| ФИТЦ | 1 | 1½ | 2 | 2½ | 2 | |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | ||||||
Пример 5
В данном примере сравнивают интенсивность сигнала и интенсивность фона от образцов, обработанных композициями с блокирующими ПНК и без них.
FISH Композиции зонда: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат, 7,5 нг/мкл меченого Texas Red ДНК зонда гена CCNDI.
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| Этиленкарбонат(ЕС) | ||
| ПНК-блокирование | Без ПНК блокирования | |
| Интенсивность сигнала | 3 | 3 |
| Интенсивность фона | ½+ | ½+ |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | ||
Пример 6
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, в зависимости от концентрации зонда и времени гибридизации.
FISH Композиции зонда: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат и 10, 7,5, 5 или 2,5 нг/мкл меченого Texas Red ДНК зонда гена CCND1 (как указано).
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 3 часов, 2 часов и 1 часа.
Результаты:
| Время гибридизации | Интенсивность сигнала | |||
| (I)10 нг/мкл | (II)7,5 нг/мкл | (III)5 нг/мкл | (IV)2,5 нг/мкл | |
| 3 часа | 3 | 3 | 3 | 3 |
| 2 часа | 3 | 3 | 3 | 1 |
| 1 час | 3 | 3 | 3 | ½ |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | ||||
Пример 7
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, в зависимости от концентраций соли, фосфата и буфера.
FISH Композиции зонда: 10% декстрансульфат, ([NaCl], [фосфатный буфер], [Трис-буфер], как указано в Результатах), 40% этиленкарбонат, 7,5 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| [NaCl] | |||
| 300 мМ | 100 мМ | 0 мМ | |
| Интенсивность сигнала фосфат [0 мМ] | 2 | 1 | ½ |
| Интенсивность сигнала фосфат [5 мМ] | 3 | 2½ | ½ |
| Интенсивность сигнала фосфат [35 мМ] | - | - | 3 |
| Интенсивность сигнала Трис [40 мМ] | - | - | 2 |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. | |||
Пример 8
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, в зависимости от концентрации декстрансульфата.
FISH Композиции зонда: 0, 1, 2, 5 или 10% декстран сульфат (как указано), 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат, 5 нг/мкл меченого Texas Red ДНК зонда гена SIL-TAL1 (RP1-278013; размер 67 кб) и 6 нг/мкл ФИТЦ-SIL-TAL1 (ICRFc112-112C1794, RP11-184J23, RP11-8J9, CTD-2007B18, 133 В9; размер 560 кб).
Фазы различной вязкости, если они присутствовали, смешивали перед применением. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут. Без блокирования.
Результаты:
| % Декстрансульфат | Интенсивность сигнала | |
| Зонд Texas Red | Зонд ФИТЦ | |
| 0% | 1 | 1 |
| 1% | 1 | 1 |
| 2% | 1½ | 1½ |
| 5% | 2 | 2½ |
| 10% | 2 | 2½ |
| ПРИМЕЧАНИЕ: в данном эксперименте не получены результаты, оцененные как "3", поскольку зонд SIL-TAL1, меченый Texas Red, имеет размер только 67 кб и взят из не оптимизированного препарата. | ||
Пример 9
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, в зависимости от концентраций декстрансульфата, соли, фосфата и полярного апротонного растворителя.
FISH Композиция зонда la: 34% декстрансульфат, 0 мМ NaCl, 0 мМ фосфатный буфер, 0% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда Ib: 34% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 0% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда Ic: 34% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер, 0% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда llа: 32% декстрансульфат, 0 мМ NaCl, 0 мМ фосфатный буфер, 5% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда llb: 32% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 5% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда llc: 32% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер, 5% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда llla: 30% декстрансульфат, 0 мМ NaCl, 0 мМ фосфатный буфер, 10% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда lllb: 30% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 10% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда lllc: 30% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер, 10% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда IVa: 28% декстрансульфат, 0 мМ NaCl, 0 мМ фосфатный буфер, 15% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда IVb: 28% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 15% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Композиция зонда IVc: 28% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер, 15% этиленкарбонат, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 (размер 218 кб) и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7.
FISH Референсный зонд V: Стандартный имеющийся в продаже флакон смеси зонда HER2 PharmDx (K5331, Dako), содержащей блокирующую ПНК. Ночная гибридизация в течение 20 часов.
Все композиции присутствовали в виде одной фазы. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут без блокирования за исключением FISH Референсного зонда V, который имел блокирующие ПНК и гибридизовался в течение 20 часов.
Результаты:
| Сила сигнала | ||
| ДНК зонды | ПНК зонды | |
| Композиция Ia | 0 | ½ |
| Композиция Ib | 0 | ½ |
| Композиция Ic | ½ | 2½ |
| Композиция IIа | ½ | 3 |
| Композиция IIb | 1 | 2 |
| Композиция IIc | ½ | 3 |
| Композиция IIIa | 1 | 2½ |
| Композиция IIIb | 1½ | 2½ |
| Композиция IIIc | 2 | 3 |
| Композиция IVa | 2½-3 | 3 |
| Композиция IVb | 3 | 3 |
| Композиция IVc | 3 | 3 |
| Референсный V | 2 | 2½ |
| ПРИМЕЧАНИЕ: Композиция IVa давала сильные сигналы ДНК без соли. Это невозможно со стандартными FISH композициями, где связывание ДНК является зависимым от соли. | ||
Пример 10
В данном примере сравнивают интенсивность сигнала от образцов, обработанных композициями по изобретению, в зависимости от концентрации полярного апротонного растворителя и декстрансульфата в условиях высокой (4х нормальной) концентрации соли.
FISH Композиция зонда I: 0% этиленкарбонат, 29% декстрансульфат, 1200 мМ NaCl, 20 мМ фосфатный буфер, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7. Композиция представляла собой одну фазу.
FISH Композиция зонда II: 5% этиленкарбонат, 27% декстрансульфат, 1200 мМ NaCl, 20 мМ фосфатный буфер, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7. Композиция представляла собой одну фазу.
FISH Композиция зонда III: 10% этиленкарбонат, 25% декстрансульфат, 1200 мМ NaCl, 20 мМ фосфатный буфер, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7. Композиция представляла собой одну фазу.
FISH Композиция зонда IV (не тестировали): 20% этиленкарбонат, 21% декстрансульфат, 1200 мМ NaCl, 20 мМ фосфатный буфер, 10 нг/мкл меченого Texas Red ДНК зонда гена HER2 и 50 нМ ФИТЦ-меченого ПНК зонда CEN-7. Композиция имела две фазы.
Результаты:
| Сила сигнала | ||
| ДНК зонды | ПНК зонды | |
| Композиция I | ½ | 3 |
| Композиция II | 2 | 2½ |
| Композиция III | 3 | 3 |
| Композиция IV | - | - |
| Примечание: Композиция II давала хорошие сигналы ДНК только с 5% ЕС и сильные сигналы ДНК с 10% ЕС. | ||
Пример 11
В данном примере сравнивают интенсивность сигнала и фона от образцов, обработанных различными фазами композиций по изобретению.
FISH Композиция зонда: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этиленкарбонат, 8 нг/мкл меченого Texas Red ДНК зонда гена HER2 и 600 нМ ФИТЦ-меченого ПНК зонда CEN-17. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут. Без блокирования.
Результаты:
| Интенсивность сигнала | |||
| ДНК зонд | ПНК зонд | Фон | |
| Верхняя фаза | 3 | 1½ | +2 |
| Нижняя фаза | 3 | 2½ | +1 |
| Смесь верхней и нижней фаз | 2½ | 3 | +½ |
| ПРИМЕЧАНИЕ: в этих экспериментах верхняя фаза имела больше фона, чем нижняя фаза. | |||
Пример 12
Данный пример подобен предыдущему примеру, но в нем используют другой ДНК зонд и GBL вместо ЕС.
FISH Композиция зонда: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% GBL, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1 и 600 нМ ФИТЦ-меченого ПНК зонда CEN-17.
FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут. Без блокирования.
Результаты:
| Сила сигнала | Фон | ||
| ДНК зонд | ПНК зонд | ||
| Верхняя фаза | 3 | 0-½ | +1½ |
| Нижняя фаза | 2 | ½ | +3 |
| Смешанные фазы | 2½ | ½ | +2½ |
Пример 13
В данном примере исследуют число фаз в композициях по изобретению в зависимости от концентрации полярного апротонного растворителя и декстрансульфата.
FISH Композиции зонда: 10 или 20% декстрансульфат; 300 мМ NaCl; 5 мМ фосфатный буфер; 0, 5, 10, 15, 20, 25, 30% ЕС; 10 нг/мкл зонда.
Результаты:
| %ЕС | Число фаз 10% Декстран | Число фаз 20% Декстран |
| 0 | 1 | 1 |
| 5 | 1 | 1 |
| 10 | 1 | 1 |
| 15 | 1 | 1 |
| 20 | 2 | 2 |
| 25 | 2 | 2 |
| 30 | 2 | 2 |
| ПРИМЕЧАНИЕ: 15% ЕС, 20% декстрансульфат образует самые лучшие высокие интенсивности сигнала приведенного выше однофазного раствора. Двухфазный 20% ЕС имеет даже более высокие интенсивности сигнала, чем 15%. (Данные не представлены). | ||
Пример 14
В данном примере сравнивают интенсивность сигнала и фона от образцов, обработанных различными композициями по изобретению в зависимости от концентрации зонда и времени гибридизации.
FISH Композиция зонда I: 10 нг/мкл HER2 TxRed меченый ДНК зонд (стандартная концентрация) и стандартная концентрация CEN7 ФИТЦ-меченого ПНК зонда (50 нМ); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ фосфатный буфер.
FISH Композиция зонда II: 5 нг/мкл HER2 TxRed меченый ДНК зонд (1/2 стандартной концентрации) и стандартная концентрация CEN7 ФИТЦ-меченых ПНК зондов (50 нМ); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ фосфатный буфер.
FISH Композиция зонда III: 2,5 нг/мкл HER2 TxRed меченого ДНК зонда (1/4 стандартной концентрации) и Уг стандартной концентрации (25 нМ) CEN7 ПНК зондов; 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ фосфатный буфер.
Композиции I-III существовали в виде одной фазы. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 3 часов, 2 часов и 1 часа.
Результаты:
| Время гибридизации | Интенсивность сигнала | ||||||||
| I | II | III | |||||||
| ДНК | ПНК | Ф | ДНК | ПНК | Ф | ДНК | ПНК | Ф | |
| 3 часов | 3 | 3 | +3 | 3 | 3 | +2,5 | 3 | 3 | +1,5 |
| 2 часов | 2,5 | 2,5 | +3 | 3 | 3 | +3 | 3 | 3 | +1,5 |
| 1 часов | 2,5 | 2,5 | +3 | 3 | 3 | +1,5 | 2,5 | 3 | +1 |
| Сигналы, оцененные как "3", были четко видны в 20x объективе. Ф: Фон. | |||||||||
Пример 15
В данном примере сравнивают интенсивность сигнала и фона от образцов, обработанных композициями по изобретению, в зависимости от блокирующего агента.
FISH Композиции зонда: 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ фосфатный буфер; 2,5 нг/мкл HER2 TxRed меченого ДНК зонда (1/4 стандартной концентрации) и ½ стандартной концентрации (300 нМ) ФИТЦ-меченого CEN17 ПНК зонда. Образцы блокировали: (а) не блокировали; (б) 0,1 мкг/мкл СОТ1 (15279-011, Invitrogen); (в) 0,3 мкг/мкл СОТ1; или (г) 0,1 мкг/мкл суммарной ДНК человека перед гибридизацией с использованием композиций по изобретению.
Все образцы присутствовали в виде одной фазы. FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| Блокирующий агент | Фон | Интенсивность сигнала | |
| ДНК | ПНК | ||
| Без блокирования | +1-1,5 | 3 | 2,5 |
| 0,1 мкг/мкл СОТ1 | +1 | 3 | 2,5 |
| 0,3 мкг/мкл СОТ1 | +1,5 | 3 | 2,5 |
| 0,1 мкг/мкл суммарной ДНК человека | +½ | 3 | 2,5 |
| ПРИМЕЧАНИЕ: Уровни фона без блокирования значительно ниже, чем обычно наблюдают путем стандартной FISH без блокирования. Напротив, если стандартная композиция FISH не содержит блокирующий агент, сигналы обычно невозможно считывать. | |||
Пример 16
В данном эксперименте сравнивают различные пути удаления фонового окрашивания с использованием композиций по изобретению.
Все композиции содержали 15% ЕС, 20% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер, 2,5 нг/мкл HER2 ДНК зондов (1/4 стандартной концентрации), 300 нМ CEN17 ПНК зонда (1/2 стандартной концентрации) и один из приведенных ниже агентов, снижающих фон:
A) 5 мкМ блокирующей ПНК (см. Kirsten Vang Nielsen et al., PNA Suppression Method Combined with Fluorescence In Situ Hybridisation (FISH) Technique inPRINS and PNA Technologies in Chromosomal Investigation, Chapter 10 (Franck Pellestor ed.) (Nova Science Publishers, Inc. 2006))
Б) 0,1 мкг/мкл СОТ-1 ДНК
B) 0,1 мкг/мкл суммарной ДНК человека (THD) (обработанная ультразвуком, немеченая THD)
Г) 0,1 мкг/мкл деградированной в результате гидродинамического сдвига ДНК спермы лосося (АМ9680, Ambion)
Д) 0,1 мкг/мкл ДНКтимуса теленка (D8661, Sigma)
Е) 0,1 мкг/мкл ДНК спермы сельди (D7290, Sigma)
Ж) 0,5% формамид
3) 2% формамид
И) 1% этиленгликоль (1.09621, Merck)
К) 1% глицерин (1.04095, Merck)
Л) 1% 1,3-пропандиол (533734, Aldrich)
M) 1% Н2O (контроль)
Все образцы присутствовали в виде одной фазы. Зонды инкубировали при 82°С в течение 5 минут, а затем при 45°С на FFPE тканевых срезах в течение 60 и 120 минут.
Результаты:
| Блокирование фона | Гибридизация/мин | Фон | Интенсивность сигнала | |
| ДНК | ПНК | |||
| Блокирующая ПНК | 60 | +1 | 3 | 2,5 |
| Блокирующая ПНК | 120 | +1-1½ | 3 | 2,5 |
| СОТ-1 | 60 | +½ | 3 | 2,5 |
| СОТ-1 | 120 | +0-½ | 3 | 2,5 |
| THD | 60 | +0 | 3 | 3 |
| THD | 120 | +½ | 3 | 2,5 |
| ДНК спермы лосося | 60 | +0 | 3 | 3 |
| ДНК спермы лосося | 120 | +0 | 3 | 3 |
| ДНК тимуса теленка | 60 | +0 | 2,5 | 3 |
| ДНК тимуса теленка | 120 | +½ | 3 | 2,5 |
| ДНК спермы сельди | 60 | +0 | 3 | 3 |
| ДНК спермы сельди | 120 | +½ | 2,5 | 3 |
| 0,5% формамид | 60 | +0 | 2,5 | 3 |
| 0,5% формамид | 120 | +0 | 3 | 3 |
| 2% формамид | 60 | +½ | 2,5 | 3 |
| 2% формамид | 120 | +½ | 3 | 3 |
| 1% этиленгликоль | 60 | +½ | 2,5 | 3 |
| 1% этиленгликоль | 120 | +1½ | 3 | 2,5 |
| 1% глицерин | 60 | +½ | 0,5 | 3 |
| 1% глицерин | 120 | +1 | 3 | 2,5 |
| 1% 1,3-пропандиол | 60 | +0 | 3 | 2,5 |
| 1% 1,3-пропандиол | 120 | +1 | 3 | 2,5 |
| Без блокирования | 60 | +1 | 2,5 | 2,5 |
| Без блокирования | 120 | +1½ | 3 | 2,5 |
| ПРИМЕЧАНИЕ: все реагенты, снижающие фон, за исключением блокирующей ПНК, показали эффект при снижении фона. Таким образом, специфичное блокирование против повторяющихся последовательностей ДНК не требуется. | ||||
Пример 17
В данном эксперименте сравнивают интенсивность сигнала от верхней и нижней фаз при использовании двух различных полярных апротонных растворителей.
FISH Композиция зонда I: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% этилентритиокарбонат (ЕТ) (Е27750, Aldrich), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH Композиция зонда II: 10% декстрансульфат, 300 мМ NaCl, 5 мМ фосфатный буфер, 40% гликольсульфит (GS) (G7208, Aldrich), 5 мкМ блокирующие ПНК, 10 нг/мкл меченого Texas Red ДНК зонда гена CCND1.
FISH зонды инкубировали при 82°С в течение 5 мин, а затем при 45°С в течение 60 минут.
Результаты:
| Интенсивность сигнала | ||
| I(ЕТ) | II(GS) | |
| Верхняя фаза | 1½ | 0 |
| Нижняя фаза | 0 | 3 |
| Смесь верхней и нижней фаз | 2½ | 3 |
Пример 18.
В данном эксперименте исследуют способность различных полярных апротонных растворителей к образованию однофазной системы.
Все композиции содержали: 20% декстрансульфат, 600 мМ NaCl, 10 мМ фосфатный буфер и 10, 15, 20 или 25% одного из приведенных ниже полярных апротонных растворителей:
Сульфолан
γ-Бутиролактон
Этилентритиокарбонат
Гликольсульфит
Пропиленкарбонат
Результаты: все полярные апротонные растворители при всех исследованных концентрациях образовывали по меньшей мере двухфазную систему в использованных композициях. Однако это не исключает, что эти соединения могут образовать однофазную систему при других условиях композиции.
Пример 19
В данном эксперименте исследуют применение композиций по изобретению в анализе хромогенной гибридизации in situ (CISH) на множественных FFPE тканевых срезах.
FISH Композиция зонда 1: 4,5 нг/мкл ФИТЦ-меченого ДНК зонда гена TCRAD (1/4 стандартной концентрации) (RP11-654A2, RP11-246A2, CTP-2355L21, RP11-158G6, RP11-780M2, RP11-481C14; размер 1018 кб); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0.
FISH Композиция зонда II: 4,5 нг/мкл ФИТЦ-меченого ДНК зонда гена TCRAD (1/4 стандартной концентрации) (RP11-654A2, RP11-246A2, CTP-2355L21, RP11-158G6, RP11-780M2, RP11-481C14; размер 1018 кб); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0; 0,1 мкг/мкл деградированной в результате гидродинамического сдвига ДНК спермы лосося.
FISH Композиция зонда III: 300 нМ каждого индивидуального ФИТЦ-меченого ПНК зонда CEN17 (1/2 стандартной концентрации); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0.
Все образцы анализировали, используя протокол Dako DuoCISH (SK108) и композиции для разделенных зондов за исключением того, что жесткую отмывку проводили в течение 20 минут вместо 10 минут, и без использования стадии красного хромогена DuoCISH.
Результаты:
| Сила сигнала | ||
| Композиция | ФИТЦ ДНК | ФИТЦ ПНК |
| I | 3 | - |
| II | 3 | - |
| III | - | 3 |
| Примечание: Интенсивности сигнала были очень сильными. Вследствие высоких уровней фона было невозможно отличить, снижает ли фон добавление ДНК смермы лосося в Композиции II. Сигналы были четко видимыми при использовании 10x объектива, например, в миндалинах, которые вообще имеют меньше фона. Если ткани обладали высоким фоном, сигналы были четко видимыми при использовании 20x объектива. | ||
Пример 20
В данном примере сравнивают интенсивность сигнала и фона от FFPE тканевых срезов, обработанных композициями по изобретению с двумя ДНК зондами.
FISH Композиция зонда I: 9 нг/мкл ФИТЦ-меченого ДНК зонда гена IGH (RP11-151B17, RP11-112H5, RP11-101G24, RP11-12F16, RP11-47P23, СТР-3087С18; размер 612 кб); 6,4 нг/мкл Тх Red меченого ДНК зонда гена MYC (CTD-2106F24, CTD-2151C21, CTD-2267H22; размер 418 кб); 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0.
FISH Композиция зонда II: 9 нг/мкл ФИТЦ-меченого ДНК зонда гена IGH; 6,4 нг/мкл Тх Red меченого ДНК зонда гена MYC; 15% ЕС, 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0; 0,1 мкг/мкл деградированной в результате гидродинамического сдвига ДНК спермы лосося.
| Сила сигнала | |||
| ДНК лосося | ФИТЦ зонд | Texas Red зонд | Фон |
| - | 2½ | 2½ | +2,5 |
| + | 3 | 3 | +1,5 |
| ПРИМЕЧАНИЕ: высокий фон был, вероятно, следствием того факта, что использовали стандартные концентрации зонда. | |||
Пример 21
В данном эксперименте исследовано применение композиций по изобретению на цитологических образцах.
FISH Композиция зонда: 15% ЕС; 20% декстрансульфат; 600 мМ NaCl; 10 мМ фосфатный буфер; 5 нг/мкл HER2 TxRed меченого ДНК зонда (1/2 стандартной концентрации) и Vi стандартной концентрации CEN7 (25 нМ).
FISH зонды инкубировали на метафазных хромосомных препаратах при 82°С в течение 5 минут, затем при 45°С в течение 30 минут, все без блокирования.
Результаты:
| Сила сигнала | Фон | |
| ДНК зонд | ПНК зонд | |
| 3 | 3 | +1 |
Никакой исчерченности хромосом (R-характера исчерченности) не наблюдали с композициями по изобретению, в противоположность традиционным ISH растворам, которые типично показывают R-исчерченность. Наблюдали низкое однородно красное фоновое окрашивание интерфазных ядер и метафазных хромосом.
Пример 22
В данном примере сравнивают интенсивность сигнала и фона от ДНК зондов на цитологических образцах, метафазных препаратах, с блокированием и без блокирования.
FISH Композиция зонда 1: 6 нг/мкп меченого Texas Red ДНК зонда гена TCRAD (стандартная концентрация) (СТР-31666К20, CTP-2373N7; размер 301 кб) и 4,5 нг/мкл ФИТЦ-меченого ДНК зонда (1/4 стандартной концентрации); 15% ЕС, 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0.
FISH Композиция зонда II: 6 нг/мкл меченого Texas Red ДНК зонда гена TCRAD (стандартная концентрация) (размер 301 кб) и 4,5 нг/мкл ФИТЦ-меченого ДНК зонда (1/4 стандартной концентрации); 15% ЕС, 20% декстрансульфат; 600 мМ NaCl; 10 мМ цитратный буфер, рН 6,0; 0,1 мкг/мкл деградированной в результате гидродинамического сдвига ДНК спермы лосося.
FISH зонды инкубировали на метафазных препаратах при 82°С в течение 5 мин, затем при 45°С в течение 60 мин.
Результаты:
| Блокирующий агент | Фон | Интенсивность сигнала | |
| Тx Red | ФИТЦ | ||
| Нет | +0 | 3 | 3 |
| 0,1 мкг/мкл ДНК лосося | +0 | 3 | 3 |
Снова никакой исчерченности хромосом (R-характера исчерченности) не наблюдали с композициями по изобретению. Кроме того, не наблюдали фонового окрашивания интерфазных ядер или метафазных хромосом.
ДОПОЛНИТЕЛЬНЫЕ ФОРМЫ ОСУЩЕСТВЛЕНИЯ
Форма осуществления 1. Композиция для гибридизации, содержащая по меньшей мере одну нуклеиново-кислотную последовательность, по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и раствор для гибридизации, где полярный апротонный растворитель представляет собой не диметилсульфоксид (ДМСО).
Форма осуществления 2. Композиция для гибридизации в соответствии с формой осуществления 1, где концентрация полярного апротонного растворителя составляет примерно от 1% до 95% (об/об).
Форма осуществления 3. Композиция для гибридизации в соответствии с формой осуществления 1 или 2, где концентрация полярного апротонного растворителя составляет от 5% до 10% (об/об).
Форма осуществления 4. Композиция для гибридизации в соответствии с формой осуществления 1 или 2, где концентрация полярного апротонного растворителя составляет от 10% до 20% (об/об).
Форма осуществления 5. Композиция для гибридизации в соответствии с формой осуществления 1 или 2, где концентрация полярного апротонного растворителя составляет от 20% до 30% (об/об).
Форма осуществления 6. Композиция для гибридизации в соответствии с любой из форм осуществления 1-5, где полярный апротонный растворитель является нетоксичным.
Форма осуществления 7. Композиция для гибридизации в соответствии с любой из форм осуществления 1-6 при условии, что композиция для гибридизации не содержит формамид.
Форма осуществления 8. Композиция для гибридизации в соответствии с формой осуществления 6 при условии, что композиция для гибридизации содержит менее 10% формамида.
Форма осуществления 9. Композиция для гибридизации в соответствии с формой осуществления 8 при условии, что композиция для гибридизации содержит менее 2% формамида.
Форма осуществления 10. Композиция для гибридизации в соответствии с формой осуществления 9 при условии, что композиция для гибридизации содержит менее 1% формамида.
Форма осуществления 11. Композиция для гибридизации в соответствии с любой из форм осуществления 1-10, где полярный апротонный растворитель имеет лактоновую, сульфоновую, сульфитную, нитрильную и/или карбонатную функциональную группу.
Форма осуществления 12. Композиция для гибридизации в соответствии с любой из форм осуществления 1-11, где полярный апротонный растворитель имеет дисперсионный параметр растворимости в интервале от 17,7 МПа1/2 до 22,0 МПа1/2, полярный параметр растворимости в интервале от 13 МПа1/2 до 23 МПа1/2 и параметр растворимости за счет водородных связей в интервале от 3 МПа1/2 до 13 МПа1/2.
Форма осуществления 13. Композиция для гибридизации в соответствии с любой из форм осуществления 1-12, где полярный апротонный растворитель имеет циклическую основную структуру.
Форма осуществления 14. Композиция для гибридизации в соответствии с любой из форм осуществления 1-13, где полярный апротонный растворитель выбран из группы, состоящей из:
где Х представляет собой О и R1 представляет собой алкилдиил, и
где Х является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О или N или S или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и
где Y представляет собой О или S или С.
Форма осуществления 15. Композиция для гибридизации в соответствии с любой из форм осуществления 1-14, где полярный апротонный растворитель выбран из группы, состоящей из: ацетанилида, ацетонитрила, N-ацетилпирролидона, 4-аминопиридина, бензамида, бензимидазола, 1,2,3-бензотриазола, бутадиендиоксида, 2,3-бутиленкарбоната, γ-бутиролактона, капролактона (эпсилон), малеинового хлорангидрида, 2-хлорциклогексанона, хлорэтиленкарбоната, хлорнитрометана, цитраконового ангидрида, кротонлактона, 5-циано-2-тиоурацила, циклопропилнитрила, диметилсульфата, диметилсульфона, 1,3-диметил-5-тетразола, 1,5-диметилтетразола, 1,2-динитробензола, 2,4-динитротолуола, дифенилсульфона, 1,2-динитробензола, 2,4-динитротолуола, дифенилсульфона, эпсилон-капролактама, этансульфонилхлорида, этилэтилфосфината, N-этилтетразола, этиленкарбоната, этилентритиокарбоната, этиленгликольсульфата, этиленгликольсульфита, фурфураля, 2-фуронитрила, 2-имидазола, изатина, изоксазола, малононитрила, 4-метоксибензонитрила, 1-метокси-2-нитробензола, метил-альфа-бромтетроната, 1-метилимидазола, N-метилимидазола, 3-метилизоксазола, N-метилморфолин-N-оксида, метилфенилсульфона, N-метилпирролидинона, метилсульфолана, метил-4-толуолсульфоната, 3-нитроанилина, нитробензимидазола, 2-нитрофурана, 1-нитрозо-2-пирролидинона, 2-нитротиофена, 2-оксазолидинона, 9,10-фенантренхинона, N-фенилсиднона, фталевого ангидрида, пиколинонитрила (2-цианопиридина), 1,3-пропансульфона, β-пропиолактона, пропиленкарбоната, 4Н-пиран-4-тиона, 4Н-пиран-4-она (γ-пирона), пиридазина, 2-пирролидона, сахарина, сукцинонитрила, сульфаниламида, сульфолана, 2,2,6,6-тетрахлорциклогексанона, тетрагидротиапирана оксида, тетраметиленсульфона (сульфолана), тиазола, 2-тиоурацила, 3,3,3-трихлорпропена, 1,1,2-трихлорпропена, 1,2,3-трихлорпропена, триметиленсульфида диоксида и триметиленсульфита.
Форма осуществления 16. Композиция для гибридизации в соответствии с любой из форм осуществления 1-14, где полярный апротонный растворитель выбран из группы, состоящей из:
Форма осуществления 17. Композиция для гибридизации в соответствии с любой из форм осуществления 1-14, где полярный апротонный растворитель представляет собой:
Форма осуществления 18. Композиция для гибридизации в соответствии с любой из форм осуществления 1-17, дополнительно содержащая по меньшей мере один дополнительный компонент, выбранный из группы, состоящей из: буферных агентов, солей, катализаторов, хелатирующих агентов, детергентов и блокирующих агентов.
Форма осуществления 19. Композиция для гибридизации в соответствии с формой осуществления 18, где катализатор представляет собой декстрансульфат, и соли представляют собой хлорид натрия и/или фосфатный буфер.
Форма осуществления 20. Композиция для гибридизации в соответствии с формой осуществления 19, где декстрансульфат присутствует в концентрации от 5% до 40%, хлорид натрия присутствует в концентрации от 0 мМ до 1200 мМ и/или фосфатный буфер присутствует в концентрации от 0 мМ до 50 мМ.
Форма осуществления 21. Композиция для гибридизации в соответствии с формой осуществления 20, где декстрансульфат присутствует в концентрации от 10% до 30%, хлорид натрия присутствует в концентрации от 300 мМ до 1200 мМ и/или фосфатный буфер присутствует в концентрации от 5 мМ до 20 мМ.
Форма осуществления 22. Композиция для гибридизации в соответствии с формой осуществления 18, где катализатор выбран из группы, состоящей из:
формамида, глицерина, пропиленгликоля, 1,2-пропандиола, диэтиленгликоля, этиленгликоля, гликоля и 1,3-пропандиола, а буферный агент представляет собой цитратный буфер.
Форма осуществления 23. Композиция для гибридизации в соответствии с формой осуществления 22, где формамид присутствует в концентрации 0,1-5%, глицерин, пропиленгликоль, 1,2-пропандиол, диэтиленгликоль, этиленгликоль, гликоль и 1,3-пропандиол присутствуют в концентрации от 0,1% до 10%, и цитратный буфер присутствует в концентрации от 1 мМ до 50 мМ.
Форма осуществления 24. Композиция для гибридизации в соответствии с формой осуществления 18, где блокирующий агент выбран из группы, состоящей из: суммарной ДНК человека, ДНК спермы сельди, ДНК спермы лосося и ДНК тимуса теленка.
Форма осуществления 25. Композиция для гибридизации в соответствии с формой осуществления 24, где суммарная ДНК человека, ДНК спермы сельди, ДНК спермы лосося и ДНК тимуса теленка присутствуют в концентрации от 0,01 до 10 мкг/мкл.
Форма осуществления 26. Композиция для гибридизации в соответствии с любой из форм осуществления 1-25, содержащая 40% по меньшей мере одного полярного апротонного растворителя, 10% декстрансульфат, 300 мМ хлорид натрия и 5 мМ фосфатный буфер.
Форма осуществления 27. Композиция для гибридизации в соответствии с любой из форм осуществления 1-25, содержащая 15% по меньшей мере одного полярного апротонного растворителя, 20% декстрансульфат, 600 мМ хлорид натрия, 10 мМ фосфатный буфер и 0,1 мкг/мкл суммарной ДНК человека.
Форма осуществления 28. Композиция для гибридизации в соответствии с любой из форм осуществления 1-25, содержащая 15% по меньшей мере одного полярного апротонного растворителя, 20% декстрансульфат, 600 мМ хлорид натрия, 10 мМ цитратный буфер рН 6,2 и 0,1 мкг/мкл ДНК спермы сельди или ДНК спермы лосося или ДНК тимуса теленка, или 0,5% формамид, или 1% этиленгликоль, или 1% 1,3-пропандиол.
Форма осуществления 29. Композиция для гибридизации в соответствии с любой из форм осуществления 1-28, содержащая более чем одну фазу при комнатной температуре.
Форма осуществления 30. Композиция для гибридизации в соответствии с формой осуществления 29, содержащая две фазы при комнатной температуре.
Форма осуществления 31. Композиция для гибридизации в соответствии с формой осуществления 29, содержащая три фазы при комнатной температуре.
Форма осуществления 32. Способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности,
- получение второй нуклеиново-кислотной последовательности,
- получение композиции для гибридизации, содержащей по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и
- объединение первой и второй нуклеиново-кислотной последовательности и композиции для гибридизации в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей,
где полярный апротонный растворитель представляет собой не диметилсульфоксид (ДМСО).
Форма осуществления 33. Способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности в биологическом образце in situ, и
- нанесение композиции для гибридизации, содержащей вторую нуклеиново-кислотную последовательность и по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, на первую нуклеиново-кислотную последовательность в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей,
где полярный апротонный растворитель представляет собой не диметилсульфоксид (ДМСО).
Форма осуществления 34. Способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности,
- получение второй нуклеиново-кислотной последовательности,
- получение композиции для гибридизации в соответствии с любой из форм осуществления 1-31, и
- объединение первой и второй нуклеиново-кислотной последовательности и композиции для гибридизации в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей.
Форма осуществления 35. Способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности, и
- нанесение композиции для гибридизации в соответствии с любой из форм осуществления 1-31 на первую нуклеиново-кислотную последовательность в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей.
Форма осуществления 36. Способ в соответствии с формами осуществления 30 или 31, где полярный апротонный растворитель определен в соответствии с любой из форм осуществления 2-6 или 11-17.
Форма осуществления 37. Способ в соответствии с любой из форм осуществления 30-36, где обеспечивают достаточное количество энергии для гибридизации первой и второй нуклеиновых кислот.
Форма осуществления 38. Способ в соответствии с формой осуществления 37, где энергию обеспечивают путем нагревания композиции для гибридизации и нуклеиново-кислотной последовательности.
Форма осуществления 39. Способ в соответствии с формой осуществления 38, где стадию нагревания осуществляют путем использования микроволн, горячих бань, горячих пластин, нагревательной спирали, элемента Пельтье, индукционного нагревания или нагревательных ламп.
Форма осуществления 40. Способ в соответствии с любой из форм осуществления 32-39, где первая нуклеиново-кислотная последовательность является двунитевой, а вторая нуклеиновая кислота является однонитевой.
Форма осуществления 41. Способ в соответствии с любой из форм осуществления 32-40, где стадии денатурации и гибридизации проходят по отдельности.
Форма осуществления 42. Способ в соответствии с любой из форм осуществления 32-41, где стадия гибридизации включает стадии нагревания и охлаждения композиции для гибридизации и нуклеиново-кислотных последовательностей.
Форма осуществления 43. Способ в соответствии с любой из форм осуществления 32-42, где стадия гибридизации занимает менее 8 часов.
Форма осуществления 44. Способ в соответствии с формой осуществления 43, где стадия гибридизации занимает менее 1 часа.
Форма осуществления 45. Способ в соответствии с формой осуществления 44, где стадия гибридизации занимает менее 30 минут.
Форма осуществления 46. Способ в соответствии с формой осуществления 45, где стадия гибридизации занимает менее 15 минут.
Форма осуществления 47. Способ в соответствии с формой осуществления 46, где стадия гибридизации занимает менее 5 минут.
Форма осуществления 48. Способ в соответствии с любой из форм осуществления 32-47, где стадия охлаждения занимает менее 1 часа.
Форма осуществления 49. Способ в соответствии с формой осуществления 48, где стадия охлаждения занимает менее 30 минут.
Форма осуществления 50. Способ в соответствии с формой осуществления 49, где стадия охлаждения занимает менее 15 минут.
Форма осуществления 51. Способ в соответствии с формой осуществления 50. где стадия охлаждения занимает менее 5 минут.
Форма осуществления 52. Способ в соответствии с любой из форм осуществления 32-51, где нуклеиново-кислотная последовательность находится в биологическом образце.
Форма осуществления 53. Способ в соответствии с формой осуществления 52, где биологический образец представляет собой цитологический или гистологический образец.
Форма осуществления 54. Способ в соответствии с любой из форм осуществления 32-53, где композиция для гибридизации содержит одну фазу при комнатной температуре.
Форма осуществления 55. Способ в соответствии с любой из форм осуществления 32-53, где композиция для гибридизации содержит множественные фазы при комнатной температуре.
Форма осуществления 56. Способ в соответствии с формой осуществления 55, где композиция для гибридизации содержит две фазы при комнатной температуре.
Форма осуществления 57. Способ в соответствии с формой осуществления 55 или 56, где фазы композиции для гибридизации смешивают.
Форма осуществления 58. Способ в соответствии с любой из форм осуществления 32-57, дополнительно включающий стадию блокирования.
Форма осуществления 59. Применение композиции для гибридизации, содержащей от 1 до 95% (об/об) по меньшей мере одного полярного апротонного растворителя, в гибридизационных анализах.
Форма осуществления 60. Применение композиции в соответствии с формой осуществления 59, где композиция для гибридизации соответствует любой из форм осуществления 1-31.
Claims (19)
1. Способ гибридизации нуклеиново-кислотных последовательностей, включающий:
- получение первой нуклеиново-кислотной последовательности в цитологическом или гистологическом образце,
- получение второй нуклеиново-кислотной последовательности,
- получение композиции для гибридизации, содержащей по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и
- объединение первой и второй нуклеиново-кислотной последовательности и композиции для гибридизации в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей,
где полярный апротонный растворитель имеет циклическую основную структуру и не является диметилсульфоксидом (ДМСО).
- получение первой нуклеиново-кислотной последовательности в цитологическом или гистологическом образце,
- получение второй нуклеиново-кислотной последовательности,
- получение композиции для гибридизации, содержащей по меньшей мере один полярный апротонный растворитель в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и
- объединение первой и второй нуклеиново-кислотной последовательности и композиции для гибридизации в течение по меньшей мере периода времени, достаточного для гибридизации первой и второй нуклеиново-кислотных последовательностей,
где полярный апротонный растворитель имеет циклическую основную структуру и не является диметилсульфоксидом (ДМСО).
2. Способ по п.1, где указанная композиция для гибридизации содержит вторую нуклеиново-кислотную последовательность.
3. Способ по п.1, где полярный апротонный растворитель является нетоксичным.
4. Способ по п.1, где полярный апротонный растворитель имеет лактоновую, сульфоновую, сульфитную, нитрильную и/или карбонатную функциональную группу.
5. Способ по п.1, где полярный апротонный растворитель имеет параметр дисперсионной растворимости в интервале от 17,7 МПа1/2 до 22,0 МПа1/2, параметр полярной растворимости в интервале от 13 МПа1/2 до 23 МПа1/2 и параметр растворимости за счет водородных связей в интервале от 3 МПа1/2 до 13 МПа1/2.
6. Способ по п.1, где полярный апротонный растворитель выбран из группы, состоящей из:
, , ,
где X представляет собой О и R1 представляет собой алкилдиил, и
где X является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О, или N, или S, или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и где Y представляет собой О, или S, или С.
, , ,
где X представляет собой О и R1 представляет собой алкилдиил, и
где X является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О, или N, или S, или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и где Y представляет собой О, или S, или С.
8. Способ по любому из пп.1-7, где стадия гибридизации занимает менее 8 ч, менее 1 ч, менее 30 мин, менее 15 мин или менее 5 мин.
9. Композиция для гибридизации нуклеиновых кислот, содержащая от 1% до 95% (об./об.) по меньшей мере одного полярного апротонного растворителя, имеющего циклическую основную структуру, в количестве, эффективном для денатурации двунитевых нуклеотидных последовательностей, и раствор для гибридизации, где полярный апротонный растворитель не является диметилсульфоксидом (ДМСО).
10. Композиция для гибридизации по п.9, характеризующаяся тем, что полярный апротонный растворитель является нетоксичным.
11. Композиция для гибридизации по п.9, характеризующаяся тем, что композиция содержит менее 10% формамида, предпочтительно не содержит формамид.
12. Композиция для гибридизации по п.9, где полярный апротонный растворитель имеет лактоновую, сульфоновую, сульфитную, нитрильную и/или карбонатную функциональную группу.
13. Композиция для гибридизации по п.9, где полярный апротонный растворитель имеет параметр дисперсионной растворимости в интервале от 17,7 МПа1/2 до 22,0 МПа1/2, параметр полярной растворимости в интервале от 13 МПа1/2 до 23 МПа1/2 и параметр растворимости за счет водородных связей в интервале от 3 МПа1/2 до 13 МПа1/2.
14. Композиция для гибридизации по п.9, где полярный апротонный растворитель выбран из группы, состоящей из:
, , ,
где X представляет собой О и R1 представляет собой алкилдиил, и
где X является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О, или N, или S, или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и где Y представляет собой О, или S, или С.
, , ,
где X представляет собой О и R1 представляет собой алкилдиил, и
где X является необязательным и, если присутствует, выбран из О или S;
где Z является необязательным и, если присутствует, выбран из О или S;
где А и В независимо представляют собой О, или N, или S, или часть алкилдиила или первичного амина;
где R представляет собой алкилдиил; и где Y представляет собой О, или S, или С.
16. Композиция для гибридизации по п.9, дополнительно содержащая катализатор и по меньшей мере одну соль, при этом указанный катализатор представляет собой декстрансульфат, и по меньшей мере одна соль представляет собой хлорид натрия и/или фосфатный буфер.
17. Композиция для гибридизации по п.16, где декстрансульфат присутствует в концентрации от 10% до 30%, хлорид натрия присутствует в концентрации от 300 мМ до 600 мМ и/или фосфатный буфер присутствует в концентрации от 5 мМ до 20 мМ.
18. Композиция для гибридизации по п.9, содержащая 15% по меньшей мере одного полярного апротонного растворителя, 20% декстрансульфата, 600 мМ хлорида натрия, 10 мМ цитратного буфера рН 6,2.
19. Применение композиции для гибридизации по любому из пп.9-18 в гибридизационных анализах.
Applications Claiming Priority (9)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US5608908P | 2008-05-27 | 2008-05-27 | |
| DKPA200800727 | 2008-05-27 | ||
| US61/056,089 | 2008-05-27 | ||
| DKPA200800727 | 2008-05-27 | ||
| US15568309P | 2009-02-26 | 2009-02-26 | |
| US61/155,683 | 2009-02-26 | ||
| DKPA200900278 | 2009-02-27 | ||
| DKPA200900278 | 2009-02-27 | ||
| PCT/IB2009/005893 WO2009144581A1 (en) | 2008-05-27 | 2009-05-27 | Hybridization compositions and methods |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010151493A RU2010151493A (ru) | 2012-07-10 |
| RU2505609C2 true RU2505609C2 (ru) | 2014-01-27 |
Family
ID=58714504
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010151495A RU2618868C2 (ru) | 2008-05-27 | 2009-05-27 | Композиции и способы определения хромосомных аберраций с новыми буферами для гибридизации |
| RU2010151493/10A RU2505609C2 (ru) | 2008-05-27 | 2009-05-27 | Композиции и способы гибридизации |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010151495A RU2618868C2 (ru) | 2008-05-27 | 2009-05-27 | Композиции и способы определения хромосомных аберраций с новыми буферами для гибридизации |
Country Status (9)
| Country | Link |
|---|---|
| US (4) | US11118214B2 (ru) |
| EP (8) | EP2636756B2 (ru) |
| JP (2) | JP5588970B2 (ru) |
| CN (3) | CN102084004B (ru) |
| BR (1) | BRPI0912046B1 (ru) |
| CA (2) | CA2724638C (ru) |
| ES (4) | ES2610588T3 (ru) |
| RU (2) | RU2618868C2 (ru) |
| WO (2) | WO2009147537A2 (ru) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2618868C2 (ru) | 2008-05-27 | 2017-05-11 | Дако Денмарк А/С | Композиции и способы определения хромосомных аберраций с новыми буферами для гибридизации |
| EP2401396B1 (en) * | 2009-02-26 | 2016-11-23 | Dako Denmark A/S | Methods for performing a stringent wash step in hybridization applications |
| CA2781907C (en) * | 2009-12-02 | 2019-07-16 | Dako Denmark A/S | Compositions and methods for performing hybridizations with no denaturation |
| US20120065085A1 (en) * | 2010-05-10 | 2012-03-15 | Abbott Laboratories | Detection of chromosomal abnormalities associated with endometrial cancer |
| CN105223357A (zh) * | 2010-09-16 | 2016-01-06 | Cbs生物科学有限公司 | 预测肝癌预后的组合物或试剂盒 |
| CN103403543B9 (zh) * | 2011-01-25 | 2017-05-17 | 阿尔玛克诊断有限公司 | 结肠癌基因表达签名及使用方法 |
| CN104846073B (zh) * | 2011-09-16 | 2018-04-13 | 上海长海医院 | 前列腺癌的生物学标志物、治疗靶点及其用途 |
| US10662465B2 (en) | 2011-09-30 | 2020-05-26 | Agilent Technologies, Inc. | Hybridization compositions and methods using formamide |
| US11118226B2 (en) | 2011-10-21 | 2021-09-14 | Agilent Technologies, Inc. | Hybridization compositions and methods |
| US20130171622A1 (en) * | 2011-12-30 | 2013-07-04 | Abbott Laboratories | Compositions and methods for detecting viral infection using direct-label fluorescence in situ hybridization |
| KR101938699B1 (ko) | 2012-07-23 | 2019-01-16 | 삼성전자주식회사 | Lrig1의 항 c―met 항체 적용 대상 환자 선별을 위한 용도 |
| DK3030682T3 (da) | 2013-08-05 | 2020-09-14 | Twist Bioscience Corp | De novo synthesized gene libraries |
| GB201319180D0 (en) * | 2013-10-30 | 2013-12-11 | Mast Group Ltd | Nucleic acid probe |
| WO2015085194A1 (en) * | 2013-12-06 | 2015-06-11 | The Broad Institute, Inc. | Enhanced methods of ribonucleic acid hybridization |
| US9587268B2 (en) * | 2014-01-29 | 2017-03-07 | Agilent Technologies Inc. | Fast hybridization for next generation sequencing target enrichment |
| US9994912B2 (en) | 2014-07-03 | 2018-06-12 | Abbott Molecular Inc. | Materials and methods for assessing progression of prostate cancer |
| ES2707970T3 (es) * | 2014-09-29 | 2019-04-08 | Ventana Med Syst Inc | Ensayo múltiple de detección simultánea de gen-proteína de TP53/CEN17/linfocito B y sondas excepcionalmente específicas para 19q12, INSR, ATM, DLEU2, TP53 y 13q12 |
| WO2016126882A1 (en) | 2015-02-04 | 2016-08-11 | Twist Bioscience Corporation | Methods and devices for de novo oligonucleic acid assembly |
| WO2016133218A1 (ja) * | 2015-02-20 | 2016-08-25 | 国立大学法人名古屋大学 | ホスファフルオレセイン化合物若しくはその塩、又はそれを用いた蛍光色素 |
| US9981239B2 (en) | 2015-04-21 | 2018-05-29 | Twist Bioscience Corporation | Devices and methods for oligonucleic acid library synthesis |
| ES2753274T5 (es) * | 2015-08-21 | 2023-05-26 | 42 Life Sciences Gmbh & Co Kg | Composición y procedimiento de hibridación |
| IL258164B (en) | 2015-09-18 | 2022-09-01 | Twist Bioscience Corp | Methods to regulate the activity of proteins and cells and a method for the production of nucleic acids |
| US11512347B2 (en) | 2015-09-22 | 2022-11-29 | Twist Bioscience Corporation | Flexible substrates for nucleic acid synthesis |
| JP2019502386A (ja) * | 2016-01-08 | 2019-01-31 | アボツト・モレキユラー・インコーポレイテツド | グアニジウムチオシアネートを含むハイブリダイゼーション緩衝液 |
| CN105755136B (zh) * | 2016-04-13 | 2017-08-25 | 武汉康录生物技术有限公司 | 一种人12号染色体着丝粒探针试剂盒及其制备方法和应用 |
| CN107419001A (zh) * | 2016-05-23 | 2017-12-01 | 益善生物技术股份有限公司 | Brca1、pten基因异常检测试剂盒及检测方法 |
| CN107058565A (zh) * | 2016-08-31 | 2017-08-18 | 郭军 | 肢端型黑色素瘤的诊断和治疗 |
| US10417457B2 (en) | 2016-09-21 | 2019-09-17 | Twist Bioscience Corporation | Nucleic acid based data storage |
| WO2018093777A1 (en) * | 2016-11-15 | 2018-05-24 | The Regents Of The University Of Michigan | Centromere analysis |
| CN118116478A (zh) | 2017-02-22 | 2024-05-31 | 特韦斯特生物科学公司 | 基于核酸的数据存储 |
| CN107227359A (zh) * | 2017-06-19 | 2017-10-03 | 福建万科药业有限公司 | 一种亚型Ph‑likeALL的检测试剂盒及其检测方法 |
| CN107312838A (zh) * | 2017-06-28 | 2017-11-03 | 广西大学 | 细胞荧光原位杂交方法 |
| CA3079613A1 (en) | 2017-10-20 | 2019-04-25 | Twist Bioscience Corporation | Heated nanowells for polynucleotide synthesis |
| AU2019270243A1 (en) * | 2018-05-18 | 2021-01-07 | Twist Bioscience Corporation | Polynucleotides, reagents, and methods for nucleic acid hybridization |
| JP7090793B2 (ja) * | 2018-07-27 | 2022-06-24 | エフ.ホフマン-ラ ロシュ アーゲー | 次世代配列決定用途向けのホルムアミド非含有標的濃縮組成物 |
| CN108998531B (zh) * | 2018-08-31 | 2021-10-01 | 昆明医科大学第一附属医院 | 肺癌下调长链非编码rna标志物及其应用 |
| WO2020092796A1 (en) | 2018-11-01 | 2020-05-07 | Advanced Cell Diagnostics, Inc. | Methods for digital multiplexing of nucleic acids in situ |
| US10768173B1 (en) | 2019-09-06 | 2020-09-08 | Element Biosciences, Inc. | Multivalent binding composition for nucleic acid analysis |
| US10704094B1 (en) * | 2018-11-14 | 2020-07-07 | Element Biosciences, Inc. | Multipart reagents having increased avidity for polymerase binding |
| CN111781356A (zh) * | 2019-04-04 | 2020-10-16 | 清华大学 | 一种胃癌极早期细胞标志和胃癌前病变早期细胞标志及其在诊断试剂盒中的应用 |
| CN110172511A (zh) * | 2019-05-10 | 2019-08-27 | 广州安必平医药科技股份有限公司 | 用于检测her-2基因扩增水平的探针组、试剂盒及其应用 |
| CN110257483B (zh) * | 2019-07-10 | 2022-08-05 | 厦门通灵生物医药科技有限公司 | 用于原位杂交的杂交液、其制备方法及检测试剂盒 |
| US12091777B2 (en) | 2019-09-23 | 2024-09-17 | Twist Bioscience Corporation | Variant nucleic acid libraries for CRTH2 |
| US11287422B2 (en) | 2019-09-23 | 2022-03-29 | Element Biosciences, Inc. | Multivalent binding composition for nucleic acid analysis |
| EP4237581A1 (en) | 2020-10-30 | 2023-09-06 | Element Biosciences, Inc. | Reagents for massively parallel nucleic acid sequencing |
| CN112626180A (zh) * | 2020-12-30 | 2021-04-09 | 北京思尔成生物技术有限公司 | 一种dna杂交增强液及其制备方法与应用 |
| CN114561449B (zh) * | 2022-02-28 | 2022-10-14 | 深圳大学 | 一种免预杂交的Northern blot杂交液及其应用 |
| CN116144780A (zh) * | 2023-03-17 | 2023-05-23 | 重庆医科大学 | 一种慢性淋巴细胞白血病的细胞的遗传学检测方法 |
| CN117247995A (zh) * | 2023-09-12 | 2023-12-19 | 上海新培晶医学检验所有限公司 | 一种在g-显带的玻片上进行分子荧光原位杂交处理方法 |
| CN117887813B (zh) * | 2023-11-28 | 2024-07-12 | 首都医科大学附属北京口腔医院 | 一种杂交缓冲液与应用 |
| CN118454487A (zh) * | 2024-05-20 | 2024-08-09 | 上海乐纯生物技术股份有限公司 | 一种亲水改性聚偏氟乙烯过滤膜的制备方法 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1992007956A1 (en) * | 1990-11-05 | 1992-05-14 | British Bio-Technology Limited | Process for amplifying nucleic acid |
| US6361940B1 (en) * | 1996-09-24 | 2002-03-26 | Qiagen Genomics, Inc. | Compositions and methods for enhancing hybridization and priming specificity |
| US20080050393A1 (en) * | 1998-12-03 | 2008-02-28 | Tang Y Tom | Novel nucleic acids and polypeptides |
| RU2338787C2 (ru) * | 2006-03-15 | 2008-11-20 | Институт белка Российской академии наук | Обнаружение молекулярных колоний посредством гибридизации на мембранах с флуоресцентными зондами |
Family Cites Families (189)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3151405A (en) | 1960-12-15 | 1964-10-06 | Ludwig Herbert | Ladies' slipper having a plastic bead construction |
| US4652517A (en) | 1984-06-11 | 1987-03-24 | Diagnostic Research Limited Partnership | Methods for the in vitro detection and identification of unknown pathogens or genetic entities |
| US5132207A (en) | 1984-07-05 | 1992-07-21 | Gen-Probe Incorporated | Accelerated nucleic acid reassociation method |
| US4888278A (en) | 1985-10-22 | 1989-12-19 | University Of Massachusetts Medical Center | In-situ hybridization to detect nucleic acid sequences in morphologically intact cells |
| US6344315B1 (en) | 1986-01-16 | 2002-02-05 | The Regents Of The University Of California | Chromosome-specific staining to detect genetic rearrangements associated with chromosome 3 and/or chromosome 17 |
| US6475720B1 (en) | 1986-01-16 | 2002-11-05 | The Regents Of The University Of California | Chromosome-specific staining to detect genetic rearrangements associated with chromosome 3 and/or chromosome 17 |
| EP0261955A3 (en) | 1986-09-26 | 1989-06-07 | E.I. Du Pont De Nemours And Company | Process for immobilization of dna |
| US4886741A (en) * | 1987-12-09 | 1989-12-12 | Microprobe Corporation | Use of volume exclusion agents for the enhancement of in situ hybridization |
| US4996359A (en) | 1988-03-14 | 1991-02-26 | Arco Chemical Technology, Inc. | Process for the preparation of aromatic bis dialkyl ureas |
| US5869237A (en) | 1988-11-15 | 1999-02-09 | Yale University | Amplification karyotyping |
| US6203977B1 (en) | 1988-11-15 | 2001-03-20 | Yale University | Delineation of individual human chromosomes in metaphase and interphase cells by in situ suppression hybridization |
| US5650148A (en) | 1988-12-15 | 1997-07-22 | The Regents Of The University Of California | Method of grafting genetically modified cells to treat defects, disease or damage of the central nervous system |
| US5925525A (en) | 1989-06-07 | 1999-07-20 | Affymetrix, Inc. | Method of identifying nucleotide differences |
| US5633129A (en) | 1989-07-13 | 1997-05-27 | Massachusetts Institute Of Technology | Electrophoretic detection and separation of mutant DNA using replaceable polymer matrices |
| WO1991002088A1 (en) | 1989-07-24 | 1991-02-21 | Microprobe Corporation | Lactam-containing compositions and methods useful for the hybridization of nucleic acids |
| US5106730A (en) | 1989-07-24 | 1992-04-21 | Microprobe Corporation | Lactam-containing compositions and methods useful for the hybridization of nucleic acids |
| DE69130668T2 (de) | 1990-08-30 | 1999-05-20 | Tropix, Inc., Bedford, Mass. | Chemolumineszente 3-(substituierte adamant-2'-ylidene)1,2-dioxetane |
| WO1992007959A1 (en) | 1990-11-05 | 1992-05-14 | Biowhittaker Inc. | Homogeneous membrane lytic immunoassay method utilizing contact sensitive liposome formulations |
| US5714331A (en) | 1991-05-24 | 1998-02-03 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity, sequence specificity and solubility |
| US5719262A (en) | 1993-11-22 | 1998-02-17 | Buchardt, Deceased; Ole | Peptide nucleic acids having amino acid side chains |
| US5641625A (en) | 1992-05-22 | 1997-06-24 | Isis Pharmaceuticals, Inc. | Cleaving double-stranded DNA with peptide nucleic acids |
| US5766855A (en) | 1991-05-24 | 1998-06-16 | Buchardt, Deceased; Ole | Peptide nucleic acids having enhanced binding affinity and sequence specificity |
| US6228982B1 (en) | 1992-05-22 | 2001-05-08 | Benget Norden | Double-stranded peptide nucleic acids |
| US5539082A (en) | 1993-04-26 | 1996-07-23 | Nielsen; Peter E. | Peptide nucleic acids |
| DK51092D0 (da) | 1991-05-24 | 1992-04-15 | Ole Buchardt | Oligonucleotid-analoge betegnet pna, monomere synthoner og fremgangsmaade til fremstilling deraf samt anvendelser deraf |
| GB9211979D0 (en) | 1992-06-05 | 1992-07-15 | Buchard Ole | Uses of nucleic acid analogues |
| EP0662153A1 (en) | 1992-07-17 | 1995-07-12 | Aprogenex, Inc. | Free radical scavengers useful for reducing autofluorescence in fixed cells |
| US5521061A (en) | 1992-07-17 | 1996-05-28 | Aprogenex, Inc. | Enhancement of probe signal in nucleic acid-mediated in-situ hybridization studies |
| AU5355594A (en) | 1992-10-09 | 1994-05-09 | Oncor, Inc. | Methods for the detection of chromosome structural abnormalities by (in situ) hybridization to fixed tissue |
| US5432065A (en) | 1993-03-30 | 1995-07-11 | United States Biochemical Corporation | Cycle sequencing with non-thermostable DNA polymerases |
| US5382285A (en) | 1993-04-06 | 1995-01-17 | Regents Of The University Of California | Biofoam |
| US5527675A (en) | 1993-08-20 | 1996-06-18 | Millipore Corporation | Method for degradation and sequencing of polymers which sequentially eliminate terminal residues |
| DE4331012A1 (de) | 1993-09-13 | 1995-03-16 | Bayer Ag | Nukleinsäuren-bindende Oligomere mit N-Verzweigung für Therapie und Diagnostik |
| GB2284209A (en) | 1993-11-25 | 1995-05-31 | Ole Buchardt | Nucleic acid analogue-induced transcription of RNA from a double-stranded DNA template |
| US5705333A (en) | 1994-08-05 | 1998-01-06 | The Regents Of The University Of California | Peptide-based nucleic acid mimics(PENAMS) |
| US5582985A (en) | 1994-08-05 | 1996-12-10 | The Regents Of The University Of California | Detection of mycobacteria |
| DE59510515D1 (de) | 1994-09-02 | 2003-01-30 | Novartis Ag | Funktionelle terpyridin-metallkomplexe, verfahren zu deren herstellung und oligonukleotid-konjugate mit terpyridin-metallkomplexen |
| US5718915A (en) | 1994-10-31 | 1998-02-17 | Burstein Laboratories, Inc. | Antiviral liposome having coupled target-binding moiety and hydrolytic enzyme |
| US20010011131A1 (en) | 1997-07-28 | 2001-08-02 | Luyten Frank P. | DNA molecules encoding cartilage-derived morphogenetic proteins |
| US5750340A (en) * | 1995-04-07 | 1998-05-12 | University Of New Mexico | In situ hybridization solution and process |
| DE19516399A1 (de) | 1995-05-04 | 1996-11-07 | Bayer Ag | Verfahren zur Herstellung von Polymeren mit wiederkehrenden Succinyleinheiten |
| JP2000500341A (ja) | 1995-11-13 | 2000-01-18 | ユニバーシティ・オブ・ロチェスター | 組換え基質による哺乳類体細胞モザイク現象の生成 |
| US5962227A (en) | 1996-07-26 | 1999-10-05 | The Regents Of The University Of California | DNA-based diagnostic test for detecting myxobolus, the cause of salmonid whirling disease |
| US6582921B2 (en) | 1996-07-29 | 2003-06-24 | Nanosphere, Inc. | Nanoparticles having oligonucleotides attached thereto and uses thereof |
| ES2201323T3 (es) | 1996-10-04 | 2004-03-16 | Dako A/S | Nuevas sondas para la deteccion de micobacterias. |
| US6329197B2 (en) | 1996-10-09 | 2001-12-11 | Synaptic Pharmaceutical Corporation | DNA encoding galanin GALR3 receptors and uses thereof |
| US5858671A (en) | 1996-11-01 | 1999-01-12 | The University Of Iowa Research Foundation | Iterative and regenerative DNA sequencing method |
| AU751956B2 (en) | 1997-03-20 | 2002-09-05 | University Of Washington | Solvent for biopolymer synthesis, solvent microdroplets and methods of use |
| US6716625B1 (en) | 1997-04-16 | 2004-04-06 | Claude Selitrennikoff | Histidine kinases of Aspergillus and other fungal species, related compositions, and methods of use |
| US6534273B2 (en) | 1997-05-02 | 2003-03-18 | Gen-Probe Incorporated | Two-step hybridization and capture of a polynucleotide |
| EP0878552A1 (en) | 1997-05-13 | 1998-11-18 | Erasmus Universiteit Rotterdam | Molecular detection of chromosome aberrations |
| US6107470A (en) | 1997-05-29 | 2000-08-22 | Nielsen; Peter E. | Histidine-containing peptide nucleic acids |
| CA2242035C (en) * | 1997-07-01 | 2004-11-23 | Transgene S.A. | Compositions useful for transferring therapeutically active substances into a target cell, and their use in gene therapy |
| CA2301924C (en) | 1997-08-20 | 2008-12-09 | The University Of Miami | A high quality, continuous throughput, tissue fixation-dehydration-fat removal-impregnation method |
| US6794499B2 (en) | 1997-09-12 | 2004-09-21 | Exiqon A/S | Oligonucleotide analogues |
| EP2341058A3 (en) | 1997-09-12 | 2011-11-23 | Exiqon A/S | Oligonucleotide Analogues |
| US7572582B2 (en) | 1997-09-12 | 2009-08-11 | Exiqon A/S | Oligonucleotide analogues |
| US20020192659A1 (en) | 1997-09-17 | 2002-12-19 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| EP0905123B1 (de) | 1997-09-24 | 2001-12-12 | Infineon Technologies AG | o-Amino(thio)phenol-carbonsäuren und deren Herstellung |
| CZ300849B6 (cs) | 1997-11-26 | 2009-08-26 | Zymogenetics, Inc. | Polynukleotid kódující polypeptid podobný savcímu cytokinu |
| US5972615A (en) | 1998-01-21 | 1999-10-26 | Urocor, Inc. | Biomarkers and targets for diagnosis, prognosis and management of prostate disease |
| US6043039A (en) | 1998-02-17 | 2000-03-28 | Applied Spectral Imaging | Method of and composite for in situ fluorescent hybridization |
| US7396508B1 (en) | 2000-07-12 | 2008-07-08 | Ventana Medical Systems, Inc. | Automated molecular pathology apparatus having independent slide heaters |
| US6405609B1 (en) | 1998-02-27 | 2002-06-18 | Ventana Medical Systems, Inc. | System and method of aspirating and dispensing reagent |
| US6265168B1 (en) | 1998-10-06 | 2001-07-24 | Transgenomic, Inc. | Apparatus and method for separating and purifying polynucleotides |
| US6287772B1 (en) | 1998-04-29 | 2001-09-11 | Boston Probes, Inc. | Methods, kits and compositions for detecting and quantitating target sequences |
| CA2327542C (en) | 1998-05-04 | 2011-11-22 | Dako A/S | Method and probes for the detection of chromosome aberrations |
| DE69931497T2 (de) | 1998-08-07 | 2007-05-03 | Cellay LLC, Cambridge | Gel mikrotropfen für die genetische analyse |
| DE69934415T2 (de) | 1998-08-24 | 2007-09-27 | Fuso Pharmaceutical Industries, Ltd. | Neuartiges collectin |
| EP1013772A1 (en) | 1998-12-21 | 2000-06-28 | Transgene S.A. | Method for preparing suspension of stable posiplexes |
| US6331618B1 (en) | 1999-05-13 | 2001-12-18 | Pe Corporation (Ny) | Compositions of solvents and high concentrations of nucleic acid analogs |
| US6300073B1 (en) | 1999-10-01 | 2001-10-09 | Clontech Laboratories, Inc. | One step RT-PCR methods, enzyme mixes and kits for use in practicing the same |
| EP1218547A4 (en) | 1999-10-15 | 2005-04-20 | Ventana Med Syst Inc | METHOD FOR DETECTING UNIQUE GENE IN SITU COPIES |
| US8012471B2 (en) | 1999-11-19 | 2011-09-06 | Abbott Healthcare Products B.V. | Screening and treatment methods using IGS5 enzymes of the metalloprotease family |
| US20010026919A1 (en) | 2000-02-08 | 2001-10-04 | Alex Chenchik | Nucleic acid assays employing universal arrays |
| WO2001066804A2 (en) | 2000-03-09 | 2001-09-13 | Protogene Laboratories, Inc. | Methods for optimizing hybridization performance of polynucleotide probes and localizing and detecting sequence variations |
| US6617131B2 (en) | 2000-03-21 | 2003-09-09 | Aventis Pharma Deutschland Gmbh | Nucleic acid molecule encoding the potassium channel protein, KCNQ5 |
| US6969587B2 (en) | 2000-04-04 | 2005-11-29 | Taylor Paul D | Detection of nucleic acid heteroduplex molecules by anion-exchange chromatography |
| US20040048376A1 (en) * | 2000-04-10 | 2004-03-11 | Benoit Chabot | Methods for modulating splicing and/or alternative splicing, and for identifying alternatively spliced units in genes |
| WO2001079462A2 (en) | 2000-04-14 | 2001-10-25 | Novozymes A/S | Nucleic acids encoding polypeptides having haloperoxidase activity |
| US7482151B2 (en) | 2000-05-19 | 2009-01-27 | Aquaria, Inc. | Method of using ammonia-oxidizing bacteria |
| DE60125243T2 (de) | 2000-07-03 | 2007-05-31 | Applera Corp., Foster City | Polynukleotid-sequenzassay |
| US6716829B2 (en) | 2000-07-27 | 2004-04-06 | Pharmacia Corporation | Aldosterone antagonist and cyclooxygenase-2 inhibitor combination therapy to prevent or treat inflammation-related cardiovascular disorders |
| US6942970B2 (en) | 2000-09-14 | 2005-09-13 | Zymed Laboratories, Inc. | Identifying subjects suitable for topoisomerase II inhibitor treatment |
| US20030175852A1 (en) | 2000-09-15 | 2003-09-18 | Kalra Krishan L | Ehancement of in situ hybridization |
| CA2422440C (en) | 2000-09-15 | 2010-07-27 | Ventana Medical Systems, Inc. | Oligonucleotide sequence formula for labeling oligonucleotide probes and proteins for in situ analysis |
| WO2002026868A1 (fr) | 2000-09-28 | 2002-04-04 | Sanyo Chemical Industries, Ltd. | Catalyseur metallique conçu pour la polymerisation avec ouverture de cycles de composes heterocycliques |
| JP2002112777A (ja) | 2000-10-03 | 2002-04-16 | Livestock Improvement Association Of Japan Inc | 新規精巣特異的遺伝子 |
| DE10053047A1 (de) | 2000-10-13 | 2002-06-06 | Univ Lausanne Epalinges | Verwendung von Caveolin-1 oder des Gens desselben zur Behandlung von nichtsteroidabhängigem Karzinom |
| US7309573B2 (en) | 2000-11-21 | 2007-12-18 | Stratagene California | Methods for detection of a nucleic acid by sequential amplification |
| DE60140317D1 (de) | 2000-12-14 | 2009-12-10 | Gen Probe Inc | Verfahren und kits zur verbesserung der hybridisierungsraten von polynukleotiden |
| TW201022287A (en) | 2001-01-03 | 2010-06-16 | Senomyx Inc | T1R taste receptors and genes encoding same |
| WO2003014398A2 (en) * | 2001-01-03 | 2003-02-20 | Transgenomic, Inc. | Methods and compositions for mutation detection by liquid chromatography |
| US6656685B2 (en) | 2001-01-29 | 2003-12-02 | Ventana Medical Systems, Inc. | Hybridization buffers using low molecular weight dextran sulfate and methods for their use |
| US6949368B2 (en) | 2001-01-30 | 2005-09-27 | The Trustees Of Princeton University | Compositions and methods for enhancing polynucleotide amplification reactions |
| WO2002088389A1 (fr) | 2001-04-26 | 2002-11-07 | Nof Corporation | Inhibiteurs d'hybridation non specifiques, reactifs d'examen clinique et procede d'examen clinique |
| CN1384203A (zh) | 2001-04-30 | 2002-12-11 | 香港科技创业股份有限公司 | 具有高度延伸专一性的dna低温循环延伸反应方法 |
| EP1385999B1 (en) | 2001-04-30 | 2012-12-12 | Ventana Medical Systems, Inc. | Reagents and methods for automated in situ or microarray hybridization |
| US7297494B2 (en) | 2001-06-25 | 2007-11-20 | Georgia Tech Research Corporation | Activatable probes and methods for in vivo gene detection |
| US7297553B2 (en) | 2002-05-28 | 2007-11-20 | Nanosphere, Inc. | Method for attachment of silylated molecules to glass surfaces |
| US20030108903A1 (en) | 2001-07-19 | 2003-06-12 | Liman Wang | Multiple word DNA computing on surfaces |
| EP1424392B1 (en) | 2001-09-03 | 2012-10-24 | Takeda Pharmaceutical Company Limited | RF-peptide ligands of G-protein coupled receptor |
| EP1432826B1 (en) | 2001-09-24 | 2012-12-12 | Life Technologies Corporation | Methods, kits and compositions pertaining to the suppression of detectable probe binding to randomly distributed repeat sequences in genomic nucleic acid |
| US20040106109A1 (en) | 2001-10-02 | 2004-06-03 | Belly Robert T | Detection of ras mutations |
| US7132236B2 (en) | 2001-10-25 | 2006-11-07 | Agilent Technologies, Inc. | Composition and method for optimized hybridization using modified solutions |
| US6783940B2 (en) | 2001-10-31 | 2004-08-31 | Applera Corporation | Method of reducing non-specific amplification in PCR |
| DE10154291B4 (de) | 2001-11-05 | 2005-05-19 | Hain Lifescience Gmbh | Verfahren zum Nachweis von Nukleinsäuren in Form eines Trockenschnelltestes |
| US20060270595A1 (en) | 2001-12-18 | 2006-11-30 | Denis Jullien | Nucleic acids encoding compositions of THAP-family chemokine binding domains |
| US7153390B2 (en) | 2001-12-31 | 2006-12-26 | Kimberly-Clark Wordwide, Inc. | Process for manufacturing a cellulosic paper product exhibiting reduced malodor |
| RU2360923C2 (ru) | 2002-01-18 | 2009-07-10 | Займоджинетикс, Инк. | Новый лиганд рецептора цитокина zcytor17 |
| US7772383B2 (en) | 2002-01-25 | 2010-08-10 | The Trustees Of Princeton University | Chemical PCR: Compositions for enhancing polynucleotide amplification reactions |
| US7456219B2 (en) | 2002-03-04 | 2008-11-25 | Merck Hdac Research, Llc | Polymorphs of suberoylanilide hydroxamic acid |
| US20060030541A1 (en) | 2002-04-05 | 2006-02-09 | Proskelia | Genes involved in osteogenesis, and methods of use |
| EP1540006B1 (en) | 2002-07-02 | 2009-01-07 | Nanosphere, Inc. | Nanoparticle polyanion conjugates and methods of use thereof in detecting analytes |
| US20040029184A1 (en) | 2002-08-09 | 2004-02-12 | Pickcell Laboratories B.V. | Method for antigen retrieval and submersion fluid compositions for use therein |
| TWI228511B (en) | 2002-10-25 | 2005-03-01 | Univ Nat Cheng Kung | Genes controlling floral development in orchid |
| AU2003269379A1 (en) | 2002-10-31 | 2004-05-25 | Pfizer Products Inc. | Suspension method for producing embryoid bodies, and compositions and methods related thereto |
| US7517697B2 (en) * | 2003-02-05 | 2009-04-14 | Applied Biosystems, Llc | Compositions and methods for preserving RNA in biological samples |
| US7601491B2 (en) | 2003-02-06 | 2009-10-13 | Becton, Dickinson And Company | Pretreatment method for extraction of nucleic acid from biological samples and kits therefor |
| US20040224343A1 (en) | 2003-05-06 | 2004-11-11 | Biochain Inc. | Methods and products to enhance interactions among molecules |
| US7064196B2 (en) | 2003-05-20 | 2006-06-20 | E. I. Du Pont De Nemours And Company | Genes encoding carotenoid compounds |
| US20050250094A1 (en) | 2003-05-30 | 2005-11-10 | Nanosphere, Inc. | Method for detecting analytes based on evanescent illumination and scatter-based detection of nanoparticle probe complexes |
| US20040241666A1 (en) | 2003-05-30 | 2004-12-02 | Amorese Douglas A. | Ligand array assays that include an organic fluid wash step and compositions for practicing the same |
| US20050064472A1 (en) | 2003-07-23 | 2005-03-24 | Affymetrix, Inc. | Methods of monitoring gene expression |
| WO2005033333A2 (en) | 2003-10-07 | 2005-04-14 | Dako Denmark A/S | Methods and compositions for the diagnosis of cancer |
| CA2482097C (en) † | 2003-10-13 | 2012-02-21 | F. Hoffmann-La Roche Ag | Methods for isolating nucleic acids |
| US20050191657A1 (en) | 2003-11-18 | 2005-09-01 | Demorest David M. | Stringency modifiers in hybridization assays |
| EP1711590B1 (en) | 2004-01-08 | 2016-12-14 | Dako Denmark A/S | Apparatus and methods for processing biological samples and a reservoir therefore |
| JP2005300998A (ja) | 2004-04-13 | 2005-10-27 | Tokyo Ohka Kogyo Co Ltd | ポジ型レジスト組成物及びレジストパターン形成方法 |
| CA2563225A1 (en) | 2004-04-15 | 2005-10-27 | F. Hoffmann-La Roche Ag | Process for preparing pyridazinone compounds |
| JP2007535966A (ja) | 2004-05-04 | 2007-12-13 | ダコ デンマーク アクティーゼルスカブ | 染色体異常を検出するための方法 |
| US20060024751A1 (en) | 2004-06-03 | 2006-02-02 | Fluidigm Corporation | Scale-up methods and systems for performing the same |
| JPWO2005121340A1 (ja) | 2004-06-14 | 2008-04-10 | 株式会社ガルファーマ | 新規ガレクチン8改変体タンパク質及びその用途 |
| CA2574014A1 (en) | 2004-07-16 | 2006-01-26 | Oy Jurilab Ltd | Method for detecting the risk of and for treatment of type 2 diabetes |
| US7867443B2 (en) | 2004-07-23 | 2011-01-11 | Dako Denmark A/S | Method and apparatus for automated pre-treatment and processing of biological samples |
| WO2006073504A2 (en) | 2004-08-04 | 2006-07-13 | President And Fellows Of Harvard College | Wobble sequencing |
| US7709201B2 (en) | 2004-08-24 | 2010-05-04 | Cornell Research Foundation, Inc. | Detection of nucleic acid differences using endonuclease cleavage/ligase resealing reactions and capillary electrophoresis or microarrays |
| US20060147957A1 (en) | 2004-11-12 | 2006-07-06 | Affymetrix, Inc. | Methods for high throughput sample preparation for microarray analysis |
| PE20060739A1 (es) | 2004-12-15 | 2006-08-16 | Bristol Myers Squibb Co | FORMAS CRISTALINAS DE 3-(1-HIDROXI-1-METIL-ETIL)-1-(4-METOXI-FENIL)-6-[4-(2-OXO-2H-PIRIDIN-1-IL)-FENIL]-1,4,5,6-TETRAHIDRO-PIRAZOLO[3,4-c]PIRIDIN-7-ONA COMO INHIBIDORES DEL FACTOR Xa |
| AU2005316449B2 (en) | 2004-12-17 | 2010-10-14 | Ventana Medical Systems, Inc. | High temperature tissue conditioning with low volatility solutions and applications |
| EP1836297A2 (en) * | 2004-12-30 | 2007-09-26 | Amersham Biosciences Corp. | Phi 15 dna polymerase |
| AU2006219332B2 (en) | 2005-02-28 | 2010-11-11 | Eisai R & D Management Co., Ltd. | Signal amplification method |
| PT103257B (pt) | 2005-04-05 | 2007-05-31 | Inst Superior Tecnico | Método de produção subcrítica de xerogéis e aerogéis monolíticos híbridos de sílica e látex modificado com grupos alcoxissilano |
| AU2006244394B2 (en) * | 2005-05-06 | 2010-10-21 | Gen-Probe Incorporated | Methods of nucleic acid target capture |
| MX2008001745A (es) | 2005-08-05 | 2008-04-09 | Xm Satelite Radio Inc | Dispositivo de interfase de senal de difusion y metodo del mismo. |
| JP5088134B2 (ja) | 2005-09-28 | 2012-12-05 | 日本電気株式会社 | 信号測定装置 |
| US8092670B2 (en) | 2005-09-29 | 2012-01-10 | Toto Ltd. | Method for specifically detecting analyte using photocurrent, and electrode, measuring cell and measuring device for use therein |
| JP4712814B2 (ja) * | 2005-11-17 | 2011-06-29 | 独立行政法人科学技術振興機構 | 特定の塩基配列の標的核酸類を検出する方法、及び検出のための核酸類セット |
| US20070141583A1 (en) | 2005-12-20 | 2007-06-21 | Weiwei Li | Methods of rapid chromatin immunoprecipitation |
| US7807354B2 (en) | 2005-12-28 | 2010-10-05 | Agilent Technologies, Inc. | Low volume hybridization |
| US7660454B2 (en) | 2006-03-13 | 2010-02-09 | Ikonisys, Inc. | Process for identifying FISH signals |
| US7820883B2 (en) | 2006-03-15 | 2010-10-26 | Dow Agrosciences Llc | Resistance to auxinic herbicides |
| EP2336309A3 (en) | 2006-03-20 | 2011-08-10 | Novozymes A/S | Polypeptides having endoglucanase activity and polynucleotides encoding same |
| WO2007109941A1 (fr) | 2006-03-29 | 2007-10-04 | Huawei Technologies Co., Ltd. | Procédé et application de réduction d'interruption de trafic pendant une procédure de transfert ps de communication mobile |
| EP1870411B1 (en) | 2006-06-21 | 2016-03-16 | Fidia Farmaceutici S.p.A. | Process for the preparation and purification of valgancyclovir |
| US8568982B2 (en) | 2006-08-09 | 2013-10-29 | National University Of Singapore | Methods of nucleic acid synthesis using particular crowding agents and concentrations |
| US7846703B2 (en) | 2006-10-02 | 2010-12-07 | Takara Bio Inc. | Method for enhancing polymerase activity |
| GB0701253D0 (en) | 2007-01-23 | 2007-02-28 | Diagnostics For The Real World | Nucleic acid amplification and testing |
| US8686129B2 (en) | 2007-03-20 | 2014-04-01 | Agilent Technologies, Inc. | Methods for the separation of biological molecules using sulfolane |
| CA2684086C (en) | 2007-04-24 | 2014-05-27 | F. Hoffmann-La Roche Ag | Process for hcv protease inhibitor intermediate |
| US8841437B2 (en) | 2008-06-20 | 2014-09-23 | The Board Of Trustees Of The Leland Stanford Junior University | Precursor miRNA loop-modulated target regulation |
| JP2010538658A (ja) | 2007-09-14 | 2010-12-16 | ベンタナ・メデイカル・システムズ・インコーポレーテツド | 前立腺癌バイオマーカー |
| WO2009074154A2 (en) | 2007-12-10 | 2009-06-18 | Dako Denmark A/S | A tissue processing apparatus |
| US9409166B2 (en) | 2007-12-10 | 2016-08-09 | The Trustees Of The University Of Pennsylvania | Integrated PCR reactor for cell lysis, nucleic acid isolation and purification, and nucleic acid amplication related applications |
| US9261508B2 (en) | 2008-04-25 | 2016-02-16 | Istituto Superiore Di Sanita | Antisense RNA for treating cancer and inhibition of metastasis and vectors for antisense sequestration |
| RU2618868C2 (ru) | 2008-05-27 | 2017-05-11 | Дако Денмарк А/С | Композиции и способы определения хромосомных аберраций с новыми буферами для гибридизации |
| ITMI20081002A1 (it) | 2008-05-30 | 2009-11-30 | Kardia S R L | Dispositivo per il trattamento di occlusioni arteriose degli arti inferiori |
| US8193161B2 (en) | 2008-06-09 | 2012-06-05 | New York Medical College | Compositions comprising cardiac stem cells overexpressing specific micrornas and methods of their use in repairing damaged myocardium |
| US20100047671A1 (en) | 2008-06-12 | 2010-02-25 | Massachusetts Institute Of Technology | High energy density redox flow device |
| US7750208B2 (en) | 2008-07-09 | 2010-07-06 | National Taiwan University | Anther-specific expression promoter in plant and application thereof |
| EP2391725A4 (en) | 2009-01-30 | 2013-01-02 | Us Health | METHOD AND SYSTEMS FOR CLEANING TRANSMITTING AND / OR MANIPULATING NUCLEIC ACIDS |
| EP2401396B1 (en) | 2009-02-26 | 2016-11-23 | Dako Denmark A/S | Methods for performing a stringent wash step in hybridization applications |
| CN105296474B (zh) | 2009-03-24 | 2020-05-12 | 奥斯瑞根公司 | 对fmr1和fmr2基因5’非翻译区进行表征的pcr方法 |
| CA2781907C (en) | 2009-12-02 | 2019-07-16 | Dako Denmark A/S | Compositions and methods for performing hybridizations with no denaturation |
| WO2011147690A1 (en) | 2010-05-28 | 2011-12-01 | Syngenta Participations Ag | Pyrazolecarboxamide derivatives and their use as microbiocides |
| WO2011153354A1 (en) | 2010-06-03 | 2011-12-08 | Cellay, Inc. | Methods and kits for in situ detection of nucleotide sequences |
| JP6013376B2 (ja) | 2011-02-28 | 2016-10-25 | ダコ・デンマーク・エー/エス | 包埋生体試料の前処置のための2相非混和系 |
| US10662465B2 (en) | 2011-09-30 | 2020-05-26 | Agilent Technologies, Inc. | Hybridization compositions and methods using formamide |
| US11118226B2 (en) | 2011-10-21 | 2021-09-14 | Agilent Technologies, Inc. | Hybridization compositions and methods |
| US9651549B2 (en) | 2012-07-13 | 2017-05-16 | Genisphere, Llc | Lateral flow assays using DNA dendrimers |
| WO2014070460A1 (en) | 2012-10-31 | 2014-05-08 | Cellay, Inc. | Methods and kits for performing in situ hybridization |
| GB201303666D0 (en) | 2013-03-01 | 2013-04-17 | Goldsborough Andrew S | Sample fixation and stabilisation |
| US9745571B2 (en) | 2013-03-07 | 2017-08-29 | Bio-Rad Laboratories, Inc. | Repetitive reverse transcription partition assay |
| AU2014256903B2 (en) | 2013-04-25 | 2020-09-24 | Firefly Bioworks, Inc. | Multiplexed analysis of target nucleic acids |
| JP2017506910A (ja) | 2013-12-30 | 2017-03-16 | ザ ヘンリー エム. ジャクソン ファウンデーション フォー ザ アドヴァンスメント オブ ミリタリー メディシン インコーポレイテッド | 前立腺癌に関連したゲノム再編成及び該ゲノム再編成の使用方法 |
| CN103966321A (zh) | 2014-04-24 | 2014-08-06 | 哈尔滨工业大学(威海) | 一种区域选择性抗生物污染阵列芯片的制备方法 |
| WO2015184144A1 (en) | 2014-05-28 | 2015-12-03 | Siemens Healthcare Diagnostics Inc. | Rare molecule signal amplification |
| CN104032033B (zh) | 2014-07-07 | 2015-09-23 | 玉峰惠仁生物医药科技(北京)有限公司 | 用于荧光原位杂交检测粪肠球菌和/或其他肠球菌的肽核酸探针组及其试剂盒、使用方法、用途 |
| CN107406877B (zh) | 2015-02-04 | 2021-06-18 | 博洛尼亚大学 | 用于加快杂交反应的添加剂 |
-
2009
- 2009-05-27 RU RU2010151495A patent/RU2618868C2/ru not_active Application Discontinuation
- 2009-05-27 EP EP13164094.8A patent/EP2636756B2/en active Active
- 2009-05-27 US US12/994,492 patent/US11118214B2/en active Active
- 2009-05-27 EP EP17150792.4A patent/EP3219812B1/en active Active
- 2009-05-27 EP EP09757890.0A patent/EP2285982B1/en active Active
- 2009-05-27 ES ES13164099.7T patent/ES2610588T3/es active Active
- 2009-05-27 ES ES09757890.0T patent/ES2668555T3/es active Active
- 2009-05-27 RU RU2010151493/10A patent/RU2505609C2/ru active
- 2009-05-27 CA CA2724638A patent/CA2724638C/en active Active
- 2009-05-27 CN CN200980121810.XA patent/CN102084004B/zh active Active
- 2009-05-27 JP JP2011511105A patent/JP5588970B2/ja not_active Expired - Fee Related
- 2009-05-27 WO PCT/IB2009/006548 patent/WO2009147537A2/en active Application Filing
- 2009-05-27 ES ES13164094T patent/ES2595031T5/es active Active
- 2009-05-27 US US12/994,495 patent/US9297035B2/en active Active
- 2009-05-27 EP EP13164099.7A patent/EP2636757B1/en active Active
- 2009-05-27 EP EP18165184.5A patent/EP3360973A1/en active Pending
- 2009-05-27 CN CN200980119333.3A patent/CN102046808B/zh active Active
- 2009-05-27 BR BRPI0912046-7A patent/BRPI0912046B1/pt active IP Right Grant
- 2009-05-27 CA CA2724552A patent/CA2724552C/en active Active
- 2009-05-27 EP EP20167307.6A patent/EP3733871A1/en active Pending
- 2009-05-27 WO PCT/IB2009/005893 patent/WO2009144581A1/en active Application Filing
- 2009-05-27 EP EP09754209.6A patent/EP2285979B2/en active Active
- 2009-05-27 CN CN201710332220.8A patent/CN107254513B/zh active Active
- 2009-05-27 JP JP2011511111A patent/JP5592357B2/ja not_active Expired - Fee Related
- 2009-05-27 EP EP16180119.6A patent/EP3138925B8/en active Active
- 2009-05-27 ES ES09754209T patent/ES2613481T5/es active Active
-
2021
- 2021-09-13 US US17/473,524 patent/US11834703B2/en active Active
-
2023
- 2023-10-25 US US18/494,603 patent/US20240124922A1/en active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1992007956A1 (en) * | 1990-11-05 | 1992-05-14 | British Bio-Technology Limited | Process for amplifying nucleic acid |
| US6361940B1 (en) * | 1996-09-24 | 2002-03-26 | Qiagen Genomics, Inc. | Compositions and methods for enhancing hybridization and priming specificity |
| US20080050393A1 (en) * | 1998-12-03 | 2008-02-28 | Tang Y Tom | Novel nucleic acids and polypeptides |
| RU2338787C2 (ru) * | 2006-03-15 | 2008-11-20 | Институт белка Российской академии наук | Обнаружение молекулярных колоний посредством гибридизации на мембранах с флуоресцентными зондами |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2505609C2 (ru) | Композиции и способы гибридизации | |
| US20220154263A1 (en) | Compositions and methods for performing hybridizations with separate denaturation of the sample and probe | |
| US20220162683A1 (en) | Compositions and methods for performing hybridizations with no denaturation | |
| JP2022530140A (ja) | ハイブリダイゼーション組成物ならびに組成物を調製および使用するための方法 | |
| ES2845073T3 (es) | Composiciones de hibridación y métodos |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC43 | Official registration of the transfer of the exclusive right without contract for inventions |
Effective date: 20210802 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20210803 |