RU2495666C2 - Фармацевтическая композиция для модифицированного высвобождения - Google Patents
Фармацевтическая композиция для модифицированного высвобождения Download PDFInfo
- Publication number
- RU2495666C2 RU2495666C2 RU2011117274/15A RU2011117274A RU2495666C2 RU 2495666 C2 RU2495666 C2 RU 2495666C2 RU 2011117274/15 A RU2011117274/15 A RU 2011117274/15A RU 2011117274 A RU2011117274 A RU 2011117274A RU 2495666 C2 RU2495666 C2 RU 2495666C2
- Authority
- RU
- Russia
- Prior art keywords
- pharmaceutical composition
- modified release
- hydrogel
- mpa
- forming polymer
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/426—1,3-Thiazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2009—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2095—Tabletting processes; Dosage units made by direct compression of powders or specially processed granules, by eliminating solvents, by melt-extrusion, by injection molding, by 3D printing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/2853—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers, poly(lactide-co-glycolide)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/28—Dragees; Coated pills or tablets, e.g. with film or compression coating
- A61K9/2806—Coating materials
- A61K9/2833—Organic macromolecular compounds
- A61K9/286—Polysaccharides, e.g. gums; Cyclodextrin
- A61K9/2866—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Diabetes (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Urology & Nephrology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Child & Adolescent Psychology (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Фармацевтическая композиция для модифицированного высвобождения содержит (1) анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемую соль, (2) по меньшей мере, одну добавку, которая обеспечивает проникновение воды в фармацевтическую композицию и которая имеет растворимость, такую что объем воды, требуемой для растворения 1 г добавки, равен 10 мл или меньше, и (3) гидрогель-образующий полимер, имеющий среднюю молекулярную массу приблизительно 100000 или более, или вязкость 12 мПа·с или более в 5% водном растворе при 25°С. Изобретение обеспечивает высвобождение указанного активного агента, не затронутое эффектами пищевого рациона. 2 н. и 21 з.п. ф-лы, 1 ил., 4 табл., 17 пр.
Description
Область техники, к которой относится изобретение
Данное изобретение относится к фармацевтической композиции для модифицированного высвобождения, способного к снижению эффектов пищи, которые наблюдаются с обычными таблетками, комбинацией активного ингредиента с определенными ингредиентами для контроля скорости высвобождения активного ингредиента.
Точнее, данное изобретение относится к фармацевтической композиции, содержащей анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемую соль, добавку, которая обеспечивает проникновение воды в фармацевтическую композицию (иногда называемую в настоящем описании гидрофильной основой), и полимер, который образует гидрогель, в которой изменения в AUC и Cmax, вызываемые потреблением пищи, могут быть снижены контролированием скорости высвобождения активного ингредиента.
Уровень техники
Анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты был разработан фирмой Astellas Pharma Inc., и было опубликовано, что данное соединение обладает не только активностью как по стимулированию секреции инсулина, так и активностью по усилению инсулиновой чувствительности, но также и активностью против ожирения и антигиперлипемической активностью, основанной на активности селективно стимулированного β3-рецептора, и применимо в лечении диабета (см., например, патентную литературу 1).
Кроме того, опубликовано, что данное соединение может быть использовано в качестве терапевтического средства для гиперактивного мочевого пузыря, а именно, гиперактивного мочевого пузыря, сопровождаемого гиперплазией простаты, или гиперактивного мочевого пузыря, сопровождаемого безотлагательностью мочеиспускания, недержанием мочи и частотой мочеиспускания (см., например, патентную литературу 2).
Клиническое испытание анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты в форме обычных композиций выявило недостатки, например, состоящие в том, что фармакокинетические данные неожиданно изменялись согласно наличию или отсутствию потребления пищи (неопубликованные данные). Например, скорость снижения Cmax в состоянии потребления пищи была равна 67%, и скорость уменьшения AUC в состоянии потребления пищи была равна 47% по сравнению с данными показателями в состоянии намеренного голодания. В данном случае Сmax в состоянии намеренного голодания была в три раза больше, чем эта величина в состоянии потребления пищи. Данные проблемы, как полагают, подняты, например, изменениями в фармакокинетике, вызываемыми пищей, и поэтому желательна разработка композиции, способной к предотвращению эффектов от приема пищи.
В качестве методологии приготовления композиции для модифицированного высвобождения, раскрыта гидрогелевая таблетка с пролонгированным высвобождением, содержащая добавку, которая обеспечивает проникновение воды в таблетку, и гидрогель-образующий полимер (см., например, патентную литературу 3).
Однако, патентная литература 3 не относится к анилиду (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты, и требуются дополнительные усовершенствования, чтобы создать фармацевтическую композицию.
Список ссылок
Патентная литература
[Патентная литература 1] International Publication No. WO 99/20607 (пример 41)
[Патентная литература 2] International Publication No. WO 2004/041276
[Патентная литература 3] International Publication No. WO 94/06414
Сущность изобретения
Техническая проблема
Цель данного изобретения состоит в том, чтобы предложить фармацевтическую композицию для модифицированного высвобождения, содержащую анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемую соль, в котором фармацевтическая композиция имеет эффективность, аналогичную или более высокую, чем эффективности обычных препаратов, и не имеет никаких ограничений на прием пищи, и способ изготовления фармацевтической композиции.
Решение проблемы
Период полувыведения (Т1/2) анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты является долгим (приблизительно от 18 до 24 часов), и, следовательно, препарат из него для модифицированного высвобождения не обязательно необходим, чтобы поддерживать его уровень в крови. Принимая в рассмотрение результаты клинического испытания, описанного выше, данные изобретатели провели интенсивные исследования, чтобы создать препарат, с акцентом на контроль скорости высвобождения лекарственного средства из препарата до степени, при которой высвобождение не подвержено воздействию приема пищи или тому подобного, а не на усиление контроля высвобождения.
На основе профилей концентрации в крови (в состоянии намеренного голодания/после потребления пищи) после введения обычного препарата (препарата с быстрым высвобождением) скорость абсорбции лекарственного средства в состоянии потребления пищи вычислена методом деконволюции, чтобы прогнозировать непрерывную абсорбцию в течение примерно 4 часов. Данные изобретатели считали из этого результата, что препарат, способный к непрерывному высвобождению лекарственного средства в течение 4 часов или более, был бы способен снижать эффекты от пищи, потому что высвобождение лекарственного средства из препарата стало бы стадией, ограничивающей скорость для абсорбции.
Данные изобретатели проводили клиническое испытание на человеке, используя три типа препаратов, в которых скорость высвобождения лекарственного средства контролировалась (время, когда процент высвобождения лекарственного средства из стандартного препарата был 80% (Т80%)=4 часа, 6 часов и 10 часов), и нашли, что все препараты могли снижать эффекты от пищи, чтобы завершить данное изобретение.
Общеизвестно, что время удерживания в желудке и скорость высвобождения препаратов для модифицированного высвобождения меняются согласно наличию или отсутствию пищевого рациона, и в результате этого существует возможность того, что профили концентрации в крови изменены. Однако, удивительно, при применении данного препарата, изменение профилей концентрации в крови было небольшим в присутствии или в отсутствие пищевого рациона.
Данное изобретение отличается тем, что предлагает фармацевтическую композицию для модифицированного высвобождения, которое не затронуто эффектами пищевого рациона и проявляет сниженное изменение в AUC и Cmax.
В данном изобретении предлагается:
[1] фармацевтическая композиция для модифицированного высвобождения, содержащая (1) анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемую соль, (2) по меньшей мере, одну добавку, которая обеспечивает проникновение воды в фармацевтическую композицию и которая имеет растворимость, такую что объем воды, требуемой для растворения 1 г добавки, равен 10 мл или меньше, и (3) гидрогель-образующий полимер, имеющий среднюю молекулярную массу приблизительно 100000 или более, или вязкость 12 мПа·с или более в 5% водном растворе при 25°С;
[2] фармацевтическая композиция для модифицированного высвобождения по [1], в которой добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, D-сорбита, ксилита, лактозы, сахарозы, безводной мальтозы, D-фруктозы, декстрана, глюкозы, полиоксиэтилен гидрированного касторового масла, полиоксиэтилен полиоксипропиленгликоля, сложного эфира высшей жирной кислоты и полиоксиэтиленсорбитана, хлорида натрия, хлорида магния, лимонной кислоты, винной кислоты, глицина, β-аланина, гидрохлорида лизина и меглумина;
[3] фармацевтическая композиция для модифицированного высвобождения по [2], в которой добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, лактозы, сахарозы, хлорида натрия и полиоксиэтилен полиоксипропиленгликоля;
[4] фармацевтическая композиция для модифицированного высвобождения по любому одному из [1]-[3], в которой количество добавки, которая обеспечивает проникновение воды в фармацевтическую композицию, составляет от 5% масс. до 75% масс. по отношению к общей массе фармацевтической композиции;
[5] фармацевтическая композиция для модифицированного высвобождения по [4], в которой количество добавки, которая обеспечивает проникновение воды в фармацевтическую композицию, составляет от 5% масс. до 70% масс. по отношению к общей массе фармацевтической композиции;
[6] фармацевтическая композиция для модифицированного высвобождения по любому одному из [1]-[5], в которой гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, натрий карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы и карбоксивинильного полимера;
[7] фармацевтическая композиция для модифицированного высвобождения по [6], в которой гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы и гидроксипропилцеллюлозы;
[8] фармацевтическая композиция для модифицированного высвобождения по любому одному из [1]-[7], в которой количество гидрогель-образующего полимера составляет от 1% масс. до 70% масс. по отношению к общей массе фармацевтической композиции;
[9] фармацевтическая композиция для модифицированного высвобождения по любому одному из [1]-[8], дополнительно содержащая антиоксидант;
[10] фармацевтическая композиция для модифицированного высвобождения по [9], в которой антиоксидант представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из бутилгидрокситолуола, пропилгаллата и аскорбата натрия;
[11] фармацевтическая композиция для модифицированного высвобождения по [10], в которой антиоксидант представляет собой бутилгидрокситолуол;
[12] фармацевтическая композиция для модифицированного высвобождения по любому одному из [9]-[11], в которой количество гидрогель-образующего полимера составляет от 0,025% масс. до 0,25% масс.;
[13] фармацевтическая композиция для модифицированного высвобождения по любому одному из [1]-[12], дополнительно содержащая стабилизатор;
[14] фармацевтическая композиция для модифицированного высвобождения по [13], в которой стабилизатор представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из желтого оксида железа(III), красного оксида железа(III), черного оксида железа;
[15] фармацевтическая композиция для модифицированного высвобождения по [14], в которой стабилизатор представляет собой желтый оксид железа(III) и/или красный оксид железа(III);
[16] фармацевтическая композиция для модифицированного высвобождения по любому одному из [13]-[15], в которой количество стабилизатора составляет от 0,05% масс. до 1% масс.;
[17] способ изготовления фармацевтической композиции для модифицированного высвобождения, отличающийся тем, что включает смешивание (1) анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемой соли с (2), по меньшей мере, одной добавкой, которая обеспечивает проникновение воды в фармацевтическую композицию и которая имеет растворимость, такую что объем воды, требуемой для растворения 1 г добавки, равен 10 мл или меньше, и (3) гидрогель-образующим полимером, имеющим среднюю молекулярную массу приблизительно 100000 или более, или вязкость в 12 мПа·с или более в 5% водном растворе при 25°С, где количество добавки составляет от 5% масс. до 75% масс. по отношению к общей массе фармацевтической композиции, и количество гидрогель-образующего полимера составляет от 1% масс. до 70% масс. по отношению к общей массе фармацевтической композиции;
[18] способ по [17], в котором добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, D-сорбита, ксилита, лактозы, сахарозы, безводной мальтозы, D-фруктозы, декстрана, глюкозы, полиоксиэтилен гидрированного касторового масла, полиоксиэтилен полиоксипропиленгликоля, сложного эфира высшей жирной кислоты и полиоксиэтиленсорбитана, хлорида натрия, хлорида магния, лимонной кислоты, винной кислоты, глицина, β-аланина, гидрохлорида лизина и меглумина; и
[19] способ по [17] или [18], в котором гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, натрий карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы и карбоксивинильного полимера.
В качестве методик приготовления лекарственного средства для снижения или исключения изменений в фармакокинетиках, а именно, AUC и Cmax, сопровождаемых рационом питания, раскрыта методика приготовления, относящаяся к фармацевтической композиции с пролонгированным высвобождением, содержащей гидрохлорид тамсулозина (см. Japanese Unexamined Patent Publication (Kokai) No. 2005-162736 и Japanese Unexamined Patent Publication (Kokai) No. 2005-162737). Данная методика приготовления лекарственного средства ограничена тамсулозином и применена к препарату, содержащему лекарственное средство в малой дозе (0,4 мг на стандартный препарат). Данный препарат создает возможность для контроля высвобождения из него тамсулозина, за счет большого содержания основы для пролонгированного высвобождения. В противоположность этому, фармацевтическая композиция данного изобретения содержит лекарственное средство в высокой дозе (т.е. высокое содержание на стандартный препарат), и, как считают, это затрудняет контроль скорости высвобождения лекарственного средства из препарата, включающего основу для пролонгированного высвобождения при низком содержании, и поэтому данное изобретение методически совершенно отлично от препарата, описанного в данных ссылках.
Полезные эффекты изобретения
Согласно данному изобретению может быть предложена фармацевтическая композиция для модифицированного высвобождения, которая не имеет ограничений на пищевой рацион и является устойчивой (например, снижение изменений в профиле последующего растворения).
Кроме того, может быть предложена фармацевтическая композиция для модифицированного высвобождения, в которой AUC не уменьшена.
Что касается обычного препарата, скорость снижения Сmax в состоянии потребления пищи была равна 67% по сравнению с данным показателем в состоянии намеренного голодания. Напротив, что касается фармацевтической композиции для модифицированного высвобождения по данному изобретению, скорость снижения Сmax в состоянии потребления пищи была равна 42% по сравнению с данным показателем в состоянии намеренного голодания, и данный результат показал, что снижение Сmax, вызываемое пищевым рационом, могло быть значительно уменьшено созданием композиции в виде фармацевтического препарата для модифицированного высвобождения.
Краткое описание чертежей
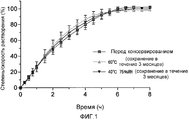
[Фиг. 1] Фигура 1 представляет собой график, показывающий профили растворения фармацевтической композиции для модифицированного высвобождения, приготовленной в примере 11, и их временные продолжительности.
Описание вариантов осуществления
Фармацевтическая композиция для модифицированного высвобождения по данному изобретению будет объяснена в настоящем описании далее.
Термин “препарат для быстрого высвобождения (обычный препарат)”, как он использован в настоящем описании, означает препарат, в котором скорость растворения лекарственного средства из препарата составляет 85% или больше спустя 30 минут от начала теста по растворению, который выполняют в соответствии с тестом по растворению (метод с использованием лопастной мешалки), описанным в фармакопее США, с условиями, что используют 900 мл соответствующей тест-жидкости (такой как USP-буфер, рН 6,8), и скорость вращения лопастной мешалки составляет 100 об/мин. В альтернативном случае, данный термин означает препарат, в котором скорость растворения лекарственного средства из препарата составляет 85% или больше спустя 30 минут от начала теста по растворению, который выполняют в соответствии с тестом по растворению, методом 2, описанным в японской фармакопеи, с условиями, что используют 900 мл соответствующей тест-жидкости (такой как буферный раствор Мак-Илвейна, рН 6,8), и скорость вращения лопастной мешалки составляет 50 об/мин.
Термин “фармацевтическая композиция для модифицированного высвобождения”, как он использован в настоящем описании, означает препарат, в котором скорость растворения лекарственного средства из препарата составляет меньше чем 85% спустя 30 минут от начала теста по растворению в вышеприведенных условиях, и высвобождение лекарственного средства контролируют до степени, при которой эффекты, вызываемые пищей, снижены. Точнее, эта композиция является препаратом, в котором добавка (гидрофильная основа), которая обеспечивает проникновение воды в препарат, объединена с полимером, который образует гидрогель.
Выражение “эффекты, вызываемые пищей, снижены”, как оно использовано в настоящем описании, означает, например, 10% снижение, 20% снижение в другом варианте осуществления и 30% снижение в еще другом варианте осуществления по сравнению с Сmax обычного препарата. В альтернативном случае, данный термин означает, например, 10% снижение относительно скоростей снижения Сmax и AUC при введении после приема пищи по сравнению с Сmax и AUC при введении в состоянии намеренного голодания, 20% снижение в другом варианте осуществления и 30% снижение в еще другом варианте осуществления.
Скорости снижения Сmax и AUC вычислены по следующим уравнениям:
Rd(Cmax)=[Cmax(FS)-Cmax(FI)]×100/Cmax(FS)
Rd(AUC)=[AUC(FS)-AUC(FI)]×100/AUC(FS)
Rd(Cmax):скорость снижения Cmax (%)
Cmax(FS) Cmax при введении в состоянии намеренного голодания
Cmax(FI):Cmax при введении после приема пищи
Rd(AUC):скорость уменьшения AUC (%)
AUC(FS):AUC при введении в состоянии намеренного голодания
AUC(FI):AUC при введении после приема пищи
Выражение “препарат, в котором эффекты, вызываемые пищей, уменьшены”, как оно использовано в настоящем описании, означает препарат, в котором степень растворения лекарственного средства из препарата составляет 75% или меньше спустя 1,5 часа и 100% или меньше спустя 4 часа от начала теста по растворению, который выполняют в вышеприведенных условиях [в соответствии с тестом по растворению (метод с использованием лопастной мешалки), описанным в фармакопее США, с условиями, что используют 900 мл соответствующей тест-жидкости (такой как USP-буфер, рН 6,8), и скорость вращения лопастной мешалки составляет 50-200 об/мин]. В другом варианте осуществления, данный термин означает препарат, в котором степень растворения лекарственного средства из препарата составляет 75% или меньше спустя 1,5 часа и от 75% или больше до 100% или меньше спустя 7 часов.
Термин “устойчивый”, как он использован в настоящем описании, означает устойчивость композиции, например, против нагревания, температуры, влажности или света. Точнее, данный термин означает, что, например, когда пластмассовый сосуд наполняют фармацевтической композицией и герметизируют и затем сосуд хранят в течение трех месяцев в условиях при 40°С и 75% RH/ОВ или при 60°С, изменение в степени растворения в точке, показывающей степень растворения в 50%, принимает значения внутри пределов ±5% или меньше.
Анилид (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты (далее в настоящем описании иногда называемый как соединение А) представлен следующей структурной формулой.
Химическая структура 1
Соединение А может быть использовано в свободной форме, которая не является солью, и может образовывать соль с кислотой в других вариантах осуществления. Примеры такой соли включают кислотно-аддитивную соль с минеральной кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота, или тому подобное; и кислотно-аддитивную соль с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота, этансульфоновая кислота, глутаминовая кислота, или тому подобное.
Доза соединения А может быть надлежащим образом выбрана в соответствии с симптомом, возрастом, полом и тому подобным для пациента, подлежащего лечению. Суточная доза соединения А для перорального введения во взрослую особь обычно принимает значение в интервале от 0,01 до 100 мг/кг, которую вводят сразу иди делят на две-четыре дозы в сутки.
Содержание соединения А на препарат составляет, например, от 1% масс. до 70% масс., от 5% масс. до 70% масс. в другом варианте осуществления и от 5% масс. до 50% масс. в еще другом варианте осуществления. Содержание соединения А на препарат составляет от 1 мг до 50 мг и от 10 мг до 200 мг в другом варианте осуществления.
Требуется, что гидрогель-образующий полимер, использованный в настоящем изобретении, может контролировать скорость высвобождения лекарственного средства до степени, при которой профиль концентрации в крови лекарственного средства не затронут присутствием или отсутствием приема пищи.
Молекулярная масса гидрогель-образующего полимера равна, например, 100000 или больше, от 100000 до 8000000 в другом варианте осуществления, от 100000 до 5000000 в еще другом варианте осуществления, и от 100000 до 2000000 в еще другом варианте осуществления. Вязкость гидрогель-образующего полимера составляет, например, 12 мПа·с или больше в 5% водном растворе при 25°С; 12 мПа·с или больше в 5% водном растворе при 25°С, и 40000 мПа·с или меньше в 1% водном растворе при 25°С в другом варианте осуществления; 400 мПа·с или больше в 2% водном растворе при 25°С, и 7500 мПа·с или меньше в 1% водном растворе при 25°С в еще другом варианте осуществления; и 400 мПа·с или больше в 2% водном растворе при 25°С, и 5500 мПа·с или меньше в 1% водном растворе при 25°С в еще другом варианте осуществления.
В фармацевтической композиции для модифицированного высвобождения по данному изобретению, период времени высвобождения лекарственного средства из препарата можно произвольно контролировать регулированием вязкости полимера, который использован в качестве гидрогель-образующего полимера.
Гидрогель-образующий полимер, используемый в данном изобретении, особенно не ограничивают, пока высвобождение лекарственного средства можно контролировать до степени, при которой эффекты пищи на соединение А могут быть снижены. Примеры гидрогель-образующего полимера включают полиэтиленоксид, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натрий карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и карбоксивинильные полимеры. Примеры гидрогель-образующего полимера в другом варианте осуществления включают полиэтиленоксид, гидроксипропилметилцеллюлозу и гидроксипропилцеллюлозу.
Примеры полиоксиэтиленоксида (далее в настоящем описании называемого иногда как РЕО) включают названия продукта, полиокс WSR-308 [средняя молекулярная масса: 8000000, вязкость: 10000-15000 мПа·с) (1% водный раствор при 25°С)], полиокс WSR-303 [средняя молекулярная масса: 7000000, вязкость: 7500-10000 мПа·с) (1% водный раствор при 25°С)], полиокс WSR коагулятн [средняя молекулярная масса: 5000000, вязкость: 5500-7500 мПа·с) (1% водный раствор при 25°С)], полиокс WSR-301 [средняя молекулярная масса: 4000000, вязкость: 1650-5500 мПа·с) (1% водный раствор при 25°С)], полиокс WSR-N-60K [средняя молекулярная масса: 2000000, вязкость: 2000-4000 мПа·с) (2% водный раствор при 25°С)], полиокс WSR-N-12K [средняя молекулярная масса: 1000000, вязкость: 400-800 мПа·с) (2% водный раствор при 25°С)], полиокс WSR-1105 [средняя молекулярная масса: 900000, вязкость: 8800-17600 мПа·с) (5% водный раствор при 25°С)], полиокс WSR-205 [средняя молекулярная масса: 600000, вязкость: 4500-8800 мПа·с) (5% водный раствор при 25°С)], полиокс WSR-N-750 [средняя молекулярная масса: 300000, вязкость: 600-1200 мПа·с) (5% водный раствор при 25°С)], полиокс WSR-N-80 [средняя молекулярная масса: 200000, вязкость: 55-90 мПа·с) (5% водный раствор при 25°С)] и полиокс WSR-N-10 [средняя молекулярная масса: 100000, вязкость: 12-50 мПа·с) (5% водный раствор при 25°С)] (Dow).
Примеры гидроксипропилметилцеллюлозы (далее в настоящем описании обозначаемой иногда как НРМС) включают название продукта метолоза 90SH50000 [вязкость в 2% водном растворе при 20°С: 2900-3900 мПа·с], метолоза SB-4 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4 мПа·с), TC-5RW (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 6 мПа·с), TC-5S (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 15 мПа·с), TC-5R (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 6 мПа·с), TC-5M (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4 мПа·с), TC-5E (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 3 мПа·с), метолоза 60SH-50 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 50 мПа·с), метолоза 65SH-50 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 50 мПа·с), метолоза 90SH-100 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 100 мПа·с), метолоза 90SH-100SR (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 100 мПа·с), метолоза 65SH-400SR (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 400 мПа·с), метолоза 90SH-400 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 400 мПа·с), метолоза 65SH-1500SR (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 1500 мПа·с), метолоза 60SH-4000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4000 мПа·с), метолоза 65SH-4000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4000 мПа·с), метолоза 90SH-4000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4000 мПа·с), метолоза 90SH-4000SR (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4000 мПа·с), метолоза 90SH-15000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 15000 мПа·с), метолоза 90SH-15000SR (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 15000 мПа·с), метолоза 90SH-30000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 30000 мПа·с).
Примеры гидроксипропилцеллюлозы (далее в настоящем описании обозначаемой иногда как НРС) включают HPC-SSL (название продукта, Nippon Soda Co., Ltd.) (вязкость в 2% водном растворе при 20°С: 2,0-2,9 мПа·с), HPC-SL (название продукта, Nippon Soda Co., Ltd.) (вязкость в 2% водном растворе при 20°С: 3,0-5,9 мПа·с), HPC-L (название продукта, Nippon Soda Co., Ltd.) (вязкость в 2% водном растворе при 20°С: 6,0-10,0 мПа·с), HPC-М (название продукта, Nippon Soda Co., Ltd.) (вязкость в 2% водном растворе при 20°С: 150-400 мПа·с) и HPC-Н (название продукта, Nippon Soda Co., Ltd.) (вязкость в 2% водном растворе при 20°С: 1000-4000 мПа·с).
Примеры метилцеллюлозы (далее в настоящем описании обозначаемой иногда как МС) включают метолозу SM15 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 15 мПа·с), метолозу SM25 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 25 мПа·с), метолозу SM100 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 100 мПа·с), метолозу SM400 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 400 мПа·с), метолозу SM1500 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 1500 мПа·с), метолозу SM4000 (название продукта, Shin-Etsu Chemical Co., Ltd.) (вязкость в 2% водном растворе при 20°С: приблизительно 4000 мПа·с).
Примеры натрий карбоксиметилцеллюлозы (далее в настоящем описании обозначаемой иногда как CMCNa) включают названия продукта, Sunrose F-30MC [вязкость: 250-350 мПа·с (1% водный раствор при 25°С)], Sunrose F-150MC [средняя молекулярная масса: 200000, вязкость: 1200-1800 мПа·с (1% водный раствор при 25°С)], Sunrose F-600MC [вязкость: 6000-8000 мПа·с (1% водный раствор при 25°С)], Sunrose F-1000MC [средняя молекулярная масса: 420000, вязкость: 8000-12000 мПа·с (тот же)], Sunrose F-1400MC [вязкость: 12000-15000 мПа·с (1% водный раствор при 25°С)] и Sunrose F-300MC [средняя молекулярная масса: 300000, вязкость: 2500-3000 мПа·с (тот же)], (Nippon Paper Chemical Co., Ltd.).
Примеры гидроксиэтилцеллюлозы (далее в настоящем описании обозначаемой иногда как НЕС) включают названия продукта, HEC DAICEL SE850 [средняя молекулярная масса: 1480000, вязкость: 2400-3000 мПа·с (1% водный раствор при 25°С)] и HEC DAICEL SE900 [средняя молекулярная масса: 1560000, вязкость: 4000-5000 мПа·с (1% водный раствор при 25°С)] (Daicel Chemical Industries, Ltd.).
Примеры карбоксивинильных полимеров включают карбопол 71G (вязкость: 4000-11000 мПа·с), карбопол 971P (вязкость: 4000-11000 мПа·с), карбопол 981 (вязкость: 4000-10000 мПа·с), карбопол 941 (вязкость: 4000-10000 мПа·с), карбопол 934 (вязкость: 30500-39400 мПа·с) и карбопол 934Р (вязкость: 29400-39400 мПа·с), (B.F. Googrich Chemical).
Данные гидрогель-образующие полимеры могут быть использованы по отдельности или как соответствующая комбинация из двух или более полимеров. Может быть использована комбинация из различных количеств.
Содержание гидрогель-образующего полимера особенно не ограничивают, пока оно представляет собой количество до значения, при котором профиль концентрации лекарственного средства в крови не затронут наличием или отсутствием приема пищи. Содержание гидрогель-образующего полимера составляет, например, от 1% масс. до 70% масс. по отношению к общей массе препарата, и от 3% масс. до 70% масс. в другом варианте осуществления. Содержание гидрогель-образующего полимера составляет от 5% масс. до 70% масс. по отношению к общей массе препарата, от 10% масс. до 60% масс. в другом варианте осуществления и от 10% масс. до 40% масс. в еще другом варианте осуществления. Содержание гидрогель-образующего полимера составляет от 0,1% масс. до 1000% масс. по отношению к общей массе лекарственного средства, от 1% масс. до 500% масс. в другом варианте осуществления и от 5% масс. до 300% масс. в еще другом варианте осуществления.
Полимер, вязкость которого (перед смешиванием) находится за пределами определенного интервала, может быть использован как соответствующая комбинация с одним или несколькими другими полимерами в случае, если смесь, полученная смешиванием данных многих полимеров, имеет вязкость (измеренную перед применением) в рамках определенного интервала.
В добавке, которая обеспечивает проникновение воды в фармацевтическую композицию данного изобретения (гидрофильная основа), количество воды, необходимой для растворения 1 г гидрофильной основы при 20±5°С, равно 10 мл или меньше, 6 мл или меньше в другом варианте осуществления, 5 мл или меньше в еще другом варианте осуществления и 4 мл или меньше в еще другом варианте осуществления. Когда гидрофильная основа имеет высокую растворимость в воде, эффект, который позволяет воде проникать в препарат, является высоким.
Примеры гидрофильной основы включают водорастворимые полимеры, такие как полиэтиленгликоль [PEG: например, названия продуктов PEG 400, PEG 1500, PEG 4000, PEG 6000 и PEG 20000 (NOF Corporation)], поливинилпирролидон (PVP: например, название продукта PVP K30 (BASF)), и тому подобное; спирты сахаров, такие как D-маннит, D-сорбит, ксилит, и тому подобное; сахариды, такие как лактоза, сахароза, безводная мальтоза, D-фруктоза, декстран (например, декстран 40), глюкоза, и тому подобное); сурфактанты, такие как гидрированное полиоксиэтиленкасторовое масло [HCO: например, кремофор RH40 (BASF), HCO-40, HCO-60 (Nikko Chemicals)], полиоксиэтиленполиоксипропиленгликоль [например, плуроник F68 (Asahi Denka и тому подобное)], сложные эфиры высших жирных кислот и полиоксиэтиленсорбитана [твин, например, твин 80 (Kanto Chemical)], и тому подобное; соли, такие как хлорид натрия, хлорид магния, и тому подобное; органические кислоты, такие как лимонная кислота, винная кислота, и тому подобное; аминокислоты, такие как глицин, β-аланин, гидрохлорид лизина, и тому подобное; и аминосахариды, такие как меглумин, и тому подобное.
Как другой вариант осуществления, могут быть использованы PEG, PVP, D-маннит, D-сорбит, ксилит, лактоза, сахароза, безводная мальтоза, D-фруктоза, декстран, глюкоза, полиоксиэтиленполиоксипропиленгликоль, хлорид натрия, хлорид магния, лимонная кислота, винная кислота, глицин, β-аланин, гидрохлорид лизина или меглумин. В качестве еще другого варианта осуществления могут быть использованы PEG, PVP, D-маннит, лактоза, сахароза, хлорид натрия, полиоксиэтиленполиоксипропиленгликоль, или тому подобное.
Данные гидрофильные основы могут быть использованы по отдельности или как соответствующая комбинация из двух или более основ.
Содержание гидрофильной основы особенно не ограничивают, пока оно представляет собой количество, способное контролировать высвобождение лекарственного средства до степени, при которой высвобождение лекарственного средства не затронуто влиянием пищи. Содержание гидрофильной основы составляет, например, от 5% масс. до 75% масс., от 5% масс. до 70% масс. в другом варианте осуществления, и от 20% масс. до 60% масс. в еще другом варианте осуществления.
Фармацевтическая композиция для модифицированного высвобождения по данному изобретению может быть приготовлена в виде разных лекарственных форм, которые включают, например, препараты для перорального введения, такие как таблетки, капсулы (включая микрокапсулы), гранулы и порошок, и препараты для парентерального введения, такие как суппозитории (например, ректальные суппозитории или вагинальные суппозитории). Данные препараты могут быть безопасно введены перорально или парентерально. Препараты для перорального введения, такие как таблетки, капсулы и гранулы, могут быть выбраны в другом варианте осуществления.
Фармацевтическая композиция для модифицированного высвобождения по данному изобретению может быть приготовлена смешиванием лекарственного средства, гидрогель-образующих полимеров и гидрофильной основы и приданием смеси заранее определенной формы. Смешивание и формование может быть выполнено в соответствии с общепринятыми методами, широко применяемыми в технологической области для приготовления лекарственного средства. Если желательно, то может быть использован фармацевтически приемлемый носитель.
В приготовлении фармацевтической композиции для модифицированного высвобождения по данному изобретению могут быть использованы, если желательно, дополнительные различные фармацевтические добавки. Такие фармацевтические добавки на особенно ограничивают, пока они являются фармацевтически приемлемыми. Примеры фармацевтических добавок включают различные органические или неорганические вещества-носители, которые широко используются как продукты для приготовления препаратов, а именно, наполнители, замасливатели, связующие вещества и дезинтеграторы. Если желательно, то могут быть использованы другие добавки для приготовления препаратов, такие как консерванты, антиоксиданты, стабилизаторы, средства для покрытия пленкой, окрашивающие средства и подсластители.
Примеры наполнителей включают лактозу, сахарозу, D-маннит, D-сорбит, крахмал, желатинированный крахмал, декстрин, кристаллическую целлюлозу, малозамещенную гидроксипропилцеллюлозу, карбоксиметилцеллюлозу натрия, аравийскую камедь, пуллулан, слабообезвоженную кремниевую кислоту, синтетический силикат алюминия, алюминатметасиликат магния и тому подобное.
Примеры замасливателей включают стеарат магния, стеарат кальция, тальк, коллоидный диоксид кремния и тому подобное.
Примеры связующих веществ включают желатинированный крахмал, сахарозу, желатин, аравийскую камедь, метилцеллюлозу, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, кристаллическую целлюлозу натрия, D-маннит, трегалозу, декстрин, пуллулан, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон и тому подобное.
Примеры дезинтегрирующих средств включают лактозу, сахарозу, крахмал, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу кальция, кроскармелозу натрия, карбоксиметилкрахмал натрия, слабообезвоженную кремниевую кислоту, малозамещенную гидроксипропилцеллюлозу и тому подобное.
Примеры консервантов включают п-гидроксибензоатные сложные эфиры, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и тому подобное.
Антиоксиданты особенно не ограничивают, поскольку ими можно избежать эффектов распада. Примеры антиоксидантов включают бутилированный гидрокситолуол (ВТН), пропилгаллат (PG), бутилгидроксианизол (ВНА), аскорбиновую кислоту, аскорбат натрия, эриторбовую кислоту, нитрит натрия, бисульфит натрия, пиросульфит натрия, лимонную кислоту и эдетат натрия; ВТН, PG и аскорбат натрия в другом варианте осуществления; и ВНТ в еще другом варианте осуществления.
Примеры стабилизаторов включают желтый оксид железа(III), красный оксид железа(III), черный оксид железа и тому подобное.
Примеры средств для пленочных покрытий включают обычно используемые в фармацевтике основы, такие как водорастворимые полимеры, пластификаторы и неорганические вещества или их комбинации.
Примеры окрашивающих средств включают водорастворимые съедобные смоляные пигменты (примеры: съедобные пигменты, такие как пищевой красный № 2, пищевой красный № 3, пищевой желтый № 4, пищевой желтый № 5, пищевой голубой № 1 и пищевой голубой № 2), водорастворимые красноватые пигменты (примеры: алюминиевые соли вышеприведенных водорастворимых съедобных смоляных пигментов), природные пигменты (примеры: β-каротин, хлорофилл и колкотар), и тому подобное.
Примеры подсластителей включают натрия сахарин, дикалия глициризинат, аспартам, стевию и тому подобное.
Данные носители и препаративные добавки могут быть использованы по отдельности или как соответствующая комбинация двух или более компонентов.
Что касается их содержаний, то они могут быть использованы в целесообразных количествах. Например, содержание антиоксиданта принимает значения от 0,025% масс. до 0,25% масс. по отношению к общей массе препарата, и содержание стабилизатора принимает значения от 0,05% масс. до 1% масс. по отношению к общей массе препарата.
Далее в настоящем описании будет раскрыт способ изготовления фармацевтической композиции для модифицированного высвобождения по данному изобретению, данное изобретение не органичено следующими конкретными вариантами осуществления.
Фармацевтическая композиция для модифицированного высвобождения по данному изобретению может быть приготовлена непосредственно известными способами, такими как сухое гранулирование, мокрое гранулирование, гранулирование в псевдоожиженном слое, прерывистое гранулирование, гранулирование с перемешиванием, или тому подобное.
В качестве способа измельчения комков или пульверизации лекарственного средства, могут быть применены обычные способы дробления или пульверизации, например, с применением ударной мельницы (Hosokawa Micron Corporation; тонкая ударная мельница), сухой и мокрой мельницы (Powrex Corporation: Comil) или режущего мельничного гранулятора (Dalton Corporation; Power Mill).
В качестве способа пульверизации гидрофильной основы, гидрогель-образующего полимера или препаративных добавок, могут быть применены обычные способы пульверизации, например, с применением ударной мельницы (Hosokawa Micron Corporation; тонкая ударная мельница или мельница для проб) или струйной мельницы (Horkos Corp.; струйная мельница).
В качестве способа гранулирования лекарственного средства, могут быть использованы обычные способы гранулирования. Примеры таких способов включают способ гранулирования в псевдоожиженном слое, прерывистый способ гранулирования, способ гранулирования с перемешиванием, высокоскоростной способ гранулирования с перемешиванием, способ гранулирования в псевдоожиженном слое c вращением гранулы, способ гранулирования экструзией, способ гранулирования пульверизацией, способ сухого гранулирования, и тому подобный. В другом варианте осуществления, примеры способов включают способ гранулирования в псевдоожиженном слое, прерывистый способ гранулирования, способ гранулирования с перемешиванием, высокоскоростной способ гранулирования с перемешиванием, способ гранулирования в псевдоожиженном слое c вращением гранулы и способ сухого гранулирования, и может быть использован любой способ, способный к гранулированию лекарственного средства. Примеры гранулятора включают гранулятор с псевдоожиженным слоем (например, Flow Coater; Freund Corporation или GPCG; Glatt GmbH), аппарат для гранулирования и нанесения покрытий, оборудованный горизонтальным вращающимся диском, имеющим плоскую часть для контакта с порошком [например, центробежный гранулятор с псевдоожиженным слоем (например, CF гранулятор; Freund Corporation)], аппарат для гранулирования и нанесения покрытий, имеющий вращающийся диск с плоской поверхностью, расположенной на дне псевдоожиженного слоя и имеющей участок для аэрирования (например, Spiralflow или Flowcoater с роторным контейнером; Freund Corporation) и сухой гранулятор, в котором порошок продукта непосредственно уплотняют, прессуют, дробят и просеивают (например, Roller Compactor; Freund Corporation).
В сухом гранулировании, например, лекарственное средство, гидрогель-образующий полимер, гидрофильную основу и добавки, такие как наполнитель, можно уплотнять-прессовать, применяя сухой гранулятор, и затем можно измельчать и просеивать, чтобы получить гранулированные продукты, имеющие желаемый размер.
В мокром гранулировании, например, хотя лекарственное средство, гидрогель-образующий полимер, гидрофильная основа и добавки, такие как наполнитель, разжижены, соответствующее количество воды или жидкости, содержащей гидрофильную основу и связующее вещество, можно впрыскивать. Жидкость, содержащая гидрофильную основу, может быть приготовлена растворением или диспергированием необходимого компонента в растворителе, таком как вода, этанол, метанол, или тому подобное. Данные растворители могут быть использованы в виде соответствующих смесей из них.
Количество воды, используемой в гранулировании, особенно не ограничивают, пока связующее вещество и препаративные добавки могут быть равномерно растворены и/или суспендированы (диспергированы) в воде. Когда гидрофильную основу используют в твердой форме, количество воды особенно не ограничивают, пока гидрогель-образующий полимер можно гранулировать.
Когда гидрофильную основу используют в жидкой форме, количество воды к гидрогель-содержащему полимеру составляет обычно 10% масс. или меньше, 8% масс. или меньше в другом варианте осуществления, и 5% масс. или меньше в еще другом варианте осуществления. Способ добавления воды при гранулировании особенно не ограничивают, поскольку неоднородную смесь, содержащую необработанный порошок и агрегаты, которые обычно являются порошкообразными, не генерируют. Примеры его включают непрерывный способ опрыскивания, в котором вода добавляется непрерывно, и прерывистый способ опрыскивания, в котором сухая стадия (и стадия встряхивания, если желательно) выполняются в течение стадии гранулирования, и тому подобное.
Скорость добавления воды при гранулировании особенно не ограничивают, поскольку неоднородную смесь, содержащую необработанный порошок и агрегаты, которые обычно являются порошкообразными, не генерируют. При гранулировании в псевдоожиженном слое, скорость добавления воды к гидрогель-образующему полимеру обычно составляет от 0,1% масс./мин до 1% масс./мин, от 0,2% масс./мин до 0,8% масс./мин в другом варианте осуществления, и от 0,4% масс./мин до 0,6% масс./мин в еще другом варианте осуществления.
Температуру порошка при гранулировании особенно не ограничивают, пока она не вызывает термическую денатурацию гидрогель-образующего полимера. Температура составляет, например, от 20°С до температуры плавления (62°С-67°С) гидрогель-образующего полимера, от 20°С до 50°С в другом варианте осуществления, от 20°С до 35°С в еще другом варианте осуществления, и от 25°С до 30°С в еще другом варианте осуществления.
Концентрация связующей жидкости в виде содержания твердого вещества, которое может быть использовано при гранулировании, составляет, например, от 1% до 20% от количества препарата. Связующее вещество особенно не ограничивают, поскольку оно является фармацевтически доступным.
Связующее вещество может быть добавлено в твердой форме в гранулятор, и затем вода может быть внесена опрыскиванием как связующая жидкость. В альтернативном случае, связующее вещество можно растворить в воде, и затем полученная связующая жидкость может быть внесена опрыскиванием.
Соответствующая скорость опрыскивания связующей жидкости меняется согласно способу изготовления, предназначенному для применения, или масштабу производства. При масштабе производства в 1 кг по способу гранулирования в псевдоожиженном слое скорость опрыскивания составляет от 2 г/мин до 20 г/мин и от 5 г/мин до 15 г/мин в другом варианте осуществления.
Соответствующая температура продукта при гранулировании составляет от 15°С до 50°С и от 15°С до 40°С в другом варианте осуществления.
Полученные гранулированные продукты могут быть, например, высушены или нагреты.
На стадии сушки аппарат и способ особенно не ограничивают, поскольку гранулированные продукты могут быть высушены. Примеры аппарата для сушки включают гранулятор с псевдоожиженным слоем (например, Flow Coater; Freund Corporation, или GPCG; Glatt GmbH), аппарат для гранулирования и нанесения покрытий, оборудованный горизонтальным вращающимся диском, имеющим плоскую часть для контакта с порошком [например, центробежный гранулятор с псевдоожиженным слоем (например, CF гранулятор; Freund Corporation)], аппарат для гранулирования и нанесения покрытий, имеющий вращающийся диск с плоской поверхностью, расположенной на дне псевдоожиженного слоя и имеющей участок для аэрирования (например, Spiralflow или Flowcoater с роторным контейнером; Freund Corporation), и тому подобное. Условия для сушки особенно не ограничивают, поскольку гранулированные продукты обычно могут быть высушены в псевдоожиженном слое. Сушка гранулированных продуктов будет почти завершена, например, в условиях, при которых температура сухого воздуха на входе составляет 50°С, и сушку проводят до тех пор, пока температура гранулированных продуктов не станет равна 40°С, в другом варианте осуществления, в условиях, при которых температура сухого воздуха на входе составляет 40°С, и сушку проводят до тех пор, пока температура гранулированных продуктов не станет равна 30°С. В качестве способа сушки может быть использована сушка активным вентилированием воздуха или сушка при пониженном давлении.
После окончания гранулирования может быть добавлен антиоксидант.
Гранулированные продукты могут быть просеяны.
На стадии просеивания аппарат и способ особенно не ограничивают, поскольку гранулированные продукты можно просеивать. Примеры аппарата для просеивания включают сито, сухую и мокрую мельницу (Powrex Corporation: Comil), режущий мельничный гранулятор (Dalton Corporation; Power Mill), и тому подобное. Условия для просеивания особенно не ограничивают, поскольку гранулированные продукты обычно можно просеивать, чтобы получить частицы, имеющие желаемый размер.
После окончания просеивания может быть добавлен антиоксидант.
Примеры таблетирования включают способ прямого таблетирования, в котором лекарственное средство, гидрофильную основу и гидрогель-образующий полимер смешивают с соответствующей добавкой(ами), и смесь уплотняют-формуют, чтобы получить таблетки; способ, в котором композицию, полученную мокрым гранулированием (гранулирование выполнено опрыскиванием смеси лекарственного средства, гидрофильной основы, гидрогель-образующего полимера и добавок связывающей жидкостью) или гранулированием расплава (гранулирование выполнено нагреванием смеси лекарственного средства, гидрофильной основы, гидрогель-образующего полимера и соответствующего низко плавящегося вещества) формуют в таблетки; и тому подобное.
В качестве машины для изготовления таблеток может быть использована роторная машина для таблетирования, одноштамповая машина для изготовления таблеток, и тому подобное. Способ, а также аппарат особенно не ограничивают, поскольку продукт с уплотнением-формованием (предпочтительно таблетки) может быть произведен фармацевтически.
После таблетирования полученные таблетки могут быть высушены. Начальное содержание воды в таблетке составляет, например, 2% масс./таблетка или меньше, 1,5% масс./таблетка или меньше в другом варианте осуществления и 0,9% масс./таблетка или меньше в еще другом варианте осуществления.
После таблетирования полученные таблетки могут быть покрыты пленкой с применением формовочной машины для нанесения покрытия в количестве от 1% масс. до 5% на таблетку.
Примеры
Данное изобретение далее будет дополнительно проиллюстрировано следующими примерами, но без ограничения только ими.
Пример 1
В ступке основательно смешивали 10 г соединения А, 2,5 г полиэтиленоксида (Dow Chemical; название продукта: WSR N-60K; то же соединение использовали в последующих примерах, если не отмечено особо) и 7,5 г полиэтиленгликоля (Sanyo Chemical Industries, Ltd.; PEG 6000; то же соединение использовали в последующих примерах). Данную смесь формовали в таблетки, используя автограф (Shimadzu; тот же аппарат использовали в последующих примерах), чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 2
В ступке основательно смешивали 10 г соединения А, 3,5 г полиэтиленоксида и 6,5 г полиэтиленгликоля, и данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 3
В ступке основательно смешивали 10 г соединения А, 6,25 г полиэтиленоксида и 5 г полиэтиленгликоля, и данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 425 мг.
Пример 4
В ступке основательно смешивали 10 г соединения А, 5 г гидроксипропилметилцеллюлозы (Shin-Etsu Chemical Co., Ltd; HPMC90SH-4000SR) и 5 г полиэтиленгликоля, и данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 5
В ступке основательно смешивали 10 г соединения А, 5 г гидроксипропилметилцеллюлозы (Shin-Etsu Chemical Co., Ltd; HPMC90SH-100000SR) и 5 г полиэтиленгликоля, и данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 6
В ступке основательно смешивали 10 г соединения А, 7,5 г гидроксипропилметилцеллюлозы (Shin-Etsu Chemical Co., Ltd; HPMC90SH-100SR) и 2,5 г полиэтиленгликоля, и данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 7
После того как отвешивали 400 г соединения А, 140 г полиэтиленоксида, 251,2 г полиэтиленгликоля, 0,8 г тонко размолотого ВНТ (Merck; то же соединение использовали в последующих примерах) и 8 г стеарата магния, данные соединения смешивали, используя миксер. Данную смесь уплотняли-формовали, применяя роликовый мини-уплотнитель/Roller Compactor Mini (Freund Corporation), и просеивали, чтобы получить фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению. Полученные гранулы формовали в таблетки, применяя роторную машину для таблетирования (Hata Iron Works Co., Ltd; тот же аппарат использовали в последующих примерах), чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 8
Таблетки, полученные в примере 7, покрывали средством для нанесения пленки [Colorcon; Opadry (содержащий желтый оксид железа(III) в качестве стабилизатора); то же средство использовали в последующих примерах, если не отмечено особо], диспергированным в воде, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению.
Пример 9
В аппарат для гранулирования в псевдоожиженном слое GPCG-5 (Freund Corporation; тот же аппарат использовали в последующих примерах) загружали 1500 г измельченного соединения А, 1050 г полиэтиленоксида и 1764 г полиэтиленгликоля и гранулировали с 1350 г 10% масс. водного раствора гидроксипропилцеллюлозы (Nippon Soda Co., Ltd; HPC-SL; то же соединение использовали в последующих примерах), чтобы получить фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению. Полученную фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению просеивали и смешивали с 4 г тонко размолотого ВНТ и 30 г стеарата магния, и смесь формовали в таблетки, применяя роторную машину для таблетирования, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 300 мг. Полученные таблетки опрыскивали покровным составом водной дисперсии средства для нанесения пленки, применяя устройство HiCoater, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 309 мг.
Пример 10
В аппарат для гранулирования в псевдоожиженном слое GPCG-5 загружали 1500 г измельченного соединения А, 1050 г полиэтиленоксида, 1764 г полиэтиленгликоля и 135 г гидроксипропилцеллюлозы (HPC-SL), и гранулировали с очищенной водой, чтобы получить фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению. Полученную фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению просеивали и смешивали с 4 г тонко размолотого ВНТ и 30 г стеарата магния, и смесь формовали в таблетки, применяя роторную машину для таблетирования, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 300 мг. Полученные таблетки опрыскивали покровным составом водной дисперсии средства для нанесения пленки, применяя устройство HiCoater, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 309 мг.
Пример 11
После того как отвешивали 400 г соединения А, 100 г полиэтиленоксида, 290 г полиэтиленгликоля, 2 г тонко размолотого ВНТ и 8 г стеарата магния, данные соединения смешивали, используя миксер. Данную смесь уплотняли-формовали, применяя роликовый мини-уплотнитель/Roller Compactor Mini и просеивали, чтобы получить фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению. Полученные гранулы формовали в таблетки, применяя роторную машину для таблетирования, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 12
В ступке основательно смешивали 10 г соединения А, 2,5 г полиэтиленоксида (Dow Chemical; название продукта: WSR коагулянт) и 12,5 г полиэтиленгликоля. Данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 400 мг.
Пример 13
В ступке основательно смешивали 10 г соединения А, 0,5 г полиэтиленоксида (Dow Chemical; название продукта: WSR 301) и 5 г полиэтиленгликоля. Данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 310 мг.
Пример 14
В ступке основательно смешивали 5 г соединения А, 15 г полиэтиленоксида и 5 г полиэтиленгликоля. Данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 250 мг.
Пример 15
В ступке основательно смешивали 10 г соединения А, 10 г полиэтиленоксида (Dow Chemical; название продукта: WSR N-12K) и 5 г D-маннита (Towa Chemical Industry Co., Ltd; название продукта: маннит Р). Данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 500 мг.
Пример 16
В ступке основательно смешивали 2 г соединения А, 2 г полиэтиленоксида и 10 г полиэтиленгликоля. Данную смесь формовали в таблетки, используя автограф, чтобы получить фармацевтическую композицию для модифицированного высвобождения по данному изобретению, имеющую массу таблетки в 350 мг.
Пример 17
В аппарат для гранулирования в псевдоожиженном слое GPCG-5 загружали 400 г измельченного соединения А, 1120 г полиэтиленоксида и 2313,6 г полиэтиленгликоля и гранулировали с 1200 г 10% масс. водного раствора гидроксипропилцеллюлозы, чтобы получить фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению. Полученную фармацевтическую композицию для модифицированного высвобождения (гранулы) по данному изобретению просеивали и смешивали с 6,4 г тонко размолотого ВНТ и 40 г стеарата магния, и смесь формовали в таблетки, применяя роторную машину для таблетирования, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 250 мг. Полученные таблетки опрыскивали покровным составом водной дисперсии средства для нанесения пленки (содержащего желтый оксид железа(III) и красный оксид железа(III) в качестве стабилизаторов), применяя устройство HiCoater, чтобы получить фармацевтическую композицию для модифицированного высвобождения (таблетки) по данному изобретению, имеющую массу таблетки в 257,5 мг.
Препараты в примерах 1-17 показаны в таблицах 1-3.
| Таблица 1 | ||||||
| Примеры | 1 | 2 | 3 | 4 | 5 | 6 |
| Соединение А (г) | 10 | 10 | 10 | 10 | 10 | 10 |
| PEO WSR N-60K (г) | 2,5 | 3,5 | 6,25 | - | - | - |
| НРМС 90SH-4000SR (г) | - | - | - | 5 | - | - |
| НРМС 90SH-100000SR (г) | - | - | - | - | 5 | - |
| НРМС 90SH-100SR (г) | - | - | - | - | - | 7,5 |
| PEG (г) | 7,5 | 6,5 | 5 | 5 | 5 | 2,5 |
| Таблица 2 | |||||
| Примеры | 7 | 8 | 9 | 10 | 11 |
| Соединение А (г) | 400 | 400 | 1500 | 1500 | 400 |
| РЕО WSR N-60K (г) | 140 | 140 | 1050 | 1050 | 100 |
| PEG (г) | 251,2 | 251,2 | 1764 | 1764 | 290 |
| HPC-SL (г) | - | - | 135 | 135 | - |
| Магния стеарат (г) | 8 | 8 | 30 | 30 | 8 |
| ВНТ (г) | 0,8 | 0,8 | 4 | 4 | 2 |
| Средство для пленочного покрытия (г) | - | 23,7 | 134 | 134 | - |
| Таблица 3 | ||||||
| Примеры | 12 | 13 | 14 | 15 | 16 | 17 |
| Соединение А (г) | 10 | 10 | 5 | 10 | 2 | 400 |
| РЕО WSR N-60K (г) | - | - | 15 | - | 2 | 1120 |
| РЕО WSR коагулянт (г) | 2,5 | - | - | - | - | - |
| РЕО WSR 301 (г) | - | 0,5 | - | - | - | - |
| РЕО WSR N-12K (г) | - | - | - | 10 | - | - |
| PEG (г) | 12,5 | 5 | 5 | - | 10 | 2313,6 |
| D-маннит | - | - | - | 5 | - | - |
| HPC-SL (г) | - | - | - | - | - | 120 |
| Магния стеарат (г) | - | - | - | - | - | 40 |
| ВНТ (г) | - | - | - | - | - | 6,4 |
| Средство для пленочного покрытия (г) | - | - | - | - | - | 120 |
Сравнительный пример 1
После того как 400 г размельченного соединения А смешивали с 1200 г D-маннита, добавляли еще 320 г очищенной воды, и все содержимое замешивали, используя гранулятор для перемешивания (Powrex Corporation; VG-25). Полученный агрегат просеивали через сито, имеющее отверстия в 850 мкм и сушили, используя аппарат для гранулирования в псевдоожиженном слое (Freund Corporation; FLO-1). Высушенные продукты просеивали через сито, имеющее отверстия в 500 мкм, и загружали в капсулы № 1 с содержанием 320 мг на капсулу, чтобы получить фармацевтическую композицию для сравнения, содержащую 80 мг соединения А.
Экспериментальные примеры
1.Тест на растворение
Фармацевтические композиции, приготовленные в примерах 2, 8 и 9, подвергали оценке на растворение, выполненной в соответствии с UPS-тестом на растворение (метод с использованием лопастной мешалки). В качестве тест-жидкости использовали 900 мл фосфатного буфера (рН 6,8). Фармацевтическую композицию, приготовленную в сравнительном примере 1, оценивали в соответствии с тестом на растворение, методом 2, описанным в японской фармакопее. В качестве тест-жидкости использовали 900 мл буферный раствор Мас-Илвейна (рН 6,8), и скорость вращения лопастной мешалки составляла 50 об/мин.
Результаты показаны в таблице 4. Скорость растворения фармацевтической композиции для модифицированного высвобождения спустя 1,5 часа, приготовленной в каждом примере, была меньше чем 40%. В противоположность этому, композиция, приготовленная в сравнительном примере, показала высокую скорость растворения в 85% или больше после 0,5 часа.
| Таблица 4 | ||||
| Пример 2 | Пример 8 | Пример 9 | Сравнительный пример 1 | |
| 0,5 ч | - | - | - | 95% |
| 1,5 ч | 35% | 39% | 32% | - |
| 2,5 ч | 57% | 61% | 54% | - |
| 4,5 ч | 93% | 95% | 92% | - |
2. Тест на устойчивость
Пластмассовые емкости заполняли фармацевтической композицией для модифицированного высвобождения, приготовленной в примере 11, и закупоривали. Данные емкости сохраняли в условиях при 40°С и 75% ОВ/RH или при 60°С в течение 3 месяцев. После хранения каждая фармацевтическая композиция была объектом для теста на растворение, проведенного в соответствии с USP-тестом на растворение (метод с использованием лопастной мешалки). В качестве тест-жидкости использовали 900 мл фосфатного буфера (рН 6,8). Результаты показаны на фигуре 1. Ускорение в степени растворения не наблюдали после хранения в течение 3 месяцев в условиях при 40°С и 75% ОВ/RH или при 60°С, и данные результаты указали, что фармацевтическая композиция была устойчивой.
Фармацевтические композиции для модифицированного высвобождения, приготовленные в примерах 8 и 9, упаковывали посредством алюминий/алюминиевого блистера и сохраняли в условиях при 40°С и 75% ОВ/RH или при 60°С в течение 6 месяцев. После хранения каждая фармацевтическая композиция была объектом для теста на растворение, проведенного в соответствии с USP-тестом на растворение (метод с использованием лопастной мешалки). В качестве тест-жидкости использовали 900 мл фосфатного буфера (рН 6,8). В результате этого, изменения в степени растворения в точке, показывающей степень растворения приблизительно в 50%, составляли 2% и 3%, по отношению к фармацевтическим композициям, приготовленным в примерах 8 и 9, соответственно, и результаты указали, что фармацевтические композиции были устойчивыми.
Фармацевтическую композицию для модифицированного высвобождения, приготовленную в примере 17, подвергали воздействию света в 1,2 миллион люкс·ч. После экспозиции фармацевтическая композиция была объектом для теста на растворение, проведенного в соответствии с USP-тестом на растворение (метод с использованием лопастной мешалки). В качестве тест-жидкости использовали 900 мл фосфатного буфера (рН 6,8). В результате этого изменение в степени растворения в точке, показывающей степень растворения приблизительно в 50%, составляло меньше чем 1% и результат указал, что фармацевтическая композиция была устойчивой.
3. Фармакокинетический (РК) тест на человеке
Фармацевтическую композицию для модифицированного высвобождения, приготовленную в примере 8, которая содержала эквивалент, соответствующий 200 мг соединения А, вводили здоровым людям в состоянии намеренного голодания или спустя 30 минут после потребления пищи, и измеряли уровни лекарственного средства в крови.
Для сравнения, 2 капсулы фармацевтической композиции (обычный препарат), приготовленной в сравнительном примере 1, которая содержала эквивалент, соответствующий 160 мг соединения А, вводили здоровым людям в состоянии намеренного голодания или спустя 30 минут после потребления пищи, и измеряли уровни лекарственного средства в крови.
Что касается обычного препарата, степень снижения Сmax в состоянии потребления пищи составляла 67% по сравнению с аналогичной величиной в состоянии намеренного голодания, и степень уменьшения AUC составляла 47% (Сmax в состоянии намеренного голодания была приблизительно в три раза выше, чем эта величина в состоянии потребления пищи). Что касается фармацевтической композиции для модифицированного высвобождения по данному изобретению, степень снижения Сmax без потребления пищи была 42% по сравнению с аналогичной величиной в состоянии намеренного голодания, и степень уменьшения AUC составляла 25%. Данные результаты указывали, что снижения Cmax и AUC, вызванные потреблением пищи, могли быть значительно уменьшены фармацевтической композицией для модифицированного высвобождения по данному изобретению.
Промышленная применимость
Согласно данному изобретению, может быть предложена фармацевтическая композиция для модифицированного высвобождения, при котором изменения в AUC и Cmax, вызываемые потреблением пищи, могут быть снижены контролированием скорости высвобождения активного ингредиента.
Как приведено выше, данное изобретение было рассмотрено с указанием определенных вариантов осуществления, но модификации и усовершенствования, очевидные для специалистов в данной области, включены в охват данного изобретения.
Claims (23)
1. Фармацевтическая композиция для модифицированного высвобождения, содержащая (1) анилид (R)-2-(2-аминотиазол-4-ил)-4'- [2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемую соль, (2) по меньшей мере, одну добавку, которая обеспечивает проникновение воды в фармацевтическую композицию и которая имеет растворимость, такую что объем воды, требуемой для растворения 1 г добавки, равен 10 мл или меньше, и (3) гидрогель-образующий полимер, имеющий среднюю молекулярную массу приблизительно 100000 или более, или вязкость 12 мПа·с или более в 5% водном растворе при 25°С.
2. Фармацевтическая композиция для модифицированного высвобождения по п.1, в которой добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, D-сорбита, ксилита, лактозы, сахарозы, безводной мальтозы, D-фруктозы, декстрана, глюкозы, полиоксиэтилен гидрированного касторового масла, полиоксиэтилен полиоксипропиленгликоля, сложного эфира высшей жирной кислоты и полиоксиэтиленсорбитана, хлорида натрия, хлорида магния, лимонной кислоты, винной кислоты, глицина, β-аланина, гидрохлорида лизина и меглумина.
3. Фармацевтическая композиция для модифицированного высвобождения по п.2, в которой добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, лактозы, сахарозы, хлорида натрия и полиоксиэтилен полиоксипропиленгликоля.
4. Фармацевтическая композиция для модифицированного высвобождения по п.1, в которой количество добавки, которая обеспечивает проникновение воды в фармацевтическую композицию, составляет от 5 мас.% до 75 мас.% по отношению к общей массе фармацевтической композиции.
5. Фармацевтическая композиция для модифицированного высвобождения по п.4, в которой количество добавки, которая обеспечивает проникновение воды в фармацевтическую композицию, составляет от 5 мас.% до 70 мас.% по отношению к общей массе фармацевтической композиции.
6. Фармацевтическая композиция для модифицированного высвобождения по п.1, в которой гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, натрий карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы и карбоксивинильного полимера.
7. Фармацевтическая композиция для модифицированного высвобождения по п.6, в которой гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы и гидроксипропилцеллюлозы.
8. Фармацевтическая композиция для модифицированного высвобождения по п.1, в которой количество гидрогель-образующего полимера составляет от 1 мас.% до 70 мас.% по отношению к общей массе фармацевтической композиции.
9. Фармацевтическая композиция для модифицированного высвобождения по п.1, дополнительно содержащая антиоксидант.
10. Фармацевтическая композиция для модифицированного высвобождения по п.9, в которой антиоксидант представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из бутилгидрокситолуола, пропилгаллата и аскорбата натрия.
11. Фармацевтическая композиция для модифицированного высвобождения по п.10, в которой антиоксидант представляет собой бутилгидрокситолуол.
12. Фармацевтическая композиция для модифицированного высвобождения по п.9, в которой количество гидрогель-образующего полимера составляет от 0,025 мас.% до 0,25 мас.%.
13. Фармацевтическая композиция для модифицированного высвобождения по п.1, дополнительно содержащая стабилизатор.
14. Фармацевтическая композиция для модифицированного высвобождения по п.13, в которой стабилизатор представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из желтого оксида железа(III), красного оксида железа(III), черного оксида железа.
15. Фармацевтическая композиция для модифицированного высвобождения по п.14, в которой стабилизатор представляет собой желтый оксид железа(III) и/или красный оксид железа(III).
16. Фармацевтическая композиция для модифицированного высвобождения по п.13, в которой количество стабилизатора составляет от 0,05 мас.% до 1 мас.%.
17. Фармацевтическая композиция для модифицированного высвобождения по п.1, в которой средний молекулярный вес гидрогель-образующего полимера от 100000 до 8000000.
18. Фармацевтическая композиция для модифицированного высвобождения по п.1, отличающаяся тем, что вязкость гидрогель-образующего полимера составляет 400 мПа·с или более в 2% водном растворе при 25°С и 7500 мПа·с или менее в 1% водном растворе при 25°С.
19. Способ получения фармацевтической композиции для модифицированного высвобождения, отличающийся тем, что включает смешивание (1) анилида (R)-2-(2-аминотиазол-4-ил)-4'-[2-[(2-гидрокси-2-фенилэтил)амино]этил]уксусной кислоты или его фармацевтически приемлемой соли с (2) по меньшей мере, одной добавкой, которая обеспечивает проникновение воды в фармацевтическую композицию и которая имеет растворимость, такую что объем воды, требуемой для растворения 1 г добавки, равен 10 мл или меньше, и (3) гидрогель-образующим полимером, имеющим среднюю молекулярную массу приблизительно 100000 или более, или вязкость в 12 мПа·с или более в 5% водном растворе при 25°С, где количество добавки составляет от 5 мас.% до 75 мас.% по отношению к общей массе фармацевтической композиции, и количество гидрогель-образующего полимера составляет от 1 мас.% до 70 мас.% по отношению к общей массе фармацевтической композиции.
20. Способ по п.19, в котором добавка, которая обеспечивает проникновение воды в фармацевтическую композицию, представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленгликоля, поливинилпирролидона, D-маннита, D-сорбита, ксилита, лактозы, сахарозы, безводной мальтозы, D-фруктозы, декстрана, глюкозы, полиоксиэтилен гидрированного касторового масла, полиоксиэтилен полиоксипропиленгликоля, сложного эфира высшей жирной кислоты и полиоксиэтиленсорбитана, хлорида натрия, хлорида магния, лимонной кислоты, винной кислоты, глицина, β-аланина, гидрохлорида лизина и меглумина.
21. Способ по п.19 или 20, в котором гидрогель-образующий полимер представляет собой одно соединение или два или более соединений, выбираемых из группы, состоящей из полиэтиленоксида, гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозы, натрий карбоксиметилцеллюлозы, гидроксиэтилцеллюлозы и карбоксивинильного полимера.
22. Способ по п.19, в котором средний молекулярный вес гидрогель-образующего полимера от 100000 до 8000000.
23. Способ по п.19, в котором вязкость гидрогель-образующего полимера составляет 400 мПа·с или более в 2% водном растворе при 25°С и 7500 мПа·с или менее в 1% водном растворе при 25°С.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10133808P | 2008-09-30 | 2008-09-30 | |
| US61/101,338 | 2008-09-30 | ||
| PCT/JP2009/066742 WO2010038690A1 (ja) | 2008-09-30 | 2009-09-28 | 放出制御医薬組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2011117274A RU2011117274A (ru) | 2012-11-10 |
| RU2495666C2 true RU2495666C2 (ru) | 2013-10-20 |
Family
ID=42073454
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2011117274/15A RU2495666C2 (ru) | 2008-09-30 | 2009-09-28 | Фармацевтическая композиция для модифицированного высвобождения |
Country Status (24)
| Country | Link |
|---|---|
| US (4) | US20160184275A2 (ru) |
| EP (2) | EP3827826A1 (ru) |
| JP (2) | JP4688089B2 (ru) |
| KR (1) | KR101524164B1 (ru) |
| CN (2) | CN102170878A (ru) |
| AU (1) | AU2009300752C1 (ru) |
| BR (1) | BRPI0919466B1 (ru) |
| CA (1) | CA2740342C (ru) |
| CY (1) | CY1123724T1 (ru) |
| DK (1) | DK2345410T3 (ru) |
| ES (1) | ES2847876T3 (ru) |
| HK (1) | HK1216232A1 (ru) |
| HR (1) | HRP20210179T1 (ru) |
| HU (1) | HUE052874T2 (ru) |
| IL (1) | IL212033A (ru) |
| LT (1) | LT2345410T (ru) |
| MX (1) | MX351855B (ru) |
| PL (1) | PL2345410T3 (ru) |
| PT (1) | PT2345410T (ru) |
| RU (1) | RU2495666C2 (ru) |
| SI (1) | SI2345410T1 (ru) |
| TW (1) | TWI478712B (ru) |
| WO (1) | WO2010038690A1 (ru) |
| ZA (1) | ZA201102406B (ru) |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2179829T3 (es) * | 1992-09-18 | 2003-02-01 | Yamanouchi Pharma Co Ltd | Preparacion de hidrogel de liberacion prolongada. |
| TWI478712B (zh) | 2008-09-30 | 2015-04-01 | Astellas Pharma Inc | 釋控性醫藥組成物 |
| US20120070465A1 (en) | 2010-03-29 | 2012-03-22 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
| US8877214B2 (en) * | 2010-03-29 | 2014-11-04 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
| CN103189053A (zh) * | 2010-09-01 | 2013-07-03 | 艾尼纳制药公司 | 用于体重控制的5-ht2c激动剂的调节释放剂型 |
| UA113858C2 (uk) | 2011-10-21 | 2017-03-27 | Такеда Фармасьютікал Компані Лімітед | Лікарський засіб піоглітазону з уповільненим вивільненням |
| JPWO2013147134A1 (ja) | 2012-03-30 | 2015-12-14 | アステラス製薬株式会社 | ミラベグロン含有医薬組成物 |
| WO2013147135A1 (ja) * | 2012-03-30 | 2013-10-03 | アステラス製薬株式会社 | 放出制御医薬組成物 |
| CN104602693A (zh) * | 2012-08-31 | 2015-05-06 | 安斯泰来制药株式会社 | 口服给药用药物组合物 |
| JP2017078023A (ja) * | 2014-02-28 | 2017-04-27 | アステラス製薬株式会社 | 経口投与用医薬組成物 |
| CN104523635B (zh) * | 2014-12-23 | 2017-05-03 | 深圳万乐药业有限公司 | 米拉贝隆缓释药物组合物 |
| JP2018090490A (ja) | 2015-03-31 | 2018-06-14 | アステラス製薬株式会社 | ミラベグロン含有医薬組成物 |
| JP6618736B2 (ja) * | 2015-09-01 | 2019-12-11 | 沢井製薬株式会社 | ミラベグロン含有錠剤、ミラベグロン含有製剤の製造方法及びミラベグロン含有造粒物の製造方法 |
| US20190307696A1 (en) | 2016-04-25 | 2019-10-10 | Synthon B.V. | Tablets comprising mirabegron and solifenacin |
| US10543174B2 (en) | 2016-04-25 | 2020-01-28 | Synthon B.V. | Modified release tablet composition comprising mirabegron |
| SI3360866T1 (sl) | 2017-02-14 | 2019-04-30 | Alfred E. Tiefenbacher (Gmbh & Co. Kg) | Mirabegronska predzdravila |
| KR102051132B1 (ko) * | 2017-03-17 | 2019-12-02 | 주식회사 종근당 | 미라베그론 또는 이의 염을 포함하는 방출조절용 약제학적 조성물 |
| KR20170088783A (ko) * | 2017-07-07 | 2017-08-02 | 지엘팜텍주식회사 | 미라베그론의 습식과립 조성물 |
| KR101937713B1 (ko) * | 2017-07-14 | 2019-01-14 | 주식회사 대웅제약 | 약제학적 제제 및 그 제조방법 |
| WO2019013583A2 (ko) | 2017-07-14 | 2019-01-17 | 주식회사 대웅제약 | 약제학적 제제 및 그 제조방법 |
| US10478399B2 (en) | 2017-10-12 | 2019-11-19 | Synthon B.V. | Modified release tablet composition comprising mirabegron |
| CA3078568A1 (en) | 2017-10-12 | 2019-04-18 | Synthon B.V. | Modified release tablet composition comprising mirabegron |
| EP3292864A1 (en) | 2017-10-12 | 2018-03-14 | Synthon B.V. | Modified release tablet composition comprising mirabegron |
| KR20190089758A (ko) | 2018-01-22 | 2019-07-31 | (주)동구바이오제약 | 미라베그론 또는 이의 약제학적으로 허용가능한 염을 함유하는 지속 방출 제제 |
| KR102371567B1 (ko) | 2018-04-06 | 2022-03-07 | 한미약품 주식회사 | 미라베그론이 함유된 방출 제어 약학적 조성물 |
| KR102659760B1 (ko) | 2018-10-18 | 2024-04-23 | 한미약품 주식회사 | 미라베그론이 함유된 방출 제어 약제학적 조성물 |
| KR102062791B1 (ko) * | 2019-02-26 | 2020-01-06 | 신일제약 주식회사 | 미라베그론 또는 그의 약제학적으로 허용되는 염을 함유한 방출조절 제제 |
| KR20210001710A (ko) | 2019-06-28 | 2021-01-06 | 한미약품 주식회사 | 제어 방출형 미라베그론 제제 및 이의 제조방법 |
| WO2021153716A1 (en) * | 2020-01-31 | 2021-08-05 | Nippon Shinyaku Co., Ltd. | Controlled release composition |
| KR102546923B1 (ko) * | 2020-03-03 | 2023-06-26 | 동광제약 주식회사 | 미라베그론을 포함하는 제어 방출 제제 |
| CN113662922A (zh) * | 2020-10-29 | 2021-11-19 | 北京莱瑞森医药科技有限公司 | 一种米拉贝隆缓释组合物及其制备方法和应用 |
| CN114306262B (zh) * | 2021-12-30 | 2023-09-05 | 乐泰药业有限公司 | 米拉贝隆缓释片及其制备方法和质量检测方法 |
| EP4338729A1 (en) * | 2022-09-19 | 2024-03-20 | Sanovel Ilac Sanayi Ve Ticaret A.S. | A tablet comprising mirabegron |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1994006414A1 (en) * | 1992-09-18 | 1994-03-31 | Yamanouchi Pharmaceutical Co., Ltd. | Sustained-release hydrogel preparation |
| US20030198619A1 (en) * | 2001-12-19 | 2003-10-23 | Dong Liang C. | Formulation and dosage form for increasing oral bioavailability of hydrophilic macromolecules |
| WO2004041276A1 (ja) * | 2002-11-07 | 2004-05-21 | Yamanouchi Pharmaceutical Co., Ltd. | 酢酸アニリド誘導体を有効成分とする過活動膀胱治療剤 |
| US20050100603A1 (en) * | 2003-11-10 | 2005-05-12 | Yamanouchi Pharmaceutical Co., Ltd. | Sustained release pharmaceutical composition |
Family Cites Families (65)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8531071D0 (en) | 1985-12-17 | 1986-01-29 | Boots Co Plc | Therapeutic compound |
| JPH03145418A (ja) | 1989-10-27 | 1991-06-20 | Sumitomo Pharmaceut Co Ltd | 塩基性薬物塩酸塩の徐放性製剤 |
| GB9111426D0 (en) | 1991-05-28 | 1991-07-17 | Ici Plc | Chemical compounds |
| DE4225730C2 (de) | 1992-08-04 | 2003-04-30 | Merz Pharma Gmbh & Co Kgaa | Verfahren zur Herstellung von festen Arzneiformkörpern mit protrahierter 2-Stufen-Freisetzung |
| KR100337985B1 (ko) | 1993-06-14 | 2002-11-23 | 얀센 파마슈티카 엔.브이. | 아스테미졸및슈도에페드린의서방성필름-코팅정제 |
| US5605889A (en) | 1994-04-29 | 1997-02-25 | Pfizer Inc. | Method of administering azithromycin |
| RO114740B1 (ro) | 1994-05-06 | 1999-07-30 | Pfizer | Compozitie cu eliberare controlata, procedeu de obtinere a acesteia si metoda de tratament |
| GB9523752D0 (en) | 1995-11-21 | 1996-01-24 | Pfizer Ltd | Pharmaceutical formulations |
| WO1997049384A1 (en) | 1996-06-26 | 1997-12-31 | Board Of Regents, The University Of Texas System | Hot-melt extrudable pharmaceutical formulation |
| WO1998000016A1 (en) | 1996-07-01 | 1998-01-08 | Sepracor, Inc. | Methods and compositions for treating urinary incontinence using enantiomerically enriched (r,r)-glycopyrrolate |
| AU731391B2 (en) | 1996-08-19 | 2001-03-29 | Kissei Pharmaceutical Co. Ltd. | Drug for the prevention or treatment of pollakiuria and urinary incontinence |
| CA2302496C (en) | 1997-08-28 | 2009-12-08 | Afferon Corporation | Urinary incontinence therapy |
| US6346532B1 (en) * | 1997-10-17 | 2002-02-12 | Yamanouchi Pharmaceutical Co., Ltd. | Amide derivatives or salts thereof |
| DE69818516T2 (de) | 1997-12-18 | 2004-07-08 | Kissei Pharmaceutical Co., Ltd., Matsumoto | Phenylaminoalkylcarbonsäure-derivate und medizinische zusammensetzungen, die diese enthalten |
| US6099859A (en) | 1998-03-20 | 2000-08-08 | Andrx Pharmaceuticals, Inc. | Controlled release oral tablet having a unitary core |
| ATE275126T1 (de) | 1998-04-14 | 2004-09-15 | Kissei Pharmaceutical | 2-methylpropionsäure-derivate und sie enthaltende medizinische zubereitungen |
| US6541669B1 (en) | 1998-06-08 | 2003-04-01 | Theravance, Inc. | β2-adrenergic receptor agonists |
| GB9812709D0 (en) | 1998-06-13 | 1998-08-12 | Glaxo Group Ltd | Chemical compounds |
| MY126489A (en) | 1998-07-08 | 2006-10-31 | Kissei Pharmaceutical | Phenoxyacetic acid derivatives and medicinal compositions containing the same |
| DE19842753A1 (de) | 1998-09-18 | 2000-03-23 | Bayer Ag | Agitationsunabhängige pharmazeutische Retardzubereitungen und Verfahren zu ihrer Herstellung |
| US6562375B1 (en) | 1999-08-04 | 2003-05-13 | Yamanouchi Pharmaceuticals, Co., Ltd. | Stable pharmaceutical composition for oral use |
| ES2262528T3 (es) | 1999-08-04 | 2006-12-01 | Astellas Pharma Inc. | Composiciones medicinales estables para administracion oral que utilizan oxidos de hierro. |
| GB2356197A (en) | 1999-10-12 | 2001-05-16 | Merck & Co Inc | Amide derivatives as beta 3 agonists |
| JP2001114736A (ja) | 1999-10-19 | 2001-04-24 | Kissei Pharmaceut Co Ltd | 2−アミノプロパノール誘導体 |
| US8012504B2 (en) | 2000-04-28 | 2011-09-06 | Reckitt Benckiser Inc. | Sustained release of guaifenesin combination drugs |
| US6419954B1 (en) | 2000-05-19 | 2002-07-16 | Yamanouchi Pharmaceutical Co., Ltd. | Tablets and methods for modified release of hydrophilic and other active agents |
| US6368628B1 (en) | 2000-05-26 | 2002-04-09 | Pharma Pass Llc | Sustained release pharmaceutical composition free of food effect |
| AUPQ841300A0 (en) | 2000-06-27 | 2000-07-20 | Fujisawa Pharmaceutical Co., Ltd. | New aminoalcohol derivatives |
| US6451814B1 (en) | 2000-07-17 | 2002-09-17 | Wyeth | Heterocyclic β-3 adrenergic receptor agonists |
| KR20030044013A (ko) | 2000-10-20 | 2003-06-02 | 화이자 프로덕츠 인코포레이티드 | 알파-아릴 에탄올아민 및 이들의 베타-3 아드레날린성수용체 작용제로서의 용도 |
| AR035605A1 (es) | 2000-12-11 | 2004-06-16 | Bayer Corp | Derivados de aminometil cromano di-sustituidos, un metodo para su preparacion, composiciones farmaceuticas y el uso de dichos derivados para la manufactura de medicamentos utiles como agonistas beta-3-adreno-receptores |
| GB0117618D0 (en) | 2001-07-19 | 2001-09-12 | Phoqus Ltd | Pharmaceutical dosage form |
| US20030072802A1 (en) | 2001-10-11 | 2003-04-17 | R.T. Alamo Ventures, Inc. | Sustained release topiramate |
| US7342117B2 (en) | 2001-10-30 | 2008-03-11 | Astellas Pharma Inc. | α-form or β-form crystal of acetanilide derivative |
| ZA200403281B (en) | 2001-11-07 | 2005-12-13 | Synthon Bv | Tamsulosin tablets. |
| US6864268B2 (en) | 2002-02-27 | 2005-03-08 | Pfizer Inc. | β3 adrenergic receptor agonists |
| EP1503732B1 (en) | 2002-04-29 | 2008-10-08 | Alza Corporation | Reduced formate poly(alkylene oxides) with reboxetine for reducing impurity formation |
| JP2006506378A (ja) | 2002-10-24 | 2006-02-23 | メルツ・ファルマ・ゲゼルシヤフト・ミト・ベシュレンクテル・ハフツング・ウント・コンパニー・コマンデイトゲゼルシヤフト・アウフ・アクティーン | 1−アミノシクロヘキサン誘導体及びアセチルコリンエステラーゼ阻害薬を用いる併用療法 |
| EP1424079A1 (en) | 2002-11-27 | 2004-06-02 | Boehringer Ingelheim International GmbH | Combination of a beta-3-receptor agonist and of a reuptake inhibitor of serotonin and/or norepinephrine |
| US7442387B2 (en) * | 2003-03-06 | 2008-10-28 | Astellas Pharma Inc. | Pharmaceutical composition for controlled release of active substances and manufacturing method thereof |
| JP2006520799A (ja) | 2003-03-21 | 2006-09-14 | ダイノジェン ファーマシューティカルズ, インコーポレイテッド | 平滑筋調節因子およびα2δサブユニットカルシウムチャネル調節因子を用いた、下部尿路障害を処置するための方法 |
| DK1631251T3 (da) | 2003-04-24 | 2011-10-03 | Jagotec Ag | Tablet til forsinket frigørelse med defineret kernegeometri |
| US20050042289A1 (en) | 2003-04-29 | 2005-02-24 | Yamanouchi Pharma Technologies, Inc. | Tablets and methods for modified release of hydrophylic and other active agents |
| EP1663216B1 (en) | 2003-08-29 | 2011-11-02 | Veloxis Pharmaceuticals A/S | Modified release compositions comprising tacrolimus |
| DE10352132A1 (de) | 2003-11-04 | 2005-06-09 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Pharmazeutische Zusammensetzung aus einem Beta-3-Adrenozeptor-Agonisten und einem Alpha Agonisten |
| DK2210605T3 (en) | 2003-11-04 | 2017-05-22 | Tcd Royalty Sub Llc | Daily single dose doses of trospium. |
| JP2005162737A (ja) | 2003-11-10 | 2005-06-23 | Astellas Pharma Inc | 徐放性医薬組成物 |
| JP2005162736A (ja) | 2003-11-10 | 2005-06-23 | Astellas Pharma Inc | 徐放性医薬組成物 |
| US8197846B2 (en) | 2003-11-10 | 2012-06-12 | Astellas Pharma Inc. | Sustained release pharmaceutical composition |
| US7387793B2 (en) | 2003-11-14 | 2008-06-17 | Eurand, Inc. | Modified release dosage forms of skeletal muscle relaxants |
| DK1753395T3 (da) | 2004-05-24 | 2010-11-08 | Warner Chilcott Co Llc | Enterisk, fast, oral doseringsform af et bisphosphonat, der indeholder et chelateringsmiddel |
| MXPA06014587A (es) | 2004-06-17 | 2007-04-27 | Forest Laboratories | Formulaciones de liberacion modificada de formulaciones de dosificacion oral de memantina. |
| US20050287185A1 (en) | 2004-06-23 | 2005-12-29 | David Wong | Extended release oxybutynin formulation |
| ATE451925T1 (de) | 2004-10-06 | 2010-01-15 | Eisai R&D Man Co Ltd | Medizinische zusammensetzung, verfahren zu ihrer herstellung und verfahren zur stabilisierung einer dihydropyridin-verbindung in einer medizinischen zusammensetzung |
| DE102004062475A1 (de) | 2004-12-24 | 2006-07-06 | Bayer Healthcare Ag | Feste, oral applizierbare pharmazeutische Darreichungsformen mit modifizierter Freisetzung |
| JP2008532953A (ja) | 2005-03-08 | 2008-08-21 | ライフサイクル ファーマ エー/エス | シロリムスおよび/またはその類縁物質を含む医薬組成物 |
| EP1769792A1 (de) | 2005-09-30 | 2007-04-04 | Boehringer Ingelheim Pharma GmbH & Co.KG | Verwendung eines beta-3-Adrenozeptor-Agonisten zur Behandlung von Nieren- und Blasenbeschwerden |
| WO2007080776A1 (ja) | 2006-01-10 | 2007-07-19 | Kissei Pharmaceutical Co., Ltd. | 徐放性製剤およびその製造方法 |
| WO2008084698A1 (ja) * | 2006-12-28 | 2008-07-17 | Astellas Pharma Inc. | タクロリムス徐放性医薬組成物 |
| US8871275B2 (en) | 2007-08-08 | 2014-10-28 | Inventia Healthcare Private Limited | Extended release compositions comprising tolterodine |
| WO2009052353A2 (en) | 2007-10-17 | 2009-04-23 | Dr. Reddy's Laboratories Ltd. | Trospium pharmaceutical formulations |
| TWI478712B (zh) | 2008-09-30 | 2015-04-01 | Astellas Pharma Inc | 釋控性醫藥組成物 |
| US8877214B2 (en) | 2010-03-29 | 2014-11-04 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
| US20120070465A1 (en) | 2010-03-29 | 2012-03-22 | Astellas Pharma Inc. | Pharmaceutical composition for modified release |
| CN103229162B (zh) | 2010-09-28 | 2016-08-10 | 国际商业机器公司 | 使用候选答案逻辑综合提供问题答案 |
-
2009
- 2009-09-25 TW TW098132502A patent/TWI478712B/zh active
- 2009-09-28 LT LTEP09817723.1T patent/LT2345410T/lt unknown
- 2009-09-28 JP JP2010531838A patent/JP4688089B2/ja active Active
- 2009-09-28 AU AU2009300752A patent/AU2009300752C1/en active Active
- 2009-09-28 PL PL09817723T patent/PL2345410T3/pl unknown
- 2009-09-28 EP EP20212426.9A patent/EP3827826A1/en active Pending
- 2009-09-28 RU RU2011117274/15A patent/RU2495666C2/ru active
- 2009-09-28 DK DK09817723.1T patent/DK2345410T3/da active
- 2009-09-28 ES ES09817723T patent/ES2847876T3/es active Active
- 2009-09-28 CA CA2740342A patent/CA2740342C/en active Active
- 2009-09-28 CN CN2009801386919A patent/CN102170878A/zh active Pending
- 2009-09-28 PT PT98177231T patent/PT2345410T/pt unknown
- 2009-09-28 EP EP09817723.1A patent/EP2345410B1/en active Active
- 2009-09-28 HU HUE09817723A patent/HUE052874T2/hu unknown
- 2009-09-28 MX MX2011003445A patent/MX351855B/es active IP Right Grant
- 2009-09-28 CN CN201510642287.2A patent/CN105232448A/zh active Pending
- 2009-09-28 US US12/568,313 patent/US20160184275A2/en not_active Abandoned
- 2009-09-28 BR BRPI0919466-5A patent/BRPI0919466B1/pt not_active IP Right Cessation
- 2009-09-28 WO PCT/JP2009/066742 patent/WO2010038690A1/ja active Application Filing
- 2009-09-28 SI SI200932110T patent/SI2345410T1/sl unknown
- 2009-09-28 KR KR1020117009897A patent/KR101524164B1/ko active IP Right Review Request
-
2010
- 2010-12-13 JP JP2010276634A patent/JP5625855B2/ja active Active
-
2011
- 2011-03-30 IL IL212033A patent/IL212033A/en active IP Right Grant
- 2011-03-31 ZA ZA2011/02406A patent/ZA201102406B/en unknown
-
2016
- 2016-04-13 HK HK16104217.1A patent/HK1216232A1/zh unknown
-
2017
- 2017-02-14 US US15/432,854 patent/US10842780B2/en active Active
-
2020
- 2020-11-19 US US16/952,795 patent/US20210322387A1/en not_active Abandoned
-
2021
- 2021-01-18 CY CY20211100034T patent/CY1123724T1/el unknown
- 2021-02-02 HR HRP20210179TT patent/HRP20210179T1/hr unknown
-
2024
- 2024-03-22 US US18/613,270 patent/US12059409B1/en active Active
Patent Citations (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1994006414A1 (en) * | 1992-09-18 | 1994-03-31 | Yamanouchi Pharmaceutical Co., Ltd. | Sustained-release hydrogel preparation |
| US6436441B1 (en) * | 1992-09-18 | 2002-08-20 | Yamanouchi Pharmaceutical Co., Ltd. | Hydrogel-forming sustained-release preparation |
| US20030198619A1 (en) * | 2001-12-19 | 2003-10-23 | Dong Liang C. | Formulation and dosage form for increasing oral bioavailability of hydrophilic macromolecules |
| WO2004041276A1 (ja) * | 2002-11-07 | 2004-05-21 | Yamanouchi Pharmaceutical Co., Ltd. | 酢酸アニリド誘導体を有効成分とする過活動膀胱治療剤 |
| EP1559427A1 (en) * | 2002-11-07 | 2005-08-03 | Yamanouchi Pharmaceutical Co. Ltd. | Remedy for overactive bladder comprising acetic acid anilide derivative as the active ingredient |
| US20060115540A1 (en) * | 2002-11-07 | 2006-06-01 | Toshiyuki Takasu | Remedy for overactive bladder comprising acetic acid anilide derivative as the active ingredient |
| US20050100603A1 (en) * | 2003-11-10 | 2005-05-12 | Yamanouchi Pharmaceutical Co., Ltd. | Sustained release pharmaceutical composition |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US12059409B1 (en) | Pharmaceutical composition for modified release | |
| EP2422783B1 (en) | Pharmaceutical Composition | |
| CA2813781C (en) | Pharmaceutical compositions containing a dgat1 inhibitor | |
| EP2891493A1 (en) | Orally administered medical composition | |
| RU2580652C2 (ru) | Фармацевтическая композиция для орального введения | |
| AU2006216856A1 (en) | A solid pharmaceutical dosage formulation | |
| EP2832730A1 (en) | Mirabegron-containing pharmaceutical composition | |
| CA3224531A1 (en) | A pharmaceutical composition comprising combination of sitagliptin and empagliflozin | |
| WO2023012817A1 (en) | A pharmaceutical composition comprising combination of dapagliflozin and sitagliptin |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| TK4A | Correction to the publication in the bulletin (patent) |
Free format text: AMENDMENT TO CHAPTER -FG4A- IN JOURNAL: 29-2013 FOR TAG: (57) |
|
| RZ4A | Other changes in the information about an invention |