RU2195332C2 - Способ и устройство для использования опосредованной электропорообразованием доставки лекарственных препаратов и генов - Google Patents
Способ и устройство для использования опосредованной электропорообразованием доставки лекарственных препаратов и генов Download PDFInfo
- Publication number
- RU2195332C2 RU2195332C2 RU99109111/14A RU99109111A RU2195332C2 RU 2195332 C2 RU2195332 C2 RU 2195332C2 RU 99109111/14 A RU99109111/14 A RU 99109111/14A RU 99109111 A RU99109111 A RU 99109111A RU 2195332 C2 RU2195332 C2 RU 2195332C2
- Authority
- RU
- Russia
- Prior art keywords
- electrode
- applicator
- needles
- therapy
- tissue
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/327—Applying electric currents by contact electrodes alternating or intermittent currents for enhancing the absorption properties of tissue, e.g. by electroporation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/05—Electrodes for implantation or insertion into the body, e.g. heart electrode
- A61N1/0502—Skin piercing electrodes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/32—Applying electric currents by contact electrodes alternating or intermittent currents
- A61N1/325—Applying electric currents by contact electrodes alternating or intermittent currents for iontophoresis, i.e. transfer of media in ionic state by an electromotoric force into the body
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Radiology & Medical Imaging (AREA)
- Engineering & Computer Science (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Biophysics (AREA)
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Electrotherapy Devices (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Изобретение относится к области медицины. Способ и устройство предназначены для электропорообразующей терапии. С использованием электропорообразующей терапии (ЭПТ) и химиотерапевтического средства была вызвана регрессия опухолей in vivo. В одном варианте реализации способ представляет ЭПТ с использованием низкого напряжения и большой длительности импульса для индуцирования гибели клеток. В одном варианте устройство для клинического электропорообразования включает электрод в виде группы иголок, который определяет заданную величину напряжения импульса лечения. Ряд конструкций электродного аппликатора обеспечивает возможность доступа и лечения разных участков ткани. Другой вариант реализации предоставляет лапароскопический игольный аппликатор, который предпочтительно комбинируется с эндоскопом для минимально инвазивной ЭПТ. Способ и устройство позволяют увеличить прочищаемость клетки при доставке фармацевтических соединений и генов. 14 с. и 54 з. п. ф-лы, 17 ил., 9 табл.
Description
Изобретение относится в целом к использованию электрических импульсов для увеличения проницаемости клетки, а более конкретно к способу и устройству для применения контролируемых электрических полей для доставки in vivo фармацевтических соединений и генов в клетки с помощью электропорообразующей терапии (ЭПТ), известной так же, как терапия с клеточным порообразованием (ТКП) и электрохимиотерапия (ЭХТ).
В 1970-е гг. было обнаружено, что электрические поля могут использоваться для создания пор в клетках, не вызывая постоянного повреждения. Это открытие обеспечило возможность введения крупных молекул в клеточную цитоплазму. Известно, что гены и другие молекулы, такие как фармакологические соединения, могут включаться в живые клетки посредством процесса, известного как электропорообразование. Гены или другие молекулы смешиваются с живыми клетками в буферной среде, и подаются короткие импульсы сильных электрических полей. Клеточные мембраны временно становятся пористыми, и гены или молекулы поступают в клетки, где они могут изменить геном клетки.
Электропорообразование in vivo в целом ограничено тканью или клетками, которые расположены близко к коже организма, куда могут помещаться электроды. Поэтому ткань, которую иначе можно лечить путем системной доставки препаратов или химиотерапии, такая как опухоль, в целом недоступна для электродов, используемых для электропорообразования. При лечении определенных видов рака с помощью химиотерапии необходимо использовать достаточно большую дозу препарата для уничтожения раковых клеток без уничтожения неприемлемо большого количества нормальных клеток. Если бы химиотерапевтический препарат мог быть введен непосредственно в раковые клетки, эту задачу можно было бы разрешить. Некоторые противораковые препараты, например блеомицин, обычно не могут эффективно проникнуть через мембраны определенных раковых клеток. Однако электропорообразование обеспечивает возможность введения блеомицина в клетки.
Лечение обычно проводится путем инъекции противоракового препарата непосредственно в опухоль и подачей электрического поля на опухоль между парой электродов. Силу поля необходимо подбирать достаточно точно с тем, чтобы происходило электропорообразование клеток опухоли без повреждения, или, по меньшей мере, с минимальным повреждением каких-либо нормальных или здоровых клеток. Это можно обычно легко осуществить при наружных опухолях с помощью наложения электродов на противоположные стороны опухоли так, чтобы электрическое поле было между электродами. Если поле однородное, затем можно измерить расстояние между электродами и на электроды можно подать подходящее напряжение в соответствии с формулой Е=V/d (Е=сила электрического поля в В/см; V= напряжение в вольтах и d=расстояние в см). Если предполагается лечение крупных или внутренних опухолей, нелегко правильно расположить электроды и измерить расстояние между ними. Упомянутая выше основная заявка раскрывает устройство электродов для электропорообразования in vivo, в которой электроды могут вставляться в опухоль. В соответствующем патенте США 5273525 в шприце для инъекции молекул и макромолекул для электропорообразования используются иглы для инъекции, которые также функционируют в качестве электродов. Эта конструкция обеспечивает возможность размещения электродов под поверхностью.
Лечение субъекта с использованием терапии с образованием пор в клетках предоставляет средство, позволяющее избежать повреждающие воздействия, обычно связанные с введением противораковых или цитотоксических средств. Такое лечение позволило бы вводить эти средства для избирательного повреждения или уничтожения нежелательных клеток, в то же самое время избегая окружающие здоровые клетки или ткань.
Первостепенной задачей изобретения является предоставление усовершенствованного устройства, которое может быть удобно и эффективно расположено для создания заданных электрических полей в предварительно выбранной ткани.
В соответствии с первостепенным аспектом изобретения, электродное устройство для применения электропорообразования в части тела пациента включает опорный элемент, множество игольчатых электродов, установленных в выбранных положениях и на выбранных расстояниях друг от друга на указанном опорном элементе для введения в ткань, и средство, включающее генератор сигналов, реагирующий на сигнал указанного расстояния, для подачи на электроды электрического сигнала, пропорционального расстоянию между указанными электродами, для создания электрического поля заданной силы.
Изобретение включает иглы, которые предназначены для инъекции терапевтических веществ в ткань и функционируют в качестве электродов для создания электрических полей для части клеток ткани.
Один вариант реализации изобретения включает устройство для клинической электропорообразующей терапии, которое включает набор игольчатых электродов, имеющий "манипуляционный" элемент, такой как резистор или активный контур, который определяет заданное значение напряжения терапевтического импульса, а также выбираемую схему последовательности включения (устройство, имеющее это приспособление, было названо MedPulserTM). Ряд конструкций аппликатора электродов обеспечивает возможность доступа к различным участкам ткани и их лечения.
Другой вариант реализации изобретения предоставляет лапароскопический игольчатый аппликатор, который предпочтительно комбинируется с эндоскопом для минимально инвазивной электропорообразующей терапии.
Изобретение предоставляет способ лечения с использованием устройства с набором иголок для обработки клеток, в частности опухолевых клеток.
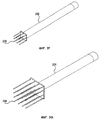
Фиг. 1 представляет собой общий вид в разрезе устройства одного варианта реализации изобретения.
Фиг.2А-2G представляют собой схематические иллюстрации нескольких альтернативных вариантов реализации электродов в соответствии с изобретением.
Фиг. 3 представляет собой блок-схему устройства для лечения в соответствии с изобретением.
Фиг. 4 представляет собой блок-схему компоновки контура устройства для лечения, изображенного на фиг.3.
Фиг. 5 представляет собой схематический чертеж элементов избирательного включения контура, показанного на фиг.4.
Фиг.6 схематически показывает предпочтительную схему расположения иголок 4 х 4, образующих 9 зон лечения в соответствии с одним вариантом реализации изобретения.
Фиг. 7А показывает последовательность импульсов для зоны лечения 2 х 2 в соответствии с одним вариантом реализации изобретения.
Фиг. 7В-7D показывают последовательность импульсов для 6-игольной схемы расположения в соответствии с одним вариантом реализации изобретения.
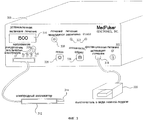
Фиг. 8 представляет собой схему устройства эндоскопического исследования предшествующего уровня техники.
Фиг. 9А-9В показывают в деталях комплект иголок в выдвинутом/отведенном назад состоянии в соответствии с изобретением.
Фиг. 10 показывает объем опухоли до 120 д. ЭПТ блеомицином у безволосых мышей с ксенотрансплантатом Рапс-3 опухоли (D=препарат; Е=электропорообразование) для венозных контрольных групп (D+E-, D-E-, D-E+) и леченой группы (D+E+).
Фиг. 11А и 11В показывают влияние ЭПТ Рапс-3 неокарциностатином соответственно для инъекции препарата перед и после импульса, до 24 д.
Фиг.12 показывает объем опухоли после 34 д. ЭПТ блеомицином у безволосых мышей с ксенотрансплантатом не мелкоклеточной карциномы легких (НМККЛ). Стрелка показывает повторное лечение одной мыши на 27 д. (П=препарат; Е= электропорообразование).
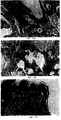
Фиг. 13А-13D показывают последовательность событий, происходящих при лечении ксенотрансплантата опухоли (а) с помощью ЭПТ. Лечение привело к образованию рубца (b), который высох и в конечном итоге отпал (с), оставив чистую зажившую область кожи (d), свободную от опухоли.
Фиг.14А-14С показывают результаты гистологического исследования образцов опухоли, проведенное через 35 д. после лечения. В группе D+E+ выявляются "тени" некротических клеток опухоли (b), в сравнении со смесью жизнеспособных и некротических клеток в группе D+E- (а). Гистологическое исследование образцов из участка опухоли через 120 д. выявляет полное отсутствие опухолевых клеток (с).
Фиг. 15А и 15В показывают выживание клеток MCF-7 (рака молочной железы) после воздействия ЭПТ соответственно с низким и высоким напряжением.
Фиг. 16А и 16В показывают выживание клеток MCF-7 после воздействия ЭПТ соответственно с низким и высоким напряжением с блеомицином.
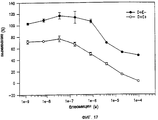
Фиг. 17 показывает эффект на клетки MCF-7 не импульсного и импульсного воздействия с различной концентрацией блеомицина и MedPulserTM.
Одинаковые ссылочные номера и обозначения на различных чертежах указывают одинаковые элементы.
Изобретение предоставляет устройство и способ для лечебного применения электропорообразования. Способ включает инъекцию химиотерапевтического средства или молекулы и введение средства или молекулы в опухоль посредством электропорообразования. В частности, средство или молекула вводится в ткань, и между "игольчатыми" электродами, расположенными в ткани, подаются импульсы напряжения, воздействуя таким образом электрическими полями на клетки ткани. Описанные ниже устройства игольчатых электродов обеспечивают in vitro и in vivo возможность расположения электродов в находящихся под поверхностью опухолях или в прилегающей к ним или другой ткани. Такое терапевтическое лечение называется электропорообразующей терапией (ЭПТ), а также называется электрохимиотерапией. Хотя следующее ниже описание сосредоточено на ЭПТ, изобретение может применяться при других видах лечения, таких как генная терапия определенных органов тела.
Общее обсуждение ЭПТ проводится в одновременно рассматриваемой заявке серии 08/537265, поданной 29 сентября 1995 г., которая является частичным продолжением заявки серии 08/467566, поданной 6 июня 1995 г., которая является частичным продолжением заявки серии 08/042039, поданной 1 апреля 1993 г. , которая в настоящее время аннулирована, все из которых включены сюда в виде ссылки.
Электродные устройства
Фиг. 1 представляет собой схематическое изображение устройства в разрезе, показывающее вид игольчатого устройства 100 в соответствии с одним вариантом реализации изобретения. Игольчатое устройство 100 включает удлиненный трубчатый опорный корпус или стержень 112, который может быть изготовлен из полой трубки из нержавеющей стали или пластика медицинской степени очистки (например, нейлона). Если стержень изготовлен из электропроводного материала, на внешние элементы следует нанести электрическую изоляцию для защиты и пациента, и врача. Стержень 112 включает множество электродных иголок 114 на дистальном конце, соединенных с соответствующими проводниками многожильного проволочного кабеля 116. Электродные иголки 114 могут быть острыми или тупыми, полыми или сплошными и любой желательной длины. Материал электродных иголок 114 должен быть электропроводным, но не должен быть металлом или однородным (т.е. может использоваться композиционная или слоистая структура, такая как пластиковые или керамические иглы, покрытые металлом). Для инъекции терапевтического вещества может использоваться одна или более полых электродных иголок 114. В различных вариантах реализации электродные иголки 114 имеют прямоугольное, шестиугольное или круговое расположение. Однако могут использоваться другие типы.
Фиг. 1 представляет собой схематическое изображение устройства в разрезе, показывающее вид игольчатого устройства 100 в соответствии с одним вариантом реализации изобретения. Игольчатое устройство 100 включает удлиненный трубчатый опорный корпус или стержень 112, который может быть изготовлен из полой трубки из нержавеющей стали или пластика медицинской степени очистки (например, нейлона). Если стержень изготовлен из электропроводного материала, на внешние элементы следует нанести электрическую изоляцию для защиты и пациента, и врача. Стержень 112 включает множество электродных иголок 114 на дистальном конце, соединенных с соответствующими проводниками многожильного проволочного кабеля 116. Электродные иголки 114 могут быть острыми или тупыми, полыми или сплошными и любой желательной длины. Материал электродных иголок 114 должен быть электропроводным, но не должен быть металлом или однородным (т.е. может использоваться композиционная или слоистая структура, такая как пластиковые или керамические иглы, покрытые металлом). Для инъекции терапевтического вещества может использоваться одна или более полых электродных иголок 114. В различных вариантах реализации электродные иголки 114 имеют прямоугольное, шестиугольное или круговое расположение. Однако могут использоваться другие типы.
При использовании многожильный проволочный кабель 116 соединяется с генератором высокого напряжения. В иллюстрируемом варианте реализации отводимый назад щит 118, ограниченный фрикционным уплотнителем 120 около дистального конца, может скользить по всей длине вдоль корпуса стержня 112 для защиты или раскрытия электродных иголок 114.
Фиг. 2А-2Е представляют собой схематические иллюстрации нескольких альтернативных вариантов реализации электродов в соответствии с изобретением. Фиг. 2А и 2В показывают электроды с прямым корпусом, имеющие иголки 200, расположенные на различном расстоянии друг от друга. Например, иголки на фиг. 2А располагаются в конфигурацию диаметром 0,5 см, тогда как на фиг. 2В они располагаются в конфигурацию диаметром 1,4 см. Различные размеры корпуса также могут меняться. Например, электрод на фиг. 2А имеет ступенчатую структуру корпуса с передней частью 202 меньшего диаметра относительно задней части 204 большего диаметра. Электрод на фиг. 2В имеет корпус 206 одинакового диаметра. Электроды на фиг. 2А и 2В особенно хорошо приспособлены для лечения мелких поверхностных опухолей.
Фиг. 2С и 2D показывают электроды с расположенной под углом головкой, имеющей игольчатые наконечники 200, установленные под углом относительно корпусов 206 электродов. Фиг.2C показывает игольчатые наконечники под углом приблизительно 45o относительно корпуса 206. Фиг.2D показывает игольчатые наконечники под углом приблизительно 90o относительно корпуса 206. Электроды на фиг. 2C и 2D особенно хорошо приспособлены для лечения опухолей головы и шеи.
Фиг.2Е показывает электрод с двойным углом, имеющий набор игольчатых наконечников 200, расположенных под углом относительно передней части 202 корпуса меньшего диаметра. Задняя часть 204 большего диаметра также расположена под углом. Электрод на фиг.2Е особенно хорошо приспособлен для лечения опухолей гортани, но может также использоваться в других полостях тела.
Фиг. 2F показывает электрод, особенно хорошо приспособленный для лечения крупных опухолей. Расстояние между иголками 208 может составлять, например, приблизительно 0,65 см. Фиг.2G показывает электрод, особенно хорошо приспособленный для лечения внутренних опухолей. Расстояние между иголками 208 может составлять, например, приблизительно 1,0 см.
Любые из отдельных элементов конфигурации (например, размер и конфигурация корпуса, угол расположения головки и корпуса и т.д.), показанных на фиг. 2A-2G, могут по желанию комбинироваться. Для удовлетворения потребностей определенного размера и доступа могут использоваться другие конфигурации электродных устройств.
Прибор для ЭПТ
Фиг. 3 представляет собой схему устройства 300 для ЭПТ лечения, реализующего изобретение. Электродный аппликатор 312 съемно соединен посредством адаптера аппликатора 317 с устройством 300, которое избирательно подает импульсы напряжения на выбранные электродные иголки 314 электродного аппликатора 312. Все параметры - длительность импульса, уровень напряжения и тип выходного сигнала адресации или включения электродных иголок устройства 300 - программируемые. Дисплей 316 указывает заданное значение регулируемой величины напряжения лечения. Предоставляется соединение 318 дистанционной активации лечения для размещения выключателя 320 в виде ножной педали, подающего активирующие импульсы на электродный аппликатор 312. Выключатель 320 в виде ножной педали позволяет врачу включать устройство 300, в то же самое время освобождая обе руки для размещения электродного аппликатора 312 в ткани пациента.
Фиг. 3 представляет собой схему устройства 300 для ЭПТ лечения, реализующего изобретение. Электродный аппликатор 312 съемно соединен посредством адаптера аппликатора 317 с устройством 300, которое избирательно подает импульсы напряжения на выбранные электродные иголки 314 электродного аппликатора 312. Все параметры - длительность импульса, уровень напряжения и тип выходного сигнала адресации или включения электродных иголок устройства 300 - программируемые. Дисплей 316 указывает заданное значение регулируемой величины напряжения лечения. Предоставляется соединение 318 дистанционной активации лечения для размещения выключателя 320 в виде ножной педали, подающего активирующие импульсы на электродный аппликатор 312. Выключатель 320 в виде ножной педали позволяет врачу включать устройство 300, в то же самое время освобождая обе руки для размещения электродного аппликатора 312 в ткани пациента.
Для удобства предоставлены индикаторные лампочки 322 для обнаружения повреждений, контроля включения питания и индикации завершения сеанса лечения. Предоставлены другие индикаторные лампочки 324 для положительной индикации того, что электродный аппликатор 312 соединен с устройством 300 и для индикации типа конфигурации иголок (см. обсуждение ниже). Предоставлена кнопка готовности/сброса 326 для "паузы" в работе прибора и сброса всех функций прибора в состояние по умолчанию. Для подготовки устройства 300 к сеансу лечения предоставляется кнопка готовности 328. Выступающая индикаторная лампочка 330 "идет лечение" показывает, что на электродные иголки 314 подаются импульсы напряжения. Кроме того, устройство 300 может иметь аудиоиндикаторы для таких функций, как нажатие кнопки, состояние отказа, завершение или окончание сеанса лечения, индикация проведения лечения и т.д.
В альтернативном варианте реализации устройство 300 может быть соединено с датчиком обратной связи, который выявляет сердечные сокращения. Подача импульсов около сердца может создать помехи нормальному сердечному ритму. С помощью синхронизации импульсов с безопасными периодами между сокращениями возможность такой помехи уменьшается.
Фиг. 4 представляет собой блок-схему компоновки контура 400 устройства для лечения 300, изображенного на фиг. 3. Модуль 402 управления силовым вводом переменного тока обеспечивает электрически изолированное питание всего устройства 300. Блок подачи постоянного тока низкого напряжения 404 обеспечивает подходящее питание для контрольной схемы устройства 300. Блок электропитания высокого напряжения 406 обеспечивает подходящее высокое напряжение (например, до нескольких тысяч вольт), необходимое для ЭПТ лечения. Выход блока электропитания высокого напряжения 406 соединен с блоком импульсной подачи энергии 408, который генерирует импульсы различной ширины и напряжения под контролем устройства управления 410. Выход блока импульсной подачи энергии 408 соединен через высоковольтную батарею включения 412 с соединителем 414 набора иголок. Соединитель 416 ножной педали дистанционной активации лечения обеспечивает возможность прикрепления выключателя 320 в виде ножной педали.
Высоковольтная батарея включения 412 обеспечивает возможность подачи необходимого для ЭПТ высокого напряжения на выбранные подгруппы электродов в игольчатом устройстве 100. В предшествующих вариантах устройств ЭПТ подача такого напряжения обычно была связана с применением ручного поворотного "распределительного" выключателя, или варианта такого выключателя с электрическим приводом. Однако в настоящем изобретении все включения осуществляются с помощью электронно управляемых реле, обеспечивающих более быстрое и бесшумное включение, более длительную работу и улучшенный и более гибкий контроль типов включения.
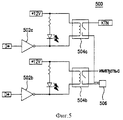
Фиг. 5 представляет собой схематический чертеж элементов избирательного включения 500 высоковольтной батареи включения 412 контура, показанного на фиг. 4. Количество таких элементов включения 500 должно, по меньше мере, соответствовать самому большому числу электродов любого прикрепленного игольчатого устройства 100. Каждый элемент включения 500 обеспечивает контроль высокого напряжения, подаваемого на электрод игольчатого устройства 100, и способен обеспечить напряжение на связанный электрод с любой полярностью.
В частности, когда на один инвертирующий входной усилитель 502а подается "отрицательное" контрольное напряжение, связанное, обычно открытое реле 504а закрыто, устанавливая отрицательную возвратную цепь для импульса, подаваемого на парные электроды, которые предполагается соединить посредством соединителя 506 электродов. Аналогичным образом, когда на второй инвертирующий входной усилитель 502b подается "положительное" контрольное напряжение, связанное, обычно открытое реле 504b закрыто, устанавливая цепь для положительного импульса, который предполагается подать на электрод, соединенный посредством электродного соединения 506.
Адресация набора иголок
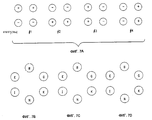
Устройство 300, изображенное на фиг. 3, предназначено для размещения электродных аппликаторов 312, имеющих различное количество электродных иголок 314. Соответственно, была разработана схема адресации, использующая различные "манипуляционные" резисторы, и которая содержит отображение в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций для определения зоны лечения. В предпочтительном варианте схема адресации иголок обеспечивает возможность адресации по 16 различных иголок, обозначенных от А до Р, образующих по 9 квадратных зон лечения и несколько типов увеличенных зон лечения. Зона лечения включает по меньшей мере 4 иглы в конфигурации противоположных пар, который адресуются во время определенного импульса. Так, каждая зона лечения имеет по меньшей мере четыре стороны. Во время определенного импульса две из иголок зоны лечения имеют положительную полярность, а две - отрицательную полярность. Способ избирательной адресации множества электродных игольчатых конфигураций, каждая из которых включает по меньшей мере четыре электродных иголки, приспособленных для электропорообразующей терапии, содержит этапы отображения в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций с тем, чтобы определить зоны лечения, имеющие по меньшей мере четыре стороны, и подачу импульсов напряжения переменной полярности на противоположные пары электродных иголок, определяющих каждую зону лечения.
Устройство 300, изображенное на фиг. 3, предназначено для размещения электродных аппликаторов 312, имеющих различное количество электродных иголок 314. Соответственно, была разработана схема адресации, использующая различные "манипуляционные" резисторы, и которая содержит отображение в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций для определения зоны лечения. В предпочтительном варианте схема адресации иголок обеспечивает возможность адресации по 16 различных иголок, обозначенных от А до Р, образующих по 9 квадратных зон лечения и несколько типов увеличенных зон лечения. Зона лечения включает по меньшей мере 4 иглы в конфигурации противоположных пар, который адресуются во время определенного импульса. Так, каждая зона лечения имеет по меньшей мере четыре стороны. Во время определенного импульса две из иголок зоны лечения имеют положительную полярность, а две - отрицательную полярность. Способ избирательной адресации множества электродных игольчатых конфигураций, каждая из которых включает по меньшей мере четыре электродных иголки, приспособленных для электропорообразующей терапии, содержит этапы отображения в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций с тем, чтобы определить зоны лечения, имеющие по меньшей мере четыре стороны, и подачу импульсов напряжения переменной полярности на противоположные пары электродных иголок, определяющих каждую зону лечения.
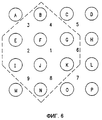
Фиг.6 схематически показывает предпочтительную схему расположения иголок 4х4, образующих 9 квадратных зон лечения, пронумерованных от центра с продолжением по часовой стрелке. В предпочтительном варианте реализации эта схема картирования определяет 4-игольные, 6-игольные, 8-игольные, 9-игольные и 16-игольные конфигурации электродов. 4-игольный электрод включает иголки, размещенные в положениях F, G, К и J (зона лечения 1). 9-игольный электрод включает иголки, размещенные в положениях, определяющих зоны лечения 1-4. 16-игольный электрод включает иголки, размещенные в положениях, определяющих зоны лечения 1-9.
Фиг. 7А показывает последовательность импульсов для зоны лечения 2 х 2 в соответствии с одним вариантом реализации изобретения. Как показано, во время любого из четырех импульсов, составляющих цикл, противоположные пары иголок заряжены соответственно положительно и отрицательно. Возможны другие виды таких пар, такие как продвижение по часовой стрелке или против часовой стрелки. Для 9-игольной конфигурации электрода предпочтительный цикл включает 16 импульсов (4 зоны лечения при 4 импульсах каждая). Для 16-игольной конфигурации электрода предпочтительный цикл включает 36 импульсов (9 зон лечения при 4 импульсах каждая).
6-игольный электрод может включать круговую или шестиугольную схему, как показано на фиг. 7B-7D. Альтернативно, 6-игольный электрод может определяться в виде подкомплекта более крупной конфигурации, такой как показано на фиг. 6. Например, со ссылкой на фиг.6, 6-игольный электрод может быть образован в виде прямоугольной конфигурации 2 х 3 иголок, размещенных в положениях, определяющих зоны лечения 1-2 (или любую другую линейную пару зон лечения), или шестиугольное расположение иголок В, G, К, N, I, E (или любой другой набор положений, образующих шестиугольник), определяющее увеличенную зону лечения (показано очерчивающей пунктирной линией на фиг.6). Аналогичным образом, 8-игольный электрод может включать восьмиугольник или подкомплект более крупной схемы, показанной на фиг.6. Например, со ссылкой на фиг.6, 8-игольный электрод может быть образован в виде прямоугольной конфигурации 2 х 4 иголок, размещенных в положениях, определяющих зоны лечения 1, 2 и 6 (или любой другой линейный триплет зон лечения), или восьмиугольное расположение иголок В, С, Н, L, О, N, I, E (или любой другой набор положений, образующих восьмиугольник), определяющее увеличенную зону лечения.
Фиг. 6B-6D показывают шестиугольное расположение и одну возможную последовательность активации. Фиг. 6D показывает первую последовательность, при которой в течение первого импульса иголки G и К являются положительными, а иголки I и Е являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки В и N, показанные пунктирной очерчивающей линией, являются неактивными. Фиг. 6С показывает вторую последовательность, при которой в течение первого импульса иголки К и N являются положительными, а иголки Е и В являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки G и I являются неактивными. Фиг. 6DE показывает третью последовательность, при которой в течение первого импульса иголки N и I являются положительными, а иголки В и G являются отрицательными, а во время следующего импульса имеют обратную полярность; иголки К и Е являются неактивными. Во время цикла последовательностей подается всего 6 импульсов. Аналогичная последовательность активации может использоваться для восьмиугольного расположения.
Независимо от физической конфигурации, в предпочтительных варианта реализации изобретения всегда используются по меньшей мере две включенные пары электродов (например, как показано на фиг.7А) для достижения относительно однородного электрического поля в ткани, подвергающейся ЭПТ. Интенсивность электрического поля должна быть достаточной, чтобы обеспечить возможность включения лечебного средства для воздействия на процесс электропорообразования.
Автоматическая идентификация электродных аппликаторов
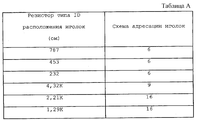
Схема картирования, описанная выше, позволяет соединять различные электродные аппликаторы 312 с одним и тем же устройством 300. Поскольку количество электродных иголок 314 может изменяться, изобретение включает средство для автоматической настройки устройства 300 для адресации соответствующего количества электродных иголок 314. В одном варианте реализации каждый электродный аппликатор 312 включает элемент идентификации встроенного типа, такой как "манипуляционный" резистор, который позволяет устройству 300 определить количество электродных иголок 314 и, следовательно, настроиться на соответствие схеме адресования. Когда электродный аппликатор 312 соединен с устройством 300, устройство 300 считывает элемент идентификации типа. Элемент идентификации типа может быть включен в соединитель для электродного аппликатора 312 и иметь доступ посредством общих или выделенных электрических соединений.
Схема картирования, описанная выше, позволяет соединять различные электродные аппликаторы 312 с одним и тем же устройством 300. Поскольку количество электродных иголок 314 может изменяться, изобретение включает средство для автоматической настройки устройства 300 для адресации соответствующего количества электродных иголок 314. В одном варианте реализации каждый электродный аппликатор 312 включает элемент идентификации встроенного типа, такой как "манипуляционный" резистор, который позволяет устройству 300 определить количество электродных иголок 314 и, следовательно, настроиться на соответствие схеме адресования. Когда электродный аппликатор 312 соединен с устройством 300, устройство 300 считывает элемент идентификации типа. Элемент идентификации типа может быть включен в соединитель для электродного аппликатора 312 и иметь доступ посредством общих или выделенных электрических соединений.
В качестве иллюстративного примера в табл. А представлена карта распределения резисторных величин по ряду электродных иголок 314.
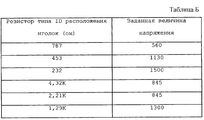
Аналогичная методика может использоваться для автоматической установки напряжения терапии для устройства 300, т.е. каждый электродный аппликатор 312 включает встроенный элемент идентификации напряжения, такой как "манипуляционный" резистор, который позволяет устройству 300 определить соответствующий уровень напряжения для лечебных импульсов для определенного электродного аппликатора 312. Устройство 300 считывает элемент идентификации напряжения, когда электродный аппликатор 312 соединен с устройством 300.
В качестве иллюстративного примера в табл. Б представлена карта распределения резисторных величин по заданным величинам напряжения.
Для идентификации типа и идентификации напряжения могут использоваться те же или другие идентификационные элементы. Тип идентификационного элемента также может меняться. Например, в каждый электродный аппликатор 312 может быть включен электронный контур с хранящимися цифровыми или аналоговыми величинами различных показателей. Примерами информации, которая может кодироваться в электродный аппликатор 312, являются: параметры типа конфигурации иголок, такие как количество иголок, расстояния между иголками, геометрия расположения иголок и/или последовательность включения иголок; параметры электрического импульса, такие как заданная величина напряжения, длительность импульса и/или форма импульса; длительность хранения и срок годности. Если в электродном аппликаторе 312 используется активный контур ввода, который может хранить данные (например, NVRAM), другая информация, которая может кодироваться в электродный аппликатор 312, включает: блокировку по истечении срока годности (т.е. код, который отменяет применение электродного аппликатора 312, если срок его годности истек); учет использования и блокировка (т. е. код, который отменяет использование электродного аппликатора 312, если было достигнуто количество разрешенных использований; когда электродный аппликатор 312 предназначен для одноразового использования, этот признак предотвращает загрязнение в результате повторного использования); историю использования (например, логарифм, который регистрирует количество поданных импульсов, дату и время наложения и т.д.) и выявление кода ошибки (например, для обеспечения возможности возврата электродного аппликатора 312 производителю и анализа типов отказа аппликатора или устройства 300).
Блокировка может определяться продолжительностью периода от первоначального применения аппликатора, а также количеством лечебных сеансов, проведенных с использованием одного устройства. Это может осуществляться с помощью ввода программной отметки времени в активный контур "манипуляционного" элемента одноразового аппликатора после первоначального соединения с устройством и не позволит в последующем его использовать после определенного периода времени. Предел периода времени будет определяться максимальной продолжительностью одной хирургической процедуры на практике.
Кроме того, использование "манипуляционного" элемента может включать информацию по производству и контролю качества. Одним примером такой информации является код серии устройства. Это также может помочь в контроле качества устройства путем запрета использования неисследованного материала, например, устройство конфигурируется для использования только после того, как оно успешно прошло инспекцию производственного теста.
Лапароскопический игольчатый аппликатор
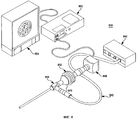
Один вариант реализации изобретения, который может, в частности, применяться для лечения внутренних опухолей, сочетает набор иголок на лапороскопе и устройство эндоскопического исследования для обеспечения возможности минимально инвазивной ЭПТ. Фиг. 8 представляет собой схему устройства эндоскопического исследования 800 предшествующего уровня техники. Свет от источника света 840 известным образом передается через волоконно-оптический световод 842 к эндоскопу 844. Ткань освещается светом, испускаемым из дистального конца эндоскопа 844. Отраженный свет собирается дистальным концом эндоскопа 844 и передается в окуляр 846 или в видеокамеру 848 через оптрон 850. Сигнал от видеокамеры 848 может записываться на видеомагнитофон 852 и/или высвечивается на видеомониторе 854.
Один вариант реализации изобретения, который может, в частности, применяться для лечения внутренних опухолей, сочетает набор иголок на лапороскопе и устройство эндоскопического исследования для обеспечения возможности минимально инвазивной ЭПТ. Фиг. 8 представляет собой схему устройства эндоскопического исследования 800 предшествующего уровня техники. Свет от источника света 840 известным образом передается через волоконно-оптический световод 842 к эндоскопу 844. Ткань освещается светом, испускаемым из дистального конца эндоскопа 844. Отраженный свет собирается дистальным концом эндоскопа 844 и передается в окуляр 846 или в видеокамеру 848 через оптрон 850. Сигнал от видеокамеры 848 может записываться на видеомагнитофон 852 и/или высвечивается на видеомониторе 854.
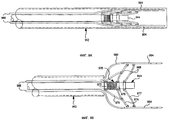
Фиг. 9А-9B представляют собой частичное схематическое изображение вида сбоку дистального конца усовершенствованного эндоскопа 844, изображенного на фиг. 8, показывающие в деталях группы иголок 960 в выдвинутом/отведенном назад состоянии в соответствии с изобретением. Смещаемый кожух 962 охватывает эндоскоп 944 и группу иголок 960. Фиг.9А показывает кожух 962 в расправленном положении, полностью покрывающий эндоскоп 944 и группу иголок 960. Фиг.9B показывает кожух 962 в отведенном назад положении, открывающий дистальные концы эндоскопа 944 и группу иголок 960. (Хотя в предпочтительном варианте реализации используется подвижный кожух 962, все, что требуется - это относительное движение между кожухом 962 и эндоскопом 944; следовательно, эндоскоп 944 может рассматриваться как подвижный элемент.)
В предпочтительном варианте реализации группа иголок 960 включает по меньшей мере две электродные иглы 964, каждая из которых соединена с подачей напряжения (не показана), а по меньшей мере одна из которых может быть полой и соединена через трубку 966 с подачей препарата (не показано). Наконечники электродных иголок 964 предпочтительно расположены, простираясь за пределы дистального конца эндоскопа 944 так, что с помощью эндоскопа 944 можно осматривать участок ткани, в то время как электродные иголки 964 вставлены в ткань.
В предпочтительном варианте реализации группа иголок 960 включает по меньшей мере две электродные иглы 964, каждая из которых соединена с подачей напряжения (не показана), а по меньшей мере одна из которых может быть полой и соединена через трубку 966 с подачей препарата (не показано). Наконечники электродных иголок 964 предпочтительно расположены, простираясь за пределы дистального конца эндоскопа 944 так, что с помощью эндоскопа 944 можно осматривать участок ткани, в то время как электродные иголки 964 вставлены в ткань.
Каждая электродная игла 964 соединена со сжимаемым механизмом 968, прикрепленным по меньшей мере к одной электродной игле для перемещения каждой прикрепленной электродной иглы от зачехленной конфигурации, когда кожух находится в выдвинутом положении, в развернутую конфигурацию, когда кожух находится в отведенном назад положении, в котором электродные иглы имеют большее расстояние относительно друг друга в развернутой конфигурации, чем в зачехленной конфигурации. В иллюстрируемом варианте реализации сжимаемый механизм 968 включает для каждой электродной иглы 964 опорное плечо 970, шарнирно соединенное со смещаемым основанием 972, которое может свободно двигаться вдоль эндоскопа 944 и к плечу первичного расправления 974. Каждое плечо первичного расправления 974 шарнирно соединено с фиксированным основанием 976, которое прикреплено к эндоскопу 944 и к соответствующей электродной игле 964. Плечо вторичного расправления 977, аналогичное по конструкции плечу первичного расправления 974 (но без опорного плеча 970), предоставлено для дополнительной устойчивости электродных иголок 964 при описанной ниже расправленной конфигурации.
Когда кожух 962 находится в расправленном положении, электродные иголки 964 находятся относительно близко друг к другу. Хотя при некоторых видах использования эта степень близости может соответствовать определенным уровням напряжения, при других видах использования электродные иголки 964 должны находиться на большем расстоянии друг от друга.
Соответственно, в предпочтительном варианте реализации, когда кожух 962 смещается в отведенное назад положение, компрессионный элемент 978 (например, пружина) подает напряжение смещения на каждое смещаемое основание 972, направленное в сторону от фиксированного основания 976, заставляя каждое опорное плечо 970 толкать соединенное плечо первичного расправления 974. Эта отводящая назад сила заставляет плечи расправления 974, 977 отгибаться под углом от эндоскопа 944 в расправленную конфигурацию, увеличивая таким образом расстояние между электродными иголками 964, как показано на фиг.9B.
Когда кожух 962 смещается в расправленное положение, кожух 962 сжимает вместе электродные иглы 964, заставляя складываться плечи расправления 974, 977. Это заставляет каждое плечо первичного расплавления 974 толкать соединенное опорное плечо 970. Отводящая назад сила, действующая на каждое опорное плечо 970, заставляет каждое смещаемое основание 972 двигаться по направлению к фиксированному основанию 976 в покрытую кожухом конфигурацию, сжимая компрессионный элемент 978, как показано на фиг.9А.
Для разделения электродных иголок 964 могут использоваться другие сжимаемые механизмы 968, такие как клины (или конус с полой сердцевиной) из сжимаемого эластомерного материала (такого, как поропласт или резина), помещенные между эндоскопом 944 и электродными иголками 964 так, что самая широкая часть клинов находится у дистального конца эндоскопа 944. Когда кожух 962 находится в отведенном назад положении, эластомерный материал больше расширяется в дистальном конце клинов, чем в проксимальном конце клинов, увеличивая таким образом расстояние между электродными иголками 964. Далее, нет необходимости в смещаемости каждой электродной иглы 964 сжимаемым механизмом 968. Например, достаточное разделение между двумя электродными иглами 964 может быть достигнуто, если одна из электродных иголок 964 удерживается в фиксированном положении относительно эндоскопа 944, в то время как другая электродная игла 964 может смещаться между сжатым и расправленным положением; в расправленной конфигурации две электродные иглы 964 будут расположены асимметрично относительно эндоскопа 944.
В любом случае, сжимаемый механизм 968 должен обеспечить электрическую изоляцию между каждой электродной иглой 964 и, следовательно, предпочтительно должен быть изготовлен целиком или частично из диэлектрика, такого как не обладающий электропроводностью пластик.
Хотя предпочтительный вариант реализации лапороскопической группы иголок включает эндоскоп, в некоторых вариантах реализации может использоваться лапороскопическая группа иголок с отдельным эндоскопом. В этой конфигурации опорный стержень может быть замещен на фиг.15А и 15В на эндоскоп 944.
Параметры электрического поля
Природа электрического поля, которое предполагается генерировать, определяется природой ткани, размером выбранной ткани и ее расположением. Желательно, чтобы поле было насколько возможно однородным и имело правильную амплитуду. Избыточная сила поля приводит к лизированию клеток, в то время как маленькая сила поля приводит к снижению эффективности. Возможны различные способы установки и манипуляции электродами, включая, но не ограничивая, способы, описанные в основной заявке. Для помещения во внутреннее положение электродами легко манипулировать с помощью пинцета.
Природа электрического поля, которое предполагается генерировать, определяется природой ткани, размером выбранной ткани и ее расположением. Желательно, чтобы поле было насколько возможно однородным и имело правильную амплитуду. Избыточная сила поля приводит к лизированию клеток, в то время как маленькая сила поля приводит к снижению эффективности. Возможны различные способы установки и манипуляции электродами, включая, но не ограничивая, способы, описанные в основной заявке. Для помещения во внутреннее положение электродами легко манипулировать с помощью пинцета.
Форма волн электрического сигнала, обеспечиваемого импульсным генератором, может представлять собой экспоненциально угасающий импульс, прямоугольный импульс, серию униполярных осциллирующих импульсов, серию биполярных осциллирующих импульсов или комбинацию любых из этих форм. Номинальная сила электрического поля может составлять от приблизительно 10 В/см приблизительно 20 кВ/см (номинальная сила электрического поля определяется с помощью расчета напряжения между электродными иглами, деленного на расстояние между иглами). Продолжительность импульса может составлять от приблизительно 10 до приблизительно 100 мкс. Может быть любое желаемое количество импульсов, обычно от одного до 100 импульсов в 1 с. Ожидание между группами импульсов может продолжаться любое желательное время, такое как 1 с. Форма волн, сила электрического поля и продолжительность импульса могут также зависеть от типа клеток и типа молекул, которые должны войти в клетки посредством электропорообразования.
Различные показатели, включая силу электрического поля, требуемые для электропорообразования любой известной клетки, в целом доступны из многих научных статей с данными по этому предмету, а также в базе данных, хранимых GENETRONICS, INC. , San Diego, California, правопреемника настоящей заявки. Электрические поля, необходимые для электропорообразования in vivo, такие как ЭПТ, в целом аналогичны по величине полям, требуемым для клеток in vitro. Недавние исследования авторов изобретения показывают, что предпочтительные величины находятся в диапазоне от 10 до приблизительно 1300 В/см. Верхний предел этого диапазона, выше приблизительно 600 В/см, был подтвержден данными научных публикаций о других экспериментах in vivo.
Номинальное электрическое поле может определяться как "высокое" или "низкое". Предпочтительно, при использовании высоких полей номинальное электрическое поле составляет от приблизительно 700 до 1300 В/см, а предпочтительно от приблизительно 1000 до 1300 В/см. Предпочтительно, при использовании низких полей номинальное электрическое поле составляет от приблизительно 10 до 100 В/см, а более предпочтительно, от приблизительно 25 до 75 В/см. В конкретном варианте реализации предпочтительно, чтобы, когда электрическое поле является низким, длительность импульса была большой. Например, когда номинальное электрическое поле составляет приблизительно 25-75 В/см, предпочтительно, чтобы длительность импульса составляла приблизительно 10 мс.
Предпочтительно, в способе лечения изобретения используется устройство изобретения, которое обеспечивает электродное устройство для применения электропорообразования в части тела пациента, включающее опорный элемент, множество игольчатых электродов, установленных на указанный опорный элемент, для введения в ткань в выбранных положениях и на выбранных расстояниях друг от друга, и средство, включающее генератор сигналов, реагирующий на указанное расстояние, для подачи на электроды электрического сигнала, пропорционального расстоянию между указанными электродами, для создания электрического поля заданной силы.
Альтернативно, понятно, что в способе лечения изобретения могут использоваться другие системы (например, для обработки низким напряжением и длинным импульсом), например устройство электропорообразования с прямоугольными импульсами. Например, может использоваться ElectroSquarePorator (T820), имеющийся в продаже у GENETRONICS, INC. of San Diego, California, U.S.A. Устройства для электропорообразования, генерирующие прямоугольные волны, подают контролируемые электрические импульсы, которые быстро нарастают до установленного напряжения, остаются на этом уровне в течение заданного периода времени (длительность импульса), а затем быстро падают до нуля. Этот тип устройства дает лучшую эффективность преобразования для электропорообразования протопласта растений и линий клеток млекопитающих, чем устройство с экспоненциальным угасанием.
ElectroSquarePorator (T820) представляет собой первое имеющееся в продаже устройство электропорообразования, генерирующее прямоугольные волны и способное создавать напряжение до 3000 В. Длительность импульса может устанавливаться от 5 мкс до 99 мс. Импульсы электропорообразования с волнами прямоугольной формы оказывают более щадящее воздействие на клетки, что приводит к повышению жизнеспособности клеток.
ElectroSquarePorator T820 работает и в режиме высокого напряжения (РВН) (100-3000 В), и в режиме низкого напряжения (РНН) (10-500 В). Длительность импульса для РНН составляет приблизительно от 0,3 до 99 мс, а для РВН - от 5 до 99 мкс. T820 обладает возможностью множественной импульсации от приблизительно 1 до 99 импульсов.
Способ лечения
Способ лечения по изобретению включает электротерапию, именуемую здесь так же, как электропорообразующая терапия (ЭПТ), с использованием устройства изобретения для доставки макромолекул в клетку или ткань. Как описано ранее, используемый здесь термин "макромолекула" или "молекула" относится к лекарственным препаратам (например, химиотерапевтическим средствам), нуклеиновым кислотам (например, полинуклеотидам), пептидам и полипептидам, включая антитела. Термин полинуклеотиды включает последовательности ДНК, кДНК и РНК.
Способ лечения по изобретению включает электротерапию, именуемую здесь так же, как электропорообразующая терапия (ЭПТ), с использованием устройства изобретения для доставки макромолекул в клетку или ткань. Как описано ранее, используемый здесь термин "макромолекула" или "молекула" относится к лекарственным препаратам (например, химиотерапевтическим средствам), нуклеиновым кислотам (например, полинуклеотидам), пептидам и полипептидам, включая антитела. Термин полинуклеотиды включает последовательности ДНК, кДНК и РНК.
Лекарственные препараты, которые предполагается применять в способе изобретения, обычно представляют собой химиотерапевтические средства, оказывающие противоопухолевое или цитотоксическое действие. Такие препараты или средства включают блеомицин, неокарционостатин, сурамин, доксорубицин, карбоплатин, таксол, митомицин С и цисплатин. Специалистам в этой области будут известны другие химиотерапевтические средства (см., например, указатель The Merck Index). Кроме того, в способ изобретения также включены средства, которые являются "действующими на мембраны". Эти средства могут также представлять собой перечисленные выше средства или, альтернативно, средства, которые действуют в первую очередь путем повреждения клеточных мембран. Примеры действующих на мембраны средств включают N-алкилмеламид и пара-хлорбензоат ртути. Химическое строение средства будет определять наиболее подходящее время введения средства относительно подачи электрического импульса. Хотя и не желая ограничиваться определенной теорией, считается, например, что препарат, имеющий низкую изоэлектрическую точку (например, неокарциностатин, ИЭТ=3,78) вероятно будет более эффективен при введении после электропорообразования во избежание электростатического взаимодействия высокозаряженного препарата внутри поля. Кроме того, такие препараты как блеомицин, которые имеют очень отрицательный логарифм Р (причем Р является коэффициентом разделения между октанолом и водой), являются очень крупными по размеру (мол. вес = 1400) и являются гидрофильными, тесно связываясь вследствие этого с липидной мембраной, очень медленно диффундируют в опухолевую клетку и обычно вводятся перед или одновременно с подачей электрического импульса. Кроме того, определенные средства могут потребовать модификации для обеспечения возможности более эффективного входа в клетку. Например, средство, такое как таксол, может модифицироваться для увеличения растворимости в воде, что обеспечит возможность более эффективного входа в клетку. Электропорообразование облегчает вход блеомицина или других аналогичных препаратов в опухолевую клетку с помощью создания пор в клеточной мембране.
В одном варианте реализации изобретение предоставляет способ терапевтического применения электропорообразования в ткани индивидуума для введения молекул в его клетки, включающий предоставление группы электродов, причем по меньшей мере один из электродов имеет конфигурацию иглы для проникновения в ткань; введение игольного электрода в выбранную ткань для введения молекул в ткань; расположение второго электрода из группы электродов в электропроводной связи с выбранной тканью; подачу на электроды импульсов электрических сигналов высокой амплитуды, пропорциональных расстоянию между электродами, для электропорообразования в ткани. Следует понимать, что электропорообразование в ткани может выполняться in vitro, in vivo или ex vivo. Электропорообразование может также выполняться с использованием одиночных клеток, например суспензий одиночных клеток или in vitro или ex vivo в клеточной культуре.
Может быть желательно модулировать экспрессию гена в клетке введением молекулы с помощью способа изобретения. Термин "модулировать" предусматривает подавление экспрессии гена при его избыточной экспрессии или усиление экспрессии, когда он недостаточно экспрессирован. Когда нарушение пролиферации клеток связано с экспрессией гена, могут использоваться последовательности нуклеиновых кислот, которые вмешиваются в экспрессию гена на уровне трансляции. В этом подходе используются, например, антисмысловая нуклеиновая кислота, рибозимы или триплексные средства для блокады транскрипции или трансляции определенной мРНК, или с помощью маскировки этой мРНК антисмысловой нуклеиновой кислотой или триплексным средством, или с помощью расщепления рибозимом.
Антисмысловые нуклеиновые кислоты представляют собой молекулы ДНК или РНК, которые комплементарны по меньшей мере для части молекулы специфичной мРНК (Weintraub, Scientific American, 262:40, 1990). В клетке антисмысловые нуклеиновые кислоты гибридизируются в соответствующую мРНК, образуя двухцепочечную молекулу. Антисмысловые нуклеиновые кислоты вмешиваются в трансляцию мРНК, поскольку клетка не будет транслировать мРНК, которая является двухцепочечной. Предпочтительны антисмысловые олигомеры приблизительно из 15 нуклеотидов, поскольку они легко синтезируются и связаны с меньшей вероятностью возникновения проблем при введении в целевую клетку, чем более крупные молекулы. Использование антисмысловых способов для ингибирования трансляции генов in vitro хорошо известно в предшествующем уровне техники (Marcus-Sakura, Anal. Biochem., 172:289, 1988).
Применение олигонуклетоидов для задержки транскрипции известно в виде триплексной стратегии, поскольку олигомер наматывается вокруг двуспиральной ДНК, образуя трехнитевую спираль. Поэтому эти триплексные соединения могут быть предназначены для распознавания специфичного участка на выбранном гене (Maher, et al., Antisense Res. and Dev., 1(3):227, 1991; Helene, C., Anticancer Drug Design, 6(6):569, 1991).
Рибозимы представляют собой молекулы РНК, обладающие способностью специфично расщеплять другую одноцепочечную РНК образом, аналогичным рестрикционным эндонуклеазам ДНК. Посредством модификации нуклеотидных последовательностей, которые кодируют эти РНК, можно методом генной инженерии создать молекулы, которые распознают специфические нуклеотидные последовательности в молекуле РНК и расщепляют ее (Cech, J.Amer.Med. Assn., 260:3030, 1988). Основное преимущество этого подхода состоит в том, что ввиду специфичности для последовательности инактивируются только мРНК с определенными последовательностями.
Существуют два основных типа рибозимов, а именно типа тетрагимена (Hasselhoff, Nature, 334: 585, 1988) и типа "молотоглава". Рибозимы типа тетрагимена распознают последовательности, которые представляют собой четыре основания по длине, в то время как рибозимы типа "молотоглава" распознают основные последовательности длиной в 11-18 оснований. Чем длиннее распознаваемая последовательность, тем больше вероятность того, что последовательность встретится исключительно в целевых видах мРНК. Следовательно, для инактивации специфических видов мРНК предпочтительнее рибозимы типа молотоглава, чем рибозимы типа тетрагимена, и последовательности распознавания длиной 18 оснований предпочтительнее более коротких последовательностей распознавания.
Изобретение также обеспечивает генетическую терапию для лечения клеточных пролиферативных или иммунологических расстройств, опосредованных определенным геном или его отсутствием. Такая терапия достигла бы своего терапевтического эффекта путем введения специфичного смыслового или антисмыслового полинуклеотида в клетку, имеющую расстройство. Доставка полинуклеотидов может быть достигнута с использованием рекомбинантного вектора экспрессии, такого как химерный вирус, или полинуклеотид может доставляться, например, в виде депротеинизированной ДНК.
Различные вирусные векторы, которые могут использоваться для генной терапии, в соответствии с положениями настоящего изобретения, включают аденовирус, вирус герпеса, вирус коровьей оспы или предпочтительно вирус РНК, такой как ретровирус. Предпочтительно, ретровирусный вектор является производным мышиного или птичьего ретровируса. Примеры ретровирусных векторов, в которые может быть вставлен одиночный инородный ген, включают, но не ограничиваются: вирус мышиного лейкоза Moloney (MoMuLV), вирус мышиной саркомы Harvey (HaMuSV), мышиный вирус опухоли молочной железы (МиМТV) и вирус саркомы Рауша (RSV). Когда индивидуумом является человек, может использоваться такой вектор, как вирус обезьяньего лейкоза гиббонов (GaLV). Ряд дополнительных ретровирусных векторов могут включать множественные гены. Все эти векторы могут переносить или включать ген для отбираемого маркера так, что могут быть выявлены и генерированы трансдуцированные клетки.
Терапевтические пептиды или полипептиды могут также быть включены в способ лечения изобретения. Например, для включения клеткой могут вводиться иммуномоделирующие средства и другие модификаторы биологической реакции. Термин "модификаторы биологической реакции" подразумевает охват веществ, которые участвуют в модификации иммунного ответа. Примеры модификаторов иммунного ответа включают такие соединения, как лимфокины. Лимфокины включают фактор некроза опухолей интерлейкины 1, 2 и 3, лимфотоксин, фактор активации макрофагов, фактор ингибирования миграции, колониестимулирующий фактор и альфа-интерферон, бета-интерферон и гамма-интерферон и их подтипы.
Включены также полинуклеотиды, которые кодируют метаболические ферменты и белки, включая соединения антиангиогенеза, например фактор VIII или фактор IX. Макромолекула изобретения также включает молекулы антител. Используемый здесь термин "антитело" подразумевает включение интактных молекул, а также их фрагментов, таких как Fab и F(ab')2.
Ведение лекарственного препарата, полинуклеотида или полипептида в способе изобретения может осуществляться, например, парентерально с помощью инъекции, быстрой инфузии, всасывания в носоглотке, всасывания через кожу и орально. Например, в случае опухоли химиотерапевтическое или другое средство может вводиться местно, системно или в виде инъекции непосредственно в опухоль. Если, например, препарат вводится непосредственно в опухоль, имеет преимущество производить инъекцию препарата "веерным" способом. Термин "веерный" относится к введению препарата с помощью изменения направления иглы во время инъекции препарата или с помощью множественных инъекций в различных направлениях, подобно раскрытию ручного веера, а не в виде болюса, для обеспечения большего распределения препарата по опухоли. По сравнению с объемом, который обычно используется в предшествующем уровне техники, для обеспечения соответствующего распределения препарата по опухоли желательно увеличить объем раствора, содержащего лекарственный препарат, когда препарат вводится (например, в виде инъекции) в опухоль. Например, в приведенных здесь примерах с использованием мышей специалист в этой области обычно производит инъекцию 50 мкл раствора, содержащего лекарственный препарат, однако результаты значительно улучшаются с помощью увеличения объема до 150 мкл. В клинических исследованиях у людей для обеспечения соответствующей перфузии опухоли производилась инъекция приблизительно 20 мл. Инъекцию предпочтительно следует делать очень медленно вокруг всего основания и веерным способом. Хотя интерстициальное давление в центре опухоли очень высокое, в этой области очень часто имеется некроз опухоли.
Молекула предпочтительно вводится по существу одновременно с электропорообразуюшей обработкой. Термин "по существу одновременно" обозначает, что введение молекулы и электропорообразующая обработка производятся приемлемо близко друг к другу с точки зрения времени. Введение молекулы или терапевтического средства может осуществляться с любым интервалом, в зависимости от таких факторов, как, например, природа опухоли, состояние пациента, размер и химические характеристики молекулы и период полувыведения молекулы.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и пригодные для инъекции органические эфиры, такие как этиолеат. Кроме интертных разбавителей, такие композиции могут также включать адъюванты, увлажнители, эмульсификаторы и суспендирующие средства. Кроме того, для удерживания терапевтического средства в локализованном состоянии перед подачей импульсов могут использоваться сосудосуживающие средства.
С помощью способа изобретения можно обрабатывать любую клетку. Представленные здесь иллюстративные примеры демонстрируют использование способа изобретения для обработки опухолевых клеток, например, поджелудочной железы, легких, головы и шеи, кожных и подкожных раковых опухолей. Лечению с помощью способа электропорообразования изобретения подлежат другие клеточные пролиферативные расстройства. Термин "клеточное пролиферативное расстройство" обозначает популяции злокачественных, а также незлокачественных клеток, которые, как оказывается, часто отличаются от окружающей ткани и морфологически, и генотипически. Злокачественные клетки (т.е. опухоли или рак) развиваются в результате многоэтапного процесса. Способ изобретения может использоваться при лечении злокачественных поражений или других расстройств различных систем органов, в частности, например, клеток в поджелудочной железе, голове и шее (например, гортани, носоглотке, ротоглотке, гортанной части глотки, губ, горла) и легких, а также включая клетки сердца, почек, мышц, молочных желез, толстой кишки, предстательной железы, вилочковой железы, семенников и яичников. Кроме того, с помощью способа лечения изобретения можно также лечить злокачественные поражения кожи, такие как базальноклеточная карцинома или меланома (см. пример 2). Предпочтительно, индивидуумом является человек, однако следует понимать, что изобретение может также использоваться в ветеринарии у животных или млекопитающих.
Еще в одном варианте реализации изобретение предоставляет способ терапевтического применения электропорообразования в ткани индивидуума для повреждения или уничтожения в ней клеток. Способ включает предоставление группы электродов, расположение второго электрода из группы электродов в электропроводной связи с выбранной тканью; и подачу на электроды импульсов электрических сигналов высокой амплитуды, пропорционально расстоянию между электродами, для электропорообразования в ткани. В способе предпочтительно используется низкое напряжение и большая длительность импульса, что исключает необходимость в дополнительных цитотоксических или химиотерапевтических средствах. Предпочтительно, номинальное электрическое поле, например, составляет от приблизительно 25 до 75 В/см, а длина импульса составляет от приблизительно 5 мкс до 99 мс.
Следующие примеры предназначены для иллюстрации, а не ограничения изобретения. Хотя они типичны для тех, которые могут использоваться, альтернативно могут применяться другие процедуры, известные специалистам в этой области.
Следующие примеры иллюстрируют применение ЭПТ в линиях клеток у животных и людей. Пример 1 иллюстрирует ЭПТ в слабо дифференцированных опухолях поджелудочной железы человека (Рапс-3), ксенотрансплантированных подкожно на бок безволосых мышей. Пример 2 показывает результаты клинических испытаний у людей с использованием ЭПТ для лечения базальноклеточных карцином и меланом. Пример 3 показывает результаты клинических испытаний у людей с использованием ЭПТ для лечения опухолей головы и шеи. Пример 4 предоставляет данные in vitro для ЭПТ с использованием низкого напряжения (электрического поля) и импульсов большой длительности. Параметры ЭПТ описаны в примерах; для примера 1 и для клинических испытаний при поражении головы и шеи номинальное электрическое поле было 1300 В/см и 6 импульсов в течение 99-100 мкс, разделенных интервалами 1 с. В клинических испытаниях (пример 2) использовались аналогичные параметры, однако электрическое поле составило 1130 В/см. (Номинальное электрическое поле (В/см) представляет собой напряжение (В) между парами иголок, разделенное на расстояние между парами иголок (см)). Примеры иллюстрируют применение ЭПТ для эффективного уничтожения нежелательных клеточных популяций (например, опухоли) in vitro и in vivo.
Пример 1 - ЭПТ для лечения опухолей in vivo
Одиночная лечебная процедура включала инъекцию блеомицина (0,5 единиц в 0,15 мл солевого раствора) внутрь опухоли с использованием веерного введения, как описано здесь, с последующей подачей шести электрических импульсов волн прямоугольной формы через 10 мин, с использованием электродов из группы иголок, как описано в настоящей заявке, расположенных вдоль окружности круга диаметром 1 см. Для соответствия опухолям различного размера может также использоваться группа иголок, расположенных по кругу различного диаметра (например, 0,5 см, 0,75 см и 1,5 см). Для изменения глубины проникновения иголок в опухоль в центр группы могут вставляться стопоры. Встроенный механизм обеспечивал возможность включения электродов для максимального охвата опухоли импульсным полем. Электрические параметры были следующими: сила поля в центре 780 В/см и 6 импульсов по 99 мкс, разделенных интервалом 1 с.
Одиночная лечебная процедура включала инъекцию блеомицина (0,5 единиц в 0,15 мл солевого раствора) внутрь опухоли с использованием веерного введения, как описано здесь, с последующей подачей шести электрических импульсов волн прямоугольной формы через 10 мин, с использованием электродов из группы иголок, как описано в настоящей заявке, расположенных вдоль окружности круга диаметром 1 см. Для соответствия опухолям различного размера может также использоваться группа иголок, расположенных по кругу различного диаметра (например, 0,5 см, 0,75 см и 1,5 см). Для изменения глубины проникновения иголок в опухоль в центр группы могут вставляться стопоры. Встроенный механизм обеспечивал возможность включения электродов для максимального охвата опухоли импульсным полем. Электрические параметры были следующими: сила поля в центре 780 В/см и 6 импульсов по 99 мкс, разделенных интервалом 1 с.
Результаты показали тяжелый некроз и отек почти у всех мышей в участке лечения. В то время как в группе лечения (D+E+; D=npenapar, Е=электрическое поле) наблюдалось существенное уменьшение объема опухолей (после небольшого первоначального увеличения вследствие отека), у мышей в контрольной группе (D+E-) объем опухолей резко увеличился. Гистологический анализ образцов опухолей показал тени некротических опухолевых клеток в группе D+E+, в сравнении со смесью жизнеспособных и некротических клеток в группе D+E-. Предварительные исследования с немелкоклеточными раковыми опухолями легких человека (НМКРЛ), ксенотрансплантированными безволосым мышам, также дали очень воодушевляющие результаты при лечении ЭПТ с блеомицином.
Линия опухолевых клеток Рапс-3, линии слабо дифференцированных клеток аденокарциномы поджелудочной железы поставлялись AntiCancer, Inc., San Diego. Для экспериментов ЭПТ ткань, взятую у линейных мышей, у которых поддерживалась опухолевая линия, оттаивали и разрезали на очень маленькие кусочки размером приблизительно 1 мм каждый, и 8-10 кусочков ксенотрансплантировали хирургическим способом в подкожный мешок, созданный на левом боку безволосых мышей, и затем ушивали хирургической нитью 6.0. После того как средний размер опухоли достигал приблизительно 5 мм, мыши с пальпируемыми опухолями были разделены методом рандомизации; 10 мышей были включены в контрольную группу (D+E-; D= npenapaT, Е=электрическое поле) и 10 мышей - в группу лечения ЭПТ, а именно инъекции блеомицина с последующей импульсацией (D+E+) от генератора импульсов прямоугольных волн ВТХ Т820. Измеряли размеры опухоли и рассчитывали объем опухоли с использованием формулы
(11/6)а х b х с,
где а, b и с представляют собой соответственно длину, ширину и толщину опухоли. 0,5 единиц блеомицина (Sigma Chemicals) растворяют в 0,15 мл 0,9% NaCi и с помощью веерного введения производят инъекцию в опухоль каждой мыши и в группе контроля (D+E-), и в группе лечения (D+E+). Через 10 мин после инъекции у каждой мыши из группы D+E+ проводят импульсацию с помощью электропорообразующего устройства, генерирующего импульсы прямоугольных волн ВТХ Т820 с использованием набора электродов в виде группы иголок, как описано в настоящем изобретении. Используемые электрические параметры были следующими: сила поля 1300 В/см, 6 импульсов по 99 мкс каждый с интервалом 1 с.
(11/6)а х b х с,
где а, b и с представляют собой соответственно длину, ширину и толщину опухоли. 0,5 единиц блеомицина (Sigma Chemicals) растворяют в 0,15 мл 0,9% NaCi и с помощью веерного введения производят инъекцию в опухоль каждой мыши и в группе контроля (D+E-), и в группе лечения (D+E+). Через 10 мин после инъекции у каждой мыши из группы D+E+ проводят импульсацию с помощью электропорообразующего устройства, генерирующего импульсы прямоугольных волн ВТХ Т820 с использованием набора электродов в виде группы иголок, как описано в настоящем изобретении. Используемые электрические параметры были следующими: сила поля 1300 В/см, 6 импульсов по 99 мкс каждый с интервалом 1 с.
Ежедневно контролировали мышей с учетом смертности и отмечали признаки болезненного состояния. С равными промежутками времени измеряли размеры опухолей и контролировали замедление или ускорение роста опухолей.
Фиг. 10 показывает результаты ЭПТ различных контрольных и леченых животных с использованием блеомицина и без препарата, а также с использованием импульсации и без ее применения по поводу опухолей Рапс-3. Было резкое различие между нелечеными и лечеными мышами с точки зрения объема опухолей. Приблизительно после 24 д. лечения по существу не было выявляемой опухоли. Результаты, представленные на фиг. 10, суммированы также ниже в табл. 1 до 43 д. Иллюстрация действительной регрессии опухоли последовательно показана на фиг. 13A-13D, а соответствующая гистология на фиг.14A-14C.
Эксперимент с Рапс-3 повторяли с использованием линии клеток немелкоклеточного рака легких (НМКРЛ), 177 (AntiCancer, San Diego, CA). Результаты были аналогичны результатам, обнаруженным при использовании блеомицина и Рапс-3, как показано на фиг. 10. В одном эксперименте опухоль, которая рецидивировала, лечили на 27 д. (фиг. 12), и через 7 д. данных о наличии опухоли не было.
Модели Рапс-3 и НМКРЛ использовались с препаратом неокарциностатин (НКС) с последующей такой же процедурой, как указывалось выше. Как показано на фиг. 11А, введение НКС перед импульсацией методом, аналогичным методу, который использовался для исследований блеомицина, был совсем неэффективен в уменьшении размера опухолей. Считалось, что вследствие низкой изоэлектрической точки НКС, электростатическое взаимодействие препятствовало входу препарата в опухолевую клетку. Поэтому эксперимент повторяли, сначала воздействуя импульсацией, а после импульса - производя инъекцию НКС.
Фиг.11В показывает первоначальный объем опухоли (1), в сравнении с окончательным объемом опухоли (F) на 13 д. у 7 леченых мышей (Мышь ID 1-7). У нескольких мышей (ID 1, 2, 4 и 7) наблюдалось увеличение объема опухоли, но, как оказалось, вследствие отека. Однако, как показано на фиг.20D, когда отдельную группу из 5 мышей исследовали на 23 д., у всех мышей было обнаружено выраженное уменьшение объема опухоли.
Сравнение фиг.11А и 11В показало, что введение НКС после импульсации было более эффективно, чем введение НКС перед импульсацией.
Настоящий пример иллюстрирует, что слабо дифференцированный рак поджелудочной железы (Рапс-3) и немелкоклеточный рак легких (НМКРЛ), ксенотрансплантированные под кожу безволосым мышам, можно эффективно лечить с помощью способа ЭПТ изобретения с использованием блеомицина или НКС и электродов в виде группы иголок. При использовании способа изобретения эффективными могут быть также другие аналогичные химиотерапевтические средства.
Реакция Рапс-3 на ЭХТ блеомицином показана в табл. 2. У 68% (17/25) леченых мышей через 28 д. после лечения наблюдалась полная регрессия опухоли, в то время как через 28 д. после лечения у 20% (5/25) отмечена частичная (>80%) регрессия, у 8% (2/25) реакция не наблюдалась и 4% (1/25) умерли через 20 д. после лечения. Даже через 120 д. после лечения в 64% (16/25) случаев не наблюдалась пальпируемая опухоль. Во время наблюдения репрезентативных животных (2/17) из этой группы в течение 243 д. опухолей не было, после чего животные были гуманно умерщвлены. Однако у 8% мышей через 35 д. после лечения был отмечен повторный рост опухоли, но с гораздо более медленной скоростью.
Гистологические исследования отчетливо показали тяжелый некроз области опухоли у группы, подвергнутой ЭПТ, тогда как в контрольной группе не было очевидного некроза. Было обнаружено, что инъекция препарата в опухоль при большем объеме блеомицина в комбинации с веерным введением для максимально однородного распределения препарата по объему опухоли очень эффективна в сравнении с обычным способом инъекции препарата перед импульсацией.
Результаты in vivo при использовании MedPulserTM
Предварительные эксперименты с использованием MedPulserTM (устройство изобретения) для лечения ксенотрансплантатов опухолей, выращенных подкожно у безволосых мышей, дали обнадеживающие результаты. Приблизительно у 75% мышей, леченных с помощью ЭПТ с использованием MedPulserTM, до 39 д. наблюдения выявлена полная регрессия ксенотрансплантата опухоли поджелудочной железы человека (Panc-4). Лечение ксенотрансплантатов предстательной железы человека (РС-3) также показало полную регрессию опухолей приблизительно в 66% случаев. (До 60 д. после лечения опухоли не наблюдались). При лечении опухолей с помощью ЭПТ эффективна и 4-, и 6-игольная конфигурация.
Предварительные эксперименты с использованием MedPulserTM (устройство изобретения) для лечения ксенотрансплантатов опухолей, выращенных подкожно у безволосых мышей, дали обнадеживающие результаты. Приблизительно у 75% мышей, леченных с помощью ЭПТ с использованием MedPulserTM, до 39 д. наблюдения выявлена полная регрессия ксенотрансплантата опухоли поджелудочной железы человека (Panc-4). Лечение ксенотрансплантатов предстательной железы человека (РС-3) также показало полную регрессию опухолей приблизительно в 66% случаев. (До 60 д. после лечения опухоли не наблюдались). При лечении опухолей с помощью ЭПТ эффективна и 4-, и 6-игольная конфигурация.
Сравнение 4- и 6-игольной конфигурации MedPulserTM для экспериментов in vitro с РС-3
Эксперименты проводились для сравнения эффективности 6-игольной с 4-игольной конфигурацией MedPulserTM на РС-3 (линии клеток предстательной железы человека) in vitro. Клетки суспендируют в средах RPMI и равномерно засевают при концентрации 200 000 клеток/мл. В ячейки добавляют блеомицин при 2 х 10-5M (только для D+E- и D+E+). Клетки подвергают электропорообразованию в 24-ячеечных планшетах с использованием электродов с 6-игольной и 4-игольной конфигурацией, соединенных с MedPulser. Параметры электрических импульсов были при 6-игольной конфигурации 6 х 99 мкс, 1129 В, а при 4-игольной конфигурации - 4 х 99 мкс, 848 В. Клетки переносят в 96-ячеечные планшеты и инкубируют в течение 20 ч при 37oС. Выживание клеток определяют с использованием теста ХТТ, который основан на метаболическом превращении ХТТ в формазан и измеряется спектрофотометрически при 450 нм. Только живые клетки превращают ХТТ в формазан. Процентные величины выживания клеток представляют собой относительные величины, рассчитанные по значениям оптической плотности образца, контроля со 100% выживанием клеток (D-E-) и контроля с 0% выживания клеток (D-E- с додецилсульфатом натрия, который лизирует все клетки). Данные выживания клеток представлены в табл.3.
Эксперименты проводились для сравнения эффективности 6-игольной с 4-игольной конфигурацией MedPulserTM на РС-3 (линии клеток предстательной железы человека) in vitro. Клетки суспендируют в средах RPMI и равномерно засевают при концентрации 200 000 клеток/мл. В ячейки добавляют блеомицин при 2 х 10-5M (только для D+E- и D+E+). Клетки подвергают электропорообразованию в 24-ячеечных планшетах с использованием электродов с 6-игольной и 4-игольной конфигурацией, соединенных с MedPulser. Параметры электрических импульсов были при 6-игольной конфигурации 6 х 99 мкс, 1129 В, а при 4-игольной конфигурации - 4 х 99 мкс, 848 В. Клетки переносят в 96-ячеечные планшеты и инкубируют в течение 20 ч при 37oС. Выживание клеток определяют с использованием теста ХТТ, который основан на метаболическом превращении ХТТ в формазан и измеряется спектрофотометрически при 450 нм. Только живые клетки превращают ХТТ в формазан. Процентные величины выживания клеток представляют собой относительные величины, рассчитанные по значениям оптической плотности образца, контроля со 100% выживанием клеток (D-E-) и контроля с 0% выживания клеток (D-E- с додецилсульфатом натрия, который лизирует все клетки). Данные выживания клеток представлены в табл.3.
На основании предварительных данных, полученных в экспериментах, можно сделать вывод, что статистически и 4-, и 6-игольная конфигурация, как оказывается, одинаково эффективны в уничтожении опухолевых клеток in vitro.
ПРИМЕР 2 - Клинические испытания по поводу базально-клеточных карцином и меланом
К концу восьминедельного периода нужно было оценить эффективность воздействия блеомицина-ЭПТ на опухоли с использованием тех же критериев реакции опухолей, которые использовались в примере 1.
К концу восьминедельного периода нужно было оценить эффективность воздействия блеомицина-ЭПТ на опухоли с использованием тех же критериев реакции опухолей, которые использовались в примере 1.
Концентрация вводимого блеомицина была 5 ЕД/мл. Вводили следующие дозировки блеомицина (см. табл.4 в конце описания).
В табл.5 представлены результаты реакций на лечение.
ОЭ = отсутствие эффекта; уменьшение объема опухоли менее, чем на 50%.
ЧР = частичная реакция; уменьшение объема опухоли на 50% или более.
ПР = полная реакция; исчезновение всех показателей наличия опухоли по данным физикального обследования и/или биопсии.
ПРИМЕР 3 - ЭПТ по поводу раковых опухолей головы и шеи
Всех следующих больных лечили внутриопухолевой инъекцией блеомицина и игольными конфигурациями различных диаметров с шестью иглами. Напряжение устанавливалось для достижения номинальной силы электрического поля 1300 В/см (для получения напряжения, которое было задано для подачи на генератор, диаметр игольной конфигурации умножали на 1300). Длительность импульса была 100 мкс.
Всех следующих больных лечили внутриопухолевой инъекцией блеомицина и игольными конфигурациями различных диаметров с шестью иглами. Напряжение устанавливалось для достижения номинальной силы электрического поля 1300 В/см (для получения напряжения, которое было задано для подачи на генератор, диаметр игольной конфигурации умножали на 1300). Длительность импульса была 100 мкс.
Методы исследования
Исследование структурировалось в виде одноцентрового клинического исследования возможности применения метода лечения, в котором эффективность процедуры ЭПТ в комбинации с введением блеомицина в очаг поражения сравнивали с традиционным хирургическим способом, облучением и/или системной химиотерапией. В исследование были включены приблизительно 50 пациентов. У всех пациентов перед лечением состояние оценивали с помощью обследования и биопсии. Послеоперационная оценка состояния пациентов осуществлялась еженедельно в течение 4-6 нед. всего в течение 12 мес. Приблизительно через 8-12 нед. после лечения выполняли биопсию участка опухоли. Компьютерная томография или магнитно-резонансная визуализация использовались в соответствии со стандартным контрольным медицинским наблюдением больных раком головы и шеи.
Исследование структурировалось в виде одноцентрового клинического исследования возможности применения метода лечения, в котором эффективность процедуры ЭПТ в комбинации с введением блеомицина в очаг поражения сравнивали с традиционным хирургическим способом, облучением и/или системной химиотерапией. В исследование были включены приблизительно 50 пациентов. У всех пациентов перед лечением состояние оценивали с помощью обследования и биопсии. Послеоперационная оценка состояния пациентов осуществлялась еженедельно в течение 4-6 нед. всего в течение 12 мес. Приблизительно через 8-12 нед. после лечения выполняли биопсию участка опухоли. Компьютерная томография или магнитно-резонансная визуализация использовались в соответствии со стандартным контрольным медицинским наблюдением больных раком головы и шеи.
Оценка опухоли включает измерение диаметра опухоли (в см) и оценку ее объема (в см3). Перед введением блеомицина сульфата в опухоль участок опухоли анестезируют 1% лидокаином (ксилокаином) и 1:100,000 адреналина. Концентрация инъецируемого блеомицина сульфата составляет 4 ЕД на 1 мл вплоть до максимальной дозы 5 ЕД на опухоль. Если у одного больного проводится лечение более одной опухоли, не следует вводить общую дозу, превышающую 20 единиц на одного больного. Вводимая доза блеомицина должна составлять 1 ЕД/см3 рассчитанного объема опухоли. Приблизительно через 10 мин после инъекции блеомицина сульфата на опухоль помещают аппликатор и начинают электрическую импульсацию. Каждая подача или инициация электрических импульсов именуется циклом. Применение ЭПТ не является противопоказанием к любому последующему паллиативному лечению, требуемому индивидуумом.
В этом исследовании успех определялся как значительная регрессия опухоли в течение периода 16 нед. или менее без выраженных побочных эффектов, наблюдаемых при традиционном лечении. Существует три возможных исхода в виде реакции на лечение:
- Полная реакция (ПР): Исчезновение всех доказательств наличия опухоли по данным физикального исследования и/или биопсии.
- Полная реакция (ПР): Исчезновение всех доказательств наличия опухоли по данным физикального исследования и/или биопсии.
- Частичная реакция (ЧР): уменьшение объема опухоли на 50% или более.
- Отсутствие реакции (ОР): уменьшение объема опухоли менее чем на 50%.
Если опухоль увеличивалась в объеме (на 25% объема опухоли), при наличии показаний в соответствии с желанием больного применяли другое лечение.
Реакция индивидуума на лечение
В табл. 6 представлена реакция индивидуума на лечение. У трех лиц имелась полная реакция (Индивидуум 1, 3 и 4) ; у четырех индивидуумов имелась частичная реакция (Индивидуум 2, 6, 8 и 9) и у двух индивидуумов не было реакции (Индивидуумы 5 и 7) на лечение. Три человека умерли до достижения 12 нед. вследствие прогрессирующего заболевания или осложнений, не связанных с исследуемым лечением (Индивидуум 2, 5 и 7). Один из трех индивидуумов через 4 нед. достиг ЧР (Индивидуум 2). Два человека перед включением в исследование не получали предшествующего стационарного лечения рака по поводу их опухоли (Индивидуумы 4 и 8). У трех человек была опухоль, которая была не полностью доступной для аппликаторного компонента устройства, и поэтому они получали сегментарное лечение (Индивидуумы 5, 7-и 9).
В табл. 6 представлена реакция индивидуума на лечение. У трех лиц имелась полная реакция (Индивидуум 1, 3 и 4) ; у четырех индивидуумов имелась частичная реакция (Индивидуум 2, 6, 8 и 9) и у двух индивидуумов не было реакции (Индивидуумы 5 и 7) на лечение. Три человека умерли до достижения 12 нед. вследствие прогрессирующего заболевания или осложнений, не связанных с исследуемым лечением (Индивидуум 2, 5 и 7). Один из трех индивидуумов через 4 нед. достиг ЧР (Индивидуум 2). Два человека перед включением в исследование не получали предшествующего стационарного лечения рака по поводу их опухоли (Индивидуумы 4 и 8). У трех человек была опухоль, которая была не полностью доступной для аппликаторного компонента устройства, и поэтому они получали сегментарное лечение (Индивидуумы 5, 7-и 9).
В табл. 6 обобщены результаты клинических исследований с использованием блеомицина сульфата и ЭПТ с применением устройства изобретения MedPulserТМ.
ПРИМЕР 4 - ЭПТ низким напряжением с большой продолжительностью импульса (ННБПИ)
При обычной электрохимиотерапии для лечения опухолей используются импульсы высокого напряжения короткой продолжительности. Было установлено, что параметры электрического поля 1200-1300 В/см и 100 мкс очень эффективны in vitro и in vivo в комбинации с противораковыми препаратами, подобными блеомицину, цисплатину, пепломицину, митомицину С и карбоплатину. Эти результаты относятся к работе in vitro и in vivo. Хотя такие электрические условия хорошо переносятся пациентами в клинических ситуациях, такие виды лечения обычно вызовут мышечные судороги и изредка ощущение дискомфорта у пациентов. Обнаружено, что ощущение дискомфорта связано с индивидуальным восприятием боли пациентом. Часто в одних и тех же условиях эксперимента больные реагируют весьма по-разному. Некоторые из этих проблем можно значительно уменьшить с помощью применения для электрохимиотерапии импульсов низкого напряжения и большой длительности. По имеющимся данным (Т. Nishi et al., Cancer Res. 56: 1050-1055, 1996), самая маленькая сила поля, которую использовали для переноса гена in vivo, составляет 600 В/см. Максимальные величины силы поля, используемые в экспериментах ЭПТ in vitro, показаны в табл. 7, где сила поля, необходимая для уничтожения 50% клеток, составляет ≤50 В/см.
При обычной электрохимиотерапии для лечения опухолей используются импульсы высокого напряжения короткой продолжительности. Было установлено, что параметры электрического поля 1200-1300 В/см и 100 мкс очень эффективны in vitro и in vivo в комбинации с противораковыми препаратами, подобными блеомицину, цисплатину, пепломицину, митомицину С и карбоплатину. Эти результаты относятся к работе in vitro и in vivo. Хотя такие электрические условия хорошо переносятся пациентами в клинических ситуациях, такие виды лечения обычно вызовут мышечные судороги и изредка ощущение дискомфорта у пациентов. Обнаружено, что ощущение дискомфорта связано с индивидуальным восприятием боли пациентом. Часто в одних и тех же условиях эксперимента больные реагируют весьма по-разному. Некоторые из этих проблем можно значительно уменьшить с помощью применения для электрохимиотерапии импульсов низкого напряжения и большой длительности. По имеющимся данным (Т. Nishi et al., Cancer Res. 56: 1050-1055, 1996), самая маленькая сила поля, которую использовали для переноса гена in vivo, составляет 600 В/см. Максимальные величины силы поля, используемые в экспериментах ЭПТ in vitro, показаны в табл. 7, где сила поля, необходимая для уничтожения 50% клеток, составляет ≤50 В/см.
Следующие эксперименты in vitro с клеточными линиями различных опухолей, такими как MCF-7 (рак молочной железы человека), РС-3 (рак предстательной железы человека) и С6 (глиома крыс), показали, что с точки зрения уничтожения опухолевых клеток импульсы низкого напряжения и большой продолжительности одинаково или более эффективны, чем импульсы высокого напряжения и короткой продолжительности. Результаты проиллюстрированы в пределах MCF-7. Подбор длительности импульса показал, что она может находиться в пределах от 4 до 15 мс. Оценка реакции MCF-7 на электропорообразование проводилась и при высоком напряжении/короткой продолжительности импульса (ВНКИ), и при низком напряжении/большой продолжительности импульса (ННБПИ) с использованием теста ХТТ через 70 ч, который основан на метаболическом превращении ХТТ в формазан, который измеряется спектрофотометрически при 450 нм (M.W. Roehm, et al. . An Improved Colorimetric Assay for Cell Proliferation and Viability Utilizing the Tetrazolium Salt XTT, J. Immunol. Methods 142: 2, 257-265, 1991). XTT представляет собой тетразолиевый реактив, 2,3-бис(2-метокси-4-нитро-5-сульфофенил)-5-[(фениламино)карбонил]-2Н-тетразолий гидроксид (XTT), который метаболически восстанавливается в жизнеспособных клетках в водорастворимый продукт формазана. Процентные величины выживания клеток представляют собой относительные величины, рассчитанные с использованием формулы по значениям оптической плотности образца. (Контроль со 100% выживанием клеток (D-E) и контроль с 0% выживания клеток (D-E с додецилсульфатом натрия)). Эксперименты с ВНКИ проводились для обеспечения возможности прямого сравнения с разработанным в настоящее время способом ННБПИ ЭПТ.
Напряжение всего 25 В/см вызвало значительное цитотоксическое действие на клетки. Увеличение электрического поля привело к полному уничтожения клеток. Некоторые клеточные линии, подобные глиоме С6, которые не подвергались существенному воздействию импульсами высокого напряжения, полностью уничтожались импульсами низкого напряжения 20-30 В/см. Эти полученные in vitro результаты отчетливо устанавливают возможность использования ЭПТ формы ННБПИ.
Цитотоксичность препаратов в комбинации с ЭПТ in vitro
Результаты экспериментов ЭПТ in vitro с различными препаратами с использованием MCF-7 и при высоком напряжении, и при низком напряжении описаны ниже.
Результаты экспериментов ЭПТ in vitro с различными препаратами с использованием MCF-7 и при высоком напряжении, и при низком напряжении описаны ниже.
Клетки получали у АТСС (American Type Tissue Collection, Rockville, MD, USA) и сохраняли с помощью рекомендуемых ими методик. Клетки суспендировали в соответствующей среде и равномерно засевали в планшеты с 24/96 ячейками. Непосредственно в клеточную суспензию добавляли один из следующих препаратов: блеомицин, цисплатин, митомицин С, доксорубицин и таксол добавляли непосредственно в клеточную суспензию при конечной концентрации приблизительно от 1•10-4 (1Е-4) до 1,3•10-9 (1,3Е-9). Электрические импульсы, генерируемые порообразующим устройством с импульсами прямоугольной формы ВТХ Т 820, подавали на клеточные суспензии в микропланшетах с использованием электрода ВТХ в виде комплекта иголок, как описано здесь. В зависимости от эксперимента с помощью выключателя комплекта иголок ЕРТ-196 между двумя противоположными парами шестиугольной конфигурации подавали 6 импульсов длительностью или 100 мкс, или 10 мс и при различных номинальных электрических полях высокого напряжения или низкого напряжения. Микропланшеты инкубировали или в течение 20 ч, или 70 ч и определяли выживание клеток с помощью теста ХТТ. Некоторые результаты представлены на фиг. 15(А), 15(В), 16(A), 16(В) и 17.
Кривые, соответствующие фиг. 17, были получены с использованием MedPulserТМ.
Для режима ННБПИ способ показывает, что выживаемость клеток намного ниже 50%, даже когда на клетки подаются импульсы в отсутствие препаратов; эта процентная доля еще больше снижается, когда импульсы комбинируются с препаратами. Более желательно показать, что эффект скорее оказывают препараты, а не импульсы, и требуется выбор исходных величин выживания на уровне приблизительно 80% при использовании только импульсации. Типичные кривые уничтожения клеток в режиме ННБПИ показаны на фиг.15(А).
Хотя изобретение было описано со ссылкой на предпочтительные в настоящее время варианты реализации, следует понимать, что могут быть внесены различные модификации без отхода от сущности изобретения. Соответственно, изобретение ограничено только следующей формулой изобретения.
Claims (68)
1. Способ терапевтического электропорообразования в ткани индивидуума для введения молекул в его клетки, включающий введение системы для электропрообразования, содержащей электрически связанные компоненты: электродный аппликатор, имеющий по меньшей мере две противоположные пары электродов, расположенных в электропроводной связи с выбранной тканью, причем по меньшей мере один из электродов имеет конфигурацию иглы для проникновения в ткань и введения молекул в ткань, по меньшей мере один элемент идентификации типа для обеспечения информации об электродном аппликаторе к системе, по меньшей мере один включающий элемент, электрически соединенный с каждым электродом для направления электрических импульсов к выбранным парам электродов, а также включающий подачу электропитания к системе, введение молекул в ткань через по меньшей мере один игольчатый электрод, одновременное приложение импульсов напряжения противоположной полярности к выбранным противоположным парам электродов, причем приложенное напряжение пропорционально расстоянию между электродами в паре электродов, таким образом обеспечивается электропорообразование ткани и введение молекул в клетки ткани.
2. Способ по п. 1, в котором способ представляет собой способ in vitro.
3. Способ по п. 1, в котором способ представляет собой способ in vivo.
4. Способ по п. 1, в котором способ представляет собой способ ex vivo.
5. Способ по п. 1, в котором индивидуум является млекопитающим.
6. Способ по п. 1, в котором индивидуум является человеком.
7. Способ по п. 1, в котором молекула выбрана из группы, состоящей из химиотерапевтического средства, полинуклеотида и полипептида.
8. Способ по п. 1, в котором молекула вводится с помощью способа, выбранного из группы, состоящей из внутриопухолевого, системного или местного введения.
9. Способ по п. 7, в котором химиотерапевтическое средство выбрано из группы, состоящей из бленомицита, неокарциностатина, карбоплатина, сурамина, доксорбуцина, митомицина С и цисплатина.
10. Способ по п. 1, в котором ткань выбрана из группы, состоящей из поджелудочной железы, гортани, носоглотки, гортанной части глотки, ротоглотки, губы, горла, легких, сердца, почки, мышцы, молочной железы, толстой кишки, предстательной железы, вилочковой железы, семенников, кожи и яичников.
11. Способ по п. 1, в котором ткань представляет собой поджелудочную железу.
12. Способ по п. 10, в котором ткань представляет собой ткань рака головы и шеи.
13. Способ по п. 12, в котором ткань представляет собой ткань гортани, носоглотки, гортанной части глотки, губы или горла.
14. Способ по п. 1, в котором импульсы создают номинальное электрическое поле от приблизительно 10 до 1300 В/см.
15. Способ по п. 1, в котором импульсы создают номинальное электрическое поле от приблизительно 25 до 75 В/см.
16. Способ по п. 1, в котором импульсы создают номинальное электрическое поле от приблизительно 1000 до 1300 В/см.
17. Способ по п. 1, в котором длина импульса составляет от приблизительно 5 до 99 мс.
18. Способ электропорообразующего лечения in vivo клетки индивидуума, включающий введение системы для электропорообразования, содержащей электрически связанные компоненты: электродный аппликатор, имеющий по меньшей мере две противоположные пары электродов, расположенных в электропроводной связи с выбранной тканью, причем по меньшей мере один из электродов имеет конфигурацию иглы для проникновения в ткань и введения молекул в ткань, по меньшей мере один элемент идентификации типа для обеспечения информации об электродном аппликаторе к системе, по меньшей мере один включающий элемент, электрически соединенный с каждым электродом для направления электрических импульсов к выбранным парам электродов, а также включающий подачу электропитания к системе, введение молекул в ткань через по меньшей мере один игольчатый электрод, одновременное приложение импульсов напряжения противоположно полярности к выбранным противоположным парам электродов, причем приложенное напряжение пропорционально расстоянию между электродами в паре электродов, таким образом обеспечивается электропорообразование ткани in vivo и введение молекул в клетки ткани.
19. Способ по п. 1 или 18, в котором имеются три противоположные пары электродов, образующие шестиугольник.
20. Способ по п. 1 или 18, в котором имеются четыре противоположные пары электродов, образующие восьмиугольник.
21. Способ по п. 1 или 18, в котором имеются две противоположные пары электродов, образующие прямоугольник.
22. Способ по п. 1 или 18, в котором информацией, подаваемой к системе идентификационным элементом, является количество иголок, расстояние между ними, геометрия расположения иголок, последовательность включения иголок, заданная величина напряжения, длительность импульса, форма импульса, длительность хранения электрода, срок годности использования электрода, выявление кода ошибки, код блокировки по истечении срока годности и количества разрешенных использований.
23. Лапароскопический игольчатый аппликатор для электропорообразующей терапии, содержащий опорный стержень, кожух, окружающий опорный стержень и спрофилированный для движения относительно опорного стержня между выдвинутым положением, покрывающим дистальный конец опорного стержня, и отведенным назад положением, отрывающим дистальный конец опорного стержня, по меньшей мере две электродные иглы, приспособленные для электропорообразующей терапии и расположенные между опорным стержнем и кожухом, сжимаемый механизм, прикрепленный по меньшей мере к одной электродной игле для перемещения каждой прикрепленной электродной иглы от зачехленной конфигурации, когда кожух находится в выдвинутом положении, в развернутую конфигурацию, когда кожух находится в отведенном назад положении, причем электродные иглы имеют большее расстояние относительно друг друга в развернутой конфигурации, чем в зачехленной конфигурации.
24. Лапароскопический игольчатый аппликатор по п. 23, в котором опорный стержень представляет собой эндоскоп.
25. Способ избирательной адресации множества электродных игольчатых конфигураций, каждая из которых включает по меньшей мере четыре электродные иголки, приспособленные для электропорообразующей терапии, содержащий этапы отображения в виде карты распределения каждой электродной иголки, одной из множества электродных игольчатых конфигураций с тем, чтобы определить зоны лечения, имеющие по меньшей мере четыре стороны, подачи импульсов напряжения переменной полярности на противоположные пары электродных иголок, определяющих каждую зону лечения.
26. Способ по п. 25, в котором одна электродная игольчатая конфигурация включает 4 иглы, определяющие одну зону лечения.
27. Способ по п. 25, в котором одна электродная игольчатая конфигурация включает 9 иголок, определяющих 4 зоны лечения.
28. Способ по п. 25, в котором одна электродная игольчатая конфигурация включает 16 иголок, определяющих 9 зон лечения.
29. Способ по п. 25, в котором одна электродная игольчатая конфигурация включает 6 иголок, определяющих шестиугольную зону лечения.
30. Способ по п. 25, в котором одна электродная игольчатая конфигурация включает 8 иголок, определяющих восьмиугольную зону лечения.
31. Способ автоматической настройки схемы адресации электродной иглы для устройства электропорообразующей терапии, способного принимать множество электродных аппликаторов, имеющих различное количество электродных иголок, включающий введение элемента идентификации типа в электродном аппликаторе, имеющем ряд электродных иголок, причем элемент идентификации типа представляет ряд таких электродных иголок, соединение электродного аппликатора с устройством для электропорообразующей терапии, определение количества электродных иголок с помощью элемента идентификации типа, настройку устройства для электропорообразующей терапии для адресации определенного количества электродных иголок.
32. Способ по п. 31, кроме того включающий настройку устройства для электропорообразующей терапии для адресации определенного количества электродных иголок в отобранном типе.
33. Способ автоматической настройки параметров электрической обработки для устройства электропорообразующей терапии, способного принимать множество различных электродных аппликаторов, включающий введение элемента идентификации типа в электродном аппликаторе, причем элемент идентификации типа представляет по меньшей мере один из следующих параметров электрической обработки для использования с электродным аппликатором: заданное значение напряжения, подаваемого на иглу, длительность импульса или форму импульса, соединение электродного апплиткатора с устройством для электропорообразующей терапии, определение количества параметров электрической обработки с помощью элемента идентификации типа, настройку устройства для электропорообразующей терапии на определенные параметры электрической обработки.
34. Устройство для автоматической настройки схем адресации электродной иглы для устройства электропорообразующей терапии, способного принимать множество электродных аппликаторов, имеющих различное количество электродных аппликаторов, имеющих различные количества электродных иголок, содержащее электродный аппликатор, имеющий ряд электродных иголок, и элемент идентификации типа, причем элемент идентификации типа представляет по меньшей мере ряд таких электродных иголок, контур в устройстве электропорообразующей терапии для определения количества электродных иголок с помощью элемента идентификации типа, когда электродный аппликатор соединен с устройством электропорообазующей терапии, контур для настройки устройства электропорообразующей терапии для адресации определенного количества электродных иголок.
35. Электродный аппликатор для автоматической настройки схемы адресации электродных иголок в устройстве для электропорообразующей терапии, способном принимать множество электродных аппликаторов, имеющих различное количество электродных иголок, содержащий ряд электродных иголок в конфигурации для электропорообразующей терапии, и элемент идентификации типа в конфигурации для электрического соединения с устройством электропорообразующей терапии, причем элемент идентификации типа представляет по меньшей мере ряд таких электродных иголок, при этом элемент идентификации типа, когда электродный аппликатор соединен с устройством для электропорообразующей терапии, предоставляет элемент идентификации типа для устройства электропорообразующей терапии и позволяет устройству для элетропорообразующей терапии автоматически настраиваться для адресации определенного числа электродных иголок.
36. Электродный аппликатор для автоматической настройки параметров электрической обработки для устройства электропорообразующей терапии, способного принимать множество различных электродных аппликаторов, содержащий ряд электродных иголок для электропорообразующей терапии, элемент идентификации типа в конфигурации для электрического соединения с устройством электропорообразующей терапии, причем элемент идентификации типа представляет по меньшей мере один из следующих параметров электрической обработки для использования с электродным аппликатором: заданное значение напряжения, подаваемого на иглу, длительность импульса или форму импульса, причем элемент идентификации типа, когда электродный аппликатор соединен с устройством для электропорообразующей терапии, предоставляет элемент идентификации типа для устройства электропорообразующей терапии и позволяет устройству для электропорообразующей терапии автоматически настраиваться на определенные параметры электрической обработки.
37. Устройство для электропорообразующей терапии, содержащее источник для генерирования импульсов напряжения, соединитель для одного или множества электродных аппликаторов, имеющий различное количество электродных иголок, причем каждый электродный аппликатор содержит элемент идентификации типа, причем элемент идентификации типа представляет по меньшей мере ряд таких электродных иголок, контур для определения количества электродных иголок с помощью элемента идентификации типа, когда один такой электродный адаптер соединен с соединителем, контур для настройки устройства электропорообазующей терапии для адресации определенного количества электродных иголок и подачи генерированных импульсов напряжения на адресованные электродные иголки.
38. Устройство для электропорообразующей терапии по п. 37, кроме того содержащее устройство дистанционной активации лечения для контроля генерирования импульсов напряжения.
39. Устройство для электропорообразующей терапии по п. 38, в котором устройство дистанционной активации лечения содержит выключатель в виде ножной педали.
40. Устройство для электропорообазующей терапии, содержащее источник для генерирования импульсов напряжения, имеющий программируемые параметры электрической обработки, содержащее по меньшей мере один из заданного значения напряжения, подаваемого на иглу, длительности импульса или формы импульса, соединитель для одного из множества электродных аппликаторов, имеющий электродные иголки, причем каждый электродный аппликатор требует выбранные параметры электрической обработки, причем каждый электрод содержит элемент идентификации типа, представляющий параметры электрической обработки для использования с электродным аппликатором, контур для определения параметров электрической обработки с помощью элемента идентификации типа, когда электродный адаптер соединен с соединителем, контур для программирования параметров электрической обработки для устройства электропорообразующей терапии по параметрам электрической обработки.
41. Устройство для электропорообразующей терапии по п. 40, кроме того содержащее устройство дистанционной активации лечения для контроля генерирования импульсов напряжения.
42. Устройство для электропорообразующей терапии по п. 41, в котором устройство дистанционной активации лечения содержит включатель в виде ножной педали.
43. Электродный аппликатор для автоматической настройки параметров типа игольной конфигурации для устройства электропорообразующей терапии, способного принять множество различных электродных аппликаторов, содержащий ряд электродных иголок для электропорообразующей терапии, элемент идентификации типа в конфигурации для электрического соединения с устройством электропорообразующей терапии, причем элемент идентификации типа представляет по меньшей мере один из следующих параметров типа игольной конфигурации: количество иголок, расстояние между иголками или последовательность включения иголок, в котором элемент идентификации типа, когда электродный аппликатор соединен с устройством для электропорообразующей терапии, представляет элемент идентификации типа для устройства электропорообразующей терапии и позволяет устройству для электропорообразующей терапии автоматически реагировать на определенные параметры типа игольной конфигурации.
44. Электродный аппликатор для предоставления параметров аппликатора для устройства электропорообразующей терапии, способного принимать множество различных электродных аппликаторов, содержащий ряд электродных иголок для электропорообразующей терапии, и элемент идентификации типа в конфигурации для электрического соединения с устройством электропорообразующей терапии, причем элемент идентификации типа представляет индикацию по меньшей мере одного аппликатора параметра, в котором элемент идентификации типа, когда электродный аппликатор соединен с устройством для электропорообразующей терапии, представляет элемент идентификации типа для устройства электропорообазующей терапии и позволяет устройству для элетропорообразующей терапии реагировать на параметры аппликатора.
45. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой количество иголок в электродном аппликаторе.
46. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой расстояние между иголками в электродном аппликаторе.
47. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой последовательность включения иголок в электродном аппликаторе.
48. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой заданную величину напряжения, которое предполагается подавать на иголки в электродном аппликаторе.
49. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой длительность импульса, который предполагается подавать на иголки в электродном аппликаторе.
50. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой форму импульса, который предполагается подавать на иголки в электродном аппликаторе.
51. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой длительность хранения электродного аппликатора.
52. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой срок годности электродного аппликатора.
53. Электродный аппликатор по п. 44, кроме того содержащий вводимый активный контур, который может хранить данные электродного аппликатора.
54. Электродный аппликатор по п. 44, в котором по меньшей мере один параметр аппликатора представляет собой длительность хранения электродного аппликатора и код блокировки по истечении срока годности хранится в вводимом активном контуре, когда превышается длительность хранения.
55. Электродный аппликатор по п. 54, в котором по меньшей мере один параметр аппликатора представляет собой предел использования электродного аппликатора и код блокировки предела использования хранится в вводимом активном контуре, когда превышается предел использования.
56. Электродный аппликатор по п. 54, в котором история использования электродного аппликатора хранится в вводимом активном контуре.
57. Электродный аппликатор по п. 54, в котором собранные данные о кодах ошибки хранятся в вводимом активном контуре.
58. Способ терапевтического электропорообразования в ткани индивидуума для повреждения клеток в ней, включающий введение системы для электропорообразования, содержащей электрически связанные компоненты: электродный аппликатор, имеющий по меньшей мере две противоположные пары электродов, расположенных в электропроводной связи с выбранной тканью, причем по меньшей мере один из электродов имеет конфигурацию иглы для проникновения в ткань и введения молекул в ткань, по меньшей мере один элемент идентификации типа для обеспечения информации об электродном аппликаторе к системе, по меньшей мере один включающий элемент, электрически соединенный с каждым электродом для направления электрических импульсов к выбранным парам электродов, а также включающий введение молекул в ткань через по меньшей мере один игольчатый электрод, подачу электропитания, одновременное приложение импульсов напряжения противоположной полярности к выбранным противоположным парам электродов, причем приложенное напряжение пропорционально расстоянию между электродами в паре электродов, таким образом обеспечивается разрушение клетки ткани.
59. Способ по п. 58, в котором способ представляет собой способ iv vitro.
60. Способ по п. 58, в котором способ представляет собой способ iv vivo.
61. Способ по п. 58, в котором способ представляет собой способ eх vivo.
62. Способ по п. 58, в котором, кроме того, избирательно соединяют противоположные пары электродов с импульсным генератором.
63. Способ по п. 58, в котором ткань выбрана из группы, состоящей из поджелудочной железы, гортани, носоглотки, гортанной части глотки, ротоглотки, губы, горла, легких, сердца, почки, мышцы, молочной железы, толстой кишки, предстательной железы, вилочковой железы, семенников, кожи и яичников.
64. Способ по п. 63, в котором ткань представляет собой поджелудочную железу.
65. Способ по п. 63, в котором ткань представляет собой ткань рака головы и шеи.
66. Способ по п. 63, в котором ткань представляет собой ткань гортани, носоглотки, гортанной части глотки, губы или горла.
67. Способ по п. 58, в котором поле приложенного напряжения составляет от приблизительно 25 до 75 В/см.
68. Способ по п. 58, в котором длина импульсов составляет от приблизительно 5 до 99 мс.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/905,240 US6055453A (en) | 1997-08-01 | 1997-08-01 | Apparatus for addressing needle array electrodes for electroporation therapy |
| US08/905,240 | 1997-08-01 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU99109111A RU99109111A (ru) | 2001-04-27 |
| RU2195332C2 true RU2195332C2 (ru) | 2002-12-27 |
Family
ID=25420478
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU99109111/14A RU2195332C2 (ru) | 1997-08-01 | 1998-07-31 | Способ и устройство для использования опосредованной электропорообразованием доставки лекарственных препаратов и генов |
Country Status (14)
| Country | Link |
|---|---|
| US (5) | US6055453A (ru) |
| EP (1) | EP0999867B1 (ru) |
| JP (2) | JP2000503586A (ru) |
| KR (1) | KR100756252B1 (ru) |
| CN (2) | CN1768873B (ru) |
| AT (1) | ATE480294T1 (ru) |
| AU (1) | AU734343B2 (ru) |
| BR (1) | BR9806069A (ru) |
| CA (1) | CA2268026C (ru) |
| DE (1) | DE69841888D1 (ru) |
| HK (1) | HK1027049A1 (ru) |
| RU (1) | RU2195332C2 (ru) |
| TW (1) | TW396043B (ru) |
| WO (1) | WO1999006101A1 (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012178095A1 (en) * | 2011-06-22 | 2012-12-27 | Ifluidics, Inc. | Electromotive system for high-throughput screening |
Families Citing this family (366)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6602248B1 (en) * | 1995-06-07 | 2003-08-05 | Arthro Care Corp. | Methods for repairing damaged intervertebral discs |
| WO2003024506A2 (en) * | 2001-09-14 | 2003-03-27 | Arthrocare Corporation | Methods and apparatus for treating intervertebral discs |
| US20050004634A1 (en) * | 1995-06-07 | 2005-01-06 | Arthrocare Corporation | Methods for electrosurgical treatment of spinal tissue |
| IL125756A (en) | 1996-02-15 | 2003-05-29 | Biosense Inc | Catheter for use in surgery |
| US6726684B1 (en) * | 1996-07-16 | 2004-04-27 | Arthrocare Corporation | Methods for electrosurgical spine surgery |
| US7357798B2 (en) * | 1996-07-16 | 2008-04-15 | Arthrocare Corporation | Systems and methods for electrosurgical prevention of disc herniations |
| US6708066B2 (en) * | 1999-12-10 | 2004-03-16 | Ewa Herbst | Electrochemical treatment of tissues, especially tumors |
| US20060089751A1 (en) * | 1997-01-27 | 2006-04-27 | Ewa Herbst | Electronic delivery systems and methods with feedback |
| JP4664450B2 (ja) | 1997-06-30 | 2011-04-06 | アンステイテユ・ギユスタブ・ルシー | 多細胞化真核生物細胞に核酸を導入する改良法およびその組合せ |
| DE69826124T3 (de) | 1997-06-30 | 2007-10-11 | Institut Gustave Roussy | Verabreichung der nukleinsäure in den quergestreiften muskel |
| US6778853B1 (en) * | 1997-12-17 | 2004-08-17 | University Of South Florida | Electroporation device |
| US6208893B1 (en) | 1998-01-27 | 2001-03-27 | Genetronics, Inc. | Electroporation apparatus with connective electrode template |
| US7749215B1 (en) | 1998-02-05 | 2010-07-06 | Biosense, Inc. | Intracardiac cell delivery and cell transplantation |
| DE69838526T2 (de) | 1998-02-05 | 2008-07-03 | Biosense Webster, Inc., Diamond Bar | Gerät zum Freisetzen eines Medikaments im Herzen |
| US20030129750A1 (en) * | 1998-02-05 | 2003-07-10 | Yitzhack Schwartz | Homing of donor cells to a target zone in tissue using active therapeutics or substances |
| US20030113303A1 (en) * | 1998-02-05 | 2003-06-19 | Yitzhack Schwartz | Homing of embryonic stem cells to a target zone in tissue using active therapeutics or substances |
| US6045532A (en) * | 1998-02-20 | 2000-04-04 | Arthrocare Corporation | Systems and methods for electrosurgical treatment of tissue in the brain and spinal cord |
| CA2626830A1 (en) | 1998-02-24 | 1999-08-26 | Boston Scientific Limited | High flow rate dialysis catheters and related methods |
| US6022316A (en) * | 1998-03-06 | 2000-02-08 | Spectrx, Inc. | Apparatus and method for electroporation of microporated tissue for enhancing flux rates for monitoring and delivery applications |
| US6347247B1 (en) | 1998-05-08 | 2002-02-12 | Genetronics Inc. | Electrically induced vessel vasodilation |
| WO1999063049A1 (de) * | 1998-05-29 | 1999-12-09 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Neues verfahren zum transfer von biologischem material |
| AU760619B2 (en) * | 1998-06-26 | 2003-05-22 | Genetronics, Inc. | Synergism of photodynamic and electropermeation effects on cell vitality as a novel cytotoxic agent |
| US6678556B1 (en) * | 1998-07-13 | 2004-01-13 | Genetronics, Inc. | Electrical field therapy with reduced histopathological change in muscle |
| US7922709B2 (en) | 1998-07-13 | 2011-04-12 | Genetronics, Inc. | Enhanced delivery of naked DNA to skin by non-invasive in vivo electroporation |
| JP2003505114A (ja) | 1998-07-13 | 2003-02-12 | ジェネトロニクス、インコーポレーテッド | パルス電場による皮膚および筋肉を標的とした遺伝子治療 |
| EP1109594B1 (en) | 1998-08-31 | 2004-10-27 | Johnson & Johnson Consumer Companies, Inc. | Electrotransport device comprising blades |
| US6217895B1 (en) | 1999-03-22 | 2001-04-17 | Control Delivery Systems | Method for treating and/or preventing retinal diseases with sustained release corticosteroids |
| US6678558B1 (en) * | 1999-03-25 | 2004-01-13 | Genetronics, Inc. | Method and apparatus for reducing electroporation-mediated muscle reaction and pain response |
| WO2000056395A1 (en) | 1999-03-25 | 2000-09-28 | Genetronics, Inc. | Method and apparatus for reducing electroporation-mediated muscle reaction and pain response |
| US6678554B1 (en) | 1999-04-16 | 2004-01-13 | Johnson & Johnson Consumer Companies, Inc. | Electrotransport delivery system comprising internal sensors |
| US6514762B1 (en) | 1999-04-23 | 2003-02-04 | New Mexico State University Technology Transfer Corporation | Delivery of nucleotides by electrochemical release |
| US6221071B1 (en) * | 1999-06-04 | 2001-04-24 | Scimed Life Systems, Inc. | Rapid electrode deployment |
| US6256533B1 (en) * | 1999-06-09 | 2001-07-03 | The Procter & Gamble Company | Apparatus and method for using an intracutaneous microneedle array |
| US7074747B1 (en) * | 1999-07-01 | 2006-07-11 | Johnson & Johnson Consumer Companies, Inc. | Cleansing compositions |
| US20050009717A1 (en) * | 1999-07-01 | 2005-01-13 | Lukenbach Elvin R. | Foaming make-up removing cleansing compositions |
| US6762158B2 (en) | 1999-07-01 | 2004-07-13 | Johnson & Johnson Consumer Companies, Inc. | Personal care compositions comprising liquid ester mixtures |
| WO2001001949A1 (en) | 1999-07-01 | 2001-01-11 | Johnson And Johnson Consumer Companies, Inc. | Cleansing compositions |
| US6300108B1 (en) * | 1999-07-21 | 2001-10-09 | The Regents Of The University Of California | Controlled electroporation and mass transfer across cell membranes |
| US6326177B1 (en) | 1999-08-04 | 2001-12-04 | Eastern Virginia Medical School Of The Medical College Of Hampton Roads | Method and apparatus for intracellular electro-manipulation |
| US6237604B1 (en) | 1999-09-07 | 2001-05-29 | Scimed Life Systems, Inc. | Systems and methods for preventing automatic identification of re-used single use devices |
| US6387092B1 (en) * | 1999-09-07 | 2002-05-14 | Scimed Life Systems, Inc. | Systems and methods to identify and disable re-used single use devices based on time elapsed from first therapeutic use |
| US6651669B1 (en) | 1999-09-07 | 2003-11-25 | Scimed Life Systems, Inc. | Systems and methods to identify and disable re-used single use devices based on cataloging catheter usage |
| US6611793B1 (en) | 1999-09-07 | 2003-08-26 | Scimed Life Systems, Inc. | Systems and methods to identify and disable re-use single use devices based on detecting environmental changes |
| US6587718B2 (en) * | 1999-10-08 | 2003-07-01 | Scimed Life Systems, Inc. | Iontophoretic delivery to heart tissue |
| US6556869B1 (en) | 1999-12-01 | 2003-04-29 | Vertis Neuroscience, Inc. | Electrode introducer for a percutaneous electrical therapy system |
| US6549810B1 (en) | 1999-12-01 | 2003-04-15 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system with electrode depth control |
| US6912424B2 (en) * | 1999-12-01 | 2005-06-28 | Meagan, Medical, Inc. | Apparatus and method for coupling therapeutic and/or monitoring equipment to a patient |
| US6516226B1 (en) | 1999-12-01 | 2003-02-04 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system for minimizing electrode insertion discomfort |
| US6539264B1 (en) | 1999-12-01 | 2003-03-25 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system with sharp point protection |
| US6560491B1 (en) | 1999-12-01 | 2003-05-06 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system providing electrode axial support |
| US6493592B1 (en) * | 1999-12-01 | 2002-12-10 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system with electrode position maintenance |
| US6522927B1 (en) | 1999-12-01 | 2003-02-18 | Vertis Neuroscience, Inc. | Electrode assembly for a percutaneous electrical therapy system |
| US6549797B1 (en) | 1999-12-01 | 2003-04-15 | Vertis Neuroscience, Inc. | Electrode remover for a percutaneous electrical therapy system |
| US6542780B1 (en) | 1999-12-01 | 2003-04-01 | Vertis Neuroscience, Inc. | Method and apparatus for electrically coupling a percutaneous probe |
| US6622051B1 (en) | 1999-12-01 | 2003-09-16 | Vertis Neuroscience, Inc. | Percutaneous electrical therapy system with electrode entry angle control |
| US6904324B2 (en) * | 1999-12-01 | 2005-06-07 | Meagan Medical, Inc. | Method and apparatus for deploying a percutaneous probe |
| KR100406729B1 (ko) * | 2000-02-15 | 2003-11-21 | 사회복지법인삼성생명공익재단(삼성서울병원) | 생리학적 전기신호에 동조화된 의료기기 |
| US8175698B2 (en) * | 2000-02-17 | 2012-05-08 | Novocure Ltd. | Treating bacteria with electric fields |
| US7890183B2 (en) * | 2000-02-17 | 2011-02-15 | Novocure Ltd. | Treating parasites with electric fields |
| US8447395B2 (en) * | 2000-02-17 | 2013-05-21 | Novocure Ltd | Treating bacteria with electric fields |
| US7146210B2 (en) * | 2000-02-17 | 2006-12-05 | Standen Ltd. | Apparatus and method for optimizing tumor treatment efficiency by electric fields |
| US7089054B2 (en) * | 2002-10-02 | 2006-08-08 | Standen Ltd. | Apparatus and method for treating a tumor or the like |
| CA2400526C (en) | 2000-02-17 | 2013-04-23 | Yoram Palti | Method and apparatus for destroying dividing cells |
| US6868289B2 (en) * | 2002-10-02 | 2005-03-15 | Standen Ltd. | Apparatus for treating a tumor or the like and articles incorporating the apparatus for treatment of the tumor |
| US7136699B2 (en) * | 2002-10-02 | 2006-11-14 | Standen, Ltd. | Apparatus for destroying dividing cells |
| US7599746B2 (en) | 2000-02-17 | 2009-10-06 | Standen Ltd | Apparatus and method for preventing the spread of cancerous metastases and for elimination of metastases |
| US7016725B2 (en) * | 2001-11-06 | 2006-03-21 | Standen Ltd. | Method and apparatus for destroying dividing cells |
| US6375972B1 (en) | 2000-04-26 | 2002-04-23 | Control Delivery Systems, Inc. | Sustained release drug delivery devices, methods of use, and methods of manufacturing thereof |
| WO2001093930A1 (en) * | 2000-06-02 | 2001-12-13 | The University Of Utah Research Foundation | Active needle devices with integrated functionality |
| US7588554B2 (en) * | 2000-06-26 | 2009-09-15 | Boston Scientific Scimed, Inc. | Method and apparatus for treating ischemic tissue |
| USRE44145E1 (en) | 2000-07-07 | 2013-04-09 | A.V. Topchiev Institute Of Petrochemical Synthesis | Preparation of hydrophilic pressure sensitive adhesives having optimized adhesive properties |
| US6795728B2 (en) | 2001-08-17 | 2004-09-21 | Minnesota Medical Physics, Llc | Apparatus and method for reducing subcutaneous fat deposits by electroporation |
| US6892099B2 (en) | 2001-02-08 | 2005-05-10 | Minnesota Medical Physics, Llc | Apparatus and method for reducing subcutaneous fat deposits, virtual face lift and body sculpturing by electroporation |
| US6697670B2 (en) * | 2001-08-17 | 2004-02-24 | Minnesota Medical Physics, Llc | Apparatus and method for reducing subcutaneous fat deposits by electroporation with improved comfort of patients |
| US8251986B2 (en) * | 2000-08-17 | 2012-08-28 | Angiodynamics, Inc. | Method of destroying tissue cells by eletroporation |
| US7118555B2 (en) * | 2000-09-21 | 2006-10-10 | Meagan Medical, Inc. | Method and apparatus for repositioning a percutaneous probe |
| US20030158545A1 (en) * | 2000-09-28 | 2003-08-21 | Arthrocare Corporation | Methods and apparatus for treating back pain |
| US6671557B1 (en) | 2000-10-10 | 2003-12-30 | Meagan Medical, Inc. | System and method for providing percutaneous electrical therapy |
| US6846306B1 (en) * | 2000-10-10 | 2005-01-25 | Cold Spring Harbor Laboratory | Single cell electroporation |
| US7131987B2 (en) | 2000-10-16 | 2006-11-07 | Corium International, Inc. | Microstructures and method for treating and conditioning skin which cause less irritation during exfoliation |
| US7828827B2 (en) | 2002-05-24 | 2010-11-09 | Corium International, Inc. | Method of exfoliation of skin using closely-packed microstructures |
| US7108681B2 (en) * | 2000-10-16 | 2006-09-19 | Corium International, Inc. | Microstructures for delivering a composition cutaneously to skin |
| US6821274B2 (en) | 2001-03-07 | 2004-11-23 | Gendel Ltd. | Ultrasound therapy for selective cell ablation |
| WO2002040093A2 (en) | 2000-11-17 | 2002-05-23 | Gendel Limited | Ablation of cells using combined electric field and ultrasound therapy |
| US20050043726A1 (en) * | 2001-03-07 | 2005-02-24 | Mchale Anthony Patrick | Device II |
| US6663820B2 (en) * | 2001-03-14 | 2003-12-16 | The Procter & Gamble Company | Method of manufacturing microneedle structures using soft lithography and photolithography |
| US6625486B2 (en) | 2001-04-11 | 2003-09-23 | Advanced Cardiovascular Systems, Inc. | Method and apparatus for intracellular delivery of an agent |
| US8728445B2 (en) * | 2001-05-01 | 2014-05-20 | A.V. Topchiev Institute Of Petrochemical Synthesis, Russian Academy Of Sciences | Hydrogel Compositions |
| US8541021B2 (en) * | 2001-05-01 | 2013-09-24 | A.V. Topchiev Institute Of Petrochemical Synthesis | Hydrogel compositions demonstrating phase separation on contact with aqueous media |
| US8206738B2 (en) | 2001-05-01 | 2012-06-26 | Corium International, Inc. | Hydrogel compositions with an erodible backing member |
| US20050215727A1 (en) * | 2001-05-01 | 2005-09-29 | Corium | Water-absorbent adhesive compositions and associated methods of manufacture and use |
| DE60239528D1 (de) * | 2001-05-01 | 2011-05-05 | Corium International Redwood City | Zweiphasige, wasserabsorbierende bioadhäsive zusammenstezung |
| US8840918B2 (en) | 2001-05-01 | 2014-09-23 | A. V. Topchiev Institute of Petrochemical Synthesis, Russian Academy of Sciences | Hydrogel compositions for tooth whitening |
| US20050113510A1 (en) | 2001-05-01 | 2005-05-26 | Feldstein Mikhail M. | Method of preparing polymeric adhesive compositions utilizing the mechanism of interaction between the polymer components |
| US6733485B1 (en) | 2001-05-25 | 2004-05-11 | Advanced Bionics Corporation | Microstimulator-based electrochemotherapy methods and systems |
| ITTO20010534A1 (it) * | 2001-06-04 | 2002-12-04 | Igea Srl | Dispositivo e metodo per elettroporazione che riduce la contrazione muscolare e la sensazione di dolore. |
| US7127284B2 (en) * | 2001-06-11 | 2006-10-24 | Mercator Medsystems, Inc. | Electroporation microneedle and methods for its use |
| US20040204669A1 (en) * | 2001-07-05 | 2004-10-14 | Hofmann Gunter A. | Apparatus for electroporation mediated delivery for drugs and genes |
| US7130697B2 (en) * | 2002-08-13 | 2006-10-31 | Minnesota Medical Physics Llc | Apparatus and method for the treatment of benign prostatic hyperplasia |
| US6994706B2 (en) | 2001-08-13 | 2006-02-07 | Minnesota Medical Physics, Llc | Apparatus and method for treatment of benign prostatic hyperplasia |
| USRE42016E1 (en) | 2001-08-13 | 2010-12-28 | Angiodynamics, Inc. | Apparatus and method for the treatment of benign prostatic hyperplasia |
| US7879610B1 (en) * | 2001-08-24 | 2011-02-01 | University Of South Florida | Electroporation system and method for facilitating entry of molecules into cells in vivo |
| US7713740B2 (en) * | 2001-08-24 | 2010-05-11 | University Of South Florida | Method of using electric fields to facilitate the entry of molecules into cells in vivo |
| US20040087992A1 (en) * | 2002-08-09 | 2004-05-06 | Vladimir Gartstein | Microstructures for delivering a composition cutaneously to skin using rotatable structures |
| EP1444004B1 (en) * | 2001-10-18 | 2011-12-14 | Uroplasty, Inc. | Electro-nerve stimulator system and methods |
| FR2831026B1 (fr) * | 2001-10-18 | 2004-05-28 | Commissariat Energie Atomique | Dispositif et procede de traitement par champ electrique pulse d'une substance en ecoulement colonisee par des organismes indesirables |
| US8812114B2 (en) | 2001-10-18 | 2014-08-19 | Uroplasty, Inc. | Lead set for nerve stimulator and method of operation thereof |
| DE60217393T2 (de) * | 2001-11-27 | 2007-10-18 | Cellectricon Ab | Verfahren zur kombinierten parallelen zuführung von agentien und elektroporation für zellstrukturen und verwendung davon |
| AU2002360540A1 (en) * | 2001-12-04 | 2003-06-17 | University Of Southern California | Method for intracellular modifications within living cells using pulsed electric fields |
| EP2368635A3 (en) * | 2002-02-12 | 2012-03-07 | Cellectricon Ab | Systems and methods for rapidly changing the solution environment around sensors |
| JP2005530695A (ja) * | 2002-02-15 | 2005-10-13 | ザイコス インク. | 生理活性物質を細胞内に導入するエレクトロポレーション法 |
| US7245963B2 (en) * | 2002-03-07 | 2007-07-17 | Advisys, Inc. | Electrode assembly for constant-current electroporation and use |
| PT1480720T (pt) * | 2002-03-07 | 2018-11-23 | Inovio Pharmaceuticals Inc | Conjunto de elétrodos para eletroporação de corrente constante e uso |
| US8209006B2 (en) * | 2002-03-07 | 2012-06-26 | Vgx Pharmaceuticals, Inc. | Constant current electroporation device and methods of use |
| WO2003082007A2 (en) * | 2002-03-22 | 2003-10-09 | The Regent Of The University Of California | Method and apparatus for using an electromagnetic field in cellular transplantation |
| US7218962B2 (en) * | 2002-03-29 | 2007-05-15 | Boston Scientific Scimed, Inc. | Magnetically enhanced injection catheter |
| US6912417B1 (en) | 2002-04-05 | 2005-06-28 | Ichor Medical Systmes, Inc. | Method and apparatus for delivery of therapeutic agents |
| AU2003223351A1 (en) | 2002-04-16 | 2003-11-03 | Cyto Pulse Sciences, Inc. | Method of treating biological materials with translating electrical fields and electrode polarity reversal |
| US20030204161A1 (en) * | 2002-04-25 | 2003-10-30 | Bozidar Ferek-Petric | Implantable electroporation therapy device and method for using same |
| US8871241B2 (en) | 2002-05-07 | 2014-10-28 | Psivida Us, Inc. | Injectable sustained release delivery devices |
| JP2005526579A (ja) * | 2002-05-23 | 2005-09-08 | ジェンデル・リミテッド | 焼灼デバイス |
| US10130415B2 (en) * | 2002-06-10 | 2018-11-20 | Wisconsin Alumni Research Foundation | Circumferential electrode array for tissue ablation |
| US7328064B2 (en) * | 2002-07-04 | 2008-02-05 | Inovio As | Electroporation device and injection apparatus |
| US20050070841A1 (en) * | 2002-07-04 | 2005-03-31 | Inovio As | Electroporation device and injection apparatus |
| US20040127893A1 (en) * | 2002-12-13 | 2004-07-01 | Arthrocare Corporation | Methods for visualizing and treating intervertebral discs |
| US6997903B2 (en) * | 2003-02-10 | 2006-02-14 | Bandula Wijay | Local drug delivery catheter |
| US7578954B2 (en) * | 2003-02-24 | 2009-08-25 | Corium International, Inc. | Method for manufacturing microstructures having multiple microelements with through-holes |
| US7794456B2 (en) * | 2003-05-13 | 2010-09-14 | Arthrocare Corporation | Systems and methods for electrosurgical intervertebral disc replacement |
| US6969604B1 (en) | 2003-06-20 | 2005-11-29 | Yakovenko Sergey A | Electroporation chamber |
| GB0322766D0 (en) * | 2003-09-29 | 2003-10-29 | Emcision Ltd | Surgical resection device |
| US7708733B2 (en) | 2003-10-20 | 2010-05-04 | Arthrocare Corporation | Electrosurgical method and apparatus for removing tissue within a bone body |
| US8500713B2 (en) * | 2003-10-29 | 2013-08-06 | Medtronic, Inc. | Implantable electroporation therapy device and method for using same |
| US8298222B2 (en) | 2003-12-24 | 2012-10-30 | The Regents Of The University Of California | Electroporation to deliver chemotherapeutics and enhance tumor regression |
| AU2004311842C1 (en) * | 2003-12-24 | 2011-01-06 | The Regents Of The University Of California | Tissue ablation with irreversible electroporation |
| KR20070007299A (ko) | 2004-01-30 | 2007-01-15 | 코리움 인터네셔널, 인크. | 활성제의 전달을 위한 급속 용해 필름 |
| FR2867054B1 (fr) * | 2004-03-04 | 2006-09-15 | Future Medical System | Systeme d'endoscopie et connecteur a detecteur de pression destine a un tel systeme |
| HUE025052T2 (en) | 2004-03-08 | 2016-01-28 | Ichor Medical Systems Inc | A sharpened device for electrically mediated delivery of medical substances |
| EP1737357B1 (en) * | 2004-03-24 | 2019-12-11 | Corium, Inc. | Transdermal delivery device |
| WO2005092433A1 (en) * | 2004-03-25 | 2005-10-06 | University College Cork - National University Of Ireland, Cork | Apparatus for prophylaxis or treatment of tissue |
| JP4443278B2 (ja) * | 2004-03-26 | 2010-03-31 | テルモ株式会社 | 拡張体付カテーテル |
| EP1742588B1 (en) | 2004-04-01 | 2016-10-19 | The General Hospital Corporation | Apparatus for dermatological treatment and tissue reshaping |
| US20050226991A1 (en) * | 2004-04-07 | 2005-10-13 | Hossainy Syed F | Methods for modifying balloon of a catheter assembly |
| CA2562699C (en) | 2004-04-16 | 2015-07-21 | Critical Care Innovations, Inc. | Systems and methods for improving image-guided tissue ablation |
| CA2563817C (en) * | 2004-04-23 | 2018-07-10 | Yoram Palti | Treating a tumor or the like with electric fields at different frequencies |
| TW200613554A (en) | 2004-06-17 | 2006-05-01 | Wyeth Corp | Plasmid having three complete transcriptional units and immunogenic compositions for inducing an immune response to HIV |
| FR2880808A1 (fr) | 2005-01-20 | 2006-07-21 | Yves Scherman | Dispositif pour l'administration de principe actif aux cellules et tissus a l'aide d'electrodes de surface non invasives |
| FR2872055B1 (fr) | 2004-06-24 | 2008-02-08 | Yves Leon Scherman | Dispositif pour le transfert de molecules aux cellules utilisant une force d'origine physique et combinaison permettant la mise en oeuvre du procede |
| FR2872056B1 (fr) | 2004-06-24 | 2007-08-10 | Yves Scherman | Dispositif pour l'administration de principe actif aux cellules et tissus utilisant une ou deux forces physiques |
| EP1786514B1 (fr) | 2004-06-24 | 2015-01-07 | Sphergen | Dispositif our le transfert de molecules aux cellules utilisant une force electrique |
| CN103497713B (zh) * | 2004-08-05 | 2018-07-17 | 考里安国际公司 | 粘合剂组合物 |
| ATE463277T1 (de) * | 2004-12-07 | 2010-04-15 | Standen Ltd | Elektroden zum anlegen eines elektrischen felds in vivo über einen längeren zeitraum |
| EP1833554A2 (en) * | 2004-12-27 | 2007-09-19 | Standen Ltd. | Treating a tumor or the like with electric fields at different orientations |
| WO2007012907A2 (en) * | 2005-02-08 | 2007-02-01 | Allen, John | Electric therapy machine |
| US7850645B2 (en) * | 2005-02-11 | 2010-12-14 | Boston Scientific Scimed, Inc. | Internal medical devices for delivery of therapeutic agent in conjunction with a source of electrical power |
| AU2006226753A1 (en) * | 2005-03-19 | 2006-09-28 | The Regents Of The University Of California | Ultra low strength electric field network-mediated ex vivo gene, protein and drug delivery in cells |
| US20060264752A1 (en) * | 2005-04-27 | 2006-11-23 | The Regents Of The University Of California | Electroporation controlled with real time imaging |
| CA2612866A1 (en) * | 2005-05-11 | 2006-11-23 | Corium International, Inc. | Permeabilization of biological membranes |
| WO2006137401A1 (ja) * | 2005-06-20 | 2006-12-28 | Nippon Telegraph And Telephone Corporation | ダイヤモンド半導体素子およびその製造方法 |
| US20060293725A1 (en) * | 2005-06-24 | 2006-12-28 | Boris Rubinsky | Methods and systems for treating fatty tissue sites using electroporation |
| US20060293730A1 (en) | 2005-06-24 | 2006-12-28 | Boris Rubinsky | Methods and systems for treating restenosis sites using electroporation |
| US20060293731A1 (en) * | 2005-06-24 | 2006-12-28 | Boris Rubinsky | Methods and systems for treating tumors using electroporation |
| US8114070B2 (en) * | 2005-06-24 | 2012-02-14 | Angiodynamics, Inc. | Methods and systems for treating BPH using electroporation |
| EP1908057B1 (en) * | 2005-06-30 | 2012-06-20 | LG Electronics Inc. | Method and apparatus for decoding an audio signal |
| US20070066934A1 (en) * | 2005-09-19 | 2007-03-22 | Transport Pharmaceuticals, Inc. | Electrokinetic delivery system and methods therefor |
| JP2009520509A (ja) | 2005-10-03 | 2009-05-28 | ノヴォキュアー・リミテッド | 増殖細胞における電場の効果を増大させるための電場の最適化特性 |
| US20070156135A1 (en) * | 2006-01-03 | 2007-07-05 | Boris Rubinsky | System and methods for treating atrial fibrillation using electroporation |
| US20080045880A1 (en) * | 2006-02-11 | 2008-02-21 | Rune Kjeken | Device and method for single-needle in vivo electroporation |
| US20080287857A1 (en) * | 2006-02-11 | 2008-11-20 | Rune Kjeken | Device and method for single-needle in vivo electroporation |
| US10369359B2 (en) | 2006-02-11 | 2019-08-06 | Genetronics, Inc. | Device and method for single-needle in vivo electroporation |
| US7879034B2 (en) | 2006-03-02 | 2011-02-01 | Arthrocare Corporation | Internally located return electrode electrosurgical apparatus, system and method |
| CA2644163C (en) | 2006-03-03 | 2020-05-05 | Genetronics, Inc. | Method and device for treating microscopic residual tumors remaining in tissues following surgical resection |
| US20070232984A1 (en) * | 2006-03-30 | 2007-10-04 | Michael Lovell | Hand-held electrical stimulation device |
| US8019414B2 (en) | 2006-04-05 | 2011-09-13 | Novocure Ltd. | Treating cancer using electromagnetic fields in combination with other treatment regimens |
| WO2007117651A2 (en) * | 2006-04-07 | 2007-10-18 | University Of South Florida | Passive electric field focus system for in vivo and in vitro applications |
| US7856272B2 (en) * | 2006-04-28 | 2010-12-21 | Flint Hills Scientific, L.L.C. | Implantable interface for a medical device system |
| US7668598B2 (en) | 2006-05-18 | 2010-02-23 | Uroplasty, Inc. | Method and apparatus for stimulating a nerve of a patient |
| AU2007260354B2 (en) * | 2006-06-12 | 2014-01-23 | Region Hovedstaden V/Herlev Hospital | Electrode introducer device |
| US20090281475A1 (en) * | 2006-06-22 | 2009-11-12 | Koninklijke Philips Electronics N.V. | Iontophoretic electrotransport device |
| EP2068975A4 (en) * | 2006-08-08 | 2013-10-30 | Peak Biosciences Inc | CATHETER AND ARRAY FOR ANTIQUE THERAPY |
| EP2076313A4 (en) * | 2006-10-16 | 2012-07-25 | Univ California | PREDETERMINED CONDUCTIVITY GELS FOR IRREVERSIBLE ELECTROPORATION OF FABRICS |
| WO2008048632A1 (en) | 2006-10-17 | 2008-04-24 | Vgx Pharmaceuticals, Inc. | Electroporation devices and methods of using same for electroporation of cells in mammals |
| WO2008118212A2 (en) * | 2006-11-08 | 2008-10-02 | Veritas, Llc | In vivo delivery of double stranded rna to a target cell |
| US20080132884A1 (en) * | 2006-12-01 | 2008-06-05 | Boris Rubinsky | Systems for treating tissue sites using electroporation |
| US8821446B2 (en) * | 2007-01-22 | 2014-09-02 | Corium International, Inc. | Applicators for microneedles |
| WO2009044289A1 (en) | 2007-03-06 | 2009-04-09 | Novocure Ltd. | Treating cancer using electromagnetic fields in combination with photodynamic therapy |
| US20110135569A1 (en) * | 2007-03-20 | 2011-06-09 | Peak Biosciences Inc. | Method for therapeutic administration of radionucleosides |
| EP2146689B1 (en) | 2007-04-16 | 2020-08-12 | Corium, Inc. | Solvent-cast microneedle arrays containing active |
| WO2008140808A1 (en) * | 2007-05-10 | 2008-11-20 | Peak Biosciences, Inc. | Methods for administration of radiotherapeutic agents |
| US20080312648A1 (en) * | 2007-06-12 | 2008-12-18 | Darion Peterson | Fat removal and sculpting device |
| WO2009048607A1 (en) * | 2007-10-10 | 2009-04-16 | Corium International, Inc. | Vaccine delivery via microneedle arrays |
| CN101888874B (zh) * | 2007-10-11 | 2013-11-13 | 京畿州海莱乌医院 | 用于改进的电场控制的电穿孔装置 |
| JP5178132B2 (ja) * | 2007-10-11 | 2013-04-10 | キヤノン株式会社 | 画像処理システム並びに画像処理方法 |
| US20100004623A1 (en) * | 2008-03-27 | 2010-01-07 | Angiodynamics, Inc. | Method for Treatment of Complications Associated with Arteriovenous Grafts and Fistulas Using Electroporation |
| US20090247933A1 (en) * | 2008-03-27 | 2009-10-01 | The Regents Of The University Of California; Angiodynamics, Inc. | Balloon catheter method for reducing restenosis via irreversible electroporation |
| JP5744719B2 (ja) * | 2008-04-04 | 2015-07-08 | ザ トラスティーズ オブ ザ ユニバーシティ オブ ペンシルバニア | チクングニヤウィルスタンパク質の共通配列、これをコードする核酸分子、並びにこれを使用する組成物および方法 |
| CN105535961A (zh) * | 2008-04-04 | 2016-05-04 | 宾夕法尼亚大学托管会 | 使用il-28和组合物的疫苗和免疫治疗及其使用方法 |
| US10117707B2 (en) | 2008-04-29 | 2018-11-06 | Virginia Tech Intellectual Properties, Inc. | System and method for estimating tissue heating of a target ablation zone for electrical-energy based therapies |
| US9198733B2 (en) | 2008-04-29 | 2015-12-01 | Virginia Tech Intellectual Properties, Inc. | Treatment planning for electroporation-based therapies |
| US9283051B2 (en) | 2008-04-29 | 2016-03-15 | Virginia Tech Intellectual Properties, Inc. | System and method for estimating a treatment volume for administering electrical-energy based therapies |
| US10238447B2 (en) | 2008-04-29 | 2019-03-26 | Virginia Tech Intellectual Properties, Inc. | System and method for ablating a tissue site by electroporation with real-time monitoring of treatment progress |
| US10702326B2 (en) | 2011-07-15 | 2020-07-07 | Virginia Tech Intellectual Properties, Inc. | Device and method for electroporation based treatment of stenosis of a tubular body part |
| US10245098B2 (en) | 2008-04-29 | 2019-04-02 | Virginia Tech Intellectual Properties, Inc. | Acute blood-brain barrier disruption using electrical energy based therapy |
| US9598691B2 (en) | 2008-04-29 | 2017-03-21 | Virginia Tech Intellectual Properties, Inc. | Irreversible electroporation to create tissue scaffolds |
| US8926606B2 (en) * | 2009-04-09 | 2015-01-06 | Virginia Tech Intellectual Properties, Inc. | Integration of very short electric pulses for minimally to noninvasive electroporation |
| US8992517B2 (en) | 2008-04-29 | 2015-03-31 | Virginia Tech Intellectual Properties Inc. | Irreversible electroporation to treat aberrant cell masses |
| US9867652B2 (en) | 2008-04-29 | 2018-01-16 | Virginia Tech Intellectual Properties, Inc. | Irreversible electroporation using tissue vasculature to treat aberrant cell masses or create tissue scaffolds |
| US10272178B2 (en) | 2008-04-29 | 2019-04-30 | Virginia Tech Intellectual Properties Inc. | Methods for blood-brain barrier disruption using electrical energy |
| US11254926B2 (en) | 2008-04-29 | 2022-02-22 | Virginia Tech Intellectual Properties, Inc. | Devices and methods for high frequency electroporation |
| US11272979B2 (en) | 2008-04-29 | 2022-03-15 | Virginia Tech Intellectual Properties, Inc. | System and method for estimating tissue heating of a target ablation zone for electrical-energy based therapies |
| US8348938B2 (en) * | 2008-05-06 | 2013-01-08 | Old Dominian University Research Foundation | Apparatus, systems and methods for treating a human tissue condition |
| WO2009137800A2 (en) | 2008-05-09 | 2009-11-12 | Angiodynamics, Inc. | Electroporation device and method |
| US8849395B2 (en) | 2008-05-30 | 2014-09-30 | Boston Scientific Scimed, Inc. | Guide catheter having vasomodulating electrodes |
| US9173704B2 (en) * | 2008-06-20 | 2015-11-03 | Angiodynamics, Inc. | Device and method for the ablation of fibrin sheath formation on a venous catheter |
| WO2010008834A2 (en) * | 2008-06-23 | 2010-01-21 | Angiodynamics, Inc. | Treatment devices and methods |
| US20100152725A1 (en) * | 2008-12-12 | 2010-06-17 | Angiodynamics, Inc. | Method and system for tissue treatment utilizing irreversible electroporation and thermal track coagulation |
| WO2010083035A2 (en) * | 2009-01-14 | 2010-07-22 | Corium International, Inc. | Transdermal administration of tamsulosin |
| US8753335B2 (en) * | 2009-01-23 | 2014-06-17 | Angiodynamics, Inc. | Therapeutic energy delivery device with rotational mechanism |
| KR100943089B1 (ko) * | 2009-01-23 | 2010-02-18 | 강동환 | 피부처치 장치 |
| US8231603B2 (en) * | 2009-02-10 | 2012-07-31 | Angiodynamics, Inc. | Irreversible electroporation and tissue regeneration |
| US11638603B2 (en) | 2009-04-09 | 2023-05-02 | Virginia Tech Intellectual Properties, Inc. | Selective modulation of intracellular effects of cells using pulsed electric fields |
| US11382681B2 (en) | 2009-04-09 | 2022-07-12 | Virginia Tech Intellectual Properties, Inc. | Device and methods for delivery of high frequency electrical pulses for non-thermal ablation |
| AU2010238605B2 (en) * | 2009-04-24 | 2015-10-29 | Corium Pharma Solutions, Inc. | Methods for manufacturing microprojection arrays |
| USD630321S1 (en) | 2009-05-08 | 2011-01-04 | Angio Dynamics, Inc. | Probe handle |
| US20100298825A1 (en) * | 2009-05-08 | 2010-11-25 | Cellutions, Inc. | Treatment System With A Pulse Forming Network For Achieving Plasma In Tissue |
| US8903488B2 (en) | 2009-05-28 | 2014-12-02 | Angiodynamics, Inc. | System and method for synchronizing energy delivery to the cardiac rhythm |
| US9895189B2 (en) | 2009-06-19 | 2018-02-20 | Angiodynamics, Inc. | Methods of sterilization and treating infection using irreversible electroporation |
| WO2011030322A2 (en) * | 2009-09-10 | 2011-03-17 | University College Cork - National University Of Ireland, Cork | A device for treating tissue |
| CN102821790A (zh) | 2009-09-14 | 2012-12-12 | 宾夕法尼亚大学托管会 | 包含IL-15受体α和/或编码IL-15受体α的核酸分子的疫苗和免疫治疗剂,以及其使用方法 |
| US20110118732A1 (en) | 2009-11-19 | 2011-05-19 | The Regents Of The University Of California | Controlled irreversible electroporation |
| US11097099B2 (en) * | 2010-03-01 | 2021-08-24 | Inovio Pharmaceuticals, Inc. | Multiple tissue layer electroporation applicator and device |
| CA2798145C (en) | 2010-05-04 | 2022-10-18 | Corium International, Inc. | Method and device for transdermal delivery of parathyroid hormone using a microprojection array |
| US8979838B2 (en) | 2010-05-24 | 2015-03-17 | Arthrocare Corporation | Symmetric switching electrode method and related system |
| US9289606B2 (en) * | 2010-09-02 | 2016-03-22 | St. Jude Medical, Atrial Fibrillation Division, Inc. | System for electroporation therapy |
| EP2621522A2 (en) | 2010-09-27 | 2013-08-07 | China Agricultural University | Combined antigen and dna vaccine for preventing and treating autoimmune diseases |
| US9700368B2 (en) | 2010-10-13 | 2017-07-11 | Angiodynamics, Inc. | System and method for electrically ablating tissue of a patient |
| WO2012088149A2 (en) | 2010-12-20 | 2012-06-28 | Virginia Tech Intellectual Properties, Inc. | High-frequency electroporation for cancer therapy |
| US20120220813A1 (en) * | 2011-01-25 | 2012-08-30 | Sanford Lane | Devices and methods for applying energy to a muscular layer |
| WO2012158132A1 (en) | 2011-05-18 | 2012-11-22 | Eteka Llc | Apparatus for the enhancement of food properties by electroporation or pulsed electric fields |
| US9457183B2 (en) | 2011-06-15 | 2016-10-04 | Tripep Ab | Injection needle and device |
| KR102436439B1 (ko) | 2011-06-28 | 2022-08-25 | 이노비오 파마수티컬즈, 인크. | 최소 침습 피부 전기천공 장치 |
| KR101955365B1 (ko) | 2011-07-12 | 2019-03-07 | 필라델피아 헬스 앤드 에듀케이션 코포레이션 디/비/에이 드렉셀 유니버시티 컬리지 오브 메디슨 | 신규한 클로스트리듐 디피실(Clostridium Difficile) DNA 백신 |
| CN102334988B (zh) * | 2011-07-28 | 2013-07-03 | 河海大学常州校区 | 手动组合式微电极推进器及制作方法 |
| AU2012308205A1 (en) | 2011-09-16 | 2014-03-13 | The Trustees Of The University Of Pennsylvania | RNA engineered T cells for the treatment of cancer |
| WO2013044225A1 (en) | 2011-09-22 | 2013-03-28 | The Trustees Of The University Of Pennsylvania | A universal immune receptor expressed by t cells for the targeting of diverse and multiple antigens |
| US9078665B2 (en) | 2011-09-28 | 2015-07-14 | Angiodynamics, Inc. | Multiple treatment zone ablation probe |
| US9272002B2 (en) | 2011-10-28 | 2016-03-01 | The Trustees Of The University Of Pennsylvania | Fully human, anti-mesothelin specific chimeric immune receptor for redirected mesothelin-expressing cell targeting |
| CN108095821B (zh) | 2011-11-08 | 2021-05-25 | 波士顿科学西美德公司 | 孔部肾神经消融 |
| CN103169510B (zh) * | 2011-12-20 | 2016-07-06 | 刘兴鹏 | 用于治疗房颤的化学消融装置 |
| US9414881B2 (en) | 2012-02-08 | 2016-08-16 | Angiodynamics, Inc. | System and method for increasing a target zone for electrical ablation |
| CN103239734B (zh) | 2012-02-10 | 2016-02-24 | 北京艾棣维欣生物技术有限公司 | 用于预防和/或治疗呼吸道合胞病毒感染的疫苗 |
| CA2864688C (en) | 2012-02-22 | 2023-09-05 | The Trustees Of The University Of Pennsylvania | Use of icos-based cars to enhance antitumor activity and car persistence |
| MX2014010185A (es) | 2012-02-22 | 2014-11-14 | Univ Pennsylvania | Uso de dominio de señalizacion cd2 en receptores de antigeno quimericos de segunda generacion. |
| ES2786263T3 (es) | 2012-07-13 | 2020-10-09 | Univ Pennsylvania | Mejora de la actividad de los CAR de linfocitos T mediante la introducción conjunta de un anticuerpo biespecífico |
| WO2014055442A2 (en) | 2012-10-01 | 2014-04-10 | The Trustees Of The University Of Pennsylvania | Compositions and methods for targeting stromal cells for the treatment of cancer |
| WO2014055771A1 (en) | 2012-10-05 | 2014-04-10 | The Trustees Of The University Of Pennsylvania | Human alpha-folate receptor chimeric antigen receptor |
| US10117896B2 (en) | 2012-10-05 | 2018-11-06 | The Trustees Of The University Of Pennsylvania | Use of a trans-signaling approach in chimeric antigen receptors |
| AU2013358947B2 (en) | 2012-12-13 | 2016-10-20 | Inovio Pharmaceuticals, Inc. | WT1 vaccine |
| AU2013364053B2 (en) | 2012-12-21 | 2018-08-30 | Corium Pharma Solutions, Inc. | Microarray for delivery of therapeutic agent and methods of use |
| CN105142711B (zh) | 2013-03-12 | 2019-01-22 | 考里安国际公司 | 微突起施加器 |
| CA2906541C (en) | 2013-03-15 | 2022-06-21 | Corium International, Inc. | Microarray for delivery of therapeutic agent and methods of use |
| JP2016512754A (ja) | 2013-03-15 | 2016-05-09 | コリウム インターナショナル, インコーポレイテッド | 治療剤の送達のためのマイクロアレイ、使用方法および製造方法 |
| US10384045B2 (en) | 2013-03-15 | 2019-08-20 | Corium, Inc. | Microarray with polymer-free microstructures, methods of making, and methods of use |
| JP6689187B2 (ja) | 2013-03-15 | 2020-04-28 | コリウム, インコーポレイテッド | 複数の衝突微小突起アプリケータおよび使用方法 |
| WO2014160886A2 (en) * | 2013-03-27 | 2014-10-02 | Washington State University | Systems and methods for treating material surfaces |
| US10364451B2 (en) | 2013-05-30 | 2019-07-30 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| EP3003342B1 (en) | 2013-05-30 | 2022-01-26 | Duke University | Enzyme-catalyzed synthesis of site-specific and stoichiometric biomolecule-polymer conjugates |
| US10392611B2 (en) | 2013-05-30 | 2019-08-27 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| JP6692294B2 (ja) | 2013-07-31 | 2020-05-13 | バイオベンチャーズ・リミテッド・ライアビリティ・カンパニーBioVentures, LLC | 腫瘍関連糖鎖抗原を標的として癌を治療及び予防するための組成物及び方法 |
| KR101582988B1 (ko) * | 2013-09-30 | 2016-01-06 | (주)휴먼드림 | 전립선 고주파 치료기 |
| EP3054972B1 (en) | 2013-10-07 | 2019-02-27 | The Trustees Of The University Of Pennsylvania | Vaccines with interleukin-33 as an adjuvant |
| US10370664B2 (en) | 2013-11-07 | 2019-08-06 | University Of Southern California | Use of IKK epsilon inhibitors to activate NFAT and T cell response |
| EP3068427A1 (en) | 2013-11-14 | 2016-09-21 | The Trustees Of The University Of Pennsylvania | Hiv-1 env dna vaccine plus protein boost |
| IL276210B2 (en) | 2013-11-29 | 2024-01-01 | Inovio Pharmaceuticals Inc | MERS-COV vaccine |
| CA3156357A1 (en) | 2014-01-06 | 2015-07-09 | The Trustees Of The University Of Pennsylvania | Pd1 and pdl1 antibodies and vaccine combinations and use of same for immunotherapy |
| US10166321B2 (en) | 2014-01-09 | 2019-01-01 | Angiodynamics, Inc. | High-flow port and infusion needle systems |
| ES2963718T3 (es) | 2014-01-21 | 2024-04-01 | Novartis Ag | Capacidad presentadora de antígenos de células CAR-T potenciada mediante introducción conjunta de moléculas co-estimuladoras |
| CN103861202B (zh) * | 2014-03-18 | 2016-06-01 | 苏州壹达生物科技有限公司 | 一种利用空心电极针电穿孔给药的装置 |
| US12070601B2 (en) * | 2014-03-28 | 2024-08-27 | Pinnacle Bionics. Inc. | Stimulation system for exercising diaphragm and method of operation thereof |
| CN112807074A (zh) | 2014-05-12 | 2021-05-18 | 弗吉尼亚暨州立大学知识产权公司 | 电穿孔系统 |
| US12114911B2 (en) | 2014-08-28 | 2024-10-15 | Angiodynamics, Inc. | System and method for ablating a tissue site by electroporation with real-time pulse monitoring |
| US10624843B2 (en) | 2014-09-04 | 2020-04-21 | Corium, Inc. | Microstructure array, methods of making, and methods of use |
| AU2015323944B2 (en) | 2014-10-01 | 2018-11-29 | Inovio Pharmaceuticals, Inc. | Vaccines having an antigen and interleukin-21 as an adjuvant |
| CN114836385A (zh) | 2014-10-31 | 2022-08-02 | 宾夕法尼亚大学董事会 | 改变cart细胞中的基因表达及其用途 |
| CA2966035A1 (en) | 2014-10-31 | 2016-05-06 | The Trustees Of The University Of Pennsylvania | Compositions and methods of stimulating and expanding t cells |
| US10694972B2 (en) | 2014-12-15 | 2020-06-30 | Virginia Tech Intellectual Properties, Inc. | Devices, systems, and methods for real-time monitoring of electrophysical effects during tissue treatment |
| KR102698184B1 (ko) | 2015-01-29 | 2024-08-23 | 더 트러스티스 오브 더 유니버시티 오브 펜실바니아 | 관문 억제제 및 백신 조합 및 면역요법을 위한 이들의 사용 |
| WO2016122738A1 (en) | 2015-01-31 | 2016-08-04 | The Trustees Of The University Of Pennsylvania | Compositions and methods for t cell delivery of therapeutic molecules |
| WO2016154530A1 (en) | 2015-03-26 | 2016-09-29 | Duke University | Targeted therapeutic agents comprising multivalent protein-biopolymer fusions |
| RU2754661C2 (ru) | 2015-05-01 | 2021-09-06 | Дзе Реджентс Оф Дзе Юниверсити Оф Калифорния | Гликанзависимые иммунотерапевтические молекулы |
| US10857093B2 (en) | 2015-06-29 | 2020-12-08 | Corium, Inc. | Microarray for delivery of therapeutic agent, methods of use, and methods of making |
| CN108463244B (zh) | 2015-08-04 | 2022-05-27 | 杜克大学 | 用于递送的基因编码的固有无序隐形聚合物及其使用方法 |
| EP3340998B1 (en) | 2015-08-28 | 2023-01-11 | The Trustees of the University of Pennsylvania | Methods and compositions for cells expressing a chimeric intracellular signaling molecule |
| KR101788301B1 (ko) * | 2015-09-17 | 2017-10-20 | 주식회사 엘림텍 | 전기천공장치 및 그 제어방법 |
| WO2017070196A1 (en) * | 2015-10-21 | 2017-04-27 | The Methodist Hospital System | Cellular vectors for delivery of therapeutics |
| WO2017112825A2 (en) | 2015-12-21 | 2017-06-29 | Duke University | Polymer conjugates having reduced antigenicity and methods of using the same |
| US11752213B2 (en) | 2015-12-21 | 2023-09-12 | Duke University | Surfaces having reduced non-specific binding and antigenicity |
| KR102711822B1 (ko) | 2015-12-30 | 2024-09-30 | 이노비오 파마수티컬즈, 인크. | 락-아웃 시스템으로 분리가능한 바늘 어레이를 갖는 전기천공 디바이스 |
| US11549099B2 (en) | 2016-03-23 | 2023-01-10 | Novartis Ag | Cell secreted minibodies and uses thereof |
| EA202191975A2 (ru) | 2016-03-28 | 2022-03-31 | Айкор Медикэл Системс, Инк. | Устройство для доставки терапевтических средств |
| WO2017173398A1 (en) | 2016-04-01 | 2017-10-05 | Duke University | Alpha-helical peptide nanofibers as a self-adjuvanting vaccine platform |
| KR102443064B1 (ko) | 2016-04-29 | 2022-09-14 | 이노비오 파마수티컬즈, 인크. | 제제의 전달을 향상시키기 위한 콘드로이티나제 및/또는 히알루로니다제의 생체내 용도 |
| WO2017210476A1 (en) | 2016-06-01 | 2017-12-07 | Duke University | Nonfouling biosensors |
| US10233419B2 (en) | 2016-06-30 | 2019-03-19 | Zymergen Inc. | Apparatuses and methods for electroporation |
| JP2018035137A (ja) | 2016-07-13 | 2018-03-08 | マブイミューン ダイアグノスティックス エイジーMabimmune Diagnostics Ag | 新規な抗線維芽細胞活性化タンパク質(fap)結合薬剤およびその使用 |
| EP3512868A4 (en) | 2016-09-14 | 2020-04-15 | Duke University | NANOPARTICLES BASED ON TRIBLOCK POLYPEPTIDE FOR THE DELIVERY OF HYDROPHILIC DRUGS |
| US11155584B2 (en) | 2016-09-23 | 2021-10-26 | Duke University | Unstructured non-repetitive polypeptides having LCST behavior |
| EP3532819B1 (en) * | 2016-10-31 | 2021-08-25 | Agilent Technologies, Inc. | Deparaffinization of tissue by electric field generation and ionization |
| US10905492B2 (en) | 2016-11-17 | 2021-02-02 | Angiodynamics, Inc. | Techniques for irreversible electroporation using a single-pole tine-style internal device communicating with an external surface electrode |
| US10376495B2 (en) | 2016-11-23 | 2019-08-13 | University Of South Florida | Small molecules that mimic or antagonize actions of granulocyte colony-stimulating-factor (G-CSF) |
| WO2018119090A1 (en) | 2016-12-22 | 2018-06-28 | Ohio State Innovation Foundation | Interpentrating microstructures for nanochannel-based cargo delivery |
| US11648200B2 (en) | 2017-01-12 | 2023-05-16 | Duke University | Genetically encoded lipid-polypeptide hybrid biomaterials that exhibit temperature triggered hierarchical self-assembly |
| CN107212920A (zh) * | 2017-01-23 | 2017-09-29 | 杭州安杰思医学科技有限公司 | 内窥镜用处理装置、内窥镜、及扩展支架 |
| US10813935B2 (en) | 2017-02-23 | 2020-10-27 | Transgenex Nanobiotech, Inc. | Methods and compositions for treating drug resistance in cancer |
| US11318155B2 (en) | 2017-02-24 | 2022-05-03 | University Of South Florida | Hsp90 activator Aha1 drives production of pathological tau aggregates |
| US10272052B2 (en) | 2017-02-24 | 2019-04-30 | University Of South Florida | Compositions and methods for the treatment of tauopathies |
| US11554097B2 (en) | 2017-05-15 | 2023-01-17 | Duke University | Recombinant production of hybrid lipid-biopolymer materials that self-assemble and encapsulate agents |
| US11680083B2 (en) | 2017-06-30 | 2023-06-20 | Duke University | Order and disorder as a design principle for stimuli-responsive biopolymer networks |
| GB201710973D0 (en) | 2017-07-07 | 2017-08-23 | Avacta Life Sciences Ltd | Scaffold proteins |
| SE541651C2 (en) * | 2017-07-28 | 2019-11-19 | Scandinavian Chemotech Ab | An electrode device and a needle electrode for use in delivery of electrical pulses to a desired tissue of a mammal |
| US10850095B2 (en) | 2017-08-08 | 2020-12-01 | Pulse Biosciences, Inc. | Treatment of tissue by the application of energy |
| US11590345B2 (en) | 2017-08-08 | 2023-02-28 | Pulse Biosciences, Inc. | Treatment of tissue by the application of energy |
| US10857347B2 (en) | 2017-09-19 | 2020-12-08 | Pulse Biosciences, Inc. | Treatment instrument and high-voltage connectors for robotic surgical system |
| US11607537B2 (en) | 2017-12-05 | 2023-03-21 | Virginia Tech Intellectual Properties, Inc. | Method for treating neurological disorders, including tumors, with electroporation |
| CN118383863A (zh) | 2017-12-26 | 2024-07-26 | 盖能适治疗股份有限公司 | 用于各种应用的能量输送的优化 |
| EP3684399A1 (en) | 2017-12-29 | 2020-07-29 | Cellectis | Method for improving production of car t cells |
| US11925405B2 (en) | 2018-03-13 | 2024-03-12 | Virginia Tech Intellectual Properties, Inc. | Treatment planning system for immunotherapy enhancement via non-thermal ablation |
| US11311329B2 (en) | 2018-03-13 | 2022-04-26 | Virginia Tech Intellectual Properties, Inc. | Treatment planning for immunotherapy based treatments using non-thermal ablation techniques |
| US11525759B2 (en) | 2018-04-24 | 2022-12-13 | Agilent Technologies, Inc. | Deparaffinization of tissue utilizing electric field |
| KR20210018228A (ko) | 2018-05-02 | 2021-02-17 | 온코섹 메디컬 인코포레이티드 | 전기천공 시스템, 방법, 및 장치 |
| EP3829622A4 (en) | 2018-08-02 | 2022-05-11 | Duke University | DUAL AGONIST FUSION PROTEINS |
| US20220170097A1 (en) | 2018-10-29 | 2022-06-02 | The Broad Institute, Inc. | Car t cell transcriptional atlas |
| WO2020094622A1 (en) * | 2018-11-05 | 2020-05-14 | Region Hovedstaden V/Herlev Hospital | An electrode assembly for improved electric field distribution |
| US20220054827A1 (en) | 2018-12-13 | 2022-02-24 | Newsouth Innovations Pty Limited | Method and system for controlling molecular electrotransfer |
| US11571569B2 (en) | 2019-02-15 | 2023-02-07 | Pulse Biosciences, Inc. | High-voltage catheters for sub-microsecond pulsing |
| WO2020191102A1 (en) | 2019-03-18 | 2020-09-24 | The Broad Institute, Inc. | Type vii crispr proteins and systems |
| US11090336B2 (en) | 2019-03-27 | 2021-08-17 | The Trustees Of The University Of Pennsylvania | Tn-MUC1 chimeric antigen receptor (CAR) T cell therapy |
| WO2020209961A1 (en) | 2019-04-08 | 2020-10-15 | Udayan Patel | Inflatable balloon over catheter with bypass passageway |
| US11950835B2 (en) | 2019-06-28 | 2024-04-09 | Virginia Tech Intellectual Properties, Inc. | Cycled pulsing to mitigate thermal damage for multi-electrode irreversible electroporation therapy |
| US11512314B2 (en) | 2019-07-12 | 2022-11-29 | Duke University | Amphiphilic polynucleotides |
| CN114364433A (zh) | 2019-08-30 | 2022-04-15 | 诺沃库勒有限责任公司 | 向颈部输送肿瘤治疗场(TTFields) |
| WO2021074695A1 (en) | 2019-10-16 | 2021-04-22 | Avacta Life Sciences Limited | PD-L1 INHIBITOR - TGFβ INHIBITOR BISPECIFIC DRUG MOIETIES. |
| CN110946642A (zh) * | 2019-12-13 | 2020-04-03 | 天津市鹰泰利安康医疗科技有限责任公司 | 一种高频双极性不可恢复电穿孔系统 |
| IL295697A (en) | 2020-02-25 | 2022-10-01 | Inovio Pharmaceuticals Inc | Vaccines against corona virus and methods of use |
| CA3174103A1 (en) | 2020-03-06 | 2021-09-10 | Go Therapeutics, Inc. | Anti-glyco-cd44 antibodies and their uses |
| WO2021191871A1 (en) | 2020-03-27 | 2021-09-30 | Dcprime B.V. | In vivo use of modified cells of leukemic origin for enhancing the efficacy of adoptive cell therapy |
| EP4127139A1 (en) | 2020-03-27 | 2023-02-08 | Mendus B.V. | Ex vivo use of modified cells of leukemic origin for enhancing the efficacy of adoptive cell therapy |
| AU2021271860A1 (en) | 2020-05-14 | 2022-12-15 | Inovio Pharmaceuticals, Inc. | Vaccines for recurrent respiratory papillomatosis and methods of using the same |
| GB202101299D0 (en) | 2020-06-09 | 2021-03-17 | Avacta Life Sciences Ltd | Diagnostic polypetides and methods |
| CA3181680A1 (en) | 2020-06-12 | 2021-12-16 | University Of Rochester | Encoding and expression of ace-trnas |
| EP4210832A1 (en) | 2020-09-14 | 2023-07-19 | Vor Biopharma, Inc. | Chimeric antigen receptors for treatment of cancer |
| AU2021375493A1 (en) | 2020-11-05 | 2023-06-29 | Mendus B.V. | Use of tumor-independent antigens in immunotherapies |
| EP4301782A1 (en) | 2021-03-05 | 2024-01-10 | Go Therapeutics, Inc. | Anti-glyco-cd44 antibodies and their uses |
| JP2024510989A (ja) | 2021-03-12 | 2024-03-12 | メンドゥス・ベスローテン・フェンノートシャップ | ワクチン接種方法及びcd47遮断薬の使用 |
| WO2022234003A1 (en) | 2021-05-07 | 2022-11-10 | Avacta Life Sciences Limited | Cd33 binding polypeptides with stefin a protein |
| WO2023010118A1 (en) | 2021-07-29 | 2023-02-02 | Vor Biopharma Inc. | Nfat-responsive reporter systems for assessing chimeric antigen receptor activation and methods of making and using the same |
| WO2023010126A2 (en) | 2021-07-29 | 2023-02-02 | Vor Biopharma Inc. | Chimeric antigen receptors for treatment of cancer |
| AU2022324456A1 (en) | 2021-08-05 | 2024-02-15 | Go Therapeutics, Inc. | Anti-glyco-muc4 antibodies and their uses |
| CA3230934A1 (en) | 2021-09-03 | 2023-03-09 | Go Therapeutics, Inc. | Anti-glyco-cmet antibodies and their uses |
| JP2024534910A (ja) | 2021-09-03 | 2024-09-26 | ジーオー セラピューティクス,インコーポレイテッド | 抗グリコlamp1抗体およびその使用 |
| EP4412711A1 (en) | 2021-10-07 | 2024-08-14 | Avacta Life Sciences Limited | Serum half-life extended pd-l1 binding polypeptides |
| TW202334196A (zh) | 2021-10-07 | 2023-09-01 | 英商阿法克塔生命科學有限公司 | Pd-l1結合多肽 |
| WO2023150753A1 (en) | 2022-02-07 | 2023-08-10 | University Of Rochester | Optimized sequences for enhanced trna expression or/and nonsense mutation suppression |
| KR20230121575A (ko) | 2022-02-10 | 2023-08-18 | 주식회사 아피셀테라퓨틱스 | Cd40l에 특이적으로 결합하는 스테핀 a 단백질 변이체 및 이의 용도 |
| US20240002800A1 (en) | 2022-05-16 | 2024-01-04 | Mendus B.V. | Use of leukemia-derived cells for enhancing natural killer (nk) cell therapy |
| WO2024102187A1 (en) | 2022-11-07 | 2024-05-16 | Pinetree Therapeutics, Inc. | Combination therapy comprising bispecific antibodies comprising an nrp1 binding domain |
| WO2024129459A1 (en) | 2022-12-16 | 2024-06-20 | University Of Rochester | Repairmen! of barrier dysfunction in esophagus |
Family Cites Families (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE863111C (de) | 1951-07-03 | 1953-01-15 | Walter Hallegger | Instrument zur transkutanen und subkutanen Erwaermung und Iontophorese und Verfahrenzu seiner Anwendung |
| DE2800039C2 (de) | 1978-01-02 | 1984-06-20 | Horst Dr.Med. 6700 Ludwigshafen Kief | Akupunkturgerät |
| US5421819A (en) * | 1992-08-12 | 1995-06-06 | Vidamed, Inc. | Medical probe device |
| US5370675A (en) * | 1992-08-12 | 1994-12-06 | Vidamed, Inc. | Medical probe device and method |
| US4712559A (en) * | 1985-06-28 | 1987-12-15 | Bsd Medical Corporation | Local current capacitive field applicator for interstitial array |
| US4931046A (en) * | 1987-05-15 | 1990-06-05 | Newman Martin H | Iontophoresis drug delivery system |
| US5389069A (en) * | 1988-01-21 | 1995-02-14 | Massachusetts Institute Of Technology | Method and apparatus for in vivo electroporation of remote cells and tissue |
| EP0398960B1 (en) * | 1988-01-21 | 1995-12-06 | Massachusetts Institute Of Technology | Transport of molecules across tissue using electroporation |
| US5749847A (en) | 1988-01-21 | 1998-05-12 | Massachusetts Institute Of Technology | Delivery of nucleotides into organisms by electroporation |
| US5547467A (en) | 1988-01-21 | 1996-08-20 | Massachusettes Institute Of Technology | Method for rapid temporal control of molecular transport across tissue |
| US4860752A (en) * | 1988-02-18 | 1989-08-29 | Bsd Medical Corporation | Invasive microwave array with destructive and coherent phase |
| EP0346513A1 (de) | 1988-06-15 | 1989-12-20 | Etama Ag | Anordnung zur Elektrotherapie |
| ES2012944A6 (es) | 1989-01-09 | 1990-04-16 | Tomas Justribo Jose Ramon | Procedimiento y su dispositivo para la admionistracion de farmacos mediante ionoforesis, para tratamiento loco-regionales. |
| CS275292B2 (en) | 1989-02-22 | 1992-02-19 | Cvut Fakulta Elektrotechnick | Private rehabilitation apparatus with ion transcutaneous acceleration |
| US6001617A (en) | 1989-06-07 | 1999-12-14 | Queen's University At Kingston | Electroporation device and method of use |
| US5215088A (en) | 1989-11-07 | 1993-06-01 | The University Of Utah | Three-dimensional electrode device |
| DE4000893A1 (de) | 1990-01-15 | 1991-07-18 | Bosch Gmbh Robert | Mehrkanaliges geraet zur elektrostimulation |
| US5620481A (en) * | 1991-07-05 | 1997-04-15 | Desai; Jawahar M. | Device for multi-phase radio-frequency ablation |
| US5328451A (en) | 1991-08-15 | 1994-07-12 | Board Of Regents, The University Of Texas System | Iontophoretic device and method for killing bacteria and other microbes |
| PT101031B (pt) | 1991-11-05 | 2002-07-31 | Transkaryotic Therapies Inc | Processo para o fornecimento de proteinas por terapia genetica |
| US5425752A (en) | 1991-11-25 | 1995-06-20 | Vu'nguyen; Dung D. | Method of direct electrical myostimulation using acupuncture needles |
| US5545130A (en) * | 1992-04-08 | 1996-08-13 | Genetronics, Inc. | Flow through electroporation method |
| US5507724A (en) | 1992-07-01 | 1996-04-16 | Genetronics, Inc. | Electroporation and iontophoresis apparatus and method for insertion of drugs and genes into cells |
| US5304120A (en) | 1992-07-01 | 1994-04-19 | Btx Inc. | Electroporation method and apparatus for insertion of drugs and genes into endothelial cells |
| US5514131A (en) | 1992-08-12 | 1996-05-07 | Stuart D. Edwards | Method for the ablation treatment of the uvula |
| US5273525A (en) * | 1992-08-13 | 1993-12-28 | Btx Inc. | Injection and electroporation apparatus for drug and gene delivery |
| US5688233A (en) * | 1992-08-17 | 1997-11-18 | Genetronics, Inc. | Electronincorporation enhanced transdermal delivery of molecules |
| US5468223A (en) * | 1992-11-30 | 1995-11-21 | C.N.R.S. Paris | Electrochemotherapy |
| JPH08506259A (ja) * | 1993-02-02 | 1996-07-09 | ヴィーダメッド インコーポレイテッド | 経尿道ニードル切除装置および方法 |
| FR2703253B1 (fr) * | 1993-03-30 | 1995-06-23 | Centre Nat Rech Scient | Applicateur d'impulsions electriques pour traitement de tissus biologiques. |
| US5702359A (en) * | 1995-06-06 | 1997-12-30 | Genetronics, Inc. | Needle electrodes for mediated delivery of drugs and genes |
| US5439440A (en) * | 1993-04-01 | 1995-08-08 | Genetronics, Inc. | Electroporation system with voltage control feedback for clinical applications |
| US5993434A (en) | 1993-04-01 | 1999-11-30 | Genetronics, Inc. | Method of treatment using electroporation mediated delivery of drugs and genes |
| WO1994027670A1 (en) | 1993-06-02 | 1994-12-08 | Cardiac Pathways Corporation | Catheter having tip with fixation means |
| US5551426A (en) * | 1993-07-14 | 1996-09-03 | Hummel; John D. | Intracardiac ablation and mapping catheter |
| US5536267A (en) * | 1993-11-08 | 1996-07-16 | Zomed International | Multiple electrode ablation apparatus |
| US5814599A (en) | 1995-08-04 | 1998-09-29 | Massachusetts Insitiute Of Technology | Transdermal delivery of encapsulated drugs |
| US5571083A (en) * | 1994-02-18 | 1996-11-05 | Lemelson; Jerome H. | Method and system for cell transplantation |
| IL108775A (en) * | 1994-02-25 | 2003-09-17 | Univ Ramot | Method for efficient incorporation of molecules into cells |
| US5728094A (en) * | 1996-02-23 | 1998-03-17 | Somnus Medical Technologies, Inc. | Method and apparatus for treatment of air way obstructions |
| US5786454A (en) | 1994-09-16 | 1998-07-28 | Washington University School Of Medicine | Modified SH2 domains |
| US5645526A (en) * | 1994-09-30 | 1997-07-08 | Becton Dickinson And Company | Apparatus and method for ensuring compatibility of a reusable iontophoretic controller with an iontophoretic patch |
| US5720921A (en) | 1995-03-10 | 1998-02-24 | Entremed, Inc. | Flow electroporation chamber and method |
| US5868740A (en) * | 1995-03-24 | 1999-02-09 | Board Of Regents-Univ Of Nebraska | Method for volumetric tissue ablation |
| US5810762A (en) * | 1995-04-10 | 1998-09-22 | Genetronics, Inc. | Electroporation system with voltage control feedback for clinical applications |
| US5780052A (en) | 1995-04-24 | 1998-07-14 | Northeastern University | Compositions and methods useful for inhibiting cell death and for delivering an agent into a cell |
| US5789213A (en) | 1995-05-11 | 1998-08-04 | Health Research Inc. | Method and compositions for high efficiency loading, transfection and fusion of cells by electric pulses |
| US6041252A (en) | 1995-06-07 | 2000-03-21 | Ichor Medical Systems Inc. | Drug delivery system and method |
| US6041253A (en) | 1995-12-18 | 2000-03-21 | Massachusetts Institute Of Technology | Effect of electric field and ultrasound for transdermal drug delivery |
| US6002961A (en) | 1995-07-25 | 1999-12-14 | Massachusetts Institute Of Technology | Transdermal protein delivery using low-frequency sonophoresis |
| US5983131A (en) | 1995-08-11 | 1999-11-09 | Massachusetts Institute Of Technology | Apparatus and method for electroporation of tissue |
| US5980517A (en) * | 1995-08-15 | 1999-11-09 | Rita Medical Systems, Inc. | Cell necrosis apparatus |
| WO1997007826A1 (en) | 1995-08-29 | 1997-03-06 | Cbr Laboratories, Inc. | In vivo electroporation of cells |
| US5688232A (en) * | 1995-09-28 | 1997-11-18 | Becton Dickinson And Company | Iontophoretic drug delivery device having an improved controller |
| US6010613A (en) | 1995-12-08 | 2000-01-04 | Cyto Pulse Sciences, Inc. | Method of treating materials with pulsed electrical fields |
| WO1997047355A1 (en) | 1996-06-12 | 1997-12-18 | Alza Corporation | Reduction of skin sensitization in electrotransport drug delivery |
| GB2314274A (en) | 1996-06-20 | 1997-12-24 | Gyrus Medical Ltd | Electrode construction for an electrosurgical instrument |
| US5911223A (en) | 1996-08-09 | 1999-06-15 | Massachusetts Institute Of Technology | Introduction of modifying agents into skin by electroporation |
| US5869326A (en) | 1996-09-09 | 1999-02-09 | Genetronics, Inc. | Electroporation employing user-configured pulsing scheme |
| US5874268A (en) | 1996-09-23 | 1999-02-23 | Duke University | Method of introducing exogenous compounds into cells by electroporation and apparatus for same |
| US5908753A (en) | 1996-10-04 | 1999-06-01 | Merck & Co., Inc. | Transformation of Candida albicans by electroporation |
| US5845646A (en) | 1996-11-05 | 1998-12-08 | Lemelson; Jerome | System and method for treating select tissue in a living being |
| EA002087B1 (ru) | 1997-04-03 | 2001-12-24 | Электрофект Ас | Способ введения фармацевтических препаратов и нуклеиновых кислот в скелетную мышцу |
| US5873849A (en) | 1997-04-24 | 1999-02-23 | Ichor Medical Systems, Inc. | Electrodes and electrode arrays for generating electroporation inducing electrical fields |
| US5879891A (en) | 1997-09-17 | 1999-03-09 | Merck & Co., Inc. | Transformation of saccharomyces cerevisiae by electroporation |
| TW368420B (en) | 1997-11-04 | 1999-09-01 | Genetronics Inc | Apparatus and method for transdermal molecular delivery by applying sufficient amplitude of electric field to induce migration of molecules through pores in the stratum corneum |
| US6022316A (en) | 1998-03-06 | 2000-02-08 | Spectrx, Inc. | Apparatus and method for electroporation of microporated tissue for enhancing flux rates for monitoring and delivery applications |
| CA2326786A1 (en) | 1998-04-14 | 1999-10-21 | Charles L. Brown, Iii | Iontophoresis, electroporation and combination catheters for local drug delivery to arteries and other body tissues |
| US6040184A (en) | 1998-10-09 | 2000-03-21 | Stratagene | Method for more efficient electroporation |
-
1997
- 1997-08-01 US US08/905,240 patent/US6055453A/en not_active Expired - Lifetime
-
1998
- 1998-07-31 WO PCT/US1998/016042 patent/WO1999006101A1/en active IP Right Grant
- 1998-07-31 BR BR9806069-4A patent/BR9806069A/pt not_active Application Discontinuation
- 1998-07-31 JP JP11511309A patent/JP2000503586A/ja active Pending
- 1998-07-31 DE DE69841888T patent/DE69841888D1/de not_active Expired - Lifetime
- 1998-07-31 AU AU86823/98A patent/AU734343B2/en not_active Expired
- 1998-07-31 CN CN2005100847339A patent/CN1768873B/zh not_active Expired - Lifetime
- 1998-07-31 KR KR1019997002781A patent/KR100756252B1/ko not_active IP Right Cessation
- 1998-07-31 AT AT98938256T patent/ATE480294T1/de not_active IP Right Cessation
- 1998-07-31 CN CN988014610A patent/CN1217717C/zh not_active Expired - Lifetime
- 1998-07-31 RU RU99109111/14A patent/RU2195332C2/ru not_active IP Right Cessation
- 1998-07-31 CA CA002268026A patent/CA2268026C/en not_active Expired - Lifetime
- 1998-07-31 EP EP98938256A patent/EP0999867B1/en not_active Expired - Lifetime
- 1998-09-18 TW TW087115609A patent/TW396043B/zh not_active IP Right Cessation
- 1998-11-09 US US09/189,070 patent/US6068650A/en not_active Expired - Lifetime
- 1998-11-09 US US09/189,062 patent/US6233482B1/en not_active Expired - Lifetime
- 1998-11-09 US US09/189,360 patent/US6181964B1/en not_active Expired - Lifetime
-
1999
- 1999-01-08 US US09/227,416 patent/US6014584A/en not_active Expired - Lifetime
-
2000
- 2000-09-27 HK HK00106147A patent/HK1027049A1/xx not_active IP Right Cessation
-
2002
- 2002-03-04 JP JP2002057679A patent/JP4180285B2/ja not_active Expired - Lifetime
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012178095A1 (en) * | 2011-06-22 | 2012-12-27 | Ifluidics, Inc. | Electromotive system for high-throughput screening |
Also Published As
| Publication number | Publication date |
|---|---|
| TW396043B (en) | 2000-07-01 |
| JP2000503586A (ja) | 2000-03-28 |
| US6233482B1 (en) | 2001-05-15 |
| JP2002291910A (ja) | 2002-10-08 |
| US6068650A (en) | 2000-05-30 |
| WO1999006101A1 (en) | 1999-02-11 |
| EP0999867B1 (en) | 2010-09-08 |
| US6055453A (en) | 2000-04-25 |
| EP0999867A4 (en) | 2008-03-26 |
| AU8682398A (en) | 1999-02-22 |
| JP4180285B2 (ja) | 2008-11-12 |
| EP0999867A1 (en) | 2000-05-17 |
| BR9806069A (pt) | 2000-01-25 |
| HK1027049A1 (en) | 2001-01-05 |
| CA2268026A1 (en) | 1999-02-11 |
| KR20000068678A (ko) | 2000-11-25 |
| KR100756252B1 (ko) | 2007-09-07 |
| CN1768873A (zh) | 2006-05-10 |
| CA2268026C (en) | 2003-07-29 |
| US6014584A (en) | 2000-01-11 |
| DE69841888D1 (de) | 2010-10-21 |
| CN1217717C (zh) | 2005-09-07 |
| CN1248923A (zh) | 2000-03-29 |
| ATE480294T1 (de) | 2010-09-15 |
| US6181964B1 (en) | 2001-01-30 |
| CN1768873B (zh) | 2011-04-13 |
| AU734343B2 (en) | 2001-06-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2195332C2 (ru) | Способ и устройство для использования опосредованной электропорообразованием доставки лекарственных препаратов и генов | |
| US6516223B2 (en) | Apparatus for electroporation mediated delivery for drugs and genes | |
| US6216034B1 (en) | Method of programming an array of needle electrodes for electroporation therapy of tissue | |
| US20040204669A1 (en) | Apparatus for electroporation mediated delivery for drugs and genes | |
| US9020605B2 (en) | Electroporation device | |
| RU2168337C2 (ru) | Способ лечения с введением лекарственных препаратов и генов посредством электропорации | |
| CA2331532A1 (en) | Electrically induced vessel vasodilation | |
| AU4177100A (en) | Method and apparatus for reducing electroporation-mediated muscle reaction and pain response | |
| MXPA97008316A (en) | Method of treatment using administration of drugs and genes through electroporac |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20100801 |