RU2168508C2 - Бензонитрилы и бензофториды, способ их получения, фармацевтическая композиция, способ ее получения - Google Patents
Бензонитрилы и бензофториды, способ их получения, фармацевтическая композиция, способ ее получения Download PDFInfo
- Publication number
- RU2168508C2 RU2168508C2 RU96106426/04A RU96106426A RU2168508C2 RU 2168508 C2 RU2168508 C2 RU 2168508C2 RU 96106426/04 A RU96106426/04 A RU 96106426/04A RU 96106426 A RU96106426 A RU 96106426A RU 2168508 C2 RU2168508 C2 RU 2168508C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- cyano
- piperazinyl
- indole
- butyl
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/04—Indoles; Hydrogenated indoles
- C07D209/10—Indoles; Hydrogenated indoles with substituted hydrocarbon radicals attached to carbon atoms of the hetero ring
- C07D209/14—Radicals substituted by nitrogen atoms, not forming part of a nitro radical
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/26—Psychostimulants, e.g. nicotine, cocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Psychiatry (AREA)
- Anesthesiology (AREA)
- Pain & Pain Management (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Indole Compounds (AREA)
Abstract
Изобретение относится к бензонитрилам и бензофторидам формулы I, где Аr - означает одно- или двухкратно замещенный с помощью CN и/или F фенильный остаток; Q означает СnН2n; n означает 3 или 4; а также их соли присоединения кислот, за исключением 3-/4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола и 3-4-(4-(2-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола, но не их солей присоединения кислот. Соединение I получают из соединения II, где X' означает X; Х означает Cl, Br, J, ОН или реакционноспособную, функционально превращенную ОН-группу, Q указано выше, и соединения III: X2-CH2-CH2NAr-CH2-СН2Х3, где Х2 и Х3 вместе обозначают NH; Аr указан выше или соединение I получают взаимодействием соединения IV, где Х и Q указаны выше с соединением ArNH2, где Аr указан выше. Соединения I используют в фармацевтической композиции, обладающей агонистической активностью по отношению к серотонину. 5 с. и 4 з.п. ф-лы, 1 табл.
Description
Изобретение относится к соединениям формулы (I)
где Ar означает одно- или двукратно замещенный с помощью CN и/или F фенильный остаток;
Q обозначает CnH2n; и n обозначает 3 или 4;
а также к их солям, за исключением 3-[4-(4-(4-фторфенил)-1- пиперазинил)бутил] -5-циан-индола и 3-[4-(4-(2-фторфенил)-1- пиперазинил)бутил]-5-циан-индола, но не их кислотноаддитивных солей.
где Ar означает одно- или двукратно замещенный с помощью CN и/или F фенильный остаток;
Q обозначает CnH2n; и n обозначает 3 или 4;
а также к их солям, за исключением 3-[4-(4-(4-фторфенил)-1- пиперазинил)бутил] -5-циан-индола и 3-[4-(4-(2-фторфенил)-1- пиперазинил)бутил]-5-циан-индола, но не их кислотноаддитивных солей.
Подобные соединения известны из европейского патента EP 0376607, патента Бельгии 771285, патента Великобритании 1075156, патента Франции 1551082 и в частности из патента ФРГ 4101686-A1 (соответствующего европейскому патенту EP 0496222-A1).
По отношению к указанной последней заявке на патент предлагаемые согласно изобретению соединения по сравнению с замещенными метоксигруппами известными соединениями отличаются улучшенной оральной биодоступностью и представляют собой селективное изобретение, в частности в патенте ФРГ 4101686.
В основу изобретения положена задача получения новых соединений с ценными свойствами, в частности таких, которые можно применять для приготовления лекарственных средств. Найдено, что соединения формулы (I) и их физиологически приемлемые соли присоединения кислоты при хорошей совместимости обладают очень ценными фармакологическими свойствами. Так, они в частности оказывают воздействие на центральную нервную систему, прежде всего они проявляют 5-HT1A-антагонистические и подавляющие 5-HT- Reuptake активности. Они подавляют связывание содержащих тритий серотониновых лигандов с гиппокампальными рецепторами (Cossery и др., European J. Pharmacol., 140 (1987), 143-155). Кроме того, происходят изменения в отношении аккумуляции DOPA (диоксифенилаланина) в Striatum и 5-HTP-аккумуляции в N. raphe (Seyfried и дp. , European J. Pharmacol. 160 (1989), 31-41). Далее, проявляются анальгетические и снижающие кровяное давление активности; так, в случае бодрствующих, со вставленным катетером, спонтанно гипертонических крыс (род SHR/Okamoto /N1H-MO-CHB-Kisslegg; Методы; см. Weeks и Jones, Proc. Soc. Exptl. Biol.Med 104 (1960), 646-648) прямо измеряемое кровяное давление снижается после перорального введения соединений. Точно так же они пригодны для профилактики и для борьбы с последствиями церебрального инфаркта (apoplexia cerebri), как инсульт и церебральные ишемии, а также для лечения экстрапирамидально-двигательных побочных действий нейролептических средств, а также болезни Паркинсона.
Соединения формулы (I) и их физиологически приемлемые соли присоединения кислоты поэтому можно применять в качестве биологически активных веществ в лекарственных средствах, в частности для анксиолитических, антидепрессивных, антипсихотических, нейролептических и/или антигипертонических средств и также в качестве промежуточных продуктов для получения других биологически активных веществ лекарственных средств.
Предметом изобретения являются также фармацевтические композиции, отличающиеся тем, что они содержат по меньшей мере одно соединение формулы (I) и/или одну из его физиологически приемлемых солей присоединения кислоты.
Предметом изобретения являются в частности фармацевтические композиции, содержащие по меньшей мере одно соединение, выбираемое из группы, состоящей из:
а) 3-/4-(4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола;
б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)пропил/-5-циан-индола;
в) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол- метан-сульфоната;
г) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола;
д) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола или
е) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол- гидрохлорида.
а) 3-/4-(4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола;
б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)пропил/-5-циан-индола;
в) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол- метан-сульфоната;
г) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола;
д) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола или
е) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол- гидрохлорида.
Предметом изобретения являются также лекарственные средства формулы (I) и их физиологически приемлемые соли присоединения кислоты в качестве агонистов и антагонистов 5-гидрокси-триптамина.
Остаток Ar обозначает одно- или двукратно замещенный с помощью CN и/или F фенильный остаток.
Остаток Q обозначает -(CH2)3- или -(CH2)4-.
Предметом изобретения являются в частности соединения:
а) 3-/4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индол;
б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)пропил-5-циан-индол;
в) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индол;
г) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан- индол;
а также соли присоединения кислоты указанных соединений.
а) 3-/4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индол;
б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)пропил-5-циан-индол;
в) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индол;
г) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан- индол;
а также соли присоединения кислоты указанных соединений.
Далее, предпочтительным предметом изобретения является 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол-гидрохлорид.
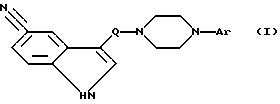
Предметом изобретения является, далее, способ получения соединений формулы (I) по п. 1 формулы изобретения, а также их солей, отличающийся тем, что
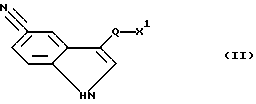
соединение формулы (II)
где X1 обозначает X или NH2; и X обозначает Cl, Br, I, OH или реакционноспособную, функционально превращенную OH-группу; и
Q имеет указанное значение;
вводят во взаимодействие с соединением формулы (III):
X2-CH2-CH2 NAr-CH2-CH2X3,
где X2 и X3 могут быть одинаковыми или разными и, если X1=NH2, каждый означает X; в другом случае вместе обозначают NH;
и Ar имеет указанное значение; или
соединение формулы (IV)
где X и Q, имеют указанные значения, вводят во взаимодействие с соединением формулы (V)
Ar-NH2,
где Ar имеет указанное значение; или
полученное основание формулы (I) путем обработки с помощью кислоты превращают в одну из его кислотоаддитивных солей.
соединение формулы (II)
где X1 обозначает X или NH2; и X обозначает Cl, Br, I, OH или реакционноспособную, функционально превращенную OH-группу; и
Q имеет указанное значение;
вводят во взаимодействие с соединением формулы (III):
X2-CH2-CH2 NAr-CH2-CH2X3,
где X2 и X3 могут быть одинаковыми или разными и, если X1=NH2, каждый означает X; в другом случае вместе обозначают NH;
и Ar имеет указанное значение; или
соединение формулы (IV)
где X и Q, имеют указанные значения, вводят во взаимодействие с соединением формулы (V)
Ar-NH2,
где Ar имеет указанное значение; или
полученное основание формулы (I) путем обработки с помощью кислоты превращают в одну из его кислотоаддитивных солей.
Соединения формулы (I) и также исходные вещества для их получения получают само по себе известными способами, которые описываются в литературе (например, в стандартных работах, как Губен-Вейл, Методы органической химии, изд. Georg-Thieme Штутгарт; в особенности, однако, в патенте ФРГ 4101686), а именно при реакционных условиях, которые известны и пригодны для указанных взаимодействий. При этом также можно использовать само по себе известные, здесь подробнее не упомянутые варианты.
Исходные вещества, если желательно, также можно получать in situ, так что их не выделяют из реакционной смеси, а тотчас вводят во взаимодействие далее до получения соединений формулы (I). Соединения формулы (I) предпочтительно можно получать тем, что соединения формулы (II) вводят во взаимодействие с соединениями формулы (III).
В соединениях формулы (II) X1 предпочтительно обозначает X; соответственно этому в соединениях формулы (III) X2 и X3 предпочтительно вместе обозначают NH. Остаток X предпочтительно представляет собой Cl или Br; однако он может также обозначать I, OH или реакционноспособную, измененную OH-группу, как алкилсульфонилоксигруппа с 1-6 C-атомами (предпочтительно метилсульфонилоксигруппа) или арилсульфонилоксигруппа с 6-10 C-атомами (предпочтительно фенил- или п-толил-сульфонилоксигруппа).
Соответственно этому соединения формулы (I) получают в частности путем взаимодействия соединений формулы (II), где X1 обозначает Cl или Br, с производными пиперазина формулы (III), где X2 и X3 вместе обозначают NH-группу (ниже обозначают как формула (IIIа)).
Соединения формул (II) и в частности (III) отчасти известны; неизвестные соединения формул (II) и (III) можно легко получать аналогично известным соединениям.
Соединения формулы (II), где X1 обозначает OH, получают, например, путем восстановления соответствующих карбоновых кислот или их сложных эфиров. Обработка тионилхлоридом, бромистым водородом, трихлоридом фосфора или подобными галоидными соединениями дает соответствующие соединения формулы (II), где X1 обозначает Cl или Br. Соответствующие сульфонилоксисоединения получают из соединений формулы (II), где X1 обозначает OH, путем взаимодействия с соответствующими хлорангидридами сульфокислот.
Йодсодержащие соединения формулы (II) получают, например, путем воздействия йодида калия на соответствующие сложные эфиры п-толуолсульфокислоты. Соединения формулы (II), где X1 обозначает NH2, получают, например, из галогенидов с помощью фталимида калия.
Производные пиперазина формулы (III) большей частью известны и их получают, например, путем взаимодействия ди-(2-хлор-этил) амина с соответствующим, замещенным в фенильном кольце производным анилина. Соединения формулы (III) (X2 и X3 каждый означает X) получают, например, путем восстановления сложных диэфиров формулы алкил-OOC-CH2-NAr-CH2-COO-алкил до соединений формулы HO-CH2-CH2-NAr-CH2-CH2-OH (формула (III), X2=X3= OH) и в случае необходимости последующего введения во взаимодействие с SOCl2, соответственно PBr3.
Взаимодействие соединений формул (II) и (III) протекает по способам, которые известны из литературы для алкилирования аминов. Можно компоненты сплавлять друг с другом, в отсутствие растворителя, в случае необходимости в закрытой трубке или в автоклаве. Однако также можно соединения вводить во взаимодействие в присутствии индифферентного растворителя. В качестве растворителей пригодны, например, углеводороды, как бензол, толуол, ксилол; кетоны, как ацетон, бутанон; спирты, как метанол, этанол, изопропанол, н-бутанол; простые эфиры, как тетрагидрофуран (ТГФ) или диоксан; амиды, как диметилформамид (ДМФ) или N-метил-пирролидон, нитрилы, как ацетонитрил; в случае необходимости также смеси этих растворителей друг с другом или смеси с водой. Может быть благоприятной добавка кислотосвязующего средства, например гидроксида, карбоната или бикарбоната щелочного или щелочно-земельного металла или другой соли слабой кислоты щелочных или щелочно-земельных металлов, предпочтительно калия, натрия или кальция, или добавка органического основания, как триэтиламин, диметиланилин, пиридин или хинолин, или избытка аминокомпоненты формулы (II), соответственно, производного пиперазина формулы (IIIа). Время реакции составляет, в зависимости от используемых условий, от нескольких минут до 14 дней; температура реакции составляет примерно 0-150oC, обычно 20-130oC.
Далее, соединение формулы (I) можно получать тем, что соединение формулы (IV) вводят во взаимодействие с соединением формулы (V).
Соединения формулы (IV) и в частности (V) отчасти известны; неизвестные соединения можно легко получать по аналогии с известными. Так, соединения формулы (IV) можно легко получать путем взаимодействия соединений формулы (II), где X1 обозначает NH2, с 1-2-дигалогенэтаном, причем галогеном предпочтительно является хлор или бром. Точно так же соединения типа (IV) можно получать путем взаимодействия соединений формулы (II), где X1 обозначает Cl, Br или I, со вторичными аминами формулы HN(CH2- CH2-X)2.
Первичные амины формулы (V) можно получать исходя из анилина за счет различных, само по себе известных возможностей электрофильного замещения в ароматическом углеводороде. Далее соответствующим образом замещенные нитросоединения путем восстановления можно переводить в амины формулы (V).
Взаимодействие соединений формул (IV) и (V) протекает по способам, которые известны из литературы для алкилирования аминов. Компоненты можно сплавлять друг с другом в отсутствие растворителя, в случае необходимости в закрытой трубке или в автоклаве, при обычном давлении или при повышенном давлении, причем для повышения давления подают инертный газ, как например азот. Однако также соединения можно вводить во взаимодействие в присутствии индифферентного растворителя. В качестве растворителей пригодны вышеуказанные в случае взаимодействия соединений формул (II) и (III) растворители. Точно так же благоприятствующе может воздействовать добавка к реакционной смеси кислотосвязующего средства. Принимают во внимание такие же основания, как и описано выше в случае взаимодействия соединений формул (II) и (III).
Оптимальное время реакции, в зависимости от выбранных реакционных условий, составляет от нескольких минут до 14 дней; температура реакции составляет примерно 0-150oC, обычно 20-130oC.
Основание формулы (I) с помощью кислоты можно переводить в соответствующую соль присоединения кислоты, например, путем взаимодействия эквивалентных количеств основания и кислоты в инертном растворителе, как этанол, и последующего выпаривания. Для этого взаимодействия применяют в частности кислоты, которые дают физиологически приемлемые соли. Так, можно применять неорганические кислоты, например, серную кислоту; азотную кислоту; галогенводородные кислоты, как соляная кислота или бромводородная кислота; фосфорные кислоты, как ортофосфорная кислота; сульфаминовую кислоту; далее, органические кислоты, в особенности алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- или многоосновные карбоновые, сульфоновые или серные кислоты, например, как муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфокислота, этандисульфокислота, 2- гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталин-моно- и -дисульфокислоты, лаурилсерная кислота. Соли с физиологически неприемлемыми кислотами, например пикраты, можно использовать для выделения и/или очистки соединений формулы (I).
Предметом изобретения, далее, является применение соединений формулы (I) и/или их физиологически приемлемых солей для приготовления фармацевтических композиций, в частности нехимическим путем. При этом их вместе по меньшей мере с одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и в случае необходимости в комбинации с одним или несколькими другими биологически активными веществами можно доводить до пригодной дозировочной формы.
Эти композиции можно применять в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей принимают во внимание органические или неорганические вещества, которые пригодны для кишечного (например, орального), парентерального или топического применения и не реагируют с новыми соединениями, например, как вода, растительные масла, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, глицеринтриацетат, желатина, углеводы, как лактоза или крахмал, стеарат магния, тальк, вазелин. Для орального применения служат в частности таблетки, пилюли, драже, капсулы с лекарством, порошки, грануляты, сиропы, соки или капли; для ректального применения служат свечи; для парентерального применения служат растворы, предпочтительно масляные или водные растворы, далее, суспензии, эмульсии или имплантаты; для топического применения служат мази, кремы или пудры. Новые соединения также можно лиофилизировать и полученные лиофилизаты применять, например, для приготовления препаратов для инъекций. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные вещества, как придающие скользкость (таблеткам) средства, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для влияния на осмотическое давление, буферные вещества, красители, вкусовые вещества, и/или одно или несколько других биологически активных веществ, например, один или несколько витаминов.
Соединения формулы (I) и их физиологически приемлемые соли можно применять при терапии человеческого или животного организма и при борьбе с заболеваниями. Они пригодны для лечения заболеваний центральной нервной системы, как состояния напряженности, депрессии и/или психозы, и побочных действий при лечении гипертонии (например, с помощью α-метил-3,4-диокси-фенилаланина). Далее, соединения могут найти применение в эндокринологии и гинекологии, например, для терапии акромегалии, гипогоданизма, вторичной аменореи, предменструального синдрома, нежелательной пуэрперальной лактации, далее, для профилактики и терапии церебральных нарушений (например, мигрени), в особенности в гериатрии, подобно как известные Ergot-алкалоиды, и для борьбы с последствиями церебральных инфарктов (Apoplexia cerebri), как инсульт и церебральные ишемии.
При этом предлагаемые согласно изобретению вещества, как правило, вводят по аналогии с известными, находящимися в продаже препаратами (например, Бромокриптин, Дигидроэргокорнин), предпочтительно в дозировках примерно 0,2-500 мг, в частности 0,2-50 мг, на дозировочную единицу. Суточная дозировка предпочтительно составляет примерно 0,001 - 10 мг/кг веса тела. Низкие дозировки (примерно 0,2-1 мг на дозировочную единицу, примерно 0,001-0,005 мг/кг веса тела) используют, в частности, для применения в качестве средств против мигреней; для остальных показаний предпочтительны дозировки 10-50 мг на дозировочную единицу. Специальная доза для каждого пациента зависит, однако, от самых различных факторов, например от эффективности используемого специального соединения, от возраста, веса тела, общего состояния здоровья, пола, от стоимости, от момента и пути введения, от скорости выделения, комбинации лекарственных средств и тяжести соответствующего заболевания, которое имеет значение для терапии. Предпочтительно оральное применение.
Выше- и нижеуказанные, все температуры указываются в oC. В нижеследующих примерах выражение "обычная обработка" обозначает: добавляют, если требуется, воду; устанавливают, если требуется, в зависимости от строения целевого продукта, pH-значение в пределах 2-10; экстрагируют этилацетатом или дихлорметаном; разделяют; органическую фазу сушат над сульфатом натрия, выпаривают и очищают путем хроматографии на силикагеле и/или путем кристаллизации.
Пример 1
Раствор из 2,6 г 3-(4-хлорбутил)-5-циан-индола ("А") и 1,7 г 1-(4-циан-фенил)пиперазина ("Б") в 200 мл ацетонитрила перемешивают в течение 12 часов при 20oC, обрабатывают как обычно и получают 3-/4-(4-(4-циан-фенил)-1- пиперазинил)бутил/-5-циан-индол-гидрохлорид; т.пл. 262,5 - 263,5oC.
Раствор из 2,6 г 3-(4-хлорбутил)-5-циан-индола ("А") и 1,7 г 1-(4-циан-фенил)пиперазина ("Б") в 200 мл ацетонитрила перемешивают в течение 12 часов при 20oC, обрабатывают как обычно и получают 3-/4-(4-(4-циан-фенил)-1- пиперазинил)бутил/-5-циан-индол-гидрохлорид; т.пл. 262,5 - 263,5oC.
Аналогичным образом, путем взаимодействия "А" с 1-(4- фтор-фенил)-пиперазином получают 3-/4-(4-(4-фтор-фенил)-1- пиперазинил)бутил/-5-циан-индол-гилрохлорид, т.пл. 248-249oC;
3-(3-хлорпропил)-5-циан-индола с "Б" получают 3-/3-(4- 4-циан-фенил)-1-пиперазинил)-пропил/-5-циан-индол, т.пл. 219-220oC;
"А" с 1-(2-циан-фенил)-пиперазином получают 3-/4-(4- (2-циан-фенил)-1-пиперазинил) бутил/-5-циан-индол-гидрохлорид, т.пл. 232oC.
3-(3-хлорпропил)-5-циан-индола с "Б" получают 3-/3-(4- 4-циан-фенил)-1-пиперазинил)-пропил/-5-циан-индол, т.пл. 219-220oC;
"А" с 1-(2-циан-фенил)-пиперазином получают 3-/4-(4- (2-циан-фенил)-1-пиперазинил) бутил/-5-циан-индол-гидрохлорид, т.пл. 232oC.
Пример 2
Раствор из 10,8 г 3-/4-N,N-бис-(2-хлор-этил)- аминобутил)-5-циан-индола и одного эквивалента 3-фтор-4-циан- анилина в 200 мл ацетонитрила перемешивают в течение 12 часов при комнатной температуре, обрабатывают как обычно и получают 3- /4-(4-(3-фтор-4-циан-фенил)-1-пиперазинкл) бутил/-5-циан-индол; т.пл. 117,5-118,5oC.
Раствор из 10,8 г 3-/4-N,N-бис-(2-хлор-этил)- аминобутил)-5-циан-индола и одного эквивалента 3-фтор-4-циан- анилина в 200 мл ацетонитрила перемешивают в течение 12 часов при комнатной температуре, обрабатывают как обычно и получают 3- /4-(4-(3-фтор-4-циан-фенил)-1-пиперазинкл) бутил/-5-циан-индол; т.пл. 117,5-118,5oC.
Была исследована ингибирующая активность некоторых соединений формулы (I), а также соединений сравнения C1 и C2, известных из EP 0496222 A1. Соединения использовали в концентрации нмоль/литр, температура плавления приведена в oC.
Ингибирующую активность определяли в соответствии с методом, описанным K.A.Sherman, M.J.Zigmond, J. Hamin, Life Sciences, 1978, 23, 1863-1870.
Данные по биопригодности определяли стандартным способом. После использования 1 мг вещества на кг веса тела (i.v., р.о.) определяли концентрацию в плазме.
Приведенные данные свидетельствуют об ингибирующей активности соединений в отношении повторного поглощения серотонина. Соединения C1 и C2 характеризуются IC50 более 1000 и 10 нмоль/литр, в то время как соединения формулы (I) согласно изобретению IC50 от 6 до 0,7, т.е. соединения формулы (I) проявляют активность в 1000 раз большую, чем известные соединения.
Нижеследующие примеры относятся к фармацевтическим композициям.
Пример А: Флаконы для инъекций
Раствор из 100 г биологически активного вещества формулы (I) и 5 г вторичного кислого фосфата натрия в 3 л дважды перегнанной воды доводят до pH= 6,5 с помощью 2 н. соляной кислоты, стерильно фильтруют, разливают в флаконы для инъекции, лиофилизируют в стерильных условиях и стерильно закрывают. Каждый флакон с препаратом для инъекции содержит 5 мг биологически активного вещества.
Раствор из 100 г биологически активного вещества формулы (I) и 5 г вторичного кислого фосфата натрия в 3 л дважды перегнанной воды доводят до pH= 6,5 с помощью 2 н. соляной кислоты, стерильно фильтруют, разливают в флаконы для инъекции, лиофилизируют в стерильных условиях и стерильно закрывают. Каждый флакон с препаратом для инъекции содержит 5 мг биологически активного вещества.
Пример Б: Свечи
Расплавлять смесь из 20 г биологически активного вещества формулы (I) вместе со 100 г соевого лецитина и 1400 г масла какао, разливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества.
Расплавлять смесь из 20 г биологически активного вещества формулы (I) вместе со 100 г соевого лецитина и 1400 г масла какао, разливают в формы и оставляют охлаждаться. Каждая свеча содержит 20 мг биологически активного вещества.
Пример В: Раствор
Готовят раствор из 1 г биологически активного вещества формулы (I), 9,38 г NaH2PO4•2H2O, 28,48 г Na2HPO4•12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH = 6,8, доливают до общего объема 1 л и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Готовят раствор из 1 г биологически активного вещества формулы (I), 9,38 г NaH2PO4•2H2O, 28,48 г Na2HPO4•12H2O и 0,1 г бензальконийхлорида в 940 мл дважды перегнанной воды. Устанавливают pH = 6,8, доливают до общего объема 1 л и стерилизуют путем облучения. Этот раствор можно применять в форме глазных капель.
Пример Г: Мазь
Смешивают 500 мг биологически активного вещества формулы (I) с 99,5 г вазелина в асептических условиях.
Смешивают 500 мг биологически активного вещества формулы (I) с 99,5 г вазелина в асептических условиях.
Пример Д: Таблетки
Смесь из 1 кг биологически активного вещества формулы (I), 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния прессуют обычным образом в таблетки так, что каждая таблетка содержит 10 мг биологически активного вещества.
Смесь из 1 кг биологически активного вещества формулы (I), 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния прессуют обычным образом в таблетки так, что каждая таблетка содержит 10 мг биологически активного вещества.
Прмимер Е: Драже
Аналогично примеру Д прессуют таблетки, на которые затем обычным образом наносят покрытие из сахарозы, картофельного крахмала, талька, траганта и красителя.
Аналогично примеру Д прессуют таблетки, на которые затем обычным образом наносят покрытие из сахарозы, картофельного крахмала, талька, траганта и красителя.
Пример Ж: Капсулы с лекарством
2 кг биологически активного вещества формулы (I) обычным образом вносят в твердые желатиновые капсулы так, что каждая капсула содержит 20 мг биологически активного вещества.
2 кг биологически активного вещества формулы (I) обычным образом вносят в твердые желатиновые капсулы так, что каждая капсула содержит 20 мг биологически активного вещества.
Пример 3: Ампулы
Раствор из 1 кг биологически активного вещества формулы (I) в 60 л дважды перегнанной воды стерильно фильтруют, заполняют им ампулы, лиофилизируют в стерильных условиях и стерильно закрывают (запаивают). Каждая ампула содержит 10 мг биологически активного вещества.
Раствор из 1 кг биологически активного вещества формулы (I) в 60 л дважды перегнанной воды стерильно фильтруют, заполняют им ампулы, лиофилизируют в стерильных условиях и стерильно закрывают (запаивают). Каждая ампула содержит 10 мг биологически активного вещества.
Claims (9)
1. Бензонитрилы и бензофториды формулы I
где Ar обозначает одно- или двукратно замещенный с помощью CN и/или F фенильный остаток;
Q обозначает CnH2 и
n обозначает 3 или 4;
а также их соли присоединения кислот, за исключением 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола и 3-/4-(4-(2-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола, но не их солей присоединения кислот.
где Ar обозначает одно- или двукратно замещенный с помощью CN и/или F фенильный остаток;
Q обозначает CnH2 и
n обозначает 3 или 4;
а также их соли присоединения кислот, за исключением 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола и 3-/4-(4-(2-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индола, но не их солей присоединения кислот.
2. Соединения формулы I по п.1, представляющие собой: а) 3-/4-(4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; в) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; г) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; а также их соли присоединения кислот.
3. Соединение формулы I по п.1, представляющее собой 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол-гидрохлорид.
4. Соединение формулы I по п.1 и/или их физиологически приемлемые соли присоединения кислот в качестве агонистов 5-гидрокси-триптамина.
5. Способ получения соединений формулы I по п.1, а также их солей присоединения кислот, отличающийся тем, что соединение формулы II
где X1 обозначает X;
X обозначает Cl, Br, J, OH или реакционноспособную, функционально превращенную OH-группу;
Q имеет указанное значение,
вводят во взаимодействие с соединением формулы III
X2-CH2-CHAr-CH2-CH2X3
где X2 и X3 вместе обозначают NH;
Ar имеет указанное значение;
и в случае необходимости полученное основание формулы I путем обработки кислотой превращают в одну из его солей.
где X1 обозначает X;
X обозначает Cl, Br, J, OH или реакционноспособную, функционально превращенную OH-группу;
Q имеет указанное значение,
вводят во взаимодействие с соединением формулы III
X2-CH2-CHAr-CH2-CH2X3
где X2 и X3 вместе обозначают NH;
Ar имеет указанное значение;
и в случае необходимости полученное основание формулы I путем обработки кислотой превращают в одну из его солей.
6. Способ получения соединений формулы I по п.1, а также их солей присоединения кислот, отличающийся тем, что соединение формулы IV
где X и Q имеет указанные значения, вводят во взаимодействие с соединением формулы V
Ar - NH2
где Ar имеет указанное значение,
и в случае необходимости полученное основание формулы I путем обработки кислотой превращают в одну из его солей.
где X и Q имеет указанные значения, вводят во взаимодействие с соединением формулы V
Ar - NH2
где Ar имеет указанное значение,
и в случае необходимости полученное основание формулы I путем обработки кислотой превращают в одну из его солей.
7. Фармацевтическая композиция, обладающая агонистической активностью по отношению к серотонину, отличающаяся тем, что в качестве активного вещества она содержит соединение формулы I по п.1 и/или одну из его физиологически приемлемых солей присоединения кислот в эффективном количестве.
8. Фармацевтическая композиция по п.7, отличающаяся тем, что в качестве активного вещества она содержит соединение, выбранное из группы, состоящей из а) 3-/4-(4-(4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; б) 3-/3-(4-(4-циан-фенил)-1-пиперазинил)пропил/-5-циаг-индола; в) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол-метансульфоната; г) 3-/4-(4-(2-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола; д) 3-/4-(4-(3-фтор-4-циан-фенил)-1-пиперазинил)бутил/-5-циан-индола или е) 3-/4-(4-(4-фтор-фенил)-1-пиперазинил)бутил/-5-циан-индол-гидрохлорида.
9. Способ получения фармацевтической композиции, обладающей агонистической активностью по отношению к серотонину, отличающийся тем, что соединение формулы I по п.1 и/или одну из его физиологически приемлемых солей присоединения кислот вместе по меньшей мере с одним твердым, жидким или полужидким носителем или вспомогательным веществом доводят до пригодной дозировочной формы.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19512639A DE19512639A1 (de) | 1995-04-05 | 1995-04-05 | Benzonitrile und -fluoride |
| DE19512639.4 | 1995-04-05 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU96106426A RU96106426A (ru) | 1998-07-20 |
| RU2168508C2 true RU2168508C2 (ru) | 2001-06-10 |
Family
ID=7758788
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU96106426/04A RU2168508C2 (ru) | 1995-04-05 | 1996-04-03 | Бензонитрилы и бензофториды, способ их получения, фармацевтическая композиция, способ ее получения |
Country Status (28)
| Country | Link |
|---|---|
| US (1) | US6310068B1 (ru) |
| EP (1) | EP0736525B1 (ru) |
| JP (1) | JP3834098B2 (ru) |
| KR (1) | KR100437751B1 (ru) |
| CN (1) | CN1072209C (ru) |
| AR (1) | AR002982A1 (ru) |
| AT (1) | ATE194595T1 (ru) |
| AU (1) | AU709708B2 (ru) |
| BR (1) | BR9601275A (ru) |
| CA (1) | CA2173418C (ru) |
| CO (1) | CO4700469A1 (ru) |
| CY (1) | CY2242B1 (ru) |
| CZ (1) | CZ289449B6 (ru) |
| DE (2) | DE19512639A1 (ru) |
| DK (1) | DK0736525T3 (ru) |
| ES (1) | ES2150039T3 (ru) |
| GR (1) | GR3034514T3 (ru) |
| HU (1) | HUP9600876A3 (ru) |
| NO (1) | NO305903B1 (ru) |
| PL (1) | PL183147B1 (ru) |
| PT (1) | PT736525E (ru) |
| RU (1) | RU2168508C2 (ru) |
| SI (1) | SI0736525T1 (ru) |
| SK (1) | SK281457B6 (ru) |
| TR (1) | TR199600286A2 (ru) |
| TW (1) | TW323279B (ru) |
| UA (1) | UA45325C2 (ru) |
| ZA (1) | ZA962768B (ru) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA011085B1 (ru) * | 2004-12-23 | 2008-12-30 | Кова Ко., Лтд. | Средство для профилактики или лечения глаукомы |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AR004229A1 (es) * | 1995-11-06 | 1998-11-04 | Wyeth Corp | Derivados indolalquilo de benzodioxanmetilamina y su uso para preparar medicamentos |
| US7189753B1 (en) | 1997-11-06 | 2007-03-13 | Cady Roger K | Preemptive prophylaxis of migraine |
| US7517880B2 (en) | 1997-12-22 | 2009-04-14 | Bayer Pharmaceuticals Corporation | Inhibition of p38 kinase using symmetrical and unsymmetrical diphenyl ureas |
| CN1166636C (zh) * | 1999-01-07 | 2004-09-15 | 惠氏 | 用于治疗抑郁症的芳基哌嗪基-环己基吲哚衍生物 |
| US8124630B2 (en) | 1999-01-13 | 2012-02-28 | Bayer Healthcare Llc | ω-carboxyaryl substituted diphenyl ureas as raf kinase inhibitors |
| EP1140840B1 (en) * | 1999-01-13 | 2006-03-22 | Bayer Pharmaceuticals Corp. | -g(v)-carboxyaryl substituted diphenyl ureas as raf kinase inhibitors |
| ES2384160T3 (es) * | 1999-01-13 | 2012-07-02 | Bayer Healthcare Llc | Difenil ureas sustituidas con omega-carboxi arilo como agentes inhibidores de la cinasa p38 |
| ME00275B (me) | 1999-01-13 | 2011-02-10 | Bayer Corp | ω-KARBOKSIARIL SUPSTITUISANI DIFENIL KARBAMIDI KAO INHIBITORI RAF KINAZE |
| ES2296820T3 (es) * | 2000-11-14 | 2008-05-01 | Merck Patent Gmbh | Nuevos usos de agonistas 5-ht1a y de inhibidores de reabsorcion de serotina combinadas. |
| UA76130C2 (en) * | 2000-11-20 | 2006-07-17 | Merck Patent Gmbh | Use of compounds combining properties of selective inhibitors of serotonin re-uptake and agonists of 5-ht1a receptor for treatment of irritable bowel syndrome |
| AR035521A1 (es) * | 2000-12-22 | 2004-06-02 | Lundbeck & Co As H | Derivados de 3-indolina y composicion farmaceutica que los comprende |
| US7371763B2 (en) * | 2001-04-20 | 2008-05-13 | Bayer Pharmaceuticals Corporation | Inhibition of raf kinase using quinolyl, isoquinolyl or pyridyl ureas |
| PT2305255E (pt) * | 2001-12-03 | 2012-09-04 | Bayer Healthcare Llc | Compostos de arilureia em combinação com outros agentes citostáticos ou citotóxicos para tratamento de cancros humanos |
| US20030207872A1 (en) * | 2002-01-11 | 2003-11-06 | Bayer Corporation | Omega-carboxyaryl substituted diphenyl ureas as raf kinase inhibitors |
| US20030216396A1 (en) | 2002-02-11 | 2003-11-20 | Bayer Corporation | Pyridine, quinoline, and isoquinoline N-oxides as kinase inhibitors |
| EP1478358B1 (en) | 2002-02-11 | 2013-07-03 | Bayer HealthCare LLC | Sorafenib tosylate for the treatment of diseases characterized by abnormal angiogenesis |
| US7557129B2 (en) | 2003-02-28 | 2009-07-07 | Bayer Healthcare Llc | Cyanopyridine derivatives useful in the treatment of cancer and other disorders |
| DK1626714T3 (da) | 2003-05-20 | 2007-10-15 | Bayer Pharmaceuticals Corp | Dirarylurinstoffer mod sygdomme medieret af PDGFR |
| EA010485B1 (ru) | 2003-07-23 | 2008-10-30 | Байер Фамэсьютиклс Копэрейшн | Производное n,n'-дифенилмочевины, фармацевтическая композиция (варианты) и способ лечения и предупреждения заболеваний и состояний с его использованием (варианты) |
| CN102875538A (zh) * | 2012-10-16 | 2013-01-16 | 北京诚创思达医药科技有限公司 | 维拉唑酮或其盐酸盐的制备方法 |
| CN104337812B (zh) | 2013-07-29 | 2018-09-14 | 广东东阳光药业有限公司 | 取代的杂芳基化合物及其使用方法和用途 |
| US9714232B2 (en) | 2013-12-20 | 2017-07-25 | Sunshine Lake Pharma Co., Ltd. | Substituted piperazine compounds and methods of use thereof |
| WO2016192657A1 (en) | 2015-06-03 | 2016-12-08 | Sunshine Lake Pharma Co., Ltd. | Substituted piperazine compounds and methods of use and use thereof |
| CA3077383A1 (en) | 2017-09-29 | 2019-04-04 | Sunshine Lake Pharma Co., Ltd. | Substituted pyrimidine piperazine compound and use thereof |
| CN118834152B (zh) * | 2023-04-23 | 2025-09-23 | 复旦大学附属肿瘤医院 | 一种维拉佐酮衍生物v02及其合成方法和在制备抗肿瘤药物中的应用 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0407844A1 (de) * | 1989-07-13 | 1991-01-16 | MERCK PATENT GmbH | Indolderivate |
| EP0496222A1 (de) * | 1991-01-22 | 1992-07-29 | MERCK PATENT GmbH | Indolderivate |
| EP0562832A1 (en) * | 1992-03-23 | 1993-09-29 | Sankyo Company Limited | Indole and indazole derivatives, for the treatment and prophylaxis of cerebral disorders, their preparation and their use |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1075156A (en) | 1963-08-27 | 1967-07-12 | Luso Farmaco Inst | Substituted piperazines |
| US3468882A (en) | 1966-10-07 | 1969-09-23 | Sterling Drug Inc | Phenylhydrazone derivatives as intermediates for preparing indoles |
| DE2138865A1 (de) | 1970-08-15 | 1973-02-22 | Sumitomo Chemical Co | 3-indolylpiperazine, verfahren zu ihrer herstellung und arzneimittel |
| GB8830312D0 (en) | 1988-12-28 | 1989-02-22 | Lundbeck & Co As H | Heterocyclic compounds |
-
1995
- 1995-04-05 DE DE19512639A patent/DE19512639A1/de not_active Withdrawn
-
1996
- 1996-03-13 TW TW085103014A patent/TW323279B/zh active
- 1996-03-27 SK SK403-96A patent/SK281457B6/sk unknown
- 1996-03-28 PT PT96104955T patent/PT736525E/pt unknown
- 1996-03-28 DE DE59605568T patent/DE59605568D1/de not_active Expired - Fee Related
- 1996-03-28 EP EP96104955A patent/EP0736525B1/de not_active Expired - Lifetime
- 1996-03-28 ES ES96104955T patent/ES2150039T3/es not_active Expired - Lifetime
- 1996-03-28 SI SI9630240T patent/SI0736525T1/xx unknown
- 1996-03-28 DK DK96104955T patent/DK0736525T3/da active
- 1996-03-28 AT AT96104955T patent/ATE194595T1/de not_active IP Right Cessation
- 1996-03-29 AU AU50408/96A patent/AU709708B2/en not_active Ceased
- 1996-04-02 CZ CZ1996964A patent/CZ289449B6/cs not_active IP Right Cessation
- 1996-04-02 NO NO961346A patent/NO305903B1/no not_active IP Right Cessation
- 1996-04-03 UA UA96041301A patent/UA45325C2/uk unknown
- 1996-04-03 CA CA002173418A patent/CA2173418C/en not_active Expired - Fee Related
- 1996-04-03 CO CO96016455A patent/CO4700469A1/es unknown
- 1996-04-03 AR AR10204696A patent/AR002982A1/es active IP Right Grant
- 1996-04-03 RU RU96106426/04A patent/RU2168508C2/ru not_active IP Right Cessation
- 1996-04-04 PL PL96313632A patent/PL183147B1/pl not_active IP Right Cessation
- 1996-04-04 BR BR9601275A patent/BR9601275A/pt not_active Application Discontinuation
- 1996-04-04 KR KR1019960010119A patent/KR100437751B1/ko not_active Expired - Fee Related
- 1996-04-04 TR TR96/00286A patent/TR199600286A2/xx unknown
- 1996-04-04 HU HU9600876A patent/HUP9600876A3/hu unknown
- 1996-04-04 ZA ZA962768A patent/ZA962768B/xx unknown
- 1996-04-04 CN CN96100544A patent/CN1072209C/zh not_active Expired - Fee Related
- 1996-04-05 US US08/628,250 patent/US6310068B1/en not_active Expired - Fee Related
- 1996-04-05 JP JP10871996A patent/JP3834098B2/ja not_active Expired - Fee Related
-
2000
- 2000-09-29 GR GR20000402204T patent/GR3034514T3/el not_active IP Right Cessation
-
2001
- 2001-10-12 CY CY0100031A patent/CY2242B1/xx unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0407844A1 (de) * | 1989-07-13 | 1991-01-16 | MERCK PATENT GmbH | Indolderivate |
| DE3923045A1 (de) * | 1989-07-13 | 1991-01-17 | Merck Patent Gmbh | Indolderivate |
| EP0496222A1 (de) * | 1991-01-22 | 1992-07-29 | MERCK PATENT GmbH | Indolderivate |
| EP0562832A1 (en) * | 1992-03-23 | 1993-09-29 | Sankyo Company Limited | Indole and indazole derivatives, for the treatment and prophylaxis of cerebral disorders, their preparation and their use |
Non-Patent Citations (1)
| Title |
|---|
| Машковский М.Д. Лекарственные средства. - М.: Медицина, ч.1, 1996 , с.66. * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EA011085B1 (ru) * | 2004-12-23 | 2008-12-30 | Кова Ко., Лтд. | Средство для профилактики или лечения глаукомы |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2168508C2 (ru) | Бензонитрилы и бензофториды, способ их получения, фармацевтическая композиция, способ ее получения | |
| RU2132848C1 (ru) | Производные пиперидина и пиперазина, способ их получения, содержащие их фармацевтические композиции и способ их получения | |
| JP4276376B2 (ja) | 複素環式化合物及びそれを有効成分とする抗腫瘍剤 | |
| US5723614A (en) | Benzofurans | |
| US4988723A (en) | Benzopyran derivatives and their use as anti-hypertensives | |
| PL181165B1 (pl) | Pochodne podstawionego chromanu, sposób ich wytwarzania oraz preparat farmaceutyczny | |
| HU220061B (hu) | Eljárás indolszármazékok és az e vegyületeket tartalmazó gyógyszerkészítmények előállítására | |
| JPH09501171A (ja) | 5ht1d受容体アンタゴニストとしてのアミド誘導体 | |
| CZ20012270A3 (cs) | Derivát amidu a močoviny jako inhibitor 5-HT reabsorbce a jako inhibitor 5-HT 1B/1D ligandů | |
| EP0784055B1 (en) | Pyrimidinylpyrazole derivative | |
| RU2196140C2 (ru) | Производные оксазолидинонов в качестве антагонистов 5-ht2а, способ их получения и фармацевтическая композиция | |
| US5106850A (en) | Indole derivatives | |
| JP4564713B2 (ja) | 窒素性複素環式化合物、ならびに窒素性複素環式化合物およびその中間体を作製するための方法 | |
| AU715785B2 (en) | 1-(pyrazol-3-ylethyl)-4-(indol-3-yl) piperdines as compositions affecting the central nervous system | |
| US5070088A (en) | Pyranyl quinoline calcium channel blockers | |
| JPS5877880A (ja) | テトラゾ−ル誘導体 | |
| KR20020027502A (ko) | 피페리딘 알콜 | |
| JPH0673008A (ja) | アンジオテンシンii拮抗性ピリジン誘導体 | |
| JPS62226977A (ja) | ピリジン誘導体 | |
| HK1001396B (en) | Pyrimidinylpyrazole derivative |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20060404 |