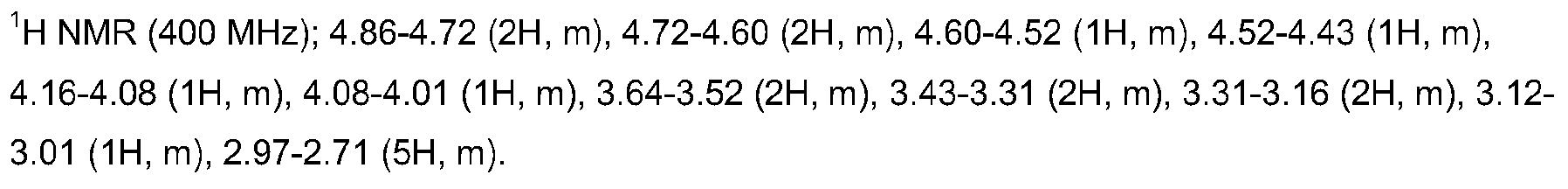KR20100040722A - 수 안정성 화합물, 촉매 및 촉매화된 반응 - Google Patents
수 안정성 화합물, 촉매 및 촉매화된 반응 Download PDFInfo
- Publication number
- KR20100040722A KR20100040722A KR1020107000957A KR20107000957A KR20100040722A KR 20100040722 A KR20100040722 A KR 20100040722A KR 1020107000957 A KR1020107000957 A KR 1020107000957A KR 20107000957 A KR20107000957 A KR 20107000957A KR 20100040722 A KR20100040722 A KR 20100040722A
- Authority
- KR
- South Korea
- Prior art keywords
- reaction
- alkyl
- aryl
- metal
- water
- Prior art date
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2204—Organic complexes the ligands containing oxygen or sulfur as complexing atoms
- B01J31/2208—Oxygen, e.g. acetylacetonates
- B01J31/2226—Anionic ligands, i.e. the overall ligand carries at least one formal negative charge
- B01J31/2243—At least one oxygen and one nitrogen atom present as complexing atoms in an at least bidentate or bridging ligand
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2204—Organic complexes the ligands containing oxygen or sulfur as complexing atoms
- B01J31/2208—Oxygen, e.g. acetylacetonates
- B01J31/2226—Anionic ligands, i.e. the overall ligand carries at least one formal negative charge
- B01J31/2247—At least one oxygen and one phosphorous atom present as complexing atoms in an at least bidentate or bridging ligand
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/30—Addition reactions at carbon centres, i.e. to either C-C or C-X multiple bonds
- B01J2231/34—Other additions, e.g. Monsanto-type carbonylations, addition to 1,2-C=X or 1,2-C-X triplebonds, additions to 1,4-C=C-C=X or 1,4-C=-C-X triple bonds with X, e.g. O, S, NH/N
- B01J2231/341—1,2-additions, e.g. aldol or Knoevenagel condensations
- B01J2231/342—Aldol type reactions, i.e. nucleophilic addition of C-H acidic compounds, their R3Si- or metal complex analogues, to aldehydes or ketones
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/40—Substitution reactions at carbon centres, e.g. C-C or C-X, i.e. carbon-hetero atom, cross-coupling, C-H activation or ring-opening reactions
- B01J2231/42—Catalytic cross-coupling, i.e. connection of previously not connected C-atoms or C- and X-atoms without rearrangement
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2231/00—Catalytic reactions performed with catalysts classified in B01J31/00
- B01J2231/70—Oxidation reactions, e.g. epoxidation, (di)hydroxylation, dehydrogenation and analogues
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/30—Complexes comprising metals of Group III (IIIA or IIIB) as the central metal
- B01J2531/31—Aluminium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/40—Complexes comprising metals of Group IV (IVA or IVB) as the central metal
- B01J2531/46—Titanium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/40—Complexes comprising metals of Group IV (IVA or IVB) as the central metal
- B01J2531/48—Zirconium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/80—Complexes comprising metals of Group VIII as the central metal
- B01J2531/84—Metals of the iron group
- B01J2531/842—Iron
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/90—Catalytic systems characterized by the solvent or solvent system used
- B01J2531/96—Water
Landscapes
- Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Catalysts (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
Abstract
본 발명은 하기 화학식 I의 금속 유기 화합물을 포함하는 루이스 산 촉매의 존재하에 루이스 산 촉매화된 유기 반응을 수행하는 방법을 제공한다. 금속 유기 화합물은 물에서 루이스 산 촉매 특성을 갖는 안정한 수화물을 형성한다.
<화학식 I>
상기 식 중,
M은 금속 원자, 바람직하게는 티탄, 지르코늄, 하프늄 또는 철(III)이고, Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고, 각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고, R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고, d 및 a는 각각 0 또는 1이고, b 및 c는 각각 1 또는 2이고, (b+c)는 M의 원자가이고, (a+b+c+d)는 4이고, 각각의 z는 독립적으로 1, 2, 3 또는 4이고, x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고, n은 0 내지 4 범위의 수이다.
<화학식 I>
상기 식 중,
M은 금속 원자, 바람직하게는 티탄, 지르코늄, 하프늄 또는 철(III)이고, Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고, 각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고, R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고, d 및 a는 각각 0 또는 1이고, b 및 c는 각각 1 또는 2이고, (b+c)는 M의 원자가이고, (a+b+c+d)는 4이고, 각각의 z는 독립적으로 1, 2, 3 또는 4이고, x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고, n은 0 내지 4 범위의 수이다.
Description
본 발명은 물과 접촉시에 안정하며 루이스 산 특성을 갖는 신규한 리간드 조성물을 포함하는 금속 유기 화합물, 특히 금속 킬레이트 화합물에 관한 것이다. 화합물은 광범위한 루이스 산 촉매화된 유기 반응, 특히 물이 존재할 수 있는 반응에 유용하다.
금속 화합물과 히드록실 기가 있는 유기 화합물을 반응시킴으로써 형성되는 금속 유기 화합물은 매우 잘 알려져 있다. 특히, 예를 들면 티탄 테트라이소프로폭사이드 및 티탄 아세틸아세토네이트와 같은 금속 알콕사이드 및 베타-디케토네이트가 수년 동안 산업 용도로 공지되고 사용되었다. 또한, 티탄 화합물과 알칸올아민의 반응이 안정한 킬레이트를 제공하는데 사용되었다. 예를 들면, 영국 특허 제GB-A-2207426호에는 티탄 오르토에스테르, 글리콜 또는 글리콜 에테르, 알칸올아민 및 히드록시 모노카르복실산 또는 히드록시 디카르복실산인 알파-히드록시 카르복실산의 반응 생성물인 티탄 킬레이트의, 수성 에멀젼 페인트에서의 요변제(thixotropic agent)로서의 용도가 기재되어 있다. 베르카데(Verkade) 등의 문헌 [Y. Kim and J. G. Verkade, Organometallics (2002), 21, 2395-2399]에는 테트라(이소프로필)티타네이트와 2,6-디이소프로필페놀 및 트리스(2-히드록시-3,5-디메틸벤질)아민 또는 트리에탄올아민 또는 2-히드록시-3,5-디메틸벤질 및 히드록시에틸 치환기가 조합된 3차 아민의 반응에 의해 형성된 티타나트란(titanatrane)이 기재되어 있다. 추바(Tshuva) 등의 문헌 [Dalton Trans., (2006) 4169-4172]에서는 특히 가수분해적으로 안정한 형태의 활성 티탄 화합물로서의 잠재성을 조사하기 위해 티탄의 히드록실아민 착물이 연구되었다. 이들은 형성된 착물이 pH 5에서는 물에 비교적 안정하지만 보다 높은 pH에서는 몇 시간에 걸쳐 분해됨을 발견하였다. 유럽 특허 제EP-A-0368911호에는 티탄 테트라알콕사이드와 디알칸올아민을 1:1의 몰 비율로 반응시키고, 이어서 생성된 생성물을 제어 가수분해시킴으로써 형성된 티탄의 화합물이 기재되어 있다. 상기 화합물은 물에 안정하며 에스테르화 반응을 위한 촉매로서 활성인 것으로 기재되어 있다.
루이스 산은 많은 유기 반응에서 사용되는 중요한 촉매이지만, 통상적으로 물에 대해 고반응성이며 이에 따라 물이 존재하는 반응에서 사용하는 것이 어려울 수 있다는 점에서 큰 단점이 있다. 고바야시(Kobayashi) 등의 문헌 [J. Am. Chem. Soc. (1998) 120, 8287-8288]에는 희토류 금속 트리플레이트인 신규한 수 안정성 루이스 산이 기재되어 있으며, 고바야시 및 마나베(Manabe)의 문헌 [Pure Appl. Chem., vol 72, No 7, 1373-1380 (2000)] 및 미국 특허 제US-A-6525227호에는 이의 유기 합성 반응을 위한 "그린(green)" 루이스 산 촉매로서의 용도가 논의되어 있다. 그러나, 물에 안정하며 경제적이고 불소를 함유하지 않는 루이스 산 촉매로서 유용한 별법의 화합물이 요구되고 있다.
유럽 특허 제EP-A-0278684호에는 수압 파쇄 유체(hydraulic fracturing fluid)에서의 가교제로서의 N-(2-히드록시에틸)-N-(2-히드록시프로필)-N',N'-비스-(2-히드록시프로필)에틸렌디아민과 지르코늄 테트라알콕사이드의 반응에 의해 형성된 수용성 지르코늄 킬레이트가 기재되어 있다. 미국 특허 제2824115호에는 티탄 또는 지르코늄 및 "쿼드롤(Quadrol)" (N,N,N',N'-테트라키스(2-히드록시프로필)에틸렌디아민)을 비롯한 아미노알코올의 에스테르인 유기금속 화합물, 및 이의 분산제, 페인트 첨가제, 양모 및 다른 섬유를 위한 처리제로서의 그리고 화장품 적용에서의 용도가 기재되어 있다. 미국 특허 제3294689호에는 Fe, Mn, Cu, Zn 및 Ni 이온을 위한 금속이온봉쇄제(sequestering agent)의 성분으로서의 N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민 및 유사한 폴리히드록시아민의 용도가 기재되어 있다. 종래 기술 문헌의 어디에도 본원에 기재된 금속 유기 화합물의 촉매로서의 용도는 기재되어 있지 않다.
본 발명의 목적은 신규한 금속 유기 화합물을 제공하는 것이다. 본 발명의 추가의 목적은 촉매화에 유용한 가수분해적으로 안정한 금속 착물, 및 루이스 산 촉매화된 반응을 수행하는 방법을 제공하는 것이다.
본 발명에 따라, 본 발명자들은 하기 화학식 I의 금속 유기 화합물을 포함하는 촉매를 제공한다.
<화학식 I>
상기 식 중,
M은 금속 원자이고,
Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고,
각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고,
R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고,
d 및 a는 각각 0 또는 1이고,
b 및 c는 각각 1 또는 2이고,
(b+c)는 M의 원자가이고,
(a+b+c+d)는 4이고,
각각의 z는 독립적으로 1, 2, 3 또는 4이고,
x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고,
n은 0 내지 4 범위의 수이다.
화학식 I의 금속 유기 화합물은 루이스 산 특성을 갖고, 이의 물 및 극성 알코올에서의 안정성으로 인해 루이스 산 촉매로서 유용하다. 이에 따라, 본 발명의 중요한 양태는 탄소와 탄소, 탄소와 산소, 탄소와 질소, 산소와 질소, 산소와 황 및/또는 질소와 질소 원자 사이에 하나 이상의 단일 또는 다중 결합을 형성하기 위한, 유기 합성에 유용한 반응을 포함하나 이에 제한되지 않는 화학 반응을 위한 촉매로서, 화학식 I의 금속 유기 화합물의 용도에서 발견된다. 이러한 반응은 알돌 반응, 마이클(Michael) 부가, 마니히(Mannich) 반응, 에스테르화, 에테르 형성, 산화, 산화적 커플링, 펩티드 합성, 아미드 합성, 클라이젠(Claisen) 반응 및 중합과 같은 축합 반응을 포함한다.
본 발명의 추가의 양태에 따라, 본 발명자들은 화학식 I의 루이스 산 촉매 0.01 중량% 내지 70 중량% 및 물 또는 알코올 또는 이들의 혼합물 0.1 중량% 내지 99.99 중량%를 포함하며, 나머지가 1종 이상의 유기 화합물로 구성된 조성물 제공한다.
조성물은 루이스 산 촉매화된 반응의 공급원료(feedstock), 촉매, 반응 혼합물 또는 생성물의 형태일 수 있다. 금속 유기 화합물은 물 또는 알코올 또는 이들의 혼합물에 용해될 수 있다. 다른 용매가 존재할 수도 있다. 루이스 산 촉매는 임의의 적합한 용매에 용해될 수 있다.
본 발명의 추가의 양태에서, 본 발명자들은 화학식 I의 금속 유기 화합물을 포함하는 촉매의 존재하에 촉매화된 반응을 수행하는 것을 포함하는, 촉매화된 반응을 수행하는 방법을 제공한다.
본 발명의 추가의 양태에서, 본 발명자들은 본 발명의 조성물이 공급원료, 촉매, 반응 혼합물 또는 생성물로서 존재하는, 루이스 산 촉매화된 유기 반응을 수행하는 방법을 제공한다.
금속 M은 금속-산소 공유 결합을 형성할 수 있는 임의의 금속으로부터 선택될 수 있다. 바람직한 금속은 티탄, 지르코늄, 하프늄, 철(III), 알루미늄 및 주석, 특히 티탄, 지르코늄, 하프늄 및 철(III)을 포함한다. 특히 바람직한 금속은 티탄 및 지르코늄, 특히 티탄을 포함한다.
Y는 질소 또는 인, 가장 바람직하게는 질소 원자를 나타낸다. Y 원자는 착물이 안정화되도록 금속과 배위 결합을 형성할 수 있다. 이론에 얽매이고자 하는 것은 아니지만, N의 전자 구조는 특히 착물에서의 이러한 결합 형성을 허용하는 것으로 여겨진다.
각각의 R1 및 R2는 서로 다른 R1 및/또는 R2와 동일하거나 상이할 수 있다. 또한, 이는 화학식 I의 일부인 (HO(CR1R2)z)2에서, 각각의 두 (CR1R2)z 잔기가 동일하거나 상이할 수 있음을 의미한다. R1 및 R2는 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택될 수 있다. R1 및/또는 R2가 알킬 또는 치환된 알킬인 경우, 알킬 기는 탄소 원자수가 바람직하게는 1 내지 12, 더 바람직하게는 1 내지 8이며, 선형 또는 분지형일 수 있다. R1 및/또는 R2가 아릴 또는 치환된 아릴 기인 경우, 이는 바람직하게는 페닐 기 또는 치환된 페닐이다. -(CR1R2)z- 기는 예를 들어 아릴 또는 시클로알킬 고리와 같은 큰 구조의 일부를 형성할 수 있으며, 이러한 경우 R1 및 R2는 서로 연결될 수 있거나 z가 1을 초과하는 경우에는 또다른 CR1R2 잔기로 연결될 수 있다. 임의의 CR1R2 잔기는 예를 들어 비닐 중합체와 같은 중합체 구조의 일부를 형성할 수 있거나, 중합체 분자에 부착된 펜던트 기의 일부를 형성할 수 있다. 바람직한 실시양태에서, 각각 하나의 R1 및 R2는 수소 원자, 메틸 또는 에틸 기이다.
R3 및 R4는 서로 동일하거나 상이할 수 있다. 이들은 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택될 수 있으며, R1 및 R2에 대해 기재된 기와 동일한 기로부터 선택될 수 있다. R3 및 R4는 R1 및/또는 R2와 동일하거나 상이할 수 있다. -(CR3R4)x-는 두 Y 원자들 사이의 가교 기이다. x는 두 Y 원자들 사이의 C 원자의 개수를 나타내며, 바람직하게는 2 또는 3이어서, Y 원자가 각각 배위 결합을 형성하는 경우 금속, Y 원자 및 가교 기 -(CR3R4)x-가 함께 5원 또는 6원의 고리를 형성한다. 가교 기 -(CR3R4)x-는 예를 들어 아릴 또는 시클로알킬 고리와 같은 큰 구조의 일부를 형성할 수 있으며, 이러한 경우 R3 및 R4는 서로 연결될 수 있거나 x가 1을 초과하는 경우에는 또다른 CR3R4 잔기로 연결될 수 있다. 임의의 CR3R4 잔기는 예를 들어 비닐 중합체와 같은 중합체 구조의 일부를 형성할 수 있거나, 중합체 분자에 부착된 펜던트 기의 일부를 형성할 수 있다. 바람직한 일 실시양태에서, 각각 하나의 R3 및 R4는 수소 원자 또는 메틸 기, 더 바람직하게는 수소 원자이다.
R1, R2, R3 및 R4의 적절한 선택에 의해, 화합물은 CR1R2 또는 CR3R4 탄소 원자들 중 하나 이상에서 키랄성일 수 있다.
각각의 z는 1, 2, 3 또는 4이며, 서로 다른 z와 동일하거나 상이할 수 있다. z는 바람직하게는 2 이상, 더 바람직하게는 2 또는 3이다. z가 2 또는 3인 경우, 금속, 각각의 -O(CR1R2)z 잔기 및 Y 원자는 함께 금속 유기 화합물에서 5원 또는 6원의 고리를 형성할 수 있다.
본 발명의 금속 유기 화합물은 하기 화학식 II의 킬레이트 화합물과 금속 M의 화합물의 반응에 의해 형성되는 킬레이트이다.
<화학식 II>
금속 M의 원자가가 4인 경우, 임의의 또는 모든 4개의 히드록실 기는 금속 산소 공유 결합이 형성되도록 금속과 반응할 수 있다. 이러한 경우, 화학식 I에서, b 및 c는 각각 2이고, d 및 a는 둘 다 0이다. M의 원자가가 4 미만인 경우, 모든 관능기가 어느 한번에 반응하지 않을 수 있으며, 이에 따라 반응하지 않은 히드록실 기가 킬레이트에 존재할 수 있다. 그러나, 이러한 히드록실 기는 금속 M과 배위 결합을 형성할 수 있어서, 킬레이트를 안정화시키는데 참여할 수 있다. M이 3가 금속인 경우, 화학식 I에서, a는 1이고, b는 1이고, c는 2이고, d는 0이다.
바람직한 킬레이트 화합물은 THEED로서 공지될 수 있고 본원에서 THEED로서 나타낼 수 있는 (HO(CH2)2)2N-(CH2)2-N((CH2)2OH)2, 즉 N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민을 포함한다. 바람직한 일 실시양태에서, 금속 유기 화합물은 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄 Ti(TOEED)를 포함한다. 이는 신규한 화합물인 것으로 여겨진다. 상기 화합물은 가수분해에 매우 안정하여서, 물이 존재하는 반응을 위한 촉매로서 사용될 수 있다. 제2의 바람직한 킬레이트 화합물은 THPED로서 공지될 수 있고 본원에서 THPED로서 나타낼 수 있는 (HOCH(CH3)CH2)2N-(CH2)2-N(CH2CH(CH3)OH)2, 즉 N,N,N',N'-테트라키스(2-히드록시프로필)에틸렌디아민을 포함한다. THPED로부터 형성되는 바람직한 촉매는 N,N,N'N'-테트라키스(2-히드록시프로필)에틸렌디아민 티탄이다 (이는 Ti(TOPED)로서 공지될 수 있고 본원에서 Ti(TOPED)로서 나타낼 수 있음).
n의 값은 금속의 산화 상태 및 이의 배위수에 따라 좌우된다. M이 산화 상태가 4이며 기재된 화합물에서 배위수가 7인 것으로 여겨지는 티탄과 같은 금속인 경우, n은 1이다. M이 산화 상태가 4이며 배위수가 8인 지르코늄 또는 하프늄과 같은 금속인 경우, n은 1 내지 3, 보통 1 또는 2이다.
n이 0을 초과하는 경우, R5OH가 금속 킬레이트에 배위되며, 금속 킬레이트와의 혼합물에 존재하는 용매, 반응물 또는 다른 분자로부터 유도된다. 평형 상태인 이러한 혼합물은 R5OH가 R5O-로서 존재하여 킬레이트 화합물의 히드록실 기들 중 하나 이상을 대신하여 금속에 공유 결합된 금속 킬레이트의 하나 이상의 분자를 포함할 수 있다. 예를 들면, 메탄올 중 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄의 용액은 (OCH2CH2)2N-(CH2)2-N-CH2CH2OH(CH2CH2O)-Ti-OCH3 유형의 다양한 종을 포함할 수 있다. 그러나, 단순성을 위해, 본원에서는 용매화 또는 배위 분자를 R5OH로서 나타낼 것이다.
R5는 R5OH가 물, 알킬 알코올 또는 디올 또는 폴리올인 경우 수소, 알킬 기 또는 히드록시 관능화된 알킬 기 또는 폴리옥시알킬 잔기이다. 바람직한 수화된, 즉 R5OH가 물인 화합물은 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 금속 수화물 및 N,N,N',N'-테트라키스(2-프로폭시)에틸렌디아민 금속 수화물을 포함하며, 여기서 금속은 티탄, 지르코늄, 하프늄 및 철(III)로부터 선택된다. 화합물의 수화된 형태는 가수분해에 특히 안정하여, 촉매 활성이 현저하게 손실되지 않으면서 연장된 시간 동안 물과 접촉하게 저장될 수 있다. 수화된 화합물은 수화되지 않은 화합물을 물과 혼합하는 경우 형성된다. 이에 따라, 또한, 화합물이 물을 포함하는 반응 혼합물 중에 존재하는 경우 계내에서(in situ) 형성될 수 있을 것이다. R5OH가 알코올 (또는 디올을 비롯한 폴리올)인 경우에는, 알코올이 금속에 배위하여, 착물을 안정화시킨다. 물이 존재하는 경우에는, 수 안정화된 착물 및 알코올 안정화된 착물이 평형 상태로 있게 된다. 화학식 I의 화합물을 포함하는 조성물이 화학 기재의 산화를 위한 과산화수소, 유기 히드로퍼옥사이드 또는 퍼옥시산의 활성화를 위한 촉매로서 사용되는 경우에는, 금속 유기 화합물이 물 또는 용매의 분자, 또는 퍼옥사이드 또는 퍼옥시산에 배위될 것이다. R5가 퍼옥사이드 또는 히드로퍼옥사이드로부터 유도되는 경우, R5는 R6O이다. R5가 퍼옥시산으로부터 유도되는 경우, R5는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있다. 퍼옥사이드 또는 퍼옥시산의 용액 중에 착물이 있는 경우에는 수화된 (또는 달리 용매화된) 형태의 착물 및 퍼옥소 배위된 형태의 착물이 둘 다 존재할 것이다.
화합물은 비교적 높은 농도까지, 예를 들면 물 중 Ti(TOEED) 약 70 중량%까지 약 20℃에서 물 또는 알코올에서 안정한 용액을 형성할 수 있다. 수용액은 낮은 pH에서 더 안정한 것으로 보인다. 예를 들면, Ti(TOEED)의 10 중량% 수용액은 pH 10에서는 안정하지만, pH가 11 이상으로 상승된 경우에는 침전물이 형성되기 시작한다. 예를 들면 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄의 경우로 여겨지는 바와 같이, 수화되지 않은 형태가 이량체인 경우에는, 물이 존재할 때 이량체 및 수화물이 평형 상태로 있게 된다.
금속 유기 화합물은 금속 화합물과 킬레이트 화합물을 교반하면서 함께 혼합함으로써 제조될 수 있다. 반응물들은 임의의 순서로 첨가될 수 있다. 필요에 따라, 가열 또는 냉각될 수 있다. 예를 들면, 금속 유기 화합물이 리간드 화합물을 티탄 알콕사이드에 첨가하여 형성되는 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄 Ti(TOEED)를 포함하는 경우, 반응은 매우 고온이 된다. 열은, 성분들을 매우 서서히 혼합하거나 혼합물을 냉각시킴으로써 제어될 수 있다. 리간드 형성 화합물과 금속 화합물의 반응으로부터의 공생성물(들)은 생성물의 특성에 따라 증류, 유도체화 또는 다른 분리 방식과 같은 적합한 방식에 의해 반응 혼합물로부터 제거될 수 있다. 공생성물은, 예를 들면 출발 금속 화합물로서 금속 할라이드 또는 알콕사이드가 사용되는 경우 수소 할라이드 또는 알코올이다. 별법으로, 공생성물은 목적하는 경우 최종 생성물 중에 보유될 수 있다. 반응은 필요에 따라 적합한 용매의 존재하에 수행될 수 있다.
금속 화합물은 킬레이트 화합물에 존재하는 히드록실 기들 중 적어도 하나와 반응하여 금속-산소 결합을 형성할 수 있다. 적합한 금속 화합물은 금속 할라이드, 금속 알콕사이드, 금속 할로-알콕사이드, 금속 카르복실레이트 및 이들 화합물의 혼합물을 포함한다. 전형적인 알콕사이드의 화학식은 M(OR)y (식 중, M은 Ti, Zr, Hf, Al, Fe 또는 Sn이고, y는 금속의 산화 상태, 즉 3 또는 4이고, R은 치환된 또는 비치환된, 환형 또는 선형, 알킬, 알케닐, 아릴 또는 알킬-아릴 기 또는 이들의 혼합물임)이다. 바람직하게는, R은 탄소 원자수가 8 이하, 더 바람직하게는 6 이하이다. 일반적으로, 모든 OR 기는 동일하지만, 알코올들의 혼합물로부터 유도된 알콕사이드가 사용될 수 있으며, 하나를 초과하는 금속이 착물에 존재하는 경우 알콕사이드들의 혼합물이 이용될 수 있다. 금속이 티탄인 경우, 바람직한 티탄 화합물은 화학식 Ti(OR)4 (식 중, R은 바람직하게는 탄소 원자수가 1 내지 8인 알킬 기이며, 각각의 R 기는 다른 R 기와 동일하거나 상이할 수 있음)의 티탄 알콕사이드를 포함한다. 특히 적합한 금속 화합물은 티탄 테트라클로라이드, 티탄 테트라이소프로폭사이드, 티탄 테트라-n-프로폭사이드, 티탄 테트라-n-부톡사이드, 티탄 테트라에톡사이드 (테트라에틸 티타네이트), 지르코늄 n-프로폭사이드, 지르코늄 부톡사이드, 하프늄 부톡사이드, 주석 이소프로폭사이드, 주석 부톡사이드, 주석 테트라클로라이드, 주석 테트라브로마이드, 알루미늄 sec-부톡사이드, 알루미늄 트리클로라이드, 철(III) 클로라이드, 알루미늄 트리메톡사이드, 철 트리메톡사이드, 알루미늄 트리에톡사이드, 철 트리에톡사이드, 알루미늄 트리이소프로폭사이드, 철 트리이소프로폭사이드, 알루미늄 트리-n-프로폭사이드, 철 트리-n-프로폭사이드, 알루미늄 트리-tert-부톡사이드, 철 트리-tert-부톡사이드, 및 철 트리-sec-부톡사이드를 포함한다.
본 발명의 화합물은 많은 루이스 산 촉매화된 유기 반응에서 촉매로서 사용될 수 있다. 물 및 알코올에서의 본 발명의 금속 유기 화합물의 안정성은 이를 예를 들어 용매 또는 반응물로서 물이 존재하는 반응에서 사용하는 것을 가능하게 한다. 본 발명의 루이스 산 촉매가 사용되는 경우 반응을 위한 용매로서의 물의 이용가능성은 물에 안정하지 않은 루이스 산 촉매를 사용하는 경우보다 현저한 환경적 이점을 명백하게 제공한다. 더욱이, 물 또는 알코올이 반응 동안 생성되는 경우, 또는 미량의 물이 (즉, "습윤" 용매의 사용에 의해) 반응 혼합물에 존재하거나 이러한 반응이 수행되는 분위기하에 존재할 수 있는 경우, 본 발명의 화합물은 촉매의 원하지 않는 가수분해의 위험성 없이 이러한 반응에서 내수성(water-tolerant) 루이스 산 촉매로서 사용될 수 있다. 또한, 본 발명의 화합물을 촉매로서 사용하는 경우, 반응 생성물 혼합물의 후처리시에 물이 사용될 수 있는 이점이 있다. 예를 들면, 반응의 촉매가 본 발명의 수 안정성 화합물인 경우에는, 이를 물 또는 수용액으로 세척함으로써 유기 반응 혼합물로부터 분리할 수 있고, 이어서 임의로는 재사용할 수 있다. 루이스 산 촉매를 포함하는 조성물에 존재할 수 있는 전형적인 알코올은 1가 알코올, 특히 메탄올 및 에탄올과 같은 C1-C8 알킬 알코올; 및 에틸렌 글리콜, 디에틸렌 글리콜 및 폴리에틸렌 글리콜과 같은 다가 알코올이다. 티탄 촉매는, 예를 들면 메탄올의 존재하의 티탄 메톡사이드의 형성에 대해 내성이어서, 티탄 알콕사이드와 같은 통상적인 티탄 촉매를 사용하는 경우에 비해 현저한 이점을 제공한다. 본 발명의 방법에서 사용되는 촉매의 높은 루이스 산 활성 및 높은 가수분해 안정성은 촉매의 불연성과 함께, 촉매를 많은 산업적인 반응에 매우 바람직하게 만든다. 더욱이, 반응의 생성물은 표준 금속 알콕사이드 촉매로부터 방출되는 불안정성(labile) 알콕시 기에 의한 오염을 회피할 것이다.
촉매화된 반응은 탄소와 탄소, 탄소와 산소, 탄소와 질소, 산소와 질소, 산소와 황 및/또는 질소와 질소 원자 사이의 하나 이상의 단일 또는 다중 결합을 형성하기 위한, 유기 합성에 유용한 반응을 포함할 수 있다. 이러한 반응은 알돌 반응, 마이클 부가, 마니히 반응, 에스테르화, 에테르 형성, 산화, 펩티드 합성, 아미드 합성, 클라이젠 반응 및 중합과 같은 축합 반응을 포함한다.
화학 기재의 산화를 위한 본 발명에 따른 방법은 목적하는 산화 반응을 수행하기에 적합한 온도 및 압력의 조건하에서, 화학 기재를 과산화수소, 유기 히드로퍼옥사이드 또는 퍼옥시산, 및 화학식 I의 금속 유기 화합물과 접촉시키는 것을 포함한다. 이러한 방법은, 예를 들면 히드록실아민, 니트로소 화합물, 아족시 화합물 및 니트론을 형성하기 위한 N-산화와 같은 산화를 수반하는 화학 합성 공정과 같은 다양한 산업 공정에 유용하다. 또다른 중요한 산업 공정은 퍼옥사이드, 특히 과산화수소와, 산, 특히 카르복실산, 예를 들면 과아세트산을 형성하기 위한 아세트산과의 반응에 의한 과산(peracid)의 형성 공정이며, 과산은 이어서 에폭사이드를 형성하기 위해 불포화 탄화수소, 예를 들면 알켄 및 알킨과 같은 산화성 기재의 산화 또는 과산화를 위해 사용될 수 있다. 이로써 형성되는 에폭사이드는 알코올을 사용하여 가수분해 또는 개환되어 디올을 형성할 수 있다. 표백(bleaching)은 과산화수소의 사용이 현저한 환경적 이점을 제공할 수 있는 중요한 산업 공정이다. 이러한 공정은 세탁용 세제와 같은 표백 작용이 있는 세제 제형물에서의 용도를 비롯한 목재 및 종이 펄프, 텍스타일 표백을 포함한다. 공정은 폐 스트림, 예를 들면 도시 하수(municipal waste)의 처리, 및 H2S, 유기 황화물 및 티오펜과 같은 환형 황 화합물과 같은 황 함유 화합물의 산화를 위해 사용될 수 있다. 산업 방출물은, 예를 들면 시아나이드, 니트라이트 및 하이포클로라이트를 해독하기 위해, 그리고 술파이트, 티오술파이트 및 술파이드 화합물을 제거하기 위해, 본 발명의 방법을 사용하여 처리될 수 있다.
본 발명의 특히 중요한 공정은 아족시 화합물을 형성하기 위한 방향족 아민의 산화적 커플링 공정이다. 아족시 화합물은 액정 디스플레이의 염료로서의 용도 및 치료 용도와 같은 다른 적용을 위해 중요하다. 특정 유형의 금속 유기 화합물이 촉매로서 사용되는 본 발명의 방법을 사용하는 경우, 물을 용매로서 사용하여 아민으로부터 아족시 화합물을 80%를 초과하는 선택성으로 제조하는 것이 가능해진다. 놀랍게도, 반응 혼합물 중 물의 존재는 심지어 티탄 화합물이 사용되는 경우에도 촉매를 불활성화시키지 않으며, 촉매는 여러 배치에 걸쳐 여전히 활성이다. 아족시 화합물의 제조는 생성된 착색 아족시 화합물(들)에 의해 염색되는 기재 상에서 계내에서 수행될 수 있다. 이러한 적용은 섬유 및 천의 염색, 및 인간 및 동물 모발 및 피부의 착색을 포함한다. 특히, 영구 모발 착색제의 적용은 통상적으로 과산화수소 및 활성화제의 사용을 수반한다. 퍼옥사이드는 이러한 계에서 여러 작용을 하며, 중요한 작용은 아족시 화합물을 비롯한 착색 종을 형성하기 위해 방향족 아민을 산화적으로 커플링시키는 것이다. 화학식 I의 금속 유기 조성물을 사용한 과산화수소의 활성화는 암모니아의 사용을 회피하는 수 안정성 산화 계를 제공한다. 본 발명의 방법을 사용한 방향족 아민으로부터의 아족시 화합물의 형성의 활성 및 선택성은 부산물의 형성을 회피한다. 국제 특허 제WO-2006/106366호에는 신체 표면과 제품 사이의 커플링을 개선하기 위해 모발 착색제를 비롯한 피부 및 모발에 적용하기 위한 국소 제품에서 티탄 화합물을 사용하는 것이 기재되어 있다. 이러한 제품에서 화학식 I의 화합물을 사용하는 경우, 물에서의 금속 유기 화합물의 본질적인 안정성으로 인해 제품의 성능을 추가로 개선할 수 있다.
에스테르화 반응에서 화학식 I의 촉매를 사용하는 경우 알코올과 카르복실산 또는 무수물과의 반응에 의해 에스테르를 형성하는 직접 에스테르화, 예를 들면 디옥틸 프탈레이트를 형성하기 위한 프탈산과 2-에틸헥산올과 같은 알코올 사이의 반응을 포함한다. 알코올 잔기의 교환으로 두 에스테르를 반응시키는 인터에스테르화(interesterification), 및 에스테르를 알코올과 반응시키는 (예를 들면, 지방 및 오일의 반응물, 즉 글리세라이드를 메탄올과 같은 알코올과 반응시키는) 트랜스에스테르화(transesterfication)가 또한 화학식 I의 촉매가 사용될 수 있는 산업적으로 중요한 공정이다.
본 발명은 하기 실시예에 증명될 것이다.
실시예 1 Ti[TOEED]의 제조
N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민 (THEED) (시그마-알드리치(Sigma-Aldrich)/플루카(Fluka) 제조) 236 g (1 몰)을 테트라(이소프로폭시)티탄 (존슨 매테이 카탈리스츠(Johnson Matthey Catalysts) 제조의 베르텍(VERTEC™) TIPT) 284 g (1 몰)에 교반하면서 서서히 첨가하여, 투명한 황색 용액을 수득하였다. 반응에서 생성된 이소프로판올을 감압하에서 회전 증발로 제거하여, N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄 (Ti[TOEED])의 담황색 분말 (280 g)을 수득하였다.
실시예 2
실시예 1의 화합물을 10% w/w 수용액이 형성되도록 물에 용해시켰다. 용액을 1시간 동안 비등시키고, 이어서 물을 증발로 제거하였다. 생성된 담황색 분말은 출발 물질과 동일한 화합물인 것으로 발견되었으며, 이는 사용된 조건하에서 가수분해에 안정한 화합물임을 나타낸다. 황색 분말을 클로로포름에서 재결정화시키고, 1H-NMR, 원소 분석 및 X-선 결정학으로 측정된 결정 구조를 사용하여 분석하였다.
NMR 분석 결과, (테트라메틸 실란 (TMS)에 대한) 하기 화학적 이동 데이터를 수득하였으며 (m은 다중항을 나타냄), 이는 N,N,N',N'-테트라키스(2-에톡시)에틸렌디아민 티탄의 존재와 일치하였다.
원소 분석 결과, 하기 데이터를 수득하였다.
결정 구조는 도 1에 나타내었다. 구조는 다이어그램에서 O1 및 O5로 나타낸 2개의 산소 원자에 의해 가교된 2개의 Ti 중심이 있는 이량체인 것으로 나타났다.
실시예 3
THEED에 TIPT를 첨가하는 것을 제외하고 실시예 1을 반복하였다. 유사한 담황색 분말이 생성되었다.
실시예 4
THEED 236 g (1 몰)을 TIPT 284 g (1 몰)에 교반하면서 서서히 첨가하여, 투명한 황색 용액을 수득하였다. 상기 용액에 물 360 g을 첨가하고, 모든 프로판올이 제거될 때까지 물과 이소프로판올의 혼합물을 공비 증류로 제거하였다. 생성된 수용액을 분무 건조시켜, 담황색 분말 (280 g)을 수득하였다.
실시예 5 Ti(TOPED)의 제조
N,N,N',N'-테트라키스(2-히드록시프로필)에틸렌디아민 (THPED) (알파 아에사르(Alfa Aesar) 제조) 292 g (1 몰)을 테트라(이소프로폭시)티탄 (존슨 매테이 카탈리스츠 제조의 베르텍™ TIPT) 284 g (1 몰)에 교반하면서 첨가하여, 투명한 용액을 수득하였다. 반응 동안 생성된 이소프로판올을 감압하에서 회전 증발로 제거하여, N,N,N',N'-테트라키스(2-옥시프로필)에틸렌디아민 티탄 (Ti(TOPED))의 백색 분말 (336 g)을 수득하였다. 상기 백색 분말을 1H-NMR 및 원소 분석을 사용하여 분석하였다.
NMR 분석 결과, (테트라메틸 실란 (TMS)에 대한) 하기 화학적 이동 데이터를 수득하였으며 (m은 다중항을 나타냄), 이는 N,N,N',N'-테트라키스(2-옥시프로필)에틸렌디아민 티탄의 존재와 일치하였다.
원소 분석 결과, 하기 데이터를 수득하였다.
실시예 6 Ti[TOBED]의 제조
테트라이소프로필 티타네이트 (28.422 g)를 N,N,N',N'-테트라(2-히드록시부틸)에틸렌디아민 (38.853 g)에 일정하게 혼합하면서 서서히 첨가하였으며, 열이 방출되었다. 이어서, 생성된 N,N,N',N'-테트라키스(부톡시)에틸렌디아민 티탄 (Ti[TOBED])의 용액을 디에틸렌 글리콜 (16.73 g)로 희석하였다.
실시예 7
실시예 1의 화합물을 10% w/w 용액이 형성되도록 메탄올에 용해시켰다. 용액을 1시간 동안 비등시키고, 이어서 메탄올을 증발로 제거하였다. 생성된 담황색 분말은 출발 물질과 동일한 화합물인 것으로 발견되었으며, 이는 사용된 조건하에서 가메탄올분해(methanolysis)에 안정한 화합물임을 나타낸다.
실시예 8 Zr(TOEED)의 제조
n-프로필 알코올 중 n-프로필 지르코네이트의 용액 44.3 g (지르코늄 0.1 몰)을 N,N,N',N'-테트라(히드록시-2-에틸)에틸렌디아민 (23.631 g)에 일정하게 혼합하면서 서서히 첨가하였으며, 열이 방출되었다. 무색 액체가 생성되었으며, 정치시켰을 때 이로부터 결정이 침전되었다. 결정은 이량체, 즉 [Zr(TOEED)]2인 것으로 추정되었다.
실시예 9 Zr(TOPED)의 제조
n-프로필 알코올 중 n-프로필 지르코네이트의 용액 44.3 g (지르코늄 0.1 몰)을 N,N,N',N'-테트라(히드록시-2-프로필)에틸렌디아민 (29.242 g)에 일정하게 교반하면서 서서히 첨가하였으며, 열이 방출되었다. 무색 액체가 생성되었으며, 정치시켰을 때 이로부터 결정이 침전되었다.
실시예 10 직접 에스테르화
자기 교반 막대, 수바 실(suba seal), 모세관 및 온도계가 장착된 1 리터 플라스크에 프탈산 무수물 (148 g, 1.00 몰) 및 2-에틸-1-헥산올 (315 g, 2.42 몰)을 첨가하였다. 반응 부산물로서의 물을 제거하기 위해 반응 플라스크에 가열 맨틀 및 딘 스타크 장치(Dean and Stark apparatus)를 장착하였다. 이어서, 질소 주입구를 모세관에 연결하였다. TIPT (0.40 g, 1.41×10-3 몰) 또는 Ti[TOEED] (0.40 g, 1.43×10-3 몰)인 촉매를 2-에틸-1-헥산올 (10 g, 0.08 몰)에 용해시키고, 주사기를 사용하여 주변 온도에서 상기 반응 혼합물에 첨가하였다. 이어서, 반응 플라스크를 맨틀의 가장 높은 설정으로 가열하고, 반응 타이머를 시작시켰다. 반응 혼합물이 200±5℃의 온도에 도달하였을 때, 빠른 증류 속도를 유지하는데 필요한 만큼 진공을 적용하고, 반응 온도를 200±5℃로 유지하였다. 전환율은 0.1N 알코올 KOH 및 브로모-티몰-블루 지시약을 사용하여 적정으로 결정되는 산가(acid value)로부터 계산하였다. 결과를 하기 표 1에 나타내었다.
비교 방법 (고온 첨가)
2-에틸-1-헥산올 용액 중 TIPT 촉매를 가열된 반응 혼합물에 첨가하고, 이어서 반응 타이머를 시작시키는 것을 제외하고 상기 방법을 반복하였다. 본 비교 방법은 TIPT가 반응의 부산물로서 생성된 물과 접촉시에 가수분해될 가능성을 최소화시키려는 의도였다.
표 1의 결과는 디옥틸프탈레이트를 제조하기 위한 프탈산 무수물과 2-에틸-1-헥산올의 직접 에스테르화에서 Ti[TOEED]가 TIPT보다 활성인 루이스 산 촉매임을 나타내었다. 티탄 촉매의 가수분해는 촉매 활성이 낮은 것으로 알려져 있는 수산화티탄 종의 불용성 응집물을 형성시켰다. TIPT에 비해 높은 Ti[TOEED]의 가수분해 안정성은 상기 반응의 촉매 활성에서 관찰된 차이의 원인이 된다. 직접 에스테르화 반응의 부산물인 물에 의한 TIPT의 불활성화는 반응의 초기 단계 동안 생성되는 물 및 반응물 중 임의의 물이 제거됨으로 인해 반응 온도가 180℃에 도달한 이후 촉매를 첨가하는 경우 (고온 방법)에 감소되었다. 저온 첨가에 비해 고온 혼합물에 첨가되는 TIPT를 사용한 경우의 감소된 가수분해의 영향은 높은 전환율로 나타났다.
실시예 11 트랜스에스테르화
바이오디젤을 형성하기 위한 평지씨유와 메탄올의 트랜스에스테르화를 트리-글리세라이드/메탄올 1:6의 몰 비율을 사용하여 수행하고, Ti[TOPED] (트리-글리세라이드를 기준으로 1.8% w/w)로 촉매화하였다. 오버헤드 교반기 (300 rpm)가 장착된 파르(Parr) 4843 1-L 오토클레이브의 유리 라이너 내에 평지씨유 (220 g, 0.25 몰), 메탄올 (48.0 g, 1.50 몰) 및 Ti[TOPED] (4.00 g, 1.19×10-2 몰)의 반응 혼합물을 칭량하였다. 오토클레이브를 실온에서 밀봉한 후, 질소로 3회 퍼징하였다. 반응기를 200℃의 온도까지 90시간 동안 가열하고, 이어서 냉각시켰다. 생성된 물질을 오토클레이브로부터 꺼내고, 분리 깔대기에 넣어, 글리세롤 상을 분리시킨 후, 고성능 액체 크로마토그래피 (HPLC)로 분석하기 위해 생성물을 테트라히드로푸란 (THF)으로 희석하였다. HPLC 분석은 용리액으로서 HPLC 등급의 THF를 사용하여 UV-Vis 검출기가 장착된 워터스(Waters) 2690 HPLC 시스템 상에서 수행하였다. 회수된 전체 부피를 HPLC 등급의 THF를 사용하여 500 ml까지 만들었다. 상기의 10 ml 분취액을 100 ml까지 만들고, 분석을 위해 사용하였다. HPLC를 트리-글리세라이드 (평지씨유), 디-글리세라이드, 모노-글리세라이드 및 에스테르 (바이오디젤)에 대한 표준물을 사용하여 보정하고, 하기 표 2에 나타낸 결과는 피크 크기로부터 계산되고 전체가 100%가 되도록 정규화된 백분율로서 기록되었다. 비교를 위해 블랭크로서 임의의 티탄 촉매의 부재하에 반응을 반복하였다.
Ti[TOPED]는 메틸 에스테르 (바이오디젤)를 고수율로 제조하기 위한 메탄올과 트리-, 디- 및 모노-글리세라이드 사이의 트랜스에스테르화 반응을 위한 효과적인 루이스 산 촉매인 것으로 나타났다. 촉매의 높은 활성은 이의 가메탄올분해에 대한 안정성과 관련된 것으로 여겨지며, 예상되는 촉매의 안정성이 높을수록 높은 촉매 활성이 제공된다. 티탄 촉매의 가메탄올분해는 촉매 활성이 낮은 것으로 알려진 일련의 티탄 메톡사이드 종의 불용성 응집물을 형성시켰다.
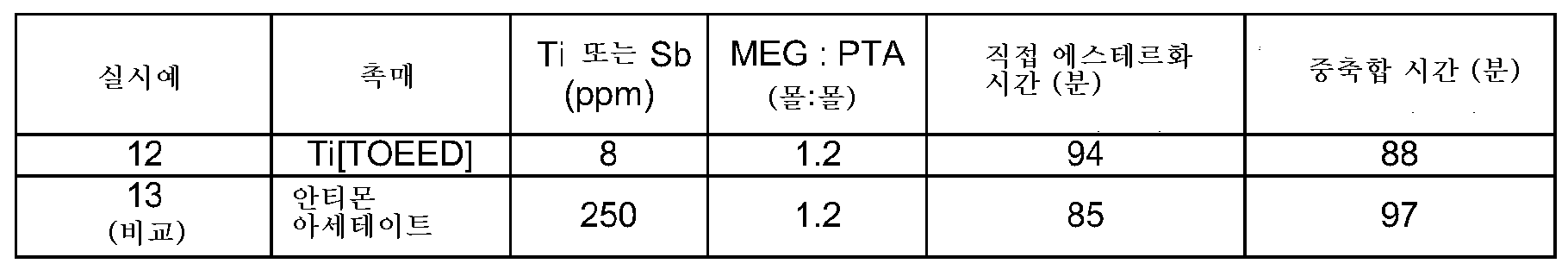
실시예 12 및 비교 실시예 13 폴리에틸렌 테레프탈레이트의 제조
고체 테레프탈산 (PTA)을 모노에틸렌 글리콜 (MEG) 및 촉매가 있는 반응기에 충전하였다. 모든 물이 제거될 때까지 40 psi에서 90분에 걸쳐 온도를 60℃에서 260℃로 상승시켰다 (직접 에스테르화). 축합 반응이 진행됨에 따라, 물이 생성되었으며, 일부 MEG와 함께 증발하였다. MEG는 증류 컬럼에서 분리하고, 반응기로 다시 재순환시켰으며, 분리된 물은 제거하였다. 직접 에스테르화 시간은 에스테르화의 시작 (대략 210℃) 시간과 계로부터 물의 완전한 제거 시간 사이의 시간으로서 측정하였다. 이어서, 제1 반응 단계에서 형성되는 생성된 비스-히드록시 에틸 테레프탈레이트 (BHET) 단량체를 중합체의 고유 강도가 0.6 dl/g이 될 때까지 2 mbar 압력 및 290℃에서 중합시켰다. 축합 반응이 진행됨에 따라, MEG 및 소량의 물이 생성되었으며, 반응기로부터 제거하였다. 중축합 시간은 저압을 적용하기 시작한 시간과 표적 고유 점도에 도달한 시간 사이의 시간으로서 측정하였다.
하기 표 3에 나타낸 결과는 Ti[TOEED]가 비스-히드록시 에틸 테레프탈레이트를 제조하기 위한 테레프탈산과 에틸렌 글리콜의 직접 에스테르화 및 폴리에틸렌 테레프탈레이트를 제조하기 위한 비스-히드록시 에틸 테레프탈레이트의 중축합에서 활성인 루이스 산 촉매임을 증명하였다. Ti[TOEED]의 높은 가수분해 안정성은 중축합 반응에서 이의 촉매 활성이 유지되게 하며 비교적 빠른 반응이 생성되게 한다.
실시예 14 1 Ti[TOEED]:100 아닐린:160 H2O2를 사용한 아닐린의 N-산화
하기에 기재된 수용액 중 과산화수소를 화학양론적 양보다 약간 (대략 6%) 과잉으로 사용하여 반응을 수행하였다. 과잉의 H2O2는 반응의 설정 동안 일어날 수 있는 과산화수소의 임의의 분해를 보상하기 위해 제공되었다.
Ti[TOEED] (15.1 mg, 53.9 μmol)를 탈염수 (25.0 ml)에 용해시키고, 아닐린 (500 mg, 5.38 mmol) 및 자기 교반 막대가 담겨 있는 유리 바이알에 첨가하였다. 물 중 대략 35%의 과산화수소 (840 mg, 8.65 mmol)를 탈염수 (25.0 ml)에 용해시키고, 상기 유리 바이알에 첨가하였다. 반응 혼합물을 수조에서 냉각시키면서 주변 온도에서 2시간 동안 교반하였다. 반응 혼합물은 과산화수소 용액을 첨가하였을 때 즉시 밝은 황색의 균질 용액으로 변하였다. 반응의 진행 동안 용액은 암색의 불균질 액적을 포함한 암적갈색을 띠었다.
상기 수성 반응 혼합물을 에틸 아세테이트로 추출하여 (3×50 ml), 투명한 담황색 용액을 수득하였다. 암적/갈색 유기물을 황산마그네슘 상으로 건조시키고, 여과하였다. 회전 증발기에서 유기 용매를 제거하여, 암적/갈색 반고체(semi-solid)를 수득하였다. 샘플을 반응 생성물의 확인을 위해 기체 크로마토그래피 질량 분석기 (GC-MS) 전자 충돌 (EI+) 분석하고, 반응 생성물의 정량 분석을 위해 기체 크로마토그래피 (GC) 화염 이온화 검출 (FID)하였다. 반응 생성물 혼합물에서 발견된 화합물은 니트로소벤젠, 아닐린, 니트로벤젠, 아조벤젠, 아족시벤젠 및 다른 생성물 이후에 용리된 미확인된 생성물이었다. 100%로 정규화된 피크 면적을 아닐린 전환율 및 아족시벤젠에 대한 아닐린 전환율의 선택성과 함께 하기 표 4에 나타내었다. 촉매로서 Ti[TOEED]를 사용한 결과는, 화학양론적으로 당량의 과산화수소 및 낮은 수준의 촉매 (100 아닐린:1 Ti)를 사용한 아닐린의 아족시벤젠으로의 단 2시간 이내의 전환율 수준이 높음을 나타내었다. 아족시벤젠 형성 대 아조벤젠 형성의 반응 선택성 (각각 84:1)은 짧은 반응 시간을 고려하면 비교적 높았다. 아닐린 전환율을 기준으로 한 아족시벤젠 형성의 반응 선택성은 약 97%였다.
실시예 15 (비교)
비교예로서 촉매로서 트리에탄올아민티타네이트 (베르텍™ TET)를 사용하는 것을 제외하고 실시예 14를 반복하였다. TET를 사용한 아닐린의 아족시벤젠으로의 매우 낮은 수준의 전환율 (4% 미만)은 촉매가 불활성화 가수분해 반응되었음을 나타내었다. 이는 또한 반응 선택성이 열악하였다. 아족시벤젠 형성 대 아조벤젠 형성의 반응 선택성은 각각 4:1이었다. 아닐린 전환율을 기준으로 한 아족시벤젠 형성의 반응 선택성은 약 57%였다.
실시예 16 (높은 반응물 농도) 1 Ti[TOEED]:100 아닐린:160 H2O2
Ti[TOEED] (151 mg, 539 μmol)를 탈염수 (25.0 ml)에 용해시키고, 아닐린 (5.00 g, 53.9 mmol) 및 자기 교반 막대가 담겨 있는 유리 바이알에 첨가하였다. 물 중 약 35%의 과산화수소 (8.40 g, 86.5 mmol)를 탈염수 (25.0 ml)에 용해시키고, 상기 유리 바이알에 첨가하였다. 반응 혼합물을 수조에서 냉각시키면서 주변 온도에서 2시간 동안 교반하였다. 반응 혼합물은 과산화수소 용액을 첨가하였을 때 즉시 밝은 황색 균질 용액으로 변하였다. 반응의 진행 동안 용액은 암색의 불균질 액적을 포함한 암적갈색을 띠었다.
상기 수성 반응 혼합물을 실시예 12에 기재된 바와 같이 추출하고 분석하였다. 결과는 화학양록적으로 당량의 과산화수소 및 낮은 수준의 촉매 (100 아닐린:1 Ti)를 사용한 아닐린의 아족시벤젠으로의 단 2시간 이내의 전환율 수준이 높음 (약 90%)을 나타내었다. 상기 반응은 실시예 14에 비해 비교적 높은 농도 (물 50 ml 중 5.0 g 아닐린)로 수행되었다. 아족시벤젠 형성 대 아조벤젠 형성의 반응 선택성은 225:1이었다. 아닐린 전환율을 기준으로 한 아족시벤젠 형성의 반응 선택성은 94%였다.
실시예 17 (비교) 1 TET:100 아닐린:160 H2O2
Ti[TOEED] 대신에 촉매로서 베르텍 TET (314 mg, 539 μmol)를 사용하는 것을 제외하고 용액 중 반응물을 동일하게 높은 농도로 사용하여 실시예 16에 기재된 바와 같이 반응을 수행하였다. TET를 사용한 아닐린의 아족시벤젠으로의 전환율 수준 (약 39%)은 촉매가 가수분해 반응을 통해 일부 불활성화되었음을 나타내었다. 아족시벤젠 형성 대 아조벤젠 형성의 반응 선택성은 각각 35:1이었다. 아닐린 전환율을 기준으로 한 아족시벤젠 형성의 반응 선택성은 95%였다.
실시예 18 1 Ti[TOEED]:500 아닐린:800 H2O2
Ti[TOEED] (3.02 mg, 10.8 μmol)를 탈염수 (25.0 ml)에 용해시키고, 아닐린 (500 mg, 5.39 mmol) 및 자기 교반 막대가 담겨 있는 유리 바이알에 첨가하였다. 과산화수소의 35% 수용액 (840 mg, 8.65 mmol)을 탈염수 (25.0 ml)에 용해시키고, 상기 유리 바이알에 첨가하였다. 반응 혼합물을 수조에서 냉각시키면서 주변 온도에서 24시간 동안 교반하였다. 반응 혼합물은 과산화수소 용액을 첨가하였을 때 즉시 밝은 황색의 균질 용액으로 변하였다. 반응의 진행 동안 용액은 암색의 불균질 액적을 포함한 암적갈색을 띠었다.
상기 수성 반응 혼합물을 실시예 14에 기재된 바와 같이 추출하고 분석하였다. 결과는 화학양론적으로 당량의 과산화수소 및 매우 낮은 수준의 촉매 (500 아닐린:1 Ti)를 사용한 아닐린의 아족시벤젠으로의 96.6% 전환율을 나타내었다. 아족시벤젠 형성 대 아조벤젠 형성의 선택성은 1000:1을 초과하였다.
실시예 19 내지 21 1 Ti[TOEED]:100 아닐린:160 H2O2
Ti[TOEED] (75.5 mg, 269 μmol)를 탈염수 (25.0 ml)에 용해시키고, 아닐린 (2.50 g, 26.9 mmol) 및 자기 교반 막대가 담겨 있는 유리 바이알에 첨가하였다. 물 중 약 35%의 과산화수소 (4.20 g, 43.2 mmol)를 탈염수 (25.0 ml)에 용해시키고, 상기 유리 바이알에 첨가하였다. 반응 혼합물을 수조에서 냉각시키면서 주변 온도에서 3시간 동안 교반하였다. 반응 혼합물은 과산화수소 용액을 첨가하였을 때 즉시 밝은 황색의 균질 용액으로 변하였다. 반응의 진행 동안 용액은 암색의 불균질 액적을 포함한 암적갈색을 띠었다.
상기 수성 반응 혼합물을 실시예 14에 기재된 바와 같이 추출하고 분석하였다. 투명한 담황색 수성 층을 두 추후 반응에서 재사용하였으며, 아닐린 (2.50 g, 26.9 mmol) 및 과산화수소 35% 용액 (4.20 g, 43.2 mmol)을 추가로 첨가하였다. 각각의 반응에 이어서, 반응 생성물 혼합물을 추출하고, 유기 층을 실시예 14의 GC-MS 및 GC 방법으로 분석하였다. 두 추후 반응을 표 4에 실시예 20 및 21로 나타내었다. 추후 배치 반응들 사이에서의 활성 (아닐린의 전환율)의 손실은 각각 에틸 아세테이트 세척으로 수성 층으로부터 촉매가 점차 손실됨으로 인한 것으로 여겨진다. 아닐린 전환율을 기준으로 한 아족시벤젠 형성의 반응 선택성은 각각의 추후 배치에 대해 증가하였으며, 실시예 19는 95%이고, 실시예 20은 96%이고, 실시예 21은 98%였다.
실시예 22 N,N,N',N'-테트라키스(2-옥시프로필)에틸렌디아민 주석의 합성
디클로로메탄 (25 ml) 중 주석 테트라부톡사이드 5.0 g (1.22×10-2 몰)에 N,N,N',N'-테트라키스(2-히드록시프로필)에틸렌디아민 (THPED) 3.55 g (1.22×10-2 몰)을 교반하면서 첨가하여, 투명한 용액을 수득하였다. THPED의 첨가 동안 발열이 관찰되었다. 반응 동안 생성된 디클로로메탄 및 부탄올을 감압하에서 회전 증발로 제거하여, 백색 고체를 수득하였다. 고체를 헥산으로 세척하고, 여과하고, 건조시켜, 백색 분말로서의 N,N,N',N'-테트라키스(2-옥시프로필)에틸렌디아민 주석 (4.9 g, 1.21×10-2 몰)을 수득하였다.
실시예 23 N,N,N',N'-테트라키스(2-옥시에틸)에틸렌디아민 주석의 합성
디클로로메탄 (25 ml) 중 주석 테트라부톡사이드 5.0 g (1.22×10-2 몰)에 N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민 (THEED) 2.87 g (1.22×10-2 몰)을 교반하면서 첨가하여, 투명한 용액을 수득하였다. THEED의 첨가 동안 발열이 관찰되었다. 반응 동안 생성된 디클로로메탄 및 부탄올을 감압하에서 회전 증발로 제거하여, 백색 고체를 수득하였다. 고체를 헥산으로 세척하고, 여과하고, 건조시켜, 백색 분말로서의 N,N,N',N'-테트라키스(2-옥시에틸)에틸렌디아민 주석 (4.2 g, 1.21×10-2 몰)을 수득하였다.
실시예 24 Al[(OCH2CH2)2NCH2CH2N(CH2CH2O)(CH2CH2OH)]의 합성
알루미늄 트리-sec-부톡사이드 0.30 g (1.22×10-3 몰)에 N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민 (THEED) 0.287 g (1.22×10-3 몰)을 교반하면서 첨가하여, 투명한 용액을 수득하였다. THEED의 첨가 동안 발열이 관찰되었다. 반응 동안 생성된 디클로로메탄 및 sec-부탄올을 감압하에서 회전 증발로 제거하여, 황색 액체 (0.3 g, 1.20× 10-3 몰)를 수득하였다.
Claims (16)
- 하기 화학식 I의 금속 유기 화합물을 포함하는 촉매의 존재하에 촉매화된 반응을 수행하는 것을 포함하는, 촉매화된 반응을 수행하는 방법.
<화학식 I>
M은 금속 원자이고,
Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고,
각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고,
R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고,
d 및 a는 각각 0 또는 1이고,
b 및 c는 각각 1 또는 2이고,
(b+c)는 M의 원자가이고,
(a+b+c+d)는 4이고,
각각의 z는 독립적으로 1, 2, 3 또는 4이고,
x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고,
n은 0 내지 4 범위의 수이다. - 제1항에 있어서, Y가 질소 원자를 나타내는 것인 방법.
- 제1항 또는 제2항에 있어서, M이 티탄, 지르코늄, 하프늄 또는 철(III)을 포함하는 것인 방법.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 각각의 R3 및 R4가 H인 방법.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 각각의 R1 및 R2가 H, 메틸 또는 에틸 기인 방법.
- 제1항 내지 제5항 중 어느 한 항에 있어서, 각각의 z가 2 또는 3인 방법.
- 제6항에 있어서, 금속 유기 화합물이 금속 화합물과, N,N,N',N'-테트라키스(2-히드록시에틸)에틸렌디아민, N,N,N',N'-테트라키스(2-히드록시프로필)에틸렌디아민 또는 N,N,N',N'-테트라키스(2-히드록시부틸)에틸렌디아민과의 반응 생성물을 포함하는 것인 방법.
- 제1항 내지 제7항 중 어느 한 항에 있어서, 반응 혼합물에 물 또는 알코올이 존재하는 방법.
- 제8항에 있어서, 반응 혼합물이 유기 화합물 이외에 상기 금속 유기 화합물 0.01 중량% 내지 70 중량% 및 물 99 중량% 내지 0.1 중량%를 포함하는 것인 방법.
- 제1항 내지 제9항 중 어느 한 항에 있어서, n이 1 또는 2인 방법.
- 제1항 내지 제10항 중 어느 한 항에 있어서, 촉매화된 반응이 탄소와 탄소, 탄소와 산소, 탄소와 질소, 질소와 산소, 황과 산소 및/또는 질소와 질소 원자 사이에 하나 이상의 단일 또는 다중 결합을 형성하기 위한 반응을 포함하는 것인 방법.
- 제1항 내지 제11항 중 어느 한 항에 있어서, 상기 촉매화된 반응이 알돌 반응, 마이클(Michael) 부가, 마니히(Mannich) 반응, 에테르 형성, 산화, 산화적 커플링, 펩티드 합성, 아미드 합성 또는 클라이젠(Claisen) 반응을 포함하는 것인 방법.
- 제12항에 있어서, 목적하는 반응을 수행하기에 적합한 온도 및 압력의 조건하에서, 화학 기재를 (i) 과산화수소, 유기 히드로퍼옥사이드 및 퍼옥시산으로 이루어진 군으로부터 선택되는 산화제, 및 (ii) 상기 금속 유기 화합물과 접촉시킴으로써 화학 기재를 산화 또는 산화적 커플링시키는 것을 포함하는 방법.
- 제13항에 있어서, 상기 화학 기재가 알켄, 알킨, 카르복실산, 황 함유 화합물, H2S, 유기 술파이드, 환형 황 화합물, 목재 펄프, 텍스타일, 하이포클로라이트, 니트릴, 니트라이트, 아민, 히드록실아민, 니트로소 화합물, 아족시 화합물 및/또는 니트론을 포함하는 것인 방법.
- (a) 하기 화학식 I의 금속 유기 화합물 0.01 중량% 내지 70 중량%,
(b) 물 또는 알코올 1 중량% 내지 99.99 중량%, 및
(c) 과산화수소, 유기 히드로퍼옥사이드 및 퍼옥시산으로 이루어진 군으로부터 선택되는 산화제 1 중량% 내지 50 중량%
를 포함하는 조성물.
<화학식 I>
M은 금속 원자이고,
Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고,
각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고,
R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고,
d 및 a는 각각 0 또는 1이고,
b 및 c는 각각 1 또는 2이고,
(b+c)는 M의 원자가이고,
(a+b+c+d)는 4이고,
각각의 z는 독립적으로 1, 2, 3 또는 4이고,
x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고,
n은 0 내지 4 범위의 수이다. - 하기 화학식 I의 금속 유기 화합물의 화학 반응의 촉매로서의 용도.
<화학식 I>
M은 금속 원자이고,
Y는 P 및 N으로부터 선택되며, 매우 바람직하게는 N이고,
각각의 R1, R2, R3 및 R4는 독립적으로 H, 알킬, 아릴, 치환된 알킬 또는 치환된 아릴로부터 선택되고,
R5는 수소, 알킬 기, 히드록시 관능화된 알킬 기, 폴리옥시알킬 잔기, R6O 또는 R7COO이며, 여기서 R6 및 R7은 각각 H, 알킬, 아릴 또는 알킬-아릴을 나타낼 수 있고,
d 및 a는 각각 0 또는 1이고,
b 및 c는 각각 1 또는 2이고,
(b+c)는 M의 원자가이고,
(a+b+c+d)는 4이고,
각각의 z는 독립적으로 1, 2, 3 또는 4이고,
x는 Y 원자들 사이의 C 원자의 최소의 개수를 나타내며, 2 또는 3이고,
n은 0 내지 4 범위의 수이다.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB0711733A GB0711733D0 (en) | 2007-06-18 | 2007-06-18 | Lewis-acidic compounds and lewis-acid catalysed reactions |
| GB0711733.6 | 2007-06-18 | ||
| GB0723162A GB0723162D0 (en) | 2007-11-27 | 2007-11-27 | Oxidation reacation and catalyst thereof |
| GB0723162.4 | 2007-11-27 | ||
| GB0800257A GB0800257D0 (en) | 2008-01-08 | 2008-01-08 | Lewis acidic compounds and lewis-acid catalysed reactions |
| GB0800257.8 | 2008-01-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20100040722A true KR20100040722A (ko) | 2010-04-20 |
Family
ID=39673285
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020107000957A KR20100040722A (ko) | 2007-06-18 | 2008-06-16 | 수 안정성 화합물, 촉매 및 촉매화된 반응 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20100292449A1 (ko) |
| EP (1) | EP2162213A1 (ko) |
| JP (1) | JP2010530301A (ko) |
| KR (1) | KR20100040722A (ko) |
| CN (1) | CN101678343A (ko) |
| AR (1) | AR067039A1 (ko) |
| BR (1) | BRPI0813477A2 (ko) |
| CA (1) | CA2687834A1 (ko) |
| CL (1) | CL2008001797A1 (ko) |
| TW (1) | TW200909053A (ko) |
| WO (1) | WO2008155568A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6172693B1 (ja) * | 2016-09-06 | 2017-08-02 | 小西化学工業株式会社 | アゾ化合物の製造方法 |
| CN108976116B (zh) * | 2017-06-02 | 2021-02-02 | 中国科学院大连化学物理研究所 | 一种钛螯合物催化酯交换制备邻苯二甲酸高碳醇酯的方法 |
| WO2019142945A1 (ja) | 2018-01-22 | 2019-07-25 | 旭化成株式会社 | 部材の再生方法及び海水の淡水化方法 |
| CN112852401B (zh) * | 2021-01-15 | 2022-03-29 | 常熟理工学院 | 一种高悬浮分散型胶囊破胶剂及其制备方法 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US2824115A (en) * | 1954-11-09 | 1958-02-18 | Nat Lead Co | Titanium and zirconium organic compounds |
| US2985685A (en) * | 1959-01-26 | 1961-05-23 | American Cyanamid Co | Alkanolamine aluminates as catalysts for ester redistribution |
| US3131062A (en) * | 1960-01-27 | 1964-04-28 | Miehle Goss Dexter Inc | Triphenyl leucocyanide sensitive compositions and elements |
| US3121012A (en) * | 1960-02-08 | 1964-02-11 | Miehle Goss Dexter Inc | Light sensitive triphenylmethane leucocyanide compositions |
| US3294689A (en) * | 1963-10-24 | 1966-12-27 | John S Pierce | Synergistic sequestering agent |
| US3245776A (en) * | 1964-06-09 | 1966-04-12 | Rubin Martin | Fertilizer composition comprising chelated micronutrients and polyurethane foam |
| BE794578A (fr) * | 1972-04-21 | 1973-07-26 | Du Pont | Stabilisation de catalyseurs au fer |
| US4142061A (en) * | 1974-06-14 | 1979-02-27 | Chevron Research Company | Hydroformylation of olefins using azoxy-dentated ligands |
| US4325740A (en) * | 1979-04-04 | 1982-04-20 | E. I. Du Pont De Nemours And Company | Polymeric amine metallate coatings |
| US4568703A (en) * | 1984-07-27 | 1986-02-04 | Bp Chemicals Limited | Process for the production of polymers containing isocyanurate and or oxazolidone linkages |
| US4798902A (en) * | 1987-02-09 | 1989-01-17 | E. I. Du Pont De Nemours And Company | Zirconium chelates and their use for cross-linking |
| US5217838A (en) * | 1991-11-26 | 1993-06-08 | Eastman Kodak Company | Moisture stable biasable transfer members |
| JP2558617Y2 (ja) * | 1993-02-05 | 1997-12-24 | 株式会社共立 | 手持式クリーナー |
| JP3377449B2 (ja) * | 1998-08-04 | 2003-02-17 | 科学技術振興事業団 | 水系ルイス酸触媒反応方法 |
| US6166170A (en) * | 1999-12-02 | 2000-12-26 | E. I. Du Pont De Nemours And Company | Esterification catalysts and processes therefor and therewith |
| JP2002187942A (ja) * | 2000-12-21 | 2002-07-05 | Toray Ind Inc | ポリエステルの製造方法及びそれに用いるポリエステル用触媒 |
| US6489433B2 (en) * | 2001-02-23 | 2002-12-03 | E. I. Du Pont De Nemours And Company | Metal-containing composition and process therewith |
-
2008
- 2008-06-16 CN CN200880020976A patent/CN101678343A/zh active Pending
- 2008-06-16 CA CA002687834A patent/CA2687834A1/en not_active Abandoned
- 2008-06-16 US US12/665,387 patent/US20100292449A1/en not_active Abandoned
- 2008-06-16 WO PCT/GB2008/050450 patent/WO2008155568A1/en active Application Filing
- 2008-06-16 JP JP2010512774A patent/JP2010530301A/ja active Pending
- 2008-06-16 EP EP08762560A patent/EP2162213A1/en not_active Ceased
- 2008-06-16 KR KR1020107000957A patent/KR20100040722A/ko not_active Application Discontinuation
- 2008-06-16 BR BRPI0813477-4A patent/BRPI0813477A2/pt not_active IP Right Cessation
- 2008-06-17 AR ARP080102586A patent/AR067039A1/es not_active Application Discontinuation
- 2008-06-17 TW TW097122578A patent/TW200909053A/zh unknown
- 2008-06-17 CL CL2008001797A patent/CL2008001797A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| AR067039A1 (es) | 2009-09-30 |
| CA2687834A1 (en) | 2008-12-24 |
| CL2008001797A1 (es) | 2008-11-03 |
| TW200909053A (en) | 2009-03-01 |
| BRPI0813477A2 (pt) | 2015-08-04 |
| CN101678343A (zh) | 2010-03-24 |
| US20100292449A1 (en) | 2010-11-18 |
| JP2010530301A (ja) | 2010-09-09 |
| WO2008155568A1 (en) | 2008-12-24 |
| EP2162213A1 (en) | 2010-03-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2181307C2 (ru) | Катализаторы этерификации | |
| KR101863154B1 (ko) | 혼합된 염 아세틸아세토네이트 촉매를 이용한 에스터교환 방법 | |
| Verspui et al. | A Stable, Conspicuously Active, Water‐Soluble Pd Catalyst for the Alternating Copolymerization of Ethene and CO in Water | |
| JP2017523038A (ja) | 金属錯体の合成およびその使用 | |
| KR20010052255A (ko) | 티타늄 화합물, 아민 및 인 화합물을 포함하는 촉매조성물, 그의 제조 방법 및 용도 | |
| CN100413908C (zh) | 用于制造酯的催化剂 | |
| JPH01319458A (ja) | ビシナルジアシルオキン置換化合物の製法 | |
| KR20100040722A (ko) | 수 안정성 화합물, 촉매 및 촉매화된 반응 | |
| EP1222164B1 (en) | Process for the production of 5-sulfo isophthalate bis-glycolate ester metal salts and oxysulfonated polyesters made therefrom | |
| TWI413640B (zh) | 環氧乙基羧酸酯或縮水甘油羧酸酯之製備 | |
| BR112014014850B1 (pt) | Método para produzir um poliéster-poliéter híbrido | |
| CA2834800C (en) | Low temperature cure using benzopinacol polymerization initiator | |
| EA034373B1 (ru) | Способ получения сложных эфиров карбоновых кислот в присутствии титансодержащего катализатора | |
| JP5220868B2 (ja) | ジルコニウム化合物を含むエステル化触媒組成物およびこれを用いたエステル化合物の製造方法 | |
| US2883406A (en) | Phenol addition salts | |
| JP4385879B2 (ja) | ビフェニル類の製造方法、及び製造用触媒 | |
| TWI617543B (zh) | Process for preparing bis(2-hydroxyethyl) terephthalate | |
| WO2004007073A1 (en) | Supported catalyst | |
| Carrascosa Estaún | Activation of carbon dioxide mediated by organometallic complexes derived from earth-abundant metals | |
| KR20230039328A (ko) | 리간드 화합물, 이의 제조방법 및 이를 이용한 α,β-불포화 카르복실레이트의 제조방법 | |
| JP2008247873A (ja) | 錯体、エステル合成用触媒、及びエステルの製造方法 | |
| Hipólito | Syntheses and Reactivity of Titanium and Zirconium Complexes Supported by Salan and Salen Ligands | |
| KR20230039329A (ko) | 리간드 화합물, 이의 제조방법 및 이를 이용한 아크릴레이트의 제조방법 | |
| KR101888210B1 (ko) | 살렌형 촉매, 이의 제조방법 및 이를 이용한 방향족 탄산에스테르의 제조방법 | |
| CN117069763A (zh) | 离子液体催化剂及其制备方法与应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |