DE69635550T2 - Verfahren und mittel zur anregung des neuritwachstums - Google Patents
Verfahren und mittel zur anregung des neuritwachstums Download PDFInfo
- Publication number
- DE69635550T2 DE69635550T2 DE69635550T DE69635550T DE69635550T2 DE 69635550 T2 DE69635550 T2 DE 69635550T2 DE 69635550 T DE69635550 T DE 69635550T DE 69635550 T DE69635550 T DE 69635550T DE 69635550 T2 DE69635550 T2 DE 69635550T2
- Authority
- DE
- Germany
- Prior art keywords
- fkbp12
- neurotrophic
- pharmaceutically acceptable
- neurotrophic factor
- factor
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000034 method Methods 0.000 title abstract description 16
- 210000002241 neurite Anatomy 0.000 title abstract description 3
- 150000001875 compounds Chemical class 0.000 claims abstract description 54
- 108010025020 Nerve Growth Factor Proteins 0.000 claims abstract description 47
- 239000000203 mixture Substances 0.000 claims abstract description 40
- 102000007072 Nerve Growth Factors Human genes 0.000 claims abstract description 28
- 239000003900 neurotrophic factor Substances 0.000 claims abstract description 28
- 102000015336 Nerve Growth Factor Human genes 0.000 claims abstract description 19
- 230000000508 neurotrophic effect Effects 0.000 claims abstract description 15
- 230000004936 stimulating effect Effects 0.000 claims abstract description 9
- 210000002569 neuron Anatomy 0.000 claims abstract description 8
- -1 pyrrolidyl Chemical group 0.000 claims description 65
- QJJXYPPXXYFBGM-LFZNUXCKSA-N Tacrolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1\C=C(/C)[C@@H]1[C@H](C)[C@@H](O)CC(=O)[C@H](CC=C)/C=C(C)/C[C@H](C)C[C@H](OC)[C@H]([C@H](C[C@H]2C)OC)O[C@@]2(O)C(=O)C(=O)N2CCCC[C@H]2C(=O)O1 QJJXYPPXXYFBGM-LFZNUXCKSA-N 0.000 claims description 20
- 229960001967 tacrolimus Drugs 0.000 claims description 20
- QJJXYPPXXYFBGM-SHYZHZOCSA-N tacrolimus Natural products CO[C@H]1C[C@H](CC[C@@H]1O)C=C(C)[C@H]2OC(=O)[C@H]3CCCCN3C(=O)C(=O)[C@@]4(O)O[C@@H]([C@H](C[C@H]4C)OC)[C@@H](C[C@H](C)CC(=C[C@@H](CC=C)C(=O)C[C@H](O)[C@H]2C)C)OC QJJXYPPXXYFBGM-SHYZHZOCSA-N 0.000 claims description 20
- 229940053128 nerve growth factor Drugs 0.000 claims description 17
- 230000014511 neuron projection development Effects 0.000 claims description 17
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 claims description 15
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 claims description 15
- 229960002930 sirolimus Drugs 0.000 claims description 15
- 239000003937 drug carrier Substances 0.000 claims description 8
- 239000003102 growth factor Substances 0.000 claims description 7
- 102000004219 Brain-derived neurotrophic factor Human genes 0.000 claims description 6
- 108090000715 Brain-derived neurotrophic factor Proteins 0.000 claims description 6
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 claims description 6
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 claims description 6
- 102000004230 Neurotrophin 3 Human genes 0.000 claims description 6
- 108090000742 Neurotrophin 3 Proteins 0.000 claims description 6
- 108090000099 Neurotrophin-4 Proteins 0.000 claims description 6
- 102100033857 Neurotrophin-4 Human genes 0.000 claims description 6
- 229940077737 brain-derived neurotrophic factor Drugs 0.000 claims description 6
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 claims description 6
- 229940032018 neurotrophin 3 Drugs 0.000 claims description 6
- 239000001301 oxygen Substances 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 5
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 claims description 5
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 claims description 5
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 claims description 5
- 229910052799 carbon Inorganic materials 0.000 claims description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 5
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims description 4
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 4
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 4
- 239000001257 hydrogen Chemical group 0.000 claims description 4
- 150000002431 hydrogen Chemical group 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 208000024827 Alzheimer disease Diseases 0.000 claims description 3
- 102000004877 Insulin Human genes 0.000 claims description 3
- 108090001061 Insulin Proteins 0.000 claims description 3
- 102000003683 Neurotrophin-4 Human genes 0.000 claims description 3
- 208000018737 Parkinson disease Diseases 0.000 claims description 3
- 208000008765 Sciatica Diseases 0.000 claims description 3
- 208000006011 Stroke Diseases 0.000 claims description 3
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 claims description 3
- 230000001886 ciliary effect Effects 0.000 claims description 3
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 3
- 125000005805 dimethoxy phenyl group Chemical group 0.000 claims description 3
- 125000002541 furyl group Chemical group 0.000 claims description 3
- 125000001041 indolyl group Chemical group 0.000 claims description 3
- 229940125396 insulin Drugs 0.000 claims description 3
- 208000028867 ischemia Diseases 0.000 claims description 3
- 125000001624 naphthyl group Chemical group 0.000 claims description 3
- 230000001537 neural effect Effects 0.000 claims description 3
- 230000004770 neurodegeneration Effects 0.000 claims description 3
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 3
- 229940097998 neurotrophin 4 Drugs 0.000 claims description 3
- 125000006501 nitrophenyl group Chemical group 0.000 claims description 3
- 125000005936 piperidyl group Chemical group 0.000 claims description 3
- 238000002360 preparation method Methods 0.000 claims description 3
- 125000004076 pyridyl group Chemical group 0.000 claims description 3
- 208000020431 spinal cord injury Diseases 0.000 claims description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 3
- 125000001544 thienyl group Chemical group 0.000 claims description 3
- 125000001680 trimethoxyphenyl group Chemical group 0.000 claims description 3
- 125000002941 2-furyl group Chemical group O1C([*])=C([H])C([H])=C1[H] 0.000 claims description 2
- 125000005809 3,4,5-trimethoxyphenyl group Chemical group [H]C1=C(OC([H])([H])[H])C(OC([H])([H])[H])=C(OC([H])([H])[H])C([H])=C1* 0.000 claims description 2
- 125000003349 3-pyridyl group Chemical group N1=C([H])C([*])=C([H])C([H])=C1[H] 0.000 claims description 2
- 125000001207 fluorophenyl group Chemical group 0.000 claims description 2
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 claims description 2
- 102100027913 Peptidyl-prolyl cis-trans isomerase FKBP1A Human genes 0.000 claims 8
- 108010006877 Tacrolimus Binding Protein 1A Proteins 0.000 claims 8
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 claims 4
- 208000026072 Motor neurone disease Diseases 0.000 claims 2
- 102000018679 Tacrolimus Binding Proteins Human genes 0.000 abstract description 61
- 108010027179 Tacrolimus Binding Proteins Proteins 0.000 abstract description 61
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 5
- 201000010099 disease Diseases 0.000 abstract description 4
- 208000014674 injury Diseases 0.000 abstract description 4
- 230000003961 neuronal insult Effects 0.000 abstract description 2
- 230000008439 repair process Effects 0.000 abstract description 2
- 239000008194 pharmaceutical composition Substances 0.000 abstract 1
- 230000008733 trauma Effects 0.000 abstract 1
- 239000003814 drug Substances 0.000 description 16
- 235000002639 sodium chloride Nutrition 0.000 description 15
- 150000003839 salts Chemical class 0.000 description 9
- 230000000694 effects Effects 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 239000000243 solution Substances 0.000 description 6
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 5
- 102000019027 Ryanodine Receptor Calcium Release Channel Human genes 0.000 description 5
- 229910052791 calcium Inorganic materials 0.000 description 5
- 239000011575 calcium Substances 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 235000019198 oils Nutrition 0.000 description 5
- 108091052345 ryanodine receptor (TC 1.A.3.1) family Proteins 0.000 description 5
- 210000003594 spinal ganglia Anatomy 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 108090000317 Chymotrypsin Proteins 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 229960002376 chymotrypsin Drugs 0.000 description 4
- 230000006870 function Effects 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 102000004631 Calcineurin Human genes 0.000 description 3
- 108010042955 Calcineurin Proteins 0.000 description 3
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 3
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 208000027418 Wounds and injury Diseases 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 239000002270 dispersing agent Substances 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- PUPZLCDOIYMWBV-UHFFFAOYSA-N (+/-)-1,3-Butanediol Chemical compound CC(O)CCO PUPZLCDOIYMWBV-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 0 B*C(I(N(C(C(*)=*)O)I)I)=O Chemical compound B*C(I(N(C(C(*)=*)O)I)I)=O 0.000 description 2
- 102000003922 Calcium Channels Human genes 0.000 description 2
- 108090000312 Calcium Channels Proteins 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 208000028389 Nerve injury Diseases 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 2
- ZVQOOHYFBIDMTQ-UHFFFAOYSA-N [methyl(oxido){1-[6-(trifluoromethyl)pyridin-3-yl]ethyl}-lambda(6)-sulfanylidene]cyanamide Chemical compound N#CN=S(C)(=O)C(C)C1=CC=C(C(F)(F)F)N=C1 ZVQOOHYFBIDMTQ-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 235000019445 benzyl alcohol Nutrition 0.000 description 2
- 150000001649 bromium compounds Chemical class 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 230000002860 competitive effect Effects 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 150000002148 esters Chemical class 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 230000029142 excretion Effects 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 210000001035 gastrointestinal tract Anatomy 0.000 description 2
- 125000005456 glyceride group Chemical group 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000002401 inhibitory effect Effects 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 150000004694 iodide salts Chemical class 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000008764 nerve damage Effects 0.000 description 2
- 239000000346 nonvolatile oil Substances 0.000 description 2
- 235000016709 nutrition Nutrition 0.000 description 2
- 230000035764 nutrition Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 235000019271 petrolatum Nutrition 0.000 description 2
- 208000028591 pheochromocytoma Diseases 0.000 description 2
- 229920001451 polypropylene glycol Polymers 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 108090000623 proteins and genes Proteins 0.000 description 2
- 102000004169 proteins and genes Human genes 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- VFWCMGCRMGJXDK-UHFFFAOYSA-N 1-chlorobutane Chemical class CCCCCl VFWCMGCRMGJXDK-UHFFFAOYSA-N 0.000 description 1
- VUQPJRPDRDVQMN-UHFFFAOYSA-N 1-chlorooctadecane Chemical class CCCCCCCCCCCCCCCCCCCl VUQPJRPDRDVQMN-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- LEACJMVNYZDSKR-UHFFFAOYSA-N 2-octyldodecan-1-ol Chemical compound CCCCCCCCCCC(CO)CCCCCCCC LEACJMVNYZDSKR-UHFFFAOYSA-N 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical class BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-M 3-phenylpropionate Chemical compound [O-]C(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-M 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- 102000009728 CDC2 Protein Kinase Human genes 0.000 description 1
- 108010034798 CDC2 Protein Kinase Proteins 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229930105110 Cyclosporin A Natural products 0.000 description 1
- PMATZTZNYRCHOR-CGLBZJNRSA-N Cyclosporin A Chemical compound CC[C@@H]1NC(=O)[C@H]([C@H](O)[C@H](C)C\C=C\C)N(C)C(=O)[C@H](C(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](CC(C)C)N(C)C(=O)[C@@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)N(C)C(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)N(C)C(=O)CN(C)C1=O PMATZTZNYRCHOR-CGLBZJNRSA-N 0.000 description 1
- 108010036949 Cyclosporine Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical class C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- 241000792859 Enema Species 0.000 description 1
- 102100031706 Fibroblast growth factor 1 Human genes 0.000 description 1
- 102100024785 Fibroblast growth factor 2 Human genes 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 102000024452 GDNF Human genes 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 101000623857 Homo sapiens Serine/threonine-protein kinase mTOR Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000007640 Inositol 1,4,5-Trisphosphate Receptors Human genes 0.000 description 1
- 108010032354 Inositol 1,4,5-Trisphosphate Receptors Proteins 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- MBBZMMPHUWSWHV-BDVNFPICSA-N N-methylglucamine Chemical compound CNC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO MBBZMMPHUWSWHV-BDVNFPICSA-N 0.000 description 1
- 102000002673 NFATC Transcription Factors Human genes 0.000 description 1
- 108010018525 NFATC Transcription Factors Proteins 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- HVUMOYIDDBPOLL-XWVZOOPGSA-N Sorbitan monostearate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O HVUMOYIDDBPOLL-XWVZOOPGSA-N 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- 102000014384 Type C Phospholipases Human genes 0.000 description 1
- 108010079194 Type C Phospholipases Proteins 0.000 description 1
- MMWCIQZXVOZEGG-HOZKJCLWSA-N [(1S,2R,3S,4S,5R,6S)-2,3,5-trihydroxy-4,6-diphosphonooxycyclohexyl] dihydrogen phosphate Chemical compound O[C@H]1[C@@H](O)[C@H](OP(O)(O)=O)[C@@H](OP(O)(O)=O)[C@H](O)[C@H]1OP(O)(O)=O MMWCIQZXVOZEGG-HOZKJCLWSA-N 0.000 description 1
- 229940124532 absorption promoter Drugs 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001350 alkyl halides Chemical class 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 150000003862 amino acid derivatives Chemical class 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 230000037007 arousal Effects 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 210000003050 axon Anatomy 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- XMIIGOLPHOKFCH-UHFFFAOYSA-N beta-phenylpropanoic acid Natural products OC(=O)CCC1=CC=CC=C1 XMIIGOLPHOKFCH-UHFFFAOYSA-N 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 101150073031 cdk2 gene Proteins 0.000 description 1
- 230000006369 cell cycle progression Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 229960001265 ciclosporin Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 239000008119 colloidal silica Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 238000007821 culture assay Methods 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000030609 dephosphorylation Effects 0.000 description 1
- 238000006209 dephosphorylation reaction Methods 0.000 description 1
- 150000008050 dialkyl sulfates Chemical class 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- GXGAKHNRMVGRPK-UHFFFAOYSA-N dimagnesium;dioxido-bis[[oxido(oxo)silyl]oxy]silane Chemical compound [Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O GXGAKHNRMVGRPK-UHFFFAOYSA-N 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- GAFRWLVTHPVQGK-UHFFFAOYSA-N dipentyl sulfate Chemical class CCCCCOS(=O)(=O)OCCCCC GAFRWLVTHPVQGK-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 210000002257 embryonic structure Anatomy 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000008387 emulsifying waxe Substances 0.000 description 1
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 1
- 239000007920 enema Substances 0.000 description 1
- 229940095399 enema Drugs 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 230000001815 facial effect Effects 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 238000002376 fluorescence recovery after photobleaching Methods 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 210000000609 ganglia Anatomy 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- MNWFXJYAOYHMED-UHFFFAOYSA-N heptanoic acid Chemical compound CCCCCCC(O)=O MNWFXJYAOYHMED-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 238000007917 intracranial administration Methods 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007919 intrasynovial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 238000006317 isomerization reaction Methods 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 239000000391 magnesium silicate Substances 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 229940099273 magnesium trisilicate Drugs 0.000 description 1
- 229910000386 magnesium trisilicate Inorganic materials 0.000 description 1
- 235000019793 magnesium trisilicate Nutrition 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 208000005264 motor neuron disease Diseases 0.000 description 1
- 210000004165 myocardium Anatomy 0.000 description 1
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 239000007922 nasal spray Substances 0.000 description 1
- 230000007896 negative regulation of T cell activation Effects 0.000 description 1
- 230000025020 negative regulation of T cell proliferation Effects 0.000 description 1
- 210000000944 nerve tissue Anatomy 0.000 description 1
- 210000004498 neuroglial cell Anatomy 0.000 description 1
- 230000007514 neuronal growth Effects 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 229940060184 oil ingredients Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 229940100618 rectal suppository Drugs 0.000 description 1
- 239000006215 rectal suppository Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- AWUCVROLDVIAJX-GSVOUGTGSA-N sn-glycerol 3-phosphate Chemical compound OC[C@@H](O)COP(O)(O)=O AWUCVROLDVIAJX-GSVOUGTGSA-N 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 239000001587 sorbitan monostearate Substances 0.000 description 1
- 235000011076 sorbitan monostearate Nutrition 0.000 description 1
- 229940035048 sorbitan monostearate Drugs 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- ZDPHROOEEOARMN-UHFFFAOYSA-N undecanoic acid Chemical compound CCCCCCCCCCC(O)=O ZDPHROOEEOARMN-UHFFFAOYSA-N 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- 210000002268 wool Anatomy 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/541—Non-condensed thiazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/38—Heterocyclic compounds having sulfur as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/401—Proline; Derivatives thereof, e.g. captopril
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/4025—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil not condensed and containing further heterocyclic rings, e.g. cromakalim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/444—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring heteroatom, e.g. amrinone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4525—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with oxygen as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4535—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom, e.g. pizotifen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/4545—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a six-membered ring with nitrogen as a ring hetero atom, e.g. pipamperone, anabasine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/496—Non-condensed piperazines containing further heterocyclic rings, e.g. rifampin, thiothixene or sparfloxacin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/535—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one oxygen as the ring hetero atoms, e.g. 1,2-oxazines
- A61K31/5375—1,4-Oxazines, e.g. morpholine
- A61K31/5377—1,4-Oxazines, e.g. morpholine not condensed and containing further heterocyclic rings, e.g. timolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/18—Growth factors; Growth regulators
- A61K38/185—Nerve growth factor [NGF]; Brain derived neurotrophic factor [BDNF]; Ciliary neurotrophic factor [CNTF]; Glial derived neurotrophic factor [GDNF]; Neurotrophins, e.g. NT-3
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/02—Drugs for disorders of the nervous system for peripheral neuropathies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Psychology (AREA)
- Psychiatry (AREA)
- Gastroenterology & Hepatology (AREA)
- Urology & Nephrology (AREA)
- Cardiology (AREA)
- Zoology (AREA)
- Heart & Thoracic Surgery (AREA)
- Immunology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Hospice & Palliative Care (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Steroid Compounds (AREA)
- Crystals, And After-Treatments Of Crystals (AREA)
- Saccharide Compounds (AREA)
- Hydrogenated Pyridines (AREA)
- Pyridine Compounds (AREA)
Description
- Die vorliegende Erfindung betrifft Zusammensetzungen und ihre Verwendung zur Herstellung von Arzneimitteln zur Anregung des Wachstums von Neuriten in Nervenzellen. Die Zusammensetzungen umfassen eine neurotrophe Menge einer Verbindung, welche an das FK-506-bindende Protein (FKBP) bindet, und einen neurotrophen Faktor wie Nervenwachstumsfaktor NGF. Die Anregungsverfahren umfassen Behandeln von Nervenzellen mit den vorstehend beschriebenen Zusammensetzungen oder mit Zusammensetzungen, welche die FKBP-bindende Verbindung ohne einen neurotrophen Faktor umfassen. Die beschriebenen Anregungsverfahren können verwendet werden, um eine Reparatur eines neuronalen Schadens, welcher durch eine Erkrankung oder eine körperliche Verletzung verursacht wurde, zu fördern.
- Immunophiline sind eine Familie von löslichen Proteinen, welche die Wirkungen von Immunsuppressiva wie Cyclosporin A, FK-506 und Rapamycin vermitteln. Von besonderem Interesse ist das 12 kDa-Immunophilin FK-506-bindendes Protein (FKBP12). FKBP12 bindet FK-506 und Rapamycin, was zu einer Inhibierung der T-Zellen-Aktivierung und -Proliferation führt. Interessanterweise sind die Wirkmechanismen von FK-506 und Rapamycin unterschiedlich. Für eine Überprüfung siehe S.H. Solomon et al., Nature Med., 1, S. 32–37 (1995).
- FK-506 bindet an FKBP12 und der resultierende Komplex bindet an und inhibiert Calcineurin, eine cytoplasmatische Phosphatase. Die Phosphataseaktivität von Calcineurin ist zur Dephosphorylierung und der darauffolgenden Translokation des Transkriptionsfaktors NF-AT in den Kern notwendig. NF-AT verursacht eine Interleukin-2-Genaktivierung, welche ihrerseits die T-Zellen-Proliferation vermittelt.
- Auf der anderen Seite assoziiert der Rapamycin-FKBP12-Komplex mit einem Protein unbekannter Funktion, welches RAFT1/FRAP genannt wird. Es ist bekannt, dass dieser dreiteilige Komplex verschiedene Kinasen in der Zelle (d.h. p70S6, p34cdc2, cdk2) inhibiert, welche für den Zellcyclusablauf in T-Zellen notwendig sind. Es ist auch bekannt, dass Rapamycin ein wirksamer Antagonist von FK-506, vermutlich durch Wirken als ein kompetitiver Inhibitor für die FKBP12-Bindung, ist.
- Kürzlich wurde entdeckt, dass FKBP andere wichtige Aufgaben im Körper hat. Es wurde gefunden, dass FKBP12 einen Komplex mit den intrazellulären Calciumionenkanälen – dem Ryanodinrezeptor (RyR) und dem Inosit-1,4,5-triphosphat-Rezeptor (IP3R) bildet [T. Jayaraman et al., J. Biol. Chem., 267, S. 9474–77 (1992); A.M. Cameron et al., Proc. Natl. Acad. Sci. USA, 92, S. 1784–44 (1995)], bildet, was eine Stabilisierung der Calciumfreisetzung unterstützt. Der Ryanodinrezeptor wurde im Skelettmuskel, Herzmuskel, Gehirn und anderen zur Erregung befähigten Geweben gefunden. IP3R vermittelt die intrazelluläre Calciumfreisetzung, welche durch Hormone und Neurotransmitter ausgelöst wird, die auf der Zelloberfläche wirken, wobei Phospholipase C aktiviert und Inosit-1,4,5-triphosphat (IP3) erzeugt wird. Man fand, dass der Großteil von IP3R assoziiert mit dem endoplasmatischen Retikulum vorliegt, dass aber ein kleinerer Teil auf der Zelloberfläche vorkommen und den Calciumfluss in die Zelle vermitteln kann.
- Es wurde sowohl für den RyR als auch für den IP3R gezeigt, dass FK-506 und Rapamycin in der Lage sind, FKBP12 vom Rezeptor zu dissoziieren. In jedem Fall führt das „Ablösen" von FKBP12 zu einer erhöhten Durchlässigkeit des Calciumkanals und niedrigeren intrazellulären Calciumkonzentrationen.
- Eine andere Aufgabe von FKBP12 ist die Regulation des Neuritauswachsens in Nervenzellen. W.E. Lyons et al. [Proc. Natl. Acad. Sci. USA, 91, S. 3191–95 (1994)] zeigten, dass FK-506 synergistisch mit dem Nervenwachstumsfaktor (NGF) bei der Anregung des Neuritenauswachsens in einer Rattenphäochromozytomzelllinie wirkt. Interessanterweise inhibierte Rapamycin die Wirkungen von FK-506 auf das Neuritauswachsen nicht, sondern war vielmehr selbst neurotroph, wobei eine additive Wirkung mit FK-506 gezeigt wurde. In Spinalganglien zeigte FK-506 ähnliche neurotrophe Wirkungen, aber jene Wirkungen wurden durch Rapamycin blockiert. Diese Ergebnisse führten dazu, dass die Autoren vermuteten, dass FK-506 seine neurotrophe Wirkung durch sein Komplexieren mit FKBP12 und Calcineurin und durch Inhibierung der Phosphatase-Aktivität des letzteren ausübte. Alternativ schlugen die Autoren vor, dass FK-506 über einen „Ablöse"-Mechanismus wirkt, wie jenem, welcher in die Entfernung von FKBP12 von RyR und IP3R einbezogen ist.
- Im Hinblick auf die große Vielzahl von Störungen, welche durch Anregen des Neuritauswachsens behandelt werden können, und die relativ wenigen FKBP12-bindenden Verbindungen, von welchen bekannt ist, dass sie diese Eigenschaft besitzen, bleibt ein großer Bedarf für zusätzliche neurotrophe, FKBP12-bindende Verbindungen.
- Der Anmelder löste das Problem, auf welches vorstehend Bezug genommen wird, indem er diese neuen FKBP12-bindenden Verbindungen entdeckte, von welchen er vor kurzem auch das Aufweisen von neurotropher Aktivität entdeckte. Der Anmelder beschrieb vor kurzem in den PCT-Patentveröffentlichungen WO 92/19593 und WO 94/07858 eine Reihe von acylierten Aminosäure-Derivaten, welche an FKBP12 binden. Andere Reihen von FKBP12-Liganden werden in den US-Patenten 5,192,773 und 5,330,993 und in der PCT-Patentveröffentlichung WO 92/00278 des Anmelders beschrieben. Jede Reihe von Verbindungen regt das Neuritenauswachsen in der Gegenwart von exogenem oder endogenem NGF an.
- Die bereitgestellten Zusammensetzungen umfassen eine wie vorstehend beschriebene Verbindung und einen neuronalen Wachstumsfaktor. Die hier beschriebenen Verfahren verwenden jene vor kurzem beschriebenen Verbindungen und Zusammensetzungen, welche sie umfassen, um ein Neuritauswachsen zu bewirken, und sie sind zur Behandlung eines Nervenschadens nützlich, welcher durch verschiedene Erkrankungen und körperliche Verletzungen verursacht wird.
- Demgemäß stellt die vorliegende Erfindung pharmazeutisch verträgliche Zusammensetzungen bereit, welche umfassen:
- a) eine neurotrophe Menge einer Verbindung mit Affinität für FKBP12, die die Formel (I) aufweist: und pharmazeutisch verträgliche Derivate davon, wobei A Sauerstoff ist; J und K zusammengenommen werden, um Pyrrolidyl oder Piperidyl zu bilden; E Sauerstoff ist; B Benzyl, Naphthyl, tert-Butyl, Wasserstoff, E-3-Phenyl-2-methyl-prop-2-enyl, E-3-(4-Hydroxyphenyl)-2-methyl-prop-2-enyl, E-3-[trans(4-Hydroxycyclohexyl)]-2-methyl-prop-2-enyl, Cyclohexylethyl, Cyclohexylpropyl, Cyclohexylbutyl, Cyclopentylpropyl, E-3-(4-Methoxyphenyl)-2-methyl-prop-2-enyl, E-3-(3,4-Dimethoxyphenyl)-2-methyl-prop-2-enyl oder E-3-[cis(4-Hydroxycyclohexyl)]-2-methyl-prop-2-enyl ist; und D Phenyl, Methoxyphenyl, Cyclohexyl, Ethyl, Methoxy, Nitrobenzyl, Thiophenyl, Indolyl, Furyl, Pyridyl, Pyridyl-N-oxid, Nitrophenyl, Fluorphenyl, Trimethoxyphenyl oder Dimethoxyphenyl ist; und die Stereochemie in Kohlenstoffposition 1 S ist;
- b) einen neurotrophen Faktor, ausschließlich der FKBP12-bindenden Verbindungen, wie sie in Absatz a) beschrieben sind, FK-506 und Rapamycin; und
- c) einen pharmazeutisch geeigneten Träger.
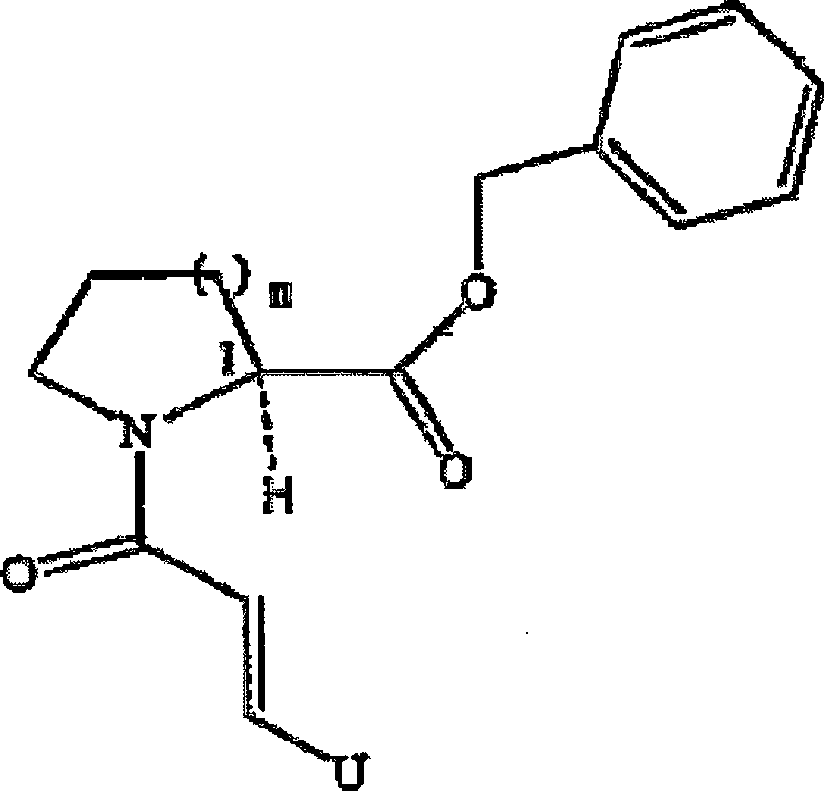
- Eine alternative Ausführungsform einer Verbindung mit Affinität für FKBP12 sind Verbindungen, die die Formel: aufweisen,
und pharmazeutisch verträgliche Derivate davon, wobei,
wenn n 1 ist, U 3,4-Methylendioxyphenyl, 4-Methoxyphenyl, 2,5-Dimethoxyphenyl, 2,4,5-Trimethoxyphenyl oder 3,4,5-Trimethoxyphenyl ist;
wenn n 2 ist, U Wasserstoff, Phenyl, 3,4-Methylendioxyphenyl, 4-Methoxyphenyl, 4-Dimethylaminophenyl, 4-Nitrophenyl, 1-Furyl, 2-Furyl, 3-Indolyl oder 3-Pyridyl ist;
die Stereochemie an Kohlenstoffposition 1 S ist. - Die am stärksten bevorzugten Verbindungen der Formel (I), welche in den erfindungsgemäßen Zusammensetzungen und Verfahren nützlich sind, sind jene der Formeln Ia und Ib, welche in den in Beispiel 1 nachstehend dargelegten Tabellen 1a und 1b aufgelistet sind.
- Die Synthese von Verbindungen der Formel (I) mit Affinität für FKBP12 in diesen Zusammensetzungen wird in den US-Patenten 5,192,773 und 5,330,993 und in der PCT-Patentveröffentlichung WO 92/00278 beschrieben.
- Wie hier verwendet, sind die in den erfindungsgemäßen Arzneimitteln und Verwendungen verwendeten FKBP12-bindenden Verbindungen so definiert, dass sie pharmazeutisch verträgliche Derivate davon einschließen. Ein „pharmazeutisch verträgliches Derivat" bezeichnet jedwedes/jedweden pharmazeutisch verträgliche(n) Salz, Ester oder Salz eines solchen Esters einer erfindungsgemäßen Verbindung oder jedwede andere Verbindung, welche über Verabreichung an einen Patienten zur (direkten oder indirekten) Bereitstellung einer erfindungsgemäßen Verbindung oder eines Metaboliten oder Rests davon in der Lage ist, die durch die Fähigkeit das Neuritauswachsen zu fördern oder zu vermehren charakterisiert sind.
- Wenn pharmazeutisch verträgliche Salze der FKBP12-bindenden Verbindungen verwendet werden, werden solche Salze bevorzugt von anorganischen oder organischen Säuren und Basen abgeleitet. Eingeschlossen unter solchen Säuresalzen sind die Folgenden: Acetat, Adipat, Alginat, Aspartat, Benzoat, Benzolsulfonat, Bisulfat, Butyrat, Citrat, Camphorat, Camphersulfonat, Cyclopentanpropionat, Digluconat, Dodecylsulfat, Ethansulfonat, Fumarat, Glucoheptanoat, Glycerophosphat, Hemisulfat, Heptanoat, Hexanoat, Hydrochlorid, Hydrobromid, Hydroiodid, 2-Hydroxyethansulfonat, Lactat, Maleat, Methansulfonat, 2-Naphthalinsulfonat, Nicotinat, Oxalat, Pamoat, Pectinat, Persulfat, 3-Phenylpropionat, Picrat, Pivalat, Propionat, Succinat, Tartrat, Thiocyanat, Tosylat und Undecanoat. Basensalze schließen Ammoniumsalze, Alkalimetallsalze wie Natrium- und Kaliumsalze, Erdalkalimetallsalze wie Calcium- und Magnesiumsalze, Salze mit organischen Basen wie Dicyclohexylamin-Salze, N-Methyl-D-glucamin und Salze mit Aminosäuren wie Arginin, Lysin und so weiter ein. Auch können die basischen Stickstoff enthaltenden Reste mit solchen Mitteln wie Niederalkylhalogenide wie Methyl-, Ethyl-, Propyl- und Butylchloride, -bromide und -iodide; Dialkylsulfate wie Dimethyl-, Diethyl-, Dibutyl- und Diamylsulfate, langkettige Halogenide wie Decyl-, Lauryl-, Myristyl- und Stearylchloride, -bromide und -iodide, Aralkylhalogenide wie Benzyl- und Phenethylbromide und andere quaternisiert werden. In Wasser oder Öl lösliche oder dispergierbare Produkte werden dabei erhalten.
- Die FKBP12-bindenden Verbindungen, welche in den erfindungsgemäßen Zusammensetzungen und Verwendungen verwendet werden, können auch durch Anfügen von geeigneten Funktionen modifiziert werden, um selektive biologische Eigenschaften zu erhöhen. Solche Modifizierungen sind auf dem Fachgebiet bekannt und schließen jene ein, welche die biologische Penetration in ein gegebenes biologisches System (z.B. Blut, lymphatisches System, zentrales Nervensystem) steigern, die orale Verfügbarkeit erhöhen, die Löslichkeit erhöhen, um eine Verabreichung durch Injektion zu ermöglichen, den Metabolismus verändern und die Ausscheidungsrate verändern.
- Die neurotrophe Aktivität der erfindungsgemäßen FKBP12-bindenden Verbindungen steht in direktem Bezug zu ihrer Affinität für FKBP12 und ihrer Fähigkeit zur Inhibierung von FKBP12-Rotomaseaktivität. Um diese Eigenschaften zu quantifizieren, können mehrere auf dem Fachgebiet bekannte Tests verwendet werden. Zum Beispiel wurden kompetitive LH20-Bindungstests unter Verwendung von markiertem FK-506 als ein Reporterligand von M.W. Harding et al., Nature, 341, S. 758–60 (1989) und von J.J. Siekierka et al., Nature, 341, S. 755–57 (1989) beschrieben.
- Bevorzugt misst der Test die Inhibierung von FKBP12-Rotomaseaktivität. Ein solcher Test wurde auch von M.W. Harding et al., vorstehend und von J.J. Siekierka et al., vorstehend beschrieben. Bei diesem Test verfolgt man die Isomerisierung eines künstlichen Substrats – N-Succinyl-Ala-Ala-Pro-Phe-p-nitroanilid – spektrophotometrisch. Der Test schließt die cis-Form des Substrats, FKBP12, den Inhibitor und Chymotrypsin ein. Chymotrypsin kann p-Nitroanilid von der trans-Form des Substrats abspalten, aber nicht von der cis-Form. Die Freisetzung von p-Nitroanilid wird gemessen.
- Die zweite Komponente in jedem der vorstehend beschriebenen Arzneimittel ist ein neurotropher Faktor. Der Ausdruck „neurotropher Faktor", wie hier verwendet, betrifft Verbindungen, welche das Wachstum oder die Proliferation von Nervengewebe anregen können. Wie in dieser Anmeldung verwendet, schließt der Ausdruck „neurotropher Faktor" die hier beschriebenen FKBP12-bindenden Verbindungen sowie FK-506 und Rapamycin aus.
- Zahlreiche neurotrophe Faktoren wurden auf dem Fachgebiet identifiziert und jedweder dieser Faktoren kann in den erfindungsgemäßen Zusammensetzungen verwendet werden. Diese neurotrophen Faktoren schließen Nervenwachstumsfaktor (NGF), Insulinwachstumsfaktor (IGF-1) und seine aktiven verkürzten Derivate wie gIGF-1, sauren und basischen Fibroblasten-Wachstumsfaktor (aFGF beziehungsweise bFGF), von Blutplättchen abgeleitete Wachstumsfaktoren (PDGF), vom Gehirn stammenden neurotrophen Faktor (BDNF), ziliäre neurotrophe Faktoren (CNTF), von Gliazelllinien abgeleiteten neurotrophen Faktor (GDNF), Neurotrophin-3 (NT-3) und Neurotrophin 4/5 (NT-4/5) ein, sind aber nicht darauf eingeschränkt. Der am stärksten bevorzugte neurotrophe Faktor in den erfindungsgemäßen Zusammensetzungen ist NGF.
- Die dritte Komponente der erfindungsgemäßen pharmazeutisch verträglichen Zusammensetzungen ist ein pharmazeutisch verträglicher Träger. Pharmazeutisch verträgliche Träger, welche in diesen Arzneimitteln verwendet werden können, schließen Ionenaustauscher, Aluminiumoxid, Aluminiumstearat, Lecithin, Serumproteine wie Serumalbumin des Menschen, Puffersubstanzen wie Phosphate, Glycin, Sorbinsäure, Kaliumsorbat, partielle Glyceridgemische von gesättigten pflanzlichen Fettsäuren, Wasser, Salze oder Elektrolyte wie Protaminsulfat, Dinatriumhydrogenphosphat, Kaliumhydrogenphosphat, Natriumchlorid, Zinksalze, kolloidales Siliciumdioxid, Magnesiumtrisilicat, Polyvinylpyrrolidon, auf Cellulose basierende Substanzen, Polyethylenglycol, Natriumcarboxymethylcellulose, Polyacrylate, Wachse, Polyethylen-Polyoxypropylen-Blockpolymere, Polyethylenglycol und Wollfett ein, sind aber nicht darauf eingeschränkt.
- Die erfindungsgemäßen Zusammensetzungen können oral, parenteral, durch Inhalationsspray, topisch, rektal, nasal, bukkal, vaginal oder über ein implantiertes Reservoir verabreicht werden. Der Ausdruck „parenteral", wie hier verwendet, schließt subkutane, intravenöse, intramuskuläre, intraartikuläre, intrasynoviale, intrasternale, intrathekale, intrahepatische, intraläsionale und intrakraniale Injektions- oder Infusionstechniken ein. Bevorzugt werden die Zusammensetzungen oral, intraperitoneal oder intravenös verabreicht.
- Sterile injizierbare Formen der erfindungsgemäßen Zusammensetzungen können wässrige oder ölige Suspensionen sein. Diese Suspensionen können gemäß auf dem Fachgebiet bekannten Techniken unter Verwendung von geeigneten dispergierenden oder benetzenden Mitteln und Suspendiermitteln formuliert werden. Die sterile injizierbare Zubereitung kann auch eine sterile injizierbare Lösung oder Suspension in einem nicht toxischen, parenteral verträglichen Verdünnungsmittel oder Lösungsmittel sein, zum Beispiel als eine Lösung in 1,3-Butandiol. Unter den verträglichen Vehikeln und Lösungsmitteln, welche verwendet werden können, sind Wasser, Ringer-Lösung und isotonische Natriumchlorid-Lösung. Zusätzlich werden sterile, nicht-flüchtige Öle herkömmlicherweise als ein Lösungsmittel oder Suspendiermedium verwendet. Für diesen Zweck kann jedwedes milde, nicht-flüchtige Öl verwendet werden, einschließlich synthetische Mono- oder Diglyceride. Fettsäuren wie Ölsäure und ihre Glycerid-Derivate sind bei der Herstellung von injizierbaren Zubereitungen nützlich, so wie es natürliche pharmazeutisch verträgliche Öle wie Olivenöl oder Rizinusöl, insbesondere in ihren polyoxyethylierten Versionen, sind. Diese Öllösungen oder -suspensionen können auch ein langkettiger Alkohol-Verdünnungsmittel oder -Dispersionsmittel, wie in Ph. Helv. beschrieben, oder einen ähnlichen Alkohol enthalten.
- Die erfindungsgemäßen Arzneimittel können oral in jedweder oral verträglichen Dosierungsform verabreicht werden, einschließlich, aber nicht einschränkt auf, Kapseln, Tabletten, wässrige Suspensionen oder Lösungen. Im Falle von Tabletten für orale Verwendung schließen Träger, welche herkömmlich verwendet werden, Lactose und Maisstärke ein. Gleitmittel wie Magnesiumstearat werden auch typischerweise zugegeben. Für orale Verabreichung in einer Kapselform schließen nützliche Verdünnungsmittel Lactose und getrocknete Maisstärke ein. Wenn wässrige Suspensionen für orale Verwendung erforderlich sind, wird der Wirkstoff mit Emulgier- und Suspendiermitteln kombiniert. Wenn gewünscht, können auch bestimmte Süßstoffe, Geschmackstoffe oder farbgebende Mittel zugegeben werden.
- Alternativ können die erfindungsgemäßen Arzneimittel in der Form von Zäpfchen für rektale Verabreichung verabreicht werden. Diese können durch Mischen des Mittels mit einem geeigneten nicht-irritierenden Exzipienten, welcher bei Raumtemperatur fest ist, aber bei rektaler Temperatur flüssig ist und deshalb im Rektum zur Freisetzung des Arzneistoffes schmelzen wird, hergestellt werden. Solche Materialien schließen Kakaobutter, Bienenwachs und Polyethylenglycole ein.
- Die erfindungsgemäßen Arzneimittel können auch topisch verabreicht werden, insbesondere wenn das Ziel der Behandlung Bereiche oder Organe einschließt, welche einfach für topische Anwendung zugänglich sind, einschließlich Erkrankungen des Auges, der Haut oder des unteren Intestinaltrakts. Geeignete topische Formulierungen können einfach für jedweden dieser Bereiche oder Organe hergestellt werden.
- Topische Anwendung für den unteren Intestinaltrakt kann in einer rektalen Zäpfchenformulierung (siehe vorstehend) oder in einer geeigneten Einlaufformulierung erfolgen. Topisch transdermale Pflaster können auch verwendet werden.
- Für topische Anwendungen können die Arzneimittel in einer geeigneten Salbe formuliert werden, welche den Wirkstoff suspendiert oder gelöst in einem oder mehreren Trägern enthält. Träger für eine topische Verabreichung der erfindungsgemäßen Verbindungen schließen medizinisches Öl, Mineralöl, weißes Petrolatum, Propylenglycol, Polyoxyethylen, eine Polyoxypropylen-Verbindung, Emulgierwachs und Wasser ein, sind aber nicht darauf einschränkt. Alternativ kann das Arzneimittel in einer geeigneten Lotion oder Creme formuliert werden, welche die Wirkstoffe suspendiert oder gelöst in einem oder mehreren pharmazeutisch verträglichen Trägern enthalten. Geeignete Träger schließen medizinisches Öl, Sorbitanmonostearat, Polysorbat 60, Cetylester-Wachs, Cetarylalkohol, 2-Octyldodecanol, Benzylalkohol und Wasser ein, sind aber nicht darauf einschränkt.
- Für ophthalmische Verwendung können die Arzneimittel als mikronisierte Suspensionen in isotonischer, pH-Wert eingestellter, steriler Salzlösung oder bevorzugt als Lösungen in isotonischer, pH-Wert eingestellter, steriler Salzlösung entweder mit oder ohne einen Konservierungsstoff wie Benzylalkoniumchlorid formuliert werden. Alternativ können die Arzneimittel für ophthalmische Verwendungen in einer Salbe wie Rohvaselin formuliert werden.
- Die erfindungsgemäßen Arzneimittel können auch durch ein Nasalaerosol oder Inhalation verabreicht werden. Solche Zusammensetzungen werden gemäß auf dem Fachgebiet der pharmazeutischen Formulierung bekannten Techniken hergestellt und können als Lösungen in Salzlösung unter Verwendung von Benzylalkohol oder anderen geeigneten Konservierungsstoffen, Absorptionsförderungsmitteln zur Erhöhung der Bioverfügbarkeit, Fluorkohlenstoffen und/oder anderen herkömmlichen löslichmachenden oder dispergierenden Mitteln hergestellt werden.
- Die Menge von sowohl der FKBP12-bindenden Verbindung als auch des neurotrophen Faktors, welche mit den Trägermaterialien kombiniert werden können, um eine Einzeldosierungsform herzustellen, wird abhängig von behandelten Wirt und der besonderen Verabreichungsweise variieren. Die zwei Wirkstoffe der erfindungsgemäßen Arzneimittel wirken synergistisch, wobei das Neuritauswachsen angeregt wird. Deshalb wird die Menge an neurotrophem Faktor in solchen Zusammensetzungen niedriger sein als die, welche bei einer Monotherapie unter Verwendung von nur diesem Faktor erforderlich ist. Bevorzugt sollten die Zusammensetzungen so formuliert werden, dass eine Dosierung zwischen 0,01 und 100 mg/kg Körpergewicht/Tag des FKBP12-bindenden Proteins verabreicht werden kann und dass eine Dosierung zwischen 0,01 und 100 μg/kg Körpergewicht/Tag des neurotrophen Faktors an einen Patienten, welcher diese Zusammensetzungen erhält, verabreicht werden kann.
- Es sollte auch als selbstverständlich angesehen werden, dass ein spezielles Dosierungs- und Behandlungsschema für jedweden besonderen Patienten von einer Vielzahl an Faktoren abhängen wird, einschließlich der Aktivität der speziellen verwendeten Verbindung, des Alters, des Körpergewichts, der allgemeinen Gesundheit, des Geschlechts, der Ernährung, der Zeit der Verabreichung, der Ausscheidungsrate, der Arzneistoffkombination und der Einschätzung des behandelten Arztes und der Schwere der besonderen Erkrankung, welche behandelt wird. Die Menge an Wirkstoffen wird auch von der besonderen FKBP12-bindenden Verbindung und dem neurotrophen Faktor in der Zusammensetzung abhängen.
- Gemäß einer anderen Ausführungsform stellt diese Erfindung die Verwendung der erfindungsgemäßen Verbindungen zur Herstellung eines Arzneimittels zur Anregung des Neuritenauswachsens bereit. Solche Anregungsverfahren umfassen den Schritt der Behandlung von Nervenzellen mit jedweder der vorstehend beschriebenen FKBP12-bindenden Verbindungen. Bevorzugt wird dieses Verfahren zur Anregung des Neuritenauswachsens in einem Patienten verwendet und die FKBP12-bindende Verbindung wird in einer Zusammensetzung formuliert, welche zusätzlich einen pharmazeutisch verträglichen Träger umfasst. Die Menge an FKBP12-bindender Verbindung, welche in diesen Verfahren verwendet wird, liegt zwischen etwa 0,01 und 100 mg/kg Körpergewicht/Tag.
- Gemäß einer alternativen Ausführungsform umfasst das Verfahren zur Anregung des Neuritenauswachsens den zusätzlichen Schritt des Behandelns von Nervenzellen mit einem neurotrophen Faktor wie jenem, welcher in den erfindungsgemäßen Arzneimitteln enthalten ist. Diese Ausführungsform schließt das Verabreichen der FKBP12-bindenden Verbindung und des neurotrophen Mittels in einer Einzeldosierungsform oder in getrennten mehrfachen Dosierungsformen ein. Wenn getrennte Dosierungsformen verwendet werden, können sie gleichzeitig, aufeinanderfolgend oder innerhalb von weniger als etwa 5 Stunden getrennt voneinander verabreicht werden.
- Bevorzugt werden die beschriebenen Verfahren zur Anregung des Neuritenauswachsens in einem Patienten verwendet.
- Die erfindungsgemäßen Verwendungen und Zusammensetzungen können zur Behandlung von einem Nervenschaden, welcher von einer großen Vielzahl an Erkrankungen oder körperlichen Verletzungen verursacht wurde, verwendet werden. Diese schließen Alzheimer-Krankheit, Parkinson-Krankheit, ALS, Schlaganfall und mit Schlaganfall assoziierte Ischämie, neurale Paropathie, andere neurodegenerative Erkrankungen, Motoneuronenerkrankungen, Ischiasquetschung, Rückenmarkverletzungen und Fazialisquetschung ein, sind aber nicht darauf eingeschränkt.
- Damit die hier beschriebene Erfindung vollständiger verstanden wird, werden die folgenden Beispiele dargelegt. Es soll als selbstverständlich angesehen werden, dass diese Beispiele nur für veranschaulichende Zwecke gegeben sind und nicht so ausgelegt werden sollen, dass sie diese Erfindung in irgendeiner Weise einschränken.
- BEISPIEL 1
- FKBP12-Bindungstest
- Die Inhibierung der FKBP-Rotomaseaktivität durch die in den erfindungsgemäßen Zusammensetzungen vorhandenen bevorzugten FKBP12-bindenden Verbindungen wurde getestet. Bei diesem Test wurden unterschiedliche Mengen an FKBP12-bindender Verbindung (0,1 nM bis 10 μM) zu cis-N-Succinyl-Ala-Ala-Pro-Phe-p-nitroanilid in der Gegenwart von FKBP12 und Chymotrypsin gegeben. FKBP12 wandelt die cis-Form des Substrats in die trans-Form um. Dies ermöglicht, dass Chymotrypsin p-Nitroanilid von dem Substrat abspaltet. Die Freisetzung von p-Nitroanilid wurde spektrophotometrisch gemessen. Dieser Test ermöglichte für mich eine Messung der Veränderung der Konstante erster Ordnung der Rotomaseaktivität als eine Funktion der Konzentration der FKBP12-bindenden Verbindung und führte zu einer Abschätzung des scheinbaren Ki-Wertes. Die am stärksten bevorzugten FKBP12-bindenden Verbindungen, welche in den erfindungsgemäßen Zusammensetzungen und Verwendungen verwendet werden, und ihr berechneter Ki-Wert sind nachstehend tabellarisiert.
- BEISPIEL 2
- Test auf Neuritenauswachsen in PC12-Kulturen
- Um direkt die neurotrophe Aktivität der in dieser Erfindung verwendeten FKBP12-bindenden Verbindungen zu bestimmen, wird der von W.E. Lyons et al., Proc. Natl. Acad. Sci. USA, 91, S. 3191–95 (1994) beschriebene Test durchgeführt.
- PC12-Rattenphäochromozytomzellen werden bei 37°C und 5% CO2 in Dulbecco modifiziertem Eagle Medium (DMEM), welches mit 10% wärme-inaktiviertem Pferdeserum (HS) und 5% wärme-inaktiviertem fötalem Kälberserum (FBS) ergänzt wurde, gehalten. Die Zellen werden dann zu 105 pro 35 mm-Kulturvertiefung, welche mit 5 μg/cm2 Rattenschwanzkollagen beschichtet waren, ausgesät and man lässt sie anwachsen. Das Medium wird dann mit DMEM + 2% HS und 1% FBS, NGF (1 bis 100 ng/ml) und variierenden Konzentrationen einer FKBP12-bindenden Verbindung (0,1 nM bis 10 μM) ersetzt. An Kontrollkulturen wird NGF ohne FKBP12-bindende Verbindung verabreicht.
- Die in dieser Erfindung verwendeten FKBP12-bindenden Verbindungen verursachen einen signifikanten Anstieg des Neuritenauswachsens gegenüber Kontrollkulturen.
- BEISPIEL 3
- Test auf Neuritenauswachsen in Spinalganglionkultur
- Ein anderer Weg zur direkten Bestimmung der neurotrophen Aktivität der in dieser Erfindung verwendeten FKBP12-bindenden Verbindungen ist der Spinalganglionkultur-Test, welcher auch von W.E. Lyons et al., Proc. Natl. Acad. Sci. USA, 91, S. 3191–95 (1994) beschrieben wird.
- In diesem Test werden Spinalganglien aus 16 Tage-Rattenembryos präpariert und in 35 mm-Schalen, die mit Kollagen beschichtet waren, mit N2-Medium bei 37°C in einer 15% CO2-Umgebung kultiviert. Die Spinalganglien werden dann mit unterschiedlichen Konzentrationen an NGF (0 bis 100 ng/ml) und einer FKB12-bindenden Verbindung (0,1 nM bis 10 μM) behandelt. Die Ganglien werden alle zwei Tage unter einem Phasenkontrastmikroskop beobachtet und die Axonlängen werden gemessen. Kontrollkulturen enthalten entweder keine FKBP12-bindende Verbindung oder keine FKBP12-bindende Verbindung und kein NGF.
- Die in dieser Erfindung verwendeten FKBP12-bindenden Verbindungen verursachen einen signifikanten Anstieg des Neuritenauswachsens gegenüber Kontrollkulturen, welche keine solchen Verbindungen enthalten, sowohl in der Gegenwart als auch in der Abwesenheit von NGF.
Claims (11)
- Pharmazeutisch verträgliche Zusammensetzung, umfassend: a) eine neurotrophe Menge einer Verbindung mit Affinität für FKBP12, die die Formel (I) aufweist: und pharmazeutisch verträgliche Derivate davon, wobei A Sauerstoff ist; J und K zusammengenommen werden, um Pyrrolidyl oder Piperidyl zu bilden; E Sauerstoff ist; B Benzyl, Naphthyl, tert-Butyl, Wasserstoff, E-3-Phenyl-2-methyl-prop-2-enyl, E-3-(4-Hydroxyphenyl)2-methyl-prop-2-enyl, E-3-[trans(4-Hydroxycyclohexyl)]-2-methyl-prop-2-enyl, Cyclohexylethyl, Cyclohexylpropyl, Cyclohexylbutyl, Cyclopentylpropyl, E-3-(4-Methoxyphenyl)-2-methyl-prop-2-enyl, E-3-(3,4-Dimethoxyphenyl)-2-methyl-prop-2-enyl oder E-3-[cis(4-Hydroxycyclohexyl)]-2- methyl-prop-2-enyl ist; und D Phenyl, Methoxyphenyl, Cyclohexyl, Ethyl, Methoxy, Nitrobenzyl, Thiophenyl, Indolyl, Furyl, Pyridyl, Pyridyl-N-oxid, Nitrophenyl, Fluorphenyl, Trimethoxyphenyl oder Dimethoxyphenyl ist; und die Stereochemie in Kohlenstoffposition 1 S ist; b) einen neurotrophen Faktor, ausschließlich der FKBP12-bindenden Verbindungen, wie sie in Absatz a) beschrieben sind, FK-506 und Rapamycin; und c) einen pharmazeutisch geeigneten Träger.
- Pharmazeutisch verträgliche Zusammensetzung, umfassend: a) eine neurotrophe Menge einer Verbindung mit Affinität für FKBP12, die die Formel: aufweist, und pharmazeutisch verträgliche Derivate davon, wobei n 2 ist; B und D wie in der nachstehenden Tabelle definiert sind: die Stereochemie an Kohlenstoffposition 1 S ist; b) einen neurotrophen Faktor, ausschließlich der FKBP12-bindenden Verbindungen, wie sie in Absatz a) beschrieben sind, FK-506 und Rapamycin; und c) einen pharmazeutisch geeigneten Träger.
- Pharmazeutisch verträgliche Zusammensetzung, umfassend: a) eine neurotrophe Menge einer Verbindung mit Affinität für FKBP12, die die Formel: aufweist, und pharmazeutisch verträgliche Derivate davon, wobei wenn n 1 ist, U 3,4-Methylendioxyphenyl, 4-Methoxyphenyl, 2,5-Dimethoxyphenyl, 2,4,5-Trimethoxyphenyl oder 3,4,5-Trimethoxyphenyl ist; wenn n 2 ist, U Wasserstoff, Phenyl, 3,4-Methylendioxyphenyl, 4-Methoxyphenyl, 4-Dimethylaminophenyl, 4-Nitrophenyl, 1-Furyl, 2-Furyl, 3-Indolyl oder 3-Pyridyl ist; die Stereochemie an Kohlenstoffposition 1 S ist; b) einen neurotrophen Faktor, ausschließlich der FKBP12-bindenden Verbindungen, wie sie in Absatz a) beschrieben sind, FK-506 und Rapamycin; und c) einen pharmazeutisch geeigneten Träger.
- Zusammensetzung nach Anspruch 1, 2 oder 3, wobei der neurotrophe Faktor ausgewählt ist aus Nervenwachstumsfaktor (NGF), Insulinwachstumsfaktor (IGF) und aktiven verkürzten Derivaten davon, saurem Fibroblasten-Wachstumsfaktor (aFGF), basischem Fibroblasten-Wachstumsfaktor (bFGF), von Blutplättchen abgeleiteten Wachstumsfaktoren (PDGF), vom Gehirn stammendem neurotrophem Faktor (BDNF), ziliären neurotrophen Faktoren (CNTF), von Glialzelllinien abgeleitetem neurotrophem Faktor (GDNF), Neurotrophin-3 (NT-3) und Neurotrophin 4/5 (NT-4/5).
- Zusammensetzung nach Anspruch 4, wobei der neurotrophe Faktor NGF ist.
- Verwendung der Verbindung mit Affinität für FKBP12 nach Anspruch 1, 2 oder 3 für die Herstellung einer pharmazeutisch verträglichen Zusammensetzung zur Anregung des Neuritwachstums in Nervenzellen.
- Verwendung nach Anspruch 6, wobei die Zusammensetzung zusätzlich einen neurotrophen Faktor, ausschließlich der FKBP12-bindenden Verbindungen, wie sie in Anspruch 1, Absatz a) beschrieben sind, FK-506 und Rapamycin, umfasst.
- Verwendung nach Anspruch 7, wobei der neurotrophe Faktor ausgewählt ist aus Nervenwachstumsfaktor (NGF), Insulinwachstumsfaktor (IGF) und aktiven verkürzten Derivaten davon, saurem Fibroblasten-Wachstumsfaktor (aFGF), basischem Fibroblasten-Wachstumsfaktor (bFGF), von Blutplättchen abgeleiteten Wachstumsfaktoren (PDGF), vom Gehirn stammendem neurotrophem Faktor (BDNF), ziliären neurotrophen Faktoren (CNTF), von Glialzelllinien abgeleitetem neurotrophem Faktor (GDNF), Neurotrophin-3 (NT-3) und Neurotrophin 4/5 (NT-4/5).
- Verwendung nach Anspruch 8, wobei der neurotrophe Faktor NGF ist.
- Verwendung nach Anspruch 6, wobei die Zusammensetzung verwendet wird, um einen Patienten zu behandeln, der an Alzheimer-Krankheit, Parkinson-Krankheit, ALS, Schlaganfall und mit Schlaganfall assoziierter Ischämie, neuraler Paropathie, anderen neurodegenerativen Erkrankungen, Motorneuronenerkrankungen, Ischiasquetschungen, Rückenmarkverletzungen oder Fazialisquetschung leidet oder gelitten hat.
- Verwendung nach Anspruch 7, wobei die Zusammensetzung verwendet wird, um einen Patienten zu behandeln, der an Alzheimer-Krankheit, Parkinson-Krankheit, ALS, Schlaganfall und mit Schlaganfall assoziierter Ischämie, neuraler Paropathie, anderen neurodegenerativen Erkrankungen, Motorneuronenerkrankungen, Ischiasquetschungen, Rückenmarkverletzungen oder Fazialisquetschung leidet oder gelitten hat.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US48600495A | 1995-06-08 | 1995-06-08 | |
| US486004 | 1995-06-08 | ||
| PCT/US1996/010123 WO1996041609A2 (en) | 1995-06-08 | 1996-06-06 | Methods and compositions for stimulating neurite growth |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69635550D1 DE69635550D1 (de) | 2006-01-12 |
| DE69635550T2 true DE69635550T2 (de) | 2006-08-24 |
Family
ID=23930232
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69635550T Expired - Lifetime DE69635550T2 (de) | 1995-06-08 | 1996-06-06 | Verfahren und mittel zur anregung des neuritwachstums |
Country Status (17)
| Country | Link |
|---|---|
| US (3) | US6037370A (de) |
| EP (2) | EP0831812B1 (de) |
| JP (1) | JP2007308517A (de) |
| KR (1) | KR100480662B1 (de) |
| CN (1) | CN1202104A (de) |
| AT (1) | ATE311875T1 (de) |
| BR (1) | BR9609333A (de) |
| CA (1) | CA2222430A1 (de) |
| DE (1) | DE69635550T2 (de) |
| DK (1) | DK0831812T3 (de) |
| ES (1) | ES2255077T3 (de) |
| IL (1) | IL122346A (de) |
| NZ (1) | NZ310339A (de) |
| PL (1) | PL185798B1 (de) |
| RU (1) | RU2197240C2 (de) |
| WO (1) | WO1996041609A2 (de) |
| ZA (1) | ZA964852B (de) |
Families Citing this family (73)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5798355A (en) * | 1995-06-07 | 1998-08-25 | Gpi Nil Holdings, Inc. | Inhibitors of rotamase enzyme activity |
| US5846981A (en) * | 1993-05-28 | 1998-12-08 | Gpi Nil Holdings Inc. | Inhibitors of rotamase enzyme activity |
| US5696135A (en) | 1995-06-07 | 1997-12-09 | Gpi Nil Holdings, Inc. | Inhibitors of rotamase enzyme activity effective at stimulating neuronal growth |
| US7056935B2 (en) * | 1995-06-07 | 2006-06-06 | Gpi Nil Holdings, Inc. | Rotamase enzyme activity inhibitors |
| US5859031A (en) | 1995-06-07 | 1999-01-12 | Gpi Nil Holdings, Inc. | Small molecule inhibitors of rotamase enzyme activity |
| US6291510B1 (en) | 1995-06-07 | 2001-09-18 | Gpi Nil Holdings, Inc. | Small molecule inhibitors of rotamase enzyme activity |
| US6509477B1 (en) | 1998-11-12 | 2003-01-21 | Guilford Pharmaceuticals Inc. | Small molecule inhibitors of rotamase enzyme activity |
| US5801197A (en) * | 1995-10-31 | 1998-09-01 | Gpi Nil Holdings, Inc. | Rotamase enzyme activity inhibitors |
| US5801187A (en) | 1996-09-25 | 1998-09-01 | Gpi-Nil Holdings, Inc. | Heterocyclic esters and amides |
| US5786378A (en) * | 1996-09-25 | 1998-07-28 | Gpi Nil Holdings, Inc. | Heterocyclic thioesters |
| US6218424B1 (en) * | 1996-09-25 | 2001-04-17 | Gpi Nil Holdings, Inc. | Heterocyclic ketone and thioester compounds and uses |
| US5811434A (en) * | 1996-11-13 | 1998-09-22 | Vertex Pharmacueticals Incorporated | Methods and compositions for stimulating neurite growth |
| US5840736A (en) * | 1996-11-13 | 1998-11-24 | Vertex Pharmaceuticals Incorporated | Methods and compositions for stimulating neurite growth |
| US5780484A (en) * | 1996-11-13 | 1998-07-14 | Vertex Pharmaceuticals Incorporated | Methods for stimulating neurite growth with piperidine compounds |
| US5874449A (en) * | 1996-12-31 | 1999-02-23 | Gpi Nil Holdings, Inc. | N-linked sulfonamides of heterocyclic thioesters |
| SK57899A3 (en) * | 1996-12-31 | 2000-05-16 | Guilford Pharm Inc | N-linked ureas and carbamates of heterocyclic thioesters |
| US5935989A (en) | 1996-12-31 | 1999-08-10 | Gpi Nil Holdings Inc. | N-linked ureas and carbamates of heterocyclic thioesters |
| JP2002515051A (ja) | 1996-12-31 | 2002-05-21 | ジーピーアイ エヌアイエル ホールディングス インコーポレイテッド | ヘテロ環式チオエステルのn−結合スルホンアミド |
| US5721256A (en) * | 1997-02-12 | 1998-02-24 | Gpi Nil Holdings, Inc. | Method of using neurotrophic sulfonamide compounds |
| US6242468B1 (en) | 1997-02-27 | 2001-06-05 | Jia-He Li | Carbamate and urea compositions and neurotrophic uses |
| ZA98825B (en) * | 1997-02-27 | 1998-10-19 | Guilford Pharm Inc | Method of using neurotrophic carbamates and ureas |
| US5846979A (en) * | 1997-02-28 | 1998-12-08 | Gpi Nil Holdings, Inc. | N-oxides of heterocyclic esters, amides, thioesters, and ketones |
| US5945441A (en) | 1997-06-04 | 1999-08-31 | Gpi Nil Holdings, Inc. | Pyrrolidine carboxylate hair revitalizing agents |
| US6852496B1 (en) * | 1997-08-12 | 2005-02-08 | Oregon Health And Science University | Methods of screening for agents that promote nerve cell growth |
| US5968921A (en) * | 1997-10-24 | 1999-10-19 | Orgegon Health Sciences University | Compositions and methods for promoting nerve regeneration |
| AU3193399A (en) | 1998-03-23 | 1999-10-18 | Genentech Inc. | Method of selection for genes encoding secreted and transmembrane proteins |
| US6096762A (en) * | 1998-06-02 | 2000-08-01 | Bristol-Myers Squibb Company | Neurotrophic difluoroamide agents |
| AU756912B2 (en) | 1998-07-17 | 2003-01-23 | Agouron Pharmaceuticals, Inc. | Compounds, compositions, and methods for stimulating neuronal growth and elongation |
| US6376517B1 (en) * | 1998-08-14 | 2002-04-23 | Gpi Nil Holdings, Inc. | Pipecolic acid derivatives for vision and memory disorders |
| US6218423B1 (en) * | 1998-08-14 | 2001-04-17 | Gpi Nil Holdings, Inc. | Pyrrolidine derivatives for vision and memory disorders |
| US6335348B1 (en) * | 1998-08-14 | 2002-01-01 | Gpi Nil Holdings, Inc. | Nitrogen-containing linear and azepinyl/ compositions and uses for vision and memory disorders |
| US7338976B1 (en) * | 1998-08-14 | 2008-03-04 | Gpi Nil Holdings, Inc. | Heterocyclic esters or amides for vision and memory disorders |
| US6384056B1 (en) * | 1998-08-14 | 2002-05-07 | Gpi Nil Holdings, Inc. | Heterocyclic thioesters or ketones for vision and memory disorders |
| EP1105112A2 (de) * | 1998-08-14 | 2001-06-13 | GPI NIL Holdings, Inc. | Zusammensetzungen und verwendungen für sehens-, und gedächtnisstörungen |
| US6462072B1 (en) * | 1998-09-21 | 2002-10-08 | Gpi Nil Holdings, Inc. | Cyclic ester or amide derivatives |
| US6228872B1 (en) | 1998-11-12 | 2001-05-08 | Bristol-Myers Squibb Company | Neurotrophic diamide and carbamate agents |
| DE19905255A1 (de) * | 1999-02-03 | 2000-08-10 | Schering Ag | Piperidin- und Pyrrolidin-Derivate |
| DE19905256A1 (de) * | 1999-02-03 | 2000-08-10 | Schering Ag | Piperidin- und Pyrrolidin-Derivate |
| WO2000046181A1 (en) * | 1999-02-03 | 2000-08-10 | Schering Aktiengesellschaft | Carboxylic acid derivatives, process for their preparation and their use as rotamase enzyme activity inhibitors |
| DE19905254A1 (de) * | 1999-02-03 | 2000-08-10 | Schering Ag | Piperidin- und Pyrrolidin-Derivate |
| AU3587300A (en) * | 1999-02-03 | 2000-08-25 | Schering Aktiengesellschaft | Ether derivatives |
| US6284779B1 (en) | 1999-02-03 | 2001-09-04 | Schering Aktiiengesellschaft | Heteroaromatic compounds |
| AU5919900A (en) | 1999-07-06 | 2001-01-22 | Vertex Pharmaceuticals Incorporated | Cyclized amino acid derivatives |
| EP1196385A1 (de) * | 1999-07-06 | 2002-04-17 | Vertex Pharmaceuticals Incorporated | Beta-aminosäure derivate zur behandlung von neurologischen krankheiten |
| WO2001002368A1 (en) | 1999-07-06 | 2001-01-11 | Vertex Pharmaceuticals Incorporated | N-heterocyclic derivatives with neuronal activity |
| EP1196386A2 (de) * | 1999-07-06 | 2002-04-17 | Vertex Pharmaceuticals Incorporated | N-substituierte glycin-derivate |
| WO2001002362A1 (en) | 1999-07-06 | 2001-01-11 | Vertex Pharmaceuticals Incorporated | Azo amino acid derivatives for the treatment of neurological diseases |
| US6323215B1 (en) * | 1999-07-09 | 2001-11-27 | Ortho-Mcneil Pharmaceutical, Inc. | Neurotrophic tetrahydroisoquinolines and tetrahydrothienopyridines, and related compositions and methods |
| US6734211B1 (en) | 1999-07-09 | 2004-05-11 | Oregon Health & Sciences University | Compositions and methods for promoting nerve regeneration |
| AU6076000A (en) * | 1999-07-30 | 2001-02-19 | Vertex Pharmaceuticals Incorporated | Cyclic amine derivatives for the treatment of neurological diseases |
| WO2001008685A1 (en) * | 1999-07-30 | 2001-02-08 | Vertex Pharmaceuticals Incorporated | Acyclic and cyclic amine derivatives |
| US6417189B1 (en) | 1999-11-12 | 2002-07-09 | Gpi Nil Holdings, Inc. | AZA compounds, pharmaceutical compositions and methods of use |
| US7253169B2 (en) | 1999-11-12 | 2007-08-07 | Gliamed, Inc. | Aza compounds, pharmaceutical compositions and methods of use |
| GT200000203A (es) | 1999-12-01 | 2002-05-24 | Compuestos, composiciones y metodos para estimular el crecimiento y elongacion de neuronas. | |
| US6818643B1 (en) | 1999-12-08 | 2004-11-16 | Bristol-Myers Squibb Company | Neurotrophic bicyclic diamides |
| US7060676B2 (en) | 1999-12-20 | 2006-06-13 | Trustees Of Tufts College | T. cruzi-derived neurotrophic agents and methods of use therefor |
| ATE319712T1 (de) | 1999-12-21 | 2006-03-15 | Mgi Gp Inc | Hydantoin derivate, pharmazeutische zusammensetzungen und verfahren zu ihrer verwendung |
| JP2005500270A (ja) * | 2001-05-29 | 2005-01-06 | ギルフォード ファーマシュウティカルズ インコーポレイテッド | 手術の結果として発生した神経損傷を治療するための方法 |
| CN1240691C (zh) | 2001-12-06 | 2006-02-08 | 中国人民解放军军事医学科学院毒物药物研究所 | 取代五元氮杂环类化合物及其预防和治疗神经退行性疾病的用途 |
| KR20040011237A (ko) * | 2002-07-29 | 2004-02-05 | 김윤희 | Pdgf, 그의 유도체 및 약학적으로 허용되는 그의 염을함유하는 신경세포 보호 및 재생용 조성물 |
| AU2003259846A1 (en) * | 2002-08-16 | 2004-03-03 | The General Hospital Corporation | Non-invasive functional imaging of peripheral nervous system activation in humans and animals |
| CA2539324A1 (en) | 2003-09-18 | 2005-03-31 | Macusight, Inc. | Transscleral delivery |
| US8637070B2 (en) | 2005-02-09 | 2014-01-28 | Santen Pharmaceutical Co., Ltd. | Rapamycin formulations and methods of their use |
| US8663639B2 (en) | 2005-02-09 | 2014-03-04 | Santen Pharmaceutical Co., Ltd. | Formulations for treating ocular diseases and conditions |
| EP2001438A2 (de) | 2006-02-09 | 2008-12-17 | Macusight, Inc. | Stabile formulierungen sowie verfahren zu ihrer herstellung und verwendung |
| ES2563288T3 (es) | 2006-03-23 | 2016-03-14 | Santen Pharmaceutical Co., Ltd | Rapamicina en dosis bajas para el tratamiento de enfermedades relacionadas con la permeabilidad vascular |
| PT2544679T (pt) | 2010-03-12 | 2019-07-11 | Omeros Corp | Inibidores de pde-10 e composições e métodos relacionados |
| WO2012151476A1 (en) * | 2011-05-05 | 2012-11-08 | Emory University | Glial cell line derived neurotrophic factor, obesity, and obesity-related diseases and conditions |
| US10052362B2 (en) | 2011-05-05 | 2018-08-21 | Emory University | Glial cell line derived neurotrophic factor, obesity, and obesity-related diseases and conditions |
| NZ716462A (en) | 2014-04-28 | 2017-11-24 | Omeros Corp | Optically active pde10 inhibitor |
| NZ716494A (en) | 2014-04-28 | 2017-07-28 | Omeros Corp | Processes and intermediates for the preparation of a pde10 inhibitor |
| US9879002B2 (en) | 2015-04-24 | 2018-01-30 | Omeros Corporation | PDE10 inhibitors and related compositions and methods |
| JP2018535969A (ja) | 2015-11-04 | 2018-12-06 | オメロス コーポレーション | Pde10阻害剤の固体状態形態 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5192773A (en) * | 1990-07-02 | 1993-03-09 | Vertex Pharmaceuticals, Inc. | Immunosuppressive compounds |
| DE69229782T2 (de) * | 1991-05-09 | 2000-04-27 | Vertex Pharmaceuticals Inc., Cambridge | Neue immunsuppressive verbindungen |
| WO1993000427A2 (en) * | 1991-06-24 | 1993-01-07 | Erziehungsdirektion Of The Canton Zurich | Neurite growth regulatory factors |
| NZ314207A (en) * | 1992-09-28 | 2000-12-22 | Vertex Pharma | 1-(2-Oxoacetyl)-piperidine-2-carboxylic acid derivatives as multi drug resistant cancer cell sensitizers |
| US5543423A (en) | 1994-11-16 | 1996-08-06 | Vertex Pharmaceuticals, Incorporated | Amino acid derivatives with improved multi-drug resistance activity |
| US5696135A (en) * | 1995-06-07 | 1997-12-09 | Gpi Nil Holdings, Inc. | Inhibitors of rotamase enzyme activity effective at stimulating neuronal growth |
| US5859031A (en) * | 1995-06-07 | 1999-01-12 | Gpi Nil Holdings, Inc. | Small molecule inhibitors of rotamase enzyme activity |
| DE69625197T2 (de) * | 1995-06-07 | 2003-09-25 | Chromatics Color Sciences International, Inc. | Verfahren und vorrichtung zum nachweis und messen von zuständen,welche die farbe beeinflussen |
| US5614547A (en) * | 1995-06-07 | 1997-03-25 | Guilford Pharmaceuticals Inc. | Small molecule inhibitors of rotamase enzyme |
| US5801197A (en) * | 1995-10-31 | 1998-09-01 | Gpi Nil Holdings, Inc. | Rotamase enzyme activity inhibitors |
-
1995
- 1995-06-08 US US08/486,004 patent/US6037370A/en not_active Expired - Lifetime
-
1996
- 1996-06-06 BR BR9609333-1A patent/BR9609333A/pt not_active IP Right Cessation
- 1996-06-06 RU RU98100456/14A patent/RU2197240C2/ru not_active IP Right Cessation
- 1996-06-06 EP EP96918469A patent/EP0831812B1/de not_active Expired - Lifetime
- 1996-06-06 ES ES96918469T patent/ES2255077T3/es not_active Expired - Lifetime
- 1996-06-06 DK DK96918469T patent/DK0831812T3/da active
- 1996-06-06 KR KR1019970709288A patent/KR100480662B1/ko not_active IP Right Cessation
- 1996-06-06 CA CA002222430A patent/CA2222430A1/en not_active Abandoned
- 1996-06-06 CN CN96195690A patent/CN1202104A/zh active Pending
- 1996-06-06 WO PCT/US1996/010123 patent/WO1996041609A2/en active IP Right Grant
- 1996-06-06 IL IL12234696A patent/IL122346A/en not_active IP Right Cessation
- 1996-06-06 PL PL96328723A patent/PL185798B1/pl not_active IP Right Cessation
- 1996-06-06 AT AT96918469T patent/ATE311875T1/de not_active IP Right Cessation
- 1996-06-06 DE DE69635550T patent/DE69635550T2/de not_active Expired - Lifetime
- 1996-06-06 EP EP05026521A patent/EP1666037A3/de not_active Withdrawn
- 1996-06-06 NZ NZ310339A patent/NZ310339A/xx unknown
- 1996-06-07 ZA ZA964852A patent/ZA964852B/xx unknown
-
1997
- 1997-02-28 US US08/795,956 patent/US6124328A/en not_active Expired - Lifetime
-
2000
- 2000-07-14 US US09/616,539 patent/US6326387B1/en not_active Expired - Lifetime
-
2007
- 2007-09-03 JP JP2007227995A patent/JP2007308517A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| IL122346A (en) | 2002-05-23 |
| IL122346A0 (en) | 1998-04-05 |
| KR19990022819A (ko) | 1999-03-25 |
| EP0831812A2 (de) | 1998-04-01 |
| ES2255077T3 (es) | 2006-06-16 |
| US6037370A (en) | 2000-03-14 |
| DK0831812T3 (da) | 2006-07-17 |
| NZ310339A (en) | 2000-03-27 |
| JP2007308517A (ja) | 2007-11-29 |
| ATE311875T1 (de) | 2005-12-15 |
| EP0831812B1 (de) | 2005-12-07 |
| CA2222430A1 (en) | 1996-12-27 |
| CN1202104A (zh) | 1998-12-16 |
| EP1666037A2 (de) | 2006-06-07 |
| BR9609333A (pt) | 1999-10-13 |
| DE69635550D1 (de) | 2006-01-12 |
| EP1666037A3 (de) | 2006-06-21 |
| US6326387B1 (en) | 2001-12-04 |
| PL328723A1 (en) | 1999-02-15 |
| PL185798B1 (pl) | 2003-07-31 |
| US6124328A (en) | 2000-09-26 |
| KR100480662B1 (ko) | 2005-09-12 |
| ZA964852B (en) | 1996-07-29 |
| RU2197240C2 (ru) | 2003-01-27 |
| WO1996041609A2 (en) | 1996-12-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69635550T2 (de) | Verfahren und mittel zur anregung des neuritwachstums | |
| DE69725293T2 (de) | N-(2 oxoacetyl oder sulphonyl)-pyrrolidine/piperidine-2-carbonsäurederivate mit verbesserter multi-drug resistenz aktivität | |
| DE69725169T2 (de) | Zusammensetzungen und verfahren zur anregung des wachstums von neuriten | |
| DE69629392T2 (de) | Inhibitoren der aktivität der cyclophilin rotamase | |
| DE69837261T2 (de) | Behandlung der diabetes mit thiazolidindione und metformin | |
| CH689541A5 (de) | Inhibitoren der Enzymaktivität von Rotamase. | |
| DE69738382T2 (de) | Heterozyklische Thioester und Ketone | |
| US20010029263A1 (en) | Novel pyrrolidine carboxylate hair revitalizing agents | |
| CZ125198A3 (cs) | Použití derivátu kyseliny pipekolinové a jeho farmaceuticky přijatelných solí pro výrobu léčiva pro ovlivňování neurologické aktivity u zvířete | |
| DE3784977T2 (de) | Verwendung von adenosin-derivaten als anti-dementia-mittel. | |
| EP1397138B1 (de) | WIRKSTOFF-KOMBINATION (z.B. Galanthamin oder Desoxypeganin mit Acamprosat oder Memantin) ZUR MEDIKAMENTÖSEN SUCHT- ODER RAUSCHMITTELTHERAPIE | |
| DE69825605T2 (de) | Behandlung der schizophrenie und der psychose | |
| DE69614419T2 (de) | Transdermale Formulierung eines Mittels muscarinischer Wirkung | |
| DE60130365T2 (de) | Die Verwendung von Rosiglitazon zur Behandlung von psychiatrischen Erkrankungen. | |
| DE60206289T2 (de) | Verwendung von bibn4096 in kombination mit anderen migränemitteln zur behandlung von migräne | |
| US6274617B1 (en) | Heterocyclic ester and amide hair growth compositions and uses | |
| DE69524590T2 (de) | Zusammensetzung von 5htida und 5htid antagonisten | |
| DE69910425T2 (de) | Neue therapeutische verwendung von nicergoline | |
| WO2000048599A1 (de) | Verwendung von desoxypeganin zur behandlung von alzheimerischer demenz | |
| DE69814089T2 (de) | Verwendung von einem draflazin analog zur schmerzbehandlung | |
| DE60215525T2 (de) | Kombination aus quetiapin und zolmitriptan | |
| DE3779991T2 (de) | Dioxopiperidin-derivate enthaltende anxiolytische zusammensetzungen. | |
| DE69820911T2 (de) | Verwendung einer Verbindung zur Herstellung eines Medikaments zur Behandlung von Alopecia oder zur Förderung des Haarwuchses bei Tieren | |
| DE60212813T2 (de) | Metronomische dosierung von taxanen zur hemmung von krebswachstum | |
| DE69835543T2 (de) | Haarwuchszusammensetzungen basierend auf einem heterozyklischen ester und keton und anwendungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |