-
Gebiet der
Erfindung
-
Die
vorliegende Erfindung betrifft Pyran-2-one und 5,6-Dihydropyran-2-one,
die zur Behandlung von Hyperplasie und anderen Erkrankungen verwendbar
sind.
-
Hintergrund
der Erfindung
-
Es
ist einschlägig
bekannt, dass gewisse unerwünschte
physiologische Manifestationen, wie Akne vulgaris, Seborrhoe, weiblicher
Hirsutismus, männliche
Glatzenbildung und benigne Prostatahypertrophie, das Ergebnis einer
hyperandrogenen Stimulierung, die durch eine übermäßige Ansammlung von Testosteron
oder verwandten aktiven Hormonen im Zielgewebe verursacht ist, sind;
siehe US-A-4 377 584, Spalte 1, Zeile 18–24. Ferner wurde gezeigt,
dass die Verringerung von Androgenspiegeln eine therapeutische Wirkung
auf Prostatakrebs hat; siehe beispielsweise US-A-5 017 568, Spalte
2, Zeile 4–6.
-
Es
ist auch einschlägig
bekannt, dass der Hauptvermittler androgener Aktivität in einigen
Zielorganen 5α-Dihydrotestosteron
(und verwandten 5α-reduzierte
Androgene) ist und dass es lokal im Zielorgan durch die Wirkung
von Steroid-5α-Reduktase
gebildet wird. Inhibitoren von Steroid-5α-Reduktase
verhindern oder verringern Symptome einer hyperandrogenen Stimulierung.
Siehe beispielsweise US-A-4 377 584, Spalte 1, Zeile 38–45.
-
Beispiele
für Verbindungen,
die aufgrund ihrer Fähigkeit
zur Hemmung von Testosteron-5α-Reduktase Antiandrogene
sind, sind in US-A-4 377 584, US-A-4 760 071 und US-A-5 017 568
offenbart.
-
Finasterid
[auch als N-(1,1-Dimethylethyl)-3-oxo-4-aza-5α-androst-1-en-17β-carboxamid bezeichnet] (PROSCAR®)
ist ein 5α-Reduktase-Inhibitor,
der zur Verringerung der Prostatagröße bei Männern verwendet wird. Es wurde
vor kurzem von der FDA zur Behandlung von benigner Prostatahyperplasie
zugelassen.
-
Die
US-A-4 377 584 und US-A-4 760 071 offenbaren, dass 4-Aza-17β-substituierte-5α-androstan-3-one,
insbesondere die Verbindung 17β-(N-tert-Butylcarbamoyl)-4-aza-5α-androst-1-en-3-on und deren A-Homoanaloga
als Testosteron-5α-Reduktaseinhibitoren
aktiv sind und daher topisch zur Behandlung von Akne, Seborrhoe
und weiblichem Hirsutismus und systemisch bei der Behandlung von
benigner Prostatahypertrophie verwendbar sind. Siehe auch Journal
of Andrology, 10: 259–262
(1989); J. Steroid. Biochem. Molec. Biol., Band 44, Nr. 2, S. 121–131 (1993).
-
Die
US-A-5 017 568 offenbart substituierte Acrylatanaloga von steroidalen
synthetischen Verbindungen mit 5α-Reduktaseinhibitoraktivität, und die
daher bei der Behandlung von Erkrankungen wie Akne vulgaris, Seborrhoe,
weiblichem Hirsutismus, Prostataerkrankungen, wie benigner Prostatahypertrophie
und Prostataadenokarzinom und männlicher
Glatzenbildung verwendbar sind.
-
Ein
selektiver nicht-steroidaler Inhibitor von humaner Steroid-5α-Reduktase
Typ 1 ist LY 191704 [8-Chlor-4-methyl-1,2,3,4,4α,5,6,10b-octahydro-benzo[f]chinolin-3(2H)-on];
Proc. Natl. Acad. Sci. USA, Band 90: 5277–5281 (1993).
-
Die
FR-A-1 276 654 offenbart 4-Hydroxy-2-pyrone und deren Verwendung
als Antipilzmittel und Antikoagulantien.
-
Zusammenfassung
der Erfindung
-
Gemäß der vorliegenden
Erfindung wird eine Verbindung der Formel I, die in Anspruch 1 definiert
ist, zur Herstellung eines Medikaments zur Prävention oder Behandlung von
benigner Prostatahypertrophie oder -hyperplasie, Prostatakrebs,
Alopezie, Hirsutismus, Akne vulgaris oder Seborrhoe bei einem eine
derartige Prävention
oder Behandlung benötigenden
Säuger
verwendet. Bevorzugte Verbindungen zur Verwendung in der Erfindung
sind in den Ansprüchen
2 bis 5 definiert.
-
Beschreibung
der Erfindung
-
Die
Verbindungen der vorliegenden Erfindung werden nach dem IUPAC- oder
CAS-Nomenklatursystem benannt.
-
Der
Kohlenstoffatomgehalt von verschiedenen kohlenwasserstoffhaltigen
Einheiten wird durch ein Präfix
angegeben, das die minimale und maximale Zahl der Kohlenstoffatome
in der Einheit bezeichnet, d.h. das Präfix Ci-Cj gibt eine Einheit mit der ganzen Zahl "i" bis einschließlich der ganzen Zahl "j" Kohlenstoffatomen an. Daher bezeichnet
beispielsweise C1-C3-Alkyl
Alkyl mit einem bis einschließlich
drei Kohlenstoffatomen oder Methyl, Ethyl, Propyl und Isopropyl.
-
Alkyl
mit einem bis neun Kohlenstoffatomen bedeutet Methyl, Ethyl, Propyl,
Butyl, Pentyl, Hexyl, Heptyl, Octyl, Nonyl und alle isomeren Formen
derselben, gerade und verzweigte.
-
Alkenyl
mit bis zu fünf
Kohlenstoffatomen bedeutet Ethenyl, Propenyl, Butenyl, Pentenyl
und alle isomeren Formen derselben.
-
Beispiele
für "Halo" oder "Halogen" sind Fluor, Chlor
und Brom.
-
"Aminosäurerest" bedeutet den Rest
einer natürlich
vorkommenden Aminosäure,
wie: Alanin, Arginin, Asparagin, Asparaginsäure, Cystein, Glutamin, Glutaminsäure, Glycin,
Histidin, Isoleucin, Leucin, Lysin, Methionin, Phenylalanin, Prolin,
Serin, Threonin, Tryptophan, Tyrosin, Valin, Asparaginsäure oder
Asparagin, und synthetische Derivate derselben. Diese Aminosäurereste
können
in der L- oder D-Konfiguration
sein und sind ohne weiteres bekannt und dem Fachmann verfügbar. Diese
Aminosäurereste
(oder deren N-terminal
geschützte
Formen) sind über
ihren C-Terminus an eine freie Aminogruppe gebunden.
-
Verbindungen
der Formel I werden wie in den folgenden Herstellungsbeispielen
und Beispielen beschrieben oder durch dazu analoge Verfahren, die
einem Fachmann üblicher
Erfahrung auf dem Gebiet der organischen Synthese ohne weiteres
bekannt und verfügbar
sind, hergestellt.
-
REAKTIONSSCHEMA
A
-
Die
Herstellung von 6-Aryl-4-hydroxy-2-pyron (beispielsweise A-4: X
ist CH) und 3-alkyliertem 6-Aryl-4-hydroxy-2-pyron (beispielsweise A-5: X ist CH,
R ist Ethyl) sind in Reaktionsschema A angegeben. Die Deprotonierung
von Ethylacetoacetat der Formel A-1, das im Handel erhältlich ist,
mit Kaliumhydrid und n-Butyllithium in Tetrahydrofuran und die anschließende Zugabe
von Ethylbenzoat, die die Verbindung der Formel A-2 (worin X CH
ist) ist, ergibt Ethyl-5-phenyl-3,5-dioxopentanoat
der Formel A-3 (worin X CH ist). Erhitzen der Verbindung der Formel
A-3 bei 120°C
unter vermindertem Druck (1 mm Hg, pur) ergibt 4-Hydroxy-6-phenyl-2-pyron, die
Verbindung der Formel A-4 (worin X CH ist). Die Alkylierung der
Verbindung der Formel A-4 durch Erhitzen mit einer Zahl der entsprechenden
substituierten Benzylbromide oder die Behandlung der Verbindung
der Formel A-4 mit den entsprechenden substituierten Benzylalkoholen
in Gegenwart von Bortrifluorid-Diethylether führt zu dem gewünschten
Produkt der Formel A-5 (worin X CH ist und R Ethyl ist), das die Verbindung
3-(α-Ethylbenzyl)-4-hydroxy-6-phenyl-2H-pyran-2-on
ist.
-
REAKTIONSSCHEMA
B
-
Die
Herstellung der Verbindung der Formel B-5 (worin n 1 ist), die die
Verbindung 6-Benzyl-3-(α-ethylbenzyl)-4-hydroxy-2H-pyran-2-on
ist, und der Verbindung der Formel B-5 (worin n 2 ist), die die Verbindung 3-(α-Ethylbenzyl)-6-phenethyl-4-hydroxy-2H-pyran-2-on
ist, sind in Reaktionsschema B angegeben. Das Dianion der Formel
B-1 wird durch die gleichen Bedingungen, die in Reaktionsschema
A beschrieben sind, erzeugt. Entweder Ethylphenylacetat der Formel
B-2 (worin n 1 ist) oder Ethyldihydrocinnamat der Formel B-2 (worin
n 2 ist) wird dann zugegeben, wobei Ethyl-6-phenyl-3,5-dioxohexanoat
der Formel B-3 (worin n 1 ist) bzw. Ethyl-7-phenyl-3,5-dioxoheptanoat
der Formel B-3 (worin n 2 ist) erhalten werden. Die Bildung des
Pyronrings in der Verbindung der Formel B-4 (worin n 1 oder 2 ist)
wird durch Erhitzen der Verbindung der Formel B-3 (worin n 1 bzw.
2 ist) unter vermindertem Druck erreicht. Erhitzen der Verbindung
der Formel B-4 (worin n 1 oder 2 ist) mit (±)-1-Brom-1-phenylpropan oder
die Behandlung mit (±)-1-Phenylpropanol in
Gegenwart von Bortrifluorid in Dioxan ergibt die gewünschten
Produkte der Formel B-5 (worin n 1 bzw. 2 ist).
-
REAKTIONSSCHEMA C
-
Das
gewünschte
Produkt der Formel C-4, das die Verbindung 4-Hydroxy-6-phenethyl-3-(alpha-propyl-p-brombenzyl)-2H-pyran-2-on ist, wird
durch Erhitzen des Pyrons der Formel C-3 (in Reaktionsschema B als
die Verbindung der Formel B-4 (worin n 2 ist) hergestellt) mit der
Verbindung der Formel C-2 (worin R Bromid ist) erhalten. Die erforderliche
Verbindung der Formel C-2 (worin R Bromid ist) wird durch eine zweistufige Reaktionsfolge
ausgehend von 4-Brombenzaldehyd, der Verbindung der Formel C-1,
erhalten. Die Behandlung der Verbindung der Formel C-1 mit Propylmagnesiumbromid
ergibt 1-(4'-Bromphenyl)-1-butanol,
die Verbindung der Formel C-2 (worin R OH ist). Der gebildete Alkohol,
die Verbindung der Formel C-2 (worin R OH ist), wird dann mit 48%-iger
Bromwasserstoffsäure
behandelt, wobei das gewünschte
Bromid der Formel C-2 (worin R Bromid ist) erhalten wird.
-
REAKTIONSSCHEMA
D
-
Die
O-Allylierung von 4-Hydroxy-6-methyl-2-pyron, der Verbindung der
Formel D-1, mit Cinnamylbromid ergibt die Verbindung der Formel
D-2. Eine Claisen-Umlagerung des gebildeten Pyrons der Formel D-2 wird
in refluxierendem Toluol durchgeführt, wobei das Vinylanalogon
der Formel D-3 erhalten wird. Das Claisen-Produkt der Formel D-3
wird einer katalytischen Hydrierung unterzogen, wobei die Verbindung
der Formel D-4 erhalten wird. Die Behandlung der Formel D-4 mit
zwei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran und die anschließende Zugabe
eines Elektrophils, wie Benzylbromid, ergibt das Produkt der Formel D-5,
das die Verbindung 3-(α-Ethylbenzyl)-6-phenethyl-4-hydroxy-2H-pyran-2-on
ist. Dies ist das bevorzugte Verfahren zur Herstellung dieser Verbindung.
-
REAKTIONSSCHEMA E
-
Eine
Vielzahl von Analoga kann unter Verwendung ähnlicher Bedingungen, wie sie
bei der Herstellung der Verbindung der Formel D-5 von Reaktionsschema
D verwendet werden, hergestellt werden. Unter diesen Bedingungen
werden 4-Brombenzylbromid, 2-Fluorbenzylbromid oder Allylbromid
mit dem Dianion der Formel E-1 (in Reaktionsschema D als die Verbindung
der Formel D-4 hergestellt) rasch umgesetzt, wobei die Verbindungen
der Formel E-2 (worin R 4-Brombenzyl, 2-Fluorbenzyl oder 3-Propylen ist), die
die Verbindungen 6-(p-Bromphenethyl)-3-(α-ethylbenzyl)-4-hydroxy-2H-pyran-2-on, 3-(α-Ethylbenzyl)-6-(o-fluorphenethyl)-4-hydroxy-2H-pyran-2-on bzw. 3-(α-Ethylbenzyl)-4-hydroxy-6-(3-butenyl)-2H-pyran-2-on sind,
erhalten werden. Jedoch erfordert die Umsetzung von Iodethan und
Phenylethylbromid mit der Verbindung der Formel E-1 das Rühren des
Reaktionsgemischs bei Raumtemperatur während einiger Stunden, wobei
die Verbindungen der Formel E-2 (worin R Ethyl oder Phenylethyl
ist), die die Verbindungen 3-(α-Ethylbenzyl)-4-hydroxy-6-propyl-2H-pyran-2-on bzw.
3-(α-Ethylbenzyl)-4-hydroxy-6-(3-phenyl-propyl)-2H-pyran-2-on
sind, erhalten werden.
-
REAKTIONSSCHEMA
F
-
Die
Behandlung der Verbindung der Formel F-1 (als die Verbindung der
Formel D-4 in Reaktionsschema D hergestellt) mit 2 Äq. Lithiumdiisopropylamid
und Tetrahydrofuran bei –40°C und die
anschließende
Zugabe von Phenylisocyanat ergibt die Verbindung der Formel F-2,
die die Verbindung 3-(α-Ethylbenzyl)-4-hydroxy-6-[[(phenyl-amino)carbonyl]methyl]-2H-pyran-2-on
ist.
-
REAKTIONSSCHEMA
G
-
Die
Herstellung der Verbindung der Formel G-2, die die Verbindung 4-Hydroxy-6-phenethyl-3-(α-vinylbenzyl)-2H-pyran-2- on ist, wird durch
die direkte Alkylierung der Verbindung der Formel G-1 (als die Verbindung
der Formel D-3 in Reaktionsschema D hergestellt) mit Benzylbromid
erreicht.
-
REAKTIONSSCHEMA
H
-
Im
Handel erhältliches
6-Methyl-4-hydroxy-2H-pyran-2-on der Formel H-1 wird mit im Handel
erhältlichem α-Ethylbenzyl-alkohol der Formel
H-2 mit einem sauren Katalysator umgesetzt, wobei die Verbindung der
Formel H-3 erhalten wird.
-
Die
Behandlung der Verbindung der Formel H-3 (kann auch als die Verbindung
der Formel D-4 in Reaktionsschema D hergestellt werden) mit drei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran und die anschließende aufeinanderfolgende
Zugabe von Benzylbromid und Ethyliodid ergeben die Verbindung der Formel
H-4 (worin R1 Benzyl ist und R2 Ethyl
ist), die die Verbindung 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
ist. Unter ähnlichen
Bedingungen wird die Verbindung der Formel H-4 (worin R1 Ethyl
ist und R2 Ethyl ist), die die Verbindung
3-(α-Ethylbenzyl)-1-ethylpropyl-4-hydroxy-2H-pyran-2-on
ist, durch Verwendung von zwei Äquivalenten
Ethyliodid als Elektrophil erhalten.
-
REAKTIONSSCHEMA
I
-
Die
Alkylierung des Anions von Methylacetoacetat der Formel I-1, das
im Handel erhältlich
ist, ergibt nach einer Behandlung mit Natriumhydrid mit α-Ethylbenzylbromid
der Formel I-2, das im Handel erhältlich ist, Methyl-2-(α-ethylbenzyl)-acetoacetat
der Formel I-3. Das entsprechende Dianion, das durch aufeinanderfolgende
Behandlung mit Natriumhydrid und n-Butyllithium erzeugt wird, addiert
sich an Propriophenon der Formel I-4, das im Handel erhältlich ist, wobei
Methyl-2-(α-ethylbenzyl)-5-hydroxy-3-oxo-5-phenylheptanoat
der Formel I-5 erhalten wird. Der Methylester wird dann mit Natriumhydroxid
hydrolysiert, und bei Ansäuern
mit Salzsäure
wird das gewünschte
Material, 6-Ethyl-3-(α-ethylbenzyl)-6-phenyl-tetrahydropyran-2,4-dion
der Formel I-6, isoliert.
-
REAKTIONSSCHEMA
J
-
Die
Alkylierung des Anions von Methylacetoacetat der Formel J-1 (auch
in Reaktionsschema I als die Verbindung der Formel I-1 verwendet),
das im Handel erhältlich
ist, ergibt nach einer Behandlung mit Natriumhyrid mit 1-Brom-3-phenylpropan
der Formel J-2, das im Handel erhältlich ist, Methyl-2-(3-phenylpropyl)-acetoacetat
der Formel J-3. Das entsprechende Dianion, das durch aufeinanderfolgende
Behandlung mit Natriumhydrid und n-Butyllithium erzeugt wird, addiert
sich an 3-Pentanon der Formel J-4, das im Handel erhältlich ist,
wobei Methyl-2-(3-phenylpropyl)-5-ethyl-5-hydroxy-3-oxo-heptanoat der Formel J-5
erhalten wird. Der Methylester wird dann mit Natriumhydroxid hydrolysiert,
und bei Ansäuern
mit Salzsäure
wird das gewünschte Material,
6,6-Diethyl-3-(3-phenylpropyl)-tetrahydropyran-2,4-dion der Formel
J-6, isoliert.
-
REAKTIONSSCHEMA
K
-
Das
Reaktionsschema K bietet einen alternativen hocheffektiven Weg zur
Einführung
von C-3-Substituenten an dem 4-Hydroxy-α-pyron- und
5,6-Dihydro-4-hydroxy-2H-pyran-2-on-Ring. Allylcarbonate der Formel K-2
(a, b und c) und nukleophile 5,6-Dihydro-4-hydroxy-2-pyrone der
Formel K-1 (a, b und c) werden mit Palladiumacetat und Triphenylphosphin
in Toluol bei 50°C
behandelt, wobei Verbindungen der Formel K-3 (a, b und c) erhalten
werden. Repräsentative Beispiele
für diese
Reaktion folgen in Reaktionsschema K. Ferner ist es möglich, Allylcarbonate,
die eine Substitution im Phenylring enthalten, zu verwenden (Reaktionsschema K,
Gleichung a, b). In Fällen,
in denen diastereomere Produkte möglich sind (Reaktionsschema
K, Gleichung a, b), werden chromatographisch nicht trennbare Gemische
gebildet. Die Endprodukte werden durch Desilylierung und Reduktion
erhalten. In einigen Fällen
ist es möglich,
ein Diastereomer des Produkts durch aufeinanderfolgende Umkristallisation
zu isolieren. Die Mutterlaugen enthalten ein an dem anderen Diastereomer
angereichertes Gemisch, doch können
Versuche zur Reinigung derselben durch weitere Umkristallisationen
fehlschlagen. Anschließende
chemische Manipulationen an den Substituenten an der 6-Position
des 5,6-Dihydropyran-2-on-Rings
werden vom Fachmann durchgeführt.
-
REAKTIONSSCHEMA
L
-
Das
Reaktionsschema L beschreibt ein generisches Verfahren zur Synthese
von C-3-α-verzweigt-substituierten
4-Hydroxy-2-pyronen
oder 4-Hydroxy-5,6-dihydropyran-2-onen. Die Schlüsselreaktion umfasst eine palladiumkatalysierte
Allylalkylierung des cyclischen β-Ketoester-Nukleophils
der Formel L-1 (worin R11 und R3 oben
definiert sind) unter Verwendung eines silylsubstituierten Allylcarbonats
der Formel L-2.
Die anschließende
Desilylierung und Reduktion der Verbindung der Formel L-3 (worin
R11 und R3 oben
definiert sind) ergibt die gewünschten
Endprodukte, beispielsweise Verbindungen der Formel L-4 (worin R11 Phenyl ist und R3 Propyl oder
Cyclohexyl ist; und R8 Wasserstoff oder
Hydroxy ist), die die Verbindungen 4-Hydroxy-6-propyl-6-phenyl-3-(1-phenylpropyl)-2H-pyran-2-on,
4-Hydroxy-6-phenyl-6-propyl-3-[1-(2-hydroxyphenyl)-propyl]-2H-pyran-2-on
und 4-Hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-hydroxyphenyl)propyl]-2H-pyran-2-on
sind. Dieses Verfahren ist beson ders zur Synthese von 6,6-disubstituierten
5,6-Dihydro-2H-pyran-2-onen,
wie die in den Reaktionsschemata K und L, verwendbar.
-
REAKTIONSSCHEMA
M
-
Das
Dianion des im Handel erhältlichen
4-Hydroxy-6-methyl-2-pyrons
der Formel M-1 wird durch Deprotonierung mit zwei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran und Hexamethylphosphoramid erzeugt.
Die Alkylierung mit Benzylbromid ergibt die Verbindung der Formel
M-2. Sie wird dann mit zwei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran und Hexamethylphosphoramid
und anschließend
Ethyliodid behandelt, wobei die Verbindung der Formel M-3 erhalten
wird. Die Umsetzung zwischen der Verbindung der Formel M-3 und der
Verbindung der Formel O-5, die wie in Reaktionsschema O beschrieben
hergestellt wurde, in Benzol mit einem p-Toluolsulfonsäure-Katalysator
in Gegenwart von Molekularsieben ergibt die Verbindung der Formel
M-4, die 3-(α-Cyclopropyl-meta-(tert-butyloxycarbonylamino)benzyl)-6-(α-ethyl-phenethyl)-4-hydroxy-2H-pyran-2-on
ist.
-
Die
Hydrogenolyse der Verbindung der Formel M-4 in Methanol mit Wasserstoff
und Palladium-auf-Kohle ergibt das freie Amin der Formel M-5. Die
Kondensation der Verbindung der Formel M-5 mit tert-Butyloxycarbonyl-β-alanin in
Dichlormethan unter Verwendung von Diisopropylcarbodiimid ergibt
die Verbindung der Formel M-6, die N-(3-Cyclopropyl-[6-(1-ethyl-phenethyl)-4-hydroxy-2-oxo-5,6-dihydro-2H-pyran-3-yl]-methyl)-phenyl)-3-(tert-butyloxycarbonylamino)-propionamid
ist. Das Amin 5 wird mit Alkylsulfonylchlorid oder Arylsulfonylchlorid
in Gegenwart von Pyridin umgesetzt, wobei eine Verbindung der Formel
M-7, worin R1 Aryl, beispielsweise Phenyl, ist,
3-(α-Cyclopropyl-meta-(phenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran- 2-on, erhalten wird.
-
REAKTIONSSCHEMA
N
-
Die
Behandlung von im Handel erhältlichem
4-Hydroxy-6-methyl-2-pyron
der Formel N-1 mit drei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran und Hexamethylphosphoramid
und anschließend
Brommethylcyclopropan ergibt die Verbindung der Formel N-2. Die
Umsetzung zwischen der Verbindung der Formel N-2 und der Verbindung
der Formel O-5,
die wie in Reaktionsschema O beschrieben hergestellt wurde, in Benzol
mit p-Toluolsulfonsäure-Katalysator
in Gegenwart von Molekularsieben ergibt die Verbindung der Formel N-3,
die 3-(α-Cyclopropyl-meta-(tert-butyloxycarbonylamino)benzyl)-6-(α-cyclopropylmethyl-cyclopropylethyl)-4-hydroxy-2H-pyran-2-on
ist.
-
Die
Hydrogenolyse der Verbindung der Formel N-3 in Methanol mit Wasserstoff
und Palladium-auf-Kohle ergibt das freie Amin der Formel N-4. Die
Kondensation der Verbindung der Formel N-4 mit 3-(1-Indolyl)-propionsäure in Dichlormethan
und Dimethylformamid unter Verwendung von Diisopropylcarbodiimid
ergibt die Verbindung der Formel N-5, die N-(3-{Cyclopropyl-[6-(2-cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-2-oxo-5,6-dihydro-2H-pyran-3-yl]-methyl}-phenyl)-3-indol-l-yl-propionamid
ist.
-
REAKTIONSSCHEMA O
-
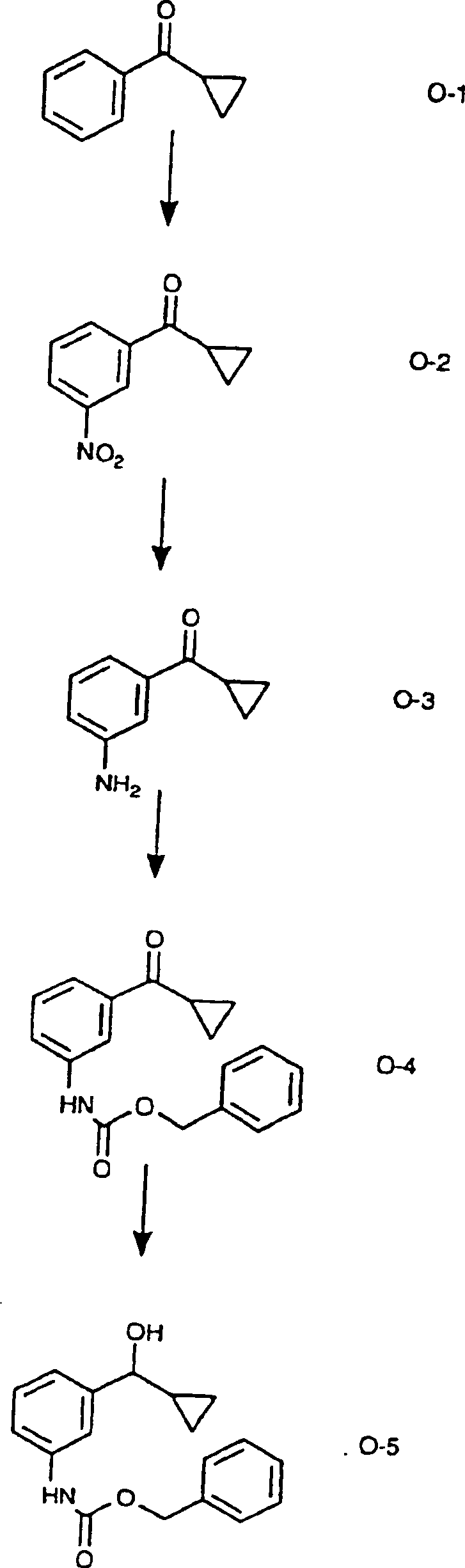
Die
Nitrierung von im Handel erhältlichem
Cyclopropylphenylketon der Formel O-1 mit rauchender Salpetersäure ergibt
die Verbindung der Formel O-2. Die Reduktion der Verbindung der
Formel O-2 in Methanol mit Wasserstoff unter Katalyse von Platin-auf-Kohle
ergibt das Amin der Formel O-3. Die Verbindung der Formel O-3 wird
mit Benzylchlorformiat und Diisopropylethylamin in Dichlormethan
behandelt, wobei die Verbindung der Formel O-4 erhalten wird. Die
Reduktion der Verbindung der Formel O-4 mit Natriumborhydrid in
Tetrahydrofuran und Ethanol ergibt die Verbindung der Formel O-5.
-
REAKTIONSSCHEMA
P
-
Die
Reaktion zwischen 5-Brom-4-hydroxy-6-methyl-pyran-2-on der Formel
P-1 (die Herstellung dieses Materials ist in Syn. Comm. 1984, 14,
521 beschrieben) und im Handel erhältlichem 1-Phenyl-1-propanol
in Benzol unter Katalyse von p-Toluolsulfonsäure ergibt
die Verbindung der Formel P-2. Die Behandlung der Verbindung der
Formel P-2 mit Lithiumdiisopropylamid und im Handel erhältlichem
(Brommethyl)cyclopropan ergibt die Verbindung der Formel P-3, die
5-Brom-6-(2-cyclopropyl-cyclopropylmethyl-ethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
ist.
-
REAKTIONSSCHEMA
Q
-
Die
Behandlung von 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-methyl-pyran-2-on
der Formel Q-1 von Beispiel 20 mit Lithiumdiisopropylamid und anschließend 2-(2-Methoxyethoxy)-ethyltosylat
ergibt die Verbindung der Formel Q-2. Die Behandlung der Verbindung
der Formel Q-2 mit Lithiumdiisopropylamid und anschließend Ethyliodid
ergibt die Verbindung der Formel Q-3, die 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-5-(2-(2-methoxy-ethoxy)-ethyl)-6-propyl-pyran-2-on ist.
-
REAKTIONSSCHEMA
R
-
Die
Reaktion von im Handel erhältlichem
1,3-Diphenylaceton der Formel R-1 mit dem Anion von tert-Butyl-P,P-dimethyl phosphonoacetat
ergibt die Verbindung der Formel R-2, die in Ethylacetat mit 50
psi Wasserstoff und Platin-auf-Kohle hydrogenolysiert wird, wobei
die Verbindung der Formel R-3 erhalten wird. Die Behandlung der
Verbindung der Formel R-3 mit Lithiumdiisopropylamid und anschließend Diketen
ergibt die Verbindung der Formel R-4, die mit Trifluoressigsäure und
anschließend
Essigsäureanhydrid
behandelt wird, wobei die Verbindung der Formel R-5 erhalten wird.
Die Behandlung der Verbindung der Formel R-5 mit Lithiumdiisopropylamid
und anschließend
(Brommethyl)cyclopropan ergibt die Verbindung der Formel R-6, die 3-(1-Benzyl-2-phenyl-ethyl)-6-(2-cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-pyran-2-on
ist.
-
REAKTIONSSCHEMA
S
-
Die
Verbindung der Formel S-1 wird durch das Verfahren von Y. S. Shabanov,
N. A. Donskaya und R. Y. Lovina, Zh. Obshch. Khim., 33: 3434 (1963)
(CA60:1624c) hergestellt. Die Verbindung der Formel S-3 wird aus
den Verbindungen S-1 und S-2 (M-2) durch das im folgenden Beispiel
1 beschriebene Verfahren hergestellt. Die Endverbindung der Formel
S-4, die 4-Hydroxy-3-(1-phenylcyclobutyl)-6-[1-(phenylmethyl)propyl]-2H-pyran-2-on
ist, wird durch ein zu Beispiel 6 analoges Verfahren hergestellt.
-
REAKTIONSSCHEMA
T
-
Die
Verbindung der Formel T-5, die 4-Hydroxy-3-(1-phenyl-2-propenyl)-1-oxaspiro[5.7]tridec-3-en-2-on
ist, wird aus Cyclooctanon (Verbindung T-1) durch in den folgenden
Herstellungsbeispielen 16A, 16B und 16C beschriebene Verfahren hergestellt.
Die Verbindung der Formel T-6, die 4-Hydroxy-3-(1-phenylpropyl)-1-oxaspiro[5.7]tridec-3-en-2-on
ist, wird aus der Verbindung T-5 durch ein im folgenden Herstel lungsbeispiel
16D beschriebenes Verfahren hergestellt.
-
REAKTIONSSCHEMA
U
-
Das
ungesättigte
Amid U-1 (Chemistry Letters (1981), 913–16) wird mit Ethylmagnesiumbromid
in Diethylether bei –40°C behandelt,
wobei U-2 erhalten wird. Die saure Hydrolyse von U-2 ergibt das
Zwischenprodukt U-3. In einer zur obigen ähnlichen Weise ergibt die Behandlung
von U-4 mit Phenylmagnesiumbromid in Diethylether U-5, das bei Behandlung
mit einer Säure
das Zwischenprodukt U-6 ergibt. Die Verbindungen der Formel U-3
und U-6, worin Phenyl mit beispielsweise Halogen, Trifluormethyl,
-NHBOC, -NHCBZ, NHSO2Ph oder N-(1,1,4,4-Tetramethyl-1,4-bisdisilethylen)
substituiert ist (beispielsweise siehe die Formel BBB-5 in Reaktionsschema
BBB) oder worin Phenyl durch optional substituierte Heterocyclen,
beispielsweise Furan und Thiophen, ersetzt ist, werden durch das
obige Verfahren hergestellt.
-
REAKTIONSSCHEMA
V
-
Das
ungesättigte
Amid V-1 (Hruby et al., J. Org. Chem. (1993) 58, 766) wird mit Phenylmagnesiumbromid
in Gegenwart eines Kupferkatalysators in Tetrahydrofuran behandelt,
wobei V-2 erhalten wird. Die Hydrolyse von V-2 ergibt V-3 (gleich
U-6). In ähnlicher
Weise wird V-4 in V-5 und schließlich V-6 (gleich U-3) umgewandelt.
Verbindungen der Formel V-3 und V-6, worin Phenyl mit beispielsweise
Halogen, Trifluormethyl, -NHBOC oder -NHCBZ substituiert ist oder
worin Phenyl durch optional substituierte Heterocyclen, beispielsweise
Furan und Thiophen, ersetzt ist, werden gemäß dem obigen Verfahren hergestellt.
Ebenfalls ausgehend von Verbindungen der Formel V-7 und V-8 werden
Verbindungen der Formel V-3 und V-6, worin die Ethylgruppe durch
ein Cyclopropyl ersetzt ist, durch das Verfahren die ses Reaktionsschemas
hergestellt.
-
REAKTIONSSCHEMA
W
-
[4S,5R]-(+)-4-Methyl-5-phenyl-2-oxazolidinon,
das im Handel erhältlich
ist, wird in THF gelöst
und auf –78°C gekühlt. n-Butyllithium
wird über
5 min zugegeben und das Rühren
wird 1 h fortgesetzt. Butyrylchlorid wird in einer einzigen Portion
zugesetzt, wobei nach wässriger
Aufarbeitung W-1 erhalten wird. W-1 wird mit Lithiumdiisopropylamid
(LDA) behandelt und mit W-2, das im Handel erhältlich ist, (oder mit anderen
Benzylhalogeniden, die mit beispielsweise Halogen, Alkoxy, -CN,
Nitro oder Trifluormethyl substituiert sind, um die substituierten
Verbindungen entsprechend dem folgenden zu erreichen) umgesetzt,
wobei W-3 als einziges Diastereomer erhalten wird. Die Behandlung
von W-3 mit Lithiumhydroxid und Wasserstoffperoxid in einem THF/Wasser-Gemisch ergibt [R]-W-4,
das dann mit Methyllithium in Ethylether umgesetzt wird, wobei das
Methylketon W-5 erhalten wird. Die Carboxylierung von W-5 ergibt
die β-Ketosäure W-6
(siehe Hogeveen, Menge, Tetrahedron Letters (1986) 2767), die mit
Essigsäureanhydrid
und Säure
in Gegenwart von Aceton behandelt wird, wobei das 1,3-Dioxin-4-on-Derivat
W-7 erhalten wird.
-
W-4
wird auch mit Oxalylchlorid behandelt, wobei W-8 erhalten wird.
W-8 wird mit dem von tert-Butylacetat abgeleiteten Lithiumenolat
(W-9; das Enolat wurde in THF mit Lithiumdiisopropylamid bei –78°C gebildet)
umgesetzt, wobei der β-Ketoester
W-10 erhalten wird. Die Behandlung von W-10 mit H2SO4/Essigsäureanhydrid/Aceton
ergibt dann W-7 (Kaneko, Sato, Sakaki, Abe, J. Hetercyclic Chem.
(1990) 27: 25).
-
REAKTIONSSCHEMA X
-
[4R,5S]-(–)-4-Methyl-5-phenyl-2-oxazolidinon,
das im Handel erhältlich
ist, wird in THF gelöst
und auf –78°C gekühlt. n-Butyllithium
wird über
5 min zugegeben und das Rühren
wird 1 h fortgesetzt. Butyrylchlorid wird in einer einzigen Portion
zugesetzt, wobei nach wässriger
Aufarbeitung X-1 erhalten wird. X-1 wird mit Lithiumdiisopropylamid
(LDA) behandelt und mit X-2, das im Handel erhältlich ist, (oder mit anderen
Benzylhalogeniden, die mit beispielsweise Halogen, Alkoxy, -CN,
Nitro oder Trifluormethyl substituiert sind, um die substituierten
Verbindungen entsprechend dem folgenden zu erreichen) umgesetzt,
wobei X-3 als einziges Diastereomer erhalten wird. Die Behandlung
von X-3 mit Lithiumhydroxid und Wasserstoffperoxid in einem THF/Wasser-Gemisch ergibt [S]-X-4,
das dann mit Methyllithium in Ethylether umgesetzt wird, wobei das
Methylketon X-5 erhalten wird. Die Carboxylierung von X-5 ergibt
die β-Ketosäure X-6
(siehe Hogeveen, Menge, Tetrahedron Letters (1986) 2767), die mit
Essigsäureanhydrid
und Säure
in Gegenwart von Aceton umgesetzt wird, wobei das 1,3-Dioxin-4-on-Derivat
X-7 erhalten wird.
-
X-4
wird auch mit Oxalylchlorid behandelt, wobei X-8 erhalten wird.
X-8 wird mit dem Lithiumenolat von tert-Butylacetat (X-9) wie im
obigen Beispiel umgesetzt, wobei X-10 erhalten wird. Die Behandlung
von X-10 mit H2SO4/Essigsäureanhydrid/Aceton
ergibt dann X-7 (Kaneko, Sato, Sakaki, Abe, J. Hetercyclic Chem. (1990)
27: 25).
-
REAKTIONSSCHEMA
Y
-
Die
Behandlung von Y-1, das im Handel erhältlich ist, mit Oxalylchlorid
in Methylenchlorid ergibt das Säurechlorid
Y-2. Die Behandlung
eines Gemischs von Y-2 und 2,2,6-Trimethyl-4H-1,3-dioxin-4-on (Y-3),
das im Handel erhältlich
ist, mit Triethylamin (TEA) in Toluol bei einer erhöhten Temperatur
ergibt das Pyron Y-4. Die Behandlung von Y-4 mit Na2CO3 in Methanol ergibt das Hydroxypyron Y-5
(3-α-Methylbenzyl-4-hydroxy-6-methyl-2H-pyran-2-on)
und den Ester Y-6.
-
REAKTIONSSCHEMA
Z
-
Die
Behandlung von Z-1 (das gleich U-3 ist) mit Oxalylchlorid in Methylenchlorid
ergibt das Säurechlorid
Z-2. Die Behandlung eines Gemischs von Z-2 und im Handel erhältlichem
2,2,6-Trimethyl-4H-1,3-dioxin-4-on (Z-3) (das gleich Y-3 ist) mit
Triethylamin (TEA) in Toluol bei einer erhöhten Temperatur ergibt das
Pyron Z-4. Die Behandlung von Z-4 mit Na2CO3 in Methanol ergibt das Hydroxypyron Z-5
(3[R]-α-Ethylbenzyl-4-hydroxy-6-methyl-2H-pyran-2-on)
und den Ester Z-6.
-
REAKTIONSSCHEMA
AA
-
Die
Behandlung von AA-1 (das gleich U-3 ist) mit Oxalylchlorid in Methylenchlorid
ergibt das Säurechlorid
AA-2. Die Behandlung eines Gemischs von (S)-3-Phenylvalerylchlorid
(AA-2) (das gleich Z-2 ist) und (R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
(AA-3) (das gleich W-7 ist) mit Triethylamin (TEA) in Toluol bei
erhöhten
Temperaturen ergibt das Pyron AA-4. Eine basische Hydrolyse von
AA-4 in Methanol ergibt das Endprodukt Hydroxypyron AA-5 (3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on) und
den Ester AA-6 (der gleich Z-6 ist).
-
REAKTIONSSCHEMA
BB
-
Die
Behandlung von BB-1 (das gleich U-3 ist) mit Oxalylchlorid in Methylenchlorid
ergibt das Säurechlorid
BB-2. Die Behandlung eines Gemischs von (S)-3-Phenylvalerylchlorid
(BB-2) (das gleich Z-2 ist) und (S)-2,2-Dimethyl-6-(α- ethylphenethyl)-4H-1,3-dioxin-4-on
(BB-3) (das gleich X-7 ist) mit Triethylamin (TEA) in Toluol bei
erhöhten
Temperaturen ergibt das Pyron BB-4. Die basische Hydrolyse von BB-4 in Methanol ergibt das
Endprodukt Hydroxypyron BB-5 (3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on) und den
Ester BB-6 (der gleich Z-6 ist).
-
REAKTIONSSCHEMA
CC
-
Die
Behandlung von CC-1 (das gleich U-6 ist) mit Oxalylchlorid in Methylenchlorid
ergibt das Säurechlorid
CC-2. Die Behandlung eines Gemischs von (R)-3-Phenylvalerylchlorid
(CC-2) und (R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on (CC-3)
(das gleich W-7 ist) mit einem Trialkylamin, beispielsweise Triethylamin
(TEA), in einem Kohlenwasserstofflösemittel, beispielsweise Toluol,
bei erhöhten
Temperaturen (beispielsweise 100°C)
ergibt das Pyron CC-4. Die basische Hydrolyse von CC-4 unter Verwendung
von beispielsweise Natriumcarbonat in einem Wasser/Alkohol (beispielsweise
Methanol)-Gemisch (etwa 1:9) und die anschließende Behandlung mit einer
Säure,
beispielsweise 1 N Salzsäure,
ergibt das Endprodukt Hydroxypyron CC-5(3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on) und den Ester
CC-6.
-
Ferner
ergibt die Entfernung von Triethylaminhydrochlorid durch Filtration
und die anschließende
Zugabe eines molaren Äquivalents
von Natriumhydroxid (Methanol) zu der Toluol-lösung
von CC-4 das Natriumsalz von CC-5 als Niederschlag. Die Gewinnung
dieses Niederschlags wird nach Standardverfahren durchgeführt.
-
REAKTIONSSCHEMA
DD
-
Die
Behandlung von DD-1 (das gleich U-6 ist) mit Oxalyl chlorid in Methylenchlorid
ergibt das Säurechlorid
DD-2. Die Behandlung eines Gemischs von (R)-3-Phenylvalerylchlorid
(DD-2) (das gleich CC-2 ist) und (S)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
(DD-3) (das gleich X-7 ist) mit Triethylamin (TEA) in Toluol bei
erhöhten
Temperaturen ergibt das Pyron DD-4. Die basische Hydrolyse von DD-4 in Methanol ergibt das
Endprodukt Hydroxypyron DD-5 (3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on) und den
Ester DD-6 (der gleich CC-6 ist).
-
Die
Synthese aller vier Diastereomere von 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
wird vorzugsweise durch Verfolgen der Verfahren der Reaktionsschemata
AA, BB, CC und DD durchgeführt.
-
REAKTIONSSCHEMA
EE
-
(R)-3-Phenylvaleriansäure (EE-1)
(die gleich U-3 ist) wird in den entsprechenden Methylester mit
Thionylchlorid in Methanol umgewandelt, wobei EE-2 (das gleich Z-6
ist) erhalten wird. EE-2 wird mit einer starken Base, wie Lithiumdiisopropylamid,
und anschließend
Trimethylsilylchlorid behandelt, wobei EE-3 erhalten wird. Ein Gemisch
aus EE-3 und EE-4 (W-7) wird in einem organischen Lösemittel,
wie Toluol, erhitzt und anschließend wird das Reaktionsgemisch
mit einer Säure
behandelt, wobei das Endprodukt EE-5 (das gleich AA-5 ist) (3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on)
erhalten wird.
-
REAKTIONSSCHEMA
FF
-
Ein
Gemisch aus FF-1 (das gleich EE-3 ist und von (S)-3-Phenylvaleriansäure (U-3)
abgeleitet ist) und FF-2 (das gleich X-7 in Reaktionsschema X ist)
wird in einem organischen Lösemittel,
wie Toluol, erhitzt und anschließend wird das Reaktionsgemisch
mit einer Säure
behandelt, wobei FF-3 (das gleich BB-5 ist) (3-([R]-α-Methylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on)
erhalten wird.
-
REAKTIONSSCHEMA
GG
-
(R)-3-Phenylvaleriansäure (GG-1)
(das gleich U-6 ist) wird in den entsprechenden Methylester mit
Thionylchlorid in Methanol umgewandelt, wobei GG-2 (das gleich CC-6
ist) erhalten wird. GG-2 wird mit einer starken Base, wie Lithiumdiisopropylamid,
und anschließend
Trimethylsilylchlorid behandelt, wobei GG-3 erhalten wird. Ein Gemisch
aus GG-3 und GG-4 (W-7) wird in einem organischen Lösemittel,
wie Toluol, erhitzt und anschließend wird das Reaktionsgemisch
mit einer Säure
behandelt, wobei das Endprodukt (GG-5) (das gleich CC-5 ist) (3-([S]-α-Methylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on)
erhalten wird.
-
REAKTIONSSCHEMA
HH
-
Ein
Gemisch aus HH-1 (das gleich GG-3 in Reaktionsschema GG ist) und
HH-2 (X-7) wird in einem organischen Lösemittel, wie Toluol, erhitzt
und anschließend
wird das Reaktionsgemisch mit Säure
behandelt, wobei das Endprodukt HH-3 (das gleich DD-5 ist) (3-([S]-α-Methylbenzyl)-4-hydroxy-6-([S-α-ethylphenethyl)-2H-pyran-4-on)
erhalten wird.
-
REAKTIONSSCHEMA
II
-
Furfurylalkohol
(II-1), der im Handel erhältlich
ist, wird mit Chlormethylmethylether in Gegenwart von Diisopropylethylamin
in einem organischen Lösemittel
behandelt, wobei der geschützte
Alkohol II-2 erhalten wird. II-2 wird mit n-Butyllithium bei niedriger Temperatur
in einem Etherlösemittel
mehrere Stunden behandelt und anschließend mit Cyclopropylcarboxaldehyd,
der im Handel erhältlich
ist, versetzt, wobei der Alkohol II-3 erhalten wird. Ein Gemisch
aus dem Alkohol II-3 und dem Pyron II-4, das im Handel erhältlich ist,
wird mit einer katalytischen Menge Trifluoressigsäure in Methylenchlorid
behandelt, wobei II-5 erhalten wird. II-5 wird mit 2,2 Äquivalenten
LDA und anschließend
Ethyliodid behandelt, wobei II-6 erhalten wird. Die Behandlung von
II-6 mit 2,2 Äquivalenten
LDA und anschließend
Benzylbromid ergibt das Endprodukt II-7, das mit einer milden Säure behandelt
wird, wobei das Endprodukt II-8 (3-(α-Cyclopropyl((5-hydroxymethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyron-4-on)
erhalten wird. Bei dem obigen Verfahren werden andere Alkylaldehyde
anstelle von Cyclopropylcarboxaldehyd verwendet, um Alkylverbindungen
entsprechend II-3 zu erhalten. Ferner werden andere Alkyl- oder Cycloalkylhalogenide
anstelle von Ethyliodid verwendet, um Verbindungen entsprechend
II-6 zu erhalten und andere Benzylhalogenide, die mit beispielsweise
Halogen, Trifluormethyl, -CN, Nitro der Alkoxy substituiert sind,
anstelle von Benzylbromid verwendet, um substituierte Verbindungen entsprechend
II-7 zu erhalten.
-
REAKTIONSSCHEMA
JJ
-
Die
Behandlung von II-8 mit Methansulfonylchlorid in Gegenwart einer
Base, wie Pyridin, ergibt das Sulfonat JJ-1. Die Behandlung von
JJ-1 mit Natriummethoxy in Methanol ergibt das Endprodukt JJ-2.
Die Behandlung von JJ-1 mit Natriumazid in einem organischen Lösemittel
ergibt das Endprodukt, das Azid JJ-3, das mit Wasserstoff (Pd/Kohle)
reduziert wird, wobei das Endprodukt JJ-4 erhalten wird. JJ-4 wird
mit Acetylchlorid in Gegenwart von Triethylamin in einem Chlorkohlenstoff-
oder Etherlösemittel
oder in Pyridin ohne eine zusätzliche
Base acyliert, wobei das Endprodukt JJ-5 erhalten wird, oder mit
einem Alkyl- oder Arylsulfonylhalo genid umgesetzt, wobei das Endprodukt,
das Sulfonat JJ-6, erhalten wird. JJ-3 wird mit Methylpropionat
in einem organischen Lösemittel
bei erhöhten
Temperaturen umgesetzt, wobei das Endprodukt JJ-7 erhalten wird. Andere
Alkylalkohole werden anstelle von Methanol, das bei der Herstellung
von JJ-2 aus JJ-1 verwendet wird, verwendet, wobei die entsprechenden
Alkylanaloga von JJ-2 erhalten werden. Andere Säurechloride werden anstelle
von Acetylchlorid, das bei der Herstellung von JJ-5 aus JJ-4 verwendet
wird, verwendet, wobei die entsprechenden Analoga von JJ-5 erhalten
werden. Andere Acetylene, die mit Alkyl- und Arylgruppen substituiert
sind, werden anstelle von Methylpropionat, das bei der Herstellung
von JJ-7 aus JJ-3 verwendet wird, verwendet, um die entsprechenden
Analoga von JJ-7 zu erhalten. Aryl- oder heterocyclussubstituierte
Sulfonylhalogenide werden bei der Herstellung der entsprechenden
Analoga von JJ-6 verwendet.
-
REAKTIONSSCHEMA
KK
-
KK-1
(JJ-4) wird mit 1,1-Bis(methylthio)-2-nitroethylen (KK-2), das im
Handel erhältlich
ist, in einem organischen Lösemittel
umgesetzt, wobei das Endprodukt KK-3 erhalten wird. Die Umsetzung
von KK-3 mit einem Äquivalent
eines primären
oder sekundären
Amins ergibt das Endprodukt KK-4. Auf ähnliche Weise wird KK-1 (JJ-4)
mit Dimethyl-N-cyanothioiminocarbonat (KK-5), das im Handel erhältlich ist,
umgesetzt, wobei das Endprodukt KK-6 erhalten wird, das mit einem
primären
oder sekundären
Amin umgesetzt wird, wobei das Endprodukt KK-7 erhalten wird. Andere
Amine, wie primäre
und sekundäre
Amine, werden anstelle von Isopropylamin zur Herstellung der entsprechenden
Analoga von KK-4 und KK-7
verwendet.
-
REAKTIONSSCHEMA LL
-
LL-1,
das im Handel erhältlich
ist, wird zu einer gesättigten
Lösung
von NaHCO3 gegeben. Zu dieser Suspension
wird Benzylchlorformiat gegeben, wobei LL-2 erhalten wird. LL-2
wird in Methylenchlorid gelöst und
auf 0°C
gekühlt.
Cyclopropylcarbonsäurechlorid,
das aus im Handel erhältlicher
Cyclopropancarbonsäure unter
Verwendung von Oxalylchlorid hergestellt wird, und anschließend ein Überschuss
von AlCl3 werden zugegeben. Das Reaktionsgemisch
wird auf Eiswasser gegossen, wobei LL-3 erhalten wird. Die Reduktion
von LL-3 mit Natriumborhydrid in einem Gemisch aus THF und Ethanol
ergibt LL-4. Die Behandlung einer Lösung von LL-4 und Pyron LL-5
(das gleich M-3 ist) in Methylenchlorid mit Trifluoressigsäure ergibt
das Endprodukt LL-6. Die Hydrierung von LL-6 ergibt das Endprodukt
LL-7 (3-(α-Cyclopropyl((5-aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on)
(das gleich JJ-4 ist). Andere Alkylsäurechloride werden anstelle von
Cyclopropylcarbonsäurechlorid,
das bei der Herstellung von LL-3 aus LL-2 verwendet wird, verwendet,
um die folgenden entsprechenden Analoga zu erhalten.
-
REAKTIONSSCHEMA
MM
-
MM-1,
das im Handel erhältlich
ist, wird zu einer gesättigten
Lösung
von NaHCO3 gegeben. Zu dieser Suspension
wird Benzylchlorformiat gegeben, wobei MM-2 erhalten wird. MM-2
wird in Methylenchlorid gelöst und
auf 0°C
gekühlt.
Cyclopropylcarbonsäurechlorid,
das aus im Handel erhältlicher
Cyclopropancarbonsäure unter
Verwendung von Oxalylchlorid hergestellt wird, und anschließend ein Überschuss
von AlCl3 werden zugegeben. Das Reaktionsgemisch
wird auf Eiswasser gegossen, wobei MM-3 erhalten wird. Die Reduktion
von MM-3 mit Natriumborhydrid in einem Gemisch aus THF und Ethanol
ergibt MM-4. Die Behandlung einer Lösung von MM-4 und Pyron MM-5
(das gleich M-3 ist) in Methylenchlorid mit Trifluoressigsäure ergibt
das Endprodukt MM-6. Die Hydrierung von MM-6 ergibt das Endprodukt
MM-7 (3-(α-Cyclopropyl((5-aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on).
Die Behandlung von MM-7 mit Phenylsulfonylchlorid ergibt das Endprodukt
MM-8. Andere Alkylsäurechloride
und substituierte Heterocyclen werden anstelle von Cyclopropylcarbonsäure verwendet,
um Analoga entsprechend M-3 zu erhalten. Andere substituierte Arylsulfonylhalogenide
werden anstelle von Phenylsulfonylchlorid verwendet, um Analoga
entsprechend MM-8 zu erhalten.
-
REAKTIONSSCHEMA
NN
-
Ein
Gemisch von NN-1, das im Handel erhältlich ist, und Cyclopropylcarbonsäurechlorid,
das aus im Handel erhältlicher
Cyclopropancarbonsäure
hergestellt wird, wird mit einer Lewis-Säure, wie AlCl3,
in Methylenchlorid bei 0°C
behandelt, wobei NN-2 erhalten wird. Die Behandlung von NN-2 mit
Natriumborhydrid in einem Alkohollösemittel ergibt NN-3. Die Behandlung
von einem Gemisch aus NN-3 und NN-4 (das gleich M-3 ist) in Methylenchlorid
oder Toluol mit einer wasserfreien Säure, wie Trifluoressigsäure oder
p-Toluolsulfonsäure,
ergibt das Endprodukt NN-5. Die Behandlung von NN-5 mit Azasulfen
(NN-6), S. K. Gupta, Synthesis, S. 39 (1977), ergibt dann das Endprodukt
NN-7. Auf ähnliche
Weise ergeben die Behandlung von NN-5 mit Chlorsulfonsäure und
die anschließende
Zugabe von Anilin ebenfalls NN-7 in einem zweistufigen Protokoll.
Anilin, das mit einem oder mehreren Resten von Halogen, Alkoxy,
Trifluormethyl, Alkyl, Nitro und -CN substituiert ist, wird ebenfalls
bei diesem Verfahren verwendet, wobei substituierte Analoga von
NN-7 erhalten werden.
-
REAKTIONSSCHEMA OO
-
Thiophen-2-yl-methanol
(OO-1), das im Handel erhältlich
ist, wird mit Chlormethylmethylether in Gegenwart von Diisopropylethylamin
in einem organischen Lösemittel
behandelt, wobei der geschützte
Alkohol OO-2 erhalten wird. OO-2 wird mit n-Butyllithium bei niedriger
Temperatur in einem Etherlösemittel
mehrere Stunden behandelt und anschließend mit Cyclopropylcarboxaldehyd
versetzt, wobei die Alkohole OO-3 und OO3a erhalten werden. Ein
Gemisch aus dem Alkohol OO-3 und dem Pyron OO-4 (das gleich D-1
ist) wird mit einer katalytischen Menge Trifluoressigsäure in Methylenchlorid
behandelt, wobei OO-5 erhalten wird. OO-5 wird mit 2,2 Äquivalenten
LDA und anschließend
Ethyliodid behandelt, wobei OO-6 erhalten wird. Die Behandlung von
OO-6 mit 2,2 Äquivalenten
LDA und anschließend
Benzylbromid ergibt das Endprodukt OO-7, das mit einer milden Säure behandelt
wird, wobei das Endprodukt OO-8 (3-(α-Cyclopropyl((5-hydroxymethyl)thiophen-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyron-4-on) erhalten
wird. Bei dem obigen Verfahren werden andere Aldehyde anstelle von
Cyclopropylcarboxaldehyd verwendet, um Alkylverbindungen entsprechend OO-3
zu erhalten. Auch werden andere Alkyl- oder Cycloalkylhalogenide
anstelle von Ethyliodid verwendet, um Verbindungen entsprechend
OO-6 zu erhalten, und andere Benzylhalogenide, die mit beispielsweise
Halogen, Trifluormethyl, -CN, Nitro oder Alkoxy substituiert sind,
anstelle von Benzylbromid verwendet, um substituierte Verbindungen
entsprechend OO-7 zu erhalten.
-
REAKTIONSSCHEMA
PP
-
Die
Behandlung von OO-8 mit Methansulfonylchlorid in Gegenwart einer
Base, wie Triethylamin, ergibt das Sulfonat PP-1. Die Behandlung von PP-1 mit Natriummethoxid
in Methanol ergibt das Endprodukt PP-2. Die Behandlung von PP-1
mit Natriumazid in einem organischen Lösemittel ergibt das End produkt,
das Azid PP-3, das mit Wasserstoff (Pd/Kohle) reduziert wird, wobei
das Endprodukt PP-4 erhalten wird. PP-4 wird mit Acetylchlorid in
Gegenwart von Triethylamin in einem Chlorkohlenstoff- oder Etherlösemittel
oder in Pyridin ohne zusätzliche
Base acyliert, wobei das Endprodukt PP-5 erhalten wird, oder mit
einem Alkyl- oder Arylsulfonylhalogenid umgesetzt, wobei das Endprodukt,
das Sulfonat PP-6, (N-(5-(1-Cyclopropyl)-1-(4-hydroxy-6-(α-ethylphenethyl)-2H-pyron-4-on-3-yl))methyl)thiophen-2-yl-phenylsulfonamid)
erhalten wird. PP-3 wird mit Methylpropiolat in einem organischen
Lösemittel
bei erhöhten
Temperaturen umgesetzt, wobei das Endprodukt PP-7 erhalten wird.
Andere Alkylalkohole werden anstelle von Methanol, das bei der Herstellung
von PP-2 aus PP-1 verwendet wird, verwendet, wobei die entsprechenden
Alkylanaloga von PP-2 erhalten werden. Andere Säurechloride werden anstelle
von Acetylchlorid, das bei der Herstellung von PP-5 aus PP-4 verwendet
wird, verwendet, wobei die entsprechenden Analoga von PP-5 erhalten
werden. Andere Acetylene, die mit Alkyl- und Arylgruppen substituiert
sind, werden anstelle von Methylpropionat, das bei der Herstellung
von PP-7 aus PP-3 verwendet wird, verwendet, um die entsprechenden
Analoga von PP-7 zu erhalten. Aryl- oder heterocyclussubstituierte
Sulfonylhalogenide werden bei der Herstellung der entsprechenden
Analoga von PP-6 verwendet.
-
REAKTIONSSCHEMA
QQ
-
Ein
Gemisch aus QQ-1 (OO-3a von Reaktionsschema OO) und QQ-2 (das gleich D-1
ist) in Methylenchlorid wird mit einer katalytischen Menge Trifluoressigsäure behandelt,
wobei QQ-3 erhalten
wird. QQ-3 wird mit 3,3 Äquivalenten
Lithiumdiisopropylamid (LDA) in einem Etherlösemittel unter Raumtemperatur
behandelt und anschließend
mit Ethyliodid versetzt, wobei das Endprodukt QQ-4 erhalten wird.
Die Behandlung von QQ-4 mit 3,3 Äquivalenten
LDA in einem Etherlösemittel
und die anschließende
Zugabe von Benzylbromid ergeben das Endprodukt QQ-5 (das gleich
OO-8 ist).
-
REAKTIONSSCHEMA
RR
-
RR-1
(PP-4) wird mit 1,1-Bis(methylthio)-2-nitroethylen (RR-2), das im
Handel erhältlich
ist, in einem organischen Lösemittel
umgesetzt, wobei das Endprodukt RR-3 erhalten wird. Die Umsetzung
von RR-3 mit einem Äquivalent
eines primären
oder sekundären
Amins ergibt das Endprodukt RR-4. Auf ähnliche Weise wird RR-1 mit
Dimethyl-N-cyanothioiminocarbonat (RR-5), das im Handel erhältlich ist,
umgesetzt, wobei das Endprodukt RR-6 erhalten wird, das mit einem
primären
oder sekundären
Amin umgesetzt wird, wobei das Endprodukt RR-7 erhalten wird. Andere
Amine, wie primäre
und sekundäre
Amine, werden anstelle von Isopropylamin verwendet, um die entsprechenden
Analoga von RR-4 und RR-7 herzustellen.
-
REAKTIONSSCHEMA
SS
-
Ein
Gemisch von SS-1, das im Handel erhältlich ist, und Cyclopropylcarbonsäurechlorid,
das aus im Handel erhältlicher
Cyclopropancarbonsäure
hergestellt wird, wird mit einer Lewis-Säure, wie AlCl3,
in Methylenchlorid bei 0°C
behandelt, wobei SS-2 erhalten wird. Die Behandlung von SS-2 mit
Natriumborhydrid in einem Alkohollösemittel ergibt SS-3. Die Behandlung
eines Gemischs von SS-3 und SS-4 (das gleich M-3 ist) in Methylenchlorid
oder Toluol mit einer wasserfreien Säure, wie Trifluoressigsäure oder
p-Toluolsulfonsäure,
ergibt das Endprodukt SS-5. Die Behandlung von SS-5 mit Azasulfen
SS-6, S. K. Gupta, Synthesis, S. 39 (1977), ergibt dann das Endprodukt
SS-7. Auf eine ähnliche
Weise ergeben die Behandlung von SS-5 mit Chlorsulfonsäure und
die anschließende
Zugabe von Anilin ebenfalls SS-7 in einem zweistufigen Protokoll.
Anilin, das mit einem oder mehreren Resten von Halogen, Alkoxy,
Trifluormethyl, Alkyl, Nitro und -CN substituiert ist, wird ebenfalls
bei diesem Verfahren verwendet, wobei substituierte Analoga von
SS-7 erhalten werden.
-
REAKTIONSSCHEMA
TT
-
Das
Pyron TT-1 (das gleich Q-1 ist) wird mit zwei Äquivalenten Lithiumdiisopropylamid
in einem Etherlösemittel
behandelt. Ein Arylaldehyd wird bei niedriger Temperatur zugegeben
und das Reaktionsgemisch wird durch die Zugabe einer gesättigten
NH4Cl-Lösung
gequencht. Dies ergibt das Endprodukt TT-2. Zusätzlich wird TT-1 mit 2,2 Äquivalenten
Lithiumdiisopropylamid (LDA) in einem Etherlösemittel behandelt und anschließend mit
Ethyliodid versetzt, wobei TT-3
erhalten wird. Zu dieser Lösung
wird ein weiteres Äquivalent LDA
und anschließend
Benzaldehyd gegeben, wobei das Endprodukt TT-4 erhalten wird.
-
REAKTIONSSCHEMA
UU
-
Die
Carbonsäuren
UU-1 und UU-7 werden durch Methoden gemäß der Beschreibung in J. Amer. Chem.
Soc (1981) 103: 2127 und Tetrahedron Letters (1986) 27: 897 hergestellt.
Die β-Hydroxylgruppe in
sowohl UU-1 als auch UU-7 wird durch Umsetzung der Hydroxysäure mit
tert-Butyldimethylsilylchlorid in DMF in Gegenwart von Imidazol
(oder 2,6-Lutidin, Ethyldiisopropylamin) geschützt und anschließend wird
mit einer wässrigen
Base behandelt, wobei die freie Carbonsäure erhalten wird. Die Carbonsäure wird
mit Oxalylchlorid (oder einem anderen Reagens) behandelt, wobei
die Säurechloride
UU-2 und UU-8 erhalten werden. Falls erforderlich, wird eine weitere
von Silyl abgeleitete Schutzgruppe, wie die tert-Butyldiphenylsilylgruppe,
oder eine andere geeignete Alkoholschutzgruppe verwendet. Sowohl
UU-2 als auch UU-8 werden mit dem von tert-Butylacetat abgeleiteten
Lithiumenolat umgesetzt (LDA/THF/–78°C), wobei die β-Ketoester
UU-3 und UU-9 erhalten werden. Die Behandlung von UU-3 und UU-9
mit H2SO4/Essigsäureanhydrid/Aceton
ergibt UU-4 und UU-10
[Kaneko, Sato, Sakaki, Abe, J. Heterocyclic Chem. (1990) 27: 25],
von denen beide mit dem Säurechlorid
UU-5 in heißem
Toluol in Gegenwart von Triethylamin reagieren, wobei die Endprodukte
UU-6 und UU-11 erhalten werden. Die Oxidation von UU-6 und UU-11
mit CrO3 oder Swern-Bedingungen ergeben
die Endprodukte UU-12 und UU-14, von denen beide, wenn sie mit Natriumborhydrid
(oder anderen Hydridreagentien) behandelt werden, Diastereomerengemische
ergeben. Die Reduktion von UU-12 ergibt UU-6 und UU-13 als trennbare
Diastereomerengemische. Die Reduktion von UU-14 ergibt UU-11 und
UU-15 als trennbares Diastereomerengemisch. Die übrigen Diastereomerenprodukte
werden unter Verwendung dieser gleichen Strategie, jedoch unter
Verwendung des (S)-Säurechlorids
UU-16 anstelle von UU-5 hergestellt.
-
REAKTIONSSCHEMA
VV
-
Das
Reaktionsschema VV ist eine modifizierte Version des obigen Reaktionsschemas
L. Dieses Reaktionsschema beschreibt die palladiumkatalysierte Allylalkylierung
des cyclischen β-Ketoester-Nukleophils der
Formel VV-1 (worin beispielsweise R1 Phenyl,
Phenethyl oder Phenylmethyl ist; R2 Phenylmethyl
oder Propyl ist) unter Verwendung eines silylsubstituierten Allylcarbonats
der Formel VV-2. Die Desilylierung führt zur Verbindung der Formel
VV-4 (worin beispielsweise R1 Phenyl, Phenethyl
oder Phenylmethyl ist; R2 Phenylmethyl oder
Propyl ist) und die anschließende
Reduktion führt
zur Verbindung der Formel VV-5 (worin bei spielsweise R1 Phenyl,
Phenethyl oder Phenylmethyl ist; R2 Phenylmethyl
oder Propyl ist).
-
REAKTIONSSCHEMA
WW
-
Dieses
Reaktionsschema beschreibt ein generisches Verfahren zur Synthese
der C-3α-verzweigten 5,6-Dihydropyrone
durch Alkylierung mit 1,3-Diphenylallylalkohol. So ergibt die durch
Bortrifluoridetherat katalysierte Reaktion der Verbindung der Formel
WW-1 (worin beispielsweise R1 Phenyl, Phenethyl
oder Phenylmethyl ist; R2 Propyl, Phenylmethyl
oder 2-Methylpropyl ist) mit 1,3-Diphenylallylalkohol (WW-2) Verbindungen der
Formel WW-3 (worin beispielsweise R1 Phenyl,
Phenethyl oder Phenylmethyl ist; R2 Propyl,
Phenylmethyl oder 2-Methylpropyl ist). Die anschließende, durch
Pd/C katalysierte Hydrierung ergibt die Verbindung der Formel WW-4
(worin beispielsweise R1 Phenyl, Phenethyl
oder Phenylmethyl ist; R2 Propyl, Phenylmethyl
oder 2-Methylpropyl ist).
-
REAKTIONSSCHEMA
XX
-
Dieses
Reaktionsschema ist eine Variation von Reaktionsschema WW. Die einzige Änderung
besteht darin, dass trans-Stilbenoxid
1,3-Diphenylallylalkohol ersetzt. Dieses Reaktionsschema beschreibt
ein generisches Verfahren zur Synthese von C-3α-verzweigten 5,6-Dihydropyronen
durch Alkylierung mit trans-Stilbenoxid. So ergibt die durch Bortrifluoridetherat
katalysierte Reaktion der Verbindung der Formel XX-1 (worin beispielsweise
R1 Phenethyl ist; R2 Propyl
ist) mit trans-Stilbenoxid (XX-2) Verbindungen der Formel XX-3 (worin beispielsweise
R1 Phenethyl ist; R2 Propyl
ist). Die anschließende,
durch Pd/C katalysierte Hydrierung ergibt die Verbindung der Formel
XX-4 (worin beispielsweise R1 Phenethyl
ist; R2 Propyl ist).
-
REAKTIONSSCHEMA
YY
-
Racemische
3-Phenylpentansäure
(YY-4) wird durch Hydrierung von YY-2 unter Verwendung von Pd/C
und anschließende
basische Hydrolyse des Esters YY-3 hergestellt. Der Ester YY-2 wird
durch eine Orthoester-Claisen-Umlagerung am Cinnamylalkohol YY-1
unter Verwendung von 1,1,1-Triethoxyethan hergestellt. Die Säure YY-4
wird durch Umsetzung der Säure
YY-4 mit Diethylphosphorylchlorid
in Gegenwart von Triethylamin, wobei ein aktiviertes Acylzwischenprodukt
erhalten wird, das dann mit (S)-α-Methylbenzylamin behandelt
wird, wobei ein Gemisch von YY-5 und YY-6 erhalten wird, ohne weiteres
aufgetrennt. YY-5 wird diastereomerenrein als kristalliner Feststoff
erhalten (das andere Diastereomer YY-6 befindet sich in den Mutterlaugen).
Die Behandlung von YY-5 mit H3PO4 bei 150–60°C ergibt dann reine (R)-3-Phenyl-pentansäure YY-7 (die
gleich CC-1 ist). Die (S)-3-Phenyl-pentansäure wird gemäß den obigen
Verfahren erhalten, wenn (R)-α-Methylbenzylamin
verwendet wird, wobei die diastereomeren Amide der racemischen Säure YY-4
gebildet werden.
-
REAKTIONSSCHEMA
ZZ
-
Diethylmalonat
(ZZ-1) wird mit Ethyliodid alkyliert, wobei eine Verbindung der
Formel ZZ-2 erhalten wird, die des weiteren mit Benzylbromid alkyliert
wird, wobei eine Verbindung der Formel ZZ-3 erhalten wird (Verfahren
in Organic Synthesis, Coll. VI: 250). Die Hydrolyse von ZZ-3 ergibt
die racemische Säure
ZZ-4. Die optisch aktiven Säuren
ZZ-5 (das gleich W-4 ist) und ZZ-6 (das gleich X-4 ist) werden durch
fraktionierte Kristallisation der racemischen Säure ZZ-4 mit entweder dem R-
oder dem S-Isomer von α-Methylbenzylamin
erhalten.
-
REAKTIONSSCHEMA
AAA
-
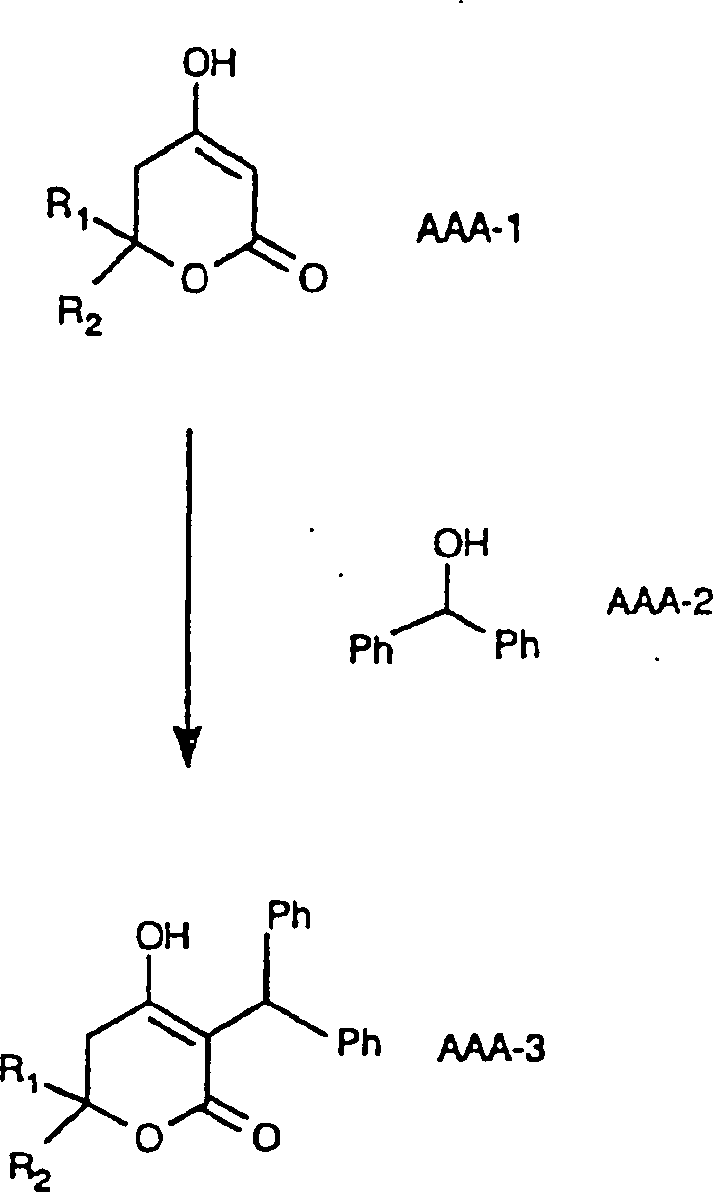
Dieses
Reaktionsschema erläutert
die durch eine Lewis-Säure
katalysierte Kopplungsreaktion zwischen 5,6-Dihydro-6,6-disubstituierten-2H-pyran-2-onen
(AAA-1, worin beispielsweise R1 2-Methylpropyl
ist, R2 Phenylethyl ist) und Benzhydrol
(AAA-2), wobei 3-Diphenylmethylderivate (AAA-3, worin beispielsweise
R1 Phenylethyl ist, R2 2-Methylpropyl
ist) erhalten werden.
-
REAKTIONSSCHEMA
BBB
-
Essigsäure (BBB-1)
wird mit zwei Äquivalenten
Lithiumdiisopropylamid in Tetrahydrofuran behandelt. Zu dieser Lösung wird
Cyclopropancarboxaldehyd (im Handel erhältlich) gegeben. Nach wässriger
Aufarbeitung wird racemisches BBB-2 isoliert. (R)-BBB-2b und (S)-BBB-2a
werden durch fraktionierte Kristallisation der racemischen Säure mit
entweder dem (R)- oder (S)-Isomer von α-Methylbenzylamin, Ephedrin,
Brucin, Strychnin, Chinin, Cinchonidin, Chinidin oder Cinchonin
erhalten. Alternativ ergibt eine Aldolkondensation unter Verwendung
der Strategie von Evan (J. Amer. Chem. Soc. (1981) 103, 2127) ebenfalls
die reinen Enantiomere BBB-2a und BBB-2b. BBB-2a wird mit Triethylorthoacetat
behandelt, wobei BBB-3 erhalten wird (Helv. Chim. Acta (1987) 70,
1320). Bei Thermolyse von BBB-3 wird BBB-4 erhalten (Helv. Chim.
Acta (1987) 70, 1320). Die Behandlung von BBB-4 mit BBB-5 in Gegenwart
von Kupfer(I)-iodid (Tetrahedron Letters 1253 (1984)) ergibt BBB-6.
Die Behandlung von BBB-6 mit Oxalylchlorid in Methylenchlorid während mehrerer
Stunden ergibt BBB-7. Zu einer heißen Toluollösung von BBB-7 wird eine Toluollösung von
Triethylamin und BBB-8 gegeben. Das Reaktionsgemisch wird mehrere
Stunden erhitzt und das Lösemittel
wird durch Abdampfen entfernt, wenn eine Dünnschichtchromatographie (Silicagel,
Ethylacetat) den vollständigen
Verbrauch von BBB-8 anzeigt. Das rohe Reaktionsgemisch wird mit
einem 10/1-Gemisch von Methanol/Wasser verdünnt und anschließend mit
Natriumcarbonat versetzt. Dies ergibt dann BBB-9. Die Behandlung
von BBB-9 mit einer katalytischen Menge p-Toluolsulfonsäure und
mehreren Äquivalenten
Methanol in Ether ergibt BBB-10. Die Behandlung einer Methylenchloridlösung von
BBB-10 mit p-Cyanobenzolsulfonylchlorid
in Gegenwart von Triethylamin ergibt BBB-11.
-
Alternativ
ergibt die Behandlung von BBB-3 mit BBB-5 in Gegenwart von Kupfer(I)-iodid
(Tetrahedron Letters 1253 (1984)) BBB-12, das das Enantiomer von
BBB-6 ist, und wenn die analogen Stufen wie bei BBB-6 durchgeführt werden,
wird BBB-13 erhalten.
-
Ferner
werden BBB-4 und BBB-3 durch BBB-14 und BBB-15 ersetzt, um die entsprechenden
Ethylstereoisomere herzustellen.
-
REAKTIONSSCHEMA
CCC
-
Das
Keton CCC-1 wird mit (Carbethoxymethylen)triphenylphosphoran behandelt,
wobei der ungesättigte
Ester CCC-2 erhalten wird. Die Reduktion (Red-Al/CuBr, DIBAH/MeCu;
NaBH4/Harz; NaBH4/Cu2Cl2; Ref. Reduction
by the Alumino and Borohydrides in Organic Synthesis, J. Seyden-Penne, VCH Publishers,
Inc. Lavoisier – Tec & Doc, 1991, S.
156) von CCC-2 und die anschließende
Esterhydrolyse ergeben CCC-3. (R)-CCC-4a und (S)-CCC-4b werden durch
fraktionierte Kristallisation der racemischen Säure CCC-3 mit entweder dem
(R)- oder (S)-Isomer von α-Methylbenzylamin,
Ephedrin, Brucin, Strychnin, Chinin, Cinchonidin, Chinidin oder
Cinchonin erhalten. Alternativ werden CCC-4a und CCC-4b durch asymmetrische
Reduktion (Angew. Chem. Int. Ed. Engl. (1989), 28, 60) und anschließende basische
Hydrolyse erhalten. Gemäß dem in Reaktionsschema
BBB beschriebenen Protokoll wird CCC-6 hergestellt.
-
REAKTIONSSCHEMA
DDD
-
2-Thienylamin
DDD-1 (im Handel erhältlich)
wird mit 2 Äquivalenten
n-Butyllithium in Ether bei –78°C behandelt.
Nach 30-minütigem
Rühren
bei –78°C wird die
Temperatur 30 min auf 0°C
erhöht
und anschließend wird
Schwefel (feines Pulver) zugesetzt. Nach wässriger Aufarbeitung wird DDD-2
isoliert (J. Amer. Chem. Soc. (1955) 77, 5357, 5446; Org. Syn. Band
VI, 979 (1988)). DDD-2 wird mit p-Fluorphenylsulfonylchlorid in Methylenchlorid
in Gegenwart von Triethylamin behandelt, wobei DDD-3 erhalten wird.
DDD-3 ist auch durch zunächst
Umsetzung von DDD-1 mit p-Fluorbenzolsulfonylchlorid und anschließende Behandlung
dieses Zwischenprodukts mit 2 Äquivalenten
n-Butyllithium in Ether und anschließende Zugabe von Schwefel erhältlich. Die
Behandlung eines Gemischs von DDD-3 und DDD-4 in Ether mit Triethylamin
ergibt DDD-5 (US-Patent 4 968 815). Nach dem gleichen Verfahren,
wie es in Reaktionsschema BBB angegeben ist, wird DDD-5 in ein Säurechlorid
umgewandelt und mit (R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
umgesetzt, wobei DDD-6 erhalten wird.
-
Wie
dies einem Fachmann üblicher
Erfahrung klar ist, können
die Verbindungen der vorliegenden Erfindung in Abhängigkeit
von der Konfiguration um die asymmetrischen Kohlenstoffatome in
mehreren diastereomeren Formen auftreten. Alle derartigen diastereomeren
Formen sind vom Umfang der vorliegenden Erfindung umfasst. Auch
können
die Verbindungen der vorliegenden Erfindung in mehreren tautomeren
Formen existieren, die die spezielle Enolform, die im folgenden
Formeldiagramm durch Formel I angegeben ist, und die Keto form der
Formel II und Gemische derselben umfassen. (Für die Formeln I und II gibt
die gestrichelte Linie an, dass eine Doppelbindung vorhanden oder
nicht vorhanden sein kann.) Alle derartigen tautomeren Formen sind
vom Umfang der vorliegenden Erfindung umfasst. Für Verbindungen der vorliegenden
Erfindung, die 4-Hydroxy-pyran-2-one der Formel IV in dem folgenden
Formeldiagramm sind, überwiegt
die Enolform. Für Verbindungen
der vorliegenden Erfindung, die 5,6-Dihydro-4-hydroxy-pyran-2-one
der Formel III in dem folgenden Formelschema sind, wird üblicherweise
ein Gemisch aus den Enol- und Ketoformen erwartet.
-
Die
Verbindungen der vorliegenden Erfindung können in entweder der freien
Form oder der geschützten
Form an einem oder mehreren der verbliebenen (nicht zuvor geschützten) Carboxyl-,
Amino-, Hydroxy- oder anderen reaktiven Gruppen vorliegen. Die Schutzgruppen
können
beliebige der einschlägig
bekannten sein. Beispiele für
Stickstoff- und Sauerstoffschutzgruppen sind bei T. W. Greene, Protecting
Groups in Organic Synthesis, Wiley, New York (1981); J. F. W. McOmie,
Hrsg., Protective Groups in Organic Chemistry, Plenum Press (1973);
und J. Fuhrhop und G. Benzlin, Organic Synthesis, Verlag Chemie
(1983) angegeben. Zu den Stickstoffschutzgruppen gehören tert-Butoxycarbonyl
(BOC), Benzyloxycarbonyl, Acetyl, Allyl, Phthalyl, Benzyl, Benzoyl,
Trityl und dgl. Zu den Ketonschutzgruppen gehört 1,3-Dioxalan.
-
Die
vorliegende Erfindung stellt Verbindungen der Formel I oder pharmakologisch
akzeptable Salze und/oder Hydrate derselben bereit. Pharmakologisch
akzeptable Salze bezeichnen die Salze, bei denen einem herstellenden
pharmazeutischen Chemiker ohne weiteres klar ist, dass sie hinsichtlich
Eigenschaften wie Formulierung, Stabilität, Patientenakzeptanz und biologischer
Verfügbarkeit
der Stammverbindung äquivalent sind.
Beispiele für
Salze der Verbindungen der vorliegenden Erfindung umfassen saure
Salze, wie Natrium- und
Kaliumsalze der Verbindungen der Formel I, und basische Salze, wie
das Hydrochloridsalz der Verbindungen der Formel I, worin die R-Substituenten
eine basische Einheit enthalten.
-
Dem
Fachmann ist die Formulierung der Verbindungen dieser Erfindung
unter Verwendung pharmazeutisch akzeptabler Träger zu passenden pharmazeutischen
Dosierungsformen bekannt. Beispiele für die Dosierungsformen umfassen
orale Formulierungen, wie Tabletten oder Kapseln, oder parenterale
Formulierungen, wie sterile Lösungen.
-
Wenn
die Verbindungen dieser Erfindung oral verabreicht werden, beträgt eine
wirksame Menge etwa 0,1 mg bis 100 mg pro kg Körpergewicht pro Tag. Entweder
feste oder flüssige
Dosierungsformen können
zur oralen Verabreichung hergestellt werden. Feste Zusammensetzungen
werden durch Mischen der Verbindungen dieser Erfindung mit üblichen
Bestandteilen, wie Talkum, Magnesiumstearat, Dicalciumphosphat,
Magnesiumaluminiumsilicat, Calciumsulfat, Stärke, Lactose, Akaziengummi,
Methylcellulose oder funktional ähnlichen
pharmazeutischen Verdünnungsmitteln
und Trägern
hergestellt. Kapseln werden durch Mischen der Verbindungen dieser
Erfindung mit einem inerten pharmazeutischen Verdünnungsmittel
oder Träger
und Platzieren des Gemischs in eine harte Gelatinekapsel geeigneter
Größe hergestellt.
Weiche Gelatinekapseln werden durch Maschinenverkapselung einer
Aufschlämmung
der Verbindungen dieser Erfindung mit einem akzeptablen inerten Öl, wie einem
pflanzlichen Öl
oder weißem
flüssigem
Petrolatum, hergestellt. Sirupe werden durch Lösen der Verbindungen dieser
Erfindung in einem wässrigen
Vehikel und die Zugabe von Zucker, aromatischen Aromatisierungsmitteln
und Konservierungsmitteln hergestellt. Eli xiere werden unter Verwendung
eines wässrig-alkoholischen
Vehikels, wie Ethanol, geeigneter Süßungsmittel, wie Zucker oder
Saccharin, und eines aromatischen Aromatisierungsmittels hergestellt.
Suspensionen werden mit einem wässrigen
Vehikel und einem Suspendiermittel, wie Akaziengummi, Tragant oder
Methylcellulose, hergestellt.
-
Wenn
die Verbindungen dieser Erfindung parenteral verabreicht werden,
können
sie durch Injektion oder durch intravenöse Infusion gegeben werden.
Eine wirksame Menge beträgt
etwa 0,1 mg bis 100 mg pro kg Körpergewicht
pro Tag. Parenterale Lösungen
werden durch Lösen
der Verbindungen dieser Erfindung in einem wässrigen Vehikel und Filtrationssterilisation
der Lösung
vor dem Platzieren in einer geeigneten verschließbaren Phiole oder Ampulle
hergestellt. Parenterale Suspensionen werden auf im wesentlichen
die gleiche Weise hergestellt, wobei jedoch ein steriles Suspensionsvehikel
verwendet wird und die Verbindungen dieser Erfindung mit Ethylenoxid
oder einem geeigneten Gas vor dem Suspendieren in dem Vehikel sterilisiert werden.
-
Der
genaue Verabreichungsweg, die Dosis oder die Häufigkeit der Verabreichung
werden vom Fachmann ohne weiteres bestimmt und hängen vom Alter, Gewicht, dem
allgemeinen physischen Zustand oder anderen klinischen Symptomen,
die für
den zu behandelnden Patienten spezifisch sind, ab.
-
Überraschenderweise
und unerwarteterweise wurde ermittelt, dass die Verbindungen der
vorliegenden Erfindung die Größe und das
Gewicht der Prostatadrüse
bei männlichen
Säugern
verringern. Dies ist insbesondere unerwartet im Hinblick auf die
Tatsache, dass diese Verbindungen strukturell ganz unähnlich jedem bekannten
Testosteron-5α-Reduktaseinhibitor
sind. Auch können
die Verbindungen dieser Erfindung eine Zahl anderer Verwendungszwecke
besitzen, was im folgenden vollständiger beschrieben wird.
-
Daher
stellt die vorliegende Erfindung die Verwendung von Verbindungen,
wie 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on,
zur Prävention
und Behandlung von androgenabhängigen Erkrankungen
bereit, was die Prävention
und Behandlung von Prostataläsionen
bei Menschen und Tieren, wie benigne Prostatahypertrophie und -hyperplasie
(nicht-neoplastische Vergrößerungen
der Prostata) durch beispielsweise Halten und Verringern der Größe der Prostatadrüse und von
Prostatakrebs umfasst, bei männlichen
Säugern
bereit. Auch stellt die vorliegende Erfindung die Verwendung dieser
Verbindungen zur Prävention
und Behandlung von androgenabhängigen
Hauterkrankungen, wie Allopezie, Hirsutismus, insbesondere weiblichem
Hirsutismus, Akne vulgaris und Seborrhoe, bei Säugern bereit.
-
"Prävention" bedeutet das Vermeiden
des Auftretens einer Erkrankung.
-
"Behandlung" bedeutet die Verbesserung
oder Vermeidung der Wirkungen einer Erkrankung.
-
"Halten" bedeutet das Halten
im bestehenden Zustand.
-
"Säuger" bedeutet alle warmblütigen Wirbeltiere
der Klasse Mammalia, die Menschen und alle anderen Tiere, die ihre
Jungen mit aus den Brustdrüsen
sezernierter Milch ernähren
und die Haut üblicherweise mehr
oder weniger mit Haar bedeckt haben, umfassen. Besonders umfasst
werden Menschen, Hunde und Ratten.
-
"Hypertrophie" bedeutet die Vergrößerung oder übermäßiges Wachstum
eines Organs oder Teils aufgrund einer Zunahme der Größe der dieses
aufbauenden Zellen.
-
"Hyperplasie" bedeutet die anomale
Vervielfachung oder Zunahme der Zahl normaler Zellen bei normaler
Anordnung in einem Gewebe.
-
Daher
befasst sich die vorliegende Erfindung auch mit der Bereitstellung
eines Verfahrens zur Prävention
oder Behandlung der androgenabhhängigen
Erkrankungen Allopezie, Hirsutismus, Akne vulgaris und Seborrhoe
durch topische Verabreichung und eines Verfahrens zur Prävention
oder Behandlung aller obigen Zustände sowie von benigner Prostatahypertropie
und Prostatakrebs durch topische oder parenterale Verabreichung
der Verbindungen der vorliegenden Erfindung. Daher befasst sich
die vorliegende Erfindung mit der Bereitstellung geeigneter topischer
und parenteraler pharmazeutischer Formulierungen zur Verwendung
bei den neuen Verfahren zur Behandlung gemäß der vorliegenden Erfindung.
-
Die
Vielzahl therapeutischer Dosierungsformen für unterschiedliche Verabreichungsweisen
und deren Zubereitung werden hierdurch unter Bezugnahme auf die
folgenden: US-Patent 4 377 584, Spalte 10, Zeile 52 bis Spalte 11,
Zeile 31; US-Patent
4 760 071, Spalte 6, Zeile 62 bis Spalte 7, Zeile 42 und US-Patent
5 017 568, Spalte 28, Zeile 3–39
aufgenommen.
-
Die
Menge der Verbindung der Formel I, die zur Behandlung der oben angegeben
Zustände
wirksam ist, liegt im Bereich von 1 bis 1000 mg/kg/Tag, wobei 50
bis 400 mg/kg/Tag zweckmäßig und
100 bis 400 mg/kg/Tag bevorzugt sind. Die exakte therapeutische
Dosierungsform, die Art und Weise und die Häufigkeit der Verabreichung
und die Dosierung werden vom Fachmann ohne weiteres bestimmt und
sind von dem Alter, Gewicht, dem allgemeinen physischen Zustand
oder anderen klinischen Symptomen, die für den zu behandelnden Patien ten,
Menschen oder anderen Säuger,
spezifisch sind, abhängig.
-
Die
folgenden fünf
(5) Verbindungen der vorliegenden Erfindung wurden in einem In-vitro-Testosteron-5α-Reduktase-Inhibitor-Test
getestet: 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on; 6-(1-Benzyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on;
3-(α-Ethylbenzyl)-6-(α-ethylbenzyl)-4-hydroxy-2H-pyran-2-on;
3-(α-Ethylbenzyl)-6-phenethyl-4-hydroxy-2H-pyran-2-on;
4-Hydroxy-3-(1-phenylpropyl)-6-[1-[(tetrahydro-2H-pyran-3-yl)methyl]propyl]-2H-pyran-2-on.
Dieser Test ist sehr ähnlich
den in den folgenden Literaturstellen beschriebenen, mit Ausnahme
der Verwendung von Hunde- und Rattenprostatas anstelle von humanen
Prostatas: Proc. Natl. Acad. Sci. USA, Band 90: 5277–5281 (1993);
J. Steroid. Biochem. Molec. Biol. Band 44, Nr. 2, S. 121–131 (1993).
Alle fünf
(5) Verbindungen besaßen
bei diesem Test bei einer Dosis von mindestens 0,1 mM Aktivität.
-
Daher
und ohne auf einen speziellen Wirkmechanismus beschränkt zu sein,
wurde gefolgert, dass diese Verbindungen und andere verwandte Verbindungen
der vorliegenden Erfindung zur Prävention oder Behandlung von
androgenabhängigen
Erkrankungen wie den im vorhergehenden beschriebenen verwendbar sind.
-
Der
Nutzen von repräsentativen
Verbindungen der vorliegenden Erfindung wurde in den im folgenden beschriebenen
biologischen Tests belegt:
3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on wurde des weiteren
in vivo in einer vierwöchigen
Studie der oralen Arzneimittelsicherheit und Toxizität an Beaglehunden
gemäß der Beschreibung
im folgenden Beispiel 208 getestet. Es wurde ermittelt, dass bei
der Durchführung
der Bewertung von Daten nach einer Dosisgabe aus dieser Untersuchung
eine dosisabhängige
Verringerung von Prostatagröße und -gewicht bei
männlichen
Hunden bestand. Mittlere Prostatagewichte (n = 3, 3 Hunde in jeder
der Gruppen 1–5)
sind in der folgenden Tabelle I angegeben. Die lichtmikroskopische
Prüfung
von Hoden, Nebennierendrüsen
und Hypophysen mit hoher Dosis und zur Kontrolle zeigten keine arzneimittelbedingten Änderungen.
-
In
einer Wiederholungsstudie (Gruppen 6 und 7 von jeweils 4 Hunden),
deren Ergebnisse ebenfalls in Tabelle I angegeben sind, hatten 2/4
Hunde mit hoher Dosis niedrigere absolute und relative Prostatagewichte als
die Kontrollen, jedoch war die Verringerung nur bei 1/4 Hunden deutlich.
-
Wie
bei diesem In-vivo-Test belegt wurde, zeigt die Fähigkeit
von 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on zur
Verringerung der Größe und des
Gewichts der Prostatadrüse,
insbesondere ohne signifikante Wirkungen auf Hoden und andere endokrine
Drüsen,
dass diese Verbindung und verwandte Verbindungen gemäß der vorliegenden
Erfindung zur Prävention
oder Behandlung von androgenabhängigen Erkrankungen,
wie die im vorhergehenden beschriebenen, insbesondere benigner Prostatahypertrophie
und -hyperplasie bei männlichen
Säugern
verwendbar sind.
-
BESCHREIBUNG
DER BEVORZUGTEN AUSFÜHRUNGSFORMEN
-
In
den folgenden Herstellungsbeispielen und Beispielen und durchgängig in
diesem Dokument bedeuten:
- °C
- Grad Celsius
- M
- molar (Konzentration)
- N
- normal (Konzentration)
- ml
- Milliliter
- mg
- Milligramm
- mmHg
- Millimeter Quecksilber
- 1H-NMR
- Protonkernresonanzspektrum
- 13C-NMR
- Kohlenstoffkernresonanzspektrum
- δ
- chemische Verschiebung
(parts per million), bezogen auf TMS
- CDCl3
- Deuteriochloroform
- CD3OD
- Deuteriomethanol
- FAB-MS
- Fast-Atom-Bombardment-Massenspektroskopie
- HRMS
- hochauflösende Massenspektroskopie
- Anal.
- Analysedaten
- Pd/C
- Palladium-auf-Kohle
- THF
- Tetrahydrofuran.
-
Die
folgenden Herstellungsbeispiele und Beispiele erläutern die
vorliegende Erfindung:
-
Herstellungsbeispiel 1:
Ethyl-5-phenyl-3,5-dioxopentanoat (Formel A-3: X ist CH) Siehe Reaktionsschema
A
-
Zu
einer Suspension von 50 mg Kaliumhydrid in 1 ml trockenem Tetrahydrofuran
werden tropfenweise 130 mg Ethylacetoacetat (A-1) bei 0°C und anschließend 0,7
ml einer 1,6 M n-Butyllithium/Hexan-Lösung gegeben. Zu dem gebildeten
gelben Reaktionsgemisch werden dann 150 mg Ethylbenzoat (A-2: X
ist CH) gegeben und es wird weitere 5 min gerührt. Das Reaktionsgemisch wird
mit 0,5 ml Eisessig gequencht und dann mit 1 ml Wasser verdünnt. Das
Tetrahydrofuran wird unter vermindertem Druck entfernt und die wässrige Schicht
wird mit Methylenchlorid (2 × 5
ml) extrahiert. Die vereinigten organischen Schichten werden mit
Wasser (2 ml) gewaschen, getrocknet (Magnesiumsulfat) und dann eingeengt.
Der Rückstand
wird durch Flashsäulenchromatographie
(0 bis 30 Ethylacetat in Hexan) gereinigt, wobei 201 mg des Titelprodukts
als farbloses Öl
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 1,29,
3,48, 4,22, 6,30, 7,47, 7,87, 15,81.
13C-NMR
(CDCl3) δ 13,8,
45,6, 61,2, 96,5, 126,8, 128,4, 132,4, 133,8, 167,3, 182,3, 189,1.
-
Herstellungsbeispiel 2:
4-Hydroxy-6-phenyl-2-pyron (Formel A-4: X ist CH) Siehe Reaktionsschema
A
-
Das
Titelprodukt von Herstellungsbeispiel 1 (700 mg) wird bei 120°C unter vermindertem
Druck (1 mmHg) 10 h erhitzt. Der gebildete bräunliche Kuchen wird mit Diethylether
gewaschen, unter vermindertem Druck getrocknet, wobei 411 mg des
Titelprodukts als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1M-NMR
(CDCl3) δ 5,40,
6,78, 7,53, 7,85.
-
Beispiel 1: 4-Hydroxy-6-phenyl-3-(1'-phenyl-propyl)-2-pyron; auch als 3-(α-Ethylbenzyl)-4-hydroxy-6-phenyl-2H-pyran-2-on bezeichnet
(Formel A-5: X ist CH, R ist Ethyl) Siehe Reaktionsschema A
-
Zu
einer Lösung
von 94 mg des Titelprodukts von Herstellungsbeispiel 2 und 104 mg
(±)-1-Phenyl-1-propanol
in 3 ml Dioxan werden 0,3 ml Bortrifluorid-Diethylether bei Raumtemperatur
gegeben und 10 h gerührt,
und dann wird mit 1 ml Wasser gequencht. Das Reaktionsgemisch wird
mit Methylenchlorid (3 × 5
ml) extrahiert und die vereinigten organischen Schichten werden
mit Wasser (2 × 3
ml), Kochsalzlösung
(3 ml) gewaschen, getrocknet (Natriumsulfat) und dann eingeengt.
Der Rückstand
wird durch Säulenchromatographie (20
bis 80% Ethylacetat in Hexan) gereinigt, wobei 37,5 mg des Titelprodukts
als lohfarbener Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3/CD3OD) δ 0,94, 2,17,
2,35, 4,05, 4,23, 6,55, 7,17, 7,26, 7,42, 7,50, 7,75.
13C-NMR (CDCl3/CD3OD) δ 12,4,
23,8, 41,8, 97,7, 106,1, 124,5, 127,5, 127,8, 128,4, 130,2, 130,9,
143,7, 158,0, 165,8.
FAB-MS [M]+ =
306.
-
Herstellungsbeispiel 3:
Ethyl-6-phenyl-3,5-dioxohexanoat (Formel B-3: n ist 1) Siehe Reaktionsschema
B
-
Zu
einer Suspension von 580 mg Kaliumhydrid in 15,0 ml Tetrahydrofuran
werden 1,82 g Ethylacetoacetat (B-1) bei 0°C gegeben und 30 min gerührt, und
dann werden 9,0 ml einer 1,6 M n-Butyllithium-Hexan-Lösung zugegeben
und es wird 1 h bei 0°C
gerührt.
Zu dem Reaktionsgemisch werden 2,30 g Ethylphenylacetat (B-2: n
ist 1) gegeben, was zu einer Ausfällung führt, und es werden daher weitere
50 ml Tetrahydrofuran zugesetzt. Nach 12-stündigem Rühren bei Raumtemperatur wird
das Reaktionsgemisch mit 10 ml Eisessig gequencht. Das Tetrahydrofuran
wird unter vermindertem Druck entfernt und die wässrige Schicht wird mit Ethylacetat
(3 × 30
ml) extrahiert. Die vereinigten organischen Schichten werden mit
Wasser (3 × 10
ml), Kochsalzlösung
(10 ml) gewaschen, getrocknet (Natriumsulfat) und dann eingeengt.
Der Rückstand
wird dann durch Flashsäulenchromatographie
(10% Ethylacetat in Hexan) gereinigt, wobei 1,03 g des Titelprodukts
als hellgelbes Öl
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 1,22,
2,18, 3,24, 3,40, 3,54, 3,59, 4,16, 7,22.
-
Herstellungsbeispiel 4:
Ethyl-7-phenyl-3,5-dioxoheptanoat (Formel B-3: n ist 2) Siehe Reaktionsschema
B
-
Zu
einer Suspension von 580 mg Kaliumhydrid in 15,0 ml Tetrahydrofuran
werden 1,82 g Ethylacetoacetat (B-1) bei 0°C gegeben und 30 min gerührt, und
dann werden 9,0 ml einer 1,6 M n-Butyllithium-Hexan-Lösung zugegeben
und es wird 1 h bei 0°C
gerührt.
Zu dem Reaktionsgemisch werden 2,49 g Ethyldihydrocinnamat (B-2:
n ist 2) gegeben, was zu einer Ausfällung führt, und es werden weitere
50 ml Tetrahydrofuran zugesetzt. Nach 12-stündigem Rühren bei Raumtemperatur wird
das Reaktionsgemisch mit 10 ml Eisessig gequencht. Das Tetrahydrofuran
wird unter vermindertem Druck entfernt und die wässrige Schicht wird mit Ethylacetat
(3 × 30
ml) extrahiert. Die vereinigten organischen Schichten werden mit
Wasser (3 × 10
ml), Kochsalzlösung
(10 ml) gewaschen, getrocknet (Natriumsulfat) und dann eingeengt.
Der Rückstand
wird dann durch Flashsäulenchromatographie
(10% Ethylacetat in Hexan) gereinigt, wobei 718 mg des Titelprodukts
als hellgelbes Öl
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 1,27,
2,28, 2,63, 2,88, 2,95, 3,31 3,43, 4,19, 7,23.
-
Herstellungsbeispiel 5:
6-Benzyl-4-hydroxy-2-pyron (Formel B-4: n ist 1) Siehe Reaktionsschema
B
-
Das
Titelprodukt von Herstellungsbeispiel 3 (510 mg) wird bei 100°C unter vermindertem
Druck (1 mmHg) 16 h erhitzt. Der gebildete weiße Feststoff wird mit Diethylether
(10 ml) gewaschen, unter vermindertem Druck getrocknet, wobei 226
mg des Titelprodukts als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 3,80,
5,32, 5,90, 7,29.
13C-NMR (CD3OD) δ 40,6,
89,9, 102,3, 128,3, 129,9, 130,3, 136,8, 167,3, 168,2, 173,3.
FAB-MS
[M]+ = 202.
-
Herstellungsbeispiel 6:
4-Hydroxy-6-phenethyl-2-pyron (Formel B-4: n ist 2) Siehe Reaktionsschema
B
-
Das
Titelprodukt von Herstellungsbeispiel 4 (718 mg) wird bei 100°C unter vermindertem
Druck (1 mmHg) 16 h erhitzt. Der gebildete weiße Feststoff wird mit Diethylether
(10 ml) gewaschen, unter vermindertem Druck getrocknet, wobei 346
mg des Titelprodukts als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 2,73,
2,90, 5,34, 5,86, 7,20.
13C-NMR (CD3OD) δ 33,8,
36,4, 89,9, 102,2, 127,4, 129,4, 129,6, 141,4, 167,3, 168,4, 173,3.
FAB-MS
[M]+ = 216.
-
Beispiel 2: 6-Benzyl-4-hydroxy-3-(1'-phenylpropyl)-2-pyron;
auch als 6-Benzyl-3-(α-ethylbenzyl)-4-hydroxy-2H-pyran-2-on
bezeichnet (Formel B-5: n ist 1) Siehe Reaktionsschema B
-
Ein
Gemisch aus dem Titelprodukt von Herstellungsbeispiel 5 (21 mg)
und (±)-1-Brom-1-phenylpropan (0,2
ml) wird 16 h bei 100°C
erhitzt. Das rohe Reaktionsgemisch wird durch Flashsäulenchromatographie
(10 bis 30% Ethylacetat in Hexan) gereinigt, wobei 11,2 mg des Titelprodukts
als gelber Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,96,
2,17, 3,80, 4,24, 5,93, 7,15–7,45.
-
Beispiel 3: 4-Hydroxy-6-phenethyl-3-(1'-phenylpropyl)-2-pyron; auch als 3-(α-Ethylbenzyl)-6-phenethyl-4-hydroxy-2H-pyran-2-on bezeichnet
(Formel B-5: n ist 2) Siehe Reak tionsschema B
-
Ein
Gemisch aus 22 mg des Titelprodukts von Herstellungsbeispiel 6 und
0,2 ml (±)-1-Brom-1-phenylpropan
wird 16 h bei 100°C
erhitzt. Das rohe Reaktionsgemisch wird durch Flashsäulenchromatographie
(10 bis 30% Ethylacetat in Hexan) gereinigt, wobei 14 mg des Titelprodukts
als gelber Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,96,
2,17, 2,67, 2,89, 4,25, 5,93, 7,10–7,45.
FAB-MS [M]+ = 334.
-
Herstellungsbeispiel 7:
1-(4'-Bromphenyl)-butanol
(Formel C-2: R ist OH) Siehe Reaktionsschema C
-
Zu
einer Lösung
von 1,90 g 4-Brombenzaldehyd (C-1) in 20 ml Tetrahydrofuran bei
0°C werden
7,5 ml einer 2 M Propylmagnesiumbromid-Tetrahydrofuran-Lösung gegeben
und 2 h gerührt.
Das Reaktionsgemisch wird mit 10 ml gesättigter Ammoniumchloridlösung und
10 ml Wasser gequencht. Die wässrige
Schicht wird mit Diethylether (3 × 30 ml) extrahiert und die
vereinigten organischen Schichten werden mit Kochsalzlösung (20
ml) gewaschen, getrocknet (Natriumsulfat) und dann unter vermindertem
Druck eingeengt. Der Rückstand wird
durch Flashsäulenchromatographie
(5% Ethylacetat in Hexan) gereinigt, wobei 1,97 g des Titelprodukts als
farbloses Öl
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,93,
1,26–1,42,
1,59–1,76,
4,64, 7,21, 7,46.
-
Herstellungsbeispiel 8:
1-Brom-1-(4'-bromphenyl)-butan
(Formel C-2: R ist Br) Siehe Reaktionsschema C
-
Zu
einer Lösung
von 229 mg des Titelprodukts von Herstellungsbeispiel 7 in 2 ml
Diethylether werden 2 ml 48%-iger Bromwasserstoffsäure bei
Raumtemperatur gegeben und dann wird 72 h gerührt. Die wässrige Schicht wird mit Diethylether
(3 × 5
ml) extrahiert und die vereinigten organischen Schichten werden
mit festen Natriumbicarbonat im Überschuss
behandelt. Nach der Filtration wird die organische Phase unter vermindertem
Druck eingeengt, wobei 135 mg der Titelverbindung erhalten werden
und ohne weitere Reinigung verwendet werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,93,
1,30–1,38,
1,45–1,48,
2,01–2,13,
2,18–2,26,
4,91, 7,25, 7,47.
-
Beispiel 4: 3-[1'-(4''-Bromphenyl)-butyl]-4-hydroxy-6-phenethyl-2-pyron;
auch als 4-Hydroxy-6-phenethyl-3-(α-propyl-p-brombenzyl)-2H-pyran-2-on bezeichnet
(Formel C-4) Siehe Reaktionsschema C
-
Ein
Gemisch aus 22 mg des Titelprodukts von Herstellungsbeispiel 6 und
115 mg des Titelprodukts von Herstellungsbeispiel 8 in 1 ml Toluol
wird 16 h unter Rückflusskühlung erhitzt.
Das rohe Gemisch wird dann durch Schwerkraftsäulenchromatographie (10–60% Ethylacetat
in Hexan) gereinigt, wobei 13,9 mg des Titelprodukts als gelber
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,92,
1,87–1,95,
2,27–2,35,
2,67, 2,89, 4,64, 5,86, 7,26, 7,53, 7,71.
FAB-MS [M]+ = 426.
-
Herstellungsbeispiel 9:
4-O-Cinnamyl-4-hydroxy-6-methyl-2-pyron (Formel D-2) Siehe Reaktionsschema
D
-
Zu
einer Lösung
von 2,522 g 4-Hydroxy-6-methyl-2-pyron (D-1) in 20 ml Dimethylformamid werden 2,764
Kaliumcarbonat bei Raumtemperatur gegeben. Die gebildete Suspension
wird 1 h bei 90°C
erhitzt und mit 3,942 g Cinnamylbromid versetzt. Nach 12-stündigem Rühren bei
90°C wird
das Reaktionsgemisch mit 10%-iger Essigsäure (5 ml) gequencht. Das Dimethylformamid
wird unter vermindertem Druck entfernt und die wässrige Phase wird mit Ethylacetat
(3 × 30
ml) extrahiert. Die vereinigten organischen Schichten werden schichtkonzentriert,
der Rückstand
wird durch Flashsäulenchromatographie
(10 bis 30% Ethylacetat in Hexan) gereinigt, wobei 3,970 g des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 2,21,
4,65, 5,46, 5,82, 6,32, 6,72, 7,24–7,42.
13C-NMR
(CDCl3) δ 19,8,
26,7, 69,2, 88,1, 100,4, 121,4, 126,0, 126,6, 128,3, 128,4, 128,6,
134,9.
FAB-MS [M – 1]+ = 241. Anal. gefunden: C, 76,27; H, 5,74.
-
Herstellungsbeispiel 10:
4-Hydroxy-6-methyl-3-(1'-phenyl-2'-propenyl)-2-pyron (Formel D-3) Siehe
Reaktionsschema D
-
Eine
Lösung
von 968 mg des Titelprodukts von Herstellungsbeispiel 9 in Toluol
(10 ml) wird 8 h unter Rückflusskühlung erhitzt.
Das Toluol wird unter vermindertem Druck entfernt und der Rückstand
wird durch Flashsäulenchromatographie
(50 bis 80% Ethylacetat in Hexan) gereinigt, wobei 817 mg des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3/CD3OD) δ 2,15, 4,97,
5,14, 5,89, 6,53, 7,15– 7,31.
13C-NMR CDCl3/CD3OD) δ 19,3,
43,9, 48,9, 100,7, 104,0, 115,8, 126,8, 127,4, 127,8, 137,7, 142,0,
160,5, 166,2.
FAB-MS [M]+ = 242. Anal.
gefunden: C, 73,92; H, 5,80.
-
Von
dieser Verbindung wurde auch ermittelt, dass sie HIV-Aktivität besitzt.
-
Herstellungsbeispiel 11:
4-Hydroxy-6-methyl-3-(1'-phenylpropyl)-2-pyron
(Formel D-4) Siehe Reaktionsschema D
-
Ein
Gemisch aus 2,48 g des Titelprodukts von Herstellungsbeispiel 10
und 100 mg 10% Pd/C in Methanol (50 ml) wird 10 h bei Raumtemperatur
unter Wasserstoffatmosphäre
(30 psi) geschüttelt.
Der Katalysator wird über
Celite abfiltriert und Methanol wird unter vermindertem Druck entfernt,
wobei 2,501 g des Titelprodukts als weißer Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,95,
2,12, 2,18, 2,32, 4,24, 6,13, 7,22, 7,47.
FAB-MS [M]+ = 244.
-
Beispiel 5: 4-Hydroxy-6-phenethyl-3-(1'-phenylpropyl)-2-pyron; auch als 3-(α-Ethylbenzyl)-6-phenethyl-4-hydroxy-2H-pyran-2-on bezeichnet
(Formel D-4) Siehe Reaktionsschema D
-
Zu
einer Lösung
von 61 mg Diisopropylamin in THF (2 ml) werden 0,375 ml einer 1,6
M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 49 mg des Titelprodukts von Herstellungsbeispiel
11 in Tetrahydrofuran (3 ml) zugesetzt. Nach 30-minütigem Rühren bei –20°C wird das
Reaktionsgemisch mit 34 mg Benzylbromid versetzt und weitere 30
min gerührt
und dann mit 2 N Salz säure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige Schicht
wird mit Ethylacetat (3 × 5
ml) extrahiert. Die vereinigten organischen Schichten werden getrocknet (Natriumsulfat),
eingeengt, und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(20 bis 60% Ethylacetat in Hexan) gereinigt, wobei 53 mg des Titelprodukts
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Das 1H-NMR-Spektrum
ist mit dem in Beispiel 3 angegeben identisch.
-
Beispiel 6: 6-(4'-Bromphenethyl)-4-hydroxy-3-(1'-phenylpropyl)-2-pyron; auch als 6-(p-Bromphenethyl)-3-(α-ethylbenzyl)-4-hydroxy-2H-pyran-2-on
bezeichnet (Formel E-2:
R ist 4-Brom-phenyl-CH2-) Siehe Reaktionsschema
E
-
Zu
einer Lösung
von 61 mg Diisopropylamin in THF (2 ml) werden 0,375 ml einer 1,6
M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 49 mg E-1 in Tetrahydrofuran (3 ml) zugesetzt.
Nach 30-minütigem Rühren bei –20°C wird das
Reaktionsgemisch mit 50 mg 4-Brombenzylbromid versetzt und weitere
30 min gerührt
und dann mit 2 N Salzsäure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige
Schicht wird mit Ethylacetat (3 × 5 ml) extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(20 bis 60% Ethylacetat in Hexan) gereinigt, wobei 23 mg des Titelprodukts
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 0,92,
2,12–2,26,
2,60, 2,80, 4,22, 6,00, 6,90–7,51.
HRMS
gefunden 413,0674.
Anal. gefunden: C, 64,04; H, 5,28.
-
Beispiel 7: 6-(2'-Fluorphenethyl)-4-hydroxy-3-(1'-phenylpropyl)-2-pyron; auch als 3-(α-Ethylbenzyl)-6-(o-fluorphenethyl)-4-hydroxy-2H-pyran-2-on
bezeichnet (Formel E-2: R ist 2-Fluor-phenyl-CH2-)
Siehe Reaktionsschema E
-
Zu
einer Lösung
von 61 mg Diisopropylamin in Tetrahydrofuran (2 ml) werden 0,375
ml einer 1,6 M n-Butyllithium-Hexan-Lösung bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 49 mg E-1 in Tetrahydrofuran (3 ml) zugesetzt.
Nach 30-minütigem
Rühren
bei –20°C wird das
Reaktionsgemisch mit 38 mg 2-Fluorbenzylbromid versetzt und weitere
30 min gerührt
und dann mit 2 N Salzsäure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige
Schicht wird mit Ethylacetat (3 × 5 ml) extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(20 bis 60% Ethylacetat in Hexan) gereinigt, wobei 6,1 mg des Titelprodukts
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,97,
2,16, 2,69, 2,96, 4,24, 5,80, 7,02–7,45.
FAB-MS [M]+ = 352.
-
Beispiel 8: 4-Hydroxy-3-(1'-phenylpropyl)-6-(3'-phenylpropyl)-2-pyron;
auch als 3-(α-Ethylbenzyl)-4-hydroxy-6-(3-phenylpropyl)-2H-pyran-2-on
bezeichnet (Formel E-2: R ist Phenyl-CH2CH2-) Siehe Reaktionsschema E
-
Zu
einer Lösung
von 49 mg E-1 in Tetrahydrofuran (2 ml) werden 0,31 ml einer 1,6
M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 37 mg (2-Bromethyl)benzol in Tetrahydrofuran (3
ml) zugesetzt. Nach 30-minütigem
Rühren
bei –20°C wird das
Reaktionsgemisch mit 2 N Salzsäure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige
Schicht wird mit Ethylacetat (3 × 5 ml) extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(20 bis 60% Ethylacetat in Hexan) gereinigt, wobei 21,3 mg des Titelprodukts
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,93,
1,87, 2,17, 2,35, 2,59, 4,23, 5,99, 7,08–7,46, 9,55.
FAB-MS [M]+ = 348.
-
Beispiel 9: 4-Hydroxy-3-(1'-phenylpropyl)-6-propyl-2-pyron;
auch als 3-(α-Ethylbenzyl)-4-hydroxy-6-propyl-2H-pyran-2-on
bezeichnet (Formel E-2: R ist Ethyl) Siehe Reaktionsschema E
-
Zu
einer Lösung
von 122 mg E-1 in Tetrahydrofuran (4 ml) werden 0,67 ml einer 1,6
M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 78 mg Iodethan in Tetrahydrofuran (6 ml) zugesetzt.
Nach 30-minütigem
Rühren
bei –20°C wird das
Reaktionsgemisch mit 2 N Salzsäure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige Schicht
wird mit Ethylacetat (3 × 5
ml) extrahiert. Die vereinigten organischen Schichten werden getrocknet (Natriumsulfat),
eingeengt, und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(20 bis 60% Ethylacetat in Hexan) gereinigt, wobei 39 mg des Titelprodukts
als wei ßer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 0,90–1,05, 1,60,
2,14–2,37,
4,24, 6,00, 7,18–7,48.
FAB-MS
[M]+ = 372.
-
Beispiel 10: 6-Allyl-4-hydroxy-3-(1'-phenylpropyl)-2-pyron;
auch als 3-(α-Ethylbenzyl)-4-hydroxy-6-(3-butenyl)-2H-pyran-2-on bezeichnet
(Formel E-2: R ist CH2=CHCH2-)
Siehe Reaktionsschema E
-
Zu
einer Lösung
von 61 mg Diisopropylamin in Tetrahydrofuran (2 ml) werden 0,94
ml einer 1,6 M n-Butyllithiumhexanlösung bei –20°C gegeben und es wird 30 min
gerührt
und dann werden 122 mg E-1 in Tetrahydrofuran (3 ml) zugesetzt.
Nach 30-minütigem
Rühren
bei –20°C wird das
Reaktionsgemisch mit 61 mg Allylbromid versetzt und weitere 30 min
gerührt
und dann mit 2 N Salzsäure
gequencht. Das Tetrahydrofuran wird unter vermindertem Druck entfernt
und die wässrige
Schicht wird mit Ethylacetat (3 × 5 ml) extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Natriumsulfat), eingeengt
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(10 bis 40% Ethylacetat in Hexan) gereinigt, wobei 39 mg eines untrennbaren
Gemischs (3:1) des Titelprodukts und von 6,6-Diallyl-4-hydroxy-3-(1'-phenylpropyl)-2-pyron
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
FAB-MS [M]+ = 324 & 364.
-
Beispiel 11: 3-(α-Ethylbenzyl)-4-hydroxy-6-[[(phenylamino)carbonyl]methyl]-2H-pyran-2-on
(Formel F-2) Siehe Reaktionsschema F
-
Zu
einer Lösung
von 304 mg Diisopropylamin in Tetrahydrofuran (5 ml) werden 1,7
ml einer 1,6 M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben.
Die gebildete Lithiumdiisopropylamidlösung wird 30 min gerührt und
dann werden 220 mg F-1
in Tetrahydrofuran (5 ml) zugesetzt, wobei die Lösung unmittelbar eine tiefrote
Farbe erhält.
Das Reaktionsgemisch wird mit 119 mg Phenylisocyanat versetzt und
1 h bei –20°C, 2 h bei 0°C gerührt und
dann mit 2 N Salzsäure
(3 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem Druck entfernt,
und die wässrige
Schicht wird mit Ethylacetat (3 × 10 ml) extrahiert. Die vereinigten
organischen Schichten werden mit 1 N Salzsäure (5 ml), Wasser (5 ml) gewaschen,
getrocknet (Natriumsulfat), eingeengt, und der Rückstand wird durch Schwerkraftsäulenchromatographie
(2 bis 5% Methanol in Methylenchlorid) gereinigt, wobei 247,7 mg
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 0,88,
2,08, 2,25, 3,57, 4,12, 6,19, 7,09–7,51.
13C-NMR
(CD3OD) δ 10,1,
22,1, 39,2, 40,3, 100,6, 103,8, 118,2, 122,5, 123,8, 125,8, 126,0,
126,8, 136,0, 142,3, 155,8, 165,8, 164,5, 1647.
HRMS gefunden
363,1470.
Anal. gefunden: C, 71,20; H, 5,71; N, 3,70.
-
Beispiel 12: 4-Hydroxy-3-(1'-phenyl-2'-propenyl)-6-propyl-2-pyron; auch als
4-Hydroxy-6-phenethyl-3-(α-vinylbenzyl)-2H-pyran-2-on bezeichnet
(Formel G-2) Siehe Reaktionsschema G
-
Zu
einer Lösung
von 121 mg G-1 in Tetrahydrofuran (4 ml) werden 0,67 ml einer 1,6
M n-Butyllithium-Hexan-Lösung
bei –20°C gegeben
und es wird 30 min gerührt,
und danach werden 86 mg Benzylbromid in Tetrahydrofuran (6 ml) zugesetzt.
-
Nach
30-minütigem
Rühren
bei –20°C wird das
Reaktionsgemisch mit 2 N Salzsäure
(0,5 ml) gequencht. Das Tetrahydrofuran wird unter vermindertem
Druck entfernt, und die wässrige
Schicht wird mit Ethylacetat (3 × 5 ml) extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(10 bis 40% Ethylacetat in Hexan) gereinigt, wobei 26,9 mg des Titelprodukts
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 2,05,
2,71, 2,93, 5,09, 5,30, 5,90, 6,47, 7,13–7,53.
FAB-MS [M]+ = 332.
-
Beispiel 13: 6-(1'-Benzylpropyl)-4-hydroxy-3-(1'-phenylpropyl)-2-pyron;
auch als 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
bezeichnet (Formel H-4: R1 ist -CH2-phenyl; R2 ist
Ethyl) Siehe Reaktionsschema H.
-
Zu
einer Lösung
von 244 mg H-3 und 101 mg Diisopropylamin in Tetrahydrofuran (25
ml) werden 1,88 ml einer 1,6 M n-Butyllithium-Hexan-Lösung bei
0°C gegeben
und es wird 10 min gerührt.
Zu dem Reaktionsgemisch werden 156 mg Iodethan gegeben und es wird
10 min gerührt
und dann werden 171 mg Benzylbromid zugesetzt. Das Reaktionsgemisch
wird 2 h bei 0°C
gerührt
und dann mit 2 N Salzsäure
(2 ml) und Wasser (10 ml) gequencht. Das Tetrahydrofuran wird unter
vermindertem Druck entfernt, und die wässrige Schicht wird mit Methylenchlorid
(3 × 5
ml) extrahiert. Die vereinigten organischen Schichten werden mit
Wasser (10 ml) gewaschen, getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(10 bis 40% Ethylacetat in Hexan) gereinigt, wobei 58 mg des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,76–1,01, 1,50–1,70, 2,05–2,30, 2,45,
2,76–2,96,
4,19–4,33,
5,95, 6,09, 7,00–7,48.
FAB-MS
[M]+ = 362.
-
Beispiel 14: 6-(1'-Ethyl-propyl)-4-hydroxy-3-(1'-phenylpropyl)-2-pyron;
auch als 3-(α-Ethylbenzyl)-1-ethylpropyl-4-hydroxy-2H-pyran-2-on
bezeichnet (Formel H-4: R1 ist Ethyl; R2 ist Ethyl) Siehe Reaktionsschema H
-
Zu
einer Lösung
von 125 mg H-3 und 56 mg Diisopropylamin in Tetrahydrofuran (10
ml) werden 1,0 ml einer 1,6 M n-Butyllithium-Hexan-Lösung bei
0°C gegeben
und es wird 10 min gerührt.
Zu dem Reaktionsgemisch werden 164 mg Iodethan gegeben. Das Reaktionsgemisch
wird 2 h bei 0°C
gerührt
und dann mit 2 N Salzsäure
(2 ml) und Wasser (10 ml) gequencht. Das Tetrahydrofuran wird unter
vermindertem Druck entfernt, und die wässrige Schicht wird mit Methylenchlorid
(5 × 30
ml) extrahiert. Die vereinigten organischen Schichten werden mit
Wasser (10 ml) gewaschen, getrocknet (Natriumsulfat), eingeengt,
und der Rückstand
wird durch Schwerkraftsäulenchromatographie
(10 bis 40% Ethylacetat in Hexan) gereinigt, wobei 89 mg des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3) δ 0,80,
0,93, 1,56, 2,06–2,21,
2,27, 4,23, 6,10, 7,14–7,49.
FAB-MS
[M]+ = 300.
-
Beispiele 15–25
-
Gemäß zu den
oben beschriebenen analogen Verfahren und un ter Verwendung von Ausgangsmaterialien
und Reagentien, die einem Fachmann üblicher Erfahrung auf dem Gebiet
der organischen Synthese ohne weiteres bekannt und verfügbar sind,
werden die folgenden weiteren Verbindungen der vorliegenden Erfindung
hergestellt:
-
Beispiel 15: 4-Hydroxy-6-(trans-4'-methoxybenzyliden)-methyl-3-(1'-phenylpropyl)-2-pyron;
auch als 3-(α-Ethyl-benzyl)-4-hydroxy-6-(p-methoxystyryl)-2H-pyran-2-on
bezeichnet
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CD3OD) δ 0,94,
2,27, 4,61, 5,97, 6,50, 6,62, 7,12–7,56.
FAB-MS [M]+ = 362.
-
Beispiel 16: 3-(α-Ethylbenzyl)-4-hydroxy-6-(2-naphth-3-ylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 384,1736.
-
Beispiel 17: 3-(α-Ethylbenzyl)-4-hydroxy-6-(1-ethyl-2-naphth-2-ylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 412,2033.
-
Beispiel 18: 3-(α-Ethylbenzyl)-4-hydroxy-6-(2-naphth-1-ylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 384,1736.
-
Beispiel 19: 3-(α-Ethylbenzyl)-4-hydroxy-6-(1-ethyl-2-naphth-1-ylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 412,2041.
-
Beispiel 20: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-methyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 256,1116.
-
Beispiel 21: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(3-phenylpropyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 360 (nur niedrige Auflösung).
-
Beispiel 22: 3-(α-Cyclopropylbenzyl)-6-(1-ethylpropyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 312,1725.
-
Beispiel 23: 3-(α-Cyclopropylbenzyl)-6-(α-benzylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 436,2035.
-
Beispiel 24: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-phenethyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 346,1568.
-
Beispiel 25: 3-(α-Cyclopropylbenzyl)-6-(1-propylbutyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Massenspektraldaten
(EI-Modus) Gefunden: 340,2042.
-
Herstellungsbeispiel 12:
Methyl-2-(α-ethylbenzyl)-acetoacetat
(Formel I-3) Siehe Reaktionsschema 1
-
Zu
einer gerührten
Suspension von 216 mg Natriumhydrid in 15 ml trockenem Tetrahydrofuran
bei 0°C werden
0,86 ml Methylacetoacetat der Formel I-1 gegeben. Nach 15 min wird
eine Lösung
von 1,9 g α-Ethylbenzylbromid
der Formel I-2 in 5 ml Tetrahydrofuran zugesetzt. Das gebildete
Reaktionsgemisch wird 2 Tage auf 65°C erhitzt. Das gekühlte Gemisch
wird dann zwischen Diethylether und 1 N wässriger Salzsäure verteilt. Die
wässrige
Phase wird mit zwei weiteren Portionen Diethylether extrahiert.
Die vereinigte organische Phase wird über Magnesiumsulfat getrocknet
und dann eingeengt. Der gebildete Rückstand wird auf Silicagel
mit 40–50
Diethylether in Hexan chromatographiert, wobei 0,53 g des diastereomeren
Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,4–7,1, 3,9–3,8, 3,76,
3,38, 3,3–3,2,
2,3, 1,89, 1,8–1,5,
0,94–0,88,
0,77–0,67.
-
Herstellungsbeispiel 13:
Methyl-2-(α-ethylbenzyl)-5-hydroxy-3-oxo-5-phenyl-heptanoat
(Formel I-5) Siehe Reaktionsschema I
-
Zu
einer gerührten
Suspension von 60 mg Natriumhydrid in 5 ml trockenem Tetrahydrofuran
bei 0°C wird
eine Lösung
von 0,53 g Methyl-2-(α-ethylbenzyl)-acetoacetat
von Herstellungsbeispiel 12 in 5 ml Tetrahydrofuran gegeben. Das
gebildete Gemisch wird 1 h bei Raumtemperatur gerührt und
dann erneut auf 0°C
gekühlt.
Eine Lösung
von 1,55 ml von 1,6 M n-Butyllithium in Hexan wird dann langsam
zugegeben. Nach 15 min werden 0,33 ml Propiophenon der Formel I-4
zugegeben. Nach 30 min wird 1 ml konzentrierte wässrige Salzsäure zugegeben
und das gebildete Gemisch zwischen Wasser und Diethylether verteilt.
Die wässrige
Phase wird mit zwei weiteren Portionen Diethylether extrahiert.
Die vereinigte organische Phase wird über Magnesiumsulfat getrocknet
und dann eingeengt. Der gebildete Rückstand wird auf Silicagel
mit 5–15%
Ethylacetat in Hexan chromatographiert, wobei 0,48 g des diastereomeren
Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δmit einem
Gemisch von Tautomeren und Diastereomeren des konsistent;
MS-EI:
M+-29 = 368, Fragmente mit der Struktur
konsistent.
-
Beispiel 26: 6-Ethyl-3-(α-ethylbenzyl)-6-phenyl-tetrahydropyran-2,4-dion
(Formel I-6) Siehe Reaktionsschema I
-
Zu
einer gerührten
Lösung
von 149 mg Methyl-2-(α-ethylbenzyl)-5-hydroxy-3-oxo-5-phenyl-heptanoat von
Herstellungsbeispiel 13 in 10 ml Tetrahydrofuran werden 40 ml von
0,1 N wässrigem
Natriumhydroxid gegeben. Nach 4 h wird das Reaktionsgemisch eingeengt,
um Tetrahydrofuran zu entfernen, und die verbliebene wässrige Phase
mit zwei Portionen Diethylether gewaschen. Die wässrige Phase wird auf 0°C gekühlt und dann
mit 2 N wässriger
Salzsäure
angesäuert.
Sie wird mit vier Portionen Diethylether extrahiert, und die vereinigte
organische Phase wird über
Magnesiumsulfat getrocknet und dann eingeengt. Der Rückstand
wird auf Silicagel mit 30% Ethylacetat in Hexan chromatographiert,
wobei 69 mg des tautomeren Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,1, 4,0–3,9, 3,6–3,3, 3,1–2,9, 2,2–1,6, 0,9–0,5;
MS-EI:
M+ = 336,1722 gefunden.
-
Herstellungsbeispiel 14:
Methyl-2-(3-phenylpropyl)-acetoacetat (Formel J-3) Siehe Reaktionsschema
J
-
Zu
einer gerührten
Suspension von 240 mg Natriumhydrid in 20 ml trockenem Tetrahydrofuran
bei 0°C werden
0,9 ml Methylacetoacetat der Formel J-1 gegeben. Nach 30 min wird
eine Lösung
von 1,6 ml 1-Brom-3-phenylpropan der Formel J-2 in 5 ml Tetrahydrofuran
zugegeben. Das gebildete Reaktionsgemisch wird über Nacht auf 65°C erhitzt.
Das gekühlte
Gemisch wird dann zwischen Diethylether und 1 N wässriger Salzsäure verteilt.
Die wässrige
Phase wird mit zwei weiteren Portionen Diethylether extrahiert.
Die vereinigte organische Phase wird über Magnesiumsulfat getrocknet
und dann eingeengt. Der gebildete Rückstand wird auf Silicagel
mit 40% Ethylacetat in Hexan chromatographiert, wobei 0,75 g des
Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,1, 3,72,
3,44, 2,61, 2,19, 1,92–1,85,
1,67–1,26.
-
Herstellungsbeispiel 15:
Methyl-2-(3-phenylpropyl)-5-ethyl-5-hydroxy-3-oxo-heptanoat (Formel J-5)
Siehe Reaktionsschema J
-
Zu
einer gerührten
Suspension von 84 mg Natriumhydrid in 8 ml trockenem Tetrahydrofuran
bei 0°C wird
eine Lösung
von 0,75 g Methyl-2-(3-phenylpropyl)-acetoacetat von Herstellungsbeispiel
14 in 5 ml Tetrahydrofuran gegeben. Das gebildete Gemisch wird 30
min bei Raumtemperatur gerührt
und dann erneut auf 0°C
gekühlt.
Eine Lösung
von 2,2 ml von 1,6 M n-Butyllithium in Hexan wird dann langsam zugegeben.
Nach 15 min werden 0,37 ml 3-Pentanon der Formel J-4 zugegeben.
Nach 30 min wird 1 ml konzentrierte wässrige Salzsäure zugegeben
und das gebildete Gemisch zwischen Wasser und Diethylether verteilt.
Die wässrige Phase
wird mit zwei weiteren Portionen Diethylether extrahiert. Die vereinigte
organische Phase wird über
Magnesiumsulfat getrocknet und dann eingeengt. Der gebildete Rückstand
wird auf Silicagel mit 10–25%
Ethylacetat in Hexan chromatographiert, wobei 0,435 g des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,1, 3,71,
3,5–3,4,
2,7–2,3,
1,9–1,8,
1,6–1,4,
0,86,–0,81.
-
Beispiel 27: 6,6-Diethyl-3-(3-phenylpropyl)-tetrahydropyran-2,4-dion
(Formel J-6) Siehe Reaktionsschema J
-
Zu
einer gerührten
Lösung
von 435 mg Methyl-2-(3-phenylpropyl)-5-ethyl-5-hydroxy-3-oxo-heptanoat von
Herstellungsbeispiel 15 in 20 ml Tetrahydrofuran werden 100 ml von
0,125 N wässrigem
Natriumhydroxid gegeben. Nach 4 h wird das Reaktionsgemisch eingeengt,
um Tetrahydrofuran zu entfernen, und die verbliebene wässrige Phase
mit drei Portionen Diethylether gewaschen. Die wässrige Phase wird auf 0°C gekühlt und
dann mit 2 N wässriger
Salzsäure
angesäuert.
Sie wird mit vier Portionen Diethylether extrahiert und die vereinigte
organische Phase wird über
Magnesiumsulfat getrocknet und dann eingeengt. Der Rückstand
wird auf Silicagel mit 40% Ethylacetat in Hexan chromatographiert,
wobei 316 mg des tautomeren Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 9,34, 7,3–7,1, 3,22,
2,7–2,3,
2,14, 2,05, 1,8–1,6,
0,97–0,85;
MS-EI:
M+ = 288,1734 gefunden.
-
Herstellungsbeispiel 16:
Allgemeine Verfahren für
die folgenden Herstellungsbeispiele und Beispiele
-
A. Allgemeines Verfahren
für die
Dianionsynthese von 5,6-Dihydropyronen
-
Methylacetoacetat
wird in Tetrahydrofuran (0,5 M) bei 0°C gelöst. Natriumhydrid (1,1 Äquivalent, 60%-ige
Dispersion in Mineralöl)
wird zugegeben und das Reaktionsgemisch wird 15 min bei 0°C gerührt. Dann
wird n-Butyllithium (1,1 Äquivalente,
1,6 M Lösung
in Hexan) tropfenweise zugegeben und das Reaktionsgemisch wird 15
min bei 0°C
gerührt.
Das Keton wird in Tetrahydrofuran gelöst und dann wird alles auf
einmal zu dem Reaktionsgemisch gegeben. Das Reaktionsgemisch wird
eine weitere Stunde gerührt
und dann in eine gesättigte
Ammoniumchloridlösung
gegossen. Es wird mit Methylenchlorid extrahiert, über wasserfreiem Natriumsulfat
getrocknet und unter Vakuum eingedampft. Das erhaltene Material
wird in Tetrahydrofuran (0,3 M) gelöst und eine 0,1 N Natriumhydroxid
(1 Äq.)-Lösung wird
zugegeben. Nach einstündigem
Rühren
wird das Gemisch mit Ethylacetat (1 ×) extrahiert. Die wässrige Schicht
wird mit Salzsäure
auf pH 3 eingestellt, dann mit Ethylacetat extrahiert, über wasserfreiem
Natriumsulfat getrocknet und eingedampft, wobei das gewünschte Pyronprodukt
erhalten wird.
-
B. Allgemeines Verfahren
für die
palladiumkatalysierte Allylalkylierung
-
Pyron
oder 5,6-Dihydropyron (1 Äq.),
Methyl-(1-phenyl-3-trimethylsilyl)-2E-propenyl)carbonat
(1,1 Äq.)
oder ein anderes geeignet substituiertes Carbonat, Palladiumacetat
(0,05 Äquivalente)
und Triphenylphosphin (0,20 Äquivalente)
werden in destilliertem Toluol unter einer sorgfältig gespülten Stickstoffatmosphäre suspendiert.
Das Reaktionsgemisch wird 1–2
h auf 70°C
erhitzt. Dann wird das Reaktionsgemisch in Wasser gegossen, mit
Ethylacetat extrahiert und durch Flashsäulenchromatographie auf Silicagel
mit einem Ethylacetat/Hexan-Lösemittelgemisch
gereinigt, wobei die gewünschten
3-substituierten Pyrone oder 5,6-Dihydropyron erhalten werden.
-
C. Allgemeines Verfahren
zur Protodesilylierung
-
Das
Vinylsilan von B. (1 Äq.)
und p-Toluolsulfonsäure
(0,5 Äq.)
werden 1–2
h in Acetonitril unter Rückflusskühlung erhitzt.
Das Reaktionsgemisch wird in Wasser gegossen, mit Ethylacetat extrahiert, über wasserfreiem
Natriumsulfat getrocknet und unter Vakuum eingedampft, wobei das
desilylierte 3-substituierte Pyron- oder 5,6-Dihydropyronprodukt
erhalten wird.
-
D. Allgemeines Verfahren
zur katalytischen Hydrierung
-
Die
olefinischen 3-substituierten Produkte von obigem C. werden in Methanol,
Ethanol oder einem Gemisch von Methanol/Tetrahydrofuran gelöst. 10%
Palladiumhydroxid oder Palladium-auf-Kohle wird zugegeben und das
Gemisch wird 4–6
h mit 40 psi hydriert. Filtration, Eindampfen und entweder Flashsäulenchromatographie
oder Kristallisation ergeben das gewünschte Produkt.
-
Beispiel 28: Dimethyl-3-[(4-hydroxy-2-oxo-6-phenyl-2H-1-pyran-3-yl)(4-nitrophenyl)methyl]-1,3-propandioat
-
4-Hydroxy-6-phenyl-2H-pyran-2-on
(0,5 g), Dimethyl-(4-nitrobenzyliden)malonat
(0,70 g) und Cäsiumcarbonat
(0,86 g) werden in 7 ml Tetrahydrofuran suspendiert und 2 h unter
Rückflusskühlung erhitzt.
Dann wird das Reaktionsgemisch auf Raumtemperatur gekühlt, mit
Wasser verdünnt
und mit Methylenchlorid extrahiert. Die organische Schicht wird
mit Kochsalzlösung
gewaschen, über
wasserfreiem Natriumsulfat getrocknet und unter Vakuum eingeengt.
Reinigung durch Flashsäulenchromatographie
(5% Ethylacetat/Methylenchlorid) ergibt 0,16 g des gewünschten
Titelprodukts als Diastereomerengemisch. (Ein Teil des Produkts
kann in den wässrigen
Schichten verloren gehen, da sie nicht neutralisiert werden.)
-
Die
physikalischen Eigenschaften des Diastereomerengemischs sind folgende:
1H-NMR (300 MHz, CD3OD) δ 8,10, 7,63,
7,36, 5,31, 4,99, 3,69, 3,53, 2,86, 2,70.
HRMS gefunden: 456,1296.
-
Beispiel 29: Dimethyl-3-[(4-hydroxy-2-oxo-6-phenyl-2H-1-pyran-3-yl)(3-nitrophenyl)methyl]-1,3-propandioat
-
4-Hydroxy-6-phenyl-2H-pyran-2-on
(1,83 g), Dimethyl-(3-nitrobenzyliden)malonat
(2,54 g) und Cäsiumcarbonat
(3,44 g) werden in 24 ml Tetrahydrofuran suspendiert und 3 h unter
Rückflusskühlung erhitzt.
Nach dem Abkühlen
auf Raumtemperatur wird das Reaktionsgemisch in 2 N Salzsäure gegossen
und mit Ethylacetat extrahiert. Die organischen Schichten werden
mit Kochsalzlösung
gewaschen, über
wasserfreiem Natriumsulfat getrocknet und unter Vakuum eingeengt.
Reinigung durch Flashsäulenchromatographie
(5% Methanol/Chloroform) ergibt 4,16 g des Titelprodukts als Diastereomerengemisch
(Schaum).
-
Die
physikalischen Eigenschaften sind folgende:
IR (Nujol): 3541–3035 (br),
1754, 1738, 1703, 1646, 1529 cm–1.
1H-NMR (300 MHz, CDCl3): δ 8,11, 7,84,
7,63, 7,21–7,02,
5,11, 5,01, 4,87–4,74,
3,54, 3,54, 3,39, 3,37, 2,74–2,53.
HRMS
gefunden: 456,1296.
-
Herstellungsbeispiel 17:
Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat (Formel K-2(c))
Siehe Reaktionsschema K
-
tert-Butyllithium
(116,4 ml, 1,7 M in Pentan) wird zu 188,4 ml getrocknetem Tetrahydrofuran
unter Stickstoff gegeben und auf –78°C gekühlt (2-Bromvinyl)trimethylsilan
(15,18 ml) wird tropfenweise über
10 min zugegeben. Das Reaktionsgemisch wird 15 min bei –78°C gerührt und
dann werden 10,00 g Benzaldehyd über eine
Spritze zugegeben. Das Reaktionsgemisch wird 45 min bei –78°C gerührt. Das
Reaktionsgemisch wird mit frisch destilliertem Methylchlorformiat
(7,64 ml) gequencht. Das Gemisch wird sich auf Raumtemperatur erwärmen gelassen
und das Rühren
wird 2 h fortgesetzt, und an diesem Zeitpunkt wird das Gemisch dann
in Wasser gegossen und mit Ethylacetat extrahiert, mit Kochsalzlösung gewaschen, über wasserfreiem
Natriumsulfat getrocknet und unter Vakuum eingeengt. Reinigung durch
Flashsäulenchromatographie
(1%, dann 2% Ethylacetat:Hexan) ergibt 21,5 g eines Öls.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 7,33–7,18, 6,10, 5,99, 5,90, 3,71,
0,03.
HRMS gefunden: 264,1189.
-
Herstellungsbeispiel 18:
Methyl-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]carbonat
(Formel K-2(a) und K-2(b))
Siehe Reaktionsschema K
-
Das
Titelprodukt wird gemäß dem einstufigen
Verfahren, das für
die Synthese von Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat
von Herstellungsbeispiel 17 verwendet wurde, jedoch unter Ersetzen von
Benzaldehyd durch 3-Benzyloxybenzaldehyd
(6,58 g) erhalten.
-
Die
Reinigung durch Flashsäulenchromatographie
(5% Ethylacetat:Hexan) ergibt 8,18 g eines Öls.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 7,39–7,12, 6,92–6,85, 6,06, 5,96, 5,91, Hz
5,00, 3,71, 0,01.
MS m/e (rel %): 370(85), 279(13), 204(63),
203(69), 189(80), 91(100), 73(37).
-
Herstellungsbeispiel 19:
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-2H-pyran-2-on
(Formel K-1(a)) Siehe Reaktionsschema K
-
Methylacetoacetat
(8,0 g) wird in 60 ml Tetrahydrofuran gelöst und auf 0°C gekühlt. Natriumhydrid (3,03
g einer 60%-igen Dispersion in Mineralöl) wird zugegeben und das Gemisch
wird 15 min bei 0°C
gerührt. n-Butyllithium
(47,4 ml einer 1,6 M Lösung
in Hexanen) wird tropfenweise zugegeben. Nach 15 min werden 11,5
ml Butyrophenon in 5 ml Tetrahydrofuran auf einmal zugegeben. Das
Reaktionsgemisch wird 1 h bei 0°C gerührt, dann
in gesättigte
Ammoniumsulfatlösung
gegossen und mit Methylenchlorid extrahiert. Der Extrakt wird über wasserfreiem
Natriumsulfat getrocknet und unter Vakuum zu einem Öl eingedampft.
Das Öl
wird in 180 ml Tetrahydrofuran gelöst und mit 680 ml 0,1 N Natriumhydroxidlösung versetzt.
Nach 2-stündigem
Rühren
bei Raumtemperatur wird das Gemisch mit Ethylacetat (1 ×) extrahiert.
Die wässrige
Schicht wird mit Salzsäure
auf pH 3 eingestellt und dann mit Chloroform/Methanol extrahiert.
Der Extrakt wird über
Natriumsulfat getrocknet und eingedampft, wobei 12,54 g eines weißen Feststoffs
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 130–132°C
1H-NMR (300 MHz, CDCl3): δ 7,40–7,25, 3,35,
3,23, 2,91, 2,88, 1,95, 1,33–1,25,
0,87.
IR (Mineralölverreibung):
1663, 1635, 1592, 1582, 1450, 1342, 1332, 1319, 1285, 1263, 1244
cm–1.
MS
m/e (rel %): 232(2), 189(50), 149(11), 147(11), 105(100).
-
Herstellungsbeispiel 20:
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]-2H-pyran-2-on
(Formel K-3(a)) Siehe Reaktionsschema K
-
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-2H-pyran-2-on
von Herstellungsbeispiel 19 und die Ausgangsverbindung Methyl-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]carbonat
von Herstellungsbeispiel 18 (3,50 g) werden in 50 ml destilliertem
Toluol gelöst.
Palladiumacetat (96 mg) und Triphenylphosphin (450 mg) werden zugegeben.
Auf den Kolben wird ein Kühler
gesetzt, der Kolben wird sorgfältig
mit Stickstoff gespült
und 1,25 h auf 70°C
erhitzt. Das Gemisch wird in Wasser gegossen, mit Ethylacetat extrahiert, über Natriumsulfat
getrocknet und eingedampft. Flashsäulenchromatographie auf einer
Silicagelsäule
mit 25 Ethylacetat:Hexan ergibt 2,97 g des Titelprodukts als Diastereomerengemisch.
-
Die
physikalischen Eigenschaften sind folgende:
1H-
und 13C-NMR sind durch das Vorhandensein
von Diastereomeren kompliziert:
1H-NMR
(300 MHz, CDCl3): δ 7,48–7,34, 6,92, 6,85–5,18, 5,11–4,87, 3,25–2,92, 1,98,
1,54–1,17,
0,91, 0,12 und 0,00.
13C-NMR (75 MHz,
CDCl3): δ 164,7,
159,2, 158,6, 146,3, 142,8, 142,4, 142,2, 136,5, 134,2, 132,4, 130,0, 129,3,
128,4, 128,3, 127,8, 127,7, 127,5, 127,3, 124,8, 124,7, 120,2, 119,7,
114,4, 113,4, 113,0, 105,3, 82,8, 69,7, 69,5, 46,0, 45,2, 45,0,
37,1, 36,7, 16,5, 13,8, –1,5.
MS
m/e (rel %): 525(4), 508(3), 393(7), 261(6), 205(6), 131(6), 91(100).
-
Herstellungsbeispiel 21:
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-[1-(3-benzyloxyphenyl)-2-propenyl]-2H-pyran-2-on
-
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]-2H-pyran-2-on
von Herstellungsbeispiel 20 (2,95 g) wird unter Verwendung des allgemeinen
Verfahrens von Herstellungsbeispiel 16, C. desilyliert, wobei 2,53
g des gewünschten
Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 7,34–7,15, 6,90–6,40, 6,35–5,80, 5,28–4,22, 3,10–2,78, 1,84, 1,40–1,05, 0,77. (1H-NMR durch Vorhandensein von Diastereomeren
kompliziert.)
HRMS gefunden: 454,2144.
-
Beispiel 30: 5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-[1-(3-hydroxyphenyl)-propyl]-2H-pyran-2-on
-
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-[1-(3-benzyloxyphenyl)-2-propenyl]-2H-pyran-2-on
(2,41 g) von Herstellungsbeispiel 21 wird unter Verwendung des allgemeinen
Verfahrens von Herstellungsbeispiel 16, D. hydriert, wobei 1,88
g des rohen Produkts erhalten werden. Flashsäulenchromatographie auf Silicagel mit
2% Methanol/Methylenchlorid ergibt 1,59 g eines weißen Feststoffs
(Diastereomerengemisch). Zwei aufeinanderfolgende Kristallisationen
aus Acetonitril ergeben 450 mg eines Diastereomers.
-
Die
physikalischen Eigenschaften des kristallinen Diastereomers sind
folgende:
Fp 191–192°C
1H-NMR (300 MHz, CD3OD): δ 7,40, 7,00,
6,81, 6,62, 3,87, 3,16, 2,25–1,90,
1,51–1,37,
1,30–1,15,
0,95, 0,73.
Analyse gefunden: C, 74,94; H, 7,38; N, 0,10.
MS
m/e (rel %): 366(43), 348(7), 192(34), 175(78), 146(89), 118(100).
IR
(Mineralölverreibung):
1645, 1616, 1599, 1588, 1495, 1448, 1321, 1252, 1225, 1160 cm–1.
-
Herstellungsbeispiel 22:
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-2H-pyran-2-on
(Formel K-1(b)) Siehe Reaktionsschema K
-
Cyclohexylphenylketon
(14,92 g) wird in das Titelprodukt unter Verwendung des allgemeinen
Verfahrens zur Synthese von 5,6-Dihydropyronen von Herstellungsbeispiel
16, A. umgewandelt, wobei 15,34 g eines weißen Feststoffs des Titelprodukts
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 168–170°C.
1H-NMR (300 MHz, CD3OD): δ 7,48, 3,19,
2,05–1,75,
1,45–1,05.
13C-NMR (75 MHz, d6-DMSO): δ 172,0, 166,4,
141,8, 127,9, 127,2, 125,5, 91,2, 85,1, 47,7, 33,5, 26,7, 26,5, 25,8.
MS
m/e (rel %): 272(1), 189(62), 160(5), 147(12), 131(5), 105(100).
IR
(Mineralölverreibung):
1675, 1629, 1598, 1474, 1447, 1349, 1297, 1280, 1265, 1255, 1240,
1215 cm–1.
-
Herstellungsbeispiel 23:
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]-2H-pyran-2-on
(Formel K-3(b)) Siehe Reaktionsschema K
-
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-2H-pyran-2-on
(2,48 g) von Herstellungsbeispiel 22 wird mit Methyl-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]carbonat
von Herstellungsbeispiel 18 gemäß dem allgemeinen
palladiumkatalysierten Alkylierungsverfahren von Herstellungsbeispiel 16,
B. umgesetzt. Flashsäulenchromatographie
auf Silicagel mit 25% Ethylacetat:Hexan ergibt 2,63 g des Titelprodukts
als amorphen Feststoff (Diastereomerengemisch).
-
Die
physikalischen Eigenschaften sind folgende:
Fp 89–91°C.
1H-NMR (300 MHz, CDCl3): δ 7,50–7,35, 7,00–6,88, 6,50–5,69, 5,13–4,83, 3,31–2,89, 2,00–1,65, 1,42–0,90, 0,13
und 0,00.
(1H-NMR durch Vorhandensein
von Diastereomeren kompliziert.)
MS m/e (rel %): 566(5), 483(11),
393(5), 261(4), 213(8), 171(17), 129(7), 105(14), 91(100).
-
Herstellungsbeispiel 24:
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-benzyloxyphenyl)-2E-propenyl]-2H-pyran-2-on
-
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-benzyloxyphenyl)-3-trimethylsilyl-2E-propenyl]-2H-pyran-2-on
von Herstellungsbeispiel 23 (2,62 g) wird unter Verwendung des allgemeinen
Verfahrens von Herstellungsbeispiel 16, C. desilyliert, wobei 2,26
g Produkt erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 163–165°C.
1H-NMR durch Vorhandensein von Diastereomeren
kompliziert.
1H-NMR (300 MHz, CDCl3): δ 7,36–7,17, 6,84–6,78, 6,42–5,21, 4,98–4,77, 4,05–3,98, 3,15–2,75, 1,82–1,50, 1,19–0,78.
MS
m/e (rel %): 494(5), 411(35), 291(10), 270(4), 224(5), 213(7), 171(15),
105(36), 91(100).
-
Beispiel 31: 5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-hydroxyphenyl)propyl]-2H-pyran-2-on
-
5,6-Dihydro-4-hydroxy-6-cyclohexyl-6-phenyl-3-[1-(3-benzyl oxyphenyl)-2E-propenyl]-2H-pyran-2-on (2,22
g) von Herstellungsbeispiel 24 wird unter Verwendung des allgemeinen
Verfahrens von Herstellungsbeispiel 16, D. hydriert. Flashsäulenchromatographie
auf Silicagel mit 25–50%
Ethylacetat:Hexan ergibt 0,97 g des Titelprodukts als schaumigen
Feststoff und ein Diastereomerengemisch.
-
Die
physikalischen Eigenschaften sind folgende:
IR (Mineralölverreibung):
1645, 1616, 1599, 1588, 1448, 1334, 1260, 1255, 1235, 1160 cm–1.
1H-NMR (300 MHz, d6-DMSO): δ 9,01, 8,99,
7,32–7,20,
6,90–6,32,
3,83–3,45,
3,15–2,98,
1,95–1,50, 1,18–0,69, 0209
und 0,20.
HRMS gefunden: 406,2144.
Anal. gefunden: C,
75,36; H, 7,58; N, 0,10.
-
Herstellungsbeispiel 25:
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-(1-phenyl-3-trimethylsilyl-2E-propenyl)-2H-pyran-2-on
-
5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-2H-pyran-2-on
(2,50 g) von Herstellungsbeispiel 19 wird mit Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat
von Herstellungsbeispiel 17 unter Verwendung des allgemeinen Verfahrens
für eine
palladiumkatalysierte Alkylierung von Herstellungsbeispiel 16, B.
behandelt, wobei 6,50 g rohes Produkt erhalten werden. Die Reinigung
durch Flashsäulenchromatographie
auf Silicagel (25% Ethylacetat:Hexan) ergibt 2,68 g des Titelprodukts
als Diastereomerengemisch.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 7,44–7,05, 6,74–5,62, 5,10–5,03, 3,18–2,93, 2,05–1,90, 1,52–1,20, 0,91 und 0,89, 0,10
und 0,00. (1H-NMR durch Vorhandensein von
Diastereomeren kompliziert.)
MS m/e (rel %): 420(6), 402(9),
377(22), 303(14), 287(25), 274(12), 230(13), 184(34), 173(55), 73(100).
-
Beispiel 32: 5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-(1-phenylpropyl)-2H-pyran-2-on
-
- A) 5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-(1-phenyl-3-trimethylsilyl-2E-propenyl)-2H-pyran-2-on
(2,65 g) von Herstellungsbeispiel 25 wird unter Verwendung des allgemeinen
Verfahrens von Herstellungsbeispiel 16, C. desilyliert, wobei 2,21
g des gewünschten
Produkts erhalten werden, das zur nächsten Umsetzung ohne eine
weitere Reinigung weitergeführt
wird.
Die physikalischen Eigenschaften sind folgende:
MS
m/e (rel %): 348(18), 330(19), 305(37), 287(29), 277(17), 230(17),184(28),
173(49), 146(41), 131(49), 117(100).
- B) 5,6-Dihydro-4-hydroxy-6-phenyl-6-propyl-3-(1-phenyl-2E-propenyl)-2H-pyran-2-on
von Teil A (2,2 g) wird unter Verwendung des allgemeinen Verfahrens
von Herstellungsbeispiel 16, D. hydriert. Das Produkt wird aus Acetonitril
kristallisiert, wobei 947 mg des gewünschten Titelprodukts erhalten
werden. NMR zeigte, dass ein Diastereomer aus dem Diastereomerengemisch
kristallisiert war.
-
Die
physikalischen Eigenschaften eines Diastereomers sind folgende:
Fp
197–198°C.
1H-NMR (300 MHz, d6-DMSO): δ 7,35–7,23, 7,12–6,98, 3,72–3,68, 3,07,
2,05–1,65,
1,30–1,10,
1,08–0,90, 0,77,
0,50.
MS m/e (rel %): 350(5), 332(4), 306(42), 277(29), 173(91),
159(47), 146(52).
IR (Mineralölverreibung): 1642, 1603, 1595,
1575, 1448, 1329, 1317, 1276 cm–1.
Analyse
gefunden: C, 78,50; H, 7,61.
-
Herstellungsbeispiel 26:
4-Hydroxy-1-oxaspiro[5,5]undec-3-en-2-on
(Formel K-1(c)) Siehe Reaktionsschema K
-
Cyclohexanon
(3,89 g) wird in das Titelprodukt unter Verwendung des allgemeinen
Verfahrens für
die Dianionsynthese von 5,6-Dihydropyran-2-onen von Herstellungsbeispiel
16, A. umgewandelt. Kristallisation aus Methanol:Diethylether ergibt
das gewünschte
Titelprodukt (3,26 g).
-
Die
physikalischen Eigenschaften sind folgende:
Fp 118–120°C.
1H-NMR (300 MHz, CDCl3): δ 3,41, 2,67,
1,89–1,72,
1,60–1,32.
13C-NMR (75 MHz, CDCl3): δ 200,7, 167,3,
80,4, 49,4, 44,4, 36,8, 24,5, 21,4.
MS m/e (rel %): 182(41),
139(28), 126(86), 111(11), 98(44), 84(100).
IR (Mineralölverreibung):
1653, 1615, 1581, 1351, 1325, 1285, 1265, 1256, 1223, 1014 cm–1.
Analyse
gefunden: C, 66,24; H, 7,88, N, 0,17.
-
Herstellungsbeispiel 27:
4-Hydroxy-1-oxa-8-[1-phenyl-3-trimethylsilyl-2E-propenyl]spiro[5,5]undec-3-en-2-on (Formel
K-3(c)) Siehe Reaktionsschema K
-
4-Hydroxy-1-oxaspiro[5,5]undec-3-en-2-on
(1,06 g) wird mit Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat
von Herstellungsbeispiel 17 unter Verwendung des allgemeinen Verfahrens
für die
palladiumkatalysierte Alkylierung von Herstellungsbeispiel 16, B.
umgesetzt, wobei 2,75 g des rohen Titelprodukts erhalten werden.
Flashsäulenchromatographie
auf Silicagel mit 5% Methanol:Toluol und eine anschließend ähnliche
Chromatographie mit 20% Ethylace tat:Hexan ergeben 1,26 g des gewünschten
Titelprodukts.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 7,30–7,13, 6,52, 6,43, 5,65, 5,00,
2,45, 1,99–1,82,
1,79–1,20,
0,00.
MS m/e (rel %): 370(6), 352(15), 280(23), 247(19), 231(18),
198(17), 184(14), 173(21), 157(25), 73(100).
IR (Mineralölverreibung):
1641, 1612, 1602, 1450, 1303, 1287, 1261, 1247 cm–1.
-
Herstellungsbeispiel 28:
4-Hydroxy-1-oxa-3-(1-phenyl-2-propenyl)spiro[5,5]undec-3-en-2-on
-
4-Hydroxy-1-oxa-8-[1-phenyl-3-trimethylsilyl-2E-propenyl]spiro[5,5]undec-3-en-2-on
(1,25 g) von Herstellungsbeispiel 27 wird unter Verwendung des allgemeinen
Verfahrens desilyliert. Flashsäulenchromatographie
auf Silicagel mit 25% Ethylacetat:Hexan ergibt 660 mg eines schaumigen
Feststoffs.
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
298,1567.
IR (Mineralölverreibung):
1631, 1493, 1449, 1431, 1338, 1331, 1316, 1304, 1286, 1268, 1244,
1232 cm–1.
-
Beispiel 33: 4-Hydroxy-1-oxa-3-(1-phenylpropyl)spiro[5,5]undec-3-en-2-on-natriumsalz
-
4-Hydroxy-1-oxa-3-(1-phenyl-2-propenyl)spiro[5,5]undec-3-en-2-on (0,63 g)
von Herstellungsbeispiel 28 wird unter Verwendung des allgemeinen
Verfahrens hydriert, wobei 640 mg Produkt als Öl erhalten werden. Das Öl wird in
Methanol gelöst
und mit 0,487 ml Natriummethoxid (25 Gew.-% in Methanol) versetzt.
Das Gemisch wird unter Vakuum eingedampft und aus Acetonitril kristallisiert,
wobei 375 mg des Titel produkts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 201–204°C.
1H-NMR (300 MHz, CD3OD): δ 7,55, 7,30,
7,16, 4,23, 2,52, 2,46–2,35,
2,23–2,02,
1,96–1,83,
1,78–1,50,
1,08.
13C-NMR (75 MHz, CD3OD): δ 183,5, 172,8,
149,0, 129,1, 128,0, 125,2, 99,1, 77,7, 45,6, 42,5, 87,2, 37,0,
26,7, 26,2, 22,9, 13,5.
FAB-MS [M + H]+ bei
m/z 323.
IR (Mineralölverreibung):
1629, 1515, 1450, 1421, 1409, 1365, 1341, 1310 cm–1.
Analyse
gefunden: C, 68,60; H, 7,25.
-
Beispiel 34: Dihydro-6-methyl-6-phenyl-3-(1-phenyl-2-propenyl)-2H-pyran-2,4(3H)-dion
-
Die
physikalischen Eigenschaften sind folgende: Fp 147–149°C.
-
Beispiel 35: Dihydro-3-(1-(3-hydroxyphenyl)propyl]-6-phenyl-6-propyl-2H-pyran-2,4(3H)-dion
-
Die
physikalischen Eigenschaften des Diastereomerengemischs sind folgende:
MS
m/e (relative Intensität):
366(100), 192(34), 175(78), 146(89).
-
Herstellungsbeispiel 29:
4-Hydroxy-6-phenethyl-2H-pyran-2-on
(Formel M-2) Siehe Reaktionsschema M
-
In
einen flammgetrockneten Kolben, der eine gerührte Lösung von 0,90 ml Diisopropylamin
in 6 ml wasserfreiem Tetrahydrofuran bei –78°C unter Argonatmosphäre enthält, werden
4,0 ml einer 1,6 M Lösung von
n-Butyllithium in Hexan gege ben. Die gebildete Lösung wird sich während 20
min auf 0°C
erwärmen
gelassen und dann über
eine Kanüle
mit einer Lösung
von 378 mg von im Handel erhältlichem
4-Hydroxy-6-methyl-2-pyron
der Formel M-1 in 15 ml Tetrahydrofuran behandelt. Die gebildete
rote dicke Aufschlämmung
wird langsam mit 6,0 ml destilliertem Hexamethylphosphoramid behandelt
und 30 min gerührt.
Die rote trübe
Lösung
wird dann mit 0,36 ml Benzylbromid behandelt. Das Reaktionsgemisch
wird schnell eine tieforange Lösung
und wird weitere 60 min bei 0°C
gerührt.
Das Gemisch wird mit überschüssiger 1
N wässriger
Salzsäure gequencht
und das gebildete gelbe zweiphasige Gemisch wird eingeengt, um das
Tetrahydrofuran zu entfernen. Das gebildete Gemisch wird zwischen
Dichlormethan und Wasser verteilt und die saure wässrige Phase wird
ferner mit weiteren Portionen Dichlormethan extrahiert. Die vereinigten
organischen Phasen werden über Magnesiumsulfat
getrocknet und dann unter vermindertem Druck eingeengt. Das gebildete
Material wird mit einem großen
Volumen Diethylether verdünnt
und mit verdünnter
wässriger
Salzsäure
gewaschen. Die Etherphase wird mit zwei weiteren Portionen Salzsäure, einmal
mit Kochsalzlösung
gewaschen, über
Magnesiumsulfat getrocknet und schließlich unter vermindertem Druck
eingeengt. Der Rückstand
wird auf Silicagel 60 (230–400
mesh) unter Elution mit 1% Essigsäure und 20% bis 40% Ethylacetat
in Dichlormethan flashchromatographiert, wobei 440 mg der Titelverbindung
als lohfarbener Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 2,7, 3,0,
5,46, 5,84, 7,1–7,3.
DC
Rf 0,38 (1% Essigsäure und 25% Ethylacetat in
Dichlormethan)
Fp 137–138°C.
-
Herstellungsbeispiel 30:
6-(α-Ethyl-phenethyl)-4-hydroxy-2H-pyran-2-on (Formel
M-3) Siehe Reaktionsschema M
-
Zu
einer kalten (–78°C) gerührten Lösung von
0,29 ml Diisopropylamin in 4 ml trockenem Tetrahydrofuran unter
Argon werden 1,2 ml einer 1,6 M Lösung von n-Butyllithium in
Hexan gegeben. Die Lösung
wird auf 0°C
erwärmt,
10 min bei dieser Temperatur gehalten und dann auf –30°C gekühlt. In
diese Lösung
wird über
eine Kanüle
eine Lösung
von 189 mg der Verbindung von Herstellungsbeispiel 29 in 4 ml Tetrahydrofuran gegeben.
Das gebildete heterogene Gemisch wird auf 0°C erwärmt und mit ausreichend Hexamethylphosphoramid
(etwa 1 ml) versetzt, um das Gemisch größtenteils homogen zu machen.
Nach 30-minütigem
Rühren des
Gemischs bei 0°C
werden 77 μl
Ethyliodid tropfenweise zugegeben. Nach weiteren 90 min wird das
Reaktionsgemisch mit 1 N Salzsäure
im Überschuss
gequencht und Tetrahydrofuran unter vermindertem Druck entfernt.
Der Rückstand
wird mit drei Portionen Ethylacetat extrahiert, und der vereinigte
organische Extrakt wird mit verdünnter
Salzsäure
gewaschen, getrocknet (Magnesiumsulfat) und unter vermindertem Druck
eingeengt. Der Rückstand
wird auf Silicagel 60 (230–400
mesh) unter Verwendung von 1% Essigsäure und 25% Ethylacetat in
Dichlormethan flashchromatographiert, wobei 182 mg der Titelverbindung
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,85, 1,6,
2,6, 2,9, 5,59, 5,86, 7,0–7,3.
FAB-MS
[M + H] = 245, 1185.
DC Rf 0,33 (1%
Essigsäure
und 25% Ethylacetat in Dichlormethan)
-
Beispiel 36: 3-(α-Cyclopropyl-meta-(benzyloxycarbonylamino)benzyl)-6-(α-ethyl-phenethyl)-4-hydroxy-2H-pyran-2-on
(Formel M-4) Siehe Reaktionsschema M
-
Ein
Gemisch aus 181 mg der Titelverbindung von Herstellungsbeispiel
30, 220 mg der Titelverbindung von Herstellungsbeispiel 37 (siehe
im folgenden), 28 mg p-Toluolsulfonsäuremonohydrat und 600 mg von 3-Å-Molekularsieben
in 2 ml Benzol wird 21 h unter Argon unter Rückflusskühlung erhitzt, und dann gekühlt und über Celite
filtriert. Das Filtrat wird unter vermindertem Druck eingeengt und
der Rückstand
wird auf Silicagel 60 (230–400
mesh) unter Verwendung von 50–100%
Ethylacetat in Hexan flashchromatographiert, wobei 250 mg eines
Gemischs von Materialien erhalten werden. Dieses wird erneut einer
Silicagelchromatographie unter Verwendung von 5–20% Ethylacetat in Dichlormethan
unterzogen, wobei 154 mg (40%) der Titelverbindung erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,26, 0,48,
0,67, 0,81, 1,6, 1,8, 2,5, 2,7, 2,9, 3,48, 5,14, 5,86, 6,81, 7,0–7,5, 9,46.
EI-HRMS
m/z = 523,2350.
DC Rf 0,27 (5% Ethylacetat
in Dichlormethan)
-
Herstellungsbeispiel 31:
3-(α-Cyclopropyl-meta-aminobenzyl)-6-(α-ethyl-phenethyl)-4-hydroxy-2H-pyran-2-on (Formel
M-5) Siehe Reaktionsschema M
-
Ein
Gemisch von 146 mg der Titelverbindung von Beispiel 36 und 50 mg
von 5% Palladium-auf-Kohle in 2 ml Methanol wird 2 h unter 40 psi
Wasserstoff geschüttelt
und dann über
Celite filtriert. Das Filtrat wird unter vermindertem Druck eingeengt,
wobei 105 mg (96%) der Titelverbindung erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,25, 0,5,
0,65, 0,81, 1,6, 2,5, 2,7, 2,9, 3,4, 5,79, 6,5, 6,8–7,3.
DC
Rf 0,38 (30% Ethylacetat in Dichlormethan)
-
Beispiel 37: N-(3-(Cyclopropyl-[6-(1-ethyl-phenethyl)-4-hydroxy-2-oxo-2H-pyran-3-yl]-methyl)-phenyl)-3-(tert-butyloxycarbonylamino)-propionamid
(Formel M-6) Siehe Reaktionsschema M
-
Zu
einer gerührten
Lösung
von 50 mg der Titelverbindung von Herstellungsbeispiel 31 und 29
mg tert-Butyloxycarbonyl-β-alanin in 0,5 ml
Dichlormethan werden 22 μl
Diisopropylcarbodiimid gegeben. Die Lösung wird 18 h gerührt und
dann auf Silicagel 60 (230–400
mesh) unter Verwendung von 5–10
Methanol und 30% Ethylacetat in Dichlormethan flashchromatographiert.
Erhalten werden 71 mg Produkt, das durch Nebenprodukte der Kopplungsreaktion
verunreinigt ist. Das Material wird erneut auf Silica unter Verwendung
von 30–70
Ethylacetat in Dichlormethan chromatographiert, wobei 34 mg (47%)
der Titelverbindung als weißer Feststoff
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,2, 0,5,
0,6, 0,81, 1,41, 1,6, 1,8, 2,4, 2,8, 2,9, 3,3, 3,4, 5,4, 5,8, 7,0–7,3, 7,5.
FAB-HRMS
[m + H] = 561,2995.
DC Rf 0,17 (30%
Ethylacetat in Dichlormethan)
-
Herstellungsbeispiel 32:
6-(α-Cyclopropylmethyl-cyclopropylethyl)-4-hydroxy-2H-pyran-2-on
(Formel N-2) Siehe Reaktionsschema N
-
Zu
einer kalten (–78°C) gerührten Lösung von
1,5 ml Diisopropylamin in 9 ml trockenem Tetrahydrofuran unter Argon
werden 6,2 ml einer 1,6 M Lösung
von n-Butyllithium in Hexan gegeben. Die Lösung wird auf 0°C erwärmt und
in diese wird über
eine Kanüle
eine Lösung
von 378 mg von im Handel erhältlichem
4-Hydroxy-6-methyl-2-pyron der Formel N-1 in 8 ml Hexamethylphosphoramid
gegeben. Nach 30 min bei 0°C
werden 0,32 ml Brommethylcyclopropan zugegeben; nach weiteren 10
min wird eine zweite Portion der gleichen Menge zugegeben. Das Reaktionsgemisch
wird über
Nacht gerührt
und sich auf Raumtemperatur erwärmen
gelassen und dann zwischen Ethylacetat und verdünnter Salzsäure im Überschuss verteilt. Die organische
Phase wird mit Kochsalzlösung
gewaschen, über
Magnesiumsulfat getrocknet und unter vermindertem Druck eingeengt.
Der Rückstand
wird auf Silicagel 60 (230–400
mesh) unter Verwendung von 1% Essigsäure und 25 Ethylacetat in Dichlormethan
flashchromatographiert, wobei 371 mg der Titelverbindung zusammen
mit 206 mg eines monoalkylierten Materials erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,0, 0,4,
0,6, 1,5, 1,6, 2,2, 5,6, 6,1, 7,2–7,3, 11,5.
EI-MS m/z
= 234.
DC Rf 0,29 (1% Essigsäure und
25% Ethylacetat in Dichlormethan)
-
Beispiel 38: 3-(α-Cyclopropyl-meta(tert-butyloxycarbonylamino)benzyl)-6-(α-cyclopropylmethyl-cyclopropylethyl)-4-hydroxy-2H-pyran-2-on
(Formel N-3) Siehe Reaktionsschema N
-
Ein
Gemisch von 367 mg der Titelverbindung von Herstellungsbeispiel
32, 470 mg der Titelverbindung von Herstellungsbeispiel 37 (siehe
im folgenden), 60 mg p-Toluolsulfonsäuremonohydrat und 1 g von 3-Å-Sieben
in 5 ml Benzol wird unter Rühren über Nacht
unter Argon erhitzt. Das Gemisch wird mit Dichlormethan und Ether
verdünnt
und über
einen Natriumsulfatpfropfen filtriert. Nach dem Entfernen des Lösemittels
unter vermindertem Druck wird der Rückstand auf Silicagel 60 (230–400 mesh)
unter Verwendung von 5–20
Ethylacetat in Dichlormethan flashchromatographiert, wobei 399 mg
der Titelverbindung erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ –0,06, 0,3,
0,5, 1,4, 1,5, 2,3, 3,5, 5,1, 7,2–7,4.
EI-HRMS m/z = 513,2513.
DC
Rf 0,28 (5% Ethylacetat in Dichlormethan)
-
Herstellungsbeispiel 33:
3-(α-Cyclopropyl-metaaminobenzyl)-6-(α-cyclopropylmethyl-cyclopropylethyl)-4-hydroxy-2H-pyran-2-on
(Formel N-4) Siehe Reaktionsschema N
-
Ein
Gemisch von 391 mg der Titelverbindung von Beispiel 38 und 100 mg
von 5% Palladium-auf-Kohle in 10 ml Methanol wird über Nacht
unter 40 psi Wasserstoff geschüttelt.
Das Gemisch wird dann über
Celite filtriert und das Filtrat wird unter vermindertem Druck eingeengt,
wobei 280 mg der Titelverbindung erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,0, 0,2–0,7, 1,4,
1,6, 1,8, 2,6, 6,8, 7,2–7,4.
DC
Rf 0,38 (30% Ethylacetat in Dichlormethan)
-
Beispiel 39: N-(3-(Cyclopropyl-[6-(2-Cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-2-oxo-2H-pyran-3-yl]-methyl)-phenyl)-3-indol-1-yl-propionamid
(Formel N-5) Siehe Reaktionsschema N
-
Eine
gerührte
Lösung
von 50 mg der Titelverbindung von Herstellungsbeispiel 33 und 27
mg 3-(1-Indolyl)-propionsäure
in 1 ml Dichlormethan und 0,1 ml Dimethylformamid wird auf 0 gekühlt und
mit 23 μl
Diisopropylcarbodiimid versetzt. Die Lösung wird sich langsam über Nacht
auf Raumtemperatur erwärmen
gelassen und am folgenden Tag wird das Lösemittel unter vermindertem
Druck entfernt. Der Rückstand
wird auf Silicagel 60 (230–400
mesh) unter Verwendung von 0–4%
Methanol und 20% Ethylacetat in Dichlormethan flashchromatographiert;
wobei 24 mg der Titelverbindung als weißer Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ –0,06, 0,2–0,7, 1,4,
1,5, 2,6, 3,5, 4,4, 6,06, 6,41, 7,0–7,7, 7,80.
DC Rf 0,41 (20% Ethylacetat in Dichlormethan)
-
Herstellungsbeispiel 34:
Cyclopropyl-meta-nitrophenylketon (Formel O-2) Siehe Reaktionsschema
O
-
Ein
mit einem Thermometer und Zugabetrichter ausgestatteter 250-ml-Dreihalskolben
wird mit 130 ml rauchender 90%-iger Salpetersäure beschickt. Dieser wird
in einem Acetonbad von –40°C auf –10°C gekühlt und
in die gerührte
Flüssigkeit
werden tropfenweise 21 ml von im Handel erhältlichem Cyclopropylphenylketon der
Formel O-1 gegeben. Die Zugaberate wird so geregelt, dass die Reaktionstemperatur
bei etwa –10°C gehalten
wird. Die fertige klare gelbe Lösung
wird weitere 10 min bei –10°C gerührt und
dann auf 1 l zerstoßenes Eis
gegossen. Der ausgefallene gummiartige gelbe Feststoff wird mit
700 ml Toluol extrahiert und der Extrakt wird zweimal mit 5%-iger
Natriumhydroxidlösung
und einmal mit Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Nach dem Entfernen des Lösemittels
unter vermindertem Druck wird der Rückstand aus Methanol bei –25°C umkristallisiert,
wobei 14,6 g der Titelverbindung als dichte blassgelbe Prismen erhalten
werden. Die Mutterlauge enthielt wesentliche Mengen des ortho-Isomers.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 1,2, 1,3,
2,7, 7,70, 8,3, 8,4, 8,85.
IR 1664, 1529, 1352, 1225, 1082,
1017, 852, 689 cm–1.
Anal. gefunden:
C, 62,89; H, 4,73; N, 7,32.
EI-MS m/z 191.
DC Rf 0,32 (25% Ethylacetat in Hexan)
-
Herstellungsbeispiel 35:
meta-Aminophenylcyclopropylketon (Formel O-3) Siehe Reaktionsschema
O
-
Eine
Lösung
von 5,76 g der Titelverbindung von Herstellungsbeispiel 34 wird
mit Hilfe von Wärme
in 100 ml Methanol hergestellt. Zu dieser werden 450 mg eines 5%
Platin-auf-Kohle-Katalysators
gegeben und das Gemisch wird unter einer Atmosphäre Wasserstoff kräftig gerührt. Nach
5 h wird das Gemisch über
einen Celitepfropfen filtriert und das Filtrat unter vermindertem
Druck eingeengt, wobei 4,89 g der Titelverbindung als grünliches Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 1,0, 1,2,
2,6, 3,9, 6,8, 7,2, 7,4.
DC Rf 0,50
(80% Ethylacetat in Hexan)
-
Herstellungsbeispiel 36:
meta-Benzyloxycarbonylaminophenylcyclopropylketon (Formel O-4) Siehe
Reaktionsschema O
-
Zu
einer kalten (0°C)
gerührten
Lösung
von 4,89 g der Titelverbindung von Herstellungsbeispiel 35 und 6,3
ml Diisopropylethylamin in 90 ml Dichlormethan werden tropfenweise
4,7 ml Benzylchlorformiat gegeben, und die fertige Lösung wird
sich auf Raumtemperatur erwärmen
gelassen. Nach 4 h wird das Gemisch mit verdünnter Salzsäure gewaschen und die wässrige Phase
mit zwei weiteren Portionen Dichlormethan extrahiert. Die vereinigte
organische Phase wird über
Magnesiumsulfat getrocknet und unter vermindertem Druck zu einem
gelben Feststoff eingeengt. Dieser wird mit zwei 30-ml-Portionen
Hexan verrieben, die verworfen werden, und der verbliebene Feststoff
wird unter Vakuum getrocknet, wobei 8,74 g der Titelverbindung erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
DC Rf 0,45
(5% Ethylacetat in Dichlormethan)
-
Herstellungsbeispiel 37:
meta-Benzyloxycarbonylaminophenylcyclopropylcarbinol (Formel O-5)
Siehe Reaktionsschema O
-
Zu
einer gerührten
Lösung
von 8,74 g der Verbindung O-4 in 100 ml Tetrahydrofuran und 100
ml Ethanol werden in Portionen 4,5 g Natriumborhydrid gegeben. Nach
3 h bei Raumtemperatur wird das Gemisch zur Zugabe von 100 ml 1
N Salzsäure
in Eis gekühlt.
Das Gemisch wird dreimal mit Dichlormethan extrahiert und der vereinigte
Extrakt wird über
Magnesiumsulfat getrocknet. Das Lösemittel wird unter vermindertem
Druck entfernt und der Rückstand
wird über
Silicagel 60 (230–400
mesh) unter Verwendung von 40% Ethylacetat in Hexan flashchromatographiert,
wobei 8,48 g der Titelverbindung als weißer kristalliner Feststoff
erhalten werden. Dieser wird optional aus Ethylacetat-Hexan umkristallisiert.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,3–0,6, 1,1,
2,35, 3,92, 5,17, 7,1, 7,2–7,4.
IR
1693, 1599, 1449, 1235, 1054, 697 cm–1.
Anal.
gefunden: C, 72,57; H, 6,51; N, 4,61.
-
Beispiele 40–76
-
Gemäß den oben
beschriebenen analogen Verfahren und unter Verwendung von Ausgangsmaterialien
und Reagentien, die einem Fachmann üblicher Erfahrung auf dem Gebiet
der organischen Synthese ohne weiteres bekannt und verfügbar sind,
werden die folgenden weiteren Verbindungen der vorliegenden Erfindung
hergestellt:
-
Beispiel 40: 4-Hydroxy-3-(1-phenyl-propyl)-6-(1-propyl-butyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Schmelzpunkt: 132–134°C.
-
Beispiel 41: 4-Hydroxy-3-(1-phenyl-allyl)-6-(1-propyl-butyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Schmelzpunkt: 114–116°C.
-
Beispiel 42: 3-(5-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-oxo-6H-pyran-2-yl)-propionsäure-tert-butylester
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 71,16; H, 7,19.
-
Beispiel 43: 3-(Cyclopropyl-phenyl-methyl)-6-(2-(3,5-dimethyl-isoxazol-4-yl)ethyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 71,07; H, 6,17; N, 4,28.
-
Beispiel 44: 6-(2-(5-tert-Butyl-(1,2,4)oxadiazol-3-yl)-ethyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 70,26; H, 6,68; N, 6,10.
HRMS gefunden: 394,1896.
-
Beispiel 45: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-(tetrahydro-furan-3-ylmethyl)-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 74,51; H, 7,63.
HRMS gefunden: 368,1981.
-
Beispiel 46: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(2-phenyl-1-pyridin-2-ylmethyl-ethyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
437,1989.
-
Beispiel 47: 3-(Cyclopropyl-phenyl-methyl)-6-(2-(1,3)dioxolan-2-yl-ethyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
342,1462.
-
Beispiel 48: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(4-morpholin-4-yl-butyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
383,2108.
-
Beispiel 49: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(2-pyridin-2-yl-ethyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
347,1531.
-
Beispiel 50: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(2-(2-methyl-thiazol-4-yl)-ethyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
367,1247.
-
Beispiel 51: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(2-(chinolin-2-yl-ethyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
397,1688.
-
Beispiel 52: 6-(1-(5-Chlor-thiophen-2-ylmethyl)-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
414,1042.
-
Beispiel 53: 6-(3-Chlor-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 67,61; H, 5,89.
-
Beispiel 54: 3-(Cyclopropyl-phenyl-methyl)-6-(1-(3,5-dimethyl-isoxazol-4-ylmethyl)-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
393,1932.
-
Beispiel 55: 6-(1-(2-(4-Chlor-phenyl)-thiazol-4-ylmethyl)-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 68,25; H, 5,58; N, 2,52.
-
Beispiel 56: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-(tetrahydro-furan-2-ylmethyl)-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
368,1984.
-
Beispiel 57: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-thiophen-2-ylmethyl-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 72,33; H, 6,32.
-
Beispiel 58: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-tetrahydro-pyran-4-ylmethyl)-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
382,2142.
-
Beispiel 59: 3-(Cyclopropyl-phenyl-methyl)-6-(1-furan-2-ylmethyl-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
364,1673.
-
Beispiel 60: 3-(Cyclopropyl-phenyl-methyl)-6-(1-(1,3)dioxolan-2-ylmethyl-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
370,1775.
-
Beispiel 61: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-(tetrahydro-pyran-3-ylmethyl)-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
382,2140.
-
Beispiel 62: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-(tetrahydro-pyran-2-ylmethyl)-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
382,2141.
-
Beispiel 63: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-pyridin-2-ylmethyl-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
375,1837.
-
Beispiel 64: 6-(4-Chlor-1-ethyl-butyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Anal. gefunden:
C, 69,65; H, 7,02; N, 8,26.
HRMS gefunden: 360,1492.
-
Beispiel 65: 3-(Cyclopropyl-phenyl-methyl)-6-(3-(1,3)dioxan-2-yl-1-ethyl-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
398,2094.
-
Beispiel 66: 6-(3-Chlor-1-ethyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
346,1332.
-
Beispiel 67: 3-(Cyclopropyl-phenyl-methyl)-6-[ethyl-3-(tetrahydro-pyran-2-yloxy)-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
412,2237.
-
Beispiel 68: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-pyridin-4-ylmethyl-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
375,1829.
-
Beispiel 69: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-3-morpholin-4-yl-3-oxo-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
411,2057.
-
Beispiel 70: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-pyridin-3-ylmethyl-propyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
375,1827.
-
Beispiel 71: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-3-thiophen-3-yl-propyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
394,1593.
-
Beispiel 72: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-[1-(tetrahydro-pyran-3-ylmethyl)-butyl]-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
396,2298.
-
Beispiel 73: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-4-morpholin-4-yl-butyl)-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
41,2404.
-
Beispiel 74: 3-(Cyclopropyl-phenyl-methyl)-6-[1-(2,3-dihydro-benzo[1,4]dioxin-2-ylmethyl)-propyl]-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
432,1931.
-
Beispiel 75: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-isobutyl-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
298,1566.
-
Beispiel 76: 3-(Cyclopropyl-phenyl-methyl)-6-[1-(5,6-dihydro-2H-pyran-3-ylmethyl)-propyl]-4-hydroxy-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden:
380,1987.
-
Herstellungsbeispiel 38:
5-Brom-4-hydroxy-6-methyl-3-(1-phenyl-propyl)-pyran-2-on
(Formel P-2) Siehe Reaktionsschema P
-
In
einen Kolben, der eine Suspension von 110 mg 5-Brom-4-hydroxy-6-methyl-pyran-2-on
der Formel P-1 (die Herstellung dieses Materials ist in Syn. Comm.
1984, 14, 521 beschrieben) und 30 mg p-Toluolsulfonsäurehydrat
in 10 ml Benzol enthält,
werden 0,25 ml von handelsüblichem
1-Phenyl-1-propanol
gegeben. Der Kolben wird mit einem weiteren Trichter, der 3-Å-Molekularsiebe
(mit Benzol vorgenässt)
enthält,
und einem Rückflusskühler unter
einem Argonballon ausgestattet. Das Gemisch wird in ein Ölbad von
100°C gegeben. Nach
12 h wird die gebildete Lösung
auf Raumtemperatur gekühlt
und zwischen Diethylether und 1 N wässrigem Natriumhydroxid im Überschuss
verteilt. Die basische wässrige
Phase wird mit Diethylether gewaschen, mit 6 N wässri ger Salzsäure auf
pH 1 angesäuert
und der gebildete Niederschlag wird wiederholt mit Chloroform-Methanol
extrahiert. Die vereinigten organischen Schichten werden mit Kochsalzlösung gewaschen,
getrocknet (Magnesiumsulfat) und unter vermindertem Druck eingeengt.
Der Rückstand
wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 100% Ethylacetat bis 20% Methanol
in Ethylacetat gereinigt, wobei 123 mg des Titelprodukts als weißer Feststoff
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,42, 7,22,
7,12, 4,20, 2,32, 2,28, 2,09, 0,90.
EI-MS: [M+]
= 322,0216 gefunden
-
Beispiel 77: 5-Brom-6-(2-cyclopropyl-cyclopropylmethylethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
(Formel P-3) Siehe
Reaktionsschema P
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
0,23 ml destilliertes Diisopropylamin und 1,6 ml trockenes Tetrahydrofuran
gegeben. Die Lösung
wird auf –78°C gekühlt und
mit 1,0 ml (1,6 M in Hexan) n-Butyllithium behandelt. Die Lösung wird
15 min auf 0°C
erwärmt
und dann auf –30°C gekühlt. Die Lithiumdiisopropylaminlösung wird
mit 162 mg 5-Brom-4-hydroxy-6-methyl-3-(1-phenyl-propyl)-pyran-2-on (das Titelprodukt
von Herstellungsbeispiel 38) als Lösung in 2,5 ml Tetrahydrofuran
behandelt. Die gebildete orangerote Lösung wird 30 min gerührt, während die
Badtemperatur auf –20°C steigt.
Die Lösung
wird dann mit 0,11 ml von handelsüblichem (Brommethyl)cyclopropan
behandelt. Das Reaktionsgemisch wird sich über 3 h auf 0°C erwärmen gelassen.
Das Reaktionsgemisch wird dann mit 1 N wässriger Salzsäure im Überschuss gequencht
und zwischen Ethylacetat und Wasser verteilt. Die wässrige Phase
wird mit Ethylacetat extrahiert und die vereinigten organischen Schichten
werden getrocknet (Magnesiumsulfat) und dann unter vermindertem
Druck eingeengt. Der Rückstand
wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 2% bis 10% Ethylacetat in Dichlormethan
gereinigt, wobei 98 mg des Titelprodukts als lohfarbenes Öl erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,45, 7,3–7,1, 6,34,
4,24, 3,31, 2,3–2,1,
1,6–1,2,
0,91, 0,55, 0,35, 0,4–0,1;
EI-MS:
[M+] = 430,1134 gefunden.
-
Herstellungsbeispiel 39:
3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-5-[2-(2-methoxy-ethoxy)-ethyl]-6-methyl-pyran-2-on
(Formel Q-2) Siehe Reaktionsschema Q
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
0,60 ml destilliertes Diisopropylamin und 4,0 ml trockenes Tetrahydrofuran
gegeben. Die Lösung
wird auf –78°C gekühlt und
mit 2,7 ml (1,6 M in Hexan) n-Butyllithium behandelt. Die Lösung wird
20 min auf 0°C
erwärmt
und dann auf –40°C gekühlt. Die Lithiumdiisopropylaminlösung wird
mit 513 mg 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-methyl-pyran-2-on der
Formel Q-1 (hergestellt wie in Beispiel 20 beschrieben) als Lösung in
17 ml Tetrahydrofuran behandelt. Das orange Dianion bildet sich
während
20 min, während
die Badtemperatur auf –20°C steigt.
Die Lösung
wird dann mit 565 mg 2-(2-Methoxy-ethoxy)-ethyltosylat als Lösung in
2 ml Tetrahydrofuran behandelt. Das Reaktionsgemisch wird sich über 2 h
langsam auf 0°C
erwärmen
gelassen. Das Reaktionsgemisch wird mit 1 N wässriger Salzsäure im Überschuss
gequencht und unter vermindertem Druck eingeengt. Der Rückstand
wird zwischen Ethylacetat und Wasser verteilt. Die wässrige Phase
wird mit weiteren Portionen Ethylacetat extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Magnesiumsulfat) und dann
unter ver mindertem Druck eingeengt. Der Rückstand wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 50 bis 100% Ethylacetat in Hexan
gereinigt, wobei 105 mg des Titelprodukts als lohfarbenes Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 8,75, 7,50,
7,26, 7,17, 3,68, 3,48, 3,33, 2,66, 2,20, 2,0–1,8, 0,68, 0,50, 0,28;
EI-MS:
[M+] = 358,1777 gefunden.
-
Beispiel 78: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-5-[2-(2-methoxy-ethoxy)-ethyl]-6-propyl-pyran-2-on (Formel
Q-3) Siehe Reaktionsschema Q
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
0,125 ml destilliertes Diisopropylamin und 1,0 ml trockenes Tetrahydrofuran
gegeben. Die Lösung
wird auf –78°C gekühlt und
mit 0,5 ml (1,6 M in Hexan) n-Butyllithium behandelt. Die Lösung wird
15 min auf 0°C
erwärmt
und dann auf –30°C gekühlt. Die
Lithiumdiisopropylaminlösung
wird mit 93 mg 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-5-[2-(2-methoxy-ethoxy)-ethyl]-6-methyl-pyran-2-on
(das Titelprodukt von Herstellungsbeispiel 39) als Lösung in
2,5 ml Tetrahydrofuran behandelt. Das orange Dianion bildet sich
während
30 min, während
die Badtemperatur auf –20°C steigt.
Die Lösung
wird dann mit 55 μl
Ethyliodid behandelt. Das Reaktionsgemisch wird sich über 2 h auf
0°C erwärmen gelassen.
Das Reaktionsgemisch wird mit 1 N wässriger Salzsäure im Überschuss
gequencht und zwischen Ethylacetat und Kochsalzlösung verteilt. Die wässrige Phase
wird mit weiteren Portionen Ethylacetat extrahiert. Die vereinigten
organischen Schichten werden getrocknet (Magnesiumsulfat) und dann
unter vermindertem Druck eingeengt. Der Rückstand wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 2% bis 6% Ethylacetat in Dichlor methan
gereinigt, wobei 51 mg des Titelprodukts als lohfarbenes Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 8,77, 7,54,
7,3–7,1,
3,67, 3,46, 3,31, 2,66, 2,43, 1,95, 1,66, 0,94, 0,67, 0,49, 0,26;
EI-MS:
[M+] = 386, 2097 gefunden.
-
Herstellungsbeispiel 40:
3-Benzyl-4-phenyl-but-2-ensäure-tert-butylester (Formel
R-2) Siehe Reaktionsschema R
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
400 mg Natriumhydrid (60 Gew.-% in Öl) und 5 ml trockenes Benzol
gegeben. Die graue Suspension wird auf 5°C gekühlt und tropfenweise mit 2,0
ml des Reagens tert-Butyl-P,P-dimethylphosphonoacetat
zur Kontrolle der Reaktion behandelt. Nach 10 min wird das Gemisch
auf Raumtemperatur erwärmt.
Nach einer weiteren Stunde wird die lohfarbene trübe Lösung auf
5°C gekühlt und
mit 2,1 g von handelsüblichem
1,3-Diphenylaceton der Formel R-1 behandelt. Nach 10 min wird das
Reaktionsgemisch sich auf Raumtemperatur erwärmen gelassen und über Nacht gerührt. Die
gebildete orangefarbene trübe
Suspension wird zwischen Diethylether und kalter wässriger
Phosphatpufferlösung
verteilt. Die wässrige
Phase wird mit einer weiteren Portion Diethylether extrahiert. Die
vereinigten organischen Schichten werden mit Kochsalzlösung gewaschen,
getrocknet (Magnesiumsulfat) und dann unter vermindertem Druck eingeengt.
Der gebildete Rückstand
wird durch Flashsäulenchromatographie auf
Silicagel unter Elution mit 30% bis 40% Dichlormethan in Hexan gereinigt,
wobei 2,96 mg des Titelprodukts als klares farbloses Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,4–7,1, 7,10,
5,69, 3,94, 3,29, 1,48;
EI-MS: [M+]
= 308.
-
Herstellungsbeispiel 41:
3-Benzyl-4-phenyl-butansäure-tert-butylester (Formel
R-3) Siehe Reaktionsschema R
-
In
eine Parr-Flasche, die 200 mg 5%-Platin-auf-Kohle enthält, werden
2,81 g tert-Butyl-3-benzyl-4-phenyl-butenoat (das Titelprodukt von
Herstellungsbeispiel 40) als Lösung
in 30 ml Ethylacetat gegeben. Das Gemisch wird unter 50 psi Wasserstoffgas über Nacht
hydriert. Die schwarze Suspension wird durch einen Celitepfropfen
unter Nachwaschen mit Ethylacetat filtriert und das Filtrat wird
unter vermindertem Druck eingeengt. Der Rückstand wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 50 Dichlormethan in Hexan gereinigt,
wobei 2,41 g des Titelprodukts als weißer Feststoff erhalten werden.
Eine Analysenprobe wird durch Umkristallisation aus Methanol hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 77–78,5°C.
1H-NMR δ 7,3–7,1, 2,60,
2,47, 2,13, 1,43;
Anal. gefunden: C, 81,16; H, 8,38.
-
Herstellungsbeispiel 42:
2-(1-Benzyl-2-phenyl-ethyl)-3,5-dioxo-hexansäure-tert-butylester
(Formel R-4) Siehe Reaktionsschema R
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
0,15 ml destilliertes Diisopropylamin und 1,0 ml trockenes Tetrahydrofuran
gegeben. Die Lösung
wird auf –78°C gekühlt und
mit 0,65 ml (1,6 M in Hexan) n-Butyllithium behandelt. Die Lösung wird
10 min auf 0°C
erwärmt
und dann erneut auf –78°C gekühlt. Die
Lithiumdiisopropylaminlösung
wird mit 282 mg 3-Benzyl-4-phenyl-butansäure-tert-butyl ester (das Titelprodukt
von Herstellungsbeispiel 41) als Lösung in 2,5 ml Tetrahydrofuran über eine
Kanüle
behandelt. Das gebildete lohfarbene Enolat wird über 20 min gebildet. Die Enolatlösung wird
dann mit 85 μl
destilliertem Diketen behandelt. Das Reaktionsgemisch wird unmittelbar
darauf leuchtend gelb und wird sich über 1 h auf 0°C erwärmen gelassen.
Das Reaktionsgemisch wird 2 h bei 0°C gehalten und dann durch Zugabe
von kalter verdünnter
1 M wässriger
Kaliumhydrogensulfatlösung
gequencht. Das Gemisch wird mit drei Portionen Diethylether extrahiert.
Die vereinigten organischen Schichten werden getrocknet (Magnesiumsulfat)
und dann unter vermindertem Druck eingeengt. Der Rückstand
wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 10% bis 20% Ethylacetat in Hexan
gereinigt, wobei 126 mg der tautomeren Titelverbindung als lohfarbenes Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,1, 5,52,
3,20, 2,8–2,6,
2,03, 1,49;
EI-MS: [M+] = 394.
-
Herstellungsbeispiel 43:
3-(1-Benzyl-2-phenyl-ethyl)-4-hydroxy-6-methyl-pyran-2-on
(Formel R-5) Siehe Reaktionsschema R
-
In
einen Kolben, der 315 mg des tautomeren 2-(1-Benzyl-2-phenyl-ethyl)-3,5-dioxo-hexansäure-tert-butylesters
(Titelprodukt von Herstellungsbeispiel 42) enthält, werden 3 ml Trifluoressigsäure gegeben. Die
gebildete gelbe Lösung
wird bei Raumtemperatur gerührt.
Nach 15 h wird das Reaktionsgemisch unter vermindertem Druck eingeengt.
Die verbliebene Trifluoressigsäure
wird durch eine Behandlung mit Toluol und anschließendes zweimaliges
Einengen unter vermindertem Druck entfernt. Die gebildete rohe Säure wird
als gelbes Öl,
das beim Stehenlassen fest wird, isoliert.
-
In
einen Kolben, der die obige Säure
enthält,
werden 8 ml Essigsäureanhydrid
gegeben. Das Material löst
sich und es bildet sich rasch ein Niederschlag. Das Gemisch wird
bei Raumtemperatur über
Nacht gerührt. Das
Reaktionsgemisch wird mit Methanol behandelt und unter vermindertem
Druck eingeengt. Dieses Konzentrationsverfahren wird mit Methanol
und zweimal mit Toluol wiederholt. Der Rückstand wird dann durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 40% bis 60% Ethylacetat in Hexan
gereinigt, wobei 165 mg der Titelverbindung als weißer Feststoff
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,0, 5,70,
3,64, 3,16, 2,94, 2,04;
EI-MS: [M+]
= 320;
Anal. gefunden: C, 78,81; H, 6,19.
-
Beispiel 79: 3-(1-Benzyl-2-phenyl-ethyl)-6-(2-cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-pyran-2-on (Formel
R-6) Siehe Reaktionsschema
R
-
In
einen flammgetrockneten Kolben unter Argonatmosphäre werden
0,23 ml destilliertes Diisopropylamin und 1,6 ml trockenes Tetrahydrofuran
gegeben. Die Lösung
wird auf –78°C gekühlt und
mit 1,0 ml (1,6 M in Hexan) n-Butyllithium behandelt. Die Lösung wird
15 min auf 0°C
erwärmt
und dann auf –35°C gekühlt. Die Lithiumdiisopropylaminlösung wird
mit 160 mg 3-(1-Benzyl-2-phenyl-ethyl)-4-hydroxy-6-methylpyran-2-on
(Titelprodukt von Herstellungsbeispiel 43) als Lösung in 2,5 ml Tetrahydrofuran
behandelt. Die Lösung
wird 20 min gerührt,
während
die Badtemperatur auf –25°C steigt.
Die Lösung
wird dann mit 0,12 ml (Brommethyl)cyclopropan behandelt. Das Reaktionsgemisch
wird sich über
2 h auf 0°C
erwärmen
gelassen. Das Reaktionsgemisch wird dann mit 1 N wässriger
Salzsäure
im Überschuss
gequencht und mit Diethylether verteilt. Die wässrige Phase wird mit zwei
weiteren Portionen Diethylether extrahiert. Die vereinigten organischen
Schichten werden getrocknet (Magnesiumsulfat) und dann unter vermindertem
Druck eingeengt. Der Rückstand
wird durch Flashsäulenchromatographie
auf Silicagel unter Elution mit 20% bis 40% Ethylacetat in Hexan
gereinigt, wobei 56 mg des Titelprodukts als klares farbloses Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 7,3–7,0, 6,05,
3,62, 3,22, 3,02, 2,52, 1,46, 0,5–0,2, 0,0–0,15;
EI-MS: [M+] = 428,2359 gefunden.
-
Beispiele 80–123
-
Gemäß den oben
beschriebenen analogen Verfahren und unter Verwendung von Ausgangsmaterialien
und Reagentien, die einem Fachmann üblicher Erfahrung auf dem Gebiet
der organischen Synthese ohne weiteres bekannt und verfügbar sind,
werden die folgenden weiteren Verbindungen der vorliegenden Erfindung mit
den in der folgenden Tabelle III angegebenen Massenspektrumdaten
hergestellt:
-
Beispiel 80: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(1-isobutyl-3-methyl-butyl)-pyran-2-on
-
Beispiel 81: 6-(2-Cyclopropylmethyl-ethyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 82: 3-Dicyclopropylmethyl-4-hydroxy-6-phenethyl-pyran-2-on
-
Beispiel 83: 6-(1-Cyclopropyl-ethyl)-3-dicyclopropylmethyl-4-hydroxy-pyran-2-on
-
Beispiel 84: 6-(1-Cyclopropyl-1-cyclopropylmethyl-ethyl)-3-dicyclopropylmethyl-4-hydroxy-pyran-2-on
-
Beispiel 85: 6-(1-Cyclohexyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 86: 6-(1-Benzyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 87: 6-(2-Cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 88: 6-(1-Benzyl-2-cyclopropyl-ethyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 89: 6-(2-Cyclopropyl-ethyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 90: 6-(1-Cyclopropylmethyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 91: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(4-phenyl-butyl)-pyran-2-on
-
Beispiel 92: 3-(Cyclohexyl-cyclopropyl-methyl)-6-(2-cyclopropyl-1-cyclopropylmethyl-ethyl)-4-hydroxy-pyran-2-on
-
Beispiel 93: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-4-phenyl-butyl)-4-hydroxy-pyran-2-on
-
Beispiel 94: 6-(3-Cyclohexyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 95: 6-(3-Cyclohexyl-1-ethyl-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 96: 6-(2-Cyclopropyl-ethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 97: 6-(1-Allyl-but-3-enyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 98: 6-But-3-enyl-3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 99: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-3-phenyl-propyl)-4-hydroxy-pyran-2-on
-
Beispiel 100: 5-Brom-6-(2-cyclopropyl-ethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 101: 6-(1-Benzyl-2-phenyl-ethyl)-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 102: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(3-(2-methoxy-ethoxy)-propyl)-pyran-2-on
-
Beispiel 103: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-5-(2-(2-methoxy-ethoxy)-ethyl)-6-(3-(2-methoxy-ethoxy)-pyran-2-on
-
Beispiel 104: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-propyl-pyran-2-on
-
Beispiel 105: 5-Brom-4-hydroxy-6-phenylethyl-(3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 106: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-3-(2-methoxy-ethoxy)-propyl)-4-hydroxy-pyran-2-on
-
Beispiel 107: 6-(1-Benzyl-3-(2-methoxy-ethoxy)-propyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-pyran-2-on
-
Beispiel 108: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(3-(2-methoxy-ethoxy)-ethoxy)-propyl)-pyran-2-on
-
Beispiel 109: 5-Brom-4-hydroxy-3-(1-phenyl-propyl)-6-propyl-pyran-2-on
-
Beispiel 110: 3-(Cyclopropyl-phenyl-methyl)-6-(1-ethyl-propyl)-4-hydroxy-5-(2-(2-methoxy-ethoxy)ethyl)-pyran-2-on
-
Beispiel 111: 6-(1-Benzyl-propyl)-5-brom-4-hydroxy-3-(1-phenyl-propyl)-pyran-2-on
-
Beispiel 112: 6-(2-Cyclopropyl-1-cyclopropylmethyl-ethyl)-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-5-(2-(2-methoxy-ethoxy)-ethoxy)-ethyl)-pyran-2-on
-
Beispiel 113: 12-Hydroxy-11-(1-phenyl-allyl)-1,4,9-trioxa-dispiro[4.2.5.2]pentadec-11-en-10-on
-
Beispiel 114: 12-Hydroxy-11-(1-phenyl-propyl)-1,4,9-trioxa-dispiro[4.2.5.2]pentadec-11-en-10-on
-
Beispiel 115: 4-Hydroxy-3-(1-phenyl-propyl)-1-oxa-spiro[5.5]undec-3-en-2,9-dion
-
Beispiel 116: 4,9-Dihydroxy-3-(1-phenyl-propyl)-1-oxa-spiro[5.5]undec-3-en-2-on
-
Beispiel 117: 3-(Cyclopropyl-phenyl-methyl)-6-(2-furan-2-yl-2-hydroxy-ethyl)-4-hydroxy-pyran-2
-
Die
physikalischen Eigenschaften sind folgende:
MS: m/z (relative
Intensität)
352 (3, Stammverbindung), 334 (27), 256(100), 131(30), 121(36),
118(21).
-
Beispiel 118: 3-(Cyclopropyl-phenyl-methyl)-4-hydroxy-6-(4,4,4-trifluor-butyl)-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: m/z (relative
Intensität)
352 (87, Stammverbindung), 261(78), 235(80), 131(88), 144(53), 115(68).
-
Beispiel 119: 6-[2-(1-(Cyclohexyl-1H-tetrazol-5-yl)-ethyl]-3-(cyclopropyl-phenyl-methyl)-4-hydroxy-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: m/z (relative
Intensität)
420 (48, Stammverbindung), 221(45), 172(46), 125(46), 115(52), 91(71),
85(100), 83(45), 69(56).
-
Beispiel 120: 6,6-Dibenzyl-4-hydroxy-3-(1-phenyl-propyl)-5,6-dihydro-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: 412,2032 gefunden.
1H-NMR: 7,5–7,0, 4,11, 3,1–2,8, 2,42,
2,09, 0,95.
-
Beispiel 121: 4-Hydroxy-3-(1-phenyl-allyl)-1,9-dioxa-spiro[5.5]undec-3-en-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: m/e (relative
Intensität)
117(100), 129(65), 175 (36), 256(14), 282(22), 300(11).
NMR
(CDCl3, TMS): 7,3–7,5, 6,8, 6,3, 5,0–5,5, 3,7–3,9, 2,5,
1,5–1,9.
-
Beispiel 122: 4-Hydroxy-6-methyl-3-(3-phenyl-prop-2-enyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR:
7,4–7,1,
6,4–6,1,
6,0, 3,15, 2,14.
-
Beispiel 123: 4-Hydroxy-3-(1-phenyl-propyl)-1-oxa-spiro[5.5]undec-3-en-2,9-dionmonooxim
-
Die
physikalischen Eigenschaften sind folgende:
Fp 209–211°C (Zersetzung).
MS:
m/e (relative Intensität)
329 (28), 267 (7), 212 (7), 176 (19), 159 (40), 119 (84), 91 (100).
-
Herstellungsbeispiel 44:
4-Hydroxy-3-(1-phenylcyclobutyl)-6-phenethyl)-2H-pyran-2-on
(Formel S-3) Siehe Reaktionsschema S
-
Diese
Verbindung wird durch die in obigem Beispiel 1 beschriebenen Verfahrensmaßnahmen
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 215–216°C.
Anal.
gefunden: C, 79,37; H, 6,33.
-
Beispiel 124: 4-Hydroxy-3-(1-phenylcyclobutyl)-6-[1-(phenylmethyl)propyl]-2H-pyran-2-on
(Formel S-4) Siehe Reaktionsschema S
-
Diese
Verbindung wird durch in obigem Beispiel 6 beschriebene Verfahrensmaßnahmen
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
EI-HRMS: gefunden:
374,1877.
1H-NMR (CDCl3): δ 0,79, 1,5–1,6, 1,7–2,0, 2,1,
2,47, 2,7–2,9,
5,97, 7,0–7,3,
7,7.
-
Herstellungsbeispiel 45:
4-Hydroxy-1-oxaspiro[5.7]tridec-3-en-2-on (Formel T-3) Siehe Reaktionsschema
T
-
Diese
Verbindung wird durch in obigem Herstellungsbeispiel 16A beschriebene
Verfahrensmaßnahmen
hergestellt.
Fp: 128–130°C.
Anal.
gefunden: C, 68,44; H, 8,7.
-
Herstellungsbeispiel 46:
4-Hydroxy-3-(1-phenyl-3-trimethylsilyl-2E-propenyl)-1-oxaspiro[5.7]tridec-3-en-2-on (Formel
T-4) Siehe Reaktionsschema T
-
Diese
Verbindung wird durch in obigem Herstellungsbeispiel 16B beschriebene
Verfahrensmaßnahmen
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(CDCl3): δ 0,7,
1,0–2,1,
2,4–2,5,
3,5, 4,3, 4,4, 5,0, 5,6–5,9,
6,4–6,6,
7,1–7,3.
-
Beispiel 125: 4-Hydroxy-3-(1-phenyl-2-propenyl)-1-oxaspiro[5.7]tridec-3-en-2-on
(Formel T-5) Siehe Reaktionsschema T
-
Diese
Verbindung wird durch in obigem Herstellungsbeispiel 16C beschriebene
Verfahrensmaßnahmen
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 152–153°C.
EI-HRMS:
gefunden 326,1894.
-
Beispiel 126: 4-Hydroxy-3-(1-phenylpropyl)-1-oxaspiro[5.7]tridec-3-en-2-on
(Formel T-6) Siehe Reaktionsschema T
-
Diese
Verbindung wird durch in obigem Herstellungsbeispiel 16D beschriebene
Verfahrensmaßnahmen
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 166,5–167°C.
EI-HRMS:
gefunden 328,2039.
-
Beispiele 127–130
-
Gemäß zu den
in Reaktionsschema L beschriebenen analogen Verfahren werden die
folgenden Verbindungen der vorliegenden Erfindung hergestellt:
-
Beispiel 127: 4-Hydroxy-3-(1-phenylallyl)-1-oxa-spiro[5.6]dodec-3-en-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 120–121°C.
-
Beispiel 128: 4-Hydroxy-3-(1-phenylallyl)-1-oxa-spiro[5.4]-dec-3-en-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 115–117°C.
-
Beispiel 129: 7-Benzyl-4-hydroxy-3-(1-phenylallyl)-1-oxa-spiro[5.5]undec-3-en-2-on
-
Die
physikalischen Eigenschaften (eines Gemischs von Diastereomeren
am 1-Phenylallyl-Zentrum) sind folgende:
MS m/e (rel %): 388,
370, 297, 279, 172, 171, 117, 115.
HRMS gefunden: 388,2033.
-
Beispiel 130: 4-Hydroxy-3-(1-phenylpropyl)-1-oxa-spiro[5.4]-dec-3-en-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp: 158–161°C.
-
Beispiele 131–145
-
Gemäß den oben
beschriebenen analogen Verfahren werden die folgenden Verbindungen
der vorliegenden Erfindung hergestellt:
-
Beispiel 131: 3-(Cyclopropylphenylmethyl)-6-[1-ethyl-3-(4-morpholinyl)propyl]-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
397,2253.
-
Beispiel 132: 3-(Cyclopropylphenylmethyl)-β-ethyl-4-hydroxy-2-oxo-2H-pyran-6-propansäure-phenylmethylester
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
432,1926.
-
Beispiel 133: 3-(Cyclopropylphenylmethyl)-4-hydroxy-6-[2-methyl-1-(phenylmethyl)propyl]-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
389,2108.
-
Beispiel 134: 3-(Cyclopropylphenylmethyl)-4-hydroxy-6-[2-methyl-1-[(tetrahydro-2H-pyran-3-yl)methyl]propyl]-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
396,2309.
-
Beispiel 135: 4-Hydroxy-3-(1-phenylpropyl)-6-[1-[(tetrahydro-2H-pyran-3-yl)methyl]propyl]-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
370,2139.
-
Beispiel 136: 3-(Cyclopropylphenylmethyl)-6-(1-ethyl-4,4,4-trifluorbutyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
380,1588
Anal. gefunden: C, 66,34; H, 6,27.
-
Beispiel 137: 3-[2-[3-(Cyclopropylphenylmethyl)-4-hydroxy-2-oxo-2H-pyran-6-yl]butyl]-1-[(4-methylphenyl)sulfonyl]-piperidin
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
536,2482
Anal. gefunden: C, 69,40; H, 7,04; N, 2,21.
-
Beispiel 138: 2-[2-[3-(Cyclopropylphenylmethyl)-4-hydroxy-2-oxo-2H-pyran-6-yl]butyl]-1-[(4-methylphenyl)sulfonyl]-pyrrolidin
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
521,2229
Anal. gefunden: C, 68,45; H, 6,81; N, 2,35.
-
Beispiel 139: 3-(Cyclopropylphenylmethyl)-4-hydroxy-6-(3,3,3-trifluorpropyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
338,1143,
Anal. gefunden: C, 63,22; H, 5,28.
-
Beispiel 140: 2-[2-[3-(Cyclopropylphenylmethyl)-4-hydroxy-2-oxo-2H-pyran-6-yl]butyl]-1-[(4-methylphenyl)sulfonyl]-piperidin
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
535,2398
Anal. gefunden: C, 68,74; H, 7,10; N, 2,36.
-
Beispiel 141: 4-[2-[3-(Cyclopropylphenylmethyl)-4-hydroxy-2-oxo-2H-pyran-6-yl]butyl]-1-[(4-methylphenyl)sulfonyl]-piperidin
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
535,2394.
-
Beispiel 142: 4-[2-[3-(Cyclopropylphenylmethyl)-4-hydroxy-2-oxo-2H-pyran-6-yl]butyl]-1-(phenylmethyl)-2-pyrrolidinon
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
471,2414.
-
Beispiel 143: 6-(Cyclopentylmethyl)-3-(cyclopropylphenylmethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
324,1736
Anal. gefunden: C, 77,49; H, 7,37.
-
Beispiel 144: 3-(Cyclopropylphenylmethyl)-4-hydroxy-6-[(tetrahydro-2H-pyran-4-yl)methyl]-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
340,1672
Anal. gefunden: C, 73,90; H, 7,55.
-
Beispiel 145: 3-(Cyclopropylphenylmethyl)-6-(3-fluorpropyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
HRMS gefunden =
302,1311
Anal. gefunden: C, 70,85; H, 6,36.
-
Beispiele 146–153
-
Gemäß den zu
den oben beschriebenen analogen Verfahren werden die folgenden Verbindungen
der vorliegenden Erfindung hergestellt.
-
Beispiel 146: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-β-hydroxyphenethyl)-2H-pyran-2-on
(Formel TT-4) Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 73–90°C
-
Beispiel 147: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxy-p-methylphenethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 87–9°C
-
Beispiel 148: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxy-p-fluorphenethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 68–73°C
-
Beispiel 149: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxy-p-chlorphenethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 76–79°C
-
Beispiel 150: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxy-m-chlorphenethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 62–75°C
-
Beispiel 151: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxy-o-chlorphenethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
sDie
physikalischen Eigenschaften sind folgende:
Fp 65–78°C
-
Beispiel 152: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(2-(furan-3-yl)-2-hydroxyethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 66–78°C
-
Beispiel 153: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(2-(thiophen-3-yl)-2-hydroxyethyl)-2H-pyran-2-on.
Siehe Reaktionsschema TT
-
Die
physikalischen Eigenschaften sind folgende:
Fp 71–89°C
-
Beispiele 154–167
-
Gemäß zu den
in Reaktionsschema H beschriebenen analogen Verfahren, jedoch unter
Verwendung von Q-1 (siehe Reaktionsschema Q) als Ausgangsmaterial
werden die folgenden Verbindungen hergestellt:
-
Beispiel 154: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-p-fluorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 52–63°C
-
Beispiel 155: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-p-chlorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 61–77°C
-
Beispiel 156: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-m-chlorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 45–56°C
-
Beispiel 157: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-o-chlorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 168–74°C
-
Beispiel 158: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-p-bromphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 64–75°C
-
Beispiel 159: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-m-bromphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 54–66°C
-
Beispiel 160: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-p-trifluormethylphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 180–6°C
-
Beispiel 161: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-m-trifluormethylphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 47–61°C
-
Beispiel 162: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-o-trifluormethylphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 180–4°C
-
Beispiel 163: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-p-methoxyphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 49–61°C
-
Beispiel 164: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-m-methoxyphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 42–57°C
-
Beispiel 165: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(p-fluorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Öl
-
Beispiel 166: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(p-chlorphenethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
Fp 64–78°C
-
Beispiel 167: 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(p-bromphenethyl)-2H-pyran-2-on
-
sDie
physikalischen Eigenschaften sind folgende:
Fp 56–68°C
-
Herstellungsbeispiel 47:
5,6-Dihydro-4-hydroxy-6-phenyl-6-phenylmethyl-2H-pyran-2-on
(Formel VV-1; R1 = Phenyl, R2 =
Phenylmethyl) Siehe Reaktionsschema VV
-
Benzylphenylketon
(3,1 g) wird in die Titelverbindung unter Verwendung des allgemeinen
Verfahrens zur Synthese von 5,6-Dihydropyronen
von Herstellungsbeispiel 16, A. umgewandelt. Flashchromatographie des
Rückstands
mit Hexanen/Ether (2:1, 1:1) und anschließend Ether ergibt 3,6 g der
Titelverbindung als weißen
Feststoff.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 89–92°C.
1H-NMR (300 MHz, CDCl3): δ 2,75–2,89, 3,09–3,19, 3,28–3,39, 7,06–7,08, 7,25–7,28, 7,35–7,39.
M/S
m/e (rel %): 190 (8), 189 (65), 147 (10), 105 (100), 77 (30).
Anal.
gefunden: C, 77,09; H, 5,78.
-
Herstellungsbeispiel 48:
5,6-Dihydro-4-hydroxy-6-phenethyl-6-propyl-2H-pyran-2-on (Formel VV-1;
R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema VV
-
1-Phenyl-3-hexanon
(2,0 g) wird in die Titelverbindung unter Verwendung des allgemeinen
Verfahrens zur Synthese von 5,6-Dihydropyronen von Herstellungsbeispiel
16, A. umgewandelt, wobei 1,96 g der Titelverbindung als hellgelbes Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 0,96, 1,21, 1,48, 1,72, 1,98,
2,73, 3,43, 7,15–7,32.
Anal.
gefunden: C, 73,77; H, 7,96.
-
Herstellungsbeispiel 49:
5,6-Dihydro-4-hydroxy-6-phenylmethyl-6-propyl-2H-pyran-2-on
(Formel VV-1; R1 = Phenylmethyl, R2 = Propyl) Siehe Reaktionsschema VV
-
1-Phenyl-2-pentanon
(2 g) wird in die Titelverbindung unter Verwendung des allgemeinen
Verfahrens zur Synthese von 5,6-Dihydropyronen
von Herstellungsbeispiel 16, A. umgewandelt, wobei 2,1 g der Titelverbindung
als weißer
Feststoff erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 101–103°C.
1H-NMR (300 MHz, CDCl3): δ 0,97, 1,51,
1,72, 2,62, 2,84– 2,91,
3,11–3,27,
7,12–7,34.
-
Beispiel 168: 5,6-Dihydro-4-hydroxy-6-phenyl-6-(phenylmethyl)-3-(1-phenyl-2-propenyl)-2H-pyran-2-on
(Formel VV-4; R1 = Phenyl, R2 =
Phenylmethyl) Siehe Reaktionsschema VV
-
5,6-Dihydro-4-hydroxy-6-phenyl-6-phenylmethyl-2H-pyran-2-on
(0,2 g) von Herstellungsbeispiel 47 wird mit Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat
(W-2) von Herstellungsbeispiel 17 unter Verwendung des allgemeinen
Verfahrens zur palladiumkatalysierten Alkylierung von Herstellungsbeispiel
16, B. umgesetzt. Die Desilylierung unter Verwendung des allgemeinen
Verfahrens in Herstellungsbeispiel 16, C. ergibt 0,14 g der Titelverbindung
als weißen
Schaum.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 2,79–3,39, 4,31,
4,83–5,15,
5,34, 5,90–5,99,
6,03, 6,23–6,31,
6,50–6,54, 6,87–7,34.
HRMS
gefunden: 397,1794.
-
Beispiel 169: 5,6-Dihydro-4-hydroxy-6-phenyl-6-(phenylmethyl)-3-(1-phenylpropyl)-2H-pyran-2-on
(Formel VV-5; R1 = Phenyl, R2 =
Phenylmethyl) Siehe Reaktionsschema VV
-
Die
Titelverbindung von Beispiel 168, 5,6-Dihydro-4-hydroxy-6-phenyl-6-(phenylmethyl)-3-(1-phenyl-2-propenyl)-2H-pyran-2-on, (47
mg) wird unter Verwendung des allgemeinen Verfahrens in Herstellungsbeispiel
16, D. unter Verwendung von 10% Palladium/Kohle als Katalysator
hydriert, wobei 47 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,42, 0,95,
1,30–2,10,
2,77, 2,98, 3,14, 3,33, 3,91, 4,13, 5,48, 5,03, 6,86–6,92, 6,93–7,07, 7,08–7,49.
HRMS
gefunden: 399,1598.
-
Beispiel 170: 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(2-phenylethyl)-6-propyl-(E)-2H-pyran-2-on
(Formel WW-3; R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema WW
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-phenethyl-6-propyl-2H-pyran-2-on (100 mg) von Herstellungsbeispiel
48 und 1,3-Diphenyl-allylalkohol (WW-2) (161 mg) in Dioxan unter
Argon wird Bortrifluorid-Diethylether (237 μl) gegeben. Das Reaktionsgemisch
wird bei Raumtemperatur 5 min gerührt und dann mit Wasser gequencht.
Ether wird zugegeben und die vereinigten organischen Schichten werden
mit 0,1 N Natriumhydroxid (3 × 10
ml) extrahiert. Die vereinigten wässrigen Schichten werden auf
0°C gekühlt und
durch tropfenweise Zugabe von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden
mit gesättigtem
Natriumchlorid gewaschen, getrocknet (Natriumsulfat) und unter vermindertem
Druck eingedampft, wobei 155 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,90–1,02, 1,38–1,53, 1,73–2,18, 2,49–2,75, 5,23,
6,36–6,75,
7,04–7,41.
MS
m/e (rel %): 453(20), 331(17), 201(39), 175(33), 173 (16), 115(30),
105(19), 91(100).
-
Beispiel 171: 3-(1,3-Diphenylpropyl)-5,6-dihydro-4-hydroxy-6-(2-phenylethyl)-6-propyl-2H-pyran-2-on
(Formel WW-4; R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema WW
-
Die
Titelverbindung von Beispiel 170, 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(2-phenylethyl)-6-propyl-(E)-2H-pyran-2-on,
(100 mg) wird unter Verwendung des allgemeinen Verfahrens in Herstellungsbeispiel
16, D. unter Verwendung von 10% Palladium/Kohle als Katalysator
hydriert, wobei 100 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,72–1,03, 1,17–2,78, 4,36,
5,84, 6,97–7,45.
HRMS
gefunden: 455,2609.
-
Beispiel 172: 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-phenyl-6-(phenylmethyl)-2H-pyran-2-on (Formel
WW-3; R1 =
Phenyl, R2 = Phenylmethyl) Siehe Reaktionsschema
WW
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-phenyl-6-phenylmethyl-2H-pyran-2-on (200 mg)
von Herstellungsbeispiel 47 und 1,3-Diphenylallylalkohol (WW-2)
(300 mg) in Dioxan unter Argon wird Bortrifluorid-Diethylether (440 μl) gegeben.
Das Reaktionsgemisch wird bei Raumtemperatur 5 min gerührt und
dann mit Wasser gequencht. Ether wird zugegeben und die vereinigten
organischen Schichten werden mit 0,1 N Natriumhydroxid (3 × 10 ml)
extrahiert. Die vereinigten wässrigen
Schichten werden auf 0°C
gekühlt
und durch tropfenweise Zugabe von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden mit
gesättigter
Natriumchloridlösung gewaschen,
getrocknet (Natriumsulfat) und unter vermindertem Druck eingedampft,
wobei die Titelverbindung als weißer Schaum erhalten wird.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 181–185°C (Zers.)
1H-NMR durch Vorhandensein von Diastereomeren
kompliziert.
1H-NMR (300 MHz, CDCl3): δ 2,82–2,88, 3,04–3,16, 3,30–3,39, 4,97,
5,09, 5,61, 5,66, 5,87, 6,18–6,26,
6,41, 6,52–6,60,
6,96–7,40.
MS
m/e (rel %): 454(27), 363(44), 233(39), 205(28), 193 (100), 115(94),
91(75).
Anal. gefunden: C, 83,43; H, 5,90.
-
Beispiel 173: 3-(1,2-Diphenylethenyl)-5,6-dihydro-4-hydroxy-6-(2-phenylethyl)-6-propyl-(E)-2H-pyran-2-on (Formel
XX-2; R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema XX
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-phenethyl-6-propyl-2H-pyran-2-on (100 mg) von Herstellungsbeispiel
48 und Stilbenoxid (151 mg) in Dioxan unter Argon wird Bortrifluorid-Diethylether
(237 μl)
gegeben. Das Reaktionsgemisch wird 16 h bei Raumtemperatur gerührt und
dann mit Wasser gequencht. Ether wird zugegeben und die vereinigten
organischen Schichten werden mit 0,1 N Natriumhydroxid (3 × 10 ml)
extrahiert. Die vereinigten wässrigen
Schichten werden auf 0°C
gekühlt
und durch tropfenweise Zugabe von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden
mit gesättigter
Natriumchloridlösung
gewaschen, getrocknet (Natriumsulfat) und unter vermindertem Druck
eingedampft, wobei die Titelverbindung als weißer Schaum erhalten wird.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 0,96, 1,29–1,46, 1,54–1,71, 1,80–2,04, 2,38, 2,59–2,71, 4,92,
5,78, 6,61, 7,13–7,41.
MS
m/e (rel %): 439(22), 438(66), 247(31), 220(100), 105(29), 91(71).
HRMS
gefunden: 439,2261.
-
Beispiel 174: 5,6-Dihydro-4-hydroxy-6-(2-phenylethyl)-3-(1-phenyl-2-propenyl)-6-propyl-2H-pyran-2-on
(Formel VV-4; R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema VV
-
5,6-Dihydro-4-hydroxy-6-phenethyl-6-propyl-2H-pyran-2-on
(0,3 g) von Herstellungsbeispiel 48 wird mit Methyl-(1-phenyl-3-trimethylsilyl-2E-propenyl)carbonat
(W-2) von Herstellungsbeispiel 17 unter Verwendung des allgemeinen
Verfahrens zur palladiumkatalysierten Alkylierung von Herstellungsbeispiel
16, B. umgesetzt. Die Desilylierung unter Verwendung des allgemeinen
Verfahrens in Herstellungsbeispiel 16, C. ergibt 0,24 g der Titelverbindung
als weißen
Schaum.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,87–1,04, 1,34–1,55, 1,68–1,77, 1,77–2,14, 2,45–2,77, 5,06,
5,40–5,47, 6,30–6,45, 6,56,
6,62, 7,08, 7,19–7,38.
HRMS
gefunden: 377,2128.
-
Beispiel 175: 5,6-Dihydro-4-hydroxy-6-(2-phenylethyl)-3-(1-phenylpropyl)-6-propyl-2H-pyran-2-on
(Formel VV-5; R1 = Phenethyl, R2 =
Propyl) Siehe Reaktionsschema VV
-
Die
Titelverbindung von Beispiel 174, 5,6-Dihydro-4-hydroxy-6-(2-phenylethyl)-3-(1-phenyl-2-propenyl)-6-propyl-2H-pyran-2-on, (69
mg) wird unter Verwendung des allgemeinen Verfahrens in Herstellungsbeispiel
16, D. unter Verwendung von 10% Palladium/Kohle als Katalysator
hydriert, wobei 66 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,87–1,13, 1,25–2,20, 2,33–2,54, 2,60–2,78, 4,23,
5,68, 7,13–7,42.
HRMS
gefunden: 379,2264.
-
Beispiel 176: 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(phenylmethyl)-6-propyl-2H-pyran-2-on (Formel
WW-3; R1 =
Phenylmethyl, R2 = Propyl) Siehe Reaktionsschema
WW
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-phenylmethyl-6-propyl-2H-pyran-2-on (200 mg) von Herstellungsbeispiel
49 und 1,3-Diphenylallylalkohol (WW-2) (341 mg) in Dioxan unter
Argon wird Bortrifluorid-Diethylether (200 μl) gegeben. Das Reaktionsgemisch
wird 5 min bei Raumtemperatur gerührt und dann mit Wasser gequencht.
Ether wird zugegeben und die vereinigten organischen Schichten werden
mit 0,1 N Natriumhydroxid (3 × 10
ml) extrahiert. Die vereinigten wässrigen Schichten werden auf
0°C gekühlt und
durch tropfenweise Zugabe von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden
mit gesättigter
Natriumchloridlösung gewaschen,
getrocknet (Natriumsulfat) und unter vermindertem Druck eingedampft,
wobei die Titelverbindung als weißer Schaum erhalten wird.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,90, 1,40–1,76, 2,37–2,52, 2,95–3,18, 5,12,
5,24, 6,28–6,71,
7,11–7,45.
HRMS
gefunden: 439,2274.
-
Beispiel 177: 3-(1,3-Diphenylpropyl)-5,6-dihydro-4-hydroxy-6-(phenylmethyl)-6-propyl-2H-pyran-2-on
(Formel WW-4; R1 = Phenylmethyl, R2 = Propyl) Siehe Reaktionsschema WW
-
Die
Titelverbindung von Beispiel 176, 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(phenylmethyl)-6-propyl-2H-pyran-2-on, (62
mg) wird unter Verwendung des allgemeinen Verfahrens in Herstellungsbeispiel
16, D. unter Verwendung von 10% Palladium/Kohle als Katalysator
hydriert, wobei 62 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durchVorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,90, 1,35–1,78, 2,36–2,61, 2,63–2,80, 2,95–3,10, 4,34,
5,71, 6,88–7,46.
HRMS
gefunden: 441,2430.
-
Beispiel 178: 3-(α-Cyclopropyl-meta-(phenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
(Formel M-7, worin R1 = Phenyl ist) Siehe
Reaktionsschema M
-
Zu
einer kalten (0°)
gerührten
Lösung
von 65 mg Amin (M-5) werden 27 μl
Pyridin und anschließend 23 μl Benzolsulfonylchlorid
gegeben. Die Lösung
wird gerührt
und sich langsam auf Raumtemperatur erwärmen gelassen. Nach 18 h wird
mit Ethylacetat verdünnt
und die Lösung
mit verdünnter
wässriger
Salzsäure und
Kochsalzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Die Lösung wird unter vermin dertem Druck
eingeengt und der Rückstand
wird auf Silicagel unter Verwendung von 10–15% Ethylacetat in Dichlormethan
flashchromatographiert, wobei 66,7 mg der Titelverbindung als weißer Schaum
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,098, 0,24,
0,45, 0,6, 0,78, 1,55, 1,95, 2,49, 2,75, 2,84, 3,40, 5,84, 6,87,
7,0–7,70.
IR
3253, 2964, 2661, 1572, 1414, 1284, 1158, 731 cm–1
DC
Rf 0,23 (10% Ethylacetat in Dichlormethan).
HRMS
M+ bei m/z 529,1927; ber. 529,1923.
-
Beispiele 179–185
-
Unter
Verwendung von zu den oben in Beispiel 178 beschriebenen Verfahren
werden die folgenden weiteren Verbindungen der vorliegenden Erfindung
hergestellt:
-
Beispiel 179: 3-(α-Cyclopropyl-meta-(propylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 495,2074.
-
Beispiel 180: 3-(α-Cyclopropyl-meta-((E)-2-phenylethenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 555,2088.
-
Beispiel 181: 3-(α-Cyclopropyl-meta-(4-bromphenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 607,1023.
-
Beispiel 182: 3-(α-Cyclopropyl-meta-(2,5-dichlorphenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 597,1143.
-
Beispiel 183: 3-(α-Cyclopropyl-meta-(4-tert-butylphenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 585,2558.
-
Beispiel 184: 3-(α-Cyclopropyl-meta-(4-cyanophenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 554.
-
Beispiel 185: 3-(α-Cyclopropyl-meta-(4-methoxyphenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende: M+ 559.
-
Beispiel 186: 3-α-Ethylbenzyl-6-α-ethylbenzyl-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3) δ 7,44, 7,23–7,09, 6,08, 4,17, 3,31, 2,24–2,10, 1,95,
1,75, 0,89, 0,74.
-
Herstellungsbeispiel 50:
4-Hydroxy-6-methyl-3-(α-methylbenzyl)-2H-pyran-2-on
(Formel Y-5) Siehe Reaktionsschema Y
-
Gemäß dem Verfahren
von Reaktionsschema Y wurden 0,743 g von Y-5 erhalten.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 1,64, 2,12,
4,50, 5,99, 7,2, 7,35.
-
Herstellungsbeispiel 51:
4-Hydroxy-3-(α-(R)-ethylbenzyl)-6-methyl-2H-pyran-2-on
(Formel Z-5) Siehe Reaktionsschema Z
-
Gemäß dem Verfahren
von Reaktionsschema Z wurden 0,160 g von Z-5 erhalten.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 0,92, 2,1,
2,2, 4,2, 6,1, 7,2, 7,4.
-
Beispiel 187: 3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on
(Formel AA-5) Siehe Reaktionsschema AA
-
Beispiel 188: 3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on
(Formel BB-5) Siehe Reaktionsschema BB
-
Beispiel 189: 3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on
(Formel CC-5) Siehe Reaktionsschema CC
-
Beispiel 190: 3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on
(Formel DD-5) Siehe Reaktionsschema DD
-
Beispiel 191: 3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on
(Formel EE-5) Siehe Reaktionsschema EE
-
Beispiel 192: 3-([R]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on
(Formel FF-3) Siehe Reaktionsschema FF
-
Beispiel 193: 3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([R]-α-ethylphenethyl)-2H-pyran-2-on
(Formel GG-5) Siehe Reaktionsschema GG
-
Beispiel 194: 3-([S]-α-Ethylbenzyl)-4-hydroxy-6-([S]-α-ethylphenethyl)-2H-pyran-2-on
(Formel HH-5) Siehe Reaktionsschema HH
-
Beispiel 195: Siehe Reaktionsschema
II
-
- 3-(α-Cyclopropyl((5-methoxymethylhydroxymethylether)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel II-7)
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 0,3, 0,4–0,7, 0,9,
1,3, 1,6, 2,5, 2,9, 3,3, 3,8, 4,4, 4,6, 5,65, 5,68, 6,2, 6,3, 7,1–7,3.
3-(α-Cyclopropyl((5-hydroxymethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel II-8)
-
Beispiel 196: Siehe Reaktionsschema
JJ
-
- 3-(α-Cyclopropyl((5-methoxymethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel JJ-2)
- 3-(α-Cyclopropyl((5-azidomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel JJ-3)
- 3-(α-Cyclopropyl((5-aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel JJ-4)
- 3-(α-Cyclopropyl((5-[N-acetyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel JJ-5)
- 3-(α-Cyclopropyl((5-[N-phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel JJ-6)
-
Die
folgenden Verbindungen werden unter Verwendung der Verfahrensmaßnahmen
von Reaktionsschema JJ, jedoch mit einem substituierten Sulfonylhalogenid,
hergestellt:
3-(α-Cyclopropyl((5-[N-(o-fluor)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(p-fluor)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(m-fluor)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(m-fluor)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(o-cyano)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(p-cyano)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(m-cyano)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-[N-(m- cyano)phenylsulfonyl]aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
3-(α-Cyclopropyl((5-(4-carboethoxy-1,2,3-triazol-1-yl)methyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on (Formel
JJ-7)
3-(α-Cyclopropyl((5-(4-carboxyl-1,2,3-triazol-1-yl)methyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on (hergestellt
durch Hydrolyse von JJ-7 zu dessen entsprechender Carbonsäure)
-
Beispiel 197: Siehe Reaktionsschema
KK
-
- 3-(α-Cyclopropyl((5-(N-(1-nitro-2-methylthioethen-2-yl)aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on(Formel
KK-3)
- 3-(α-Cyclopropyl((5-(N-(1-nitro-2-[N-isopropyl])ethen-2-yl)aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on(Formel
KK-4)
- 3-(α-Cyclopropyl((5-(N-(N-cyano,methylthioimino)aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel KK-6)
- 3-(α-Cyclopropyl((5-(N-(N-cyano,N'-isopropylguanidin)aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel KK-7)
-
Beispiel 198: Siehe Reaktionsschema
LL
-
- 3-(α-Cyclopropyl((5-(N-benzylcarbamat)aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel LL-6)
- 3-(α-Cyclopropyl((5-aminomethyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel LL-7)
-
Beispiel 199: Siehe Reaktionsschema
MM
-
- 3-(α-Cyclopropyl((5-(N-benzylcarbamat)aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel MM-6)
- 3-(α-Cyclopropyl((5-aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel MM-7)
- 3-(α-Cyclopropyl((5-(N-phenylsulfonyl)aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel MM-8)
-
Beispiel 200: Siehe Reaktionsschema
NN
-
- 3-(α-Cyclopropylfurfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel NN-5)
- 3-(α-Cyclopropyl(5-N-phenylsulfonyl)furfur-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel NN-7)
-
Beispiel 201: Siehe Reaktionsschema
OO
-
- 3-(α-Cyclopropyl((5-methoxymethylhydroxymethylether)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel OO-7)
- 3-(α-Cyclopropyl((5-hydroxymethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel OO-8)
-
Beispiel 202: Siehe Reaktionsschema
PP
-
- 3-(α-Cyclopropyl((5-methoxymethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on (Formel
PP-2)
- 3-(α-Cyclopropyl((5-azidomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel PP-3)
- 3-(α-Cyclopropyl((5-aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel PP-4)
- 3-(α-Cyclopropyl((5-[N-acetyl]aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel PP-5)
- 3-(α-Cyclopropyl((5-[N-phenylsulfonyl]aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel PP-6)
- 3-(α-Cyclopropyl((5-(4-carboethoxy-1,2,3-triazol-1-yl)methyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel PP-7)
- 3-(α-Cyclopropyl((5-(4-carboxyl-1,2,3-triazol-1-yl)methyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(hergestellt durch Hydrolyse von PP-7 zu dessen entsprechender Carbonsäure).
-
Beispiel 203: 3-(α-Cyclopropyl((5-hydroxymethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel QQ-5) Siehe Reaktionsschema QQ
-
Beispiel 204: Siehe Reaktionsschema
RR
-
- 3-(α-Cyclopropyl((5-(N-(1-nitro-2-methylthioethen-2-ylmethyl)aminomethyl)thiophen-2-yl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel RR-3)
- 3-(α-Cyclopropyl((5-(N-(1-nitro-2-[N-isopropyl])ethen-2-yl)aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel RR-4)
- 3-(α-Cyclopropyl((5-(N-(N-cyano,methylthioimino)aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel RR-6)
- 3-(α-Cyclopropyl((5-(N-(N-cyano,N'-isopropylguanidin)aminomethyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel RR-7)
-
Beispiel 205: Siehe Reaktionsschema
SS
-
3-(α-Cyclopropylthiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel SS-5)
-
3-(α-Cyclopropyl(5-N-phenylsulfonyl)thiophen-2-ylmethyl))-4-hydroxy-6-(α-ethylphenethyl)-2H-pyran-2-on
(Formel SS-7)
-
Beispiel 206: Siehe Reaktionsschema
TT
-
- 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(β-hydroxyphenethyl)-2H-pyran-2-on (Formel
TT-2)
- 3-(α-Cyclopropylbenzyl)-4-hydroxy-6-(α-ethyl-β-hydroxyphenethyl)-2H-pyran-2-on
(Formel TT-4)
-
Beispiel 207: Siehe Reaktionsschema
UU
-
- 3-(α[S]-Ethylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
(Formel UU-6)
- 3-(α[S]-Ethylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
(Formel UU-11)
- 3-(α[S]-Ethylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
(Formel UU-13)
- 3-(α[S]-Ethylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
(Formel UU-14)
-
Die
folgenden Verbindungen sind aus UU-16 hergestellte Diastereomere:
3-(α[R]-Ethylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Ethylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Ethylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Ethylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
-
Die
folgenden Verbindungen werden durch die Verfahren von Reaktionsschema
UU, jedoch mit UU-16, worin die Ethylgruppe durch eine Cyclopropylgruppe
ersetzt ist, hergestellt:
3-(α[S]-Cyclopropylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[S]-Cyclopropylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[S]-Cyclopropylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[S]-Cyclopropylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Cyclopropylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Cyclopropylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[R]- hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Cyclopropylbenzyl)-4-hydroxy-6-(α[R]-ethyl-β[R]-hydroxyphenethyl)-2H-pyran-2-on
3-(α[R]-Cyclopropylbenzyl)-4-hydroxy-6-(α[S]-ethyl-β[S]-hydroxyphenethyl)-2H-pyran-2-on
-
Beispiel 208: 3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on:
Eine vierwöchige
Studie der oralen Arzneimittelsicherheit und Toxizität an Beaglehunden
-
Fünf Gruppen
von drei (3) männlichen
und drei (3) weiblichen jungen ausgewachsenen Beaglehunden erhielten
3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
in 95% Ethylalkohol oral in Gelatinekapseln mit Dosen von 0 (95%-iger
Ethylalkohol als Vehikelkontrolle), 50, 100, 200 oder 400 mg/kg/Tag
während
achtundzwanzig (28) aufeinanderfolgenden Tagen. Die oralen Tagesdosen
waren in zwei (2) gleiche Dosen mit mindestens sieben (7) Stunden
zwischen der Morgen- und Nachmittagsdosis geteilt. Die bewerteten Parameter
umfassten klinische Beobachtungen zweimal am Tag; die tägliche Bewertung
von Futter- und Wasseraufnahme; das Körpergewicht zweimal pro Woche;
Elektrokardiogramme vor dem Test und am Dosierungstag (dd) 15 oder
16 und 24 oder 25; ophthalmologische Prüfungen vor dem Test und an
dd 23 oder 24; Plasmaarzneimittelspiegel vor dem Test und an dd
1, 8, 14, 21 und 28; Hämogramme
und Serumchemie vor dem Test und an dd 8, 14, und 28; Urinanalysen
vor dem Test und an dd 14 und 28; Körpergewicht, grobe Nekropsiebeobachtungen
und absolute und relative Organgewichte am Ende; und histopathologische
Bewertung von Organen und Geweben.
-
Unter
anderen Beobachtungen waren orale Tagesdosen von 50 bis 400 mg/kg/Tag
mit einer dosisabhängigen
Verringerung von Prostatagröße und -gewicht
verbunden. Die folgende Ta belle IV zeigt, dass Dosen von 50 bis
400 mg/kg/Tag und insbesondere Dosen von 100 bis 400 mg/kg/Tag verminderte
Größe und Gewicht
der Prostatadrüse
verursachten.
-
Herstellungsbeispiel 52:
5,6-Dihydro-4-hydroxy-6-(2-methylpropyl)-6-phenylethyl-2H-pyran-2-on
(Formel AAA-1; R1 = 2-Methylpropyl, R2 = Phenylethyl) Siehe Reaktionsschema AAA
-
5-Methyl-1-phenyl-3-hexanon
(4,0 g) wird in die Titelverbindung unter Verwendung des allgemeinen Verfahrens
zur Synthese von 5,6-Dihydropyronen von Herstellungsbeispiel 16,
A. umgewandelt, wobei 4,0 g der Titelverbindung als weißer Feststoff
erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 63–65°C.
1H-NMR (300 MHz, CDCl3): δ 0,98, 1,65,
1,83–1,91,
1,93–2,06,
2,66–2,75,
3,42, 7,14–7,32.
-
Beispiel 209: 3-Diphenylmethyl-5,6-dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-2H-pyran-2-on (Formel
AAA-3; R1 = Phenylethyl, R2 =
2-Methylpropyl) Siehe Reaktionsschema AAA
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-(2-methylpropyl)-6-phenylethyl-2H-pyran-2-on
(150 mg) von Herstellungsbeispiel 52 und Benzyhydrol (AAA-2) (202
mg) in Dioxan unter Argon wird Bortrifluoridetherat (68 μl) gegeben.
Das Reaktionsgemisch wird 12 h bei Raumtemperatur gerührt und
dann mit Wasser gequencht. Ether wird zugegeben und die vereinigten
organischen Schichten werden mit 0,1 N Natriumhydroxid (3 × 10 ml)
extrahiert. Die vereinigten wässrigen
Schichten werden auf 0°C
gekühlt
und unter tropfenweiser Verwendung von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden
mit gesättigter
Natriumchloridlösung
gewaschen, getrocknet (Natriumsulfat) und unter vermindertem Druck
eingedampft, wobei die Titelverbindung als hellgelber Schaum erhalten
wird.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 0,94, 1,63–1,92, 1,97–2,22, 2,51–2,82, 5,77, 5,82, 7,10–7,39.
HRMS
gefunden: 440,2351
-
Beispiel 210: 3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-2H-pyran-2-on
(Formel WW-3; R1 = Phenylethyl, R2 = 2-Methylpropyl) Siehe Reaktionsschema
WW
-
Zu
einer Lösung
von 5,6-Dihydro-4-hydroxy-6-(2-methylpropyl)-6-phenylethyl-2H-pyran-2-on
(250 mg) von Herstellungsbeispiel 52 und 1,3-Diphenylallylalkohol
(WW-2) (383 mg) in Dioxan unter Argon wird Bortrifluoridetherat
(112 μl)
gegeben. Das Reaktionsgemisch wird 5 min bei Raumtemperatur gerührt und
dann mit Wasser gequencht. Ether wird zugegeben und die vereinigten
organischen Schichten werden mit 0,1 N Natriumhydroxid (3 × 10 ml)
gewaschen. Die vereinigten wässrigen
Schichten werden auf 0°C
gekühlt
und unter tropfenweiser Verwendung von 2 N Salzsäure auf pH 1 angesäuert. Die
milchige Lösung
wird mit Methylenchlorid (3 × 15
ml) extrahiert und die vereinigten organischen Schichten werden
mit gesättigter
Natriumchloridlösung
gewaschen, getrocknet (Natriumsulfat) und unter vermindertem Druck
eingedampft, wobei die Titelverbindung als weißer Schaum erhalten wird.
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,91–1,00, 1,57–2,19, 2,49–2,73, 5,25,
6,42–6,49
6,63–6,71,
7,05–7,43.
HRMS
gefunden: 467,2591
-
Beispiel 211: 3-(1,3-Diphenyl-2-propyl)-5,6-dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-2H-pyran-2-on
(Formel WW-4; R1 = Phenylethyl, R2 = 2-Methylpropyl) Siehe Reaktionsschema
WW
-
3-(1,3-Diphenyl-2-propenyl)-5,6-dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-2H-pyran-2-on
von Beispiel 210 (100 mg) wird unter Verwendung des allgemeinen
Verfahrens in Herstellungsbeispiel 16, D. unter Verwendung von 10
Pd/C als Katalysator hydriert, wobei 99 mg der Titelverbindung als
weißer
Schaum erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
V1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,64–1,05, 1,52–2,18, 2,26–2,75, 4,37,
5,74, 6,95–7,48.
HRMS
gefunden: 468,2664
-
Gemäß zu den
oben beschriebenen analogen Verfahren und unter Verwendung von Ausgangsmaterialien
und Reagentien, die einem Fachmann üblicher Erfahrung auf dem Gebiet
der organischen Synthese ohne weiteres bekannt und verfügbar sind,
werden die folgenden weiteren Verbindungen der vorliegenden Erfindung
hergestellt:
-
Beispiel 212: 3-(α-Cyclopropyl-meta-[(phenylaminocarbonyl)amino]benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
FAB-HRMS: 509,2451
(gefunden).
-
Beispiel 213: 3-(α-Cyclopropyl-meta-[(benzylaminocarbonyl)amino]benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
FAB-HRMS: 523,2600
(gefunden).
-
Beispiel 214: 3-(α-Cyclopropyl-meta-[(4-methoxyphenylaminocarbonyl)amino]benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR: δ 0,15, 0,38,
0,57, 0,76, 1,51, 1,78, 2,41, 2,69, 2,81, 3,26, 3,67, 5,69, 6,72,
6,9–7,4.
-
Beispiel 215: 3-(α-Cyclopropyl-meta-[(4-bromphenylaminocarbonyl)amino]benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR: δ 0,15, 0,36,
0,57, 0,76, 1,51, 1,70, 2,40, 2,65–2,85, 3,25, 5,71, 6,8–7,6.
-
Beispiel 216: 3-(α-Cyclopropyl-meta-[(phenylsulfonylaminocarbonyl)amino]benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR: δ 0,11, 0,19,
0,40, 0,53, 0,81, 1,59, 1,81, 2,45, 2,7–2,85, 3,29, 5,7, 6,8–8,0.
-
Beispiel 217: 6-Butyl-5,6-dihydro-3-(1,3-diphenyl-2-propenyl)-4-hydroxy-6-phenylmethyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
EI-MS: (M+) = 452
1H-NMR: 0,8, 1,35, 1,6, 2,49, 2,98, 5,07,
6,5, 6,9, 7,1–7,4.
-
Beispiel 218: 6-Butyl-5,6-dihydro-3-(1,3-diphenylpropyl)-4-hydroxy-6-phenylmethyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR:
0,85, 1,1–1,3,
1,6, 2,3–2,6,
2,94, 4,23, 7,0–7,5.
-
Beispiel 219: 6-Butyl-5,6-dihydro-4-hydroxy-6-phenylmethyl-3-(1-phenyl-2-propenyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR:
0,89, 1,1–1,7,
2,48, 3,0, 4,9–5,3,
6,3–6,6,
7,0–7,4.
-
Beispiel 220: 6-Butyl-5,6-dihydro-4-hydroxy-6-phenylmethyl-3-(1-phenylpropyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR:
0,8–1,0,
1,2–1,7,
1,9–2,3,
2,45, 2,97, 4,05, 7,0–7,5.
-
Beispiel 221: 3-(α-Cyclopropyl-meta-(tert-butyloxycarbonyl-L-alanylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
(M + H)+ 583,2801.
-
Beispiel 222: 3-(α-Cyclopropyl-meta-(N-α-tert-butyloxycarbonyl-N-im-p-toluolsulfonyl-L-histidylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
(M + H)+ 781, 3268.
-
Beispiel 223: 3-(α-Cyclopropyl-meta-(4-bromphenylbenzoylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
M+ 571,1385.
-
Beispiel 224: 3-(α-Cyclopropyl-meta-(4-chlorphenylsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
M+ 563,1528.
-
Beispiel 225: 3-(α-Cyclopropyl-meta-(N-benzyloxycarbonyl-O-α-benzyl-L-glutamylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
(M + H)+ 743,3330.
-
Beispiel 226: 3-(α-Cyclopropyl-meta-(N-α-tert-butyloxycarbonyl-L-histidylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
(M + H)+ 627,3186.
-
Beispiel 227: 3-(α-Cyclopropyl-meta-(4-cyanophenylbenzoylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
(M + H)+ 519,2277.
-
Beispiel 228: 3-(α-Cyclopropyl-meta-(L-glutamylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Beispiel 229: 3-(α-Cyclopropyl-meta-(8-chinolinsulfonylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
M+ 580.
-
Beispiel 230: 3-(α-Cyclopropyl-meta-(3-(1-indolyl)propanoylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
M+ 560.
-
Beispiel 231: 3-(α-Cyclopropyl-meta-(2-pyridylacetylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
M+ 508.
-
Beispiel 232: 3-(α-Cyclopropyl-[5-(methoxymethoxy-methyl)-thiophen-2-yl]-methyl)-5,6-dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 0,33, 0,46, 0,65, 0,92, 1,54–1,68, 1,70–1,84, 1,90–2,18, 3,37,
3,57, 4,65, 6,79, 6,86, 7,10–7,28.
HRMS
gefunden: 423,2002.
-
Beispiel 233: 5,6-Dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-3-(1-phenyl-2-propenyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3,
CD3OD): δ 0,95–0,98, 1,60–1,71, 1,73–1,89, 1,90,
2,14, 2,56–2,72,
3,46, 4,91, 5,11–5,20,
6,44–6,59,
7,11–7,33.
HRMS
gefunden: 391,2273.
-
Beispiel 234: 5,6-Dihydro-4-hydroxy-6-(2-methylpropyl)-6-(2-phenylethyl)-3-(1-phenylpropyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,88–1,02, 1,54–2,36, 2,59,
3,36, 4,09, 7,03–7,28,
7,41–7,43.
HRMS
gefunden: 393,2430.
-
Beispiel 235: 5,6-Dihydro-3-diphenylmethyl-4-hydroxy-6,6-di-(2-phenylethyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 2,09–2,24, 2,63–2,74, 5,79,
5,87, 7,10–7,35.
HRMS
gefunden: 489,2430.
-
Beispiel 236: 5,6-Dihydro-4-hydroxy-6,6-di-(2-phenylethyl)-3-(1,3-diphenyl-2-propenyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 2,03–2,27, 2,66–2,82, 5,24, 6,43, 6,68, 7,10–7,43.
HRMS
gefunden: 515,2586.
-
Beispiel 237: 5,6-Dihydro-4-hydroxy-6,6-di-(2-phenylethyl)-3-(1,3-diphenylpropyl)-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert. 1H-NMR
(300 MHz, CDCl3): δ 1,52–1,91, 2,03–2,25, 2,31–2,78, 4,36, 5,96, 7,08–7,41.
HRMS
gefunden: 517,2743.
-
Beispiel 238: 5,6-Dihydro-4-hydroxy-3-(1,3-diphenyl-2-propenyl)-6-(3-phenylpropyl)-6-propyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,84–0,93, 2,21–1,42, 1,56–1,85, 2,49–2,64, 5,17,
6,32–6,44,
6,48–6,66, 7,09–7,41.
-
Beispiel 239: 5,6-Dihydro-4-hydroxy-3-(1,3-diphenylpropyl)-6-(3-phenylpropyl)-6-propyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,79–1,05, 1,16–1,87, 2,23–2,74, 4,31,
5,64, 7,05–7,48.
-
Beispiel 240: 3-(α-Cyclopropyl-[-5-(methoxymethoxy-methyl)-thiophen-2-yl]-methyl)-5,6-dihydro-4-hydroxy-6-(2-phenylethyl)-6-propyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR δ 300
MHz, CDCl3): δ 0,38, 0,51, 0,72, 0,95, 1,37–1,51, 1,62–2,21, 2,44–2,58, 2,61–2,72, 3,39,
3,40, 3,80, 4,67, 6,51, 6,65, 6,88, 6,99, 7,16–7,30.
-
Beispiel 241: 3-(α-Cyclopropyl-[5-(methoxymethoxy-methyl)-thiophen-2-yl]-methyl)-5,6-dihydro-4-hydroxy-6-(3-phenylpropyl)-6-propyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
durch Vorhandensein von Diastereomeren kompliziert.
1H-NMR (300 MHz, CDCl3): δ 0,36–0,58, 0,71,
0,90, 1,23–1,42,
1,61–1,83,
2,47–2,62,
3,40, 3,43, 3,75, 4,68, 6,41, 6,86, 6,88, 6,92, 7,10–7,21, 7,26–7,32.
-
Beispiel 242: 5,6-Dihydro-3-diphenylmethyl-4-hydroxy-6-(3-phenylpropyl)-6-propyl-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR
(300 MHz, CDCl3): δ 0,88, 1,22–1,38, 1,59–1,82, 2,48, 2,58, 5,71, 5,76,
7,07–7,39.
-
Beispiel 243: 3-(α-Cyclopropylbenzyl)-6-[1-cyclopropylmethyl-2-(tetrahydropyran-3-yl)ethyl]-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: gefunden m/z
= 408.
-
Beispiel 244: 3-(α-Cyclopropyl-meta-(ethylsulfonylamino)benzyl-6-[1-cyclopropylmethyl-2-(tetrahydropyran-3-yl)ethyl]-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: gefunden m/z
= 515.
-
Beispiel 245: 3-(α-Cyclopropyl-meta-(4-methylphenylsulfonylamino)benzyl-6-[1-cyclopropylmethyl-2-(tetrahydropyran-3-yl)ethyl]-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: gefunden m/z
= 577.
-
Beispiel 246: 3-(α-Cyclopropyl-meta-(4-methylphenylsulfonylamino)benzyl-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: gefunden m/z
= 543.
-
Beispiel 247: 3-(α-Cyclopropyl-meta-(ethylsulfonylamino)benzyl-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
MS: gefunden m/z
= 481.
-
Beispiel 248: 3-(α-Cyclopropyl-meta-(3-pyridylacetylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,22, 0,48,
0,64, 0,82, 1,60, 1,89, 2,48, 2,8, 2,9, 3,32, 5,69, 7,1, 7,2, 7,5,
7,8, 8,4, 8,5 ppm.
-
Beispiel 249: 3-(α-Cyclopropyl-meta-(4-pyridylacetylamino)benzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
-
Die
physikalischen Eigenschaften sind folgende:
1H-NMR δ 0,22, 0,48,
0,64, 0,82, 1,6, 1,9, 2,5, 2,8, 2,9, 3,3, 5,71, 7,05, 7,2, 7,3,
7,5, 8,40 ppm.
-
Herstellungsbeispiel 53:
(4S,5R)-3-Butyryl-4-methyl-5-phenyl-2-oxazolidinon
(Formel W-1) Siehe Reaktionsschema W
-
(4S,5R)-4-Methyl-5-phenyl-2-oxazolidinon
(10,0 g) wird zu Tetrahydrofuran (115 ml) gegeben und auf –78°C gekühlt. Zu
dieser Lösung
wird n-Butyllithium (38,8 ml, 1,6 M in Hexan) gegeben und das gebildete
Reaktionsgemisch wird bei –78°C 1 h gerührt. Zu
dieser Lösung
wird Butyrylchlorid (6,75 ml) gegeben und das Reaktionsgemisch wird
weitere 1,5 h gerührt.
Das Reaktionsgemisch wird auf Raumtemperatur erwärmt und durch Zugabe von Wasser
(100 ml) gequencht. Das Reaktionsgemisch wird mit Ethylacetat extrahiert,
getrocknet (Natriumsulfat) und das Lösemittel wird unter Vakuum
entfernt, wobei das rohe Produkt erhalten wird. Der Rückstand
wird in Hexan gelöst
und über
Nacht in den Gefrierschrank gegeben. Zwei Chargen Kristalle werden
erhalten (8,5 9, 4,5 g), wobei insgesamt 13,0 g des Titelprodukts
erhalten werden.
-
Herstellungsbeispiel 54:
(4S,5R)-3-(α[R]-Benzyl)butyryl-4-methyl-5-phenyl-2-oxazolidinon
(Formel W-3) Siehe Reaktionsschema W
-
(4S,5R)-3-Butyryl-4-methyl-5-phenyl-2-oxazolidinon
von Herstellungsbeispiel 53 (4,0 g) wird auf –78°C in Tetrahydrofuran (54 ml)
unter Stickstoffatmosphäre
gekühlt.
Lithiumdiisopropylamid (LDA, 2,0 M) wird über mehrere Minuten tropfenweise
zugegeben und das Rühren
wird 30 min fortgesetzt. Die Reaktionstemperatur wird dann auf 0°C eingestellt
und Benzylbromid (2,15 ml) wird zugegeben. Das Reaktionsgemisch
wird dann sich auf Raumtemperatur erwärmen gelassen und nach 30 min
bei Raumtemperatur wird Wasser (150 ml) zugesetzt und das Reaktionsgemisch
mit Ethylacetat extrahiert. Die vereinigten Ethylacetatextrakte
werden getrocknet und unter Vakuum vom Lösemittel befreit, wobei ein
blassgelbes Öl
erhalten wird. Das Öl
wird in Toluol gelöst
und auf eine Silicagelsäule
appliziert, wobei mit Hexan eluiert wird, wobei 4,4 g des gewünschten
Titelprodukts als Öl
erhalten werden.
[α]D = –69°.
-
Herstellungsbeispiel 55:
(R)-α-Ethyl-hydrozimtsäure (Formel
W-4) Siehe Reaktionsschema W
-
(4S,5R)-3-(α[R]-Benzyl)butyryl-4-methyl-5-phenyl-2-oxazolidinon von
Herstellungsbeispiel 54 (3,48 g) wird zu einem 3:1-Gemisch von Tetrahydrofuran/Wasser
(35 ml) gegeben. Zu dieser Lösung
wird eine Lithiumhydroxid/Wasserstoffperoxid-Lösung (aus 10,3 ml einer etwa
10 M Lösung
von Wasserstoffperoxid und 911 mg Lithiumhydroxidmonohydrat) gegeben
und die gebildete Lösung
wird 3 h gerührt.
Wasser (50 ml) wird zugegeben und das Reaktionsgemisch wird dann
mit Ethylacetat extrahiert. Die wässrige Phase wird mit 2 N Salzsäure angesäuert und
mit Methylenchlorid extrahiert, wobei 1,71 g reines Titelprodukt
als farblose Flüssigkeit
erhalten werden.
[α]D = –36°.
-
Herstellungsbeispiel 56:
(R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
(Formel W-7) Siehe Reaktionsschema W
-
(R)-α-Ethyl-hydrozimtsäure von
Herstellungsbeispiel 55 (1,58 g) wird zu Methylenchlorid (5 ml)
gegeben und anschließend
wird Oxalylchlorid (0,82 ml, 1,05 Äquiv.) bei Raumtemperatur zugegeben.
Nach 4-stündigem
Rühren
werden das Lösemittel
und überschüssiges Oxalylchlorid
durch Abdampfen entfernt, wobei W-8 erhalten wird.
-
tert-Butylacetat
(2,4 ml, 17,8 mmol) wird tropfenweise zu einer Tetrahydrofuranlösung (10
ml) von Lithiumdiisopropylamid (8,9 ml, 2,0 M LDA) bei –78°C gegeben.
Nach 30-minütigem Rühren wird
dieses Lithiumenolat (W-9) zu dem obigen Säurechlorid (W-8) (in Tetrahydrofuran
(5 ml)) tropfenweise über
eine Kanüle bei –78°C gegeben.
Nach 20 min bei –78°C wird Wasser
(5 ml) zugesetzt und das Reaktionsgemisch auf 0°C erwärmt. 1 N Salzsäure (10
ml) und anschließend
Ethylacetat (20 ml) werden langsam bei 0°C zugegeben. Die organische
Schicht wird abgetrennt und die wässrige Phase wird mit Ethylacetat
unter mehrmaliger Zugabe extrahiert. Die vereinigten Extrakte werden
getrocknet und das Lösemittel
wird unter Vakuum entfernt, wobei 3,00 g tert-Butyl-5-phenyl-4[R]-ethyl-3-oxo-pentanoat
(W-10) erhalten werden. Schwefelsäure (0,44 ml) wird tropfenweise
zu einem Gemisch von tert-Butyl-5-phenyl-4[R]-ethyl-3-oxo-pentanoat (3,0 g), Aceton
(1,5 ml) und Essigsäureanhydrid
(3 ml) gegeben, wobei über
Nacht bei 0°C
gerührt
wird. Das Reaktionsgemisch wird dann in gesättigte Natriumbicarbonatlösung (50
ml) und Eis gegossen. Das Gemisch wird 30 min gerührt und auf
Raumtemperatur erwärmt
und dann mit Ether (2 × 30
ml) extrahiert. Die vereinigten Etherextrakte werden über Magnesiumsulfat
getrocknet und das Lösemittel
wird unter Vakuum entfernt, wobei 2,81 g des rohen Titelprodukts
erhalten werden.
-
Silicagelchromatographie
(Aceton/Ethylacetat/Hexan, 1:3:16) ergibt 2,10 g des gewünschten
Produkts als farbloses Öl.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 0,92 (m),
1,60 (s), 1,61 (s), 2,41 (m), 2,77, 2,80, 5,13, 7,12–7,27.
-
Beispiel 250: (3S,6R)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
(Formel CC-5) Siehe Reaktionsschema CC
-
Zu
(R)-3-Phenylvaleriansäure
(CC-1) (Chemistry Letters (1981) 913–16) (400 mg) in wasserfreiem Methylenchlorid
(5 ml) wird Oxalylchlorid (0,21 ml) gegeben und die gebildete Lösung wird
2 h unter Rückflusskühlung erhitzt.
Das Reaktionsgemisch wird dann auf Raumtemperatur gekühlt und
das Lösemittel
und überschüssiges Oxalylchlorid
werden unter Vakuum entfernt, wobei das rohe Säurechlorid (CC-2) erhalten
wird. Das Säurechlorid
wird in Toluol (10 ml) gelöst
und dann auf Rückflusstemperatur
erhitzt. Zu dieser Lösung
wird unter Refluxieren tropfenweise ein Gemisch von Triethylamin
(202 mg) und (R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
(350 mg) (CC-3) in Toluol (1,5 ml) gegeben. Eine lange Nadel wird über ein
Kautschukseptum unmittelbar über
dem Lösemittel
eingeführt,
um Aceton aus dem Reaktionsgemisch abzusaugen. Das Reaktionsgemisch
wird 2,5 h unter Refluxieren gehalten. Das Reaktionsgemisch wird
auf Raumtemperatur gekühlt
und das Triethylaminhydrochlorid wird durch Filtration entfernt.
Das Filtrat wird unter Vakuum eingedampft und der Rückstand,
der CC-4 enthält,
wird zu einem Methanol/Wasser-Gemisch (6:1; 35 ml) gegeben und 0,5
g Natriumcarbonat werden zugegeben und das Reaktionsgemisch wird
bei Raumtemperatur über
Nacht gerührt.
Das Methanol wird unter Vakuum entfernt und eine gesättigte Natriumcarbonatlösung (20 ml)
wird zu dem rohen Reaktionsgemisch gegeben. Das Material wird extrahiert
mit Hexan (2 × 20
ml), das den Methylester von (R)-α-Ethyl-hydrozimtsäure (CC-6)
enthält.
Die wässrige
Schicht wird durch Zugabe von 1 N Salzsäure bei 0°C auf einen pH bei 3 angesäuert. Diese
wässrige
Schicht wird mit Ethylacetat (2 × 30 ml) extrahiert, getrocknet
(Natriumsulfat) und unter Vakuum vom Lösemittel befreit, wobei 359
mg rohes Titelprodukt erhalten werden. Chromatographie (Silicagel,
15 Ethylacetat/Methylenchlorid) ergibt 299,9 mg eines Materials,
das umkristallisiert wird, wobei 210,0 mg des Produkts erhalten
werden. Weitere 20 mg des Produkts werden aus den Mutterlaugen gewonnen,
wobei insgesamt 230,0 mg des Titelprodukts erhalten werden.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 141–2°C.
-
Herstellungsbeispiel 57:
(4R,5S)-3-Butyryl-4-methyl-5-phenyl-2-oxazolidinon
(Formel X-1) Siehe Reaktionsschema X
-
(4R,5S)-4-Methyl-5-phenyl-2-oxazolidinon
(10,0 g) wird zu Tetrahydrofuran (115 ml) gegeben und auf –78°C gekühlt. Zu
dieser Lösung
wird n-Butyllithium (38,8 ml, 1,6 M in Hexan) gegeben und das gebildete
Reaktionsgemisch wird 1 h bei –78°C gerührt. Zu
dieser Lösung
wird Butyrylchlorid (6,75 ml) gegeben und das Reaktionsgemisch wird
weitere 1,5 h gerührt.
Das Reaktionsgemisch wird auf Raumtemperatur erwärmt und durch Zugabe von Wasser
(100 ml) gequencht. Das Reaktionsgemisch wird mit Ethylacetat extrahiert,
getrocknet (Natriumsulfat) und unter Vakuum vom Lösemittel
befreit, wobei das rohe Titelprodukt (X-1) erhalten wird. Der Rückstand
wird in Hexan gelöst
und über
Nacht in den Gefrierschrank gegeben. Zwei Chargen Kristalle werden
erhalten (11,5 g, 1,7 g), wobei insgesamt 13,2 g Produkt erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR (CDCl3) 0,88, 0,91, 0,98, 1,00, 1,03, 1,68, 1,70,
1,73, 1,75, 2,88, 2,91, 2,92, 2,93, 2,95, 2,97, 4,74, 4,77, 4,79,
4,74, 4,77, 4,79, 5,66, 5,68, 7,26–42.
-
Herstellungsbeispiel 58:
(4R,5S)-3-(α[S]-Benzyl)butyryl-4-methyl-5-phenyl-2-oxazolidinon
(Formel X-3) Siehe Reaktionsschema X
-
(4R,5S)-3-Butyryl-4-methyl-5-phenyl-2-oxazolidinon
von Herstellungsbeispiel 57 (11,5 g) wird auf –78°C in Tetrahydrofuran (100 ml)
unter Stickstoffatmosphäre
gekühlt.
Lithiumdiisopropylamid (LDA, hergestellt aus 33,5 ml von 1,6 M n-Butyllithium
und 7,83 ml Diisopropylamin; das Gesamtvolumen von Tetrahydrofuran
beträgt
80 ml) wird tropfenweise über
mehrere Minuten zugegeben und das Rühren wird 30 min fortgesetzt.
Die Reaktionstemperatur wird dann auf 0°C eingestellt und Benzylbromid
(8,3 ml) wird zugegeben. Das Reaktionsgemisch wird sich dann auf
Raumtemperatur erwärmen
gelassen und nach 30 min bei Raumtemperatur wird das Reaktionsgemisch
mit 0,25 M Salzsäure
gequencht. Das Reaktionsgemisch wird mit Ethylacetat (3 × 100 ml)
extrahiert. Die vereinigten Ethylacetatextrakte werden getrocknet
und das Lösemittel
wird unter Vakuum entfernt, wobei ein blassgelbes Öl erhalten
wird. Das Ö1
wird in Toluol gelöst
und auf eine Silicagelsäule
appliziert, wobei mit Hexan (500 ml) und dann 15% Ethylacetat/Hexan
eluiert wird, wobei 13,8 g des gewünschten Titelprodukts als Öl erhalten
werden.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR (CDCl3) 0,691, 0,641, 0,024, 0,949, 0,973, 1,56,
1,58, 1,60, 1,62, 1,72, 1,75, 1,78, 1,80, 2,74, 2,76, 2,79, 2,81,
2,97, 2,99, 3,01, 3,04, 4,16, 4,16, 4,20, 4,71, 4,74, 4,76, 5,59,
5,61, 7,16–7,42.
-
Herstellungsbeispiel 59:
(S)-α-Ethyl-hydrozimtsäure (Formel
X-4) Siehe Reaktionsschema X
-
(4R,5S)-3-(α[S]-Benzyl)butyryl-4-methyl-5-phenyl-2- oxazolidinon von
Herstellungsbeispiel 58 (1,50 g) wird zu einem 3:1-Gemisch von Tetrahydrofuran/Wasser
(15 ml) gegeben. Zu dieser Lösung
wird eine Lithiumhydroxid/Wasserstoffperoxid-Lösung (aus 4,45 ml einer etwa
10 M Lösung
von Wasserstoffperoxid und 393 mg Lithiumhydroxidmonohydrat) gegeben
und die gebildete Lösung
wird 3 h gerührt.
Wasser (50 ml) wird zugegeben und das Reaktionsgemisch wird dann
mit Ethylacetat extrahiert. Die wässrige Phase wird mit 2 N Salzsäure angesäuert und
mit Methylenchlorid extrahiert, wobei 0,746 g reines Titelprodukt
als farblose Flüssigkeit
erhalten werden.
[α]D n = +34°.
-
Herstellungsbeispiel 60:
(S)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on
(Formel X-7) Siehe Reaktionsschema X
-
Gemäß dem zur
Herstellung von (R)-2,2-Dimethyl-6-(α-ethylphenethyl)-4H-1,3-dioxin-4-on von
Herstellungsbeispiel 56 beschriebenen Verfahren werden 6,5 g des
Titelprodukts hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 0,92 (m),
1,60 (s), 1,16 (s), 2,41 (m), 2,77, 2,80, 5,13, 7,12–7,27.
-
Beispiel 251: (3S,6S)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
(Formel DD-5) Siehe Reaktionsschema DD
-
Gemäß dem zur
Herstellung von (3S,6R)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
von Beispiel 250 beschriebenen Verfahren werden 1,40 g des Titelprodukts
hergestellt.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 162–164°C.
-
Beispiel 252: Natrium-(3S,6R)-3-(α-ethylbenzyl)-6-(α-ethylphenethyl)-2H-pyran-2-on-4-oxid
-
(3S,6R)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on von
Beispiel 250 (36,2 mg) wird zu 1,0 ml Tetrahydrofuran gegeben. Zu
dieser Lösung
werden 0,4 ml von 0,25 N Natriumhydroxid bei Raumtemperatur gegeben.
Dieses Gemisch wird 30 min gerührt
und das Tetrahydrofuran und Wasser werden unter Vakuum entfernt.
Das gebildete Salz wird mit Ethylether gewaschen und über Nacht
im Vakuumofen getrocknet. Dies ergibt 37,5 mg des gewünschten
Titelprodukts des Natriumsalzes.
-
Die
physikalischen Eigenschaften sind folgende:
Fp 210°C (Zersetzung).
H-NMR
(DMSO-d6) 0,739 (Multiplett), 0,758 (Multiplett),
1,431 (Multiplett), 1,896 (Multiplett), 2,298 (Multiplett), 2,658
(Teil eines ABX), 2,759 (Teil eines ABX), 3,982 (Triplett), 5,199
(Singulett), 6,99–7,37
(Multiplett).
-
Beispiel 253: (3R,6R)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
(Formel AA-5) Siehe Reaktionsschema AA
-
Die
physikalischen Eigenschaften sind folgende:
Fp 161–3°C.
-
Beispiel 254: (3R,6S)-3-(α-Ethylbenzyl)-6-(α-ethylphenethyl)-4-hydroxy-2H-pyran-2-on
(Formel BB-5) Siehe Reaktionsschema BB
-
Die
physikalischen Eigenschaften sind folgende:
H-NMR: 0,83 (m),
0,95 (m), 1,62 (m), 2,13 (m), 2,49 (m), 2,80 (m), 2,88 (m), 4,26
(m), 5,7 (s), 7,02–7,43
(m). STRUKTURDIAGRAMM
REAKTIONSSCHEMA
A
REAKTIONSSCHEMA
B
REAKTIONSSCHEMA
C
REAKTIONSSCHEMA
D
REAKTIONSSCHEMA
E
REAKTIONSSCHEMA
F
REAKTIONSSCHEMA
G
REAKTIONSSCHEMA
H
REAKTIONSSCHEMA
I
REAKTIONSSCHEMA
J
REAKTIONSSCHEMA
K
REAKTIONSSCHEMA
L
REAKTIONSSCHEMA
M
REAKTIONSSCHEMA
N
REAKTIONSSCHEMA
0
REAKTIONSSCHEMA
P
REAKTIONSSCHEMA
Q
REAKTIONSSCHEMA
R
REAKTIONSSCHEMA
R (Fortsetzung)
REAKTIONSSCHEMA
S
REAKTIONSSCHEMA
T
REAKTIONSSCHEMA
U
REAKTIONSSCHEMA
V
REAKTIONSSCHEMA
W
REAKTIONSSCHEMA
X
REAKTIONSSCHEMA
Y
REAKTIONSSCHEMA
Z
REAKTIONSSCHEMA
AA
REAKTIONSSCHEMA
BB
REAKTIONSSCHEMA
CC
REAKTIONSSCHEMA
DD
REAKTIONSSCHEMA
EE
REAKTIONSSCHEMA
FF
REAKTIONSSCHEMA
GG
REAKTIONSSCHEMA
HH
REAKTIONSSCHEMA
II
REAKTIONSSCHEMA
JJ
REAKTIONSSCHEMA
KK
REAKTIONSSCHEMA
LL
REAKTIONSSCHEMA
MM
REAKTIONSSCHEMA
NN
REAKTIONSSCHEMA
OO
REAKTIONSSCHEMA
PP
REAKTIONSSCHEMA
QQ
REAKTIONSSCHEMA
RR
REAKTIONSSCHEMA
SS
REAKTIONSSCHEMA
TT
REAKTIONSSCHEMA
UU
REAKTIONSSCHEMA
UU (Fortsetzung)
REAKTIONSSCHEMA
VV
REAKTIONSSCHEMA
WW
REAKTIONSSCHEMA
XX
REAKTIONSSCHEMA
YY
REAKTIONSSCHEMA
ZZ
REAKTIONSSCHEMA
AAA
REAKTIONSSCHEMA
BBB
REAKTIONSSCHEMA
BBB (Fortsetzung)
REAKTIONSSCHEMA
CCC
REAKTIONSSCHEMA
DDD
TABELLE
I MITTLERE
ABSOLUTE UND RELATIVE (%) PROSTATAGEWICHTE BEI MÄNNLICHEN HUNDEN