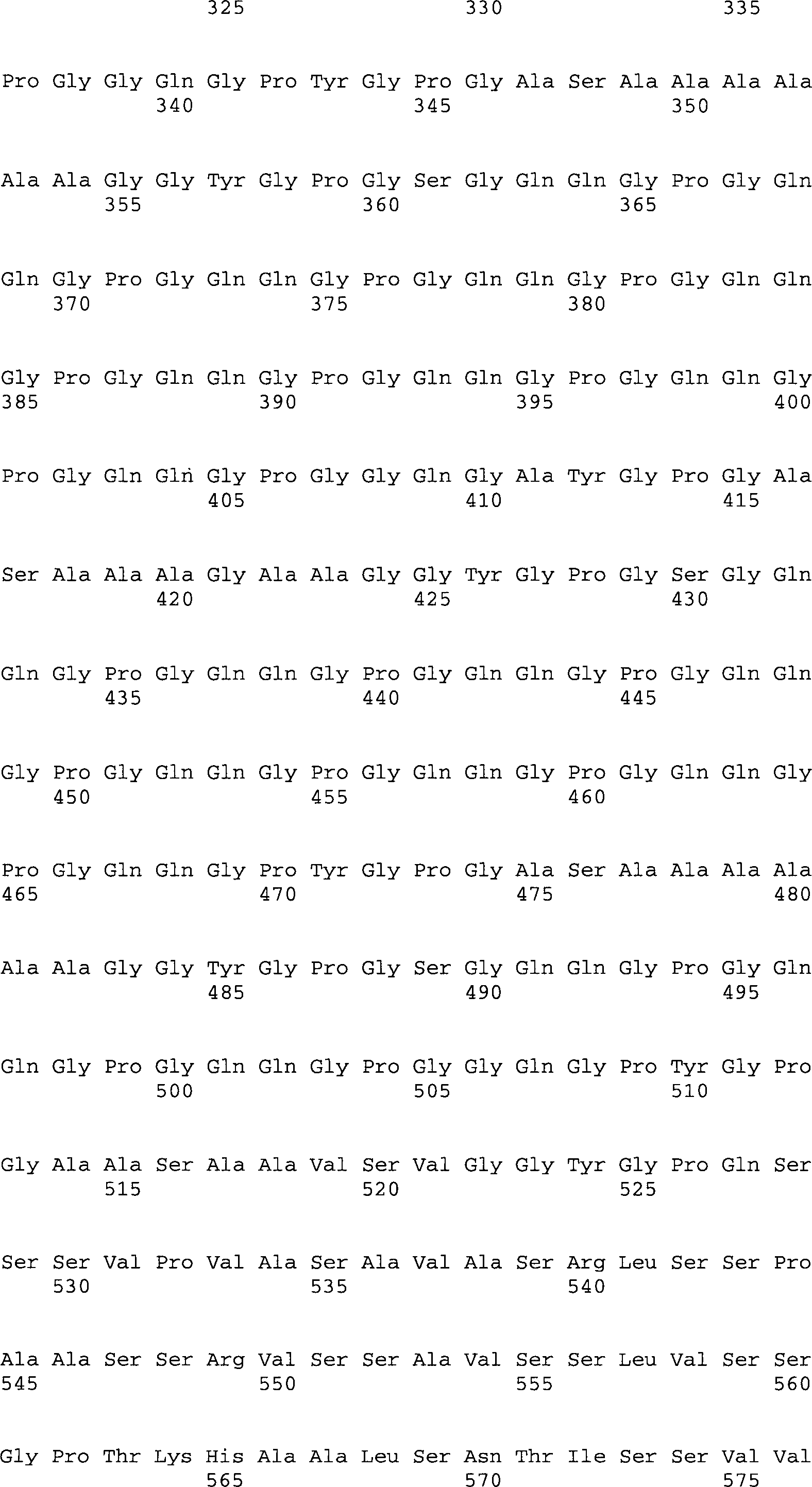DE602005002654T2 - Prozess zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenprotein - Google Patents
Prozess zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenprotein Download PDFInfo
- Publication number
- DE602005002654T2 DE602005002654T2 DE602005002654T DE602005002654T DE602005002654T2 DE 602005002654 T2 DE602005002654 T2 DE 602005002654T2 DE 602005002654 T DE602005002654 T DE 602005002654T DE 602005002654 T DE602005002654 T DE 602005002654T DE 602005002654 T2 DE602005002654 T2 DE 602005002654T2
- Authority
- DE
- Germany
- Prior art keywords
- nano
- emulsion
- proteins
- phase
- microcapsules
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108090000623 proteins and genes Proteins 0.000 title claims abstract description 98
- 102000004169 proteins and genes Human genes 0.000 title claims abstract description 95
- 238000000034 method Methods 0.000 title claims abstract description 42
- 229920001872 Spider silk Polymers 0.000 title claims abstract description 40
- 239000002088 nanocapsule Substances 0.000 title claims abstract description 31
- 239000003094 microcapsule Substances 0.000 title claims abstract description 28
- 230000008569 process Effects 0.000 title claims description 19
- 238000002360 preparation method Methods 0.000 title claims description 7
- 235000013305 food Nutrition 0.000 claims abstract description 7
- 239000000839 emulsion Substances 0.000 claims description 40
- 239000002904 solvent Substances 0.000 claims description 29
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 14
- 229920000642 polymer Polymers 0.000 claims description 13
- 239000003921 oil Substances 0.000 claims description 12
- 239000000725 suspension Substances 0.000 claims description 9
- 239000002537 cosmetic Substances 0.000 claims description 8
- 229910052760 oxygen Inorganic materials 0.000 claims description 7
- 238000005119 centrifugation Methods 0.000 claims description 5
- 239000008194 pharmaceutical composition Substances 0.000 claims description 5
- 239000002105 nanoparticle Substances 0.000 claims description 3
- 239000008177 pharmaceutical agent Substances 0.000 claims description 3
- 238000000926 separation method Methods 0.000 claims description 3
- 239000007787 solid Substances 0.000 claims description 3
- 239000003937 drug carrier Substances 0.000 claims description 2
- 239000011859 microparticle Substances 0.000 claims description 2
- 235000015872 dietary supplement Nutrition 0.000 claims 2
- 101710191900 Actin-depolymerizing factor 4 Proteins 0.000 claims 1
- 239000000047 product Substances 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 9
- 235000018102 proteins Nutrition 0.000 description 88
- 230000003252 repetitive effect Effects 0.000 description 23
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 21
- 239000002245 particle Substances 0.000 description 20
- 101710191899 Actin-depolymerizing factor 3 Proteins 0.000 description 13
- 241000239290 Araneae Species 0.000 description 13
- 239000000243 solution Substances 0.000 description 13
- 235000019198 oils Nutrition 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 241000193935 Araneus diadematus Species 0.000 description 8
- 239000003814 drug Substances 0.000 description 8
- 239000004615 ingredient Substances 0.000 description 8
- 239000003795 chemical substances by application Substances 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 238000005538 encapsulation Methods 0.000 description 7
- 210000004907 gland Anatomy 0.000 description 7
- 108010054442 polyalanine Proteins 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 230000000694 effects Effects 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 238000001338 self-assembly Methods 0.000 description 6
- 108010028203 spidroin 2 Proteins 0.000 description 6
- 241000238902 Nephila clavipes Species 0.000 description 5
- 239000004480 active ingredient Substances 0.000 description 5
- 150000001413 amino acids Chemical group 0.000 description 5
- -1 fatty acid esters Chemical class 0.000 description 5
- 238000001727 in vivo Methods 0.000 description 5
- 239000004094 surface-active agent Substances 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 4
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 238000004945 emulsification Methods 0.000 description 4
- 150000007523 nucleic acids Chemical group 0.000 description 4
- 239000012460 protein solution Substances 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 150000003839 salts Chemical class 0.000 description 4
- 108010028210 spidroin 1 Proteins 0.000 description 4
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- 108091035707 Consensus sequence Proteins 0.000 description 3
- 229920002307 Dextran Polymers 0.000 description 3
- 108010022355 Fibroins Proteins 0.000 description 3
- 241000023946 Gasteracantha Species 0.000 description 3
- 241001499232 Gasteracantha cancriformis Species 0.000 description 3
- 241001419196 Neoscona Species 0.000 description 3
- 241000023955 Nephila senegalensis Species 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 230000008859 change Effects 0.000 description 3
- 238000010367 cloning Methods 0.000 description 3
- 239000000084 colloidal system Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 238000005245 sintering Methods 0.000 description 3
- 241000894007 species Species 0.000 description 3
- 230000007704 transition Effects 0.000 description 3
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 241001157788 Araneus Species 0.000 description 2
- 241001072627 Araneus ventricosus Species 0.000 description 2
- 241000023936 Argiope aurantia Species 0.000 description 2
- 241000326709 Argiope keyserlingi Species 0.000 description 2
- 241000023938 Argiope trifasciata Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 239000004971 Cross linker Substances 0.000 description 2
- 241000386111 Cyclosa Species 0.000 description 2
- 241001140774 Cyrtophora Species 0.000 description 2
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- BFPYWIDHMRZLRN-SLHNCBLASA-N Ethinyl estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@](CC4)(O)C#C)[C@@H]4[C@@H]3CCC2=C1 BFPYWIDHMRZLRN-SLHNCBLASA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000023953 Latrodectus geometricus Species 0.000 description 2
- 241000210679 Nephila inaurata madagascariensis Species 0.000 description 2
- 208000030852 Parasitic disease Diseases 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000005062 Polybutadiene Substances 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000008186 active pharmaceutical agent Substances 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 150000001298 alcohols Chemical class 0.000 description 2
- 239000001961 anticonvulsive agent Substances 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 238000004581 coalescence Methods 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 238000002296 dynamic light scattering Methods 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 235000021323 fish oil Nutrition 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- ZJYYHGLJYGJLLN-UHFFFAOYSA-N guanidinium thiocyanate Chemical compound SC#N.NC(N)=N ZJYYHGLJYGJLLN-UHFFFAOYSA-N 0.000 description 2
- DCAYPVUWAIABOU-UHFFFAOYSA-N hexadecane Chemical compound CCCCCCCCCCCCCCCC DCAYPVUWAIABOU-UHFFFAOYSA-N 0.000 description 2
- 230000002209 hydrophobic effect Effects 0.000 description 2
- 238000002347 injection Methods 0.000 description 2
- 239000007924 injection Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 235000015097 nutrients Nutrition 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 229920002857 polybutadiene Polymers 0.000 description 2
- 229920000136 polysorbate Polymers 0.000 description 2
- 229940068965 polysorbates Drugs 0.000 description 2
- 108090000765 processed proteins & peptides Proteins 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 230000008961 swelling Effects 0.000 description 2
- 229940042585 tocopherol acetate Drugs 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 230000014616 translation Effects 0.000 description 2
- 239000011782 vitamin Substances 0.000 description 2
- 235000013343 vitamin Nutrition 0.000 description 2
- 229940088594 vitamin Drugs 0.000 description 2
- 229930003231 vitamin Natural products 0.000 description 2
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- XZIIFPSPUDAGJM-UHFFFAOYSA-N 6-chloro-2-n,2-n-diethylpyrimidine-2,4-diamine Chemical compound CCN(CC)C1=NC(N)=CC(Cl)=N1 XZIIFPSPUDAGJM-UHFFFAOYSA-N 0.000 description 1
- 241000298986 Acusilas coccineus Species 0.000 description 1
- 241001235531 Arachnura Species 0.000 description 1
- 241000238901 Araneidae Species 0.000 description 1
- 241001157789 Araneus bicentenarius Species 0.000 description 1
- 241000299018 Araneus mitificus Species 0.000 description 1
- 241000356504 Argiope Species 0.000 description 1
- 241000326736 Argiope aemula Species 0.000 description 1
- 241000633949 Argiope argentata Species 0.000 description 1
- 241000356536 Argiope bruennichi Species 0.000 description 1
- 241000326716 Argiope picta Species 0.000 description 1
- 241000326721 Argiope versicolor Species 0.000 description 1
- 241000293099 Arkys Species 0.000 description 1
- 241001641966 Arkys lancearius Species 0.000 description 1
- 108010000241 Arthropod Proteins Proteins 0.000 description 1
- 241001061264 Astragalus Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241001153678 Calyptra Species 0.000 description 1
- 241000905805 Celaenia excavata Species 0.000 description 1
- 241000511998 Ceropegia Species 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 241001235526 Cyrtophora exanthematica Species 0.000 description 1
- 241001599766 Cyrtophora hirta Species 0.000 description 1
- 241001221772 Cyrtophora moluccensis Species 0.000 description 1
- 241001669164 Cyrtophora unicolor Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- SNPLKNRPJHDVJA-ZETCQYMHSA-N D-panthenol Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCCO SNPLKNRPJHDVJA-ZETCQYMHSA-N 0.000 description 1
- 206010012335 Dependence Diseases 0.000 description 1
- 208000020401 Depressive disease Diseases 0.000 description 1
- 206010013654 Drug abuse Diseases 0.000 description 1
- 241000326717 Eriophora Species 0.000 description 1
- 241000005106 Eriophora pustulosa Species 0.000 description 1
- 241000299431 Eriovixia Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241001598868 Gasteracantha kuhlii Species 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000599005 Herennia multipuncta Species 0.000 description 1
- 241000498254 Heterodera glycines Species 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 101000668058 Infectious salmon anemia virus (isolate Atlantic salmon/Norway/810/9/99) RNA-directed RNA polymerase catalytic subunit Proteins 0.000 description 1
- 241000320843 Macracantha arcuata Species 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 208000019695 Migraine disease Diseases 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241001419198 Neoscona nautica Species 0.000 description 1
- 241000238903 Nephila Species 0.000 description 1
- 241000693064 Nephila antipodiana Species 0.000 description 1
- 241001221062 Nephila clavata Species 0.000 description 1
- 241001221743 Nephila pilipes Species 0.000 description 1
- 241000293091 Nephilengys malabarensis Species 0.000 description 1
- 241000533689 Ordgarius Species 0.000 description 1
- 241000905801 Ordgarius magnificus Species 0.000 description 1
- 238000001016 Ostwald ripening Methods 0.000 description 1
- 241001216761 Parawixia Species 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 241000533713 Poecilopachys australasia Species 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 101800004937 Protein C Proteins 0.000 description 1
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 1
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 1
- 102100036546 Salivary acidic proline-rich phosphoprotein 1/2 Human genes 0.000 description 1
- 101800001700 Saposin-D Proteins 0.000 description 1
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical class [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 108700005078 Synthetic Genes Proteins 0.000 description 1
- 241001261166 Tegenaria atrica Species 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 241000557193 Zygiella Species 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000011149 active material Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 235000021120 animal protein Nutrition 0.000 description 1
- 238000010539 anionic addition polymerization reaction Methods 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001088 anti-asthma Effects 0.000 description 1
- 230000001773 anti-convulsant effect Effects 0.000 description 1
- 230000003556 anti-epileptic effect Effects 0.000 description 1
- 230000002921 anti-spasmodic effect Effects 0.000 description 1
- 239000000924 antiasthmatic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 229960003965 antiepileptics Drugs 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 229940124575 antispasmodic agent Drugs 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 239000002249 anxiolytic agent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- 230000008033 biological extinction Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- ZEASOXUPPLSUSE-UHFFFAOYSA-N butanedioic acid;sulfane Chemical class S.OC(=O)CCC(O)=O ZEASOXUPPLSUSE-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000002490 cerebral effect Effects 0.000 description 1
- 239000013043 chemical agent Substances 0.000 description 1
- 238000010382 chemical cross-linking Methods 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 239000000645 desinfectant Substances 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 230000002500 effect on skin Effects 0.000 description 1
- 238000000635 electron micrograph Methods 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 235000013373 food additive Nutrition 0.000 description 1
- 239000002778 food additive Substances 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 235000013376 functional food Nutrition 0.000 description 1
- 230000014509 gene expression Effects 0.000 description 1
- YQEMORVAKMFKLG-UHFFFAOYSA-N glycerine monostearate Natural products CCCCCCCCCCCCCCCCCC(=O)OC(CO)CO YQEMORVAKMFKLG-UHFFFAOYSA-N 0.000 description 1
- SVUQHVRAGMNPLW-UHFFFAOYSA-N glycerol monostearate Natural products CCCCCCCCCCCCCCCCC(=O)OCC(O)CO SVUQHVRAGMNPLW-UHFFFAOYSA-N 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 150000002314 glycerols Chemical class 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 230000009931 harmful effect Effects 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000003667 hormone antagonist Substances 0.000 description 1
- 230000003345 hyperglycaemic effect Effects 0.000 description 1
- 239000003326 hypnotic agent Substances 0.000 description 1
- 230000000147 hypnotic effect Effects 0.000 description 1
- 239000005554 hypnotics and sedatives Substances 0.000 description 1
- 229940005535 hypnotics and sedatives Drugs 0.000 description 1
- 230000002218 hypoglycaemic effect Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 206010027599 migraine Diseases 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 239000003471 mutagenic agent Substances 0.000 description 1
- 231100000707 mutagenic chemical Toxicity 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 230000006855 networking Effects 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 235000020939 nutritional additive Nutrition 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 230000003204 osmotic effect Effects 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 229940101267 panthenol Drugs 0.000 description 1
- 235000020957 pantothenol Nutrition 0.000 description 1
- 239000011619 pantothenol Substances 0.000 description 1
- 230000005501 phase interface Effects 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 239000000419 plant extract Substances 0.000 description 1
- 235000021118 plant-derived protein Nutrition 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001987 poloxamine Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920000867 polyelectrolyte Polymers 0.000 description 1
- 229920002643 polyglutamic acid Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920000056 polyoxyethylene ether Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229960000856 protein c Drugs 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 230000002797 proteolythic effect Effects 0.000 description 1
- 208000020016 psychiatric disease Diseases 0.000 description 1
- 229940001470 psychoactive drug Drugs 0.000 description 1
- 239000004089 psychotropic agent Substances 0.000 description 1
- 230000000506 psychotropic effect Effects 0.000 description 1
- 239000005871 repellent Substances 0.000 description 1
- 230000002940 repellent Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000007151 ring opening polymerisation reaction Methods 0.000 description 1
- 201000000980 schizophrenia Diseases 0.000 description 1
- 229910052711 selenium Inorganic materials 0.000 description 1
- 239000011669 selenium Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000010008 shearing Methods 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 229940035044 sorbitan monolaurate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000000021 stimulant Substances 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 208000011117 substance-related disease Diseases 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- CMQCNTNASCDNGR-UHFFFAOYSA-N toluene;hydrate Chemical compound O.CC1=CC=CC=C1 CMQCNTNASCDNGR-UHFFFAOYSA-N 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- 239000011573 trace mineral Substances 0.000 description 1
- 235000013619 trace mineral Nutrition 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 210000003956 transport vesicle Anatomy 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/02—Cosmetics or similar toiletry preparations characterised by special physical form
- A61K8/11—Encapsulated compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/42—Proteins; Polypeptides; Degradation products thereof; Derivatives thereof, e.g. albumin, gelatin or zein
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/64—Proteins; Peptides; Derivatives or degradation products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5052—Proteins, e.g. albumin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5192—Processes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/43504—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
- C07K14/43563—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/40—Chemical, physico-chemical or functional or structural properties of particular ingredients
- A61K2800/41—Particular ingredients further characterized by their size
- A61K2800/412—Microsized, i.e. having sizes between 0.1 and 100 microns
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2800/00—Properties of cosmetic compositions or active ingredients thereof or formulation aids used therein and process related aspects
- A61K2800/40—Chemical, physico-chemical or functional or structural properties of particular ingredients
- A61K2800/41—Particular ingredients further characterized by their size
- A61K2800/413—Nanosized, i.e. having sizes below 100 nm
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Physics & Mathematics (AREA)
- Nanotechnology (AREA)
- Optics & Photonics (AREA)
- Biomedical Technology (AREA)
- Birds (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Insects & Arthropods (AREA)
- Biochemistry (AREA)
- Toxicology (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Gastroenterology & Hepatology (AREA)
- Dermatology (AREA)
- Inorganic Chemistry (AREA)
- Cosmetics (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Manufacturing Of Micro-Capsules (AREA)
- Coloring Foods And Improving Nutritive Qualities (AREA)
Description
- Die vorliegende Erfindung betrifft ein Verfahren zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenproteinen. Die Erfindung betrifft weiterhin Nano- oder Mikrokapseln, die durch dieses Verfahren gewinnbar sind, ebenso wie pharmazeutische, kosmetische und Nahrungsmittelzusammensetzungen, die dieselben enthalten.
- Strukturen im kleinen Maßstab sind von großem Interesse als Transportvesikel und als potentielle Bausteine für Vorrichtungen der Zukunft. Eine Aufgabe besteht darin, Reaktanten oder Teilchen in kleinem Maßstab zu verkapseln oder die ausgelöste Freisetzung des eingekapselten Materials zu ermöglichen, nachdem dieses an einem speziellen Ort angeordnet wurde. Eine Lösung für ein derartiges Problem ist die Verwendung chemischer Vesikeln, sog. Nanokapseln. Die Nanokapseln werden so entwickelt, dass die Reaktanten nach Einwirkung eines externen Auslösers oder Stimulus bzw. Reizes freigesetzt werden. Es ergeben sich mehrere Probleme aus einem derartigen Bestreben: das Bedeutendste besteht darin, wie solche Nanokapseln auf definiertem Wege um beispielsweise chemisch oder biologisch aktive Reaktanten herum aufgebaut werden sollen.
- Kürzlich wurden „Hybrid" Stimuli-Responsive Nanokapseln entwickelt, um diesem Bedarf entgegen zukommen. Die Strukturen (Vesikeln, jedoch auch Mizellen) werden aus der Selbst-Assemblierung beispielsweise amphiphiler Polybutadien (PB)-b-Poly(Glutaminsäure) (PGA) Diblock-Copolymere gewonnen, die eine pH-empfindliche Konformation aufweisen. Die pH-Empfindlichkeit kann dazu verwendet werden, die Vesikeln zu entladen. Diese PB-b-PGA-Copolymere, die einen vernetzbaren hydrophoben Block und einen hydrophilen peptidischen Block tragen, wurden durch Kombinieren einer anionischen und einer Ringöffnungspolymerisation synthetisiert (Chécot et al., 2002). Die Polydispersität der Copolymere ist klein genug, um wohl definierte selbst-assemblierte Aggregate zu gewinnen. Beispielsweise formt ein PB40-b-PGA100 Copolymer, wenn es sich in Wasser befindet, geschlossene Bilayer-Vesikeln, die als Polymersome bezeichnet werden. (Won et al., 1999). Eine Eigenschaft der Vesikeln besteht darin, dass sie auf eine äußere pH-Verschiebung durch Veränderung ihrer Größe reagieren (
1 ). Dieser Übergang nach pH-Veränderung ist reversibel und nur mode rat gegenüber der Salinität empfindlich, weil er nicht auf einem einfachen Polyelektrolyt-Quelleffekt beruht, sondern auf der peptidischen Natur des PGA-Blocks (1 ). Diese Vesikeln sind nicht nur dazu in der Lage, Verbindungen mit niedrigem Molekulargewicht einzukapseln (wie Lösungsmittelmoleküle, wie beispielsweise Fluorophore (Chécot et al., 2003)), sondern können auch größere Nanopartikel stabilisieren. Der Nachteil derartiger Systeme besteht in der teilweisen Inkompatibilität mit biologischen Systemen, die üblicherweise gegenüber dramatischen pH-Veränderungen hoch empfindlich sind, weil pH-Veränderungen einen Verlust der biologischen Aktivität der verkapselten Probe zur Folge haben können. -
1 zeigt zur Veranschaulichung (a) eine Dynamische Lichtstreuung (= Dynamic Light Scattering) des hydrodynamischen Peptosom-Radius RH als eine Funktion der NaCl-Konzentration und des pH. (b) Schematische Darstellung des Peptosoms und seiner Größenveränderung als Funktion des pHs aufgrund eines Knäuel-zu-α-Helixsekundärstrukturübergangs im Peptidanteil. - Ein weiteres etabliertes Verkapselungsverfahren ist die Selbst-Assemblierung kolloidaler Teilchen an der Öl/Wasser-Grenzfläche. Die Antriebskraft für den Selbst-Assemblierungsprozess ist die Minimierung der Gesamtoberflächenenergie – somit kann eine breite Vielzahl von Teilchen und Lösungsmitteln verwendet werden. Derart stabilisierte Emulsionen sind als Pickering-Emulsionen wohl bekannt. Die Stabilisierung einer Vernetzung der Teilchen führt zu mechanisch stabilen Käfigen, die dann in die kontinuierliche Phase übertragen werden können. Die Vorteile der sog. Kolloidosomen sind die Kontrolle des zu verkapselnden Stoffes und die Erleichterung der Abstimmung der mechanischen und chemischen Stabilität der Außenhülle. Die Selbst-Assemblierung der Teilchen hat eine beinahe kristalline Struktur zur Folge und somit treten Löcher zwischen den Teilchen auf. Diese Löcher sind ein größenselektiver Filter, der die Kontrolle der Diffusion über die Membrane hinweg ermöglicht (Dinsmore et al., 2000). Der gesamte Prozess kann auf eine biokompatible Weise durchgeführt werden. Jedoch sind die kolloidalen Teilchen selbst nicht notwendigerweise biokompatibel.
-
US 6 303 150 beschreibt Nanokapseln mit vernetzten Protein-basierten Wänden. Das Protein muss Film-bildende Effekte aufweisen und kann aus einer Gruppe von Pflanzen- oder Tierproteinen wie beispielsweise Seide ausgewählt sein. Ein Vernetzungsmittel ist erforderlich. -
WO 02/47665 WO 02/47665 - Es ist deswegen eine Aufgabe der vorliegenden Erfindung, Nano- und Mikrokapseln bereitzustellen, die in hohem Maße biokompatibel und somit für in vivo-Anwendungen geeignet sind. Es ist eine weitere Aufgabe dieser Erfindung, Nano- und Mikrokapseln zu gewinnen, die dazu in der Lage sind, unterschiedliche Typen und variierende Mengen wirksamer Mittel oder Nährstoffe etc. aufzunehmen. Es ist eine weitere Aufgabe der vorliegenden Erfindung, Nano- und Mikrokapseln bereitzustellen, die biologisch abbaubar sind, d. h., die zu einer kontrollierten Freisetzung der wirksamen Stoffe etc. in vivo in der Lage sind, beispielsweise bei topischen oder systemischen Verabreichungen.
- Diese Aufgaben werden durch den Gegenstand der unabhängigen Ansprüche gelöst. Bevorzugte Ausführungsformen sind in den abhängigen Ansprüchen angegeben.
- Es hat sich in der vorliegenden Erfindung erstaunlicher Weise herausgestellt, dass Spinnenseidenproteine als Basis zur Ausbildung von Mikro- und Nanokapseln dienen können, die für verschiedene in vivo-Anwendungen verwendet werden. Es hat sich insbesondere herausgestellt, dass dies durch ein verbessertes Verfahren zur Herstellung dieser Kapseln getan werden kann, das den Bedarf nach der Verwendung von Schritten zur Bindung oder Stabilisierung der Teilchen, aus denen die Kapseln gebildet werden, durch Zusatz von Chemikalien wie Vernetzern umgeht oder dass das Sintern oder dergleichen erfordert, was nachteilige Effekte auf die in die Mikro- und Nanokapseln zu verpackenden Mittel aufweisen könnte.
- Weil die meisten gegenwärtig verwendeten Verkapselungstechniken (siehe beispielsweise
WO 02/47665 - Beispielsweise könnten Nano- oder Mikrokapseln zerstört werden und ihre Inhalts-stoffe könnten in vivo chemisch, physikalisch (beispielsweise durch Scherkräfte) oder biologisch (durch proteolytischen Verdau) freigesetzt werden.
- Die Selbst-Assemblierung der Spinnenseidenproteine an der Grenzfläche wurde durch Einbringen des Proteins in die Wasserphase einer Wasser/Öl-Emulsion (siehe
2 ) erreicht. Die Minimierung der Oberflächenenergie trieb die Proteine zur Grenzfläche und induzierte eine Aggregation der Monomere zu einem dichten Polymernetzwerk (3 ). - Die Spinnentaschen/Ballons, die aus diesem Verfahren gebildet werden, werden beispielsweise mit dem Inhalt der Wasserphase gefüllt und können in organischen Lösungsmitteln, Alko holen ebenso wie in Wasser existieren (
3 ). Deswegen zeigen sie eine unerwartete Stabilität in stark unterschiedlichen Umgebungen. Prinzipiell ist die Selbst-Assemblierung von Proteinen an einer inversen Emulsionsoberfläche ebenfalls möglich – somit wird der Inhalt der Ölphase (siehe ebenfalls unten) eingekapselt. - Auffälligerweise können die Taschen/Ballons mit Proteinen, chemischen Reaktanten, Nano- und Mikrometer großen Teilchen etc. befüllt werden, was beispielhaft durch Befüllung der Teilchen mit Fluoreszenz- (FITC) markierten Dextranteilchen (
4 ) dargestellt ist. - Die Impermeabilität der Membrane und die mechanische Stabilität der Beutel bzw. der Taschen gegen osmotische Belastungen sind unter Berücksichtigung der Dicke der Membran beide relativ groß. Elektronenmikroskopie-Bilder zeigen, dass die Dicke zwischen 10 und 70 nm liegt (
5 ). - Der gegenwärtige Ansatz wurde durch Verwendung synthetischer Spinnenseidenproteine demonstriert, insbesondere durch Verwendung der synthetischen Sequenz C16 (Huemmerich et al., 2004) zur Erzeugung einer biologischen Verkapselung aktiver Mittel.
- Spinnenseiden sind allgemein Proteinpolymere, die außerordentliche physikalische Eigenschaften zeigen, es existieren jedoch nur begrenzte Informationen bezüglich der Zusammensetzung der verschiedenen Seiden, die durch unterschiedliche Spinnen produziert wurden (siehe Scheibel, 2004). Unter den verschiedenen Typen von Spinnenseiden wurden die Abseilfäden bzw. Draglines der golden Seidenspinne Nephila Clavipes und der Gartenkreuzspinne Araneus Diadematus am intensivsten untersucht. Abseilfaden-Seiden sind im Allgemeinen aus zwei Hauptproteinen zusammengesetzt und es bleibt unklar, ob zusätzliche Proteine eine signifikante Rolle in der Assemblierung der Seide und der endgültigen Seiden-Struktur spielen. Die beiden Hauptproteinkomponenten von Abseilfäden von Araneus Diadematus sind ADF-3 und ADF-4 (Araneus Diadematus Fibroin).
- Gene, die für spinnenseidenartige Proteine kodieren wurden unter Verwendung einer Klonierungsstrategie erzeugt, die auf einer Kombination synthetischer DNA-Modul und PCR-amplifizierter authentischer Gen-Sequenzen basierte (Huemmerich et al., 2004). Die Abseilfaden-Spinnenproteine ADF-3 und ADF-4 von der Gartenspinne Araneus Diadematus wurden als Matrizen für die synthetischen Konstrukte gewählt. Eine nahtlose Klonierungsstrategie ermöglichte die kontrollierte Kombination unterschiedlicher synthetischer DNA-Modul ebenso wie authentischer Genfragmente. Ein Klonierungsvektor wurde entwickelt, der eine Klonierungskassette mit einem Spacer umfasste, der als Platzhalter für synthetische Gene diente (Huemmerich et al., 2004).
- Um die repetitive Sequenz von ADF-4 nachzuahmen, wurde eine einzige konservierte Repeat- bzw. Wiederholungseinheit entwickelt, um ein Konsensus-Modul mit der Bezeichnung C zu gewinnen, das multimerisiert wurde, um das repetitive Protein C16 zu gewinnen, das im gegebenen Ansatz als Beispiel verwendet wurde.
- Es existieren viele mögliche Anwendungen für die präsentierten Spinnenseidentaschen/Ballons, die sich von Functional Food bis pharmazeutische oder kosmetische Anwendungen bewegen. Beispielsweise könnte die Verkapselung in der Nahrungsmitteltechnologie bestimmte Inhaltsstoffe wie beispielsweise Vitamine vor einer oxidierenden Umgebung schützen. In anderen Nahrungsmitteltechnologieanwendungen könnten Inhaltsstoffe wie beispielsweise Fischöl in ihrem Geschmack kaschiert werden. In pharmazeutischen Anwendungen ermöglicht die Diffusionsbarriere der Proteinhülle langsame (kontrollierte) Freisetzungsprozesse für das eingekapselte Material. Das weitere Design der Proteinhüllen könnte einen definierten Freisetzungs-Behälter zur Folge haben, der den Inhalt nur nach Aktivierung unter Verwendung bestimmter Proteasen oder anderer Auslöser bzw. Trigger freisetzt. In der Kosmetik könnte der Transport wasseraktiver Inhaltsstoffe in die Haut durch die präsentierten Beutel/Ballons erleichtert werden, nach langsamem Abbau der Proteinhülle, beispielsweise durch Proteasen der Haut. Weiterhin könnte eine mechanische Scherung dazu verwendet werden, den Inhalt nach Exposition gegenüber der Haut freizusetzen.
- Die vorliegende Erfindung betrifft insbesondere die folgenden Aspekte und Ausführungsformen:
Gemäß einem ersten Aspekt betrifft die vorliegende Erfindung ein Verfahren zur Herstellung von Nano- und Mikrokapseln, das die folgenden Schritte umfasst: - a) Bereitstellung von Spinnenseidenproteinen;
- b) Ausbilden einer Lösung oder Suspension dieser Proteine in einem geeigneten Lösungsmittel;
- c) Erzeugen einer Emulsion mit zumindest zwei Phasen, wobei die Emulsion die Lösung oder Suspension, gebildet in b) als erste Phase und zumindest eine weitere Phase enthält, die im Wesentlichen mit der ersten Phase nicht mischbar ist;
- d) Ausbilden eines Polymernetzwerks der Spinnenseidenproteine einer Grenzfläche der zumindest zwei Phasen;
- e) Abtrennen des Proteinpolymernetzwerks, erzeugt in (d) aus der Emulsion.
- Wie oben erklärt, hat es sich unerwarteter Weise herausgestellt, dass die Bildung des Polymernetzwerks in Schritt d) nicht den Zusatz irgendwelcher weiterer Inhalts-stoffe (beispielsweise Vernetzer) erfordert und kein Bedarf nach zusätzlichen Schritten wie Sintern, Vernetzen etc. besteht.
- Es sei erwähnt, dass der Begriff „Spinnenseidenprotein" wie hierin verwendet, nicht nur alle natürlichen Sequenzen, sondern auch alle künstlichen oder synthetischen Sequenzen umfasst, die hieraus abgeleitet sind.
- Demgemäß können die Spinnenseidensequenzen aus Sequenzen gewonnen werden, die hierin als „authentisch" bezeichnet werden. Dieser Begriff bedeutet, dass die zugrunde liegenden Nukleinsäuresequenzen aus ihrer natürlichen Umgebung ohne Durchführung substantieller Änderungen in der Sequenz selbst isoliert werden. Die einzige Modifikation, die eintreten darf besteht darin, wenn die authentische Nukleinsäuresequenz modifiziert wird, um die Sequenz an die Expressionen einem Wirt ohne Veränderung der kodierten Aminosäuresequenz anzupassen. Bevorzugte Sequenzen sind NR3 (SEQ ID No. 10, gewonnen aus ADF-3) und NR4 (SEQ ID No. 11, gewonnen aus ADF-4). In beiden Sequenzen wurde zur effizienteren Translation das Codon AGA (Arg), das selten in E. coli translatiert wird, zu CGT (Arg) unter Verwendung von PCR-Mutagene mutiert.
- Die authentischen nicht-repetitiven Sequenzen sind bevorzugt aus den aminoterminalen nicht-repetitiven Regionen (flagelliforme Proteine) abgeleitet und/oder der carboxyterminalen nicht-repetitiven Region (Flagelliform- und Dragline-Proteine) von natürlich vorkommenden Spinnenseidenproteinen. Bevorzugte Beispiele dieser Proteine sind unten angegeben.
- Gemäß einer weiteren Ausführungsform sind die authentischen nicht-repetitiven Sequenzen von der aminoterminalen nicht-repetitiven Region (flagelliforme Proteine) und/oder der carboxyterminalen nicht-repetitiven Region (flagelliforme und Dragline-Proteine) eines natürlich vorkommenden Spinnenseidenproteins abgeleitet.
- Bevorzugte authentische Sequenzen flagelliformer Proteine sind die Aminosäuresequenz und Nukleinsäuresequenz von FlagN-NR (SEQ ID No. 31 und 32) und FlagC-NR (SEQ ID No. 33 und 34).
- Die rekombinanten Spinnenseidenproteine der Erfindung können im Allgemeinen von Spinnen-Dragline-Proteinen aus der großen Ampullen drüse bzw. „major ampullate"-Drüse und/oder von Proteinen, abgeleitet aus der Flagelliform-Drüse abgeleitet sein.
- Gemäß einer Ausführungsform sind die rekombinanten (synthetischen/künstlichen) Spinnenseidenproteine, die in der vorliegenden Erfindung verwendet werden können, im Allgemeinen von Spinnenseiden Dragline-Proteinen aus der „major ampullate"-Drüse der Spinne und/oder aus Proteinen, die aus der Flagelliform-Drüse gewonnen werden, abgeleitet.
- Es wird im Allgemeinen bevorzugt, die Dragline- und/oder Flagelliform-Sequenzen aus Dragline- und Flagelliform-Proteinen von Radnetzspinnen (Araneidae und Araneoiden) auszuwählen.
- Besonders bevorzugt werden die Dragline-Proteine und/oder Flagelliform-Proteine aus einer oder mehreren der nachfolgenden Spinnen ausgewählt: Arachnura Higginsi, Araneus Circulissparsus, Araneus Diadematus, Argiope Picta, Wespenspinne (Argiope Trifasciata), Nephila Antipodiana, Cyrtophora Beccarii, Celaenia Excavata, Gasteracantha Kuhlii, Argiope Aurantia, Ordgarius Furcatus, Ordgarius Magnificus, Neoscona Nautica, Neoscona Rufofemorata, Zygiella Calyptra, Parawixia Dehaani, Neoscona Oxancensis, Gasteracantha Cancriformis (elipsoides), Gasteracantha Arcuata, Cyrtophora Moluccensis, Cyrtophora Parnasia, Dolophones Conifera, Dolophones Turrigera, Gasteracantha Doriae, Gasteracantha Mammosa, Cyrtophora Exanthematica, Aculeperia Ceropegia, Eriophora Pustulosa, Anespsion Depressi um, Gasteracantha Quadrispinosa, Eriophora Transmarina, Araneus Bicentenarius, Nephila Maculata, Gasteracantha Hasseltii, Tegenaria Atrica, Heurodes Turrita, Cyclosa Insulana, Astracantha Minax, Araneus Mitificus, Eriovixia Laglaisei, Cyclosa Bifida, Nephilengys Malabarensis, Argiope Versicolor, Herennia Ornatissima, Argiope Aemula, Cyrtophora Unicolor, Cyrtophora Hirta, Argiope Keyserlingi, Acusilas coccineus, Argiope Argentata, Gasteracantha Cancriformis, Neoscona Domiciliorum, Argiope Aetheria, Argiope Keyserlingi, Polytys Illepidus, Arkys Clavatus, Arkys Lancearius, Poecilopachys Australasia, Nephila Species, z. B. Nephila Clavipes, Nephila Senegalensis, Nephila Madagascariensis und viele mehr (bezüglich weiterer Spinnenspezies, siehe ebenfalls unten). Am meisten bevorzugt sind die Dragline-Proteine von Araneus Diadematus abgeleitet und die Flagelliform- Proteine sind von Nephila Clavipes abgeleitet.
- Im Kontext dieser Erfindung sollte klar sein, dass ein rekombinantes Spinnenseidenprotein nicht nur Proteinsequenzen aus einer Spezies umfassen kann, sondern auch Sequenzen enthalten kann, die aus unterschiedlichen Spinnenspezies abgeleitet sind. Als Beispiel könnte die ein oder mehrere synthetische repetitiven Spinnenseidenproteinsequenzen aus einer Spezies abgeleitet sein, die ein oder mehreren authentischen nicht-repetitiven Spinnenseidenproteinsequenzen von einer anderen. Als weiteres Beispiel ist es ebenfalls möglich, ein rekombinantes Spinnenseidenprotein zu entwickeln, das mehr als eine Art einer repetitiven Sequenz enthält, wobei die unterschiedlichen Typen aus unterschiedlichen Spezies abgeleitet sind.
- Gemäß einer bevorzugten Ausführungsform ist das Dragline-Protein Wildtyp ADF-3, ADF-4, MaSp I, MaSp II und ist das flagelliforme Protein FLAG. Der Begriff ADF-3/-4 wird im Kontext von MaSp-Proteinen verwendet, die durch Araneus Diadematus erzeugt werden. (Araneus Diadematus Fibroin 3/4). Beide Proteine, ADF-3 und -4 gehören zur Klasse von MaSp II-Proteinen (Major Ampullate Spidroin II).
- In einer weiteren Ausführungsform ist die bereitgestellte Nukleinsäuresequenz ADF-3 (SEQ ID No. 1) und/oder ADF-4 (SEQ ID No. 2) oder eine Variante hiervon.
- Es wird angemerkt, dass zwei unterschiedliche Arten von ADF-3 und ADF-4 codierenden Sequenzen und Proteinen in dieser Erfindung betrachtet werden: zunächst die bereits veröffentlichte Sequenz von ADF-3 und ADF-4 (hierin „Wildtyp"-Sequenz) und zweitens, eine Variante hiervon, codiert von SEQ ID No. 1 (ADF-3) und 2 (ADF-4). Die Wildtyp- Sequenzen wurden bereits veröffentlicht und sind unter den Zugangsnummern U47855 und U47856 (SEQ ID No. 8 und 9) verfügbar.
- Weitere Spinnenseidenproteine, die in dieser Erfindung verwendet werden können (d. h. alleine oder in Kombination mit weiteren Proteinen) und ihre Datenbankzugangsnummern sind:
Spidroin 2 [Araneus Bicentenarius]gi|27228957
Major Ampullate Gland Dragline Silk Protein-1 [Araneus Ventricosus]gi|27228959
Major Ampullate Gland Dragline Silk-Protein-2 [Araneus Ventricosus]gi|27228959
Ampullate
Spidroin 1 [Nephila Madagascariensis]gi|13562006
Major Ampullate Spidroin 1 [Nephila Senegalensis]gi|13562010
Major Ampullate Spidroin 1 [Latrodectus Geometricus]gi|13561998
Major Ampullate Spidroin 1 [Argiope Trifasciata]gi|13561984
Major Ampullate Spidroin 1 [Argiope Aurantia]gi|13561976
Dragline Silk Protein Spidroin 2 [Nephila Clavata]gi|16974791
Major Ampullate Spidroin 2 [Nephila Senegalensis]gi|13562012
Major Ampullate Spidroin 2 [Nephila Madagascariensis]gi|13562008
Major Ampullate Spidroin 2 [Latrodectus Geometricus]gi|13562002 - Gemäß einer weiteren bevorzugten Ausführungsform ist das flagelliforme Protein SEQ ID No. 6 (Flag-N) und/oder SEQ ID No. 7 (Flag-C) oder eine Variante hiervon.
- Jedoch können ebenfalls bereits bekannte und veröffentlichte flagelliforme Sequenzen hierin verwendet werden, insbesondere die folgenden:
Flagelliform Silk Protein Partial cds [Nephila Clavipes]gi|2833646
Flagelliform Silk Protein Partial cds [Nephila Clavipes]gi|2833648 - In einer bevorzugten Ausführungsform umfasst das rekombinante Spinnenseidenprotein eine oder mehrere synthetische repetitive Sequenzen, die ein oder mehrere Polyalanin enthaltende Konsensus-Sequenzen enthalten. Solche Polyalanin-Sequenzen können von 6 bis 9 Alaninreste enthalten. Siehe beispielsweise SEQ ID No. 1, die mehrere Polyalaninmotive von 6 Alaninresten enthält.
- Vorzugsweise wird die Polyalanin enthaltende Konsensus-Sequenz von ADF-3 abgeleitet und weist die Aminosäuresequenz von SEQ ID No. 3 (Modul A) oder eine Variante hiervon auf. Modul A enthält ein Polyalanin mit 6 Alaninresten. Eine weitere bevorzugte Polyalanin enthaltende Konsensus-Sequenz, abgeleitet von ADF-4, ist Modul C (SEQ ID No. 5), das 8 Alaninreste enthält.
- Gemäß einer weiteren bevorzugten Ausführungsform wird im rekombinanten Spinnenseidenprotein der Erfindung die synthetische repetitive Sequenz von ADF-3 abgeleitet und umfasst ein oder mehrere Repeats bzw. Wiederholungen der Aminosäuresequenz von SEQ ID No. 4 (Modul Q) oder einer Variante hiervon.
- In allgemeinen Worten kann eine synthetische repetitive Sequenz ebenfalls die allgemeinen Motive: GGX oder GPGXX enthalten, d. h. glycinreiche Regionen. Wie oben erwähnt werden diese Regionen dem Protein eine Flexibilität verleihen und somit dem aus dem rekombinanten Spinnenseidenprotein, das die Motive enthält, gebildeten Faden.
- Es sei erwähnt, dass die speziellen Modul für die synthetische repetitive Sequenz zur Verwendung in der vorliegenden Erfindung ebenfalls miteinander verwendet werden können, d. h. Modul (Wiederholungseinheiten), die A und Q, Q und C etc. kombinieren sind ebenfalls von der vorliegenden Erfindung mit umfasst. Obwohl die Anzahl der in das Spinnenseidenprotein einzuführenden Modul nicht beschränkt ist wird es bevorzugt, mehrere Modul der synthetischen repetitiven Sequenz für jedes rekombinante Protein zu verwenden, deren Anzahl sich vorzugsweise von 5 bis 50 Moduln, besonders bevorzugt 10 bis 40 Moduln und am meisten bevorzugt zwischen 15 und 35 Moduln bewegt.
- Die synthetische repetitive Sequenz umfasst vorzugsweise eines oder mehreres von (AQ) und/oder (QAQ) als Repeat-Einheiten. Noch mehr bevorzugt ist die synthetische repetitive Sequenz (AQ)12, (AQ)24, (QAQ)8 oder (QAQ)16.
- Wenn immer die synthetische repetitive Sequenz von ADF-4 abgeleitet ist, kann sie vorzugsweise ein oder mehrere Repeats der Aminosäuresequenz von SEQ ID No. 5 (Modul C) enthalten oder eine Variante hiervon, wie oben erwähnt, wobei die synthetische repetitive Gesamtsequenz C16 oder C32 ist.
- Bevorzugte Ausführungsformen der vollständigen rekombinanten Spinnenseidenproteine der Erfindung sind (QAQ)8NR3, (QAQ)16NR3, (AQ)12NR3, (AQ)24NR3, C16NR4 und C32NR4, d. h. Proteine, die diese Sequenzen umfassen oder aus diesen bestehen.
- Es sei erwähnt, dass die obige Konfiguration der synthetischen repetitiven Sequenz (unter Verwendung des A-, Q- und C-Systems) ebenfalls auf alle anderen Wiederholungseinheiten, die oben offenbart wurden, angewendet werden können, beispielsweise können alle Polyalanine enthaltenden Sequenzen für A und/oder C genommen werden und alle glycinreichen Sequenzen können als Q verwendet werden.
- Neue Modul für synthetische repetitive Sequenzen, die aus flagelliformen Sequenzen abgeleitet sind, sind die Modul K (SEQ ID No. 35 und 36), SP (SEQ ID No. 37 und 38), X (SEQ ID No. 39 und 40) und Y (SEQ ID No. 41 und 42):
Die synthetische repetitive Sequenz umfasst vorzugsweise ebenfalls Y8, Y16, X8, X16, K8, K16 oder besteht aus diesen. - Es ist weiterhin möglich, solche Sequenzen zu kombinieren, die aus ADF-3, ADF-4 und Flag abgeleitet wurden, in einer rekombinanten Sequenz zu kombinieren.
- In der vorliegenden Erfindung wird es jedoch sehr bevorzugt, Spinnenseidenproteine in Schritt a) zu verwenden, die aus Sequenzen der Gruppe von ADF-4 Sequenzen und Derivaten hiervon, die C16, C16NR4, C32 und/oder C32NR4 einschließen, ausgewählt sind oder diese enthalten.
- Gemäß einer weiteren Ausführungsform wird das Lösungsmittel in b) und/oder die Lösungsmittel der zumindest einen weiteren Phase aus der Gruppe ausgewählt, die aus hydrophilen Lösungsmitteln, vorzugsweise Wasser, Alkoholen wie Ethanol, Glycerol oder lipophilen Lösungsmitteln, vorzugsweise natürlichen Ölen, beispielsweise Ölen von Pflanzen oder Tier Ursprung, synthetischen Ölen, wie beispielsweise Miglyol, Silikonöl, organische Lösungsmittel wie beispielsweise aromatischen Kohlenwasserstoffen, beispielsweise Toluol, Benzol etc. besteht.
- Es sei erwähnt, dass eine einzige Phase ebenfalls mehr als ein Lösungsmittel enthalten kann (d. h. ein Gemisch) solange die Lösungsmittel im Wesentlichen identisch sind. „Im Wesentlichen identisch" bedeutet, dass die Lösungsmittel ähnliche Solubilitätseigenschaften aufweisen und somit nur eine gemeinsame Phase bilden. Somit schließen „im Wesentlichen identische" Lösungsmittel Lösungsmittel ein, in denen man keine getrennten Phase beobachten kann, wenn die Lösungsmittel gemischt werden. Als Beispiel können zwei oder mehr lipophile Lösungsmittel in einer Phase kombiniert werden, beispielsweise ein Pflanzenöl (beispielsweise Olivenöl und Rizinusöl) und Miglyol und/oder Hexadekan. Oder, als Alternative, kann eine hydrophile Phase zwei oder mehrere hydrophile Bestandteile umfassen, beispielsweise Wasser, Glycerol und dergleichen.
- Wie oben erwähnt, ist das einzige Erfordernis, dass das Emulsionssystem zur Herstellung der Nano- und Mikrokapseln der Erfindung zumindest zwei Phasen ausweist, wobei die Phasen im Wesentlichen nicht miteinander mischbar sind.
- Alle bekannten Emulsionstypen können in Schritt c) des vorliegenden Verfahrens verwendet werden, beispielsweise W/O, O/W, O/W/O oder W/O/W Typ Emulsionen. Diese Emulsionstypen sind in der Technik wohl bekannt und es wird bezüglich weiterer Informationen auf „Remington's Pharmaceutical Sciences", Mack Publishing Co., Easton, PA, letzte Ausgabe oder weitere verfügbare Informationen Bezug genommen.
- Ein bevorzugtes Verfahren zur Ausbildung der Emulsionen der vorliegenden Erfindung besteht darin, eine Miniemulsion zu erzeugen. Miniemulsionen sind Dispersionen von kritisch stabilisierten Öltröpfchen mit einer Größe zwischen 50 und 500 nm, hergestellt durch Scheren eines Systems, das Öl, Wasser, ein Tensid und ein Hydrophob enthält. Polymerisationen in derartigen Miniemulsionen haben, wenn sie sorgfältig vorbereitet werden, Teilchen zur Folge, die ungefähr dieselbe Größe wie die ursprünglichen Tropfen haben. Dies bedeutet, dass die geeignete Formulierung einer Miniemulsion eine Koaleszenz von Tröpfchen oder ein Ostwald-Ripening unterdrückt. Die Herstellung der Miniemulsion wird durch Hochscherungs-Vorrichtungen wie beispielsweise Ultraschall und Hochdruckhomogenisatoren durchgeführt. Es wird auf die verschiedenen Veröffentlichungen von K. Landfester und Mitarbeiter verwiesen.
- Im Falle einer Emulsion des W/O-Typs wird die W-(hydrophile)-Phase die Emulsionströpfchen bilden und in diesem Falle sind die Spinnenseidenproteine in der W-Phase enthalten. Die O-Phase ist die lipophile Phase und bildet die kontinuierliche Phase.
- Im Falle einer Emulsion des O/W-Typs wird die O-(lipophile)-Phase die Emulsionströpfchen bilden und in diesem Falle sind die Spinnenseidenproteine in der O-Phase enthalten. Die W-Phase ist die hydrophile Phase und bildet die kontinuierliche Phase.
- Die Tenside, die in den obigen Emulsionen verwendet werden, können aus solchen Verbindungen ausgewählt werden, die der Fachmann auf dem Gebiet auf Grundlage des verfügbaren Wissens auf dem Gebiet der pharmazeutischen und verwandter Wissenschaften auswählen wird. Eine beispielhafte Auswahl von Tensiden bzw. oberflächenaktiven Stoffen zur Verwendung in der Gewinnung der vorliegenden Emulsionen sind Fettsäureester von Glycerolen, Sorbitol und andere multifunktionelle Alkohole, vorzugsweise Glycerolmonostearat, Sorbitanmonolaurat, oder Sorbitanmonoleat; Poloxamine, Polyoxyethylenether und Polyoxyethylenester; ethoxylierte Triglyceride; ethoxylierte Phenole und ethoxylierte Diphenole; Metallsalze von Fettsäuren, Metallsalze von Fettalkoholsulfaten, Natriumlaurylsulfat; und Metallsalze von Sulfursuccinaten; Polysorbaten, bevorzugt Polysorbate 20, 40, 60 und 80; Poloxamere, Polyoxyethylenglycole; und Gemische dieser Substanzen.
- Es sei jedoch ausdrücklich erwähnt, dass es kein essentielles Merkmal dieser Erfindung ist, ein Tensid zu verwenden. Der Fachmann auf dem Gebiet kennt Emulsionssysteme, die keine Tenside erfordern.
- In einer bevorzugten Ausführungsform der vorliegenden Erfindung enthält das in 1b) verwendete Lösungsmittel weiterhin ein oder mehrere pharmazeutische Wirkstoffe, kosmetische Mittel, Nährstoffe oder Nahrungsadditive. Mit anderen Worten werden zusätzliche Inhaltsstoffe üblicherweise in der Phase vorhanden sein, die ebenfalls die Spinnenseidenproteine enthält. In diesem Falle werden die ein oder mehreren Inhaltsstoffe/Mittel in das Polymernetzwerk eingekapselt werden, das an der Phasengrenzfläche gebildet wird.
- Es ist als Alternative ebenfalls möglich, die oben erwähnten Mittel zur kontinuierlichen Phase hinzuzufügen, die die Spinnenseidenproteine nicht enthält. In diesem Falle werden die Nano- und Mikrokapseln der Erfindung durch diese Mittel beschichtet werden.
- Als weitere Alternative können die Mittel in die Nano- und Mikrokapseln der Erfindung eingebaut werden, nachdem sie durch das vorliegende Verfahren gewonnen wurden. Dies kann durch Quellen der Membran mit bestimmten Lösungsmitteln und durch Diffundieren des eingekapselten Stoffes (Wirkstoff) innerhalb dieser erreicht werden. Ein Quellen kann ebenfalls durch Temperatur, Druck oder nicht nur Lösungsmittel, sondern auch andere chemische Mittel (wie beispielsweise chemische Mittel, pH und andere) durchgeführt werden.
- Es ist ebenfalls möglich, das zu verkapselnde Mittel in die Membran einzubauen. Dieser Ansatz kann veränderte oder verbesserte Freisetzungseigenschaften als die Verkapselung des zu verkapselnden Stoffes in diese ergeben.
- Der Typ an Wirkstoff, der zusätzlich in die Nano- und Mikrokapseln der Erfindung eingebaut wird, ist in keiner Weise beschränkt.
- Beispielsweise kann das pharmazeutische Mittel bzw. der pharmazeutische Wirkstoff aus der Gruppe ausgewählt sein, die aus Analgetika; Hypnotika und Sedativa; Arzneistoffen zur Behandlung von psychiatrischen Störungen wie beispielsweise Depression und Schizophrenie; Anti-Epileptika und Anti-Konvulsiva; Arzneistoffen für die Behandlung von Parkinson und Huntington-Krankheit, Alters- und Alzheimer Krankheit; Arzneistoffen, die die Behandlung von ZNS-Traumata oder Schlaganfällen zum Ziel haben; Arzneistoffen zur Behandlung von Sucht und Drogenmissbrauch; chemotherapeutischen Mitteln für parasitäre Infektionen und Erkrankungen, die durch Mikroben verursacht sind; immunsuppressiven Mitteln und Anti-Krebsarzneistoffen; Hormonen und Hormonantagonisten; Antagonisten für nicht-metallische toxische Mittel; zytostatische Mittel zur Behandlung von Krebs; diagnostische Substanzen zur Verwendung in der Medizin; immunaktive und immunreaktive Mittel; Antibiotika; Antispasmodika; Antihistaminika; Mitteln gegen Übelkeit; Relaxanzien; Stimulanzien; Zerebraldilatatoren; Psychotropika; vaskulären Dilatatoren und Konstriktoren; Antihypertensiva; Arzneistoffen für die Migränebehandlung; Hypnotika, hyperglykämische und hypoglykämische Mitteln; Anti-Asthmatika; antiviralen Mitteln; und Gemischen hiervon ausgewählt sein.
- Nahrungsmittel und Nahrungsmittelzusatzstoffe können aus der Gruppe ausgewählt sein, die aus Vitaminen (Ascorbinsäure, Tocopherolacetat und dergleichen), Mineralien (Kalzium, Magnesium, Kalium, Natrium, beispielsweise), Spurenelementen (Selen), Extrakten natürlichen Ursprungs, natürlichen Ölen (Fischöl) etc. umfassen.
- Kosmetische Mittel können beispielsweise aus Tocopherolacetat, Ölen natürlichen und synthetischen Ursprungs, Panthenol, Pflanzenextrakten, UV absorbierenden Mitteln, Desinfektionsmitteln, Anti-Irritationsmitteln, Repellanzien ausgewählt sein.
- Es sei erwähnt, dass die Mittel im Lösungsmittel in gelöster, suspendierter oder fester Form vorliegen könnten. Im letzteren Fall wird ein fester Kern bereitgestellt, der durch die Spinnenseidenproteine der vorliegenden Erfindung beschichtet wird.
- In einer bevorzugten Ausführungsform wird die Auftrennung bzw. Abtrennung des Polymernetzwerks in Schritt e) mittels Zentrifugation oder durch Zerstören der in Schritt c) gebildeten Emulsion und durch Bilden einer einphasigen Lösung durchgeführt. Jedoch können auch andere Verfahren verwendet werden, um die Nano- und Mikrokapseln der vorliegenden Erfindung vom Emulsionssystem abzutrennen.
- Die in den Schritten b) bis e) verwendete Temperatur ist 5–40°C, vorzugsweise 10–30 und besonders bevorzugt Raumtemperatur. Der in den Schritten b) bis e) verwendete pH ist 3–9, vorzugsweise 5–8, besonders bevorzugt 7.
- Die Größe der Emulsionströpfchen und der Nano- und Mikroteilchen, die hiervon abgeleitet sind, liegt vorzugsweise von 10 nm bis 20 μm, vorzugsweise zwischen 500 nm und 10 μm, am meisten bevorzugt ungefähr bei 5 μm. Die Wanddicke der erzielten Nano- und Mikrokapseln ist vorzugsweise 5 und 100 nm, besonders bevorzugt zwischen 10 und 70 nm (siehe beispielsweise
5 ). - In einem zweiten Aspekt betrifft die vorliegende Erfindung Nano- und Mikrokapseln, die durch das oben offenbarte Verfahren gewinnbar sind.
- Ein dritter Aspekt der vorliegenden Erfindung betrifft eine pharmazeutische Zusammensetzung, die wie oben definierte Nano- und Mikrokapseln enthält und ein oder mehrere pharmazeutisch verträgliche Träger. Somit werden die aktiven Bestandteile der vorliegenden Erfindung vorzugsweise in einer solchen pharmazeutischen Zusammensetzung in Dosen bzw. Do sierungen verwendet, und werden mit einem verträglichen Träger oder Trägermaterial vermischt, so dass die Erkrankung behandelt oder zumindest gelindert werden kann. Eine derartige Zusammensetzung kann (zusätzlich zum aktiven Bestandteil und dem Träger) Füllmaterial, Salze, Puffer, Stabilisatoren, Solubilisierungsmittel und andere Materialien einschließen, die Stand der Technik sind.
- Der Begriff „pharmazeutisch verträglich" ist als nicht toxisches Material definiert, das die mit der Wirksamkeit der biologischen Aktivität des aktiven Bestandteils nicht interferiert. Die Auswahl des Trägers hängt von der Anwendung ab.
- Die pharmazeutische Zusammensetzung kann zusätzliche Bestandteile enthalten, die die Aktivität des aktiven Bestandteils erhöhen oder die die Behandlung ergänzen. Derartige zusätzliche Bestandteile und/oder Faktoren können Teil der pharmazeutischen Zusammensetzung sein, um synergistische Wirkungen zu erzielen oder um abträgliche oder unerwünschte Wirkungen zu minimieren.
- Techniken zur Formulierung oder Zubereitung und Anwendung/Medikation von Verbindungen der vorliegenden Erfindung sind in „Remington's Pharmaceutical Sciences" Mack Publishing Co., Easton, PA, letzte Ausgabe (siehe ebenfalls oben) veröffentlicht. Eine geeignete Anwendung kann beispielsweise eine orale, dermale oder transmucosale Anwendung und eine parenterale Anwendung einschließen, einschließlich einer intramuskulären, subkutanen, intramedulären Injektion ebenso wie intrathekalen, direkt intraventrikulären, intravenösen, intraperitonealen oder intranasalen Injektionen.
- In einem vierten Aspekt stellt die vorliegende Erfindung ein kosmetisches oder Nahrungsmittelprodukt bereit, das wie oben offenbarte Nano- und Mikrokapseln enthält.
- Die vorliegende Erfindung wird nunmehr durch die beigefügten Figuren veranschaulicht, bei denen Folgendes gezeigt wird:
-
1(a) eine Dynamische Lichtstreuung des hydrodynamischen Peptosomen-Radius RH als Funktion der NaCl-Konzentration und des pHs zeigt. (b) Schematische Darstellung des Peptosoms und seiner Größenveränderung als Funktion des pHs aufgrund eines Knäuel zu α-Helix Sekundärstrukturübergangs im Peptidanteil. -
2 ist eine schematische Darstellung des Spinnenbeutel/Ballonbildungsprozesses. (A) Eine wässrige Proteinsuspension wird in Toluol emulgiert. (B) Ein Protein absorbiert an der Wasser-Toluol-Grenzfläche und denaturiert, wodurch ein Polymernetzwerk gebildet wird (Einfügung). (C) Wenn es einmal absorbiert ist, kann das Proteinnetzwerk in Wasser durch Zentrifugation übertragen werden. Endgültige Beutel/Ballonstrukturen weisen Wasser auf der Innenseite und Wasser auf der Außenseite auf. (D) Alternativ kann das Proteinnetzwerk, wenn es einmal absorbiert ist, in eine einphasige Lösung durch Zusatz von Ethanol übertragen werden. -
3 zeigt ein Bild von Spinnenbeutel/Ballons in (A) Toluol/Ethanol (50:50) und (B) nach Transfer in Wasser. -
4 ist ein Bild von Spinnenbeutel/Ballons befüllt mit FITC-markiertem Dextran (MW 500kDa) nach Transfer in die kontinuierliche Wasserphase: (A) helles Feld-Bild. (b) Fluoreszierendes Bild. -
5 zeigt Spinnenbeutel/Ballons, die durch SEM wiedergegeben werden. Die Membrandicke wurde als kleiner als 70 nm bestimmt. - Beispiele:
- Proteinherstellung
- Die Proteinlösung, aus der die Spinnenballons gebildet wurden, wurde durch zunächst Auflösen von rekombinanten Spinnendragline-Seidenprotein (C16, siehe Huemmerich et al., 2004) in einer Konzentration von 10 mg/ml in 6M Guanidinthiocyanat hergestellt. Die Proteinlösung wurde auf 4°C abgekühlt und die Konzentration von Guanidinthiocyanat wurde 1 mM durch Dialysieren der Proteinlösung gegen einen 10 mM Trispuffer, pH 8,0 über Nacht unter Verwendung eines Dialyseröhrchens von Carl Roth Gmbh mit einer Molekulargewichtsgrenze von 14 kDa reduziert. Jegliches undispergiertes Protein wurde durch Zentrifugieren der dialysierten Lösung für 30 Minuten bei einer Kraft von 100.000 × g entfernt, während die Lösungstemperatur bei 4°C aufrecht erhalten wurde. Die endgültige Proteinkonzentration wurde unter Verwendung einer UV Absorption bestimmt, unter Verwendung des Extinktionskoeffizienten der Proteine von 0,859 bei einer Wellenlänge von 276 nm.
- Beutel/Ballonbildung
- Beutel/Ballons aus Spinnenseide wurden durch Emulgieren von 5 μl dialysierter Proteinsuspension in 300 μl Toluol für 90 Sekunden (
2A ) gebildet. Während der Emulgierung absorbiert Seidenprotein und verändert seine strukturelle Konformation an der Oberfläche der Emulsionströpfchen, was ein Polymernetzwerk zur Folge hat, das das Emulsionströpfchen einkapselt (2B ). Spinnenseidenbeutel/Ballons wurden unter Verwendung von Proteinsuspensionen mit Konzentrationen im Bereich von 1–6 mg/ml und mit Emulsifikationszeiten von nur 20 Sekunden gebildet. Die Größe der Beutel/Ballons, die sich bildeten, hängt von der Größe der Emulsionströpfchen ab. - Wenn sie einmal gebildet wurden, wurden die Proteinhüllen, die die Emulsionströpfchen umgeben, aus der Zwei-Phasen-Emulsion in eine Ein-Phasen-Lösung übertragen. Zwei unterschiedliche Verfahren sind bei Übertragen der Proteinhüllen effektiv. Beim ersten Verfahren wurden 300 μl Wasser dem Toluol zugesetzt, um eine wässrige Sub-Schicht zu bilden. Die Proteinhüllen, die die Wassertröpfchen umgeben, wurden aus der Toluolschicht in die wässrige untere Schicht bei einer Kraft von 100 × g für 4 Minuten zentrifugiert (
2C ). Bei zweiten Verfahren wurde eine einphasige Lösung durch Zusatz von 300 μl Ethanol zur zweiphasigen Lösung gebildet, um das Toluol und Wasser zu solubilisieren (2D ). Nach Verwendung jedes Verfahrens zur Übertragung der Beutel/Ballons auf eine Einphasen-Lösung wurden die sich ergebenden Strukturen mit einem optischen Mikroskop bzw. Lichtmikroskop untersucht (3 ). - Die Integrität der zentrifugierten Ballon-artigen Proteinhüllen wurden durch Zusatz von 0,5 Gew.-% FITC markiertem 500 kDa Dextran (Sigma-Aldrich) zur Proteinlösung vor der Emulsifikation verifiziert. Nach Emulsifikation und Zentrifugation wiesen die gebildeten Ballon-artigen Strukturen nach wie vor eine Fluoreszenz auf, was darauf hinweist, dass die Proteinhülle dieser Strukturen während der Zentrifugation nicht zerrissen wurde (
4 ). - Literatur
-
- Chécot F, Lecommandoux S, Gnanou Y, Klok HA (2002) Angew. Chem. Int. Ed. 41, 1339
- Chécot F, Lecommandoux S, Klok HA, Gnanou Y (2003) Euro. Phys. J. E 10, 25
- Dinsmore AD, Hsu MF, Nikolaides MG, Marquez M, Bausch AR, Weitz DA. (2002) Colloidosomes: Selectively permeable capsules composed of colloidal particles. Science 298(5595):1006–1009.
- Y. -Y. Won, H. Davis, F. Bates, Science 283, 960 (1999)
- Huemmerich D, Helsen CW, Quedzuweit S, Oschmann J, Rudolph R, Scheibel T (2004) Primary structure elements of spider dragline silks and their contribution to protein solubility. Biochemistry 43: 13604–12
- Scheibel T (2004) Spider silks: recombinant synthesis, assembly, spinning, and engineering of synthetic proteins, Microbial Cell Factories 3, 14
Claims (13)
- Verfahren zur Herstellung von Nano- und Mikrokapseln, das die folgenden Schritte umfasst: a) Bereitstellen von Spinnenseidenproteinen; b) Bilden einer Lösung oder Suspension dieser Proteine in einem geeigneten Lösungsmittel; c) Erzeugen einer Emulsion aus zumindest 2 Phasen, wobei die Emulsion die Lösung oder Suspension, gebildet in b), als eine erste Phase enthält und zumindest eine weitere Phase enthält, die im Wesentlichen mit der ersten Phase unmischbar ist; d) Ausbilden eines Polymernetzwerkes der Spinnenseidenproteine an der Grenzfläche der zumindest 2 Phasen; e) Auftrennen des Proteinpolymernetzwerks, erzeugt in (d) aus der Emulsion.
- Verfahren nach Anspruch 1, wobei die Spinnseidenproteine, die in a) bereitgestellt werden, aus der Gruppe ausgewählt sind, die aus ADF-4 und Derivaten hiervon besteht, einschließlich C16, C16NR4, C32, C32NR4.
- Verfahren nach Anspruch 1 oder 2, wobei das Lösungsmittel in b) und/oder die Lösungsmittel der zumindest einen weiteren Phase aus der Gruppe ausgewählt ist, die aus hydrophilen Lösungsmitteln, vorzugsweise Wasser und Alkohol oder lipophilen Lösungsmitteln besteht, vorzugsweise natürlichen Ölen oder synthetischen Ölen.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei die Emulsion, die in c) gebildet wird, W/O, O/W, O/W/O oder W/O/W-Typ aufweist.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei das in 1 b) verwendete Lösungsmittel weiterhin ein oder mehrere pharmazeutische Mittel, kosmetische Mittel, Nahrungsmittel oder Nahrungszusatzstoffe enthält.
- Verfahren nach Anspruch 5, wobei das pharmazeutische Mittel im Lösungsmittel gelöst, suspendiert oder in fester Form vorliegt.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei die Abtrennung des Polymernetzwerks in Schritt e) mittels Zentrifugation oder durch Zerstören der in Schritt c) gebildeten Emulsion und durch Bilden einer einphasigen Lösung durchgeführt wird.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei die in den Schritten b) bis e) verwendete Temperatur 5 bis 40 °C, vorzugsweise 10 bis 30 °C und besonders bevorzugt Raumtemperatur ist, und wobei der in den Schritten b) bis e) verwendete pH 3 bis 9, vorzugsweise 5 bis 8, besonders bevorzugt 7 ist.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei die Größe der Emulsionströpfchen und die hiervon gewonnenen Nano- und Mikropartikel von 100 nm bis 20 μm, vorzugsweise zwischen 500 nm und 10 μm, am Meisten bevorzugt ungefähr 5 μm beträgt.
- Verfahren nach einem oder mehreren der vorhergehenden Ansprüche, wobei die Wanddicke der erzielten Nano- und Mikrokapseln zwischen 5 und 100 nm, vorzugsweise zwischen 10 und 70 nm liegt.
- Nano- und Mikrokapsel, gewinnbar durch das Verfahren nach einem oder mehreren der Ansprüche 1 bis 10.
- Pharmazeutische Zusammensetzung, die Nano- und Mikrokapseln nach Anspruch 11 und einen pharmazeutisch verträglichen Träger enthält.
- Kosmetik- oder Nahrungsmittelprodukt, das Nano- und Mikrokapseln nach Anspruch 11 enthält.
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP05016712A EP1757276B1 (de) | 2005-08-01 | 2005-08-01 | Prozess zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenprotein |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE602005002654D1 DE602005002654D1 (de) | 2007-11-08 |
| DE602005002654T2 true DE602005002654T2 (de) | 2008-06-19 |
Family
ID=35197006
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE602005002654T Active DE602005002654T2 (de) | 2005-08-01 | 2005-08-01 | Prozess zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenprotein |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US8372436B2 (de) |
| EP (1) | EP1757276B1 (de) |
| JP (1) | JP5129746B2 (de) |
| CN (1) | CN101309676B (de) |
| AT (1) | ATE374018T1 (de) |
| CA (1) | CA2617530C (de) |
| DE (1) | DE602005002654T2 (de) |
| DK (1) | DK1757276T3 (de) |
| ES (1) | ES2294606T3 (de) |
| PL (1) | PL1757276T3 (de) |
| PT (1) | PT1757276E (de) |
| WO (1) | WO2007014755A1 (de) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS6092337A (ja) * | 1983-10-26 | 1985-05-23 | Sekisui Plastics Co Ltd | 発泡フエノ−ル樹脂成形物の製造方法 |
| EP1978937A1 (de) * | 2006-01-20 | 2008-10-15 | Basf Se | Verwendung von amphiphilen selbstassemblierenden proteinen zur formulierung von schwer wasserlöslichen effektstoffen |
| WO2008071226A1 (en) * | 2006-12-11 | 2008-06-19 | Medizinische Hochschule Hannover | Implant of cross-linked spider silk threads |
| JP2008201767A (ja) * | 2007-01-24 | 2008-09-04 | Fujifilm Corp | 頭髪用組成物 |
| US20080175807A1 (en) | 2007-01-24 | 2008-07-24 | Fujifilm Corporation | Composition for hair |
| JP2008255020A (ja) * | 2007-04-02 | 2008-10-23 | Fujifilm Corp | 抗老化皮膚外用剤 |
| CN101677966A (zh) * | 2007-04-18 | 2010-03-24 | 加利福尼亚大学董事会 | 蛋白质改性的纳米滴、组合物和制备方法 |
| ES2530190T3 (es) | 2007-06-20 | 2015-02-27 | Basf Se | Proteínas repetitivas sintéticas, su producción y su uso |
| US9233067B2 (en) | 2009-11-30 | 2016-01-12 | Amsilk Gmbh | Silk particles for controlled and sustained delivery of compounds |
| JP2013523651A (ja) | 2010-03-24 | 2013-06-17 | ノースイースタン ユニヴァーシティ | 多重コンパートメントのマクロファージ送達 |
| KR101494711B1 (ko) | 2011-11-04 | 2015-02-26 | 동아대학교 산학협력단 | 산왕거미 유래 메이저 엠풀레이트 스피드로인 단백질의 반복적인 c-말단 영역의 폴리펩티드 서열 및 이를 코딩하는 염기서열 |
| CN104684540A (zh) * | 2012-07-13 | 2015-06-03 | 塔夫茨大学 | 在丝纤蛋白生物材料中对不相混溶的相的包封 |
| EP2872114A4 (de) * | 2012-07-13 | 2016-04-06 | Univ Tufts | Verkapselung von duft- und/oder aromastoffen seidenfibroinbiomaterialien |
| JP6450680B2 (ja) * | 2012-09-06 | 2019-01-09 | アーエムシルク ゲーエムベーハー | 高靱性シルク繊維を作製する方法 |
| US9968561B2 (en) * | 2013-03-15 | 2018-05-15 | Patheon Softgels Inc. | Silk-based capsules |
| GB201415681D0 (en) | 2014-09-04 | 2014-10-22 | Cambridge Entpr Ltd And President And Fellows Of Harvard College | Protien Capsules |
| DE102014218507A1 (de) | 2014-09-16 | 2016-03-17 | Henkel Ag & Co. Kgaa | Spinnenseidenproteine als Enzymstabilisatoren |
| DE102014218502A1 (de) | 2014-09-16 | 2016-03-17 | Henkel Ag & Co. Kgaa | Proteinhaltiges Reinigungsmittel |
| DE102014218503A1 (de) | 2014-09-16 | 2016-03-17 | Henkel Ag & Co. Kgaa | Proteinhaltiges Waschmittel |
| EP3226835A4 (de) | 2014-12-02 | 2018-09-26 | Silk Therapeutics, Inc. | Funktionskleidungsstück aus seide sowie produkte und verfahren zur herstellung davon |
| CN104927777B (zh) * | 2015-06-02 | 2018-04-24 | 清华大学深圳研究生院 | 相变储能微胶囊制备方法及应用 |
| AU2016294611B2 (en) | 2015-07-14 | 2022-08-11 | Evolved By Nature, Inc. | Silk performance apparel and products and methods of preparing the same |
| CA3028523A1 (en) | 2016-06-22 | 2017-12-28 | Amsilk Gmbh | Articles comprising a silk polypeptide for antigen delivery |
| DE102016222480B4 (de) | 2016-11-16 | 2020-02-13 | Adidas Ag | Bekleidungsstück, das Spinnenseide aufweist oder Schuh, der Spinnenseide aufweist, und ein entsprechendes Herstellungsverfahren |
| CN111712514A (zh) | 2017-09-27 | 2020-09-25 | 自然进化公司 | 丝涂布织物和产品及其制备方法 |
| WO2020035361A1 (en) | 2018-08-17 | 2020-02-20 | Amsilk Gmbh | Use of a structural polypeptide for plant coating |
| CN109329910A (zh) * | 2018-09-28 | 2019-02-15 | 青岛大学 | 一种蜘蛛丝组合物口服液的制备方法 |
| JP2022541411A (ja) * | 2019-07-12 | 2022-09-26 | ボルト スレッズ インコーポレイテッド | 組換えスパイダーシルク押出物製剤 |
| CN111214385B (zh) * | 2020-03-13 | 2022-05-17 | 珀莱雅化妆品股份有限公司 | 一种负载皮肤营养剂的纳米粒乳液及其制备方法 |
| WO2022123996A1 (ja) | 2020-12-07 | 2022-06-16 | 山下マテリアル株式会社 | フレキシブル多層基板及びその製造方法 |
| KR20230122099A (ko) * | 2020-12-24 | 2023-08-22 | 고쿠리쯔 다이가쿠 호징 츠쿠바 다이가쿠 | 피브로인 마이크로 구체 및 그의 제조 방법 |
| WO2023152202A1 (en) | 2022-02-10 | 2023-08-17 | Amsilk Gmbh | Gradient printing reservoir and printing method |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2683159B1 (fr) * | 1991-10-31 | 1994-02-25 | Coletica | Procede de fabrication de nanocapsules a paroi a base de proteines reticulees; nanocapsules ainsi obtenues et compositions cosmetiques, pharmaceutiques et alimentaires en comportant application. |
| JP3094181B2 (ja) * | 1992-04-09 | 2000-10-03 | 清 山内 | 再生天然ケラチンを壁材とするマイクロカプセル及びその製造方法 |
| EP1413585A3 (de) | 1993-06-15 | 2004-08-04 | E.I. Du Pont De Nemours And Company | Neue, rekombinant produzierte Analoge der Spinnenseide |
| JPH08268905A (ja) | 1995-03-31 | 1996-10-15 | Takayuki Nagashima | コロイド状絹フィブロイン及びそれを含有する組成物 |
| JPH08295697A (ja) | 1995-04-26 | 1996-11-12 | Kanebo Ltd | 高濃度絹フィブロイン水溶液の製造方法 |
| JP2997758B2 (ja) | 1996-01-23 | 2000-01-11 | 農林水産省蚕糸・昆虫農業技術研究所長 | 創傷被覆材 |
| JP3537297B2 (ja) | 1996-08-15 | 2004-06-14 | 聖治 寺内 | フィブロイン流動体及びその製造方法 |
| FR2774588B1 (fr) * | 1998-02-11 | 2000-05-05 | Oreal | Composition cosmetique ou dermatologique contenant au moins une proteine de soie d'arachnides naturelle, recombinante ou un analogue |
| JP2972877B1 (ja) * | 1998-07-24 | 1999-11-08 | 農林水産省蚕糸・昆虫農業技術研究所長 | 高分子素材のドープ、高分子素材からなるマイクロビーズおよびそのビーズの製造方法 |
| JP2001163899A (ja) | 1999-12-09 | 2001-06-19 | Natl Inst Of Sericultural & Entomological Science | 機能性絹フィブロインの製造方法とその利用 |
| US6608242B1 (en) | 2000-05-25 | 2003-08-19 | E. I. Du Pont De Nemours And Company | Production of silk-like proteins in plants |
| WO2003045336A1 (fr) * | 2001-11-29 | 2003-06-05 | National Institute Of Agrobiological Sciences | Emulsifiant et procede d'elaboration correspondant |
| US20040132978A1 (en) * | 2002-11-12 | 2004-07-08 | Fahnestock Stephen R. | Method for purifying and recovering silk proteins in soluble form and uses thereof |
| CN1288193C (zh) * | 2004-03-10 | 2006-12-06 | 复旦大学 | 蚕丝蛋白纳米微球及其制备方法 |
| WO2005123114A2 (en) | 2004-06-11 | 2005-12-29 | Trustees Of Tufts College | Silk-based drug delivery system |
-
2005
- 2005-08-01 DK DK05016712T patent/DK1757276T3/da active
- 2005-08-01 EP EP05016712A patent/EP1757276B1/de active Active
- 2005-08-01 DE DE602005002654T patent/DE602005002654T2/de active Active
- 2005-08-01 PL PL05016712T patent/PL1757276T3/pl unknown
- 2005-08-01 ES ES05016712T patent/ES2294606T3/es active Active
- 2005-08-01 PT PT05016712T patent/PT1757276E/pt unknown
- 2005-08-01 AT AT05016712T patent/ATE374018T1/de active
-
2006
- 2006-08-01 CN CN2006800354404A patent/CN101309676B/zh active Active
- 2006-08-01 WO PCT/EP2006/007608 patent/WO2007014755A1/en active Application Filing
- 2006-08-01 JP JP2008524422A patent/JP5129746B2/ja active Active
- 2006-08-01 CA CA2617530A patent/CA2617530C/en active Active
- 2006-08-01 US US11/989,907 patent/US8372436B2/en active Active
-
2012
- 2012-12-27 US US13/728,762 patent/US8729238B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| JP2009502492A (ja) | 2009-01-29 |
| EP1757276B1 (de) | 2007-09-26 |
| CN101309676A (zh) | 2008-11-19 |
| PL1757276T3 (pl) | 2008-02-29 |
| ES2294606T3 (es) | 2008-04-01 |
| US20100056438A1 (en) | 2010-03-04 |
| WO2007014755A1 (en) | 2007-02-08 |
| EP1757276A1 (de) | 2007-02-28 |
| CA2617530A1 (en) | 2007-02-08 |
| US8729238B2 (en) | 2014-05-20 |
| CA2617530C (en) | 2013-10-01 |
| DK1757276T3 (da) | 2008-02-04 |
| ATE374018T1 (de) | 2007-10-15 |
| US8372436B2 (en) | 2013-02-12 |
| CN101309676B (zh) | 2012-02-29 |
| DE602005002654D1 (de) | 2007-11-08 |
| JP5129746B2 (ja) | 2013-01-30 |
| US20130136779A1 (en) | 2013-05-30 |
| PT1757276E (pt) | 2008-01-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE602005002654T2 (de) | Prozess zur Herstellung von Nano- und Mikrokapseln aus Spinnenseidenprotein | |
| Abdullah et al. | Core–shell fibers: design, roles, and controllable release strategies in tissue engineering and drug delivery | |
| DE69818295T2 (de) | Einhüllungssverfahren | |
| Zhang et al. | Formation and stability of core–shell nanofibers by electrospinning of gel-like corn oil-in-water emulsions stabilized by gelatin | |
| Chae et al. | Micro/nanometer‐scale fiber with highly ordered structures by mimicking the spinning process of silkworm | |
| DE60104340T2 (de) | Verfahren zur Herstellung von wirkstoffbeladenen Polymer-Mizellen-Zusammen- setzung | |
| DE60310967T2 (de) | Herstellungsverfahren für verbundteilchen | |
| DE69516296T2 (de) | Herstellung von proteinmikrospähren, filmen und beschichtungen | |
| DE69507339T2 (de) | Polymer-mikrokugeln und verfahren zu deren herstellung | |
| DE3927298C2 (de) | Mehrfachemulsion und Verfahren zu ihrer Herstellung | |
| DE69816778T2 (de) | Beschichtete teilchen, methode zu ihrer herstellung und verwendung | |
| DE10001172A1 (de) | Templatieren von Feststoffpartikeln mit Polymermultischichten | |
| DE69505697T2 (de) | Biologisch abbaubare mikrosphären mit gesteuerter freigabe und verfahren zu deren herstellung | |
| US20080175918A1 (en) | Chemically cross-linked elastomeric microcapsules | |
| DE102018006443A1 (de) | Verfahren zur Verkapselung von Wirkstoffen in Liposomen | |
| KR20100075441A (ko) | 코폴리머-안정화된 에멀션 | |
| DE3012233A1 (de) | Verfahren zum einkapseln von lebensfaehigem gewebe in eine membran | |
| Khoshakhlagh et al. | Encapsulation of D-limonene in Alyssum homolocarpum seed gum nanocapsules by emulsion electrospraying: Morphology characterization and stability assessment | |
| DE69729312T2 (de) | Mikropartikel mit gesteuerter Freisetzung | |
| Panigrahi et al. | Nanoencapsulation strategies for lipid-soluble vitamins | |
| EP2089468B1 (de) | Verfahren zur herstellung von funktionellen cellulosischen formkörpern | |
| DE60120124T2 (de) | Verfahren zur herstellung von kolloidalen partikeln in form von nanokapseln | |
| DE69738124T2 (de) | Verfahren zur Herstellung von hochmonodisperser, Polymeren, hydrophiler Nanopartikel | |
| DE60224215T2 (de) | Herstellungsverfahren einer interaktionverbindung von wirkstoffen mit einem porösen träger durch ein überkritisches fluidum | |
| Wilson et al. | Keratin–chitosan microcapsules via membrane emulsification and interfacial complexation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |